В настоящем описании представлены комплексы, содержащие антиген и антитело, где компоненты комплекса ковалентно связаны друг с другом с помощью простой связи. В заявке описаны также способы получения ковалентно связанных комплексов и их применения.
Предпосылки создания изобретения
Основными «узкими местами» для терапевтического применения полипептидов являются их ограниченная растворимость, стабильность in vivo, короткое время полужизни в сыворотке и быстрый клиренс из кровотока.
Известны различные подходы преодоления указанных недостатков. Однако ни одна их этих технологий не обеспечивает робастную и универсальную платформу, позволяющую осуществлять фармакокинетическую (ФК) модуляцию без возникновения связанных с иммуногенностью рисков или возможного снижения биологической активности.
Один из подходов к улучшению ФК/стабильности и биофизических свойств терапевтических полипептидов предусматривает их слияние с субстанциями, которые стабилизируют полипептид, сохраняют его в растворе и удлиняют его время полужизни. Примерами указанных субстанций являются человеческий сывороточный альбумин или Fc-области человеческого иммуноглобулина. Указанный подход можно применять ко многим линейным полипептидам, которые состоят из встречающихся в естественных условиях аминокислотных остатков и для которых допустимы модификации на С- или N-конце, не приводящие к снижению их биологической активности. Циклические, «сшитые», содержащие не встречающиеся в естественных условиях аминокислотные остатки или дополнительные модификации полипептиды нельзя получать методами рекомбинации в виде слитых полипептидов. Однако указанные полипептиды могут быть отобраны для терапевтических применений, поскольку они часто превосходят «нормальные» линейные пептиды по таким параметрам, как стабильность к протеазам, активность и специфичность.
Одним из подходов к улучшению ФК/стабильности и биофизических свойств терапевтических полипептидов, который можно применять также для циклических, «сшитых» или содержащих не встречающиеся в естественных условиях структуры полипептидов, является их химическая или ферментативная конъюгация с полимерами, например, ПЭГилирование или ГЭКилирование (получение конъюгатов с гидроксиэтилкарахмалом). Однако указанные модификации часто приводят к существенному снижению биологической активности полипептида и в определенных обстоятельствах могут быть причиной проблем, связанных с безопасностью или токсичностью.
Основным недостатком большинства существующих технологий химического сочетания с целью стабилизации или модуляции ФК терапевтических полипептидов является их сложность. При осуществлении стадии химического сочетания методы во многих случаях приводят к образованию смеси производных полипептидов, которые соединены с модулирующей ФК субстанцией с неясной стехиометрией и/или в неопределенных положениях. Кроме того, известные в настоящее время технологии модификации полипептидов часто приводят к снижению в значительной степени или даже к полной элиминации биологической активности терапевтического полипептида. Кроме того, трудно прогнозировать фармакологические свойства и/или возможные пути расщепления химических конъюгатов.
В US 5804371 описаны меченные гаптеном пептиды и их применения в иммунологическом методе обнаружения. Меченный дигоксигенином пептид (брадикинин) и его применение в хемилюминисцентном ферментном иммуноанализе брадикинина в воспаленных тканях описано у Decarie А. и др., Peptides, 15, 1994, сс. 511-518.
В WO 2004/065569 описаны многофункциональные антитела.
Краткое изложение сущности изобретения
Установлено, что путем ковалентного связывания гаптенилированного соединения с антителом к гаптену можно достигать стабилизации и улучшения ФК-свойств соединения.
Одним из объектов представленного в настоящем описании изобретения является конъюгат, содержащий антиген и антитело, которое специфически связывается с антигеном, отличающийся наличием ковалентной связи между антигеном и аминокислотным остатком в CDR2 антитела, где CDR2 определяют согласно Кэботу.
Установлено, что в конъюгатах и способах, представленных в настоящем описании, можно применять любой антиген после дериватизации с помощью универсального линкера, который содержит функциональный остаток для образования ковалентной связи между антигеном и аминокислотным остатком в CDR2 антитела. Локализация функциональной группы в универсальном линкере обладает преимуществом, состоящем в том, что отсутствует необходимость преобразовывать синтез и положение функциональной группы в CDR2 антитела.
Одним из объектов изобретения, указанных в настоящем описании, является конъюгат, содержащий гаптенилированное соединение и антитело, которое специфически связывается с гаптеном гаптенилированного соединения (антитело к гаптену, антигаптеновое антитело), отличающийся наличием ковалентной связи между гаптенилированным соединением и аминокислотным остатком в CDR2 антитела, где CDR2 определяют согласно Кэботу.
В одном из вариантов осуществления всех объектов изобретения CDR2 представляет собой CDR2 тяжелой цепи.
В одном из вариантов осуществления всех объектов изобретения гаптенилированное соединение содержит гаптен, необязательный линкер и «полезный груз».
В одном из вариантов осуществления всех объектов изобретения ковалентная связь находится между линкером гаптенилированного соединения и аминокислотным остатком в CDR2 антитела.
В одном из вариантов осуществления всех объектов изобретения ковалентная связь находится между функциональной группой в гаптенилированном соединении и аминокислотным остатком в CDR2 антитела.
В одном из вариантов осуществления изобретения функциональная группа находится в линкере гаптенилированного соединения.
В одном из вариантов осуществления всех объектов изобретения, указанных в настоящем описании, ковалентная связь находится между остатком цистеина в CDR2 тяжелой цепи антитела и функциональной группой антигена или функциональной группой гаптенилированного соединения.
В одном из вариантов осуществления изобретения остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52 или положении 52а, или положении 52b, или положении 52 с, или положении 52d, или положении 53 согласно нумерации по Кэботу вариабельного домена тяжелой цепи.
В одном из вариантов осуществления изобретения остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52а или в положении 52b, или в положении 52 с, или в положении 53 согласно нумерации по Кэботу вариабельного домена тяжелой цепи.
В одном из вариантов осуществления изобретения остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52b или в положении 53 согласно нумерации по Кэботу вариабельного домена тяжелой цепи.
В одном из вариантов осуществления всех объектов изобретения ковалентная связь представляет собой дисульфидную связь.
В одном из вариантов осуществления всех объектов изобретения антитело представляет собой биспецифическое антитело, которое содержит первую специфичность, связывающуюся с первым антигеном или первым гаптеном, и вторую специфичность, связывающуюся со вторым антигеном или вторым гаптеном, где первый антиген/гаптен отличается от второго антигена/гаптена.
В одном из вариантов осуществления изобретения антитело содержит первую специфичность, связывающуюся с первым гаптеном, и вторую специфичность, связывающуюся со вторым гаптеном.
В одном из вариантов осуществления изобретения антитело содержит первую специфичность, связывающуюся с гаптеном, и вторую специфичность, связывающуюся с (не являющимся гаптеном) антигеном.
В одном из вариантов осуществления изобретения (не являющийся гаптеном) антиген представляет собой антиген клеточной поверхности. В одном из вариантов осуществления изобретения антиген клеточной поверхности представляет собой ассоциированный с опухолью антиген.
В одном из вариантов осуществления изобретения биспецифическое антитело представляет собой полноразмерное антитело. В одном из вариантов осуществления изобретения одна тяжелая цепь биспецифического антитела содержит мутацию, приводящую к образованию впадины, а соответствующая другая цепь содержит мутацию, приводящую к образованию выступа.
В одном из вариантов осуществления всех объектов изобретения «полезный груз» выбирают из связывающего фрагмента, предназначенного для мечения фрагмента и биологически активного фрагмента.
В одном из вариантов осуществления всех объектов изобретения антитело представляет собой полноразмерное антитело.
В одном из вариантов осуществления всех объектов изобретения антитело представляет собой гуманизированное или человеческое антитело.
В одном из вариантов осуществления изобретения константная область антитела представляет собой область иммуноглобулина подкласса IgG1 или подкласса IgG4.
В одном из вариантов осуществления изобретения антитело имеет константную область подкласса IgG1 с аланином в положении 234 и 235 и глицином в положении 329 в соответствии с нумерацией согласно EU-индексу Кэбота.
В одном из вариантов осуществления изобретения антитело имеет константную область подкласса IgG4 с пролином в положении 228, глутаминовой кислотой в положении 235 и глицином в положении 329 в соответствии с нумерацией согласно EU-индексу Кэбота.
В одном из вариантов осуществления всех объектов изобретения, представленного в настоящем описании, антитело представляет собой фрагмент антитела. В одном из вариантов осуществления изобретения фрагмент представляет собой Fab или (Fab)2.
В одном из вариантов осуществления всех объектов изобретения конъюгат содержит только одну ковалентную связь на CDR2 тяжелой цепи.
В одном из вариантов осуществления всех объектов изобретения, представленного в настоящем описании, антиген или гаптенилированное соединение содержит реакционноспособную группу, которая может образовывать ковалентную связь с тиольной группой остатка цистеина в CDR2 антитела. В одном из вариантов осуществления изобретения реакционноспособная группа представляет собой тиол или малеимид, или галогенацетил.
В одном из вариантов осуществления всех объектов изобретения, представленного в настоящем описании, ковалентная связь представляет собой дисульфидную связь, и она образуется без добавления агентов, обладающих окислительно-восстановительной активностью.
В одном из вариантов осуществления всех объектов изобретения конъюгат содержит терапевтический или выявляемый фрагмент. В одном из вариантов осуществления изобретения терапевтический или выявляемый фрагмент ковалентно конъюгирован с антигеном или гаптеном.
В одном из вариантов осуществления изобретения антиген или гаптен конъюгирован с полипептидом, состоящим из 5-60 аминокислотных остатков. В одном из вариантов осуществления изобретения полипептид содержит 10-50 аминокислотных остатков. В одном из вариантов осуществления изобретения полипептид содержит 12-40 аминокислотных остатков. В одном из вариантов осуществления изобретения полипептид содержит 12-30 аминокислотных остатков.
В одном из вариантов осуществления изобретения антиген или гаптен конъюгирован с выявляемой меткой.
В одном из вариантов осуществления изобретения антиген или гаптен конъюгирован с полипептидом или с выявляемой меткой, или с «полезным грузом» через линкер. В одном из вариантов осуществления изобретения линкер представляет собой непептидный линкер.
Одним из объектов изобретения, представленного в настоящем описании, является антитело, которое имеет в CDR2 легкой и/или тяжелой цепи остаток цистеина, где CDR определяют согласно Кэботу.
В одном из вариантов осуществления изобретения остаток цистеина находится в CDR2 тяжелой цепи.
В одном из вариантов осуществления изобретения остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52 или в положении 52а, или в положении 52b, или в положении 52с, или в положении 52d, или в положении 53 согласно нумерации вариабельного домена тяжелой цепи по Кэботу.
В одном из вариантов осуществления изобретения остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52а или в положении 52b, или в положении 52с, или в положении 53 согласно нумерации вариабельного домена тяжелой цепи по Кэботу.
В одном из вариантов осуществления изобретения остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52b или в положении 53 согласно нумерации вариабельного домена тяжелой цепи по Кэботу.
В одном из вариантов осуществления изобретения антитело имеет остаток цистеина только в одном вариабельном домене тяжелой цепи в положении 52b или положении 53.
В одном из вариантов осуществления изобретения гаптен представляет собой биотин или теофиллин, или дигоксигенин, или карборан, или флуоресцеин.
В одном из вариантов осуществления изобретения антитело представляет собой гуманизированное или человеческое антитело.
В одном из вариантов осуществления изобретения антитело представляет собой полноразмерное антитело или Fab, или scFv, или scFv, конъюгированный с Fc-областью.
В одном из вариантов осуществления изобретения цистеин образует дисульфидную связь с выделенным остатком цистеина или выделенным остатком гомоцистеина.
Одним из объектов изобретения, представленного в настоящем описании, является иммуноконъюгат, содержащий конъюгат, указанный в настоящем описании, и цитотоксическое средство.
Одним из объектов изобретения, представленного в настоящем описании, является фармацевтическая композиция, содержащая конъюгат, указанный в настоящем описании, и фармацевтически приемлемый носитель.
Конъюгат, указанный в настоящем описании, предназначен для применения в качестве лекарственного средства.
Конъюгат, указанный в настоящем описании, предназначен для лечения рака.
Конъюгат, указанный в настоящем описании, предназначен для лечения диабета.
Конъюгат, указанный в настоящем описании, предназначен для лечения ожирения.
Конъюгат, указанный в настоящем описании, предназначен для лечения воспалительного заболевания.
Конъюгат, указанный в настоящем описании, предназначен для лечения метаболического нарушения.
Конъюгат, указанный в настоящем описании, предназначен для лечения вирусного заболевания
Одним из объектов изобретения, представленного в настоящем описании, является применение конъюгата, указанного в настоящем описании, для приготовления лекарственного средства.
Одним из объектов изобретения, представленного в настоящем описании, является применение конъюгата, указанного в настоящем описании, в качестве диагностического агента.
Одним из объектов изобретения, представленного в настоящем описании, является применение конъюгата, указанного в настоящем описании, который содержит терапевтический полипептид, для повышения стабильности терапевтического полипептида.
Одним из объектов изобретения, представленного в настоящем описании, является применение конъюгата, указанного в настоящем описании, который содержит терапевтический полипептид, для повышения активности терапевтического полипептида.
Одним из объектов изобретения, представленного в настоящем описании, является применение конъюгата, указанного в настоящем описании, который содержит терапевтический полипептид, для удлинения времени полужизни in vivo терапевтического полипептида.
Одним из объектов изобретения, представленного в настоящем описании, является применение конъюгата, указанного в настоящем описании, для лечения заболевания.
Одним из объектов изобретения, представленного в настоящем описании, является способ лечения индивидуума, который имеет заболевание, заключающийся в том, что вводят индивидууму в эффективном количестве конъюгат, указанный в настоящем описании.
Одним из объектов изобретения, представленного в настоящем описании, является способ лечения заболевания у индивидуума, заключающийся в том, что вводят индивидууму в эффективном количестве конъюгат, указанный в настоящем описании.
В одном из вариантов осуществления изобретения заболевание представляет собой рак.
В одном из вариантов осуществления изобретения заболевание представляет собой диабет.
В одном из вариантов осуществления изобретения заболевание представляет собой ожирение.
Одним из объектов изобретения, представленного в настоящем описании, является способ получения конъюгата, указанного в настоящем описании, заключающийся в том, что объединяют антитело, которое содержит первую реакционноспособную группу, и антиген, который содержит вторую реакционноспособную группу, при этом альфа-углеродный атом аминокислотного остатка, который несет первую реакционноспособную группу, находится на расстоянии примерно 10-11 ангстремов от атома антигена, с которым слит линкер.
Одним из объектов изобретения, представленного в настоящем описании, является способ получения конъюгата, указанного в настоящем описании, заключающийся в том, что осуществляют стадии, на которых
- объединяют в растворе антитело, которое специфически связывается с гаптеном и содержит реактивную группу на одном аминокислотном остатке в CDR2, с гаптенилированным соединением, содержащим реактивную группу, где гаптенилированное соединение содержит «полезный груз», такой как пептид, состоящий из 5-60 аминокислот, или выявляемую метку, и
- выделяют конъюгат из раствора.
Одним из объектов изобретения, представленного в настоящем описании, является способ получения антитела, которое предназначено для образования конъюгата, указанного в настоящем описании, заключающийся в том, что осуществляют стадии, на которых
- культивируют клетку, которая содержит нуклеиновую кислоту, кодирующую антитело, и
- выделяют антитело из клетки или среды для культивирования,
где в антителе остаток в CDR2 тяжелой цепи изменен в результате мутации на цистеин, который по данным рентгеноструктурного анализа нековалентного комплекса антитела и его антигена или гаптенилированного соединения находится на расстоянии 10-11 ангстремов между альфа-углеродным атомом аминокислотного остатка в CDR2 антитела и атомом гаптена, с которым соединен линкер, или с атомом антигена между которыми должна быть образована ковалентная связь.
Одним из объектов изобретения, представленного в настоящем описании, является способ идентификации положения в CDR2 антитела, которое можно изменять в результате мутации на цистеин для образования ковалентной связи между остатком в CDR2 антитела и связанным антигеном или гаптенилированным соединением, заключающийся в том, что осуществляют стадии, на которых
- определяют кристаллическую структуру нековалентного комплекса антитела и антигена или гаптенилированного соединения, где антиген или гаптенилированное соединение содержит линкерную последовательность, и
- идентифицируют аминокислотный остаток в CDR2 антитела и в линкерной последовательности, находящийся на расстоянии 10-11 ангстремов между альфа-углеродными атомами аминокислотного остатка в CDR2 антитела и атомом в антигене, с которым слит линкер,
где идентифицированное положение представляет собой положение в CDR2 антитела, которое можно изменять в результате мутации на цистеин для образования ковалентной связи между остатком в CDR2 антитела и связанным антигеном или гаптенилированным соединением.
Одним из объектов изобретения, представленного в настоящем описании, является биспецифическое антитело, предназначенное для целенаправленного переноса гаптенилированного соединения к клетке-мишени, где биспецифическое антитело содержит первый сайт связывания, который специфически связывается с гаптенилированным соединением, и вторую связывающую специфичность, которая специфически связывается с маркером клеточной поверхности клетки.
Описание чертежей
На чертежах показано:
на фиг. 1 - процедура дигоксигенилирования (конъюгация дигоксигенина с) пептидов (фиг. 1А). Примеры дигоксигенилированной метки (флуорофор Dig-Су5; фиг. 1Б) и дигоксигенилированного полипептида (PYY-производное (DIG-PYY); фиг. 1В);
на фиг. 2 - схематическое изображение комплекса моноспецифического двухвалентного антитела к дигоксигенину и конъюгата дигоксигенин-Су5 (фиг. 2А) и комплекса моноспецифического двухвалентного антитела к дигоксигенину и конъюгата дигоксигенин-полипептид (фиг. 2Б); схематическое изображение комплекса биспецифического четырехвалентного антитела к дигоксигенину и конъюгата дигоксигенин-полипептид (фиг. 2В);
на фиг. 3 - хроматограмма, полученная методом гель-фильтрации (считывание при 280 нм) комплекса, содержащего антитело к дигоксигенину и дигоксигенин, конъюгированный с пептидом (DIG-PYY), на которой продемонстрировано наличие одного пика, соответствующего комплексу определенного размера;
на фиг. 4 - структурная модель Fab к дигоксигенину (слева), демонстрирующая, что дигоксигенин (обозначен окружностью) «захвачен» и находится в глубоком кармане, который образован CDR-участками VH- и VL-областей. Б - структурная модель Fab к биотину (справа), демонстрирующая, что биоцитинамид (обозначен окружностью) «захвачен» и находится в глубоком кармане, который образован CDR-участками VH- и VL-областей;
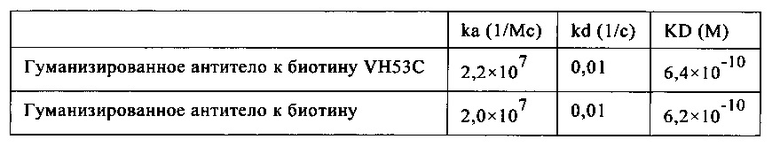
на фиг. 5 - сравнительные данные о связывании рекомбинантных гуманизированных антител к биотину, в которых интродуцирована мутация VH53C, и без указанной мутации. Характеристики связывания анализировали с помощью технологии поверхностного плазмонного резонанса (ППР), используя устройство BIAcore Т100 или BIAcore 3000. На фиг. 5а - данные для гуманизированного антитела к биотину. Связывание биотинилированной siPHK с гуманизированные антителом к биотину, KD=624пМ. На фиг. 5б - данные для антитела к биотину с мутантным Cys53. Связывание биотинилированной siPHK, KD=643пМ; концентрации siPHK: 0,14, 0,41, 1,23, 3,70, 11,1, 33,3 и ЮОнМ; концентрация антитела к биотину: 2нМ; сенсорный чип СМ3; связывание антитела через античеловеческое антитело к Fc-области IgG;
на фиг. 6 - схематическое изображение интродукции функциональных групп SH в гаптен, а также в антитело в соответствующие положения, которые позволяют образовываться ковалентной связи между антителом и гаптеном с получением конъюгата;
на фиг. 7 - схематическое изображение результатов ДСН-ПААГ в условиях самофлуоресценции полос (без дополнительного окрашивания геля для ДСН-ПААГ-анализа):
А: в случае, если не имело место образование ковалентной связи между антителом и конъюгатом гаптен-флуорофор, то как в восстанавливающих, так и в невосстанавливающих условиях удалось обнаружить одну самофлуоресцирующую полосу, которая соответствовала молекулярной массе свободного конъюгата гаптен-флуорофор.
Б: в случае, если образовывалась ковалентная связь между антителом и конъюгатом гаптен-флуорофор в невосстанавливающих условиях, то удалось обнаружить одну самофлуоресцирующую полосу, которая соответствовала молекулярной массе комплекса антитела и конъюгата гаптен-флуорофор. В восстанавливающих условиях дисульфидные мостики в конъюгате, включающем антитело и конъюгат гаптен-флуорофор (гаптенилированное соединение), расщеплялись, и удалось обнаружить одну самофлуоресцирующую полосу, которая соответствовала молекулярной массе свободного конъюгата гаптен-флуорофор;
на фиг. 8 - результаты изучения образования конъюгата гаптенсвязывающих несущих мутантный Cys антител с конъюгатами гаптен-Cys-флуоресцентная метка (гаптенилированное соединение) в присутствии агентов, обладающих окислительно-восстановительной активностью: окислитель (глутатиондисульфид, GSSG) и восстановитель (дитиоэритритол, DTE): комплексообразование антител и последующее ковалентное связывание в определенных положениях оценивали с помощью сигналов флуоресценции с использованием ДСН-ПААГ-анализов. ДСН-ПААГ в невосстанавливающих (верхние изображения) и восстанавливающих условиях (нижние изображения) осуществляли согласно методу, описанному в примере 11. Ковалентно связанные с гаптенами антитела можно обнаруживать в невосстанавливающих условиях по сигналам, связанным с более крупными по размеру белками, в соответствующих положениях. Указанные сигналы отделялись от белка при восстановлении и были видны как небольшие субстанции в восстанавливающих условиях.
Слева: флуоресцентное изображение;
справа: окрашивание кумасси бриллиантовым голубым;
серии 1: антитело к дигоксигенину с мутацией 52bС;
серии 2: антитело к дигоксигенину с остатком дикого типа в положении 52b;
(A) ковалентное связывание с 3 мМ DTE и 10 мМ GSSG;
(Б) ковалентное связывание с 0,3 мМ DTE и 1 мМ GSSG;
(B) ковалентное связывание с 0,03 мМ DTE и 0,1 мМ GSSG;
на фиг. 9 - результаты изучения образования комплексов гаптенсвязывающих несущих мутантный Cys антител с конъюгатами гаптен-Cys-флуоресцентная метка в присутствии только окислителя (глутатиондисульфид, GSSG), но в отсутствии восстановителя или в отсутствии их обоих: комплексообразование антител и последующее ковалентное связывание в определенных положениях оценивали с помощью сигналов флуоресценции с использованием ДСН-ПААГ-анализов. ДСН-ПААГ в невосстанавливающих (верхние изображения) и восстанавливающих условиях (нижние изображения) осуществляли согласно методу, описанному в примере 12. Ковалентно связанные с гаптенами антитела можно обнаруживать в невосстанавливающих условиях по сигналам, связанным с более крупными по размеру белками, в соответствующих положениях. Указанные сигналы отделялись от белка при восстановлении и были видны как небольшие субстанции в восстанавливающих условиях.
Слева: флуоресцентное изображение;
справа: окрашивание кумасси бриллиантовым голубым;
серии 1: антитело к дигоксигенину с мутацией 52bС;
серии 2: антитело к дигоксигенину с остатком дикого типа в положении 52b;
(A) без добавок;
(Б) ковалентное связывание с 1 мМ GSSG;
(B) ковалентное связывание с 0,1 мМ GSSG;
на фиг. 10 - структура Ac-PYY(PEG3-Cys-4Abu-NH2);
на фиг. 11 - структура DIG-3-cme-eda-Cy5;
на фиг. 12 - структура DIG-малеимид-Су5;
на фиг. 13 - структура DIG-eda-Cys-Cy5;
на фиг. 14 - структура DIG-Ahx-Cys-Cy5:
на фиг. 15 - структура DIG-Cys-MR121;
на фиг. 16 - структура Ac-PYY(PEG3-Dig);
на фиг. 17 - структура Ac-PYY(PEG3-Cys-4Abu-Dig);
на фиг. 18 - структура PEG3-PYY(PEG3-Cys-4Abu-Dig);
на фиг. 19 - структура Dy636-eda-Btn;
на фиг. 20 - структура Dy636-Ser-Btn;
на фиг. 21 - структура Dy636-Cys-Btn;
на фиг. 22 - структура Cy5-Cys-Btn;
на фиг. 23 - структура Cy5-Ser-Btn;
на фиг. 24 - структура Ac-PYY(PEG2-Btn);
на фиг. 25 - структура Ac-PYY-PEG3-Cys-p-Ala-Btn);
на фиг. 26 - структура Ac-PYY-PEG3-Ser-PEG2-Btn);
на фиг. 27 - структура Ac-PYY-PEG3-Cys-PEG2-Btn;
на фиг. 28 - структура Ac-PYY(PEG3-Cys-4-Abu-5-фтop);
на фиг. 29 - структура Ac-PYY(PEG3-Cys-PEG2-5-фтop);
на фиг. 30 - схема создания Ac-PYY(PEG2-Btn);
на фиг. 31 - схема создания Ac-PYY(PEG3-Cys-β-Ala-Btn);
на фиг. 32 - схема создания Ac-PYY(PEG3-Cys-4-Abu-Dig);
на фиг. 33 - структура в рентгеновских лучах мышиного антитела к биотину в комплексе с биоцитинамидом. Аминокислотные остатки, которые взаимодействуют с биоцитинамидом, представлены в виде палочек;
на фиг. 34 - результаты исследования ФК в крови in vivo с использованием ковалентных конъюгатов и нековалентных комплексов в сравнении с не входящим в комплекс антигеном/гаптеном; представлены данные об относительной сохранившейся интенсивности флуоресценции (%, закрашенные значки) опосредуемой Су5 флуоресценции нековалентных комплексов биотин-Су5 (фиг. 34А) и ковалентных (связанных SS) конъюгатов (фиг. 35Б), а также с не входящим комплекс биотином-Sеr-Су5 (звездочки); сигнал флуоресценции в момент времени t=0,08 ч принимали за 100%; кроме того, представлены данные об относительном оставшемся количестве человеческого IgG в образцах мышиной сыворотки (незакрашенные значки); концентрацию (мг/мл) в сыворотке IgG в t=0,08 ч принимали за 100%;
на фиг. 35 -полученные с помощью Вестерн-блоттинга результаты определения количества дигоксигенилированного полипептида PYY в сыворотке мышей;
на фиг. 36 - результаты анализа опосредуемого аффинностью комплексообразования гаптенилированных соединений с антителами к гаптену. Комплексообразование антител и последующее ковалентное связывание в определенных положениях оценивали с помощью сигналов флуоресценции с использованием ДСН-ПААГ-анализов, которые осуществляли согласно методу, описанному в примере 19.
Слева: флуоресцентное изображение, полученное для образцов в невосстанавливающих (левая сторона геля) и восстанавливающих условиях (правая сторона геля);
справа: окрашивание кумасси бриллиантовым голубым;
1: гуманизированное антитело к дигоксигенину + биотин-Cys-Cy5;
2: гуманизированное антитело к дигоксигенину VH52bC + биотин-Cys-Cy5;
3: гуманизированное антитело к биотину + биотин-Суs-Су5;
4: гуманизированное антитело к биотину VH53C + биотин-Cys-Cy5.
Белыми стрелками обозначен избыток (несвязанного) биотина-Суs-Су5, который существенно выше, когда применяют антитело к дигоксигенину VH52bC, поскольку в этом случае реакция конъюгации не опосредуется аффинностью;
на фиг. 37 - положения остатков цистеина и схемы распределения дисульфидных мостиков в Fab-области, необходимые для образования Dig-связывающего антитела, с дополнительным цистеином в положении 52b для опосредуемого гаптеном сайтнаправленного целевого ковалентного связывания «полезного груза». (А) Схема распределения остатков цистеина и дисульфидов в VH- и СН1-доменах и в VL- и CL-доменах, которая требуется для образования функциональных Fab-фрагментов. (Б) Схема распределения остатков цистеина и дисульфидов в VH- и СН1-доменах и в VL- и CL-доменах, которая требуется для образования функциональных Fab-фрагментов, с дополнительным цистеином в положении 52b для опосредуемого гаптеном сайтнаправленного целевого ковалентного связывания «полезного груза». (В и Г) Схема, обусловливающая возможность формирования неправильных дисульфидных связей в VH-домене варианта VH52b, которые могут приводить к образованию имеющих неправильный фолдинг нефункциональных антител. Д) Пример потенциально неправильного междоменного дисульфидного мостика в Fv-области варианта VH52b, что может приводить к образованию имеющих неправильный фолдинг нефункциональных антител;
на фиг. 38 - положения остатков цистеина и схемы распределения дисульфидных мостиков, необходимые для образования Dig-связывающего стабилизированного дисульфидом одноцепочечного Fv с дополнительным остатком цистеина в положении 52b для опосредуемого гаптеном сайтнаправленного целевого ковалентного связывания «полезного груза». (А) Остатки цистеина в VH- и VL-доменах, которые требуются для образования функциональных scFv, dsscFv и dsscFv с мутацией в положении 52b. (Б) Правильная схема распределения дисульфидных мостиков, которые должны образовываться для создания функциональных scFv, dsscFv и dsscFv с мутацией в положении 52b. (В) Схема, обусловливающая возможность формирования неправильных дисульфидных связей, которые могут приводить к формированию имеющих неправильный фолдинг нефункциональных scFv. (Г) Схема, обусловливающая возможность формирования неправильных дисульфидных связей, которые могут приводить к образованию имеющих неправильный фолдинг нефункциональных dsscFv. (Д) Схема, обусловливающая возможность формирования неправильных дисульфидных связей, которые могут приводить к образованию имеющих неправильный фолдинг нефункциональных dsscFv с мутацией в положении 52b;
на фиг. 39 - состав производного биспецифического антитела LeY-Dig в качестве транспортирующего вектора для ковалентно связанных «полезных грузов»;
на фиг. 40 - данные об экспрессии и очистке производных биспецифических антигаптеновых антител, предназначенных для целенаправленного введения ковалентно сшитых «полезных грузов».
(А) Для осуществления анализа методом Вестерн-блоттинга супернатанты клеточных культур подвергали ДСН-ПААГ-анализу (гель NuPAGE 4-12% Бис-Трис (1,0 мм × 12 лунок) (фирма Invitrogen; каталожный № NP0322) и затем белки переносили на мембраны Immobilon Transfer (Immobilon-P) (фирма Millipore; каталожный № IPVH07850), из ПВДФ с размером пор: 0,45 мкм. Для обнаружения производных антител применяли полученное в козах антитело к человеческой легкой каппа-цепи, конъюгированное со щелочной фосфатазой (аффинно очищенное), фирма Sigma (каталожный № А3813), в разведении 1:1000 и полученное в козах антитело к человеческому IgG (Fc-специфическое), конъюгированное со щелочной фосфатазой, фирма Sigma (каталожный № А9544), в разведении 1:1000. Применяли в качестве субстрата жидкий субстрат BCIP/NBT-Blue (фирма Sigma, каталожный № B3804) для проявления Вестерн-блота. Полоса 1 - маркер молекулярной массы; полосы 2 и 3 - контрольное антитело с немодифицированной тяжелой цепью; полоса 4 - биспецифическое антитело LeY-Dig(52bC) с удлиненной Н-цепью.
(Б) Анализы методом ДСН-ПААГ (гель NuPAGE 4-12% Бис-Трис (фирма Invitrogen) и последующее окрашивание кумасси бриллиантовым голубым продемонстрировали чистоту белковых препаратов и позволяли визуализировать полипептидные цепи, родственные IgG, с кажущимися молекулярными размерами, которые соответствовали их рассчитанным молекулярным массам. Полоса 1 - маркер молекулярной массы; полоса 2 - биспецифическое антитело LeY-Dig(52bC) с удлиненной Н-цепью, восстановленное; полоса 3 - биспецифическое антитело LeY-Dig(52bC) с удлиненной тяжелой цепью, невосстановленное;
(В) Результаты гель-фильтрации (Superdex 200) продемонстрировали гомогенность и отсутствие агрегатов в белковых препаратах производного биспецифического антитела LeY-Dig(52bC) после очистки на белке А;
на фиг. 41 - данные об оставшейся относительной интенсивности флуоресценции (%) опосредуемой Су5 флуоресценции нековалентных комплексов Dig-Cy5 и ковалентных (связанных дисульфидными мостиками) конъюгатов, а также не входящих в комплекс Dig-Cy5; сигнал флуоресценции в момент времени t=0,08 ч принимали за 100%; кроме того, представлены данные об относительном оставшемся количестве человеческого IgG в образцах мышиной сыворотки; концентрацию в сыворотке IgG в t=0,08 ч принимали за 100%;
на фиг. 42 - данные о фармакокинетике в условиях, напоминающих условия in vivo, полученные на основе опосредуемой Су5 флуоресценции входящих в нековалентные комплексы и ковалентные (связанные дисульфидными мостиками) конъюгаты биотин-Су5, а также не входящих в комплекс биотин-Су5, при определении с помощью неинвазивной зрительной визуализации; закрашенный ромб: биотин-Су5, закрашенный квадрат: биотин-Су5 + антитело к биотину (комплекс); треугольник: конъюгат Су5-биотин - антитело к биотину;
на фиг. 43 - а) Состав, структура и молекулярная масса конструкции теофиллин-Суз-Су5; б) Данные гель-фильтрации продемонстрировали чистоту и гомогенность очищенных вариантов теофиллинсвязывающих антител; пик №2 соответствовал очищенному продукту, отсутствие пика №1 свидетельствовало о том, что в указанных препаратах отсутствовали агрегаты; в) образование ковалентных комплексов между теофиллинсвязывающими антителами и конструкцией теофиллин-Cys-Cy5, продемонстрированное с помощью ДСН-ПААГ в невосстанавливающих (левые полосы) и восстанавливающих условиях (правые полосы); связывание Су5 с Н-цепью обнаружено в восстанавливающих условиях только в образцах, которые содержали теофиллин-Cys-Cy5 и антитело с мутантным cys, указанные ковалентные конъюгаты расщеплялись при восстановлении (правые полосы); полосы 1: маркер молекулярной массы; 2-4: невосстанавливающие условия - 2: антитело к теофиллину (без мутации cys) + теофиллин-Cys-Cy5 (комплекс); 3: антитело к теофиллину-суs_55+теофиллин-Cys-Cy5 (конъюгат); 4: антитело к теофиллину-суз_54+теофиллин-Суз-Су5 (конъюгат); 5-7: восстанавливающие условия - 5: антитело к теофиллину (без мутации cys)+теофиллин-Cys-Cy5 (комплекс); 6: антитело к теофиллину-суs_55+теофиллин-Cys-Cy5 (конъюгат); 7: антитело к теофиллину-суs_54+теофиллин-Cys-Cy5 (конъюгат);
на фиг. 44 - образование ковалентных комплексов между биотинсвязывающими антителами и конструкцией биотин-Cys-Cy5 продемонстрировано с помощью ДСН-ПААГ в невосстанавливающих и восстанавливающих условиях; реакцию сочетания осуществляли в мышиной сыворотке при 37°С в течение 1 ч. Связывание Су5 с Н-цепью обнаружено в восстанавливающих условиях только в образцах, которые содержали биотин-Cys-Cy5 и антитело с мутантным cys; указанные ковалентные конъюгаты расщеплялись при восстановлении (правые полосы); полосы 1: маркер молекулярной массы; 2-3 невосстанавливающие условия - 2: антитело к биотину (без мутации cys) + биотин-Суs-Су5 (комплекс); 3: антитело к биотину-cys + биотин-Cys-Cy5 (конъюгат); 4-5 восстанавливающие условия - 5: антитело к биотину (без мутации cys)+биотин-Cys-Cy5 (комплекс); 6: антитело к биотину-cys + биотин-Суs-Су5 (конъюгат);
на фиг. 45 - данные о фармакокинетике in vivo, полученные на основе опосредуемой Су5 флуоресценции конструкций биотин-Су5, входящих в нековалентные комплексы и ковалентные (связанные дисульфидными мостиками) конъюгаты, а также не входящих в комплекс конструкций биотин-Су5, при определении с помощью неинвазивной визуализации глаза; закрашенный ромб: конструкция биотин-Су5, закрашенная окружность: конструкция биотин-Су5, введенная через 24 ч после введения антитела к биотину (образование комплекса in vivo); закрашенный квадрат: конструкция биотин-Cys-Cy5, введенная через 24 ч после введения антитела к биотину-cys (образование конъюгата in vivo);
на фиг. 46 - белковая структура Fab-фрагмента мышиного антитела к биотину, определенная в комплексе с биоцитинамидом: входящий в комплекс гаптен расположен в непосредственной близости от отрицательно заряженного кластера аминокислот; биотин, который - в качестве гаптена - дериватизировали для связывания с «полезным грузом» на карбоксильной группе, связывался с высокой эффективностью, поскольку в этом положении отсутствовало отталкивание зарядов (в результате отсутствия СООН-группы); в противоположность этому, свободный (обычный) биотин не мог эффективно связываться с антителом, поскольку его карбоксильная группа должна находиться в непосредственной близости от указанного отрицательно заряженного кластера и поэтому должна отталкиваться.
Подробное описание изобретения
I. Определения
В контексте настоящего описания «акцепторный человеческий каркасный участок» означает каркасный участок, содержащий аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасного участка вариабельного домена тяжелой цепи (VH), выведенного из каркасного участка человеческого иммуноглобулина или консенсусного человеческого каркасного участка, указанного ниже. Акцепторный человеческий каркасный участок «выведенный из» каркасного участка человеческого иммуноглобулина или консенсусного человеческого каркасного участка, может содержать такую же аминокислотную последовательность или может содержать замены в аминокислотной последовательности. В некоторых вариантах осуществления изобретения количество аминокислотных замен составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых вариантах осуществления изобретения последовательность акцепторного человеческого каркасного участка VL идентична последовательности каркасного участка VL человеческого иммуноглобулина или последовательности консенсусного человеческого каркасного участка.
Понятие «аминокислота» относится к группе карбокси-α-аминокислот, которые либо встречаются в естественных условиях, т.е. которые непосредственно или в форме предшественника могут кодироваться нуклеиновой кислотой, либо не встречаются в естественных условиях. Индивидуальные встречающиеся в естественных условиях аминокислоты кодируются нуклеиновыми кислотами, состоящим из трех нуклеотидов, так называемыми кодонами или триплетами оснований. Каждая аминокислота кодируется по меньшей мере одним кодоном. Это обозначают как «вырожденность генетического кода». Понятие «аминокислота» в контексте настоящего описания относится к группе встречающихся в естественных условиях карбокси-α-аминокислот, включающей аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновую кислоту (asp, D), цистеин (cys, С), глутамин (gin, Q), глутаминовую кислоту (glu, Е), глицин (gly, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, К), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серии (ser, S), треонин (thr, Т), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V). Примеры не встречающихся в естественных условиях аминокислот включают (но, не ограничиваясь только ими) Aad (альфа-аминоадипиновая кислота), Abu (аминомасляная кислота), Ach (альфа-аминоциклогексанкарбоновая кислота), Аср (альфа-аминоциклопентанкарбоновая кислота), Асрс (1-аминоциклопропан-1-карбоновая кислота), Aib (альфа-аминоизомасляная кислота), Aic (2-аминоиндан-2-карбоновая кислота; которую обозначают также как 2-2-Aic), 1-1-Aic (1-аминоиндан-1-карбоновая кислота), (2-аминоиндан-2-карбоновая кислота), аллилглицин (аллилС1у), аллоизолейцин (алло-Ilе), Asu (альфа-аминосубериновая кислота, 2-аминооктадиеновая кислота), Bip (4-фенилфенилаланинкарбоновая кислота), ВnНР ((2S,4R)-4-гидроксипролин), Cha (бета-циклогексилаланин), Cit (цитруллин), циклогексилглицин (Chg), циклопентилаланин, бета-циклопропилаланин, Dab (1,4-диаминомасляная кислота), Dap (1,3-диаминопропионовая кислота), р (3,3-дифенилалнинкарбоновая кислота), 3,3-дифенилаланин, ди-н-пропилглицин (Dpg), 2-фурилаланин, гомоциклогексилаланин (HoCha), гомоцитруллин (HoCit), гомоциклолейцин, гомолейцин (HoLeu), гомоаргинин (HoArg), гомосерин (HoSer), гидроксипролин, Lys(Ac), (1) Nal (1-нафтилаланин), (2) Nal (2-нафтилаланин), 4-МеО-Аре (1 -амино-4-(4-метоксифенил)циклогексан-1 -карбоновая кислота), норлейцин (Nle), Nva (норвалин), оматин, 3-Pal (альфа-амино-3-пиридилаланинкарбоновая кислота), 4-Раl (альфа-амино-4-пиридилаланинкарбоновая кислота), 3,4,5,F3-Phe (3,4,5-трифторфенилаланин), 2,3,4,5,6,F5-Phe (2,3,4,5,6-пентафторфенилаланин), Pqa (4-оксо-6-(1-пиперазинил)-3(4Н)-хиназолинуксусная кислота (CAS 889958-08-1)), пиридилаланин, хинолилаланин, саркозин (Sar), тиазолилаланин, тиенилаланин, Tic (альфа-амино-1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота), Tic(OH), Tle (тpет-бутилглицин) и Туr(Ме).
Понятие «вариант аминокислотной последовательности» относится к полипептидам, имеющим аминокислотные последовательности, отличающиеся в некоторой степени от нативной последовательности полипептида. Как правило, последовательности вариантов аминокислотной последовательности должны быть по меньше мере примерно на 70% идентичны нативной последовательности полипептида. В одном из вариантов осуществления изобретения вариант имеет последовательность, которая примерно на 80% или более идентична нативной последовательности полипептида. В одном из вариантов осуществления изобретения вариант имеет последовательность, которая примерно на 90% или более идентична нативной последовательности полипептида. В одном из вариантов осуществления изобретения вариант имеет последовательность, которая примерно на 95% или более идентична нативной последовательности полипептида. В одном из вариантов осуществления изобретения вариант имеет последовательность, которая примерно на 98% или более идентична нативной последовательности полипептида. Аминокислотная последовательность вариантов несет замены, делеции и/или инсерции в определенных положениях в аминокислотной последовательности нативной аминокислотной последовательности. Аминокислоты обозначают с использованием общепринятых названий, однобуквенным и трехбуквенным кодами.
Понятие «антитело» в контексте настоящего описания применяют в его наиболее широком смысле, и оно относится к антителам различной структуры, включая (но, не ограничиваясь только ими) моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, если они сохраняют требуемую активность связывания с антигеном.
Понятие «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающуюся с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают (но, не ограничиваясь только ими) Fv, Fab, Fab', Fab'-SH, F(ab')2; димерные антитела (диабоди); линейные антитела; молекулы одноцепочечных антител (например, scFv) и мультиспецифические антитела, образованные из фрагментов антител.
Понятие «биотин», сокращенно «ВI», означает 5-[(3aS,4S,6aR)-2-оксогексагидро-1Н-тиено[3,4-(1]имидазол-4-ил]пентановую кислоту. Биотин известен также как витамин Н или кофермент R.
Понятие «биспецифические антитела» относится к антителам, которые имеют две различные (антиген/гаптен) связывающие специфичности. В одном из вариантов осуществления изобретения биспецифические антитела, указанные в настоящем описании, являются специфическими в отношении двух различных антигенов, т.е. гаптена и не представляющего собой гаптен антигена.
Понятие «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи выведена из конкретного источника или вида, в то время как остальная часть тяжелой и/или легкой цепи выведена их другого источника или вида.
Понятие «класс» антитела относится к типу константного домена или константной области, который/которая входит в его тяжелую цепь. Известно пять основных классов антител: IgA, IgD, IgE, IgG и IgM и некоторые из них можно подразделять дополнительно на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулина, обозначают как α, δ, ε, γ и μ соответственно.
Понятие «цитотоксический агент» в контексте настоящего описания относится к субстанции, которая ингибирует или препятствует осуществлению клеточной функции и/или вызывает гибель или деструкцию клеток. Цитотоксические агенты включают (но, не ограничиваясь только ими) радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); ингибирующие рост агенты; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты; и различные противоопухолевые или противораковые агенты, которые описаны ниже.
Понятие «дигоксигенин», сокращенно «DIG», означает 3-[(3S,5R,8R,9S,10S,12R,13S,14S,17R)-3,12,14-тригидрокси-10,13-диметил-1,2,3,4,5,6,7,8,9,11,12,15,16,17-тетрадекагидроциклопента[а] фенантрен-17-ил]-2Н-фуран-5-он (CAS-номер 1672-46-4). Дигоксигенин (DIG) представляет собой стероид, обнаруженный исключительно в цветках и листьев растений Digitalis purpurea, Digitalis orientalis и Digitalis lanata (наперстянка) (Polya G., Biochemical targets of plant bioactive compounds, изд-во CRC Press, New York, 2003, c. 847).
Понятие «эффекторные функции» относится к тем видам биологической активности, которые связаны с Fc-областью антитела, которые варьируются в зависимости от класса антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность (CDC); связывании Fc-рецептора; антитело-обусловленную клеточнозависимую цитотоксичность (ADCC); фагоцитоз; понижающую регуляция рецепторов клеточной поверхности (например, В-клеточного рецептора) и активацию В-клеток.
Понятие «эффективное количество» агента, например, фармацевтической композиции, означает количество, эффективное в дозах и в течение периода времени, необходимых для достижения требуемого терапевтического или профилактического результата.
Расщепление антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, которые называют «Раb»-фрагментами, каждый с одним антигенсвязывающим центром, при этом остается «Fc»-фрагмент, название которого отражает его способность легко кристаллизоваться. Обработка пепсином приводит к образованию Р(аb')2-фрагмента, который имеет два антигенсвязывающих центра и все еще сохраняет способность к перекрестному сшиванию антигена.
Fab-фрагмент содержит также константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагмент отличается от Fab-фрагментов добавлением нескольких остатков к карбоксильному концу СН1-домена тяжелой цепи, включая один или несколько остатков цистеина из шарнирной области антитела. В контексте настоящего описания Fab'-SH применяют для обозначения Fab', в котором остаток(ки) цистеина константных доменов несет(ут) по меньшей мере одну свободную тиольную группу. F(ab')2-фрагменты антитела исходно получают в виде пар Fab'-фрагментов, между которыми находятся остатки цистеина шарнирной области. Известны также другие химически связи фрагментов антител.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный распознающий антиген и антигенсвязывающий центр. Эта область состоит из димера, содержащего вариабельный домен одной тяжелой цепи и одной легкой цепи в тесной нековалентной ассоциации. Именно в такой конфигурации три гипервариабельных участка каждого вариабельного домена взаимодействуют, создавая антигенсвязывающий центр на поверхности VH-VL-димера. В целом, шесть гипервариабельных участков определяют антигенсвязывающую специфичность антитела. Однако даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельных участка, специфических в отношении антигена) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем полный сайт связывания.
Понятие «Fc-область» в контексте настоящего описания относится к С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Понятие включает нативную последовательность Fc-областей и вариант Fc-областей. В одном из вариантов осуществления изобретения Fc-область тяжелой цепи человеческого IgG простирается с Cys226 или с Рrо230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) Fc-области может присутствовать или отсутствовать. Если специально не указано иное, то нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации EU, которую обозначают также как EU-индекс, описанной у Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991, NIH публикация 91-3242.
Понятие «флуоресцеин», сокращенно «FLUO», означает 6-гидрокси-9-(2-карбоксифенил)-(3Н)-ксантен-3-он, другое название 2-(6-гидрокси-3-оксо-(3Н)-ксантен-9-ил)бензойная кислота. Флуоресцеин известен также как резорцинолфталеин, СЛ. 45350, флуоресцеин спиртовлажный (solvent yellow 94), D&С желтый №7, ангиофлор (angiofluor), японский желтый (Japan yellow) 201 или флуоресцеин-натрий (soap yellow).
Понятие «каркасный участок», сокращенно «FR», означает аминокислотные остатки вариабельного домена тяжелой и легкой цепи, отличные от остатков гипервариабельного участка (HVR). FR вариабельного домена, как правило, состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, имеют следующее расположение в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Понятие «цистеин в виде свободной аминокислоты» относится к аминокислотному остатку цистеина, который сконструирован в родительском антителе, имеет функциональную тиольную группу (SH) и не спарен с образованием внутримолекулярного дисульфидного мостика. Тем не менее, цистеин в виде свободной аминокислоты может быть спарен, например, с глутатионом, с образованием внутримолекулярного дисульфидного мостика.
Понятие «полноразмерное антитело» относится к антителу, имеющему структуру, практически сходную со структурой нативного антитела, или имеющему тяжелые цепи, которые содержат Fc-область, указанную в настоящем описании. Нативные антитела в виде IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Да, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидными мостиками. Начиная с N- конца к С-концу, каждая тяжелая цепь имеет вариабельную область (VH), которую называют также вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следует три константных домена (CH1, СН2 и СН3). Аналогично этому, начиная с N-конца к С-концу, каждая легкая цепь имеет вариабельную область (VL), которую называют также вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL). Легкая цепь антитела может принадлежать к одному из двух типов, называемых каппа (κ) и лямбда (λ), в зависимости от аминокислотной последовательности ее константного домена.
«Полноразмерное антитело» представляет собой антитело, содержащее VL-и VH-домен, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи CH1, СН2 и СН3. Константные домены могут представлять собой имеющие нативную последовательность константные домены (например, константные домены, имеющие человеческую нативную последовательность) или вариант их аминокислотной последовательности. Полноразмерное антитело может обладать одной или несколькими «эффекторными функциями», т.е. видами биологической активности, связанными с Fc константной области (нативная последовательность Fc-области или вариант аминокислотной последовательности Fc-области) антитела. Примеры эффекторных функций антитела включают связывание C1q; комплементзависимую цитотоксичность; связывании Fc-рецептора; антитело-обусловленную клеточнозависимую цитотоксичность (ADCC); фагоцитоз и понижающую регуляция рецепторов клеточной поверхности, например, В-клеточного рецептора и BCR.
Понятие «гаптен» означает небольшую молекулу, которая может вызывать иммунный ответ только, если они присоединена к крупному носителю, такому как белок. Примерами гаптенов являются анилин, о-, м- и n-аминобензойная кислота, хинон, гистамин-сукцинил-глицин (HSG), гидралазин, галотан, индий-DTPA (диэтилентриаминпентаацетиловая кислота), флуоресцеин, биотин, дигоксигенин, теофиллин и динитрофенол. В одном из вариантов осуществления изобретения гаптен представляет собой дигоксигенин или теофиллин, или карборан.
Понятие «гаптен, который конъюгирован с» или «гаптенилированное соединение» относится к гаптену, ковалентно связанному с другим фрагментом, таким как полипептид или метка. Активированные производные гаптенов часто применяют в качестве исходных продуктов для получения указанных конъюгатов. В одном из вариантов осуществления изобретения гаптен представляет собой дигоксигенин, и он конъюгирован (в одном из вариантов осуществления изобретения через его 3-гидроксигруппу) с фрагментом через линкер. В одном из вариантов осуществления изобретения линкер содержит а) один или несколько (в одном из вариантов осуществления изобретения три-шесть) метиленкарбоксиметильных групп (-СН2-С(O)-), и/или б) от 1 до 10 (в одном из вариантов осуществления изобретения от 1 до 5) аминокислотных остатков (в одном из вариантов осуществления изобретения выбранных из глицина, серина, глутамата, β-аланина, γ-аминомасляной кислоты, ε-аминокаприновой кислоты или лизина), и/или в) одно или несколько (в одном из вариантов осуществления изобретения один или два) соединений, имеющих структурную формулу NH2-[(CH2)nO]xCH2-CH2-COOH, в которой п обозначает 2 или 3 и х обозначает 1-10, в одном из вариантов осуществления изобретения 1-7. Последний элемент позволяет получать (по меньшей мере частично) линкер (его часть) формулы -NH-[(CH2)nO]xCH2-CH2-C(O)-. Одним из примеров указанного соединения является, например, 12-амино-4,7,10-триоксадодекановая кислота (позволяющая получать TEG- (триэтиленгликольный) линкер). В одном из вариантов осуществления изобретения линкер содержит также малеимидогруппу. Линкер обладает стабилизирующим и солюбилизирующим действием, поскольку он содержит заряды и/или может образовывать водородные мостики. Кроме того, он может стерически облегчать связывание антигаптенового антитела с конъюгированным с гаптеном полипептидом. В одном из вариантов осуществления изобретения линкер локализован на боковой цепи аминокислоты полипептида (например, конъюгирован с боковой цепью лизина или цистеина через аминогруппу или тиольную группу). В одном из вариантов осуществления изобретения линкер локализован на аминоконце или на карбоксиконце полипептида. Положение линкера на полипептиде, как правило, выбирают в области, которая не влияет на биологическую активность полипептида. Таким образом, место присоединения линкера зависит от природы полипептида и соответствующих структурных элементов, которые ответственны за биологическую активность. Биологическую активность полипептида, к которому присоединен гаптен, можно тестировать с помощью анализа in vitro.
Понятия «клетка-хозяин», «клеточная линия-хозяин» и «клеточная культура-хозяин» используются взаимозаменяемо, и они относятся к клеткам, в которые интродуцирована экзогенная нуклеиновая кислота, включая потомство указанных клеток. К клеткам-хозяевам относятся «трансформанты» и «трансформированные клетки», которые включают первично трансформированную клетку и полученное из нее потомство безотносительно к количеству пересевов. Потомство может не быть полностью идентичным по составу нуклеиновых кислот родительской клетке, но может содержать мутации. Под объем изобретения подпадает мутантное потомство, которое обладает такой же функцией или биологической активностью, которая обнаружена в результате скрининга или отобрана у исходной трансформированной клетки.
«Человеческое антитело» представляет собой антитело, которое имеет аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого человеком или человеческой клеткой, или выведенную из источника, отличного от человека, с использованием спектра человеческих антител или других кодирующих человеческое антитело последовательностей. Указанное определение человеческого антитела специально исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
Понятие «гуманизированное» антитело относится к химерному антителу, которое содержит аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых вариантах осуществления изобретения гуманизированное антитело может содержать практически все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или практически все HVR (например, CDR) соответствуют участкам нечеловеческого антитела, а все или практически все FR соответствуют участкам человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, выведенной из человеческого антитела. Понятие «гуманизированная форма» антитела, например, нечеловеческого антитела, относится к антителу, которое подвергали гуманизации.
Понятие «гипервариабельный участок» или «HVR» в контексте настоящего описания относится к каждому из участков вариабельного домена антитела, последовательности которых являются гипервариабельными («определяющие комплементарность участки» или «CDR») и/или формируют петли определенной структуры («гипервариабельные петли»), и/или содержат контактирующие с антигеном остатки («контакты с антигеном»). Как правило, антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3).
В контексте настоящего описания HVR включают
(а) гипервариабельные петли, включающие аминокислотные остатки 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia С. и Lesk A.M., J. Mol. Biol. 196, 1987, cc. 901-917);
(б) CDR, включающие аминокислотные остатки 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (H2) и 95-102 (Н3) (Kabat E.A. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Рublic Health Service, National Institutes of Health, Bethesda, MD, 1991, публикация NIH 91-3242);
(в) области контакта с антигеном, включающие аминокислотные остатки 27с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum и др., J. Mol. Biol. 262, 1996, cc. 732-745); и
(г) комбинации остатков, указанных в подпунктах (а), (б) и/или (в), включающие аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (Н2), 93-102 (Н3) и 94-102 (Н3).
«Индивидуум» или «субъект» представляет собой млекопитающее. К млекопитающим относятся (но, не ограничиваясь только ими) одомашненные животные (например, коровы, овцы, кошки, собаки и лошади), приматы (например, люди и приматы кроме человека, например, обезьяны), кролики и грызуны (например, мыши и крысы). В некоторых вариантах осуществления изобретения индивидуум или субъект представляет собой человека.
«Выделенное» антитело представляет собой антитело, которое отделено от компонента его естественного окружения. В некоторых вариантах осуществления изобретения антитело очищают до чистоты, превышающей 95% или 99% по данным, например, электрофоретических (например, ДСН-ПААГ, изоэлектрическое фокусирование (ИЭФ), капиллярный электрофорез) или хроматографических анализов (например, ионообменной хроматографии или ЖХВР с обращенной фазой). Обзор методов оценки чистоты антител см., например, у Flatman S. и др., J. Chrom. В 848, 2007, с. 79-87.
«Выделенная» нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, которая отделена от компонента ее естественного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетке, которая в норме включает молекулу нуклеиновой кислоты, но в которой молекула нуклеиновой кислоты присутствует вне хромосомы или в которой ее локализация на хромосоме отличается от ее встречающейся в естественных условиях локализации на хромосоме.
В контексте настоящего описании понятие «моноклональное антитело» относится к антителу, полученному из популяции практически гомогенных антител, т.е., из популяции антител, которые являются идентичными и/или связываются с одним и тем же эпитопом за исключением возможных вариантов, которые могут возникать при получении моноклонального антитела, такие варианты, как правило, присутствуют в небольших количествах. В отличие от препаратов поликлональных антител, которые включают различные антитела к различным детерминантам (эпитопам), мишенью каждого моноклонального антитела является одна детерминанта антигена. Таким образом, прилагательное «моноклональный» указывает на тот отличительный признак, что антитело получено из практически гомогенной популяции антител, и оно не подразумевает требования, что антитело должно быть получено каким-либо конкретным методом. Например, моноклональные антитела, предназначенные для применения согласно настоящему изобретению, можно создавать с помощью различных методов, включая (но, не ограничиваясь только ими) метод гибридом, методы рекомбинантной ДНК, методы фагового дисплея ДНК и методы, основанные на применении трансгенных животных, которые содержат все или часть локусов человеческих иммуноглобулинов, указанные методы и другие, приведенные в качестве примеров методы получения моноклональных антител, представлены ниже в настоящем описании.
Понятие «моноспецифическое антитело» относится к антителу, которое имеет один или несколько сайтов связывания, каждый из которых имеет одинаковую связывающую специфичность, т.е. связывается с одним и тем же антигеном или гаптеном.
Понятие «оголенное антитело» относится к антителу, которое не конъюгировано с гетерологичным фрагментом (например, цитотоксическим фрагментом) или радиоактивной меткой. Оголенное антитело может присутствовать в фармацевтической композиции.
Понятие «листовка-вкладыш в упаковке» относится к инструкциям, которые обычно входят в поступающие в продажу упаковки терапевтических продуктов, содержащим информацию о показаниях, применении, дозе, пути введения, комбинированной терапии, противопоказаниях и/или мерах предосторожности, которые связаны с применением указанных терапевтических продуктов.
«Родительское антитело» представляет собой антитело, содержащее аминокислотную последовательность, в которой один или несколько аминокислотных остатков заменены на один или несколько остатков цистеина. Родительское антитело может содержать нативную последовательность или последовательность дикого типа. Родительское антитело может иметь ранее существующие модификации аминокислотной последовательности (такие как добавления, делеции и/или замены) относительно других нативных, дикого типа или модифицированных форм антитела. Родительское антитело специфически связывается с гаптеном. Родительское антитело может быть дополнительно направлено также против представляющего интерес антигена-мишени, например, биологически важного полипептида. Под определение подпадают также антитела против неполипептидных антигенов.
Понятие «полезный груз» относится к любой молекуле или комбинации молекул, активность которых требуется вводить в клетку и/или локализовать в клетке. «Полезный груз» включает (но, не ограничиваясь только ими) метки, цитотоксины (например, экзотоксин Pseudomonas, рицин, абрин, дифтерийный токсин и т.п.), ферменты, факторы роста, факторы транскрипции, лекарственные средства, радионуклиды, лиганды, антитела, липосомы, наночастицы, вирусные частицы, цитокины и т.п.
«Химиотерапевтическое средство» представляет собой химическое соединение, которое можно применять для лечения рака. Примерами химиотерапевтических средств являются алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, такие как алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеланин; азотные аналоги горчичного газа, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфанид, урациловый аналог горчичного газа; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубинцин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-ФУ; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренальные средства, такие как аминоглутетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиния ацетат; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK®; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Аrа-С»); циклофосфамид; тиопета; таксаны, например, паклитаксел (TAXOL™, фирма Bristol-Myers Squibb Oncology, Принстон, шт. Нью-Джерси) и доцетаксел (TAXOTERE®, фирма Rhone-Poulenc Rorer, Антони, Франция); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин: винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ-II; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноевая кислота; эсперамицины; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше агентов. Также под определение подпадают антигормональные средства, действие которых направлено на регулирование или ингибирование гормонального воздействия на опухоли, такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (фарестон); и антианрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и госерелин и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше агентов.
«Антиангиогенное средство» представляет собой соединение, которое блокирует или оказывает определенное интерферирующее воздействие на развитие кровеносных сосудов. Антиангиогенный фактор может представлять собой, например, низкомолекулярное соединение или антитело, которое связывается с фактором роста или рецептором фактора роста, участвующим в ускорении ангиогенеза. В одном из вариантов осуществления изобретения антиангиогенным фактором является антитело, которое связывается с сосудистым эндотелиальным фактором роста (VEGF).
Понятие «цитокин» является родовым названием белков, которые высвобождаются одной клеточной популяцией и оказывают воздействие на другую клетку в качестве межклеточных медиаторов. Примерами указанных цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. К цитокинам относятся такие ростовые гормоны, как человеческий гормон роста, N-метионилированный человеческий гормон роста и бычий гормон роста, гормон паращитовидных желез, тироксин, инсулин, проинсулин, релаксин; прорелаксин, гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (ФСГ), тиреотропный гормон (ТТГ) и лютеинизирующий гормон (ЛГ), гепатоцитарный фактор роста; фактор роста фибробластов, пролактин, плацентарный лактоген, фактор некроза опухолей α и β, ингибирующее вещество Мюллера, мышиный гонадотропинассоциированный пептид, ингибин; активин, сосудистый эндотелиальный фактор роста, интегрин, тромбопоэтин (ТРО), факторы роста нервов, такие как NGF-β, тромбоцитарный фактор роста; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β, инсулиноподобный фактор роста-I и -II, эритропоэтин (ЕРО), остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ, колониестимулирующие факторы (CSF), такие как CSF макрофагов (M-CSF), CSF гранулоцитов-микрофагов (GM-CSF) и CSF гранулоцитов (G-CSF), интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, фактор некроза опухолей, такой как TNF-α или TNF-β, и другие полипептидные факторы, включая LIF (фактор, ингибирующий миграцию лейкоцитов) и набор лигандов (KL). В контексте настоящего описания понятие «цитокин» относится к белкам, выведенным из встречающихся в естественных условиях источников или из рекомбинантной клеточной культуры, и к биологически активным эквивалентам нативных последовательностей цитокинов.
Понятие «fMLP» означает трипептид, состоящий из N-формилметионина, лейцина и фенилаланина. В одном из вариантов осуществления изобретения эффекторный фрагмент представляет собой fMLP или его производное.
Понятие «пролекарство» относится к форме, представляющей собой предшественник или производное фармацевтически активной субстанции, которая является менее токсичной для опухолевых клеток по сравнению с исходным лекарственным средством и может ферментативно активироваться или превращаться в более активную лекарственную форму (см., например, Wilman, «Prodrugs in Cancer Chemotherapy», Biochemical Society Transactions, т. 14, 615-ая конференция в Белфасте (Meeting Belfast), 1986, cc. 375-382 и Stella и др., «Prodrugs: A Chemical Approach to Targeted Drug Delivery)), Directed Drug Delivery, под ред. Borchardt и др., изд-во Humana Press, 1985, cc.247-267). Пролекарства, которые можно применять в качестве эффекторного фрагмента, включают (но, не ограничиваясь только ими) фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, модифицированные D-аминокислотой пролекарства, гликозилированные пролекарства, b-лактамсодержащие пролекарства, содержащие необязательно замещенный феноксиацетамид или содержащие необязательно замещенный фенилацетамид пролекарства, содержащие 5-фторцитозин и другие 5-фторуридиновые пролекарства, пролекарства, которые можно превращать в более активное свободное цитотоксическое лекарственное средство. Примеры цитотоксических лекарственных средств, которые можно дериватизировать с получением пролекарственной формы, предназначенной для применения в настоящем изобретении, включают (но, не ограничиваясь только ими) указанные в настоящем описании химиотерапевтические средства.
Понятие «цитотоксический фрагмент» в контексте настоящего описания относится к субстанции, которая ингибирует или предотвращает функцию клеток и/или вызывает гибель или разрушение клеток. Цитотоксические агенты включают (но, не ограничиваясь только ими) радиоактивные изотопы (например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 212Pb и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); ингибирующие рост агенты; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или обладающие ферментативной активностью токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты; и различные противоопухолевые или противораковые средства, указанные в настоящем описании.
«Процент (%) идентичности аминокислотной последовательности» относительно полипептидной референс-последовательности определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в полипептидной референс-последовательности, после выравнивая последовательностей и при необходимости интродукции брешей для достижения максимального процента идентичности последовательностей, и не рассматривая какие-либо консервативные замены в качестве компонента при оценке идентичности последовательностей. Сравнительный анализ для целей определения процента идентичности аминокислотных последовательностей можно осуществлять различными путями, известными в данной области, используя, например, публично доступные компьютерные программы, такие как программа BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения величины % идентичности аминокислотных последовательностей получают, используя компьютерную программу для сравнения последовательностей ALIGN-2. Авторство компьютерной программы для сравнения последовательностей ALIGN-2 принадлежит фирме Genentech, Inc., и исходный код был подан в комплексе с документацией для пользователей в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован как U.S. Copyright Registration № TXU510087. Программа ALIGN-2 публично доступна от фирмы Genentech, Inc., Южный Сан-Франциско, шт. Калифорния, или ее можно компилировать на основе исходного кода. Программу ALIGN-2 можно компилировать для применения в операционной системе UNIX, включая цифровую систему UNIX V4.0D. Все параметры, требуемые для сравнения последовательностей, устанавливаются программой ALIGN-2 и не должны изменяться.
В ситуациях, в которых ALIGN-2 применяют для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей данной аминокислотной последовательности А по сравнению, с или относительно данной аминокислотной последовательности Б (что в альтернативном варианте можно обозначать как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности по сравнению, с или относительно данной аминокислотной последовательности Б), рассчитывают следующим образом:
100 × дробь X/Y,
где X обозначает количество аминокислотных остатков, определенных как идентичные совпадения при оценке с помощью программы для сравнительного анализа последовательностей ALIGN-2, где с помощью программы осуществляли сравнение А и Б, и где Y обозначает общее количество аминокислотных остатков в Б. Должно быть очевидно, что, если длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, то % идентичности аминокислотных последовательностей А относительно Б не может быть равен % идентичности аминокислотной последовательности Б относительно А. Если специально не указано иное, то все величины % идентичности аминокислотных последовательностей, указанные в настоящем описании, получали с использованием описанной в предыдущем параграфе компьютерной программы ALIGN-2.
Понятие «фармацевтическая композиция» относится к препарату, который находится в такой форме, которая обеспечивает эффективное проявление биологической активности действующего вещества и которая не содержит дополнительных компонентов, которые обладают неприемлемой токсичностью для субъекта, которому требуется вводить композицию.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от действующего вещества, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает (но, не ограничиваясь только ими) буфер, эксципиент, стабилизатор или консервант.
«Полипептид» представляет собой полимер, состоящий из аминокислот, сцепленных пептидными связями, который либо образуется в естественных условиях, либо получают путем синтеза. Полипептиды, состоящие менее чем примерно из 20 аминокислотных остатков, можно обозначать как «пептиды», а молекулы, состоящие из двух или большего количества полипептидов или состоящие из одного полипептида, который содержит более 100 аминокислотных остатков, можно обозначать как «белки». Полипептид может содержать также компоненты, отличные от аминокислот, такие как углеводные группы, ионы металлов или эфиры карбоновых кислот. Компоненты, отличные от аминокислот, могут добавляться клеткой, в которой полипептид экспрессируется, и они могут варьироваться в зависимости от типа клетки. Полипептиды в контексте настоящего описания обозначают в понятиях структуры их аминокислотного каркаса или нуклеиновой кислоты, кодирующей их. Добавления указанных углеводных групп, как правило, не конкретизируют, но, тем не менее, они могут присутствовать.
Все полипептидные последовательности записывают согласно общепринятому порядку, при котором остаток альфа-N-концевой аминокислоты находится слева, а остаток альфа-С-концевой аминокислоты находится справа. В контексте настоящего описании понятие «N-конец» относится к свободной альфа-аминогруппе аминокислоты в полипептиде, а понятие «С-конец» относится к свободному концу альфа-карбоновой кислоты аминокислоты в полипептиде. Полипептид с N-концевой группой означает полипептид, несущий группу на атому азота альфа-аминогруппы N-концевого аминокислотного остатка. Аминокислота с N-концевой группой означает аминокислоту, несущую группу на атоме азота альфа-аминогруппы.
Если не используется специальное обозначение с помощью префикса «D», например, D-Ala или N-Me-D-Ile, или при использовании записи строчными буквами, например, a, i, 1, (D-версии Ala, Ilе, Leu), то стереохимия альфа-углерода аминокислот и аминоацильных остатков в полипептидах, представленных в настоящем описании и прилагаемой формуле изобретения, является встречающейся в естественных условиях или «Е»-конфигурацией. Согласно правилу Канна-Ингольда-Прелога обозначения «R» и «S» применяют для описания стереохимии хиральных центров в определенных ацильных заместителях на N-конце полипептидов. Подразумевается, что «R,S» обозначает рацемическую смесь двух энантиомерных форм. Указанная номенклатура соответствует описанной у Cahn R.S. и др., Angew. Chem. Int. Ed. Engl. 5, 1966, cc. 385-415.
Понятие «одноцепочечный Fv», сокращенно «scFv» означает фрагмент антитела, который содержит VH- и VL-домены антитела, при этом указанные домены присутствуют в одной полипептидной цепи. В одном из вариантов осуществления изобретения Fv-полипептид дополнительно содержит полипептидный линкер между VH- и VL-доменами, который обеспечивает способность scFv образовывать структуру, требуемую для связывания антигена (см. обзор у Plueckthun в The Pharmacology of Monoclonal Antibodies, под ред. Rosenburg и Moore, изд-во Springer-Verlag, New York, т. 113, 1994, cc. 269-315).
Понятие «теофиллин», сокращенно «ТНЕО», означает 1,3-диметил-7Н-пурин-2,6-дион. Теофиллин называют также диметилксантином.
В контексте настоящего описания понятие «лечение» (и его грамматические вариации, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного процесса у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики, либо в процессе развития клинической патологии. Требуемые результаты лечения включают (но, не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, снижение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или ослабление состояния болезни и ремиссию или улучшение прогноза. В некоторых вариантах осуществления изобретения антитела, предлагаемые в изобретении, применяют для задержки развития болезни или для замедления развития болезни.
Понятие «х-валентный», например, «одновалентный» или «двухвалентный», или «трехвалентный», или «четырехвалентный» относится к присутствию конкретного количества сайтов связывания, т.е. «х», в молекуле антитела. Так понятия «двухвалентный», «четырехвалентный» и «шестивалентный» означает присутствии двух сайтов связывания, четырех сайтов связывания и шести сайтов связывания соответственно в молекуле антитела. Указанные в настоящем описании биспецифические антитела являются по меньшей мере «двухвалентными» и могут быть «трехвалентными» или «мультивалентными» (например, «четырехвалентными» или «шестивалентными»). В одном из вариантов осуществления изобретения биспецифическое антитело, указанное в настоящем описании, является двухвалентным, трехвалентным или четырехвалентным. В одном из вариантов осуществления изобретения биспецифическое антитело является двухвалентным. В одном из вариантов осуществления изобретения биспецифическое антитело является трехвалентным. В одном из вариантов осуществления изобретения биспецифическое антитело является четырехвалентным.
В некоторых объектах и вариантах осуществления изобретения антитела, указанные в настоящем описании, имеют два или большее количество сайтов связывания и являются биспецифическими. Это означает, что антитела могут быть биспецифическими даже в случаях, когда они имеют больше двух сайтов связывания (т.е. указанное антитело является трехвалентным или мультивалентным). Под понятие биспецифические антитела подпадают, например, мультивалентные одноцепочечные антитела, диабоди (димерные антитела) и триабоди (тримерные антитела), а также антитела, которые имеют структуру константного домена полноразмерных антител, с которой через один или несколько пептидных линкеров связаны дополнительные антигеневязывающие центры (например, одноцепочечный Fv, VH-домен и/или VL-домен, Fab или (Fab)2). Антитела могут представлять собой полноразмерные антитела из одного вида или могут представлять собой химерные или гуманизированные антитела. В антителе с более чем двумя антигенсвязывающими центрами некоторые сайты связывания могут быть идентичными, если белок имеет сайты связывания для двух различных антигенов. Это означает, что, если первый сайт связывания является специфическим для гаптена, то второй сайт связывания является специфическим для антигена, не представляющего собой гаптен, и наоборот.
Понятие «вариабельная область» относится к домену тяжелой или легкой цепи антитела, который принимает участие в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела, как правило, имеют сходные структуры, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельные области (HVR) (см., например, Kindt T.J. и др., Kuby Immunology, 6-ое изд., изд-во W.H. Freeman и Co., N.Y. 2007, с 91). Индивидуального VH- или VL-домена может быть достаточно для обеспечения специфического связывания с антигеном. Кроме того, антитела, которые связываются с конкретным антигеном, можно выделять, используя VH- или VL-домен из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов соответственно (см., например, Portolano S. и др., J. Immunol. 150, 1993, cc. 880-887; Clackson Т. и др., Nature 352, 1991, cc. 624-628).
Понятие «вектор» в контексте настоящего описания относится к молекуле нуклеиновой кислоты, которая может обеспечивать воспроизводство другой нуклеиновой кислоты, с которой она связана. Под указанное понятие подпадает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую он интродуцирован. Некоторые векторы обладают способностью оказывать направленное воздействие на экспрессию нуклеиновых кислот, с которыми они функционально связаны. Указанные векторы в контексте настоящего описания обозначают как «экспрессионные векторы».
II. Конъюгаты, представленные в настоящем описании
Один из объектов изобретения базируется на открытии того факта, что ковалентный конъюгат, содержащий антиген и антитело, которое специфически связывается с антигеном, можно получать путем образования ковалентной связи между соответствующим образом (правильно) расположенной функциональной группой в антигене и аминокислотным остатком, содержащим функциональную группу, в вариабельном домене антитела, прежде всего в CDR2 антитела, где CDR2 определяют согласно нумерации вариабельного домена тяжелой цепи по Кэботу.
В некоторых вариантах осуществления изобретения антиген представляет собой гаптен. В одном из вариантов осуществления изобретения гаптен представляет собой биотин или дигоксигенин, или флуоресцеин, или теофиллин, или карборан.
В одном из вариантов осуществления изобретения антиген представляет собой гаптенилированное соединение. В одном из вариантов осуществления изобретения гаптенилированное соединение представляет собой конъюгат, содержащий гаптен, линкер и «полезный груз». В одном из вариантов осуществления изобретения гаптен представляет собой биотин или дигоксигенин, или флуоресцеин, или теофиллин, или карборан.
В некоторых вариантах осуществления изобретения функциональная группа может содержать электронодефицитные двойные связи или тиол. В одном из вариантов осуществления изобретения функциональная группа представляет собой малеимид или цистеин.
Некоторыми объектами изобретения являются антитела, которые специфически связываются с дигоксигенином.
Некоторыми объектами изобретения являются антитела, которые специфически связываются с биотином.
Некоторыми объектами изобретения являются антитела, которые специфически связываются с теофиллином.
Поскольку конъюгаты, представленные в настоящем описании, можно применять в качестве терапевтического средства, предназначенного для людей, то в изобретении предложены также гуманизированные варианты указанных выше антител к дигоксигенину, биотину и теофиллину.
Ковалентные конъюгаты, содержащие конъюгат гаптен-полипептид (гаптенилированное соединение) и антитело к гаптену, могут обеспечивать благоприятное биофизическое поведение и улучшенные ФК-свойства полипептида. Кроме того, в случае применения биспецифического антитела конъюгаты можно использовать для направленного переноса полипептида в клетки, которые экспонируют антиген, распознаваемый второй связывающей специфичностью биспецифического антитела. Указанные конъюгаты состоят из одной антигаптеновой связывающей специфичности и одной (негаптеновой) антигенсвязывающей специфичности. Стехиометрическое соотношение антитела и конъюгата гаптен-полипептид зависит от формата биспецифического антитела и может составлять 1:1, 1:2, 2:1, 2:2, 2:4 и 4:2 (антитело:гаптен-полипептид).
Требуется, чтобы полипептид сохранял высокую биологическую активность, несмотря на конъюгацию с гаптеном, а также конъюгацию с антителом. Требуется также (в случае биспецифических обеспечивающих направленный перенос модулей), чтобы специфический для клеточной поверхности-мишени сайт связывания биспецифического антитела сохранял специфичность связывания и аффинность в присутствии ковалентно конъюгированного гаптенилированного соединения.
Реакционноспособная группа в антигене (гаптен) может представлять собой любую реакционноспособную группу, такую, например, как малеимид, например, N-этилмалеимид (NEM), йодацетамид, пиридилдисульфид или другой реакционноспособный партнер по конъюгации (см., например, Haugland, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, изд-во Molecular Probes, Inc., 2003; Brinkley, Bioconjugate Chem. 3, 1992, c. 2; Garman, Non-Radioactive Labeling: A Practical Approach, изд-во Academic Press, London, 1997; Means, Bioconjugate Chem. 1, 1990, c. 2; Hermanson G. в: Bioconjugate Techniques, изд-во Academic Press, San Diego, 1996, cc. 40-55 и cc. 643-671).
Реакционноспособная группа антитела ограничена группами, которые могут образовываться избирательно, т.е. специфически в отношении положения. Таким образом, она ограничена группами боковых цепей аминокислотных остатков цистеина, серина, аспарагина, глутамина, тирозина, лизина, аргинина, аспарагиновой кислоты и глутаминовой кислоты.
Для образования ковалентного конъюгата между антителом и антигеном/гаптеном оба соединения должны быть модифицированы путем интродукции реакционноспособной группы. При связывании антигена /гаптена антителом две реакционноспособные группы оказываются в тесной близости, что позволяет образовываться ковалентной связи. В одном из вариантов осуществления изобретения модификация представляет собой интродукцию тиольной функциональности в каждое из соединений. В одном из вариантов осуществления изобретения тиольное производное представляет собой остаток цистеина.
Положение, подлежащее мутации, должно одновременно удовлетворять двум требованиям: (I) положение, в которых происходит сочетание, должно находиться вблизи области связывания для использования позиционного эффекта антигена/гаптена для непосредственного сочетания, и (II) мутация и положение, в котором имеет место сочетание, должны быть расположены так, чтобы на них не влияло само связывание антигена/гаптена. Эти требования, связанные с поиском приемлемого положения, фактически «противоречат» друг другу, поскольку требование (I) наилучшим образом соблюдается, если положение находится вблизи сайта связывания, а требование (II) наиболее хорошо достигается в случае положений, удаленных от сайта связывания.
Несмотря на эти фактически исключающие друг друга требования, идентифицировали положения, которые можно изменять путем мутации без влияния на позиционирование гаптена, и которые, тем не менее, одновременно позволяют осуществлять непосредственное ковалентное сочетание.
Первое положение локализовано в положении VH52b или в положении VH53 соответственно согласно нумерации вариабельного домена тяжелой цепи по Кэботу. Если антитело имеет короткий CDR2 VH, который не включает промежуточные остатки, такие как 52а, 52с, 52с и 52d, то положение представляет собой 53 (нумерация и сравнительный анализ согласно системе нумерации и правилам Кэбота для вариабельного домена тяжелой цепи антитела). Если антитело имеет длинный CDR2 VH, содержащий остатки 52а и 52b и необязательно дополнительные остатки, такие как 52с и 52d и т.д., то положение представляет собой 52b (нумерация и сравнительный анализ согласно системе нумерации и правилам Кэбота для вариабельного домена тяжелой цепи антитела).
Второе положение локализовано в положении VH28 согласно нумерации по Кэботу.
Например, в структуре антитела к дигоксигенину гаптен связывается в глубоком кармане, образованном гидрофобными остатками. В указанном кристаллографическом анализе применяли флуоресцентный конъюгат дигоксигенин-Су5, в котором флуорофор, а также линкер между дигоксигенином и Су5, не были видны в структуре из-за высокой гибкости и являющегося результатом этого нарушения в кристалле. Однако линкер и Су5 присоединяли к O32 дигоксигенина, которое указывает на направление к CDR2 тяжелой цепи. Расстояние между 032 дигоксигенина и Сα аминокислотного остатка в положении 52b согласно Кэботу составляет примерно 10,5 Å.
Было установлено, что эти положения представляют собой «универсальное» положение, т.е. положение, приемлемое для любого (антигаптенового) антитела и, таким образом, не требуется начинать каждый раз с исследования нового (антигаптенового) антитела, подлежащего модификации, путем получения кристаллической структуры и определения соответствующего положения, в котором может происходить ковалентное сочетание, связанное с положением гаптена.
Неожиданного установлено, что мутацию VH52bC или VH53C соответственно согласно системе нумерации по Кэботу можно применять для каждого анализируемого гаптенсвязывающего антитела. Даже несмотря на то, что антитела и структуры их связывающих карманов весьма разнообразны, было установлено, что мутацию VH52bC/VH53C можно применять для ковалентного присоединения антигенов/гаптенов к антителам, которые связывают дигоксигенин, биотин, флуоресцеин, а также теофиллин. Таким образом, установлено также, что изменение аминокислотного остатка в положении VH52b/VH53 согласно нумерации по Кэботу, где указанный остаток находится внутри CDR2 тяжелой цепи антитела, на цистеин является приемлемым для других (антигаптеновых) антител, при этом не требуются дополнительно создание структуры или наличие сведений о специфических структурах антител и не имеет место воздействие на способности к связыванию, которые присущи вариабельным доменам антитела.
Антитела, модифицированные согласно методам, представленным в настоящем описании, сохраняют способность к связыванию с гаптеном (антигеном), свойственную их родительским копиям (т.е. антителу дикого типа). Таким образом, сконструированное антитело обладает способностью к связыванию, в одном из вариантов осуществления изобретения способностью к специфическому связыванию, с гаптенами (антигенами).
Понятие «связывающая специфичность» или «антитело, которое связывается с» означает, что молекула, содержащая связывающую специфичность, или антитело, может образовывать комплекс с другой молекулой специфическим образом. Связывание можно выявлять с помощью анализа in vitro, такого как анализ плазмонного резонанса (устройство BIAcore, фирма GE-Healthcare, Уппсала, Швеция). Аффинность комплексообразования оценивают в понятиях kа (константа скорости ассоциации соединений, образующих комплекс), kD (константа диссоциации, диссоциация комплекса) и КD (kD/kа). Связывание или специфическое связывание означает аффинность связывания (КD), составляющую примерно 10-8 М или менее, в одном из вариантов осуществления изобретения от примерно 10-8 до примерно 10-13 М, в одном из вариантов осуществления изобретения от примерно 10-9 до примерно 10-13 М. Таким образом, антитело, которое связывается с гаптеном с образованием комплекса, указанного в настоящем описании, специфически связывается с гаптеном с аффинностью связывания (KD), составляющей примерно 10-8 моля/л или менее, в одном из вариантов осуществления изобретения от примерно 10-8 до примерно 10-13 моля/л, в одном из вариантов осуществления изобретения примерно от 10-9 до 10-13 моля/л.
Установлено, что образование ковалентной связи между модифицированным цистеином антителом и модифицированным цистеином конъюгатом гаптен-полипептид, который несет остаток цистеина в линкере между гаптеном и полипептидом, имеет место при связывании антитела с гаптеном без потребности в дополнительных восстановителях и/или окислителях, если образовавшаяся связь представляет собой дисульфидную связь. Таким образом, дисульфидный мостик между двумя соединениями образуется спонтанно при образовании нековалентного комплекса. Таким образом, для осуществления способа образования ковалентного комплекса, представленного в настоящем описании, требуется просто смешать два соединения. Единственным необходимым условием для образования дисульфидной связи является правильная ориентация двух соединений относительно друг друга.
Сконструированные антитела, представленные в настоящем описании, могут быть сайт-специфическими и эффективно сочетаться с гаптеном, содержащим реакционноспособную группу.
Замена аминокислотного остатка в положении VH52b и VH53 соответственно (согласно системе нумерации по Кэботу) на остаток Cys приводила к получению производных антител, последовательности вариабельных областей тяжелых цепей которых представлены в SEQ ID NO: 20 и 28 для антитела к дигоксигенину-VН52bС, в SEQ ID NO: 84 и 92 для антитела к теофиллину-VH53C, в SEQ ID NO: 52 и 60 для антитела к биотину-УН53С, в SEQ ID NO: 108 для антитела к флуоресцеину-VН52bС.
Замена аминокислотного остатка в вариабельном домене тяжелой цепи в положении VH28 (согласно системе нумерации по Кэботу) на остаток Cys приводила к получению производных антител, последовательности вариабельных областей тяжелых цепей которых представлены в SEQ ID NO: 116, 124, 132, 140, 148, 156 и 164 соответственно.
Одним из объектов изобретения является антитело к дигоксигенину, представляющее собой гуманизированное антитело.
Одним из объектов изобретения является антитело к дигоксигенину, содержащее по меньшей мере один, два, три, четыре, пять или шесть CDR, выбранных из (a) CDR1 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 09 или 25, (б) CDR2 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 10 или 26, (в) CDR3 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 11 или 27, (г) CDR1 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 13 или 29, (д) CDR2 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 14 или 30, и (е) CDR3 легкой цепи, который содержит аминокислотную последовательность SEQ IDNO: 15 или 31.
Одним из объектов изобретения является антитело к биотину, представляющее собой гуманизированное антитело.
Одним из объектов изобретения является антитело к биотину, содержащее по меньшей мере один, два, три, четыре, пять или шесть CDR, выбранных из (а) CDR1 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 41 или 57, (б) CDR2 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 42 или 58, (в) CDR3 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 43 или 59, (г) CDR1 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 45 или 61, (д) CDR2 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 46 или 62, и (е) CDR3 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 47 или 64.
Одним из объектов изобретения является антитело к флуоресцеину, содержащее по меньшей мере один, два, три, четыре, пять или шесть CDR, выбранных из (a) CDR1 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 105 или 113, (б) CDR2 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 106 или 114, (в) CDR3 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 107 или 115, (г) CDR1 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 109 или 117, (д) CDR2 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 110 или 118, и (е) CDR3 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 111 или 119.
Одним из объектов изобретения является антитело к теофиллину. В одном из вариантов осуществления изобретения антитело к теофиллину представляет собой гуманизированное антитело.
Одним из вариантов осуществления изобретения является антитело к теофиллину, содержащее по меньшей мере один, два, три, четыре, пять или шесть CDR, выбранных из (a) CDR1 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 73 или 89, (б) CDR2 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 74 или 90, (в) CDR3 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 75 или 91, (г) CDR1 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 77 или 93, (д) CDR2 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 78 или 94, и (е) CDR3 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 79 или 95.
Одним из объектов изобретения является антитело к дигоксигенину, содержащее (а) VH-домен, который содержит по меньшей мере одну, по меньшей мере две или все три CDR-последовательности VH, выбранные из (I) CDR1 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 09 или 25, (II) CDR2 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 10 или 26, и (III) CDR3 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 11 или 27, и (б) VL-домен, который содержит по меньшей мере одну, по меньшей мере две или все три CDR-последовательности VL, выбранные из (I) CDR1 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 13 или 29, (И) CDR2 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 14 или 30, и (в) CDR3 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 15 или 31.
Одним из объектов изобретения является антитело к биотину, содержащее (a) VH-домен, который содержит по меньшей мере одну, по меньшей мере две или все три CDR-последовательности VH, выбранные из (I) CDR1 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 41 или 57, (II) CDR2 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 42 или 58, и (III) CDR3 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 43 или 59, и (б) VL-домен, который содержит по меньшей мере одну, по меньшей мере две или все три CDR-последовательности VL, выбранные из (I) CDR1 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 45 или 61, (II) CDR2 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 46 или 62, и (в) CDR3 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 47 или 63.
Одним из объектов изобретения является антитело к флуоресцеину, содержащее (а) VH-домен, который содержит по меньшей мере одну, по меньшей мере две или все три CDR-последовательности VH, выбранные из (I) CDR1 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 105 или 113, (II) CDR2 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 106 или 114, и (III) CDR3 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 107 или 115, и (б) VL-домен, который содержит по меньшей мере одну, по меньшей мере две или все три CDR-последовательности VL, выбранные из (I) CDR1 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 109 или 117, (И) CDR2 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 110 или 118, и (в) CDR3 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 111 или 119.
Одним из объектов изобретения является антитело к теофиллину, содержащее (а) VH-домен, который содержит по меньшей мере одну, по меньшей мере две или все три CDR-последовательности VH, выбранные из (I) CDR1 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 73 или 89, (II) CDR2 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 74 или 90, и (III) CDR3 тяжелой цепи, который содержит аминокислотную последовательность SEQ ID NO: 75 или 91, и (б) VL-домен, который содержит по меньшей мере одну, по меньшей мере две или все три CDR-последовательности VL, выбранные из (I) CDR1 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 77 или 93, (II) CDR2 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 78 или 94, и (в) CDR3 легкой цепи, который содержит аминокислотную последовательность SEQ ID NO: 79 или 95.
В одном из указанных выше объектов и вариантов осуществления изобретения антитело к дигоксигенину и/или антитело к биотину, и/или антитело к теофиллину является гуманизированным.
В одном из вариантов осуществления изобретения антитело к дигоксигенину содержит CDR, указанные в любом из представленных выше объектов и/или вариантов осуществления изобретения, и содержит также акцепторный человеческий каркасный участок, например, каркасный участок человеческого иммуноглобулина или человеческий консенсусный каркасный участок.
В одном из вариантов осуществления изобретения антитело к биотину содержит CDR, указанные в любом из представленных выше объектов и/или вариантов осуществления изобретения, и содержит также акцепторный человеческий каркасный участок, например, каркасный участок человеческого иммуноглобулина или человеческий консенсусный каркасный участок.
В одном из вариантов осуществления изобретения антитело к теофиллину содержит CDR, указанные в любом из представленных выше объектов и/или вариантов осуществления изобретения, и содержит также акцепторный человеческий каркасный участок, например, каркасный участок человеческого иммуноглобулина или человеческий консенсусный каркасный участок.
Другим объектом изобретения является антитело к дигоксигенину, которое содержит последовательность вариабельного домена тяжелой цепи (VH), идентичную по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 04 или 12, или 20, или 28. В некоторых вариантах осуществления изобретения VH-последовательность, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к дигоксигенину, содержащее указанную последовательность, сохраняет способность связываться с дигоксигенином. В некоторых вариантах осуществления изобретения в SEQ ID NO: 01 или 09, или 17, или 25 заменено, встроено путем инсерции и/или удалено путем делеции в целом от 1 до 10 аминокислот.В некоторых вариантах осуществления изобретения замены, инсерции или делеции имеют место вне CDR (т.е. в FR). Необязательно антитело к дигоксигенину содержит VH-последовательность, представленную в SEQ ID NO: 01 или 09, или 17, или 25, включая пост-трансляционные модификации указанной последовательности.
Другим объектом изобретения является антитело к дигоксигенину, которое содержит последовательность вариабельного домена легкой цепи (VL), идентичную по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 08 или 16, или 24, или 32. В некоторых вариантах осуществления изобретения VL-последовательность, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к дигоксигенину, содержащее указанную последовательность сохраняет способность связываться с дигоксигенином. В некоторых вариантах осуществления изобретения в SEQ ID NO: 08 или 16, или 24, или 32 заменено, встроено путем инсерции и/или удалено путем делеции в целом от 1 до 10 аминокислот.В некоторых вариантах осуществления изобретения замены, инсерции или делеции имеют место вне CDR (т.е. в FR). Необязательно антитело к дигоксигенину содержит VL-последовательность, представленную в SEQ ID NO: 08 или 16, или 24, или 32, включая пост-трансляционные модификации указанной последовательности.
Другим объектом изобретения является антитело к биотину, которое содержит последовательность вариабельного домена тяжелой цепи (VH), идентичную по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 36 или 44, или 52, или 60. В некоторых вариантах осуществления изобретения VH-последовательность, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к биотину, содержащее указанную последовательность сохраняет способность связываться с биотином. В некоторых вариантах осуществления изобретения в SEQ ID NO: 36 или 44, или 52, или 60 заменено, встроено путем инсерции и/или удалено путем делеции в целом от 1 до 10 аминокислот.В некоторых вариантах осуществления изобретения замены, инсерции или делеции имеют место вне CDR (т.е. в FR). Необязательно антитело к биотину содержит VH-последовательность, представленную в SEQ ID NO: 36 или 44, или 52, или 60, включая пост-трансляционные модификации указанной последовательности.
Другим объектом изобретения является антитело к флуоресцеину, которое содержит последовательность вариабельного домена тяжелой цепи (VH), идентичную по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 108 или 116. В некоторых вариантах осуществления изобретения VH-последовательность, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к флуоресцеину, содержащее указанную последовательность сохраняет способность связываться с флуоресцеином. В некоторых вариантах осуществления изобретения в SEQ ID NO: 108 или 116 заменено, встроено путем инсерции и/или удалено путем делеции в целом от 1 до 10 аминокислот.В некоторых вариантах осуществления изобретения замены, инсерции или делеции имеют место вне CDR (т.е. в FR). Необязательно антитело к флуоресцеину содержит VH-последовательность, представленную в SEQ ID NO: 108 или 116, включая пост-трансляционные модификации указанной последовательности.
Другим объектом изобретения является антитело к теофиллину, которое содержит последовательность вариабельного домена тяжелой цепи (VH), идентичную по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 68 или 76, или 84, или 92. В некоторых вариантах осуществления изобретения VH-последовательность, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к теофиллину, содержащее указанную последовательность сохраняет способность связываться с теофиллином. В некоторых вариантах осуществления изобретения в SEQ ID NO: 68 или 76, или 84, или 92 заменено, встроено путем инсерции и/или удалено путем делеции в целом от 1 до 10 аминокислот.В некоторых вариантах осуществления изобретения замены, инсерции или делеции имеют место вне CDR (т.е. в FR). Необязательно антитело к теофиллину содержит VH-последовательность, представленную в SEQ ID NO: 68 или 76, или 84, или 92, включая пост-трансляционные модификации указанной последовательности.
Другим объектом изобретения является антитело к дигоксигенину, где антитело содержит VH, представленный в любом из объектов и/или вариантов осуществления изобретения, указанных выше, и VL, представленный в любом из объектов и/или вариантов осуществления изобретения, указанных выше. В одном из вариантов осуществления изобретения антитело содержит последовательности VH и VL, представленные в SEQ ID NO: 04 или 12, или 20, или 28 и в SEQ ID NO: 08 или 16, или 24, или 32 соответственно, включая посттрансляционные модификации указанных последовательностей.
Другим объектом изобретения является антитело к биотину, где антитело содержит VH, представленный в любом из объектов и/или вариантов осуществления изобретения, указанных выше, и VL, представленный в любом из объектов и/или вариантов осуществления изобретения, указанных выше. В одном из вариантов осуществления изобретения антитело содержит последовательности VH и VL, представленные в SEQ ID NO: 36 или 44, или 52, или 60 и в SEQ ID NO: 40 или 48, или 56, или 64 соответственно, включая посттрансляционные модификации указанных последовательностей.
Другим объектом изобретения является антитело к флуоресцеину, где антитело содержит VH, представленный в любом из объектов и/или вариантов осуществления изобретения, указанных выше, и VL, представленный в любом из объектов и/или вариантов осуществления изобретения, указанных выше. В одном из вариантов осуществления изобретения антитело содержит последовательности VH и VL, представленные в SEQ ID NO: 108 или 116 и в SEQ ID NO: 112 или 120 соответственно, включая пост-трансляционные модификации указанных последовательностей.
Другим объектом изобретения является антитело к теофиллину, где антитело содержит VH, представленный в любом из объектов и/или вариантов осуществления изобретения, указанных выше, и VL, представленный в любом из объектов и/или вариантов осуществления изобретения, указанных выше. В одном из вариантов осуществления изобретения антитело содержит последовательности VH и VL, представленные в SEQ ID NO: 68 или 76, или 84, или 92 и в SEQ ID NO: 72 или 80, или 88, или 96 соответственно, включая посттрансляционные модификации указанных последовательностей.
Дополнительным положением, идентифицированным в качестве точки модификации, является положение VH28 согласно нумерации по Кэботу.
Замена аминокислоты в положении VH28 согласно нумерации по Кэботу на Cys приводит к созданию производных антител, последовательности вариабельных областей которых представлены в SEQ ID NO: 124 и 132 в случае антитела к дигоксигенину-VH28C, SEQ ID NO: 156 и 164 в случае антитела к теофиллину-УН28С, SEQ ID NO: 140 и 148 в случае антитела к биотину-VH28C и SEQ ID NO: 116 в случае антитела к флуоресцеину-VН28С.
ESI-MC-анализы продемонстрировали, что ковалентная конъюгация антитела с гаптенилированными терапевтическими пептидами приводит к получению конъюгата определенного размера, большего, чем размер не входящего в комплекс антитела или не входящего в комплекс пептида.
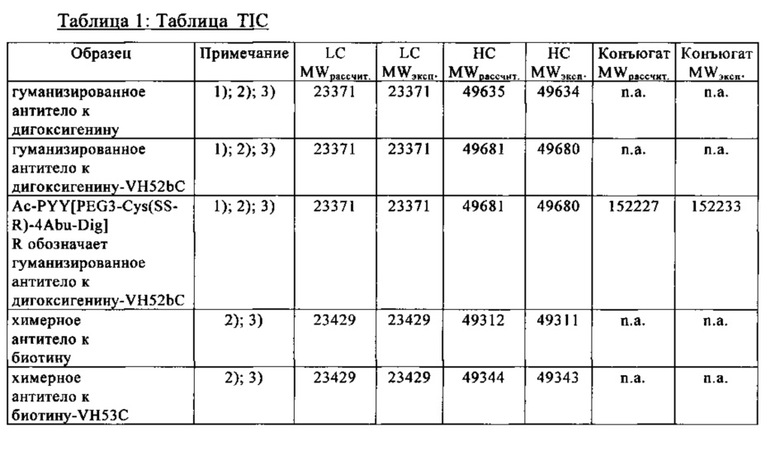
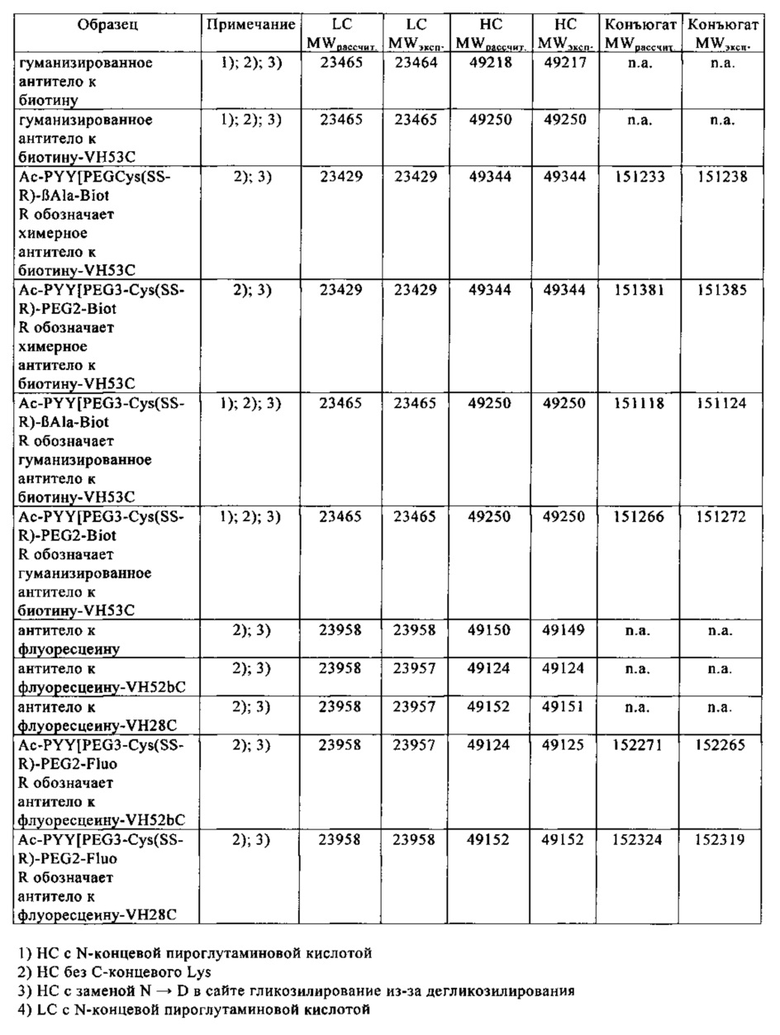
Аффинность антител
В некоторых вариантах осуществления изобретения представленное в настоящем описании антитело само по себе или антитело в представленном в настоящем описании комплексе имеет константу диссоциации (Kd)≤10нМ, ≤1нМ, ≤0,1нМ, ≤0,01нМ или ≤0,001нМ (например, примерно 10-8 М или менее, например, от примерно 10-8 М до примерно 10-13 М, например, от примерно 10-9 М до примерно 10-13 М).
В одном из вариантов осуществления изобретения Kd измеряют с помощью анализа связывания радиоактивномеченого антигена (РИА), который осуществляли с использованием Fab-версии представляющего интерес антитела и его антигена, с использованием указанного ниже анализа. Аффинность связывания в растворе Fab и антигена измеряли путем уравновешивания Fab с минимальной концентрацией 125I-меченного антигена в присутствии титруемых серий немеченого антигена, с последующей иммобилизацией связанного антигена на сенсибилизированном антителом к Fab планшете (см., например, Chen Y. ей др., J. Mol. Biol. 293, 1999, cc. 865-881). Для создания условий для осуществления анализа многолуночные планшеты MICROTITER® (фирма Thermo Scientific) сенсибилизировали в течение ночи с помощью взятого в концентрации 5 мкг/мл иммобилизующего антитела к Fab (фирма Cappel Labs) в 50 мМ карбонате натрия (рН 9,6), а затем блокировали в помощью 2% (мас./об.) бычьего сывороточного альбумина в ЗФР в течение 2-5 ч при комнатной температуре (примерно 23°С). В планшете, в котором не происходила адсорбция (фирма Nunc №269620), смешивали 100пМ или 26пМ [125I]-антигена с серийными разведениями представляющего интерес Fab (например, согласно методу оценки антитела к VEGF, Fab-12, описанному у Presta L.G. и др., Cancer Res. 57, 1997, cc. 4593-4599). Затем представляющий интерес Fab инкубировали в течение ночи; однако период инкубации может быть более длительным (например, составлять примерно 65 ч) для гарантии достижения равновесия. Затем смеси переносили в планшет для иммобилизации для инкубации при комнатной температуре (например, в течение 1 ч). Затем раствор удаляли и планшет отмывали 8 раз, используя 0,1% полисорбата 20 (TWEEN-20®) в ЗФР. Затем планшеты сушили, добавляли 150 мкл/лунку сцинтиллятора (MICROSCINT-20™; фирма Packard) и планшеты считывали с помощью гамма-счетчика TOPCOUNT™ 111 (фирма Packard) в течение 10 мин. Концентрации каждого Fab, связывание которого составляло менее 20% или было равно 20% от максимального связывания, отбирали для применения в анализах связывания в условиях конкуренции.
Согласно другому варианту осуществления изобретения Kd измеряли с помощью анализов поверхностного плазменного резонанса, используя устройство BIACORE®-2000 или BIACORE®-3000 (фирма BIAcore, Inc., Пискатавей, шт. Нью-Джерси), при 25°С с антигеном, иммобилизованном на СМ5-чипах при ~10 единицах ответа (RU). В целом, метод состоял в следующем: биосенсорные чипы с карбоксиметилированным декстраном (СМ5, фирма BIAcore, Inc.) активировали гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разводили 1 ОмМ ацетатом натрия, рН 4,8, до концентрации 5 мкг/мл (~0,2 мкМ), после чего осуществляли инъекцию со скоростью потока 5 мкл/мин до достижения примерно 10 единиц ответа (RU) сшитого белка. После инъекции антигена инъецировали 1М этаноламин для блокирования непрореагировавших групп. Для кинетических измерений инъецировали двукратные серийные разведения Fab (от 0,78 до 500нМ) в ЗФР, дополненном 0,05% поверхностно-активного вещества, такого как полисорбат 20 (TWEEN-20™) (ЗФРТ), при 25°С со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывали с использованием простой модели связывания Ленгмюра при соотношении 1:1 (программа BIACORE® Evaluation, версия 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Константу равновесия реакции диссоциации (Kd) рассчитывали с использованием соотношения koff/kon (см., например, Chen Y. И др., J. Mol. Biol. 293, 1999, cc. 865-881). Если скорость реакции ассоциации превышала 106 М-1 с при анализе с помощью описанного выше метода поверхностного плазмонного резонанса, то скорость реакции ассоциации можно определять с помощью методики гашения флуоресценции, которая позволяет измерять увеличение или понижение интенсивности испускания флуоресценции (длина волны возбуждения = 295 нм; длина волны испускания = 340 нм, полоса пропускания 16 нм) при 25°С, используя 20нМ антитело к антигену (Fab-формат) в ЗФР, рН 7,2 в присутствии возрастающих концентраций антигена, проводя измерения с помощью спектрометра, такого как спектрофотометр, работающий в режиме остановленного потока (фирма Aviv Instruments), или 8000-серийного спектрофотометра SLM-AMINCO™ (фирма ThermoSpectronic) с перемешиванием содержимого кюветы.
Фрагменты антител
В некоторых вариантах осуществления изобретения антитело, полученное согласно настоящему изобретению, или входящее в состав конъюгата, указанного в настоящем описании, представляет собой фрагмент антитела. Фрагменты антител включают (но, не ограничиваясь только ими) такие фрагменты как Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv, и другие описанные ниже фрагменты. Обзор некоторых фрагментов антител см., у Hudson P.J. и др., Nat. Med. 9, 2003, cc. 129-134. Обзор scFv-фрагментов см., например, у Plueckthun А. в: The Pharmacology of Monoclonal Antibodies, под ред. Rosenburg и Moore, изд-во Springer-Verlag, New York, т.113, 1994, cc. 269-315; см. также WO 93/16185; и US №№5571894 и 5587458. Обсуждение, касающееся Fab- и Р(аb')2-фрагментов, которые содержат эпитоп, связывающийся в рецептором спасения, и обладают удлиненным временем полужизни in vivo, см. US №5869046.
Димерные антитела представляют собой фрагменты антител с двумя антигенсвязывающими центрами, которые могут быть двухвалентными или биспецифическими (см., например, ЕР 0404097; WO 1993/01161; Hudson P.J. и др., Nat. Med. 9, 2003, cc. 129-134; и Holliger Р. и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc. 6444-6448). Тримерные и тетрамерные антитела описаны также у Hudson P.J. и др., Nat. Med. 9, 2003, cc. 129-134).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (фирма Domantis, Inc., Валтман, шт. Массачусетс; см., например, US №6248516).
Фрагменты антител можно создавать различными методиками, включая (но, не ограничиваясь только ими) протеолитическое расщепление интактного антитела, а также получать с помощью рекомбинантных клеток-хозяев (например, Е. coli или фаг), указанных в настоящем описании.
Химерные и гуманизированные антитела
В некоторых вариантах осуществления изобретения антитело, полученное согласно настоящему изобретению, или входящее в состав конъюгата, указанного в настоящем описании, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в US №4816567; и у Morrison S.L. и др., Proc. Natl. Acad. Sci. USA 81, 1984, cc. 6851-6855. В одном из примеров химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область из антитела мышей, крыс, хомяков, кроликов или приматов кроме человека, таких как обезьяны) и человеческую константную область. В другом примере химерное антитело представляет собой антитело «переключенного класса», класс или подкласс которого был изменен относительно родительского антитела. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых вариантах осуществления изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют для снижения иммуногенности для людей, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. Как правило, гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR, например, CDR (или их части), выведены из нечеловеческого антитела, a FR (или их части) выведены из последовательностей человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть человеческой константной области. В некоторых вариантах осуществления изобретения некоторые остатки FR в гуманизированном антителе заменены на соответствующие остатки из нечеловеческого антитела (например, антитела, из которого выведены остатки HVR), например, для сохранения или улучшения специфичности или аффинности антитела.
Гуманизированные антитела и методы их создания обобщены, например, у Almagro J.С.и Fransson J., Front. Biosci. 13, 2008, cc. 1619-1633, и описаны также у Riechmann I. и др., Nature 332, 1988, cc. 323-329; Queen С. и др., Proc. Natl. Acad. Sci. USA 86, 1989, cc. 10029-10033; US №№5821337, 7527791, 6982321 и 7087409; Kashmiri S.V. и др., Methods 36, 2005, cc. 25-34 (описание трансплантации SDR (a-CDR)); Padlan E.A., Mol. Immunol. 28, 1991, cc. 489-498 (описание «перекладки»); Dall'Acqua W.F. и др., Methods 36, 2005, cc. 43-60 (описание «перестановки FR»); и Osbourn J. и др., Methods 36, 2005, cc. 61-68 и Klimka А. и др., Br. J. Cancer 83, 2000, cc. 252-260 (описание подхода «направленной селекции» для перестановки FR).
Человеческие каркасные участки, которые можно применять для гуманизации, включают (но, не ограничиваясь только ими): каркасные участки, выбранные с помощью метода «наилучшей подгонки» (см., например, Sims M.J. и др., J. Immunol. 151, 1993, cc. 2296-2308; каркасные области, выведенные из консенсусной последовательности человеческих антител с конкретной подгруппой вариабельных областей легких или тяжелых цепей (см., например, Carter Р. и др., Proc. Natl. Acad. Sci. USA 89, 1992, cc. 4285-4289; и Presta L.G. и др., J. Immunol. 151, 1993, cc. 2623-2632); человеческие зрелые (с соматической мутацией) каркасные области или каркасные области человеческой зародышевой линии (см., например, Almagro J.С.и Fransson J., Front. Biosci. 13, 2008, cc. 1619-1633); и каркасные участки, выведенные путем скрининга библиотек FR (см., например, Baca М. и др., J. Biol. Chem. 272, 1997, cc. 10678-10684 и Rosok M.J. и др., J. Biol. Chem. 271, 1996, cc. 22611-22618).
Человеческие антитела
В некоторых вариантах осуществления изобретения антитело, полученное согласно настоящему изобретению, или входящее в составе конъюгата, указанного в настоящем описании, представляет собой человеческое антитело. Человеческие антитела можно получать, используя различные методики, известные в данной области. Человеческие антитела описаны в целом у van Dijk М.А. и van de Winkel J.G., Curr. Opin. Pharmacol. 5, 2001, cc. 368-374 и Lonberg N., Curr. Opin. Immunol. 20, 2008, cc. 450-459.
Человеческие антитела можно получать путем введения иммуногена трансгенному животному, модифицированному таким образом, чтобы оно продуцировало интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на контрольное заражение антигеном. Указанные животные, как правило, содержат все или часть локусов человеческого иммуноглобулина, вместо эндогенных иммуноглобулиновых локусов, которые либо присутствуют вне хромосом, либо интегрированы произвольно в хромосомы животного. У таких трангенных мышей эндогенные иммуноглобулиновые локусы, как правило, инактивированы. Обзор методов получения человеческих антител в трансгенных животных см. у Lonberg N., Nat. Biotech. 23, 2005, cc. 1117-1125 (см., например, также в US №6075181 и US №6150584 описание технологии XENOMOUSE™; в US №5770429 описание технологии HuMab®; в US №7041870 описание технологии К-М MOUSE® и в US №2007/0061900 описание технологии VelociMouse®). Человеческие вариабельные области из интактных антител, полученных с помощью указанных животных, можно дополнительно модифицировать, например, путем объединения с другой человеческой константной областью.
Человеческие антитела можно создавать с помощью методов на основе гибридом. Описаны клеточные линии человеческой миеломы и мышиной-человеческой гетеромиеломы, предназначенные для получения человеческих моноклональных антител (см., например, Kozbor D., J. Immunol. 133, 1984, cc. 3001-3005; Brodeur B.R. и др., Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, cc. 51-63 и Boerner P. и др., J. Immunol. 147, 1991, cc. 86-95). Человеческие антитела, созданные с использованием технологии на основе человеческих В-клеточных гибридом, описаны также у Li J. и др., Proc. Natl. Acad. Sci. USA 103, 2006, cc. 3557-3562. Дополнительные методы включают методы, описанные, например, в US №7189826 (описание получения моноклональных человеческих антител типа IgM из клеточных линий гибридом), и у Ni J., Xiandai Mianyixue 26, 2006, cc. 265-268 (описание человеческих-человеческих гибридом). Технология человеческих гибридом (технология Trioma) описана также у Vollmers Н.Р. и Brandlein S., Histology and Histopathology 20, 2005, cc. 927-937 и Vollmers Н.Р. и Brandlein S., Methods and Findings in Experimental and Clinical Pharmacology 27, 2005, cc. 185-191.
Человеческие антитела можно получать также путем выделения последовательностей вариабельных доменов клона Fv, отобранных из человеческих фаговых дисплейных библиотек. Указанные последовательности вариабельных доменов затем можно объединять с требуемым человеческим константным доменом. Технологии отбора человеческих антител из библиотек антител описаны ниже.
Полученные из библиотек антитела
Антитела, предлагаемые в изобретении, или антитела, входящие в конъюгат, представленный в настоящем описании, можно выделять путем скрининга комбинаторных библиотек антител с требуемой активностью или видами активности. Например, в данной области известны различные методы создания фаговых дисплейных библиотек антител и скрининга указанных антител в отношении антител, имеющих требуемые характеристики связывания. Указанные методы обобщены, например, у Hoogenboom H.R. и др., Methods in Molecular Biology 178, 2001, cc. 1-37, и описаны также, например, у McCafferty J. и др., Nature 348, 1990, cc. 552-554; Clackson Т. и др., Nature 352, 1991, cc. 624-628; Marks J.D. и др., J. Mol. Biol. 222, 1992, cc. 581-597; Marks J.D. и Bradbury A., Methods in Molecular Biology 248, 2003, cc. 161-175; Sidhu S.S. и др., J. Mol. Biol. 338, 2004, cc. 299-310; Lee C.V. и др., J. Mol. Biol. 340, 2004, cc. 1073-1093; Fellouse F.A., Proc. Natl. Acad. Sci. USA 101, 2004, cc. 12467-12472 и Lee C.V. и др., J. Immunol. Methods 284, 2004, cc. 119-132.
В некоторых методах на основе фагового дисплея спектры генов VH и VL по отдельности клонируют с помощью полимеразной цепной реакции (ПЦР) и произвольно рекомбинируют в фаговых библиотеках, которые затем подвергают скринингу в отношении антигенсвязывающего фага согласно методу, описанному у Winter G. и др., Ann. Rev. Immunol. 12, 1994, cc. 433-455. Фаг, как правило, экспонирует фрагменты антител либо в виде одноцепочечных Fv-(scFv) фрагментов, либо Fab-фрагментов. Библиотеки, созданные на основе иммунизированных источников, позволяют получать обладающие высокой аффинностью антитела к иммуногену без необходимости в создании гибридом. Альтернативно этому, можно клонировать «наивный» спектр (например, из организма человека) для создания одного источника антител к широкому спектру неаутоантигенов, а также аутоантигенов без какой-либо иммунизации согласно методу, описанному у Griffiths A.D. и др., EMBO J. 12, 1993, сс.725-734. И, наконец, библиотеки «наивных» антител можно создавать также путем синтеза посредством клонирования неперегруппированных сегментов V-гена из стволовых клеток и применения ПЦР-праймеровв, содержащих произвольную последовательность для кодирования CDR3 высоковариабельных областей и для осуществления перегруппировки in vitro, согласно методу, описанному у Hoogenboom H.R. и Winter G., J. Mol. Biol. 227, 1992, cc. 381-388. Патентные публикации, в которых описаны фаговые библиотеки человеческих антител, включают, например: US №5750373 и публикации патентов США №№2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, в контексте настоящего описания рассматриваются как человеческие антитела или фрагменты человеческих антител.
Форматы антител
Указанные выше антитела и фрагменты антител можно объединять многочисленные путями с получением различных форматов антител.
Например, один или несколько scFv-фрагментов антител можно сливать с С-концом одной или нескольких полипептидных цепей полного антитела. В частности, scFv-фрагмент антитела можно сливать с каждым С-концом тяжелой цепи или с каждым С-концом легкой цепи.
Например, один или несколько Fab-фрагментов антител можно сливать с С-концом одной или нескольких полипептидных цепей полного антитела. В частности, Fab-фрагмент антитела можно сливать с каждым С-концом тяжелой цепи или с каждым С-концом легкой цепи.
Например, один scFv- и один Fab-фрагмент антитела можно сливать с N-концами Fc-области антитела.
Например, один scFv- или Fab-фрагмент антитела можно сливать с N-концом Fc-области антитела и один scFv- или Fab-фрагмент антитела можно сливать с С-концом соответствующей другой цепи Fc-области антитела.
Мультиспецифические антитела
Разработано широкое разнообразие форматов рекомбинантных антител, например, четырехвалентные биспецифические антитела, путем слияния, например, антитела IgG-формата и одноцепочечных доменов (см., например, Coloma M.J. и др., Nature Biotech 15, 1997, cc. 159-163; WO 2001/077342 и Morrison S.L., Nature Biotech 25, 2007, cc. 1233-1234).
Кроме того, разработано несколько других форматов, в которых коровая структура антител (IgA, IgD, IgE, IgG или IgM) не сохранена, такие диа-, триа-или тетрабоди, миниантитела, несколько одноцепочечных форматов (scFv, бис-scFv), которые обладают способностью связываться с двумя или большим количеством антигенов (Holliger Р. и др., Nature Biotech 23, 2005, cc. 1126-1136; Fischer N., Leger O., Pathobiology 74, 2007, cc. 3-14; Shen J. и др., Journal of Immunological Methods 318, 2007, cc. 65-74; Wu С.и др., Nature Biotech. 25, 2007, cc. 1290-1297).
Во всех указанных форматах применяют линкеры либо для слияния ядра антитела (IgA, IgD, IgE, IgG или IgM) с дополнительным связывающим белком (например, scFv) или для слияния, например, двух Fab-фрагментов или scFv (Fischer N. и Leger О., Pathobiology 74, 2007, cc. 3-14). Следует иметь в виду, что при необходимости можно сохранять эффекторные функции, такие как комплементзависимая цитотоксичность (CDC) или антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), которые опосредуются связыванием с Fc-рецептором, путем сохранения высокой степени сходства с встречающимися в естественных условиях антителами.
В WO 2007/024715 описаны иммуноглобулины с удвоенными вариабельными доменами, сконструированные в виде мультивалентных и мультиспецифических связывающих белков. Процесс получения биологически активных димеров антител описан в US №6897044. Мультивалентная конструкция FV-антитела, имеющая по меньшей мере четыре вариабельных домена, которые сцеплены друг с другом через пептидные линкеры, описана в US №7129330. Димерные и мультимерные антигенсвязывающие структуры описаны в US 2005/0079170. Трех- или четырехвалентные моноспецифические антигенсвязывающие белки, содержащие три или четыре Fab-фрагмента, связанных друг с другом ковалентно с помощью соединяющей структуры, в которых белок не представляет собой встречающийся в естественных условиях иммуноглобулин, описаны в US №6511663. В WO 2006/020258 описаны четырехвалентные биспецифические антитела, которые могут эффективно экспрессироваться в прокариотических и эукариотических клетках и которые можно применять в терапевтических и диагностических методах. Метод отделения димеров, которые связаны по меньшей мере через один межцепочечный дисульфидный мостик, от димеров, которые не связаны по меньшей мере через один межцепочечный дисульфидный мостик, из смеси, содержащей два типа полипептидных димеров, или предпочтительно метод их синтеза описан в US 2005/0163782. Биспецифические четырехвалентные рецепторы описаны в US №5959083. Сконструированные антитела с тремя или большим количеством функциональных антигенсвязывающих центров описаны в WO 2001/077342.
Мультиспецифические и многовалентные антигенсвязывающие полипептиды описаны в WO 1997/001580. В WO 1992/004053 описаны гомоконъюгаты, как правило, полученные из моноклональных антител IgG-класса, которые связываются с одной и той же антигенной детерминантной, ковалентно связанные синтетическим перекрестносшивающим агентом. Олигомерные моноклональные антитела с высокой авидностью к антигену описаны в WO 1991/06305, при этом секретируются олигомеры, как правило, IgG-класса, имеющие два или большее количество иммуноглобулиновых мономеров, которые ассоциированы вместе с образованием четырехвалентных или шестивалентных молекул IgG. В US №6350860 описаны овечьи антитела и созданные конструкции антител, которые можно применять для лечения заболеваний, при которых активность интерферона гамма является патогенной. В US 2005/0100543 описаны конструкции, которые можно использовать для направленного переноса, представляющие собой многовалентные носители биспецифических антител, т.е. каждая молекула конструкции, которую можно использовать для направленного переноса, может служить в качестве носителя двух или большего количества биспецифических антител. Генетически сконструированные биспецифические четырехвалентные антитела описаны в WO 1995/009917. В WO 2007/109254 описаны стабилизированные связывающие молекулы, которые состоят из стабилизированного scFv или содержат его.
В некоторых вариантах осуществления изобретения антитело, представленное в настоящем описании, или антитело, входящее в состав конъюгата, указанного в настоящем описании, представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела, представляют собой моноклональные антитела, которые имеют специфичности, связывающиеся по меньше мере с двумя различными сайтами. В некоторых вариантах осуществления изобретения одна из специфичностей связывается с гаптеном, а другая с любым другим (не являющимся гаптеном) антигеном. Биспецифические антитела можно применять также для локализации цитотоксических агентов в клетках. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
Методики создания мультиспецифических антител включают (но, не ограничиваясь только ими) рекомбинантную совместную экспрессию двух пар тяжелых цепей-легких цепей иммуноглобулинов, обладающих различными специфичностями (см. Milstein С.и Cuello А.С., Nature 305, 1983, cc. 537-540, WO 93/08829 и Traunecker А. и др., EMBO J. 10,1991, cc. 3655-3659), и технологию «knob-in-hole» (обеспечение взаимодействия по типу «выступ-во впадину») (см., например, US №5731168). Мультиспецифические антитела можно получать также путем создания регулируемых электростатических воздействий для получения гетеродимерных молекул Fc антитела (WO 2009/089004); перекрестного связывания двух или большего количества антител или фрагментов (см., например, US №4676980 и Brennan М. и др., Science 229, 1985, cc. 81-83); применения лейциновых молний для получения биспецифических антител (см., например, Kostelny S.A. и др., J. Immunol. 148, 1992, cc. 1547-1553; применение технологии «димерных антител (диабоди)» для создания фрагментов биспецифических антител (см., например, Holliger Р. и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc. 6444-6448); и применение димеров одноцепочечных Fv (sFv) (см., например, Gruber М и др., J. Immunol. 152, 1994, cc. 5368-5374); и получение триспецифических антител согласно методу, описанному, например, у Tutt А. и др., J. Immunol. 147, 1991, cc. 60-69).
В одном из вариантов осуществления изобретения СН3-домены тяжелых цепей биспецифического антитела изменяют с помощью технологии «knob-into-holes», которая подробно описана в нескольких примерах, например, в WO 96/027011, WO 98/050431, у Ridgway J.B. и др., Protein Eng. 9, 1996, cc. 617-621, Merchant A.M. и др., Nat Biotechnol 16,1998, cc. 677-681. При осуществлении этого метода поверхности раздела двух СН3-доменов изменяют для повышения гетеродимеризации обеих тяжелых цепей, содержащих указанные два СН3-домена. Каждый из двух СН3-доменов (двух тяжелых цепей) может представлять собой «выступ», а другой представлять собой «впадину». Интродукция дисульфидного мостика стабилизирует гетеродимеры (Merchant А.М и др., Nature Biotech 16, 1998, cc. 677-681, Atwell S. и др., J. Mol. Biol. 270, 1997, cc. 26-35) и повышает выход.
В одном из вариантов осуществления всех объектов изобретения биспецифическое антитело отличается тем, что
- СН3-домен одной тяжелой цепи и СН3-домен другой тяжелой цепи каждый вступает в контакт на поверхности раздела, которая представляет собой исходную поверхность раздела между СН3-доменами антитела,
где указанную поверхность изменяют так, чтобы способствовать образованию биспецифического антитела, где изменение отличается тем, что
а) изменяют СН3-домен одной тяжелой цепи,
так, что в исходной поверхности раздела СН3-домена одной тяжелой цепи, которая контактирует с исходной поверхностью раздела СН3-домена другой тяжелой цепи в биспецифическим антителе,
аминокислотный остаток заменяют на аминокислотной остаток, имеющий больший объем боковой цепи, создавая тем самым выпуклость на поверхности раздела СН3-домена одной тяжелой цепи, которая может помещаться в полость в поверхности раздела СН3-домена другой тяжелой цепи,
и
б) изменяют СН3-домен другой тяжелой цепи,
так, что в исходной поверхности раздела второго СН3-домена, которая контактирует с исходной поверхностью раздела первого СН3-домена в биспецифическом антителе,
аминокислотный остаток заменяют на аминокислотный остаток, имеющий меньший объем боковой цепи, создавая тем самым полость в поверхности раздела второго СН3-домена, в которую может помещаться выпуклость на поверхности раздела первого СН3-домена.
Таким образом, в одном из вариантов осуществления изобретения антитела, указанные в настоящем описании, отличаются тем, что
- СН3-домен первой тяжелой цепи полноразмерного антитела и СН3-домен второй тяжелой цепи полноразмерного антитела каждый вступает в контакт на поверхности раздела, которая имеет изменение в исходной поверхности раздела между СН3-доменами антитела,
где I) в СН3-домене первой тяжелой цепи
аминокислотный остаток заменяют на аминокислотной остаток, имеющий больший объем боковой цепи, создавая тем самым выпуклость на поверхности раздела СН3-домена одной тяжелой цепи, которая может помещаться в полость в поверхности раздела СН3-домена другой тяжелой цепи,
и где II) в СН3-домене второй тяжелой цепи
аминокислотный остаток заменяют на аминокислотный остаток, имеющий меньший объем боковой цепи, создавая тем самым полость в поверхности раздела второго СН3-домена, в которую может помещаться выпуклость на поверхности раздела первого СН3-домена.
В одном из вариантов осуществления изобретения аминокислотный остаток, имеющий больший объем боковой цепи, выбирают из группы, состоящей из аргинина (R), фенилаланина (F), тирозина (Y), триптофана (W).
В одном из вариантов осуществления изобретения аминокислотный остаток, имеющий меньший объем боковой цепи, выбирают из группы, состоящей из аланина (А), серина (S), треонина (Т), валина (V).
В одном из вариантов осуществления изобретения оба СН3-домена дополнительно изменяют путем интродукции такой аминокислоты, как цистеин (С), в соответствующие положения каждого СН3-домена, так, чтобы мог образовываться дисульфидный мостик между обоими СН3-доменами.
В одном из вариантов осуществления изобретения биспецифическое антитело содержит мутацию T366W в СН3-домене «цепи с выступами» и мутации T366S, L368A, Y407V в СН3-домене «цепи с впадиной». Можно применять также дополнительный межцепочечный дисульфидный мостик между СН3-доменами (Merchant А.М и др., Nature Biotech 16, 1998, cc. 677-681), например, путем интродукции мутации Y349C в СН3-домен «цепи с выступами» и мутации Е356С или мутации S354C в СН3-домен «цепи с впадиной» (нумерация в соответствии с EU-индексом согласно Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991).
В одном из вариантов осуществления изобретения биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации Е356С, T366S, L368A, Y407V во втором из двух СН3-доменов. В одном из вариантов осуществления изобретения биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V во втором из двух СН3-доменов (дополнительная мутация Y349C в одном из СН3-доменов и дополнительная мутация Е356С или S354C в другом СН3-домене приводит к образованию межцепочечного дисульфидного мостика) (нумерация согласно EU-индексу Кэбота (Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991)). Альтернативно или дополнительно можно применять другие варианты технологии «knobs-in-holes», представленные в ЕР 1870459 А1. Так, в случае биспецифического антитела другим примером являются мутации R409D, К370Е в СН3-домене «цепи с выступами» и мутации D399K, Е357К в СН3-домене «цепи с впадиной» (нумерация согласно EU-индексу Кэбота (Kabat и др., Sequences of Proteins of Immunological Interest, 5-e изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991)).
В одном из вариантов осуществления изобретения биспецифическое антитело содержит мутацию T366W в СН3-домене «цепи с выступами» и мутации T366S, L368A, Y407V в СН3-домене «цепи с впадиной» и дополнительно мутации R409D, К370Е в СН3-домене «цепи с выступами» и мутации D399K, Е357К в СН3-домене «цепи с впадиной».
В одном из вариантов осуществления изобретения биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V во втором из двух СН3-доменов, или биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V во втором из двух СН3-доменов и дополнительно мутации R409D, К370Е в СН3-домене «цепи в выступами» и мутации D399K, Е357К в СН3-домене «цепи с впадиной». Указанные мутации, приводящие к образованию выступа или впадины в СН3-домене, как правило, применяют в константных областях человеческих тяжелых цепей, которые имеют SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171 или SEQ ID NO: 172 (аллотипы человеческого иммуноглобулина подкласса IgGl (кавказский или афроамериканский) или мутации L234A/L235A и L234A/L235A/P329G), SEQ ID NO: 173, SEQ ID NO: 174 или SEQ ID NO: 175 (человеческий иммуноглобулин подкласса IgG4 или мутанты S228P, L235E и S228P/L235E/P329G) (нумерация в соответствии с EU-индексом согласно Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991).
В одном из вариантов осуществления изобретения биспецифическое антитело содержит константные области человеческой тяжелой цепи, которые имеют SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171 или SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174 или SEQ ID NO: 175, дополнительно включающие указанные мутации, приводящие к образованию «выступа» и «впадины» в СН3-домене (например, мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V во втором из двух СН3-доменов) (нумерация в соответствии с EU-индексом согласно Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991).
Под объем настоящего изобретения подпадают также сконструированные антитела с тремя или большим количеством функциональных антигенсвязывающих центров, включая «антитела-осьминоги» (см., например, US 2006/0025576).
Антитело или фрагмент, представленное/представленный в настоящем описании, включают также «Fab с двойным действием» (Dual Acting Fab) или «DAF», содержащие антигенсвязывающий центр, который связывается с гаптеном, а также с другим, отличным от него антигеном (см., например, US 2008/0069820).
Антитело или фрагмент, представленное/представленный в настоящем описании, включает также мультиспецифические антитела, которые описаны в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
В одном из вариантов осуществления изобретения первая специфичность биспецифического антитела связывается с гаптеном, а вторая специфичность связывается с отличным от гаптена антигеном. В одном из вариантов осуществления изобретения отличный от гаптена антиген выбирают из маркеров лейкоцитов, таких как CD2, CD3, CD4, CD5, CD6, CD7, CD8, CD11a,b,c, CD13, CD14, CD18, CD19, CD22, CD23, CD27 и его лиганд, CD28 и его лиганды В7.1, В7.2, В7.3, CD29 и его лиганд, CD30 и его лиганд, CD40 и его лиганд gp39, CD44, CD45 и изоформы, CD56, CD58, CD69, CD72, CTLA-4, LFA-1 и TCR; антигенов гистосовместимости, таких как ГКГС класса I или II, Y-антигены Льюиса, SLex, SLey, SLea и SLeb; интегринов, VLA-1, VLA-2, VLA-3, VLA-4, VLA-5, VLA-6, αVβ3 и LFA-1, Мас-1 и pl50,95, αVβ1, gpIIbIIIa, αR β3, α6β4, αVβ5, αVβ6 и αV 62 7; селектинов, таких как L-селектин, Р-селектин и Е-селектин, и их контр-рецепторов VCAM-1, ICAM-1, ICAM-2 и LFA-3; интерлейкинов, таких как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14 и IL-15; рецепторов интерлейкинов, выбранных из группы, состоящей из IL-1R, IL-2R, IL-3R, IL-4R, IL-5R, IL-6R, IL-7R, IL-8R, IL-9R, IL-10R, IL-11R, IL-12R, IL-13R, IL-14R и IL-15R; хемокина, выбранного из группы, состоящей из PF4, RANTES, MlPla, МСР1, NAP-2, Groa, Grop и IL-8; фактора роста, выбранного из группы, состоящей из ТИРальфа, TGF6eTa, TSH, VEGF/VPF, VEGFA, VEGFB, VEGF111, VEGF121, VEGF165, VEGF189, VEGF206, РТНгР, EGF-семейства, PDGF-семейства, эндотелина, фиброзина (FSF-1), человеческого ламинина и гастрин-рилизинг пептида (GRP), PLGF, HGH, HGHR; рецептора фактора роста, выбранного из группы, состоящей из TNFaльфaR, RGF6eTaR, TSHR, VEGFR/VPFR, EGFR, PTHrPR, PDGFR-семейства, EPO-R, GCSF-R и других гематопоэтических рецепторов; рецептора интерферона, выбранного из группы, состоящей из IFNCαR, IFNβR и IFNλR; Ig и его рецептора, выбранного из группы, состоящей из IgE, FcγRI и FcγRII; опухолевого антигена, выбранного из группы, состоящей из her2-neu, муцина, СЕА и эндосиалина; аллергена, выбранного из группы, состоящей из антигена клещей домашней пыли, антигенов lol pi (пыльца трав) и урушиола; вирусного полипептида, выбранного из группы, состоящей из гликопротеинов В, Н и gCIII CMV, оболочечных гликопротеинов ВИЧ-1, оболочечных гликопротеинов RSV, оболочечных гликопротеинов HSV, оболочечных гликопротеинов HPV, семейства поверхностных антигенов вируса гепатита; токсина, выбранного из группы, состоящей из эндотоксина и остеопонтина/уропонтина Pseudomonas, конотоксина змеиного яда, яда пауков и пчелиного яда; фактора крови, выбранного из группы, состоящей из комплемента С3b, комплемента С4а, комплемента С4b-9, Rh-фактора, фибриногена, фибрина и ассоциированного с миелином ингибитора роста; и фермента, выбранного из группы, состоящей из полипептида-переносчика сложного эфира холестерина, связанных с мембраной матричных металлопротеиназ и декарбоксилазы глутаминовой кислоты (GAD).
Варианты антител
Некоторые варианты осуществления изобретения относятся к вариантам аминокислотных последовательностей антител, представленных в настоящем описании. Например, может требоваться повышать аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела можно получать путем интродукции соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем синтеза пептидов Указанные модификации включают, например, делеции и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечной конструкции можно использовать любую комбинацию делеций, инсерций и замен, при условии, что конечная конструкция обладает требуемыми характеристиками, например, способностью связываться с антигеном.
а) Полученные путем замены, инсерции и делеции варианты
Конкретными вариантами осуществления изобретения являются варианты антител, которые имеют одну или несколько аминокислотных замен. Сайты, представляющие интерес для замещающего мутагенеза, включают HVR и FR. Аминокислотные замены можно интродуцировать в представляющее интерес антитело и продукты подвергать скринингу в отношении требуемой активности, например, сохранения/улучшения связывания антигена, снижения иммуногенности или улучшения ADCC или CDC.

Аминокислоты можно группировать на основе общих свойств боковых цепей следующим образом:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ilе;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Тrр, Туr, Phe.
Под неконсервативными заменами подразумевают замену представителя одного из указанных классов на представителя из другого класса.
Один тип полученного в результате замены варианта включает замену одного или нескольких остатков гипервариабельного участка родительского антитела (например, гуманизированного или человеческого антитела). Как правило, полученный(ые) в результате вариант(ы), отобранный(ые) для дополнительного исследования, должен(ы) иметь модификации (например, улучшения) некоторых биологических свойств (например, повышенную аффинность, пониженную иммуногенность) относительно родительского антитела, и/или должен(ы) иметь практически сохраненные определенные биологические свойства родительского антитела. Примером полученного в результате замены варианта является антитело с созревшей аффинностью, которое можно создавать, например, с использованием технологий созревания аффинности на основе фагового дисплея, например, указанных в настоящем описании. В целом, метод состоит в следующем: один или несколько остатков HVR подвергают мутации и варианты антител экспонируют на фаге и подвергают скринингу в отношении конкретной биологической активности (например, аффинности связывания).
Изменения (например, замены) могут быть сделаны в HVR, например, для улучшения аффинности антитела. Указанные изменения могут быть сделаны в «горячих точках» в HVR, т.е. в остатках, которые кодируются кодонами, которые с высокой частотой подвергаются мутациям в процессе соматического созревания (см., например, Chowdhury P.S., Methods Mol. Biol. 207, 2008, cc. 179-196), и/или SDR (a-CDR) с последующим тестированием варианта VH или VL в отношении аффинности связывания. Созревание аффинности путем создания и повторной селекции из вторичных библиотек описано, например, у Hoogenboom H.R. и др., Methods in Molecular Biology 178, 2002, cc. 1-37. В некоторых вариантах осуществления процесса созревания аффинности интродуцируют разнообразие в гены вариабельной области, выбранные для создания мутации, с помощью любого из широкого разнообразия методов (например, ПЦР пониженной точности, перестановка цепи или сайт-направленный мутагенез с использованием олигонуклеотидов). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу для идентификации вариантов антител с требуемой аффинностью. Другой метод, применяемый для интродукции разнообразия, включает подходы, мишенью которых является HVR, при которых несколько остатков HVR (например, 4-6 остатков одновременно) рандомизируют. Остатки HVR, участвующие в связывании антигена, можно специфически идентифицировать, например, используя аланин-сканирующий мутагенез или моделирование. Часто мишенями являются, прежде всего, CDR3 тяжелой цепи и CDR3 легкой цепи.
В некоторых вариантах осуществления изобретения замены, инсерции или делеции могут затрагивать один или несколько HVR, если указанные изменения не снижают существенно способность антитела связываться с антигеном. Например, консервативные изменения (например, консервативные замены, указанные в настоящем описании), которые не снижают существенно аффинность связывания, могут быть сделаны в HVR. Указанные изменения могут не затрагивать «горячие точки» HVR или SDR. В некоторых вариантах последовательностей VH и VL, представленных выше, каждый HVR либо является неизмененным, либо содержит не более одной, двух или трех аминокислотных замен.
Ценным методом идентификации остатков или областей антитела, которые можно подвергать мутагенезу, является так называемый «аланин-сканирующий мутагенез», описанный у Cunningham B.C. и Wells J.A., Science 244, 1989, cc. 1081-1085. При осуществлении этого метода остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) идентифицируют и заменяют на нейтральную или отрицательно заряженную аминокислоту (например, аланин или полиаланин) для решения вопроса о том, будет ли это влиять на взаимодействие антитела с антигеном. Дополнительные замены можно интродуцировать в те положения аминокислот, для которых продемонстрирована функциональная чувствительность к начальным заменам. В альтернативном или дополнительном варианте изучают кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Указанные контактирующие остатки и соседние остатки можно рассматривать в качестве мишеней или исключать из рассмотрения в качестве кандидатов для замены. Варианты можно подвергать скринингу для решения вопроса о том, обладают ли они требуемыми свойствами.
Инсерции в аминокислотные последовательности включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или большее количество остатков, а также инсерции одного или нескольких аминокислотных остатков внутрь последовательности. Примером результата осуществления концевых инсерций является полипептид с N-концевым метионильным остатком. Другие инсерционные варианты молекул антител включают слияние N- или С-концов антитела с ферментом (например, для ADEPT (антитело-направляемый фермент пролекарственной терапии) или полипептидом, который удлиняет время полужизни антитела в сыворотке.
б) Варианты гликозилирования
В некоторых вариантах осуществления изобретения антитело, предлагаемое в изобретении, или входящее в конъюгат, указанный в настоящем описании, изменяют с целью повышения или понижения степени гликозилирования антитела. Добавление или делецию сайтов гликозилирования в антителе можно легко осуществлять путем такого изменения аминокислотной последовательности, которое позволяет создавать или удалять один или несколько сайтов гликозилирования.
Если антитело содержит Fc-область, то можно изменять присоединенный к ней углевод. Нативные Fc-области, которые продуцируются клетками млекопитающих, как правило, содержат разветвленный, биантенный олигосахарид, присоединенный с помощью N-связи к Asn297 СН2-домена Fc-области (см., например, Wright А. и Morrison S.L., TIBTECH 15, 1997, cc. 26-32). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стебле» биантенной олигосахаридной структуры. В некоторых вариантах осуществления изобретения модификации олигосахарида в антителе, предлагаемом в изобретении, можно осуществлять для создания вариантов антитела с определенными улучшенными свойствами.
Одним из вариантов осуществления изобретения являются варианты антитела, имеющие углеводную структуру, в которой снижено содержание фукозы, присоединенной (прямо или косвенно) к Fc-области. Например, содержание фукозы в указанной Fc-области может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Содержание фукозы определяют путем расчета среднего содержания фукозы в сахарной цепи на Asn297 относительно суммы всех гликоструктур, присоединенных к Asn 297 (например, комплексных, гибридных структур и структур с высоким содержанием маннозы), которое измеряют с помощью MALDI-TOF-масс-спектрометрии согласно методу, описанному, например, в WO 2008/077546. Asn297 обозначает остаток аспарагина, присутствующий примерно в положении 297 в Fc-области (EU-нумерация остатков Fc-области); однако вследствие минорных вариаций последовательности антитела Asn297 может располагаться также примерно на ±3 аминокислоты в прямом или обратном направлении относительно положения 297, т.е. между положениями 294 и 300. Указанные фукозилированные варианты могут обладать улучшенной ADCC-функцией (см., например, US 2003/0157108; US 2004/0093621). Примерами публикаций, касающихся «дефукозилированных» вариантов антител или вариантов антител «с дефицитом фукозы» являются: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki и др., J. Mol. Biol. 336, 2004, cc. 1239-1249; Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, c. 614-622). Примерами клеточных линий, которые обладают способностью продуцировать дефукозилированные антитела, являются Lecl3 СНО-клетки с дефицитом белкового фукозилирования (Ripka и др., Arch. Biochem. Biophys. 249, 1986, cc. 533-545; US 2003/0157108 и WO 2004/056312, см., прежде всего, пример 11), и клеточные линии с «выключенным» геном, например, СНО-клетки с «выключенным» геном альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, с. 614-622); Kanda Y. и др., Biotechnol. Bioeng., 94(4), 2006, cc. 680-688; и WO 2003/085107).
Кроме того, описаны варианты антител с бисекционными олигосахаридами, например, в которых биантенный олигосахарид, присоединенный к Fc-области антитела, бисекционнируется с помощью GlcNAc. Указанные варианты антител могут отличаться пониженным фукозилированием и/или повышенной ADCC-функцией. Примеры указанных вариантов антител описаны, например, в WO 2003/011878; US 6602684 и US 2005/0123546. Предложены также варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, присоединенном к Fc-области. Указанные варианты антител могут обладать повышенной CDC-функцией. Указанные варианты антител описаны, например, в WO 1997/30087; WO 98/58964 и WO 99/22764.
в) Варианты Fc-области
Согласно конкретным вариантам осуществления изобретения можно интродуцировать в Fc-область антитела, представленного в настоящем описании, одну или несколько аминокислотных модификаций, создавая тем самым вариант Fc-области. Вариант Fc-области может содержать последовательность человеческой Fc-области (например, Fc-области человеческого IgG1, IgG2, IgG3 или IgG4), включающую аминокислотную модификацию (например, замену) в одном или нескольких аминокислотных положениях.
Некоторые варианты осуществления изобретения относятся к варианту антитела, который обладает некоторыми, но не всеми эффекторными функциями, что делает его перспективным кандидатом для путей применения, для которых является важным время полужизни комплекса in vivo, однако некоторые эффекторные функции (такие как связанные с комплементом и ADCC) не являются необходимыми или являются вредными. Можно осуществлять анализы цитотоксичности in vitro и/или in vivo для подтверждения снижения/истощения CDC- и/или ADCC-активности. Например, можно осуществлять анализы связывания Fc-рецептора (FcR) для гарантии того, что у комплекса отсутствует способность к связыванию с FcγR (и поэтому, вероятно, отсутствует ADCC-активность), но сохраняется способность связываться с FcRn. Первичные клетки, опосредующие ADCC, т.е. NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные об экспрессии FcR на гематопоэтических клетках обобщены в таблице 3 на с. 464 у Ravetch и Kinet, Annu. Rev. Immunol. 9, 1991, cc. 457-492. Примерами анализов in vitro ADCC-активности представляющей интерес молекулы являются (но, не ограничиваясь только ими) анализы, описанные в US №5500362 (см., например, Hellstrom I. и др., Proc. Natl. Acad. Sci. USA 83, 1986, cc. 7059-7063 и Hellstrom I. и др., Proc. Nat'l Acad. Sci. USA 82, 1985, cc. 1499-1502); US №5821337 (cm. Bruggemann M. и др., J. Exp. Med. 166, 1987, cc. 1351-1361). В альтернативном варианте можно применять нерадиоактивные методы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ на основе проточной цитометрии (фирма CellTechnology, Inc. Маунтин-Вью, шт. Калифорния); и нерадиоактивный анализ цитотоксичности CytoTox 96® (фирма Promega, Мэдисон, шт. Висконсин). Пригодными для таких анализов эффекторными клетками являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). В альтернативном или дополнительном варианте ADCC-активность представляющей интерес молекулы можно оценивать in vivo, например, на животной модели, например, как описано у Clynes и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc. 652-656. Можно осуществлять также анализы связывания Clq для подтверждения того, что антитело не может связывать С1q и поэтому у него отсутствует CDC-активность (см., например, описание ELISA для оценки связывания C1q и С3с в WO 2006/029879 и WO 2005/100402). Для оценки активации комплемента можно осуществлять CDC-анализ (см., например, Gazzano-Santoro и др., J. Immunol. Methods 202, 1996, cc. 163-171; Cragg M.S. и др., Blood 101, 2003, cc. 1045-1052; и Cragg M.S. и M.J. Glennie, Blood 103, 2004, cc. 2738-2743). Определение FcRn-связывания и клиренса/времени полужизни in vivo можно осуществлять также с использованием методов, известных в данной области (см., например, Petkova S.B. и др., Int'l. Immunol. 18(12), 2006, cc. 1759-1769).
Антитела с пониженной эффекторной функцией включают антитела с заменой одного или нескольких следующих остатков Fc-области, таких как 234, 235, 238, 265, 269, 270, 297, 327 и 329 (см., например, US №6737056). К указанным мутантам Fc относятся мутанты Fc с заменами в двух или большем количестве из следующих аминокислотных положений: 265, 269, 270, 297 и 327, включая так называемый мутант «DANA» Fc-области, несущий замену остатков 265 и 297 на аланин (US №7332581).
Описаны некоторые варианты антител с повышенной или пониженной способностью связываться с FcR (см., например, US №6737056; WO 2004/056312 и Shields и др., J. Biol. Chem. 9(2), 2001, cc. 6591-6604).
Согласно конкретным вариантам осуществления изобретения вариант антитела содержит Fc-область с одной или несколькими аминокислотными заменами, которые повышают ADCC, например, замены в положениях 298, 333, и/или 334 Fc-области (EU-нумерация остатков).
В некоторых вариантах осуществления изобретения в Fc-области осуществляют изменения, которые приводят к измененной (т.е. либо повышенной, либо пониженной) способности связывать C1q и/или комплементзависимой цитотоксичности (CDC), что описано, например, в US №6194551, WO 99/51642 и у Idusogie и др., J. Immunol. 164, 2000, cc. 4178-4184.
Антитела с удлиненным временем полужизни и повышенной способностью к связыванию с неонатальным Fc-рецептором (FcRn), который ответствен за перенос материнских IgG эмбриону (Guyer и др., J. Immunol. 117, 1976, cc. 587-593 и Kim и др., J. Immunol. 24, 1994, cc. 2429-2434), описаны в US №2005/0014934А1. Эти антитела содержат Fc-область с одной или несколькими заменами, которые повышают связывание Fc-области с FcRn. Указанные варианты Fc-области включают варианты с заменами одного или нескольких следующих остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка 434 в Fc-области (US №7371826).
Дополнительные примеры, касающиеся других вариантов Fc-области, описаны также у Duncan и Winter, Nature 322, 1988, cc. 738-740; в US №5648260; US №5624821 и WO 94/29351.
г) Варианты антител, сконструированные с помощью цистеина
В некоторых вариантах осуществления изобретения может оказаться желательным создавать антитела, сконструированные с помощью цистеина, например, «тиоМАт», в которых один или несколько остатков в антителе заменены на остатки цистеина. В конкретных вариантах осуществления изобретения замененные остатки находятся в доступных сайтах антитела. Путем замены этих остатков на цистеин реакционноспособные тиольные группы помещаются в доступные сайты антитела и могут использоваться для конъюгации антитела с другими фрагментами, такими как фрагменты, представляющие собой лекарственное средство, или фрагменты, представляющие собой линкер, связанный с лекарственным средством, с созданием иммуноконъюгата, указанного ниже в настоящем описании. В некоторых вариантах осуществления изобретения любой(ые) один или несколько следующих остатков может(гут) быть заменен(ы) на цистеин: V205 (нумерация по Кэботу) легкой цепи; А118 (EU-нумерация) тяжелой цепи и S400 (EU-нумерация) Fc-области тяжелой цепи. Антитела, сконструированные с помощью цистеина, можно создавать согласно методу, например, описанному в US №7521541.
д) Производные антител
В некоторых вариантах осуществления изобретения антитело, представленное в настоящем описании, можно дополнительно модифицировать таким образом, чтобы оно содержало дополнительные небелковые фрагменты, известные в данной области и легко доступные. Фрагменты, пригодные для дериватизации антитела, включают (но, не ограничиваясь только ими) водорастворимые полимеры. Примерами водорастворимых полимеров являются (но, не ограничиваясь только ими) полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо статистические сополимеры) и декстран- или поли(н-винилпиролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры пропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликольпропиональдегид может иметь преимущество при производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, присоединенных к антителу, может варьироваться и, если присоединено более одного полимера, то они могут представлять собой одинаковые или различные молекулы. В целом, количество и/или тип полимеров, применяемых для дериватизации, можно определять с учетом таких особенностей (но, не ограничиваясь только ими), как конкретные свойства или функции антитела, подлежащие усовершенствованию, предполагается ли применение производного антитела в терапии в определенных условиях, и т.д.
Другим вариантом осуществления изобретения являются конъюгаты антитела и небелкового фрагмента, которые можно избирательно нагревать, воздействуя на него излучением. В одном из вариантов осуществления изобретения небелковый фрагмент представляет собой углеродную нанотрубку (Кат и др., Proc. Natl. Acad. Sci. USA 102, 2005, cc. 11600-11605). Излучение может иметь любую длину волны и включает (но, не ограничиваясь только ими) длины волн, которые не повреждают обычные клетки, но которые нагревают небелковый фрагмент до температуры, при которой уничтожаются клетки, ближайшие к конъюгату: антитело-небелковый фрагмент.
Гаптенилированные соединения
Гаптен в конъюгате, указанном в настоящем описании, может быть конъюгирован, если он сам не представляет собой одну из таких молекул, с терапевтическим агентом (лекарственным средством), цитотоксическим агентом (например, токсином, таким как доксорубицин или коклюшный токсин), флуорофорами, такими как флуоресцентный краситель типа флуоресцеина или родамина, хелатирующим агентом для визуализации или радиотерапевтическим металлом, пептидильной или непептидильной меткой или меткой для обнаружения, или модифицирующим клиренс агентом, таким как различные изомеры полиэтиленгликоля, пептидом, который связывается с третьим компонентом или другим углеводом или липофильным агентом. Указанный конъюгат обозначают как гаптенилированное соединение. Конъюгация может быть осуществлена либо непосредственно, либо через промежуточный линкер.
а) Терапевтические фрагменты
Фрагмент, представляющий собой лекарственное средство (D) конъюгата гаптен-лекарственное средство (ADC, гаптенилированное лекарственное средство), может представлять собой любое соединение, фрагмент или группу, обладающее/обладающую цитотоксическим или цитостатическим действием. Фрагмент, представляющий собой лекарственное средство, включает (I) химиотерапевтические средства, которые могут функционировать в качестве ингибиторов микротрубок, ингибиторов митоза, ингибиторов топоизомеразы или интеркаляторов ДНК; (II) белковые токсины, которые могут обладать ферментативной функцией; и (III) радиоизотопы.
Примеры фрагментов, представляющих собой лекарственное средство, включают (но, не ограничиваясь только ими) майтансиноид, ауристатин, доластатин, трихотецен, СС1065, калихеамицин и другие энедииновые антибиотики, таксан, антрациклин и их стереоизомеры, изостеры, аналоги или производные.
Белковые токсины включают А-цепь дифтерийного токсина, несвязыванющиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина (Vitetta и др., Science, 238, 1987, с. 1098), А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, РАРII и PAP -5), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, неомицин и трихотецены (WO 93/21232).
Терапевтические изотопы включают 32Р, 33Р, 90Y, 1251, 131I, 131In, 153Sm, 186Re, 188Re, 211At, 212B, 212Pb и радиоактивные изотопы Lu.
Радиоизотоп или другие метки можно включать известными путями (Fraker и др., Biochem. Biophys. Res. Commun. 80, 1978, cc. 49-57; «Monoclonal Antibodies in Immunoscintigraphy» Chatal, изд-во CRC Press, 1989). Меченная углеродом14 1-изотиоцианатобензил-3-мети лдиэти л ентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента, применяемого для конъюгации радионуклида с комплексом (WO 94/11026).
б) Метки
Гаптенилированное соединение может представлять собой гаптенилированную метку. Можно использовать любой представляющий собой метку фрагмент, который можно ковалентно связывать с гаптеном (см., например, Singh и др., Anal. Biochem. 304, 2002, cc. 147-150; Harlow E. и Lane D. Using Antibodies: A Laboratory Manual, изд-во Cold Springs Harbor Laboratory Press, Cold Spring Harbor, N.Y, 1999; Lundblad R. L. Chemical Reagents for Protein Modification, 2-ое изд., изд-во. CRC Press, Boca Raton, Fla., 1991). Метка может функционировать для (I) обеспечения выявляемого сигнала; (II) взаимодействия со второй меткой для модификации выявляемого сигнала, получаемого от первой или второй меткой, например, для обеспечения FRET (флуоресцентного резонансного переноса энергии); (III) воздействия на подвижность, например, электрофоретическую подвижность или клеточную проницаемость, посредством заряда, гидрофобности, формы или других физических параметров, или (IV) получения «захватывающего» фрагмента, например, для модуляции ионного комплексообразования.
Конъюгаты, содержащие гаптенилированную метку, указанные в настоящем описании, можно применять в диагностических анализах, например, для обнаружения экспрессии представляющего интерес антигена в конкретных клетках, тканях или сыворотке. Для диагностических применений можно использовать биспецифическое антитело, в котором первая связывающая специфичность связывается с мишенью, а вторая связывающая специфичность связывается с гаптенилированной меткой. Гаптен, как правило, метят с помощью выявляемого фрагмента. Доступны многочисленные метки, которые, как правило, группируют в следующие категории:
(а) Радиоизотопы (радионуклиды), такие как 3H, 11С, 14С, 18F, 32Р, 35S, 64Сu, 68Gn, 86Y, 89Zr, 99ТС, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At или 131Bi. Меченные радиоизотопами конъюгаты можно применять в экспериментах по целенаправленной визуализации рецепторов. Антиген (гаптен) можно метить реагентами, представляющими собой лиганды, которые связываются, хелатируют или иным образом образуют комплекс с радиоизотопным металлом, используя методики, описанные в Current Protocols in Immunology, под ред. Coligen и др., изд-во Wiley-Interscience, New York, N.Y., Pubs, т. 1 и 2, 1991. Хелатирующие лиганды, которые могут образовывать комплекс с ионом металла, включают DOTA, DOTP, DOTMA, DTPA и ТЕТА (фирма Macrocyclics, Даллас, шт. Техас). Радионуклиды можно выявлять посредством комплексообразования с комплексом, указанным в настоящем описании (Wu и др., Nature Biotechnology 23(9) (2005) 1137-1146). Целенаправленная визуализация рецептора с помощью меченных радионуклидом комплексов может являться маркером пути активации посредством выявления и количественной оценки постоянно возрастающего накопления комплексов или соответствующих терапевтических антител в опухолевой ткани (Albert и др., Bioorg. Med. Chem. Lett. 8, 1998, cc. 1207-1210).
Хелатные комплексы металлов можно применять в качестве меток в экспериментах по визуализации (US 2010/0111856; US №5342606; US №5428155; US №5316757; US №5480990; US №5462725; US №5428139; US №5385893; US №5739294; US №5750660; US №5834456; Hnatowich и др., J. Immunol. Methods 65, 1983, cc. 147-157; Meares и др., Anal. Biochem. 142, 1984, cc. 68-78; Mirzadeh и др., Bioconjugate Chem. 1, 1990, cc. 59-65; Meares и др.,, J. Cancer, дополн. 10, 1990, cc. 21-26; Izard и др., Bioconjugate Chem. 3, 1992, cc. 346-350; Nikula и др., Nucl. Med. Biol. 22, 1995, cc. 387-390; Camera и др., Nucl. Med. Biol. 20, 1993, cc. 955-962; Kukis и др., J. Nucl. Med. 39, 1998, cc. 2105-2110; Verel и др., J. Nucl. Med. 44, 2003, cc. 1663-1670; Camera и др., J. Nucl. Med. 21, 1994, cc. 640-646; Ruegg и др., Cancer Res. 50, 1990, cc. 4221-4226; Verel и др., J. Nucl. Med. 44, 2003, cc. 1663-1670; Lee и др., Cancer Res. 61, 2001, cc. 4474-4482; Mitchell и др., J. Nucl. Med. 44, 2003, cc. 1105-1112; Kobayashi и др., Bioconjugate Chem. 10, 1999, cc. 103-111; Miederer и др., J. Nucl. Med. 45, 2004, cc. 129-137; DeNardo и др., Clinical Cancer Research 4, 1998, cc. 2483-2490; Blend и др., Cancer Biotherapy & Radiopharmaceuticals 18, 2003, cc. 355-363; Nikula и др., J. Nucl. Med. 40, 1999, cc. 166-176; Kobayashi и др., J. Nucl. Med. 39, 1998, cc. 829-836; Mardirossian и др., Nucl. Med. Biol. 20, 1993, cc. 65-74; Roselli и др., Cancer Biotherapy & Radiopharmaceuticals, 14, 1999, cc. 209-220).
(б) Флуоресцентные метки, такие как хелаты редкоземельных (хелаты европия), метки типа флуоресцеина, включающие ФИТЦ, 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин; метки типа родамина, включающие TAMRA (тетраметилродамин); дансил; лиссамин; цианиды; фикоэритрины; техасский красный; и их аналоги. Флуоресцентные метки можно конъюгировать с антигеном (гаптеном), используя методики, описанные, например, в Current Protocols in Immunology, выше. Флуоресцентные красители и реагенты, представляющие собой флуоресцентные метки, включают субстанции, поступающие в продажу от фирмы Invitrogen/Molecular Probes (Юджин, шт. Орегон, США) и фирмы Pierce Biotechnology, Inc. (Рокфорд, шт. Иллинойс).
Выявляемые метки, такие как флуоресцентные красители и хемилюминисцентные красители (Briggs и др., «Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids», J. Chem. Soc, Perkin-Trans. 1, 1997, cc. 1051-1058), дают выявляемый сигнал и их, как правило, можно применять для мечения, прежде всего отличающегося следующими свойствами: (I) меченый конъюгат должен продуцировать очень сильный сигнал с очень низкими фоновым сигналом, благодаря чему небольшие количества конъюгата можно с большой чувствительностью выявлять как в бесклеточных, так и в клеточных анализах; и (II) меченый конъюгат должен обладать фотостабильностью, благодаря чему флуоресцентный сигнал можно обнаруживать, осуществлять его мониторинг и регистрировать без значительного фотообесцвечивания. Для применений, включающих связывание на клеточной поверхности меченых конъюгатов с мембранами или поверхностями клеток, прежде всего живых клеток, метки должны (III) обладать хорошей растворимостью в воде для достижения эффективной концентрации конъюгата и чувствительности выявления и (IV) являться нетоксичными для живых клеток для того, чтобы не нарушать нормальные метаболические процессы клеток или не вызывать преждевременной гибели клеток.
(в) Различные фермент-субстратные метки доступны или описаны (см., например, US №4275149). Фермент, как правило, катализирует химическое изменение хромогенного субстрата, которое можно измерять, используя различные методики. Например, фермент может катализировать изменение цвета у субстрата, которое можно измерять спектрофотометрически. Альтернативно этому, фермент может изменять флуоресценцию или хемилюминисценцию субстрата. Хемилюминисцентный субстрат становится электронно-возбужденным в результате химической реакции и может затем испускать свет, который можно измерять (используя, например, хемилюминометр) или передавать энергию флуоресцентному акцептору. Примеры ферментативных меток включают люциферазы (например, люциферазу светляка и бактериальную люциферазу; US №4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазы, пероксидазу, такую как пероксидаза из хрена (HRP), щелочную фосфатазу (АР), β-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаридов (например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу), гетероциклические оксидазы (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и т.п.Методики конъюгирования ферментов с полипептидами описаны у O'Sullivan и др., «Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay)), в: Methods in Enzym., под ред. J. Langone и IT Van Vunakis, изд-во Academic Press, New York, 73, 1981, cc. 147-166.
Примеры комбинаций фермент-субстрат (US №4275149; US №4318980) включают, например:
(I) Пероксидаза из хрена (HRP) и пероксид водорода в качестве субстрата, где пероксидаза водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или гидрохлорид 3,3',5,5'-тетраметилбензидина (ТМВ));
(II) щелочная фосфатаза (АР) и пара-нитрофенилфосфат в качестве хромогенного субстрата; и
(III) β-D-галактозидаза (β-D-Gal) и хромогенный субстрат (например, пара-нитрофенил-(β-D-галактозидаза) или флуорогенный субстрат 4-метилумбеллиферил-β-D-галактозидаза.
Меченый конъюгат, указанный в настоящем описании, можно применять в любом известном методе анализа, таком как ELISA, анализы связывания в условиях конкуренции, прямые и косвенные сэндвич-анализы и анализы методом иммунопреципитации (Zola, Monoclonal Antibodies: A Manual of Techniques, 1987, cc. 147-158, изд-во CRC Press, Inc.).
Меченые конъюгаты, указанные в настоящем описании, можно применять в качестве визуализирующих биомаркеров и зондов с использованием различных методов и технологий биомедицинской и молекулярной визуализации, таких как: (I) MRI (ЯМР-томография) (визуализация методом ядерно-магнитного резонанса); (II) MicroCT (МикроКТ, компьютеризованная томография); (III) SPECT (ОФЭКТ) (однофотонная эмиссионная компьютерная томография); (IV) PET (ПЭТ) (позитронно-эмиссионная томография) Tinianow J. и др., Nuclear Medicine and Biology, 37(3), 2010, cc. 289-297; Chen и др., Bioconjugate Chem. 15, 2004, cc. 41-49; US 2010/0111856, (V) биолюминисценция; (VI) флуоросценция и (VII) ультразвук. Иммуносцинтиграфия представляет собой процедуру визуализации, при которой конъюгаты, меченные радиоактивными субстанциями, вводят животному или больному человеку и получают картину областей в организме, в которых локализован конъюгат (US №6528624). Визуализирующие биомаркеры можно объективно измерять и оценивать в качестве индикатора нормальных биологических процессов, патогенных процессов или фармакологических ответов на терапевтическое вмешательство. Биомаркеры могут относиться к нескольким типам: маркеры типа 0 исторически служили в качестве естественных маркеров заболевания и в течение длительного периода установлена их корреляция с известными клиническими симптомами, например, MRI-оценка воспаления синовиальной сумки при ревматоидном артрите; маркеры типа I отражают эффект вмешательства в зависимости от механизма действия, даже, если механизм не ассоциирован с клиническим исходом; маркеры типа II функционируют в качестве суррогатных конечных точек, когда изменения биомаркера или его сигнала прогнозируют клиническое благоприятное воздействие для «валидации» требуемого ответа, например, оценка эрозии кости при ревматоидном артрите с помощью КТ. Таким образом, визуализирующие биомаркеры могут давать фармакодинамическую (ФД) терапевтическую информацию, касающуюся: (I) экспрессии белка-мишени, (И) связывания терапевтического агента с белком-мишенью, т.е. избирательности действия, и (III) клиренса и фармакокинетических данных о времени полужизни. Преимуществами применяемых in vivo визуализирующих биомаркеров относительно применяемых в лабораторных условиях биомаркеров являются: неинвазивная обработка, возможность количественного определения, оценка всего организма, повторное дозирование и оценка, т.е. получение множества временных точек и потенциальная возможность переноса доклинических результатов (полученных на небольших животных) на клинические результаты (на человека). При некоторых применениях биовизуализация вытесняет эксперименты на животных в доклинических исследованиях или минимизирует их.
Методы мечения пептидов хорошо известны (см. Haugland, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, изд-во Molecular Probes, Inc., 2003; Brinkley, Bioconjugate Chem. 3, 1992, c. 2; Garman, Non-Radioactive Labeling: A Practical Approach, изд-во Academic Press, London, 1997; Means, Bioconjugate Chem. 1, 1990, c. 2; Glazer и др., Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology, под ред. Т. S. Work и E. Work, изд-во American Elsevier Publishing Co., New York; Lundblad R. L. и Noyes С.M., Chemical Reagents for Protein Modification, т.I и т.II, изд-во CRC Press, New York, 1984; Pfleiderer G. «Chemical Modification of Proteins», Modern Methods in Protein Chemistry, под ред. H. Tschesche, изд-во Walter DeGruyter, Berlin and New York, 1985; и Wong, Chemistry of Protein Conjugation and Cross-linking, изд-во CRC Press, Boca Raton, Fla., 1991; DeLeon-Rodriguez и др.,, Chem. Eur. J. 10, 2004, cc. 1149-1155; Lewis и др., Bioconjugate Chem. 12, 2001, cc. 320-324; Li и др., Bioconjugate Chem. 13, 2002, cc. 110-115; Mier и др., Bioconjugate Chem. 16, 2005, cc. 240-237.
Конъюгаты антител
Антитело в конъюгате, указанном в настоящем описании, может быть дополнительно конъюгировано, если оно само не представляет одну из указанных молекул, с терапевтическим агентом (лекарственным средством), цитотоксическим агентом (например, токсином, таким как доксорубицин или коклюшный токсин), флуорофором, таким как флуоресцентный краситель типа флуоресцеина или родамина, хелатирующим агентом для визуализации или радиотерапевтическим металлом, пептидильной или непептидильной меткой или выявляемой меткой или модифицирующим клиренс агентом, таким как различные изомеры полиэтиленгликоля, пептидом, который связывается с третьим компонентом, или другим углеводом или липофильным агентом.
Иммуноконъюгаты
Изобретение относится также к иммуноконъюгатам, содержащим антитело, указанное в настоящем описании, или конъюгат, указанный в настоящее описании, конъюгированное/конъюгированный с одним или несколькими цитотоксическим агентами, такими как химиотерапевтические агенты или лекарственные средства, ингибирующие рост агенты, токсины (например, белковые токсины, обладающие ферментативной активностью токсины бактериального, грибного, растительного или животного происхождения или их фрагменты) или радиоактивные изотопы.
В одном из вариантов осуществления изобретения иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или несколькими лекарственными средствами, включая (но, не ограничиваясь только ими) майтансиноид (см. US №5208020, US №5416064 и ЕР 0425235 В1); ауристатин, например, фрагменты DE и DF монометилауристатина (ММАЕ и MMAF) (см. US 5635483, US 5780588 и US 7498298); доластатин; калихеамицин или его производные (см. US №5712374, US №5714586, US №5739116, US №5767285, US №5770701, US №5770710, US №5773001 и US №5877296; Hinman L.M. и др., Cancer Res. 53, 1993, cc. 3336-3342; и Lode H.N. и др., Cancer Res. 58, 1998, cc. 2925-2928); антрациклин, такой как дауномицин или доксорубицин (см. Kratz F. и др., Curr. Med. Chem. 13, 2006, cc. 477-523; Jeffrey S.C. и др., Bioorg. Med. Chem. Lett. 16, 2006, cc. 358-362; Torgov M.Y. и др., Bioconjug. Chem. 16, 2005, cc. 717-721; Nagy А. и др., Proc. Natl. Acad. Sci. USA 97, 2000, cc. 829-834; Dubowchik G.M. и др., Bioorg. & Med. Chem. Letters 12, 2002, cc. 1529-1532; King H.D. и др., J. Med. Chem. 45, 2002, cc. 4336-4343; и US №6630579); метотрексат; виндесин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тесетаксел и ортатаксел; трихотецен и СС1065.
В другом варианте осуществления изобретения иммуноконъюгат содержит антитело, представленное в настоящем описании, конъюгированное с обладающим ферментативной активностью токсином или его фрагментом, включая (но, не ограничиваясь только ими) А-цепь дифтерийного токсина, несвязыванющиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, РАРII и PAP -5), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, неомицин и трихотецены.
В другом варианте осуществления изобретения иммуноконъюгат содержит антитело, представленное в настоящем описании, или комплекс, указанный в настоящем описании, конъюгированное/конъюгированный с радиоактивным атомом с образованием радиоконъюгата. Широкое разнообразие радиоактивных изотопов можно применять для получения радиоконъюгатов. Примеры включают 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 212Pb и радиоактивные изотопы Lu. Когда радиоконъюгат применяют для детекции, то он может содержать радиоактивный атом для сцинтиграфических исследований, например, ТС99m или I123, или спиновую метку для визуализации методом ядерного магнитного резонанса (ЯМР) (известный также как магнитно-резонансная визуализации, МРВ), такую как йод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента можно получать с использованием широкого разнообразия бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидатхНСЬ), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бисазидопроизводные (такие как бис(иара-азидобензоил)гександиамин), производные бисдиазония (такие как бис(пара-диазониумбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат), и обладающие двойной активностью фторсодержащие соединения (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получать согласно методу, описанному у Vitetta E.S. и др., Science 238, 1987, cc. 1098-1104. Меченная с помощью С14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента, применяемого для конъюгации радионуклеотида с антителом (см. WO 94/11026). Линкер может представлять собой «расщепляемый линкер», облегчающий высвобождение цитотоксического лекарственного средства. Например, можно использовать неустойчивый в кислой среде линкер, чувствительный к действию пептидаз линкер, фотолабильный линкер, диметильный линкер или содержащий дисульфид линкер (Chari R.V. и др., Cancer Res. 52, 1992, cc. 127-131; US №5208020).
В контексте настоящего описания под иммуноконъюгатами или ADC подразумеваются (но, не ограничиваясь только ими) указанные конъюгаты, полученные с использованием перекрестносшивающих реагентов, которые включают (но, не ограничиваясь только ими) BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, а также SVSB (сукцинимидил(4-винилсульфон)бензоат), которые поступают в продажу (например, от фирмы Pierce Biotechnology, Inc., Рокфорд, шт. Иллинойс, США).
Линкер
Понятие «линкер» относится к бифункциональному или многофункциональному фрагменту, который можно применять для конъюгации (связывания) антигена (например, гаптена) с другими фрагментами, такими как выявляемые метки или лекарственные средства. Конъюгаты антигена (гаптена) легко можно получать с использованием линкера, имеющего реакционноспособную функциональность, предназначенную для связывания с лекарственным средством, с антигеном (гаптен) или антителом к гаптену.
В одном из вариантов осуществления изобретения линкер имеет реакционноспособный сайт, который несет электрофильную группу, которая является реакционноспособной в отношении нуклеофильной группы, присутствующей на антителе к гаптену. Тиольная группа цистеина на антителе, например, обладает реакционной способностью в отношении электрофильной группы на линкере и образует ковалентную связь с линкером. Пригодные электрофильные группы включают (но, не ограничиваясь только ими) другие тиольные, малеимидные и галоацетамидные группы (см., например, метод конъюгации, описанный на с. 766 у Klussman и др., Bioconjugate Chemistry 15(4), 2004, cc. 765-773).
Примеры реакционноспособных функциональных тиольных групп включают (но, не ограничиваясь только ими) тиол, малеимид, альфа-галогенацетил, активированные сложные эфиры, такие как сукцинимидные сложные эфиры, 4-нитрофениловые сложные эфиры, пентафторфениловые сложные эфиры, тетрафторфениловые сложные эфиры, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты.
Линкер может содержать аминокислотные остатки, которые связывают антиген (гаптен) с «полезным грузом». Аминокислотные остатки могут образовывать дипептидное, трипептидное, тетрапептидное, пентапептидное, гексапептидное, геаптапептидное, октапептидное, нонапептидное, декапептидное, ундекапептидное или додекапептидное звено. Аминокислотные остатки включают встречающиеся в естественных условиях остатки, а также не встречающиеся в естественных условиях аминокислотные аналоги, такие, например, как цитруллин или β-аминокислоты, такие, например, как β-аланин, или ω-аминокислоты, такие как ω-аминомасляная кислота.
В другом варианте осуществления изобретения линкер имеет реакционноспособную функциональную группу, которая несет нуклеофильную группу, реакционноспособную в отношении электрофильной группы, присутствующей на антигене (гаптене) или антителе (антитело к гаптену). Пригодные электрофильные группы включают (но, не ограничиваясь только ими) карбонильные группы альдегида и кетона. Гетероатом нуклеофильной группы линкера может вступать в реакцию с электрофильной группой на гаптене или антителе и образовывать ковалентную связь с антигеном (гаптеном) или антителом. Пригодные нуклеофильные группы на линкере включают (но, не ограничиваясь только ими) гидразид, оксим, аминогруппу, гидразин, тиосемикарбазон, гидразинкарбоксилат и арилгидразид. Ээлектрофильная группа на антигене (гаптене) представляет собой удобный сайт для присоединения к линкеру.
Как правило, линкеры пептидного типа можно получать путем образования пептидной связи между двумя или большим количеством аминокислот и/или пептидных фрагментов. Указанные пептидные связи можно получать, например, методом синтеза в жидкой фазе (Е. Schroder и К. Lubke, The Peptides, т. 1, 1965, cc. 76-136, изд-во Academic Press), хорошо известного в области химии пептидов.
В другом варианте осуществления изобретения линкер можно замещать группами, которые модулируют растворимость или реакционную способность. Например, заряженный заместитель, такой как сульфонат (SO3-) или аммоний, или полимер, такой как ПЭГ, может повышать растворимость в воде реагента и облегчать реакцию сочетания реагента, представляющего собой линкер, с антигеном (гаптеном) или фрагментом, представляющим собой лекарственное средство, или облегчать реакцию сочетания, зависящую от применяемого пути синтеза.
К конъюгатам, содержащим лекарственное средство или метку, указанным в настоящем описании, относятся (но, не ограничиваясь только ими) комплексы, полученные с помощью следующих представляющих собой линкеры реагентов: ВМРЕО, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, а также SVSB (сукцинимидил(4-винилсульфон)бензоат), в включая бисмалеимидные реагенты: DTME, ВМВ, BMDB, ВМН, ВМОЕ, ВМ(РЕО)3 и ВМ(РЕО)4, которые поступают в продажу от фирмы Pierce Biotechnology, Inc. Бисмалеимидные реагенты позволяют осуществлять присоединение, например, тиольной группы в тиолсодержащему фрагменту, представляющему собой лекарственное средство, метке или промежуточному линкеру, последовательно или одновременно. Другие функциональные группы помимо малеимида, вступающие в реакцию, например, с тиольной группой, включают йодацетамид, бромацетамид, винилпиридин, дисульфид, пиридилдисульфид, изоцианат и изотиоцианат.
Примером линкера является валин-цитруллиновый (val-cit или vc) дипептидный линкерный реагент, имеющий малеимидный удлиняющий участок и пара-аминобензилкарбамоильный (РАВ) саморасщепляющийся спейсер, и phe-lys(Mtr) дипептидный линкерный реагент, имеющий малеимидный удлиняющий участок и гагра-аминобензильный саморасщепляющийся спейсер.
Тиольные группы цистеина являются нуклеофильными и обладают способностью вступать во взаимодействие с образованием ковалентных связей с электрофильными группами на линкерных реагентах и гаптенилированных соединениях, которые включают: (I) активные сложные эфиры, такие как сложные NHS-эфиры, сложные HOBt-эфиры, галоформиаты и галоангидриды; (II) алкил- и бензилгалогениды, такие как галоацетамиды; (III) альдегиды, кетоны, карбоксильные и малеимидные группы; и (IV) дисульфиды, включая пиридилдисульфиды, через обмен сульфида. Нуклеофильные группы на гаптенилированном соединении включают (но, не ограничиваясь только ими): амин, тиол, гидроксил, гидразид, оксим, гидразин, тиосемикарбазон, гидразин карбоксилат и арилгидразидные группы, обладающие способностью вступать во взаимодействие с образованием ковалентных связей с электрофильными группами на линкерных фрагментах и линкерных реагентах.
III. Нуклеиновая кислота
ДНК, кодирующую аминокислотную последовательность варианта антитела, указанного в настоящем описании, или входящего в конъюгат, указанный в настоящем описании, можно получать различными методами, известными в данной области. Эти методы включают (но, не ограничиваясь только ими) получение с помощью сайт-направленного (или опосредуемого олигонуклеотидом) мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза полученной ранее ДНК, кодирующей полипептид. Варианты рекомбинантных антител можно создавать также путем манипуляции с полученным с помощью рестрикции фрагментом или с помощью ПЦР с перекрывающимися расширениями с использованием синтетических олигонуклеотидов. Мутагенные праймеры кодируют замену(ы) кодона(ов) цистеина. Можно применять стандартные методики мутагенеза для создания ДНК, кодирующей указанные модифицированные сконструированные антитела. Общее руководство представлено у Sambrook и др., Molecular Cloning, A Laboratory Manual, изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; и у Ausubel и др., Current Protocols in Molecular Biology, изд-во Greene Publishing and Wiley-Interscience, New York, N.Y., 1993.
IV. Экспрессия и очистка
Антитела можно получать, используя методы рекомбинации и композиции, например, описанные в US №4816567. Одним из вариантов осуществления изобретения является выделенная нуклеиновая кислота, кодирующая антитело, представленное в настоящем описании. Указанная нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкие и/или тяжелые цепи антитела). Следующим вариантом осуществления изобретения является(ются) один или несколько векторов (например, экспрессионных векторов), которые содержат указанную нуклеиновую кислоту. Еще одним вариантом осуществления изобретения является клетка-хозяин, которая содержит указанную нуклеиновую кислоту. В одном из указанных вариантов осуществления изобретения клетка-хозяин содержит (например, в результате трансформации указанными векторами): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (СНО) или лимфоидную клетку (например, Y0-, NS0-, Sр20-клетку). Одним из вариантов осуществления изобретения является способ получения антитела, указанного в настоящем описании, заключающийся в том, что культивируют клетку-хозяина, содержащую нуклеиновую кислоту, которая кодирует антитело, описанное выше, в условиях, пригодных для экспрессии антитела, и необязательно выделяют антитело из клетки-хозяина (или среды для культивирования клетки-хозяина).
Для рекомбинантного получения антитела, указанного в настоящем описании, нуклеиновую кислоту, кодирующую антитело, например, описанное выше, выделяют и встраивают в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Указанную нуклеиновую кислоту легко можно выделять и секвенировать с использованием общепринятых процедур (например, путем использования олигонуклеотидных зондов, которые обладают способностью специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Приемлемые клетки-хозяева для клонирования или экспрессии кодирующих антитело векторов включают прокариотические или эукариотические клетки, представленные в настоящем описании. Например, антитела можно получать в бактериях, в частности, когда не требуется гликозилирование и связанная с Fc эффекторная функция. Сведения об экспрессии фрагментов антитела и полипептидов в бактериях см. например, в US №5648237, US №5789199 и US №5840523 (см. также у Charlton К.А. в: Methods in Molecular Biology, под ред. Lo В.К.С., изд-во Humana Press, Totowa, NJ, т. 248, 2003, cc. 245-254 описание экспрессии фрагментов антител в Е. coli.) После экспрессии антитело можно выделять из пасты бактериальных клеток в виде растворимой фракции и можно дополнительно очищать.
Помимо прокариотических организмов в качестве хозяев, пригодных для клонирования или экспрессии векторов, которые кодируют антитела, можно использовать эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, пути гликозилирования которых были «гуманизированы», что позволяет получать антитело с частично или полностью человеческой схемой гликозилирования (см. Gerngross, Nat. Biotech. 22, 2004, cc. 1409-1414 и Li и др., Nat. Biotech. 24, 2006, cc. 210-215).
Клетки-хозяева, которые можно использовать для экспрессии гликозилированного антитела, получают также из многоклеточных организмов (беспозвоночных и позвоночных животных). Примерами клеток беспозвоночных являются клетки насекомых, а также можно применять клетки растений. Были выявлены многочисленные штаммы бакуловирусов и соответствующие пригодные для них в качестве хозяев клетки насекомых, прежде всего для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев можно применять также культуры растительных клеток (см., например, US №№5959177, 6040498, 6420548, 7125978 и 6417429 (описание технологии PLANTIBODIES™ для получения антител в трансгенных растениях).
В качестве хозяев можно применять также клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, которые адаптированы к росту в суспензии. Другими примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированная с помощью ОВ40 (COS-7); линия клеток почки эмбриона человека (НЕК 293-клетки или клетки линии 293, описанные, например, у Graham и др., J. Gen. Virol., 36, 1977, с. 59-74); клетки почки детеныша хомяка (ВНК); клетки Сертоли мыши (ТМ4-клетки, описанные, например, у Mather, Biol. Reprod., 23, 1980, cc. 243-251); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76,); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени бычьей крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, у Mather и др., Annals N.Y. Acad. Sci., 383, 1982, cc. 44-68); клетки MRC 5 и клетки FS4. Другими ценными линиями клеток-хозяев млекопитающих являются клетки яичника китайского хомячка (СНО), включая DHFR--CHO-клетки (Urlaub и др., Proc. Natl. Acad. Sci. USA, 77, 1980, cc. 4216-4220); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор конкретных линий клеток-хозяев млекопитающих, которые можно применять для производства антител, см., например, у Yazaki и Wu, в: Methods in Molecular Biology под ред. В.К.С. Lo, изд-во Humana Press, Totowa, NJ, т. 248, 2003, cc. 255-268. V. Способы и композиции для диагностирования и обнаружения В некоторых вариантах осуществления изобретения любое из антител, прежде всего биспецифических антител и конъюгатов, указанных в настоящем описании, можно применять для обнаружения присутствия одной или нескольких молекул-мишеней в биологическом образце. Понятие «обнаружение (детекция)» в контексте настоящего описания предусматривает количественное или качественное обнаружение. В одном из вариантов осуществления изобретения биологический образец содержит клетку или ткань.
Одним из вариантов осуществления изобретения является антитело или конъюгат, указанное/указанный в настоящем описании, для применения в способе диагностирования или обнаружения. В некоторых вариантах осуществления изобретения способ заключается в том, что приводят в контакт биологический образец с антителом или конъюгатом, указанным в настоящем описании, в условиях, обеспечивающих связывание антитела или конъюгата с мишенью, и выявляют образование комплекса между антителом или конъюгатом и мишенью. Указанный способ может представлять собой способ in vitro или in vivo.
Некоторыми вариантами осуществления изобретения являются меченые антитела или конъюгаты. Метки включают (но, не ограничиваясь только ими) метки или фрагменты, которые можно обнаруживать непосредственно (такие как флуоресцентные, хромофорные, электронноплотные, хемилюминисцентые и радиоактивные метки), а также фрагменты, такие как ферменты или лиганды, которые подлежат косвенному обнаружению, например, посредством ферментативной реакции или молекулярного взаимодействия. Примеры меток включают (но, не ограничиваясь только ими) радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люцифераза светляка и бактериальная люцифераза (US №4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидаза из хрена (HRP), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, оксидазы сахаридов, например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфатдегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, сшитые с ферментом, который использует пероксид водорода для окисления предшественника красителя, такого как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, метки в виде бактериофагов, стабильные свободные радикалы и т.п.
VI. Фармацевтические композиции
Фармацевтические композиции антитела или конъюгата, указанного в настоящем описании, получают путем смешения указанного антитела или конъюгата, имеющего необходимую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences, 16-е изд. под ред. A. Osol, 1980) в форме лиофилизированных композиций или водных растворов. Фармецевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях, они включают (но, не ограничиваясь только ими): буферы, такие как фосфатный, цитратный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и мета-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). В контексте настоящего описания примеры фармацевтически приемлемых носителей включают также диспергирующие агенты интерстициальных лекарственных средств, такие как растворимые активные в нейтральной среде гликопротеины гиалуронидаз (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX®, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и методы их применения, в том числе rHuPH20, описаны в публикациях патентов США №№2005/0260186 и 2006/0104968. Согласно одному из объектов изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных композиций антител описаны в US №6267958. Водные композиции антител включают композиции, описанные в US №6171586 и WO 2006/044908, последние композиции включают гистидин-ацетатный буфер.
Композиция, предлагаемая в изобретении, может содержать также более одного действующего вещества, если это необходимо для конкретного подлежащего лечению показания, предпочтительно вещества с дополнительными видами активности, которые не оказывают отрицательного воздействия друг на друга. Такие действующие вещества должны присутствовать в комбинации в количествах, эффективных для решения поставленной задачи.
Действующие вещества можно включать также в микрокапсулы, например, полученные с помощью методов коацервации или межфазной полимеризации, например в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы введения лекарственного средства (например в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences, 16-е изд., под ред. A. Osol, 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, включающие антитело или конъюгат, такие матрицы представляют собой изделия определенной формы, например, пленки или микрокапсулы.
Композиции, предназначенные для применения in vivo, как правило, должны быть стерильными. Стерильность можно легко обеспечивать, например, путем фильтрации через стерильные фильтрующие мембраны.
VII. Терапевтические методы и композиции
Любое из антител или конъюгатов, указанных в настоящем описании, можно применять в терапевтических способах.
Одним из объектов изобретения является антитело или конъюгат, указанное/указанный в настоящем описании, для применения в качестве лекарственного средства. Другими объектами изобретения является антитело или конъюгат, указанное/указанный в настоящем описании, для применения для лечения заболевания. Некоторыми вариантами осуществления изобретения является антитело или конъюгат, указанное/указанный в настоящем описании, для применения в способе лечения. Некоторыми вариантами осуществления изобретения является антитело или конъюгат, указанное/указанный в настоящем описании, для применения в способе лечения индивидуума, заключающемся в том, что вводят индивидууму в эффективном количестве антитело или конъюгат, указанное/указанный в настоящем описании. В одном из указанных вариантов осуществления изобретения способ заключается также в том, что вводят индивидууму в эффективном количестве по меньшей мере одно дополнительное терапевтическое средство, например, описанное ниже. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
Следующим объектом изобретения является применение антитела или конъюгата, указанного в настоящем описании, для приготовления или создания препарата лекарственного средства. В одном из вариантов осуществления изобретения лекарственное средство предназначено для лечения заболевания. В другом варианте осуществления изобретения лекарственное средство применяют в способе лечения заболевания, заключающемся в том, что вводят индивидууму, имеющему заболевание, в эффективном количестве лекарственное средство. В одном из указанных вариантов осуществления изобретения способ заключается также в том, что вводят индивидууму в эффективном количестве по меньшей мере одно дополнительное терапевтическое средство, например, описанное ниже. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
Следующим объектом изобретения является способ лечения заболевания. В одном из вариантов осуществления изобретения способ заключается в том, что вводят индивидууму, имеющему указанное заболевание, в эффективном количестве антитело или конъюгат, указанное/указанный в настоящем описании. В одном из указанных вариантов осуществления изобретения способ заключается также в том, что вводят индивидууму в эффективном количестве по меньшей мере одно дополнительное терапевтическое средство, например, описанное ниже. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
Следующим объектом изобретения являются фармацевтические композиции, содержащие любое из антител или любой из конъюгатов, указанных в настоящем описании, предназначенные для применения в любом из указанных выше терапевтических способов. В одном из вариантов осуществления изобретения фармацевтическая композиция содержит любое из антител или любой из конъюгатов, указанных в настоящем описании, и фармацевтически приемлемый носитель. В другом варианте осуществления изобретения фармацевтическая композиция содержит любое из антител или любой из конъюгатов, указанных в настоящем описании, и по меньшей мере одно дополнительное терапевтическое средство, например, указанное ниже.
Антитела и конъюгаты, указанные в настоящем описании, для лечения можно применять либо индивидуально, либо в сочетании с другими агентами. Например, антитело или конъюгат, указанное/указанный в настоящем описании, можно вводить совместно по меньшей мере с одним дополнительным терапевтическим средством.
Такие комбинированные терапии, указанные выше, предусматривают совместное введение (когда два или большее количество терапевтических средств включены в одну и ту же или различные композиции) и раздельное введение, в каждом случае введение антитела, предлагаемого в изобретении, можно осуществлять до, одновременно и/или после введения дополнительного терапевтического средства или адъюванта. Антитела или конъюгаты, предлагаемые в изобретении, можно применять также в сочетании с лучевой терапией.
Антитело или конъюгат, указанное/указанный в настоящем описании (и любое дополнительное терапевтическое средство), можно вводить любыми приемлемыми путями, включая парентеральный, внутрилегочный и интраназальный и при необходимости применять для местной обработки, введения в повреждение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование можно осуществлять любым приемлемым путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, в зависимости, в том числе, от того, является ли лечение кратковременным или хроническим. Можно применять различные схемы дозирования, включая (но, не ограничиваясь только ими) однократное введение или несколько введений в различные моменты времени, болюсное введение и пульсирующую инфузию.
Антитела или конъюгаты, указанные в настоящем описании, можно включать в состав композиций, дозировать и вводить в соответствии с надлежащей клинической практикой. Рассматриваемые в этом контексте факторы включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину нарушения, область введения агента, метод введения, схему введения и другие факторы, известные практикующим медикам. Антитело или конъюгат можно, но это не является обязательным, включать в композицию в сочетании с одним или несколькими другими агентами, которые в настоящее время применяют для лечения рассматриваемого нарушения. Эффективное количество указанных других агентов зависит от количества антитела или конъюгата, присутствующего в композиции, типа нарушения или лечения и других указанных выше факторов. Их, как правило, применяют в таких же дозах и с использованием таких же путей введения, которые указаны в настоящем описании, или в количестве, составляющем от 1 до 99% от дозы, указанной в настоящем описании, или в любой дозе и с помощью любого пути, которые по данным эмпирической/клинической оценки являются пригодными.
Для предупреждения или лечения заболевания приемлемая доза антитела или конъюгата, указанного в настоящем описании (при его применении индивидуально или в сочетании с одним или несколькими другими дополнительными терапевтическими средствами), должна зависеть от типа заболевания, подлежащего лечению, типа антитела или конъюгата, серьезности и течения болезни, применяют ли антитело или конъюгат для превентивных или терапевтических целей, предшествующей терапии, истории болезни пациента и ответа на антитело или конъюгат, а также предписания лечащего врача. Антитело или конъюгат можно вводить пациенту однократно или в виде серий обработок. В зависимости от типа и серьезности заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,5-10 мг/кг) антитела или конъюгата может представлять собой начальную возможную дозу для введения пациенту, например, с помощью одной или нескольких отдельных обработок или с помощью непрерывной инфузии. Одним из примеров типичных суточных доз может являться доза, составляющая от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. При использовании повторных введений в течение нескольких дней или более длительного периода времени, в зависимости от состояния, лечение, как правило, следует продолжать до достижения подавления симптомов заболевания. Одним из примеров доз антитела или конъюгата является доза, составляющая от примерно 0,05 до примерно 10 мг/кг.Так, пациенту можно вводить одну или несколько следующих доз: примерно 0,5, 2,0, 4,0 или 10 мг/кг (или любую их комбинацию). Указанные дозы можно вводить дробно, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати, например, примерно шесть доз антитела). Можно применять начальную повышенную ударную дозу с последующим введением одной или нескольких более низких доз. Однако можно применять другие схемы введения доз. С помощью общепринятых методов и анализов можно легко осуществлять мониторинг действия указанной терапии.
Очевидно, что любые из вышеуказанных комбинаций или терапевтических методов можно применять с использованием иммуноконъюгата, предлагаемого в изобретении, вместо или в дополнение к антителу или конъюгату, указанному в настоящем описании.
VIII. Изделия
Другим объектом изобретения является изделие, которое содержит продукты, применяемые для лечения, предупреждения и/или диагностирования указанных выше нарушений. Изделие представляет собой контейнер и этикетку или листовку-вкладыш в упаковку, которые размещены на контейнере или вложены в него. Приемлемыми контейнерами являются, например банки, пузырьки, шприцы, пакеты для внутривенного раствора и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностирования состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или пузырек, снабженный пробкой, которую можно прокалывать с помощью иглы для подкожных инъекций). По меньшей мере одно действующее вещество в композиции представляет собой антитело или комплекс, указанное/указанный в настоящем описании. На этикетке или листовке-вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния. Кроме того, изделие может включать (а) первый контейнер с находящейся в нем композицией, где композиция содержит антитело или комплекс, указанное/указанный в настоящем описании; и (б) второй контейнер с находящейся в нем композицией, где композиция содержит дополнительное цитотоксическое или иное терапевтическое средство. Согласно этому варианту осуществления изобретения изделие может содержать листовку-вкладыш в упаковку, которая содержит информацию о том, что композиции можно использовать для лечения конкретного состояния. В альтернативном или дополнительном варианте изделие может дополнительно включать второй (или третий) контейнер с фармацевтически приемлемым буфером, таким как бактериостатическая вода для инъекций (БСВИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие продукты, необходимые с коммерческой точки зрения и с точки зрения потребителя, в частности, другие буферы, разбавители, фильтры, иглы и шприцы.
Как должно быть очевидно, любое из указанных выше изделий может включать иммуноконъюгат, предлагаемый в изобретении, вместо или в дополнение к антителу или конъюгату, указанному в настоящем описании.
Все процитированные в настоящем описании ссылки включены в него в качестве ссылки.
Представленные ниже примеры, чертежи и последовательности даны с целью лучшего понимания настоящего изобретения, истинный объем которого представлен в прилагаемой формуле изобретения, Как должно быть очевидно, в представленных процедурах можно осуществлять модификации без отклонения от сущности изобретения.
Примеры
Пример 1
Выделение из мышиной гибридомы и характеризация кДНК. кодирующих VН- и VL-домены мышиного антитела к дигоксигенину и мышиного антитела к биотину IgG1-класса с легкой каппа-цепью
Выделение и характеризация кДНК, кодирующих VH- и VL-домены антител к дигоксигенину, получение РНК, создание ДНК-фрагментов, клонирование ДНК-фрагментов в плазмидах и определение ДНК- и аминокислотных последовательностей описано в WO 2011/003557 и WO 2011/003780 соответственно.
Информацию о белковых и (ДНК) последовательностях VH- и VL-доменов мышиных гаптенсвязывающих антител получали непосредственно из клонов гибридом. Осуществляли следующие экспериментальные стадии (I) выделение РНК из продуцирующих антитело клеток гибридомы, (II) превращение указанной РНК в кДНК, перенос в несущие VH и VL ПЦР-фрагменты и (III) интеграция этих ПЦР-фрагментов в плазмидные векторы для размножения в E.coli и определение их последовательностей ДНК (и выведенного белка).
Получение РНК из клеток гибридомы:
РНК получали из 5×106 экспрессирующих антитело клеток гибридомы, применяя набор RNeasy (фирма Qiagen). В целом, метод состоял в следующем: осажденные клетки отмывали один раз в ЗФР и осаждали, а затем ресуспендировали для лизиса в 500 мкл RLT-буфера (+β-МЕ). Клетки полностью лизировали, пропуская через устройство Qiashredder (фирма Qiagen), а затем подвергали опосредуемой матриксом процедуре очистки (фирма ЕТОН, колонки из набора RNeasy) согласно руководству производителя. После последней стадии отмывки РНК выделяли из колонок в 50 мкл свободной от РНКазы воды. Определяли концентрацию выделенной РНК путем оценки при А260 и А280 разведенных в соотношении 1:20 образцов. Целостность (качество, уровень расщепления) выделенных образцов РНК анализировали с использованием гель-электрофореза РНК в денатурирующих условиях на формамид-агарозных гелях (см. руководство Maniatis). Получали дискретные полосы, соответствующие интактным 18s- и 28s рибосомальным РНК, и целостность (и соотношения интенсивностей полос, составляющие примерно 2:1) указанных полос свидетельствовала о высоком качестве препаратов РНК. Выделенные из гибридома РНК замораживали и хранили при -80°С в виде аликвот.
Получение ДНК-фрагментов, кодирующих VН и VН, с помощью RACE-ПЦР, клонирования этих ДНК-фрагментов в плазмидах и определение их ДНК- и аминокислотных последовательностей
кДНК для последующих (RACE (быстрая амплификация концов ДНК))-ПЦР-реакций получали из препаратов РНК, применяя технологии, описанные в международной заявке на патент РСТ/ЕР 2011/074273. Затем кодирующие VH и VL ПЦР-фрагменты выделяли путем экстракции агарозных гелей и последующей очистки стандартными методами молекулярной биологии. Полученные с помощью PWO очищенные ПЦР-фрагменты встраивали в вектор pCR bluntII topo, используя набор pCR bluntII topo (фирма Invitrogen), точно следуя инструкциям производителя. Продуктами лигирования, полученными в результате Торо-реакций, трансформировали компетентные клетки E.coli Topo10-one-shot. Затем клоны E.coli, содержащие векторы с вставками, содержащими либо VL, либо VH, идентифицировали в колониях на агаровых LB-пластинах с канамицином. Из этих колоний получали плазмиды и присутствие требуемой вставки в векторе подтверждали расщеплением с помощью рестриктазы EcoRI. Поскольку в каркасе вектора присутствуют сайты рестрикции, распознаваемые EcoRI, фланкирующие каждую сторону вставки, плазмиды, несущие вставки, определяли по присутствию высвобождаемых с помощью EcoRI вставок размером примерено 800 пар оснований (для VL) или 600 пар оснований (для VH). Последовательность ДНК и выведенную белковую последовательность VL и VH определяли путем автоматического секвенирования ДНК, используя множество клонов для VH и VL.
Мышиная VL-последовательность антитела к биотину представлена в SEQ ID NO: 40. Мышиная VH-последовательность антитела к биотину представлена в SEQ ID NO: 36.
Мышиная VL-последовательность антитела к дигоксигенину представлена в SEQ ID NO: 08. Мышиная VH-последовательность антитела к дигоксигенину представлена в SEQ ID NO: 04.
Пример 2
Выделение из мышиной гибридомы и характеризация кДНК, кодирующих VН- и VL-домены мышиного антитела к теофиллину IgG1-класса с легкой каппа-цепью
Последовательности антитела к теофиллину получали согласно методу, описанному в примере 1.
Мышиная VL-последовательность антитела к теофиллину представлена в SEQ ID NO: 72. Мышиная VH-последовательность антитела к теофиллину представлена в SEQ ID NO: 68.
Пример 3
Гуманизация VН- и VL-доменов мышиного антитела к дигоксигенину и антитела к биотину
Создание гуманизированных вариантов дигоксигенинсвязывающего антитела подробно описано в WO 2011/003557 и WO 2011/003780. Мышиное биотинсвязывающее антитело ггшМЗЗ гуманизировали сходным методом следующим образом:
Создание и характеризация кодирующих последовательностей и аминокислотных последовательностей, которые содержат VH- и VL-домены мышиного антитела к биотину IgG1-класса с легкой каппа-цепью, из мышиной гибридомы описано в WO 2011/003557 и WO 2011/003780. С учетом этой информации создавали соответствующее гуманизированное антитело к биотину (huМ33), основанное на комбинации каркасных участков человеческих зародышевых линий IGHV1-69-02 и IGKV1-27-01. Для VL было необходимо интегрировать любую обратную мутацию в каркасный участок человеческой линии IGKV1-27-01 и человеческий J-элемент зародышевой линии IGKJ2-01. Основой гуманизированного VH являлась человеческая зародышевая линия IGHV1-69-02 и человеческий J-элемент зародышевой линии IGHJ4-01-3. Интродуцировали две обратные мутации в каркасный участок 1 в положение 24 (A24S) и в каркасный участок 3 в положение 73 (К73Т). Аминокислотная последовательность гуманизированного VH представлена в SEQ ID NO: 44, а аминокислотная последовательность гуманизированного VL представлена в SEQ ID NO: 48.
Пример 4
Гуманизация VН- и VL-доменов мышиного антитела к теофиллину
Мышиное теофиллинсвязывающее антитело гуманизировали следующий образом: гуманизированное антитело к теофиллину создавали на основе комбинации каркасных участков человеческих зародышевых линий IGHV4-31-02 и IGKV2-30-01. Основой гуманизированного VH являлась человеческая зародышевая линия IGHV4-31-02 и человеческий J-элемент зародышевой линии IGHJ4-01-3. Интродуцировали одну обратную мутацию в каркасный участок 3 в положение 71 (V71R). Основой гуманизированного VL являлась человеческая зародышевая линии IGHV2-30-01 и человеческий J-элемент зародышевой линии IGKJ2-01. Интродуцировали одну обратную мутацию в каркасный участок 2 в положение 46 (R46L). Аминокислотная последовательность гуманизированного VH представлена в SEQ ID NO: 76, а аминокислотная последовательность гуманизированного VL представлена в SEQ ID NO: 80.
Пример 5
Кристаллизация и оценка структуры в рентгеновских лучах связывающей области Fv-фрагмента мышиного антитела к дигоксигенину в присутствии дигоксигенина и связывающей области Fv-фрагмента мышиного антитела к биотину в присутствии биотина
Определение структуры Fab-фрагмента дигоксигенинсвязывающего антитела подробно описано в WO 2011/003557 и WO 2011/003780, а также опубликовано (3RA7) у Metz S. и др., Proc. Natl. Acad. Sci. USA 108, 2011, cc. 8194-8199.
Определяли структуру мышиного антитела к биотину. Для этого создавали Fab-фрагменты путем расщепления протеазой очищенных IgG и последующей очистки с применением хорошо известных в данной области методов (расщепление папаином).
Для кристаллизации аро-формы концентрировали Fab-фрагмент (очищенные Fab) в 20 мМ His-HCl, 140 мМ NaCl, рН 6,0 до достижения концентрации 13 мг/мл. В экспериментах по осуществлению диффузии паров методом «сидящей капли» кристаллизационные капли создавали при 21°С путем смешения 0,2 мкл раствора белка с 0,2 мкл раствора, находящегося в резервуаре. Кристаллы образовывались из 0,1М Трис, рН 8,5, 0,01М хлорида кобальта, 20% поливинилпирролидона К15 в течение 5 дней и вырастали до конечного размера 0,3 мм × 0,06 мм × 0,03 мм в течение 8 дней.
Кристаллы собирали с использованием 15% глицерина в качестве криопротектанта и затем мгновенно замораживали в жидком N2. Дифракционные изображения собирали с помощью детектора Pilatus 6М при температуре 100К с использованием канала пучка XI0SА швейцарского источника синхротронного излучения (Swiss Light Source) и обрабатывали с помощью программ XDS (Kabsch W., J. Appl. Cryst. 26, 1993, cc. 795-800) и масштабировали с помощью SCALA (предоставленных фирмой BRUKER AXS), получая данные с разрешением 2,22 Å. Указанный кристалл Fab-фрагмента относится к моноклинической пространственной группе Р21 с размерами ячейки а=90,23Å, b=118,45Å, с=96,79Å и β=117,53° и он содержит четыре молекулы Fab на одну кристаллографическую асимметричную элементарную ячейку (см. таблицу 3).
Применяли стандартные кристаллографические программы из набора программ ССР4 с использованием входа 3PQP PDB в качестве поисковой модели для определения структуры методом молекулярного замещения, для расчета электронной плотности и для уточнения рентгенографической структуры (ССР4, Collaborative Computational Project, Acta Crystallogr. D, 1994, cc. 760-763). Структурные модели преобразовывали в электронную плотность с помощью программы COOT (Emsley Р. и др., Acta Crystallogr. D Biol. Crystallogr. 60, 2010, cc. 486-501). Координаты утоняли с помощью программ REFMAC5 (Murshudov G.N. и др., Acta Crystallogr. D Biol. Crystallogr. 53, 1997, cc. 240-255) и autoBUSTER (Global Phasing Ltd.).
Для кристаллизации Fab-фрагмента в комплексе с биотиновым производным аро-кристаллы Fab-фрагмента, которые использовали в экспериментах по пропитке, выделяли из 0,8М янтарной кислоты в течение периода времени до 3 дней после скрининга и выращивали в течение 5 дней до конечного размера 0,25 мм × 0,04 мм × 0,04 мм. Биоцитинамид растворяли в воде до концентрации 100мМ. Затем соединение разводили до рабочей концентрации 10мМ в растворе для кристаллизации и наносили на кристаллы в кристаллизационной капле. Кристаллы отмывали трижды с помощью 2 мкл 10мМ раствора соединения и в завершение инкубировали в течение 16 ч с биоцитинамидом при 21°С.
Кристаллы собирали с использованием 15% глицерина в качестве криопротектанта и затем мгновенно замораживали в жидком N2. Дифракционные изображения собирали с помощью детектора Pilatus 6М при температуре 100К с использованием канала пучка XI0SА швейцарского источника синхротронного излучения (Swiss Light Source) и обрабатывали с помощью программ XDS (Kabsch W., J. Appl. Cryst. 26, 1993, cc. 795-800) и масштабировали с помощью SCALA (предоставленных фирмой BRUKER AXS), получая данные с разрешением 2,35Å. Указанный кристалл Fab-фрагмента относится к моноклинической пространственной группе Р21 с размерами ячейки а=89,09Å, b=119,62Å, с=96,18Å и β=117,15° и он содержит четыре молекулы Fab на одну кристаллографическую асимметричную элементарную ячейку (см. таблицу 4).
Применяли стандартные кристаллографические программы из набора программ ССР4 с использованием входа 3PQP PDB в качестве поисковой модели для определения структуры методом молекулярного замещения, для расчета электронной плотности и для уточнения рентгенографической структуры до достижения разрешения 2,5Å (ССР4, Collaborative Computational Project, Acta Crystallogr. D, 1994, cc. 760-763). Структурные модели преобразовывали в электронную плотность с помощью программы COOT (Emsley Р. и др., Acta Crystallogr. D Biol. Crystallogr. 60, 2010, cc. 486-501). Координаты утоняли с помощью программ REFMAC5 (Murshudov G.N. и др., Acta Crystallogr. D Biol. Crystallogr. 53, 1997, cc. 240-255) и autoBUSTER (Global Phasing Ltd.).
Результаты экспериментального определения структуры представлены на фиг. 33. Кристаллическая форма комплекса содержит четыре независимых комплекса биоцитинамид:РаЬ-фрагмент к биотину в ассиметричной структурной единице, при этом биоцитинамид связан со всеми молекулами Fab сходным образом. Биоцитидинамид связан в кармане, образованном CDR 1 и CDR 3 тяжелой цепи и всеми 3 CDR легкой цепи. Связывающий карман лиганда определяется остатками ASN29, ASP31, THR32, РНЕ33, GLN35, TRP99 и TRP106 тяжелой цепи и ASN31, TYR32, LEU33, SER34, TYR49, SER50, РНЕ91 и TYR96 легкой цепи. Головная биотиновая группа образует водородные связи с остатками CDR2 и CDR1 на одном конце кармана: N3 биоцитинамида взаимодействует с кислородом гидроксила Ser50, в то время как O22 находится в контакте с атомом азота каркасного амида того же самого остатка. Кроме того, O22 биоцитинамида также связан водородной связью с кислородом гидроксильной группы Ser34. Кроме этого, имеют место гидрофобные взаимодействия между биоцитинамидом и ароматическими боковыми цепями, «выстилающими» связывающий карман. Амидная связь на конце алифатического (СН2)4-конца биотина накладывается на РНЕ33 CDR1 тяжелой цепи и стабилизируется посредством дополнительной водородной связи с атомом азота амида РНЕ33 каркаса и с Asp31. В результате этого атом азота амида, который является сайтом связывания с активной субстанцией, располагается таким образом, что атомы, следующие за атомом азота, направлены от связывающего кармана в сторону растворителя.
Результаты экспериментального определения связывающей области с разрешением 2,5 Å позволяют охарактеризовать механизм связывания лиганда с его антителом, что является предпосылкой для более подробного моделирования и дальнейшего улучшения методами белковой инженерии рекомбинантных биотинсвязывающих модулей.
Пример 6
Определение и создание антигаптенового антитела с интродуцированными функциональностями для ковалентной конъюгации
Дериватизацию гуманизированных VH- и VL-последовательностей антигаптенового антитела, описанного выше, осуществляли для создания соединений, которые обеспечивают ковалентное связывание антигенов/гаптенов с антителом в определенном положении.
Установленную экспериментальным путем структуру Fab-фрагмента к дигоксигенину, связанного с дигоксигенином (3RA7) (Metz S. и др., Proc. Natl. Acad. Sci. USA 108, 2011, cc. 8194-8199) использовали для идентификации положения, в котором изменения позволяют проходить сайт-направленной реакции сочетания между антителом и образующим с ним комплекс антигеном/гаптеном. Структуру Fab-фрагмента к биотину, связанного с биоцитинамид (см. пример 5), применяли для подтверждения правильного положения интродуцированного остатка цистеина для фрагмента биотинсвязывающего антитела и доказательства применимости в целом идентифицированного(ых) положения(й).
Подлежащие мутации положения должны одновременно удовлетворять двум требованиям: (I) положения, в которых происходит сочетание, должны находиться вблизи области связывания для использования связанного с расположением антигена/гаптена действия на направленное сочетание, и (II) мутация и положение, в котором происходит сочетание, должны быть расположены так, чтобы не оказывать влияния на само связывание антигена/гаптена. Эти требования к поиску приемлемого положения de facto являются «противоречивающими» друг другу, поскольку требованию (I) наилучшим образом соответствует положение, близкое к сайту связывания, а требование (И) наиболее успешно достигается при использовании положений, отдаленных от сайта связывания.
Несмотря на эти фактически исключающие друг друга требования, при создании изобретения удалось идентифицировать положения, которые можно подвергать мутации, не влияя на расположение гаптена, и которые тем не менее позволяют одновременно осуществлять направленное ковалентное сочетание гаптенилированного соединения.
Первое положение локализовано в положении VH52b или VH53 согласно нумерации Кэбота в зависимости от фактической длины CDR2 соответствующего антитела. В структуре антитела к дигоксигенину гаптен связан в глубоком кармане, образованном гидрофобными остатками. В указанном кристаллографическом анализе применяли флуоресцентный конъюгат дигоксигенин-Су5, в котором флуорофор, а также линкер между дигоксигенином и Су5 не были видны в структуре из-за высокой гибкости и являющегося результатом этого нарушения в кристалле. Однако линкер и Су5 присоединяли к положению O32 дигоксигенина, которое указывает направление CDR2 тяжелой цепи. Расстояние между O32 дигоксигенина (см. выше) и Сα аминокислотного остатка в положении 52b согласно Кэботу составляет примерно 10,5Å.
Замена аминокислоты в положении VH52b/VH53 на Cys позволяла получать производные антитела, последовательности вариабельных областей тяжелых цепей которых представлены в SEQ ID NO: 20 и 28 для антитела к дигоксигенину-VН52bС, SEQ ID NO: 84 и 92 для антитела к теофиллину-VH53С, SEQ ID NO: 52 и 60 для антитела к биотину-VH53C и SEQ ID NO: 108 для антитела к флуоресцеину-VH52bC.
Дополнительное положение, идентифицированное в качестве точки модификации, представляет собой положение VH28 согласно нумерации Кэбота.
Таким образом, при создании изобретения интродуцировали цистеин в положение VH28 по Кэботу. Замена аминокислоты в положении VH28 на Cys позволяла получать производные антитела, последовательности вариабельных областей тяжелых цепей которых представлены в SEQ ID NO: 124 и 132 для антитела к дигоксигенину-VH28C, SEQ ID NO: 156 и 164 для антитела к теофиллину-VH28C, SEQ ID NO: 140 и 148 для антитела к биотину-VH28C и SEQ ID NO: 116 для антитела к флуоресцеину-VH28C.
Было установлено, что одно из этих положений представляет собой «универсальное» положение, т.е. положение, приемлемое для любого антитела и, в результате не требуется начинать каждый раз с исследования нового антитела, подлежащего модификации, путем получения кристаллической структуры и определения соответствующего положения, в котором может происходить ковалентное сочетание, связанное с положением гаптена.
Мутацию VH52bC или VH53C соответственно (согласно нумерации вариабельной области тяжелой цепи по Кэботу) можно применять для каждого гаптенсвязывающего антитела (антигаптеновое антитело). Даже несмотря на то, что антитела и структуры их карманов, в которых происходит связывание, значительно различаются, было установлено, что мутацию VH52bC/VH53C можно применять для ковалентного присоединения антигенов/гаптенов к антителам, которые связываются с дигоксигенином, биотином, флуоресцеином, а также теофиллином.
Связывающиеся субстанции, которые состоят из этих последовательностей, можно экспрессировать и очищать с использованием стандартной хроматографии на белке А и гель-фильтрации (см. пример 7). Образовавшиеся молекулы были полностью функциональными и сохраняли такую же аффинность к соответствующим гаптенам, которая была характерна для их родительских немодифицированных молекул. Это продемонстрировано в экспериментах с использованием поверхностного плазмонного резонанса (ППР) (см. пример 9).
Пример 7
Состав, экспрессия и очистка рекомбинантных антител к гаптенам
Вариабельные области мышиных и гуманизированных антител к гаптенам объединяли с константными областями человеческого происхождения с получением моно- или биспецифических химерных или гуманизированных антител.
Для создания моноспецифических гуманизированных антител к гаптенам и биспецифических гуманизированных антител к гаптенам, которые специфически связывают гаптен, а также другую, отличную от гаптена мишень (например, рецепторные тирозинкиназы или IGF-1R), требуется (I) конструирование и определение аминокислотных и нуклеотидных последовательностей таких молекул, (II) экспрессия этих молекул в трансфектированных клетках млекопитающих в культуре и (III) очистка этих молекул из супернатантов трансфектированных клеток. Эти стадии осуществляли согласно методам, описанным ранее в РСТ/ЕР2011/074273.
В целом, для создания гуманизированного антитела IgG-класса, которое имеет связывающую специфичность (исходного) мышиного антитела к гаптену, гуманизированную VH-последовательность сливали в рамке считывания с N-концом конструкции СН1-шарнир-СН2-СН3 человеческой Fc-области IgG1-подкласса. Аналогично этому, гуманизированную VL-последовательность сливали в рамке считывания с N-концом человеческой константной области CLKanna.
Для создания производных биспецифического антитела, которые содержат гаптенсвязывающую специфичность, а также специфичности к другим мишеням, scFv или Fab-фрагмент антитела к гаптену сливали в рамке считывания с С-концом тяжелой цепи описанных ранее антител. Во многих случаях применяемый scFv антитела к гаптену дополнительно стабилизировали путем описанной ранее интродукции дисульфидной связи VH44-VL100 (например, Reiter Y., и др., Nature biotechnology 14, 1996, cc. 1239-1245).
Экспрессионные плазмиды
Экспрессионные плазмиды, содержащие кассеты экспрессии для экспрессии тяжелых и легких цепей, собирали по отдельности в экспрессионных векторах, применяемых в клетках млекопитающих.
Тем самым объединяли генные сегменты кодирующие индивидуальные элементы, как описано выше.
Общая информация, касающаяся нуклеотидных последовательностей человеческих легких и тяжелых цепей, на основе которой можно выводить наиболее часто встречающиеся кодоны, представлена у: Kabat Е.А., и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991, NIH Publication No 91-3242.
Транскрипционная единица легкой к-цепи состоит из следующих элементов:
- немедленно-ранний энхансер и промотор из человеческого цитомегаловируса (hCMV),
- синтетический 5'-UT, включающий последовательность Козака,
- сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включая интрон сигнальной последовательности,
- клонированная кДНК вариабельной области легкой цепи, созданная с уникальным сайтом рестрикции BsmI на 5'-конце и донорным сайтом сплайсинга и уникальным сайтом рестрикции NotI на 3'-конце,
- ген κ-цепи геномной человеческой константной области, включая интрон 2 энхансера мышиного Ig-κ (Picard D. и Schaffner W. Nature 307, 1984, cc. 80-82), и
- сигнальная последовательность полиаденилирования («поли А») κ-цепи человеческого иммуноглобулина.
Транскрипционная единица тяжелой γl-цепи состоит из следующих элементов:
- немедленно-ранний энхансер и промотор из человеческого цитомегаловируса (hCMV),
- синтетический 5'-UT, включающий последовательность Козака,
- модифицированная сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включая интрон сигнальной последовательности,
- клонированная кДНК моноспецифической вариабельной области тяжелой цепи или клонированная кДНК биспецифического слияния scFv-вариабельная область тяжелой цепи, созданная с уникальным сайтом рестрикции BsmI на 5'-конце и донорным сайтом сплайсинга и уникальным сайтом рестрикции NotI на 3'-конце,
- ген тяжелой γl-цепи геномной человеческой константной области, включая μ-энхансер мышиного Ig (Neuberger M.S., EMBO J. 2, 1983, cc. 1373-1378), и
- сигнальная последовательность полиаденилирования («полиА») γl-цепи человеческого иммуноглобулина.
Помимо кассеты экспрессии легкой κ-цепи или тяжелой γl-цепи эти плазмиды содержат
- ген, обусловливающий устойчивость к гигромицину,
- сайт инициации репликации, oriP, вируса Эпштейна-Барра (EBV),
- сайт инициации репликации из вектора pUC18, который обеспечивает репликацию этой плазмиды в Е. coli, и
- ген β-лактамазы, который обусловливает устойчивость к ампициллину в Е.coli.
Методы рекомбинантной ДНК
Клонирование осуществляли с использованием стандартных методов клонирования, описанных у Sambrook и др., 1999 (выше). Все применяемые в молекулярной биологии реагенты поступают в продажу (если не указано иное) и их применяли согласно инструкциям производителя.
ДНК, содержащую кодирующие последовательности, мутации или дополнительные генетические элементы, синтезировали на фирме Geneart AG, Регенсбург.
ДНК-последовательности определяли путем секвенирования двух цепей, которое осуществляли на фирме SequiServe (SequiServe GmbH, Германия).
Анализ последовательностей ДНК и белков и использование данных о последовательностях
Применяли программу Vector NTI Advance suite, версия 9.0 для создания, картирования, аннотации и иллюстрации последовательностей.
Экспрессия антигаптеновых антител и их производных
Антигаптеновые антитела экспрессировали путем кратковременной трансфекции клеток почки человеческого эмбриона 293 (НЕК293) в суспензии. Для этого создавали легкие и тяжелые цепи соответствующих моно- или биспецифических антител в экспрессионных векторах, несущих прокариотические или эукариотические маркеры селекции, согласно изложенному выше методу. Эти плазмиды амплифицировали в E.coli, очищали и затем применяли для кратковременных трансфекций. Использовали стандартные методики культивирования клеток, применяемые при работе с клетками, которые описаны в Current Protocols в: Cell Biology, под ред. Bonifacino J.S., Dasso М., Harford J.В., Lippincott-Schwartz J. и Yamada K.M., изд-во John Wiley & Sons, Inc., 2000.
Клетки культивировали в пригодной для экспрессии среде при 37°С/8% СО2. В день трансфекций клетки высевали в свежую среду с плотностью 1-2×106 жизнеспособных клеток/мл. ДНК-комплексы с реагентами для трансфекций получали в среде Opti-MEM I (фирма Invitrogen, США), содержащей 250 мкг плазмидной ДНК тяжелой и легкой цепи в молярном соотношении 1:1 для трансфекций конечного объема 250 мл. Содержащие моноспецифическое или биспецифическое антитело супернатанты клеточных культур осветляли через 7 дней после трансфекций путем центрифугирования при 14000 g в течение 30 мин и фильтрации через стерильный фильтр (0,22 мкм). Супернатанты хранили при -20°С до очистки.
Для определения концентрации антител и их производных в супернатантах клеточных культур применяли аффинную ЖХВР-хроматографию. Для этого супернатант клеточной культуры, содержащий моно- или биспецифическое антитело или его производные, которые связываются с белком А, наносили на колонку Applied Biosystems Poros А/20 в растворе, содержащем 200 мМ КН2РО4, 100мМ цитрат натрия, рН 7,4. Элюцию из продукта, полученного после хроматографии, осуществляли, используя раствор, содержащий 200 мМ NaCl, 100мМ лимонную кислоту, рН 2,5. Использовали ЖХВР-систему UltiMate 3000 (фирма Dionex). Элюированный белок оценивали количественно по УФ-абсорбции и путем интегрирования площадей пиков. Очищенное антитело в виде IgG1 служило в качестве стандарта.
Очистка антигаптеновых антител, которые связываются с дигоксигенином, флуоресцеином, теофиллином или биотином
Через 7 дней после трансфекций собирали супернатанты клеток НЕК 293. Входящее в них рекомбинантное антитело (или их производные) очищали из супернатанта с использованием двух стадий с применением аффинной хроматографии на белок A-Sepharose™ (фирма GE Healthcare, Швеция) и гель-фильтрации с использованием Superdex200. В целом, метод состоял в следующем: содержащие антитело осветленные очищенные супернатанты культур вносили на колонку MabSelectSuRe, заполненную белком А (5-50 мл), уравновешенную ЗФР-буфером (10 мМ Na2HPO4, 1 мМ КН2РO4, 137 мМ NaCl и 2,7 мМ КСl, рН 7,4). Несвязанные белки отмывали уравновешивающим буфером. Антитела (или их производные) элюировали 50 мМ цитратным буфером, рН 3,2. Содержащие белок фракции нейтрализовали с помощью 0,1 мл 2М Трис-буфера, рН 9,0. Затем элюированные белковые фракции объединяли, концентрировали с использованием фильтрующей центрифуги Amicon Ultra (MWCO: 30 К, фирма Millipore) и вносили на колонку для гель-фильтрации Superdex200 HiLoad 26/60 (фирма GE Healthcare, Швеция), уравновешенную 20 мМ гистидином, 140 мМ NaCl, рН 6,0. Определяли концентрацию белка очищенных антител и производных, оценивая оптическую плотность (ОП) при 280 нм, применяя ОП, измеренную при 320 нм, для коррекции фона, используя коэффициент молярной экстинции, который рассчитывали на основе аминокислотной последовательности согласно методу, описанному у Расе и др., Protein Science 4, 1995, cc. 2411-2423. Мономерные фракции антитела объединяли, мгновенно замораживали и хранили при -80°С. Часть образцов применяли для последующего аналитического анализа и характеризации белков.
Гомогенность антител подтверждали с помощью ДСН-ПААГ в присутствии восстановителя (5 мМ 1,4-дитиотреитол) и без него и осуществляли окрашивание кумасси бриллиантовым голубым. Применяли систему геля NuPAGE® Pre-Cast (фирма Invitrogen, США) согласно инструкции производителя (4-20% Трис-глициновые гели).
После осуществления ДСН-ПААГ в восстанавливающих условиях идентифицировали полипептидные цепи, родственные IgG, с кажущимся молекулярным размером, соответствующим рассчитанным молекулярным массам. Уровни экспрессии всех конструкций анализировали с помощью белка А. Средние выходы белков в указанных экспериментах с использованием неоптимизированной кратковременной экспрессии составляли от 6 до 35 мг очищенного белка на литр супернатанта клеточной культуры.
Пример 8
Создание гаптенилированных соединений
Для создания соединений, пригодных для нековалентного комплексообразования, а также для конъюгации (ковалентное комплексообразование) необходимо (I) сшивать гаптен через приемлемые линкеры с соединением (т.е. с «полезным грузом») и (И) гарантировать, что сочетание происходит так, что позволяет соединению сохранять его функциональность.
а) Конъюгаты гаптен-полипептид:
Любой полипептид можно дериватизировать на N- или С-конце или в положении в боковой цепи с помощью гаптена, несущего линкер, если реакционноспособный остаток, такой как цистеиновый остаток, можно интродуцировать в линкер между полипептидом и гаптеном. Предпочтительно полипептид может содержать не встречающиеся в естественных условиях аминокислотные остатки.
Примеры гаптенилированных соединений перечислены ниже в таблице 5.


Схема процедуры сочетания и применяемые реагенты представлены на фиг. 30, 31 и 32.
Примером полипептида, который применяли в настоящем изобретении, является производное агониста рецептора нейропептид-2. Указанный полипептид представляет собой пептид тирозин-тирозин или короткий аналог панкреатического пептида YY PYY(3-36), описанный в WO 2007/065808. Его дигоксигенилировали через аминокислотный остаток лизина в положении 2. Дигоксигенилированный PYY- полипептид обозначали ниже как DIG-PYY вне зависимости от связывания боковой цепи полипептида с остатком дигоксигенина.
Другими примерами соединений являются непептидные флуоресцентные красители Су5, Dy636 и MR121. Эти соединения можно сшивать с содержащими дигоксигенин или биотин линкерными системами, используя химию на основе сложного NHS-эфира.
I) Общий метод создания выведенного из PYY(3-36) полипептида-предшественника конъюгации
Стандартный протокол для производных PYY на автоматизированном мульти-синтезаторе:


Ас-IК-Рqа-R(Рbf)Н(Тrt)Y(tВu)LN(Тrt)W(Вос)VТ(Вut)R(Рbf)Q(Тrt)-МеАrg(Мtr)-Y(tВu)-смола TentaGel S RAM (SEQ ID NO: 176)
Производное РYY(3-36)-полипептида (обозначенное как PYY) получали путем автоматизированного твердофазного синтеза последовательности связанного со смолой пептида Ac-IK(Mmt)-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(tBu)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-cмoлa TentaGel-RAM. Пептидный синтез осуществляли на мульти-синтезаторе SYRO I (фирма MultiSynTech GmbH, Виттен) с системой интенсивного перемешивания, используя Fmoc-химию. Применяя смолу TentaGel RAM (загрузка: 0,25 ммоля/г; фирма Rapp Polymers, Германия), осуществляли сборку пептидной последовательности с использованием итерационных циклов последовательного сочетания соответствующих Fmoc-аминокислот (масштаб: 0,05 ммоля). В каждой стадии сочетания N-концевую Fmoc-группу удаляли путем обработки смолы (5 мин + 12 мин) 30%-ным раствора пиперидина в диметилформамиде (ДМФ). Сочетания осуществляли, применяя защищенные с помощью Fmoc аминокислоты (0,25 ммоля), активированные TBTU (0,25 ммоля) в положениях 1, 13, 14и 15, и 50%-ного раствора NMM в NMP (двойное сочетание 2×30 мин при интенсивном перемешивании). Для активации всех остальных положений применяли HATU (0,25 ммоля) и 50%-ный раствор NMM в NMP. Между каждой стадией сочетания смолу промывали 5×1 мин ДМФ. После синтеза линейного предшественника осуществляли ацетилирование путем взаимодействия с ДМФ/DIРЕА/Ас2О в течение 15 мин и промывки с помощью ДМФ, получая Ас-IK(Mmt)-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tВu)-смола TentaGel S RAM.
Для удаления Mmt-группы пептид обрабатывали DCM/HFIP/TFE/TIS (6.5:2:1:0.5), 2×1 ч, получая после промывки ДМФ частично деблокированный предшественник
Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tВu)-смола TentaGel S RAM.
Ac-PYY(PEG3-Dig)/Ac-IK(PEG3-Dig)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 177)
Описание синтеза см. также в WO 2012/093068.
К раствору пептида Ac-IK(H2N-TEG)-Pqa-RHYLNWVTRQ(N-метил)RY (100 мг, 40,6 ммоля) в воде (5 мл) добавляли дигоксигенин-3-карбоксиметил-N-гидроксисукцинимид (26,6 мг, 48,8 ммоля), растворенный в NMP (1 мл). Добавляли триэтиламин (13,6 мкл, 97,6 мкмоля) и смесь переворачивали в течение 2 ч при комнатной температуре. Затем вносили дополнительную порцию дигоксигенин-3-карбоксиметил-N-гидроксисукцинимида (13,3 мг, 24,4 мкмоля), растворенного в NMP (0,5 мл) и триэтиламина (6,8 мкл, 48,8 мкмоля) и раствор перемешивали в течение 15 ч. Неочищенный продукт очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрил/вода, содержащий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), с получением пептида Dig-PYY (29 мг, 10,0 мкмолей, 25%) в виде бесцветного твердого вещества. Для аналитической характеризации пептидного производного применяли указанные ниже условия, при этом были получены следующие данные: аналитическая ЖХВР: tR=11,3 мин (колонка Merck Chromolith Performance RP-18e, 100×4,6 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК, 80:20, 25 мин); ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для C140H207N35O32: 2892,4; обнаружено: 964,9 [М+2Н]2+, рассчитано: 965,1. До момента получения комплекса с антителом, дигоксигенилированный пептид хранили в виде лиофилизата при 4°С.На фиг. 2В представлена структура DIG-moPYY.
II) Создание полипептидов, выведенных из дигоксигенилированных PYYO-36), с содержащим цистеин линкером
Ac-IK(PEG3-Cys-4Abu-NH2)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 178)
Используя в качестве предшественника Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-cмола TentaGel S RAM (SEQ ID NO: 176) пептидный синтез продолжали, используя следующие стадии:
Осуществляли вручную двойное сочетание с 66,5 мг (3 экв.) Fmoc-12-амино-4,7,10-триоксадодекановой кислоты (PEG3-спейсер), 57,0 мг (3 экв.) HATU и 16,7 мкл (3 экв.) NMM в 1,2 мл ДМФ, 2×30 мин. После промывки ДМФ (5×1 мин) Fmoc-группу отщепляли 30% Pip/ДМФ и смолу промывали ДМФ, используя стандартный протокол.
Следующие двойные сочетания Fmoc-Cys(Trt)-OH и Fmoc-4-Abu-OH осуществляли автоматически с использованием синтезатора SYRO 1 согласно протоколу, описанному в стандартном протоколе для производных PYY в автоматическом мульти-синтезаторе. И, наконец, смолу отмывали с помощью ДМФ, EtOH, МТВЕ и сушили
Отщепление от смолы осуществляли с помощью 8 мл ТФК/тиоанизол/тиокрезол/TIS (95:2,5:2,5:3) в течение 4 ч. Раствор, в котором проходило расщепление, фильтровали и концентрировали до 1-2 мл и пептид осаждали, добавляя МТВЕ. Твердое вещество белого цвета собирали центрифугированием, дважды промывали МТВЕ и сушили.
Неочищенный продукт очищали препаративной ЖХВР с обращенной фазой, получая бесцветное твердое вещество. Выход: 28,0 мг.


m/z: рассчитано для C122H185N37O28S=2650,13; обнаружено 2650,3
Ac-IK(PEG3-Cys-4Abu-Dig)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEP ID NO: 179)
К раствору, содержащему 15 мг пептида Ac-IK(PEG3-Cys-4Abu-NH2)-Pqa-RHYLNWVTRQ-MeArg-Y-амид (SEQ ID NO: 180) в 50 мкл ДМСO, добавляли 250 мкл ЗФР-буфера, рН 7,4 и раствор перемешивали в течение ночи. Рбразование димера контролировали с помощью ЖХВР. Через 18 ч образовывалось примерно 90% димера.
К этому раствору добавляли 7,3 мг дигоксигенин-3-карбоксиметил-N-гидроксисукцинимида (Dig-OSu), растворенного в 100 мкл ДМФ, и смесь перемешивали в течение 5 ч при комнатной температуре. Затем добавляли дополнительную порцию 16,9 мг Dig-OSu, растворенного в 100 мкл ДМФ, и перемешивали в течение 2 ч. Добавляли дополнительное количество 6,9 мг в 100 мкл ДМФ и перемешивали в течение 18 ч. Для восстановления димера добавляли ТСЕР, перемешивали в течение 3 ч и раствор применяли непосредственно для очистки с помощью препаративной ЖХВР с обращенной фазой.
Аналитические данные:
Применяли такие же условия, которые описаны для SEQ ID NP: 178.
Градиент для препаративной ЖХВР: 38-58% Б в течение 30 мин.
Выход: 5,3 мг
m/z: рассчитано для C147H219N37O34S=3080,7; обнаружено: 3079,8
PEG3-IK(PEG3-Cys-4Abu-Dig)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEP ID NP: 180)
Автоматизированный твердофазный синтез связанной со смолой PYY-последовательности:
PEG2-IK(ivDde)-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(tBu)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-cмола TentaGel-RAM SEQ ID NО: 181).
Пептидный синтез осуществляли согласно принятым протоколам (FastMoc 0,25 ммоля) в автоматизированном пептидном синтезаторе Applied Biosystems ABI 433А, используя Fmoc-химию. Применяя смолу TentaGel RAM (загрузка: 0,18 ммоля/г; фирма Rapp Polymers, Германия), осуществляли сборку пептидной последовательности с использованием итерационных циклов последовательного сочетания соответствующих Fmoc-аминокислот (масштаб: 0,25 ммоля). В каждой стадии сочетания N-концевую Fmoc-группу удаляли путем обработки смолы (3×2,5) 20%-ным раствора пиперидина в N-метилпирролидоне (NMP). Сочетания осуществляли, применяя защищенные с помощью Fmoc аминокислоты (1 ммоль), активированные HBTU/HGBt (1 ммоль каждого) и DIPEA (2 ммоля) в ДМФ (интенсивное перемешивание 45-60 мин). В синтезированные последовательности включали аминокислотные производные Fmoc-Lys(ivDde)-OH, Fmoc-Pqa-OH и Fmoc-N-Me-Arg(Mtr)-OH в положениях 2, 3 и 14 соответственно. После каждой стадии сочетания непрореагировавшие аминогруппы кэпировали обработкой смесью Ас2O (0,5М), DIPEA (0,125М) и HPBt (0,015М) в NMP (интенсивное перемешивание 10 мин). Между каждой стадией смолу интенсивно промывали N-метилпирролидоном и ДМФ. При осуществлении двойного автоматизированного сочетания включали имеющие стерические помехи аминокислоты. Для этой цели смолу обрабатывали дважды 1 ммолем активированного конструктивного элемента без стадии кэпирования между циклами сочетания. После завершения синтеза последовательности-мишени N-концевую Fmoc-группу удаляли с помощью 20% пиперидина в NMP и 2-[2-(метоксиэтокси)этокси]уксусную кислоту (4 ммоля) сшивали после активации с помощью HBTU/HPBt (2 ммоля каждого) и DIPEA (4 ммоля). Затем смолу переносили в фриттрованный реактор для твердофазного синтеза для дополнительных манипуляций.
PEG2-IK(PEG3-Cys-Abu-NH2)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 182)
Для удаления ivDde-группы давали набухать содержащей пептид смоле (PEG2-IK(ivDde)-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(tBu)R(Pbf)Q(Trt)-МеАrg(Мtr)-Y(tВu)-смола TentaGel-RAM; SEQ ID NO: 181) в ДМФ в течение 30 мин, а затем обрабатывали 2%-ным раствором гидрата гидразина в ДМФ (60 мл) в течение 2 ч. После интенсивной промывки смолы изопропанолом и ДМФ добавляли раствор Fmос-12-амино-4,7,10-триоксадодекановой кислоты (PEG3-спейсер) (887 мг, 2 ммоля), HBTU (2 ммоля), HOBt (2 ммоля) и 2М диизопропилэтиламина (2 мл, 4 ммоля) в ДМФ (3 мл) и смесь встряхивали в течение 3 ч. Смолу промывали ДМФ и Fmoc-группу отщепляли смесью 20% пиридина в ДМФ. Затем смолу обрабатывали смесью Fmoc-Cys(Trt)-OH (1,2 г; 2 ммоля), HBTU/HOBt (2 ммоля каждого) и DIPEA (4 ммоля) в течение 2 ч. Смолу промывали ДМФ и Fmoc-группу отщепляли смесью 20% пиридина в ДМФ и сшивали с Fmoc-4-аминомасляной кислотой (0,65 г, 2 ммоля), активированной HBTU/HOBt (2 ммоля каждого) и DIPEA (4 ммоля) (2 ч). N-концевую Fmoc-группу удаляли с помощью 20% пиперидина в NMP и смолу повторно промывали ДМФ. Затем смолу обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (19 мл:0,5 мл:0,5 мл) в течение 2,5 ч. Раствор, в котором проходило расщепление, фильтровали и пептид осаждали, добавляя холодный (0°С) простой диизопропиловый эфир (300 мл) для получения бесцветного твердого вещества, которое повторно промывали простым диизопропиловым эфиром. Неочищенный продукт повторно растворяли в смеси уксусной кислоты/воды и лиофилизировали и очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающей 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм).
Аналитическая ЖХВР: tR=8,6 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин); ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для C127H195N37O31S: 2768,3; обнаружено: 1385,0 [M+2H]2+, рассчитано: 1385,1; 923,7 [М+3Н]3+, рассчитано: 923,8; 693,1 [М+4Н]4+, рассчитано: 693,1.
PEG2-IK(PEG3-Cys-4Abu-Dig)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (PEG2-PYY(PEG3-Cys-4Abu-Dig) (SEQ ID NO: 183)
К раствору пептида PEG2-IK(PEG3-Cys-Abu-NH2)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 182, 4,1 мг, 1,48 мкмоля) в ДМФ (3 мл) добавляли дигоксигенин-3-карбоксиметил-N-гидроксисукцинимид (0,81 мг, 1,48 мкмоля), растворенный в NMP (1 мл). Добавляли триэтиламин (0,41 мкл, 97,6 ммоля) в ДМФ и смесь переворачивали в течение 2 ч при комнатной температуре. Неочищенный продукт очищали препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая пептид PEG3-Cys-4Abu-Dig (1,2 мг, 0,375 мкмоля, 25%) в виде твердого бесцветного вещества.
Аналитическая ЖХВР: tR=10,2 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин); ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для C152H229N37O37S: 3198,8; обнаружено: 1067,3 [M+3H]3+, рассчитано: 1067,3.
III) Создание выведенных из PYY(3-36) полипептидов с биотином или с биотином и содержащим цистеин линкером:
Ac-IK(PEG2-6HOTHH)-Pqa-RHYLNWVTRQ-MeArg-Y-aмид/Ac-PYY(PEG2-Biof) (SEP ID NO: 184)
Начиная процесс с обычного связанного со смолой пептида-предшественника (SEQ ID NO: 176), пептид сшивали вручную дважды с 57,8 мг (3 экв.) Fmoc-8-аминодиоксаоктановой кислоты (PEG2-cneftcep), 48,2 мг (3 экв.) TBTU и 33,3 мкл (6 экв.) NMM в 1,2 мл ДМФ, каждый раз в течение 30 мин и промывали ДМФ. Fmoc-группу отщепляли с помощью 30% Pip/ДМФ, используя стандартный протокол, описанный для SEQ ID NO: 176, смолу промывали ДМФ и обрабатывали в течение 2 ч раствором биотин-OBt в NMP (48,9 мг биотина (4 экв.), 64,2 мг TBTU (4 экв.) и 44,4 мкл NMM (8 экв.) в 1,2 мл NMP, предварительная активация в течение 3 мин). После промывки с помощью ДМФ, EtOH и МТВЕ содержащую пептид смолу сушили.
Окончательное расщепление осуществляли согласно описанному выше методу. Неочищенный продукт очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент 22-52%Б в течение 30 мин с получением твердого вещества. Выход: 42 мг.

m/z: рассчитано для C122H181N37O27S=2630,10; обнаружено 2631,5.
Ac-IK(PEG3-Cys-β-Ala-биотин)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2/Ac-PYY(PEG3-Cys-β-Ala-Biot) (SEP ID NO: 185)
Используя в качестве предшественника продукт Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-cмoлa TentaGel S RAM (SEQ ID NP: 176), пептид сшивали вручную дважды по 30 мин с 66,5 мг (3 экв.) Fmос-12-амино-4,7,10-триоксадодекановой кислоты (PEG3-спейсер), 57,0 мг (3 экв.) HATU и 16,7 мкл (3 экв.) NMM в 1,2 мл ДМФ. После промывки с помощью ДМФ Fmoc-группу отщепляли с помощью 30% Pip/ДМФ и смолу промывали с помощью ДМФ, используя стандартный протокол.
После двойных сочетаний Fmoc-Cys(Trt)-OH и Fmoc-β-Ala-OH, которые осуществляли автоматически в синтезаторе SYRO 1 с использованием стандартного протокола, добавляли вручную раствор, содержащий биотин-OBt в NMP (полученный из 48,9 мг биотина (4 экв.), 64,2 мг TBTU (4 экв.) и 44,4 мкл NMM (8 экв.) в 1,2 мл NMP, предварительная активация в течение 3 мин), и перемешивали при комнатной температуре. Через 2 ч смолу отмывали с помощью ДМФ, EtOH, МТВЕ и сушили.
Окончательное расщепление осуществляли согласно описанному выше методу. Неочищенный продукт очищали с помощью препаративной ЖХВР с обращенной фазой, согласно процедуре, описанной для SEQ ID NO: 184, получая бесцветное твердое вещество. Выход: 41,4 мг.
Аналитические данные:
Градиент для препаративной ЖХВР: 28-58% Б в течение 30 мин.
m/z: рассчитано для C131H197N39O30S2=2862,4; обнаружено: 2862,4.
Ac-IK(PEG3-Cys-PEG2-биотин)-Pqa-RHYLNWVTRQ-MeAre-Y-NH2/Ac-PYY(PEG3-Cys-PEG2-Biot) (SEP ID NO: 186)
Используя в качестве предшественника продукт Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-cмола TentaGel S RAM (SEQ ID NP: 176), проводили пептидный синтез, осуществляя следующие стадии:
двойное сочетание с Fmoc-PEG3-ОH (согласно стандартному протоколу),
двойное сочетание Cys(Trt)-ОH (согласно стандартному протоколу),
двойное сочетание Fmoc-PEG2-ОH с 57,8 мг (3 экв.) Fmoc-8-аминодиоксаоктановой кислоты (PEG2-cnettcep), 48,2 мг (3 экв.) TBTU и 33,3 мкл (6 экв.) NMM в 1,2 мл ДМФ, 2×30 мин и биотинилирование с использованием раствора, содержащего 48,9 мг биотина (4 экв.), 64,2 мг TBTU (4 экв.) и 44,4 мкл NMM (8 экв.) в 1,2 мл NMP (предварительная активация в течение 3 мин), одно сочетание в течение 2 ч.
Отщепление от смолы, очистку и анализ осуществляли согласно методу, описанному для SEQ ID NO: 184. Выход: 47,7 мг.
Аналитические данные:
Условия такие же, как и для SEQ ID NO: 184.
Градиент для препаративной ЖХВР: 25-45% Б в течение 30 мин.
m/z: рассчитано для C134H203N39O32S2=2936,5; обнаружено: 2937,8.
IV) Создание выведенных из PYY(3-36) полипептидов с флуоресцеином или с флуоресцеином и содержащим цистеин линкером
Ac-IK(PEG3-Cys-4-Abu-5-Fluo)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2/Ac-PYY(PEG3-Cys-4-Abu-5-Fluo) (SEP ID NO: 187)
Используя в качестве предшественника продукт Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-cмoлa TentaGel S RAM (SEQ ID NO: 176), пептидный синтез осуществляли аналогично описанному для SEQ ID NO: 179. Для мечения добавляли раствор, содержащий 54,2 мг 5-карбоксифлуоресцеина, 33,1 мг HOBt и 35,6 мкл DIC в ДМФ, и перемешивали в течение 18 ч при комнатной температуре.
Отщепление от смолы, очистку и анализ осуществляли согласно методу, описанному для SEQ ID NO: 179. Выход: 41,6 мг.
Аналитические данные:
Градиент для препаративной ЖХВР: 29-49% Б в течение 30 мин.
m/z: рассчитано для C143H195N37O34S=3008,44; обнаружено: 3007,2.
Ac-IK(PEG3-Cys-PEG2-5-Fluo)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2/Ac-PYY(PEG3-Cys-PEG2-5-Fluo) (SEP ID NO: 188)
Используя в качестве предшественника продукт Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-cмoлa TentaGel S RAM (SEQ ID NP: 176), проводили пептидный синтез, осуществляя следующие стадии:
двойное сочетание с Fmoc-PEG3-GH (согласно стандартному протоколу),
двойное сочетание Fmoc Cys(Trt)-PH (согласно стандартному протоколу),
двойное сочетание Fmoc-PEG2-GH (см. SEQ ID NP: 186).
Для мечения содержащую пептид смолу перемешивали в течение 18 ч с раствором, содержащим 56,7 мг 5-карбоксифлуоресцеин, 34,6 мг HOBt и 37,3 мкл DIC в ДМФ. Ртщепление от смолы, очистку и анализ осуществляли согласно методу, описанному для SEQ ID NP: 185. Выход: 41,7 мг.
Аналитические данные:
Градиент для препаративной ЖХВР: 34-64% Б в течение 30 мин.
m/z: рассчитано для C145H199N37C36S1=3068,5; обнаружено: 3069,2.
б) Меченные гаптеном флуоросцентные красители:
I) Создание дигоксигенилированного Су5
Описание синтеза см. в WO 2012/093068.
II) Создание комплекса Dig-Cys-MR121
В колбе Эрленмейера давали набухать 1,2-диаминопропантритиловой смоле (250 мг, 0,225 ммоля, загрузка 0,9 ммоля/г) в ДМФ (5 мл) в течение 30 мин. Затем к смоле добавляли раствор, содержащий Fmoc-Cys(Trt)-OH (395 мг, 0,675 ммоля) в ДМФ (2 мл), и раствор, содержащий HATU (433 мг, 1,2375 ммоля) и HOAt (164 мг, 1,2375 ммоля) в ДМФ (8 мл). К этой суспензии добавляли DIPEA (385 мкл, 2,25 ммоля) и смесь вращали в течение 16 ч при температуре окружающей среды, фильтровали и промывали повторно ДМФ. После стадии сочетания непрореагировавшие аминогруппы кэпировали обработкой смесью Ac2O (20%) в ДМФ, после чего осуществляли стадию промывки в ДМФ. Удаление iV-концевой Fmoc-группы осуществляли путем обработки смолы пиперидином (20%) в ДМФ в течение 2 ч. Затем смолу интенсивно промывали ДМФ и изопропанолом и вновь ДМФ, а затем обрабатывали раствором MR121 (25 мг, 0,05 ммоля) в 1% DIPEA в ДМФ (10 мл) в течение 16 ч. После фильтрации и промывки ДМФ смолу обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9 мл:9 мл: 1 мл) в течение 3 ч. Раствор, в котором проходило расщепление, фильтровали, концентрировали при пониженном давлении и образовавшееся твердое вещество очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм) и лиофилизировали.
Аналитическая ЖХВР: tR=7,7 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода+0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин). Затем часть этого промежуточного продукта (10,0 мг, 17,6 мкмоля) растворяли в ДМФ (1 мл) и добавляли раствор дигоксигенин-3-карбоксиметил-N-гидроксисукцинимида (9,6 мг, 17,6 мкмоля) в ДМФ (1 мл) и 1% триэтиламина в ДМФ (2 мл) и смесь переворачивали в течение 16 ч. Затем раствор концентрировали и требуемое соединение очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм). Выход: 1,0 мг.Аналитическая ЖХВР: tR=10,1 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 996,3; обнаружено: 995,8 [М]1+.
III) Создание комплекса DIG-Cys-Ahx-Cy5
В колбе Эрленмейера давали набухать 1,2-диаминопропантритиловой смоле (250 мг, 0,225 ммоля, загрузка 0,9 ммоля/г) в ДМФ (5 мл) в течение 30 мин. Затем к смоле добавляли раствор, содержащий Fmoc-Cys(Trt)-OH (395 мг, 0,675 ммоля) в ДМФ (2 мл), и раствор, содержащий HATU (433 мг, 1,2375 ммоля) и НОAt (164 мг, 1,2375 ммоля) в ДМФ (8 мл). К этой суспензии добавляли DIPEA (385 мкл, 2,25 ммоля) и смесь вращали в течение 16 ч при температуре окружающей среды, фильтровали и промывали повторно ДМФ. После стадии сочетания непрореагировавшие аминогруппы кэпировали обработкой смесью Ac2O (20%) в ДМФ, после чего осуществляли стадию промывки в ДМФ. Удаление N-концевой Fmoc-группы осуществляли путем обработки смолы пиперидином (20%) в ДМФ в течение 2 ч. Затем смолу интенсивно промывали ДМФ и изопропанолом и вновь ДМФ, а затем обрабатывали раствором Су5-моно-NHS-эфира (25 мг, 0,0316 ммоля) в 1% DIPEA в ДМФ (10 мл) в течение 16 ч. После фильтрации и промывки ДМФ смолу обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9 мл:9 мл:1 мл) в течение 3 ч. Раствор, в котором проходило расщепление, фильтровали, концентрировали при пониженном давлении и образовавшееся твердое вещество повторно растворяли в воде и лиофилизировали. Очистку промежуточного продукта осуществляли с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации твердое вещество голубого цвета. Аналитическая ЖХВР: tR=6,2 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин). Затем часть указанного промежуточного продукта (6,5 мг, 7,9 мкмоля) растворяли в ДМФ (1 мл) и добавляли раствор, содержащий Dig-Amcap-OSu (5,2 мг, 7,9 мкмоля) в ДМФ (1 мл), и раствор, содержащий 1% триэтиламина в ДМФ (2 мл), и смесь переворачивали в течение 16 ч. Затем раствор концентрировали, требуемое соединение очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм). Выход: 3 мг. Аналитическая ЖХВР: tR=8,7 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 1360,0; обнаружено: 1360,7 [М+Н]1+.
IV) Создание биотин-еdа-Dу636
К раствору гидробромида биотинэтилендиамина (2,14 мг, 5,83 мкмоля) в 0,1М К3РO4-буфере (рН 8,0, 500 мкл) добавляли раствор Dy636-OSu (5 мг, 5,83 мкмоля) в 0,1М К3РO4-буфере (рН 8,0, 500 мкл) и образовавшуюся смесь перемешивали в течение 2 ч при температуре окружающей среды, фильтровали и требуемое соединение выделяли с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм). После лиофилизации получали конъюгат Dу636-этилендиамин-Вi в виде бесцветного твердого вещества (2,8 мг, 48%). Аналитическая ЖХВР: tR=8,5 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для С50Н65N6O10S3: 1006,3; обнаружено: 1007.3 [М+Н]+.
V) Создание комплекса биотин-Sеr-Dу636
Стадия 1: Биотин-O2Oc-Ser-O2Oc-DADOO-NH2
На О-бис(аминоэтил)этиленгликольтритильной смоле (176 мг, 0,125 ммоля, загрузка 0,71 ммоля/г, фирма Novabiochem) последовательно сшивали Fmoc-O2Ос-ОН, Fmoc-Ser(tBu)-OH, Fmoc-O2Oc-OH (все фирмы Iris Biotech) и DMTr-D-биотин (фирма Roche). Пептидный синтез осуществляли согласно принятым протоколам (FastMoc 0,25 ммоля) в автоматизированном синтезаторе пептидов Applied Biosystems ABI 433А, применяя Fmoc-химию (согласно методу, описанному для SEQ ID NO: 180).
После синтеза смолу интенсивно промывали ДМФ, метанолом, дихлорметаном и сушили в вакууме. Затем смолу помещали в колбу Эрленмейера и обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9,5 мл:250 мкл:250 мкл) в течение 2 ч при комнатной температуре. Раствор, в котором проходило расщепление, фильтровали и пептид осаждали, добавляя холодный (0°С) простой диизопропиловый эфир (80 мл), получая твердое бесцветное вещество, которое повторно промывали простым диизопропиловым эфиром. Неочищенный продукт повторно растворяли в воде, лиофилизировали и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации бесцветное твердое вещество. Выход: 56 мг (60%). Аналитическая ЖХВР: tR=4,5 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 751,9; обнаружено: 752,4 [М+Н]+; 376,9 [М+2Н]2+.
Стадия 2: Биотин-O2Ос-Sеr-O2Ос-DАDОО-Dу-636 (Bi-Ser-Dy-636)
Пептид (5,3 мг, 7,0 мкмолей) растворяли в 200 мМ калий-фосфатном буфере, рН 7,5 (583 мкл). Dу-636-NНS-эфир (4 мг, 4,7 мкмоля, фирма Dyomics) растворяли в воде (583 мкл) и добавляли к содержащему пептид раствору. Реакционный раствор перемешивали в течение 2 ч при комнатной температуре и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации твердый продукт голубого цвета. Выход: 3,9 мг (55%). Аналитическая ЖХВР: tR=8,3 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,025% ТФК → ацетонитрил/вода + 0,023% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 1472,8; обнаружено: 1472,8 [М+Н]+; 737,0 [М+2Н]2+.
VI) Создание комплекса биотин-Суs-Dу636
Стадия 1: Биотин-О2Оc-Cys-О2Oc-DADOO-NH2
На O-бис(аминоэтил)этиленгликольтритильной смоле (352 мг, 0,25 ммоля, загрузка 0,71 ммоля/г, фирма Novabiochem) последовательно сшивали Fmoc-O2Ос-ОН, Fmoc-Cys(Trt)-OH, Fmoc-O2Oc-OH (все фирмы Iris Biotech) и DMTr-D-биотин (фирма Roche). Пептидный синтез осуществляли согласно принятым протоколам (FastMoc 0,25 ммоля) в автоматизированном синтезаторе пептидов Applied Biosystems ABI 433А, применяя Fmoc-химию (согласно методу, описанному для SEQ ID NO: 180).
После синтеза смолу интенсивно промывали ДМФ, метанолом, дихлорметаном и сушили в вакууме. Затем смолу помещали в колбу Эрленмейера и обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9,5 мл:250 мкл:250 мкл) в течение 2 ч при комнатной температуре. Раствор, в котором проходило расщепление, фильтровали и пептид осаждали, добавляя холодный (0°С) простой диизопропиловый эфир (100 мл), получая твердое бесцветное вещество, которое повторно промывали простым диизопропиловым эфиром. Неочищенный продукт повторно растворяли в воде, лиофилизировали и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации бесцветное твердое вещество. Выход: 79 мг (41%). Аналитическая ЖХВР: tR=5,3 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 767,9; обнаружено: 768,4 [М+Н]+; 384,8 [М+2Н]2+.
Стадия 2: Биотин-О2Oc-Cys(TNB)-O2Oc-DADOO-NH2
Пептид (30 мг, 39 мкмолей) растворяли в 100мМ калий-фосфатном буфере, рН 7,5 и добавляли 5,5'-дитиобис(2-нитробензойную кислоту) (77 мг, 195 мкмолей). Смесь перемешивали в течение 30 мин при комнатной температуре и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации твердый продукт желтого цвета. Выход: 31 мг (83%). Аналитическая ЖХВР: tR=5,4 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,025% ТФК → ацетонитрил/вода + 0,023% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 965,1; обнаружено 965,4 [М+Н]+; 483,3 [М+2Н]2+.
Стадия 3: Биотин-О2Oc-Cys(TNB)-O2Oc-DADОO-Dy-636
Защищенный с помощью TNB пептид (1,35 мг, 1,4 мкмоля) растворяли в 200 мМ калий-фосфатной буфере, рН 7,5 (291 мкл). Dу-бЗб-ЫНБ-эфир (1 мг, 1,2 мкмоля, фирма Dyomics) растворяли в воде (291 мкл) и добавляли к содержащему пептид раствору. Реакционный раствор перемешивали в течение 1 ч при комнатной температуре и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды, включающий 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации твердый продукт голубого цвета. Выход: 1 мг (50%). Аналитическая ЖХВР: tR=9,0 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,025% ТФК → ацетонитрил/вода + 0,023% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 1686,0; обнаружено: 1686,7 [М+Н]+; 844,2 [М+2Н]2+.
Стадия 4: Биотин-O2Ос-Суs-O2Ос-DАDОО-Dу-636 (Bi-Cys-Dy-636)
Защищенный с помощью TNB и меченный красителем пептид (1 мг, 0,6 мкмоля) растворяли в смеси 200 мМ калий-фосфатного буфера, рН 7,5 (250 мкл) и воды (192 мкл). Добавляли 100мМ раствор гидрохлорида трис(2-карбоксиэтил)фосфина (58 мкл) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Очистку осуществляли с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды с 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации твердый продукт голубого цвета. Выход: 0,7 мг (79%). Аналитическая ЖХВР: tR=8,6 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,025% ТФК → ацетонитрил/вода + 0,023% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 1488,9; обнаружено: 1488,6 [М+Н]+; 745,1 [М+2Н]2+.
VII) Создание комплекса биотин-Cys-Cy5
Стадия 1: Биотин-O2Oc-Cys-O2Oc-DADOO-NH2
На O-бис(аминоэтил)этиленгликольтритильной смоле (352 мг, 0,25 ммоля, загрузка 0,71 ммоля/г, фирма Novabiochem) последовательно сшивали Fmoc-O2Ос-ОН, Fmoc-Cys(Trt)-OH, Fmoc-O2Oc-OH (все фирмы Iris Biotech) и DMTr-D-биотин (фирма Roche). Пептидный синтез осуществляли согласно принятым протоколам (FastMoc 0,25 ммоля) в автоматизированном синтезаторе пептидов Applied Biosystems ABI 433А, применяя Fmoc-химию (согласно методу, описанному для SEQ ID NO: 180).
После синтеза смолу интенсивно промывали ДМФ, метанолом, дихлорметаном и сушили в вакууме. Затем смолу помещали в колбу Эрленмейера и обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9,5 мл:250 мкл:250 мкл) в течение 2 ч при комнатной температуре. Раствор, в котором проходило расщепление, фильтровали и пептид осаждали, добавляя холодный (0°С) простой диизопропиловый эфир (100 мл), получая твердое бесцветное вещество, которое повторно промывали простым диизопропиловым эфиром. Неочищенный продукт повторно растворяли в воде, лиофилизировали и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды с 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации бесцветное твердое вещество. Выход: 79 мг (41%). Аналитическая ЖХВР: tR=5,3 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 767,9; обнаружено: 768,4 [М+Н]+; 384,8 [М+2Н]2+.
Стадия 2: Биотин-O2Oc-Cys(TNB)-O2Oc-DADOO-NH2
Пептид (30 мг, 39 мкмолей) растворяли в 100мМ калий-фосфатном буфере, рН 7,5 (4 мл) и добавляли 5,5'-дитиобис(2-нитробензойную кислоту) (77 мг, 195 мкмолей). Смесь перемешивали в течение 30 мин при комнатной температуре и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды с 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации твердый продукт желтого цвета. Выход: 31 мг (83%). Аналитическая ЖХВР: tR=5,4 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,025% ТФК → ацетонитрил/вода + 0,023% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 965,1; обнаружено: 965,4 [М+Н]+; 483,3 [М+2Н]2+.
Стадия 3: Биотин-О2Оc-Cys(TNB)-O2Oc-DADOO-Cv5
Защищенный с помощью TNB пептид (9,9 мг, 10,3 мкмоля) растворяли в 200 мМ калий-фосфатной буфере, рН 7,5 (1026 мкл). Cy5-моно-NHS-эфир (6,5 мг, 8,2 мкмоля, фирма GE Healthcare) растворяли в воде (1026 мкл) и добавляли к содержащему пептид раствору. Реакционный раствор перемешивали в течение 2 ч при комнатной температуре и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды с 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации твердый продукт голубого цвета. Выход: 10 мг (80%). Аналитическая ЖХВР: tR=7,2 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,025% ТФК → ацетонитрил/вода + 0,023% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 1603,9; обнаружено: 1604,9 [М+Н]+; 803,1 [М+2Н]2+.
Стадия 4: Биотин-О2Ос-Суs-O2Ос-DАDОО-Су5 (Bi-Cys-Cy5)
Защищенный с помощью TNB и меченный красителем пептид (10 мг, 6,1 мкмоля) растворяли в смеси 200 мМ калий-фосфатного буфера, рН 7,5 (1522 мкл) и воды (1218 мкл). Добавляли ЮОмМ раствор гидрохлорида трис(2-карбоксиэтил)фосфина (304 мкл) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Очистку осуществляли с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды с 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации твердый продукт голубого цвета. Выход: 7,6 мг (86%). Аналитическая ЖХВР: tR=6,4 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,025% ТФК ацетонитрил/вода + 0,023% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 1406,8; обнаружено: 1406,8 [М+Н]+; 704,0 [М+2Н]2+.
VIII) Создание комплекса биотин-Sеr-Су5
Стадия 1: Биотин-O2Oc-Ser-O2Oc-DADOO-NH2
На O-бис(аминоэтил)этиленгликольтритильной смоле (176 мг, 0,125 ммоля, загрузка 0,71 ммоля/г, фирма Novabiochem) последовательно сшивали Fmoc-O2Ос-ОН, Fmoc-Ser(tBu)-OH, Fmoc-O2Oc-OH (все фирмы Iris Biotech) и PMTr-P-биотин (фирма Roche). Пептидный синтез осуществляли согласно принятым протоколам (FastMoc 0,25 ммоля) в автоматизированном синтезаторе пептидов Applied Biosystems ABI 433А, применяя Fmoc-химию (согласно методу, описанному для SEQ ID NO: 180).
После синтеза смолу интенсивно промывали ДМФ, метанолом, дихлорметаном и сушили в вакууме. Затем смолу помещали в колбу Эрленмейера и обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9,5 мл:250 мкл:250 мкл) в течение 2 ч при комнатной температуре. Раствор, в котором проходило расщепление, фильтровали и пептид осаждали, добавляя холодный (0°С) простой диизопропиловый эфир (80 мл), получая твердое бесцветное вещество, которое повторно промывали простым диизопропиловым эфиром. Неочищенный продукт повторно растворяли в воде, лиофилизировали и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды с 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации бесцветное твердое вещество. Выход: 56 мг (60%). Аналитическая ЖХВР: tR=4,5 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,1% ТФК → ацетонитрил/вода + 0,1% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 751,9; обнаружено: 752,4 [М+Н]+; 376,9 [М+2Н]2+.
Стадия 2: Биотин-O2Ос-Sеr-O2Ос-DАDОО-Су5 (Bi-Ser-Cy5)
Пептид (5,7 мг, 7,6 мкмоля) растворяли в 200 мМ калий-фосфатной буфере, рН 7,5 (789 мкл). Су5-моно-NHS-эфир (5 мг, 6,3 мкмоля, фирма GE Healthcare) растворяли в воде (789 мкл) и добавляли к содержащему пептид раствору. Реакционный раствор перемешивали в течение 2 ч при комнатной температуре и затем очищали с помощью препаративной ЖХВР с обращенной фазой, применяя градиент ацетонитрила/воды с 0,1% ТФК (колонка Merck Chromolith prep RP-18e, 100×25 мм), получая после лиофилизации твердый продукт голубого цвета. Выход: 6 мг (58%). Аналитическая ЖХВР: tR=6,1 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода + 0,025% ТФК → ацетонитрил/вода + 0,023% ТФК 80:20, 25 мин). ESI-MC (режим регистрации положительных ионов): m/z: рассчитано для [М]: 1390,72; обнаружено: 1391,2 [М+Н]+.
Пример 9
Связывание рекомбинантного гуманизированного антитела к биотину с меченым биотином соединением (гаптенилированное соединение)
Для решения вопроса о том, может ли процедура гуманизации и последующая интродукция мутаций, приводящих к замене на цистеин, обеспечивать получение производных, которые полностью сохраняют способность к связыванию, проводили следующие эксперименты.
Особенности связывания производных рекомбинантного антитела к биотину анализировали с помощью технологии бислойной интерферометрии (ВЫ), используя устройство Octet QK (фирма Fortebio Inc.). Эта система создана для изучения молекулярных взаимодействий. BLI-технология основана на измерении схемы интерференции белого цвета, отражающегося от поверхности кончика биосенсора, и внутреннего стандарта. Связывание молекул с кончиком биосенсора приводит к сдвигу картины интерференции, который поддается измерению. Для анализа того, снижает ли описанная выше процедура гуманизации способность антитела к биотину связываться с биотином, осуществляли непосредственное сравнение способности химерных и гуманизированных версий антитела связываться с биотинилированным белком. Изучение связывания осуществляли путем «захвата» антитела к биотину на биосенсорах для «захвата» антитела к hulgG Fc (anti-huIgG Fc antibody Capture, АНС) (фирма Fortebio Inc.). Сначала биосенсоры инкубировали с раствором антитела в концентрации 0,5 мг/мл в 20 мМ гистидине, 140 мМ NaCl, рН 6,0 в течение 1 мин. Затем биосенсоры инкубировали в течение 1 мин в 1 × ЗФР, рН 7,4 до достижения стабильной базисной линии. Связывание измеряли путем инкубации покрытых антителом биосенсоров в растворе, содержащем биотинилированный белок в концентрации 0,06 мг/мл в 20 мМ гистидине, 140 мМ NaCl, рН 6,0 в течение 5 мин. Мониторинг диссоциации осуществляли в течение 5 мин в 1 × ЗФР, рН 7,4. Осуществляли непосредственное сравнение полученных кривые связывания для химерных и гуманизированных антител к биотину.
Для гуманизированной версии антитела выявлена такая же или даже более высокая способность к связыванию биотинилированного антигена, чем у химерного антитела. Такой же факт установлен для гуманизированного антитела с мутацией, приводящей к замене на Cys, в положении VH53 по Кэботу. Для биотинилированного белка обнаружено остаточное неспецифическое связывание с биосенсорами, которое снижается, когда биосенсоры покрывают герцептином, который не дает связываться биотину. Таким образом, функциональность антитела к биотину сохранялась у гуманизированного варианта (который описывается последовательностями, представленными в SEQ ID NO: 44 и 48, SEQ ID NO: 60 и 64).
Поверхностный плазмонный резонанс
Анализ методом поверхностного плазмонного резонанса осуществляли с помощью устройства BIAcore® Т200 (фирма GE Healthcare Biosciences АВ, Швеция) при 25°С. Примерно 4300 резонансных единиц (RU) системы для «захвата» (10 мкг/мл античеловеческого антитела для «захвата» (IgG-Fc) из набора для «захвата» человеческих антител (набор Human Antibody Capture, BR-1008-39, фирма GE Healthcare Biosciences АВ, Швеция) сшивали на СМ3-чипе (фирма GE Healthcare, BR-1005-36) при рН 5,0, применяя набор для стандартного аминного сочетания, поставляемый фирмой GE Healthcare (BR-1000-50). Подвижный буфер для аминного сочетания представлял собой HBS-N (10мМ HEPES, рН 7,4, 150 мМ NaCl, фирма GE Healthcare, BR-1006-70). Подвижный буфер и буфер для разведения, применяемые в последующем опыте по связыванию, представляли собой ЗФР-Т (10мМ забуференный фосфатом физиологический раствор, включающий 0,05% Твин 20), рН 7,4. Гуманизированное антитело к биотину «захватывали» путем инъекции 2нМ раствора в течение 60 с при скорости потока 5 мкл/мин. Биотинилированную siPHK разводили ЗФР-Т до концентраций 0,14-100нМ (серийные разведения 1:3). Связывание измеряли путем инъекции каждой концентрации в течение 180 с при скорости потока 30 мкл/мин, продолжительность диссоциации составляла 600 с. Поверхность регенерировали путем промывки в течение 30 с 3М раствором MgCl2 при скорости потока 5 мкл/мин. Данные оценивали с помощью программы BIAevaluation (фирма GE Healthcare Biosciences АВ, Швеция). Различия всех коэффициентов отражения корректировали путем вычитания ответа, полученного от поверхности с антителом к человеческому IgG Fc. Вычитали также величины, полученные для «пустых» инъекций (т.е. двойной контроль). Для расчета KD и кинетических параметров применяли модель Ленгмюра 1:1.
Кинетический анализ связывания с использованием поверхностного плазмонного резонанса (ППР) осуществляли для гуманизированного антитела к биотину, имеющему SEQ ID NO: 44 и 48, и гуманизированного антитела к биотину VH53C, имеющему SEQ ID NO: 60 и 64. Антитела к биотину в концентрации 2нМ «захватывали» антителом к человеческому IgG-Fc, которое было связано с сенсорным СМ3-чипом. Связывание биотинилированной siPHK (ММ: 13868 Да) определяли в концентрациях 0,41, 1,23, 3,7, 11,1, 33,3, 100 и 300нМ. Измерения осуществляли с дублированием. Рассчитанные величины Ко гуманизированного антитела к биотину и гуманизированного антитела к биотину VH53C составляли 0,633нМ и 0,654нМ соответственно.
Пример 10
Создание нековалентных комплексов гаптенилированных соединений с антителами к гаптенам Общий метод:
Создание комплексов антител к гаптенам с гаптенилированными соединениями (т.е. гаптенами, конъюгированными с «полезным грузом») должно приводить в получению определенных комплексов и при этом должна быть получена гарантия того, что соединение (т.е.«полезный груз») в этих комплексах сохраняет собой активность. Для создания комплексов гаптенилированных соединений с соответствующим антигаптеновым антителом гаптенилированное соединение растворяли в Н20 до конечной концентрации 1 мг/мл. Антитело концентрировали до конечной концентрации 1 мг/мл (4,85 мкМ) в 20 мМ гистидиновом буфере, 140 мМ NaCl, рН=6,0. Гаптенилированный «полезный груз» и антитело смешивали в молярном соотношении 2:1 (соединение к антителу) путем пипетирования, осуществляя всасывание-выпуск смеси, и инкубировали в течение 15 мин при КТ.
Альтернативно этому, гаптенилированное соединение растворяли в 100% ДМФ до конечной концентрации 10 мг/мл. Антитело концентрировали до конечной концентрации 10 мг/мл в 50 м Трис-HCl, 1 мМ ЭДТК, рН=8,2. Гаптенилированное соединение и антитело смешивали в молярном соотношении 2,5:1 (соединение к антителу) путем пипетирования, осуществляя всасывание-выпуск смеси, и инкубировали в течение 60 мин при КТ и 350 об/мин.
Пример метода получения комплексов гаптенилированных флуоросцентных красителей и антигаптеновых антител - нековалентный комплекс дигоксигенин-Су5
Гуманизированное и мышиное антитело к дигоксигенину или биспецифические производные антител к дигоксигенину применяли в качестве компонентов, представляющих собой антитело. Для создания комплексов дигоксигенилированного Су5 с антителами к дигоксигенину конъюгат Су5-дигоксигенин растворяли в ЗФР до конечной концентрации 0,5 мг/мл. Антитело применяли в концентрации 1 мг/мл (примерно 5 мкМ) в буфере, состоящем из 20 мМ гистидина и 140 мМ NaCl, рН 6. Дигоксигенилированный Су5 и антитело смешивали в молярном соотношении (дигоксигенилированный Су5 к антителу), составляющем 2:1. Эта процедура позволяла получать гомогенный препарат комплексов определенного состава.
Можно осуществлять мониторинг реакции комплексообразования путем определения флуоресценции (650/667 нм) ассоциированного с антителом флоурофора на колонке для гель-фильтрации. Результаты этих экспериментов продемонстрировали, что комплексообразование может происходить только, если антитело содержит специфичности, связывающиеся с дигоксигенином. Антитела без специфичностей, связывающихся с дигоксигенином, не связываются с конъюгатом дигоксигенин-Су5. Увеличение сигнала удалось обнаружить для двухвалентных антител к дигоксигенину вплоть до соотношения между конъюгатом дигоксигенин-Су5 и антителом, составляющего 2:1. После этого зависящие от состава сигналы флуоресценции достигали плато.
Пример метода получения комплексов гаптенилированных флуоресцентных красителей и антигаптеновых антител - комплекс биотин-Су5/химерное антитело к биотину (человеческое IgG-подкласса)
Для создания комплексов дериватизированного биотином Су5 (биотин-Cys-Су5), содержащего цистеинилированный линкер, 0,16 мг конъюгата биотин-Cys-Су5 растворяли в 100% ДМФ до концентрации 10 мг/мл. Использовали 1 мг антитела в концентрации 10,1 мг/мл (примерно 69 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном соотношении (биотин-Суs-Су5 к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин.
Образовавшийся конъюгат анализировали с помощью ДСН-ПААГ согласно методу, описанному в примере 11 а. Обнаружение флуоресценции осуществляли согласно методу, описанному в примере 11а.
Пример метода получения конъюгатов биотинилированных флуоресцентных красителей и антител к биотину - биотин-Sеr-Су5/гуманизированное антитело к биотину
Для создания комплексов дериватизированного биотином Су5 (биотин-Ser-Су5), содержащего остаток серина в линкере, 0,61 мг конъюгата биотин-Sеr-Су5 растворяли в 20 мМ гистидине, 140 мМ NaCl, рН 6,0 до концентрации 10 мг/мл. Использовали 18,5 мг гуманизированного антитела к биотину в концентрации 10 мг/мл (примерно 69 мкМ) в буфере, состоящем из 50мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Биотин-Sеr-Су5 и антитело смешивали в молярном соотношении (биотин-Sеr-Су5 к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Затем образец подвергали гель-фильтрации, применяя препаративную колонку высокой емкости Superdex 200 16/60 (фирма GE Healthcare), используя скорость потока 1,5 мл/мин и 20 мМ гистидин, 140 мМ NaCl, рН 6,0 в качестве подвижной фазы. Пиковые фракции собирали и анализировали их чистоту с помощью ДСН-ПААГ. Соотношение красителя и антитела рассчитывали путем (1) измерения абсорбции образцов при длине волны 280 нм (белок) и 650 нм (Су5); путем (2) применения формулы: Аб5о меченого белка /ε(Су5)х концентрация белка (М) = количество молей красителя на моль белка, в которой ε(Су5)=250000 М-1 см-1, А650 комплекса = 47,0 и концентрация белка составляет 86,67 мкМ. Полученное в результате соотношение красителя и молекулы антитела составляло 2,17, что позволяет предположить, что все паратопы антител насыщались молекулами комплекса биотин-Су5.
Пример метода получения комплексов гаптенилированных полипептидов и антигаптеновых антител - комплекс дигоксигенин-РYY(3-36)/антитело к дигоксигенину
Для создания нековалентных комплексов дигоксигенилированных полипептидов с антителом к дигоксигенину выведенное из мышиной гибридомы антитело (лиофилизат из 10мМ КРО4, 70 мМ NaCl; рН 7,5) растворяли в 12 мл воды и диализировали в противотоке раствора, содержащего 20 мМ гистидин, 140 мМ NaCl, рН 6,0, получая 300 мг (2×10-6 моля) в 11 мл буфера (с=27,3 мг/мл). Конъюгат дигоксигенин-РYY(3-36) (11,57 мг, 4×10-6 моля, 2 экв.) добавляли в виде 4 порций по 2,85 мг в течение 1 ч и инкубировали в течение еще 1 ч при комнатной температуре. После завершения реакции комплексообразования комплексы очищали с помощью гель-фильтрации, используя колонку Superdex 200 26/60 GL (320 мл) в 20 мМ гистидине, 140 мМ NaCl, рН 6,0 при скорости потока 2,5 мл/мин. Элюированный комплекс собирали в виде фракций объемом 4 мл, объединяли и стерилизовали с помощью фильтра с размером пор 0,2 мкм, получая 234 мг комплекса в концентрации 14,3 мг/мл. Аналогичным образом для создания комплексов, включающих гуманизированное антитело к дигоксигенину, концентрацию антитела доводили до 10,6 мг/мл (9,81 мг, 6,5×10-8 моля в 0,93 мл) в 20 мМ гистидине, 140 мМ NaCl, рН 6,0. К раствору антитела добавляли в виде лиофилизата 0,57 мг (что соответствует 1,97×10-7 моля=3,03 экв.) дигоксигенилированного полипептида (DIG-PYY). Полипептид и антитело инкубировали в течение 1,5 ч при комнатной температуре. Избыток полипептида удаляли гель-фильтрацией на колонке Superose 6 10/300 GL, используя 20 мМ гистидин, 140 мМ NaCl, рН 6,0 со скоростью потока 0,5 мл/мин. Элюированный комплекс собирали в виде фракций объемом 0,5 мл, объединяли и стерилизовали с помощью фильтра с размером пор 0,2 мкм, получая 4,7 мг комплекса в концентрации 1,86 мг/мл.
Установлено, что образовавшийся комплекс гаптенилированный полипептид-антигаптеновое антитело представляет собой мономерную IgG-подобную молекулу, поскольку ему соответствовал один пик, полученный при гель-фильтрации. Установлено, что образовавшийся комплекс представляет собой мономерную IgG-подобную молекулу, несущую две молекулы производных дигоксигенина-PYY на молекулу антитела. Установленный состав этих пептидных комплексов подтверждали гель-фильтрацией, с помощью которой продемонстрировано также отсутствие белковых агрегатов. Установленный состав (и соотношение 2:1 полипептида к белку) этих биспецифических пептидных комплексов дополнительно подтверждали с помощью SEC-MALS (гель-фильтрация - многоугловое светорассеяние). Для осуществления SEC-MALS-анализа 100-500 мкг соответствующего образца вносили на колонку для гель-фильтрации Superdex 200 10/300 GL со скоростью потока 0,25-0,5 мл/мин, используя 1 × ЗФР, рН 7,4 в качестве подвижной фазы. Светорассеяние выявляли с помощью детектора Wyatt miniDawn TREOS/QELS, коэффициент преломления измеряли с помощью детектора Wyatt Optilab гЕХ. Полученные данные анализировали с использованием программы ASTRA (версия 5.3.4.14). Результаты SEC-MALLS-анализов позволили получить информацию о массе, радиусе и размере комплекса. Затем эти данные сравнивали с данными для соответствующего не входящего в комплекс антитела. Результаты этих экспериментов продемонстрировали, что обработка дигоксигенилированным-PYY антитела к дигоксигенину позволяла получать комплексы, содержащие две молекулы производных дигоксигенина-PYY на одну молекулу антитела. Таким образом, дигоксигенилированный PYY можно объединять в комплекс с антителом к дигоксигенину в определенных сайтах (область связывания) и в соответствии с определенной стехиометрией.
Характеризация комплекса с использованием исследований на основе поверхностного плазмонного резонанса обеспечила дополнительное доказательство того, что имела место определенная реакция комплексообразования и полное включение молекул в комплекс.Антитело к дигоксигенину может связываться с ППР-чипом, что приводит к увеличению сигнала. Последующее добавление конъюгата дигоксигенин-PYY приводило к дополнительному увеличению сигнала до тех пор пока не происходила полная оккупация всех сайтов связывания. В этих условиях дополнительное введение конъюгата дигоксигенин-PYY не приводило к дальнейшему увеличению сигнала. Это свидетельствует о специфичности реакции комплексообразования и о том, что сигналы не вызываются неспецифическим сцеплением дигоксигенилированного полипептида.
Пример метода получения комплексов гаптенилированных полипептидов и антигаптеновых антител - комплекс Ac-PYY-PEG3-Cys-β-Ala-Biot/химерное антитело к биотину
Для создания нековалентных комплексов биотинилированного PYY-полипептида, содержащего цистеинилированный линкер, 0,19 мг Ac-PYY-PEG3-Cys-β-Ala-Biot растворяли в 100% ДМФ до концентрации 10 мг/мл. Антитело применяли в концентрации 10,7 мг/мл (примерно 73 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Ac-PYY-PEG3-Cys-β-Ala-Biot и антитело смешивали в молярном соотношении (Ac-PYY-PEG3-Cys-β-Ala-Biot к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ и 350 об/мин. Установлено, что образовавшийся комплекс представляет собой мономерную IgG-подобную молекулу, поскольку ему соответствовал один пик, полученный при гель-фильтрации (95% мономера). Образовавшийся комплекс дополнительно анализировали с помощью ДСН-ПААГ, а затем Вестерн-блоттинга. 10 мкг комплекса смешивали с 4×LDS-буфером для образцов (фирма Invitrogen) и инкубировали при 95°С в течение 5 мин. Образец вносили в 4-12% Бис-Трис полиакриламидный гель (NuPAGE, фирма Invitrogen), который разгоняли в течение 35 мин при 200 В и 120 мА. Затем молекулы, разделившиеся в полиакриламидном геле, переносили на мембрану из ПВДФ (размер пор 0,2 мкм, фирма Invitrogen) и выдерживали в течение 40 мин при 25 В и 160 мА. Мембрану блокировали в 1% (масс/об.) обезжиренного молока в 1 × ЗФРТ (1 × ЗФР + 0,1% Твин20) в течение 1 ч при КТ. Мембрану промывали 3× в течение 5 мин в 1 × ЗФРТ и затем инкубировали с конъюгатом стрептивидин-POD (2900 ед./мл, фирма Roche), который применяли в разведении 1:2000. Обнаружение конъюгата стрептивидин-POD, связанного с биотином на мембране, осуществляли, используя субстрат для Вестерн-блоттинга Lumi-Light (фирма Roche).
Пример метода получения комплексов гаптенилированных полипептидов и антигаптеновых антител - комплекс Ac-PYY-PEG3-Cys-PEG2-Biot)/xимернoe антитело к биотину
Для создания нековалентных комплексов биотинилированного-PYY-полипептида, содержащего цистеинилированный линкер, 0,16 мг Ac-PYY-PEG3-Cys-PEG2-Biot растворяли в 100% ДМФ до концентрации 10 мг/мл. Антитело применяли в концентрации 10,7 мг/мл (примерно 73 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Ac-PYY-PEG3-Cys-PEG2-Biot и антитело смешивали в молярном соотношении (Ac-PYY-PEG3-Cys-PEG2-Biot к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ и 350 об/мин. С помощью гель-фильтрации установлено, что образовавшийся комплекс содержал 63% мономерной IgG-подобной молекулы и 37% димерных растворимых агрегатов. Образовавшийся комплекс дополнительно анализировали с помощью ДСН-ПААГ, а затем Вестерн-блоттинга. 10 мкг комплекса смешивали с 4×LDS-буфером для образцов (фирма Invitrogen) и инкубировали при 95°С в течение 5 мин. Образец вносили в 4-12% Бис-Трис полиакриламидный гель (NuPAGE, фирма Invitrogen), который разгоняли в течение 35 мин при 200 В и 120 мА. Затем молекулы, разделившиеся в полиакриламидном геле, переносили на мембрану из ПВДФ (размер пор 0,2 мкм, фирма Invitrogen) и выдерживали в течение 40 мин при 25 В и 160 мА. Мембрану блокировали в 1% (мас./об.) обезжиренного молока в 1 × ЗФРТ (1 × ЗФР + 0,1% Твин20) в течение 1 ч при КТ. Мембрану промывали 3×5 мин в 1 × ЗФРТ и затем инкубировали с конъюгатом стрептивидин-POD (2900 ед./мл, фирма Roche), который применяли в разведении 1:2000. Обнаружение конъюгата стрептивидин-POD, связанного с биотином на мембране, осуществляли, используя субстрат для Вестерн-блоттинга Lumi-Light (фирма Roche).
Пример метода получения комплексов гаптенилированных полипептидов и антигаптеновых антител - комплекс Ac-PYY(PEG3-Cys-PEG2-5-Fluo)/xHMepHoe антитело к флуоресцеину
Для создания нековалентных комплексов конъюгированного с флуоресцеином PYY-полипептида, содержащим цистеинилированный линкер, 0,33 мг Ac-PYY(PEG3-Cys-PEG2-5-Fluo) растворяли в 100% ДМФ до концентрации 10 мг/мл. Антитело применяли в концентрации 9,99 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-5-Fluo) и антитело смешивали в молярном соотношении (Ac-PYY(PEG3-Cys-PEG2-5-Fluo) к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ и 350 об/мин. С помощью гель-фильтрации установлено, что образовавшийся комплекс содержит 76% мономерной IgG-подобной молекулы и 24% димерных растворимых агрегатов. Образовавшийся комплекс дополнительно анализировали с помощью ДСН-ПААГ и затем осуществляли детекцию обусловленной флуоресцеином флуоресценции в полиакриламидном геле. 8 мкг комплекса смешивали с 4×LDS-буфером для образцов (фирма Invitrogen) и инкубировали при 95°С в течение 5 мин. Обусловленную флуоресцеином флуоресценцию определяли с помощью устройства Lumilmager F1 (фирма Roche) при длине волны возбуждения 645 нм.
Пример 11
Создание определенных ковалентных конъюгатов гаптенилированных красителей или полипептидов с антигаптеновым антителом VН52bС/VН53С в присутствии окислительно-восстановительных агентов
Пример метода получения конъюгатов гаптенилированных флуоресцентных красителей и антигаптеновых антител - Dig-Суs-Аhх-Су5/антитело к дигоксигенину VН52bС
Создание ковалентных конъюгатов антигаптеновых антител и гаптенилированных флуоресцентных красителей, содержащих цистеиновый линкер, позволяло получать определенные конъюгаты, в которых дисульфидный мостик образовывался в конкретном положении между VH52bC в CDR2 антигаптененового антитела и цистеином в линкере между гаптеном и флуоресцентным красителем. Реакцию конъюгации осуществляли в присутствии окислительно-восстановительных реагентов. Dig-Cys-Ahx-Cy5 растворяли в 20 мМ гистидине, 140 мМ NaCl, рН 6,0. Солюбилизацию облегчали путем добавления по каплям 10 об.% уксусной кислоты. Конечную концентрацию доводили до 0,4 мг/мл. Концентрацию антитела к дигоксигенину VH52bC в 20 мМ гистидине, 140 мМ NaCl, рН 6,0 доводили до 10 мг/мл. Антитело к дигоксигенину применяли в качестве контроля и обрабатывали также, как и антитело к дигоксигенину VH52bC. По 4,7 нмоля каждого антитела смешивали с 2,5 молярными эквивалентами Dig-Cys-Ahx-Cy5. Для этой цели добавляли 11,7 нмоля указанной субстанции в виде 4 порций (по 2,9 нмоля каждая) каждые 15 мин. В промежутке между указанными добавлениями образцы инкубировали при 25°С при осторожном встряхивании. После добавления последней порции 0,64 нмоля каждого комплекса aнтитeлo-Dig-Cys-Ahx-Cy5 переносили в буфер, содержащий следующие окислительно-восстановительные реагенты: 3 мМ DTE (дитиоэритритол) + 10 мм GSSG (окисленный глутатион), 0,3мМ DTE + 1 мМ GSSG и 0,03 мМ DTE + 0,1 мМ GSSG. Все образцы инкубировали в течение 15 мин в указанных условиях. После инкубации образцы разделяли пополам (0,34 нмоля каждого) и подготавливали для электрофореза в геле в присутствии ДСН. Для этого добавляли 4×LDS-буфер для образцов (фирма Invitrogen). Для каждого образца получали также восстановленную версию, добавляя 10× восстановитель для образцов, входящий в набор NuPAGE (фирма Invitrogen). Все образцы инкубировали при 70°С в течение 5 мин до осуществления электрофореза в 4-12% Бис-Трис полиакриламидном геле (NuPAGE, фирма Invitrogen) с 1× MOPS-буфером (фирма Invitrogen). Обусловленную Су5 флуоресценцию в геле оценивали с помощью устройства Lumilmager F1 (фирма Roche) при длине волны возбуждения 645 нм. После детекции флуоресценции гель окрашивали с помощью SimplyBlue SafeStain (фирма Invitrogen). Гели показаны на фиг. 8.
Образование сайт-специфического дисульфидного мостика продемонстрировано для антитела к дигоксигенину VH52bC (фиг. 8, представленные вверху гели, полосы 1 А-В), при этом имел место низкий фоновый сигнал флуоресценции в том случае, когда применяли антитело к дигоксигенину без цистеина в CDR2 (полосы 2 А-В). Фоновые сигналы в контрольных реакциях можно объяснить сочетанием Dig-Cys-Ahx-Cy5 с цистеинами, которые в норме участвуют в образовании межцепочечных дисульфидных связей в антителе. Увеличение количеств окислительно-восстановительных реагентов существенно снижало количество дисульфидных мостиков, которые соединяют тяжелые и легкие цепи антитела, приводя к образованию главным образом 3/4 антител (-1×LC), НС-димеров (-2×LC) и ½ антител (1×НС+1×LC). На показанных внизу чертежа гелях можно обнаружить флуоресценцию комплекса Dig-Cys-Ahx-Cy5, который не был ковалентно связан с антителом. На гелях в нижней части фиг. 8 продемонстрировано, что после восстановления образцов никакой обусловленной Су5 флуоресценции не обнаружено вблизи тяжелых и легких цепей антитела, это свидетельствует о том, что ковалентная связь действительно образуется с помощью дисульфидного мостика. Окрашивание кумассии каждого геля позволило установить, что общее количество белка в каждой полосе было одинаковым.
Пример метода получения конъюгатов гаптенилированных флуоросцентных красителей и антигаптеновых антител - Dig-Cys-Cy5/aнтитeлo к дигоксигенину VН52bС
Dig-Cys-Cy5 растворяли в 8,3мМ НСl, 10 об.% ДМФ до конечной концентрации 3,25 мг/мл. Концентрацию антитела к дигоксигенину VH52bC в 20 мМ гистидине, 140 мМ NaCl, рН 6,0 доводили до 15 мг/мл. Антитело к дигоксигенину применяли в качестве контроля и обрабатывали так же, как и антитело к дигоксигенину VH52bC. По 13,3 ммоля каждого антитела смешивали с 2 молярными эквивалентами Dig-Cys-Cy5, используя антитело в конечной концентрации 10 мг/мл, в присутствии 1 мМ GSH (восстановленный глутатион) и 5 мМ GSSG (окисленный глутатион). Для этой цели добавляли 26,6 нмоля указанной субстанции в виде 2 порций каждые 5 мин. В промежутке между указанными добавлениями образцы инкубировали при КТ при осторожном встряхивании. После добавления последней порции образцы инкубировали в течение 1 ч при КТ. Эффективность реакции сочетания оценивали с помощью ДСН-ПААГ и затем определяли обусловленный Су5 сигнал флуоресценции. По 5, 10 и 20 мкг каждого образца подготавливали для ДСН-ПААГ. Для этого добавляли 4 × LDS-буфер для образцов (фирма Invitrogen). Все образцы инкубировали при 70°С в течение 5 мин до электрофореза на 4-12% Бис-Трис полиакриламидном геле (NuPAGE, фирма Invitrogen) с 1 × MOPS- буфером (фирма Invitrogen). Обусловленную Су5 флуоресценцию в геле оценивали с помощью устройства Lumilmager F1 (фирма Roche) при длине волны возбуждения 645 нм. После детекции флуоресценции гель окрашивали с помощью SimplyBlue SafeStain (фирма Invitrogen).
Пример метода получения конъюгатов гаптенилированных полипептидов и антигаптеновых антител - PEG3-PYY(PEG3-Cys-4Abu-Dig)/гуманизированное антитело к дигоксигенину VН52bС
Для создания конъюгатов дериватизированного дигоксигенином PYY-полипептида, содержащего цистеинилированный линкер, 1,4 мг PEG3-PYY(PEG3-Cys-4Abu-Dig) растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли 1 мг антитела в концентрации 10 мг/мл (примерно 68 мкМ) в буфере, состоящем из 5 мМ Трис-HCl, 1 мМ ЭДТК, 1 мМ GSH, 5 мМ GSSG, рН 8,2. PEG3-PYY(PEG3-Cys-4Abu-Dig) и антитело смешивали в молярном соотношении (PEG3-PYY(PEG3-Cys-4Abu-Dig) к антителу), составлявшем 2:1, и инкубировали в течение 60 мин при КТ, перемешивали при 100 об/мин. Образовавшийся конъюгат анализировали с помощью масс-спектрометрии. 43% изученных видов идентифицировали как антитело, сшитое с 2 молекулами полипептида, 46% как антитело, сшитое с 1 молекулой полипептида, и 11% идентифицировали как несшитое антитело.
Пример 12
Создание определенных ковалентных конъюгатов гаптенилированных красителей и полипептидов с антигаптеновым антителом VН52bС/VН53С в отсутствии окислительно-восстановительных агентов
Для создания ковалентных связанных дисульфидным мостиком конъюгатов антигаптенового антитела/гаптенилированного полипептида или гаптенилированного красителя необходимо (I) осуществлять сочетание гаптена (например, дигоксигенина, флуоресцеина, биотина или теофиллина) через приемлемую реакционноспособную группу (такую, например, как цистеин, малеимид), содержащую линкеры для полипептида или красителя, которые позволяют полипептиду экспонироваться над поверхностью антитела и поэтому сохранять его активность, и (II) создавать ковалентные сайт-специфические конъюгаты гаптенилированных полипептидов с антигаптеновым антителом с мутацией, приводящей к замене на цистеин (=антитело VH52bC/VH53C), в которых сохраняется биологическая активность полипептида, и (III) осуществлять реакцию в отсутствии восстановителя для того, чтобы избегать восстановления межцепочечных дисульфидных мостиков антитела.
Общий метод:
Создание конъюгатов антигаптеновых антител с гаптенилированными соединениями должно приводить к получению конъюгатов с определенной стехиометрией, и оно должно гарантировать, что соединение в этих конъюгатах сохраняет свою активность. Для создания конъюгатов гаптенилированных соединений с соответствующим антигаптеновым антителом гаптенилированное соединение растворяли в 100% ДМФ до конечной концентрации 10 мг/мл. Концентрацию антигаптенового антитела VH52bC/VH53C доводили до 10 мг/мл в 50 мМ Трис-HCl, 1 мМ ЭДТК, рН=8,2. Гаптенилированное соединение и антигаптеновое антитело VH52bC/VH53C смешивали в молярном соотношении 2,5:1 (соединение к антителу) путем пипетирования, осуществляя всасывание-выпуск смеси, и инкубировали в течение 60 мин при КТ и 350 об/мин.
Полипептид, конъюгированный с гаптеном через содержащий цистеин линкер, обозначали далее как гаптен-Cys-полипептид или полипептид-Cys-гаптен. Полипептид может иметь либо свободный N-конец, либо кэпированный N-конец, например, с помощью ацетильной группы (Ас-полипептид-Суs-гаптен) или остатка ПЭГ (ПЭГ-полипептид-Суs-гаптен).
Флуоресцентный краситель, конъюгированный с гаптеном через содержащий цистеин линкер, обозначали далее как краситель-Суs-гаптен или гаптен-Суs-краситель.
Пример метода получения конъюгатов гаптенилированных флуоросцентных красителей и антигаптеновых антител - Dig-Cys-Ahx-Су5/антитело к дигоксигенину VН52bС
Образцы приготавливали в целом согласно методу, описанному в примере Па, с тем отличием, что комплексы антитело-Dig-Cys-Ahx-Cy5 переносили в буфер, либо не содержащий окислительно-восстановительные соединения, либо содержащий 0,1 мМ GSSG (окисленный глутатион) или 1 мМ GSSG. Полученные в результате полиакриламидные гели, у которых сканировали флуоресценцию и которые окрашивали кумасси, представлены на фиг. 9. При применении всех трех условий обнаружена сходная специфичность в отношении образования сайт-специфической дисульфидной связи (фиг. 9, гели в верхней части чертежа, полосы 1 А-В) с низким уровнем фоновых реакций (фиг. 9, полосы 2 А-В). Эти данные подтверждают, что образование дисульфидной связи может происходить без необходимости применения восстановителей. Это значительно стабилизирует антитело/снижает расщепление антитела, поскольку по сравнению с примером 11 обнаружены лишь остаточные количества 3/4 антител (-1 × LC), НС-димеров (-2 × LC) и ½ антител (1 × НС + 1 × LC).
Пример метода получения конъюгатов гаптенилированных флуоросцентных красителей и антигаптеновых антител - Dig-Суs-Су5/антитело к дигоксигенину VН52bС
Образцы приготавливали в целом согласно методу, описанному в примере 11б, с тем отличием, что 13,3 нмоля антитела смешивали с 2 молярными эквивалентами Dig-Cys -Су5, используя антитело в конечной концентрации 10 мг/мл в отсутствии окислительно-восстановительных реагентов.
Пример метода получения конъюгатов гаптенилированных флуоросцентных красителей и антигаптеновых антител - биотин-Cys-Су5/химерное антитело к биотину VH53C
Для создания конъюгатов дериватизированного биотином Су5, содержащего цистеинилированный линкер, 0,16 мг комплекса биотин-Суs-Су5 растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли 1 мг антитела к биотину VH53C в концентрации 9,7 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8.2. Биотин-Cys-Cy5 и антитело смешивали в молярном соотношении (Ас-биотин-Cys-Cy5 к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Образовавшийся конъюгат анализировали с помощью ДСН-ПААГ согласно методу, описанному в примере 11а. Детекцию флуоресценции осуществляли согласно методу, описанному в примере 11а.
Пример метода получения конъюгатов гаптенилированных флуоросцентных красителей и антигаптеновых антител - биотин - Cys-Су5/гуманизированное антитело к биотину VH53C
Для создания конъюгатов дериватизированного биотином Су5, содержащего цистеинилированный линкер, 0,16 мг комплекса биотин-Cys-Cy5 растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли 1 мг гуманизированного антитела к биотину VH53C в концентрации 7,4 мг/мл (примерно 51 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8.2. Биотин-Cys-Cy5 и антитело смешивали в молярном соотношении (Ас-биотин-Cys-Cy5 к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Образовавшийся конъюгат анализировали с помощью ДСН-ПААГ согласно методу, описанному в примере 11а. Детекцию флуоресценции осуществляли согласно методу, описанному в примере 11а.
Пример метода получения конъюгатов гаптенилированных полипептидов и антигапттеновых антител - Ac-PYY(PEG3-Cys-4Abu-Dig)/гуманизироваееое антитело к дигоксигенину VН52bС
Для создания конъюгатов дериватизированного дигоксигенином PYY-полипептида, содержащего цистеинилированный линкер, 2,4 мг Ac-PYY(PEG3-Cys-4Abu-Dig) растворяли в 20% ацетата до концентрации 5 мг/мл. Применяли 10 мг гуманизированного антитела к дигоксигенину VH52bC (68,4 нмоля) в концентрации 19,5 мг/мл (примерно 133 мкМ) в буфере, состоящем из 20 мМ гистидина, 140 мМ NaCl, рН 6,0. Ac-PYY(PEG3-Cys-4Abu-Dig) и антитело смешивали в молярном соотношении (Ac-PYY(PEG3-Cys-4Abu-Dig) к антителу), составляющем 2:1, и инкубировали в течение 60 мин при КТ, встряхивая при 100 об/мин. Образовавшийся конъюгат анализировали с помощью масс-спектрометрии. 7,4% обнаруженных видов идентифицировали как антитело, сшитое с 2 молекулами пептида, 40% приходилось на долю антитела, сшитого с 1 молекулой пептида, а 52% идентифицировали как несшитое антитело.
Пример метода получения конъюгатов гаптенилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-BAla-Biot)/xHMepHoe антитело к биотину VH53C
Для создания конъюгатов дериватизированного биотином PYY-полипептида, содержащего цистеинилированный линкер, 0,19 мг Ac-PYY(PEG3-Cys-βAla-Biot) растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли 1 мг химерного антитела к биотину VH53C в концентрации 9,7 мг/мл (примерно 67 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Ас-PYY[PEG3-Cys-βAla-Biot] и антитело смешивали в молярном соотношении 2,5:1 (Ac-PYY[PEG3-Cys-pAla-Biot] к антителу) и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Образовавшийся конъюгат анализировали с помощью масс-спектрометрии. 87,7% обнаруженных видов идентифицировали как антитело, сшитое с 2 молекулами пептида, 12,3% приходилось на долю антитело, сшитого с 1 молекулой пептида.
Пример метода получения конъюгатов гаптенилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-PEG2-Biot)/химерное антитело к биотину VH53C
Для создания конъюгатов дериватизированным биотином PYY-полипептида, содержащего цистеинилированный линкер, 0,16 мг Ac-PYY(PEG3-Cys-PEG2-Biot) растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли 1 мг химерного антитела к биотину VH53C в концентрации 9,9 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Ас-PYY[PEG3-Cys-PEG2-Biot] и антитело смешивали в молярном соотношении (Ас-PYY[PEG3-Cys-PEG2-Biot] к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Образовавшийся конъюгат анализировали с помощью масс-спектрометрии. 100% обнаруженных видов идентифицировали как антитело, сшитое с 2 молекулами пептида.
Пример метода получения конъюгатов гаптенилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-βAla-Biot)/гуманизированное антитело к биотину VH53C
Для создания конъюгатов дериватизированного биотином PYY-полипептида, содержащего цистеинилированный линкер, 0,06 мг Ac-PYY(PEG3-Cys-βAla-Biot) растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли 0,8 мг гуманизированного антитела к биотину VH53C в концентрации 9 мг/мл (примерно 62 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2 Ac-PYY[PEG3-Cys-βAla-Biot] и антитело смешивали в молярном соотношении (Ac-PYY[PEG3-Cys-βAla-Biot] к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Образовавшийся конъюгат анализировали с помощью масс-спектрометрии. 62,2% обнаруженных видов идентифицировали как антитело, сшитое с 2 молекулами пептида, 33,9% идентифицировали как антитело, сшитое с 1 молекулой пептида, а 3,9% идентифицировали как несшитое антитело.
Пример метода получения конъюгатов гаптенилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-PEG2-Biot)/гуманизированное антитело к биотину VH53C
Для создания конъюгатов дериватизированного биотином PYY-полипептида, содержащего цистеинилированный линкер, 0,08 мг Ac-PYY(PEG3-Cys-PEG2-Biot) растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли 0,8 мг гуманизированного антитела к биотину VH53C в концентрации 9 мг/мл (примерно 62 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Ac-PYY[PEG3-Cys-PEG2-Biot] и антитело смешивали в молярном соотношении (Ac-PYY[PEG3-Cys-PEG2-Biot] к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Образовавшийся конъюгат анализировали с помощью масс-спектрометрии. 71,4% обнаруженных видов идентифицировали как антитело, сшитое с 2 молекулами пептида, 26% идентифицировали как антитело, сшитое с 1 молекулой пептида, а 2,5% идентифицировали как несшитое антитело.
Пример метода получения конъюгатов гаптенилированный полипептидов и антигаптеновых антител - Ас-РYY(РЕG3-Суз-РЕG2-Fluо)/антитело к флуоресцеину VН52bС
Для создания конъюгатов дериватизированного флуоресцеином PYY-полипептида, содержащего цистеинилированный линкер, 0,33 мг Ac-PYY[PEG3-Cys-PEG2-Fluo] растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли 1 мг антитела к флуоресцеину VH52bC в концентрации 9,3 мг/мл (примерно 63мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Ас-PYY[PEG3-Cys-PEG2-Fluo] и антитело смешивали в молярном соотношении (Ас-PYY[PEG3-Cys-PEG2-Fluo] к антителу), составляющей 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Образовавшийся конъюгат анализировали с помощью масс-спектрометрии. 95% обнаруженных видов идентифицировали как антитело, сшитое с 2 молекулами пептида, 5% идентифицировали как антитело, сшитое с 1 молекулой пептида.
Пример метода получения конъюгатов гаптенилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-PEG2-Fluoy антитело к флуоресцеину VH28C
Для создания конъюгатов дериватизированного флуоресцеином PYY-полипептида, содержащего цистеинилированный линкер, 0,33 мг Ac-PYY[PEG3-Cys-PEG2-Fluo] растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли 1 мг антитела к флуоресцеину VH28C в концентрации 9,5 мг/мл (примерно бЗмкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Ас-PYY[PEG3-Cys-PEG2-Fluo] и антитело смешивали в молярном соотношении (Ас-PYY[PEG3-Cys-PEG2-Fluo] к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Образовавшийся конъюгат анализировали с помощью масс-спектрометрии. 100% обнаруженных видов идентифицировали как антитело, сшитое с 2 молекулами пептида.
Пример 13
Создание ковалентных комплексов теофиллин-антитело к теофиллину
Для оценки путей получения ковалентных включающих антитело комплексов, в которых применяли теофиллин и теофиллинсвязывающие антитела в качестве распознающей гаптен системы, создавали конструкцию теофиллин-Суs-Су5 в качестве флуоросцентного «полезного груза», применяя в целом методы синтеза и очистки, которые были описаны для конструкций дигоксигенин-Cys-Cy5 или биотин-Cys-Cy5, с тем исключением, что гаптен заменяли на теофиллин (см. пример 8 и фиг. 13, 14 и 22). Состав производного теофиллин-Cys-Cy5, которое было синтезировано, представлен на фиг. 43а). Для демонстрации образования ковалентной дисульфидной связи создавали теофиллинсвязывающие антитела, которые содержали сконструированный Cys в положении 54 или 55 вариабельной области тяжелой цепи (антитело-Cys к теофиллину). На фиг. 436) приведен пример очистки этих антител на примере варианта Y54C. Получали комплексы указанных производных антител с конструкцией теофиллин-Cys-Cy5 и затем подвергали ДСН-ПААГ в восстанавливающих и невосстанавливающих условиях согласно методу, описанному в примере 12. При применении невосстанавливающих условий связанное дисульфидным мостиком антитело к теофиллину, образующее комплекс с Су5, выявляли по его ассоциированной с Н-цепью флуоресценции в геле согласно такому же методу, который описан в примере 12. Результаты, представленные на фиг. 43в), демонстрируют, что ковалентные комплексы с антителом были образованы в результате реакции при простой загрузке, такой же как в случае дисульфидов, что было обнаружено, когда в качестве гаптена применяли дигоксигенин, флуоресцеин или биотин. Как и ожидалось, при восстановлении имела место диссоциация этих комплексов, т.е. «полезный груз» высвобождался из Н-цепи, только после восстановления дисульфида (фиг. 43в)).
Пример 14
Создание ковалентных комплексов гаптен-антитело в условиях, напоминающих условия in vivo, и доказательство требуемого формирования дисульфидной связи in vivo
Для изучения образования ковалентных комплексов гаптен-антитело в условиях, напоминающих условия in vivo, антитела-Cys к биотину инкубировали при 37°С в мышиной сыворотке с конструкцией биотин-Cys-Cy5 в течение 60 мин. Затем антитело удаляли из мышиной сыворотки с помощью белка-А. Затем «захваченные» антитела подвергали ДСН-ПААГ в невосстанавливающих и восстанавливающих условиях согласно методу, описанному в примере 12. Связанное дисульфидом антитело, образующее комплекс с Су5, выявляли по его ассоциированной с Н-цепью флуоресценции в геле согласно такому же методу, который описан в примере 12. На фиг. 44 продемонстрировано, что ковалентные комплексы между антителом образовывались в сыворотке при 37°С, т.е. в условиях, напоминающих условиях in vivo. Как и ожидалось, при восстановлении имела место диссоциация этих комплексов, т.е. «полезный груз» высвобождался из Н-цепи, только после восстановления дисульфида (фиг. 44). Данные о том, что в результате позиционирования гаптена может образовываться требуемая дисульфидная связь между антителом и «полезным грузом» даже в присутствии сыворотки, являются неожиданными, поскольку в сыворотке содержится высокое количество белков, пептидов и других соединений (которые могут влиять на реакции образования дисульфида). Данные о том, что в результате позиционирования гаптена может образовываться требуемая дисульфидная связь между антителом и «полезным грузом» в сыворотке при 37°С, открывает также возможность применения указанной системы модуляции ФК в условиях, предшествующих направленному воздействию, а именно: раздельное применение антитела и конструкции гаптен-«полезный груз» с последующей сборкой in vivo включающих антитело комплексов и последующем образованием дисульфидной связи.
Для дальнейшей оценки возможности применения in vivo « до направленного воздействия» изучали фармакокинетику биотина-Су5 в условиях, предшествующих направленному воздействию, с помощью неинвазивной технологии оптической визуализации глаза животных, описанной в примере 18. В этих экспериментах присутствие Су5 выявляли неинвазивным методом, посредством оптической визуализации глаз животных, что позволяло обнаруживать флуоресценцию Су5 в капиллярах. Величины обусловленной Су5 флуоресценции, которые обнаружены в глазах мышей через 10 мин после инъекции конструкции биотин-Су5, принимали за 100%, а величины флуоресценции, измеренные в последующие моменты времени, выражали относительно указанного значения. В этом эксперименте 1 мг антитела (либо антитело к биотину, либо антитело-Cys к биотину (т.е. Cys-мутант антитела к биотину)) вносили за 24 ч до инъекции биотина-Су5 и начинали визуализацию глаз. Контрольной группе не инъецировали предварительно антитело к биотину.
Результаты этих экспериментов представлены на фиг. 45: установлено, что после инъекции конструкции биотин-Су5 животным, которым не вводили предварительно путем инъекции антитело, конструкция элиминировалась, о чем свидетельствовали короткое время полужизни в сыворотке и низкие уровни экспозиции (ромбы). Уровни в сыворотке и время полужизни конструкции биотин-Су5, инъецированной животным, которым за 24 ч до этого инъецировали антитело к биотину (без Cys-мутации), значительно возрастали. Это свидетельствует о том, что антитело «захватывает» свой антиген (с «полезным грузом») в кровотоке и пролонгирует время полужизни в сыворотке антигена (и также конъюгированного с ним «полезного груза»). Относительный уровень и время полужизни в сыворотке конструкции биотин-Cys-Cy5, инъецированной животным, которым за 24 ч до этого инъецировали антитело-Cys к биотину (т.е. антитело, имеющее мутацию, приводящую к замене на Cys, как указано в настоящем описании, для ковалентного связывания «полезного груза») еще более возрастали. В этих образцах относительные уровни Су5 были не только выше, чем в случае не образующего комплекс соединения, но также выше, чем уровни входящего в комплекс (но не связанного с помощью дисульфидного мостика) Су5. Таким образом, входящие в комплекс с гаптеном, связанные дисульфидным мостиком «полезные грузы» (которые образовались в условиях предварительного направленного воздействия in vivo), были более стабильными в кровотоке и могли обеспечивать более высокие уровни экспозиции, чем входящие в нековалентные комплексы «полезные грузы».
Пример 15
Полипептиды в конъюгатах и комплексах с антигаптеновым антителом охраняют функциональность
Ранее при создании изобретения было продемонстрировано, что полипептиды, которые являются компонентом нековалентных конъюгатов гаптен-полипептид и комплексов с антигаптеновыми антителами, сохраняют функциональность (WO 2011/003557, WO 2011/003780 и РСТ/ЕР 2011/074273). Для демонстрации того, что сшитые пептиды сохраняют функциональность также после ковалентного дисульфидного связывания, сравнивали биологическую активность антитела к дигоксигенину, образующего комплекс с полипептидами, и их полученных с помощью дисульфидной связи конъюгатов с антителом к дигоксигенину VН52bС.
Терапевтически требуемой функциональностью выведенных из PYY пептидов является связывание с его когнатным рецептором NPY2 и воздействие на передачу сигналов. Передача сигналов через ЫРУ2-рецептор участвует и/или регулирует метаболические процессы.
Для оценки того, влияет ли комплексообразование или SS-конъюгация полипептида Dig-PYY с антителом к дигоксигенину или конъюгация полипептида Dig-Cys-PYY с антителом к дигоксигенину VH52bC соответственно на его активность, при создании изобретения оценивали способность ингибировать стимулированное форсколином накопление цАМФ в НЕК293-клетках, экспрессирующих рецептор NPY2 (анализ цАМФ).
Ниже в таблице 6 представлены результаты анализов цАМФ, которые осуществляли для оценки биологической активности PYY(3-36), его специфического для У2-рецептора модифицированного аналога moPYY, его образующего комплекс с антителом Dig-варианта и его конъюгированного с помощью дисульфидного мостика Dig-Cys-производного.

Для анализа агонистов цАМФ применяли следующие материалы: 384-луночный планшет; набор для скрининга цАМФ Tropix; система ELISA для цАМФ (фирма Applied Biosystems, каталожный №Т1505; CS 20000); форсколин (фирма Calbiochem, каталожный №344270); клетки: HEK293/hNPY2R; питательная среда: модифицированная по методу Дульбекко среда Игла (D-МЕМ, фирма Gibco); 10% сыворотки плода коровы (FBS, фирма Gibco), инактивированной тепловой обработкой; 1% пенициллина/стрептомицина (Реп 10000 ед./мл: Strep 10000 мг/мл, фирма Gibco); 500 мкг/мл G418 (генетицин, фирма Gibco, каталожный №11811-031); и среда для посева: DMEM/F12 без фенолового красного (фирма Gibco); 10% FBS (фирма Gibco, каталожный №10082-147), инактивированной тепловой обработкой; 1% пенициллина/стрептомицина (фирма Gibco, каталожный №15140-122); 500 мкг/мл G418 (генетицин, фирма Gibco, каталожный №11811-031).
Для осуществления анализа в первый день среду отбрасывали и клеточный монослой промывали, используя 10 мл ЗФР на колбу (Т225). После декантации с использованием ЗФР, 5 мл VERSENE (фирма Gibco, каталожный №1504006) применяли для удаления клеток (5 мин, 37°С). Содержимое колбы осторожно сцеживали и клеточную суспензию объединяли. Каждую колбу отмывали 10 мл среды для посева и центрифугировали при 1000 об/мин в течение 5 мин. Суспензию объединяли и подсчитывали количество клеток. Суспензию ресуспендировали в среде для посева с плотностью 2,0×105 клеток HEK293/hNPY2R на 1 мл. 50 мкл клеток (HEK293/hNPY2R - 10000 клеток/лунку) переносили в 384-луночный планшет, используя диспенсер Multidrop. Планшеты инкубировали при 37°С в течение ночи. На следующий день клетки достигали 75-85% конфлюэнтности. Средам и реагентам давали охладиться до комнатной температуры. Перед приготовлением разведений маточному раствору соединения-стимулятора в диметилсульфоксиде (ДМСО, фирма Sigma, каталожный № D2650) давали нагреться до 32°С в течение 5-10 мин. Разведения приготавливали в среде DMEM/F12, дополненной 0,5 мМ 3-изобутил-1-метилксантином (IBMX, фирма Calbiochem, каталожный №410957) и 0,5 мг/мл БСА. Конечная концентрация ДМСО в стимулирующей среде составляла 1,1% с концентрацией форсколина 5 мкМ. Клеточную среду сцеживали путем осторожного переворачивания планшета с клетками на бумажное полотенце. Вносили 50 мкл стимулирующей среды на лунку (каждую концентрацию использовали в четырех повторностях). Планшеты инкубировали при комнатной температуре в течение 30 мин и клетки оценивали под микроскопом в отношении токсичности. После 30 мин обработки стимулирующую среду отбрасывали и добавляли 50 мкл/лунку применяемого в анализе буфера для лизиса (входит в набор Tropix). Планшеты инкубировали в течение 45 мин при 37°С.20 мкл лизата переносили из стимулированных планшетов в предварительно сенсибилизированные антителом планшеты (384-луночные) из набора Tropix. Добавляли 10 мкл АР-конъюгата и 20 мкл антитела к цАМФ. Планшеты инкубировали при комнатной температуре при встряхивании в течение 1 ч. Затем планшеты промывали 5 раз буфером для промывки, используя для каждой промывки по 70 мкл на лунку. Планшеты промокали досуха. Добавляли 30 мкл /лунку раствора субстрата/энхансера CSPD/Sapphire-II RTU и инкубировали в течение 45 мин при КТ (встряхивание). Сигнал измеряли в течение 1 с/лунку с помощью люменометра (VICTOR-V).
Результаты этих анализов (таблица 6) продемонстрировали, что модифицированное производное пептида moPYY обладало несущественно более низкой активностью, чем PYY дикого типа. Величина IC50 в цАМФ-анализе составляла 0,09нМ для PYY дикого типа и 0,14нМ для модифицированного аналога. Ковалентная с применением дисульфидного мостика конъюгация приводила к небольшому снижению биологической активности. Величина IC50 для конъюгата составляла 5-36нМ. Неожиданно было установлено, что ковалентный полученный с помощью дисульфидного мостика конъюгат оказался в 2-раза более активным, чем нековалентный комплекс, величина IC50 для которого составляла 10,91нМ.
Пример 16
Стабильность в сыворотке комплексов биотинилированного Су5 с гуманизированным антителом к биотину в сравнении с ковалентными конъюгатами биотинилированного Су5 с гуманизированным антителом к биотину VH53C
Целью описанной технологии модификации пептидов было улучшение терапевтической применимости пептидов. В настоящее время основными «узкими местами», ограничивающими терапевтическое применение пептидов является стабильность in vivo и/или короткое время полужизни в сыворотке и быстрый клиренс.ФК-параметры конъюгатов антител с флоурофорами определяли in vivo и сравнивали с ФК нековалентных комплексов антитело-флоурофор. Для этого, (I) антитело к биотину VH53C ковалентно конъюгировали с биотинилированным флуорофором Biot-Cys-Cy5, (II) создавали нековалентный комплекс антитела к биотину с биотинилированным флоурофором Biot-Cy5, (III) ковалентно конъюгированные и образующие нековалентный комплекс соединения вводили животным, (IV) измеряли концентрации в сыворотке соединений в течение времени путем определения флуоресценции Су5 (А650) и соответствующего антитела с помощью метода ELISA, которые позволяет специфически определять гуманизированное антитело.
Экспериментальная процедура
Для анализа влияния на ФК-параметры образования комплекса антитела с небольшим флуоросцентным субстратом 13 нмолей конъюгата Су 5-биотин/гуманизированное антитело к биотину VH53C или соответствующего антитела, образующего нековалентный комплекс с соединением, или только флуоросцентного соединения в 20 мМ гистидине/140 мМ NaCl, рН 6,0 применяли для обработки каждой субстанцией шести самок мышей (линия NRMI). Образцы крови объемом примерно 0,1 мл собирали после следующих моментов времени: 0,08 ч, 4 ч и 48 ч для мышей 1, 2 и 3 в первой группе и 0,08 ч, 24 ч и 72 ч для мышей 1, 2 и 3 во второй группе. Образцы сыворотки объемом по меньшей мере 50 мкл получали через 1 ч при КТ путем центрифугирования (9300 × g, 3 мин, 4°С). Образы сыворотки хранили при -80°С.
Для определение количества соединения в сыворотке в данные моменты времени использовали флуоросцентные свойства Су5: обусловленную Су5 флуоресценцию в образцах сыворотки оценивали количественно в 120-микролитровых кварцевых кюветах при комнатной температуре с помощью флуоресцентного спектрофотометра Сагу Eclipse (фирма Varian). Длина волны возбуждения составляла 640 нм. Испускание измеряли при 667 нм. Образцы сыворотки разводили в 1 × ЗФР до достижения соответствующего диапазона интенсивности испускания. Сыворотку крови необработанной мыши в таком же разведении в 1 × ЗФР, что и соответствующий образец, применяли в качестве «пустой» пробы и в ней не обнаружен никакой сигнал флуоресценции.
На фиг. 34 представлены результаты анализа ковалентных конъюгатов, нековалентных комплексов и не включенного в комплекс гаптена-Су5. Данные представлены в виде уровней (в %) обусловленной Су5 флуоресценции, стандартизованных относительно (пиковых) уровней в сыворотке через 5 мин после инъекции. Являясь соединением с относительно малой молекулярной массой не включенный в комплекс биотин-Ser-Cy5, быстро элиминировался из сыворотки. Через 1 ч после инъекции удалось обнаружить только 6% флуоресценции, от внесенной и выявляемой в сыворотке через 5 мин. В более поздние моменты времени, т.е. через 2, 4 и 24 ч после инъекции, обусловленные Су5 сигналы не были выявлены.
В случае комплекса антитела с соединением через 4 ч после инъекции в сыворотке все еще обнаружено примерно 50% от внесенной флуоресценции (уровни через 5 мин принимали за 100%). Уровни обусловленной Су5 флуоресценции были выявлены в более поздние моменты времени, при этом примерно 22% от выявленного через 5 мин уровня обнаружено через 2 ч и примерно 12% выявлено через 48 ч после инъекции, и 8% все удалось обнаружить через 72 ч. В случае антитела, конъюгированного с соединением, обнаружено существенно более длительное время полужизни in vivo по сравнению с комплексом антитела с соединением. Через 4 ч после инъекции в сыворотке все еще обнаружено примерно 58% от внесенной флуоресценции (уровни через 5 мин принимали за 100%) (что в 1,16 раза превышает уровни в случае комплекса антитела с соединением). Через 24 ч в сыворотке обнаружено 35% (фактор 1,6) обусловленной Су5 флуоресценции, через 48 ч - 31% (фактор 2,6) и через 72 ч. 26% (фактор 3,3). Сопоставимое снижение флуоресценции у образующих комплекс и конъюгированых соединений в первые 24 ч экспериментов может быть связано с начальным распределением, которое является сходным у комплексов и конъюгатов. Обнаруженное через 24 ч различие связано со стабильностью in vivo конъюгированных с антителом соединений.
Для определения количества в сыворотке человеческого антитела IgG-типа в данные моменты времени применяли следующий принцип анализа: человеческие антитела IgGl-типа в образцах сыворотки иммобилизовывали на твердой фазе (титрационный планшет Maxisorb®, NUNC-Immuno™), сенсибилизированной каппа-цепью античеловеческого моноклонального антитела IgG-типа. Образцы сыворотки разводили в соотношении 1:105 и 1:106 и в лунки добавляли по 100 мкл указанных разведений. После инкубации лунки промывали трижды, каждый раз используя по 300 мкл ЗФР/0,05% Твин 20. Детекцию человеческих антител IgG-типа осуществляли, добавляя сначала 100 мкл античеловеческого IgG СH1 - домен-специфического, который был дигоксигенилирован на С-конце, в концентрации 0,25 мкг/мл. После трехкратной промывки, каждый раз с помощью 300 мкл ЗФР/0,05% Твин 20, добавляли 100 мкл Fab-фрагмента антитела к дигоксигенину, конъюгированного с пероксидазой из хрена (HRP), в концентрации 25 мед./мл. И, наконец, добавляли по 100 мкл на лунку ABTS®. После инкубации в течение 30 мин при температуре окружающей среды измеряли экстинкцию (ОП) при 405 нм и 492 нм [405/492] с помощью поступающего в продажу ридера для микропланшетов, применяемого для ELISA (например, Tecan Sunrise).
На фиг. 34 продемонстрированы уровни Biot-Cy5 в сыворотке, а также уровни человеческого IgG в сыворотке мышей, обработанных комплексами и конъюгатами антитело-биотин-Су5. Данные представлены в виде уровней (в %) человеческого IgG, стандартизованных относительно (пиковых) уровней в сыворотке через 5 мин после инъекции. Относительные уровни в сыворотке человеческого IgG как для комплексов, так и для конъюгатов антитело-гаптен коррелировали с относительными уровнями флуоресценции, измеренными для конъюгатов антитело-гаптен. Так, для соединения биотин-Суs-Су5 обнаружена стабильность in vivo, сходная со стабильностью антитела, с которым оно конъюгировано, это означает, что конъюгаты антитело-гаптен остаются интактными in vivo. Ясно, что это не имеет места в случае комплексов антитело-гаптен, для которых относительная обусловленная Су5 флуоресценция снижалась быстрее, чем относительные уровни в сыворотке человеческого IgG. Это означает, что in vivo комплексы высвобождают «полезный груз» с течением времени.
В целом, установлено, что стабильность in vivo гаптенилированных соединений существенно возрастала при связывании с антигаптеновым антителом. Однако комплексы антитело-гаптен не были полностью стабильными in vivo, поскольку уровни в сыворотке гаптена-Су5 снижались быстрее, чем уровни антитела в сыворотке. Это не происходило в случае конъюгатов антитело-гаптен-Су5, для которых обнаружено поведение in vivo, сходное с поведением обычных антител IgG-типа.
Кинетика в сыворотке Dig-пептида (сравнение нековалентного комплекса и ковалентного конъюгата)
Для анализа влияния на ФК-параметры включения антитела в комплекс и конъюгации антитела с дигоксигенилированным полипептидом 32,1 нмоля полипептида или соответствующего образующего нековалентный комплекс с антителом полипептида в 20 мМ гистидине/ 140 мМ NaCl, рН 6,0 вводили, используя для каждой субстанции по 2 самки мышей (штамм NRMI). Мыши, которым вводили MAK-DIG-PYY, имели вес 23 г и 25 г, а мыши, которым вводили DIG-PYY, имели вес 28 и 26 г. Получали образцы крови объемом примерно 0,1 мл после следующих моментов времени: 0,08 ч, 2 ч и 24 ч для мыши 1 и 0,08 ч, 4 ч, 24 ч для мыши 2. Образцы сыворотки объемом по меньшей мере 40 мкл получали через 1 ч при КТ путем центрифугирования (9300 × g, 3 мин, 4°С). Образы сыворотки хранили при -80°С.
Определение количества дигоксигенилированного пептида в сыворотке в данные моменты времени было более трудным по сравнению с обнаружением Dig-Cy5, поскольку отсутствуют средства непосредственного обнаружения полипептида в образцах сыворотки. По этой причине разрабатывали анализ, сходный с Вестерн-блоттингом, для детекции дигоксигенилированного пептида в сыворотке. На первой стадии образцы сыворотки разделяли с помощью ДСН-ПААГ в восстанавливающих условиях. Поскольку приготовление образца включало воздействие на сыворотку ДСН и восстановителей в высоких концентрациях, то конъюгаты, включающие комплекс Dig-полипептид, могли отделяться от (полностью денатурированного/не имеющего укладку) антитела к дигоксигенину, в то время как ковалентные конъюгаты оставались связанными. Для того, чтобы опосредовать высвобождение полипептида из нековалентного комплекса с антителом и разделения индивидуальных компонентов с помощью ДСН-ПААГ, по 2 мкл каждого образца сыворотки разводили в 18 мкл 20 мМ гистидина/140 мМ NaCl рН 6,0, смешивали с 6,7 мкл 4 × LDS буфера для образца и 3 мкл 10× восстановителя для образца (набор NuPAGE, фирма Invitrogen) в течение 5 мин при 95°С. В качестве контроля использовали 2 мкл сыворотки необработанной мыши этой же линии. Образцы вносили в 4-12% Бис-Трис гель (NuPAGE, фирма Invitrogen), который разгоняли при 200 В/120 мА в течение 20 мин, используя 1 × MES (фирма Invitrogen) в качестве подвижного буфера. Затем разделенные полипептиды блоттировали на мембрану из ПВДФ (размер пор 0,22 мкм, фирма Invitrogen), используя систему XCell Sure Lock® Mini-Cell (фирма Invitrogen), в течение 40 мин при 25 В/130 мА. Мембраны блокировали в 1% обезжиренном молоке в 1 × ЗФР+1% Твин20 (ЗФРТ) в течение 1 ч при КТ. Затем дигоксигенилированные полипептиды выявляли на мембране с помощью антитела к дигоксигенину. Для этого антитело к дигоксигенину наносили на мембраны в концентрации 13 мкг/мл в 10 мл 1% обезжиренного молока/ЗФРТ в течение 2 ч при КТ. Мембраны промывали 3×5 мин в 1 × ЗФРТ. Fab-фрагменты антимышиного IgG, сшитые с POD из набора для Вестерн-блоттинга LumiLightPLUS (фирма Roche), вносили в разведении 1:25 в 10 мл 1% обезжиренного молока/ЗФРТ в течение 1 ч при КТ. Мембраны промывали 3×5 мин 1 × ЗФРТ. Детекцию осуществляли путем инкубации мембран в 4 мл субстрата для Вестерн-блоттинга LumiLight в течение 5 мин при КТ. Хемилюминисценцию выявляли с помощью устройства Lumilmager F1 (фирма Roche), время экспозиции составляло 20 мин.
Результаты этих анализов представлены на фиг. 35А и Б. Определяли присутствие/количество дигоксигенилированного полипептида в мышиной сыворотке в различные моменты времени. У мышей, которых обрабатывали образующими комплекс с антителом пептидами (фиг. 35, слева), обнаружены сильные сигналы в самый ранний момент времени (5 мин после введения). Эти сигналы могут быть четко установлены, что видно по размеру и локализации в блоте контрольных образцов. В сыворотке мышей, которых обрабатывали образующим комплекс с антителом полипептидом, ассоциированные с полипептидом сигналы были более сильными в ранние моменты времени и снижались с течением времени. Тем не менее, полипептид все еще поддавался обнаружению по хорошим сигналам во все моменты времени и даже через 24 ч после введения.
У мышей, которых обрабатывали не входящим в комплекс полипептидом, только лишь сигнал, связанный с полипептидом, удавалось обнаружить даже в самый ранний момент времени. На фиг. 35 справа продемонстрировано, что в нормальных условиях экспозиции на блоте не был виден свободный полипептид. Контрастное усиление блота доказало присутствие какого-то полипептида через 5 мин после введения, но только в следовых количествах. В более поздние моменты времени, полоса, соответствующая требуемому полипептиду, не обнаружена.
Удалось продемонстрировать, что не входящий в комплекс полипептид имеет очень короткое время полужизни в сыворотке мышей. У мышей, которым вводили одинаковые полипептиды, но в комплексе с антителом, обнаружено присутствие указанных полипептидов в сыворотке в течение более длительных периодов времени. Через 24 ч после инъекции полипептид удавалось обнаружить в сыворотке указанных мышей.
Пример 17
Время полужизни в сыворотке ковалентно связанных комплексов дигоксигенин-антитело и дигоксигенинсвязываюших IgG
Для анализа того, может ли ковалентное комплексообразование дополнительно улучшать ФК-свойства относительно нековалентно связанных комплексов с гаптенами, изучали in vivo ФК-параметры комплексов антитело к дигоксигенину-дигоксигенин-Су5, а также ковалентно связанных конъюгатов [антитело к дигоксигенину-Суs]-[дигоксигенин-Суs-Су5]. Для этого дигоксигенин-Су5 определяли, используя его флуоресценцию (А650), а соответствующее антитело определяли с помощью метода ELISA, который позволяет осуществлять специфическое обнаружение гуманизированного антитела. Дигоксигенин-Су5 применяли в качестве низкомолекулярного «суррогата» сшитых с гаптеном пептидом, поскольку его флуоресцентные свойства позволяют легко и точно осуществлять обнаружение в сыворотке.
Таким же методом, который описан для конструкции биотин-Су5 или биотин-Cys-Cy5 (см. пример 16), дигоксигенин-Су5 либо в комплексе с антителом, либо дигоксигенин-Су5, дополнительно связанный с антителом через cys-линкер, инъецировали внутривенно самкам мышей линии NRMI, после чего брали образцы крови через 0,08, 2, 4 и 24 ч. Уровни обусловленной Су5 флуоресценции, обнаруженные у обеих мышей через 5 мин после инъекции (t=0,08), принимали за 100%, а уровни флуоресценции, измеренные в последующие моменты времени, выражали относительно указанной величины.
Результаты этих экспериментов продемонстрировали, что для дигоксигенина-Су5 менее 10% от внесенной флуоресценции (уровень, обнаруженный через 5 мин) было обнаружено через 2 ч после инъекции. В более поздние моменты времени, т.е. через 4 и 24 ч соответственно после инъекции, не были обнаружены обусловленные Су5 сигналы (см. фиг. 41). В отличие от не входящего в комплекс соединения, значительно более высокие уровни и в течение более продолжительных периодов времени выявлены для образующего комплекс с антителом соединения (фиг. 41). Это свидетельствует о том, что комплексообразование с антителом существенно повышало время полужизни в сыворотке плазмы небольшого соединения, такого как дигоксигенин-Су5. Кроме того, для ковалентно связанных «полезных грузов» характерна большая ФК-пролонгация по сравнению с нековалентно связанными комплексами. Непосредственное сравнение уровней дигоксигенина-Су5 и уровней антитела продемонстрировало, что «полезный груз» с течением времени отделялся от антитела, причем, уровни Су5 снижались быстрее, чем уровни антитела. В противоположность этому, для ковалентно связанных содержащих дигоксигенин конъюгатов продемонстрировано практически идентичное время полужизни в сыворотке для Су5 и IgG (фиг. 41). Это свидетельствует о том, что связанные дисульфидным мостиком «полезные грузы» остаются стабильно связанными с антителами, в то время как в случае нековалентных комплексов имеет место диссоциация с течением времени. Пример 18
Время полужизни в сыворотке и уровни экспозиции ковалентно связанных комплексов гаптен-антитело и комплексов, которые соединены только через гаптенсвязываюший сайт
Для анализа того, может ли ковалентное комплексообразование дополнительно улучшать ФК-свойства по сравнению с нековалентно связанными комплексами с гаптенами, изучали in vivo ФК комплекса антитело к биотину с биотином-Су5, а также ковалентно связанного конъюгата [антитело к биотину-Cys]-[биотин-Cys-Cy5]. Присутствие Су5 определяли неинвазивно с помощью оптической визуализации глаз животных, которая позволяет выявлять флуоресценцию Су5 в капиллярах. Уровни обусловленной Су5 флуоресценци, обнаруженные в глазах мышей через 10 мин после инъекции, принимали за 100%, уровни флуоресценции, измеренные в последующие моменты времени, выражали относительно этой величины. Результаты этих экспериментов представлены на фиг. 42: продемонстрировано, что не входящий в комплекс биотин-Су5 имел короткое время полужизни в сыворотке и низкие уровни экспозиции. Обнаружены более высокие уровни и удлиненное время полужизни для образующего комплекс с антителом соединения, которое не было соединено с помощью ковалентной связи. Кроме того, для ковалентно связанных «полезных грузов» характерна большая ФК-пролонгация и более высокие уровни в сыворотке по сравнению с нековалентно связанными комплексами. Это свидетельствует о том, что образующие комплекс с гаптенами связанные дисульфидным мостиком «полезные грузы» являются более стабильными в кровотоке и могут обеспечивать более высокие уровни экспозиции, чем входящие в нековалентные комплексы «полезные грузы».
Пример 19
Комплексообразование с пептидами и ковалентная конъюгация с антителами, которые связывают различные гаптены
Применение гаптенсвязывающий модулей для сочетания гаптенилированных соединений (т.е. «полезных грузов») с обеспечивающими направленный перенос носителями, является одной из технических возможностей, с помощью которой можно реализовать опосредованное гаптеном введение. Концепция может распространяться на дополнительные гаптены или другие субстанции, которые «захватывают» соединения и соединяют их с обеспечивающим направленный перенос модулем. Например, для введения или стабилизации полипептида можно применять моно- или биспецифические антитела, которые связываются с дигоксигенином или другими гаптенами, для стабилизации и оптимизации ФК терапевтических полипептидов.
Предпосылками для применения в качестве «захватывающих» полипептид модулей являются: (I) связывание соединений с гаптеном не оказывает серьезного влияния на активность полипептида и (II) возможность эффективного связывания/комплексообразования антитела с гаптенилированными соединениями.
Обусловленное гаптеном связывание является предпосылкой эффективного ковалентного сочетания гаптенилированных красителей или полипептидов с цистеинилированным антигаптеновым антителом.
Для демонстрации того, что обусловленное аффинностью комплексообразование гаптенилированных соединений с антигаптеновыми антителами является предпосылкой для эффективного образования дисульфидной связи, биотин-Cys-Cy5 инкубировали с гуманизированным антителом к дигоксигенину и гуманизированным антителом к дигоксигенину VH53C. Инкубацию конструкции биотин-Суs-Су5 с гуманизированным антителом к биотину и гуманизированным антителом к биотину VH53C осуществляли в качестве контрольной реакции.
0,13 мг конструкции биотин-Cys-Cy5 растворяли в 100% ДМФ до концентрации 10 мг/мл. По 0,7 мг каждого антитела применяли в концентрации 6,7 мг/мл (примерно 46 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Биотин-Cys-Cy5 и антитела смешивали в молярном соотношении (Ас-биотин-Cys-Cy5 к антителу), составляющем 2,5:1, и инкубировали в течение 60 мин при КТ, встряхивая при 350 об/мин. Образовавшийся комплекс/конъюгат дополнительно анализировали с помощью ДСН-ПААГ и затем выявляли обусловленную Су5 флуоресценцию в полиакриламидном геле. По 15 мкг комплекса/конъюгата смешивали с 4×LDS-буфером для образца (фирма Invitrogen) и инкубировали при 95°С в течение 5 мин. Обусловленную Су5 флуоресценцию определяли с помощью устройства Lumilmager F1 (фирма Roche) при длине волны возбуждения 645 нм.
В невосстановленных образцах обнаружено образование ковалентной сайт-специфической дисульфидной связи в случае гуманизированного антитела к биотину VH53C (фиг. 36, полоса 4) с очень низким фоновым сигналом флуоресценции, когда применяли гуманизированное антитело к биотину без цистеина в CDR2 (фиг. 36, полоса 3). Биотин-Суs-Су5 также ковалентно сшивали с гуманизированным антителом к дигоксигенину VH52bC (фиг. 36, полоса 2) с очень низким фоновым сигналом, когда применяли гуманизированное антитело к дигоксигенину (фиг. 36, полоса 1), но с существенно более низкой эффективностью. Это может быть результатом избыточного количества конструкции биотин-Суs-Су5, обнаруженного в нижней части геля (обозначено стрелками). В случае гуманизированного антитела к дигоксигенину VH52bC удалось обнаружить большее количество несвязанной конструкции биотин-Суs-Су5 (полоса 2), чем в случае гуманизированного антитела к биотину VH53C (полоса 4). После восстановления образцов никакой обусловленной Су5 флуоресценции не удалось обнаружить вблизи тяжелых и легких цепей антитела, что свидетельствует о том, что ковалентная связь может действительно образовываться с помощью дисульфидного мостика. Окрашивание кумасси каждого геля продемонстрировало, что общее количество белка в каждой полосе было одинаковым.
Пример 20
Обусловленное гаптеном связывание является предпосылкой эффективного ковалентного сочетания гаптенилированных красителей или полипептидов с антигаптеновым цистеинилированным антителом
Для демонстрации того, что обусловленное аффинностью комплексообразование гаптенилированных соединений с антигаптеновыми антителами является предпосылкой для эффективного образования дисульфидной связи, негаптенилированный пептид Ac-PYY(PEG3-Cys-4Abu-NH2) (Biosynthan 1763.1, SEQ ID NO: 178) инкубировали с гуманизированным антителом к дигоксигенину VH52bC и гуманизированным антителом к дигоксигенину. 1,4 мг Ac-PYY(PEG3-Cys-4Abu-NH2) растворяли в 100% ДМФ до концентрации 10 мг/мл. Применяли по 2 мг каждого антитела в концентрации 11-13 мг/мл (примерно 75-89 мкМ) в буфере, состоящем из 50 мМ Трис-HCl, 1 мМ ЭДТК, рН 8,2. Ac-PYY(PEG3-Cys-4Abu-NH2) и антитела смешивали в молярном соотношении (Ac-PYY(PEG3-Cys-4Abu-NH2 к антителу)), составляющем 2,1:1. Добавляли пептид в виде 3 порций, при этом раствор перемешивали со скоростью 500 об/мин с помощью стрежневой мешалки. В промежутке между каждыми добавлениями образцы инкубировали в течение 5 мин при 200 об/мин. После добавления последней порции образцы инкубировали в течение 1 ч при КТ и 200 об/мин.
С помощью гель-фильтрации установлено, что образовавшийся комплекс/конъюгат содержал 97% мономерной IgG-подобной молекулы и 3% димерных растворимых агрегатов Ac-PYY(PEG3-Cys-4Abu-NH2): конъюгат гуманизированного антитела к дигоксигенину VH52bC и 100% мономера Ас-PYY(PEG3-Cys-4Abu-NH2): комплекс гуманизированного антитела к дигоксигенину. Кроме того, образовавшийся комплекс/конъюгат анализировали с помощью масс-спектрометрии. В случае конструкции Ac-PYY(PEG3-Cys-4Abu-NH2):конъюгат гуманизированного антитела к дигоксигенину VH52bC 17% обнаруженных видов идентифицировали как антитело, сшитое с 2 молекулами пептида, 51% идентифицировали как антитело, сшитое с 1 молекулой пептида и 32% идентифицировали как антитело без сшитого пептида. В случае конструкции Ас-РУУ(РЕО3-Суs-4Аbu-NН2):комплекс гуманизированного антитела к дигоксигенину 100% видов идентифицировали как несшитое антитело.
Пример 21
Дисульфидные схемы, которые требуются для образования имеющих правильную укладку гаптенсвязывающих антител с мутацией, приводящей к замене на цистеин. для ковалентного связывания «полезного груза»
Гаптенсвязывающие модули для ковалентного связывания соединения/ «полезного груза» могут состоять из «стандартных» антител, таких как IgG, содержащих дополнительные остатки цистеина, которые могут обеспечивать ковалентное присоединение гаптенилированных соединений/«полезных грузов». Согласно методу, изложенному в настоящем описании, интродуцируют требуемые функциональности (остатки цистеина) в уложенные домены, структура и последовательность которых обеспечивают основу для функциональности антитела. Правильное образование определенных дисульфидных связей внутри доменов, а также между доменами антител является существенным для образования и поддержания правильной структуры и функциональности. На фиг. 37(A) представлена схема дисульфидов, которая требуется для образования функциональных связывающих плечей, таких как Fab немодифицированных антител, а на фиг. 37(Б) представлена схема дисульфидов, которая необходима для поддержания структуры и функциональности мутантного производного антитела VH52cB/VH53C. Для поддержания правильной схемы дисульфидов дополнительный остаток цистеина, интродуцированный в VH-домен, не должен быть оккупирован и не должен оказывать интерферирующее действие или вступать в реакцию с соседними остатками цистеина. На фиг. 37(B) и 37(Г) продемонстрировано, что добавление дополнительных остатков цистеина создает возможность образования неправильных дисульфидов в VH-доменах в процессе биосинтеза указанных молекул. Тот факт, что положение VH52bC/VH53C локализовано внутри VH-домена (и очень близко к другим остаткам цистеина) повышает риск того, что в процессе биосинтеза тяжелой цепи могут образовываться неправильные дисульфиды. Другой потенциальной проблемой является то, что происходит сборка VH- и VL-доменов в секреторном пути на одном Fv-фрагменте. Секреторный путь включает условия окислительно-восстановительного сдвига и образования дисульфидов и перестановку ферментов. Таким образом, возможность интродукции неправильных дисульфидов в результате добавления мутации VH52bC/VH53C может «распространяться» также на дисульфиды легкой цепи (пример представлен на фиг. 37(Д)). Это может дополнительно повышать риск получения/создания имеющих неправильный фолдинг нефункциональных молекул. Поэтому является совершенно неожиданным, что, несмотря на указанных риски, можно экспрессировать и получать в более высоких количествах гомогенные функциональные производные антител, которые содержат мутацию VH52bC/VH53C и которые могут ковалентно связываться с гаптенилированными соединениями/«полезными грузами».
Пример 22
Состав и создание антигаптеновых стабилизированных дисульфидами одноцепочечных Fv-фрагментов с мутацией, приводящей к замене на цистеин, для ковалентного связывания
Гаптенсвязывающие модули для ковалентного связывания соединения/ «полезного груза» могут состоять из «стандартных» антител, таких как IgG. Альтернативно этому, они могут представлять собой модифицированные субстанции, такие как рекомбинантные Fv- или Fab-фрагменты или их производные. Одноцепочечные Fv-фрагменты часто применяют в качестве альтернативы полноразмерным антителам, прежде всего в тех случаях, когда требуется малый размер модуля или когда дополнительные связывающие модули требуются для создания би- или мультиспецифических производных антител. Одним из примеров созданных субстанций, выведенных из антигаптенового Fv, является стабилизированный дисульфидами одноцепочечный Fv, который обладает способностью связываться и ковалентно соединять дигоксигенилированные соединения/«полезные грузы». Стабилизированный дисульфидами одноцепочечный Fv с Dig-связывающей специфичностью создавали путем соединения друг с другом VH- и VL-доменов антитела к дигоксигенину через гибкий богатый Gly и Ser линкер. Эти VH- и VL-домены несли дополнительные мутации, приводящие к замене на цистеин, в положении 44 VH и положении 100 VL (положения согласно Кэботу и др.). Указанные дополнительные остатки цистеина образовывали стабильный межмолекулярный дисульфидный мостик между VH и VL. Это, как описано ранее, приводило к стабилизации scFv (например, Reite, Y. и др., Nature Biotechnology 14, 1996, cc. 1239-1245).
Помимо этого интродуцировали другой остаток цистеина в VH в положение 52b или 53 соответственно согласно нумерации Кэбота, добавляя Fv-фрагменту функциональность в отношении образования ковалентной связи.
Однако интродукция указанной мутации в стабилизированные дисульфидом Fv-фрагменты является намного более проблематичной, чем введение ее в полноразмерные антитела. Одноцепочечным Fv-фрагментам присуща меньшая стабильность, чем полноразмерным IgG или Fab-фрагментам, поскольку у них отсутствуют константные домены в качестве стабилизирующих и усиливающих гетеродимеризацию субстанций. Стабильность можно придавать путем введения в Fv-фрагменты дополнительных мутаций, приводящих к замене на цистеин, таких как дисульфид VH44-VL100. Однако указанный принцип стабилизации «работает» только, если дисульфид образуется в правильных положениях между правильными остатками цистеина. Таким образом, в дополнение к определенным внутридоменным дисульфидам (один в VH и один в VL), требуется, чтобы был образован один индивидуальный определенный правильный междоменный дисульфид. Дисульфидные связи между неспаренными цистеинами могут приводить к образованию имеющих неправильный фолдинг нестабильным и нефункциональным субстанциям. С учетом того, что стабилизированный дисульфидами Fv-фрагмент содержит 6 остатков цистеина, теоретически можно получать 21 различную дисульфидную связь, но только правильная комбинация 3 определенных дисульфидов может приводить к образованию функциональных стабилизированных scdsFv. Эта проблема усложняется после добавления другого свободного остатка цистеина в VH-домен. Стабилизированный dsFv должен содержать два определенных внутридоменных дисульфида (по одному в VH и VL), один определенный междоменный дисульфид (между VH и VL) и еще один свободный остаток цистеина для сочетания с гаптенилированным соединением/«полезным грузом» (в VH в положении 52b/53). С учетом того, что стабилизированный дисульфидами Fv-фрагмент с дополнительной мутацией, приводящей к замене на цистеин, для ковалентного сочетания содержит 7 остатков цистеина, теоретически может образовываться много различных дисульфидных связей, но только правильная комбинация 3 определенных дисульфидов со свободным остатком цистеина, расположенным точно в положении VH52b/VH53, может приводить к образованию функционального стабилизированного ковалентно связанного компетентного dsFv. Одной дополнительной проблемой является тот факт, что дополнительный свободный остаток цистеина (VH52b/VH53) локализован в непосредственной близости к остатку цистеина в положении VH44, который представляет собой не встречающийся в естественных условиях цистеин, но который интродуцирован путем мутации для дисульфидной стабилизации. VH44C необходим для образования правильного междоменного дисульфида, и этот дисульфид, не вдаваясь в конкретную теорию, наиболее вероятно образуется после независимого фолдинга и сборки VH и VL. Близость VH44C и VH52bC/VH53C увеличивает риск того, что внутридоменный дисульфид не может образовываться требуемым образом. Однако было установлено, что можно получать функциональные стабилизированные дисульфидом одноцепочечные Fv-модули, которые связывают дигоксигенин и которые одновременно обладают способностью ковалентно связываться с дигоксигенилированными «полезными грузами». Состав стабилизированной дисульфидами молекулы одноцепочечного Fv, которая содержит правильные дисульфиды и свободный остаток цистеина в правильном положении, и ее сравнение с нежелательными имеющими неправильный фолдинг молекулами, представлено на фиг. 38. Последовательности, которые кодируют вариабельные области легких цепей и модифицированные вариабельные области тяжелых цепей указанного Dig-связывающего scdsFv с VН52bС-мутацией производного Fv-фрагмента антитела, представлены в SEQ ID NO: 190 (VH), а соответствующая VL-область - в SEQ ID NO: 189. Успешное создание указанных dsFv в качестве модулей для конструирования производных биспецифических антител описано в примере 23 (ниже), а также на фиг. 40(A), фиг. 40(Б) и фиг. 40(B).
Пример 23
Состав, экспрессия и очистка биспецифических производных антигаптеновых антител для направленного введения ковалентно сшитых соединений/«полезных грузов»
Создавали биспецифические антитела, содержащие гаптенсвязывающие модули антитела для ковалентного связывания соединения/«полезного груза». Эти антитела дополнительно содержали связывающие модули, которые обеспечивают направленный перенос к другим антигенам. Пути применения указанных биспецифических антител включают специфический направленный перенос гаптенилированных соединений/«полезных грузов» к клеткам или тканям, которые несут целевой антиген. Одним из примеров указанных созданных молекул является биспецифическое антитело, имеющее связывающие области, которые распознают опухоль, ассоциированную с углеводным антигеном LeY, и одновременно со стабилизированными дисульфидами Fv-фрагментами, которые связывают и осуществляют ковалентное сочетание дигоксигенилированных соединений/«полезных грузов». Для этого стабилизированные дисульфидами одноцепочечные Fv соединяли через гибкие богатые Gly и Ser связывающие пептиды с С-концами СН3-доменов антитела к LeY, что позволяет получать четырехвалентные молекулы с двумя связывающими LeY плечами и дополнительно с двумя связывающими дигоксигенин компонентами. Связывающие дигоксигенин компоненты, несущие дисульфидную связь VH44-VL100, описаны ранее (см., например, Reiter Y., и др., Nature Biotechnology 14, 1996, cc. 1239-1245). Связывающий дигоксигенин компонент содержал дополнительно мутацию VH52bC для ковалентного сочетания. Последовательности, которые кодируют легкую цепь и модифицированную тяжелую цепь указанного производного антитела к LeY-Dig, представлены в SEQ ID NO: 191 и SEQ ID NO: 192. Состав биспецифического производного антитела LeY-Dig в качестве вектора для переноса ковалентно сшитых соединений/«полезных грузов» схематически представлен на фиг. 39.
Биспецифические молекулы создавали с помощью методов молекулярной биологии, экспрессировали путем секреции из культивируемых клеток, затем очищали из супернатантов культур согласно описанным выше методам. На фиг. 40(A) показано присутствие модифицированной Н-цепи и L-цепи этого биспецифического антитела LeY-Dig (52bС) в супернатантах клеточных культур, визуализированных с помощью анализов методом Вестерн-блоттинга, которые позволяют выявлять L-цепи и Н-цепи антитела. На фиг. 40(Б) продемонстрирована гомогенность этих антител после очистки с помощью ДСН-ПААГ в присутствии восстановителя. Окрашивание ДСН-ПААГ с помощью кумасси бриллиантового голубого позволило визуализировать полипептидные цепи, родственные IgG, с кажущимися молекулярными размерами, аналогичными их рассчитанным молекулярным массам. На фиг. 40(B) представлен SEC-профиль биспецифического антитела LeY-Dig (52bС) после очистки на белке А, демонстрирующий гомогенность и отсутствие агрегатов в белковых препаратах. Таким образом, биспецифические антитела, которые содержат обеспечивающие направленный перенос модули, а также модули для ковалентного сочетания гаптенилированных соединений/«полезных грузов», можно создавать и очищать для гомогенного состояния.
Пример 24
Определение структуры в рентгеновских лучах Fab-фрагментов мышиного антитела к биотину в комплексе с биоцитинамидом
Белковую структуру Fab-фрагмента мышиного антитела к биотину определяли в комплексе с биоцитинамидом. Для этого кристаллы Fab-фрагмента выращивали в 0,8М янтарной кислоте, затем вносили в кристаллы антитела биоцидинамид (разведенный до рабочей концентрации 10мМ в растворе для кристаллизации, наносили на кристаллы в кристаллизационной капле). Кристаллы промывали трижды 2 мкл 10мМ раствора биоцититидинамида и окончательно инкубировали в течение 16 ч с биоцидинамидом при 21°С, собирали с использование 15% глицерина в качестве криопротектанта и мгновенно замораживали в жидком азоте. Обработанные дифракционные изображения позволяли получать белковую структуру с разрешением 2,5 А. Структура и распределение зарядов биотинсвязывающей вариабельной области представлены на фиг. 46: продемонстрировано, что биотин связывается на поверхности кармана, который фланкирован заряженными областями, которые состоят из аминокислот из CDR-областей. Входящий в комплекс гаптен расположен в непосредственной близости от отрицательно заряженного кластера аминокислот. Биотин, который в качестве гаптена, дериватизовали для сшивания «полезного груза» на карбоксильной группе, связывался с высокой эффективностью, поскольку в этом положении отсутствует отталкивание зарядов (из-за отсутствия СООН-группы). В противоположность этому свободный (обычный) биотин не может эффективно связываться с антителом, поскольку его карбоксильная группа может находиться в непосредственной близости к указанному отрицательно заряженному кластеру и поэтому отталкивается.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧНЫЕ АНТИТЕЛА ПРОТИВ ГАПТЕНА/ПРОТИВ РЕЦЕПТОРА ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА, ИХ КОМПЛЕКСЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЧЕЛНОКОВ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2014 |
|
RU2693438C2 |
| КОНЪЮГАТЫ ПОЛИПЕПТИДНОГО ТОКСИНА И АНТИТЕЛА, СОЕДИНЕННЫХ КОВАЛЕНТНОЙ СВЯЗЬЮ | 2014 |
|
RU2682754C2 |
| КОВАЛЕНТНО СВЯЗАННЫЕ КОНЪЮГАТЫ ХЕЛИКАР-АНТИТЕЛО ПРОТИВ ХЕЛИКАРА И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2694981C2 |
| АНТИТЕЛА К БИОТИНУ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2630296C2 |
| АНТИТЕЛА К ТЕОФИЛЛИНУ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2630664C2 |
| АНТИТЕЛА ПРОТИВ 5-БРОМ-2'-ДЕЗОКСИУРИДИНА И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2705299C2 |
| КОНЪЮГАТЫ ГАПТЕН-НОСИТЕЛЬ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2326693C2 |
| СЛИТЫЕ КОНСТРУКЦИИ ЛЕКАРСТВЕННОГО СРЕДСТВА И КОНЪЮГАТЫ | 2005 |
|
RU2428431C2 |
| НОВЫЕ СПОСОБЫ ОПОСРЕДОВАННОГО ФЕРМЕНТАМИ КОНЪЮГИРОВАНИЯ ПОЛИПЕПТИДОВ С ИСПОЛЬЗОВАНИЕМ СОРТАЗЫ | 2015 |
|
RU2714963C2 |
| АНТИТЕЛО К РЕЦЕПТОРУ ТРОМБОЦИТАРНОГО ФАКТОРА РОСТА (PDGF) И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2778023C1 |




































































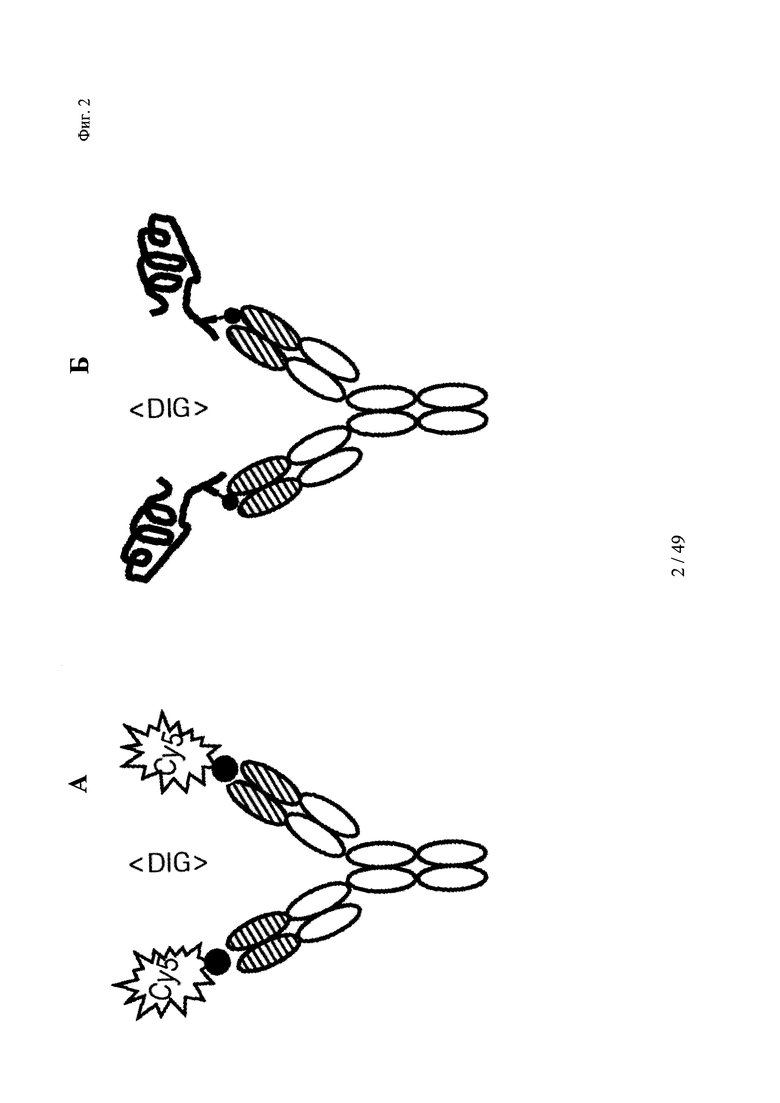
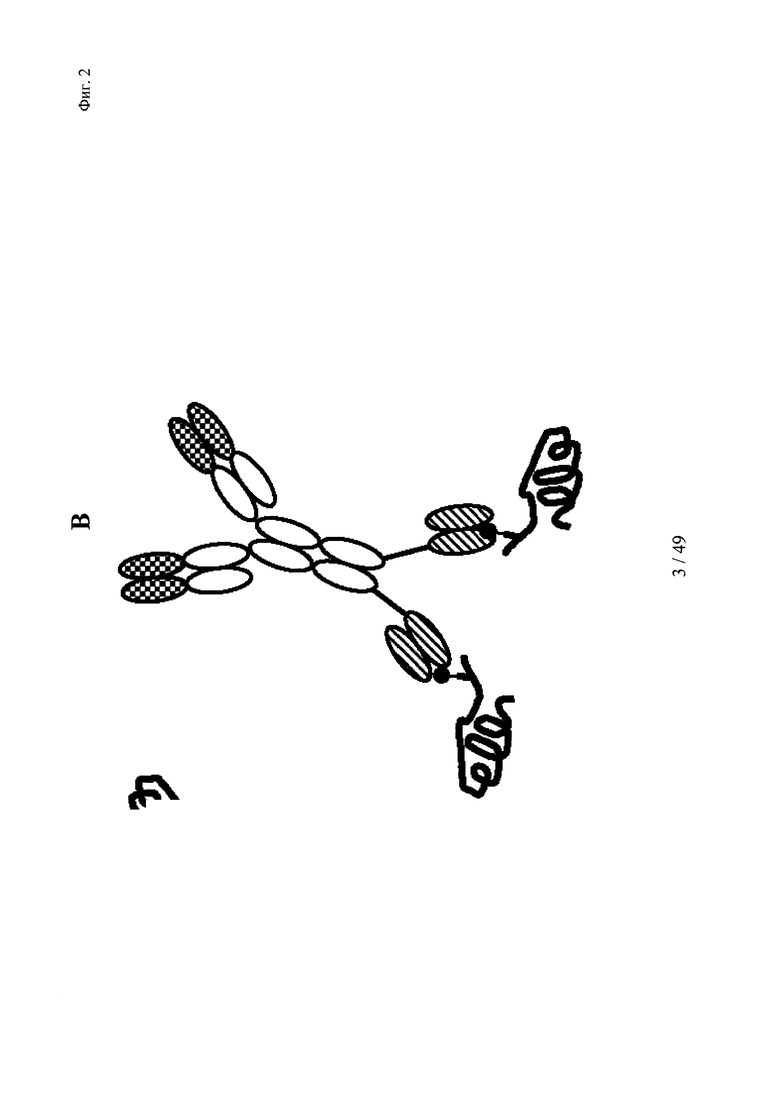
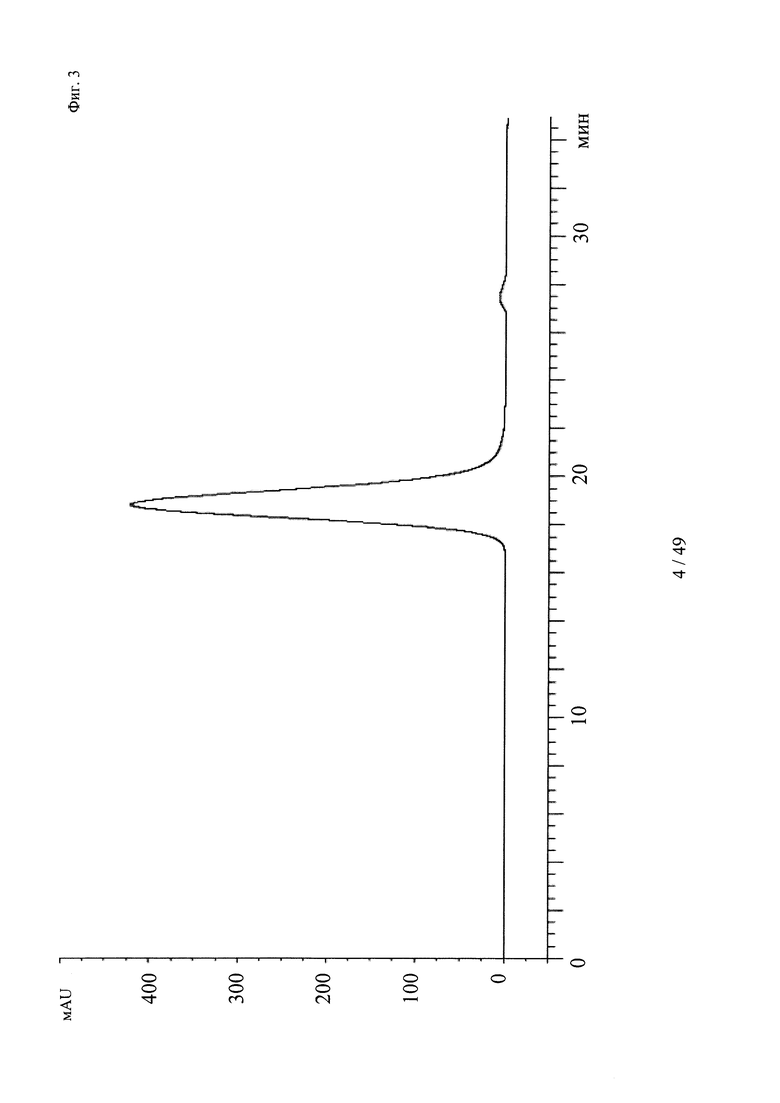


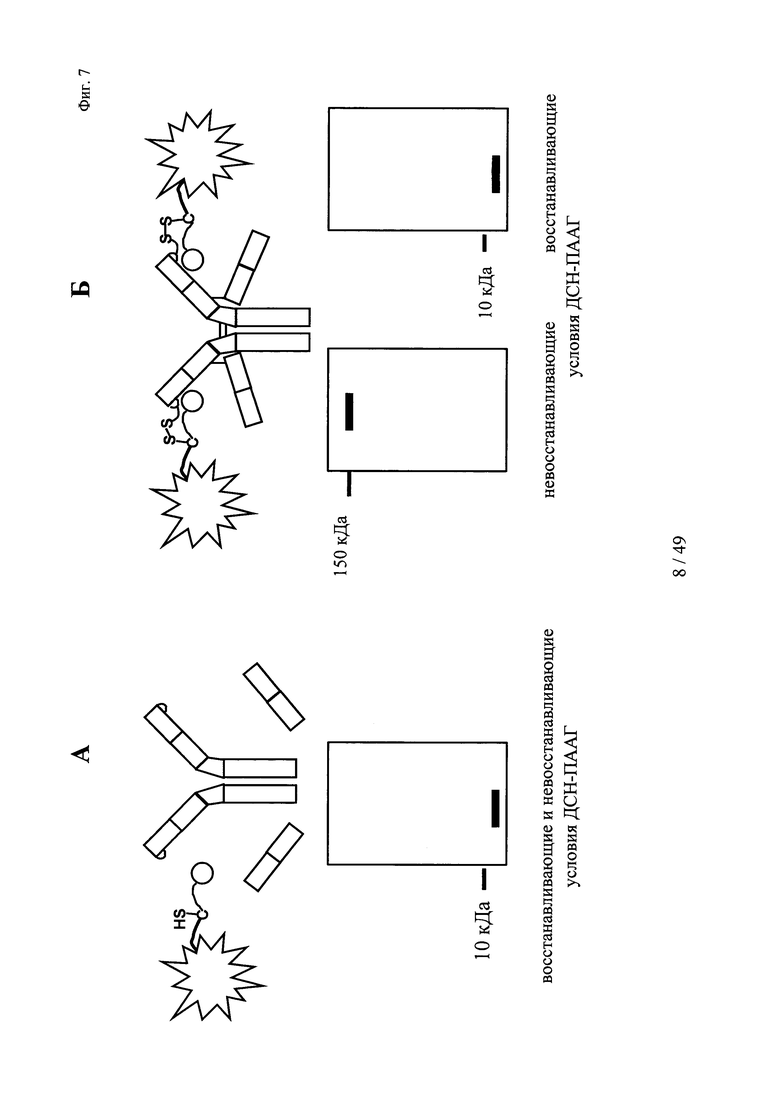
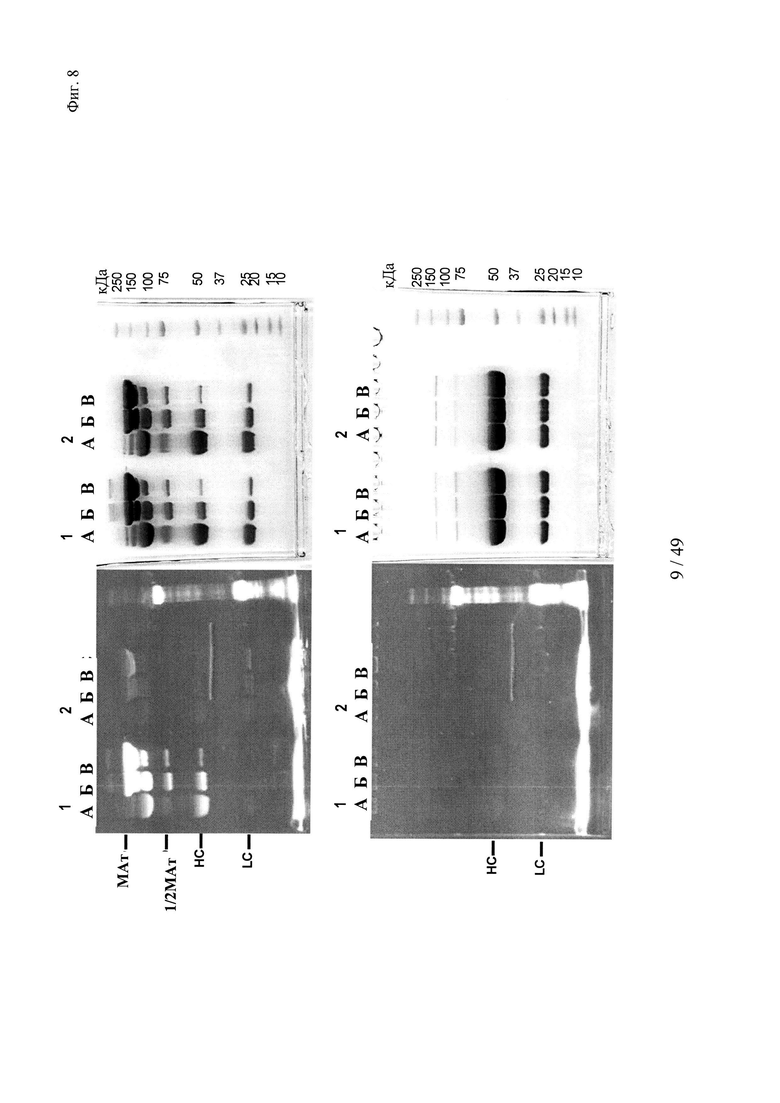
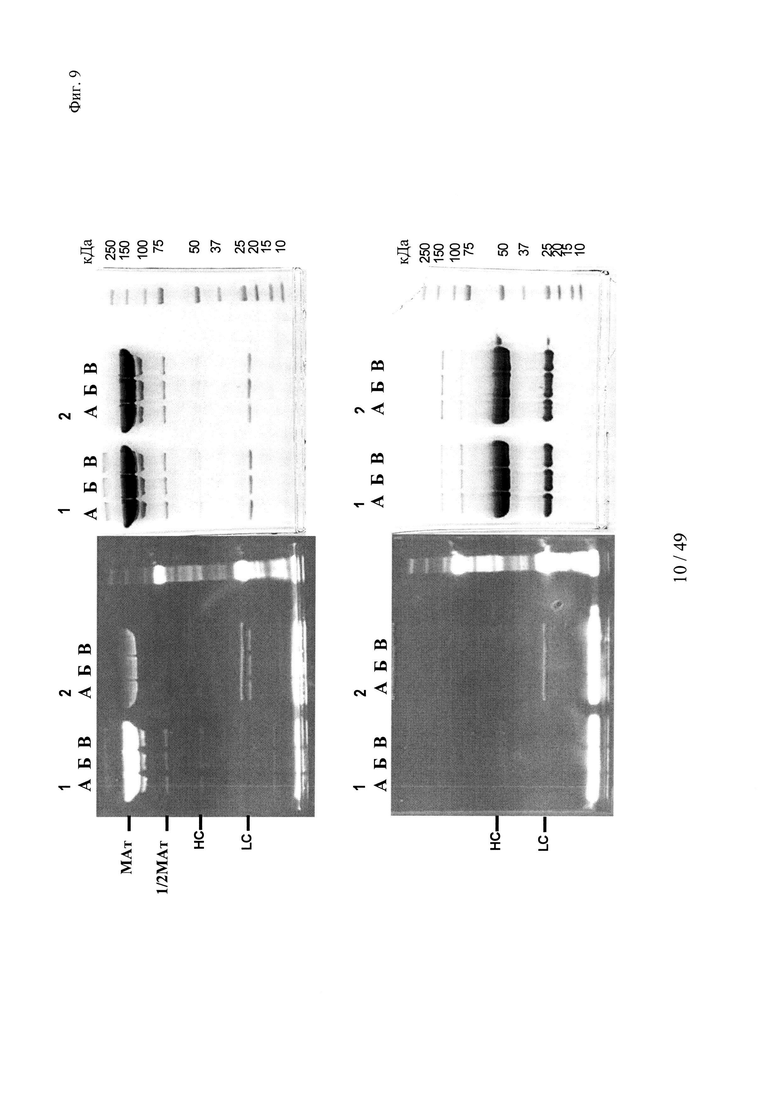
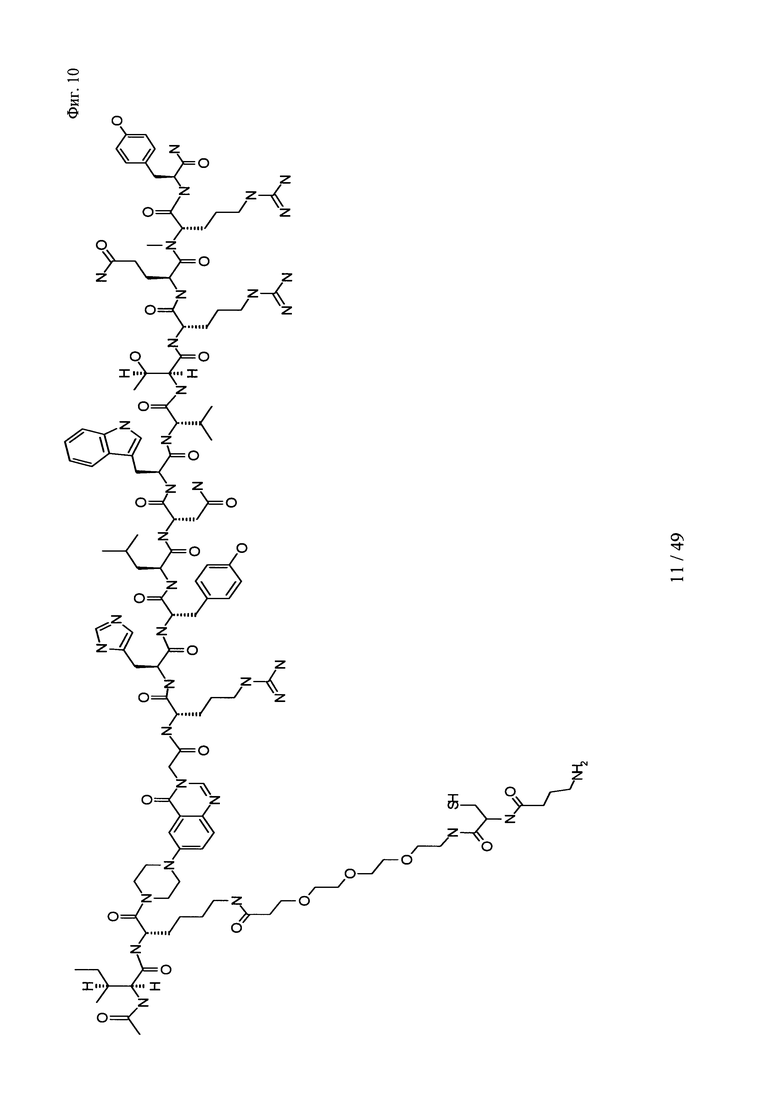
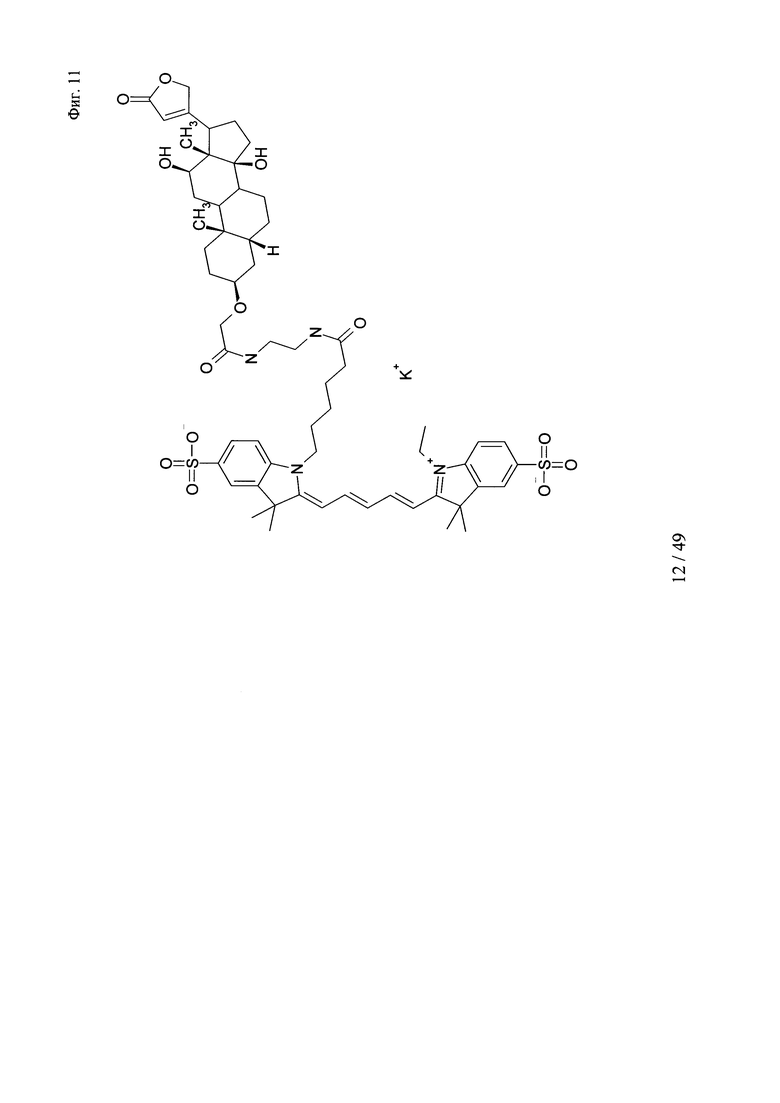
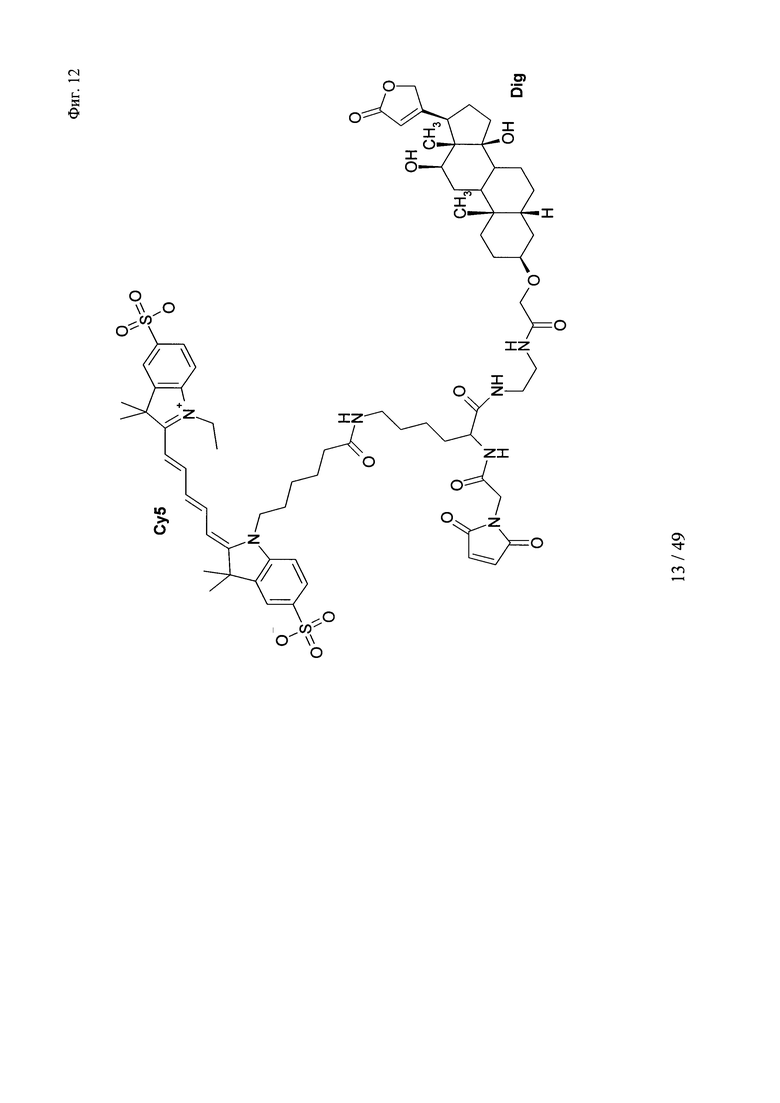
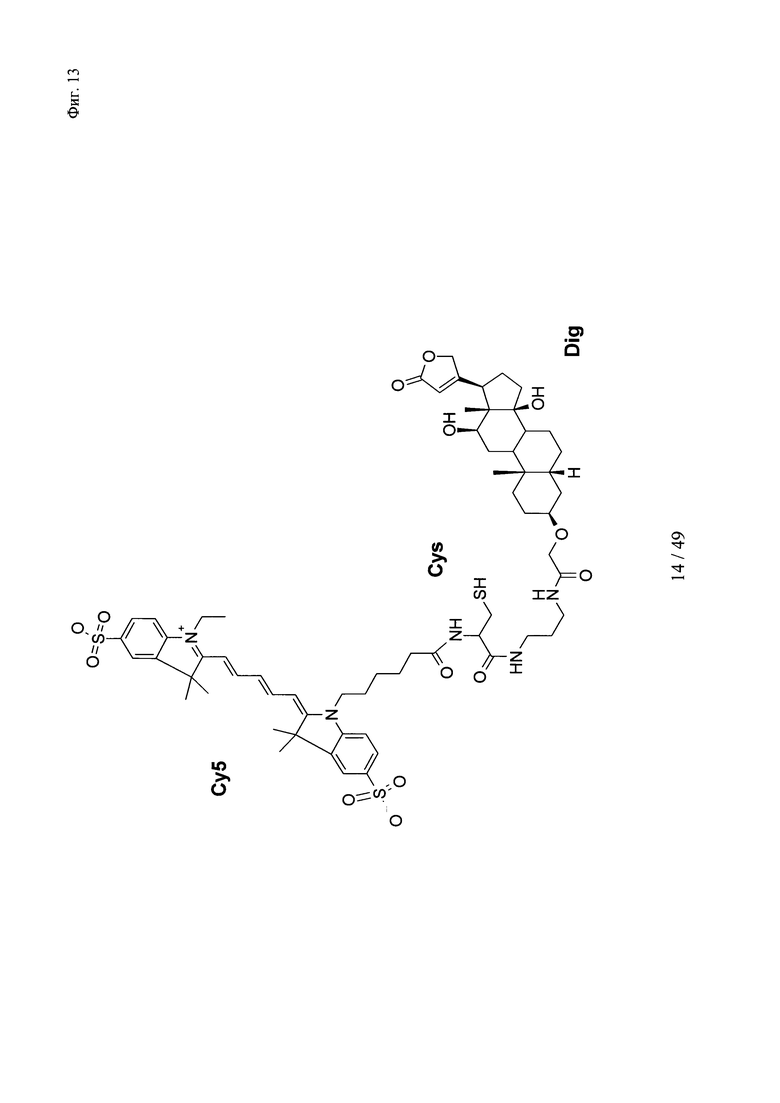
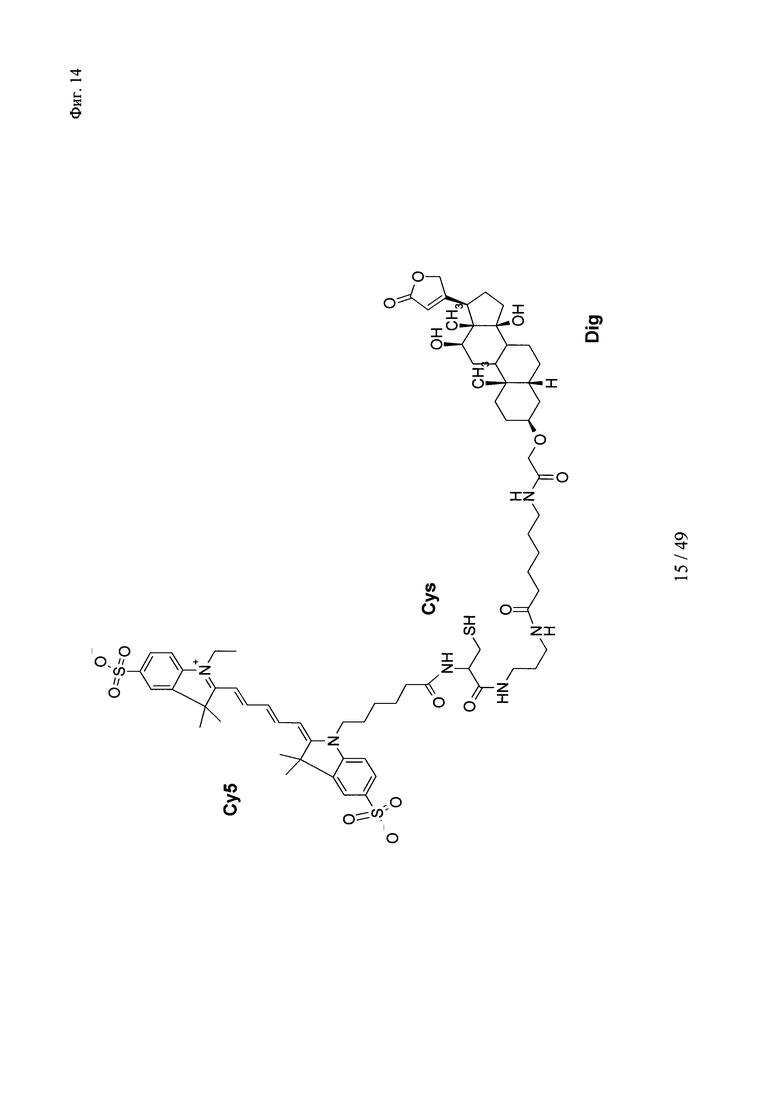
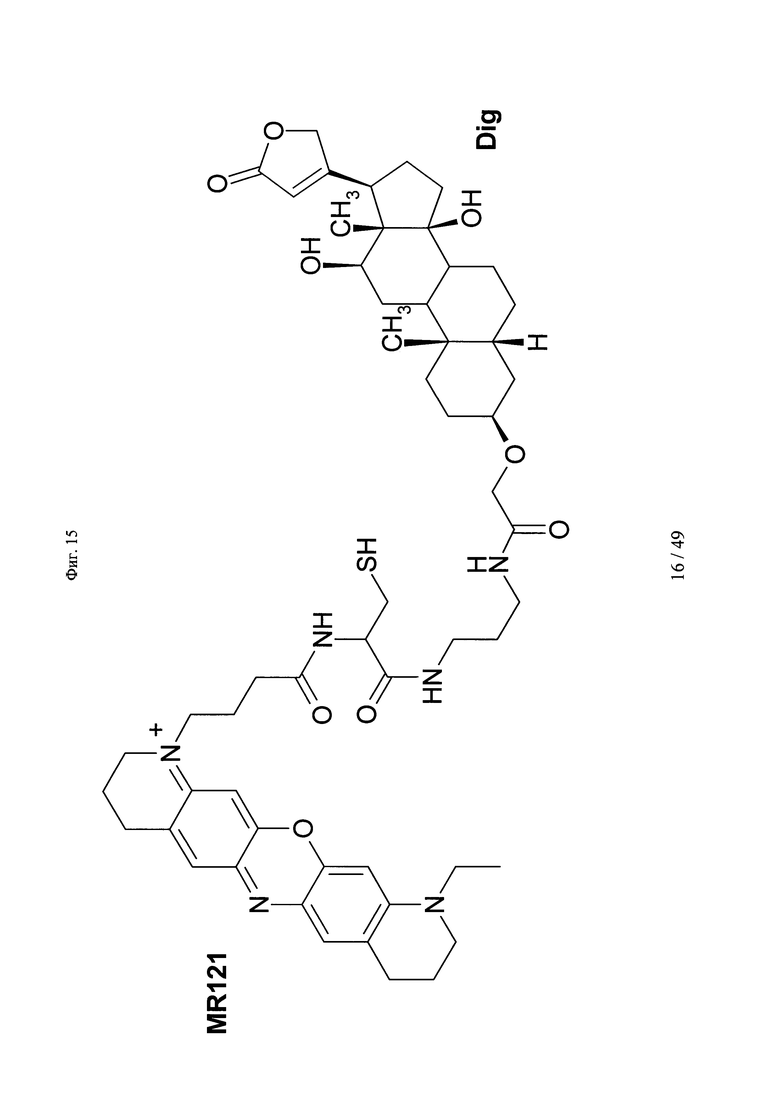
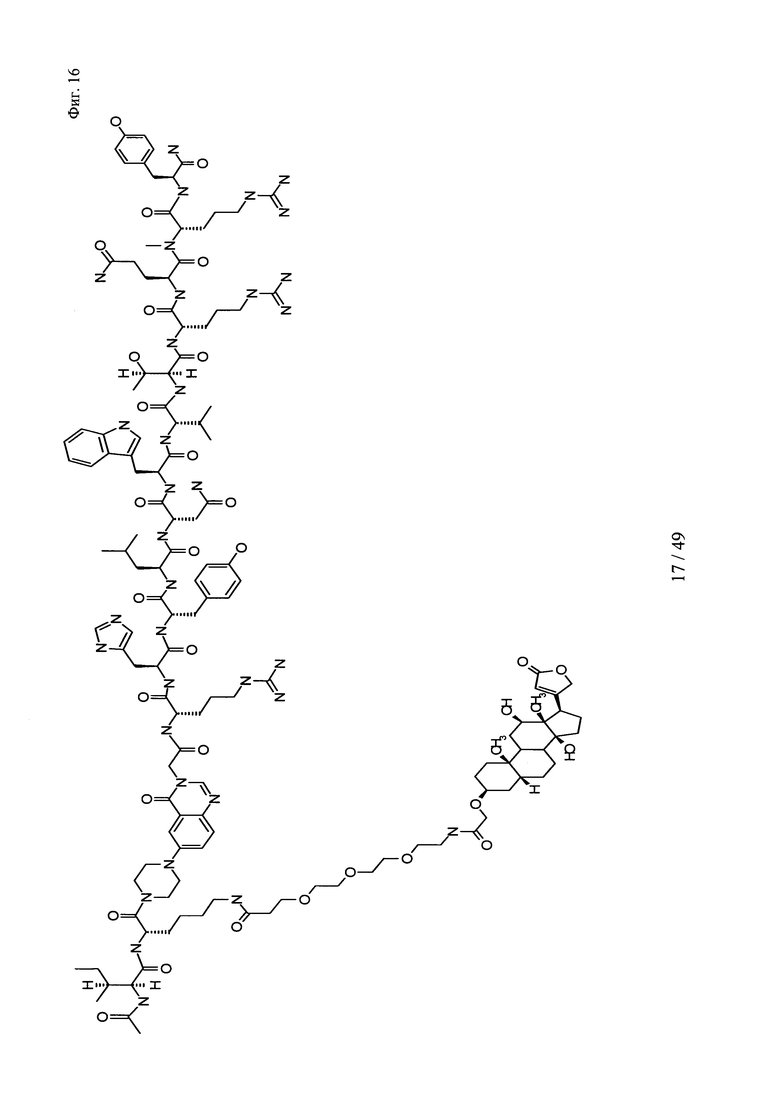
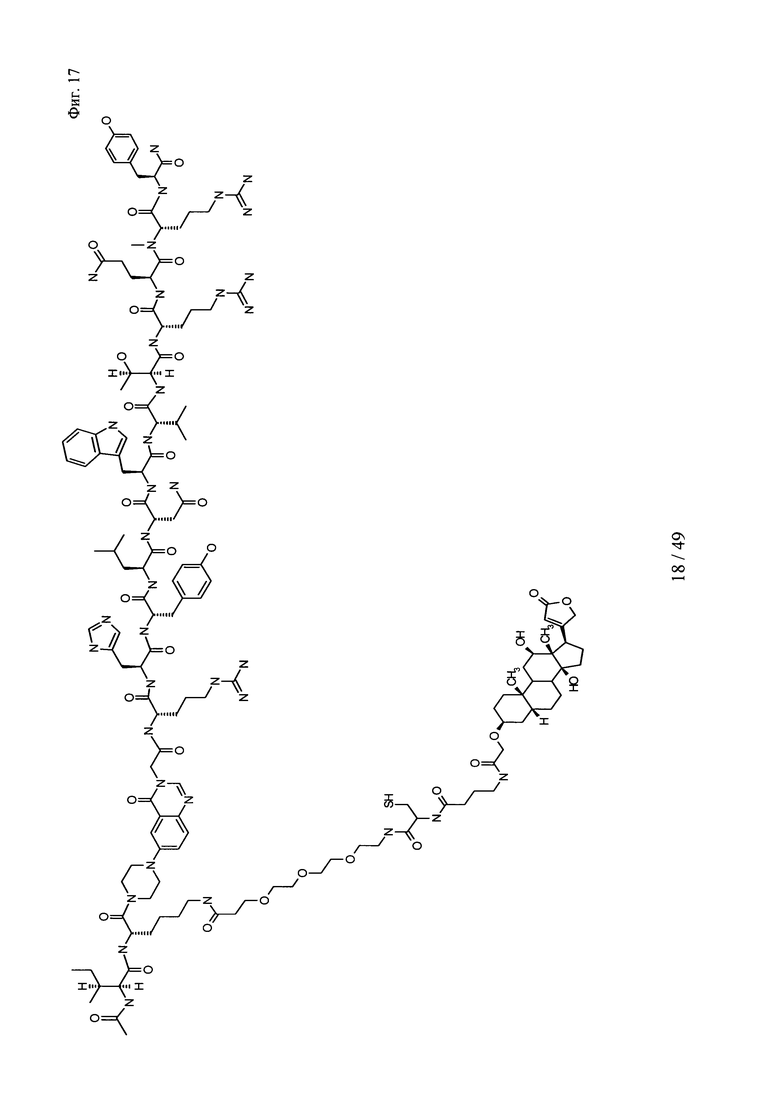
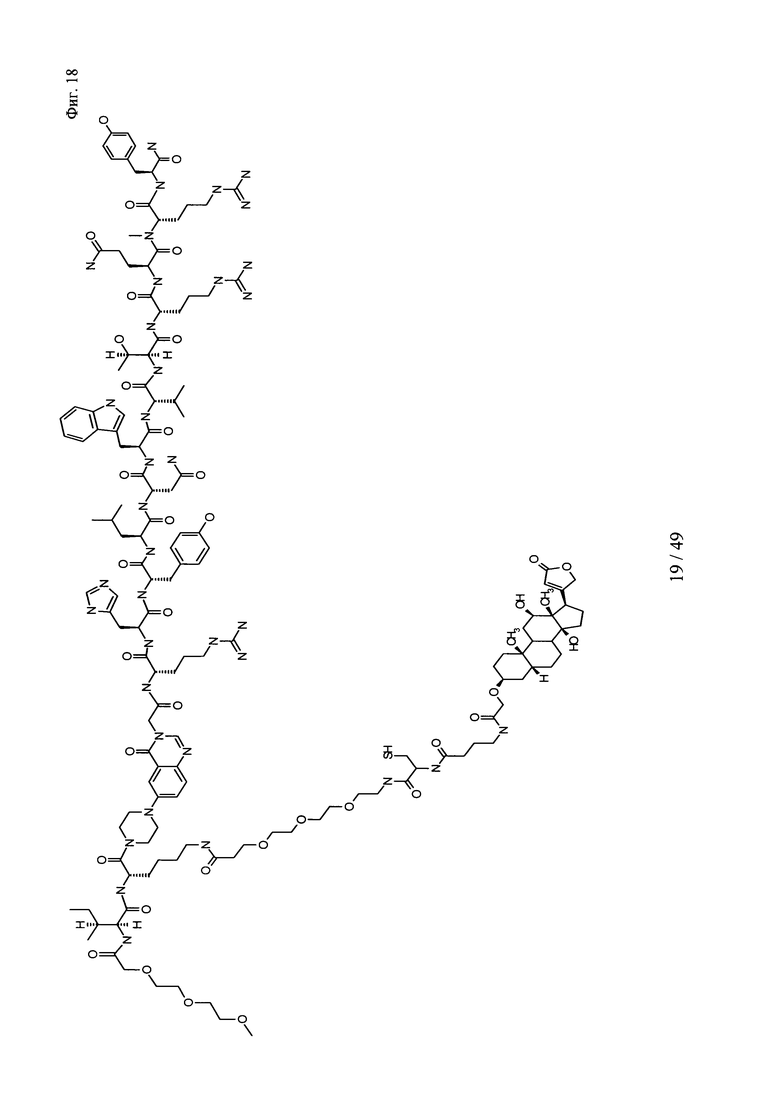
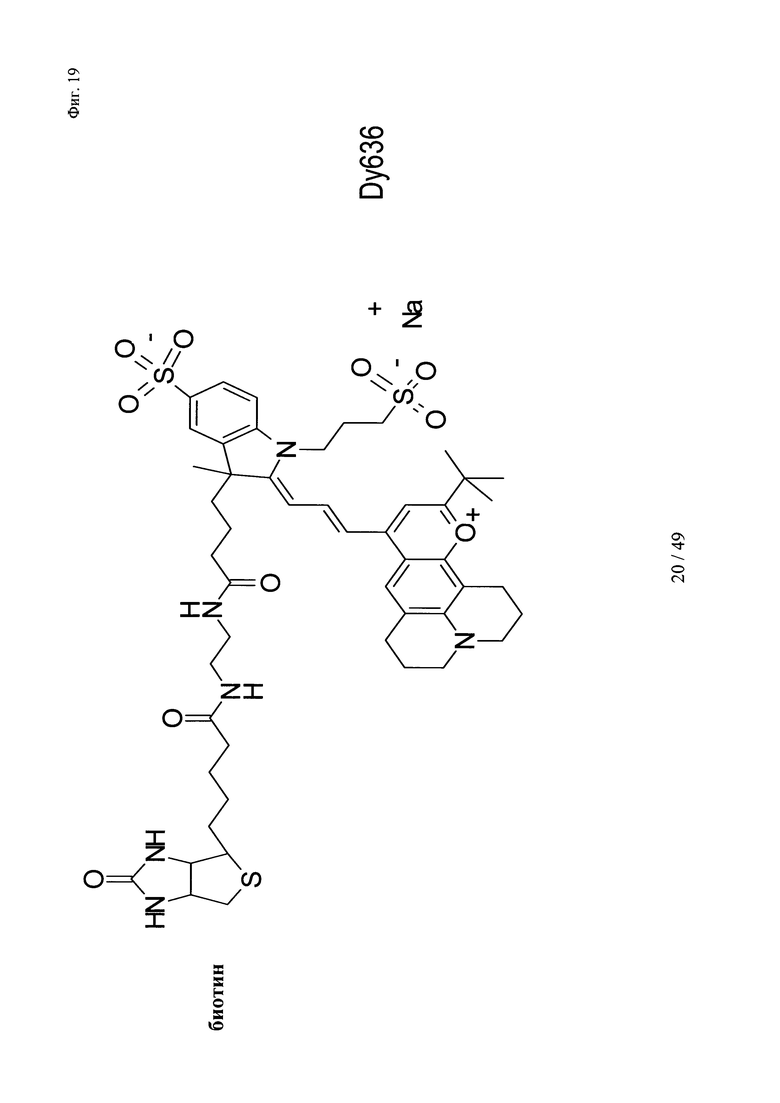
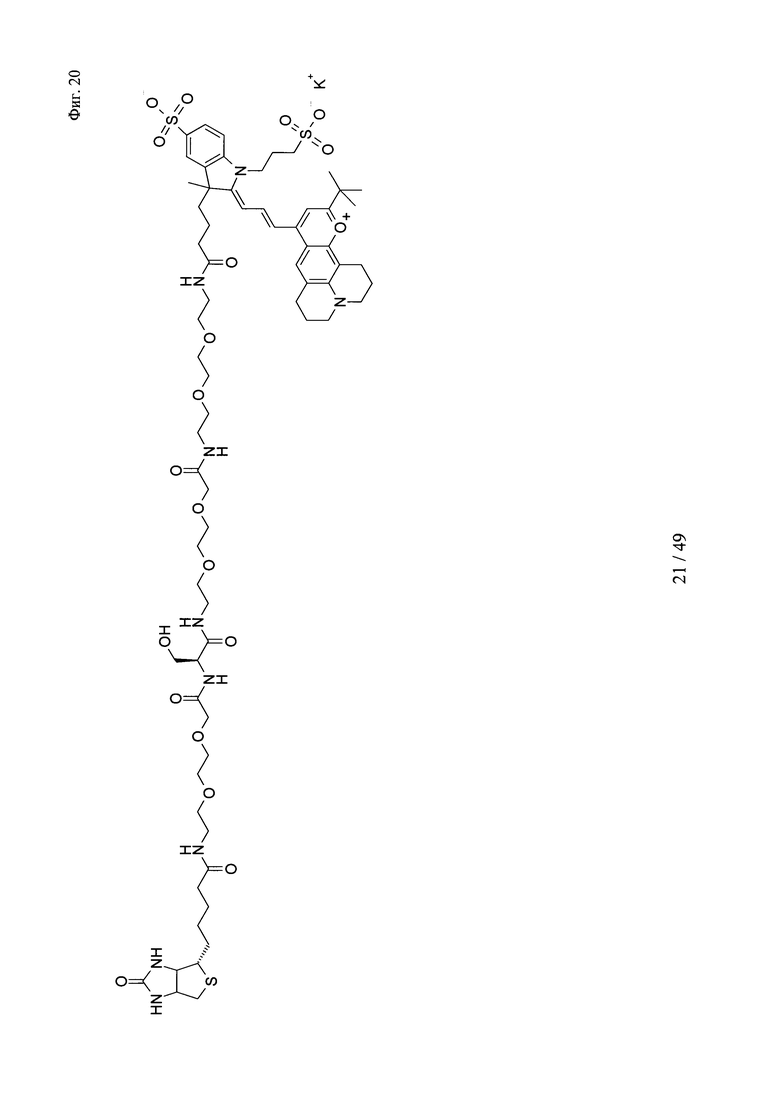


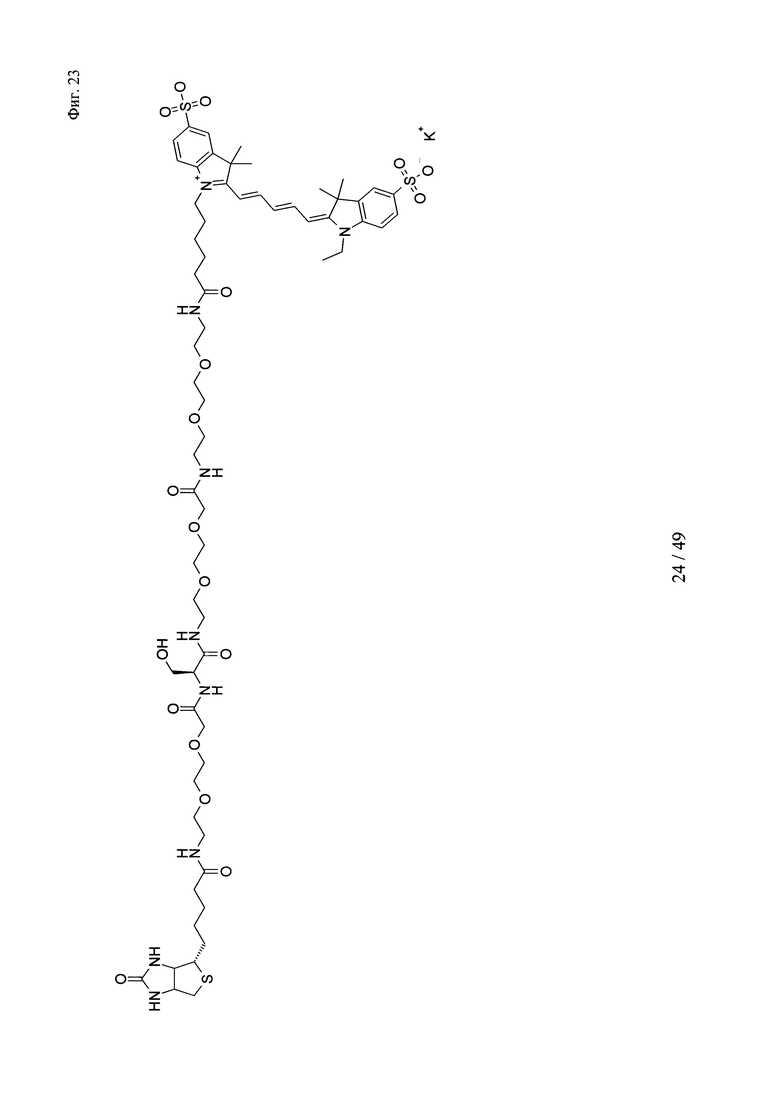
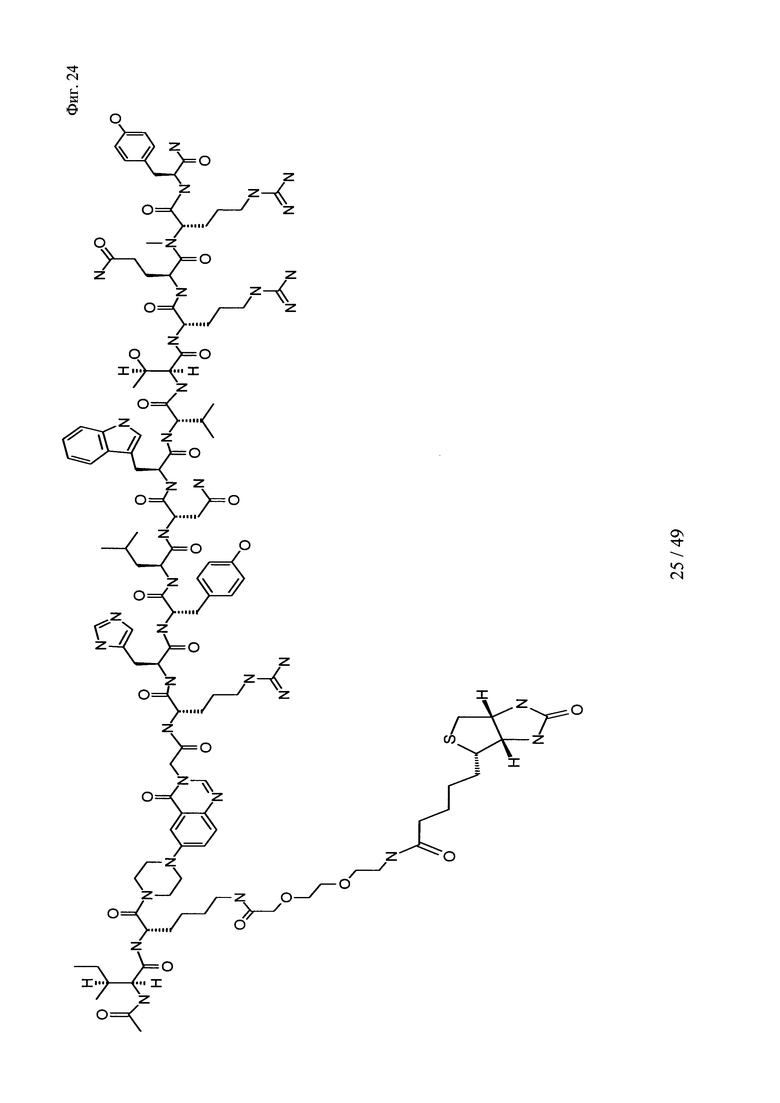
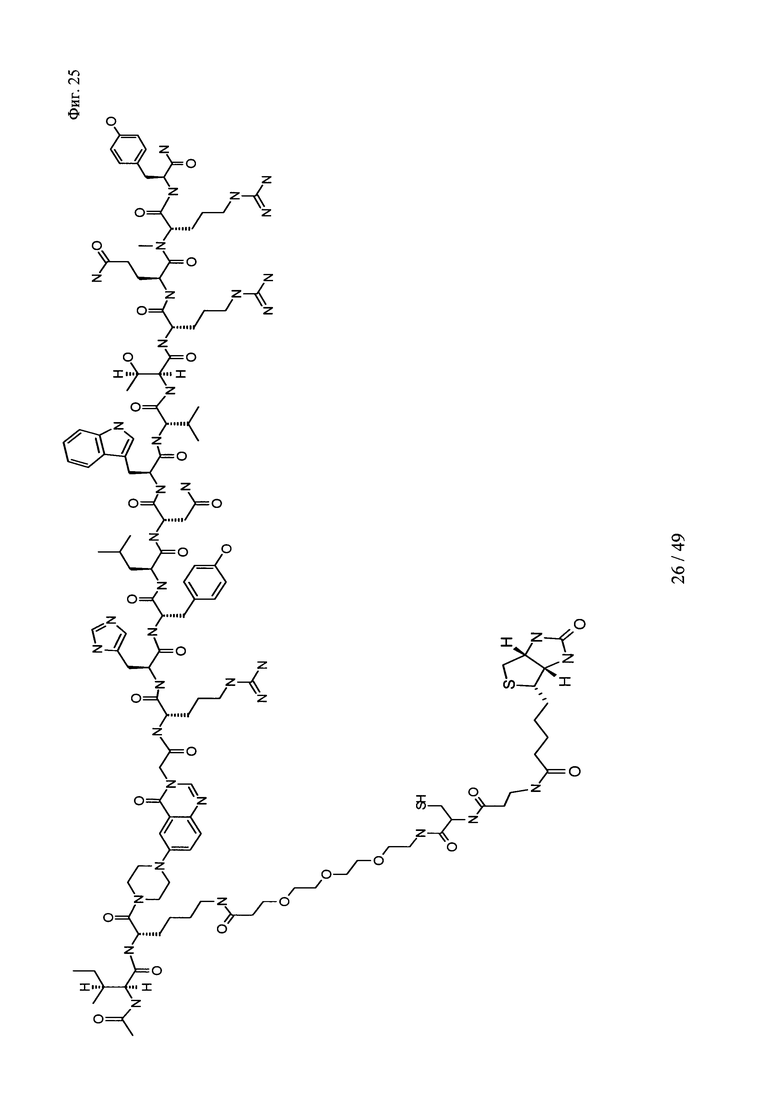
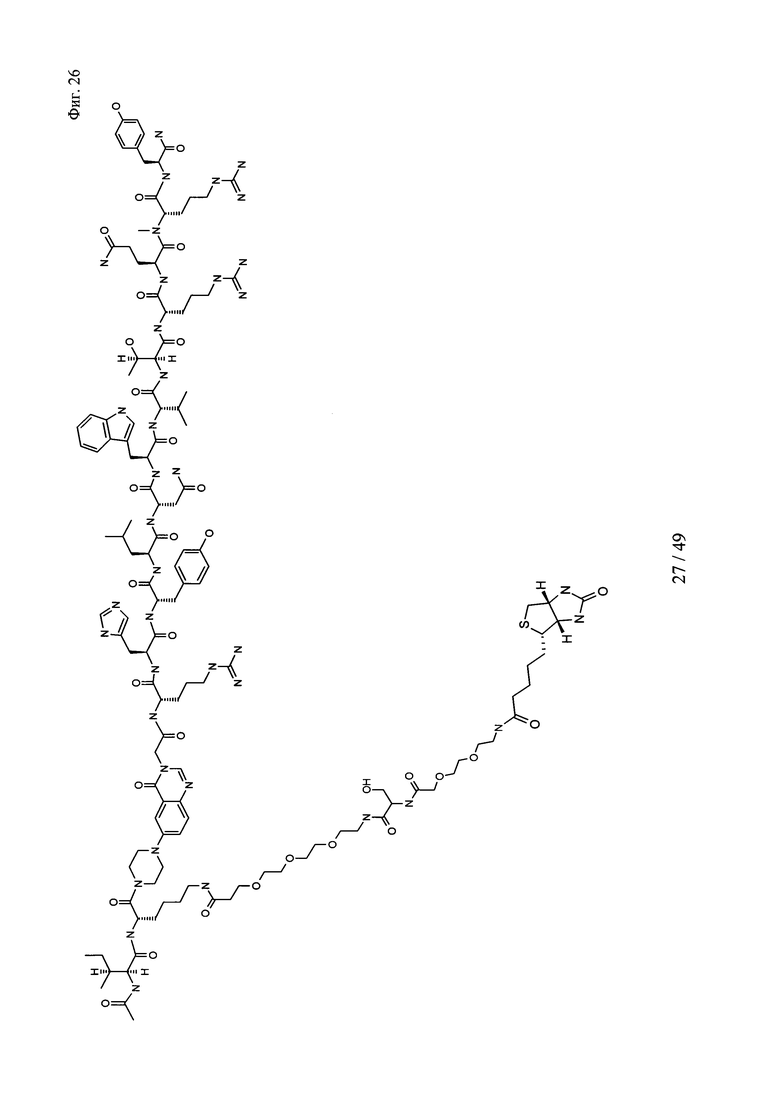

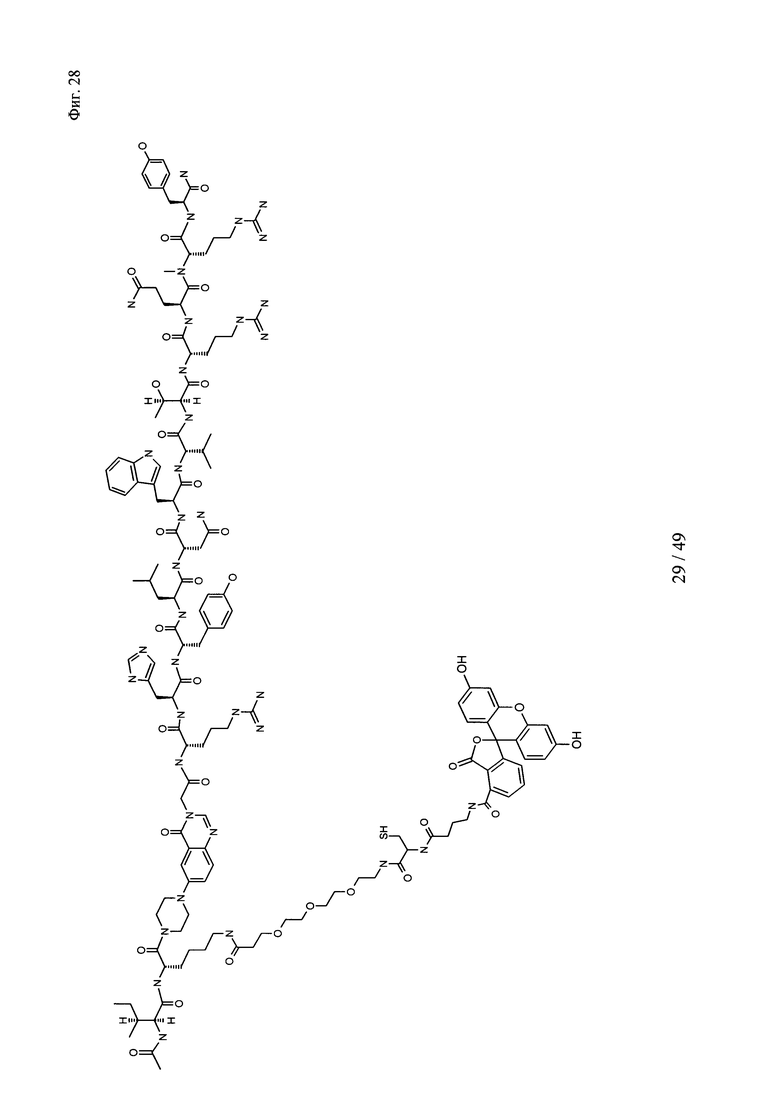
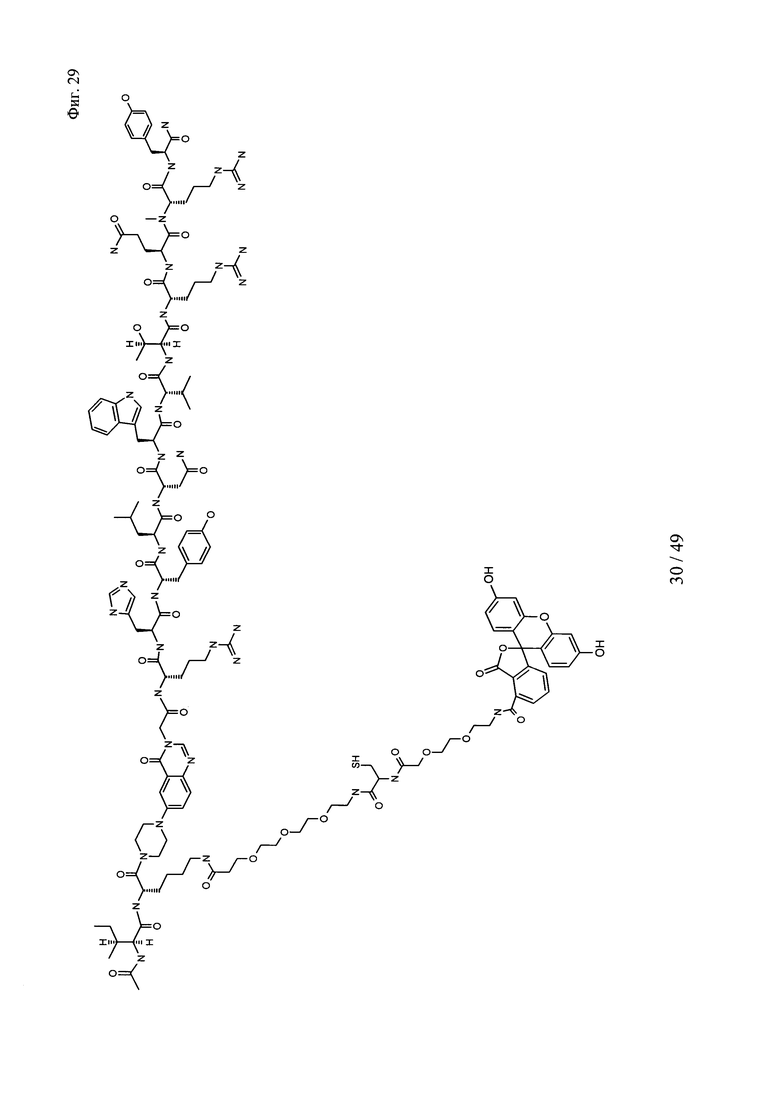

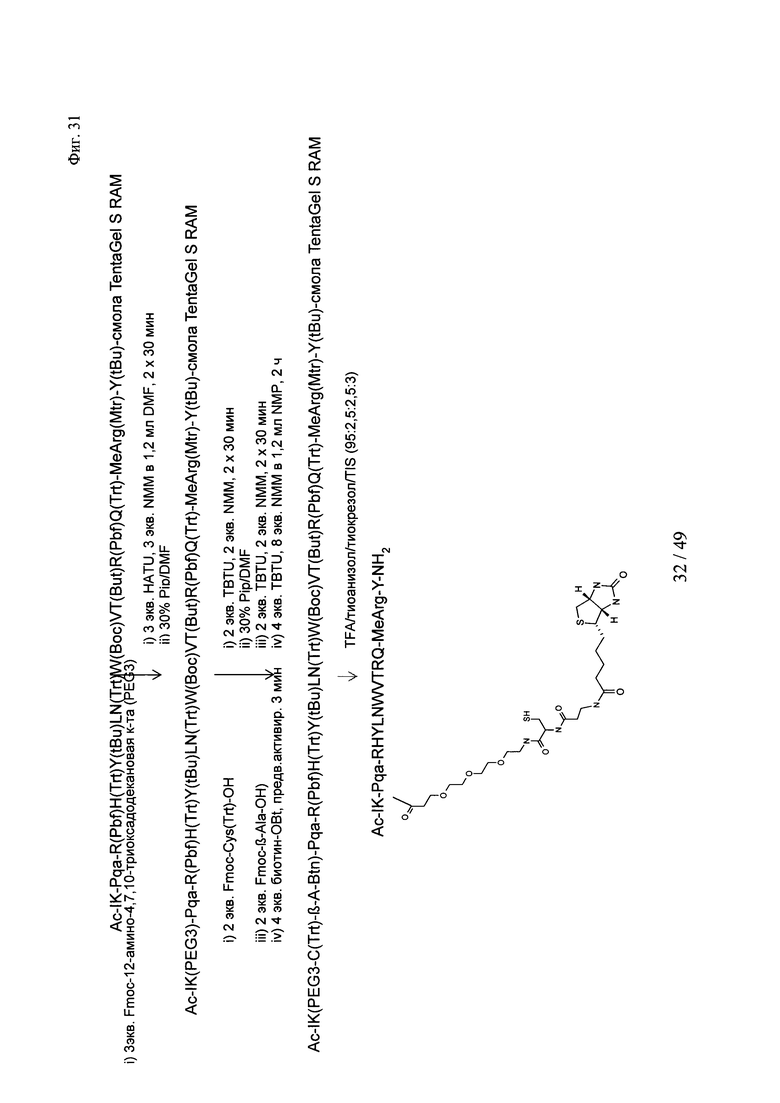
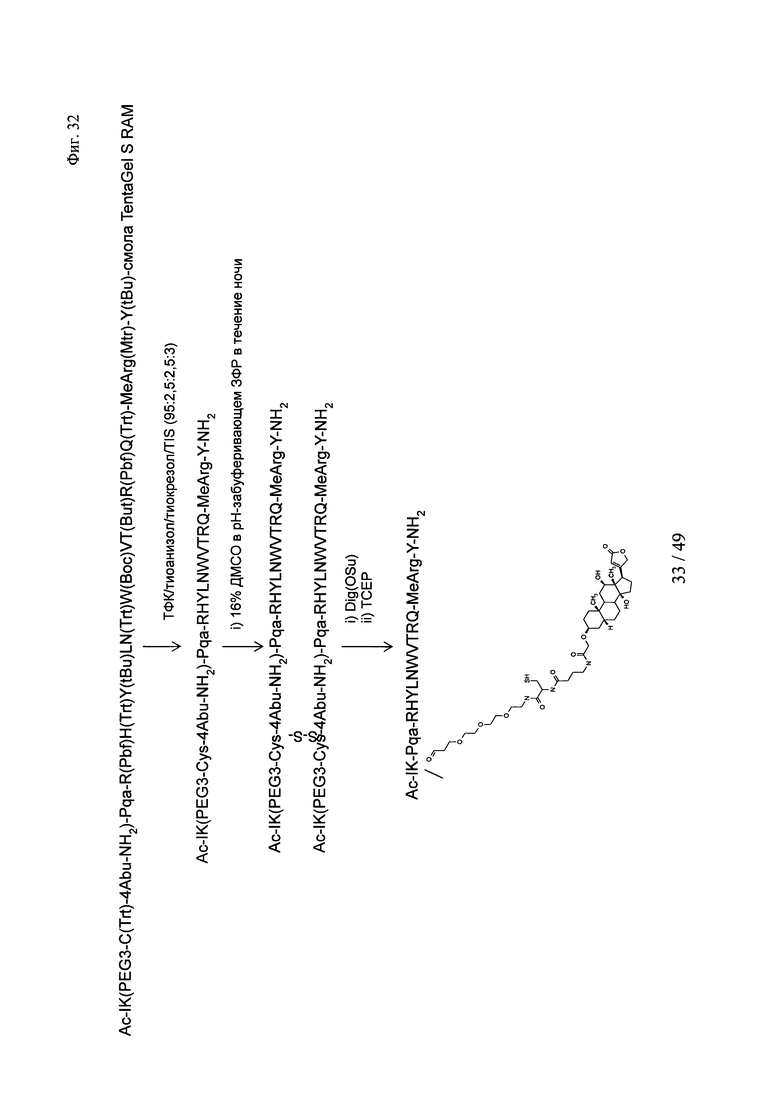

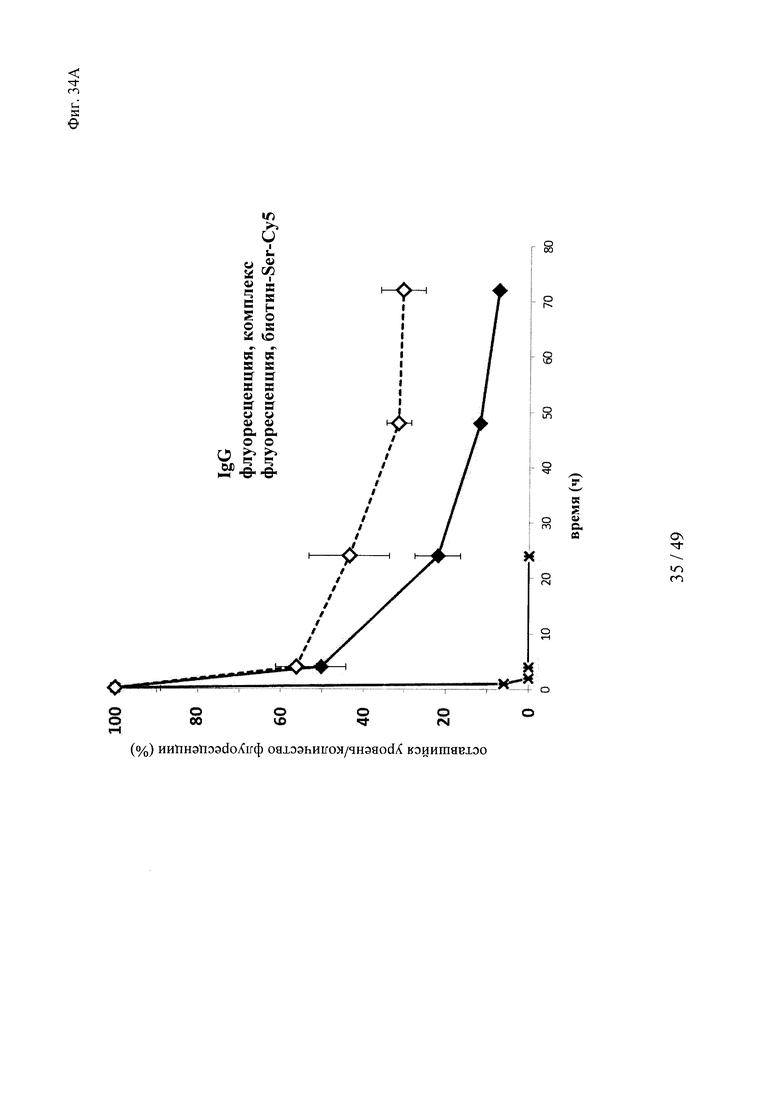
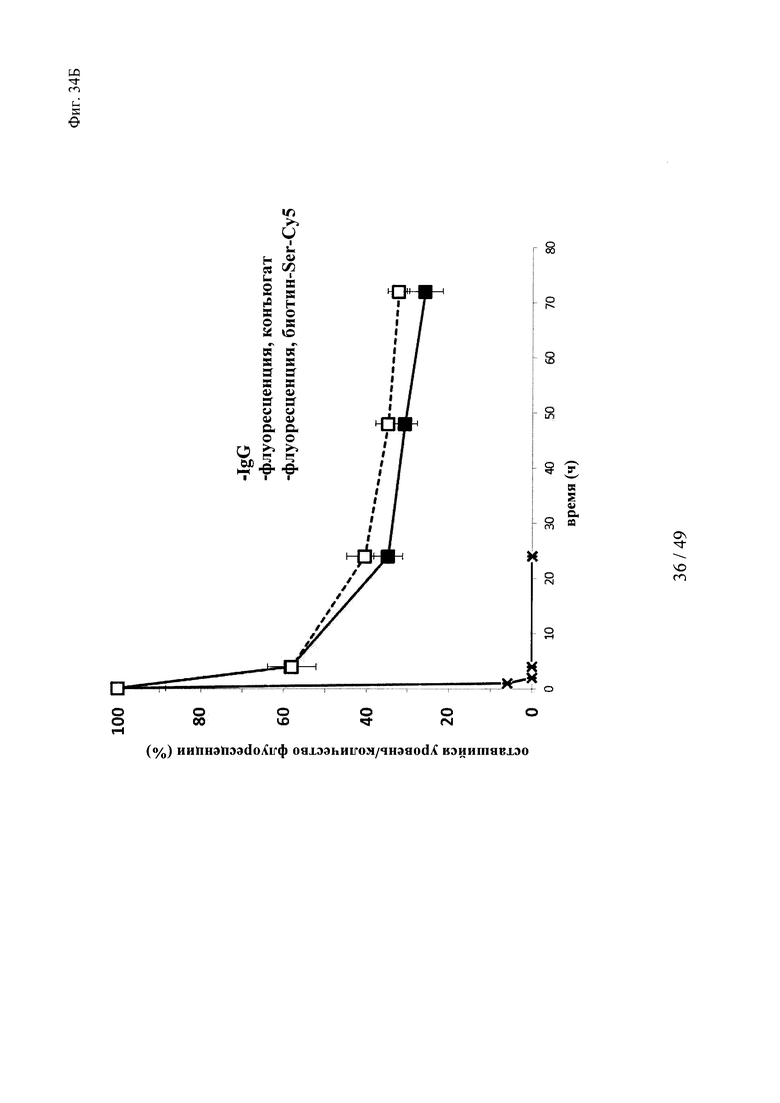
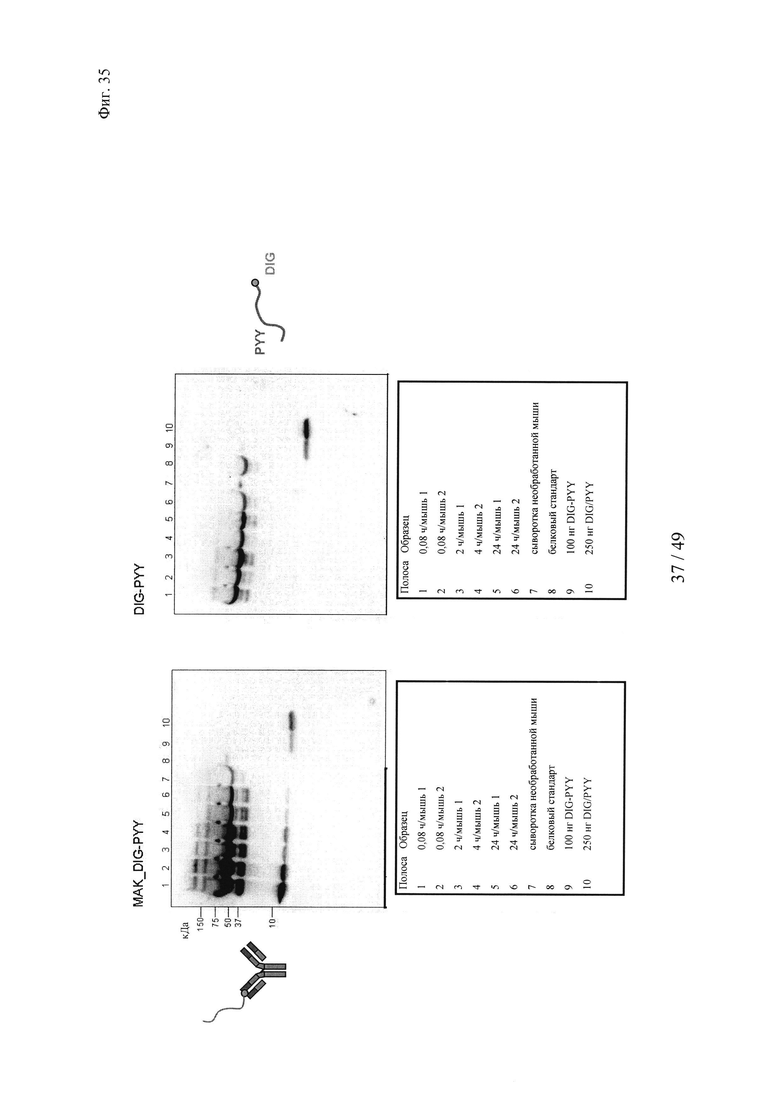
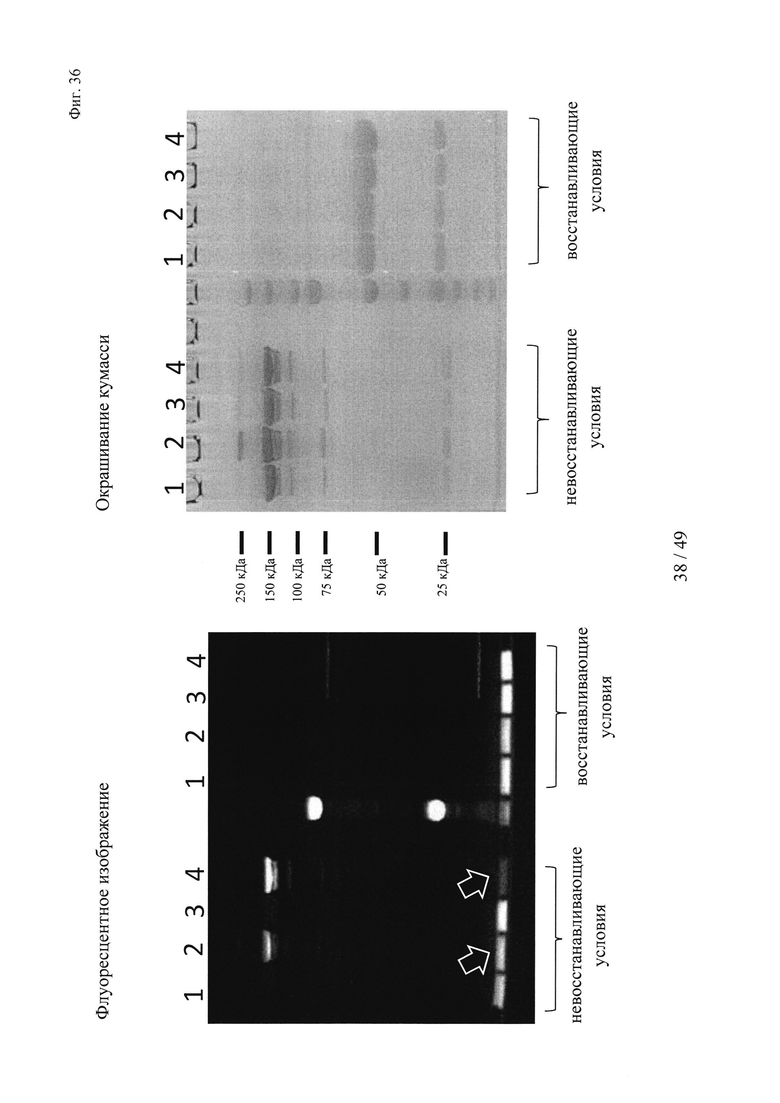
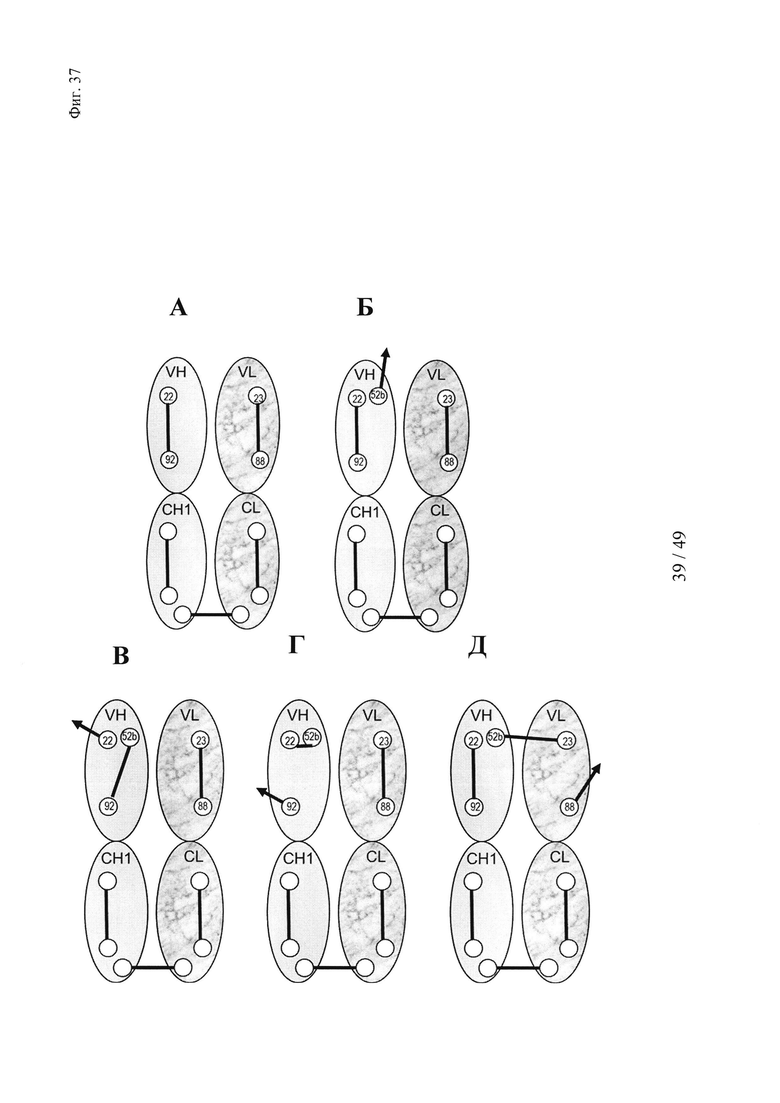
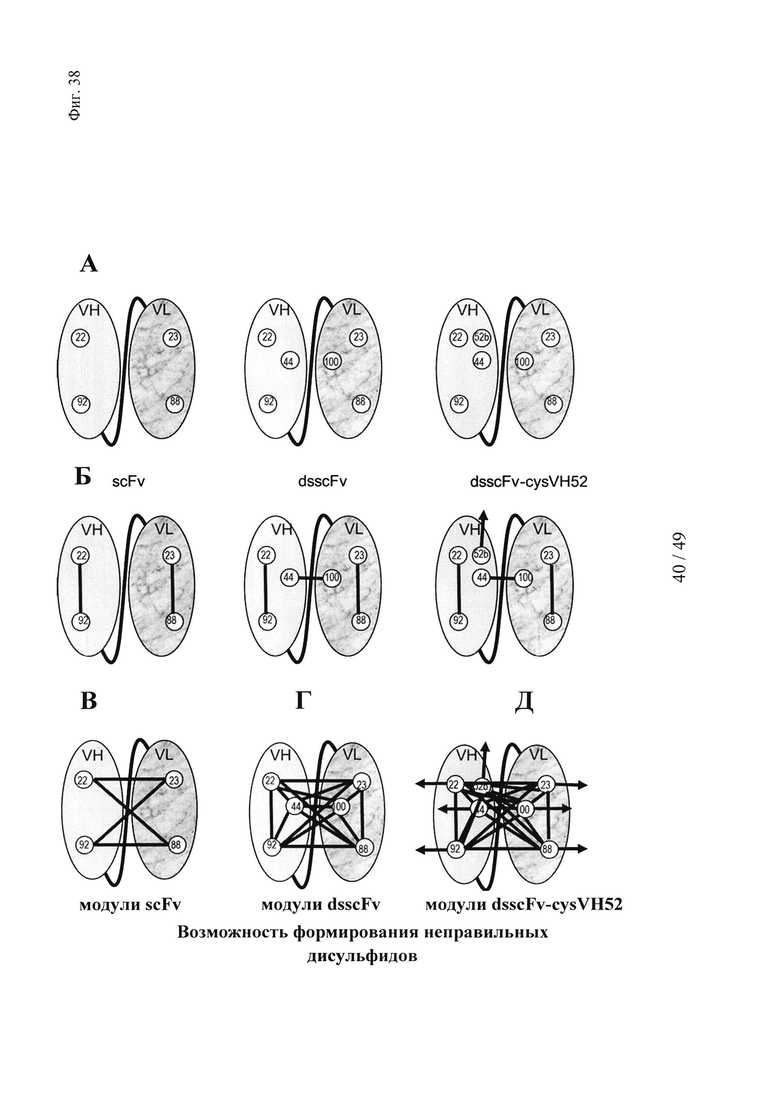
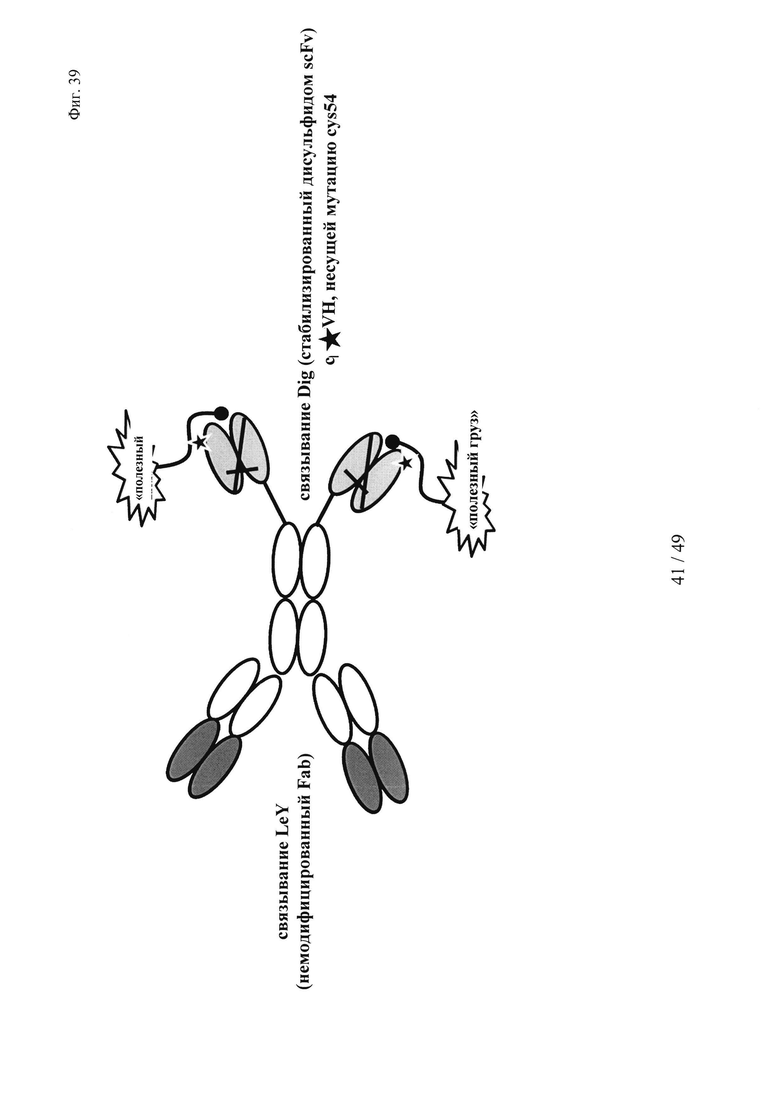
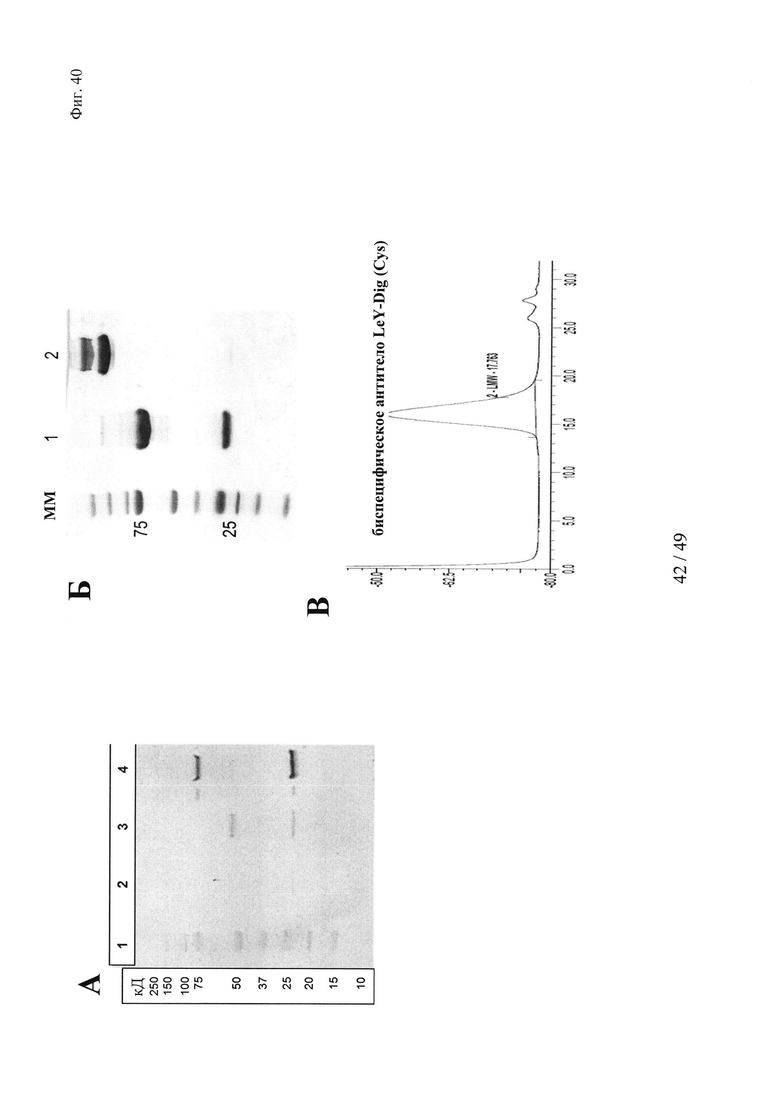

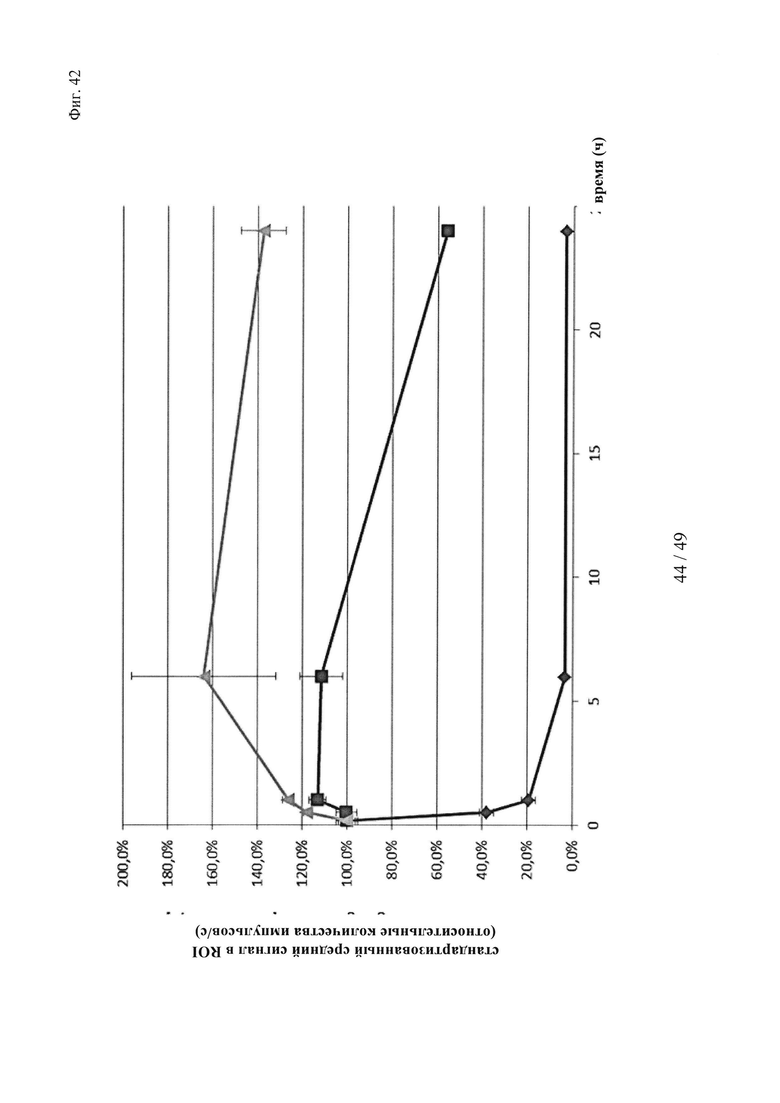
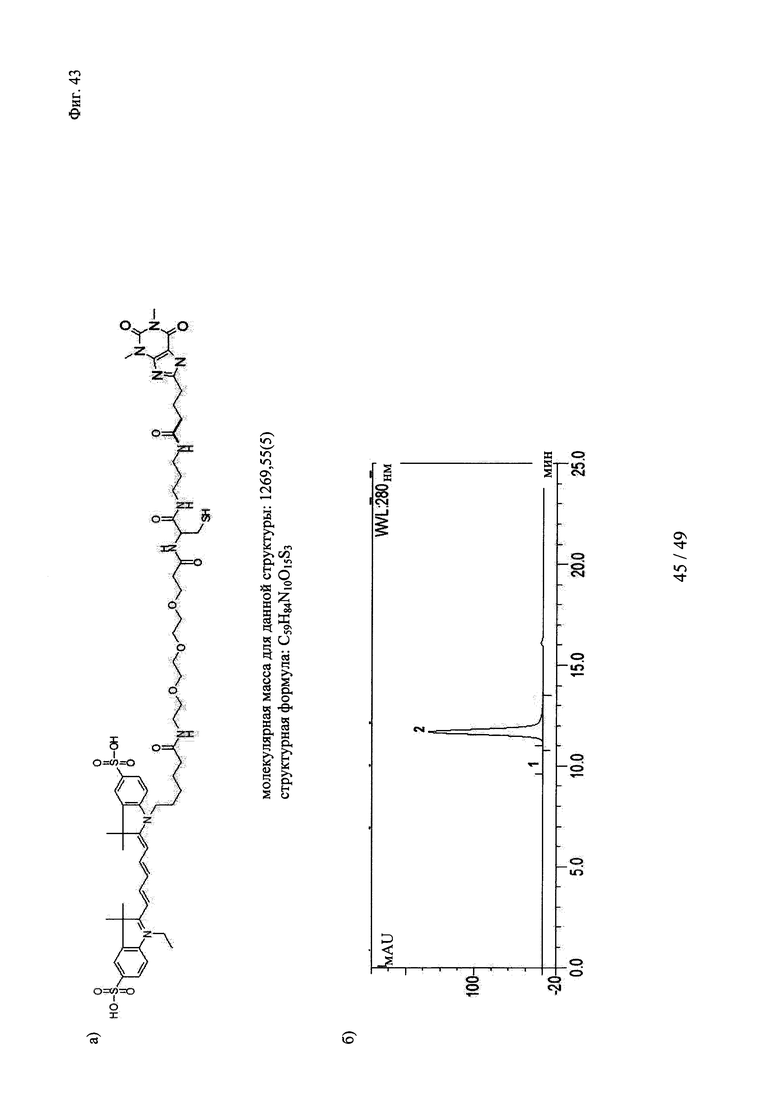
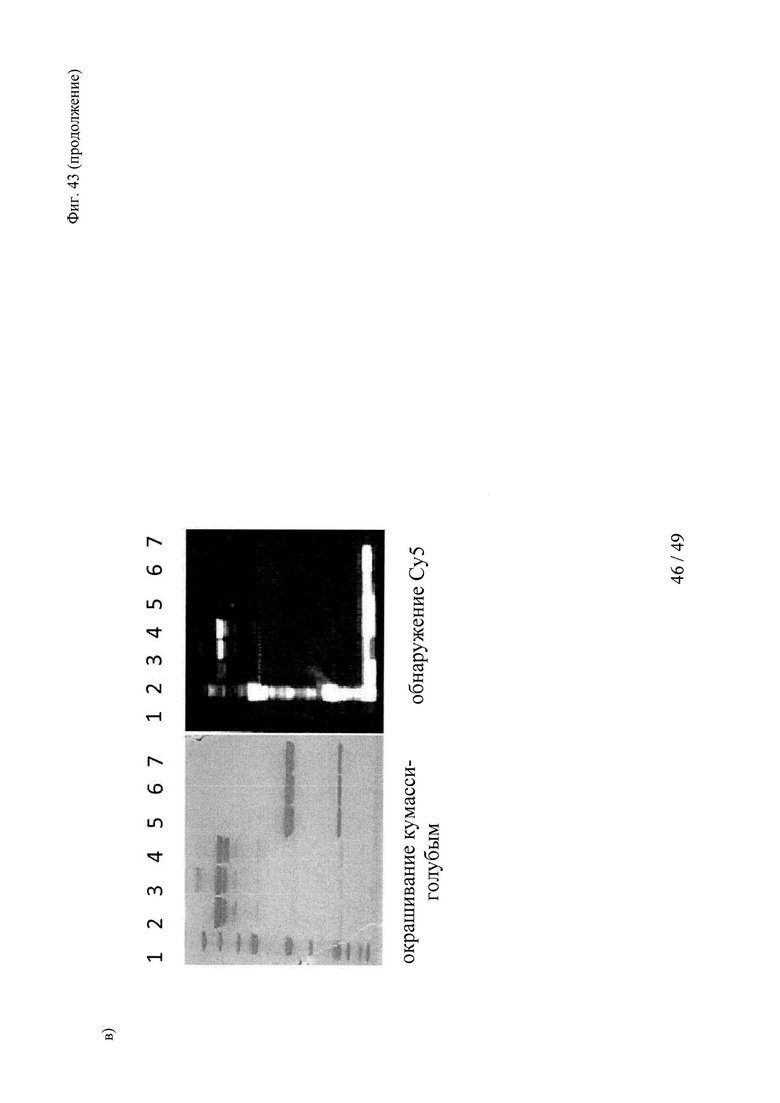
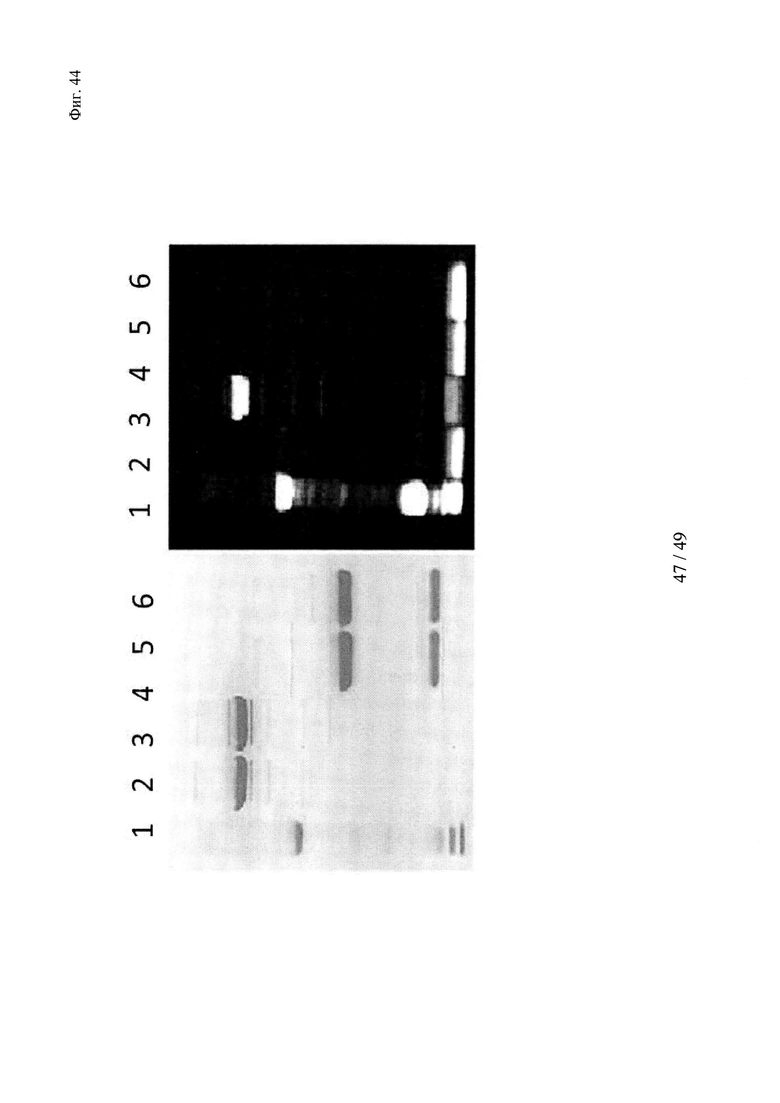
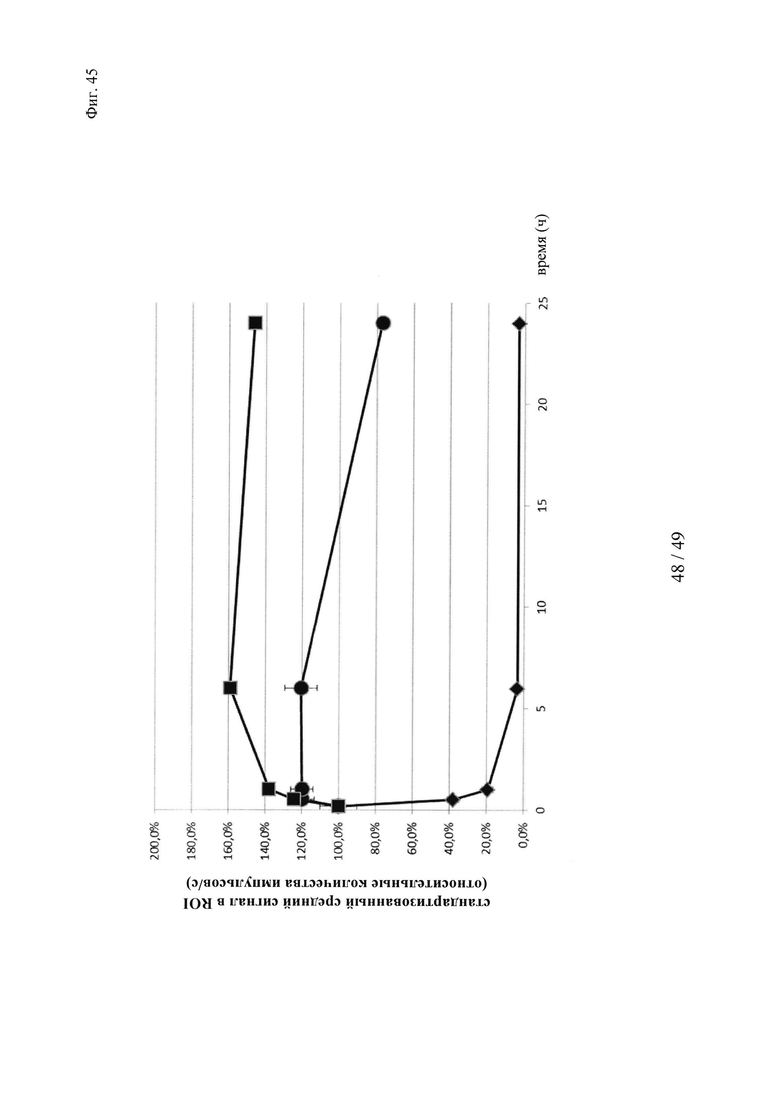
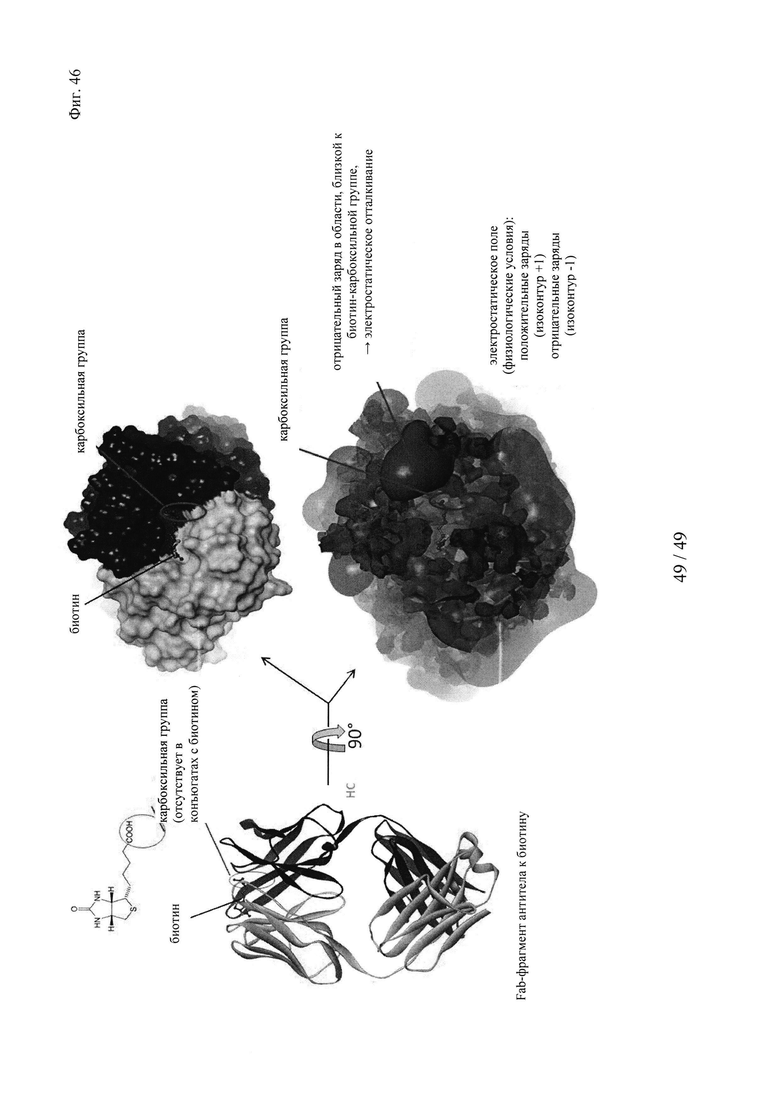
Настоящее изобретение относится к биотехнологии. Предложен конъюгат для направленной доставки терапевтического полипептида in vivo, содержащий биспецифическое антитело и гаптенилированный терапевтический полипептид, где биспецифическое антитело содержит первый сайт связывания, который специфически связывается с гаптеном, и второй сайт связывания, который специфически связывается с маркером клеточной поверхности клетки, причем первый сайт антитела ковалентно связан с гаптеном с помощью остатка цистеина в положении 52b или 53 в CDR2 тяжелой цепи согласно нумерации Кэбота, и где гаптен выбирают из группы, состоящей из биотина, дигоксигенина, теофиллина и флуоресцеина. Ковалентная связь с гаптеном обеспечивает стабилизацию терапевтического полипептида. В этой связи данное изобретение может найти применение в терапии. 3 з.п. ф-лы, 46 ил., 6 табл., 24 пр.
1. Конъюгат антитела и гаптенилированного терапевтического полипептида для направленной доставки терапевтического полипептида in vivo, содержащий биспецифическое антитело и гаптенилированный терапевтический полипептид, где биспецифическое антитело содержит первый сайт связывания, который специфически связывается с гаптеном, и второй сайт связывания, который специфически связывается с маркером клеточной поверхности клетки, причем первый сайт указанного антитела ковалентно связан с гаптеном с помощью остатка цистеина в положении 52b или 53 в CDR2 тяжелой цепи согласно нумерации вариабельного домена тяжелой цепи по Кэботу, и где гаптен выбирают из группы, состоящей из биотина, дигоксигенина, теофиллина и флуоресцеина.
2. Конъюгат по п. 1, отличающийся тем, что ковалентная связь представляет собой дисульфидную связь.
3. Конъюгат по п. 1 или 2, отличающийся тем, что антитело представляет собой полноразмерное антитело.
4. Конъюгат по любому из пп. 1-3, отличающийся тем, что антитело представляет собой гуманизированное антитело или человеческое антитело.
| KABAT E.A | |||
| et al | |||
| Sequences of proteins of immunological interest | |||
| DIANE publishing, 1991, Vol.1, стр.311 (кол.43) | |||
| YASUI HISASHI et al | |||
| "Class switch from μ to δ is mediated by homologous recombination between σμ and σμ sequences in human immunoglobulin gene loci." European journal of immunology, 1989, 19(8): 1399-1403 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| OHNO SUSUMU et | |||
| al., "Antigen-binding specificities of antibodies are primarily determined by seven residues of VH", Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA, 1985, 82: 2945-2949 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| KANDA P | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| KNAPPIK ACHIM et al | |||
| "Fully synthetic human combinatorial antibody libraries (HuCAL) based on modular consensus frameworks and CDRs randomized with trinucleotides." Journal of molecular biology, 2000, 296(1): 57-86 | |||
| ДЕЕВ С.М., ЛЕБЕДЕНКО Е.Н | |||
| "Современные технологии создания неприродных антител для клинического применения." Acta Naturae (русскоязычная версия), 2009, 1:32-50. | |||
Авторы
Даты
2019-04-09—Публикация
2013-07-04—Подача