Область изобретения
Данное изобретение относится к гуманизированным антителам против 5-бром-2'-дезоксиуридина (BRDU, от англ. - bromodeoxyuridine) и производным гуманизированных антител против BRDU, а также к способам их применения.
Уровень техники
Гаптен-связывающие антитела могут быть применены в качестве захватывающих модулей для терапевтических и диагностических применений. Например, гаптен-связанные частицы, такие как флуорофоры, хелатирующие реагенты, пептиды, нуклеиновые кислоты, белки, липиды, наночастицы и многие другие агенты, могут вступать в реакцию с гаптен-связывающими антителами и производными антител. Это позволяет эффективно обнаруживать такие "полезные нагрузки", а также собирать, накапливать в нужных местах, сшивать и использовать другие опосредованные антителами эффекты. Поскольку особенности и состав гаптенов могут влиять на состав и "поведение" гаптен-связанных частиц (включая размер, растворимость, активность, биофизические свойства, РК, биологические эффекты и многое другое), то очень желательно разработать множество различных гаптен-связывающих частиц. Таким образом, можно найти соответствие выбранного гаптена с данной полезной нагрузкой для создания оптимизированных конъюгатов гаптена. Впоследствии оптимальные гаптен-связывающие частицы можно объединить с указанными конъюгатами для создания оптимальных комплексов "антитело - гаптен - полезная нагрузка". Кроме того, желательно иметь гаптен-связывающие частицы, такие как производные антител, которые являются гуманизированными. Это делает возможным их применение со значительно меньшим риском помех при терапевтических целях, таких как иммуногенность. Антитела, которые описаны в данном документе, связывают BRDU, а также производные BRDU. Эти антитела называются в данном документе "BRDU-связывающими" или "анти-BRDU-антителами".
Краткое описание
Данное изобретение относится к анти-BRDU-антителам и производным анти-BRDU-антител, а также к способам их применения.
Одним из аспектов, описанных в данном документе, является гуманизированное анти-BRDU-антитело, где указанное антитело содержит (a) HVR-Н1 (HVR, от англ. hyper variable region - гипервариабельная область) с аминокислотной последовательностью SEQ ID NO 01, (b) HVR-H2 с аминокислотной последовательностью SEQ ID NO 04, и (с) HVR-H3 с аминокислотной последовательностью SEQ ID NO 05. Это антитело специфически связывается с BRDU.
В одном из воплощений указанное антитело имеет в позиции 30 вариабельного домена тяжелой цепи аминокислотный остаток пролин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело имеет в позиции 58 вариабельного домена тяжелой цепи аминокислотный остаток фенилаланин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело имеет в позиции 108 вариабельного домена тяжелой цепи аминокислотный остаток треонин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит в позиции 30 вариабельного домена тяжелой цепи аминокислотный остаток пролин, в позиции 58 вариабельного домена тяжелой цепи аминокислотный остаток фенилаланин, а в позиции 108 вариабельного домена тяжелой цепи аминокислотный остаток треонин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит: (1) HVR-H1 с аминокислотной последовательностью SEQ ID NO 01, (2) в позиции 30 вариабельного домена тяжелой цепи аминокислотный остаток пролин, (3) HVR-H2 с аминокислотной последовательностью SEQ ID NO 04, (4) в позиции 58 вариабельного домена тяжелой цепи аминокислотный остаток фенилаланин, (5) HVR-H3 с аминокислотной последовательностью SEQ ID NO 05, и (6) в позиции 108 вариабельного домена тяжелой цепи аминокислотный остаток триптофан (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит HVR-H1 с аминокислотной последовательностью SEQ ID NO 02.
В одном из воплощений указанное антитело содержит HVR-H2 с аминокислотной последовательностью SEQ ID NO 03.
В одном из воплощений указанное антитело содержит HVR-H2 с аминокислотной последовательностью SEQ ID NO 12.
В одном из воплощений указанное антитело также содержит (a) HVR-L1 с аминокислотной последовательностью SEQ ID NO 06, (b) HVR-L2 с аминокислотной последовательностью SEQ ID NO 07, и (с) HVR-L3 с аминокислотной последовательностью SEQ ID NO 08.
В одном из воплощений указанное антитело содержит в позиции 49 вариабельного домена легкой цепи аминокислотный остаток лизин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит в позиции 98 вариабельного домена легкой цепи аминокислотный остаток лейцин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит в позиции 49 вариабельного домена легкой цепи аминокислотный остаток лизин и в позиции 98 вариабельного домена легкой цепи аминокислотный остаток лейцин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело (1) содержит в позиции 30 вариабельного домена тяжелой цепи аминокислотный остаток пролин, в позиции 58 вариабельного домена тяжелой цепи аминокислотный остаток фенилаланин, а в позиции 108 вариабельного домена тяжелой цепи аминокислотный остаток треонин, и (2) содержит в позиции 49 вариабельного домена легкой цепи аминокислотный остаток лизин и в позиции 98 вариабельного домена легкой цепи аминокислотный остаток лейцин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит: (1) HVR-H1 с аминокислотной последовательностью SEQ ID NO 01, (2) в позиции 30 вариабельного домена тяжелой цепи аминокислотный остаток пролин, (3) HVR-H2 с аминокислотной последовательностью SEQ ID NO 04, (4) в позиции 58 вариабельного домена тяжелой цепи аминокислотный остаток фенилаланин, (5) HVR-H3 с аминокислотной последовательностью SEQ ID NO 05, (6) в позиции 108 вариабельного домена тяжелой цепи аминокислотный остаток триптофан, (7) HVR-L1 с аминокислотной последовательностью SEQ ID NO 06, (8) в позиции 49 вариабельного домена легкой цепи аминокислотный остаток лизин, (9) HVR-L2 с аминокислотной последовательностью SEQ ID NO 07, (10) в позиции 98 вариабельного домена легкой цепи аминокислотный остаток лейцин, и (11) HVR-L3 с аминокислотной последовательностью SEQ ID NO 08 (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит (а) последовательность VH (от англ. variable heavy - вариабельный домен тяжелой цепи), имеющую по меньшей мере 95% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 09, (b) последовательность VL (от англ. variable light - вариабельный домен легкой цепи), имеющую по меньшей мере 95% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 10, или (с) последовательность VH, как в (а), и последовательность VL, как в (b), где (1) в позиции 30 вариабельного домена тяжелой цепи находится аминокислотный остаток пролин, в позиции 58 вариабельного домена тяжелой цепи находится аминокислотный остаток фенилаланин, а в позиции 108 вариабельного домена тяжелой цепи находится аминокислотный остаток треонин, и (2) в позиции 49 вариабельного домена легкой цепи находится аминокислотный остаток лизин, и в позиции 98 вариабельного домена легкой цепи находится аминокислотный остаток лейцин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит последовательность VH с SEQ ID NO 09.
В одном из воплощений указанное антитело содержит последовательность VLcSEQ ID NO 10.
Один из аспектов, описанных в данном документе, представляет собой антитело, содержащее последовательность VH с SEQ ID NO 09 и последовательность VL с SEQ ID NO 10.
В одном из воплощений указанное антитело представляет собой полноразмерное антитело lgG1 или полноразмерное антитело lgG4.
В одном из воплощений указанное антитело представляет собой моноклональное антитело.
В одном из воплощений указанное антитело представляет собой фрагмент антитела, который связывает BRDU.
Один из аспектов, описанных в данном документе, представляет собой гуманизированный вариант мышиного антитела, содержащий вариабельный домен тяжелой цепи, полученный из аминокислотной последовательности SEQ ID NO 11, и вариабельный домен легкой цепи, полученный из аминокислотной последовательности SEQ ID NO 12, который специфически связывается с BRDU.
В одном из воплощений указанное антитело имеет в позиции 30 вариабельного домена тяжелой цепи аминокислотный остаток пролин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело имеет в позиции 58 вариабельного домена тяжелой цепи аминокислотный остаток фенилаланин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело имеет в позиции 108 вариабельного домена тяжелой цепи аминокислотный остаток треонин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит в позиции 30 вариабельного домена тяжелой цепи аминокислотный остаток пролин, в позиции 58 вариабельного домена тяжелой цепи аминокислотный остаток фенилаланин, а в позиции 108 вариабельного домена тяжелой цепи аминокислотный остаток треонин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит в позиции 49 вариабельного домена легкой цепи аминокислотный остаток лизин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит в позиции 98 вариабельного домена легкой цепи аминокислотный остаток лейцин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело содержит в позиции 49 вариабельного домена легкой цепи аминокислотный остаток лизин и в позиции 98 вариабельного домена легкой цепи аминокислотный остаток лейцин (нумерация в соответствии с Kabat).
В одном из воплощений указанное антитело (1) содержит в позиции 30 вариабельного домена тяжелой цепи аминокислотный остаток пролин, в позиции 58 вариабельного домена тяжелой цепи аминокислотный остаток фенилаланин, а в позиции 108 вариабельного домена тяжелой цепи аминокислотный остаток треонин, и (2) содержит в позиции 49 вариабельного домена легкой цепи аминокислотный остаток лизин и в позиции 98 вариабельного домена легкой цепи аминокислотный остаток лейцин (нумерация в соответствии с Kabat).
Один из аспектов, описанных в данном документе, представляет собой фармацевтический состав, содержащий антитело, описанное в данном документе, и фармацевтически приемлемый носитель.
Один из аспектов, описанных в данном документе, представляет собой антитело, описанное в данном документе, для применения в качестве лекарственного средства.
Один из аспектов, описанных в данном документе, представляет собой применение антитела, описанного в данном документе, в изготовлении лекарственного средства.
Описание графических материалов
Фиг. 1: А: Анализ эксклюзионная хроматография с детектированием рассеивания лазерного излучения с кратными углами (SEC-MALLS, от англ. - Size-Exclusion Chromatography Combined with Multiangle Laser Light Scattering) проводили с целью выявления и характеризации комплексов биспецифических анти-TfR/BRDU-антител с BRDU-меченной ДНК, а также свободного биспецифического антитела и свободной BRDU-ДНК. Комплексы элюировались с колонки с молекулярной массой (ММ), равной 244,9 кДа, свободное биспецифическое антитело обнаруживалось с ММ, равной 215,4 кДа, а свободная BRDU-ДНК обнаруживалась с ММ, равной 16,4 кДа.
В: Анализ SEC-MALLS проводили с целью выявления и характеризации комплексов биспецифических анти-TfR/BRDU-антител с BRDU-меченной ДНК, а также свободного биспецифического антитела и свободной BRDU-ДНК. Комплексы демонстрировали гидродинамический радиус 6,8 нм, тогда как свободное биспецифическое антитело демонстрировало гидродинамический радиус 6,2 нм.
Подробное описание воплощений данного изобретения
I. Определения
Используемые в данном документе аминокислотные позиции во всех константных областях и доменах тяжелой и легкой цепей пронумерованы в соответствии с системой нумерации Kabat, описанной в Kabat, et al., Sequences of Protein of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), и упоминаемой в данном документе как "нумерация согласно Kabat". В частности, система нумерации Kabat (см. страницы 647-660) в Kabat, et al., Sequences of Protein of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), используется для константного домена легкой цепи CL изотипа каппа и лямбда, и система нумерации EU-индекса Kabat (см. страницы 661-723) используется для константных доменов тяжелой цепи (СН1, шарнир, СН2 и CH3).
"Акцепторная человеческая каркасная область" в рамках данного изобретения является каркасной областью, включающей аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), полученную из каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, определенной ниже. Акцепторная человеческая каркасная область, "полученная из" каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, может содержать такую же аминокислотную последовательность, или она может содержать аминокислотные замены. В некоторых воплощениях число аминокислотных замен составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых воплощениях акцепторная человеческая каркасная область VL по своей последовательности идентична последовательности каркасной области VL человеческого иммуноглобулина или последовательности человеческой консенсусной каркасной области.
Понятие "аффинность" относится к силе суммарных общих нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иное, то термин "аффинность связывания", используемый в данном документе, относится к внутренней аффинности связывания, которая отражает взаимодействие 1:1 между элементами пары связывания (антителом и антигеном). Аффинность молекулы X в отношении ее партнера Y можно выразить, в целом, константой диссоциации (Kd). Аффинность можно измерить обычными способами, известными в данной области, включая описанные в данном документе. Конкретные иллюстративные и примерные воплощения измерения аффинности связывания описаны далее.
Понятие "антитела со зрелой аффинностью" относится к антителу с одним или более чем одним изменением в одной или более чем одной гипервариабельной области (hypervariable region, HVR) по сравнению с родительским антителом, которое не содержит таких изменений, причем такие изменения приводят к повышению аффинности антитела к антигену.
Термины "анти-BRDU-антитело" и "антитело, которое связывается с BRDU" относятся к антителу, которое способно связывать BRDU с достаточной аффинностью, так что данное антитело может быть использовано в качестве диагностического и/или терапевтического агента для нацеливания на BRDU.
Термин "антитело" в данном документе используется в самом широком его смысле и охватывает различные структуры антитела, в том числе, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, до тех пор пока они проявляют нужную антигенсвязывающую активность.
Термин "фрагмент антитела" относится к молекуле, отличающейся от интактного антитела, которая содержит часть интактного антитела, которая связывается с антигеном, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваясь ими, Fv, Fab, Fab’, Fab’-SH, F(ab’)2; димерные антитела; линейные антитела; одноцепочечные молекулы антител (например, scFv); и мультиспецифические антитела, сформированные из фрагментов антител.
Термин "химерное" антитело относится к антителу, в котором часть тяжелой и/или легкой цепи получена из конкретного источника или вида, в то время как остальная часть тяжелой и/или легкой цепи получена из другого источника или вида.
Понятие "класса" антитела относится к типу константного домена или константной области, которой обладает его тяжелая цепь. Есть пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть далее разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно.
Термин "цитотоксический агент", используемый в данном документе, относится к веществу, которое ингибирует или предотвращает клеточное функционирование и/или вызывает гибель или разрушение клеток. Цитотоксические агенты включают, но не ограничиваясь ими, радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); агенты-ингибиторы роста; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или их варианты; и различные противоопухолевые или противораковые агенты, описанные в данном документе.
Термин "полученный из" означает, что аминокислотная последовательность получена из родительской аминокислотной последовательности путем введения изменений по меньшей мере в одной позиции. Таким образом, полученная аминокислотная последовательность отличается от соответствующей родительской аминокислотной последовательности по меньшей мере в одной соответствующей позиции (нумерация в соответствии с системой нумерации индекса EU Kabat для Fc-областей антител). В одном из воплощений аминокислотная последовательность, полученная из родительской аминокислотной последовательности, отличается от родительской аминокислотной последовательности более чем одним аминокислотным остатком в соответствующих позициях. В одном из воплощений аминокислотная последовательность, полученная из родительской аминокислотной последовательности, отличается от родительской аминокислотной последовательности более чем десятью аминокислотными остатками в соответствующих позициях. В одном из воплощений аминокислотная последовательность, полученная из родительской аминокислотной последовательности, отличается от родительской аминокислотной последовательности более чем пятнадцатью аминокислотными остатками в соответствующих позициях. Таким образом, родительская аминокислотная последовательность формирует основу для производной аминокислотной последовательности.
Понятие "эффекторных функций" относится к таким биологическим активностям, связанным с Fc-областью антитела, которые изменяются в зависимости от класса антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность (complement dependent cytotoxicity, CDC); Fc-рецепторное связывание; антителозависимую клеточно-опосредованную цитотоксичность (antibody-dependent cell-mediated cytotoxicity, ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора); и активацию В-клеток.
Понятие "эффективного количества" агента, например, фармацевтического состава, относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения нужного терапевтического или профилактического результата.
Термин "Fc-область" в данном документе используется для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Этот термин включает Fc-области нативной последовательности и вариантные Fc-области. В одном воплощении Fc-область тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбокси-конца тяжелой цепи. Тем не менее, С-концевой лизин (Lys447) Fc-области может присутствовать или отсутствовать. Если не указано иное, то нумерация аминокислотных остатков в Fc-области или константной области осуществляется в соответствии с системой нумерации EU, также называемой индексом EU, как описано в Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
Понятие "каркасного участка", или "FR" (от англ. - framework), относится к остаткам вариабельного домена, отличающимся от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно появляются в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины "полноразмерное антитело", "интактное антитело" и "целое антитело" используются в данном документе взаимозаменяемо для обозначения антитела, имеющего структуру, по существу аналогичную структуре нативного антитела, или содержащего тяжелые цепи с Fc-областью, определенной в данном документе.
Термины "клетка-хозяин", "клеточная линия-хозяин" и "клеточная культура-хозяин" используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают "трансформантов" и "трансформированные клетки", которые включают первичные трансформированные клетки и потомство, полученное из них, независимо от числа пассажей. Потомство может не быть полностью идентичным родительской клетке по содержанию нуклеиновых кислот, но может содержать мутации. Мутантное потомство, которое имеет такую же функцию или биологическую активность, как при скрининге или селекции первоначально трансформированной клетки, включено в данный документ.
"Человеческое антитело" является таким антителом, которое обладает аминокислотной последовательностью, которая соответствует антителу, продуцируемому человеком или человеческой клеткой или получено из нечеловеческого источника, который использует репертуар человеческих антител или других последовательностей, кодирующих человеческие антитела. Это определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
"Человеческая консенсусная каркасная область" является каркасной областью, которая представляет наиболее часто встречающиеся аминокислотные остатки в выборе последовательностей каркасных областей VL или VH человеческого иммуноглобулина. Как правило, выбор VL- или VH-последовательностей человеческого иммуноглобулина осуществляется из подгруппы последовательностей вариабельного домена. Как правило, подгруппа последовательностей является такой подгруппой, как описано в Kabat, Е.А. et al., Sequences of Proteins of Immunological Interest, 5th ed., Bethesda MD (1991), NIH Publication 91-3242, Vols. 1-3. В одном воплощении для VL подгруппа является подгруппой каппа I, как описано в Kabat et al., см. выше. В одном воплощении для VH подгруппа является подгруппой III, как описано в Kabat et al., см. выше.
"Гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых воплощениях гуманизированное антитело будет содержать по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все HVR (например, CDR, от англ. complementary determining region - участки, определяющие комплементарность) соответствуют таковым в нечеловеческом антителе, и все или по существу все FR соответствуют таковым в человеческом антителе. Гуманизированное антитело, возможно, может содержать по меньшей мере часть константной области антитела, полученной из человеческого антитела. "Гуманизированная форма" антитела, например, нечеловеческого антитела, относится к антителу, которое подверглось гуманизации.
Термин "гипервариабельная область", или "HVR", используемый в данном документе, относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными в последовательности и/или образуют структурно определенные петли ("гипервариабельные петли"). Как правило, нативные четырехцепочечные антитела содержат шесть HVR; три в VH (Н1, Н2, H3) и три в VL (L1, L2, L3). HVR, как правило, содержат аминокислотные остатки из гипервариабельных петель и/или из "участков, определяющих комплементарность" (CDR), причем последние имеют наивысшую изменчивость последовательности и/или участвуют в распознавании антигена. Иллюстративные гипервариабельные петли возникают на аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (H3) (Chothia, С. and Lesk, A.M., J. Mol. Biol. 196 (1987) 901-917). Иллюстративные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) возникают на аминокислотных остатках 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35 В в Н1, 50-65 в Н2 и 95-102 в H3 (Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242). За исключением CDR1 в VH, CDR, как правило, содержат аминокислотные остатки, которые формируют гипервариабельные петли. CDR также содержат "остатки, определяющие специфичность", или "SDR" (от англ. specificity determining residues), которые являются остатками, контактирующими с антигеном. SDR содержатся в областях CDR, называемых сокращенно -CDR, или а-CDR. Иллюстративные a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) возникают на аминокислотных остатках 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35 В в Н1, 50-58 в Н2 и 95-102 в H3 (см. Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633). Если не указано иное, то HVR-остатки и другие остатки в вариабельном домене (например, FR-остатки) пронумерованы в данном документе в соответствии с Kabat et al., см. выше.
"Иммуноконъюгат" представляет собой антитело, конъюгированное с одной или более чем одной гетерологичной молекулой (молекулами), включая цитотоксический агент, но не ограничиваясь им.
"Индивидуум" или "субъект" является млекопитающим. Млекопитающие включают, но не ограничиваясь ими, домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых воплощениях индивидуум или субъект является человеком.
"Изолированное" ("выделенное") антитело является таким антителом, которое было отделено от компонентов его природной среды. В некоторых воплощениях антитело очищают до чистоты более 95% или 99%, которую определяют, например, с помощью электрофореза (например, SDS-PAGE, изоэлектрофокусировки (IEF, isoelectric focusing), капиллярного электрофореза) или хроматографии (например, ионнообменной или обращено-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ)). Обзор способов оценки чистоты антител см., например, в Flatman, S. et al., J. Chromatogr. В 848 (2007) 79-87.
Понятие "изолированной" нуклеиновой кислоты относится к нуклеиновокислотной молекуле, которая была отделена от компонентов ее природной среды. Изолированная нуклеиновая кислота включает нуклеиновокислотную молекулу, содержащуюся в клетках, которые обычно содержат эту нуклеиновокислотную молекулу, но эта нуклеиновокислотная молекула находится вне хромосомы или в том месте хромосомы, которое отличается от ее природной хромосомной локализации.
"Изолированная нуклеиновая кислота, кодирующая анти-BRDU-антитело" относится к одной или более чем одной нуклеиновокислотной молекуле, кодирующей тяжелую и легкую цепи антитела (или их фрагменты), включая такие нуклеиновокислотные молекулы в одном векторе или в отдельных векторах, и такие нуклеиновокислотные молекулы присутствуют в одном или более чем одном месте в клетке-хозяине.
Термин "моноклональное антитело", используемый в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантных антител, например, содержащих природные мутации или возникающих в процессе производства препарата моноклональных антител, при этом такие варианты, как правило, присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклонального антитела направлено против одной единственной детерминанты на антигене. Таким образом, понятие "моноклональное" указывает на характер антитела, полученного по существу из гомогенной популяции антител, и не должно быть истолковано как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые будут использоваться в соответствии с данным изобретением, могут быть получены с помощью различных методик, включая, но не ограничиваясь ими, гибридомную методику, методики рекомбинантной ДНК, методики фагового дисплея, а также методики, использующие трансгенных животных, содержащих все или часть локусов человеческого иммуноглобулина, при этом такие методики и другие иллюстративные методики получения моноклональных антител описаны в данном документе.
Понятие "голое антитело" относится к антителу, которое не конъюгировано с гетерологичной группировкой (например, цитотоксической группировкой) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтическом составе.
Понятие "нативных антител" относится к молекулам иммуноглобулина природного происхождения с различными структурами. Например, нативные антитела IgG являются гетеротетрамерными гликопротеинами размером примерно 150000 Да, состоящими из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидными мостиками. От N- к С-концу каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, а затем три константных домена (СН1, СН2 и CH3). Аналогично, от N- к С-концу каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, с последующим константным легким доменом (CL). Легкая цепь антитела может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотной последовательности его константного домена.
Термин "вкладыш в упаковку" используется для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов.
"Процент (%) идентичности аминокислотной последовательности" по отношению к референсной полипептидной последовательности определяется как процент аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в референсной полипептидной последовательности после выравнивания последовательностей и введения при необходимости пробелов для достижения максимального процента идентичности последовательностей, и без учета любых консервативных замен как части идентичности последовательности. Выравнивание с целью определения процента идентичности аминокислотных последовательностей может быть достигнуто различными способами, которые известны специалистам в данной области, например, с использованием общедоступного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Тем не менее, для целей данного изобретения значения % идентичности аминокислотных последовательностей получают с использованием компьютерной программы для сравнивания последовательностей ALIGN-2. Компьютерная программа для сравнивания последовательностей ALIGN-2 была разработана Genentech, Inc, и исходный код был подан с пользовательской документацией в бюро авторских прав США, Вашингтон, округ Колумбия, 20559, где он был зарегистрирован под номером TXU510087. Программа ALIGN-2 находится в открытом доступе от Genentech, Inc., Саут-Сан-Франциско, Калифорния, или может быть скомпилирована из исходного кода. Программа ALIGN-2 должна быть скомпилирована для применения на операционной системе UNIX, включая цифровую UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не меняются.
В ситуациях, когда для сравнивания аминокислотных последовательностей используется ALIGN-2, процент идентичности аминокислотной последовательности данной аминокислотной последовательности А с данной аминокислотной последовательностью В (альтернативно можно сказать, что данная аминокислотная последовательность А имеет или содержит определенный процент идентичности аминокислотной последовательности с данной аминокислотной последовательностью В) вычисляется следующим образом:
100 × доля X/Y,
где X обозначает число аминокислотных остатков, оцененных как идентичные совпадения с помощью программы для выравнивания последовательностей ALIGN-2 при выравнивании в этой программе А и В, и где Y обозначает общее число аминокислотных остатков в В. Следует иметь в виду, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то % идентичности аминокислотной последовательности А с В не будет равен % идентичности аминокислотной последовательности В с А. Если специально не указано иное, то все значения % идентичности аминокислотной последовательности, используемые в данном описании, получены так, как описано в предыдущем абзаце, с использованием компьютерной программы ALIGN-2.
Термин "фармацевтический состав" относится к препарату, который находится в такой форме, чтобы обеспечить биологическую активность активного ингредиента, содержащегося в нем, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому будет осуществляться введение состава.
Понятие "фармацевтически приемлемого носителя" относится к ингредиенту фармацевтического состава, помимо активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемые носители включают, но не ограничиваясь ими, буфер, эксципиент, стабилизатор или консервант.
Термин "BRDU", используемый в данном документе, обозначает бромдезоксиуридин с химической формулой 5-бром-2'-дезоксиуридина. Другими сокращениями являются BrdU, BUdR, BrdUrd.
Используемый в данном документе термин "лечение" (и его грамматические варианты, такие как "лечить") относится к клиническому вмешательству в попытке изменить естественный ход заболевания у индивидуума, которого лечат, и которое может быть выполнено либо для профилактики, либо в ходе клинической патологии. Желательные эффекты лечения включают, но не ограничиваясь ими, предотвращение возникновения или рецидива заболевания, ослабление симптомов, уменьшение любого прямого или косвенного патологического последствия заболевания, предотвращение метастазирования, уменьшение скорости прогрессирования заболевания, улучшение или временное облегчение болезненного состояния, достижение ремиссии или улучшение прогноза. В некоторых воплощениях антитела согласно данному изобретению используются для задержки развития заболевания или для замедления прогрессии заболевания.
Термин "вариабельная область" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют аналогичную структуру, при этом каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR) (см., например, Kindt, T.J. et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), page 91). Один VH- или VL-домен может быть достаточным для придания антигенсвязывающей специфичности. Кроме того, антитела, которые связывают конкретный антиген, могут быть выделены с помощью VH- или VL-домена из антитела, которое связывается с этим антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов, соответственно. См., например, Portolano et al., J. Immunol. 150 (1993) 880-887; Clarkson et al., Nature 352 (1991) 624-628).
Термин "вектор", используемый в данном документе, относится к нуклеиновокислотной молекуле, способной размножать другую нуклеиновую кислоту, с которой она связана. Этот термин включает вектор как самореплицирующуюся нуклеиновокислотную структуру, а также как вектор, включенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называют в данном документе "экспрессионными векторами".
Термин "гаптен" обозначает небольшую молекулу, которая может вызвать иммунный ответ только при прикреплении к большому носителю, такому как белок. Примерами гаптенов являются анилин, о-, м- и п-аминобензойная кислота, хинон, гидралазин, галотан, флуоресцеин, биотин, BRDU, дигоксигенин, теофиллин и динитрофенол. В одном из воплощений гаптен представляет собой биотин, или дигоксигенин, или теофиллин, или карборан, или BRDU. В одном из воплощений гаптен представляет собой BRDU.
Термин "BRDU, который конъюгирован с" обозначает остаток BRDU, который ковалентно связан, непосредственно или косвенно, с другой группировкой, такой как эффекторная нуклеиновая кислота, полипептид или метка. В одном предпочтительном воплощении другая группировка представляет собой нуклеиновую кислоту.
Термин "ковалентное формирование комплекса" означает, что после формирования нековалентного комплекса, например, между анти-BRDU-антителом и BRDU, между двумя партнерами в комплексе формируется ковалентная связь. Формирование этой ковалентной связи происходит без необходимости добавления дополнительных реагентов.
II. Композиции и способы
В одном из аспектов данное изобретение основано на гуманизированных антителах, которые связываются с BRDU. Эти антитела представлены в данном документе. Антитела согласно данному изобретению могут быть использованы, например, в виде моноспецифических антител для связывания BRDU-содержащих нуклеиновых кислот и в виде мультиспецифических антител для диагностики или лечения всех видов заболеваний с использованием специфичности связывания с BRDU-содержащей нуклеиновой кислотой в качестве универсальной полезной нагрузки, характерной для антитела.
А. Иллюстративные анти-BRDU-антитела
В одном из аспектов данное изобретение относится к выделенным антителам, которые связываются с BRDU. В некоторых воплощениях анти-BRDU-антитела являются гуманизированными анти-BRDU-антителами. В некоторых воплощениях анти-BRDU-антитела, описанные в данном документе, связываются с BRDU-содержащими нуклеиновыми кислотами, не мешая биологической активности нуклеиновой кислоты. Таким образом, эти антитела могут быть использованы для улучшения фармакокинетических свойств BRDU-содержащих нуклеиновых кислот, если антитело представляет собой моноспецифическое антитело. Кроме того, эти антитела могут быть использованы для целевой доставки BRDU-содержащих нуклеиновых кислот, если антитело представляет собой би- или мультиспецифическое антитело, когда одна специфичность связывания направлена против BRDU и может быть использована в качестве универсальной специфичности полезной нагрузки, тогда как вторая специфичность связывания специфически связывается, например, с молекулой клеточной поверхности и обеспечивает нацеливающую характеристику/компонент би- или мультиспецифического антитела.
Для адресной доставки нуклеиновых кислот (т.е. полезной нагрузки в виде нуклеиновых кислот) к клеткам или в клетки, желательно ввести в нуклеиновую кислоту полезной нагрузки как можно меньше изменений.
При конъюгации нуклеиновой кислоты с полипептидами в нуклеиновую кислоту вводится значительная модификация.
В качестве альтернативы возможна конъюгация нуклеиновой кислоты с ненуклеотидным гаптеном. Модификация нуклеиновой кислоты в результате этого является меньшей по сравнению с модификацией, полученной в результате конъюгации с полипептидом. Но ненуклеотидные гаптены, такие как биотин, дигоксигенин, теофиллин, флуоресцеин, по-прежнему существенно отличаются от нуклеотидов, таких как, например, в их структуре. Таким образом, конъюгация с ненуклеотидным гаптеном все еще может привести к нетолерантным модификациям.
В настоящее время было обнаружено, что аналог тимидина, т.е. бромдезоксиуридин (BRDU), может быть использован для получения гаптена, который, с одной стороны, может распознаваться антителом, а с другой стороны, не вносит существенных изменений в нуклеиновую кислоту полезной нагрузки.
В одном из аспектов данное изобретение относится к анти-BRDU-антителу, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных среди: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 01; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 04; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 05; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 06; (е) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 07; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 08.
В одном из аспектов данное изобретение относится к анти-BRDU-антителу, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных среди: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 02; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 04; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 05; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 06; (е) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 07; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 08.
В одном из аспектов данное изобретение относится к анти-BRDU-антителу, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных среди: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 01; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 03; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 05; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 06; (е) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 07; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 08.
В одном из аспектов данное изобретение относится к анти-BRDU-антителу, содержащему по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных среди: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 02; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 03; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 05; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 06; (е) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 07; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 08.
В одном из аспектов данное изобретение относится к анти-BRDU-антителу, содержащему по меньшей мере одну, две или три последовательности VH HVR, выбранные среди: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 01; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 04; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 05. В одном из воплощений антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05. В другом воплощении антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 08. В другом воплощении антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 08, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 04. В другом воплощении антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 01; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 04; и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05.
В другом аспекте данное изобретение относится к анти-BRDU-антителу, содержащему по меньшей мере одну, по меньшей мере две или все три последовательности VL HVR, выбранные среди (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 06; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 07; и (с) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 08. В одном из воплощений данное антитело содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO 06; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO 07; и (с) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 08.
В другом аспекте анти-BRDU-антитело согласно данному изобретению содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH HVR, выбранные среди (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 01, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 04, и (iii) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 05; и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VL HVR, выбранные среди (i) HVR-L1, содержащей аминокислотную последовательность из SEQ ID NO 06, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 07, и (iii) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 08.
В другом аспекте данное изобретение относится к анти-BRDU-антителу, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 01; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 04; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO 06; (е) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO 07; и (f) HVR-L3, содержащую аминокислотную последовательность, выбранную среди SEQ ID NO 08.
В одном из воплощений анти-BRDU-антитело является гуманизированным.
Было установлено, что в гуманизированном анти-BRDU-антителе в определенной позиции необходимы конкретные остатки, чтобы поддерживать характеристики негуманизированного родительского антитела.
Гуманизированное анти-BRDU-антитело содержит в позиции 30 согласно Kabat в вариабельном домене тяжелой цепи аминокислотный остаток Р.
Гуманизированное анти-BRDU-антитело содержит в позиции 58 согласно Kabat в вариабельном домене тяжелой цепи аминокислотный остаток F.
Гуманизированное анти-BRDU-антитело содержит в позиции 108 согласно Kabat в вариабельном домене тяжелой цепи аминокислотный остаток Т.
В одном из воплощений гуманизированное анти-BRDU-антитело содержит HVR, как в любом из указанных выше воплощений, и также содержит человеческую акцепторную каркасную область, например, каркасную область человеческого иммуноглобулина или человеческую консенсусную каркасную область.
В одном из воплощений гуманизированное анти-BRDU-антитело содержит VH, содержащую HVR-Hs, как в любом из указанных выше воплощений, и также содержит один или более чем один из следующих остатков:
- Р в позиции 30 вариабельного домена тяжелой цепи, и/или
- F в позиции 58 вариабельного домена тяжелой цепи, и/или
- Т в позиции 108 вариабельного домена тяжелой цепи, и/или
- К в позиции 49 вариабельного домена легкой цепи, и/или
- L в позиции 98 вариабельного домена легкой цепи (все позиции в соответствии с Kabat).
Позиция 30 вариабельного домена тяжелой цепи согласно Kabat соответствует остатку номер 30 в SEQ ID NO 09 и 11.
Позиция 58 вариабельного домена тяжелой цепи согласно Kabat соответствует остатку номер 59 в SEQ ID NO 09 и 11.
Позиция 108 вариабельного домена тяжелой цепи согласно Kabat соответствует остатку номер 114 в SEQ ID NO 09 и 11.
Позиция 49 вариабельного домена легкой цепи согласно Kabat соответствует остатку номер 49 в SEQ ID NO 10 и 12.
Позиция 98 вариабельного домена легкой цепи согласно Kabat соответствует остатку номер 98 в SEQ ID NO 10 и 12.
Эти изменения (обратные мутации) могут быть введены для повышения аффинности связывания гуманизированного анти-BRDU-антитела.
В другом аспекте анти-BRDU-антитело содержит последовательность вариабельного домена тяжелой цепи (VH) по меньшей мере с 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO 09. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по отношению к референсной последовательности, но анти-BRDU-антитело, содержащее эту последовательность, сохраняет способность связываться с BRDU. В некоторых воплощениях в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO 09. В некоторых воплощениях замены, вставки или делеции имеют место в областях вне HVR (т.е. в FR). Возможно, анти-BRDU-антитело содержит последовательность VH в SEQ ID NO 09, включая посттрансляционные модификации этой последовательности. В конкретном воплощении VH содержит одну, две или три HVR, выбранные среди: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 01 или 02, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 03 или 04, и (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 05.
В другом аспекте предложено анти-BRDU-антитело, которое содержит вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO 10. В некоторых воплощениях последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%), 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по отношению к референсной последовательности, но анти-BRDU-антитело, содержащее эту последовательность, сохраняет способность связываться с BRDU. В некоторых воплощениях в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены в SEQ ID NO 10. В некоторых воплощениях замены, вставки или делеции возникают в областях вне HVR (т.е. в FR). Возможно, анти-BRDU-антитело содержит последовательность VL в SEQ ID NO 10, включая посттрансляционные модификации этой последовательности. В конкретном воплощении VL содержит одну, две или три HVR, выбранные среди: (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 06, (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 07, и (с) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 08.
В другом аспекте предложено анти-BRDU-антитело, которое содержит VH как в любом из воплощений, приведенных выше, и VL как в любом из воплощений, приведенных выше. В одном из воплощений антитело содержит последовательности VH и VL в SEQ ID NO 09 и SEQ ID NO 10, соответственно, в включая посттрансляционные модификации этих последовательностей.
В другом аспекте данного изобретения анти-BRDU-антитело согласно любому из указанных выше воплощений представляет собой моноклональное антитело, в том числе химерное, гуманизированное или человеческое антитело. В одном из воплощений анти-BRDU-антитело представляет собой фрагмент антитела, например, Fv, Fab, Fab’, scFv, димерное антитело или Р(ab’)2-фрагмент. В другом воплощении данное антитело представляет собой полноразмерное антитело, например, интактное IgG1- или IgG4-антитело или антитело другого класса или изотипа, определенного в данном документе.
В другом аспекте анти-BRDU-антитело согласно любому из вышеописанных воплощений может включать любой из признаков, по отдельности или в комбинации, описанных в разделах 1-5 ниже:
1. Аффинность антитела
Kd можно измерить с помощью анализа связывания антигена, меченного радиоактивным изотопом (radiolabeled antigen binding assay, RIA), проводимого с Fab-версией антитела, представляющего интерес, и его антигеном, как описано далее. Например, аффинность связывания Fab с антигеном в растворе измеряют, уравновешивая Fab с минимальной концентрацией (125I)-меченного антигена в присутствии серии титров немеченого антигена с последующим захватом связанного антигена на планшете, покрытом анти-Fab-антителом (см., например, Chen, Y., et al., J. Mol. Biol. 293 (1999) 865-881). Для создания условий анализа многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи 5 мкг/мл захватывающего анти-Fab-антитела (Cappel Labs) в 50 мМ растворе карбоната натрия (рН 9,6), а затем блокируют 2% (вес/объем) раствором бычьего сывороточного альбумина в PBS в течение 2-5 часов при комнатной температуре (примерно 23°C). В неадсорбирующем планшете (Nunc №269620) смешивают 100 пМ или 26 пМ [125I]-антиген с серийными разведениями Fab, представляющего интерес (например, сообразно оценке анти-VEGF-антитела, Fab-12, в Presta, L.G., et al., Cancer Res. 57 (1997) 4593-4599). Затем Fab, представляющий интерес, инкубируют в течение ночи; тем не менее, инкубацию можно продолжать в течение более долгого периода (например, примерно 65 часов) для гарантии того, что равновесие достигнуто. После этого смеси переносят в планшет для захвата и инкубируют при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и планшет промывают восемь раз 0,1% раствором полисорбата 20 (TWEEN-20®) в PBS. После высушивания планшетов добавляют 150 мкл/лунка сцинтиллянта (MICROSCINT-20™; Packard) и регистрируют сигнал на гамма-счетчике TOPCOUNT™ (Packard) в течение десяти минут. Выбирают концентрации каждого Fab, которые дают 20% или меньше от максимального связывания, для использования в анализах на конкурентное связывание.
Альтернативно, Kd можно измерить с помощью анализов поверхностного плазмонного резонанса с использованием BIACORE®-2000 или BIACORE®-3000 или BIACORE® Т-100 (BIAcore, Inc., Пискатавэй, Нью-Джерси). Например, антиген иммобилизируют на чипе СМ5 примерно на уровне 10 единиц ответа (RU) и определяют значение Kd при 25°C. Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (СМ5, BIACORE, Inc.) активируют N-этил-N’-(3-диметиламинопропил)карбодиимида гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разводят в 10 мМ растворе ацетата натрия, рН 4,8, до концентрации 5 мкг/мл (примерно 0,2 мкМ) и вводят со скоростью потока 5 мкл/мин до достижения примерно 10 единиц ответа (RU) связанного белка. После введения антигена вводят 1 М этаноламин для блокировки непрореагировавших групп. Для измерений кинетики двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) вводят в PBS с 0,05% поверхностно-активного вещества полисорбата 20 (TWEEN-20™) (PBST) при 25°C со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают с помощью простой модели связывания Ленгмюра 1:1 (программное обеспечение BIACORE® Evaluation Software версии 3.2), одновременно подгоняя сенсограммы ассоциации и диссоциации. Константа равновесия диссоциации (Kd) рассчитывается как отношение kon/koff. См., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881. Если on-скорость превышает 106 M-1 с-1 в анализе поверхностного плазмонного резонанса, описанном выше, то on-скорость может быть определена с помощью методики тушения флуоресценции, которая измеряет увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение составляет 295 нм; излучение составляет 340 нм; 16 нм полосовой фильтр) при 25°C с 20 нМ антителом против антигена (Fab-форма) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, измеряемых спектрометром, таким как спектрофотометр, оборудованный системой быстрого смешивания с последующей остановкой (stop-flow) (Aviv Instruments) или спектрофотометр SLM-AMINCO™ серии 8000 (ThermoSpectronic) со встряхивающейся кюветой.
2. Фрагменты антител
В некоторых воплощениях антитело, описанное в данном документе, представляет собой фрагмент антитела. Фрагменты антитела включают, но не ограничиваясь ими, Fab-, Fab’-, Fab’-SH-, F(ab’)2-, Fv- и scFv-фрагменты, а также другие фрагменты, описанные ниже. Обзор определенных фрагментов см. в Hudson P.J., et al., Nat. Med. 9 (2003) 129-134. Обзор scFv-фрагментов см., например, в Pleuckthun, A., In: The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore (eds.), Springer-Verlag, New York (1994), pp. 269-315; см. также WO 93/16185; и US 5571894 и US 5587458. Обсуждения Fab- и F(ab’)2-фрагментов, содержащих остатки эпитопов, связывающих рецепторы реутилизации, и имеющих повышенный период полужизни in vivo, см. в US 5869046.
Димерные антитела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифическими. См., например, ЕР 0404097, WO 93/01161, Hudson, P.J., et al., Nat. Med. 9 (2003) 129-134, и Holliger, P., et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448. Тримерные и тетрамерные антитела также описаны в Hudson, P.J., et al., Nat. Med. 9(2003) 129-134.
Однодоменные антитела представляют собой фрагменты антител, содержащие весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В некоторых воплощениях однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Уолтем, Массачусетс; US 6248516).
Фрагменты антител могут быть получены различными способами, включая, но не ограничиваясь ими, протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, Е. coli или фаг), как описано в данном документе.
3. Химерные и гуманизированные антитела
В некоторых воплощениях антитело, предложенное в данном документе, является химерным антителом. Некоторые химерные антитела описаны, например, в US 4816567; и в Morrison, S.L et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855. В одном примере химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область, полученную от мыши, крысы, хомяка, кролика или примата, например, обезьяны) и человеческую константную область. В другом примере химерное антитело представляет собой антитело "с переключением класса", в котором класс или подкласс был изменен по сравнению с родительским антителом. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых воплощениях химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют, чтобы уменьшить иммуногенность для людей, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. Как правило, гуманизированное антитело содержит один или более чем один вариабельный домен, в котором HVR, например, CDR (или их части) получены из последовательностей нечеловеческого антитела, a FR (или их части) получены из последовательностей человеческого антитела. Гуманизированное антитело, возможно, также будет содержать по меньшей мере часть человеческой константной области. В некоторых воплощениях некоторые FR-остатки в гуманизированном антителе замещены соответствующими остатками из нечеловеческого антитела (например, антитела, из которого получены HVR-остатки), например, для восстановления или повышения специфичности или аффинности антитела.
Гуманизированные антитела и способы их получения приведены, например, в Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633, а также описаны, например, в Riechmann, I., et al., Nature 332 (1988) 323-329; Queen, C, et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033; US 5821337, US 7527791, US 6982321 и US 7087409; Kashmiri, S.V., et al., Methods 36 (2005) 25-34 (описывает прививание SDR (a-CDR)); Padlan, E.A., Mol. Immunol. 28 (1991) 489-498 (описывает "перекладку"); Dall’Acqua, W.F. et al., Methods 36 (2005) 43-60 (описывает "перетасовку FR"); и Osbourn, J. et al., Methods 36 (2005) 61-68, и Klimka, A. et al., Br. J. Cancer 83 (2000) 252-260 (описывают подход "направляемой селекции" к перетасовке FR).
Человеческие каркасные области, которые могут быть использованы для гуманизации, включают, но не ограничиваясь ими: каркасные области, выбранные с помощью методики "наилучшего соответствия" (см., например, Sims, M.J., et al., J. Immunol. 151 (1993) 2296-2308); каркасные области, полученные из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных областей легкой или тяжелой цепей (см., например, Carter, P., et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289; и Presta, L.G., et al., J. Immunol. 151 (1993) 2623-2632); человеческие зрелые (соматически мутантные) каркасные области или человеческие зародышевые каркасные области (см., например, Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633); и каркасные области, полученные при скрининге FR-библиотек (см., например, Baca, М. et al., J. Biol. Chem. 272 (1997) 10678-10684, и Rosok, M.J. et al., J. Biol. Chem. 271 (19969 22611-22618).
4. Мультиспецифические антитела
В некоторых воплощениях антитело, предложенное в данном документе, является мультиспецифическим антителом, например, биспецифическим антителом. Мультиспецифические антитела представляют собой моноклональные антитела, которые обладают специфичностью связывания по меньшей мере с двумя различными сайтами. В некоторых воплощениях одна из специфичностей связывания является специфичностью в отношении BRDU, а другая в отношении любого другого антигена. В некоторых воплощениях биспецифические антитела также могут быть использованы для локализации цитотоксических агентов на клетках, которые экспрессируют BRDU. Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител.
Методики изготовления мультиспецифических антител включают, но не ограничиваясь ими, рекомбинантную коэкспрессию двух пар тяжелых цепей и легких цепей иммуноглобулина, имеющих различные специфичности (см. Milstein, С.and Cuello, А.С., Nature 305 (1983) 537-540, WO 93/08829, и Traunecker, A. et al., EMBO J. 10 (1991) 3655-3659), и инженерию типа "ключ в замке" (см., например, US 5731168). Мультиспецифические антитела также могут быть получены за счет использования инженерных электростатических перемешивающих влияний для создания Fc-гетеродимерных молекул антитела (WO 2009/089004); поперечного сшивания двух или более антител или фрагментов (см., например, US 4676980 и Brennan, М. et al., Science 229 (1985) 81-83); использования лейциновых застежек для получения биспецифических антител (см., например, Kostelny, S.A. et al., J. Immunol. 148 (1992) 1547-1553); использования методики "димерного антитела" для получения биспецифических фрагментов антител (см., например, Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448); и использования одноцепочечных Fv-димеров (sFv) (см., например, Gruber, М et al., J. Immunol. 152 (1994) 5368-5374); и получения триспецифических антител, как описано, например, в Tutt, A. et al., J. Immunol. 147 (1991)60-69).
Инженерные антитела с тремя или более функциональными антигенсвязывающими сайтами, в том числе "антитела-осьминоги", также включены в данный документ (см., например, US 2006/0025576).
Антитело или фрагмент в данном документе также включает "Fab двойного действия" или "DAF" (от англ. dual acting Fab), включающий антигенсвязывающий сайт, который связывается с BRDU, а также с другим, отличающимся, антигеном (см., например, US 2008/0069820).
Антитело или фрагмент в данном документе также включают мультиспецифические антитела, описанные в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
В одном из воплощений, описанных в данном документе, мультиспецифическое антитело, описанное в данном документе, является биспецифическим двухвалентным антителом.
В одном из воплощений биспецифическое двухвалентное антитело, описанное в данном документе, характеризуется тем, что содержит
а) тяжелую цепь и легкую цепь первого полноразмерного антитела, которое специфически связывается с первым антигеном, и
b) модифицированную тяжелую цепь и модифицированную легкую цепь второго полноразмерного антитела, которое специфически связывается со вторым антигеном, в котором константные домены CL и СН1 поменяны местами.
Эти антитела, основанные на этом биспецифическом двухвалентном формате антител, называются CrossMab.
В одном из воплощений биспецифическое двухвалентное антитело, характеризуется тем, что содержит
a) тяжелую цепь и легкую цепь первого полноразмерного антитела, которое специфически связывается с первым антигеном, и
b) тяжелую цепь и легкую цепь второго полноразмерного антитела, которое специфически связывается со вторым антигеном, где N-конец тяжелой цепи соединен с С-концом легкой цепи через пептидный линкер.
Эти антитела, основанные на этом биспецифическом двухвалентном формате антител, называются одноцепочечными Fab-фрагментами с одной ветвью (OAscFabs).
5. Варианты антител
В некоторых воплощениях рассматриваются варианты аминокислотных последовательностей антител, предложенных в данном документе. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела могут быть получены путем введения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или вставки и/или замены остатков в аминокислотных последовательностях антитела. Можно использовать любую комбинацию делеций, вставок и замен, чтобы получить конечную конструкцию, при условии, что конечная конструкция обладает желаемыми характеристиками, например, связыванием антигена.
а) Варианты с заменой, вставкой и делецией
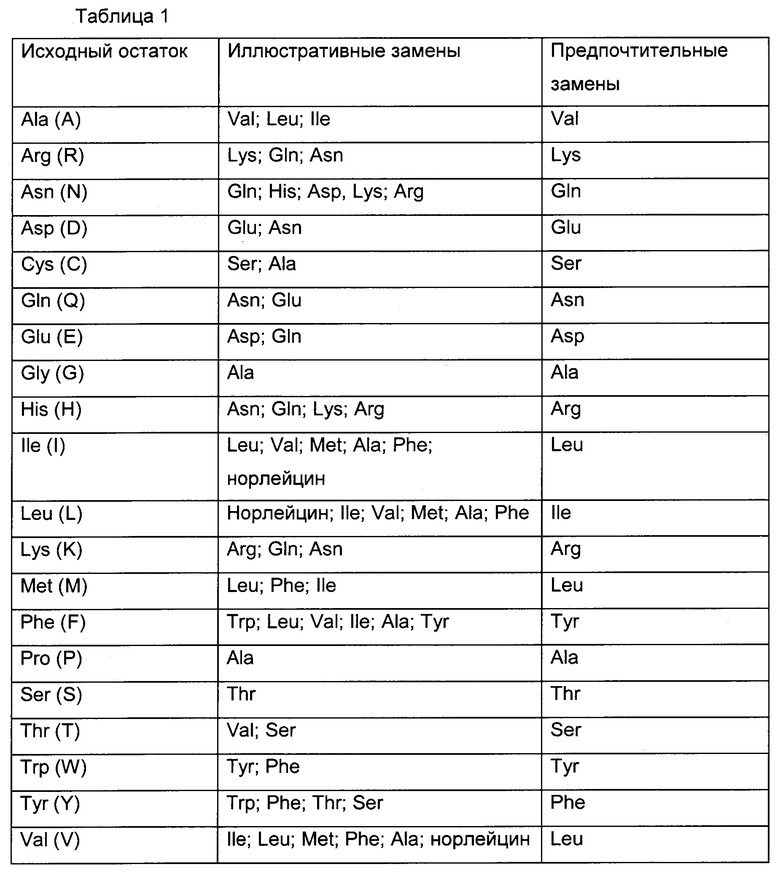
В некоторых воплощениях предложены варианты антител, имеющие одну или более чем одну аминокислотную замену. Сайты для мутагенеза путем замен, представляющие интерес, включают HVR и FR. Консервативные замены приведены в таблице 1 под заголовком "предпочтительные замены". Более существенные изменения приведены в таблице 1 под заголовком "иллюстративные замены" и дополнительно описаны ниже со ссылкой на классы аминокислот по боковой цепи. Аминокислотные замены могут быть введены в антитело, представляющее интерес, и продукты могут быть проверены на нужную активность, например, сохранившееся/улучшенное связывание антигена, сниженную иммуногенность или улучшенную ADCC или CDC.
Аминокислоты могут быть сгруппированы в соответствии с общими свойствами боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены влекут за собой замену члена одного из этих классов на член другого класса.
Один тип варианта с заменой предполагает замену одного или более чем одного остатка гипервариабельной области родительского антитела (например, гуманизированного или человеческого антитела). Как правило, полученный вариант(ы), выбранный для дальнейшего изучения, будет иметь модификации (например, улучшения) определенных биологических свойств (например, повышенную аффинность, сниженную иммуногенность) относительно родительского антитела и/или будет иметь практически сохранившиеся определенные биологические свойства родительского антитела. Иллюстративным вариантом с заменой является антитело со зрелой аффинностью, которое можно легко получить, например, с помощью методик созревания аффинности на основе фагового дисплея, таких как описанные в данном документе. Вкратце, один или более чем один остаток HVR подвергается мутированию, и вариантные антитела выставляются на фаге и проверяются на конкретную биологическую активность (например, аффинность связывания).
Изменения (например, замены) могут быть сделаны в HVR, например, для улучшения аффинности антитела. Такие изменения могут быть сделаны в "горячих точках" HVR, т.е. остатках, кодируемых кодонами, которые подвергаются мутации с высокой частотой в ходе процесса соматического созревания (см., например, Chowdhury, P.S., Methods Mol. Biol. 207 (2008) 179-196), и/или в SDR (a-CDR), при этом образующиеся вариантные VH или VL исследуются на аффинность связывания. Созревание аффинности путем конструирования и повторного выбора из вторичных библиотек было описано, например, в Hoogenboom, H.R. et al. in Methods in Molecular Biology 178 (2002) 1-37. В некоторых воплощениях созревания аффинности разнообразие вводится в вариабельные гены, выбранные для созревания, с помощью любой из разнообразных методик (например, ПЦР с внесением ошибок, перестановка цепей или олигонуклеотид-направленный мутагенез). Затем создается вторичная библиотека. Затем эту библиотеку скринируют для выявления любых вариантов антител с нужной аффинностью. Другой способ внесения разнообразия включает HVR-направленные подходы, в которых рандомизируют несколько остатков HVR (например, 4-6 остатков за один раз). HVR-остатки, участвующие в связывании антигена, могут быть специфически выявлены, например, с помощью сканирующего аланином мутагенеза или моделирования. CDR-H3 и CDR-L3, в частности, часто становятся мишенями.
В некоторых воплощениях в одном или более чем одном HVR могут возникать замены, вставки или делеции до тех пор, пока такие изменения не вызывают существенного снижения способности антитела связывать антиген. Например, в HVR могут быть сделаны консервативные изменения (например, консервативные замены, предложенные в данном документе), которые существенно не снижают аффинность связывания. Такие изменения могут находиться вне "горячих точек" в HVR или SDR. В некоторых воплощениях вариантных VH- и VL-последовательностей, предложенных выше, каждый HVR либо не меняется, либо содержит не более чем одну, две или три аминокислотные замены.
Способ, который может быть использован для выявления остатков или областей антитела, которые могут стать мишенями мутагенеза, называется "сканирующим аланином мутагенезом", который описан в Cunningham, B.C. and Wells, J.A., Science 244 (1989) 1081-1085. В этом способе остаток или группу остатков-мишеней (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) выявляют и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином), чтобы определить, влияют ли они на взаимодействие антитела с антигеном. Другие замены могут быть введены в аминокислотных позициях, демонстрирующих функциональную чувствительность к первоначальным заменам. Альтернативно или дополнительно может быть использована кристаллическая структура комплекса "антиген - антитело" для выявления точек контакта между антителом и антигеном. Такие контактные остатки и соседние остатки могут стать мишенями или могут быть устранены в качестве кандидатов на замену. Варианты можно подвергнуть скринингу, чтобы определить, содержат ли они нужные свойства.
Вставки в аминокислотную последовательность включают амино- и/или карбокси-концевые слияния длиной от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки одного или множества аминокислотных остатков внутрь последовательности. Примеры концевых вставок включают антитела с N-концевым остатком метионина. Другие варианты молекул антитела со вставками включают слияние N- или С-конца антитела с ферментом (например, ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Одним из предпочтительных вариантов является вариант с одним цистеином, в котором аминокислотный остаток в позиции 53 согласно Kabat в вариабельном домене тяжелой цепи представляет собой цистеин.
b) Варианты гликозилирования
В некоторых воплощениях антитело, предложенное в данном документе, изменено для увеличения или уменьшения степени, в которой антитело гликозилировано. Добавление к антителу или удаление сайтов гликозилирования может быть удобно проведено путем изменения аминокислотной последовательности, так что создается или удаляется один или более чем один сайт гликозилирования.
Если антитело содержит Fc-область, то углевод, прикрепленный к ней, может быть изменен. Нативные антитела, продуцируемые клетками млекопитающих, обычно содержат разветвленный двухантенный олигосахарид, который, как правило, прикреплен с помощью N-связи к Asn297 СН2-домена Fc-области. См., например, Wright, A. and Morrison, S.L., TIBTECH 15 (1997) 26-32. Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, прикрепленную к GlcNAc в "стволе" двухантенной олигосахаридной структуры. В некоторых воплощениях модификации олигосахаридов в антителе изобретения могут быть сделаны для того, чтобы получить варианты антитела с определенными улучшенными свойствами.
В одном воплощении предложены варианты антитела, имеющее углеводную структуру, в которой отсутствует фукоза, прикрепленная (прямо или косвенно) к Fc-области. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяется путем вычисления среднего количества фукозы в сахарной цепи на Asn297 по отношению к сумме всех гликоструктур, прикрепленных к Asn 297 (например, сложных, гибридных и высокоманнозных структур), измеренного путем MALDI-TOF-масс-спектрометрии, как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному примерно в позиции 297 в Fc-области (EU-нумерация остатков Fc-области); тем не менее, Asn297 также может быть расположен в позиции примерно ±3 аминокислоты до или после позиции 297, т.е. между позициями 294 и 300, в связи с минорными изменениями последовательности в антителах. Такие варианты фукозилирования могут иметь улучшенные ADCC-функции. См., например, US 2003/0157108; US 2004/0093621. Примеры публикаций, связанных с "дефукозилированными" или "фукозодефицитными" вариантами антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2005/031140; Okazaki, A. et al., J. Mol. Biol. 336 (2004) 1239-1249; Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622. Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают СНО-клетки Lec13, дефицитные по фукозилированию белка (Ripka, J. et al., Arch. Biochem. Biophys. 249 (1986) 533-545; US 2003/0157108; и WO 2004/056312, особенно пример 11), и нокаутные клеточные линии, такие как СНО-клетки с нокаутом гена альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622; Kanda, Y. et al., Biotechnol. Bioeng. 94 (2006) 680-688; и WO 2003/085107).
Также предложены варианты антител с олигосахаридами с симметричным разветвлением, например, в которых двухантенный олигосахарид, присоединенный к Fc-области антитела, разделен пополам посредством GlcNAc. Такие варианты антител могут обладать уменьшенным фукозилированием и/или улучшенной ADCC-функцией. Примеры таких вариантов антител описаны, например, в WO 2003/011878; US 6602684 и US 2005/0123546. Также предусмотрены варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, прикрепленном к Fc-области. Такие варианты антител могут обладать улучшенной CDC-функцией. Такие варианты антител описаны, например, в WO 1997/30087, WO 1998/58964 и WO 1999/22764.
с) варианты Fc-области
В некоторых воплощениях в Fc-область антитела, предложенного в данном документе, может быть введена одна или более чем одна аминокислотная модификация, образующая тем самым вариант Fc-области. Вариант Fc-области может содержать последовательность человеческой Fc-области (например, Fc-области человеческого IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) в одной или более чем одной аминокислотной позиции.
В некоторых воплощениях данное изобретение предусматривает вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, которые делают его желательным кандидатом для применений, в которых время полужизни антитела in vivo является важным, а еще некоторые эффекторные функции (такие как комплемент и ADCC) являются не необходимыми или вредными. Можно провести анализ цитотоксичности in vitro и/или in vivo, чтобы подтвердить уменьшение/истощение CDC- и/или ADCC-активности. Например, можно провести анализы Fc-рецепторного (FcR) связывания для того, чтобы убедиться, что антитело не связывается с FcγR (и, следовательно, скорее всего не обладает ADCC-активностью), но сохраняет FcRn-связывающую способность. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 в Ravetch, J.V. and Kinet, J.P., Annu. Rev. Immunol. 9 (1991) 457-492. Неограничивающие примеры анализов in vitro для оценки ADCC-активности молекулы, представляющей интерес, описаны в US 5500362 (см., например, Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 83 (1986) 7059-7063; и Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 82 (1985) 1499-1502); US 5821337 (см. Bruggemann, M. et al., J. Exp. Med. 166 (1987) 1351-1361). Альтернативно, могут быть использованы нерадиоактивные способы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ для проточной цитометрии (CellTechnology Inc., Маунтин-Вью, Калифорния; и нерадиоактивный анализ цитотоксичности CytoTox96® (Promega, Мэдисон, Висконсин). Используемые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и натуральные киллеры (NK-клетки). Альтернативно или дополнительно ADCC-активность молекулы, представляющей интерес, может быть оценена in vivo, например, на животной модели, такой как описана в Clynes, R. et al., Proc. Natl. Acad. Sci. USA 95 (1998) 652-656. Также можно выполнить анализы Clq-связывания, чтобы подтвердить, что антитело не может связываться с C1q и, следовательно, не обладает CDC-активностью. См., например, C1q- и С3с-связывающий анализ ELISA в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента может быть выполнен анализ CDC (см., например, Gazzano-Santoro, Н. et al., J. Immunol. Methods 202 (1996) 163-171; Cragg, M.S. et al., Blood 101 (2003) 1045-1052; и Cragg, M.S. and M.J. Glennie, Blood 103 (2004) 2738-2743). Определение FcRn-связывания и периода выведения/полужизни in vivo также можно проводить с использованием способов, известных в данной области (см., например, Petkova, S.B. et al., Int. Immunol. 18 (2006) 1759-1769).
Антитела со сниженной эффекторной функцией включают таковые с заменой одного или более чем одного из остатков Fc-области 238, 265, 269, 270, 297, 327 и 329 (US 6737056). Такие Fc-мутанты включают Fc-мутанты с заменами в двух или более чем двух из аминокислотных позиций 265, 269, 270, 297 и 327, включая так называемый "DANA”-мутант Fc-области с заменами остатков 265 и 297 на аланин (US 7332581).
Описаны некоторые варианты антител с улучшенным или уменьшенным связыванием с FcR (см., например, US 6737056; WO 2004/056312, и Shields, R.L. et al., J. Biol. Chem. 276 (2001) 6591-6604).
В некоторых воплощениях вариант антитела содержит Fc-область с одной или более чем одной аминокислотной заменой, которая улучшает ADCC, например, с заменами в позициях 298, 333 и/или 334 в Fc-области (EU-нумерация остатков).
В некоторых воплощениях в Fc-области сделаны изменения, которые приводят к измененному (т.е. повышенному или пониженному) Clq-связыванию и/или комплемент-зависимой цитотоксичности (CDC), например, как описано в US 6194551, WO 99/51642 и Idusogie, Е.Е. et al., J. Immunol. 164 (2000) 4178-4184.
Антитела с удлиненным периодом полужизни и повышенным связыванием с неонатальным Fc-рецептором (FcRn), который отвечает за перенос материнских IgG к плоду (Guyer, R.L. et al., J. Immunol. 117 (1976) 587-593, и Kim, J.K. et al., J. Immunol. 24 (1994) 2429-2434), описаны в US 2005/0014934. Эти антитела содержат Fc-область с одной или более чем одной заменой в ней, что улучшает связывание Fc-области с FcRn. Такие варианты Fc-области включают варианты с заменами в одном или более чем одном из остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, с заменой в Fc-области остатка 434 (US 7371826).
См. также Duncan, A.R. and Winter, G., Nature 322 (1988) 738-740; US 5648260; US 5624821 и WO 94/29351, касающиеся других примеров вариантов Fc-области.
d) Цистеин-инженерные варианты антител
В некоторых воплощениях может быть желательным создание цистеин-инженерных антител, например, "тиоМКА" ("thioMAb"), в которых один или более чем один остаток антитела замещен на остаток цистеина. В конкретных воплощениях замещенные остатки находятся в доступных сайтах антитела. При замещении этих остатков цистеином реактивные тиольные группы, таким образом, располагаются в доступных участках антитела и могут быть использованы для конъюгирования антитела с другими группировками, такими как лекарственные группировки или линкер-лекарственные группировки, для образования иммуноконъюгата, описанного далее. В некоторых воплощениях один или более чем один из следующих остатков может быть замещен цистеином: V205 (нумерация Kabat) легкой цепи; А118 (EU-нумерация) тяжелой цепи; и S400 (EU-нумерация) Fc-области тяжелой цепи. Цистеин-инженерные антитела могут быть получены, как описано, например, в US 7521541.
е) Производные антител
В некоторых воплощениях антитело, предложенное в данном документе, может быть дополнительно модифицировано так, чтобы содержать дополнительные небелковые группировки, которые известны в данной области и легко доступны. Группировки, пригодные для получения производных антител, включают, но не ограничиваясь ими, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, но не ограничиваясь ими, полиэтиленгликоль (PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимеры этилена/малеинового ангидрида, полиаминокислоты (гомополимеры или рандомные сополимеры), и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропропиленгликоля, сополимеры оксида полипропиленгликоля/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликоля пропиональдегид может давать преимущества в производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать, и если присоединено больше одного полимера, то они могут быть одинаковыми или различными молекулами. Как правило, число и/или тип полимеров, используемых для получения производных, можно определить на основании соображений, включая, но не ограничиваясь ими, конкретные свойства или функции антитела, которые будут улучшены, будет ли использоваться производное антитела в терапии в определенных условиях и т.д.
В другом воплощении предложены конъюгаты антитела и небелковой группировки, которая может селективно нагреваться при воздействии излучения. В одном воплощении небелковая группировка представляет собой углеродную нанотрубку (Kam, N.W. et al., Proc. Natl. Acad. Sci. USA 102 (2005) 11600-11605). Излучение может иметь любую длину волны, включая, но не ограничиваясь ими, такие длины волн, которые не повреждают обычные клетки, но нагревают небелковую группировку до температуры, при которой клетки, ближайшие к небелковой группировке антитела, погибают.
f) Гетеродимеризация
Для создания мультиспецифических антител может быть необходимым усиление формирования гетеродимерного спаривания тяжелых цепей. Существует несколько подходов к СН3-модификации, обеспечивающих гетеродимеризацию, которые хорошо описаны, например, в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012058768, WO 2013157954, WO 2013096291. Как правило, во всех таких подходах СН3-домен первой тяжелой цепи и СН3-домены второй тяжелой цепи разработаны на основе комплементарности, так что каждый СН3-домен (или тяжелая цепь, содержащая его) не может больше гомодимеризоваться сам с собой, но вынужден гетеродимеризоваться с комплементарно разработанным другим СН3-доменом (так что первый и второй СН3-домен (и с ними первая и вторая тяжелые цепи) гетеродимеризуются, и между двумя первыми или двумя вторыми СН3-доменами гомодимеры не формируются).
Эти различные подходы к улучшению гетеродимеризации тяжелой цепи рассматриваются как различные альтернативы в сочетании с модификациями тяжелой и/или легкой цепи (обмен/замена VH и VL в одной связывающей ветви и введение замен заряженных аминокислот с противоположными зарядами в контактную поверхность CH1/CL) в мультиспецифических антителах согласно изобретению, которые снижают число побочных продуктов типа Бенс-Джонса с ошибочным спариванием легкой цепи.
В одном предпочтительном воплощении данного изобретения (в случае, когда мультиспецифическое антитело содержит СН3-домены в тяжелых цепях) СН3-домены указанного мультиспецифического антитела согласно изобретению могут быть изменены с помощью технологии "ключ в замке", которая подробно описана на нескольких примерах, например в WO 96/027011, Ridgway J.В., et al., Protein Eng. 9 (1996) 617-621, и Merchant, A.M., et al., Nat. Biotechnol. 16 (1998) 677-681; WO 98/050431. В этом подходе поверхности взаимодействия двух СН3-доменов изменены так, чтобы увеличить гетеродимеризацию обеих тяжелых цепей, содержащих эти два СН3-домена. Каждый из двух СН3-доменов (двух тяжелых цепей) может быть "ключом", в то время как другой является "замком". Введение дисульфидного мостика также стабилизирует гетеродимеры (Merchant, А.М, et al., Nature Biotech. 16 (1998) 677-681, Atwell, S., et al. J. Mol. Biol. 270 (1997) 26-35) и повышает выход гетеродимера.
Так, в одном воплощении указанное мультиспецифическое антитело (содержит СН3-домен в каждой тяжелой цепи и) характеризуется тем, что
первый СН3-домен первой тяжелой цепи мультиспецифического антитела в и второй СН3-домен второй тяжелой цепи мультиспецифического антитела встречаются на контактной поверхности, которая содержит исходную контактную поверхность между СН3-доменами антитела;
где указанная контактная поверхность изменена таким образом, чтобы способствовать формированию мультиспецифического антитела, где изменение характеризуется тем, что
i) СН3-домен одной тяжелой цепи изменен так,
что в исходной контактной поверхности СН3-домена одной тяжелой цепи, которая встречается с исходной контактной поверхностью СН3-домена другой тяжелой цепи в мультиспецифическом антителе,
аминокислотный остаток заменен аминокислотным остатком, имеющим больший объем боковой цепи, тем самым формируя выступ в контактной поверхности СН3-домена одной тяжелой цепи, который может быть расположен в полости на контактной поверхности СН3-домена другой тяжелой цепи
и
ii) СН3-домен другой тяжелой цепи изменен так,
что в исходной контактной поверхности второго СН3-домена, которая встречается с исходной контактной поверхностью первого СН3-домена в мультиспецифическом антителе,
аминокислотный остаток заменен на аминокислотный остаток, имеющий меньший объем боковой цепи, тем самым формируя полость в контактной поверхности второго СН3-домена, в которой может быть расположен выступ на контактной поверхности первого СН3-домена.
Предпочтительно, указанный аминокислотный остаток, имеющий боковую цепь большего объема, выбран из группы, состоящей из аргинина (R), фенилаланина (F), тирозина (Y), триптофана (W).
Предпочтительно указанный аминокислотный остаток, имеющий боковую цепь меньшего объема, выбран из группы, состоящей из аланина (А), серина (S), треонина (Т), валина (V).
В одном из воплощений оба СН3-домена также изменены путем введения цистеина (С) в качестве аминокислоты в соответствующих позициях каждого СН3-домена, так что между двумя СН3-доменами может быть сформирован дисульфидный мостик.
В одном предпочтительном воплощении указанное мультиспецифическое антитело содержит аминокислотную мутацию T366W в первом СН3-домене "цепи-ключа" и аминокислотные мутации T366S, L368A, Y407V во втором СН3-домене "цепи-замка". Также может быть использован дополнительный межцепочечный дисульфидный мостик между СН3-доменами (Merchant, А.М, et al., Nature Biotech 16 (1998) 677-681), например, путем введения аминокислотной мутации Y349C в СН3-домен "цепи-ключа" и аминокислотной мутации Е356С или аминокислотной мутации S354C в СН3-домен "цепи-замка".
В одном предпочтительном воплощении указанное мультиспецифическое антитело (которое содержит СН3-домен в каждой тяжелой цепи) содержит аминокислотные мутации S354C, T366W в одном из двух СН3-доменов и аминокислотные мутации Y439C, T366S, L368A, Y407V в другом из двух СН3-доменов (дополнительная аминокислотная мутация S354C в одном СН3-домене и дополнительная аминокислотная мутация Y349C в другом СН3-домене для формирования межцепочечного дисульфидного мостика) (нумерация согласно Kabat).
Другие методики СН3-модификаций, обеспечивающие гетеродимеризацию, предусмотрены в качестве альтернатив и описаны, например, в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012058768, WO 2013157954, WO 2013096291.
В одном из воплощений может быть использован подход к гетеродимеризации, описанный в ЕР 1870459 А1. Этот подход основан на введении замен/мутаций заряженных аминокислот с противоположным зарядом в определенных аминокислотных позициях на контактной поверхности CH3/СН3-доменов между обеими тяжелыми цепями. В одном из предпочтительных воплощений указанное мультиспецифическое антитело содержит аминокислотные мутации R409D; К370Е в СН3-домене первой тяжелой цепи (мультиспецифического антитела) и аминокислотные мутации D399K; Е357К в СН3-домене второй тяжелой цепи мультиспецифического антитела (нумерация согласно Kabat).
В другом воплощении указанное мультиспецифическое антитело содержит аминокислотную мутацию T366W в СН3-домене "цепи-ключа" и аминокислотные мутации T366S, L368A, Y407V в СН3-домене "цепи-замка" и дополнительные аминокислотные мутации R409D; К370Е в СН3-домене "цепи-ключа" и аминокислотные мутации D399K; Е357К в СН3-домене "цепи-замка".
В другом воплощении указанное мультиспецифическое антитело содержит аминокислотные мутации S354C, T366W в одном из двух СН3-доменов и аминокислотные мутации Y349C, T366S, L368A, Y407V в другом из двух СН3-доменов, или указанное мультиспецифическое антитело содержит аминокислотные мутации Y349C, T366W в одном из двух СН3-доменов и аминокислотные мутации S354C, T366S, L368A, Y407V в другом из двух СН3-доменов и дополнительные аминокислотные мутации R409D; К370Е в СН3-домене "цепи-ключа" и аминокислотные мутации D399K; Е357К в СН3-домене "цепи-замка".
В одном из воплощений может быть использован подход к гетеродимеризации, описанный в WO 2013/157953. В одном воплощении первый СН3-домен содержит аминокислотную мутацию Т366К, а второй полипептид СН3-домена содержит аминокислотную мутацию L351D. В другом воплощении первый СН3-домен также содержит аминокислотную мутацию L351K. В другом воплощении второй СН3-домен также содержит аминокислотную мутацию, выбранную среди Y349E, Y349D и L368E (предпочтительно L368E).
В одном из воплощений может быть использован подход к гетеродимеризации, описанный в WO2012/058768. В одном воплощении первый СН3-домен содержит аминокислотные мутации L351Y, Y407A, а второй СН3-домен содержит аминокислотные мутации Т366А, K409F. В другом воплощении второй СН3-домен содержит дополнительную аминокислотную мутацию в позиции Т411, D399, S400, F405, N390 или К392, например, выбранную среди a) T411N, T411R, T411Q, Т411К, T411D, Т411Е или T411W, b) D399R, D399W, D399Y или D399K, с) S400E, S400D, S400R или S400K, F405I, F405M, F405T, F405S, F405V или F405W, N390R, N390K или N390D, K392V, К392М, K392R, K392L, K392F или К392Е. В другом воплощении первый СН3-домен содержит аминокислотные мутации L351Y, Y407A, а второй СН3-домен содержит аминокислотные мутации T366V, K409F. В другом воплощении первый СН3-домен содержит аминокислотную мутацию Y407A, а второй СН3-домен содержит аминокислотные мутации Т366А, K409F. В другом воплощении второй СН3-домен также содержит аминокислотные мутации К392Е, Т411Е, D399RH S400R.
В одном из воплощений может быть использован подход к гетеродимеризации, описанный в WO 2011/143545, например, с модификацией аминокислоты в позиции, выбранной из группы, состоящей из 368 и 409.
В одном из воплощений может быть использован подход к гетеродимеризации, описанный в WO 2011/090762, который также использует технологию типа "ключ в замке". В одном воплощении первый СН3-домен содержит аминокислотную мутацию T366W, а второй СН3-домен содержит аминокислотную мутацию Y407A. В одном воплощении первый СН3-домен содержит аминокислотную мутацию T366Y, а второй СН3-домен содержит аминокислотную мутацию Y407T.
В одном из воплощений мультиспецифическое антитело относится к изотипу IgG2, и может быть использован подход к гетеродимеризации, описанный в WO 2010/129304.
В одном из воплощений может быть использован подход к гетеродимеризации, описанный в WO 2009/089004. В одном воплощении первый СН3-домен содержит замену аминокислотного остатка К392 или N392 отрицательно заряженной аминокислотой (например, глутаминовой кислотой (Е) или аспарагиновой кислотой (D), предпочтительно K392D или N392D), а второй СН3-домен содержит замену аминокислотного остатка D399, Е356, D356 или Е357 положительно заряженной аминокислотой (например, лизином (К) или аргинином (R)), предпочтительно D399K, Е356К, D356K или Е357К, и более предпочтительно D399K и Е356К. В другом воплощении первый СН3-домен также содержит замену аминокислотного остатка К409 или R409 отрицательно заряженной аминокислотой (например, глутаминовой кислотой (Е) или аспарагиновой кислотой (D), предпочтительно K409D или R409D). В другом воплощении первый СН3-домен дополнительно или альтернативно содержит замену аминокислотного остатка К439 и/или К370 отрицательно заряженной аминокислотой (например, глутаминовой кислотой (Е) или аспарагиновой кислотой (D)).
В одном из воплощений может быть использован подход к гетеродимеризации, описанный в WO 2007/147901. В одном воплощении первый СН3-домен содержит аминокислотные мутации К253Е, D282K и K322D, а второй СН3-домен содержит аминокислотные мутации D239K, Е240К и K292D.
В одном из воплощений может быть использован подход к гетеродимеризации, описанный в WO2007/110205.
В. Комплексы анти-BRDU-антитела и нуклеиновой кислоты
миРНК и гаптен-содержащие производные миРНК
Общие принципы проектирования и конструирования миРНК известны специалистам в данной области и не будут подробно рассматриваться в данном документе.
Важной особенностью модульного нацеленного подхода является связывание миРНК с гаптенами или гаптен-содержащей группировкой без ущерба для функциональности миРНК или взаимодействия гаптена и гаптен-связывающего домена bsAb (bispecific antibody, биспецифического антитела).
Для прямого соединения гаптена с миРНК выбора был выбран 3'-конец смысловой цепи производных двухцепочечных миРНК. Ранее было установлено, что эта позиция в миРНК толерантна к добавленным частицам (например, холестерину (25)) и не влияет на активность миРНК. В соответствии с этим было отмечено, что активность 3'-гаптен-конъюгированных производных миРНК, т.е. их способность снижать уровни мРНК-мишени, является такой же, как у немодифицированной миРНК (13). В качестве дополнительной модификации к 5'-концу смысловой цепи можно присоединить флуоресцентные соединения, такие как Су5, чтобы обеспечить визуализацию и отслеживание миРНК (например, Dig-миРНК-Су5). Гаптен, связанный с 5'-концом смысловой цепи, в нашем опыте также дает миРНК с хорошей активностью, но не превосходящей связывание с 3'-концом.
Гаптен-содержащие наночастицы
Гаптен-связанная миРНК может находиться непосредственно в комплексе с bsAb. Эти комплексы способны доставлять миРНК специфически к клеткам, которые экспрессируют соответствующий антиген-мишень на своей поверхности. Тем не менее, специфическое накопление миРНК на и во внутриклеточных везикулах (при интернализации) само по себе в большинстве случаев не приводит к специфическому нокдауну гена. Причина этого заключается в том, что немодифицированная миРНК накапливается в эндосомальных компартментах, но не выходит в цитоплазму (13). Для того чтобы обеспечить доставку в цитозоль, миРНК можно упаковать в наночастицы (1, 2, 26, 27, 3, 28, 29, 30, 5, 31, 32, 9), которые несут гаптены на своей поверхности. Эти гаптены должны быть доступны для bsAb, когда они включены в структуру (большой) наночастицы. Были описаны различные виды наночастиц для эффективной доставки миРНК, многие из которых содержат ПЭГ. Таким образом, один из способов получения гаптен-содержащих наночастиц является применение гаптен-связанных производных ПЭГ в качестве компонентов для производства наночастиц. Включение этих реагентов в составы формирует наночастицы с встроенным гаптеном (например, миРНК в Dig-LNP). В некоторых случаях наночастицы с встроенным гаптеном также можно получить путем сборки в состав гаптен-связанных миРНК в стандартные наночастицы. Удивительно, но это приводит к формированию наночастиц, которые имеют молекулы гаптена, экспонированные на их поверхности, доступным для антител образом. Таким же образом в наночастицы с встроенным гаптеном могут быть включены меченные флуоресцентными метками миРНК без потери флуоресцентного сигнала. Это может быть использовано для визуализации и отслеживания гаптен-содержащих bsAb-нацеленных наночастиц.
Двумя признанными типами наночастиц являются динамические поликонъюгаты (dynamic polyconjugates, DPC) и наночастицы на основе липидов (lipid-based nanoparticles, LNP). DPC и LNP, содержащие гаптен-конъюгированные ПЭГ-липиды, были использованы для конструирования функциональных группировок миРНК для клеточного нацеливания (13). DPC включают матрицы-реагенты, такие как полибутил и аминовиниловый эфир (PBAVE), эндосомолитический полимер, который экранирован от неспецифических клеточных взаимодействий за счет обратимой ковалентной модификации с полиэтиленгликолем (ПЭГ, PEG). Как миРНК, так и гаптен могут быть присоединены к полимеру с помощью линкеров, которые либо являются стабильными (например, для связывания гаптена), либо обеспечивают рН-зависимое высвобождение полезной нагрузки (30, 32, 33).
DPC с встроенным гаптеном могут находиться в виде комплекса с bsAb в определенном молярном соотношении (например, 1:1 или 2:1), чтобы образовать bsAb-нацеленные DPC. Загрузка bsAb-антитела миРНК, содержащей DPC, приводит к увеличению молекулярной массы и гидродинамического радиуса, которые могут быть обнаружены с помощью SEC-MALLS. Например, DPC Dig-полимер-миРНК без bsAb являются полидисперсным раствором с молекулами с ориентировочной молекулярной массой 300-720 кДа и гидродинамическим радиусом 7-10 нм. Добавление bsAb с формированием комплексов DPC гаптен-полимер-миРНК - BsAb увеличивает диапазон молекулярной массы до 500-1100 кДа и гидродинамический радиус до 9-12,5 нм (13).
LNP содержат полиэтиленгликоль (РЕС)-липиды, липофильные ацильные цепи которых заякоривают гидрофильные молекулы ПЭГ в частице. Это обеспечивает стабильность и структурную целостность частиц. Ацильные цепи ПЭГ-липидов могут быть различной длины. LNP, которые мы успешно использовали, содержали ПЭГ-липиды либо с относительно длинным якорем С18, который состоит из 18 метандиил-групп и считается незаменяемым, либо с более коротким якорем С16, который состоит из 16 метандиил-групп и является высоко заменяемым (34, 35). Гаптен-конъюгированные миРНК-содержащие LNP по отдельности или в виде комплекса с bsAb в PBS можно проанализировать с помощью динамического рассеяния света (dynamic light scattering, DLS), чтобы определить их гидродинамические радиусы и индексы полидисперсности (polydispersity index, PDI). LNP можно инкубировать вместе с bsAb при комнатной температуре (примерно 25°C; до 3 часов) и с помощью DLS определить изменения размера частиц и полидисперсности стечением времени (13, 36).
LNP-составы с встроенным гаптеном, которые были успешно нами использованы, содержали в общей сложности 1,4 моль % ПЭГ-липидов, из них 0,4 или 0,04 моль % были гаптен-связанными (Dig-модифицированными) С18 ПЭГ-липидами. Оставшиеся безгаптеновые ПЭГ-липиды содержали С16-липидные якори для обеспечения эффективного деэкранирования LNP и высокой активности переноса/трансфекции миРНК (34, 35 и 36). При использовании таких LNP была достигнута эффективность нокдауна до 90% с IC50 1,7 нМ. Более того, в отличие от результатов, полученных с другими составами миРНК (37), с этими LNP не наблюдалось никаких иммуностимулирующих влияний (13).
Цитируемые документы:
1. Akinc, A., et al. Mol. Ther. 18 (2010) 1357-1364.
2. Bhattarai, S. R., et al., Pharm. Res. 27 (2010) 2556-2568.
3. Lee, S.K., et al., Meth. Enzymol. 502 (2012) 91-122.
4. Leus, N.G., et al., Int. J. Pharm. 459 (2014) 40-50.
5. Semple, S.C., et al., Nat. Biotechnol. 28 (2010) 172-176.
6. Song, E., et al., Nat. Biotechnol. 23 (2005) 709-717.
7. Toloue, M.M. and Ford, L. P., Methods Mol. Biol. 764(2011) 123-139.
8. Yu, B„ et al., AAPS J 11 (2009) 195-203.
9. Zimmermann, T.S., et al., Nature 441 (2006) 111-114.
10. Beck, A., et al., Nat. Rev. Immunol. 10 (2010) 345-352.
11. Weidle, U.H., et al., Cancer Genomics Proteomics 10(2013) 1-18.
12. MetzS., et al., Proc. Natl. Acad. Sci. USA 108(2011)8194-8199.
13. Schneider, В., et al., Mol. Ther. Nucleic Acids. 1 (2012) e46.
14. Jung, S.H., et al., Proteins 19 (1994) 35-47.
15. Reiter, Y., et al., Protein Eng. 8(1995) 1323-1331.
16. Reiter, Y., et al., Nat. Biotechnol. 14 (1996) 1239-1245.
17. Ridgway, J.В., et al., Protein Eng. 9 (1996) 617-621.
18. Molina, M.A., et al., Cancer Res. 61 (2001) 4744-4749.
19. Baselga, J., Eur. J. Cancer 37 (2001) Suppl. 4, S16-S22.
20. Kies, M.S. and Harari, P.M., Curr. Opin. Investig. Drugs 3 (2002) 1092-1100.
21. Chitnis, M.M., et al., Clin. Cancer Res. 14 (2008) 6364-6370.
22. Mansfield, E., et al., Blood 90 (1997) 2020-2026.
23. Brinkmann, U., et al., Proc. Natl. Acad. Sci. USA 88 (1991) 8616-8620.
24. Pastan, I., etal., Cancer Res. 51 (1991) 3781-3787.
25. Soutschek, J., et al., Nature 432 (2004) 173-178.
26. Chan, D.P., et al., Biomaterials 34 (2013) 8408-8415.
27. Jhaveri, A.M. and Torchilin, V.P., Front Pharmacol. 5 (2014) 77.
28. Malhotra, M., et al., Int. J. Nanomedicine 8 (2013) 2041-2052.
29. Miele E., et al., Int. J. Nanomedicine 7 (2012) 3637-3657.
30. Rozema, D.В., et al., Proc. Natl. Acad. Sci. USA 104 (2007) 12982-12987.
31. Tiera, M.J., etal., Curr. Gene Ther. 13(2013)358-369.
32. Wolff, J.A. and Rozema, D.В., Mol. Ther. 16 (2008) 8-15.
33. Wong, S.C., et al., Nucleic Acid Ther. 22 (2012) 380-390.
34. Akinc, A., et al., Mol. Ther. 17 (2009) 872-879.
35. Sou, K., et al., Bioconjug. Chem. 11 (2000) 372-379.
36. Tao, W., et al., Mol. Ther. 18 (2010) 1657-1666.
37. Robbins, M., et al., Oligonucleotides 19 (2009) 89-102.
38. Grate, M., et al., Methods Mol. Biol. 901 (2012) 247-263.
39. Haas, A.K., et al., Methods Mol. Biol. 901 (2012) 265-276.
40. Aigner, A., Curr. Pharm. Des. 14 (2008) 3603-3619.
41. Leucuta, S.E., Curr. Drug. Deliv. 10 (2013) 208-240.
42. Burris, T.P., et al., Mol. Endocrinol. 13 (1999) 410-417.
43. Collins, M.L, et al., Nucleic Acids Res. 25 (1997) 2979-2984.
С. Рекомбинантные способы и композиции
Антитела могут быть получены с использованием рекомбинантных способов и композиций, например, описанных в US 4816567. В одном из воплощений предложена изолированная (выделенная) нуклеиновая кислота, кодирующая анти-BRDU-антитело, описанное в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В другом воплощении предложен один или более чем один вектор (например, экспрессионный вектор), содержащий такую нуклеиновую кислоту. В другом воплощении предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком воплощении клетка-хозяин содержит (например, была трансформирована им): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном из воплощений клетка-хозяин является эукариотической, например, клеткой яичника китайского хомячка (СНО) или лимфоидной клеткой (например, Y0, NS0, Sp2/0). В одном из воплощений предложен способ получения анти-BRDU-антитела, который включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, описанное выше, в условиях, подходящих для экспрессии антитела, и, возможно, извлечение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантной продукции анти-BRDU-антитела нуклеиновую кислоту, кодирующую антитело, например, описанное выше, выделяют и встраивают в один или более чем один вектор для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такая нуклеиновая кислота может быть легко выделена и секвенирована с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии векторов, кодирующих антитела, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела могут быть получены в бактериях, в частности, когда не нужны гликозилирование и Fc-эффекторные функции. Про экспрессию фрагментов антитела и полипептидов в бактериях см., например, в US 5648237, US 5789199 и US 5840523. (См. также Charlton, К.А., In: Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2003), pp. 245-254, где описывается экспрессия фрагментов антител в Е. coli). После экспрессии антитело может быть выделено из массы бактериальных клеток в растворимой фракции и может быть далее очищено.
Помимо прокариотов для векторов, кодирующих антитела, подходящими клонирующими или экспрессирующими хозяевами являются эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, у которых пути гликозилирования являются "гуманизированными", что приводит к продукции антитела с частично или полностью человеческим характером гликозилирования. См. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414; и Li, Н. et al., Nat. Biotech. 24 (2006) 210-215.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые могут быть использованы в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также могут быть использованы культуры растительных клеток. См., например, US 5959177, US 6040498, US 6420548, US 7125978 и US 6417429 (описывающие технологию PLANTIBODIES™ для получения антител в трансгенных растениях).
В качестве хозяев также могут быть использованы клетки позвоночных животных. Например, могут быть использованы клеточные линии млекопитающих, приспособленные к росту в суспензии. Другими примерами используемых клеточных линий-хозяев от млекопитающих являются линия почки обезьяны CV1, трансформированная SV40 (COS-7); человеческая эмбриональная почечная линия (293 или клетки 293, описанные, например, в Graham, F.L. et al., J. Gen Virol. 36 (1977) 59-74); клетки почек детенышей хомяка (ВНК); мышиные клетки Сертоли (ТМ4-клетки, описанные, например, в Mather, J.P., Biol. Reprod. 23 (1980) 243-252); клетки почки обезьяны (CV1); клетки почки африканской зеленой обезьяны (VERO-76); клетки человеческой карциномы шейки матки (HELA); клетки почки собаки (MDCK); клетки печени крысы buffalo (BRL 3А); клетки легких человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); TRI-клетки, описанные, например, в Mather, J.P. et al., Annals N.Y. Acad. Sci. 383 (1982) 44-68; клетки MRC 5; и клетки FS4. Другие используемые линии клеток-хозяев от млекопитающих включают клетки яичника китайского хомячка (СНО), в том числе DHFR-CHO-клетки (Urlaub, G. et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216-4220); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор некоторых линий клеток-хозяев от млекопитающих, подходящих для продукции антител, см., например, в Yazaki, P. and Wu, A.M., Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2004), pp. 255-268.
D. Анализы
АНТИ-BRDU-антитела, описанные в данном документе, могут быть идентифицированы, подвергнуты скринингу или охарактеризованы на предмет их физических/химических свойств и/или биологической активности с помощью различных анализов, известных в данной области.
Анализы связывания и другие анализы
В одном из аспектов антитело согласно данному изобретению анализируют на его активность связывания с антигеном, например, с помощью известных способов, таких как ИФА (ELISA), вестерн-блот и т.п.
В другом аспекте конкурентные анализы могут быть использованы для определения антитела, которое конкурирует с антителами, предложенными в данном документе для связывания с BRDU.
В иллюстративном конкурентном анализе иммобилизованный BRDU инкубируют в растворе, содержащем первое меченое антитело, которое связывается с BRDU, и второе немеченое антитело, которое проверяют на его способность конкурировать с первым антителом за связывание BRDU. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный BRDU инкубируют в растворе, содержащем первое меченое антитело, но не содержащем второе немеченое антитело. После инкубации в условиях, разрешающих связывание первого антитела с BRDU, избыток несвязанного антитела удаляют и измеряют количество метки, связанной с иммобилизованным BRDU. Если количество метки, связанной с иммобилизованным BRDU, существенно снижено в анализируемом образце по сравнению с контрольным образцом, то это указывает на то, что второе антитело конкурирует с первым антителом за связывание BRDU. См. Harlow, Е. and Lane, D., Antibodies: A Laboratory Manual, Chapter 14, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1988).
E. Иммуноконъюгаты
Данное изобретение также предусматривает иммуноконъюгаты, содержащие анти-BRDU-антитело, описанное в данном документе, которое конъюгировано с одним или более чем одним цитотоксическим агентом, таким как химиотерапевтические агенты или лекарственные препараты, ингибирующие рост агенты, токсины (например, белковые токсины, ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения или их фрагменты) или радиоактивные изотопы.
В одном из воплощений иммуноконъюгат является конъюгатом "антитело - лекарственный препарат" (antibody-drug conjugate, ADC), в котором антитело конъюгировано с одним или более чем одним лекарственным препаратом, включая, но не ограничиваясь ими, мейтансиноид (см. US 5208020, US 5416064 и ЕР 0425235 В1); ауристатин, такой как монометилауристатиновые лекарственные группировки DE и DF (ММАЕ и MMAF) (см. US 5635483, US 5780588 и US 7498298); доластатин; калихеамицин или его производное (см. US 5712374, US 5714586, US 5739116, US 5767285, US 5770701, US 5770710, US 5773001 и US 5877296; Hinman, L.M. et al., Cancer Res. 53 (1993) 3336-3342; и Lode, H.N. et al., Cancer Res. 58 (1998) 2925-2928); антрациклины, такие как дауномицин или доксорубицин (см. Kratz, F. et al., Curr. Med. Chem. 13 (2006) 477-523; Jeffrey, S.C. et al., Bioorg. Med. Chem. Lett. 16 (2006) 358-362; Torgov, M.Y. et al., Bioconjug. Chem. 16 (2005) 717-721; Nagy, A. et al., Proc. Natl. Acad. Sci. USA 97 (2000) 829-834; Dubowchik, G.M. et al., Bioorg. & Med. Chem. Letters 12 (2002) 1529-1532; King, H.D. et al., J. Med. Chem. 45 (2002) 4336-4343; и US 6630579); метотрексат; виндезин; таксаны, такие как доцетаксел, паклитаксел, ларотаксел, тезетаксел и ортатаксел; трихотецен; и СС1065.
В другом воплощении иммуноконъюгат содержит антитело, описанное в данном документе, конъюгированное с ферментативно активным токсином или его фрагментом, включая, но не ограничиваясь ими, дифтерийную А-цепь, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модецина, альфа-сарцин, белки Aleurites ford/7, белки диантина, белки Phytoiacca americana (PAPI, РАРII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены.
В другом воплощении иммуноконъюгат содержит антитело, описанное в данном документе, конъюгированное с радиоактивным атомом с образованием радиоактивного конъюгата. Множество радиоактивных изотопов доступно для получения радиоактивных конъюгатов. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Когда радиоактивный конъюгат используется для обнаружения, он может содержать радиоактивный атом для сцинтиграфических исследований, например, TC99m или I123, или спиновую метку для визуализации путем ядерного магнитного резонанса (NMR) (также известного как магнитно-резонансная томография, MRI), такую как снова йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента могут быть получены с использованием множества бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(параазидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta, E.S. et al., Science 238 (1987) 1098-1104. Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксксная кислота (MX-DTPA) является примером хелатирующего агента для конъюгации радионуклида с антителом. См. WO 94/11026. Линкер может представлять собой "расщепляемый линкер", облегчающий высвобождение цитотоксического лекарственного агента в клетке. Например, может быть использован кислотно-лабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, линкер, содержащий диметил или дисульфид (Chari, R.V. et al., Cancer Res. 52 (1992) 127-131; US 5208020).
Среди иммуноконъюгаты или ADC в данном документе особенно рассмтариваются, но не ограничиваясь ими, такие конъюгаты, полученные с помощью сшивающих реагентов, включая, но не ограничиваясь ими, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, Pierce Biotechnology, Inc., Рокфорд, Иллинойс, США).
F. Способы и композиции для диагностики и обнаружения
Термин "обнаружение", используемый в данном документе, включает количественное или качественное обнаружение.
В одном из воплощений предложено анти-BRDU-антитело для применения в способах диагностики или обнаружения. Такой способ может быть способом in vitro или in vivo.
В некоторых воплощениях предложены меченые анти-BRDU-антитела. Метки включают, но не ограничиваясь ими, метки или группировки, которые обнаруживаются непосредственно (такие как флуоресцентные, хромофорные, электронно-плотные, хемилюминесцентные и радиоактивные метки), а также группировки, такие как ферменты или лиганды, которые обнаруживаются косвенно, например, через ферментативную реакцию или молекулярное взаимодействие. Примеры меток включают, но не ограничиваясь ими, радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например люциферазу светлячка и бактериальную люциферазу (US 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаридов, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, гетероциклические оксидазы, например, уриказу и ксантиноксидазу, в сочетании с ферментом, который использует пероксид водорода для окисления предшественника метки, таким как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и т.п.
G. Фармацевтические составы
Фармацевтические составы анти-BRDU-антитела, описанного в данном документе, получают путем смешивания такого антитела, имеющего требуемую степень чистоты, с одним или более чем одним возможным фармацевтически приемлемым носителем (Osol, A. (ed.) Remington’s Pharmaceutical Sciences, 16th edition, (1980)) в виде лиофилизированных составов или водных растворов. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают, но не ограничиваясь ими: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензетониума хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и N-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (PEG). Иллюстративные фармацевтически приемлемые носители в данном документе также включают агенты для диспергирования лекарственного средства в интерстициальном пространстве, такие как растворимые нейтрально-активные гликопротеины гиалуронидазы (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rhuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые типичные sHASEGP и способы их применения, в том числе rhuPH20, описаны в US 2005/0260186 и US 2006/0104968. В одном из аспектов sHASEGP комбинирован с одной или более чем одной дополнительной гликозамингликаназой, такой как хондроитиназа.
Иллюстративные лиофилизированные составы антител описаны в US 6267958. Водные составы антител включают те, которые описаны в US 6171586 и WO 2006/044908, последние составы включают гистидин-ацетатный буфер.
Состав в данном документе также может содержать более чем один активный ингредиент, что необходимо при лечении по конкретным показаниям, предпочтительно с дополняющими активностями, которые не влияют друг на друга. Такие активные ингредиенты предпочтительно присутствуют в комбинации в количествах, которые эффективны для данной цели.
Активные ингредиенты могут быть заключены в микрокапсулы, полученные, например, с помощью методик коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, соответственно, в коллоидных системах доставки лекарственных средств (таких как липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие методики раскрыты в Remington’s Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980).
Могут быть изготовлены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, при этом матрицы находятся в виде формованных изделий, например, пленок, или в виде микрокапсул.
Составы, используемые для введения in vivo, как правило, являются стерильными. Стерильность может быть легко достигнута, например, путем фильтрации через стерилизующие фильтрационные мембраны.
Н. Терапевтические способы и композиции
Любое из анти-BRDU-антител, описанных в данном документе, может быть использовано в терапевтических способах.
В одном из аспектов предусмотрено анти-BRDU-антитело для применения в качестве лекарственного средства. В некоторых воплощениях предусмотрено анти-BRDU-антитело для применения в способе лечения.
В другом аспекте данное изобретение относится к применению анти-BRDU-антитела в производстве или получении лекарственного препарата.
В другом аспекте данное изобретение относится к фармацевтическим составам, содержащим любое из анти-BRDU-антител, предложенных в данном документе. В одном из воплощений фармацевтический состав содержит любое из анти-BRDU-антител, предложенных в данном документе, и фармацевтически приемлемый носитель.
Антитела согласно данному изобретению могут быть использованы в терапии по отдельности или в комбинации с другими агентами. Например, антитело согласно данному изобретению может быть введено совместно по меньшей мере с одним дополнительным терапевтическим агентом.
Такие комбинированные терапии, отмеченные выше, охватывают комбинированное введение (когда два или более двух терапевтических агентов включены в один и тот же или в раздельные составы) и раздельное введение, в случае которого введение антитела согласно данному изобретению может осуществляться до, одновременно и/или после введения дополнительного агента и/или адъюванта. Антитела согласно данному изобретению также могут быть введены в комбинации с радиационной терапией.
Антитело согласно данному изобретению (и любой дополнительный терапевтический агент) может быть введено с помощью любых подходящих средств, в том числе путем парентерального, внутрилегочного и интраназального, и, если нужно местное лечение, внутриочагового введения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Введение дозы может быть осуществлено любым подходящим способом, например, с помощью инъекций, таких как внутривенные или подкожные инъекции, частично в зависимости от того, является ли введение кратковременным или хроническим. В данном документе рассматриваются различные схемы дозировки, включая, но не ограничиваясь ими, одно или множество введений в различные временные точки, болюсное введение и импульсную инфузию.
Антитела согласно данному изобретению будут собраны в состав, дозированы и введены в соответствии с надлежащей медицинской практикой. Факторы, подлежащие рассмотрению в этом контексте, включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние отдельного пациента, причину нарушения, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Антитело не обязательно, но может быть собрано в состав с одним или более чем одним агентом, используемым в настоящее время для профилактики или лечения рассматриваемого нарушения. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в составе, от типа заболевания или лечения, а также от других факторов, описанных выше. Как правило, они используются в тех же дозировках и с теми же путями введения, которые описаны в данном документе, или в дозировках примерно от 1 до 99% от описанных в данном документе, или в любой дозировке и любым путем, который является эмпирически/клинически подходящим.
Для профилактики или лечения заболевания подходящая доза антитела согласно данному изобретению (при использовании его отдельно или в комбинации с одним или более чем одним другим дополнительным терапевтическим агентом) будет зависеть от типа заболевания, подлежащего лечению, от типа антитела, от тяжести и течения заболевания, от того, вводят ли антитело с профилактической или терапевтической целью, от предыдущей терапии, истории болезни пациента и ответа на антитело, а также по усмотрению лечащего врача. Данное антитело вводят пациенту подходящим образом одномоментно или серийно. В зависимости от типа и тяжести заболевания изначальной кандидатной дозировкой антитела для введения пациенту может быть дозировка от примерно 1 мкг/кг до 15 мг/кг (например, от 0,5 мг/кг до 10 мг/кг) независимо от того, например, вводится ли оно в ходе одного или более отдельных введений или путем непрерывной инфузии. Одна из типичных суточных доз может варьировать от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. В случае повторных введений в течение нескольких дней или дольше в зависимости от состояния лечение, как правило, может быть продолжено до требуемого подавления симптомов заболевания. Один из примеров дозировки антитела будет находиться в диапазоне от примерно 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту может быть введена одна или более чем одна доза примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любая их комбинация). Такие дозы можно вводить периодически, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати доз антитела или, например, примерно шесть доз антитела). Может быть введена изначальная более высокая нагрузочная доза с последующей одной или более чем одной более низкой дозой. Прогресс этой терапии легко контролировать с помощью обычных методик и анализов.
Понятно, что любой из вышеуказанных составов или терапевтических способов может быть осуществлен с использованием иммуноконъюгата согласно данному изобретению вместо или в дополнение к анти-BRDU-антителу.
III. Продукты производства
В другом аспекте данного изобретения предложен продукт производства, содержащий материалы, используемые для лечения, профилактики и/или диагностики нарушений, описанных выше. Продукт производства содержит контейнер и этикетку или листок-вкладыш, прикрепленный или связанный с контейнером. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, пакеты для внутривенно вводимых растворов и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию саму по себе или в сочетании с другой композицией, эффективной для лечения, профилактики и/или диагностики состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет для внутривенно вводимого раствора или флакон с пробкой, прокалываемой иглой для подкожной инъекции). По меньшей мере один активный агент в композиции представляет собой антитело согласно данному изобретению. На этикетке или вкладыше в упаковку указывается, что композиция используется для лечения выбранного состояния. Кроме того, продукт производства может содержать: (а) первый контейнер с композицией, содержащейся в нем, где композиция содержит антитело согласно данному изобретению; и (b) второй контейнер с композицией, содержащейся в нем, где композиция также содержит цитотоксический или другой терапевтический агент. Продукт производства в этом воплощении изобретения также может содержать вкладыш в упаковку, указывающий, что композиции могут быть использованы для лечения конкретного состояния. Альтернативно или дополнительно, изделие также может включать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, например, бактериостатическую воду для инъекций (bacteriostatic water for injection, BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он также может включать другие материалы, желательные с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
Следует понимать, что любой из указанных выше продуктов производства может включать иммуноконъюгат согласно данному изобретению вместо или в дополнение к анти-BRDU-антителу.
IV. Конкретные воплощения
1. Гуманизированное анти-BRDU-антитело, где указанное антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 01, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 04, и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05.
2. Гуманизированное анти-BRDU-антитело, где указанное антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 02, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 04, и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05.
3. Гуманизированное анти-BRDU-антитело, где указанное антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 01, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 03, и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05.
4. Гуманизированное анти-BRDU-антитело, где указанное антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 02, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 03, и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05.
5. Гуманизированное анти-BRDU-антитело, где указанное антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 01, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 13, и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05.
6. Гуманизированное анти-BRDU-антитело, где указанное антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 02, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 13, и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05.
7. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-6, также содержащее (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO 06, (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO 07, и (с) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 08.
8. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-7, где указанное антитело имеет в позиции 30 тяжелой цепи аминокислотный остаток пролин (нумерация согласно Kabat).
9. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-8, где указанное антитело имеет в позиции 58 тяжелой цепи аминокислотный остаток фенилаланин (нумерация согласно Kabat).
10. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-9, где указанное антитело имеет в позиции 108 тяжелой цепи аминокислотный остаток треонин (нумерация согласно Kabat).
11. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-10, где указанное антитело имеет в позиции 49 легкой цепи аминокислотный остаток лизин (нумерация согласно Kabat).
12. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-11, где указанное антитело имеет в позиции 98 легкой цепи аминокислотный остаток лейцин (нумерация согласно Kabat).
13. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-12, где указанное антитело содержит один или более чем один из следующих остатков
- Р в позиции 30 вариабельного домена тяжелой цепи, и/или
- F в позиции 58 вариабельного домена тяжелой цепи, и/или
- Т в позиции 108 вариабельного домена тяжелой цепи, и/или
- R в позиции 49 вариабельного домена легкой цепи, и/или
- L в позиции 98 вариабельного домена легкой цепи (все позиции согласно Kabat).
14. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-13, где указанное антитело содержит последовательность VH, имеющую по меньшей мере 95% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 09, и последовательность VL, имеющую по меньшей мере 95% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 10.
15. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-13, где указанное антитело содержит аминокислотную последовательность VH, полученную из аминокислотной последовательности вариабельного домена тяжелой цепи SEQ ID NO 11, и аминокислотную последовательность VL, полученную из аминокислотной последовательности вариабельного домена легкой цепи SEQ ID NO 12.
16. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-13, где указанное антитело представляет собой гуманизированный вариант нечеловеческого анти-BRDU-антитела, содержащий вариабельный домен тяжелой цепи SEQ ID NO 11 и вариабельный домен легкой цепи SEQ ID NO 12.
17. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-16, где указанное антитело содержит VH с аминокислотной последовательностью SEQ ID NO 09.
18. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-17, где указанное антитело содержит VL с аминокислотной последовательностью SEQ ID NO 10.
19. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-18, где указанное антитело представляет собой полноразмерное IgG1-антитело или полноразмерное lgG4-антитело.
20. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-19, где указанное антитело представляет собой моноклональное антитело.
21. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-20, где указанное антитело представляет собой двухвалентное антитело.
22. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-21, где указанное антитело представляет собой биспецифическое антитело.
23. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-22, где указанное антитело содержит
a) тяжелую цепь и легкую цепь первого полноразмерного антитела, которое специфически связывается с первым антигеном, и
b) модифицированную тяжелую цепь и модифицированную легкую цепь второго полноразмерного антитела, которое специфически связывается со вторым антигеном, в котором константные домены CL и СН1 поменяны местами друг с другом,
где первый антиген или второй антиген представляет собой BRDU.
24. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-22, где указанное антитело содержит
а) легкую цепь первого антитела, которое специфически связывается с первым антигеном, и
b) тяжелую цепь первого антитела, которое специфически связывается с первым антигеном, конъюгированную на ее С-конце с scFv или scFab, полученным из второго антитела, которое специфически связывается со вторым антигеном,
где первый антиген или второй антиген представляет собой BRDU.
25. Гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-20, где указанное антитело представляет собой фрагмент антитела, который связывается с BRDU.
26. Комплекс, содержащий гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-25 и нуклеиновую кислоту, содержащую BRDU.
27. Ковалентный комплекс, содержащий гуманизированное анти-BRDU-антитело согласно любому из воплощений 3-25 и BRDU, конъюгированный с остатком цистеина.
28. Фармацевтический состав, содержащий гуманизированное анти-BRDU-антитело согласно любому из воплощений 1-25 или комплекс согласно любому из воплощений 26-27 и фармацевтически приемлемый носитель.
29. Применение гуманизированного анти-BRDU-антитела согласно любому из воплощений 1-25 для доставки BRDU-содержащей нуклеиновой кислоты к клетке.
30. Применение гуманизированного анти-BRDU-антитела согласно любому из воплощений 1-25 для доставки BRDU-содержащей нуклеиновой кислоты через гематоэнцефалический барьер.
V. ПРИМЕРЫ
Ниже приведены примеры способов и композиций согласно данному изобретению. Нужно понимать, что на практике можно осуществить различные другие воплощения, учитывая общее описание, представленное выше.
Пример 1
Выделение и характеризация кДНК, кодирующих домены VH и VL мышиного анти-BRDU-антитела от мышиной гибридомы
Информацию о белке и последовательности (ДНК) доменов VH и VL мышиного анти-BRDU-антитела получали непосредственно из гибридомных клонов. Этапы эксперимента, проведенные последовательно, включали (i) выделение РНК из гибридомных клеток, продуцирующих антитела, (ii) превращение этой РНК в кДНК, перенос в VH- и VL-несущие ПЦР-фрагменты, и (iii) интеграция этих ПЦР-фрагментов в плазмидные векторы для размножения в Е. coli и определение их ДНК- (и выведенных белковых) последовательностей.
Получение РНК из гибридомных клеток:
Для выделения мРНК из гибридомных клеток использовали набор RNeasy Mini Kit (Qiagen). Примерно 106 клеток лизировали в RLT-буфере и лизат помещали на колонку Qiashredder. мРНК концентрировали и промывали с помощью набора RNeasy Mini column.
Создание фрагментов ДНК, кодирующих VL и VH, с помощью RACE PCR, клонирование этих фрагментов ДНК в плазмиды и определение их ДНК- и аминокислотных последовательностей:
Создание кДНК и амплификацию специфических последовательностей кДНК антител проводили с помощью набора SMART Race cDNA Amplification kit (Clontech) в соответствии с протоколом производителя. Для специфической амплификации использовали универсальный праймер из набора и специфические праймеры из константной области легкой и тяжелой цепи антитела, соответственно.
Продукт ПЦР очищали с помощью электрофореза в геле и выделяли из агарозы (набор QIAquick Gel extraction kit; Qiagen).
Продукты ПЦР клонировали в векторы pCR4-TOPO (набор клонирования для секвенирования ТОРО ТА cloning kit for sequencing, Life Technologies). После трансформации клеток E.coli собирали 5-10 колоний, выделяли плазмидную ДНК в соответствии со стандартными методиками и клонированные вставки подвергали анализу на их последовательность ДНК.
Последовательность мышиного VL анти-BRDU-антитела показана в SEQ ID NO 12. Последовательности мышиного VH анти-BRDU-антитела показана в SEQ ID NO 11.
Пример 2
Гуманизация доменов VH и VL мышиного анти-BRDU-антитела
Мышиное BRDU-связывающее антитело гуманизировали следующим образом: создание и характеризация кодирующих последовательностей и аминокислотных последовательностей, которые содержат домены VH и VL мышиного анти-BRDU-антитела класса IgG1 с легкой каппа-цепью из мышиной гибридомы, описаны в WO 2011/003557 и WO 2011/003780. Основываясь на этой информации, создавали соответствующее гуманизированное анти-BRDU-антитело на основе комбинации человеческой зародышевой каркасной области IGHV1-18-01 и IGKV3-15-01. Аминокислотная последовательность гуманизированного VH изображена в SEQ ID NO 09, а аминокислотная последовательность гуманизированного VL показана в SEQ ID NO 10.
Пример 3
Сборка, экспрессия и очистка рекомбинантных анти-BRDU-антител
Вариабельные области мышиных анти-BRDU-антител объединяли с константными областями человеческого происхождения для формирования моно- или биспецифических химерных антител.
Для создания моноспецифических анти-BRDU-антител и биспецифических анти-BRDU-антител, которые специфически связываются с BRDU, а также с другой нe-BRDU-мишенью (например, рецепторными тирозинкиназами или IGF-1R), требуется (i) разработка и определение аминокислотных и нуклеотидных последовательностей для таких молекул, (ii) экспрессия этих молекул в трансфицированных культивируемых клетках млекопитающих, и (iii) очистка этих молекул из супернатантов трансфицированных клеток. Эти этапы выполняли, как было описано ранее в WO 2012/093068.
Как правило, для создания антитела класса IgG, которое обладает специфичностью связывания мышиного анти-BRDU-антитела, последовательность VH сливали в рамке считывания с N-концом СН1-шарнир-СН2-CH3 человеческой Fc-области подкласса IgG1. Аналогичным образом, последовательность VL сливали в рамке считывания с N-концом человеческой константной области CL-каппа.
Для создания производных биспецифических антител, которые обладают BRDU-связывающей специфичностью, а также специфичностью к другим мишеням, анти-BRDU-антитело, scFv- или Fab-фрагмент сливали в рамке считывания с С-концом тяжелой цепи описанных ранее антител. Во многих случаях применяемый антигаптеновый scFv дополнительно стабилизировали введением дисульфидной связи VH44-VL100, которая была описана ранее (например, Reiter, Y., et al., Nature biotechnology 14 (1996) 1239-1245).
Экспрессионные плазмиды
Экспрессионные плазмиды, содержащие экспрессионные кассеты для экспрессии тяжелой и легкой цепей, по отдельности собирали в векторах для экспрессии в клетках млекопитающих.
При этом генные сегменты, кодирующие отдельные элементы, соединяли, как описано выше.
Общие сведения касательно нуклеотидных последовательностей человеческих легких и тяжелых цепей, из которых может быть выведено использование кодонов, даны в: Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication No 91-3242.
Транскрипционный блок для легкой κ-цепи состоял из следующих элементов:
- немедленный ранний энхансер и промотор из человеческого цитомегаловируса (hCMV),
- синтетическая 5'-UT-область, включающая последовательность Козака,
- сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включающая интрон сигнальной последовательности,
- клонированная кДНК вариабельной области легкой цепи, собранная с уникальным сайтом рестрикции Bsml на 5'-конце и сайтом-донором для сплайсинга и уникальным сайтом рестрикции Notl на 3'-конце,
- геномная константная область человеческого κ-гена, включающая энхансер интрона 2 κ-цепи мышиного lg (Picard, D., and Schaffner, W. Nature 307 (1984) 80-82), и
- сигнальная последовательность κ-полиаденилирования иммуноглобулина человека ("поли А").
Транскрипционный блок для тяжелой y1-цепи состоял из следующих элементов:
- немедленный ранний энхансер и промотор из человеческого цитомегаловируса (hCMV),
- синтетическая 5'-UT-область, включающая последовательность Козака,
- модифицированная сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включающая интрон сигнальной последовательности,
- клонированная кДНК моноспецифической вариабельной области тяжелой цепи или клонированная кДНК биспецифического гибрида scFv-вариабельная тяжелая цепь, собранная с уникальным сайтом рестрикции Bsml на 5'-конце и сайтом-донором для сплайсинга и уникальным сайтом рестрикции Notl на 3'-конце,
- геномная константная область человеческого гена тяжелой y1-цепи, включающая μ-энхансер мышиного lg (Neuberger, M.S., EMBO J. 2 (1983) 1373-1378), и
- сигнальная последовательность полиаденилирования y1-иммуноглобулина человека ("поли А").
Помимо экспрессионной кассеты легкой κ-цепи или тяжелой y1-цепи эти плазмиды содержали
- ген устойчивости к гигромицину,
- сайт начала репликации, oriP, из вируса Эпштейна-Барр (EBV),
- сайт начала репликации из вектора pUC18, который делает возможной репликацию этой плазмиды в Е. coli, и
- ген β-лактамазы, который придает Е. coli устойчивость к ампициллину.
Методики рекомбинантной ДНК
Клонирование проводили с использованием стандартных методик клонирования, описанных в Sambrook, J. et al., Molecular Cloning, second edition, Cold Spring Harbor Laboratory Press (1989). Все молекулярно-биологические реагенты были коммерчески доступны (если не указано иное) и использовались в соответствии с инструкциями производителя.
ДНК, которая содержит кодирующие последовательности, мутации или другие генетические элементы, была синтезирована в Geneart AG, Регенсбург.
ДНК-последовательности определяли с помощью секвенирования двунитевой ДНК, проведенного в SequiServe (SequiServe GmbH, Германия).
Анализ ДНК- и белковой последовательности и управление данными о последовательности
Программу Vector NTI Advance версии 9.0 использовали для создания, картирования, анализа, аннотирования и иллюстрирования последовательности.
Экспрессия анти-BRDU-антител и их производных
Анти-BRDU-антитела экспрессировали путем временной трансфекции клеток почек эмбриона человека 293 (НЕК293) в суспензии. Для этого легкие и тяжелые цепи соответствующих моно- или биспецифических антител встраивали в экспрессионные векторы, несущие маркеры прокариотической и эукариотической селекции, описанные выше. Эти плазмиды амплифицировали в Е. coli, очищали, а затем использовали для временных трансфекций. Для процедур с клетками использовали стандартные методики культивирования клеток, описанные в Current Protocols in Cell Biology (2000), Bonifacino, J.S., Dasso, M., Harford, J.В., Lippincott-Schwartz, J. and Yamada, K.M. (eds.), John Wiley & Sons, Inc.
Клетки культивировали в соответствующей среде для экспрессии при 37°C/8% CO2. В день трансфекции клетки высевали в свежей среде с плотностью 1-2×106 жизнеспособных клеток/мл. ДНК-комплексы с реагентами для трансфекции готовили в среде Opti-MEM I (Invitrogen, США), содержащей 250 мкг плазмидной ДНК с тяжелой и легкой цепями в молярном соотношении 1:1, в конечном объеме для трансфекции 250 мл. Клеточные культуральные супернатанты, содержащие моноспецифические или биспецифические антитела, осветляли через 7 дней после трансфекции путем центрифугирования со скоростью 14000 g в течение 30 минут и фильтрации через стерилизующий фильтр (0,22 мкм). Супернатанты хранили при -20°C до очистки.
Для определения концентрации антител и производных в клеточных культуральных супернатантах применяли аффинную ВЭЖХ-хроматографию. Для этого клеточный культуральный супернатант, содержащий моно- или биспецифическое антитело или его производные, которые связываются с белком А, наносили на колонку Applied Biosystems Poros А/20 в растворе, содержащем 200 мМ KH2PO4, 100 мМ цитрат натрия, рН 7,4. Элюирование с хроматографического материала проводили путем подачи раствора, содержащего 200 мМ NaCl, 100 мМ лимонную кислоту, рН 2,5. Использовали ВЭЖХ-систему UltiMate 3000 (Dionex). Элюированный белок количественно оценивали по УФ-поглощению и интеграции площади пиков. Очищенное антитело IgG1 служило в качестве стандарта.
Очистка анти-BRDU-антител
Через семь дней после трансфекции собирали клеточные супернатанты НЕК293. Рекомбинантное антитело, содержащееся в них, очищали из супернатанта в два этапа путем аффинной хроматографии с использованием аффинной хроматографии на белке A-Sepharose™ (GE Healthcare, Швеция) и эксклюзионной хроматографии Superdex200. Вкратце, содержащие антитело осветленные культуральные супернатанты наносили на колонку MabSelectSuRe Protein А (5-50 мл), уравновешенную PBS-буфером (10 мМ Na2HPO4, 1 мМ KH2PO4, 137 мМ NaCl и 2,7 мМ KCl, рН 7,4). Несвязанные белки отмывали уравновешивающим буфером. Антитела (или их производные) элюировали с помощью 50 мМ цитратного буфера, рН 3,2. Содержащие белок фракции нейтрализовали с помощью 0,1 мл 2 М Tris-буфера, рН 9,0. Затем элюированные белковые фракции объединяли, концентрировали на устройстве с фильтрованием центрифугированием Amicon (MWCO: 30 К, Millipore) и наносили на гель-фильтрационную колонку Superdex200 HiLoad 26/60 (GE Healthcare, Швеция), уравновешенную раствором, содержащим 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Белковую концентрацию очищенных антител и их производных оценивали путем определения оптической плотности (OD) при 280 нм, используя OD при 320 нм в качестве фоновой коррекции и коэффициент молярной экстинкции, рассчитанный на основании аминокислотной последовательности в соответствии с Расе et. al., Protein Science 4 (1995) 2411-2423. Фракции мономерных антител объединяли, мгновенно замораживали и хранили при -80°C. Часть образцов использовали для последующего анализа и характеризации белка.
Гомогенность антител подтверждали путем SDS-PAGE в присутствии и в отсутствие восстанавливающего агента (5 мМ 1,4-дитиотреитола) и окрашивания Кумасси бриллиантовым синим. Использовали гель-систему NuPAGE® Pre-Cast (Invitrogen, США) в соответствии с инструкцией производителя (4-20% Tris-глициновые гели).
При SDS-PAGE в восстанавливающих условиях полипептидные цепи, связанные с IgG, показали кажущиеся молекулярные размеры, аналогичные расчетным молекулярным массам. Уровни экспрессии всех конструкций анализировали с помощью белка А. Средний выход белка в таких экспериментах с неоптимизированной временной экспрессией составлял от 6 мг до 35 мг очищенного белка на литр клеточного культурального супернатанта.
На Фиг. 1 показаны результаты экспрессии и очистки гуманизированного антитела, которое связывает BRDU и производные BRDU. SDS PAGE в восстанавливающих и невосстанавливающих условиях показывает состав и гомогенность гуманизированных антител с цистеином в позиции 53 согласно Kabat и без него после очистки с помощью белка A (MabSelect) и SEC. Маркер молекулярных весов находится в непомеченных дорожках. Н-цепи (верхняя полоса на 50 кДа) и L-цепи (нижняя полоса на 25 кДа) антитела обнаруживаются в восстанавливающих условиях в виде уникальных полос без присутствия видимых количеств дополнительных белковых примесей.
Пример 5
BRDU-связывающие биспецифические антитела формируют комплексы с BRDU-содержащими полезными нагрузками
Анализы SEC-MALLS применяли для оценки того, способно ли и до какой степени биспецифическое антитело (bsAb) против рецептора трансферрина (TfR) и бромдезоксиуридина (BRDU) связываться с BRDU-содержащими полезными нагрузками. Для этого BRDU-ДНК добавляли к TfR-BRDU-bsAb в стехиометрическом соотношении 2:1 (350 мкг; 2,5 мг/мл) и инкубировали в течение 30 минут при комнатной температуре для формирования комплексов bsAb/полезная нагрузка. В качестве контрольных реагентов мы подготовили свободное bsAb (2,5 мг/мл) и свободную BRDU-ДНК (3,2 мг/мл). BRDU-ДНК (BRDU-ACC AAG ССТ AGA GAG GAG САА ТАС AAC AGT АСА TAT CGC GTG GTA AGС GT; SEQ ID NO 14) содержала одну молекулу BRDU на одну молекулу ДНК на 5'-конце ДНК. Комплексы и контрольные реагенты хранили при -80°C до анализа.
Полученные таким образом комплексы и контрольные реагенты подвергали анализу SEC-MALLS для определения и характеризации свободного bsAb, свободной полезной нагрузки и комплексов их обоих. Анализ SEC-MALLS проводили на инструменте Dionex Ultimate 3000 ВЭЖХ, снабженном детекторами Wyatt miniDawnTREOS/QELS и Optilab rЕХ. Анализируемые вещества растворяли в концентрации 1 мг/мл в PBS-буфере, рН 7,4, наносили на колонну Superdex200 10/300GL со скоростью потока 0,5 мл/мин и элюировали PBS-буфером с рН 7,4 в течение 60 минут.
Результаты этих анализов (показаны на фиг. 1) показывают, что BRDU-содержащие ДНК формируют определенные комплексы с bsAb. Эти комплексы элюируются из колонки с ММ, равной 244,9 кДа (Фиг. 1А) и демонстрируют гидродинамический радиус 6,8 нм (Фиг. 1В), что позволяет рассчитать стехиометрическое соотношение как примерно две (1,8) молекулы ДНК на одну молекулу bsAb. По сравнению с этим у свободного bsAb была выявлена ММ 215,4 кДа, а его гидродинамический радиус составлял 6,2 нм. Свободная BRDU-ДНК выявлялась с ММ 16,4 кДа.
Таким образом, было показано, что BRDU-содержащая ДНК эффективно и стехиометрически связывается с TfR-BRDU bsAb, образуя комплексы в молярном соотношении 2:1.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИТИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2799436C1 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2694659C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2731156C1 |
| АНТИТЕЛА К ТЕОФИЛЛИНУ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2630664C2 |
| АНТИТЕЛА К БИОТИНУ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2630296C2 |
| КОНЪЮГАТЫ ПОЛИПЕПТИДНОГО ТОКСИНА И АНТИТЕЛА, СОЕДИНЕННЫХ КОВАЛЕНТНОЙ СВЯЗЬЮ | 2014 |
|
RU2682754C2 |
| АНТИТЕЛА ПРОТИВ ТРАНСФЕРРИНОВОГО РЕЦЕПТОРА, ОБЛАДАЮЩИЕ ИНДИВИДУАЛИЗИРОВАННОЙ АФФИННОСТЬЮ | 2016 |
|
RU2831724C2 |
| БИСПЕЦИФИЧНЫЕ АНТИТЕЛА ПРОТИВ ГАПТЕНА/ПРОТИВ РЕЦЕПТОРА ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА, ИХ КОМПЛЕКСЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЧЕЛНОКОВ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2014 |
|
RU2693438C2 |
| МОДИФИЦИРОВАННЫЕ АСИММЕТРИЧНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕ Fc-РЕЦЕПТОР, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2687043C2 |
| АНТИТЕЛА К PD1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2746409C1 |






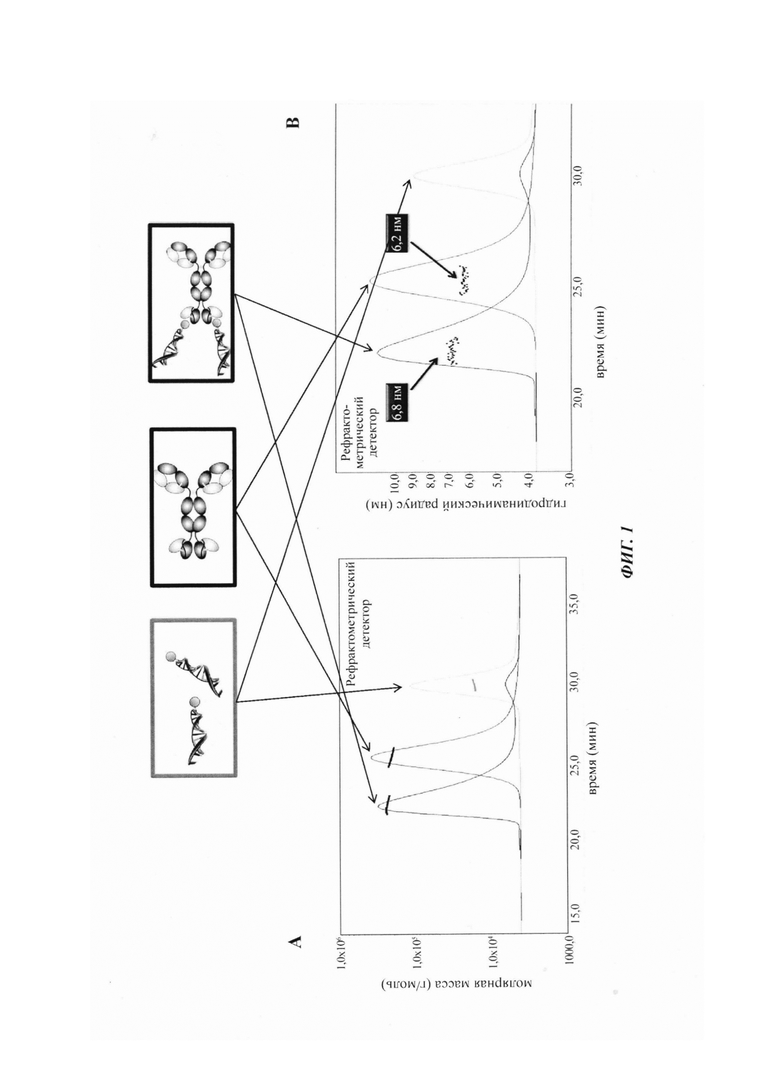
Изобретение относится к области биохимии, в частности к гуманизированному антителу 5-бром-2’-дезоксиуридина (анти-BRDU). Также раскрыты комплекс, конъюгат и фармацевтический состав для доставки BRDU-содержащей нуклеиновой кислоты к клетке. Также раскрыто применение указанного антитела. Изобретение обладает способностью специфически распознавать BRDU. 6 н. и 6 з.п. ф-лы, 1 ил., 1 табл., 5 пр.
1. Гуманизированное антитело против 5-бром-2’-дезоксиуридина (анти-BRDU-антитело), где указанное антитело содержит: (a) HVR-H1 (HVR - гипервариабельная область), содержащую аминокислотную последовательность SEQ ID NO 01, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 04, и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05; а также содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO 06, (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO 07, и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 08,
где указанное антитело содержит
- P в позиции 30 вариабельного домена тяжелой цепи, и
- F в позиции 58 вариабельного домена тяжелой цепи, и
- T в позиции 108 вариабельного домена тяжелой цепи, и
- К в позиции 49 вариабельного домена легкой цепи, и
- L в позиции 98 вариабельного домена легкой цепи (все позиции согласно Kabat).
2. Гуманизированное анти-BRDU-антитело, где указанное антитело содержит (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 01, (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 13, и (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 05; а также содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO 06, (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO 07, и (c) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 08, где указанное антитело содержит
- P в позиции 30 вариабельного домена тяжелой цепи, и
- F в позиции 58 вариабельного домена тяжелой цепи, и
- T в позиции 108 вариабельного домена тяжелой цепи, и
- К в позиции 49 вариабельного домена легкой цепи, и
- L в позиции 98 вариабельного домена легкой цепи (все позиции согласно Kabat).
3. Гуманизированное анти-BRDU-антитело по п. 1 или 2, где указанное антитело содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую аминокислотную последовательность SEQ ID NO 09, и последовательность вариабельного домена лёгкой цепи (VL), имеющую аминокислотную последовательность SEQ ID NO 10.
4. Гуманизированное анти-BRDU-антитело по п. 1 или 2, где указанное антитело представляет собой гуманизированный вариант нечеловеческого анти-BRDU-антитела, содержащий вариабельный домен тяжелой цепи SEQ ID NO 11 и вариабельный домен легкой цепи SEQ ID NO 12.
5. Гуманизированное анти-BRDU-антитело по п. 1, где указанное антитело содержит VH с аминокислотной последовательностью SEQ ID NO 09.
6. Гуманизированное анти-BRDU-антитело по п. 1 или 2, где указанное антитело содержит VL с аминокислотной последовательностью SEQ ID NO 10.
7. Комплекс для доставки BRDU-содержащей нуклеиновой кислоты к клетке, содержащий эффективное количество гуманизированного анти-BRDU-антитела по любому из пп. 1-6 и нуклеиновую кислоту, содержащую 5-бром-2’-дезоксиуридин (BRDU).
8. Конъюгат для доставки BRDU-содержащей нуклеиновой кислоты к клетке, содержащий гуманизированное анти-BRDU-антитело по любому из пп. 2-6 и BRDU, конъюгированный с остатком цистеина.
9. Фармацевтический состав для доставки BRDU-содержащей нуклеиновой кислоты к клетке, содержащий эффективное количество гуманизированного анти-BRDU-антитела по любому из пп. 1-6 или комплекс по п. 7 или конъюгат по п. 8 и фармацевтически приемлемый носитель.
10. Применение антитела, содержащего
a) легкую цепь первого антитела, которое специфически связывается с первым антигеном, и
b) тяжелую цепь первого антитела, которое специфически связывается с первым антигеном, конъюгированную на ее C-конце с scFv или scFab, полученным из второго антитела, которое специфически связывается со вторым антигеном, где первое антитело или второе антитело представляет собой анти-BRDU-антитело по любому из пп. 1-6, при этом соответственно первый или второй антиген представляет собой BRDU, а оставшийся из первого или второго антигена представляет собой молекулу клеточной поверхности, для доставки BRDU-содержащей нуклеиновой кислоты к клетке.
11. Применение по п. 10, где анти-BRDU-антитело содержит последовательность VH, имеющую аминокислотную последовательность SEQ ID NO 09, и последовательность VL, имеющую аминокислотную последовательность SEQ ID NO 10.
12. Применение по п. 10 или 11, где анти-BRDU-антитело представляет собой гуманизированный вариант нечеловеческого анти-BRDU-антитела, содержащий вариабельный домен тяжелой цепи SEQ ID NO 11 и вариабельный домен легкой цепи SEQ ID NO 12.
| ИМИДАЗОХИНОЛИНЫ И ПРОИЗВОДНЫЕ ПИРИМИДИНА В КАЧЕСТВЕ ПОТЕНЦИАЛЬНЫХ МОДУЛЯТОРОВ VEGF-СТИМУЛИРУЕМЫХ АНГИОГЕННЫХ ПРОЦЕССОВ | 2009 |
|
RU2509558C2 |
| EA 18708 B1, 30.10.2013 | |||
| КОМПОЗИЦИЯ ФИЛЛЕРА ДЛЯ МЯГКИХ ТКАНЕЙ ДЛЯ ИНЪЕКЦИИ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2007 |
|
RU2396084C1 |
| СПОСОБ ТУШЕНИЯ ПОЖАРА И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2006 |
|
RU2319529C2 |
| Кабина транспортного средства | 1990 |
|
SU1798240A1 |
Авторы
Даты
2019-11-06—Публикация
2015-06-25—Подача