Изобретение относится к биологии и токсикологической химии, а именно к способам определения нифедипина в биологическом материале, и может быть использовано в практике химико-токсикологических, экспертно-криминалистических и клинических лабораторий. Способ относится к числу массовых.
Известен способ определения органических веществ, к которым относится нифедипин, заключающийся в том, что биологический объект измельчают, неоднократно настаивают с подкисленным этанолом (каждый раз в течение суток), отдельные извлечения объединяют, объединенное извлечение концентрируют, осаждают в нем белки и некоторые другие эндогенные вещества биоматериала абсолютным этанолом, выпавший осадок отфильтровывают, процесс концентрирования объединенного извлечения, осаждения в нем эндогенных веществ биоматериала и отделения осадка фильтрованием неоднократно повторяют до прекращения появления осадка, фильтрат сгущают до густоты сиропа, разбавляют водой и экстрагируют анализируемые соединения вначале из кислого, а затем из щелочного раствора (Швайкова М.Д. Токсикологическая химия. - М.: Медицина, 1975. - С. 119-123).
Способ трудоемок, длителен по выполнению, характеризуется низкой степенью извлечения нифедипина.
Известен способ определения нифедипина в биологическом материале (крови), который заключается в том, что биологический объект обрабатывают при перемешивании дважды по 30 минут порциями хлороформа, объем каждой из которых в два раза превышает объем биологического объекта, полученные хлороформные извлечения объединяют, в 4-5 раз упаривают при комнатной температуре в токе воздуха, доводят до определенного объема хлороформом, часть хлороформного раствора хроматографируют в тонком слое на пластине «Сорбфил» UV-254 с обращенной фазой, применяя элюент ацетонитрил-вода в отношении 6:4 по объему, в присутствии вещества-свидетеля, анализируемое вещество элюируют из сорбента хлороформом, оптическую плотность хлороформного элюата измеряют при длине волны 243 нм, а содержание нифедипина рассчитывают по величине оптической плотности (Квачахия Л.Л., Шорманов В.К. Идентификация нифедипина в биологических жидкостях // Фармация. -2013. - N 8. - C. 16-19).
Способ характеризуется недостаточно высокими чувствительностью и селективностью.
Наиболее близким является способ определения нифедипина в биологическом материале, заключающийся в том, что биологический объект измельчают, двукратно по 30 минут обрабатывают порциями органического изолирующего агента, которым является этилацетат, при условии, что масса каждой порции изолирующего агента в 2 раза превышает массу биологического объекта, полученные органические извлечения объединяют, растворитель из объединенного извлечения испаряют в токе воздуха, остаток растворяют в смеси растворителей ацетонитрил-буферный раствор с рН 3 в отношении 6:4 по объему, хроматографируют в макроколонке с сорбентом «Силасорб С-18» 30 μ, элюируя смесью растворителей ацетонитрил-буферный раствор с рН 3 в отношении 6:4 по объему, фракции элюата, содержащие анализируемое вещество, объединяют, элюент испаряют, остаток растворяют в смеси растворителей гексан - диоксан - пропанол-2 в отношении 15:5:1 по объему и проводят определение методом ВЭЖХ в аналитической колонке размерами 64×2 мм, заполненной сорбентом «Силасорб 600», с применением подвижной фазы гексан - диоксан -пропанол-2 в отношении 15:5:1 по объему, подаваемой со скоростью 100 мкл/мин, и УФ-детектора, регистрирующего оптическую плотность при 280 нм (Шорманов В.К., Квачахия Л.Л., Маркелов М.Ю., Конарева Е.Г. Определение нифедипина в биологическом материале // Судебно-медицинская экспертиза. - 2011. - Т. 54, №4. - С. 31-34).
Способ характеризуется недостаточно высокой чувствительностью определения.
Техническим результатом настоящего изобретения является повышение чувствительности определения.
Технический результат достигается тем, что биологический объект измельчают, двукратно по 30 минут обрабатывают порциями органического изолирующего агента, которым является ацетон, при условии, что масса каждой порции изолирующего агента в 2 раза превышает массу биологического объекта, полученные органические извлечения объединяют, растворитель из объединенного извлечения испаряют в токе воздуха, остаток неоднократно обрабатывают ацетоном, ацетоновые извлечения отделяют, объединяют, упаривают в токе воздуха при температуре 18-22°С до полного удаления растворителя, остаток растворяют в смеси растворителей ацетон-вода в отношении 7:3 по объему, хроматографируют в макроколонке с сорбентом «Силасорб С-18» 30 μ, элюируя смесью растворителей ацетон-вода в отношении 7:3 по объему, фракции элюата, содержащие анализируемое вещество, объединяют, элюент испаряют, остаток растворяют в смеси растворителей ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему и проводят определение методом ВЭЖХ в аналитической колонке Hibar размерами 150×4,6 мм, заполненной сорбентом Purospher STAR RP-18 endcapped, с применением подвижной фазы ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему, подаваемой со скоростью 1000 мкл/мин, и УФ-детектора, регистрирующего оптическую плотность при 250 нм.
Способ осуществляется следующим образом: биологический объект, содержащий нифедипин, измельчают, двукратно по 30 минут обрабатывают порциями органического изолирующего агента, которым является ацетон, при условии, что масса каждой порции изолирующего агента в 2 раза превышает массу биологического объекта, полученные органические извлечения объединяют, растворитель из объединенного извлечения испаряют в токе воздуха, остаток неоднократно обрабатывают ацетоном, ацетоновые извлечения отделяют, объединяют, упаривают в токе воздуха при температуре 18-22°С до полного удаления растворителя, остаток растворяют в смеси растворителей ацетон-вода в отношении 7:3 по объему, хроматографируют в макроколонке с сорбентом «Силасорб С-18» 30 μ, элюируя смесью растворителей ацетон-вода в отношении 7:3 по объему, фракции элюата, содержащие анализируемое вещество, объединяют, элюент испаряют, остаток растворяют в смеси растворителей ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему и проводят определение методом ВЭЖХ в аналитической колонке Hibar размерами 150×4,6 мм, заполненной сорбентом Purospher STAR RP-18 endcapped, с применением подвижной фазы ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему, подаваемой со скоростью 1000 мкл/мин, и УФ-детектора, регистрирующего оптическую плотность при 250 нм. Способ иллюстрируется следующими примерами.
Пример 1
Определение нифедипина (1,4-дигидро-2,6-диметил-4-(2-нитрофенил)-3,5-пиридиндикарбоновой кислоты диметилового эфира) в ткани печени
К 10 г измельченной до размеров частиц 0,2-0,5 мм ткани печени прибавляют 10 мг нифедипина, тщательно перемешивают биологический объект с веществом и оставляют на 1,5 часа при температуре 18-22°С. По истечении указанного времени биологический объект двукратно по 30 минут обрабатывают порциями органического изолирующего агента, которым является ацетон, при условии, что масса каждой порции изолирующего агента в 2 раза превышает массу биологического объекта. При этом биологический объект заливают 20 г ацетона и выдерживают 30 минут при периодическом перемешивании. Извлечение отделяют от твердых частиц биоматериала, операцию настаивания повторяют в указанных условиях.
Полученные органические извлечения объединяют, растворитель из объединенного извлечения испаряют в токе воздуха, остаток неоднократно (трижды по 3 минуты) обрабатывают порциями ацетона по 15 мл каждая при энергичном перемешивании, извлечения отделяют, объединяют, упаривают в токе воздуха при температуре 18-22°С до полного удаления растворителя, остаток растворяют в смеси ацетонитрил-вода в отношении 7:3 по объему путем обработки остатка 2,8 мл ацетонитрила и последующего прибавления к ацетонитрильному раствору 1,2 мл воды. Полученный раствор вносят в хроматографическую макроколонку размерами 490×11 мм, заполненную 7,5 г сорбента «Силасорб С-18» 30 μ, и хроматографируют, элюируя смесью растворителей ацетон-вода в отношении 7:3 по объему. Элюат собирают отдельными фракциями по 2 мл каждая.
Фракции элюата с 4 по 6 включительно, содержащие анализируемое вещество, объединяют, элюент испаряют в токе воздуха при температуре 18-22°С. Остаток растворяют в смеси растворителей ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему. Для этого остаток обрабатывают 5 мл ацетонитрила, ацетонитрильный раствор количественно переносят в мерную колбу вместимостью 10 мл и доводят до метки фосфатным буферным раствором с рН 9 (раствор А). 0,5 мл раствора А вносят в мерную колбу вместимостью 25 мл и доводят до метки смесью растворителей ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему (раствор Б).
4 мкл полученного раствора вводят в жидкостный хроматограф типа Agilent 1100.
Проводят определение, хроматографируя методом ВЭЖХ в аналитической колонке Hibar размерами 150×4,6 мм, заполненной сорбентом Purospher STAR RP-18 endcapped, с применением подвижной фазы ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему и УФ-детектора.
Скорость подачи элюента составляет 1000 мкл/мин. Температура термостата колонки составляет 20°С. Оптическую плотность регистрируют при длине волны 250 нм.
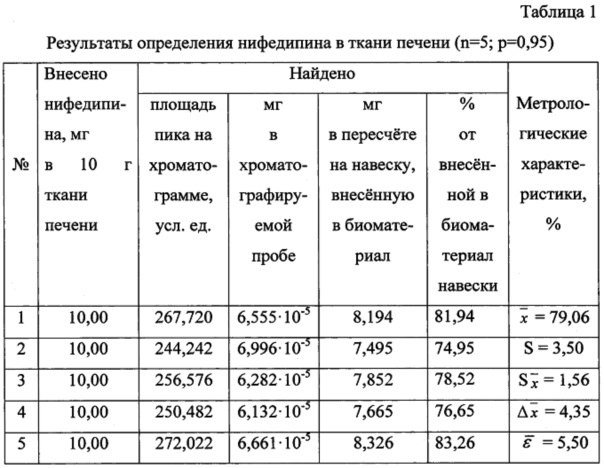
Пик на хроматограмме с временем удерживания 2,97 мин (объемом удерживания 2970 мкл) соответствует нифедипину.
Количественное содержание нифедипина определяют, исходя из площади хроматографического пика, по уравнению градуировочного графика и пересчитывают на навеску вещества, внесенную в ткань печени.
Построение градуировочного графика
В ряд мерных колб вместимостью 10 мл вносят 0,01; 0,02, 0,03; 0,08, 0,16, 0,80, 2,0, 3,2, 4,0 и 5,0 мл 0,025% раствора нифедипина в ацетонитриле, соответственно 4,99, 4,98, 4,97, 4,92, 4,84, 4,20, 3,0, 2,8, 1,0 и 0 мл ацетонитрила и доводят содержимое каждой колбы до метки фосфатным буферным раствором с рН 9. 4 мкл каждого из полученных растворов вводят в хроматограф Agilent 1100.
Хроматографирование осуществляют в аналитической колонке Hibar размерами 150×4,6 мм, заполненной сорбентом Purospher STAR RP-18 endcapped, с применением подвижной фазы ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему и УФ-детектора.
Скорость подачи элюента составляет 1000 мкл/мин. Температура термостата колонки составляет 20°С. Оптическую плотность регистрируют при длине волны 250 нм.
Пик на хроматограмме с временем удерживания 2,97 мин (объемом удерживания 2970 мкл) соответствует нифедипину.
По результатам измерений на хроматографе строят график зависимости площади хроматографического пика от концентрации определяемого вещества. График линеен в интервале концентраций 1-500 нг нифедипина в хроматографируемой пробе.
Методом наименьших квадратов рассчитывают уравнение градуировочного графика, которое в данном случае имеет вид:
S=4,073367⋅C+0,702833,
где S - площадь хроматографического пика, С - концентрация определяемого вещества в хроматографируемой пробе, нг.
Результаты количественного определения нифедипина в ткани печени представлены в таблице 1.
Пример 2
Определение нифедипина (1,4-дигидро-2,6-диметил-4-(2-нитрофенил)-3,5-пиридиндикарбоновой кислоты диметилового эфира) в ткани желудка
К 10 г измельченной (до размеров частиц 0,2-0,5 мм) ткани желудка прибавляют 10 мг нифедипина, тщательно перемешивают биологический объект с веществом и оставляют на 1,5 часа при температуре 18-22°С. По истечении указанного времени биологический объект двукратно по 30 минут обрабатывают порциями органического изолирующего агента, которым является ацетон, при условии, что масса каждой порции изолирующего агента в 2 раза превышает массу биологического объекта. При этом биологический объект заливают 20 г ацетона и выдерживают 30 минут при периодическом перемешивании. Извлечение отделяют от твердых частиц биоматериала, операцию настаивания повторяют в указанных условиях.
Полученные органические извлечения объединяют, растворитель из объединенного извлечения испаряют в токе воздуха, остаток неоднократно (трижды по 3 минуты) обрабатывают порциями ацетона по 15 мл каждая при энергичном перемешивании, извлечения отделяют, объединяют, упаривают в токе воздуха при температуре 18-22°С до полного удаления растворителя, остаток растворяют в смеси ацетонитрил-вода в отношении 7:3 по объему путем обработки остатка 2,8 мл ацетонитрила и последующего прибавления к ацетонитрильному раствору 1,2 мл воды. Полученный раствор вносят в хроматографическую макроколонку размерами 490×11 мм, заполненную 7,5 г сорбента «Силасорб С-18» 30 μ, и хроматографируют, элюируя смесью растворителей ацетон-вода в отношении 7:3 по объему. Элюат собирают отдельными фракциями по 2 мл каждая.
Фракции элюата с 4 по 6 включительно, содержащие анализируемое вещество, объединяют, элюент испаряют в токе воздуха при температуре 18-22°С. Остаток растворяют в смеси растворителей ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему. Для этого остаток обрабатывают 5 мл ацетонитрила, ацетонитрильный раствор количественно переносят в мерную колбу вместимостью 10 мл и доводят до метки фосфатным буферным раствором с рН 9 (раствор А). 0,5 мл раствора А вносят в мерную колбу вместимостью 25 мл и доводят до метки смесью растворителей ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему (раствор Б).
4 мкл полученного раствора вводят в жидкостный хроматограф типа Agilent 1100.
Проводят определение, хроматографируя методом ВЭЖХ в аналитической колонке Hibar размерами 150×4,6 мм, заполненной сорбентом Purospher STAR RP-18 endcapped, с применением подвижной фазы ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему и УФ-детектора.
Скорость подачи элюента составляет 1000 мкл/мин. Температура термостата колонки составляет 20°С. Оптическую плотность регистрируют при длине волны 250 нм.
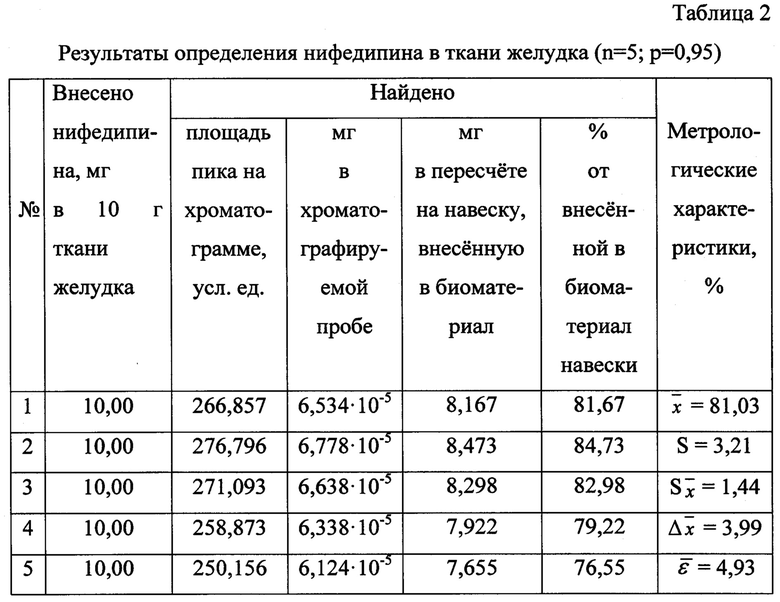
Пик на хроматограмме с временем удерживания 2,97 мин (объемом удерживания 2970 мкл) соответствует нифедипину.
Количественное содержание нифедипина определяют, исходя из площади хроматографического пика, по уравнению градуировочного графика и пересчитывают на навеску вещества, внесенную в ткань желудка.
Построение градуировочного графика и его уравнение приводятся выше в примере 1.
Результаты количественного определения нифедипина в ткани желудка представлены в таблице 2.
Пример 3
Определение нифедипина (1,4-дигидро-2,6-диметил-4-(2-нитрофенил)-3,5-пиридиндикарбоновой кислоты диметилового эфира) в ткани селезенки
К 10 г измельченной (до размеров частиц 0,2-0,5 мм) ткани селезенки прибавляют 10 мг нифедипина, тщательно перемешивают биологический объект с веществом и оставляют на 1,5 часа при температуре 18-22°С. По истечении указанного времени биологический объект двукратно по 30 минут обрабатывают порциями органического изолирующего агента, которым является ацетон, при условии, что масса каждой порции изолирующего агента в 2 раза превышает массу биологического объекта. При этом биологический объект заливают 20 г ацетона и выдерживают 30 минут при периодическом перемешивании. Извлечение отделяют от твердых частиц биоматериала, операцию настаивания повторяют в указанных условиях.
Полученные органические извлечения объединяют, растворитель из объединенного извлечения испаряют в токе воздуха, остаток неоднократно (трижды по 3 минуты) обрабатывают порциями ацетона по 15 мл каждая при энергичном перемешивании, извлечения отделяют, объединяют, упаривают в токе воздуха при температуре 18-22°С до полного удаления растворителя, остаток растворяют в смеси ацетонитрил-вода в отношении 7:3 по объему путем обработки остатка 2,8 мл ацетонитрила и последующего прибавления к ацетонитрильному раствору 1,2 мл воды. Полученный раствор вносят в хроматографическую макроколонку размерами 490×11 мм, заполненную 7,5 г сорбента «Силасорб С-18» 30 μ, и хроматографируют, элюируя смесью растворителей ацетон-вода в отношении 7:3 по объему. Элюат собирают отдельными фракциями по 2 мл каждая.
Фракции элюата с 4 по 6 включительно, содержащие анализируемое вещество, объединяют, элюент испаряют в токе воздуха при температуре 18-22°С. Остаток растворяют в смеси растворителей ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему. Для этого остаток обрабатывают 5 мл ацетонитрила, ацетонитрильный раствор количественно переносят в мерную колбу вместимостью 10 мл и доводят до метки фосфатным буферным раствором с рН 9 (раствор А). 0,5 мл раствора А вносят в мерную колбу вместимостью 25 мл и доводят до метки смесью растворителей ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему (раствор Б).
4 мкл полученного раствора вводят в жидкостный хроматограф типа Agilent 1100.
Проводят определение, хроматографируя методом ВЭЖХ в аналитической колонке Hibar размерами 150×4,6 мм, заполненной сорбентом Purospher STAR RP-18 endcapped, с применением подвижной фазы ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему и УФ-детектора.
Скорость подачи элюента составляет 1000 мкл/мин. Температура термостата колонки составляет 20°С. Оптическую плотность регистрируют при длине волны 250 нм.
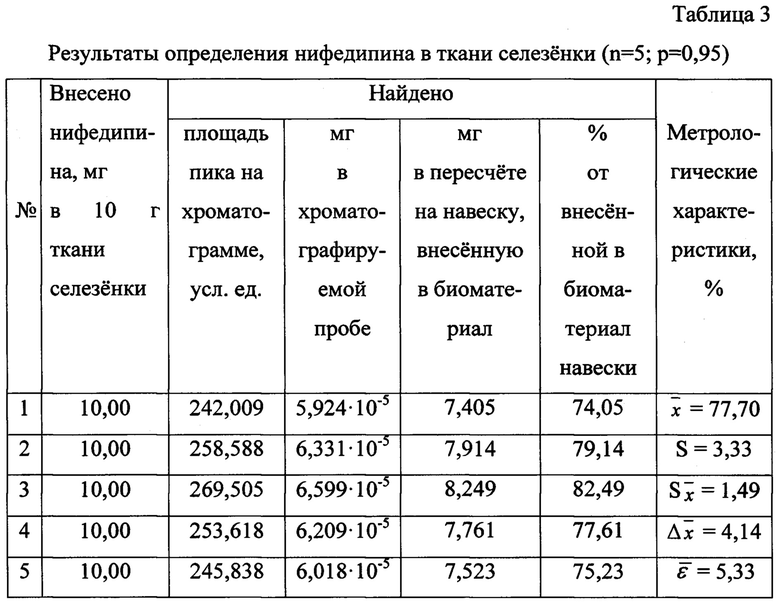
Пик на хроматограмме с временем удерживания 2,97 мин (объемом удерживания 2970 мкл) соответствует нифедипину.
Количественное содержание нифедипина определяют, исходя из площади хроматографического пика, по уравнению градуировочного графика и пересчитывают на навеску вещества, внесенную в ткань селезенки.
Построение градуировочного графика и его уравнение приводятся выше в примере 1.
Результаты количественного определения нифедипина в ткани селезенки представлены в таблице 3.
Предлагаемый способ по сравнению с прототипом в 10 раз повышает чувствительность определения в биологическом материале и в 320 раз в хроматографируемой пробе. Сравнительная характеристика предлагаемого и известного способов представлена в таблице 4.

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения нифедипина в биологическом материале | 2023 |
|
RU2812598C1 |
| Способ определения N-(бензимидазолил-2)-О-метилкарбамата в биологическом материале | 2018 |
|
RU2692127C1 |
| Способ определения 2,6-бис-[бис-(бета-оксиэтил)-амино]-4,8-ди-N-пиперидино-пиримидо(5,4-d)пиримидина в биологическом материале | 2016 |
|
RU2617176C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ 2-МЕТОКСИ-4-АЛЛИЛГИДРОКСИБЕНЗОЛА В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2011 |
|
RU2456597C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ 2-МЕТОКСИ-4-АЛЛИЛГИДРОКСИБЕНЗОЛА В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2008 |
|
RU2395081C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ О-(2,3-ДИГИДРО-2,2-ДИМЕТИЛ-7-БЕНЗОФУРАНИЛ)-N-МЕТИЛКАРБАМАТА В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2014 |
|
RU2548742C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ N-(4-НИТРО-2-ФЕНОКСИФЕНИЛ)-МЕТАНСУЛЬФОНАМИДА В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2013 |
|
RU2537121C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОКСИБЕНЗОЛА И ЕГО МОНОМЕТИЛЬНЫХ ПРОИЗВОДНЫХ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2004 |
|
RU2269137C1 |
| Способ определения О-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата и О-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-(дибутиламиносульфенил)-N-метилкарбамата в биологическом материале | 2016 |
|
RU2623070C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ Н-БУТИЛОВОГО ЭФИРА 2-[4-(5-ТРИФТОРМЕТИЛПИРИДИЛ-2-ОКСИ)ФЕНОКСИ]ПРОПИОНОВОЙ КИСЛОТЫ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2011 |
|
RU2477479C1 |
Изобретение относится к биологии и токсикологической химии. Способ определения нифедипина в биологическом материале заключается в том, что биологический объект измельчают, двукратно по 30 минут обрабатывают порциями органического изолирующего агента, которым является ацетон, полученные органические извлечения объединяют, растворитель из объединенного извлечения испаряют в токе воздуха, остаток неоднократно обрабатывают ацетоном, ацетоновые извлечения отделяют, объединяют, упаривают в токе воздуха при температуре 18-22°С до полного удаления растворителя, остаток растворяют в смеси растворителей ацетон-вода в отношении 7:3 по объему, хроматографируют в макроколонке с сорбентом «Силасорб С-18» 30 μ, элюируя смесью растворителей ацетон-вода в отношении 7:3 по объему, фракции элюата, содержащие анализируемое вещество, объединяют, элюент испаряют, остаток растворяют в смеси растворителей ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему и проводят определение методом ВЭЖХ с применением подвижной фазы ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему, подаваемой со скоростью 1000 мкл/мин, и УФ-детектора, регистрирующего оптическую плотность при 250 нм. 4 табл., 3 пр.
Способ определения нифедипина в биологическом материале, заключающийся в том, что биологический объект измельчают, двукратно по 30 минут обрабатывают порциями органического изолирующего агента при условии, что масса каждой порции изолирующего агента в 2 раза превышает массу биологического объекта, полученные органические извлечения объединяют, растворитель из объединенного извлечения испаряют в токе воздуха, остаток растворяют в смеси растворителей, хроматографируют в макроколонке с сорбентом «Силасорб С-18» 30 μ, элюируя смесью растворителей, фракции элюата, содержащие анализируемое вещество, объединяют, элюент испаряют, остаток растворяют в смеси растворителей и проводят определение методом ВЭЖХ в аналитической колонке, заполненной сорбентом, с применением подвижной фазы и УФ-детектора, регистрирующего оптическую плотность, отличающийся тем, что органическим изолирующим агентом является ацетон, остаток, полученный после испарения растворителя из объединенного извлечения, неоднократно обрабатывают ацетоном, ацетоновые извлечения отделяют, объединяют, упаривают в токе воздуха при температуре 18-22°С до полного удаления растворителя, остаток растворяют в смеси растворителей ацетон-вода в отношении 7:3 по объему, при хроматографировании в макроколонке с сорбентом «Силасорб С-18» 30 μ элюируют смесью растворителей ацетон-вода в отношении 7:3 по объему, определение методом ВЭЖХ проводят в аналитической колонке Hibar размерами 150×4,6 мм, заполненной сорбентом Purospher STAR RP-18 endcapped, с применением подвижной фазы ацетонитрил-фосфатный буферный раствор с рН 9 в отношении 5:5 по объему, которую подают со скоростью 1000 мкл/мин, а оптическую плотность регистрируют при 250 нм.
| Л.Л | |||
| Квачахия и др | |||
| ИДЕНТИФИКАЦИЯ НИФЕДИПИНА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ / Фармация, 2013, N 8, стр | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| P | |||
| Tulasamma et al | |||
| Spectrophotometric determination of nifedipine in pharmaceutical formulations, serum and urine samples via oxidative coupling reaction / Arabian Journal of Chemistry, 2016, vol | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| N | |||
| Rahman et al | |||
| Validated Spectrophotometric Method for the Assay of Nifedipine in Bulk and Commercial Dosage Forms / ScienceAsia, 2006, 32 (4), pages 429-435. | |||
Авторы
Даты
2019-04-30—Публикация
2018-06-05—Подача