Область техники
Изобретение относится к биотехнологии и медицине. Более подробно изобретение относится к области создания биорезорбируемых, биосовместимых трехмерных структур, полученных фотоотверждением смеси метакрилированного желатина и фиброина шелка Bombyx mori и предназначенных для тканевой инженерии и регенеративной медицины.
Уровень техники
Актуальность исследований в области тканевой инженерии и регенеративной медицины определяется дефицитом донорских тканей и органов, что является причиной инвалидизации и смертности населения и основным сдерживающим фактором развития трансплантологии. В открытом доступе наиболее полная статистика, касающаяся данной проблемы, представлена для США. По данным организации Donatelife America 118.000 человек в США ожидают пересадку донорских органов, 33 600 человек ее получили, 8000 умерли, не дождавшись (данные на 2016 г). Кроме того, обширные ожоги, хронические раны (трофические язвы), в США 600.000-1.500.000 случаев в год, требуют лечения путем трансплантации кожи. Использование донорского материала ограничивается его нехваткой, этическими сложностями, рисками вирусного инфицирования и иммунологического отторжения. Дефицит донорского материала и ограничения в его использовании стимулировали развитие тканевой инженерии, разрабатывающей биоискусственные заменители тканей и органов. Основа таких заменителей - структуры, имитирующие бесклеточную составляющую соединительной ткани, на поверхности Фиброин - основной компонент шелка тутового шелкопряда Bombyx mori. Он обладает рядом уникальных свойств и активно используется для разработки биомедицинских изделий различной формы и предназначения: губчатых пористых матриксов, пленок, гидрогелей, микрочастиц, трубок, электроспиннинговых волокон, повязок и пр. [Т.J. Phillips, "Current Approaches to Venous Ulcers and Compression," Dermatologic Surg., vol. 27, no. 7, pp. 611-621, Jul. 2001, M. Braddock, C.J. Campbell, and D. Zuder, "Current therapies for wound healing: electrical stimulation, biological therapeutics, and the potential for gene therapy," Int. J. Dermatol., vol. 38, no. 11, pp. 808-817, Nov. 1999, С. Harvey, "Wound healing.," Orthop. Nurs., vol. 24, no. 2, pp. 143-57-9, 2005, A. Cole-King and K.G. Harding, "Psychological factors and delayed healing in chronic wounds.," Psychosom. Med., vol. 63, no. 2, pp. 216-20, 2001, J. Walburn, K. Vedhara, M. Hankins, L. Rixon, and J. Weinman, "Psychological stress and wound healing in humans: A systematic review and meta-analysis," J. Psychosom. Res., vol. 67, no. 3, pp. 253-271, Sep. 2009.] Преимуществами фиброина являются доступность, возможность получения водных растворов, способность к биологическому разложению с образованием не токсичных продуктов распада, низкая иммуногенность, термостабильность, присутствие легкодоступных химических групп для функциональных модификаций, возможность газовой стерилизации и устойчивость к радиации, возможность создания композиционных материалов на его основе, которых могут размножаться и дифференцироваться тканеспецифичные клетки, в результате чего формируется ткань, близкая по свойствам к утраченной. Для лечения обширных и хронических ран, в частности, ран кожи, используется ауто- или аллотрансплантация кожи. В случае аутотрансплантации используется тонкий слой кожи, который включает в себя полностью эпидермис и часть дермы, который выделяют с внутренней части бедра и ягодиц и помещают на место раны. Результат лечения зависит от толщины подстилающей дермы в трансплантате. Наличие толстого слоя дермы ведет к более быстрому заживлению и лучшему эстетическому виду зажившей раны. Поскольку аутотрансплантат является собственной тканью пациента, то нет риска отторжения, однако кожа может быть взята ограниченное количество раз после заживления, поскольку каждый раз донорские участки истончаются из-за замедления регенерации дермы [М. Akan, S. Yildirim, A. Misirliolu, G. Ulusoy, Т. Akz, and G. Ave, "An Alternative Method to Minimize Pain in the Split-Thickness Skin Graft Donor Site," Plast. Reconstr. Surg., vol. 111, no. 7, pp. 2243-2249, Jun. 2003.]. Аллотрансплантация трупной кожи позволяет частично преодолеть дефицит донорского материала и наиболее широко используются при лечении ожоговых ран. Аллотрансплантаты защищают основную ткань, образуя барьер, обеспечивают образование грануляционной ткани, но служат временно из-за отторжения иммунной системой хозяина и требуют последующей аутотрансплантации. Кроме того, существует риск заражения, например, гепатитом В и С или ВИЧ. Наиболее перспективная альтернатива использованию донорской кожи - использование тканеинженерных заменителей. Тканеинженерные заменители ткани являются новым терапевтическим инструментом с широким спектром применений. Кожные заменители действуют как временное защитное покрытие раны, защищают поврежденную ткань от потери жидкости и загрязнения, ускоряя заживление ран. Тканеинженерные заменители тканей включают в свой состав аналог внеклеточного матрикса и/или клетки (клеточные композиции) [Y.М. Bello, A.F. Falabella, and W.Н. Eaglstein, "Tissue-Engineered Skin," Am. J. Clin. Dermatol., vol. 2, no. 5, pp. 305-313, 2001, S. MacNeil, "Progress and opportunities for tissue-engineered skin," Nature, vol. 445, no. 7130, pp. 874-880, Feb. 2007]. Внесение клеточного компонента в состав тканеинженерных конструкций в значительной степени усиливает их регенеративный потенциал. Важной задачей данного направления регенеративной медицины является создание новых высокотехнологичных материалов и конструкций. С развитием аддитивных технологий появилась потребность в создании новых биорезорбируемых материалов, адаптированных для 3D-печати. Трехмерная биопечать (3D-печать) возникла как гибкий инструмент для использования в различных областях регенеративной медицины. Она является относительно новой областью биотехнологии и биоинженерии и позволяет создавать жизнеспособные тканевые структуры в трехмерном пространстве [R.P. Visconti, V. Kasyanov, С. Gentile, J. Zhang, R.R. Markwald, and V. Mironov, "Towards organ printing: engineering an intra-organ branched vascular tree," Expert Opin. Biol. Ther., vol. 10, no. 3, pp. 409-420, Mar. 2010.]. 3D-печать или стереолитография - последовательное нанесение тонких слоев материала, который можно сделать твердым при помощи ультрафиолетового света. Слои наносятся в определенном порядке с образованием твердой трехмерной структуры. Этот процесс в настоящее время применяется для создания трехмерных каркасов из биологических материалов. Разработка жидких материалов позволяет выполнять прямую печать биологически совместимых каркасов, которые могут быть использованы для трансплантации или культивирования клеток [М. Nakamura, S. Iwanaga, С. Henmi, K. Arai, and Y. Nishiyama, "Biomatrices and biomaterials for future developments of bioprinting and biofabrication," Biofabrication, vol. 2, no. 1, p. 14110, Mar. 2010]. Важным преимуществом природных полимеров для 3D-биопечати является их большая биосовместимость с тканями и лучшая адгезия клеток [L. Bedian, А.М.  , G.
, G.  , R. Parra-saldivar, and H.M.N. Iqbal, "International Journal of Biological Macromolecules Bio-based materials with novel characteristics for tissue engineering applications - A review," vol. 98, pp. 837-846, 2017]. Недостатками синтетических полимеров являются плохая биосовместимость, наличие токсичных продуктов деградации и утрата механических свойств в процессе деградации. Существующие технологии позволяют осуществлять 3D-печать из синтетических материалов, таких как полимолочная кислота и ее производные, но общеизвестен факт, что биодеградация полилактатов сопровождается локальным закислением, что является причиной локального воспаления [Manavitehrani, A. Fathi, Y. Wang, Р. K. Maitz, and F. Dehghani, "Reinforced Poly(Propylene Carbonate) Composite with Enhanced and Tunable Characteristics, an Alternative for Poly(lactic Acid)," ACS Appl. Mater. Interfaces, vol. 7, no. 40, pp. 22421-22430, Oct. 2015]. Полипропиленфумарат (ППФ) является одним из наиболее широко изученных биодеградируемых полимеров, используемых в стереолитографии, считается биологически совместимым материалом для тканевой инженерии: он деградирует в пропиленгликоль и остатки фумаровой кислоты. Оба продукта разложения являются нетоксичными; фумаровая кислота является природным промежуточным продуктом в метаболизме глюкозы. Однако существуют ограничения связанные с глубиной поглощения смеси, которые могут быть ограничивающим фактором для изготовления 3D тканевой инженерии каркасов
, R. Parra-saldivar, and H.M.N. Iqbal, "International Journal of Biological Macromolecules Bio-based materials with novel characteristics for tissue engineering applications - A review," vol. 98, pp. 837-846, 2017]. Недостатками синтетических полимеров являются плохая биосовместимость, наличие токсичных продуктов деградации и утрата механических свойств в процессе деградации. Существующие технологии позволяют осуществлять 3D-печать из синтетических материалов, таких как полимолочная кислота и ее производные, но общеизвестен факт, что биодеградация полилактатов сопровождается локальным закислением, что является причиной локального воспаления [Manavitehrani, A. Fathi, Y. Wang, Р. K. Maitz, and F. Dehghani, "Reinforced Poly(Propylene Carbonate) Composite with Enhanced and Tunable Characteristics, an Alternative for Poly(lactic Acid)," ACS Appl. Mater. Interfaces, vol. 7, no. 40, pp. 22421-22430, Oct. 2015]. Полипропиленфумарат (ППФ) является одним из наиболее широко изученных биодеградируемых полимеров, используемых в стереолитографии, считается биологически совместимым материалом для тканевой инженерии: он деградирует в пропиленгликоль и остатки фумаровой кислоты. Оба продукта разложения являются нетоксичными; фумаровая кислота является природным промежуточным продуктом в метаболизме глюкозы. Однако существуют ограничения связанные с глубиной поглощения смеси, которые могут быть ограничивающим фактором для изготовления 3D тканевой инженерии каркасов
В литературе описано множество технологических приемов для получения полимерных изделий сложной формы на основе растворов фиброина шелка. Основная масса этих методов основана на получении «физически сшитого» полимера. Ключевой этап получения этого полимера - индуцирование сворачивания повторов - GAGAGS-первичной последовательности фиброина в антипараллельные бета-листы с образованием прочных кристаллических доменов. Нерастворимый в воде полимерный материал, полученный подобным образом, является «физически сшитым». Это означает, что между белковыми цепями отсутствуют ковалентные связи, а роль узлов сшивки выполняют кристаллические домены. Материал такого строения обладает превосходными механическими свойствами, формируется из водных растворов и обладает относительно невысокой скоростью деградации. Подобные методы («замораживание-оттаивание», обработка спиртами или ультразвуком) хорошо зарекомендовали для получения макроскопических изделий, таких как двумерные пленки и трехмерные пористые скаффолды, однако они не успели продемонстрировать значительных успехов в изготовлении изделий более сложной геометрии, порядок структуры которых сопоставим с размерами живых клеток (например, «микропаттернированные» поверхности).
Существует множество способов синтеза GMA, но они все представляют из себя вариации первого предложенного Van Den Bulcke et al. метода [A.I. Van Den Bulcke, B. Bogdanov, N. De Rooze, E.H. Schacht, M. Cornelissen, H. Berghmans, Structural and rheological properties of methacrylamide modified gelatin hydrogels, Biomacromolecules 1 (2000) 31-38]. Фотосшивание синтезированного GelMA может проводиться с использованием водорастворимого инициатора под ультрафиолетовым светом. Обычно используют 2-гидрокси-1-[4-(2-гидроксиэтокси)фенил]-2-метил-1-пропанон (Irgacure 2959) [.W. Nichol, S.T. Koshy, H. Bae, C.M. Hwang, S. Yamanlar, A. Khademhosseini, Cell-laden microengineered gelatin methacrylate hydrogels, Biomaterials 31 (2010) 5536-5544, J.A. Benton, C.A. DeForest, V. Vivekanandan, K.S. Anseth, Photocrosslinking of gelatin macromers to synthesize porous hydrogels that promote valvular interstitial cell function, Tissue Eng. Part A 15 (2009) 3221-3230] и литий-ацилфосфинатную соль (LAP) [B.D. Fairbanks, M.P. Schwartz, C.N. Bowman, K.S. Anseth, Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility, Biomaterials 30 (2009) 6702-6707]. Irgacure 2959, коммерчески доступный фотоинициатор, обладает растворимостью в воде не менее 5 мг/мл [J.A. Benton, B.D. Fairbanks, K.S. Anseth, Characterization of valvular interstitial cell function in three dimensional matrix metalloproteinase degradable PEG hydrogels, Biomaterials 30 (2009) 6593-6603], что является достаточно высоким значением для большинства реакций фотополимеризации, проводимых в водных средах. LAP, недавно разработанный альтернативный водорастворимый фотоинициатор, обладает более высокой растворимостью в воде (до 8,5 мас. %) и более высоким молярным коэффициентом экстинкции при 365 нм, чем Irgacure 2959 [B.D. Fairbanks, M.P. Schwartz, C.N. Bowman, K.S. Anseth, Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility, Biomaterials 30 (2009) 6702-6707].
Из уровня техники известны возможные варианты получения структур на оснвое желатина и его производных.
Из публикаций WO 2012164032 A1 «Crosslinked gelatin hydrogels», ЕР 2574349 A1 «Therapeutic use of gelatin hydrogels with a gel-sol transition at body temperature», WO 2013040559 A1 «Fabrication of gelatin hydrogel sheet for the transplantation of corneal endothelium» известны способы получения пленок на оснвое метакрилированного желатина. Несмотря на низкую стоимость реактивов, легкость получения пленок из метакрилированного желатина, такие изделия представляют собой желатиновый гидрогель и, соответственно, обладают недостаточными механическими свойствами, плохо сохраняют фиксированную форму в физиологических условиях, обладают высокой скоростью биодеградации, изменение которой возможно лишь путем химических модификаций, снижающих биосовместимость материала.
Фиброин шелка является самособирающимся структурным белком, который обладает многими важными свойствами материала для тканевой инженерии и регенеративной медицины, такие как хорошая механическая прочность, биосовместимость, высокая проницаемость растворенного кислорода и водяного пара, и сопротивление ферментативной деградации.
По сравнению с другими полимерами, важным преимуществом фиброина шелка для систем типа гидрогель является его способность физически сшиваться без каких-либо химических модификаций. Гелеобразование фиброина шелка является процессом агрегации белков, и связано с изменением конформации молекул фиброина от случайной укладки до β-листа. Механические свойства и склонность к деградации гидрогеля в значительной степени зависят от степени кристалличности и степени физической сшивки.
Раскрытие изобретения
Задачей изобретения является необходимость разработки способа формирования биорезорбируемых, биосовместимых трехмерных структур на основе метакрилированного производного желатина и структурного белка шелка - фиброина, которые могут быть использованы в тканевой инженерии и регенеративной медицине.
Гидрогели синтезированы по типу взаимопроникающих полимерных сеток (ВПС). ВПС гидрогели являются сшитыми полимерными сетками, которые способны поглощать большое количество воды и набухать до равновесного состояния. Благодаря этой способности ВПС гидрогели очень схожи с натуральными тканями и часто показывают хорошую биосовместимость.
В заявляемом изобретении фотосшиваемые ВПС гидрогели на основе метакрилированного желатина (GelMA) и фиброина шелка (FB), образованные путем последовательной полимеризации, которые обладают настраиваемыми структурными и биологическими свойствами.
Техническим результатом, достигаемым при использовании изобретения, является обеспечение возможности получения биорезорбируемых трехмерных структур с применением технологии фотополимеризации, используемой в фотополимерных 3D-принтерах. При этом обеспечивается высокая скорость фотополимеризации.
Изобретение позволит получать пористые конструкции заданной формы и с контролируемой структурой, в том числе на основе компьютерных моделей.
Заявляемый способ характеризуется простотой и технологичностью, возможностью использования недорогого и доступного сырья, что в сочетании с уникальными свойствами получаемых описанных способом структур, а именно обладающих достаточными механическими свойствами для поддержания целостности структуры в физиологических условиях, пористой структурой, обеспечивающей миграцию клеток, в том числе прогениторных и свободное проникновение растворенных питательных веществ и факторов, обеспечивает возможность получения доступного конкурентоспособного продукта.
Поставленная задача решается тем, что способ формирования биорезорбируемых трехмерных структур, согласно техническому решению, включает следующие стадии:
а) подготовку водного раствора фиброина шелка путем растворения фиброина из расчета 150-300 мг/мл в 9.3М водном растворе бромида лития в течение 5-7 часов при нагревании до 85°C±5°C и последующего диализа против воды;
б) заморозку полученного на стадии а) водного раствора фиброина в течение 12-24 часов при температуре (-18-25°C) и последующую лиофилизацию до постоянной массы;
в) получение однородного раствора желатина путем его растворения из расчета 50 мг на 1 мл в 0,1 М калий-фосфатном буфере рН 7,2 на водяной бане при 50°C и постоянном перемешивании;
г) добавление к полученному на стадии в) раствору избытка метакрилового ангидрида: не менее 50 мкл на 1 мл;
д) проведение реакции метакрилирования путем инкубации смеси, полученной на стадии г) в течение 3 часов, при постоянном перемешивании и температуре 50°C;
е) добавление к реакционной смеси, полученной после завершения этапа, описанного в пункте д), 0,1М калий-фосфатного буфера раствор рН 7,2 из расчета 1 мл на 50 мг желатина;
ж) охлаждение реакционной смеси до комнатной температуры и диализ в целлюлозных мембранах против двадцатикратного объема dH2O при постоянном перемешивании на магнитной мешалке со сменой каждый час в течение трех - пяти дней до исчезновения запаха метакрилового ангидрида;
з) заморозку полученного на стадии ж) продукта при (-18°C) и последующую лиофилизацию до достижения постоянной массы;
и) подготовку водного раствора регенерированного фиброина, полученного на стадии б), путем растворения 90-180 мг регенерированного фиброина в 1 мл дистиллированной воды при 50-60°C в течение 30-180 минут
к) подготовку раствора метакрилированного желатина, полученного на стадии з), путем растворения 180 мг метакилированного желатина в 2 мл диметилсульфоксида (ДМСО) при 50-60°C в течение 30-180 минут;
л) охлаждение раствора метакрилированного желатина, полученного на стадии к) до температуры 30-35°C;
м) получение раствора, содержащего метакрилированный желатин и фотоинициатор путем добавления к раствору, полученному на стадии л), ТРО (дифенил(2,4,6-триметилбензоил)фосфин оксид (97%)) из расчета 3 масс. %. по меткрилированному желатину;
н) получение смеси фиброина и желатина для фотоотверждения путем внесения раствора регенерированного фиброина, полученного на стадии и) в смесь метакрилированного желатина и фотоинициатора, полученную на стадии м) при постоянном перемешивании;
о) фотополимеризацию смеси, полученной на стадии н), путем облучения смеси в полипропиленовой форме светом ультрафиолетовой лампы (мощностью 36 Вт) в течение 5-15 минут.
п) индукцию перехода молекул фиброина из α-спиралей и статистического клубка в β-слои путем обработки 96%-ным этиловым спиртом гидрогелей, полученных на стадии о) при комнатной температуре в течение 1-6 часов;
р) удаление остатков растворителей путем промывки избытком дистилированной воды в течение 2-6 часов при постоянном перемешивании и смене раствора каждые 30-45 минут.
В заявляемом изобретении может быть использован фиброин шелка каркасной нити пауков, фиброин шелка тутового шелкопряда и других видов шелкопрядов, фиброин рекомбинантного шелка, а также искусственные аналоги шелка.
В качестве фотоинициатора был выбран дифенил(2,4,6-триметилбензоил)фосфин оксид (97%), являющийся высокореактивным, нерастворимым в воде соединением, применяемым для быстрого фотоотверждения, например, для лазерной стереолитографии. В ранее описанной системе с метакрилированным желатином и фиброином был использован 2-гидрокси-4'-(2-гидроксиэтокси)-2-метилпропиофенон (Irgacure 2959). Это изменение позволило сократить время требуемого УФ-облучения в 5-10 раз и осуществлять фотополимеризацию в слоях раствора толщиной до 5 мм.
Трехмерные структуры, полученные в соответствии с заявляемым изобретением могут применяться для регенерации тканей и органов, в том числе для восстановления покровных тканей организма.
Краткое описание чертежей
Изобретение поясняется чертежами.
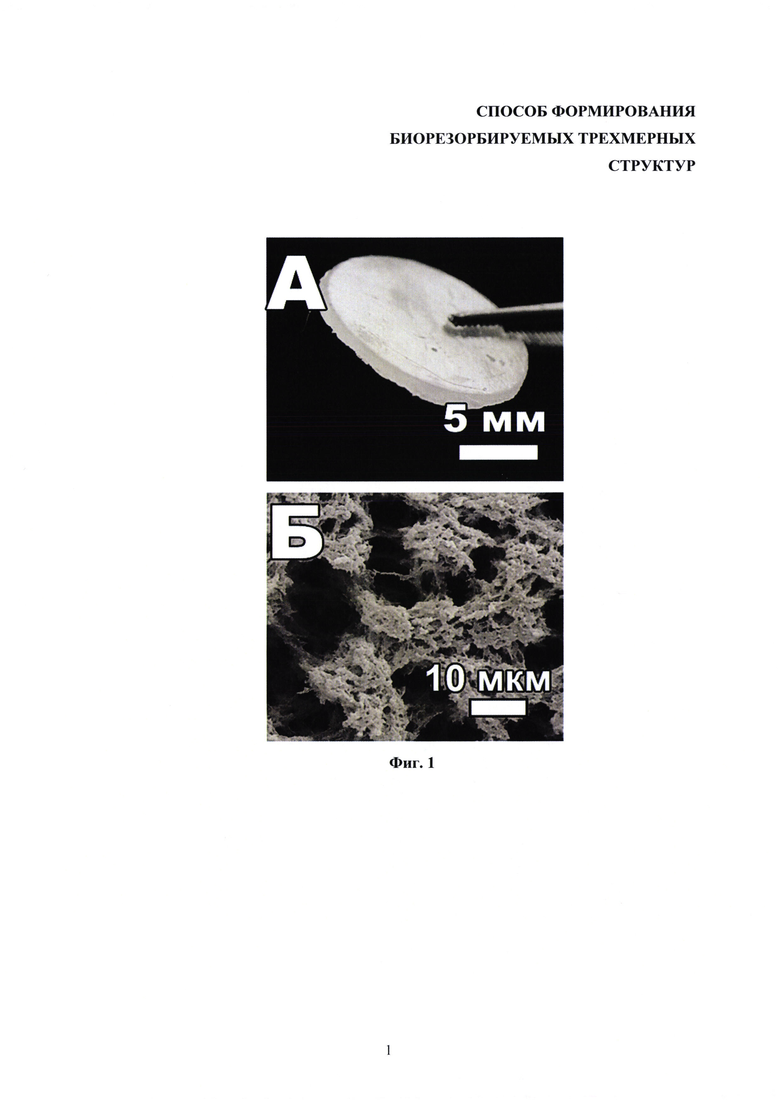
На фиг. 1 представлены: А - внешний вид трехмерной биорезорбируемой структуры на основе фиброина и метакрилированного желатина, Б - пористая структура конструкций. Изображения получены методом сканирующей электронной микроскопии.
Осуществление изобретения
Получение водного раствора фиброина шелка осуществляли с использованием Нитей хирургических нестерильных 100% натуральный шелк, произведенных по ГОСТ 396-84 (Соответствие упаковки и маркировки ГОСТу 396-84, наличие сертификата соответствия №0302120, гарантии производителя, срок годности, условия хранения по ГОСТ 396-84, сертификат соответствия), растворяя навеску в водном 9.3М растворе лития бромистого (х.ч., о.с.ч., ТУ 2154-006-00750907-2016; Соответствие упаковки и маркировки ГОСТу 3885-73, наличие гарантии производителя, срок годности, внешний вид) с последующим замораживанием в чашках Петри диаметром десять см и лиофилизацией на приборе Alpha 1-2 LDplus (Martin Christ Gefriertrocknungsanlagen GmbH, Германия) до постоянной массы. Необходимую для получения раствора с нужной концентрацией массу белка растворяли в дистиллированной воде.
Синтез метакрилированного желатина осуществляли с использованием желатина кристаллического (особо чистый, Carl Roth, Германия). Навеску кристаллического желатина (1 г) помещали в кругло донную колбу, оснащенную магнитной мешалкой, и добавляли 20 мл 0,1 М калий-фосфатного буферного раствора с рН 7,2. Растворение желатина производили на водяной бане (50°C) при постоянном перемешивании на магнитной мешалке. Итоговая концентрация раствора составляла 6 мас. %. В полученный раствор вносили избыток метакрилового ангидрида. Реакцию проводили в течение трех часов при постоянном перемешивании и нагревании (50°C). Далее к реакционной смеси добавляли 0,1 М калий-фосфатный буферный раствор с рН 7,2 (20 мл), после чего охлаждали смесь до комнатной температуры и очищали диализом в целлюлозных мембранах против двадцатикратного объема дистиллированной воды при постоянном перемешивании на магнитной мешалке со сменой каждый час в течение трех сут до исчезновения запаха метакрилового ангидрида. Продукт реакции переносили в чашку Петри, замораживали при (-18°C) и лиофилизировали на приборе Alpha 1-2 LDplus (Martin Christ Gefriertrocknungsanlagen GmbH, Германия) до достижения постоянной массы.
Смесь мономеров для фототверждения получали на основе водного раствора фиброина и метакрилированного желатина, который растворяли в диметилсульфоксиде в термошкафу при температуре 50-60°C до его полного растворения и добавляли фотоинициатор дифенил(2,4,6-триметилбензоил)фосфин оксид (97%) (3 мас. % по метакрилированному желатину). Далее по каплям при перемешивании вносили водный раствор фиброина в смесь метакрилированного желатина и фотоинициатора. Концентрация метакрилированного желатина в итоговом растворе составляла не менее 3 мас. %, а соотношение мономеров (метакрилированный желатин: фиброин) - 2:1 и 1:1.
Для получения трехмерных биорезорбируемых конструкций на основе фиброина растворы мономеров (300 мкл) вносили в полипропиленовую форму диаметром 13 мм так, чтобы образовался ровный слой. После этого фотополимеризовали в свете ультрафиолетовой лампы (мощностью 36 Вт) в течение 10 мин. Далее в формы добавляли 96%-ный этиловый спирт и выдерживали при комнатной температуре в течение одного часа. Затем отмывали растворители избытком дистилированной воды в течение двух-трех часов при постоянном перемешивании и смене раствора.
Все перечисленные выше процедуры осуществлялись с использованием следующего оборудования: Система очистки воды Elix 70, «Millipore» (Франция, система включает: картридж предварительной очистки Progard TL, картридж обратного осмоса, модуль Elix; производительность 70 л/час при температуре 7-30о С, рабочее давление 0,7-1,0 МПа, 220 В, 50 Гц, габариты (ШГВ): 662×441×733 мм, 56 кг); Резервуар для сбора очищенной воды SDS 200, «Millipore» (Франция, объем 200 л), Весы электронные RV 1502, «OHAUS» (США, (1500,00±0,01) г, 220 В, 50 Гц); Шкаф вытяжной 1200 ШВМкв (Россия, ООО «ЛаМО» макс, мощность подключаемых приборов 3,5 кВт, 220 В, габариты (ШГВ): 1280×750×2400 мм); Холодильник бытовой Атлант МХМ 1707-02 (Минск, Белоруссия, емкость камеры холодильника 175 л, температура от 0°C до 10°C, емкость мороз, камеры 115 л, температура минус 18 до минус 24°C, 220 В, 50 Гц); Баня водяная BWT-U/20, Biosan (Латвия, ванна из н/ж стали объем 20 л. Диапазон регулирования температуры от 30°C до 100°C, точность поддержания температуры ±0,1°C, внутренняя циркуляция, внутр. размеры ванны: 300×320×140 мм, габариты: 345×550×290 мм, 11 кг, 220 В, 50 Гц, 1 кВт), Термостат ТС-1/80, СКТБ (80 л, температура до +60°C, принудительная вентиляция, камера - нержавеющая сталь), Центрифуга для микропробирок Eppendorf 5418R 18×1,5/2 мл, 14000 об/мин, 16873g, с охлаждением, ротор FA-45-18-11, 18×1,5/2 мл, UV лампа BURANO® (36 W).
Ниже приведены примеры конкретного выполнения. Специалисту в данной области техники понятно, что данные примеры не являются ограничивающими изобретение, а лишь показывают возможность его реализации.
Пример 1.
Навеску хирургических шелковых нитей растворяли в 9,3 М растворе бромида лития в течение 6 часов при 80°C, затем диализовали против дистиллированной воды в течение суток с десятью сменами воды. Раствор фиброина замораживали в чашках Петри диаметром десять см и лиофилизировали на приборе Alpha 1-2 LDplus (Martin Christ Gefriertrocknungsanlagen GmbH, Германия). Необходимую для получения раствора с концентрацией 3 мас % массу белка растворяли в дистиллированной воде.
Навеску кристаллического желатина (1 г) помещали в кругл о донную колбу, оснащенную магнитной мешалкой, и добавляли 20 мл 0,1 М калий-фосфатного буферного раствора с рН 7,2. Растворение желатина производили на водяной бане (50°C) при постоянном перемешивании на магнитной мешалке. Итоговая концентрация раствора составляла 5 мас. %. В полученный раствор вносили избыток метакрилового ангидрида. Реакцию проводили в течение трех ч при постоянном перемешивании и нагревании (50°C). Далее к реакционной смеси добавляли 0,1 М калий-фосфатный буферный раствор с рН 7,2 (20 мл), после чего охлаждали смесь до комнатной температуры и очищали диализом в целлюлозных мембранах против двадцатикратного объема дистиллированной воды при постоянном перемешивании на магнитной мешалке со сменой каждый час в течение трех сут. до исчезновения запаха метакрилового ангидрида. Продукт реакции переносили в чашку Петри, замораживали при (-18°C) и лиофилизировали на приборе Alpha 1-2 LDplus (Martin Christ Gefriertrocknungsanlagen GmbH, Германия) до постоянной массы.
Навеску метакрилированного желатина растворяли в диметилсульфоксиде в термошкафу при температуре 50-60°C до его полного растворения и добавляли фотоинициатор дифенил(2,4,6-триметилбензоил)фосфин оксид (97%) (3 мас. % по метакрилированному желатину). Далее аккуратно при перемешивании приливали водный раствор фиброина. Концентрация метакрилированного желатина в итоговом растворе составляла не менее 3 мас. %, а соотношение мономеров (метакрилированный желатин: фиброин) - 1:1.
Для получения образцов трехмерных биорезорбируемх конструкций по 300 мкл растворов мономеров вносили в полипропиленовую форму диаметром 13 мм так, чтобы образовался ровный слой. После этого фотополимеризовали в свете ультрафиолетовой лампы (мощностью 36 Вт) в течение десяти мин. Далее в формы добавляли 96%-ный этиловый спирт и выдерживали при комнатной температуре в течение одного часа. Затем отмывали растворители избытком дистилированной воды в течение двух-трех часов при постоянном перемешивании и смене раствора. При необходимости дальнейшего хранения переносили гидрогелевые образцы в 70%-ный раствор этилового спирта. Полученные биорезорбируемые трехмерные структуры представлены на фиг. 1А.
Пример 2.
Исследование структуры полученных образцов.
Образцы обезвоживали в возрастающих концентрациях этилового спирта и ацетоне, затем высушивали на приборе Critical point dryer НСР-2 (Hitachi Ltd., Япония) и напыляли слоем платины толщиной 20 нм с использованием прибора IB-3 Ion Coater (Eiko Engineering Co, Япония). Полученные образцы изучали на микроскопе CamScan S2 (Cambridge Instruments, Великобритания).
Внутреннее пространство трехмерных конструкций характеризовалось пористой структурой (фиг. 1Б).
Таким образом, были получены фотоотверждаемые трехмерные структуры на основе метакрилированного желатина и фиброина шелка, которые могут быть использованы при формировании скаффолдов для тканевой инженерии, раневых покрытий, в том числе микроструктурированных.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФОРМИРОВАНИЯ БИОРЕЗОРБИРУЕМЫХ ФИБРОИНОВЫХ ПЛЕНОК С ИСПОЛЬЗОВАНИЕМ МЕТАКРИЛИРОВАННОГО ЖЕЛАТИНА | 2016 |
|
RU2645200C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОРЕЗОРБИРУЕМОЙ ТРУБКИ НА ОСНОВЕ МЕТАКРИЛИРОВАННОГО ЖЕЛАТИНА И МЕТАКРИЛИРОВАННОГО ФИБРОИНА И СПОСОБ ПОВЫШЕНИЯ СОСТОЯТЕЛЬНОСТИ КИШЕЧНОГО АНАСТОМОЗА С ИСПОЛЬЗОВАНИЕМ ТАКОЙ ТРУБКИ | 2018 |
|
RU2711545C1 |
| СПОСОБ ПОВЫШЕНИЯ СОСТОЯТЕЛЬНОСТИ КИШЕЧНОГО АНАСТОМОЗА С ИСПОЛЬЗОВАНИЕМ БИОРЕЗОРБИРУЕМОЙ ТРУБКИ НА ОСНОВЕ МЕТАКРИЛИРОВАННОГО ЖЕЛАТИНА И МЕТАКРИЛИРОВАННОГО ФИБРОИНА | 2019 |
|
RU2749871C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОРЕЗОРБИРУЕМОЙ ТРУБКИ НА ОСНОВЕ МЕТАКРИЛИРОВАННОГО ЖЕЛАТИНА И МЕТАКРИЛИРОВАННОГО ФИБРОИНА И СПОСОБ ВОССТАНОВЛЕНИЯ СТЕНКИ ТОНКОЙ КИШКИ В ЭКСПЕРИМЕНТЕ С ПОМОЩЬЮ ТАКОЙ ТРУБКИ | 2018 |
|
RU2714200C1 |
| БИОРЕЗОРБИРУЕМЫЙ МИКРОНОСИТЕЛЬ ДЛЯ ДОСТАВКИ КЛЕТОК В ОБЛАСТЬ ЗАЖИВЛЕНИЯ И РЕГЕНЕРАЦИИ РАН | 2015 |
|
RU2616866C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ КОЖНОГО ПОКРОВА | 2016 |
|
RU2658707C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ КОЖНОГО ПОКРОВА | 2016 |
|
RU2644633C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИНЕРАЛИЗОВАННЫХ КОМПОЗИТНЫХ МИКРОСКАФФОЛДОВ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2016 |
|
RU2660558C2 |
| ИМПЛАНТАТ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2017 |
|
RU2692578C1 |
| СПОСОБ АКТИВАЦИИ ПРОЦЕССА ФОТОПОЛИМЕРИЗАЦИИ БЛИЖНИМ ИНФРАКРАСНЫМ ИЗЛУЧЕНИЕМ | 2015 |
|
RU2611395C2 |
Изобретение относится к области медицины и биотехнологии. Предложен способ получения биорезорбируемых трехмерных пористых структур на основе метакрилированного желатина и фиброина шелка, включающий следующие стадии: растворение фиброина шелка в водном растворе бромида лития; заморозка водного раствора фиброина шелка и лиофилизация; растворение желатина в калий-фосфатном буфере и добавление к раствору избытка метакрилового ангидрида; проведение реакции метакрилирования желатина; добавление к реакционной смеси калий-фосфатного буфера с последующим ее охлаждением и диализом; заморозка полученного продукта и лиофилизация; получение водного раствора регенерированного фиброина шелка; получение раствора метакрилированного желатина в ДМСО и его охлаждение; добавление к раствору метакрилированного желатина фотоинициатора; внесение раствора регенерированного фиброина шелка в смесь метакрилированного желатина и фотоинициатора с последующим проведением фотополимеризации; обработка 96%-ным этиловым спиртом гидрогелей, полученных после фотополимеризации; удаление остатков растворителей. Изобретение обеспечивает высокую скорость фотополимеризации, а также возможность получения пористых конструкций заданной формы и с контролируемой структурой. 3 з.п. ф-лы, 2 пр., 1 ил.
1. Способ получения биорезорбируемых трехмерных пористых структур на основе метакрилированного желатина и фиброина шелка, включающий следующие стадии:
а) подготовка водного раствора фиброина шелка путем растворения фиброина шелка из расчета 150-300 мг/мл в 9,3М водном растворе бромида лития в течение 5-7 часов при нагревании до 85±5°С и последующего диализа против воды;
б) заморозка водного раствора фиброина шелка, полученного на стадии а), в течение 12-24 часов при температуре от -18 до -25°С с последующей лиофилизацией до постоянной массы;
в) растворение желатина из расчета 50 мг на 1 мл в 0,1М калий-фосфатном буфере с рН 7,2 на водяной бане при 50°С и постоянном перемешивании до получения однородного раствора;
г) добавление к полученному на стадии в) раствору избытка метакрилового ангидрида в количестве не менее 50 мкл на 1 мл;
д) проведение реакции метакрилирования желатина путем инкубации смеси, полученной на стадии г), в течение 3 часов при постоянном перемешивании и температуре 50°С;
е) добавление к реакционной смеси, полученной после завершения стадии д), 0,1М калий-фосфатного буфера с рН 7,2 из расчета 1 мл на 50 мг желатина;
ж) охлаждение реакционной смеси до комнатной температуры и диализ в целлюлозных мембранах против двадцатикратного объема dH2O при постоянном перемешивании на магнитной мешалке со сменой каждый час в течение 3-5 дней до исчезновения запаха метакрилового ангидрида;
з) заморозка полученного на стадии ж) продукта при -18°C с последующей лиофилизацией до постоянной массы;
и) подготовка водного раствора регенерированного фиброина шелка, полученного на стадии б), путем растворения 90-180 мг регенерированного фиброина шелка в 1 мл дистиллированной воды при 50-60°С в течение 30-180 минут;
к) подготовка раствора метакрилированного желатина, полученного на стадии з), путем растворения 180 мг метакрилированного желатина в 2 мл диметилсульфоксида (ДМСО) при 50-60°С в течение 30-180 минут;
л) охлаждение раствора метакрилированного желатина, полученного на стадии к), до температуры 30-35°С;
м) получение раствора, содержащего метакрилированный желатин и фотоинициатор, путем добавления к раствору, полученному на стадии л), фотоинициатора, представляющего собой дифенил(2,4,6-триметилбензоил)фосфин оксид (ТРО), из расчета 3% мас. по метакрилированному желатину;
н) получение смеси фиброина шелка и метакрилированного желатина для фотоотверждения путем внесения раствора регенерированного фиброина шелка, полученного на стадии и), в смесь метакрилированного желатина и фотоинициатора, полученную на стадии м) при постоянном перемешивании;
о) фотополимеризация смеси, полученной на стадии н), путем облучения указанной смеси в полипропиленовой форме светом ультрафиолетовой лампы мощностью 36 Вт в течение 5-15 минут;
п) индукция перехода молекул фиброина шелка из α-спиралей и статистического клубка в β-слои путем обработки 96%-ным этиловым спиртом гидрогелей, полученных на стадии о), при комнатной температуре в течение 1-6 часов;
р) удаление остатков растворителей путем промывки избытком дистиллированной воды в течение 2-6 часов при постоянном перемешивании и смене раствора каждые 30-45 минут.
2. Способ по п. 1, характеризующийся тем, что в смеси для фотополимеризации на стадии о) массовое соотношение метакрилированного желатина к фиброину шелка составляет 1:1.
3. Способ по п. 1, характеризующийся тем, что в смеси для фотополимеризации на стадии о) массовое соотношение метакрилированного желатина к фиброину шелка составляет 2:1.
4. Способ по п. 1, характеризующийся тем, что фотополимеризация смеси на стадии о) проводится в течение 10 минут.
| Wenqian Xiao et al | |||
| Synthesis and characterization of photocrosslinkable gelatin and silk fibroin interpenetrating polymer network hydrogels / Acta Biomater, 2011, Vol.7, N.6, pp.2384-2393 | |||
| СПОСОБ ПОЛУЧЕНИЯ БИОДЕГРАДИРУЕМОГО КОМПОЗИТНОГО МАТРИКСА НА ОСНОВЕ РЕГЕНЕРИРОВАННОГО ФИБРОИНА ШЕЛКА Bombyx mori И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2483756C1 |
| Мойсенович М.М | |||
| и др | |||
| Композитные матриксы на основе фиброина шелка, желатина и гидроксиапатита для регенеративной медицины и культивирования клеток в трехмерной культуре / Acta naturae, 2014, Т.6, N.1 (20), с.103-109 | |||
| WO 2014123761 A1, 14.08.2014 | |||
| Kan Yue et al | |||
| Synthesis, properties, and biomedical applications of gelatin methacryloyl (GelMA) hydrogels / Biomaterials, 2015, Vol.73, pp.254-271. | |||
Авторы
Даты
2019-06-18—Публикация
2017-12-29—Подача