УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
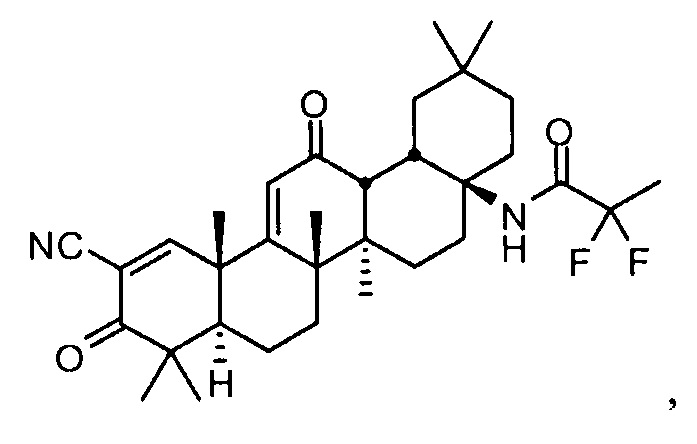
Настоящее изобретение в целом относится к соединению:
N-((4aS,6aR,6bS,8aR,12aS,14aR,14bS)-11-циано-2,2,6a,6b,9,9,12a-гептаметил-10,14-диоксо-1,2,3,4,4a,5,6,6a,6b,7,8,8a,9,10,12a,14,14a,14b-октадекагидропицен-4a-ил)-2,2-дифторпропанамиду,
также называемому RTA 408, 63415 или PP415. Настоящее изобретение также относится к его полиморфным формам, способам его приготовления и применения, его фармацевтическим композициям и наборам и изделиям его изготовления.
Описание предшествующего уровня техники
Противовоспалительная и антипролиферативная активность тритерпеноида природного происхождения, олеанолевой кислоты, была улучшена посредством химических модификаций. Например, разработаны 2-циано-3,12-диооксоолеана-1,9(11)-диен-28-оевая кислота (CDDO) и родственные соединения. См. Honda et al. 1997; Honda et al. 1998; Honda et al. 1999; Honda et al. 2000a; Honda et al. 2000b; Honda et al. 2002; Suh et al. 1998; Suh et al. 1999; Place et al. 2003; Liby et al. 2005; и Патенты США 8129429, 7915402, 8124799 и 7943778, которые все включены в данный документ посредством ссылки. Метиловый эфир, бардоксолон-метил (CDDO−Me), оценили в клинических испытаниях II и III фазы для лечения и профилактики диабетической нефропатии и хронической болезни почек. См. Pergola et al. 2011, которая включена в данный документ посредством ссылки.
Также было показано, что синтетические тритерпеноидные аналоги олеанолевой кислоты являются ингибиторами воспалительных процессов в клетках, таких как индуцирование посредством IFN-γ индуцибельной синтазы оксида азота (iNOS) и COX-2 в макрофагах мышей. См. Honda et al, (2000a), Honda et al. (2000b), Honda et al. (2002), и Патенты США 8129429, 7915402, 8124799 и 7943778, которые включены в данный документ посредством ссылки. Было показано, что соединения, производные олеанолевой кислоты, влияют на функцию многочисленных белков-мишеней и тем самым модулируют активность нескольких важных клеточных сигнальных путей, связанных с окислительным стрессом, регуляцией клеточного цикла и воспалением (напр., Dinkova-Kostova et al. 2005; Ahmad et al. 2006; Ahmad et al. 2008; Liby et al. 2007, и Патенты США 8129429, 7915402, 8124799 и 7943778).
Учитывая, что биологические характеристики активности известных тритерпеноидных производных различаются, и принимая во внимание широкий спектр заболеваний, которые можно лечить или предотвращать соединениями, обладающими мощным антиоксидантным и противовоспалительным действием, и высокую степень неудовлетворенной медицинской потребности, представленной в данном ряду заболеваний, является необходимым синтезировать новые соединения с различными биологическими профилями активности для лечения или профилактики одного или более признаков.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В некоторых аспектах настоящего изобретения предоставлено соединение формулы (также именуемое RTA 408, 63415 или PP415):
или его фармацевтически приемлемая соль.
В некоторых вариантах осуществления соединение находится в форме фармацевтически приемлемой соли. В некоторых вариантах осуществления соединение находится не в форме соли.
В другом аспекте настоящего изобретения предоставлены полиморфные формы указанного выше соединения.
В некоторых вариантах осуществления полиморфная форма является кристаллической, имеющей картину порошковой рентгеновской дифракции (CuKα), содержащую пики приблизительно на 10601, 11638, 12121, 13021, 13435, 15418, 15,760, 17830, 18753 и 19671°2θ. В некоторых вариантах осуществления паттерн порошковой рентгеновской дифракции (CuKα) по существу такой, как показано на ФИГ.53.
В некоторых вариантах осуществления полиморфная форма является кристаллической, имеющей картину порошковой рентгеновской дифракции (CuKα), содержащую пики приблизительно на 7552, 10339, 11159, 12107, 14729, 15,329, 15857, 16824, 17994, 18344, 19444, 19764, 20801 и 22414°2θ. В некоторых вариантах осуществления картина рентгеновской дифракции (CuKα) по существу такая, как показано на ФИГ.56.
В другом аспекте настоящего изобретения предоставлены фармацевтические композиции, включающие в себя эффективный ингредиент, состоящий из указанного выше соединения или его полиморфных форм (таких как, напр. любая из полиморфных форм, описанных в данном документе выше или ниже), и фармацевтически приемлемого носителя. В некоторых вариантах осуществления фармацевтическая композиция приготовлена в виде лекарственной формы для введения: перорально, интрадипозально, внутриартериально, внутрисуставно, интракраниально, интрадермально, внутрь патологического очага, внутримышечно, интраназально, интраокулярно, интраперикардиально, интраперитонеально, внутриплеврально, внутрь простаты, интраректально, интратекально, интратрахеально, интратуморально, интраумбиликально, интравагинально, внутривенно, внутрипузырно, интравитреально, липосомально, местно, мукозально, парентерально, ректально, субконъюнктивально, подкожно, сублингвально, локально, трансбуккально, трансдермально, вагинально, в кремах, в липидных композициях, через катетер, посредством лаважа, посредством продолжительной инфузии, посредством инфузии, посредством ингаляции, посредством инъекции, посредством местной доставки или посредством регионарной перфузии. В некоторых вариантах осуществления фармацевтическая композиция приготовлена в виде лекарственной формы для перорального, внутриартериального, внутривенного или локального введения. В некоторых вариантах осуществления фармацевтическая композиция приготовлена в виде лекарственной формы для перорального введения.
В некоторых вариантах осуществления фармацевтическая композиция приготовлена в виде лекарственной формы в виде твердой или мягкой капсулы, таблетки, сиропа, суспензии, твердой дисперсии, облатки или эликсира. В некоторых вариантах осуществления фармацевтическая композиция в соответствии с изобретением дополнительно включает в себя агент, который усиливает растворимость и диспергируемость. В некоторых вариантах осуществления соединение или полиморфная форма суспендирована в кунжутном масле.
В других вариантах осуществления фармацевтическая композиция приготовлена в виде лекарственной формы для локального введения. В других вариантах осуществления фармацевтическая композиция приготовлена в виде лекарственной формы в виде лосьона, крема, геля, масла, мази, бальзама или суспензии. В некоторых вариантах осуществления фармацевтическая композиция приготовлена в виде лекарственной формы в виде лосьона, в виде крема или в виде геля. В некоторых вариантах осуществления количество активного ингредиента составляет от приблизительно 0,01% до приблизительно 5% по массе, от приблизительно 0,01% до приблизительно 3% по массе или 0,01%, 0,1%, 1% или 3% по массе.
В другом аспекте настоящего изобретения предоставлены способы лечения или профилактики патологического состояния, ассоциированного с воспалением или окислительным стрессом у нуждающегося в этом пациента, включающие в себя введение пациенту терапевтически эффективного количества фармацевтической композиции, как описано выше или ниже. Изобретение таким же образом относится к соединению N-((4aS,6aR,6bS,8aR,12aS,14aR,14bS)-11-циано-2,2,6a,6b,9,9,12a-гептаметил-10,14-диоксо-1,2,3,4,4a,5,6,6a,6b,7,8,8a,9,10,12a,14,14a,14b-октадекагидропицен-4a-ил)-2,2-дифторпропанамиду (или RTA 408, 63415 или PP415) или его фармацевтически приемлемой соли или полиморфной форме данного соединения (такой как, напр., любая из полиморфных форм, описанных в данном документе выше или ниже) или фармацевтической композиции, включающей в себя любое из упомянутых выше соединений и фармацевтически приемлемому носителю (включая, напр. фармацевтические композиции, описанные выше), для применения в лечении или профилактике патологического состояния, ассоциированного с воспалением или окислительным стрессом. Изобретение также относится к применению упомянутого выше соединения, полиморфной формы или фармацевтической композиции для приготовления лекарственного препарата для лечения или профилактики патологического состояния, ассоциированного с воспалением или окислительным стрессом. В некоторых вариантах осуществления патологическое состояние ассоциировано с воспалением. В других вариантах осуществления патологическое состояние ассоциировано с окислительным стрессом. В некоторых вариантах осуществления патологическое состояние представляет собой кожное заболевание или расстройство, сепсис, дерматит, остеоартрит, рак, воспаление, аутоиммунное заболевание, воспалительное заболевание кишечника, осложнение локального или общего воздействия ионизирующего излучения, воспаление слизистой оболочки ротовой полости, острую или хроническую органную недостаточность, заболевание печени, панкреатит, заболевания глаз, болезнь легких или диабет.
Настоящее изобретение также относится к соединению N-((4aS,6aR,6bS,8aR,12aS,14aR,14bS)-11-циано-2,2,6a,6b,9,9,12a-гептаметил-10,14-диоксо-1,2,3,4,4a,5,6,6a,6b,7,8,8a,9,10,12a,14,14a,14b-октадекагидропицен-4a-ил)-2,2-дифторпропанамиду (или RTA 408) или его фармацевтически приемлемой соли или полиморфной форме данного соединения (такой как, напр., любая из полиморфных форм, описанных в данном документе выше или ниже) или фармацевтической композиции, включающей в себя любое из упомянутых выше соединений и фармацевтически приемлемый носитель (включая, напр. фармацевтические композиции, описанные выше), для применения в лечении или профилактике патологического состояния, выбранного из кожного заболевания или расстройства, сепсиса, дерматита, остеоартрита, рака, воспаления, аутоиммунного заболевания, воспалительного заболевания кишечника, осложнения локального или общего воздействия ионизирующего излучения, воспаления слизистой оболочки ротовой полости, острой или хронической органной недостаточности, заболевания печени, панкреатита, заболевания глаз, болезни легких или диабета. Соответственно, изобретение относится к применению упомянутого выше соединения, полиморфной формы или фармацевтической композиции для приготовления лекарственного препарата для лечения или профилактики патологического состояния, выбранного из кожного заболевания или расстройства, сепсиса, дерматита, остеоартрита, рака, воспаления, аутоиммунного заболевания, воспалительного заболевания кишечника, осложнения локального или общего воздействия ионизирующего излучения, воспаления слизистой оболочки ротовой полости, острой или хронической органной недостаточности, заболевания печени, панкреатита, заболевания глаз, болезни легких или диабета. Изобретение также относится к способу лечения или профилактики патологического состояния, выбранного из кожного заболевания или расстройства, сепсиса, дерматита, остеоартрита, рака, воспаления, аутоиммунного заболевания, воспалительного заболевания кишечника, осложнения локального или общего воздействия ионизирующего излучения, воспаления слизистой оболочки ротовой полости, острой или хронической органной недостаточности, заболевания печени, панкреатита, заболевания глаз, болезни легких или диабета у нуждающегося в этом пациента, при этом способ включает введение пациенту терапевтически эффективного количества упомянутого выше соединения, полиморфной формы или фармацевтической композиции.
В некоторых вариантах осуществления патологическое состояние представляет собой кожное заболевание или нарушение, такое как дерматит, термический или химический ожог, хроническая рана, акне, алопеция, другие нарушения волосяного фолликула, буллезный эпидермолиз, солнечный ожог, осложнения солнечного ожога, нарушения пигментации кожи, связанное с возрастом патологическое состояние кожи; послеоперационная рана, рубец в результате повреждения кожи или ожога, псориаз, дерматологическая манифестация аутоиммунных заболеваний или реакции «трансплантант против хозяина», рак кожи; или нарушение, связанное с гиперпролиферацией клеток кожи. В некоторых вариантах осуществления кожное заболевание или нарушение представляет собой дерматит. В некоторых вариантах осуществления дерматит представляет собой аллергический дерматит, атопический дерматит, дерматит вследствие химического воздействия или дерматит, индуцированный излучением. В других вариантах осуществления кожное заболевание или нарушение представляет собой хроническую рану. В некоторых вариантах осуществления хроническая рана представляет собой диабетическую язву, пролежень или венозную язву. В других вариантах осуществления кожное заболевание или нарушение представляет собой алопецию. В некоторых вариантах осуществления алопеция выбрана из облысения или лекарственно-индуцированной алопеции. В других вариантах осуществления кожное заболевание или нарушение представляет собой нарушение пигментации кожи. В некоторых вариантах осуществления нарушение пигментации кожи представляет собой витилиго. В других вариантах осуществления кожное заболевание или нарушение представляет собой нарушение, связанное с гиперпролиферацией клеток кожи. В некоторых вариантах осуществления нарушение, связанное с гиперпролиферацией клеток кожи, представляет собой гиперкератоз.
В других вариантах осуществления патологическое состояние представляет собой аутоиммунное заболевание, такое как ревматоидный артрит, волчанка, болезнь Крона или псориаз. В других вариантах осуществления патологическое состояние представляет собой заболевание печени, такое как жировой гепатоз или гепатит.
В других вариантах осуществления патологическое состояние представляет собой заболевания глаз, такие как увеит, макулярная дегенерация, глаукома, диабетический макулярный отек, блефарит, диабетическая ретинопатия, заболевание или нарушение эндотелия роговицы, послеоперационное воспаление, сухость глаз, аллергический конъюнктивит или форма конъюнктивита. В некоторых вариантах осуществления заболевание глаз представляет собой макулярную дегенерацию. В некоторых вариантах осуществления макулярная дегенерация представляет собой сухую форму. В других вариантах осуществления макулярная дегенерация представляет собой влажную форму. В некоторых вариантах осуществления заболевание или нарушение эндотелия роговицы представляет собой эндотелиальную дистрофию роговицы Фукса.
В других вариантах осуществления патологическое состояние представляет собой заболевание легких, такое как воспаление легких, фиброз легких, ХНЗЛ, астма, муковисцидоз или идиопатический фиброз легких. В некоторых вариантах осуществления ХНЗЛ индуцировано сигаретным дымом.
В других вариантах осуществления патологическое состояние представляет собой сепсис. В других вариантах осуществления патологическое состояние представляет собой мукозит вследствие лучевой терапии или химиотерапии. В некоторых вариантах осуществления имеет место мукозит ротовой полости. В других вариантах осуществления патологическое состояние связано с воздействием излучения. В некоторых вариантах осуществления облучение вызывает дерматит. В некоторых вариантах осуществления воздействие излучения является сильным. В других вариантах осуществления воздействие излучения является фракционированным.
В других вариантах осуществления патологическое состояние представляет собой рак. В некоторых неограничивающих вариантах осуществления рак представляет собой лейкоз, лимфому, множественную миелому или рак молочной железы, кожи, легкого, поджелудочной железы, печени, желудка, тонкой кишки, толстой или ободочной, кишки, желчного пузыря, пищевода, яичников, эндометрия, шейки матки, слизистой оболочки ротовой или носовой полости, головного мозга, простаты, мочевого пузыря, мочеполовой системы, яичка, почки, половых органов, щитовидной железы или мышечной ткани. В некоторых вариантах осуществления рак представляет собой карциному или саркому.
В некоторых вариантах осуществления соединение или композицию изобретения вводят перед или сразу после лечения больного лучевой терапией, химиотерапией или и тем и другим. В некоторых вариантах осуществления соединение или композицию изобретения вводят как перед, так и после лечения больного лучевой терапией, химиотерапией или и тем и другим. В некоторых вариантах осуществления действие композиции изобретения состоит в снижении побочных эффектов лучевой терапии, химиотерапии или комбинированной лучевой и химиотерапии, включая воспаление слизистой оболочки ротовой полости и дерматит. В некоторых вариантах осуществления действие композиции изобретения состоит в повышении эффективности лучевой терапии, химиотерапии или комбинированной лучевой и химиотерапии. В некоторых вариантах осуществления действие композиции изобретения состоит в уменьшении побочных эффектов и повышении эффективности лучевой терапии, химиотерапии или комбинированной лучевой и химиотерапии.
Также настоящим раскрытием предусматривается комбинированное лечение. Например, что касается способов лечения рака у больного, включающих в себя введение больному фармацевтически активного количества соединения настоящего раскрытия, способ может дополнительно включать в себя лечение, выбранное из группы, состоящей из введения фармацевтически активного количества второго лекарственного препарата, лучевой терапии, генной терапии и операции. Такие способы могут дополнительно включать в себя (1) контактирование опухолевой клетки с соединением перед контактированием опухолевой клетки со вторым лекарственным препаратом, (2) контактирование опухолевой клетки со вторым лекарственным препаратом перед контактированием опухолевой клетки с соединением или (3) одновременное контактирование опухолевой клетки с соединением и вторым лекарственным препаратом. В определенных вариантах осуществления второй лекарственный препарат может представлять собой антибиотик, противовоспалительный, противоопухолевый, антипролиферативный, противовирусный, иммуномодулирующий или иммуносупрессивный препарат. Второй лекарственный препарат может представлять собой алкилирующий агент, модулятор андрогеновых рецепторов, вещество, разрушающее цитоскелет, модулятор эстрогеновых рецепторов, ингибитор гистондеацетилазы, ингибитор HMG-CoA-редуктазы, ингибитор пренилпротеинтрансферазы, модулятор ретиноидных рецепторов, ингибитор топоизомеразы или ингибитор тирозинкиназы. В определенных вариантах осуществления второй лекарственный препарат представляет собой 5-азацитидин, 5-фторурацил, 9-цис-ретиноевую кислоту, актиномицин D, алитретиноин, политрансретиноевую кислоту, аннамицин, акситиниб, белиностат, бевацизумаб, бексаротен, босутиниб, бусульфан, капецитабин, карбоплатин, кармустин, CD437, цедираниб, цетуксимаб, хлорамбуцил, цисплатин, циклофосфамид, цитарабин, дакарбазин, дазатиниб, даунорубицин, децитабин, доцетаксел, доластатин-10, доксифлуридин, доксорубицин, доксорубицин, эпирубицин, эрлотиниб, этопозид, этопозид, гефитиниб, гемцитабин, гемтузумаб озогамицин, гексаметилмеламин, идарубицин, ифосфамид, иматиниб, иринотекан, изотретиноин, иксабепилон, лапатиниб, LBH589, ломустин, мехлоретамин, мелфалан, меркаптопурин, метотрексат, митомицин, митоксантрон, MS-275, нератиниб, нилотиниб, нитрозомочевина, оксалиплатин, паклитаксел, пликамицин, прокарбазин, семаксаниб, семустин, натрия бутират, натрия фенилацетат, стрептозоцин, субероиланилид гидроксамовой кислоты, сунитиниб, тамоксифен, тенипозид, тиопету, тиогуанин, топотекан, TRAIL, трастузумаб, третиноин, трихостатин A, вальпроевую ксилоту, валрубицин, вандетаниб, винбластин, винкристин, виндезин или винорелбин.
Также рассматриваются способы лечения или профилактики заболевания с воспалительным компонентом у больного, включающие в себя введение больному фармацевтически активного количества соединения настоящего раскрытия. Заболевание может представлять собой, например, волчанку или ревматоидный артрит. Заболевание может представлять собой воспалительное заболевание кишечника, такое как болезнь Крона или неспецифический язвенный колит. Заболевание с воспалительным компонентом может представлять собой сердечно-сосудистое заболевание. Заболевание с воспалительным компонентом может представлять собой диабет, такой как диабет 1 типа или 2 типа. Применять RTA 408 можно также для лечения осложнений, ассоциированных с диабетом. Такие осложнения являются хорошо известными в данной области и включают, например, ожирение, гипертензию, атеросклероз, ишемическую болезнь сердца, инсульт, болезнь периферических сосудов, гипертензию, нефропатию, нейропатию, некроз мышц, ретинопатию и метаболический синдром (синдром X). Заболевание с воспалительным компонентом может представлять собой кожное заболевание, такое как псориаз, акне или атопический дерматит. Введение RTA 408 в способах лечения данных кожных заболеваний может быть, например, местным или пероральным.
Заболевание с воспалительным компонентом может представлять собой метаболический синдром (синдром X). Пациент, имеющий данный синдром, характеризуется наличием трех или более симптомов, выбранных из следующей группы из пяти симптомов: (1) абдоминальное ожирение; (2) гипертриглицеридемия; (3) низкий холестерин липопротеинов высокой плотности (HDL); (4) высокое артериальное давление; и (5) повышенный уровень глюкозы крови натощак, который может находиться в диапазоне, характерном для диабета 2 типа, если у пациента также имеется диабет. Каждый из данных симптомов определен в третьем докладе группы экспертов Национальной образовательной программы по холестерину об определении, оценке и лечении высокого уровня холестерина крови у взрослых (Adult Treatment Panel III или ATP III), National Institutes of Health, 2001, NIH Publication №01-3670, включенном в данный документ посредством ссылки. Пациенты с метаболическим синдромом, независимо от наличия клинически выраженного сахарного диабета или он у них развивается, имеют повышенный риск развития макрососудистых и микрососудистых осложнений, которые перечислены выше, которые возникают при диабете 2 типа, такие как атеросклероз и ишемическая болезнь сердца.
Другой общий способ настоящего раскрытия влечет за собой способ лечения или профилактики сердечно-сосудистого заболевания у больного, включающий введение больному фармацевтически активного количества соединения настоящего раскрытия. Сердечно-сосудистое заболевание может представлять собой, например, атеросклероз, кардиомиопатию, врожденный порок сердца, застойную сердечную недостаточность, миокардит, ревматическое поражение сердца, поражение клапанов, ишемическую болезнь сердца, эндокардит или инфаркт миокарда. Для таких способов также предусматривается комбинированная терапия. Например, такие способы могут дополнительно включать в себя введение фармацевтически активного количества второго лекарственного препарата. Второй лекарственный препарат может представлять собой, например, препарат, снижающий холестерин, антигиперлипидемический препарат, блокатор кальциевых каналов, антигипертензивный препарат или ингибитор HMG-CoA-редуктазы. Неограничивающие примеры вторых лекарственных препаратов включают амлодипин, аспирин, эзетимиб, фелодипин, лацидипин, леркандипин, никардипин, нифедипин, нимодипин, нисолдипин или нитрендипин. Другие неограничивающие примеры вторых лекарственных препаратов включают атенолол, буциндолол, карведилол, клонидин, доксазозин, индорамин, лабеталол, метилопа, метопролол, надолол, окспренолол, феноксибензамин, фентоламин, пиндолол, празозин, пропранолол, теразозин, тимолол или толазолин. Второй лекарственный препарат может представлять собой, например, статин, такой как аторвастатин, церивастатин, флувастатин, ловастатин, мевастатин, питавастатин, правастатин, розувастатин или симвастатин.
Также рассматриваются способы лечения или профилактики нейродегенеративного заболевания у больного, включающие в себя введение больному фармацевтически активного количества соединения настоящего раскрытия. Нейродегенеративное заболевание может, например, быть выбрано из группы, состоящей из болезни Паркинсона, болезни Альцгеймера, рассеянного склероза (MS), хореи Хантингтона и бокового амиотрофического склероза. В конкретных вариантах осуществления нейродегенеративное заболевание представляет собой болезнь Альцгеймера. В конкретных вариантах осуществления нейродегенеративное заболевание представляет собой MS, такой как первичный прогрессирующий, возвратно-ремиттирующий вторичный прогрессирующий или прогрессирующе-рецидивирующий MS. Пациентом может быть, например, примат. Пациентом может быть человек.
В особых вариантах осуществления способов лечения или профилактики нейродегенеративного заболевания у больного, включающих в себя введение больному фармацевтически активного количества соединения настоящего раскрытия, лечение подавляет демиелинизацию нейронов в головном мозге или спинном мозге больного. В определенных вариантах осуществления лечение подавляет воспалительную демиелинизацию. В определенных вариантах осуществления лечение подавляет фрагментацию аксонов нейронов в головном мозге или спинном мозге больного. В определенных вариантах осуществления лечение подавляет фрагментацию нейритов в головном мозге или спинном мозге больного. В определенных вариантах осуществления лечение подавляет апоптоз нейронов в головном мозге или спинном мозге больного. В определенных вариантах осуществления лечение стимулирует ремиелинизацию аксонов нейронов в головном мозге или спинном мозге больного. В определенных вариантах осуществления лечение восстанавливает утеряную функцию после атаки MS. В определенных вариантах осуществления лечение предотвращает новую атаку MS. В определенных вариантах осуществления лечение предотвращает инвалидность вследствие атаки MS.
Один общий аспект настоящего раскрытия предусматривает способ лечения или профилактики нарушения, характеризующегося сверхэкспрессией генов iNOS у больного, включающий в себя введение больному фармацевтически активного количества соединения настоящего раскрытия.
Другой общий аспект настоящего раскрытия предусматривает способ ингибирования IFN-γ-индуцированной продукции оксида азота в клетках больного, включающий в себя введение указанному больному фармацевтически активного количества соединения настоящего раскрытия.
Другой общий способ настоящего раскрытия предусматривает способ лечения или профилактики нарушения, характеризующегося сверхэкспрессией генов COX-2 у больного, включающий в себя введение больному фармацевтически активного количества соединения настоящего раскрытия.
Также рассматриваются способы лечения ренального/почечного заболевания (RKD) у больного, включающие в себя введение больному фармацевтически активного количества соединения настоящего раскрытия. См. патентную заявку США серийный № 12/352473, которая включена в данный документ посредством ссылки во всей своей полноте. RKD может быть следствием, например, токсического повреждения. Токсическое повреждение может быть следствием, например, радиофармацевтического агента или лекарственного препарата. Лекарственный препарат может представлять собой, например, химиотерапевтический препарат. В определенных вариантах осуществления RKD может быть следствием ишемически-реперфузионного повреждения. В определенных вариантах осуществления RKD является следствием диабета или гипертензии. RKD может быть следствием аутоиммунного заболевания. RKD можно дополнительно определить как хроническое RKD или острое RKD.
В определенных способах лечения ренального/почечного заболевания (RKD) у больного, включающих в себя введение больному фармацевтически активного количества соединения настоящего раскрытия, больного подвергают или он проходит курс диализа. В определенных вариантах осуществления больного подвергают или он становится кандидатом на проведение трансплантации почки. Пациентом может быть примат. Приматом может быть человек. При данном или любом другом способе пациентом может быть, например, корова, лошадь, собака, кошка, свинья, мышь, крыса или морская свинка.
Также настоящим раскрытием предусматривается способ улучшения скорости клубочковой фильтрации или креатининового клиренса у больного, включающий в себя введение больному фармацевтически активного количества соединения настоящего раскрытия.
В некоторых вариантах осуществления фармацевтическую композицию вводят в виде единственной дозы в день. В других вариантах осуществления фармацевтическую композицию вводят более чем один раз в день. В некоторых вариантах осуществления фармацевтическую композицию вводят в фармацевтически активном количестве.
В некоторых вариантах осуществления эффективный ингредиент вводят в дозе от приблизительно 1 мг/кг до приблизительно 2000 мг/кг. В других вариантах осуществления доза составляет от приблизительно 3 мг/кг до приблизительно 100 мг/кг. В других вариантах осуществления доза составляет приблизительно 3, 10, 30 или 100 мг/кг.
В других вариантах осуществления фармацевтическую композицию вводят местно. В некоторых вариантах осуществления местное введение осуществляют в кожу. В других вариантах осуществления местное введение осуществляют в глаз.
В других вариантах осуществления фармацевтическую композицию вводят перорально. В других вариантах осуществления фармацевтическую композицию вводят интраокулярно.
Другие цели, признаки и преимущества настоящего раскрытия станут более очевидны из следующего подробного описания. Однако должно быть понятно, что подробное описание и конкретные примеры, показывающие конкретные варианты осуществления изобретения, приведены только в качестве иллюстрации, поскольку различные изменения и модификации в пределах сущности и объема правовых притязаний изобретения станут более очевидны квалифицированным специалистам в данной области из данного подробного описания. Следует заметить, что просто от того, что конкретное соединение отнесено к одной конкретной общей формуле, это не означает, что оно не может также относиться к другой общей формуле.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующие чертежи образуют часть представленного описания и включены для дополнительной демонстрации некоторых аспектов настоящего раскрытия. Изобретение может быть более понятным посредством ссылки на один из данных чертежей в комбинации с подробным описанием конкретных вариантов осуществления, представленных в данном документе.
ФИГ.1 - Действие RTA 408 на IFNγ-индуцированную выработку оксида азота и жизнеспособность клеток в клетках RAW264.7.
ФИГ.2 a и b - Действие RTA 408 на активацию антиоксидантного ответного элемента: (a) NQO1-ARE люциферазная активность; (b) GSTA2-ARE люциферазная активность.
ФИГ.3 a-d - Действие RTA 408 на экспрессию гена-мишени Nrf2 в HFL1 фибробластах легкого: (a) NQO1; (b) HMOX1; (c) GCLM; (d) TXNRD1.
ФИГ.4a-d - Действие RTA 408 на экспрессию гена-мишени Nrf2 в BEAS-2B эпителиальных клетках бронхов: (a) NQO1; (b) HMOX1; (c) GCLM; (d) TXNRD1.
ФИГ.5 a и b - Действие RTA 408 на Nrf2 уровни белка-мишени: (a) клеток SH-SY5Y; (b) клеток BV2.
ФИГ.6 - Действие RTA 408 на ферментативную активность NQO1 в клетках RAW264.7.
ФИГ.7 - Действие RTA 408 на уровни общего глутатиона в клеточной линии гепатоцитов AML-12.
ФИГ.8 - Действие RTA 408 на поглощение WST-1 в качестве маркера NADPH.
ФИГ.9 a-d - Действие RTA 408 на экспрессию генов, участвующих в синтезе NADPH: (a) H6PD; (b) PGD; (c) TKT; (d) ME1.
ФИГ.10 - Действие RTA 408 на TNFα-индуцированную активацию NF-κB люциферазного репортерного конструкта.
ФИГ.11 - Действие RTA 408 на TNFα-индуцированное фосфорилирование IκBα.
ФИГ.12 a-d - Действие RTA 408 на экспрессию гена трансаминазы: (a) ALT1 (GPT1); (b) ALT2 (GPT2); (c) AST1 (GOT1); (d) AST1 (GOT2). Звездочки указывают на статистически значимое различие с контрольной группой (*P<0,05; **P<0,01).
ФИГ.13 - Действие RTA 408 на уровни пирувата в культивируемых мышечных клетках (*P<0,05).
ФИГ.14 - Активность RTA 408 в модели LPS-опосредованного воспаления легких (% изменение в провоспалительных цитокинов относительно лечения LPS). RTA 408 вводили самкам мышей BALB/c QD×3 в момент времени 0, 24, и 48 часов с последующим введением LPS через час после последней дозы RTA 408. Животные были умервщлены через 20 часов после введения LPS. BALF исследовали на экспрессию провоспалительных цитокинов. RTA 408 снижал провоспалительные цитокины: наблюдали дозозависимое снижение с уменьшением пиков, варьирующим от 50%-80% в TNF, IL-6 и IL-12.
ФИГ.15 a и b - Действие RTA 408 на LPS-индуцированное воспаление легких у мыши: (a) воспалительные цитокины; (b) Nrf2 мишени. Способы: RTA 408 вводили самкам мышей BALB/c (n=10) QD×6 в момент времени 0, 24, 48, 72, 96 и 120 часов с последующим LPS через 121 час с умервщлением животных на 141 час. Проводили анализ BALF на экспрессию белка провоспалительных цитокинов; проводили анализ биомаркеров Nrf2 в легком. Звездочки указывают на статистически значимое различие с контрольной группой раствора хлорида натрия (*P<0,05; **P<0,01; ***P<0,001).
ФИГ.16 a и b - RTA 408 уменьшает инфильтраты BALF при блеомицин-индуцированном воспалении легких: (a) количество клеток в жидкости бронхоальвеолярного лаважа; (b) масса тела. RTA 408 вводили мышам C57BL/6 QD×39 в дни с -10 до 28. Блеомицин был дан на день 0. Ежеднедневно измеряли массу. Количество клеток в жидкости бронхоальвеолярного лаважа получали при умервщлении. Наблюдалась значительная редукция воспалительного инфильтрата. Не наблюдалось значительного улучшения в оценке хронического воспаления, интерстициального фиброза или количестве очагов фиброза.
ФИГ.17 a и b - Действие RTA 408 на блеомицин-индуцированный фиброз легких у крыс: (a) PMN; (b) Гидроксипролин. Звездочки указывают на статистически значимое различие с контрольной группой блеомицина (*P<0,05).
ФИГ.18 - Действие RTA 408 на Nrf2 ферменты-мишени в легких крыс с блеомицин-индуцированным фиброзом легких. Звездочки указывают на статистически значимое различие с контрольной группой раствора хлорида натрия (*P<0,05; **P<0,01; ***P<0,001).
ФИГ.19 a-e - Действие RTA 408 на индуцированное сигаретным дымом ХНЗЛ у мышей: (a) KC; (b) IL-6; (c) TNF-α; (d) IFN-γ; (e) RANTES. RTA 408 (63415) тестировали при уровнях доз, составивших 3 мг/кг (низкая), 10 мг/кг (средняя) и 30 мг/кг (высокая). В том же исследовании для сравнения тестировали аналог AIM (63355). Звездочки указывают на статистически значимое различие с контрольной группой CS.
ФИГ.20 - Действие RTA 408 на ферменты-мишени Nrf2 в легких мышей с индуцированным сигаретным дымом ХНЗЛ. Звездочки указывают на статистически значимое различие с контрольной группой раствора хлорида натрия (*P<0,05; **P<0,01; ***P<0,001). Крестики представляют статистически значимое различие с мышами, подвергавшимися воздействию сигаретного дыма и вводимого носителя (†P<0,05).
ФИГ.21 a-d - показывают массу тела в качестве функции времени мышей BALB/c, обработанных 63415, которые служили в качестве модели сепсиса. LPS вводили всем животным на день 0. (a) Масса тела: 63415, (b) Масса тела: RTA 405, (c) Системный LPS: % выживаемости: 63415, (d) Системный LPS: % выживаемости: RTA 405, И RTA 408, и 63415 вводили QD×5 в Дни от -2 до 2, 63415 улучшал выживаемость.
ФИГ.22 - Активность RTA 408 в модели индуцированного излучением воспаления слизистой оболочки ротовой полости. RTA 405 или RTA 408 (63415) вводили BID×20 в дни от -5 до -1 и дни от 1 до 15 самцам сирийских золотистых хомячков. Излучение имело место на день 0. Оценка воспаления слизистой оболочки ротовой полости варьировала от 0 до 5, основываясь на клинических проявлениях (0: полное здоровье; 1-2: эритема от легкой до тяжелой; 3-5: различные степени изъязвления). RTA 408 (63415) выраженно улучшал воспаление слизистой оболочки ротовой полости при 30 мг/кг и 100 мг/кг вплоть до 36% уменьшения изъязвления.
ФИГ.23 - Индукция гена-мишени Nrf2, согласующаяся с токсикологическим исследованием RTA 408 (63415) у мышей C57BL/6 на 14-дневных мышах. мРНК генов-мишеней Nrf2 оценивали в печени мышей, обработанных PO QD×14. Наблюдали значительное увеличение экспрессии мРНК для множественных генов-мишеней Nrf2, которое согласовывалось с воздействием на ткань.
ФИГ.24 a и b - Индукция генов-мишеней Nrf2 в печени крыс посредством RTA 408 (63415): (a) Гены-мишени; (b) Негативные регуляторы. мРНК генов-мишеней Nrf2 оценивали в печени крыс, обработанных PO QD×14.
ФИГ.25 a и b - RTA 408 (63415) индуцирует гены-мишени Nrf2 в тканях обезьян: (a) Печень; (b) Легкое. мРНК генов-мишеней Nrf2 оценивали у обезьян, обработанных PO QD×14 с использованием Panomics QuantiGene® 2.0 Plex technology.
ФИГ.26 a и b - RTA 408 (63415) индуцирует активность фермента-мишени Nrf2 в печени мышей: (a) активность NQO1; (b) активность GST. Активность фермента-мишени Nrf2 оценивали в печени мышей, обработанных PO QD×14. Активность ферментов NQO1 и GST индуцировалась дозозависимым образом.
ФИГ.27 a и b - Индукция активности фермента-мишени в печени крыс посредством RTA 408 (63415): (a) NQO1; (b) GST. Активность фермента-мишени Nrf2 оценивали в печени крыс, обработанных PO QD×14. Активность ферментов NQO1 и GST индуцировалась дозозависимым образом.
ФИГ.28 a и b - RTA 408 (63415) индуцирует активность фермента-мишени Nrf2 в различных тканях у яванских макак: (a) активность NQO1; (b) активность GSR.
ФИГ.29 a и b - Концентрация RTA 408 в печени, легком и головном мозге мышей, и активность NQO1 в печени мышей после 14 дней ежедневного перорального введения. (a) Распределение в тканях RTA 408 у мышей после 14 дней ежедневного перорального введения. Данные представляют собой среднее ± СО концентраций RTA 408 в ткани, собранной через 4 часа после заключительной дозы исследования. Цифры над столбиками погрешности являются показателем среднего. (b) Корреляция содержания RTA 408 в печени мыши с активностью фермента NQO1. содержание RTA 408 в печени отдельных мышей наносили на график напротив активности отдельного фермента из данного отчета.
ФИГ.30 a и b - Концентрация RTA 408 в плазме, печени, легком и головном мозге крыс, и активность NQO1 в печени крыс после 14 дней ежедневного перорального введения. (a) Распределение в тканях RTA 408 у крыс после 14 дней ежедневного перорального введения. Данные представляют собой среднее ± СО концентраций RTA 408 в ткани, собранной через 4 часа после заключительной дозы исследования. Цифры над столбиками погрешности являются показателем среднего. *Два значения были исключены из расчета среднего вследствие их выпадения, определяемого как значения, вызывающие расхождение набора данных с критерием нормальности Шапиро-Вилка. (b) Корреляция содержания RTA 408 в печени крысы с активностью фермента NQO1. Содержание RTA 408 в печени отдельных крыс наносили на график напротив активности отдельного фермента из данного отчета. Ткани из группы дозы RTA 408 100 мг/кг собирали на день 6, а наблюдаемая токсичность в данной группе препятствовала оценкам активность фермента NQO1 в печени.
ФИГ.31 a и b - Лечение RTA 408 (63415) обезьян, активировало Nrf2 в клетках PBMC: (a) NQO1 PBMC vs. концентрации в плазме; (b) NQO1 легкого vs. NQO1 PBMC.
ФИГ.32 - Сущность 14-дневного токсикологического исследования RTA 408 (63415) на обезьянах. Все дозы были хорошо переносимыми без побочных клинических проявлений. Клинические биохимические данные свидетельствовали об отсутствии выраженной токсичности.
ФИГ.33 - Концентрация RTA 408 в плазме после локального окулярного и перорального введения в различные временные точки после введения дозы. Концентрацию RTA 408 в плазме также измеряли после 5 дней ежедневного локального окулярного введения RTA 408 и, как определили, она оставалась относительно непротиворечивой с измерениями, сделанными после первого дня.
ФИГ.34 a и b - Корреляция воздействия RTA 408 в плазме обезьян с NQO1 и экспрессией мРНК SRXN1 в PBMC: (a) NQO1; (b) SRXN1.
ФИГ.35 - Концентрация RTA 408 в ряде различных тканей или текучих сред внутри глаза в качестве функции времени после 5 дней локального окулярного введения дозы. Концентрацию RTA 408 в плазме также измеряли после локального окулярного введения.
ФИГ.36 - Действие RTA 408 на заболеваемость дерматитом 3 степени, вызванным сильным облучением, для различных концентраций RTA, вводимых локально.
ФИГ.37 - Действие RTA 408 на заболеваемость дерматитом 2 степени, вызванного сильным облучением, в течение 30-дневного курса, для различных концентраций RTA, вводимых локально.
ФИГ.38 - Действие RTA 408 на заболеваемость дерматитом 2 степени, вызванного сильным облучением, в течение 28-дневного курса, для различных концентраций RTA, вводимых перорально.
ФИГ.39a и b-a) анализ площади под кривой клинической оценки дерматита в качестве функции времени для каждой из различных контрольных групп, включая всех животных, применявшихся в исследовании. b) анализ площади под кривой клинической оценки дерматита в качестве функции продолжительности данной оценки для каждой из различных контрольных групп, включая только животных, которые полностью завершили испытание в 30 дней.
ФИГ.40 - Средняя первая слепая оценка острого радиационного дерматита в качестве функции времени для нелеченных, нелеченных без лучевого воздействия, только носителя и трех пероральных количеств RTA 408 при 3, 10 и 30 мг/кг. Оценка дерматита основана на шкале, в которой 0 представляет полное здоровье, 1-2 демонстрирует эритему от легкой до умеренной с десквамацией от минимальной до легкой, 3-4 демонстрирует эритему и десквамацию от умеренной до тяжелой, и 5 демонстрирует очевидную язву.
ФИГ.41 - Средняя оценка острого радиационного дерматита в качестве функции времени для нелеченных, нелеченных без лучевого воздействия, только носителя и трех пероральных количеств RTA 408 при 3, 10 и 30 мг/кг, измеряемая через день от дня 4 до дня 30, при этом оценка дерматита основана на шкале, в которой 0 представляет полное здоровье, 1-2 демонстрирует эритему от легкой до умеренной с десквамацией от минимальной до легкой, 3-4 демонстрирует эритему и десквамацию от умеренной до тяжелой, и 5 демонстрирует очевидную язву.
ФИГ.42 - Средняя оценка острого радиационного дерматита в качестве функции времени для нелеченных, нелеченных без лучевого воздействия, только носителя и трех пероральных количеств RTA 408 при 0,01, 0,1 и 1%, измеряемая через день от дня 4 до дня 30, при этом оценка дерматита основана на шкале, в которой 0 представляет полное здоровье, 1-2 демонстрирует эритему от легкой до умеренной с десквамацией от минимальной до легкой, 3-4 демонстрирует эритему и десквамацию от умеренной до тяжелой, и 5 демонстрирует очевидную язву.
ФИГ.43 - Клинические оценки дерматита, вызванного фракционированным облучением, нанесенные на график относительно времени, которые демонстрируют изменение в оценке дерматита для каждой тестируемой группы. Шкала включает в себя оценку дерматита от 0 до 5, где 0 представляет полное здоровье, 1-2 демонстрирует эритему от легкой до умеренной с десквамацией от минимальной до легкой, 3-4 демонстрирует эритему и десквамацию от умеренной до тяжелой, а 5 демонстрирует очевидную язву.
ФИГ.44 - Анализ графика AUC, показывающий оценку дерматита (степень тяжести * дни) для каждой тестируемой группы в течение всего периода наблюдения. Оценку дерматита выполняли каждые два дня от дня 4 до дня 30 исследования.
ФИГ.45 - Снижение концентраций белка в водянистой влаге для различных готовых форм RTA 408 (темные столбцы) по сравнению с литературными значениями для MaxiDex® (0,1% дексаметазон) и мапракората (светлые столбцы) после индукцией пункцией.
ФИГ.46 - RTA 408 (63415) дозозависимым образом подавляет NO in vivo. Мышам CD-1 (n=6) вводили дозу диметилсульфоксида или AIM посредством перорального принудительного кормления. Через 24 ч вводили LPS (5 мг/кг). Через двадцать четыре часа после введения LPS собирали всю кровь для анализа NO. Ингибирование NO определяли с помощью реакции Грисса в редуцированной, депротеинизированной плазме.
ФИГ.47 - RTA 408 (63415) интенсивно распределяется по тканям мышей. Мышам вводили дозу 25 мг/кг PO QDx3 либо RTA 408 (63415), либо RTA 405. Кровь (плазму и цельную кровь) и ткани (головной мозг, печень, легкое и почки) собирали через 6 часов после последней дозы. Выполняли полуколичественный анализ содержания лекарственного препарата. Значительные уровни наблюдали в ЦНС.
ФИГ.48 - RTA 408 (63415) индуцирует активность NQO1 в печени, легких и почках мышей. Мышам вводили дозу 25 мг/кг PO QD×3, через 6 часов после последней дозы собирали ткани и выполняли анализ активности NQO1. Значительная активация NQO1 наблюдалась в различных тканях.
ФИГ.49 - Сущность 14-дневного токсикологического исследования RTA 408 (63415) на мышах. Мышам C57BL/6 вводили дозу PO QD×14. Конечные точки включали выживаемость, массу и клинические биохимические показатели. Все животные выжили к 14 дню, не имело места значительное изменение массы по сравнению с группой носителя и не наблюдалось выраженной токсичности любой дозы, исходя из клинических биохимических показателей.
ФИГ.50 - Распределение RTA 408 (63415) в тканях, исходя из 14-дневного токсикологического исследования на мышах C57BL/6. Головной мозг, легкое и печень: Собирали через 4 часа после заключительной дозы, проводили количественный анализ на содержание RTA 408 (63415) с использованием чувствительного способа LC/MS/MS. Воздействие при 10 и 100 мг/кг: IC50 для индуцирования NO в легком превышало in vitro в 55 и 1138 раз, соответственно, и IC50 для индуцирования NO в головном мозге превышало in vitro в 29 и 541 раз, соответственно.
ФИГ.51 - Распределение RTA 408 (63415) в тканях крыс линии Спрег-Доули. RTA 408 (63415) хорошо распределяется в тканях-мишенях. Ткани собирали через четыре часа после заключительной дозы на день 14 или день 6 (100 мг/кг), экстрагировали и проводили количественный анализ на содержание RTA 408 (63415) с использованием чувствительного способа LC/MS/MS. Воздействие при 10 мг/кг: IC50 для ингибирования NO в легком и головном мозге превышало in vitro в 294 и 240 раз, соответственно.
ФИГ.52 - распределение RTA 408 (63415) в тканях-мишенях у яванских макак. Ткани собирали через четыре часа после заключительной дозы на день 14. Содержащийся RTA 408 (63415) экстрагировали и проводили количественный анализ с использованием чувствительного способа LC/MS/MS.
ФИГ.53 - образцы PXRD (2-30°2θ) Формы A RTA 408.
ФИГ.54 - термограмма DSC (25-280°C) Формы A RTA 408.
ФИГ.55 - термограмма TGA-MS (25-200°C) Формы A RTA 408.
ФИГ.56 - образцы PXRD (2-30°2θ) формы B RTA 408.
ФИГ.57 - термограмма DSC (25-280°C) формы B RTA 408.
ФИГ.58 - термограмма TGA-MS (25-200°C) формы B RTA 408.
ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
В одном аспекте настоящее изобретение предоставляет соединение:
N-((4aS,6aR,6bS,8aR,12aS,14aR,14bS)-11-циано-2,2,6a,6b,9,9,12a-гептаметил-10,14-диоксо-1,2,3,4,4a,5,6,6a,6b,7,8,8a,9,10,12a,14,14a,14b-октадекагидропицен-4a-ил)-2,2-дифторпропанамид,
которое также именуется RTA 408. В других неограничивающих аспектах настоящее изобретение также предоставляет его полиморфные формы, включая его сольваты. В других неограничивающих аспектах изобретение также предоставляет его фармацевтически приемлемые соли. В других неограничивающих аспектах также предоставлены способы получения, фармацевтические композиции и наборы и изделия изготовления данных соединений и его полиморфные формы.
Определения
При использовании в контексте химической группы: «водород» означает −H; «гидрокси» означает −OH; «оксо» означает =O; «карбонил» означает −C(=O)−; «карбокси» означает −C(=O)OH (также пишущееся как −COOH или −CO2H); «гало» означает независимо −F, −Cl, −Br или −I; «амино» означает −NH2; «гидроксиамино» означает −NHOH; «циано» означает −CN; «изоцианат» означает −N=C=O; «азидо» означает −N3; «фосфат» в моновалентном контексте означает −OP(O)(OH)2 или его депротонированную форму; в бивалентном контексте «фосфат» означает −OP(O)(OH)O− или его депротонированную форму; «тио» означает =S; и «сульфонил» означает −S(O)2−. любая неопределенная валентность на атоме структуры, показанной в данной заявке, косвенно представляет связанный с атомом атом водорода.
Применение слова «a» или «an» при использовании в сочетании с термином «включающий в себя» в формуле изобретения и/или описании может означать «один», но также согласуется со значением «один или более», «по меньшей мере один», и «один или более чем один».
На всем протяжении данной заявки термин «приблизительно» используют для обозначения, что значение включает в себя присущее варьирование ошибки для устройства, при этом способ используют для определения значения или колебания, которое существует среди пациентов исследования. При использовании в контексте порошковой рентгеновской дифракции, термин «приблизительно» используют для обозначения значения, составляющего ± 0,2°2θ от сообщаемого значения, предпочтительно значения, составляющего ± 0,1°2θ от сообщаемого значения. При использовании в контексте дифференциальной сканирующей калориметрии или температур перехода в стеклообразное состояние термин «приблизительно» используют для обозначения значения, составляющего ±10°C относительно максимума пика, предпочтительно значения, составляющего ±2°C относительно максимума пика. При использовании в другом контексте термин «приблизительно» используют для обозначения значения, составляющего ±10% сообщаемого значения, предпочтительно значения, составляющего ±5% сообщаемого значения. Должно быть понятно, что всякий раз, когда используют термин «приблизительно», также содержится конкретная ссылка на указанное точное числовое значение.
Термины «содержат», «имеют» и «включают» представляют собой неограничивающие связующие глаголы. Любые формы или времена одного или более данных глаголов, такие как «содержит», «содержащий», «имеет», «имеющий», «включает в себя» и «включающий в себя», также являются неограничивающими. Например, любой способ, который «содержит», «имеет» или «включает в себя» одну или более стадий, не ограничен наличием только данных одной или более стадий, а также охватывает другие неперечисленные стадии.
Термин «эффективный» так, как данный термин используют в описании и/или формуле изобретения, означает адекватный для достижения желательного, ожидаемого или предполаемого результата. «Эффективное количество», «терапевтически эффективное количество» или «фармацевтически эффективное количество» при использовании в контексте лечения пациента или больного соединением означает, что количество соединения, которое, при введении больному или пациенту для лечения заболевания, является достаточным для осуществления подобного лечения для заболевания.
Термин «гидрат», при использовании в качестве модификатора соединения, означает, что соединение имеет менее чем одну (напр., гемигидрат), одну (напр., моногидрат) или более чем одну (напр., дигидрат) молекулу воды, ассоциированную с каждой молекулой соединения, например, в твердых формах соединения.
Как используется в данном документе, термин «IC50» относится к ингибирующей дозе, которая составляет 50% максимального полученного ответа. Данная количественная мера показывает, сколько конкретного лекарственного средства или другого вещества (ингибитора) необходимо для ингибирования наполовину данного биологического, биохимического или химического процесса (или компонента процесса, т.е. фермента, клетки, клеточного рецептора или микроорганизма).
«Изомером» первого соединения является отдельное соединение, в котором каждая молекула содержит такие же составляющие атомы, что и первое соединение, но где отличается конфигурация данных атомов в трех измерениях.
Как используется в данном документе, термин «пациент» или «больной» относится к живому млекопитающему организму, такому как человек, обезьяна, корова, овца, коза, собака, кошка, мышь, крыса, морская свинка или их трансгенные виды. В определенных вариантах осуществления пациентом или больным является млекопитающее не человек. В определенных вариантах осуществления пациентом или больным является примат. В определенных вариантах осуществления пациентом или больным является человек. Неограничивающими примерами больных людей являются взрослые, подростки, дети и утробные плоды.
Как используется в данном документе в большинстве случаев, «фармацевтически приемлемый» относится к таким соединениям, материалам, композициям и/или лекарственным формам, которые в рамках медицинской точки зрения подходят для применения в контакте с тканями, органами и/или текучими средами организма человеческих существ и животных без чрезмерной токсичности, раздражения, аллергического ответа или других проблем или осложнений, соразмерных разумному соотношению пользы/риска.
«Фармацевтически приемлемые соли» означают соли соединений настоящего изобретения, которые являются фармацевтически приемлемыми по определению выше и которые обладают желательной фармакологической активностью. Такие соли включают соли присоединения кислоты, образованные неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное; или органическими кислотами, такими как 1,2-этандисульфокислота, 2-гидроксиэтансульфоновая кислота, 2-нафталенсульфоновая кислота, 3-фенилпропионовая кислота, 4.4'-метиленбис(3 гидрокси-2-ен-1-карбоновая кислота), 4-метилбицикло[2.2.2]окт-2-ен-1-карбоновая кислота, уксусная кислота, алифатические моно- и дикарбоновые кислоты, алифатические серные кислоты, ароматические серные кислоты, бензенсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, угольная кислота, коричная кислота, лимонная кислота, циклопентанпропионовая кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глютаминовая кислота, гликолевая кислота, гептановая кислота, капроновая кислота, гидроксинафтойная кислота, молочная кислота, лаурилсерная кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, муконовая кислота, о-(4 гидроксибензоил)бензойной кислота, щавелевая кислота, р-хлорбензенсульфоновая кислота, фенилзамещенные алкановые кислоты, пропионовая кислота, р-толуэнсульфоновая кислота, пировиноградная кислота, салициловая кислота, стеариновая кислота, янтарная кислота, виннокаменная кислота, уксуснокислый третичный бутил, триметилуксусная кислота и тому подобное. Фармацевтически приемлемые соли также включают соли присоединения основания, которые могут образовываться, когда имеющиеся кислые протоны способны реагировать с неорганическими или органическими основаниями. Приемлемые неорганические основания включают натрия гидроксид, натрия карбонат, калия гидроксид, алюминия гидроксид и кальция гидроксид. Приемлемые органические основания включают этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и тому подобное. Необходимо понимать, что конкретные анион или катион, образующие часть любой соли данного изобретения, не являются важными, при условии, что соль в целом является фармакологически приемлемой. Дополнительные примеры фармацевтически приемлемых солей и способы их получения и применения представлены в Handbook of Pharmaceutical Salts: Properties, and Use (P. H. Stahl и C. G. Wermuth eds., Verlag Helvetica Chimica Acta, 2002).
«Профилактика» или «предотвращение» включает в себя: (1) ингибирование начала заболевания у больного или пациента, у которого может иметься риск и/или предрасположенность к заболеванию, но который еще не испытывает или не демонстрирует какой-либо или всей патологии или симптоматики заболевания, и/или (2) замедление наступления патологии или симптоматики заболевания у больного или пациента, у которого может быть риск и/или предрасположенность к заболеванию, но который еще не испытывает или не демонстрирует какой-либо или всей патологии или симптоматики заболевания.
«Пролекарство» означает соединение, которое может быть метаболически преобразовано in vivo в ингибитор в соответствии с настоящиим изобретением. Само пролекарство может обладать или не обладать активностью в отношении данного белка-мишени. Например, соединение, включающее в себя гидроксигруппу, может быть введено в виде сложного эфира, который преобразуется посредством гидролиза in vivo в гидроксисоединение. Подходящие сложные эфиры, которые могут преобразовываться in vivo в гидроксисоединения, включают ацетаты, цитраты, лактаты, фосфаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-β-гидроксинафтоат, гентисаты, изетионаты, ди-p-толуоилтартраты, метансульфонаты, этансульфонаты, бензенсульфонаты, p-толуэнсульфонаты, циклогексилсульфаматы, соли или эфиры хинной кислоты, сложные эфиры аминокислот и тому подобное. Аналогичным образом соединение, включающее в себя аминогруппу, может быть введено в виде амида, который преобразуется посредством гидролиза in vivo в соединение амина.
«Стереоизомером» или «оптическим изомером» является изомер данного соединения, в котором одни и те же атомы связаны с одними и теми же другими атомами, но где отличается конфигурация данных атомов в трех измерениях. «Энантиомерами» являются стереоизомеры данного соединения, которые являются зеркальными изображениями друг друга, например, лево и правосторонние. «Диастереомерами» являются стереоизомеры данного соединения, которые не являются энантиомерами. Хиральные молекулы имеют в своем составе хиральный центр, также именуемый стереоцентр или стереогенный центр, которым является любая точка, хотя не обязательно атом, в молекуле, имеющей такие группы, что взаимная замена любых двух групп приводит к стереоизомеру. В органических соединениях хиральным центром обычно является атом углерода, фосфора или серы, хотя также возможно, чтобы стереоцентрами были другие атомы в органических и неорганических соединениях. молекула может иметь множество стереоцентров, давая множество стереоизомеров. в соединениях, стереоизомерия которых обусловлена четырехгранными стереогенными центрами (напр., четырехгранным углеродом), общее количество гипотетически возможных стереоизомеров не будет превышать 2n, где n представляет собой количество четырехгранных стереоцентров. Молекулы с симметрией часто имеют менее чем максимально возможное количество стереоизомеров. Смесь энантиомеров 50:50 называется рацемической смесью. В качестве альтернативы смесь энантиомеров можнт быть энантиомерно обогащенной таким образом, что один энантиомер присутствует в большем количестве, чем 50%. Типично, энантиомеры и/или диастереомеры могут быть разделены или отдельны друг от друга с использованием методик, известных в данной области. Предусматривается, что для любого стереоцентра или оси хиральности, для которых стереохимия не была определена, стереоцентр или ось хиральности может присутствовать в его R-форме, S-форме или в виде смеси R- и S-форм, включая рацемические и нерацемические смеси. Как используется в данном документе, фраза «по существу не содержащая другие стереоизомеры» означает, что композиция содержит ≤15%, более предпочтительно ≤10%, даже более предпочтительно ≤5% или наиболее предпочтительно ≤1% другого стереоизомера (стереоизомеров).
«Обработка» или «лечение» включает в себя (1) подавление заболевания у больного или пациента, испытывающего или демонстрирующего патологию или симптоматику заболевания (напр., купируя дальнейшее прогрессирование патологии и/или симптоматики), (2) ослабление заболевания у больного или пациента, который испытывает или демонстрирует патологию или симптоматику заболевания (напр., способствуя регрессии патологии и/или симптоматики), и/или (3) осуществление любого измеряемого уменьшения заболевания у больного или пациента, который испытывает или демонстрирует патологию или симптоматику заболевания.
В контексте данного раскрытия формулы:
Представляют одни и те же структуры. Когда на углероде нарисована точка, точка показывает, что атом водорода, присоединенный к данному углероду, выходит из плоскости страницы.
Вышеуказанные определения вытесняют любое противоречивое определение в любой из ссылок, которые включены в данный документ посредством ссылки. Однако тот факт, что некоторые термины имеют определение, не следует рассматривать как указание, что любой термин, который не имеет определения, является неопределенным. Точнее, можно полагать, что все используемые термины описывают изобретение в таких терминах, чтобы рядовой специалист мог оценить объем правовых притязаний и осуществление на практике настоящего изобретения.
RTA 408 и синтетические способы
RTA 408 может быть приготовлен в соответствии со способами, описанными разделе ниже. Данные способы могут быть дополнительно модифицированы и оптимизированы с использованием принципов и методик органической химии, которые применяются квалифицированным специалистом в данной области. Такие принципы и методики затронуты, например, в March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (2007), которая включена в данный документ посредством ссылки.
Необходимо понимать, что конкретный анион или катион, образующий часть любой соли данного изобретения, не является первостепенно важным при условии, что соль, в целом, является фармакологически приемлемой. Дополнительные примеры фармацевтически приемлемых солей и способы их получения и применения представлены в Handbook of Pharmaceutical Salts: Properties, and Use (2002), которая включена в данный документ посредством ссылки.
RTA 408 также может существовать в форме пролекарства. Поскольку известно, что пролекарства усиливают ряд требуемых качеств лекарств, напр., растворимость, биодоступность, выработку и т.д., соединения, используемые в некоторых способах изобретения, при необходимости можно доставлять в форме пролекарства. Таким образом, изобретение предусматривает пролекарства соединений настоящего изобретения, а также способы доставки пролекарств. Пролекарства соединений, используемых в изобретении, можно приготовить посредством модифицирования функциональных групп, присутствующих в соединении, таким образом, что модификации расщепляются в исходное соединение, либо при плановых процедурах, либо in vivo. Соответственно, пролекарства включают, например, соединения, описанные в данном документе, в которых гидрокси, амино или карбоксигруппа связана с любой группой, которая, когда пролекарство вводят пациенту, расщепляется с образованием гидрокси, амино или карбоновой кислоты, соответственно.
RTA 408 может иметь в своем составе один или более атомов асимметрично замещенного углерода или азота и может быть выделен в оптически активной или рацемической форме. Таким образом, имеются в виду все хиральные, диастереомерные, рацемические формы, эпимерные формы и все геометрические изомерные формы структуры, за исключением конкретно указанных особых стереохимических или изомерных форм. RTA 408 может встречаться в виде рацематов и рацемических смесей, единичных энантиомеров, диастереомерных смесей и отдельных диaстереомеров. В некоторых вариантах осуществления получают единичный диастереомер. Хиральные центры RTA 408 в соответствии с настоящиим изобретением могут иметь S- или R-конфигурацию.
В дополнение предполается, что атомы, образующие RTA 408 настоящего изобретения, включают все изотопные формы данных атомов. Изотопы, как используется в данном документе, включают в себя такие атомы, которые имеют одинаковое атомное число, но различные массовые числа. Посредством общего примера и без ограничения, изотопы водорода включают тритий и дейтерий, а изотопы углерода включают 13C и 14C. Аналогичным образом предусматривается, что один атом или более атомов углерода соединения настоящего изобретения может быть замещен на атом (атомы) кремния. Кроме того, предусматривается, что один атом или более атомов кислорода RTA 408 может быть замещен на атом (атомы) серы или селена.
RTA 408 и его полиморфная форма также может иметь преимущество в том, что они могут быть более более эффективными, быть менее токсичными, быть более длительно действующими, быть более мощными, продуцировать меньше побочных эффектов, более легко абсорбироваться и/или иметь лучший фармакокинетический профиль (напр., более высокую пероральную биодоступность и/или низкий клиренс), и/или иметь другие более пригодные фармакологические, физические или химические преимущества, чем соединения, известные в предыдущем уровне техники, для применения при показаниях, установленных в данном документе.
Полиморфные формы RTA 408
В некоторых вариантах осуществления настоящее изобретение предоставляет различные твердые формы RTA 408, включая его сольваты. Выполнили исследование полиморфизма, и RTA 408 был обнаружен в двух, по существу не содержащих растворитель, кристаллических формах (форме A и форме B). Для описания классов см. таблицу 1 ниже. Кристаллическая форма A является метастабильной и имеет точку плавления 181,98°C и теплоту плавления ΔH=42,01 Дж/г. Данная форма может быть полезна для получения аморфных форм RTA 408 или при экструзии готовых форм. Кристаллическая форма A может быть незначительно гигроскопична (потеря массы составляет ~0,5 масс.% при TGA-MS, ФИГ.55). Кристаллическая форма B обладает большей термодинамической устойчивостью, чем форма A, на что указывает более высокая точка плавления (250,10°C) и большая энтальпия плавления (теплота плавления ΔH=47,85 Дж/г). По сравнению с формой А, для формы В ожидается большая химическая и физическая стабильность как при обычной, так и при повышенной температуре. На форме B может существовать минимальное количество поверхностной воды, на что указывает TGA-MS (ФИГ.58).
Новые формы были охарактеризованы с помощью PXRD (Таблица 8 и Таблица 9).
Перечень твердых форм
Заболевания, ассоциированные с воспалением и/или окислительным стрессом
Воспаление представляет собой биологический процесс, который обеспечивает устойчивость к инфекционным или паразитическим организмам и восстановление поврежденной ткани. Воспаление в целом характеризуется локальной вазодилятацией, покраснением, отечностью и болью, привлечением лейкоцитов к участку инфекции или повреждения, продукцией воспалительных цитокинов, таких как TNF-α и IL-1, и продукцией активных форм кислорода или азота, таких как перекись, супероксид водорода и пероксинитрит. В поздних стадиях воспаления могут развиваться ремоделирование ткани, ангиогенез и формирование рубца (фиброз) как часть процесса заживления раны. В нормальных обстоятельствах воспалительный ответ является регулируемым, временным и регулируется упорядоченным образом, после адекватного воздействия на инфекцию или повреждение. Однако острое воспаление может стать чрезмерным и жизнеугрожающим при несостоятельности регуляторных механизмов. В качестве альтернативы воспаление может стать хроническим и вызвать накапливающееся повреждение тканей или системные осложнения. Исходя по меньшей мере из фактического материала, представленного в данном документе, RTA 408 можно использовать в лечении или профилактике воспаления или заболеваний, ассоциированных с воспалением.
Многие серьезные и неустранимые заболевания человека включают нарушение регуляции воспалительных процессов, включая такие заболевания, как рак, атеросклероз и диабет, которые традиционно не рассматривались как воспалительные патологические состояния. В случае рака воспалительные процессы связаны с образованием, прогрессированием, метастазированием и устойчивостью опухоли к терапии. Атеросклероз, долго рассматривавшийся как нарушение обмена жиров, как теперь понимают, в основном представляет собой воспалительное патологическое состояние с активированными макрофагами, играющими важную роль в образовании и возможном разрыве атеросклеротических бляшек. Также было показано, что активация воспалительных сигнальных путей играет роль в развитии инсулинорезистентности, а также в повреждении периферических тканей, ассоциированном с диабетической гипергликемией. Усиленная выработка активных форм кислорода и активных форм азота, таких как супероксид, перекись водорода, оксид азота и пероксинитрит, является отличительной чертой воспалительных патологических состояний. Сообщалось о наличии свидетельства о разрегулированном производстве пероксинитритов при широком спектре заболеваний (Szabo et al., 2007; Schulz et al., 2008; Forstermann, 2006; Pall, 2007).
Аутоиммунные заболевания, такие как ревматоидный артрит, волчанка, псориаз и рассеянный склероз, включают нефизиологическую и хроническую активацию воспалительных процессов в пораженных тканях, возникающую в результате дисфункции распознавания «своего» и «чужого» и механизмов реагирования в иммунной системе. При нейродегенеративных заболеваниях, таких как болезнь Альцгеймера и болезнь Паркинсона, повреждение нейронов коррелирует с активацией микроглии и повышенными уровнями провоспалительных белков, таких как индуцируемая синтаза оксида азота (iNOS). Хроническая органная недостаточность, такая как почечная недостаточность, сердечная недостаточность, печеночная недостаточность и хроническое обстркутивное заболевание легких тесно связаны с наличием хронического окислительного стресса и воспаления, приводящих к развитию фиброза и возможной потере функции органов. Окислительный стресс в эндотелиальных клетках сосудов, которые выстилают крупные и мелкие кровеносные сосуды, может привести к эндотелиальной дисфункции и, как полагают, является важным фактором, участвующим в развитии системного сердечно-сосудистого заболевания, осложнений диабета, хронической болезни почек и других форм органной недостаточности и ряда других связанных с возрастом заболеваний, включая дегенеративные заболевания центральной нервной системы и сетчатки.
Многие другие нарушения включают окислительный стресс и воспаление в пораженных тканях, включая воспалительное заболевание кишечника; воспалительные кожные заболевания; воспаление слизистой оболочки ротовой полости и дерматит, связанный с лучевой терапией и химиотерапией; глазные заболевания, такие как увеит, глаукома, макулярная дегенерация и различные формы ретинопатии; недостаточность и отторжение трансплантата; ишемически-реперфузионное повреждение; хроническую боль; дегенеративные патологические состояния костей и суставов, включая остеоартрит и остеопороз; астму и муковисцидоз; судорожные припадки; и психоневрологические патологические состояния, включая шизофрению, депрессию, биполярное расстройство, посттравматическое стрессовое расстройство, расстройства дефицита внимания, расстройства аутического спектра и расстройства приема пищи, такие как нервная анорексия. Нарушение регуляции воспалительных сигнальных путей, как полагают, является основным фактором патологии мышечных атрофических заболеваний, включая миодистрофию и различные формы кахексии.
Ряд острых жизнеугрожающих нарушений также включает разрегулированную передачу сигналов воспаления, включая острую органную недостаточность, затрагивающую поджелудочную железу, почки, печень или легкие, инфаркт миокарда или острый коронарный синдром, инсульт, септический шок, травму, тяжелые ожоги и анафилаксию.
Многие осложнения инфекционных заболеваний также включают нарушение регуляции воспалительных ответов. Хотя воспалительный ответ может убивать инвазивные патогены, чрезмерный воспалительный ответ также может быть достаточно разрушительным и в некоторых случаях может являться первичным источником повреждения инфицированных тканей. Также чрезмерный воспалительный ответ может приводить к системным осложнениям вследствие избыточного синтеза воспалительных цитокинов, таких как TNF-α и IL-1. Как полагают, это является фактором смертности, возникающим в результате тяжелого гриппа, тяжелого острого респираторного синдрома и сепсиса.
Аномальная или чрезмерная экспрессия либо iNOS, либо циклооксигеназы-2 (COX-2) вовлекается в патогенез многих болезненных процессов. Например, ясно, что NO является мощным мутагеном (Tamir and Tannebaum, 1996), и что оксид азота также может активировать COX-2 (Salvemini et al., 1994). Кроме того, имеется значительное увеличение iNOS в опухолях толстой кишки крыс, индуцированное канцерогеном азоксиметаном (Takahashi et al., 1997). Было показано, что серия синтетических тритерпеноидных аналогов олеанолевой кислоты являются мощными ингибиторами воспалительных процессов в клетках, таких как индуцирование посредством IFN-γ индуцибельной синтазы оксида азота (iNOS) и COX-2 в макрофагах мышей. См. Honda et al. (2000a), Honda et al. (2000b), и Honda et al. (2002), которые включены в данный документ посредством ссылки.
В одном аспекте RTA 408, раскрытый в данном документе, частично характеризуется своей способностью ингибировать выработку оксида азота в макрофагальных клетках RAW 264.7, индуцированных воздействием γ-интерферона. RTA 408 дополнительно характеризуется способностью индуцировать экспрессию антиоксидантных белков, таких как NQO1, и уменьшать экспрессию провоспалительных белков, таких как COX-2 и индуцируемая синтаза оксида азота (iNOS). Данные свойства имеют отношение к лечению широкого ряда заболеваний и расстройств, затрагивающих окислительный стресс и нарушение регуляции воспалительных процессов, включая рак, осложнения в результате локального или воздействующего на весь организм ионизирующего излучения, мукозит и дерматит вследствие лучевой терапии или химиотерапии, аутоиммунные заболевания, сердечно-сосудистые заболевания, включая атеросклероз, ишемически-реперфузионное повреждение, острую и хроническую органную недостаточность, включая почечную недостаточность и сердечную недостаточность, респираторные заболевания, диабет и осложнения диабета, тяжелые аллергии, отторжение трансплантата, реакцию «трансплантат против хозяина», нейродегенеративные заболевания, заболевания глаза и сетчатки, острую и хроническую боль, дегенеративные костные заболевания, включая остеоартрит и остеопороз, воспалительные заболевания кишечника, дерматит и другие кожные заболевания, сепсис, ожоги, судорожные припадки и психоневрологические нарушения.
В другом аспекте RTA 408 можно применять для лечения больного, имеющего патологическое состояние, такое как глазные заболевания. Например, неограничивающими примерами глазных заболеваний, которые можно лечить RTA 408, являются увеит, макулярная дегенерация (как сухая форма, так и влажная форма), глаукома, диабетический макулярный отек, блефарит, диабетическая ретинопатия, заболевания и нарушения эндотелия роговицы, такие как эндотелиальная дистрофия роговицы Фукса, послеоперационное воспаление, сухость глаз, аллергический конъюнктивит и другие формы конъюнктивита.
В другом аспекте RTA 408 можно применять для лечения больного, имеющего патологическое состояние, такое как кожные заболевания или нарушения. Например, неограничивающими примерами кожных заболеваний, которые можно лечить RTA 408, являются дерматит, включая аллергический дерматит, атопический дерматит, дерматит вследствие химического воздействия и дерматит, индуцированный излучением; термические или химические ожоги; хронические раны, включая диабетические язвы, пролежни и венозные язвы; акне; алопеция, включая облысение и лекарственно-индуцированную алопецию; другие нарушения волосяного фолликула; буллезный эпидермолиз; солнечный ожог и его осложнения; нарушения пигментации кожи, включая витилиго; связанные с возрастом патологические состояния кожи; заживление послеоперационной раны; профилактика или подавление рубцевания вследствие повреждения кожи, операции или ожоги; псориаз; дерматологические проявления аутоиммунных заболеваний или реакция «трансплантат против хозяина»; профилактика или лечение рака кожи; нарушения с вовлечением гиперпролиферации клеток кожи, такие как гиперкератоз.
Не будучи связанными теорией, активация антиоксидантного/противовоспалительного пути Keap1/Nrf2/ARE, как полагают, включена как в противовоспалительные, так и в противораковые свойства соединения, раскрытого в данном документе.
В другом аспекте RTA 408 можно применять для лечения больного, имеющего патологическое состояние, вызванное повышенными уровнями окислительного стресса в одной или более тканях. Окислительный стресс является следствием патологически высоких или продолжительных уровней активных форм кислорода, таких как супероксид, перекись водорода, оксид азота и пероксинитрит (образованный посредством взаимодействия оксида азота и супероксида). Окислительный стресс может сопровождаться либо сильным, либо хроническим воспалением. Окислительный стресс может быть вызван митохондриальной дисфункцией, активацией иммунных клеток, таких как макрофаги и нейтрофилы, сильным воздействием внешнего агента, такого как ионизирующее излучение или цитотоксический химиотерапевтический агент (напр., доксорубицин), травмой или другими сильным повреждением ткани, ишемией/реперфузией, бедным кровообращением или анемией, локальной или системной гипоксией или гипероксией, повышенными уровнями воспалительных цитокинов и других ассоциированных с воспалением белков и/или другими патологическими физиологическими состояниями, такими как гипергликемия или гипокликемия.
Было показано, что у животных моделей многих данных патологических состояний стимулирование экспрессии индуцируемой гемоксигеназы (HO-1), гена-мишени пути Nrf2, имеет значительное терапевтические действие, включая модели инфаркта миокарда, почечной недостаточности, недостаточности и отторжения трансплантата, инсульта, сердечно-сосудистого заболевания и аутоиммунного заболевания (напр., Sacerdoti et al. 2005; Abraham и Kappas, 2005; Bach, 2006; Araujo et al. 2003; Liu et al. 2006; Ishikawa et al. 2001; Kruger et al. 2006; Satoh et al. 2006; Zhou et al. 2005; Morse и Choi, 2005; Morse и Choi, 2002). Данный фермент разделяет свободный гем на железо, монооксид углерода (CO) и биливердин (который в последующием превращается в мощную антиоксидантную молекулу, билирубин).
В другом аспекте RTA 408 можно применять в профилактике или лечении тканевых повреждений или органной недостаточности, острой и хронической, возникающих в результате окислительного стресса, усугубленного воспалением. Примеры заболеваний, которые попадают в данную категорию, включают сердечную недостаточность, печеночную недостаточность, недостаточность и отторжение трансплантата, почечную недостаточность, панкреатит, фиброзные заболевания легких (муковисцидоз, ХНЗЛ и идиопатический фиброз легких, среди прочих), диабет (включая осложнения), атеросклероз, ишемически-реперфузионное повреждение, глаукому, инсульт, аутоиммунное заболевание, аутизм, макулярную дегенерацию и мышечную дистрофию. Например, в случае аутизма исследование предполагает, что усиление окислительного стресса в центральной нервной системе может способствовать развитию заболевания (Chauhan и Chauhan, 2006).
Также очевидны связи окислительного стресса и воспаления с развитием и патологией многих других нарушений центральной нервной системы, включая психиатрические рассройства, такие как психоз, большая депрессия и биполярное расстройство; судорожные припадки, такие как эпилепсия; болевой и сенсорный синдромы, такие как мигрень, нейропатическая боль или шум в ушах; и поведенческие синдромы, такие как расстройства, связанные с дефицитом внимания. См., напр., Dickerson et al. 2007; Hanson et al. 2005; Kendall-Tackett, 2007; Lencz et al. 2007; Dudhgaonkar et al. 2006; Lee et al. 2007; Morris et al. 2002; Ruster et al. 2005; McIver et al. 2005; Sarchielli et al. 2006; Kawakami et al. 2006; Ross et al. 2003, которые все включены в данный документ посредством ссылки. Например, повышенные уровни воспалительных цитокинов, включая TNF, интерферон-γ и IL-6, связаны с большим психическим расстройством (Dickerson et al. 2007). Активация микроглии также связана с большим психическим расстройством. Вследствие этого, понижающе регулирующие воспалительные цитокины и ингибирование чрезмерной активации микроглии могут быть полезными у пациентов с шизофренией, большой депрессией, биполярным расстройством, расстройствами аутического спектра и другими психоневрологическими нарушениями.
Соответственно, при патологических состояниях, затрагивающих один лишь окислительный стресс или окислительный стресс, усугубленный воспалением, лечение может включать в себя введение больному терапевтически эффективного количества соединения данного изобретения, такого как соединения, описанные выше или на всем протяжении данного описания. Лечение может проводиться превентивно, заранее до прогнозируемого состояния окислительного стресса (напр., трансплантацией органа или введением лучевой терапии пациенту с раком) или оно может быть проводиться терапевтически в условиях, включающих установленный окислительный стресс и воспаление. В некоторых примерах, таких как пациент с раком, получающий лучевую терапию или химиотерапию (или обе), соединение изобретения может быть введено как перед, так и после облучения или химиотерапии или может быть введено в комбинации с другими видами лечения. В зависимости от природы лучевой терапии или химиотерапии, можно применять различные комбинации предварительного лечения, последующего лечения или одновременного введения соединения изобретения. Соединение изобретения может предотвращать или уменьшать степень тяжести побочных эффектов, связанных с лучевой терапией или химиотерапией. Поскольку данные побочные эффекты могут являться дозолимитирующими, их уменьшение или профилактика может сделать возможным введение более высокой дозы или более частое введение дозы лучевой терапии или химиотерапии, приводящее к большей эффективности. В качестве альтернативы, как показано в данном документе, применение соединения изобретения в комбинации с лучевой терапией или химиотерапией может повысить эффективность данной дозы облучения или химиотерапии. В том числе, данная сочетанная эффективность может быть следствием ингибирования активности провоспалительного фактора транскрипции NF-κB посредством соединения изобретения. NF-κB часто хронически активирован в раковых клетках, и данная активация связана с устойчивостью к терапии и стимуляцией прогрессирования опухоли (напр., Karin M, Nature. 2006 May 25;441(7092):431-6; Aghajan et al. J Gastroenterol Hepatol. 2012 Mar;27 Suppl 2:10-4). Другие факторы транскрипции, которые способструют воспалению и раку, такие как STAT3 (напр., He G и Karin M, Cell Res. 2011 Jan;21(1):159-68; Grivennikov SI и Karin M, Cytokine Growth Factor Rev. 2010 Feb;21(1):11-9), также могут ингибироваться соединением изобретения.
RTA 408 можно применять для лечения или профилактики воспалительных патологических состояний, таких как сепсис, дерматит, аутоиммунные заболевания и остеоартрит. RTA 408 также можно применять для лечения или профилактики боли воспалительного генеза и/или нейропатической боли, например, посредством индукции Nrf2 и/или ингибирования NF-κB.
RTA 408 также можно применять для лечения или профилактики заболеваний, таких как рак, воспаление, болезньи Альцгеймера, болезнь Паркинсона, рассеянный склероз, аутизм, боковой амиотрофический склероз, хорея Хантингтона, аутоиммунных заболеваний, таких как ревматоидный артрит, волчанка, болезнь Крона и псориаз, воспалительное заболевание кишечника, всех других заболеваний, патогенез которых, как предполагается, включает повышенную выработку либо оксида азота, либо простагландинов, и патологических состояний, затрагивающих один лишь окислительный стресс, либо окислительный стресс, усугубленный воспалением.
Другой аспект воспаления состоит в выработке воспалительных простагландинов, таких как простагландин E. RTA 408 можно применять для стимуляции вазодилятации, экстравазации плазмы, локализации боли, повышенной температуре и других симптомах воспаления. С их появлением связана индуцибельная форма фермента COX-2, и в воспаленных тканях обнаружены высокие уровни COX-2. Следовательно, ингибирование COX-2 может облегчить многие симптомы воспаления, и ряд важных противовоспалительных лекарственных средств (напр., ибупрофен и целекоксиб) действуют посредством ингибирования активности COX-2. Было продемонстрировано, что класс циклопентеноновых простагландинов (cyPG) (напр., 15-деоксипростагландин J2, a.k.a. PGJ2) играет роль в стимулировании координированного разрешения воспаления (напр., Rajakariar et al. 2007). COX-2 также связан с выработкой циклопентеноновых простагландинов. Следовательно, ингибирование COX-2 может мешать полному прекращению воспаления, потенциально способствуя персистированию активированных иммунных клеток в тканях и приводя к хроническому, «вялотекущему» воспалению. Данный эффект может быть ответственным за увеличение частоты сердечно-сосудистых заболеваний у пациентов, использующих селективные ингибиторы COX-2 в течение продолжительных периодов времени.
В одном аспекте RTA 408 можно применять для регулирования выработки провоспалительных цитокинов внутри клетки посредством избирательной активации регуляторных цистеиновых остатков (RCR) на белках, которые регулируют активность редокс-чувствительных факторов транскрипции. Активация RCR посредством cyPG, как было показано, инициирует программу, способствующую прекращению, при которой выраженно индуцируется активность антиоксидантного и цитопротекторного фактора транскрипции Nrf2 и подавляется активность прооксидантного и провоспалительного факторов транскрипции NF-κB и STAT. В некоторых вариантах осуществления RTA 408 можно применять для увеличения выработки антиоксидантных и восстановительных молекул (NQO1, HO-1, SOD1, γ-GCS) и уменьшения окислительного стресса и выработки прооксидантных и провоспалительных молекул (iNOS, COX-2, TNF-α). В некоторых вариантах осуществления RTA 408 можно применять, чтобы заставлять клетки, в которых происходит воспалительное явление, возвращаться в невоспаленное состояние за счет содействия прекращению воспаления и ограничению чрезмерного повреждения тканей у хозяина.
A. Рак
Дополнительно, RTA 408 можно применять для индуцирования апоптоза в опухолевых клетках, индуцирования клеточной дифференциации, ингибирования пролиферации раковых клеток, ингибирования воспалительного ответа и/или функционирования при хемопревентивной способности. Например, RTA 408 обладает одним или более следующими свойствами: (1) способностью индуцировать апоптоз и дифференцировать как злокачественные, так и незлокачественные клетки, (2) активностью на субмикромолярных или наномолярных уровнях в качестве ингибитора пролиферации многих злокачественных клеток или клеток в состоянии злокачественного перерождения, (3) способностью подавлять новый синтез синтазы оксида азота (iNOS), индуцируемой воспалительным ферментом, (4) способностью ингибировать активацию NF-κB и (5) способностью индуцировать экспрессию гемоксигеназы-1 (HO-1).
При некоторых видах рака уровни iNOS и COX-2 являются повышенными и участвуют в канцерогенезе, и было показано, что ингибиторы COX-2 уменьшают частоту первичной аденомы толстой кишки человека (Rostom et al., 2007; Brown and DuBois, 2005; Crowel et al., 2003). iNOS экспрессируется в миелоидзависимых клетках-супрессорах (MDSC) (Angulo et al. 2000) и, как было показано, активность COX-2 в раковых клетках приводит к выработке простагландина E2 (PGE2), который, как было показано, индуцирует экспрессию аргиназы в MDSC (Sinha et al. 2007). Аргиназа и iNOS представляют собой ферменты, которые в качестве субстрата используют L-аргинин и продуцируют L-орнитин и мочевину, и L-цитруллин и NO, соответственно. Было показано, что истощение аргинина в микросреде опухоли посредством MDSC в сочетании с выработкой NO и пероксинитритом ингибирует пролиферацию и индуцирует апоптоз T-клеток (Bronte et al. 2003). Как было показано, ингибирование COX-2 и iNOS уменьшает накопление MDSC, восстанавливает цитотоксическую активность опухоль-ассоциированных T-клеток и задерживает рост опухоли (Sinha et al. 2007; Mazzoni et al. 2002; Zhou et al. 2007).
Ингибирование сигнальных путей NF-κB и JAK/STAT вовлекается в качестве стратегии ингибирования пролиферации раковых эпителиальных клеток и индуцирования их апоптоза. Как было показано, активация STAT3 и NF-κB приводит к супрессии апоптоза в раковых клетках и содействию пролиферации, инвазии и метастазирования. Было показано, что многие из генов-мишеней, участвующих в данных процессах, транскрипционно регулируются как NF-κB, так и STAT3 (Yu et al. 2007).
В дополнение к их прямой роли в раковых эпителиальных клетках, NF-κB и STAT3 также играют важную роль в других клетках, обнаруженных внутри микросреды опухоли. Эксперименты на животных моделях пропродемонстрировали, что NF-κB требуется как в раковых клетках, так и в гематопоэтических клетках для распространения действия воспаления на инициирование и прогрессирование рака (Greten et al. 2004). Соответственно, ингибирование NF-κB в раковых и миелоидных клетках уменьшает количество и размер образующихся в результате опухолей. Активация STAT3 в раковых клетках приводит к выработке нескольких цитокинов (IL-6, IL-10) которые подавляют созревание опухоль-ассоциированных дендритных клеток (DC). Кроме того, STAT3 активируется данными цитокинами в самих дендритных клетках. Ингибирование STAT3 в мышиных моделях рака восстанавливает созревание DC, способствует противоопухолевому имунитету и ингибирует рост опухоли (Kortylewski et al. 2005).
B. Лечение рассеянного склероза и других нейродегенеративных патологических состояний
Соединение и способы данного изобретения можно применять для лечения у пациентов рассеянного склероза (MS). Известно, что MS представляет собой воспалительное патологическое состояние центральной нервной системы (Williams et al., 1994; Merrill and Benvenist, 1996; Genain and Nauser, 1997). На основании нескольких исследований имеется свидетельство, подтверждающее, что в патогенезе болезни Альцгеймера (AD), болезни Паркинсона (PD), бокового амиотрофического склероза (ALS) и MS участвуют воспалительные, окислительные и/или иммунные механизмы (Bagasra et al., 1995; McGeer and McGeer, 1995; Simonian and Coyle, 1996; Kaltschmidt et al., 1997). Как активные астроциты, так и активированная микроглия участвуют в этиологии нейродегенеративного заболевания (NDD) и нейровоспалительного заболевания (NID); особенно выделяют микроглию в качестве клеток, которые синтезируют как NO, так и простагландины в качестве продуктов соответствующих ферментов, iNOS и COX-2. Образование вновь данных ферментов может направляться воспалительными цитокинами, такими как интерферон-γ или интерлейкин-1. В свою очередь, усиленная выработка NO может приводить к воспалительным каскадам и/или окислительному повреждению в клетках и тканях многих органов, включая нейроны и олигодендроциты нервной системы с последующими проявлениями при AD и MS и возможными PD и ALS (Coyle and Puttfarcken, 1993; Beal, 1996; Merrill and Benvenist, 1996; Simonian and Coyle, 1996; Vodovotz et al., 1996). Эпидемиологические данные показывают, что постоянное применение НПВС, которые блокируют синтез простагландинов из арахидоната, значительно снижает риск развития AD (McGeer et al. 1996; Stewart et al. 1997). Таким образом, агенты, которые блокируют образование NO и простагландинов, можно применять в подходах по профилактике и лечению NDD. Успешные терапевтические кандидаты для лечения подобного заболевания обычно требуют способности проникать через барьер крови головного мозга. См., например, публикацию Патента США 2009/0060873, которая включена в данный документ посредством ссылки во всей своей полноте.
C. Нейровоспаление
Соединение и способы данного изобретения можно применять для лечения пациентов с нейровоспалением. Нейровоспаление заключает в себе идею, что ответы и действия микроглии и астроцитов в центральной нервной системе имеют в основе аналогичную воспалению природу, и что данные ответы являются центральными для патогенеза и прогрессирования большого множества неврологических нарушений. Данная идея происходила из области болезни Альцгеймера (Griffin et al. 1989; Rogers et al. 1988), где она перевернула понимание авторов изобретения данного заболевания (Akiyama et al. 2000). Данные идеи были распространены на другие нейродегенеративные заболевания (Eikelenboom et al., 2002; Ishizawa and Dickson, 2001), на ишемические/токсические заболевания (Gehrmann et al. 1995; Touzani et al. 1999), на биологию опухоли (Graeber et al. 2002) и даже на нормальное развитие головного мозга.
Нейровоспаление включает широкий спектр сложных клеточных реакций, которые включают активацию микроглии и астроцитов и индукцию цитокинов, хемокинов, белков комплемента, белков острой фазы, окислительных повреждений и связанных молекулярных процессов. Данные явления могут оказывать пагубные воздействия на функцию нейронов, приводящие к повреждению нейронов, дополнительной активации глии и в конечном итоге к нейродегенерации.
D. Лечение почечной недостаточности
Соединение и способы данного изобретения могут использоваться для лечения пациентов с почечной недостаточностью. См. патентную заявку США серийный № 12/352473, которая включена в данный документ посредством ссылки во всей своей полноте. Другой аспект настоящего раскрытия касается новых способов и соединений для лечения и профилактики почечного заболевания. Почечная недостаточность, приводящая к неадекватному клиренсу конечных продуктов обмена из крови и ненормальным концентрациям электролитов в крови, представляет собой значительную медицинскую проблему во всем мире, особенно в развивающихся странах. Диабет и гипертензия находятся среди наиболее важных причин хронической почечной недостаточности, также известной как хронические болезни почек (CKD), но они также связаны с другими патологическими состояниями, такими как волчанка. Острая почечная недостаточность может возникать в результате воздействия некоторых лекарственных средств (напр., ацетаминофена) или токсичных химических веществ или в результате ишемически-реперфузионного повреждения, связанного с инсультом или хирургическими процедурами, такими как трансплантация, и может приводить к хронической почечной недостаточности. У многих пациентов почечная недостаточность предшествует стадии, на которой пациенту для продолжения жизни требуется регулярный диализ или трансплантация почки. Обе данные процедуры являются высокоинвазивными и связаны со значительными побочными эффектами и качеством жизни. Хотя существуют активные способы лечения некоторых осложнений почечной недостаточности, таких как гиперпаратироидизм и гиперфосфотемия, не было показано ни одного доступного лечения для остановки или обратного развития лежащего в основе прогрессирования почечной недостаточности. Таким образом, агенты, которые могут улучшать нарушечную почечную функцию, являлись бы значительным продвижением при лечении почечной недостаточности.
Воспаление в значительной степени участвует в патологии CKD. Также между окислительным стрессом и почечной дисфункцией существует сильная связь по механизму. Путь передачи сигналов NF-κB играет важную роль в прогрессировании CKD, так как NF-κB регулирует транскрипцию MCP-1, хемокина, который является ответственным за привлечение моноцитов/макрофагов, приводящее к воспалительному ответу, который в конечном итоге поражает почки (Wardle, 2001). Путь Keap1/Nrf2/ARE регулирует транскрипцию нескольких генов, кодирующих антиоксидантные ферменты, включая гемоксигеназу-1 (HO-1). Абляция гена Nrf2 у самок мышей приводит к развитию похожего на волчанку гломерулярного нефрита (Yoh et al. 2001). Кроме того, несколько исследований пропродемонстрировали, что экспрессия HO-1 индуцируется в ответ на почечное повреждение и воспаление и что данный фермент и его продукты - билирубин и моноксид углерода - играют в почках защитную роль (Nath et al. 2006).
Почеченый клубочек и окружающая боуменова капсула составляют основную функциональную единицу почки. Скорость клубочковой фильтрации (GFR) является стандартной мерой почечной функции. Для измерения GFR широко используют креатининовый клиренс. Однако в качестве показателя, суррогатного для креатининового клиренса, широко используют уровень креатинина сыворотки. Например, избыточные уровни креатинина сыворотки повсеместно приняты для обозначения неадекватной почечной функции, а снижение креатинина сыворотки с течением времени принято в качестве показателя улучшения почечной функции. Нормальные уровни креатинина в крови приблизительно составляют от 0,6 до 1,2 миллиграмм (мг) на децилитр (дл) у взрослых мужчин и от 0,5 до 1,1 миллиграмм на децилитр у взрослых женщин.
Острое повреждение почки (AKI) может возникать после ишемической реперфузии, лечения определенными фармакологическими агентами, такими как цисплатин и рапамицин, и внутривенной инъекции радиоконтрастной среды, используемой при медицинской визуализации. Как и в CKD, воспаление и окислительный стресс участвуют в патологии AKI. Молекулярные механизмы, лежащие в основе радиоконтрастно-индуцированной нефропатии (RCN), не вполне понятны; однако вероятно, что комбинация явлений, включая пролонгированную вазоконстрикцию, нарушенное саморегулирование почки и непосредственную токсичность контрастной среды, способствует почечной недостаточности (Tumlin et al. 2006). Вазоконстрикция приводит к уменьшению почечного кровотока и вызывает ишемическую реперфузию и выработку активных форм кислорода. В данных условиях значительно индуцируется HO-1, и было продемонстрировано, что он предотвращает ишемически-реперфузионное повреждение в нескольких различных органах, включая почки (Nath et al. 2006). Конкретно, в крысиной модели RCN было показано, что индукция HO-1 является защитной (Goodman et al. 2007). Реперфузия также индуцирует воспалительный ответ, частично за счет активации передачи сигналов NF-κB (Nichols, 2004). Выделение NF-κB было предложено в качестве терапевтической стратегии предотвращения повреждения органов (Zingarelli et al. 2003).
E. Сердечно-сосудистое заболевание
Соединение и способы данного изобретения могут использоваться для лечения пациентов с сердечно-сосудистым заболеванием. См. патентную заявку США серийный № 12/352473, которая включена в данный документ посредством ссылки во всей своей полноте. Сердечно-сосудистое (CV) заболевание находится среди наиболее важных причин смертности во всем мире и является основной причиной смерти у многих развитых народов. Этиология CV заболевания является сложной, но большинство причин связаны с неадекватным или полностью нарушенным снабжением кровью жизненно важного органа или ткани. Часто подобное патологическое состояние возникает в результате разрыва одной или более атеросклеротических бляшек, что приводит к образованию тромба, который блокирует ток крови в жизненно важном сосуде. Такой тромбоз является принципиальной причиной сердечных приступов, при которых блокируется одна или более коронарных артерий, и нарушается ток крови в само сердце. Возникающая в результате ишемия серьезно повреждает сердечную ткань, как из-за недостатка кислорода во время ишемического события, так и из-за чрезмерного образования свободных радикалов после восстановления кровотока (явление, известное как ишемически-реперфузионное повреждение). Аналогичное повреждение возникает в головном мозге во время тромботического инсульта, когда в результате тромбоза блокируется церебральная артерия или другой главный сосуд. В отличие от этого, геморрагические инсульты включают в себя разрыв кровеносного сосуда и кровотечение в окружающую ткань головного мозга. Это создает окислительный стресс в ближайшей к кровоизлиянию области вследствие присутствия больших количеств свободного гема и других активных форм и ишемии в других частях головного мозга вследствие нарушенного кровотока. Субарахноидальное кровоизлияние, которое часто сопровождается спазмом церебральных сосудов, также вызывает ишемически-реперфузионное повреждение в головном мозге.
В качестве альтернативы, атеросклероз может быть настолько интенсивен в жизненно важных кровеносных сосудах, что развивается стеноз (сужение артерий), и ток крови к жизненно важным органам (включая сердце) является хронически недостаточным. Такая хроническая ишемия может приводить к циркуляторно-ишемическому повреждению органа многих типов, включая сердечную гипертрофию, связанную с застойной сердечной недостаточностью.
Атеросклероз, лежащий в основе дефекта, приводящего к многим формам сердечно-сосудистого заболевания, возникает, когда физический дефект или повреждение выстилки (эндотелия) артерии инициирует воспалительный ответ, затрагивающий пролиферацию клеток гладкой мускулатуры сосудов и инфильтрацию лейкоцитов пораженной области. В конечном итоге, может образоваться осложненное нарушение, известное как атеросклеротическая бляшка, состоящее из упомянутых выше клеток в сочетании с отложениями несущих холестерин липопротеинов и других материалов (напр., Hansson et al. 2006).
Фармацевтические виды лечения сердечно-сосудистого заболевания включают превентивные виды лечения, например, применение лекарственных средств, предназначенных для понижения артериального давления или уровней циркулирующего холестерина и липопротеинов, а также виды лечения, разработанные для уменьшения тенденций агрегации тромбоцитов и других кровяных клеток (уменьшая тем самым скорость прогрессирования бляшек и риск образования тромба). В последнее время были внедрены лекарственные средства, такие как стрептокиназа и тканевой активатор плазминогена, которые применяются для растворения тромбов и восстановления кровотока. Хирургические виды лечения включают обходное шунтирование коронарной артерии для создания альтернативной подачи крови, баллонную ангиопластику для сдавливания ткани бляшек и увеличения диаметра артериального просвета и каротидную эндартерэктомию для удаления ткани бляшек в сонной артерии. Такие виды лечения, особенно баллонная ангиопластика, могут сопровождаться применением стентов, расширяющихся сетчатых трубок, разработанных для поддержки стенок артерий в пораженной области и сохранения сосуда открытым. В настоящее время применение выделяющих лекарственное средство стентов становится обычным для того, чтобы предотвращать послеоперационный рестеноз (повторное сужение артерии) в пораженной области. Данные устройства представляют собой проволочные стенты, покрытые биосовместимой полимерной матрицей, содержащей лекарственное средство, которое ингибирует клеточную пролиферацию (напр., паклитаксел или рапамицин). Полимер обеспечивает возможность медленного, локального высвобождения лекарственного средства в пораженной области с минимальным воздействием на не являющиеся мишенью ткани. Несмотря на значительную пользу, предлагаемую такими видами лечения, смертность от сердечно-сосудистых заболеваний остается высокой, и остаются значительные неудовлетворенные потребности в лечении сердечно-сосудистых заболеваний.
Как замечено выше, было показано, что индукция HO-1 является полезной в ряде моделей сердечно-сосудистых заболеваний, а низкие уровни экспрессии HO-1 клинически коррелировали с повышенным риском сердечно-сосудистого заболевания. Вследствие этого соединения изобретения могут использоваться для лечения или предотвращения ряда сердечно-сосудистых нарушений, включая, но без ограничения, атеросклероз, гипертензию, инфаркт миокарда, хроническую сердечную недостаточность, инсульт, субарахноидальное кровоизлияние и рестеноз.
F. Диабет
Соединение и способы данного изобретения могут использоваться для лечения пациентов с диабетом. См. патентную заявку США серийный № 12/352473, которая включена в данный документ посредством ссылки во всей своей полноте. Диабет представляет собой сложное заболевание, характеризующееся неспособностью организма регулировать уровни циркулирующей глюкозы. Данная неспособность может быть следствием отсутствия инсулина, пептидного гормона, который регулирует как выработку, так и поглощение глюкозы в различных тканях. Недостаточность инсулина подвергает риску способность мышечных, жировых и других тканей должным образом поглощать глюкозу, приводя к гипергликемии (патологически высоким уровням глюкозы в крови). Наиболее часто такой дефицит инсулина является следствием его неадекватной выработки в инсулоцитах поджелудочной железы. В большинстве случаев это происходит в результате аутоиммунного разрушения данных клеток, патологического состояния, известного как тип 1, или ювенильный диабет, но также может быть следствием физической травмы или некоторых других причин.
Диабет также может возникать, когда мышечные и жировые клетки становятся менее чувствительными к инсулину и не поглощают глюкозу должным образом, приводя к гипергликемии. Данное явление известно как инсулинорезистентность и получается в результате патологического состояния, известного как диабет 2 типа. Диабет 2 типа, наиболее распространенный тип, тесно связан с ожирением и гипертензией. Ожирение связано с воспалительным состоянием жировой ткани, которая, как полагают, играет главную роль в развитии инсулинорезистентности (напр., Hotamisligil, 2006; Guilherme et al. 2008).
Диабет связан с повреждением многих тканей в основном в результате гипергликемии (и гипокликемии, которая может возникать в результате чрезмерных или слабо синхронизированных доз инсулина) является значительным источником окислительного стресса. Хроническая почечная недостаточность, ретинопатия, периферическая нейропатия, периферический васкулит и развитие кожных язв, которые медленно заживают или вообще не относятся к числу распространенных осложнений сахарного диабета. Вследствие своей способности защищать от окислительного стресса, особенно за счет индукции экспрессии HO-1, соединения изобретения могут использоваться в способах лечения многих осложнений диабета. Как замечено выше (Cai et al. 2005), предполагается, что хроническое воспаление и окислительный стресс в печени являются важнейшими факторами в развитии диабета 2 типа. Кроме того, агонисты PPARγ, такие как триазолидинедионы, способны снижать инсулинорезистентность и, как известно, являются эффективными способами лечения диабета 2 типа.
Эффект лечения диабета можно оценивать следующим образом. Если возможно, оценивают как биологическую эффективность метода лечения, так и клиническую эффективность. Например, вследствие того, что само заболевание проявляется посредством повышенного сахара в крови, биологическая эффективность лечения вследствие этого может быть оценена, например, путем наблюдения возврата оцениваемой глюкозы в крови в сторону нормальной. Измерение гликозилированного гемоглобина, также называемого A1c или HbA1c, представляет собой другой широко используемый параметр контроля глюкозы в крови. Измерение клинического результата, который может дать показание регенерации b-клеток после, например, шестимесячного периода времени, может дать показание клинической эффективности лечебной схемы.
G. Ревматоидный артрит
Соединение и способы данного изобретения могут использоваться для лечения пациентов с RA. Обычно первые признаки ревматоидного артрита (RA) возникают в слое синовиальной выстилки с пролиферации синовиальных фибробластов и их прикреплению к суставной поверхности у края сустава (Lipsky, 1998). В последующем макрофаги, T-клетки и другие клетки воспаления перемещаются в сустав, где они продуцируют ряд медиаторов, включая цитокины интерлейкин-1 (IL-1), который способствует развитию хронических последствий, приводящих к разрушению кости и хряща, и фактор некроза опухоли (TNF-α), который играет роль в воспалении (Dinarello, 1998; Arend и Dayer, 1995; van den Berg, 2001). Концентрация IL-1 в плазме является значительно более высокой у пациентов с RA, чем у здоровых индивидов и, в частности, уровни IL-1 в плазме коррелируют с активностью заболевания RA (Eastgate et al. 1988). Более того, уровни IL-1 в синовиальной текучей среде коррелируют с различными рентгенологическими и гистологическими особенностями RA (Kahle et al. 1992; Rooney et al. 1990).
В здоровых суставах действие данных и других провоспалительных цитокинов уравновешивается рядом противовоспалительных цитокинов и регуляторных факторов (Burger и Dayer, 1995). Важность данного баланса цитокинов проиллюстрирована у пациентов ювенильным RA, которые имеют волгообразные повышения температуры в течение дня (Prieur et al. 1987). После каждого пика лихорадки в сыворотке и моче обнаруживают фактор, который блокирует действие IL-1. Данный фактор был выделен, клонирован и идентифицирован как антагонист рецептора к интерлeйкину-1 (IL-1ra), член семейства генов IL-1 (Hannum et al. 1990). IL-1ra, как показывает его незвание, представляет собой природный антагонист рецепторов, который конкурирует с IL-1 с целью связывания с рецепторами к IL-1 типа I и в результате блокирует действие IL-1 (Arend et al. 1998). Чтобы эффективно блокировать IL-1, может потребоваться 10-100-кратное повышение IL-1ra; однако синовиальные клетки, выделенные от пациентов с RA, не показывают продукции IL-1ra, достаточной для противодействия эффектам IL-1 (Firestein et al. 1994; Fujikawa et al. 1995).
H. Псориатический артрит
Соединение и способы данного изобретения могут использоваться для лечения пациентов с псориатическим артритом. Псориаз представляет собой воспалительное и пролиферативное поражение кожи с распространенностью 1,5-3%. Приблизительно у 20% пациентов с псориазом развивается характерная форма артрита, которая имеет несколько видов (Gladman, 1992; Jones et al. 1994; Gladman et al. 1995). У некоторых индивидов первыми появляются суставные симптомы, но у большинства первым появляется псориаз кожи. Приблизительно одна треть пациентов имеет одновременное обострение их кожного и суставного заболевания (Gladman et al. 1987), и имеется топографическая взаимосвязь между заболеванием ногтей и дистальных межфаланговых суставов (Jones et al. 1994; Wright, 1956). Хотя воспалительные процессы, которые связаны с заболеванием кожи, ногтей и суставов, остаются неяными, задействованной является иммунноопосредованная патология.
Псориатический артрит (PsA) представляет собой хроническую воспалительную артропатию, характеризующуюся взаимосвязью артрита и псориаза, и было признано нозологической единицей, не являющейся ревматоидным артритом (RA), в 1964 году (Blumberg et al. 1964). Последующие исследования выявили, что PsA имеет ряд генетических, патологических и клинических свойств, общий с другими спондилоартропатиями (SpA), группой заболеваний, которые включают в себя анкилозирующий спондилит, реактивный артрит и энтеропатический артрит (Wright, 1979). Точка зрения, что PsA принадлежит к группе SpA, в настоящее время получила дополнительное подтверждение радиофармацевтическими исследованиями, демонстрирующими распространенный энтезит, включая PsA, но не RA (McGonagle et al. 1999; McGonagle et al. 1998). Более конкретно, утверждают, что энтезит является одним из наиболее ранних событий, возникающих при SpA, приводящих к ремоделированию кости и анкилозу позвоночника, а также к суставному синовиту, когда воспаленные энтезисы расположены в непосредственной близости к периферическим суставам. Однако связь между энтезитом и клиническими проявлениями при PsA остается во многом неясной, поскольку PsA может присутствовать с достаточно разнородными формами поражения суставов с различной степенью тяжести (Marsal et al. 1999; Salvarani et al. 1998). Таким образом, для объяснения разнообразных признаков PsA за основу должны быть взяты другие факторы, только немногие из которых (такие как экспрессия молекулы HLA-B27, которая тесно связана с основным заболеванием) были определены. Как следствие, остается трудным спроецировать проявления заболевания на специфические механизмы развития патологического процесса, что означает, что лечение данного патологического состояния остается во многом эмпирическим.
Семейные исследования предположили роль генетики в развитии PsA (Moll и Wright, 1973). Считается, что сложную генетическую основу имеют другие хронические воспалительные формы артрита, такие как анкилозирующий спондилит и ревматоидный артрит. Однако генетический компонент PsA было трудно оценить по нескольким причинам. Существует убедительное доказательство генетической предрасположенности к одному лишь псориазу, который может маскировать генетические факторы, которые являются важными для развития PsA. Хотя PsA лучше было бы признать отдельную нозологической единицей, иногда существует фенотипическое совпадение ревматоидного артрита и анкилозирующего спондилита. Кроме того, сам по себе PsA не является однородным патологическим состоянием, и были предложены различные подгруппы.
Сообщали о повышенных количествах TNF-α как в псориатически измененной коже (Ettehadi et al. 1994), так и в синовиальный текучей среде (Partsch et al. 1997). Недавние испытания продемонстрировали положительный эффект анти-TNF лечения как при PsA (Mease et al. 2000), так и при анкилозирующем спондилите (Brandt et al. 2000).
I. Реактивный артрит
Соединение и способы данного изобретения могут использоваться для лечения пациентов с реактивным артритом. При реактивном артрите (ReA) механизм повреждения суставов не ясен, но возможно, что особо важную роль играют цитокины. Сообщалось о более превалирующем профиле Th1, высоких уровнях гамма-интерферона (IFN-γ) и низких уровнях интерлейкина-4 (IL-4) (Lahesmaa et al. 1992; Schlaak et al. 1992; Simon et al. 1993; Schlaak et al. 1996; Kotake et al. 1999; Ribbens et al. 2000), но несколько исследований показали относительное преобладание IL-4 и IL-10 и относительный недостаток IFN-γ и фактора некроза опухоли альфа (TNF-α) в синовиальный оболочке (Simon et al. 1994; Yin et al. 1999) и текучей среде (SF) (Yin et al. 1999; Yin et al. 1997) у пациентов с реактивным артритом по сравнению с пациентами с ревматоидным артритом (RA). Также сообщалось о более низком уровне секреции TNF-α у пациентов с реактивным артритом, чем у пациентов с RA, после стимуляции ex vivo мононуклеарных клеток периферической крови (PBMC) (Braun et al. 1999).
Было обосновано, что клиренс бактерий, ассоциированных с реактивным артритом, требует выработки соответствующих уровней IFN-γ и TNF-α несмотря на то, что IL-10 действует путем подавления данных ответов (Autenrieth et al. 1994; Sieper и Braun, 1995). IL-10 представляет собой регуляторный цитокин, который ингибирует синтез IL-12 и TNF-γ посредством активации макрофагов (de Waal et al. 1991; Hart et al. 1995; Chomarat et al. 1995) и IFN-γ T-клетками (Macatonia et al. 1993).
J. Энтеропатический артрит
Соединение и способы данного изобретения могут использоваться для лечения пациентов с энтеропатическим артритом. Обычно энтеропатический артрит (EA) возникает в комбинации с воспалительными заболеваниями кишечника (IBD), такими как болезнь Крона или неспецифический язвенный колит. Он также могут влиять на позвоночник и крестцово-подвздошные суставы. Энтеропатический артрит затрагивает периферические суставы, обычно нижних конечностей, такие как коленные или голеностопные. В основном он затрагивает только немногие, или ограниченное количество, суставов и может сопровождать патологическое состояние кишечника. Он возникает приблизительно у 11% пациентов с неспецифическим язвенным колитом и 21% больных с болезнью Крона. Синовит является в основном самокупирующимся и недеформирующим.
Энтеропатические артропатии включают в себя группу ревматологических патологических состояний, которые имеют связь с патологией ЖКТ. Данные патологические состояния включают в себя реактивный (т.е. связанный с инфекцией) артрит, вызванный бактериями (напр., Shigella, Salmonella, Campylobacter, виды Yersinia, Clostridium difficile), паразитами (напр., Strongyloides stercoralis, Taenia saginata, Giardia lamblia, Ascaris lumbricoides, виды Cryptosporidium), и спондилоартропатии, ассоциированные с воспалительным заболеванием кишечника (IBD). Другие патологические состояния и нарушения включают шунтирование тонкой кишки (тоще-подвздошнокишечный), артрит, глютеновую энтеропатию, болезнь Уиппла и коллагенозный колит.
K. Ювенильный ревматоидный артрит
Соединение и способы данного изобретения могут использоваться для лечения пациентов с JRA. Ювенильный ревматоидный артрит (JRA), термин для наиболее превалирующейм формы артрита у детей, применяют к семейству болезней, характеризующихся хроническим воспалением и гипертрофией синовиальных оболочек. Термин совпадает, но не является полным синонимом с семейством болезней, именуемым в Европе ювенильный хронический артрит и/или ювенильный идиопатический артрит.
Как врожденная, так и адаптивная иммунная система использует множество типов клеток, огромную массу клеточных поверхностей и секретируемых белков и взаимосвязанные переплетения положительных и отрицательных обратных связей (Lo et al. 1999). Кроме того, несмотря на надуманную раздельность, врожденное и адаптивное звенья иммунной системы функционально совпадают (Fearon и Locksley, 1996), и патологические явления, возникающие в данных совпадающих точках, вероятно, имеют серьезное отношение к пониманию авторами изобретения патогенеза взрослой и детской форм хронического артрита (Warrington, et al. 2001).
Полиартикулярный JRA представляет собой отдельный клинический подтип, характеризующийся воспалением и синовиальной пролиферацией во множестве суставов (четырех или более), включая мелкие суставы кистей (Jarvis, 2002). Данный подтип JRA может представлять собой тяжелое, вследствие как множественного поражения суставов, так и его способностью к быстрому прогрессированию с течением времени. Несмотря на клиническую обособленность, полиартикулярный JRA не является однородным, и пациенты различаются по проявлениям заболевания, возрасту возникновения, прогнозу и терапевтическому ответу. Данные различия, весьма вероятно, отражают спектр изменений в природе иммунной и воспалительной атаки, которая может возникать при данном заболевании (Jarvis, 1998).
L. Ранний воспалительный артрит
Соединение и способы данного изобретения могут использоваться для лечения пациентов с ранним воспалительным артритом. Клиническая картина различных воспалительных артропатии сходна на ранних стадиях заболевания. В результате часто является трудным распознать пациентов, которые имеют риск развития тяжелого и персистирующего синовита, который приводит к эрозивному поражению суставов, от пациентов, у которых артрит является более самокупирующимся. Данное распознавание является весьма важным для должной таргетной терапии, активного лечения больных с эрозивным заболеванием и избежания излишней токсичности у пациентов с более самокупирующимся заболеванием. Современные клинические критерии для диагностики эрозивных артропатий, таких как ревматоидный артрит (RA), являются менее эффективными при раннем заболевании, и традиционные маркеры активности заболевания, такие как количество суставов и ответ острой фазы, не идентифицируют пациентов адекватно и, вероятно, имеют плохие результаты (Harrison et al. 1998). Наиболее вероятно, важное прогностическое значение имеют параметры, отражающие патологические явления, возникающие в синовии.
Недавние усилия идентифицировать прогностические факторы плохого результата при раннем воспалительном артрите выявили присутствие RA-специфических аутоантител, в частности антител к цитруллинированным пептидам, для связи с эрозивным и персистирующим заболеванием в когортах больных с ранним воспалительным артритом. На основании этого для помощи идентификации анти-CCP антител в сыворотке пациента был обнаружен циклический цитруллинированный пептид (CCP). С использованием данного подхода было показано, что присутствие анти-CCP антител является специфическим и чувствительным для RA, может отличить RA от других артропатий и может потенциально прогнозировать персистирующий, эрозивный синовит до того, как данные результаты клинически проявятся. Важно, что анти-CCP антитела часто определяют в сыворотке многие годы до клинических симптомов, предполагая, что они могут отражать субклинические иммунные события (Nielen et al. 2004; Rantapaa-Dahlqvist et al. 2003).
M. Анкилозирующий спондилит
Соединение и способы данного изобретения могут использоваться для лечения пациентов с анкилозирующим спондилитом. AS представляет собой разновидность заболевания в обширной классификации заболеваний спондилоартропатий. Пациенты, пораженные различными разновидностями спондилоартропатий, имеют этиологию заболевания, которая часто весьма различна, варьируя от бактериальных инфекций до наследственности. При этом во всех подгруппах конечным результатом процесса заболевания является аксиальный артрит. Несмотря на ранние клинические различия, наблюдаемые в различных популяциях пациентов, многие из них завершаются практически одинаково после течения болезни от десяти до двадцати лет. Недавние исследования предполагают, что среднее время до установки клинического диагноза анкилозирующего спондилита от начала заболевания составляет 7,5 лет (Khan, 1998). Эти же исследования предполагают, что спондилоартропатии могут иметь распространенность, близкую к таковой у ревматоидного артрита (Feldtkeller et al. 2003; Doran et al. 2003).
AS представляет собой хроническое системное воспалительное ревматическое расстройство осевого скелета с внескелетными проявлениями или без них. Прежде всего поражаются крестцово-подвздошные суставы и позвоночник, но также могут быть поражены тазобедренные и плечевые суставы, и менее часто периферические суставы или определенные внесуставные структуры, такие как глаз, сосудистая система, нервная система и желудочно-кишечный тракт. Его этиология все еще полностью не ясна (Wordsworth, 1995; Calin и Taurog, 1998). Он тесно связан с аллелью HLA-B27 главного комплекса гистосовместимости класса I (MHC I) (Calin и Taurog, 1998). AS поражает индивидов в расцвете их жизни и является грозным вследствие его способности вызывать хроническую боль и необратимые повреждения сухожилий, связок, суставов и костей (Brewerton et al. 1973a; Brewerton et al. 1973b; Schlosstein et al. 1973). AS может возникать отдельно или в связи с другой формой спондилоартропатии, такой как реактивный артрит, псориаз, псориатический артрит, энтезит, неспецифический язвенный колит, воспалительное заболевание кишечника или болезнь Крона, в случае которых его классифицируют как вторичный AS.
Пораженные участки обычно включают дисковертебральные, апофизарные, реберно-позвоночные и реберно-поперечные суставы позвоночника и паравертебральный связочный аппарат. Также при данном заболевании является выраженным воспаление энтезисов, которые являются местами мышечно-сухожильных и связочных прекреплений к костям (Calin и Taurog, 1998). Известно, что участок энтезита инфильтрируется плазматическим клетками, лимфоцитами и полиморфно-ядерными клетками. Воспалительный процесс часто приводит к постепенному фиброзному и костному анкилозу (Ball, 1971; Khan, 1990).
В основном установка диагноза задерживается вследствие того, что симптомы часто приписывают более частым проблемам со спиной. Ранним признаком AS является выраженная потеря гибкости в поясничном отделе позвоночника. Другие частые симптомы включают хроническую боль и тугоподвижность в нижней части спины, которая обычно начинается, где нижний отдел позвоночника сочленяется с тазом или бедром. Хотя основные симптомы начинаются в поясничной и крестцово-подвздошных облястях, они могут вовлекать шею, а также верхнюю часть спины. Артрит также может возникать в плечевых, тазобедренных суставах и суставах стоп. Некоторые пациенты имеют воспаление глаз, и более тяжелые случаи должны наблюдаться на поражение клапанов сердца.
Наиболее частым проявлением является боль в спине, но заболевание может начинаться атипично в периферических суставах, особенно у детей и женщин, и редко с сильным иритом (передним увеитом). Дополнительными ранними симптомами и признаками являются сниженная экскурсия грудной клетки вследствие диффузного поражения реберно-позвоночных суставов, субфебрильная лихорадка, слабость, отсутствие аппетита, потеря массы тела и анемия. Рецидивирующая боль в спине - часто ночная и различной интенсивности - является возможной жалобой, как и утренняя тугоподвижность, обычно ослабляющая при активности. Боль в спине и спазм околопозвоночных мышц облегчает согнутое или наклоненное положение; таким образом, у нелеченных пациентов частой является некоторая степень кифоза.
Системные проявления возникают у ⅓ пациентов. Рецидивирующий, обычно самокупирующийся, острый ирит (передний увеит) редко является продолжительным и достаточно тяжелым, чтобы нарушить зрение. Неврологические признаки могут изредка быть следствием компрессионного или пояснично-крестцового радикулита, перелома или подвывиха позвонков и синдрома конского хвоста (который состоит из импотенции, ночного недержания мочи, сниженной чувствительности мочевого пузыря и прямой кишки и отсутствия ахиллова рефлекса). Сердечно-сосудистые проявления могут включать в себя аортальную недостаточность, стенокардию, перикардит и нарушения ЭКГ. Редкой легочной находкой является фиброз верхней доли, изредка с образованием полостей, который может быть принят за TB и может осложняться инфицированием Aspergillus.
AS характеризуется обострениями активного спондилита легкой или средней тяжести, чередующимися с периодами почти или полностью неактивного воспаления. Надлежащее лечение у большинства пациентов приводит к минимальной или отсутствию инвалидизации и в полной мере продуктивной жизни несмотря на тугоподвижность спины. Изредка течение является тяжелым и прогрессирующим, приводя к ярко выраженным инвалидизирующим деформациям. Прогноз неблагоприятный для пациентов с рефрактерным иритом и для редких пациентов с вторичным амилоидозом.
N. Неспецифический язвенный колит
Соединение и способы данного изобретения могут использоваться для лечения пациентов с неспецифическим язвенным колитом. Неспецифический язвенный колит представляет собой заболевание, которые вызывает воспаление и открытые поражения, называемые язвы, в слизистой толстой кишки. Воспаление обычно возникает в прямой кишке и нижней части ободочной, но оно может поражать всю толстую кишку. Неспецифический язвенный колит редко поражает тонкую кишку за исключением концевого участка, называемого терминальный отдел подвздошной кишки. Неспецифический язвенный колит также может называться колит или проктит. Воспаление часто делает толстую кишку опорожненной, вызывая диарею. Язвы образуются в местах, где воспаление убивает клетки слизистой толстой кишки; язвы кровоточат и продуцируют гной.
Неспецифический язвенный колит представляет собой воспалительное заболевание кишечника (IBD), общее название для заболеваний, которые вызывают воспаление в тонкой и толстой кишке. Неспецифический язвенный колит может быть трудным для диагностики вследствие того, что его симптомы являются аналогичными другим расстройствам кишечника и другому типу IBD, болезни Крона. Болезнь Крона отличается от неспецифического язвенного колита вследствие того, что она вызывает более глубокое воспаление в пределах стенки кишки. Кроме того, болезнь Крона обычно возникает в тонкой кишке, хотя она также может возникать в ротовой полости, пищеводе, желудке, двенадцатиперстной кишке, толстой кишке, червеобразном отростке и анусе.
Неспецифический язвенный колит может возникать у людей любого возраста, но наиболее часто он начинается в возрасте между 15 и 30 годами или менее часто в возрасте между 50 и 70 годами. Иногда заболевание развивается у детей и подростков. Неспецифический язвенный колит поражает одинаково мужчин и женщин и возникает, распространяясь в некоторых семьях. Теории о причинах неспецифического язвенного колита многочисленны, но ни одна не была доказана. Наиболее популярна теория, что иммунная система организма реагирует на вирусы или бактерии, вызывая продолжающееся воспаление в стенке кишки. Люди с неспецифическим язвенным колитом имеют нарушения в иммунной системе, но врачи не знают, данные нарушения - это причина или результат заболевания. Неспецифический язвенный колит не обусловлен эмоциональным дистрессом или чувствительностью к определенной пище или пищевым продуктам, но у некоторых людей данные факторы могут запускать симптомы.
Наиболее частыми симптомами неспецифического язвенного колита являются абдоминальная боль и кровавый понос. Пациенты также может испытывать слабость, потерю массы тела, потерю аппетита, кровотечение из прямой кишки и потерю жидкостей организма и патитальеных веществ. Приблизительно половина пациентов имеют легкие симптомы. Другие страдают от частой лихорадки, кровавого поноса, тошноты и тяжелой абдоминальной колики. Неспецифический язвенный колит также может вызывать такие проблемы, как артрит, воспаление глаза, заболевание печени (гепатит, цирроз и первичный склерозирующий холангит), остеопороз, кожную сыпь и анемию. Никто не знает точно, почему возникают проблемы за пределами толстой кишки. Ученые думают, данные осложнения могут возникать, когда иммунная система инициирует воспаление в других частях организма. Некоторые данные проблемы уходят, когда вылечен колит.
Для диагностики язвенного колита может потребоваться тщательный медицинский осмотр и ряд анализов. Можно сделать анализы крови для проверки на анемию, которая может указать на кровотечение в толстой кишке или прямой кишке. Также анализы крови могут выявить большое количество белых кровяных клеток, что является признаком воспаления где-либо в организме. Посредством исследования образцов кала врач может определить кровотечение или инфекцию в толстой или прямой кишке. Врач может выполнить колоноскопию или сигмоскопию. Для того или другго исследования врач вводит эндоскоп - длинную, гибкую, оборудованную освещением трубку, соединенную с компьютером и телемонитором - в анус с целью осмотра толстой и прямой кишки изнутри. Врач сможет увидеть любое воспаление, кровотечение или язвы на стенке толстой кишки. Во время исследования врач может сделать биопсию, которая включает в себя взятие образца ткани из слизистой толстой кишки, чтобы рассмотреть его в микроскоп. Также может потребоваться рентгеноконтрастное исследование толстой кишки с бариевой клизмой. Данная манипуляция заключается в заполнении толстой кишки барием, мелово-белым раствором. На рентгеновской пленке барий выглядит белым, делая возможным для врача четкое изображение толстой кишки, включая любые язвы или другие нарушения, которые там могут быть.
Лечение неспецифического язвенного колита зависит от степени тяжести заболевания. Большинство людей лечатся с помощью лекарственных препаратов. В тяжелых случаях пациент может нуждаться в операции для удаления пораженной болезнью толстой кишки. Операция является единственным лечением для неспецифического язвенного колита. Некоторые люди, у которых симптомы были инициированы определенной пищей, способны регулировать симптомы путем избегания пищи, которая вызывает расстройство их кишечника, например, сильно приправленная пища, сырые фрукты и овощи или молочный сахар (лактоза). Каждый человек может по-своему переносить неспецифический язвенный колит, так что лечение подбирается для каждого отдельно. Важной является эмоциональная и психологическая поддержка. Некоторые люди имеют ремиссии - периоды, когда симптомы уходят - которые длятся месяцы или даже годы. Однако симптомы большинства пациентов в конечном счете возвращаются. Данное изменение картины заболевания означает, что не всегда можно сказать, что лечение помогло. Некоторым людям с неспецифическим язвенным колитом в течение некоторого времени может требоваться медицинская помощь с регулярными посещениями врача, чтобы контролировать состояние.
O. Болезнь Крона
Соединение и способы данного изобретения могут использоваться для лечения пациентов с болезнью Крона. Другим расстройством, для которого была апробирована на практике иммуносупрессия, является болезнь Крона. Симптомы болезни Крона включают воспаление кишечника и развитие стеноза и свищей кишки; часто данные симптомы сопровождает нейропатия. Обычно предписываемые противовоспалительные лекарственные средства, такие как 5-аминосалицилаты (напр., месаламин), или кортикостероиды не всегда являются эффективными (изложено у Botoman et al. 1998). Иногда иммуносупрессия циклоспорином является полезной для пациентов, резистентных или не переносящих кортикостероиды (Brynskov et al. 1989).
Усилия для развития средств диагностики и лечения болезни Крона сфокусированы на центральной роли цитокинов (Schreiber, 1998; van Hogezand и Verspaget, 1998). Цитокины представляют собой небольшие секретируемые белки или факторы (от 5 до 20 кДа), которые обладают специфическим действием на межклеточные взаимодействия, межклеточную коммуникацию или поведение других клеток. Цитокины продуцируются лимфоцитами, особенно TH1 и TH2 лимфоцитами, моноцитами, кишечными макрофагами, гранулоцитами, эпителиальными клетками и фибробластами (изложено у Rogler и Andus, 1998; Galley и Webster, 1996). Некоторые цитокины являются провоспалительными (напр., TNF-α, IL-1(α и β), IL-6, IL-8, IL-12 или фактор, ингибирующий лейкоз [LIF]); другие являются противовоспалительными (напр., антагонист рецептора к интерлeйкину-1, IL-4, IL-10, IL-11 и TGF-β). Однако при определенных воспалительных патологических состояниях может иметь место совпадение и функциональная избыточность в их действии.
В активных случаях болезни Крона в кровоток секретируются повышенные концентрации TNF-α и IL-6 и TNF-α, IL-1, IL-6 и IL-8 в избытке продуцируются местно мукозными клетками (id.; Funakoshi et al. 1998). Данные цитокины могут обладать дистантным действием на физиологические системы, включая развитие костей, кроветворение и функцию печени, щитовидной железы и психоневрологические функции. Кроме того, у пациентов с болезнью Крона наблюдали дисбаланс соотношения IL-1β/IL-1ra в пользу провоспалительных IL-1β (Rogler и Andus, 1998; Saiki et al. 1998; Dionne et al. 1998; но см. Kuboyama, 1998). Одно исследование предположило, что профили цитокинов в образцах кала могло бы быть пригодным диагностическим средством для болезни Крона (Saiki et al. 1998).
Виды лечения, которые были предложены для болезни Крона, включают применение различных антагонистов цитокинов (напр., IL-1ra), ингибиторов (напр., IL-1β-превращающего фермента и антиоксидантов) и антицитокиновых антител (Rogler и Andus, 1998; van Hogezand и Verspaget, 1998; Reimund et al. 1998; Lugering et al. 1998; McAlindon et al. 1998). В частности, с некоторым успехом в лечении болезни Крона были апробированы на практике моноклональные антитела против TNF-α (Targan et al. 1997; Stack et al. 1997; van Dullemen et al. 1995). Данные соединения могут использоваться в комбинированной терапии с соединениями настоящего раскрытия.
Другой подход к лечению болезни Крона сфокусирован по меньшей мере на частичной эрадикации сообщества бактерий, которые могут являться инициатором воспалительного ответа, и его замещения на непатогенное сообщество. Например, Патент США № 5599795 раскрывает способ профилактики и лечения болезни Крона у пациентов людей. Их способ был направлен на стерилизацию пищеварительного тракта по меньшей мере с помощью одного антибиотика и по меньшей мере одного противогрибкового агента с целью уничтожения существующей флоры и ее замещения другими, отобранными, хорошо изученными бактериями, взятыми от здоровых людей. Borody коснулся способа лечения болезни Крона с помощью по меньшей мере частичной замены существующей кишечной микрофлоры посредством лаважа и замещения новым бактериальным сообществом, внедренным посредством инокуляции фекалий от донора человека с проведенным скринингом на заболевание или посредством композиции, включающей в себя виды Bacteroides и Escherichia coli (Патент США № 5443826).
P. Системная красная волчанка
Соединение и способы данного изобретения могут использоваться для лечения пациентов с SLE. Причина аутоиммунных заболеваний, таких как системная красная волчанка, также не известна. Системная красная волчанка (SLE) представляет собой аутоиммунное ревматическое заболевание, характеризующееся отложением в тканях аутоантител и иммунных комплексов, приводящее к повреждению тканей (Kotzin, 1996). В отличие от аутоиммунных заболеваний, таких как MS и сахарный диабет 1 типа, SLE, возможно, непосредственно затрагивает множество систем органов, и ее клинические проявления разнообразны и изменчивы (изложено Kotzin и O'Dell, 1995). Например, некоторые пациенты могут демонстрировать в первую очередь кожную сыпь и боль в суставах, показывать спонтанные ремиссии и требуют легкое лекарственное лечение. В другой части спектра находятся пациенты, которые демонстрируют тяжелое и прогрессирующее поражение почек, которое требует терапию высокими дозами стероидов и цитотоксических лекарственных средств, таких как циклофосфамид (Kotzin, 1996).
Серологическим критерием SLE и первичным доступным диагностическим тестом является повышенные уровни в сыворотке антител IgG к составляющим элементам ядра клетки, таким как двухспиральная ДНК (dsDNA), односпиральная ДНК (ss-DNA) и хроматин. Среди данных аутоантител анти-dsDNA антитела IgG играют главную роль в развитии волчаночного гломерулонефрита (GN) (Hahn и Tsao, 1993; Ohnishi et al. 1994). Гломерулонефрит представляет собой тяжелое патологическое состояние, при котором стенки капилляров очищающих почечную кровь гломерул становятся утолщенными из-за отложений на эпителиальной стороне клубочковых базальных мембран. Заболевание часто является хроническим и прогрессирующим и может привести в конечном счете к почечной недостаточности.
Q. Синдром раздраженной кишки
Соединение и способы данного изобретения могут использоваться для лечения пациентов с синдромом раздраженной кишки (IBS). IBS представляет собой функциональное нарушение, характеризующегося абдоминальной болью и изменением ритма дефекации. Данный синдром может начаться в молодости и может быть связан со значительной инвалидизацией. Данный синдром не является однородным нарушением. Точнее, подтипы IBS были описаны на основании преобладающего симптома - диареи, запора или боли. При отсутствии предупреждающих симптомов, таких как лихорадка, потеря массы тела и желудочно-кишечное кровотечение, необходимо ограниченное обследование. Как только диагноз IBS установлен, комплексный лечебный подход может эффективно уменьшить степень тяжести симптомов. IBS представляет собой часто встречающееся нарушение, хотя коэффициент его распространенности варьирует. В целом, в США IBS поражает приблизительно 15% взрослых и возникает приблизительно в три раза чаще у женщин, чем у мужчин (Jailwala et al. 2000).
Ежегодно IBS насчитывает между 2,4 миллиона и 3,5 миллиона посещений к врачам. Он не только является наиболее частым состоянием, наблюдаемым гастроэнтерологами, но также является одним из наиболее частых патологических состояний желудочно-кишечного тракта, наблюдаемым врачами первичного звена (Everhart et al. 1991; Sandler, 1990).
Также IBS является затратным расстройством. По сравнению с людьми, которые не имеют симптомов со стороны кишечника, люди с IBS пропускают в три раза больше рабочих дней и более вероятно сообщают о том, что были слишком больны, чтобы работать (Drossman et al. 1993; Drossman et al. 1997). Более того, больные IBS несут расходы на сотни долларов больше, чем люди без расстройств кишечника (Talley et al. 1995).
Никакая конкретная патология не является причиной для обострения и ремиссии абдоминальной боли и изменения ритма дефекации, испытываемых пациентами с IBS. Развиваемая теория IBS предполагает нарушение регуляции на множестве уровней оси головной мозг - кишка. Задействованы нарушение моторики, висцеральная гиперчувствительность, патологические изменения в центральной нервной системе (CNS) и инфекция. В дополнение, важную модифицирующую роль играют психосоциальные факторы. Аномальная кишечная перистальтика уже давно считается фактором патогенеза IBS. Было показано, что время прохождения по тонкой кишке после еды является более коротким у пациентов с IBS с превалирующей диареей, чем у пациентов, имеющих подтип с превалирующим запором или с превадирующей болью (Cann et al. 1983).
В исследованиях тонкой кишки во время голодания сообщалось о наличии у пациентов с IBS как дискретных, групповых сокращений, так и пролонгированных, распространяющихся сокращений (Kellow и Phillips, 1987). Они также испытывают боль с нерегулярными сокращениями более часто, чем здоровые люди (Kellow и Phillips, 1987; Horwitz и Fisher, 2001).
Данные сведения о моторике не объясняют весь симптомокомплекс у пациентов с IBS; в действительности, большинство данных пациентов не имеют доказанной патологии (Rothstein, 2000). Пациенты с IBS имеют повышенную чувствительность к висцеральной боли. Исследования с использованием баллонного растяжения ректосигмоидного отдела толстой кишки показали, что пациенты с IBS испытывают боль и вздутие при гораздо более низком давлении и объеме, чем контрольные больные (Whitehead et al. 1990). Данные пациенты сохраняли нормальное восприятие соматических раздражителей.
Для объяснения данного явления было предложено множество теорий. Например, рецепторы во внутренних органах могут иметь повышенную чувствительность в ответ на растяжение или на содержимое в просвете. Нейроны в дорсальном роге спинного мозга могут иметь повышенную возбудимость. В дополнение, могут быть затронуты изменения в обработке ощущений в ЦНС (Drossman et al. 1997). В настоящее время исследования с помощью функциональной магнитно-резонансной томографии показывают, что по сравнению с контрольными больными пациенты с IBS имеют повышенную активацию передней поясной коры, важного болевого центра, в ответ на болевой ректальный раздражитель (Mertz et al. 2000).
Все больше и больше доказательств предполагают взаимосвязь между инфекционным энтеритом и последующим развитием IBS. Могут играть роль воспалительные цитокины. При опросе пациентов с подтвержденным бактериальным гастроэнтеритом в анамнезе (Neal et al. 1997) 25% сообщили о постоянном изменении ритма дефекации. Стойкость симптомов может быть связана с психологическим стрессом во время острой инфекции (Gwee et al. 1999).
Недавние данные предполагают, что избыточный бактериальный рост в тонкой кишке может играть роль в симптомах IBS. В одном исследовании (Pimentel et al. 2000) 157 (78%) из 202 пациентов с IBS, направленных на водородный дыхательный тест, имели результаты теста, положительные на избыточный бактериальный рост. Из 47 больных, которые имели последующее тестирование, 25 (53%) сообщали об улучшении симптомов (т.е. абдоминальной боли и диареи) при лечении антибиотиками.
IBS может присутствовать с диапазоном симптомов. Однако абдоминальная боль и изменение ритма дефекации остаются первичными признаками. Абдоминальный дискомфорт часто описывают как спастический по природе и локализованный в левом нижнем квадранте, хотя степень тяжести и локализация могут значительно различаться. Пациенты могут сообщать о диарее, запоре или чередующихся эпизодах диареи и запора. Симптомы диареи типично описывают как кашицеобразный стул малыми объемами, и иногда стул сопровождается выделением слизи. Пациенты также может сообщать о вздутии, позывах к дефекации, неполном опорожнении кишки и увеличении размеров живота. Также могут иметь место верхние желудочно-кишечные симптомы, такие как желудочно-пищеводный рефлюкс, диспепсия или тошнота. (Lynn и Friedman, 1993).
Стойкость симптомов не является показанием для дополнительного обследования; оно характерно для IBS и само по себе является ожидаемым симптомом синдрома. Более расширенное диагностическое обследование показано пациентам, чьи симптомы ухудшаются или изменяются. Показания для дополнительного обследования также включают в себя наличие предупреждающих симптомов, появления симптомов в возрасте после 50 лет и семейный анамнез рака толстой кишки. Исследования могут включать колоноскопию, компьютерную томографию органов брюшной полости и таза и исследование с барием тонкой и толстой кишки.
R. Синдром Шегрена
Соединение и способы данного изобретения могут использоваться для лечения пациентов с синдромом Шегрена. Первичный синдром Шегрена (SS) представляет собой хроническое, медленно прогрессирующее, системное аутоиммунное заболевание, которое поражает преимущественно женщин среднего возраста (соотношение женщин и мужчин 9:1), хотя его можно наблюдать в любом возрасте, включая детский (Jonsson et al. 2002). Он характеризуюется лимфоцитарной инфильтрацией и разрушением экзокринных желез, которые инфильтрированы мононуклеарными клетками, включая лимфоциты CD4+, CD8+, и B-клетками (Jonsson et al. 2002). В дополнение, у одной трети пациентов наблюдаются проявления вне желез (системные) (Jonsson et al. 2001).
Лимфоцитарная инфильтрация желез представляет собой прогрессирующий признак (Jonsson et al. 1993), которая, при интенсивном процессе, может замещать обширные участки органов. Интересно, что у некоторых пациентов инфильтраты желез весьма напоминают эктопические лимфоидные микроструктуры в слюнных железах (обозначаемые как эктопические зародышевые центры) (Salomonsson et al. 2002; Xanthou et al. 2001). При SS эктопические GC определяют как T- и B-клеточные скопления пролиферирующих клеток с сетью фолликулярных дендритных клеток и активированных эндотелиальных клеток. Данные GC-подобные структуры, сформированные в пределах ткани-мишени, также обрисовывают функциональные свойства с выработкой аутоантител (анти-Ro/SSA и анти-La/SSB) (Salomonsson и Jonsson, 2003).
При других системных аутоиммунных заболеваниях, таких как RA, были идентифицированы факторы, особенно важные для эктопических GC. Ревматоидные синовиальные ткани с GC продемонстрировали продукцию хемокинов CXCL13, CCL21 и лимфотоксина (LT)-β (выявленных на B-клетках фолликулярного центра и мантийной зоны). Многомерный регрессионный анализ данных анализируемых веществ идентифицировал CXCL13 и LT-β в виде единичных цитокинов, прогнозирующих появление GC при ревматоидном синовите (Weyand и Goronzy, 2003). В настоящее время показано, что CXCL13 и CXCR5 в слюнных железах играют незаменимую роль в воспалительном процессе вследствие рекрутирования B- и T-клеток, и вследствие этого способствуя неогенезу лимфоидной ткани и образованию эктопических GC при SS (Salomonsson et al. 2002).
S. Псориаз
Соединение и способы данного изобретения могут использоваться для лечения пациентов с псориазом. Псориаз представляет собой хроническое кожное заболевание, включающее шелушение и воспаление, которое поражает от 2 до 2,6 процентов населения Соединенных Штатов, или между 5,8 и 7,5 миллионов людей. Хотя заболевание возникает во всех возрастных группах, в первую очередь он поражает взрослых. Онн возникает приблизительно в равной мере у мужчин и женщин. Псориаз возникает, когда клетки кожи быстро поднимаются от места их возникновения ниже поверхности кожи и нагромождаются на поверхности до появления у них возможности созреть. Обычно данное перемещение (также называемое ремоделирование) занимает приблизительно месяц, но при псориазе оно может происходить лишь в течение немногих дней. При своей типичной форме псориаз приводит к образованию участков утолщенной, красной (воспаленной) кожи, покрытой серебристыми чешуйками. Данные участки, которые иногда называют бляшками, обычно зудят или являются болезненными. Наиболее часто они возникают на локтях, коленях, других частях ног, волосистой части головы, нижней части спины, лице, ладонях и подошвах стоп, но они могут возникать на коже в любом месте тела. Заболевание также может поражать ногти пальцев кистей и стоп и мягкие ткани гениталий и ротовой полости. Несмотря на то, что для кожи вокруг пораженных суставов не является нетипичным трескаться, приблизительно 1 миллион человек с псориазом испытывают воспаление суставов, которое формирует симптомы артрита. Данное патологическое состояние называется псориатический артрит.
Псориаз представляет собой заболевание кожи, обусловленное иммунной системой, преимущетвенно затрагивающее тип белых клеток крови, называемых T-клетки. Обычно T-клетки помогают защищать организм от инфекции и заболеваний. В случае псориаза T-клетки вводятся в действие по ошибке и становятся настолько активны, что они инициируют другие иммунные ответы, которые приводят к воспалению и быстрому ремоделированию клеток кожи. Приблизительно в одной трети случаев имеется семейный анамнез псориаза. Исследователи изучили большое количество семей, пораженных псориазом, и идентифицировали гены, связанные с заболеванием. Люди с псориазом могут отмечать, что существуют периоды времени, когда их кожа ухудшается, затем улучшается. Патологические состояния, которые может вызывать резкие обострения болезни, включают инфекции, стресс и изменения климата, которые сушат кожу. Кроме того, инициировать резкое обострение болезни или ухудшить заболевание могут определенные лекарства, включая литий и бета-блокаторы, которые выписывают при высоком артериальном давлении.
T. Инфекционные заболевания
Соединение настоящего раскрытия может быть пригодным для лечения инфекционных заболеваний, включая вирусные и бактериальные инфекции. Как отмечено выше, данные инфекции могут быть ассоциированны с тяжелыми локальными или системными воспалительными ответами. Например, грипп может вызывать тяжелое воспаление легких, а бактериальная инфекция может вызывать системный чрезмерный воспалительный ответ, включающий в себя усиленную выработку множества воспалительных цитокинов, что является характерным признаком сепсиса. В дополнение, соединения изобретения могут быть полезными при непосредственном ингибировании репликации вирусных возбудителей. Предыдущие исследования пропродемонстрировали, что родственные соединения, такие как CDDO, могут ингибировать репликацию ВИЧ в макрофагах (Vazquez et al. 2005). Другие исследования показали, что ингибирование передачи сигналов NF-каппа B может ингибировать репликацию вируса гриппа и что циклопентеноновые простагландины могут ингибировать репликацию вируса (напр., Mazur et al. 2007; Pica et al. 2000).
Настоящее изобретение относится к лечению или профилактике каждого из заболевания/нарушения/патологического состояния, упомянутого выше в разделе IV с использованием соединения RTA 408 или его фармацевтически приемлемой соли или полиморфной формы данного соединения (такого как, напр., любая из полиморфных форм, описанных в данном документе выше или ниже) или фармацевтической композиции, включающей в себя любое из упомянутых выше соединений и фармацевтически приемлемый носитель (включая, напр., фармацевтические композиции, описанные в данном документе выше или ниже).
Фармацевтические Готовые Формы и Пути Введения
RTA 408 может быть введен посредством множества способов, напр., перорально или с помощью инъекции (напр., подкожной, внутривенной, интраперитонеальной и т.д.). В зависимости от пути введения, активные соединения могут быть покрыты материалом для защиты соединения от действия кислот и других природных условий, которые могут инактивировать соединение. Также их можно вводить с помощью продленной перфузии/инфузии в участок заболевания или раны.
Для введения RTA 408 с помощью введения, не являющегося парентеральным, необходимо покрыть соединение или соединение для совместного введения материалом для предотвращения его инактивации. Например, терапевтическое соединение может быть введено пациенту в соответствующем носителе, например, липосомах или разбавителе. Фармацевтически приемлемые разбавители включают раствор хлорида натрия и водные буферные растворы. Липосомы включают эмульсии CGF типа вода-в-масле-в-воде, а также традиционные липосомы (Strejan et al. 1984).
RTA 408 также можно вводить парентерально, интраперитонеально, интраспинально или интрацеребрально. Дисперсии могут быть приготовлены в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. При обычных условиях хранения и применения данные препараты могут иметь в своем составе консервант для предотвращения роста микроорганизмов.
Стерильные растворы для инъекций могут быть приготовлены посредством заключения RTA 408 в требуемом количестве в соответствующем растворителе с одним или комбинацией ингредиентов, перечисленных выше, с последующей стерилизацией фильтрованием при необходимости. В целом дисперсии готовят посредством заключения терапевтического соединения в стерильный носитель, который содержит базовую дисперсионную среду и требуемые другие ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций, предпочтительными способами приготовления являются вакуумная сушка и лиофилизация, которые дают порошок активного ингредиента (т.е. терапевтическое соединение) плюс какой-либо дополнительный необходимый ингредиент из его предварительно стерилизованного фильтрованием раствора.
RTA 408 может быть представлен полностью аморфным с использованием методики сушки с прямым распылением. RTA 408 можно вводить перорально, например, с инертным разбавителем или усваиваемым съедобным носителем. Терапевтическое соединение и другие ингредиенты также могут быть заключены в капсулу с твердой или мягкой желатиновой оболочкой, спрессованы в таблетки или включены непосредственно в рацион пациента. Для перорального терапевтического введения терапевтическое соединение может быть объединено с эксципиентами и применяться в форме проглатываемых таблеток, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и тому подобного. Процентная доля терапевтического соединения в композициях и препаратах, конечно, может варьировать. Количество терапевтического соединения в данных терапевтически пригодных композициях таково, что будет получена подходящая дозировка.
Особенно предпочтительным является составление парентеральных композиций в виде единичной дозы для легкого введения и равномерности дозы. Единичная доза, как используется в данном документе, относится к физически дискретным единицам, подходящим в качестве однократных дозировок для пациентов, подлежащих лечению, при этом каждая единица содержт предварительно заданное количество терапевтического соединения, расчитанное для оказания необходимого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем. Описание единичной дозы изобретения определяется и непосредственно зависит от (a) уникальных характеристик терапевтического соединения и конкретного терапевтического действия, которое должно быть достигнуто, и (b) ограничений, присущих данной области, для составления подобного терапевтического соединения для лечения выбранного патологического состояния у пациента.
RTA 408 также можно вводить локально в кожу, глаз или слизистую. В качестве альтернативы при необходимости местной доставки в легкие терапевтическое соединение может быть введено посредством ингаляции в виде сухого порошка или аэрозольной лекарственной формы.
Как правило, RTA 408 необходимо вводить в терапевтически эффективной дозировке, достаточной для лечения патологического состояния, связанного с данным пациентом. Например, эффективность соединения можно оценить в системе животной модели, которая может прогнозировать эффективность при лечении заболевания у людей, такой как системы моделей, показанные в примерах и на чертежах.
Величина фактической дозировки RTA 408 или композиции, включающей в себя RTA 408, вводимой пациенту, может быть определена врачом-клиницистом и физиологическими факторами, такими как возраст, пол, масса тела, степень тяжести патологического состояния, тип заболевания, подлежащего лечению, предшествующие или сопутствуюшие терапевтические вмешательства, индивидуальные особенности пациента и путь введения. Данные факторы могут определяться квалифицированным специалистом. Практикующий врач, ответственный за введение, обычно будет определять концентрацию активного ингредиента (ингредиентов) в композиции и соответствующую дозу (дозы) для конкретного пациента. В случае какого-либо осложнения дозировка может регулироваться конкретным врачом.
Эффективное количество обычно будет варьировать от приблизительно 0,001 мг/кг до приблизительно 1000 мг/кг, от приблизительно 0,01 мг/кг до приблизительно 750 мг/кг, от приблизительно 100 мг/кг до приблизительно 500 мг/кг, от приблизительно 1,0 мг/кг до приблизительно 250 мг/кг, от приблизительно 10,0 мг/кг до приблизительно 150 мг/кг за одно или более введение доз в день в течение одного или нескольких дней (в зависимости от курса, режима введения и факторов, обсуждавшихся выше). Другие подходящие диапазоны доз включают от 1 мг до 10000 мг в день, от 100 мг до 10000 мг в день, от 500 мг до 10000 мг в день и от 500 мг до 1000 мг в день. В некоторых конкретных вариантах осуществления количество составляет менее чем 10000 мг в день с диапазоном от 750 мг до 9000 мг в день.
Эффективное количество может быть менее чем 1 мг/кг/день, менее чем 500 мг/кг/день, менее чем 250 мг/кг/день, менее чем 100 мг/кг/день, менее чем 50 мг/кг/день, менее чем 25 мг/кг/день или менее чем 10 мг/кг/день. В качестве альтернативы оно может находиться в диапазоне от 1 мг/кг/день до 200 мг/кг/день. В некоторых вариантах осуществления количество может составлять 10, 30, 100 или 150 мг/кг, составленное в виде суспензии в кунжутном масле. В некоторых вариантах осуществления количество может составлять 3, 10, 30 или 100 мг/кг, вводимое ежедневно посредством перорального принудительного кормления. В некоторых вариантах осуществления количество может составлять 10, 30 или 100 мг/кг, вводимое перорально. Например, что касается лечения пациентов с диабетом, единица дозирования может представлять собой количество, которое уменьшает глюкозу в крови по меньшей мере на 40% по сравнению с нелеченным пациентом. В другом варианте осуществления единица дозирования представляет собой количество, которое уменьшает глюкозу в крови до уровня, который составляет ±10% уровня глюкозы в крови у пациента, не страдающего диабетом.
В других неограничивающих примерах доза также может содержать от приблизительно 1 микрограмм/кг/массы тела, приблизительно 5 микрограмм/кг/массы тела, приблизительно 10 микрограмм/кг/массы тела, приблизительно 50 микрограмм/кг/массы тела, приблизительно 100 микрограмм/кг/массы тела, приблизительно 200 микрограмм/кг/массы тела, приблизительно 350 микрограмм/кг/массы тела, приблизительно 500 микрограмм/кг/массы тела, приблизительно 1 миллиграмм/кг/массы тела, приблизительно 5 миллиграмм/кг/массы тела, приблизительно 10 миллиграмм/кг/массы тела, приблизительно 50 миллиграмм/кг/массы тела, приблизительно 100 миллиграмм/кг/массы тела, приблизительно 200 миллиграмм/кг/массы тела, приблизительно 350 миллиграмм/кг/массы тела, приблизительно 500 миллиграмм/кг/массы тела, до приблизительно 1000 мг/кг/массы тела или более на введение и любой выводимый из них диапазон. В неограничивающих примерах диапазона, выводимого из чисел, перечисленных в данном документе, можно вводить диапазон от приблизительно 5 мг/кг/массы тела до приблизительно 100 мг/кг/массы тела, от приблизительно 5 микрограмм/кг/массы тела до приблизительно 500 миллиграмм/кг/массы тела и т.д., на основании чисел, описанных выше.
В определенных вариантах осуществления фармацевтическая композиция настоящего раскрытия может включать в себя, например, по меньшей мере приблизительно 0,01% RTA 408. В других вариантах осуществления RTA 408 может составлять между приблизительно 0,01% и приблизительно 75% массы единицы или между приблизительно 0,01% и приблизительно 5%, например, и любой выводимый из них диапазон. В некоторых вариантах осуществления RTA 408 может использоваться в лекарственной форме, такой как 0,01, 0,1 или 1% суспензия в кунжутном масле.
Предусматриваются единичный или многократный прием агента, содержащего RTA 408. Необходимые временные интервалы для доставки множественных доз могут быть определены квалифицированным специалистом в данной области с использованием не более чем стандартных экспериментов. В качестве примера пациенту может быть введено две дозы ежедневно с приблизительно 12-часовыми интервалами. В некоторых вариантах осуществления агент вводят один раз в день. Агент (агенты) можно вводить по стандартной схеме. Как используется в данном документе, стандартная схема относится к предварительно заданному обозначенному периоду времени. Стандартная схема может охватывать периоды времени, которые являются идентичными или которые отличаются по продолжительности при условии, что схема предварительно задана. Например, стандартная схема может включать введение два раза в день, каждый день, каждые два дня, каждые три дня, каждые четыре дня, каждые пять дней, каждые шесть дней, на еженедельной основе, на ежемесячной основе или любое установленное число дней или недель между ними. В качестве альтернативы, предварительно заданная стандартная схема может включать введение на основе два раза в день в течение первой недели за которым седует на ежедневной основе в течение нескольких месяцев и т.д. В других вариантах осуществления изобретение предусматривает, что агент (агенты) можно принимать перорально и что время приема зависит или не зависит от приема пищи. Таким образом, например, агент можно принимать каждое утро и/или каждый вечер независимо от того, когда пациент ел или будет есть.
Примеры
Для демонстрации предпочтительных вариантов осуществления изобретения включены следующие примеры. Квалифицированные специалисты в данной области должны понять, что методики, раскрытые в примерах, которые следуют за представленными методиками, раскрытыми авторами изобретения, должным образом функционируют при осуществлении изобретения на практике, и таким образом, как можно заключить, составляют предпочтительные режимы для их осуществления на практике. Однако квалифицированные специалисты в данной области в свете настоящего раскрытия должны понять, что в конкретных раскрытых вариантах осуществления могут быть сделаны многие изменения, которые все-таки получают одинаковый или аналогичный результат без выхода за пределы сущности и объема правовых притязаний изобретения.
Синтез RTA 408 (63415)
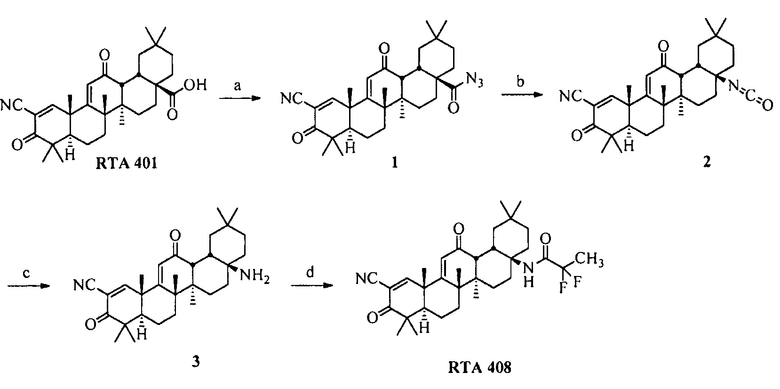
Реагенты и условия: (a) (PhO)2PON3 (DPPA), триэтиламин, толуэн, 0°C в течение 5 минут, затем окружающая температура в течение ночи, ~94%; (b) бензен, 80°C в течение 2 часов; (c) HCl, CH3CN, окружающая температура в течение 1 часа; (d) CH3CF2CO2H, дициклогексилкарбодиимид, 4-(диметиламино)пиридин, CH2Cl2, окружающая температура в течение ночи, 73% от RTA 401 (4 стадии).
Соединение 1: RTA 401 (20,0 г, 40,6 ммоль), триэтиламин (17,0 мл, 122,0 ммоль) и толуэн (400 мл) добавляли в реактор и охлаждали до 0°C со встряхиванием. Дифенилфосфорилазид (DPPA) (13,2 мл, 61,0 ммоль) добавляли со встряхиванием при 0°C в течение 5 минут, и смесь непрерывно встряхивали при комнатной температуре в течение ночи (проверка HPLC-MS демонстрирует отсутствие оставшегося RTA 401). Реакционную смесь загружали непосредственно в колонку с силикагелем и очищали посредством колоночной хроматографии (силикагель, 0%-5% этилацетат в CH2Cl2) чтобы предоставить соединение 1 (19,7 г, ~94%, частичной преобразованное в соединение 2) в виде белой пены.
Соединение 2: Соединение 1 (19,7 г, ~38,1 ммоль) и бензен (250 мл) добавляли в реактор и нагревали до 80°C со встряхиванием в течение 2 часов (проверка HPLC-MS демонстрирует отсутствие оставшегося соединения 1). Реакционную смесь концентрировали при пониженном давлении для получения неочищенного соединения 2 в виде твердого осадка, который использовали для следующей стадия без очистки.
Соединение 3: Неочищенное соединение 2 (≤38,1 ммоль) и CH3CN (200 мл) добавляли в реактор и охлаждали до 0°C со встряхиванием. HCl (12 N, 90 мл) добавляли при 0 C в течение 1 минуты, и смесь непрерывно встряхивали при комнатной температуре в течение 1 часа (проверка HPLC-MS демонстрирует отсутствие оставшегося соединения 2). Реакционную смесь охлаждали до 0°C и добавляли со встряхиванием 10% NaOH (~500 мл). Затем добавляли со встряхиванием насыщенный NaHCO3 (1 л). Водную фазу экстрагировали с помощью этилацетата (2×500 мл). Объединенную органическую фазу промывали H2O (200 мл), насыщали NaCl (200 мл), сушили через Na2SO4 и концентрировали для получения неочищенного соединения 3 (16,62 г) в виде светло-желтой пены, которую использовали для следующей стадии без очистки.
RTA 408: Неочищенный амин 3 (16,62 г, 35,9 ммоль), CH3CF2CO2H (4,7388 г, 43,1 ммоль) и CH2Cl2 (360 мл) добавляли со встряхиванием в реактор при комнатной температуре. Затем добавляли дициклогексилкарбодиимид (DCC) (11,129 г, 53,9 ммоль) и 4-(диметиламино)пиридин (DMAP) (1,65 г, 13,64 ммоль), и смесь непрерывно встряхивали при комнатной температуре в течение ночи (проверка HPLC-MS демонстрирует отсутствие оставшегося соединения 3). Реакционную смесь фильтровали для удаления твердых побочных продуктов, и фильтрат загружали непосредственно в колонку с силикагелем и два раза очищали посредством колоночной хроматографии (силикагель, 0%-20% этилацетат в гексанах), чтобы предоставить соединение RTA 408 (16,347 г, 73% от RTA 401 в течение 4 стадий) в виде белой пены: 1H ЯМР (400 МГц, CD3Cl) δ частей на миллион 8,04 (с, 1H), 6,00 (с, 1H), 5,94 (с,уш., 1H), 3,01 (д, 1H, J=4,8 Гц), 2,75-2,82 (м, 1H), 1,92-2,18 (м, 4H), 1,69-1,85 (м, 7H), 1,53-1,64 (м, 1H), 1,60 (с, 3H), 1,50 (с, 3H), 1,42 (с, 3H), 1,11-1,38 (м, 3H), 1,27 (с, 3H), 1,18 (с, 3H), 1,06 (с, 3H), 1,04 (с, 3H), 0,92 (с, 3H); m/z 555 (M+1).
Фармакодинамика
Ниже предоставлена суть исследований in vitro и in vivo для оценки первичных фармакодинамических эффектов RTA 408.
Эффекты RTA 408 на Keap1-Nrf2 и NF-κB in Vitro
Ингибирование IFNγ-индуцированной выработки NO AIM является Nrf2-зависимым (Dinkova Kostova, 2005). Мышиные макрофаги RAW264.7 предварительно обрабатывали диметилсульфоксидом (носителем) или RTA 408 в течение 2 часов с последующей обработкой 20 нг/мл мышиного IFNγ в течение 24 часов. Уровни нитрита (NO2-) в среде измеряли в виде суррогата для оксида азота с использованием анализа с реагентом Грисса. Жизнеспособность клеток оценивали с использованием анализа WST-1. Обработка RTA 408 привела к дозозависимой супрессии IFNγ-индуцированной выработки NO со средним значением IC50, составляющим 3,8±1,2 нМ. Результаты репрезентативного эксперимента показаны на ФИГ.1. Было обнаружено, что значение IC50 для RTA 408 на 45%-65% ниже, чем значения IC50 для соединений 63170 (8±3 нМ), 63171 (6,9±0,6 нМ), 63179 (11±2 нМ) и 63189 (7±2 нМ). 63170, 63171, 63179 и 63189 представляют собой соединения формул:
Действие RTA 408 на гены-мишени Nrf2
RTA 408 исследовали в двух различных репортерных анализах для оценки активации антиоксидантного ответного элемента (ARE). Первый исследуемый репортер контролировали посредством ARE, полученного из гена NQO1 человека. Клеточную линию HuH-7 гепатомы человека временно транфицировали люциферазной репортерной плазмидой NQO1-ARE, и клетки обрабатывали RTA 408 в течение 18 часов. ФИГ.2a демонстрирует дозозависимую индукцию активности люциферазы посредством RTA 408 в данной клеточной линии. Значения представляют среднее трех независимых экспериментов. Для увеличения транскрипции с NQO1 ARE в клетках HuH-7 в 2 раза RTA 408 (12 нМ) потребовалось на двадцать процентов меньше, чем 63189 (14,9 нМ). Таким же образом, для увеличения транскрипции с NQO1 ARE в клетках HuH-7 в 2 раза RTA 408 потребовалось в 2,1-2,4 раза меньше, чем 63170 (25,2 нМ) и 63179 (29,1 нМ), соответственно. Действие RTA 408 на активацию репортера люциферазы также оценивали в репортерной клеточной линии AREc32. Данную клеточную линию получали из клеток MCF-7 карциномы молочной железы человека и стабильно транфицировали геном-репортером люциферазы под транскрипционным контролем восьми копий последовательности GSTA2 ARE крысы. После обработки RTA 408 в течение 18 часов наблюдали аналогичный дозозависимый ответ в репортерной клеточной линии AREc32 (ФИГ.2b). В обоих репортерных анализах после обработки 15,6 нМ RTA 408 была очевидна ~2-кратная индукция люциферазной активности.
Также было показано, что RTA 408 увеличивает уровни транскриптов известного гена-мишени Nrf2s в клеточных линиях HFL1 фибробластов легких человека и бронхиального эпителия BEAS-2B человека. Обработка фибробластов легкого HFL1 RTA 408 в течение 18 часов привела к повышенной экспрессии нескольких генов-мишеней Nrf2, включая NQO1, HMOX1, GCLM и TXNRD1, которую измеряли посредством количественной ПЦР (ФИГ.3a-d). Для всех исследуемых генов индукция посредством RTA 408 была дозозависимой и выраженной при концентрациях до 15,6 нМ. Обработка клеток BEAS-2B бронхиального эпителия RTA 408 в течение 18 часа привела к аналогичному дозозависимому увеличению всех оцениваемых генов-мишеней Nrf2 (ФИГ.4a-d). RTA 408 также повышало экспрессию генов-мишеней Nrf2 в нормальных мезангиальных клетках (nHMC) человека, клеточной линии BV2 микроглии мышей и в клеточной линии SH-SY5Y нейробластомы человека при аналогичных концентрациях.
Обработка RTA 408 также дозозависимо повышала уровни белка NQO1 в клетках SH-SY5Y (ФИГ.5a). В необработанных или обработанных RTA 408 клетках SH-SY5Y белок HMOX1 не был обнаружен. В клетках BV2 обработка RTA 408 повышала уровни белков NQO1 и HMOX1 в концентрациях до 125 нМ (ФИГ.5b). Значение EC50 для индукции экспрессии белка Nrf2 в клетках SK-N-SH посредством RTA 408 (56,4 нМ) было на 45%-65% ниже, чем значение EC50 для 63171 (122 нМ), 63189 (102 нМ) и 63179 (126 нМ). Потребовалось такое же количество 63170 (54,6 нМ).
EC50 измеряли с использованием внутриклеточного вестерн-анализа NQO1, где клетки инкубировали с соединением с оценкой в течение 3 дней. После инкубирования с исследуемым соединением клетки подвергали взаимодействию с мышином антителом NQO1, а затем на следующий день клетки подвергали взаимодействию с IRDye-800CW-антимышиным IgG антителом. Сигналы-мишени визуализировали, а затем анализировали.
В соответствии с индукцией генов-мишеней Nrf2 и соответствующих белковых продуктов, обработка макрофагальными клетками RAW264.7 мышей в течение 24 часов дозозависимым образом повышала ферментативную активность NQO1 с явным повышением при 7,8 нМ (ФИГ.6).
Взятые вместе, эти данные от множества клеточных линий демонстрируют, что обработка RTA 408 повышает транскрипционную активность, регулируемую антиоксидантными ответными элементами, повышает экспрессию генов-мишеней Nrf2 и повышает активность NQO1, продукт гена-мишени Nrf2.
Действие RTA 408 на Маркеры Клеточного Редокс-Потенциала
Глутатион и NADPH являются жизненно важными факторами, требующимися для поддержания клеточного редокс-потенциала. Было продемонстрировано, что несколько генов, участвующих в синтезе глутатиона (напр., GCLC и GLCM) и NADPH [напр., гексоз-6-фосфатдегидрогеназа (H6PD) и малеиновый фермент 1 (ME1)] регулируются Nrf2 (Wu, 2011). Действие обработки RTA 408 на общие уровни глутатиона оценивали в клеточной линии гепатоцитов AML-12 мышей. Обработка клеток AML-12 в течение 24 часов RTA 408 дозозависимым образом повышала уровни общего глутатиона клетки (ФИГ.7). Показанные данные яляются репрезентативными для двух независимых экспериментов. >2-кратное увеличение общего глутатиона наблюдалось при концентрациях RTA 408 до 15,6 нМ. Значение EC50 с использованием мышиной модели RAW264.7 для индукции уровней глутатиона посредством RTA 408 (9,9 нМ) было на 22%-57% ниже, чем значение EC50 для 63170 (12,1 нМ), 63171 (23,2 нМ) и 63189 (16 нМ).
Действие обработки RTA 408 на уровни NADPH, которое измеряли посредством поглощения редокс-чувствительного красителя WST-1, оценивали в клетках HCT-116. Обработка RTA 408 в течение 24 часов дозозависимым образом повышала поглощение WST-1 (ФИГ.8), предполагая, что повышались уровни NADPH.
Также в данном исследовании оценивали действие RTA 408 на экспрессию генов, участвующих в путях синтеза NADPH. Клетки HCT-116 обрабатывали RTA 408 в течение 24 часов и измеряли уровни мРНК H6PD, фосфоглюконатдегидрогеназы (PGD), транскетолазы (TKT) и ME1 с использованием количественной ПЦР. Обработка RTA 408 привела к дозозависимому увеличению экспрессии генов, участвующих в синтезе NADPH (ФИГ.9a-d).
В итоге обработка RTA 408 повышала уровни общего глутатиона в гепатоцитах AML-12 и повышала поглощение WST-1, маркера выработки NADPH, в клетках HCT-116. Данное наблюдение коррелирует с увеличением экспрессии нескольких ключевые генов, кодирующих ферменты, участвующие в синтезе NADPH.
Действие RTA 408 на Передачу сигналов TNFα-индуцированного NF-κB
NF-κB представляет собой фактор транскрипции, который играет центральную роль в регуляции многих иммунных и воспалительных ответов. Было показано, что RTA 402 и другие AIM ингибируют в ряде клеточных линий передачу сигналов провоспалительного NF-κB (Shishodia, 2006; Ahmad, 2006; Yore, 2006). Действие RTA 408 на передачу сигналов TNFα-индуцированного NF-κB оценивали в клетках HeLa/NF-κB-Luc, в клеточной линии аденокарциномы шейки матки человека стабильно транфицированной люциферазным репортерным конструктом, под контролем множества NF-κB транскрипционных ответных элементов. Клетки HeLa/NF-κB-Luc предварительно обрабатывали RTA 408 в течение 1 часа с последующей обработкой TNFα (10 нг/мл) в течение дополнительных 5 часов. После обработки измеряли люминисценцию и определяли действие предварительной обработки RTA 408 на TNFα-индуцированную люциферазную активность. Средние результаты и стандартные отклонения трех независимых экспериментов показаны на ФИГ.10. RTA 408 дозозависимым образом ингибировало TNFα-индуцированную активацию NF-κB со значением IC50, составляющим 517±83 нМ. Аналогичные результаты наблюдали в другой NF-κB репортерной клеточной линии (A549/NF-κB-Luc), где RTA 408 ингибировало активацию TNFα-индуцированного NF-κB со значением IC50, равным 627 нМ (диапазон 614-649 нМ). RTA 408 было в 1,6-1,8 раза более эффективным при пониженной экспрессии от репортера промотера NF-κB в клетках HeLa/NF-κB-Luc, чем 63189 (854 нМ) и 63170 (953 нМ), соответственно.
Действие RTA 408 на TNFα-индуцированное фосфорилирование IκBα, ключевую стадию активации пути NF-κB, также оценивали в клетках HeLa. Клетки HeLa предварительно обрабатывали RTA 408 в течение 6 часов с последующей обработкой TNFα (20 нг/мл) в течение 5 мин. Уровни общего и фосфорилированного IκBα оценивали посредством вестерн-блоттинга. В соответствии с результатами анализа репортеров люциферазы RTA 408 дозозависимым образом ингибировало TNFα-индуцированное фосфорилирование IκBα (ФИГ.11).
Также было продемонстрировано, что RTA 408 ингибирует другие провоспалительные сигнальные пути, такие как фосфорилирование IL-6-индуцированного сигнального трансдьюсера и активатора транскрипции 3 (STAT3) и лиганд рецептора активатора NF-κB (RANKL)-индуцированного остеокластогенеза. В клетках HeLa предварительная обработка 1 мкм RTA 408 в течение 6 часов ингибировала фосфорилирование STAT3, индуцированное IL-6. Остеокластогенез представляет собой многостадийный процесс дифференцировки, которая является следствием связывания RANKL со своим рецептором, RANK, на клетках гематопоэтического происхождения. Это приводит к активации NF-κB и MAPK, которые в свою очередь увеличивают транскрипцию остеокласт-специфических генов-мишеней, включая тартрат-устойчивую кислую фосфатазу (TRAP). Действие RTA 408 на RANKL-индуцированный остеокластогенез оценивали в мышиной макрофагальной клеточной линии RAW264.7. Клетки RAW264.7 предварительно обрабатывали в течение 2 часов RTA 408, а затем обрабатывали 50 нг/мл рекомбинантным мышиным RANKL. RTA 408 дозозависимым образом ингибировало активность RANKL-индуцированной TRAP и образование остеокластов, с IC50, составляющим ~5-10 нМ.
Действие RTA 408 на Экспрессию Генов, кодирующих Ферменты Трансаминазы
Повышение уровней трансаминазы наблюдали в 28-дневном токсикологическом исследовании RTA 408 у крыс и в гораздо меньшей степени у обезьян. Аналогичные показатели наблюдались после перорального введения родственного AIM (бардоксолон-метила) у людей (Pergola, 2011). Одна гипотеза для данного действия состоит в том, что AIM непосредственно или опосредованно повышает экспрессию гена трансаминазы при отсутствии клеточной токсичности. Для оценки, нарушает ли обработка RTA 408 уровни мРНК трансаминазы, гепатоциты AML-12 мышей обрабатывали RTA 408 в течение 18 часов, и уровни мРНК генов, кодирующих трансаминазу, измеряли с использованием количественной ПЦР. Обработка RTA 408 повышала уровни мРНК аланинтрансаминазы 1 (Alt1 или Gpt1) и аспартаттрансаминазы 1 (Ast1 или Got1) (ФИГ.12a,c). RTA 408 не оказывало действия на уровни мРНК аланинтрансаминазы 2 (Alt2 или Gpt2) и снижало уровни мРНК аспартаттрансаминазы 2 (Ast2 или Got2) (ФИГ.12b,d). Данные результаты демонстрируют, что RTA 408 в исследуемых концентрациях (250 нМ или 500 нМ) воздействует на экспрессию гена трансаминазы in vitro способом, согласующимся с действием других соединений класса AIM. Однако неясно, как результаты данной системы in vitro в исследуемых концентрациях RTA 408 связаны с потенциальным действием на трансаминазы при уровнях клинически значимых доз у людей.
Действие RTA 408 на Уровни Интермедиатов Гликолиза
Исследования на больных диабетом мышах пропродемонстрировали, что бардоксолон-метил повышает поглощение специфической для мышц инсулин-стимулированной глюкозы (Saha, 2010). У людей более высокая процентная доля пациентов, принимающих бардоксолон-метил, сообщала о перенесенных мышечных судорогах по сравнению с пациентами, принимающими плацебо (Pergola, 2011). О мышечных спазмах также сообщали пациенты, страдающие диабетом, после введения инсулина, предполагая возможную связь с метаболизмом глюкозы в мышцах. Действие RTA 408 на процесс гликолиза оценивали посредством оценки уровней лактата и пирувата в культивируемых мышечных клетках C2C12 грызунов. Аналогично обработке инсулином, обработка дифференцированных мышечных трубочек C2C12 1 мкм или 2 мкм RTA 408 в течение 3 часов в значительной степени повышала уровни внутриклеточного и межклеточного лактата дозозависимым образом.
Обработка дифференцированных мышечных трубочек C2C12 250 нМ или 500 нМ RTA 408 в течение 18 часов также в значительной степени (P<0,0001, отмечено звездочками) повышала уровни внутриклеточного пирувата дозозависимым образом (ФИГ.13). В совокупности, данные результаты демонстрируют, что RTA 408 в исследуемых концентрациях может влиять на интермедиаты мышечного кликолиза in vitro; однако неясно, как результаты данной системы in vitro в исследуемых концентрациях RTA 408s связаны с потенциальным действием на обмен глюкозы при уровнях клинически значимых доз у людей.
Оценка выхода RTA 408 In Vitro посредством MRP-1
Посредством MRP-1 экспериментально определили, что соотношение выхода для RTA 408 (1,3) было приблизительно в десять раз ниже, чем для 63170 (10) и 63171 (11,2) и более чем в 40 раз ниже, чем для 63189 (57,1). Значение, определенное для RTA 408, показывает, что оно не является субстратом MRP-1, тогда как другие соединения являются.
Защитные Эффекты RTA 408 в Животных Моделях Заболевания Легких
RTA 408 тестировали в нескольких животных моделях легочного заболевания для оценки его потенциальной эффективности в легких. Для всех исследований RTA 408 перорально вводили ежедневно в кунжутном масле на уровнях доз в диапазоне от 3 до 150 мг/кг. В большинстве случаев RTA 408 вводили, начиная за несколько дней до индукции ответа на повреждение легкого.
LPS-индуцированное Воспаление легких у мышей
RTA 408 тестировали в двух исследованиях LPS-индуцированного воспаления легких у мышей. В первом исследовании, предназначенном для предварительного поиска диапазона доз, RTA 408 (30, 100 или 150 мг/кг) вводили ежедневно в течение 3 дней с последующим введением LPS через 1 час после заключительной дозы. Промывную бронхоальвеолярную жидкость (BALF) собирали через 20 часов после введения LPS (через 21 час после заключительной дозы RTA 408) и оценивали на уровни провоспалительных маркеров (т.е. IL-6, IL-12p40, TNF-α и RANTES). Обработка RTA 408 привела к значительному снижениию IL-12p40 при всех дозах и TNFα при дозах 100 и 150 мг/кг (ФИГ.14). Во втором исследовании RTA 408 (10, 30 или 100 мг/кг) вводили ежедневно в течение 6 дней с последующим введением LPS через 1 час после заключительной дозы. В данном исследовании наблюдалось значительное уменьшение массы тела при уровне дозы 100 мг/кг, начиная на 3 дня. Наблюдалось значительное уменьшение TNFα при дозе 10 мг/кг, и наблюдалось значительное уменьшение IL-12p40, TNFα и RANTES при дозе 30 мг/кг (ФИГ.15a). Дополнительная оценка легких мышей в данном исследовании выявила значительное взаимодействие соответствующих генов-мишеней Nrf2, в том числе значительную индукцию активности фермента NQO1 и увеличение общего GSH при 10 и 30 мг/кг (ФИГ.15b).
Блеомицин-индуцированный Фиброз легких
Действие RTA 408 также оценивали в моделях блеомицин-индуцированного фиброза легких у мышей и крыс. В первом предварительном исследовании RTA 408 (10, 30 или 100 мг/кг) вводили мышам ежедневно посредством перорального принудительного кормления в течение 39 дней, с введением блеомицина (интраназально) на 10 день. В последний день введения дозы легочную ткань собирали и выполняли гистологический анализ для оценки степени воспаления и интерстициального фиброза. В данной модели при тестируемых дозах RTA 408 не наблюдалось никаких статистически достоверных эффектов (ФИГ.16a и b). Дополнительную оценку проводили с использованием крысиной модели фиброза легких, который был всесторонне характеризован Lovelace Respiratory Research Institute. В данном исследовании крысам вводили блеомицин или раствор хлорида натрия посредством интратрахеального введения на 0 день. После введения животные получали RTA 408 (3, 10 или 30 мг/кг) ежедневно посредством перорального принудительного кормления в течение 28 дней. Введение дозы 30 мг/кг останавливали на день 14 вследствие чрезмерного обезвоживания и диареи у животных. У оставшихся животных промывную бронхоальвеолярную жидкость собирали на 28 день для оценки провоспалительных инфильтратов, и легочную ткань анализировали на уровни гидроксипролина и гистопатологию. Введение сульфата блеомицина индуцировало значительное высвобождение нейтрофилов и увеличение растворенного коллагена в BALF, а также увеличение гидроксипролина в легком. Обработка 3 и 10 мг/кг RTA 408 в значительной степени подавляла инфильтрацию полиморфно-ядерными (PMN) клетками легкого, а также вызывала значительное снижение (~10%-20%) отложения гидроксипролина (ФИГ.17a и b).
Важно, что патогистологическая оценка выявила значительное уменьшение отложения коллагена, которое оценивали посредством трехцветного окрашивания у крыс, обработанных RTA 408. Тогда как животные блеомицинового контроля демонстрировали главным образом умеренное окрашивание, животные, обработанные 10 мг/кг RTA 408, преимущественно имели окрашивание от минимального до слабого (Таблица 2).
Действие RTA 408 на отложение коллагена в легком крысы, которое оценивали посредством интенсивности трехцветного окрашивания
Значения представляют интенсивность окрашивания у животных с интерстициальным трехцветным окрашиванием в зонах изменений блеомицин-индуцированного легкого.
Дополнительная оценка легких крыс в данном исследовании также выявила значительное взаимодействие соответствующих генов-мишеней Nrf2 (ФИГ.18). RTA 408 в значительной степени и дозозависимо повышало активность ферментов NQO1, Txnrd, Gsr и Gst в легких крыс, подвергнутых воздействию блеомицина, демонстрируя активацию Nrf2 RTA 408 в условиях данного заболевания.
Индуцированное сигаретным дымом ХНЗЛ у мышей
RTA 408 также исследовали в мышиной модели индуцированного сигаретным дымом ХНЗЛ. Мыши получали RTA 408 (3, 10 или 30 мг/кг) ежедневно посредством перорального принудительного кормления в течение двух недель и подвергались воздействию сигаретного дыма пять дней в неделю во время периода введения дозы RTA 408. В конце исследования легочную ткань и BALF собирали для анализа воспалительных инфильтратов и цитокинов. В данном эксперименте введение множества доз RTA 408 в дозах на уровне 3 мг/кг RTA 408 привело к значительной супрессии провоспалительных цитокинов, включая KC (функциональный мышиный гомолог IL-8 человека) и TNFα. Суть результатов данного исследования представлена на фигурах 19a-e. В том же исследовании для сравнения тестировали аналог AIM (63355). 63355 представляет собой соединение формулы:
Дополнительная оценка легких мышей в данном исследовании также выявила значительное взаимодействие соответствующих генов-мишеней Nrf2s (ФИГ.20). Активность фермента NQO1 в легком была в значительной степени уменьшена воздействием сигаретного дыма; введение RTA 408 компенсировало данную потерю. Активность фермента Txnrd также была индуцирована дозой 30 мг/кг RTA 408. В целом активность фермента Gsr не изменилась, а активность фермента Gst уменьшалась с обработкой - и то и другое, вероятно, было следствием временного ответа на данные ферменты.
Овальбумин-индуцированная Астма у мышей
Потенциальная активность RTA 408 также оценивали в пилотном исследовании в мышиной модели овальбумин-индуцированной астмы. Мышей сенсибилизировали IP инъекцией овальбумина и гидроксида алюминия на 0 день и 14 день и интраназально вводили овальбумин в растворе хлорида натрия в дни 14, 25, 26 и 27. Мыши получали RTA 408 (3, 10 или 30 мг/кг) ежедневно посредством перорального принудительного кормления в дни 1-13 и 15-27. После сенсибилизации и введения овальбумина обработанные носителем мыши имели значительное увеличение общего количествоа лейкоцитов по сравнению с обработанными положительным контролем (дексаметазоном) мышами. Также у обработанных носителем мышей наблюдалось увеличение количества T-клеток и B-клеток. Обработка RTA 408 при 30 мг/кг в значительной степени снижала количество и процентную долю B-клеток в дыхательных путях. RTA 408 (3 и 30 мг/кг) также в значительной степени снижало количество макрофагов, но не среднюю процентную долю макрофагов, выявленных в дыхательных путях. Данные наблюдения наводят на мысль о потенциальной эффективности в данной модели.
Действие RTA 408 на LPS-индуцированный сепсис у мышей
Сепсис индуцировали на 0 день интраперитонеальной инъекцией LPS (21 мг/кг), и срок жизни продолжался до 4 дня. RTA 408 (10, 30 или 100 мг/кг) вводили ежедневно посредством перорального принудительного кормления с -2 дня до 2 дня. В группе контроля средой до 4 дня прожило 60% животных (выше чем ~40% норма выживаемости, ожидавшаяся для данной модели). В группах обработки RTA 408 до 4 дня прожило 80% животных в группе дозы 10 мг/кг и 90% животных в группе дозы 30 мг/кг (ФИГ.21c и d). В группе дозы 100 мг/кг до 4 дня прожило 90% животных, только с единственной смертью, произошедшей на 4 день. Хотя данные RTA 408-индуцированные действия свидетельствуют о полной эффективности в данной модели, относительно высокая норма выживаемости в группе контроля средой препятствовала статистически значимому различию между контролем и группами, обработанными RTA 408. Также представлены результаты, полученные с использованием соединения RTA 405 (ФИГ.21a и b). RTA 405 представляет собой соединение формулы:
Действие RTA 408 против индуцированного излучением воспаления слизистой оболочки ротовой полости
Воздействие острого излучения, направленного на ротовой защечный мешок у хомяков, производит действие, аналогичное действию, наблюдаемому при язвенном воспалении слизистой оболочки ротовой полости у людей. Данное действие включает воспаление слизистой оболочки ротовой полости от умеренного до тяжелого, характеризующегося тяжелой эритемой и вазодилятацией, эрозией поверхностной слизитсой оболочки и образованием язвы. Для оценки действия RTA 408 в данной модели было проведено единственное исследование. На 0 день каждому хомяку была дана доза острого излучения, равная 40 Гр, направленного на левый ротовой защечный мешок. RTA 408 (10, 30 или 100 мг/кг) вводили перорально два раза ежедневно с -5 дня до -1 дня и с 1 дня до 15 дня. Начиная с 6 дня и продолжая до 28 дня, через день оценивали воспаление слизистой оболочки ротовой полости с использованием стандартной 6-балльной оценочной шкалы. Как 30, так и 100 мг/кг дозы RTA 408 вызывали значительное уменьшение продолжительности язвенного воспаления слизистой оболочки ротовой полости (ФИГ.22). Кроме того, также наблюдалось дозозависимое уменьшение процентной доли животных с оценкой воспаления слизистой оболочки ≥3. Однако введение RTA 408 при 30 или 100 мг/кг вызывало значительное дозозависимое снижение набора массы у облученных хомяков. Вследствие потери массы тела, превышающей 20%, двух из восьми хомяков в группе дозы 100 мг/кг умертвили на 2 день.
Действие RTA 408 на индукцию биомаркеров Nrf2 in Vivo
Как описано выше, ключевой молекулярной мишенью RTA 408 является Nrf2, регулятор центральной транскрипции антаокислительной клеточной защиты. Активация Nrf2 индуцирует повышающую регуляцию группы цитопротекторных генов, включая NQO1, ферментов, участвующих в синтезе GSH [т.е. каталитической и регуляторной субъединиц (Gclc и Gclm) глутаматцистеин лигазы], ферментов, участвующих в детоксификации (т.е. глутатион-S-трансферазы [Gsts]) и эффлюксный переносчик [т.е. белки множественной лекарственной резистентности (Mrps)]. Индукция данных генов приводит к скоординированному клеточному усилию для защиты против окислительного инсульта, выдвигаемому на первый план повышенной антиокислительной способностью, индукцией синтеза глутатиона и конъюгацией и выводом потенциально вредных молекул из клетки. В дополнение к эффективным показателям и экспрессии генов-мишеней Nrf2, оцененным в различных животных моделях, описанных выше, также оценивали способность RTA 408 индуцировать экспрессию генов-мишеней Nrf2 с использованием тканей, собранных у здоровых обработанных RTA 408 мышей, крыс и обезьян.
В качестве части не-GLP 14-дневных исследований токсичности RTA 408 у мышей, крыс и обезьян, ткани собирали с целью измерения уровней мРНК и ферментативной активности выбранных генов-мишеней Nrf2. Для мышей и крыс образцы печени собирали через 4 часа после заключительной дозы на 14 день, для обезьян кровь (для выделения PBMC), ткань печени, легкого и головного мозга собирали через 24 часа после заключительной дозы на 14 день. Активность ферментов для NQO1, Gst и глутатионредуктазы (Gsr) измеряли в тканевых гомогенатах. Уровни мРНК определяли с использованием технологии Quantigene Plex 2.0, которая включает основанный на гибридизации анализ с использованием магнитных шариков xMAP® Luminex® для прямого количественного определения мишеней мРНК. В дополнение, в плазме и тканях измеряли концентрацию RTA 408s с помощью способов LC/MS/MS.
RTA 408 в общем дозозависимым образом повышало экспрессию различных генов-мишеней Nrf2 при дозах, составляющих 10, 30 и 100 мг/кг (ФИГ.23, ФИГ.24a, ФИГ.25 a и b). Повышающее регулирование транскрипции генов-мишеней Nrf2 за счет RTA 408 также привело к функциональному увеличению антиоксидантного ответа, который проявляется посредством дозозависимого увеличения активности ферментов NQO1, Gst, и Gsr в печени грызунов, а также печени и легкого обезьяны (ФИГ.26 a и b, ФИГ.27 a и b, ФИГ.28 a и b). Кроме того, воздействие RTA 408 на печень грызунов коррелировало с уровнем активности фермента NQO1, прототипического гена-мишени для Nrf2 (ФИГ.29b, ФИГ.30b). У обезьян уровень экспрессии мРНК в PBMC как NQO1, так и сульфиредоксина 1 (SRXN1) коррелировал с воздействием на плазму RTA 408 (ФИГ.34 a и b). В общем, RTA 408 повышало уровни мРНК и активность мишеней Nrf2, и подобное увеличение в целом коррелировало с воздействием на ткань и плазму, предполагая, что мишени Nrf2 могут служить в качестве возможных биомаркеров для активации Nrf2 (ФИГ.31 a и b) и могут подходить для оценки фармакологической активности RTA 408 у здоровых пациентов-людей.
Фармакология безопасности
GLP-совместимая программа фармакологии безопасности была выполнена с использованием RTA 408. Она включала исследования in vitro и in vivo (обезьяна) на сердечно-сосудистой системе, а также исследования на респираторной системе и центральной нервной системе у крыс.
Оценка действия RTA 408 на клонированные hERG-каналы, экспрессируемые в клетках HEK293
Данное исследование проводили для оценки действия RTA 408 на быструю активацию обращенного внутрь выпрямляющего тока калия (IKr), проводимого hERG-каналами (ген специфических калиевых каналов сердца человека), устойчиво экспрессируемыми в клеточной линии почки эмбриона человека (HEK293). Действие RTA 408 на связанный с hERG ток калия оценивали с использованием электрофизиологических методов локальной фиксации потенциала в целой клетке. В анализе hERG QPatch_Kv11.1 определили, что RTA 408 имеет значение IC50, равное 12,4 мкм. Данное значение было в 2,5-3 разы выше, чем значения для 63170 (4,9 мкм) и 63189 (3,8 мкм), соответственно. Значение IC50 RTA 408 было аналогично значению 63171 (15,7 мкм).
Сердечно-сосудистая оценка RTA 408 у яванских обезьян
Одно исследование было проведено для оценки потенциального сердечно-сосудистого действия RTA 408 у свободно передвигающихся яванских макак. Одним и тем же четырем самцам и четырем самкам яванских макак вводили носитель (кунжутное масло) и RTA 408 с уровнями доз, составляющими 10, 30 и 100 мг/кг в соответствии с методом латинских квадратов, с одним животным/пол/получением дозы лекарства каждую неделю с последующим 14-дневным периодом промывания между введениями, до тех пор, пока каждое животное не получало все виды лечения. Носитель и RTA 408 вводили всем животным посредством перорального принудительного кормления с объемом дозы, составляющим 5 мл/кг.
Животных снабжали телеметрическими передатчиками для измерения температуры тела, артериального давления, частоты сердечных сокращений и оценки электрокардиограммы (ЭКГ). Начиная по меньшей мере за 2 часа до введения дозы до по меньшей мере 24 часов после введения дозы, проводили непрерывный мониторинг температуры тела, систалического, диастолического и среднего артериального кровяного давления, частоты сердечных сокращений и параметров ЭКГ (продолжительности QRS и интервалов RR, PR и QT). Кривые ЭКГ распечатывались в обозначенные временные точки из данных сердечно-сосудистого мониторинга и качественно оценивались получившим профессиональную сертификацию ветеринаром-кардиологом. Перед первым введением в исследовании проводили непрерывный мониторинг необработанных животных на сердечно-сосудистые конечные точки в течение по меньшей мере 24 часов, и эти данные использовали в расчете правильного интервала QT на всем протяжении исследования.
Наблюдения за заболеваемостью, смертностью, повреждениями и доступностью пищи и воды проводили по меньшей мере два раза в день для всех животных. Клинические наблюдения проводили перед введением дозы, приблизительно через 4 часа после ведения дозы и после завершения периода сердечно-сосудистого мониторинга. Массы тела измеряли и записывали в день перед каждым проведением обработки.
RTA 408 при уровнях дозы, составляющих 10, 30 и 100 мг/кг, не вызывало смертность, побочных клинических признаков или не приводило к значительным изменениям массы тела (ФИГ.32), температуры тела, артериального давлениея или качественных или количественных (интервалы PR, RR, QRS, QT) параметров ЭКГ. В группе дозы 100 мг/кг наблюдалось небольшое (в среднем 1,6%), но статистически достоверное увеличение скорректированного интервала QT; однако данные отдельных животных не показали последовательного стойкого увеличения QT, что должно означать действие, связанное с тестируемым изделием. Следовательно, вследствие небольшой величины изменения и отсутствия стойкого ответа у отдельных животных, данное небольшое повышение QT не считалось связанным с обработкой RTA 408. Вследствие этого пероральное введение RTA 408 не оказывало действия на сердечно-сосудистую функцию у яванских макак в дозах до и 100 мг/кг включительно.
Нейробихейвиоральная оценка RTA 408 у крыс
У крыс оценивали возможную острую нейробихейвиоральную токсичность RTA 408. Три лечебных группы из 10 самцов и 10 самок крыс CD® [Crl:CD® (SD)] получали RTA 408 с уровнями доз, составляющими 3, 10 или 30 мг/кг. Одна дополнительная группа из 10 животных/пол служила в качестве контроля и получала носитель (кунжутное масло). Носитель или RTA 408 вводили всем группам посредством перорального принудительного кормления один раз в 1 день с объемом дозы, составляющим 10 мл/кг.
Наблюдения за заболеваемостью, смертностью, повреждениями и доступностью пищи и воды проводили два раза в день для всех животных. Наблюдения за клиническими признаками проводили перед введением дозы в 1 день и после каждой оценки группы функциональных наблюдений (FOB). Оценку FOB проводили перед введением дозы (День -1) и приблизительно через 4 и 24 часа после ведения дозы. Массы тела измеряли и записывали перед введением дозы в день 1.
RTA 408 в дозах, составляющих 3, 10 и 30 мг/кг, не вызывали смертность, побочных клинических наблюдений или действие на какие-либо из исследуемых нейробихейвиоральных измерений. Легкое снижение набора массы тела наблюдали приблизительно через 24 часа после введения дозы в группе 30 мг/кг, которое возможно могло быть связано тестируемым изделием. В отношении основных нейробихейвиоральных конечных точек, оцениваемых в данном исследовании, RTA 408 не вызывало каких-либо побочных эффектов у крыс в дозах до и 30 мг/кг включительно.
Оценка влияния RTA 408 на легкие у крыс
Возможное действие RTA 408 на функцию легких оценивали у крыс. Три лечебные группы по восемь самцов и восемь самок крыс CD® [Crl:CD® (SD)] получали RTA 408 с уровнями доз, составляющими 3, 10 или 30 мг/кг. Одна дополнительная группа из восьми животных/пол служила в качестве контроля и получала носитель (кунжутное масло). Носитель или RTA 408 вводили всем группам посредством перорального принудительного кормления один раз в 1 день с объемом дозы, составляющим 10 мл/кг.
Наблюдения за заболеваемостью, смертностью, повреждениями и доступностью пищи и воды проводили два раза в день для всех животных. Клинические наблюдения проводили перед введением дозы, приблизительно через 4 часа после ведения дозы и после завершения 8-часового периода наблюдения за состоянием легких. Массы тела измеряли и записывали на день введения RTA 408. Проводили мониторинг функции легких (частоты дыхательных движений, дыхательного объема и минутного объема) по меньшей мере в течение 1 часа перед введением дозы для установления исходного уровня и по меньшей мере в течение 8 часов после ведения дозы.
RTA 408 в дозах, составляющих 3, 10 и 30 мг/кг, не вызывало смертность, неблагоприятных клинических наблюдений или действия на какие-либо оцениваемые легочные параметры. Вследствие этого в отношении основных легочных конечных точек, оцениваемых в данном исследовании, RTA 408 не вызывало каких-либо побочных эффектов у крыс в дозах до и 30 мг/кг включительно.
Неклинический обзор
Фармакокинетика
RTA 408 исследовали как in vitro, так и in vivo для оценки его PK и свойств метаболизма. Исследования in vitro проводили для определения связывания RTA 408 белками плазмы и распределения в крови/плазме, ингибирования и индукции цитохрома P450 (CYP450) и идентификации метаболитов, образуемых микросомами печени мышей, крыс, обезьян и людей. Данные, относящиеся к поглощению in vivo и распределению RTA 408 после повторного введения, были получены заблаговременно посредством мониторинга уровней лекарственного средства в плазме и отбора тканей при токсикологических исследованиях. Для измерения концентраций RTA 408 в плазме, крови и тканях с соответствующей точностью и правильностью были использованы чувствительные и селективные биоаналитические способы, основанные на жидкостной хроматографии, масс-спектрометрии (LC/MS/MS).
Поглощение
Поглощение и системное фармакокинеическое поведение RTA 408 исследовали на мышах, крысах и обезьянах после однократного и повторного (ежедневно) перорального введения. После перорального введения суспензионной лекарственной формы в дозах от 10 до 100 мг/кг максимальные концентрации наблюдались в пределах от 1 до 2 часов у мышей, и в пределах от 1 до 24 часов у крыс и обезьян. Системное воздействие RTA 408 имело тенденцию быть наиболее высоким у крыс, с меньшими уровнями, наблюдаемыми у мышей и обезьян. Оценки кажущегося конечного периода полувыведения RTA 408, наблюдаемые после перорального введения, в общем находились в 6-26-часовом диапазоне, хотя фаза кажущегося пролонгированного поглощения в некоторых случаях препятствовала расчету окончательной оценки периода полувыведения.
Системное воздействие RTA 408 было в общем схожим у самок и у самцов. Воздействие RTA 408 после повторного ежедневного перорального введения имело тенденцию быть немного более высоким (≤2-кратно), чем воздействие, наблюдаемое после разовой дозы. Введение RTA 408 сверх диапазона доз от 3 до 100 мг/кг в суспензионной лекарственной форме в общем привело к пропорциональному дозе увеличению системного воздействия. Однако введение более высоких доз (100-800 мг/кг у обезьян; 500-2000 мг/кг у крыс) не приводило к аналогичному усилению воздействия, предполагая насыщение поглощения при дозировках свыше 100 мг/кг. После перорального введения обезьянам неоптимизированной (свободно заполненной) капсульной лекарственной формы RTA 408 (3 мг/кг) системное воздействие с нормализованной дозой имело тенденцию быть немного ниже, чем воздействие, наблюдаемое при суспензионной лекарственной форме.
Поглощение и системное фармакокинетическое поведение RTA 408 исследовали у крыс с использованием разового и повторного местного введения. Введение RTA 408 сверх диапазона от 0,01 до 3% продемонстрировало более низкие концентрации в плазме по отношению к аналогичным дозам для перорального введения. Системное воздействие RTA 408 в общем увеличивалось дозозависимым образом. Лекарственная форма для местного введения была приготовлена в виде суспензии в кунжутном масле.
Глазное поглощение и системное фармакокинетическое поведение RTA 408 оценивали с использованием кроликов. RTA 408 вводили локально в глаз один раз в день в течение 5 дней. Глазное введение продемонстрировало пониженную концентрацию RTA 408 в плазме по отношению к пероральному введению RTA 408 (фиг.33). Количество RTA 408 в плазме даже спустя пять последующих дней продемонстрировало лишь небольшое изменение по сравнению с концентрацией после первой дозы по отношению к пероральному введению RTA 408, где концентрации в плазме были почти в 100 раз выше (ФИГ.33).
Распределение
Связывание белков плазмы с RTA 408 оценивали в плазме мышей, крыс, кроликов, собак, карликовых свиней, обезьян и людей при концентрациях RTA 408, составляющих 10-2000 нг/мл с использованием методики ультрацентрифугирования. RTA 408 интенсивно связывалось с белками плазмы. Связывание белков плазмы у неклинических видов колебалось от 93% (мышь) до >99% (карликовая свинья) со связыванием, составляющим 95%, у видов для токсикологического анализа (крыса и обезьяна) и 97% у человека. Не было подтверждения зависимого от концентрации связывания белков у каких-либо исследуемых видов. Результаты экспериментов распределения в крови/плазме показывают, что RTA 408 имело тенденцию к распределению главным образом во фракции крови в плазме линейным образом с отношениями кровь:плазма <1,0 для всех видов и всех исследуемых концентраций.
Распределение RTA 408 в тканях исследовали после перорального введения мышам, крысам и обезьянам. В 14-дневных неGLP исследованиях токсичности выбранные ткани (печени, легкого и головного мозга) собирали в одной временной точке (4 часа для крыс и мышей; 24 часа для обезьян) после введения заключительной дозы исследования и анализировали на содержание RTA 408 с использованием LC/MS/MS. RTA 408 легко распределяется в легких, печени и головном мозге. В легких концентрации RTA 408 на 4 часу у мышей и крыс были аналогичными или немного выше (<2-кратно), чем концентрации в плазме, несмотря на то, что на 24 часу у обезьян, концентрации RTA 408 в легком были от 6 до 16 раз выше, чем концентрации в плазме. Аналогичная картина наблюдалась для головного мозга. В отличие от этого, концентрации RTA 408 в печени были от 5 до 17 раз выше, чем в плазме у мышей и крыс на 4 часу, и от 2 до 5 раз выше, чем в плазме на 24 часу у обезьян.
Фармакокинетическое действие RTA 408 в тканях оценивали у мышей, крыс и обезьян посредством мониторинга индукции генов-мишеней Nrf2 в тех же самых тканях, которые были собраны для воздействия лекарственного средства из 14-дневных исследований токсичности. Индукция генов-мишеней Nrf2 за счет RTA 408 привела к увеличению антиоксидантного ответа, который проявлялся посредством дозозависимого увеличения активности фермента NQO1, глутатион-S-трансферазы (Gst) и глутатионредуктазы (Gsr) в изучаемых тканях. Кроме того, у грызунов содержание RTA 408 в печени коррелирует с уровнем активности фермента для NQO1, прототипного гена-мишени для Nrf2. У обезьян уровень экспрессии мРНК в мононуклеарных клетках периферической крови (PBMC) как для NQO1, так и для сульфиредоксина 1 (SRXN1) коррелирует с воздействием RTA 408 на плазму (ФИГ.34a и b). В общем RTA 408 индуцировало биомаркеры Nrf2 у грызунов и обезьян, и такая индукция в общем хорошо коррелировала с воздействием ткани и плазмы на RTA 408.
Когда RTA 408 вводили кроликам посредством местного введения в глаз, наиболее высокие концентрации соединения были обнаружены в роговице, сетчатке или радужке, тогда как стекловидное тело, внутриглазная жидкость и плазма продемонстрировали значительно более низкие концентрации RTA 408 (ФИГ.35).
Метаболизм
Метаболизм RTA 408 исследовали после инкубирования RTA 408 in vitro в течение 60 минут с микросомами печени от мышей, крыс, обезьян и людей в присутствии системы регенерирования никотинамидадениндинуклеотидфосфата (NADPH) и реакционной смеси уридиндифосфатглюкуронозилтрансферазы (UGT). Обширный оборот RTA 408 наблюдался с микросомами приматов с <10% исходных молекул, остающихся в конце 60-минутного инкубирования как в микросомах обезьян, так и человека. В отличие от этого степень метаболизма была ниже в микросомах грызунов с >65% исходных молекул, остающихся в конце инкубирования. Отсутствие доступных аутентичных стандартов для различных возможных метаболитов RTA 408 препятствовало количественной оценке наблюдаемых метаболитов. С качественной точки зрения аналогичная картина метаболитов RTA 408 наблюдалась у всех видов и включала пики с массами в соответствии с сокращением и гидроксилированием RTA 408, а также глюкуронидацией RTA 408 или уменьшением/гидроксилированием его метаболитов. Не наблюдалось уникальных метаболитов человека, при этом все пики при инкубировании человеческих микросом также наблюдались у одного или более доклинических видов. В частности, на основании данных микросом in vitro все человеческие метаболиты присутствовали у крыс или обезьян, выбранных для токсикологического исследования видов грызунов и негрызунов.
Фармакокинетическое Взаимодействие Лекарственных средств
Возможность RTA 408 ингибировать опосредованный цитохромом P450 (CYP450) метаболизм оценивали с использованием накопленных микросом и стандартных субстратов печени человека для специфических ферментов CYP450. RTA 408 непосредственно ингибировало CYP2C8 и CYP3A4/5 со значениями Ki, равными приблизительно 0,5 мкм для каждого фермента. Не наблюдалось значительного ингибирования других исследуемых ферментов (CYP1A2, CYP2B6, CYP2C9, CYP2C19 или CYP2D6) с ингибированием <50% при наивысшей исследуемой концентрации (3 мкм). В дополнение, имелось небольшое или отсутствовало свидетельство зависимого от метаболизма ингибирования какого-либо из исследуемых ферментов. Будущие исследования, изучающие возможность взаимодействия опосредованного лекарственным средством CYP3A4/5 с лекарственным средством, могут быть оправданы на основании этих данных и потенциально высоких концентраций, которые могут достигаться местно в желудочно-кишечном (GI) тракте после перорального введения.
Возможность RTA 408 индуцировать экспрессию фермента CYP450 оценивали с использованием культивируемых гепатоцитов человека. В условиях, когда прототипические индьюсеры вызывали ожидаемое увеличение активности CYP, RTA 408 (до 3 мкм) не было индьюсером активности ферментов CYP1A2, CYP2B6 или CYP3A4 в культивируемых гепатоцитах человека.
Действие RTA 408 на Острый радиационный дерматит
Исследовали действие RTA 408 в качестве местного или перорального профилактического средства для острого радиационного дерматита. Используя самцов мышей BALB/c, в 0 день вводили дозу излучения 30 Гр (Таблица 3). С -5 по -1 день и с 1 по 30 день крысам вводили носитель кунжутное масло или RTA 408. RTA 408 вводили как перорально по 3, 10 и 30 мг/кг в кунжутном масле, так и локально в композиции с процентной долей, равной 0,01, 0,1 и 1% в кунжутном масле. Дерматит слепо оценивали через день с 4 дня по 30 день. На 12 день наблюдался типичный пик дерматита, и 4 мышей умертвили через 4 часа после введения дозы. Оставшихся мышей умертвили на 30 день на 4 час после ведения дозы. Плазму собирали на 12 и 30 день, а также образцы облученной кожи для исследования мРНК и гистологического исследования.
Дизайн исследования для модели острого радиационного дерматита
(День 0)
В тестируемых группах, где мышей обрабатывали RTA 408, оказалось, что тяжесть заболеваемости дерматитом слегка уменьшилась, когда RTA 408 давали либо при пероральном, либо при местном введении (ФИГ.36-39). Кроме того, кривые, отражающие на графике средний клинический показатель дерматита для тестируемых групп в качестве функции времени, показывают некоторое отличие при введении RTA 408 либо пероральным, либо локальным образом от нелеченных тестируемых групп (ФИГ.40-42), особенно в случае, когда RTA 408 давали посредством перорального введения. Кроме того, как можно видеть в таблицах 4 и 5 ниже, процентная доля мышей, страдающих от дерматита с клиническим показателем выше 3, была существенно ниже для мышей, обработанных RTA 408 посредством перорального введения, тогда как процентная доля мышей, страдающих от дерматита с клиническим показателем выше 2, была немного ниже для тестируемых групп, которым давали RTA 408 посредством местного введения.
Процентная доля мышей на тестируемую группу, показатель которых превышал 2 при клиническом обследовании их дерматита и приведенная местная обработка, содержащая RTA 408
Процентная доля мышей на тестируемую группу, показатель которых превышал 3 при клиническом обследовании их дерматита и приведенная пероральная обработка, содержащая RTA 408 RTA 408
Действие RTA 408 на Фракционированный Радиационный Дерматит
Применяя RTA 408 посредством местного введения, измеряли действие RTA 408 в направлении ослабления действия фракционированного радиационного дерматита. Применяя мышей Balb/c, RTA 408 в местном препарате вводили мышам ежедневно с -5 дня по 30 день в трех дозах, варьирующих от 0,01 до 1%. Мышей облучали в 0-2 и 5-7 дни шестью дозами по 10 Гр в день. Клинические показатели дерматита для мышей оценивали слепо каждые два дня с 4 дня до конца исследования. На ФИГ.43 график показывает изменение среднего клинического показателя для каждой группы, который нанесли на график в качестве функции времени. График демонстрирует статистически достоверное улучшение показателей для мышей, обработанных 0,1-1% местными готовыми формами RTA 408. В таблице 6 можно найти параметры исследование и обработки.
Исследование условий для Фракционированного Дерматита, индуцированного излучением
(Дни 0-2, 5-7)
За счет анализа средних клинических показателей, которые были показаны на ФИГ.43, проводили анализ площади под кривой (AUC), который давал степень тяжести дерматита относительно того, как долго сохранялся дерматит. Данный анализ AUC предусматривал прямое сравнение между различными группами мышей и действие композиций с различными процентными долями RTA 408 (фиг.44 и Таблица 7). Введение местных готовых форм RTA 408 уменьшало поражения класса 2 и класса 3 с 60% и 33%, когда мышей обрабатывали только носителем, до 21% и 6% с RTA 408 при 1% концентрации, соответственно. Другая композиция RTA продемонстрировала некоторую активность, но не была настолько значительной, как это показала 1% лекарственная форма.
Процентная доля показателя дерматита для каждой Группы обработки
Действие RTA 408 на модель воспаления глаз
Исследование действия RTA 408 на глазное воспаление осуществляли с использованием кроликов породы новозендский альбинос. Кроликов разделили на 5 групп по 12 кроликов, которым давали три различные концентрации RTA 408 (0,01, 0,1 и 1%), 0,1% Voltarene©collyre и носитель (кунжутное масло). Каждому кролику проводили три капельных вливания в пределах 60 минут перед индукцией пункцией и два капельных вливания в пределах 30 минут после индукции пункцией. Каждое капельное вливание, составляющее 50 мкл, выполняли в оба глаза. Внутриглазную жидкость у 6 животных в момент времени собирали через 30 минут, а затем через 2 часа после индукции пункцией. Величину воспаления определяли посредством концентрации белка во внутриглазной жидкости. Как показано на ФИГ.45, RTA 408 продемонстрировало уменьшение белка во внутриглазной жидкости аналогично уменьшению при наивысшей концентрации любого другого справочного соединения (MaxiDex или мапракората) только при 0,01% RTA 408 в лекарственной форме. Похоже, что действием повышенной концентрации RTA 408 необходимо пренебречь, так как похоже, что все концентрации RTA 408 показывают относительно сходное действие в пределах ошибки по уменьшению концентрации белка во внутриглазной жидкости.
Полиморфы RTA 408
Полиморфная форма A RTA 408
Пример 1: 17 г RTA 408 растворили в 68 г ацетона. В 500 мл реактор с рубашкой добавили 620 г деионизированной воды и охлаждали до 2°C. Когда вода была ниже 7°C, в реактор добавляли раствор RTA 408 посредством добавляющей воронки. Образовывалась суспензия из твердых частиц. Суспензию встряхивали в реакторе с продувкой азотом. Твердые вещества выделяли с использованием вакуумного фильтрования и сушили в вакууме при комнатной температуре с получением формы A.
Пример 2: 300 мг RTA 408 растворили в 1 мл этилацетата. В прозрачный раствор добавляли 2 мл гептана. Кристаллизация происходила в течение 30 минут. Суспензию встряхивали в течение ночи, и твердые вещества выделяли посредством вакуумного фильтрования и сушили при комнатной температуре в течение 1 часа. Затем твердые вещества сушили в вакуумном сушильном шкафу при 50°C в течение ночи с получением формы A.
На фигуре 53 и в Таблице 8, соответственно, показаны картина порошковой рентеновской дифракции (PXRD) и список пиков с относительными интенсивностями. На фигурах 54 и 55, соответственно, показаны дифференциальная сканирующая калориметрия (DSC) и термогравиметрический анализ с масс-спектроскопией (TGA-MS).
DSC формы A показала по существу не содержащую растворитель форму с температурой плавления, равной 181,98°C, и энтальпией плавления, равной 42,01 Дж/г. TGA-MS формы A демонстрирует потерю ~0,5 масс-% со следами H2O между 25 и 200°C, преимущественно свыше 160°C, указывая, что полиморфная форма A RTA 408 может быть слегка гигроскопичной.
Список пиков формы A RTA 408
Полиморфная форма B RTA 408
Пример 3: 1,0 г RTA 408 растворили в 1,5 мл ацетона. В сцинтилляционном флаконе 10 мл деионизированной воды нагрели до 50°C, и во флакон каплями добавляли раствор RTA 408. При встряхивании в течение 2 часов образовывалась суспензия твердых веществ. Затем суспензию охлаждали до комнатной температуры. Получающиеся в результате твердые вещества выделяли посредством фильтрования и сушили в вакуумном сушильном шкафу при 50°C в течение ночи с получением формы B.
Пример 4: 2,9 г RTA 408 растворили в 20 мл изопропилового спирта с обратным потоком. 20 мл гептана добавляли в раствор с обратным потоком. Раствор охлаждали до комнатной температуры и перемешивали в течение 1 часа. Образовывалась суспензия твердых веществ. Твердые вещества выделяли посредством вакуумного фильтрования и сушили в вакууме при комнатной температуре с получением формы B.
На фигуре 56 и в Таблице 9 показаны картина порошковой рентеновской дифракции (PXRD) и список пиков с относительными интенсивностями, соответственно. Дифференциальная сканирующая калориметрия (DSC) и термогравиметрический анализ с масс-спектроскопией (TGA-MS) показаны на фигурах 57 и 58, соответственно.
DSC формы B показала по существу не содержащую растворитель форму с температурой плавления, равной 250,10°C, и энтальпией плавления, равной 42,01 Дж/г. TGA-MS формы B демонстрирует небольшую потерю ~0,2 масс-% со следами H2O между 25 и 200°C, показывающую, что полиморфная форма B RTA 408 может быть весьма незначительно гигроскопична.
Список пиков формы B RTA 408
Условия типичных инструментальных измерений
Порошковая рентеновская дифракция (PXRD)
Данные PXRD собирали с использованием дифрактометра G3000 (Inel Corp. Artenay, France), оборудованного изогнутым позиционно-чувствительным детектором и оптической системой пучков параллельных лучей. Дифрактометр был подключен к медной анодной трубке (1,5 кВт тонкая фокусировка) при 40 кВ и 30 мА. Германиевый монохроматр с падающим пучком обеспечивал монохромное излучение. Дифрактометр калибровали с использованием затухающего прямого пучка с интервалами в один градус. Калибровку проверяли с использованием стандарта определения положения линии рентгенограммы кремниевого порошка (NIST 640c). Инструментом является компьютер, управляемый с использованием программного обеспечения Symphonix (Inel Corp. Artenay, France), и данные анализировали с использованием программного обеспечения Jade (version 9.0.4, Materials Data, Inc. Livermore, CA). Оразец загружали в алюминиевый держатель образцов и выравнивали предметным стеклом.
Термогравиметрический Анализ/Масс спектрометрия
TGA проводили с помощью TA Instruments, данные собирали при тепловом равновесии (Q-5000, TA Instruments, New Castle, DE) с оборудованным анализатором данных (Universal Analysis 2000, version 4,5A, TA Instruments, New Castle, DE). Во время экспериментов печь продували азотом при 60 мл/минуту, в то время как уравнительную камеру продували при 40 мл/минуту. Температуру печи TGA калибровали с использованием точек Кюри алюминия и никеля. Размер образца колебался от 2 до 20 мг, и использовали скорость нагревания, равную 10°C/минуту.
Для TGA-MS часть термогравиметрического анализа была такой же, как указанная выше. Массу выделяющегося газа анализировали PFEIFFER GSD 301 T3 ThermoStar (PFEIFFER Vacuum, Asslar, Germany). Прибор находился под управлением программного обеспечения Quadstar 32-bit, которое оценивало данные (V7.01, Inficon, LI-9496 Balzers, Liechtenstein).
Дифференциальная сканирующая калориметрия
DSC (Q-2000, TA Instruments, New Castle, DE), оснащенный программным обеспечением Universal Analysis 2000 (Version 4,5A, TA Instruments, New Castle, DE) использовали для определения тепловых следов DSC. Температурную ось калибровали со стандартами бифенила, индия и олова. Во время исследования константу ячейки калибровали с индием. Если не указано иное, образец (2-5 мг) заключали в вентилируемую алюминиевую ванночку и нагревали при скорости 10°C/минуту в потоке газообразного азота, равном 50 мл/минуту.
Сокращения
Способы:
AUC - анализ площади под кривой
DSC - дифференциальная сканирующая калориметрия
1H-ЯМР - спектроскопия протонным ядерным магнитным резонансом
HPLC-MS - высокопроизводительная жидкостная хроматография, совмещенная с масс-спектроскопией
LC/MS/MS - жидкая хроматография-тандемная масс-спектроскопия
PXRD - порошковая рентгеновская дифракция
TGA-MS - термогравиметрический анализ, совмещенный с масс-спектроскопией
Гены, Белки и Биологические Параметры:
AIM - антиоксидантный модулятор воспаления
ARE - антиоксидантный ответный элемент
ALP - щелочная фосфатаза
ALT - аланинтрансаминаза
ARE - антиоксидантным ответный элемент
AST - аспартаттрансаминаза
AUC - площадь под кривой
BAL - бронхоальвеолярный лаваж
BALF - жидкость бронхоальвеолярного лаважа
COPD - хроническое обстркутивное заболевание легких
COX-2 циклооксигеназа-2
Cr - креатин
CYP450 - цитохром P450
Gclc - каталитическая субединица глутаматцистеин лигазы
Gclm - регуляторная субъединица глутаматцистеин лигазы
Glu - глюкоза
GOT - глютамино-щавелевоуксусная трансаминаза
GPT1 - глютамино-пируватная трансаминаза
GSH - глутатион
GSR - глутатионредуктаза
GST - глутатион-S-трансфераза
Gy - Грей
H6PD - гексоза-6-фосфатдегидрогеназа
hERG - ген специфических калиевых каналов сердца человека
HMOX1 - гемоксигеназа (дециклинг) 1
HO-1 - гемоксигеназа
IFNγ - интерферон-гамма
IL - интерлейкин
iNOS - индуцируемая синтаза оксида азота
IκBα - ядерный фактор энхансера гена легких каппа-полипептидов в ингибиторе B-клеток, альфа
KC - белок, связанный с мышиным IL-8
Keap1 - ECH-связанный белок, подобный Kelch-1
LPS - липополисахариды
ME1 - малоновый фермент 1
MPCE - микроядерные полихроматические эритроциты
Mrps - белки множественной лекарственной резистентности
NADPH - никотинамидадениндинуклеотидфосфат, восстановленный
NF-κB - ядерный фактор энхансера каппа легких цепей активированных B-клеток
NO - оксид азота
NQO1 NAD(P)H - хинон-оксидоредуктаза 1
Nrf2 - ядерный фактор-эритроид 2-связанный фактор
p-IκBα - фосфорилированная IκBα
PBMC - мононуклеарне клетки периферической крови
PCE - полихроматические эритроциты
PGD - фосфоглюконатдегидрогеназа
PMN - полиморфоядерный
RANTES - экспрессируемый и секретируемый регулированными и нормальными T-клетками
SOD1 - супероксиддисмутаза 1
SRXN1 - сульфиредоксин-1
TG - общие глицериды
TKT - транскетолаза
TNFα - фактор некроза опухоли альфа
TXNRD1 - тиоредоксинредуктаза-1
Прочие термины:
Мин - минута (минуты)
m.p. - точка плавления
Ph - фенил
T - температура
wt.-% - масс-проценты
Дополнительные Таблицы
Параметры фиг.46
Первичный ADMET In Vivo- Ключевые Первичные Анализы ADMET и Конечные точки
Распределение в тканях
Экспрессия мРНК гена-мишени Nrf2 и активация ферментов в печени
Распределение в тканях и TK плазмы
Экспрессия мРНК гена-мишени Nrf2 и активация ферментов в печени
Распределение в тканях и TK плазмы
Экспрессия мРНК гена-мишени Nrf2 и активация ферментов в различных тканях и PBMC
Параметры фиг.49
Является отрицательным для генотоксичности в Микроядерном исследовании In Vivo
(n=5/группа)
(Среднее +/- СО)
(Среднее +/- СО)
Параметры фиг.32
(ЕД/Л)
(ЕД/Л)
(ЕД/Л)
Активность 63415 и 63355 In Vitro
Параметры фиг.47
Параметры фиг.48
Все соединения, полиморфы, готовые формы и способы, раскрытые и заявленные в данном документе, в свете настоящего раскрытия могут быть сделаны и выполнены без излишних экспериментов. Несмотря на то, что соединения, полиморфы, готовые формы и способы данного изобретения были описаны в терминах предпочтительных вариантов осуществления, квалифицированным специалистам в данной области будет понятно, что могут быть применены изменения к соединениям, полиморфам, готовым формам и способам, а также в стадиях или в последовательности стадий способа, описанного в данном документе, без выхода за пределы концепции, сущности и объема правовых притязаний изобретения. Более конкретно, должно быть понятно, что некоторые агенты, которые как химически, так и физиологически являются родственными, могут быть замещены на агенты, описанные в данном документе, при том что будут достигнуты одинаковые или аналогичные результаты. Считается, что все такие аналогичные заместители и модификации, очевидные квалифицированным специалистам в данной области, находятся в пределах сущности, объема правовых притязаний и концепции изобретения, которые определены в приложенной формуле изобретения.
Ссылки
Следующие ссылки в той степени, в которой они предоставляют иллюстративные процедурные или другие детали в дополнение к тем, которые изложены в данном документе, специально включены в данный документ посредством ссылки.
Abraham and Kappas, Free Radical Biol. Med., 39:1-25, 2005.
Ahmad, et. al., Cancer Res., 68:2920-2926, 2008.
Ahmad, et. al., J. Biol. Chem., 281:35764-9, 2006.
Akiyama et al., Alzheimer Dis. Assoc. Disord., 14(1): S47-53, 35, 2000.
Angulo et al., Eur. J. Immunol., 30:1263-1271, 2000.
Araujo, et. al., J. Immunol., 171(3):1572-1580, 2003.
Arend and Dayer, Arthritis Rheum., 38:151-160, 1995.
Arend et al., Annu. Rev. Immunol., 16:27-55, 1998.
Autenrieth et al., Infect. Immun., 62:2590-2599, 1994.
Bach, Hum. Immunol., 67(6):430-432, 2006.
Bagasra et al., Proc. Natl. Acad. Sci. USA, 92:12041-12045, 1995.
Ball, Ann. Rheum. Dis., 30:213-223, 1971.
Beal, Curr. Opin. Neurobiol., 6:661-666, 1996.
Blumberg et al., Arthritis Rheum., 7:93-97, 1964.
Botoman et al., Am. Fam. Physician, 57(1):57-68, 1998.
Brandt et al., Arthritis Rheum., 43:1346-1352, 2000.
Braun et al., Arthritis Rheum., 42:2039-2044, 1999.
Brewerton et al., Lancet., 1:904-907, 1973a.
Brewerton et al., Lancet., 1:956-957, 1973b.
Bronte et al., Trends Immunol., 24:302-306, 2003.
Brown and DuBois, J. Clin. Oncol., 23:2840-2855, 2005.
Brynskov et al., N. Engl. J. Med., 321(13):845-850, 1989.
Burger and Dayer, Neurology, 45(6S-6):$39-43, 1995.
Cai et al., Nat. Med., 11(2):183-190, 2005.
Calin and Taurog, In: The Spondylarthritides, Calin et al. (Eds.), Oxford, UK. Oxford University Press, 179, 1998.
Cann et al., Gut., 24(12):1135-1140, 1983.
Chauhan and Chauhan, Pathophysiology, 13(3):171-181. 2006.
Chomarat et al.,ArthritisRheum., 38:1046-1054, 1995. 65.
Coyle and Puttfarcken, Science, 262:689-695, 1993.
Crowell et al., Mol. Cancer. Ther., 2:815-823, 2003.
Dickerson, et. al., Prog Neuropsychopharmacol Biol. Psychiatry, March 6, 2007.
de Waal et al., J. Exp. Med., 174:1209-1220, 1991.
Dinarello, Int. Rev. Immunol., 16:457-499, 1998.
Dinkova-Kostova, et. al., Proc. Natl. Acad. Sci. USA, 102(12):4584-4589, 2005.
Dionne et al., Clin. Exp. Immunol., 112(3):435-442, 1998.
Doran et al., J. Rheumatol., 30(2):316-320, 2003.
Drossman et al., Dig. Dis. Sci., 38(9):1569-1580, 1993.
Drossman et al., Gastroenterol., 112(6):2120-2137, 1997.
Dudhgaonkar, et al., Eur. J. Pain, 10(7):573-9, 2006.
Eastgate, et al., Lancet, 2(8613): 706-9, 1988.
Eikelenboom et al., Glia, 40(2):232-239, 2002.
Ettehadi et al., Clin. Exp. Immunol., 96(1):146-151, 1994.
Everhart et al., Gastroenterol., 100(4):998-1005, 1991.
Fearon and Locksley, Science, 272(5258):50-53, 1996.
Feldtkeller et al., Rheumatol. Int., 23(2):61-66, 2003.
Firestein et al., Arthritis Rheum., 37:644-652, 1994.
Forstermann, Biol. Chem., 387:1521, 2006.
Fujikawa et al., Ann. Rheum. Dis., 54:318-320, 1995.
Funakoshi et al., Digestion, 59(1):73-78, 1998.
Galley and Webster, Br. J. Anaesth., 77:11-16, 1996.
Gehrmann et al., Glia, 15(2):141-151, 1995.
Genain and Nauser, J. Mol. Med., 75:187-197, 1997.
Gladman et al., Br. J. Rheumatol., 22:675-679, 1995.
Gladman et al., J. Med., 62:127-141, 1987.
Gladman, Rheum. Dis. Clin. North Am., 18:247-256, 1992.
Goodman et al., Kidney Int., 72(8):945-953, 2007.
Graeber et al., Glia, 40(2):252-259, 2002.
Greten et al., Cell, 118:285-296, 2004.
Griffin et al., Proc. Natl. Acad. Sci. USA, 86(19):7611-7615, 1989.
Guilherme et al., Nat. Rev. Mol. Cell. Biol., 9(5):367-77, 2008.
Gwee et al., Gut., 44(3):400-406, 1999.
Hahn and Tsao, In: Dubois’ Lupus Erythematosus, 4th Ed, Wallace and Hahn (Eds.), Lea and Febiger, Philadelphia, 195-201, 1993.
Handbook of Pharmaceutical Salts: Properties, and Use, Stahl and Wermuth Eds.), Verlag Helvetica Chimica Acta, 2002.
Hannum et al., Nature, 343:336-340, 1990.
Hanson et al., BMC Medical Genetics, 6(7), 2005.
Hansson et al., Annu. Rev. Pathol. Mech. Dis., 1:297-329, 2006.
Harrison et al., J. Rheumatol., 25(12):2324-2330, 1998.
Hart et al., Immunology, 84:536-542, 1995.
Honda, et. al. Bioorg. Med. Chem. Lett., 12:1027-1030, 2002.
Honda, et. al., Bioorg. Med. Chem. Lett., 7:1623-1628, 1997.
Honda, et. al., Bioorg. Med. Chem. Lett., 8(19):2711-2714, 1998.
Honda, et. al., Bioorg. Med. Chem. Lett., 9(24):3429-3434, 1999.
Honda, et. al., J. Med. Chem., 43:4233-4246, 2000a.
Honda, et. al., J. Med. Chem., 43:1866-1877, 2000b.
Horwitz and Fisher, N. Engl. J. Med., 344(24):1846-1850, 2001.
Hotamisligil, Nature, 444(7121):860-7, 2006.
Ishikawa et al., Circulation, 104(15): 1831-1836, 2001.
Ishizawa and Dickson, J. Neuropathol. Exp. Neurol., 60(6): 647-657, 2001.
Jacob et al., Proc. Natl. Acad. Sci. USA, 87:1233-1237, 1990.
Jailwala et al., Ann. Intern. Med., 133(2):136-147, 2000.
Jarvis, Curr. Opin. Rheumatol., 10(5):459-467, 1998.
Jarvis, Pediatr. Ann., 31(7):437-446, 2002.
Jones et al., Br. J. Rheumatol., 33(9):834-839, 1994.
Jonsson et al., Br. J. Rheumatol., 32(7):578-581 1993.
Jonsson et al., Oral Dis., 8(3): 130-140, 2002.
Jonsson et al., Trends Immunol., 22(12):653-654, 2001.
Kahle et al., Ann. Rheum. Dis., 51:731-734, 1992.
Kaltschmidt et al., Proc. Natl. Acad. Sci. USA, 94:2642-2647, 1997.
Kawakami et al., Brain Dev., 28(4):243-246, 2006.
Kellow and Phillips, Gastroenterol., 92(6): 1885-1893, 1987.
Kendall-Tackett, Trauma Violence Abuse, 8(2):117-126, 2007.
Khan et al., J. Neurochem., 71:78-87, 1998.
Khan et al., Toxicol. AppliedPharmacol., 103:482-490, 1990.
Kortylewski et al., Nat. Med., 11:1314-1321, 2005.
Kotake et al., Infect. Immun., 67:2682-2686, 1999.
Kotzin and O’Dell, In: Sampler’s Immunologic Diseases, 5th Ed., Frank et al. (Eds.), Little Brown и Co., Boston, 667-697, 1995.
Kotzin, Cell, 85:303-306, 1996.
Kruger et al., J. Pharmacol. Exp. Ther., 319(3): 1144-1152, 2006.
Kuboyama, KurumeMed. J, 45(1):33-37, 1998.
Lahesmaa et al., J. Immunol., 148:3079-3085, 1992.
Lee, et. al., Glia., 55(7):712-22, 2007.
Lencz, et. al., Mol. Psychiatry, 12(6):572-80, 2007.
Liby, et. al., Cancer Res., 65(11):4789-4798, 2005.
Liby, et. al., Nat. Rev. Cancer, 7(5):357-356, 2007.
Lipsky, In: Harrison ’s Principles of Internal Medicine, Fauci et al. (Eds.), 14th Ed., NY, McGraw-Hill, 1880-1888, 1998.
Liu, et. al., FASEB J., 20(2):207-216, 2006.
Lo et al., Curr. Dir. Autoimmun., 1:226-246, 1999.
Lugering et al., Ital. J. Gastroenterol. Hepatol., 30(3):338-344, 1998.
Lynn and Friedman, N. Engl. J. Med., 329(26):1940-1945, 1993.
Macatonia et al., J. Immunol., 150:3755-3765, 1993.
March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 2007.
Marsal et al., Rheumatology, 38:332-337, 1999.
Mazur et al., Cell Microbiol., 9(7): 1683-94, 2007.
Mazzoni et al., J. Immunol., 168:689-695, 2002.
McAlindon et al., Gut, 42(2):214-219, 1998.
McGeer and McGeer, Brain Res. Brain Res. Rev., 21:195-218, 1995.
McGeer et al., Neurology, 19:331-338, 1996.
McGonagle et al., Arthritis Rheum., 41: 694-700, 1998.
McGonagle et al., Curr. Opin. Rheumatol., 11:244-250, 1999.
McIver et al., Pain, 120(1-2):161-9, 2005.
Mease et al., Lancet, 356:385-390, 2000.
Merrill and Benvenist, Trends Neurosci., 19:331-338, 1996.
Mertz et al., Gastroenterol., 118(5):842-848, 2000.
Moll and Wright, Ann. Rheum. Dis., 32:181-201, 1973.
Moll and Wright, Semin. Arthritis Rheum., 3:55-78, 1973.
McIver, et. al., Pain, 120(1-2):161-9, 2005.
Morris, et. al., J. Mol. Med., 80(2):96-104, 2002.
Morse and Choi, Am. J. Respir. Crit. Care Med., 172(6):660-670, 2005.
Morse and Choi, Am. J. Respir. Crit. Care Med., 27(1):8-16, 2002.
Nath et al., Neurology, 66(1):149-150, 2006.
Neal et al., BMJ., 314(7083):779-782, 1997.
Nichols, Drug News Perspect., 17(2):99-104, 2004.
Nielen et al., Arthritis Rheum., 50(2):380-386, 2004.
Ohnishi et al., Int. Immunol., 6:817-830, 1994.
Pall, Med. Hypoth., 69:821-825, 2007.
Partsch et al., Br. J. Rheumatol., 24:518-523, 1997.
Pica et al., AntimicrobAgents Chemother., 44(1):200-4, 2000.
Pergola, et. al., N Engl J Med 365:327-336, 2011.
Pimentel et al., Am. J. Gastroenterol., 95(12):3503-3506, 2000.
Prieur et al., Lancet., 2:1240-1242, 1987.
Place, et. al., Clin. Cancer Res., 9(7):2798-806, 2003.
Rajakariar, et. al., Proc. Natl. Acad. Sci. USA, 104(52):20979-84, 2007.
Rantapaa-Dahlqvist et al., Arthritis Rheum., 48(10):2741-2749, 2003.
Reimund et al., Eur. J. Clin. Invest., 28(2):145-150, 1998.
Ribbens et al., Eur. Cytokine Netw., 11:669-676, 2000.
Rogers et al., Neurobiol Aging, 9(4):339-349, 1988.
Rogler and Andus, WorldJ. Surg., 22(4):382-389, 1998.
Rooney et al., Rheumatollnt., 10:217-219, 1990.
Ross, et. al., Am. J. Clin. Pathol., 120(Suppl):S53-71, 2003.
Ross, et. al., Expert Rev. Mol. Diagn., 3(5):573-585, 2003.
Rostom et al., Ann. Intern. Med., 146, 376-389, 2007.
Rothstein, Med. Clin. North Am., 84(5):1247-1257, 2000.
Ruster, et. al., Scand. J. Rheumatol., 34(6):460-3, 2005.
Sacerdoti, et. al., Curr Neurovasc Res. 2(2):103-111, 2005.
Saha, et. al., J Biol Chem 285:40581-92, 2010.
Saiki et al., Scand. J. Gastroenterol., 33(6):616-622, 1998.
Salomonsson and Jonsson, Arthritis Rheum., 48(11):3187-3201, 2003.
Salomonsson et al., Scand. J. Immunol., 55(4):336-342, 2002.
Salvarani et al., Curr. Opin. Rheumatol. 1998; 10:299-305, 25 1998.
Salvemini et al., J. Clin. Invest., 93:1940-1947, 1994.
Sandler, Gastroenterol., 99(2):409-415, 1990.
Salvemini, et. al., J. Clin. Invest., 93(5):1940-1947, 1994.
Sarchielli, et. al., Cephalalgia, 26(9):1071-1079, 2006.
Satoh, et. al., Proc. Natl. Acad. Sci. USA, 103(3):768-773, 2006.
Schlaak et al., Clin. Exp. Rheumatol., 14:155-162, 1996.
Schlaak et al., Eur. J. Immunol., 22:2771-2776, 1992.
Schlosstein et al., NE J. Medicine, 288:704-706, 1973.
Schreiber, Neth. J. Med., 53(6):S24-31, 1998.
Schulz et al., Antioxid. Redox. Sig., 10:115, 2008.
Shishodia, et. al., Clin Cancer Res 12:1828-38, 2006.
Sieper and Braun, Arthritis Rheum., 38:1547-1554, 1995.
Simon et al., Clin. Exp. Immunol., 94:122-126, 1993.
Simon et al., Proc. Natl. Acad. Sci. USA, 91:8562-85666, 40 1994.
Simonian and Coyle, Annu. Rev. Pharmacol. Toxicol., 36:83-106, 1996.
Sinha et al., CancerRes., 67:4507-4513, 2007.
Stack et al., Lancet, 349(9051):521-524, 1997.
Stewart et al., Neurology, 48:626-632, 1997.
Strejan, et. al., J. Neuroimmunol., 7:27, 1984.
Suh, et. al., Cancer Res., 58:717-723, 1998.
Suh, et. al., Cancer Res., 59(2):336-341, 1999.
Szabo, et. al., Nature Rev. Drug Disc., 6:662-680, 2007.
Takahashi, et. al., Cancer Res., 57:1233-1237, 1997.
Talley et al., Gastroenterol., 109(6):1736-1741, 1995.
Tamir and Tannenbaum, Biochim. Biophys. Acta., 1288:F31-F36, 1996.
Targan et al., N. Engl. J. Med., 337(15):1029-1035, 1997.
Touzani et al., J. Neuroimmunol., 100(1-2):203-215, 1999.
Tumlin et al., Am. J. Cardiol., 98(6A): 14K-20K, 2006.
van den Berg, Semin. Arthritis Rheum., 30(5S-2):7-16, 2001.
van Dullemen et al., Gastroenterol., 109(1):129-135, 1995.
van Hogezand and Verspaget, Drugs, 56(3):299-305, 1998.
Vazquez et al., J. Virol., 79(7):4479-91, 2005.
Vodovotz et al., In; Handbook ofExperimental Immunology,Volumes I-IV, 1996.
Wardle, Nephrol. Dial, Transplant., 16(9):1764-8, 2001.
Warrington et al., Arthritis and Rheumatism, 44:13-20, 2001.
Weyand and Goronzy, Ann. NY Acad. Sci., 987:140-149, 2003.
Whitehead et al., Gastroenterol., 98(5 Pt 1):1187-1192, 1990.
Williams et al., Clin. Neurosci., 2(3-4):229-245, 1994.
Wordsworth, In: Genes andArthritis, Brit. Medical Bulletin, 51:249-266, 1995.
Wright, Ann. Rheum. Dis., 15:348-356, 1956.
Wright, Clin. Orthop. Related Res., 143:8-14, 1979.
Xanthou et al., Arthritis Rheum., 44(2):408-418, 2001.
Yin et al., Arthritis Rheum., 40:1788-1797, 1997.
Yin et al., Rheumatology, 38:1058-1067, 1999.
Yoh et al., Kidney Int., 60(4): 1343-1353, 2001.
Yore, et. al., Mol Cancer Ther 5:3232-9, 2006.
Yu et al., Nat. Rev. Immunol., 7:41-51, 2007.
Zhou et al., Am. J. Pathol., 166(1):27-37, 2005.
Zhou et al., Cancer Sci., 98:882-889, 2007.
Zingarelli et al., J. Immunol., 171(12):6827-6837, 2003.
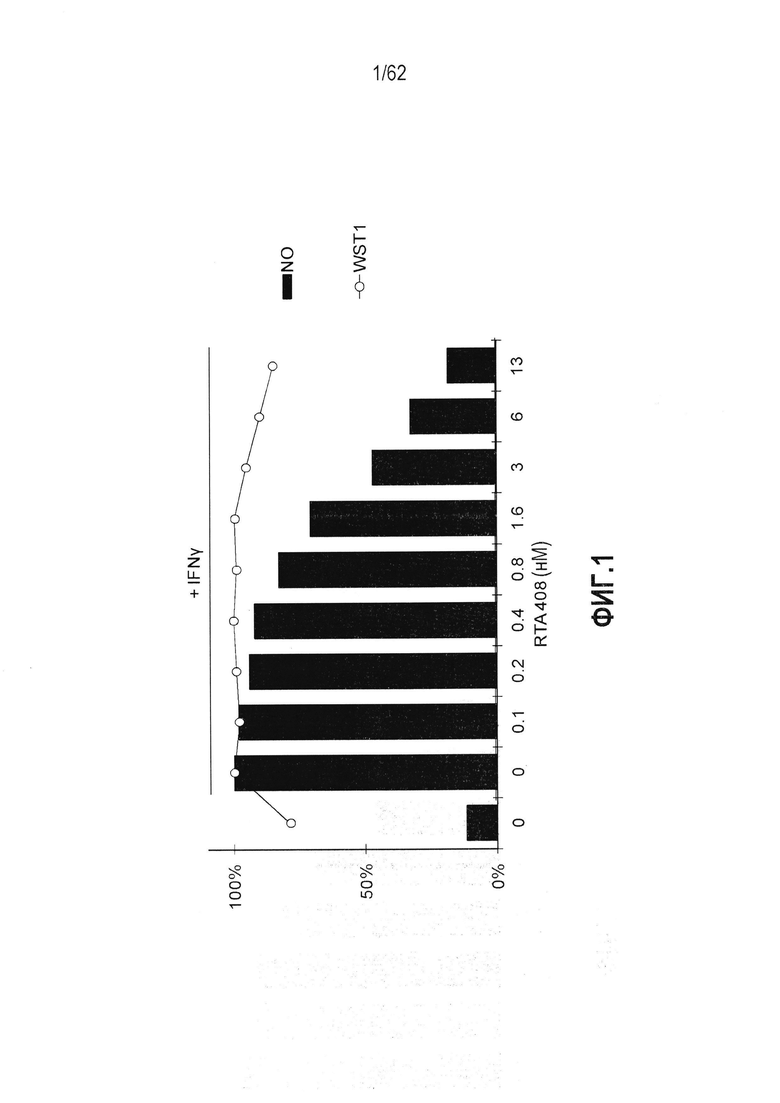
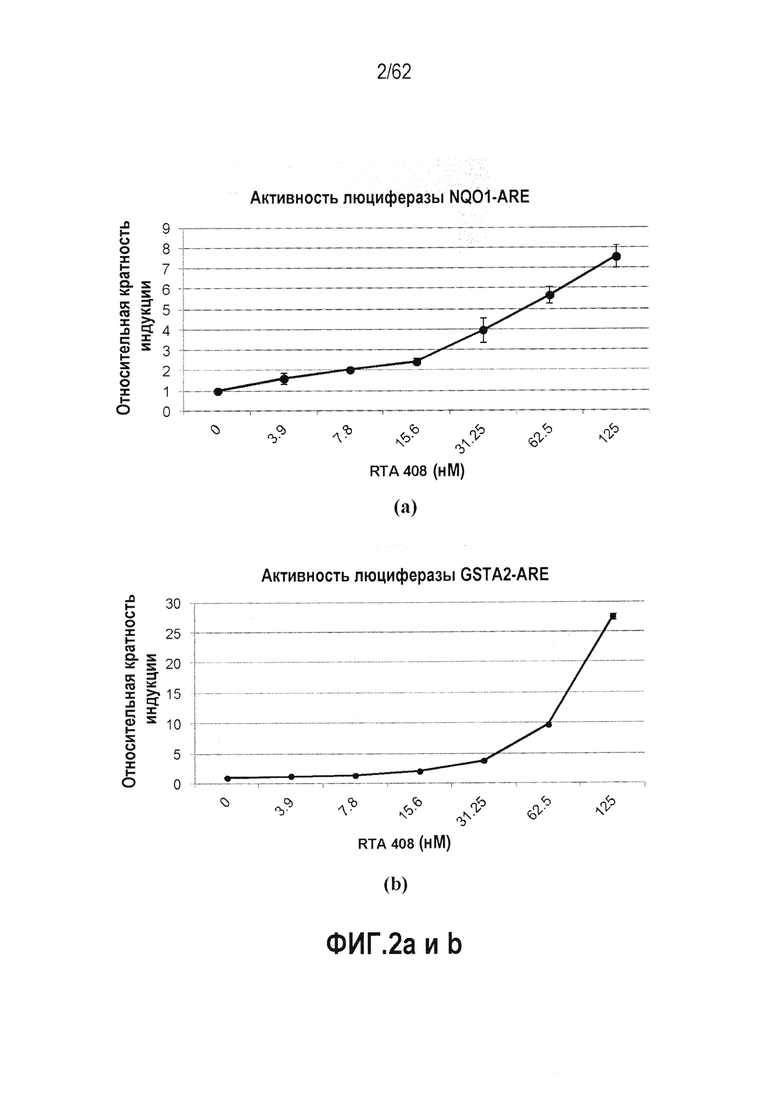
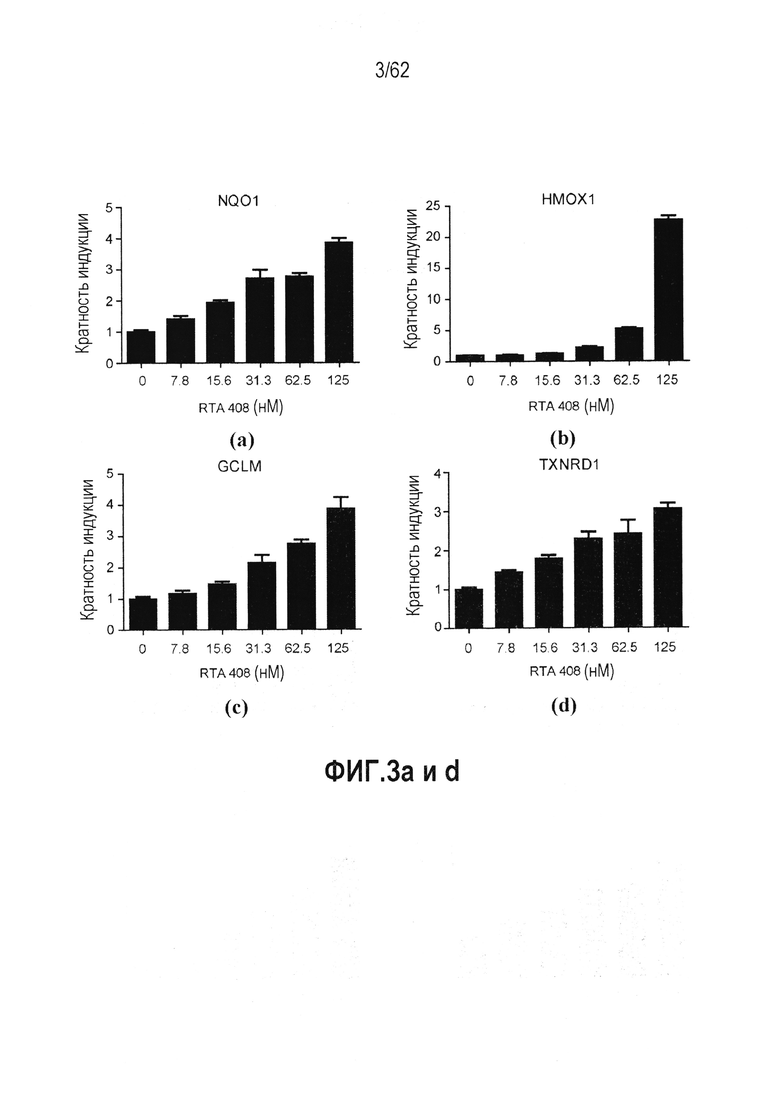
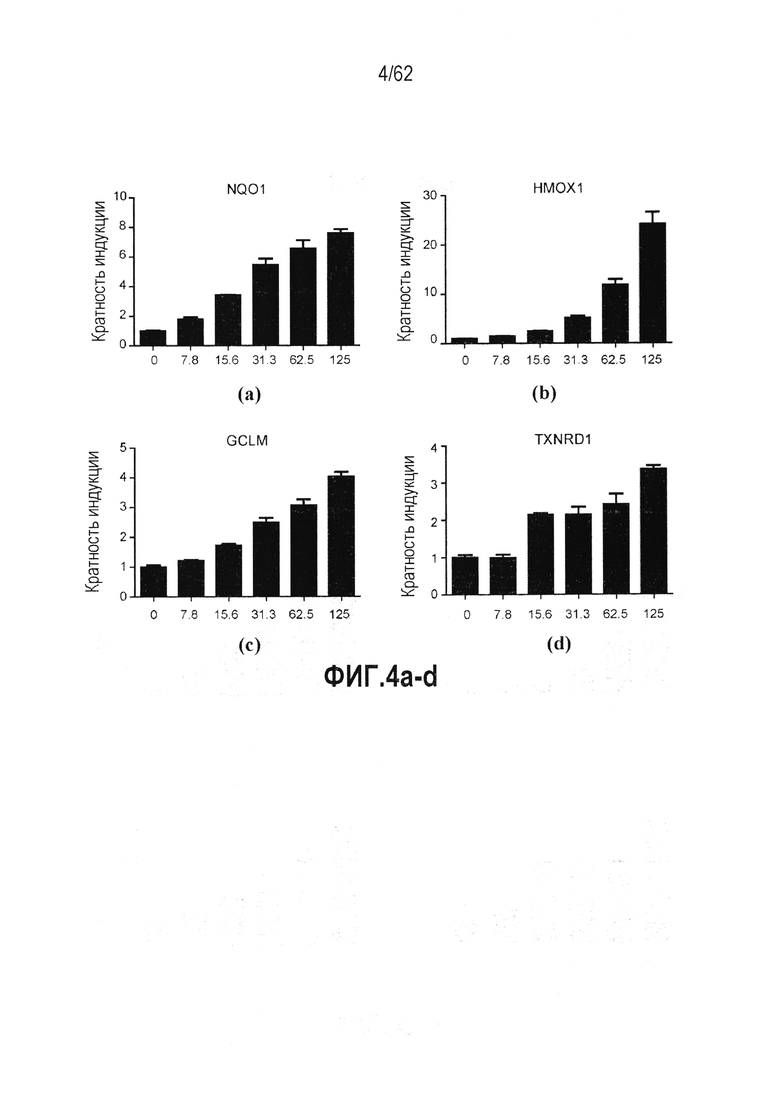
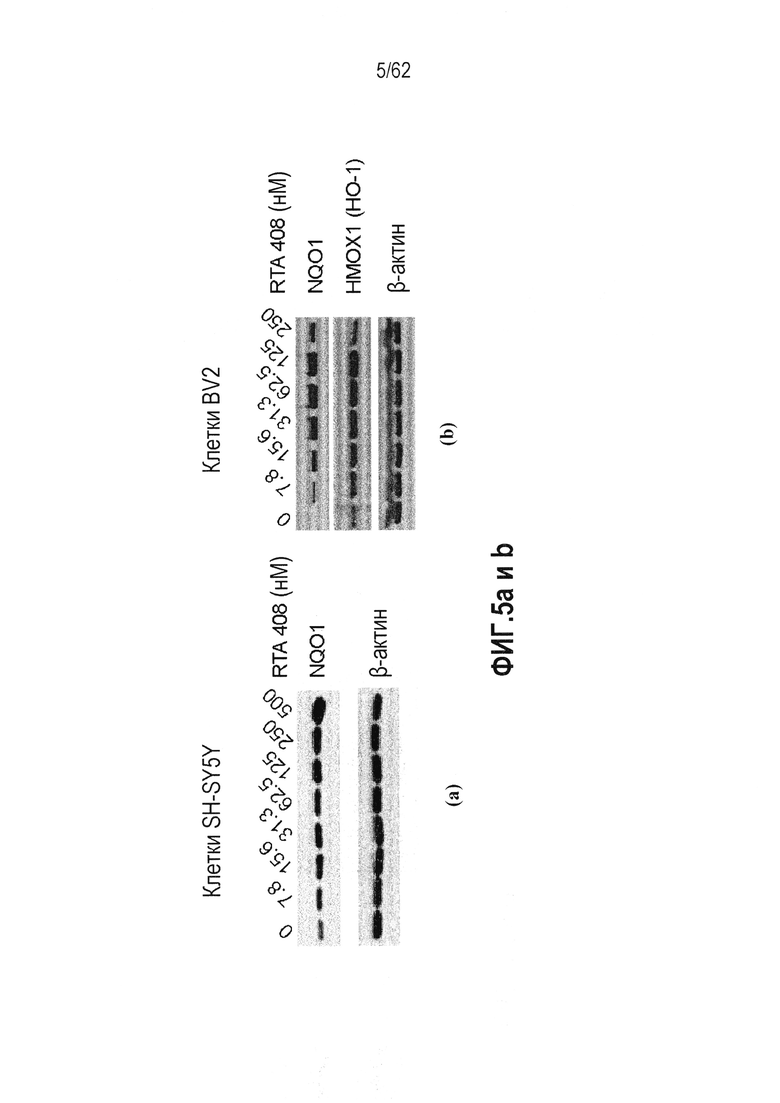
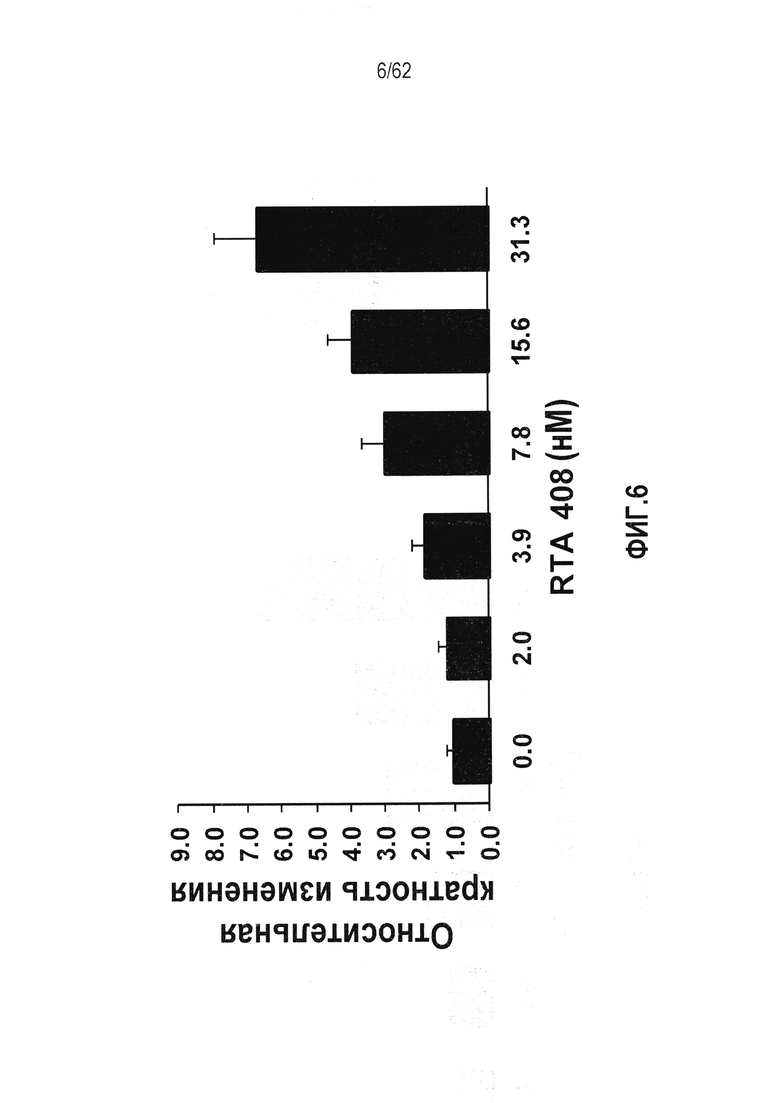
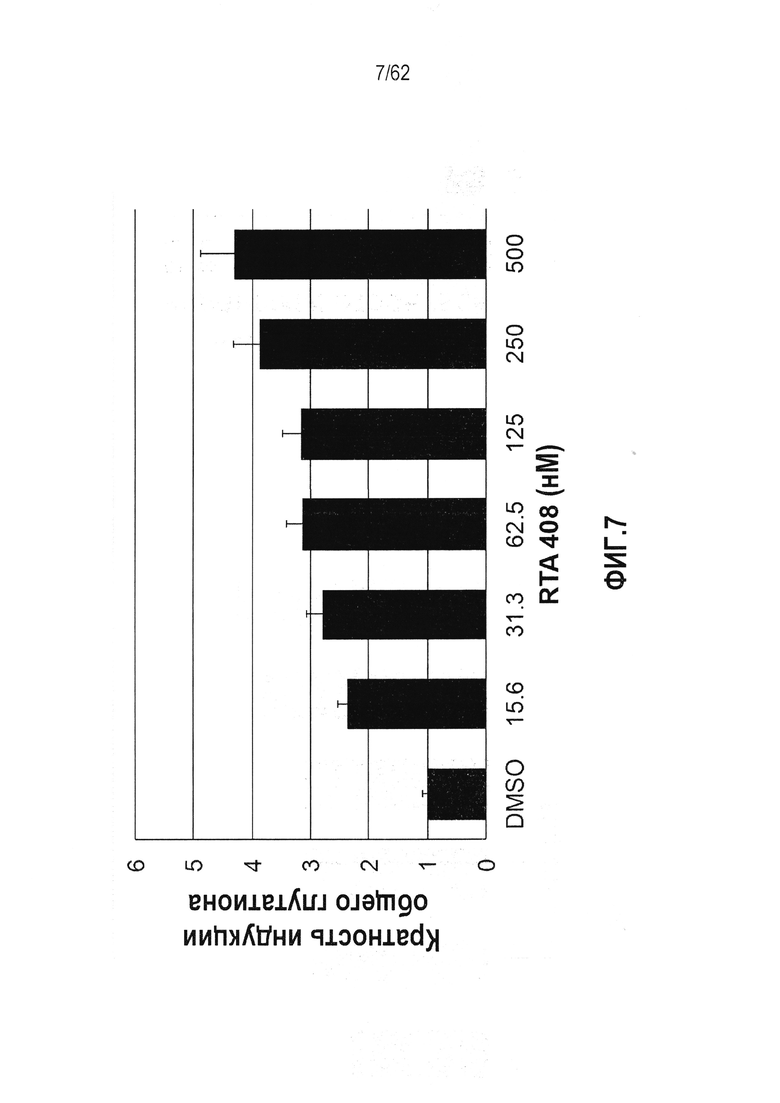
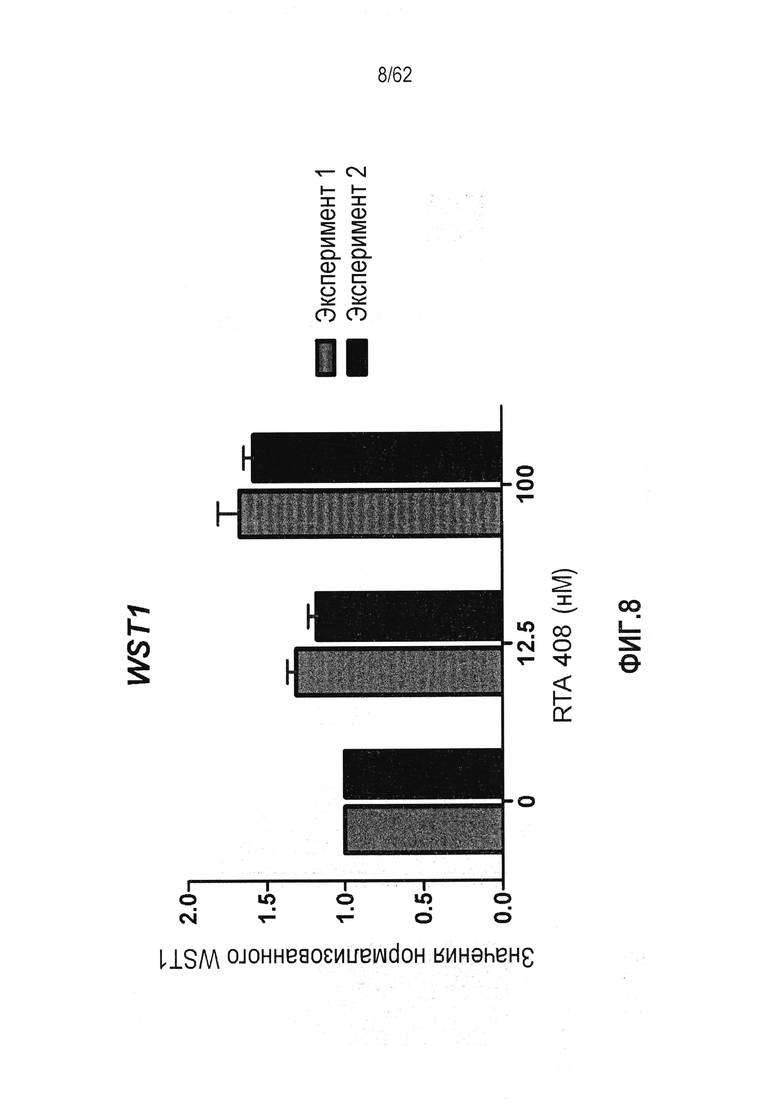
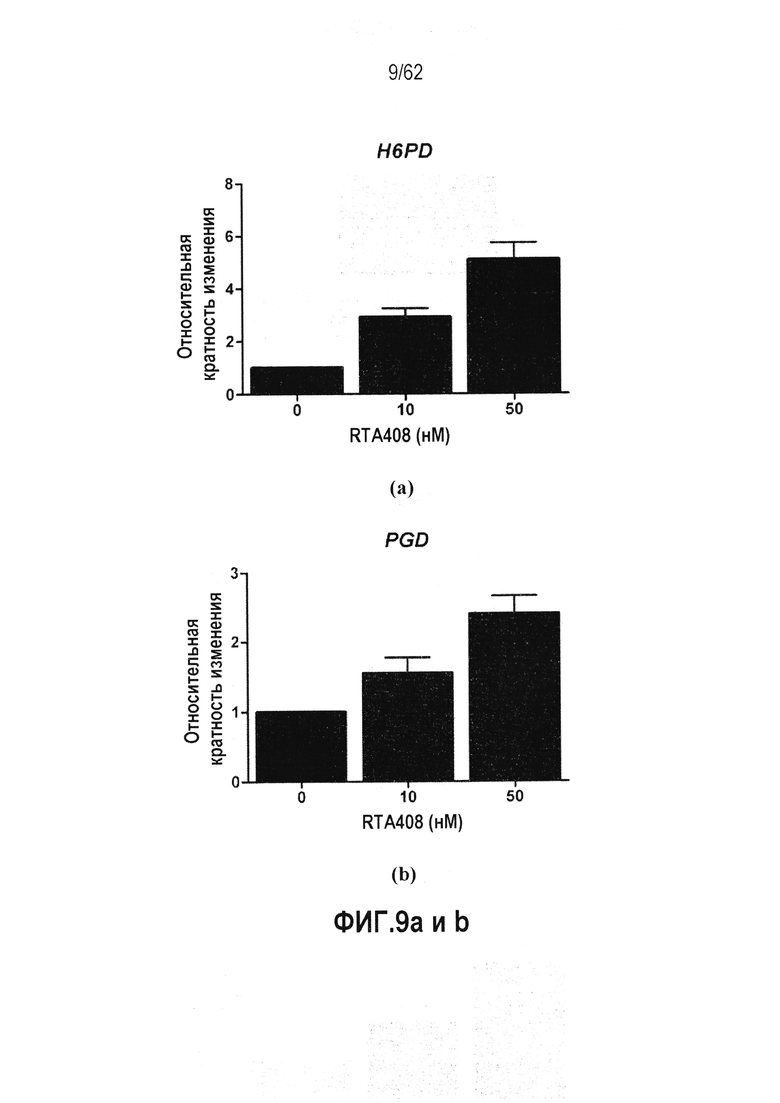
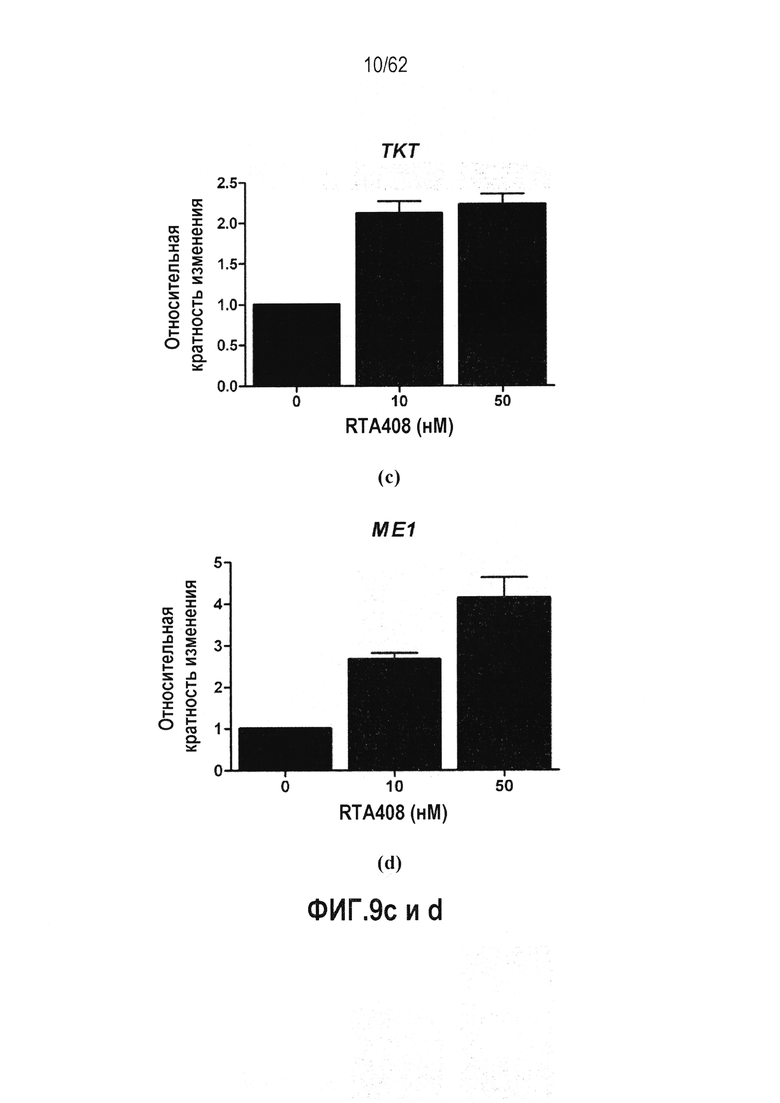
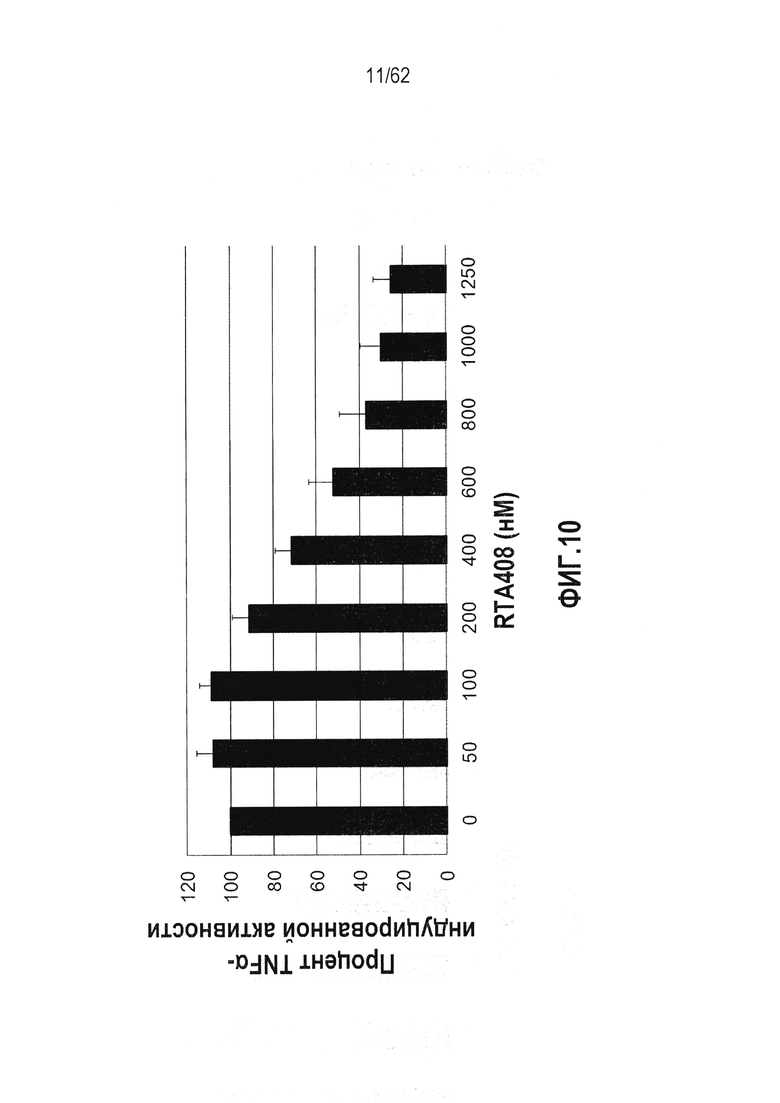
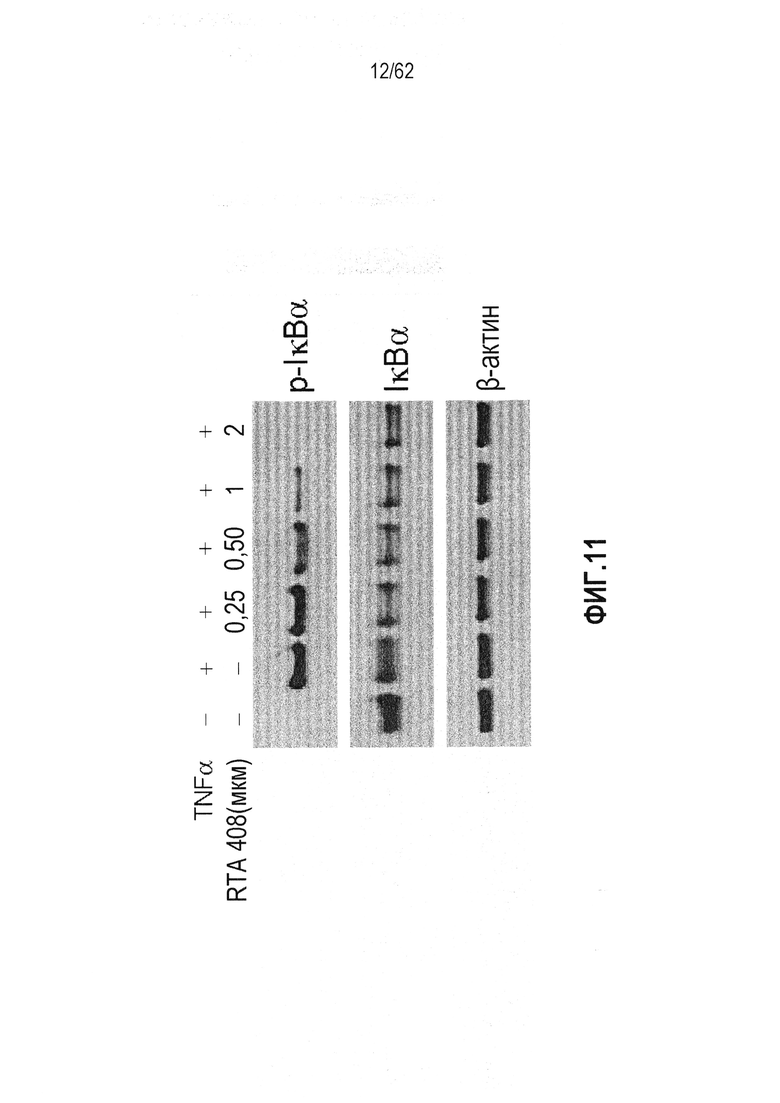
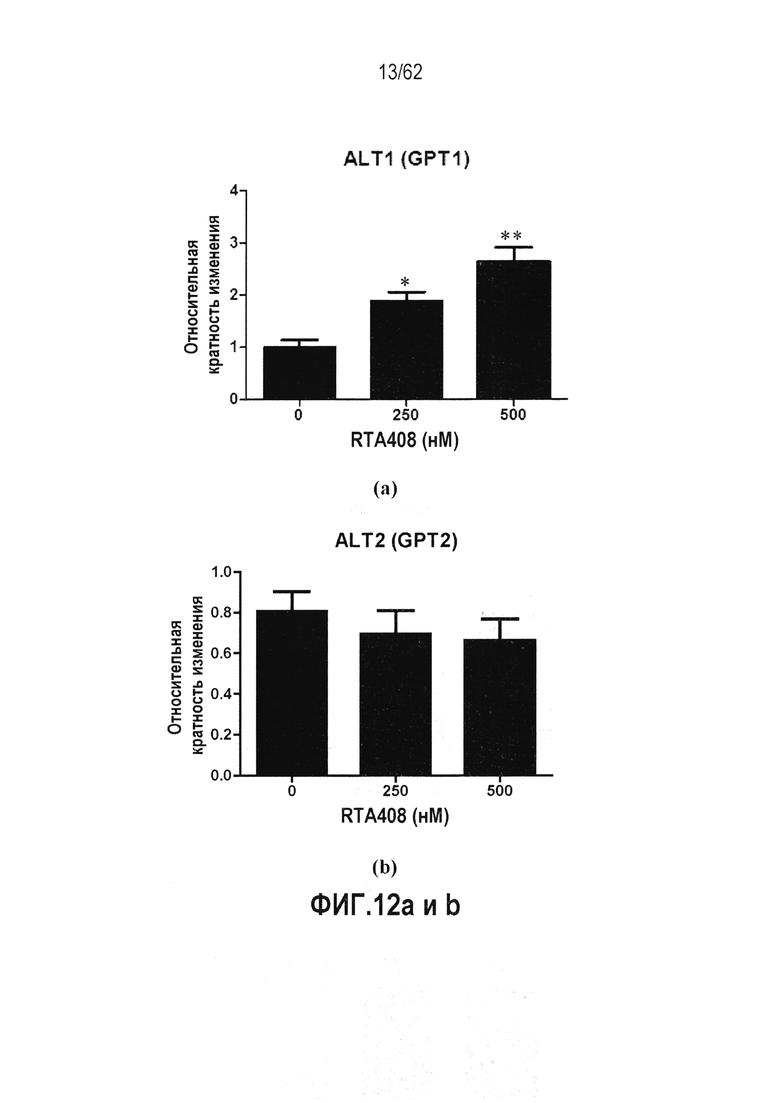
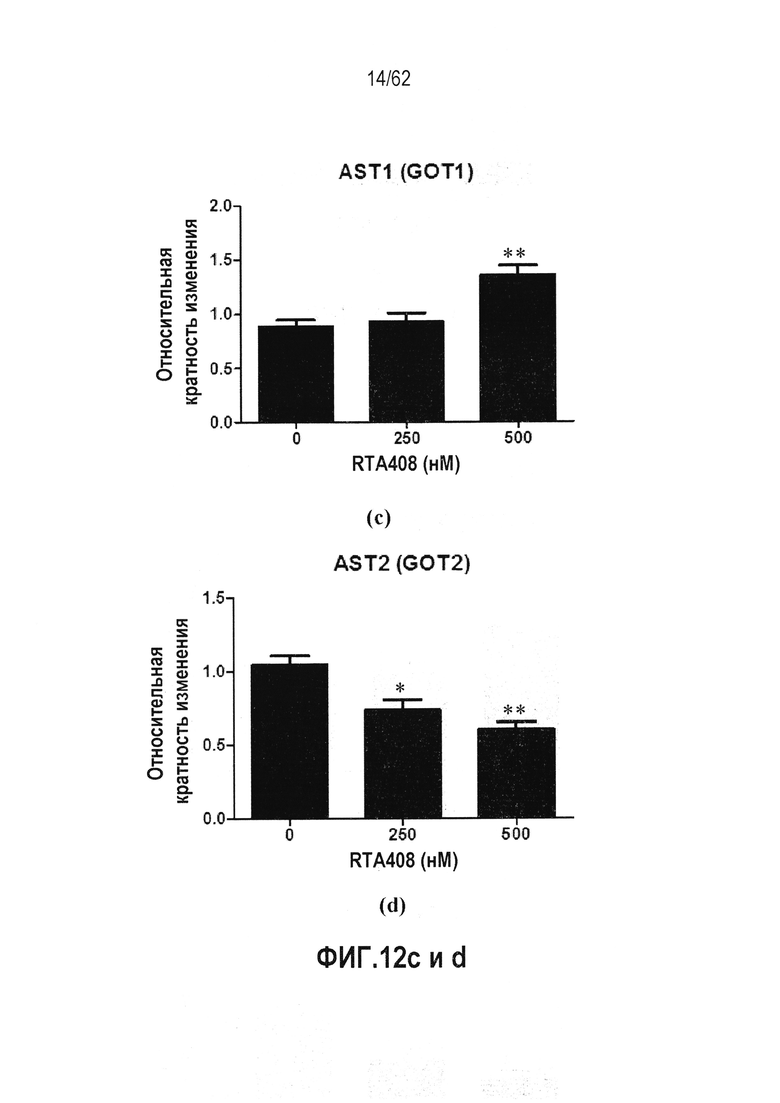
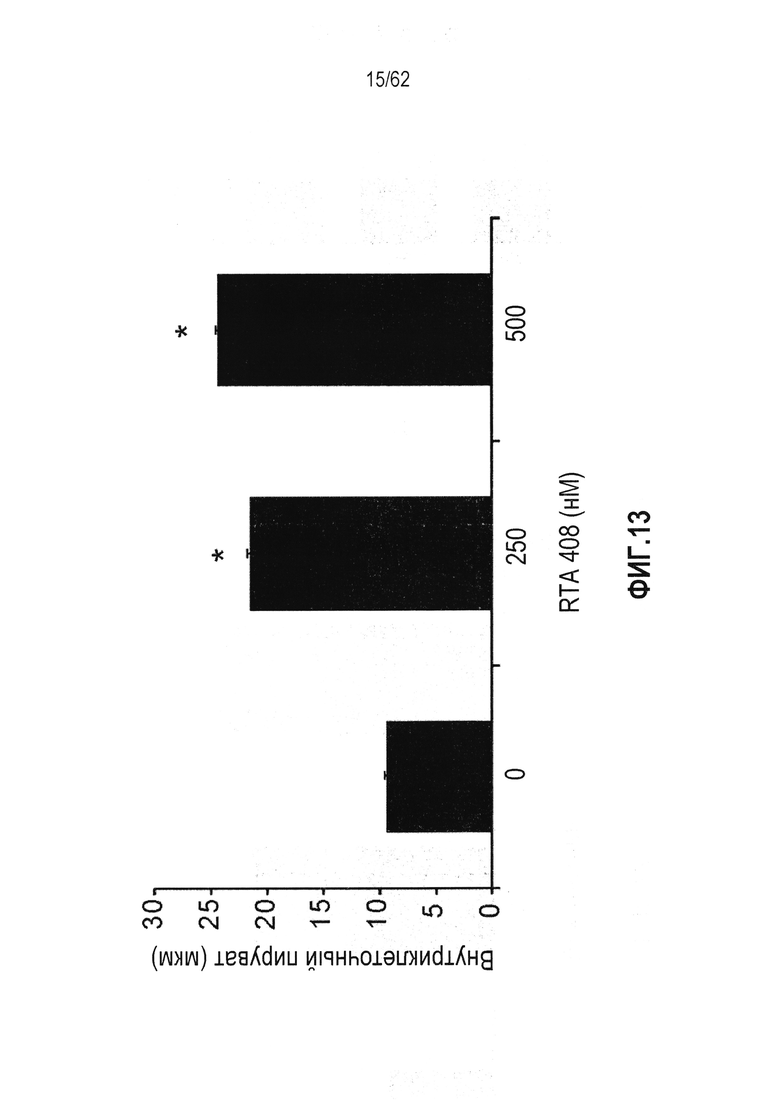
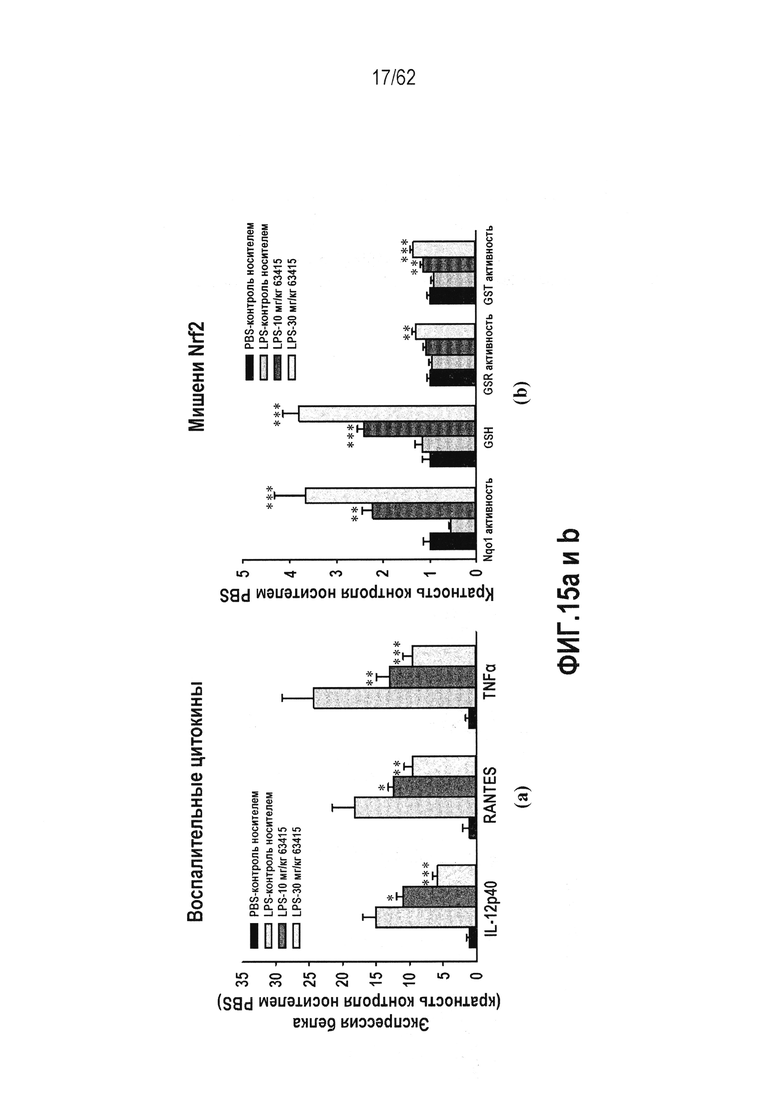
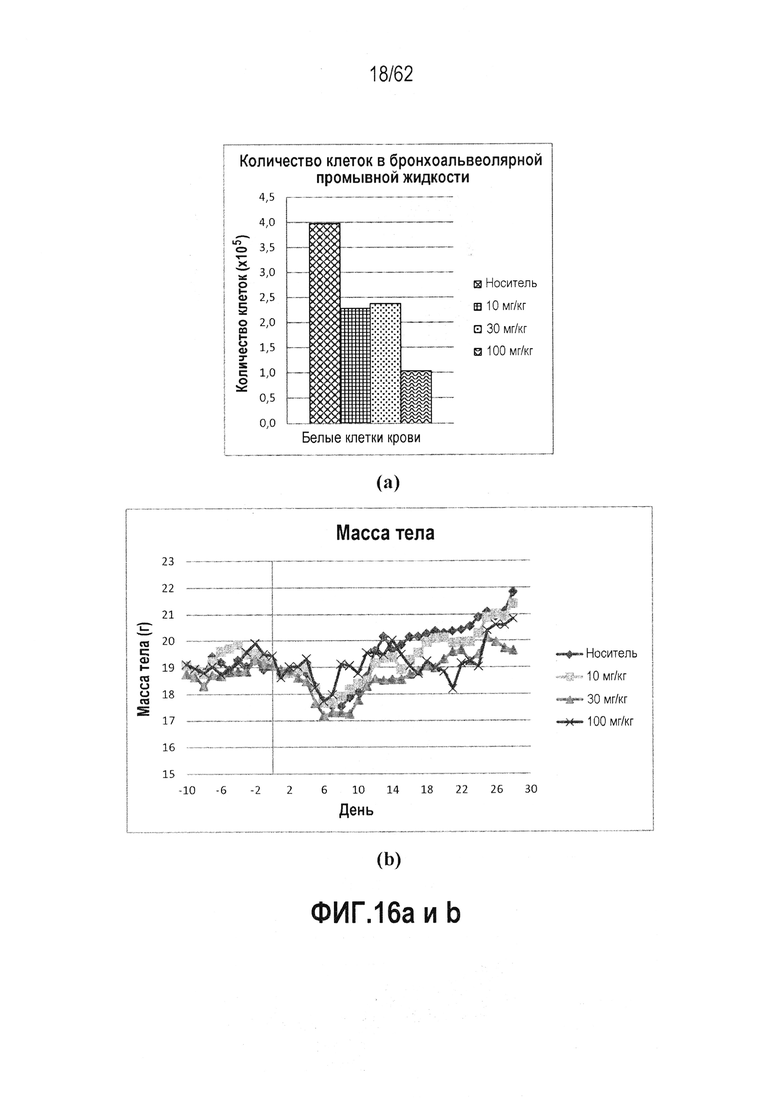
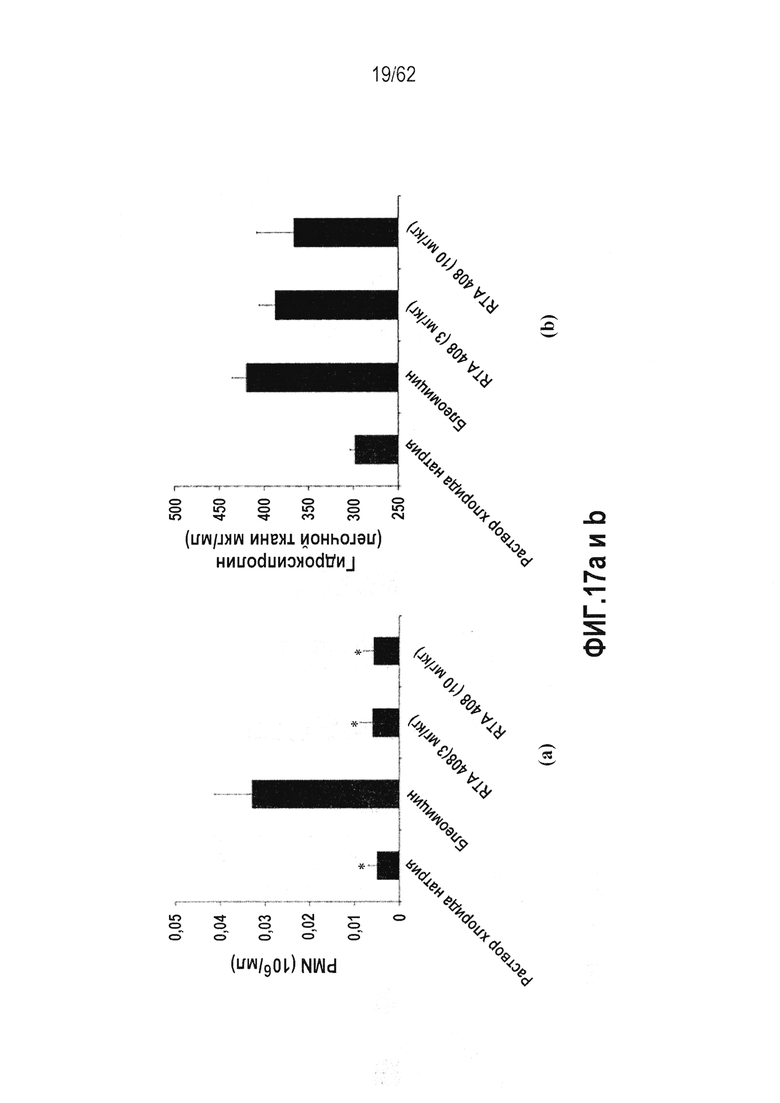
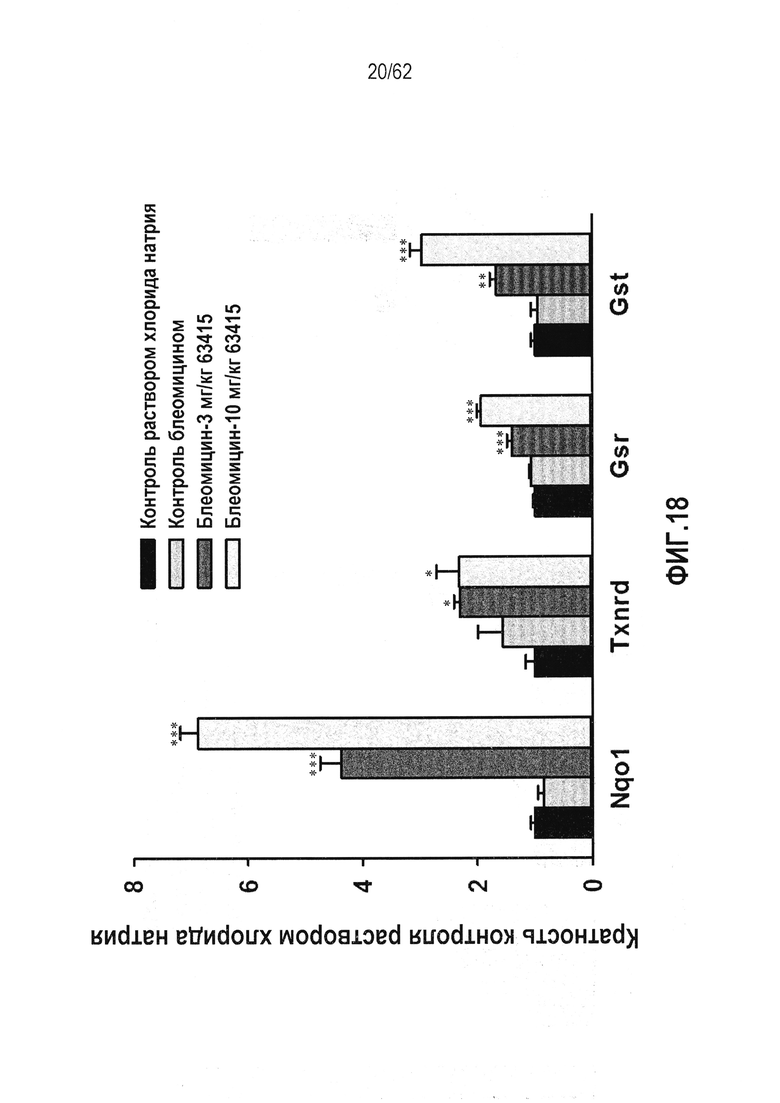
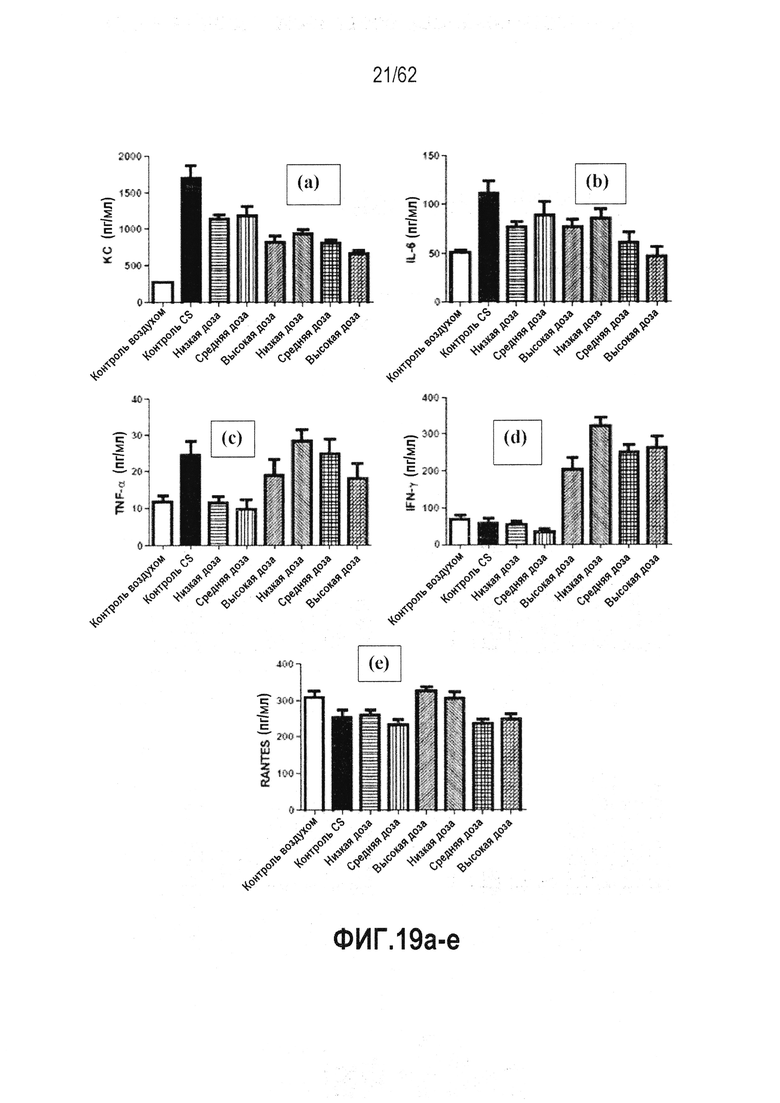
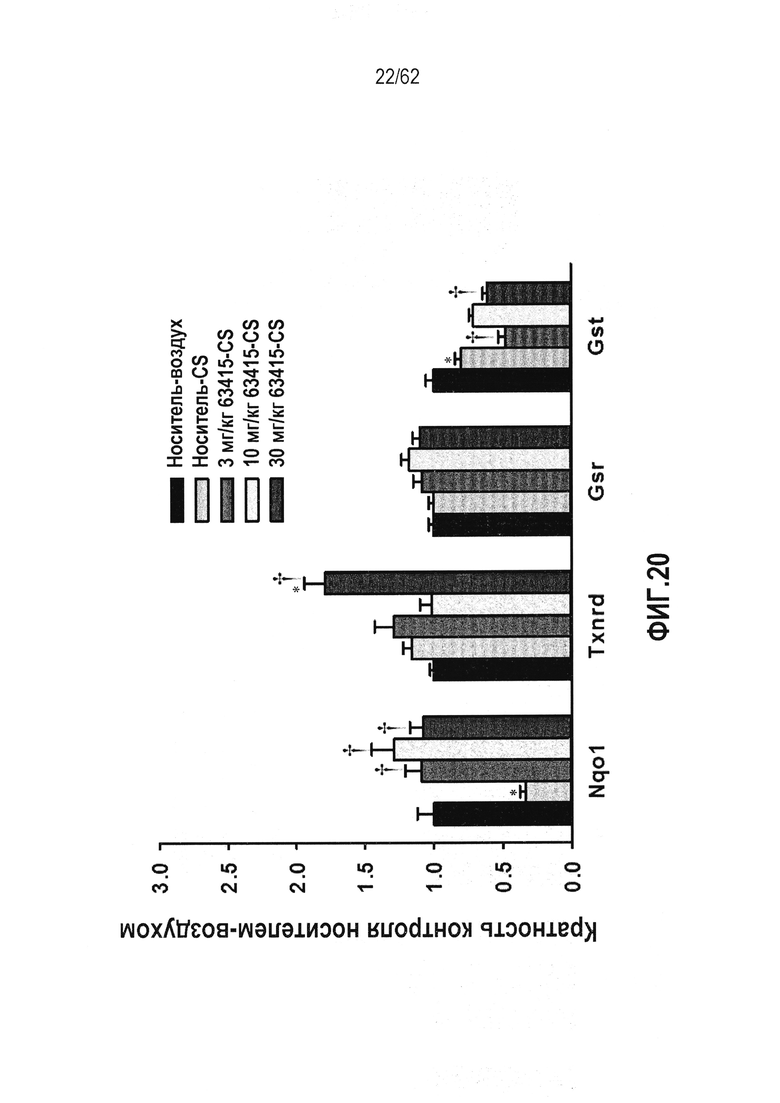
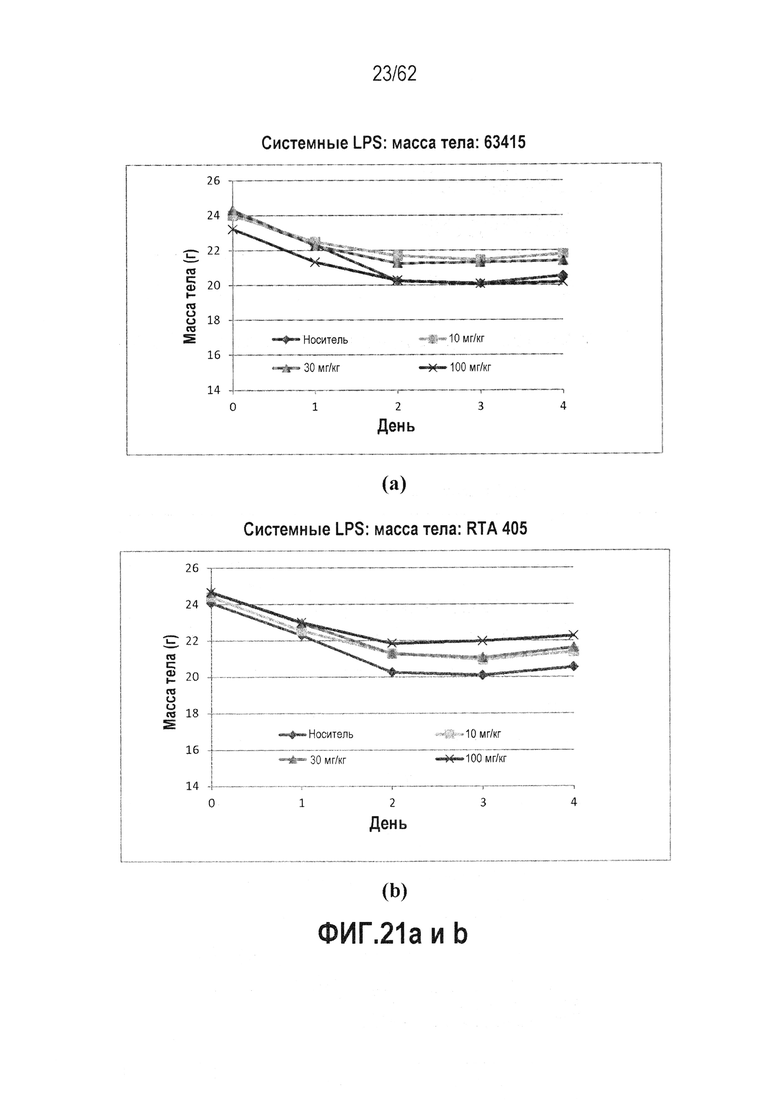
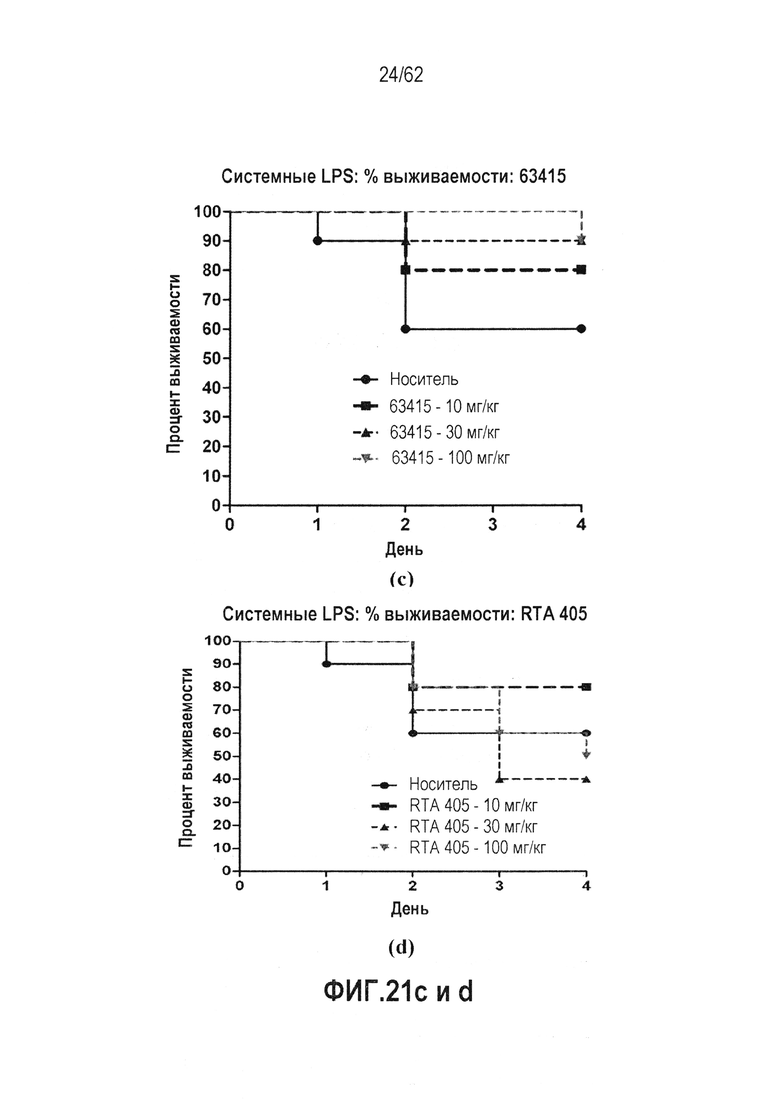
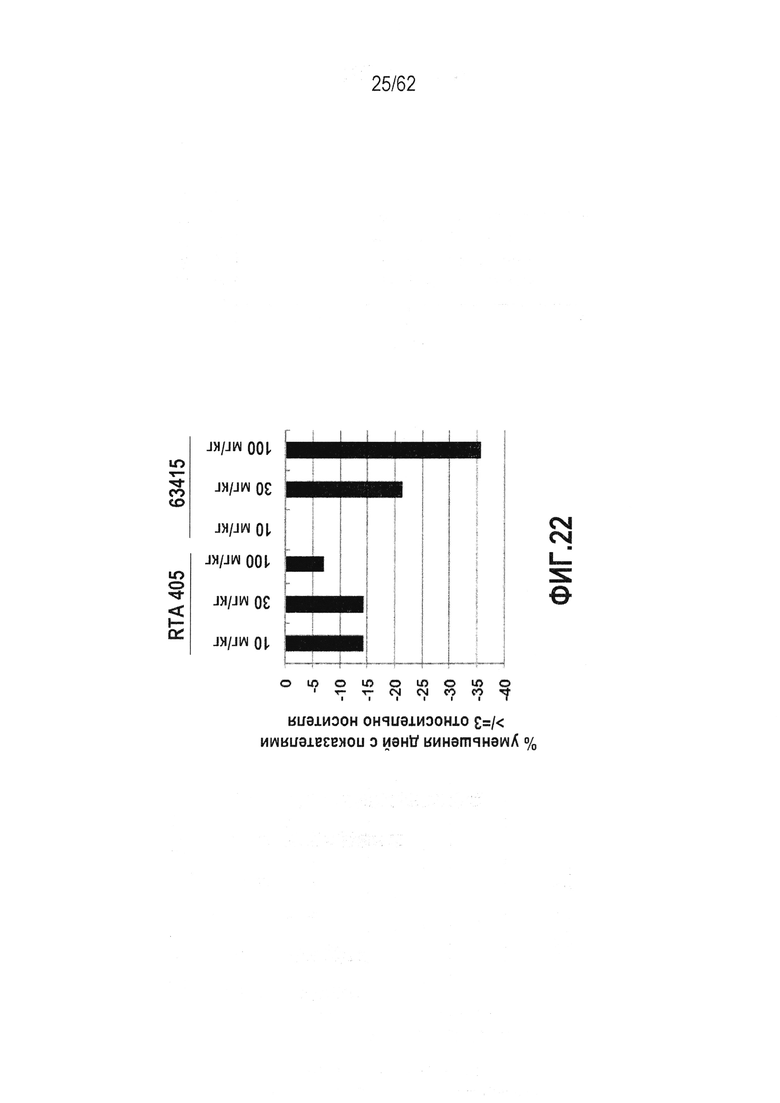
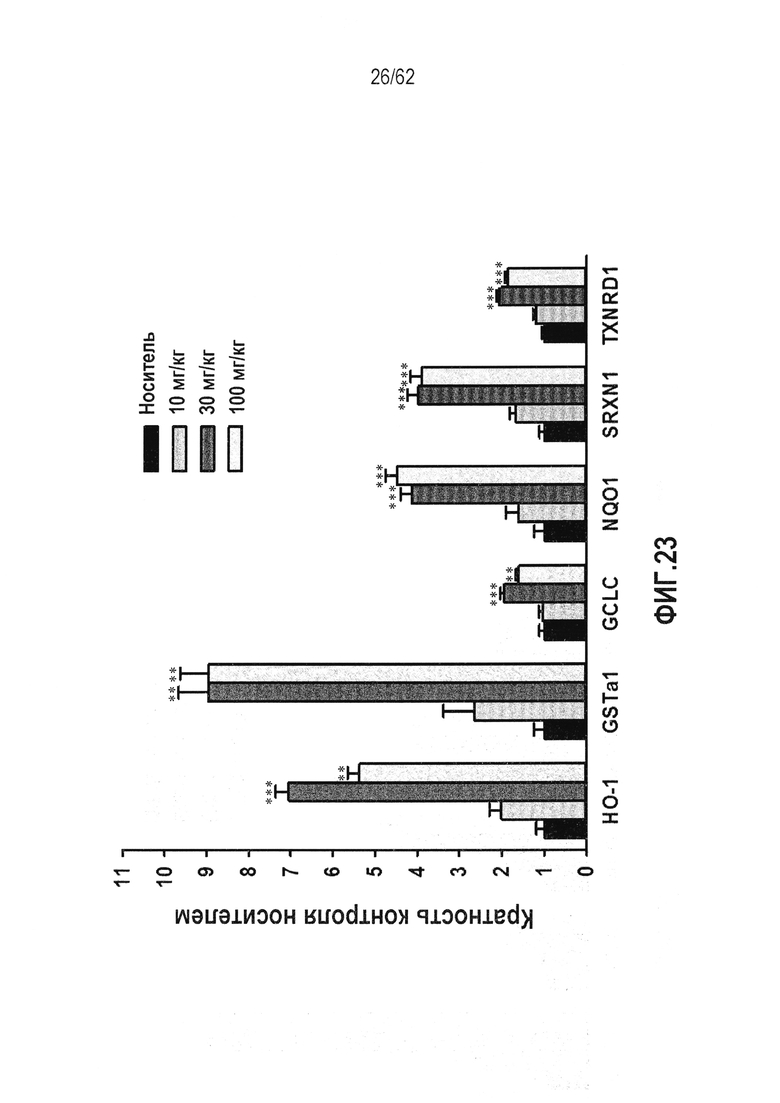
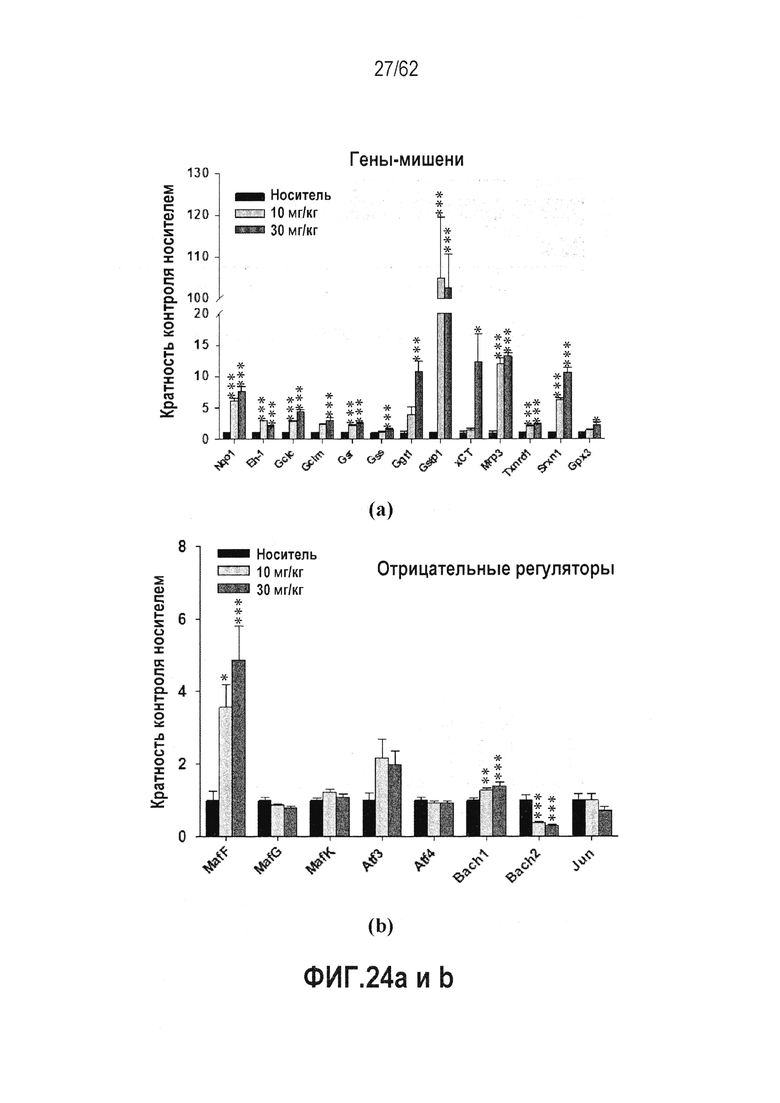
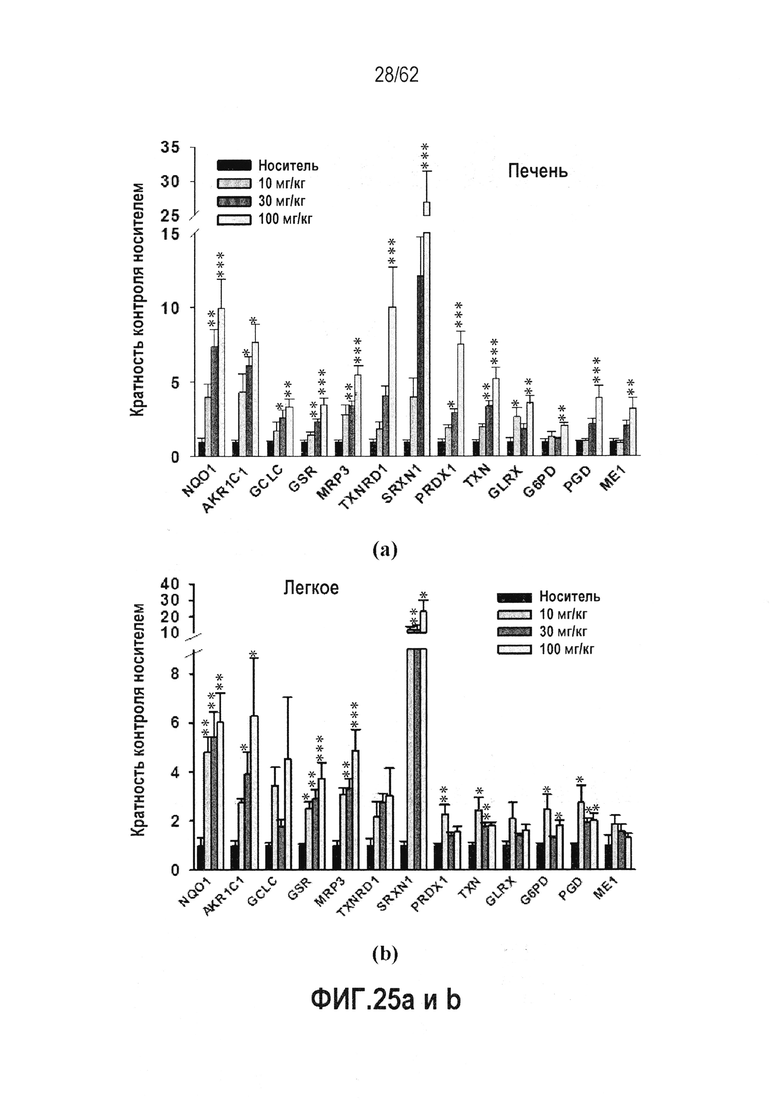
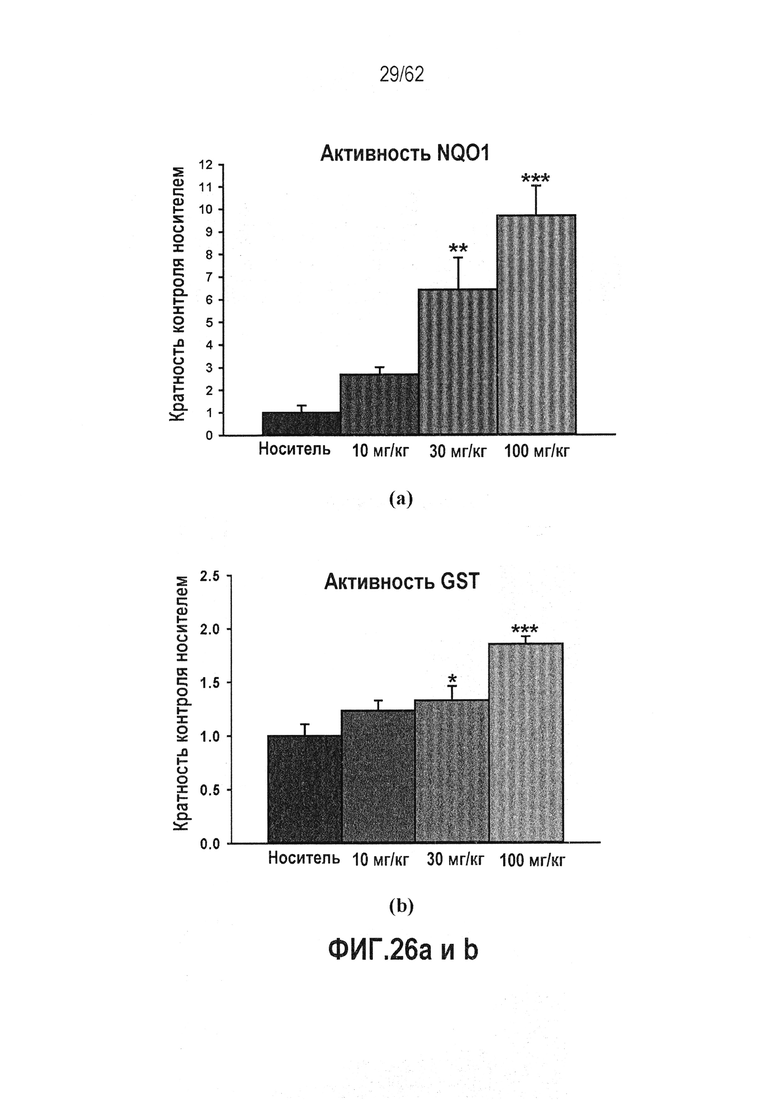
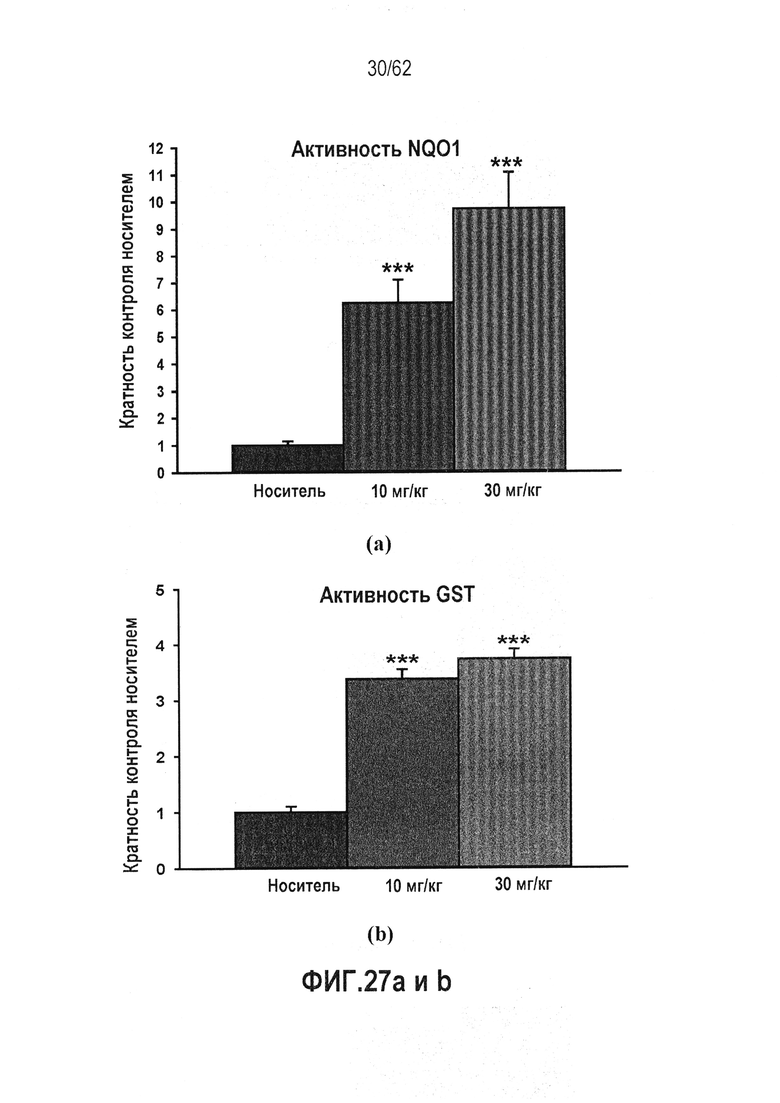
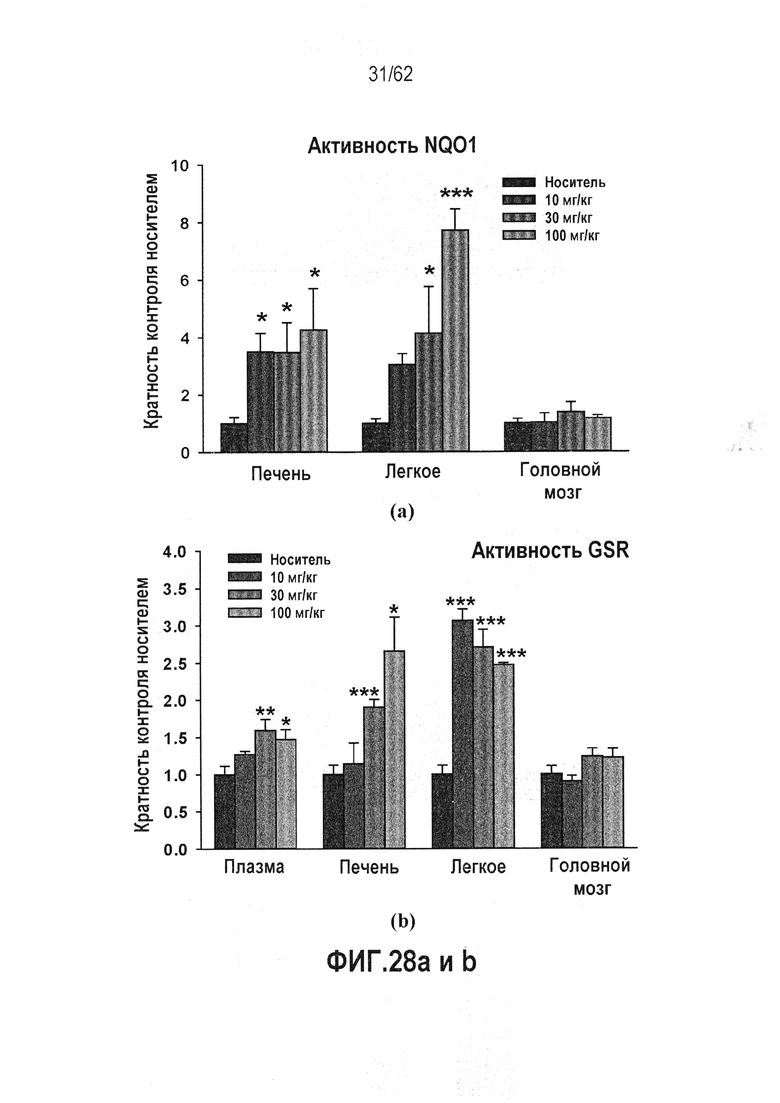
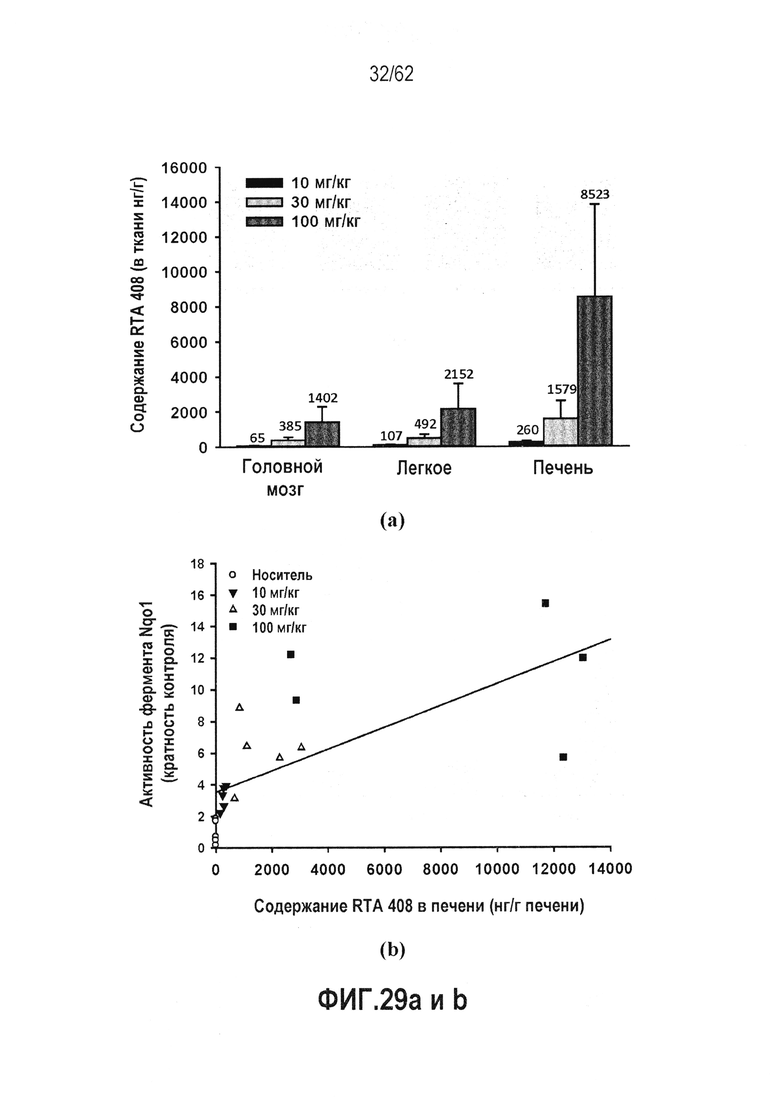
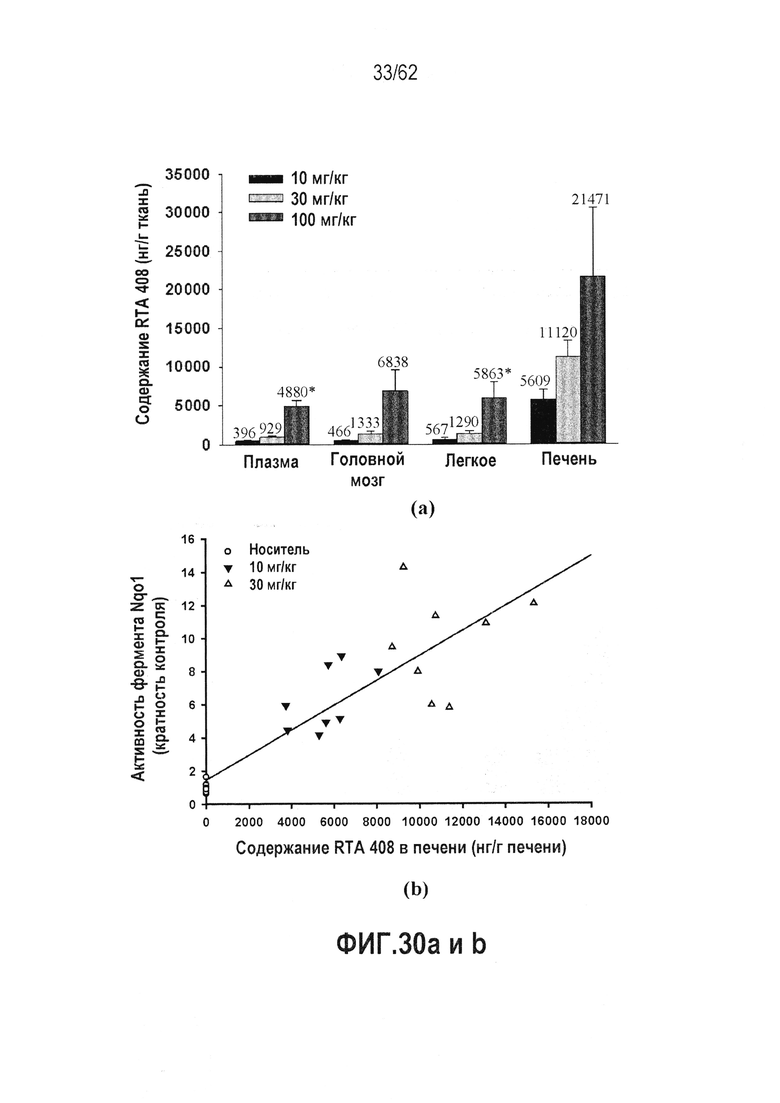
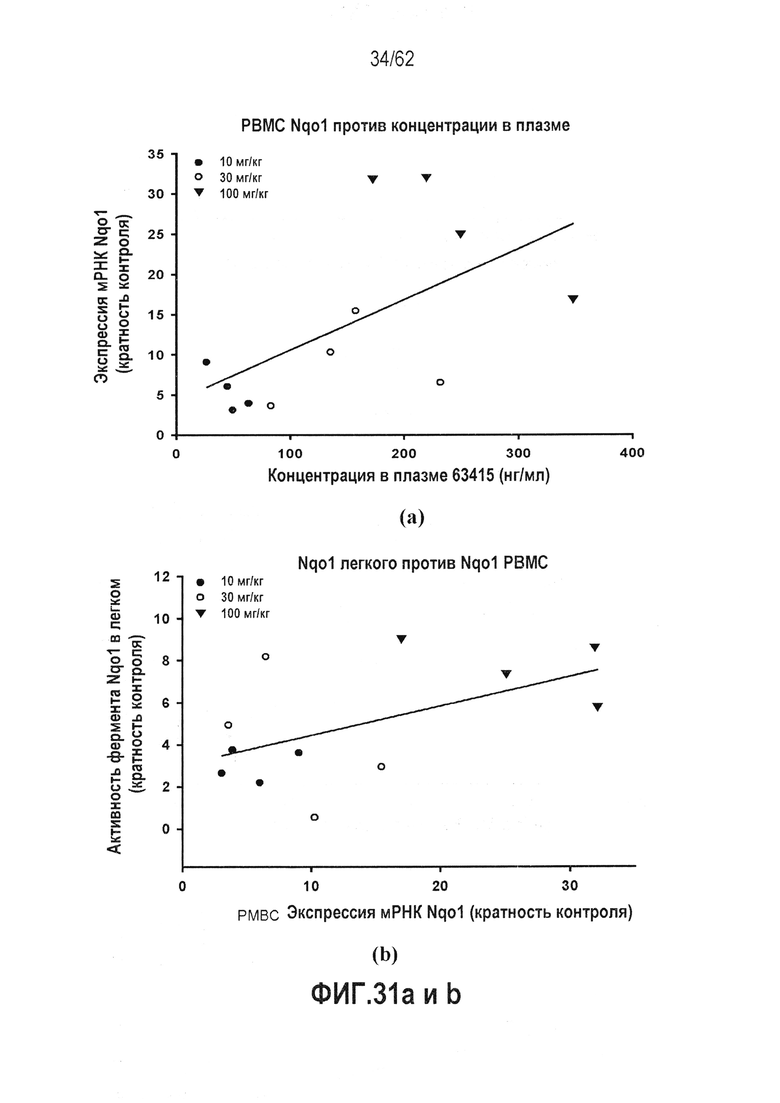
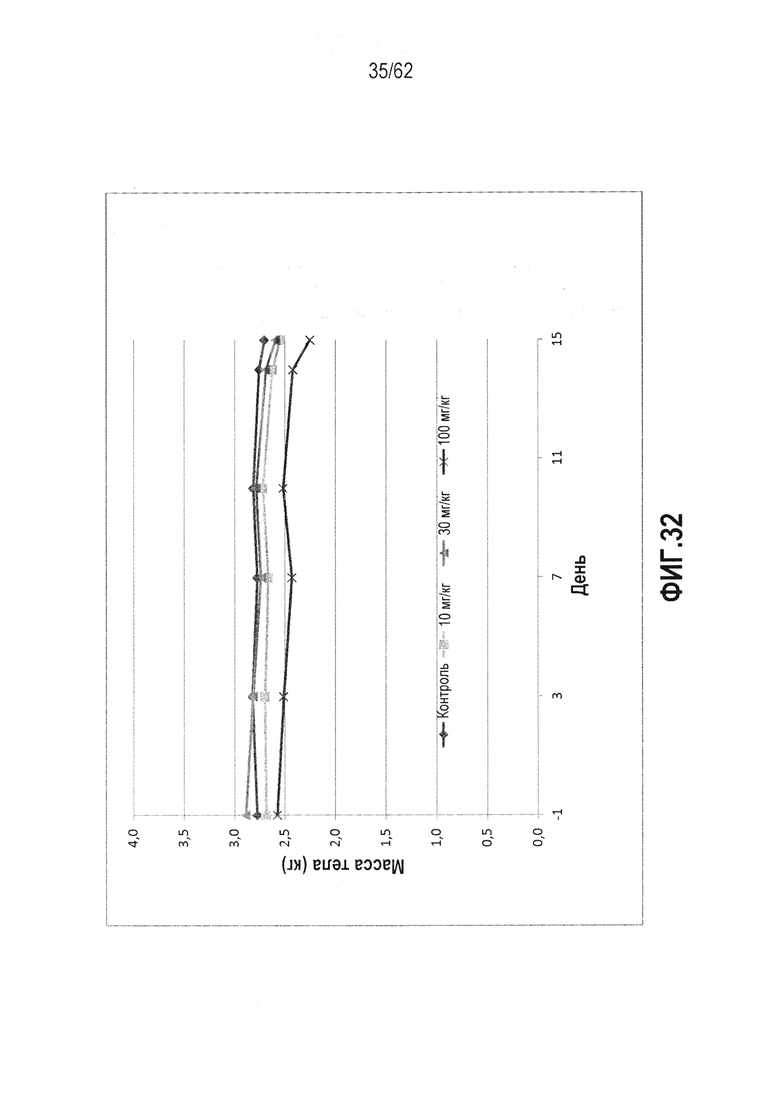
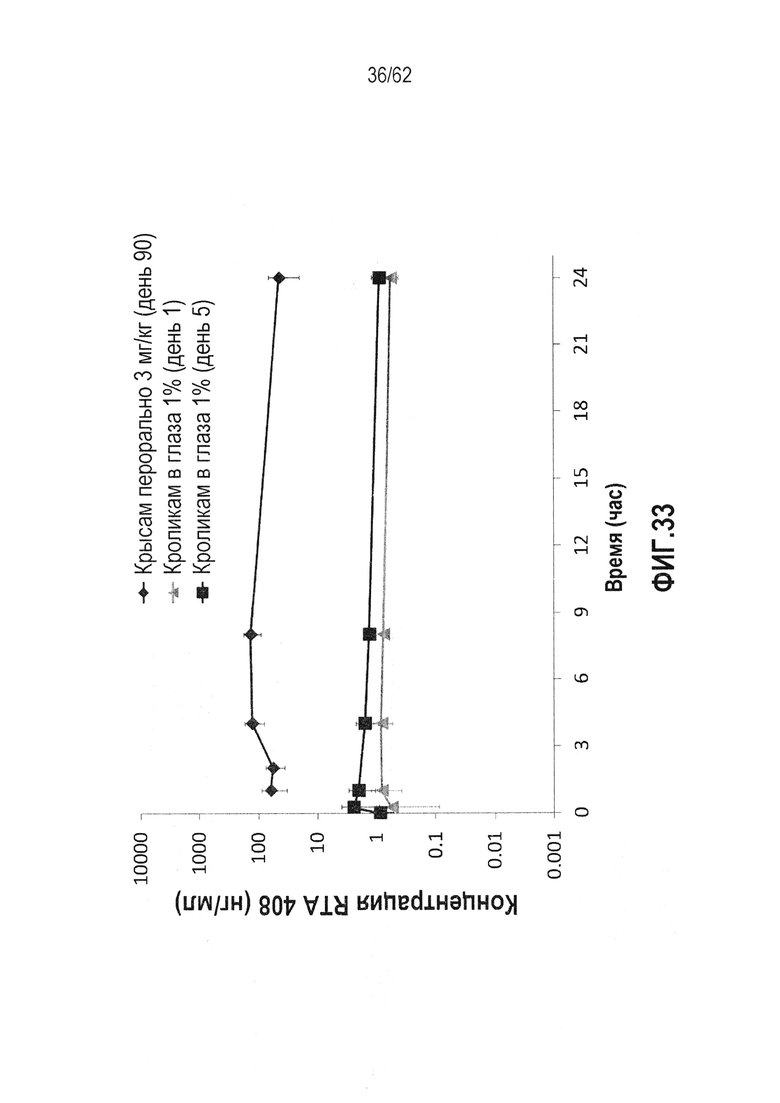
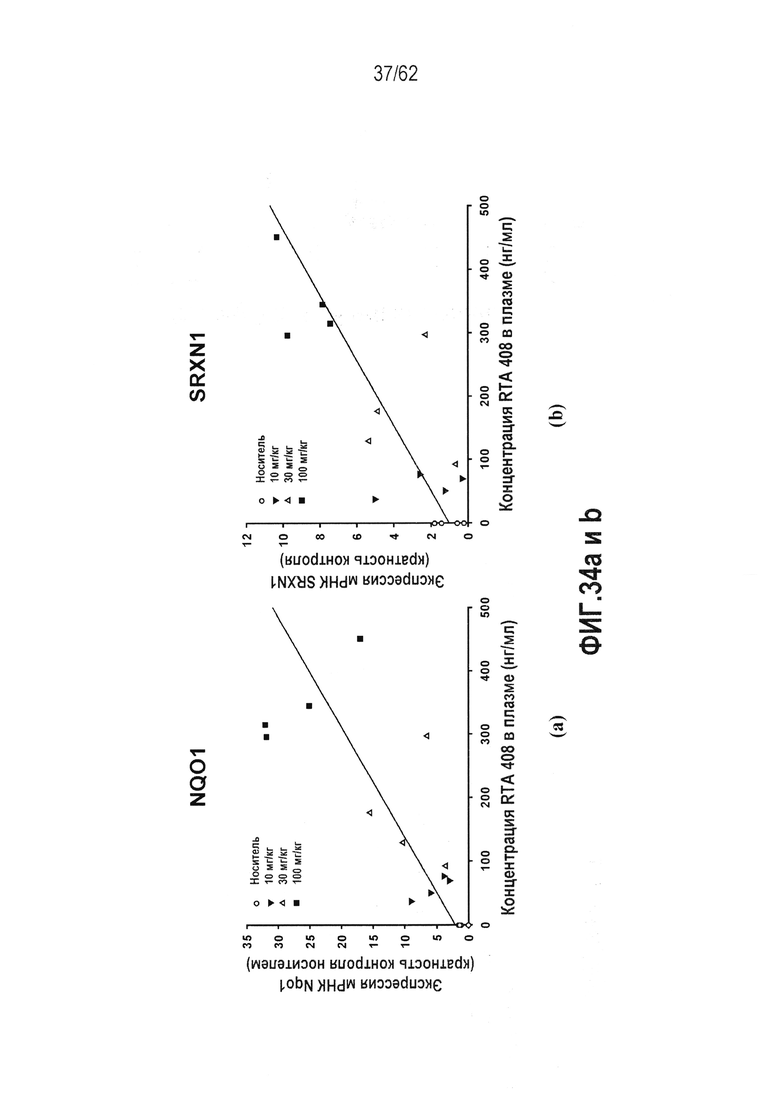
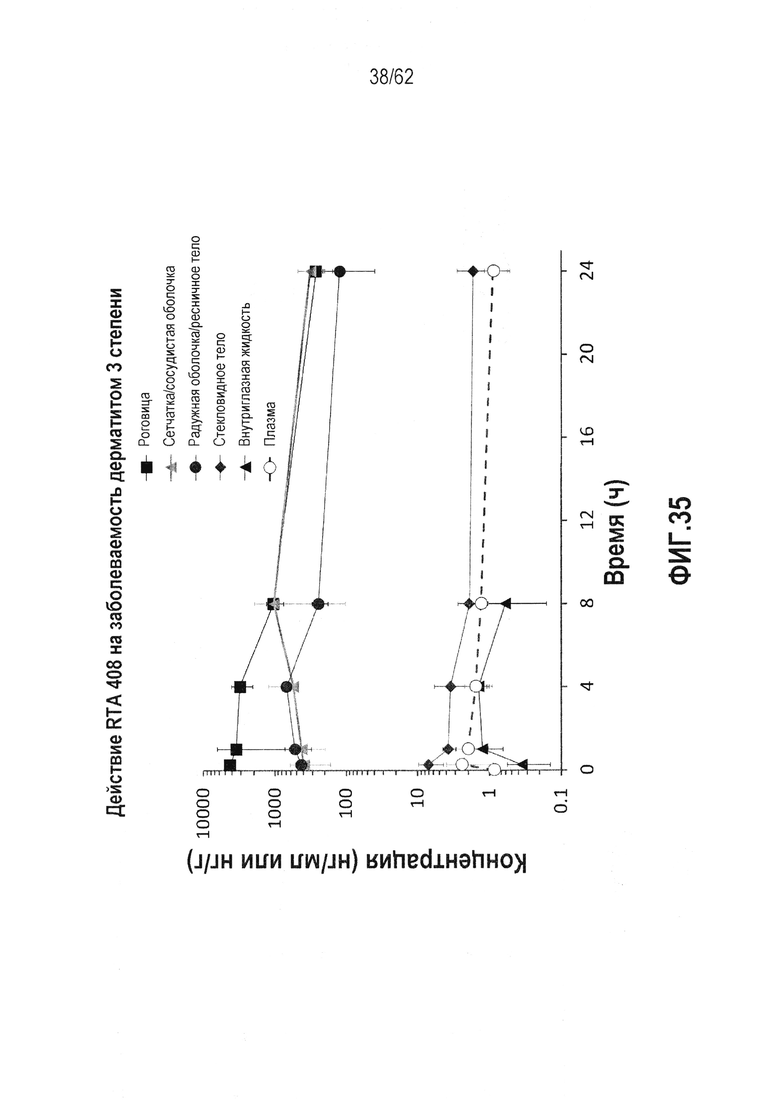
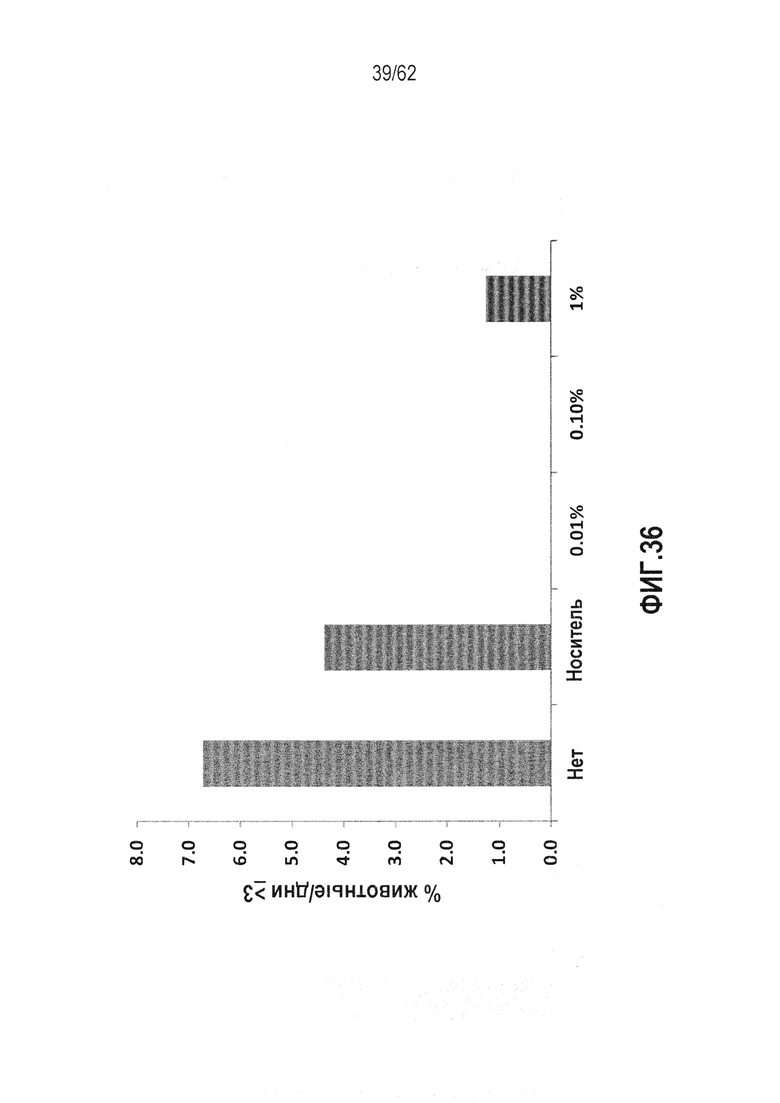
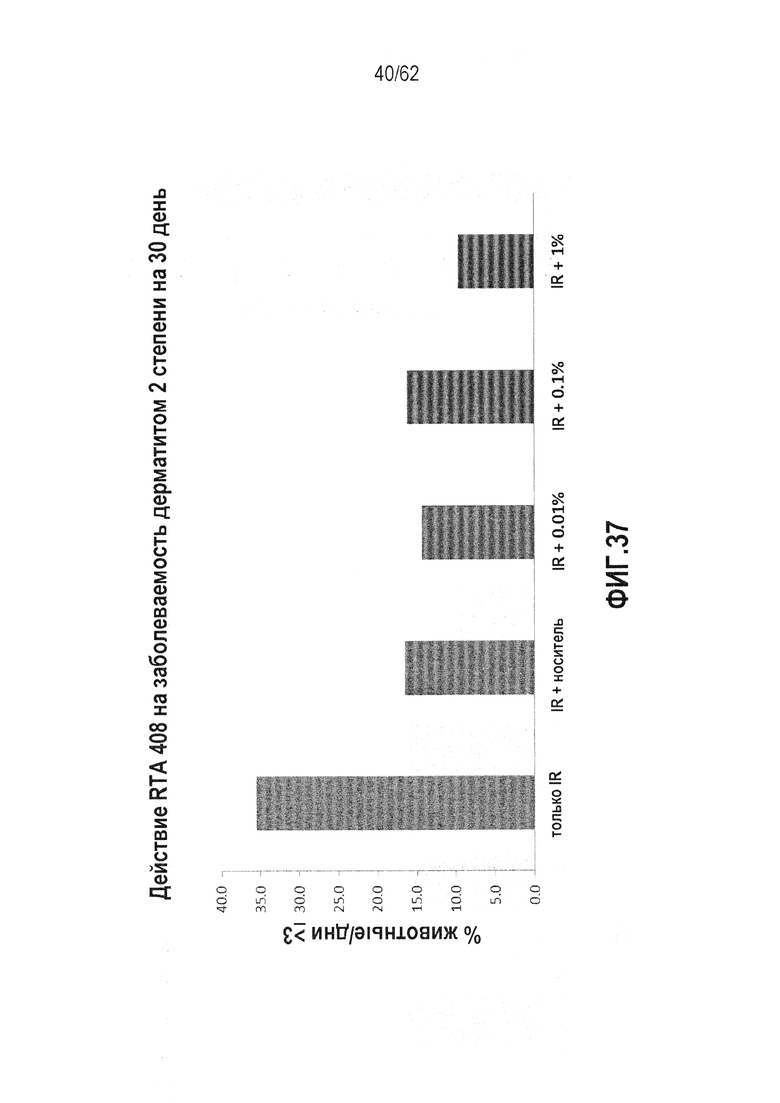
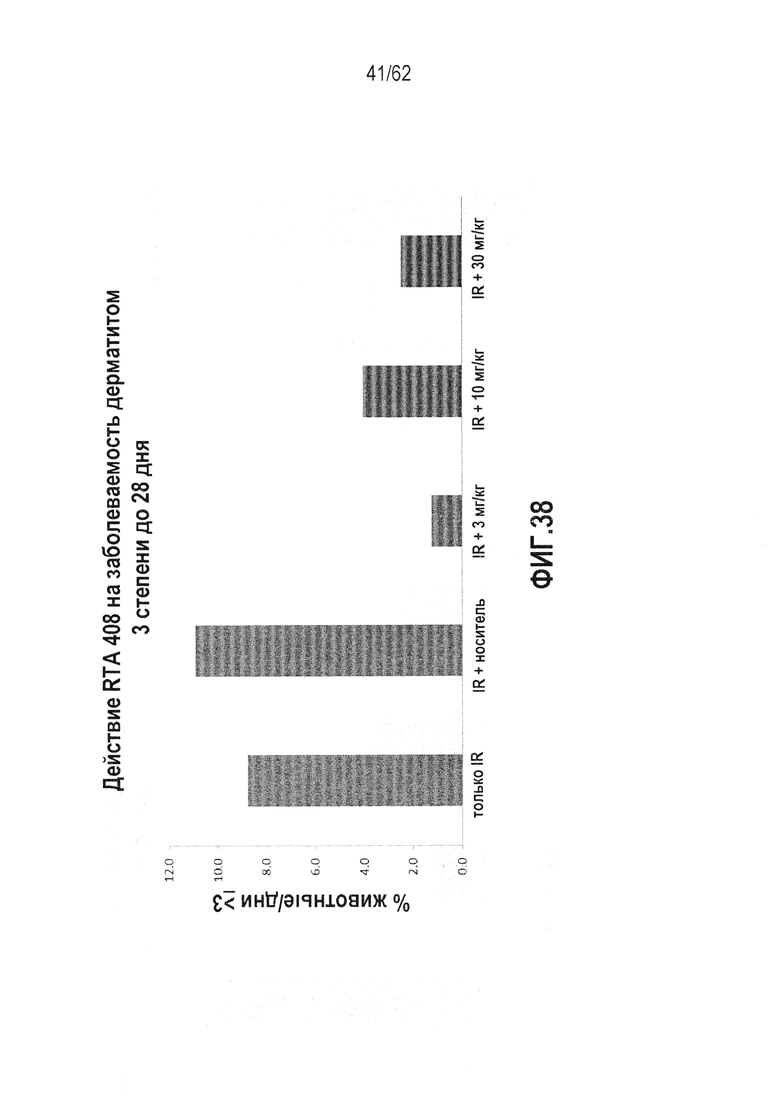
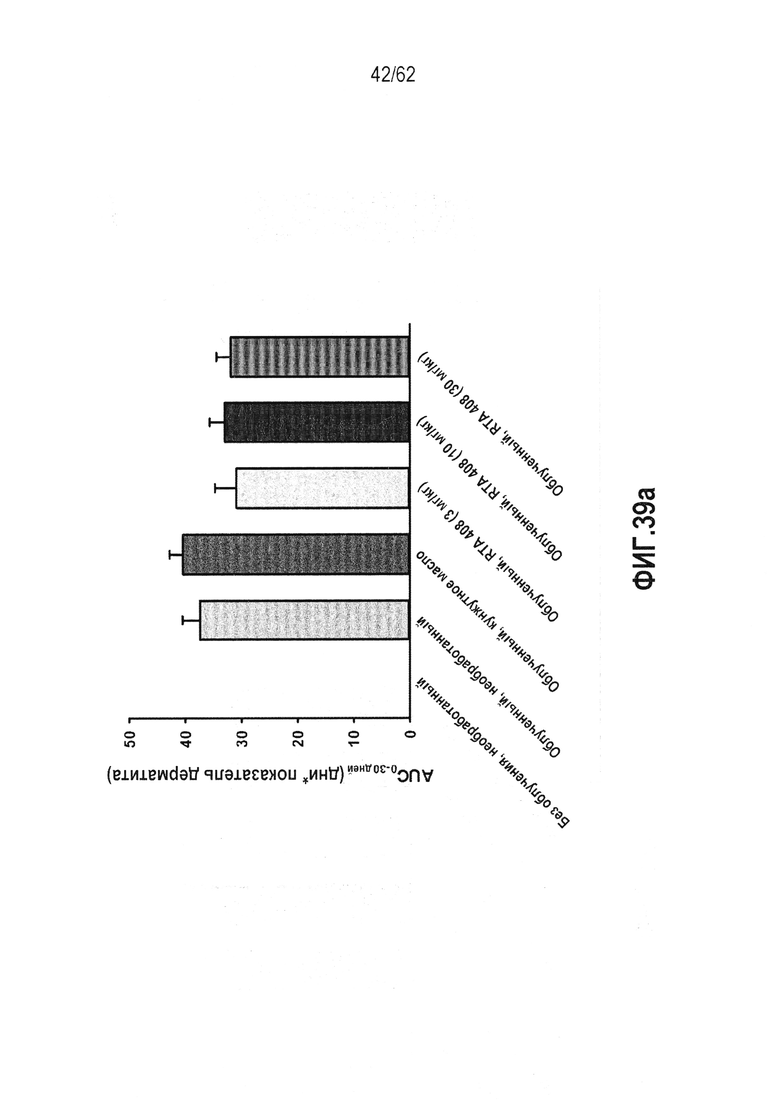
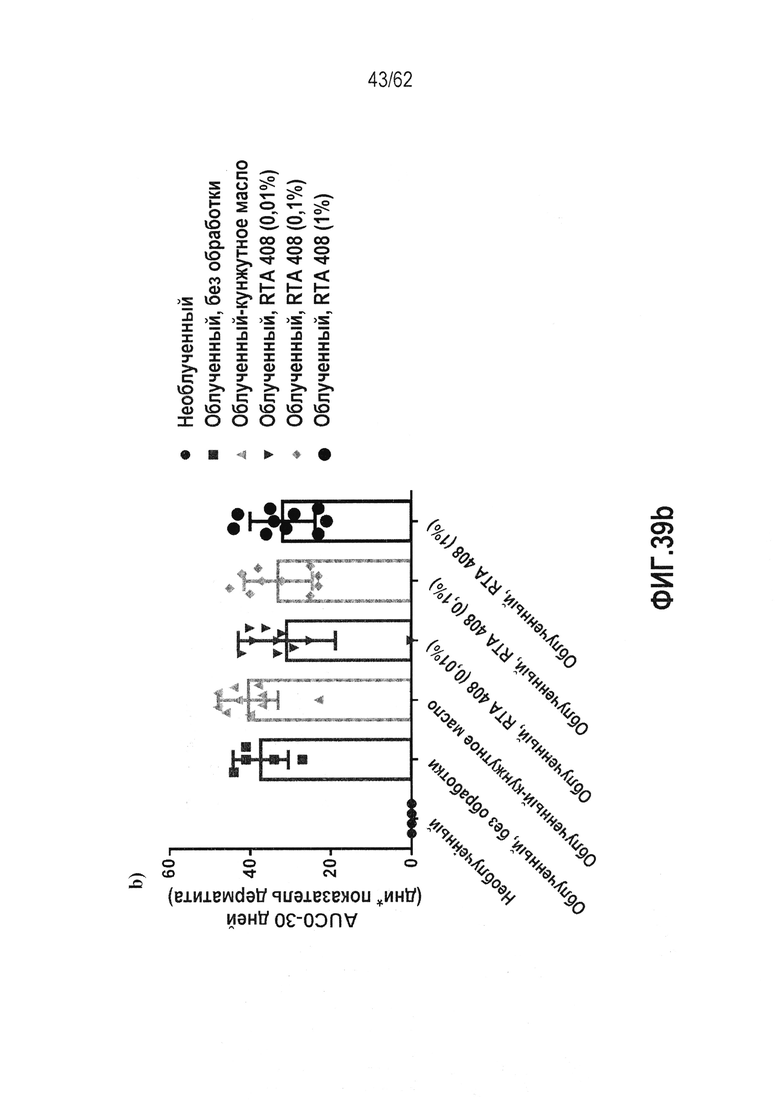
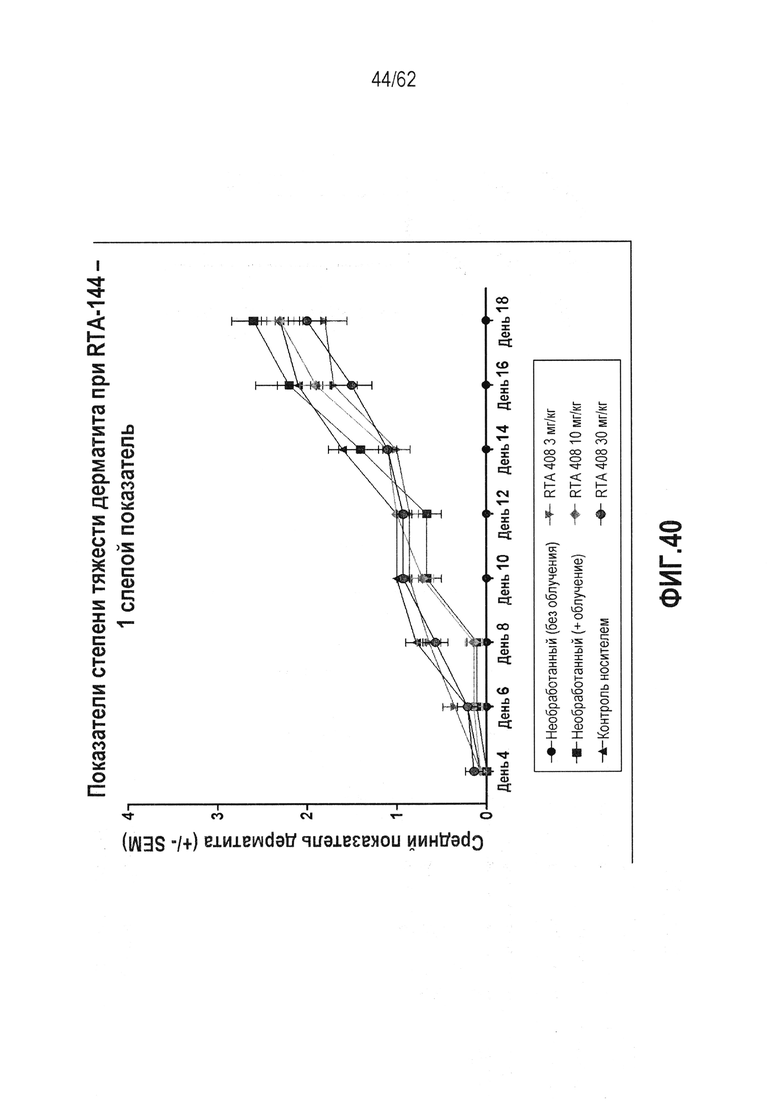
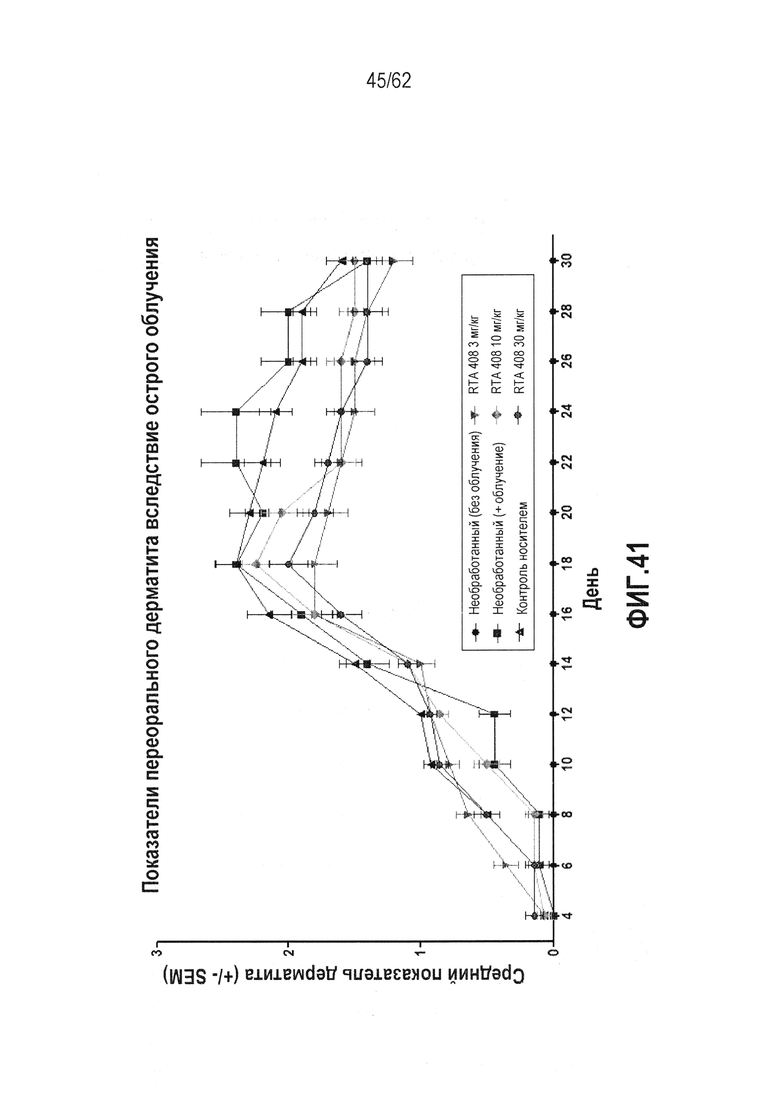
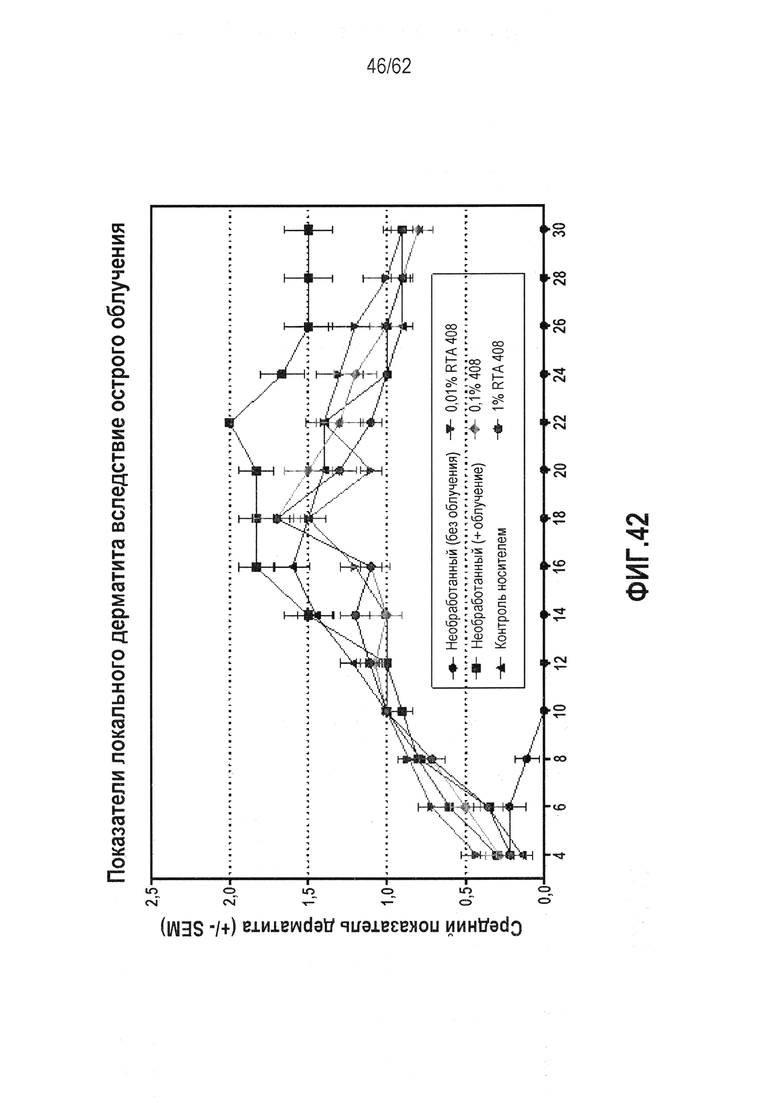
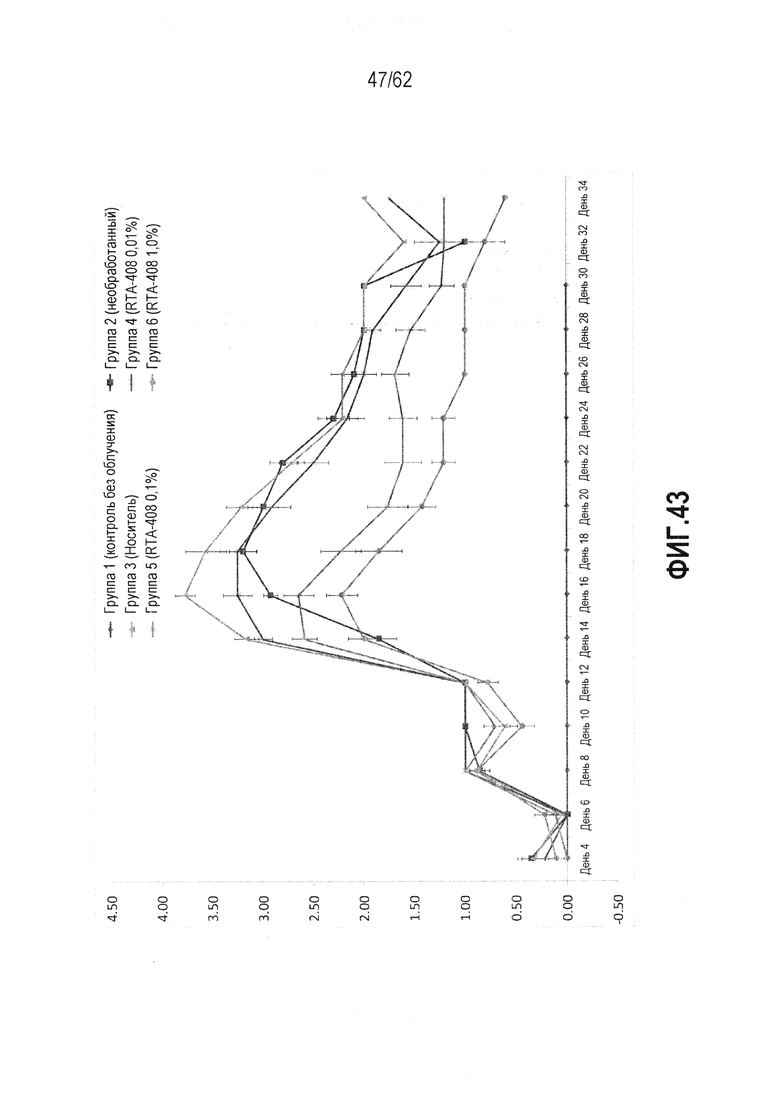
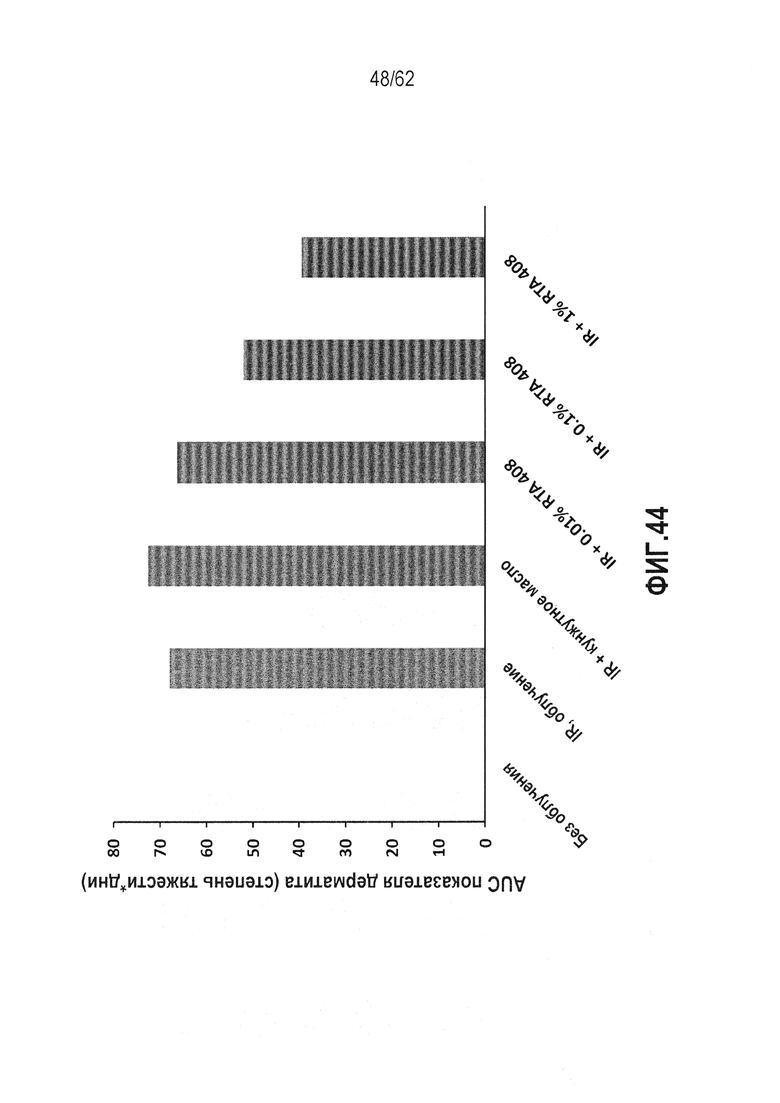
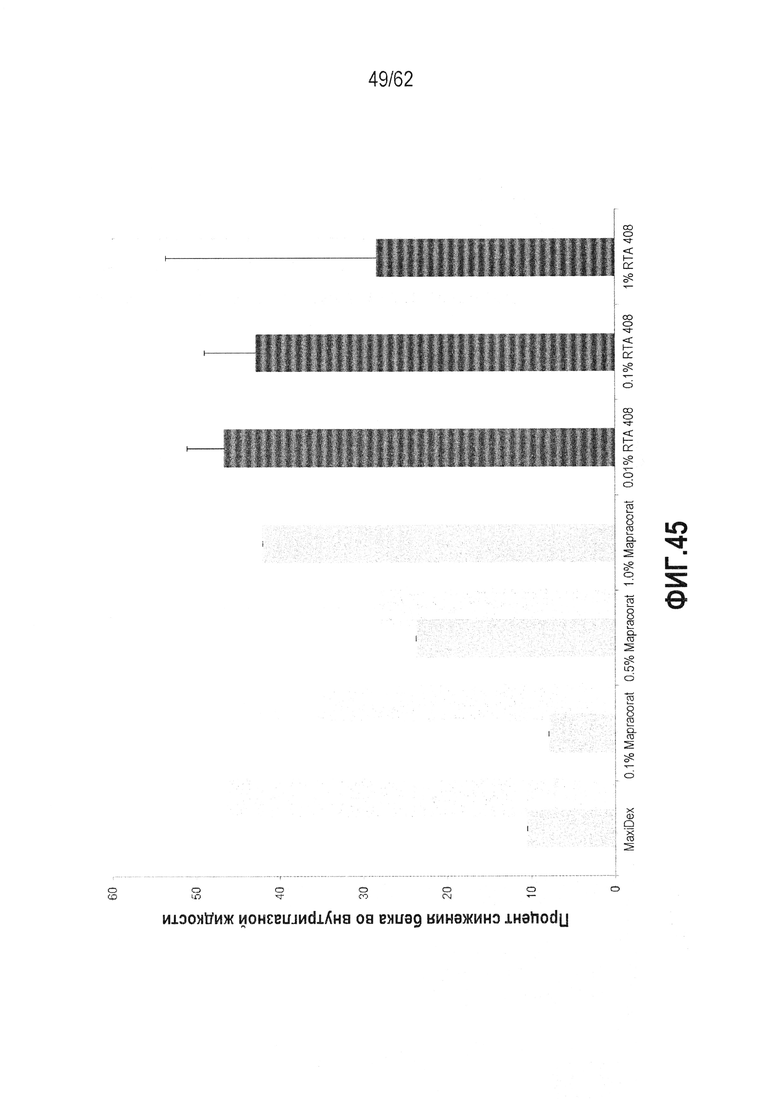
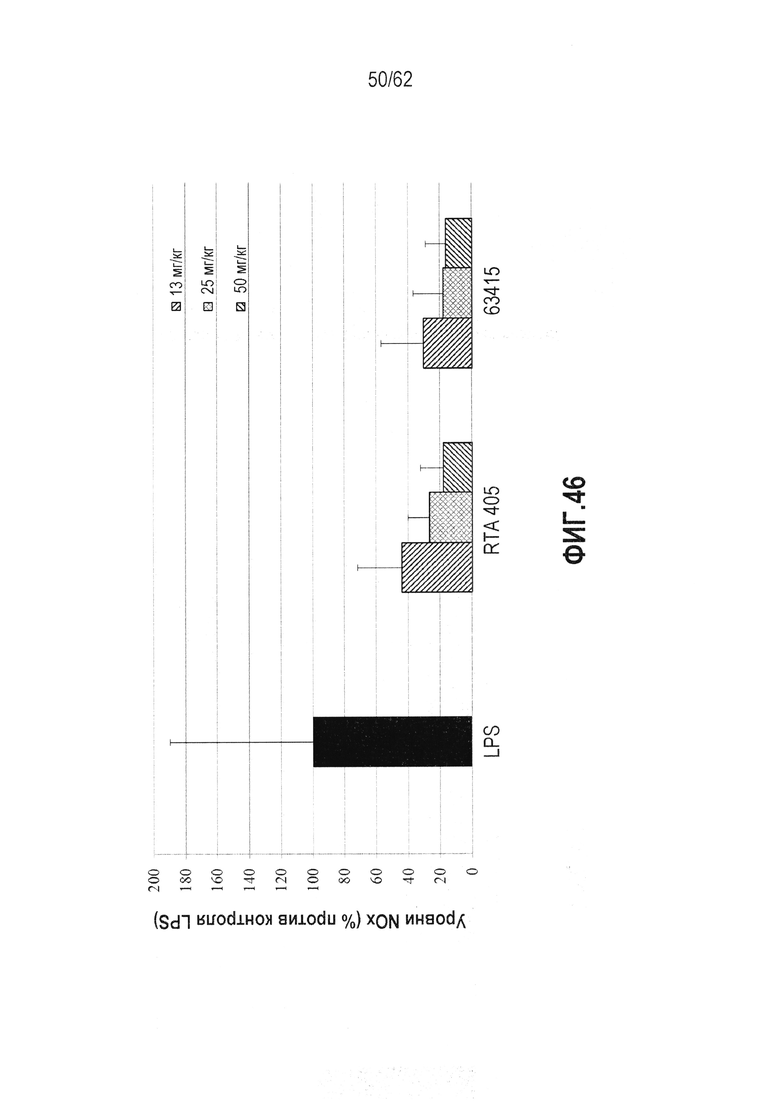
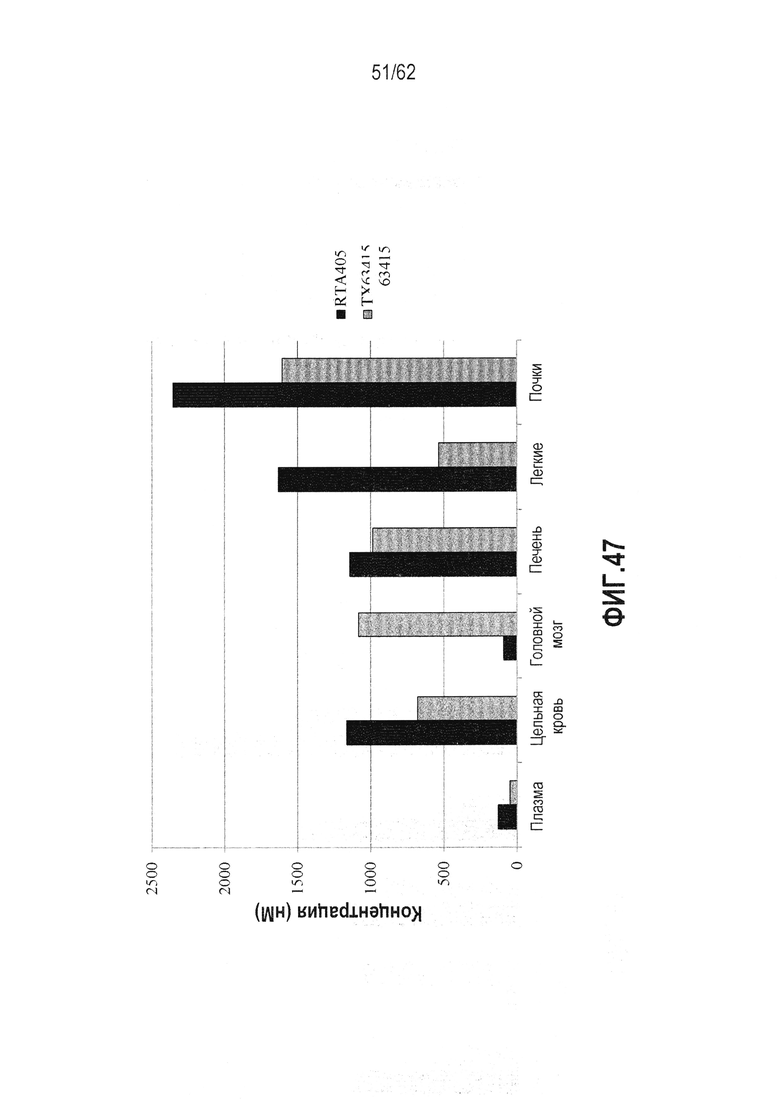
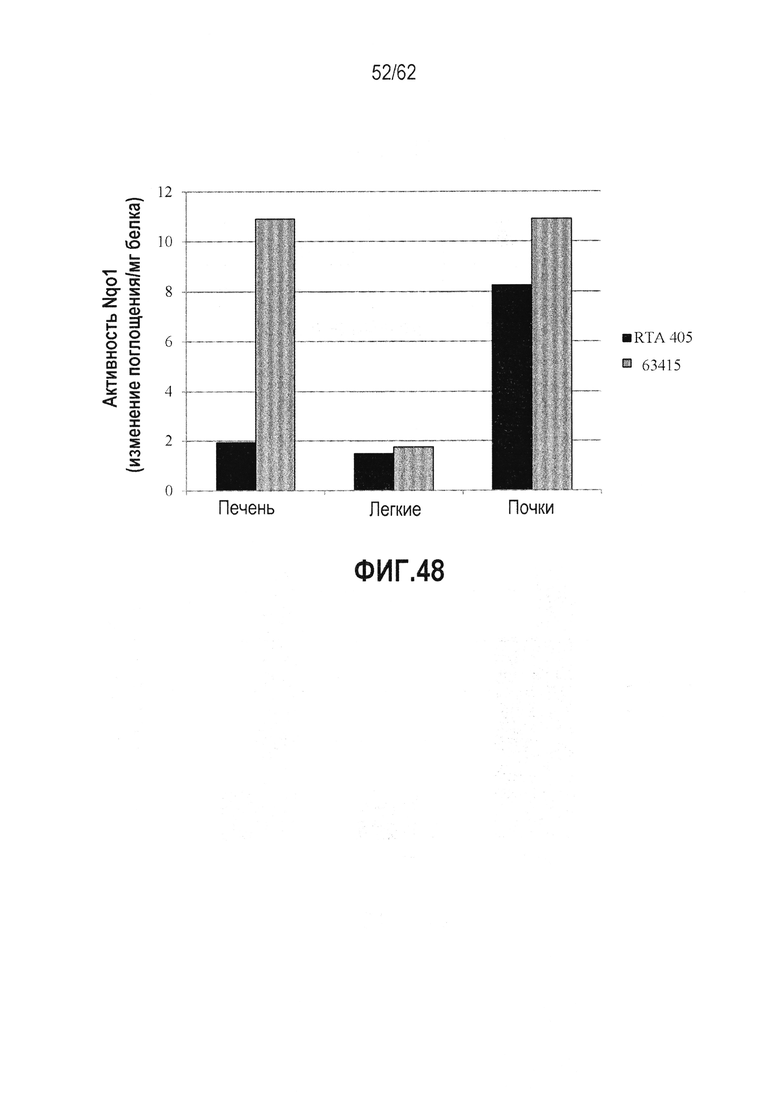
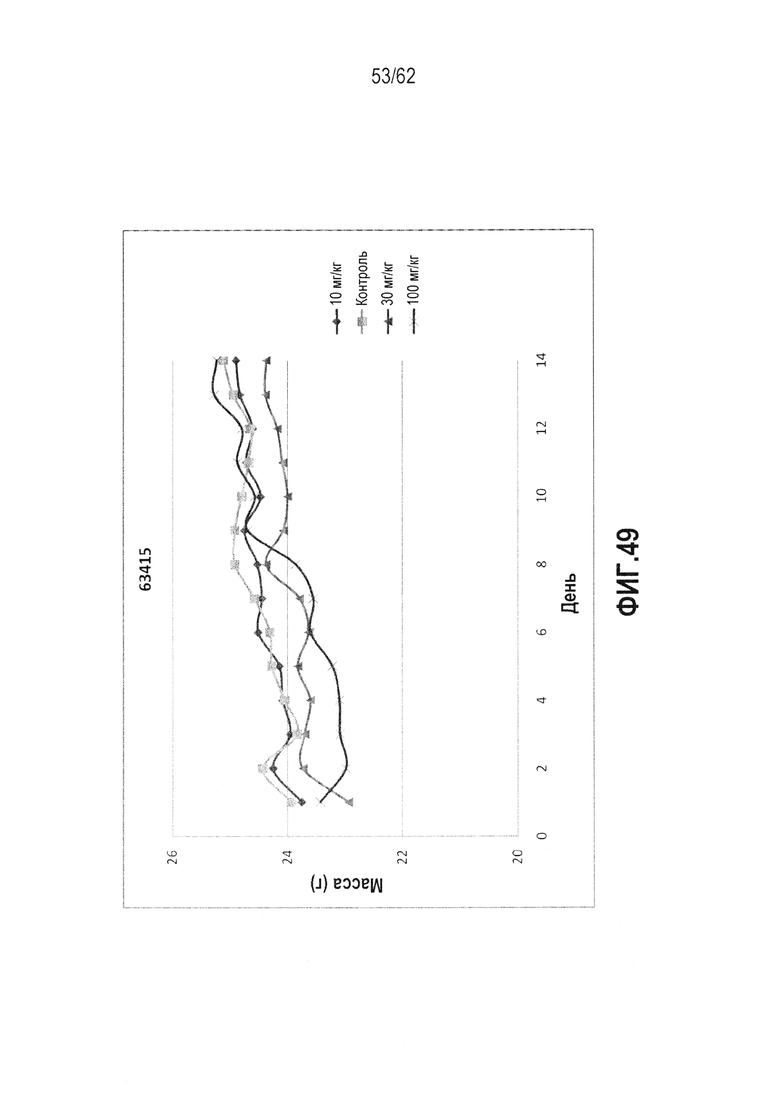
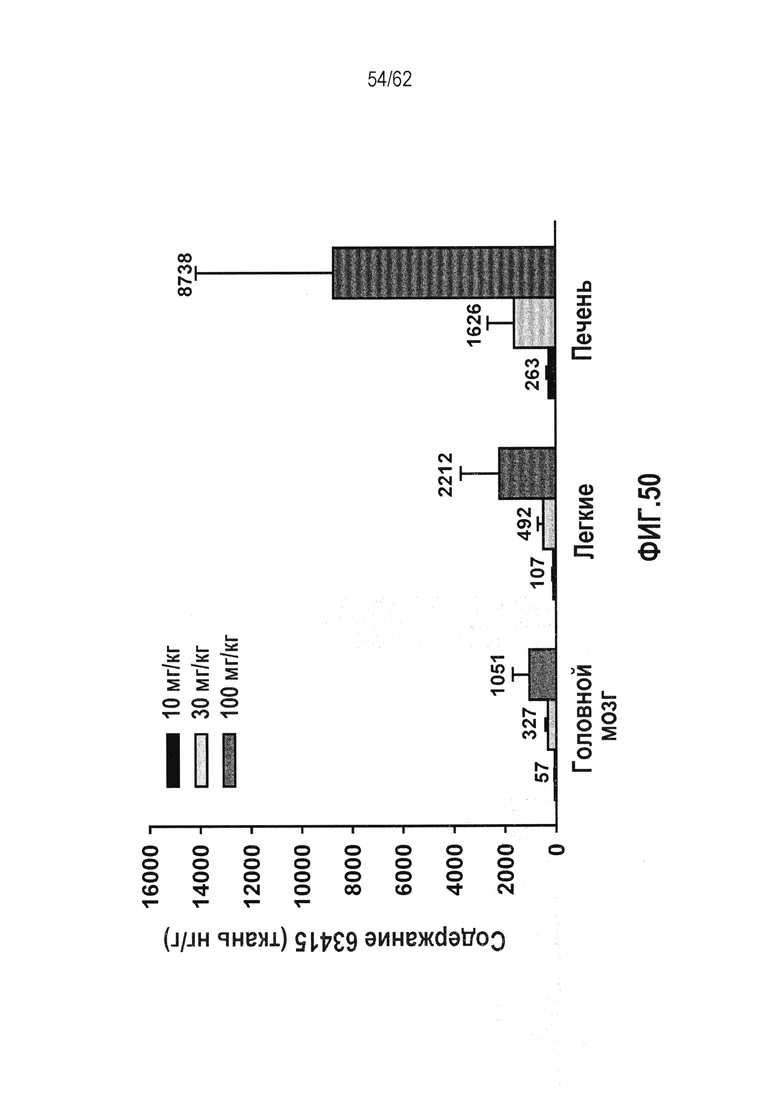
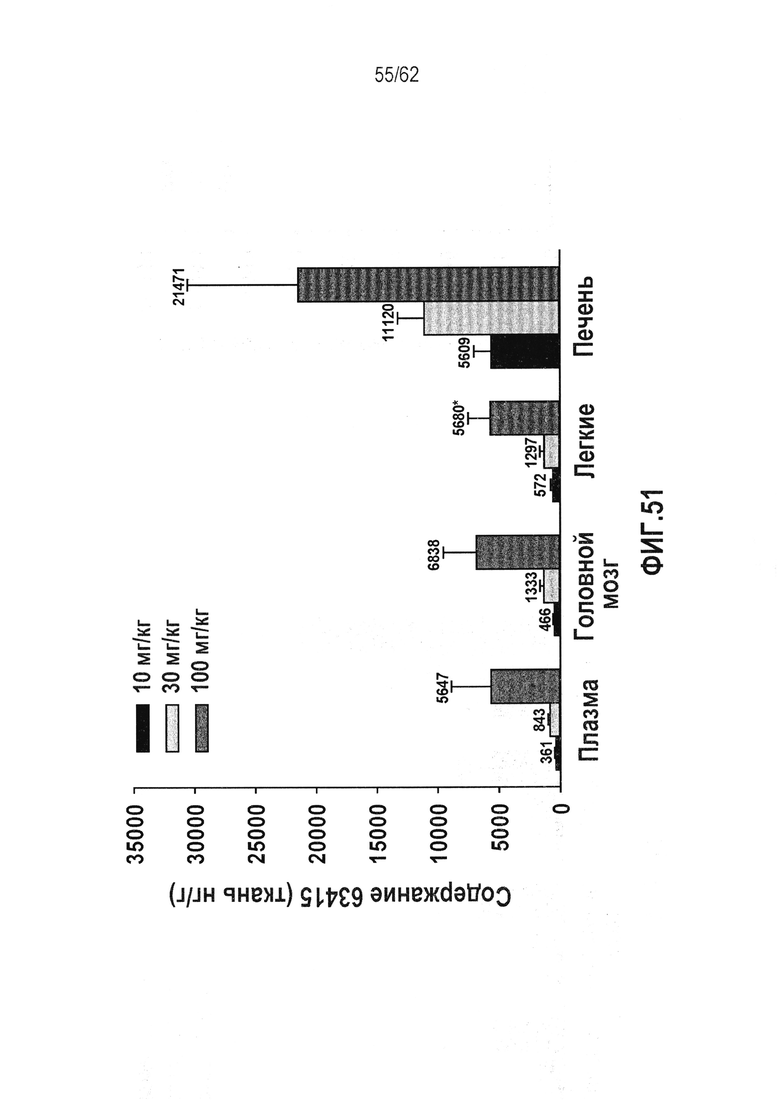
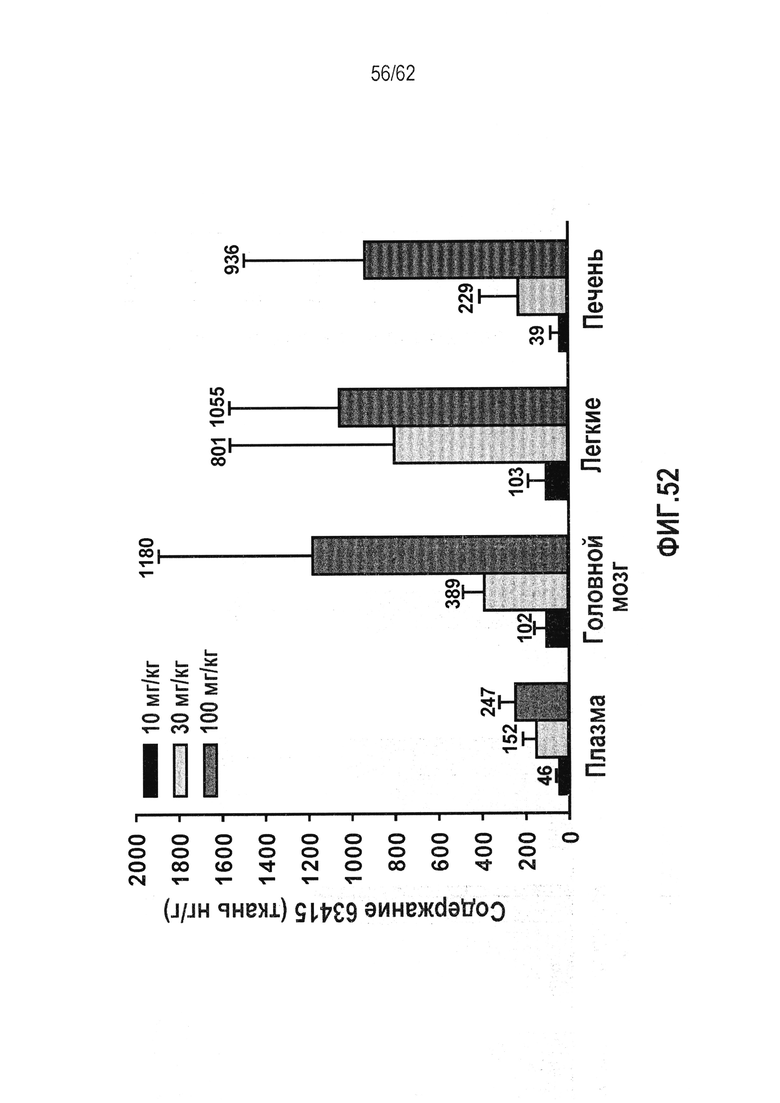
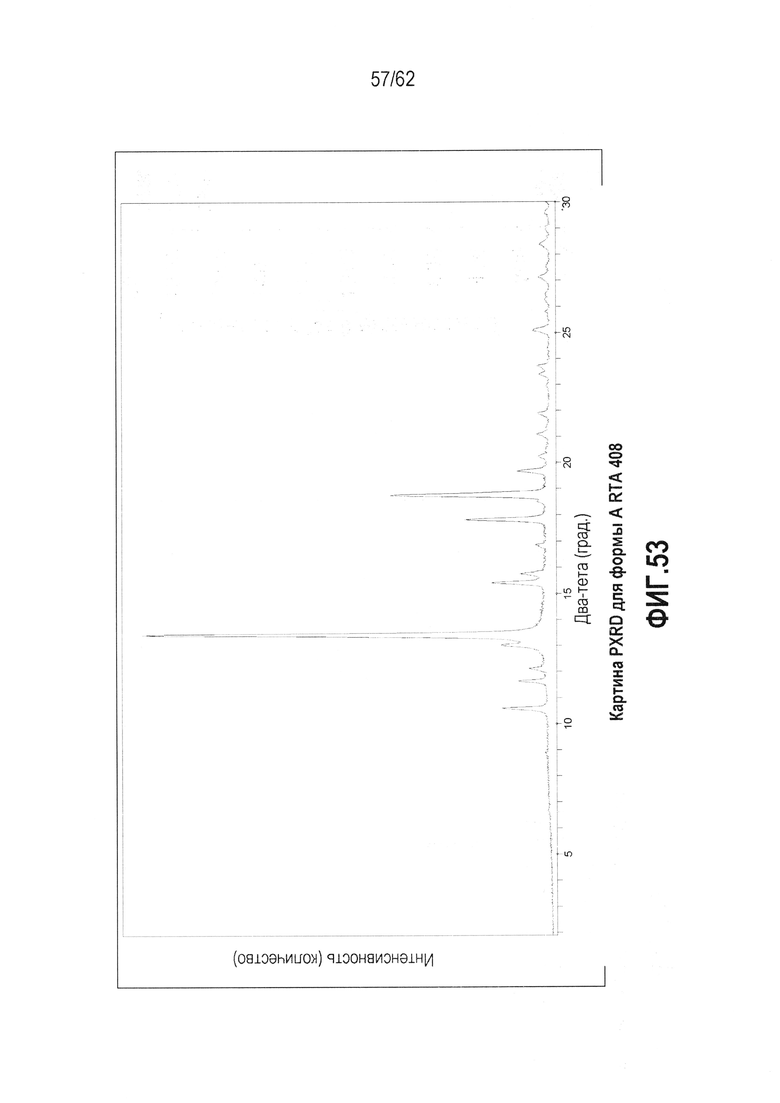
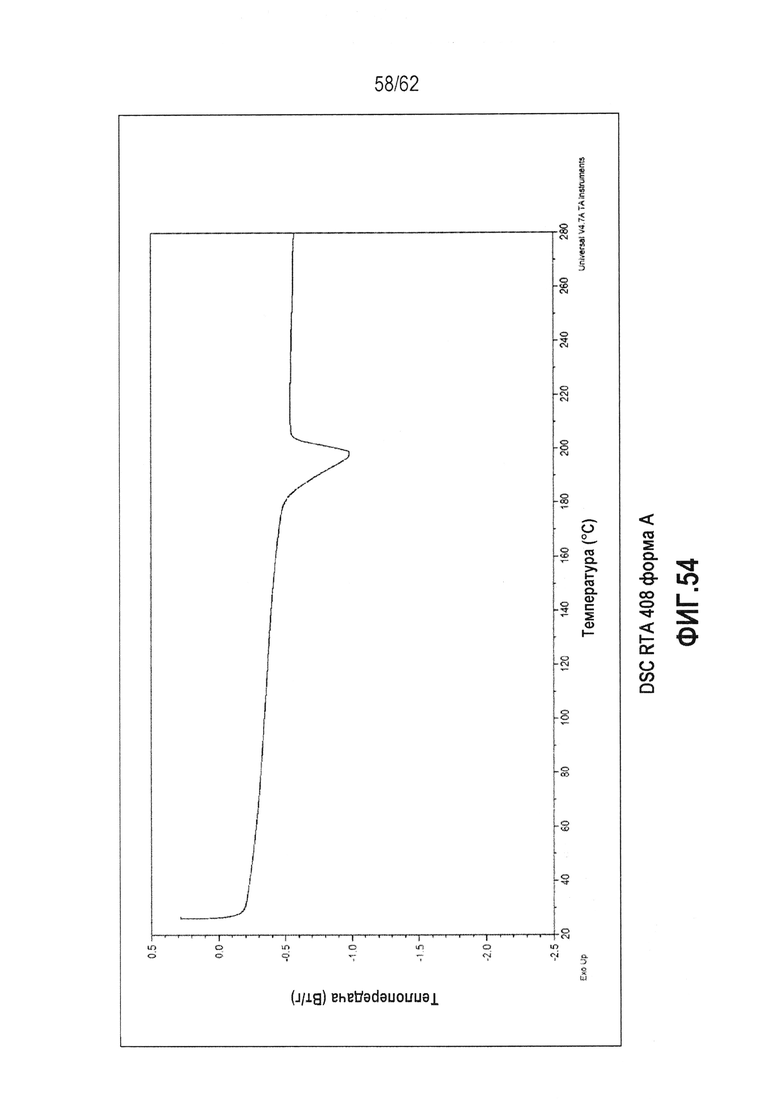
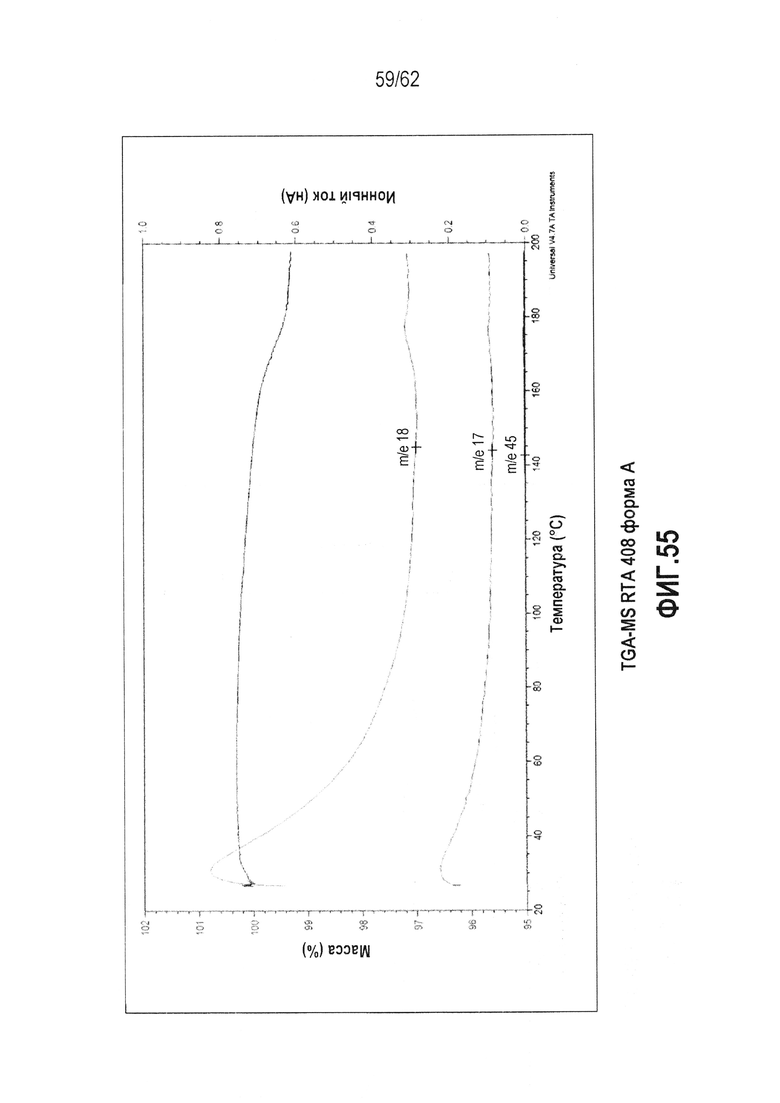

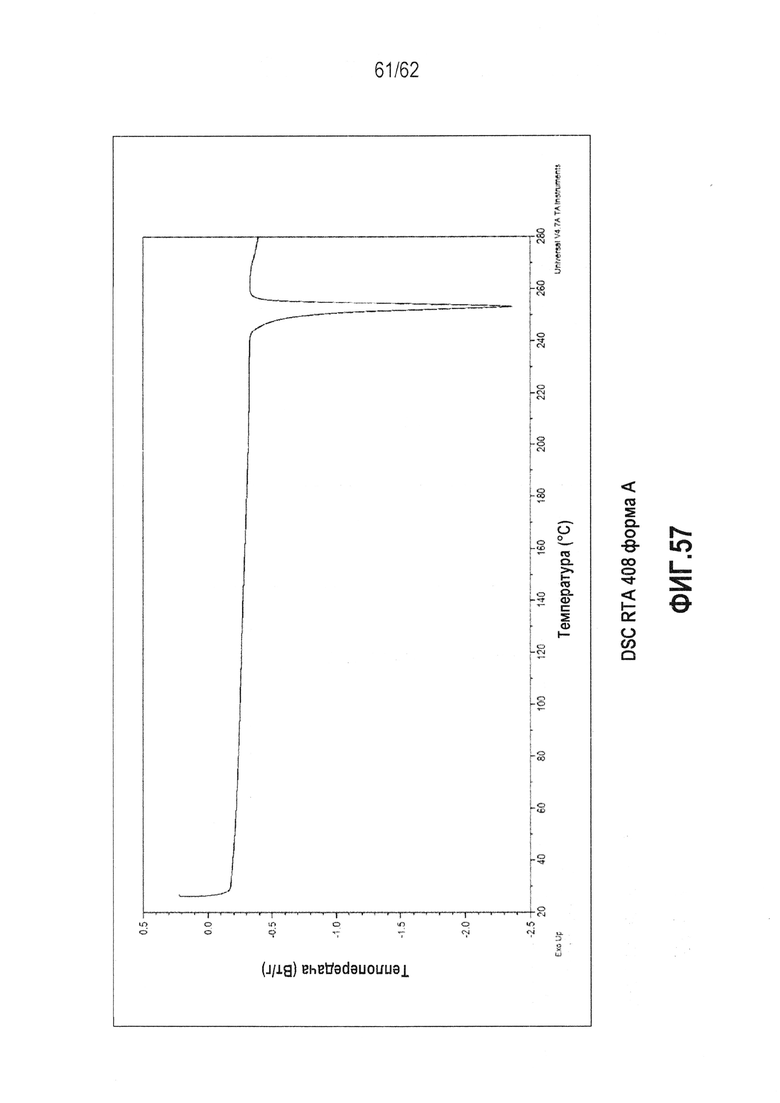
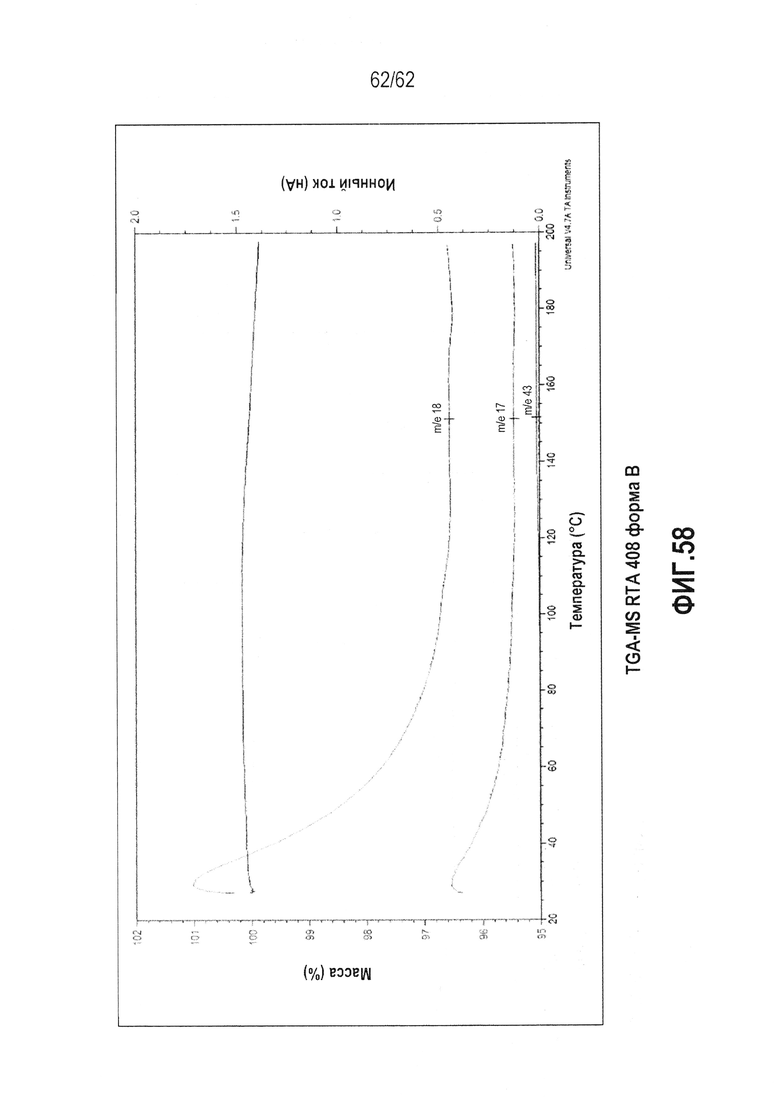
Изобретение относится к полиморфной форме соединения N-((4aS,6aR,6bS,8aR,12aS,14aR,14bS)-11-циано-2,2,6a,6b,9,9,12a-гептаметил-10,14-диоксо-1,2,3,4,4a,5,6,6a,6b,7,8,8a,9,10,12a,14,14a,14b-октадекагидропицен-4a-ил)-2,2-дифторпропанамида, имеющего формулу, указанную ниже, при этом полиморфная форма является кристаллической, имеющей картину порошковой рентгеновской дифракции (CuKα), содержащую пики при 10,601, 11,638, 12,121, 13,021, 13,435, 15,418, 15,760, 17,830, 18,753 и 19,671 ±0,2°2θ. Изобретение также относится к ещё одной полиморфной форме указанного соединения. Технический результат: получены новые формы соединения N-((4aS,6aR,6bS,8aR,12aS,14aR,14bS)-11-циано-2,2,6a,6b,9,9,12a-гептаметил-10,14-диоксо-1,2,3,4,4a,5,6,6a,6b,7,8,8a,9,10,12a,14,14a,14b-октадекагидропицен-4a-ил)-2,2-дифторпропанамида, которое может применяться в лечении или профилактике патологического состояния, ассоциированного с воспалением или окислительным стрессом. 2 н. и 6 з.п. ф-лы, 58 ил., 17 табл., 4 пр.
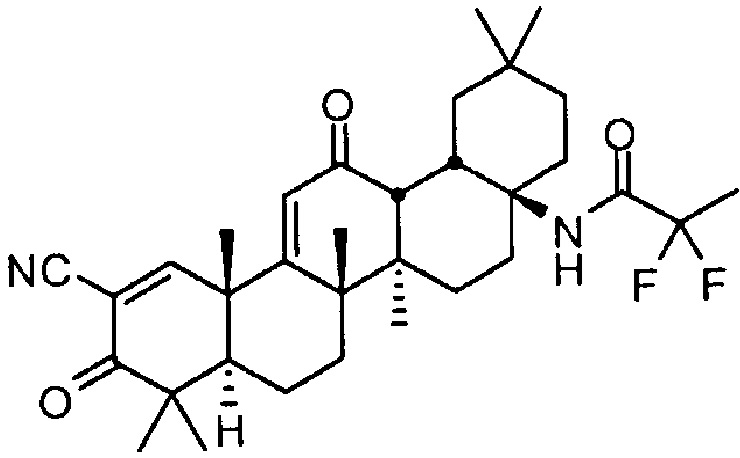
1. Полиморфная форма соединения, имеющего формулу:
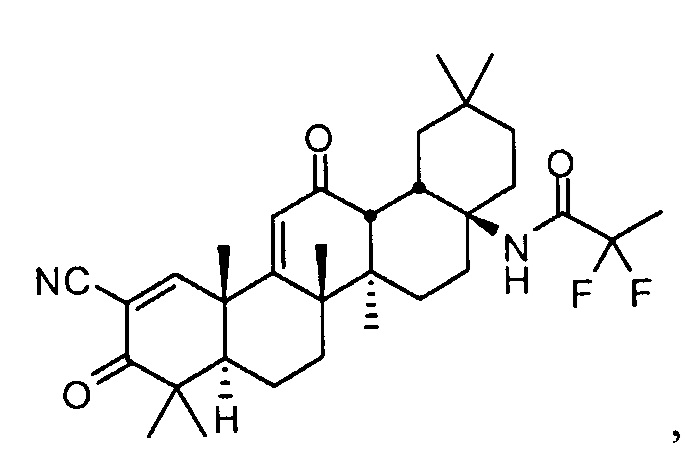
при этом полиморфная форма является кристаллической, имеющей картину порошковой рентгеновской дифракции (CuKα), содержащую пики при 10,601, 11,638, 12,121, 13,021, 13,435, 15,418, 15,760, 17,830, 18,753 и 19,671 ±0,2°2θ.
2. Полиморфная форма по п.1, в которой картина порошковой рентгеновской дифракции (CuKα) по существу такая, как показано на ФИГ.53.
3. Полиморфная форма по п.1, в которой точка плавления составляет приблизительно 181,98°C.
4. Полиморфная форма по п.1, имеющая кривую дифференциальной сканирующей калориметрии (DSC) по существу, как показано на ФИГ.54.
5. Полиморфная форма соединения, имеющего формулу:
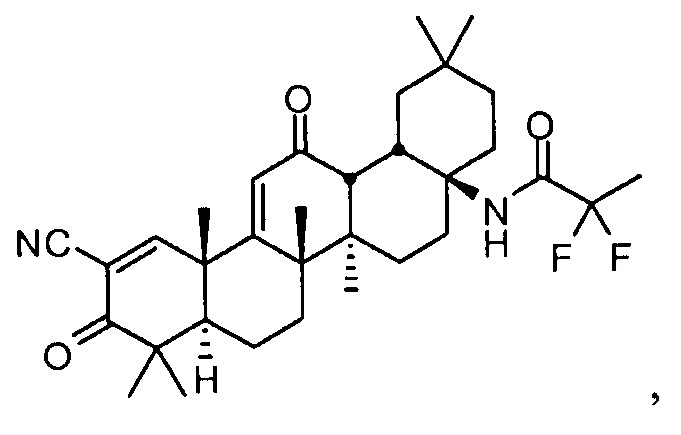
при этом полиморфная форма является кристаллической, имеющей картину порошковой рентгеновской дифракции (CuKα), содержащую пики при 7,552, 10,339, 11,159, 12,107, 14,729, 15,329, 15,857, 16,824, 17,994, 18,344, 19,444, 19,764, 20,801 и 22,414 ±0,2°2θ.
6. Полиморфная форма по п.5, в которой картина порошковой рентгеновской дифракции (CuKα) по существу такая, как показано на ФИГ.56.
7. Полиморфная форма по п.5, в которой точка плавления составляет приблизительно 250,10°C.
8. Полиморфная форма по п.5, имеющая кривую дифференциальной сканирующей калориметрии (DSC) по существу, как показано на ФИГ.57.
| EA 201491972 A1, 27.02.2015 | |||
| EA 201001555 A1, 30.06.2011 | |||
| WO 2012125488 A1, 20.09.2012. |
Авторы
Даты
2019-07-05—Публикация
2014-04-24—Подача