Настоящее изобретение относится к новым иммуногенным полипептидам и их применению в вакцинных композициях. Изобретение также относится к нуклеиновым кислотам, векторам и клеткам, экспрессирующим полипептиды, и их применению. Более конкретно, полипептиды по изобретению содержат иммуногенный домен и домен адресации к мембранам клеток, полученный из гена B5R. В частности, изобретение применимо для получения вакцин для животных, в частности, для вакцинации свиней против инфекции PCV2.
Уровень техники
Цирковирус свиней (PCV) исходно идентифицировали как контаминанта культур клеток почки свиньи (PK15 ATCC CCL-33). Вирион PCV характеризуют как икосаэдрический, безоболочечный вирус с одноцепочечной кольцевой ДНК размером приблизительно 1,76 т.п.н. PCV классифицируют как принадлежащий роду Circovirus семейства Circoviridae, состоящего из других цирковирусов животных, таких как вирус заболевания клюва и перьев попугаев, цирковирус гусей, цирковирус канареек и цирковирус голубей. Определено два генотипа PCV. PCV, полученный из клеток PK15, считают непатогенным для свиней и обозначают как PCV типа 1 (PCV1). С другой стороны, PCV типа 2 (PCV2) считается основным возбудителем инфекции, участвующим в нескольких заболеваниях свиней. PCV2-ассоциированные заболевания вызывают значительные экономические потери среди свиноводов по всему миру. PCV2-ассоциированные заболевания описаны в WO2007/076520, и они включают, например, мультисистемный синдром истощения после отъема (PMWS), синдром дерматита и нефропатии поросят (PDNS), комплекс респираторных заболеваний свиней (PRDC), репродуктивные нарушения, гранулематозный энтерит, экссудативный эпидермодермит, некротизирующий лимфаденит и эссенциальный тремор. О случаях PCV2 подтипа A (PCV2A) и PCV2 подтипа B (PCV2B) сообщали, в частности, в Восточной Европе в 2000 году и в Центральной Европе в 2003 году. В последнее время аналогичные изменения зарегистрированы в 2008 году у диких кабанов.
Недавно разработанные вакцины против PCV2, такие как Circovac® (Merial), Ingelvac®, CircoFLEX (Boehringer lngelheim Vetmedica) или Suvaxyn®, являются инактивированными вакцинами против PCV2 или субъединичными вакцинами. Что касается инактивированных вакцин PCV2, существующие в настоящее время штаммы PCV2 подтипа A или B имеют несколько недостатков. В частности, вирусы PCV2 могут продуцироваться с низкими титрами, как правило, менее чем 105 TCID50 вирусных частиц на мл. Кроме того, эти вирусы нельзя поддерживать в культурах ткани и перманентно инфицированных клеточных линиях. Что касается субъединичных вакцин против PCV2, как правило, в них используют очищенный, рекомбинантный белок капсида PCV2, получаемый с помощью экспрессии гена ORF2 PCV2 в бакуловирусной системе. В связи с этим, о белке, кодируемом ORF2 изолятов Imp1011 PCV2, сообщают в EP 1741785. О белке, кодируемом ORF2 изолята PCV2 PCV2Rm, сообщают в WO2010/061000. О белке, кодируемом ORF2 изолята PCV2 412, сообщают в EP1816200. О другом белке, кодируемом ORF2 еще одного изолята PCV2, сообщают в EP 1036180 или EP2225367.
Однако эффективность экспрессии и иммуногенность эти природных белков капсида является неоптимальной и не всегда обеспечивает необходимый уровень иммунитета у вакцинированных животных. В частности, белок ORF2 содержит последовательность ядерной локализации, приводящую к экспрессии белка в ядре клеток. Такая внутриклеточная локализация не облегчает экстракцию или очистку белка и также может предотвращать или снижать эффективность ДНК- или векторных вакцин, экспрессирующих белок ORF2 in vivo у животных.
В WO2010/068969 предлагается модификация профиля экспрессии ORF2 для экспрессии антигена ORF2 в растворимой форме с использованием чужеродных последовательностей секреторного сигнального пептида. В этой заявке предлагается слияние ORF2 с секреторной сигнальной последовательностью или сигнальной последовательностью локализации в клеточной мембране и включение в конструкцию участка расщепления таким образом, что растворимый ORF2 может высвобождаться в растворимой форме. В этой заявке предлагается длинный прогностический список потенциальных секреторных пептидов-кандидатов. Однако эта заявка не содержит каких-либо экспериментальных данных, демонстрирующих, что можно достигать эффективной или улучшенной экспрессии/иммуногенности посредством модификации профиля экспрессии ORF2. Не описаны конструкции, делающие возможной эффективную иммунизацию.
В настоящем изобретении предлагаются новые улучшенные конструкции для экспрессии антигенных полипептидов. Настоящее изобретение относится к слитым продуктам, конкретно адаптированным для улучшенной экспрессии антигенных полипептидов на поверхности клетки, в частности, с использованием вирусного экспрессирующего вектора, такого как вирус оспы свиней.
Изобретение демонстрирует, что с помощью экспрессии антигенного полипептида на поверхности инфицированных/трансдуцированных клеток с использованием сигнала адресации, полученного из B5R, достигают улучшенного иммунного ответа, приводящего к эффективной защите. С помощью презентации антигена на поверхности клетки in vivo у животного вакцины по изобретению наиболее эффективно доставляют и подвергают антиген воздействию иммунной системы, конкретно, клеток иммунной системы, таких как лимфоциты, дендритные клетки и макрофаги. С помощью презентации антигена на поверхности клетки изобретение обеспечивает нахождение иммуногена в активной конформации для индуцирования мощного протективного иммунного ответа. Изобретение можно использовать по отношению к любому антигенному полипептиду, в частности, вирусным антигенам.
Сущность изобретения
Настоящая заявка относится к полипептиду, содержащему сигнальный пептид, полученный из гена B5R вируса Vaccinia, функционально связанный с гетерологичным антигенным полипептидом.
В конкретном варианте осуществления сигнальный пептид содержит SEQ ID NO: 1 или последовательность, имеющую по меньшей мере 90% идентичности по отношению к SEQ ID NO: 1. Антигенный полипептид может являться вирусным, бактериальным или паразитарным антигеном. Предпочтительно, он является вирусным антигеном, более конкретно - белком капсида или его иммуногенным доменом.
В конкретном варианте осуществления антигенный полипептид является ORF2 вируса PCV2 или его антигенным доменом. В предпочтительном варианте осуществления используют антигенный полипептид, содержащий последовательность SEQ ID NO: 3 или последовательность, имеющую по меньшей мере 80% идентичности по отношению к SEQ ID NO: 3.
Полипептид по изобретению может являться синтетическим или рекомбинантным и может содержать посттранскрипционные модификации, такие как гликозилирование, добавленные химические группы и т.д. Наиболее предпочтительно, полипептид по изобретению не содержит участок расщепления между пептидом адресации и антигенным пептидом.
Другим объектом изобретения является клетка, экспрессирующая на своей поверхности полипептид, как определено выше.
Дополнительный объект изобретения относится к нуклеиновой кислоте, кодирующей полипептид, как определено выше.
Другим объектом изобретения является вектор, содержащий нуклеиновую кислоту по изобретению. Предпочтительно, вектор является вирусным вектором, таким как, наиболее предпочтительно, вирус болезни Ауески (PRV) или вирус оспы свиней (SPV). Использование вируса оспы свиней является особенно предпочтительным, т.к. сигнальный пептид B5R, полученный из вируса Vaccinia, имеет улучшенную совместимость с вирусом оспы свиней.
Дополнительный объект изобретения относится к композиции, содержащей полипептид, клетку, нуклеиновую кислоту или вектор, как определено выше.
Дополнительным объектом изобретения является вакцина, содержащая полипептид, клетку, нуклеиновую кислоту или вектор, как определено выше, и, необязательно, адъювант.
Настоящее изобретение также относится к способам иммунизации или индуцирования иммунного ответа у животных (например, свиней), включающим введение указанному животному полипептида, нуклеиновой кислоты, клетки, вектора или вакцины, как описано выше.
Настоящее изобретение также относится к способам лечения и/или профилактики PCV2-ассоциированных заболеваний у животных (например, свиней), включающим введение указанному животному полипептида, нуклеиновой кислоты, клетки, вектора или вакцины, как описано выше.
Изобретение также относится к применению сигнального пептида, полученного из гена B5R вируса Vaccinia, для экспрессии гетерологичного антигенного полипептида в клетке.
Изобретение можно применять для индуцирования иммунного ответа и/или вакцинации любого животного. Оно особенно применимо для вакцинации свиней против инфекции PCV2 или PCV2-ассоциированных заболеваний.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
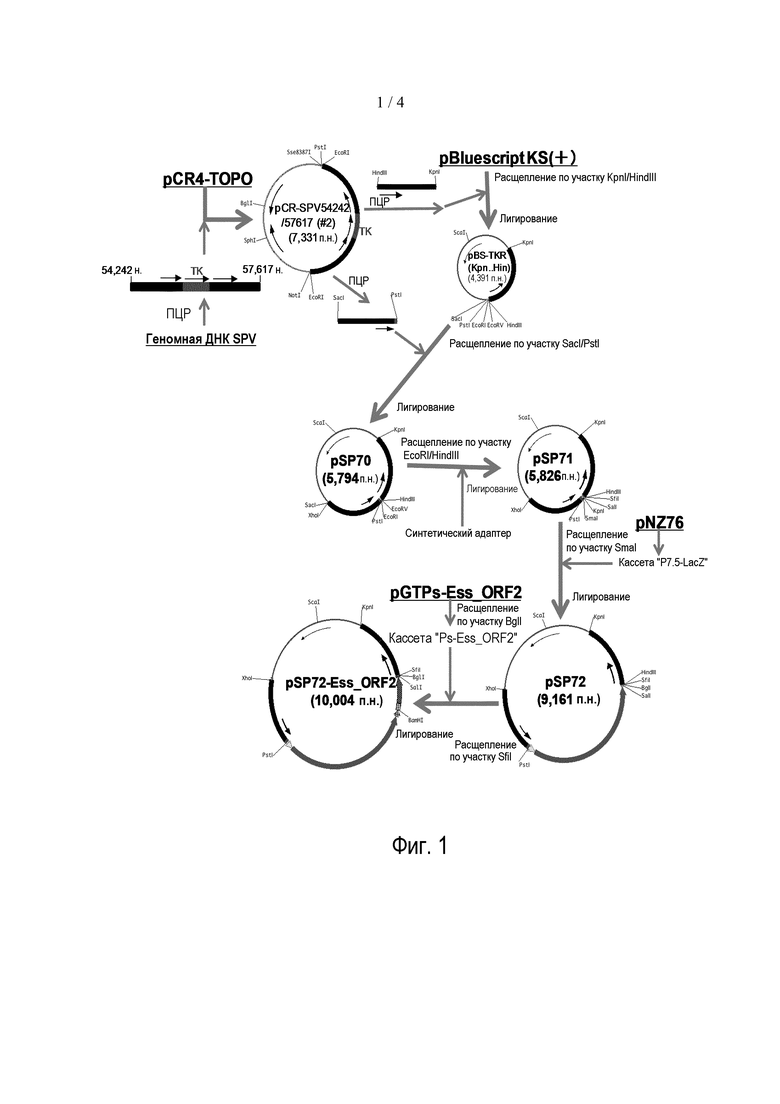
Фигура 1: Схема конструкции гомологичной плазмиды pSP72-Ess_ORF2.
Фигура 2: Анализ способом "черных бляшек" rSPV (SVR3, SVR7) с использованием моноклонального антитела 36F1. Клетки ESK-4 инфицировали родительским или рекомбинантными SPV (SVR3 или SVR7). Через шесть дней клетки подвергали анализу способом "черных бляшек" с использованием моноклонального антитела 36F1 (1:500), конъюгированного с биотином антитела кролика против IgG мыши, и ABC-ALP (Vecterstain).
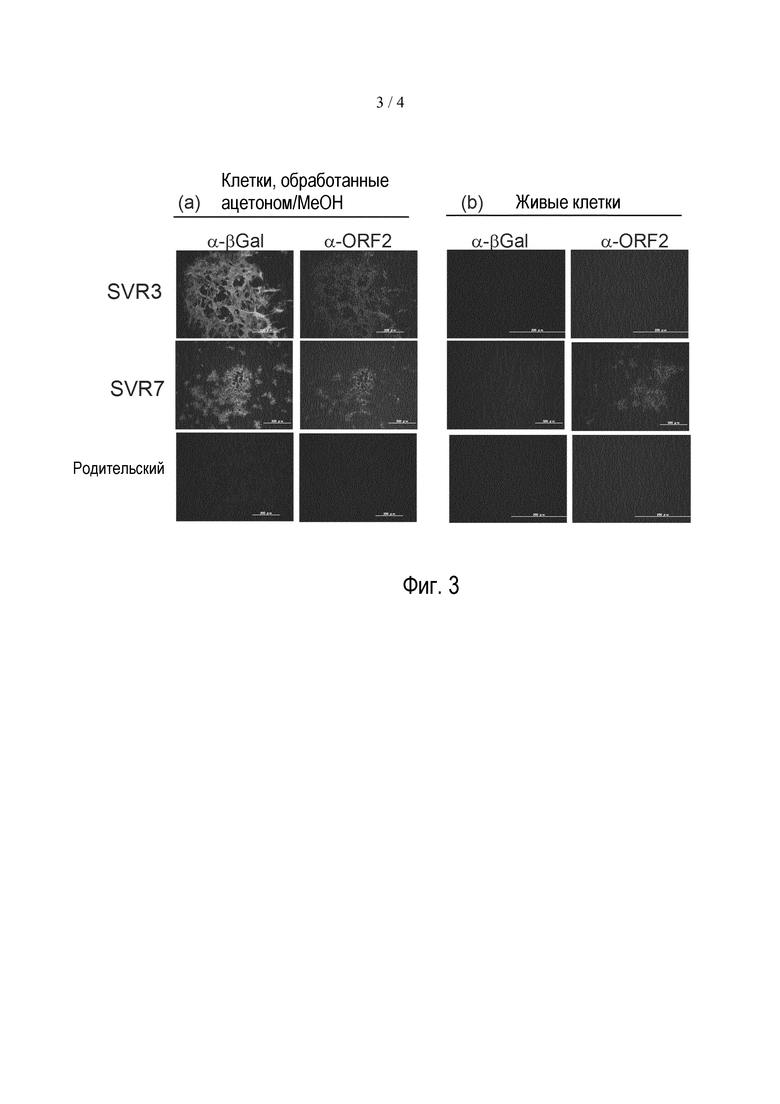
Фигура 3: IFA SPV-инфицированных клеток. Клетки ESK-4 инфицировали rSPV (SVR3 или SVR7) или родительским SPV. Через пять дней инфицированные клетки обрабатывали ацетоном/метанолом (a) или не обрабатывали (b), и проводили реакцию с 1-ми антителами [антителом кролика против β-галактозидазы (α-βGal) и антителом крысы против PCV2-ORF2 (α-ORF2) (1: 1000)] и 2-ми антителами [антителом козы против IgG кролика с Alexa Fluor 488 и против IgG крысы с Alexa Fluor 546 (1:1000)].
Фигура 4: серологические титры IF против PCV2. Rm40-инфицированными клетками RPL-2 покрывали каждую лунку 96-луночных планшетов. Клетки фиксировали ацетоном/метанолом, и двукратные разведения сывороток инкубировали в течение 1 часа после блокирования (0,5% обезжиренного молока в PBS). Антитело против IgG свиньи-FITC, продуцируемое кроликом (SIGMA кат. №:F1638, 1:1000), использовали в качестве вторичного антитела. Титр IF стандартной положительной сыворотки свиньи PAB-PCV2 (VMRD) составлял 2560.
Подробное описание изобретения
Настоящее изобретение относится к новым иммуногенным полипептидам и их применению, в частности, в вакцинных композициях. Изобретение также относится к нуклеиновым кислотам, векторам и клеткам, экспрессирующим полипептиды, и их применению. Более конкретно, полипептиды по изобретению содержат иммуногенный домен и домен адресации к мембране клеток, являющиеся функционально связанными, где домен адресации к мембране клеток получают из гена B5R. В частности, изобретение применимо для получения вакцин для не относящихся к человеку животных, в частности, для вакцинации свиней против инфекции PCV2.
Пептид адресации к мембране клеток, полученный из B5R
Термин "полученный из" означает, что последовательность пептида адресации идентична или, по существу, схожа с последовательностью сигнального пептида гена B5R вируса Vaccinia. В предпочтительном варианте осуществления пептид адресации содержит последовательность, имеющую по меньшей мере 90% идентичности по отношению к последовательности сигнального пептида гена B5R вируса Vaccinia, даже более предпочтительно - по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичности последовательности.
Наиболее предпочтительным примером последовательности сигнального пептида гена B5R является SEQ ID NO: 1 или последовательность, имеющая по меньшей мере 90% идентичности по отношению к SEQ ID NO: 1, более предпочтительно - по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичности по отношению к SEQ ID NO: 1. Таким образом, в конкретном варианте осуществления полипептид по изобретению содержит последовательность сигнального пептида, содержащую SEQ ID NO: 1 или последовательность, имеющую по меньшей мере 90% идентичности по отношению к SEQ ID NO: 1.
Сигнальный пептид может содержать дополнительные аминокислоты, полученные из гена B5R, при условии, что эти аминокислоты не изменяют мембрано-адресующие свойства пептида. В связи с этим, в конкретном варианте осуществления сигнальный пептид содержит SEQ ID NO: 2. Аминокислоты 23-36 SEQ ID NO: 2, по существу, не участвуют в мембрано-адресующей функции. Однако представленные результаты свидетельствуют о том, что эти аминокислоты облегчают стабилизацию и правильную конформацию слитого полипептида.
Альтернативно или дополнительно, сигнальный пептид может содержать дополнительные аминокислоты, полученные не из гена B5R, при условии, что эти аминокислоты не изменяют мембрано-адресующие свойства пептида. Эти аминокислоты могут быть применимы в клонировании (например, участки рестрикции) или могут участвовать в стабилизации полипептида.
Предпочтительно, сигнальный пептид содержит не более 100 аминокислот, даже более предпочтительно - не более 50 аминокислот.
Как указано выше, изобретение включает сигнальные пептиды, содержащие последовательность, имеющую по меньшей мере 90% идентичности по отношению к SEQ ID NO: 1 или 2. Степень гомологии между двумя аминокислотными последовательностями или последовательностями нуклеиновой кислоты можно определять с помощью компьютерных программ, по существу, известных в этой области, таких как GAP, представленная в пакете программ GCG (Program Manual for the Wisconsin Package, Version 8, August 1996, Genetics Computer Group, 575 Science Drive, Madison, Wisconsin, USA 5371 1) (Needleman, S. B. and Wunsch, CD., (1970), Journal of Molecular Biology, 48, 443-453). Использовали GAP со следующими параметрами для сравнения последовательностей ДНК: штраф за открытие пропуска 5,0 и штраф за удлинение пропуска 0,3. Молекулы нуклеиновой кислоты/аминокислот можно выравнивать друг с другом с использованием программного обеспечения для выравнивания Pileup, доступного как часть пакета программ GCG, с использованием, например, параметров по умолчанию со штрафом за открытие пропуска 5 и штрафом за удлинение пропуска 0,3.
Подходящие экспериментальные условия для определения того, гибридизуется ли указанная молекула нуклеиновой кислоты с конкретной нуклеиновой кислотой, могут включать предварительное вымачивание фильтра, содержащего соответствующий образец нуклеиновой кислоты, подлежащий анализу, в 5-кратном SSC в течение 10 минут, и предварительную гибридизацию фильтра в растворе 5-кратного SSC, 5-кратного раствора Денхардта, 0,5% SDS и 100 мкг/мл денатурированной обработанной ультразвуком ДНК спермы лосося, с последующей гибридизацией в том же растворе, содержащем концентрацию 10 нг/мл P-dCTP-меченого зонда, в течение 12 часов при приблизительно 45°C, в соответствии со способами гибридизации, как описано в Sambrook et al. (1989; Molecular Cloning, A Laboratory Manual, 2nd edition, Cold Spring Harbour, New York). Затем фильтр два раза промывают в течение 30 минут в 2-кратном SSC, 0,5% SDS при по меньшей мере 55°C (условия пониженной жесткости), по меньшей мере 60°C (условия средней жесткости), по меньшей мере 65°C (условия средней/высокой жесткости), по меньшей мере 70°C (условия высокой жесткости) или по меньшей мере 75°C (условия очень высокой жесткости). Гибридизацию можно определять посредством экспозиции фильтра на рентгеновской пленке.
В предпочтительном варианте осуществления сигнальный пептид содержит SEQ ID NO: 1 или 2.
В конкретном варианте осуществления сигнальный пептид состоит из SEQ ID NO: 1 или 2.
Антигенные полипептиды
Изобретение можно применять с любым антигенным полипептидом, т.е. с любым полипептидом, содержащим один или несколько эпитопов, которые могут вызывать иммунный ответ. Полипептид может являться целым белком, фрагментом белка или небольшим пептидом, например, из 10 аминокислот. Предпочтительно, антигенный полипептид содержит менее приблизительно 500 аминокислот.
Антигенный полипептид является "гетерологичным" в отношении сигнального пептида, что означает, что антигенный полипептид в природе не связан с сигнальным пептидом. Как правило, антигенный полипептид не является последовательностью белка B5R. Термин "гетерологичный" свидетельствует, например, о том, что антигенный полипептид является полипептидом из вируса, отличающегося от вируса Vaccinia, или из белка, отличающегося например, от белка B5R.
Антигенный полипептид может являться антигенным полипептидом вирусного, клеточного (например, бактериального) или паразитарного возбудителя.
В связи с этим, как указано выше, в предпочтительном варианте осуществления антигенный полипептид является белком ORF2 вируса PCV2 или его антигенным доменом.
О белке ORF2 изолята PCV2 Imp1011 сообщают в EP1741785. О белке ORF2 изолята PCV2 PCV2Rm сообщают в WO2010/061000. О белке ORF2 изолята PCV2 412 сообщают в EP1816200. О другом белке ORF2 другого изолята PCV2 сообщают в EP 1036180 или EP2225367. Все эти белки ORF2 предлагают для использования в настоящем изобретении.
В предпочтительном варианте осуществления белок ORF2 для использования в изобретении содержит SEQ ID NO: 3 или любую последовательность, имеющую по меньшей мере 80% идентичности по отношению к SEQ ID NO: 3, даже более предпочтительно - по меньшей мере 82, 84, 86, 88, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичности по отношению к SEQ ID NO: 3.
Как правило, белки ORF2 PCV2 содержат приблизительно 234 аминокислоты. Последовательность содержит последовательность ядерной локализации, как правило, соответствующую аминокислотам 1-42 последовательности.
В случае настоящего изобретения, предпочтительно использовать часть белка ORF2, не содержащую нативную последовательность ядерной локализации (т.е. последовательность остатков 1-42 нативного ORF2), и заменять эту последовательность пептидом мембранной адресации. SEQ ID NO: 3 является аминокислотной последовательностью белка ORF2, не содержащего последовательность ядерной локализации.
Последовательность, имеющую идентичность по отношению к SEQ ID NO: 3 и сохраняющую иммуногенную активность PCV2, можно получать искусственно или получать из серотипов PCV2, указанных выше, или из других дополнительных серотипов. Как правило, первые 42 аминокислоты белка ORF2 удаляют для супрессии функции ядерной локализации.
Как указано, можно применять изобретение с иммуногенными полипептидами других вирусных или патогенных антигенов, таких как, например, любой белок (например, гликопротеин, белок капсида или его антигенный фрагмент) вируса или патогена, выбранного, например, из Actinobacillus pleuropneunomia; аденовируса; альфавируса, такого как вирусы восточного энцефаломиелита лошадей; Balantidium coli; Bordetella bronchiseptica; Brachyspira spp., предпочтительно, B. hyodyentheriae, B. pilosicoli, B. innocens, Brucella suis, предпочтительно, биоваров 1, 2 и 3; вируса классической чумы свиней, вируса африканской чумы свиней; Chlamydia и Chlamydophila sp. и, предпочтительно, C. pecorum и C. abortus; Clostridium spp., предпочтительно, Cl. difficile, Cl. perfringens типов A, B и C, Cl. novyi, Cl. septicum, Cl. tetani; пищеварительного и респираторного коронавируса; Cryptosporidium parvum; Eimeria spp; Eperythrozoonis suis, в настоящее время называемого Mycoplasma haemosuis; Erysipelothrix rhusiopathiae; Escherichia coli; Haemophilus parasuis, предпочтительно, подтипов 1, 7 и 14; вируса гемагглютинирующего энцефаломиелита; Isospora suis; вируса японского энцефалита; Lawsonia intracellulars; Leptospira spp., предпочтительно, Leptospira australis, Leptospira canicola, Leptospira grippotyphosa, Leptospira icterohaemorrhagicae, Leptospira interrogans, Leptospira Pomona и Leptospira tarassovi; Mannheimia haemolytica; Mycobacterium spp., предпочтительно, M. avium, M. intracellular и M. bovis: Mycoplasma hyopneumoniae; парвовируса; Pasteurella multocida; цитомегаловируса свиней; парвовируса свиней, вируса репродуктивно-респираторного синдрома свиней: вируса болезни Ауески; ротавируса; вируса Сагияма; Salmonella spp., предпочтительно, S. thyhimurium и S. choleraesuis; Staphylococcus spp., предпочтительно, S. hyicus; Streptococcus spp., предпочтительно, Strep. suis; цитомегаловируса свиней; вируса герпеса свиней; вируса свиного гриппа; вируса оспы свиней; Toxoplasma gondii; вируса везикулярного стоматита или вируса экзантемы свиней; или других изолятов и подтипов цирковируса свиней.
Сборка и продукция полипептида
Полипептид по изобретению, как правило, содержит пептид адресации к мембране клеток, функционально связанный с антигенным полипептидом. Термин "функционально связанный" свидетельствует о том, что два домена подвергнуты слиянию друг с другом, прямо или косвенно, таким образом, который делает возможной адресацию полипептида к мембране клетки и экспрессию антигенного полипептида вне клетки.
Наиболее предпочтительно, пептид адресации к мембране клетки локализован на N-конце, и иммуногенный полипептид локализован на C-конце. Оба домена соединяют ковалентно, предпочтительно, с помощью пептидной связи. Таким образом, полипептид по изобретению предпочтительно содержит, от N- к C-концу:
. пептид адресации к мембране клетки,
. иммуногенный полипептид
Полипептид дополнительно может содержать дополнительные домены или последовательности. Например, полипептид может содержать последовательность линкера между пептидом адресации к мембране клетки и иммуногенным полипептидом. Однако, предпочтительно, два домена соединяют напрямую без последовательности линкера. Кроме того, в предпочтительном варианте осуществления полипептид не содержит участок расщепления таким образом, что иммуногенный полипептид экспонирован на поверхности клетки и, по существу, не высвобождается в растворимой форме.
Предпочтительный и конкретный пример полипептида по изобретению содержит аминокислотную последовательность SEQ ID NO: 4.
Полипептид по изобретению дополнительно может содержать N-концевой остаток метионина.
Полипептид по изобретению может являться гликозилированным.
Полипептиды по изобретению можно получать с помощью синтетического способа или рекомбинантных средств. Предпочтительно, полипептиды по изобретению конструируют так, чтобы они продуцировались/экспрессировались непосредственно в клетках или целых организмах посредством экспрессии кодирующей молекулы нуклеиновой кислоты. Фактически, новый профиль экспрессии полипептидов по изобретению, в частности, адаптирован для дизайна ДНК- или векторных вакцин, содержащих молекулу нуклеиновой кислоты, кодирующую полипептид по изобретению. После введения в организм нуклеиновая кислота проникает в клетки и с нее экспрессируется полипептид, затем экспонируемый на поверхности клетки и проявляющий улучшенную иммуногенность. Как описано ниже, нуклеиновая кислота может являться депротеинизированной, или ее можно составлять с любым подходящим вектором. Альтернативно, в изобретении можно использовать клеточные вакцины, где полипептид экспрессируется в культуре на поверхности клеток и полученные клетки используют в качестве вакцинной композиции.
Таким образом, изобретение также включает и в нем используют молекулы нуклеиновой кислоты, кодирующие полипептиды, как определено выше.
Нуклеиновая кислота
Дополнительная цель изобретения относится к молекуле нуклеиновой кислоты, кодирующей полипептид, как определено выше. Нуклеиновую кислоту можно использовать для получения полипептида in vitro, или для получения клеток, экспрессирующих полипептид на своей поверхности, или для получения вакцин, где активным средством является нуклеиновая кислота или вектор, содержащий нуклеиновую кислоту.
Нуклеиновая кислота по изобретению может являться ДНК или РНК, одно- или двухцепочечной. Нуклеиновая кислота, как правило, является кДНК или РНК. Нуклеиновую кислоту можно получать хорошо известными в этой области способами, такими как синтез, или клонирование, или амплификация последовательности, кодирующей иммуногенный полипептид; синтез, или клонирование, или амплификация последовательности, кодирующей последовательность адресации к мембране клетки; лигирование последовательностей и их клонирование/амплификация в соответствующих векторах и клетках.
В конкретном варианте осуществления изобретение относится к молекуле нуклеиновой кислоты, содержащей SEQ ID NO: 5.
Вектор
Молекулы нуклеиновой кислоты по изобретению можно предоставлять в форме молекулы нуклеиновой кислоты как таковой, такой как депротеинизированные молекулы нуклеиновой кислоты; вектора; вируса или клетки-хозяина и т.д. прокариотического или эукариотического происхождения. Векторы включают экспрессирующие векторы, содержащие молекулу нуклеиновой кислоты по изобретению. Векторы по настоящему изобретению, например, могут содержать промотор транскрипции и/или терминатор транскрипции, где промотор функционально связан с молекулой нуклеиновой кислоты, и где молекула нуклеиновой кислоты функционально связана с терминатором транскрипции.
В связи с этим, конкретной целью изобретения является вирусный вектор, содержащий нуклеиновую кислоту, как определено выше. Вирусный вектор можно получать из различных типов вирусов, таких как, предпочтительно, вирус оспы свиней, вирус оспы кур, вирус болезни Ауески, вирус болезни Ауески, сальмонелла, вирус Vaccinia, BHV (вирус герпеса крупного рогатого скота), HVT (вирус герпеса индеек), аденовирус, TGEV (коронавирус трансмиссивного гастроэнтерита), эритровирус и SIV (вирус иммунодефицита обезьян).
В предпочтительном варианте осуществления вектор является рекомбинантным вирусом оспы свиней. Вирус оспы свиней (SPV) является лишь слегка патогенным у свиней и вызывает протективный иммунный ответ. Таким образом, SPV является превосходным кандидатом для вирусного вектора у свиней. Общий способ получения рекомбинантного SPV описан в нескольких источниках (Vet Rec. 1994 Jan 1; 134(1): 13-8.). В типичном способе первым этапом в конструировании рекомбинантного SPV является получение гомологичных плазмид, которые могут направлять встраивание транскрипционных единиц для гена антигенного полипептида по настоящему изобретению в геном SPV. Встраивание происходит посредством гомологичной рекомбинации, и, таким образом, для нее необходимо, чтобы встраиваемая ДНК была фланкирована смежной геномной областью SPV. В случае рекомбинантных SPV ген тимидинкиназы (TK) сначала подвергали селекции в качестве участка встраивания, и он оказывался областью, не важной для репликации вируса. Т.к. транскрипционный аппарат поксвируса не будет распознавать промоторы клетки-хозяина, ген антигенного полипептида по настоящему изобретению, предпочтительно, соединяют с промоторами поксвируса. Промоторы вируса Vaccinia, такие как P11 или P7.5 являются предпочтительными для экспрессии в рекомбинантном SPV, но можно использовать другие промоторы поксвируса. После получения гомологичной плазмиды ее трансфицируют в компетентные клетки, такие как эмбриональные клетки почки свиньи (ESK-4) или клетки почки свиньи (PK-15), предварительно инфицированные SPV. Рекомбинанты получают гомологичной рекомбинацией между реплицирующимися геномами SPV и трансфицированной плазмидой. Рекомбинантный SPV можно подвергать селекции/скринингу с использованием общепринятых способов. В одном из способов идентификации используют ген Escherichia coli lacZ в качестве маркера. В этом случае хромогенный субстрат 5-бром-4-хлор-3-индолил-β-D-галактозид (X-gal), преобразующийся в соединение синего цвета под действием экспрессирующегося фермента (β-галактозидазы), затем используют для идентификации вирусных бляшек, образуемых рекомбинантным вирусом в потомстве, на фоне бесцветных бляшек, образованных нерекомбинантными вирусами. В случае отсутствия маркерного гена продукцию антигенного полипептида, экспрессируемого рекомбинантным SPV, можно проверять с использованием специфичных антител против антигенного полипептида в иммунофлуоресцентном анализе. Используя указанные выше протоколы, можно получать рекомбинантный SPV, экспрессирующий антигенный полипептид по настоящему изобретению.
Также можно использовать другие системы экспрессии и векторы, такие как плазмиды, реплицирующиеся и/или встраивающиеся в дрожжевые клетки.
Изобретение также относится к способу получения полипептида по изобретению, включающему культивирование клетки-хозяина, содержащей нуклеиновую кислоту или вектор, как определено выше, в условиях, подходящих для экспрессии нуклеиновой кислоты и выделения полипептида. Как указано выше, белки и пептиды можно очищать способами, известными в этой области. Изобретение также относится к наборам для экспрессии, содержащим (a) клетку-хозяина (предпочтительно, клетки насекомых или дрожжевые клетки), (b) средства экспрессии полипептида по изобретению, например, содержащие векторную систему, способную реплицироваться в указанной клетке, и (c) средства выделения белка или пептида по изобретению.
Вакцинные композиции
Как применяют в настоящем описании, термин "вакцина" включает средство, которое можно использовать для индуцирования, стимуляции или усиления иммунитета животных (например, свиней) против патогена. Вакцины по изобретению способны индуцировать, или стимулировать, или усиливать иммунитет против вируса PCV2.
Термин "иммунизация" включает процесс доставки иммуногена субъекту. Например, иммунизация может делать возможным поддержание высокого уровня гуморального и/или клеточного ответа, при котором T-лимфоциты могут уничтожать или супрессировать патоген у иммунизированного, не относящегося к человеку животного, такого как свинья, направленного против патогена или антигена, воздействию которого животное подвергали ранее.
Вакцины по изобретению содержат иммунологически эффективное количество полипептида, клетки или нуклеиновой кислоты, как описано выше, в фармацевтически приемлемом наполнителе. В результате вакцинации композицией по изобретению животные становятся, по меньшей мере, частично или полностью иммунными к инфекциям PCV2 или резистентными к развитию умеренных или тяжелых инфекций PCV2. Вакцины против PCV2 можно использовать для вызывания гуморального и/или клеточного ответа.
Инфекции PCV2 или PCV2-ассоциированные заболевания включают, помимо прочего, мультисистемный синдром истощения после отъема (PMWS), синдром дерматита и нефропатии поросят (PDNS), комплекс респираторных заболеваний свиней (PRDC), репродуктивные нарушения, гранулематозный энтерит, экссудативный эпидермодермит, некротизирующий лимфаденит и эссенциальный тремор. Предпочтительно, не относящееся к человеку животное, такое как свинья, защищено до такой степени, что значимо снижают, улучшают или полностью предотвращают от одного до всех из неблагоприятных физиологических симптомов или эффектов инфекций PCV2.
Настоящее изобретение также относится к комбинированной вакцине, содержащей полипептид, нуклеиновую кислоту или клетку по изобретению в комбинации по меньшей мере с одним дополнительным белком-антигеном [Gupi P. S. Nayar et al. (Can. Vet. J, vol. 38, 1997: 385-387) и Clark E.G. (Proc. Am. Assoc. Swine Prac. 1997; 499-501)].
На практике точное количество, необходимое для иммунологически эффективной дозы, может варьироваться от субъекта к субъекту в зависимости от факторов, таких как возраст и общее состояние субъекта, природа состава и способ введения. Специалист в этой области может определять подходящее "эффективное количество" с использованием всего лишь рутинного экспериментирования. Например, в этой области известны способы определения или титрования подходящей дозировки вакцины для нахождения минимальных эффективных дозировок с учетом массы не относящегося к человеку животного, концентрации вакцины и других типичных факторов.
В типичном варианте осуществления вакцина содержит однократную дозу 0,1-50 мкг, предпочтительно - от 0,1 до 25, даже более предпочтительно - от 1 до 15 мкг, как правило, приблизительно 10 мкг полипептида- или нуклеиновой кислоты-антигена по изобретению.
Дозировку вакцины, концентрацию компонентов в ней и время введения вакцины, вызывающей подходящий иммунный ответ, можно определять способами, такими как титрование антител в сыворотке, например, с помощью ELISA, и/или анализа серонейтрализации и/или оценки провокационной вакцинации.
В конкретном варианте осуществления вакцина содержит полипептид по изобретению в очищенной форме, необязательно, в комбинации с любым подходящим эксципиентом или носителем.
В другом конкретном варианте осуществления вакцина содержит нуклеиновую кислоту, как определено выше, необязательно, в комбинации с любым подходящим эксципиентом или носителем. Наиболее предпочтительная вакцина содержит вирусный вектор, содержащий нуклеиновую кислоту, как определено выше. Другая предпочтительная вакцина содержит вирус оспы свиней, содержащий нуклеиновую кислоту, как определено выше.
Вакцины могут содержать другие ингредиенты, известные специалисту в этой области, такие как фармацевтически приемлемые носители, эксципиенты, дилюенты, адъюванты, стабилизаторы для лиофилизации, увлажнители или эмульгаторы, pH-буферные средства, загустители и консерванты, в зависимости от пути введения.
Примеры фармацевтически приемлемых носителей, эксципиентов или дилюентов включают, в качестве неограничивающих примеров, деминерализованную или дистиллированную воду; физиологический раствор; растительные масла, такие как арахисовое масло, арахисовое масло, сафлоровое масло, оливковое масло, хлопковое масло, кукурузное масло, сезамовое масло или кокосовое масло; силиконовые масла, включая полисилоксаны, такие как метил-полисилоксан, фенил-полисилоксан и метилфенил-полисилоксан; летучие силиконы; минеральные масла, такие как легкое вазелиновое масло или тяжелое вазелиновое масло; сквален; производные целлюлозы, такие как метилцеллюлоза, этилцеллюлоза, карбоксиметилцеллюлоза, натрий-карбоксиметилцеллюлоза или гидроксипропилметилцеллюлоза; низшие алифатические спирты, например, этанол или изопропанол; низшие аралканолы; низшие полиалкиленгликоли или низшие алкиленгликоли, например, полиэтиленгликоль, полипропиленгликоль, этиленгликоль, пропиленгликоль, 1,3-бутиленгликоль или глицерин; сложные эфиры жирных кислот, такие как изопропилпальмитат, изопропилмиристат или этилолеат; поливинилпирролидон; агар; каррагенан; трагакантовую камедь или гуммиарабик, и нефтяной вазелин. Как правило, носитель или носители будут образовывать от 10% до 99,9% по массе вакцинной композиции, и их можно забуферивать общепринятыми способами с использованием реагентов, известных в этой области, таких как гидрофосфат натрия, дигидрофосфат натрия, гидрофосфат калия, дигидрофосфат калия, их смесь и т.п.
Примеры адъювантов включают, в качестве неограничивающих примеров, эмульсии "масло-в-воде", гидроксид алюминия (alum), иммуностимулирующие комплексы, неионные блок-полимеры или сополимеры, цитокины (такие как ИЛ-1, ИЛ-2, ИЛ-7, ИФН-альфа, ИФН-бета, ИФНγ и т.д.), сапонины, монофосфорил-липид A (MLA), мурамилдипептиды (MDP) и т.п. Другие подходящие адъюванты включают, например, сульфат алюминия-калия, термолабильные или термостабильные энтеротоксины, выделенные из Escherichia coli, холерный токсин или его B-субъединица, дифтерийный токсин, столбнячный токсин, коклюшный токсин, неполный или полный адъювант Фрейнда и т.д. Адъюванты на основе токсинов, такие как дифтерийный токсин, столбнячный токсин и коклюшный токсин, перед использованием можно инактивировать, например, с помощью обработки формальдегидов.
Примерами стабилизатора для лиофилизации могут являться, например, углеводы, такие как сорбит, маннит, крахмал, сахароза, декстран или глюкоза, белки, такие как альбумин или казеин, и их производные.
Вакцины могут дополнительно содержать по меньшей мере один иммуноген по меньшей мере из одного дополнительного патогена, например, патогена свиньи, такого как Actinobacillus pleuropneunomia; аденовирус; альфавирус, такой как вирусы восточного энцефаломиелита лошадей; Balantidium coli; Bordetella bronchiseptica; Brachyspira spp., предпочтительно, B. hyodyentheriae, B. pilosicoli, B. innocens, Brucella suis, предпочтительно, биоваров 1, 2 и 3; вирус классической чумы свиней, вирус африканской чумы свиней; Chlamydia и Chlamydophila sp. и, предпочтительно, C. pecorum и C. abortus; Clostridium spp., предпочтительно, Cl. difficile, Cl. perfringens типов A, B и C, Cl. novyi, Cl. septicum, Cl. tetani; пищеварительного и респираторного коронавируса; Cryptosporidium parvum; Eimeria spp; Eperythrozoonis suis, в настоящее время называемого Mycoplasma haemosuis; Erysipelothrix rhusiopathiae; Escherichia coli; Haemophilus parasuis, предпочтительно, подтипов 1, 7 и 14; вирус гемагглютинирующего энцефаломиелита; Isospora suis; вирус японского энцефалита; Lawsonia intracellulars; Leptospira spp., предпочтительно, Leptospira australis, Leptospira canicola, Leptospira grippotyphosa, Leptospira icterohaemorrhagicae, Leptospira interrogans, Leptospira Pomona и Leptospira tarassovi; Mannheimia haemolytica; Mycobacterium spp. предпочтительно, M. avium, M. intracellular и M. bovis: Mycoplasma hyopneumoniae; парвовирус; Pasteurella multocida; цитомегаловирус свиней; парвовирус свиней, вирус репродуктивно-респираторного синдрома свиней: вирус болезни Ауески; ротавирус; вирус Сагияма; Salmonella spp., предпочтительно, S. thyhimurium и S. choleraesuis; Staphylococcus spp., предпочтительно, S. hyicus; Streptococcus spp., предпочтительно, Strep. suis; цитомегаловирус свиней; вирус герпеса свиней; вирус свиного гриппа; вирус оспы свиней; Toxoplasma gondii; вирус везикулярного стоматита и вирус экзантемы свиней; или другие изоляты и подтипы цирковируса свиней.
Вакцинные композиции по изобретению могут являться жидкими составами, такими как водный раствор, эмульсия "вода-в-масле" или эмульсия "масло-в-воде", сироп, эликсир, настойка, препарат для парентерального, подкожного, внутрикожного, внутримышечного или внутривенного введения (например, инъекционного введения), такой как стерильные суспензии или эмульсии. Такие составы известны в этой области, и, как правило, их получают растворением антигена и других типичных добавок в соответствующем носителе или системах растворителей. Жидкие составы также могут включать суспензии и эмульсии, содержащие суспендирующее средство или эмульгаторы.
Путь введения может являться чрескожным введением, введением через слизистые оболочки или парентеральным путем (внутрикожным, внутримышечным, подкожным, внутривенным или интраперитонеальным). Вакцинные композиции по настоящему изобретению можно вводить в отдельности или можно вводить совместно или последовательно с другими лекарственными средствами или терапевтическими средствами.
Настоящее изобретение также относится к способам иммунизации или индуцирования иммунного ответа у не относящихся к человеку животных (например, свиней), включающим введение указанному животному полипептида, нуклеиновой кислоты, клетки, вектора или вакцины, как описано выше.
Настоящее изобретение также относится к способам лечения и/или профилактики PCV2-ассоциированных заболеваний у не относящихся к человеку животных (например, свиней), включающим введение указанному животному полипептида, нуклеиновой кислоты, клетки, вектора или вакцины, как описано выше.
Как указано выше, инфекции PCV2 или PCV2-ассоциированные заболевания включают, помимо прочего мультисистемный синдром истощения после отъема (PMWS), синдром дерматита и нефропатии поросят (PDNS), комплекс респираторных заболеваний свиней (PRDC), репродуктивные нарушения, гранулематозный энтерит, экссудативный эпидермодермит, некротизирующий лимфаденит и эссенциальный тремор.
Вакцину по изобретению можно удобно вводить интраназально, трансдермально (т.е. наносить на поверхность кожи для системной абсорбции), парентерально, через глаза и т.д. Парентеральный путь введения включает, в качестве неограничивающих примеров, внутримышечный, внутривенный, интраперитонеальный пути и т.п.
Дозировка вакцин по настоящему изобретению будет зависеть от вида, породы, возраста, размера, вакцинационного анамнеза, состояния здоровья животного, подлежащего вакцинации, а также пути введения, например, подкожного, внутрикожного, перорального, внутримышечного или внутривенного введения.
Вакцины по изобретению можно вводить в виде однократных доз или повторных доз. Вакцины по изобретению можно вводить в отдельности или можно вводить одновременно или последовательно с одной или несколькими дополнительными композициями, такими как, например, другие иммуногенные или вакцинные композиции для свиней. При введении композиций в различные моменты времени введения можно отделять друг от друга или они могут перекрываться по времени.
В одном из вариантов осуществления вакцинные композиции по изобретению вводят субъекту, восприимчивому или иным образом имеющему риск инфекции PCV2, для повышения возможностей иммунного ответа самого субъекта. Субъект, которому вводят вакцину, в одном из вариантов осуществления является свиньей. Животное может являться восприимчивым к инфекции PCV2 или близкородственным вирусом.
Вакцины по изобретению, предпочтительно, вводят свиньям, взрослым свиньям, но также и молодым свиньям, поросятам или беременным самкам или другим типам не относящихся к человеку животных. Вакцинация беременных самок является особенно предпочтительной, т.к. она придает пассивный иммунитет новорожденным посредством переноса материнских антител. Свиньи могут иметь возраст менее 7, 6, 5, 4, 3, 2 или 1 недели; от 1 до 6 недель; от 2 до 5 недель; или от 3 до 4 недель. Например, "тестируемым" животным можно вводить вакцину по изобретению для оценки свойств вакцины с учетом возможного применения или разработки вакцины для свиней. Желательно, вакцину вводят субъекту, ранее не подвергавшемуся воздействию вируса PCV2. Предпочтительно, субъект является свиньей, нуждающейся в вакцинации против мультисистемного синдрома истощения после отъема (PMWS) и/или синдрома дерматита и нефропатии поросят (PDNS).
Настоящее изобретение также относится к комбинированной вакцине, содержащей вакцины по изобретению и по меньшей мере один иммуногенный активный компонент, эффективный против организма-возбудителя другого заболевания свиней, такого как, например, Actinobacillus pleuropneunomia; аденовирус; Balantidium coli; Bordetella bronchiseptica; Brachyspira spp., предпочтительно, B. hyodyentheriae, B. pilosicoli, Brucella suis, предпочтительно, биоваров 1, 2 и 3; вирус классической чумы свиней, вирус африканской чумы свиней; Chlamydia и Chlamydophila sp. и, предпочтительно, C. pecorum и C. abortus; Clostridium spp., предпочтительно, Cl. difficile, Cl. perfringens; респираторный коронавирус свиней; Cryptosporidium parvum; Eimeria spp; Eperythrozoonis suis, в настоящее время называемого Mycoplasma haemosuis; Erysipelothrix rhusiopathiae; Escherichia coli; Haemophilus parasuis; вирус гемагглютинирующего энцефаломиелита; Isospora suis; Lawsonia intracellulars; Leptospira spp., предпочтительно, Leptospira Pomona; Mannheimia haemolytica; Mycobacterium spp., предпочтительно, M. avium; Mycoplasma hyopneumoniae; Pasteurella multocida; цитомегаловирус свиней; парвовирус свиней, вирус репродуктивно-респираторного синдрома свиней, вирус болезни Ауески; ротавирус; Salmonella spp., предпочтительно, S. thyhimurium и S. choleraesuis; Staphylococcus spp., предпочтительно, S. hyicus; Streptococcus spp., предпочтительно, S. suis; цитомегаловирус свиней; вирус свиного гриппа; вирус оспы свиней; Toxoplasma gondii; вирус везикулярного стоматита и вирус экзантемы свиней или другие изоляты и подтипы цирковируса свиней.
Настоящее изобретение также относится к контейнеру, содержащему иммунологически эффективное количество полипептида, нуклеиновой кислоты или вакцины, как описано выше. Изобретение также относится к наборам для вакцинации, содержащим, необязательно, стерильный контейнер, содержащий иммунологически эффективное количество вакцины, средства для введения вакцины животным и, необязательно, инструкции, включающие информацию о введении иммунологически эффективного количества композиции для лечения и/или профилактики PCV2-ассоциированных заболеваний.
Дополнительные аспекты и преимущества изобретения представлены в следующем разделе, который необходимо рассматривать исключительно как иллюстративный.
Примеры
Пример 1: Конструирование нуклеиновой кислоты, кодирующей антигенный полипептид, содержащий сигнальный пептид B5R и ORF2 PCV2
Две синтетические двухцепочечные ДНК, приведенные в SEQ ID NO: 6 и NO: 7, заказывали в Takara Bio (Japan). Их 5/3'-концевыми участки распознавания рестрикционных ферментов являются BamHI/SalI и XbaI/SalI, соответственно. ДНК клонировали в плазмиды pMD18-Ess (B/X/S) и pMD18-ORF2(X/S), соответственно.
Т.к. перед 3'-концевым участком SalI в SEQ ID NO: 6 присутствует участок XbaI, pMD18-Ess (B/X/S) разрезали с использованием двух ферментов рестрикции, XbaI и SalI. Фрагменты ДНК размером 561 п.н., полученные из pMD18-ORF2 (X/S), разрезанной с использованием XbaI и SalI, встраивали в участок XbaI/SalI pMD18-Ess (B/X/S). Полученная плазмида pMD18-Ess_ORF2 включает ген антигенного пептида SEQ ID NO: 5.
Плазмиду pGTPs40K-S (приведенную на фиг. 2 патента США № 7348422) разрезали с использованием двух ферментов рестрикции, BamHI и SalI, и заменяли отрезанным по BamHI/SalI фрагментом размером 0,7 т.п.н., полученным из pMD18-Ess_ORF2. Полученную плазмиду обозначали как pGTPs-Ess_ORF2. Эта плазмида включает сильный промотор вируса оспы (Ps) и ген антигенного пептида SEQ ID NO: 5.
Пример 2: Плазмиды для получения рекомбинантного SPV
Сначала получали геномную ДНК SPV следующим образом:
Штамм SPV kasza (VR-363) и эмбриональные клетки почки свиньи, клетки ESK-4 (CL-184), можно приобретать в American Type Culture Collection (ATCC). Клетки ESK-4 общепринятым образом культивировали при 37°C и 5% CO2 в среде Хэма F-12K (Gibco, кат. №21127-022), дополненной 1% стрептомицином-пенициллином (Gibco, кат. №15140-122) и 5% FBS (Gibco, кат. №10437-028). Для получения геномной ДНК SPV конфлюэнтные клетки ESK-4 во флаконе 225 см2 инфицировали SPV и инкубировали в течение 6 дней до демонстрации клетками 100% цитопатического эффекта (CPE). Затем инфицированные клетки собирали, соскребая клетки в среду и центрифугируя при 1300 об./мин. в течение 5 мин. Среду сливали, осторожно ресуспендировали клеточный осадок в 2 мл фосфатно-солевого буфера (PBS: 1,5 г Na2HPO4, 0,2 г KH2PO4, 0,8 г NaCl и 0,2 г KCl на литр H2O) и подвергали двум последовательным замораживаниям и размораживания. Затем клеточный дебрис удаляли посредством центрифугирования при 3000 об./мин. в течение 5 мин при 4°C. Затем вирионы SPV, присутствующие в супернатанте, осаждали посредством центрифугирования при 20000 × g в течение 20 мин при 4°C. Затем полученный осадок суспендировали с использованием 10 мМ Трис, pH 7,5. Затем геномную ДНК SPV выделяли из вирионов SPV посредством суспендирования с лизирующим буфером (20 мМ Трис, pH 9, 0,1M NaCl2, 5 мМ ЭДТА, 0,1% SDS, 0,2 мг/мл протеиназы K) и инкубации при 60°C в течение 5 мин. Выделение фенолхлороформом (1:1) осуществляли два раза и осаждали образец добавлением двух объемов этанола и центрифугированием. Сливали супернатант и осадок (ДНК SPV) высушивали воздухом и регидратировали в 10 мМ Трис, pH 7,5, 1 мМ ЭДТА при 4°C.
Затем фланкирующие области TK в геноме SPV клонировали с помощью полимеразной цепной реакции (ПЦР). Два праймера (синтетических олигонуклеотида) SP54242F и SP57617R, приведенные в SEQ ID NO: 8 и 9, приобретали в Takara Bio. Реакцию ПЦР осуществляли с использованием Taq-полимеразы LA (Takara Bio) и набора праймеров SP54242F и SP57617R с ДНК SPV в качестве матрицы по инструкциям производителя.
Амплифицированную ДНК размером приблизительно 3,4 т.п.н. проверяли с помощью электрофореза в 0,8% агарозном геле и выделяли из геля с использованием набора QIAquick Gel Extraction Kit (Qiagen). Очищенный фрагмент ДНК клонировали в вектор pCR4-TOPO (Invitrogen) по инструкциям производителя. Выбирали 14 белых ампициллин-резистентных трансформантов, выращивали их в LB-бульоне и каждую плазмиду получали с использованием набора QuickLyse Miniprep Kit (Qiagen). Каждую плазмиду расщепляли с использованием SpeI и выбирали два типа плазмид-кандидатов (с обоими направлениями встроенной ДНК). Встроенную в них ДНК секвенировали с использованием реагента Dye Terminator Cycle Sequencing reagent (DTCS) и секвенатора CEQ2000XL (Beckman Coulter). Подтверждали, что одна из плазмид-кандидатов, pCR-SPV54242/57617 (#2), содержит фрагмент ДНК от 54242 н. до 57617 н. геномной ДНК SPV (GeneBank Acc: NC_003389), и использовали ее в качестве основной плазмиды (фиг. 1).
Затем осуществляли ПЦР-мутагенез для делеции части гена TK и для встраивания множества участков распознавания рестрикционных ферментов с использованием pCR-SPV54242/57617 (#2) в качестве матрицы и двух типов наборов праймеров, (1) SEQ ID NO: 10 и 11 или (2) SEQ ID NO: 12 и 13.
Каждый из продуктов ПЦР анализировали с помощью электрофореза в 0,8% агарозном геле и выделяли с использованием набора QIAquick Gel Extraction Kit. Очищенный фрагмент ДНК, амплифицированный посредством ПЦР с использованием набора праймеров SEQ ID NO: 10 и 11, расщепляли двумя рестрикционными ферментами, KpnI и HindIII и лигировали с разрезанной теми же рестрикционными ферментами pBluescript KS (+) (Stratagene). Полученную плазмиду pBS-TKR (Kpn.Hin) (фиг. 1) расщепляли SacI и PstI и встраивали в нее разрезанный теми же рестрикционными ферментами фрагмент ДНК, амплифицированный посредством ПЦР с использованием набора праймеров SEQ ID NO: 12 и 13. Полученную плазмиду обозначали как pSP70 (фиг. 1).
Между участками EcoRI и HindIII во множественных участках распознавания рестрикционных ферментов pSP70 встраивали олигонуклеотидный адаптер, получаемый отжигом двух синтетических олигонуклеотидов ДНК SEQ ID NO: 14 и 15. Полученную плазмиду обозначали как pSP71 (фиг. 1).
Фрагмент ДНК генетической кассеты "P7.5 промотор-LacZ", полученной из pNZ76, вырезанный с использованием HindIII и SmaI из pNZ76 с последующим затуплением концов ДНК-полимеразой (описываемой в патенте США №5387519), лигировали по участку SmaI в pSP71. Полученную плазмиду обозначали как pSP72 (фиг. 1) и встраивали генетическую кассету "P7.5-LacZ" в ген TK (от 55625 н. до 56170 н. в геноме SPV).
Фрагмент BgH-cvA размером 0,8 т.п.н., полученный из pGTPs-Ess_ORF2 (пример 1), встраивали по участку SfiI в pSP72 и полученную плазмиду обозначали как pSP72-Ess_ORF2 (фиг. 1). Эта плазмида включала генетическую кассету "сильный промотор вируса оспы (Ps)-Ess_ORF2" также в гене TK, и ее использовали в качестве гомологичной плазмиды для получения рекомбинантной SPV, SVR7.
Вместо Ess_ORF2 в другую гомологичную плазмиду встраивали природный ген PCV2-ORF2 для использования в качестве референса. Хотя опубликовано множество данных о последовательности PCV2-ORF2, синтезировали одну из них, двухцепочечную ДНК SEQ ID NO: 16. SEQ ID NO: 16 является комплементарной ДНК, кодирующей ORF2 PCV2, выделенного во Франции (GenBank: AF055393), к 5'- и 3'-концам которой прикреплены участки BamHI и SalI, соответственно. Синтезированную ДНК разрезали с использованием BamHI и SalI и заменяли областью BamHI/SalI из pSP72-Ess_ORF2. Полученную плазмиду обозначали как pSP72-ORF2 и использовали в качестве гомологичной плазмиды для получения рекомбинантной SPV, SVR3.
Пример 3: Получение рекомбинантных SPV, SVR3 и SVR7
(1) Получение рекомбинантных SPV, SVR3 и SVR7
Рекомбинантные SPV получали в клетках ESK-4 посредством гомологичной рекомбинации между геномом SPV дикого типа и гомологичными векторами. Субконфлюэнтные клетки ESK-4 в 6-луночном планшете инфицировали SPV дикого типа за 4 часа до трансфекции 2 мкг каждой из pSP72-Ess_ORF2 или pSP72-ORF2 с использованием реагента Lipofectamin Plus (Invitrogen) и позволяли инкубироваться при 37°C в течение 5 дней до появления цитопатического эффекта (CPE). Клеточные лизаты из инфицированных и трансфицированных клеток подвергали скринингу на рекомбинантные бляшки, экспрессирующие β-галактозидазу, посредством добавления 0,5 мг/мл Bluo-gal (Invitrogen, кат. №: 15519-028) в питательный верхний слой агарозы. Не содержащие дикий тип рекомбинантные вирусы очищали посредством 4-6 раундов скрининга. Рекомбинантные SPV, полученные с использованием pSP72-Ess_ORF2 или pSP72-ORF2, обозначали как SVR7 и SVR3, соответственно.
(2) Анализ способом "черных бляшек" (BPA)
Клетки ESK-4 в 24-луночном планшете инфицировали SVR3, SVR7 или SPV дикого типа и инкубировали при 37°C. Через 6 дней монослой фиксировали ацетоном и метанолом (2:1). Нейтрализующее моноклональное антитело против PCV2 (Ingenase, клон 36F1) разводили (разведение 1:500) в 5% сухом молоке в PBS, и добавляли к инфицированным клеткам и инкубировали в течение 2 часов при комнатной температуре (RT). Инфицированные клетки промывали PBS и проводили реакцию с антителом кролика против IgG мыши, конъюгированным с биотином (разведение 1:1000), и набором VECTASTAIN ABC Standard Kit (Vector Laboratory PK-4000). Стоковый раствор субстрата щелочной фосфатазы NBT/BCIP (Roche, кат. №11681451001) разводили в 0,1M Трис, pH 9,5, 0,1M NaCl, 50 мМ MgCl2, добавляли к инфицированным клеткам и инкубировали в течение 5-30 мин при RT до достижения бляшками SVR3 или SVR7 фиолетового/черного цвета. В то время как бляшки с SPV дикого типа являлись белыми (отрицательными), подтверждали, что все бляшки с SVR3 и SVR7 являлись черными (положительными) (фиг.2).
Пример 4: Поликлональные антитела для определения PCV2-ORF2
Для получения поликлонального антитела против PCV2-ORF2 в E. coli экспрессировали слитые белки глутатион-S-трансферазы (GST) с C-концевой областью PCV2-ORF2. Сначала фрагмент ДНК получали посредством ПЦР с использованием pMD18-ORF2(X/S) (пример 1) в качестве матрицы и набора праймеров SEQ ID NO: 17 и 18.
Амплифицированную ДНК размером 0,45 т.п.н. разрезали с использованием BamHI и SalI и встраивали в участки BamHI/SalI pGEX-6p-3 (GE Healthcare, 28-9546-51). Плазмиды-кандидатов секвенировали с использованием праймеров для секвенирования pGEX-5'-SP или -3'-SP (GE Healthcare, 27-1410-01 или 27-1411-01, соответственно) и подтверждали, что они соответствуют плану конструкции
Клетки-хозяева E. coli BL21 (GE Healthcare, 27-1542-01) трансформировали с использованием pGEX-TGXR2 и подтверждали, что трансформанты экспрессируют слитый белок приблизительно 40 кДа посредством индукции изопропил-β-D-тио-галактозида (IPTG). Для получения слитого белка для иммунизации животных отдельную колонию трансформанта инокулировали в аликвоты 5 мл LB-бульона, содержащего 5 мкг/мл ампициллина (Amp), и культивировали в течение ночи при 37°C со встряхиванием. На следующее утро ночную культуру инокулировали в 1 литр LB-бульона, содержащего Amp, и культивировали при 37°C со встряхиванием до достижения OD600 0,7, когда в культуры добавляли IPTG до конечной концентрации 0,1 мМ. Культуры инкубировали в течение еще 3 часов при 37°C со встряхиванием. Бактерии собирали посредством центрифугирования при 3500 × g в течение 20 мин и ресуспендировали в 20 мл лизирующего буфера PBS (1% Triton X-100 в PBS). Бактериальную суспензию обрабатывали ультразвуком на льду с импульсами по 10 сек и перерывом в 10 сек на льду три раза. Лизат центрифугировали при 17000 × g в течение 20 минут при 4°C и переносили супернатант в новую пробирку.
Когда целевые GST-слитые белки образовывали тельца включения, их очищали с использованием Mini Whole Gel Eluter (Bio-Rad Laboratories, кат. №165-1255) по инструкциям производителя.
Целевые GST-слитые белки массой ~40 кДа очищали во фракции №7 из Mini Whole Gel Eluter (фиг. 3b). Раствор фракции №7 диализовали PBS. Поликлональные антитела против этого слитого белка получали с помощью иммунизации крыс. Трех самок крыс Wister (SPF) возрастом 5 недель иммунизировали подкожно 0,1 мг белка GST-ORF2 в виде эмульсии в полном адъюванте Фрейнда и через три недели проводили бустерную иммунизацию 0,05 мг того же антигена, смешанного с неполным адъювантом Фрейнда, три раза с 3-недельными интервалами. Через две недели после последней иммунизации крыс обескровливали для сбора сыворотки ~1 мл на крысу.
Пример 5: Определение характеристик антигенных пептидов, экспрессируемых рекомбинантными SPV
Осуществляли иммунофлуоресцентный анализ (IFA) для подтверждения локализации белков ORF2, экспрессируемых SVR3 или SVR7. Клетки ESK-4 инфицировали rSPV (SVR3 или SVR7) или родительским SPV. Через пять дней инфицированные клетки дважды промывали PBS, обрабатывали (a) ацетоном/метанолом (2:1) или (b) PBS при комнатной температуре в течение 5 минут. Удаляли ацетон/метанол или PBS и добавляли PBS для предотвращения высушивания образцов. Их дважды промывали PBS и проводили реакцию с первичными антителами [антителом кролика против β-галактозидазы (α-βGal) (CAPPEL, кат. №0631-0002) и антителом крысы против PCV2-ORF2 (α-ORF2) (пример 4) (разведения 1:1000 в PBS)] при 37°C в течение 30 мин. Затем образцы трижды промывали PBS и проводили реакцию со вторичными антителами [антителом козы против IgG кролика (H+L) с Alexa Fluor 488 (Life technology, A-11006) и антителом против IgG крысы (H+L) с Alexa Fluor 546 (A-11081) (разведения 1:1000 в PBS)] при 37°C в течение 30 мин. Образцы трижды промывали PBS и исследовали с помощью флуоресцентного микроскопа.
В случае (a) клеток, обработанных ацетоном/MeOH, наблюдали β-галактозидазу (зеленый сигнал) и ORF2 (красный сигнал) в клетках, инфицированных каждым из SVR3 или SVR7, т.к. клеточные мембраны являлись проницаемыми (фиг. 3a). Напротив, в случае (b) интактных клеток не определяли β-галактозидазу (зеленый сигнал) и ORF2 (красный сигнал) в клетках, инфицированных SVR3, но ORF2 (красный сигнал) четко наблюдали в клетках, инфицированных SVR7 (фиг. 3b). Эти результаты убедительно свидетельствуют о том, что локализация белков ORF2 изменилась с внутриклеточной, такой как в случае исходного ORF2, экспрессируемого SVR3, на внеклеточную и на поверхности клеток, как в случае SVR7.
Таким образом, эффективность вакцины с SVR7 выше, чем в случае SVR3, и полученный из B5R сигнал адресации может улучшать иммунный ответ против PCV2-ORF2.
Пример 6: Эффективность вакцинации in vivo
Свиней вакцинировали с использованием векторов, кодирующих полипептид SVR7 по изобретению. В качестве сравнительного примера, свиней вакцинировали с использованием SVR3. Для иммунизации инъецировали 3-5×104 TCID50/дозу. Затем осуществляли заражение свиней с использованием PCV2.
Более конкретно, 24 поросенка, не содержащих или отрицательных по PCV2, включали в исследование в возрасте 3 недель перед вакцинацией и разделяли на различные группы, как представлено ниже:
Группа SVR3: 7 поросят,  4,
4,  3.
3.
Группа SVR7: 7 поросят,  4,
4,  3.
3.
Группа неиммунизированных: 7 поросят,  4,
4,  3.
3.
Группа неиммунизированных, незараженных: 3 поросят,  3.
3.
Вакцинацию осуществляли в возрасте 4 недель и заражение PCV2 осуществляли через 2 недели после иммунизации. Для заражения PCV2 инъецировали 6×105 TCID50 PCV2/дозу. При вскрытии (4 недели после заражения PCV2) забирали несколько органов для определения PCV2, включая tree лимфоидные органы, миндалину, паховые лимфоузлы, лимфоузлы кишечника и тимус.
Количество копий генома PCV2 определяли в сыворотке через 1, 2 и 3 недели после вакцинации. Представленные ниже результаты свидетельствуют о том, что вакцины по изобретению вызывают выраженное снижение количества копий генома PCV2. Результаты свидетельствуют о том, что вакцина по изобретению является более мощной, чем вакцина на основе нативной последовательности ORF2.
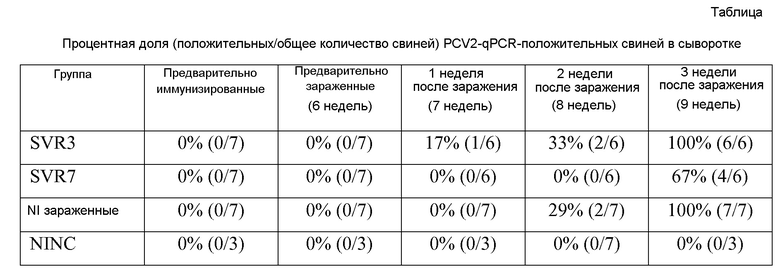
Кроме того, результаты, представленные на фигуре 4, четко свидетельствуют о том, что SVR7 индуцировал сильный гуморальный ответ против PCV2. Результаты свидетельствуют о том, что SVR7 индуцировал устойчивое антитело против ORF2 PCV2. Гуморальный ответ являлся более сильным, чем в случае SVR3. Индукция значительного гуморального ответа коррелирует со значительным снижением количества копий генома PCV2.
Эти данные четко иллюстрируют эффективность вакцинации полипептидами и векторами по изобретению.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ 










Изобретение относится к области биохимии. Описана группа изобретений, включающая полипептид, подходящий для индукции иммунного ответа против вируса PCV2, рекомбинантную клетку, содержащую молекулу нуклеиновой кислоты, кодирующую вышеуказанный полипептид, нуклеиновую кислоту, вектор, содержащий нуклеиновую кислоту, рекомбинантный вирус оспы свиней, содержащий в своем геноме нуклеиновую кислоту, композицию, вакцину, применение полипептида, клетки и нуклеиновой кислоты для получения лекарственного средства для лечения или профилактики PCV2-ассоциированного заболевания у свиньи. В одном из вариантов реализации полипептид содержит пептид адресации к мембране клеток длиной не более 50 аминокислот последовательности SEQ ID NO: 1 или последовательности, имеющей по меньшей мере 95% идентичности по отношению к SEQ ID NO: 1. Изобретение расширяет арсенал средств для индукции иммунного ответа против вируса PCV2. 10 н. и 10 з.п. ф-лы, 4 ил., 1 табл., 6 пр.
1. Полипептид, подходящий для индукции иммунного ответа против вируса PCV2, содержащий пептид адресации к мембране клеток длиной не более 50 аминокислот, причем указанный пептид содержит SEQ ID NO: 1 или последовательность, имеющую по меньшей мере 95% идентичности по отношению к SEQ ID NO: 1, функционально связанный с антигенным полипептидом вируса PCV2.
2. Полипептид по п. 1, где пептид адресации к мембране клеток длиной не более 50 аминокислот содержит SEQ ID NO: 1 или состоит из нее.
3. Полипептид по п. 2, где пептид адресации к мембране клеток длиной не более 50 аминокислот содержит SEQ ID NO: 2 или состоит из нее.
4. Полипептид по любому из пп. 1-3, где антигенный полипептид является ORF2 вируса PCV2 или его антигенным доменом.
5. Полипептид по п. 4, где антигенный полипептид содержит последовательность SEQ ID NO: 3 или последовательность, имеющую по меньшей мере 80% идентичности по отношению к SEQ ID NO: 3.
6. Полипептид по п. 5, где антигенный полипептид содержит последовательность SEQ ID NO: 3 или последовательность, имеющую по меньшей мере 90% идентичности по отношению к SEQ ID NO: 3.
7. Полипептид по п. 5, где антигенный полипептид содержит последовательность SEQ ID NO: 3.
8. Полипептид по п. 1, содержащий аминокислотную последовательность SEQ ID NO: 4.
9. Полипептид по п. 1, дополнительно содержащий N-концевой остаток метионина.
10. Полипептид по п. 1, являющийся гликозилированным.
11. Рекомбинантная клетка, причем указанная клетка содержит молекулу нуклеиновой кислоты, кодирующую полипептид по любому из пп. 1-9, и причем указанная клетка экспрессирует указанный полипептид на своей поверхности.
12. Нуклеиновая кислота, кодирующая полипептид по любому из пп. 1-9.
13. Вектор, содержащий нуклеиновую кислоту по п. 12, подходящий для экспрессии указанной нуклеиновой кислоты в клетке.
14. Вектор по п. 13, являющийся вирусным вектором, предпочтительно вирусом болезни Ауески или вирусом оспы свиней.
15. Рекомбинантный вирус оспы свиней, подходящий для индукции иммунного ответа против вируса PCV2, содержащий в своем геноме нуклеиновую кислоту по п. 12.
16. Композиция, подходящая для индукции иммунного ответа против вируса PCV2, содержащая полипептид по любому из пп. 1-10, клетку по п. 11, нуклеиновую кислоту по п. 12 или вектор по любому из пп. 13-15 в количестве, эффективном для индукции иммунного ответа у млекопитающего.
17. Вакцина, подходящая для индукции иммунного ответа против вируса PCV2, содержащая полипептид по любому из пп. 1-10, клетку по п. 11, нуклеиновую кислоту по п. 12 или вектор по любому из пп. 13-15 в количестве, эффективном для индукции иммунного ответа у млекопитающего, и, необязательно, адъювант.
18. Применение полипептида по любому из пп. 1-10, содержащего (i) пептид адресации к мембране клеток длиной не более 50 аминокислот, причем указанный пептид содержит SEQ ID NO: 1 или последовательность, имеющую по меньшей мере 95% идентичности по отношению к SEQ ID NO: 1, функционально связанный с (ii) антигенным полипептидом вируса PCV2, для получения лекарственного средства для лечения или профилактики PCV2-ассоциированного заболевания у свиньи.
19. Применение клетки по п. 11, экспрессирующей на своей поверхности полипептид, содержащий (i) пептид адресации к мембране клеток длиной не более 50 аминокислот, причем указанный пептид содержит SEQ ID NO: 1 или последовательность, имеющую по меньшей мере 95% идентичности по отношению к SEQ ID NO: 1, функционально связанный с (ii) антигенным полипептидом вируса PCV2, для получения лекарственного средства для лечения или профилактики PCV2-ассоциированного заболевания у свиньи.
20. Применение нуклеиновой кислоты по п. 12, кодирующей полипептид, содержащий (i) пептид адресации к мембране клеток длиной не более 50 аминокислот, причем указанный пептид содержит SEQ ID NO: 1 или последовательность, имеющую по меньшей мере 95% идентичности по отношению к SEQ ID NO: 1, функционально связанный с (ii) антигенным полипептидом вируса PCV2, для получения лекарственного средства для лечения или профилактики PCV2-ассоциированного заболевания у свиньи.
Авторы
Даты
2019-09-02—Публикация
2014-04-10—Подача