Настоящее изобретение относится к полимерным частицам на основе полимера поли(молочная-со-гликолевая кислота) (PLGA, от англ. poly(lactic-co-glycolic acid), сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA, от англ. poly(lactic-co-glycolic acid) или их смеси, объединенным с молекулами гиалуроновой кислоты или солями гиалуроновой кислоты, и к способу их получения. Другим объектом настоящего изобретения являются инъецируемые фармацевтические или косметические композиции, содержащие такие полимерные частицы, способ получения таких композиций и их применение в качестве лекарственного средства, в частности, для предупреждения и/или лечения скелетно-мышечных расстройств, заболеваний и травматических состояний кожи, патологических состояний полости рта, сухости вагинальной слизистой оболочки и мочевых инфекций или цистита, сухости роговицы, глазных инфекций и ожирения, и также их применение в борьбе со старением кожи и/или в восстановлении кожной ткани (мезотерапия). Более конкретно, композиции по изобретению могут быть предназначены для дополнения суставных жидкостей, в частности, синовиальной жидкости, путем восстановления физиологического и реологического состояния патологического сустава, например, сустава, пораженного остеоартритом, или также для ухода и восстановления эпидермиса посредством реконструкции, гидратации и защиты кожи. Наконец, изобретение направлено на набор, состоящий из двух контейнеров, по меньшей мере один из которых содержит полимерные частицы согласно изобретению, и также направлено на готовый к применению шприц, содержащий композицию по изобретению.
Остеоартрит характеризуется потерей трудоспособности и потерей подвижности. Затрагиваемыми суставами сперва являются коленный сустав, но также и суставы плеча, шейных позвонков и бедренный сустав. В восстановлении вязкости синовиальной жидкости против данных болезненных проявлений остеоартрита (таких как неэкссудативный остеоартрит колена) могут быть терапевтически использованы местные внутрисуставные инъекции гиалуроновой кислоты.
Инъекции гиалуроновой кислоты также могут занимать важное место в косметике для лечения физиологического старения кожи или травмы кожи путем обеспечения восстановления тканей.
Главное преимущество инъецируемых композиций на основе гиалуроновой кислоты состоит в сохранении всех свойств гиалуроновой кислоты, а именно:
- на клеточном и биохимическом уровне: антиапоптозных свойств (Ponta Н. et al., Nature Reviews, Molecular Cell Biology, 2003, Vol. 4, 33-45; Ando A. et al., Tohoku J. Exp. Med., 2008, 215, 321-331; Zhou PH et al., Journal of Orthopaedic Research, 2008, 1643-1648), противовоспалительных свойств (Vignon et al., 1997, 47, S11-S15; Ando A. et al., 2008; Zhou PH et al., Journal of Orthopaedic Research, 2008, 1643-1648), антиоксидантных свойств (Mendoza G. et al., Mini-Reviews in Medicinal Chemistry, 2009, 9, 1479-1488), свойств, имеющих отношение к улучшению синтеза гиалуроновой кислоты синовиоцитами (Nagaoka I. et al., Advances in Food and Nutrition Research, 2012, Vol. 65, Chap. 22), противофиброзных свойств (Li J. et al., Arthritis Research & Therapy, 2012, 14:R151) и увлажняющих свойств (Masson, F., Annales de dermatologie, 2010, 137,  1, S23-S25; Hargittai I. et al., Struct. Chem., 2008, 19, 697-717),
1, S23-S25; Hargittai I. et al., Struct. Chem., 2008, 19, 697-717),
- на биомеханическом уровне: восстановление вязкости синовиальной жидкости (Bellamy N. et al., Viscosupplementation for the treatment of osteoarthritis of the knee (Review), 2006, The Cochrane Collaboration®, John Wiley & Sons).
При патологиях сустава инъецируемые растворы гиалуроновой кислоты являются эффективными и хорошо переносимыми фармацевтическими средствами. Данные растворы предотвращают быстрый распад гиалуроновой кислоты и продлевают ее эффективность в месте инфекции. Это приводит к заметному улучшению функциональности суставов на протяжении длительного периода времени. Кроме того, гиалуроновая кислота превосходно переносится в суставах и не демонстрирует иммуногенности.
В настоящее время периодичность инъекций гиалуроновой кислоты составляет от одной до пяти, через сустав или подкожно, с интервалом одна неделя. Они демонстрируют эффект в случае сустава, эффективность которого не превышает 6-8 месяцев. Кроме того, даже если инъекция несшитой гиалуроновой кислоты дает быстрый эффект в десенсибилизации суставов, обнаруживается, что в среднем через 24 ч в месте инъекции больше не остается каких-либо следов гиалуроновой кислоты.
В патенте US 7456275 В2 описан фармацевтический препарат низкой вязкости, состоящий из гиалуроновой кислоты, связанной посредством химической модификации с блок-полимером, причем данный препарат демонстрирует длительный болеутоляющий эффект. Способ, применяемый для изготовления такого препарата, демонстрирует недостаток, заключающийся в модификации химической структуры активного начала - гиалуроновой кислоты путем создания сильных ковалентных связей между гиалуроновой кислотой и полимером. Кроме того, гиалуроновая кислота, химически модифицированная таким образом, является нерастворимой в водной среде, но растворяется только в органических средах, таких как диметилсульфоксид. Таким образом, перед инъекцией необходимо получить эмульсию в минеральном масле, причем добавление такого растворителя частично денатурирует активное начало.
В заявке WO 2006/071694 описана эмульсия гиалуроновой кислоты, объединенная с биодеградируемым полимером, используемая в качестве продукта, восстанавливающего вязкость синовиальной жидкости, для уменьшения боли в суставах. Гиалуроновая кислота присутствует в капельках, диспергированных в фазе органического полимера, причем применение органических растворителей и поверхностно-активных веществ, возможно, оказывается вредным. Способ приготовления такой эмульсии также демонстрирует проблемы воспроизводимости, поскольку не может контролироваться размер образующихся частиц. Наконец другим недостатком данного способа является необходимость хранения в условиях холода в течение нескольких суток, как только была получена эмульсия.
Авторы изобретения теперь разработали способ получения полимерных частиц, объединенных с молекулами гиалуроновой кислоты или солями гиалуроновой кислоты, что делает возможным преодоление недостатков композиций, описанных в предшествующем уровне техники. Композиции, содержащие полимерные частицы по изобретению, демонстрируют более медленный профиль высвобождения в отношении гиалуроновой кислоты, чем композиции предшествующего уровня техники (длительная диффузия гиалуроновой кислоты во времени), следовательно, продолжительность доступности гиалуроновой кислоты увеличивается. Композиции по изобретению имеют длительный эффект во времени, что уменьшает частоту суставных инъекций, причем для композиций по изобретению возможна инъекция лишь один раз в год. Гиалуроновая кислота, объединенная с полимерными частицами, затем диффундирует в виде малых доз в течение нескольких месяцев, как если бы это имело отношение к непрерывной «инфузии» гиалуроновой кислоты, например, в сустав, значительно уменьшая число инъекций. Кроме того, композиция по изобретению демонстрирует преимущество стабильной стерильной лиофилизированной композиции, которую можно использовать лишь в одном шприце, в отличие от композиции заявки WO 2006/071694.
Таким образом, первым объектом настоящего изобретения являются полимерные частицы, состоящие из по меньшей мере полимера поли(молочная-со-гликолевая кислота) (PLGA), сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) или их смеси, объединенные с молекулами гиалуроновой кислоты или солями гиалуроновой кислоты.
Структура полимера PLGA представлена ниже:
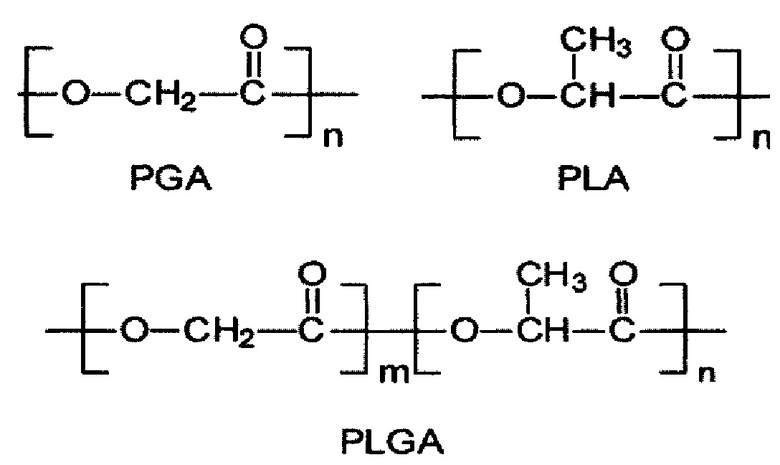 I
I
Гиалуроновая кислота по изобретению может существовать либо в сшитой форме, либо в несшитой форме. Сшитая гиалуроновая кислота состоит из двух или более чем двух молекул гиалуроновой кислоты, связанных друг с другом ковалентными связями, формируя, таким образом, связанную и стабильную гелевую массу гиалуроновой кислоты (De Boulle K. et al., Dermatologic Surgery, 2013, 39, 1758-1766;  С.E. et al., Carbohydrate Polymers, 85, 2011, 469-489). Предпочтительно гиалуроновая кислота по изобретению существует в несшитой форме.
С.E. et al., Carbohydrate Polymers, 85, 2011, 469-489). Предпочтительно гиалуроновая кислота по изобретению существует в несшитой форме.
Когда молекулы гиалуроновой кислоты предоставлены в форме солей, они предпочтительно представляют собой натриевые соли.
Молекулы гиалуроновой кислоты или соли гиалуроновой кислоты предпочтительно объединяют с полимером поли(молочная-со-гликолевая кислота) и/или с сополимером поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) через низкоэнергетические связи и предпочтительно через водородные связи и/или ванн-дер-ваальсовы связи. Это делается потому, что способ получения полимерных частиц по изобретению делает возможным объединение молекул гиалуроновой кислоты с полимером поли(молочная-со-гликолевая кислота) (PLGA), с сополимером поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) или с их смесью без химической модификации структуры гиалуроновой кислоты, то есть, без образования ковалентных связей между гиалуроновой кислотой и полимером. Таким образом, в способе по изобретению избегается применение активирующих агентов и связующих агентов, таких как гидразин, обычно необходимых для модификации структуры гиалуроновой кислотой и для создания ковалентных связей ( С.Е. et al., Carbohydrate Polymers, 85, 2011, 469-489).
С.Е. et al., Carbohydrate Polymers, 85, 2011, 469-489).
Согласно предпочтительному воплощению полимерные частицы по изобретению состоят из смеси полимера поли(молочная-со-гликолевая кислота) (PLGA) и сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA). Преимущественно отношение по массе полимера поли(молочная-со-гликолевая кислота) (PLGA) к сополимеру поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) варьирует от 40/60 до 60/40 и предпочтительно составляет 50/50.
Согласно даже более предпочтительному воплощению полимерные частицы по изобретению состоят только из сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) (100% PLGA-PEG-PLGA).
Полиэтиленгликоль (PEG, от англ. polyethylene glycol) предпочтительно имеет высокую молекулярную массу, варьирующую от 4000 до 10000 г⋅моль-1. PLGA предпочтительно имеет молекулярную массу, варьирующую от 54000 до 69000 г⋅моль-1. Сополимер поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) предпочтительно имеет молекулярную массу, варьирующую от 50000 до 70000 г⋅моль-1. Данные полимеры имеются в продаже, например, у Evonik под индексами LSB 5050 DLG/PEG 6000 и Resomer RG 505.
Полимерные частицы по изобретению предпочтительно имеют размер, варьирующий от 10 до 130 мкм и, более предпочтительно, варьирующий от 20 до 85 мкм. Размер частиц может быть определен по полидисперсности согласно распределению размера частиц с использованием счетчика Multisizer® 3 Coulter (Beckman Coulter).
Молекулы гиалуроновой кислоты или соли гиалуроновой кислоты, объединенные с полимерными частицами, в отношении их части предпочтительно имеют молекулярную массу, которая может варьировать от 0,8×106 до 1,2×106 г⋅моль-1, например, определенную гель-фильтрацией (ГФ) или высокоэффективной жидкостной хроматографией (ВЭЖХ), причем молекулы гиалуроновой кислоты или соли гиалуроновой кислоты, имеющиеся в продаже, имеют молекулярную массу, варьирующую от 0,5×106 до 6,0×106 г⋅моль-1.
Преимущественно содержание по массе гиалуроновой кислоты или солей гиалуроновой кислоты, объединенных с полимерными частицами, варьирует от 1 до 50 мкг⋅мг-1, предпочтительно от 5 до 30 мкг⋅мг-1 и еще более предпочтительно - от 10 до 30 мкг⋅мг-1.
Другим объектом изобретения является способ получения полимерных частиц, как определено по изобретению, включающий следующие стадии:
(i) эмульгирование с перемешиванием водного раствора гиалуроновой кислоты или солей гиалуроновой кислоты в органическом растворе, содержащем по меньшей мере полимер поли(молочная-со-гликолевая кислота) (PLGA), сополимер поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) или их смесь,
(ii) смешивание с перемешиванием эмульсии, полученной на стадии (i), с водным раствором поливинилового спирта (PVA, от англ. polyvinyl alcohol),
(iii) добавление с перемешиванием водного растворителя к эмульсии, полученной на стадии (ii), причем указанным используемым водным растворителем предпочтительно является очищенная вода,
(iv) фильтрование эмульсии, полученной на стадии (iii), для того, чтобы удалить водную фазу,
(v) лиофилизация полимерных частиц, полученных на стадии (iv), причем данная стадия обеспечивает удаление следов воды, возможно присутствующих в полимерных частицах, полученных на стадии (iv),
(vi) возможно стерилизация лиофилизированных полимерных частиц, полученных на стадии (v).
Во время стадии (i) водный раствор гиалуроновой кислоты или солей гиалуроновой кислоты может быть основан на очищенной воде и, возможно, на поливиниловом спирте (PVA); предпочтительно включают водный раствор поливинилового спирта (PVA), имеющий концентрацию поливинилового спирта (PVA) от 1 до 10 мас. %, предпочтительно от 2 до 5 мас. % и еще более предпочтительно 4 мас. %. Полимер поли(молочная-со-гликолевая кислота) (PLGA) и/или сополимер поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) предпочтительно находится в растворе в органическом растворителе, выбранном из дихлорметана, ацетона или их смеси. Стадию (i) предпочтительно проводят с перемешиванием, используя мешалку типа Ultra-Turrax® или источник ультразвука. Стадия (i) может проводиться при комнатной температуре и затем в условиях холода в бане со льдом.
Водный раствор поливинилового спирта (PVA), используемый во время стадии (ii), предпочтительно имеет концентрацию поливинилового спирта (PVA) от 1 до 10 мас. %, преимущественно от 2 до 5 мас. % и еще более преимущественно 4 мас. %. Указанный поливиниловый спирт (PVA) предпочтительно имеет молекулярную массу, варьирующую от 30000 до 50000 г⋅моль-1. Отношение по объему водного раствора поливинилового спирта (PVA) к эмульсии, полученной на стадии (i), преимущественно варьирует от 20/1 до 40/1.
Во время стадии (ii) эмульсию, полученную на стадии (i), можно инъецировать, используя шприц, в реактор, предпочтительно в гомогенизатор типа Silverson или в реактор, имеющий цилиндрическую симметрию, содержащий водный раствор поливинилового спирта (PVA). Перемешивание можно поддерживать в течение 1-10 минут перед добавлением в эмульсию водного растворителя (стадия (iii)). Перемешивание затем можно вновь поддерживать в течение 5-15 минут для того, чтобы растворитель, присутствующий в образовавшихся капельках, диффундировал в водный раствор, содержащий поливиниловый спирт (PVA), с образованием комбинации гиалуроновой кислоты с полимерными частицами. Возможно растворитель, присутствующий в эмульсии, полученной на стадии (iii), можно затем выпаривать перед фильтрованием согласно стадии (iv).
Предпочтительно стадию фильтрования (iv) проводят на гидрофильном фильтре, таком как 0,45 мкм HVLP или 3 мкм SSWP фильтры.
После стадии (iv) полученные полимерные частицы можно промывать очищенной водой.
После этой возможной стадии промывки полученные полимерные частицы можно упаковывать во флакон или шприц перед лиофилизацией.
Согласно предпочтительному воплощению после данной стадии упаковки полимерные частицы по изобретению можно приводить в контакт с поглощаемым раствором, содержащим фармацевтически или косметически приемлемый эксципиент и/или другое активное начало (отличное от гиалуроновой кислоты), причем данный раствор добавляют к полимерным частицам, полученным на стадии (iv), и после возможной стадии промывки до лиофилизации. Поглощаемым раствором по изобретению может быть очищенная вода, буферизованный водный раствор гиалуроновой кислоты (сшитой или несшитой) или солей гиалуроновой кислоты, или водный раствор другой соли, такой как хлорид натрия (NaCl), причем возможно, что указанный поглощаемый раствор также содержит, в зависимости от конечного намеченного применения, один или более чем один растворитель, выбранный из этанола, пропиленгликоля, полиэтиленгликоля, сквалена, растительных масел, таких как масла, основанные на моно-, ди- или триглицеридах, минеральные масла или жир печени трески. Данный поглощаемый раствор предпочтительно представляет собой изотоничный раствор, природа которого зависит от конечного намеченного применения. Например, он может представлять собой водный раствор несшитой гиалуроновой кислоты или солей гиалуроновой кислоты, когда конечное применение направлено на предупреждение и/или лечение остеоартрита; водный раствор сшитой гиалуроновой кислоты для заполнения морщин; или водный раствор хлорида натрия (NaCl) для мезотерапии. Преимущественно поглощаемый раствор, используемый после стадии (iv) и возможно после стадии упаковки, представляет собой очищенную воду, возможно содержащую сорбит, маннит или трегалозу, предпочтительно сорбит, в качестве фармацевтически приемлемого эксципиента и анестетик в качестве активного начала.
Выражение «фармацевтически или косметически приемлемый эксципиент» обозначает разбавители, адъюванты или носители, такие как консерванты, наполнители, разрыхлители, увлажнители, эмульгаторы, суспендирующие агенты, растворители, диспергирующие агенты, смазки, покрытия, антибактериальные и противогрибковые агенты, изотоничные агенты, агенты, замедляющие поглощение и их аналоги. Фармацевтически или косметически приемлемый эксципиент по изобретению предпочтительно выбран сорбита, маннита, трегалозы или лактозы, предпочтительно сорбита. Могут рассматриваться другие фармацевтически или косметически подходящие эксципиенты, в зависимости от конечного намеченного применения, например, для того, чтобы модифицировать цвет или вкус композиции по изобретению, если последняя предназначена для перорального применения.
Дополнительным активным началом может быть анестетик, такой как лидокаин.
Некоторые фармацевтически приемлемые эксципиенты, такие как сорбит, могут действовать в качестве фармацевтически приемлемого эксципиента и в качестве дополнительного активного начала, причем указанный сорбит, помимо его роли в качестве эксципиента, демонстрирует противовоспалительные свойства (ловушка свободных радикалов) (Mongkhon J-M. et al., Inflamm. Res., Springer, 2014).
Стадия лиофилизации (v) преимущественно проводится согласно следующему циклу:
- уменьшение температуры до температуры -38°С на протяжении периода времени, варьирующего от 30 минут до 1 ч 30 мин,
- увеличение температуры до температуры, варьирующей от -38°С до +15°С на протяжении периода времени, варьирующего от 1 ч 30 мин до 2 ч 30 мин,
- сушка при температуре +15°С в течение периода времени, варьирующего от 4 до 6 ч,
- увеличение температуры до температуры, варьирующей от +15 до +25°С на протяжении периода времени, варьирующего от 15 до 45 минут, затем
- сушка при температуре +25°С в течение периода времени от 8 до 12 ч.
Частицы лиофилизированного полимера можно затем стерилизовать стерилизацией гамма-излучением во время стадии (vi). Данный тип стерилизации делает возможным предотвращение какого-либо нарушения структуры и какое-либо вредное изменение свойств полученных полимерных частиц.
Композиция, предпочтительно фармацевтическая или косметическая композиция, содержащая полимерные частицы, как определено согласно изобретению, составляет другой объект изобретения. В такой композиции полимерные частицы находятся в суспензии в поглощаемом растворе, как определено выше, причем возможно, что указанный поглощаемый раствор является идентичным или отличным от раствора, который используется после стадии промывки, проведенной после стадии (iv). Преимущественно поглощаемый раствор, присутствующий в композиции по изобретению, представляет собой очищенную воду, буферизованный водный раствор гиалуроновой кислоты (сшитой или несшитой) или солей гиалуроновой кислоты, или водный раствор другой соли, такой как хлорид натрия (NaCl). Еще более предпочтительно, поглощаемый раствор, присутствующий в композиции по изобретению, представляет собой буферизованный водный раствор гиалуроновой кислоты (сшитой или несшитой) или солей гиалуроновой кислоты, предпочтительно в концентрации гиалуроновой кислоты или солей гиалуроновой кислоты по массе, варьирующей от 0,5 до 10 мас. % и предпочтительно от 0,5 до 4 мас. %.
Согласно преимущественному воплощению композиция по изобретению также может содержать фармацевтически или косметически приемлемый эксципиент, как описано выше. Согласно другому преимущественному воплощению композиция по изобретению также может содержать другое активное начало. Указанное дополнительное активное начало является таким, как определено выше.
Изобретение также относится к способу получения композиции, как определено согласно изобретению, включающему стадии (i)-(vi), как определено выше, и стадию (vii) суспендирования лиофилизированных полимерных частиц, полученных на стадии (v) или (vi), в поглощаемом растворе, как определено выше, причем для указанного поглощаемого раствора также возможно, что он содержит фармацевтически или косметически приемлемый эксципиент и/или другое активное начало. Преимущественно поглощаемый раствор, используемый во время стадии (vii), представляет собой очищенную воду, буферизованный водный раствор гиалуроновой кислоты (сшитой или несшитой) или солей гиалуроновой кислоты, или водный раствор другой соли, такой как хлорид натрия (NaCl). Еще более предпочтительно поглощаемый раствор, используемый во время стадии (vii), представляет собой буферизованный водный раствор гиалуроновой кислоты (сшитой или несшитой) или солей гиалуроновой кислоты, предпочтительно в концентрации гиалуроновой кислоты или солей гиалуроновой кислоты по массе, варьирующей от 0,5 до 10 мас. % и предпочтительно от 0,5 до 4 мас. %.
Другим объектом настоящего изобретения является композиция по изобретению для ее применения в качестве лекарственного средства и предпочтительно в предупреждении и/или лечении скелетно-мышечных расстройств, заболеваний и травматических состояний кожи, таких как ожоги, патологические состояния полости рта, сухость вагинальной слизистой оболочки и мочевые инфекции, глазные инфекции и ожирение, во время вставки желудочного бандажа, и также в предупреждении и/или лечении ревматологических заболеваний у животных и более конкретно у скаковых лошадей.
Более конкретно объектом изобретения является предупреждение и/или лечение:
- скелетно-мышечных расстройств, таких как остеоартрит, и более конкретно остеоартрит колена и неэкссудативный остеоартрит,
- патологических состояний полости рта, выбранных из сухости слизистых оболочек полости рта (WO 2012/093753 А1), воспаления и травматических состояний слизистой оболочки рта,
- сухости вагинальной слизистой оболочки и мочевых инфекций или цистита (WO 1996/025168 А1; ЕР 0813417 А1; S. Van Agt et al.,  en urologie, том 21, номер 3, 2011, стр. 218-225), и
en urologie, том 21, номер 3, 2011, стр. 218-225), и
- сухости роговицы и глазных инфекций.
Композиции по изобретению также можно использовать для борьбы со старением кожи и/или для восстановления кожной ткани (мезотерапия).
Наконец, данное изобретение относится к набору, содержащему:
(а) первый контейнер, содержащий полимерные частицы, как определено согласно изобретению, и
(б) второй контейнер, содержащий поглощаемый раствор, как определено выше, причем для указанного поглощаемого раствора также возможно, что он содержит фармацевтически или косметически приемлемый эксципиент и/или другое активное начало, как определено выше.
Согласно преимущественному воплощению набора по изобретению, более конкретно предназначенного для предупреждения и/или лечения скелетно-мышечных расстройств, первый контейнер представляет собой бутыль или шприц, и второй контейнер представляет собой шприц, причем указанные контейнеры соединены друг с другом через подходящий соединитель.
Таким образом, композиции по изобретению могут присутствовать либо в одном инъекционном модуле, либо в двух частях (набора) и, в последнем случае, могут быть смешаны во время применения, до инъекции in situ либо внутриартериальным путем для лечения суставов, либо подкожным путем для восстановления кожи.
Последний объект изобретения направлен на готовый к применению шприц, содержащий композицию, как определено согласно изобретению. Такой шприц особенно подходит для косметического применения, например, для ухода за и для восстановления эпидермиса путем коррекции или увлажнения.
Помимо предыдущих положений данное изобретение также включает другие положения, которые будут возникать из остальной части описания, которая следует далее, которая относится к примерам получения полимерных частиц и композиций согласно изобретению и к оценке in vivo толерантности к данным композициям во время инъекций во внутрисуставное пространство кроликов и также к приложенным графическим материалам, в которых:
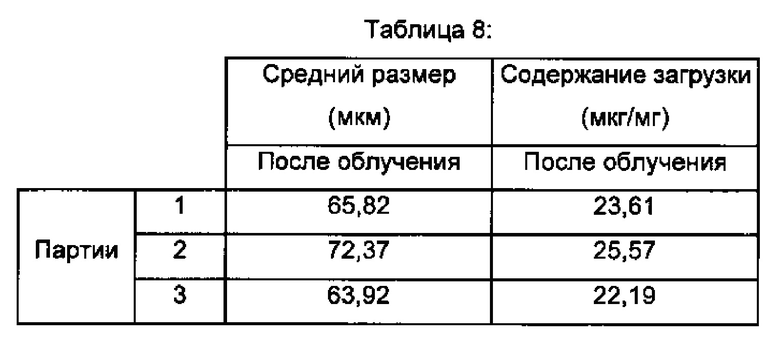
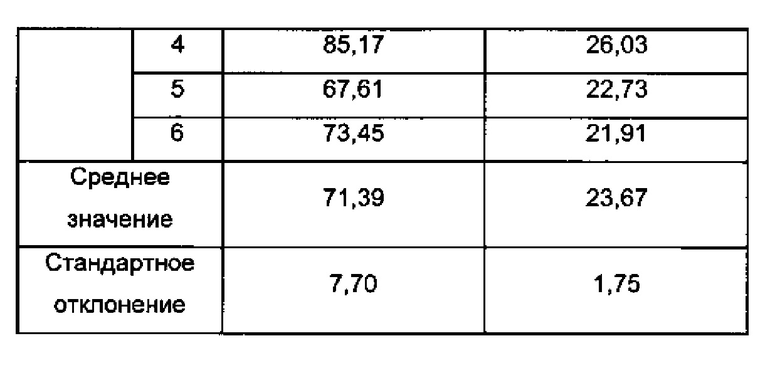
- Фиг. 1а и 1б представляют собой соответственно изображения полимерных частиц, в которых связанные молекулы гиалуроновой кислоты согласно изобретению получены согласно примеру 1 и примеру 2 (изображения сканирующей электронной микроскопии),
- Фиг. 2а и 2б соответственно представляют полимерные частицы PLGA согласно изобретению, объединенные с молекулами гиалуроновой кислоты (Фиг. 2а), и полимерные частицы PLGA-PEG-PLGA согласно изобретению, объединенные с молекулами гиалуроновой кислоты (Фиг. 2б),
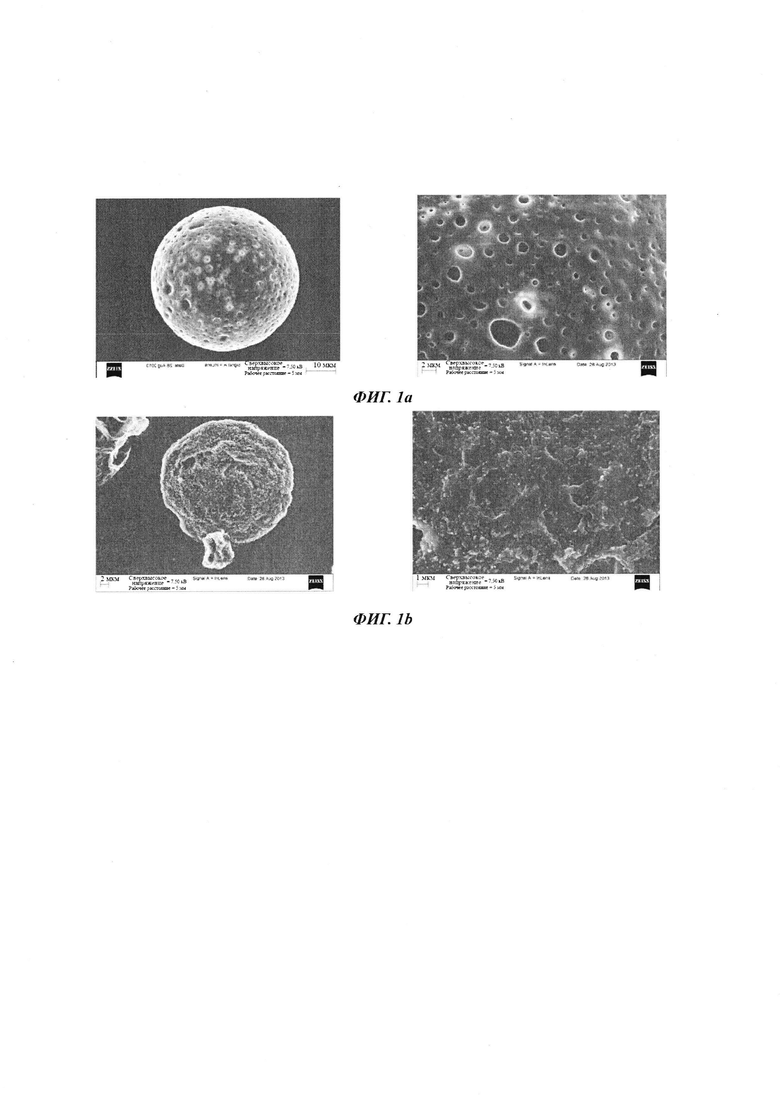
- Фиг. 3 представляет профиль высвобождения полимерных частиц, объединенных с молекулами гиалуроновой кислоты, полученных согласно примеру 1, и
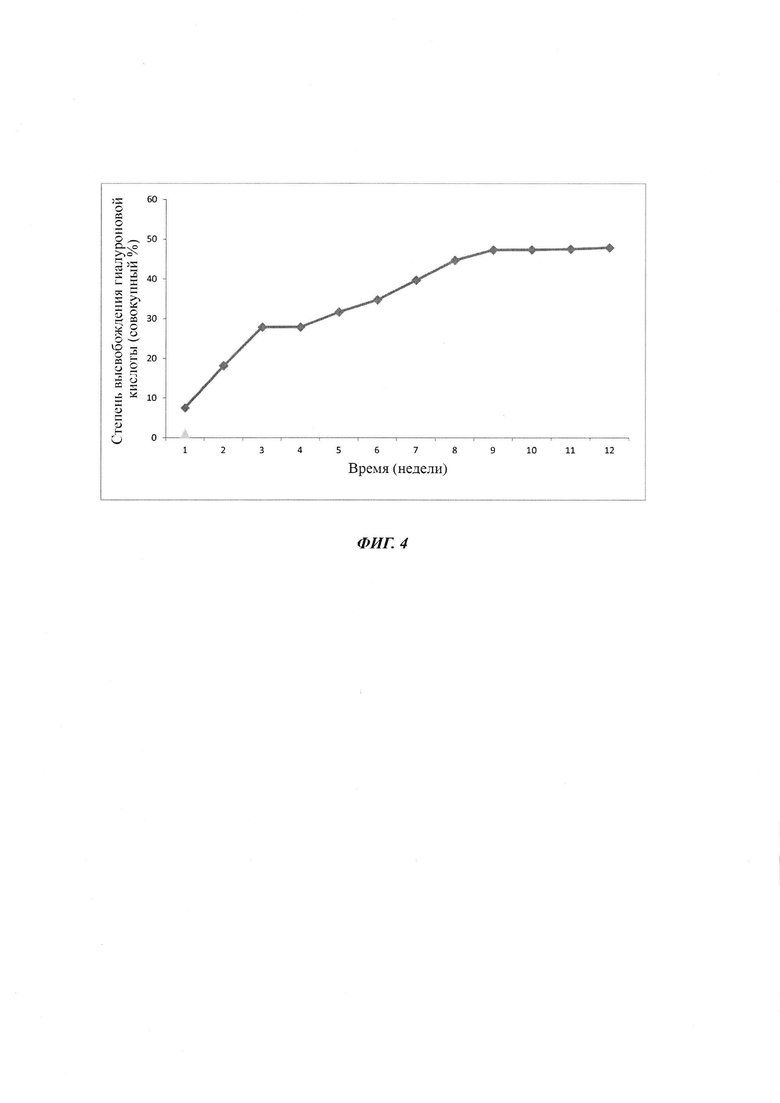
- Фиг. 4 представляет собой профиль высвобождения полимерных частиц, объединенных с молекулами гиалуроновой кислоты, полученных согласно примеру 2.
Примеры:
Исходными используемыми веществами были следующие:
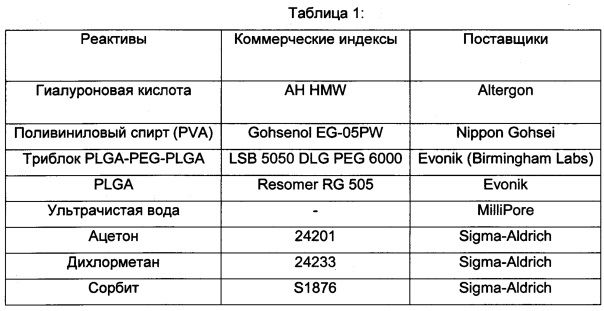
Пример 1:
Получение полимерных частиц согласно изобретению:
1-я стадия: «первичное» эмульгирование
Водный раствор гиалуроновой кислоты получают растворением 50 мг гиалуроновой кислоты в 5 мл 4%-ного по массе раствора поливинилового спирта (PVA). Органический раствор полимера также получают растворением 900 мг триблокполимера PLGA-PEG-PLGA в 12 мл смеси дихлорметан/ацетон (3/1 об./об.). Два этих раствора эмульгируют при комнатной температуре в течение двух минут с мешалкой типа Ultra-Turrax® IKA Т25 Basic при скорости 16000 оборотов/минуту и одновременно с магнитным перемешиванием с использованием магнитного бруска при скорости 500 оборотов/минуту. Второй цикл перемешивания проводится идентичным образом в бане со льдом.
2-я стадия: «вторичное» эмульгирование
Стабильная эмульсия, полученная на 1-й стадии, вводится в стеклянный шприц и затем инъецируется в реактор для приготовления композиции, содержащий 450 мл 4%-ного по массе поливинилового спирта (PVA), с магнитным перемешиванием при скорости 750 оборотов/минуту.
3-я стадия: добавление водного растворителя
Перемешивание поддерживается в течение двух минут и затем в реактор добавляют 500 мл ультрачистой воды (удельное сопротивление больше чем 18 МΩ⋅см-1). Затем поддерживают перемешивание в течение еще десяти минут при скорости 750 оборотов/минуту. Растворитель, присутствующий в преформированных капельках, затем диффундирует в водную фазу, содержащую поливиниловый спирт (PVA), и затем образуются полимерные частицы, объединенные с молекулами гиалуроновой кислоты.
4-я стадия: очистка и экстракция растворителя
Растворитель, присутствующий в эмульсии, полученной на 3-й стадии, затем выпаривают посредством магнитного перемешивания при скорости 500 оборотов/минуту в течение 4 ч при 20°С в тяге.
Полимерные частицы, загруженные гиалуроновой кислотой, затем фильтруют на 3 мкм гидрофильном фильтре SSWP для того, чтобы удалить водную фазу. Полученные частицы затем промывают ультрачистой водой в пропорции 3 л на 900 мг частиц.
Полимерные частицы затем упаковывают в бутыли, сделанные из желтого стекла, высотой 50 мм и диаметром 24 мм (150 мг частиц на бутыль). Частицы затем покрывают 1 мл ультрачистой воды на 150 мкг полимерных частиц.
5-я стадия: лиофилизация и стерилизация
Полимерные частицы, присутствующие в бутылях, затем лиофилизируют для того, чтобы получить лиофилизат сухих частиц. Лиофилизацию проводят согласно следующему циклу: уменьшение температуры до температуры -38°С на протяжении 1 ч, затем увеличение температуры от -38°С до +15°С на протяжении 2 ч, с последующей сушкой при +15°С в течение 5 ч, затем увеличение температуры от +15°С до +25°С на протяжении 30 мин, с последующей сушкой при +25°С в течение 10 ч.
Лиофилизированные частицы, загруженные гиалуроновой кислотой, затем стерилизуют облучением гамма-излучением при 15 кГр.
6-я стадия:
150 мг полимерных частиц растворяют в 1 мл стерильного водного раствора, содержащего 2 мл NaCl, в котором растворены 16 мг гиалуроновой кислоты. Растворение проводится с использованием шприцевой системы Luer-Lock®.
Анализ полимерных частиц по изобретению согласно примеру 1:
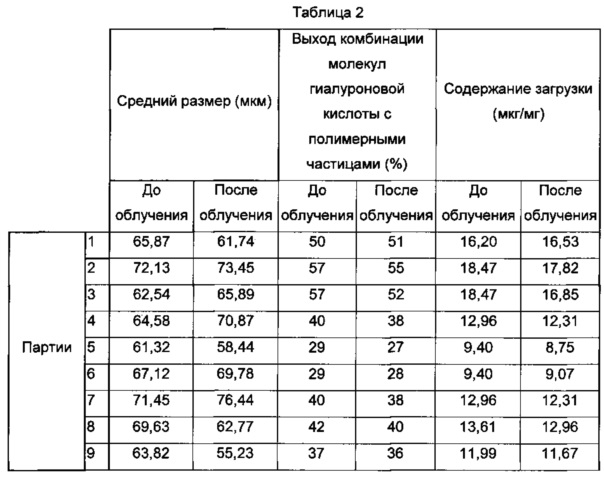
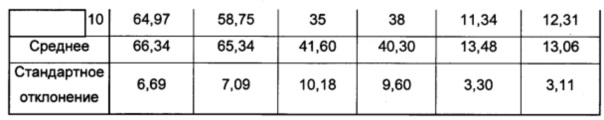
Анализы проводили на 10 партиях полимерных частиц согласно изобретению. Полученные результаты являются следующими:
- размер полученных частиц по полидисперсности согласно анализу размера частиц с использованием счетчика Multisizer® 3 Coulter (Beckman Coulter): 66,34 мкм плюс/минус 3,6 мкм (до облучения) и 65,34 мкм плюс/минус 7,09 мкм (после облучения),
- содержание гиалуроновой кислоты: 13 мкг гиалуроновой кислоты на мг лиофилизированных полимерных частиц и
- выход комбинации молекул гиалуроновой кислоты с полимерными частицами - приблизительно 40%.
Полученные результаты обобщены в таблице 2 (размер частиц, загруженных гиалуроновой кислотой, выход комбинации молекул гиалуроновой кислоты с полимерными частицами и содержание загрузки гиалуроновой кислоты в частицах).
Изображения полимерных частиц, объединенных с молекулами гиалуроновой кислоты, согласно изобретению, полученных согласно примеру 1, представлены на фиг. 1а.
Результаты:
Профиль высвобождения полимерных частиц, связанных с молекулами гиалуроновой кислоты, полученных согласно примеру 1, представлен на фиг. 3. Измерения проводили в биомиметической среде - среде, аналогичной синовиальной жидкости (среда, лишенная белков, имеющая вязкость, идентичную вязкости синовиальной жидкости), воссозданной согласно N. Gerwin et al., Advanced Drug Delivery Reviews, 2006, 58, 226-242 (проведение анализа один раз в неделю в течение 12 недель с совокупными результатами в каждом случае). Полимерные частицы по изобретению добавляли к данной среде при 37°С с перемешиванием и затем центрифугировали для того, чтобы выделить высвобожденную гиалуроновую кислоту и проанализировать высвобожденную гиалуроновую кислоту способом анализа со Stain-All (колориметрический анализ с комплексом Stain-All при 460 нм) (Fagnola М. et al., Contact Lens & Anterior Eye, 2009, 108-112; Langeslay D.J. et al., Proteoglycans: Methods and Protocols, Methods in Molecular Biology, Vol. 836, Chap. 9, pp. 131-143). Для того, чтобы экстрагировать среду для анализа с гиалуроновой кислотой, 10 мг полимерных частиц согласно изобретению смешивают в течение 30 секунд с 2 мл CH2Cl2 при перемешивании на мешалке вихревого типа (Vortex-Genie 2, Scientific Industries, Bohemia, Нью Йорк, США), дают постоять в течение 5 мин перед добавлением 2 мл воды при перемешивании на мешалке вихревого типа, дают постоять в течение 30 мин и затем центрифугируют при скорости 3500 оборотов/мин при 4°С в течение 5 мин (центрифуга Jouan Thermo CR3). 150 мкл выделенной водной фазы смешивают в течение 30 секунд с 1850 мл воды при рН 7,4 при перемешивании на мешалке вихревого типа (Vortex-Genie 2, Scientific Industries, Bohemia, Нью Йорк, США). Затем добавляют в среду раствор Stain-All (1 мл), и анализ проводят при поглощении 640 нм с использованием спектрофотометра, работающего в УФ (ультрафиолетовая область) - видимой области, с использованием калибровочной кривой для гиалуроновой кислоты.
Оценки толерантности in vivo также проводили на фармацевтической композиции, полученной согласно примеру 1. Данная композиция инъецируется во внутрисуставное пространство кроликов, и был исследован эффект на синовиальную оболочку и на синовиальную жидкость. Количественные и полуколичественные анализы тканевых эффектов проводили согласно стандарту ISO 10993-6 на разных циркулирующих клетках иммунной системы. Результаты, полученные в отношении синовиальной оболочки, представлены в таблице 3, и результаты, полученные в отношении синовиальной жидкости, представлены в таблице 4.
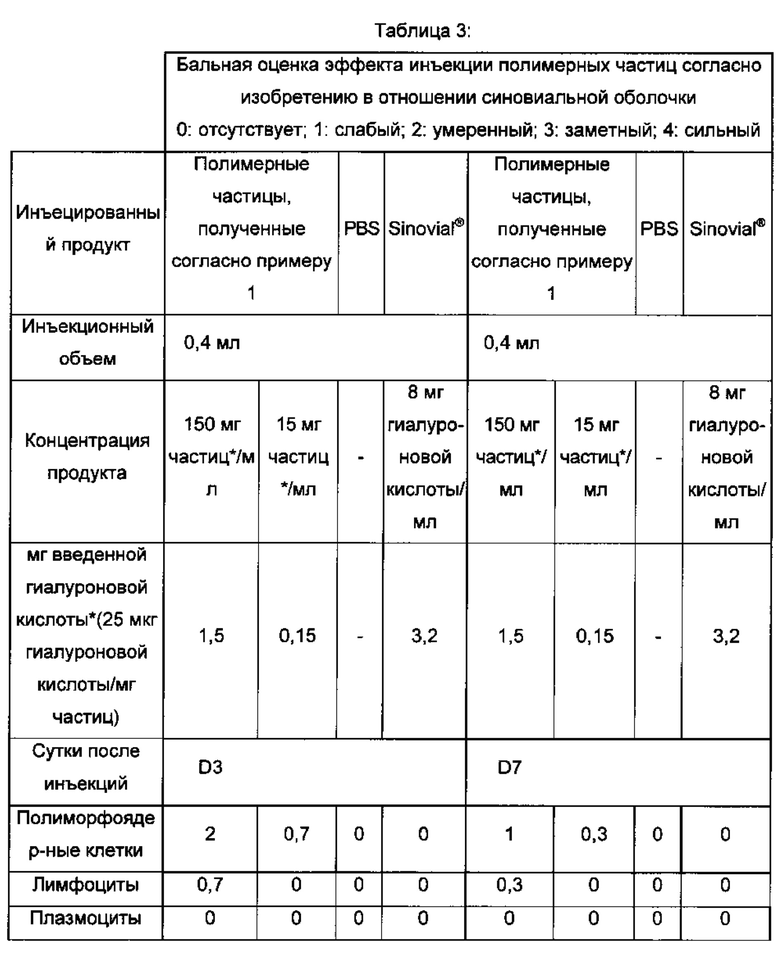
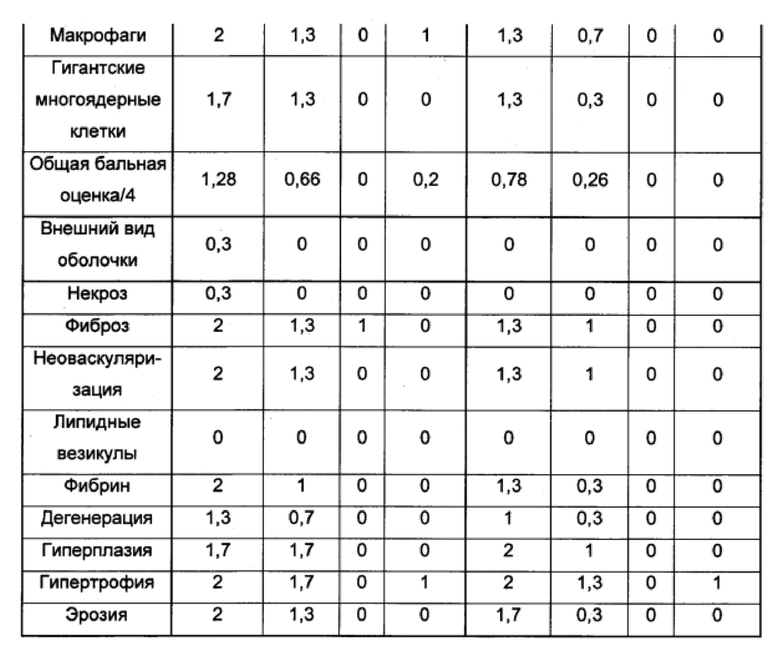
Данные результаты демонстрируют то, что инъецированная композиция по изобретению хорошо переносится синовиальной оболочкой сустава кроликов. Легкий воспалительный эффект при наивысшей дозе, наблюдаемый на 3-й сутки, исчезает на 7-е сутки.
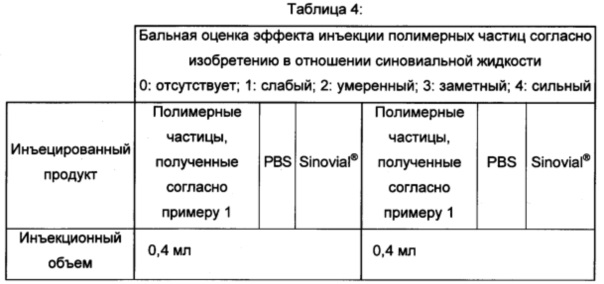
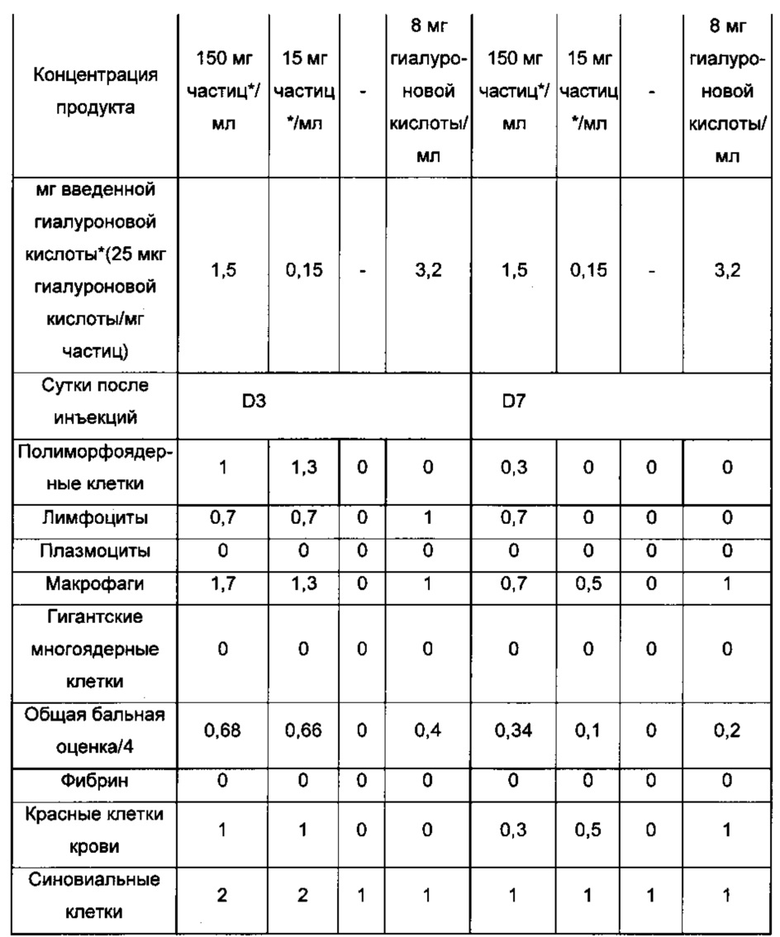
Данные результаты показывают то, что инъецируемая композиция согласно изобретению хорошо переносится в том, что касается синовиальной жидкости кроликов.
Затем проводили макроскопические измерения воспаления коленного сустава кроликов в месте, где была инъецирована композиция согласно изобретению. Толщину сустава относительно суток 0 (D0) измеряли с использованием штангенциркуля с нониусом. «Макроскопические измерения отека (%/D0)», представленные в таблице 5 ниже, представляют увеличение в виде % объема отека относительно D0.
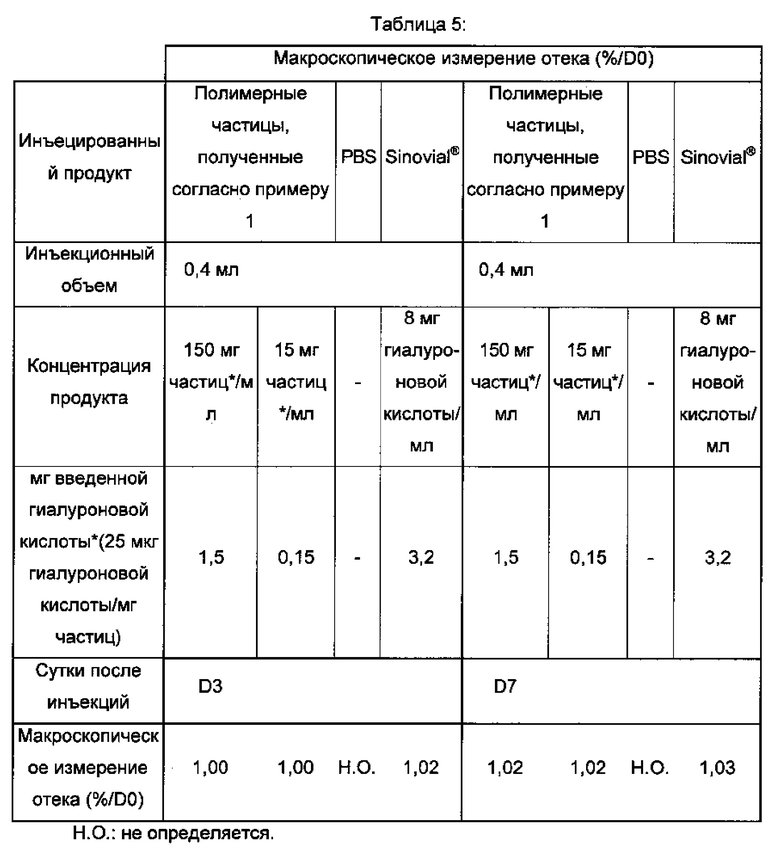
Данные результаты показывают то, что инъецированная композиция согласно изобретению хорошо переносится в том, что касается коленного сустава кроликов, и не вызывает макроскопического отека.
Пример 2:
Получение полимерных частиц согласно изобретению:
Для получения полимерных частиц согласно изобретению используется способ, аналогичный способу примера 1. Единственным изменением, которое было сделано по отношению к способу примера 1, является получение «вторичной» эмульсии во время 2-ой стадии с использованием мешалки Сильверсона на скорости 2800 оборотов/минуту, вместо магнитного перемешивания при 750 оборотах/минуту в примере 1.
Анализ полимерных частиц по изобретению согласно примеру 2:
Анализы проводили на 10 партиях полимерных частиц согласно изобретению. Полученные результаты являются следующими:
- размер частиц, полученный по полидисперсности, согласно анализу размера частиц с использованием счетчика Multisizer® 3 Coulter (Beckman Coulter): 34,98 мкм плюс/минус 7,02 мкм (до облучения) и 34,12 мкм плюс/минус 7,23 мкм (после облучения),
- содержание загрузки гиалуроновой кислоты - 16 мкг гиалуроновой кислоты на мг лиофилизированных полимерных частиц и
- выход комбинации молекул гиалуроновой кислоты с полимерными частицами приблизительно 20%.
Полученные результаты обобщены в таблице 6 (размер частиц, загруженных гиалуроновой кислотой, выход комбинации молекул гиалуроновой кислоты с полимерными частицами и содержание загрузки гиалуроновой кислоты в частицах).
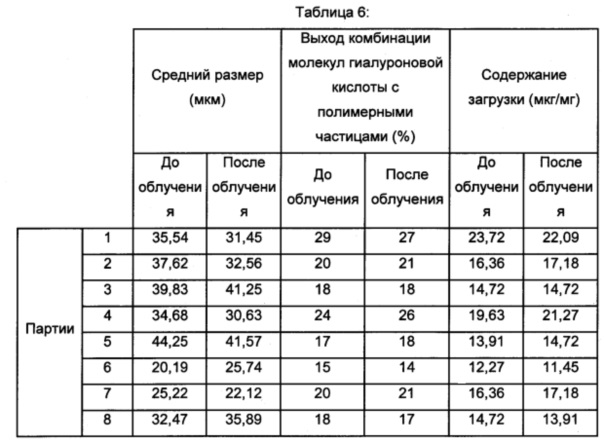
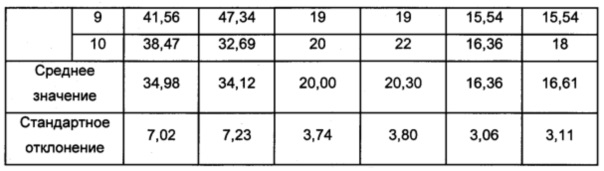
Изображения полимерных частиц, объединенных с молекулами гиалуроновой кислоты согласно изобретению, полученных согласно примеру 2, представлены на фиг. 16.
Результаты:
Профиль высвобождения молекул гиалуроновой кислоты, объединенных с полимерными частицами, полученными согласно примеру 2, представлен на фиг. 4.
Пример 3:
Получение полимерных частиц согласно изобретению:
Для того чтобы получить полимерные частицы согласно изобретению, использовали способ, аналогичный способу примера 2. Единственным изменением, которое делается по отношению к способу примера 2, является добавление фармацевтически приемлемого эксципиента, также имеющего противовоспалительные свойства (ловушка свободных радикалов), а именно 1 мл сорбита в форме 10%-ного по массе раствора сорбита в ультрачистой воде, вместо ультрачистой воды, используемой в примере 2.
Анализ полимерных частиц по изобретению согласно примеру 3:
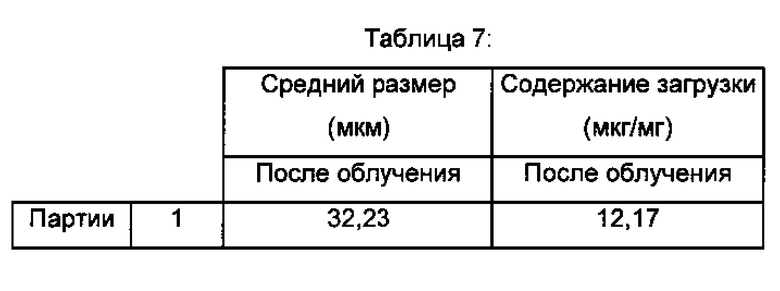
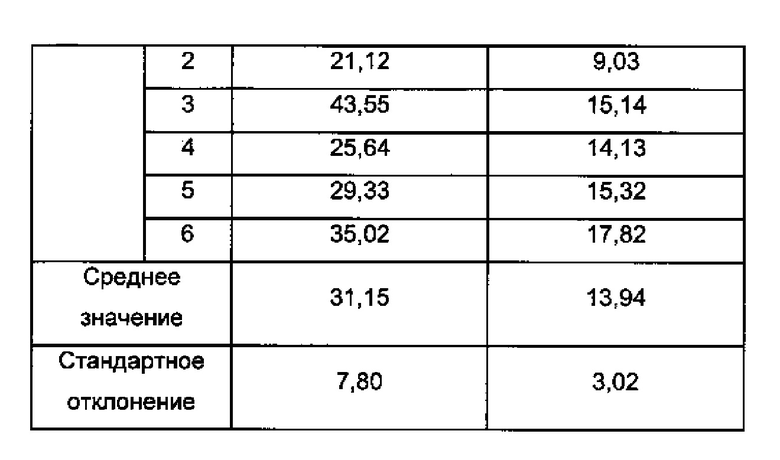
Анализы проводили на 6 партиях полимерных частиц согласно изобретению. Полученные результаты являются следующими:
- размер частиц, определенный по полидисперсности, согласно анализу размера частиц с использованием счетчика Multisizer® 3 Coulter (Beckman Coulter): 31,15 мкм плюс/минус 7,80 мкм и
- содержание загрузки гиалуроновой кислоты - 13,94 мкг гиалуроновой кислоты на мг лиофилизированных полимерных частиц.
Пример 4:
Получение полимерных частиц согласно изобретению:
Для того чтобы получить полимерные частицы согласно изобретению, использовали способ, аналогичный способу примера 1. Единственным изменением, которое делается по отношению к способу примера 1, является добавление фармацевтически приемлемого эксципиента, также имеющего противовоспалительные свойства (ловушка свободных радикалов), а именно 1 мл сорбита в форме 10%-ного по массе раствора сорбита в ультрачистой воде, вместо ультрачистой воды, используемой в примере 1.
Анализ полимерных частиц по изобретению согласно примеру 4:
Данные анализы проводили на 6 партиях полимерных частиц согласно изобретению. Полученные результаты являются следующими:
- размер частиц, определенный по полидисперсности согласно анализу размера частиц с использованием счетчика Multisizer® 3 Coulter (Beckman Coulter): 71,39 мкм плюс/минус 7,70 мкм и
- содержание загрузки гиалуроновой кислоты - 23,67 мкг гиалуроновой кислоты на мг лиофилизированных полимерных частиц.

Группа изобретений относится к полимерным частицам, обеспечивающим длительную диффузию гиалуроновой кислоты. Полимерные частицы состоят по меньшей мере из сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) или смеси полимера поли(молочная-со-гликолевая кислота) (PLGA) и сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA), объединенные с молекулами гиалуроновой кислоты или с солями гиалуроновой кислоты, и где сополимер поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) имеет молекулярную массу, варьирующуюся от 50000 до 70000 г⋅моль-1. Также раскрыты способ получения полимерных частиц, инъецируемая композиция гиалуроновой кислоты, способ получения композиции, применение композиции для борьбы со старением кожи и для восстановления кожной ткани, набор для приготовления инъецируемой композиции гиалуроновой кислоты. Группа изобретений обеспечивает медленный профиль высвобождения гиалуроновой кислоты. 7 н. и 24 з.п. ф-лы, 6 ил., 8 табл., 4 пр.
1. Полимерные частицы, обеспечивающие длительную диффузию гиалуроновой кислоты, состоящие по меньшей мере из сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) или смеси полимера поли(молочная-со-гликолевая кислота) (PLGA) и сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA), объединенные с молекулами гиалуроновой кислоты или с солями гиалуроновой кислоты, и где сополимер поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) имеет молекулярную массу, варьирующуюся от 50000 до 70000 г⋅моль-1.
2. Полимерные частицы по п. 1, в которых молекулы гиалуроновой кислоты или соли гиалуроновой кислоты связаны через водородные связи и/или ванн-дер-ваальсовы связи с полимером поли(молочная-со-гликолевая кислота) и/или сополимером поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота).
3. Полимерные частицы по п. 1 или 2, где указанные частицы состоят только из сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA).
4. Полимерные частицы по п. 1 или 2, где указанные частицы состоят из смеси полимера поли(молочная-со-гликолевая кислота) (PLGA) и сополимера поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA).
5. Полимерные частицы по п. 4, в которых отношение по массе полимера поли(молочная-со-гликолевая кислота) (PLGA) к сополимеру поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) варьирует от 40/60 до 60/40 и предпочтительно составляет 50/50.
6. Полимерные частицы по п. 1, в которых молекулы гиалуроновой кислоты имеют молекулярную массу, варьирующую от 0,8×106 до 1,2×106 г⋅моль-1.
7. Полимерные частицы по п. 1, имеющие размер, варьирующий от 10 до 130 мкм и, предпочтительно, от 20 до 85 мкм.
8. Полимерные частицы по п. 1, в которых содержание по массе гиалуроновой кислоты или солей гиалуроновой кислоты, объединенных с сополимером PLGA-PEG-PLGA или смесью полимера PLGA и сополимера PLGA-PEG-PLGA, варьируется от 1 до 50 мкг⋅мг-1, предпочтительно от 5 до 30 мкг⋅мг-1 и еще более предпочтительно от 10 до 30 мкг мг-1.
9. Способ получения полимерных частиц, как определено по любому из пп. 1-8, включающий следующие стадии:
(i) эмульгирование с перемешиванием водного раствора гиалуроновой кислоты или солей гиалуроновой кислоты в органическом растворе, содержащем по меньшей мере полимер поли(молочная-со-гликолевая кислота) (PLGA), сополимер поли(молочная-со-гликолевая кислота)-полиэтиленгликоль-поли(молочная-со-гликолевая кислота) (PLGA-PEG-PLGA) или их смесь,
(ii) смешивание с перемешиванием эмульсии, полученной на стадии (i), с водным раствором поливинилового спирта (PVA),
(iii) добавление с перемешиванием водного растворителя к эмульсии, полученной на стадии (ii),
(iv) фильтрование эмульсии, полученной на стадии (iii),
(v) лиофилизация полимерных частиц, полученных на стадии (iv),
(vi) стерилизация лиофилизированных полимерных частиц, полученных на стадии (v).
10. Способ по п. 9, в котором указанным водным растворителем является очищенная вода.
11. Способ по п. 9, в котором водный раствор гиалуроновой кислоты или солей гиалуроновой кислоты со стадии (i) представляет собой водный раствор поливинилового спирта (PVA), содержащий гиалуроновую кислоту или соли гиалуроновой кислоты, имеющий концентрацию поливинилового спирта (PVA) от 1 до 10 мас. %, предпочтительно от 2 до 5 мас. % и еще более предпочтительно 4 мас. %.
12. Способ по любому из пп. 9-11, в котором водный раствор поливинилового спирта (PVA), используемый на протяжении стадии (ii), имеет концентрацию поливинилового спирта (PVA) от 1 до 10 мас. %, предпочтительно от 2 до 5 мас. % и еще более предпочтительно 4 мас. %.
13. Способ по п. 9, в котором растворитель, присутствующий в эмульсии, полученной на стадии (iii), выпаривают перед фильтрованием согласно стадии (iv).
14. Способ по п. 9, в котором полимерные частицы, полученные на стадии (iv), промывают очищенной водой перед лиофилизацией согласно стадии (v).
15. Способ по п. 9, в котором поглощаемый раствор, содержащий фармацевтически или косметически приемлемый эксципиент и/или другое активное начало, добавляют к полимерным частицам, полученным на стадии (iv), перед лиофилизацией согласно стадии (v), причем указанный поглощаемый раствор предпочтительно представляет собой очищенную воду, указанный эксципиент предпочтительно выбран из сорбита, маннита или трегалозы, и указанное другое активное начало предпочтительно представляет собой анестетик.
16. Способ по п. 9, в котором стадия стерилизации (vi) проводится посредством стерилизации гамма-излучением.
17. Инъецируемая композиция гиалуроновой кислоты, содержащая частицы, обеспечивающие длительную диффузию гиалуроновой кислоты, как определено по любому из пп. 1-8, в суспензии в поглощаемом растворе.
18. Композиция по п. 17, в которой указанный поглощаемый раствор представляет собой раствор очищенной воды, водный раствор гиалуроновой кислоты или солей гиалуроновой кислоты, или водный раствор другой соли.
19. Композиция по п. 17, в которой поглощаемый раствор представляет собой водный раствор гиалуроновой кислоты или солей гиалуроновой кислоты, концентрация гиалуроновой кислоты или солей гиалуроновой кислоты которого варьирует от 0,5 до 10 мас. % и предпочтительно от 0,5 до 4 мас. %.
20. Композиция по п. 17, где указанная композиция также содержит фармацевтически или косметически приемлемый эксципиент, предпочтительно выбранный из сорбита, маннита или трегалозы.
21. Композиция по п. 17, где указанная композиция также содержит другое активное начало, предпочтительно анестетик.
22. Композиция по п. 17, где указанная композиция содержится в шприце.
23. Композиция по любому из пп. 17-22 для ее применения в качестве лекарственного средства.
24. Композиция для ее применения по п. 22 в предупреждении или лечении скелетно-мышечных расстройств, заболеваний и травматических состояний кожи, патологических состояний полости рта, сухости вагинальной слизистой оболочки и мочевых инфекций или цистита, сухости роговицы, глазных инфекций и ожирения.
25. Композиция для ее применения по п. 24, при котором скелетно-мышечное расстройство представляет собой остеоартрит и, более конкретно, остеоартрит колена или неэкссудативный остеоартрит.
26. Композиция для ее применения по п. 24, при котором патологические состояния полости рта выбраны из сухости слизистых оболочек рта, воспаления и травматических состояний слизистой оболочки рта.
27. Применение композиции по любому из пп. 17-22 для борьбы со старением кожи.
28. Применение композиции по любому из пп. 17-22 для восстановления кожной ткани.
29. Способ получения композиции, как определено по любому из пп. 17-21, включающий стадии (i)-(vi), как определено выше по пп. 9-16, и стадию (vii) суспендирования лиофилизированных полимерных частиц, полученных на стадии (v) или (vi), в поглощаемом растворе, как определено по пп. 17-19.
30. Набор для приготовления инъецируемой композиции гиалуроновой кислоты, содержащий:
(а) первый контейнер, содержащий полимерные частицы, обеспечивающие длительную диффузию гиалуроновой кислоты, как определено по любому из пп. 1-8, и
(б) второй контейнер, содержащий поглощаемый раствор, как определено по пп. 17-19, причем для указанного поглощаемого раствора возможно, что он содержит фармацевтически или косметически приемлемый эксципиент, как определено по п. 20, и/или другое активное начало, как определено по п. 21.
31. Набор по п. 30, в котором первый контейнер представляет собой бутыль или шприц, и второй контейнер представляет собой шприц, причем указанные контейнеры связаны друг с другом посредством подходящего соединителя.
| US 20060040894 A1, 23.02.2006 | |||
| US 7456275 B2, 25.11.2008 | |||
| US 20080124400 A1, 29.05.2008 | |||
| US 5972906 A, 26.10.1999 | |||
| WO 2003041685 A1, 22.05.2003 | |||
| RAVI B | |||
| PATEL ET AL | |||
| CHARACTERIZATION OF FORMULATION PARAMETERS AFFECTING LOW MOLECULAR WEIGHT DRUG RELEASE FROM IN SITU FORMING DRUG DELIVERY SYSTEMS/ J Biomed Mater Res A | |||
| Экономайзер | 0 |
|
SU94A1 |
| Электрический аппарат для охраны касс, основанный на действии катодного реле | 1922 |
|
SU476A1 |
| ГЕЛЬ ГИАЛУРОНОВОЙ КИСЛОТЫ ДЛЯ ВНУТРИКОЖНОЙ ИНЪЕКЦИИ | 2007 |
|
RU2448740C2 |
Авторы
Даты
2019-09-18—Публикация
2014-08-06—Подача