ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к гемостатическому продукту со свойством адгезии к тканям, содержащему твердый пористый субстрат и покрытие, которое содержит электрофильно активированный полиоксазолин (EL-POX). Этот новый гемостатический продукт демонстрирует превосходную способность к биологическому разложению, адгезивность и гемостатические свойства. Примеры гемостатических продуктов, включенных в настоящее изобретение, включают гемостатические ячеистые материалы, гемостатические пенистые материалы и гемостатические порошки.
Также предоставлен способ получения гемостатического продукта со свойством адгезии к тканям, который включает покрытие твердого пористого субстрата электрофильно активированным полиоксазолином (EL-POX).
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
Перевязочные средства для ран формируют важный сегмент глобального рынка ухода за ранами. Эти продукты широко используют при лечении травм, таких как раны, кровотечения, поврежденные ткани и тканевые кровотечения. Идеальное перевязочное средство должно предотвращать избыточное кровотечение и обеспечивать быстрое заживление при приемлемых затратах с минимальным неудобством для пациента.
Гемостатические свойства перевязочного средства для ран определяют структура и пористость материала. В отношении пористости, поры перевязочного средства, как правило, являются настолько маленькими, что они не видны глазом человека при поверхностном осмотре. Однако они обладают достаточным размером, чтобы не только обеспечить достаточное испарение влаги кожи и раневые испарения, но также допускают впитывание крови так, что перевязочное средство после коагуляции крови плотно закрепляется на ткани.
Перевязочные средства для ран должны быть способны поддерживать влажную среду вокруг раны, эффективную циркуляцию кислорода, способствуя регенерации клеток и тканей, и низкую бактериальную нагрузку. Перевязочные средства для ран, которые применяют при хирургических операциях и которые остаются в организме, должны быть биоразлагаемыми и полностью рассасывающимися.
Общепринятые перевязочные средства для ран со свойством адгезии к тканям включают фибриновые герметики, герметики на основе цианоакрилатов и другие синтетические герметики и полимеризуемые мономеры. Эти средства для адгезии к тканям подходят только для специальных применений ввиду нескольких недостатков, включая высвобождение токсичных продуктов разрушения, высокую стоимость, необходимость хранения при пониженной температуре, медленное отверждение, ограниченную механическую прочность и риск инфекции. Таким образом, на основе реакционноспособных предшественников полиэтиленгликоля (PEG) разработаны гидрогелевые средства для адгезии к тканям. Однако эти гидрогелевые средства для адгезии к тканям слишком быстро разбухают или растворяются, или у них отсутствует достаточная прочность сцепления, таким образом, снижающие их эффективность в качестве хирургического адгезивного средства. Кроме того, свойства такого материала на основе PEG непросто контролировать.
Другим широко используемым примером гемостатического продукта являются гемостатические порошки. Примеры коммерчески доступных гемостатических порошков, также известных как кровоостанавливающие порошки, включают абсорбирующий гемостатический желатиновый порошок (порошок спонгостан (Spongostan®)) и нагруженную кальцием форму цеолита, также известную как квикклот (QuikClot®). Эти гемостатические порошки можно использовать для остановки тяжелого кровотечения.
В US 5614587 описаны композиции на основе коллагена, пригодные для прикрепления тканей, или прикрепления тканей к синтетическим имплантируемым материалам. Композиции содержат фибриллярный коллаген, средство разрушения волокон и многофункциональный активированный синтетический гидрофильный полимер, такое как полиэтиленгликоль, где коллаген и синтетический полимер ковалентно связаны, формируя конъюгат коллаген-синтетический полимер.
В WO 2004/028404 описан тканевой герметик, состоящий из синтетического коллагена или синтетического желатина и электрофильного сшивающего средства, который предоставлен в сухом состоянии. В этой международной публикации сшивающее средство содержит электрофильно активированный (EA) поли(этиленгликоль) (PEG) или EA производное PEG, такой как сложный сукцинимидильный эфир PEG, в частности сукцинимидилпропионат PEG, сукцинимидилбутаноат PEG или сукцинимидилглутарат PEG. После увлажнения этой композиции при соответствующем pH происходит реакция между этими 2 компонентами и формируется гель с герметизирующими свойствами.
В US 2011/0251574 описана гемостатическая пористая составная губка, содержащая матрикс из биоматериала и гидрофильный полимерный компонент, содержащий реакционноспособные группы, где указанный полимерный компонент наносят на поверхность указанного матрикса из биоматериала или указанный матрикс пропитывают указанным полимерным материалом или и то, и другое. В предпочтительном варианте осуществления полимер представляет собой полиалкиленоксидный полимер, более конкретно мультиэлектрофильный полиэтиленгликоль (PEG). Материал матрикса можно выбирать из коллагена, желатина, фибрина, полисахарида (такого как хитозан), синтетического биоразлагаемого биоматериала (такого как полимолочная кислота или полигликолевая кислота) и их производных.
В US 2010/069579 описано подвергнутое концевому активированию полиоксазолиновое (POZ) соединение, где указанное POZ соединение содержит POZ полимер с одной активной функциональной группой на его конце, где указанная функциональная группа способна к реакции с группой на молекуле-мишени с получением конъюгата молекула-мишень-POZ, где все связи между молекулой-мишенью и POZ соединением являются устойчивыми к гидролизу связями.
В WO 2012/057628 описаны сшитые полиоксазолиновые полимеры со свойствами адгезии к тканям вследствие присутствия электрофильных групп, способных к реакции с содержащими нуклеофилы химическими структурными элементами природных тканей.
Целью изобретения является предоставления гемостатического продукта со свойством адгезии к тканям с улучшенными свойствами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения установили, что гемостатический продукт со свойством адгезии к тканям с улучшенными свойствами можно получать способом, который включает следующие этапы:
· предоставление твердого пористого субстрата;
· покрытие субстрата покрывающей жидкостью, содержащей электрофильно активированный полиоксазолин (EL-POX) и растворитель, с получением покрытого субстрата, где указанный EL-POX содержит по меньшей мере 2 реакционноспособные электрофильные группы;
· удаление растворителя с покрытого субстрата.
Авторы изобретения неожиданно выявили, что EL-POX можно наносить на твердый пористый субстрат способом по настоящему изобретению без негативного воздействия на пористую структуру субстрата. Способ по настоящему изобретению позволяет наносить покрытие с EL-POX, которое оставляет пористую структуру субстрата в основном неизменной так, что способность пористого субстрата впитывать жидкости организма, такие как кровь, остается по существу незатронутой. Покрытый EL-POX гемостатический продукт, получаемый способом по настоящему изобретению, обладает превосходными адгезионными свойствами вследствие наличия электрофильных реакционноспособных групп, которые способны к реакции, например, с аминогруппами, которые в природе присутствуют в ткани, с формированием ковалентных связей.
Настоящее изобретение также относится к гемостатическому продукту со свойством адгезии к тканям, выбранному из покрытого ячеистого материала, покрытого пенистого материала и покрытого порошка, где указанный гемостатический продукт содержит:
· твердый пористый субстрат с пористостью по меньшей мере 5% об. и с внешней поверхностью, которая содержит нуклеофильный полимер, содержащий реакционноспособные нуклеофильные группы;
· адгезивное покрытие, которое покрывает по меньшей мере часть твердого субстрата, где указанное покрытие содержит электрофильно активированный полиоксазолин (EL-POX), где указанный EL-POX содержит в среднем по меньшей мере 1 реакционноспособную электрофильную группу.
Полимер EL-POX, содержащийся в покрытии гемостатического продукта, обеспечивает преимущество тем, что он может нести большое количество электрофильных реакционноспособных групп вследствие того факта, что полимер EL-POX может содержать большое количество боковых групп, каждая из которых может нести одну или несколько таких реакционноспособных групп. Таким образом, адгезивные свойства гемостатического продукта можно оптимизировать для определенных применений, выбирая EL-POX с оптимальной плотностью электрофильных групп. Также, изменяя концентрацию и/или свойства боковых групп, можно соответствующим образом оптимизировать другие свойства EL-POX, такие как гидрофильный/гидрофобный баланс и меньшая критическая температура растворения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, один из аспектов изобретения относится к способу получения гемостатического продукта со свойством адгезии к тканям, где указанный способ включает этапы:
· предоставления твердого пористого субстрата;
· покрытия субстрата покрывающей жидкостью, содержащей электрофильно активированный полиоксазолин (EL-POX) и растворитель, с получением покрытого субстрата, где указанный EL-POX содержит по меньшей мере 2 реакционноспособные электрофильные группы;
· удаления растворителя с покрытого субстрата.
Как используют в настоящем документе, термин "со свойством адгезии к тканям" относится к способности гемостатического продукта прилипать к ткани вследствие формирования между указанным продуктом и тканью ковалентных связей. В случае адгезии гемостатического продукта со свойством адгезии к тканям к ткани может потребоваться присутствие воды.
Как используют в настоящем документе, термин "пористый", если не указано иначе, означает, что гемостатический продукт содержит поры и/или пустоты, которые обеспечивают поступление жидкости в продукт.
Термин "пористость" относится к мере свободного (т.е., "пустого") пространства в субстрате или гемостатическом продукте и представляет собой долю объема пор в общем объеме. Пористость гемостатических продуктов по настоящему изобретению можно соответствующим образом определять известными в данной области способами, такими как анализ адсорбции газа. Анализ адсорбции газа включает воздействие на твердый пористый материал газами или парами в различных условиях и оценку накопление массы или изменение объема образца. Анализ этих данных предоставляет информацию о физических характеристиках твердого вещества, включая: скелетную плотность, пористость и общий объем пор. Как правило, скелетную плотность оценивают посредством экспериментов по гелиевой пикнометрии, и она представляет собой и истинную плотность твердого вещества материала при отсутствии скрытой пористости. Следует понимать, что в случае, когда субстрат состоит более чем из одной части, пористость относится к средней пористости отдельных частей. Таким образом, если субстрат представляет собой пористый порошок, пористость соответствует проценту объема пористых частиц, занимаемому порами.
Как используют в настоящем документе, термин "средний размер пор" относится к среднему диаметру пор, определяемому посредством сканирующей электронной микроскопии (SEM). Подходящий способ описан в Faraj et al., Tissue Engineering, 2007, 13, 10, 2387-2394.
Как используют в настоящем документе, термин "водопоглощающая способность" представляет собой меру способности твердого пористого субстрата адсорбировать воду. Водопоглощающая способность твердого пористого субстрата определяют, взвешивая образец сухого пористого субстрата (масса=Wd) с последующим погружением пористого субстрата в дистиллированную воду (37°C) на период 45 минут. Затем образец вынимают из воды вода и удаляют воду снаружи субстрата с последующим повторных взвешиванием образца (масса=Ww). Водопоглощающая способность=100%×(Ww-Wd)/Wd. Водопоглощающая способность является показателем пористости субстрата, а также его способности к набуханию в присутствии воды.
Как используют в настоящем документе, термин "полиоксазолин" относится к поли(N-ацилалкиленимину) или поли(ароилалкиленимину), и его дополнительно обозначают как POX. Примером POX является поли(2-этил-2-оксазолин). Термин "полиоксазолин" также включает сополимеры POX.
Термин "электрофильная группа" относится к функциональной группе, которая восприимчива к нуклеофильной атаке нуклеофильной группы и которая способна к реакции с такой нуклеофильной группой с формированием ковалентной связи. Как правило, электрофильные группы являются положительно заряженными и/или электронодефицитными.
Термин "нуклеофильная группа" относится к функциональной группа, которая восприимчива к электрофильной атаке электрофильной группы и которая способна к реакции с электрофильной группой с формированием ковалентной связи. Как правило, нуклеофильные группы являются электронодонорными с наличием неразделенной пары электронов, действующей в качестве реактивного центра.
Если не указано иначе, термин "активированный" относится к модификации полимера с получением или внесением новой реакционноспособной функциональной группы, где новая реакционноспособная функциональная группа способна к реакции с другой функциональной группой с формированием ковалентной связи.
Как используют в настоящем документе, термин "сшитые" относится к таким компонентам, как полимеры, которые связаны межмолекулярными ковалентными связями. Ковалентное связывание между двумя сшиваемыми компонентами может быть прямым или опосредованным линкерной группой.
Как используют в настоящем документе, термин "буферная система" относится к веществу или комбинации веществ, которые можно использовать в водных системах для доведения раствора до определенного буферного pH и где буферная система обладает способностью предотвращать изменение этого буферного pH.
Как используют в настоящем документе, "буферный pH" жидкости относится к значению pH при 20°C, измеряемому после разведения жидкости дистиллированной водой в 10 раз.
Как используют в настоящем документе, "буферная емкость" относится к способности жидкости противостоять изменениям pH. Буферная емкость β жидкости (покрывающей жидкости или биферной жидкости) измеряют при 20°C после разведения дистиллированной водой в 10 раз и выражают в ммоль·л-1·pH-1. Буферную емкость определяют следующим образом:
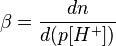
где dn представляет собой бесконечно малое количество добавляемого основания, а d(p[H+]) представляет собой итоговое бесконечно малое изменение логарифм обратной концентрации ионов водорода.
EL-POX, используемый по настоящему изобретению, предпочтительно получают из полиоксазолина, повторяющиеся единицы которого представимы следующей формулой (I):
(CHR1)mNCOR2
где R2 и каждый из R1 независимо выбраны из H, необязательно замещенного C1-22-алкила, необязательно замещенного циклоалкила, необязательно замещенного аралкила, необязательно замещенного арила; и m представляет собой 2 или 3.
По предпочтительному варианту осуществления, полиоксазолин представляет собой полимер, даже более предпочтительно гомополимер 2-алкил-2-оксазолина, где указанный 2-алкил-2-оксазолин выбран из 2-метил-2-оксазолина, 2-этил-2-оксазолина, 2-пропил-2-оксазолина, 2-бутил-2-оксазолина и их сочетаний. Предпочтительно, полиоксазолин представляет собой гомополимер 2-пропил-2-оксазолина, а более предпочтительно 2-этилоксазолина.
EL-POX может нести электрофильные группы (также обозначаемые как боковые электрофильные группы) на своих боковых цепях, на своих концах или и на тех, и на других. Примером кэпированного на концах EL-POX является сложный сукцинимидилсукцинатный эфир, такой как CH3O-POX-O2C-CH2-C(CH2CO2-NHS)3. Примером активированного по боковым цепям EL-POX является POX, несущий группы NHS на алкильной боковой цепи. Еще одним примером EL-POX являются звездообразные полимеры POX функционализированные на концах сложными эфирами с NHS.
Электрофильные группы, находящиеся в EL-POX, предпочтительно выбраны из: сложных эфиров карбоновых кислот, сложных эфиров сульфокислот, сложных эфиров фосфокислот, пентафторфенильных сложных эфиров, п-нитрофенильных сложных эфиров, п-нитротиофенильных сложных эфиров, галогенангидридных групп, ангидридов, кетонов, альдегидов, изоцианато, тиоизоцианато (изотиоцианато), изоциано, эпоксидов, активированных гидроксильных групп, олефинов, простых глицидиловых эфиров, карбоксила, сукцинимидильных сложных эфиров, сукцинимидилкарбонатов, сукцинимидилкарбаматов, сульфосукцинимидиловых сложных эфиров, сульфосукцинимидилкарбонатов, малеимидо (малеимидил), этенсульфонила, имидоэфиров, ацетоацетата, галогенацеталей, ортопиридилдисульфида, дигидроксифенильных производных, винила, акрилата, акриламида, йодацетамида и их сочетаний. Более предпочтительно, электрофильные группы, находящиеся в EL-POXЮ, выбраны из: сложных эфиров карбоновых кислот, хлорангидридных групп, ангидридов, кетонов, альдегидов, изоцианато, тиоизоцианато, эпоксидов, активированных гидроксильных групп, олефинов, карбоксила, сукцинимидильного сложного эфира, сукцинимидилкарбонатов, сукцинимидилкарбаматов, сульфосукцинимидильного сложного эфира, сульфосукцинимидилкарбоната, малеимидо, этенсульфонила и их сочетаний. Даже более предпочтительно, электрофильные группы, находящиеся в EL-POX, выбраны из альдегидов, изоцианато, тиоизоцианато, сукцинимидильного сложного эфира, сульфосукцинимидильного сложного эфира, малеимидо и их сочетанийя. Наиболее предпочтительно, электрофильные группы, находящиеся в EL-POX, выбраны из изоцианато, тиоизоцианато, сукцинимидильного сложного эфира, сульфосукцинимидильного сложного эфира, малеимидо и их сочетаний.
Примеры сложных эфиров сульфокислот, которые можно использовать, в качестве электрофильных групп, включают мезилат, тозилат, нозилат, трифлат и их сочетания. Примеры олефинов, которые можно использовать, включают акрилат, метакрилат, этилакрилат и их сочетания. Примеры активированных гидроксильных групп включают гидроксильные группы, которые активированы активаторами, выбранными из п-нитрофенилхлоркарбонатов, карбонилдиимидазолов (например, 1,1-карбонилдиимидазола) и сульфонилхлорида.
EL-POX, применяемые в способе по настоящему изобретению, предпочтительно содержат по меньшей мере 10 реакционноспособных электрофильных групп. Более предпочтительно, EL-POX содержат по меньшей мере 25, даже более предпочтительно по меньшей мере 35, а наиболее предпочтительно по меньшей мере 50 реакционноспособных электрофильных групп.
EL-POX по настоящему изобретению преимущественно содержит одну или несколько боковых электрофильных групп. Как правило, EL-POX содержит от 3 до 50 боков электрофильных группы на 100 мономеров, более предпочтительно - от 4 до 35 боковых электрофильных групп на 100 мономеров, даже более предпочтительно - по меньшей мере от 5 до 25 боковых электрофильных группы на 100 мономеров.
Как правило, средняя молекулярная масса EL-POX, применяемого по настоящему изобретению, находится в диапазоне от 1000 до 100000 г/моль, более предпочтительно 5000 до 50000 и наиболее предпочтительно 10000 до 30000 г/моль.
В одном из вариантов осуществления изобретения твердый пористый субстрат содержит по меньшей мере 50% масс., наиболее предпочтительно - по меньшей мере 80% масс. полисахарида, выбранного из декстрана, альгинатов, окисленной целлюлозы, окисленной регенерированной целлюлозы (ORC), гидроксиэтилцеллюлозы, гидроксиметилцеллюлозы, гиалуроновой кислоты и их сочетаний. В особенно предпочтительном варианте осуществления твердый пористый субстрат содержит по меньшей мере 50% масс., наиболее предпочтительно - по меньшей мере 80% масс. ORC.
Целлюлоза представляет собой гомополисахарид глюкопиранозы, полимеризованный посредством β-глюкозидных связей. Перед окислением целлюлоза может оставаться нерегенерированной с неорганизованными волокнами, или ее можно регенерировать с формированием организованных волокон. Когда целлюлозные волокна обрабатывают тетраоксидом азота, гидроксильные группы окисляются в карбоксильные группы с получением полиуроновой кислоты. Хотя основным компонентом окисленной целлюлозы является полиуроновая кислота, в качестве компонента волокон остаются неокисленные гидроксильные группы.
В дополнительном варианте осуществления изобретения твердый пористый субстрат обладает внешней поверхностью, которая содержит нуклеофильный полимер, содержащий реакционноспособные нуклеофильные группы. Предпочтительно, твердый пористый субстрат содержит по меньшей мере 5% масс., более предпочтительно - по меньшей мере 10% масс., а более предпочтительно - по меньшей мере 50% масс. нуклеофильного полимера. Наиболее предпочтительно субстрат состоит из указанного нуклеофильного полимера.
Как правило, нуклеофильный полимер содержит по меньшей мере 2 нуклеофильные группы, более предпочтительно - по меньшей мере 10 нуклеофильных групп, наиболее предпочтительно - по меньшей мере 20 нуклеофильных групп.
Нуклеофильные группы нуклеофильного полимера предпочтительно выбраны из аминогрупп, тиольных групп, фосфиновых групп и их сочетаний. Более предпочтительно эти нуклеофильные группы представляют собой аминогруппы. Эти аминогруппы предпочтительно выбраны из первичных аминогрупп, вторичных аминогрупп и их сочетаний.
Нуклеофильный полимер на внешней поверхности твердого пористого субстрата предпочтительно представляет собой богатый азотом полимер с содержанием азота по меньшей мере 1% масс., более предпочтительно - 5-10% масс. и наиболее предпочтительно - 15-25% масс.
Нуклеофильный полимер предпочтительно выбран из белковых, хитозановых и синтетических или углеводных полимеров, содержащих реакционноспособные нуклеофильные группы, выбранные из амина, тиола, фосфина и их сочетаний. Более предпочтительно нуклеофильный полимер выбран из коллагена, хитозана и их сочетаний.
Как используют в настоящем документе, термин коллаген относится ко всем формам коллагена, включая процессированные производные. Предпочтительные коллагены не содержат телопептидных областей ("ателопептидный коллаген"), растворимы и могут находиться в фибриллярной и нефибриллярной форме. Коллаген можно выбирать из группы микрофибриллярного коллагена, синтетического коллагена человека, такого как коллаген I типа, коллаген III типа или комбинации коллагена I типа и коллагена III типа. Для формирования особенно прочных сшитых композиций также можно использовать коллаген, сшитый с применением нагревания, радиации или химических средств, таких как глутаровый альдегид. Особенно предпочтительны сухие, пористые полученные лиофилизацией коллагеновые губки.
Хитозан является биоразлагаемым, нетоксичным, сложным углеводным производным хитина (поли-[134]-N-ацетил-D-глюкозамин), природным веществом. Хитозан представляет собой деацетилированную форму хитина. Как правило, общее обозначение хитозан применяют, когда степень деацетилирования составляет более 70%, а общее обозначение хитин используют, когда степень деацетилирования является незначительной или менее 20%. Когда деацетилировании, меньшем 100%, хитозановый полисахарид представляет собой линейный блок-сополимер, содержащий N-ацетил-D-глюкозаминовые и D-глюкозаминовые мономерные единицы.
По одному из предпочтительных вариантов осуществления нуклеофильные группы нуклеофильного полимера, находящиеся на поверхности твердого пористого субстрата, представляют собой аминогруппы, а электрофильные группы, содержащиеся в EL-POX, выбраны из сложных эфиров карбоновых кислот, сложных эфиров сульфокислот, сложных эфиров фосфокислот, пентафторфенильных сложных эфиров, п-нитрофенильных сложных эфиров, п-нитротиофенильных сложных эфиров, галогенангидридных групп, ангидридов, кетонов, альдегидов, изоцианато, тиоизоцианато, изоциано, эпоксидов, активированных гидроксильных групп, простых глицидиловых эфиров, карбоксилов, сукцинимидильных сложных эфирыов, сукцинимидилкарбонатов, сукцинимидилкарбаматов, сульфосукцинимидильных сложных эфиров, сульфосукцинимидилкарбонатов, сложных имидоэфиров, дигидроксифенильных производных и их сочетаний.
Примеры сукцинимидильных производных, которые можно использовать, включают сукцинимидилглутарат, сукцинимидилпропионат, сукцинимидилсукцинамид, сукцинимидилкарбонат, дисукцинимидилсуберат, бис(сульфосукцинимидил)суберат, дитиобис(сукцинимидилпропионат), бис(2-сукцинимидооксикарбонилокси)этилсульфон и 3,3'-дитиобис(сульфосукцинимидилпропионат). Примеры сульфосукцинимидильных производных, которые можно использовать, включают сульфосукцинимидил(4-йодацетил)аминобензоат, бис(сульфосукцинимидил)суберат, сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, дитиобиссульфосукцинимидилпропионат, дисульфосукцинимидилтартрат; бис[2-(сульфосукцинимидилоксикарбонилоксиэтилсульфон)], этиленгликольбис(сульфосукцинимидилсукцинат), дитиобис(сукцинимидилпропионат). Примеры дигидроксифенильных производных включают дигидроксифенилаланин, 3,4-дигидроксифенилаланин (DOPA), дофамин, 3,4-дигидроксигидрокоричную кислоту (DOHA), норадреналин, эпинефрин и катехол.
По другому предпочтительному варианту осуществления нуклеофильные группы нуклеофильного полимера на внешней поверхности твердого пористого субстрата представляют собой тиольные группы, а электрофильные группы, содержащиеся в EL-POX, выбраны из галогенацеталей, ортопиридилдисульфида, малеинимидов, винилсульфона, дигидроксифенильных производных, винила, акрилата, акриламида, йодацетамида, сукцинимидильных сложных эфиров, сукцинимидилкарбонатов, сукцинимидилкарбаматов, сульфосукцинимидильных сложных эфиров, сульфосукцинимидилкарбонатов и их сочетаний. Более предпочтительно электрофильные группы выбраны из сукцинимидильных сложных эфиров, галогенацеталей, малеинимидов, или дигидроксифенильных производных и их сочетаний. Наиболее предпочтительно электрофильные группы выбраны из малеинимидов или дигидроксифенильных производных и их сочетаний.
Пористость твердого пористого субстрата, применяемого в способе по настоящему изобретению, предпочтительно составляет по меньшей мере 5% об. В случае, когда субстрат представляет собой пенистый или ячеистый материал, пористость субстрата предпочтительно составляет по меньшей мере 50% об., более предпочтительно - по меньшей мере 70% об., а наиболее предпочтительно - по меньшей мере 85% об. В случае, когда субстрат представляет собой пористый порошок, пористость предпочтительно составляет по меньшей мере 20% об., более предпочтительно - по меньшей мере 50% об., а наиболее предпочтительно - по меньшей мере 75% об.
Средний размер пор твердого пористого субстрата, применяемого в способе по настоящему изобретению, предпочтительно составляет по меньшей мере 2 мкм. В случае, когда субстрат представляет собой пенистый или ячеистый материал, средний размер пор субстрата предпочтительно составляет от 5 до 500 мкм, предпочтительно - от 10 до 200 мкм. В случае, когда субстрат представляет собой пористый порошок, средний размер пор предпочтительно составляет от 4 до 50 мкм, более предпочтительно - от 6 до 25 мкм.
Водопоглощающая способность твердого пористого субстрата составляет по меньшей мере 25%, более предпочтительно - по меньшей мере 100%, даже более предпочтительно - по меньшей мере 250%, а наиболее предпочтительно - по меньшей мере 1000%.
Твердый пористый субстрат, применяемый в способе по настоящему изобретению, предпочтительно представляет собой объект в форме ячеистого или пенистого материала, где указанный объект обладает формой, которая облегчает применение покрытого субстрата в качестве перевязочного средства для ран, например, листа. Как правило, длина субстрата составляет от 10 мм до 200 мм, ширина - от 5 мм до 200 мм, и толщина - от 0,5 мм до 10 мм.
В одном из вариантов осуществления настоящего изобретения твердый пористый субстрат представляет собой ячеистый материал. Примером ячеистого материала является лист или марля, получаемая из тканых или нетканых волокон. Волокна, содержащиеся в ячеистом материале, предпочтительно получают из биосовместимых и биоразлагаемых полимеров, таких как желатин, коллаген, ORC или их сочетания.
В другом варианте осуществления настоящего изобретения твердый пористый субстрат представляет собой твердый пенистый материал, иногда также обозначаемый как губки. Твердый пенистый материал предпочтительно получают из сшитого желатина (Гельфоум).
В дополнительном варианте осуществления изобретения твердый пористый субстрат представляет собой порошок. Пористый порошок предпочтительно получают из желатина или полисахарида. Подходящими полисахаридами являются крахмал, модифицированные крахмалы, альгинаты, хитозан, декстран и их сочетания. Наиболее предпочтительно применяемый полисахарид представляет собой модифицированный крахмал.
Предпочтительно пористый порошок находится в форме сыпучего стерильного порошка. Преимущественно порошок представляет собой микропористый порошок.
Как правило, средневзвешенный размер частиц пористого порошка находится в диапазоне 10-200 мкм, более предпочтительно - 25-100 мкм, а наиболее предпочтительно - 50-75 мкм.
Покрывающая жидкость, применяемая в способе по настоящему изобретению, предпочтительно содержит по меньшей мере 50% масс., более предпочтительно - по меньшей мере 60% масс., наиболее предпочтительно - по меньшей мере 80% масс. растворителя. Растворитель предпочтительно выбран из 2-пропанола, этилового спирта, метанола, дихлорметана, ацетона, анизола, 1-бутанола, 2-бутанола, бутилацетата, простого трет-бутилметилового эфира, изопропилбензола, диметилсульфоксида, этилацетата, простого этилового эфира, этилформиата, гептана, изобутилацетата, изопропилацетата, метилацетата, 3-метил-1-бутанола, метилэтилкетона, метилизобутилкетона, 2-метил-1-пропанола, пентана, 1-пентанола, 1-пропанола, пропилацетата и их сочетаний. Более предпочтительно растворитель выбран из 2-пропанола, этилового спирта, метанола, ацетона и их сочетаний.
Соответственно, покрывающая жидкость может содержать определенное количество воды. Как правило, покрывающая жидкость содержит менее 5% масс. воды, более предпочтительно - менее 1% масс. воды.
Покрывающая жидкость, применяемая в способе по настоящему изобретению, предпочтительно содержит по меньшей мере 1% масс. EL-POX. Более предпочтительно содержание EL-POX в покрывающей жидкость составляет по меньшей мере 5% масс., даже более предпочтительно - по меньшей мере 10% масс., а наиболее предпочтительно - по меньшей мере 20% масс.
По предпочтительному варианту осуществления изобретения твердый пористый субстрат покрывают, распыляя покрывающую жидкость на субстрат. По особенно предпочтительному варианту осуществления покрывающую жидкость распыляют на субстрат через ультразвуковую форсунку. Авторы изобретения выяснили, что использование ультразвуковой форсунки обеспечивает возможность гомогенного покрытия субстрата покрывающей жидкостью, содержащей существенное количество EL-POX.
Растворитель можно соответствующим образом удалять с покрытого субстрата посредством испарения. Испарение предпочтительно проводят при пониженном давлении, например, при давлении менее 100 Па.
Альтернативно растворитель можно удалять с покрытого субстрата посредством контакта покрытого субстрата с сжиженным газом или сверхкритической жидкостью. Предпочтительно, давление сжиженного газа или суперкритической жидкости составляет по меньшей мере 3 МПа.
По предпочтительному варианту осуществления настоящего изобретения твердый порист субстрат обладает внешней поверхностью, которая содержит нуклеофильный полимер, как ранее описано в настоящем документе, и после покрытия субстрата покрывающей жидкостью и перед и/или в течение удаления растворителя реакционноспособные электрофильные группы EL-POX реагируют с реакционноспособными нуклеофильными группами нуклеофильного полимера с формированием ковалентных связей. Предпочтительно указанная реакция происходит при температуре менее 50°C, более предпочтительно - при температуре в диапазоне 15-25°C (условия окружающей среды). Этот вариант осуществления способа по настоящему изобретению обеспечивает преимущество того, что реакция между реакционноспособными электрофильными группами и реакционноспособными нуклеофильными группами может проходить в отсутствие буферной системы.
В способе по настоящему изобретению реакционноспособные электрофильные группы в EL-POX могут реагировать с реакционноспособными нуклеофильными группами, находящимися в твердом пористом субстрате, и/или с нуклеофильными группами, находящимися в других компонентах, которые применяют в способе (например, нуклеофильные сшивающие средства). Предпочтительно после удаления растворителя с покрытого субстрата EL-POX все еще содержит в среднем по меньшей мере одну, более предпочтительно по меньшей мере 5, а наиболее предпочтительно по меньшей мере 40 реакционноспособных электрофильных групп. Эти реакционноспособные электрофильные группы придают покрытому субстрату адгезивные свойства, так как они могут формировать ковалентные связи, например, с аминогруппами, существующими в ткани в природе.
Покрывающая жидкость, применяемая в способе по настоящему изобретению, может содержать EL-POX в растворенной и/или диспергированной форме.
По одному из вариантов осуществления изобретения покрывающая жидкость содержит EL-POX в полностью растворенной форме и покрывающая жидкость дополнительно содержит диспергированную буферную систему. Предпочтительно буферный pH покрывающей жидкости находится в диапазоне от 7 до 11, более предпочтительно - в диапазоне от 8 до 10. Буферная емкость покрывающей жидкости предпочтительно составляет по меньшей мере 10 ммоль·л-1·pH-1. Более предпочтительно, буферная емкость составляет по меньшей мере 25 ммоль·л-1·pH-1, наиболее предпочтительно буферная емкость составляет по меньшей мере 50 ммоль·л-1·pH-1.
В другом варианте осуществления изобретения покрывающая жидкость содержит EL-POX в полностью растворенной форме и способ включает нанесение на твердый пористый субстрат до покрытия субстрата содержащей EL-POX покрывающей жидкостью буферной жидкости, где указанная буферная жидкость содержит буферную систему. Предпочтительно, буферный pH буферной жидкость находится в диапазоне от 7 до 11, более предпочтительно - в диапазоне от 8 до 10. Буферная емкость буферной жидкости предпочтительно составляет по меньшей мере 10 ммоль·л-1·pH-1. Более предпочтительно буферная емкость составляет по меньшей мере 25 ммоль·л-1·pH-1, наиболее предпочтительно буферная емкость составляет по меньшей мере 50 ммоль·л-1·pH-1. В случае, когда буферная жидкость является водной, субстрат после нанесения буферной жидкости перед покрытием покрывающей жидкостью предпочтительно высушивают. Таким образом, можно минимизировать нежелательное сшивание между EL-POX и субстратам и разрушение EL-POX. Этот вариант осуществления обеспечивает преимущество того, что EL-POX может проникать в поры твердого пористого субстрата и формировать покрытие внутри этих пор. Буферная жидкость, применяемая по этому варианту осуществления, может соответственно содержать нуклеофильное сшивающее средство, где указанное нуклеофильное сшивающее средство содержит по меньшей мере 2 реакционноспособные нуклеофильные группы.
В еще одном варианте осуществления по меньшей мере 80% масс. EL-POX, находящегося в покрывающей жидкости, когда покрывающую жидкость наносят на твердый пористый субстрат, является нерастворенным. Преимущественно, кроме нерастворенного EL-POX покрывающая жидкость содержит растворенную или нерастворенную буферную систему. Буферный pH покрывающей жидкости предпочтительно находится в диапазоне от 7 до 11, более предпочтительно - в диапазоне от 8 до 10. Буферная емкость покрывающей жидкости предпочтительно составляет по меньшей мере 10 ммоль·л-1·pH-1. Более предпочтительно буферная емкость составляет по меньшей мере 25 ммоль·л-1·pH-1, даже более предпочтительно буферная емкость составляет по меньшей мере 50 ммоль·л-1·pH-1. Предпочтительно, после покрытия субстрата покрывающей жидкостью, содержащей нерастворенный EL-POX, на субстрат наносят жидкую композицию растворителя в котором растворяется EL-POX. Этот вариант осуществления обеспечивает преимущество того, что EL-POX не входит в поры и покрытие из слоя EL-POX сконцентрировано на поверхности пористого субстрата. По особенно предпочтительному варианту осуществления композиция жидкого растворителя содержит нуклеофильное сшивающее средство.
Примеры нуклеофильных сшивающих средств, которые можно соответствующим образом использовать, включают нуклеофильно активированный PEG, нуклеофильно активированный POX, трилизин и их сочетания.
Нуклеофильное сшивающее средство предпочтительно содержит по меньшей мере 3 реакционноспособные нуклеофильные группы. Нуклеофильные группы нуклеофильного сшивающего средства предпочтительно выбраны из аминогрупп, тиольных групп, фосфиновых групп и их сочетания. Более предпочтительно, эти нуклеофильные группы представляют собой аминогруппы. По предпочтительному варианту осуществления, нуклеофильные группы, присутствующие в нуклеофильном сшивающем средстве представляют собой первичные аминогруппы.
В одном из вариантов осуществления изобретения нуклеофильное сшивающее средство представляет собой низкомолекулярный полиамин с молекулярной массой менее 1000 г/моль, более предпочтительно - менее 700 г/моль, и наиболее предпочтительно - менее 400 г/моль. Даже более предпочтительно, нуклеофильное сшивающее средство выбран из группы дилизина; трилизина; тетрализина; пентализина; дицистеина; трицистеина; тетрацистеина; пентацистеина; олигопептидов, содержащих два или более аминокислотных остатка, выбранных из лизина, орнитина, цистеина, аргинина и их сочетаний, и другие аминокислотные остатки; спермин; трис(аминометил)амин; аргинин и их сочетания.
По другому варианту осуществления изобретения нуклеофильное сшивающее средство представляет собой высокомолекулярный полиамин, выбранный из группы: нуклеофильно активированного POX (NU-POX), содержащего по меньшей мере две аминогруппы; хитозана; производных хитозана (например, дериватизированные дикарбоксгруппами хитозановых полимеров, как описано в WO 2009/028965), полиэтилениминов; поливиниламина; полиаллиламина; функционализированных аминами поли(мет)акрилатов; полисахаридов, содержащих функциональные аминогруппы, таких как аминогликозиды, таких как 4,6-дизамещенный дезоксистрептамин (канамицин A, амикацин, тобрамицин, дибекацин, гентамицин, сизомицин, нетилмицин), 4,5-дизамещенный дезоксистрептамин (Неомицины B, C и неомицин E (паромомицин)) и недезоксистрептаминовые аминогликозиды, например, стрептомицин; стирольных соединений; полипептидов, содержащих два или более аминокислотных остатка, выбранных из лизина, орнитина, цистеина, аргинина и их сочетаний, и другие аминокислотные остатки; и их сочетаний. Примером полипептида, который можно соответственно использовать в качестве полипептида является альбумин из природного источника или рекомбинантный альбумин. Другим примером высокомолекулярного полиамина, который можно соответственно использовать в качестве нуклеофильного сшивающего средства, является функционализированный аминами полиэтиленгликоль.
По другому предпочтительному варианту осуществления нуклеофильные группы, присутствующие в нуклеофильном сшивающем средстве, представляют собой тиольные (сульфгидрильные) группы.
В одном из вариантов осуществления изобретения нуклеофильное сшивающее средство, используемое в сшитом полимере, представляет собой низкомолекулярный политиол, содержащий 2 или более тиольных группы, с молекулярной массой менее 1000 г/моль, более предпочтительно - менее 700 г/моль, а наиболее предпочтительно - менее 400 г/моль. Даже более предпочтительно, нуклеофильное сшивающее средство выбрано из группы тримеркаптопропана, этандитиола, пропандитиола, простого 2-меркаптоэтилового эфира, 2,2'-(этилендиокси)диэтантиола, тетра(этиленгликоль)дитиола, пента(этиленгликоль)дитиола, гексаэтиленгликольдитиола; модифицированного тиолами пентаэритритола, дипентаэритритола, триметилолпропана или дитриметилолпропана; олигопептидов, содержащих по меньшей мере два цистеиновых единицы.
По другому варианту осуществления изобретения нуклеофильное сшивающее средство, используемое в сшитом полимере, представляет собой высокомолекулярный политиол, выбранный из группы: NU-POX, содержащего по меньшей мере две тиольных группы; функционализированных тиолами поли(мет)акрилатов; полисахаридов, содержащих функциональные тиольные группы; стирольных соединений; полипептидов, содержащих две или более тиольных группы.
Нуклеофильное сшивающее средство, как определено в настоящем документе ранее, можно соответствующим образом использовать в покрывающей жидкости и/или буферной жидкости для ковалентного связывания EL-POX с твердым пористым субстратом с внешней поверхностью, которая содержит полимер, содержащий реакционноспособные электрофильные группы. Подходящим полимером с электрофильными группами является сополимер молочной и гликолевой кислот, хондроитинсульфат-NHS, хондроитинсульфат-сукцинимидилсукцинат, альгинат-NHS, гиалуроновая кислота-NHS, сополимеры, содержащие N-гидроксисукцинимидкарбонат, содержащий мономеры метакрилата (как описано в Cengiz et al., 2010, J. of Polymer Science Part A: Polymer Chemistry, vol. 48, issue 21, 4737-4746), биологические низкомолекулярные производные, получаемые посредством модификации по меньшей мере одной карбоксильной группы биологического низкомолекулярного соединения с двумя или более карбоксильными группами N-гидроксисукцинимидами, N-гидроксисульфосукцинимидами или их производными (как описано в EP1548004). Предпочтительно нуклеофильное сшивающее средство используют в покрывающей жидкости.
В другом предпочтительном варианте осуществления изобретения EL-POX и нуклеофильное сшивающее средство находятся в разных, но одновременно наносимых одновременно на твердый пористый субстрат жидкостях. Соответственно это можно проводить с использованием двух ультразвуковых распылительных форсунок. Таким образом, способ по этому предпочтительному варианту осуществления включает:
· предоставление твердого пористого субстрата,
· предоставление покрывающей жидкости, содержащей EL-POX в первом растворителе;
· предоставление второй жидкости, содержащей буферную систему и/или нуклеофильное сшивающее средство, а также второй растворитель;
· получение первого распылительного потока, пропуская покрывающую жидкость через первую ультразвуковую форсунку;
· получение второго распылительного потока, пропуская вторую жидкость через вторую ультразвуковую форсунку;
· одновременное помещение по меньшей мере части поверхности твердого пористого субстрата в первый распылительный поток и второй распылительный поток, покрывая указанную часть твердого пористого субстрата смесью покрытий, содержащей EL-POX, а также нуклеофильное сшивающее средство и/или буферную систему;
· удаление первого и второго растворителя из смеси покрытий с получением твердого пористого субстрата, который по меньшей мере частично покрыт сухим слоем, содержащим EL-POX и нуклеофильное сшивающее средство.
EL-POX в этом способе можно, соответственно, заменять на PVP-акриловая кислота-NHS или (поли-((N-винилпирролидон)50-со-(акриловая кислота)25-со-(сложный N-гидроксисукцинимидный эфир акриловой кислоты)25).
В случае использования в описанном выше способе с двойным распылением нуклеофильного сшивающего средства, EL-POX и нуклеофильное сшивающее средство могут реагировать друг с другом с формированием сшитого полимера до, в течение или после удаления растворителей. В предпочтительном варианте осуществления сшитый полимер, который находится в сухом слое, содержит непрореагировавшие электрофильные группы. Подходящие растворители являются такие, как ранее определено в настоящем документе. В предпочтительном варианте осуществления первый и втор растворитель являются смешиваемыми, в более предпочтительном варианте осуществления первый и второй растворитель являются одинаковыми.
В случае, когда вторая жидкость содержит буферную систему, буферный pH второй жидкости предпочтительно находится в диапазоне от 7 до 11, более предпочтительно - в диапазоне от 8 до 10. Буферная емкость второй жидкости предпочтительно составляет по меньшей мере 10 ммоль·л-1·pH-1. Более предпочтительно буферная емкость составляет по меньшей мере 25 ммоль·л-1·pH-1, наиболее предпочтительно буферная емкость составляет по меньшей мере 50 ммоль·л-1·pH-1.
Другой аспект изобретения относится к адгезивному гемостатическому продукту, выбранному из покрытого ячеистого материала, покрытого пенистого материала или покрытого порошка, где указанный гемостатический продукт содержит:
· твердый пористый субстрат с пористостью по меньшей мере 20% об. и обладающий внешней поверхностью, которая содержит нуклеофильный полимер, содержащий реакционноспособные нуклеофильные группы;
· адгезивное покрытие, которое покрывает по меньшей мере часть твердого субстрата, где указанное покрытие содержит EL-POX, содержащий в среднем по меньшей мере 1 реакционноспособную электрофильную группу.
Этот адгезивный гемостатический продукт можно соответствующим образом получать способом, описываемым ранее в настоящем документе.
Как описано ранее в настоящем документе, гемостатический продукт обладает превосходными адгезивными свойствами вследствие присутствия электрофильных реакционноспособных групп, которые способны к реакции с нуклеофильными группами, которые в природе присутствуют в ткани. Кроме того, этот гемостатический продукт обеспечивает преимущество того, что при контакте с кровью или другими водными жидкостями, адгезивное покрытие прикрепляется к пористому субстрату, так как реакционноспособные электрофильные группы в EL-POX реагируют с реакционноспособными нуклеофильными группами нуклеофильного полимера с формированием ковалентных связей.
EL-POX, находящийся в покрытии адгезивного гемостатического материала, может ковалентно связываться с твердым пористым субстратом. Кроме того, EL-POX может быть сшитым.
Предпочтительные формы твердого пористого субстрата, EL-POX и нуклеофильного полимера описаны ранее в настоящем документе.
EL-POX в покрытии гемостатического продукта предпочтительно содержит 5 реакционноспособных электрофильных групп, более предпочтительно - 25 реакционноспособных электрофильных групп, а наиболее предпочтительно - 50 реакционноспособных электрофильных групп.
Как правило, субстрат составляет по меньшей мере 10% масс., более предпочтительно - по меньшей мере 50% масс., а наиболее предпочтительно - по меньшей мере 75% масс. гемостатического продукта.
Как правило, содержащее EL-POX покрытие составляет 5-75% масс. гемостатического продукта. Более предпочтительно покрытие составляет 10-50% масс., наиболее предпочтительно - 12-25% масс. гемостатического продукта.
Покрытие предпочтительно содержит 25-100% масс. EL-POX. Более предпочтительно содержание EL-POX в покрытии составляет по меньшей мере 50% масс., наиболее предпочтительно - по меньшей мере 75% масс.
Настоящее изобретение обеспечивает получение покрытых гемостатических продуктов, где адгезивное покрытие содержит поры, которые сообщаются с порами твердого пористого субстрата.
По особенно предпочтительному варианту осуществления плотность пор адгезивного гемостатического продукта составляет по меньшей мере 50%, более предпочтительно - по меньшей мере 80%
Изобретение далее проиллюстрировано приведенными ниже неограничивающими примерами.
ПРИМЕРЫ
Пример 1
Сополимер NHS-поли[2-(пропил/сложный этиловый эфир NHS)-2-оксазолин] с активированными боковыми цепями, содержащий 25% единиц сложного эфира NHS (= EL-POX, 25% NHS) синтезировали следующим образом:
Поли[2-(пропил/метоксикарбонилэтил)-2-оксазолиновый] сополимер (степень полимеризации=DP=приблизительно 100) синтезировали посредством катионной полимеризации с раскрытием цикла (CROP) с использованием 75% 2-н-пропил-2-оксазолина (nPropOx) и 25% 2-метоксикарбонилэтил-2-оксазолина (MestOx). Получали статистический сополимер, содержащий 25% 2-метоксикарбонилэтильных групп (1H-ЯМР). Полимер, содержащий 25% 2-метоксикарбонилэтильные группы, гидролизовали с использованием гидроксида натрия (1M) с получением сополимера с 25% 2-карбоксиэтильными группами (1H-ЯМР). 2-карбоксиэтильные группы активировали посредством N-гидроксисукцинимида (NHS) и диизопропилкарбодиимида (DIC) с получением 2-(пропил/сложный этиловый эфир NHS)-2-оксазолинового] сополимера (=EL-POX, 25% NHS). По данным 1H-ЯМР и УФ-спектроскопии полимер содержал 25% сложноэфирных групп NHS.
Губки из коллагена коровы получали способом, описанным в Faraj et al., Tissue Engineering, 2007, 13, 10, 2387-2394. Коллаген экстрагировали из сухожилия коровы. Пористость полученных таким образом коллагеновых губок составляла от 95% до 98%, и средний размер пор составлял 80-100 мкм. Пористость рассчитывали, сравнивая плотность коллагеновой пленки (без объема пор) с плотностью коллагеновой губки. Размеры пор определяли с использованием сканирующей электронной микроскопии способом, описанным в Faraj et al., Tissue Engineering, 2007, 13, 10, 2387-2394.
EL-POX, 25% NHS, растворяли в ацетоне (180 мг/мл). Раствор равномерно капельно наносили сверху лиофилизированных губок из коллагена коровы. Непосредственно после нанесения покрытия губки сушили при комнатной температуре при пониженном давлении (100 Па) в течение 8 часов. Получали адгезивные коллагеновые губки с покрытием EL-POX, 25% NHS (15 мг/см2).
Для оценки возможного сшивания между EL-POX, 25% NHS, и нуклеофильными аминогруппами, присутствующими в коллагене, покрытую коллагеновую губку промывали ацетоном. Весь EL-POX, 25% NHS, извлекали в ацетоновом экстракте, что указывало на то, что электрофильные группы в EL-POX не реагировали с аминогруппами в коллагене при покрытии и/или сушке.
Гемостатические свойства покрытых коллагеновых губок оценивали следующим образом:
· сверху покрытой EL-POX, 25% NHS, стороны коллагеновой губки капельно добавляли 100 мкл свежей гепаринизированной цельной крови.
· сверху покрытой кровью коллагеновой губки помещали другую покрытую EL-POX, 25% NHS, губку с покрытой EL-POX стороной, обращенной к крови ("способ сэндвича").
· с использованием марли прикладывали небольшое давление в течение 10 секунд. Затем, сэндвич помещали в стакан, содержащий воду, и воду перемешивали в течение двух минут. В этих условиях две коллагеновые губки оставались скрепленными, и крови из губок не вытекало, что указывало на гемостаз и адгезию.
В контрольном эксперименте с использованием непокрытых коллагеновых губок, губки в воде разделялись через 20 секунд, и вода приобретала красную окраску, что указывало на отсутствие гемостаза.
Пример 2
Терполимер NHS-поли-2-(пропил/гидроксиэтиламидэтил/сложноэфирная этиламидэтилльная группа сложного этилового эфира NHS)-2-оксазолин] с активированными боковыми цепями, содержащий 15% сложноэфирных групп NHS (= EL-POX, 15% NHS) синтезировали следующим образом:
Сополимер поли[2-(пропил/метоксикарбонилэтил)-2-оксазолин] (DP=+/-100) синтезировали посредством CROP с использованием 70% 2-пропил-2-оксазолина и 30% 2-метоксикарбонилэтил-2-оксазолина. Получали статистический сополимер, содержащий 30% 2-метоксикарбонилэтильных групп (1H-ЯМР). Затем полимер, содержащий 30% 2-метоксикарбонилэтильных групп подвергали реакции с этаноламином с получением сополимера с 30% 2-гидроксиэтиламидэтильных групп (1H-ЯМР). После этого часть 2-гидроксиэтиламидэтильных групп подвергали реакции с янтарным ангидридом с получением по данным 1H-ЯМР терполимера с 70% 2-пропильных групп, 15% 2-гидроксиэтиламидэтильных групп и 15% 2-сложноэфирых карбоксиэтилэтиламидэтильных групп. В заключение, 2-сложноэфирые карбоксиэтилэтиламидэтильные группы активировали N-гидроксисукцинимидом (NHS) и диизопропилкарбодиимидом (DIC) с получением EL-POX, 15% NHS. По данным 1H-ЯМР полимер содержал 15% сложноэфирных групп NHS.
EL-POX, 15% NHS (130 мг), и безводный борат натрия (47 мг) взвешивали и добавляли раствор изопропанол/2-бутанона (1,6 мл, об./об., 1:1) с получением высокодисперсной суспензии так как безводный борат натрия нерастворим в изопропаноле/2-бутаноне (об./об., 1:1). Суспензию равномерно капельно распределяли сверху лиофилизированной губки из коллагена коровы. Непосредственно после нанесения покрытия губки сушили при комнатной температуре при пониженном давлении (100 Па) в течение 8 часов. Получали адгезивные коллагеновые губки с EL-POX, 15% NHS, и покрытием с безводным боратом натрия (19 мг/см2).
Гемостатические свойства покрытых коллагеновых губок оценивали следующим образом:
· сверху покрытой EL-POX, 15% NHS, и безводным боратом натрия стороны коллагеновой губки капельно добавляли 100 мкл свежей гепаринизированной цельной крови.
· сверху покрытой кровью коллагеновой губки помещали другую покрытую EL-POX, 25% NHS, и безводным боратом натрия губку с покрытой EL-POX стороной, обращенной к крови ("способ сэндвича").
· с использованием марли прикладывали небольшое давление в течение 10 секунд. Затем, сэндвич помещали в стакан, содержащий воду, и воду перемешивали в течение трех минут.
В этих условиях две коллагеновые губки оставались скрепленными, и крови из губок не вытекало, что указывало на гемостаз и адгезию.
Пример 3
В этом примере тестировали несколько полимеров на прочность при сдвиге, обзор образцов приведен в таблице 1. Полимеры (DP=+/-100) синтезировали посредством CROP из 2-н-пропил-2-оксазолина, 2-этил-2-оксазолина и 2-метоксиэтил-2-оксазолина. EL-POX, используемый в качестве образцов 1-3, подвергали постмодификации способом, описанным в примере 1. EL-POX, используемых в качестве образцов 4-6, синтезировали способом, описанным в примере 2. Все активированные полимеры посредством 1H-ЯМР и УФ-спектроскопии анализировали на содержание NHS. 4-замещенный NHS PEG (тетрасукцинимидилглутарат пентаэритритолполи(этиленгликолевого) простого эфира, образец 7,) получали из NOF America corporation. В качестве контроля тестировали губки из коллагена коровы (5×7×1 см (ш×д×в)) (образец 8). Все покрытые губки получали, как описано в примере 1.
Способ получения
· взвешивали пористые коллагеновые губки (n=7).
· растворы EL-POX получали, растворяя определенное количество полимера в органическом растворителе (дихлорметан(DCM)/изопропиловый спирт (IPA) (об./об., 1:1)) до конечной концентрации 300 мг/мл.
· раствор EL-POX капельно наносили на части пористых коллагеновых губок (14 см2) с получением намеченной плотности покрытия 15 мг/см2. Покрытые пористые коллагеновые губки сушили в течение ночи в вакуумном сушильном шкафу (500 Па) при комнатной температуре.
· покрытые пористые коллагенов губки повторно взвешивали и определяли плотность покрытия. Обзор использованных полимеров и плотностей покрытия предоставлен в таблице 1.
Способ тестирования
Эти полимеры тестировали на прочность при сдвиге следующим способом:
· конструкции разрезали на равные части по 5×1 см (ш×д).
· покрытые стороны соединяли с адгезивными сторонами, обращенными друг к другу, с использованием 200 мкл гепаринизированной крови человека. Прикладывали массу (10 г) в течение 10 секунд для получения стандартизированного давления.
· у конструкций позволяли происходить сшиванию в течение определенных периодов времени: 1 минуту (t1) или 15 минут (t15).
· через определенные моменты времени конструкции помещали в устройство определения силы сдвига (Zwicky Roell, датчик напряжения 20 Н) и определяли прочность при сдвиге до разрыва.
· результат: Определенную силу (Н) делили на площадь перекрывания конструкций (см2) с получением прочности при сдвиге (в кПа). Результаты приведены в таблице 1.
Таблица 1: Результаты теста прочности при сдвиге
Из этих результатов можно заключить, что:
· полимеры EL-POX (1-6) демонстрируют более высокую прочность при сдвиге с увеличением времени сшивания.
· полимеры EL-POX (2 и 5) при t15 демонстрируют более высокие значения прочности при сдвиге, чем полимер 4-замещенного NHS PEG (7).
· контрольный образец (8) демонстрирует от ограниченной до отсутствующей прочности при сдвиге, что указывает на то, что сшивание обеспечивают сложноэфирные группы NHS.
Этот пример иллюстрирует, что EL-POX, нанесенный на коллаген, способен к сшиванию в присутствии крови, обеспечивая более высокую прочность при сдвиге, чем та же концентрация 4-замещенного NHS PEG, нанесенного на коллаген.
Пример 4
Терполимер NHS-поли-2-(пропил/гидроксиэтиламидэтил/сложноэфирная этиламидэтилльная группа сложного этилового эфира NHS)-2-оксазолин] с активированными боковыми цепями, содержащий 20% сложноэфирных группы NHS (= EL-POX, 20% NHS) синтезировали следующим образом
Сополимер поли[2-(пропил/метоксикарбонилэтил)-2-оксазолин] (DP=+/-100) синтезировали посредством CROP с использованием 70% 2-пропил-2-оксазолина и 30% 2-метоксикарбонилэтил-2-оксазолина. Получали статистический сополимер, содержащий 30% 2-метоксикарбонилэтильных групп (1H-ЯМР). Затем полимер, содержащий 30% 2-метоксикарбонилэтильных групп подвергали реакции с этаноламином с получением сополимера с 30% 2-гидроксиэтиламидэтильных групп (1H-ЯМР). Затем часть 2-гидроксиэтиламидэтильных групп подвергали реакции с янтарным ангидридом с получением по данным 1H-ЯМР терполимера с 70% 2-пропильных групп, 10% 2-гидроксиэтиламидэтильных групп и 20% 2-сложноэфирых карбоксиэтилэтиламидэтильных групп. В заключение, 2-сложноэфирые карбоксиэтилэтиламидэтильные группы активировали N-гидроксисукцинимидом (NHS) и диизопропилкарбодиимидом (DIC) с получением EL-POX, 20% NHS. По данным 1H-ЯМР полимер содержал 20% сложноэфирных групп NHS.
Функционализированный аминами NU-POX, содержащий пропильные группы и аминогруппы в алкильной боковой цепи, синтезировали посредством CROP из nPropOx и MestOx и последующего амидирования сложноэфирных метильных боковых цепей этилендиамином с получением сополимера поли(2-пропил/аминоэтиламидоэтил-2-оксазолина) (NU-POX). По данным 1H-ЯМР полимер содержал 20% NH2.
Использовали губки из коллагена коровы (7×5×1 см), которые получали, как описано в примере 1. Для этих экспериментов для покрытия коллагеновых губок использовали устройство ультразвукового распыления ExactaCoat (Sono-Tek), оборудованное нагревательной плитой.
Тест 4A: EL-POX в растворе
Раствор EL-POX (EL-POX, 20% NHS) в IPA/2-бутаноне (об./об., 1:1) (90 мг/мл) равномерно распределяли на коллагене посредством ультразвукового распыления в соответствии с условиями, приведенными в таблице 2, что приводило к плотности покрытия 5 мг/см2. Изображения SEM демонстрировали, что пористая структура коллагена сохранялась.
Конструкции разрезали на части (2 см2) и тестировали с использованием теста прочности при сдвиге с t15, как описано в примере 3. Результаты представляли собой 10,9+/-3,3 кПа (n=4), что указывало на хорошую адгезию и гемостаз.
Таблица 2: Параметры ультразвукового распыления
Тест 4B: EL-POX с суспендированным буфером
Раствор EL-POX в IPA/2-бутаноне (об./об., 1:1) (10 мг/мл) с суспендированным буфером HEPES (1,7 г) равномерно распределяли на коллагене посредством ультразвукового распыления в соответствии с условиями, приведенными в таблице 2, что приводило к плотности покрытия 5 мг/см2. Изображения SEM демонстрировали, что пористая структура коллагена сохранялась. Конструкции разрезали на части (2 см2) и тестировали с использованием теста прочности при сдвиге с t15, как описано в примере 3. Измеренная средняя прочность при сдвиге составляла 2,6 +/- 0,8 кПа (n=3), что указывало на хорошую адгезию и гемостаз.
Тест 4C: (1) раствор NU-POX и буфера+(2) раствор EL-POX
Раствор NU-POX в воде (10 мг/мл) с HEPES (1,7 г) равномерно распределяли на коллагене посредством ультразвукового распыления в соответствии с условиями, приведенными в таблице 2. Растворителю позволяли испаряться в течение 30 минут. После этого сверху покрытого коллагена раствор EL-POX в IPA/2-бутаноне (об./об., 1:1) (15 мг/мл) равномерно распределяли посредством ультразвукового распыления в соответствии с условиями, приведенными в таблице 2. После нанесения покрытия получали плотность покрытия 5 мг/см2 (±40% масс. NU-POX и ±60% масс. EL-POX). Изображения SEM демонстрировали, что пористая структура коллагена сохранялась. Конструкции разрезали на части (2 см2) и тестировали с использованием теста прочности при сдвиге с t15, как описано в примере 3. Измеренная средняя прочность при сдвиге составляла 3,9 +/- 2,9 кПа (n=2), что указывало на хорошую адгезию и гемостаз.
Тест 4D: Раствор буфера (суспензия EL-POX)
Суспензию EL-POX в IPA/диэтиловом эфире/триэтиламине (об./об./v, 50:50:1) равномерно распределяли на коллагене посредством ультразвукового распыления в соответствии с условиями, приведенными в таблице 2. После нанесения покрытия получали плотность покрытия 4 мг/см2. Изображения SEM демонстрировали, что пористая структура коллагена сохранялась. Конструкции разрезали на части (2 см2) и тестировали с использованием теста прочности при сдвиге, как описано в примере 3. Измеренная средняя прочность при сдвиге составляла 4,2 +/- 3,5 кПа (n=3), что указывало на хорошую адгезию и гемостаз.
Кроме того, гемостатические свойства покрытых с помощью ультразвука коллагеновых губок 4A-4D оценивали следующим образом:
· сверху покрытой EL-POX стороны коллагеновой губки капельно добавляли 100 мкл свежей гепаринизированной цельной крови.
· сверху покрытой кровью коллагеновой губки помещали другую покрытую EL-POX губку, с покрытой EL-POX стороной, обращенной к крови ("способ сэндвича").
· с использованием марли прикладывали небольшое давление в течение 10 секунд. Затем, сэндвич помещали в стакан, содержащий воду, и воду перемешивали в течение двух минут.
В этих условиях две коллагеновые губки из всех 4A-4D оставались скрепленными, и крови из губок не вытекало, что указывало на гемостаз и адгезию.
Пример 5
Терполимер NHS-поли-2-(пропил/гидроксиэтиламидэтил/сложноэфирная этиламидэтилльная группа сложного этилового эфира NHS)-2-оксазолин] с активированными боковыми цепями (=EL-POX, 20% NHS) синтезировали, как описано в примере 2.
EL-POX, 20% NHS растворяли в метаноле (180 мг/мл). Раствор равномерно капельно распределяли сверху куска окисленной регенерированной целлюлозы (ORC, Gelita-Cel). Непосредственно после нанесения покрытия пластыри сушили при комнатной температуре в потоке воздуха в течение 4 часов. Получали покрытие ORC с EL-POX, 20% NHS (12 мг/см2).
Гемостатические свойства покрытых ORC оценивали следующим образом:
· сверху покрытой EL-POX, 20% NHS, стороны ORC (1×1 см) капельно добавляли 100 мкл свежей гепаринизированной цельной крови.
· сверху покрытой кровью ORC помещали другую покрытую EL-POX, 20% NHS, ORC с покрытой EL-POX стороной, обращенной к крови ("способ сэндвича").
· с использованием марли прикладывали небольшое давление в течение 10 секунд. Затем, сэндвич помещали в стакан, содержащий воду, и воду перемешивали в течение пяти минут. В этих условиях два куска ORC оставались скрепленными в течение пяти минут, и среда не приобретала красной окраски.
В контрольном эксперименте с использованием непокрытой ORC ORC в перемешиваемой воде разделялись в пределах минуты, и вода приобретала красную окраску, что указывало на отсутствие гемостаза.
Пример 6
Терполимер NHS-поли-2-(пропил/гидроксиэтиламидэтил/сложноэфирная этиламидэтилльная группа сложного этилового эфира NHS)-2-оксазолин] с активированными боковыми цепями (=EL-POX, 20% NHS) синтезировали, как описано в примере 2. Порошок хитозана получали из Sigma-Aldrich. (степень деацетилирования 75-85%, Mn 10,000). Порошок крахмала (HaemoCer®) получали из BioCer, Germany.
Порошки раздельно покрывали EL-POX, 20% NHS (EL-POX) следующим образом.
· порошок (хитозан или крахмал) взвешивали и покрывали раствором EL-POX (15 мг/мл) в DCM.
· суспензию сушили при пониженном давлении.
· после этого высушенный покрытый порошок растирали с получением гомогенного тонкодисперсного порошка. Порошок покрытого хитозана содержит приблизительно 25% масс. EL-POX. Порошок покрытого крахмала содержит приблизительно 10% масс. EL-POX.
В качестве контроля тестировали растертый непокрытый порошок хитозана, растертый непокрытый порошок крахмала и растертый EL-POX.
Покрытые EL-POX порошки и контрольные образцы для оценки гемостатических свойств смешивали с (1) карбонатным буфером (0,1 M, pH 9) или (2) гепаринизированной кровью человека (pH 7,4). Это тестировали следующим способом: порошки взвешивали в пробирке Eppendorf и смешивали с 250 мкл буфера (1) или кровью (2). Время гелеобразования определяли, переворачивая пробирку вверх и вниз до формирования геля.
Количество используемых материалов и результаты тестов по сшиванию приведены в таблице 3.
Таблица 3: Результаты тестов по сшиванию
*рассчитано на основе % масс. EL-POX в покрытых порошках
Эти результаты демонстрируют, что хитозан способен образовывать сшивки с EL-POX (образец 2), и что крахмал не способен образовывать сшивки с EL-POX (образец 7). Покрытые EL-POX хитозан и крахмал были способны к образованию сшивок с кровью (образцы 1 и 10), тогда как порошки непокрытых хитозана и крахмала не формируют гель в присутствии буфера и/или крови (образцы 3, 4, 8 и 9). Порошок EL-POX способен к формированию геля посредством реакции с аминами в крови (образец 5), тогда как формирования геля при комбинировании порошка EL-POX с буфером не наблюдали (образец 6).
Выявлено, что гели, содержащие EL-POX, стабильны в воде. В отличие от этого гели с кровью, получаемые при добавлении 200 мг крахмала или хитозана к 250 мкл крови, были не стабильны в воде.
Пример 7
Терполимер NHS-поли-2-(пропил/гидроксиэтиламидэтил/сложноэфирная этиламидэтилльная группа сложного этилового эфира NHS)-2-оксазолин] с активированными боковыми цепями (=EL-POX, 20% NHS) синтезировали, как описано в примере 3. 4-замещенный NHS PEG (тетрасукцинимидилглутарат пентаэритритолполи(этиленгликолевого) простого эфира, EL-PEG) получали из NOF America corporation. Губки из коллагена коровы (7×5 × 1 см) получали, как описано в примере 1.
Сравнивали два способа нанесения: (I) способ расплавления и (II) способ с покрывающей жидкостью.
(I) Способ расплавления (сравнительные примеры)
Известное количество порошков полимеров, EL-POX, 20% NHS и EL-PEG, равномерно распределяли сверху коллагеновых губок с получением плотностей покрытия, указанных в таблице 4. EL-POX, 20% NHS и EL-PEG нагревали до температур, указанных в таблице 4, в предварительно нагретой печи в течение 5 минут с расплавлением порошка полимера. В этих временных рамках и температурных условиях EL-POX и EL-PEG оставались стабильными.
Изображения SEM полученных конструкций продемонстрировали, что сформированная пленка полимера запаивала пористую структуру верхнего слоя коллагена.
Таблица 4: Условия (I) в способе расплавления
(II) Способ с покрывающей жидкостью
Порошок EL-POX, 20% NHS, растворяли в IPA/DCM (об./об., 1:1) (15 мг/мл) и раствор равномерно распределяли сверху коллагеновых губок посредством капельного покрытия с получением плотности покрытия 12 мг/см2. Губки сушили в вакуумной печи в течение 2 часов. Изображения SEM демонстрировали, что пористая структура коллагена сохранялась.
Гемостатические свойства покрытых коллагеновых губок оценивали следующим образом:
· сверху покрытой EL-POX, 20% NHS, или EL-PEG стороны коллагеновой губки капельно добавляли 100 мкл свежей гепаринизированной цельной крови.
· сверху покрытой кровью коллагеновой губки помещали другую покрытую губку с покрытыми сторонами, обращенными к крови ("способ сэндвича").
· с использованием марли прикладывали небольшое давление в течение 10 секунд. Затем, сэндвич помещали в стакан, содержащий воду, и воду перемешивали в течение одной минуты.
Коллагеновые губки, полученные посредством расплавления (EL-POX и EL-PEG), разделялись в течение минуты, что указывало на отсутствие гемостаза и адгезии. Коллагенов губки (с EL-POX), полученные посредством капельного покрытия, оставлялись скрепленными в течение 1 минуты, что указывало на гемостаз и адгезию.
Этот пример демонстрирует, что способ нанесения влияет на доступность поры в коллагене и объясняет различия в гемостазе и адгезии между губками, получаемыми посредством расплавления, и губками, получаемыми посредством покрытия жидкостью.
Пример 8
Обработка травматизированной печени и разрыва селезенки представляет собой большую проблему в хирургии. Так как селезенка обладает превосходным кровоснабжением, и разрыв селезенки часто ассоциирован с кровотечением в брюшную полость.
Проводили стандартизированный комбинированный проникающий разрыв селезенки у n=1 анестезированной свиньи (домашняя свинья, самец, масса тела: 40 кг, взрослая). Проводили срединную лапаротомию для оценки селезенки. Скальпелем проводили субкапсулярные стандартизированные повреждения (10 мм x 10 мм) n=3 (S1…S3.
Тестировали три типа гемостатических продуктов, обзор приведен в таблице 5.
Таблица 5: Описание тестируемых продуктов
Прикладывали гемостатические продукты с легким надавливанием. После прикладывания продукта оценивали время до гемостаза, см. таблицу 6.
Таблица 6: Результаты в модели на животных
TTH=время до гемостаза; n=количество продуктов, необходимых для достижения гемостаза
Этот пример демонстрируют гемостатическую эффективность покрытой EL-POX губки для селезенки свиньи. На основе результатов, приведенных в таблице 6, покрытая EL-POX губка в этой модели действовала для достижения гемостаза равным образом хорошо с эталонным продуктом (Hemopatch™) и лучше, чем контроль. Кроме того, наблюдали, что объем впитывания крови покрытой EL-POX губки превышал объем впитывания крови эталонного продукта. Таким образом, гемостаз, достигаемый с использованием покрытой EL-POX губки способствовал быстрому началу свертывания крови.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОСОВМЕСТИМЫЙ ГИБКИЙ ГЕМОСТАТИЧЕСКИЙ ЛИСТ | 2020 |
|
RU2824580C2 |
| ГЕМОСТАТИЧЕСКИЙ ПОРОШОК | 2020 |
|
RU2820476C2 |
| СШИТЫЕ ПОЛИМЕРЫ И ИМПЛАНТАТЫ, ПРОИЗВЕДЕННЫЕ ИЗ ЭЛЕКТРОФИЛЬНО АКТИВИРОВАННОГО ПОЛИОКСАЗОЛИНА | 2012 |
|
RU2593755C2 |
| ГЕМОСТАТИЧЕСКАЯ ГУБКА | 2011 |
|
RU2562569C2 |
| БЫСТРОДЕЙСТВУЮЩИЙ ГЕРМЕТИК И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ И ИЗГОТОВЛЕНИЯ | 2007 |
|
RU2442612C2 |
| АППЛИКАЦИОННЫЙ ГЕМОСТАТИЧЕСКИЙ МАТЕРИАЛ И СПОСОБ ЕГО ПРОИЗВОДСТВА | 2020 |
|
RU2810165C1 |
| СРЕДСТВО ДЛЯ ГЕМОСТАТИЧЕСКОЙ ОБРАБОТКИ РАНЫ | 2013 |
|
RU2661036C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ПОВЯЗКИ | 2007 |
|
RU2444375C2 |
| ГЕМОСТАТИЧЕСКАЯ ГУБКА, ОСНОВАННАЯ НА КОЛЛАГЕНЕ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ, ПОВЯЗКА ДЛЯ РАН, ВКЛЮЧАЮЩАЯ ТАКУЮ ГУБКУ, И НАБОР ДЛЯ ПРИГОТОВЛЕНИЯ ПОВЯЗКИ ДЛЯ РАН | 1997 |
|
RU2193897C2 |
| Композиционный биоматериал, обладающий гемостатической и регенеративной активностью (варианты) | 2022 |
|
RU2794766C1 |
Изобретение относится к способу получения адгезивного гемостатического продукта, где указанный способ включает этапы: предоставления твердого пористого субстрата; покрытия субстрата покрывающей жидкостью, содержащей электрофильно активированный полиоксазолин (EL-POX) и растворитель, с получением покрытого субстрата, где указанный EL-POX содержит по меньшей мере 2 реакционноспособные электрофильные группы; удаление растворителя с покрытого субстрата. Способ по настоящему изобретению обеспечивает применение покрытия с EL-POX, которое оставляет пористую структуру субстрата в основном неизменной так, что способность пористого субстрата впитывать жидкости организма, такие как кровь, остается по существу незатронутой. Покрытый EL-POX гемостатический продукт, получаемый способом по настоящему изобретению, обладает превосходными адгезионными свойствами вследствие наличия электрофильных реакционноспособных групп, которые способны к реакции, например, с аминогруппами, которые в природе присутствуют в ткани, с формированием ковалентных связей. Настоящее изобретение также относится к гемостатическому продукту со свойством адгезии к тканям, выбранному из покрытого ячеистого материала, покрытого пенистого материала и покрытого порошка, где указанный гемостатический продукт содержит: твердый пористый субстрат с пористостью по меньшей мере 5 об.% и с внешней поверхностью, которая содержит нуклеофильный полимер, содержащий реакционноспособные нуклеофильные группы; адгезивное покрытие, которое покрывает по меньшей мере часть твердого субстрата, где указанное покрытие содержит электрофильно активированный полиоксазолин (EL-POX), где указанный EL-POX в среднем содержит по меньшей мере 1 реакционноспособную электрофильную группу. 2 н. и 13 з.п. ф-лы, 8 пр., 6 табл.
1. Способ получения адгезивного гемостатического продукта, где указанный способ включает этапы:
- предоставление твердого пористого субстрата;
- покрытия субстрата покрывающей жидкостью, содержащей электрофильно активированный полиоксазолин (EL-POX) и растворитель, с получением покрытого субстрата, где указанный EL-POX содержит по меньшей мере 10 реакционноспособных электрофильных групп;
- удаление растворителя с покрытого субстрата.
2. Способ по п. 1, где пористость твердого субстрата составляет по меньшей мере 20 об.%, предпочтительно по меньшей мере 50 об.% и более предпочтительно по меньшей мере 85 об.%.
3. Способ по п. 1 или 2, где субстрат обладает внешней поверхностью, которая содержит нуклеофильный полимер, содержащий реакционноспособные нуклеофильные группы.
4. Способ по п. 1 или 2, где твердый субстрат представляет собой ячеистый или пенистый материал в форме листа с длиной от 10 до 200 мм, шириной от 5 до 200 мм и толщиной от 0,5 до 10 мм.
5. Способ по п. 1 или 2, где твердый субстрат представляет собой порошок, где средневзвешенный размер частиц указанного порошка находится в диапазоне 10-200 мкм.
6. Способ по п. 1 или 2, где субстрат покрывают, распыляя покрывающую жидкость на субстрат через ультразвуковую форсунку.
7. Способ по п. 1 или 2, где EL-POX содержит по меньшей мере 2 реакционноспособные электрофильные группы, выбранные из сложных эфиров карбоновых кислот, сложных эфиров сульфокислот, сложных эфиров фосфокислот, пентафторфенильных сложных эфиров, п-нитрофенильных сложных эфиров, п-нитротиофенильных сложных эфиров, галогенангидридных групп, ангидридов, кетонов, альдегидов, изоцианато, тиоизоцианато, изоциано, эпоксидов, активированных гидроксильных групп, олефинов, простых глицидиловых эфиров, карбоксилов, сложного сукцинимидильного эфира, сукцинимидилкарбоната, сукцинимидилкарбаматов, сложного сульфосукцинимидильного эфира, сульфосукцинимидилкарбоната, малеимидо (малеимидил), этенсульфонила, сложных имидоэфиров, ацетоацетата, галогенацеталя, ортопиридилдисульфида, дигидроксифенильных производных, винила, акрилата, акриламида, йодацетамида и их сочетаний.
8. Способ по п. 1 или 2, где нуклеофильный полимер выбран из белка, хитозана и синтетических или углеводных полимеров, и где реакционноспособные нуклеофильные группы могут быть выбраны из амина, тиола, фосфина и их сочетаний.
9. Способ по п. 1 или 2, где покрывающая жидкость содержит по меньшей мере 50 мас.% растворителя, выбранного из 2-пропанола, этилового спирта, метанола, дихлорметана, ацетона, анизола, 1-бутанола, 2-бутанола, бутилацетата, простого трет-бутилметилового эфира, изопропилбензола, диметилсульфоксида, этилацетата, простого этилового эфира, этилформиата, гептана, изобутилацетата, изопропилацетата, метилацетата, 3-метил-1-бутанола, метилэтилкетона, метилизобутилкетона, 2-метил-1-пропанола, пентана, 1-пентанола, 1-пропанола, пропилацетата и их сочетаний.
10. Способ по п. 1 или 2, где после покрытия субстрата покрывающей жидкостью и перед и/или в течение удаления растворителя реакционноспособные электрофильные группы EL-POX реагируют с реакционноспособными нуклеофильными группами нуклеофильного полимера, который находится на поверхности субстрата, с формированием ковалентных связей.
11. Способ по п. 1 или 2, где EL-POX растворяют в покрывающей жидкости, и где покрывающая жидкость содержит диспергированную, нерастворенную буферную систему, где буферный pH указанной покрывающей жидкости находится в диапазоне 7-11, а буферная емкость составляет по меньшей мере 10 ммоль⋅л-1⋅pH-1.
12. Способ по п. 1 или 2, где EL-POX растворяют в покрывающей жидкости, и где способ включает покрытие субстрата буферной жидкостью до покрытия субстрата содержащей EL-POX покрывающей жидкостью, где буферный pH указанной буферной жидкости находится в диапазоне 7-11, а буферная емкость составляет по меньшей мере 10 ммоль⋅л-1⋅pH-1.
13. Способ по п. 1 или 2, где по меньшей мере 80 мас.% EL-POX, находящегося в покрывающей жидкости, не растворено при нанесении покрывающей жидкости на субстрат, и где покрывающая жидкость содержит растворенную или нерастворенную буферную систему, где буферный pH указанной покрывающей жидкости находится в диапазоне 7-11, и буферная емкость составляет по меньшей мере 10 ммоль⋅л-1⋅pH-1.
14. Способ по п. 1 или 2, где после удаления растворителя EL-POX в среднем содержит по меньшей мере 5 реакционноспособных электрофильных групп.
15. Адгезивный гемостатический продукт, выбранный из покрытого ячеистого материала, покрытого пенистого материала или покрытого порошка, где указанный гемостатический продукт содержит:
- твердый пористый субстрат с внешней поверхностью, которая содержит нуклеофильный полимер, содержащий реакционноспособные нуклеофильные группы;
- адгезивное покрытие, которое покрывает по меньшей мере часть твердого субстрата, где указанное покрытие содержит электрофильно активированный полиоксазолин (EL-POX), где покрытие составляет 5-75 мас.% от гемостатического продукта; и
где адгезивный гемостатический продукт получают способом включающем этапы:
• предоставление твердого пористого субстрата, где указанный пористый субстрат обладает внешней поверхностью, которая содержит нуклеофильный полимер, содержащий реакционноспособные нуклеофильные группы;
• покрытия субстрата покрывающей жидкостью, содержащей электрофильно активированный полиоксазолин (EL-POX) и растворитель, с получением покрытого субстрата, где указанный EL-POX содержит по меньшей мере 10 реакционноспособных электрофильных групп;
• удаление растворителя с покрытого субстрата.
| US 2011251574 A1, 2011.10.13 | |||
| WO 2012057628 A2, 2012.05.03 | |||
| WO 2012122044 A2, 2012.09.13 | |||
| ГЕМОСТАТИЧЕСКАЯ, АНТИСЕПТИЧЕСКАЯ И РАНОЗАЖИВЛЯЮЩАЯ ГУБКА | 2002 |
|
RU2226406C1 |
| WO 2011113436 A1, 2011.09.22 | |||
| US 8377466 B2, 2013.02.19. | |||
Авторы
Даты
2019-10-25—Публикация
2015-10-05—Подача