УРОВЕНЬ ТЕХНИКИ
[0001] Активность клеток может регулироваться внешними сигналами, которые стимулируют или ингибируют внутриклеточные события. Процесс, посредством которого стимулирующие или ингибирующие сигналы передаются внутрь и внутри клетки для индукции внутриклеточного ответа, называют передачей сигнала. На протяжении последних десятилетий были установлены каскады событий передачи сигналов и было выявлено, что они играют центральную роль во множестве биологических ответов. Было выявлено, что дефекты различных компонентов передачи сигнала ответственны за широкое множество заболеваний, включая многочисленные формы злокачественной опухоли, воспалительные нарушения, метаболические нарушения, сосудистые и нейрональные заболевания (Gaestel et al. Current Medicinal Chemistry (2007) 14:2214-2234).
[0002] Киназы представляют собой класс важных молекул передачи сигнала. Киназы, как правило, могут быть подразделены на протеинкиназы и киназы липидов, и определенные киназы проявляют двойную специфичность. Протеинкиназы представляют собой ферменты, которые фосфорилируют другие белки и/или сами себя (т.е. аутофосфорилирование). Протеинкиназы, главным образом, могут быть подразделены на три основных группы, исходя из утилизации ими субстратов: тирозинкиназы, которые в основном фосфорилируют субстраты по остаткам тирозина (например, erb2, рецептор PDGF, рецептор EGF, рецептор VEGF, src, abl), серин/треониновые киназы, которые в основном фосфорилируют субстраты по остаткам серина и/или треонина (например, mTorC1, mTorC2, ATM, ATR, DNA-PK, Akt), и киназы с двойной специфичностью, которые фосфорилируют субстраты по остаткам тирозина, серина и/или треонина.
[0003] Киназы липидов представляют собой ферменты, которые катализируют фосфорилирование липидов. Эти ферменты и конечные фосфорилированные липиды и происходящие из липидов биологически активные органические молекулы играют роль во множестве различных физиологических процессов, включая пролиферацию, миграцию, адгезию и дифференцировку клеток. Определенные киназы липидов являются ассоциированными с мембраной, и они катализируют фосфорилирование липидов, содержащихся в клеточных мембранах или связанных с ними. Примеры таких ферментов включают киназы фосфоинозитида(ов) (например, PI3-киназы, PI4-киназы), диацилглицеринкиназы и сфингозинкиназы.
[0004] Каскад передачи сигнала фосфоинозитид-3-киназ (PI3K) является одной из наиболее мутантных систем в злокачественных опухолях человека. Передача сигнала PI3K также является ключевым фактором при многих других заболеваниях у человека. Передача сигнала PI3K вовлечена во многие болезненные состояния, включая аллергический контактный дерматит, ревматоидный артрит, остеоартрит, воспалительные заболевания кишечника, хроническое обструктивное нарушение легких, псориаз, рассеянный склероз, астму, нарушения, связанные с осложнениями диабета, и воспалительные осложнения в сердечно-сосудистой системе, такие как острый коронарный синдром.
[0005] PI3K являются представителями уникального и консервативного семейства внутриклеточных киназ липидов, которые фосфорилируют 3’-OH-группу на фосфатидилинозитолах или фосфоинозитидах. Семейство PI3K включает 15 киназ с различной субстратной специфичностью, профилями экспрессии и способами регуляции. PI3K класса I (p110α, p110β, p110δ и p110γ), как правило, активируются тирозинкиназами или сопряженными с G-белком рецепторами, в результате чего образуется PIP3, которая привлекает последующие эффекторы, такие как эффекторы каскада Akt/PDK1, mTOR, киназы семейства Tec, и GTP-азы семейства Rho. PI3K классов II и III играют ключевую роль во внутриклеточном транспорте посредством синтеза PI(3)P и PI(3,4)P2. PI3K представляют собой протеинкиназы, которые контролируют рост клеток (mTORC1) или осуществляют мониторинг целостности генома (ATM, ATR, DNA-PK и hSmg-1).
[0006] У млекопитающих существует четыре изоформы PI3Ks класса I: PI3K-α, β, δ (PI3K класса Ia) и PI3K-γ (PI3K класса Ib). Эти ферменты катализируют продуцирование фосфатидилинозитол-(3,4,5)-трифосфата (PIP3), что приводит к активации нижеследующих эффекторных каскадов, важных для выживания, дифференцировки и функционирования клеток. PI3K-α и PI3K-β широко экспрессируются и являются важными медиаторами передачи сигнала с рецепторов клеточной поверхности. PI3K-α представляет собой изоформу, наиболее часто являющуюся мутантной в злокачественных опухолях, и она играет роль в передачи сигнала инсулина и гомеостазе глюкозы (Knight et al. Cell (2006) 125(4):733-47; Vanhaesebroeck et al. Current Topic Microbiol. Immunol. (2010) 347:1-19). PI3K-β активируется в злокачественных опухолях с делецией гомолога фосфатазы и тензина (PTEN). Обе изоформы являются мишенями для низкомолекулярных терапевтических средств против злокачественной опухоли, находящихся на стадии разработки.
[0007] PI3K-δ и -γ предпочтительно экспрессируются в лейкоцитах и являются важными для функционирования лейкоцитов. Эти изоформы также вносят вклад в развитие и поддержание воспалительных и аутоиммунных заболеваний и гематологических злокачественных опухолей (Vanhaesebroeck et al. Current Topic Microbiol. Immunol. (2010) 347:1-19; Clayton et al. J Exp Med. (2002) 196(6):753-63; Fung-Leung Cell Signal. (2011) 23(4):603-8; Okkenhaug et al. Science (2002) 297(5583):1031-34). PI3K-δ активируется клеточными рецепторами (например, рецепторные тирозинкиназы) через взаимодействие с доменами гомологии с Sarc 2 (SH2) регуляторной субъединицы PI3K (p85), или через прямое взаимодействие с RAS.
[0008] PI3K-γ ассоциирована с сопряженными с G-белком рецепторами (GPCR), ответственна за очень быструю индукцию PIP3 в ответ на GPCR, и также может активироваться RAS, нижеследующими после других рецепторов. PIP3, продуцируемый PI3K, активирует нижеследующие эффекторные каскады путем взаимодействия с доменом гомологии с плекстрином (PH), содержащим ферменты (например, PDK-1 и AKT [PKB]).
[0009] Было показано, что как изоформа PI3K-δ, так и изоформа -γ, являются важными во многих аспектах биологии лейкоцитов. Центральные регуляторные роли для любого или обоих из этих ферментов были продемонстрированы в B-клетках (Vanhaesebroeck et al. Current Topic Microbiol. Immunol. (2010) 347:1-19; Clayton et al. J Exp Med. (2002) 196(6):753-63; Fung-Leung Cell Signal. (2011) 23(4):603-8; Al-Alwan et al. J Immunol. (2007) 178(4):2328-35; Bilancio et al. Blood (2006) 107(2):642-50; Dil et al. Mol Immunol. (2009) 46(10):1970-78; Durand et al. J Immunol. (2009) 183(9):5673-84; Srinivasan et al. Cell (2009) 139(3):573-86; Zhang et al. J. Allergy & Clin. Immunol. (2008) 122(4):811-9.e2), T-клетках (Vanhaesebroeck et al. Current Topic Microbiol. Immunol. (2010) 347:1-19; Garcon et al. Blood (2008) 111(3):1464-71; Haylock-Jacobs et al. J Autoimmun. (2011) 36(3-4):278-87; Jarmin et al. J. Clin. Invest. (2008) 118(3):1154-64; Ji et al. Blood (2007) 110(8):2940-47; Liu et al. J Immunol. (2010) 184(6):3098-105; Okkenhaug et al. J. Immunol. (2006) 177(8):5122-28; Reif et al. J. Immunol. (2004) 173(4):2236-40; Soond et al. Blood (2010) 115(11):2203-13; Webb et al. J. Immunol. (2005) 175(5):2783-87), нейтрофилах (Schmid et al. Cancer Cell (2011) 19(6):715-27), макрофагах/моноцитах (Schmid et al. Cancer Cell (2011) 19(6):715-27, Konrad et al. J. Biol. Chem. (2008) 283(48):33296-303; Marwick et al. Am J Respir Crit Care Med. (2009) 179(7):542-48; Randis et al. Eur J Immunol. (2008) 38(5):1215-24), тучных клетках (Ali et al. Nature (2004) 431(7011):1007-11; Kim et al. Trends Immunol. (2008) 29(10):493-501; Lee et al. FASEB J. (2006) 20(3):455-65), и NK cells (Guo et al. J Exp Med. (2008) 205(10):2419-35; Kim et al. Blood (2007) 110(9):3202-08; Saudemont et al. Proc Natl Acad Sci U S A. (2009) 106(14):5795-800; Tassi et al. Immunity. (2007) 27(2):214-27).
[0010] Полагают, что как PI3K-δ, так и -γ, являются важными для развития и персистирования аутоиммунных заболеваний и гематологических злокачественных опухолей.
[0011] Остается существенная потребность в усовершенствованной терапии злокачественных опухолей, таких как гематологические злокачественные опухоли.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0012] В рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения злокачественных опухолей или заболеваний, таких как гематологические злокачественные опухоли, которые обладают высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K (например, PI3K-δ и/или PI3K-γ). В одном варианте осуществления способы, композиции и наборы, описанные в настоящем описании, связаны с введением селективного модулятора изоформы PI3K (например, соединение, описанное в настоящем описании, которое селективно снижает или ингибирует активность одной или нескольких изоформы(изоформ) PI3K, например, PI3K-δ и/или PI3K-γ), отдельно или в комбинации с одним или несколькими другими средствами или способами лечения, индивидууму, например, млекопитающему, например, человеку, имеющему злокачественную опухоль или заболевание, такое как гематологическая злокачественная опухоль, которая обладает высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K.
[0013] В одном варианте осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа злокачественной опухоли или заболевания, таких как конкретный тип гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K. В одном варианте осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного подтипа злокачественной опухоли или заболевания, такого как конкретный подтип гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K. В одном варианте осуществления конкретный тип или конкретный подтип злокачественной опухоли или гематологической злокачественной опухоли обладает высокой экспрессией изоформы(изоформ) PI3K, включая одну или несколько из PI3K-δ или PI3K-γ или их комбинацию. В одном варианте осуществления конкретный тип или конкретный подтип гематологической злокачественной опухоли имеет высокую экспрессию PI3K-δ или PI3K-γ, или как PI3K-δ, так и PI3K-γ.
[0014] В одном варианте осуществления способы, композиции и наборы включают или относятся к стадии выбора конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например конкретного типа или конкретного подтипа гематологической злокачественной опухоли, для лечения с использованием биомаркера, описанного в настоящем описании (например, выбор конкретного типа или подтипа злокачественной опухоли или гематологической злокачественной опухоли, которые обладают высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K при определении с использованием биомаркера, описанного в настоящем описании). В одном варианте осуществления способы, композиции и наборы включают или относятся к стадии введения индивидууму, имеющего конкретный тип или конкретный подтип злокачественной опухоли или заболевания, например, конкретный тип или конкретный подтип гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K, модулятора PI3K, который селективно модулирует (например, селективно ингибирует) изоформу(изоформы) PI3K, которая на высоком уровне экспрессируется в конкретном типе или подтипе заболевания.
[0015] В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например, конкретного типа или конкретного подтипа гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии PI3K-δ. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например, конкретного типа или конкретного подтипа гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии PI3K-γ. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например, конкретного типа или конкретного подтипа гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии PI3K-δ и PI3K-γ. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например, конкретного типа или конкретного подтипа гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии PI3K-γ и PI3K-α. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например, конкретного типа или конкретного подтипа гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии PI3K-γ и PI3K-β. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например, конкретного типа или конкретного подтипа гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии PI3K-δ и PI3K-α. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например, конкретного типа или конкретного подтипа гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии PI3K-δ и PI3K-β. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например, конкретного типа или конкретного подтипа гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии PI3K-δ, PI3K-γ и PI3K-α. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения конкретного типа или конкретного подтипа злокачественной опухоли или заболевания, например, конкретного типа или конкретного подтипа гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии PI3K-δ, PI3K-γ и PI3K-β.
[0016] В одном варианте осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, такое как гематологическая злокачественная опухоль, где конкретный пациент или группа пациентов обладает(обладают) высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K. В одном варианте осуществления изоформа PI3K включает одну или несколько из PI3K-δ или PI3K-γ или их комбинацию. В одном варианте осуществления конкретный пациент или группа пациентов, имеющих злокачественную опухоль или гематологическую злокачественную опухоль, обладает(обладают) высокой экспрессией PI3K-δ или PI3K-γ, или как PI3K-δ, так и PI3K-γ.
[0017] В одном варианте осуществления способы, композиции и наборы содержат или относятся к стадии выбора пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, для лечения с использованием биомаркера, описанного в настоящем описании (например, выбор пациента или группы пациентов, который обладает(обладают) высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K при определении с использованием биомаркера, описанного в настоящем описании). В одном варианте осуществления способы, композиции и наборы содержат или относятся к стадии введения пациенту или группе пациентов, обладающих высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K, модулятора PI3K, который селективно модулирует (например, селективно ингибирует) изоформу(изоформы) PI3K, которая/которые на высоком уровне экспрессируются у пациента(ов).
[0018] В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, например, гематологическую злокачественную опухоль, которая обладает высоким уровнем экспрессии PI3K-δ. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль, например гематологическую злокачественную опухоль, которая обладает высоким уровнем экспрессии PI3K-γ. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, например гематологическую злокачественную опухоль, которая обладает высоким уровнем экспрессии PI3K-δ и PI3K-γ. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, например гематологическую злокачественную опухоль, которая обладает высоким уровнем экспрессии PI3K-γ и PI3K-α. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, например гематологическую злокачественную опухоль, которая обладает высоким уровнем экспрессии PI3K-γ и PI3K-β. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, например гематологическую злокачественную опухоль, которая обладает высоким уровнем экспрессии PI3K-δ и PI3K-α. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, например гематологическую злокачественную опухоль, которая обладает высоким уровнем экспрессии PI3K-δ и PI3K-β. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, например, гематологическую злокачественную опухоль, которая обладает высоким уровнем экспрессии PI3K-δ, PI3K-γ и PI3K-α. В конкретных вариантах осуществления в рамках настоящего изобретения предусматриваются способы, композиции и наборы для лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, например гематологическую злокачественную опухоль, которая обладает высоким уровнем экспрессии PI3K-δ, PI3K-γ и PI3K-β.
[0019] В определенных вариантах осуществления уровень экспрессии одной или нескольких конкретных изоформ PI3K в злокачественной опухоли или при заболевании (например, гематологическая злокачественная опухоль), или у пациента или в группе пациентов, можно определять путем выявления уровня экспрессии белка конкретной изоформы PI3K или ДНК конкретной изоформы PI3K, или РНК конкретной изоформы PI3K, например, с использованием способа, описанного в настоящем описании, или способа, известного в данной области. В других вариантах осуществления уровень экспрессии одной или нескольких конкретных изоформ PI3K в злокачественной опухоли или при заболевании (например, гематологическая злокачественная опухоль), или у пациента или в группе пациентов, можно определять путем количественного определения биомаркера, описанного в настоящем описании (например, биомаркер каскада передачи сигнала, или биомаркер мутации белка, биомаркер экспрессии белка, биомаркер мутации гена, биомаркер экспрессии гена, биомаркер цитокина, биомаркер хемокина или биомаркер конкретных злокачественных клеток, среди прочих). В другом варианте осуществления уровень экспрессии одной или нескольких конкретных изоформ PI3K в злокачественной опухоли или при заболевании (например, гематологическая злокачественная опухоль), или у пациента или в группе пациентов можно определять, исходя из информации, известной в данной области или основанной на предшествующих исследованиях злокачественной опухоли или заболевания (например, гематологическая злокачественная опухоль) или в предшествующем исследовании пациента или группы пациентов.
[0020] В одном варианте осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K (например, соединение, которое селективно снижает активность одной или нескольких изоформы(изоформ) PI3K), отдельно или в комбинации с одним или несколькими другими средствами или способами лечения, индивидууму, например, млекопитающему, например человеку. В одном варианте осуществления модулятор PI3K является селективным в отношении одной или нескольких изоформы(изоформ) PI3K относительно другой изоформы(изоформ) PI3K. В одном варианте осуществления модулятор PI3K (например, соединение, описанное в настоящем описании) является селективным в отношении PI3K-δ; селективным в отношении PI3K-γ; селективным в отношении PI3K-δ и PI3K-γ; селективным в отношении PI3K-γ и PI3K-α; селективным в отношении PI3K-γ и PI3K-β; селективным в отношении PI3K-δ и PI3K-α; селективным в отношении PI3K-δ и PI3K-β; селективным в отношении PI3K-δ, PI3K-γ и PI3K-α; или селективным в отношении PI3K-δ, PI3K-γ и PI3K-β; относительно другой изоформы(изоформ) PI3K. В одном варианте осуществления селективность модулятора PI3K (например, соединение, описанное в настоящем описании) в отношении одной изоформы PI3K относительно другой изоформы PI3K отличается приблизительно в 2 раза, приблизительно в 5 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 30 раз, приблизительно в 40 раз, приблизительно в 50 раз, приблизительно в 100 раз, приблизительно в 200 раз, приблизительно в 300 раз, приблизительно в 400 раз, приблизительно в 500 раз, приблизительно в 1000 раз, приблизительно в 2000 раз, приблизительно в 5000 раз, приблизительно в 10000 раз или более чем приблизительно в 10000 раз. В одном варианте осуществления селективность соединения, описанного в настоящем описании, в отношении одной изоформы PI3K относительно другой изоформы PI3K отличается более чем приблизительно в 2 раза, более чем приблизительно в 5 раз, более чем приблизительно в 10 раз, более чем приблизительно в 20 раз, более чем приблизительно в 30 раз, более чем приблизительно в 40 раз, более чем приблизительно в 50 раз, более чем приблизительно в 100 раз, более чем приблизительно в 200 раз, более чем приблизительно в 300 раз, более чем приблизительно в 400 раз, более чем приблизительно в 500 раз, более чем приблизительно в 1000 раз, более чем приблизительно в 2000 раз, более чем приблизительно в 5000 раз или более чем приблизительно в 10000 раз.
[0021] В определенных вариантах осуществления селективность модулятора PI3K (например, соединение, описанное в настоящем описании) в отношении одной или нескольких изоформы(изоформ) PI3K относительно другой изоформы(изоформ) PI3K можно определять путем измерения активности модулятора PI3K в отношении изоформ PI3K (например, PI3K-α, PI3K-β, PI3K-δ и/или PI3K-γ), например, с использованием способа, описанного в настоящем описании, или способа, известного в данной области.
[0022] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, у которого развилась устойчивость к предшествующему способу терапии, включающий идентификацию индивидуума, которому проводили предшествующее лечение, и введение индивидууму терапевтически эффективного количества модулятора PI3K или его фармацевтически приемлемой формы, отдельно или в комбинации с одним или несколькими другими терапевтическими средствами.
[0023] В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими ингибиторами BTK, антителами против CD20, ингибиторами протеасом или алкилирующими средствами. В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими ингибиторами BTK.
[0024] В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб (1-[(3R)-3-[4-амино-3-(4-феноксифенил)-1H-пиразолo[3,4-d]пиримидин-1-ил]пиперидин-1-ил]проп-2-ен-1-он) или AVL-292 (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид). В одном варианте осуществления ингибитор BTK представляет собой RN-486 (6-циклопропил-8-фтор-2-(2-гидроксиметил-3-{1-метил-5-[5-(4-метил-пиперазин-1-ил)пиридин-2-иламино]-6-оксо-1,6-дигидропиридин-3-ил}фенил)-2H-изохинолин-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил)фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид]), CGI-560 (N-[3-(8-анилиноимидазо[1,2-a]пиразин-6-ил)фенил]-4-трет-бутилбензамид), CGI-1746 (4-(трет-бутил)-N-(2-метил-3-(4-метил-6-((4-(морфолин-4-карбонил)фенил)амино)-5-оксо-4,5-дигидропиразин-2-ил)фенил)бензамид), HM-71224, ONO-4059, ACP-196, CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпиримидин-2-ил)амино)фенокси)-N-метилпиколинамид) или LFM-A13 (2Z-циано-N-(2,5-дибромфенил)3-гидрокси-2-бутенамид).
[0025] В одном варианте осуществления способ, описанный в настоящем описании, включает получение биологического образца от индивидуума и обнаружение присутствия одной или нескольких мутаций, выбранных из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена LCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R), и WHIM-подобной мутации CXCR4 в образце.
[0026] В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими ингибиторами протеасом. В одном варианте осуществления ингибитором протеасом является бортезомиб. В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими алкилирующими средствами. В одном варианте осуществления алкилирующее средство представляет собой азотистый иприт. В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими антителами против CD20. В одном варианте осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб,131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб или офатумумаб.
[0027] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения индивидуума со злокачественной опухолью или гематологической злокачественной опухолью, включающий:
идентификацию индивидуума с одной или несколькими мутациями, выбранными из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) и WHIM-подобной мутации CXCR4; и
введение терапевтически эффективного количества модулятора PI3K или его фармацевтически приемлемой формы индивидууму, у которого идентифицированы одна или несколько мутаций.
[0028] В другом варианте осуществления введение дополнительно включает комбинирование с одним или несколькими другими лекарственными средствами у индивидуума, у которого идентифицированы одна или несколько мутаций.
[0029] В одном варианте осуществления идентификация включает получение биологического образца от индивидуума и обнаружение одной или нескольких мутаций, выбранных из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) и WHIM-подобной мутации CXCR4 в образце. В одном варианте осуществления обнаружение включает проведение полимеразной цепной реакции (ПЦР) или гибридизации для обнаружения одной или нескольких мутаций.
[0030] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ выбора индивидуума, у которого диагностирована злокачественная опухоль или гематологическая злокачественная опухоль, в качестве кандидата для лечения терапевтически эффективным количеством модулятора PI3K или его фармацевтически приемлемой формы, включающий:
(a) обнаружение присутствия или отсутствия одной или нескольких мутаций, выбранных из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) и WHIM-подобной мутации CXCR4 в образце, полученном от индивидуума, где присутствие одной или нескольких мутаций указывает на то, что индивидуум является кандидатом для лечения терапевтически эффективным количеством модулятора PI3K или его фармацевтически приемлемой формы; и
(b) введение индивидууму терапевтически эффективного количества модулятора PI3K или его фармацевтически приемлемой формы, где в образце присутствует одна или несколько мутаций.
[0031] В одном варианте осуществления введение дополнительно включает комбинирование с одним или несколькими другими терапевтическими средствами у индивидуума, у которого идентифицированы одна или несколько мутаций.
[0032] В одном варианте осуществления модулятор PI3K представляет собой соединение 292. В другом варианте осуществления модулятор PI3K представляет собой CAL-101 (GS-1101, иделалисиб, (S)-2-(1-(9H-пурин-6-иламино)пропил)-5-фтор-3-фенилхиназолин-4(3H)-он).
[0033] В одном варианте осуществления другое терапевтическое средство представляет собой химиотерапевтическое средство или терапевтическое антитело. В одном варианте осуществления химиотерапевтическое средство выбрано из ингибиторов митоза, алкилирующих средств, антиметаболитов, ингибитора протеасом, интераклирующих антибиотиков, ингибиторов факторов, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомераз, модификаторов биологического ответа, антигормональных средств, ингибиторов ангиогенеза или антиандрогенов.
[0034] В одном варианте осуществления терапевтическое антитело выбрано из антитела против CD37, антитела против CD20 и антитела против CD52. В одном варианте осуществления терапевтическое антитело представляет собой антитело против CD20. В одном варианте осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб,131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб или офатумумаб. В одном варианте осуществления антитело против CD20 представляет собой обинутузумаб.
[0035] В одном варианте осуществления молярное соотношение модулятора PI3K и другого терапевтического средства составляет приблизительно 500:1, приблизительно 250:1, приблизительно 100:1, приблизительно 50:1, приблизительно 25:1, приблизительно 20:1, приблизительно 19:1, приблизительно 18: 1, приблизительно 17:1, приблизительно 16:1, приблизительно 15:1, приблизительно 14:1, приблизительно 13:1, приблизительно 12:1, приблизительно 11:1, приблизительно 10:1, приблизительно 5:1, приблизительно 4:1, приблизительно 3:1, приблизительно 2:1, или приблизительно 1:1.В одном варианте осуществления модулятор PI3K вводят в суточной дозе от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 10 мг до приблизительно 60 мг, от приблизительно 20 мг до приблизительно 60 мг, от приблизительно 30 мг до приблизительно 60 мг, от приблизительно 40 мг до приблизительно 60 мг, от приблизительно 45 мг до приблизительно 55 мг, приблизительно 10 мг, приблизительно 20 мг или приблизительно 50 мг; или при дозировании два раза в сутки от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 25 мг или приблизительно 50 мг; и
другое терапевтическое средство вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 10000 мг, от приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг, от приблизительно 900 мг до приблизительно 1000 мг или приблизительно 1000 мг.
[0036].
[0037] В одном варианте осуществления модулятор PI3K вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 500 мг, от приблизительно 1 мг до приблизительно 500 мг, от приблизительно 100 мг до приблизительно 500 мг, от приблизительно 150 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 400 мг или от приблизительно 250 мг до приблизительно 350 мг; и
обинутузумаб вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 10000 мг, от приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг или от приблизительно 900 мг до приблизительно 1000 мг.
[0038] В одном варианте осуществления модулятор PI3K вводят в количестве для достижения максимальной концентрации в плазме в стационарном состоянии (Cmaxss) от приблизительно 1000 нг/мл до приблизительно 5000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 4000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 3000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 2500 нг/мл или от приблизительно 1400 нг/мл до приблизительно 2200 нг/мл; и
другое средство вводят в количестве для достижения Cmaxss от приблизительно 100 нг/мл до приблизительно 1000 нг/мл, от приблизительно 250 нг/мл до приблизительно 1000 нг/мл, от приблизительно 500 нг/мл до приблизительно 1000 нг/мл, от приблизительно 600 нг/мл до приблизительно 1000 нг/мл, от приблизительно 700 нг/мл до приблизительно 1000 нг/мл, от приблизительно 740 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 900 нг/мл или от приблизительно 750 нг/мл до приблизительно 800 нг/мл.
[0039] В одном варианте осуществления модулятор PI3K вводят в количестве для достижения площади под кривой концентрация в плазме-время в стационарном состоянии (AUCss) от приблизительно 5000 нг/мл*ч до приблизительно 10000 нг/мл*ч, от приблизительно 5000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 7000 нг/мл*ч до приблизительно 9000 нг/мл*ч, приблизительно 7000 нг/мл*ч, приблизительно 7500 нг/мл*ч, приблизительно 8000 нг/мл*ч, приблизительно 8500 нг/мл*ч, приблизительно 8600 нг/мл*ч, приблизительно 8700 нг/мл*ч или приблизительно 8800 нг/мл*ч; и
другое средство вводят в количестве для достижения AUCss от приблизительно 1000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 2000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч.
[0030] В одном варианте осуществления модулятор PI3K представляет собой соединение 292 или его фармацевтически приемлемую форму, а другое лекарственное средство представляет собой обинутузумаб.
[0041] В другом варианте осуществления модулятор PI3K представляет собой CAL-101 или его фармацевтически приемлемую форму, а другое лекарственное средство представляет собой обинутузумаб.
[0042] В одном варианте осуществления молярное соотношение соединения 292 и обинутузумаба составляет приблизительно 500:1, приблизительно 250:1, приблизительно 100:1, приблизительно 50:1, приблизительно 25:1, приблизительно 20:1, приблизительно 19:1, приблизительно 18: 1, приблизительно 17:1, приблизительно 16:1, приблизительно 15:1, приблизительно 14:1, приблизительно 13:1, приблизительно 12:1, приблизительно 11:1, приблизительно 10:1, приблизительно 5:1, приблизительно 4:1, приблизительно 3:1, приблизительно 2:1 или приблизительно 1:1. В одном варианте осуществления молярное соотношение составляет от 25:1 до приблизительно 1:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 20:1 до приблизительно 5:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 20:1 до приблизительно 10:1. В одном варианте осуществления молярное соотношение составляет приблизительно 20:1, приблизительно 19:1, приблизительно 18:1, приблизительно 17:1, приблизительно 16:1 или приблизительно 15:1. В одном варианте осуществления молярное соотношение составляет приблизительно 16:1. В одном варианте осуществления молярное соотношение составляет приблизительно 17:1.
[0043] В одном варианте осуществления молярное соотношение CAL-101 и обинутузумаба составляет приблизительно 500:1, приблизительно 250:1, приблизительно 100:1, приблизительно 50:1, приблизительно 25:1, приблизительно 20:1, приблизительно 19:1, приблизительно 18: 1, приблизительно 17:1, приблизительно 16:1, приблизительно 15:1, приблизительно 14:1, приблизительно 13:1, приблизительно 12:1, приблизительно 11:1, приблизительно 10:1, приблизительно 5:1, приблизительно 4:1, приблизительно 3:1, приблизительно 2:1 или приблизительно 1:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 150:1 до приблизительно 50:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 150:1 до приблизительно 75:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 125:1 до приблизительно 75:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 110:1 до приблизительно 90:1. В одном варианте осуществления молярное соотношение составляет приблизительно 100:1.
[0044] В одном варианте осуществления соединение 292 вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 10 мг до приблизительно 60 мг, от приблизительно 20 мг до приблизительно 60 мг, от приблизительно 30 мг до приблизительно 60 мг, от приблизительно 40 мг до приблизительно 60 мг, от приблизительно 45 мг до приблизительно 55 мг, приблизительно 10 мг, приблизительно 20 мг или приблизительно 50 мг; или в дозировке два раза в сутки от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, 25 мг или приблизительно 50 мг; и обинутузумаб вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 10000 мг, от приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг, от приблизительно 900 мг до приблизительно 1000 мг или приблизительно 1000 мг.
[0045] В одном варианте осуществления соединение 292 вводят в суточной дозировке от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 15 мг до приблизительно 60 мг, от приблизительно 20 мг до приблизительно 60 мг, от приблизительно 30 мг до приблизительно 60 мг или от приблизительно 40 мг до приблизительно 60 мг. В одном варианте осуществления соединение 292 вводят в суточной дозировке приблизительно 50 мг. В одном варианте осуществления соединение 292 вводят два раза в сутки в дозировке от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 15 мг до приблизительно 30 мг или от приблизительно 20 мг до приблизительно 30 мг. В одном варианте осуществления соединение 292 вводят два раза в сутки в дозировке приблизительно 25 мг. В одном варианте осуществления обинутузумаб вводят в суточной дозировке от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг или от приблизительно 900 мг до приблизительно 1000 мг. В одном варианте осуществления обинутузумаб вводят в суточной дозировке приблизительно 1000 мг.
[0046] В одном варианте осуществления CAL-101 вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 500 мг, от приблизительно 1 мг до приблизительно 500 мг, от приблизительно 100 мг до приблизительно 500 мг, от приблизительно 150 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 400 мг или от приблизительно 250 мг до приблизительно 350 мг; и
[0047] обинутузумаб вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 10000 мг, от приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг или от приблизительно 900 мг до приблизительно 1000 мг. В одном варианте осуществления CAL-101 вводят в суточной дозировке от приблизительно 200 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 400 мг или от приблизительно 250 мг до приблизительно 350 мг. В одном варианте осуществления CAL-101 вводят в суточной дозировке приблизительно 300 мг. В одном варианте осуществления CAL-101 вводят два раза в сутки в дозировке от приблизительно 10 мг до приблизительно 250 мг, от приблизительно 75 мг до приблизительно 200 мг, от приблизительно 100 мг до приблизительно 200 мг или от приблизительно 125 мг до приблизительно 1750 мг. В одном варианте осуществления CAL-101 вводят два раза в сутки в дозировке приблизительно 150 мг. В одном варианте осуществления обинутузумаб вводят в суточной дозировке от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг или от приблизительно 900 мг до приблизительно 1000 мг. В одном варианте осуществления обинутузумаб вводят в суточной дозировке приблизительно 1000 мг.
[0048] В одном варианте осуществления соединение 292 вводят в количестве для достижения Cmaxss от приблизительно 1000 нг/мл до приблизительно 5000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 4000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 3000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 2500 нг/мл или от приблизительно 1400 нг/мл до приблизительно 2200 нг/мл; и
обинутузумаб вводят в количестве для достижения Cmaxss от приблизительно 100 нг/мл до приблизительно 1000 нг/мл, от приблизительно 250 нг/мл до приблизительно 1000 нг/мл, от приблизительно 500 нг/мл до приблизительно 1000 нг/мл, от приблизительно 600 нг/мл до приблизительно 1000 нг/мл, от приблизительно 700 нг/мл до приблизительно 1000 нг/мл, от приблизительно 740 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 900 нг/мл или от приблизительно 750 нг/мл до приблизительно 800 нг/мл.
[0049] В одном варианте осуществления соединение 292 вводят в количестве для достижения Cmaxss от приблизительно 1500 нг/мл до приблизительно 1000 нг/мл, от приблизительно 1500 нг/мл до приблизительно 1200 нг/мл, от приблизительно 1500 нг/мл до приблизительно 1300 нг/мл или от приблизительно 1500 нг/мл до приблизительно 1400 нг/мл. В одном варианте осуществления соединение 292 вводят в количестве для достижения Cmaxss приблизительно 1487 нг/мл. В одном варианте осуществления Cmaxss составляет по меньшей мере 700 нг/мл, по меньшей мере 1000 нг/мл, по меньшей мере 1200 нг/мл, по меньшей мере 1400 нг/мл, по меньшей мере 1450 нг/мл или по меньшей мере 1480 нг/мл. В одном варианте осуществления обинутузумаб вводят в количестве для достижения Cmaxss от приблизительно 750 нг/мл до приблизительно 900 нг/мл, от приблизительно 750 нг/мл до приблизительно 850 нг/мл или от приблизительно 750 нг/мл до приблизительно 800 нг/мл. В одном варианте осуществления обинутузумаб вводят в количестве для достижения Cmaxss приблизительно 741 нг/мл. В одном варианте осуществления Cmaxss составляет по меньшей мере 200 нг/мл, по меньшей мере 500 нг/мл, по меньшей мере 600 нг/мл, по меньшей мере 700 нг/мл, по меньшей мере 720 нг/мл или по меньшей мере 740 нг/мл.
[0050] В одном варианте осуществления CAL-101 вводят в количестве для достижения Cmaxss от приблизительно 1000 нг/мл до приблизительно 5000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 4000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 3000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 2500 нг/мл или от приблизительно 1400 нг/мл до приблизительно 2200 нг/мл; и обинутузумаб вводят в количестве для достижения Cmaxss от приблизительно 100 нг/мл до приблизительно 1000 нг/мл, от приблизительно 250 нг/мл до приблизительно 1000 нг/мл, от приблизительно 500 нг/мл до приблизительно 1000 нг/мл, от приблизительно 600 нг/мл до приблизительно 1000 нг/мл, от приблизительно 700 нг/мл до приблизительно 1000 нг/мл, от приблизительно 740 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 900 нг/мл или от приблизительно 750 нг/мл до приблизительно 800 нг/мл.
[0051] В одном варианте осуществления CAL-101 вводят в количестве для достижения Cmaxss от приблизительно 1000 нг/мл до приблизительно 2500 нг/мл, от 1500 нг/мл до приблизительно 2500 или от приблизительно 2000 нг/мл до приблизительно 2500 нг/мл. В одном варианте осуществления CAL-101 вводят в количестве для достижения Cmaxss приблизительно 2200 нг/мл. В одном варианте осуществления Cmaxss составляет по меньшей мере 1000 нг/мл, по меньшей мере 1500 нг/мл, по меньшей мере 1750 нг/мл, по меньшей мере 2000 нг/мл, по меньшей мере 2100 нг/мл, по меньшей мере 2150 нг/мл, по меньшей мере 2175 нг/мл, или по меньшей мере 2200 нг/мл. В одном варианте осуществления обинутузумаб вводят в количестве для достижения Cmaxss от приблизительно 750 нг/мл до приблизительно 900 нг/мл, от приблизительно 750 нг/мл до приблизительно 850 нг/мл или от приблизительно 750 нг/мл до приблизительно 800 нг/мл. В одном варианте осуществления обинутузумаб вводят в количестве для достижения Cmaxss приблизительно 741 нг/мл. В одном варианте осуществления Cmaxss составляет по меньшей мере 200 нг/мл, по меньшей мере 500 нг/мл, по меньшей мере 600 нг/мл, по меньшей мере 700 нг/мл, по меньшей мере 720 нг/мл или по меньшей мере 740 нг/мл.
[0052] В одном варианте осуществления соединение 292 вводят в количестве для достижения AUCss от приблизительно 5000 нг/мл*ч до приблизительно 10000 нг/мл*ч, от приблизительно 5000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 7000 нг/мл*ч до приблизительно 9000 нг/мл*ч, приблизительно 7000 нг/мл*ч, приблизительно 7500 нг/мл*ч, приблизительно 8000 нг/мл*ч, приблизительно 8500 нг/мл*ч, приблизительно 8600 нг/мл*ч, приблизительно 8700 нг/мл*ч или приблизительно 8800 нг/мл*ч; и обинутузумаб вводят в количестве для достижения AUCss от приблизительно 1000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 2000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч.
[0053] В одном варианте осуществления соединение 292 вводят в количестве для достижения AUCss от приблизительно 7000 нг/мл*ч до приблизительно 9000 нг/мл*ч или от приблизительно 8000 нг/мл*ч до приблизительно 8500 нг/мл*ч. В одном варианте осуществления соединение 292 вводят в количестве для достижения AUCss приблизительно 8600 нг/мл*ч, приблизительно 8700 нг/мл*ч или приблизительно 8800 нг/мл*ч. В одном варианте осуществления соединение 292 вводят в количестве для достижения AUCss приблизительно 8787 нг/мл*ч. В одном варианте осуществления обинутузумаб вводят в количестве для достижения AUCss от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч. В одном варианте осуществления обинутузумаб вводят в количестве для достижения AUCss приблизительно 4044 нг/мл*ч.
[0054] В одном варианте осуществления CAL-101 вводят в количестве для достижения AUCss от приблизительно 5000 нг/мл*ч до приблизительно 10000 нг/мл*ч, от приблизительно 5000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 7000 нг/мл*ч до приблизительно 9000 нг/мл*ч, приблизительно 7000 нг/мл*ч, приблизительно 7500 нг/мл*ч, приблизительно 8000 нг/мл*ч, приблизительно 8500 нг/мл*ч, приблизительно 8600 нг/мл*ч, приблизительно 8700 нг/мл*ч или приблизительно 8800 нг/мл*ч; и обинутузумаб вводят в количестве для достижения AUCss от приблизительно 1000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 2000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч.
[0055] В одном варианте осуществления CAL-101 вводят в количестве для достижения AUCss от приблизительно 6000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 8000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 7500 нг/мл*ч или от приблизительно 6500 нг/мл*ч до приблизительно 7500 нг/мл*ч. В одном варианте осуществления CAL-101 вводят в количестве для достижения AUCss приблизительно 7000 нг/мл*ч. В одном варианте осуществления обинутузумаб вводят в количестве для достижения AUCss от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч. В одном варианте осуществления обинутузумаб вводят в количестве для достижения AUCss приблизительно 4044 нг/мл*ч.
[0056] В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL, макроглобулинемию Вальденстрема (WM), лимфому из клеток мантийной зоны, NHL, iNHL, диффузную крупноклеточную B-клеточную лимфому или T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой фолликулярную лимфому.
[0057] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения конкретной злокачественной опухоли или заболевания, такого как гематологическая злокачественная опухоль (например, конкретный тип или конкретный подтип гематологической злокачественной опухоли), которая обладает высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K, где способ включает: (1) определение уровня экспрессии одной или нескольких изоформы(изоформ) PI3K в злокачественной опухоли или при заболевании; (2) выбор терапевтического средства (например, модулятор PI3K, обладающий конкретным профилем селективности с отношении одной или нескольких изоформы(изоформ) PI3K), исходя из уровней экспрессии изоформ PI3K в злокачественной опухоли или при заболевании, подлежащих лечению; и (3) введение терапевтического средства пациенту, имеющему злокачественную опухоль или заболевание, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии. В одном варианте осуществления уровень экспрессии одной или нескольких изоформы(изоформ) PI3K в злокачественной опухоли или при заболевании можно измерять путем определения уровня экспрессии белка, ДНК и/или РНК изоформы PI3K; или путем количественного определения одного или нескольких биомаркеров, описанных в настоящем описании (например, биомаркер каскада передачи сигнала, биомаркер мутации белка, биомаркер экспрессии белка, биомаркер мутации гена, биомаркер экспрессии гена, биомаркер цитокина, биомаркер хемокина или биомаркер конкретных злокачественных клеток, среди прочих). В других вариантах осуществления уровень экспрессии одной или нескольких изоформы(изоформ) PI3K в злокачественной опухоли или при заболевании можно определять на основе информации, известной в данной области, или информации, полученной в предшествующих исследованиях злокачественной опухоли или заболевания.
[0058] Определенная злокачественная опухоль или нарушение, например, гематологическая злокачественная опухоль (например, конкретный тип или конкретный подтип гематологической злокачественной опухоли) может проявлять гетерогенность экспрессии изоформы PI3K среди популяций пациентов. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, такое как гематологическая злокачественная опухоль, где способ включает: (1) определение уровней экспрессии одной или нескольких изоформы(изоформ) PI3K у пациента или в группе пациентов, имеющих злокачественную опухоль или заболевание; (2) выбор терапевтического средства (например, модулятор PI3K, обладающий конкретным профилем селективности в отношении одной или нескольких изоформы(изоформ) PI3K), исходя из уровней экспрессии изоформ PI3K у пациента(ов), подлежащего лечению; и (3) введение терапевтического средства пациенту(ам), отдельно или в комбинации с одним или несколькими другими средствами или способами терапии. В одном варианте осуществления уровень экспрессии одной или нескольких изоформы(изоформ) PI3K у пациента или в группе пациентов можно измерять путем определения уровня экспрессии белка, ДНК и/или РНК изоформы PI3K у пациента или в группе пациентов; или путем измерения одного или нескольких биомаркеров, описанных в настоящем описании, у пациента или в группе пациентов (например, биомаркер каскада передачи сигнала, биомаркер мутации белка, биомаркер экспрессии белка, биомаркер мутации гена, биомаркер экспрессии гена, биомаркер цитокина, биомаркер хемокина или биомаркер конкретных злокачественных клеток, среди прочих). В других вариантах осуществления уровень экспрессии одной или нескольких изоформы(изоформ) PI3K у пациента или в группе пациентов можно определять, исходя из информации, известной в данной области, или информации, полученной при предшествующем исследовании пациента или группы пациентов.
[0059] В конкретных вариантах осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении PI3K-δ относительно других изоформ PI3K. В конкретных вариантах осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении PI3K-γ относительно других изоформ PI3K. В конкретных вариантах осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении PI3K-δ и PI3K-γ относительно других изоформ PI3K. В конкретных вариантах осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении PI3K-γ и PI3K-α относительно других изоформ PI3K. В конкретных вариантах осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении PI3K-γ и PI3K-β относительно других изоформ PI3K. В конкретных вариантах осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении PI3K-δ и PI3K-α относительно других изоформ PI3K. В конкретных вариантах осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении PI3K-δ и PI3K-β относительно других изоформ PI3K. В конкретных вариантах осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении PI3K-δ, PI3K-γ и PI3K-α относительно другой изоформы PI3K. В конкретных вариантах осуществления способы, композиции и наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении PI3K-δ, PI3K-γ и PI3K-β относительно другой изоформы PI3K.
[0060] В одном варианте осуществления способы, композиции или наборы, описанные в настоящем описании, относятся к введению модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении одной или нескольких изоформы(изоформ) PI3K относительно других изоформ PI3K (например, селективный к PI3K-δ, селективный к PI3K-γ или селективный к PI3K-δ и PI3K-γ); и индивидуум, подвергаемый лечению, обладает высоким уровнем экспрессии конкретной изофомы(изоформ) PI3K (например, высокая экспрессия PI3K-δ, высокая экспрессия PI3K-γ или высокая экспрессия как PI3K-δ, так и PI3K-γ). Не ограничиваясь конкретной теорией, способы, композиции или наборы, описанные в настоящем описании, могут обеспечить уменьшение побочных эффектов и/или увеличение эффективности. Таким образом, в одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения злокачественной опухоли или заболевания, такого как гематологическая злокачественная опухоль, или конкретного типа или подтипа злокачественной опухоли или заболевания, таких как конкретный тип или подтип гематологической злокачественной опухоли, имеющие высокий уровень экспрессии одной или нескольких изоформы(изоформ) PI3K, где неблагоприятные эффекты, ассоциированные с введением ингибиторов PI3K, снижены.
[0061] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения злокачественной опухоли или заболевания, такого как гематологическая злокачественная опухоль, или конкретного типа или подтипа злокачественной опухоли или заболевания, таких как конкретный тип или подтип гематологической злокачественной опухоли, селективным ингибитором PI3K-γ, где неблагоприятные эффекты, ассоциированные с введением ингибиторов другой изоформы(изоформ) PI3K (например, PI3K-α или PI3K-β), снижены. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения злокачественной опухоли или заболевания, такого как гематологическая злокачественная опухоль, или конкретного типа или подтипа злокачественной опухоли или заболевания, таких как конкретный тип или подтип гематологической злокачественной опухоли, селективным ингибитором PI3K-γ в более низкой дозе (например, приблизительно на 10%, приблизительно на 20%, приблизительно на 30%, приблизительно на 40%, приблизительно на 50%, приблизительно на 60%, приблизительно на 70% или приблизительно на 80%) по сравнению с лечением неселективным ингибитором или менее селективным ингибитором PI3K-γ (например, общий ингибитор PI3K (например, PI3K-α, β, γ, δ)).
[0062] В одном варианте осуществления способы, композиции или наборы, описанные в настоящем описании, относятся к введению модулятора PI3K в комбинации с одним или несколькими вторым активным средством(ами), например, одним или несколькими лекарственным средством(ами) против злокачественной опухоли. В одном варианте осуществления вторые активные средства, которые можно использовать в способах, композициях или наборах, описанных в настоящем описании, включают, но не ограничиваются ими, одно или несколько из: ингибитора BTK, например, такого как ибрутиниб, RN-486 (6-циклопропил-8-фтор-2-(2-гидроксиметил-3-{1-метил-5-[5-(4-метилпиперазин-1-ил)пиридин-2-иламино]-6-оксо-1,6-дигидропиридин-3-ил}-фенил)-2H-изозинолин-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил)фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид]), CGI-560 (N-[3-(8-анилиноимидазо[1,2-a]пиразин-6-ил)фенил]-4-трет-бутилбензамид), CGI-1746 (4-(трет-бутил)-N-(2-метил-3-(4-метил-6-((4-(морфолин-4-карбонил)фенил)амино)-5-оксо-4,5-дигидропиразин-2-ил)фенил)бензамид), HM-71224 (Hammi Pharmaceticals), ONO-4059 (Ono Pharmaceuticals Co., LTD), CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпирмидин-2-ил)амино)фенокси)-N-метилпиколинамид), LFM-A13 (2Z-циано-N-(2,5-дибромфенил)3-гидрокси-2-бутенамид) и AVL-292 (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид), который может быть обозначен как CC-292; ингибитора HDAC, например, такого как белиностат, вориностат, панобиностат или ромидепсин; ингибитора mTOR, например, такого как эверолимус (RAD 001); ингибитора протеасом, например, такого как бортезомиб или карфилзомиб; ингибитора JAK или ингибитора JAK/STAT, например, такого как тофацитиниб, INCB16562 или AZD1480; ингибитора BCL-2, например, такого как ABT-737, ABT-263 или навитоклакс; ингибитора MEK, например, такого как AZD8330 или ARRY-424704; антифолата, например, такого как пралатрексат; ингибитора фарнезилтрансферазы, например, такого как типифарниб; антитела или биологического средства, например, такого как обинутузумаб (GA101), алемтузумаб, ритуксимаб, офатумумаб или брентуксимаб ведотин (SGN-035); конъюгата антитело-лекарственное средство, например, такого как инотузумаб озагомицин или брентуксимаб ведотин; цитотоксического средства, например, такого как бендамустин, гемцитабин, оксалиплатин, циклофосфамид, винкристин, винбластин, антрациклин (например, даунорубицин или дауномицин, доксорубицин, или актиномицин или дактиномицин), блеомицин, клофарабин, неларабин, кладрибин, аспарагиназа, метотрексат или пралатрексат; или других средств против злокачественной опухоли или химиотерапевтических средств, например, таких как флударабин, ибрутиниб, фостаматиниб, леналидомид, талидомид, ритуксимаб, циклофосфамид, доксорубицин, винкристин, преднизон или R-CHOP (ритуксимаб, циклофосфамид, доксорубицин или гидроксидауномицин, винкристин или онковин, преднизон). Дополнительные варианты осуществления вторых активных средств описаны далее в настоящем описании.
[0063] Не ограничиваясь конкретной теорией, в одном варианте осуществления злокачественная опухоль или заболевание, подвергаемые лечению или предупреждению, такие как нарушение крови или гематологическая злокачественная опухоль, имеют высокий уровень экспрессии одной или нескольких изоформы(изоформ) PI3K (например, PI3K-α, PI3K-β, PI3K-δ или PI3K-γ, или их комбинация). В одном варианте осуществления злокачественная опухоль или заболевание, которые можно лечить или предупреждать с помощью способов, композиций или наборов, описанных в настоящем описании, включает нарушение крови или гематологическую злокачественную опухоль, включая, но не ограничиваясь ими, миелоидное нарушение, лимфоидное нарушение, лейкоз, лимфому, миелодиспластический синдром (MDS), миелопролиферативное заболевание (MPD), нарушение тучных клеток и миелому (например, множественная миелома), среди прочих. В одном варианте осуществления нарушение крови или гематологическая злокачественная опухоль включает, но не ограничивается ими, острый лимфобластный лейкоз (ALL), T-клеточный ALL (T-ALL), B-клеточный ALL (B-ALL), острый миелоидный лейкоз (AML), хронический лимфоцитарный лейкоз (CLL), хронический миелогенный лейкоз (CML), CML бластной фазы, мелколимфоцитарную лимфому (SLL), CLL/SLL, лимфому Ходжкина (HL), неходжкинскую лимфому (NHL), B-клеточную NHL, T-клеточную NHL, вялотекущую NHL (iNHL), диффузную крупроклеточную B-клеточную лимфому (DLBCL), лимфому из клеток мантийной зоны (MCL), агрессивную B-клеточную NHL, B-клеточную лимфому (BCL), синдром Рихтера (RS), T-клеточную лимфому (TCL), лимфому периферических T-клеток (PTCL), Т-клеточную лимфому кожи (CTCL), трансформированный фунгоидный микоз, синдром Сезари, анапластическую крупноклеточную лимфому (ALCL), фолликулярную лимфому (FL), макроглобулинемию Валденстрема (WM), лимфоплазматическую лимфому, лимфому Беркитта, множественную миелому (MM), амилоидоз, MPD, эссенциальный тромбоцитоз (ET), миелофиброз (MF), истинную полицитемию (PV), хронический миеломоноцитарный лейкоз (CMML), миелодиспластический синдром (MDS), MDS высокого риска и MDS низкого риска. В одном варианте осуществления гематологическая злокачественная опухоль является рецидивирующей. В одном варианте осуществления гематологическая злокачественная опухоль является рефрактерной. В одном варианте осуществления злокачественная опухоль или заболевание представляет собой заболевание педиатрического пациента (в том числе пациента младшего возраста). В одном варианте осуществления злокачественная опухоль или заболевание представляет собой заболевание взрослого пациента. Дополнительные варианты осуществления злокачественной опухоли или заболевания, подвергаемого лечению или предупреждению с помощью способов, композиций или наборов, описанных в настоящем описании, описаны в настоящем описании далее.
[0064] В одном варианте осуществления злокачественная опухоль или заболевание, подвергаемое лечению или предупреждению, такое как нарушение крови или гематологическая злокачественная опухоль, имеет высокий уровень экспрессии PI3K-δ и/или PI3K-γ, включая, но не ограничиваясь ими, CLL, CLL/SLL, CLL бластной фазы, CML, DLBCL, MCL, B-ALL, T-ALL, множественную миелому, B-клеточную лимфому, CTCL (например, фунгоидный микоз или синдром Сезари), AML, лимфому Беркитта, фолликулярную лимфому (FL), ходжкинскую лимфому, ALCL или MDS.
[0065] В одном варианте осуществления в рамках настоящего изобретения предусматривается модулятор PI3K, в качестве единственного средства или в комбинации с одним или несколькими дополнительными способами терапии, для применения в способе, композиции или в наборе, описанном в настоящем описании, для смягчения злокачественной опухоли или гематологического заболевания, такого как гематологическая злокачественная опухоль (например, путем уменьшения одного или нескольких симптомов, ассоциированных со злокачественной опухолью или гематологическим заболеванием) у индивидуума, например, у млекопитающего. Симптомы злокачественной опухоли или гематологического заболевания, которые можно смягчать, включают любой или комбинацию симптомов злокачественной опухоли или гематологического заболевания, как известно в данной области и/или как описано в настоящем описании. Экспериментальные условия для оценки эффектов модулятора PI3K в отношении смягчения злокачественной опухоли или гематологического заболевания в моделях злокачественной опухоли или гематологического заболевания на животных, описаны в настоящем описании или известны в данной области.
[0066] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ уменьшения симптома, ассоциированного со злокачественной опухолью или гематологическим заболеванием, таким как гематологическая злокачественная опухоль, в биологическом образце, включающий контактирование биологического образца с модулятором PI3K, например, соединением, описанным в настоящем описании (например, соединение формулы I, например, соединение 292) или его фармацевтически приемлемой солью (например, его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф), в количестве, достаточном для уменьшения симптома, ассоциированного со злокачественной опухолью или гематологическим заболеванием.
[0067] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения злокачественной опухоли или гематологического заболевания (например, гематологическая злокачественная опухоль) у индивидуума, включающий введение эффективного количества модулятора PI3K, например, соединения, описанного в настоящем описании (например, соединение формулы I, например соединение 292), или его энантиомера или смеси энантиомеров, или его фармацевтически приемлемой соли, сольвата, гидрата, сокристалла, клатрата или полиморфа.
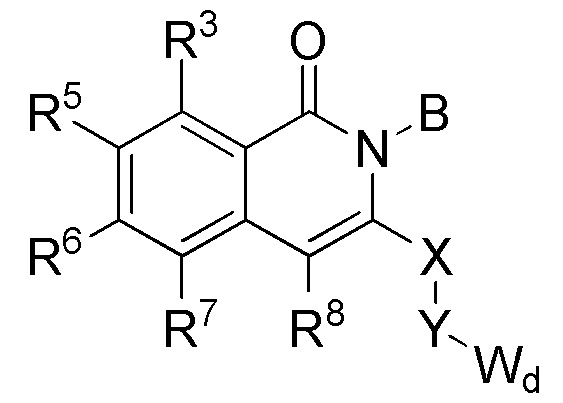
[0068] В одном варианте осуществления соединение представляет собой соединение формулы I или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемую соль, сольват, гидрат, сокристалл, клатрат или полиморф:
Формула I
где
Wd представляет собой гетероциклоалкил, арил или гетероарил;
B представляет собой алкил или часть формулы II;
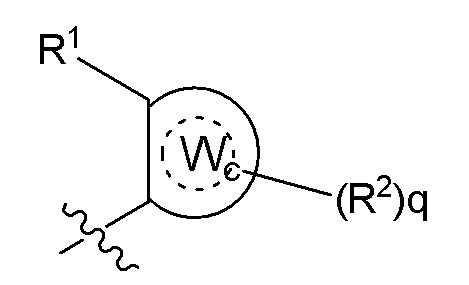
Формула II
где Wc представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, и q представляет собой целое число, равное 0, 1, 2, 3 или 4;
X отсутствует или представляет собой -(CH(R9))z-, и z представляет собой целое число, равное 1;
Y отсутствует или представляет собой -N(R9)-;
R1 представляет собой водород, алкил, алкенил, алкинил, алкокси, амидо, алкоксикарбонил, сульфонамидо, галоген, циано или нитро;
R2 представляет собой алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, гетероарил, гетероарилалкил, алкокси, амино, галоген, циано, гидрокси или нитро;
R3 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, алкокси, амидо, амино, алкоксикарбонил сульфонамидо, галоген, циано, гидрокси или нитро;
каждый из R5, R6, R7 и R8 независимо представляет собой водород, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, алкокси, амидо, амино, ацил, ацилокси, сульфонамидо, галоген, циано, гидрокси или нитро; и
R9 в каждом случае независимо представляет собой водород, алкил, циклоалкил или гетероциклоалкил.
[0069] В некоторых вариантах осуществления когда присутствуют как X, так и Y, тогда Y представляет собой -NH-.
[0070] В некоторых вариантах осуществления X отсутствует или представляет собой -(CH(R9))z-, и z независимо представляет собой целое число, равное 1, 2, 3 или 4; и Y отсутствует, -O-, -S-, -S(=O)-, -S(=O)2-, -N(R9)-, -C(=O)-(CHR9)z-, -C(=O)-, -N(R9)(C=O)-, -N(R9)(C=O)NH- или-N(R9)C(R9)2-.
[0071] В некоторых вариантах осуществления -X- представляет собой -CH2-, -CH(CH2CH3)- или -CH(CH3)-.
[0072] В некоторых вариантах осуществления -X-Y- представляет собой -CH2-N(CH3)-, -CH2-N(CH2CH3)-, -CH(CH2CH3)-NH- или -CH(CH3)-NH-.
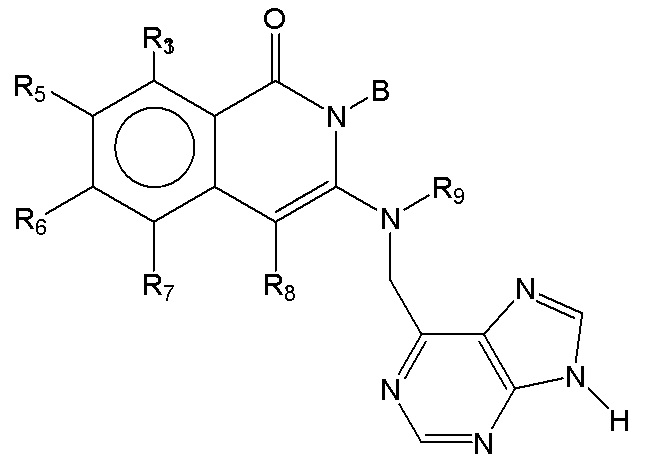
[0073] В некоторых вариантах осуществления Wd представляет собой пиразолопиримидин формулы III(a), или пурин формулы III(b), формулы III(c) или формулы III(d):

[0074] где Ra’ формулы III(d) представляет собой водород, галоген, фосфат, мочевина, карбонат, амино, алкил, алкенил, алкинил, циклоалкил, гетероалкил или гетероциклоалкил; R11 формулы III(a) представляет собой H, алкил, галоген, амино, амидо, гидрокси или алкокси; и R12 формулы III(a), формулы III(c) или формулы III(d) представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил. В некоторых вариантах осуществления Wd представляет собой пиразолопиримидин формулы III(a), где R11 представляет собой H, алкил, галоген, амино, амидо, гидрокси или алкокси, и R12 представляет собой циано, амино, карбоновую кислоту или амидо.
[0074] В некоторых вариантах осуществления соединение формулы I имеет структуру формулы IV:

Формула IV
где R11 представляет собой H, алкил, галоген, амино, амидо, гидрокси или алкокси, и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил. В некоторых вариантах осуществления соединение формулы I имеет структуру формулы IV, где R11 представляет собой H, алкил, галоген, амино, амидо, гидрокси или алкокси, и R12 представляет собой циано, амино, карбоновую кислоту или амидо.
[0075] В некоторых вариантах осуществления R11 представляет собой амино. В некоторых вариантах осуществления R12 представляет собой алкил, алкенил, алкинил, гетероарил, арил или гетероциклоалкил. В некоторых вариантах осуществления R12 представляет собой циано, амино, карбоновую кислоту, амидо, моноциклический гетероарил или бициклический гетероарил.
[0076] В некоторых вариантах осуществления соединения формулы I, соединение имеет структуру формулы V:

Формула V
[0077] В некоторых вариантах осуществления -NR9- представляет собой -N(CH2CH3)CH2- или -N(CH3)CH2-.
[0078] В некоторых вариантах осуществления соединения формулы I соединение имеет структуру формулы VI:
Формула VI
[0079] В некоторых вариантах осуществления R3 представляет собой -H, -CH3, -Cl или -F, и R5, R6, R7 и R8 независимо представляют собой водород.
[0080] В некоторых вариантах осуществления B представляет собой часть формулы II;
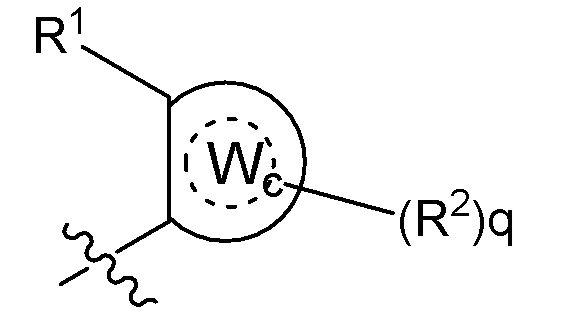
Формула II
где Wc представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, и q представляет собой целое число, равное 0, 1, 2, 3 или 4.
[0081] В одном варианте осуществления модулятор киназы PI3 представляет собой соединение или его фармацевтически приемлемая соль, имеющие структуру формулы I-1:

Формула I-1
где B представляет собой часть формулы II;
где Wc в B представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, и q представляет собой целое число, равное 0, 1, 2, 3 или 4;
X отсутствует или представляет собой -(CH(R9))z-, и z представляет собой целое число, равное 1;
Y отсутствует или представляет собой -N(R9)-;
когда Y отсутствует, Wd представляет собой 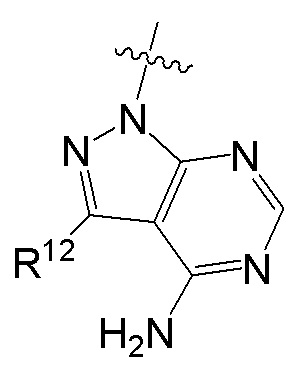 , или когда Y присутствует, Wd представляет собой
, или когда Y присутствует, Wd представляет собой 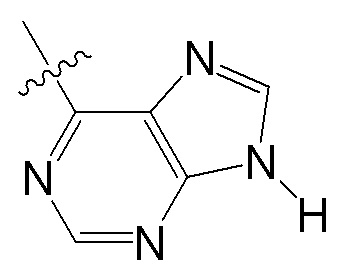 ;
;
R1 представляет собой водород, алкил, алкенил, алкинил, алкокси, амидо, алкоксикарбонил, сульфонамидо, галоген, циано или нитро;
R2 представляет собой алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, гетероарил, гетероарилалкил, алкокси, амино, галоген, циано, гидрокси или нитро;
R3 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, алкокси, амидо, амино, алкоксикарбонил, сульфонамидо, галоген, циано, гидрокси или нитро;
R9 в каждом случае независимо представляет собой водород, C1-C10 алкил, циклоалкил или гетероциклоалкил; и
R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил.
[0082] В некоторых вариантах осуществления соединение формулы I или формулы I-1 имеет структуру формулы IV-A:

Формула IV-A
[0083] В некоторых вариантах осуществления R12 представляет собой замещенный бензоксазол.
[0084] В некоторых вариантах осуществления соединение формулы I или формулы I-1 имеет структуру формулы V-A:

Формула V-A
[0085] В некоторых вариантах осуществления соединение формулы I или формулы I-1 имеет структуру формулы IV-A или формулы V-A.
[0086] В некоторых вариантах осуществления соединение формулы I или формулы I-1 имеет структуру формулы V-B:

Формула V-B
[0087] В некоторых вариантах осуществления соединение формулы I или формулы I-1 имеет структуру формулы VI-A:
Формула VI-A
[0088] В некоторых вариантах осуществления соединение формулы I или формулы I-1 представляет собой соединение, где B представляет собой часть формулы II:
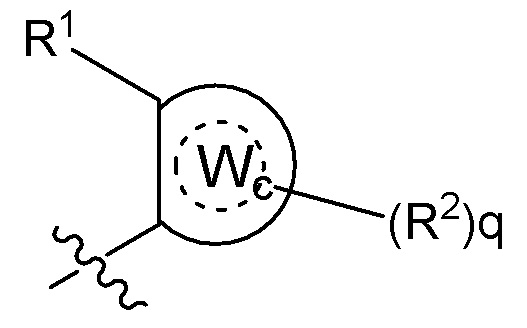
Формула II
где Wc представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил; q представляет собой целое число, равное 0 или 1; R1 представляет собой водород, алкил или галоген; R2 представляет собой алкил или галоген; и R3 представляет собой водород, алкил или галоген. В некоторых вариантах осуществления, когда присутствуют как X, так и Y, тогда Y представляет собой -NH-. В других вариантах осуществления R3 представляет собой -H, -CH3, -CH2CH3, -CF3, -Cl или -F. В других вариантах осуществления R3 представляет собой метил или хлор.
[0089] В некоторых вариантах осуществления X представляет собой -(CH(R9))z-, где R9 представляет собой метил и z представляет собой 1; и Wd представляет собой 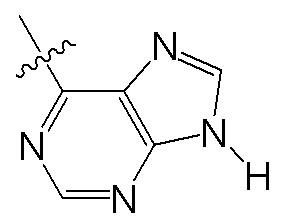 .
.
[0090] В некоторых вариантах осуществления соединения формулы I или формулы I-1, соединение в основном находится в стереохимической конфигурации (S).
[0091] В некоторых вариантах осуществления соединения формулы I или формулы I-1, соединение имеет структуру формулы V-A2:

Формула V-A2
[0092] В некоторых вариантах осуществления R12 представляет собой моноциклический гетероарил, бициклический гетероарил или гетероциклоалкил.
[0093] В некоторых вариантах осуществления B представляет собой часть формулы II:
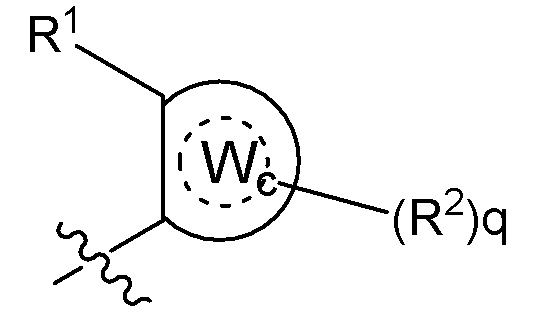
Формула II
где Wc представляет собой арил или циклоалкил.
[0094] В некоторых вариантах осуществления соединение формулы I представляет собой полиморфную форму C соединения 292, как описано в настоящем описании.
[0095] В некоторых вариантах осуществления соединение ингибирует или снижает активность PI3K класса I. В определенных вариантах осуществления PI3K класса I представляет собой p110 α, p110 β, p110 γ или p110 δ.
[0096] В некоторых вариантах осуществления соединение ингибирует одну или несколько изоформ PI3K класса I, выбранных из группы, состоящей из PI3-киназы-α, PI3-киназы-β, PI3-киназы-γ и PI3-киназы-δ.
[0097] В некоторых вариантах осуществления соединение селективно ингибирует изоформу PI3-киназы-δ класса I, по сравнению с другими изоформами PI3-киназы класса I. В некоторых вариантах осуществления соединение селективно ингибирует изоформу PI3-киназы-γ класса I по сравнению с другими изоформами PI3-киназы класса I. В некоторых вариантах осуществления соединение селективно ингибирует изоформу PI3-киназы-δ и PI3-киназы-γ класса I по сравнению с другими изоформами PI3-киназы класса I.
[0098] В некоторых вариантах осуществления используют фармацевтическую композицию, где композиция содержит фармацевтически приемлемый эксципиент и одно или несколько соединений любых формул, описанных в настоящем описании, включая, но не ограничиваясь ими, формулы I, I-1 и IV-XVIII (включая IV-A, V, V-A, V-A2, V-B, VI и VI-A, среди прочих). В некоторых вариантах осуществления композиция имеет жидкую, твердую, полутвердую, гелеобразную или аэрозольную форму.
[0099] В некоторых вариантах осуществления два или более модуляторов PI3K (например, два или более модуляторов PI3K, описанных в настоящем описании) вводят в комбинации. В одном варианте осуществления модуляторы PI3K вводят одновременно. В другом варианте осуществления модуляторы вводят последовательно. Например, комбинацию, например, соединения 292 и второго модулятора PI3K, можно вводить одновременно или последовательно. В одном варианте осуществления сначала вводят второй модулятор PI3K, за которым вводят, с периодом перекрывания или без него, соединение 292. В другом варианте осуществления сначала вводят соединение 292, за которым вводят, с периодом перекрывания или без него, второй модулятор PI3K.
[0100] В других вариантах осуществления модулятор PI3K (например, один или несколько модуляторов PI3K, описанных в настоящем описании) вводят в комбинации с одним или несколькими дополнительными лекарственными средствами, такими как лекарственное средство против злокачественной опухоли, описанное в настоящем описании. В одном варианте осуществления модулятор PI3K и второе средство вводят одновременно. В другом варианте осуществления модулятор PI3K и второе средство вводят последовательно. Например, комбинацию, например, соединения 292 и второго средства можно вводить одновременно или последовательно. В одном варианте осуществления сначала вводят второе средство, а затем вводят, с периодом перекрывания или без него, соединение 292. В другом варианте осуществления сначала вводят соединение 292, за которым вводят, с периодом перекрывания или без него, второе средство.
[0101] В одном варианте осуществления индивидуумом, подвергаемым лечению, является млекопитающее, например, пример, как правило, человек (например, пациент, имеющий злокачественную опухоль или гематологическое нарушение, такое как гематологическая злокачественная опухоль, или имеющий риск их наличия, как описано в настоящем описании). В некоторых вариантах осуществления индивидуум, подвергаемый лечению, нуждается в ингибировании PI3-киназы (например, согласно оценкам, проявляет повышенные уровни PI3K или изменения другого компонента каскада PI3K). В одном варианте осуществления индивидууму ранее проводили другое лечение (например, лечение злокачественной опухоли или лечение гематологического нарушения).
[0102] В некоторых вариантах осуществления модулятор PI3K вводят в качестве фармацевтической композиции, содержащей модулятор PI3K или его фармацевтически приемлемую соль, и фармацевтически приемлемый эксципиент.
[0103] В определенных вариантах осуществления модулятор PI3K вводят в композиции или он присутствует в композиции, например, в фармацевтической композиции.
[0104] Модуляторы PI3K, описанные в настоящем описании, можно вводить индивидууму системно (например, перорально, парентерально, подкожно, внутривенно, ректально, внутримышечно, внутрибрюшинно, интраназально, трансдермально, или путем ингаляции или путем помещения внутрь полости). Как правило, модуляторы PI3K вводят перорально.
[0105] В одном варианте осуществления модулятором PI3K является соединение 292, как описано в таблице 4, или его фармацевтически приемлемая соль. Соединение 292, или его фармацевтически приемлемую соль можно вводить перорально. Также в настоящем описании предусматриваются другие пути введения.
[0106] Способы и композиции, описанные в настоящем описании, необязательно можно использовать в комбинации с другими способами терапии (например, одним или несколькими средствами, хирургическими процедурами или лучевыми процедурами). Можно использовать любую комбинацию из одного или нескольких модулятора(ов) PI3K и одного или нескольких других средств или способов терапии. Введение модулятора(ов) PI3K и проведение других способов терапии можно осуществлять до лечения, одновременно с лечением, после лечения или во время ремиссии заболевания. В одном варианте осуществления второе средство вводят одновременно или последовательно с модулятором PI3K.
[0107] В одном варианте осуществления в рамках настоящего изобретения предусматривается биомаркер (например, диагностический биомаркер, предсказывающий биомаркер или прогностический биомаркер), для применения для лечения или предупреждения злокачественной опухоли или заболевания (например, гематологическая злокачественная опухоль), описанного в настоящем описании. В одном варианте осуществления биомаркер, описанный в настоящем описании, включает, но не ограничиваются ими: биомаркер мишени, биомаркер каскада передачи сигнала, биомаркер мутации белка, биомаркер экспрессии белка, биомаркер мутации гена, биомаркер экспрессии гена, биомаркер цитокина, биомаркер хемокина или биомаркер конкретных злокачественных клеток. В одном варианте осуществления биомаркер можно использовать для оценки конкретного типа злокачественной опухоли или заболевания, или конкретного пациента или группы пациентов. В одном варианте осуществления биомаркер вовлекает иммуногистохимию (IHC) конкретного белка-мишени. В одном варианте осуществления биомаркер вовлекает РНК (например, мРНК) (например, гибридизация мРНК in situ (ISH)) конкретного белка-мишени. В одном варианте осуществления биомаркер вовлекает ДНК конкретного белка-мишени, включая генетическое изменение, такое как соматическая мутация, изменения числа копий, такие как амплфикация или делеция, и хромосомная транслокация, а также эпигенетическое изменение, такое как метилирование и модификация гистонов. В одном варианте осуществления биомаркер вовлекает микро-РНК (miRNA), которая регулирует экспрессию конкретного белка-мишени. В одном варианте осуществления биомаркер вовлекает измерение модификации белок/белок. В одном варианте осуществления биомаркер вовлекает количественное определение небелкового маркера, как например, метаболомика. В одном варианте осуществления биомаркер количественно определяют с помощью ELISA, вестерн-блоттинга или масс-спектроскопии. В одном варианте осуществления биомаркер представляет собой сывороточный биомаркер. В одном варианте осуществления биомаркер представляет собой биомаркер крови. В одном варианте осуществления биомаркер представляет собой биомаркер костного мозга. В одном варианте осуществления биомаркер представляет собой биомаркер мокроты. В одном варианте осуществления биомаркер представляет собой биомаркер мочи. В одном варианте осуществления биомаркер вовлекает биоматрицы, включая, но не ограничиваясь ими, сыворотку, кровь, костный мозг, мокроту или мочу.
[0108] В иллюстративных вариантах осуществления, биомаркер, описанный в настоящем описании, представляет собой биомаркер мишени, например, такой как биомаркер для определения экспрессии белка и/или РНК одной или нескольких конкретных изоформ PI3K; например, биомаркер экспрессии PI3K-α, экспрессии PI3K-β, экспрессии PI3K-δ или экспрессии PI3K-γ, или их комбинации. В других вариантах осуществления биомаркер может представлять собой изменение ДНК одной или нескольких конкретных изоформ PI3K (например, мутация, изменение количества копий или эпигенетическая модификация).
[0109] В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер каскада передачи сигнала, например, такой как биомаркер каскада PTEN и/или биомаркер активации каскада передачи сигнала, такой как pAKT, pS6 и/или pPRAS40 (например, биомаркер IHC, биомаркер изменения ДНК, биомаркер делеции ДНК или биомаркер мутации ДНК). В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер мутации, такой как биомаркер мутации белка или биомаркер мутации гена, для оценки мутации одной или нескольких мишеней, например, таких как IGH7, KRAS, NRAS, A20, CARD11, CD79B, TP53, CARD11, MYD88, GNA13, MEF2B, TNFRSF14, MLL2, BTG1, EZH2, NOTCH1, JAK1, JAK2, PTEN, FBW7, PHF6, IDH1, IDH2, TET2, FLT3, KIT, NPM1, CEBPA, DNMT3A, BAALC, RUNX1, ASXL1, IRF8, POU2F2, WIF1, ARID1A, MEF2B, TNFAIP3, PIK3R1, MTOR, PIK3CA, PI3Kδ и/или PI3Kγ. В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер экспрессии, такой как биомаркер экспрессии белка, биомаркер экспрессии гена, для оценки экспрессии одной или нескольких мишеней, или активации или подавления каскада, например, такой как биомаркер pERK IHC или биомаркер экспрессии pERK, например, для оценки активации каскада RAS или PI3K.
[0110] В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер цитокина (например, биомаркеры сывороточных цитокинов или биомаркеры других цитокинов, описанные в настоящем описании). В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер хемокина (например, биомаркеры сывороточных хемокинов или биомаркеры других хемокинов, описанные в настоящем описании).
[0111] В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер злокачественных клеток (например, конкретная линия клеток злокачественной опухоли, конкретный тип клеток злокачественной опухоли, конкретный профиль клеточного цикла).
[0112] В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, относится к определению профиля экспрессии гена у пациента или группы пациентов, например, в качестве прогностического маркера активации каскада PI3Kδ и/или PI3Kγ, или в качестве прогностического маркера ответа на лечение, описанное в настоящем описании. В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, относится к классификатору экспрессии гена, например, в качестве прогностического биомаркера экспрессии или активации PI3Kδ и/или PI3Kγ (например, дифференциальная экспрессия или активация при подтипах DLBCL ABC, GCB, с окислительным фосфорилированием (Ox Phos), B-клеточным рецептором/пролиферацией (BCR), или ответом хозяина (HR)).
[0113] В одном варианте осуществления способы, описанные в настоящем описании, дополнительно могут включать стадию оценки индивидуума, например, в отношении одного или нескольких признаков, или симптомов, или биологических сопутствующих факторов злокачественной опухоли или гематологического нарушения, как описано в настоящем описании, например, оценки биомаркера, описанного в настоящем описании, у индивидуума. В некоторых вариантах осуществления один или несколько из этих биологических сопутствующих факторов или биомаркеров коррелируют с увеличенной вероятностью ответа индивидуума на конкретную терапию. В некоторых вариантах осуществления один или несколько из этих биологических сопутствующих факторов или биомаркеров коррелируют со сниженным побочным эффектом конкретной терапии у индивидуума.
[0114] В одном варианте осуществления способы, описанные в настоящем описании, дополнительно могут включать стадию мониторинга индивидуума, например, в отношении изменения (например, увеличения или снижения) уровней одного или нескольких признаков, или симптомов, или биологических сопутствующих факторов злокачественной опухоли или гематологического нарушения, как описано в настоящем описании, например, биомаркера, описанного в настоящем описании. В некоторых вариантах осуществления один или несколько из этих биологических сопутствующих факторов или биомаркеров коррелируют со снижением одного или нескольких клинических симптомов, ассоциированных со злокачественной опухолью или гематологическим нарушением. В некоторых вариантах осуществления один или несколько из этих биологических сопутствующих факторов или биомаркеров коррелируют с увеличенной вероятностью ответа у индивидуума на конкретную терапию. В некоторых вариантах осуществления один или несколько из этих биологических сопутствующих факторов или биомаркеров коррелируют со сниженным побочным эффектом конкретной терапии у индивидуума.
[0115] В некоторых вариантах осуществления нормализация или изменение (например, снижение увеличенного уровня или увеличение сниженного уровня) биологического сопутствующего фактора или биомаркера указывает на эффективность лечения и/или прогнозирует улучшение клинических симптомов. В некоторых вариантах осуществления осуществляют мониторинг индивидуума в отношении изменения биологического сопутствующего фактора или биомаркера (например, снижение или увеличение биологического сопутствующего фактора или биомаркера, которые могут указывать на эффективность лечения).
[0116] В одном варианте осуществления у индивидуума можно проводить оценку или мониторинг в один или несколько из следующих периодов: перед началом лечения; в ходе лечения; или после проведения одного или нескольких этапов лечения. Оценку и мониторинг можно использовать для определения потребности в дальнейшем лечении тем же модулятором PI3K, отдельно или в комбинации с другим средством, или в дополнительном лечении дополнительными средствами, или для коррекции режима дозирования того же модулятора PI3K.
[0117] В одном варианте осуществления способы, описанные в настоящем описании, могут дополнительно включать стадию анализа нуклеиновой кислоты или белка индивидуума, например, анализа генотипа индивидуума. В одном варианте осуществления анализируют белок PI3K или нуклеиновую кислоту, кодирующую белок PI3K, и/или вышележащий или нижеследующий компонент(ы) каскада передачи сигнала PI3K. Нуклеиновую кислоту или белок можно выявлять в любом биологическом образце (например, кровь, моча, циркулирующие клетки, биоптат ткани или биоптат костного мозга) с использованием любого способа, описанного в настоящем описании или известного в данной области. Например, выявление белка PI3K можно осуществлять путем системного введения меченой формы антитела к PI3K с последующей визуализацией.
[0118] Анализ можно использовать, например, для оценки пригодности или для выбора между альтернативными способами лечения, например, конкретной дозировки, способа доставки, времени доставки, включения дополнительной терапии, например, введения в комбинации со вторым средством или, как правило, для определения фенотипа или генотипа вероятного ответа индивидуума на лекарственное средство. Нуклеиновую кислоту или белок можно анализировать на любой стадии лечения. В одном варианте осуществления нуклеиновую кислоту или белок можно анализировать по меньшей мере перед введением модулятора PI3K и/или средства, чтобы тем самым определить подходящую дозировку(и) и режим(ы) лечения модулятором PI3K (например, количество на введение или частота введений) для профилактического или терапевтического лечения индивидуума.
[0119] В определенных вариантах осуществления способы, описанные в настоящем описании, дополнительно включают стадию выявления измененного уровня PI3K у пациента до или после введения пациенту модулятора PI3K. Уровень PI3K можно оценивать в любом биологическом образце, например, крови, моче, циркулирующих клетках или биоптате ткани. В некоторых вариантах осуществления уровень PI3K оценивают путем системного введения меченой формы антитела к PI3K с последующей визуализацией.
[0120] В другом варианте осуществления в рамках настоящего изобретения предусматривается композиция, например, фармацевтическая композиция, которая включает один или несколько модуляторов PI3K, например, модулятор PI3K, как описано в настоящем описании, и одно или несколько средств (например, второе активное средство, как описано в настоящем описании). Кроме того, композиция может включать фармацевтически приемлемый носитель или эксципиент.
[0121] В другом варианте осуществления в рамках настоящего изобретения предусматривается композиция для применения или применение модулятора PI3K, отдельно или в комбинации со вторым средством или способом терапии, описанным в настоящем описании, для лечения злокачественной опухоли или нарушения, такого как гематологическая злокачественная опухоль, как описано в настоящем описании.
[0122] В другом варианте осуществления в рамках настоящего изобретения предусматриваются терапевтические наборы, которые включают модулятор PI3K, отдельно или в комбинации с одним или несколькими дополнительными средствами, и инструкции по применению для лечения злокачественной опухоли или нарушения, такого как гематологическая злокачественная опухоль, как описано в настоящем описании.
ВКЛЮЧЕНИЕ В КАЧЕСТВЕ ССЫЛКИ
[0123] Все публикации, патенты и патентные заявки, упомянутые в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме и в той степени, как если бы было конкретно и индивидуально указано, что каждая индивидуальная публикация, патент или патентная заявка включены в качестве ссылок.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0124] На фиг.1 представлена взаимосвязь PK/PD между средней концентрацией лекарственного средства в плазме и средним % снижением от уровня до введения дозы активации базофилов с течением времени, после введения однократной дозы соединения 292 у человека.
[0125] На фиг.2 представлена взаимосвязь PK/PD между средней концентрацией лекарственного средства в плазме и средним % снижением от уровня до введения дозы активации базофилов с течением времени, после многократного введения дозы соединения 292 у человека.
[0126] На фиг.3 представлен фармакодинамический ответ против концентрации соединения 292 у человека.
[0127] На фиг.4 представлены стационарные концентрации в плазме (C2D1) с течением времени после введения соединения 292 у человека.
[0128] На фиг.5 представлено фосфорилирование AKT в клетках CLL/SLL после обработки соединением 292.
[0129] На фиг.6 представлены изменения размера опухоли после введения соединения 292 у человека.
[0130] На фиг.7 представлено быстрое возникновение клинической активности соединения 292 у пациентов с CLL/SLL.
[0131] На фиг.8 представлена клиническая активность соединения 292 у пациентов с T-клеточной лимфомой.
[0132] На фиг.9 представлена клиническая активность соединения 292 у пациента с T-клеточной лимфомой.
[0133] На фиг.10 представлены процентные изменения поддающегося количественному определению заболевания у пациентов с периферической T-клеточной лимфомой (PTCL) и Т-клеточной лимфомой кожи.
[0134] На фиг.11 представлены процентные изменения поддающегося количественному определению заболевания у пациентов с агрессивной NHL (aNHL), лимфомой Ходжкина и лимфомой из клеток мантийной зоны (MCL).
[0135] На фиг.12 представлены процентные изменения поддающегося количественному определению заболевания у пациентов с вялотекущей NHL (iNHL). Пациенты с iNHL включали пациентов с фолликулярной лимфомой, макроглобулинемией Валденстрема (лимфоплазматическая лимфома) и лимфомой маргинальной зоны (MZL).
[0136] На фиг.13 представлены месяцы исследования по индивидуумам и диагнозу для пациентов, которых лечили соединением 292.
[0137] На фиг.14 показано, что соединение 292 ингибирует продукцию TNF-α и IL-10 из разбавленной цельной крови, стимулированной LPS.
[0138] На фиг.15 представлены эффекты введения соединения 292 на сывороточную концентрацию CXCL13 у пациентов с CLL/SLL и iNHL/MCL/FL.
[0139] На фиг.16 представлены эффекты введения соединения 292 на сывороточную концентрацию CCL4 у пациентов с CLL/SLL и iNHL/MCL/FL.
[0140] На фиг.17 представлены эффекты введения соединения 292 на сывороточную концентрацию CCL17 у пациентов с CLL/SLL и iNHL/MCL/FL.
[0141] На фиг.18 представлены эффекты введения соединения 292 на сывороточную концентрацию CCL22 у пациентов с CLL/SLL и iNHL/MCL/FL.
[0142] На фиг.19 представлены эффекты введения соединения 292 на сывороточную концентрацию TNF-α у пациентов с CLL/SLL и iNHL/MCL/FL.
[0143] На фиг.20 представлены эффекты введения соединения 292 на сывороточную концентрацию MMP9 у некоторых пациентов с не-CLL/iNHL.
[0144] На фиг.21 представлен возможный механизм действия определенных хемокинов у пациентов с гематологическими злокачественными опухолями.
[0145] На фиг.22 представлены стационарные концентрации в плазме соединения 292 на 2 курсе, 1 сутки 28-суточного курса, с введением 25 мг и 75 мг BID.
[0146] На фиг.23 представлено снижение уровней биомаркеров CLL в сыворотке в различные моменты времени после 28-суточного курса с введением 25 мг соединения 292 BID.
[0147] На фиг.24 представлено снижение уровней биомаркеров CLL в сыворотке в различные моменты времени после 28-суточного курса с введением 25 мг или 75 мг соединения 292 BID.
[0148] На фиг.25 представлено среднее абсолютное количество лимфоцитов (ALC) в различные моменты времени после 28-суточного курса с введением 25 мг BID у пациентов с исходным уровнем ALC, превышающим 10×103/мкл (более темная линия), и исходным уровнем ALC, более низким, чем 10×103/мкл (более светлая линия).
[0149] На фиг.26 представлены средние уровни ALC в различные моменты времени после 28-суточного курса с введением 25 мг BID и изменения размеров опухоли.
[0150] На фиг.27A представлено снижение уровней биомаркеров лимфомы в сыворотке в различные моменты времени после 28-суточного курса с введением 25 мг соединения 292 BID.
[0151] На фиг.27B представлено снижение уровней биомаркеров iNHL в сыворотке в различные моменты времени после 28-суточного курса с введением 25 мг соединения 292 BID.
[0152] На фиг.28 представлено снижение уровней биомаркеров T-клеточной лимфомы в сыворотке в различные моменты времени после 28-суточного курса с введением 25 мг соединения 292 BID.
[0153] На фиг.29 представлено снижение уровней биомаркеров iNHL в сыворотке в различные моменты времени после 28-суточного курса с введением 25 мг или 75 мг соединения 292 BID.
[0154] На фиг.30A представлено количество клеток Сезари на микролитр периферической крови в различные моменты времени после 28-суточного курса с введением 25 мг соединения 292 BID.
[0155] На фиг.30B представлен ответ CT, представленный в значениях суммы произведений диаметров (SPD), в различные моменты времени после 28-суточного курса с введением 25 мг соединения 292 BID.
[0156] На фиг.30C представлен показатель mSWAT в различные моменты времени после 28-суточного курса с введением 25 мг соединения 292 BID.
[0157] На фиг.31 представлена корреляция между ингибированием роста и фармакодинамическим ответом в клеточных линиях DLBCL DHL-6, DHL-4, Ri-1 и U2932, при оценке различных белков с использованием вестерн-блоттинга.
[0158] На фиг.32 представлена чувствительность клеточной линии Loucy ALL к различным ингибиторам изоформ PI3K.
[0159] На фиг.33 представлено снижение уровня pPRAS40 при обработке соединениям 292, по сравнению с обработкой GS-1101, и показано, что уровень pERK1/2 является значительно более низким в клетках HH, чем в клетках MJ или HuT78.
[0160] На фиг.34 представлено увеличение количества положительных по Ki-67/pAKT клеток CLL через 30 минут, 4 часа, 24 часа и 72 часа после обработки коктейлем цитокинов, состоящим из CD40L, IL-2 и Il-10.
[0161] На фиг.35 представлено уменьшение количества положительных по Ki-67/pAKT клеток CLL, обработанных коктейлем цитокинов в ходе обработки 100 нМ соединением 292.
[0162] На фиг.36 представлено процентное ингибирование пролиферации клеток CLL соединением 292 по сравнению с CAL-101.
[0163] На фиг.37A представлены абсолютные количества лимфоцитов у пациентов с CLL, которым вводили 25 мг соединения 292 BID.
[0164] На фиг.37B представлено уменьшение количества положительных по CD38 циркулирующих клеток CLL у пациентов с CLL, которым вводили 25 мг соединения 292 BID.
[0165] На фиг.37C представлено уменьшение количества положительных по CD69 циркулирующих клеток CLL у пациентов с CLL, которым вводили 25 мг соединения 292 BID.
[0166] На фиг.37D представлено уменьшение количества двойных положительных по CD38/CD69 циркулирующих клеток CLL у пациентов с CLL, которым вводили 25 мг соединения 292 BID.
[0167] На фиг.38 представлены эффекты комбинации соединение 292/ибрутиниб на жизнеспособность клеток DLBCL по сравнению с монотерапией.
[0168] На фиг.39 представлены эффекты соединения 292 на pATK у пациентов с CLL, у которых ранее произошло прогрессирование при лечении ибрутинибом.
[0169] На фиг.40 представлена изоболограмма, демонстрирующая синергический эффект комбинации соединения 292 и ибрутиниба в линии TMD-8.
[0170] На фиг.41 представлена изоболограмма, на которой представлен синергический эффект комбинации соединения 292 и ибрутиниба в клеточной линии WSU-NHL.
[0171] На фиг.42 представлена изоболограмма, на которой показан синергический эффект комбинации соединения 292 и ибрутиниба в клеточной линии Farage.
ПОДРОБНОЕ ОПИСАНИЕ
[0172] Хотя конкретные варианты осуществления обсуждаются, описание является только иллюстративным и не является ограничивающим. Многие варианты настоящего изобретения станут очевидными специалистам в данной области при рассмотрении настоящего описания.
[0173] Если не определено иначе, все технические и научные термины, используемые в настоящем описании, имеют то же значение, которое обычно подразумевает специалист в данной области. Все патенты и публикации, описанные в настоящем описании, включены в качестве ссылок.
[0174] Как используют в описании и формуле изобретения, форма единственного числа включает множественное число упоминаемых объектов, если контекст явно не указывает на иное.
[0175] Как используют в рамках изобретения и если нет иных указаний, термин "приблизительно" или "примерно" означает приемлемую погрешность для конкретной величины, как определит специалист в данной области, которая частично зависит от того, каким образом величину измеряют или определяют. В определенных вариантах осуществления термин "приблизительно" или "примерно" означает нахождение в пределах 1, 2, 3 или 4 стандартных отклонений. В определенных вариантах осуществления термин "приблизительно" или "примерно" означает нахождение в пределах 50%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5% или 0,05% от данной величины или диапазона.
[0176] Как используют в рамках изобретения, термин "пациент" или "индивидуум" относится к животному, как правило, человеку (например, мужчина или женщина любой возрастной группы, например, пациент детского возраста (например, младенец, ребенок, подросток) или взрослый пациент (например, молодой, взрослый среднего возраста или пожилой) или другому млекопитающему, такому как примат (например, яванский макак, макак-резус); другим млекопитающим, таким как грызуны (мыши, крысы), крупный рогатый скот, свиньи, лошади, овцы, козы, кошки, собаки; и/или птицам, которые будут или являются объектом лечения, наблюдения и/или эксперимента. Когда термин используют применительно к введению соединения или лекарственного средства, тогда пациент является объектом лечения, наблюдения и/или введения соединения или лекарственного средства.
[0177] "Терапевтический эффект", как используют в настоящем описании, охватывает терапевтическую пользу и/или профилактическую пользу, как описано в настоящем описании. Профилактический эффект включает задерживание или предотвращение появления заболевания или состояния, задерживание или предотвращение появления симптомов заболевания или состояния, замедление, остановку или реверсию прогрессирования заболевания или состояния, или любую их комбинацию.
[0178] Термин "эффективное количество" относится к количеству соединения или фармацевтической композиции, описанной в настоящем описании, которое является достаточным для осуществления намеченного применения, включая, но не ограничиваясь ими, лечение заболевания, как проиллюстрировано ниже. Эффективное количество может варьировать в зависимости от предполагаемого применения (in vitro или in vivo), или индивидуума и болезненного состояния, подвергаемого лечению, например, массы тела и возраста индивидуума, тяжести болезненного состояния, способа введения и т.п., которые может без труда определить специалист в данной области. Термин также применим к дозе, которая индуцирует конкретный ответ в клетках-мишенях. Конкретная доза варьирует в зависимости, например, от конкретного выбранного соединения, режима дозирования, которому следуют, введения с другими средствами, расписания введения, ткани, в которую ее вводят, и физической системы для доставки, в которой она содержится.
[0179] Как используют в рамках изобретения, термины "лечение", "осуществление лечения", "облегчение" и "ослабление" используют в настоящем описании взаимозаменяемо. Эти термины относятся к подходу для достижения благоприятных или желаемых результатов, включая, но не ограничиваясь ими, терапевтическую пользу и/или профилактическую пользу. Под терапевтической пользой подразумевают устранение или смягчение основного нарушения, подвергаемого лечению. Также терапевтической пользой достигают путем устранения или смягчения одного или нескольких физиологических симптомов, ассоциированных с основным нарушением, так чтобы у пациента наблюдалось улучшение, несмотря на то, что пациент все еще может страдать основным нарушением. Для профилактической пользы фармацевтические композиции можно вводить пациенту, имеющему риск развития конкретного заболевания, или пациенту, сообщающему об одном или нескольких физиологических симптомах заболевания, даже несмотря на то, что диагноз данного заболевания может быть не поставлен. В одном варианте осуществления эти термины также относятся к частичному или полному ингибированию или уменьшению состояния, которым страдает индивидуум. В одном варианте осуществления эти термины относятся к действию, которое происходит, в то время как пациент страдает от состояния или у него диагностировано состояние, которое снижает тяжесть состояния или задерживает или замедляет прогрессирование состояния. Лечение не должно приводить к полному излечению состояния; этот термин охватывает частичное ингибирование или уменьшение состояния. Подразумевают, что лечение охватывает предупреждение или профилактику.
[0180] "Терапевтически эффективное количество", как используют в рамках изобретения, относится к минимальному количеству или концентрации соединения, такого как модулятор PI3K, которое, при введении отдельно или в комбинации, является достаточным для обеспечения терапевтической пользы при лечении состояния или для задерживания или минимизации одного или нескольких симптомов, ассоциированных с состоянием. Термин "терапевтически эффективное количество" может охватывать количество, которое улучшает терапию в целом, снижает или предотвращает симптомы или причины состояния, или повышает терапевтическую эффективность другого лекарственного средства. Терапевтическое количество не должно приводить к полному излечению состояния; этот термин охватывает частичное ингибирование или уменьшение состояния. Терапевтически эффективное количество также может охватывать профилактически эффективное количество.
[0181] Как используют в рамках изобретения, если нет иных указаний, термины "предупреждать", "осуществление предупреждения" и "предупреждение" относятся к действию, которое происходит до того, как индивидуум начинает страдать от состояния, или у него возникнет рецидив состояния. Предупреждение не должно приводить к полному предупреждению состояния; этот термин охватывает частичное предупреждение или уменьшение состояния или симптома состояния, или уменьшение риска развития состояния.
[0182] Как используют в рамках изобретения, если нет иных указаний, "профилактически эффективное количество" соединения, такого как модулятор PI3K, представляет собой количество, которое при введении отдельно или в комбинации предупреждает или уменьшает риск развития состояния или одного или нескольких симптомов, ассоциированных с состоянием, или предупреждает его рецидив. Термин "профилактически эффективное количество" может охватывать количество, которое улучшает профилактику в целом или усиливает профилактическую эффективность другого профилактического средства. Профилактическое количество не должно приводить к полному предупреждению состояния; этот термин охватывает частичное предупреждение или уменьшение состояния.
[0183] Как используют в рамках изобретения, "снижать", "смягчать", "уменьшать", "лечить" (и т.п.) состояние или симптомы, ассоциированные с состоянием, включает уменьшение тяжести и/или частоты симптомов состояния, а также предупреждение состояния и/или симптомов состояния (например, путем снижения тяжести и/или частоты обострений симптомов). В некоторых вариантах осуществления симптом снижается по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, или по меньшей мере на 95% относительно контрольного уровня. Контрольный уровень включает любой подходящий контроль, как известно в данной области. Например, контрольный уровень может представлять собой уровень до введения в образце или у индивидуума, подвергаемого лечению, или он может представлять собой уровень в контрольной популяции (например, уровень у индивидуумов, которые не имеют состояния, или уровень в образцах, взятых от индивидуумов, которые не имеют состояния). В некоторых вариантах осуществления снижение является статистически значимым, например, при оценке с использованием соответствующего параметрического или непараметрического статистического сравнения.
[0184] Как используют в рамках изобретения, "средство" или "биологически активное средство" или "второе активное средство" относится к биологическому, фармацевтическому или химическому соединению или другой части. Неограничивающие примеры включают простые или сложные органические или неорганические молекулы, пептид, белок, олигонуклеотид, антитело, производное антитела, фрагмент антитела, витамин, производное витамина, углевод, токсин или химиотерапевтическое соединение, и их метаболиты. Различные соединения можно синтезировать, например, низкомолекулярные соединения и олигомеры (например, олигопептиды и олигонуклеотиды), и синтетические органические соединения на основе различных центральных структур. Кроме того, различные природные источники могут обеспечить соединения для скрининга, такие как растительные или животные экстракты и т.п. Квалифицированный специалист без труда признает, что отсутствует ограничение структурной природы средств по настоящему изобретению.
[0185] Термин "агонист", как используют в рамках изобретения, относится к соединению или средству, обладающему способностью инициировать или усиливать биологическую функцию белка-мишени или полипептида-мишени, как например, увеличение активности или экспрессии белка-мишени или полипептида-мишени. Таким образом, термин "агонист" определяют в контексте биологической роли белка-мишени или полипептида-мишени. В то время как некоторые агонисты в рамках настоящего изобретения специфически взаимодействуют (например, связываются) с мишенью, также в это определение конкретно включены соединения и/или средства, которые инициируют или усиливают биологическую активность белка-мишени или полипептида-мишени путем взаимодействия с другими членами каскада передачи сигнала, членом которого является полипептид-мишень.
[0186] Термины "антагонист" и "ингибитор" используют взаимозаменяемо, и они относятся к соединению или средству, способному ингибировать биологическую функцию белка-мишени или полипептида-мишени, как например, путем ингибирования активности или экспрессии белка-мишени или полипептида-мишени. Таким образом, термины "антагонист" и "ингибитор" определяют в контексте биологической роли белка-мишени или полипептида-мишени. В то время как некоторые антагонисты, описанные в настоящем описании, специфически взаимодействуют (например, связываются с) мишенью, в это определение конкретно включены соединения, которые ингибируют биологическую активность белка-мишени или полипептида-мишени путем взаимодействия с другими членами каскада передачи сигнала, членами которого являются белок-мишень или полипептид-мишень. Неограничивающие примеры биологической активности, ингибируемой антагонистом, включают биологическую активность, ассоциированную с развитием, ростом или распространением опухоли или нежелательным иммунным ответом, проявляющимся аутоиммунным заболеванием.
[0187] "Средство против злокачественной опухоли", "противоопухолевое средство" или "химиотерапевтическое средство" относится к любому средству, пригодному для лечения неопластического состояния. Один класс средств против злокачественной опухоли включает химиотерапевтические средства. "Химиотерапия" означает введение одного или нескольких химиотерапевтических средств и/или других средств пациенту со злокачественной опухолью различными способами, включая внутривенное, пероральное, внутримышечное, внутрибрюшинное, внутрипузырное, подкожное, трансдермальное или буккальное введение, или ингаляцию, или в форме суппозитория.
[0188] Термин "клеточная пролиферация" относится к явлению, при котором количество клеток изменяется в результате деления. Этот термин также охватывает рост клеток, при котором изменяется морфология клеток (например, увеличивается размер) в соответствии с пролиферативным сигналом.
[0189] Термин "совместное введение", "введенный в комбинации с" и их грамматические эквиваленты, как используют в рамках изобретения, охватывает введение двух или более средств индивидууму, так чтобы оба средства и/или их метаболиты присутствовали у индивидуума одновременно. Совместное введение включает одновременное введение в отдельных композициях, введение в различные моменты времени в отдельных композициях, или введение в композиции, в которой присутствуют оба средства.
[0190] Как используют в рамках изобретения, если нет иных указаний, "модулятор фосфоинозитид-3-киназы (PI3K)" или "модулятор PI3K" относится к модулятору PI3K, включая ингибитор PI3K. PI3K являются членами уникального и консервативного семейства внутриклеточных киназ липидов, которые фосфорилируют 3’-OH-группу на фосфатидилинозитолах или фосфоинозитидах. Семейство PI3K включает киназы с различной субстратной специфичностью, профилями экспрессии и способами регуляции (см., например, Katso et al., 2001, Annu. Rev. Cell Dev. Biol. 17, 615 -675; Foster, F.M. et al., 2003, J Cell Sci 116, 3037-3040). PI3K класса I (например, p110 α, p110 β, p110 γ и p110 δ), как правило, активируются тирозинкиназамии или сопряженными с G-белком рецепторами с образованием PIP3, который привлекает нижеследующие медиаторы, такие как медиаторы каскада Akt/PDK1, mTOR, киназы семейства Tec и GTP-азы семейства Rho. PI3K класса II (например, PI3K-C2α, PI3K-C2β, PI3K-C2γ) и PI3K класса III (например, Vps34) играют ключевую роль во внутриклеточном транспорте посредством синтеза PI(3)P и PI(3,4)P2. Конкретные иллюстративные модуляторы и ингибиторы PI3K описаны в настоящем описании.
[0191] PI3K класса I содержит каталитическую субъединицу p110 и регуляторную адаптерную субъединицу. См., например, Cantrell, D.A. (2001) Journal of Cell Science 114: 1439-1445. Четыре изоформы субъединицы p110 (включая изоформы PI3K-α (альфа), PI3K-β (бета), PI3K-γ (гамма) и PI3K-δ (дельта)) вовлечены в различные биологические функции. PI3Kα класса I вовлечена, например, в передачу сигнала инсулина, и было выявлено, что она является мутантной в солидных опухолях. PI3K-β класса I вовлечена, например, в активацию тромбоцитов и передачу сигнала инсулина. PI3K-γ класса I участвует в активации тучных клеток, врожденной иммунной функции и транспорте иммунных клеток (хемокины). PI3K-δ класса I вовлечена, например, в активацию и функционирование B-клеток и T-клеток и в передачу сигнала Fc-рецептора в тучных клетках. В некоторых вариантах осуществления, описанных в настоящем описании, модулятор PI3K представляет собой модулятор PI3K класса I (например, ингибитор). В некоторых вариантах осуществления модулятор PI3K ингибирует или снижает активность изоформы PI3K-α (альфа), PI3K-β (бета), PI3K-γ (гамма) или PI3K-δ (дельта) или их комбинации.
[0192] Нижеследующие медиаторы передачи сигнала PI3K включают Akt и мишень рапамицина (mTOR) у млекопитающих. Akt обладает доменом гомологии с плекстрином (PH), который связывает PIP3, что приводит к активации киназы Akt. Akt фосфорилирует множество субстратов и является центральным нижеследующим эффектором PI3K для разнообразных клеточных ответов. Одной из функций Akt является усиление активности mTOR посредством фосфорилирования TSC2 и других механизмов. mTOR представляет собой серин-треониновую киназу, родственную киназам липидов семейства PI3K.
[193] "Передача сигнала" представляет собой процесс, в ходе которого стимулирующие или ингибирующие сигналы передаются в клетку и внутри клетки, индуцируя внутриклеточный ответ. "Модулятор" каскада передачи сигнала относится к соединению, которое модулирует активность одного или нескольких клеточных белков, картированных в том же конкретном каскаде передачи сигнала. Модулятор может усиливать (агонист) или подавлять (антагонист) активность молекулы передачи сигнала.
[194] Если нет иных указаний, термин "селективное ингибирование" или "селективно ингибировать" или "селективный в отношении", используемый в отношении биологически активного средства, относится к способности средства селективно снижать активность передачи сигнала мишени по сравнению с не направленной на мишень активностью передачи сигнала, посредством прямого или непрямого взаимодействия с мишенью. Например, соединение, которое селективно ингибирует одну изоформу PI3K относительно другой изоформы PI3K, обладает по меньшей мере 2X активностью в отношении первой изоформы относительно активности соединения в отношении второй изоформы (например, по меньшей мере приблизительно 3X, 5X, 10X, 20X, 50X, 100X, 200X, 500X или 1000X).
[195] Термин "in vivo" относится к событию, которое происходит в организме индивидуума.
[196] Термин "in vitro" относится к событию, которое происходит вне организма индивидуума. Например, анализ in vitro охватывает любой анализ, проводимый вне индивидуума. Анализы in vitro охватывают клеточные анализы, в которых используют клетки, живые или погибшие. Анализы in vitro также охватывают бесклеточный анализ, в котором используют неизмененные клетки.
[197] "Лучевая терапия" означает воздействие на пациента, с использованием общепринятых способов и композиций, известных практикующему специалисту, источниками излучение, такими как, но не ограничиваясь ими, радионуклиды, испускающие альфа-частицы (например, радионуклиды актиния и тория), источники излучения с низким линейным переносом энергии (LET) (например, бета-излучатели), излучатели конверсионных электронов (например, стронций 89 и самарий 153-EDTMP), или излучение высокой энергии, включая, но не ограничиваясь ими, рентгеновское излучение, гамма-лучи и нейтроны.
[198] "Способ терапии" относится к любому агенту, применяемому для обеспечения терапевтических изменений в биологических тканях, включая но не ограничиваясь ими, термическую, звуковую, световую, механическую или электрическую энергию. Например, средство может представлять собой любое из средств, описанных в настоящем описании.
[199] "Фармацевтически приемлемый носитель" или "фармацевтически приемлемый эксципиент" включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание средства и т.п. Использование таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением случаев, когда какая-либо общепринятая среда или средство несовместимы с активным ингредиентом, предусматривается их применение в терапевтических композициях, описанных в настоящем описании. Также в фармацевтические композиции могут быть включены дополнительные активные ингредиенты.
[200] Как используют в рамках изобретения, "фармацевтически приемлемая форма" описанного соединения включает, но не ограничивается ими, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные описанных соединений. В одном варианте осуществления "фармацевтически приемлемая форма" включает, но не ограничивается ими, фармацевтически приемлемые соли, изомеры, пролекарства и изотопно меченные производные описанных соединений.
[201] В определенных вариантах осуществления фармацевтически приемлемая форма представляет собой фармацевтически приемлемую соль. Как используют в рамках изобретения, термин "фармацевтически приемлемая соль" относится к солям, которые с точки зрения медицины пригодны для применения в контакте с тканями индивидуумов без излишней токсичности, раздражения, аллергического ответа и т.п., и которые соответствуют приемлемому соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Например, Berge et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences (1977) 66:1-19. Фармацевтически приемлемые соли соединений, описанных в настоящем описании, включают соли, образованные из пригодных неорганических и органических кислот и оснований. Примеры фармацевтически приемлемых, нетоксичных кислотно-аддитивных солей являются соли аминогруппы, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, виннокаменная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с использованием других способов, используемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипаты, альгинаты, аскорбаты, аспартаты, бензолсульфонаты, безилаты, бензоаты, бисульфаты, бораты, бутираты, камфораты, камфоросульфонаты, цитраты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, формиаты, фумараты, глюкогептаноаты, глицерофосфаты, глюконаты, гемисульфаты, гептаноаты, гексаноаты, гидройодиды, 2-гидроксиэтансульфонаты, лактобионаты, лактаты, лаураты, лаурилсульфаты, малаты, малеаты, малонаты, метансульфонаты, 2-нафталинсульфонаты, никотинаты, нитраты, олеаты, оксалаты, пальмитаты, памоаты, пектинаты, персульфаты, 3-фенилпропионаты, фосфаты, пикраты, пивалаты, пропионаты, стеараты, сукцинаты, сульфаты, тартраты, тиоцианаты, п-толуолсульфонаты, ундеканоаты, валераты и т.п. В некоторых вариантах осуществления органические кислоты, из которых могут быть образованы соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, виннокаменную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п.
[202] Фармацевтически приемлемые соли, происходящие из соответствующих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммония и N+(C1-4алкила)4. Репрезентативные соли щелочных и щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Кроме того, фармацевтически приемлемые соли включают в соответствующих случаях нетоксичные соли аммония, четвертичного аммония и катионов аминов, образованные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат. Органические основания, из которых могут происходить соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, включающие встречающиеся в природе замещенные амины, циклические амины, основные ионообменные смолы и т.п., такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. В некоторых вариантах осуществления фармацевтически приемлемая основно-аддитивная соль выбрана из солей аммония, калия, натрия, кальция и магния.
[203] В определенных вариантах осуществления фармацевтически приемлемая форма представляет собой сольват (например гидрат). Как используют в рамках изобретения, термин "сольват" относится к соединениям, которые дополнительно включают стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. Сольват может представлять собой сольват описанного соединения или его фармацевтически приемлемой соли. Когда растворитель представляет собой воду, сольват представляет собой "гидрат". Фармацевтически приемлемые сольваты и гидраты представляют собой комплексы, которые, например, могут включать от 1 до приблизительно 100, или от 1 до приблизительно 10, или от одной до приблизительно 2, приблизительно 3 или приблизительно 4 молекулы растворителя или воды. Будет понятно, что термин "соединение", как используют в рамках изобретения, охватывает соединение и сольваты соединения, а также их смеси.
[204] В определенных вариантах осуществления фармацевтически приемлемая форма представляет собой пролекарство. Как используют в рамках изобретения, термин "пролекарство" относится к соединениям, которые преобразуются in vivo с образованием описанного соединения или фармацевтически приемлемой формы соединения. Пролекарство может быть неактивным при введении индивидууму, но конвертируется in vivo в активное соединение, например, гидролизом (например, гидролизом в крови). В определенных случаях пролекарство имеет улучшенные физические свойства и/или свойства доставки относительно родительского соединения. Пролекарства, как правило, предназначены для усиления фармацевтических и/или фармакокинетических свойств, ассоциированных с родительским соединением. Пролекарственное соединение часто обеспечивает преимущества растворимости, совместимости с тканью или замедленного высвобождения в организме млекопитающего (см., например, Bundgard, H., Design of Prodrugs (1985), pp. 7 9, 21 24 (Elsevier, Amsterdam). Обсуждение пролекарств представлено в Higuchi, T., et al., "Prodrugs as Novel Delivery Systems," A.C.S. Symposium Series, Vol. 14, и в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, обе из которых полностью включены в настоящее описание в качестве ссылок. Иллюстративные преимущества пролекарства могут включать, но не ограничиваться ими, его физические свойства, такие как увеличенная растворимость в воде при физиологических значениях pH для парентерального введения по сравнению с родительским соединением, или оно усиливает всасывание из пищеварительного тракта, или оно может повышать стабильность лекарственного средства для длительного хранения.
[205] Термин "пролекарство" также включает любые ковалентно связанные носители, которые высвобождают активное соединение in vivo, когда такое пролекарство вводят индивидууму. Пролекарства активного соединения, как описано в настоящем описании, можно получать путем модификации функциональных групп, присутствующих в активном соединении, таким образом, что модификации отщепляются, либо путем стандартного манипулирования, либо in vivo, до родительского активного соединения. Пролекарства включают соединения, где гидрокси, амино или меркаптогруппа связана с любой группой, которая, когда пролекарство активного соединения вводят индивидууму, отщепляется с образованием свободной гидроксигруппы, свободной аминогруппы или свободной меркаптогруппы, соответственно. Примеры пролекарств включают, но не ограничиваются ими, ацетатные, формиатные и бензоатные производные спирта или ацетамида, формамидные и бензамидные производные функциональной аминогруппы в активном соединении, и т.п. Другие примеры пролекарств включают соединения, которые содержат части -NO, -NO2, -ONO или -ONO2. Пролекарства, как правило, можно получать с использованием хорошо известных способов, таких как способы, описанные в Burger’s Medicinal Chemistry and Drug Discovery, 172-178, 949-982 (Manfred E. Wolff ed., 5th ed., 1995), и Design of Drugs (H. Bundgaard ed., Elsevier, New York, 1985).
[206] Например, если описанное соединение или фармацевтически приемлемая форма соединения содержит функциональную группу карбоновой кислоты, пролекарство может содержать фармацевтически приемлемый сложный эфир, образованный путем замены атома водорода кислотной группы на группу, такую как (C1-C8)алкил, (C2-C12)алканоилоксиметил, 1-(алканоилокси)этил, имеющий от 4 до 9 атомов углерода, 1-метил-1-(алканоилокси)этил, имеющий от 5 до 10 атомов углерода, алкоксикарбонилоксиметил, имеющий от 3 до 6 атомов углерода, 1-(алкоксикарбонилокси)этил, имеющий от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилокси)этил, имеющий от 5 до 8 атомов углерода, N-(алкоксикарбонил)аминометил, имеющий от 3 до 9 атомов углерода, 1-(N-(алкоксикарбонил)амино)этил, имеющий от 4 до 10 атомов углерода, 3-фталидил, 4-кротонолатонил, гамма-бутиролактон-4-ил, ди-N,N-(C1-C2)алкиламино(C2-C3)алкил (такой как β-диметиламиноэтил), карбамоил-(C1-C2)алкил, N,N-ди(C1-C2)алкилкарбамоил-(C1-C2)алкил и пиперидино-, пирролидинo- или морфолино(C2-C3)алкил.
[207] Аналогично, если описанное соединение или фармацевтически приемлемая форма соединения содержит спиртовую функциональную группу, пролекарство может быть образовано путем замены атома водорода спиртовой группой на группу, такую как (C1-C6)алканоилоксиметил, 1-((C1-C6)алканоилокси)этил, 1-метил-1-((C1-C6)алканоилокси)этил (C1-C6)алкоксикарбонилоксиметил, N-(C1-C6)алкоксикарбониламинометил, сукциноил, (C1-C6)алканоил, α-амино(C1-C4)алканоил, арилацил и α-аминоацил, или α-аминоацил-α-аминоацил, где каждая α-аминоацильная группа независимо выбрана из встречающихся в природе L-аминокислот, P(O)(OH)2, -P(O)(O(C1-C6)алкила)2 и гликозила (радикал, образованный удалением гидроксильной группой гемиацетальной формы углевода).
[208] Если описанное соединение или фармацевтически приемлемая форма соединения включает функциональную аминогруппу, пролекарство может быть образовано путем замены атома водорода в аминогруппе на группу, такую как R-карбонил, RO-карбонил, NRR′-карбонил, где каждый из R и R′ независимо представляет собой (C1-C10)алкил, (C3-C7)циклоалкил, бензил, природный α-аминоацил или природный α-аминоацил-природный α-аминоацил, -C(OH)C(O)OY1, где Y1 представляет собой H, (C1-C6)алкил или бензил, -C(OY2)Y3, где Y2 представляет собой (C1-C4)алкил и Y3 представляет собой (C1-C6)алкил, карбокси(C1-C6)алкил, амино(C1-C4)алкил или моно-N- или ди-N,N-(C1-C6)алкиламиноалкил, -C(Y4)Y5, где Y4 представляет собой H или метил и Y5 представляет собой моно-N- или ди-N,N-(C1-C6)алкиламино, морфолино, пиперидин-1-ил или пирролидин-1-ил.
[209] В определенных вариантах осуществления фармацевтически приемлемая форма представляет собой изомер. "Изомеры" представляют собой различные соединения, которые имеют одинаковую молекулярную формулу. "Стереоизомеры" представляют собой изомеры, которые отличаются только тем, как атомы расположены в пространстве. Как используют в рамках изобретения, термин "изомер" включает любые и все геометрические изомеры и стереоизомеры. Например, "изомеры" включают геометрические цис- и транс-изомеры по двойной связи, также называемые E- и Z-изомерами; R- и S-энантиомеры; диастереомеры, (d)-изомеры и (l)-изомеры, их рацемические смеси; и другие их смеси, как находящиеся в объеме настоящего изобретения.
[210] В одном варианте осуществления в рамках настоящего изобретения предусматриваются различные геометрические изомеры и их смеси, являющиеся результатом расположения заместителей вокруг углерод-углеродной двойной связи или расположения заместителей вокруг карбоциклического кольца. Заместители вокруг углерод-углеродной двойной связи обозначают как находящиеся в конфигурации "Z" или "E", где термины "Z" и "E" используют в соответствии со стандартами IUPAC. Если нет иных указаний, структуры, изображающие двойные связи, охватывают как "E"-, так и "Z"-изомеры.
[211] Альтернативно заместители вокруг углерод-углеродной двойной связи могут обозначаться как "цис" или "транс", где "цис" обозначает заместители на той же стороне двойной связи и "транс" обозначает заместители на противоположных сторонах двойной связи. Расположение заместителей вокруг карбоциклического кольца также может быть обозначено как "цис" или "транс". Термин "цис" обозначает заместители на одной стороне плоскости кольца, и термин "транс" обозначает заместители на противоположных сторонах плоскости кольца. Смеси соединений, где заместители расположены как на одной, так и на противоположных сторонах плоскости кольца, обозначают "цис/транс".
[212] "Энантиомеры" представляют собой пару стереоизомеров, изображения которых являются не совпадающими при наложении друг на друга. Смесь пары энантиомеров в любом соотношении может быть известна как "рацемическая" смесь. Термин "(±)" используют для обозначения рацемической смеси, когда это целесообразно. "Диастереоизомеры" представляют собой стереоизомеры, которые имеют по меньшей мере два асимметричных атома, но изображения которых не являются совпадающими при наложении друг на друга. Абсолютная стереохимия может быть указана согласно системе R-S Cahn-Ingold-Prelog. Когда соединение представляет собой энантиомер, стереохимия каждого хирального атома углерода может быть указана либо как R, либо как S. Разделенные соединения, абсолютная конфигурация которых неизвестна, могут быть обозначены как (+) или (-) в зависимости от направления (правовращающее или левовращающее), в котором они вращают плоскополяризованный свет при длине волны D-линии натрия. Определенные соединения, описанные в настоящем описании, содержат один или несколько асимметричных центров и, таким образом, могут давать начало энантиомерам, диастереомерам и другим стереоизомерным формам, которые могут быть определены, с точки зрения абсолютной стереохимии по каждому асимметричному атому, как (R) или (S). Подразумевают, что химические структуры, фармацевтические композиции и способы по настоящему изобретению включают все такие возможные изомеры, включая рацемические смеси, по существу оптически чистые формы и смеси промежуточных соединений. Оптически активные изомеры (R) и (S) можно получать, например, с использованием хиральных синтонов или хиральных реагентов, или разделять с использованием общепринятых способов.
[213] "Энантиомерный избыток" или "% энантиомерный избыток" композиции можно вычислять с использованием уравнения, представленного ниже. В примере, представленном ниже, композиция содержит 90% одного энантиомера, например, S-энантиомера, и 10% другого энантиомера, например, R-энантиомера.
ee=(90-10)/100=80%.
[214] Таким образом, считают, что композиция, содержащая 90% одного энантиомера и 10% другого энантиомера имеет энантиомерный избыток 80%. Некоторые композиции, описанные в настоящем описании, содержат энантиомерный избыток по меньшей мере приблизительно 1%, приблизительно 5%, приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 75%, приблизительно 90%, приблизительно 95% или приблизительно 99% S-энантиомера. Иными словами, композиции содержат энантиомерный избыток S-энантиомера относительно R-энантиомера. В других вариантах осуществления некоторые композиции, описанные в настоящем описании, содержат энантиомерный избыток по меньшей мере приблизительно 1%, приблизительно 5%, приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 75%, приблизительно 90%, приблизительно 95% или приблизительно 99% R-энантиомера. Иными словами, композиции содержат энантиомерный избыток R-энантиомера относительно S-энантиомера.
[215] Например, в некоторых вариантах осуществления может быть предоставлен изомер/энантиомер, по существу свободный от соответствующего энантиомера, и он также может быть обозначен как "оптически обогащенный", "энантиомерно обогащенный", "энантиомерно чистый" и "нерацемический", как используют в настоящем описании взаимозаменяемо. Эти термины относятся к композициям, в которых количество одного энантиомера превышает количество этого одного энантиомера в контрольной смеси рацемической композиции (например, более чем 1:1 по массе). Например, энантиомерно обогащенный препарат S-энантиомера означает препарат соединения, имеющий более чем приблизительно 50% по массе S-энантиомера относительно общей массы препарата (например, общая масса S- и R-изомеров), как например, по меньшей мере приблизительно 75% по массе, более того, например, по меньшей мере приблизительно 80% по массе. В некоторых вариантах осуществления увеличение содержание может значительно превышать 80% по массе, обеспечивая "по существу энантиомерно обогащенный", "по существу энантиомерно чистый" или "по существу нерацемический" препарат, который относится к препаратам композиций, которые имеют по меньшей мере приблизительно 85% по массе одного энантиомера относительно общей массы препарата, как например, по меньшей мере приблизительно 90% по массе, и, более того, например, по меньшей мере приблизительно 95% по массе. В определенных вариантах осуществления соединение, описанное в настоящем описании, состоит по меньшей мере приблизительно на 90% по массе одного энантиомера. В других вариантах осуществления соединение состоит из по меньшей мере приблизительно 95%, приблизительно 98% или приблизительно 99% по массе одного энантиомера.
[216] В некоторых вариантах осуществления соединение представляет собой рацемическую смесь (S)- и (R)-изомеров. В других вариантах осуществления в рамках настоящего изобретения предусматривается смесь соединений, где отдельные соединения смеси существуют в основном в (S)- или (R)-изомерной конфигурации. Например, в некоторых вариантах осуществления соединение смесь имеет избыток (S)-энантиомера, превышающий приблизительно 10%, превышающий приблизительно 20%, превышающий приблизительно 30%, превышающий приблизительно 40%, превышающий приблизительно 50%, превышающий приблизительно 55%, превышающий приблизительно 60%, превышающий приблизительно 65%, превышающий приблизительно 70%, превышающий приблизительно 75%, превышающий приблизительно 80%, превышающий приблизительно 85%, превышающий приблизительно 90%, превышающий приблизительно 95%, превышающий приблизительно 96%, превышающий приблизительно 97%, превышающий приблизительно 98% или превышающий приблизительно 99%. В некоторых вариантах осуществления соединение смесь имеет избыток (S)-энантиомера приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или приблизительно 99,5%, или более. В некоторых вариантах осуществления смесь соединений имеет избыток (S)-энантиомера от приблизительно 55% до приблизительно 99,5%, от приблизительно 60% до приблизительно 99,5%, от приблизительно 65% до приблизительно 99,5%, от приблизительно 70% до приблизительно 99,5%, от приблизительно 75% до приблизительно 99,5%, от приблизительно 80% до приблизительно 99,5%, от приблизительно 85% до приблизительно 99,5%, от приблизительно 90% до приблизительно 99,5%, от приблизительно 95% до приблизительно 99,5%, от приблизительно 96% до приблизительно 99,5%, от приблизительно 97% до приблизительно 99,5%, от приблизительно 98% до приблизительно 99,5%, или от приблизительно 99% до приблизительно 99,5%, или более чем приблизительно 99,5%.
[217] В других вариантах осуществления смесь соединений имеет избыток (R)-энантиомеров, превышающий приблизительно 10%, превышающий приблизительно 20%, превышающий приблизительно 30%, превышающий приблизительно 40%, превышающий приблизительно 50%, превышающий приблизительно 55%, превышающий приблизительно 60%, превышающий приблизительно 65%, превышающий приблизительно 70%, превышающий приблизительно 75%, превышающий приблизительно 80%, превышающий приблизительно 85%, превышающий приблизительно 90%, превышающий приблизительно 95%, превышающий приблизительно 96%, превышающий приблизительно 97%, превышающий приблизительно 98%, или превышающий приблизительно 99%. В некоторых вариантах осуществления соединение смесь имеет избыток (R)-энантиомера приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, или приблизительно 99,5%, или более. В некоторых вариантах осуществления смесь соединений имеет избыток (R)-энантиомера от приблизительно 55% до приблизительно 99,5%, от приблизительно 60% до приблизительно 99,5%, от приблизительно 65% до приблизительно 99,5%, от приблизительно 70% до приблизительно 99,5%, от приблизительно 75% до приблизительно 99,5%, от приблизительно 80% до приблизительно 99,5%, от приблизительно 85% до приблизительно 99,5%, от приблизительно 90% до приблизительно 99,5%, от приблизительно 95% до приблизительно 99,5%, от приблизительно 96% до приблизительно 99,5%, от приблизительно 97% до приблизительно 99,5%, от приблизительно 98% до приблизительно 99,5%, или от приблизительно 99% до приблизительно 99,5%, или более чем приблизительно 99,5%.
[218] В других вариантах осуществления смесь соединений содержит идентичные химические структуры, за исключением их стереохимических ориентаций, а именно (S)- или (R)-изомеры. Например, если соединение, описанное в настоящем описании, имеет элемент -CH(R)- и R не является водородом, тогда -CH(R)- находится в (S)- или (R)-стереохимической ориентации для каждой из идентичных химических структур (т.е. (S)- или (R)-стереоизомеры). В некоторых вариантах осуществления смесь идентичных химических структур (т.е. смесь стереоизомеров) представляет собой рацемическую смесь (S)- и (R)-изомеров. В другом варианте осуществления смесь идентичных химических структур (т.е. смесь стереоизомеров) содержит в основном (S)-изомер или в основном (R)-изомер. Например, в некоторых вариантах осуществления (S)-изомер в смеси идентичных химических структур (т.е. смесь стереоизомеров) присутствует в количестве приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или приблизительно 99,5% по массе или более, относительно общей массы смеси (S)- и (R)-изомеров. В некоторых вариантах осуществления (S)-изомер в смеси идентичных химических структур (т.е. смесь стереоизомеров) присутствует в избытке (S)-энантиомера, составляющем от приблизительно 10% до приблизительно 99,5%, от приблизительно 20% до приблизительно 99,5%, от приблизительно 30% до приблизительно 99,5%, от приблизительно 40% до приблизительно 99,5%, от приблизительно 50% до приблизительно 99,5%, от приблизительно 55% до приблизительно 99,5%, от приблизительно 60% до приблизительно 99,5%, от приблизительно 65% до приблизительно 99,5%, от приблизительно 70% до приблизительно 99,5%, от приблизительно 75% до приблизительно 99,5%, от приблизительно 80% до приблизительно 99,5%, от приблизительно 85% до приблизительно 99,5%, от приблизительно 90% до приблизительно 99,5%, от приблизительно 95% до приблизительно 99,5%, от приблизительно 96% до приблизительно 99,5%, от приблизительно 97% до приблизительно 99,5%, от приблизительно 98% до приблизительно 99,5%, или от приблизительно 99% до приблизительно 99,5%, или более чем приблизительно 99,5%.
[219] В других вариантах осуществления (R)-изомер в смеси идентичных химических структур (т.е. смесь стереоизомеров) присутствует в количестве приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или приблизительно 99,5% по массе или более, относительно от общей массы смеси (S)- и (R)-изомеров. В некоторых вариантах осуществления (R)-изомеры в смеси идентичных химических структур (т.е. смесь стереоизомеров) присутствуют в избытке (R)-энантиомера, составляющем от приблизительно 10% до приблизительно 99,5%, от приблизительно 20% до приблизительно 99,5%, от приблизительно 30% до приблизительно 99,5%, от приблизительно 40% до приблизительно 99,5%, от приблизительно 50% до приблизительно 99,5%, от приблизительно 55% до приблизительно 99,5%, от приблизительно 60% до приблизительно 99,5%, от приблизительно 65% до приблизительно 99,5%, от приблизительно 70% до приблизительно 99,5%, от приблизительно 75% до приблизительно 99,5%, от приблизительно 80% до приблизительно 99,5%, от приблизительно 85% до приблизительно 99,5%, от приблизительно 90% до приблизительно 99,5%, от приблизительно 95% до приблизительно 99,5%, от приблизительно 96% до приблизительно 99,5%, от приблизительно 97% до приблизительно 99,5%, от приблизительно 98% до приблизительно 99,5%, или от приблизительно 99% до приблизительно 99,5%, или более чем приблизительно 99,5%.
[0220] Энантиомеры можно выделять из рацемических смесей любым способом, известным специалистам в данной области, включая хиральную жидкостную хроматографию высокого давления (HPLC), формирование и кристаллизацию хиральных солей, или можно получать асимметричным синтезом. См., например, Enantiomers, Racemates and Resolutions (Jacques, Ed., Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Stereochemistry of Carbon Compounds (E.L. Eliel, Ed., McGraw-Hill, NY, 1962); и Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972).
[0221] В определенных вариантах осуществления фармацевтически приемлемая форма представляет собой таутомер. Как используют в рамках изобретения, термин "таутомер" представляет собой тип изомера, который включает два или более взаимно преобразующихся соединений, являющихся результатом по меньшей мере одной формальной миграции атома водорода и по меньшей мере одного изменения валентности (например, одинарная связь на двойную связь, тройная связь на двойную связь, или тройная связь на одинарную связь, или наоборот). "Таутомеризация" включает прототропную таутомеризацию или таутомеризацию с протоновым сдвигом, которая считается разновидностью кислотно-основной химии. "Прототропная таутомеризация" или "таутомеризация с протоновым сдвигом" вовлекает миграцию протона, сопровождаемую изменениями порядка связей. Точное соотношение таутомеров зависит от нескольких факторов, включая температуру, растворитель и pH. Когда таутомеризация возможна (например, в растворе), может достигаться химическое равновесие таутомеров. Таутомеризация (т.е. реакция, обеспечивающая таутомерную пару) может катализироваться кислотной или основанием или может происходить без действия или присутствия внешнего агента. Иллюстративные таутомеризации включают, но не ограничиваются ими, кето-енольную; амид-имидную; лактам-лактимную; енамин-иминовую таутомеризацию и таутомеризацию енамин-(отличающийся) енамин. Конкретным примером кето-енольной таутомеризации является взаимное преобразование таутомеров пентан-2,4-диона и 4-гидроксипент-3-ен-2-она. Другим примером таутомеризации является фенол-кето таутомеризация. Конкретным примером фенол-кето таутомеризации является взаимное преобразование таутомеров пиридин-4-ола и пиридин-4(1H)-она.
[0222] Если нет иных указаний, структуры, изображенные в настоящем описании, включают соединения, которые отличатся только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие структуры по настоящему изобретению, за исключением замены водорода дейтерием или тритием или обогащения дейтерием или тритием, или замены углерода на 13C или 14C или обогащения 13C или 14C, входят в объем настоящего изобретения.
[0223] Изобретение также охватывает изотопно меченные соединения, которые идентичны соединениям, описанным в настоящем описании, за исключением того, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличающиеся от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть включены в описанные соединения, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, например, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl, соответственно. Определенные изотопно меченные описанные соединения (например, соединения, меченные 3H и/или 14C) пригодны в анализах распределения соединения и/или субстрата в тканях. Изотопы трития (т.е. 3H) и углерода-14 (т.е. 14C) могут обеспечить простоту получения и возможность выявления. Кроме того, замена на более тяжелые изотопы, такие как дейтерий (т.е. 2H) может обеспечить определенные терапевтические преимущества вследствие большей метаболической стабильности (например, увеличенное время полужизни in vivo или снижение требуемых дозировок). Изотопно меченные описанные соединения, как правило, можно получать путем замены изотопно меченным реагентом не меченного изотопно реагента. В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются соединения, которые также могут содержать неприродные соотношения атомных изотопов в одном или нескольких атомах, которые составляют такие соединения. Все изотопные варианты соединений, описанные в настоящем описании, являющиеся или не являющиеся радиоактивными, входят в объем настоящего изобретения.
[0224] Когда в настоящем описании используются диапазоны для физических свойств, таких как молекулярная масса, или химических свойств, таких как химическая формула, предполагается включение в них всех комбинаций и подкомбинаций диапазонов и конкретных вариантов осуществления. Термин "приблизительно", при указании на число или числовой диапазон, означает, что упоминаемое число или числовой диапазон представляет собой аппроксимацию в пределах вариабельности эксперимента (или в пределах статистической погрешности эксперимента), и, таким образом, число или числовой диапазон могут варьировать, например, от 1% до 15% указанного числа или числового диапазона. Когда приведен диапазон величин, подразумевается, что он охватывает каждую величину и поддиапазон в диапазоне. Например, подразумевают, что "C1-6алкил" охватывает C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5 и C5-6алкил.
[0225] Определения конкретных функциональных групп и химических терминов более подробно описано ниже. Химические элементы указаны в соответствии с периодической таблицей элементов, версия CAS, Handbook of Chemistry и Physics, 75th ed., с внутренней стороны обложки, и конкретные функциональные группы, как правило, определяют, как описано в настоящем описании. Кроме того, общие принципы органической химии, а также конкретные функциональные части и реактивность, описаны в Organic Chemistry, Thomas Sorrell, University Science Books, Sausalito, 1999; Smith and March March’s Advanced Organic Chemistry, 5th ed., John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; и Carruthers, Some Modern Methods of Organic Synthesis, 3rd ed., Cambridge University Press, Cambridge, 1987.
[0226] Сокращения, используемые в настоящем описании, имеют их общепринятое значение в химической и биологической области. Следующие сокращения и термины имеют указанные значения в описании: PI3K = Фосфоинозитид-3-киназа; PI = фосфатидилинозитол; PDK = фосфоинозитид-зависимая киназа; DNA-PK = зависимая от дезоксирибонуклениновой кислоты протеинкиназа; PTEN = гомолог фосфатазы и тензина, делетированный на хромосоме с Ten; PIKK = киназа, подобная фосфоинозитид-киназе; СПИД = синдром приобретенного иммунодефицита; ВИЧ = Вирус иммунодефицита человека; MeI = Метилйодид; POCl3 = оксихлорид фосфора; KCNS = Изотиоцианат калия; TLC = Тонкослойная хроматография; MeOH = Метанол и CHCl3 = Хлороформ.
[0227] "Алкил" относится к прямому или разветвленному радикалу с углеводородной цепью, состоящий только из атомов углерода и водорода, не содержащий ненасыщенности, имеющий от одного до десяти атомов углерода (например, C1-C10алкил). Когда бы ни появлялся в настоящем описании, числовой диапазон, такой как "от 1 до 10", относится к каждому целому числу в данном диапазоне; например, "от 1 до 10 атомов углерода" означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и т.д., вплоть до и включая 10 атомов углерода, хотя настоящее определение также охватывает термин "алкил", где числовой диапазон не указан. В некоторых вариантах осуществления он представляет собой C1-C4алкильную группу. Типичные алкильные группы включают, но никоим образом не ограничиваются ими, метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутилизобутил, третичный бутил, пентил, изопентил, неопентил, гексил, септил, октил, нонил, децил и т.п. Алкил связан с остальной частью молекулы одиночной связью, например, метил (Me), этил (Et), н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил, 1,1-диметилэтил (трет-бутил), 3-метилгексил, 2-метилгексил и т.п. Если в описании нет иных конкретных указаний, алкильная группа необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t представляет собой 1 или 2), -S(O)tORa (где t представляет собой 1 или 2), -S(O)tN(Ra)2 (где t представляет собой 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0228] "Алкиларил" относится к -(алкил)арильному радикалу, где арил и алкил являются такими, как описано в настоящем описании, и необязательно замещены одним или нескольким заместителями, описанными в качестве подходящих заместителей для арила и алкила, соответственно.
[0229] "Алкилгетероарил" относится к -(алкил)гетероарильному радикалу, где гетероарил и алкил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для гетероарила и алкила, соответственно.
[0230] "Алкилгетероциклоалкил" относится к-(алкил)гетероциклильному радикалу, где алкил и гетероциклоалкил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для гетероциклоалкила и алкила, соответственно.
[0231] "Алкеновая" часть относится к группе, состоящей по меньшей мере из двух атомов углерода и по меньшей мере одной углерод-углеродной двойной связи, и "алкиновая" часть относится к группе, состоящей по меньшей мере из двух атомов углерода и по меньшей мере одной углерод-углеродной тройной связи. Алкильная часть, являющаяся или не являющаяся ненасыщенной, может быть разветвленной, неразветвленной или циклической.
[0232] "Алкенил" относится к прямой или разветвленной радикальной группе с углеводородной цепью, состоящей только из атомов углерода и водорода, содержащей по меньшей мере одну двойную связь и имеющей от двух до десяти атомов углерода (т.е. C2-C10 алкенил). Когда бы ни встречался в настоящем описании, числовой диапазон, такой как "от 2 до 10", относится к каждому целому числу в данном диапазоне; например, "от 2 до 10 атомов углерода" означает, что алкенильная группа может состоять из 2 атомов углерода, 3 атомов углерода и т.д., вплоть до и включая 10 атомов углерода. В определенных вариантах осуществления алкенил содержит от двух до восьми атомов углерода. В других вариантах осуществления алкенил содержит от двух до пяти атомов углерода (например, C2-C5 алкенил). Алкенил связан с остальной частью молекулы через одинарную связь, например, этенил (т.е. винил), проп-1-енил (т.е. аллил), бут-1-енил, пент-1-енил, пента-1,4-диенил и т.п. Если в настоящем описании нет иных конкретных указаний, алкениловая группа необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2) или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0233] "Алкенил-циклоалкил" относится к -(алкенил)циклоалкиловому радикалу, где алкенил и циклоалкил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими подходящими заместителями для алкенила и циклоалкила, соответственно.
[0234] "Алкинил" относится к прямой или разветвленной радикальной группе с углеводородной цепью, состоящей только из атомов углерода и водорода, содержащей по меньшей мере одну тройную связь, имеющей от двух до десяти атомов углерода (т.е. C2-C10 алкинил). Когда бы ни встречался в настоящем описании, числовой диапазон, такой как "от 2 до 10", относится к каждому целому числу в данном диапазоне; например, "от 2 до 10 атомов углерода" означает, что алкинильная группа может состоять из 2 атомов углерода, 3 атомов углерода и т.д., вплоть до и включая 10 атомов углерода. В определенных вариантах осуществления алкинил содержит от двух до восьми атомов углерода. В других вариантах осуществления алкинил имеет от двух до пяти атомов углерода (например, C2-C5 алкинил). Алкинил связан с остальной частью молекулы одинарной связью, например, этинил, пропинил, бутинил, пентинил, гексинил и т.п. Если в описании нет иных конкретных указаний, алкинильная группа необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0235] "Алкинилциклоалкил" относится к -(алкинил)циклоалкильному радикалу, где алкинил и циклоалкил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для алкинила и циклоалкила, соответственно.
[0236] "Карбоксальдегид" относится к радикалу -(C=O)H.
[0237] "Карбоксил" относится к радикалу -(C=O)OH.
[0238] "Циано" относится к радикалу -CN.
[0239] "Циклоалкил" относится к моноциклическому или полициклическому радикалу, который содержит только углерод и водород, и он может быть насыщенным или частично ненасыщенным. Циклоалкильные группы включают группы, имеющие от 3 до 10 атомов кольца (т.е. C2-C10 циклоалкил). Когда бы ни встречался в настоящем описании, числовой диапазон, такой как "от 3 до 10", относится к каждому целому числу в данном диапазоне; например, "от 3 до 10 атомов углерода" означает, что циклоалкильная группа может состоять из 3 атомов углерода и т.д., вплоть до и включая 10 атомов углерода. В некоторых вариантах осуществления она представляет собой C3-C8 циклоалкильный радикал. В некоторых вариантах осуществления она представляет собой C3-C5 циклоалкильный радикал. Иллюстративные примеры циклоалкильных групп включают, но не ограничиваются ими, следующие части: циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклосептил, циклооктил, циклононил, циклодецил, норборнил и т.п. Если в описании нет иных конкретных указаний, циклоалкильная группа необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0240] "Циклоалкилалкенил" относится к -(циклоалкил)алкенильному радикалу, где циклоалкил и гетероциклоалкил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для гетероциклоалкила и циклоалкила, соответственно.
[0241] "Циклоалкилгетероциклоалкил" относится к -(циклоалкил)гетероциклильному радикалу, где циклоалкил и гетероциклоалкил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для гетероциклоалкила и циклоалкила, соответственно.
[0242] "Циклоалкилгетероарил" относится к -(циклоалкил)гетероарильному радикалу, где циклоалкил и гетероциклоалкил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для гетероциклоалкила и циклоалкила, соответственно.
[0243] Термин "алкокси" относится к группе -O-алкил, включающей от 1 до 8 атомов углерода с прямой, разветвленной, циклической конфигурацией и их комбинациями, связанной с основной структурой через кислород. Примеры включают метокси, этокси, пропокси, изопропокси, циклопропилокси, циклогексилокси и т.п. "Низший алкокси" относится к алкоксигруппам, содержащим от одного до шести атомов углерода. В некоторых вариантах осуществления C1-C4 алкил представляет собой алкильную группу, которая охватывает как прямые, так и разветвленные алкилы из от 1 до 4 атомов углерода.
[0244] Термин "замещенный алкокси" относится к алкокси, где алкильный компонент является замещенным (т.е. -O-(замещенный алкил)). Если в описании нет иных конкретных указаний, алкильная часть алкоксигруппы необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0245] Термин "алкоксикарбонил" относится к группе формулы (алкокси)(C=O)-, связанной через углерод карбонила, где алкоксигруппа имеет указанное число атомов углерода. Таким образом, C1-C6 алкоксикарбонильная группа представляет собой алкоксигруппу, имеющую от 1 до 6 атомов углерода, связанных через ее кислород с карбонильным линкером. "Низший алкоксикарбонил" относится к алкоксикарбонильной группе, где алкоксигруппа представляет собой низшую алкоксигруппу. В некоторых вариантах осуществления C1-C4 алкокси представляет собой алкоксигруппу, которая охватывает как прямые, так и разветвленные алкоксигруппы из от 1 до 4 атомов углерода.
[0246] Термин "замещенный алкоксикарбонил" относится к группе (замещенный алкил)-O-C(O)-, где группа связана с основной структурой через карбонильную функциональную группу. Если в описании нет иных конкретных указаний, алкильная часть алкоксикарбонильной группы необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, кирбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0247] "Ацил" относится к группам (алкил)-C(O)-, (арил)-C(O)-, (гетероарил)-C(O)-, (гетероалкил)-C(O)- и (гетероциклоалкил)-C(O)-, где группа связана с основной структурой через карбонильную функциональную группу. В некоторых вариантах осуществления он представляет собой C1-C10 ацильный радикал, относящийся к общему числу атомов цепи и кольца части алкила, арила, гетероарила или гетероциклоалкила в ацилоксигруппе вместе с углеродом карбонила в ациле, т.е. с тремя другими атомами кольца или цепи вместе с карбонилом. Если радикал R представляет собой гетероарил или гетероциклоалкил, то гетероатомы кольца или цепи вносят вклад в общее количество атомов цепи или кольца. Если в описании нет иных конкретных указаний, "R" ацилоксигруппы необязательно замещен одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0248] "Ацилокси" относится к радикалу R(C=O)O-, где "R" представляет собой алкил, арил, гетероарил, гетероалкил или гетероциклоалкил, которые являются такими, как описано в настоящем описании. В некоторых вариантах осуществления он представляет собой радикал C1-C4 ацилокси, относящийся к общему количеству атомов цепи или кольца части алкила, арила, гетероарила или гетероциклоалкила в ацилоксигруппе вместе с атомом углерода карбонила в ациле, т.е. к трем другим атомам кольца или цепи вместе с карбонилом. Если R радикал представляет собой гетероарил или гетероциклоалкил, гетероатомы кольца или цепи вносят вклад в общее количество атомов цепи или кольца. Если в описании нет иных конкретных указаний, "R" в ацилоксигруппе необязательно замещен одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2-S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0249] "Амино" или "амин" относится к группе радикала -N(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, если в описании нет иных конкретных указаний. Когда группа -N(Ra)2 имеет два Ra, отличных от водорода, они могут быть объединены c атомом азота с образованием 4-, 5-, 6- или 7-членного кольца. Например, подразумевают, что -N(Ra)2 включает, но не ограничивается ими, 1-пирролидинил и 4-морфолинил. Если в описании нет иных конкретных указаний, аминогруппа необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2) или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил и каждая из этих частей может быть необязательно замещена, как определено в настоящем описании.
[0250] Термин "замещенный амино" также относится к N-оксидам групп -NHRd и NRdRd, каждая из которых является такой, как описано выше. N-оксиды можно получать путем обработки соответствующей аминогруппы, например, пероксидом водорода или м-хлорпероксибензойной кислотой. Специалисту в данной области известны условия реакции для осуществления N-окисления.
[0251] "Амид" или "амидо" относится к химической части с формулой -C(O)N(R)2 или -NRC(O)R, где R выбран из группы, состоящей из водорода, алкила, циклоалкила, арила, гетероарила (связанного через углерод кольца) и гетероалициклической группы (связанной через атом углерода кольца), каждый из которых сам по себе может быть необязательно замещенным. В некоторых вариантах осуществления он представляет собой радикал C1-C4 амидо или амид, который включает карбонил амида в общем количестве атомов углерода радикала. R2 в -N(R)2 амида необязательно может быть взят вместе с азотом, с которым он связан, с образованием 4-, 5-, 6- или 7-членного кольца. Если в описании нет иных конкретных указаний, амидогруппа необязательно независимо замещена одним или несколькими заместителями, как описано в настоящем описании для алкила, циклоалкила, арила, гетероарила или гетероциклоалкила. Амид может представлять собой молекулу аминокислоты или пептида, связанную с соединением формулы (I), тем самым образуя пролекарство. Любая амино, гидрокси или карбоксильная боковая цепь на соединениях, описанных в настоящем описании, может быть амидирована. Методики и конкретные группы для получения таких амидов известны специалистам в данной области и могут быть без труда найдены в справочных материалах, таких как Greene and Wuts, Protective Groups in Organic Synthesis, 3.sup.rd Ed., John Wiley & Sons, New York, N.Y., 1999, который включен в настоящее описание в качестве ссылки в полном объеме.
[0252] "Ароматическая группа" или "арил" относится к ароматическому радикалу, имеющему от шести вплоть до четырнадцати атомов кольца (например, C6-C10 ароматическая группа или C6-C10 арил), который имеет по меньшей мере одно кольцо, имеющее сопряженную пи-электронную систему, которая является карбоциклической (например, фенил, флуоренил и нафтил). Двухвалентные радикалы, образованные из замещенных бензольных производных и имеющие свободные валентности в атомах кольца, называют замещенными фениленовыми радикалами. Двухвалентные радикалы, образованные из одновалентных полициклических углеводородных радикалов, названия которых оканчиваются на "-ил", путем удаления одного атома водорода с атома углерода со свободной валентностью, обозначают путем добавления "-иден" к называнию соответствующего одновалентного радикала, например, нафтильную группу с двумя точками присоединения называют нафтилиденом. Когда бы ни встречался в настоящем описании, числовой диапазон, такой как "от 6 до 10", относится к каждому целому числу в данном диапазоне; например, "от 6 до 10 атомов кольца" означает, что арильная группа может состоять из 6 атомов кольца, 7 атомов кольца и т.д., вплоть до и включая 10 атомов кольца. Термин включает моноциклические или конденсированные кольцевые полициклические (т.е. кольца, которые имеют общие соседние пары атомов кольца) группы. Если в описании нет иных конкретных указаний, арильная часть необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0253] "Аралкил" или "арилалкил" относится к радикалу (арил)алкил-, где арил и алкил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для арила и алкила, соответственно.
[0254] "Сложный эфир" относится к химическому радикалу формулы -COOR, где R выбран из группы, состоящей из алкила, циклоалкила, арила, гетероарила (связанного через атом углерода кольца) и гетероалициклической группы (связанной через атом углерода кольца). Любая амино, гидрокси или карбоксильная боковая цепь на соединениях, описанных в настоящем описании, может быть этерифицирована. Методики и конкретные группы для получения таких сложных эфиров известны специалистам в данной области и могут быть без труда найдены в справочных материалах, таких как Greene and Wuts, Protective Groups in Organic Synthesis, 3.sup.rd Ed., John Wiley & Sons, New York, N.Y., 1999, который включен в настоящее описание в качестве ссылки в полном объеме. Если в описании нет иных конкретных указаний, сложноэфирная группа необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, трифторметил, трифторметокси, нитро, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -OC(O)N(Ra)2, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, - N(Ra)C(O)N(Ra)2, N(Ra)C(NRa)N(Ra)2, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0255] "Фторалкил" относится к алкильному радикалу, как определено выше, который замещен одним или несколькими радикалами фтора, как определено выше, например, трифторметил, дифторметил, 2,2,2-трифторэтил, 1-фторметил-2-фторэтил и т.п. Алкильная часть фторалкильного радикала может быть необязательно замещенной, как определено выше для алкильной группы.
[0256] "Гало", "галогенид", или альтернативно "галоген" означает фтор, хлор, бром или йод. Термины "галогеналкил", "галогеналкенил", "галогеналкинил" и "галогеналкокси" включают алкильные, алкенильные, алкинильные и алкоксиструктуры, которые замещены одной или несколькими группами галогена или их комбинациями. Например, термины "фторалкил" и "фторалкокси" включает группы галогеналкила и галогеналкокси, соответственно, в которых галоген представляет собой фтор.
[0257] "Гетероалкил" "гетероалкенил" и "гетероалкинил" включают необязательно замещенные алкильные, алкенильные и алкинильные радикалы, и имеют один или нескольких атомов основной цепи, выбранных из атомов, отличных от углерода, например, кислорода, азота, серы, фосфора или их комбинаций. Может быть приведен числовой диапазон, например, C1-C4 гетероалкил, который относится к длине цепи в целом, которая в этом примере составляет 4 атома. Например, радикал -CH2OCH2CH3 обозначают "C4"-гетероалкил, и он включает гетероатомный центр в описании длины цепи атомов. Связь с остальной частью молекулы может осуществляться в гетероалкильной цепи либо через гетероатом, либо через углерод. Гетероалкильная группа может быть замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, нитро, оксо, тиоксо, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0258] "Гетероалкиларил" относится к -(гетероалкил)арильному радикалу, где гетероалкил и арил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для гетероалкила и арила, соответственно.
[0259] "Гетероалкилгетероарил" относится к -(гетероалкил)гетероарильному радикалу, где гетероалкил и гетероарил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для гетероалкила и гетероарила, соответственно.
[0260] "Гетероалкилгетероциклоалкил" относится к -(гетероалкил)гетероциклоалкильному радикалу, где гетероалкил и гетероарил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для гетероалкила и гетероциклоалкила, соответственно.
[0261] "Гетероалкилциклоалкил" относится к -(гетероалкил)циклоалкильному радикалу, где гетероалкил и циклоалкил являются такими, как описано в настоящем описании, и необязательно замещены одним или несколькими заместителями, описанными в качестве подходящих заместителей для гетероалкила и циклоалкила, соответственно.
[0262] "Гетероарил" или альтернативно "гетероароматическая группа" относится к 5-18-членному ароматическому радикалу (например, C5-C13 гетероарил), который включает один или несколько гетероатомов кольца, выбранных из азота, кислорода и серы, и который может представлять собой моноциклическую, бициклическую, трициклическую или тетрациклическую кольцевую систему. Когда бы ни встречался в настоящем описании, числовой диапазон, такой как "от 5 до 18", относится к каждому целому числу в данном диапазоне; например, "от 5 до 18 атомов кольца" означает, что гетероарильная группа может состоять из 5 атомов кольца, 6 атомов кольца и т.д. и вплоть до и включая 18 атомов кольца. Двухвалентные радикалы, образованные из одновалентных гетероарильных радикалов, называния которых оканчиваются на "-ил" вследствие удаления одного атома водорода с атома со свободной валентностью обозначают добавлением "-иден" к называнию соответствующего одновалентного радикала, например, пиридильная группа с двумя точками присоединения представляет собой пиридилиден. N-содержащая "гетероароматическая" или "гетероарильная" часть относится к ароматической группе, в которой по меньшей мере один из атомов основной цепи кольца представляет собой атом азота. Полициклическая гетероарильная группа может быть конденсированной или неконденсированной. Гетероатом(ы) в гетероарильном радикале необязательно является окисленным. Один или несколько атомов азота, если присутствуют, необязательно являются кватернизованными. Гетероарил связан с остальной частью молекулы через любой атом кольца(колец). Примеры гетероарилов включают, но не ограничиваются ими, азепинил, акридинил, бензимидазолил, бинзиндолил, 1,3-бензодиоксолил, бензофуранил, бензооксазолил, бензо[d]тиазолил, бензотиадиазолил, бензо[b][1,4]диоксепинил, бензо[b][1,4]оксазинил, 1,4-бензодиоксанил, бензонафтофуранил, бензоксазолил, бензодиоксолил, бензодиоксинил, бензоксазолил, бензопиранил, бензопиранонил, бензофуранил, бензофураноинл, бензофуразинил, бензотиазолил, бензотиенил (бензотиофенил), бензотиено[3,2-d]пиримидинил, бензотриазолил, бензо[4,6]имидазо[1,2-a]пиридинил, карбазолил, циннолинил, циклопента[d]пиримидинил, 6,7-дигидро-5H-циклопента[4,5]тиено[2,3-d]пиримидинил, 5,6-дигидробензо[h]хиназолинил, 5,6-дигидробензо[h]циннолинил, 6,7-дигидро-5H-бензо[6,7]циклогепта[1,2-c]пиридазинил, дибензофуранил, дибензотиофенил, фуранил, фуразинил, фуранонил, фуро[3,2-c]пиридинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиримидинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиридазинил, 5,6,7,8,9,10-гексагидроциклоокта[d]пиридинил, изотиазолил, имидазолил, индазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, изохинолил, индолизинил, изоксазолил, 5,8-метанo-5,6,7,8-тетрагидрохиназолинил, нафтиридинил, 1,6-нафтиридинонил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, 5,6,6a,7,8,9,10,10a-октагидробензо[h]хиназолинил, 1-фенил-1H-пирролил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пиранил, пирролил, пиразолил, пиразолo[3,4-d]пиримидинил, пиридинил, пиридо[3,2-d]пиримидинил, пиридо[3,4-d]пиримидинил, пиразинил, пиримидинил, пиридазинил, пирролил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетрагидрохинолинил, 5,6,7,8-тетрагидрохиназолинил, 5,6,7,8-тетрагидробензо[4,5]тиено[2,3-d]пиримидинил, 6,7,8,9-тетрагидро-5H-циклогепта[4,5]тиено[2,3-d]пиримидинил, 5,6,7,8-тетрагидропиридо[4,5-c]пиридазинил, тиазолил, тиадиазолил, тиапиранил, триазолил, тетразолил, триазинил, тиено[2,3-d]пиримидинил, тиено[3,2-d]пиримидинил, тиено[2,3-c]пиридинил и тиофенил (т.е. тиенил). Если в описании нет иных конкретных указаний, гетероарильная часть необязательно замещена одним или несколькими заместителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, нитро, оксо, тиоксо, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил.
[0263] Замещенный гетероарил также включает кольцевые системы, замещенные одним или несколькими оксидными (-O-) заместителями, такими как пиридинил-N-оксиды.
[0264] "Гетероарилалкил" относится к части, имеющей арильную часть, как описано в настоящем описании, связанную с алкиленовой частью, как описано в настоящем описании, где связь с остальной частью молекулы осуществляется через алкиленовую группу.
[0265] "Гетероциклоалкил" относится к стабильному 3-18-членному неароматическому кольцевому радикалу, который содержит от двух до двенадцати атомов углерода и от одного до шести гетероатомов, выбранных из азота, кислорода и серы. Когда бы ни встречался в настоящем описании, числовой диапазон, такой как "от 3 до 18" относится к каждому целому числу в данном диапазоне; например, "от 3 до 18 атомов кольца" означает, что гетероциклоалкильная группа может состоять из 3 атомов кольца, 4 атомов кольца и т.д., вплоть до и включая 18 атомов кольца. В некоторых вариантах осуществления она представляет собой C5-C10 гетероциклоалкил. В некоторых вариантах осуществления она представляет собой C4-C10 гетероциклоалкил. В некоторых вариантах осуществления она представляет собой C3-C10 гетероциклоалкил. Если в описании нет иных конкретных указаний, гетероциклоалкильный радикал представляет собой моноциклическую, бициклическую, трициклическую или тетрациклическую кольцевую систему, которая может включать конденсированные или мостиковые кольцевые системы. Гетероатомы в гетероциклоалкильном радикале необязательно могут быть окисленными. Один или несколько атомов азота, если присутствуют, необязательно являются кватернизованными. Гетероциклоалкильный радикал является частично или полностью насыщенным. Гетероциклоалкил может быть связан с остальной частью молекулы через любой атом кольца(колец). Примеры таких гетероциклоалкильных радикалов включают, но не ограничиваются ими, диоксоланил, тиенил[1,3]дитианил, декагидроизохинолил, имидазолинил, имидазолидинил, изотиазолидинил, изоксазолидинил, морфолинил, октагидроиндолил, октагидроизоиндолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, оксазолидинил, пиперидинил, пиперазинил, 4-пиперидонил, пирролидинил, пиразолидинил, квинуклидинил, тиазолидинил, тетрагидрофурил, тритианил, тетрагидропиранил, тиоморфолинил, тиаморфолинил, 1-оксотиоморфолинил и 1,1-диоксотиоморфолинил. Если в описании нет иных конкретных указаний, гетероциклоалкильная часть необязательно замещена одним или несколькими заместсителями, которые независимо представляют собой: алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, галоген, циано, нитро, оксо, тиоксо, триметилсиланил, -ORa, -SRa, -OC(O)-Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORa, -N(Ra)C(O)Ra, -N(Ra)S(O)tRa (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tN(Ra)2 (где t равно 1 или 2), или PO3(Ra)2, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероарил или гетероарилалкил.
[0266] "Гетероциклоалкил" также включает бициклические кольцевые системы, где одно неароматическое кольцо, обычно с 3-7 атомами кольца, содержит по меньшей мере 2 атома углерода в дополнение к 1-3 гетероатомам, независимо выбранным из кислорода, серы и азота, а также комбинации, содержащие по меньшей мере один из указанных выше гетероатомов; и другое кольцо, обычно с 3-7 атомами кольца, необязательно содержит 1-3 гетероатома, независимо выбранных из кислорода, серы и азота, и не является ароматическим.
[0267] "Часть" относится к конкретному сегменту или функциональной группе молекулы. Химические части часто представляют собой общепризнанные химические структуры, заключенные в молекуле или присоединенные к молекуле.
[0268] "Нитро" относится к радикалу -NO2.
[0269] "Окса" относится к радикалу -O-.
[0270] "Оксо" относится к радикалу =O.
[0271] "Уходящая группа или атом" представляет собой любую группу или атом, которые в условиях реакции уходят из исходного материала, таким образом, ускоряя реакцию в конкретном участке. Подходящими примерами таких групп, если нет иных указаний, являются атомы галогена, группы мезилокси, п-нитробензилсульфонилокси и тозилокси.
[0272] "Защитная группа" имеет значение, обычно ассоциированное с ней в органическом синтезе, т.е. значение группы, которая селективно блокирует один или несколько реакционноспособных центров в полифункциональном соединении, так чтобы химическая реакция могла селективно протекать по другому незащищенному реакционноспособному центру, и так чтобы группу можно было без труда удалить после завершения селективной реакции. Различные защитные группы описаны, например, в T.H. Greene and P. G. M. Wuts, Protective Groups in Organic Synthesis, Third Edition, John Wiley & Sons, New York (1999). Например, гидроксизащищенная форма представляет собой форму, где по меньшей мере одна из гидроксигрупп, присутствующих в соединении, защищена гидрокси-защитной группой. Аналогично, могут быть сходным образом защищены амины и другие реакционноспособные группы.
[0273] "Сольват" относится к соединению (например, соединение, выбранное из соединения формулы I или его фармацевтически приемлемой соли), физически связанному с одной или несколькими молекулами фармацевтически приемлемого растворителя. Будет понятно, что "соединение формулы I" охватывает соединение формулы I и сольваты соединения, а также их смеси.
[0274] "Замещенный" означает, что указанная группа может быть замещена одной или несколькими дополнительной группой(ами), индивидуально и независимо выбранными из групп ацила, алкила, алкиларила, циклоалкила, аралкила, арила, углевода, карбоната, гетероарила, гетероциклоалкила, гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, галогена, карбонила, сложного эфира, тиокарбонила, изоцианата, тиоцианата, изотиоцианата, нитро, оксо, пергалогеналкила, перфторалкила, фосфата, силила, сульфинила, сульфонила, сульфонамидила, сульфоксила, сульфоната, мочевины и амино, включая моно- и дизамещенные аминогруппы и их защищенные производные. Дизамещенные аминогруппы охватывают группы, которые формируют кольцо вместе с азотом аминогруппы, например, такие как морфолино. Заместители сами по себе могут быть замещенными, например, циклоалкильный заместитель может иметь галогенид, замещенный по одному или нескольким атомам углерода кольца, и т.п. Защитные группы, которые могут образовывать защищенные производные указанных выше заместителей, известны специалистам в данной области и могут быть найдены в справочных материалах, таких как Greene and Wuts, выше.
[0275] "Сульфанил" относится к группам: -S-(необязательно замещенный алкил), -S-(необязательно замещенный арил), -S-(необязательно замещенный гетероарил) и -S-(необязательно замещенный гетероциклоалкил).
[0276] "Сульфинил" относится к группам: -S(O)-H, -S(O)-(необязательно замещенный алкил), -S(O)-(необязательно замещенный амино), -S(O)-(необязательно замещенный арил), -S(O)-(необязательно замещенный гетероарил) и -S(O)-(необязательно замещенный гетероциклоалкил).
[0277] "Сульфонил" относится к группам: -S(O2)-H, -S(O2)-(необязательно замещенный алкил), -S(O2)-(необязательно замещенный амино), -S(O2)-(необязательно замещенный арил), -S(O2)-(необязательно замещенный гетероарил) и -S(O2)-(необязательно замещенный гетероциклоалкил).
[0278] "Сулофонамидил" или "сульфонамидо" относится к радикалу -S(=O)2-NRR, где каждый R независимо выбран из группы, состоящей из водорода, алкила, циклоалкила, арила, гетероарила (связанного через атом углерода кольца) и гетероалициклической группы (связанной через атом углерода кольца). Группы R в -NRR радикала -S(=O)2-NRR могут быть взяты вместе с азотом, к которому они присоединены, с образованием 4-, 5-, 6- или 7-членного кольца. В некоторых вариантах осуществления он представляет собой C1-C10 сульфонамидо, где каждый R в сульфонамидо содержит всего 1 атом углерода, 2 атома углерода, 3 атома углерода или 4 атома углерода. Группа сульфонамидо необязательно замещена одним или несколькими заместителями, описанными для алкила, циклоалкила, арила, гетероарила, соответственно.
[0279] "Сульфоксил" относится к радикалу -S(=O)2OH.
[0280] "Сульфонат" относится к радикалу -S(=O)2-OR, где R выбран из группы, состоящей из алкила, циклоалкила, арила, гетероарила (связанного через атом углерода кольца) и гетероалициклической группы (связанной через атом углерода кольца). Сульфонатная группа необязательно замещена на R одним или несколькими заместителями, описанными для алкила, циклоалкила, арила, гетероарила, соответственно.
[0281] Когда группы заместителя представлены посредством их общепринятых химических формул, указанных справа налево, они в равной степени охватывают химически идентичные заместители, которые получились бы в результате указания структуры справа налево, например, -CH2O- эквивалентен -OCH2-.
[0282] Соединения, которые можно использовать, как описано в настоящем описании, также включают кристаллические и аморфные формы соединений, включая, например, полиморфы, псевдополиморфы, сольваты, гидраты, несольватированные полиморфы (включая ангидриды), конформационные полиморфы и аморфные формы соединений, а также их смеси.
[0283] Как используют в рамках изобретения и если нет иных указаний, "полиморф" можно использовать в настоящем описании для описания кристаллического материала, например, кристаллической формы. В определенных вариантах осуществления "полиморф", как используют в рамках изобретения, также включает все кристаллические и аморфные формы соединения или его соли, включая, например, кристаллические формы, полиморфы, псевдополиморфы, сольваты, гидраты, сокристаллы, несольватированные полиморфы (включая ангидриды), конформационные полиморфы, таутомерные формы, неупорядоченные кристаллические формы и аморфные формы, а также их смеси, если не упоминается конкретная кристаллическая или аморфная форма. Соединения по настоящему изобретению включают кристаллические и аморфные формы этих соединений, включая, например, кристаллические формы, полиморфы, псесдополиморфы, сольваты, гидраты, сокристаллы, несольватированные полиморфы (включая ангидриды), конформационные полиморфы, таутомерные формы, неупорядоченные кристаллические формы и аморфные формы соединений или их солей, а также их смеси.
[0284] Химические структуры включают, но не ограничиваются ими, соединения формулы I, I-1, IV, IV-A, V, V-A, V-A2, V-B, VI или VI-A, и все их фармацевтически приемлемые формы. Фармацевтически приемлемые формы соединений, указанные в настоящем описании, включают их фармацевтически приемлемые соли, хелаты, нековалентные комплексы, пролекарства и смеси. В определенных вариантах осуществления соединения, описанные в настоящем описании, находятся в форме фармацевтически приемлемых солей. Таким образом, термины "химическая структура" и "химические структуры" также охватывают фармацевтически приемлемые соли, хелаты, нековалентные комплексы, пролекарства и смеси.
[0285] Кроме того, если соединение формулы I получено в качестве кислотно-аддитивной соли, свободное основание можно получать путем подщелачивания раствора кислотной соли. Напротив, если продукт представляет собой свободное основание, аддитивную соль, в частности, фармацевтически приемлемую аддитивную соль, можно получать путем растворения свободного основания в подходящем органическом растворителе, а затем обработки раствора кислотой, в соответствии с общепринятыми методиками получения кислотно-аддитивных солей из основных соединений. Специалистам в данной области будут понятны различные методологии синтеза, которые можно использовать для получения нетоксичных фармацевтически приемлемых аддитивных солей.
Соединения
[0286] Соединения, описанные ниже, являются иллюстративными модуляторами PI3K, которые можно использовать в фармацевтических композициях, способах и наборах, описанных в настоящем описании.
[0287] В некоторых аспектах, модулятор PI3K представляет собой соединение формулы I:
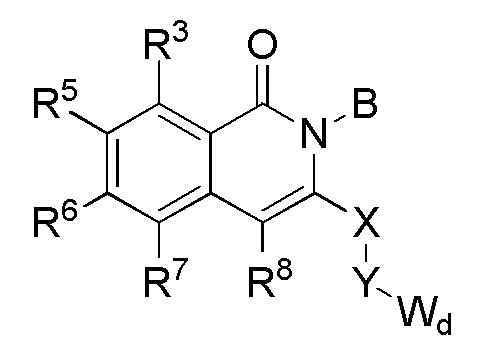
Формула I
или его фармацевтически приемлемую соль, где
Wd представляет собой гетероциклоалкил, арил или гетероарил;
B представляет собой алкил, амино, гетероалкил или часть формулы II;

Формула II
где Wc представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, и
q представляет собой целое число, равное 0, 1, 2, 3 или 4;
X отсутствует или представляет собой -(CH(R9))z- и z представляет собой целое число, равное 1, 2, 3 или 4;
Y отсутствует или представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -N(R9)-, -C(=O)-(CHR9)z-, -C(=O)-, -N(R9)-C(=O)-, или -N(R9)-C(=O)NH-, -N(R9)C(R9)2- или -C(=O)-(CHR9)z-;
R1 представляет собой водород, алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, алкокси, амидо, амино, ацил, ацилокси, алкоксикарбонил, сульфонамидо, галоген, циано, гидрокси, нитро, фосфат, мочевину или карбонат;
R2 представляет собой алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, алкокси, амидо, амино, ацил, ацилокси, алкоксикарбонил, сульфонамидо, галоген, циано, гидрокси, нитро, фосфат, мочевину или карбонат;
R3 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, алкокси, амидо, амино, ацил, ацилокси, алкоксикарбонил, сульфонамидо, галоген, циано, гидрокси, нитро, арил или гетероарил;
R5, R6, R7 и R8 независимо представляют собой водород, C1-C4алкил, C2-C5алкенил, C2-C5алкинил, C3-C5циклоалкил, C1-C4гетероалкил, C1-C4алкокси, C1-C4амидо, амино, ацил, C1-C4ацилокси, C1-C4сульфонамидо, галоген, циано, гидрокси или нитро; и
R9 в каждом случае независимо представляет собой водород, C1-C10алкил, C3-C7циклоалкил, гетероциклоалкил или C2-C10гетероалкил.
[0288] В некоторых вариантах осуществления B представляет собой незамещенный или замещенный алкил, включая, но не ограничиваясь ими, -(CH2)2-NRaRa, где каждый Ra независимо представляет собой водород, алкил, фторалкил, карбоциклил, карбоциклилалкил, арил, аралкил, гетероциклоалкил, гетероциклоалкилалкил, гетероарил или гетероарилалкил, или NRaRa объединены вместе с образованием циклической части, которая включает, но не ограничивается ими пиперидинил, пиперазинил и морфолинил. В некоторых вариантах осуществления B представляет собой незамещенный или замещенный амино. В некоторых вариантах осуществления B представляет собой незамещенный или замещенный гетероалкил.
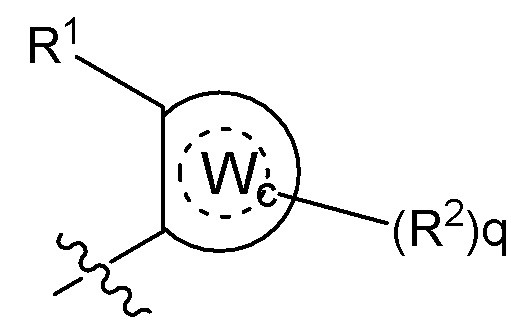
Формула II
[0289] В некоторых вариантах осуществления B представляет собой часть формулы II и где Wc является представителем, выбранным из группы, состоящей из незамещенного или замещенного арила, замещенного фенила, незамещенного или замещенного гетероарила, включая, но не ограничиваясь ими, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиримидин-4-ил, пиримидин-2-ил, пиримидин-5-ил, или пиразин-2-ил, незамещенный или замещенный моноциклический гетероарил, незамещенный или замещенный бициклический гетероарил, гетероарил, содержащий два гетероатома в качестве атомов кольца, незамещенный или замещенный гетероарил, содержащий атом азота в кольце, гетероарил, содержащий два атома азота в кольце, гетероарил, содержащий азот и серу в качестве атомов кольца, незамещенный или замещенный гетероциклоалкил, включая, но не ограничиваясь ими морфолинил, тетрагидропиранил, пиперазинил и пиперидинил, незамещенный или замещенный циклоалкил, включая, но не ограничиваясь ими циклопентил и циклогексил.
[0290] В некоторых вариантах осуществления B представляет собой одну из следующих частей:
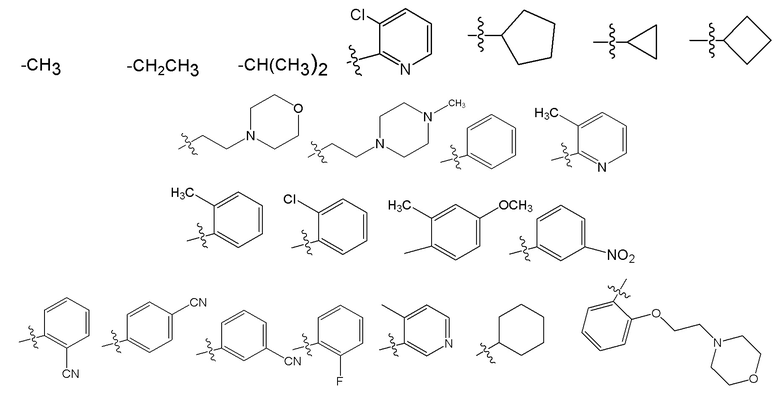
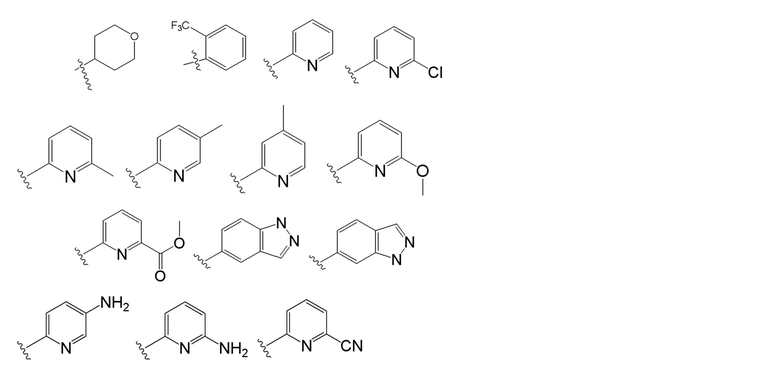
 .
.
[0291] В некоторых вариантах осуществления B замещен одним или несколькими из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сульфонамидо, галогена, циано, гидрокси или нитро, причем каждый из этих алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси или сульфонамидо сам может быть замещенным.
[0292] В некоторых вариантах осуществления R1 представляет собой представителя, выбранного из группы, состоящей из водорода, незамещенного или замещенного алкила, незамещенного или замещенного гетероалкила, незамещенного или замещенного алкенила, незамещенного или замещенного алкинила, незамещенного или замещенного циклоалкила, или незамещенного или замещенного гетероциклоалкила. В некоторых вариантах осуществления R1 представляет собой незамещенный или замещенный арил, незамещенный или замещенный арилалкил, незамещенный или замещенный гетероарил, или незамещенный или замещенный гетероарилалкил. В некоторых вариантах осуществления R1 представляет собой незамещенный или замещенный алкокси, незамещенный или замещенный амидо, незамещенный или замещенный амино. В некоторых вариантах осуществления R1 представляет собой незамещенный или замещенный ацил, незамещенный или замещенный ацилокси, незамещенный или замещенный алкоксикарбонил, или незамещенный или замещенный сульфонамидо. В некоторых вариантах осуществления R1 представляет собой галоген, который включает -Cl, -F, -I и -Br. В некоторых вариантах осуществления R1 выбран из группы, состоящей из циано, гидрокси, нитро, незамещенного или замещенного фосфата, незамещенной или замещенной мочевины, и карбоната.
[0293] В некоторых вариантах осуществления, когда R1 представляет собой алкил, R1 представляет собой метил, этил, пропил, изопропил, н-бутил, трет-бутил, втор-бутил, пентил, гексил или гептил.
[0294] В некоторых вариантах осуществления, когда R1 представляет собой алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, алкокси, амидо, амино, ацил, ацилокси, алкоксикарбонил, сульфонамидо или гидрокси, R1 замещен фосфатом, или незамещенной мочевиной, или замещенной мочевиной, или угольной кислотой, или карбонатом.
[0295] В некоторых вариантах осуществления, когда R1 представляет собой алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, алкокси, амидо, амино, ацил, ацилокси, алкоксикарбонил, или сульфонамидо, R1 замещен одним или несколькими из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сульфонамидо, галогена, циано, гидрокси или нитро, причем каждый из этих алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, арилалкила, гетероарила, гетероарилалкила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила или сульфонамидо сам может быть замещенным.
[0296] В некоторых вариантах осуществления R2 является представителем, выбранным из группы, состоящей из незамещенного или замещенного алкила, незамещенного или замещенного гетероалкила, незамещенного или замещенного алкенила, незамещенного или замещенного алкинила, незамещенного или замещенного циклоалкила, и незамещенного или замещенного гетероциклоалкила. В некоторых вариантах осуществления R2 представляет собой незамещенный или замещенный арил, незамещенный или замещенный арилалкил, незамещенный или замещенный гетероарил или незамещенный или замещенный гетероарилалкил. В некоторых вариантах осуществления R2 представляет собой незамещенный или замещенный алкокси, незамещенный или замещенный амидо, незамещенный или замещенный амино. В некоторых вариантах осуществления R2 представляет собой незамещенный или замещенный ацил, незамещенный или замещенный ацилокси, незамещенный или замещенный алкоксикарбонил, или незамещенный или замещенный сульфонамидо. В некоторых вариантах осуществления R2 представляет собой галоген, который представляет собой -I, -F, -Cl или -Br. В некоторых вариантах осуществления R2 выбран из группы, состоящей из циано, гидрокси, нитро, угольной кислоты и карбоната. В некоторых вариантах осуществления R2 представляет собой незамещенный или замещенный фосфат. В некоторых вариантах осуществления R2 представляет собой незамещенную или замещенную мочевину. В некоторых вариантах осуществления, когда R2 представляет собой алкил, R2 представляет собой метил, этил, пропил, изопропил, н-бутил, трет-бутил, втор-бутил, пентил, гексил или гептил.
[0297] В некоторых вариантах осуществления, когда R2 представляет собой алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, алкокси, амидо, амино, ацил, ацилокси, алкоксикарбонил, сульфонамидо или гидрокси, он замещен фосфатом, замещен мочевиной или замещен карбонатом.
[0298] В некоторых вариантах осуществления, когда R2 представляет собой алкил, гетероалкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, алкокси, амидо, амино, ацил, ацилокси, алкоксикарбонил или сульфонамидо, он замещен одним или несколькими из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сульфонамидо, галогена, циано, гидрокси или нитро, причем каждый из этих алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила или сульфонамидо сам может быть замещенным.
[0299] В некоторых вариантах осуществления q представляет собой целое число, равное 0. В некоторых вариантах осуществления q представляет собой целое число, равное 1. В некоторых вариантах осуществления q представляет собой целое число, равное 2. В некоторых вариантах осуществления q представляет собой целое число, равное 3. В некоторых вариантах осуществления q представляет собой целое число, равное 4.
[0300] В некоторых вариантах осуществления соединения формулы I, R3 является представителем, выбранным из группы, состоящей из водорода, незамещенного или замещенного алкила, незамещенного или замещенного алкенила, и незамещенного или замещенного алкинила. В некоторых вариантах осуществления R3 представляет собой незамещенный или замещенный арил, незамещенный или замещенный гетероарил, незамещенный или замещенный циклоалкил, или незамещенный или замещенный гетероциклоалкил. В некоторых вариантах осуществления R3 представляет собой незамещенный или замещенный алкокси, незамещенный или замещенный амидо, незамещенный или замещенный амино. В некоторых вариантах осуществления R3 представляет собой незамещенный или замещенный ацил, незамещенный или замещенный ацилокси, незамещенный или замещенный алкоксикарбонил, или незамещенный или замещенный сульфонамидо. В некоторых вариантах осуществления R3 представляет собой галоген, который представляет собой -I, -F, -Cl или -Br.
[0301] В некоторых вариантах осуществления R3 выбран из группы, состоящей из циано, гидрокси и нитро. В некоторых вариантах осуществления, когда R3 представляет собой алкил, R3 представляет собой метил, этил, пропил, изопропил, н-бутил, трет-бутил, втор-бутил, пентил, гексил или гептил. В некоторых вариантах осуществления R3 представляет собой -CF3.
[0302] В некоторых вариантах осуществления, когда R3 представляет собой алкил, алкенил, алкинил, арил, гетероарил, циклоалкил, гетероциклоалкил, алкокси, амидо, амино, ацил, ацилокси, алкоксикарбонил или сульфонамидо, он замещен одним или несколькими из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сульфонамидо, галогена, циано, гидрокси или нитро, причем каждый из этих алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила или сульфонамидо сам может быть замещенным.
[0303] В некоторых вариантах осуществления соединения формулы I, R5 представляет собой водород, незамещенный или замещенный алкил (включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4алкил). В некоторых вариантах осуществления R5 представляет собой незамещенный или замещенный алкенил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C5алкенил. В некоторых вариантах осуществления R5 представляет собой незамещенный или замещенный алкинил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C5алкинил. В некоторых вариантах осуществления R5 представляет собой незамещенный или замещенный циклоалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C3-C5циклоалкил. В некоторых вариантах осуществления R5 представляет собой незамещенный или замещенный гетероциклоалкил. В некоторых вариантах осуществления R5 представляет собой незамещенный или замещенный гетероалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4гетероалкил. В некоторых вариантах осуществления R5 представляет собой незамещенный или замещенный алкокси, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4алкокси. В некоторых вариантах осуществления R5 представляет собой незамещенный или замещенный амидо, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4амидо. В некоторых вариантах осуществления R5 представляет собой незамещенный или замещенный амино. В некоторых вариантах осуществления R5 представляет собой незамещенный или замещенный ацил, незамещенный или замещенный ацилокси, незамещенный или замещенный C1-C4ацилокси, незамещенный или замещенный алкоксикарбонил, незамещенный или замещенный сульфонамидо, или незамещенный или замещенный C1-C4сульфонамидо. В некоторых вариантах осуществления R5 представляет собой галоген, который представляет собой -I, -F, -Cl или -Br. В некоторых вариантах осуществления R5 выбран из группы, состоящей из циано, гидрокси и нитро. В некоторых других вариантах осуществления R5 представляет собой -CH3, -CH2CH3, н-пропил, изопропил, -OCH3, -OCH2CH3 или -CF3.
[0304] В некоторых вариантах осуществления, когда R5 представляет собой алкил, алкенил, алкинил, циклоалкил, гетероалкил, ацил, алкокси, амидо, амино, ацилокси, алкоксикарбонил или сульфонамидо, R5 необязательно замещен одним или нескольким из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сульфонамидо, галогена, циано, гидрокси или нитро, причем каждый из этих алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила или сульфонамидо сам может быть замещенным.
[0305] В некоторых вариантах осуществления соединения формулы I, R6 представляет собой водород, незамещенный или замещенный алкил (включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4алкил). В некоторых вариантах осуществления R6 представляет собой незамещенный или замещенный алкенил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C5алкенил. В некоторых вариантах осуществления R6 представляет собой незамещенный или замещенный алкинил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C5алкинил. В некоторых вариантах осуществления R6 представляет собой незамещенный или замещенный циклоалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C3-C5циклоалкил. В некоторых вариантах осуществления R6 представляет собой незамещенный или замещенный гетероциклоалкил. В некоторых вариантах осуществления R6 представляет собой незамещенный или замещенный гетероалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4гетероалкил. В некоторых вариантах осуществления R6 представляет собой незамещенный или замещенный алкокси, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4алкокси. В некоторых вариантах осуществления R6 представляет собой незамещенный или замещенный амидо, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4амидо. В некоторых вариантах осуществления R6 представляет собой незамещенный или замещенный амино. В некоторых вариантах осуществления R6 представляет собой незамещенный или замещенный ацил, незамещенный или замещенный ацилокси, незамещенный или замещенный C1-C4ацилокси, незамещенный или замещенный алкоксикарбонил, незамещенный или замещенный сульфонамидо, или незамещенный или замещенный C1-C4сульфонамидо. В некоторых вариантах осуществления R6 представляет собой галоген, который представляет собой -I, -F, -Cl или -Br. В некоторых вариантах осуществления R6 выбран из группы, состоящей из циано, гидрокси и нитро. В некоторых других вариантах осуществления R6 представляет собой -CH3, -CH2CH3, н-пропил, изопропил, -OCH3, -OCH2CH3 или -CF3.
[0306] В некоторых вариантах осуществления, когда R6 представляет собой алкил, алкенил, алкинил, циклоалкил, гетероалкил, ацил, алкокси, амидо, амино, ацилокси, алкоксикарбонил, или сульфонамидо, R6 необязательно замещен одним или несколькими из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сульфонамидо, галогена, циано, гидрокси или нитро, причем каждый из этих алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила или сульфонамидо сам может быть замещенным.
[0307] В некоторых вариантах осуществления соединения формулы I, R7 представляет собой водород, незамещенный или замещенный алкил (включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4алкил). В некоторых вариантах осуществления R7 представляет собой незамещенный или замещенный алкенил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C5алкенил. В некоторых вариантах осуществления R7 представляет собой незамещенный или замещенный алкинил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C5алкинил. В некоторых вариантах осуществления R7 представляет собой незамещенный или замещенный циклоалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C3-C5циклоалкил. В некоторых вариантах осуществления R7 представляет собой незамещенный или замещенный гетероциклоалкил. В некоторых вариантах осуществления R7 представляет собой незамещенный или замещенный гетероалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4гетероалкил. В некоторых вариантах осуществления R7 представляет собой незамещенный или замещенный алкокси, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4алкокси. В некоторых вариантах осуществления R7 представляет собой незамещенный или замещенный амидо, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4амидо. В некоторых вариантах осуществления R7 представляет собой незамещенный или замещенный амино. В некоторых вариантах осуществления R7 представляет собой незамещенный или замещенный ацил, незамещенный или замещенный ацилокси, незамещенный или замещенный C1-C4ацилокси, незамещенный или замещенный алкоксикарбонил, незамещенный или замещенный сульфонамидо, или незамещенный или замещенный C1-C4сульфонамидо. В некоторых вариантах осуществления R7 представляет собой галоген, который представляет собой -I, -F, -Cl или -Br. В некоторых вариантах осуществления R7 выбран из группы, состоящей из циано, гидрокси и нитро. В некоторых других вариантах осуществления R7 представляет собой -CH3, -CH2CH3, н-пропил, изопропил, -OCH3, -OCH2CH3 или -CF3.
[0308] В некоторых вариантах осуществления, когда R7 представляет собой алкил, алкенил, алкинил, циклоалкил, гетероалкил, ацил, алкокси, амидо, амино, ацилокси, алкоксикарбонил или сульфонамидо, R7 необязательно замещен одним или несколькими из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сульфонамидо, галогена, циано, гидрокси или нитро, причем каждый из этих алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила или сульфонамидо сам может быть замещенным.
[0309] В некоторых вариантах осуществления соединения формулы I, R8 представляет собой водород, незамещенный или замещенный алкил (включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4алкил). В некоторых вариантах осуществления R8 представляет собой незамещенный или замещенный алкенил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C5алкенил. В некоторых вариантах осуществления R8 представляет собой незамещенный или замещенный алкинил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C5алкинил. В некоторых вариантах осуществления R8 представляет собой незамещенный или замещенный циклоалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C3-C5циклоалкил. В некоторых вариантах осуществления R8 представляет собой незамещенный или замещенный гетероциклоалкил. В некоторых вариантах осуществления R8 представляет собой незамещенный или замещенный гетероалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4гетероалкил. В некоторых вариантах осуществления R8 представляет собой незамещенный или замещенный алкокси включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4алкокси. В некоторых вариантах осуществления R8 представляет собой незамещенный или замещенный амидо включая, но не ограничиваясь ими, незамещенный или замещенный C1-C4амидо. В некоторых вариантах осуществления R8 представляет собой незамещенный или замещенный амино. В некоторых вариантах осуществления R8 представляет собой незамещенный или замещенный ацил, незамещенный или замещенный ацилокси, незамещенный или замещенный C1-C4ацилокси, незамещенный или замещенный алкоксикарбонил, незамещенный или замещенный сульфонамидо, или незамещенный или замещенный C1-C4сульфонамидо. В некоторых вариантах осуществления R8 представляет собой галоген, который представляет собой -I, -F, -Cl или -Br. В некоторых вариантах осуществления R8 выбран из группы, состоящей из циано, гидрокси и нитро. В некоторых других вариантах осуществления R8 представляет собой -CH3, -CH2CH3, н-пропил, изопропил, -OCH3, -OCH2CH3 или -CF3.
[0310] В некоторых вариантах осуществления, когда R8 представляет собой алкил, алкенил, алкинил, циклоалкил, гетероалкил, ацил, алкокси, амидо, амино, ацилокси, алкоксикарбонил, или сульфонамидо, R8 необязательно замещен одним или нескольким из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сульфонамидо, галогена, циано, гидрокси или нитро, причем каждый из этих алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила или сульфонамидо сам может быть замещенным.
[0311] В некоторых вариантах осуществления соединения формулы I, R5, R6, R7 и R8 представляют собой H и соединение имеет структуру формулы I-1:

Формула I-1
[0312] В некоторых вариантах осуществления соединения формулы I, X отсутствует. В некоторых вариантах осуществления X представляет собой -(CH(R9))z, и z представляет собой целое число, равное 1, 2, 3 или 4.
[0313] В некоторых вариантах осуществления R9 представляет собой незамещенный или замещенный алкил, включая, но не ограничиваясь ими, незамещенный или замещенный C1-C10алкил. В некоторых вариантах осуществления R9 представляет собой незамещенный или замещенный циклоалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C3-C7циклоалкил. В некоторых вариантах осуществления R9 представляет собой этил, метил или водород. В некоторых вариантах осуществления R9 представляет собой незамещенный или замещенный гетероциклоалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C10гетероалкил. В некоторых вариантах осуществления R9 представляет собой незамещенный или замещенный гетероалкил, включая, но не ограничиваясь ими, незамещенный или замещенный C2-C10гетероалкил.
[0314] Также в рамках настоящего изобретения предусматривается соединение формулы I, где R9 представляет собой водород, и X представляет собой -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH(CH3)- или -CH(CH2CH3)-. В других вариантах осуществления X представляет собой -(CH(R9))z, R9 не является водородом, и z представляет собой целое число, равное 1. Когда X представляет собой -CH(R9)- и R9 не является водородом, тогда соединение может принимать либо стереохимическую конфигурацию (S)-, либо стереохимическую конфигурацию (R) относительно углерода X. В некоторых вариантах осуществления соединение представляет собой рацемическую смесь (S)- и (R)-изомеров относительно углерода X. В других вариантах осуществления в рамках настоящего изобретения предусматривается смесь соединений формулы I, где индивидуальные соединения смеси существуют в основном в конфигурации (S)- или (R)-изомера. Например, соединение смесь имеет чистоту (S)-энантиомера, превышающую приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,5% или более у углерода X. В других вариантах осуществления смесь соединений имеет чистоту (S)-энантиомера от более чем приблизительно 55% до приблизительно 99,5%, от более чем приблизительно 60% до приблизительно 99,5%, от более чем приблизительно 65% до приблизительно 99,5%, от более чем приблизительно 70% до приблизительно 99,5%, от более чем приблизительно 75% до приблизительно 99,5%, от более чем приблизительно 80% до приблизительно 99,5%, от более чем приблизительно 85% до приблизительно 99,5%, от более чем приблизительно 90% до приблизительно 99,5%, от более чем приблизительно 95% до приблизительно 99,5%, от более чем приблизительно 96% до приблизительно 99,5%, от более чем приблизительно 97% до приблизительно 99,5%, от более чем приблизительно 98% до более чем приблизительно 99,5%, от более чем приблизительно 99% до приблизительно 99,5%, или более.
[0315] В других вариантах осуществления соединение смесь имеет чистоту (R)-энантиомера, превышающую приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,5% или более по углероду X. В некоторых других вариантах осуществления соединение смесь имеет чистоту (R)-энантиомера более чем от приблизительно 55% до приблизительно 99,5%, более чем от приблизительно 60% до приблизительно 99,5%, более чем от приблизительно 65% до приблизительно 99,5%, более чем от приблизительно 70% до приблизительно 99,5%, более чем от приблизительно 75% до приблизительно 99,5%, более чем от приблизительно 80% до приблизительно 99,5%, более чем от приблизительно 85% до приблизительно 99,5%, более чем от приблизительно 90% до приблизительно 99,5%, более чем от приблизительно 95% до приблизительно 99,5%, более чем от приблизительно 96% до приблизительно 99,5%, более чем от приблизительно 97% до приблизительно 99,5%, более чем от приблизительно 98% до приблизительно 99,5%, более чем от приблизительно 99% до приблизительно 99,5%, или более.
[0316] В других вариантах осуществления смесь соединений содержит идентичные химические структуры, за исключением их стереохимической ориентации, а именно (S)- или (R)-изомеры. Например, в соединениях формулы I, когда X представляет собой -CH(R9)-, и R9 не является водородом, тогда -CH(R9)- находится в стереохимической ориентации (S) или (R) для каждой из идентичных химических структур. В некоторых вариантах осуществления смесь идентичных химических структур формулы I представляет собой рацемическую смесь (S)- и (R)-изомеров по углероду, обозначаемому X. В другом варианте осуществления смесь идентичных химических структур (за исключением их стереохимических ориентаций) содержит в основном (S)-изомеры или в основном (R)-изомеры. Например, (S)-изомеры в смеси идентичных химических структур присутствуют в количестве приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,5% или более, относительно (R)-изомеров. В некоторых вариантах осуществления (S)-изомеры в смеси идентичных химических структур присутствуют с чистотой (S)-энантиомера более чем от приблизительно 55% до приблизительно 99,5%, более чем от приблизительно 60% до приблизительно 99,5%, более чем от приблизительно 65% до приблизительно 99,5%, более чем от приблизительно 70% до приблизительно 99,5%, более чем от приблизительно 75% до приблизительно 99,5%, более чем от приблизительно 80% до приблизительно 99,5%, более чем от приблизительно 85% до приблизительно 99,5%, более чем от приблизительно 90% до приблизительно 99,5%, более чем от приблизительно 95% до приблизительно 99,5%, более чем от приблизительно 96% до приблизительно 99,5%, более чем от приблизительно 97% до приблизительно 99,5%, более чем от приблизительно 98% до приблизительно 99,5%, более чем от приблизительно 99% до приблизительно 99,5%, или более.
[0317] В другом варианте осуществления (R)-изомеры в смеси идентичных химических структур (за исключением их стереохимических ориентаций) присутствуют в количестве приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,5% или более, относительно (S)-изомеров. В некоторых вариантах осуществления (R)-изомеры в смеси идентичных химических структур (за исключением их стереохимических ориентаций), присутствуют с чистотой (R)-энантиомера более чем от 55% до приблизительно 99,5%, более чем от приблизительно 60% до приблизительно 99,5%, более чем от приблизительно 65% до приблизительно 99,5%, более чем от приблизительно 70% до приблизительно 99,5%, более чем от приблизительно 75% до приблизительно 99,5%, более чем от приблизительно 80% до приблизительно 99,5%, более чем от приблизительно 85% до приблизительно 99,5%, более чем от приблизительно 90% до приблизительно 99,5%, более чем от приблизительно 95% до приблизительно 99,5%, более чем от приблизительно 96% до приблизительно 99,5%, более чем от приблизительно 97% до приблизительно 99,5%, более чем от приблизительно 98% до приблизительно 99,5%, более чем от приблизительно 99% до приблизительно 99,5%, или более.
[0318] В некоторых вариантах осуществления соединения формулы I, X представляет собой -CH(R9)-, R9 представляет собой метил или этил, и соединение представляет собой (S)-изомер.
[0319] В некоторых вариантах осуществления соединения формулы I, Y отсутствует. В некоторых вариантах осуществления Y представляет собой -O-, -S-, -S(=O)-, -S(=O)2-, -C(=O)-, -N(R9)(C=O)-, -N(R9)(C=O)NH-, -N(R9)C(R9)2- (такой как -N(R9)CH2-, в частности, -N(CH3)CH2-, N(CH(CH3)2)CH2 - или N(CH2CH3)CH2-), -N(R9)-, -N(CH3)-, -N(CH2CH3)- или -N(CH(CH3)2)-. В некоторых вариантах осуществления Y представляет собой -C(=O)-(CHR9)z- и z представляет собой целое число, равное 1, 2, 3 или 4.
[0320] В некоторых вариантах осуществления присутствует по меньшей мере один из X и Y. В некоторых вариантах осуществления соединения формулы I, -XY- представляет собой -CH2-, -CH2-N(CH3), -CH2-N(CH2CH3), -CH(CH3)-NH-, (S) -CH(CH3)-NH-, или (R) -CH(CH3)-NH-. В других вариантах осуществления X-Y представляет собой -N(CH3)-CH2-, N(CH2CH3) CH2-, -N(CH(CH3)2)CH2- или -NHCH2-. В рамках настоящего изобретения предусматриваются другие соединения формулы I, где, когда в X-Y X представляет собой -(CH(R9))zN(R9)-, z представляет собой целое число, равное 1, 2, 3 или 4 и -N(R9)- не является -NH-, тогда -XY- не связан с пуринилом.
[0321] В некоторых вариантах осуществления Wd в формуле, описанной в настоящем описании (включая, но не ограничиваясь ими, I, I-1, IV, IV-A, V, V-A, V-A2, V-B, VI и VI-A), является представителем, выбранным из группы, состоящей из незамещенного или замещенного гетероциклоалкила, незамещенного или замещенного арила, и незамещенного или замещенного гетероарила.
[0322] В различных вариантах осуществления Wd представляет собой незамещенный или замещенный моноциклический гетероарил (включая, но не ограничиваясь ими, пиримидинил, пирролил, пиразинил, триазинил или пиридазинил) или незамещенный или замещенный бициклический гетероарил.
[0323] В некоторых вариантах осуществления Wd представляет собой моноциклический гетероарил следующей формулы:

где Ra’ представляет собой водород, галоген, фосфат, мочевину, карбонат, незамещенный или замещенный амино, незамещенный или замещенный алкил, незамещенный или замещенный алкенил, незамещенный или замещенный алкинил, незамещенный или замещенный циклоалкил, незамещенный или замещенный гетероалкил, или незамещенный или замещенный гетероциклоалкил; и R12 представляет собой H, незамещенный или замещенный алкил, незамещенный или замещенный циано, незамещенный или замещенный алкинил, незамещенный или замещенный алкенил, галоген, незамещенный или замещенный арил, незамещенный или замещенный гетероарил, незамещенный или замещенный гетероциклоалкил, незамещенный или замещенный циклоалкил, незамещенный или замещенный амино, карбоновая кислота, незамещенный или замещенный алкоксикарбонил, незамещенный или замещенный амидо, незамещенный или замещенный ацил, или незамещенный или замещенный сульфонамидо.
[0324] Также в настоящее включены соединения, имеющие моноциклический гетероарил Wd, включая, но не ограничиваясь ими, одну из следующих формул:

[0325] В некоторых вариантах осуществления Wd в формуле, описанной в настоящем описании (включая, но не ограничиваясь ими, I, I-1, IV, IV-A, V, V-A, V-A2, V-B, VI и VI-A), представляет собой бициклический гетероарил, имеющий по меньшей мере один гетероатом, например, бициклический гетероарил, имеющий по меньшей мере один атом азота в кольце. В некоторых вариантах осуществления Wd представляет собой бициклический гетероарил, имеющий по меньшей мере два гетероатома, например, бициклический гетероарил, имеющий по меньшей мере два атома азота в кольце. В некоторых вариантах осуществления Wd представляет собой бициклический гетероарил, имеющий два гетероатома в кольце, которое связано с XY. В некоторых вариантах осуществления Wd представляет собой бициклический гетероарил, имеющий два атома азота в кольце, с которым связан XY. В некоторых вариантах осуществления Wd представляет собой бициклический гетероарил, имеющий четыре гетероатома, например, бициклический гетероарил. имеющий четыре атома азота в кольце. В некоторых вариантах осуществления Wd представляет собой незамещенный или замещенный 4-амино-1H-пиразолo[3,4-d]пиримидин-1-ил, незамещенный или замещенный 7-амино-2-метил-2H-пиразолo[4,3-d]пиримидин-3-ил, незамещенный или замещенный 6-метиленил-9H-пурин-6-ил, или незамещенный или замещенный 6-амино-9H-пурин-9-ил.
[0326] В некоторых вариантах осуществления Wd представляет собой один из следующих:
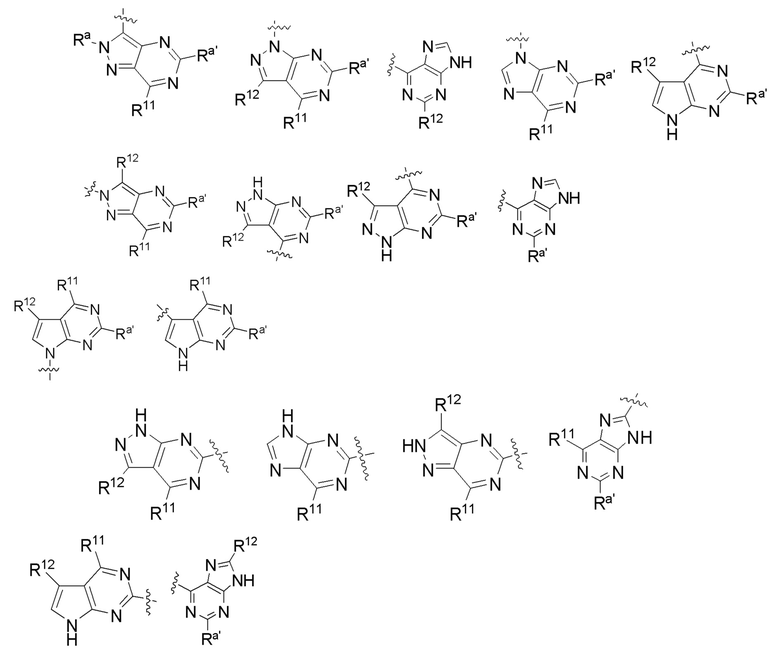
где Ra’ представляет собой водород, галоген, фосфат, мочевину, карбонат, незамещенный или замещенный амино, незамещенный или замещенный алкил, незамещенный или замещенный алкенил, незамещенный или замещенный алкинил, незамещенный или замещенный циклоалкил, незамещенный или замещенный гетероалкил, или незамещенный или замещенный гетероциклоалкил;
R11 представляет собой водород, незамещенный или замещенный алкил, галоген (который включает-I, -F, -Cl или -Br), незамещенный или замещенный амино, незамещенный или замещенный амидо, гидрокси или незамещенный или замещенный алкокси, фосфат, незамещенную или замещенную мочевину или карбонат; и
R12 представляет собой H, незамещенный или замещенный алкил, незамещенный или замещенный циано, незамещенный или замещенный алкинил, незамещенный или замещенный алкенил, галоген, незамещенный или замещенный арил, незамещенный или замещенный гетероарил, незамещенный или замещенный гетероциклоалкил, незамещенный или замещенный циклоалкил, незамещенный или замещенный амино, карбоновую кислоту, незамещенный или замещенный алкоксикарбонил, незамещенный или замещенный амидо, незамещенный или замещенный ацил, или незамещенный или замещенный сульфонамидо.
[0327] В некоторых вариантах осуществления Wd соединений формулы I, когда Ra’ представляет собой алкил, алкинил, циклоалкил, гетероалкил или гетероциклоалкил, он замещен фосфатом, мочевиной или карбонатом.
[0328] В некоторых вариантах осуществления Wd соединений формулы I, когда R11 представляет собой алкил, амино, амидо, гидрокси или алкокси, он замещен фосфатом, мочевиной или карбонатом.
[0329] В некоторых вариантах осуществления соединения формулы I, -X-Y-Wd представляет собой одну из следующих частей:
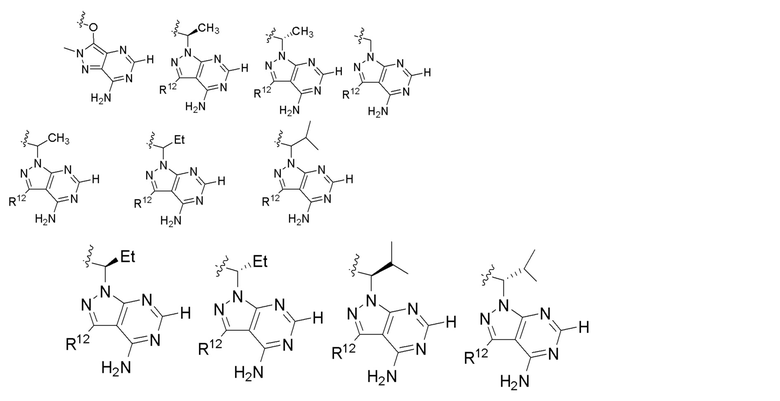
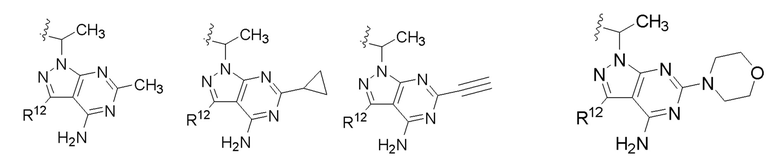

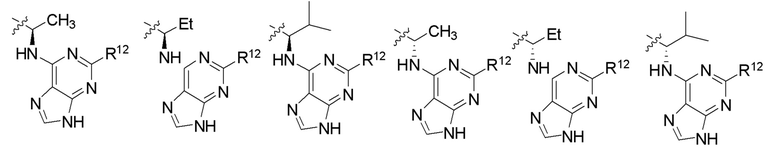

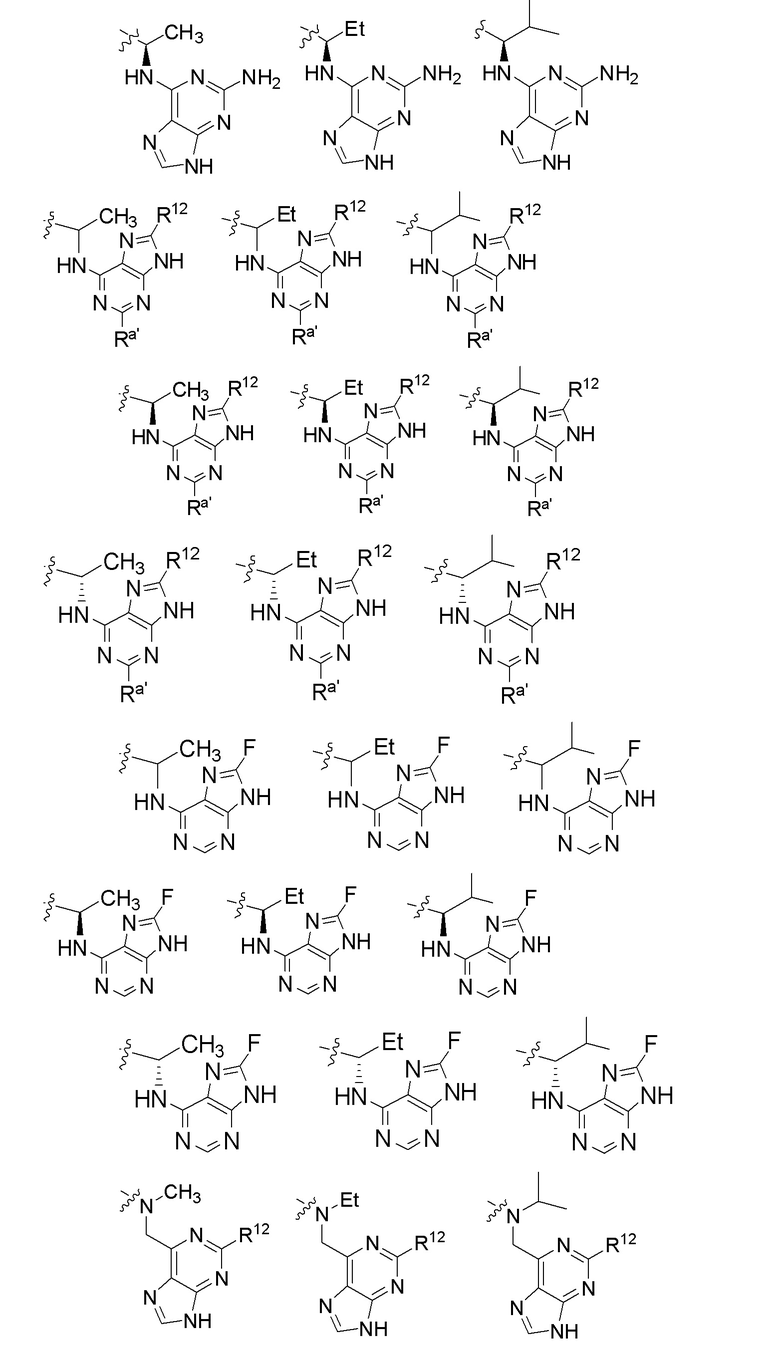

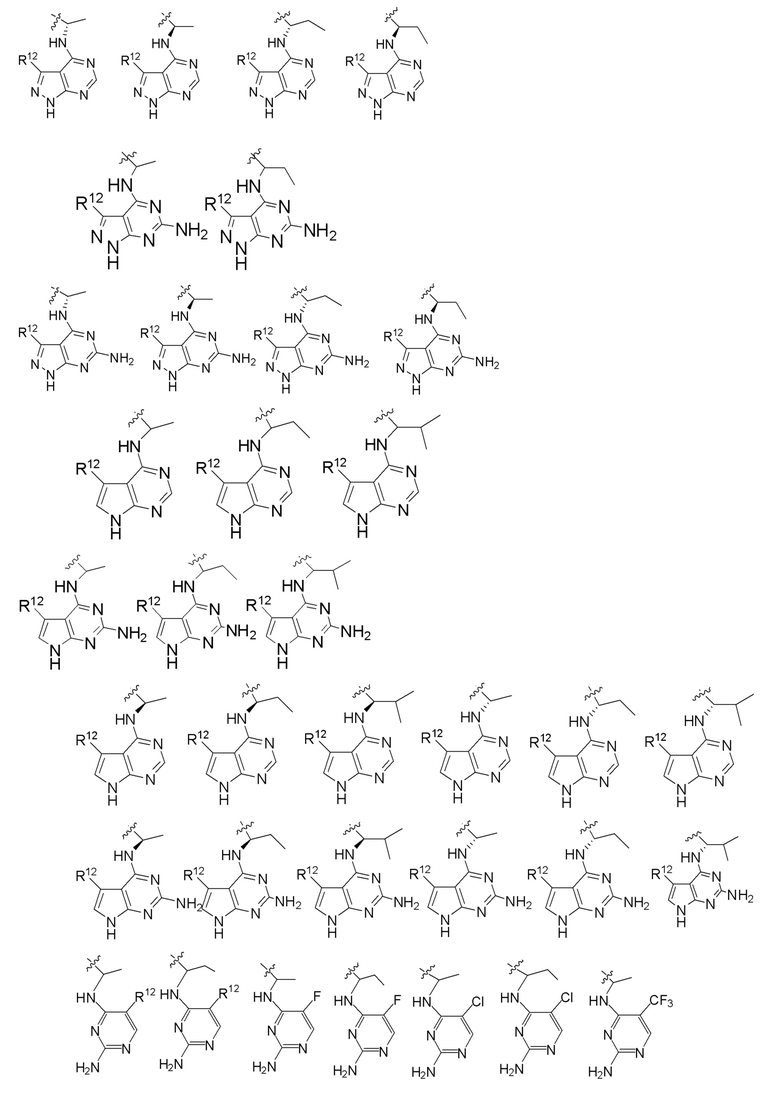

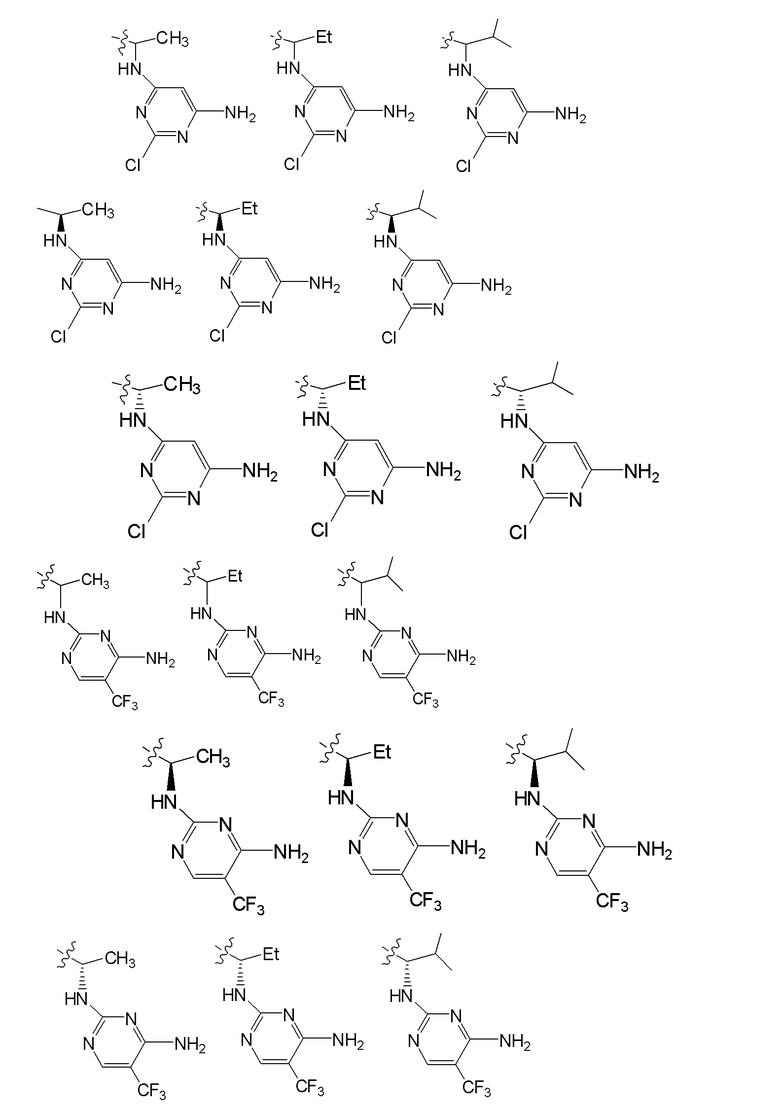
[0330] В некоторых вариантах осуществления соединения формулы I, R12 является представителем группы, состоящей из водорода, циано, галогена, незамещенного или замещенного алкила, незамещенного или замещенного алкинила, и незамещенного или замещенного алкенила. В некоторых вариантах осуществления R12 представляет собой незамещенный или замещенный арил. В некоторых вариантах осуществления R12 представляет собой незамещенный или замещенный гетероарил, который включает, но не ограничивается ими, гетероарил, имеющий 5-членное кольцо, гетероарил, имеющий шестичленное кольцо, гетероарил по меньшей мере с одним атомом азота в кольце, гетероарил с двумя атомами азота в кольце, моноциклический гетероарил и бициклический гетероарил. В некоторых вариантах осуществления R12 представляет собой незамещенный или замещенный гетероциклоалкил, который включает, но не ограничивается ими, гетероциклоалкил с одним атомом азота в кольце, гетероциклоалкил с одним атомом кислорода в кольце, R12 представляет собой гетероциклоалкил с одним атомом серы в кольце, 5-членный гетероциклоалкил, 6-членный гетероциклоалкил, насыщенный гетероциклоалкил, ненасыщенный гетероциклоалкил, гетероциклоалкил, имеющий ненасыщенную часть, связанную с гетероциклоалкильным кольцом, гетероциклоалкил, замещенный посредством оксо, и гетероциклоалкил, замещенный двумя оксо. В некоторых вариантах осуществления R12 представляет собой незамещенный или замещенный циклоалкил, включая, но не ограничиваясь ими, циклопропил, циклобутил, циклопентил, циклогексил, циклоалкил, замещенный одним оксо, циклоалкил, имеющий ненасыщенную часть, связанную с циклоалкильным кольцом. В некоторых вариантах осуществления R12 представляет собой незамещенный или замещенный амидо, карбоновую кислоту, незамещенный или замещенный ацилокси, незамещенный или замещенный алкоксикарбонил, незамещенный или замещенный ацил, или незамещенный или замещенный сульфонамидо.
[0331] В некоторых вариантах осуществления, когда R12 представляет собой алкил, алкинил, алкенил, арил, гетероарил, гетероциклоалкил или циклоалкил, он замещен фосфатом. В некоторых вариантах осуществления, когда R12 представляет собой алкил, алкинил, алкенил, арил, гетероарил, гетероциклоалкил или циклоалкил, он замещен мочевиной. В некоторых вариантах осуществления, когда R12 представляет собой алкил, алкинил, алкенил, арил, гетероарил, гетероциклоалкил или циклоалкил, он замещен карбонатом.
[0332] В некоторых вариантах осуществления, когда R12 представляет собой алкил, алкинил, алкенил, арил, гетероарил, гетероциклоалкил, циклоалкил, алкоксикарбонил, амидо, ацилокси, ацил или сульфонамидо, он замещен одним или несколькими из алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила, сульфонамидо, галогена, циано, гидрокси или нитро, причем каждый из этих алкила, гетероалкила, алкенила, алкинила, циклоалкила, гетероциклоалкила, арила, гетероарила, алкокси, амидо, амино, ацила, ацилокси, алкоксикарбонила или сульфонамидо сам может быть замещенным.
[0333] В некоторых вариантах осуществления соединения формулы I, R12 в Wd представляет собой одну из следующих частей:

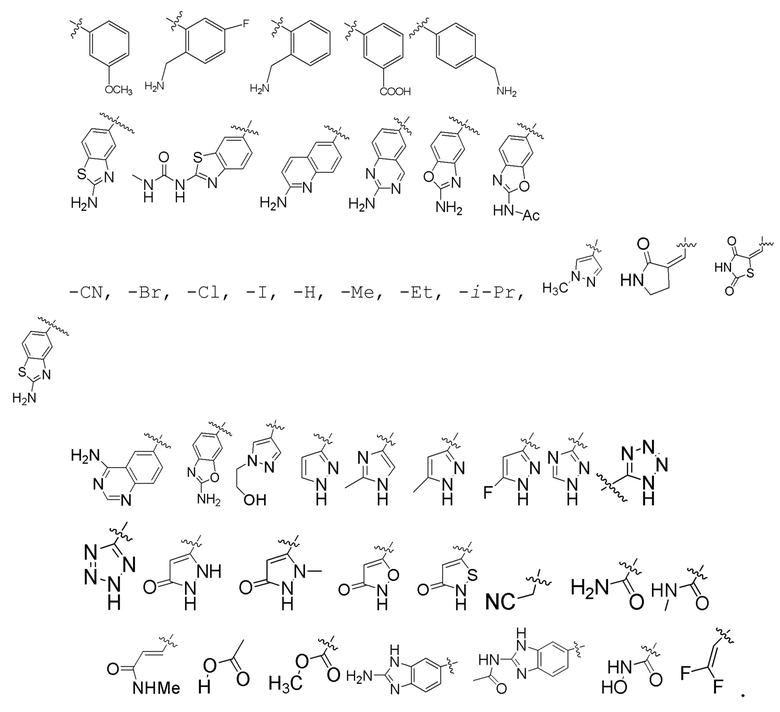
[0334] В некоторых вариантах осуществления соединения формулы I, Wd представляет собой пиразолопиримидин формулы III:

Формула III
где R11 представляет собой H, алкил, галоген, амино, амидо, гидрокси или алкокси, и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил. В некоторых вариантах осуществления R11 представляет собой амино и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил. В некоторых вариантах осуществления R11 представляет собой амино и R12 представляет собой алкил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил. В некоторых вариантах осуществления R11 представляет собой амино и R12 представляет собой моноциклический гетероарил. В некоторых вариантах осуществления R11 представляет собой амино и R12 представляет собой бициклический гетероарил. В некоторых вариантах осуществления R11 представляет собой амино и R12 представляет собой циано, амино, карбонову кислоту, ацилокси, алкоксикарбонил или амидо.
[0335] В некоторых вариантах осуществления соединение формулы I представляет собой соединение, имеющее структуру формулы IV:

Формула IV
[0336] В некоторых вариантах осуществления соединения формулы IV, R11 представляет собой H, алкил, галоген, амино, амидо, гидрокси или алкокси, и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил. В другом варианте осуществления R11 представляет собой амино и R12 представляет собой алкил, алкенил, гетероарил, арил или гетероциклоалкил. В некоторых вариантах осуществления R11 представляет собой амино и R12 представляет собой циано, амино, карбоновую кислоту, алкоксикарбонил или амидо.
[0337] В некоторых вариантах осуществления соединение формулы IV представляет собой соединение формулы IV-A:
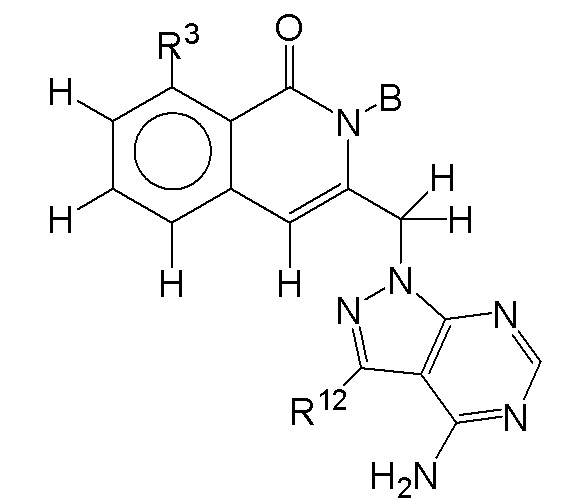
Формула IV-A
[0338] Также в рамках настоящего изобретения предусматриваются соединения формулы I, имеющие структуру любой из формул V, V-A1, V-A2, V-B, VI, VI-A, VII-A1, VII-A2, VIII-A1, VIII-A2, IX-A1, IX-A2, X-A1, X-A2, XI-A1, XI-A2, XII-A, XII-A1, XII-A2, XIII-A, XIII-A1, XIII-A2, XIV-A, XIV-A1, XIV-A2, XV-A, XV-A1, XV-A2, XVI-A, XVI-A1, XVI-A2, XVII-A, XVII-A1, XVII-A2, XVIII-A, XVIII-A1 или XVIII-A2:
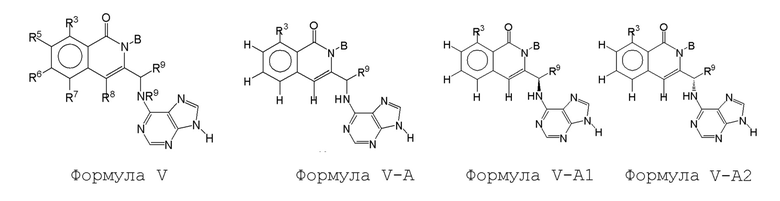

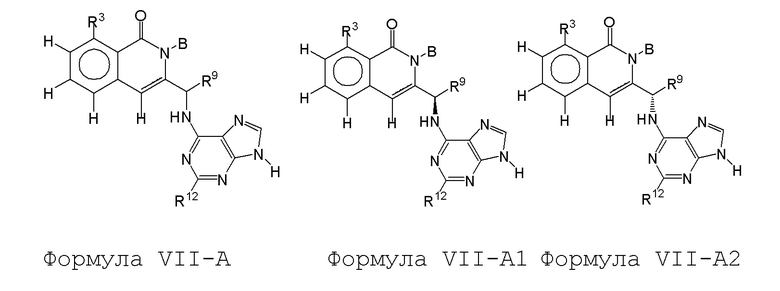
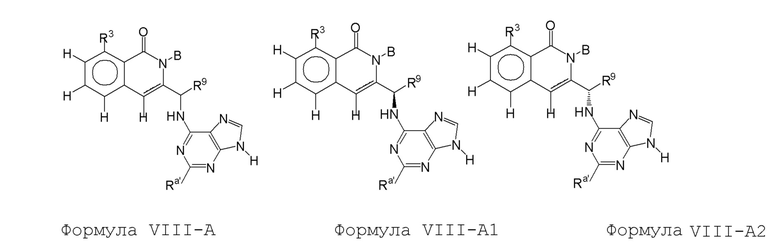


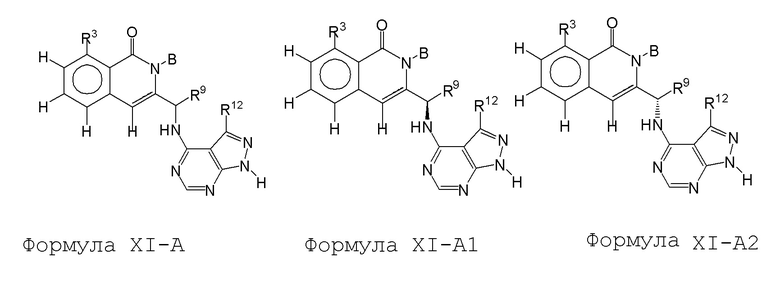

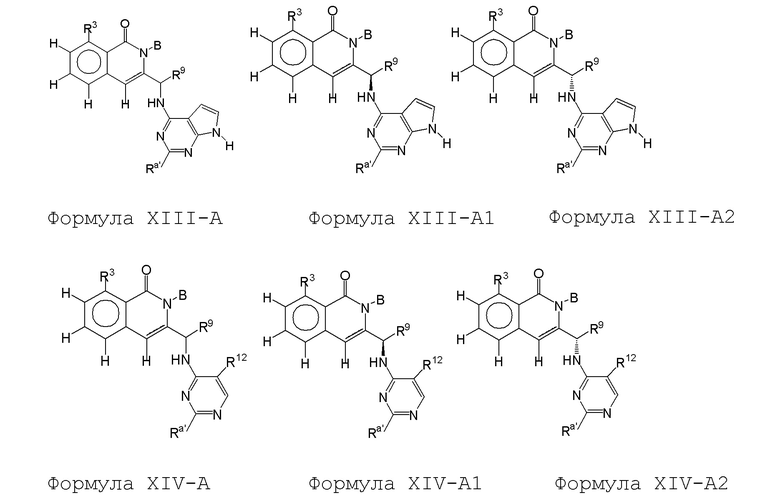
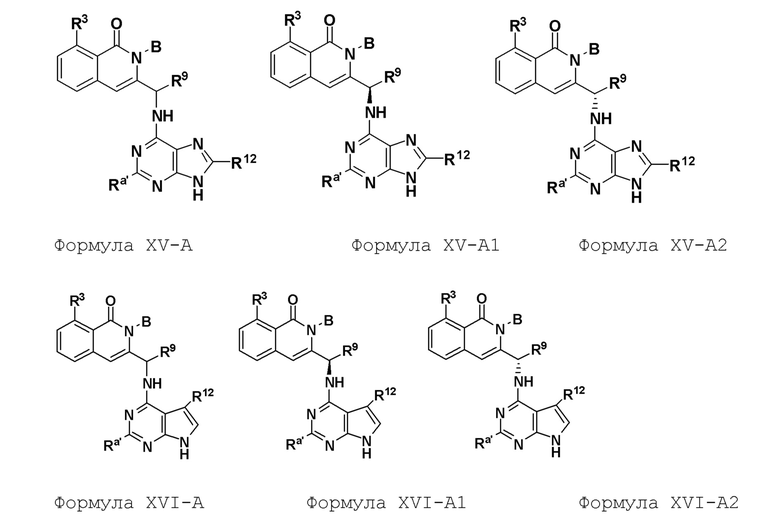
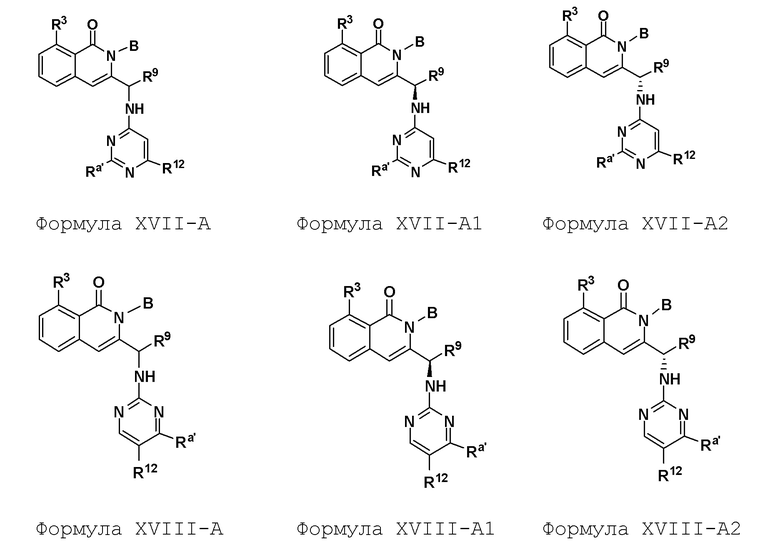
[0339] Любой из описанных элементов и их заместителей для соединений формулы I можно использовать в любой комбинации.
[0340] В одном аспекте соединений формулы I, R3 представляет собой H, CH3, CF3, Cl или F; и B представляет собой часть формулы II:

Формула II
где Wc представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил; R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро или фосфат; R2 представляет собой галоген, гидрокси, циано или нитро; q представляет собой целое число, равное 0, 1, 2, 3 или 4; R5, R6, R7 и R8 представляют собой H; X отсутствует или представляет собой (CH2)z; z равно 1; Y отсутствует или представляет собой -N(R9)-; R9 представляет собой водород, C1-C10алкил, C3-C7циклоалкил или C2-C10гетероалкил; по меньшей мере один из X и Y присутствует; и Wd представляет собой пиразолoпиримидин или пурин. В некоторых вариантах осуществления, когда X и Y присутствуют, и Wd представляет собой пурин, тогда -N(R9)- представляет собой -NH-.
[0341] В другом аспекте соединений формулы I, R3 представляет собой H, CH3, CF3, Cl или F; B представляет собой часть формулы II, которая представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро или фосфат; R2 представляет собой галоген, гидрокси, циано или нитро; q представляет собой 0, 1 или 2; R5, R6, R7 и R8 представляют собой H; X отсутствует или представляет собой (CH2)z; z равно 1; Y отсутствует или представляет собой -N(R9)-; R9 представляет собой водород, метил или этил; по меньшей мере один из X и Y присутствует; Wd представляет собой: 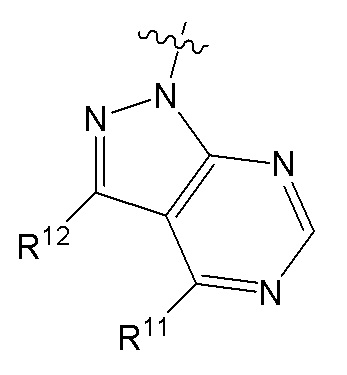 или
или 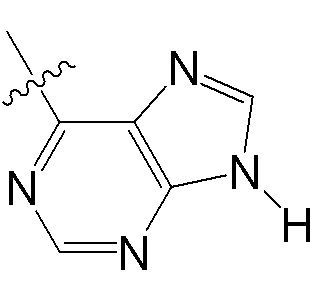 ; R11 представляет собой амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил. В некоторых вариантах осуществления, когда X и Y присутствуют и Wd представляет собой пурин, тогда -N(R9)- представляет собой -NH-.
; R11 представляет собой амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил. В некоторых вариантах осуществления, когда X и Y присутствуют и Wd представляет собой пурин, тогда -N(R9)- представляет собой -NH-.
[0342] В другом аспекте соединений формулы I, R3 представляет собой H, CH3, CF3, Cl или F; B представляет собой часть формулы II, которая представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро или фосфат; R2 представляет собой галоген, гидрокси, циано или нитро; q равно 0, 1 или 2; X представляет собой (CH2)z; z равно 1; R5, R6, R7 и R8 представляют собой H; Y отсутствует и Wd представляет собой:  ; R11 представляет собой амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил.
; R11 представляет собой амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил или циклоалкил.
[0343] В другом аспекте R3 представляет собой H, CH3, CF3, Cl или F; B представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро или фосфат; R2 представляет собой галоген, гидрокси, циано или нитро; q равно 0, 1 или 2; R5, R6, R7 и R8 представляют собой H; X представляет собой (CH2)z; z представляет собой 1; X представляет собой (CH2)z; z равно 1; Y представляет собой -N(R9)-; R9 представляет собой водород, метил или этил; и Wd представляет собой  . В некоторых вариантах осуществления Y представляет собой -NH-.
. В некоторых вариантах осуществления Y представляет собой -NH-.
[0344] В другом аспекте соединений формулы I, R3 представляет собой арил, гетероарил, H, CH3, CF3, Cl или F; B представляет собой алкил или часть формулы II;
[0345] где Wc представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, и q представляет собой целое число, равное 0, 1, 2, 3 или 4; R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро или фосфат; R2 представляет собой галоген, гидрокси, циано, нитро или фосфат; q равно 0, 1 или 2; R5, R6, R7 и R8 представляют собой H; X отсутствует или представляет собой (CH(R9))z; z представляет собой целое число, равное 1, 2, 3 или 4; Y отсутствует, представляет собой -N(R9)- или -N(R9) CH(R9)-; R9 представляет собой водород, алкил, циклоалкил или гетероалкил; по меньшей мере один из X и Y присутствует; и Wd представляет собой пиразолoпиримидин или пурин. В некоторых вариантах осуществления, когда X присутствует, Y представляет собой -N(R9)- и Wd представляет собой пурин, тогда Y представляет собой -NH-.
[0346] В другом аспекте соединений формулы I, R3 представляет собой арил, гетероарил, H, CH3, CF3, Cl или F; B представляет собой алкил или часть формулы II, которая представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро или фосфат; R2 представляет собой галоген, гидрокси, циано, нитро или фосфат; q равно 0, 1 или 2; R5, R6, R7 и R8 представляют собой H; X отсутствует или представляет собой (CH(R9))z; z представляет собой целое число, равное 1, 2, 3 или 4; Y отсутствует, представляет собой -N(R9)- или -N(R9) CH(R9)-; R9 представляет собой водород, метил или этил; по меньшей мере один из X и Y присутствует; Wd представляет собой: 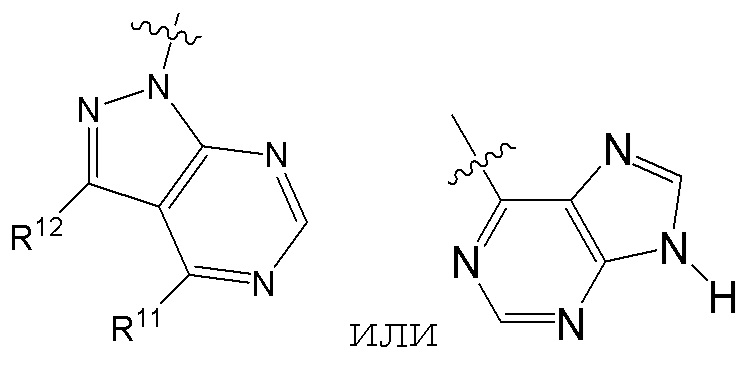 ; R11 представляет собой амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил, циклоалкил, циано, амино, карбоновая кислота, алкоксикарбонил или амидо. В некоторых вариантах осуществления, когда X присутствует, Y представляет собой -N(R9)-, и Wd представляет собой пурин, тогда Y представляет собой -NH-.
; R11 представляет собой амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил, циклоалкил, циано, амино, карбоновая кислота, алкоксикарбонил или амидо. В некоторых вариантах осуществления, когда X присутствует, Y представляет собой -N(R9)-, и Wd представляет собой пурин, тогда Y представляет собой -NH-.
[0347] В другом аспекте соединений формулы I, R3 представляет собой H, CH3, CF3, Cl или F; B представляет собой алкил или часть формулы II, которая представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро или фосфат; R2 представляет собой галоген, гидрокси, циано, нитро или фосфат; q равно 0, 1 или 2; R5, R6, R7 и R8 представляют собой H; X представляет собой (CH(R9))z; z представляет собой целое число, равное 1; Y отсутствует; R9 представляет собой водород, метил или этил; Wd представляет собой: 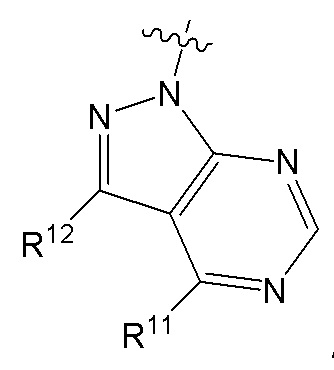 ; R11 представляет собой амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил, циклоалкил, циано, амино, карбоновую кислоту, алкоксикарбонил или амидо.
; R11 представляет собой амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил, циклоалкил, циано, амино, карбоновую кислоту, алкоксикарбонил или амидо.
[0348] В другом аспекте соединений формулы I, R3 представляет собой арил, гетероарил, H, CH3, CF3, Cl или F; B представляет собой часть формулы II, которая представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро, или фосфат; R2 представляет собой галоген, гидрокси, циано, нитро или фосфат; q равно 0, 1 или 2; R5, R6, R7 и R8 представляют собой H; X отсутствует или представляет собой (CH(R9))z; z представляет собой целое число, равное 1; Y отсутствует, представляет собой -N(R9)- или -N(R9) CH(R9)-; R9 представляет собой водород, метил, или этил; по меньшей мере один из X и Y присутствует, и Wd представляет собой:  . В некоторых вариантах осуществления, когда X присутствует, Y представляет собой -N(R9)-, и Wd представляет собой пурин, тогда Y представляет собой -NH-.
. В некоторых вариантах осуществления, когда X присутствует, Y представляет собой -N(R9)-, и Wd представляет собой пурин, тогда Y представляет собой -NH-.
[0349] В другом аспекте соединений формулы I, R3 представляет собой арил, гетероарил, H, CH3, CF3, Cl или F; B представляет собой часть формулы II, которая представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро или фосфат; R2 представляет собой галоген, гидрокси, циано, нитро или фосфат; q равно 0, 1 или 2; R5, R6, R7 и R8 представляют собой H; X отсутствует; Y представляет собой -N(R9) CH(R9)-; R9 представляет собой водород, метил или этил; и Wd представляет собой:  .
.
[0350] В другом аспекте соединений формулы I, R3 представляет собой арил, гетероарил, H, CH3, CF3, Cl или F; B представляет собой алкил или часть формулы II, которая представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, R1 представляет собой H, -F, -Cl, -CN, -CH3, изопропил, -CF3, -OCH3, нитро или фосфат; R2 представляет собой галоген, гидрокси, циано, нитро или фосфат; q равно 0, 1 или 2; R5, R6, R7 и R8 представляют собой H; X отсутствует или представляет собой (CH(R9))z; z представляет собой целое число, равное 1, 2, 3 или 4; Y отсутствует, представляет собой-N(R9)- или -N(R9) CH(R9)-; R9 представляет собой водород, метил или этил; по меньшей мере один из X и Y присутствует; Wd представляет собой:  ; Ra’ представляет собой водород, галоген или амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил, циклоалкил, циано, амино, карбоновую кислоту, алкоксикарбонил или амидо. В некоторых вариантах осуществления, когда X присутствует, Y представляет собой -N(R9)-, и Wd представляет собой пурин, тогда Y представляет собой -NH-.
; Ra’ представляет собой водород, галоген или амино; и R12 представляет собой H, алкил, алкинил, алкенил, галоген, арил, гетероарил, гетероциклоалкил, циклоалкил, циано, амино, карбоновую кислоту, алкоксикарбонил или амидо. В некоторых вариантах осуществления, когда X присутствует, Y представляет собой -N(R9)-, и Wd представляет собой пурин, тогда Y представляет собой -NH-.
[0351] Дополнительные иллюстративные соединения имеют подструктуру формулы IV-A.

Формула IV-A
[0352] Некоторые иллюстративные соединения по настоящему изобретению, имеющие структуру формулы IV-A, включают соединения, в которых R3 представляет собой -H, -Cl, -F или -CH3 в комбинации с любой частью B, описанной в таблице 1, и любым R12, как описано в таблице 2. Соединение формулы IV-A включает любую комбинацию R3, B и R12. Дополнительные иллюстративные соединения формулы IV-A проиллюстрированы в таблице 4.



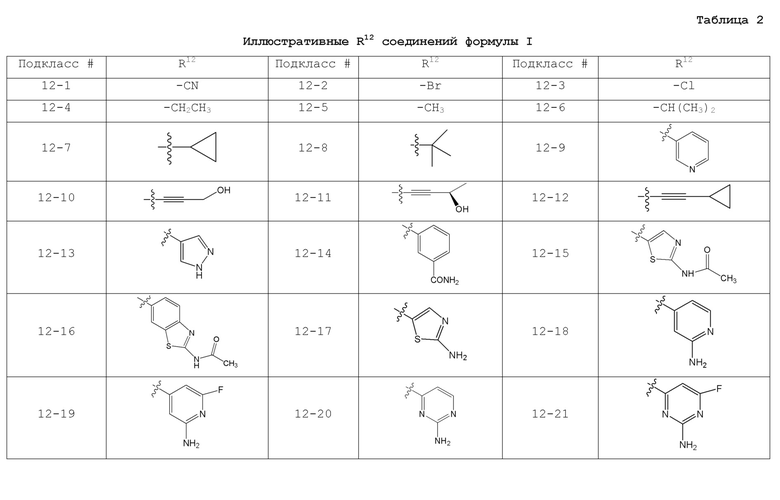



[0353] Другие иллюстративные соединения по настоящему изобретению имеют структуру формулы V-A, V-A1 или V-A2, где B представляет собой часть, описанную в таблице 1, в комбинации с R3, который представляет собой -H, -Cl, -F или CH3, и R9, который представляет собой -H, -CH3 или -CH2CH3. Соединение формулы V-A, V-A1 или V-A2 включает любую комбинацию R3, B и R9.
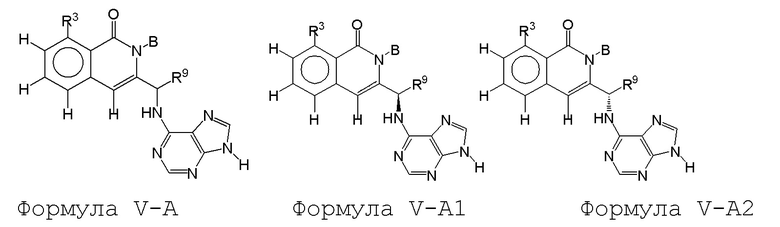
[0354] Другие иллюстративные соединения по настоящему изобретению имеют структуру формулы V-B, где B представляет собой часть, описанную в таблице 1, в комбинации с R3, который представляет собой -H, -Cl, -F или CH3, и R9, который представляет собой -H, -CH3 или -CH2CH3. Соединение формулы V-B включает любую комбинацию R3, B и R9.

Формула V-B
[0355] Некоторые другие иллюстративные соединения по настоящему изобретению имеют структуру формулы VI-A, где B представляет собой часть, описанную в таблице 1, в комбинации с R3, который представляет собой -H, -Cl, -F или CH3, и R9, который представляет собой -H, -CH3 или -CH2CH3. Соединение формулы VI-A включает любую комбинацию R3, B и R9.
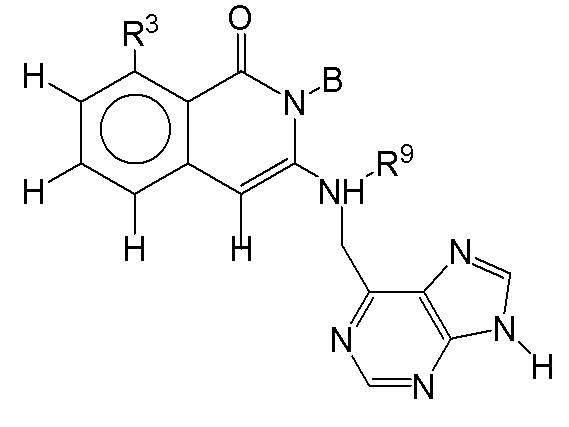
Формула VI-A
[0356] Следующие иллюстративные соединения, которые можно использовать, как описано в настоящем описании, имеют структуру одной из формул VII-A1, VII-A2, VIII-A1, VIII-A2, IX-A1, IX-A2, X-A1, X-A2, XI-A1, XI-A2, XII-A, XII-A1, XII-A2, XIII-A, XIII-A1, XIII-A2, XIV-A, XIV-A1 или XIV-A2: где B представляет собой часть, описанную в таблице 1, любой R12 является таким, как описано в таблице 2, в комбинации с R3, который представляет собой -H, -Cl, -F или CH3, R9, который представляет собой -H, -CH3 или -CH2CH3, и Ra’, который представляет собой -H, -Cl, -F или -NH2. Соединение формулы VII-A1, VII-A2, VIII-A1, VIII-A2, IX-A1, IX-A2, X-A1, X-A2, XI-A1, XI-A2, XII-A, XII-A1, XII-A2, XIII-A, XIII-A1, XIII-A2, XIV-A, XIV-A1 или XIV-A2: включает любую комбинацию Ra, R3, B, R9 и R12.
[0357] Дополнительные иллюстративные соединения включают, но не ограничиваются ими, следующие:

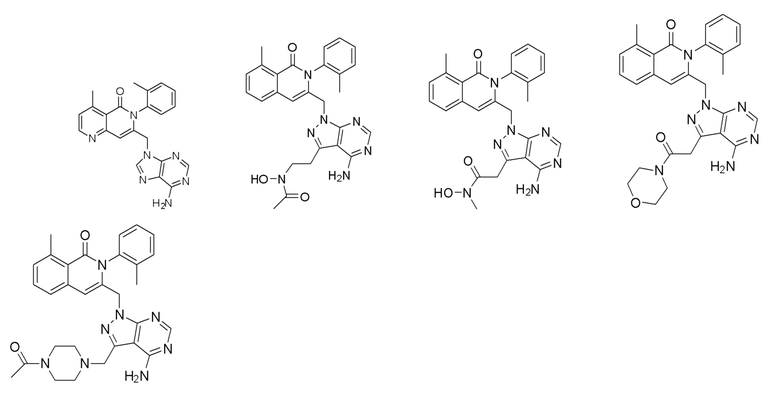

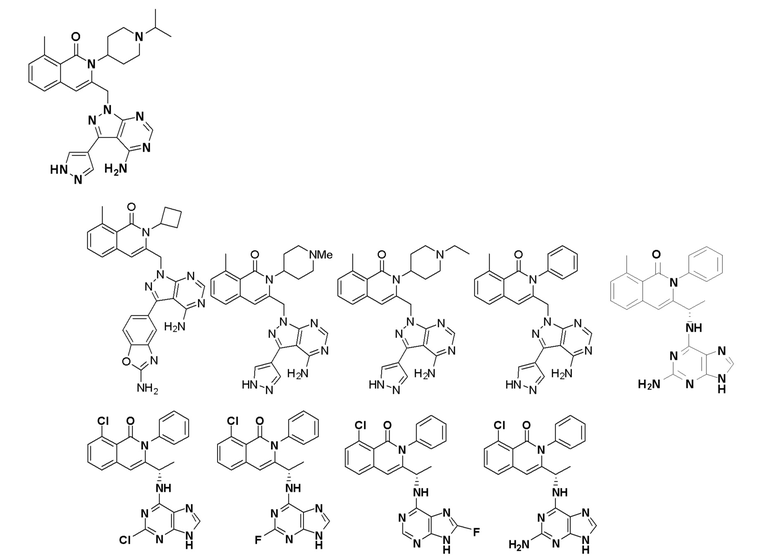
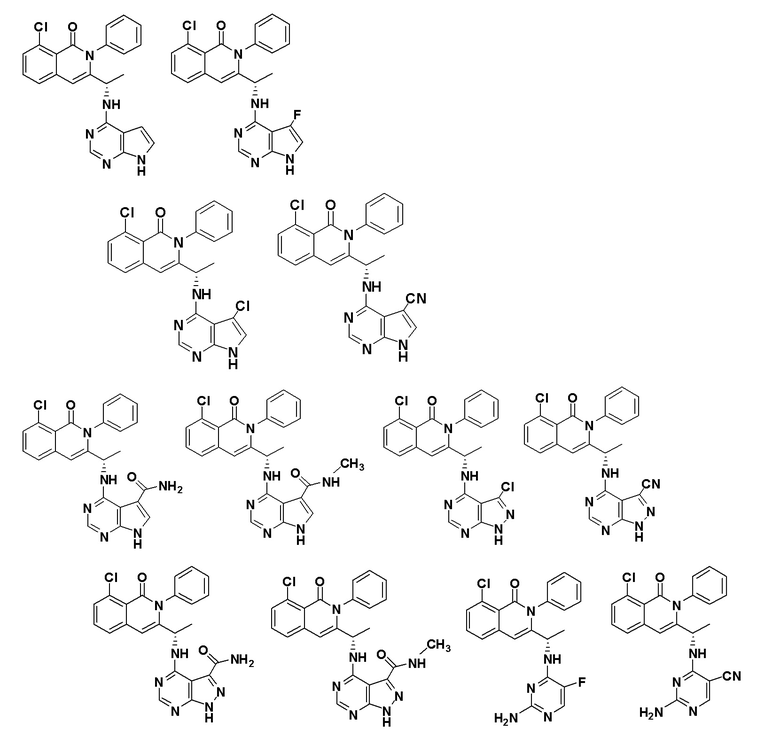



[0358] В некоторых вариантах осуществления модулятор PI3K представляет собой соединение формулы I-1:

Формула I-1
или его фармацевтически приемлемую соль, где
B представляет собой часть формулы II:
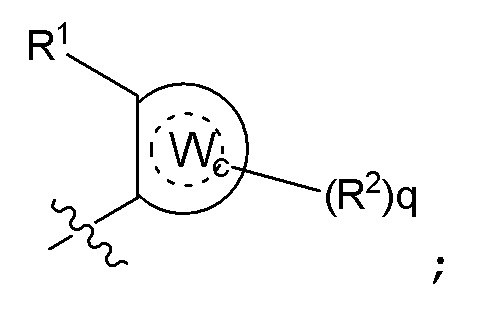
Формула II
где Wc представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил, и
q представляет собой целое число, равное 0, 1, 2, 3 или 4;
X представляет собой связь или -(CH(R9))z-, и z представляет собой целое число, равное 1;
Y представляет собой -N(R9)-;
Wd представляет собой:  ;
;
R1 представляет собой водород, алкил, алкенил, алкинил, алкокси, амидо, алкоксикарбонил, сульфонамидо, галоген, циано или нитро;
R2 представляет собой алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, гетероарил, гетероарилалкил, алкокси, амино, галоген, циано, гидрокси или нитро;
R3 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, алкокси, амидо, амино, алкоксикарбонил сульфонамидо, галоген, циано, гидрокси или нитро; и
R9 в каждом случае независимо представляет собой водород, алкил или гетероциклоалкил.
[0359] В некоторых вариантах осуществления соединение в основном находится в стереохимической конфигурации (S)
[0360] В некоторых вариантах осуществления X представляет собой -(CH(R9))z-, и Y представляет собой -NH-.
[0361] В некоторых вариантах осуществления R3 представляет собой -H, -CH3, -CH2CH3, -CF3, -Cl или -F.
[0362] В некоторых вариантах осуществления B представляет собой часть формулы II:

Формула II
где Wc представляет собой арил, гетероарил, гетероциклоалкил или циклоалкил;
q представляет собой целое число, равное 0 или 1;
R1 представляет собой водород, алкил или галоген;
R2 представляет собой алкил или галоген;
R3 представляет собой водород, алкил или галоген; и необязательно, где соединение имеет один или несколько из следующих признаков:
(i) X представляет собой -(CH(R9))z-, где R9 представляет собой метил и z=1; и Wd представляет собой  ; и/или
; и/или
(ii) R3 представляет собой метил или хлор.
[0363] В некоторых вариантах осуществления соединение имеет структуру формулы V-A2:

где необязательно
(i) B представляет собой часть формулы II:
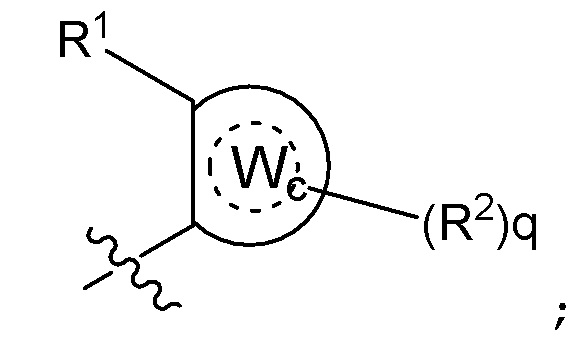
Формула II
и Wc представляет собой арил или циклоалкил, и/или
(ii) R3 представляет собой метил или хлор и, кроме того, где необязательно также применимо одно или несколько из следующих: (a) R9 представляет собой метил или этил, (b) B представляет собой замещенный или незамещенный фенил, (c) B представляет собой замещенный или незамещенный циклоалкил. В некоторых вариантах осуществления, где B представляет собой замещенный фенил, B замещен фтором. В некоторых вариантах осуществления B представляет собой фенил, который замещен одним атомом фтора в орто- или мета-положении фенильного кольца.
[0364] В некоторых вариантах осуществления соединение, используемое, как описано в настоящем описании, выбрано из

[0365] В некоторых вариантах осуществления соединение выбрано из


[0366] В некоторых вариантах осуществления соединение выбрано из
[0367] В некоторых вариантах осуществления ингибитор PI3K имеет формулу, выбранную из группы, состоящей из:

[0368] В некоторых вариантах осуществления соединение представляет собой S-энантиомер, имеющий энантиомерную чистоту, выбранную из более чем приблизительно 55%, более чем приблизительно 80%, более чем приблизительно 90% и более чем приблизительно 95%.
[0369] В некоторых таких вариантах осуществления соединение выбрано из:

[0370] В некоторых вариантах осуществления ингибитор PI3K имеет формулу, выбранную из группы, состоящей из:

[0371] В определенных таких вариантах осуществления соединение представляет собой

[0372] В других таких вариантах осуществления соединение представляет собой

[0373] В других таких вариантах осуществления соединение представляет собой

[0374] В некоторых вариантах осуществления соединение имеет следующую структуру:
которое также обозначают в настоящем описании как соединение 292.
[0375] В некоторых вариантах осуществления используют полиморф соединения, описанного в настоящем описании. Иллюстративные полиморфы описаны в публикации патента США № 2012-0184568 ("публикация ’568"), которая включена в настоящее описание в качестве ссылки в полном объеме.
[0376] В одном варианте осуществления соединение представляет собой форму A соединения 292, как описано в публикации ’568. В другом варианте осуществления соединение представляет собой форму B соединения 292, как описано в публикации ’568. В другом варианте осуществления соединение представляет собой форму C соединения 292, как описано в публикации ’568. В другом варианте осуществления соединение представляет собой форму D соединения 292, как описано в публикации ’568. В другом варианте осуществления соединение представляет собой форму E соединения 292, как описано в публикации ’568. В другом варианте осуществления соединение представляет собой форму F соединения 292, как описано в публикации ’568. В другом варианте осуществления соединение представляет собой форму G соединения 292, как описано в публикации ’568. В другом варианте осуществления соединение представляет собой форму H соединения 292, как описано в публикации ’568. В другом варианте осуществления соединение представляет собой форму I соединения 292, как описано в публикации ’568. В другом варианте осуществления соединение представляет собой форму J соединения 292, как описано в публикации ’568.
[0377] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается кристаллический моногидрат свободного основания соединения 292, как описано, например, в заявке ’568. В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтически приемлемая форма соединения 292, которая представляет собой кристаллический моногидрат свободного основания соединения 292, как описано, например, в заявке ’568.
[0378] Любые из соединений (модуляторов PI3K), описанных в настоящем описании, могут быть в форме фармацевтически приемлемых солей, гидратов, сольватов, хелатов, нековалентных комплексов, изомеров, пролекарств, изотопно меченных производных или их смесей.
[0379] Химические структуры, описанные в настоящем описании, можно синтезировать в соответствии с иллюстративными способами, описанными в публикации патента США № US 2009/0312319, международной публикации патента № WO 2011/008302A1, и публикации патента США № 2012-0184568, каждая из которых включена в настоящее описание в качестве ссылки в полном объеме, и/или в соответствии со способами, известными в данной области.
Фармацевтические композиции
[0380] В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции, содержащие соединение, как описано в настоящем описании, или его энантиомер, смесь энантиомеров, или смесь двух или более диастереомеров, или его фармацевтически приемлемую форму (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), и фармацевтически приемлемый эксципиент, разбавитель или носитель, включая инертные твердые разбавители и наполнители, стерильный водный раствор и различные органические растворители, средства, усиливающие проникновение, солюбилизаторы и адъюванты. В некоторых вариантах осуществления фармацевтическая композиция, описанная в настоящем описании, включает второе активное вещество, такое как дополнительное лекарственное средство (например, химиотерапевтическое средство).
1. Составы
[0381] Фармацевтические композиции могут быть специально составлены для введения в твердой или жидкой форме, включая формы, адаптированные для следующего: пероральное введение, например, жидкие препараты (водные или неводные растворы или суспензии), таблетки (например, таблетки, предназначенные для буккального, сублингвального и системного всасывания), капсулы, болюсы, порошки, гранулы, пасты для нанесения на язык и интрадуоденальные способы; парентеральное введение, включая внутривенное, внутриартериальное, подкожное, внутримышечное, внутрисосудистое, внутрибрюшинное введение или инфузию в качестве, например, стерильного раствора или суспензии, или состава с замедленным высвобождением; местное применение, например, в качестве крема, мази, или пластыря с контролируемым высвобождением, или спрея, наносимого на кожу; интровагинально или интраректально, например, в качестве пессария, крема, стента или пены; сублингвально; глазным путем; легочным путем; местная доставка с помощью катетера или стента; интратекально или назально.
[0382] Примеры пригодных водных и неводных носителей, которые можно использовать в фармацевтических композициях, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), и подходящие их смеси, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Надлежащую текучесть можно поддерживать, например, путем использования покрывающих материалов, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий, и путем использования поверхностно-активных веществ.
[0383] Эти композиции также могут содержать адъюванты, такие как консерванты, смачивающие вещества, эмульгаторы, диспергирующие вещества, смазывающие вещества и/или антиоксиданты. Предупреждения действия микроорганизмов на соединения, описанные в настоящем описании, можно достигать путем включения различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Также может быть желательным включение в композиции обеспечивающих изотоничность средств, таких как сахара, хлорид натрия и т.п. Кроме того, пролонгированного всасывания инъецируемой фармацевтической формы можно достигать путем включения средств, которые замедляют всасывания, таких как моностеарат алюминия и желатин.
[0384] Способы получения этих составов или композиций включают стадию объединения соединения, описанного в настоящем описании, и/или химиотерапевтического средства, с носителем и, необязательно, одним или несколькими вспомогательными ингредиентами. Как правило, составы получают путем единообразного и равномерного объединения соединения, описанного в настоящем описании, с жидкими носителями или тонкоизмельченными твердыми носителями, или и с теми, и с другими, а затем, если необходимо, придания продукту формы.
[0385] Препараты для таких фармацевтических композиций хорошо известны в данной области. См., например, Anderson, Philip O.; Knoben, James E.; Troutman, William G, eds., Handbook of Clinical Drug Data, Tenth Edition, McGraw-Hill, 2002; Pratt and Taylor, eds., Principles of Drug Action, Third Edition, Churchill Livingston, New York, 1990; Katzung, ed., Basic and Clinical Pharmacology, Twelfth Edition, McGraw Hill, 2011; Goodman and Gilman, eds., The Pharmacological Basis of Therapeutics, Tenth Edition, McGraw Hill, 2001; Remingtons Pharmaceutical Sciences, 20th Ed., Lippincott Williams & Wilkins., 2000; Martindale, The Extra Pharmacopoeia, Thirty-Second Edition (The Pharmaceutical Press, London, 1999); все из которых включены в настоящее описание в качестве ссылок в полном объеме. За исключением случаев, когда какой-либо общепринятый эксципиент несовместим с соединениями, описанными в настоящем описании, например вследствие возникновения какого-либо нежелательного биологического эффекта или иного вредоносного взаимодействия с любым другим компонентом(ами) фармацевтически приемлемой композиции, предусматривается, что использование эксципиента входит в объем настоящего изобретения.
[0386] В некоторых вариантах осуществления концентрация одного или нескольких соединений, предоставленных в описанных фармацевтических композициях, равна или меньше чем приблизительно 100%, приблизительно 90%, приблизительно 80%, приблизительно 70%, приблизительно 60%, приблизительно 50%, приблизительно 40%, приблизительно 30%, приблизительно 20%, приблизительно 19%, приблизительно 18%, приблизительно 17%, приблизительно 16%, приблизительно 15%, приблизительно 14%, приблизительно 13%, приблизительно 12%, приблизительно 11%, приблизительно 10%, приблизительно 9%, приблизительно 8%, приблизительно 7%, приблизительно 6%, приблизительно 5%, приблизительно 4%, приблизительно 3%, приблизительно 2%, приблизительно 1%, приблизительно 0,5%, приблизительно 0,4%, приблизительно 0,3%, приблизительно 0,2%, приблизительно 0,1%, приблизительно 0,09%, приблизительно 0,08%, приблизительно 0,07%, приблизительно 0,06%, приблизительно 0,05%, приблизительно 0,04%, приблизительно 0,03%, приблизительно 0,02%, приблизительно 0,01%, приблизительно 0,009%, приблизительно 0,008%, приблизительно 0,007%, приблизительно 0,006%, приблизительно 0,005%, приблизительно 0,004%, приблизительно 0,003%, приблизительно 0,002%, приблизительно 0,001%, приблизительно 0,0009%, приблизительно 0,0008%, приблизительно 0,0007%, приблизительно 0,0006%, приблизительно 0,0005%, приблизительно 0,0004%, приблизительно 0,0003%, приблизительно 0,0002% или приблизительно 0,0001%, масс./масс., масс./об. или об./об.
[0387] В некоторых вариантах осуществления концентрация одного или нескольких соединений, описанных в настоящем описании, превышает приблизительно 90%, приблизительно 80%, приблизительно 70%, приблизительно 60%, приблизительно 50%, приблизительно 40%, приблизительно 30%, приблизительно 20%, приблизительно 19,75%, приблизительно 19,50%, приблизительно 19,25%, приблизительно 19%, приблизительно 18,75%, приблизительно 18,50%, приблизительно 18,25%, приблизительно 18%, приблизительно 17,75%, приблизительно 17,50%, приблизительно 17,25%, приблизительно 17%, приблизительно 16,75%, приблизительно 16,50%, приблизительно 16,25%, приблизительно 16%, приблизительно 15,75%, приблизительно 15,50%, приблизительно 15,25%, приблизительно 15%, приблизительно 14,75%, приблизительно 14,50%, приблизительно 14,25%, приблизительно 14%, приблизительно 13,75%, приблизительно 13,50%, приблизительно 13,25%, приблизительно 13%, приблизительно 12,75%, приблизительно 12,50%, приблизительно 12,25%, приблизительно 12%, приблизительно 11,75%, приблизительно 11,50%, приблизительно 11,25%, приблизительно 11%, приблизительно 10,75%, приблизительно 10,50%, приблизительно 10,25%, приблизительно 10%, приблизительно 9,75%, приблизительно 9,50%, приблизительно 9,25%, приблизительно 9%, приблизительно 8,75%, приблизительно 8,50%, приблизительно 8,25%, приблизительно 8%, приблизительно 7,75%, приблизительно 7,50%, приблизительно 7,25%, приблизительно 7%, приблизительно 6,75%, приблизительно 6,50%, приблизительно 6,25%, приблизительно 6%, приблизительно 5,75%, приблизительно 5,50%, приблизительно 5,25%, приблизительно 5%, приблизительно 4,75%, приблизительно 4,50%, приблизительно 4,25%, приблизительно 4%, приблизительно 3,75%, приблизительно 3,50%, приблизительно 3,25%, приблизительно 3%, приблизительно 2,75%, приблизительно 2,50%, приблизительно 2,25%, приблизительно 2%, приблизительно 1,75%, приблизительно 1,50%, приблизительно 1,25%, приблизительно 1%, приблизительно 0,5%, приблизительно 0,4%, приблизительно 0,3%, приблизительно 0,2%, приблизительно 0,1%, приблизительно 0,09%, приблизительно 0,08%, приблизительно 0,07%, приблизительно 0,06%, приблизительно 0,05%, приблизительно 0,04%, приблизительно 0,03%, приблизительно 0,02%, приблизительно 0,01%, приблизительно 0,009%, приблизительно 0,008%, приблизительно 0,007%, приблизительно 0,006%, приблизительно 0,005%, приблизительно 0,004%, приблизительно 0,003%, приблизительно 0,002%, приблизительно 0,001%, приблизительно 0,0009%, приблизительно 0,0008%, приблизительно 0,0007%, приблизительно 0,0006%, приблизительно 0,0005%, приблизительно 0,0004%, приблизительно 0,0003%, приблизительно 0,0002%, или приблизительно 0,0001%, масс./масс., масс./об. или об./об.
[0388] В некоторых вариантах осуществления концентрация одного или нескольких соединений, описанных в настоящем описании, находится в диапазоне от приблизительно 0,0001% до приблизительно 50%, от приблизительно 0,001% до приблизительно 40%, от приблизительно 0,01% до приблизительно 30%, от приблизительно 0,02% до приблизительно 29%, от приблизительно 0,03% до приблизительно 28%, от приблизительно 0,04% до приблизительно 27%, от приблизительно 0,05% до приблизительно 26%, от приблизительно 0,06% до приблизительно 25%, от приблизительно 0,07% до приблизительно 24%, от приблизительно 0,08% до приблизительно 23%, от приблизительно 0,09% до приблизительно 22%, от приблизительно 0,1% до приблизительно 21%, от приблизительно 0,2% до приблизительно 20%, от приблизительно 0,3% до приблизительно 19%, от приблизительно 0,4% до приблизительно 18%, от приблизительно 0,5% до приблизительно 17%, от приблизительно 0,6% до приблизительно 16%, от приблизительно 0,7% до приблизительно 15%, от приблизительно 0,8% до приблизительно 14%, от приблизительно 0,9% до приблизительно 12%, или от приблизительно 1% до приблизительно 10%, масс./масс., масс./об. или об./об.
[0389] В некоторых вариантах осуществления концентрация одного или нескольких соединений, как описано в настоящем описании, находится в диапазоне от приблизительно 0,001% до приблизительно 10%, от приблизительно 0,01% до приблизительно 5%, от приблизительно 0,02% до приблизительно 4,5%, от приблизительно 0,03% до приблизительно 4%, от приблизительно 0,04% до приблизительно 3,5%, от приблизительно 0,05% до приблизительно 3%, от приблизительно 0,06% до приблизительно 2,5%, от приблизительно 0,07% до приблизительно 2%, от приблизительно 0,08% до приблизительно 1,5%, от приблизительно 0,09% до приблизительно 1%, или от приблизительно 0,1% до приблизительно 0,9%, масс./масс., масс./об. или об./об.
[0390] В некоторых вариантах осуществления количество одного или нескольких соединений, описанных в настоящем описании, равно или меньше чем приблизительно 10 г, приблизительно 9,5 г, приблизительно 9,0 г, приблизительно 8,5 г, приблизительно 8,0 г, приблизительно 7,5 г, приблизительно 7,0 г, приблизительно 6,5 г, приблизительно 6,0 г, приблизительно 5,5 г, приблизительно 5,0 г, приблизительно 4,5 г, приблизительно 4,0 г, приблизительно 3,5 г, приблизительно 3,0 г, приблизительно 2,5 г, приблизительно 2,0 г, приблизительно 1,5 г, приблизительно 1,0 г, приблизительно 0,95 г, приблизительно 0,9 г, приблизительно 0,85 г, приблизительно 0,8 г, приблизительно 0,75 г, приблизительно 0,7 г, приблизительно 0,65 г, приблизительно 0,6 г, приблизительно 0,55 г, приблизительно 0,5 г, приблизительно 0,45 г, приблизительно 0,4 г, приблизительно 0,35 г, приблизительно 0,3 г, приблизительно 0,25 г, приблизительно 0,2 г, приблизительно 0,15 г, приблизительно 0,1 г, приблизительно 0,09 г, приблизительно 0,08 г, приблизительно 0,07 г, приблизительно 0,06 г, приблизительно 0,05 г, приблизительно 0,04 г, приблизительно 0,03 г, приблизительно 0,02 г, приблизительно 0,01 г, приблизительно 0,009 г, приблизительно 0,008 г, приблизительно 0,007 г, приблизительно 0,006 г, приблизительно 0,005 г, приблизительно 0,004 г, приблизительно 0,003 г, приблизительно 0,002 г, приблизительно 0,001 г, приблизительно 0,0009 г, приблизительно 0,0008 г, приблизительно 0,0007 г, приблизительно 0,0006 г, приблизительно 0,0005 г, приблизительно 0,0004 г, приблизительно 0,0003 г, приблизительно 0,0002 г, или приблизительно 0,0001 г.
[0391] В некоторых вариантах осуществления количество одного или нескольких соединений, описанных в настоящем описании, составляет более чем приблизительно 0,0001 г, приблизительно 0,0002 г, приблизительно 0,0003 г, приблизительно 0,0004 г, приблизительно 0,0005 г, приблизительно 0,0006 г, приблизительно 0,0007 г, приблизительно 0,0008 г, приблизительно 0,0009 г, приблизительно 0,001 г, приблизительно 0,0015 г, приблизительно 0,002 г, приблизительно 0,0025 г, приблизительно 0,003 г, приблизительно 0,0035 г, приблизительно 0,004 г, приблизительно 0,0045 г, приблизительно 0,005 г, приблизительно 0,0055 г, приблизительно 0,006 г, приблизительно 0,0065 г, приблизительно 0,007 г, приблизительно 0,0075 г, приблизительно 0,008 г, приблизительно 0,0085 г, приблизительно 0,009 г, приблизительно 0,0095 г, приблизительно 0,01 г, приблизительно 0,015 г, приблизительно 0,02 г, приблизительно 0,025 г, приблизительно 0,03 г, приблизительно 0,035 г, приблизительно 0,04 г, приблизительно 0,045 г, приблизительно 0,05 г, приблизительно 0,055 г, приблизительно 0,06 г, приблизительно 0,065 г, приблизительно 0,07 г, приблизительно 0,075 г, приблизительно 0,08 г, приблизительно 0,085 г, приблизительно 0,09 г, приблизительно 0,095 г, приблизительно 0,1 г, приблизительно 0,15 г, приблизительно 0,2 г, приблизительно 0,25 г, приблизительно 0,3 г, приблизительно 0,35 г, приблизительно 0,4 г, приблизительно 0,45 г, приблизительно 0,5 г, приблизительно 0,55 г, приблизительно 0,6 г, приблизительно 0,65 г, приблизительно 0,7 г, приблизительно 0,75 г, приблизительно 0,8 г, приблизительно 0,85 г, приблизительно 0,9 г, приблизительно 0,95 г, приблизительно 1 г, приблизительно 1,5 г, приблизительно 2 г, приблизительно 2,5 г, приблизительно 3 г, приблизительно 3,5 г, приблизительно 4 г, приблизительно 4,5 г, приблизительно 5 г, приблизительно 5,5 г, приблизительно 6 г, приблизительно 6,5 г, приблизительно 7 г, приблизительно 7,5 г, приблизительно 8 г, приблизительно 8,5 г, приблизительно 9 г, приблизительно 9,5 г или приблизительно 10 г.
[0392] В некоторых вариантах осуществления количество одного или нескольких соединений, описанных в настоящем описании, находится в диапазоне от приблизительно 0,0001 до приблизительно 10 г, от приблизительно 0,0005 до приблизительно 5 г, от приблизительно 0,001 до приблизительно 1 г, от приблизительно 0,002 до приблизительно 0,5 г, от 0,005 до приблизительно 0,5 г, от приблизительно 0,01 до приблизительно 0,1 г, от приблизительно 0,01 до приблизительно 0,05 г, или от приблизительно 0,05 до приблизительно 0,1 г.
1A. Составы для перорального введения
[0393] В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для перорального введения, содержащие соединение, описанное в настоящем описании, и фармацевтический эксципиент, пригодный для перорального введения. В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для перорального введения, содержащие: (i) эффективное количество описанного соединения; необязательно (ii) эффективное количество одного или нескольких вторых средств; и (iii) один или несколько фармацевтических эксципиентов, пригодных для перорального введения. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит: (iv) эффективное количество третьего средства.
[0394] В некоторых вариантах осуществления фармацевтическая композиция может представлять собой жидкую фармацевтическую композицию, пригодную для перорального употребления. Фармацевтические композиции, пригодные для перорального введения, могут быть предоставлены в качестве дискретных дозированных форм, таких как капсулы, крахмальные капсулы или таблетки, или жидкости или аэрозольные спреи, каждый из которых содержит заданное количество активного ингредиента в качестве порошка, или в гранулах, растворе или суспензии в водной или неводной жидкости, эмульсии типа "масло в воде", или жидкой эмульсии типа "вода в масле". Такие дозированные формы можно получать любыми способами фармацевтики, однако все способы включают стадию объединения активного ингредиента с носителем, который составляет один или несколько ингредиентов. Как правило, фармацевтические композиции получают путем единообразного и равномерного смешения активного ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями или и с теми, и с другими, а затем, если необходимо, придания продукту желательной формы. Например, таблетку можно получать путем прессования или формования, необязательно с одним или несколькими дополнительными ингредиентами. Прессованные таблетки можно получать путем прессования в подходящем устройстве активного ингредиента в свободнотекущей форме, такой как порошок или гранулы, необязательно смешанного с эксципиентом, таким как, но не ограничиваясь ими, связующее вещество, смазывающее вещество, инертный разбавитель и/или поверхностно-активное или диспергирующее вещество. Формованные таблетки можно получать путем формования в подходящем устройстве смеси порошкового соединения, смоченного инертным жидким разбавителем.
[0395] Кроме того, настоящее изобретение относится к безводным фармацевтическим композициям и дозированным формам, содержащим активный ингредиент, поскольку вода может способствовать деградации некоторых соединений. Например, в фармацевтике можно добавлять воду (например, приблизительно 5%) в качестве средства для имитации длительного хранения, чтобы определить характеристики, такие как срок хранения и стабильность составов с течением времени. Безводные фармацевтические композиции и дозированные формы можно получать с использованием безводных ингредиентов или ингредиентов с низким содержанием влаги и низкой сырости или низкой влажности. Например, фармацевтические композиции и дозированные формы, которые содержат лактозу, можно изготавливать безводными, если ожидается существенный контакт с сыростью и/или влажностью во время производства, упаковывания и/или хранения. Безводную фармацевтическую композицию можно изготавливать и хранить таким образом, чтобы сохранить ее безводную природу. Таким образом, безводные фармацевтические композиции можно упаковывать с использованием материалов, о которых известно, что они предохраняют от воздействия воды, так чтобы их можно было включать в подходящие наборы с составами. Примеры подходящих упаковок включают, но не ограничиваются ими, герметичную фольгу, пластмассы и т.п., контейнеры для единичной дозы, блистерные упаковки и контурные упаковки.
[0396] Активный ингредиент можно комбинировать в однородной смеси с фармацевтическим носителем в соответствии с общепринятым способом составления фармацевтических препаратов. Носитель может иметь множество форм в зависимости от желаемой формы препарата, для введения. При получении фармацевтических композиций для пероральных дозированных форм, в качестве носителей можно использовать любую из обычных фармацевтических сред, например, такую как вода, гликоли, масла, спирты, вкусовые добавки, консерванты, красители и т.п. в случае пероральных жидких препаратов (таких как суспензии, растворы и эликсиры) или аэрозолей; или в случае твердых препаратов можно использовать носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие вещества, смазывающие вещества, связующие вещества и дезинтегрирующие вещества, в некоторых вариантах осуществления без использования лактозы. Например, пригодные носители включают порошки, капсулы и таблетки с твердыми пероральными препаратами. В некоторых вариантах осуществления таблетки могут быть покрыты стандартными водными или неводными способами.
[0397] Связующие вещества, пригодные для применения в фармацевтических композициях и дозированных формах включают, но не ограничиваются ими, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как гуммиарабик, альгинат натрия, альгиновая кислота, другие альгинаты, порошковый трагакант, гуаровая камедь, целлюлозу и ее производные (например, этилцеллюлоза, ацетат целлюлозы, кальций-карбоксиметилцеллюлоза, натрий-карбоксиметилцеллюлоза), поливинилпирролидон, метилцеллюлозу, преджелатинизированный крахмал, гидроксипропилметилцеллюлозу, микрокристаллическаяцеллюлозу и их смеси.
[0398] Примеры пригодных наполнителей для применения в фармацевтических композициях и дозированных формах, описанных в настоящем описании, включают, но не ограничиваются ими, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошковую целлюлозу, декстраты, каолин, маннит, кремниевую кислоту, сорбит, крахмал, прежелатинизированный крахмал и их смеси.
[0399] Дезинтегрирующие средства можно использовать в фармацевтических композициях, описанных в настоящем описании, для обеспечения таблеток, которые дезинтегрируют под воздействием водной среды. Слишком много дезинтегрирующего средства может обеспечить таблетки, которые могут дезинтегрировать в бутылке. Слишком мало может быть недостаточно для дезинтеграции и, таким образом, это может изменять скорость и степень высвобождения активного ингредиента(ов) из дозированной формы. Таким образом, для получения дозированных форм соединений, описанных в настоящем описании, можно использовать достаточное количество дезинтегрирующего средства, которое не является ни слишком малым, ни слишком большим, чтобы негативным образом изменить высвобождение активного ингредиента(ов). Используемое количество дезинтегрирующего средства может варьировать в зависимости от типа состава и способа введения, и его может без труда определить специалист в данной области. В фармацевтической композиции можно использовать от приблизительно 0,5 до приблизительно 15 процентов по массе дезинтегрирующего средства, или от приблизительно 1 до приблизительно 5 процентов по массе дезинтегрирующего средства. Дезинтегрирующие средства, которые можно использовать для получения фармацевтических композиций и дозированных форм, включают, но не ограничиваются ими, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, натрий-кроскармеллозу, кросповидон, полакрилин-калий, натрия крахмала гликолят, картофельный и маниоковый крахмал, другие крахмалы, прежелатинизированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди или их смеси.
[0400] Смазывающие вещества, которые можно использовать для получения фармацевтических композиций и дозированных форм, включают, но не ограничиваются ими, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрогенизированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллаурат, агар или их смеси. Дополнительные смазывающие вещества включают, например, силоидный силикагель, коагулированный аэрозоль из синтетического диокида кремния или их смеси. Смазывающее вещество необязательно можно добавлять в количестве, составляющем менее чем приблизительно 1 процент по массе фармацевтической композиции.
[0401] Когда для перорального введения являются желательными водные суспензии и/или эликсиры, активный ингредиент в них можно комбинировать с различными подсластителями или вкусовыми добавками, красящим веществом или пигментами и, например, эмульгирующими и/или суспендирующими веществами, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их различные комбинации.
[0402] Таблетки могут быть непокрытыми или покрытыми известными способами для замедления дезинтеграции и всасывания в желудочно-кишечном тракте и, тем самым, обеспечения замедленного действия в течение более длительного периода времени. Например, можно использовать задерживающий материал, такой как глицерилмоностеарат или глицерилдистеарат. Составы для перорального применения также могут присутствовать в качестве твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в качестве мягких желатиновых капсул, где активный ингредиент смешан с водой или масляным носителем, например, арахисовым маслом, вазелиновым маслом или оливковым маслом.
[0403] Поверхностно-активное вещество, которое можно использовать для получения фармацевтических композиций и дозированных форм, включает, но не ограничивается ими, гидрофильные поверхностно-активные вещества, липофильные поверхностно-активные вещества и их смеси. Следовательно, можно использовать смесь гидрофильных поверхностно-активных веществ, можно использовать смесь липопофильных поверхностно-активных веществ или можно использовать смесь по меньшей мере одного гидрофильного поверхностно-активного вещества и по меньшей мере одного липофильного поверхностно-активного вещества.
[0404] Подходящее гидрофильное поверхностно-активное вещество, как правило, может иметь величину HLB по меньшей мере приблизительно 10, в то время как подходящие липофильные поверхностно-активные вещества могут иметь величину HLB, равную или меньшую чем приблизительно 10. Эмперическим параметром, используемым для охарактеризации относительной гидрофильности и гидрофобности неионных амфифильных соединений, является гидрофильное-липофильное равновесие ("величина HLB"). Поверхностно-активные вещества с более низкими величинами HLB являются более липофильными или гидрофобными и имеют более высокую растворимость в маслах, в то время как поверхностно-активные вещества с более высокими величинами HLB являются более липофильными и имеют более высокую растворимость в водных растворах. Гидрофильными поверхностно-активными веществами, как правило, считаются соединения, имеющие величину HLB, превышающую приблизительно 10, а также анионные, катионные или цвиттерионные соединения, для которых шкала HLB обычно не применима. Аналогично, липофильные (т.е. гидрофобные) поверхностно-активные вещества представляют собой соединения, имеющие величину HLB, равную или меньшую чем приблизительно 10. Однако величина HLB поверхностно-активного вещества является только приближенным показателем, обычно используемым для обеспечения составления промышленных, фармацевтических и косметических эмульсий.
[0405] Гидрофильные поверхностно-активные вещества могут быть либо ионными, либо неионными. Подходящие ионные поверхностно-активные вещества включают, но не ограничиваются ими, соли алкиламмония; соли фусидовой кислоты; производные аминокислот, олигопептидов и полипептидов с жирными кислотами; глицеридные производные аминокислот, олигопептидов и полипептидов; лецитины и гидрогенизированные лецитины; лизолецитины и гидрогенизированные лизолецитины; фосфолипиды и их производные; лизофосфолипиды и их производные; соли сложных эфиров карнитина и жирных кислот; соли алкилсульфатов; соли жирных кислот; докузат натрия; ацилактилаты; моно- и диацетилированные сложные эфиры виннокаменной кислоты и моно- и диглицеридов; сукцинилированные моно- и диглицериды; сложные эфиры лимонной кислоты и моно- и диглицеридов; и их смеси.
[0406] В упомянутой выше группе ионные поверхностно-активные вещества включают, в качестве примера: лецитины, лизолецитин, фосфолипиды, лизофосфолипиды и их производные; соли сложного эфира карнитина и жирных кислот; соли алкилсульфатов; соли жирных кислот; докузат натрия; ацилактилаты; моно- и диацетилированные сложные эфиры виннокаменной кислоты и моно- и диглицеридов; сукцинилированные моно- и диглицериды; сложные эфиры лимонной кислоты и моно- и диглицеридов; и их смеси.
[0407] Ионные поверхностно-активные вещества могут представлять собой ионизированные формы лецитина, лизолецитина, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилглицерина, фосфатидной кислоты, фосфатидилсерина, лизофосфатидилхолина, лизофосфатидилэтаноламина, лизофосфатидилглицерина, лизофосфатидной кислоты, лизофосфатидилсерина, PEG-фосфатидилэтаноламина, PVP-фосфатидилэтаноламина, лактиловые сложные эфиры жирных кислот, стеароил-2-лактилат, стеароиллактилат, сукцинилированные моноглицериды, моно/диацетилированные сложные эфиры виннокаменной кислоты и моно/диглицеридов, сложные эфиры лимонной кислоты и моно/диглицеридов, холилсаркозин, капроат, каприлат, капрат, лаурат, миристат, пальмитат, олеат, рицинолеат, линолеат, линоленат, стеарат, лаурилульфат, терацецилсульфат, докузат, лауроилкарнитины, пальмитоилкарнитины, миристоилкарнитины, и их соли и смеси.
[0408] Гидрофобные неионные поверхностно-активные вещества могут включать, но не ограничиваться ими, алкилглюкозиды; алкилмальтозиды; алкилтиоглюкозиды; лаурилмакроголглицериды; алкиловые эфиры полиоксиалкилена, такие как алкиловые эфиры полиэтиленгликоля; полиоксиалкиленалкилфенолы, такие как полиэтиленгликольалкилфенолы; сложные эфиры полиоксиалкиленалкилфенола и жирных кислот, такие как сложные моноэфиры полиэтиленгликоля и жирных кислот и сложные диэфиры полиэтиленгликоля и жирных кислот; сложные эфиры полиэтиленгликоля глицерина и жирных кислот; сложные эфиры полиглицерина и жирных кислот; сложные эфиры полиоксиалкилена сорбитана и жирных кислот, такие как сложные эфиры полиэтиленгликоля сорбитана и жирных кислот; гидрофильные продукты трансэтерификации полиола с по меньшей мере одним представителем из глицеридов, растительных масел, гидрогенизированных растительных масел, жирных кислот и стеролов; полиоксиэтиленстеролы, их производные и аналоги; полиоксиэтилированные витамины и их производные; блок-сополимеры полиоксиэтилен-полиоксипропилен; и их смеси; сложные эфиры полиэтиленгликоля сорбитана и жирных кислот и гидрофильные продукты трансэтерификации полиола с по меньшей мере одним представителем из триглицеридов, растительных масел и гидрогенизированных растительных масел. Полиол может представлять собой глицерин, этиленгликоль, полиэтиленгликоль, сорбит, пропиленгликоль, пентаэритрит или сахарид.
[0409] Другие гидрофильные неионные поверхностно-активные вещества включают, но не ограничиваются ими, PEG-10 лаурат, PEG-12 лаурат, PEG-20 лаурат, PEG-32 лаурат, PEG-32 дилаурат, PEG-12 олеат, PEG-15 олеат, PEG-20 олеат, PEG-20 диолеат, PEG-32 олеат, PEG-200 олеат, PEG-400 олеат, PEG-15 стеарат, PEG-32 дистеарат, PEG-40 стеарат, PEG-100 стеарат, PEG-20 дилаурат, PEG-25 глицерилтриолеат, PEG-32 диолеат, PEG-20 глицериллаурат, PEG-30 глицериллаурат, PEG-20 глицерилстеарат, PEG-20 глицерилолеат, PEG-30 глицерилолеат, PEG-30 глицериллаурат, PEG-40 глицериллаурат, PEG-40 пальмоядровое масло, PEG-50 гидрогенизированное касторовое масло, PEG-40 касторовое масло, PEG-35 касторовое масло, PEG-60 касторовое масло, PEG-40 гидрогенизированное касторовое масло, PEG-60 гидрогенизированное касторовое масло, PEG-60 кукурузное масло, PEG-6 капратные/каприлатные глицериды, PEG-8 капратные/каприлатные глицериды, полиглицерил-10 лаурат, PEG-30 холестерин, PEG-25 фитостерин, PEG-30 соевый стерин, PEG-20 триолеат, PEG-40 сорбитан олеат, PEG-80 сорбитан лаурат, полисорбат 20, полисорбат 80, POE-9 лауриловый простой эфир, POE-23 лауриловый простой эфир, POE-10 олеиловый простой эфир, POE-20 олеиловый простой эфир, POE-20 стеариловый простой эфир, токоферил PEG-100 сукцинат, PEG-24 холестерин, полиглицерил-10 олеат, Tween 40, Tween 60, моностеарат сахарозы, монолаурат сахарозы, монопальмитат сахарозы, серия PEG 10-100 нонилфенолов, серия PEG 15-100 октилфенолов и полоксамеры.
[0410] Пригодные липофильные поверхностно-активные вещества включают, только в качестве примера: жирные спирты; сложные эфиры глицерина и жирных кислот; ацетилированные сложные эфиры глицерина и жирных кислот; сложные эфиры низших спиртов и жирных кислот; сложные эфиры пропиленгликоля и жирных кислот; сложные эфиры сорбитана и жирных кислот; сложные эфиры полиэтиленгликоля и жирных кислот; стерины и производные стеринов; полиоксиэтилированные стерины и производные стеринов; алкиловые простые эфиры полиэтиленгликоля; сложные эфиры сахаров; простые эфиры сахаров; производные молочной кислоты и моно- и диглицеридов; гидрофобные продукты трансэтерификации полиола с по меньшей мере одним представителем из глицеридов, растительных масел, гидрогенизированных растительных масел, жирных кислот и стеринов; жирорастворимые витамины/производные витаминов; и их смеси. В этой группе неограничивающие примеры липофильных поверхностно-активных веществ включают сложные эфиры глицерина и жирных кислот, сложные эфиры пропиленгликоля и жирных кислот, и их смеси, или гидрофобные продукты трансэтерификации полиола с по меньшей мере одним представителем растительных масел, гидрогенизированных растительных масел и триглицеридов.
[0411] В одном варианте осуществления фармацевтическая композиция может включать солюбилизатор для обеспечения хорошей солюбилизации и/или растворения соединения, описанного в настоящем описании, для минимизации осаждения соединения. Это может быть особенно важным для фармацевтических композиций для неперорального применения, например, фармацевтических композиций для инъекции. Солюбилизатор также можно добавлять для увеличения растворимости гидрофильного лекарственного средства и/или других компонентов, таких как поверхностно-активные вещества, или для поддержания фармацевтической композиции в качестве стабильного или гомогенного раствора или дисперсии.
[0412] Примеры пригодных солюбилизаторов включают, но не ограничиваются ими, следующие: спирты и полиолы, такие как этанол, изопропанол, бутанол, бензиловый спирт, этиленгликоль, пропиленгликоль, бутандиолы и их изомеры, глицерин, пентаэритрит, сорбит, маннит, транскутол, диметилизосорбит, полиэтиленгликоль, полипропиленгликоль, поливиниловый спирт, гидроксипропилметилцеллюлозу и другие производные целлюлозы, циклодекстрины и производные циклодекстринов; простые эфиры полиэтиленгликолей, имеющие среднюю молекулярную массу от приблизительно 200 до приблизительно 6000, такие как простой эфир тетрагидрофурилового спирта и PEG (гликофурол) или метокси-PEG; амиды и другие азотсодержащие соединения, такие как 2-пирролидон, 2-пиперидон, ε-капролактам, N-алкилпирролидон, N-гидроксиалкилпирролидон, N-алкилпиперидон, N-алкилкапролактам, диметилацетамид и поливинилпирролидон; сложные эфиры, такие как этилпропионат, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, триэтилцитрат, этилолеат, этилкаприлат, этилбутират, триацетин, пропиленгликоль моноацетат, пропиленгликоль диацетат, ε-капролактон и его изомеры, δ-валеролактон и его изомеры, β-бутиролактон и его изомеры; и другие солюбилизаторы, известные в данной области, такие как диметилацетамид, диметилизосорбит, N-метилпирролидоны, монооктаноин, моноэтиловый эфир диэтиленгликоля и вода.
[0413] Также можно использовать смеси солюбилизаторов. Примеры включают, но не ограничиваясь ими, триацетин, триэтилцитрат, этилолеат, этилкаприлат, диметилацетамид, N-метилпирролидон, N-гидроксиэтилпирролидон, поливинилпирролидон, гидроксипропилметилцеллюлозу, гидроксипропилциклодекстрины, этанол, полиэтиленгликоль 200-100, гликофурол, транскутол, пропиленгликоль и диметилизосорбит. В некоторых вариантах осуществления солюбилизаторы включают сорбит, глицерин, триацетин, этиловый спирт, PEG-400, гликофурол и пропиленгликоль.
[0414] Количество солюбилизатора, которое может быть включено, конкретно не ограничено. Количество данного солюбилизатора может быть ограничено биологически приемлемым количеством, которое может без труда определить специалист в данной области. В некоторых случаях, может быть преимущественным включение количеств солюбилизаторов, значительно превышающих биологически приемлемые количества, например, для максимизации концентрации лекарственного средства, с удалением избытка солюбилизатора перед предоставлением фармацевтической композиции индивидууму с использованием общепринятых способов, таких как перегонка и выпаривание. Таким образом, солюбилизатор, если он присутствует, может находиться в массовом соотношении приблизительно 10%, 25%, 50%, 100% или вплоть до приблизительно 200% по массе, исходя из совокупной массы лекарственного средства и других эксципиентов. Если желательно, также можно использовать очень небольшие количества солюбилизатора, такие как приблизительно 5%, 2%, 1% или даже менее. Как правило, солюбилизатор может присутствовать в количестве от приблизительно 1% до приблизительно 100%, более конкретно от приблизительно 5% до приблизительно 25% по массе.
[0415] Фармацевтическая композиция, кроме того, может включать одну или несколько фармацевтически приемлемых добавок и эксципиентов. Такие добавки и эксципиенты включают, но не ограничиваются ими, средства для устранения клейкости, противопенообразователи, буферные средства, полимеры, антиоксиданты, консерванты, хелатирующие агенты, модуляторы вязкости, изменяющие тоничность средства, вкусовые добавки, красители, масла, отдушки, замутнители, суспендирующие вещества, связующие вещества, наполнители, пластификаторы, смазывающие вещества и их смеси.
[0416] Иллюстративные консерванты могут включать антиоксиданты, хелатирующие агенты, противомикробные консерванты, противогрибковые консерванты, спиртовые консерванты, кислотные консерванты и другие консерванты. Иллюстративные антиоксиданты включают, но не ограничиваются ими, альфа-токоферол, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, монотиоглицерин, метабисульфит калия, пропионовую кислоту, пропилгаллат, аскорбат натрия, бисульфит натрия, метабисульфит натрия и сульфит натрия. Иллюстративные хелатирующие агенты включают этилендиаминтетрауксусную кислоту (EDTA), моногидрат лимонной кислоты, динатрий эдетат, дикалий эдетат, эдетовую кислоту, фумарову кислоту, яблочную кислоту, фосфорную кислоту, эдетат натрия, виннокаменную кислоту и тринатрий эдетат. Иллюстративные противомикробные консерванты включают, но не ограничиваются ими, хлорид бензалкония, хлорид бензэтония, бензиловый спирт, бронопол, цетримид, хлорид цетилпиридиния, хлоргексидин, хлорбутанол, хлоркрезол, хлорксиленол, крезол, этиловый спирт, глицерин, гексетидин, имидмочевину, фенол, феноксиэтанол, фенилэтиловый спирт, нитрат фенилртути, пропиленгликоль и тимеросал. Иллюстративные противогрибковые консерванты включают, но не ограничиваются ими, бутилпарабен, метилпарабен, этилпарабен, пропилпарабен, бензойную кислоту, гидроксибензойную кислоту, бензоат калия, сорбат калия, бензоат натрия, пропионат натрия и сорбиновую кислоту. Иллюстративные спиртовые консерванты включают, но не ограничиваются ими, этанол, полиэтиленгликоль, фенол, фенольные соединения, бисфенол, хлорбутанол, гидроксибензоат и фенилэтиловый спирт. Иллюстративные кислотные консерванты включают, но не ограничиваются ими, витамин A, витамин C, витамин E, бета-каротин, лимонную кислоту, уксусную кислоту, дегидроуксусную кислоту, аскорбиновую кислоту, сорбиновую кислоту и фитиновую кислоту. Другие консерванты включают, но не ограничиваются ими, токоферол, токоферола ацетат, детероксима мезилат, цетримид, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), этилендиамин, лаурилсульфат натрия (SLS), сульфат натрий-лаурилового простого эфира (SLES), бисульфит натрия, метабисульфит натрия, сульфит калия, метабисульфит калия, Glydant Plus, Phenonip, метилпарабен, Germall 115, Germaben II, Neolone, Kathon и Euxyl. В определенных вариантах осуществления консервант представляет собой антиоксидант. В других вариантах осуществления консервант представляет собой хелатирующий агент.
[0417] Иллюстративные масла включают, но не ограничиваются ими, миндальное масло, масло косточек абрикоса, масло авокадо, масло бабассу, бергамотовое масло, мало семян черной смородины, масло бурачника, можжевеловое масло, масло ромашки, масло канолы, масло тмина, масло карнаубы, касторовое масло, коричное масло, масло какао, кокосовое масло, жир печени трески, масло кофе, кукурузное масло, хлопковое масло, жир эму, эвакалиптовое масло, масло энотеры, рыбий жир, льняное масло, масло гераниола, масло горлянки, масло виноградных косточек, масло фундука, массло иссопа, изопропилмиристат, масло хохобы, масло лакового дерева, масло лавандина, масло лаванды, масло лимона, масло лицеа кубеба, масло орехов макадамия, масло просвирника, масло семян манго, масло семян пенника лугового, норковый жир, масло мускатного ореха, оливковое масло, апельсиновое масло, жир исландского берикса, пальмовое масло, пальмоядровое масло, масло из персиковых косточек, арахисовое масло, масло семян мака, масло тыквенных семян, рапсовое масло, масло из рисовых отрубей, розмариновое масло, сафлоровое масло, масло сандалового дерева, масло сасанквы, масло чабера, облепиховое масло, кунжутное масло, масло из семян дерева ши, кремниевое масло, соевое масло, подсолнечное масло, масло чайного дерева, масло чертополоха, масло цубаки, масло ветивера, масло грецкого ореха и масло ростков пшеницы. Иллюстративне масла также включают, но не ограничиваются ими, бутилстеарат, каприловый триглицерид, каприновый триглицерид, циклометикон, диэтилсебакат, диметикон 360, изопропилмиристат, минеральное масло, октилдодеканол, олеиловый спирт, силиконовое масло и их комбинации.
[0418] Кроме того, в фармацевтическую композицию можно включать кислоту или основание для облегчения переработки, для повышения стабильности или по другим причинам. Примеры фармацевтически приемлемых оснований включают аминокислоты, сложные эфиры аминокислот, гидроксид аммония, гидроксид калия, гидроксид натрия, гидрокарбонат натрия, гидроксид алюминия, карбонат кальция, гидроксид магния, алюмосиликат магния, синтетический алюмосиликат, синтетический гидрокальцит, гидроксид магния алюминия, диизопропилэтиламин, этаноламин, этилендиамин, триэтаноламин, триэтиламин, триизопропаноламин, триметиламин, трис(гидроксиметил)аминометан (TRIS) и т.п. Также являются пригодными основания, которые представляют собой соли фармацевтически приемлемой кислоты, такой как уксусная кислота, акриловая кислота, адипиновая кислота, альгиновая кислота, алкансульфоновая кислота, аминокислоты, аскорбиновая кислота, бензойная кислота, борная кислота, масляная кислота, угольная кислота, лимонная кислота, жирные кислоты, муравьиная кислота, фумаровая кислота, глюконовая кислота, гидрохиносульфоновая кислота, изоаскорбиновая кислота, молочная кислота, малеиновая кислота, щавелевая кислота, пара-бромфенилсульфоновая кислота, пропионовая кислота, п-толуолсульфоновая кислота, салициловая кислота, стеариновая кислота, янтарная кислота, дубильная кислота, виннокаменная кислота, тиогликолевая кислота, толуолсульфоновая кислота, мочевая кислота, и т.п. Также можно использовать соли многоосновных кислот, такие как фосфат натрия, гидрофосфат натрия, и дигидрофосфат натрия. Когда основание представляет собой соль, катион может представлять собой любой удобный и фармацевтически приемлемый катион, такой как аммоний, щелочные металлы, щелочноземельные металлы и т.п. Примеры могут включать, но не ограничиваться ими, натрий, калий, литий, магний, кальций и аммоний.
[0419] Пригодными кислотами являются фармацевтически приемлемые органические или неорганические кислоты. Примеры пригодных неорганических кислот включают хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, азотную кислоту, борную кислоту, фосфорную кислоту и т.п. Примеры пригодных органических кислот включают уксусную кислоту, акриловую кислоту, адипиновую кислоту, альгиновую кислоту, алкансульфоновые кислоты, аминокислоты, аскорбиновую кислоту, бензойную кислоту, борную кислоту, масляную кислоту, угольную кислоту, лимонную кислоту, жирные кислоты, муравьиную кислоту, фумаровую кислоту, глюконовую кислоту, гидрохиносульфоновую кислоту, изоаскорбиновую кислоту, молочную кислоту, малеиновую кислоту, метансульфоновую кислоту, щавелевую кислоту, пара-бромфенилсульфоновую кислоту, пропионовую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту, стеариновую кислоту, янтарную кислоту, дубильную кислоту, виннокаменную кислоту, тиогликолевую кислоту, толуолсульфоновую кислоту, мочевую кислоту и т.п.
1B. Составы для парентерального введения
[0420] В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для парентерального введения, содержащие соединение, описанное в настоящем описании, и фармацевтический эксципиент, пригодный для парентерального введения. В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для парентерального введения, содержащие: (i) эффективное количество описанного соединения; необязательно (ii) эффективное количество одного или нескольких вторых средств; и (iii) один или несколько фармацевтических эксципиентов, пригодных для парентерального введения. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит: (iv) эффективное количество третьего средства.
[0421] Формы, в которых описанные фармацевтические композиции могут быть включены для введения путем инъекции, включают водные или масляные суспензии или эмульсии с кунжутным маслом, кукурузным маслом, хлопковым маслом или арахисовым маслом, а также эликсиры, маннит, декстрозу, или стерильный водный и сходные фармацевтические носители.
[0422] Также обычно для инъекции используют водные растворы в солевом растворе. Также можно использовать этанол, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п. (и их подходящие смеси), производные циклодекстрина и растительные масла.
[0423] Также для инъекции обычно используют водные растворы в солевом растворе. Также можно использовать этанол, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п. (и их подходящие смеси), производные циклодекстрина и растительные масла. Надлежащую текучесть можно поддерживать, например, с использованием покрытия, такого как лецитин, для поддержания требуемого размера частиц в случае дисперсии и с использованием поверхностно-активных веществ. Предупреждения действия микроорганизмов можно достигать с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п.
[0424] Стерильные инъецируемые растворы получают путем включения соединения, как описано в настоящем описании, в требуемом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, в зависимости от ситуации, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают путем включения различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и соответствующие другие ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, определенные способы получения представляют собой способы вакуумной сушки и лиофилизации, которые обеспечивают порошок активного ингредиента вместе с каким-либо дополнительным ингредиентом из их ранее подвергнутого стерилизации фильтрованием раствора.
[0425] Инъецируемые составы можно стерилизовать, например, путем фильтрации через задерживающий бактерии фильтр или путем включения стерилизующих агентов в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной инъекционной среде перед применением. Инъецируемые композиции могут содержать от приблизительно 0,1 до приблизительно 5% масс./масс. соединения, описанного в настоящем описании.
1C. Составы для местного введения
[0426] В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для местного (например, трансдермального) введения, содержащие соединение, описанное в настоящем описании, и фармацевтический эксципиент, пригодный для местного введения. В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для местного введения, содержащие: (i) эффективное количество описанного соединения; необязательно (ii) эффективное количество одного или нескольких вторых средств; и (iii) один или несколько фармацевтических эксципиентов, пригодных для местного введения. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит: (iv) эффективное количество третьего средства.
[0427] Фармацевтические композиции, описанные в настоящем описании, можно составлять в препараты в твердых, полутвердых или жидких формах, пригодных для локального или местного введения, таких как гели, растворимые в воде желе, кремы, лосьоны, суспензии, пены, порошки, взвеси, мази, растворы, масла, пасты, суппозитории, спреи, эмульсии, солевые растворы, растворы на основе диметилсульфоксида (DMSO). Как правило, носители с более высокой плотностью способны обеспечивать пролонгированное воздействие активных ингредиентов на область. Напротив, состав раствора может обеспечить немедленное воздействие активного ингредиента на выбранную область.
[0428] Фармацевтические композиции также могут содержать подходящие твердые или гелеобразные носители или эксципиенты, которые представляют собой соединения, которые обеспечивают увеличенное проникновение или способствуют доставке терапевтических молекул через барьер проницаемости кожи в виде рогового слоя. Существует множество таких усиливающих проникновение молекул, известных специалисту в области составов для местного введения. Примеры таких носителей и эксципиентов включают, но не ограничиваются ими, увлажнители (например, мочевина), гликоли (например, пропиленгликоль), спирты (например, этанол), жирные кислоты (например, олеиновая кислота), поверхностно-активные вещества (например, изопропилмиристат и лаурилсульфат натрия), пирролидоны, монолаурат глицерина, сульфоксиды, терпены (например, ментол), амины, амиды, алканы, алканолы, воду, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
[0429] В другом иллюстративном составе для применения в описанных способах используются устройства для трансдермальной доставки ("пластыри"). Такие трансдермальные пластыри можно использовать для обеспечения непрерывной и прерывистой инфузии соединения, описанного в настоящем описании, в контролируемых количествах, либо с другим средством, либо без него.
[0430] Разработка и применение трансдермальных пластырей для доставки фармацевтических средств хорошо известны в данной области. См., например, патенты США № 5023252, 4992445 и 5001139. Такие пластыри можно разрабатывать для непрерывной, импульсной доставки фармацевтических средств или доставки фармацевтических средств по мере необходимости.
[0431] Подходящие устройства для применения для доставки внутрикожных фармацевтически приемлемых композиций, описанных в настоящем описании, включают короткоигольные устройства, такие как устройства, описанные в патентах США № 4886499; 5190521; 5328483; 5527288; 4270537; 5015235; 5141496 и 5417662. Внутрикожные композиции можно вводить с помощью устройств, которые ограничивают эффективную длину проникновения иглы в кожу, таких как устройства, описанные в публикации PCT WO 99/34850, и их функциональные эквиваленты. Являются пригодными струйные инъекционные устройства, которые доставляют жидкие вакцины в кожу через жидкостной струйный инъектор и/или через иглу, которая проникает через роговой слой и образует струю, которая достигает дермы. Струйные инъекционные устройства описаны, например, в патентах США 5480381; 5599302; 5334144; 5993412; 5649912; 5569189; 5704911; 5383851; 5893397; 5466220; 5339163; 5312335; 5503627; 5064413; 5520639; 4596556; 4790824; 4941880; 4940460; и публикациях PCT WO 97/37705 и WO 97/13537. Являются пригодными устройства для баллистической доставки порошка/частиц, в которых используется сжатый газ для ускорения вакцины в порошковой форме через наружные слои кожи в дерму. Альтернативно или дополнительно, можно использовать общепринятые шприцы в классическом способе внутрикожного введения манту.
[0432] Составы для местного введения могут содержать, например, от приблизительно 1% до приблизительно 10% (масс./масс.) соединения, описанного в настоящем описании, относительно общей массы состава, хотя концентрация соединения, описанного в настоящем описании, может достигать предела растворимости соединения в растворителе. В некоторых вариантах осуществления составы для местного введения могут содержать, например, от приблизительно 1% до приблизительно 9% (масс./масс.) соединения, описанного в настоящем описании, как например, от приблизительно 1% до приблизительно 8% (масс./масс.), более того, например, от приблизительно 1% до приблизительно 7% (масс./масс.), более того, например, от приблизительно 1% до приблизительно 6% (масс./масс.), более того, например, от приблизительно 1% до приблизительно 5% (масс./масс.), более того, например, от приблизительно 1% до приблизительно 4% (масс./масс.), более того, например, от приблизительно 1% до приблизительно 3% (масс./масс.), и, более того, например, от приблизительно 1% до приблизительно 2% (масс./масс.) соединения, описанного в настоящем описании. Составы для местного введения, кроме того, могут содержать один или несколько дополнительных фармацевтически приемлемых эксципиентов, описанных в настоящем описании.
1D. Составы для ингаляционного введения
[0433] В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для ингаляционного введения, содержащие соединение, описанное в настоящем описании, и фармацевтический эксципиент, пригодный для местного введения. В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для ингаляционного введения, содержащие: (i) эффективное количество описанного соединения; необязательно (ii) эффективное количество одного или нескольких вторых средств; и (iii) один или несколько фармацевтических эксципиентов, пригодных для ингаляционного введения. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит: (iv) эффективное количество третьего средства.
[0434] Фармацевтические композиции для ингаляции и инсуффляции включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смесях, и порошки. Жидкие и твердые фармацевтические композиции могут содержать пригодные фармацевтически приемлемые эксципиенты, как описано в настоящем описании. В некоторых вариантах осуществления фармацевтические композиции вводят пероральным или назальным респираторным путем для местного или системного эффекта. Фармацевтические композиции в фармацевтически приемлемых растворителях можно распылять с использованием инертных газов. Распыленные растворы могут ингалироваться прямо из распыляющего устройства или распыляющее устройство может быть подсоединено к дыхательной маске или устройству для дыхания под перемежающимся положительным давлением. Раствор, суспензию или порошковые фармацевтические композиции можно вводить, например, перорально или назально, из устройств, которые доставляют состав соответствующим образом.
1E. Составы для глазного введения
[0435] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции для лечения офтальмологических нарушений. Фармацевтическая композиция может содержать эффективное количество соединения, описанного в настоящем описании, и фармацевтический эксципиент, пригодный для глазного введения. Фармацевтические композиции, пригодные для глазного введения, могут быть представлены в качестве дискретных дозированных форм, таких как капли или спреи, каждая из которых содержит заданное количество активного ингредиента в растворе или суспензии в водной или неводной жидкости, эмульсии типа "масло в воде" или жидкой эмульсии типа "вода в масле". Другие формы введения включают внутриглазную инъекцию, инъекцию внутрь стекловидного тела, местное введение и введение с использованием устройства для излечения лекарственного средства, микрокапсулы, имплантата или микрожидкостного устройства. В некоторых случаях соединения, описанные в настоящем описании, вводят с носителем или эксципиентом, который повышает внутриглазное проникновение соединения, таким как масляная или водная эмульсия с коллоидными частицами, имеющим масляную сердцевину, окруженную межфазной пленкой. Предусматривается, что можно использовать все локальные пути введения в глаз, включая местное, подконъюктивальное, окологлазничное, ретробульбарное, субтеноновое, внутрикамерное введение, введение внутрь стекловидного тела, внутриглазное, субретинальное, околосклеральное и супрахориоидальное введение. Возможно системное или парентеральное введение, включая, но не ограничиваясь ими, внутривенную, подкожную и пероральную доставку. Иллюстративным способом введения является инъекция внутрь стекловидного тела или субтеноновая инъекция растворов или суспензий, или помещение внутрь стекловидного тела или помещение в субтеноново пространство биоразлагаемых или небиоразлагаемых устройств, или местное глазное введение растворов или суспензий, или заднее околосклеральное введение состава геля или крема.
[0436] Глазные капли можно получать путем растворения активного ингредиента в стерильном водном растворе, таком как физиологический солевой раствор, буферный раствор, и т.д., или путем комбинирования порошковых композиции для растворения перед применением. Могут быть выбраны другие носители, как известно в данной области, включая, но не ограничиваясь ими: сбалансированный солевой раствор, солевой раствор, растворимые в воде полиэфиры, такие как полиэтиленгликоль, поливинилы, такие как поливиниловый спирт и повидон, производные целлюлозы, такие как метилцеллюлоза и гидроксипропилметилцеллюлоза, производные нефти, такие как минеральное масло и белый вазелин, животные жиры, такие как ланолин, полимеры акриловой кислоты, такие как карбоксиполиметиленовый гель, растительные жиры, такие как арахисовое масло, и полисахариды, такие как декстраны, и гликозаминогликаны, такие как гиалуронат натрия. В некоторых вариантах осуществления можно добавлять добавки, обычно используемые в глазных каплях. Такие добавки включают обеспечивающие изотоничность средства (например, хлорид натрия и т.д.), буферное вещество (например, борная кислота, гидрофосфат натрия, дигидрофосфат натрия, и т.д.), консерванты (например, хлорид бензалкония, хлорид бензэтония, хлорбутанол и т.д.), загустители (например, сахарид, такой как лактоза, маннит, мальтоза и т.д.; например, гиалуроновую кислоту или ее соль, такую как гиалуронат натрия, гиалуронат калия и т.д.; например, мукополисахарид, такой как хондроитин сульфат и т.д.; например, полиакрилат натрия, карбоксивиниловый полимер, поперечно-сшитый полиакрилат, поливиниловый спирт, поливинилпирролидон, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу или другие средства, известные специалистам в данной области).
[0437] В некоторых случаях коллоидные частицы включают по меньшей мере одно катионное вещество и по меньшей мере одно некатионное поверхностно-активное вещество, такое как полоксамер, тилоксапол, полисорбат, производное касторового масла с полиоксиэтиленом, сложный эфир сорбитана или полиоксилстеарат. В некоторых случаях, катионное вещество представляет собой алкиламин, третичный алкиламин, четвертичное соединение аммония, катионный липид, аминоспирт, соль бигуанидина, катионное соединение или их смесь. В некоторых случаях катионное вещество представляет собой соль бигуанидина, такую как хлоргексидин, полиаминопропилбигуанидин, фенформин, алкилбигуанидин или их смесь. В некоторых случаях четвертичное соединение аммония представляет собой галогенид бензалкония, галогенид лауралкония, цетримид, галогенид гексадецилтриметиламмония, галогенид тетрадецилтриметиламмония, галогенид додецилтриметиламмония, галогенид цетримония, галогенид бензэтония, галогенид бегеналкония, галогенид цеталкония, гилогенид цетэтилдимония, галогенид цетилпиридиния, галогенид бензододециния, галогенид хлораллилметенамина, галогенид миристилалкония, галогенид стеаралкония или смесь двух или более из них. В некоторых случаях, катионное вещество представляет собой хлорид бензалкония, хлорид лауралкония, бромид бензодедециния, хлорид бензетония, бромид гексадецилтриметиламмония, бромид тетрадецилтриметиламмония, бромид додецилтриметиламмония или смесь двух или более из них. В некоторых случаях, масляная фаза представляет собой минеральное масло и легкое минеральное масло, триглицериды средней цепи (MCT), кокосовое масло; гидрогенизированные масла, содержащие гидрогенизированное хлопковое масло, гидрогенизированное пальмовое масло, гидрогенизированное касторовое масло или гидрогенизированное соевое масло; производные гидрогенизированного касторового масла с полиоксиэтиленом, включающие полиоксил-40 гидрогенизированное касторовое масло, полиоксил-60 гидрогенизированное касторовое масло или полиоксил-100 гидрогенизированное касторовое масло.
1F. Составы для введения с контролируемым высвобождением
[0438] В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для введения с контролируемым высвобождением, содержащие соединение, описанное в настоящем описании, и фармацевтический эксципиент, пригодный для введения с контролируемым высвобождением. В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются фармацевтические композиции для введения с контролируемым высвобождением, содержащие: (i) эффективное количество описанного соединения; необязательно (ii) эффективное количество одного или нескольких вторых средств; и (iii) один или несколько фармацевтических эксципиентов, пригодных для введения с контролируемым высвобождением. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит: (iv) эффективное количество третьего средства.
[0439] Активные вещества, такие как соединения, описанные в настоящем описании, можно вводить с помощью средств для контролируемого высвобождения или устройств для доставки, которые хорошо известны средним специалистам в данной области. Примеры включают, но не ограничиваются ими, средства, описанные в патентах США №: 3845770; 3916899; 3536809; 3598123; и 4008719; 5674533; 5059595; 5591767; 5120548; 5073543; 5639476; 5354556; 5639480; 5733566; 5739108; 5891474; 5922356; 5972891; 5980945; 5993855; 6045830; 6087324; 6113943; 6197350; 6248363; 6264970; 6267981; 6376461; 6419961; 6589548; 6613358; 6699500, каждый из которых включен в настоящее описание в качестве ссылки. Такие дозированные формы можно использовать для обеспечения медленного или контролируемого высвобождения одного или нескольких активных веществ с использованием, например, гидропропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрочастиц, липосом, микросфер или их комбинации для обеспечения желаемого профиля высвобождения в различных соотношениях. Пригодные составы с контролируемым высвобождением, известные средним специалистам в данной области, включая составы, описанные в настоящем описании, можно без труда выбирать для применения с активными веществами, описанными в настоящем описании. Таким образом, описанные фармацевтические композиции охватывают единичные дозированные формы, пригодные для перорального введения, такие как, но не ограничиваясь ими, таблетки, капсулы, желатиновые капсулы и таблетки в форме капсул, которые адаптированы для контролируемого высвобождения.
[0440] Все фармацевтические продукты для контролируемого высвобождению имеют общую цель, состоящую в улучшении терапии лекарственным средством, относительно терапии, которую обеспечивают их аналоги с неконтролируемым высвобождением. В некоторых вариантах осуществления применение препарата с контролируемым высвобождением при медикаментозном лечении характеризуется минимумом лекарственного вещества, используемого для излечения или контроля заболевания, нарушения или состояния за минимальное количество времени. Преимущества составов с контролируемым высвобождением включают увеличенную активность лекарственного средства, сниженную частоту дозирования и улучшенное соблюдение пациентом режима лечения. Кроме того, составы с контролируемым высвобождением можно использовать для влияния на время начала действия или другие характеристики, такие как уровни лекарственного средства в крови, и, таким образом, можно влиять на возникновение побочных (например, неблагоприятных) эффектов.
[0441] В некоторых вариантах осуществления составы с контролируемым высвобождением предназначены для первоначального высвобождения некоторого количества соединения, описанного в настоящем описании, которое быстро вызывает желаемый терапевтический эффект, и постепенного и непрерывного высвобождения других количеств соединения для поддержания этого уровня терапевтического или профилактического эффекта в течение длительного периода времени. Для поддержания этого постоянного уровня соединения в организме соединение должно высвобождаться из дозированной формы со скоростью, которая будет замещать количество лекарственного средства, метаболизированное и экскретированное из организма. Контролируемое высвобождение активного вещества можно стимулировать различными условиями, включая, но не ограничиваясь ими, pH, температуру, ферменты, воду или другие физиологические условия или соединения.
[0442] В определенных вариантах осуществления фармацевтическую композицию можно вводить с использованием внутривенной инфузии, имплантируемого осмотического насоса, трансдермального пластыря, липосом или других способов введения. В одном варианте осуществления можно использовать насос (см., Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al., Surgery 88:507 (1980); Saudek et al., N. Engl. J. Med. 321:574 (1989)). В другом варианте осуществления можно использовать полимерные материалы. В другом варианте осуществления систему для контролируемого высвобождения можно помещать в соответствующую область индивидуума, определяемую специалистом в данной области, что, например, в результате требует только части системной дозы (см., например, Goodson, Medical Applications of Controlled Release, 115-138 (vol. 2, 1984). Другие системы с контролируемым высвобождением рассмотрены в обзоре Langer, Science 249:1527-1533 (1990). Одно или несколько активных веществ может быть диспергировано в твердой внутренней матрице, например, из полиметилметакрилата, полибутилметакрилата, пластифицированного или непластифицированного поливинилхлорида, пластифицированного нейлона, пластифицированного полиэтилентерефталата, природного каучука, полиизопрена, полиизобутилена, полибутадиена, полиэтилена, сополимеров этилен-винилацетат, кремнийорганических каучуков, полидиметилсилоксанов, силикон-карбонатных сополимеров, гидрофильных полимеров, таких как гидрогели сложных эфиров акриловой и метакриловой кислоты, коллагена, сшитого поливинилового спирта и сшитого частично гидролизованного поливинилацетата, которая окружена наружной полимерной мембраной, например, из полиэтилена, полипропилена, сополимеров этилен/пропилен, сополимеров этилен/этилакрилат, сополимеров этилен/винилацетат, кремнийорганических каучуков, полидиметилсилоксанов, неопренового каучука, хлорированного полиэтилена, поливинилхлорида, сополимеров винилхлорида с винилацетатом, винилиденхлорида, этилена и пропилена, ионсодержащего полиэтилена терефталата, бутилового каучука, эпихлогидриновых каучуков, сополимеров этилен/виниловый спирт, терполимера этилен/винилацетат/виниловый спирт, и сополимера этилен/винилоксиэтанол, которые нерастворимы в жидкостях организма. Затем одно или несколько активных веществ диффундируют через наружную полимерную мембрану на стадии с контролируемой скоростью высвобождения. Процент активного вещества в таких парентеральных композициях в высокой степени зависит от его конкретной природы, а также от потребностей индивидуума.
2. Дозировки
[0443] Соединение, описанное в настоящем описании, можно доставлять в форме фармацевтически приемлемых композиций, которые содержат терапевтически эффективное количество одного или нескольких соединений, описанных в настоящем описании, и/или одного или нескольких дополнительных лекарственных средств, таких как химиотерапевтическое средство, составленных с одним или несколькими фармацевтически приемлемым эксципиентами. В некоторых случаях соединение, описанное в настоящем описании, и дополнительное лекарственное средство вводят в отдельных фармацевтических композициях, и их можно (например, вследствие различных физических и/или химических характеристик) вводить различными путями (например, одно терапевтическое средство вводят перорально, в то время как другое вводят внутривенно). В других случаях, соединение, описанное в настоящем описании, и дополнительное лекарственное средство можно вводить отдельно, но одним и тем же путем (например, оба перорально или оба внутривенно). В других случаях соединение, описанное в настоящем описании, и дополнительное лекарственное средство можно вводить в одной и той же фармацевтической композиции.
[0444] Выбранный уровень дозирования зависит от различных факторов, включая, например, активность конкретного используемого соединения, путь введения, время введения, скорость экскреции или метаболизм конкретного используемого соединения, скорость и степень всасывания, длительность лечения, другие лекарственные средства, соединения и/или материалы, используемые в комбинации с конкретным используемым соединением, возраст, пол, массу тела, состояние, общее состояние здоровья и предшествующий медицинский анамнез пациента, подвергаемого лечению, и подобные факторы, хорошо известны в области медицины.
[0445] Как правило, подходящая суточная доза соединения, описанного в настоящем описании, и/или химиотерапевтического средства представляет собой количество соединения, которое в некоторых вариантах осуществления может представлять собой наиболее низкую дозу, эффективную для обеспечения терапевтического эффекта. Такая эффективная доза, как правило, зависит от факторов, описанных в настоящем описании. Как правило, дозы соединений, описанных в настоящем описании, для пациента, когда их используют для указанных эффектов, могут находиться в диапазоне от приблизительно 1 мг до приблизительно 1000 мг, от приблизительно 0,01 мг до приблизительно 500 мг в сутки, от приблизительно 0,1 мг до приблизительно 500 мг в сутки, от приблизительно 1 мг до приблизительно 500 мг в сутки, от приблизительно 5 мг до приблизительно 500 мг в сутки, от приблизительно 0,01 мг до приблизительно 200 мг в сутки, от приблизительно 0,1 мг до приблизительно 200 мг в сутки, от приблизительно 1 мг до приблизительно 200 мг в сутки, от приблизительно 5 мг до приблизительно 200 мг в сутки, от приблизительно 0,01 мг до приблизительно 100 мг в сутки, от приблизительно 0,1 мг до приблизительно 100 мг в сутки, от приблизительно 1 мг до приблизительно 100 мг в сутки, от приблизительно 5 мг до приблизительно 100 мг в сутки, от приблизительно 0,01 мг до приблизительно 50 мг в сутки, от приблизительно 0,1 мг до приблизительно 50 мг в сутки, от приблизительно 1 мг до приблизительно 50 мг в сутки, от приблизительно 5 мг до приблизительно 50 мг в сутки, от приблизительно 5 мг до приблизительно 40 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, или от приблизительно 5 мг до приблизительно 20 мг в сутки. Иллюстративная дозировка составляет приблизительно от 0,1 до 100 мг в сутки. Истинные уровни дозировок активных ингредиентов в фармацевтических композициях, описанных в настоящем описании, можно варьировать таким образом, чтобы получить количество активного ингредиента, которое является эффективным для достижения желаемого терапевтического ответа для конкретного пациента, композиции и способа введения, не вызывая токсичности у пациента. В некоторых случаях уровни дозировок ниже нижнего предела упомянутого выше диапазона могут быть боле чем достаточными, в то время как в других случаях могут использоваться более высокие дозы без возникновения какого-либо вредоносного побочного эффекта, например, путем деления таких более высоких доз на несколько небольших доз для введения в течение суток.
[0446] В некоторых вариантах осуществления соединения можно вводить каждые сутки, раз в двое суток, три раза в неделю, два раза в неделю, раз в неделю или раз в две недели. Схема дозирования может включать "отдых от лекарственного средства", например, лекарственное средство можно вводить в течение двух недель с перерывом в одну неделю, или в течение трех недель с перерывом в одну неделю, или в течение четырех недель с перерывом в одну неделю и т.д., или непрерывно без отдыха от лекарственного средства. Соединения можно вводить перорально, внутривенно, внутрибрюшинно, местно, трансдермально, внутримышечно, подкожно, интраназально, сублингвально или любым другим путем.
[0447] В некоторых вариантах осуществления соединение, описанное в настоящем описании, вводят множеством доз. Дозирование может происходить приблизительно один раз, два раза, три раза, четыре раза, пять раз, шесть раз или более шести раз в сутки. Дозирование может осуществляться приблизительно один раз в месяц, приблизительно один раз каждые две недели, приблизительно один раз в неделю, или приблизительно один раз в двое суток. В другом варианте осуществления соединение, описанное в настоящем описании, и другое средство вводят вместе от приблизительно одного раза в сутки до приблизительно 6 раз в сутки. В другом варианте осуществления введение соединения, описанного в настоящем описании, и средства продолжается в течение менее чем приблизительно 7 суток. В другом варианте осуществления введение продолжается в течение более чем приблизительно 6 суток, приблизительно 10 суток, приблизительно 14 суток, приблизительно 28 суток, приблизительно двух месяцев, приблизительно шести месяцев или приблизительно одного года. В некоторых случаях непрерывное дозирование осуществляют и поддерживают настолько долго, насколько это необходимо.
[0448] Введение фармацевтических композиций, как описано в настоящем описании, можно продолжать настолько долго, насколько это необходимо. В некоторых вариантах осуществления средство, описанное в настоящем описании, вводят в течение более чем приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 14, приблизительно 21 или приблизительно 28 суток. В некоторых вариантах осуществления средство, описанное в настоящем описании, вводят в течение менее чем приблизительно 28, приблизительно 21, приблизительно 14, приблизительно 7, приблизительно 6, приблизительно 5, приблизительно 4, приблизительно 3, приблизительно 2, или приблизительно 1 суток. В некоторых вариантах осуществления средство, описанное в настоящем описании, вводят в течение приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 14, приблизительно 21 или приблизительно 28 суток. В некоторых вариантах осуществления средство, описанное в настоящем описании, вводят на постоянной основе, например, для лечения хронических эффектов.
[0449] Поскольку соединения, описанные в настоящем описании, можно вводить в комбинации с другими способами лечения (такими как дополнительные химиотерапевтические средства, лучевая терапия или хирургическая операция), дозы каждого средства или терапии могут быть ниже, чем соответствующая терапия единственным средством. Доза терапии единственным средством может находиться в диапазоне, например, от приблизительно 0,0001 до приблизительно 200 мг, или от приблизительно 0,001 до приблизительно 100 мг, или от приблизительно 0,01 до приблизительно 100 мг, или от приблизительно 0,1 до приблизительно 100 мг, или от приблизительно 1 до приблизительно 50 мг в сутки.
[0450] Когда соединение, описанное в настоящем описании, вводят в фармацевтической композиции, которая содержит одно или несколько средств, и средство имеет более короткое время полужизни, чем соединение, описанное в настоящем описании, единичные дозированные формы средства и соединения, описанного в настоящем описании, можно корректировать соответствующим образом.
[0451] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция (например, таблетка или капсула), содержащая модулятор PI3K, описанный в настоящем описании (например, соединение 292 или его фармацевтически приемлемую форму), где модулятор PI3K находится в количестве приблизительно 0,5 мг, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 75 мг, приблизительно 80 мг, или приблизительно 100 мг. В иллюстративных вариантах осуществления фармацевтическую композицию (например, таблетка или капсула), содержащую модулятор PI3K, описанный в настоящем описании (например, соединение 292 или его фармацевтически приемлемую форму) вводят один раз в сутки. В иллюстративных вариантах осуществления фармацевтическую композицию (например, таблетку или капсулу), содержащую модулятор PI3K, описанный в настоящем описании (например, соединение 292 или его фармацевтически приемлемую форму) вводят два раза в сутки. В иллюстративных вариантах осуществления фармацевтическую композицию (например, таблетку или капсулу), содержащую модулятор PI3K, описанный в настоящем описании (например, соединение 292 или его фармацевтически приемлемую форму) вводят курсом из 28 суток.
[0452] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция (например, таблетка или капсула), содержащая модулятор PI3K, описанный в настоящем описании (например, соединение 292 или его фармацевтически приемлемую форму), который получен для пероральный доставки.
[0453] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция (например, таблетка или капсула), содержащая модулятор PI3K, описанный в настоящем описании (например, соединение 292 или его фармацевтически приемлемую форму), и фармацевтически приемлемый эксципиент или носитель. В иллюстративных вариантах осуществления фармацевтически приемлемый эксципиент или носитель в композиции представляет собой один или несколько из микрокристаллической целлюлозы (например, силицифицированная микрокристаллическая целлюлоза), кросповидона и/или стеарата магния.
Способы лечения и предупреждения
[0454] Не ограничиваясь конкретной теорией, PI3K представляют собой регуляторы передачи сигнала, которые опосредуют пролиферацию, дифференцировку, выживание и миграцию клеток. PI3K-δ и PI3K-γ экспрессируются в кроветворных клетках и участвуют в гематологических злокачественных опухолях. Например, PI3K-δ и PI3K-γ участвуют в развитии и поддержании микроокружения опухоли. PI3K-δ и PI3K-γ на высоком уровне экспрессируются в содержащем гем компартменте и они могут быть пригодными для лечения гематологических злокачественных опухолей. PI3K класса I, включая изоформы PI3K-δ и PI3K-γ, также ассоциированы со злокачественными опухолями (рассмотрено, например, в Vogt, PK et al. (2010) Curr Top Microbiol Immunol. 347:79-104; Fresno Vara, JA et al. (2004) Cancer Treat Rev. 30(2):193-204; Zhao, L and Vogt, PK. (2008) Oncogene 27(41):5486-96). Было показано, что ингибиторы PI3K, например PI3K-δ и/или PI3K-γ, обладают активностью против злокачественной опухоли (например, Courtney, KD et al. (2010) J Clin Oncol. 28(6):1075-1083); Markman, B et al. (2010) Ann Oncol. 21(4):683-91; Kong, D and Yamori, T (2009) Curr Med Chem. 16(22):2839-54; Jimeno, A et al. (2009) J Clin Oncol. 27:156s (suppl; abstr 3542); Flinn, IW et al. (2009) J Clin Oncol. 27:156s (suppl; abstr 3543); Shapiro, G et al. (2009) J Clin Oncol. 27:146s (suppl; abstr 3500); Wagner, AJ et al. (2009) J Clin Oncol. 27:146s (suppl; abstr 3501); Vogt, PK et al. (2006) Virology 344(1):131-8; Ward, S et al. (2003) Chem Biol. 10(3):207-13; WO 2011/041399; US 2010/0029693; US 2010/0305096; US 2010/0305084; каждый из которых включен в настоящее описание в качестве ссылки). PI3K-δ и PI3K-γ экспрессируются в некоторых солидных опухолях, включая опухоли предстательной железы, молочной железы и глиобластомы (Chen J.S. et al. (2008) Mol Cancer Ther. 7(4):841-50; Ikeda H. et al. (2010) Blood 116(9):1460-8). Не ограничиваясь конкретной теорией, ингибирование PI3K может иметь эффект на воспаление и прогрессирование опухоли.
[0455] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения конкретного типа злокачественной опухоли или заболевания, такого как конкретный тип гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K. Изоформы PI3K включают одну или несколько из PI3K-α, PI3K-β, PI3K-δ или PI3K-γ, или их комбинацию. В одном варианте осуществления конкретный тип злокачественной опухоли или заболевания, такого как конкретный тип гематологической злокачественной опухоли, имеет высокий уровень экспрессии PI3K-δ или PI3K-γ, или как PI3K-δ, так и PI3K-γ.
[0456] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения конкретного подтипа злокачественной опухоли или заболевания, такого как конкретный подтип гематологической злокачественной опухоли, который обладает высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K. Изоформы PI3K включают одну или несколько из PI3K-α, PI3K-β, PI3K-δ или PI3K-γ, или их комбинацию. В одном варианте осуществления конкретный подтип злокачественной опухоли или заболевания, такой как конкретный подтип гематологической злокачественной опухоли, имеет высокий уровень экспрессии PI3K-δ или PI3K-γ, или как PI3K-δ, так и PI3K-γ.
[0457] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения у конкретного пациента или группы пациентов, имеющих злокачественную опухоль или заболевание, такое как гематологическая злокачественная опухоль, где конкретный пациент или группа пациентов имеет(имеют) высокий уровень экспрессии одной или нескольких изоформы(изоформ) PI3K. Изоформы PI3K включают одну или несколько из PI3K-α, PI3K-β, PI3K-δ или PI3K-γ, или их комбинацию. В одном варианте осуществления конкретный пациент или группа пациентов имеет(имеют) высокий уровень экспрессии PI3K-δ или PI3K-γ, или как PI3K-δ, так и PI3K-γ.
[0458] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, у которого развилась устойчивость к предшествующему способу терапии, включающий идентификацию индивидуума, которому проводили предшествующее лечение, и введение индивидууму терапевтически эффективного количества модулятора PI3K или его фармацевтически приемлемой формы, отдельно или в комбинации с одним или несколькими другими терапевтическими средствами.
[0459] В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими ингибиторами BTK, антителами против CD20, ингибиторами протеасом или алкилирующими средствами. В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими ингибиторами BTK.
[0460] В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб (1-[(3R)-3-[4-амино-3-(4-феноксифенил)-1H-пиразолo[3,4-d]пиримидин-1-ил]пиперидин-1-ил]проп-2-ен-1-он) или AVL-292 (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид). В одном варианте осуществления ингибитор BTK представляет собой RN-486 (6-циклопропил-8-фтор-2-(2-гидроксиметил-3-{1-метил-5-[5-(4-метил-пиперазин-1-ил)-пиридин-2-иламино]-6-оксо-1,6-дигидропиридин-3-ил}-фенил)-2H-изохинолин-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил)фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид]), CGI-560 (N-[3-(8-анилиноимидазо[1,2-a]пиразин-6-ил)фенил]-4-трет-бутилбензамид), CGI-1746 (4-(трет-бутил)-N-(2-метил-3-(4-метил-6-((4-(морфолин-4-карбонил)фенил)амино)-5-оксо-4,5-дигидропиразин-2-ил)фенил)бензамид), HM-71224, ONO-4059, ACP-196, CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпиримидин-2-ил)амино)фенокси)-N-метилпиколинамид) или LFM-A13 (2Z-циано-N-(2,5-дибромфенил)3-гидрокси-2-бутенамид).
[0461] В одном варианте осуществления способ, описанный в настоящем описании, включает получение биологического образца от индивидуума и обнаружение присутствия одной или нескольких мутаций, выбранных из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена LCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R), и WHIM-подобной мутации CXCR4 в образце.
[0462] В одном варианте осуществления мутация представляет собой одну мутацию, выбранную из мутации остатка 481 BTK (C481S) и мутации цистеина на фенилаланин в остатке 481 BTK (C481F).
[0463] В другом варианте осуществления мутация представляет собой по меньшей мере одну мутацию, выбранную из мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y) и мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R). Например, мутация может представлять собой две мутации на гене PLCgamma2, таких как M1141R и S707F.
[0464] В одном варианте осуществления мутация представляет собой одну мутацию, выбранную из мутации остатка 481 BTK (C481S) и мутации цистеина на фенилаланин в остатке 481 BTK (C481F), и по меньшей мере одну мутацию, выбранную из мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y) и мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R).
[0465] В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими ингибиторами протеасом. В одном варианте осуществления ингибитором протеасом является бортезомиб. В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими алкилирующими средствами. В одном варианте осуществления алкилирующее средство представляет собой азотистый иприт. В одном варианте осуществления предшествующее лечение представляет собой лечение одним или несколькими антителами против CD20. В одном варианте осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб,131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб или офатумумаб.
[0466] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения индивидуума со злокачественной опухолью или гематологической злокачественной опухолью, включающий:
идентификацию индивидуума с одной или несколькими мутациями, выбранными из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) и WHIM-подобной мутации CXCR4; и
введение терапевтически эффективного количества модулятора PI3K или его фармацевтически приемлемой формы индивидууму, у которого идентифицированы одна или несколько мутаций.
[0467] В одном варианте осуществления мутация представляет собой одну мутацию, выбранную из мутации остатка 481 BTK (C481S) и мутации цистеина на фенилаланин в остатке 481 of BTK (C481F).
[0468] В другом варианте осуществления мутация представляет собой по меньшей мере одну мутацию, выбранную из мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), и мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R). Например, мутация может представлять собой две мутации гена PLCgamma2, таких как M1141R и S707F.
[0469] В одном варианте осуществления мутация представляет собой одну мутацию, выбранную из мутации остатка 481 BTK (C481S) и мутации цистеина на фенилаланин в остатке 481 BTK (C481F), и по меньшей мере одну мутацию, выбранную из мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутация гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y) и мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R).
[0470] В другом варианте осуществления введение дополнительно включает комбинирование с одним или несколькими другими лекарственными средствами у индивидуума, у которого идентифицированы одна или несколько мутаций.
[0471] В одном варианте осуществления идентификация включает получение биологического образца от индивидуума и обнаружение одной или нескольких мутаций, выбранных из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) и WHIM-подобной мутации CXCR4 в образце. В одном варианте осуществления обнаружение включает проведение полимеразной цепной реакции (ПЦР) или гибридизации для обнаружения одной или нескольких мутаций.
[0472] В одном варианте осуществления мутация представляет собой одну мутацию, выбранную из мутации остатка 481 BTK (C481S) и мутации цистеина на фенилаланин в остатке 481 BTK (C481F).
[0473] В другом варианте осуществления мутация представляет собой по меньшей мере одну мутацию, выбранную из мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y) и мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R). Например, мутация может представлять собой две мутации гена PLCgamma2, таких как M1141R и S707F.
[0474] В одном варианте осуществления мутация представляет собой одну мутацию, выбранную из мутации остатка 481 BTK (C481S) и мутации цистеина на фенилаланин в остатке 481 BTK (C481F), и по меньшей мере одну мутацию, выбранную из мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y) и мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R).
[0475] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ выбора индивидуума, у которого диагностирована злокачественная опухоль или гематологическая злокачественная опухоль, в качестве кандидата для лечения терапевтически эффективным количеством модулятора PI3K или его фармацевтически приемлемой формы, включающий:
(a) обнаружение присутствия или отсутствия одной или нескольких мутаций, выбранных из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) и WHIM-подобной мутации CXCR4 в образце, полученном от индивидуума, где присутствие одной или нескольких мутаций указывает на то, что индивидуум является кандидатом для лечения терапевтически эффективным количеством модулятора PI3K или его фармацевтически приемлемой формы; и
(b) введение индивидууму терапевтически эффективного количества модулятора PI3K или его фармацевтически приемлемой формы, где в образце присутствует одна или несколько мутаций.
[0476] В одном варианте осуществления мутация представляет собой одну мутацию, выбранную из мутации остатка 481 BTK (C481S) и мутации цистеина на фенилаланин в остатке 481 BTK (C481F).
[0477] В другом варианте осуществления мутация представляет собой по меньшей мере одну мутацию, выбранную из мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y) и мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R). Например, мутация может представлять собой две мутации гена PLCgamma2, таких как M1141R и S707F.
[0478] В одном варианте осуществления мутация представляет собой одну мутацию, выбранную из мутации остатка 481 BTK (C481S) и мутации цистеина на фенилаланин в остатке 481 BTK (C481F), и по меньшей мере одну мутацию, выбранную из мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y) и мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R).
[0479] В одном варианте осуществления введение дополнительно включает комбинирование с одним или несколькими другими лекарственными средствами у индивидуума, у которого идентифицированы одна или несколько мутаций.
[0480] В одном варианте осуществления модулятор PI3K представляет собой соединение 292. В другом варианте осуществления модулятор PI3K представляет собой CAL-101 (GS-1101, иделалисиб, (S)-2-(1-(9H-пурин-6-иламино)пропил)-5-фтор-3-фенилхиназолин-4(3H)-он).
[0481] В одном варианте осуществления модуляторы PI3K включают, но не ограничиваются ими, GDC-0032 (2-[4-[2-(2-изопропил-5-метил-1,2,4-триазол-3-ил)-5,6-дигидроимидазо[1,2-d][1,4]бензаксазепин-9-ил]пиразол-1-ил]-2-метилпропанамид), MLN-1117/INK1117 и BYL-719 ((2S)-N1-[4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-4-пиридинил]-2-тиазолил]-1,2-пирролидиндикарбоксамид).
[0482] В одном варианте осуществления модуляторы PI3K включают, но не ограничиваются ими, GSK2126458 (2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид).
[0483] В одном варианте осуществления модуляторы PI3K включают, но не ограничиваются ими, TGX-221 ((±)-7-метил-2-(морфолин-4-ил)-9-(1-фениламиноэтил)пиридо[1,2-a]-пиримидин-4-он), GSK2636771 (дигидрохлорид 2-метил-1-(2-метил-3-(трифторметил)бензил)-6-морфолино-1H-бензо[d]имидазол-4-карбоновой кислоты) и KIN-193 ((R)-2-((1-(7-метил-2-морфолино-4-оксо-4H-пиридо[1,2-a]пиримидин-9-ил)этил)амино)бензойная кислота).
[0484] В одном варианте осуществления модуляторы PI3K включают, но не ограничиваются ими, TGR-1202/RP5264 (((S)-2-(l-(4-амино-3-(3-фтор-4-изопропоксифенил)-1H-пиразолo[3,4-d]пиримидин-1-ил)этил)-6-фтор-3-(3-фторфенил)-4H-хромен-4-он)), GS-9820 (CAL-120, (S)-2-(1-((9H-пурин-6-ил)амино)этил)-6-фтор-3-фенилхиназолин-4(3H)-он), GS-1101 (5-фтор-3-фенил-2-([S)]-1-[9H-пурин-6-иламино]-пропил)-3H-хиназолин-4-он), AMG-319, GSK-2269557 (2-(6-(1H-индол-4-ил)-1H-индазол-4-ил)-5-((4-изопропилпиперазин-1-ил)метил)оксазол), SAR245409 (N-(4-(N-(3-((3,5-диметоксифенил)амино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид), INCB040093 и BAY80-6946 (2-амино-N-(7-метокси-8-(3-морфолинопропокси)-2,3-дигидроимидазо[1,2-c]хиназолин-5-ил)пиримидин-5-карбоксамид).
[0485] В одном варианте осуществления модуляторы PI3K включают, но не ограничиваются ими, AS 252424 (5-[1-[5-(4-фтор-2-гидроксифенил)фуран-2-ил]мет-(Z)-илиден]тиазолидин-2,4-дион) и CZ 24832 (5-(2-амино-8-фтор-[1,2,4]триазолo[1,5-a]пиридин-6-ил)-N-трет-бутилпиридин-3-сульфонамид).
[0486] В одном варианте осуществления модуляторы PI3K включают, но не ограничиваются ими, бупарлисиб (5-[2,6-ди(4-морфолинил)-4-пиримидинил]-4-(трифторметил)-2-пиридинамин), SAR245409 (N-(4-(N-(3-((3,5-диметоксифенил)амино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид) и GDC-0941 (2-(1H-индазол-4-ил)-6-[[4-(метилсульфонил)-1-пиперазинил]метил]-4-(4-морфолинил)тиено[3,2-d]пиримидин).
[0487] В одном варианте осуществления модуляторы PI3K включают, но не ограничиваются ими, GDC-0980 ((S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-он (также известный как RG7422)), SF1126 ((8S,14S,17S)-14-(карбоксиметил)-8-(3-гуанидинопропил)-17-(гидроксиметил)-3,6,9,12,15-пентаоксо-1-(4-(4-оксо-8-фенил-4H-хромен-2-ил)морфолин-4-ий)-2-окса-7,10,13,16-тетраазаоктадекан-18-оат), PF-05212384 (N-[4-[[4-(диметиламино)-1-пиперидинил]карбонил]фенил]-N'-[4-(4,6-ди-4-морфолинил-1,3,5-триазин-2-ил)фенил]мочевина), LY3023414, BEZ235 (2-метил-2-{4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил]фенил}пропаннитрил), XL-765 (N-(3-(N-(3-(3,5-диметоксифениламино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид) и GSK1059615 (5-[[4-(4-пиридинил)-6-хинолинил]метилен]-2,4-тиазолидиндион).
[0488] В одном варианте осуществления модуляторы PI3K включают, но не ограничиваются ими, PX886, PX866 ([(3aR,6E,9S,9aR,10R,11aS)-6-[[бис(проп-2-енил)амино]метилиден]-5-гидрокси-9-(метоксиметил)-9a,11a-диметил-1,4,7-триоксо-2,3,3a,9,10,11-гексагидроиндено[4,5-h]изохромен-10-ил]ацетат (также известный как сонолисиб)).
[0489] В одном варианте осуществления модулятор PI3K представляет собой модулятор, как описано в WO 2005/113556, полное содержание которой включено в настоящее описание в качестве ссылки. В одном варианте осуществления модулятор PI3K представляет собой соединения № 113 или 107, как описано в WO2005/113556.
[0490] В одном варианте осуществления модулятор PI3K представляет собой модулятор, как описано в WO2014/006572, полное содержание которой включено в настоящее описание в качестве ссылки. В одном варианте осуществления модулятор PI3K представляет собой соединения № A1, A2, B, B1 или B2, как описано в WO2014/006572.
[0491] В одном варианте осуществления модулятор PI3K представляет собой модулятор, как описано в WO 2013/032591, полное содержание которой включено в настоящее описание в качестве ссылки. В одном варианте осуществления модулятор PI3K представляет собой соединение формулы (I), как описано в WO 2013/032591. В одном варианте осуществления модулятор PI3K представляет собой модулятор, как описано в WO 2013/032591, с IC50 (нМ) для изоформы PI3K-дельта, составляющей менее 100 нМ, и IC50 (нМ) для PI3K-альфа, бета или гамма более чем приблизительно 100 нМ, более чем приблизительно 1 мкм, или более чем приблизительно 10 мкм. В одном варианте осуществления модулятор PI3K представляет собой модулятор, который имеет соотношение селективности в отношении альфа/дельта, соотношение селективности в отношении бета/дельта или соотношение селективности в отношении гамма/дельта более 1, более чем приблизительно 10 или более чем приблизительно 100. В одном варианте осуществления модулятор PI3K представляет собой соединение № 359, как описано в WO 2013/032591.
[0492] В одном варианте осуществления модулятор PI3K представляет собой модулятор, как описано в WO2011/146882, WO2013/012915 или WO2013/012918, полное содержание которых включено в настоящее описание в качестве ссылки.
[0493] В одном варианте осуществления модуляторы PI3K включают, но не ограничиваются ими RP6503, RP6530, IC87114, паломид 529, ZSTK474, PWT33597, TG100-115, GNE-477, CUDC-907 и AEZS-136.
[0494] В одном варианте осуществления другое лекарственное средство представляет собой химиотерапевтическое средство или терапевтическое антитело. В одном варианте осуществления химиотерапевтическое средство выбрано из ингибиторов митоза, алкилирующих средств, антиметаболитов, ингибитора протеасом, интераклирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомераз, модификаторов биологического ответа, антигормональных средств, ингибиторов ангиогенеза и антиандрогенов. В одном варианте осуществления другое лекарственное средство представляет собой стероид. В другом варианте осуществления стероид представляет собой глюкокортикоид. В другом варианте осуществления глюкокортикоид представляет собой альдостерон, беклометазон, бетаметазон, кортизол (гидрокортизон), кортизон, дезоксикортикостерона ацетат (DOCA), дексаметазон, флудроацетат кортизона, метилпреднизолон, преднизолон, преднизон или триамцинолон. В другом варианте осуществления глюкокортикоид представляет собой дексаметазон.
[0495] В одном варианте осуществления терапевтическое антитело выбрано из антитела против CD37, антитела против CD20 и антитела против CD52. В одном варианте осуществления терапевтическое антитело представляет собой антитело против CD20. В одном варианте осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб,131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб или офатумумаб. В одном варианте осуществления антитело против CD20 представляет собой обинутузумаб.
[0496] В одном варианте осуществления молярное соотношение модулятора PI3K и другого терапевтического средства составляет приблизительно 500:1, приблизительно 250:1, приблизительно 100:1, приблизительно 50:1, приблизительно 25:1, приблизительно 20:1, приблизительно 19:1, приблизительно 18: 1, приблизительно 17:1, приблизительно 16:1, приблизительно 15:1, приблизительно 14:1, приблизительно 13:1, приблизительно 12:1, приблизительно 11:1, приблизительно 10:1, приблизительно 5:1, приблизительно 4:1, приблизительно 3:1, приблизительно 2:1, или приблизительно 1:1.В одном варианте осуществления модулятор PI3K вводят в суточной дозе от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 10 мг до приблизительно 60 мг, от приблизительно 20 мг до приблизительно 60 мг, от приблизительно 30 мг до приблизительно 60 мг, от приблизительно 40 мг до приблизительно 60 мг, от приблизительно 45 мг до приблизительно 55 мг, приблизительно 10 мг, приблизительно 20 мг или приблизительно 50 мг; или при дозировании два раза в сутки от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 25 мг или приблизительно 50 мг; и
другое терапевтическое средство вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 10000 мг, от приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг, от приблизительно 900 мг до приблизительно 1000 мг или приблизительно 1000 мг.
[0497]
[0498] В одном варианте осуществления модулятор PI3K вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 500 мг, от приблизительно 1 мг до приблизительно 500 мг, от приблизительно 100 мг до приблизительно 500 мг, от приблизительно 150 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 400 мг или от приблизительно 250 мг до приблизительно 350 мг; и
обинутузумаб вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 10000 мг, от приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг или от приблизительно 900 мг до приблизительно 1000 мг.
[0499] В одном варианте осуществления модулятор PI3K вводят в количестве для достижения максимальной концентрации в плазме в стационарном состоянии (Cmaxss) от приблизительно 1000 нг/мл до приблизительно 5000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 4000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 3000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 2500 нг/мл или от приблизительно 1400 нг/мл до приблизительно 2200 нг/мл; и
другое средство вводят в количестве для достижения Cmaxss от приблизительно 100 нг/мл до приблизительно 1000 нг/мл, от приблизительно 250 нг/мл до приблизительно 1000 нг/мл, от приблизительно 500 нг/мл до приблизительно 1000 нг/мл, от приблизительно 600 нг/мл до приблизительно 1000 нг/мл, от приблизительно 700 нг/мл до приблизительно 1000 нг/мл, от приблизительно 740 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 900 нг/мл или от приблизительно 750 нг/мл до приблизительно 800 нг/мл.
[0500] В одном варианте осуществления модулятор PI3K вводят в количестве для достижения площади под кривой концентрация в плазме-время в стационарном состоянии (AUCss) от приблизительно 5000 нг/мл*ч до приблизительно 10000 нг/мл*ч, от приблизительно 5000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 7000 нг/мл*ч до приблизительно 9000 нг/мл*ч, приблизительно 7000 нг/мл*ч, приблизительно 7500 нг/мл*ч, приблизительно 8000 нг/мл*ч, приблизительно 8500 нг/мл*ч, приблизительно 8600 нг/мл*ч, приблизительно 8700 нг/мл*ч или приблизительно 8800 нг/мл*ч; и
другое средство вводят в количестве для достижения AUCss от приблизительно 1000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 2000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч.
[0501] В одном варианте осуществления модулятор PI3K представляет собой соединение 292 или его фармацевтически приемлемую форму, а другое лекарственное средство представляет собой обинутузумаб.
[0502] В другом варианте осуществления модулятор PI3K представляет собой CAL-101 или его фармацевтически приемлемую форму, а другое лекарственное средство представляет собой обинутузумаб.
[0503] В одном варианте осуществления молярное соотношение соединения 292 и обинутузумаба составляет приблизительно 500:1, приблизительно 250:1, приблизительно 100:1, приблизительно 50:1, приблизительно 25:1, приблизительно 20:1, приблизительно 19:1, приблизительно 18: 1, приблизительно 17:1, приблизительно 16:1, приблизительно 15:1, приблизительно 14:1, приблизительно 13:1, приблизительно 12:1, приблизительно 11:1, приблизительно 10:1, приблизительно 5:1, приблизительно 4:1, приблизительно 3:1, приблизительно 2:1 или приблизительно 1:1. В одном варианте осуществления молярное соотношение составляет от 25:1 до приблизительно 1:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 20:1 до приблизительно 5:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 20:1 до приблизительно 10:1. В одном варианте осуществления молярное соотношение составляет приблизительно 20:1, приблизительно 19:1, приблизительно 18:1, приблизительно 17:1, приблизительно 16:1, или приблизительно 15:1. В одном варианте осуществления молярное соотношение составляет приблизительно 16:1. В одном варианте осуществления молярное соотношение составляет приблизительно 17:1.
[0504] В одном варианте осуществления молярное соотношение CAL-101 и обинутузумаба составляет приблизительно 500:1, приблизительно 250:1, приблизительно 100:1, приблизительно 50:1, приблизительно 25:1, приблизительно 20:1, приблизительно 19:1, приблизительно 18: 1, приблизительно 17:1, приблизительно 16:1, приблизительно 15:1, приблизительно 14:1, приблизительно 13:1, приблизительно 12:1, приблизительно 11:1, приблизительно 10:1, приблизительно 5:1, приблизительно 4:1, приблизительно 3:1, приблизительно 2:1 или приблизительно 1:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 150:1 до приблизительно 50:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 150:1 до приблизительно 75:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 125:1 до приблизительно 75:1. В одном варианте осуществления молярное соотношение составляет от приблизительно 110:1 до приблизительно 90:1. В одном варианте осуществления молярное соотношение составляет приблизительно 100:1. В одном варианте осуществления соединение 292 вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 150 мг, от приблизительно 1 мг до приблизительно 100 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 10 мг до приблизительно 60 мг, от приблизительно 20 мг до приблизительно 60 мг, от приблизительно 30 мг до приблизительно 60 мг, от приблизительно 40 мг до приблизительно 60 мг, от приблизительно 45 мг до приблизительно 55 мг, приблизительно 10 мг, приблизительно 20 мг или приблизительно 50 мг; или при дозировании два раза в сутки от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 10 мг до приблизительно 25 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 25 мг или приблизительно 50 мг; и
обинутузумаб вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 10,000 мг, приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг, от приблизительно 900 мг до приблизительно 1000 мг или приблизительно 1000 мг.
[0505] В одном варианте осуществления соединение 292 вводят в суточной дозировке от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 10 мг до приблизительно 60 мг, от приблизительно 20 мг до приблизительно 60 мг, от приблизительно 30 мг до приблизительно 60 мг или от приблизительно 40 мг до приблизительно 60 мг. В одном варианте осуществления соединение 292 вводят в суточной дозировке приблизительно 50 мг. В одном варианте осуществления соединение 292 вводят при дозировании два раза в сутки от приблизительно 5 мг до приблизительно 30 мг, приблизительно 15 мг до приблизительно 30 мг или от приблизительно 20 мг до приблизительно 30 мг. В одном варианте осуществления соединение 292 вводят два раза в сутки в дозировке приблизительно 25 мг. В одном варианте осуществления обинутузумаб вводят в суточной дозировке от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг или от приблизительно 900 мг до приблизительно 1000 мг. В одном варианте осуществления обинутузумаб вводят в суточной дозировке приблизительно 1000 мг.
[0506] В одном варианте осуществления CAL-101 вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 500 мг, от приблизительно 1 мг до приблизительно 500 мг, от приблизительно 100 мг до приблизительно 500 мг, от приблизительно 150 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 400 мг или от приблизительно 250 мг до приблизительно 350 мг; и
[0507] обинутузумаб вводят в суточной дозировке от приблизительно 0,1 мг до приблизительно 10000 мг, от приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг или от приблизительно 900 мг до приблизительно 1000 мг. В одном варианте осуществления CAL-101 вводят в суточной дозировке от приблизительно 200 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 400 мг или от приблизительно 250 мг до приблизительно 350 мг. В одном варианте осуществления CAL-101 вводят в суточной дозировке приблизительно 300 мг. В одном варианте осуществления CAL-101 вводят при дозировании два раза в сутки от приблизительно 10 мг до приблизительно 250 мг, от приблизительно 75 мг до приблизительно 200 мг, от приблизительно 100 мг до приблизительно 200 мг или от приблизительно 125 мг до приблизительно 1750 мг. В одном варианте осуществления CAL-101 вводят два раза в сутки в дозировке приблизительно 150 мг. В одном варианте осуществления обинутузумаб вводят в суточной дозировке от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг или от приблизительно 900 мг до приблизительно 1000 мг. В одном варианте осуществления обинутузумаб вводят в суточной дозировке приблизительно 1000 мг.
[0508] В одном варианте осуществления соединение 292 вводят в количестве для достижения Cmaxss от приблизительно 1000 нг/мл до приблизительно 5000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 4000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 3000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 2500 нг/мл или от приблизительно 1400 нг/мл до приблизительно 2200 нг/мл; и
обинутузумаб вводят в количестве для достижения Cmaxss от приблизительно 100 нг/мл до приблизительно 1000 нг/мл, от приблизительно 250 нг/мл до приблизительно 1000 нг/мл, от приблизительно 500 нг/мл до приблизительно 1000 нг/мл, от приблизительно 600 нг/мл до приблизительно 1000 нг/мл, от приблизительно 700 нг/мл до приблизительно 1000 нг/мл, от приблизительно 740 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 900 нг/мл или от приблизительно 750 нг/мл до приблизительно 800 нг/мл.
[0509] В одном варианте осуществления соединение 292 вводят в количестве для достижения Cmaxss от приблизительно 1500 нг/мл до приблизительно 1000 нг/мл, от приблизительно 1500 нг/мл до приблизительно 1200 нг/мл, от приблизительно 1500 нг/мл до приблизительно 1300 нг/мл, или от приблизительно 1500 нг/мл до приблизительно 1400 нг/мл. В одном варианте осуществления соединение 292 вводят в количестве для достижения Cmaxss приблизительно 1487 нг/мл. В одном варианте осуществления Cmaxss составляет по меньшей мере 700 нг/мл, по меньшей мере 1000 нг/мл, по меньшей мере 1200 нг/мл, по меньшей мере 1400 нг/мл, по меньшей мере 1450 нг/мл, по меньшей мере 1480 нг/мл, или по меньшей мере 1490 нг/мл, или по меньшей мере 1500 нг/мл. В одном варианте осуществления обинутузумаб вводят в количестве для достижения Cmaxss от приблизительно 750 нг/мл до приблизительно 900 нг/мл, от приблизительно 750 нг/мл до приблизительно 850 нг/мл или от приблизительно 750 нг/мл до приблизительно 800 нг/мл. В одном варианте осуществления обинутузумаб вводят в количестве для достижения Cmaxss в количестве приблизительно 741 нг/мл. В одном варианте осуществления Cmaxss составляет по меньшей мере 200 нг/мл, по меньшей мере 500 нг/мл, по меньшей мере 600 нг/мл, по меньшей мере 700 нг/мл, по меньшей мере 720 нг/мл, по меньшей мере 730 нг/мл или по меньшей мере 740 нг/мл.
[0510] В одном варианте осуществления CAL-101 вводят в количестве для достижения Cmaxss от приблизительно 1000 нг/мл до приблизительно 5000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 4000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 3000 нг/мл, от приблизительно 1000 нг/мл до приблизительно 2500 нг/мл или от приблизительно 1400 нг/мл до приблизительно 2200 нг/мл; и
обинутузумаб вводят в количестве для достижения Cmaxss от приблизительно 100 нг/мл до приблизительно 1000 нг/мл, от приблизительно 250 нг/мл до приблизительно 1000 нг/мл, от приблизительно 500 нг/мл до приблизительно 1000 нг/мл, от приблизительно 600 нг/мл до приблизительно 1000 нг/мл, от приблизительно 700 нг/мл до приблизительно 1000 нг/мл, от приблизительно 740 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 1000 нг/мл, от приблизительно 750 нг/мл до приблизительно 900 нг/мл, или от приблизительно 750 нг/мл до приблизительно 800 нг/мл.
[0511] В одном варианте осуществления CAL-101 вводят в количестве для достижения Cmaxss от приблизительно 1000 нг/мл до приблизительно 2500 нг/мл, от 1500 нг/мл до приблизительно 2500 или от приблизительно 2000 нг/мл до приблизительно 2500 нг/мл. В одном варианте осуществления CAL-101 вводят в количестве для достижения Cmaxss приблизительно 2200 нг/мл. В одном варианте осуществления Cmaxss составляет по меньшей мере 1000 нг/мл, по меньшей мере 1500 нг/мл, по меньшей мере 1750 нг/мл, по меньшей мере 2000 нг/мл, по меньшей мере 2100 нг/мл, по меньшей мере 2150 нг/мл, по меньшей мере 2175 нг/мл или по меньшей мере 2200 нг/мл. В одном варианте осуществления обинутузумаб вводят в количестве для достижения Cmaxss от приблизительно 750 нг/мл до приблизительно 900 нг/мл, от приблизительно 750 нг/мл до приблизительно 850 нг/мл или от приблизительно 750 нг/мл до приблизительно 800 нг/мл. В одном варианте осуществления обинутузумаб вводят в количестве для достижения Cmaxss приблизительно 741 нг/мл. В одном варианте осуществления Cmaxss составляет по меньшей мере 300 нг/мл, по меньшей мере 500 нг/мл, по меньшей мере 600 нг/мл, по меньшей мере 700 нг/мл, по меньшей мере 720 нг/мл, по меньшей мере 730 нг/мл или по меньшей мере 740 нг/мл.
[0512] В одном варианте осуществления соединение 292 вводят в количестве для достижения AUCss от приблизительно 5000 нг/мл*ч до приблизительно 10000 нг/мл*ч, от приблизительно 5000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 7000 нг/мл*ч до приблизительно 9000 нг/мл*ч, приблизительно 7000 нг/мл*ч, приблизительно 7500 нг/мл*ч, приблизительно 8000 нг/мл*ч, приблизительно 8500 нг/мл*ч, приблизительно 8600 нг/мл*ч, приблизительно 8700 нг/мл*ч или приблизительно 8800 нг/мл*ч; и
обинутузумаб вводят в количестве для достижения AUCss от приблизительно 1000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 2000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч.
[0513] В одном варианте осуществления соединение 292 вводят в количестве для достижения AUCss от приблизительно 7000 нг/мл*ч до приблизительно 9000 нг/мл*ч или от приблизительно 8000 нг/мл*ч до приблизительно 8500 нг/мл*ч. В одном варианте осуществления соединение 292 вводят в количестве для достижения AUCss приблизительно 8600 нг/мл*ч, приблизительно 8700 нг/мл*ч или приблизительно 8800 нг/мл*ч. В одном варианте осуществления соединение 292 вводят в количестве для достижения AUCss приблизительно 8787 нг/мл*ч. В одном варианте осуществления обинутузумаб вводят в количестве для достижения AUCss от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч. В одном варианте осуществления обинутузумаб вводят в количестве для достижения AUCss приблизительно 4044 нг/мл*ч.
[0514] В одном варианте осуществления CAL-101 вводят в количестве для достижения AUCss от приблизительно 5000 нг/мл*ч до приблизительно 10000 нг/мл*ч, от приблизительно 5000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 7000 нг/мл*ч до приблизительно 9000 нг/мл*ч, приблизительно 7000 нг/мл*ч, приблизительно 7500 нг/мл*ч, приблизительно 8000 нг/мл*ч, приблизительно 8500 нг/мл*ч, приблизительно 8600 нг/мл*ч, приблизительно 8700 нг/мл*ч или приблизительно 8800 нг/мл*ч; и
обинутузумаб вводят в количестве для достижения AUCss от приблизительно 1000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 2000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч.
[0515] В одном варианте осуществления CAL-101 вводят в количестве для достижения AUCss от приблизительно 6000 нг/мл*ч до приблизительно 9000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 8000 нг/мл*ч, от приблизительно 6000 нг/мл*ч до приблизительно 7500 нг/мл*ч или от приблизительно 6500 нг/мл*ч до приблизительно 7500 нг/мл*ч. В одном варианте осуществления CAL-101 вводят в количестве для достижения AUCss приблизительно 7000 нг/мл*ч. В одном варианте осуществления обинутузумаб вводят в количестве для достижения AUCss от приблизительно 3000 нг/мл*ч до приблизительно 5000 нг/мл*ч, от приблизительно 4000 нг/мл*ч до приблизительно 5000 нг/мл*ч или от приблизительно 4000 нг/мл*ч до приблизительно 4500 нг/мл*ч. В одном варианте осуществления обинутузумаб вводят в количестве для достижения AUCss приблизительно 4044 нг/мл*ч.
[0516] В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL, макроглобулинемию Вальденстрема (WM), лимфому из клеток мантийной зоны, NHL, iNHL, диффузную крупноклеточную B-клеточную лимфому или T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой фолликулярную лимфому.
[0517] В одном варианте осуществления способы, описанные в настоящем описании, включают введение модулятора PI3K (например, соединение, которое селективно снижает активность одной или нескольких изоформы(изоформ) PI3K), отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку. В одном варианте осуществления модулятор PI3K является селективным в отношении одной или нескольких изоформы(изоформ) PI3K относительно другой изоформы(изоформ) PI3K (например, селективный в отношении PI3K-δ, селективный в отношении PI3K-γ или селективный в отношении PI3K-δ и PI3K-γ).
[0518] Иллюстративные селективные ингибиторы PI3K-α включают, но не ограничиваются ими, GDC-0032 (2-[4-[2-(2-изопропил-5-метил-1,2,4-триазол-3-ил)-5,6-дигидроимидазо[1,2-d][1,4]бензоксазепин-9-ил]пиразол-1-ил]-2-метилпропанамид), MLN-1117/INK1117 и BYL-719 ((2S)-N1-[4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-4-пиридинил]-2-тиазолил]-1,2-пирролидиндикарбоксамид).
[0519] Иллюстративные ингибиторы PI3K-α/m-TOR включают, но не ограничиваются ими, GSK2126458 (2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид).
[0520] Иллюстративные селективные ингибиторы PI3K-β включают, но не ограничиваются ими, TGX-221 ((±)-7-метил-2-(морфолин-4-ил)-9-(1-фениламиноэтил)-пиридо[1,2-a]-пиримидин-4-он), GSK2636771 (дигидрохлорид 2-метил-1-(2-метил-3-(трифторметил)бензил)-6-морфолино-1H-бензо[d]имидазол-4-карбоновой кислоты), и KIN-193 ((R)-2-((1-(7-метил-2-морфолино-4-оксо-4H-пиридо[1,2-a]пиримидин-9-ил)этил)амино)бензойная кислота).
[0521] Иллюстративные селективные ингибиторы PI3K-δ включают, но не ограничиваются ими, TGR-1202/RP5264 (((S)-2-(l-(4-амино-3-(3-фтор-4-изопропоксифенил)-1H-пиразолo[3,4-d]пиримидин-l-ил)этил)-6-фтор-3-(3-фторфенил)-4H-хромен-4-он)), GS-9820 (CAL-120, (S)-2-(1-((9H-пурин-6-ил)амино)этил)-6-фтор-3-фенилхиназолин-4(3H)-он), GS-1101 (5-фтор-3-фенил-2-([S)]-1-[9H-пурин-6-иламино]пропил)-3H-хиназолин-4-он), AMG-319, GSK-2269557 (2-(6-(1H-индол-4-ил)-1H-индазол-4-ил)-5-((4-изопропилпиперазин-1-ил)метил)оксазол), SAR245409 (N-(4-(N-(3-((3,5-диметоксифенил)амино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид), INCB040093 и BAY80-6946 (2-амино-N-(7-метокси-8-(3-морфолинопропокси)-2,3-дигидроимидазо[1,2-c]хиназолин-5-ил)пиримидин-5-карбоксамид).
[0522] Иллюстративные селективные ингибиторы PI3K-γ включают, но не ограничиваются ими, AS 252424 (5-[1-[5-(4-фтор-2-гидроксифенил)фуран-2-ил]мет-(Z)-илиден]тиазолидин-2,4-дион), и CZ 24832 (5-(2-амино-8-фтор-[1,2,4]триазолo[1,5-a]пиридин-6-ил)-N-трет-бутилпиридин-3-сульфонамид).
[0523] Иллюстративные общие ингибиторы PI3K включают, но не ограничиваются ими, бупарлисиб (5-[2,6-ди(4-морфолинил)-4-пиримидинил]-4-(трифторметил)-2-пиридинамин), SAR245409 (N-(4-(N-(3-((3,5-диметоксифенил)амино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид) и GDC-0941 (2-(1H-индазол-4-ил)-6-[[4-(метилсульфонил)-1-пиперазинил]метил]-4-(4-морфолинил)тиено[3,2-d]пиримидин).
[0524] Иллюстративные общие ингибиторы PI3K/mTOR включают, но не ограничиваются ими, GDC-0980 ((S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-он (также известный как RG7422)), SF1126 ((8S,14S,17S)-14-(карбоксиметил)-8-(3-гуанидинопропил)-17-(гидроксиметил)-3,6,9,12,15-пентаоксо-1-(4-(4-оксо-8-фенил-4H-хромен-2-ил)морфолин-4-ий)-2-окса-7,10,13,16-тетраазаоктадекан-18-оат), PF-05212384 (N-[4-[[4-(диметиламино)-1-пиперидинил]карбонил]фенил]-N'-[4-(4,6-ди-4-морфолинил-1,3,5-триазин-2-ил)фенил]мочевина), LY3023414, BEZ235 (2-Метил-2-{4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил]фенил}пропаннитрил), XL-765 (N-(3-(N-(3-(3,5-диметоксифениламино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид) и GSK1059615 (5-[[4-(4-пиридинил)-6-хинолинил]метилен]-2,4-тиазолидендион).
[0525] Иллюстративные бета-сберегающие (PI3K-α/δ/γ) ингибиторы включают, но не ограничиваются ими, PX886, PX866 ([(3aR,6E,9S,9aR,10R,11aS)-6-[[бис(проп-2-енил)амино]метилиден]-5-гидрокси-9-(метоксиметил)-9a,11a-диметил-1,4,7-триоксо-2,3,3a,9,10,11-гексагидроиндено[4,5-h]изохромен-10-ил]ацетат (также известный как сонолисиб)).
[0526] В одном варианте осуществления ингибитор PI3K представляет собой ингибитор PI3K, как описано в WO 2005/113556, полное содержание которой включено в настоящее описание в качестве ссылки. В одном варианте осуществления ингибитор PI3K представляет собой соединения № 113 или 107, как описано в WO2005/113556.
[0527] В одном варианте осуществления ингибитор PI3K представляет собой ингибитор PI3K, как описано в WO2014/006572, полное содержание которой включено в настоящее описание в качестве ссылки. В одном варианте осуществления ингибитор PI3K представляет собой соединения № A1, A2, B, B1 или B2, как описано в WO2014/006572.
[0528] В одном варианте осуществления ингибитор PI3K представляет собой ингибитор PI3K, как описано в WO 2013/032591, полное содержание которой включено в настоящее описание в качестве ссылки. В одном варианте осуществления ингибитор PI3K представляет собой соединение формулы (I), как описано в WO 2013/032591. В одном варианте осуществления селективный ингибитор PI3K дельта представляет собой соединение, описанное в WO 2013/032591, с IC50 (нМ) для изоформы PI3K дельта менее 100 нМ и IC50 (нМ) для PI3K альфа, бета или гамма более чем приблизительно 100 нМ, более чем приблизительно 1 мкМ или более чем приблизительно 10 мкМ. В одном варианте осуществления селективный ингибитор PI3K дельта имеет соотношение селективности в отношении альфа/дельта, соотношение селективности в отношении бета/дельта или соотношение селективности в отношении гамма/дельта более 1, более чем приблизительно 10 или более чем приблизительно 100. В одном варианте осуществления модулятор PI3K представляет собой соединение № 359, как описано в WO 2013/032591.
[0529] В одном варианте осуществления ингибитор PI3K ингибитор представляет собой ингибитор PI3K, как описано в WO2011/146882, WO2013/012915 или WO2013/012918, полное содержание которых включено в настоящее описание в качестве ссылок.
[0530] В одном варианте осуществления ингибитор PI3K выбран из RP6503, RP6530, IC87114, паломида 529, ZSTK474, PWT33597, TG100-115, GNE-477, CUDC-907 и AEZS-136.
[0531] Не ограничиваясь конкретной теорией, в одном варианте осуществления, как используют в рамках изобретения и если нет иных указаний, высокая экспрессия конкретной изоформы PI3K может представлять собой увеличенное количество копий ДНК изоформы PI3K, или рецептора или мишени, связанных с изоформой PI3K, высокую экспрессию РНК изоформы PI3K, или рецептора или мишени, связанных с изоформой PI3K, высокую экспрессию белка изоформы PI3K, или рецептора или мишени, связанных с изоформой PI3K, амплификацию изоформы PI3K, или рецептора или мишени, связанных с изоформой PI3K, делецию рецептора или мишени, связанных с изоформой PI3K, подавление рецептора или мишени, связанных с изоформой PI3K, мутацию изоформы PI3K, или рецептора или мишени, связанных с изоформой PI3K, и/или активацию каскада изоформы PI3K, или рецептора или мишени, связанных с изоформой PI3K. Не ограничиваясь конкретной теорией, в одном варианте осуществления в рамках настоящего изобретения предусматриваются биомаркеры активации каскада и способы их применения, которые прогнозируют ответ на лечение, описанное в настоящем описании (например, биомаркер, связанный с pAKT, pS6, pPRAS40, или другими белками или транскрипционно регулируемыми генами ниже PI3Kδ и/или PI3Kγ).
[0532] В определенных вариантах осуществления уровень экспрессии одной или нескольких конкретных изоформ PI3K в злокачественной опухоли или при заболевании, или у пациента или в группе пациентов, можно определять путем обнаружения уровня экспрессии конкретного белка изоформы PI3K, или РНК конкретной изоформы PI3K, или увеличенного числа копий ДНК конкретной изоформы PI3K, например, с использованием способа, описанного в настоящем описании, или способа, известного в данной области. В других вариантах осуществления уровень экспрессии одной или нескольких конкретных изоформ PI3K в злокачественной опухоли или при заболевании, или у пациента или в группе пациентов, можно определять путем количественного определения биомаркера, описанного в настоящем описании (например, биомаркер каскада передачи сигнала, биомаркер мутации белка, биомаркер экспрессии белка, биомаркер мутации гена, биомаркер экспрессии гена, биомаркер цитокина, биомаркер хемокина, биомаркер матриксной металлопротеиназы или биомаркер конкретных злокачественных клеток, среди прочих). В другом варианте осуществления уровень экспрессии одной или нескольких конкретных изоформ PI3K в злокачественной опухоли или при заболевании, у пациента или в группе пациентов, можно определять, исходя из информации, известной в данной области, или на основе предшествующих исследований злокачественной опухоли или заболевания, или предшествующего исследования пациента или группы пациентов.
[0533] В определенных вариантах осуществления селективность модулятора PI3K (например, соединение, описанное в настоящем описании) в отношении одной или нескольких изоформы(изоформ) PI3K относительно другой изоформы(изоформ) PI3K можно определять путем измерения активности модулятора PI3K в отношении изоформ PI3K (например, PI3K-α, PI3K-β, PI3K-δ и/или PI3K-γ), например, с использованием способа, описанного в настоящем описании, или способа, известного в данной области.
[0534] PI3K-γ представляет собой PI3K класса 1B, которая связывается с адаптерными белками p101 и p84 (p87PIKAP) и передает канонические сигналы через GPCR. Может происходить неканоническая активация через тирозинкиназные рецепторы и RAS. Активированная PI3K-γ приводит к продуцированию PIP3, который служит в качестве участка присоединения нижеследующих эффекторных белков, включая AKT и BTK, транспортирующих эти ферменты на клеточную мембрану, где они могут активироваться. Было сделано предположение о каркасной роли PI3k-γ, и она может вносить вклад в активацию каскада RAS/MEK/ERK. Взаимодействие с каскадом RAS объясняет активность, свойственную киназе PI3K-γ в клетках или у животных. PI3K-γ необходима для функционирования различных иммунных клеток и каскадов. Продуцирование хемокинов, которые обеспечивают миграцию нейтрофилов или моноцитарных клеток, опосредуется PI3K-γ при воспалительной стимуляции (включая IL8, fMLP и C5a) (HIRSCH et al., "Central Role for G Protein-Coupled Phosphoinositide 3-Kinase γ in Inflammation", Science 287:1049-1053 (2000); SASAKI et al., "Function of PI3Kγ in Thymocyte Development, T Cell Activation, and Neutrophil Migration," Science 287:1040-1046 (2000); LI et al., "Roles of PLC-β2 and -β3 and PI3Kγ in Chemoattractant-Mediated Signal Transduction," Science 287:1046-1049 (2000)). Потребность в PI3K-γ-зависимой миграции нейтрофилов демонстрируется отсутствием развития артрита в модели артрита с переносом сыворотки K/BXN в мышей с нокаутом PI3K-γ (Randis et al., Eur. J. Immunol., 2008, 38(5), 1215-24). Аналогично, у мышей не развивается клеточное воспаление и гиперреактивность дыхательных путей в модули индуцируемой овальбумином астмы (Takeda et al., J. Allergy Clin. Immunol., 2009; 123, 805-12). Мыши с дефицитом PI3K-γ также имеют дефекты функции T-хелперных клеток. Продуцирование T-клеточных цитокинов и пролиферация в ответ на активацию снижены, и зависимое от T-хелперов выведение вирусов является дефектным (Sasaki et al., Science, 2000, 287, 1040-46). Модели зависимого от T-клеток воспалительного заболевания, включая EAE, также не развиваются у мышей с дефицитом PI3K-γ, и как дефект активации T-клеток, так и дефекты клеточной миграции могут обеспечивать эффективность в этой модели (Comerfold, PLOS One, 2012, 7, e45095). Модель индуцируемого имиквимодом псориаза использовали для определения важности PI3K-γ в воспалительном ответе. С использованием мышей с дефицитом PI3K-γ в этом модели, накопление γδ T-клеток в коже блокируется, также как и созревание и миграция дендритных клеток (ROLLER et al., "Blockade of Phosphatidylinositol 3-Kinase (PI3K)δ or PI3Kγ Reduces IL-17 and Ameliorates Imiquimod-Induced Psoriasis-like Dermatitis," J. Immunol. 189:4612-4620 (2012)). Роль PI3K-γ клеточном транспорте также может быть продемонстрирована в моделях онкологии, где воспаление в опухоли является важным для роста и метастазирования злокачественных опухолей. В модели карциномы легкого Люьиса, являются дефектными активация, миграция и дифференцировка моноцитов. Этот дефект приводит к снижению роста опухоли и увеличению выживаемости у мышей с дефицитом PI3K-γ (Schmid et al., Cancer Cell, 2011, 19, 715-27) или при лечении ингибиторами, которые нацелены на PI3K-γ. При раке поджелудочной железы PI3K-γ может экспрессироваться ненадлежащим образом, и в этой солидной злокачественной опухоли или в других опухолях, где PI3K-γ играет функциональную роль, ингибирование PI3K-γ может быть полезным. Ингибирование PI3K-γ демонстрирует перспективу для лечения гематологических злокачественных опухолей. В модели T-ALL с использованием опосредуемого T-клетками нокаута PTEN, как PI3K-δ, так и PI3K-γ являются необходимыми для соответствующего развития заболевания, как показано с помощью генетической делеции обоих генов (Subramaniam et al. Cancer Cell 21, 459-472, 2012). Кроме того, в этой модули T-ALL введение низкомолекулярного ингибитора обеих киназ приводит к увеличению выживаемости у этих мышей. При CLL сеть хемокинов поддерживает псевдофолликулярное микроокружение, которые включает клетки, подобные клеткам-"сиделкам", стромальные клетки и T-хелперные клетки. Роль PI3K-γ в нормальной передаче сигналов хемокинов и биологии T-клеток указывает на значимость ингибирования этой мишени при CLL (BURGER, "Inhibiting B-Cell Receptor Signaling Pathways in Chronic Lymphocytic Leukemia", Curr. Mematol. Malig. Rep. 7:26-33 (2012)). Таким образом, ингибиторы PI3K-γ представляют терапевтический интерес для лечения заболеваний иммунной системы, где являются важными транспорт клеток и функция T-клеток или миелоидных клеток. В онкологии можно осуществлять нацеливание на солидные опухоли, которые зависят от воспаления в опухоли, или опухоли с высокими уровнями экспрессии PI3K-γ. Для гематологических злокачественных опухолей, конкретная роль изоформ PI3K-γ и PI3K-δ в T-ALL и, возможно, в CLL указывает на то, что нацеливание на эти PI3K при данных заболеваниях возможно будет полезным.
[0535] Роль каскада PI3K-γ в ускорении транспорта миелоидных клеток в опухоли и роль блокады p110γ при подавлении воспаления в опухоли и роста при раке молочной железы, раке поджелудочной железы и раке легкого описана в Schmid et al. (2011) Cancer Cell 19, 715-727, полное содержание которой включено в настоящее описание в качестве ссылки. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения рака поджелудочной железы ингибитором PI3K. В другом варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения рака молочной железы ингибитором PI3K. В другом варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения рака легкого ингибитором PI3K. В одном варианте осуществления ингибитор PI3K представляет собой ингибитор PI3K-γ, селективный или неселективный в отношении одной или нескольких изоформы(изоформ) PI3K. В одном варианте осуществления ингибитор PI3K представляет собой селективный ингибитор PI3K-γ.
[0536] Изоформы PI3K-δ и PI3K-γ предпочтительно экспрессируются в лейкоцитах, где они имеют обособленные и не перекрывающиеся роли в развитии и функционировании иммунных клеток. См., например, PURI and GOLD, "Selective inhibitors of phosphoinositide 3-kinase delta: modulators of B-cell function with potential for treating autoimmune inflammatory disease and B-cell malignancies," Front. Immunol. 3:256 (2012); BUITENHUIS et al., "The role of the PI3k-PKB signaling module in regulation of hematopoiesis," Cell Cycle 8(4):560-566 (2009); HOELLENRIEGEL and BURGER, "Phosphoinositide 3'-kinase delta: turning off BCR signaling in Chronic Lymphocytic Leukemia," Oncotarget 2(10):737-738 (2011); HIRSCH et al., "Central Role for G Protein-Coupled Phosphoinositide 3-Kinase γ in Inflammation," Science 287:1049-1053 (2000); LI et al., "Roles of PLC-β2 and -β3 and PI3Kγ in Chemoattractant-Mediated Signal Transduction," Science 287:1046-1049 (2000); SASAKI et al., "Function of PI3Kγ in Thymocyte Development, T Cell Activation, and Neutrophil Migration," Science 287:1040-1046 (2000); CUSHING et al., "PI3Kδ and PI3Kγ as Targets for Autoimmune and Inflammatory Diseases," J. Med. Chem. 55:8559-8581 (2012); MAXWELL et al., "Attenuation of phosphoinositide 3-kinase δ signaling restrains autoimmune disease," J. Autoimmun. 38:381-391 (2012); HAYLOCK-JACOBS et al., "PI3Kδ drives the pathogenesis of experimental autoimmune encephalomyelitis by inhibiting effector T cell apoptosis and promoting Th17 differentiation," J. Autoimmun. 36:278-287 (2011); SOOND et al., "PI3K p110δ regulates T-cell cytokine production during primary and secondary immune responses in mice and humans," Blood 115(11):2203-2213 (2010); ROLLER et al., "Blockade of Phosphatidylinositol 3-Kinase (PI3K)δ or PI3Kγ Reduces IL-17 and Ameliorates Imiquimod-Induced Psoriasis-like Dermatitis," J. Immunol. 189:4612-4620 (2012); CAMPS et al., "Blockade of PI3Kγ suppresses joint inflammation and damage in mouse models of rheumatoid arthritis," Nat. Med. 11(9):936-943 (2005). В качестве ключевых ферментов в передаче сигналов лейкоцитов PI3K-δ и PI3K-γ способствуют нормальным функциям B-клеток, T-клеток и миелоидных клеток, включая дифференцировку, активацию и миграцию. См., например, HOELLENRIEGEL and BURGER, "Phosphoinositide 3'-kinase delta: turning off BCR signaling in Chronic Lymphocytic Leukemia," Oncotarget 2(10):737-738 (2011); CUSHING et al., "PI3Kδ and PI3Kγ as Targets for Autoimmune and Inflammatory Diseases," J. Med. Chem. 55:8559-8581 (2012). Активность PI3K-δ или PI3K-γ является важной в доклинических моделях аутоиммунных и воспалительных заболеваний. См., например, HIRSCH et al., "Central Role for G Protein-Coupled Phosphoinositide 3-Kinase γ in Inflammation," Science 287:1049-1053 (2000); LI et al., "Roles of PLC-β2 and -β3 and PI3Kγ in Chemoattractant-Mediated Signal Transduction," Science 287:1046-1049 (2000); SASAKI et al., "Function of PI3Kγ in Thymocyte Development, T Cell Activation, and Neutrophil Migration," Science 287:1040-1046 (2000); CUSHING et al., "PI3Kδ and PI3Kγ as Targets for Autoimmune and Inflammatory Diseases," J. Med. Chem. 55:8559-8581 (2012); MAXWELL et al., "Attenuation of phosphoinositide 3-kinase δ signaling restrains autoimmune disease," J. Autoimmun. 38:381-391 (2012); HAYLOCK-JACOBS et al., "PI3Kδ drives the pathogenesis of experimental autoimmune encephalomyelitis by inhibiting effector T cell apoptosis and promoting Th17 differentiation," J. Autoimmun. 36:278-287 (2011); SOOND et al., "PI3K p110δ regulates T-cell cytokine production during primary and secondary immune responses in mice and humans," Blood 115(11):2203-2213 (2010); ROLLER et al., "Blockade of Phosphatidylinositol 3-Kinase (PI3K)δ or PI3Kγ Reduces IL-17 and Ameliorates Imiquimod-Induced Psoriasis-like Dermatitis," J. Immunol. 189:4612-4620 (2012); CAMPS et al., "Blockade of PI3Kγ suppresses joint inflammation and damage in mouse models of rheumatoid arthritis," Nat. Med. 11(9):936-943 (2005). Учитывая ключевую роль PI3K-δ и PI3K-γ в иммунной функции, ингибиторы PI3K-δ и/или γ имеют терапевтический потенциал в иммуноопосредуемых воспалительных или неопластических заболеваниях.
[0537] PI3K-δ и PI3K-γ играют центральную роль в росте и выживании B- и T-клеточных злокачественных опухолей и ингибирование этих изоформ может эффективно ограничить эти заболевания. См., например, SUBRAMANIAM et al., "Targeting Nonclassical Oncogenes for Therapy in T-ALL," Cancer Cell 21:459-472 (2012); LANNUTTI et al., "CAL-101 a p110δ selective phosphatidylinositol-3-kinase inhibitor for the treatment of B-cell malignancies, inhibits PI3K signaling and cellular viability," Blood 117(2):591-594 (2011). PI3K-δ и PI3K-γ поддерживают рост и выживание определенных B-клеточных злокачественных опухолей путем опосредования внутриклеточной передачи сигнала BCR и взаимодействий между опухолевыми клетками и их микроокружением. См., например, PURI and GOLD, "Selective inhibitors of phosphoinositide 3-kinase delta: modulators of B-cell function with potential for treating autoimmune inflammatory disease and B-cell malignancies," Front. Immunol. 3:256 (2012); HOELLENRIEGEL et al., "The phosphoinositide 3'-kinase delta inhibitor, CAL-101, inhibits B-cell receptor signaling and chemokine networks in chronic lymphocytic leuckemia," Blood 118(13):3603-3612 (2011); BURGER, "Inhibiting B-Cell Receptor Signaling Pathways in Chronic Lymphocytic Leukemia," Curr. Mematol. Malig. Rep. 7:26-33 (2012). Увеличенная передача сигнала BCR является центральным патологическим механизмом B-клеточных злокачественных опухолей и активация PI3K является прямым следствием активации каскада BCR. См., например, BURGER, "Inhibiting B-Cell Receptor Signaling Pathways in Chronic Lymphocytic Leukemia," Curr. Mematol. Malig. Rep. 7:26-33 (2012); HERISHANU et al., "The lymph node microenvironment promotes B-cell receptor signaling, NF-κB activation, and tumor proliferation in chronic lymphocytic leukemia," Blood 117(2):563-574 (2011); DAVIS et al., "Chronic active B-cell-receptor signaling in diffuse large B-cell lymphoma," Nature 463:88-92 (2010); PIGHI et al., "Phospho-proteomic analysis of mantle cell lymphoma cells suggests a pro-survival role of B-cell receptor signaling," Cell Oncol. (Dordr) 34(2):141-153 (2011); RIZZATTI et al., "Gene expression profiling of mantle cell lymphoma cells reveals aberrant expression of genes from the PI3K-AKT, WNT and TGFβ signaling pathways," Brit. J. Haematol. 130:516-526 (2005); MARTINEZ et al., "The Molecular Signature of Mantle Cell Lymphoma Reveals Multiple Signals Favoring Cell Survival," Cancer Res. 63:8226-8232 (2003). Взаимодействия между злокачественными B-клетками и поддерживающими клетками (например, стромальные клетки, клетки, подобные клеткам-"сиделкам") в микроокружении опухоли являются важными для выживания, пролиферации, хоминга и удержания в ткани опухолевых клеток. См., например, BURGER, "Inhibiting B-Cell Receptor Signaling Pathways in Chronic Lymphocytic Leukemia," Curr. Mematol. Malig. Rep. 7:26-33 (2012); HERISHANU et al., "The lymph node microenvironment promotes B-cell receptor signaling, NF-κB activation, and tumor proliferation in chronic lymphocytic leukemia," Blood 117(2):563-574 (2011); KURTOVA et al., "Diverse marrow stromal cells protect CLL cells from spontaneous and drig-induced apoptosis: development of a reliable and reproducible system to assess stromal cell adhesion-mediated drug resistance," Blood 114(20): 4441-4450 (2009); BURGER et al., "High-level expression of the T-cell chemokines CCL3 and CCL4 by chronic lymphocytic leukemia B cells in nurselike cell cocultures and after BCR stimulation," Blood 113(13) 3050-3058 (2009); QUIROGA et al., "B-cell antigen receptor signaling enhances chronic lymphocytic leukemia cell migration and survival: specific targeting with a novel spleen tyrosine kinase inhibitor, R406," Blood 114(5):1029-1037 (2009). Ингибирование PI3K-δ, γ ингибитором в определенных злокачественных B-клетках может блокировать опосредуемые BCR сигналы внутриклеточного выживания и пролиферации в качестве ключевых взаимодействий с их микроокружением, которые являются критическими для их роста.
[0538] PI3K-δ и PI3K-γ также играют прямую роль в выживании и пролиферации определенных T-клеточных злокачественных опухолей. См., например, SUBRAMANIAM et al., "Targeting Nonclassical Oncogenes for Therapy in T-ALL," Cancer Cell 21:459-472 (2012). Аберрантная активность PI3K-δ и PI3K-γ обеспечивает сигналы, необходимые для развития и роста определенных T-клеточных злокачественных опухолей. В то время как BTK экспрессируется в B-клетках, она не экспрессируется в T-клетках, и, таким образом, BTK не является возможной мишенью для лечения T-клеточных злокачественных опухолей. См., например, NISITANI et al., "Posttranscriptional regulation of Bruton’s tyrosine kinase expression in antigen receptor-stimulated splenic B cells," PNAS 97(6):2737-2742 (2000); DE WEERS et al., "The Bruton’s tyrosine kinase gene is expressed throughout B cell differentiation, from early precursor B cell stages preceding immunoglobulin gene rearrangement up to mature B cell stages," Eur. J. Immunol. 23:3109-3114 (1993); SMITH et al., "Expression of Bruton’s Agammaglobulinemia Tyrosine Kinase Gene, BTK, Is Selectively Down-Regulated in T Lymphocytes and Plasma Cells," J. Immunol. 152:557-565 (1994). Ингибиторы PI3K-δ и/или γ могут иметь уникальный терапевтический потенциал при T-клеточных злокачественных опухолей.
[0539] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения злокачественной опухоли или гематологической злокачественной опухоли, включающий введение селективного ингибитора PI3K δ/γ. Не ограничиваясь конкретной теорией, селективное ингибирование изоформы(изоморм) δ/γ может обеспечить режим лечения, где неблагоприятные эффекты, ассоциированные с введением неселективного ингибитора PI3K, минимизированы или снижены. Не ограничиваясь конкретной теорией, полагают, что неблагоприятные эффекты могут быть снижены путем избегания ингибирования других изоформ (например, α или β) PI3K.
[0540] В одном варианте осуществления неблагоприятным эффектом является гипергликемия. В другом варианте осуществления неблагоприятным эффектом является сыпь. В другом варианте осуществления неблагоприятным эффектом является нарушенная мужская способность к оплодотворению, которая может быть результатом ингибирования β-изоформы PI3K (см., например, Ciraolo et al., Molecular Biology of the Cell, 21: 704-711 (2010)). В другом варианте осуществления неблагоприятным эффектом является токсичность в отношении яичек, которая может быть результатом ингибирования PI3K-β (см., например, Wisler et al., Amgen SOT, Abstract ID # 2334 (2012)). В другом варианте осуществления неблагоприятным эффектом является эмбриональная летальность (см., например, Bi et al., J Biol Chem, 274: 10963-10968 (1999)). В другом варианте осуществления неблагоприятным эффектом является дефектная агрегация тромбоцитов (см., например, Kulkarni et al., Science, 287: 1049-1053 (2000)). В другом варианте осуществления неблагоприятным эффектом является функционально дефектные нейтрофилы (там же).
[0541] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения конкретной злокачественной опухоли или заболевания, такого как гематологическая злокачественная опухоль, которые обладают высоким уровнем экспрессии одной или нескольких изоформы(изоформ) PI3K, где способ включает: (1) определение уровня экспрессии одной или нескольких изоформы(изоформ) PI3K в злокачественной опухоли или при заболевании; (2) выбор средства для лечения (например, модулятор PI3K, имеющий конкретный профиль селективности в отношении одной или нескольких изоформы(изоформ) PI3K, исходя из уровней экспрессии изоформ PI3K в злокачественной опухоли или при заболевании, подлежащих лечению; и (3) введение средства для лечения пациенту, имеющему злокачественную опухоль или заболевание, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии. В одном варианте осуществления уровень экспрессии одной или нескольких изоформы(изоформ) PI3K в злокачественной опухоли или при заболевании можно измерять путем определения уровня экспрессии белка, РНК и/или количества копий ДНК изоформы PI3K, или путем количественного определения одного или нескольких биомаркеров, описанных в настоящем описании (например, биомаркер каскада передачи сигнала, биомаркер мутации белка, биомаркер экспрессии белка, биомаркер мутации гена, биомаркер экспрессии гена, биомаркер цитокина, биомаркер хемокина, биомаркер матриксной металлопротеиназы или биомаркер конкретных злокачественных клеток, среди прочих). В других вариантах осуществления уровень экспрессии одной или нескольких изоформы(изоформ) PI3K в злокачественной опухоли или при заболевании можно определять, исходя из информации, известной в данной области, или информации, полученной в предшествующих исследованиях злокачественной опухоли или заболевания.
[0542] Определенная злокачественная опухоль или нарушение, например, гематологическая злокачественная опухоль, может проявлять гетерогенность экспрессии изоформы PI3K среди популяций пациентов. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения у конкретного пациента или в группе пациентов, имеющих злокачественную опухоль или заболевание, такое как гематологическая злокачественная опухоль, где способ включает: (1) определение уровней экспрессии одной или нескольких изоформы(изоформ) PI3K у пациента или в группе пациентов, имеющих злокачественную опухоль или заболевание; (2) выбор средства для лечения (например, модулятор PI3K, имеющий конкретный профиль селективности в отношении одной или нескольких изоформы(изоформ) PI3K, исходя из уровней экспрессии изоформ PI3K у пациента(ов), подлежащего лечению; и (3) введение средства для лечения пациенту(ам), отдельно или в комбинации с одним или несколькими другими средствами или способами терапии. В одном варианте осуществления уровень экспрессии одной или нескольких изоформы(изоформ) PI3K у пациента или в группе пациентов можно измерять путем определения уровня экспрессии белка, РНК и/или количества копий ДНК изоформы PI3K у пациента или в группе пациентов; или путем количественного определения одного или нескольких биомаркеров, описанных в настоящем описании, у пациента или в группе пациентов (например, биомаркер каскада передачи сигнала, биомаркер мутации белка, биомаркер экспрессии белка, биомаркер мутации гена, биомаркер экспрессии гена, биомаркер цитокина, биомаркер хемокина, биомаркер матриксной металлопротеиназы или биомаркер конкретных злокачественных клеток, среди прочих). В других вариантах осуществления уровень экспрессии одной или нескольких изоформы(изоформ) PI3K у пациента или в группе пациентов можно определять на основе информации, известной в данной области, или информации, полученной при предшествующем исследовании пациента или группы пациентов.
[0543] В одном варианте осуществления способы, описанные в настоящем описании, включают введение модулятора PI3K, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, индивидууму, например млекопитающему, например человеку; где модулятор PI3K является селективным в отношении одной или нескольких изоформы(изоформ) PI3K относительно других изоформ PI3K (например, селективный в отношении PI3K-δ, селективный в отношении PI3K-γ, или селективный в отношении как PI3K-δ, так и PI3K-γ); и индивидуум, подвергаемый лечению, имеет высокий уровень экспрессии конкретной изоформы(изоформ) PI3K (например, высокий уровень экспрессии PI3K-δ, высокий уровень экспрессии PI3K-γ или высокий уровень экспрессии как PI3K-δ, так и PI3K-γ).
[0544] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ определения того, с большей или с меньшей вероятностью индивидуум, имеющий злокачественную опухоль или гематологическую злокачественную опухоль, будет отвечать на лечение модулятором PI3K, который селективно снижает активность одной или нескольких изоформы(изоформ) PI3K относительно других изоформ PI3K, где способ включает (1) введение модулятора PI3K индивидууму; и (2) определение ответа индивидуума на лечение после приблизительно 7, 14, 21, 28, 35, 42, 49, 56, 63 или 70 суток, или приблизительно 1, 2, 3, 4 или 5 месяцев после первого введения модулятора PI3K.
[0545] Не ограничиваясь конкретной теорией, как описано в настоящем описании, лечение конкретной злокачественной опухоли или гематологической злокачественной опухоли, или конкретного подтипа злокачественной опухоли или гематологической злокачественной опухоли, или конкретного пациента, имеющего злокачественную опухоль или гематологическую злокачественную опухоль, которая имеет высокую экспрессию конкретной изоформы PI3K, ингибитором PI3K, который селективно ингибирует эту конкретную изоформу PI3K позволяет использовать более низкую дозу лекарственного средства и/или обеспечивает сниженный эффект вне мишени (например, эффекты на другие изоформы PI3K), тем самым, минимизируя потенциальные неблагоприятные эффекты. Не ограничиваясь конкретной теорией, способы, описанные в настоящем описании, могут обеспечить сниженные побочные эффекты и/или увеличенную эффективность. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения злокачественной опухоли или заболевания, такой как гематологическая злокачественная опухоль, имеющая высокий уровень экспрессии одной или нескольких изоформы(изоформ) PI3K, где неблагоприятные эффекты, ассоциированные с введением ингибитора PI3K, являются сниженными. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения злокачественной опухоли или заболевания, такого как гематологическая злокачественная опухоль, или конкретный тип или подтип злокачественной опухоли или заболевания, такой как конкретный тип или подтип гематологической злокачественной опухоли, селективным ингибитором PI3K-γ, где неблагоприятные эффекты, ассоциированные с введением ингибиторов другой изоформы(изоформ) PI3K (например, PI3K-α или PI3K-β) снижены. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или предупреждения злокачественной опухоли или заболевания, такого как гематологическая злокачественная опухоль, или конкретного типа или подтипа злокачественной опухоли или заболевания, такого как конкретный тип или подтип гематологической злокачественной опухоли, селективным ингибитором PI3K-γ, в более низкой (например, приблизительно на 10%, приблизительно на 20%, приблизительно на 30%, приблизительно на 40%, приблизительно на 50%, приблизительно на 60%, приблизительно на 70% или приблизительно на 80%) дозе по сравнению с лечением неселективным или менее селективным ингибитором PI3K-γ (например, общий ингибитор PI3K (например, PI3K-α, β, γ, δ)). Такие неблагоприятные эффекты могут включать, но не ограничиваются ими, тошноту, диарею, запор, усталость, пирексию, озноб, рвоту, снижение аппетита, сыпь, повышенный уровень ASL, повышенный уровень ALT, увеличенный уровень мочевины в крови, увеличенный уровень аланинаминотрансферазы, увеличенный уровень аспартатаминотрансферазы, увеличенный уровень щелочной фосфатазы в крови, нейтропению, тромбоцитопению, анемию, гипергликемию, гиперхолестеринемию, гипертриглицеридемию, гиперфосфатемию, гипомагниемию, боль, боль в спине, мышечную боль, кашель и диспноэ. Термин "уменьшение" одного или нескольких неблагоприятных эффектов означает снижение встречаемости и/или тяжести одного или нескольких неблагоприятных эффектов, описанных в настоящем описании или известных в данной области, которые, как правило, ассоциированы с введением ингибитора PI3K, например, приблизительно на 10%, приблизительно на 20%, приблизительно на 30%, приблизительно на 40%, приблизительно на 50%, приблизительно на 60%, приблизительно на 70%, приблизительно на 80%, приблизительно на 90%, приблизительно на 95%, приблизительно на 100% по сравнению с лечением другим ингибитором PI3K (например, неселективный или менее селективный ингибитор).
[0546] В одном варианте осуществления в настоящем описании описан способ лечения или предупреждения злокачественной опухоли или конкретного подтипа или конкретного подтипа злокачественной опухоли, описанной в настоящем описании. Примеры злокачественной опухоли, которую можно лечить или предупреждать с помощью модулятора PI3K (например, PI3K-δ и/или PI3K-γ), например, соединения, описанного в настоящем описании, включают, например, лейкоз, хронический лимфоцитарный лейкоз, острый миелоидный лейкоз, хронический миелоидный лейкоз (например, Salmena, L et al. (2008) Cell 133:403-414; Chapuis, N et al. (2010) Clin Cancer Res. 16(22):5424-35; Khwaja, A (2010) Curr Top Microbiol Immunol. 347:169-88); лимфому, например, неходжкинскую лимфому (например, Salmena, L et al. (2008) Cell 133:403-414); рак легкого, например, немелкоклеточный рак легкого, мелкоклеточный рак легкого (например, Herrera, VA et al. (2011) Anticancer Res. 31(3):849-54); меланому (например, Haluska, F et al. (2007) Semin Oncol. 34(6):546-54); рак предстательной железы (например, Sarker, D et al. (2009) Clin Cancer Res. 15(15):4799-805); глиобластому (например, Chen, JS et al. (2008) Mol Cancer Ther. 7:841-850); рак эндометрия (например, Bansal, N et al. (2009) Cancer Control. 16(1):8-13); рак поджелудочной железы (например, Furukawa, T (2008) J Gastroenterol. 43(12):905-11); почечноклеточный рак (например, Porta, C и Figlin, RA (2009) J Urol. 182(6):2569-77); рак ободочной и прямой кишки (например, Saif, MW and Chu, E (2010) Cancer J. 16(3):196-201); рак молочной железы (например, Torbett, NE et al. (2008) Biochem J. 415:97-100); рак щитовидной железы (например, Brzezianska, E and Pastuszak-Lewandoska, D (2011) Front Biosci. 16:422-39); и рак яичника (например, Mazzoletti, M and Broggini, M (2010) Curr Med Chem. 17(36):4433-47). В некоторых вариантах осуществления указанный способ относится к лечению злокачественной опухоли, такой как острый миелоидный лейкоз, рак тимуса, головного мозга, легкого, плоскоклеточный рак, рак кожи, глаза, ретинобластома, внутриглазная меланома, рак полости рта и ротоглотки, рак мочевого пузыря, гастральный рак, рак желудка, рак поджелудочной железы, рак мочевого пузыря, рак молочной железы, рак шейки матки, рак головы, шеи, ренальный рак, рак почки, рак печени, рак яичника, рак предстательной железы, рак ободочной и прямой кишки, рак пищевода, рак яичка, гинекологический рак, рак щитовидной железы, злокачественную опухоль ЦНС, ПНС, связанную со СПИД (например, лимфома и саркома Капоши) или другие индуцируемые вирусами злокачественные опухоли. В некоторых вариантах осуществления указанный способ относится к лечению незлокачественного гиперпролиферативного нарушения, такого как доброкачественная гиперплазия кожи (например, псориаз), рестеноз или незлокачественное гиперпролиферативное нарушение предстательной железы (например, доброкачественная гипертрофия предстательной железы (BPH)).
[0547] Пациенты, которых можно лечить с помощью соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), или фармацевтической композицией, описанной в настоящем описании, в соответствии со способами, описанными в настоящем описании, включают, например, но не ограничиваясь ими, пациентов, у которых диагностировано наличие рака молочной железы, такого как протоковая карцинома, долевая карцинома, медуллярные карциномы, коллоидные карциномы, тубулярные карциномы и воспалительный рак молочной железы; рака яичника, включая эпителиальные опухоли яичника, такие как аденокарцинома яичника и аденокарцинома, которая мигрировала из яичника в брюшную полость; рака тела матки; рака шейки матки, такого как эпителиальная аденокарцинома шейки матки или плоскоклеточная карцинома; рака предстательной железы, такого как рак предстательной железы, выбранный из следующих: аденокарцинома или аденокарцинома, которая мигрировала в кость; рак поджелудочной железы, такой как эпителиоидная карцинома ткани протоков поджелудочной железы и аденокарцинома протоков поджелудочной железы; рака мочевого пузыря, такого как переходно-клеточная карцинома мочевого пузыря, уротелиальные карциномы (переходно-клеточные карциномы), опухоли уротелиальных клеток, которые выстилают мочевой пузырь, плоскоклеточный рак, аденокарциномы и мелкоклеточные злокачественные опухоли; лейкоза, такого как острый миелоидный лейкоз (AML), острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, хронический миелоидный лейкоз, волосатоклеточный лейкоз, миелопролиферативные нарушения, лейкоз NK-клеток (например, новообразование бластных плазмацитоидных дендритных клеток), острый миелогенный лейкоз (AML), хронический миелогенный лейкоз (CML), мастоцитоз, хронический лимфоцитарный лейкоз (CLL), множественная миелома (MM) и миелодиспластический синдром (MDS); рак кости; рака легкого, такого как немелкоклеточный рак легкого (NSCLC), который подразделяется на плоскоклеточный рак, аденокарциномы и крупноклеточные недифференцированные карциномы и мелкоклеточный рак легкого; рака кожи, такого как базально-клеточная карцинома, меланома, плоскоклеточная карцинома и актинический кератоз, который представляет собой состояние кожи, которое иногда развивается в плоскоклеточную карциному; ретинобластомы глаза; кожной или внутриглазной (глазной) меланомы; первичного рака печени; рака почки; рака щитовидной железы, такого как папиллярный, фолликулярный, медуллярный и анапластический; лимфомы, такой как диффузная крупноклеточная B-клеточная лимфома, B-клеточная иммунобластная лимфома, лимфома NK-клеток (например, новообразование бластных плазмацитоидных дендритных клеток) и лимфома Беркитта; саркомы Капоши; индуцируемых вирусами злокачественных опухолей, включая вирус гепатита B (HBV), вирус гепатита C (HCV) и печеночно-клеточную карциному; лимфотропного вируса типа 1 человека (HTLV-1) и взрослого T-клеточного лейкоза/лимфомы; и вируса папилломы человека (HPV) и рака шейки матки; злокачественных опухолей центральной нервной системы (ЦНС), таких как первичная опухоль головного мозга, которая включает глиомы (астроцитома, анапластическая астроцитома или множественная глиобластома), олигоденроглиома, эпендимома, менингиома, лимфома, шваннома и медуллобластома; злокачественных опухолей периферической нервной системы (ПНС), таких как невриномы слухового нерва и злокачественная опухоль оболочки периферических нервов (MPNST), включая нейрофибромы и шванномы, злокачественную фиброцитому, злокачественную фиброзную гистиоцитому, злокачественную менингиому, злокачественную мезотелиому и злокачественную смешанную мюллерову опухоль; злокачественных опухолей полости рта и ротоглотки, такие как гипофарингеальный рак, рак гортани, назофарингеальный рак и орофарингеальный рак; рака желудка, такого как лимфомы, желудочные стромальные опухоли и карциноидные опухоли; злокачественных опухолей яичка, таких как герминомы (GCT), которые включают семиномы и несеминомы, и стромальные опухоли половых желез, которые включают опухоли из клеток Лейдига и опухоли из клеток Сертоли; злокачественной опухоли тимуса, такой как тимомы, тимические карциномы, лимфома Ходжкина, неходжкинские лимфомы, карциноиды или карциноидные опухоли; рака прямой кишки и рака толстого кишечника.
[0548] В одном варианте осуществления в настоящем описании описан способ лечения или предупреждения гематологической злокачественной опухоли (или конкретного типа или конкретного подтипа гематологической злокачественной опухоли, описанной в настоящем описании), включая, но не ограничиваясь ими, миелоидное нарушение, лимфоидное нарушение, лейкоз, лимфому, миелодиспластический синдром (MDS), миелопролиферативное заболевание (MPD), нарушение тучных клеток и миелома (например, множественная миелома), среди прочих. В одном варианте осуществления гематологическая злокачественная опухоль включает, но не ограничивается ими, острый лимфобластный лейкоз (ALL), T-клеточный ALL (T-ALL), B-клеточный ALL (B-ALL), острый T-клеточный лейкоз, острый B-клеточный лейкоз, острый миелоидный лейкоз (AML), хронический лимфоцитарный лейкоз (CLL), хронический миелогенный лейкоз (CML), CML бластной фазы, мелколимфоцитарную лимфому (SLL), CLL/SLL, CLL бластной фазы, лимфому Ходжкина (HL), неходжкинскую лимфому (NHL), B-клеточную NHL, T-клеточную NHL, вялотекущую NHL (iNHL), диффузную крупноклеточную B-клеточную лимфому (DLBCL), лимфому из клеток мантийной зоны (MCL), агрессивную B-клеточную NHL, B-клеточную лимфому (BCL), синдром Рихтера (RS), T-клеточную лимфому (TCL), периферическую T-клеточную лимфому (PTCL), Т-клеточную лимфому кожи (CTCL), трансформированный фунгоидный микоз, синдром Сезари, анапластическую крупноклеточную лимфому (ALCL), фолликулярную лимфому, макроглобулинемию Велденстрема (WM), лимфоплазматическую лимфому, лимфому Беркитта, множественную миелому (MM), амилоидоз, MPD, эссенциальный тромбоцитоз (ET), миелофиброз (MF), истинную полицитемию (PV), хронический миеломоноцитарный лейкоз (CMML), MDS, MDS высокого риска и MDS низкого риска.
[0549] В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL/SLL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL бластной фазы. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой SLL.
[0550] В следующих вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL, и соединение, описанное в настоящем описании, стимулирует апоптоз клеток CLL. Не ограничиваясь конкретной теорией, было выявлено, что обработка соединением, описанным в настоящем описании (например, соединение 292), сенсибилизирует клетки CLL. В некоторых случаях, не ограничиваясь конкретной теорией, защитные эффекты, индуцируемые связыванием IgM или стромальными клетками, могут смягчаться соединением, описанным в настоящем описании. Таким образом, в рамках настоящего изобретения предусматривается способ стимуляции апоптоза клеток CLL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления соединение представляет собой соединение 292. Также в настоящем описании предусматривается способ смягчения защитных эффектов на клетки CLL, индуцированных связыванием IgM, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления соединение представляет собой соединение 292. В другом варианте осуществления в рамках настоящего изобретения предусматривается способ смягчения защитных эффектов на CLL, индуцированных стромальными клетками, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления соединение представляет собой соединение 292.
[0551] В другом варианте осуществления в рамках настоящего изобретения предусматривается способ ингибирования пролиферации клеток CLL в лимфатических узлах, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления соединение представляет собой соединение 292. В другом варианте осуществления в рамках настоящего изобретения предусматривается способ обеспечения быстрого возникновения ответа у пациентов с CLL путем введения пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления соединение представляет собой соединение 292.
[0552] Не ограничиваясь конкретной теорией, как описано в настоящем описании, соединение, описанное в настоящем описании, ингибирует хемотаксис лейкоцитов в ответ на стимуляцию хемокином/цитокином (например, CXCL12, также именуемый как SDF-1). Таким образом, не ограничиваясь конкретной теорией, способы, описанные в настоящем описании, могут препятствовать способностям к хомингу и миграции имунных клеток, которые поддерживают рост клеток злокачественной опухоли, в микроокружение опухоли. В другом варианте осуществления способы, описанные в настоящем описании, прямо ингибируют миграцию злокачественных клеток в защитное микроокружение. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ предупреждения или контроля метастазирования или диссеминации злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL. В одном варианте осуществления соединение представляет собой соединение 292.
[0553] Не ограничиваясь конкретной теорией, как описано в настоящем описании, соединение, описанное в настоящем описании, не проявляет значительную цитотоксичность в нормальных иммунных клетках. Таким образом, не ограничиваясь конкретной теорией, способы, описанные в настоящем описании, могут минимизировать потенциальные неблагоприятные эффекты, ассоциированные с цитотоксичностью, в нормальных иммунных клетках. В одном варианте осуществления нормальная иммунная клетка представляет собой T-клетку (например, CD3+ T-клетка), B-клетку (например, CD19+ B-клетку) или NK-клетку (например CD56+ NK-клетку). В одном варианте осуществления соединение представляет собой соединение 292.
[0554] В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой iNHL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой DLBCL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой B-клеточную NHL (например, агрессивную B-клеточную NHL). В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой MCL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой RS. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой AML. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой MM. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой ALL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой T-ALL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой B-ALL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой TCL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой ALCL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой лейкоз. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой лимфому. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой T-клеточную лимфому. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой MDS (например, низкозлокачественную MDS). В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой MPD. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой нарушение тучных клеток. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой лимфому Ходжкина (HL). В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой неходжкинскую лимфому. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой PTCL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CTCL (например, фунгоидный микоз или синдром Сезари). В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой WM. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CML. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой FL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой трансформированный фунгоидный микоз. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой синдром Сезари. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой острый T-клеточный лейкоз. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой острый B-клеточный лейкоз. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой лимфому Беркитта. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой миелопролиферативные новообразования. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой опухоль маргнальной зоны селезенки. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой опухоль маргинальной зоны лимфатического узла. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой опухоль внеузловой маргинальной зоны.
[0555] В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой B-клеточную лимфому. В конкретном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением B-клеточной лимфомы, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления соединение представляет собой соединение 292. Также в рамках настоящего изобретения предусматривается способ лечения или уменьшения одного или нескольких симптомов, ассоциированных с B-клеточной лимфомой, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления B-клеточная лимфома представляет собой iNHL. В другом варианте осуществления B-клеточная лимфома представляет собой фолликулярную лимфому. В другом варианте осуществления B-клеточная лимфома представляет собой макроглобулинемию Вальденстрема (лимфоплазматическая лимфома). В другом варианте осуществления B-клеточная лимфома представляет собой лимфому маргинальной зоны (MZL). В другом варианте осуществления B-клеточная лимфома представляет собой MCL. В другом варианте осуществления B-клеточная лимфома представляет собой HL. В другом варианте осуществления B-клеточная лимфома представляет собой aNHL. В другом варианте осуществления B-клеточная лимфома представляет собой DLBCL. В другом варианте осуществления B-клеточная лимфома представляет собой лимфому Рихтера.
[0556] В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой T-клеточную лимфому. В конкретном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением T-клеточной лимфомы, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления соединение представляет собой соединение 292. Также в рамках настоящего изобретения предусматривается способ лечения или уменьшения одного или нескольких симптомов, ассоциированных с T-клеточной лимфомой, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления T-клеточная лимфома представляет собой периферическую T-клеточную лимфому (PTCL). В другом варианте осуществления T-клеточная лимфома представляет собой кожную T-клеточную лимфому (CTCL).
[0557] В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой синдром Сезари. В конкретном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением синдрома Сезари, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления соединение представляет собой соединение 292. Также в рамках настоящего изобретения предусматривается способ лечения или уменьшения одного или нескольких симптомов, ассоциированных с синдромом Сезари, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата). Симптомы, ассоциированные с синдромом Сезари, включают, но не ограничиваются ими, эпидермотропизм вследствие неопластических CD4+ лимфоцитов, микроабсцессы Потрие, эритродерму, лимфаденопатию, атипичные T-клетки в периферической крови и гепатоспленомегалию. В одном варианте осуществления соединение представляет собой соединение 292. В одном варианте осуществления терапевтически эффективное количество для лечения или управления течением синдрома Сезари составляет приблизительно от 25 мг до 75 мг, вводимые два раза в сутки. В других вариантах осуществления терапевтически эффективное количество составляет от приблизительно 50 мг до приблизительно 75 мг, от приблизительно 30 мг до приблизительно 65 мг, от приблизительно 45 мг до приблизительно 60 мг, от приблизительно 30 мг до приблизительно 50 мг, или от приблизительно 55 мг до приблизительно 65 мг, каждое из которых вводят два раза в сутки. В одном варианте осуществления эффективное количество составляет приблизительно 25 мг, вводимых два раза в сутки. В одном варианте осуществления эффективное количество составляет приблизительно 50 мг, вводимых два раза в сутуки.
[0558] В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль является рецидивирующей. В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль является рефрактерной. В определенных вариантах осуществления злокачественная опухоль, подвергаемая лечению или предупреждению, представляет собой конкретный подтип злокачественной опухоли, описанный в настоящем описании. В определенных вариантах осуществления гематологическая злокачественная опухоль, подвергаемая лечению или предупреждению, представляет собой конкретный подтип гематологической злокачественной опухоли, описанный в настоящем описании. Определенные классификации типов или подтипов злокачественной опухоли или гематологической злокачественной опухоли, описанных в настоящем описании, известны в данной области. Не ограничиваясь конкретной теорией, полагают, что во многих из злокачественных опухолей, которые стали рецидивирующими или рефрактерными, развивается устойчивость к конкретной терапии, проводимой для лечения злокачественных опухолей. Таким образом, не ограничиваясь конкретной теорией, соединение, описанное в настоящем описании, может обеспечить терапию второй линии путем предоставления альтернативного механизма для лечения злокачественной опухоли, отличного от механизмов, используемых в определенных предшествующих способах терапии. Таким образом, в одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата), где злокачественная опухоль или гематологическая злокачественная опухоль является рецидивирующей после предшествующей терапии или рефрактерной к ней.
[0559] В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой рефрактерную iNHL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой рефрактерный CLL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой рефрактерный SLL. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль является рефрактерной к терапии ритуксимабом. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль является рефрактерной к химиотерапии. В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль является рефрактерной к радиоиммунотерапии (RIT). В иллюстративных вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой iNHL, FL, опухоль маргинальной зоны селезенки, опухоль маргинальной зоны лимфатического узла, опухоль внеузловой маргинальной зоны или SLL, причем злокачественная опухоль или гематологическая злокачественная опухоль является рефрактерной к терапии ритуксимабом, химиотерапии и/или RIT.
[0560] Ингибиторы BTK, такие как ибрутиниб, можно использовать для лечения некоторых пациентов с рецидивирующим CLL (J. A. Woyach, et al., N Engl J Med, “Resistance Mechanisms for the Bruton’s Tyrosinekinase Inhibitor Ibrutinib”, опубликованная через Интернет 28 мая 2014 года). Однако было показано, что у некоторых пациентов может развиться устойчивость к лечению ибрутинибом. Таким образом, важно разработать способы лечения, которые могут лечить пациентов, у которых развилась такая устойчивость. Ибрутиниб представляет собой необратимый ингибитор BTK посредством его способности связываться с участком C481, отличающей его от других обратимых ингибиторов киназ. Развитие мутаций в генах, которые реактивируют нижеследующую передачу сигнала B-клеточного рецептора или другие каскады, может быть ответственным за развитие устойчивости, поскольку при ранее подвергаемом лечению CLL является частой клональная эволюция (D.A. Landau, Cell, 2013; 152:714-26). Существует потребность в лечении индивидуумов, у которых развилась устойчивость к предшествующим способам лечения, например, к предшествующему лечению ингибитором BTK, таким как ибрутиниб. Способы, описанные в настоящем описании, удовлетворяют эту потребность.
[0561] В другом иллюстративном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой лимфому, и злокачественная опухоль является рецидивирующей после или рефрактерной к лечению ингибитором BTK, таким как, но не ограничиваясь ими, ибрутиниб, RN-486 (6-циклопропил-8-фтор-2-(2-гидроксиметил-3-{1-метил-5-[5-(4-метил-пиперазин-1-ил)пиридин-2-иламино]-6-оксо-1,6-дигидропиридин-3-ил}фенил)-2H-изохинолин-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил)фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид]), CGI-560 (N-[3-(8-анилиноимидазо[1,2-a]пиразин-6-ил)фенил]-4-трет-бутилбензамид), CGI-1746 (4-(трет-бутил)-N-(2-метил-3-(4-метил-6-((4-(морфолин-4-карбонил)фенил)амино)-5-оксо-4,5-дигидропиразин-2-ил)фенил)бензамид), HM-71224 (Hammi Pharmaceticals), ONO-4059 (Ono Pharmaceuticals Co., LTD), CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпиримидин-2-ил)амино)фенокси)-N-метилпиколинамид), LFM-A13 (2Z-циано-N-(2,5-дибромфенил)3-гидрокси-2-бутенамид) и AVL-292 (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид), который также может быть обозначен как CC-292. ONO-4059 представляет собой пероральный ингибитор Btk, который используют для лечения пациентов с гематологической злокачественной опухолью. ONO-4059 описан, например, в Blood November 15, 2013 vol. 122 no. 21, p.4397, которая включена в настоящее описание в качестве ссылки. В другом иллюстративном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL, и злокачественная опухоль рецидивировала после, или является рефрактерной к, лечению ингибитором BTK, таким как, но не ограничиваясь ими, ибрутиниб и AVL-292 или другой ингибитор BTK, описанный в настоящем описании. В некоторых вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой макроглобулинемию Вальденстрема (WM), лимфому из клеток мантийной зоны, NHL, iNHL, фолликулярную лимфому, диффузную крупноклеточную B-клеточную лимфому или T-клеточную лимфому и злокачественная опухоль рецидивировала после или является рефрактерной к лечению ингибитором BTK, таким как, но не ограничиваясь ими, ибрутиниб и AVL-292 или другой ингибитор BTK, описанный в настоящем описании. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение индивидууму, у которого развилась устойчивость к лечению ингибитором BTK, терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соль или сольват), отдельно или в комбинации с одним или несколькими средствами или способами терапии. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292) представляет собой единственное лекарственное средство, которое вводят. В одном варианте осуществления другое средство представляет собой химиотерапевтическое средство или терапевтическое антитело. В одном варианте осуществления химиотерапевтическое средство выбрано из ингибиторов митоза, алкилирующих средств, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормональных средств, ингибиторов ангиогенеза и антиандрогенов. В одном варианте осуществления другое лекарственное средство представляет собой стероид. В другом варианте осуществления стероид представляет собой глюкокортикоид. В другом варианте осуществления глюкокортикоид представляет собой альдостерон, беклометазон, бетаметазон, кортизол (гидрокортизон), кортизон, дезоксикортикостерона ацетат (DOCA), дексаметазон, флудроацетат кортизона, метилпреднизолон, преднизолон, преднизон или триамцинолон. В другом варианте осуществления стероид представляет собой дексаметазон. В одном варианте осуществления терапевтическое антитело выбрано из антитела против CD37, антитела против CD20 и антитела против CD52. В одном варианте осуществления терапевтическое антитело представляет собой антитело против CD20. В одном варианте осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб,131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб или офатумумаб. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292), вводят в комбинации с ингибитором BTK (например, ибрутиниб или AVL-292). В одном варианте осуществления соединение 292 вводят в комбинации с ибрутинибом. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292), вводят в комбинации с антителом против CD20 (например, ритуксимаб или обинутузумаб). В одном варианте осуществления соединение 292 вводят в комбинации с обинутузумабом. В одном варианте осуществления индивидуум имеет мутацию цистеина на серин в остатке 481 BTK (C481S), мутацию цистеина на фенилаланин в остатке 481 BTK (C481F) или мутацию аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W). В некоторых вариантах осуществления индивидуум имеет мутацию гистидина на лейцин в остатке 257, мутацию лейцина на фенилаланин в остатке 845, мутацию серина на тирозин в остатке 707, мутацию гистидина на аргинин в остатке 244, мутацию метионина на аргинин в остатке 1141 или мутацию серина на фенилаланин в остатке 707 гена PLCgamma2. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ предупреждения устойчивости BTK у индивидуума, включающий введение индивидууму терапевтически эффективного количества модулятора PI3K или его фармацевтически приемлемой формы в комбинации с ингибитором BTK или его фармацевтически приемлемой формой. В некоторых вариантах осуществления комбинация включает антитело против CD20. Примеры такого антитела включают, но не ограничиваются ими, GA101.
[0562] Не ограничиваясь конкретной теорией, было выявлено, что пациенты, у которых развилась устойчивость к лечению ингибитором BTK, часто имеют мутацию цистеина на серин в остатке 481 BTK (C481S) или мутацию цистеина на фенилаланин в остатке 481 BTK (C481F). Мутация также может представлять собой С481A. Таким образом, также в настоящем описании предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту, имеющему мутацию цистеина на серин, цистеина на аланин или цистеина на фенилаланин в остатке 481 BTK, терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата), отдельно или в комбинации с одним или несколькими другими средствами или способами терапии, где злокачественная опухоль или гематологическая злокачественная опухоль является рецидивирующей после предшествующей терапии или рефрактерной к ней. В другом варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий: (1) идентификацию пациента, который имеет мутацию BTK, такую как, но не ограничиваясь ими, мутация цистеина на серин, цистеина на аланин или цистеина на фенилаланин в остатке 481 BTK; и (2) введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата), отдельно или в комбинации с одним или несколькими другими средствами или способами терапии. В одном варианте осуществления пациент представляет собой пациента с CLL. В другом варианте осуществления пациент представляет собой пациента с устойчивым к ибрутинибу CLL. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292), представляет собой единственное лекарственное средство, которое вводят. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292), вводят в комбинации с ингибитором BTK (например, ибрутиниб, RN-486 (6-циклопропил-8-фтор-2-(2-гидроксиметил-3-{1-метил-5-[5-(4-метилпиперазин-1-ил)пиридин-2-иламино]-6-оксо-1,6-дигидропиридин-3-ил}-фенил)-2H-изохинолин-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил)фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид]), CGI-560 (N-[3-(8-анилиноимидазо[1,2-a]пиразин-6-ил)фенил]-4-трет-бутилбензамид), CGI-1746 (4-(трет-бутил)-N-(2-метил-3-(4-метил-6-((4-(морфолин-4-карбонил)фенил)амино)-5-оксо-4,5-дигидропиразин-2-ил)фенил)бензамид), HM-71224 (Hammi Pharmaceticals), ONO-4059 (Ono Pharmaceuticals Co., LTD), CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпиримидин-2-ил)амино)фенокси)-N-метилпиколинамид), LFM-A13 (2Z-циано-N-(2,5-дибромфенил)3-гидрокси-2-бутенамид) или AVL-292 (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид), который также может быть обозначен как CC-292.) В одном варианте осуществления соединение 292 вводят в комбинации с ибрутинибом. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292), вводят в комбинации с антителом против CD20 (например, ритуксимаб или обинутузумаб (GA101)). В одном варианте осуществления соединение 292 вводят в комбинации с обинутузумабом. В некоторых вариантах осуществления рефрактерному пациенту вводят комбинацию одного или нескольких ингибиторов BTK с антителом против CD20 и соединением, описанным в настоящем описании (например, соединение 292). В некоторых вариантах осуществления рефрактерному пациенту не вводят ингибитор BTK.
[0563] В другом иллюстративном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль рецидивировала после или является рефрактерной к лечению антителом против CD20 (например, ритуксимаб или обинутузумаб). В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292) вводят индивидууму со злокачественной опухолью, которая рецидивировала после или является рефрактерной к лечению антителом против CD20 (например, ритуксимаб или обинутузумаб). В некоторых вариантах осуществления соединение вводят в комбинации с антителом против CD20. В некоторых вариантах осуществления соединение представляет собой соединение 292. В некоторых вариантах осуществления индивидуум со злокачественной опухолью или гематологической злокачественной опухолью, который рецидивировал после или является рефрактерным к лечению антителом против CD20, имеет WHIM-подобную мутацию CXCR4. (Proc ASH 2013; Abstract 251). В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292) вводят в комбинации с обинутузумабом. В некоторых вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL, макроглобулинемию Вальденстрема (WM), лимфому из клеток мантийной зоны, NHL, iNHL, фолликулярную лимфому, диффузную крупноклеточную B-клеточную лимфому или T-клеточную лимфому.
[0564] В другом иллюстративном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль рецидвировала после или является рефрактерной к лечению ингибитором протеасом (например, бортезомиб). В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292) вводят индивидууму со злокачественной опухолью, которая рецидивировала после или является рефрактерной к лечению ингибитором протеасом (например, бортезомиб). В некоторых вариантах осуществления соединение вводят в комбинации с ингибитором протеасом. В некоторых вариантах осуществления соединение представляет собой соединение 292. В некоторых вариантах осуществления индивидуум со злокачественной опухолью или гематологической злокачественной опухолью, который рецидивировал после или является рефрактерным к лечению ингибитором протеасом, имеет мутацию, идентифицированную в настоящем описании, в гене или белке BTK, в гене или белке CXCR4 или в гене PLCgamma2. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292) вводят в комбинации с бортезомибом. В некоторых вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL, макроглобулинемию Вальденстрема (WM), лимфому из клеток мантийной зоны, NHL, iNHL, фолликулярную лимфому, диффузную крупноклеточную B-клеточную лимфому или T-клеточную лимфому.
[0565] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), вводят индивидууму в комбинации с алкилирующим средством. В некоторых вариантах осуществления алкилирующее средство представляет собой азотистый иприт. В некоторых вариантах осуществления индивидуум имеет злокачественную опухоль или гематологическую злокачественную опухоль, которая рецидивировала после или является рефрактерной к лечению алкилирующим средством (например, азотистый иприт). В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292) вводят индивидууму со злокачественной опухолью, который рецидивировал после или является рефрактерным к лечению алкилирующим средством (например, азотистый иприт). В некоторых вариантах осуществления соединение вводят в комбинации с алкилирующим средством. В некоторых вариантах осуществления соединение представляет собой соединение 292. В некоторых вариантах осуществления индивидуум со злокачественной опухолью или гематологической злокачественной опухолью, который рецидивировал после или является рефрактерным к лечению алкилирующим средством (азотистый иприт), имеет мутацию, идентифицированную в настоящем описании, в гене или белке BTK, гене или белке CXCR4 или гене PLCgamma2. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292), вводят в комбинации с азотистый иприт. В некоторых вариантах осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL, макроглобулинемию Вальденстрема (WM), лимфому из клеток мантийной зоны, NHL, iNHL, фолликулярную лимфому, диффузную крупноклеточную B-клеточную лимфому или T-клеточную лимфому.
[0566]
[0567] Не ограничиваясь конкретной теорией, было обнаружено, что пациенты, у которых развилась устойчивость к лечению ингибитором BTK, также могут иметь мутацию аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W). У пациентов, у которых развилась устойчивость к лечению ингибитором BTK, также были обнаружены другие мутации в гене PLCgamma2. Примеры мутаций включают, но не ограничиваются ими, H257L, M1141R и S707F. Пациенты, у которых развилась устойчивость или которые являются устойчивыми к лечению ингибитором BTK, также могут иметь мутации в белке BTK. Примеры мутаций включают, но не ограничиваются ими, C481S, C481A и C481F. Также были идентифицированы пациенты с мутациями в других генах или белках в качестве мутаций, которые приводят к развитию устойчивости или отсутствию ответа на конкретный способ лечения. Примеры других мутаций включают, но не ограничиваются ими, WHIM-подобные мутации CXCR4 (Proc ASH 2013; Abstract 251).
[0568] Таким образом, также в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту, имеющему мутацию в гене PLCgamma2, включая мутации, описанные выше, такие как, но не ограничиваясь ими, мутация аргинина на триптофан в остатке 665, мутация гистидина на лейцин в остатке 257, мутация лейцина на фенилаланин в остатке 845, мутация серина на тирозин в остатке 707, мутация гистидина на аргинин в остатке 244, мутация метионина на аргинин в остатке 1141 или мутация серина на фенилаланин в остатке 707 гена PLCgamma2 или WHIM-подобная мутация CXCR4, терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата), отдельно или в комбинации с одним или несколькими другими средствами или способами лечения, где злокачественная опухоль или гематологическая злокачественная опухоль рецидивировала после или является рефрактерной к предшествующей терапии. В некоторых вариантах осуществления пациент имеет мутацию в белке BTK, такую как мутации, описанные выше в настоящем описании. Комбинированная терапия может представлять собой любую комбинацию, описанную в настоящем описании. В другом варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий: (1) идентификацию пациента, который имеет мутацию в PLCgamma2, которая приводит к мутации в продукте гена PLCgamma2, включая, но не ограничиваясь ими, мутацию аргинина на триптофан в остатке 665, мутацию гистидина на лейцин в остатке 257, мутацию лейцина на фенилаланин в остатке 845, мутацию серина на тирозин в остатке 707, мутацию гистидина на аргинин в остатке 244, мутацию метионина на аргинин в остатке 1141 или мутацию серина на фенилаланин в остатке 707 гена PLCgamma2 или мутацию в белке Btk или WHIM-подобную мутацию CXCR4; и (2) введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соль или сольват), отдельно или в комбинации с одним или несколькими средствами или способами терапии.
[0569] В одном варианте осуществления пациент представляет собой пациента с CLL. В другом варианте осуществления пациент представляет собой пациента с устойчивым к ибрутинибу CLL. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292) представляет собой единственное вводимое лекарственное средство. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292) вводят в комбинации с ингибитором BTK (например, ибрутиниб), RN-486 (6-циклопропил-8-фтор-2-(2-гидроксиметил-3-{1-метил-5-[5-(4-метилпиперазин-1-ил)пиридин-2-иламино]-6-оксо-1,6-дигидропиридин-3-ил}фенил)-2H-изохинолин-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил)фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид]), CGI-560 (N-[3-(8-анилиноимидазо[1,2-a]пиразин-6-ил)фенил]-4-трет-бутилбензамид), CGI-1746 (4-(трет-бутил)-N-(2-метил-3-(4-метил-6-((4-(морфолин-4-карбонил)фенил)амино)-5-оксо-4,5-дигидропиразин-2-ил)фенил)бензамид), HM-71224 (Hammi Pharmaceticals), ONO-4059 (Ono Pharmaceuticals Co., LTD), CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпиримидин-2-ил)амино)фенокси)-N-метилпиколинамид), LFM-A13 (2Z-циано-N-(2,5-дибромфенил)3-гидрокси-2-бутенамид) или AVL-292 (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид), который также может быть обозначен как CC-292). В одном варианте осуществления соединение 292 вводят в комбинации с ибрутинибом. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292), вводят в комбинации с антителом против CD20 (например, ритуксимаб или обинутузумаб). В одном варианте осуществления соединение 292 вводят в комбинации с обинутузумабом. В некоторых вариантах осуществления указанному пациенту проводят введение комбинации одного или нескольких ингибиторов Btk с антителом против CD20.
[0570] В некоторых вариантах осуществления предусматриваются способы лечения индивидуума со злокачественной опухолью или гематологической злокачественной опухолью, где способ включает идентификацию индивидуума с мутацией цистеина на серин в остатке 481 BTK (C481S), мутацией цистеина на фенилаланин в остатке 481 BTK (C481F), мутацией аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутацией гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутацией метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутацией серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутацией лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутацией серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутацией гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) или WHIM-подобной мутацией CXCR4; и введение терапевтически эффективного количества модулятора PI3K или его фармацевтически приемлемого производного, отдельно или в комбинации с одним или несколькими другими средствами или способами терапии индивидууму, у которого идентифицирована мутация цистеина на серин в остатке 481 BTK (C481S), мутация цистеина на фенилаланин в остатке 481 BTK (C481F), мутация аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутация гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутация метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутация серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутация лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутация серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутация гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R), или WHIM-подобная мутация CXCR4. В некоторых вариантах осуществления модулятор PI3K представляет собой соединение 292. В некоторых вариантах осуществления другое средство представляет собой химиотерапевтическое средство или терапевтическое антитело. В некоторых вариантах осуществления химиотерапевтическое средство выбрано из ингибиторов митоза, алкилирующих средств, антиметаболитов, ингибитора протеасом, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомераз, модификаторов биологического ответа, антигормональных средств, ингибиторов ангиогенеза и антиандрогенов. В одном варианте осуществления другое лекарственное средство представляет собой стероид. В другом варианте осуществления стероид представляет собой глюкокортикоид. В другом варианте осуществления глюкокортикоид представляет собой альдостерон, беклометазон, бетаметазон, кортизол (гидрокортизон), кортизон, дезоксикортикостерона ацетат (DOCA), дексаметазон, флудроацетат кортизона, метилпреднизолон, преднизолон, преднизон или триамцинолон. В другом варианте осуществления стероид представляет собой дексаметазон. В некоторых вариантах осуществления терапевтическое антитело выбрано из антитела против CD37, антитела против CD20 и антитела против CD52. В некоторых вариантах осуществления терапевтическое антитело представляет собой антитело против CD20. В некоторых вариантах осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб,131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб или офатумумаб. В некоторых вариантах осуществления антитело против CD20 представляет собой обинутузумаб. В некоторых вариантах осуществления модулятор PI3K вводят в комбинации с антителом против CD20. В некоторых вариантах осуществления способ дополнительно включает введение ингибитора BTK. Ингибитор BTK может представлять собой любой ингибитор, описанный в настоящем описании. В некоторых вариантах осуществления модулятор PI3K вводят в комбинации с ингибитором BTK. В некоторых вариантах осуществления ингибитор BTK представляет собой AVL-292. В некоторых вариантах осуществления модулятор PI3K вводят в комбинации с ингибитором протеасом (например, бортезомиб). В некоторых вариантах осуществления комбинацию модулятора PI3K и ингибитора протеасом также вводят с антителом против CD20 и/или ингибитором BTK. В некоторых вариантах осуществления модулятор PI3K вводят в комбинации с алкилирующим средством. В некоторых вариантах осуществления алкилирующее средство представляет собой азотистый иприт. В некоторых вариантах осуществления комбинацию модулятора PI3K и алкилирующего средства вводят с антителом против CD20 и/или ингибитором BTK. Как рассмотрено в настоящем описании, злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL, макроглобулинемию Вальденстрема (WM), лимфому из клеток мантийной зоны, NHL, iNHL, фолликулярную лимфому, диффузную крупноклеточную B-клеточную лимфому или T-клеточную лимфому.
[0571] Мутацию можно идентифицировать или обнаруживать любым способом и обнаружение или идентификация мутации в образце индивидуума является общеизвестной методикой для специалиста в данной области. В некоторых вариантах осуществления идентификация включает обнаружение мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена PLCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) или WHIM-подобной мутации CXCR4 в образце, полученном от индивидуума. Образец может представлять собой образец, как описано в настоящем описании, включающий, но не ограничивающийся ими, биоптат, кровь, мочу и т.п. В некоторых вариантах осуществления мутацию обнаруживают способом ПЦР, который включает ОТ-ПЦР или гибридизацию (например, применение генных чипов и т.п.).
[0572] В другом варианте осуществления описан способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий: введение терапевтически эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соли или сольвата) и терапевтически эффективного количества ингибитора BTK. Иллюстративные ингибиторы BTK включают, но не ограничиваются ими, ибрутиниб (1-[(3R)-3-[4-амино-3-(4-феноксифенил)пиразолo[3,4-d]пиримидин-1-ил]пиперидин-1-ил]проп-2-ен-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил)фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид]), CGI-560 (4-(трет-бутил)-N-(3-(8-(фениламино)имидазо[1,2-a]пиразин-6-ил)фенил)бензамид), CGI-1746 (4-трет-бутил-N-[2-метил-3-[4-метил-6-[4-(морфолин-4-карбонил)анилино]-5-оксопиразин-2-ил]фенил]бензамид), HM-71224, AVL-292 (CC-292) (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид), ONO-4059, CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпиримидин-2-ил)амино)фенокси)-N-метилпиколинамид) и LFM-A13 (2-циано-N-(2,5-дибромфенил)-3-гидрокси-2-бутенамид), и ингибиторы BTK, описанные в Akinleye et al., Journal of Hematology & Oncology, 2013, 6:59, полное содержание которых включено в настоящее описание в качестве ссылки. В одном варианте осуществления соединение представляет собой соединение 292 и ингибитор BTK выбран из ибрутиниба и AVL-292. В некоторых вариантах осуществления злокачественная опухоль представляет собой лимфому или лейкоз. В одном варианте осуществления лимфома представляет собой неходжкинскую лимфому. В одном варианте осуществления лейкоз представляет собой B-клеточный хронический лимфоцитарный лейкоз.
[0573] В определенных вариантах осуществления, не ограничиваясь конкретной теорией, было выявлено, что определенные подтипы конкретной злокачественной опухоли являются более чувствительными к лечению соединением, описанным в настоящем описании, чем другие. Например, хотя было выявлено, что существует чувствительность как подтипа ABC, так и подтипа GCB DLBCL, было выявлено, что клетки с зависимой от BCR передачей сигнала имеют более высокую чувствительность к соединению, описанному в настоящем описании, чем клетки без нее. Не ограничиваясь конкретной теорией, дополнительные факторы, такие как зависимость от других каскадов передачи сигнала, антиапоптотические характеристики (например, Bcl-2, HRK) и/или статус мутаций (например, IgH-BCL2, CD79b, MYD-88), могут вносить вклад в дифференциальную чувствительность, которую проявляют различные подтипы. Таким образом, в некоторых вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения конкретного подтипа злокачественной опухоли соединением, описанным в настоящем описании, где подтип включает клетки, имеющие зависимую от BCR передачу сигнала. В одном варианте осуществления подтип представляет собой Ri-1, WSU-DLCL2, Toledo, OCI-LY8, SU-DHL-4 или SU-DHL-6. В другом варианте осуществления подтип представляет собой Ri-1, SU-DHL-4 или SU-DHL-6.
[0574] В одном варианте осуществления в рамках настоящего изобретения предусматриваются способы модулирования активности PI3K-киназы (например, селективного модулирования) путем контактирования киназы с эффективным количеством соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), или фармацевтической композицией, описанной в настоящем описании. Модулирование может представлять собой ингибирование (например, снижение) или активацию (например, усиление) киназной активности.
[0575] В одном варианте осуществления в рамках настоящего изобретения предусматриваются способы ингибирования киназной активности путем контактирования киназы с эффективным количеством соединения, описанного в настоящем описании, в растворе. В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются способы ингибирования киназной активности путем контактирования клетки, ткани, органа, которые экспрессируют представляющую интерес киназу, с соединением, описанным в настоящем описании. В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются способы ингибирования киназной активности у индивидуума путем введения индивидууму эффективного количества соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы. В некоторых вариантах осуществления киназная активность ингибируется (например, снижается) более чем приблизительно на 25%, 30%, 40%, 50%, 60%, 70%, 80% или 90%, при контактировании с соединением, описанным в настоящем описании, по сравнению с киназной активностью без такого контакта. В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются способы ингибирования активности PI3-киназы у индивидуума (включая млекопитающих, таких как человек) путем контактирования указанного индивидуума с количеством соединения, описанного в настоящем описании, достаточным для ингибирования или снижения активности PI3-киназы у указанного индивидуума. В некоторых вариантах осуществления киназа представляет собой киназу липидов или проеинкиназу. В некоторых вариантах осуществления киназа выбрана из PI3-киназы, включая различные изоформы, такие как PI3-киназа α, PI3-киназа β, PI3-киназа γ, PI3-киназа δ; DNA-PK; mTOR; Abl, VEGFR, рецептор эфрина B4 (EphB4); рецепторная тирозинкиназа TEK (TIE2); FMS-родственная тирозинкиназа 3 (FLT-3); рецептор тромбоцитарного фактора роста (PDGFR); RET; ATM; ATR; hSmg-1; Hck; Src; рецептор эпидермального фактора роста (EGFR); KIT; рецептор инсулина (IR) и IGFR.
[0576] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ уменьшения симптома, ассоциированного со злокачественной опухолью или нарушением, таким как гематологическая злокачественная опухоль, в биологическом образце, включающий контактирование биологического образца с соединением, описанные в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф), в количестве, достаточном для уменьшения симптома. В одном варианте осуществления способ осуществляют in vivo, например, у млекопитающего, например, в модели на животных или в качестве части терапевтического протокола. В одном варианте осуществления соединение используют в качестве единственного средства или в комбинации с другим средством или способом терапии.
[0577] Как используют в рамках изобретения и если нет иных указаний, "контактирование" может быть прямым (например, путем прямого нанесения соединения на биологический образец, например, in vitro) или непрямым (например, путем введения соединения, описанного в настоящем описании, индивидууму (например, любым известным способом введения, например, перорально), так чтобы соединение, описанное в настоящем описании, достигало пораженного биологического образца в организме.
[0578] Как используют в рамках изобретения и если нет иных указаний, "биологический образец" включает, например, клетку или группу клеток (например, PBMC или плазмацитоидная дендритная клетка(и)), ткань или жидкость (например, цельная кровь или сыворотка), которая контактирует с соединением, описанным в настоящем описании, например, модулятором PI3K, что, тем самым, приводит к снижению или ингибированию злокачественной опухоли или гематологической злокачественной опухоли, или ассоциированных в ней симптомов. В некоторых вариантах осуществления биологический образец присутствует в или происходит из индивидуума, который имеет злокачественную опухоль или гематологическую злокачественную опухоль, или из индивидуума, имеющего риск развития злокачественной опухоли или гематологической злокачественной опухоли. В некоторых вариантах осуществления биологический образец можно контактировать с соединением, описанным в настоящем описании, вне организма, а затем вводить в организм индивидуума (например, в организм индивидуума, из которого происходит биологический образец, или в организм другого индивидуума). В некоторых вариантах осуществления биологический образец включает клетки, которые экспрессируют одну или несколько изоформ PI3K.
[0579] В определенных вариантах осуществления способ или анализ дополнительно включает стадию получения образца, например биологического образца, от индивидуума. В одном варианте осуществления способ или анализ включает стадию получения в основном неклеточной фракции от индивидуума. Неклеточная фракция может представлять собой плазму, сыворотку или другую неклеточную жидкость организма. В одном варианте осуществления образец представляет собой образец сыворотки или плазмы. В других вариантах осуществления жидкость организма, из которой получают образец от индивидуума, включает кровь (например, цельную кровь). В определенных вариантах осуществления кровь можно дополнительно обрабатывать для получения плазмы или сыворотки. В другом варианте осуществления образец содержит ткань или клетки (например, опухолевые клетки). Например, образец может представлять собой образец, полученный тонкоигольной биопсией; архивный образец (например, архивный образец с известным диагнозом и/или анамнезом лечения); гистологический срез (например, замороженный или фиксированный в формалине срез, например, после длительного хранения), среди прочих. Образец может включать любой материал, полученный и/или происходящий из биологического образца, включая полипептид и нуклеиновую кислоту (например, геномная ДНК, кДНК, РНК), очищенные или переработанные из образца. Очистка и/или переработка образца могут включать одно или несколько из экстракции, концентрирования, выделения антител, сортировки, концентрирования, фиксации, добавления реагентов и т.п. В одном варианте осуществления биологический образец включает образец, содержащий ткань, цельную кровь, сыворотку, плазму, буккальный соскоб, слюну, цереброспинальную жидкость, мочу, стул и костный мозг.
[0580] В одном варианте осуществления способы обнаружения, описанные в настоящем описании, включают, но не ограничиваясь ими, полимеразную цепную реакцию (ПЦР) или способы обнаружения на основе антител, такие как твердофазный иммуноферментный анализ (например ELISA), иммунофлуоресцентная сортировка клеток (FACS), иммуногистохимия, иммунофлуоресценция (IF), вестерн-блоттинг, аффинная очистка, визуализация с использованием резонансного переноса энергии флуоресценции (FRET), способы демаскирования антигена и/или способы обнаружения на микрочипах. В других вариантах осуществления способ обнаружения включает масс-спектрометрию. В одном варианте осуществления способ обнаружения включает мечение образца поддающейся обнаружению меткой (например, флуоресцентная или радиоактивнвая метка, обнаружение с использованием биотина-авидина). Активность или уровень маркерного белка также можно обнаруживать и/или количественно определять путем обнаружения или количественного определения экспрессируемого полипептида. Полипептид можно обнаруживать и количественно определять любым из ряда способов, хорошо известных специалистам в данной области. Они могут включать способы аналитической биохимии, такие как электрофорез, капиллярный электрофорез, высокоэффективная жидкостная хроматография (ВЭЖХ), тонкослойная хроматография (TLC), гипердиффузионная хроматография и т.п., или различные иммунологические способы, такие как реакции преципитации в жидкости или геле, иммунодиффузия (одинарная или двойная), иммуноэлектрофорез, радиоиммунный анализ (RIA), твердофазные иммуноферментные анализы (ELISA), иммунофлуоресцентные анализы, вестерн-блоттинг, иммуногистохимия и т.п. Квалифицированный специалист может без труда адаптировать известные способы обнаружения белков/антител для применения для обнаружения того, экспрессируют ли клетки маркер по настоящему изобретению.
[0581] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения, предупреждения и/или управления течением злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, включающий введение эффективного количества соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) индивидууму, нуждающемуся в этом. В одном варианте осуществления соединение вводят в качестве единственного средства. В другом варианте осуществления соединение вводят в комбинации с другим средством или способом терапии.
[0582] Как используют в рамках изобретения и если нет иных указаний, гематологическая злокачественная опухоль или симптом, ассоциированный с гематологической злокачественной опухолью, охватывает все типы проявления гематологической злокачественной опухоли, как описано в настоящем описании или как известно в данной области. Как используют в рамках изобретения и если нет иных указаний, злокачественная опухоль или симптом, ассоциированный со злокачественной опухолью, охватывает все типы проявления злокачественной опухоли, как описано в настоящем описании или как известно в данной области. Симптомы можно оценивать с использованием анализов и шкал, описанных и/или проиллюстрированных в настоящем описании и/или известных в данной области.
[0583] В некоторых вариантах осуществления симптом уменьшается по меньшей мере приблизительно на 2%, по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90%, или по меньшей мере приблизительно на 95% относительно контрольного уровня. Контрольный уровень включает любой подходящий контроль, как известно в данной области. Например, контрольный уровень может представлять собой уровень до обработки в образце или у индивидуума, подвергаемого лечению, или он может представлять собой уровень в контрольной популяции (например, уровень у индивидуумов, которые не имеют злокачественной опухоли или гематологической злокачественной опухоли, или уровень в образцах, происходящих из индивидуумов, которые не имеют злокачественной опухоли или гематологической злокачественной опухоли). В некоторых вариантах осуществления снижение является статистически значимым, например, при оценке с использованием подходящего параметрического или непараметрического статистического сравнения.
[0584] В некоторых вариантах осуществления индивидуумом является млекопитающее. В некоторых вариантах осуществления индивидуумом является человек.
[0585] В определенных вариантах осуществления индивидуум представляет собой животное в модели злокачественной опухоли или гематологической злокачественной опухоли, человека со злокачественной опухолью или гематологической злокачественной опухолью, или индивидуума (например, человека) с риском развития злокачественной опухоли или гематологической злокачественной опухоли. В некоторых вариантах осуществления индивидуум представляет собой человека, который имеет злокачественную опухоль или гематологическую злокачественную опухоль в семейном анамнезе, который имеет ген, ассоциированный со злокачественной опухолью или гематологической злокачественной опухолью, который является положительным по биомаркеру, ассоциированному со злокачественной опухолью или гематологической злокачественной опухолью (например, биомаркер, описанный в настоящем описании) или их комбинацию. В некоторых вариантах осуществления у индивидуума диагностирована злокачественная опухоль или гематологическая злокачественная опухоль. В некоторых вариантах осуществления индивидуум имеет один или несколько признаков или симптомов, ассоциированных со злокачественной опухолью или гематологической злокачественной опухолью. В некоторых вариантах осуществления индивидуум имеет риск развития злокачественной опухоли или гематологической злокачественной опухоли (например, индивидуум имеет ген, который индивидуально или в комбинации с другими генами или факторами окружающей среды ассоциирован с развитием злокачественной опухоли или гематологической злокачественной опухоли).
[0586] В некоторых вариантах осуществления индивидуум имеет повышенный уровень одной или нескольких изоформы(изоформ) PI3K (например, PI3K-δ и/или PI3K-γ, что может указывать на увеличенную вероятность ответа на или лучшую эффективность конкретного способа лечения или лекарственного средства, по сравнению с другим индивидуумом с более низким уровнем изоформы(изоформ) PI3K. Уровни изоформ PI3K можно оценивать с использованием способов, известных в данной области.
[0587] В некоторых вариантах осуществления индивидуум имеет один или несколько биомаркеров, описанных в настоящем описании, которые указывают на увеличенную вероятность ответа на конкретный способ лечения или лекарственное средство или лучшую их эффективность.
[0588] В некоторых вариантах осуществления индивидуум имеет мутацию (например, SNP) в гене, ассоциированном со злокачественной опухолью или гематологической злокачественной опухолью. В одном варианте осуществления ген выбран из CXCR4, IGH7, KRAS, NRAS, A20, CARD11, CD79B, TP53, CARD11, MYD88, GNA13, MEF2B, TNFRSF14, MLL2, BTG1, EZH2, NOTCH1, JAK1, JAK2, PTEN, FBW7, PHF6, IDH1, IDH2, TET2, FLT3, KIT, NPM1, CEBPA, DNMT3A, BAALC, RUNX1, ASXL1, IRF8, POU2F2, WIF1, ARID1A, MEF2B, TNFAIP3, PIK3R1, MTOR, PIK3CA, PI3Kδ и/или PI3Kγ, или их комбинации. В одном варианте осуществления нарушение, подлежащее лечению, предупреждению и/или управлению течением, представляет собой WM и индивидуум имеет дефицит PTEN.
[0589] В некоторых вариантах осуществления индивидуум проявляет избыточную активность PI3K или аномальную активность (например, избыточную или сниженную активность) одного или нескольких компонентов каскада передачи сигнала PI3K (например, Akt (PKB), mTOR, Tec-киназа (например, Btk, Itk, Tec), фосфолипаза C, PDK1, PKC, NFκB, Rac GEF (например, Vav-1) или Rac).
[0590] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением гематологической злокачественной опухоли, включающий введение пациенту, который имеет одну или несколько мутаций, выбранных из мутаций MYD88 (L265P), CXCR4, ARID1A, MUC16, TRAF2, TRRAP и MYBBP1A, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват). В одном варианте осуществления пациент имеет MYD88 (L265P) и/или N-концевой домен мутации CXCR4. В одном варианте осуществления гематологическая злокачественная опухоль представляет собой макроглобулинемию Валденстрема (WM). В одном варианте осуществления гематологическая злокачественная опухоль представляет собой DLBCL. В одном варианте осуществления гематологическая злокачественная опухоль представляет собой CLL. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0591] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением WM, включающий введение пациенту, который имеет мутацию CXCR4, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват). В одном варианте осуществления мутация CXCR4 находится на N-концевом домене CXCR4. В других вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0592] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением DLBCL, включающий введение пациенту, который имеет мутацию CXCR4, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соли или сольвата). В одном варианте осуществления мутация CXCR4 находится на N-концевом домене CXCR4. В других вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0593] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL включающий введение пациенту, который имеет мутацию CXCR4, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват). В одном варианте осуществления мутация CXCR4 находится на N-концевом домене CXCR4. В других вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0594] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту, который имеет CD38-положительные злокачественные клетки, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват). В других вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0595] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту, который имеет CD69-положительные злокачественные клетки, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват). В других вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0596] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту, который имеет двойные положительные по CD38/CD69 злокачественные клетки, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват). В других вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0597] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту, который имеет Ki67-положительные злокачественные клетки, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват). В других вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0598] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту, который имеет pAKT-положительные злокачественные клетки, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват). В других вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0599] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту, который имеет двойные положительные по Ki67/pAKT злокачественные клетки, терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват). В других вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват), можно использовать в комбинации с одним или несколькими другими лекарственными средствами, описанными в настоящем описании ниже.
[0600] В некоторых вариантах осуществления индивидуума ранее лечили от злокачественной опухоли или гематологической злокачественной опухоли. В некоторых вариантах осуществления индивидуума ранее лечили от злокачественной опухоли или гематологической злокачественной, опухоли, но он является не отвечающим на стандартные способы терапии. Таким образом, в одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения, предупреждения и/или управления течением злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, включающий введение эффективного количества соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смеси энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) индивидууму, нуждающемуся в этом, где индивидууму ранее проводили терапию от злокачественной опухоли или гематологической злокачественной опухоли.
[0601] В одном варианте осуществления индивидууму ранее проводили терапию от злокачественной опухоли или гематологической злокачественной опухоли по меньшей мере за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часов, 48 часов, 72 часов, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель до введения соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф). В одном варианте осуществления индивидууму ранее проводили терапию злокачественной опухоли или гематологической злокачественной опухоли по меньшей мере за 1 неделю, 2 недели, 1 месяц, 2 месяца, 3 месяца или 4 месяца до введения соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф).
[0602] В одном варианте осуществления индивидууму вводят стабильную дозу терапевтического средства от злокачественной опухоли или гематологической злокачественной опухоли перед введением соединения, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф). В одном варианте осуществления индивидууму вводят стабильную дозу терапевтического средства от злокачественной опухоли или гематологической злокачественной опухоли в течение по меньшей мере 24 часов, 48 часов, 72 часов, 96 часов, 1 недели, 2 недель, 3 недель, 4 недель, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель перед введением соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф). В одном варианте осуществления индивидууму вводят стабильную дозу терапевтического средства от злокачественной опухоли или гематологической злокачественной опухоли в течение по меньшей мере 1 недели, 2 недель, 3 недель, 4 недель, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель перед введением соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф).
[0603] В одном варианте осуществления индивидууму ранее проводили терапию от злокачественной опухоли или гематологической злокачественной опухоли по меньшей мере за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часов, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель, и индивидууму вводили стабильную дозу того же терапевтического средства от злокачественной опухоли или гематологической злокачественной опухоли в течение по меньшей мере 24 часов, 48 часов, 72 часов, 96 часов, 1 недели, 2 недель, 3 недель, 4 недели, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель перед введением соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф).
[0604] В одном варианте осуществления стабильная доза ранее вводимого терапевтического средства составляет от приблизительно 0,005 до приблизительно 1,000 мг в неделю, от приблизительно 0,01 до приблизительно 500 мг в неделю, от приблизительно 0,1 до приблизительно 250 мг в неделю, от приблизительно 1 до приблизительно 100 мг в неделю, от приблизительно 2 до приблизительно 75 мг в неделю, от приблизительно 3 до приблизительно 50 мг в неделю, от приблизительно 5 до приблизительно 50 мг в неделю, от приблизительно 7,5 до приблизительно 25 мг в неделю, от приблизительно 10 до приблизительно 25 мг в неделю, от приблизительно 12,5 до приблизительно 25 мг в неделю, от приблизительно 15 до приблизительно 25 мг в неделю, или от приблизительно 15 до приблизительно 20 мг в неделю. Общую недельную дозу можно вводить один раза или вводить разделенными дозами.
[0605] В некоторых вариантах осуществления индивидуума ранее не лечили от злокачественной опухоли или гематологической злокачественной опухоли.
[0606] В определенных вариантах осуществления терапевтически или проифлактически эффективное количество соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) составляет от приблизительно 0,005 до приблизительно 1,000 мг в сутки, от приблизительно 0,01 до приблизительно 500 мг в сутки, от приблизительно 0,01 до приблизительно 250 мг в сутки, от приблизительно 0,01 до приблизительно 100 мг в сутки, от приблизительно 0,1 до приблизительно 100 мг в сутки, от приблизительно 0,5 до приблизительно 100 мг в сутки, от приблизительно 1 до приблизительно 100 мг в сутки, от приблизительно 0,01 до приблизительно 50 мг в сутки, от приблизительно 0,1 до приблизительно 50 мг в сутки, от приблизительно 0,5 до приблизительно 50 мг в сутки, от приблизительно 1 до приблизительно 50 мг в сутки, от приблизительно 2 до приблизительно 25 мг в сутки, или от приблизительно 5 до приблизительно 10 мг в сутки.
[0607] В определенных вариантах осуществления терапевтически или профилактически эффективное количество составляет приблизительно 0,1, приблизительно 0,2, приблизительно 0,5, приблизительно 1, приблизительно 2, приблизительно 5, приблизительно 10, приблизительно 15, приблизительно 20, приблизительно 25, приблизительно 30, приблизительно 35, приблизительно 40, приблизительно 45, приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 90, приблизительно 100, или приблизительно 150 мг в сутки.
[0608] В одном варианте осуществления рекомендованный диапазон суточной дозы соединения формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф), для состояний, описанных в настоящем описании, находится в диапазоне от приблизительно 0,5 мг до приблизительно 100 мг в сутки, или от приблизительно 0,5 мг до приблизительно 50 мг в сутки, предпочтительно с введением в качестве дозы один раз в сутки или разделенными дозами в течение дня. В некоторых вариантах осуществления дозировка находится в диапазоне от приблизительно 1 мг до приблизительно 50 мг в сутки. В других вариантах осуществления дозировка находится в диапазоне от приблизительно 0,5 до приблизительно 25 мг в сутки. Конкретные дозы в сутки включают 0,1, 0,2, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или 100 мг в сутки.
[0609] В конкретном варианте осуществления рекомендованная начальная дозировка может составлять 0,5, 1, 2, 3, 4, 5, 10, 15, 20, 25, 50, или 100 мг в сутки. В другом варианте осуществления рекомендованная начальная дозировка может составлять 0,5, 1, 2, 3, 4 или 5 мг в сутки. Дозу можно повышать до 15, 20, 25, 30, 35, 40, 45, 50, 75 или 100 мг/сутки.
[0610] В определенных вариантах осуществления терапевтически или профилактически эффективное количество составляет от приблизительно 0,001 до приблизительно 100 мг/кг/сутки, от приблизительно 0,01 до приблизительно 50 мг/кг/сутки, от приблизительно 0,01 до приблизительно 25 мг/кг/сутки, от приблизительно 0,01 до приблизительно 10 мг/кг/сутки, от приблизительно 0,01 до приблизительно 9 мг/кг/сутки, 0,01 до приблизительно 8 мг/кг/сутки, от приблизительно 0,01 до приблизительно 7 мг/кг/сутки, от приблизительно 0,01 до приблизительно 6 мг/кг/сутки, от приблизительно 0,01 до приблизительно 5 мг/кг/сутки, от приблизительно 0,01 до приблизительно 4 мг/кг/сутки, от приблизительно 0,01 до приблизительно 3 мг/кг/сутки, от приблизительно 0,01 до приблизительно 2 мг/кг/сутки, или от приблизительно 0,01 до приблизительно 1 мг/кг/сутки.
[0611] Вводимая доза также может быть выражена в единицах, отличных от мг/кг/сутки. Например, дозы для парентерального введения можно выражать в качестве мг/м2/сутки. Специалисту в данной области будет понятно, как конвертировать дозы из мг/кг/сутки в мг/м2/сутки либо для данного роста, либо для данного веса индивидуума, или для обоих из них (см., www.fda.gov/cder/cancer/animalframe.htm). Например, доза 1 мг/кг/сутки для человека массой 65 кг приблизительно равна 38 мг/м2/сутки.
[0612] В одном варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации соединения в плазме, находящейся в диапазоне от приблизительно 0,005 до приблизительно 100 мкМ, от приблизительно 0,005 до приблизительно 10 мкМ, от приблизительно 0,01 до приблизительно 10 мкМ, от приблизительно 0,01 до приблизительно 5 мкМ, от приблизительно 0,005 до приблизительно 1 мкМ, от приблизительно 0,005 до приблизительно 0,5 мкМ, от приблизительно 0,005 до приблизительно 0,5 мкМ, от приблизительно 0,01 до приблизительно 0,2 мкМ, или от приблизительно 0,01 до приблизительно 0,1 мкМ. В одном варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации в плазме от приблизительно 0,005 до приблизительно 100 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации в плазме от приблизительно 0,005 до приблизительно 10 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации в плазме от приблизительно 0,01 до приблизительно 10 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации в плазме приблизительно 0,01 до приблизительно 5 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации в плазме от приблизительно 0,005 до приблизительно 1 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации в плазме от приблизительно 0,005 до приблизительно 0,5 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации соединения в плазме от приблизительно 0,01 до приблизительно 0,2 мкМ. В другом варианте осуществления вводимое количество соединение является достаточным для обеспечения стационарной концентрации в плазме от приблизительно 0,01 до приблизительно 0,1 мкМ.
[0613] Как более подробно пояснено ниже, было выявлено, что после введения 25 мг или 75 мг соединения 292 BID, соединение быстро всасывается с максимальными концентрациями в плазме, как правило, наблюдаемыми приблизительно через 1 час после введения. Также было выявлено, что AUC возрастает пропорционально дозам вплоть до 75 мг BID, однако время полувыведения (приблизительно 4-5 часов как для 25 мг, так и для и 75 мг BID) не зависит от дозы. Средняя стационарная концентрация перед введением очередной дозы после 25 мг BID составляла приблизительно 390 нг/мл, что указывает на полное подавление PI3K-δ (IC90=361 нг/мл) с ингибированием PI3K-γ (IC50=429 нг/мл) на протяжении интервала дозирования.
[0614] В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации соединения в плазме на уровне, превышающем IC50 для конкретной изоформы PI3K. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения стационарной концентрации соединения в плазме на уровне, превышающем IC90 для конкретной изоформы PI3K. В одном варианте осуществления изоформа PI3K представляет собой PI3K-δ, для которой IC90 составляет приблизительно 361 мг/мл. В другом варианте осуществления изоформа PI3K представляет собой PI3K-γ, для которой IC50 составляет приблизительно 429 нг/мл.
[0615] В одном варианте осуществления соединение представляет собой соединение 292, и изоформа PI3K представляет собой PI3K-δ. В другом варианте осуществления соединение представляет собой соединение 292, и изоформа PI3K представляет собой PI3K-γ. В другом варианте осуществления, где соединение представляет собой соединение 292, вводимое количество соединения 292 является достаточным для обеспечения стационарной концентрации соединения в плазме от приблизительно 300 нг/мл до приблизительно 500 нг/мл, от приблизительно 350 нг/мл до приблизительно 450 нг/мл, или от приблизительно 380 нг/мл до приблизительно 420 нг/мл. В другом варианте осуществления, где соединение представляет собой соединение 292, вводимое количество соединения 292 является достаточным для обеспечения стационарной концентрации соединения в плазме приблизительно 390 нг/мл. Как используют в рамках изобретения, термин "стационарная концентрация в плазме" представляет собой концентрацию, достигаемую после периода введения соединения. После достижения стационарного состояния существуют небольшие пики и минимумы на кривой зависимости концентрации соединения в плазме от времени.
[0616] В одном варианте осуществления вводимое количество является достаточным для обеспечения максимальной концентрации (пиковая концентрация) соединения в плазме, находящейся в диапазоне от приблизительно 0,005 до приблизительно 100 мкМ, от приблизительно 0,005 до приблизительно 10 мкМ, от приблизительно 0,01 до приблизительно 10 мкМ, от приблизительно 0,01 до приблизительно 5 мкМ, от приблизительно 0,005 до приблизительно 1 мкМ, от приблизительно 0,005 до приблизительно 0,5 мкМ, от приблизительно 0,01 до приблизительно 0,2 мкМ, или от приблизительно 0,01 до приблизительно 0,1 мкМ. В одном варианте осуществления вводимое количество соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от приблизительно 0,005 до приблизительно 100 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от приблизительно 0,005 до приблизительно 10 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от приблизительно 0,01 до приблизительно 10 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от приблизительно 0,01 до приблизительно 5 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от приблизительно 0,005 до приблизительно 1 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от приблизительно 0,005 до приблизительно 0,5 мкМ. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от приблизительно 0,01 до приблизительно 0,2 мкм. В другом варианте осуществления вводимое количество соединения является достаточным для обеспечения максимальной концентрации соединения в плазме от приблизительно 0,01 до приблизительно 0,1 мкМ.
[0617] В одном варианте осуществления вводимое количество является достаточным для обеспечения минимальной концентрации (остаточной концентрации) соединения в плазме, находящейся в диапазоне от приблизительно 0,005 до приблизительно 100 мкМ, от приблизительно 0,005 до приблизительно 10 мкМ, от приблизительно 0,01 до приблизительно 10 мкМ, от приблизительно 0,01 до приблизительно 5 мкМ, от приблизительно 0,005 до приблизительно 1 мкМ, приблизительно 0,005 до приблизительно 0,5 мкМ, от приблизительно 0,01 до приблизительно 0,2 мкМ, или от приблизительно 0,01 до приблизительно 0,1 мкМ, когда вводят более одной дозы. В одном варианте осуществления вводимое количество является достаточным для обеспечения минимальной концентрации соединения в плазме от приблизительно 0,005 до приблизительно 100 мкМ. В другом варианте осуществления вводимое количество является достаточным для обеспечения минимальной концентрации соединения в плазме от приблизительно 0,005 до приблизительно 10 мкМ. В другом варианте осуществления вводимое количество является достаточным для обеспечения минимальной концентрации соединения в плазме от приблизительно 0,01 до приблизительно 10 мкМ. В другом варианте осуществления вводимое количество является достаточным для обеспечения минимальной концентрации соединения в плазме от приблизительно 0,01 до приблизительно 5 мкМ. В другом варианте осуществления вводимое количество является достаточным для обеспечения минимальной концентрации соединения в плазме от приблизительно 0,005 до приблизительно 1 мкМ. В другом варианте осуществления вводимое количество является достаточным для обеспечения минимальной концентрации соединения в плазме от приблизительно 0,005 до приблизительно 0,5 мкМ. В другом варианте осуществления вводимое количество является достаточным для обеспечения минимальной концентрации соединения в плазме от приблизительно 0,01 до приблизительно 0,2 мкМ. В другом варианте осуществления вводимое количество является достаточным для обеспечения минимальной концентрации соединения в плазме от приблизительно 0,01 до приблизительно 0,1 мкМ.
[0618] В одном варианте осуществления вводимое количество является достаточным для обеспечения площади под кривой (AUC) для соединения, находящейся в диапазоне от приблизительно 50 до приблизительно 10000 нг*ч/мл, от приблизительно 100 до приблизительно 50000 нг*ч/мл, приблизительно от 100 до 25000 нг*ч/мл или приблизительно от 10000 до 25000 нг*ч/мл.
[0619] Не ограничиваясь конкретной теорией, было выявлено, что введение соединения, описанного в настоящем описании, пациенту, имеющему злокачественную опухоль или гематологическую злокачественную опухоль, приводит к быстрому появлению ответа у пациента. Таким образом, в одном варианте осуществления в рамках настоящего изобретения предусматривается способ достижения быстрого возникновения ответа у пациентов, имеющих злокачественную опухоль или гематологическую злокачественную опухоль, включающий введение пациентам соединения, описанного в настоящем описании, или его фармацевтически приемлемого производного (например, соль или сольват). В некоторых вариантах осуществления возникновения ответа достигают в пределах приблизительно 4 месяцев, 3 месяцев, 2 месяцев или 1 месяца от даты первого введения соединения, описанного в настоящем описании. В одном варианте осуществления соединение представляет собой соединение 292 или его фармацевтически приемлемое производное. В одном варианте осуществления, когда соединение представляет собой соединение 292 или его фармацевтически приемлемое производное, злокачественная опухоль или гематологическая злокачественная опухоль представляет собой T-клеточную лимфому и возникновения ответа достигают в пределах приблизительно 2 месяцев после первого введения соединения. В другом варианте осуществления когда соединение представляет собой соединение 292 или его фармацевтически приемлемое производное, злокачественная опухоль или гематологическая злокачественная опухоль представляет собой T-клеточную лимфому и возникновения ответа достигают в пределах приблизительно 1,9 месяцев после первого введения соединения. В одном варианте осуществления, когда соединение представляет собой соединение 292 или его фармацевтически приемлемое производное, злокачественная опухоль или гематологическая злокачественная опухоль представляет собой B-клеточную лимфому и возникновения ответа достигают в пределах приблизительно 2 месяцев после первого введения соединения. В другом варианте осуществления, когда соединение представляет собой соединение 292 или его фармацевтически приемлемое производное, злокачественная опухоль или гематологическая злокачественная опухоль представляет собой B-клеточную лимфому и возникновения ответа достигают в пределах приблизительно 1,8 месяцев после первого введения соединения.
[0620] Соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292) или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) можно вводить пероральным, парентеральным (например, внутримышечное, внутрибрюшинное, внутривенное введение, CIV, внутрипузырная инъекция или инфузия, подкожная инъекций, или имплантат), ингаляционным, назальным, вагинальным, ректальным, сублингвальным или местным (например, трансдермальный или локальный) путями введения. В одном варианте осуществления соединение вводят перорально. В другом варианте осуществления соединение вводят парентерально. В другом варианте осуществления соединение вводят внутривенно.
[0621] Соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) можно вводить один раз в сутки (QD), или можно разделять на множество суточных доз, как например, два раза в сутки (BID), три раза в сутки (TID) и четыре раза в сутки (QID). Кроме того, введение может быть непрерывным (т.е. раз в сутки в течение последовательных дней или каждые сутки), периодическим, например, курсами (т.е. включая дни, недели или месяцы покоя без лекарственного средства). Как используют в рамках изобретения, термин "раз в сутки" означает, что терапевтическое соединение, такое как соединение формулы I, вводят один или более одного раза каждые сутки, например, в течение периода времени. Термин "непрерывный" означает, что терапевтическое соединение, такое как соединение формулы I, вводят каждые сутки в течение непрерывного периода, составляющего по меньшей мере от 10 суток до 52 недель. Термин "периодический" или "периодически", как используют в рамках изобретения, означает остановку и начало либо с регулярными, либо с нерегулярными промежутками. Например, периодическое введение соединения формулы I представляет собой введение в течение от одних до шести дней в неделю, введение курсами (например, введение каждые сутки в течение от двух до восьми последовательных недель, а затем период покоя без введения в течение вплоть до одной недели), или введение через день. Термин "введение курсами", как используют в рамках изобретения, означает, что терапевтическое соединение, такое как соединение формулы I, вводят каждые сутки или непрерывно, но с периодом покоя (например, после дозирования в течение 7, 14, 21 или 28 дней).
[0622] В некоторых вариантах осуществления частота введения находится в диапазоне от приблизительно дозирования раз в сутки до приблизительно дозирования раз в месяц. В определенных вариантах осуществления введение проводят один раз в сутки, два раза в сутки, три раза в сутки, четыре раза в сутки, раз в двое суток, два раза в неделю, раз в неделю, раз в две недели, раз в три недели или раз в четыре недели. В одном варианте осуществления соединение, описанное в настоящем описании, вводят один раз в сутки. В другом варианте осуществления соединение, описанное в настоящем описании, вводят два раза в сутки. В другом варианте осуществления соединение, описанное в настоящем описании, вводят три раза в сутки. В другом варианте осуществления соединение, описанное в настоящем описании, вводят четыре раза в сутки.
[0623] В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 0,1, 0,2, 0,25, 0,5, 1, 2, 2,5, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50 мг, или 75 мг BID. В одном варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 0,5 мг BID. В другом варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 1 мг BID. В другом варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 5 мг BID. В другом варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 8 мг BID. В другом варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 15 мг BID. В другом варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или энантиомер или его смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 25 мг BID. В другом варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 35 мг BID. В другом варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 50 мг BID. В другом варианте осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят в количестве приблизительно 75 мг BID.
[0624] В определенных вариантах осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят один раз в сутки в течение от одних суток до шести месяцев, от одной недели до трех месяцев, от одной недели до четырех недель, от одной недели до трех недель, или от одной недели до двух недель. В определенных вариантах осуществления соединение, описанное в настоящем описании, вводят один в сутки в течение одной недели, двух недель, трех недель или четырех недель. В одном варианте осуществления соединение, описанное в настоящем описании, вводят один раз в сутки в течение одной недели. В другом варианте осуществления соединение, описанное в настоящем описании, вводят один раз в сутки в течение двух недель. В другом варианте осуществления соединение, описанное в настоящем описании, вводят один раз в сутки в течение трех недель. В другом варианте осуществления соединение, описанное в настоящем описании, вводят один раз в сутки в течение четырех недель. В другом варианте осуществления соединение, описанное в настоящем описании, вводят один раз в сутки в течение более чем четырех недель.
[0625] В определенных вариантах осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) вводят два раза в сутки в течение от одних суток до шести месяцев, от одной недели до трех месяцев, от одной недели до четырех месяцев, от одной недели до трех недель или от одной недели до двух недель. В определенных вариантах осуществления соединение, описанное в настоящем описании, вводят два раза в сутки в течение одной недели, двух недель, трех недель или четырех недель. В одном варианте осуществления соединение, описанное в настоящем описании, вводят два раза в сутки в течение одной недели. В другом варианте осуществления соединение, описанное в настоящем описании, вводят два раза в сутки в течение двух недель. В другом варианте осуществления соединение, описанное в настоящем описании, вводят два раза в сутки в течение трех недель. В другом варианте осуществления соединение, описанное в настоящем описании, вводят два раза в сутки в течение четырех недель. В другом варианте осуществления соединение, описанное в настоящем описании, вводят два раза в сутки в течение более чем четырех недель.
[0626] Соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) можно доставлять в качестве однократной дозы, например, такой как однократная болюсная инъекция или пероральные таблетки или пилюли; или в течение некоторого периода, как например, непрерывная инфузия в течение некоторого периода времени или разделенные болюсные дозы в течение некоторого периода времени. При необходимости соединение можно вводить повторно, например, до тех пор, пока у пациента не возникнет стабильная стабильное заболевание или регрессия, или до тех пор, пока у пациента не возникнет прогрессирование заболевания или неприемлемая токсичность.
Комбинированная терапия
[0627] В некоторых вариантах осуществления соединение, описанное в настоящем описании, вводят в комбинации с одним или несколькими другими способами терапии. В одном варианте осуществления в рамках настоящего изобретения предусматриваются способы комбинированной терапии, в которых средство, о котором известно, что оно модулирует другие каскады или другие компоненты того же каскада, или даже перекрывающиеся наборы ферментов-мишеней, используют в комбинации с соединением, описанным в настоящем описании, или его фармацевтически приемлемой формой (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные). В одном аспекте такая терапия включает, но не ограничивается ими, комбинации соединения по изобретению с химиотерапевтическими средствами, терапевтическими антителами и/или лучевой терапией, для достижения синергического или аддитивного терапевтического эффекта.
[0628] Под “в комбинации с” не подразумевают, что другую терапию и модулятор PI3K необходимо вводить в одно и то же время и/или составлять для совместной доставки, хотя эти способы доставки входят в объем настоящего изобретения. Соединение, описанное в настоящем описании, можно вводить одновременно, до (например, за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часа, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель) или после (например, через 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель после), одной или нескольких других терапий (например, одного или нескольких других дополнительных средств). В общем, каждое терапевтическое средство вводят в дозе и/или по расписанию, определенному для этого конкретного средства. Другое терапевтическое средство можно вводить с соединением, описанным в настоящем описании, в одной композиции или отдельно в другой композиции. Также в настоящем описании предусматривается тройная терапия.
[0629] Как правило, ожидается, что дополнительные лекарственные средства, используемые в комбинации, будут использовать на уровнях, которые не превышают уровни, которые используют по отдельности. В некоторых вариантах осуществления уровни, используемые в комбинации, являются более низкими, чем уровни, используемые по отдельности.
[0630] В некоторых вариантах осуществления соединение, описанное в настоящем описании, представляет собой терапию первой линии от злокачественной опухоли или гематологической злокачественной опухоли, т.е. ее используют у индивидуума, которому ранее не вводили другое лекарственное средство или не проводили другой терапии, предназначенной для лечения злокачественной опухоли или гематологической злокачественной опухоли, или одного или нескольких их симптомов.
[0631] В других вариантах осуществления соединение, описанное в настоящем описании, представляет собой терапию второй линии от злокачественной опухоли или гематологической злокачественной опухоли, т.е. ее используют у индивидуума, которому ранее вводили другое лекарственное средство или проводили другую терапию, предназначенную для лечения злокачественной опухоли или гематологической злокачественной опухоли, или одного или нескольких их симптомов.
[0632] В других вариантах осуществления соединение, описанное в настоящем описании, представляет собой терапию третьей или четвертой линии от злокачественной опухоли или гематологической злокачественной опухоли, т.е. ее используют у индивидуума, которому ранее вводили два или три других лекарственных средства или проводили два или три других способа терапии, предназначенных для лечения злокачественной опухоли или гематологической злокачественной опухоли, или одного или нескольких ее симптомов.
[0633] В вариантах осуществления, где вводят два средства, средства можно вводить в любом порядке. Например, два средства можно вводить одновременно (т.е. по существу одновременно или в пределах одного и того же введения) или последовательно (т.е. одно сразу после другого или альтернативно с интервалом между введениями двух средств). В некоторых вариантах осуществления соединение, описанное в настоящем описании, вводят последовательно (т.е. после первого терапевтического средства).
[0634] В одном варианте осуществления в рамках настоящего изобретения предусматривается комбинированная терапия для ингибирования аномального клеточного роста у индивидуума, которая включает введение соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные) в комбинации с некоторым количеством средства против злокачественной опухоли (например, химиотерапевтическое средство). В настоящее время в данной области известно множество химиотерапевтических средств, и их можно использовать с соединением, описанным в настоящем описании.
[0635] В некоторых вариантах осуществления химиотерапевтическое средство выбрано из ингибиторов митоза, алкилирующих средств, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологических ответов, антигормональных средств, ингибиторов ангиогенеза и антиандрогенных средств. Неограничивающими примерами являются химиотерапевтические средства, цитотоксические средства и непептидные низкомолекулярные соединения, такие как Gleevec® (иматиниба мезилат), Velcade® (бортезомиб), CasodexTM (бикалутамид), Iressa® (гефитиниб), Tarceva® (эрлотиниб), и Adriamycin® (доксорубицин), а также целый ряд химиотерапевтических средств. Неограничивающие примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXANETM); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ингибиторы BTK, такие как ибрутиниб (PCI-32765), AVL-292 (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид), который также может быть обозначен как CC-292, дасатиниб, LFM-AI3, ONO-WG-307 и GDC-0834A13(2Z-циано-N-(2,5-дибромфенил)3-гидрокси-2-бутенамид), ONO-WG-307, GDC-0834, RN-486 (6-циклопропил-8-фтор-2-(2-гидроксиметил-3-{1-метил-5-[5-(4-метилпиперазин-1-ил)пиридин-2-иламино]-6-оксо-1,6-дигидропиридин-3-ил}фенил)-2H-изохинолин-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил)фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо [b]тиофен-2-карбоксамид]), CGI-560 (N-[3-(8-анилиноимидизо[1,2-a]пиразин-6-ил)фенил]-4-трет-бутилбензамид), CGI-1746 (4-(трет-бутил)-N-(2-метил-3-(4-метил-6-((4-(морфолин-4-карбонил)фенил)амино)-5-оксо-4,5-дигидропиразин-2-ил)фенил)бензамид), HM-71224(Hammi Pharmaceticals), ONO-4059 (Ono Pharmaceuticals Co., LTD) и CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпиримидин-2-ил)амино)фенокси)-N-метилпиколинамид); ингибиторы HDAC, такие как вориностат, ромидепсин, панобиностат, вальпроевая кислота, белиностат, моцетиностат, абрексиностат, энтиностат, SB939, ресминостат, гивиностат, CUDC-101, AR-42, CHR-2845, CHR-3996, 4SC-202, CG200745, ACY-1215 и кеветрин; ингибиторы EZH2, такие как, но не ограничиваясь ими, EPZ-6438 (N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(этил(тетрагидро-2H-пиран-4-ил)амино)-4-метил-4'-(морфолинометил)-[1,1'-бифенил]-3-карбоксамид), GSK-126 ((S)-1-(втор-бутил)-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-метил-6-(6-(пиперазин-1-ил)пиридин-3-ил)-1H-индол-4-карбоксамид), GSK-343 (1-изопропил-N-((6-метил-2-оксо-4-пропил-1,2-дигидропиридин-3-ил)метил)-6-(2-(4-метилпиперазин-1-ил)пиридин-4-ил)-1H-индазол-4-карбоксамид), El1,3-деазанепланоцин A (DNNep, 5R-(4-амино-1H-имидазо[4,5-c]пиридин-1-ил)-3-(гидроксиметил)-3-циклопентен-1S,2R-диол), дуплексы малой интерферирующей РНК (миРНК), нацеленные на EZH2 (S. M. Elbashir et al., Nature 411:494-498 (2001)), изоликвиритигенин, и соединения, описанные, например, в публикациях США № 2009/0012031, 2009/0203010, 2010/0222420, 2011/0251216, 2011/0286990, 2012/0014962, 2012/0071418, 2013/0040906 и 2013/0195843, все из которых включены в настоящее описание в качестве ссылок; ингибиторы JAK/STAT, такие как лестауртиниб, тофацитиниб, руксолитиниб, пакритиниб, CYT387, барицитиниб, GLPG0636, TG101348, INCB16562, CP-690550 и AZD1480; ингибитор PKC-β, такие как энзастаурин; ингибиторы SYK, такие как, но не ограничиваясь ими, GS-9973, R788 (фостаматиниб), PRT 062607, R406, (S)-2-(2-((3,5-диметилфенил)амино)пиримидин-4-ил)-N-(1-гидроксипропан-2-ил)-4-метилтиазол-5-карбоксамид, R112, GSK143, BAY61-3606, PP2, PRT 060318, R348, и средства, описанные, например, в публикациях США № 2003/0113828, 2003/0158195, 2003/0229090, 2005/0075306, 2005/0232969, 2005/0267059, 2006/0205731, 2006/0247262, 2007/0219152, 2007/0219195, 2008/0114024, 2009/0171089, 2009/0306214, 2010/0048567, 2010/0152159, 2010/0152182, 2010/0316649, 2011/0053897, 2011/0112098, 2011/0245205, 2011/0275655, 2012/0027834, 2012/0093913, 2012/0101275, 2012/0130073, 2012/0142671, 2012/0184526, 2012/0220582, 2012/0277192, 2012/0309735, 2013/0040984, 2013/0090309, 2013/0116260, и 2013/0165431, все из которых включены в настоящее описание в качестве ссылок; двойной ингибитор SYK/JAK, такой как PRT2070; азотистые иприты, такие как бендамустин, хлорамбуцил, хлолрнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамина оксида гидрохлорид, мелфалан, новэмбихин, фенестерин, преднемустин, трофосфамид, урацил мустард; соединения нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномины, актиномицин, аутрамицин, азасерин, блеомицины, cактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, декторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марселломицин, митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, пралатрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антиаадренальные средства, такие как аминоглутетимид, митотан, трилостан; заместитель фолиевой кислоты, такой как фолиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатрексат; дефофамин; демекольцин; диазиквон; элфомитин; эллиптиний ацетат; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK.RTM.; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2’,2’’-трихлортриэтилaмин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (Ara-C); циклофосфамид; тиотепа; таксаны, например, паклитаксел (например, TAXOLTM) и доцетаксел (например, TAXOTERETM) и ABRAXANE® (связанные с белком частицы паклитаксела); ретиноевая кислота; эсперамицины; капецитабин и фармацевтически приемлемые формы (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные) любого из указанных выше. Также подходящие химиотерапевтические средства, влияющие на клетки, представляют собой антигормональные средства, которые действуют, регулируя или ингибируя действие гормонов на опухоли, такие как антиэстрогены, включая, например, тамоксифен (NolvadexTM), ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY 117018, онапристон и торемифен (фарестон); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и гозерелин; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин C; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; камптотецин-11 (CPT-11); ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO). Когда это желательно, соединения или фармацевтическую композицию, описанную в настоящем описании, можно использовать в комбинации с часто назначаемыми лекарственными средствами против злокачественной опухоли, такими как Herceptin®, Avastin®, Erbitux®, Rituxan®, Taxol®, Arimidex®, Taxotere®, ABVD, AVICINE, абаговомаб, акридин карбоксамид, адекатумумаб, 17-N-аллиламино-17-деметоксигелданамицин, альфарадин, алвоцидиб, 3-аминопиридин-2-карбоксальдегид тиосемикарбазон, амонафид, антрацендион, иммунотоксины против CD22, антинеопластические средства, противоопухолевые травы, апазиквон, атипримод, азатиоприн, белотекан, бендамустин, BIBW 2992, бирикодар, бросталлицин, бриостатин, бутионин сулофоксимин, CBV (химиотерапия), каликулин, кризотиниб, неспецифические для клеточного цикла антинеопластические средства, дихлоруксусная кислота, дискодермолид, элсамитруцин, эноцитабин, эпотилон, эрибулин, эверолимус, экзатекан, экзисулинд, ферругинол, фородезин, фосфестрол, химиотерапевтический режим ICE, IT-101, имексон, имиквимод, индолокарбазол, ирофулвен, ланиквидар, ларотаксел, леналидомид, лукантон, луртотекан, мафосфамид, митозоломид, нафоксидин, недаплатин, олапариб, ортатаксел, PAC-1, азимина, пиксантрон, ингибитор протеасом, ребеккамицин, резиквимод, рубитекан, SN-38, салиноспорамид A, сапацитабин, Stanford V, сваинсонин, талапорфин, тариквидар, тегафур-урацил, темодар, тезетаксел, триплатин тетранитрат, трис(2-хлорэтил)амин, троксацитабин, урамустин, вадимезан, винфлунин, ZD6126 и зосуквидар.
[0636] В некоторых вариантах осуществления химиотерапевтическое средство выбрано из ингибиторов hedgehog, включая, но не ограничиваясь ими, IPI-926 (см. патент США 7812164). Другие подходящие ингибиторы hedgehog включают, например, ингибиторы, описанные и раскрытые в патенте США 7230004, публикации патентной заявки США № 2008/0293754, публикации патентной заявки США № 2008/0287420 и публикации патентной заявки США № 2008/0293755, полное содержание которых включено в настоящее описание в качестве ссылок. Примеры других подходящих ингибиторов hedgehog включают ингибиторы, описанные в публикациях патентных заявок США № US 2002/0006931, US 2007/0021493 и US 2007/0060546, и в публикациях международных заявок № WO 2001/19800, WO 2001/26644, WO 2001/27135, WO 2001/49279, WO 2001/74344, WO 2003/011219, WO 2003/088970, WO 2004/020599, WO 2005/013800, WO 2005/033288, WO 2005/032343, WO 2005/042700, WO 2006/028958, WO 2006/050351, WO 2006/078283, WO 2007/054623, WO 2007/059157, WO 2007/120827, WO 2007/131201, WO 2008/070357, WO 2008/110611, WO 2008/112913 и WO 2008/131354, каждая из которых включена в настоящее описание в качестве ссылки. Дополнительные примеры ингибиторов hedgehog включают, но не ограничиваются ими, GDC-0449 (также известный как RG3616 или висмодегиб), описанный, например, в Von Hoff D. et al., N. Engl. J. Med. 2009; 361(12):1164-72; Robarge K.D. et al., Bioorg Med Chem Lett. 2009; 19(19):5576-81; Yauch, R. L. et al. (2009) Science 326: 572-574; Sciencexpress: 1-3 (10.1126/science.1179386); Rudin, C. et al. (2009) New England J of Medicine 361-366 (10.1056/nejma0902903); BMS-833923 (также известный как XL139), описанный, например, в Siu L. et al., J. Clin. Oncol. 2010; 28:15s (suppl; abstr 2501); и National Institute of Health Clinical Trial Identifier No. NCT00670189l; LDE-225, описанный, например, в Pan S. et al., ACS Med. Chem. Lett., 2010; 1(3): 130-134; LEQ-506, описанный, например, в National Institute of Health Clinical Trial Identifier No. NCT01106508; PF-04449913, описанный, например, в National Institute of Health Clinical Trial Identifier No. NCT00953758; антагонисты каскада Hedgehog, описанные в публикации патентной заявки США № 2010/0286114; SMOi2-17, описанный, например, в публикации патентной заявки США № 2010/0093625; SANT-1 и SANT-2, описанные, например, в Rominger C.M. et al., J. Pharmacol. Exp. Ther. 2009; 329(3):995-1005; 1-пиперазинил-4-арилфталазины или их аналоги, описанные в Lucas B.S. et al., Bioorg. Med. Chem. Lett. 2010; 20(12):3618-22.
[0637] Другие гормональные терапевтические средства и химиотерапевтические средства включают, но не ограничиваются ими, антиэстрогены (например, тамоксифен, ралоксифен и магестрола ацетат), агонисты LHRH (например, гозерелин и леупролид), антиандрогены (например, флутамид и бикалутамид), фотодинамические терапевтические средства (например, вертопрофин (BPD-MA), фталоцианин, фотосенсибилизатор Pc4, и деметокси-гипокреллин A (2BA-2-DMHA)), азотистые иприты (например, циклофосфамид, ифосфамид, трофосфамид, хлорамбуцил, эстрамустин и мелфалан), нитрозомочевину (например, кармустин (BCNU) и ломустин (CCNU)), алкилсульфонаты (например, бусульфан и треосульфан), триазены (например, дакарбазин, темозоломид), содержащие платину соединения (например, цисплатин, карбоплатин, оксалиплатин), алкалоиды барвинка (например, винкристин, винбластин, виндезин и винорелбин), таксоиды или таксаны (например паклитаксел или эквивалент паклитаксела, такой как связанный с наночастицами альбумина паклитаксел (абраксан), связанный с докозагексаеновой кислотой паклитаксел (DHA-паклитаксел, таксопрексин), связанный с полиглутаматом паклитаксел (PG-паклитаксел, паклитаксел полиглумекс, CT-2103, XYOTAX), активируемое опухолью пролекарство (TAP) ANG1005 (ангиопеп-2, связанный с тремя молекулами паклитаксела), паклитаксел-EC-1 (паклитаксел, связанный с распознающим erbB2 пептидом EC-1), и конъюгированный с глюкозой паклитаксел, например, 2'-паклитаксел метил 2-глюкопиранозилсукцинат; доцетаксел, таксол), эпиподофиллины (например, этопозид, этопозид фосфат, тенипозид, топотекан, 9-аминокамптотецин, камптоиринотекан, иринотекан, криснатол, митомицин C), антиметаболиты, ингибиторы DHFR (например, метотрексат, дихлорметотрексат, триметрексат, эдатрексат), ингибиторы IMP-дегидрогеназы (например, микофеноловая кислота, тиазофурин, рибавирин и EICAR), ингибиторы рибонуклеотидредуктазы (например, гидроксимочевина и дефероксамин), аналоги урацила (например, 5-фторурацил (5-FU), флоксуридин, доксифлуридин, ралтитрексед, тегафур-урацил, капецитабин), аналоги цитозина (например, цитарабин (ara C, цитозин арабинозид) и флударабин), аналоги пурина (например, меркаптопурин и тиогуанин), аналоги витамина D3 (например EB 1089, CB 1093 и KH 1060), ингибиторы изопренилирования (например, ловастатин), дофаминергические нейротоксины (например, ион 1-метил-4-фенилпиридиния), ингибиторы клеточного цикла (например, стауроспорин), актиномицин (например, актиномицин D, дактиномицин), блеомицин (например, блеомицин A2, блеомицин B2, пепломицин), антрациклины (например, даунорубицин, доксорубицин, пегилированный липосомальный доксорубицин, идарубицин, эпирубицин, пирарубицин, зорубицин, митоксантрон), ингибиторы MDR (например, верапамил), ингибиторы Ca2+ ATP-азы (например тапсигаргин), талидомид, леналидомид (REVLIMID®), ингибиторы тирозинкиназы (например, акситиниб (AG013736), босутиниб (SKI-606), цедираниб (RECENTINTM, AZD2171), дасатиниб (SPRYCEL®, BMS-354825), эрлотиниб (TARCEVA®), гефитиниб (IRESSA®), иматиниб (Gleevec®, CGP57148B, STI-571), лапатиниб (TYKERB®, TYVERB®), лестауртиниб (CEP-701), нератиниб (HKI-272), ниботиниб (TASIGNA®), семаксиниб (семаксиниб, SU5416), сунитиниб (SUTENT®, SU11248), тоцераниб (PALLADIA®), вандетаниб (ZACTIMA®, ZD6474), ваталаниб (PTK787, PTK/ZK), трастузумаб (HERCEPTIN®), бевацизумаб (AVASTIN®), ритуксимаб (RITUXAN®), цетуксимаб (ERBITUX®), панитумумаб (VECTIBIX®), ранибизумаб (Lucentis®), сорафениб (NEXAVAR®), эверолимус (AFINITOR®), алемтузумаб (CAMPATH®), гемтузумаб озагомицин (MYLOTARG®), темсиролимус (TORISEL®), ENMD-2076, PCI-32765, AC220, довитиниб лактат (TKI258, CHIR-258), BIBW 2992 (TOVOKTM), SGX523, PF-04217903, PF-02341066, PF-299804, BMS-777607, ABT-869, MP470, BIBF 1120 (VARGATEF®), AP24534, JNJ-26483327, MGCD265, DCC-2036, BMS-690154, CEP-11981, тивозаниб (AV-951), OSI-930, MM-121, XL-184, XL-647, и/или XL228), ингибиторы протеасом (например, бортезомиб (Velcade)), ингибиторы mTOR (например, рапамицин, темсиролимус (CCI-779), эверолимус (RAD-001), ридафоролимус, AP23573 (Ariad), AZD8055 (AstraZeneca), BEZ235 (Novartis), BGT226 (Norvartis), XL765 (Sanofi Aventis), PF-4691502 (Pfizer), GDC0980 (Genetech), SF1126 (Semafoe) и OSI-027 (OSI)), облимерсен, гемцитабин, карминомицин, лейковорин, пеметрексед, циклофосфамид, дакарбазин, прокарбазин, преднизолон, дексаметазон, камптотецин, пликамицин, аспарагиназа, аминоптерин, метоптерин, порфиромицин, мелфалан, леуросидин, леурозин, хлорамбуцил, трабектедин, прокарбазин, дискодермолид, карминомицин, аминоптерин и гексаметил меламин.
[0638] Иллюстративные биологические лекарственные средства включают, но не ограничиваются ими, интерфероны, цитокины (например, фактор некроза опухоли, интерферон α, интерферон γ), вакцины, гемопоэтические факторы роста, моноклональную серотерапию, иммуностимуляторы и/или иммуномодулирующие средства (например, IL-1, 2, 4, 6 или 12), факторы роста иммунных клеток (например, GM-CSF) и антитела (например Herceptin (трастузумаб), T-DM1, AVASTIN (бевацизумаб), ERBITUX (цетуксимаб), Vectibix (панитумумаб), Rituxan (ритуксимаб), Bexxar (тозитумомаб) или Perjeta (пертузумаб)).
[0639] В одном варианте осуществления биологическое лекарственное средство представляет собой антитело против CD37, такое как, но не ограничиваясь ими, IMGN529, K7153A и TRU-016. В другом варианте осуществления биологическое лекарственное средство представляет собой антитело против CD20, такое как, но не ограничиваясь ими, 131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб, обинутузумаб и офатумумаб. В другом варианте осуществления биологическое лекарственное средство представляет собой антитело против CD52, такое как, но не ограничиваясь ими, алемтузумаб.
[0640] В некоторых вариантах осуществления химиотерапевтическое средство выбрано из ингибиторов HSP90. Ингибитор HSP90 может представлять собой производное гелданамицина, например, ингибитор HSP90 на основе бензохинона или гидрохинона ансамицина (например, IPI-493 и/или IPI-504). Неограничивающие примеры ингибиторов HSP90 включают IPI-493, IPI-504, 17-AAG (также известный как танеспимицин или CNF-1010), BIIB-021 (CNF-2024), BIIB-028, AUY-922 (также известный как VER-49009), SNX-5422, STA-9090, AT-13387, XL-888, MPC-3100, CU-0305, 17-DMAG, CNF-1010, макбецин (например, макбецин I, макбецин II), CCT-018159, CCT-129397, PU-H71 или PF-04928473 (SNX-2112).
[0641] В некоторых вариантах осуществления химиотерапевтическое средство выбрано из ингибиторов PI3K (например, включая ингибиторы PI3K, описанные в настоящем описании, и ингибиторы PI3K, не описанные в настоящем описании). В некоторых вариантах осуществления ингибитор PI3K представляет собой ингибитор дельта- и гамма-изоформ PI3K. В некоторых вариантах осуществления ингибитор PI3K представляет собой ингибитор дельта-изоформы PI3K. В некоторых вариантах осуществления ингибитор PI3K представляет собой ингибитор гамма-изоформы PI3K. В некоторых вариантах осуществления ингибитор PI3K представляет собой ингибитор альфа-изоформы PI3K. В других вариантах осуществления ингибитор PI3K представляет собой ингибитор одной или нескольких из альфа-, бета-, дельта- и гамма-изоформ PI3K. Иллюстративные ингибиторы PI3K, которые можно использовать в комбинации, описаны, например, в WO 09/088990, WO 09/088086, WO 2011/008302, WO 2010/036380, WO 2010/006086, WO 09/114870, WO 05/113556; US 2009/0312310 и US 2011/0046165, каждая из которых включена в настоящее описание в качестве ссылки. Дополнительные ингибиторы PI3K, которые можно использовать в комбинации с фармацевтическими композициями, включают но не ограничиваются ими, AMG-319, GSK 2126458, GDC-0980, GDC-0941, Sanofi XL147, XL499, XL756, XL147, PF-4691502, BKM 120, GA-101 (обинутузумаб), CAL-101 (GS-1101), CAL 263, SF1126, PX-886 и двойной ингибитор PI3K (например, Novartis BEZ235). В одном варианте осуществления ингибитор PI3K представляет собой изохинолинон.
[0642] В некоторых вариантах осуществления химиотерапевтическое средство выбрано из ингибиторов polo-подобной киназы 1 (PLK1), таких как, но не ограничиваясь ими, воласертиб (BI6727; N-((1S,4S)-4-(4-(циклопропилметил)пиперазин-1-ил)циклогексил)-4-(((R)-7-этил-8-изопропил-5-метил-6-оксо-5,6,7,8-тетрагидроптеридин-2-ил)амино)-3-метоксибензамид), BI2536 ((R)-4-[(8-циклопентил-7-этил-5,6,7,8-тетрагидро-5-метил-6-оксо-2-птеридинил)амино]-3-метокси-N-(1-метил-4-пиперидинил)бензамид), ZK-тиазолидон ((2-имидазол-1-ил-1-оксадинил-1-фосфоно-этил)фосфоновая кислота), TAK-960 (4-((9-циклопентил-7,7-дифтор-5-метил-6-оксо-6,7,8,9-тетрагидро-5H-пиримидо[4,5-b][1,4]диазепин-2-ил)амино)-2-фтор-5-метокси-N-(1-метилпиперидин-4-ил)бензамид), MLN0905 (2-((5-(3-(диметиламино)пропил)-2-метилпиридин-3-ил)амино)-9-(трифторметил)-5H-бензо[b]пиримидо[4,5-d]азепин-6(7H)-тион), GSK461364 ((R)-5-(6-((4-метилпиперазин-1-ил)метил)-1H-бензо[d]имидазол-1-ил)-3-(1-(2-(трифторметил)фенил)этокси)тиофен-2-карбоксамид), ригосертиб (ON-01910; натрий (E)-2-((2-метокси-5-(((2,4,6-триметоксистирил)сульфонил)метил)фенил)амино)ацетат) и HMN-214 ((E)-4-(2-(N-((4-метоксифенил)сульфонил)ацетамидо)стирил)пиридин 1-оксид).
[0643] В некоторых вариантах осуществления химиотерапевтическое средство выбрано из ингибиторов IRAK. Ингибиторы семейства протеинкиназ IRAK относятся к соединениям, которые ингибируют функцию протеинкиназ IRAK и, более предпочтительно, к соединениям, которые ингибируют функцию IRAK-4 и/или IRAK-1. Иллюстративные ингибиторы IRAK включают, но не ограничиваются ими, ингибиторы IRAK4, такие как ND-2110 и ND-2158; ингибиторы IRAK, описанные в WO2003/030902, WO2004/041285, WO2008/030579 и Buckley et al. (IRAK-4 inhibitors. Part 1: a series of amides. Bioorganic & medicinal chemistry letters 2008, 18(11):3211-3214; IRAK-4 inhibitors. Part II: a structure-based assessment of imidazo[1,2-a]pyridin binding. Bioorganic & medicinal chemistry letters 2008, 18(11):3291-3295; IRAK-4 inhibitors. Part III: a series of imidazo[1,2-a]pyridines. Bioorganic & medicinal chemistry letters 2008, 18(11):3656-3660), полное содержание которых включено в настоящее описание в качестве ссылки; RO6245, RO0884, N-ацил-2-аминобензимидазолы 1-(2-(4-морфолинил)этил)-2-(3-нитробензоиламино)бензимидазол и/или N-(2-Морфолинилэтил)-2-(3-нитробензоиламидо)бензимидазол.
[0644] В некоторых вариантах осуществления в рамках настоящего изобретения предусматривается способ применения соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), или фармацевтической композиции, описанной в настоящем описании, в комбинации с лучевой терапией для ингибирования аномального роста клеток или лечения гиперпролиферативного нарушения у индивидуума. Способы проведения лучевой терапии известны в данной области, и эти способы можно использовать в комбинированной терапии, описанной в настоящем описании. Способ введения соединения, описанного в настоящем описании, в этой комбинированной терапии можно определять, как описано в настоящем описании.
[0645] Лучевую терапию можно проводить одним из нескольких способов или с помощью комбинации способов, включая, но не ограничиваясь этим, терапию внешним пучком, внутреннюю лучевую терапию, излучение из имплантата, стереотактическую радиохирургическую операцию, системную лучевую терапию, лучевую радиотерапию и перманентную или временную интерстициальную брахитерапию. Термин "брахитерапия", как используют в рамках изобретения, относится к лучевой терапии, осуществляемой с помощью пространственно ограниченного радиоактивного материала, помещенного в организм в опухоль или вблизи опухоли или в область другого пролиферативного заболевания тканей. Термин включает, но не ограничивается этим, воздействие радиоактивными изотопами (например, At-211, I-131, I-125, Y-90, Re-186, Re-188, Sm-153, Bi-212, P-32 и радиоактивными изотопами Lu). Походящие источники радиации для применения в качестве средства, влияющего на клетки, описанного в настоящем описании, включают как твердые вещества, так и жидкости. В качестве неограничивающего примера, источник радиации может представлять собой радионуклид, такой как I-125, I-131, Yb-169, Ir-192 в качестве твердого источника, I-125 в качестве твердого источника или другие радионуклиды, которые испускают фотоны, бета-частицы, гамма-излучение или другие терапевтические лучи. Радиоактивный материал также может представлять собой жидкость, изготовленную из любого раствора радионуклида(ов), например, раствора I-125 или I-131, или радиоактивную жидкость можно получать с использованием взвеси подходящей жидкости, содержащей мелкие частицы твердых радионуклидов, таких как Au-198, Y-90. Более того, радионуклид(ы) могут быть выполнены в виде в геля или радиоактивных микросфер.
[0646] Не ограничиваясь какой-либо теорией, соединение, описанное в настоящем описании, или его фармацевтически приемлемая форма (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), или фармацевтическая композиция, описанная в настоящем описании, могут обеспечивать более высокую чувствительность клеток к лечению лучевой терапией для целей уничтожения и/или ингибирования роста таких клеток. Таким образом, в рамках настоящего изобретения предусматривается способ сенсибилизации аномальных клеток у индивидуума к лечению лучевой терапией, который включает введение индивидууму количества соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), которое является эффективным для сенсибилизации аномальных клеток к лечению лучевой терапией. Количество соединения, используемого в этом способе, можно определять способами установления эффективных количеств таких соединений, описанными в настоящем описании.
[0647] В некоторых вариантах осуществления в рамках настоящего изобретения предусматривается способ использования соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), или фармацевтической композиции, описанной в настоящем описании, в комбинации с гормональной терапией для ингибирования аномального роста клеток или лечения гиперпролиферативного нарушения у индивидуума.
[0648] В некоторых вариантах осуществления в рамках настоящего изобретения предусматривается способ использования соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), или фармацевтической композиции, описанной в настоящем описании, в комбинации с хирургической операцией для ингибирования аномального роста клеток или лечения гиперпролиферативного нарушения у индивидуума.
[0649] В одном варианте осуществления соединение, описанное в настоящем описании, или его фармацевтически приемлемую форму (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), или фармацевтическую композицию, описанную в настоящем описании, можно использовать в комбинации с количеством одного или нескольких веществ, выбранных из антиогенных средств, ингибиторов передачи сигнала и антипролиферативных средств, ингибиторов гликолиза или ингибиторов аутофагии.
[0650] Другие лекарственные средства, такие как ингибиторы MMP-2 (матриксная металлопротеиназа 2), ингибиторы MMP-9 (матриксная металлопротеиназа 9) и ингибиторы COX-11 (циклооксигеназа 11) можно использовать вместе с соединением, описанным в настоящем описании, или его фармацевтически приемлемой формой, или фармацевтической композицией, описанной в настоящем описании. Такие лекарственные средства включают, например, рапамицин, темсиролимус (CCI-779), эверолимус (RAD001), сорафениб, сунитиниб и бевацизумаб. Примеры пригодных ингибиторов COX-II включают CELEBREXTM (алекоксиб), вальдекоксиб и рофекоксиб. Примеры пригодных ингибиторов матриксной металлопротеиназы описаны в WO 96/33172 (опубликована 24 октября 1996 года), WO 96/27583 (опубликована 7 марта 1996 года), патентной заявке Европы № 97304971.1 (поданная 8 июля 1997 года), патентной заявке Европы № 99308617.2 (поданная 29 октября 1999 года), WO 98/07697 (опубликованная 26 февраля 1998 года), WO 98/03516 (опубликованная 29 января 1998 года), WO 98/34918 (опубликованная 13 августа 1998 года), WO 98/34915 (опубликованная 13 августа 1998 года), WO 98/33768 (опубликованная 6 августа 1998 года), WO 98/30566 (опубликованная 16 июля 1998 года), публикации патента Европы 606046 (опубликованный 13 июля 1994 года), публикации патента Европы 931788 (опубликованная 28 июля 1999 года), WO 90/05719 (опубликованная 31 мая 1990 года), WO 99/52910 (опубликованная 21 октября 1999 года), WO 99/52889 (опубликованная 21 октября 1999 года), WO 99/29667 (опубликованная 17 июня 1999 года), международной заявке PCT № PCT/IB98/01113 (поданная 21 июля 1998 года), патентной заявке Европы № 99302232.1 (поданная 25 марта 1999 года), патентной заявке Великобритании № 9912961.1 (поданная 3 июня 1999 года), предварительной заявке США № 60/148464 (поданная 12 августа 1999 года), патенте США 5863949 (выданный 26 января 1999 года), патенте США 5861510 (выданный 19 января 1999 года) и публикации патента Европы 780386 (опубликованная 25 июня 1997 года), все из которых включены в настоящее описание в качестве ссылок в полном объеме. В некоторых вариантах осуществления ингибиторы MMP-2 и MMP-9 представляют собой ингибиторы, которые имеют небольшую активность или не имеют активности ингибирования MMP-1. Другие варианты осуществления включают ингибиторы, которые селективно ингибируют MMP-2 и/или AMP-9 относительно других матриксных металлопротеиназ (например, MAP-1, MMP-3, MMP-4, MMP-5, MMP-6, MMP-7, MMP-8, MMP-10, MMP-11, MMP-12 и MMP-13). Некоторые неограничивающие примеры ингибиторов MMP представляют собой AG-3340, RO 32-3555 и RS 13-0830.
[0651] Ингибиторы аутофагии включают, но не ограничиваются ими, хлороквин, 3-метиладенин, гидроксихлороквин (Plaquenil™), бафиломицин A1, 5-амино-4-имидазолкарбоксамид рибозид (AICAR), окадаиковую кислоту, подавляющие аутофагию токсины водорослей, которые ингибируют протеинфосфатазы типа 2A или типа 1, аналоги cAMP и лекарственные средства, которые повышают уровни cAMP, такие как аденозин, LY204002, N6-меркаптопурин рибозид и винбластин. Кроме того, также можно использовать антисмысловые или миРНК, которые ингибируют экспрессию белков, включая, но не ограничиваясь ими, ATG5 (которые вовлечены в аутофагию).
[0652] Другие иллюстративные лекарственные средства, пригодные для комбинированной терапии, включают, но не ограничиваются ими, средства, как описано выше, лучевую терапию, антагонисты гормонов, гормоны и их рилизинг-факторы, тиреоидные и антитиреоидные лекарственные средства, эстрогены и прогестины, андрогены, адренокортикотропный гормон; адренокортикальные стероиды и их синтетические аналоги; ингибиторы синтеза и действия адренокортикальных гормонов, инсулин, пероральные гипогликемические средства и фармацевтические средства для эндокринной части поджелудочной железы, средства, влияющие на кальцификацию и обновление костей: кальций, фосфат, паратиреоидный гормон, витамин D, кальцитонин, витамины, такие как растворимые в воде витамины, комплекс витамина B, аскорбиновая кислота, жирорастворимые витамины, витамины A, K и E, факторы роста, цитокины, хемокины, агонисты и антагонисты мускариновых рецепторов; антихолинэстеразные средства; средства, действующие на нейромышечные соединения и/или автономные ганглии; катехоламины, симпатомиметические лекарственные средства и агонисты или антагонисты адренергических рецепторов; и агонисты и антагонисты рецепторов 5-гидрокситриптамина (5-HT, серотонин).
[0653] Лекарственные средства также могут включать средства от боли и воспаления, такие как гистамин и антагонисты гистамина, брадикинин и антагонисты брадикинина, 5-гидрокситриптамин (серотонин), липидные вещества, которые получают путем биологического преобразования продуктов селективного гидролиза мембранных фосфолипидов, эйкозаноиды, простагландины, тромбоксаны, лейкотриены, аспирин, нестероидные противовоспалительные средства, аналгезирующие-жаропонижающие средства, средства, которые ингибируют синтез простагландинов и тромбоксанов, селективные ингибиторы индуцибельной циклооксигеназы, селективные ингибиторы индуцибельной циклооксигеназы-2, аутакоиды, паракринные гормоны, соматостатин, гастрин, цитокины, которые модулируют взаимодействия, вовлеченные в гуморальные и клеточные иммунные ответы, происходящие из липидов аутокоиды, эйкозаноиды, β-адренергические агонисты, ипратропиум, глюкокортикоиды, метилксантины, блокаторы натриевых каналов, агонисты опиоидных рецепторов, блокаторы кальциевых каналов, мембранные стабилизаторы и ингибиторы лейкотриенов.
[0654] Примеры терапевтических антител, которые можно комбинировать с соединением, описанным в настоящем описании, включают, но не ограничиваются ими, антитела против рецепторной тирозинкиназы (цетуксимаб, панитумумаб, трастузумаб), антитела против CD20 (ритуксимаб, тозитумомаб), и другие антитела, такие как алемтузумаб, бевацизумаб и гемтузумаб.
[0655] Более того, лекарственные средства, используемые для иммуномодулирования, такие как иммуномодуляторы, иммунодепрессивные средства, толерогенные и иммуностимуляторы, охватываются способами, описанными в настоящем описании. Кроме того, также способы, описанные в настоящем описании, предусматривают лекарственные средства, действующие на кровь и кроветворные органы, гемопоэтические средства, факторы роста, минералы и витамины, антикоагулянт, тромболитическое средство и антитромбоцитарные лекарственные средства.
[0656] В иллюстративных вариантах осуществления для лечения карциномы почек, можно комбинировать соединение, описанное в настоящем описании, или его фармацевтически приемлемую форму (например, фармацевтически приемлемые соли, гидраты, сольваты, изомеры, пролекарства и изотопно меченные производные), или фармацевтическую композицию, описанную в настоящем описании, с сорафенибом и/или авастином. Для лечения нарушения эндометрия можно комбинировать соединение, описанное в настоящем описании, с доксорубицином, таксотером (таксол) и/или цисплатином (карбоплатин). Для лечения рака яичника, можно комбинировать соединение, описанное в настоящем описании, с цисплатином, карбоплатином, доцетакселом, доксорубицином, топотеканом и/или тамоксифеном. Для лечения рака молочной железы можно комбинировать соединение, описанное в настоящем описании, с паклитакселом или доцетакселом, гемцитабином, капецитабином, тамоксифеном, лектрозолом, эрлотинибом, лапатинибом, PD0325901, бевацизумабом, трастузумабом, OSI-906 и/или OSI-930. Для лечения рака легкого можно комбинировать соединение, описанное в настоящем описании, с паклитакселом, доцетакселом, гемцитабином, цисплатином, пеметрекседом, эрлотинибом, PD0325901 и/или бевацизумабом.
[0657] В некоторых вариантах осуществления нарушение, подлежащее лечению, предупреждению и/или управлению течением, представляет собой гематологическую злокачественную опухоль, например, лимфому (например, T-клеточную лимфому; NHL), миелому (например, множественная миелома) и лейкоз (например CLL), и соединение, описанное в настоящем описании (например, соединение 292) используют в комбинации с: ингибиторами HDAC, такими как вориностат, ромидепсин и ACY-1215; ингибиторами mTOR, такими как эверолимус; антифолатами, такими как пралатрексат; азотистым ипритом, таким как бендамустин; гемцитабин, необязательно в дополнительной комбинации с оксалиплатином; комбинацией ритуксимаб-циклофосфамид; ингибиторами PI3K, такими как GS-1101, XL 499, GDC-0941 и AMG-319; ингибиторами ангиогенеза, такими как помалидомид или ингибиторы BTK, такие как ибрутиниб, AVL-292, дасатиниб, LFM-AI3, ONO-WG-307 и GDC-0834.
[0658] В некоторых вариантах осуществления нарушение, подлежащее лечению, предупреждению и/или управлению течением представляет собой DLBCL, и соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибиторами HDAC, описанными в настоящем описании. В одном конкретном варианте осуществления ингибитор HDAC представляет собой ACY-1215.
[0659] В некоторых вариантах осуществления нарушение, подлежащее лечению, предупреждению и/или управлению течением представляет собой DLBCL, и соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибиторами BTK, описанными в настоящем описании. В одном конкретном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В одном варианте осуществления ингибитор BTK представляет собой AVL-292.
[0660] В некоторых вариантах осуществления нарушение, подлежащее лечению, предупреждению и/или управлению течением представляет собой DLBCL, и соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибиторами IRAK, описанными в настоящем описании. В одном конкретном варианте осуществления ингибитор IRAK4 представляет собой ND-2110 или ND-2158.
[0661] В некоторых вариантах осуществления нарушение, подлежащее лечению, предупреждению и/или управлению течением представляет собой WM, и соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибиторами BTK, описанными в настоящем описании. В одном конкретном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В одном варианте осуществления ингибитор BTK представляет собой AVL-292.
[0662] В некоторых вариантах осуществления нарушение, подлежащее лечению, предупреждению и/или управлению течением, представляет собой WM, и соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибиторами IRAK4, описанными в настоящем описании. В одном конкретном варианте осуществления ингибитор IRAK4 представляет собой ND-2110 или ND-2158.
[0663] В некоторых вариантах осуществления нарушение, подлежащее лечению, предупреждению и/или управлению течением, представляет собой T-ALL, индивидуум/пациент имеет дефицит PTEN, и соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с доксорубицином и/или винкристином.
[0664] Следующие лекарственные средства, которые можно комбинировать с соединением, описанным в настоящем описании, могут быть найдены в Goodman and Gilman’s "The Pharmocological Basis of Therapeutics" Tenth Edition edited by Hardman, Limbird and Gilman, или Physician’s Desk Reference, оба из которых включены в настоящее описание в качестве ссылок в полном объеме.
[0665] В одном варианте осуществления соединения, описанные в настоящем описании, можно использовать в комбинации со средствами, описанными в настоящем описании, или другими подходящими средствами, в зависимости от состояния, подвергаемого лечению. Таким образом, в некоторых вариантах осуществления соединение, описанное в настоящем описании, или его фармацевтически приемлемую форму совместно вводят с другими средствами, как описано выше. При использовании с комбинированной терапией, соединение, описанное в настоящем описании или его фармацевтически приемлемую форму можно вводить со вторым средством одновременно или по отдельности. Это введение в комбинации может включать одновременное введение двух средств в одной дозированной форме, одновременное введение в раздельных дозированных формах, и раздельное введение. Следовательно, соединение, описанное в настоящем описании, и любое из средств, описанных выше, можно составлять вместе в одной дозированной форме и вводить одновременно. Альтернативно соединение, описанное в настоящем описании, и любое из средств, описанных выше, можно вводить одновременно, где средства находятся в разных составах. Альтернативно, соединение, описанное в настоящем описании можно вводить сразу после любого из средств, описанных выше, или наоборот. В отдельном протоколе введения соединение, описанное в настоящем описании, и любое из средств, описанных выше, можно вводить с интервалом несколько минут, или несколько часов, или несколько суток.
[0666] Введение соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы можно осуществлять любым способом, который обеспечивает доставку соединения в область действия. Эффективное количество соединения, описанного в настоящем описании, или его фармацевтически приемлемой формы, можно вводить либо в однократной, либо многократными дозами любым из приемлемых способов введения средств, имеющих сходную применимость, включая ректальный, буккальный, интраназальный и трансдермальный пути, внутриартериальную инъекцию, внутривенно, внутрибрюшинно, парентерально, внутримышечно, подкожно, перорально, местно, в качестве ингалируемого вещества, или через пропитанное или покрытое устройство, такое как стент, например, или помещаемый в артерию цилиндрический полимер.
[0667] Когда соединение, описанное в настоящем описании, или его фармацевтически приемлемую форму вводят в фармацевтической композиции, которая содержит одно или несколько средств, и средство имеет более короткое время полужизни, чем соединение, описанное в настоящем описании, единичные дозированные формы средства и соединения, описанного в настоящем описании, можно корректировать соответствующим образом.
[0668] В некоторых вариантах осуществления соединение, описанное в настоящем описании, вводят в качестве отдельных композиций, например, фармацевтических композиций. В некоторых вариантах осуществления модулятор PI3K и средство вводят по отдельности, но одним и тем же путем (например, оба перорально или оба внутривенно). В других вариантах осуществления модулятор PI3K и средство вводят в одной и той же композиции, например, фармацевтической композиции.
[0669] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибитором HDAC, например, таким как белиностат, вориностат, панобиностат, ACY-1215 или ромидепсин.
[0670] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибитором mTOR, например, таким как эверолимус (RAD 001).
[0671] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибитором протеасом, например, таким как бортезомиб или карфилзомиб.
[0672] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибитором PKC-β, например, таким как энзастаурин (LY317615).
[0673] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибитором JAK/STAT, например, таким как INCB16562 или AZD1480.
[0674] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с антифолатом, например, таким как пралатрексат.
[0675] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ингибитором фарнезилтрансферазы, например, таким как типифарниб.
[0676] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с бендамустином и одним дополнительным активным средством. В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой iNHL.
[0677] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с ритуксимабом и одним дополнительным активным средством. В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой iNHL.
[0678] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с бендамустином и ритуксимабом. В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой iNHL.
[0679] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с флударабином, циклофосфамидом и ритуксимабом. В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL.
[0680] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с антителом или биологическим средством, например, таким как алемтузумаб, ритуксимаб, офатумумаб или брентуксимаб ведотин (SGN-035). В одном варианте осуществления второе средство представляет собой ритуксимаб. В одном варианте осуществления второе средство представляет собой ритуксимаб и комбинированная терапия предназначена для лечения, предупреждения и/или управления течением iNHL, FL, опухоли маргинальной зоны селезенки, маргинальной зоны лимфатического узла, внеузловой маргинальной зоны и/или SLL.
[0681] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с конъюгатом антитело-лекарственное средство, например, таким как инотузумаб озагомицин или брентуксимаб ведотин.
[0682] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292) или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с цитотоксическим средством, например, таким как бендамустин, гемцитабин, оксалиплатин, циклофосфамид, винкристин, винбластин, антрациклин (например, даунорубицин или дауномицин, доксорубицин), актиномицин, дактиномицин, блеомицин, клофарабин, неларабин, кладрибин, аспарагиназа, метотрексат или пралатрексат.
[0683] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с одним или несколькими другими средствами против злокачественной опухоли или химиотерапевтическими средствами, например, такими как флударабин, ибрутиниб, фостаматиниб, леналидомид, талидомид, ритуксимаб, циклофосфамид, доксорубицин, винкристин, преднизон или R-CHOP (ритуксимаб, циклофосфамид, доксорубицин или гидроксидауномицин, винкристин или онковин, преднизон).
[0684] В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение 292), или его фармацевтически приемлемое производное (например, соль или сольват) используют в комбинации с антителом к цитокину (например, антитело против IL-15, антитело против IL-21, антитело против IL-4, антитело против IL-7, антитело против IL-2, антитело против IL-9). В некоторых вариантах осуществления второе средство представляет собой ингибитор JAK1, ингибитор JAK3, общий ингибитор JAK, ингибитор BTK, ингибитор SYK или ингибитор PI3K-дельта. В некоторых вариантах осуществления второе средство представляет собой антитело к хемокину.
[0685] Не ограничиваясь конкретной теорией, направленная комбинированная терапия, описанная в настоящем описании, имеет уменьшенные побочные эффекты и/или увеличенную эффективность. Например, в одном варианте осуществления в рамках настоящего изобретения предусматривается комбинированная терапия для лечения CLL соединением, описанным в настоящем описании (например, соединение 292), или его фармацевтически приемлемым производным (например, соль или сольват), и вторым активным средством (например, антитела к IL-15, антитела к IL-21, антитела к IL-4, антитела к IL-7, антитела к IL-2, антитела к IL-9, ингибиторы JAK1, ингибиторы JAK3, общие ингибиторы JAK, ингибиторы BTK, ингибиторы SYK и/или ингибиторы PI3K-дельта).
[0686] Кроме того, не ограничиваясь конкретной теорией, было выявлено, что соединение, описанное в настоящем описании (например, соединение 292) не влияет на каскад BTK или MEK. Таким образом, в некоторых вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват), в комбинации с ингибитором BTK. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В одном варианте осуществления ингибитор BTK представляет собой AVL-292. В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой DLBCL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой iNHL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL.
[0687] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ингибитором MEK. В одном варианте осуществления ингибитор MEK представляет собой таметиниб/GSK1120212 (N-(3-{3-циклопропил-5-[(2-фтор-4-йодфенил)амино]-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидропиридо[4,3-d]пиримидин-1(2H)-ил}фенил)ацетамид), селуметиноб (6-(4-бром-2-хлоранилино)-7-фтор-N-(2-гидроксиэтокси)-3-метилбензимидазол-5-карбоксамид), пимасертиб/AS703026/MSC1935369 ((S)-N-(2,3-дигидроксипропил)-3-((2-фтор-4-йодфенил)амино)изоникотинамид), XL-518/GDC-0973 (1-({3,4-дифтор-2-[(2-фтор-4-йодфенил)амино]фенил}карбонил)-3-[(2S)-пиперидин-2-ил]азетидин-3-ол), рефаметиниб/BAY869766/RDEA119 (N-(3,4-дифтор-2-(2-фтор-4-йодфениламино)-6-метоксифенил)-1-(2,3-дигидроксипропил)циклопропан-1-сульфонамид), PD-0325901 (N-[(2R)-2,3-дигидроксипропокси]-3,4-дифтор-2-[(2-фтор-4-йодфенил)амино]бензамид), TAK733 ((R)-3-(2,3-дигидроксипропил)-6-фтор-5-(2-фтор-4-йодфениламино)-8-метилпиридо[2,3-d]пиримидин-4,7(3H,8H)-дион), MEK162/ARRY438162 (5-[(4-бром-2-фторфенил)амино]-4-фтор-N-(2-гидроксиэтокси)-1-метил-1H-бензимидазол-6-карбоксамид), RO5126766 (3-[[3-фтор-2-(метилсульфамоиламино)-4-пиридил]метил]-4-метил-7-пиримидин-2-илоксихромен-2-он), WX-554, RO4987655/CH4987655 (3,4-дифтор-2-((2-фтор-4-йодфенил)амино)-N-(2-гидроксиэтокси)-5-((3-оксо-1,2-оксазинан-2-ил)метил)бензамид) или AZD8330 (2-((2-фтор-4-йодфенил)амино)-N-(2-гидроксиэтокси)-1,5-диметил-6-оксо-1,6-дигидропиридин-3-карбоксамид). В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой DLBCL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой ALL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CTCL.
[0688] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ингибитором EZH2. В одном варианте осуществления ингибитор EZH2 представляет собой EPZ-6438, GSK-126, GSK-343, El1 или 3-деазанепланоцин A (DNNep). В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой DLBCL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой iNHL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой ALL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CTCL.
[0689] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ингибитором bcl-2. В одном варианте осуществления ингибитор BCL2 представляет собой ABT-199 (4-[4-[[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил]пиперазин-1-ил]-N-[[3-нитро-4-[[(тетрагидро-2H-пиран-4-ил)метил]амино]фенил]сульфонил]-2-[(1H-пирроло[2,3-b]пиридин-5-ил)окси]бензамид), ABT-737 (4-[4-[[2-(4-хлорфенил)фенил]метил]пиперазин-1-ил]-N-[4-[[(2R)-4-(диметиламино)-1-фенилсульфанилбутан-2-ил]амино]-3-нитрофенил]сульфонилбензамид), ABT-263 ((R)-4-(4-((4'-хлор-4,4-диметил-3,4,5,6-тетрагидро-[1,1'-бифенил]-2-ил)метил)пиперазин-1-ил)-N-((4-((4-морфолино-1-(фенилтио)бутан-2-ил)амино)-3((трифторметил)сульфонил)фенил)сульфонил)бензамид), GX15-070 (обатоклакс мезилат, (2Z)-2-[(5Z)-5-[(3,5-диметил-1H-пиррол-2-ил)метилиден]-4-метоксипиррол-2-илиден]индол; метансульфоновая кислота))) или G3139 (облимерсен). В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой DLBCL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой iNHL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CLL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой ALL. В другом варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой CTCL.
[0690] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением iNHL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ритуксимабом. В одном варианте осуществления пациент является пожилым пациентом. В другом варианте осуществления iNHL является рецидивирующей или рефрактерной.
[0691] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением iNHL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с бендамустином. В одном варианте осуществления iNHL является рецидивирующей или рефрактерной.
[0692] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением iNHL, вклчающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват), в комбинации с ритуксимабом, и в дополнительной комбинации с бендамустином. В одном варианте осуществления iNHL является рецидивирующей или рефрактерной.
[0693] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением iNHL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с леналидомидом. В одном варианте осуществления iNHL является рецидивирующей или рефрактерной.
[0694] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ритуксимабом. В одном варианте осуществления пациентом является пожилой пациент. В другом варианте осуществления CLL является рецидивирующим или рефрактерным.
[0695] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с бендамустином. В одном варианте осуществления CLL является рецидивирующим или рефрактерным.
[0696] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ритуксимабом, и в дополнительной комбинации с бендамустином. В одном варианте осуществления CLL является рецидивирующим или рефрактерным.
[0697] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением CLL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с леналидомидом. В одном варианте осуществления CLL является рецидивирующим или рефрактерным.
[0698] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением DLBCL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ритуксимабом. В одном варианте осуществления пациент представляет собой пожилого пациента. В другом варианте осуществления DLBCL является рецидивирующим или рефрактерным.
[0699] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением DLBCL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с бендамустином. В одном варианте осуществления DLBCL является рецидивирующей или рефрактерной.
[0700] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением DLBCL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ритуксимабом, и в дополнительной комбинации с бендамустином. В одном варианте осуществления DLBCL является рецидивирующей или рефрактерной.
[0701] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением DLBCL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с R-GDP (ритуксимаб, циклофосфамид, винкристин и преднизон). В одном варианте осуществления DLBCL является рецидивирующей или рефрактерной. В другом варианте осуществления лечение проводят после лечения R-CHOP.
[0702] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением DLBCL, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ибрутинибом. В одном варианте осуществления DLBCL является рецидивирующей или рефрактерной.
[0703] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением T-клеточной лимфомы (PTCL или CTCL), включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ритуксимабом. В одном варианте осуществления T-клеточная лимфома является рецидивирующей или рефрактерной.
[0704] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением T-клеточной лимфомы (PTCL или CTCL), включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с бендамустином. В одном варианте осуществления T-клеточная лимфома является рецидивирующей или рефрактерной.
[0705] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением T-клеточной лимфомы (PTCL или CTCL), включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ритуксимабом и в дополнительной комбинации с бендамустином. В одном варианте осуществления T-клеточная лимфома является рецидивирующей или рефрактерной.
[0706] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением T-клеточной лимфомы (PTCL или CTCL), включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292) или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ромидепсином. В одном варианте осуществления T-клеточная лимфома является рецидивирующей или рефрактерной.
[0707] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением лимфомы из клеток мантийной зоны, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292) или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ритуксимабом. В одном варианте осуществления лимфома из клеток мантийной зоны является рецидивирующей или рефрактерной.
[0708] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением лимфомы из клеток мантийной зоны, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с бендамустином. В одном варианте осуществления лимфома из клеток мантийной зоны является рецидивирующей или рефрактерной.
[0709] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением лимфомы из клеток мантийной зоны, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ритуксимабом, в дополнительной комбинации с бендамустином. В одном варианте осуществления лимфома из клеток мантийной зоны является рецидивирующей или рефрактерной.
[0710] В других вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением лимфомы из клеток мантийной зоны, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с ибрутинибом. В одном варианте осуществления лимфома из клеток мантийной зоны является рецидивирующей или рефрактерной.
[0711] Кроме того, не ограничиваясь конкретной теорией, было выявлено, что злокачественные клетки проявляют дифференциальные профили чувствительности к доксорубицину и соединениям, описанным в настоящем описании. Таким образом, в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с доксорубицином. В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой ALL.
[0712] В некоторых вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение 292), или его фармацевтически приемлемого производного (например, соль или сольват) в комбинации с AraC. В одном варианте осуществления злокачественная опухоль или гематологическая злокачественная опухоль представляет собой AML.
[0713] В конкретных вариантах осуществления соединение 292 или его фармацевтически приемлемую форму используют в комбинации с одним или несколькими вторыми средствами или вторыми способами терапией, описанными в настоящем описании.
Комбинации ингибиторов PI3K и ингибиторов BTK
[0714] В рамках настоящего изобретения предусматриваются фармацевтические композиции, содержащие терапевтически эффективное количество ингибитора PI3K или его фармацевтически приемлемой формы, и ингибитора BTK или его фармацевтически приемлемой формы.
[0715] Также в рамках настоящего изобретения предусматриваются способы лечения, управления течением или предупреждения злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, включающие введение индивидууму терапевтически эффективного количества ингибитора PI3K или его фармацевтически приемлемой формы в комбинации с ингибитором BTK или его фармацевтически приемлемой формой.
[0716] Ингибиторы BTK, которые можно использовать в композициях и способах, описанных в настоящем описании, описаны в настоящем описании и в других источниках литературы. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В другом варианте осуществления ингибитор BTK представляет собой AVL-292. В некоторых вариантах осуществления ингибитор BTK представляет собой RN-486 (6-циклопропил-8-фтор-2-(2-гидроксиметил-3-{1-метил-5-[5-(4-метилпиперазин-1-ил)пиридин-2-иламино]-6-оксо-1,6-дигидропиридин-3-ил}-фенил)-2H-изохинолин-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил) фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид]), CGI-560 (N-[3-(8-анилиноимидазо[1,2-a]пиразин-6-ил)фенил]-4-трет-бутилбензамид), CGI-1746 (4-(трет-бутил)-N-(2-метил-3-(4-метил-6-((4-(морфолин-4-карбонил)фенил)амино)-5-оксо-4,5-дигидропиразин-2-ил)фенил)бензамид), HM-71224 (Hammi Pharmaceticals), ONO-4059 (Ono Pharmaceuticals Co., LTD), CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпиримидин-2-ил)амино)фенокси)-N-метилпиколинамид), LFM-A13 (2Z-циано-N-(2,5-дибромфенил)3-гидрокси-2-бутенамид) или AVL-292 (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид), который также может быть обозначен как CC-292.
[0717] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество селективного ингибитора PI3K дельта или его фармацевтически приемлемой формы и ингибитора BTK или его фармацевтически приемлемой формы. В одном варианте осуществления селективный ингибитор PI3K дельта представляет собой GS1101 (CAL-101). В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб, GDC-0834, CGI-560, CGI-1746, HM-71224, AVL-292, ONO-4059, CNX-774 или LFM-A13, или их смесь. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В другом варианте осуществления ингибитор BTK представляет собой AVL-292. В другом варианте осуществления ингибитор BTK представляет собой ингибитор BTK, описанный в настоящем описании. В одном варианте осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество GS1101 или его фармацевтически приемлемой формы и ибрутиниба или его фармацевтически приемлемой формы. В другом варианте осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество GS1101 или его фармацевтически приемлемой формы и AVL-292 или его фармацевтически приемлемой формы.
[0718] В одном варианте осуществления композиций и способов, описанных в настоящем описании, молярное соотношение селективного ингибитора PI3K дельта (например, GS1101), или его фармацевтически приемлемой формы и ингибитора BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемой формы находится в диапазоне от приблизительно 500:1 до приблизительно 1:500, от приблизительно 400:1 до приблизительно 1:400, от приблизительно 300:1 до приблизительно 1:300, от приблизительно 200:1 до приблизительно 1:200, от приблизительно 100:1 до приблизительно 1:100, от приблизительно 75:1 до приблизительно 1:75, от приблизительно 50:1 до приблизительно 1:50, от приблизительно 40:1 до приблизительно 1:40, от приблизительно 30:1 до приблизительно 1:30, от приблизительно 20:1 до приблизительно 1:20, от приблизительно 10:1 до приблизительно 1:10, или от приблизительно 5:1 до приблизительно 1:5.
[0719] В одном варианте осуществления композиция содержит селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму в количестве, находящемся в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг, или от приблизительно 10 мг до приблизительно 20 мг.
[0720] В одном варианте осуществления композиция содержит селективный ингибитор PI3K дельта (например GS1101) или его фармацевтически приемлемую форму в количестве менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг.
[0721] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества селективного ингибитора PI3K дельта (например, GS1101) или его фармацевтически приемлемой формы в комбинации с ингибитором BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемой формой, где злокачественная опухоль представляет собой диффузную крупноклеточную B-клеточную лимфому (подобная активированным B-клеткам), диффузную крупноклеточную B-клеточную лимфому (подобная B-клеткам герминативного центра), фолликулярную лимфому, вялотекущую неходжкинскую лимфому, T-клеточную лимфому, лимфому из клеток мантийной зоны или множественную миелому.
[0722] В некоторых вариантах осуществления способов, описанных в настоящем описании, селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму и ингибитор BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемую форму вводят в определенных дозировках. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества селективного ингибитора PI3K-дельта (например, GS1101) или его фармацевтически приемлемой формы в комбинации с ингибитором BTK или его фармацевтически приемлемой формой, где селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 75 мг каждые сутки и ингибитор BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 1100 мг каждые сутки.
[0723] В одном варианте осуществления селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг или от приблизительно 10 мг до приблизительно 20 мг каждые сутки.
[0724] В одном варианте осуществления селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг каждые сутки.
[0725] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество двойного ингибитора PI3K дельта/гамма или его фармацевтически приемлемой формы и ингибитора BTK или его фармацевтически приемлемой формы. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб, GDC-0834, CGI-560, CGI-1746, HM-71224, AVL-292, ONO-4059, CNX-774 или LFM-A13, или их смесь. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В другом варианте осуществления ингибитор BTK представляет собой AVL-292. Ингибитор BTK также может представлять собой другой ингибитор BTK, описанный в настоящем описании. В некоторых вариантах осуществления ингибитор BTK не комбинируют с двойным ингибитором PI3K дельта/гамма.
[0726] В одном варианте осуществления композиций и способов, описанных в настоящем описании, молярное соотношение двойного ингибитора PI3K дельта/гамма или его фармацевтически приемлемой формы и ингибитора BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемой формы находится в диапазоне от приблизительно 500:1 до приблизительно 1:500, от приблизительно 400:1 до приблизительно 1:400, от приблизительно 300:1 до приблизительно 1:300, от приблизительно 200:1 до приблизительно 1:200, от приблизительно 100:1 до приблизительно 1:100, от приблизительно 75:1 до приблизительно 1:75, от приблизительно 50:1 до приблизительно 1:50, от приблизительно 40:1 до приблизительно 1:40, от приблизительно 30:1 до приблизительно 1:30, от приблизительно 20:1 до приблизительно 1:20, от приблизительно 10:1 до приблизительно 1:10, или от приблизительно 5:1 до приблизительно 1:5. В одном варианте осуществления молярное соотношение двойного ингибитора PI3K дельта/гамма или его фармацевтически приемлемой формы и ингибитора BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемой формы составляет приблизительно 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1: 5, 1:4, 1:3, 1:2 или 1:1. В другом варианте осуществления молярное соотношение составляет приблизительно 1:12, 1:11, 1:10, 1:9, 1:8, 1:7 или 1:6.
[0727] В одном варианте осуществления молярное соотношение двойного ингибитора PI3K дельта/гамма и ингибитора BTK составляет от приблизительно 0,05 до приблизительно 3. В другом варианте осуществления молярное соотношение составляет от приблизительно 0,1 до приблизительно 2,5. В другом варианте осуществления молярное соотношение составляет от приблизительно 0,1 до приблизительно 2. В другом варианте осуществления молярное соотношение составляет от приблизительно 0,1 до приблизительно 1,5.
[0728] В одном варианте осуществления композиция содержит двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг или от приблизительно 10 мг до приблизительно 20 мг.
[0729] В одном варианте осуществления композиция содержит двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму в количестве менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг.
[0730] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества двойного ингибитора PI3K дельта/гамма или его фармацевтически приемлемой формы в комбинации с ингибитором BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемой формой, где злокачественная опухоль представляет собой диффузную крупноклеточную B-клеточную лимфому (подобная активированным B-клеткам), диффузную крупноклеточную B-клеточную лимфому (подобная B-клеткам герминативного центра), фолликулярную лимфому, T-клеточную лимфому, лимфому из клеток мантийной зоны или множественную миелому.
[0731] В некоторых вариантах осуществления способов, описанных в настоящем описании, двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму и ингибитор BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемую форму вводят в определенных дозировках. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества двойного ингибитора PI3K дельта/гамма или его фармацевтически приемлемой формы в комбинации с ингибитором BTK или его фармацевтически приемлемой формой, где двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 75 мг каждые сутки и ингибитор BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 1100 мг каждые сутки.
[0732] В одном варианте осуществления двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг или от приблизительно 10 мг до приблизительно 20 мг каждые сутки.
[0733] В одном варианте осуществления двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг каждые сутки.
[0734] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество соединения 292:

Соединение 292,
или его фармацевтически приемлемой формы и ингибитора BTK или его фармацевтически приемлемой формы. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб, GDC-0834, CGI-560, CGI-1746, HM-71224, AVL-292, ONO-4059, CNX-774 или LFM-A13, или их смесь. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В другом варианте осуществления ингибитор BTK представляет собой AVL-292.
[0735] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества соединения 292:
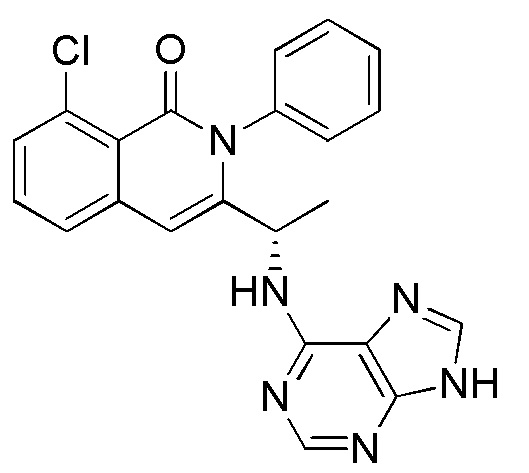
Соединение 292,
или его фармацевтически приемлемой формы в комбинации с ингибитором BTK или его фармацевтически приемлемой формой. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб, GDC-0834, CGI-560, CGI-1746, HM-71224, AVL-292, ONO-4059, CNX-774 или LFM-A13, или их смесь. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В другом варианте осуществления ингибитор BTK представляет собой AVL-292. В одном варианте осуществления ингибитор BTK представляет собой ингибитор BTK, описанный в настоящем описании.
[0736] В некоторых вариантах осуществления композиций и способов, описанных в настоящем описании, соединение 292 или его фармацевтически приемлемую форму используют в комбинации с ингибитором BTK (например, ибрутиниб или AVL-292 или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемой формой в определенных молярных соотношениях. В одном варианте осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество соединения 292:
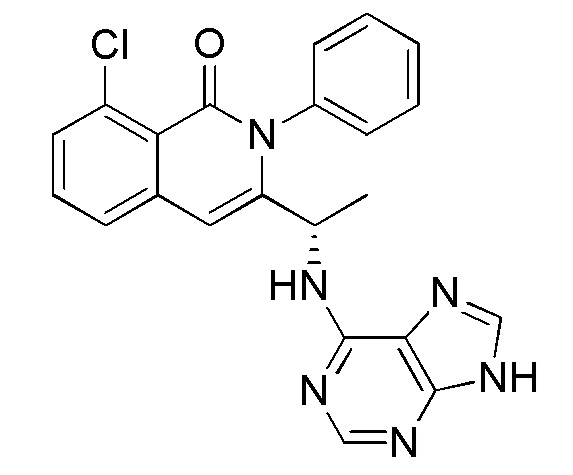
Соединение 292,
или его фармацевтически приемлемой формы и ингибитора BTK или его фармацевтически приемлемой формы, где молярное соотношение соединения 292 или его фармацевтически приемлемой формы и ингибитора BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемой формы находится в диапазоне от приблизительно 1000:1 до приблизительно 1:1000.
[0737] В одном варианте осуществления композиций и способов, описанных в настоящем описании, молярное соотношение соединения 292 или его фармацевтически приемлемой формы и ингибитора BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании), или его фармацевтически приемлемой формы находится в диапазоне от приблизительно 500:1 до приблизительно 1:500, от приблизительно 400:1 до приблизительно 1:400, от приблизительно 300:1 до приблизительно 1:300, от приблизительно 200:1 до приблизительно 1:200, от приблизительно 100:1 до приблизительно 1:100, от приблизительно 75:1 до приблизительно 1:75, от приблизительно 50:1 до приблизительно 1:50, от приблизительно 40:1 до приблизительно 1:40, от приблизительно 30:1 до приблизительно 1:30, от приблизительно 20:1 до приблизительно 1:20, от приблизительно 10:1 до приблизительно 1:10, или от приблизительно 5:1 до приблизительно 1:5. В одном варианте осуществления молярное соотношение соединения 292 или его фармацевтически приемлемой формы и ингибитора BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемой формы составляет приблизительно 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1: 5, 1:4, 1:3, 1:2 или 1:1. В другом варианте осуществления молярное соотношение составляет приблизительно 1:12, 1:11, 1:10, 1:9, 1:8, 1:7 или 1:6.
[0738] В одном варианте осуществления молярное соотношение соединение 292/ингибитор BTK составляет от приблизительно 0,05 до приблизительно 3. В другом варианте осуществления молярное соотношение составляет от приблизительно 0,1 до приблизительно 2,5. В другом варианте осуществления молярное соотношение составляет от приблизительно 0,1 до приблизительно 2. В другом варианте осуществления молярное соотношение составляет от приблизительно 0,1 до приблизительно 1,5.
[0739] В одном варианте осуществления композиций и способов, описанных в настоящем описании, соотношение масс соединения 292 или его фармацевтически приемлемой формы и ибрутиниба или его фармацевтически приемлемой формы находится в диапазоне, составляющем приблизительно 7,5-37,5 для соединения 292 к 42-210 для ибрутиниба. В одном варианте осуществления соотношение масс находится в диапазоне от приблизительно 1:1,1 до приблизительно 1:28. В одном варианте осуществления соотношение масс находится в диапазоне от приблизительно 1:2,2 до приблизительно 1:14. В одном варианте осуществления соотношение масс находится в диапазоне от приблизительно 1:3,3 до приблизительно 1:9,3.
[0740] В одном варианте осуществления композиций и способов, описанных в настоящем описании, соотношение масс соединения 292 или его фармацевтически приемлемой формы и AVL-292 (или другого ингибитора BTK, описанного в настоящем описании) или его фармацевтически приемлемой формы находится в диапазоне, составляющем от приблизительно 7,5-37,5 соединения 292 к 20-100 AVL-292. В одном варианте осуществления соотношение масс находится в диапазоне от приблизительно 1,9:1 до приблизительно 1:13,3. В одном варианте осуществления соотношение масс находится в диапазоне от приблизительно 1:1,1 до приблизительно 1:6,7. В одном варианте осуществления соотношение масс находится в диапазоне от приблизительно 1:1,6 до приблизительно 1:4,4.
[0741] В некоторых вариантах осуществления композиций и способов, описанных в настоящем описании, композиция содержит соединение 292 или его фармацевтически приемлемую форму и ингибитор BTK (например, ибрутиниб или AVL-292 или другой BTK, описанный в настоящем описании) или его фармацевтически приемлемую форму в определенных количествах. В одном варианте осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество соединения 292:
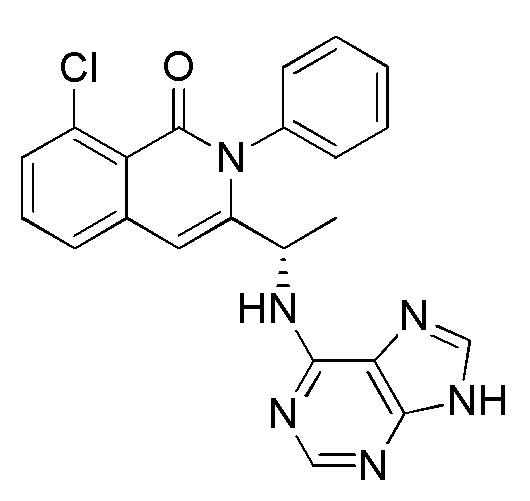
Соединение 292,
или его фармацевтически приемлемой формы и ингибитора BTK или его фармацевтически приемлемой формы, где композиция содержит соединение 292 или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,01 мг до приблизительно 75 мг и ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,01 мг до приблизительно 1100 мг.
[0742] В одном варианте осуществления композиция содержит соединение 292 или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг, или от приблизительно 10 мг до приблизительно 20 мг. В одном варианте осуществления композиция содержит соединение 292 или его фармацевтически приемлемую форму в количестве менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг. В одном варианте осуществления композиция содержит соединение 292 или его фармацевтически приемлемую форму в количестве приблизительно 50 мг, приблизительно 37,5 мг, приблизительно 25 мг, приблизительно 20 мг, приблизительно 15 мг, приблизительно 10 мг, приблизительно 5 мг или приблизительно 1 мг.
[0743] В одном варианте осуществления композиция содержит ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании), или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 800 мг, от приблизительно 0,1 мг до приблизительно 750 мг, от приблизительно 0,1 мг до приблизительно 600 мг, от приблизительно 1 мг до приблизительно 500 мг, от приблизительно 1 мг до приблизительно 400 мг, от приблизительно 10 мг до приблизительно 300 мг или от приблизительно 50 мг до приблизительно 250 мг. В одном варианте осуществления композиция содержит ингибитор BTK (например, ибрутиниб или AVL-292), или его фармацевтически приемлемую форму в количестве менее чем приблизительно 1000 мг, менее чем приблизительно 800 мг, менее чем приблизительно 750 мг, менее чем приблизительно 500 мг, менее чем приблизительно 400 мг, менее чем приблизительно 350 мг, менее чем приблизительно 300 мг, менее чем приблизительно 250 мг, менее чем приблизительно 200 мг, менее чем приблизительно 150 мг, менее чем приблизительно 100 мг, менее чем приблизительно 75 мг, менее чем приблизительно 50 мг или менее чем приблизительно 25 мг.
[0744] В одном варианте осуществления композиция содержит ибрутиниб или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 210 мг, от приблизительно 1 мг до приблизительно 150 мг, от приблизительно 5 мг до приблизительно 100 мг, от приблизительно 10 мг до приблизительно 80 мг, от приблизительно 20 мг до приблизительно 60 мг или от приблизительно 30 мг до приблизительно 50 мг. В одном варианте осуществления композиция содержит ибрутиниб или его фармацевтически приемлемую форму в количестве менее чем приблизительно 210 мг, менее чем приблизительно 150 мг, менее чем приблизительно 100 мг, менее чем приблизительно 80 мг, менее чем приблизительно 60 мг, менее чем приблизительно 50 мг, менее чем приблизительно 30 мг, менее чем приблизительно 20 мг или менее чем приблизительно 10 мг. В одном варианте осуществления композиция содержит ибрутиниб или его фармацевтически приемлемую форму в количестве приблизительно 210 мг, приблизительно 150 мг, приблизительно 100 мг, приблизительно 80 мг, приблизительно 60 мг, приблизительно 50 мг, приблизительно 30 мг, приблизительно 20 мг или приблизительно 10 мг.
[0745] В одном варианте осуществления композиция содержит AVL-292 или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 100 мг, от приблизительно 0,5 мг до приблизительно 80 мг, от приблизительно 1 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 10 мг до приблизительно 40 мг, или от приблизительно 20 мг до приблизительно 30 мг. В одном варианте осуществления композиция содержит AVL-292 или его фармацевтически приемлемую форму в количестве менее чем приблизительно 100 мг, менее чем приблизительно 80 мг, менее чем приблизительно 60 мг, менее чем приблизительно 50 мг, менее чем приблизительно 40 мг, менее чем приблизительно 30 мг, менее чем приблизительно 20 мг, менее чем приблизительно 10 мг или менее чем приблизительно 5 мг. В одном варианте осуществления композиция содержит AVL-292 или его фармацевтически приемлемую форму в количестве приблизительно 100 мг, приблизительно 80 мг, приблизительно 60 мг, приблизительно 50 мг, приблизительно 40 мг, приблизительно 30 мг, приблизительно 20 мг, приблизительно 10 мг или приблизительно 5 мг.
[0746] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества соединения 292 или его фармацевтически приемлемой формы в комбинации с ингибитором BTK или его фармацевтически приемлемой формой, где злокачественная опухоль представляет собой диффузную крупноклеточную B-клеточную лимфому (подобную активированным B-клеткам), диффузную B-клеточную лимфому (подобную B-клеткам герминативного центра), фолликулярную лимфому, T-клеточную лимфому, лимфому из клеток мантийной зоны или множественную миелому. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В другом варианте осуществления ингибитор BTK представляет собой AVL-292.
[0747] В некоторых вариантах осуществления способов, описанных в настоящем описании, соединение 292 или его фармацевтически приемлемую форму и ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемую форму вводят в определенных дозировках. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества соединения 292:

Соединение 292,
или его фармацевтически приемлемой формы в комбинации с ингибитором BTK или его фармацевтически приемлемой формой, где соединение 292 или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 75 мг каждые сутки и ингибитор BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 1100 мг каждые сутки.
[0748] В одном варианте осуществления соединение 292 или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг, или от приблизительно 10 мг до приблизительно 20 мг каждые сутки. В одном варианте осуществления соединение 292 или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг, или менее чем приблизительно 10 мг каждые сутки. В одном варианте осуществления соединение 292 или его фармацевтически приемлемую форму вводят в дозировке приблизительно 50 мг, приблизительно 37,5 мг, приблизительно 25 мг, приблизительно 20 мг, приблизительно 15 мг, приблизительно 10 мг, приблизительно 5 мг, или приблизительно 1 мг каждые сутки.
[0749] В одном варианте осуществления ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 800 мг, от приблизительно 0,1 мг до приблизительно 750 мг, от приблизительно 0,1 мг до приблизительно 600 мг, от приблизительно 1 мг до приблизительно 500 мг, от приблизительно 1 мг до приблизительно 400 мг, от приблизительно 10 мг до приблизительно 300 мг, или от приблизительно 50 мг до приблизительно 250 мг каждые сутки. В одном варианте осуществления ингибитор BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 1000 мг, менее чем приблизительно 800 мг, менее чем приблизительно 750 мг, менее чем приблизительно 500 мг, менее чем приблизительно 400 мг, менее чем приблизительно 350 мг, менее чем приблизительно 300 мг, менее чем приблизительно 250 мг, менее чем приблизительно 200 мг, менее чем приблизительно 150 мг, менее чем приблизительно 100 мг, менее чем приблизительно 75 мг, менее чем приблизительно 50 мг или менее чем приблизительно 25 мг каждые сутки.
[0750] В одном варианте осуществления ибрутиниб или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 210 мг, от приблизительно 1 мг до приблизительно 150 мг, от приблизительно 5 мг до приблизительно 100 мг, от приблизительно 10 мг до приблизительно 80 мг, от приблизительно 20 мг до приблизительно 60 мг или от приблизительно 30 мг до приблизительно 50 мг каждые сутки. В одном варианте осуществления ибрутиниб или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 210 мг, менее чем приблизительно 150 мг, менее чем приблизительно 100 мг, менее чем приблизительно 80 мг, менее чем приблизительно 60 мг, менее чем приблизительно 50 мг, менее чем приблизительно 30 мг, менее чем приблизительно 20 мг, или менее чем приблизительно 10 мг каждые сутки. В одном варианте осуществления ибрутиниб или его фармацевтически приемлемую форму вводят в дозировке приблизительно 210 мг, приблизительно 150 мг, приблизительно 100 мг, приблизительно 80 мг, приблизительно 60 мг, приблизительно 50 мг, приблизительно 30 мг, приблизительно 20 мг или приблизительно 10 мг каждые сутки.
[0751] В одном варианте осуществления AVL-292 или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 100 мг, от приблизительно 0,5 мг до приблизительно 80 мг, от приблизительно 1 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 10 мг до приблизительно 40 мг, или от приблизительно 20 мг до приблизительно 30 мг каждые сутки. В одном варианте осуществления AVL-292 или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 100 мг, менее чем приблизительно 80 мг, менее чем приблизительно 60 мг, менее чем приблизительно 50 мг, менее чем приблизительно 40 мг, менее чем приблизительно 30 мг, менее чем приблизительно 20 мг, менее чем приблизительно 10 мг или менее чем приблизительно 5 мг каждые сутки. В одном варианте осуществления AVL-292 или его фармацевтически приемлемую форму вводят в дозировке приблизительно 100 мг, приблизительно 80 мг, приблизительно 60 мг, приблизительно 50 мг, приблизительно 40 мг, приблизительно 30 мг, приблизительно 20 мг, приблизительно 10 мг или приблизительно 5 мг каждые сутки.
[0752] В одном варианте осуществления ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемую форму вводят индивидууму за по меньшей мере 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часов, 48 часов, 72 часов, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель до введения ингибитора PI3K (например, соединение 292) или его фармацевтически приемлемой формы. В другом варианте осуществления ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемую форму вводят одновременно с ингибитором PI3K (например, соединение 292) или его фармацевтически приемлемой формой в одной дозированной форме или в отдельных дозированных формах. В другом варианте осуществления ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемую форму вводят индивидууму по меньшей мере через 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часов, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель после введения ингибитора PI3K (например, соединение 292) или его фармацевтически приемлемой формы. В одном варианте осуществления ингибитор BTK представляет собой ибрутиниб. В другом варианте осуществления ингибитор BTK представляет собой AVL-292.
[0753] В определенных вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемая форма и ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описаннйы в настоящем описании) или его фармацевтически приемлемая форма находятся в одной дозированной форме. В других вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемая форма и ингибитор BTK (например, ибрутиниб или AVL-292) или его фармацевтически приемлемая форма находятся в отдельных дозированных формах.
[0754] В определенных вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемую форму и ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании), вводят одним путем, например, оба из них вводят перорально. В других вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемую форму и ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании), вводят различными путями, например, один из них вводят перорально, а другой вводят внутривенно. В одном варианте осуществления соединение 292 вводят перорально один раз в сутки и ибрутиниб вводят перорально один раз в сутки. В одном варианте осуществления соединение 292 вводят перорально один раз в сутки и AVL-292 вводят перорально один раз в сутки.
[0755] В определенных вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемая форма и ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании) или его фармацевтически приемлемая форма являются единственными терапевтически активными ингредиентами композиций и способов, описанных в настоящем описании. В других вариантах осуществления композиции, описанные в настоящем описании содержат и в способах, описанных в настоящем описании, используется по меньшей мере один дополнительный терапевтически активный ингредиент. В одном варианте осуществления композиции, описанные в настоящем описании, содержат и в способах, описанных в настоящем описании, используется селективный ингибитор PI3K дельта (например, GS1101), двойной ингибитор рPI3K дельта/гамма и ингибитор BTK (например, ибрутиниб, или AVL-292, или другой ингибитор BTK, описанный в настоящем описании).
Комбинации ингибиторов PI3K и антител против CD20
[0756] В рамках настоящего изобретения предусматриваются фармацевтические композиции, содержащие терапевтически эффективное количество ингибитора PI3K или его фармацевтически приемлемой формы и антитела против CD20 или его фармацевтически приемлемой формы.
[0757] Также в рамках настоящего изобретения предусматриваются способы лечения, управления течением или предупреждения злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, включающие введение индивидууму терапевтически эффективного количества ингибитора PI3K или его фармацевтически приемлемой формы в комбинации с антителом против CD20 или его фармацевтически приемлемой формой.
[0758] Антитела против CD20, которые можно использовать в композициях и способах, описанных в настоящем описании, описаны в настоящем описании и других источниках литературы. В одном варианте осуществления антитело против CD20 представляет собой обинутузумаб (GA101). В другом варианте осуществления антитело против CD20 представляет собой ритуксимаб.
[0759] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество селективного ингибитора PI3K дельта или его или фармацевтически приемлемой формы и антитела против CD20 или его фармацевтически приемлемой формы. В одном варианте осуществления селективный ингибитор PI3K дельта представляет собой GS1101 (CAL-101). В одном варианте осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб, 131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб или офатумумаб, или их смесь. В одном варианте осуществления антитело против CD20 представляет собой обинутузумаб. В другом варианте осуществления антитело против CD20 представляет собой ритуксимаб. В одном варианте осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество GS1101 или его фармацевтически приемлемой формы и обинутузумаба или его фармацевтически приемлемой формы. В другом варианте осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество GS1101 или его фармацевтически приемлемой формы и ритуксимаба или его фармацевтически приемлемой формы.
[0760] В одном варианте осуществления композиций и способов, описанных в настоящем описании, молярное соотношение селективного ингибитора PI3K дельта (например, GS1101) или его фармацевтически приемлемой формы и антитела против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемой формы находится в диапазоне от приблизительно 500:1 до приблизительно 1:500, от приблизительно 400:1 до приблизительно 1:400, от приблизительно 300:1 до приблизительно 1:300, от приблизительно 200:1 до приблизительно 1:200, от приблизительно 100:1 до приблизительно 1:100, от приблизительно 75:1 до приблизительно 1:75, от приблизительно 50:1 до приблизительно 1:50, от приблизительно 40:1 до приблизительно 1:40, от приблизительно 30:1 до приблизительно 1:30, от приблизительно 20:1 до приблизительно 1:20, от приблизительно 10:1 до приблизительно 1:10 или от приблизительно 5:1 до приблизительно 1:5.
[0761] В одном варианте осуществления композиция содержит селективный ингибитор PI3K дельта (например GS1101) или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг, или от приблизительно 10 мг до приблизительно 20 мг.
[0762] В одном варианте осуществления композиция содержит селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму в количестве менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг.
[0763] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества селективного ингибитора PI3K дельта (например, GS1101) или его фармацевтически приемлемой формы в комбинации с антителом против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемой формой, где злокачественная опухоль представляет собой диффузную крупноклеточную B-клеточную лимфому (подобную активированным B-клеткам), диффузную крупноклеточную B-клеточную лимфому (подобную B-клеткам герминативного центра), фолликулярную лимфому, вялотекущую неходжкинскую лимфому, T-клеточную лимфому, лимфому из клеток мантийной зоны или множественную миелому.
[0764] В некоторых вариантах осуществления способов, описанных в настоящем описании, селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму и антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят в определенных дозировках. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества селективного ингибитора PI3K дельта (например, GS1101) или его фармацевтически приемлемой формы в комбинации с антителом против CD20 или его фармацевтически приемлемой формой, где селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 75 мг каждые сутки и антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 1100 мг каждые сутки.
[0765] В одном варианте осуществления селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг, или от приблизительно 10 мг до приблизительно 20 мг каждые сутки.
[0766] В одном варианте осуществления селективный ингибитор PI3K дельта (например, GS1101) или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг каждые сутки.
[0767] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество двойного ингибитора PI3K дельта/гамма или его фармацевтически приемлемой формы и антитела против CD20 или его фармацевтически приемлемой формы. В одном варианте осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб, 131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб, или офатумумаб или их смесь. В одном варианте осуществления антитело против CD20 представляет собой обинутузумаб. В другом варианте осуществления антитело против CD20 представляет собой ритуксимаб.
[0768] В одном варианте осуществления композиций и способов, описанных в настоящем описании, молярное соотношение двойного ингибитора PI3K дельта/гамма или его фармацевтически приемлемой формы и антитела против CD20 (например, обинутузумаб или ритуксимаб), или его фармацевтически приемлемой формы находится в диапазоне от приблизительно 500:1 до приблизительно 1:500, от приблизительно 400:1 до приблизительно 1:400, от приблизительно 300:1 до приблизительно 1:300, от приблизительно 200:1 до приблизительно 1:200, от приблизительно 100:1 до приблизительно 1:100, от приблизительно 75:1 до приблизительно 1:75, от приблизительно 50:1 до приблизительно 1:50, от приблизительно 40:1 до приблизительно 1:40, от приблизительно 30:1 до приблизительно 1:30, от приблизительно 20:1 до приблизительно 1:20, от приблизительно 10:1 до приблизительно 1:10, или от приблизительно 5:1 до приблизительно 1:5.
[0769] В одном варианте осуществления композиция содержит двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг или от приблизительно 10 мг до приблизительно 20 мг.
[0770] В одном варианте осуществления композиция содержит двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму в количестве менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг.
[0771] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества двойного ингибитора PI3K дельта/гамма или его фармацевтически приемлемой формы в комбинации с антителом против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемой формой, где злокачественная опухоль представляет собой диффузную крупноклеточную B-клеточную лимфому (подобную активированным B-клеткам), диффузную крупноклеточную B-клеточную лимфому (подобную B-клеткам герминативного центра), фолликулярную лимфому, T-клеточную лимфому, лимфому из клеток мантийной зоны или множественную миелому.
[0772] В некоторых вариантах осуществления способов, описанных в настоящем описании, двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму и антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят в определенных дозировках. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества двойного ингибитора PI3K дельта/гамма или его фармацевтически приемлемой формы в комбинации с антителом против CD20 или его фармацевтически приемлемой формой, где двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 75 мг каждые сутки и антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 1100 мг каждые сутки.
[0773] В одном варианте осуществления двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг или от приблизительно 10 мг до приблизительно 20 мг каждые сутки.
[0774] В одном варианте осуществления двойной ингибитор PI3K дельта/гамма или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг каждые сутки.
[0775] В одном варианте осуществления антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 10000 мг, от приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг, от приблизительно 900 мг до приблизительно 1000 мг. В одном варианте осуществления антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 1000 мг, менее чем приблизительно 800 мг, менее чем приблизительно 750 мг, менее чем приблизительно 500 мг, менее чем приблизительно 400 мг, менее чем приблизительно 350 мг, менее чем приблизительно 300 мг, менее чем приблизительно 250 мг, менее чем приблизительно 200 мг, менее чем приблизительно 150 мг, менее чем приблизительно 100 мг, менее чем приблизительно 75 мг, менее чем приблизительно 50 мг или менее чем приблизительно 25 мг.
[0776] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество соединения 292:

Соединение 292,
или его фармацевтически приемлемой формы и антитела против CD20 или его фармацевтически приемлемой формы. В одном варианте осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб,131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб или офатумумаб, или их смесь. В одном варианте осуществления антитело против CD20 представляет собой обинутузумаб. В другом варианте осуществления антитело против CD20 представляет собой ритуксимаб.
[0777] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли или гематологической злокачественной опухоли у индивидуума, включающий введение индивидууму терапевтически эффективного количества соединения 292:

Соединение 292,
или его фармацевтически приемлемой формы в комбинации с антителом против CD20 или его фармацевтически приемлемой формой. В одном варианте осуществления антитело против CD20 представляет собой ритуксимаб, обинутузумаб, тозитумомаб,131I тозитумомаб, 90Y ибритумомаб, 111I ибритумомаб или офатумумаб, или их смесь. В одном варианте осуществления антитело против CD20 представляет собой обинутузумаб. В другом варианте осуществления антитело против CD20 представляет собой ритуксимаб.
[0778] В некоторых вариантах осуществления композиций и способов, описанных в настоящем описании, соединение 292 или его фармацевтически приемлемую форму используют в комбинации с антителом против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемой формой в определенных молярных соотношениях. В одном варианте осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество соединения 292:
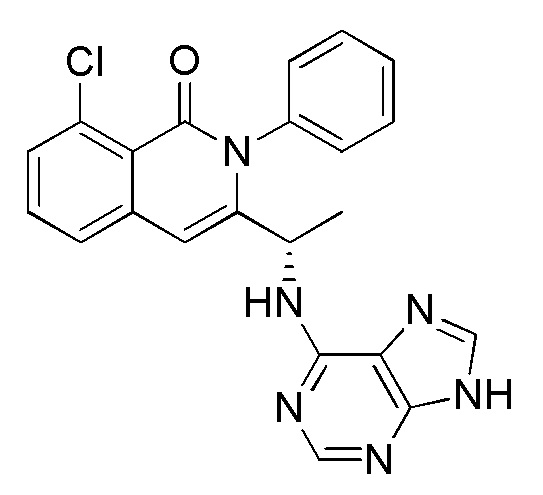
Соединение 292,
или его фармацевтически приемлемой формы и антитела против CD20 или его фармацевтически приемлемой формы, где молярное соотношение соединения 292 или его фармацевтически приемлемой формы и антитела против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемой формы находится в диапазоне от приблизительно 1000:1 до приблизительно 1:1000.
[0779] В одном варианте осуществления композиций и способов, описанных в настоящем описании, молярное соотношение соединения 292 или его фармацевтически приемлемой формы и антитела против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемой формы находится в диапазоне от приблизительно 500:1 до приблизительно 1:500, от приблизительно 400:1 до приблизительно 1:400, от приблизительно 300:1 до приблизительно 1:300, от приблизительно 200:1 до приблизительно 1:200, от приблизительно 100:1 до приблизительно 1:100, от приблизительно 75:1 до приблизительно 1:75, от приблизительно 50:1 до приблизительно 1:50, от приблизительно 40:1 до приблизительно 1:40, от приблизительно 30:1 до приблизительно 1:30, от приблизительно 20:1 до приблизительно 1:20, от приблизительно 10:1 до приблизительно 1:10, или от приблизительно 5:1 до приблизительно 1:5.
[0780] В некоторых вариантах осуществления композиций и способов, описанных в настоящем описании, композиция содержит соединение 292 или его фармацевтически приемлемую форму и антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму в определенных количествах. В одном варианте осуществления в рамках настоящего изобретения предусматривается фармацевтическая композиция, содержащая терапевтически эффективное количество соединения 292:
Соединение 292,
или его фармацевтически приемлемой формы и антитела против CD20 или его фармацевтически приемлемой формы, где композиция содержит соединение 292 или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,01 мг до приблизительно 75 мг и антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму в в количестве в диапазоне от приблизительно 0,01 мг до приблизительно 1100 мг.
[0781] В одном варианте осуществления композиция содержит соединение 292 или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг или от приблизительно 10 мг до приблизительно 20 мг. В одном варианте осуществления композиция содержит соединение 292 или его фармацевтически приемлемую форму в количестве менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг или менее чем приблизительно 10 мг. В одном варианте осуществления композиция содержит соединение 292 или его фармацевтически приемлемую форму в количестве приблизительно 50 мг, приблизительно 37,5 мг, приблизительно 25 мг, приблизительно 20 мг, приблизительно 15 мг, приблизительно 10 мг, приблизительно 5 мг или приблизительно 1 мг.
[0782] В одном варианте осуществления композиция содержит антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 800 мг, от приблизительно 0,1 мг до приблизительно 750 мг, от приблизительно 0,1 мг до приблизительно 600 мг, от приблизительно 1 мг до приблизительно 500 мг, от приблизительно 1 мг до приблизительно 400 мг, от приблизительно 10 мг до приблизительно 300 мг или от приблизительно 50 мг до приблизительно 250 мг. В одном варианте осуществления композиция содержит антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму в количестве менее чем приблизительно 1000 мг, менее чем приблизительно 800 мг, менее чем приблизительно 750 мг, менее чем приблизительно 500 мг, менее чем приблизительно 400 мг, менее чем приблизительно 350 мг, менее чем приблизительно 300 мг, менее чем приблизительно 250 мг, менее чем приблизительно 200 мг, менее чем приблизительно 150 мг, менее чем приблизительно 100 мг, менее чем приблизительно 75 мг, менее чем приблизительно 50 мг или менее чем приблизительно 25 мг.
[0783] В одном варианте осуществления композиция содержит антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую юформу в количестве в диапазоне от приблизительно 0,1 мг до приблизительно 10,000 мг, от приблизительно 0,1 мг до приблизительно 7500 мг, от приблизительно 0,1 мг до приблизительно 5000 мг, от приблизительно 1 мг до приблизительно 2500 мг, от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 10 мг до приблизительно 1000 мг, от приблизительно 500 мг до приблизительно 1000 мг, от приблизительно 750 мг до приблизительно 1000 мг, от приблизительно 800 мг до приблизительно 1000 мг, от приблизительно 900 мг до приблизительно 1000 мг.
[0784] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухоли или гематологической злокачественной опухли у индивидуума, вклчающий введение индивидууму терапевтически эффективного количества соединения 292 или его фармацевтически приемлемой формы в комбинации с антителом против CD20 или его фармацевтически приемлемой формой, где злокачественная опухоль представляет собой диффузную крупноклеточную B-клеточную лимфому (подобную активированным B-клеткам), диффузну крупноклеточную B-клеточную лимфому (подобную B-клеткам герминативного центра), фолликулярную лимфому, T-клеточную лимфому, лимфому из клеток мантийной зоны или множественную миелому. В одном варианте осуществления антитело против CD20 представляет собой обинутузумаб. В другом варианте осуществления антитело против CD20 представляет собой ритуксимаб.
[0785] В некоторых вариантах осуществления способов, описанных в настоящем описании, соединение 292 или его фармацевтически приемлемую форму и антитело против CD20 (например, обинутузумаб или ритуксимаб), или его фармацевтически приемлемую форму вводят в определенных дозировках. В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения, управления течением или предупреждения злокачественной опухолью у индивидуума, включающий введение индивидууму терапевтически эффективного количества соединения 292:
Соединение 292,
или его фармацевтически приемлемой формы в комбинации с антителом против CD20 или его фармацевтически приемлемой формой, где соединение 292 или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 75 мг каждые сутки и антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,01 мг до приблизительно 1100 мг каждые сутки.
[0786] В одном варианте осуществления соединение 292 или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 75 мг, от приблизительно 1 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 75 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 25 мг, или от приблизительно 10 мг до приблизительно 20 мг каждые сутки. В одном варианте осуществления соединение 292 или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 25 мг, менее чем приблизительно 20 мг, менее чем приблизительно 19 мг, менее чем приблизительно 18 мг, менее чем приблизительно 17 мг, менее чем приблизительно 16 мг, менее чем приблизительно 16 мг, менее чем приблизительно 15 мг, менее чем приблизительно 14 мг, менее чем приблизительно 13 мг, менее чем приблизительно 12 мг, менее чем приблизительно 11 мг, или менее чем приблизительно 10 мг каждые сутки. В одном варианте осуществления соединение 292 или его фармацевтически приемлемую форму вводят в дозировке приблизительно 50 мг, приблизительно 37,5 мг, приблизительно 25 мг, приблизительно 20 мг, приблизительно 15 мг, приблизительно 10 мг, приблизительно 5 мг, или приблизительно 1 мг каждые сутки.
[0787] В одном варианте осуществления антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят в дозировке в диапазоне от приблизительно 0,1 мг до приблизительно 1500 мг, от приблизительно 0,1 мг до приблизительно 1000 мг, от приблизительно 0,1 мг до приблизительно 800 мг, от приблизительно 0,1 мг до приблизительно 750 мг, от приблизительно 0,1 мг до приблизительно 600 мг, от приблизительно 1 мг до приблизительно 500 мг, от приблизительно 1 мг до приблизительно 400 мг, от приблизительно 10 мг до приблизительно 300 мг, или от приблизительно 50 мг до приблизительно 250 мг каждые сутки. В одном варианте осуществления антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят в дозировке менее чем приблизительно 1500 мг, менее чем приблизительно 1000 мг, менее чем приблизительно 800 мг, менее чем приблизительно 750 мг, менее чем приблизительно 500 мг, менее чем приблизительно 400 мг, менее чем приблизительно 350 мг, менее чем приблизительно 300 мг, менее чем приблизительно 250 мг, менее чем приблизительно 200 мг, менее чем приблизительно 150 мг, менее чем приблизительно 100 мг, менее чем приблизительно 75 мг, менее чем приблизительно 50 мг, или менее чем приблизительно 25 мг каждые сутки.
[0788] В одном варианте осуществления антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят индивидууму по меньшей мере за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделюл, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель до введения ингибитора PI3K (например, соединение 292) или его фармацевтически приемлемой формы. В другом варианте осуществления антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят одновременно с ингибитором PI3K (например, соединение 292) или его фармацевтически приемлемой формой в одной дозированной форме или в отдельных дозированных формах. В другом варианте осуществления антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемую форму вводят индивидууму по меньшей мере через 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель, 12 недель или 16 недель после введения ингибитора PI3K (например, соединение 292) или его фармацевтически приемлемой формы. В одном варианте осуществления антитело против CD20 представляет собой обинутузумаб. В другом варианте осуществления антитело против CD20 представляет собой ритуксимаб.
[0789] В определенных вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемая форма и антитело против CD20 (например, обинутузумаб или ритуксимаб), или его фармацевтически приемлемая форма находятся в одной дозированной форме. В других вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемая форма и антитело против CD20 (например, обинутузумаб или ритуксимаб) или его фармацевтически приемлемая форма находятся в отдельных дозированных формах.
[0790] В определенных вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемую форму и антитело против CD20 (например, обинутузумаб или ритуксимаб) вводят одним и тем же путем. В других вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемую форму и антитело против CD20 (например, обинутузумаб или ритуксимаб) вводят различными путями, например, один из них вводят перорально, а другой вводят внутривенно. В одном варианте осуществления соединение 292 вводят перорально один раз в сутки и обинутузумаб вводят внутривенно. В одном варианте осуществления соединение 292 вводят перорально один раз в сутки и ритуксимаб вводят внутривенно.
[0791] В определенных вариантах осуществления ингибитор PI3K (например, соединение 292) или его фармацевтически приемлемая форма и антитело против CD20 (например, обинутузумаб или ритуксимаб), или его фармацевтически приемлемая форма являются единственными терапевтически активными ингредиентами композиций и способов, описанных в настоящем описании. В других вариантах осуществления композиции, описанные в настоящем описании, содержат и в способах, описанных в настоящем описании, используется по меньшей мере один дополнительный терапевтически активный ингредиент. В одном варианте осуществления композиции, описанные в настоящем описании, содержат и в способах, описанных в настоящем описании, используется селективный ингибитор PI3K дельта (например, GS1101), двойной ингибитор PI3K дельта/гамма и антитело против CD20 (например, обинутузумаб или ритуксимаб).
Биомаркеры и способы скрининга
[0792] В одном варианте осуществления в рамках настоящего изобретения предусматривается биомаркер (например, диагностический биомаркер, предсказывающий биомаркер или прогностический биомаркер) для применения в способе, описанном в настоящем описании, или для применения для лечения или предупреждения злокачественной опухоли или заболевания, описанного в настоящем описании (например, гематологическая злокачественная опухоль). В одном варианте осуществления биомаркер, описанный в настоящем описании, включает, но не ограничиваются ими: биомаркер мишени, биомаркер каскада передачи сигнала, биомаркер мутации белка, биомаркер экспрессии белка, биомаркер мутации гена, биомаркер числа копий ДНК, биомаркер экспрессии гена, биомаркер цитокина, биомаркер хемокина, биомаркер матриксной металлопротеиназы или биомаркер конкретных злокачественных клеток. В одном варианте осуществления биомаркер можно использовать для оценки прогноза и/или чувствительности к средству для лечения конкретного типа злокачественной опухоли или заболевания, или у конкретного пациента и или в группе пациентов.
[0793] В одном варианте осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер мишени, например, такой как биомаркер для определения экспрессии белка и/или РНК одной или нескольких конкретных изоформ PI3K; например биомаркер экспрессии PI3K-α, экспрессии PI3K-β, экспрессии PI3K-δ или экспрессии PI3K-γ, или их комбинации. В других вариантах осуществления биомаркер мишени представляет собой изменение ДНК одной или нескольких конкретных изоформ PI3K (например, мутация, изменение числа копий или эпигенетическая модификация). В одном варианте осуществления биомаркер вовлекает IHC конкретного белка-мишени. В одном варианте осуществления биомаркер вовлекает РНК (например, мРНК) (например, ISH мРНК) конкретного белка-мишени. В одном варианте осуществления биомаркер вовлекает ДНК конкретного белка-мишени, включая генетическое изменение, такое как соматическая мутация, изменения числа копий, такие как амплификация или делеция, и хромосомную транслокацию, а также эпигенетическое изменение, такое как метилирование и модификация гистонов. В одном варианте осуществления биомаркер вовлекает микроРНК, которая регулирует экспрессию конкретного белка-мишени.
[0794] В одном варианте осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер каскада передачи сигнала, например, такой как биомаркер каскада PTEN и/или биомаркер активации каскада передачи сигнала, такой как pAKT, pS6 и/или pPRAS40 (например, биомаркер IHC, биомаркер изменения ДНК, биомаркер делеции ДНК, биомаркер числа копий ДНК или биомаркер мутации ДНК). В одном варианте осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер мутации, такой как биомаркер мутации белка или биомаркер мутации гена, для оценки мутации одной или нескольких мишеней, например, таких как CXCR4, IGH7, KRAS, NRAS, A20, CARD11, CD79B, TP53, CARD11, MYD88, GNA13, MEF2B, TNFRSF14, MLL2, BTG1, EZH2, NOTCH1, JAK1, JAK2, PTEN, FBW7, PHF6, IDH1, IDH2, TET2, FLT3, KIT, NPM1, CEBPA, DNMT3A, BAALC, RUNX1, ASXL1, IRF8, POU2F2, WIF1, ARID1A, MEF2B, TNFAIP3, PIK3R1, MTOR, PIK3CA, PI3Kδ и/или PI3Kγ. В одном варианте осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер экспрессии, такой как биомаркер экспрессии белка, биомаркер экспрессии гена, для оценки экспрессии одной или нескольких мишеней, или активации или подавления каскада, например, такой как биомаркер pERK IHC или биомаркер экспрессии pERK, например, для оценки активации каскада RAS или PI3K.
[0795] В одном варианте осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер цитокина, включая, но не ограничиваясь ими, IL-2, IL-4, IL-7, IL-9, IL-10, IL-12 (p40), IL-15, IL-16, IL-21, TNFα и TGFα. В одном варианте осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер хемокина, включая, но не ограничиваясь ими, CCL1, CXCL10, CXCL12, CXCL13, CCL2 и CCL3. В одном варианте осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер сывороточного цитокина. В одном варианте осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер сывороточного хемокина. В одном варианте осуществления биомаркер, описанный в настоящем описании, относится к профилям экспрессии генов одного или нескольких цитокинов, рецепторов цитокинов, хемокинов и/или рецепторов хемокинов. В одном варианте осуществления биомаркер, описанный в настоящем описании, по меньшей мере один, по меньшей мере два или по меньшей мере три из CXCL13, CCL3, CCL4, CCL17, CCL22, IL-2, IFN-γ, GM-CSF или TNF-α, или их комбинации. В другом варианте осуществления биомаркер, описанный в настоящем описании, представляет собой матриксные металлопротеиназы. В одном варианте осуществления матриксная металлопротеиназа представляет собой MMP-9. В другом варианте осуществления матриксная металлопротеиназа представляет собой MMP-12. В другом варианте осуществления биомаркер представляет собой CCL3 и/или CCL4.
[0796] В одном варианте осуществления биомаркеры, описанные в настоящем описании, можно использовать для идентификации, диагностики, прогнозирования эффективности, прогнозирования долговременного клинического исхода, предсказания прогноза и/или выбора пациентов для лечения, описанного в настоящем описании. В одном варианте осуществления биомаркеры, описанные в настоящем описании, можно использовать для подгрупп пациентов с различными прогностическими факторами, например, такими как стадии Rai, β2-микроглобулин, разнообразные цитогенетические факторы, включая трисомию 12, del13q, мутации и делеции 17p, PTEN и 11q, статус ZAP-70, статус CD38, статус CD49d и/или мутации в гене IgHV. В одном варианте осуществления биомаркер представляет собой делецию 11q. В другом варианте осуществления биомаркер представляет собой делецию PTEN и/или сниженную экспрессию PTEN. В другом варианте осуществления биомаркер представляет собой делецию 17p. В некоторых вариантах осуществления описан способ определения чувствительности индивидуума к лечению, включающий обнаружение присутствия биомаркера в образце от индивидуума. В некоторых вариантах осуществления присутствие одного или нескольких из стадий Rai, β2-микроглобулина, разнообразных цитогенетических факторов, включая трисомию 12, del13q, мутации или делеции 17p, PTEN и 11q, статус ZAP-70, статус CD38, статус CD49d и/или мутацию в гене IgHV, указывает на то, что индивидуум имеет увеличенную чувствительность к лечению ингибитором PI3K. В некоторых вариантах осуществления присутствие делеции 11q указывает на то, что индивидуум имеет увеличенную чувствительность к лечению ингибитором PI3K. В некоторых вариантах осуществления присутствие делеции 17p указывает на то, что индивидуум имеет увеличенную чувствительность к лечению ингибитором PI3K. В некоторых вариантах осуществления присутствие делеции PTEN и/или сниженная экспрессия PTEN указывает на то, что индивидуум имеет увеличенную чувствительность к лечению ингибитором PI3K. В некоторых вариантах осуществления присутствие pS6 указывает на то, что индивидуум имеет сниженную чувствительность к лечению ингибитором PI3K. В некоторых вариантах осуществления способ дополнительно включает введение ингибитора PI3K индивидууму, идентифицированному как имеющего увеличенную чувствительность к лечению. В некоторых вариантах осуществления ингибитор PI3K представляет собой соединение 292. В некоторых вариантах осуществления способ дополнительно включает использование информации для стратификации индивидуумов, которые имеют увеличенную вероятность ответа на лечение, относительно индивидуумов со сниженной вероятностью ответа на лечение.
[0797] В одном варианте осуществления описан способ прогнозирования вероятности того, что индивидуум будет отвечать на способ лечения злокачественной опухоли, включающий введение ингибитора PI3K (например, соединение 292), причем указанный способ включает: (a) измерение уровня экспрессии биомаркера в биологическом образце злокачественной опухоли от указанного индивидуума; (b) определение присутствия или уровня указанного биомаркера в указанном образце злокачественной опухоли относительно заданного уровня указанного биомаркера, (c) классификацию указанного индивидуума как имеющего увеличенную или сниженную вероятность терапевтического ответа на указанный способ лечения злокачественной опухоли, если указанный пациент имеет биомаркер, и (d) введение указанному пациенту, классифицированному как имеющего увеличенную вероятность ответа, ингибитора PI3K. Например, обнаружение одного или нескольких из стадий Rai, β2-микроглобулина, разнообразных цитогенетических факторов, включая трисомию 12, del13q, мутации или делеции 17p, PTEN и 11q, статус ZAP-70, статус CD38, статус CD49d и/или мутации в гене IgHV, можно классифицировать как наличие увеличенной вероятности ответа. Например, обнаружение одного или нескольких pS6 можно классифицировать как наличие сниженной вероятности ответа. В одном варианте осуществления обнаружение делеции 11q можно классифицировать как наличие увеличенной вероятности ответа. В другом варианте осуществления обнаружение делеции 17p можно классифицировать как наличие увеличенной вероятности ответа. В другом варианте осуществления обнаружение делеции PTEN и/или сниженную экспрессию PTEN можно классифицировать как увеличенную вероятность ответа. В одном варианте осуществления ингибитор PI3K вводят в заданной дозировке в течение заданного периода времени.
[0798] В некоторых вариантах осуществления после начала лечения у пациентов с увеличенной вероятностью ответа (например, пациенты, идентифицированные на основе обнаружения), также можно проводить мониторинг фактической эффективности лечения путем оценки модулирования второго набора биомаркеров, таких как pAKT, c-MYC, NOTCH1, CXCL13, CCL3, CCL4, IL-10, TNFα, IL-12p40, IL-16, MMP-9, CCL17, CCL22, CCL1, CXCL10, MMP-12 и их комбинации.
[0799] В одном конкретном варианте осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности соединения, описанного в настоящем описании (например, соединение 292) у пациента со злокачественной опухолью, имеющего делецию 11q: (a) получение первого биологического образца от пациента; (b) определение уровня биомаркера в первом биологическом образце, где биомаркер представляет собой по меньшей мере один, по меньшей мере два или по меньшей мере три из pAKT, c-MYC, NOTCH1, CXCL13, CCL3, CCL4, IL-10, TNFα, IL-12p40, IL-16, MMP-9, CCL17, CCL22, CCL1, CXCL10, MMP-12 или их комбинацию; (c) введение пациенту терапевтического соединения; (d) получение после этого второго биологического образца от пациента; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где пациент является отвечающим на лечение, если уровень биомаркера во втором биологическом образце пациента снижен по сравнению с уровнем биомаркера в первом биологическом образце пациента. В одном варианте осуществления злокачественная опухоль представляет собой гематологическую злокачественную опухоль. В одном варианте осуществления злокачественная опухоль представляет собой лимфому или лейкоз. В другом варианте осуществления злокачественная опухоль представляет собой T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль представляет собой NHL. В другом варианте осуществления злокачественная опухоль представляет собой iNHL. В другом варианте осуществления злокачественная опухоль представляет собой CTCL. В другом варианте осуществления злокачественная опухоль представляет собой CLL. В другом варианте осуществления злокачественная опухоль представляет собой SLL. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения отвечающему пациенту в заданной дозировке в течение заданного периода времени.
[0800] В другом конкретном варианте осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности соединения, описанного в настоящем описании (например, соединение 292) у пациента со злокачественной опухолью, имеющего делецию 17p, включающий: (a) получение первого биологического образца от пациента; (b) определение уровня биомаркера в первом биологическом образце, где биомаркер представляет собой по меньшей мере один, по меньшей мере два или по меньшей мере три из pAKT, c-MYC, NOTCH1, CXCL13, CCL3, CCL4, IL-10, TNFα, IL-12p40, IL-16, MMP-9, CCL17, CCL22, CCL1, CXCL10, MMP-12 или их комбинацию; (c) введение пациенту терапевтического соединения; (d) получение после этого второго биологического образца от пациента; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где пациент является отвечающим на лечение, если уровень биомаркера во втором биологическом образце пациента снижен по сравнению с уровнем биомаркера в первом биологическом образце пациента. В одном варианте осуществления злокачественная опухоль представляет собой гематологическую злокачественную опухоль. В одном варианте осуществления злокачественная опухоль представляет собой a лимфому или лейкоз. В другом варианте осуществления злокачественная опухоль представляет собой T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль представляет собой NHL. В другом варианте осуществления злокачественная опухоль представляет собой iNHL. В другом варианте осуществления злокачественная опухоль представляет собой CTCL. В другом варианте осуществления злокачественная опухоль представляет собой CLL. В другом варианте осуществления злокачественная опухоль представляет собой SLL. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения отвечающему пациенту в заданной дозировке в течение заданного периода времени.
[0801] В другом конкретном варианте осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности соединения, описанного в настоящем описании (например, соединение 292), у пациента со злокачественной опухолью, имеющего делецию PTEN и/или сниженную экспрессию PTEN, включающий: (a) получение первого биологического образца от пациента; (b) определение уровня биомаркера в первом биологическом образце, где биомаркер представляет собой по меньшей мере один, по меньшей мере два или по меньшей мере три из pAKT, c-MYC, NOTCH1, CXCL13, CCL3, CCL4, IL-10, TNFα, IL-12p40, IL-16, MMP-9, CCL17, CCL22, CCL1, CXCL10, MMP-12 или их комбинацию; (c) введение пациенту терапевтического соединения; (d) получение после этого второго биологического образца от пациента; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где пациент является отвечающим на лечение, если уровень биомаркера во втором биологическом образце пациента снижен по сравнению с уровнем биомаркера в первом биологическом образце пациента. В одном варианте осуществления злокачественная опухоль представляет собой гематологическую злокачественную опухоль. В одном варианте осуществления злокачественная опухоль представляет собой лимфому или лейкоз. В другом варианте осуществления злокачественная опухоль представляет собой T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль представляет собой NHL. В другом варианте осуществления злокачественная опухоль представляет собой iNHL. В другом варианте осуществления злокачественная опухоль представляет собой CTCL. В другом варианте осуществления злокачественная опухоль представляет собой CLL. В другом варианте осуществления злокачественная опухоль представляет собой SLL. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения отвечающему пациенту в заданной дозировке в течение заданного периода времени.
[0802] В другом конкретном варианте осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности соединения, описанного в настоящем описании (например, соединение 292) у пациента со злокачественной опухолью, имеющего делецию 13q, включающий: (a) получение первого биологического образца от пациента; (b) определение уровня биомаркера в первом биологическом образце, где биомаркер представляет собой по меньшей мере один, по меньшей мере два или по меньшей мере три из pAKT, c-MYC, NOTCH1, CXCL13, CCL3, CCL4, IL-10, TNFα, IL-12p40, IL-16, MMP-9, CCL17, CCL22, CCL1, CXCL10, MMP-12 или их комбинацию; (c) введение пациенту терапевтического соединения; (d) получение после этого второго биологического образца от пациента; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где пациент является отвечающим на лечение, если уровень биомаркера во втором биологическом образце пациента снижен по сравнению с уровнем биомаркера в первом биологическом образце пациента. В одном варианте осуществления злокачественная опухоль представляет собой гематологическую злокачественную опухоль. В одном варианте осуществления злокачественная опухоль представляет собой лимфому или лейкоз. В другом варианте осуществления злокачественная опухоль представляет собой T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль представляет собой NHL. В другом варианте осуществления злокачественная опухоль представляет собой iNHL. В другом варианте осуществления злокачественная опухоль представляет собой CTCL. В другом варианте осуществления злокачественная опухоль представляет собой CLL. В другом варианте осуществления злокачественная опухоль представляет собой SLL. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения отвечающему пациенту в заданной дозировке в течение заданного периода времени.
[0803] В другом конкретном варианте осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности соединения, описанного в настоящем описании (например, соединение 292) у пациента со злокачественной опухолью, имеющего трисомию 12, включающий: (a) получение первого биологического образца от пациента; (b) определение уровня биомаркера в первом биологическом образце, где биомаркер представляет собой по меньшей мере один, по меньшей мере два или по меньшей мере три из pAKT, c-MYC, NOTCH1, CXCL13, CCL3, CCL4, IL-10, TNFα, IL-12p40, IL-16, MMP-9, CCL17, CCL22, CCL1, CXCL10, MMP-12 или их комбинацию; (c) введение пациенту терапевтического соединения; (d) получение после этого второго биологического образца от пациента; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где пациент является отвечающим на лечение, если уровень биомаркера во втором биологическом образце пациента снижен по сравнению с уровнем биомаркера в первом биологическом образце пациента. В одном варианте осуществления злокачественная опухоль представляет собой гематологическую злокачественную опухоль. В одном варианте осуществления злокачественная опухоль представляет собой a лимфому или лейкоз. В другом варианте осуществления злокачественная опухоль представляет собой T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль представляет собой NHL. В другом варианте осуществления злокачественная опухоль представляет собой iNHL. В другом варианте осуществления злокачественная опухоль представляет собой CTCL. В другом варианте осуществления злокачественная опухоль представляет собой CLL. В другом варианте осуществления злокачественная опухоль представляет собой SLL. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения отвечающему пациенту в заданной дозировке в течение заданного периода времени.
[0804] В другом конкретном варианте осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности соединения, описанного в настоящем описании (например, соединение 292) у пациента со злокачественной опухолью, имеющего мутацию в гене IgHV, включающий: (a) получение первого биологического образца от пациента; (b) определение уровня биомаркера в первом биологическом образце, где биомаркер представляет собой по меньшей мере один, по меньшей мере два или по меньшей мере три из pAKT, c-MYC, NOTCH1, CXCL13, CCL3, CCL4, IL-10, TNFα, IL-12p40, IL-16, MMP-9, CCL17, CCL22, CCL1, CXCL10, MMP-12 или их комбинацию; (c) введение пациенту терапевтического соединения; (d) получение после этого второго биологического образца от пациента; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где пациент является отвечающим на лечение, если уровень биомаркера во втором биологическом образце пациента снижен по сравнению с уровнем биомаркера в первом биологическом образце пациента. В одном варианте осуществления злокачественная опухоль представляет собой гематологическую злокачественную опухоль. В одном варианте осуществления злокачественная опухоль представляет собой лимфому или лейкоз. В другом варианте осуществления злокачественная опухоль представляет собой T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль представляет собой NHL. В другом варианте осуществления злокачественная опухоль представляет собой iNHL. В другом варианте осуществления злокачественная опухоль представляет собой CTCL. В другом варианте осуществления злокачественная опухоль представляет собой CLL. В другом варианте осуществления злокачественная опухоль представляет собой SLL. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения отвечающему пациенту в заданной дозировке в течение заданного периода времени.
[0805] В одном варианте осуществления биомаркер, описанный в настоящем описании, представляет собой биомаркер злокачественных клеток (например, конкретная линия злокачественных клеток, конкретный тип злокачественных клеток, конкретный профиль клеточного цикла).
[0806] В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, относится к профилю экспрессии генов у пациента или в группе пациентов, например, в качестве прогностического биомаркера для активации каскада PI3Kδ и/или PI3Kγ или в качестве прогностического биомаркера для ответа на лечение, описанное в настоящем описании. В иллюстративных вариантах осуществления биомаркер, описанный в настоящем описании, относится к классификатору экспрессии гена, например, в качестве прогностического биомаркера для экспрессии или активации PI3Kδ и/или PI3Kγ (например, дифференциальная экспрессия или активация в подтипах DLBCL: ABC, GCB, с окислительным фосфорилированием (Ox Phos), с B-клеточным рецептором/пролиферацией (BCR) или ответом хозяина (HR)).
[0807] В одном варианте осуществления в рамках настоящего изобретения предусматриваются способы для применения мРНК или белков в качестве биомаркеров для установления эффективности терапии, описанной в настоящем описании. В одном варианте осуществления уровни мРНК или белка можно использовать для определения того, вероятно ли, что конкретное средство будет успешным при лечении конкретной злокачественной опухоли или гематологической злокачественной опухоли.
[0808] Как используют в рамках изобретения и если нет иных указаний, биологический маркер или биомаркер представляет собой вещество, обнаружение которого указывает на конкретное биологическое состояние, например, присутствие злокачественной опухоли или гематологической злокачественной опухоли. В некоторых вариантах осуществления биомаркеры можно либо определять индивидуально, либо несколько биомаркеров можно измерять одновременно.
[0809] В некоторых вариантах осуществления биомаркер указывает на изменение уровня экспрессии мРНК, который может коррелировать с риском или прогрессированием заболевания или с чувствительностью заболевания к данному способу лечения. В некоторых вариантах осуществления биомаркер представляет собой нуклеиновую кислоту, такую как мРНК, микроРНК или кДНК.
[0810] В дополнительных вариантах осуществления биомаркер указывает на изменение уровня экспрессии полипептида или белка, которое может коррелировать с риском, чувствительностью к лечению или прогрессированием заболевания. В некоторых вариантах осуществления биомаркер может представлять собой полипептид или белок, или их фрагмент. Относительный уровень конкретных белков можно определять способами, известными в данной области. Например, можно использовать способы на основе антител, такие как иммуноблоттинг, твердофазный иммуноферментный анализ (ELISA) или другие способы.
[0811] В одном варианте осуществления способы, описанные в настоящем описании, охватывают способы скрининга или идентификации пациентов, имеющих злокачественную опухоль или гематологическую злокачественную опухоль, для лечения соединением, описанным в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф). В одном варианте осуществления способ включает получение биологического образца от индивидуума и измерение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где аномальный исходный уровень (например, более высокий или более низкий, чем уровень в контрольной группе) биомаркера указывает на более высокую вероятность того, что индивидуум имеет злокачественную опухоль или гематологическую злокачественную опухоль, которую можно лечить соединением, описанным в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф). В одном варианте осуществления способ необязательно включает выделение или очистку мРНК из биологического образца, амплификацию мРНК-транскриптов (например, способом ОТ-ПЦР). В одном варианте осуществления уровень биомаркера представляет собой уровень мРНК или белка. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему вероятность ответа на заданную дозировку в течение заданного периода времени.
[0812] В некоторых вариантах осуществления в рамках настоящего изобретения предусматриваются способы прогнозирования чувствительности к лечению соединением, описанным в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) у пациента, имеющего злокачественную опухоль или гематологическую злокачественную опухоль. Способ включает получение биологического образца от пациента и измерение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где аномальный исходный уровень (например, более высокий или более низкий, чем уровень в контрольной группе) биомаркера указывает на более высокую вероятность того, что пациент будет чувствительным к лечению соединением, описанным в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф). В одном варианте осуществления способ необязательно включает выделение или очистку мРНК из биологического образца, амплификацию мРНК-транскриптов (например, способом ОТ-ПЦР). В одном варианте осуществления уровень биомаркера представляет собой уровень мРНК или белка. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0813] В одном варианте осуществления в рамках настоящего изобретения предусматривается способ лечения или управления течением злокачественной опухоли или гематологической злокачественной опухоли у пациента, включающий: (i) получение биологического образца от пациента и измерение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце; и (ii) введение пациенту с аномальным исходным уровнем по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров (например, более высокий или более низкий уровень, чем в контрольной группе) терапевтически эффективного количества соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф). В одном варианте осуществления стадия (i) необязательно включает выделение или очистку мРНК из биологического образца, амплификцаию мРНК-транскриптов (например, способом ОТ-ПЦР). В одном варианте осуществления уровень биомаркера представляет собой уровень мРНК или белка. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени.
[0814] В другом варианте осуществления в рамках настоящего изобретения предусматривается способ мониторинга ответа на лечение соединением, описанным в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) у пациента, имеющего злокачественную опухоль или гематологическую злокачественную опухоль. В одном варианте осуществления способ включает получение биологического образца от пациента, измерение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, введение соединения, описанного в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) пациенту, получение после этого второго биологического образца от пациента, измерение уровня биомаркера(ов) во втором биологическом образце и сравнение двух уровней биомаркера, где измененный (например, увеличенный или сниженный) уровень биомаркера(ов) после введения указывает на вероятность эффективного ответа опухоли. В одном варианте осуществления сниженный уровень биомаркера после введения указывает на вероятность эффективного ответа. В другом варианте осуществления увеличенный уровень биомаркера после введения указывает на вероятность эффективного ответа опухоли. Уровень биомаркера может представлять собой, например, уровень мРНК или белка. Экспрессия в образце после введения может возрастать, например, приблизительно в 1,5X, 2,0X, 3X, 5X или более. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему вероятность эффективного ответа опухоли при заданной дозировке в течение заданного периода времени.
[0815] В другом варианте осуществления предусматривается способ мониторинга соблюдения пациентом протокола лечения лекарственным средством. В одном варианте осуществления способ включает получение биологического образца от пациента, измерение уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех биомаркеров в образце и определение того, увеличен ли или снижен ли уровень в образце у пациента по сравнению с уровнем в контрольном необработанном образце, где увеличенный или сниженный уровень указывает на соблюдение пациентом протокола лечения лекарственным средством. В одном варианте осуществления уровень по меньшей мере одного биомаркера является увеличенным. Подвергаемый мониторингу уровень биомаркера может представлять собой, например, уровень мРНК или уровень белка. Экспрессия в обработанном образце может возрастать, например, приблизительно в 1,5X, 2,0X, 3X, 5X или более. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту в заданной дозировке в течение заданного периода времени, исходя из соблюдения пациентом режима лечения.
[0816] Также можно использовать профиль экспрессии генов, характерный для конкретного типа злокачественной опухоли или гематологической злокачественной опухоли. Определение профиля экспрессии генов может включать анализ уровня (например, экспрессии) одного или нескольких генов, вовлеченных в злокачественную опухоль или гематологическую злокачественную опухоль.
[0817] Также можно оценивать профиль метилирования генов, характерный для конкретного типа злокачественной опухоли или гематологической злокачественной опухоли. Профиль метилирования генов может включать анализ уровня (например, экспрессии) одного или нескольких генов, вовлеченных в злокачественную опухоль или гематологическую злокачественную опухоль.
[0818] Для оценки индивидуума можно использовать любую комбинацию биомаркеров, описанных в настоящем описании.
[0819] В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии PI3K-δ. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии PI3K-γ. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии PI3K-β. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии PI3K-α.
[0820] В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии мРНК PI3K-δ. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии мРНК PI3K-γ. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии мРНК PI3K-β. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии мРНК PI3K-α. В некоторых вариантах осуществления уровень экспрессии мРНК изоформы PI3K определяют в образце цельной крови индивидуума. В одном варианте осуществления уровень экспрессии мРНК изоформы PI3K определяют способами, известными в данной области (например, экспрессия РНК).
[0821] В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии белка PI3K-δ. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии белка PI3K-γ. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии белка PI3K-β. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой уровень экспрессии белка PI3K-α.
[0822] В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой высокий уровень экспрессии, увеличенную амплификацию ДНК и/или выявление мутации гена PI3K-δ. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой высокий уровень экспрессии, увеличенную амплификацию ДНК и/или выявление мутации гена PI3K-γ. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой высокий уровень экспрессии, увеличенную амплификацию ДНК и/или выявление мутации гена PI3K-β. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой высокий уровень экспрессии, увеличенную амплификацию ДНК и/или выявление мутации гена PI3K-α.
[0823] В определенных вариантах осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой выявление нормального уровня экспрессии изоформы PI3K в определенных типах клеток. В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой выявление нормального уровня экспрессии PI3K-γ и/или PI3K-δ в нормальных иммунных клетках.
[0824] В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой SNP эмбрионального типа, для которого ранее было показано сцепление с чувствительностью к злокачественной опухоли или гематологической злокачественной опухоли.
[0825] В одном варианте осуществления биомаркер, используемый в способах, описанных в настоящем описании, представляет собой SNP эмбрионального типа, для которого ранее было показано сцепление с каскадами метаболизма или транспорта лекарственных средств (например, семейство CYP3A и/или другие ферменты, метаболизирующие лекарственное средство, которые ассоциированы с метаболизмом соединения, описанного в настоящем описании).
[0826] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ идентификации индивидуума, который, вероятно, является отвечающим на лечение злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли, терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер описан в настоящем описании (например, биомаркер изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); и (b) сравнение уровня биомаркера в биологическом образце с эталонным уровнем биомаркера; где индивидуум вероятно будет отвечать на лечение, если уровень биомаркера в биологическом образце индивидуума изменен (например, высокий или низкий) по сравнению с эталонным уровнем биомаркера. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему вероятность ответа при заданной дозировке в течение заданного периода времени.
[0827] В некоторых вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования вероятности того, что индивидуум будет отвечать терапевтически на способ лечения злокачественной опухоли, включающий введение ингибитора PI3K (например, соединение 292), причем указанный способ включает: (a) введение ингибитора PI3K, (b) измерение уровня экспрессии биомаркера в биологическом образце злокачественной опухоли от указанного индивидуума через 8 суток после введения указанного ингибитора PI3K; (c) определение уровня указанного биомаркера в указанном образце злокачественной опухоли относительно заданного уровня указанного биомаркера, (d) классификацию указанного индивидуума как имеющего увеличенную вероятность терапевтического ответа на указанный способ лечения злокачественной опухоли, если указанный пациент имеет сниженный уровень указанного биомаркера после введения указанного ингибитора PI3K, и (e) введение указанному пациенту, классифицированному как имеющего увеличенную вероятность ответа, ингибитора PI3K. Например, обнаружение снижение одного или нескольких из CXCL13, CCL3, CCL4, IL-10, TNFα, IL-12p40, MMP-9, CCL17, CCL22 и CCL1 после введения можно классифицировать как наличие увеличенной вероятности ответа на лечение у индивидуума с CLL. Например, обнаружение снижения одного или нескольких из CXCL13, MMP-9, TNFα, CCL22, CCL1, CCL17 и MMP-12 после введения можно классифицировать как наличие увеличенной вероятности ответа на лечение у индивидуума с iNHL. В одном варианте осуществления ингибитор PI3K вводят в заданной дозировке в течение заданного периода времени.
[0828] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ идентификации индивидуума, который, вероятно, является отвечающим на лечение злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли, терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); (b) определение уровня биомаркера в контрольном образце; и (c) сравнение уровня биомаркера в биологическом образце от индивидуума с уровнем биомаркера в контрольном образце; где индивидуум вероятно будет отвечать на лечение, если уровень биомаркера в биологическом образце индивидуума изменен (например, высокий или низкий) по сравнению с уровнем биомаркера в контрольном образце. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высоку вероятность ответа на заданную дозировку в течение заданного периода времени.
[0829] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ идентификации индивидуума, который вероятно будет отвечать на лечение злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли, терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня биомаркера в биологическом образце, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); и (c) сравнение уровня биомаркера в биологическом образце с эталонным уровнем биомаркера; где индивидуум вероятно будет отвечать на лечение, если уровень биомаркера в биологическом образце индивидуума изменен (например, высокий или низкий) по сравнению с эталонным уровнем биомаркера.
[0830] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ идентификации индивидуума, который вероятно будет отвечать на лечение злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли, терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); (c) определение уровня биомаркера в контрольном образце; и (d) сравнение уровня биомаркера в биологическом образце от индивидуума с уровнем биомаркера в контрольном образце; где индивидуум вероятно будет отвечать на лечение, если уровень биомаркера в биологическом образце индивидуума изменен (например, высокий или низкий) по сравнению с уровнем биомаркера в контрольном образце. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0831] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на лечение злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли, терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); и (b) сравнение уровня биомаркера в биологическом образце с эталонным уровнем биомаркера; где различие между уровнем биомаркера в биологическом образце от индивидуума и эталонным уровнем биомаркера (например, более высокий или более низкий) коррелирует со способностью индивидуума отвечать на лечение. В одном варианте осуществления способ дополнительно включает стадию введения соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0832] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на злокачественную опухоль или заболевание, например, гематологическую злокачественную опухоль, терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); (b) определение уровня биомаркера в контрольном образце; и (c) сравнение уровня биомаркера в биологическом образце от индивидуума с уровнем биомаркера в контрольном образце; где различие между уровнем биомаркера в биологическом образце от индивидуума и уровнем биомаркера в контрольном образце (например, более высокий или более низкий) коррелирует со способностью индивидуума отвечать на лечение. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0833] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на злокачественную опухоль или заболевание, например, гематологическую злокачественную опухоль, терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); и (c) сравнение уровня биомаркера в биологическом образце с эталонным уровнем биомаркера; где различие между уровнем биомаркера в биологическом образце от индивидуума и эталонным уровнем биомаркера (например, более высокий или более низкий) коррелирует со способностью индивидуума отвечать на лечение. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0834] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на злокачественную опухоль или заболевание, например, гематологическую злокачественную опухоль, терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); (c) определение уровня биомаркера в контрольном образце; и (d) сравнение уровня биомаркера в биологическом образце от индивидуума с уровнем биомаркера в контрольном образце; где различие между уровнем биомаркера в биологическом образце от индивидуума и уровнем биомаркера в контрольном образце (например, более высокий или более низкий) коррелирует со способностью индивидуума отвечать на лечение. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0835] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности лечения злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли у индивидуума, которого лечат терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение первого биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в первом биологическом образце, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); (c) введение терапевтического соединения индивидууму; (d) получение после этого второго биологического образца от индивидуума; (e) определение уровня биомаркера(ов) во втором биологическом образце; и (f) сравнение уровней биомаркера(ов) в первом и втором биологических образцах; где индивидуум является отвечающим на лечение, если уровень биомаркера во втором биологическом образце от индивидуума изменен (например, высокий или низкий) по сравнению с уровнем биомаркера в первом биологическом образце индивидуума. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0836] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга соблюдения пациентом режима лечения злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли, терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)); и (c) сравнение уровня биомаркера с уровнем биомаркера в контрольном образце от индивидуума; где изменение уровня биомаркера в биологическом образце по сравнению с уровнем биомаркера в контрольном образце (например, высокий или низкий) указывает на соблюдение индивидуумом режима лечения. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту в заданной терапевтической дозировке в течение заданного периода времени, исходя из соблюдения пациентом режима лечения.
[0837] В одном варианте осуществления для способов, описанных в настоящем описании, изменение уровня биомаркера, описанного в настоящем описании, в течение периода времени указывает на намеченный эффект, такой как, но не ограничиваясь ими, вероятность того, что индивидуум является отвечающим на лечение, способность индивидуума отвечать на лечение, эффективность лечения и соблюдение индивидуумом режима лечения злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли. В одном варианте осуществления изменение уровня биомаркера представляет собой снижение уровня биомаркера. В одном варианте осуществления изменение уровня биомаркера представляет собой снижение концентрации биомаркера в сыворотке. В одном варианте осуществления изменение уровня биомаркера представляет собой снижение концентрации биомаркера цитокина/хемокина в сыворотке. В одном варианте осуществления биомаркер цитокина/хемокина представляет собой CXCL13, CCL4, CCL17, CCL22 или TNF-α, или их комбинацию. В одном варианте осуществления изменение уровня биомаркера представляет собой снижение сывороточной концентрации матриксных металлопротеиназ. В одном варианте осуществления матриксная металлопротеиназа представляет собой MMP-9.
[0838] В одном варианте осуществления период времени составляет 180 суток, 90 суток, 50 суток, 40 суток, 35 суток, 30 суток, 28 суток, 24 суток, 20 суток, 16 суток, 14 суток, 12 суток, 8 суток, 4 суток, 3 суток, 2 суток, 1 сутки, 18 часов, 12 часов, 6 часов, 3 часа или 1 час после начального момента времени (например, введение соединения, описанного в настоящем описании, индивидууму). В одном варианте осуществления период времени составляет 28 суток после введения соединения, описанного в настоящем описании (например, соединение 292), индивидууму. В другом варианте осуществления период времени составляет 14 суток после введения соединения, описанного в настоящем описании (например, соединение 292) индивидууму. В другом варианте осуществления период времени составляет 8 суток после введения соединения, описанного в настоящем описании (например, соединение 292) индивидууму.
[0839] В одном варианте осуществления для способов, описанных в настоящем описании, снижение сывороточной концентрации CXCL13, CCL4, CCL17, CCL22, TNF-α или MMP-9, или их комбинации в течение 28 суток после введения соединения, описанного в настоящем описании (например, соединение 292) индивидууму, указывает на намеченный эффект, такой как, но не ограничиваясь ими, вероятность ответа индивидуума на лечение, способность индивидуума отвечать на лечение, эффективность лечения и соблюдение индивидуумом режима лечения злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли. В другом варианте осуществления для способов, описанных в настоящем описании, снижение сывороточной концентрации CXCL13, CCL4, CCL17, CCL22, TNF-α или MMP-9, или их комбинации в течение 8 суток после введения соединения, описанного в настоящем описании (например, соединение 292) индивидууму указывает на намеченный эффект, такой как, но не ограничиваясь ими, вероятность ответа индивидуума на лечение, способность индивидуума отвечать на лечение, эффективность лечения и соблюдение индивидуумом режима лечения злокачественной опухоли или заболевания, например, гематологической злокачественной опухоли.
[0840] В одном варианте осуществления злокачественная опухоль или заболевание представляет собой лейкоз или лимфому. В другом варианте осуществления злокачественная опухоль или заболевание представляет собой B-клеточную лимфому или T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль или заболевание представляет собой B-клеточную злокачественную опухоль, включая, но не ограничиваясь ими, новообразование из предшественников B-клеток (например, лимфобластный лейкоз/лимфома из предшественников B-клеток, и острый лимфобластный лейкоз из предшественников B-клеток), и зрелые (периферические) B-клеточные новообразования (например, B-клеточный хронический лимфоцитарный лейкоз/мелколимфоцитарная лимфома (SLL/CLL), B-клеточный пролимфоцитарный лейкоз, лимфоплазматическая лимфома (LPL), B-клеточная лимфома маргинальной зоны селезенки (с ворсинчатыми лимфоцитами/без них), волосатоклеточный лейкоз, плазмацитарная миелома/плазмацитома, B-клеточная лимфома внеузловой маргинальной зоны типа MALT (MALT), B-клеточная лимфома маргинальной зоны лимфатических узлов (с моноцитоидными B-клетками/без них) (MZL), фолликулярная лимфома (FL), лимфома из клеток мантийной зоны (MCL), диффузная крупноклеточная B-клеточная лимфома (DLBCL) или лимфома Беркитта/лейкоз клеток Беркитта (BL)). В другом варианте осуществления злокачественная опухоль или заболевание представляет собой новообразования T-клеток/NK-клеток, включая, но не ограничиваясь ими, новообразование предшественников T-клеток (например, лимфобластный лимфома/лейкоз предшественников T-клеток, и острый лимфобластный лейкоз предшественников T-клеток), и зрелые (периферические) T-клеточные новообразования (например, T-клеточный пролимфоцитарный лейкоз, T-клеточный крупногранулярный лимфоцитарный лейкоз, NK-клеточная лимфома/лейкоз (NKL), взрослая T-клеточная лимфома/лейкоз (положительные по HTLV-1), внеузловая NK/T-клеточаня лимфома назального типа, T-клеточная лимфома по типу энтеропатии, печеночно-селезеночная лимфома гамма-дельта T-клеток, подобная подкожному панникулиту T-клеточная лимфома, фунгоидный микоз/синдром Сезари, анапластическая крупноклеточная лимфома T-клеток/нулевых клеток первичного кожного типа, неуточненная периферическая T-клеточная лимфома (PTL), ангиоиммунобластная T-клеточная лимфома, или анапластическая крупноклеточная лимфома T-клеток/нулевых клеток первичного системного типа)). В другом варианте осуществления злокачественная опухоль или заболевание представляет собой неходжкинскую лимфому (NHL), включая, но не ограничиваясь ими, B-клеточную NHL (например, лимфома Беркитта, хронический лимфоцитарный лейкоз/мелколимфоцитарная лимфома (CLL/SLL), диффузная крупноклеточная B-клеточная лимфома, фолликулярная лимфома, иммунобластная крупноклеточная лимфома, лимфобластная лимфома предшественников B-клеток или лимфома из клеток мантийной зоны) и T-клеточную NHL (например, фунгоидный микоз, анапластическая крупноклеточная лимфома или лимфобластная лимфома предшественников T-клеток). NHL можно подразделить на агрессивный (быстрорастущий) и вялотекущий (медленнорастущий) (iNHL) типы.) и вялотекущий (медленно растущий) (iNHL) типы.
[0841] В одном варианте осуществления злокачественная опухоль или заболевание представляет собой iNHL, MCL или FL. В другом варианте осуществления злокачественная опухоль или заболевание представляет собой T-клеточную лимфому. В другом варианте осуществления злокачественная опухоль или заболевание представляет собой CLL или SLL.
[0842] В одном варианте осуществления злокачественная опухоль или заболевание представляет собой CLL или SLL, и биомаркер представляет собой CCL1, IL-10, CXCL13, CCL3, CCL4, CCL17, CCL22, TNFα, IL-12 (p40), CXCL10, MMP-9 или их комбинацию. В одном варианте осуществления злокачественная опухоль или заболевание представляет собой CLL или SLL, и биомаркер представляет собой CCL1, IL-10, CXCL13, CCL3, CCL4, CCL17, CCL22, TNFα, IL-12 (p40), CXCL10, MMP-9, или их комбинацию, дополнительно в комбинации с другими известными биомаркерами для CLL, такими как pAKT и Ki-67.
[0843] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ идентификации индивидуума, который вероятно будет отвечать на лечение CLL или SLL терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CCL1, IL-10, CXCL13, CCL3, CCL4, CCL17, CCL22, TNFα, IL-12 (p40), CXCL10, MMP-9 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где индивидуум вероятно будет отвечать на лечение, если уровень биомаркера в биологическом образце от индивидуума снижен по сравнению с эталонным или контрольным уровнем биомаркера. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа при заданной дозировке в течение заданного периода времени.
[0844] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на лечение CLL или SLL терапевтическим соединением, включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CCL1, IL-10, CXCL13, CCL3, CCL4, CCL17, CCL22, TNFα, IL-12 (p40), CXCL10, MMP-9 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где различие между уровнем биомаркера в биологическом образце от индивидуума и эталонным или контрольным уровнем биомаркера коррелирует со способностью индивидуума отвечать на лечение. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа при заданной дозировке в течение заданного периода времени.
[0845] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности лечения CLL или SLL у индивидуума, которого лечили терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение первого биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в первом биологическом образце, где биомаркер представляет собой CCL1, IL-10, CXCL13, CCL3, CCL4, CCL17, CCL22, TNFα, IL-12 (p40), CXCL10, MMP-9 или их комбинацию; (c) введение терапевтического соединения индивидууму; (d) получение после этого второго биологического образца от индивидуума; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где индивидуум является отвечающим на лечение, если уровень биомаркера во втором биологическом образце индивидуума снижен по сравнению с уровнем биомаркера в первом биологическом образце индивидуума. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0846] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга соблюдения индивидуумом режима лечения CLL или SLL терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где биомаркер представляет собой CCL1, IL-10, CXCL13, CCL3, CCL4, CCL17, CCL22, TNFα, IL-12 (p40), CXCL10, MMP-9 или их комбинацию; и (c) сравнение уровня биомаркера с уровнем биомаркера в контрольном образце от индивидуума; где снижение уровня биомаркера в биологическом образце по сравнению с уровнем биомаркера в контрольном образце указывает на соблюдение индивидуумом режима лечения. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту в заданной дозировке в течение заданного периода времени, исходя из соблюдения пациентом режима лечения.
[0847] В другом варианте осуществления злокачественная опухоль или заболевание представляет собой лимфому, и биомаркер представляет собой CXCL13, CCL17, MMP-9 или их комбинацию.
[0848] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ идентификации индивидуума, который вероятно будет отвечать на лечение лимфомы терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CXCL13, CCL17, MMP-9 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где индивидуум вероятно будет отвечать на лечение, если уровень биомаркера в биологическом образце индивидуума снижен по сравнению с эталонным или контрольным уровнем биомаркера. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0849] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на лечение лимфомы терапевтическим соединением, включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CXCL13, CCL17, MMP-9 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где различие между уровнем биомаркера в биологическом образце индивидуума и эталонным или контрольным уровнем биомаркера коррелирует со способностью индивидуума отвечать на лечение. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему вероятность ответа в заданной дозировке в течение заданного периода времени.
[0850] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности лечения лимфомы у индивидуума, которого лечили терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение первого биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в первом биологическом образце, где биомаркер представляет собой CXCL13, CCL17, MMP-9 или их комбинацию; (c) введение терапевтического соединения индивидууму; (d) получение после этого второго биологического образца от индивидуума; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где индивидуум является отвечающим на лечение, если уровень биомаркера во втором биологическом образце индивидуума снижен по сравнению с уровнем биомаркера в первом биологическом образце индивидуума. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа при заданной дозировке в течение заданного периода времени.
[0851] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга соблюдения индивидуумом режима лечения лимфомы терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где биомаркер представляет собой CXCL13, CCL17, MMP-9 или их комбинацию; и (c) сравнение уровня биомаркера с уровнем биомаркера в контрольном образце от индивидуума; где снижение уровня биомаркера в биологическом образце по сравнению с уровнем биомаркера в эталонном образце указывает на соблюдение индивидуумом режима лечения. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту в заданной дозировке в течение заданного периода времени, исходя из соблюдения пациентом режима лечения.
[0852] В другом варианте осуществления злокачественная опухоль или заболевание представляет собой iNHL и биомаркер представляет собой CCL1, CCL17, CCL22, CXCL13, IL-12 (p40), MMP-12, MMP-9, TNFα, IL-16 или их комбинацию.
[0853] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ идентификации индивидуума, который вероятно будет отвечать на лечение iNHL терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CCL1, CCL17, CCL22, CXCL13, IL-12 (p40), MMP-12, MMP-9, TNFα, IL-16 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где индивидуум вероятно будет отвечать на лечение, если уровень биомаркера в биологическом образце индивидуума снижен по сравнению с эталонным или контрольным уровнем биомаркера. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему вероятность ответа на заданную дозировку в течение заданного периода времени.
[0854] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на лечение iNHL терапевтическим соединением, включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CCL1, CCL17, CCL22, CXCL13, IL-12 (p40), MMP-12, MMP-9, TNFα, IL-16 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где различие между уровнем биомаркера в биологическом образце от индивидуума и эталонным или контрольным уровнем биомаркера коррелирует со способностью индивидуума отвечать на лечение. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа при заданной дозировке в течение заданного периода времени.
[0855] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности лечения iNHL у индивидуума, которого лечат терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение первого биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в первом биологическом образце, где биомаркер представляет собой CCL1, CCL17, CCL22, CXCL13, IL-12 (p40), MMP-12, MMP-9, TNFα, IL-16 или их комбинацию; (c) введение терапевтического соединения индивидууму; (d) получение после этого второго биологического образца от индивидуума; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где индивидуум является отвечающим на лечение, если уровень биомаркера во втором биологическом образце индивидуума снижен по сравнению с уровнем биомаркера в первом биологическом образце индивидуума. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0856] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга соблюдения индивидуумом режима лечения iNHL терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где биомаркер представляет собой CCL1, CCL17, CCL22, CXCL13, IL-12 (p40), MMP-12, MMP-9, TNFα, IL-16 или его комбинацию; и (c) сравнение уровня биомаркера с уровнем биомаркера в контрольном образце от индивидуума; где снижение уровня биомаркера в биологическом образце по сравнению с уровнем биомаркера в контрольном образце указывает на соблюдение индивидуумом режима лечения. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту в заданной дозировке в течение заданного периода времени, исходя из соблюдения пациентом режима лечения.
[0857] В одном варианте осуществления злокачественная опухоль или заболевание представляет собой MCL, и биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9 или их комбинацию.
[0858] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ идентификации индивидуума, который вероятно будет отвечать на лечение MCL терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где индивидуум вероятно будет отвечать на лечение, если уровень биомаркера в биологическом образце от индивидуума снижен по сравнению с эталонным или контрольным уровнем биомаркера. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа при заданной дозировке в течение заданного периода времени.
[0859] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на лечение MCL терапевтическим соединением, включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где различие между уровнем биомаркера в биологическом образце от индивидуума и эталонным или контрольным уровнем биомаркера коррелирует со способностью индивидуума отвечать на лечение. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа при заданной дозировке в течение заданного периода времени.
[0860] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности лечения MCL у индивидуума, которого лечили терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение первого биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в первом биологическом образце, где биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9 или их комбинацию; (c) введение терапевтического соединения индивидууму; (d) получение после этого второго биологического образца от индивидуума; (e) определение уровня биомаркера(ов) во втором биологическом образце; и (f) сравнение уровней биомаркера(ов) в первом и втором биологических образцах; где индивидуум является отвечающим на лечение, если уровень биомаркера во втором биологическом образце индивидуума снижен по сравнению с уровнем биомаркера в первом биологическом образце индивидуума. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа при заданной дозировке в течение заданного периода времени.
[0861] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга соблюдения индивидуумом режима лечения MCL терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9 или их комбинацию; и (c) сравнение уровня биомаркера с уровнем биомаркера в контрольном образце от индивидуума; где снижение уровня биомаркера в биологическом образце по сравнению с уровнем биомаркера в контрольном образце указывает на соблюдение индивидуумом режима лечения. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту в заданной дозировке в течение заданного периода времени, исходя из соблюдением пациентом режима лечения.
[0862] В другом варианте осуществления злокачественная опухоль или заболевание представляет собой T-клеточную лимфому (например, CTCL), и биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9, GM-CSF, IL-12 (p40), TNFα, TGFα, ERK (регулируемая внеклеточными сигналами киназа), PRAS40, pS6 или их комбинацию.
[0863] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ идентификации индивидуума, который вероятно будет отвечать на лечение T-клеточной лимфомы терапевтическим соединением (например, соединение, описанное в настоящем описании) включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9, GM-CSF, IL-12 (p40), TNFα, TGFα, an ERK, PRAS40, pS6 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где индивидуум вероятно будет отвечать на лечение, если уровень биомаркера в биологическом образце от индивидуума снижен по сравнению с эталонным или контрольным уровнем биомаркера. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа на заданную дозировку в течение заданного периода времени.
[0864] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на лечение T-клеточной лимфомы терапевтическим соединением, включающий: (a) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце от индивидуума, где биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9, GM-CSF, IL-12 (p40), TNFα, TGFα, ERK, PRAS40, pS6 или их комбинацию; и (b) сравнение уровня биомаркера в биологическом образце с эталонным или контрольным уровнем биомаркера; где различие между уровнем биомаркера в биологическом образце индивидуума и эталонным или контрольным уровнем биомаркера коррелирует со способностью индивидуума отвечать на лечение. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа при заданной дозировке в течение заданного периода времени.
[0865] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга эффективности лечения T-клеточной лимфомы у индивидуума, которого лечили терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение первого биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в первом биологическом образце, где биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9, GM-CSF, IL-12 (p40), TNFα, TGFα, ERK, PRAS40, pS6 или их комбинацию; (c) введение терапевтического соединения индивидууму; (d) получение после этого второго биологического образца от индивидуума; (e) определение уровня биомаркера во втором биологическом образце; и (f) сравнение уровней биомаркера в первом и втором биологических образцах; где индивидуум является отвечающим на лечение, если уровень биомаркера во втором биологическом образце индивидуума снижен по сравнению с уровнем биомаркера в первом биологическом образце индивидуума. В одном варианте осуществления терапевтическое соединение вводят в заданной дозировке в течение заданного периода времени. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту, имеющему более высокую вероятность ответа при заданной дозировке в течение заданного периода времени.
[0866] В конкретных вариантах осуществления в рамках настоящего изобретения предусматривается способ мониторинга соблюдения индивидуумом режима лечения T-клеточной лимфомы терапевтическим соединением (например, соединение, описанное в настоящем описании), включающий: (a) получение биологического образца от индивидуума; (b) определение уровня по меньшей мере одного, по меньшей мере двух или по меньшей мере трех биомаркеров в биологическом образце, где биомаркер представляет собой CCL17, CCL22, CXCL10, CXCL13, MMP-9, GM-CSF, IL-12 (p40), TNFα, TGFα, ERK, PRAS40, pS6 или их комбинацию; и (c) сравнение уровня биомаркера с уровнем биомаркера в контрольном образце от индивидуума; где снижение уровня биомаркера в биологическом образце по сравнению с уровнем биомаркера в контрольном образце указывает на соблюдение индивидуумом режима лечения. В одном варианте осуществления способ дополнительно включает стадию введения терапевтического соединения пациенту в заданной дозировке в течение заданного периода времени, исходя из соблюдения пациентом режима лечения.
[0867] Заданная дозировка и заданный период времени, используемые в способах, описанных в настоящем описании, в каждом случае независимо могут представлять собой любую терапевтическую дозировку и терапевтический период времени, описанные в настоящем описании или других источниках литературы. В одном варианте осуществления каждая заданная дозировка, независимо, составляет от приблизительно 0,005 до приблизительно 500 мг в сутки, от приблизительно 0,01 до приблизительно 250 мг в сутки, от приблизительно 0,01 до приблизительно 100 мг в сутки, от приблизительно 0,1 до приблизительно 100 мг в сутки, от приблизительно 0,5 до приблизительно 100 мг в сутки, от приблизительно 1 до приблизительно 100 мг в сутки, от приблизительно 0,01 до приблизительно 50 мг в сутки, от приблизительно 0,1 до приблизительно 50 мг в сутки, от приблизительно 0,5 до приблизительно 50 мг в сутки, от приблизительно 1 до приблизительно 50 мг в сутки, от приблизительно 2 до приблизительно 25 мг в сутки, или от приблизительно 5 до приблизительно 10 мг в сутки. В одном варианте осуществления each predetermined dosage is, независимо, приблизительно 0,1, приблизительно 0,2, приблизительно 0,5, приблизительно 1, приблизительно 2, приблизительно 5, приблизительно 10, приблизительно 15, приблизительно 20, приблизительно 25, приблизительно 30, приблизительно 35, приблизительно 40, приблизительно 45, приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 90, приблизительно 100 или приблизительно 150 мг в сутки. В одном варианте осуществления каждая заданная дозировка независимо находится в диапазоне от приблизительно 0,5 мг до приблизительно 100 мг в сутки, или от приблизительно 0,5 мг до приблизительно 50 мг в сутки, предпочтительно вводимых в качестве однократной дозы раз в сутки или разделенных доз на протяжении суток. В некоторых вариантах осуществления дозировка находится в диапазоне от приблизительно 1 мг до приблизительно 50 мг в сутки. В одном варианте осуществления каждая заданная дозировка независимо составляет от приблизительно 0,5 до приблизительно 25 мг в сутки. Конкретные дозы в сутки включают,1, 0,2, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 75, 100 или 150 мг в сутки. В одном варианте осуществления каждая заданная дозировка независимо составляет 0,5, 1, 2, 3, 4, 5, 10, 15, 20, 25, 50 или 100 мг в сутки. В одном варианте осуществления каждая заданная дозировка независимо составляет 0,5, 1, 2, 3, 4 или 5 мг в сутки. Дозу можно повышать до 15, 20, 25, 30, 35, 40, 45, 50, 75 или 100 мг/сутки. В одном варианте осуществления каждая заданная дозировка, независимо, составляет от приблизительно 0,001 до приблизительно 100 мг/кг/сутки, от приблизительно 0,01 до приблизительно 50 мг/кг/сутки, от приблизительно 0,01 до приблизительно 25 мг/кг/сутки, от приблизительно 0,01 до приблизительно 10 мг/кг/сутки, от приблизительно 0,01 до приблизительно 9 мг/кг/сутки, 0,01 до приблизительно 8 мг/кг/сутки, от приблизительно 0,01 до приблизительно 7 мг/кг/сутки, от приблизительно 0,01 до приблизительно 6 мг/кг/сутки, от приблизительно 0,01 до приблизительно 5 мг/кг/сутки, от приблизительно 0,01 до приблизительно 4 мг/кг/сутки, от приблизительно 0,01 до приблизительно 3 мг/кг/сутки, от приблизительно 0,01 до приблизительно 2 мг/кг/сутки, или от приблизительно 0,01 до приблизительно 1 мг/кг/сутки.
[0868] В некоторых вариантах осуществления каждый заданный период времени независимо составляет более чем приблизительно 6 суток, приблизительно 10 суток, приблизительно 14 суток, приблизительно 28 суток, приблизительно два месяца, приблизительно шесть месяцев или приблизительно один год. В некоторых случаях заданный период времени имеет такую продолжительность, которая необходима. В одном варианте осуществления каждый заданный период времени независимо составляет более чем приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 14, приблизительно 21 или приблизительно 28 суток. В одном варианте осуществления каждый заданный период времени независимо составляет менее чем приблизительно 28, приблизительно 21, приблизительно 14, приблизительно 7, приблизительно 6, приблизительно 5, приблизительно 4, приблизительно 3, приблизительно 2 или приблизительно 1 сутки. В одном варианте осуществления каждый заданный период времени независимо составляет приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 14, приблизительно 21, или приблизительно 28 суток.
[0869] В одном варианте осуществления изменение уровня биомаркера в течение периода времени определяют путем сравнения уровней биомаркера в начале периода времени и в конце периода времени. В одном варианте осуществления изменение уровня биомаркера в течение периода времени определяют путем сравнения уровней биомаркера в множество моментов времени в течение периода времени (включительно). В другом варианте осуществления изменение уровня биомаркера в течение периода времени включает одно или несколько изменений уровня биомаркера в течение периода времени. В другом варианте осуществления изменение уровня биомаркера в течение периода времени определяют путем сравнения уровня биомаркера с эталонным стандартным уровнем(ями).
[0870] В одном варианте осуществления способы, описанные в настоящем описании, дополнительно включают стадию корректирования дозы при лечении (например, лечение соединением 292), исходя из изменения уровня биомаркера в течение периода времени.
[0871] В одном варианте осуществления в рамках настоящего изобретения предусматривается зонд для определения уровня биомаркера в образце путем гибридизации с полинуклеотидом биомаркера, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α, или PI3K-β или их комбинация)). В определенных вариантах осуществления уровень биомаркера используют для выбора индивидуума для лечения терапевтическим соединением (например, соединение, описанное в настоящем описании); для прогнозирования или мониторинга способности индивидуума отвечать на лечение; или мониторинга соблюдения индивидуумом режима лечения. В определенных вариантах осуществления зонд представляет собой зонд, который гибридизуется с точкой сплайсинга полинуклеотида биомаркера. В конкретных вариантах осуществления зонд является специфическим для обнаружения или количественного определения изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация).
[0872] В одном варианте осуществления в рамках настоящего изобретения предусматривается зонд для определения уровня биомаркера в образце путем гибридизации с мРНК биомаркера, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)). В определенных вариантах осуществления уровень биомаркера используют для выбора индивидуума для лечения терапевтическим соединением (например, соединение, описанное в настоящем описании); для прогнозирования или мониторинга способности индивидуума отвечать на лечение; или мониторинга соблюдения индивидуумом режима лечения. В определенных вариантах осуществления зонд представляет собой зонд, который гибридизуется с точкой сплайсинга мРНК биомаркера. В конкретных вариантах осуществления зонд является специфическим для обнаружения или количественного определения изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация).
[0873] В одном варианте осуществления в рамках настоящего изобретения предусматривается антитело для определения уровня биомаркера в образце, где биомаркер описан в настоящем описании (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)). В определенных вариантах осуществления уровень биомаркера используют для выбора индивидуума для лечения терапевтическим соединением (например, соединение, описанное в настоящем описании); для прогнозирования или мониторинга способности индивидуума отвечать на лечение; или для мониторинга соблюдения индивидуумом режима лечения. В определенных вариантах осуществления антитело представляет собой антитело, которое связывается с точкой сплайсинга биомаркера (например, биомаркер для изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация)). В конкретных вариантах осуществления антитело является специфическим для обнаружения или количественного определения изоформы PI3K (например, PI3K-δ, PI3K-γ, PI3K-α или PI3K-β, или их комбинация).
[0874] В одном варианте осуществления уровни мРНК биомаркеров можно выявлять или количественно определять способом, известным в данной области. Иллюстративные способы обнаружения или количественного определения включают, но не ограничиваются ими, нозерн-блоттинг, анализы с защитой от рибонуклеазы и способы на основе ПЦР. Когда биомаркер представляет собой молекулу мРНК, последовательность мРНК или ее фрагмент можно использовать для получения зонда, который является по меньшей мере частично комплементарным. Затем зонд можно использовать для выявления последовательности мРНК в образце с использованием способа, известного в данной области, включая, но не ограничиваясь ими, способы на основе ПЦР, нозерн-блоттинг или анализ с помощью индикаторных полосок.
[0875] В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой нозерн-блоттинг, анализ с защитой от рибонуклеазы или способ на основе ПЦР. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой нозерн-блоттинг. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой способ с защитой от рибонуклеазы. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой способ на основе ПЦР. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой кОТ-ПЦР.
[0876] В одном варианте осуществления можно использовать любую подходящую аналитическую платформу для определения присутствия мРНК в образце. Например, анализ может иметь форму индикаторной полоски, мембраны, чипа, диска, тест-полоски, фильтра, микросферы, предметного стекла, многолуночного планшета или оптического волокна. Аналитическая система может иметь твердую подложку, с которой связана нуклеиновая кислота, соответствующая мРНК. Твердая подложка может содержать, например, пластмассу, кремния, металл, смолу, стекло, мембрану, частицу, преципитат, гель, полимер, лист, сферу, полисахарид, капилляр, пленку, планшет или предметное стекло. Компоненты анализа можно получать и упаковывать вместе в качестве набора для выявления мРНК.
[0877] мРНК может быть меченной, если желательно, для получения популяции меченых мРНК. Как правило, образец можно метить с использованием способов, которые известны в данной области (например, с использованием РНК-лигазы или терминальной трансферазы, или путем мечения основной цепи РНК). См. например, Ausubel et al., Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons 1995 и Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Edition, 2001 Cold Spring Harbor, N.Y. В определенных вариантах осуществления образец является меченным флуоресцентной меткой. Иллюстративные флуоресцентные красители включают, но не ограничиваются ими, ксантеновые красители, флуоресцеиновые красители, родаминовые красители, флуоресцеин изотиоцианат (FITC), 6-карбоксифлуоресцеин (FAM), 6-карбокси-2',4',7',4,7-гексахлорфлуоресцеин (HEX), 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин (JOE или J), N,N,N',N'-тетраметил-6-карбоксиродамин (TAMRA или T), 6-карбокси-X-родамин (ROX или R), 5-карбоксиродамин 6G (R6G5 или G5), 6-карбоксиродамин 6G (R6G6 или G6), родамин 110, цианиновые красители (например, красители Cy3, Cy5 и Cy7), красители Alexa (например, Alexa-fluor-555), кумарин, диэтиламинокумарин, умбеллиферон; бензимидные красители (например, Hoechst 33258), фенантридиновые красители (например, техасский красный), красители на основе этидия, акридиновые красители, карбазоловые красители, феноксазиновые красители, порфириновые красители, полиметиновые красители, красители BODIPY, хинолиновые красители, пирен, флуоресцеин хлортриазинил, R110, эозин, JOE, R6G, тетраметилродамин, лиссамин, ROX и нафтофлуоресцеин.
[0878] В определенных вариантах осуществления зонды на основе нуклеиновой кислоты могут присутствовать в конкретных имеющих адрес положениях на твердой подложке; каждое из которых соответствует по меньшей мере части последовательностей мРНК биомаркера.
[0879] В определенных вариантах осуществления анализ мРНК включает стадии 1) получения связанных с поверхностью зондов для одного или нескольких биомаркеров; 2) гибридизации популяции мРНК со связанными с поверхностью зондами в условиях, достаточных для обеспечения специфического связывания; 3) удаления нуклеиновых кислот, не связавшихся на стадии гибридизации; и 4) выявления гибридизованных мРНК.
[0880] Гибридизацию можно проводить в подходящих условиях гибридизации, жесткость которых можно варьировать, если желательно. Типичные условия являются достаточными для образования комплексов зонд/мишень на твердой подложке между комплементарными связывающимися представителями, т.е. между связанными с поверхностью зондами и комплементарными мРНК в образце.
[0881] В определенных вариантах осуществления используют жесткие условия гибридизации. Стандартные способы гибридизации (например, в условиях, достаточных для обеспечения специфического связывания с мРНК-мишенями в образце с зондами) описаны в Kallioniemi et al., Science 258:818-821 (1992) и WO 93/18186, содержание каждого из которых включено в настоящее описание в качестве ссылки в полном объеме. Несколько справочных материалов по общим способам доступно, например, в Tijssen, Hybridization with Nucleic Acid Probes, Parts I and II (Elsevier, Amsterdam 1993). For descriptions of techniques suitable for in situ hybridizations, see Gall et al. Meth. Enzymol., 21:470-480 (1981); и Angerer et al. in Genetic Engineering: Principles and Methods (Setlow and Hollaender, Eds.) Vol. 7, pages 43-65 (Plenum Press, New York 1985). Выбор подходящих условий, включая температуру, концентрацию соли, концентрацию полинуклеотида, время гибридизации и жесткость условий промывания, зависит от схемы эксперимента, включая источник образца, тип улавливающих средств, ожидаемую степень комплементарности и т.д.
[0882] После методики гибридизации мРНК связанные с поверхностью полинуклеотиды промывают для удаления не связавшихся нуклеиновых кислот. Промывание можно проводить с использованием любого удобного протокола промывания. В определенных вариантах осуществления условия промывания являются жесткими. Затем гибридизацию мРНК-мишеней с зондами выявляют с использованием стандартных способов.
[0883] В определенных вариантах осуществления уровень мРНК биомаркера определяют с использованием способа на основе ПЦР. Примеры анализов с использованием ПЦР могут быть найдены в патенте США № 6927024, содержание которого включено в настоящее описание в качестве ссылки в полном объеме. Примеры способов ОТ-ПЦР могут быть найдены в патенте США № 7122799, содержание которого включено в настоящее описание в качестве ссылки в полном объеме. Примеры способов флуоресцентной ПЦР in situ могут быть найдены в патенте США № 7186507, содержание которого включено в настоящем описании в качестве ссылки в полном объеме.
[0884] В определенных вариантах осуществления используют ПЦР в реальном времени с обратной транскрипцией (кОТ-ПЦР) как для обнаружения, так и для количественного определения мРНК (Bustin et al., Clin. Sci., 2005, 109, 365-379). Количественные результаты, получаемые с помощью кОТ-ПЦР, как правило, являются более информативными, чем качественные данные. Примеры способов на основе кОТ-ПЦР могут быть найдены в патенте США № 7101663, содержание которого включено в настоящем описании в качестве ссылки в полном объеме.
[0885] В противоположность обычному ПЦР с обратной транскрипцией и анализу с помощью агарозных гелей, ПЦР в реальном времени дает количественные результаты. Дополнительным преимуществом ПЦР в реальном времени является относительная простота и удобство использования. Устройства для ПЦР в реальном времени, такие как Applied Biosystems 7500, являются коммерчески доступными. Реагенты для ПЦР в реальном времени, такие как TaqMan Sequence Detection chemistry, также являются коммерчески доступными.
[0886] Для определения количества циклов, при котором флуоресцентный сигнал, ассоциированный с конкретным ампликоном, пересекает пороговое значение (обозначаемое как CT), данные можно анализировать, например, с использованием программного обеспечения 7500 Real-Time PCR System Sequence Detection software v1.3, с использованием сравнительного способа вычисления CT с относительным количественным определением. С использованием этого способа выходные данные выражают в качестве кратности изменения уровней экспрессии. В некоторых вариантах осуществления пороговый уровень можно выбирать путем автоматического определения с помощью программного обеспечения. В некоторых вариантах осуществления пороговый уровень устанавливают выше исходного уровня, но достаточно низко, чтобы он находился в пределах области экспоненциального роста кривой амплификации.
[0887] Уровни белковых биомаркеров, описанных в настоящем описании, можно выявлять или количественно определять любым способом, известным в данной области. В определенных вариантах осуществления используют способы на основе антител. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой иммуноблоттинг (вестерн-блоттинг), твердофазный иммуноферментный анализ (ELISA), иммуногистохимию, проточную цитометрию, цитометрическую гранульную матрицу или масс-спектроскопию.
[0888] В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой иммуноблоттинг (вестерн-блоттинг). В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой твердофазный иммуноферментный анализ (ELISA). В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой прямой ELISA. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой непрямой ELISA. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой сэндвич ELISA. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой иммуногистохимию. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой проточную цитометрию. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой цитометрическую гранульную матрицу. В определенных вариантах осуществления способ обнаружения или количественного определения представляет собой масс-спектроскопию.
[0889] Не ограничиваясь конкретной теорией, было выявлено, что пациенты, имеющие исходное абсолютное содержание лимфоцитов (ALC) более чем приблизительно 10x103/мкл, демонстрировали закономерность в отношении ALC после исходного уровня с течением времени, относительно пациентов, имеющих ALC менее 10x103/мкл. Например, закономерность показала, что пациенты с более высоким уровнем ALC проявляли быстрое появление клинической активности при CLL после введения соединения 292 в дозе 25 мг BID, и, таким образом, они с большей вероятностью будут отвечать на лечение.
[0890] Таким образом, в другом варианте осуществления в рамках настоящего изобретения предусматривается способ прогнозирования способности индивидуума отвечать на лечение злокачественной опухоли терапевтическим соединением, включающий: (1) получение образца крови от пациента; и (2) определение абсолютного количества лимфоцитов (ALC) в образце перед введением терапевтического соединения, где пациент, вероятно, будет отвечающим, если ALC превышает приблизительно 10x103/мкл. В одном варианте осуществления злокачественная опухоль представляет собой CLL или SLL. В другом варианте осуществления соединение представляет собой соединение 292. В других вариантах осуществления также в рамках настоящего изобретения предусматривается способ лечения злокачественной опухоли, включающий введение соединения, описанного в настоящем описании, пациенту, который идентифицирован как вероятно способный к ответу при определении на основе способа, описанного выше.
[0891] Не ограничиваясь конкретной теорией, было выявлено, что коктейль цитокинов, состоящий из CD40L, IL-2 и IL-10, может имитировать пролиферативные сигналы микроокружения и индуцировать передачу сигнала PI3K и пролиферацию в клетках CLL. Таким образом, такой коктейль может обеспечить ценный инструмент in vitro для исследования поведения злокачественной опухоли и скрининга соединений против злокачественной опухоли.
[0892] В некоторых вариантах осуществления в рамках настоящего изобретения предусматривается способ индукции передачи сигнала PI3K в злокачественной клетке in vitro, включающий контактирование злокачественной клетки с коктейлем цитокинов, состоящим из CD40L, IL-2 и IL-10. В других вариантах осуществления в рамках настоящего изобретения предусматривается способ индукции пролиферации злокачественной клетки in vitro, включающий контактирование злокачественной клетки с цитокиновым коктейлем, состоящим из CD40L, IL-2 и IL-10.
[0893] В некоторых вариантах осуществления в рамках настоящего изобретения предусматривается способ определения активности исследуемого соединения в отношении злокачественной опухоли, включающий: (a) контактирование злокачественной клетки с коктейлем цитокинов, состоящим из CD40L, IL-2 и IL-10; (b) определение степени передачи сигнала PI3K и/или клеточной пролиферации; (c) контактирование обработанной коктейлем цитокинов злокачественной опухоли с исследуемым соединением; и (d) определение передачи сигнала PI3K и/или клеточной пролиферации, где снижение передачи сигнала PI3K и/или пролиферации клеток, определенное на стадии (d) по сравнению с теми, которые определены на стадии (b), указывает на активность исследуемого соединения, направленную против злокачественной опухоли.
Наборы
[0894] Также в рамках настоящего изобретения предусматриваются наборы, пригодные для прогнозирования вероятности эффективного лечения злокачественной опухоли или гематологической злокачественной опухоли или для мониторинга эффективности лечения соединением, описанным в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф).
[0895] В одном варианте осуществления набор содержит твердую подложку и средство для обнаружения экспрессии белка по меньшей мере одного биомаркера в биологическом образце. В таком наборе может использоваться, например, индикаторная полоска, мембрана, чип, диск, тест-полоска, фильтр, микросфера, предметное стекло, многолуночный планшет или оптическое волокно. Твердая подложка набора может представлять собой, например, пластмассу, кремнийорганическое вещество, металл, смолу, стекло, мембрану, частицу, преципитат, гель, полимер, лист, сферу, полисахарид, капилляр, пленку, планшет или предметное стекло. Биологический образец может представлять собой, например, клеточную культуру, клеточную линию, ткань, ткань полости рта, желудочно-кишечную ткань, орган, органеллу, биологическую жидкость, образец крови, образец мочи или образец кожи. Биологический образец может представлять собой, например, биоптат лимфатического узла, биоптат костного мозга или образец опухолевых клеток периферической крови.
[0896] В одном варианте осуществления набор содержит твердую подложку, по меньшей мере одну нуклеиновую кислоту, контактирующую с подложкой, где нуклеиновые кислоты комплементарны по меньшей мере 20, 50, 100, 200, 350 или более основаниям мРНК биомаркера, и средство для обнаружения экаспрессии мРНК в биологическом образце.
[0897] В определенных вариантах осуществления в наборах, описанных в настоящем описании, используются средства для обнаружения экспрессии биомаркера с помощью количественной ПЦР в реальном времени (кОТ-ПЦР), микрочипа, проточной цитометрии или иммунофлуоресценции. В других вариантах осуществления экспрессию биомаркера измеряют с помощью технологий на основе ELISA или других сходных способов, известных в данной области.
[0898] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается набор для выявления уровней мРНК одного или нескольких биомаркеров. В определенных вариантах осуществления набор содержит один или несколько зондов, которые специфически связываются с мРНК одного или нескольких биомаркеров. В определенных вариантах осуществления набор дополнительно содержит промывочный раствор. В определенных вариантах осуществления набор дополнительно содержит реагенты для проведения гибридизационного анализа, средства для выделения или очистки мРНК, средства для обнаружения, а также положительные и отрицательные контроли. В определенных вариантах осуществления набор дополнительно содержит инструкцию по применению набора. Набор может быть адаптирован для домашнего применения, клинического применения или применения в научных целях.
[0899] В определенных вариантах осуществления в рамках настоящего изобретения предусматривается набор для выявления уровня белка одного или нескольких биомаркеров. В определенных вариантах осуществления наборы содержат индикаторную полоску, покрытую антителом, которое распознает белковый биомаркер, промывочные растворы, реагенты для проведения анализа, средства для выделения или очистки белка, средства для обнаружения, а также положительные и отрицательные контроли. В определенных вариантах осуществления набор дополнительно содержит инструкцию по применению набора. Набор может быть адаптирован для домашнего применения, клинического применения или применения в научных целях.
[0900] В таком наборе может использоваться, например, индикаторная полоска, мембрана, чип, диск, тест-полоска, фильтр, микросфера, предметное стекло, многолуночный планшет или оптическое волокно. Твердая подложка набора может представлять собой, например, пластмассу, кремнийорганическое вещество, металл, смолу, стекло, мембрану, частицу, преципитат, гель, полимер, лист, сферу, полисахарид, капилляр, пленку, планшет или предметное стекло. Биологический образец может представлять собой, например, клеточную культуру, клеточную линию, ткань, ткань полости рта, желудочно-кишечную ткань, орган, органеллу, биологическую жидкость, образец крови, образец мочи или образец кожи.
[0901] Также в рамках настоящего изобретения предусматривается наборы для дозирования. Наборы включают соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или a его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф), или его композицию, в подходящей упаковке и письменный материал. Письменный материал может включать любую из следующей информации: инструкции по применению, обсуждение клинических испытаний, список побочных эффектов, ссылки на научную литературу, материалы вкладышей в упаковку, результаты клинических испытаний и/или их обобщение и т.п. В письменном материале могут быть указаны или установлены виды активности и/или преимущества композиции, и/или описаны дозирование, введение, побочные эффекты, взаимодействия с лекарственными средствами или другая информация, полезная для лица, осуществляющего уход за здоровьем. Такая информация может быть основана на результатах различных исследований, например, исследований с использованием экспериментальных животных, вовлекающих модели in vivo, и/или исследований на основе клинических испытаний у людей. Кроме того, набор может содержать другое терапевтическое средство (например, другое вещество) и/или письменный материал, такой как описано выше, который служит для предоставления информации, касающейся другой терапии (например, другого средства). В некоторых вариантах осуществления соединение, описанное в настоящем описании (например, соединение формулы I (например, соединение 292), или его энантиомер или смесь энантиомеров, или его фармацевтически приемлемая соль, сольват, гидрат, сокристалл, клатрат или полиморф) и средство представляются в качестве отдельных композиций в отдельных контейнерах в наборе. В некоторых вариантах осуществления соединение, описанное в настоящем описании, и средство предоставлены в качестве единой композиции в контейнере в наборе. Подходящие упаковочные и дополнительные изделия (например, мерный цилиндр для жидких препаратов, обертка из фольги для минимизации воздействия воздуха и т.п.) известны в данной области и могут быть включены в набор. Наборы, описанные в настоящем описании, могут быть предоставлены, выпущены в продажу и/или предложены для распространения лицам, осуществляющим медицинский уход, включая врачей, медицинских сестер, фармацевтов, должностных лиц и т.п. Также в некоторых вариантах осуществления наборы могут быть проданы непосредственно потребителю.
ПРИМЕРЫ
Пример 1: Величины IC50 для отдельных модуляторов PI3K
[0902] Величины IC50 для отдельных соединений определяли, и они представлены в таблице 3. Эти данные демонстрируют, что эти соединения могут служить в качестве ингибиторов PI3K-δ и/или PI3K-γ.
Данные IC50 in vitro для отдельных соединений
197, 199, 241, 259, 261, 263, 280, 282, 283, 314, 315, 318, 321, 322
1, 5, 22, 27, 38, 39, 40, 41, 46, 92, 117, 118, 120, 129, 132, 164, 165, 172, 188, 186, 193, 194, 195, 217, 242, 246, 281, 284, 305, 317, 325
4, 14, 15, 17, 18, 21, 26, 29, 31, 32, 34, 35, 36, 42, 43, 44, 45, 47, 49, 57, 69, 71, 85, 87, 94, 106, 107, 143, 175, 179, 181, 182, 183, 187, 189, 192, 225, 226, 228, 235, 236, 239, 248, 250, 258, 269, 274, 275, 285, 286, 297298299, 300, 307, 309, 313, 319
2, 3, 6, 7, 8, 9, 10, 11, 12, 13, 16, 19, 20, 23, 24, 25, 28, 30, 33, 37, 48, 50, 51, 52, 53, 54, 55, 56, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 70, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 86, 88, 89, 90, 91, 93, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 108, 109, 110, 111, 112, 113, 114, 115, 119, 123, 124, 125, 126, 128, 134, 135, 136, 137, 138, 139, 141, 142, 144, 145, 146, 147, 148, 149, 150, 151. 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 166, 167, 168, 169, 170, 171, 173, 174, 176, 177, 178, 180, 185, 188, 190, 191, 196, 198, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 218, 219, 220, 221, 222, 223, 224, 227, 229, 230, 231, 232, 233, 234, 237, 238, 240, 243, 244, 245, 247, 249, 251, 252, 253, 254, 255, 256, 257, 260, 262, 264, 265, 266, 267, 268, 270, 271, 272, 273, 276, 277, 278, 279, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 301, 302, 303, 306, 308, 310, 311, 312, 316, 320, 323, 324
1, 4, 5, 18, 38, 43, 60, 69, 169, 172, 192, 193, 194, 199, 227, 228, 233, 259, 263, 280, 281, 282, 283, 314, 315, 317, 318, 321, 322, 325
17, 34, 35, 37, 38, 40, 42, 57, 61, 65, 91, 92, 94, 105, 107, 164, 170, 175, 179, 181, 183, 184, 186, 187, 189, 195, 197, 219, 221, 224, 232, 239, 241, 242, 246, 248, 258, 261, 274, 284, 285, 294, 299, 303, 305, 307, 309, 312, 313, 319
2, 8, 9, 10, 11, 14, 15, 20, 22, 27, 28, 39, 41, 46, 47, 49, 51, 55, 58, 66, 70, 71, 73, 76, 78, 80, 93, 98, 99, 100, 103, 104, 106, 108, 109, 161, 162, 163, 165, 166, 180, 188, 202, 206, 209, 212, 214, 216, 218, 220, 222, 229, 234, 236, 238, 250, 267, 268, 269, 271, 275, 279, 286, 293, 298, 300, 301, 308, 316
3, 6, 7, 12, 13, 16, 19, 21, 23, 24, 25, 26, 29, 30, 31, 33, 36, 44, 45, 48, 50, 52, 53, 54, 56, 59, 62, 63, 64, 67, 68, 72, 74, 75, 77, 79, 81, 82, 83, 84, 86, 87, 88, 89, 90, 95, 96, 97, 101, 102, 142, 145, 146, 147, 148, 149, 150, 151, 152, 160, 167, 168, 171, 173, 174, 176, 177, 178. 182, 185, 190, 191, 196, 198, 200, 201, 203, 204, 205, 207, 208, 210, 211, 213, 215, 223, 230, 231, 235, 237, 240, 243, 244, 245, 247, 249, 251, 252, 253, 254, 255, 256, 257, 260, 262, 264, 265, 266, 270, 272, 273, 276, 277, 278, 287, 288, 289, 290, 291, 292, 295, 296, 302, 304, 306, 310, 311, 320, 323, 324
6, 8, 9, 10,11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 54, 55, 56, 57, 58, 59, 60, 61, 62, 64, 65, 67, 68, 69, 70, 71, 72, 73, 74, 79, 80, 81, 82, 83, 85, 87, 88, 91, 93, 96, 98, 99, 100, 103, 104, 105, 106, 107, 109, 110, 111, 112, 114, 146, 160, 161, 162, 163, 164, 165, 166, 167, 169, 170, 172, 174, 175, 179, 180, 181, 182, 183, 184, 186, 187, 188, 189, 191, 192, 193, 194, 197, 202, 211, 212, 214, 215, 216, 218, 219, 220, 221, 222, 224, 227, 228, 238, 239, 241, 242, 246, 247, 248, 249, 250, 258, 259, 261, 263, 265, 266, 267, 268, 271, 274, 275, 280, 281, 282, 283, 284, 285, 286, 290, 293, 294, 298, 299, 300, 304, 308, 309, 313, 314, 315, 316, 317, 318, 319, 321, 322, 324, 325
3, 7, 63, 66, 84, 86, 89, 90, 97, 108, 113, 115, 152, 168, 171, 173, 185, 190, 198, 203, 204, 205, 206, 207, 209, 210, 213, 223, 235, 237, 240, 243, 244, 245, 251, 253, 254, 255, 256, 269, 273, 279, 291, 292, 295, 296
53, 95, 101, 102, 145, 147, 149, 151, 177, 208, 257, 260, 262, 264, 270, 272, 276, 277, 278, 287, 288, 289, 320, 323
142, 148, 150, 153, 154, 155, 156, 157, 158, 159, 176, 201, 252
8, 9, 10, 11, 14, 21, 22, 24, 26, 27, 28, 29, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 46, 52, 54, 56, 57, 59, 60, 64, 68, 69, 70, 73, 76, 78, 79, 80, 87, 88, 91, 93, 98, 103, 104, 105, 107, 109, 112, 146, 152, 162, 163, 164, 165, 166, 169, 170, 172, 175, 179, 180, 181, 182, 183, 184, 186, 187, 188, 189, 192, 193, 194, 197, 216, 217, 218, 221, 222, 224, 238, 248, 259, 261, 263, 266, 271, 275, 280, 282, 283, 284, 285, 286, 294, 299, 304, 310, 311, 312, 315, 317, 321, 322, 325
3, 12, 13, 23, 25, 53, 55, 58, 61, 63, 65, 67, 71, 72, 74, 75, 77, 81, 82, 83, 84, 85, 86, 96, 99, 106, 108, 110, 111, 113, 114, 115, 145, 147, 149, 151, 154, 158, 160, 161, 167, 168, 171, 173, 174, 177, 178, 190, 191, 198, 202, 203, 205, 206, 207, 209, 210, 211, 212, 214, 215, 219, 220, 223, 228, 235, 240, 243, 244, 247, 249, 265, 269, 274, 281, 295, 296, 298, 300, 308, 316, 324
7, 62, 66, 82, 89, 90, 95, 97, 100, 102, 150, 153, 159, 176, 185, 201, 204, 208, 213, 227, 237, 251, 252, 267276277, 290, 292, 293
101, 142, 155, 156, 157, 200, 253, 254, 255, 256, 257, 260, 262, 264, 268, 270, 272, 273, 278, 279, 287, 288, 289, 291, 320, 323,
38, 162, 199
1, 2, 5, 22, 26, 27, 39, 40, 43, 49, 57, 71, 87, 112, 197, 207, 235
4, 8, 9, 10, 11, 14, 15, 18, 19, 20, 21, 24, 25, 28, 29, 30, 31, 32, 34, 35, 36, 41, 42, 45, 46, 47, 50, 51, 61, 69, 70, 76, 77, 78, 79, 80, 85, 86, 91, 98, 100, 103, 104, 105, 106, 107, 110, 111, 114, 119, 124, 133, 135, 145, 152, 161, 162, 163, 169, 195, 212, 243, 294, 312
3, 6, 7, 12, 13, 16, 17, 23, 33, 37, 44, 48, 53, 54, 55, 62, 63, 66, 67, 68, 72, 73, 74, 75, 81, 82, 83, 84, 88, 89, 90, 93, 95, 96, 97, 99, 101, 102, 108, 109, 113, 115, 123, 125, 126, 128, 134, 136, 137, 138, 139, 141, 142, 144, 146, 147, 148, 149, 150, 151, 153, 154, 155, 156, 157, 158, 159, 160, 166, 167, 168, 170, 171, 173, 174, 176, 177, 178, 180, 187, 185, 188, 190, 191. 196, 198, 200, 201, 202, 203, 204, 205, 206, 208, 209, 210, 211, 213, 214, 215, 216, 219, 220, 221, 222, 223, 224, 227, 228, 229, 230, 231, 232, 233, 234, 237, 244, 245, 247, 248, 249, 251, 252, 253, 254, 255, 256, 257, 270, 276, 277, 278, 289, 290, 292, 295, 296, 298, 300, 301, 302, 303, 306, 308, 310, 311






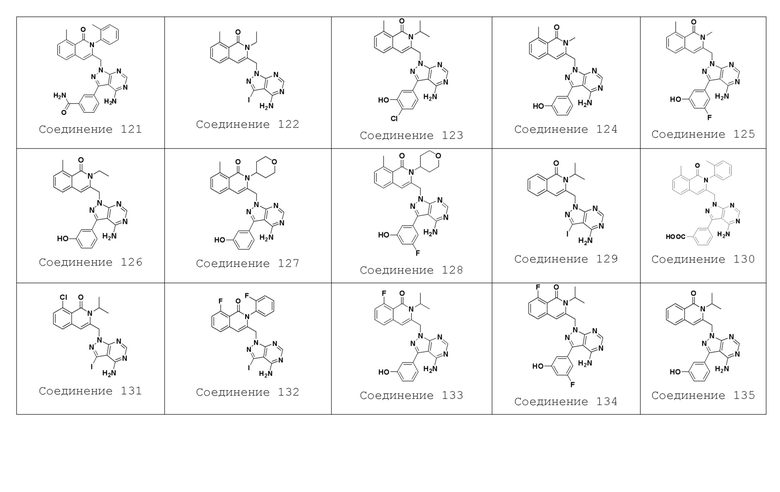
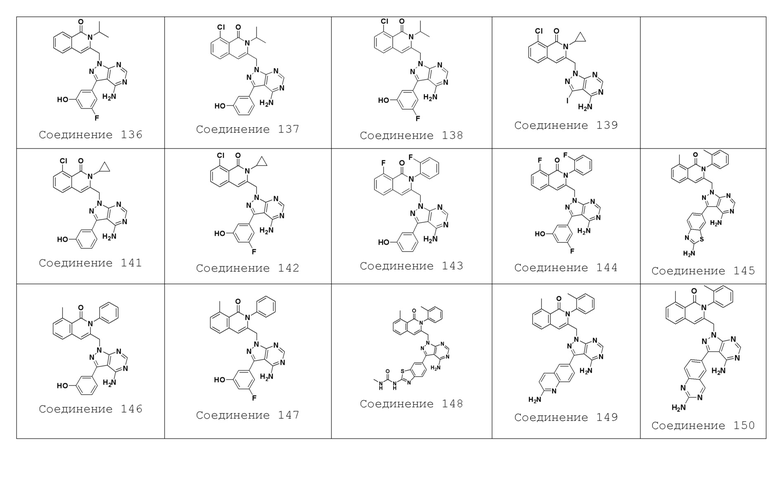






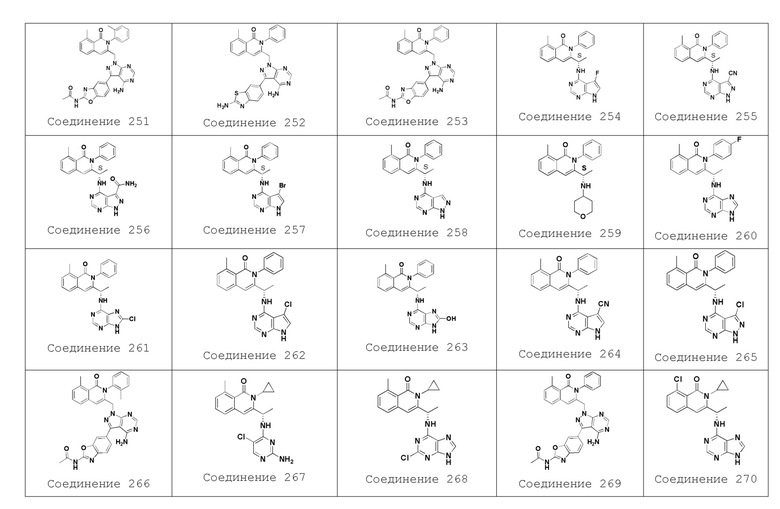
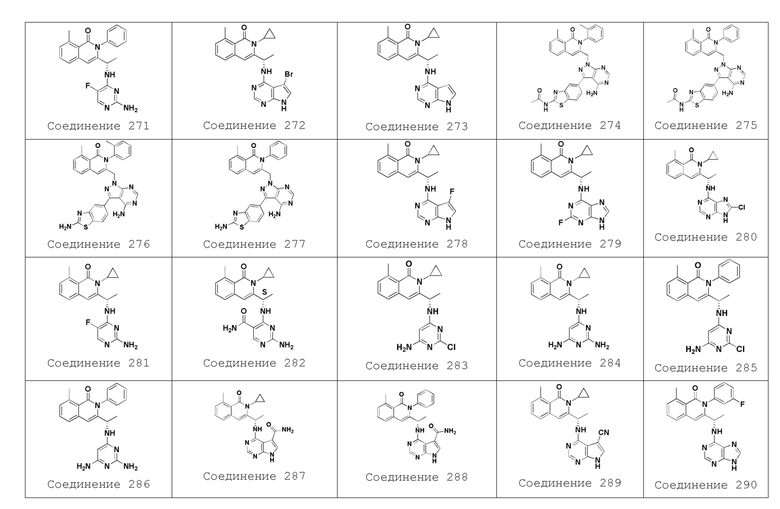

Пример 2: Анализы экспрессии и ингибирования p110α/p85α, p110β/p85α, p110δ/p85α и p110γ
[0903] PI3K класса I можно либо приобретать (p110α/p85α, p110β/p85α, p110δ/p85α от Upstate, и p110γ от Sigma) или экспрессировать, как описано ранее (Knight et al., 2004). Величины IC50 измеряют с использованием либо стандартного TLC-анализа активности киназы липидов (описанного ниже), либо высокопроизводительного анализа улавливания на мембране. Киназные реакции проводят путем приготовления реакционной смеси, содержащей киназу, соединение, описанное в настоящем описании (конечная концентрация DMSO 2%), буфер (25 мМ HEPES, pH 7,4, 10 мМ MgCl2), и непосредственно перед этим обработанный ультразвуковым излучением фосфатидилинозитол (100 мкг/мл). Реакции инициируют добавлением ATP, содержащего 10 мкКи γ-32P-ATP, до конечной концентрации 10 или 100 мкМ и им позволяют протекать в течение 5 минут при комнатной температуре. Для анализа TLC реакции завершают добавлением 105 мкл 1 Н HCl, а затем 160 мкл CHCl3:MeOH (1:1). Двухфазную смесь встряхивают, кратковременно центрифугируют и органическую фазу переносят в новую пробирку с использованием наконечника пипетки для нанесения на гель, предварительно покрытого CHCl3. Этот экстракт наносят пятнами на планшеты для TLC и проявляют в течение 3-4 часов в растворе 65:35 н-пропанол:1M уксусная кислота. Затем планшеты для TLC сушат, экспонируют на экран phosphorimager screen (Storm, Amersham) и количественно определяют. Для каждого соединения киназную активность измеряют при 10-12 концентрациях соединения, соответствующих двукратным разведениям, начиная с наиболее высокой исследуемой концентрации (как правило, 200 мкМ). Для соединений, демонстрирующих значительную активность, определения IC50 повторяют от двух до четырех раз, и указываемая величина представляет собой среднее значение этих результатов независимых измерений.
[0904] Доступны другие коммерческие наборы или системы для анализа видов активности PI3K. Коммерчески доступные наборы или системы можно использовать для скрининга модуляторов, например, ингибиторов и/или агонистов, PI3K, включая, но не ограничиваясь ими, PI3-киназу α, β, δ и γ. Иллюстративной системой является анализ PI 3-киназы (человека) HTRF™ Assay от Upstate. Анализ можно проводить в соответствии с методиками, предложенными изготовителем. В кратком изложении, анализ представляет собой анализ FRET с временным разрешением, который непрямо измеряет продукт PIP3, образующийся вследствие активности PI3K. Киназную реакцию проводят в микропланшете для титрования (например, 384-луночный микропланшет для титрования). Общий объем реакции составляет приблизительно 20 мкл на лунку. На первой стадии в каждую лунку добавляют 2 мкл исследуемого соединения в 20% диметилсульфоксиде до конечной концентрации DMSO 2%. Далее, добавляют приблизительно 14,5 мкл смеси киназа/PIP2 (разбавленная в 1X реакционном буфере) на лунку до конечной концентрации 0,25-0,3 мкг/мл киназы и 10 мкМ PIP2. Планшет закрывают и инкубируют в течение 15 минут при комнатной температуре. Для начала реакции добавляют 3,5 мкл ATP (разбавленный в 1X реакционном буфере) на лунку до конечной концентрации 10 мкМ ATP. Планшет накрывают и инкубируют в течение 1 часа при комнатной температуре. Реакцию останавливают добавлением 5 мкл стоп-раствора на лунку, а затем добавляют 5 мкл на лунку смеси для обнаружения. Планшет накрывают, инкубируют в течение 1 часа при комнатной температуре, а затем считывают на соответствующем устройстве для считывания планшетов. Данные анализируют и IC50 получают с использованием GraphPad Prism® 5.
Пример 3: Соединение 292 ингибирует PI3K-δ, PI3K-γ, PI3K-β и PI3K-α.
[0905] Активность соединения 292 в отношении ингибирования PI3K исследовали в нескольких анализах, описанных в настоящем описании. Результаты представлены в таблице 5 ниже, где показано, что соединение 292 является мощным ингибитором PI3K-δ и PI3K-γ. В этих анализах соединение 292 ингибирует активность PI3K-δ в более низких дозах по сравнению с другими PI3K (например, по меньшей мере в 10 раз более низкая доза по сравнению с PI3K-γ, PI3K-β или PI3K-α).
Биохимические данные и данные о клеточной активности для соединения 292
Пример 4: Функциональная клеточная активность соединения 292
[0906] Оценивали функциональную клеточную активность соединения 292. Результаты представлены в таблице 6 ниже. Соединение 292 подавляло пролиферацию B-клеток мыши и пролиферацию B-клеток человека в субнаномолярных концентрациях с EC50 0,5 нМ. Соединение 292 подавляло пролиферацию T-клеток человека в наномолярных концентрациях с EC50 9,5 нМ.
[0907] Для определения активности изоформы PI3K-δ,γ in vitro, Соединение 292 оценивали в селективных клеточных анализах PI3K-δ и PI3K-γ. Для оценки способности ингибировать изоформу PI3Kδ измеряли фосфорилирование AKT (T308) с помощью твердофазного иммуноферментного анализа (ELISA) в стимулированных антителом против IgM клетках RAJI, клеточной линии лимфомы Беркитта человека, в присутствии или в отсутствие соединения 292. Соединение 292 мощно ингибировало фосфорилирование AKT с величиной IC50 2,0 нМ. Для оценки способности ингибировать изоформу PI3K-γ, линию макрофаг-подобных клеток мыши RAW 264.7 стимулировали C5a, и измеряли уровень фосфорилирования AKT (T308) с помощью ELISA. Соединение 292 ингибировало PI3K-γ в активированных C5a клетках RAW 264.7 с величиной IC50 44,0 нМ. Соединение 292 является мощным ингибитором как PI3K-δ, так и PI3K-γ в селективных в отношении изоформ клеточных анализах.
Функциональная клеточная активность соединения 292
[0908] В одном иллюстративном проведенном анализе соединение 292 мощно ингибировало специфическую для PI3K-δ активацию базофилов в цельной крови человека с IC50 78 нМ.
Пример 5: Фармакологические исследования безопасности соединения 292
Анализ hERG in vitro
[0909] Эффекты соединения 292 in vitro на ток hERG в каналах исследовали в качестве заместителя IKr, быстро активирующего сердечного калиевого тока задержанного выпрямления. Соединение 292 ингибировало ток hERG на 11,9% в концентрации 10 мкМ, на 33,2% в концентрации 30 мкМ, на 71,1% в концентрации 100 мкМ и на 92,8% в концентрации 300 мкМ по сравнению с 0,9% для контроля в виде носителя. Величина IC50 для ингибиторного эффекта соединения 292 на калиевый ток hERG составляла 49,8 мкМ (коэффициент Хилла = 1,3).
[0910] Соединение 292 в высокой степени связывалось in vitro с компонентами плазмы всех исследованных видов, включая крысу, обезьяну и человека. В плазме крысы, обезьяны и человека соединение 292 составляло 85,8, 76,8 и 85,9% связавшегося белка, соответственно, в концентрации 100 мкМ (41700 нг/мл). Анализ hERG проводили на не содержащем белка растворе. Таким образом, исходя из свободных фракций, величина IC50 49,8 мкМ (20800 нг/мл) для несвязанного соединения 292 приравнивается к общим концентрациям в плазме 351 мкМ (146200 нг/мл), 215 мкМ (89500 нг/мл) и 353 мкМ (147200 нг/мл) у крысы, обезьяны и человека, соответственно. Эти высокие концентрации указывают на очень низкий потенциал к пролонгации QT у человека.
Нейрофункциональное исследование у крыс Sprague-Dawley
[0911] Данное исследование проводили для оценки потенциальных эффектов соединения 292 на центральную нервную систему после однократного перорального введения самцам крыс. В ходе этого исследования проводили батарею стандартных тестов функциональности (FOB) и оценку двигательной активности до введения дозы и через 2, 6 и 24 ч после введения соединения 292.
[0912] Соединение 292, введенное самцам крыс в качестве однократной пероральной дозы вплоть до 350 мг/кг, не вызвало изменений качественных или количественных параметров FOB вплоть до 24 ч после введения дозы. Значительное снижение двигательной активности наблюдали у животных, исследованных через 2 ч после введения дозы 350 мг/кг. Однако учитывая, что не наблюдали сопутствующих эффектов на двигательную активность или возбуждение на арене FOB в тот же период времени, окончательный эффект соединения 292 не мог быть подтвержден при этих интервалах оценки. Не наблюдали эффектов на центральную нервную систему при уровнях доз ≤50 мг/кг.
Исследование дыхательной системы у крыс Sprague-Dawley
[0913] Это исследование проводили для оценки потенциальных эффектов соединения 292 на дыхательную систему после однократного перорального введения самцу крысы. В ходе данного исследования животных помещали в плетизмографы "с внешним выходом" и параметры дыхания (дыхательный объем, интенсивность дыхания и установленный из них минутный объем) измеряли в течение приблизительно 30 до введения дозы, непрерывно от 1 до 3 x после введения дозы и с 30-минутными интервалами через 6 и 24 ч после введения дозы.
[0914] Однократное пероральное введение соединения 292 при уровнях доз вплоть до 350 мг/кг приводило к отсутствию связанных с соединением 292 эффектов на параметры дыхания, включая интенсивность дыхания, дыхательный объем и минутный объем.
Исследование сердечно-сосудистой системы у подключенного к аппаратуре яванского макака
[0915] Данное исследование проводили для оценки потенциальных эффектов соединения 292 не гемодинамические и электрокардиографические параметры после однократного перорального введения яванскому макаку посредством телеметрии. В этом исследовании использовали четырех ненаивных самцов макак, которым были имплантированы радиотелеметрические трансмиттеры.
[0916] У самцов яванских макаков не наблюдали связанных с соединением 292 эффектов на гемодинамические или электрокардиографические параметры (артериальное кровяное давление (систолическое, диастолическое, среднее и пульсовое давление), частоту сердечных сокращений и количественные электрокардиографические интервалы (PR, QRS, QT и QTc)) после однократной пероральной дозы 5, 30 и 150 мг/кг. Кроме того, не наблюдали нарушений формы сигнала или аритмий, связанных с введением соединения 292, вплоть до 150 мг/кг.
Пример 6: Фармакокинетика соединения 292 у животных
[0917] Всасывание и фармакокинетику соединения 292 исследовали в исследованиях абсолютной биодоступности у мышей, крыс, собак и обезьян. Результаты этих исследований биодоступности обобщенно представлены в таблице 7. Данные демонстрируют, что 292 быстро всасывалось у большинства видов в неклинических испытаниях при введении в качестве суспензионного состава с уровнями пероральной биодоступности 57%, 40%, 40% и 7% у крыс, обезьян, собак и мышей, соответственно. Время полужизни соединения 292 составляло 5 ч у обезьян, 2 ч у собаки и менее 2 часов у крысы и мыши. Соединение 292 достигало высокого объемного распределения и продемонстрировало клиренс от низкого до умеренного у обезьян и крыс. Связывание соединения 292 с белками плазмы было зависимым от концентрации и вида. Процент соединения 292, свободного в плазме крысы и обезьяны, был неизменно выше, чем в плазме человека при всех исследованных концентрациях. Распределение соединения 292 в тканях крысы было быстрым и обширным, исходя из соотношения между кровью и тканью, превышающего 1 для большинства тканей. Элиминация радиоактивно меченого соединения 292 из тканей также была быстрой, причем в большинстве тканей отсутствовали поддающиеся количественному определению уровни радиоактивности через 24 ч.
Фармакокинетические параметры соединения 292 у мышей BALB/c, крыс Sprague-Dawley, собак породы бигль и яванских макаков после внутривенного и перорального введения
(Номер в отчете)
(2М, 2Ж)
(2М, 2Ж)
NC = не вычислено
a. Обобщенная величина представляет собой C0
b. AUC0-24
с. в/в состав (мышь, крыса, обезьяна) = 5% NMP, 10% Solutol® HS 15, 30% PEG400, 55% воды с 3% декстрозой
d. п/о состав (мышь, крыса, обезьяна) = 0,5% (масс./об.) CMC низкой вязкости и 0,05% (об./об.) TWEEN® 80 в сверхчистой воде
e. в/в состав (собака) = 5% 0,1N HCl, 5% PEG400 в 10% (2-гидроксипропил)-β-циклодекстрине или 2,5% 1 Н HCl, 20% PEG400 в PBS
f. п/о состав (собака) = 5% NMP, 60% PEG400 и 35% водный раствор (ADME-11-008) или 5% NMP и 95% водная суспензия (ADME-11-009)
g. Fпероральный вычисляли с использованием 0,5 мг/кг в/в дозы в качестве эталона
h. Fпероральный вычисляли с использованием 1 мг/кг в/в дозы в качестве эталона
i. Fпероральный вычисляли с использованием AUC0-last
[0918] Мембранную проницаемость и взаимодействие соединения 292 с P-гликопротеином человека оценивали in vitro с использованием монослоев клеток Caco-2. Было определено, что соединение 292 имеет умеренную проницаемость через клеточную мембрану, представляет собой субстрат P-gp и имеет потенциал к ингибированию активного транспорта других субстратов P-gp.
Пример 7: Токсикология соединения 292 у животных
[0919] Исследование токсичности однократной дозы проводили для определения максимально переносимой дозы (MTD) после однократной пероральной дозы и потенциальной токсичности после повторяющихся в течение 7 суток пероральных доз соединения 292 у обезьян. Было определено, что MTD после однократного перорального введения соединения 292 у обезьян составляла 500 мг/кг.
[0920] Проводили неклинические испытания безопасности с повторяющимися дозами в течение 4 и 13 недель, в которых крысам и яванским макакам вводили суточные дозы соединения 292 посредством перорального чреззондового введения. Уровень, при котором отсутствуют видимые неблагоприятные воздействия (NOAEL), в 13-недельном исследовании у крыс составил 25 мг/кг/сутки (150 мг/м2/сутки) и NOAEL в 13-недельном исследовании у обезьян составил 5 мг/кг/сутки (60 мг/м2/сутки). На 91 сутки средние величины AUC0-24ч для обоих полов при NOAEL составила 14150 нг*ч/мл у крыс и 4015 нг*ч/мл у обезьян. На основе данных PK клинического испытания у здоровых индивидуумов, экспозиция у человека после повторяющихся пероральных доз 5 мг соединения 292 BID (средняя AUC0-24ч = 2582 нг*ч/мл после 14 суток перорального дозирования) является меньшей, чем экспозиция при NOAEL либо крыс, либо обезьян.
[0921] Отсутствовала генетическая токсичность, ассоциированная с соединением 292, в исследованиях генетической токсичности in vitro, и соединение 292 не имело прямого неблагоприятного эффекта в микроядерных анализах у крыс in vivo. Токсичность соединения 292 на репродуктивную систему оценивали в исследованиях токсичности на развитие эмбриона/плода у крыс и кроликов. Материнские и фетальные NOAEL соединения 292 у крысы и кролика составляли 35 мг/кг/сутки (210 мг/м2/сутки) и 75 мг/кг/сутки (900 мг/м2/сутки), соответственно. В последние сутки дозирования средние величины AUC0-24ч при NOAEL составляли 62200 нг*ч/мл и 66200 нг*ч/мл для беременных крыс и кроликов, соответственно.
Пример 8: Клинические испытания у человека
[0922] Рандомизированное двойное слепое плацебо-контролируемое клиническое испытание у здоровых взрослых индивидуумов проводили для соединения 292. Всего было включено сто шесть (106) индивидуумов, которые включали 36 индивидуумов в части однократной возрастающей дозы (SAD) (24 вводили активное вещество; 12 вводили плацебо), 48 индивидуумов в части многократной возрастающий дозы (MAD) (36 вводили активное вещество; 12 вводили плацебо), 6 индивидуумов в части эффекта питания (FE) (состоящий из дозирования соединения 292 последовательными частями в сытом состоянии и натощак), и 16 индивидуумов в части DDI (состоящий из периодов дозирования соединения 292 с кетоконазолом и без него). Общая экспозиция соединения 292 обобщенно представлена в таблице 8.
Экспозиция соединения 292 у индивидуума в клинических испытаниях безопасности
[0923] Соединение 292 хорошо переносилось в оцениваемых дозах. Не было смертей и серьезных неблагоприятных явлений (SAE). Оказалось, что отсутствуют зависимое от дозы увеличение AE среди диапазона однократных доз от 1 до 30 мг или диапазона многократных доз от 2 до 10 мг соединения 292 каждые сутки. Ни в одной из частей исследования не наблюдали клинически значимых лабораторных или электрокардиографических (ECG) аномалий безопасности.
[0924] Фармакокинетическая оценка продемонстрировала, что соединение 292 быстро всасывалось после однократного или многократного перорального введения дозы с максимальной концентрацией в плазме, наблюдаемой, как правило, через 1 ч после дозирования. В исследованных диапазонах дозировок экспозиция соединения 292 возрастала пропорционально дозе. Среднее половинное время элиминации находилось в диапазоне от 6,5 ч до 11,7 ч после повторного дозирования и не зависело от вводимого уровня дозы. Накопление соединения 292 было менее чем 2-кратным после 14 суток перорального введения Q12h. Обобщение параметров PK для соединения 292 для части однократной дозы представлено в таблице 9 ниже. Обобщение параметров PK для соединения 292 для части многократной дозы предоставлено в таблице 10 ниже.
Обобщение параметров PK для соединения 292 после введения однократной дозы (среднее значение, %CV)
(ч)
(1,00-1,00)
(0,50-2,00)
(0,50-1,50)
(0,50-1,50)
(1,00-1,00)
(0,50-1,00)
Обобщение параметров PK соединения 292 после многократного введения дозы (среднее значение, %CV)
[0925] Данные части эффекта питания указывают на то, что питание не изменяет значительно системную экспозицию соединения 292. При введении в присутствии пищи с высоким содержанием жиров, концентрация соединения 292 снижалась приблизительно на 10% и среднее Tmax замедлялось от 1 часа (натощак) до 3 часов (после приема пищи). Общая экспозиция при оценке по AUC (0-last) и AUC (0-inf), возрастала приблизительно на 9% в присутствии пищи с высоким содержанием жиров.
[0926] Данные части DDI показали, что одновременное введение 200 мг q12h кетоконазола увеличивало экспозицию соединения 292. В среднем, Cmax, AUC0-last и AUC0-inf возрастали приблизительно на 66%, 285% и 295%, соответственно, в присутствии кетоконазола по сравнению с соединением 292, вводимым отдельно.
[0927] После однократных и многократных доз соединения 292 наблюдали дозозависимое снижение активации базофилов при всех уровнях доз, причем максимальное снижение происходило через 1 ч после введения дозы; не наблюдали заменого изменения после введения плацебо. Обобщение PK/PD после введения однократной дозы представлено на фиг.1-3, которые демонстрируют, что ответ PD был быстрым и максимальный ответ достигался при дозировании 5 мг. Существовала явная взаимосвязь между снижением активацией базофилов и концентрациями соединения 292 в плазме, с насыщением эффекта при более высоких концентрациях соединения 292 в плазме.
[0928] Во всех исследуемых группах проводили последовательные ЭКГ в несколько моментов времени после дозирования. Ни один индивидуум не имел QTcF более 500 мс ни при одной из оценок, и наибольшее изменение QTcF от исходного уровня составляло 37 мс.
[0929] В целом, соединение 292 хорошо переносилось у здоровых индивидуумов при однократных дозах вплоть до 30 мг (наиболее высокая исследованная доза) и при общей суточной дозе вплоть до 10 мг (наиболее высокая исследованная доза; 5 мг BID или 10 мг QD) в течение 14 суток. У здоровых индивидуумов профиль PK соединения 292 характеризуется быстрым всасыванием (максимальные концентрации в плазме достигались в пределах 0,5-1 часа), умеренно быстрой элиминацией (время полужизни от 3,5 до 9,5 часов после однократной дозы и от 6,5 до 11,7 часов после повторяющегося дозирования) и пропорциональными дозе увеличениями системной экспозиции (Cmax и AUC). После многократного введения дозы наблюдали минимальное накопление (соотношение накопления 1,65-1,83 для дозирования BID и 1,54 для дозирования QD). После однократного введения пероральной дозы клиренс находился в диапазоне от 6,7 л/ч до 11,1 л/ч и объемное распределение находилось в диапазоне от 38,8 л до 147 л. Экскреция неизмененного соединения 292 в моче составляла <2% от вводимой дозы, что указывает на минимальное почечное выведение исходного лекарственного средства. Экспрессия CD63 на поверхности активированных CCR3+ базофилов снижалась дозозависимым образом при всех уровнях однократных и многократных доз с максимальным снижением через 1 час после введения дозы, что соответствует времени максимальной концентрации соединения 292 в плазме. Ингибирование активации базофилов отражало профиль концентрация соединения 292 - время, причем экспрессия CD63 возвращалась к исходным уровням по мере снижения концентраций в плазме. Введение 5 мг BID поддерживало ингибирование PI3K-δ (EC50=48 нг/мл) на протяжении 12-часового интервала между введениями. Сопутствующий прием высококалорийной пищи с высоким содержанием жиров снижал Cmax приблизительно на 10%, сдвигал среднее Tmax от 1 до 3 часов, и увеличивал общую экспозицию (AUC) приблизительно на 8-9%. Эти данные указывают на то, что 292 можно вводить безотносительно приема пищи.
[0930] Таким образом, соединение 292 быстро всасывалось после однократных и многократных доз. Средняя системная экспозиция (Cmax и AUC) возрастала пропорционально дозе, что указывает на линейную PK. Среднее кажущееся терминальное время половинной элиминации (t1/2) после 14 суток введения соединения 292 находилось в диапазоне от 6,5 до 11,7 часов. Соотношение накопления (среднее соотношение AUC 14 сутки/1 сутки) составляло 1,54 для дозирования QD относительно от 1,65 до 1,83 для диапазона доз BID. После введения с приемом высококалорийной пищи с высоким содержанием жиров AUC0-inf возрастала на 9%, Cmax снижалась на 10% и среднее Tmax сдвигалось от 1 ч до 3 ч. Исходя из величины этих изменений, соединение 292 можно вводить безотносительно приема пищи. Кроме того, наблюдали быстрый ответ, оцениваемый в качестве снижения экспрессии CD63+ на CCR3+ базофилах в анализах активации с антителом против FcεR1 ex vivo (фиг.1-3). Максимальный ответ наблюдали во время максимальных концентраций в плазме через один час после введения дозы в случае однократного или многократного введения. Экспрессия CD63+ возвращалась к исходному уровню по мере снижения концентраций лекарственного средства в плазме. Более того, соединение 292 было хорошо переносимым во всех исследованных дозах: однократные дозы вплоть до 30 мг, и многократные дозы вплоть до 10 мг каждые сутки в течение 14 суток. У индивидуумов, которые принимали многократные дозы соединения 292 (n=36) (PLB n=12) в течение 2 недель, наиболее распространенные неблагоприятные явления (AE) были связаны с взятием крови и связанными с протоколом процедурами. Наиболее распространенными не относящимися к процедурам AE, встречающимися у ≥2 индивидуумов, были головная боль (8% против 25% PLB), миалгия (6% против 8% PLB) и назофарингит (6% против 0% PLB). Не наблюдали зависимых от дозы тенденций AE. Не наблюдали клинически значимых данных в лабораторных исследованиях безопасности по ЭКГ. Не наблюдали увеличения уровня IgE, связанного с соединением 292.
Пример 9: Клинические испытания развернутых гематологических злокачественных опухолей
[0931] Испытание фазы 1 с увеличением дозы было предназначено для оценки безопасности, фармакокинетики (PK) и активности перорально вводимого соединения 292 у пациентов с развернутыми гематологическими злокачественными опухолями, включая T-клеточные лимфомы/лейкозы. Были набраны последовательные группы пациентов с постепенно возрастающими уровнями доз и расширением групп пациентов с отдельными гематологическими злокачественными опухолями. Соединение 292 вводили перорально 2 раза в сутки (BID) непрерывно курсами из 28 суток. Ответ опухоли оценивали, исходя из специфических для заболевания стандартных критериев.
[0932] В испытание включали 20 (или более) пациентов; 5 пациентов с хроническим лимфоцитарным лейкозом (CLL)/мелколимфоцитарной лимфомой (SLL), 4 пациента с вялотекущей неходжкинской лимфомой (iNHL), 3 пациента с агрессивной B-клеточной NHL [включая диффузную крупноклеточную B-клеточную лимфому (DLBCL) n=2; и лимфому Рихтера n=1], 3 пациента с множественной миеломой (MM), 2 пациента с ходжкинской лимфомой (HL), 2 пациента с T-клеточной лимфомой [анапластическая крупноклеточная лимфома (ALCL) n=2] и 1 пациент с лимфомой из клеток мантийной зоны (MCL). Среди этих пациентов 11 были мужчинами и 9 были женщинами со средним [диапазон] возрастом 63 года [30-81], причем у 36% прошло <6 месяцев от последней предшествующей системной терапии. Среднее [диапазон] количество предшествующих терапий составляло 3 [1-8].
[0933] Вводимые дозы соединения 292 включают 8 мг BID (n=1), 15 мг BID (n=6), 25 мг BID (n=7), 35 мг BID (n=3) и 50 мг BID (n=3). Среднее [диапазон] количество курсов лечения составляло 2 [1-8], причем 12 (60%) пациентов продолжили лечение. Неблагоприятные явления (AE) возникли у 13 (65%) пациентов, включая 7 (35%) пациентов с AE степени >3. Связанные с лечением AE возникли у 11 пациентов (55%) со степенью >3 у 5 пациентов (25%). Нейтропения степени 4 была единственной ограничивающей дозу токсичностью до настоящего времени (группа дозы 15 мг). Новые гематологические лабораторные аномалии степени >3 включали нейтропению [n=6 (30%)] и тромбоцитопению [n=1 (5%)]. Повышения ALT/AST степени 3 возникли у 1 (5%) пациента с MM, начавшись через 6 недель после начала дозирования соединения 292.
[0934] PK показала пропорциональное дозе увеличение Cmax и AUC в плазме в исследованном диапазоне доз. Кроме того, PK и первоначальные фармакодинамические (PD) данные для первых трех групп (8 25 мг BID) спрогнозировали непрерывное подавление каскада PI3K-δ с возрастающим ингибированием каскада PI3K-γ при дозе 25 мг BID или более.
[0935] У оцениваемых пациентов (n=11) ответы наблюдали при уровнях доз 8, 15 и 25 мг BID, включая 2/3 при CLL/SLL (0 CR/2 PR/1 SD), 1/2 при iNHL (1 CR/0 PR/1 SD) и 1/1 при MCL (1 PR). Все пациенты по меньшей мере с SD после 2 курсов (n=6) продолжили лечение, включая первого пациента, которому проводили введение.
[0936] Маркеры PK и PD оценивали после первой дозы (например, 8 мг BID) и в стационарном состоянии. Активность PD (ингибирование PI3K) в цельной крови оценивали с использованием анализа активации базофилов, который измерял снижение экспрессии CD63 на поверхности базофилов после стимуляции ex vivo.
[0937] Данные продемонстрировали быстрое всасывание лекарственного средства и пропорциональную дозе PK. Как и у здоровых индивидуумов, максимальное ингибирование активации базофилов наблюдали через 1 час после введения дозы. Перед введением дозы в начале курса 2 (т.е. через 28 суток после дозирования BID), экспрессия CD63 снижалась на 45% или более относительно начала введения. Средние стационарные остаточные концентрации сохранялись выше уровней, достаточных для ингибирования PI3K-δ, после доз ≥15 мг BID. Наблюдали клинический ответ.
[0938] Таким образом, в обоих исследованиях (у здоровых индивидуумов и при развернутых гематологических злокачественных опухолях), всасывание лекарственного средства на основе соединения 292 было быстрым и экспозиция была пропорциональна дозе. Экспрессия CD63 на поверхности активированных базофилов была снижена в присутствии соединения 292 как у здоровых индивидуумов, так и у индивидуумов с онкологическим заболеванием, и это наблюдение согласуется с ингибированием PI3K-δ. Взаимосвязь воздействие-ответ была очевидной, что указывает на зависимый от концентрации фармакологический ответ на соединение 292. Данные PK/PD из испытания при онкологическом заболевании продемонстрировали ингибирование активности PI3K-δ и показали, что более высокие дозы в возрастающей степени подавляют активность PI3K-γ.
[0939] Исходя из PK/PD и активности, наблюдаемой у пациентов с CLL (например, CLL/SLL), iNHL и MCL, расширенная группа для дальнейшей оценки безопасности и предварительной оценки активности соединения 292 включала пациентов с этими выбранными гематологическими заболеваниями, которым вводили 25 мг BID. Увеличение дозы продолжали, фокусируясь на пациентов с T-клеточными злокачественными опухолями и DLBCL, где увеличение экспрессии изоформы PI3K-γ может повысить профиль эффективности.
[0940] Дополнительные расширенные группы могут быть созданы для T-клеточной лимфомы, DLBCL, миелопролиферативных новообразований, острых лейкозов, T-клеточной/агрессивной NHL, и CLL/iNHL/MCL для дальнейшего определения специфической активности в отношении заболевания.
[0941] Таким образом, соединение 292, являющееся пероральным мощным ингибитором или модулятором PI3K-δ, γ, хорошо переносится при дозах в диапазоне от 8 мг BID до 50 мг BID, и оно продемонстрировало клиническую активность у пациентов с iNHL, MCL и CLL. Доза 25 мг BID эффективно ингибирует PI3K-δ, что дает обоснование для расширения при CLL/iNHL/MCL.
Пример 10: Клинические испытания при гематологических злокачественных опухолях: дополнительные данные
[0942] PI3K-δ и PI3K-γ вовлечены в передачу сигнала в лейкоцитах и функцию B-клеток, T-клеток и миелоидных клеток, включая дифференцировку, активацию, пролиферацию и миграцию. PI3K-δ и PI3K-γ поддерживают рост и выживание определенных B- и T-клеточных злокачественных опухолей. Как проиллюстрировано в настоящем описании, соединение 292 является мощным пероральным ингибитором изоформ PI3K-δ и PI3K-γ (например, таблица 11).
Обобщение данных об активности соединения 292 in vitro
антитело против FcεR1
fMLP
Тромбоциты
[0943] В испытании I фазы у здоровых индивидуумов однократная и многократные дозы соединения 292 хорошо переносились с пропорциональной дозе фармакокинетикой вплоть до 5 мг BID, и t1/2 от 6,5 до 11,7 ч, и фармакодинамический ответ (против FcεR1) отражал концентрации в плазме, причем максимальные эффекты наблюдались во время максимальных концентраций в плазме (например, фиг.1-3).
[0944] Схема испытания: Одно клиническое испытание соединения 292 представляет собой открытое испытание I фазы, в которое было включено 1-6 взрослых пациентов с гематологическими злокачественными опухолями на уровень дозы при постепенно возрастающих уровнях дозы. Дозирование представляло собой пероральное дозирование два раза в сутки (BID) в курсе из 28 суток. Первичными задачами было определение безопасности и MTD для соединения 292. Конечные результаты включали безопасность, эффективность, фармакокинетику (PK) и фармакодинамику (PD). Расширение групп с выбранными злокачественным опухолями были допустимы при ≤MTD, исходя из PK/PD/клинической активности в отношении ингибирования PI3K-δ и PI3K-γ. Ключевые критерии включения включали: (1) прогрессирование, рефрактерность, непереносимость или непригодность общепринятой терапии, или наличие заболевания без общепринятой терапии; (2) адекватную функцию печени и почек (≤степени 1); (3) адекватную гемопоэтическую функцию (только фаза увеличения) с ANC на исходном уровне ≥750 клеток/мкл, тромбоциты ≥75 тысяч/мкл, и гемоглобин >8,0 г/дл; (4) отсутствие предшествующей обработки ингибитором PI3K (фаза увеличения дозы) или в пределах 4 недель от первой дозы соединения 292 (фаза расширения). Испытание с увеличением дозы включало следующие дозы: 8 мг BID, 15 мг BID, 25 мг BID, 35 мг BID, 50 мг BID, 60 мг BID, 75 мг BID и 100 мг BID (включение в испытание). Расширения групп при ≤ MTD проводят при гематологических злокачественных опухолях, таких как диффузная крупноклеточная B-клеточная лимфома, T-клеточные лимфомы, острый лимфоцитарный лейкоз, миелопролиферативные новообразования, CLL/SLL, iNHL и MCL (например, расширение 25 мг BID проводили для CLL/SLL, iNHL и MCL). Ограничивающая доза токсичность (DLT) в ходе курса 1, использованная для определения MTD, включает (1) смерть; (2) гематологическую токсичность степени ≥4 длительностью >7 суток, или фебрильную нейтропению степени 3, тромбоцитопению степени 3 с геморрагией степени ≥2, или тромбоцитопению степени 4 любой продолжительности, требующую переливания крови; (3) Диарею или тошноту степени 3 длительностью ≥24 часов, несмотря на медикаментозное лечение, или любую другую негематологическую токсичность степени 3 любой длительности.
[0945] Демографические данные и распределение пациентов обобщенно представлены в таблицах 12 и 13. После увеличения дозы до 75 мг BID, MTD не была достигнута и увеличение дозы продолжили. В ходе лечение было три случая прекращения участия в исследовании, связанных с AE: (1) превмонит степени 3 (15 мг BID); (2) увеличение уровня ALT степени 4 (25 мг BID); (3) степень и этиология AE не были указаны при прекращении сбора данных (25 мг BID).
Демографические данные пациентов
Распределение пациентов
(12 PD)
[0946] Данные о фармакокинетике и фармакодинамике обобщенно представлены на фиг.4 и 5. Соединение 292 быстро всасывалось с линейным профилем PK вплоть до 50 мг BID (t1/2 элиминации составляло от 6 до 10 часов). Данные продемонстрировали, что полное ингибирование PI3K-δ может быть достигнуто в дозах 15 мг BID или более; и дозы 25 мг BID или более в возрастающей степени подавляют PI3K-γ (фиг.4). Кроме того, с помощью проточной цитометрии наблюдали быстрое и непрерывное ингибирование фосфорилирования AKT соединением 292 в клетках CLL/SLL после одной дозы (25 мг) (фиг.5). Эти результаты PK/PD послужили обоснованием для группы расширения при 25 мг BID для оценки переносимости и активности соединения 292 при выбранных гематологических злокачественных опухолях.
[0947] Данные о клинической эффективности для соединения 292 при B-клеточных и T-клеточных злокачественных опухолях обобщенно представлены в таблицах 14 и максимальное изменение размера опухоли при лечении соединением 292 представлено на фиг.6. Снижение опухолевой массы наблюдали при всех назначениях и при всех оцениваемых уровнях доз. Пациенты с поддающимся измерению заболеванием при CT-сканировании и с ≥1 CT-оценкой во время лечения представлены на фиг.6, включая пациентов (n=2), которые не имели оценки ответа. Пациенты вне испытания с PD перед первой CT-оценкой (n=2) или заболеванием, не оцененным с помощью CT (n=4), не представлены на фиг.
Клинический ответ в B-клеточных и T-клеточных гематологических злокачественных опухолях
b. По меньшей мере одна оценка ответа или прогрессирующее заболевание (PD).
c. Четыре ответа лимфатических узлов.
[0948] Быстрое появление клинической активности соединения 292 наблюдали при CLL/SLL (фиг.7). Наблюдали клиническую активность соединения 292 при T-клеточной (фиг.8), причем первую оценку ответа наблюдали после 2 курсов терапии соединением 292: 1 полный ответ (CR), 1 частичный ответ (PR), 1 стабильное заболевание (SD), 3 прогрессирующее заболевание (PD) (и 1 неизвестный статус). В испытании осталось четверо пациентов. Кроме того, у пациента в возрасте 72 лет с ассоциированной с энтеропатией T-клеточной лимфомой произошло полное рассасывание легочных метастазов (белые стрелки), как показано с помощью PET/CT, после 2 курсов соединения 292 (60 мг BID) (фиг.9).
[0949] Кроме того, было выявлено, что среди индивидуумов, имеющих T-клеточную лимфому, соединение 292 обладает эффективностью лечения как периферической T-клеточной лимфомы (PTCL), так и T-клеточной лимфомы кожи (CTCL), как показано в таблице 15:
Клинические ответы при TCL
CR = полный ответ; PR = частичный ответ; SD = стабильное заболевание; PD = прогрессирующее заболевание
[0950] Процентные изменения поддающегося измерению заболевания при оценке с помощью изображений CT после введения соединения 292 в указанных дозах (все BID) проиллюстрированы на фиг.10. Как показано на фиг., 33% пациентов (2 PTCL и 1 CTCL) продемонстрировали по меньшей мере 50% ответ опухоли.
[0951] Клинические ответы, наблюдаемые у различных пациентов с B-клеточной лимфомой, обобщенно представлены в таблице 16 ниже:
Клинические ответы при BCL
CR = полный ответ; PR = частичный ответ; MR = минимальный ответ в случае лимфомы Вальденстрема; SD = стабильное заболевание; PD = прогрессирующее заболевание
iNHL включала 11 случаев фолликулярной лимфомы, 2 случая лимфомы Вальденстрема, 1 случай лимфомы маргинальной зоны (MZL) и 12 iNHL
Как можно видеть выше, ответы наблюдали (включая CR) при вялотекущей лимфоме, лимфоме мантийной зоны и лимфоме Ходжкина. При первой оценке в пределах приблизительно 2 месяцев ответы появились только у 16 из 18 отвечающих пациентов (89%). Процентные изменения при поддающемся измерению заболевании, оцененные по изображениям CT для пациентов с MCL, HL и NHL представлены на фиг.11, а для iNHL (включая фолликулярную лимфому, лимфому Вальденстрема и MZL) они представлены на фиг.12.
[0952] Клинические данные о безопасности для соединения 292 обобщенно представлены в таблицах 17 и 18. Не наблюдали зависимых от дозы тенденций в связанных с ним AE степени 3 или степени 4. DLT включали нейтропению степени 4 (15 мг BID) и целлюлит степени 3 (раневая инфекция, 75 мг BID).
Безопасность соединения 292
(n=34)
(n=55)
Связанные SAE, n (%)
Все инфекционные SAE, n (%)
1 (3%)
1 (3%)
4 (7%)
3 (5%)
Степень 3/4 (%/%)
7/5 (21%/15%)
18/8 (33%/15%)
Степени 3/4 (%/%)
4/4 (12%/12%)
14/6 (25%/11%)
Снижение дозы, n (%)
2 (6%)
5 (9%)
Снижение дозы, n (%)
3 (9%)
6 (11%)
Безопасность соединения 292
[0953] На фиг.13 представлены количество месяцев испытания по индивидуумам и диагнозу. Ранний анализ времени испытания (среднее 2,2 месяца) продемонстрировал, что 67% от всех пациентов остались в испытании. В испытании осталось 90% (n=26) пациентов без PD (прогрессирующее заболевание) после 2 курсов лечения соединением 292.
[0954] В общем, соединение 292 является мощным пероральным ингибитором PI3K-δ и PI3K-γ, и оно является хорошо переносимым и клинически активным у пациентов с развернутыми гематологическими злокачественными опухолями. Оценивали дозы вплоть до 75 мг BID; исследовали увеличение дозы соединения 292 в качестве единственного средства. Профиль PK показал, что полное ингибирование PI3K-δ может быть достигнуто при ≥15 мг BID для соединения 292 и дозы ≥25 мг BID в возрастающей степени подавляют PI3K-γ. Группы расширения для выбранных злокачественных опухолей создают для доз на уровне или ниже MTD. SAE соответствовали сопутствующим заболеваниям, наблюдаемым у пациентов с развернутым гематологическим онкологическим заболеванием. Наиболее частыми связанными AE степени 3 или степени 4 были цитопении и повышения уровней ALT/AST. В целом, эти AE не были связанными с дозой и контролировались прекращением введения дозы и уменьшением дозы. Результаты показали, что клиническую активность наблюдали при всех дозах. Ответы наблюдали при iNHL, CLL/SLL и MCL при ≤50 мг BID. Ответы наблюдали при T-клеточной лимфоме и лимфоме Хождкина при ≥50 мг BID, что иллюстрирует, что B-клеточные и T-клеточные злокачественные опухоли являются чувствительными к ингибированию PI3K-δ и PI3K-γ.
Пример 11: Клинические испытания при гематологических злокачественных опухолях: продукция цитокинов/хемокинов в сыворотке
[0955] Было выявлено, что предварительная обработка разбавленной цельной крови (1:1) соединением 292 в течение 24 часов приводила к ингибированию продукции цитокинов (например, TNF-α и IL-10), стимулированной 100 мкг/мл LPS (фиг.14). Для дальнейшего исследования эффекта соединения 292 на продукцию цитокинов/хемокинов, образцы сыворотки собирали от индивидуумов, которые участвовали в клинических испытаниях соединения 292 против гематологических злокачественных опухолей. Сывороточные концентрации панели цитокинов/хемокинов человека определяли с помощью 96-луночного иммуноанализа Milliplex, как описано ниже.
[0956] Сбор и хранение образцов: крови позволяли свернуться в течение по меньшей мере 30 минут перед центрифугированием в течение 10 минут при 1000xg. Сыворотку удаляли и либо анализировали сразу, либо распределяли аликвотами и хранили при ≤-20°C. При использовании замороженных образцов рекомендуется разморозить образцы полностью, хорошо перемешать встряхиванием и центрифугировать перед применением в анализе для удаления частиц.
[0957] Получение сывороточного матрикса: 1,0 мл деионизированной воды добавляли в бутылку, содержавшую лиофилизированный сывороточный матрикс (каталожный номер MX HSM от MILLIPLEX® Map), и ему позволяли хорошо перемешаться в течение по меньшей мере 10 минут для полного разбавления.
[0958] Методика анализа: 200 мкл буфера для промывания добавляли в каждую лунку планшета. Планшет закрывали и перемешивали на устройстве для встряхивания планшетов в течение 10 минут при комнатной температуре (20-25°C). Буфер для промывания декантировали и остаточное количество удаляли из всех лунок путем переворачивания планшета и постукивания его аккуратно на впитывающих полотенцах несколько раз. В соответствующие лунки добавляли 25 мкл каждого стандарта или контроля. Для стандарта 0 пг/мл (фоновый уровень) использовали буфер для анализа. 25 мкл буфера для анализа добавляли в лунки с образцами. 25 мкл соответствующего матриксного раствора добавляли в лунки фонового уровня, стандартов и контрольные лунки. 25 мкл образца сыворотки добавляли в соответствующие лунки. В каждую лунку добавляли 25 мкл смешанных или предварительно смешанных гранул для исследуемых цитокинов/хемокинов. Планшет закрывали с помощью приспособления для заклеивания планшетов, оборачивали фольгой и инкубировали при встряхивании на устройстве для встряхивания планшетов в течение ночи при 4°C или в течение 2 часов при комнатной температуре (20-25°C). Инкубация в течение ночи (16-18 ч) может увеличить чувствительность анализа для нескольких анализируемых соединений. Содержимое лунки осторожно извлекали и планшет промывали два раза. В каждую лунку добавляли 25 мкл антител для обнаружения. Затем планшет закрывали, оборачивали фольгой и инкубировали при встряхивании на устройстве для встряхивания планшетов в течение 1 часа при комнатной температуре (20-25°C). В каждую лунку, содержащую 25 мкл антител для выявления, добавляли 25 мкл стрептавидина-фикоэритрина. Затем планшет закрывали, оборачивали фольгой и инкубировали при встряхивании на устройстве для встряхивания планшетов в течение 30 минут при комнатной температуре (20-25°C). Содержимое лунок осторожно удаляли и планшет промывали два раза. Во все лунки добавляли 150 мкл проточной жидкости (или рабочей жидкости, если использовать MAGPIX®). Гранулы ресуспендировали на устройстве для встряхивания планшетов в течение 5 минут.
[0959] Анализ данных: планшет анализировали на Luminex 200™, HTS, FLEXMAP 3DTM или MAGPIX® с помощью программного обеспечения xPONENT. Данные о средней интенсивности флуоресценции (MFI) сохраняли и анализировали с использованием способа аппроксимации 5-параметречиской логистической или сплайновой кривой для вычисления концентраций цитокинов/хемокинов в образцах.
[0960] Результаты: исследованные анализируемые соединения сыворотки включали: (1) сывороточные цитокины/хемокины (EGF, CCL11, FGF-2, лиганд Flt-3, CX3CL1, G-CSF, GM-CSF, CXCL1, CXCL10, IFNα2, IFNγ, IL-α, IL-β, IL-1ra, IL-2, sIL-2Rα, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12 (p40), IL-12 (p70), IL-13, IL-15, IL-17, IL-1ra, IL-1α, IL-1β, IL-2, IL-3, CCL2, CCL7, CCL22, CCL3, CCL4, PDGF-AA, PDGF-AB/BB, CCL5, sCD40L, sIL-2Rα, TGFα, TNFα, TNFβ, VEGF, CCL21, CXCL13, CCL27, CXCL5, CCL24, CCL26, CCL1, IL-16, IL-20, IL-21, IL-23, IL-28, IL-33, LIF, CCL8, CCL13, CCL15, SCF, CXCL12, CCL17, TPO, TRAIL и TSLP); и (2) матриксные металлопротеиназы (MMP-1, MMP-2, MMP-3, MMP-7, MMP-9, MMP-10, MMP-12, MMP-13, TIMP-1 и TIMP-2). Изменение анализируемого соединения в сыворотке определяли путем сравнения образцов сыворотки до и после обработки.
[0961] В одном иллюстративном исследовании образцы сыворотки собирали от пациентов с гематологическими злокачественными опухолями на 1 сутки 1 курса (C1D1), 8 сутки 1 курса (C1D8 или сутки 8), на 1 сутки 2 курса (C2D1 или сутки 28), и на 1 сутки 3 курса (C3D1). Все из CXCL13 (фиг. 15), CCL4 (фиг. 16), CCL17 (фиг. 17), CCL22 (фиг. 18) и TNF-α (фиг. 19) проявляли сниженные сывороточные концентрации при обработке соединением 292 у пациентов с CLL/SLL и iNHL/MCL/FL. Тенденцию к снижению концентрации MMP9 в сыворотке наблюдали при обработке соединением 292 при некоторых показаниях, не являющихся CLL/iNHL (фиг.20). Эти данные демонстрируют, что сниженная сывороточная концентрация CXCL13, CCL4, CCL17, CCL22, TNF-α и/или MMP9 на 28 сутки по сравнению с исходным уровнем у пациентов указывает на эффективность лечения соединением 292 B-клеточных лимфом, T-клеточных лимфом и лейкозов. Увеличение сывороточной концентрации CXCL13, CCL4, CCL17, CCL22, TNF-α и/или MMP9 наблюдали во время C3D1 для определенных пациентов, которые отменили лечение соединением 292 во время курса 2, что далее продемонстрировало, что сывороточная концентрация CXCL13, CCL4, CCL17, CCL22, TNF-α и/или MMP9 действительно указывает на фармакодинамический эффект соединения 292. Не ограничиваясь какой-либо конкретной теорией, возможный механизм действия для этих хемокинов у пациентов с гематологическими злокачественными опухолями представлен на фиг.21.
Пример 12: Экспрессия мРНК изоформы PI3K при гематологических нарушениях
[0962] Анализировали экспрессию мРНК изоформ PI3K (PI3K-α, β, δ и/или γ) при гематологических злокачественных опухолях (например, клеточные линии, типы клеток или образцы ткани гематологических злокачественных опухолей).
[0963] Выделение РНК и количественная ПЦР в реальном времени: РНК выделяли из клеточных осадков с использованием набора RNAqueous®-4PCR kit (Ambion) или материала FFPE с использованием набора Rneasy FFPE (Qiagen). Для каждой реакции объемом 25 мкл в основной смеси One-step master mix (Life technologies#4392938) добавляли пятьдесят нг РНК и анализировали на циклере 7300RT (Applied Biosystems) в течение 40 циклов. Все наборы праймеров и зондов для оценки экспрессии изоформы приобретали от Applied Biosystems: PIK3CA человека (Hs00907957_m1), PIK3CB человека (Hs00927728_m1), PIK3CD человека (Hs00192399_m1), PIK3CG человека (Hs00277090_m1) и GAPDH человека (4310884E). Все исследованные гены нормализовывали к GAPDH. Для вычисления кратности изменения экспрессии генов использовали формулу 2-ΔΔCT, где CT относится к пороговому циклу.
[0964] Выявление РНК PIK3CG и PIK3CD in situ РНК на фиксированных в формалине погруженных в парафин тканях: наборы RNAscope™ FFPE Assay kit для PIK3CG и PIK3CD были разработаны и приобретены от Advanced Cell Diagnostics, Inc (ACD). Каждый набор нацелен на область ~1 т.п.н., и на молекулу РНК нацелено 20 пар зондов, каждый длиной ~50 нуклеотидов (nt). Охват зондами PIK3CG и PIK3CD транскриптов и областей приведен в таблице 19. Все исследованные ткани фиксировали в течение 24 часов в 10% нейтральном забуференном формалине (NBF), обрабатывали, погружали в парафин и нарезали в качестве 5-мкм срезов на заряженные предметные стекла. Перед окрашиванием все предметные стекла помещали в термостат при 60°C и сушили в течение 1 часа. Срезы депарафинизировали в ксилоле (2×5 мин) и регидратировали с помощью серий градиента этанола (100%, 95%) в течение 3 минут в каждом случае. Предметным стеклам позволяли высохнуть в течение 5 минут. Следовали стандартному протоколу для набора, рекомендованному ACD для стадий предварительной обработки 1-2 и амплификации 1-6, как описано ранее (Fay Wang, et al., "RNAscope: A Novel in Situ РНК Analysis Platform for Formalin-Fixed, Paraffin-Embedded Tissues". The Journal of Molecular Diagnositcs, 2012, 14(1): 22-29). Исходя из исследуемого типа образца, определяли следующие оптимальные разведения для предварительной обработки #3: лимфоидная ткань 1:5, ткань лимфомы 1:10 и клеточные осадки 1:15. Для визуализации окрашивания предметные стекла проявляли с помощью хромогенного субстрата DAB и контрастно окрашивали гематогксилином I. Параллельно предметные стекла окрашивали на эндогенный ген домашнего хозяйства PPIB, чтобы убедиться в высоком качестве ткани.
Охват зондами PIK3CG и PIK3CD транскриптов и областей
Экспрессия мРНК изоформы PI3K при гематологических нарушениях
[0965] В одном исследовании анализировали экспрессию мРНК в клеточных линиях B-ALL, MCL, CLL, B-клеточной лимфомы, CTCL, AML, DLBCL, лимфомы Беркитта, T-ALL, CML (бластной фазы), лимфомы Ходжкина, CML, миеломы (например, множественная миелома) и ALCL. Было определено, что CLL имел относительно высокую экспрессию дельта и относительно низкую экспрессию гамма. DLBCL и B-ALL имели высокую экспрессию гамма. Миелома имела низкую экспрессию дельта и экспрессию гамма в широком диапазоне. AML и CML имели относительно высокую экспрессию бета.
[0966] В другом исследовании анализировали экспрессию мРНК при лейкозе у человека в случае педиатрического B-ALL, взрослого B-ALL, CML, лимфомы Беркитта, B-ALL детей младшего возраста, CLL, MDS, AML и T-ALL, и костный мозг без лейкоза/здоровый костный мозг. Было определено, что отсутствовала значительная вариабельность экспрессии дельта среди типов лейкоза (в противоположность клеточным линиям). CLL и T-ALL имели относительно низкую экспрессию гамма. B-ALL имел относительно высокую экспрессию гамма. AML и CML имели относительно высокую экспрессию бета. MDS имел относительно высокую экспрессию бета.
[0967] В другом исследовании анализировали экспрессию мРНК при DLBCL, FL и CTCL, что включало анализ экспрессии мРНК в B-клетках памяти, наивных B-клетках, центроцитах GC, центробластах GC, лимфобластоидных клеточных линиях, при фолликулярной лимфоме (FL) и DLBCL. Было определено, что DLBCL и FL имели широкую экспрессию гамма, которая достигала верхнего предела спектра. CTCL имела относительно экспрессию гамма, возможно вследствие таких факторов, как содержимое опухоли.
Пример 13: Стационарные концентрации соединения 292 в плазме
[0968] После курса из 28 суток с введением 25 мг или 75 мг соединения 292 BID определяли стационарные концентрации соединения 292 на 1 сутки курса 2 (C2D1) с использованием методик, по существу сходных с методиками, описанными выше в примере 8. Как показано на фиг.22, было выявлено, что соединение 292 быстро всасывается, причем максимальная концентрация в плазме, как правило, наблюдается приблизительно через 1 час после введения как при режиме 25 мг, так и при режиме 75 мг. Также было выявлено, что AUC возрастает пропорционально дозе вплоть до 75 мг BID, однако половинное время элиминации не зависит от дозы. Было определено, что средняя стационарная концентрация в плазме до введения дозы после 25 мг BID составляет 390 нг/мл, что указывает на полное подавление PI3K-δ (IC90=361 нг/мл) с ингибированием PI3K-γ (IC50=429 нг/мл) на протяжении интервала между введениями.
Пример 14: Сниженные сывороточные уровни биомаркеров у пациентов с CLL
[0969] После курса из 28 суток с введением 25 мг соединения 292 BID пациентам с CLL, определяли уровни различных цитокинов/хемокинов в сыворотке с использованием платформы Milliplex на основе методик, по существу сходных с методиками, описанными выше в примере 11. Как показано на фиг.23, как на 8 сутки 1 курса 8 (C1D8), так и на 1 сутки 2 курса (C2D1), уровни CXCL13, CCL3, CCL4, CCL17, CCL22, TNFα и IL-12 (p40) были существенно снижены по сравнению с уровнями до дозирования на 1 сутки 1 курса (C1D1). Известно, что эти цитокины/хемокины являются важными для транспорта и функционирования лимфоцитов. Более того, также было выявлено, что CCL1 и IL-10 проявляли сходное снижение после курса из 28 суток, с введением 25 мг или 75 мг соединения 292 BID.
[0970] Когда анализируемые соединения от пациентов с CLL после различных доз соединения 292 объединяли вместе (n=1 при 8 мг BID, 2 при 15 мг BID, 15 при 25 мг BID, и 13 при 75 мг BID) и оценивали в отношении постоянного изменения (снижения или увеличения) сывороточных уровней на C1D8 и/или C2D1 по сравнению с исходным уровнем (уровень до дозирования), 10 из 72 анализируемых соединений снижались после введения соединения 292 по сравнению исходным уровнем, где уровень ни одного из них не увеличивался значительно. Анализируемые соединения, уровни которых снижались после введения соединения 292, включают CXCL13, CCL3, CCL4, IL-10, TNFα, IL-12p40, MMP-9, CCL17, CCL22, CCL1 и CXCL10 (фиг.24). Средние сывороточные уровни этих анализируемых соединения снижались на C1D8, находясь в диапазоне от 16% до 59% от исходного уровня. Интересно, что многие из анализируемых соединений, уровень которых снижается при введении соединения 292, вовлечены в коммуникацию между злокачественными B-клетками и микроокружением. CCL3, CCL4, CCL17 и CCL22 экспрессируются злокачественными B-клетками и могут играть роль в привлечении T-клеток для взаимодействия со злокачественными B-клетками. CXCL13 секретируется стромальными клетками и привлекает злокачественные B-клетки в лимфатические узлы. Кроме того, IL-10 продуцируется многими нормальными типами иммунных клеток, а также неопластическими B-клетками. Известно, что IL-10 является аутокринным фактором роста для линий клеток B-клеточной лимфомы.
[0971] Результаты демонстрируют, что введение соединения 292 вызывает снижение уровней этих цитокинов/хемокинов и обосновывают применение этих цитокинов/хемокинов в качестве биомаркеров для соединений, описанных в настоящем описании, у пациентов с CLL.
Пример 15: Ответ в виде лимфоцитоза в качестве функции исходного абсолютного числа лимфоцитов
[0972] Исходный уровень абсолютного числа лимфоцитов до введения дозы (ALC) определяли в группе пациентов с CLL. В зависимости от исходного уровня ALC, пациентов подразделяли на две категории: (1) пациенты с исходным уровнем ALC, равным или превышающим 10×103/мкл; и (2) пациенты с исходным уровнем ALC менее 10×103/мкл. При начале введения соединения 292 (курс из 28 суток, 25 мг BID), взятие образцов крови проводили от пациентов во время курсов, указанных на фигуре 25, и среднее значение ALC из каждой из двух групп определяли по отдельности от другой группы. Как показано на фиг.25, пациенты с более высоким исходным уровнем ALC продемонстрировали отличающуюся тенденцию в ALC после исходного уровня с течением времени, чем пациенты с более низким исходным ALC. Эти данные указывают на то, что пациенты с более высоким исходным уровнем ALC, вероятно будут иметь значительно более быстрое начало снижения после введения соединения 292, с последующим стабильным снижением среднего уровня ALC, что указывает на то, что пациенты с более высоким исходным уровнем ALC вероятно будут более отвечающими на лечение соединением, описанным в настоящем описании, чем пациенты с более низким исходным уровнем ALC. Как показано на фиг.26, быстрый лимфоцитоз (т.е. быстрое появление), сходный с профилем, который проявляют пациенты с более высоким исходным уровнем ALC, соответствует быстрому уменьшению размера опухоли.
Пример 16: Сниженные уровни сывороточных биомаркеров у пациентов с лимфомой
[0973] После курса из 28 суток с введением 25 мг соединения 292 BID пациентам с лимфомой определяли уровни CXCL13, CCL17 и MMP-9 в сыворотке с использованием платформы Milliplex на основе методик, по существу сходных с методиками, описанными выше в примере 11. Как показано на фиг.27A, как на 8 сутки 1 курса (C1D8), так и на 1 сутки 2 курса (C2D1), уровни CXCL13, CCL17 и MMP-9 были существенно снижены по сравнению с уровнями до введения на 1 сутки 1 курса (C1D1).
[0974] Кроме того, как показано на фиг.27B, CXCX13, CCL17, CCL22 и TNFα продемонстрировали значительное снижение уровней после курса из 28 суток с введением 25 мг соединения 292 BID у пациентов с iNHL. Также было выявлено, что CCL1, CCL17, CXCL13, IL-12 (p40), MMP-12, MMP-9 и TNFα проявляли сходное снижение после курса из 28 суток с введением 25 мг или 75 мг соединения 292 BID у пациентов с iNHL. Кроме того, CCL17, CCL22, CXCL10, CXCL13 и MMP-9 проявляли сходное снижение после курса из 28 суток с введением 25 мг или 75 мг соединения 292 BID у пациентов с MCL, и CCL17, CCL22, CXCL10, CXCL13, MMP-9, CM-CSF и IL-12 (p40) проявляли сходное снижение после курса из 28 суток в введением 25 мг или 75 мг соединения 292 BID у пациентов с T-клеточной лимфомой. Более того, также было показано, что у пациентов с T-клеточной лимфомой CXCL13, IL-12 (p40), MMP-9, CCL17, CCL22, TNFα и TGFα проявляют сходную тенденцию после курса из 28 суток (фиг.28).
[0975] Когда анализируемые молекулы после различных доз соединения 292 у пациентов iNHL объединяли (n=1 при 15 мг BID, 12 при 25 мг BID, 1 при 50 мг BID, и 5 при 75 мг BID) и оценивали в отношении постоянного изменения (снижения или увеличения) сывороточных уровней на C1D8 и/или C2D1 по сравнению с исходным уровнем (уровень до введения дозы), средние сывороточные уровни для 7 анализируемых молекул снижались к C1D8 (находясь в диапазоне от 32% до 70% от исходного уровня), в то время как уровень ни одного из них не увеличивался значительно. 7 анализируемых молекул, уровни которых снижались у индивидуумов с iNHL, представляли собой CXCL13, MMP-9, TNFα, CCL22, CCL1, CCL17 и MMP-12 (фиг.29).
[0976] Результаты демонстрируют, что введение соединения 292 вызывает снижение уровней упомянутых выше цитокинов/хемокинов, и обосновывают применение этих молекул в качестве биомаркеров для соединений, описанных в настоящем описании, у пациентов с лимфомой.
Пример 17: Клиническая активность соединения 292 при синдроме Сезари
[0977] После курса из 28 суток с введением 60 мг соединения 292 BID пациентам с синдромом Сезари следующие критерии исследовали для оценки клинической эффективности соединения 292 при лечении синдрома Сезари: (1) число клеток Сезари в периферической крови; (2) ответ согласно CT; и показатели mSWAT. Число клеток Сезари определяли по следующим общепринятым методикам с использованием проточной цитометрии. Как показано на фиг.30A, в ходе курсов введения наблюдали значительное уменьшение числа клеток Сезари. Ответ согласно CT оценивали в значениях суммы произведений диаметров (SPD). Как показано на фиг.30B, снижение SPD наблюдали по мере прохождения курсов введения. Наконец, показатели mSWAT определяли с использованием общепринятых методик, хорошо известных в данной области (см., например, Olsen et al., Journal of Clinical Oncology, доступную на http://jco.ascopubs.org/cgi/doi/10.1200.JCO.2010.32.0630 (2011)). Как показано на фиг.30C наблюдали спонтанное снижение показателей mSWAT по мере прохождения курсов введения. Эти результаты четко указывают на то, что соединения, описанные в настоящем описании, могут быть эффективными при лечении синдрома Сезари.
Пример 18: Исследования биомаркеров для лечения CLL соединением, селективным в отношении изоформ PI3K
[0978] PI3Kδ сверхэкспрессируется при нескольких B-клеточных злокачественных опухолях, включая хронический лимфоцитарный лейкоз (CLL), в то время как PI3Kγ высоко экспрессируется в солидных опухолях и играет роль в транспорте иммунных клеток. B-клетки при CLL регулируются каскадами PI3K и во взаимодействии с другими иммунными клетками соединение, такое как соединения 292, может иметь влияние на регуляцию выживания B-клеток при CLL. Манипулирование потенциальными мишенями, ассоциированными с каскадом PI3K, вместе с секрецией хемокинов с использованием соединения, такого как соединение 292, может усилить апоптоз B-клеток при CLL.
[0979] Терапевтический ответ (ответ на дозу и время) соединения 292 при CLL с рецидивирующими генетическими повреждениями и неблагоприятным прогнозом: свежеполученные клетки лейкоза CLL от пациентов с CLL обрабатывают широким диапазоном концентраций соединения 292 и сенсибилизацию клеток CLL к соединению 292 измеряют с помощью анализа аннексина/PI и анализа MTS. Инкубация клеток лейкоза в различные периоды времени может определить оптимальную дозу и оптимальное время, при которых соединение 292 индуцирует цитотоксичность в первичных клетках CLL. Анализируют и количественно определяют апоптоз, проницаемость наружной мембраны митохондрий, проводят анализ с MTS и анализируют и количественно определяют расщепление белка PARP с использованием общепризнанных способов, например, Balakrishnan et al., 2010, "Influence of bone marrow stromal microenvironment on forodesine-induced responses in CLL primary cells," Blood 116, 1083-91; Balakrishnan et al., 2009, "AT-101 induces apoptosis in CLL B cells and overcomes stromal cell-mediated Mcl-1 induction and drug resistance", Blood 113, 149-53. Чтобы установить функциональную взаимосвязь между терапевтическим ответом на соединение 292 и клиническими характеристиками пациентов с CLL, в исследование включают подгруппы пациентов с различными прогностическими факторами, такими как стадии Rai, β2-микроглобулин, а также различные цитогенетические факторы, включая трисомию 12, del13q, мутации или делеции 17p и 11q, статус ZAP-70, статус CD38, статус CD49d, и мутации в гене IgHV. Те же группы образцов обрабатывают параллельно другими ингибиторами PI3K, чтобы сравнить селективность и чувствительность индивидуальных ингибиторов киназ.
[0980] Опосредуемое стромой выживание клеток CLL: PI3K и ее нижеследующие мишени активируются в ответ на микроокружение опухоли. Соединение, такое как соединение 292, может нарушать взаимодействия лейкоз-строма при CLL. Первичные клетки CLL сокультивируют со стромальными клетками или без них (стромальные клетки костного мозга; клетки NKTert и микроокружение лимфатических узлов; клетки, подобные клеткам-"сиделкам") [Balakrishnan et al., 2010, "Influence of bone marrow stromal microenvironment on forodesine-induced responses in CLL primary cells", Blood 116, 1083-91; Burger et al., 2000, "Blood-derived nurse-like cells protect chronic lymphocytic leucosis B cells from spontaneous apoptosis through stromal cell-derived factor-1", Blood 96, 2655-63.] в присутствии или в отсутствие ингибитора PI3K, и количественно определяют апоптоз, проницаемость наружной мембраны митохондрий, проводят анализ MTS и измеряют расщепление белка PARP [Balakrishnan et al., 2010, выше; Balakrishnan et al., 2009, выше.]. Для оценки роли микроокружения используют модель соскультивирования CLL-строма [Balakrishnan et al., 2010, выше], которая была разработана и исследована при CLL [Balakrishnan et al., 2009, выше]. Эти результаты используют для исследования основы преимуществ выживаемости CLL вследствие разнообразного микроокружения и устранения этой защиты ингибитором PI3K.
[0981] Молекулярный механизм, вовлеченный в активность соединения 292 в первичных клетках CLL: PI3K является нижеследующей молекулой передачи сигнала BCR, которая является главной терапевтической мишенью при CLL. Активация PI3K может влиять на нижеследующие мишени, такие как киназы Akt или Erk и вещества-мишени. Для оценки молекулярных событий, регулируемых в процессе обработки ингибитором PI3K, посттрансляционные модификации белков-мишеней, таких как Akt и Erk, оценивают путем обработки антителами, которые могут обнаруживать фосфорилирование Akt в Ser473 и Erk в Thr202/Tyr204 весте с нижеследующими медиаторами, такими как фосфо-PRAS и S6. Кроме того, определяют профили уровней экспрессии изоформ PI3K (например, гамма и дельта) из каждого исследуемого образца и устанавливают корреляцию относительных уровней с клеточным ответом на ингибитор. Соединение 292 может манипулировать клетками совместно с иммунной системой и, тем самым, продукцией хемокинов. Измеряют уровни хемокинов C-X и C-C, таких как CXCL12, CXCL13, CCL2 и CCL3, для которых показано, что они играют роль в патогенезе CLL (Sivina et al., 2011, "CCL3 (MIP-1alpha) plasma levels and the risk for disease progression in chronic lymphocytic leukemia", Blood 117, 1662-69). Как лизат, так и кондиционированную среду из этих исследований, также анализируют в отношении других потенциальных факторов.
Пример 19: Корреляция между ингибированием роста и ответами PD в клеточных линиях DLBCL
[0982] Различные клеточные линии DLBCL исследовали в отношении чувствительности к лечению соединением 292 с использованием анализа CTG в течение 72 часов. Было выявлено, что клетки Ri-1 (подтип ABC) и DHL-4 и DHL-6 (оба подтип GCB) являются более чувствительными, чем другие клеточные линии DLBCL (данные не представлены). Эти три отвечающих клеточных линии и клеточную линию U2932 (не отвечающая на соединение 292), обрабатывали DMSO (контроль) и соединением 292 в концентрациях 0,001, 0,01, 0,1 и 1 мкМ. Через 1 час после обработки оценивали уровни различных белков с помощью вестерн-блоттинга, результаты которого представлены на фиг.31. Как показано на фиг.31, во всех отвечающих клеточных линиях (SU-DHL-6, SU-DHL-4 и Ri-1), уровни pAKT, pPRAS40 и pS6 снижаются при обработке соединением 292 дозозависимым образом, хотя ответы pPRAS40 и pS6 не были настолько стойкими. Важно, что, хотя клетки DHA 4 имели высокие исходные уровни pBTK, было показано, что уровень pBTK не модулировался введением соединения 292. Кроме того, было показано, что pERK в некоторой степени модулировалась в отвечающих клеточных линиях, но степень модулирования была несколько менее значимой, чем у других хорошо модулируемых белков. Эти результаты указывают на то, что соединение 292 может не действовать через каскад BTK или MEK, и, таким образом, обеспечивает обоснование для использования ингибиторов BTK или MEK в комбинации с соединением, описанным в настоящем описании.
Пример 20: Синергический эффект комбинирования соединения 292 и ингибитора BTK
[0983] Активация каскада PI3K является важным компонентом нормальной передачи сигнала B-клеточного рецептора (BCR), и она вовлечена в патогенез DLBCL. Для дальнейшего исследования роли передачи сигнала PI3K в клеточных линиях DLBCL с различными молекулярными профилями, панель из более чем 10 клеточных линий DLBCL обрабатывали соединением 292. Было выявлено, что PI3K-δ и PI3K-γ экспрессируются на различных уровнях в панели клеточных линий DLBCL без признаков корреляции с молекулярным подтипом. В анализе ингибирования роста клеток 3 клеточных линии, включая 2 линии подтипа GCB (SU-DHL-4, SU-DHL-6) и 1 линию подтипа ABC (Ri-1) были чувствительными к обработке соединением 292 в наномолярном (нМ) диапазоне, а другие 2 клеточных линии GCB (OCI-LY-8 и WSU-DLCL-2) были умеренно чувствительными с IC50 в низком микромолекулярном (мкМ) диапазоне. Несколько клеточных линий (OCI-LY3, Pfeiffer, Toledo и U2932) были нечувствительными к соединению 292 (IC50>50 мкМ). Отсутствовали признаки корреляции между чувствительностью к соединению 292 и молекулярным профилем по COO (клетка происхождения) или CC (консесусная кластеризация) в этой панели. Чувствительность к соединению 292 коррелировала с признаками ингибирования каскада PI3K при измерении по снижению фосфо-AKT. Для лучшей охарактеризации кинетики модулирования каскада фосфорилирование AKT, PRAS40 и S6 исследовали после обработки соединением 292 с течением времени в выбранных клеточных линиях. Происходило быстрое модулирование фосфо-AKT и фосфо-PRAS40 в пределах 30 минут, в то время как модулирование фосфо-S6 не обнаруживалось вплоть до 8 часов. При стимуляции BCR путем индуцируемого антителом связывания, некоторые клеточные линии проявляли усиленное фосфорилирование AKT, которое могло ингибироваться соединением 292. Клеточная линия GCB OCI-LY-8 была умеренно чувствительной к соединению 292 без связывания BCR (низкий мкМ диапазон) и проявляла увеличенную чувствительность к соединению 292 при связывании BCR (нМ диапазон). Эти результаты указывают на то, что интактный каскад передачи сигнала BCR вносит вклад в чувствительность к соединению 292 в клеточных линиях DLBCL, независимо от подтипа COO или CC.
[0984] Активность соединения 292 также исследовали в комбинации с ибрутинибом, необратимым ингибитором тирозинкиназы агаммаглобулинемии Бруттона (BTK). Интересно, в условиях связывания BCR клетки OCI-LY-8 проявляли стойкое увеличение фосфо-AKT, которое полностью ингибировалось соединением 292, но только частично ингибировалось ибрутинибом. В других клеточных линиях, таких как SU-DHL-4, наблюдали стойкое ингибирование фосфо-BTK при обработке ибрутинибом, но не соединением 292. Эти биохимические данные указывают на механистическое обоснование для комбинирования ингибирования PI3K-δ,γ и BTK. Кроме того, значительный эффект комбинирования наблюдали в анализе ингибирования роста клеток с соединением 292 вместе с ибрутинибом в клеточной линии SU-DHL-4 и в клеточной линии OCI-LY-8 при связывании BCR.
[0985] В другом иллюстративном исследовании различные клеточные линии DLBCL высевали в 96-луночные планшеты в трех экземплярах и через 4-6 часов после посева добавляли исследуемые соединения (комбинация соединения 292 и ибрутиниба). После обработки лекарственным средством в течение 72 часов клетки инкубировали с реагентом Cell Titer Glo (Promega). Для определения индекса комбинирования (CI) использовали фиксированное соотношение лекарственных средств и вычисляли величины CI с использованием CalcuSyn. Результаты приведены в таблице 20 ниже.
Синергические эффекты комбинирования соединения 292 и ибрутиниба
Пример 21: Чувствительность клеточных линий с делецией PTEN к соединению 292
[0986] Сто сорок пять (145) разновидностей клеточных линий с делецией PTEN обрабатывали соединением 292, и для этих разновидностей определяли чувствительность к соединению 292. Было выявлено, что исследованные клеточные линии являются по-разному чувствительными к обработке соединением 292. Важно, что было выявлено, что клетки с PTEN дикого типа не чувствительны к соединению 292, что подразумевает, что мутация PTEN может играть роль в сообщении клеткам чувствительности к лечению соединением 292.
Пример 22: Чувствительность клеток T-ALL к различным ингибиторам PI3K и доксорубицину
[0987] Различные клеточные линии ALL человека и мыши, включая клеточные линии с дефицитом PTEN (Loucy, Molt-4 luc, CCRF-CEM, p12 Ichikawa, Karpas-45 и CEM/C2) и клеточные линии с PTEN дикого типа (Molt-13 и Molt-16) обрабатывали соединением 292, и оценивали ингибирование роста. Обработка приводила к различным степеням ингибирования роста, причем клеточная линия Loucy с дефицитом PTEN демонстрировала наибольшую чувствительность с IC50 245 нМ. В исследованных клеточных линиях ингибирование роста соединением 292 наблюдали только в клеточных линиях с дефицитом PTEN, в то время как все клеточные линии с PTEN дикого типа были устойчивыми к соединению 292 (данные не представлены). Кроме того, было выявлено, что обе клеточных линии мыши, происходящие из трансгенной модели T-ALL с дефицитом PTEN (т.е. LPN049 и LPN236) являются чувствительности к лечению соединением 292 при измерении с помощью анализа с MTT.
[0988] Для дальнейшего исследования индивидуального вклада различных изоформ PI3K на рост клеток T-ALL, клетки ALL Loucy обрабатывали доксорубицином и различными ингибиторами PI3K, как показано на фиг.32, в различных концентрациях, как обозначено на фиг. Как показано на фиг.32, ингибиторы PI3K изоформ δ или γ продемонстрировали постепенное увеличение процентного ингибирования клеток Loucy по мере увеличения доз. Однако, было показано, что ингибитор PI3K β является менее эффективным в отношении ингибирования клеток Loucy, чем ингибиторы других изоформ. Результаты указывают на то, что чувствительность к соединению 292 (и другим ингибиторам PI3K δ и/или γ), вероятно, является следствием ингибирования изоформ δ и/или γ PI3K, но, вероятно, не связана с изоформой β.
[0989] Более того, на фиг.32 также показано, что чувствительность клеток Loucy к доксорубицину демонстрирует профиль, отличный от профиля чувствительности к ингибиторам PI3K. Такие отличающиеся профили чувствительности могут служить обоснованием для комбинирования доксорубицина с соединением, описанным в настоящем описании.
Пример 23: Чувствительность клеток CTCL к соединению 292
[0990] Чувствительность клеточных линий CTCL к обработке соединением 292 оценивали с использованием следующих клеточных линий: клетки, происходящие из синдрома Сезари, HH; клетки, происходящие из синдрома Сезари, HuT78; и клетки, происходящие из фунгоидного микоза, MJ. Клетки MJ и HuT78 выращивали в IMDM 20% FBS, и клетки HH выращивали в RPMI 10% FBS. Для анализа цитотоксичности клетки инкубировали с соединением 292 в течение 72 часов. После инкубации с соединением 292 или без него в течение 1 или 2 часов, клетки подвергали анализу белка с использованием вестерн-блоттинга, исходя из следующей общей методики.
[0991] Клетки промывали свежей средой и лизировали добавлением 1x буфера для образцов с SDS, а затем обрабатывали ультразвуковым излучением. После нагревания образца при 95-100°C в течение 5 минут и охлаждения на льду образец подвергали микроцентрифугированию и разделяли на SDS-PAGE. Полученные образцы подвергали электропереносу на нитроцеллюлозную мембрану или PVDF-мембрану. После промывания мембрану инкубировали в блокирующем буфере в течение 1 часа при комнатной температуре, а затем промывали TBS/T. Затем мембрану и первичные антитела инкубировали в течение ночи при 4°C. Мембрану вновь промывали TBS/T и инкубировали с соответствующими конъюгированными с HRP вторичными антителами. Для биотинилированных первичных антител мембрану инкубировали с HRP-стрептавидином в молоке. После завершения инкубации мембрану промывали TBS/T и подвергали детекции с использованием LumiGLO®.
[0992] Как показано на фиг.33, было выявлено, что уровень pPRAS40 дозозависмым образом снижался соединением 292 в исследованных клетках. Кроме того, исследование цитотоксичности показало, что клетки HH являются более чувствительными к обработке соединением 292, чем клетки MJ или HuT78. Действительно, клетки MJ были устойчивыми к обработке соединением 292 или GS-1101, и клетки HuT78 продемонстрировали умеренную чувствительность. Было выявлено, что уровень pERK1/2 является наиболее низким в клетках HH по сравнению с клетками MJ или HuT78, что указывает на то, что высокий уровень ERK может быть маркером нечувствительности к лечению соединением 292. Более того, было выявлено, что pS6 не модулируется в устойчивых клетках MJ, что указывает на то, что модулирование pS6 соединением, описанным в настоящем описании, может быть более важным для эффективности уничтожения злокачественных клеток. Эти результаты также указывают на то, что модулирование pS6 также может быть биомаркером для прогнозирования эффективности лечения соединением, описанным в настоящем описании.
Пример 24: Соединение 292 ингибирует пролиферацию клеток CLL в лимфатических узлах
[0993] Для имитации пролиферативного эффекта псевдофолликула лимфатического узла, клетки CLL стимулировали к пролиферации с помощью CD40L/IL-2/IL-10 и количественно определяли эффект соединения 292. Главным образом, клетки CLL высевали и инкубировали с коктейлем для пролиферации (содержащий sCD40L, rH-IL 10 и rH-IL 2) в среде. Затем проводили четырехцветный анализ FACS с использованием антител к pAKT, Ki-67, CD19 и CD5.
[0994] Как показано на фиг.34, было выявлено, что коктейль цитокинов из CD40L/IL-2/IL-10 значительно увеличивает процентное число положительной по pAKT/Ki 67 клеточной популяции. Это указывает на то, что цитокиновый коктейль может имитировать пролиферативные сигналы микроокружения и индуцировать передачу сигнала PI3K и пролиферацию клеток при CLL.
[0995] Экспрессия как pAKT, так и Ki-67 значительно ингибировалась в первичных клетках CLL при концентрации соединения 292 в низком наномолярном диапазоне (EC50 < 10нМ; n=2), что указывает на мощный антипролиферативный эффект соединения 292 в отношении клеток CLL в узловом окружении (фиг.35 и 36). Следовательно, результаты указывают на то, что соединение 292 может ингибировать пролиферацию клеток CLL в лимфатических узлах. Кроме того, этот прямой ингибиторный эффект на клетки CLL в лимфатических узлах может приводить к быстрым и длительным ответам у пациентов со злокачественной опухолью. Таким образом, результаты также указывают на то, что соединение 292 способно вызывать быстрое появление ответа у пациентов с CLL. Учитывая значительную роль хемоаттрактанта SDF-1 (CXCL13) в направленной миграции B-клеток, анализ хемотаксиса продемонстрировал уменьшение миграции клеток CLL с помощью соединения 292 (% от снижения в случае контроля - среднее значение 23%; диапазон 2-42%; n=8). Более того, обработка соединением 292 усиливала продукцию активных форм кислорода (n=6).
Пример 25: Селективное снижение количества положительных по CD38/CD69 клеток с помощью соединения 292 у пациентов с CLL
[0996] Эффекты соединения 292 в ряде клеток CLL, ассоциированные с заболеванием высокого риска (положительные по CD38/CD69 клетки CLL) оценивали с использованием фосфоспецифической проточной цитометрии. В кратком изложении восьми (8) пациентам с CLL вводили соединение 292 в дозе 25 мг BID, и проводили взятие образцов через 1, 2, 4 и 24 часа после введения на 1 сутки курса 1, и на 1 сутки курса 2 (28 суток после курса 1), на 1 сутки курса 3 (56 суток после курса 1), и на 1 сутки курса 4 (84 суток после курса 1). Для охарактеризации поверхностного фенотипа клеток, присутствующих у пациентов с CLL, в панель включали антитела против, среди прочих, CD38 и CD69 и образцы подвергали фосфороспецифической проточной цитометрии.
[0997] Результаты фосфороспецифической проточной цитометрии наносили на график, и они представлены на фиг.37. Как показано на фиг.37, было выявлено, что происходило значительное снижение CD38-положительных циркулирующих клеток CLL, CD69-положительных циркулирующих клеток CLL, двойных положительных CD38/CD69 циркулирующих клеток CLL при обработке соединением 292. Результат указывает на то, что соединение 292 может селективно уменьшать количество клеток CLL, ассоциированных с заболеванием высокого риска.
Пример 26: Эффекты соединения 292 в комбинации с ибрутинибом на клетки DLBCL
[0998] Клеточную линию SU-DHL-4 GCB DLBCL обрабатывали различными количествами соединения 292 или ибрутиниба отдельно или соединением 292 (различные количества) в комбинации с 11 нМ или 33 нМ ибрутинибом. Через 72 часа измеряли жизнеспособность клеток с использованием CellTiter Glo®, и результаты представлены на фиг.38. Как показано на фиг., как монотерапия, так и комбинированная терапия, дозозависимым образом ингибировали жизнеспособность клеток DLBCL. Более того, комбинация, в частности с 33 нМ ибрутинибом, продемонстрировала увеличенную эффективность по сравнению с монотерапией.
Пример 27: Эффекты соединения 292 у пациентов с CLL, у которых ранее произошло прогрессирование после введения ибрутиниба
[0999] Семи пациентам, у которых произошло прогрессирование при лечении ибрутинибом, вводили соединение 292 в дозировке либо 25 мг BID, либо 75 мг BID. Взятие образцов крови проводили до введения дозы, через 1, 2, 4 и 24 часа после первой дозы на 1 сутки 1 курса (C1D1). Уровень фосфорилирования AKT по Ser473 определяли проточной цитометрией и результаты представлены на фиг.39, на которой показано, что соединение 292 ингибирует pAKT у пациентов с CLL, у которых ранее произошло прогрессирование при введении ибрутиниба. Пациент 1 имеет мутацию C481F BTK и PLCgamma2 дикого типа. Пациент 3 имеет мутацию C481S BTK и PLCgamma2 дикого типа. Пациент 4 имеет мутацию C481S BTK и PLCgamma2 дикого типа. Пациент 5 имеет BTK дикого типа и мутацию H244R PLCgamma2. Пациент 6 имеет BTK дикого типа и PLCgamma2 дикого типа. Пациент 7 имеет мутации M1141R и S707F PLCgamma2.
Пример 28: Исследования комбинаций соединения 292 и ингибиторов BTK
[1000] Исследовали синергические эффекты соединений, описанных в настоящем описании, и другого лекарственного средства. Способ является следующим. Клетки размораживают из сохраненного в жидком азоте состояния. После увеличения клеток в количестве и их деления в ожидаемые для них периоды времени удвоения, начинают скрининг. Клетки высевают в среде для роста в черные либо 1536-луночные, либо 384-луночные обработанные планшеты для культивирования тканей. Затем клетки уравновешивают в планшетах для анализа посредством центрифугирования и помещают в инкубаторы, подсоединенные к дозирующим модулям при 37oC в течение 24 часов перед обработкой. В момент обработки набор планшетов для анализа (в которых не проводят обработку) собирают и измеряют уровни ATP путем добавления ATPLite (Perkin Elmer). Считывание этих планшетов Tzero (T0) проводят с использованием сверхчувствительной люминесценции на устройствах для считывания планшетов Envision (Perkin Elmer). Обработанные планшеты для анализа инкубируют с соединением в течение 72 часов. Через 72 часа планшеты проявляют для конечного анализа с использованием ATPLite. Все данные получают посредством автоматизированного процесса, подвергают контролю качества и анализируют с использованием программного обеспечения Zalicus. Планшеты для анализа принимают, если они проходят испытание контроля качества по следующим стандартам: относительные величины люциферазы являются согласующимися на протяжении всего эксперимента, показатели Z-фактора превышают 0,6, контроли без обработки/в виде носителя имеют согласующееся поведение на планшете.
[1001] Ингибирование (I) определяют как
I=(1-T/V)*100%
где T представляет собой число обработанных клеток и V представляет собой число необработанных (носитель) клеток (через 72 часа). I находится в диапазоне от 0% (когда T=V) до 100% (когда T=0). Величину IC50 определяют как концентрацию лекарственного средства, требуемую для ингибирования 50% роста клеток по сравнению с ростом клеток, которые были обработаны носителем (концентрация лекарственного средства, которая дает I=50%). Показателем эффекта в эксперименте может быть ингибирование клеточного ответа относительно уровня без обработки (только носитель). Для уровней для носителя без обработки и для обработки V и T вычисляют парциальное ингибирование I=1-T/V. Ингибирование находится в диапазоне от 0% на уровне без обработки до 100%, когда T=0. Уровни ингибирования являются отрицательными для средств, которые в действительности повышают уровни. Другие показатели эффекта, такие как соотношение активности r=T/V, могут быть более пригодными для некоторых анализов. Когда используют соотношения активностей (например, кратное увеличение относительно контроля со стимуляцией), эффект можно измерять с использованием индукции I=ln(T/V). С использованием этого определения все выражения эффекта являются такими же, как и для ингибирования.
[1002] Ингибирование роста (GI) используют в качестве показателя жизнеспособности клеток. Жизнеспособность клеток в случае носителя измеряют в момент дозирования (T0) и через 72 часа (T72). Данные GI 0% соответствуют отсутствию ингибирования роста при сопоставлении сигналов обработки соединением -T72 и обработки носителем T72. Данные GI 100% соответствуют полному ингибированию роста при сопоставлении сигналов обработки соединением -T72 и обработки носителем T0. Количества клеток не увеличиваются в течение периода обработки в лунках с GI 100%, и это может указывать на цитостатический эффект соединения, достигающий плато на этом уровнем эффекта. Данные GI 200% соответствуют полной гибели всех клеток в лунке планшета для культивирования. Соединения, достигающие плато активности GI 200%, считаются цитотоксическими. GI вычисляют с использованием следующего критерия и уравнения:
где T представляет собой показатель сигнала для исследуемого изделия, V представляет собой показатель обработанного носителем контроля, и V0 представляет собой показатель контроля в виде носителя в нулевой момент времени. Эта формула получена путем вычисления ингибирования роста, используемого для высокопроизводительного скрининга NCI-60 в National Cancer Institute.
[1003] Данные анализа комбинирования собирали в матрицу доз 6x6. Синергию вычисляют путем сравнения ответа на комбинацию с ответом на одно соединение относительно эталонной аддитивной модели дозы лекарственного средства с этим же лекарственным средством. Отклонения от аддитивности доз можно оценивать визуально на изоболограмме или в числовой форме с использованием индекса комбинирования (CI). См. таблицу 3 ниже для CI при 50% ингибировании и CI при 50% ингибировании роста. Аддитивный эффект представляет собой CI=1,0. Синергический эффект представляет собой CI<1. Антагонистический эффект представляет собой CI>1,0.
[1004] Сдвиг эффективности оценивали с использованием изоболограммы, которая демонстрирует, несколько меньше лекарственного средства требуется в комбинации для достижения желаемого уровня эффекта по сравнению с дозами одного средства, требуемыми для достижения этого эффекта. Изоболограмму строили путем идентификации области концентрации, которая соответствует пересечению с указанным уровнем ингибирования. Это осуществляют путем поиска точки пересечения для концентрации каждого отдельного средства в матрице доз напротив концентраций другого единичного средства. Практически, каждую концентрацию CY по вертикали сохраняют постоянной, в то время как для идентификации концентрации CX по горизонтали в комбинации с этой вертикальной дозой, которая дает выбранный уровень эффекта на поверхности ответа Z(CX,CY), используют алгоритм двоичного поиска. Затем эти концентрации соединяют посредством линейной интерполяции с получением представления изоболограммы. Для синергических взаимодействий контур изоболограммы находится ниже порога аддитиивности и приближается к исходной точке и антагонистическое взаимодействие лежит выше порога аддитивности. Планка погрешности соответствует погрешности вследствие отдельных точек данных, использованных для построения изоболограммы. Погрешность для каждой точки пересечения оценивают из ошибок ответа с использованием двоичного поиска для установления концентраций, где Z-σZ(CX,CY) и Z+σZ(CX,CY) пересекают Icut, где σZ представляет собой стандартное отклонение остаточной ошибки по шкале эффекта.
[1005] Для измерения эффектов комбинации, превышающих аддитивность по Леве, разрабатывают скалярную меру для охарактеризации силы синергического взаимодействия, называемую показателем синергии. Показатель синергии вычисляют как:
Парциальное ингибирование для каждого составляющего средства и точки комбинирования в матрице вычисляют относительно медианы для всех контрольных лунок, обработанных носителем. Уравнение синергии интегрирует экспериментально наблюдаемый объем активности в каждой точке матрицы свыше модельной поверхности в цифровой форме, установленной из активности составляющих средств с использованием модели Леве для аддитивности. Дополнительные члены уравнения показателя синергии (выше) используют для нормализации по различным коэффициентам разведения, используемым для индивидуальных средств, и для обеспечения сравнения показателей синергии для всего эксперимента. Включение положительного отбора по ингибированию или множителя Idata устраняет шум вблизи нулевого уровня эффекта и смещает результаты в сторону синергических взаимодействий, которые происходят при более высоких уровнях активности.
[1006] Показатель синергии использовали для анализа самопересечений. Ожидается, что показатели синергии для самопересечений будут аддитивными по определению и, таким образом, сохранят показатель синергии, равный нулю. Однако, хотя некоторые показатели синергии для самопересечений являются близкими к нулю, многие превышают ноль, что указывает на то, что экспериментальный шум или неоптимальная аппроксимация кривой ответов на дозу одного средства приводят к небольшим искажениям показателя. Эта стратегия центрировалась на клеточной линии, фокусируясь на поведении самопересечения в каждой клеточной линии относительно глобального рассмотрения активности панели клеточных линий. Комбинации, где показатель синергии превышает среднее значение самопересечений плюс два стандартных отклонения или три стандартных отклонения, можно считать подходящей синергией при 95% и 99% доверительном уровне, соответственно. Аддитивность должна сохранять показатель синергии, равный нулю, и показатель синергии, составляющий два или три стандартных отклонения, указывает на то, что комбинация является синергической на статистически значимых уровнях 95% и 99%.
[1007] Объем по Леве (Loewe Vol) используют для оценки общей величины взаимодействия комбинации свыше модели аддитивности по Леве. Объем по Леве, в частности, является пригодным при различении синергического увеличения фенотипической активности (положительный объем по Леве) и синергического антагонизма (отрицательный объем по Леве). Когда наблюдают антагонизм, как в имеющемся наборе данных, объем по Леве следует оценивать для исследования того, существует ли какая-либо корреляция между антагонизмом и конкретной заданной активностью лекарственного средства или клеточным генотипом. Эта модель определяет аддитивность как несинергическое взаимодействие комбинации, где матрица доз комбинации должна быть неотличимой от любого лекарственного средства при пересечении с самим собой. Вычисление для аддитивности по Леве представляет собой:
I Loewe, что удовлетворяет (X/XI)+(Y/YI)=1
где XI и YI представляют собой эффективные концентрации одного средства для наблюдаемого эффекта комбинации I. Например, если ингибирование 50% достигается отдельно посредством 1 мкМ лекарственного средства A или 1 мкМ лекарственного средства B, комбинация 0,5 мкМ A и 0,5 мкМ также должна осуществлять ингибирование на 50%.
Результаты
[1008] Величины CI50 для ингибирования роста и ингибирования в таблице 21 распределены на категории следующим образом: S = от 0,01 до <0,5, T = от 0,5 до <0,7, U = от 0,7 до <1 и W = ≥1.Величины CI50 вычисляют, исходя из 5-кратного снижения количества соединения 292 в комбинациях по сравнению с количеством соединения 292 отдельно.
[1009] Величины показателя синергии для ингибирования роста и ингибирования распределены на категории следующим образом: A1 = от 0,0001 до <1, A2 = от 1 до <3, и A3=>3.
[1010] Исследованные типы клеточных линий представляют собой диффузную крупноклеточную B-клеточную лимфому (DBCL), подобную активированным B-клеткам (ABC), DBCL, подобную B-клеткам герминативного центра (GCB), фолликулярную лимфому, лимфому из клеток мантийной зоны, множественную миелому и T-клеточную лимфому. Эти клеточные линии могут иметь различные геномные профили и, таким образом, комбинация соединения 292 и лекарственного средства может иметь различные синергические эффекты на эти клеточные линии. Данные показывают, что комбинация соединения 292 и лекарственного средства обеспечивает синергический эффект в различных типах клеточных линий.
[1011] Хотя иллюстративные варианты осуществления настоящего изобретения представлены и описаны в настоящем описании, специалистам в данной области будет понятно, что такие варианты осуществления предоставлены только в качестве примера. Многочисленные варьирования, изменения и замены теперь доступны специалистам в данной области без отклонения от сущности изобретения. Следует понимать, что при применении на практике изобретения можно использовать различные альтернативы вариантам осуществления, описанным в настоящем описании. Подразумевается, что представленная ниже формула изобретения определяет объем изобретения, и что она охватывает способы и структуры в объеме этих пунктов формулы изобретения и их эквивалентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ МОДУЛЯТОРОВ ИЗОФОРМ PI3-КИНАЗЫ | 2013 |
|
RU2702908C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2017 |
|
RU2754507C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО РЕЦЕПТОРА АНТИГЕНА ПРОТИВ CD19 | 2015 |
|
RU2718542C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЛИМФОМЫ | 2019 |
|
RU2784243C2 |
| СПОСОБЫ И КОМБИНИРОВАННОЕ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РАКА ЖЕЛЧНЫХ ПРОТОКОВ | 2019 |
|
RU2793543C2 |
| ТЕТРАГИДРОПИРАНИЛ АМИНО-ПИРРОЛОПИРИМИДИНОН И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2020 |
|
RU2747991C1 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО РЕЦЕПТОРА АНТИГЕНА ПРОТИВ CD19 | 2015 |
|
RU2815417C2 |
| КОМБИНАЦИЯ ИНГИБИТОРА PIK3 И ИНГИБИТОРА С-МЕТ | 2013 |
|
RU2705095C2 |
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ SMOOTHENED ДЛЯ ЛЕЧЕНИЯ СВЯЗАННЫХ С ПУТЕМ HEDGEHOG НАРУШЕНИЙ | 2009 |
|
RU2519200C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ | 2014 |
|
RU2644769C2 |

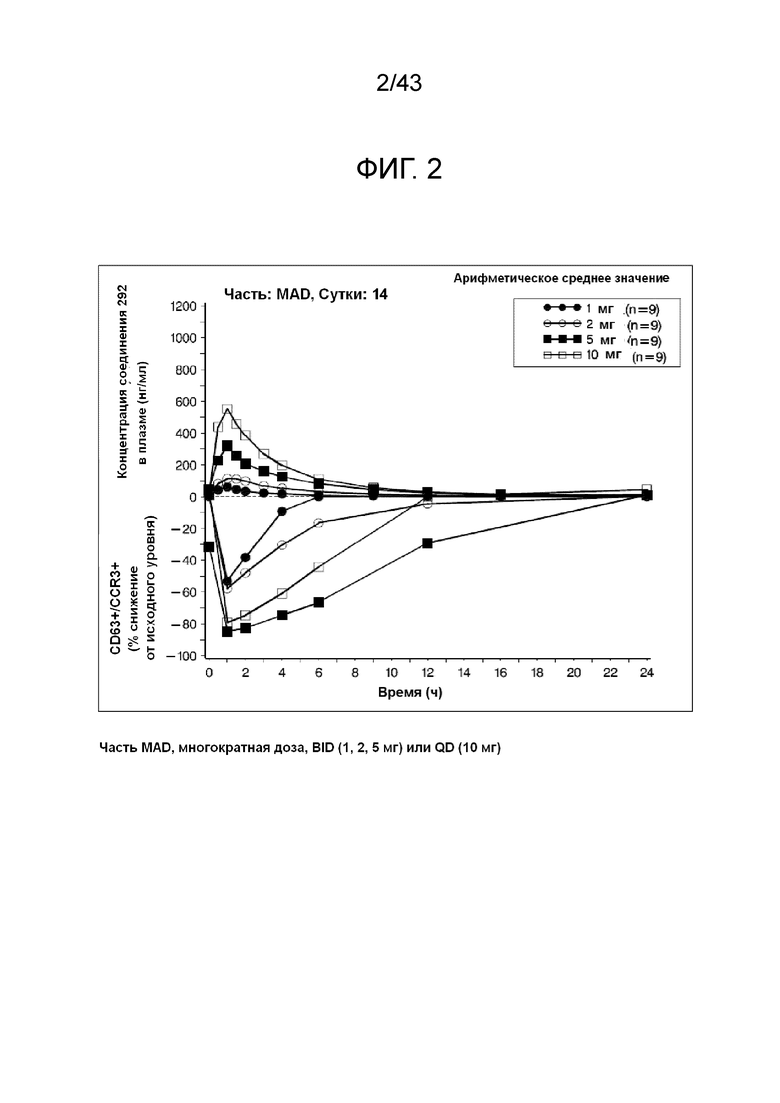




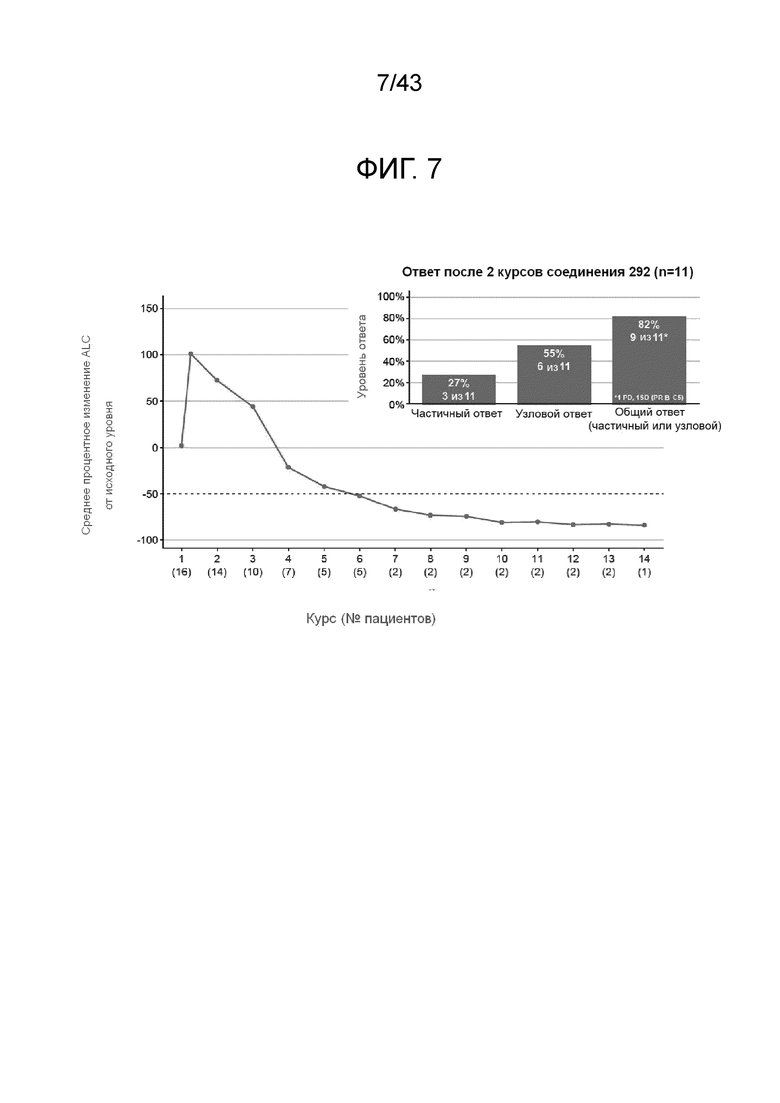





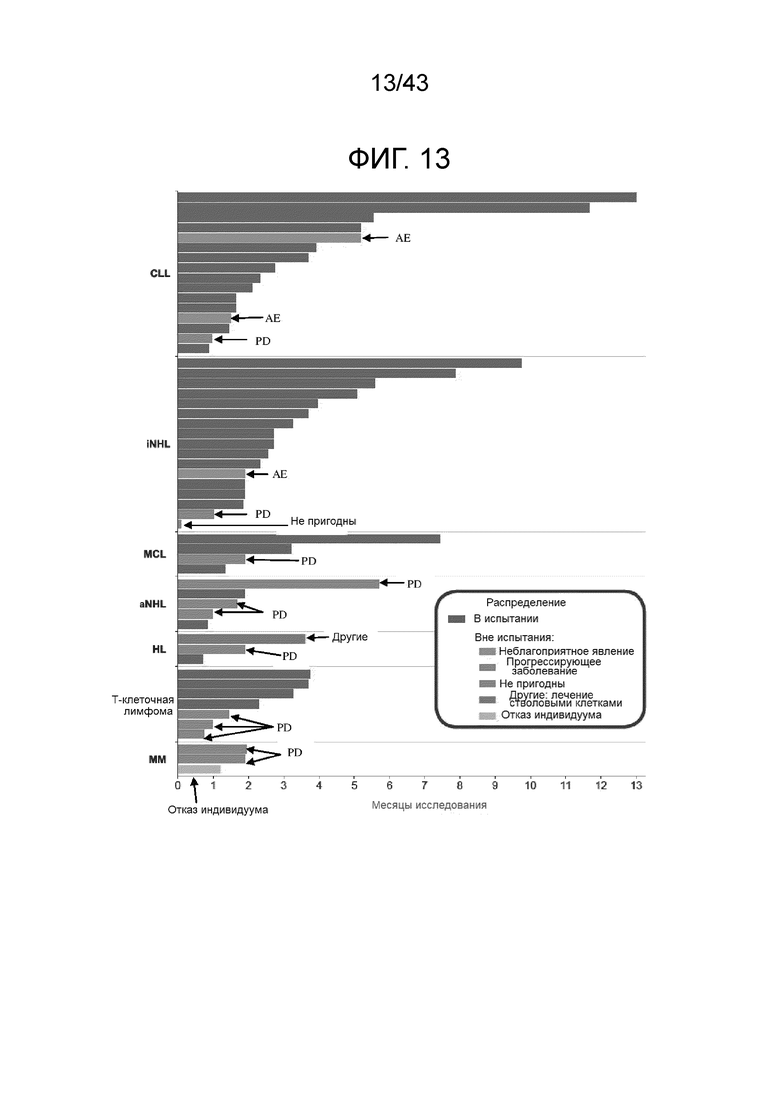
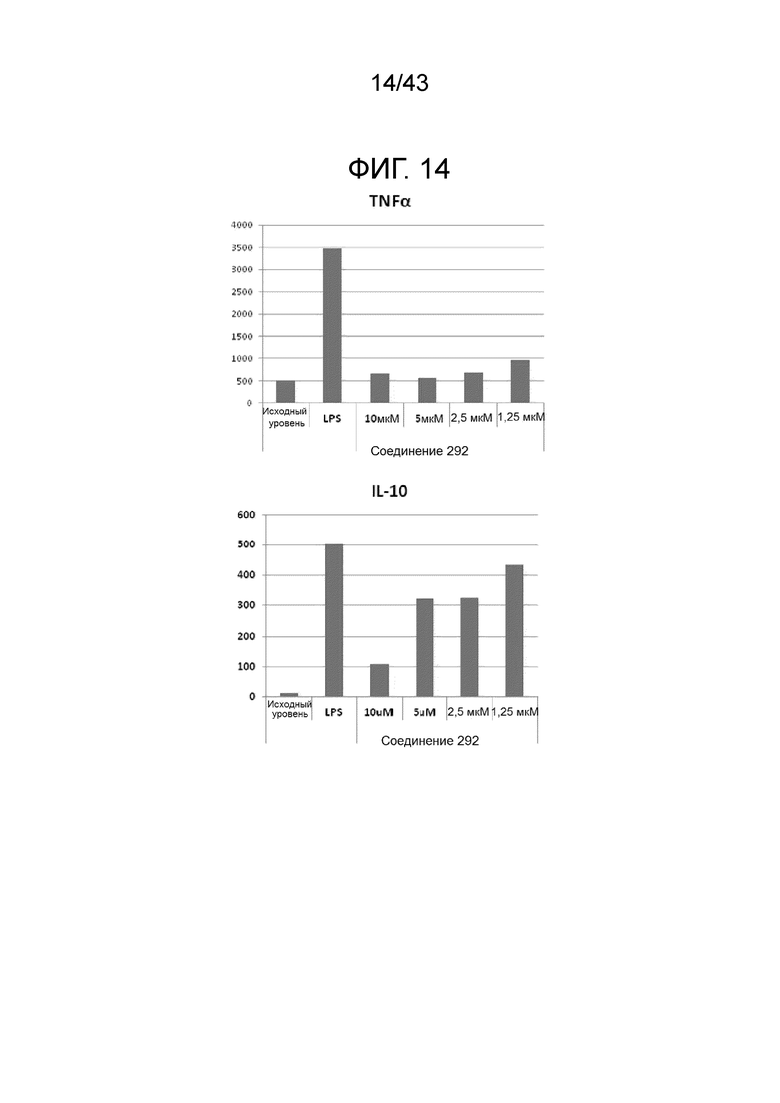
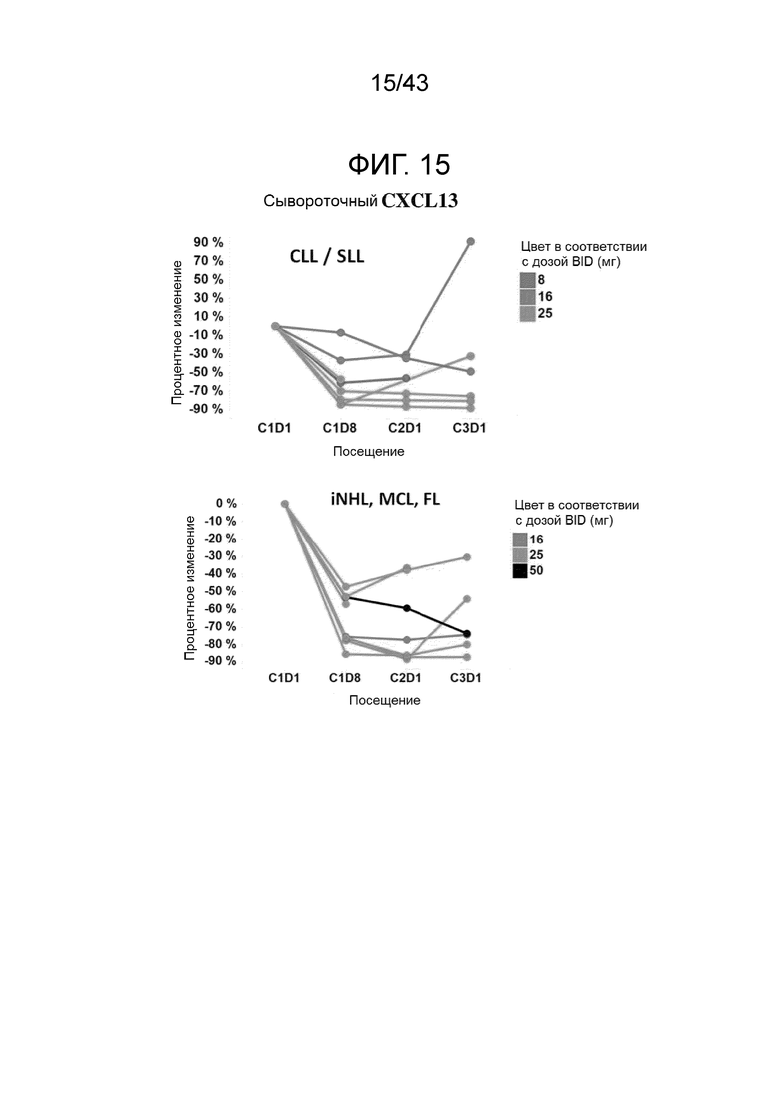


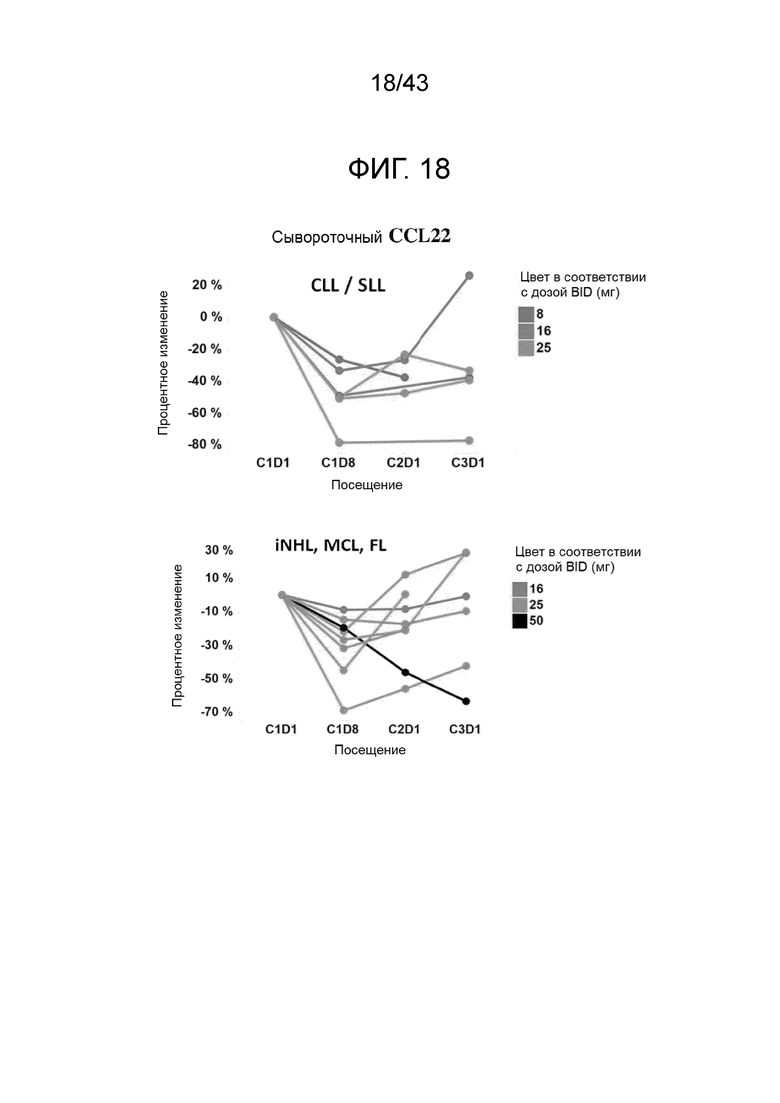

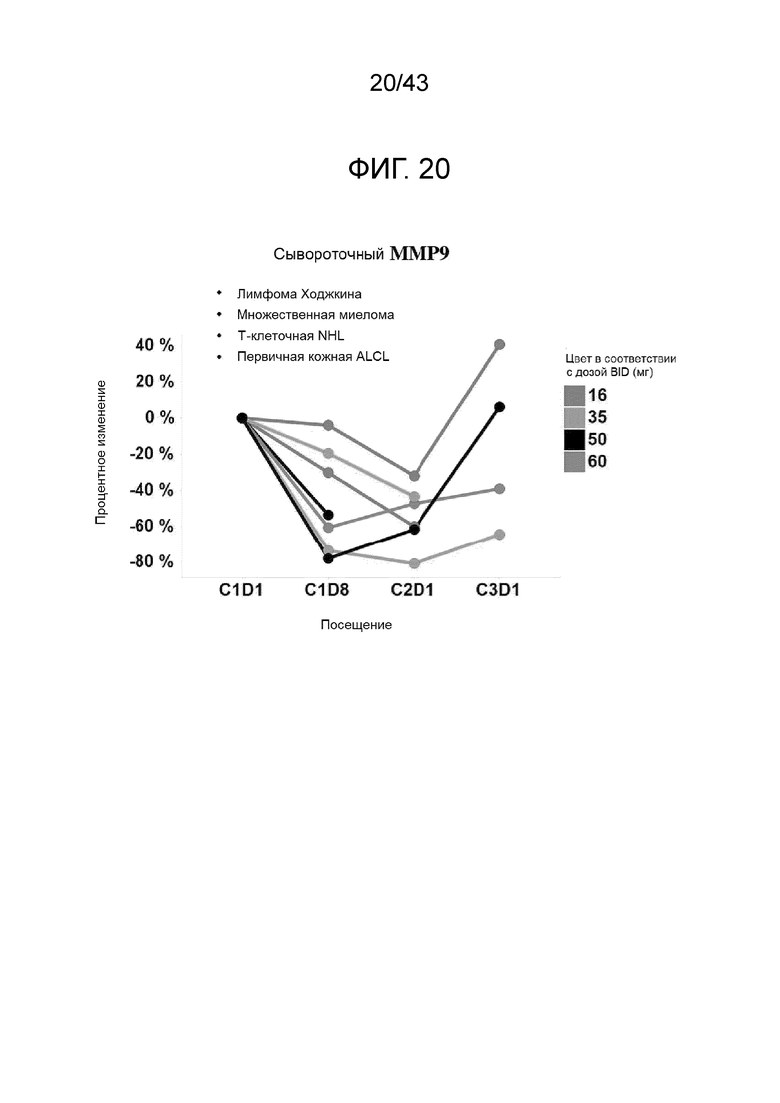


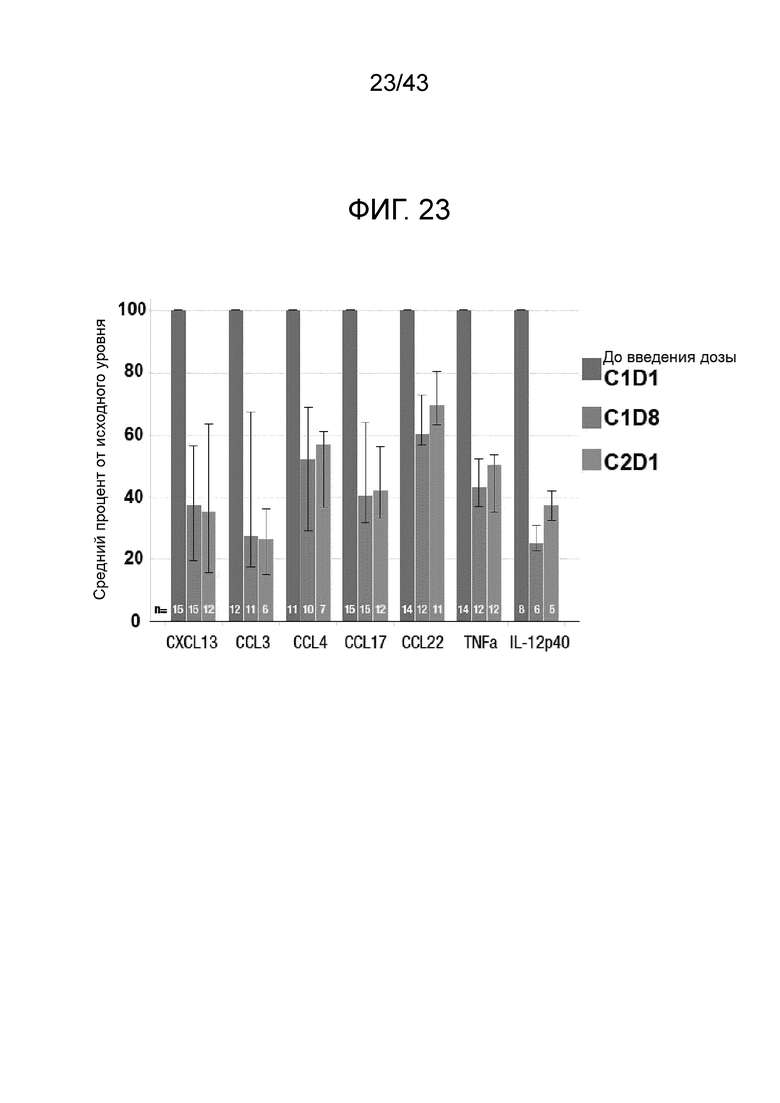

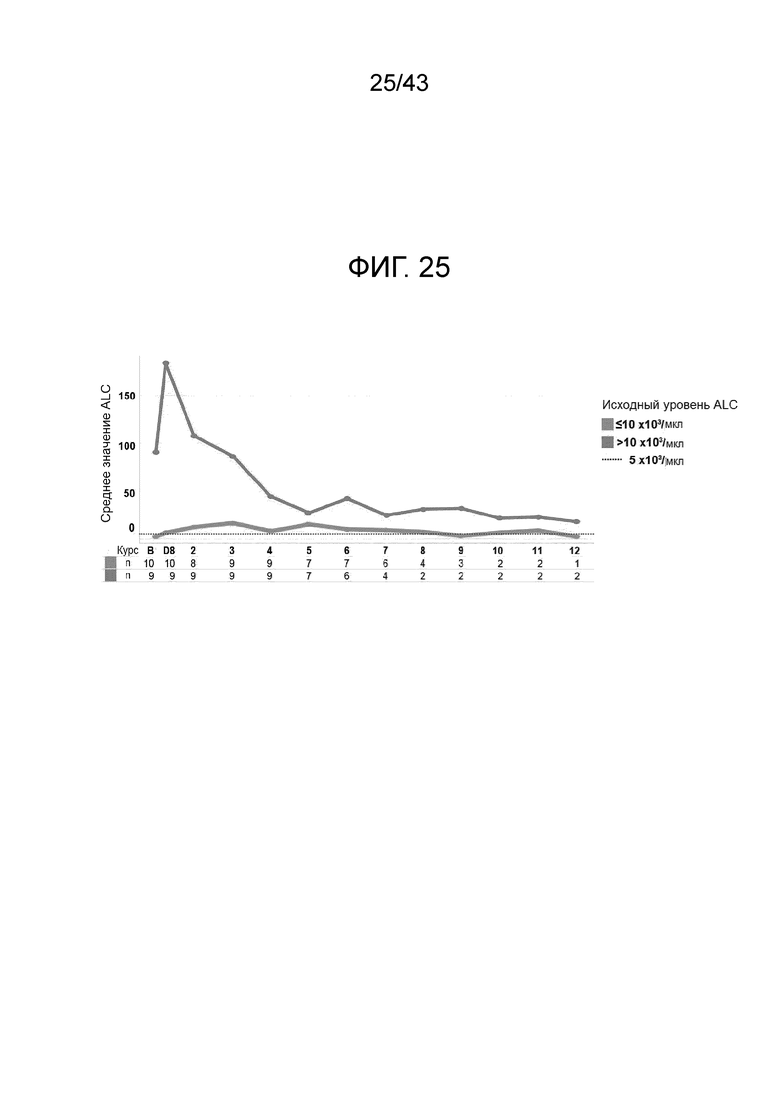



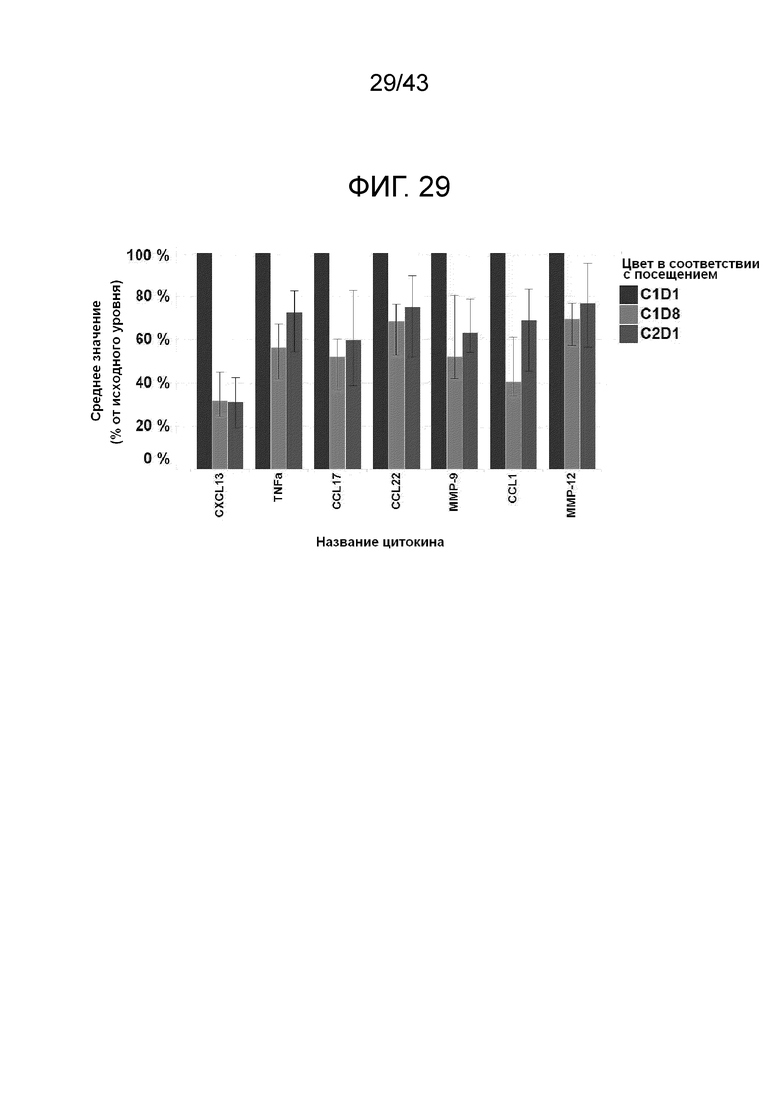
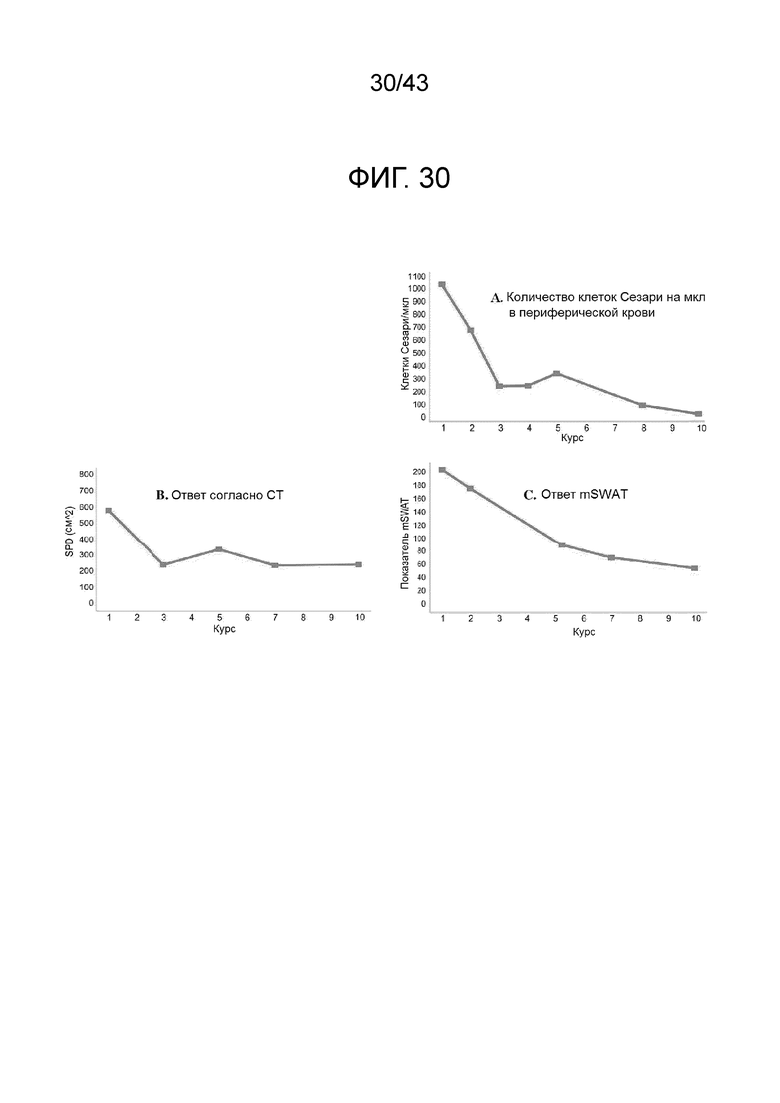

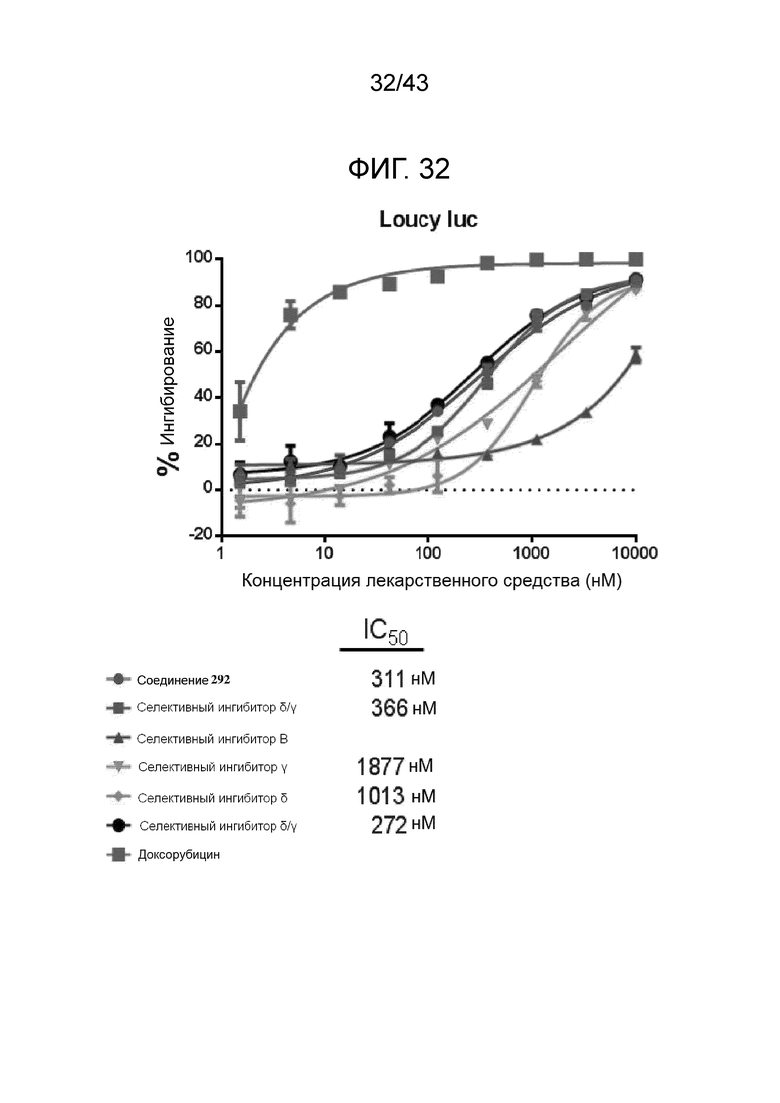
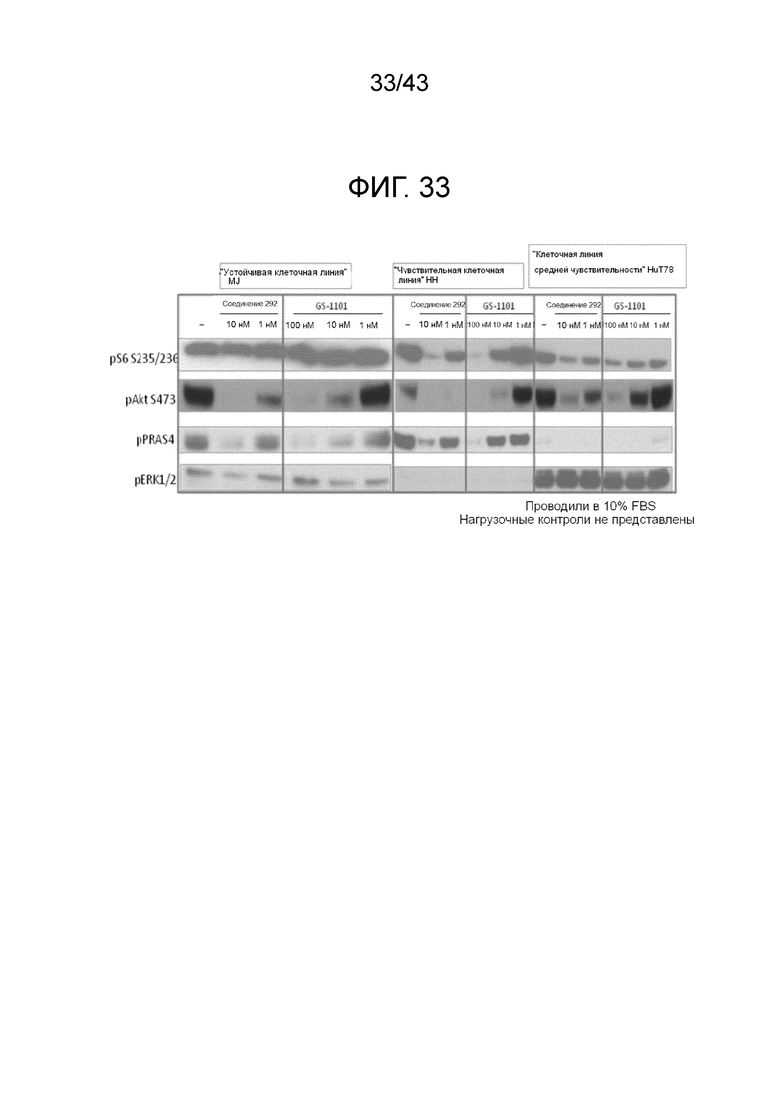
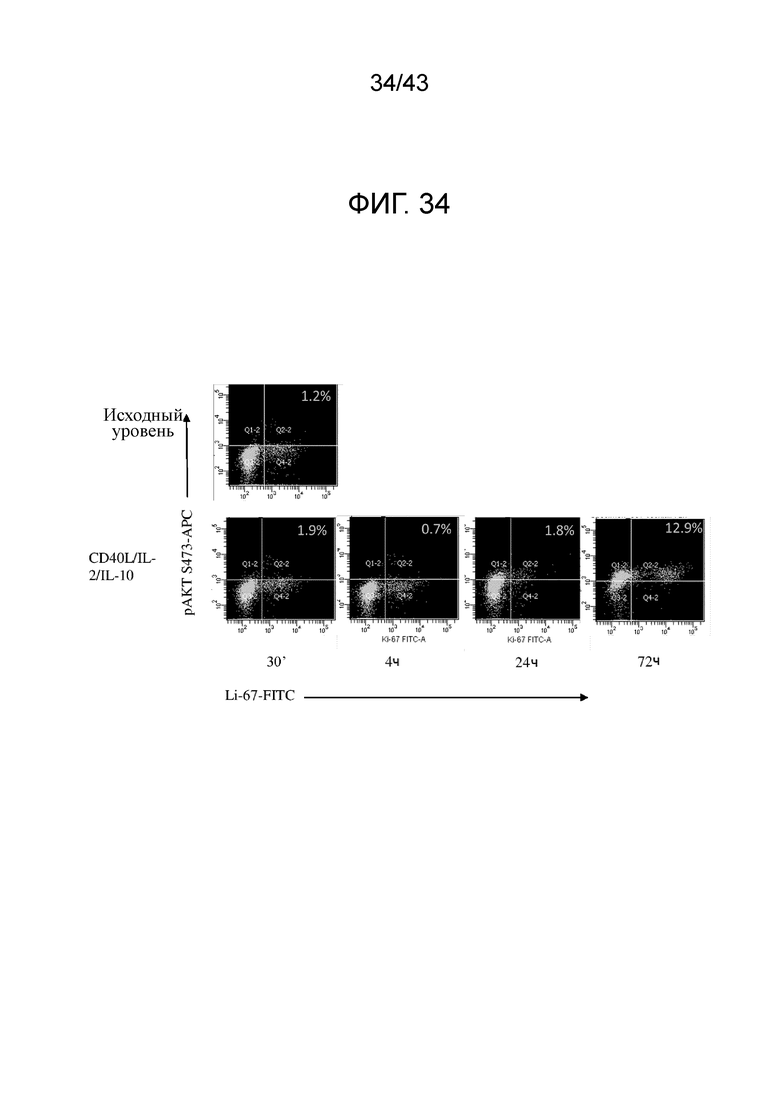
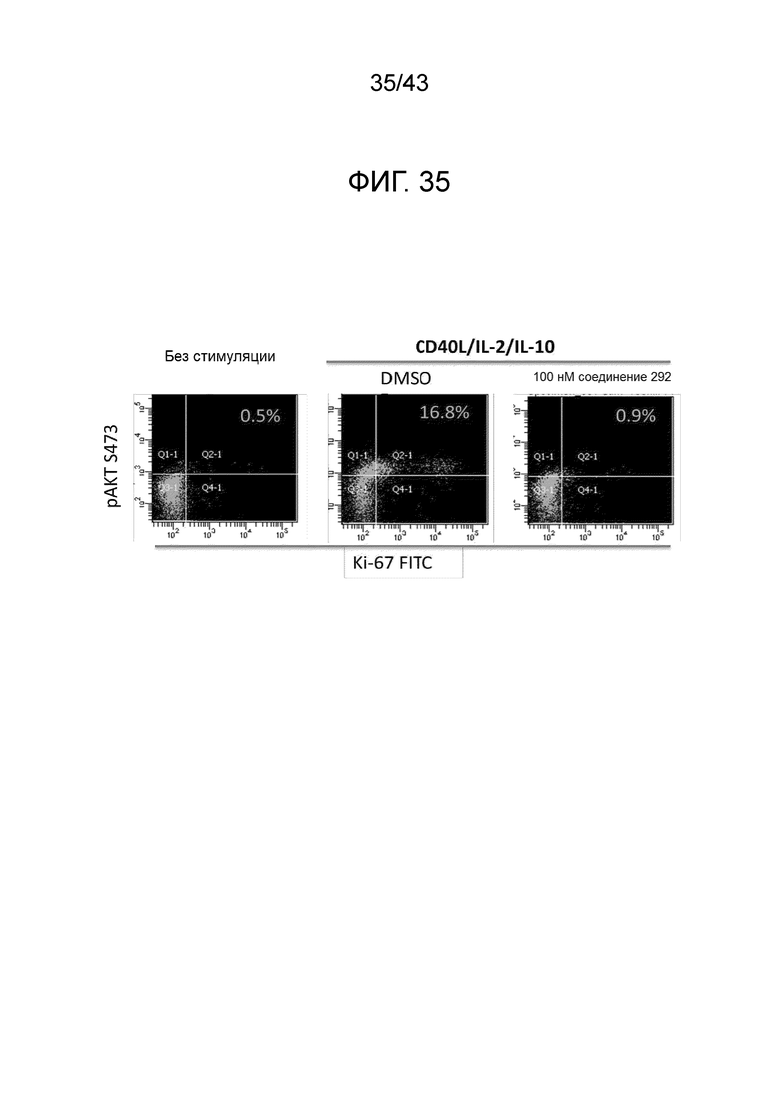
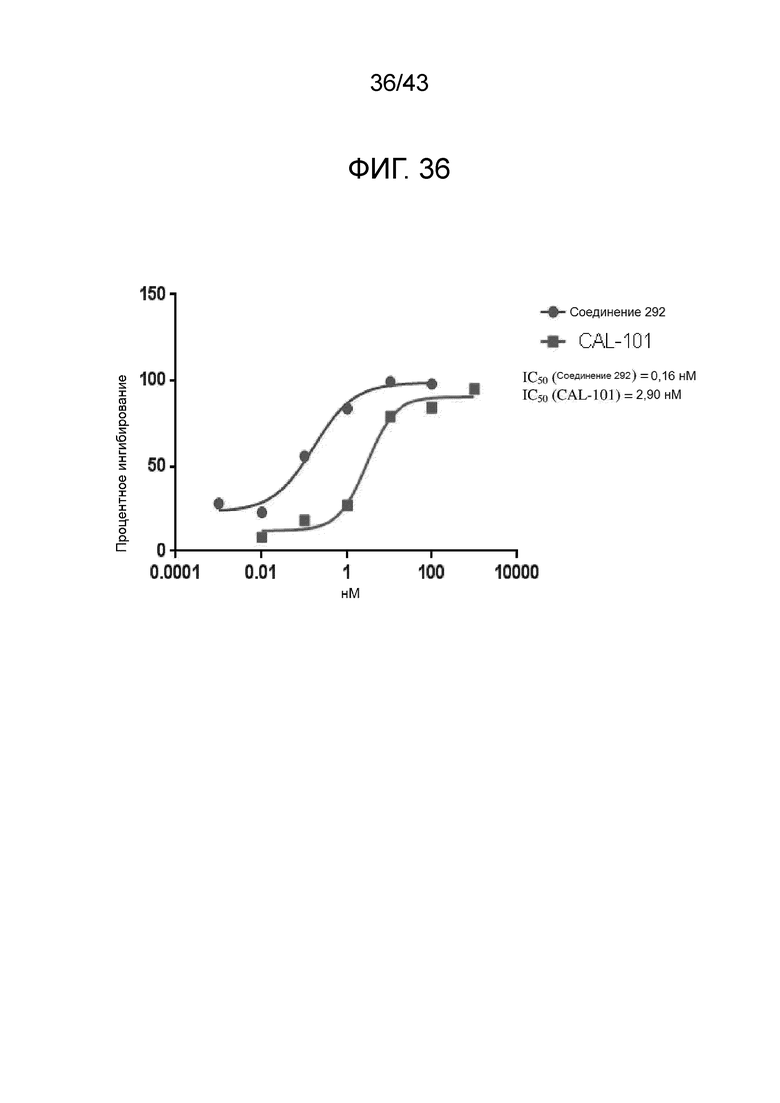
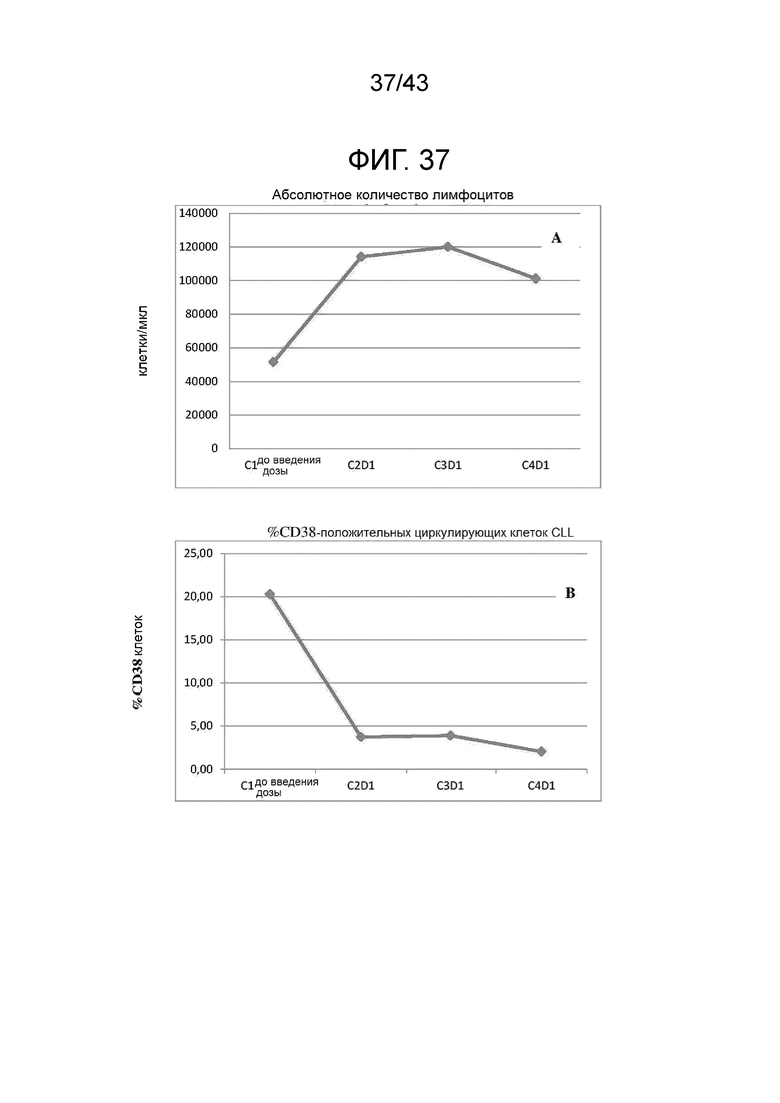
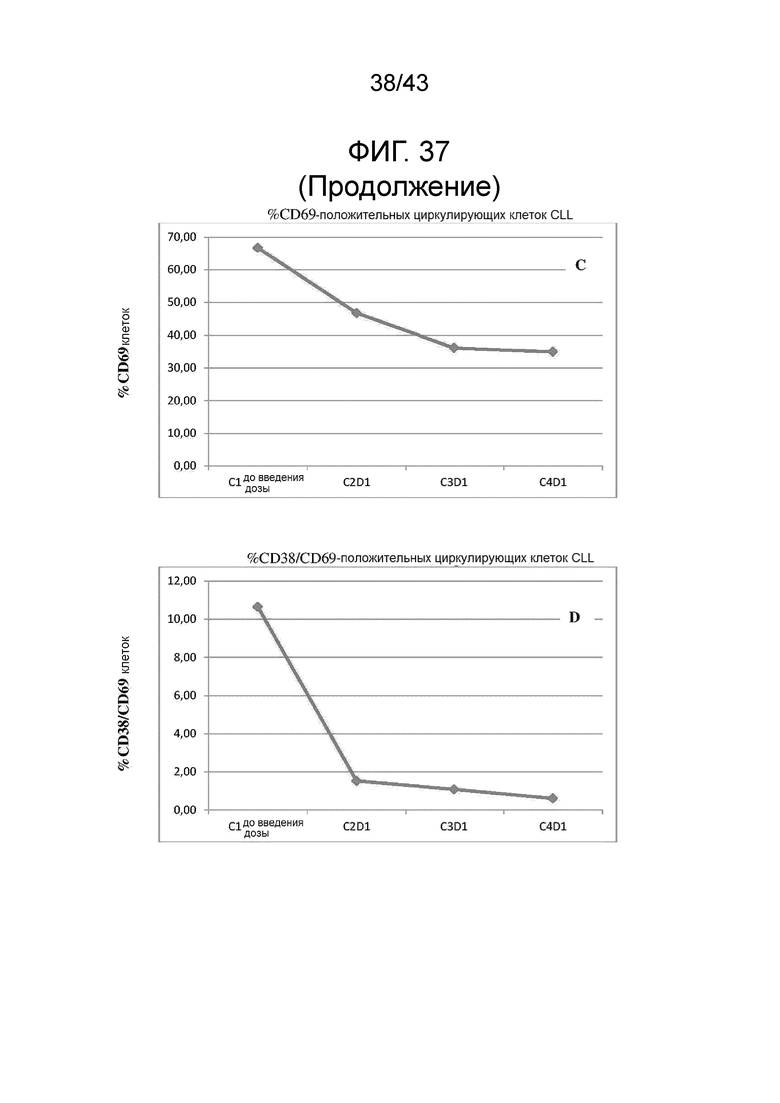





Группа изобретений относится к медицине, а именно к онкологии, и может быть использована при лечении гематологических злокачественных опухолей. Применения по изобретению касаются (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы, отдельно или в комбинации с одним или несколькими другими терапевтическими средствами, для производства лекарственного средства. Способ по изобретению касается лечения индивидуума, у которого диагностирована гематологическая злокачественная опухоль, терапевтически эффективным количеством (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы. Использование изобретений позволяет лечить опухоли, устойчивые к ингибиторам тирозинкиназы Бруттона. 4 н. и 54 з.п. ф-лы, 21 табл., 42 ил., 28 пр.
1. Применение (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы, отдельно или в комбинации с одним или несколькими другими терапевтическими средствами, для производства лекарственного средства для лечения гематологической злокачественной опухоли у индивидуума, у которого развилась или у которого идентифицировано развитие устойчивости к предшествующему лечению одним или несколькими ингибиторами тирозинкиназы Бруттона (BTK), где гематологическая злокачественная опухоль представляет собой лимфому или хронический лимфоцитарный лейкоз (CLL).
2. Применение (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы для производства лекарственного средства для предупреждения устойчивости к ингибитору тирозинкиназы Бруттона (BTK) у индивидуума, имеющего гематологическую злокачественную опухоль, где этого индивидуума лечат ингибитором BTK.
3. Применение (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы для производства лекарственного средства для лечения индивидуума с гематологической злокачественной опухолью, идентифицированного как имеющего одну или несколько мутаций, выбранных из мутации цистеина на серин в остатке 481 тирозинкиназы Бруттона (BTK) (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена LCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) и WHIM-подобной мутации CXCR4.
4. Применение по п. 3, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят в комбинации с одним или несколькими другими терапевтическими средствами индивидууму, у которого идентифицирована одна или несколько мутаций.
5. Применение по п. 3, где индивидуум идентифицирован путем получения биологического образца от индивидуума и обнаружения одной или нескольких мутаций, выбранных из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена LCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R), и WHIM-подобной мутации CXCR4 в образце.
6. Применение по п. 5, где обнаружение проводят посредством полимеразной цепной реакции (ПЦР) или гибридизации для обнаружения одной или нескольких мутаций.
7. Применение по пп. 1-6, где фармацевтически приемлемая форма представляет собой гидрат.
8. Применение по п. 1, где предшествующее лечение представляет собой лечение одним или несколькими ингибиторами BTK.
9. Применение по п. 8, где ингибитор BTK представляет собой ибрутиниб (1-[(3R)-3-[4-амино-3-(4-феноксифенил)-1H-пиразолo[3,4-d]пиримидин-1-ил]пиперидин-1-ил]проп-2-ен-1-он), AVL-292 (N-(3-((5-фтор-2-((4-(2-метоксиэтокси)фенил)амино)пиримидин-4-ил)амино)фенил)акриламид), RN-486 (6-циклопропил-8-фтор-2-(2-гидроксиметил-3-{1-метил-5-[5-(4-метил-пиперазин-1-ил)-пиридин-2-иламино]-6-оксо-1,6-дигидропиридин-3-ил}-фенил)-2H-изохинолин-1-он), GDC-0834 ([R-N-(3-(6-(4-(1,4-диметил-3-оксопиперазин-2-ил)фениламино)-4-метил-5-оксо-4,5-дигидропиразин-2-ил)-2-метилфенил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид]), CGI-560 (N-[3-(8-анилиноимидазо[1,2-a]пиразин-6-ил)фенил]-4-трет-бутилбензамид), CGI-1746 (4-(трет-бутил)-N-(2-метил-3-(4-метил-6-((4-(морфолин-4-карбонил)фенил)амино)-5-оксо-4,5-дигидропиразин-2-ил)фенил)бензамид), HM-71224, ONO-4059, ACP-196, CNX-774 (4-(4-((4-((3-акриламидофенил)амино)-5-фторпиримидин-2-ил)амино)фенокси)-N-метилпиколинамид) или LFM-A13 (2Z-циано-N-(2,5-дибромфенил)3-гидрокси-2-бутенамид).
10. Применение по п. 1 или 2, дополнительно включающее получение биологического образца от индивидуума и обнаружение присутствия одной или нескольких мутаций, выбранных из мутации цистеина на серин в остатке 481 BTK (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена LCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R) и WHIM-подобной мутации CXCR4 в образце.
11. Применение по п. 1 или 4, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма и одно или несколько других терапевтических средств составлены для одновременного введения в отдельных композициях, введения в различное время в отдельных композициях, или введения в композиции, в которой присутствуют (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма и одно или несколько других терапевтических средств.
12. Применение по п. 1 или 4, где другое терапевтическое средство представляет собой химиотерапевтическое средство или терапевтическое антитело, где химиотерапевтическое средство необязательно выбрано из ингибиторов митоза, алкилирующих средств, ингибитора протеасом, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормональных средств, ингибиторов ангиогенеза и антиандрогенных средств и где терапевтическое антитело необязательно выбрано из антитела против CD37, антитела против CD20, антитела против CD52.
13. Применение по п. 12, где другое терапевтическое средство представляет собой антитело против CD20, выбранное из ритуксимаба, обинутузумаба, тозитумомаба, 131I тозитумомаба, 90Y ибритумомаба, 111I ибритумомаба или офатумумаба.
14. Применение по п. 1 или 4, где молярное соотношение (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы и другого терапевтического средства составляет 500:1, 250:1, 100:1, 50:1, 25:1, 20:1, 19:1, 18:1, 17:1, 16:1, 15:1, 14:1, 13:1, 12:1, 11:1, 10:1, 5:1, 4:1, 3:1, 2:1 или 1:1.
15. Применение по п. 1 или 4, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в суточной дозировке от 0,1 мг до 150 мг, от 1 мг до 100 мг, от 5 мг до 75 мг, от 5 мг до 60 мг, от 10 мг до 60 мг, от 20 мг до 60 мг, от 30 мг до 60 мг, от 40 мг до 60 мг, от 45 мг до 55 мг, 10 мг, 20 мг или 50 мг; или в дозировке два раза в сутки от 0,1 мг до 75 мг, от 1 мг до 75 мг, от 5 мг до 75 мг, от 5 мг до 60 мг, от 5 мг до 50 мг, 5 мг, 10 мг, 20 мг, 25 мг или 50 мг; и другое терапевтическое средство составлено для введения в суточной дозировке от 0,1 мг до 10000 мг, от 0,1 мг до 7500 мг, от 0,1 мг до 5000 мг, от 1 мг до 2500 мг, от 1 мг до 1500 мг, от 10 мг до 1000 мг, от 500 мг до 1000 мг, от 750 мг до 1000 мг, от 800 мг до 1000 мг, от 900 мг до 1000 мг или 1000 мг.
16. Применение по п. 1 или 4, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в количестве для достижения максимальной концентрации в плазме в стационарном состоянии (Cmaxss) от 1000 нг/мл до 5000 нг/мл, от 1000 нг/мл до 4000 нг/мл, от 1000 нг/мл до 3000 нг/мл, от 1000 нг/мл до 2500 нг/мл или от 1400 нг/мл до 2200 нг/мл; и другое средство составлено для введения в количестве для достижения Cmaxss от 100 нг/мл до 1000 нг/мл, от 250 нг/мл до 1000 нг/мл, от 500 нг/мл до 1000 нг/мл, от 600 нг/мл до 1000 нг/мл, от 700 нг/мл до 1000 нг/мл, от 740 нг/мл до 1000 нг/мл, от 750 нг/мл до 1000 нг/мл, от 750 нг/мл до 900 нг/мл или от 750 нг/мл до 800 нг/мл.
17. Применение по п. 1 или 4, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в количестве для достижения площади под кривой концентрация в плазме-время в стационарном состоянии (AUCss) от 5000 нг/мл*ч до 10000 нг/мл*ч, от 5000 нг/мл*ч до 9000 нг/мл*ч, от 6000 нг/мл*ч до 9000 нг/мл*ч, от 7000 нг/мл*ч до 9000 нг/мл*ч, 7000 нг/мл*ч, 7500 нг/мл*ч, 8000 нг/мл*ч, 8500 нг/мл*ч, 8600 нг/мл*ч, 8700 нг/мл*ч или 8800 нг/мл*ч; и другое средство составлено для введения в количестве для достижения AUCss от 1000 нг/мл*ч до 5000 нг/мл*ч, от 2000 нг/мл*ч до 5000 нг/мл*ч, от 3000 нг/мл*ч до 5000 нг/мл*ч, от 4000 нг/мл*ч до 5000 нг/мл*ч или от 4000 нг/мл*ч до 4500 нг/мл*ч.
18. Применение по п. 1 или 4, где другое терапевтическое средство представляет собой обинутузумаб.
19. Применение по п. 18, где молярное соотношение (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы и обинутузумаба составляет 500:1, 250:1, 100:1, 50:1, 25:1, 20:1, 19:1, 18:1, 17:1, 16:1, 15:1, 14:1, 13:1, 12:1, 11:1, 10:1, 5:1, 4:1, 3:1, 2:1 или 1:1.
20. Применение по п. 18, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в суточной дозировке от 0,1 мг до 150 мг, от 1 мг до 100 мг, от 5 мг до 75 мг, от 5 мг до 60 мг, от 10 мг до 60 мг, от 20 мг до 60 мг, от 30 мг до 60 мг, от 40 мг до 60 мг, от 45 мг до 55 мг, 10 мг, 20 мг или 50 мг; или в дозировке два раза в сутки от 0,1 мг до 75 мг, от 1 мг до 75 мг, от 5 мг до 75 мг, от 5 мг до 60 мг, от 5 мг до 50 мг, 5 мг, 10 мг, 20 мг, 25 мг или 50 мг; и обинутузумаб составлен для введения в суточной дозировке от 0,1 мг до 10000 мг, от 0,1 мг до 7500 мг, от 0,1 мг до 5000 мг, от 1 мг до 2500 мг, от 1 мг до 1500 мг, от 10 мг до 1000 мг, от 500 мг до 1000 мг, от 750 мг до 1000 мг, от 800 мг до 1000 мг, от 900 мг до 1000 мг или 1000 мг.
21. Применение по п. 18, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в количестве для достижения Cmaxss от 1000 нг/мл до 5000 нг/мл, от 1000 нг/мл до 4000 нг/мл, от 1000 нг/мл до 3000 нг/мл, от 1000 нг/мл до 2500 нг/мл или от 1400 нг/мл до 2200 нг/мл; и обинутузумаб составлен для введения в количестве для достижения Cmaxss от 100 нг/мл до 1000 нг/мл, от 250 нг/мл до 1000 нг/мл, от 500 нг/мл до 1000 нг/мл, от 600 нг/мл до 1000 нг/мл, от 700 нг/мл до 1000 нг/мл, от 740 нг/мл до 1000 нг/мл, от 750 нг/мл до 1000 нг/мл, от 750 нг/мл до 900 нг/мл или от 750 нг/мл до 800 нг/мл.
22. Применение по п. 18, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в количестве для достижения AUCss от 5000 нг/мл*ч до 10000 нг/мл*ч, от 5000 нг/мл*ч до 9000 нг/мл*ч, от 6000 нг/мл*ч до 9000 нг/мл*ч, от 7000 нг/мл*ч до 9000 нг/мл*ч, 7000 нг/мл*ч, 7500 нг/мл*ч, 8000 нг/мл*ч, 8500 нг/мл*ч, 8600 нг/мл*ч, 8700 нг/мл*ч или 8800 нг/мл*ч; и
обинутузумаб составлен для введения в количестве для достижения AUCss от 1000 нг/мл*ч до 5000 нг/мл*ч, от 2000 нг/мл*ч до 5000 нг/мл*ч, от 3000 нг/мл*ч до 5000 нг/мл*ч, от 4000 нг/мл*ч до 5000 нг/мл*ч или от 4000 нг/мл*ч до 4500 нг/мл*ч.
23. Применение по любому из пп. 2-22, где гематологическая злокачественная опухоль представляет собой CLL, макроглобулинемию Вальденстрема (WM), лимфому из клеток мантийной зоны, NHL, iNHL, диффузную крупноклеточную B-клеточную лимфому или T-клеточную лимфому.
24. Применение по любому из пп. 1-22, где гематологическая злокачественная опухоль представляет собой фолликулярную лимфому.
25. Применение по любому из пп. 1-6, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят в количестве, достаточном для обеспечения стационарной концентрации соединения в плазме на уровне, превышающем IC90 для PI3K-δ, и на уровне, превышающем IC50 для PI3K-γ.
26. Применение по любому из пп. 1-6, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят в количестве, достаточном для обеспечения стационарной концентрации соединения в плазме от 350 нг/мл до 450 нг/мл.
27. Применение по любому из пп. 1-26, где субъектом является человек.
28. Применение по любому из пп. 1-6, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят два раза в сутки в дозировке от 5 мг до 75 мг.
29. Применение по любому из пп. 1-6, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят два раза в сутки в дозировке от 25 мг до 50 мг.
30. Применение по п. 1 или 4, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят с периодом перекрывания с другим терапевтическим средством.
31. Применение по п. 1 или 4, где другое терапевтическое средство вводят субъекту, после того как введен (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма.
32. Применение по п. 1 или 4, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят субъекту, после того как введено другое терапевтическое средство.
33. Способ выбора индивидуума, у которого диагностирована гематологическая злокачественная опухоль, в качестве кандидата для лечения терапевтически эффективным количеством (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы, включающий:
(a) обнаружение присутствия или отсутствия одной или нескольких мутаций, выбранных из мутации цистеина на серин в остатке 481 тирозинкиназы Бруттона (BTK) (C481S), мутации цистеина на фенилаланин в остатке 481 BTK (C481F), мутации аргинина на триптофан в остатке 665 гена PLCgamma2 (R665W), мутации гистидина на лейцин в остатке 257 гена PLCgamma2 (H257L), мутации метионина на аргинин в остатке 1141 гена LCgamma2 (M1141R), мутации серина на фенилаланин в остатке 707 гена PLCgamma2 (S707F), мутации лейцина на фенилаланин в остатке 845 гена PLCgamma2 (L845F), мутации серина на тирозин в остатке 707 гена PLCgamma2 (S707Y), мутации гистидина на аргинин в остатке 244 гена PLCgamma2 (H244R), и WHIM-подобной мутации CXCR4 в образце, полученном от индивидуума, где присутствие одной или нескольких мутаций указывает на то, что индивидуум является кандидатом для лечения терапевтически эффективным количеством (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемой формы; и
(b) выбор индивидуума для лечения (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-оном или его фармацевтически приемлемой формой, когда в образце присутствуют одна или несколько мутаций.
34. Способ по п. 33, где индивидуум выбран для лечения одним или несколькими другими терапевтическими средствами.
35. Способ по п. 33, где индивидууму вводят (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму, когда в образце присутствуют одна или несколько мутаций.
36. Способ по любому из пп. 33-35, где фармацевтически приемлемая форма представляет собой гидрат.
37. Способ по п. 34, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма и одно или несколько других терапевтических средств составлены для одновременного введения в отдельных композициях, введения в различное время в отдельных композициях или введения в композиции, в которой присутствуют (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма и одно или несколько других терапевтических средств.
38. Способ по п. 34, где другое терапевтическое средство представляет собой химиотерапевтическое средство или терапевтическое антитело, где химиотерапевтическое средство необязательно выбрано из ингибиторов митоза, алкилирующих средств, ингибитора протеасом, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормональных средств, ингибиторов ангиогенеза и антиандрогенных средств и где терапевтическое антитело необязательно выбрано из антитела против CD37, антитела против CD20, антитела против CD52.
39. Способ по п. 38, где другое терапевтическое средство представляет собой антитело против CD20, выбранное из ритуксимаба, обинутузумаба, тозитумомаба, 131I тозитумомаба, 90Y ибритумомаба, 111I ибритумомаба или офатумумаба.
40. Способ по п. 34, где молярное соотношение (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы и другого терапевтического средства составляет 500:1, 250:1, 100:1, 50:1, 25:1, 20:1, 19:1, 18:1, 17:1, 16:1, 15:1, 14:1, 13:1, 12:1, 11:1, 10:1, 5:1, 4:1, 3:1, 2:1 или 1:1.
41. Способ по п. 34, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в суточной дозировке от 0,1 мг до 150 мг, от 1 мг до 100 мг, от 5 мг до 75 мг, от 5 мг до 60 мг, от 10 мг до 60 мг, от 20 мг до 60 мг, от 30 мг до 60 мг, от 40 мг до 60 мг, от 45 мг до 55 мг, 10 мг, 20 мг или 50 мг; или в дозировке два раза в сутки от 0,1 мг до 75 мг, от 1 мг до 75 мг, от 5 мг до 75 мг, от 5 мг до 60 мг, от 5 мг до 50 мг, 5 мг, 10 мг, 20 мг, 25 мг или 50 мг; и другое терапевтическое средство составлено для введения в суточной дозировке от 0,1 мг до 10000 мг, от 0,1 мг до 7500 мг, от 0,1 мг до 5000 мг, от 1 мг до 2500 мг, от 1 мг до 1500 мг, от 10 мг до 1000 мг, от 500 мг до 1000 мг, от 750 мг до 1000 мг, от 800 мг до 1000 мг, от 900 мг до 1000 мг или 1000 мг.
42. Способ по п. 34, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в количестве для достижения Cmaxss от 1000 нг/мл до 5000 нг/мл, от 1000 нг/мл до 4000 нг/мл, от 1000 нг/мл до 3000 нг/мл, от 1000 нг/мл до 2500 нг/мл или от 1400 нг/мл до 2200 нг/мл; и другое средство составлено для введения в количестве для достижения Cmaxss от 100 нг/мл до 1000 нг/мл, от 250 нг/мл до 1000 нг/мл, от 500 нг/мл до 1000 нг/мл, от 600 нг/мл до 1000 нг/мл, от 700 нг/мл до 1000 нг/мл, от 740 нг/мл до 1000 нг/мл, от 750 нг/мл до 1000 нг/мл, от 750 нг/мл до 900 нг/мл или от 750 нг/мл до 800 нг/мл.
43. Способ по п. 34, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в количестве для достижения AUCss от 5000 нг/мл*ч до 10000 нг/мл*ч, от 5000 нг/мл*ч до 9000 нг/мл*ч, от 6000 нг/мл*ч до 9000 нг/мл*ч, от 7000 нг/мл*ч до 9000 нг/мл*ч, 7000 нг/мл*ч, 7500 нг/мл*ч, 8000 нг/мл*ч, 8500 нг/мл*ч, 8600 нг/мл*ч, 8700 нг/мл*ч или 8800 нг/мл*ч; и
другое средство составлено для введения в количестве для достижения AUCss от 1000 нг/мл*ч до 5000 нг/мл*ч, от 2000 нг/мл*ч до 5000 нг/мл*ч, от 3000 нг/мл*ч до 5000 нг/мл*ч, от 4000 нг/мл*ч до 5000 нг/мл*ч или от 4000 нг/мл*ч до 4500 нг/мл*ч.
44. Способ по п. 34, где другое терапевтическое средство представляет собой обинутузумаб.
45. Способ по п. 44, где молярное соотношение (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-она или его фармацевтически приемлемой формы и обинутузумаба составляет 500:1, 250:1, 100:1, 50:1, 25:1, 20:1, 19:1, 18:1, 17:1, 16:1, 15:1, 14:1, 13:1, 12:1, 11:1, 10:1, 5:1, 4:1, 3:1, 2:1 или 1:1.
46. Способ по п. 44, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в суточной дозировке от 0,1 мг до 150 мг, от 1 мг до 100 мг, от 5 мг до 75 мг, от 5 мг до 60 мг, от 10 мг до 60 мг, от 20 мг до 60 мг, от 30 мг до 60 мг, от 40 мг до 60 мг, от 45 мг до 55 мг, 10 мг, 20 мг или 50 мг; или в дозировке два раза в сутки от 0,1 мг до 75 мг, от 1 мг до 75 мг, от 5 мг до 75 мг, от 5 мг до 60 мг, от 5 мг до 50 мг, 5 мг, 10 мг, 20 мг, 25 мг или 50 мг; и обинутузумаб составлен для введения в суточной дозировке от 0,1 мг до 10000 мг, от 0,1 мг до 7500 мг, от 0,1 мг до 5000 мг, от 1 мг до 2500 мг, от 1 мг до 1500 мг, от 10 мг до 1000 мг, от 500 мг до 1000 мг, от 750 мг до 1000 мг, от 800 мг до 1000 мг, от 900 мг до 1000 мг или 1000 мг.
47. Способ по п. 44, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в количестве для достижения Cmaxss от 1000 нг/мл до 5000 нг/мл, от 1000 нг/мл до 4000 нг/мл, от 1000 нг/мл до 3000 нг/мл, от 1000 нг/мл до 2500 нг/мл или от 1400 нг/мл до 2200 нг/мл; и обинутузумаб составлен для введения в количестве для достижения Cmaxss от 100 нг/мл до 1000 нг/мл, от 250 нг/мл до 1000 нг/мл, от 500 нг/мл до 1000 нг/мл, от 600 нг/мл до 1000 нг/мл, от 700 нг/мл до 1000 нг/мл, от 740 нг/мл до 1000 нг/мл, от 750 нг/мл до 1000 нг/мл, от 750 нг/мл до 900 нг/мл или от 750 нг/мл до 800 нг/мл.
48. Способ по п. 44, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма составлен для введения в количестве для достижения AUCss от 5000 нг/мл*ч до 10000 нг/мл*ч, от 5000 нг/мл*ч до 9000 нг/мл*ч, от 6000 нг/мл*ч до 9000 нг/мл*ч, от 7000 нг/мл*ч до 9000 нг/мл*ч, 7000 нг/мл*ч, 7500 нг/мл*ч, 8000 нг/мл*ч, 8500 нг/мл*ч, 8600 нг/мл*ч, 8700 нг/мл*ч или 8800 нг/мл*ч; и обинутузумаб составлен для введения в количестве для достижения AUCss от 1000 нг/мл*ч до 5000 нг/мл*ч, от 2000 нг/мл*ч до 5000 нг/мл*ч, от 3000 нг/мл*ч до 5000 нг/мл*ч, от 4000 нг/мл*ч до 5000 нг/мл*ч или от 4000 нг/мл*ч до 4500 нг/мл*ч.
49. Способ по любому из пп. 33-48, где гематологическая злокачественная опухоль представляет собой CLL, макроглобулинемию Вальденстрема (WM), лимфому из клеток мантийной зоны, NHL, iNHL, диффузную крупноклеточную B-клеточную лимфому или T-клеточную лимфому.
50. Способ по любому из пп. 33-48, где гематологическая злокачественная опухоль представляет собой фолликулярную лимфому.
51. Способ по любому из пп. 33-35, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят в количестве, достаточном для обеспечения стационарной концентрации соединения в плазме на уровне, превышающем IC90 для PI3K-δ, и на уровне, превышающем IC50 для PI3K-γ.
52. Способ по любому из пп. 33-35, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят в количестве, достаточном для обеспечения стационарной концентрации соединения в плазме от 350 нг/мл до 450 нг/мл.
53. Способ по любому из пп. 33-52, где субъектом является человек.
54. Способ по любому из пп. 33-35, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят два раза в сутки в дозировке от 5 мг до 75 мг.
55. Способ по любому из пп. 33-35, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят два раза в сутки в дозировке от 25 мг до 50 мг.
56. Способ по п. 34, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят с периодом перекрывания с другим терапевтическим средством.
57. Способ по п. 34, где другое терапевтическое средство вводят субъекту, после того как введен (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемая форма.
58. Способ по п. 34, где (S)-3-(1-((9H-пурин-6-ил)амино)этил)-8-хлор-2-фенилизохинолин-1(2H)-он или его фармацевтически приемлемую форму вводят субъекту, после того как введено другое терапевтическое средство.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
Авторы
Даты
2019-11-06—Публикация
2014-05-30—Подача