ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет по временным заявкам США № 62/629616, поданной 12 февраля 2018 года, и № 62/728559, поданной 7 сентября 2018 года, включенным в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к способам и комбинированным терапевтическим средствам, которые можно использовать для лечения рака желчных протоков. В частности, настоящее изобретение относится к способам и комбинированным терапевтическим средствам для лечения рака желчных протоков посредством введения комбинированного терапевтического средства, состоящего, по существу, из ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства. Настоящее изобретение также относится к фармацевтическому применению комбинации по настоящему изобретению.
УРОВЕНЬ ТЕХНИКИ
[0003] Каждый год в США рак желчных протоков (BTC) диагностируют у приблизительно 8000 человек. BTC с относительно более высокой частотой определяют в странах Восточной и Юго-Восточной Азии, что связывают с паразитарными инфекциями Opisthorchis viverrini и Clonorchis sinensis. Рак желчных протоков поражает эпителиальную выстилку желчного пузыря и желчных протоков и зачастую ассоциирован с желтухой и пруритом. BTC включает рак желчного пузыря и холангиокарциномы. Коэффициент выживаемости пациентов, у которых диагностирован BTC, остается плохим, т.к. пациентам диагноз ставят зачастую только тогда, когда рак уже спрогрессировал до поздней стадии. Среди пациентов, у которых заболевание BTC диагностировано на ранней стадии, хирургическая резекция является вариантом только для 10% пациентов, и показатели рецидивирования рака остаются высокими. Для основного большинства пациентов с BTC химиотерапия представляет собой первую линию лечения. По прогнозам, время выживаемости у пациентов с диагностированным метастазирующим BTC или неоперабельным BTC составляет менее двенадцати месяцев. BTC ассоциирован с активирующими мутациями генов саркомы крыс Кирстен (Kras) и рецептора эпидермального фактора роста (EGFR), а также мутациями с потерей функции в генах Mothers against decapentaplegic homolog 4 (SMAD4), циклин-зависимой киназы 4 ингибитора p16-INK4 (P16INK4A) и опухолевого белка p53 (P53).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0004] Настоящее изобретение основано на открытии того, что комбинация ингибитора MEK (например, биниметиниба или его фармацевтически приемлемой соли) и фторпиримидин-содержащего терапевтического средства (например, капецитабина) может приводить к синергическому терапевтическому эффекту у индивидуума, имеющего рак желчных протоков (например, синергическому уменьшению объема одной или более солидных опухолей, синергическому повышению времени выживаемости индивидуума и/или синергическому повышению времени стабильного заболевания у индивидуума), например, по сравнению с аддитивным эффектом (1) той же дозы ингибитора MEK при введении индивидууму, имеющему рак желчных протоков, в качестве монотерапии и (2) той же дозы фторпиримидин-содержащего терапевтического средства при введении индивидууму, имеющему рак желчных протоков, в качестве монотерапии.
[0005] В одном из вариантов осуществления настоящее изобретение относится к способу комбинированного лечения, включающему введение нуждающемуся в этом пациенту в течение периода времени терапевтических средств, содержащих, или состоящих, по существу, или состоящих из терапевтически эффективных количеств, независимо, ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства.
[0006] В одном из вариантов осуществления настоящее изобретение относится к способу комбинированного лечения, включающему введение нуждающемуся в этом пациенту в течение периода времени терапевтических средств, содержащих терапевтически эффективные количества, независимо, ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства. В одном из вариантов осуществления ингибитор MEK является биниметинибом или его фармацевтически приемлемой солью. В одном из вариантов осуществления биниметиниб является кристаллизованным биниметинибом. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином.
[0007] В одном из вариантов осуществления настоящее изобретение относится к способу комбинированного лечения, включающему введение нуждающемуся в этом пациенту в течение периода времени терапевтических средств, состоящих, по существу, или состоящих из терапевтически эффективных количеств, независимо, ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства. В одном из вариантов осуществления ингибитор MEK является биниметинибом или его фармацевтически приемлемой солью. В одном из вариантов осуществления биниметиниб является кристаллизованным биниметинибом. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином.
[0008] В одном из вариантов осуществления настоящее изобретение относится к способу комбинированного лечения, состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени терапевтических средств, состоящих, по существу, или состоящих из терапевтически эффективных количеств, независимо, ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства. В одном из вариантов осуществления ингибитор MEK является биниметинибом или его фармацевтически приемлемой солью. В одном из вариантов осуществления биниметиниб является кристаллизованным биниметинибом. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином.
[0009] В одном из вариантов осуществления настоящее изобретение относится к способу комбинированного лечения, состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени терапевтических средств, состоящих, по существу, или состоящих из терапевтически эффективных количеств, независимо, ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства. В одном из вариантов осуществления ингибитор MEK является биниметинибом или его фармацевтически приемлемой солью. В одном из вариантов осуществления биниметиниб является кристаллизованным биниметинибом. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином.
[0010] В одном из вариантов осуществления настоящее изобретение относится к способу лечения рака желчных протоков, включающему введение нуждающемуся в этом пациенту в течение периода времени количества фторпиримидин-содержащего терапевтического средства и количества ингибитора MEK или его фармацевтически приемлемой соли, где количества вместе являются эффективными при лечении рака желчных протоков. В одном из вариантов осуществления ингибитор MEK является биниметинибом. В одном из вариантов осуществления биниметиниб является кристаллизованным биниметинибом. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином.
[0011] В одном из вариантов осуществления настоящее изобретение относится к способу лечения рака желчных протоков, состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени терапевтических средств, состоящих, по существу, или состоящих из количества фторпиримидин-содержащего терапевтического средства и количества ингибитора MEK или его фармацевтически приемлемой соли, где количества вместе являются эффективными при лечении рака желчных протоков. В одном из вариантов осуществления ингибитор MEK является биниметинибом. В одном из вариантов осуществления биниметиниб является кристаллизованным биниметинибом. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином.
[0012] В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили одним или более терапевтическими средствами, независимо выбранными из химиотерапевтических средств и таргетированных терапевтических средств. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечат одним или более химиотерапевтическими средствами (например, антиметаболитом (например, гемцитабином или капецитабином), химиотерапевтическим средством на основе платины (например, цисплатином), и, необязательно, ранее определяли, что пациент не отвечает на лечение одним или более химиотерапевтическими средствами. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили таргетированным терапевтическим средством (например, таргетированным терапевтическим средством против рецепторных тирозинкиназ (например, ингибитором EGFR), ингибитором пути передачи сигнала (например, ингибитором MEK, ингибитором RAS, ингибитором KRAS, ингибитором NRAS или ингибитором RAF) или таргетированным терапевтическим средством против ангиогенеза) в качестве монотерапии, и, необязательно, предшествующее лечение таргетированным терапевтическим средством-ингибитором в качестве монотерапии являлось неэффективным, и/или пациент становился резистентным к таргетированному терапевтическому средству. В любом из указанных вариантов осуществления неэффективное лечение, которому подвергают пациента до периода времени, может включать, в качестве неограничивающих примеров, лечение, при котором пациент не ответил на предшествующую терапию или был рефрактерным к такой предшествующей терапии, и/или при котором злокачественное новообразование метастазировало или рецидивировало.
[0013] В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили с использованием одного или более из химиотерапии, таргетированного противоопухолевого средства, лучевой терапии и хирургического вмешательства, и, необязательно, предшествующее лечение было неэффективным. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили фторпиримидин-содержащим терапевтическим средством или ингибитором MEK в качестве монотерапии. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили гемцитабином, и, необязательно, предшествующее лечение было неэффективным. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили ингибитором MEK в качестве монотерапии, и, необязательно, предшествующее лечение было неэффективным.
[0014] В некоторых вариантах осуществления любых из способов по настоящему изобретению после периода времени пациента лечат терапевтическими средствами, не состоящими, по существу, из фторпиримидин-содержащего терапевтического средства и количества ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью (например, терапевтическими средствами, состоящими из фторпиримидин-содержащего терапевтического средства и количества ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью).
[0015] В некоторых вариантах осуществления введение фторпиримидин-содержащего терапевтического средства и введение ингибитора MEK или его фармацевтически приемлемой соли в течение периода времени осуществляют, по существу, одновременно. В некоторых вариантах осуществления введение пациенту фторпиримидин-содержащего терапевтического средства осуществляют перед введением пациенту ингибитора MEK или его фармацевтически приемлемой соли в течение периода времени. В некоторых вариантах осуществления введение пациенту ингибитора MEK или его фармацевтически приемлемой соли осуществляют перед введением пациенту фторпиримидин-содержащего терапевтического средства в течение периода времени.
[0016] В некоторых вариантах осуществления пациента также подвергают хирургическому вмешательству (например, резекции солидной опухоли и/или лимфоузла) в течение периода времени. В некоторых вариантах осуществления пациента подвергают лучевой терапии в течение периода времени. В некоторых вариантах осуществления пациенту вводят одно или более средств для улучшения побочных эффектов лечения в течение периода времени (например, одно или более из противодиарейных средств (например, лоперамида), кортикостероидов, антагонистов серотонина, антагонистов дофамина, ингибиторов NK-1, каннабиноидов, лекарственных средств против тревожности (например, лоразепама или диазепама), антибиотиков, противогрибковых средств, колониестимулирующего фактора, добавок железа, прокрита, эпоэтина альфа, дарбэпоэтина альфа, антиэметиков, диуретиков, НПВС, анальгетиков, метотрексата, антидиуретиков, пробиотиков, лекарственных средств для коррекции артериального давления, средств против тошноты и т.д.) в течение периода времени.
[0017] В некоторых вариантах осуществления любых из способов по настоящему изобретению пациенту не вводят дополнительное таргетированное противоопухолевое средство (например, в течение периода времени). В некоторых вариантах осуществления любых из способов по настоящему изобретению индивидууму не вводят дополнительное химиотерапевтическое средством в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению индивидууму не вводят таргетированный ингибитор против киназы, не являющейся MEK, в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению пациенту не вводят одно или более из алкилирующих средств, антрациклинов, средств, разрушающих цитоскелет (например, таксанов), эпотилонов, ингибиторов гистоновых деацетилаз, ингибиторов топоизомеразы I, ингибиторов топоизомеразы II, аналогов нуклеотидов, пептидных антибиотиков, средств на основе платины, ретиноидов и алкалоидов барвинка и их производных в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению пациенту не вводят ингибитор c-MET в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению индивидууму не вводят ингибитор CDK4/6 в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению пациенту не вводят ингибитор PI3K в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению, индивидууму не вводят ингибитор BRAF (например, энкорафениб) в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению пациенту не вводят ингибитор FGFR в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению пациенту не вводят ингибитор BCR-ABL в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению пациенту не вводят противоопухолевое средство, являющееся иным фторпиримидин-содержащим терапевтическим средством, чем вводимое в течение периода времени. В некоторых вариантах осуществления любых из способов по настоящему изобретению пациенту не вводят иной ингибитор MEK, чем вводимый в течение периода времени. В некоторых вариантах осуществления пациенту не вводят ингибитор RAS в течение периода времени. В некоторых вариантах осуществления пациенту не вводят ингибитор CSR-1R в течение периода времени. В некоторых вариантах осуществления пациенту не вводят ингибитор EGFR в течение периода времени. В некоторых вариантах осуществления пациенту не вводят ингибитор RAF в течение периода времени. В некоторых вариантах осуществления пациенту не вводят ингибитор KRAS в течение периода времени. В некоторых вариантах осуществления пациенту не вводят ингибитор NRAS в течение периода времени.
[0018] В некоторых вариантах осуществления термин "состоящий, по существу, из" в течение периода времени включает химиотерапию. В некоторых вариантах осуществления термин "состоящий, по существу, из" в течение периода времени может включать один или более типов химиотерапевтических средств, выбранных из группы: алкилирующих средств, антрациклинов, средств, разрушающих цитоскелет (например, таксанов), эпотилонов, ингибиторов гистоновых деацетилаз, ингибиторов топоизомеразы I, ингибиторов топоизомеразы II, аналогов нуклеотидов, дополнительных аналогов предшественников нуклеотидов, пептидных антибиотиков, средств на основе платины, ретиноидов, алкалоидов барвинка и их производных. В некоторых вариантах осуществления термин "состоящий, по существу, из" в течение периода времени может включать лечение любым таргетированным химиотерапевтическим средством. В некоторых вариантах осуществления термин "состоящий, по существу, из" в течение периода времени может включать хирургическое вмешательство и/или химиотерапию. В некоторых вариантах осуществления термин "состоящий, по существу, из" в течение периода времени может включать лечение любым таргетированным химиотерапевтическим средством, за исключением одного или более из следующего: ингибитора EGFR, ингибитора RAF, ингибитора RAS, ингибитора KRAS, ингибитора NRAS, ингибитора c-MET, ингибитора CDK4/6, ингибитора PI3K, ингибитора BRAF, ингибитора FGFR, дополнительного ингибитора MEK и ингибитора BCR-ABL. В некоторых вариантах осуществления термин "состоящий, по существу, из" в течение периода времени может включать лучевую терапию. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином. В некоторых вариантах осуществления ингибитор MEK является биниметинибом. В некоторых вариантах осуществления ингибитор MEK является кристаллизованным биниметинибом.
[0019] В другом варианте осуществления изобретение относится к способу лечения рака желчных протоков, включающему или состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени терапевтических средств, содержащих, или состоящих, по существу или состоящих из количества фторпиримидин-содержащего терапевтического средства и количества ингибитора MEK или его фармацевтически приемлемой соли, где количества вместе являются эффективными при лечении рака желчных протоков (например, в течение периода времени). В одном из вариантов осуществления ингибитор MEK является биниметинибом. В одном из вариантов осуществления биниметиниб является кристаллизованным биниметинибом. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином.
[0020] В другом варианте осуществления изобретение относится к способу лечения рака желчных протоков, включающему или состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени терапевтических средств, содержащих, или состоящих, по существу, или состоящих из количества фторпиримидин-содержащего терапевтического средства, являющегося капецитабином, и количества ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, где количества вместе являются эффективными при лечении рака желчных протоков (например, в течение периода времени). В одном из вариантов осуществления биниметиниб является кристаллизованным биниметинибом. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0021] Фиг. 1A является графиком, на котором показан процент жизнеспособности клеток линий клеток рака желчных протоков (SNU245, SNU308, SNU478, SNU869, SNU1079, SNU1196, TFK1 и HuCCT1) после воздействия различными концентрациями биниметиниба.
[0022] Фиг. 1B является столбиковой диаграммой, на которой показан показатель аддитивности биниметиниба и 5-FU в линиях клеток рака желчных протоков SNU245, SNU1196, SNU869 и HuCCT1 (CI<1 при Fa=0,5).
[0023] Фиг. 1C представляет собой изображения вестерн-блоттинга, на которых показана экспрессия тимидилатсинтазы (TS), лиганда программируемой гибели 1 (PD-L1) и β-актина в клетках, обработанных биниметинибом, 5-FU или комбинацией биниметиниба и 5-FU.
[0024] Фиг. 2A является каскадной диаграммой уменьшения размеров опухоли у пациентов, которых лечили с использованием комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2, среди пациентов с внутрипеченочной холангиокарциномой (I), внепеченочной холангиокарциномой (E), раком желчного пузыря (G) и раком фатерова соска (A).
[0025] Фиг. 2B является кривой выживаемости с таблицей риска, где показаны медиана выживаемости без прогрессирования (PFS) и медиана общей выживаемости (OS) у пациентов, которых лечили с использованием комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2.
[0026] Фиг. 2C является каскадной диаграммой уменьшения размеров опухоли у пациентов, которых лечили с использованием комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2, среди пациентов с внутрипеченочной холангиокарциномой (I), внепеченочной холангиокарциномой (E), раком желчного пузыря (G) и раком фатерова соска (A), при этом сравнивали пациентов с опухолями, имеющими мутации пути RAS/RAF/MEK/ERK, и пациентов с опухолями дикого типа.
[0027] Фиг. 2D является кривой выживаемости с таблицей риска, где показана медиана выживаемости без прогрессирования (PFS) у пациентов, которых лечили с использованием комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2, при этом сравнивали пациентов с опухолями, имеющими мутации пути RAS/RAF/MEK/ERK, и пациентов с опухолями дикого типа.
[0028] Фиг. 2E является линейчатой диаграммой длительности лечения пациентов, которых лечили с использованием комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2, при этом сравнивали пациентов с опухолями, имеющими мутации пути RAS/RAF/MEK/ERK, и пациентов с опухолями дикого типа.
[0029] Фиг. 2F является кривой выживаемости с таблицей риска, где показана медиана общей выживаемости (OS) у пациентов, которых лечили с использованием комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2, при этом сравнивали пациентов с опухолями, имеющими мутации пути RAS/RAF/MEK/ERK, и пациентов с опухолями дикого типа.
[0030] Фиг. 3A является кривой выживаемости с таблицей риска, где показана медиана выживаемости без прогрессирования (PFS) у пациентов, которых лечили с использованием комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2, при этом сравнивали пациентов с более высокими начальными концентрациями ИЛ-6 в плазме (>10,3 пг/мл) и более низкими начальными концентрациями ИЛ-6 в плазме (≤10,3 пг/мл).
[0031] Фиг. 3B является кривой выживаемости с таблицей риска, где показана общая выживаемость (OS) у пациентов, которых лечили с использованием комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2, при этом сравнивали пациентов с более высокими начальными концентрациями ИЛ-6 в плазме (>10,3 пг/мл) и более низкими начальными концентрациями ИЛ-6 в плазме (≤10,3 пг/мл).
[0032] Фиг. 3C является кривой выживаемости с таблицей риска, где показана медиана выживаемости без прогрессирования (PFS) у пациентов, которых лечили с использованием двух циклов комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2, при этом сравнивали пациентов с изменением концентрации ИЛ-6 в плазме >14,8 пг/мл и ≤14,8 пг/мл от начального уровня до времени после второго цикла.
[0033] Фиг. 3D является кривой выживаемости с таблицей риска, где показана общая выживаемость (OS) у пациентов, которых лечили с использованием двух циклов комбинации биниметиниба и капецитабина в части повышения дозы исследования фазы 1b из примера 2, при этом сравнивали пациентов с изменением концентрации ИЛ-6 в плазме >14,8 пг/мл и ≤14,8 пг/мл от начального уровня до времени после второго цикла.
ПОДРОБНОЕ ОПИСАНИЕ
[0034] BTC определяют с относительно более высокой частотой у пациентов из Восточной и Юго-восточной Азии. При лишь ограниченных вариантах лечения прогноз остается плохим, и время общей выживаемости при использовании химиотерапии первой линии составляет лишь приблизительно 8-10 месяцев. Химиотерапия и лучевая терапия являются основой лечения BTC. Например, пациентам с BTC также предлагают способы комбинированного лечения с использованием 5-фторурацила, например, 5-фторурацил и лейковорин; 5-фторурацил и цисплатин; 5-фторурацил, эпирубицин и цисплатин; 5-фторурацил и иринотекан (Hezel and Zhu, The Oncologist 13(4): 415-423 (2008)).
[0035] Гемцитабин, аналог дезоксицитидина, также используют в качестве монотерапии для пациентов с BTC. Комбинированное лечение гемцитабином и цисплатином является наиболее широко используемой химиотерапией первой линии. Однако, у ряда индивидуумов, имеющих BTC, развивается резистентность к гемцитабину. Не желая быть связанными какой-либо теорией, авторы настоящего изобретения обнаружили, что комбинированное лечение фторпиримидин-содержащим терапевтическим средством (например, капецитабином) и ингибитором MEK (например, биниметинибом) имеет синергический терапевтический эффект в отношении клеток BTC.
[0036] MEK является ключевым нижележащим эффектором передачи сигнала для множества рецепторных тирозинкиназ (RTK), включая, например, рецепторы VEGF, CSF1R и киназы TAM Mer, AXL и Tyro3. Способы комбинированного лечения, включающие использование ингибитора MEK и фторпиримидин-содержащего терапевтического средства, раскрыты в настоящем описании в отношении обеспечения улучшенных противоопухолевых ответов у млекопитающего, имеющего злокачественное новообразование (например, гемцитабин-резистентное злокачественное новообразование, например, гемцитабин-резистентный BTC, необязательно, дополнительно имеющий дисрегулированную передачу сигнала по пути MAPK, например, по сравнению с контрольной тканью). Настоящее изобретение может быть более понятным с учетом следующего подробного описания предпочтительных вариантов осуществления изобретения и примеров, включенных в настоящее описание. Также следует понимать, что терминология, используемая в настоящем описании, предназначена исключительно для описания конкретных вариантов осуществления, а не для ограничения. Также следует понимать, что, если в настоящем описании конкретно не указано иное, терминология, используемая в настоящем описании, должна иметь значение, общепринятое в соответствующей области техники.
Общие определения
[0037] Для лучшего понимания настоящего изобретения ниже специально определены некоторые технические и научные термины. Если где-либо в настоящем описании не указано иное, все другие технические и научные термины, используемые в настоящем описании, имеют значение, общепринято понятное специалисту в области, к которой относится настоящее изобретение.
[0038] Термин "приблизительно" при использовании для модификации определенного числового параметра (например, дозы ингибитора MEK или фторпиримидин-содержащего терапевтического средства или длительности комбинированного лечения, представленного в настоящем описании) означает, что параметр может варьироваться на целых 10% ниже или выше указанного числового значения этого параметра. Например, доза приблизительно 5 мг/кг может варьироваться от 4,5 мг/кг до 5,5 мг/кг. Термин "приблизительно" при использовании в начале списка параметров предназначен для модификации каждого параметра. Например, приблизительно 0,5 мг, 0,75 мг или 1,0 мг означает приблизительно 0,5 мг, приблизительно 0,75 мг или приблизительно 1,0 мг. Аналогично, приблизительно 5% или более, 10% или более, 15% или более, 20% или более и 25% или более означает приблизительно 5% или более, приблизительно 10% или более, приблизительно 15% или более, приблизительно 20% или более, и приблизительно 25% или более.
[0039] Термин "5-FU" относится к 5-фторурацилу. В одном из вариантов осуществления 5-FU составляют для перорального введения. В одном из вариантов осуществления 5-FU составляют для внутривенного введения.
[0040] Термин "фторпиримидин-содержащее терапевтическое средство" относится к терапевтическому средству, выбранному из (a) пролекарств 5-FU, (b) комбинированного терапевтического средства, содержащего 5-FU, и (c) комбинированного терапевтического средства, содержащего пролекарство 5-FU.
[0041] Термин "пролекарство 5-FU" относится к соединению, подвергаемому ферментативной активации посредством одной или более ферментативных систем для внутриклеточного высвобождения 5-FU. Примеры пролекарств 5-FU включают капецитабин (n4-пентилоксикарбонил-5'-дезокси-5-фторцитидин; Кселода), который сам по себе является пролекарством другого пролекарства 5-FU (доксифлуридина), и фторафур (тегафур; [R, S-1-1(тетрагидрофуран-2-ил)-5-FU]).
[0042] Термин "ингибитор DPD" относится к соединению, обратимо или необратимо ингибирующему дигидропиримидин-дегидрогеназу (DPD). Примеры обратимых ингибиторов DPD включают урацил, 5-хлор-2,4-дигидроксипиридин (CDHP; гимерацил) и 3-циано-2,6-дигидроксипиридин (CNDP). Примером необратимого ингибитора является 5-этинилурацил (энилурацил).
[0043] Термин "комбинированное терапевтическое средство, включающее 5-FU" относится к комбинированному лечению, включающему введение 5-FU и одного или более ингибиторов DPD. В одном из вариантов осуществления ингибитор DPD вводят перед введением 5-FU.
[0044] Термин "модулятор 5-FU" относится к ингибитору фосфорибозилирования 5-FU. Примером является оксоновая кислота, являющаяся ингибитором пиримидин-фосфорибозилтрансферазы.
[0045] Термин "комбинированное терапевтическое средство, включающее пролекарство 5-FU" относится к комбинированному лечению, включающему введение пролекарства 5-FU и одного или более ингибитора DPD и/или модулятора 5-FU. В одном из вариантов осуществления "комбинированное терапевтическое средство, включающее пролекарство 5-FU" представляет собой S-1, являющийся пероральным составом фторафура, оксоновой кислоты и 5-хлор-2,4-дигидроксипиридина (CDHP) в молярном соотношении 1:0,4:1. В одном из вариантов осуществления "комбинированное терапевтическое средство, включающее пролекарство 5-FU" является пероральным составом BOF A-2, являющегося пролекарством 5-FU (1-этоксиметил-5-FU), в комбинации с ингибитором DPD 3-циано-2,6-дигидроксипиридином в молярном соотношении 1:1. В одном из вариантов осуществления "комбинированное терапевтическое средство, включающее пролекарство 5-FU" является пероральным составом UFT, представляющим собой молярную комбинацию 1:4 пролекарства 5-FU фторафура и ингибитора DPD урацила.
[0046] Термины "злокачественное новообразование" или "злокачественный" относятся к физиологическому состоянию к млекопитающих, как правило, отличающемуся нерегулируемым ростом клеток. Неограничивающие примеры злокачественных новообразований включают рак поджелудочной железы, рак молочной железы (например, трижды негативный рак молочной железы), лимфому из клеток мантийной зоны, немелкоклеточный рак легких, меланому, рак толстого кишечника, рак пищевода, липосаркому, множественную миелому, T-клеточный лейкоз, почечноклеточную карциному, рак желудка, глиобластому, печеночноклеточную карциному, рак легких, колоректальный рак, рабдоидную опухоль, злокачественные новообразование, положительные по белку ретинобластомы, рак желчного пузыря, холангиокарциному (например, внутрипеченочную холангиокарциному и внепеченочную холангиокарциному), рак фатерова соска, астроцитомы, мультиформную глиобластому, синдром Баннаяна-Зонана, болезнь Коудена, болезнь Лермитта-Дюкло, опухоль Вильмса, саркому Юинга, рабдомиосаркому, эпендимому, медуллобластому, рак головы и шеи, рак почки, рак яичников, рак предстательной железы, саркому, остеосаркому, гигантоклеточную опухоль костей, рак щитовидной железы, хронический миелогенный лейкоз, хронический лимфоцитарный лейкоз, волосатоклеточный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз, AML, хронический нейтрофильный лейкоз, плазмоцитому, иммунобластный крупноклеточный лейкоз, лейкоз из клеток мантийной зоны, мегакариобластный лейкоз, острый мегакариоцитарный лейкоз, промиелоцитарный лейкоз, эритролейкоз, злокачественную лимфому, лимфому Ходжкина, неходжкинскую лимфому, лимфобластную T-клеточную лимфому, лимфому Беркитта, фолликулярную лимфому, нейробластому, рак мочевого пузыря, уротелиальный рак, рак легких, рак женских наружных половых органов, рак шейки матки, рак эндометрия, рак почки, мезотелиому, рак слюнных желез, рак носоглотки, рак слизистой оболочки щеки, рак кротовой полости, GIST (стромальную опухоль желудочно-кишечного тракта), NSCLC или рак яичка. В некоторых вариантах осуществления злокачественное новообразование является злокачественным новообразованием с инфильтрацией T-клетками. В некоторых вариантах осуществления злокачественное новообразование выбрано из группы, состоящей из: немелкоклеточного рака легких, рака желчных протоков, рака молочной железы, рака мочевого пузыря, рака шейки матки, злокачественной мезотелиомы, рака яичников и рака поджелудочной железы. В одном из вариантов осуществления злокачественное новообразование является раком желчных протоков (BTC).
[0047] Термин "рак желчных протоков", также известный как "холангиокарцинома", относится к злокачественному новообразованию, возникающему в желчных протоках. Рак желчных протоков может образовываться в любом месте по длине желчных протоков, и каждый подтип рака желчных протоков называют по локализации первичной опухоли. Внутрипеченочный рак возникает внутри желчного протока в печени. Внепеченочный рак возникает в желчном протоке вне печени. Пятьдесят процентов случаев рака желчных протоков относятся к опухоли Клацкина, образующегося в месте соединения правого печеночного протока с левым печеночным протоком в печени. Злокачественные новообразования, возникающие в общем желчном протоке, называют раком общего желчного протока. Если присутствует множество опухолей в разных областях желчных протоков, то их называют мультифокальным раком желчных протоков. Термин "рак желчных протоков" также включает рак желчного пузыря. Термин "рак желчных протоков" так включает карциному фатерова соска. Таким образом, термин "рак желчных протоков" включает внепеченочный рак, опухоли Клацкина, рак общего желчного протока, мультифокальный рак желчных протоков, рак желчного пузыря и карциному фатерова соска. В одном из вариантов осуществления рак желчных протоков является раком желчных протоков на поздней стадии. В некоторых вариантах осуществления рак желчных протоков выбран из группы, состоящей из: внутрипеченочной холангиокарциномы, внепеченочной холангиокарциномы, рак желчного пузыря и рак фатерова соска. В некоторых вариантах осуществления рак желчных протоков является неоперабельным. В некоторых вариантах осуществления рак желчных протоков является рецидивирующим (например, "рецидивирующим заболеванием"). В одном из вариантов осуществления рак желчных протоков имеет мутацию RAS. В одном из вариантов осуществления рак желчных протоков имеет мутацию KRAS. В одном из вариантов осуществления рак желчных протоков имеет мутацию KRAS G12A. В одном из вариантов осуществления рак желчных протоков имеет мутацию KRAS G12C. В одном из вариантов осуществления рак желчных протоков имеет мутацию KRAS G12D. В одном из вариантов осуществления рак желчных протоков имеет мутацию KRAS G12V. В одном из вариантов осуществления рак желчных протоков имеет мутацию NRAS. В одном из вариантов осуществления рак желчных протоков имеет мутацию NRAS Q61L.В одном из вариантов осуществления рак желчных протоков имеет мутацию RAF. В одном из вариантов осуществления рак желчных протоков имеет мутацию BRAF. В одном из вариантов осуществления рак желчных протоков имеет мутацию MAP2K1. В одном из вариантов осуществления рак желчных протоков имеет мутацию MAP2K1 E203K. В одном из вариантов осуществления рак желчных протоков имеет мутацию MAP2K1 E203V.
[0048] Фразы "до периода времени" или "перед периодом времени" относятся к (1) завершению подвергания индивидуума хирургическому вмешательству и/или лучевой терапии перед первым введением терапевтического средства в течение периода времени, и/или (2) введению одного или более терапевтических средств индивидууму перед первым введением терапевтического средства в комбинированном лечении, представленном в настоящем описании, в течение периода времени таким образом, что одно или более терапевтических средств присутствуют на субтерапевтических и/или недетектируемых уровнях у индивидуума на момент осуществления первого введения терапевтического средства в комбинированном лечении в течение периода времени. В некоторых вариантах осуществления фраза "до периода времени" или "перед периодом времени" относится к введению одного или более терапевтических средств индивидууму перед первым введением терапевтического средства в комбинированном лечении в течение периода времени, таким образом, что одно или более терапевтические средства присутствуют на субтерапевтических уровнях у индивидуума на момент осуществления первого введения терапевтического средства в комбинированном лечении в течение периода времени. В некоторых вариантах осуществления фраза "до периода времени" или "перед периодом времени" относится к введению одного или более терапевтических средств индивидууму перед первым введением терапевтического средства в комбинированном лечении в течение периода времени, таким образом, что одно или более терапевтических средств присутствуют на недетектируемых уровнях у индивидуума на момент осуществления первого введения терапевтического средства в комбинированном лечении в течение периода времени. В некоторых вариантах осуществления фраза "до периода времени" или "перед периодом времени" относится к введению одного или более терапевтических средств индивидууму перед первым введением терапевтического средства в комбинированном лечении в течение периода времени, таким образом, что одно или более терапевтических средств присутствуют на субтерапевтических и/или недетектируемых уровнях у индивидуума на момент осуществления первого введения терапевтического средства в комбинированном лечении в течение периода времени.
[0049] Фраза "фармацевтически приемлемый" означает, что вещество или композиция должны быть химически и/или токсикологически совместимыми с другими ингредиентами, составляющими состав, и/или млекопитающим, которого подвергают лечению с помощью него. Некоторые варианты осуществления относятся к фармацевтически приемлемым солям соединений, представленных в настоящем описании. Термин "фармацевтически приемлемая соль" относится к составу соединения, не вызывающему значительное раздражение в организме, в который его вводят, и не устраняющему биологическую активность и свойства соединения. В некоторых случаях фармацевтически приемлемые соли получают посредством реакции соединения, представленного в настоящем описании, с кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, метансульфоновая кислота, этансульфоновая кислота, p-толуолсульфоновая кислота, салициловая кислота и т.п. В некоторых случаях фармацевтически приемлемые соли получают посредством реакции соединения, имеющего кислотную группу, представленную в настоящем описании, с основанием для получения соли, такой как соль аммония, соль щелочного металла, такая как соль натрия или калия, соль щелочноземельного металла, такая как соль кальция или магния, соль органических оснований, таких как дициклогексиламин, N-метил-D-глюкамин, трис(гидроксиметил)метиламин, и соли с аминокислотами, такими как аргинин, лизин и т.п., или другими способами, определенными ранее.
[0050] Термины "введение", "лечение" и "обработка" в отношении пациента, индивидуума, животного, человека, объекта эксперимента, клетки, ткани, органа или биологической жидкости, относится к контакту экзогенного фармацевтического, терапевтического, диагностического средства или композиции с животным, человеком, индивидуумом, клеткой, тканью, органом или биологической жидкостью. Обработка клетки включает контакт реагента с клеткой, а также контакт реагента с жидкостью, где жидкость контактирует с клеткой. "Введение" и "обработка" также означают обработку in vitro и ex vivo, например, клетки, с помощью реагента, диагностического, связывающего соединения или другой клетки.
[0051] Термин "лечение", как используют в клинических условиях, относится к достижению благоприятных или желаемых клинических результатов. В целях по настоящему изобретению, благоприятные или желаемые клинические результаты включают, в качестве неограничивающих примеров, одно или более из следующего: снижения пролиферации (или разрушения) неопластических или злокачественных клеток, ингибирования метастазирования неопластических клеток, уменьшения размера (например, объема) опухоли, ремиссии злокачественного новообразования, уменьшения симптомов, являющихся результатом злокачественного новообразования, повышения качества жизни индивидуумов, страдающих злокачественным новообразованием (например, по оценке с использованием FACT-G или EORTC-QLQC30), снижения дозы других лекарственных средств, необходимых для лечения злокачественного новообразования, задержки прогрессирования злокачественного новообразования и/или пролонгирования выживаемости пациентов, имеющих злокачественное новообразование. Например, лечение может представлять собой уменьшение одного или нескольких симптомов нарушения, такого как злокачественное новообразование. В рамках изобретения термин "лечение" также означает прекращение, задержку дебюта (т.е. период до клинической манифестации заболевания) и/или снижение риска развития или ухудшения злокачественного новообразования. Термин "лечение" также может означать пролонгирование выживаемости по сравнению с ожидаемой выживаемостью при отсутствии лечения, например, повышение общей выживаемости (OS) по сравнению с индивидуумом, которого не подвергали лечению, представленному в настоящем описании, и/или повышение выживаемости без прогрессирования (PFS) по сравнению с индивидуумом, которого не подвергали лечению, представленному в настоящем описании. Термин "лечение" также может означать улучшение состояния индивидуума, имеющего злокачественное новообразование, например, одно или более из уменьшения размера одной или более опухолей у индивидуума, снижения или отсутствия значительного изменения скорости роста одной или более опухолей у индивидуума, снижения метастазирования у индивидуума и увеличения периода ремиссии у индивидуума (например, по сравнению с одним или более показателями у индивидуума, имеющего схожее злокачественное новообразование, которого не подвергали лечению или которого подвергали другому лечению, или по сравнению с одним или более показателями у того же индивидуума перед лечением). Дополнительные показатели для оценки ответа на лечение у индивидуума, имеющего злокачественное новообразование, представлены в настоящем описании ниже.
[0052] Термин "индивидуум" включает любой организм, предпочтительно - животное, более предпочтительно - млекопитающее (например, крысу, мышь, собаку, кошку и кролика), и наиболее предпочтительно - человека.
[0053] Термин "пациент", подлежащий лечению по настоящему изобретению, включает любое теплокровное животное, в качестве неограничивающих примеров, такое как человек, обезьяна или другой низший примат, лошадь, собака, кролик, морская свинка или мышь. В одном из вариантов осуществления пациент является человеком. В одном из вариантов осуществления пациент является пациентом детского возраста. Специалисты в области медицины легко могут идентифицировать индивидуумов, страдающих злокачественным новообразованием и нуждающихся в лечении.
[0054] В рамках изобретения термин "пациент детского возраста" относится к пациенту возрастом менее 16 лет на момент диагностики или лечения. Термин "детский возраст" также может дополнительно включать разделение на различные субпопуляции, включая: новорожденных (от рождения вплоть до первого месяца жизни); младенцев (возрастом от 1 месяца до двух лет); детей (возрастом от двух до 12 лет) и подростков (возрастом от 12 до 21 года (до двадцать второго дня рождения, но не включая его)). Berhman RE, Kliegman R, Arvin AM, Nelson WE. Nelson Textbook of Pediatrics, 15th Ed. Philadelphia: W.B. Saunders Company, 1996; Rudolph AM, et al. Rudolph's Pediatrics, 21st Ed. New York: McGraw-Hill, 2002; и Avery MD, First LR. Pediatric Medicine, 2nd Ed. Baltimore: Williams & Wilkins; 1994.
[0055] Термины "схема лечения" и "схема дозирования" используют взаимозаменяемо для обозначения дозы и времени введения каждого терапевтического средства в комбинации по изобретению.
[0056] Термин "улучшение" означает уменьшение или улучшение одного или более симптомов по сравнению с отсутствием лечения. Термин "улучшение" также включает уменьшение длительности симптома.
[0057] Термин "надзорный орган" означает учреждение в конкретной стране для одобрения медицинского использования фармацевтических средств в этой стране. Например, неограничивающим примером надзорного органа является Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).
[0058] В способах комбинированного лечения по изобретению ингибиторы MEK включают, в качестве неограничивающих примеров, биниметиниб (также называемый MEK162, ARRY-162 и ARRY 438162), селуметиниб (также называемый AZD6244 и ARRY-142886), траметиниб (также называемый GSK1120212), кобиметиниб (также называемый GDC-0973, XL518 и RG7421), E6201 PD-325901, CI-1040 (также называемый PD 184352), PD-035901, TAK733, пимасертиб (также называемый AS703026 и MSC1936369B), рефаметиниб (также называемый RDEA119 и BAY 869766), RO5126766, WX-554, RO4987655 (также называемый CH4987655), GDC-0973 (также называемый XL518), AZD8330 (также называемый ARRY-424704 и ARRY-704) и RO5126766.
[0059] В одном из вариантов осуществления ингибитор MEK в способах комбинированного лечения по изобретению является биниметинибом или его фармацевтически приемлемой солью. Биниметиниб имеет следующую структуру:
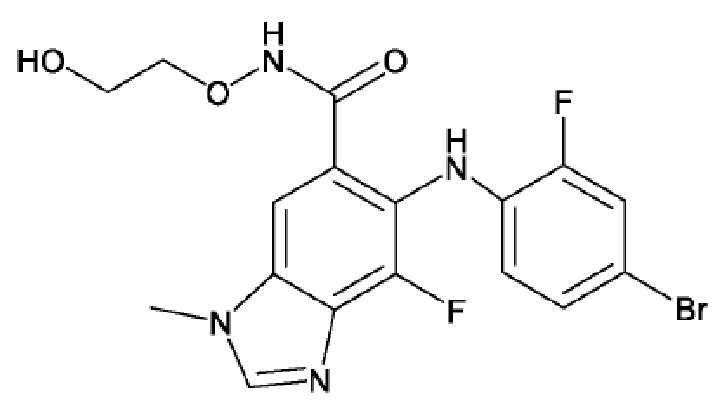
[0060] Биниметиниб также известен как ARRY-162, ARRY-438162, MEK162, (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты и 5-((4-бром-2-фторфенил)амино)-4-фтор-N-(2-гидроксиэтокси)-1-метил-1H-бензимидазол-6-карбоксамид. Способы получения биниметиниба и его фармацевтически приемлемых солей описаны в публикации PCT № WO 03/077914 в примере 18 (соединение 29lll), описание которой включено в настоящее описание в качестве ссылки в полном объеме. В одном из вариантов осуществления ингибитор MEK является биниметинибом в виде свободного основания. В одном из вариантов осуществления ингибитор MEK является фармацевтически приемлемой солью биниметиниба. В одном из вариантов осуществления ингибитор MEK является кристаллизованным биниметинибом. Кристаллизованный биниметиниб и способы получения кристаллизованного биниметиниба описаны в публикации PCT № WO 2014/063024, описание которой включено в настоящее описание в качестве ссылки в полном объеме.
[0061] В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является пролекарством 5-FU. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является пероральным составом пролекарства 5-FU. В одном из вариантов осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином.
[0062] В рамках изобретения термин "комбинированное лечение" относится к схеме дозирования двух разных терапевтически активных средств (т.е. компонентов или комбинируемых партнеров из комбинации, т.е. ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства) в течение периода времени, где терапевтически активные средства вводят совместно или раздельно так, как предписано медицинским работником или надзорным органом, как определено в настоящем описании. В одном из вариантов осуществления комбинированное лечение включает комбинацию ингибитора MEK его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства. В одном из вариантов осуществления комбинированное лечение состоит, по существу, из комбинации ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства. В одном из вариантов осуществления комбинированное лечение включает комбинацию ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, и фторпиримидин-содержащего терапевтического средства, являющегося пролекарством 5-FU, являющимся капецитабином. В одном из вариантов осуществления комбинированное лечение состоит, по существу, из комбинации ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, и фторпиримидин-содержащего терапевтического средства, являющегося пролекарством 5-FU, являющимся капецитабином.
[0063] Как известно в этой области, можно подвергать пациента комбинированному лечению в течение периода времени. В некоторых вариантах осуществления период времени наступает после использования в отношении пациента другого способа лечения злокачественного новообразования/противоопухолевого средства или другой комбинации способов лечения злокачественного новообразования/противоопухолевых средств. В некоторых вариантах осуществления период времени наступает до использования в отношении пациента другого способа лечения злокачественного новообразования/противоопухолевого средства или другой комбинации способов лечения злокачественного новообразования/противоопухолевых средств. В некоторых вариантах осуществления введение фторпиримидин-содержащего терапевтического средства и введение ингибитора MEK или его фармацевтически приемлемой соли осуществляют, по существу, одновременно. В некоторых вариантах осуществления введение фторпиримидин-содержащего терапевтического средства пациенту осуществляют до введения пациенту биниметиниба или его фармацевтически приемлемой соли в течение периода времени. В некоторых вариантах осуществления введение ингибитора MEK или его фармацевтически приемлемой соли пациенту осуществляют до введения пациенту фторпиримидин-содержащего терапевтического средства в течение периода времени. В некоторых вариантах осуществления пациента подвергают хирургическому вмешательству (например, резекции опухоли и/или резекции лимфоузла) и/или противоопухолевой терапии в течение периода времени.
[0064] Специалист в этой области (например, лечащий врач) может определять подходящий период времени. Как известно в этой области, специалист в этой области может определять подходящий период времени с учетом одного или более из: стадии заболевания пациента, массы и пола пациента, руководств по клиническим испытаниям (например, представленным на веб-сайт fda.gov) и информации на ярлыке одобренного лекарственного средства. Например, подходящий период времени может составлять, например, от 1 недели до 2 лет, от 1 недели до 22 месяцев, от 1 недели до 20 месяцев, от 1 недели до 18 месяцев, от 1 недели до 16 месяцев, от 1 недели до 14 месяцев, от 1 недели до 12 месяцев, от 1 недели до 10 месяцев, от 1 недели до 8 месяцев, от 1 недели до 6 месяцев, от 1 недели до 4 месяцев, от 1 недели до 2 месяцев, от 1 недели до 1 месяца, от 2 недель до 2 лет, от 2 недель до 22 месяцев, от 2 недель до 20 месяцев, от 2 недель до 18 месяцев, от 2 недель до 16 месяцев, от 2 недель до 14 месяцев, от 2 недель до 12 месяцев, от 2 недель до 10 месяцев, от 2 недель до 8 месяцев, от 2 недель до 6 месяцев, от 2 недель до 4 месяцев, от 2 недель до 2 месяцев, от 2 недель до 1 месяца, от 1 месяца до 2 лет, от 1 месяца до 22 месяцев, от 1 месяца до 20 месяцев, от 1 месяца до 18 месяцев, от 1 месяца до 16 месяцев, от 1 месяца до 14 месяцев, от 1 месяца до 12 месяцев, от 1 месяца до 10 месяцев, от 1 месяца до 8 месяцев, от 1 месяца до 6 месяцев, от 1 месяца до 4 месяцев, от 1 месяца до 2 месяцев, от 2 месяцев до 2 лет, от 2 месяцев до 22 месяцев, от 2 месяцев до 20 месяцев, от 2 месяцев до 18 месяцев, от 2 месяцев до 16 месяцев, от 2 месяцев до 14 месяцев, от 2 месяцев до 12 месяцев, от 2 месяцев до 10 месяцев, от 2 месяцев до 8 месяцев, от 2 месяцев до 6 месяцев, от 2 месяцев до 4 месяцев, от 3 месяцев до 2 лет, от 3 месяцев до 22 месяцев, от 3 месяцев до 20 месяцев, от 3 месяцев до 18 месяцев, от 3 месяцев до 16 месяцев, от 3 месяцев до 14 месяцев, от 3 месяцев до 12 месяцев, от 3 месяцев до 10 месяцев, от 3 месяцев до 8 месяцев, от 3 месяцев до 6 месяцев, от 4 месяцев до 2 лет, от 4 месяцев до 22 месяцев, от 4 месяцев до 20 месяцев, от 4 месяцев до 18 месяцев, от 4 месяцев до 16 месяцев, от 4 месяцев до 14 месяцев, от 4 месяцев до 12 месяцев, от 4 месяцев до 10 месяцев, от 4 месяцев до 8 месяцев, от 4 месяцев до 6 месяцев, от 6 месяцев до 2 лет, от 6 месяцев до 22 месяцев, от 6 месяцев до 20 месяцев, от 6 месяцев до 18 месяцев, от 6 месяцев до 16 месяцев, от 6 месяцев до 14 месяцев, от 6 месяцев до 12 месяцев, от 6 месяцев до 10 месяцев, от 6 месяцев до 8 месяцев, от 8 месяцев до 2 лет, от 8 месяцев до 22 месяцев, от 8 месяцев до 20 месяцев, от 8 месяцев до 18 месяцев, от 8 месяцев до 16 месяцев, от 8 месяцев до 14 месяцев, от 8 месяцев до 12 месяцев, от 8 месяцев до 10 месяцев, от 10 месяцев до 2 лет, от 10 месяцев до 22 месяцев, от 10 месяцев до 20 месяцев, от 10 месяцев до 18 месяцев, от 10 месяцев до 16 месяцев, от 10 месяцев до 14 месяцев, от 10 месяцев до 12 месяцев, от 12 месяцев до 2 лет, от 12 месяцев до 22 месяцев, от 12 месяцев до 20 месяцев, от 12 месяцев до 18 месяцев, от 12 месяцев до 16 месяцев или от 12 месяцев до 14 месяцев, включительно.
[0065] В рамках изобретения "эффективная доза", или "эффективное количество", или "терапевтически эффективное количество" лекарственного средства, соединения или фармацевтической композиции является количеством, достаточным для достижения одного или более благоприятных или желаемых результатов. В случае профилактического использования благоприятные или желаемые результаты включают снижение риска, уменьшение тяжести или задержку дебюта заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, возникающие во время развития заболевания. В случае терапевтического использования благоприятные или желаемые результаты включают клинические результаты, такие как снижение частоты или улучшение одного или более симптомов различных заболеваний или состояний (таких как, например, злокачественное новообразование), снижение дозы других лекарственных средств, необходимых для лечения заболевания, усиление эффекта другого лекарственного средства и/или задержку прогрессирования заболевания. Эффективную дозу можно вводить за одно или более введений. В целях по настоящему изобретению, эффективная доза лекарственного средства, соединения или фармацевтической композиции является количеством, достаточным для осуществления профилактического или терапевтического лечения напрямую или косвенно. Как следует понимать в клиническом контексте, эффективной дозы лекарственного средства, соединения или фармацевтической композиции можно достигать в комбинации с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, "эффективное количество" можно рассматривать в контексте введения одного или более терапевтических средств, и можно рассматривать введение отдельного средства в эффективном количестве, если в комбинации с одним или более другими средствами можно достигать или достигают желаемого результата. Что касается лечения злокачественного заболевания, термин "эффективное количество" также может относиться к количеству, имеющему эффект (1) уменьшения размера опухоли, (2) ингибирования (т.е. замедления до некоторой степени, предпочтительно - прекращения) метастазирования опухоли, (3) ингибирования до некоторой степени (т.е. замедления до некоторой степени, предпочтительно - прекращения) роста опухоли или инвазивности опухоли, и/или (4) облегчения до некоторой степени (или, предпочтительно, устранения) одного или более признаков или симптомов, ассоциированных со злокачественным новообразованием. Терапевтическую или фармакологическую эффективность доз и схемы введения также можно охарактеризовывать как способность индуцировать, повышать, поддерживать или пролонгировать контроль заболевания и/или общую выживаемость у пациентов с этими конкретными опухолями, что можно измерять как увеличение времени до прогрессирования заболевания
[0066] В рамках изобретения термин "BID" означает дважды в сутки.
[0067] Термин "опухоль" в отношении индивидуума, у которого диагностировали или предполагают наличие злокачественного новообразования, относится к злокачественной или потенциально злокачественной неоплазии или тканевой массе любого размера, и он включает первичные опухоли и вторичные неоплазии. Солидная опухоль представляет собой аномальный рост или массу ткани, как правило, не содержащей кисты или области жидкости. Различные типы солидных опухолей называют по типу клеток, образующих их. Примерами солидных опухолей являются саркомы, карциномы и лимфомы.
[0068] В рамках изобретения термин "на поздней стадии" в отношении солидных опухолей включает местнораспространенное (неметастазирующее) заболевание и метастазирующее заболевание. Местнораспространенные солидные опухоли, которые можно лечить или не лечить с целью излечения, и метастазирующее заболевание, которое нельзя лечить с целью излечения, включены в объем термина "солидные опухоли на поздней стадии", используемого в настоящем изобретении. Специалисты в этой области могут распознавать и диагностировать у пациента солидные опухоли на поздней стадии.
[0069] Термин "опухолевая масса", также обозначаемый как "опухолевая нагрузка", относится к общему количеству опухолевого материала, распространенного по всему организму. Термин "опухолевая масса" относится к общему количеству злокачественных клеток или общему размеру опухолей по всему организму, включая лимфоузлы и костный мозг. Опухолевую массу можно определять различными известными в этой области способами, например, посредством измерения размеров опухолей после удаления из индивидуума, например, с использованием калипера или, когда они находятся в организме, способов визуализации, например, ультразвукового исследования, сцинтиграфии скелета, компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ).
[0070] Термин "размер опухоли" относится к общему размеру опухоли (например, солидной опухоли), который можно измерять как длину и ширину опухоли или объем опухоли. Размер опухоли можно определять различными известными в этой области способами, например, посредством измерения размеров опухолей после удаления из индивидуума, например, с использованием калипера или, когда они находятся в организме, способов визуализации, например, сцинтиграфии скелета, ультразвукового исследования, КТ или МРТ.
[0071] "Индивидуальный ответ" или "ответ" можно оценивать с использованием любой конечной точки, означающей пользу для индивидуума, включая, в качестве неограничивающих примеров, (1) ингибирование до некоторой степени прогрессирования заболевания (например, прогрессирования злокачественного новообразования), включая замедление или полное прекращение; (2) уменьшение размера опухоли; (3) ингибирование (т.е. уменьшение, замедление или полное прекращение) инфильтрации злокачественными клетками смежных периферических органов и/или тканей; (4) ингибирование (т.е. уменьшение, замедление или полное прекращение) метастазирования; (5) облегчение до некоторой степени одного или более симптомов, ассоциированных с заболеванием или нарушением (например, злокачественным новообразованием); (6) повышение или увеличение времени выживаемости, включая общую выживаемость и выживаемость без прогрессирования; и/или (7) снижение смертности в указанный момент времени после лечения.
[0072] Термин "эффективный ответ" пациента или "отвечаемость" пациента на лечение лекарственным средством и схожий термин относится к клиническому или терапевтическому благоприятному эффекту в отношении пациента, имеющего риск или страдающего заболеванием или нарушением, таким как злокачественное новообразование. В одном из вариантов осуществления такой благоприятный эффект включает любое одно или более из: увеличения выживаемости (включая общую выживаемость и/или выживаемость без прогрессирования); достижения объективного ответа (включая полный ответ или частичный ответ) или улучшения признаков или симптомов злокачественного новообразования.
[0073] Термин "объективный ответ" или "OR" относится к измеримому ответу, включая полный ответ (CR) или частичный ответ (PR). Термин "частота объективных ответов" (ORR) относится к доле пациентов с уменьшением размера опухоли на заранее определенное количество и в течение минимального периода времени. Как правило, термин "ORR" относится к сумме частоты полных ответов (CR) и частоты частичных ответов (PR).
[0074] В рамках изобретения термин "полный ответ" или "CR" означает исчезновение всех признаков злокачественного новообразования (например, исчезновение всех целевых очагов) в ответ на лечение. Это не всегда означает излечение злокачественного новообразования.
[0075] В рамках изобретения термин "частичный ответ" или "PR" относится к уменьшению размера одной или более опухолей или очагов или степени злокачественного новообразования в организме в ответ на лечение. Например, в некоторых вариантах осуществления термин "PR" относится по меньшей мере к 30%-ному снижению суммы наибольших диаметров (SLD) целевых очагов при использовании качестве референса исходной SLD.
[0076] Термин "устойчивый ответ" относится к устойчивому эффекту снижения роста опухоли после прекращения лечения. Например, размер опухоли может являться тем же или меньшим размером по сравнению с размером в начале фазы введения лекарственного средства. В некоторых вариантах осуществления устойчивый ответ имеет по меньшей мере ту же длительность, что и длительность лечения, или длительность, по меньшей мере в 1,5, 2, 2,5 или 3 раз большую, чем длительность лечения, или еще большую длительность.
[0077] В рамках изобретения термин "выживаемость без прогрессирования" (PFS) относится к длительности периода во время и после лечения, во время которого заболевание, подвергаемое лечению (например, злокачественное новообразование), не ухудшается. Выживаемость без прогрессирования может включать время, в течение которого пациенты имеют полный ответ или частичный ответ, а также время, в течение которого у пациентов наблюдают стабильное заболевание.
[0078] В рамках изобретения термин "общая выживаемость" (OS) относится к процентной доле индивидуумов в группе, которые, вероятно, будут живы после конкретного периода времени.
[0079] В целях по настоящему изобретению термин "длительность ответа" означает время от документирования ингибирования роста модели опухоли по причине введения лекарственного средства до времени приобретения восстановленной скорости роста, схожей со скоростью роста до введения.
[0080] Термин "увеличение выживаемости" означает повышение общей выживаемости или выживаемости без прогрессирования у пациента, подвергнутого лечению, относительно пациента, не подвергнутого лечению (т.е. относительно пациента, не подвергнутого лечению с использованием лекарственного средства).
[0081] В рамках изобретения термин "связанная с лекарственным средством токсичность", "инфузионные реакции" и "иммуноопосредованные нежелательные явления" ("irAE") и их тяжесть или степени являются такими, как определено в Общих терминологических критериях нежелательных явлений Национального института рака США версии 4.0 (NCI CTCAE v 4.0).
[0082] В рамках изобретения термин "баллы потери гетерозиготности" или "баллы LOH" относится к процентной доле геномной LOH в опухолевых тканях индивидуума. Процентная доля геномной LOH и ее вычисления описаны в Swisher et al (The Lancet Oncology, 18(1):75-87, January 2017), описание которой включено в настоящее описание в качестве ссылки в полном объеме. Неограничивающие примеры генетического анализа включает секвенирование ДНК и анализ T5 на основе NGS Foundation Medicine.
[0083] В рамках изобретения термин "баллы нарушения гомологичной рекомбинации" или "баллы HRD" относится к невзвешенной числовой сумме потери гетерозиготности ("LOH"), теломерного аллельного дисбаланса ("TAI") и крупномасштабного состояния транзиции ("LST") в опухолевых тканях индивидуума. Баллы HRD вместе с LOH, баллы LOH и их вычисление описано в Timms et al, Breast Cancer Res 2014 Dec 5; 16(6):475, Telli et al Clin Cancer Res; 22(15); 3764-73,2016, описания которых включены в настоящее описание в качестве ссылки в полном объеме. Неограничивающие примеры генетического анализа включают секвенирование ДНК, анализ HRD или HRD Plus от Myriad (Mirza et al N Engl J Med 2016 Dec 1; 375(22):2154-2164, 2016).
[0084] В рамках изобретения термин "баллы пропорции опухоли" или "TPS" относится к процентной доли жизнеспособных опухолевых клеток, демонстрирующих частичное или полное мембранное окрашивание при иммуногистохимическом анализе образца. Неограничивающие примеры образцов включают биологический образец, образец ткани, фиксированный формалином и погруженный в парафин (FFPE) образец ткани человека и фиксированный формалином и погруженный в парафин (FFPE) образец опухолевой ткани человека.
[0085] В некоторых вариантах осуществления противоопухолевые эффекты способов по настоящему изобретению, включая в качестве неограничивающих примеров "объективный ответ", "полный ответ", "частичный ответ", "прогрессирующее заболевание", "стабильное заболевание", "выживаемость без прогрессирования", "длительность ответа", являются такими, как определяют и оценивают исследователи с использованием RECIST v1.1 (Eisenhauer et al, Eur J of Cancer 2009; 45(2):228-47) у пациентов с местнораспространенными или метастазирующими солидными опухолями. Описания Eisenhauer et al, Eur J of Cancer 2009; 45(2):228-47 и Scher et al, J Clin Oncol 2016 Apr 20; 34(12):1402-18 включены в настоящее описание в качестве ссылки в полном объеме.
[0086] В некоторых вариантах осуществления противоопухолевый эффект способов по настоящему изобретению, включая, в качестве неограничивающих примеров, "иммуноопосредованный объективный ответ" (irOR), "иммуноопосредованный полный ответ" (irCR), "иммуноопосредованный частичный ответ" (irCR), "иммуноопосредованное прогрессирующее заболевание" (irPD), "иммуноопосредованное стабильное заболевание" (irSD), "иммуноопосредованную выживаемость без прогрессирования" (irPFS), "иммуноопосредованную длительность ответа" (irDR), является таким, как определяют и оценивают с помощью Иммуноопосредованных критериев ответа (irRECIST, Nishino et. al. J Immunother Cancer 2014; 2:17) в случае пациентов с местнораспространенными или метастазирующими солидными опухолями, иными, чем пациенты с метастазирующим CRPC. Описание Nishino et. al. J Immunother Cancer 2014; 2:17 включено в настоящее описание в качестве ссылки в полном объеме.
[0087] В рамках изобретения термин "в комбинации с" относится к введению ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства одновременно, последовательно или поочередно в виде отдельной дозы.
[0088] Термин "аддитивный" используют для обозначения того, что результат комбинирования двух компонентов комбинированного терапевтического средства не превышает сумму каждого соединения, компонента или таргетированного средства по отдельности. Термин "аддитивный" означает, что не наблюдают улучшения заболевания, состояния или нарушения, подвергаемого лечению, по сравнению с использованием каждого компонента в отдельности.
[0089] Термин "синергия" или "синергический" используют в настоящем описании для обозначения того, что эффект комбинации двух терапевтических средств из комбинированного лечения превышает сумму эффектов каждого средства при введении по отдельности. "Синергическое количество" или "синергически эффективное количество" является количеством комбинации двух комбинируемых партнеров, приводящим к синергическому эффекту в соответствии с тем, как термин "синергический" определяют в настоящем описании. Синергические взаимодействие между двумя комбинируемыми партнерами, оптимальный диапазон эффекта и абсолютные диапазоны доз каждого компонента для достижения эффекта можно измерять посредством введения комбинируемых партнеров в разных диапазонах массовых соотношений и дозах пациентам, нуждающимся в лечении. Однако наблюдение синергии в моделях in vitro или моделях in vivo может являться прогностическим в отношении эффекта у людей и других биологических видов, и существуют модели in vitro или модели in vivo, как представлено в настоящем описании, для измерения синергического эффекта, и результаты таких исследований также можно использовать для прогнозирования эффективной дозы и диапазонов соотношений концентраций в плазме и абсолютных доз и концентраций в плазме, необходимых для людей и других биологических видов, с использованием фармакокинетических/фармакодинамических способов. Например, модели злокачественных новообразований in vitro и модели злокачественных новообразований на животных, представленные в настоящем описании, известны в этой области и описаны в примерах. Неограничивающие примеры синергического эффекта включают повышенную терапевтическую эффективность, снижение дозы при равном или повышенном уровне эффективности, сниженное или замедленное развитие резистентности к лекарственному средству и одновременно повышенные или равные терапевтические эффекты при снижении нежелательных побочных эффектов.
[0090] Например, синергическое соотношение двух терапевтических средств можно идентифицировать посредством определения синергического эффекта в известной в этой области модели in vitro (например, линии злокачественных клеток) или модели in vivo (модели на животных) любых из злокачественных новообразований, представленных в настоящем описании. Неограничивающие примеры линий злокачественных клеток и модели in vivo на животных злокачественных новообразований, представленных в настоящем описании, описаны в примерах. Дополнительные примеры линий злокачественных клеток и моделей in vivo на животных известны в этой области.
[0091] В некоторых вариантах осуществления в рамках изобретения термин "синергический эффект" относится к комбинации ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства, приводящей к эффекту, например, любому из благоприятных или желаемых результатов, включая клинические результаты, как представлено в настоящем описании, например, замедление симптоматического прогрессирования рака желчных протоков или его симптомов, где эффект превышает сумму эффектов, наблюдаемых, когда ингибитор MEK и противоопухолевое терапевтическое средство (например, фторурацил-содержащее терапевтическое средство) вводят по отдельности.
[0092] В некоторых вариантах осуществления способы по настоящему изобретению могут приводить к снижению объема или размера одной или более солидных опухолей (например, одной или более злокачественных опухолей желчных протоков) у пациента на от 1% до 99% (например, от 1% до 98%, от 1% до 95%, от 1% до 90%, 1 до 85%, 1 до 80%, от 1% до 75%, от 1% до 70%, от 1% до 65%, от 1% до 60%, от 1% до 55%, от 1% до 50%, от 1% до 45%, от 1% до 40%, от 1% до 35%, от 1% до 30%, от 1% до 25%, от 1% до 20%, от 1% до 15%, от 1% до 10%, от 1% до 5%, от 2% до 99%, от 2% до 90%, от 2% до 85%, от 2% до 80%, от 2% до 75%, от 2% до 70%, от 2% до 65%, от 2% до 60%, от 2% до 55%, от 2% до 50%, от 2% до 45%, от 2% до 40%, от 2% до 35%, от 2% до 30%, от 2% до 25%, от 2% до 20%, от 2% до 15%, от 2% до 10%, от 2% до 5%, от 4% до 99%, от 4% до 95%, от 4% до 90%, от 4% до 85%, от 4% до 80%, от 4% до 75%, от 4% до 70%, от 4% до 65%, от 4% до 60%, от 4% до 55%, от 4% до 50%, от 4% до 45%, от 4% до 40%, от 4% до 35%, от 4% до 30%, от 4% до 25%, от 4% до 20%, от 4% до 15%, от 4% до 10%, от 6% до 99%, от 6% до 95%, от 6% до 90%, от 6% до 85%, от 6% до 80%, от 6% до 75%, от 6% до 70%, от 6% до 65%, от 6% до 60%, от 6% до 55%, от 6% до 50%, от 6% до 45%, от 6% до 40%, от 6% до 35%, от 6% до 30%, от 6% до 25%, от 6% до 20%, от 6% до 15%, от 6% до 10%, от 8% до 99%, от 8% до 95%, от 8% до 90%, от 8% до 85%, от 8% до 80%, от 8% до 75%, от 8% до 70%, от 8% до 65%, от 8% до 60%, от 8% до 55%, от 8% до 50%, от 8% до 45%, от 8% до 40%, от 8% до 35%, от 8% до 30%, от 8% до 25%, от 8% до 20%, от 8% до 15%, от 10% до 99%, от 10% до 95%, от 10% до 90%, от 10% до 85%, от 10% до 80%, от 10% до 75%, от 10% до 70%, от 10% до 65%, от 10% до 60%, от 10% до 55%, от 10% до 50%, от 10% до 45%, от 10% до 40%, от 10% до 35%, от 10% до 30%, от 10% до 25%, от 10% до 20%, от 10% до 15%, от 15% до 99%, от 15% до 95%, от 15% до 90%, от 15% до 85%, от 15% до 80%, от 15% до 75%, от 15% до 70%, от 15% до 65%, от 15% до 60%, от 15% до 55%, от 15% до 50%, от 15% до 55%, от 15% до 50%, от 15% до 45%, от 15% до 40%, от 15% до 35%, от 15% до 30%, от 15% до 25%, от 15% до 20%, от 20% до 99%, от 20% до 95%, от 20% до 90%, от 20% до 85%, от 20% до 80%, от 20% до 75%, от 20% до 70%, от 20% до 65%, от 20% до 60%, от 20% до 55%, от 20% до 50%, от 20% до 45%, от 20% до 40%, от 20% до 35%, от 20% до 30%, от 20% до 25%, от 25% до 99%, от 25% до 95%, от 25% до 90%, от 25% до 85%, от 25% до 80%, от 25% до 75%, от 25% до 70%, от 25% до 65%, от 25% до 60%, от 25% до 55%, от 25% до 50%, от 25% до 45%, от 25% до 40%, от 25% до 35%, от 25% до 30%, от 30% до 99%, от 30% до 95%, от 30% до 90%, от 30% до 85%, от 30% до 80%, от 30% до 75%, от 30% до 70%, от 30% до 65%, от 30% до 60%, от 30% до 55%, от 30% до 50%, от 30% до 45%, от 30% до 40%, от 30% до 35%,от 35% до 99%, от 35% до 95%, от 35% до 90%, от 35% до 85%, от 35% до 80%, от 35% до 75%, от 35% до 70%, от 35% до 65%, от 35% до 60%, от 35% до 55%, от 35% до 50%, от 35% до 45%, от 35% до 40%, от 40% до 99%, от 40% до 95%, от 40% до 90%, от 40% до 85%, от 40% до 80%, от 40% до 75%, от 40% до 70%, от 40% до 65%, от 40% до 60%, от 40% до 55%, от 40% до 60%, от 40% до 55%, от 40% до 50%, от 40% до 45%, от 45% до 99%, от 45% до 95%, от 45% до 95%, от 45% до 90%, от 45% до 85%, от 45% до 80%, от 45% до 75%, от 45% до 70%, от 45% до 65%, от 45% до 60%, от 45% до 55%, от 45% до 50%, от 50% до 99%, от 50% до 95%, от 50% до 90%, от 50% до 85%, от 50% до 80%, от 50% до 75%, от 50% до 70%, от 50% до 65%, от 50% до 60%, от 50% до 55%, от 55% до 99%, от 55% до 95%, от 55% до 90%, от 55% до 85%, от 55% до 80%, от 55% до 75%, от 55% до 70%, от 55% до 65%, от 55% до 60%, от 60% до 99%, от 60% до 95%, от 60% до 90%, от 60% до 85%, от 60% до 80%, от 60% до 75%, от 60% до 70%, от 60% до 65%, от 65% до 99%, от 60% до 95%, от 60% до 90%, от 60% до 85%, от 60% до 80%, от 60% до 75%, от 60% до 70%, от 60% до 65%, от 70% до 99%, от 70% до 95%, от 70% до 90%, от 70% до 85%, от 70% до 80%, от 70% до 75%, от 75% до 99%, от 75% до 95%, от 75% до 90%, от 75% до 85%, от 75% до 80%, от 80% до 99%, от 80% до 95%, от 80% до 90%, от 80% до 85%, от 85% до 99%, от 85% до 95%, от 85% до 90%, от 90% до 99%, от 90% до 95% или от 95% до 100%) после комбинированного лечения в течение периода времени от 1 дня до 2 лет (например, от 1 дня до 22 месяцев, от 1 дня до 20 месяцев, от 1 дня до 18 месяцев, от 1 дня до 16 месяцев, от 1 дня до 14 месяцев, от 1 дня до 12 месяцев, от 1 дня до 10 месяцев, от 1 дня до 9 месяцев, от 1 дня до 8 месяцев, от 1 дня до 7 месяцев, от 1 дня до 6 месяцев, от 1 дня до 5 месяцев, от 1 дня до 4 месяцев, от 1 дня до 3 месяцев, от 1 дня до 2 месяцев, от 1 дня до 1 месяца, от одной недели до 2 лет, от 1 недели до 22 месяцев, от 1 недели до 20 месяцев, от 1 недели до 18 месяцев, от 1 недели до 16 месяцев, от 1 недели до 14 месяцев, от 1 недели до 12 месяцев, от 1 недели до 10 месяцев, от 1 недели до 9 месяцев, от 1 недели до 8 месяцев, от 1 недели до 7 месяцев, от 1 недели до 6 месяцев, от 1 недели до 5 месяцев, от 1 недели до 4 месяцев, от 1 недели до 3 месяцев, от 1 недели до 2 месяцев, от 1 недели до 1 месяца, от 2 недель до 2 лет, от 2 недель до 22 месяцев, от 2 недель до 20 месяцев, от 2 недель до 18 месяцев, от 2 недель до 16 месяцев, от 2 недель до 14 месяцев, от 2 недель до 12 месяцев, от 2 недель до 10 месяцев, от 2 недель до 9 месяцев, от 2 недель до 8 месяцев, от 2 недель до 7 месяцев, от 2 недель до 6 месяцев, от 2 недель до 5 месяцев, от 2 недель до 4 месяцев, от 2 недель до 3 месяцев, от 2 недель до 2 месяцев, от 2 недель до 1 месяца, от 1 месяца до 2 лет, от 1 месяца до 22 месяцев, от 1 месяца до 20 месяцев, от 1 месяца до 18 месяцев, от 1 месяца до 16 месяцев, от 1 месяца до 14 месяцев, от 1 месяца до 12 месяцев, от 1 месяца до 10 месяцев, от 1 месяца до 9 месяцев, от 1 месяца до 8 месяцев, от 1 месяца до 7 месяцев, от 1 месяца до 6 месяцев, от 1 месяца до 6 месяцев, от 1 месяца до 5 месяцев, от 1 месяца до 4 месяцев, от 1 месяца до 3 месяцев, от 1 месяца до 2 месяцев, от 2 месяцев до 2 лет, от 2 месяцев до 22 месяцев, от 2 месяцев до 20 месяцев, от 2 месяцев до 18 месяцев, от 2 месяцев до 16 месяцев, от 2 месяцев до 14 месяцев, от 2 месяцев до 12 месяцев, от 2 месяцев до 10 месяцев, от 2 месяцев до 9 месяцев, от 2 месяцев до 8 месяцев, от 2 месяцев до 7 месяцев, от 2 месяцев до 6 месяцев, или от 2 месяцев до 5 месяцев, от 2 месяцев до 4 месяцев, от 3 месяцев до 2 лет, от 3 месяцев до 22 месяцев, от 3 месяцев до 20 месяцев, от 3 месяцев до 18 месяцев, от 3 месяцев до 16 месяцев, от 3 месяцев до 14 месяцев, от 3 месяцев до 12 месяцев, от 3 месяцев до 10 месяцев, от 3 месяцев до 8 месяцев, от 3 месяцев до 6 месяцев, от 4 месяцев до 2 лет, от 4 месяцев до 22 месяцев, от 4 месяцев до 20 месяцев, от 4 месяцев до 18 месяцев, от 4 месяцев до 16 месяцев, от 4 месяцев до 14 месяцев, от 4 месяцев до 12 месяцев, от 4 месяцев до 10 месяцев, от 4 месяцев до 8 месяцев, от 4 месяцев до 6 месяцев, от 6 месяцев до 2 лет, от 6 месяцев до 22 месяцев, от 6 месяцев до 20 месяцев, от 6 месяцев до 18 месяцев, от 6 месяцев до 16 месяцев, от 6 месяцев до 14 месяцев, от 6 месяцев до 12 месяцев, от 6 месяцев до 10 месяцев или от 6 месяцев до 8 месяцев) (например, по сравнению с размером одной или более солидных опухолей у пациента перед лечением).
[0093] В некоторых вариантах осуществления любые из способов по настоящему изобретению могут обеспечивать снижение риска развития метастазирования или риска развития дополнительных метастазов у пациента, имеющего злокачественное новообразование (например, рак желчных протоков), на от 1% до 99% (например, от 1% до 98%, от 1% до 95%, от 1% до 90%, 1 до 85%, 1 до 80%, от 1% до 75%, от 1% до 70%, от 1% до 65%, от 1% до 60%, от 1% до 55%, от 1% до 50%, от 1% до 45%, от 1% до 40%, от 1% до 35%, от 1% до 30%, от 1% до 25%, от 1% до 20%, от 1% до 15%, от 1% до 10%, от 1% до 5%, от 2% до 99%, от 2% до 90%, от 2% до 85%, от 2% до 80%, от 2% до 75%, от 2% до 70%, от 2% до 65%, от 2% до 60%, от 2% до 55%, от 2% до 50%, от 2% до 45%, от 2% до 40%, от 2% до 35%, от 2% до 30%, от 2% до 25%, от 2% до 20%, от 2% до 15%, от 2% до 10%, от 2% до 5%, от 4% до 99%, от 4% до 95%, от 4% до 90%, от 4% до 85%, от 4% до 80%, от 4% до 75%, от 4% до 70%, от 4% до 65%, от 4% до 60%, от 4% до 55%, от 4% до 50%, от 4% до 45%, от 4% до 40%, от 4% до 35%, от 4% до 30%, от 4% до 25%, от 4% до 20%, от 4% до 15%, от 4% до 10%, от 6% до 99%, от 6% до 95%, от 6% до 90%, от 6% до 85%, от 6% до 80%, от 6% до 75%, от 6% до 70%, от 6% до 65%, от 6% до 60%, от 6% до 55%, от 6% до 50%, от 6% до 45%, от 6% до 40%, от 6% до 35%, от 6% до 30%, от 6% до 25%, от 6% до 20%, от 6% до 15%, от 6% до 10%, от 8% до 99%, от 8% до 95%, от 8% до 90%, от 8% до 85%, от 8% до 80%, от 8% до 75%, от 8% до 70%, от 8% до 65%, от 8% до 60%, от 8% до 55%, от 8% до 50%, от 8% до 45%, от 8% до 40%, от 8% до 35%, от 8% до 30%, от 8% до 25%, от 8% до 20%, от 8% до 15%, от 10% до 99%, от 10% до 95%, от 10% до 90%, от 10% до 85%, от 10% до 80%, от 10% до 75%, от 10% до 70%, от 10% до 65%, от 10% до 60%, от 10% до 55%, от 10% до 50%, от 10% до 45%, от 10% до 40%, от 10% до 35%, от 10% до 30%, от 10% до 25%, от 10% до 20%, от 10% до 15%, от 15% до 99%, от 15% до 95%, от 15% до 90%, от 15% до 85%, от 15% до 80%, от 15% до 75%, от 15% до 70%, от 15% до 65%, от 15% до 60%, от 15% до 55%, от 15% до 50%, от 15% до 55%, от 15% до 50%, от 15% до 45%, от 15% до 40%, от 15% до 35%, от 15% до 30%, от 15% до 25%, от 15% до 20%, от 20% до 99%, от 20% до 95%, от 20% до 90%, от 20% до 85%, от 20% до 80%, от 20% до 75%, от 20% до 70%, от 20% до 65%, от 20% до 60%, от 20% до 55%, от 20% до 50%, от 20% до 45%, от 20% до 40%, от 20% до 35%, от 20% до 30%, от 20% до 25%, от 25% до 99%, от 25% до 95%, от 25% до 90%, от 25% до 85%, от 25% до 80%, от 25% до 75%, от 25% до 70%, от 25% до 65%, от 25% до 60%, от 25% до 55%, от 25% до 50%, от 25% до 45%, от 25% до 40%, от 25% до 35%, от 25% до 30%, от 30% до 99%, от 30% до 95%, от 30% до 90%, от 30% до 85%, от 30% до 80%, от 30% до 75%, от 30% до 70%, от 30% до 65%, от 30% до 60%, от 30% до 55%, от 30% до 50%, от 30% до 45%, от 30% до 40%, от 30% до 35%, от 35% до 99%, от 35% до 95%, от 35% до 90%, от 35% до 85%, от 35% до 80%, от 35% до 75%, от 35% до 70%, от 35% до 65%, от 35% до 60%, от 35% до 55%, от 35% до 50%, от 35% до 45%, от 35% до 40%, от 40% до 99%, от 40% до 95%, от 40% до 90%, от 40% до 85%, от 40% до 80%, от 40% до 75%, от 40% до 70%, от 40% до 65%, от 40% до 60%, от 40% до 55%, от 40% до 60%, от 40% до 55%, от 40% до 50%, от 40% до 45%, от 45% до 99%, от 45% до 95%, от 45% до 95%, от 45% до 90%, от 45% до 85%, от 45% до 80%, от 45% до 75%, от 45% до 70%, от 45% до 65%, от 45% до 60%, от 45% до 55%, от 45% до 50%, от 50% до 99%, от 50% до 95%, от 50% до 90%, от 50% до 85%, от 50% до 80%, от 50% до 75%, от 50% до 70%, от 50% до 65%, от 50% до 60%, от 50% до 55%, от 55% до 99%, от 55% до 95%, от 55% до 90%, от 55% до 85%, от 55% до 80%, от 55% до 75%, от 55% до 70%, от 55% до 65%, от 55% до 60%, от 60% до 99%, от 60% до 95%, от 60% до 90%, от 60% до 85%, от 60% до 80%, от 60% до 75%, от 60% до 70%, от 60% до 65%, от 65% до 99%, от 60% до 95%, от 60% до 90%, от 60% до 85%, от 60% до 80%, от 60% до 75%, от 60% до 70%, от 60% до 65%, от 70% до 99%, от 70% до 95%, от 70% до 90%, от 70% до 85%, от 70% до 80%, от 70% до 75%, от 75% до 99%, от 75% до 95%, от 75% до 90%, от 75% до 85%, от 75% до 80%, от 80% до 99%, от 80% до 95%, от 80% до 90%, от 80% до 85%, от 85% до 99%, от 85% до 95%, от 85% до 90%, от 90% до 99%, от 90% до 95% или от 95% до 100%).
[0094] Фраза "время выживаемости" означает длительность времени между идентификацией или диагностикой злокачественного новообразования (например, любого из злокачественных новообразований, представленных в настоящем описании) у млекопитающего медицинским работником и временем смерти млекопитающего (вызванной злокачественным новообразованием). Способы увеличения времени выживаемости млекопитающего, имеющего злокачественное новообразование, представлены в настоящем описании.
[0095] В некоторых вариантах осуществления любые из способов по настоящему изобретению могут приводить к повышению (например, на от 1% до 400%, от 1% до 380%, от 1% до 360%, от 1% до 340%, от 1% до 320%, от 1% до 300%, от 1% до 280%, от 1% до 260%, от 1% до 240%, от 1% до 220%, от 1% до 200%, от 1% до 180%, от 1% до 160%, от 1% до 140%, от 1% до 120%, от 1% до 100%, от 1% до 95%, от 1% до 90%, от 1% до 85%, от 1% до 80%, от 1% до 75%, от 1% до 70%, от 1% до 65%, от 1% до 60%, от 1% до 55%, от 1% до 50%, от 1% до 45%, от 1% до 40%, от 1% до 35%, от 1% до 30%, от 1% до 25%, от 1% до 20%, от 1% до 15%, от 1% до 10%, от 1% до 5%, 5% до 400%, от 5% до 380%, от 5% до 360%, от 5% до 340%, от 5% до 320%, от 5% до 300%, от 5% до 280%, от 5% до 260%, от 5% до 240%, от 5% до 220%, от 5% до 200%, от 5% до 180%, от 5% до 160%, от 5% до 140%, от 5% до 120%, от 5% до 100%, от 5% до 90%, от 5% до 80%, от 5% до 70%, от 5% до 60%, от 5% до 50%, от 5% до 40%, от 5% до 30%, от 5% до 20%, от 5% до 10%, от 10% до 400%, от 10% до 380%, от 10% до 360%, от 10% до 340%, от 10% до 320%, от 10% до 300%, от 10% до 280%, от 10% до 260%, от 10% до 240%, от 10% до 220%, от 10% до 200%, от 10% до 180%, от 10% до 160%, от 10% до 140%, от 10% до 120%, от 10% до 100%, от 10% до 90%, от 10% до 80%, от 10% до 70%, от 10% до 60%, от 10% до 50%, от 10% до 40%, от 10% до 30%, от 10% до 20%, от 20% до 400%, от 20% до 380%, от 20% до 360%, от 20% до 340%, от 20% до 320%, от 20% до 300%, от 20% до 280%, от 20% до 260%, от 20% до 240%, от 20% до 220%, от 20% до 200%, от 20% до 180%, от 20% до 160%, от 20% до 140%, от 20% до 120%, от 20% до 100%, от 20% до 90%, от 20% до 80%, от 20% до 70%, от 20% до 60%, от 20% до 50%, от 20% до 40%, от 20% до 30%, от 30% до 400%, от 30% до 380%, от 30% до 360%, от 30% до 340%, от 30% до 320%, от 30% до 300%, от 30% до 280%, от 30% до 260%, от 30% до 240%, от 30% до 220%, от 30% до 200%, от 30% до 180%, от 30% до 160%, от 30% до 140%, от 30% до 120%, от 30% до 100%, от 30% до 90%, от 30% до 80%, от 30% до 70%, от 30% до 60%, от 30% до 50%, от 30% до 40%, от 40% до 400%, от 40% до 380%, от 40% до 360%, от 40% до 340%, от 40% до 320%, от 40% до 300%, от 40% до 280%, от 40% до 260%, от 40% до 240%, от 40% до 220%, от 40% до 200%, от 40% до 180%, от 40% до 160%, от 40% до 140%, от 40% до 120%, от 40% до 100%, от 40% до 90%, от 40% до 80%, от 40% до 70%, от 40% до 60%, от 40% до 50%, от 50% до 400%, от 50% до 380%, от 50% до 360%, от 50% до 340%, от 50% до 320%, от 50% до 300%, от 50% до 280%, от 50% до 260%, от 50% до 240%, от 50% до 220%, от 50% до 200%, от 50% до 180%, от 50% до 160%, от 50% до 140%, от 50% до 140%, от 50% до 120%, от 50% до 100%, от 50% до 90%, от 50% до 80%, от 50% до 70%, от 50% до 60%, от 60% до 400%, от 60% до 380%, от 60% до 360%, от 60% до 340%, от 60% до 320%, от 60% до 300%, от 60% до 280%, от 60% до 260%, от 60% до 240%, от 60% до 220%, от 60% до 200%, от 60% до 180%, от 60% до 160%, от 60% до 140%, от 60% до 120%, от 60% до 100%, от 60% до 90%, от 60% до 80%, от 60% до 70%, от 70% до 400%, от 70% до 380%, от 70% до 360%, от 70% до 340%, от 70% до 320%, от 70% до 300%, от 70% до 280%, от 70% до 260%, от 70% до 240%, от 70% до 220%, от 70% до 200%, от 70% до 180%, от 70% до 160%, от 70% до 140%, от 70% до 120%, до 100%, от 70% до 90%, от 70% до 80%, от 80% до 400%, от 80% до 380%, от 80% до 360%, от 80% до 340%, от 80% до 320%, от 80% до 300%, от 80% до 280%, от 80% до 260%, от 80% до 240%, от 80% до 220%, от 80% до 200%, от 80% до 180%, от 80% до 160%, от 80% до 140%, от 80% до 120%, от 80% до 100%, от 80% до 90%, от 90% до 400%, от 90% до 380%, от 90% до 360%, от 90% до 340%, от 90% до 320%, от 90% до 300%, от 90% до 280%, от 90% до 260%, от 90% до 240%, от 90% до 220%, от 90% до 200%, от 90% до 180%, от 90% до 160%, от 90% до 140%, от 90% до 120%, от 90% до 100%,100% до 400%, 100% до 380%, 100% до 360%, от 100% до 340%, от 100% до 320%, от 100% до 300%, от 100% до 280%, от 100% до 260%, от 100% до 240%, от 100% до 220%, от 100% до 200%, от 100% до 180%, от 100% до 160%, от 100% до 140%, от 100% до 120%, от 120% до 400%, от 120% до 380%, от 120% до 360%, от 120% до 340%, от 120% до 320%, от 120% до 300%, от 120% до 280%, от 120% до 260%, от 120% до 240%, от 120% до 220%, от 120% до 200%, от 120% до 180%, от 120% до 160%, от 120% до 140%, от 140% до 400%, от 140% до 380%, от 140% до 360%, от 140% до 340%, от 140% до 320%, от 140% до 300%, от 140% до 280%, от 140% до 260%, от 140% до 240%, от 140% до 220%, от 140% до 200%, от 140% до 180%, от 140% до 160%, от 160% до 400%, от 160% до 380%, от 160% до 360%, от 160% до 340%, от 160% до 320%, от 160% до 300%, от 160% до 280%, от 160% до 260%, от 160% до 240%, от 160% до 220%, от 160% до 200%, от 160% до 180%, от 180% до 400%, от 180% до 380%, от 180% до 360%, от 180% до 340%, от 180% до 320%, от 180% до 300%, от 180% до 280%, от 180% до 260%, от 180% до 240%, от 180% до 220%, от 180% до 200%, от 200% до 400%, от 200% до 380%, от 200% до 360%, от 200% до 340%, от 200% до 320%, от 200% до 300%, от 200% до 280%, от 200% до 260%, от 200% до 240%, от 200% до 220%, от 220% до 400%, от 220% до 380%, от 220% до 360%, от 220% до 340%, от 220% до 320%, от 220% до 300%, от 220% до 280%, от 220% до 260%, от 220% до 240%, от 240% до 400%, от 240% до 380%, от 240% до 360%, от 240% до 340%, от 240% до 320%, от 240% до 300%, от 240% до 280%, от 240% до 260%, от 260% до 400%, от 260% до 380%, от 260% до 360%, от 260% до 340%, от 260% до 320%, от 260% до 300%, от 260% до 280%, от 280% до 400%, от 280% до 380%, от 280% до 360%, от 280% до 340%, от 280% до 320%, от 280% до 300%, от 300% до 400%, от 300% до 380%, от 300% до 360%, от 300% до 340% или от 300% до 320%) времени выживаемости пациента (например, по сравнению с пациентом, имеющим схожее злокачественное новообразование (например, рак желчных протоков), и которого подвергали другому лечению или не подвергали лечению).
[0096] В рамках изобретения термин "цитокин", в общем, относится к белкам, высвобождаемым одной популяцией клеток, действующим на другую клетку в качестве межклеточных медиаторов или имеющим аутокринный эффект в отношении клеток, продуцирующих белки. Примеры таких цитокинов включают лимфокины, монокины; интерлейкины ("ИЛ") такие как ИЛ-1, ИЛ-1a, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-11, ИЛ-12, ИЛ-13, ИЛ-15, ИЛ-17A-F, с ИЛ-18 по ИЛ-29 (такой как ИЛ-23), ИЛ-31, включая PROLEUKIN® rIL-2; фактор некроза опухоли, такой как ФНОα или ФНО-β, TGF-1-3; и другие полипептидные факторы, включая фактор ингибирования лейкоза ("LIF"), цилиарный нейротрофический фактор ("CNTF"), CNTF-подобный цитокин ("CLC"), кардиотрофин ("CT") и лиганд Kit ("L").
[0097] В рамках изобретения термин "хемокин" относится к растворимым факторам (например, цитокинам), обладающим способностью селективно индуцировать хемотаксис и активацию лейкоцитов. Они также запускают процессы ангиогенеза, воспаления, заживления ран и образования опухоли. Пример хемокинов включают ИЛ-8, человеческий гомолог хемоаттрактанта кератиноцитов мыши (KC).
[0098] Если не указано иначе, все технические и научные термины, используемые в настоящем описании, обладают значением, общепринято понятным специалисту в области, к которой принадлежит изобретение. В случае противоречия настоящее описание, включая определения, будет обладать приоритетом. На всем протяжении настоящего описания и формулы изобретения термин "содержат" или его варианты, такие как "содержит" или "содержащий", будут понимать как подразумевающий включение указанного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел. Если контекст не требует иного, термины в единственном числе должны включать множественное число, и термины во множественном числе должны включать единственное число. В рамках изобретения форма в единственном числе включает ссылку на множественное число, если не указано иначе. Например, термин "эксципиент" включает один или более эксципиентов. Следует понимать, что аспекты и варианты изобретения, представленные в настоящем описании, включают аспекты и варианты, "состоящие из" и/или "состоящие, по существу, из". В некоторых вариантах осуществления способы, состоящие, по существу, из стадии введения, как представлено в настоящем описании, включают способы, где предшествующая терапия была неэффективной для пациента, например, введение одного или более противоопухолевых средств, например, введение одного или более противоопухолевых средств, независимо выбранных из химиотерапевтических средств и таргетированных терапевтических средств (вводимых пациенту до периода времени), или пациент являлся рефрактерным к такой предшествующей терапии, и/или где злокачественное новообразование является метастазирующим или рецидивирующим. В некоторых вариантах осуществления способы, состоящие, по существу, из стадии введения, как представлено в настоящем описании, включают способы, где пациента подвергают хирургическому вмешательству, лучевой терапии и/или другим схемам лечения до, по существу, одновременно или после такой стадии введения, как представлено в настоящем описании, и/или где пациенту вводят другие химические и/или биологические терапевтические средства после такой стадии введения, как представлено в настоящем описании.
[0099] Хотя в практическом осуществлении или тестировании изобретения также можно использовать способы и материалы, схожие или эквивалентные способам и материалам, представленным в настоящем описании, примеры способов и материалов представлены в настоящем описании. Материалы, способы и примеры являются исключительно иллюстративными, и не предназначены для ограничения. Все публикации, патентные заявки, патенты, последовательности, записи в базах данных и другие ссылки, упомянутые в настоящем описании, включены в него в полном объеме в качестве ссылки.
Способы, применение и лекарственные средства
[00100] В одном из вариантов осуществления количество ингибитора MEK или его фармацевтически приемлемой соли используют в комбинации с количеством фторпиримидин-содержащего терапевтического средства, где количества вместе являются эффективными при лечении злокачественного новообразования.
[00101] В одном из вариантов осуществления терапевтически эффективное количество каждого из комбинируемых партнеров из комбинированного лечения по изобретению вводят раздельно, и их можно вводить одновременно, последовательно или поочередно и в любом порядке с определенными или варьируемыми временными интервалами (например, в течение периода времени).
[00102] В одном из вариантов осуществления настоящее изобретение относится к способу лечения рака желчных протоков, включающему или состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени комбинированного терапевтического средства, состоящего, по существу, из ингибитора MEK или его фармацевтически приемлемой соли и фторпиримидин-содержащего терапевтического средства, где отдельные комбинируемые партнеры вводят в совместно терапевтически эффективных количествах (например, синергически эффективных количествах). Отдельные комбинируемые партнеры из комбинированного лечения по изобретению можно вводить в суточных или интервальных дозах в течение периода времени. Отдельные комбинируемые партнеры из комбинированного лечения по изобретению можно вводить раздельно в разное время и в любом порядке в течение периода времени или одновременно в раздельных комбинированных формах в течение периода времени. В одном из вариантов осуществления ингибитор MEK или его фармацевтически приемлемую соль вводят ежедневно один раз или дважды в сутки в течение периода времени. В одном из вариантов осуществления ингибитор MEK или его фармацевтически приемлемую соль вводят дважды в сутки ежедневно в течение периода времени. В одном из вариантов осуществления противоопухолевое терапевтическое средство вводят ежедневно в течение периода времени. В одном из вариантов осуществления противоопухолевое терапевтическое средство вводят дважды в сутки ежедневно в течение периода времени. Таким образом, следует понимать, что настоящее изобретение включает все такие схемы одновременного или чередуемого лечения в течение периода времени, и термин "введение" следует интерпретировать таким образом.
[00103] В рамках изобретения термин "совместно терапевтически эффективное количество" означает, что, когда терапевтические средства из комбинации, представленной в настоящем описании, вводят пациенту одновременно или раздельно (например, в хронологически чередующемся порядке, например в зависимости от последовательности) с такими временными интервалами, они демонстрируют взаимодействие (например, совместный терапевтический эффект, например, синергический эффект). Так ли это, можно определять, помимо прочего, отслеживая уровни в крови и наблюдая, что компоненты комбинации присутствуют в крови человека, подлежащего лечению, по меньшей мере в течение некоторых временных интервалов.
[00104] В одном из вариантов осуществления настоящее изобретение относится к способу лечения индивидуума, имеющего рак желчных протоков, включающему, состоящему, по существу, или состоящему из введения указанному индивидууму комбинированного терапевтического средства, как представлено в настоящем описании, в течение периода времени в количестве, являющемся совместно терапевтически эффективным против рака желчных протоков. В одном из вариантов осуществления рак желчных протоков является раком желчных протоков на поздней стадии.
[00105] В некоторых вариантах осуществления индивидуума ранее лечили до периода времени с использованием одного или более терапевтических средств, например, лечили с использованием по меньшей мере одной противоопухолевой терапии, независимо выбранной из химиотерапевтического средства (например, аналога дезоксицитидина, например, Gemzar®, гемцитабина), таргетированных терапевтических средств (например, ингибитора MEK, например, траметиниба или биниметиниба или его фармацевтически приемлемой соли, в качестве монотерапии), лучевой терапии и хирургического вмешательства.
[00106] В рамках изобретения термин "химиотерапия" или "химиотерапевтическое средство" относится к химиотерапевтическому средству или комбинации двух, трех, четырех или более химиотерапевтических средств для лечения злокачественного новообразования. Если химиотерапия состоит из более чем одного химиотерапевтического средства, химиотерапевтические средства можно вводить пациенту в один и тот же день или в разные дни одного цикла лечения.
[00107] "Химиотерапевтическое средство" является химическим соединением, которое можно использовать в лечении злокачественного новообразования. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXAN®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилaмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфамид, триэтилентиофосфамид и триметилоломеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9- тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; пеметрексед; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; TLK-286; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новэмбихин, фенестрин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как ендииновые антибиотики (например, калихимицин, в частности, калихимицин гамма II и калихимицин омега II (см., например, Nicolaou et al., Angew. Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеиновых ендииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая ADRIAMYCIN®, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин, липосомный доксорубицин HCl для инъекций (DOXIL®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и фторпиримидин-содержащие химиотерапевтические средства, такие как 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; средства, угнетающие функции надпочечников, такие как аминоглутетимид, митотан, трилостан; средства для восполнения фолиевой кислоты, такие как фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатрексат; дефофамин; демекольцин; диазиквон; эфлорнитин; ацетат эллиптиния; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (в частности, токсин T-2, верракурин A, роридин A и ангвидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гaцитозин; арабинозид ("Ara-C"); тиотепа; таксоиды, например, паклитаксел (TAXOL®), состав альбуминовых наночастиц паклитаксела, также известный как наб-паклитаксел (ABRAXANE™) и доксетаксел (TAXOTERE®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейковорин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомераз RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные любых из указанных выше соединений; а также комбинации двух или более из указанных выше соединений, такие как CHOP, что представляет собой сокращенное обозначение комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, FOLFOX, что представляет собой сокращенное обозначение схемы лечения оксалиплатином (ELOXATIN™) в комбинации 5-FU и лейковорином, FOLFOXIRI, что представляет собой сокращенное обозначение схемы лечения иринотеканом, оксалиплатином и 5-FU, и mFOLFOX-6, что представляет собой сокращенное обозначение схемы лечения лейковорином кальция (фолиновой кислотой), фторурацилом и оксалиплатином.
[00108] Дополнительные примеры химиотерапевтических средств включают противогормональные средства, регулирующие, снижающие, блокирующие или ингибирующие эффекты гормонов, стимулирующих рост злокачественного новообразования, и зачастую имеют форму системного лечения или лечения всего организма. Они сами могут являться гормонами. Примеры включают антиэстрогены и селективные модуляторы эстрогеновых рецепторов (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен (EVISTA®), дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (FARESTON®); антипрогестероны; супрессоры эстрогеновых рецепторов (ERD); антагонисты эстрогеновых рецепторов, такие как фулвестрант (FASLODEX®); средства, супрессирующие или угнетающие функцию яичников, например, агонисты рилизинг-фактора лютеинизирующего гормона (LHRF), такие как леупролида ацетат (LUPRON® и ELIGARD®), гозерелина ацетат, бузерелина ацетат и триптерелин; антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, ингибирующие фермент ароматазу, регулирующую продукцию эстрогенов в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат (MEGASE®), экземестан (AROMASIN®), форместан, фадрозол, ворозол (RIVISOR®), летрозол (FEMARA®) и анастрозол (ARIMIDEX®). Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновую кислоту/золедронат (ZOMETA®), аледронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризедронат (ACTONEL®); а также троксацитабин (аналог нуклеозида цитозина 1,3-диоксолан); вакцины, такие как вакцина THERATOPE® и генотерапевтические вакцины, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 (например, LURTOTECAN®); антиэстрогены, такие как фулвестрант; иринотекан; rmRH (например, ABARELIX®); 17AAG (производное гелданамицина, являющееся ядом для белка теплового шока (Hsp) 90) и фармацевтически приемлемые соли, кислоты или производные любых из указанных выше соединений.
[00109] В рамках изобретения термин "химиотерапевтическое средство на основе платины" относится к химиотерапии, где по меньшей мере одно химиотерапевтическое средство является координационным комплексом платины. Неограничивающие примеры химиотерапевтических средств на основе платины включают цисплатин, карбоплатин, оксалиплатин, недаплатин, гемцитабин в комбинации с цисплатином, карбоплатин в комбинации с пеметрекседом.
[00110] В рамках изобретения термин "таргетированное терапевтическое средство" относится к молекуле, блокирующей рост злокачественных клеток, противодействуя конкретным молекулам-мишеням, необходимым для канцерогенеза и роста опухоли, а не просто противодействуя всем быстро делящимся клеткам (например, с использованием общепринятой химиотерапии), и включает, в качестве неограничивающих примеров, таргетированные терапевтические средства против рецепторных тирозинкиназ (например, кабозантиниб, кризотиниб, эрлотиниб, гефитиниб, иматиниб, лапатиниб, нилотиниб, пазопаниб, пертузумаб, регорафениб, сунитиниб и трастузумаб), ингибиторы путей передачи сигнала (например, ингибиторы пути Ras-Raf-MEK-ERK (например, сорафениб, траметиниб, вемурафениб, селуметиниб, биниметиниб, кобиметиниб), ингибиторы пути PI3K-Akt-mTOR-S6K (например, эверолимус, рапамицин, перифосин, темсиролимус) и модуляторы пути апоптоза (например, обатаклакс)), антитела против EGFR (например, цетуксимаб и панитумумаб), антитела против VEGF (например, бевацизумаб), таргетированные терапевтические средства против ангиогенеза (например, афлиберцепт и бевацизумаб). В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени, являются химиотерапевтическими средствами. В одном из вариантов осуществления химиотерапевтическое средство выбрано из одного или более из химиотерапии препаратами платины и фторпиримидин-содержащего терапевтического средства. В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени, являются ингибитором пути Ras-Raf-MEK-ERK. В одном из вариантов осуществления терапевтическое средство, вводимое пациенту до периода времени, является ингибитором киназы EGFR. В одном из вариантов осуществления терапевтическое средство, вводимое пациенту до периода времени, является ингибитором MEK в виде монотерапии или фторпиримидин-содержащим терапевтическим средством в виде монотерапии. В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени, является антиметаболитом.
[00111] В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили с использованием предшествующей терапии, и, необязательно, определяли, что предшествующая терапия являлась неэффективной, и/или что пациент являлся резистентным к предшествующей терапии. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили гемцитабином (например, в качестве монотерапии), и, необязательно, определяли, что предшествующее введение гемцитабина являлось неэффективным, и/или что пациент являлся резистентным к гемцитабину. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили гемцитабином и цисплатином, и, необязательно, определяли, что предшествующее введение гемцитабина и цисплатина являлось неэффективным, и/или что пациент являлся резистентным к одному или обоим из гемцитабина и цисплатина. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили гемцитабином и оксалиплатином, и, необязательно, определяли, что предшествующее введение гемцитабина и оксалиплатина являлось неэффективным, и/или что пациент являлся резистентным к одному или обоим из гемцитабина и оксалиплатина. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили 5-фторурацилом (например, в качестве монотерапии), и, необязательно, определяли, что предшествующее введение 5-фторурацила являлось неэффективным, и/или что пациент являлся резистентным к 5-фторурацилу. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили 5-фторурацилом и лейковорином, и, необязательно, определяли, что предшествующее введение 5-фторурацила и лейковорина являлось неэффективным, и/или что пациент являлся резистентным к одному или обоим из 5-FU и лейковорина. В некоторых вариантах осуществления индивидууму вводили 5-фторурацил и цисплатин до периода времени, и, необязательно, определяли, что предшествующее введение 5-фторурацила и цисплатина являлось неэффективным, и/или что пациент являлся резистентным к одному или обоим из 5-фторурацила и цисплатина. В некоторых вариантах осуществления индивидууму вводили 5-фторурацил, эпирубицин и цисплатин до периода времени, и, необязательно, определяли, что предшествующее введение 5-фторурацила, эпирубицина и цисплатина являлось неэффективным, и/или что пациент являлся резистентным к одному или более из 5-фторурацила, эпирубицина и цисплатина. В некоторых вариантах осуществления индивидууму вводили 5-фторурацил и иринотекан до периода времени, и, необязательно, определяли, что предшествующее введение 5-фторурацила и иринотекана являлось неэффективным, и/или что пациент являлся резистентным к одному или обоим из 5-фторурацила и иринотекана. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили капецитабином (например, в качестве монотерапии), и, необязательно, определяли, что предшествующее введение капецитабина являлось неэффективным, и/или что пациент являлся резистентным к капецитабину. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили гемцитабином, и, необязательно, определяли, что предшествующее введение гемцитабина являлось неэффективным, и/или что пациент являлся резистентным к гемцитабину. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили гемцитабином и оксалиплатином, и, необязательно, определяли, что предшествующее введение гемцитабина и оксалиплатина являлось неэффективным, и/или что пациент являлся резистентным к одному или более из гемцитабина и оксалиплатина. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили лапатинибом, и, необязательно, определяли, что предшествующее введение лапатиниба являлось неэффективным, и/или что пациент являлся резистентным к лапатинибу. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили эрлотинибом, и, необязательно, определяли, что предшествующее введение эрлотиниба являлось неэффективным, и/или что пациент являлся резистентным к эрлотинибу. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили цетуксимабом или панитумумабом, и, необязательно, определяли, что предшествующее введение цетуксимаба или панитумумаба являлось неэффективным, и/или что пациент являлся резистентным к одному или обоим из цетуксимаба и панитумумаба. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили бевацизумабом (например, в качестве монотерапии), и, необязательно, определяли, что предшествующее введение бевацизумаба являлось неэффективным, и/или что пациент являлся резистентным к бевацизумабу. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили бевацизумабом и mFOLFOX6, и, необязательно, определяли, что предшествующее введение бевацизумаба и mFOLFOX6 являлось неэффективным, и/или что пациент являлся резистентным к одному или обоим из бевацизумаба и mFOLFOX6. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили бевацизумабом в комбинации с гемцитабином и капецитабином, и, необязательно, определяли, что предшествующее введение бевацизумаба в комбинации с гемцитабином и капецитабином являлось неэффективным, и/или что пациент являлся резистентным к одному или более из бевацизумаба, гемцитабина и капецитабина. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили ингибитором MEK (например, в качестве монотерапии), и, необязательно, определяли, что предшествующее введение ингибитора MEK являлось неэффективным, и/или что пациент являлся резистентным к ингибитору MEK. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили селуметинибом, и, необязательно, определяли, что предшествующее лечение селуметинибом являлось неэффективным, и/или что пациент являлся резистентным к селуметинибу. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили траметинибом, и, необязательно, определяли, что предшествующее лечение траметинибом являлось неэффективным, и/или что пациент являлся резистентным к траметинибу. В некоторых вариантах осуществления любых из способов по настоящему изобретению до периода времени пациента лечили биниметинибом, и, необязательно, определяли, что предшествующее лечение биниметинибом являлось неэффективным, и/или пациент являлся резистентным к биниметинибу. В некоторых вариантах осуществления любых из способов по настоящему изобретению одно или более терапевтических средств, вводимых пациенту до периода времени, являлись неэффективными (например, терапевтически неэффективными, что определяет лечащий врач).
[00112] В одном из вариантов осуществления пациента подвергали хирургическому вмешательству до периода времени. Неограничивающие примеры хирургического вмешательства включают, например, открытое хирургическое вмешательство или минимально инвазивное хирургическое вмешательство. Хирургическое вмешательство может включать, например, удаление целой опухоли, циторедукцию опухоли или удаление опухоли, вызывающей боль или ощущение давления у индивидуума. В этой области известны способы осуществления открытого хирургического вмешательства и минимально инвазивного хирургического вмешательства в отношении индивидуума, имеющего злокачественное новообразование.
[00113] В одном из вариантов осуществления пациента подвергали лучевой терапии до периода времени. Неограничивающие примеры лучевой терапии включают наружную дистанционную лучевую терапию (например, наружную дистанционную лучевую терапию с использованием киловольтного рентгеновского излучения или мегавольтного рентгеновского излучения) или внутреннюю лучевую терапию. Внутренняя лучевая терапия (также называемая брахитерапией) может включать использование, например, низкодозовой внутренней лучевой терапии или высокодозовой внутренней лучевой терапии. Низкодозовая внутренняя лучевая терапия включает, например, введение небольших радиоактивных пеллетов (также называемых "зернами") в злокачественную ткань индивидуума или вблизи нее. Высокодозовая внутренняя лучевая терапия включает, например, введение тонкой трубки (например, катетера) или имплантата в злокачественную ткань индивидуума или вблизи нее и подачу высокой дозы радиации к тонкой трубке или имплантату с использованием устройства-источника излучения. В этой области известны способы осуществления лучевой терапии в отношении индивидуума, имеющего злокачественное новообразование.
[00114] В одном из вариантов осуществления ингибитор MEK является биниметинибом или его фармацевтически приемлемой солью. В одном из вариантов осуществления ингибитор MEK является биниметинибом в виде свободного основания. В одном из вариантов осуществления ингибитор MEK является фармацевтически приемлемой солью биниметиниба. В одном из вариантов осуществления ингибитор MEK является кристаллизованным биниметинибом. В одном из вариантов осуществления биниметиниб вводят перорально в течение периода времени. В одном из вариантов осуществления биниметиниб вводят в виде таблетке в течение периода времени. В одном из вариантов осуществления состав таблетки биниметиниба содержит от приблизительно 5 мг до приблизительно 50 мг (например, от 5 мг до приблизительно 45 мг, от приблизительно 5 мг до приблизительно 40 мг, от приблизительно 5 мг до приблизительно 35 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 25 мг, от приблизительно 5 мг до приблизительно 20 мг, от приблизительно 5 мг до приблизительно 18 мг, от приблизительно 5 мг до приблизительно 16 мг, от приблизительно 5 мг до приблизительно 14 мг, от приблизительно 5 мг до приблизительно 12 мг, от приблизительно 5 мг до приблизительно 10 мг, от приблизительно 5 мг до приблизительно 8 мг, от приблизительно 10 мг до приблизительно 50 мг, от приблизительно 10 мг до приблизительно 45 мг, от приблизительно 10 мг до приблизительно 40 мг, от приблизительно 10 мг до приблизительно 35 мг, от приблизительно 10 мг до приблизительно 30 мг, от приблизительно 10 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 20 мг, от приблизительно 10 мг до приблизительно 18 мг, от приблизительно 10 мг до приблизительно 16 мг, от приблизительно 10 мг до приблизительно 14 мг, от приблизительно 10 мг до приблизительно 12 мг, от приблизительно 12 мг до приблизительно 50 мг, от приблизительно 12 мг до приблизительно 45 мг, от приблизительно 12 мг до приблизительно 45 мг, от приблизительно 12 мг до приблизительно 40 мг, от приблизительно 12 мг до приблизительно 35 мг, от приблизительно 12 мг до приблизительно 30 мг, от приблизительно 12 мг до приблизительно 25 мг, от приблизительно 12 мг до приблизительно 20 мг, от приблизительно 12 мг до приблизительно 18 мг, от приблизительно 12 мг до приблизительно 16 мг, от приблизительно 12 мг до приблизительно 14 мг, от приблизительно 14 мг до приблизительно 50 мг, от приблизительно 14 мг до приблизительно 45 мг, от приблизительно 14 мг до приблизительно 40 мг, от приблизительно 14 мг до приблизительно 35 мг, от приблизительно 14 мг до приблизительно 30 мг, от приблизительно 14 мг до приблизительно 25 мг, от приблизительно 14 мг до приблизительно 20 мг, от приблизительно 14 мг до приблизительно 18 мг, от приблизительно 14 мг до приблизительно 16 мг, от приблизительно 16 мг до приблизительно 50 мг, от приблизительно 16 мг до приблизительно 45 мг, от приблизительно 16 мг до приблизительно 40 мг, от приблизительно 16 мг до приблизительно 35 мг, от приблизительно 16 мг до приблизительно 30 мг, от приблизительно 16 мг до приблизительно 25 мг, от приблизительно 16 мг до приблизительно 20 мг, от приблизительно 16 мг до приблизительно 18 мг, от приблизительно 18 мг до приблизительно 50 мг, от приблизительно 18 мг до приблизительно 45 мг, от приблизительно 18 мг до приблизительно 40 мг, от приблизительно 18 мг до приблизительно 35 мг, от приблизительно 18 мг до приблизительно 30 мг, от приблизительно 18 мг до приблизительно 25 мг, от приблизительно 18 мг до приблизительно 20 мг, от приблизительно 20 мг до приблизительно 50 мг, от приблизительно 20 мг до приблизительно 45 мг, от приблизительно 20 мг до приблизительно 40 мг, от приблизительно 20 мг до приблизительно 35 мг, от приблизительно 20 мг до приблизительно 30 мг, от приблизительно 20 мг до приблизительно 25 мг, от приблизительно 25 мг до приблизительно 50 мг, от приблизительно 25 мг до приблизительно 45 мг, от приблизительно 25 мг до приблизительно 40 мг, от приблизительно 25 мг до приблизительно 35 мг, от приблизительно 25 мг до приблизительно 30 мг, от приблизительно 30 мг до приблизительно 50 мг, от приблизительно 30 мг до приблизительно 45 мг, от приблизительно 30 мг до приблизительно 40 мг, от приблизительно 30 мг до приблизительно 35 мг, от приблизительно 35 мг до приблизительно 50 мг, от приблизительно 35 мг до приблизительно 45 мг, от приблизительно 35 мг до приблизительно 40 мг, от приблизительно 40 мг до приблизительно 50 мг, от приблизительно 40 мг до приблизительно 45 мг, от приблизительно 45 мг до приблизительно 50 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг или приблизительно 50 мг) биниметиниба или его фармацевтически приемлемой соли. В одном из вариантов осуществления состав таблетки биниметиниба содержит от приблизительно 5 мг до приблизительно 50 мг (например, включая любой поддиапазон или значения в этом диапазоне, представленном в настоящем описании, например, приблизительно 15 мг) кристаллизованного биниметиниба. В одном из вариантов осуществления биниметиниб вводят перорально дважды в сутки в течение периода времени. В одном из вариантов осуществления биниметиниб вводят перорально дважды в сутки в течение периода времени, где вторую дозу биниметиниба вводят через приблизительно 1 час, приблизительно 2 часа, приблизительно 3 часа, приблизительно 4 часа, приблизительно 5 часов, приблизительно 6 часов, приблизительно 7 часов, приблизительно 8 часов, приблизительно 9 часов, приблизительно 10 часов, приблизительно 11 часов, или приблизительно 12 часов (например, 12 часов ± 2 часа) после первой дозы биниметиниба в течение периода времени. В одном из вариантов осуществления биниметиниб вводят перорально ежедневно в количестве от приблизительно 10 мг до приблизительно 100 мг (например, от приблизительно 10 мг до приблизительно 95 мг, от приблизительно 10 мг до приблизительно 90 мг, от приблизительно 10 мг до приблизительно 85 мг, от приблизительно 10 мг до приблизительно 80 мг, от приблизительно 10 мг до приблизительно 75 мг, от приблизительно 10 мг до приблизительно 70 мг, от приблизительно 10 мг до приблизительно 65 мг, от приблизительно 10 мг до приблизительно 60 мг, от приблизительно 10 мг до приблизительно 55 мг, от приблизительно 10 мг до приблизительно 50 мг, от приблизительно 10 мг до приблизительно 45 мг, от приблизительно 10 мг до приблизительно 40 мг, от приблизительно 10 мг до приблизительно 35 мг, от приблизительно 10 мг до приблизительно 30 мг, от приблизительно 10 мг до приблизительно 25 мг, от приблизительно 10 мг до приблизительно 20 мг, от приблизительно 10 мг до приблизительно 15 мг, от приблизительно 15 мг до приблизительно 100 мг, от приблизительно 15 мг до приблизительно 95 мг, от приблизительно 15 мг до приблизительно 90 мг, от приблизительно 15 мг до приблизительно 85 мг, от приблизительно 15 мг до приблизительно 80 мг, от приблизительно 15 мг до приблизительно 75 мг, от приблизительно 15 мг до приблизительно 70 мг, от приблизительно 15 мг до приблизительно 65 мг, от приблизительно 15 мг до приблизительно 60 мг, от приблизительно 15 мг до приблизительно 55 мг, от приблизительно 15 мг до приблизительно 50 мг, от приблизительно 15 мг до приблизительно 45 мг, от приблизительно 15 мг до приблизительно 40 мг, от приблизительно 15 мг до приблизительно 35 мг, от приблизительно 15 мг до приблизительно 30 мг, от приблизительно 15 мг до приблизительно 25 мг, от приблизительно 15 мг до приблизительно 20 мг, от приблизительно 20 мг до приблизительно 100 мг, от приблизительно 20 мг до приблизительно 95 мг, от приблизительно 20 мг до приблизительно 90 мг, от приблизительно 20 мг до приблизительно 85 мг, от приблизительно 20 мг до приблизительно 80 мг, от приблизительно 20 мг до приблизительно 75 мг, от приблизительно 20 мг до приблизительно 70 мг, от приблизительно 20 мг до приблизительно 65 мг, от приблизительно 20 мг до приблизительно 60 мг, от приблизительно 20 мг до приблизительно 55 мг, от приблизительно 20 мг до приблизительно 50 мг, от приблизительно 20 мг до приблизительно 45 мг, от приблизительно 20 мг до приблизительно 40 мг, от приблизительно 20 мг до приблизительно 35 мг, от приблизительно 20 мг до приблизительно 30 мг, от приблизительно 20 мг до приблизительно 25 мг, от приблизительно 25 мг до приблизительно 100 мг, от приблизительно 25 мг до приблизительно 95 мг, от приблизительно 25 мг до приблизительно 90 мг, от приблизительно 25 мг до приблизительно 85 мг, от приблизительно 25 мг до приблизительно 80 мг, от приблизительно 25 мг до приблизительно 75 мг, от приблизительно 25 мг до приблизительно 70 мг, от приблизительно 25 мг до приблизительно 65 мг, от приблизительно 25 мг до приблизительно 60 мг, от приблизительно 25 мг до приблизительно 55 мг, от приблизительно 25 мг до приблизительно 50 мг, от приблизительно 25 мг до приблизительно 45 мг, от приблизительно 25 мг до приблизительно 40 мг, от приблизительно 25 мг до приблизительно 35 мг, от приблизительно 25 мг до приблизительно 30 мг, от приблизительно 30 мг до приблизительно 100 мг, от приблизительно 30 мг до приблизительно 95 мг, от приблизительно 30 мг до приблизительно 90 мг, от приблизительно 30 мг до приблизительно 85 мг, от приблизительно 30 мг до приблизительно 80 мг, от приблизительно 30 мг до приблизительно 75 мг, от приблизительно 30 мг до приблизительно 70 мг, от приблизительно 30 мг до приблизительно 65 мг, от приблизительно 30 мг до приблизительно 60 мг, от приблизительно 30 мг до приблизительно 55 мг, от приблизительно 30 мг до приблизительно 50 мг, от приблизительно 30 мг до приблизительно 45 мг, от приблизительно 30 мг до приблизительно 40 мг, от приблизительно 30 мг до приблизительно 35 мг, от приблизительно 35 мг до приблизительно 100 мг, от приблизительно 35 мг до приблизительно 95 мг, от приблизительно 35 мг до приблизительно 90 мг, от приблизительно 35 мг до приблизительно 85 мг, от приблизительно 35 мг до приблизительно 80 мг, от приблизительно 35 мг до приблизительно 75 мг, от приблизительно 35 мг до приблизительно 70 мг, от приблизительно 35 мг до приблизительно 65 мг, от приблизительно 35 мг до приблизительно 60 мг, от приблизительно 35 мг до приблизительно 55 мг, от приблизительно 35 мг до приблизительно 50 мг, от приблизительно 35 мг до приблизительно 45 мг, от приблизительно 35 мг до приблизительно 40 мг, от приблизительно 40 мг до приблизительно 100 мг, от приблизительно 40 мг до приблизительно 95 мг, от приблизительно 40 мг до приблизительно 90 мг, от приблизительно 40 мг до приблизительно 85 мг, от приблизительно 40 мг до приблизительно 80 мг, от приблизительно 40 мг до приблизительно 75 мг, от приблизительно 40 мг до приблизительно 70 мг, от приблизительно 40 мг до приблизительно 65 мг, от приблизительно 40 мг до приблизительно 60 мг, от приблизительно 40 мг до приблизительно 55 мг, от приблизительно 40 мг до приблизительно 50 мг, от приблизительно 40 мг до приблизительно 45 мг, от приблизительно 45 мг до приблизительно 100 мг, от приблизительно 45 мг до приблизительно 95 мг, от приблизительно 45 мг до приблизительно 90 мг, от приблизительно 45 мг до приблизительно 85 мг, от приблизительно 45 мг до приблизительно 80 мг, от приблизительно 45 мг до приблизительно 75 мг, от приблизительно 45 мг до приблизительно 70 мг, от приблизительно 45 мг до приблизительно 65 мг, от приблизительно 45 мг до приблизительно 60 мг, от приблизительно 45 мг до приблизительно 55 мг, от приблизительно 45 мг до приблизительно 50 мг, от приблизительно 50 мг до приблизительно 100 мг, от приблизительно 50 мг до приблизительно 95 мг, от приблизительно 50 мг до приблизительно 90 мг, от приблизительно 50 мг до приблизительно 85 мг, от приблизительно 50 мг до приблизительно 80 мг, от приблизительно 50 мг до приблизительно 75 мг, от приблизительно 50 мг до приблизительно 70 мг, от приблизительно 50 мг до приблизительно 65 мг, от приблизительно 50 мг до приблизительно 60 мг, от приблизительно 50 мг до приблизительно 55 мг, от приблизительно 55 мг до приблизительно 100 мг, от приблизительно 55 мг до приблизительно 95 мг, от приблизительно 55 мг до приблизительно 90 мг, от приблизительно 55 мг до приблизительно 85 мг, от приблизительно 55 мг до приблизительно 80 мг, от приблизительно 55 мг до приблизительно 75 мг, от приблизительно 55 мг до приблизительно 70 мг, от приблизительно 55 мг до приблизительно 65 мг, от приблизительно 55 мг до приблизительно 60 мг, от приблизительно 60 мг до приблизительно 100 мг, от приблизительно 60 мг до приблизительно 95 мг, от приблизительно 60 мг до приблизительно 90 мг, от приблизительно 60 мг до приблизительно 85 мг, от приблизительно 60 мг до приблизительно 80 мг, от приблизительно 60 мг до приблизительно 75 мг, от приблизительно 60 мг до приблизительно 70 мг, от приблизительно 60 мг до приблизительно 65 мг, от приблизительно 65 мг до приблизительно 100 мг, от приблизительно 65 мг до приблизительно 95 мг, от приблизительно 65 мг до приблизительно 90 мг, от приблизительно 65 мг до приблизительно 85 мг, от приблизительно 65 мг до приблизительно 80 мг, от приблизительно 65 мг до приблизительно 75 мг, от приблизительно 65 мг до приблизительно 70 мг, от приблизительно 70 мг до приблизительно 100 мг, от приблизительно 70 мг до приблизительно 95 мг, от приблизительно 70 мг до приблизительно 90 мг, от приблизительно 70 мг до приблизительно 85 мг, от приблизительно 70 мг до приблизительно 80 мг, от приблизительно 70 мг до приблизительно 75 мг, от приблизительно 75 мг до приблизительно 100 мг, от приблизительно 75 мг до приблизительно 95 мг, от приблизительно 75 мг до приблизительно 90 мг, от приблизительно 75 мг до приблизительно 85 мг, от приблизительно 75 мг до приблизительно 80 мг, от приблизительно 80 мг до приблизительно 100 мг, от приблизительно 80 мг до приблизительно 95 мг, от приблизительно 80 мг до приблизительно 90 мг, от приблизительно 80 мг до приблизительно 85 мг, от приблизительно 85 мг до приблизительно 100 мг, от приблизительно 85 мг до приблизительно 95 мг, от приблизительно 85 мг до приблизительно 90 мг, от приблизительно 90 мг до приблизительно 100 мг, от приблизительно 90 мг до приблизительно 95 мг, приблизительно 95 мг до приблизительно 100 мг, приблизительно 10 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг) дважды в сутки в течение периода времени. В одном из вариантов осуществления 15 мг биниметиниба вводят перорально дважды в сутки в течение периода времени. В одном из вариантов осуществления 30 мг биниметиниба вводят перорально дважды в сутки в течение периода времени. В одном из вариантов осуществления 45 мг биниметиниба вводят перорально дважды в сутки в течение периода времени. В одном из вариантов осуществления биниметиниб вводят перорально ежедневно в количестве от приблизительно 10 мг до приблизительно 100 мг (например, включая любой поддиапазон или значения в этом диапазоне, представленном в настоящем описании, например, приблизительно 15 мг, или приблизительно 30 мг, или приблизительно 45 мг) BID в течение трех недель с последующей одной неделей, двумя неделями или тремя неделями без введения биниметиниба в по меньшей мере одном цикле лечения из трех недель в течение периода времени. В одном из вариантов осуществления биниметиниб вводят перорально дважды в сутки в количестве приблизительно 15 мг в течение трех недель с последующей одной неделей без введения биниметиниба в по меньшей мере одном цикле лечения из трех недель в течение периода времени. В одном из вариантов осуществления биниметиниб вводят перорально дважды в сутки в количестве приблизительно 30 мг в течение трех недель с последующей одной неделей без введения биниметиниба в по меньшей мере одном цикле лечения из трех недель в течение периода времени. В одном из вариантов осуществления биниметиниб вводят перорально дважды в сутки в количестве приблизительно 45 мг в течение трех недель с последующей одной неделей без введения биниметиниба в по меньшей мере одном цикле лечения из трех недель в течение периода времени. В одном из вариантов осуществления 45 мг биниметиниба вводят перорально дважды в сутки до наблюдения нежелательных явлений, после чего дважды в сутки вводят 30 мг биниметиниба в течение периода времени. В одном из вариантов осуществления в случае пациентов, дозу для которых снижали до 30 мг дважды в сутки, дозу можно снова повышать до 45 мг дважды в сутки, если нежелательные явления, приведшие к снижению дозы, улучшились до исходного уровня и оставались стабильными в течение, например, до 14 дней, или до трех недель, или до 4 недель, при условии, что отсутствуют другие сопутствующие токсичности, связанные с биниметинибом, которые могут мешать повторному повышению дозы лекарственного средства в течение периода времени.
[00115] В некоторых вариантах осуществления фторпиримидин-содержащее терапевтическое средство является капецитабином. В одном из вариантов осуществления капецитабин вводят перорально, в течение периода времени. В одном из вариантов осуществления капецитабин вводят в виде таблетки или капсулы в течение периода времени. В некоторых вариантах осуществления состав таблетки или капсулы капецитабина содержит, например, от приблизительно 10 мг до приблизительно 500 мг, от приблизительно 10 мг до приблизительно 475 мг, от приблизительно 10 мг до приблизительно 450 мг, от приблизительно 10 мг до приблизительно 425 мг, от приблизительно 10 мг до приблизительно 400 мг, от приблизительно 10 мг до приблизительно 375 мг, от приблизительно 10 мг до приблизительно 350 мг, от приблизительно 10 мг до приблизительно 325 мг, от приблизительно 10 мг до приблизительно 300 мг, от приблизительно 10 мг до приблизительно 275 мг, от приблизительно 10 мг до приблизительно 250 мг, от приблизительно 10 мг до приблизительно 225 мг, от приблизительно 10 мг до приблизительно 200 мг, от приблизительно 10 мг до приблизительно 175 мг, от приблизительно 10 мг до приблизительно 150 мг, от приблизительно 10 мг до приблизительно 125 мг, от приблизительно 10 мг до приблизительно 100 мг, от приблизительно 10 мг до приблизительно 75 мг, от приблизительно 10 мг до приблизительно 50 мг, от приблизительно 10 мг до приблизительно 25 мг, от приблизительно 25 мг до приблизительно 500 мг, от приблизительно 25 мг до приблизительно 475 мг, от приблизительно 25 мг до приблизительно 450 мг, от приблизительно 25 мг до приблизительно 425 мг, от приблизительно 25 мг до приблизительно 400 мг, от приблизительно 25 мг до приблизительно 375 мг, от приблизительно 25 мг до приблизительно 350 мг, от приблизительно 25 мг до приблизительно 325 мг, от приблизительно 25 мг до приблизительно 300 мг, от приблизительно 25 мг до приблизительно 275 мг, от приблизительно 25 мг до приблизительно 250 мг, от приблизительно 25 мг до приблизительно 225 мг, от приблизительно 25 мг до приблизительно 200 мг, от приблизительно 25 мг до приблизительно 175 мг, от приблизительно 25 мг до приблизительно 150 мг, от приблизительно 25 мг до приблизительно 125 мг, от приблизительно 25 мг до приблизительно 100 мг, от приблизительно 25 мг до приблизительно 75 мг, от приблизительно 25 мг до приблизительно 50 мг, от приблизительно 50 мг до приблизительно 500 мг, от приблизительно 50 мг до приблизительно 475 мг, от приблизительно 50 мг до приблизительно 450 мг, от приблизительно 50 мг до приблизительно 425 мг, от приблизительно 50 мг до приблизительно 400 мг, от приблизительно 50 мг до приблизительно 375 мг, от приблизительно 50 мг до приблизительно 350 мг, от приблизительно 50 мг до приблизительно 325 мг, от приблизительно 50 мг до приблизительно 300 мг, от приблизительно 50 мг до приблизительно 275 мг, от приблизительно 50 мг до приблизительно 250 мг, от приблизительно 50 мг до приблизительно 225 мг, от приблизительно 50 мг до приблизительно 200 мг, от приблизительно 50 мг до приблизительно 175 мг, от приблизительно 50 мг до приблизительно 150 мг, от приблизительно 50 мг до приблизительно 125 мг, от приблизительно 50 мг до приблизительно 100 мг, от приблизительно 50 мг до приблизительно 75 мг, от приблизительно 75 мг до приблизительно 500 мг, от приблизительно 75 мг до приблизительно 475 мг, от приблизительно 75 мг до приблизительно 450 мг, от приблизительно 75 мг до приблизительно 425 мг, от приблизительно 75 мг до приблизительно 400 мг, от приблизительно 75 мг до приблизительно 375 мг, от приблизительно 75 мг до приблизительно 350 мг, от приблизительно 75 мг до приблизительно 325 мг, от приблизительно 75 мг до приблизительно 300 мг, от приблизительно 75 мг до приблизительно 275 мг, от приблизительно 75 мг до приблизительно 250 мг, от приблизительно 75 мг до приблизительно 225 мг, от приблизительно 75 мг до приблизительно 200 мг, от приблизительно 75 мг до приблизительно 175 мг, от приблизительно 75 мг до приблизительно 150 мг, от приблизительно 75 мг до приблизительно 125 мг, от приблизительно 75 мг до приблизительно 100 мг, от приблизительно 100 мг до приблизительно 500 мг, от приблизительно 100 мг до приблизительно 475 мг, от приблизительно 100 мг до приблизительно 450 мг, от приблизительно 100 мг до приблизительно 425 мг, от приблизительно 100 мг до приблизительно 400 мг, от приблизительно 100 мг до приблизительно 375 мг, от приблизительно 100 мг до приблизительно 350 мг, от приблизительно 100 мг до приблизительно 325 мг, от приблизительно 100 мг до приблизительно 300 мг, от приблизительно 100 мг до приблизительно 275 мг, от приблизительно 100 мг до приблизительно 250 мг, от приблизительно 100 мг до приблизительно 225 мг, от приблизительно 100 мг до приблизительно 200 мг, от приблизительно 100 мг до приблизительно 175 мг, от приблизительно 100 мг до приблизительно 150 мг, от приблизительно 100 мг до приблизительно 125 мг, от приблизительно 125 мг до приблизительно 500 мг, от приблизительно 125 мг до приблизительно 475 мг, от приблизительно 125 мг до приблизительно 450 мг, от приблизительно 125 мг до приблизительно 425 мг, от приблизительно 125 мг до приблизительно 400 мг, от приблизительно 125 мг до приблизительно 375 мг, от приблизительно 125 мг до приблизительно 350 мг, от приблизительно 125 мг до приблизительно 325 мг, от приблизительно 125 мг до приблизительно 300 мг, от приблизительно 125 мг до приблизительно 275 мг, от приблизительно 125 мг до приблизительно 250 мг, от приблизительно 125 мг до приблизительно 225 мг, от приблизительно 125 мг до приблизительно 200 мг, от приблизительно 125 мг до приблизительно 175 мг, от приблизительно 125 мг до приблизительно 150 мг, от приблизительно 150 мг до приблизительно 500 мг, от приблизительно 150 мг до приблизительно 475 мг, от приблизительно 150 мг до приблизительно 450 мг, от приблизительно 150 мг до приблизительно 425 мг, от приблизительно 150 мг до приблизительно 400 мг, от приблизительно 150 мг до приблизительно 375 мг, от приблизительно 150 мг до приблизительно 350 мг, от приблизительно 150 мг до приблизительно 325 мг, от приблизительно 150 мг до приблизительно 300 мг, от приблизительно 150 мг до приблизительно 275 мг, от приблизительно 150 мг до приблизительно 250 мг, от приблизительно 150 мг до приблизительно 225 мг, от приблизительно 150 мг до приблизительно 200 мг, от приблизительно 150 мг до приблизительно 175 мг, от приблизительно 175 мг до приблизительно 500 мг, от приблизительно 175 мг до приблизительно 475 мг, от приблизительно 175 мг до приблизительно 450 мг, от приблизительно 175 мг до приблизительно 425 мг, от приблизительно 175 мг до приблизительно 400 мг, от приблизительно 175 мг до приблизительно 375 мг, от приблизительно 175 мг до приблизительно 350 мг, от приблизительно 175 мг до приблизительно 325 мг, от приблизительно 175 мг до приблизительно 300 мг, от приблизительно 175 мг до приблизительно 275 мг, от приблизительно 175 мг до приблизительно 250 мг, от приблизительно 175 мг до приблизительно 225 мг, от приблизительно 175 мг до приблизительно 200 мг, от приблизительно 200 мг до приблизительно 500 мг, от приблизительно 200 мг до приблизительно 475 мг, от приблизительно 200 мг до приблизительно 450 мг, от приблизительно 200 мг до приблизительно 425 мг, от приблизительно 200 мг до приблизительно 400 мг, от приблизительно 200 мг до приблизительно 375 мг, от приблизительно 200 мг до приблизительно 350 мг, от приблизительно 200 мг до приблизительно 325 мг, от приблизительно 200 мг до приблизительно 300 мг, от приблизительно 200 мг до приблизительно 275 мг, от приблизительно 200 мг до приблизительно 250 мг, от приблизительно 200 мг до приблизительно 225 мг, от приблизительно 225 мг до приблизительно 500 мг, от приблизительно 225 мг до приблизительно 475 мг, от приблизительно 225 мг до приблизительно 450 мг, от приблизительно 225 мг до приблизительно 425 мг, от приблизительно 225 мг до приблизительно 400 мг, от приблизительно 225 мг до приблизительно 375 мг, от приблизительно 225 мг до приблизительно 350 мг, от приблизительно 225 мг до приблизительно 325 мг, от приблизительно 225 мг до приблизительно 300 мг, от приблизительно 225 мг до приблизительно 275 мг, от приблизительно 225 мг до приблизительно 250 мг, от приблизительно 250 мг до приблизительно 500 мг, от приблизительно 250 мг до приблизительно 475 мг, от приблизительно 250 мг до приблизительно 450 мг, от приблизительно 250 мг до приблизительно 425 мг, от приблизительно 250 мг до приблизительно 400 мг, от приблизительно 250 мг до приблизительно 375 мг, от приблизительно 250 мг до приблизительно 350 мг, от приблизительно 250 мг до приблизительно 325 мг, от приблизительно 250 мг до приблизительно 300 мг, от приблизительно 250 мг до приблизительно 275 мг, от приблизительно 275 мг до приблизительно 500 мг, от приблизительно 275 мг до приблизительно 475 мг, от приблизительно 275 мг до приблизительно 450 мг, от приблизительно 275 мг до приблизительно 425 мг, от приблизительно 275 мг до приблизительно 400 мг, от приблизительно 275 мг до приблизительно 375 мг, от приблизительно 275 мг до приблизительно 350 мг, от приблизительно 275 мг до приблизительно 325 мг, от приблизительно 275 мг до приблизительно 300 мг, от приблизительно 300 мг до приблизительно 500 мг, от приблизительно 300 мг до приблизительно 475 мг, от приблизительно 300 мг до приблизительно 450 мг, от приблизительно 300 мг до приблизительно 425 мг, от приблизительно 300 мг до приблизительно 400 мг, от приблизительно 300 мг до приблизительно 375 мг, от приблизительно 300 мг до приблизительно 350 мг, от приблизительно 300 мг до приблизительно 325 мг, от приблизительно 325 мг до приблизительно 500 мг, от приблизительно 325 мг до приблизительно 475 мг, от приблизительно 325 мг до приблизительно 450 мг, от приблизительно 325 мг до приблизительно 425 мг, от приблизительно 325 мг до приблизительно 400 мг, от приблизительно 325 мг до приблизительно 375 мг, от приблизительно 325 мг до приблизительно 350 мг, от приблизительно 350 мг до приблизительно 500 мг, от приблизительно 350 мг до приблизительно 475 мг, от приблизительно 350 мг до приблизительно 450 мг, от приблизительно 350 мг до приблизительно 425 мг, от приблизительно 350 мг до приблизительно 400 мг, от приблизительно 350 мг до приблизительно 375 мг, от приблизительно 375 мг до приблизительно 500 мг, от приблизительно 375 мг до приблизительно 475 мг, от приблизительно 375 мг до приблизительно 450 мг, от приблизительно 375 мг до приблизительно 425 мг, от приблизительно 375 мг до приблизительно 400 мг, от приблизительно 400 мг до приблизительно 500 мг, от приблизительно 400 мг до приблизительно 475 мг, от приблизительно 400 мг до приблизительно 450 мг, от приблизительно 400 мг до приблизительно 425 мг, от приблизительно 425 мг до приблизительно 500 мг, от приблизительно 425 мг до приблизительно 475 мг, от приблизительно 425 мг до приблизительно 450 мг, от приблизительно 450 мг до приблизительно 500 мг, от приблизительно 450 мг до приблизительно 475 мг или от приблизительно 475 мг до приблизительно 500 мг капецитабина.
[00116] В одном из вариантов осуществления состав таблетки капецитабина содержит приблизительно 150 мг капецитабина. В одном из вариантов осуществления таблетка состав капецитабина содержит приблизительно 300 мг капецитабина. В одном из вариантов осуществления капецитабин вводят перорально один раз, дважды или трижды в сутки в течение периода времени. В одном из вариантов осуществления капецитабин вводят перорально дважды в сутки в течение периода времени, где вторую дозу капецитабина вводят через приблизительно 1 час, приблизительно 2 часа, приблизительно 3 часа, приблизительно 4 часа, приблизительно 5 часов, приблизительно 6 часов, приблизительно 7 часов, приблизительно 8 часов, приблизительно 9 часов, приблизительно 10 часов, приблизительно 11 часов или приблизительно 12 часов (например, 12 часов ± 2 часа) после первой дозы капецитабина в течение периода времени. В одном из вариантов осуществления капецитабин вводят перорально дважды в сутки в течение периода времени, где каждое введение капецитабина осуществляют по меньшей мере через 30 минут после приема пищи. В одном из вариантов осуществления капецитабин вводят перорально дважды в сутки в течение 2 недель с последующей одной неделей периода покоя в 3-недельном цикле. В одном из вариантов осуществления капецитабин вводят перорально в дозе приблизительно 800 мг/м2, или приблизительно 825 мг/м2, или приблизительно 950 мг/м2, или приблизительно 1000 мг/м2, или приблизительно 1250 мг/м2 дважды в сутки. В одном из вариантов осуществления капецитабин вводят перорально в дозе приблизительно 800 мг/м2 дважды в сутки в течение периода времени. В одном из вариантов осуществления капецитабин вводят перорально в дозе приблизительно 825 мг/м2 дважды в сутки в течение периода времени. В одном из вариантов осуществления капецитабин вводят перорально в дозе приблизительно 950 мг/м2 дважды в сутки в течение периода времени. В одном из вариантов осуществления капецитабин вводят перорально в дозе приблизительно 1000 мг/м2 дважды в сутки в течение периода времени. В одном из вариантов осуществления капецитабин вводят перорально в дозе приблизительно 1250 мг/м2 дважды в сутки в течение периода времени. В одном из вариантов осуществления, если капецитабин вводят перорально в дозе приблизительно 1250 мг/м2 дважды в сутки в течение периода времени, капецитабин можно вводить по следующей таблице:
Дважды в сутки
[00117] В одном из вариантов осуществления изобретение относится к способу лечения рака желчных протоков, включающему или состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени комбинированного терапевтического средства, содержащего, или состоящего, по существу, или состоящего из терапевтически эффективных количеств, независимо или в комбинации, ингибитора MEK и фторпиримидин-содержащего терапевтического средства, где ингибитор MEK является биниметинибом или его фармацевтически приемлемой солью. В одном из вариантов осуществления ингибитор MEK является биниметинибом в виде свободного основания. В одном из вариантов осуществления ингибитор MEK является кристаллизованным биниметинибом. В одном из вариантов осуществления биниметиниб вводят перорально дважды в сутки в количестве приблизительно 10 мг до приблизительно 100 мг (например, включая любые поддиапазоны или значения в диапазоне, представленном в настоящем описании, например, приблизительно 30 мг или приблизительно 45 мг), в течение периода времени. В одном из вариантов осуществления биниметиниб вводят дважды в сутки в течение двух недель с последующей одной неделей периода покоя в течение трехнедельного периода. В одном из вариантов осуществления пациента ранее лечили с использованием одной или более предшествующих терапий, например, одного или более терапевтических средств, например, по меньшей мере одного лечения с использованием другой противоопухолевой терапии, до периода времени.
[00118] В одном из вариантов осуществления способ лечения рака желчных протоков включает или состоит, по существу, из введения нуждающемуся в этом пациенту в течение периода времени комбинированного терапевтического средства, состоящего, по существу, или состоящего из терапевтически эффективных количеств, независимо или в комбинации, (a) ингибитора MEK и (b) фторпиримидин-содержащего терапевтического средства, являющегося капецитабином, где капецитабин вводят перорально дважды в сутки в количестве от приблизительно 100 мг/м2 до приблизительно 1250 мг/м2 (например, от приблизительно 100 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 100 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 100 мг/м2 до приблизительно 1000 мг/м2, от приблизительно 100 мг/м2 до приблизительно 900 мг/м2, от приблизительно 100 мг/м2 до приблизительно 800 мг/м2, от приблизительно 100 мг/м2 до приблизительно 700 мг/м2, от приблизительно 100 мг/м2 до приблизительно 600 мг/м2, от приблизительно 100 мг/м2 до приблизительно 500 мг/м2, от приблизительно 100 мг/м2 до приблизительно 400 мг/м2, от приблизительно 100 мг/м2 до приблизительно 300 мг/м2, от приблизительно 100 мг/м2 до приблизительно 200 мг/м2, от приблизительно 200 мг/м2 до приблизительно 1250 мг/м2, от приблизительно 200 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 200 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 200 мг/м2 до приблизительно 1000 мг/м2, от приблизительно 200 мг/м2 до приблизительно 900 мг/м2, от приблизительно 200 мг/м2 до приблизительно 800 мг/м2, от приблизительно 200 мг/м2 до приблизительно 700 мг/м2, от приблизительно 200 мг/м2 до приблизительно 600 мг/м2, от приблизительно 200 мг/м2 до приблизительно 500 мг/м2, от приблизительно 200 мг/м2 до приблизительно 400 мг/м2, от приблизительно 200 мг/м2 до приблизительно 300 мг/м2, от приблизительно 300 мг/м2 до приблизительно 1250 мг/м2, от приблизительно 300 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 300 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 300 мг/м2 до приблизительно 1000 мг/м2, от приблизительно 300 мг/м2 до приблизительно 900 мг/м2, от приблизительно 300 мг/м2 до приблизительно 800 мг/м2, от приблизительно 300 мг/м2 до приблизительно 700 мг/м2, от приблизительно 300 мг/м2 до приблизительно 600 мг/м2, от приблизительно 300 мг/м2 до приблизительно 500 мг/м2, от приблизительно 300 мг/м2 до приблизительно 400 мг/м2, от приблизительно 400 мг/м2 до приблизительно 1250 мг/м2, от приблизительно 400 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 400 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 400 мг/м2 до приблизительно 1000 мг/м2, от приблизительно 400 мг/м2 до приблизительно 900 мг/м2, от приблизительно 400 мг/м2 до приблизительно 800 мг/м2, от приблизительно 400 мг/м2 до приблизительно 700 мг/м2, от приблизительно 400 мг/м2 до приблизительно 600 мг/м2, от приблизительно 400 мг/м2 до приблизительно 500 мг/м2, от приблизительно 500 мг/м2 до приблизительно 1250 мг/м2, от приблизительно 500 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 500 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 500 мг/м2 до приблизительно 1000 мг/м2, от приблизительно 500 мг/м2 до приблизительно 900 мг/м2, от приблизительно 500 мг/м2 до приблизительно 800 мг/м2, от приблизительно 500 мг/м2 до приблизительно 700 мг/м2, от приблизительно 500 мг/м2 до приблизительно 600 мг/м2, от приблизительно 600 мг/м2 до приблизительно 1250 мг/м2, от приблизительно 600 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 600 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 600 мг/м2 до приблизительно 1000 мг/м2, от приблизительно 600 мг/м2 до приблизительно 900 мг/м2, от приблизительно 600 мг/м2 до приблизительно 800 мг/м2, от приблизительно 600 мг/м2 до приблизительно 700 мг/м2, от приблизительно 700 мг/м2 до приблизительно 1250 мг/м2, от приблизительно 700 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 700 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 700 мг/м2 до приблизительно 1000 мг/м2, от приблизительно 700 мг/м2 до приблизительно 900 мг/м2, от приблизительно 700 мг/м2 до приблизительно 800 мг/м2, от приблизительно 800 мг/м2 до приблизительно 1250 мг/м2, от приблизительно 800 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 800 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 800 мг/м2 до приблизительно 1000 мг/м2, от приблизительно 800 мг/м2 до приблизительно 900 мг/м2, от приблизительно 900 мг/м2 до приблизительно 1250 мг/м2, от приблизительно 900 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 900 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 900 мг/м2 до приблизительно 1000 мг/м2, от приблизительно 1000 мг/м2 до приблизительно 1250 мг/м2, от приблизительно 1000 мг/м2 до приблизительно 1200 мг/м2, от приблизительно 1000 мг/м2 до приблизительно 1100 мг/м2, от приблизительно 1100 мг/м2 до приблизительно 1250 мг/м2 или от приблизительно 1100 мг/м2 до приблизительно 1200 мг/м2) в течение периода времени. В одном из вариантов осуществления капецитабин вводят перорально дважды в сутки в количестве приблизительно 1000 мг/м2 или приблизительно 1250 мг/м2. В одном из вариантов осуществления капецитабин вводят дважды в сутки в течение двух недель с последующей одной неделей периода покоя в течение трехнедельного периода. В одном из вариантов осуществления пациента ранее лечили с использованием одной или более предшествующих терапий, например, одного или более терапевтических средств, например, по меньшей мере одного лечения с использованием другой противоопухолевой терапии, до периода времени.
[00119] В одном из вариантов осуществления способ лечения рака желчных протоков включает или состоит, по существу, из введения нуждающемуся в этом пациенту в течение периода времени комбинированного терапевтического средства, содержащего, или состоящего, по существу, или состоящего из терапевтически эффективных количеств, независимо или в комбинации, (a) ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, где биниметиниб вводят перорально дважды в сутки в количестве от приблизительно 10 мг до приблизительно 100 мг (например, включая любые поддиапазоны или значения в диапазоне, представленном в настоящем описании, например, приблизительно 30 мг или приблизительно 45 мг) в течение периода времени, и (b) фторпиримидин-содержащего терапевтического средства, являющегося капецитабином, где капецитабин вводят перорально дважды в сутки в количестве приблизительно 1000 мг/м2 или приблизительно 1250 мг/м2 (например, включая любые поддиапазоны или значения в диапазоне, представленном в настоящем описании) в течение периода времени. В одном из вариантов осуществления биниметиниб вводят дважды в сутки в течение двух недель с последующей одной неделей периода покоя в течение трехнедельного периода. В одном из вариантов осуществления капецитабин вводят перорально дважды в сутки в течение двух недель с последующей одной неделей периода покоя в течение трехнедельного периода. В одном из вариантов осуществления каждый из биниметиниба и капецитабина вводят дважды в сутки в течение двух недель с последующей одной неделей периода покоя в течение трехнедельного периода, где введение биниметиниба и капецитабина осуществляют в течение того же двухнедельного периода. В одном из вариантов осуществления пациента ранее лечили с использованием одного или более терапевтических средств, например, по меньшей мере одного лечения с использованием другой противоопухолевой терапии, до периода времени. В одном из вариантов осуществления количества биниметиниба и капецитабина совместно приводят к синергическому эффекту при лечении злокачественного новообразования (например, в течение периода времени). В одном из вариантов осуществления индивидуума ранее лечили с использованием одной или более предшествующих терапий, например, одного или более терапевтических средств, например, по меньшей мере одного лечения с использованием другой противоопухолевой терапии, до периода времени.
[00120] В одном из вариантов осуществления способ лечения рака желчных протоков включает или состоит, по существу, из введения нуждающемуся в этом пациенту в течение периода времени комбинированного терапевтического средства, содержащего, или состоящего, по существу, или состоящего из терапевтически эффективных количеств, независимо или в комбинации, (a) ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, где биниметиниб вводят перорально дважды в сутки в количестве приблизительно 15 мг в течение периода времени, и (b) фторпиримидин-содержащего терапевтического средства, являющегося капецитабином, где капецитабин вводят перорально дважды в сутки в количестве приблизительно 1000 мг/м2. В одном из вариантов осуществления биниметиниб и капецитабин вводят в течение двух недель с последующим однонедельным периодом покоя, в течение которого биниметиниб и капецитабин не вводят, в течение трехнедельного периода. В одном из вариантов осуществления индивидуума ранее лечили с использованием одной или более предшествующих терапий, например, одного или более терапевтических средств, например, по меньшей мере одного лечения с использованием другой противоопухолевой терапии, до периода времени.
[00121] В одном из вариантов осуществления способ лечения рака желчных протоков включает или состоит, по существу, из введения нуждающемуся в этом пациенту в течение периода времени комбинированного терапевтического средства, содержащего, или состоящего, по существу, или состоящего из терапевтически эффективных количеств, независимо или в комбинации, (a) ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, где биниметиниб вводят перорально дважды в сутки в количестве приблизительно 30 мг в течение периода времени, и (b) фторпиримидин-содержащего терапевтического средства, являющегося капецитабином, где капецитабин вводят перорально дважды в сутки в количестве приблизительно 1000 мг/м2. В одном из вариантов осуществления биниметиниб и капецитабин вводят в течение двух недель с последующим однонедельным периодом покоя, в течение которого биниметиниб и капецитабин не вводят, в течение трехнедельного периода. В одном из вариантов осуществления индивидуума ранее лечили с использованием одной или более предшествующих терапий, например, одного или более терапевтических средств, например, по меньшей мере одного лечения с использованием другой противоопухолевой терапии, до периода времени.
[00122] В одном из вариантов осуществления способ лечения рака желчных протоков включает или состоит, по существу, из введения нуждающемуся в этом пациенту в течение периода времени комбинированного терапевтического средства, содержащего, или состоящего, по существу, или состоящего из терапевтически эффективных количеств, независимо или в комбинации, (a) ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, где биниметиниб вводят перорально дважды в сутки в количестве приблизительно 30 мг в течение периода времени, и (b) фторпиримидин-содержащего терапевтического средства, являющегося капецитабином, где капецитабин вводят перорально дважды в сутки в количестве приблизительно 1250 мг/м2. В одном из вариантов осуществления биниметиниб и капецитабин вводят в течение двух недель с последующим однонедельным периодом покоя, в течение которого биниметиниб и капецитабин не вводят, в течение трехнедельного периода. В одном из вариантов осуществления индивидуума ранее лечили с использованием одной или более предшествующих терапий, например, одного или более терапевтических средств, например, по меньшей мере одного лечения с использованием другой противоопухолевой терапии, до периода времени.
[00123] В одном из вариантов осуществления настоящее изобретение относится к способу лечения рака желчных протоков, включающему или состоящему, по существу, из введения нуждающемуся в этом пациенту, в течение периода времени комбинированного терапевтического средства, содержащего, или состоящего, по существу, или состоящего из количества ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, и количества фторпиримидин-содержащего терапевтического средства, эффективного при лечении рака желчных протоков. В другом варианте осуществления настоящее изобретение относится к способу комбинированного лечения, состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, и фторпиримидин-содержащего терапевтического средства. В другом варианте осуществления настоящее изобретение относится к способу лечения рака желчных протоков, включающему или состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени комбинированного терапевтического средства, содержащего, или состоящего, по существу, или состоящего из количества ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, и количества фторпиримидин-содержащего терапевтического средства, где количества совместно приводят к синергическому эффекту при лечении злокачественного новообразования (например, в течение периода времени). В другом варианте осуществления настоящее изобретение относится к способу комбинированного лечения, состоящему, по существу, из введения нуждающемуся в этом пациенту в течение периода времени ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, и фторпиримидин-содержащего терапевтического средства, где количества обеспечивают синергический эффект (например, in vivo или in vitro, например, в подходящей модельной линии клеток или модели на животных). В одном из вариантов осуществления способ или применение по изобретению относятся к синергическому комбинированному терапевтическому средству, состоящему, по существу, из ингибитора MEK, являющегося биниметинибом или его фармацевтически приемлемой солью, в комбинации с фторпиримидин-содержащим терапевтическим средством. В одном из аспектов всех вариантов осуществления из этого абзаца фторпиримидин-содержащее терапевтическое средство является капецитабином.
[00124] Специалисты в этой области могут известными способами определять подходящее количество, дозу или дозировку каждого соединения, используемого в комбинации по настоящему изобретению, для введения пациенту с учетом таких факторов, как возраст, масса, общее состояние здоровья, вводимое соединение, путь введения, природа и стадия злокачественного новообразования, требующего лечения, и наличие других лекарственных средств.
[00125] Способ по настоящему изобретению можно осуществлять на практике посредством различных схем введения или дозирования. Соединения из комбинации по настоящему изобретению можно вводить одновременно, последовательно или поочередно и в любом порядке.
[00126] При необходимости, для достижения желаемого эффекта схемы введения или дозирования можно повторять. В рамках изобретения "схема непрерывного дозирования" представляет собой схему введения или дозирования без прерывания дозы, например, без дней без лечения. Повторение 21- или 28-дневных циклов лечения без прерывания дозы между циклами лечения является примером непрерывной схемы дозирования. В варианте осуществления один или оба компонента комбинации по настоящему изобретению можно вводить в схеме непрерывного дозирования. В рамках изобретения "схема прерывистого дозирования" представляет собой схему введения или дозирования с прерыванием доз. Например, в одном из вариантов осуществления схема прерывистого дозирования включает введение одного или более компонентов комбинированного терапевтического средства в течение двух недель с последующей одной неделей периода покоя в трехнедельном цикле.
[00127] В одном из вариантов осуществления любой из схем дозирования комбинированного терапевтического средства, как представлено в настоящем описании, вторую терапевтически эффективную дозу ингибитора MEK вводят через приблизительно 12 часов после введения первой дозы ингибитора MEK в течение периода времени. В рамках изобретения фраза "через приблизительно 12 часов после введения первой дозы ингибитора MEK" означает, что вторую дозу ингибитора MEK вводят через 10-14 часов после введения первой дозы ингибитора MEK в течение периода времени.
[00128] В одном из вариантов осуществления любой из схем дозирования комбинированного терапевтического средства, как представлено в настоящем описании, вторую терапевтически эффективную дозу фторпиримидин-содержащего терапевтического средства вводят через приблизительно 12 часов после введения первой дозы фторпиримидин-содержащего терапевтического средства в течение периода времени. В рамках изобретения фраза "через приблизительно 12 часов после введения первой дозы фторпиримидин-содержащего терапевтического средства" означает, что вторую дозу фторпиримидин-содержащего терапевтического средства вводят через 10-14 часов после введения первой дозы фторпиримидин-содержащего терапевтического средства в течение периода времени.
[00129] В одном из вариантов осуществления любой из схем дозирования комбинированного терапевтического средства, как представлено в настоящем описании, первую терапевтически эффективную дозу фторпиримидин-содержащего терапевтического средства вводят одновременно с терапевтически эффективным количеством первой терапевтически эффективной дозы ингибитора MEK. В одном из вариантов осуществления любой из схем дозирования комбинированного терапевтического средства, как представлено в настоящем описании, вторую терапевтически эффективную дозу фторпиримидин-содержащего терапевтического средства вводят одновременно с терапевтически эффективным количеством второй терапевтически эффективной дозы ингибитора MEK.
[00130] В одном из вариантов осуществления любой из схем дозирования комбинированного терапевтического средства, как представлено в настоящем описании, первую терапевтически эффективную дозу фторпиримидин-содержащего терапевтического средства вводят через по меньшей мере 5 минут после введения терапевтически эффективного количества первой терапевтически эффективной дозы ингибитора MEK. В рамках изобретения фраза "через по меньшей мере 5 минут" означает, что фторпиримидин-содержащее терапевтическое средство вводят в течение периода времени через по меньшей мере 5 минут, или по меньшей мере 10 минут, или по меньшей мере 15 минут, или по меньшей мере 20 минут, или по меньшей мере 25 минут, или по меньшей мере 30 минут, или по меньшей мере 35 минут, или по меньшей мере 40 минут, или по меньшей мере 45 минут, или по меньшей мере 50 минут, или по меньшей мере 55 минут, или по меньшей мере 60 минут, или по меньшей мере 65 минут, или по меньшей мере 70 минут, или по меньшей мере 75 минут, или по меньшей мере 80 минут, или по меньшей мере 85 минут, или по меньшей мере 90 минут после введения первой дозы ингибитора MEK в течение периода времени.
[00131] В одном из вариантов осуществления любой из схем дозирования комбинированного терапевтического средства, как представлено в настоящем описании, первую эффективную дозу терапевтически эффективной дозы вводят за по меньшей мере 5 минут до введения первой терапевтически эффективной дозы ингибитора MEK в течение периода времени. В рамках изобретения, фраза "через по меньшей мере 5 минут" означает, что фторпиримидин-содержащее терапевтическое средство вводят в течение периода времени за по меньшей мере 5 минут, или по меньшей мере 10 минут, или по меньшей мере 15 минут, или по меньшей мере 20 минут, или по меньшей мере 25 минут, или по меньшей мере 30 минут, или по меньшей мере 35 минут, или по меньшей мере 40 минут, или по меньшей мере 45 минут, или по меньшей мере 50 минут, или по меньшей мере 55 минут, или по меньшей мере 60 минут, или по меньшей мере 65 минут, или по меньшей мере 70 минут, или по меньшей мере 75 минут, или по меньшей мере 80 минут, или по меньшей мере 85 минут, или по меньшей мере 90 минут до введения первой дозы ингибитора MEK в течение периода времени.
[00132] В одном из вариантов осуществления дозу ингибитора MEK повышают в течение периода времени до достижения максимальной переносимой дозы, и фторпиримидин-содержащее терапевтическое средство вводят в фиксированной дозе в течение периода времени. Альтернативно, ингибитор MEK можно вводить в фиксированной дозе в течение периода времени, и дозу фторпиримидин-содержащего терапевтического средства можно повышать до достижения максимальной переносимой дозы в течение периода времени.
[00133] В одном из вариантов осуществления любое комбинированное лечение, представленное в настоящем описании, может дополнительно включать введение одного или более премедикационных средств перед введением фторпиримидин-содержащего терапевтического средства в течение периода времени. В одном из вариантов осуществления одно или более премедикационных средств вводят в течение периода времени не раньше, чем через 1 час после введения ингибитора MEK. В одном из вариантов осуществления одно или более премедикационных средств вводят за 30-60 минут до введения фторпиримидин-содержащего терапевтического средства в течение периода времени. В одном из вариантов осуществления одно или более премедикационных средств вводят за 30 минут до введения фторпиримидин-содержащего терапевтического средства в течение периода времени. В одном из вариантов осуществления одно или более премедикационных средств выбраны из одного или более из противодиарейных средств (например, лоперамида), антагониста H1 (например, антигистаминных средств, таких как дифенгидрамин) и ацетаминофена.
[00134] В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени, представляет собой или включает химиотерапевтическое средство. В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени, представляет собой или включает химиотерапевтическое средство на основе платины. В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени, представляет собой или включает фторпиримидин-содержащее химиотерапевтическое средство (например, в качестве монотерапии). В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени, представляет собой или включает гемцитабин. В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени, представляет собой или включает FOLFIRINOX (схема химиотерапии фолиновой кислотой (лейковорином), 5-FU (5-FU), иринотеканом и оксалиплатином). В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени, представляет собой или включает FOLFOXIRI. В одном из вариантов осуществления одно или более терапевтических средств, вводимых пациенту до периода времени представляет собой или включает таргетированное терапевтическое средство.
[00135] Улучшение злокачественного новообразования или связанного со злокачественным новообразованием заболевания можно охарактеризовывать как полный или частичный ответ. Термин "полный ответ" или "CR" относится к отсутствию клинически детектируемого заболевания с нормализацией любых ранее аномальных рентгенографических показателей, костного мозга и спинномозговой жидкости (CSF) или измерений аномального моноклонального белка. Термин "частичный ответ" относится к снижению по меньшей мере на приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% всей измеримой опухолевой массы (т.е. количества злокачественных клеток, присутствующих у индивидуума, или измеряемой совокупности опухолевых масс или количества аномального моноклонального белка) в отсутствие новых очагов.
[00136] Лечение можно оценивать с использованием одной или более клинических конечных точек, например, помимо прочего, по ингибированию прогрессирования заболевания, ингибированию роста опухоли, уменьшению первичной опухоли, облегчению связанных с опухолью симптомов, ингибированию секретируемых опухолью факторов (включая уровни экспрессии белков контрольных точек, как определено в настоящем описании), задержке возникновения первичных или вторичных опухолей, замедлению развития первичных или вторичных опухолей, снижению возникновения первичных или вторичных опухолей, замедлению или снижению тяжести вторичных эффектов заболевания, прекращению роста опухоли и регрессированию опухолей, повышению времени до прогрессирования (TTP), улучшению времени до ответа опухоли (TTR), повышению длительности ответа (DR), повышению выживаемости без прогрессирования (PFS), повышению общей выживаемости (OS), частоты объективных ответов (ORR). В рамках изобретения термин "OS" означает время от начала лечения до смерти по любой причине. В рамках изобретения термин "TTP" означает время от начала лечения до прогрессирования опухоли; TTP не включает смерть. В рамках изобретения TTR определяют для пациентов с подтвержденным объективным ответом (CR или PR) как время от даты рандомизации или даты введения первой дозы исследуемого лечения до первого задокументированного объективного ответа опухоли. В рамках изобретения термин "DR" означает время от задокументированного ответа опухоли до прогрессирования заболевания. В рамках изобретения термин "PFS" означает время от начала лечения до прогрессирования опухоли или смерти. В рамках изобретения термин "ORR" означает долю пациентов с уменьшением размера опухоли на заранее определенную величину и в течение минимального периода времени, где длительность ответа, как правило, измеряют от времени исходного ответа до задокументированного прогрессирования опухоли. В исключительном случае, полное ингибирование обозначают в настоящем описании как профилактику или химиопрофилактику.
[00137] Таким образом, настоящее изобретение относится к способам достижения одной или более клинических конечных точек, ассоциированных с лечением злокачественного новообразования с использованием комбинированного лечения, представленного в настоящем описании. В одном из вариантов осуществления у пациента, представленного в настоящем описании, могут наблюдать положительный ответ опухоли, такой как ингибирование роста опухоли или уменьшение размера опухоли, после лечения с использованием комбинации, представленной в настоящем описании. В определенных вариантах осуществления пациент, представленный в настоящем описании, может достигать полного ответа, частичного ответа или стабильного заболевания в соответствии с Критериями оценки ответов солидных опухолей (например, RECIST 1.1) после введения эффективного количества комбинированного терапевтического средства, представленного в настоящем описании. В определенных вариантах осуществления у пациента, представленного в настоящем описании, могут наблюдать повышенную выживаемость без прогрессирования опухоли. В некоторых вариантах осуществления у пациента, представленного в настоящем описании, могут наблюдать, помимо прочего, ингибирование прогрессирования заболевания, ингибирование роста опухоли, уменьшение первичной опухоли, облегчение связанных с опухолью симптомов, ингибирование секретируемых опухолью факторов (включая секретируемые опухолью гормонов, таких как гормоны, вовлеченные в карцинондный синдром), задержку возникновения первичных или вторичных опухолей, задержку развития первичных или вторичных опухолей, снижение возникновения первичных или вторичных опухолей, замедление или снижение тяжести вторичных эффектов заболевания, прекращение роста опухоли и регрессирование опухолей, снижение времени до ответа опухоли (TTR), повышение длительности ответа (DR), повышение выживаемости без прогрессирования (PFS), повышение времени до прогрессирования (TTP) и/или повышение общей выживаемости (OS).
[00138] В другом варианте осуществления настоящее изобретение относится к способам уменьшения времени до ответа опухоли (TTR), повышения длительности ответа (DR), повышения выживаемости без прогрессирования (PFS) у пациента, имеющего злокачественное новообразование, представленное в настоящем описании, включающим введение эффективного количества комбинированного терапевтического средства, как представлено в настоящем описании. В одном из вариантов осуществления настоящее изобретение относится к способу снижения времени до ответа опухоли (TTR) у пациента, имеющего злокачественное новообразование, представленное в настоящем описании, включающему введение эффективного количества комбинированного терапевтического средства, как представлено в настоящем описании. В одном из вариантов осуществления настоящее изобретение относится к способу повышения выживаемости без прогрессирования (PFS) у пациента, имеющего злокачественное новообразование, представленное в настоящем описании, включающему введение эффективного количества комбинированного терапевтического средства, как представлено в настоящем описании. В одном из вариантов осуществления настоящее изобретение относится к способу повышения выживаемости без прогрессирования (PFS) у пациента, имеющего злокачественное новообразование, представленное в настоящем описании, включающему введение эффективного количества комбинированного терапевтического средства, как представлено в настоящем описании.
[00139] В одном из вариантов осуществления способы лечения рака желчных протоков по изобретению также включают хирургическое вмешательство или лучевую терапию. Неограничивающие примеры хирургического вмешательства включают, например, открытое хирургическое вмешательство или минимально инвазивное хирургическое вмешательство. Хирургическое вмешательство может включать, например, удаление целой опухоли, циторедукцию опухоли или удаление опухоли, вызывающей боль или ощущение давления у индивидуума. В этой области известны способы осуществления открытого хирургического вмешательства и минимально инвазивного хирургического вмешательства в отношении индивидуума, имеющего злокачественное новообразование. Неограничивающие примеры лучевой терапии включают наружную дистанционную лучевую терапию (например, наружную дистанционную лучевую терапию с использованием киловольтного рентгеновского излучения или мегавольтного рентгеновского излучения) или внутреннюю лучевую терапию. Внутренняя лучевая терапия (также называемая брахитерапией) может включать использование, например, низкодозовой внутренней лучевой терапии или высокодозовой внутренней лучевой терапии. Низкодозовая внутренняя лучевая терапия включает, например, введение небольших радиоактивных пеллетов (также называемых "зернами") в злокачественную ткань индивидуума или вблизи нее. Высокодозовая внутренняя лучевая терапия включает, например, введение тонкой трубки (например, катетера) или имплантата в злокачественную ткань индивидуума или вблизи нее и подачу высокой дозы радиации к тонкой трубке или имплантату с использованием устройства-источника излучения. В этой области известны способы осуществления лучевой терапии в отношении индивидуума, имеющего злокачественное новообразование.
[00140] С помощью известных тестовых моделей можно показать, что комбинированное лечение, представленное в настоящем описании, приводит к благоприятным эффектам, представленным в настоящем описании выше. Специалист в этой области может выбирать соответствующую тестовую модель для подтверждения таких благоприятных эффектов. Фармакологическую активность комбинированного лечения, представленного в настоящем описании, например, можно продемонстрировать на модели на животных и/или в клиническом исследовании или тестировании, например, как описано ниже.
[00141] Подходящими клиническими исследованиями являются, например, открытые исследования с повышением дозы на пациентах с раком желчных протоков. В таких исследованиях можно продемонстрировать, в частности, синергизм терапевтических средств из комбинированного терапевтического средства, представленного в настоящем описании. Благоприятный эффект в отношении пролиферативных заболеваний можно определять непосредственно с помощью результатов этих исследований. Такие исследования, в частности, могут подходить для сравнения эффектов монотерапии с использованием ингибитора MEK и/или фторпиримидин-содержащего терапевтического средства и эффектов комбинированного лечения, включающего ингибитор MEK и фторпиримидин-содержащее терапевтическое средство.
[00142] Эффективность лечения можно определять в таких исследованиях, например, через 6, 12, 18 или 24 недель, посредством оценки баллов симптомов, например, каждые 6 недель.
[00143] В некоторых вариантах осуществления любых из способов по настоящему изобретению пациента определяют как имеющего опухоль или злокачественную клетку, имеющую нерегулируемый уровень MEK, мутантный MEK, имеющий повышенную активность по сравнению с MEK дикого типа, положительно регулируемый уровень киназы, вышележащей относительно киназы MEK (например, Ras (KRAS, HRAS и/или NRAS) и/или Raf), или мутантную киназу, вышележащую относительно MEK (например, Ras и/или Raf), имеющую повышенную активность по сравнению с соответствующей киназой дикого типа, вышележащей относительно MEK.
[00144] В некоторых вариантах осуществления мутантная MEK, имеющая повышенную активность по сравнению с MEK дикого типа, может иметь, например, одну или более замен аминокислот в положениях аминокислот, выбранных из группы 56 (например, Q56P) и 72 (например, S72G).
[00145] В некоторых вариантах осуществления мутантная KRAS, имеющая повышенную активность по сравнению с KRAS дикого типа, может иметь, например, одну или более замен аминокислот в положениях аминокислот 12 (например, G12A, G12R, G12S, G12C, G12D или G12V), 13 (например, G13D или G13C).
[00146] В некоторых вариантах осуществления мутантная HRAS, имеющая повышенную активность по сравнению с HRAS дикого типа, может иметь, например, одну или обе из замен аминокислот в положениях аминокислот 12 (например, G12V) и 61 (например, Q61L или Q61R).
[00147] В некоторых вариантах осуществления мутантная NRAS, имеющая повышенную активность по сравнению с NRAS дикого типа, может иметь, например, замену аминокислоты в одном или более из положений аминокислот 12 (например, G12D, G12S или G12V), 13 (например, G13R или G13V) и 61 (например, Q61H, Q61K, Q61L или Q61R).
[00148] В некоторых вариантах осуществления мутантная BRAF, имеющая повышенную активность по сравнению с BRAF дикого типа, может иметь, например, замену аминокислоты в положении аминокислоты 600 (например, V600E или V600K).
[00149] В некоторых вариантах осуществления любых из способов по настоящему изобретению пациента определяют как имеющего опухоль или злокачественную клетку, имеющею нерегулируемый уровень EGFR (например, по сравнению с незлокачественной клеткой) или мутантный EGFR, имеющий повышенную активность по сравнению с EGFR дикого типа.
[00150] В некоторых вариантах осуществления мутантный EGFR, имеющий повышенную активность по сравнению с EGFR дикого типа, может иметь, например, замену аминокислоты в положении аминокислоты 719, замену аминокислоты в положении аминокислоты 731 (например, W731L), замену аминокислоты в положении аминокислоты 734 (например, E734Q), замену аминокислоты в положении аминокислоты 785 (например, T785A), замену аминокислоты в положении аминокислоты 790 (например, T790M), замену аминокислоты в положении аминокислоты 797 (например, C797Y), замену аминокислоты в положении аминокислоты 801 (например, Y801H), замену аминокислоты в положении аминокислоты 831 (например, L831H), замену аминокислоты в положении аминокислоты 858 (например, L858R), замену аминокислоты в положении аминокислоты 861 (например, L861Q) и замену аминокислоты в положении аминокислоты 868 (например, E868G).
[00151] Способы детекции повышенного уровня MEK, Ras, Raf и/или EGFR или экспрессии мутантных MEK, Ras, Raf и/или EGFR, имеющих повышенную активность по сравнению с соответствующей киназой дикого типа в опухоли (например, биоптате) или злокачественной клетке, известны в этой области и включают, например, секвенирование нуклеиновых кислот (например, ПЦР), флуоресцентную гибридизацию in situ (FISH) с использованием меченного ДНК-зонда, иммунофлуоресцентную микроскопию, иммуноблоттинг, протеомные анализы, масс-спектрометрию и активируемую флуоресценцией сортировку клеток. В этой области известны дополнительные способы детекции повышенного уровня MEK, Ras, Raf и/или EGFR или экспрессии мутантных MEK, Ras, Raf и/или EGFR, имеющих повышенную активность по сравнению с соответствующей киназой дикого типа в опухоли (например, биоптате) или злокачественной клетке.
[00152] Некоторые варианты осуществления любых из способов по настоящему изобретению дополнительно включают идентификацию пациента как имеющего опухоль или злокачественную клетку, имеющую повышенный уровень MEK, Ras, Raf и/или EGFR или экспрессирующую мутантные MEK, Ras, Raf и/или EGFR, имеющие повышенную активность по сравнению с соответствующей киназой дикого типа, и выбор идентифицированного пациента для лечения любыми из способов, представленных в настоящем описании. Некоторые варианты осуществления любых из способов по настоящему изобретению могут дополнительно включать стадию выбора индивидуума, идентифицированного как имеющего опухоль или злокачественную клетку, имеющею повышенный уровень MEK, Ras, Raf и/или EGFR или экспрессирующую мутантные MEK, Ras, Raf и/или EGFR, имеющие повышенную активность по сравнению с соответствующей киназой дикого типа, и лечение пациента любыми из способов, представленных в настоящем описании.
[00153] В некоторых вариантах осуществления злокачественное новообразование выбрано из группы, состоящей из: рака поджелудочной железы, рака молочной железы (например, трижды негативного рака молочной железы), лимфомы из клеток мантийной зоны, немелкоклеточного рака легких, меланомы, рака толстого кишечника, рака пищевода, липосаркомы, множественной миеломы, T-клеточного лейкоза, почечноклеточной карциномы, рака желудка, глиобластомы, печеночноклеточной карциномы, рака легких, колоректального рака, рабдоидной опухоли, злокачественных новообразований, положительных по белку ретинобластомы, рака желчного пузыря, холангиокарциномы (например, внутрипеченочной холангиокарциномы и внепеченочной холангиокарциномы), рака фатерова соска, астроцитом, мультиформной глиобластомы, синдрома Баннаяна-Зонана, болезни Коудена, болезни Лермитта-Дюкло, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака головы и шеи, рака почки, рака яичников, рака предстательной железы, саркомы, остеосаркомы, гигантоклеточной опухоли костей, рака щитовидной железы, хронического миелогенного лейкоза, хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, острого миелогенного лейкоза, AML, хронического нейтрофильного лейкоза, плазмоцитомы, иммунобластного крупноклеточного лейкоза, лейкоза из клеток мантийной зоны, мегакариобластного лейкоза, острого мегакариоцитарного лейкоза, промиелоцитарного лейкоза, эритролейкоза, злокачественной лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, лимфобластной T-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, уротелиального рака, рака легких, рака женских наружных половых органов, рака шейки матки, рака эндометрия, рака почки, мезотелиомы, рака слюнных желез, рака носоглотки, рака слизистой оболочки щек, рака ротовой полости, GIST (стромальной опухоли желудочно-кишечного тракта), NSCLC и рака яичка. В некоторых вариантах осуществления злокачественное новообразование является злокачественным новообразованием с инфильтрацией T-клетками.
[00154] В некоторых вариантах осуществления злокачественное новообразование выбрано из группы, состоящей из: немелкоклеточного рака легких, рака желчных протоков, рака молочной железы, рака мочевого пузыря, рака шейки матки, злокачественной мезотелиомы, рака яичников и рака поджелудочной железы.
[00155] Соединения из способа или комбинации по настоящему изобретению можно составлять перед введением. Предпочтительно, состав будут адаптировать к конкретному способу введения. Эти соединения можно составлять с фармацевтически приемлемыми носителями, как известно в этой области, и вводить в виде широкого спектра лекарственных форм, известных в этой области. При получении фармацевтических композиций по настоящему изобретению активный ингредиент, как правило, будут смешивать с фармацевтически приемлемым носителем, или разводить носителем, или заключать в носитель. Такие носители включают, в качестве неограничивающих примеров, твердые дилюенты или наполнители, эксципиенты, стерильные водные среды и различные нетоксичные органические растворители. Стандартные лекарственные формы или фармацевтические композиции включают таблетки, капсулы, такие как желатиновые капсулы, пилюли, порошки, гранулы, водные и неводные пероральные растворы и суспензии, пастилки, троше, леденцы, спреи, кремы, слизи, суппозитории, желе, гели, пасты, лосьоны, мази, инъецируемые растворы, эликсиры, сиропы и парентеральные растворы, упакованные в контейнерах, адаптированных для разделения на отдельные дозы.
[00156] Парентеральные составы включают фармацевтически приемлемые водные или неводные растворы, дисперсии, суспензии, эмульсии и стерильные порошки для их получения. Примеры носителей включают воду, этанол, полиолы (пропиленгликоль, полиэтиленгликоль), растительные масла и инъецируемые органические сложные эфиры, такие как этилолеат. Текучесть можно поддерживать с помощью покрытия, такого как лецитин, поверхностно-активное вещество, или поддержания подходящего размера частиц. Примеры форм для парентерального введения включают растворы или суспензии соединений по изобретению в стерильных водных растворах, например, водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы, при желании, можно соответствующим образом забуферивать.
[00157] Кроме того, для таблетирования зачастую используют смазочные средства, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции схожего типа также можно использовать в мягких и твердых желатиновых капсулах. В этом случае предпочтительные материалы включают лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Если для перорального введения желательными являются водные суспензии или эликсиры, активное соединение в нем можно комбинировать с различными подсластителями или ароматизаторами, красителями и, при желании, эмульгаторами или суспендирующими средствами вместе с дилюентами, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации.
[00158] Специалисту в этой области известны или очевидны способы получения различных фармацевтических композиций с конкретным количеством активного соединения.
[00159] В одном из вариантов осуществления ингибитор MEK, являющийся биниметинибом или его фармацевтически приемлемой солью, составляют для перорального введения. В одном из вариантов осуществления ингибитор MEK составляют в виде таблетки или капсулы. В одном из вариантов осуществления ингибитор MEK составляют в виде таблетки. В одном из вариантов осуществления таблетка является таблеткой с покрытием. В одном из вариантов осуществления ингибитор MEK является биниметинибом в виде свободного основания. В одном из вариантов осуществления ингибитор MEK является фармацевтически приемлемой солью биниметиниба. В одном из вариантов осуществления ингибитор MEK является кристаллизованным биниметинибом. Способы получения пероральных составов биниметиниба описаны в публикации PCT № WO 2014/063024. В одном из вариантов осуществления состав таблетки биниметиниба содержит 15 мг биниметиниба. В одном из вариантов осуществления состав таблетки биниметиниба содержит 15 мг кристаллизованного биниметиниба. В одном из вариантов осуществления состав таблетки биниметиниба содержит 45 мг биниметиниба. В одном из вариантов осуществления состав таблетки биниметиниба содержит 45 мг кристаллизованного биниметиниба.
[00160] Изобретение также относится к набору, содержащему терапевтические средства из комбинации по настоящему изобретению и письменные инструкции по введению терапевтических средств. В одном из вариантов осуществления в письменных инструкциях тщательно разбирают и описывают способы введения терапевтических средств, например, для одновременного или последовательного введения терапевтических средств по настоящему изобретению. В одном из вариантов осуществления в письменных инструкциях тщательно разбирают и описывают способы введения терапевтических средств, например, посредством определения дней введения для каждого из терапевтических средств в течение 28-дневного цикла.
[00161] Хотя представленные идеи описаны со ссылкой на различное применение, способы, наборы и композиции, следует понимать, что различные изменения и модификации можно осуществлять без отклонения от идей, представленных в настоящем описании, и описываемого в заявке изобретения. Описанные выше примеры представлены для лучшего иллюстрирования описываемых идей, и не предназначены для ограничения объема идей, представленных в настоящем описании. Хотя представленные идеи описаны в терминах этих примеров вариантов осуществления, специалистам в этой области будет понятно, что возможны многочисленные варианты и модификации этих примеров вариантов осуществления без излишнего экспериментирования. Все такие варианты и модификации входят в объем идей по настоящему изобретению.
[00162] Все цитируемые в настоящем описании ссылки, включая патенты, патентные заявки, статьи, справочные материалы и т.п., и цитируемые в них ссылки, если это еще не сделано, включены, таким образом, в настоящее описание в качестве ссылки в полном объеме. В случае если один или более из включенных литературных источников и схожих материалов отличаются или противоречат настоящей заявке, включая, в качестве неограничивающих примеров, определенные термины, использование терминов, описанные способы или т.п., настоящая заявка обладает приоритетом.
[00163] В представленном выше описании и примерах подробно описаны некоторые конкретные варианты осуществления изобретения и лучший способ осуществления, предусмотренный авторами настоящего изобретения. Однако следует понимать, что, независимо от того, насколько подробным является представленный выше текст, настоящее изобретение можно осуществлять на практике множеством способов, и настоящее изобретение следует рассматривать в соответствии с формулой изобретения и любыми ее эквивалентами.
ПРИМЕРЫ
Пример 1
Доклиническое исследование
[00164] Эффект биниметиниба, 5-фторурацила (5-FU) или комбинации этих лекарственных средств в отношении жизнеспособности клеток оценивали с использованием восьми линий клеток BTC (SNU245, SNU308, SNU478, SNU869, SNU1079, SNU1196, TFK1 и HuCCT1). Т.к. капецитабин превращается в 5-FU in vivo, в этом доклиническом исследовании на линиях клеток 5-FU использовали в качестве эквивалента in vivo перорального введения капецитабина. В кратком изложении, конфлюэнтные монослои, выращенные в 96-луночных планшетах, подвергали воздействию лекарственных средств в течение 72 часов. Затем измеряли жизнеспособность клеток при 540 нм с помощью спектрофотометра для чтения микропланшетов Multiskan GO с использованием коммерчески доступного анализа MTT по инструкциям производителя. Для оценки комбинированного эффекта использовали способ Чоу-Талалая. Клетки также обрабатывали лекарственными средствами в течение 48 часов и определяли экспрессию тимидилатсинтазы (TS), лиганда программируемой гибели 1 (PD-L1) и β-актина с использованием анализа вестерн-блоттинга по опубликованному протоколу. Актин включали в качестве контроля нагрузки.
[00165] Подвергание линий клеток BTC воздействию биниметиниба ассоциировано со значительным снижением жизнеспособности клеток (фиг. 1A). Комбинация биниметиниба и 5-FU в SNU245, SNU1196, SNU869 и HuCCT1 демонстрировала синергический эффект (показатель аддитивности <1 в пораженной фракции=0,5; фиг. 1B). Из этих линий клеток, SNU869 и HuCCT1 имели мутацию KRAS (G12D). Для оценки основополагающего синергического механизма оценивали экспрессию белка посредством вестерн-блоттинга. Тимидилатсинтаза (TS), маркер резистентности 5-FU, подвергалась положительной регуляции при обработке 5-FU. Однако TS подвергалась отрицательной регуляции при монотерапии биниметинибом (фиг. 1C). Если клетки BTC обрабатывали и биниметинибом, и 5-FU, уровни TS, индуцируемые 5-FU, также подвергались отрицательной регуляции при добавлении биниметиниба, который может повышать чувствительность к 5-FU. Примечательно, что 5-FU индуцировал экспрессию PD-L1, и совместное введение биниметиниба и 5-FU снижало эту экспрессию (фиг. 1C).
Пример 2
Исследование фазы Ib биниметиниба (MEK162) в комбинации с капецитабином при раке желчных протоков на поздней стадии, ранее подвергавшемуся лечению гемцитабином
[00166] Известно, что при раке желчных протоков (BTC) путь RAS/RAF/MEK/ERK имеет повышенную активность (например, по сравнению с незлокачественной клеткой) в до 20-40% случаев. Биниметиниб (MEK162) является аллостерическим ингибитором MEK1/2, демонстрировавшим доклиническую активность при BTC. Ингибитор MEK и 5-FU демонстрировали синергический эффект в клетках BTC.
[00167] Используя доклинические результаты (пример 1), для оценки безопасности и ранней противоопухолевой активности проводили исследование фазы Ib биниметиниба и капецитабина на пациентах с BTC, ранее подвергавшихся лечению гемцитабином. Кроме того, идентифицировали генетические изменения пути RAS/RAF/MEK/ERK и определяли концентрации биомаркеров в плазме.
[00168] ДИЗАЙН ИССЛЕДОВАНИЯ
[00169] Исследование фазы Ib с использованием биниметиниба и капецитабина проводили на пациентах с BTC на поздней стадии, которых ранее лечили с помощью химиотерапии на основе гемцитабина. Это исследование состояло из части повышения дозы (DE) и части исследования стабильной дозы (EX). Первичной конечной точкой части DE являлось определение MTD, и вторичные конечные точки включали определение дозолимитирующей токсичности (DLT), RP2D и безопасности. Биниметиниб (B) и капецитабин (C) вводили дважды в сутки, 2 недели введения/1 неделя перерыва, каждые 3 недели. В части повышения дозы тестировали 3 уровня доз (DL) (DL1: 1000 мг/м2 C и 15 мг B; DL2: 1000 мг/м2 C и 30 мг B; DL3: C 1250 мг/м2 и 30 мг B) в соответствии с "дизайном 3+3". Первичной конечной точкой части EX исследования являлось определение 3-месячной выживаемости без прогрессирования (PFS), и вторичными конечными точками являлись частота объективного ответа (ORR), длительность ответа, частота контроля заболевания (DCR), PFS, общая выживаемость (OS), безопасность, качество жизни (QOL) и количественный анализ биомаркеров.
[00170] Пациенты
[00171] В часть повышения дозы в исследовании включали 9 пациентов (3 на DL). Целевой популяцией в этом исследовании являлись пациенты с BTC в условиях терапии второй или третьей линии, в случае которых химиотерапия на основе гемцитабина первой линии являлась неэффективной. Основными критериями включениями являлись возраст ≥20 лет; гистологически подтвержденный BTC, включая внутрипеченочную холангиокарциному, внепеченочную холангиокарциному, рак желчного пузыря или рак фатерова соска; неоперабельное или рецидивирующее заболевание; предшествующая химиотерапия на основе гемцитабина; общее состояние 0-1 по критериям Восточной объединенной онкологической группы США (ECOG); оцениваемые или измеримые очаги в соответствии с Критериями оценки ответа солидных опухолей версии 1.1 (RECIST v1.1); достаточная функция костного мозга и органов; и скорректированный интервал QT ≤480 мс. Основными критериями исключения являлись активное заболевание центральной нервной системы; метастазы в головном мозге; риск окклюзии вен сетчатки или окклюзия вен сетчатки в анамнезе; трансплантация в анамнезе; синдром Жильбера; серьезное заболевание сердца в пределах 6 месяцев; нервно-мышечное заболевание, связанное с повышением креатинкиназы. Допустимо дренирование желчных путей. Все пациенты-участники предоставляли письменное информированное согласие. Настоящее исследование было одобрено Экспертными советами организаций в каждом лечебном учреждении и зарегистрировано на ClinicalTrials.gov (идентификатор: NCT02773459).
[00172] Дозировка и модификация дозы
[00173] Биниметиниб и капецитабин перорально вводили дважды в сутки в дни 1-14 каждые 3 недели. В части повышения дозы использовали 4 заранее определенных уровня дозы (DL) (DL-1: биниметиниб/капецитабин, 15 мг/800 мг/м2; DL1: 15 мг/1000 мг/м2; DL2: 30 мг/1000 мг/м2; DL3: 30 мг/1250 мг/м2). Начальной дозой являлась DL1. Если ни один из пациентов не испытывал DLT при DL3, то DL3 считали RP2D. DLT предварительно определяли как нейтропению степени 4 с повышением температуры и/или инфекцией; нейтропению степени 4 в течение ≥7 дней; тромбоцитопению степени 3/4 с геморрагией или необходимости переливания; тромбоцитопению степени 4 в течение ≥7 дней; негематологические нежелательные явления степени 3 или 4, за исключением алопеции, анорексии, тошноты или рвоты; или тошноту, диарею или рвоту степени 3 или 4, несмотря на максимальную поддерживающую терапию. Допустимо снижение дозы биниметиниба до 15 мг дважды в сутки и капецитабина до 75 или 50% дозы на основе определенного протоколом модификаций лечения.
[00174] Оценка ответа, нежелательные явления и QOL
[00175] Рентгенографическую оценку осуществляли посредством компьютерной томографии (КТ) каждые 6 недель и оценивали ответ опухоли по RECIST v1.1. Рутинную оценку, включающую физикальный осмотр и определение показателей жизнедеятельности, и оценку нежелательных явлений осуществляли еженедельно в течение первого цикла, а затем в конце каждого цикла. Нежелательные явления регистрировали с использованием Общих терминологических критериев NCI версии 4.03. QOL оценивали с использованием опросников EORTC-QLQ-C30 и EQ5D (см. Aaronson NK, et al. J Natl Cancer Inst 85:365-76, 1993 и Health Policy 16:199-208, 1990; описания которых включены в настоящее описание в качестве ссылки в полном объеме), используя их на исходном уровне, после циклов 1, 2, 4, 6 и 8, а затем после каждого третьего цикла до конца исследования.
[00176] Анализ биомаркеров
[00177] От всех пациентов необходимо было получить опухолевые ткани при скрининге и образцы крови при скрининге, после первого цикла, после второго цикла и при прогрессировании заболевания. Генетические изменения анализировали с использованием направленного секвенирования с помощью технологии секвенирования нового поколения (NGS) для определения мутаций пути RAS/RAF/MEK/ERK. Для прогнозирования эффективности лечения анализировали концентрации интерлейкина-6 (ИЛ-6) в плазме. Концентрации ИЛ-6 в плазме измеряли с использованием твердофазного иммуноферментного анализа (ИЛ-6 человека, набор для ELISA Quantikine, R&D systems, Minneapolis, MN, USA) по инструкциям производителя. Каждый образец анализировали в двух параллелях.
[00178] Статистический анализ
[00179] Анализ безопасности и эффективности осуществляли на выборке пациентов с назначенным лечением, которым вводили по меньшей мере одну дозу биниметиниба. Непрерывные переменные обобщали с использованием описательной статистики, такой как среднее и стандартное отклонение или медиана и диапазон, в то время как категориальные переменные обобщали с использованием частот и процентных долей. Значения точки сочленения каждой непрерывной переменной для прогнозирования OS и PFS определяли посредством обнаружения оптимальной точки сочленения для непрерывных ковариат с исходами, связанными со временем до наступления события (см. Williams BA: Finding optimal cutpoints for continuous covariates with binary and time-to-event outcomes. Technical Report Series #79, June 2006, Department of Health Sciences Research, Mayo Clinic, Rochester Minnesota). Результаты EORTC-QLQ-C30 интерпретировали способом Osoba et al (см. Osoba D, et al., J Clin Oncol 16:139-44, 1998). PFS вычисляли от даты первого цикла до развития прогрессирующего заболевания (PD) или смерти, независимо от причины. OS вычисляли от даты первого цикла до смерти, независимо от причины. Все анализы осуществляли с использованием программного обеспечения PASW Statistics 18 (SPSS Inc., Chicago, IL) и статистического программного обеспечения R (R версии 3.4.4).
[00180] РЕЗУЛЬТАТЫ
[00181] Пациенты
[00182] В часть повышения дозы включали девять пациентов. Ни у одного из пациентов не наблюдали DLT вплоть до DL3, таким образом, RP2D определяли как DL3 (биниметиниб 30 мг/капецитабин 1250 мг/м2, дважды в сутки в дни 1-14 каждые 3 недели). В часть исследования стабильной дозы включали 25 пациентов. Ко времени прекращения сбора данных 22 пациента умерли, и 3 пациентов продолжали лечить. Медиана длительности последующего наблюдения составляла 6,8 месяцев (диапазон 2,0-17,8), и медиана количества циклов лечения пациентов составляла 5 (диапазон 1-16).
[00183] Начальные характеристики пациентов не отличались значимо между частью повышения дозы и частью исследования стабильной дозы. Медиана возраста составляла 63 года (диапазон 48-73). Источником первичной опухоли являлся желчный пузырь (n=10, 29,4%), внутрипеченочные желчные протоки (n=10, 29,4%), внепеченочные желчные протоки (n=9, 26,5%) и фатеров сосок (n=5, 14,7%). Двадцать пять (73,5%) пациентов находились в условиях терапии второй линии, и 9 пациентов (26,5%) находились в условиях терапии третьей линии. Двадцать пациентов (35,3%) ранее подвергали воздействию 5-FU в качестве адъюванта или в течение периода паллиативной химиотерапии, и из них для 4 пациентов (33,3%) 5-FU в качестве терапии первой или второй линии являлся неэффективным.
[00184] Нежелательные явления
[00185] Большинство нежелательных явлений являлись контролируемыми и обратимыми. Необходимо отметить, что во время первого цикла в части повышения дозы возник один случай нейтропении G3 и один случай тромбоцитопении G3, но не наблюдали DLT. Наиболее распространенными нежелательными явлениями являлись стоматит (61,7%), отек (50,0%), тошнота (41,2%), папуло-пустулезная сыпь (41,2%), ладонно-подошвенная эритродизестезия (41,2%) и утомляемость (41,2%). Не было офтальмологических нежелательных явлений, и только у одного пациента наблюдали токсичность степени 4 (гипокалиемию). Не было связанных с лечением случаев смерти.
[00186] Эффективность лечения
[00187] Все пациенты имели по меньшей мере один измеримый очаг. Из 34 пациентов у 7 пациентов (20,6%) и 19 пациентов (55,9%) наблюдали частичный ответ (PR) и стабильное заболевание (SD), соответственно (таблица 1).
Таблица 1. Ответ опухоли, выживаемость без прогрессирования и общая выживаемость.
*Сравнение терапии второй линии и третьей линии. CI, доверительный интервал
[00188] ORR и DCR составляли 20,6% (95%-ный доверительный интервал (CI), 7,0-34,2) и 76,5% (95% CI, 62,2-90,8), соответственно. У двадцати пяти пациентов (73,5%) наблюдали уменьшение размеров опухоли любой степени (фиг. 2A), и медиана длительности ответа составляла 4,7 месяца (95% CI, 2,4-7,0). Из 19 пациентов с SD у 13 (68,4%) наблюдали устойчивый контроль заболевания с длительностью SD более 12 недель. Ответ опухоли являлся схожим в условиях терапии второй и третьей линии (таблица 1). Источник опухоли также не изменял ответ опухоли. Кроме того, из 4 пациентов, для которых 5-FU являлся неэффективным в условиях терапии первой или второй линии, у одного пациента (25%) наблюдали PR и у других 3 пациентов (75%) наблюдали SD.
[00189] У всех пациентов доля 3-месячной PFS составляла 64,0%, и медиана PFS составляла 4,1 месяца (95% CI, 2,8-5,7; фиг. 2B). Медиана OS составляла 7,8 месяцев (95% CI, 5,9-12,2). Ни PFS, ни OS ни отличались значимо между условиями терапии второй и третьей линии (p=0,064, p=0,796, соответственно). Также не наблюдали значимых различий PFS или OS, если пациентов группировали по источнику опухоли (p=0,158, p=0,091, соответственно).
[00190] Анализ биомаркеров
[00191] От всех пациентов во время скрининга получали опухолевые ткани. Однако информацию о геномной последовательности получали способами NGS для 26 из 34 участников (76,5%). Генетические изменения пути RAS/RAF/MEK/ERK идентифицировали у 10 (38,5%) из 26 пациентов (таблица 2).
Таблица 2. Мутации пути RAS/RAF/MEK/ERK
[00192] Кроме того, пациенты с мутациями пути RAS/RAF/MEK/ERK значимо лучше отвечали на терапию, чем в случае дикого типа (40,0% против 12,5%; фиг. 2C и таблица 3).
Таблица 3. Ответ опухоли, выживаемость без прогрессирования и общая выживаемость в соответствии с мутационным статусом пути RAS/RAF/MEK/ERK (только онлайн)
(95% CI, 2,6-5,7)
(95% CI, 3,8-NR)
CI, доверительный интервал; NR, не достигнуто.
[00193] Пациенты с мутантным типом также демонстрировали более длительную PFS (5,4 месяцев против 3,5 месяцев; фиг. 2D и фиг. 2E) и OS (10,8 месяцев против 5,9 месяцев; фиг. 2F), чем пациенты с диким типом.
[00194] В терминах концентраций ИЛ-6 в плазме среднее значение (± стандартное отклонение) исходного ИЛ-6 в плазме составляло 11,5 пг/мл (±12,6). У пациентов с более высоким исходным ИЛ-6 наблюдали значимо меньшую PFS и OS (p=0,025, p=0,033, соответственно; фиг. 3A и 3B). Аналогично, исходно значение ИЛ-6 было ассоциировано с ответом опухоли, т.е. ИЛ-6 был более высоким у пациентов с PD, чем с PR. Средние концентрации составляли 19,9, 9,2 и 7,7 пг/мл у пациентов PD, SD и PR, соответственно (p=0,085). Что касается изменений между исходным уровнем и временем после второго цикла, более высокое повышение концентрации ИЛ-6 (Δ>14,8 пг/мл) было ассоциировано с меньшей PFS и OS (фиг. 3C и 3D). Кроме того, концентрации ИЛ-6 в плазме, когда PD было подтверждено, также значимо повышались относительно исходного уровня (среднее ± стандартное отклонение: 32,0±29,8 против 9,0±5,9 пг/мл, соответственно; парный t-критерий, p=0,008).
[00195] QOL
[00196] С учетом опросников EORTC-QLQ-C30, большинство QOL, касающихся общего состояния здоровья и жизнедеятельности, с прохождением циклов изменялись от степени "немного" до "очень значительно". QOL, касающиеся симптомов, очевидно улучшались в некоторые моменты времени. При сравнении лучшего статуса с исходным уровнем, ролевое функционирование и финансовые затруднения улучшались со степенью "немного" (p=0,028 и p=0,032, соответственно), и QOL, касающиеся боли, улучшались с "умеренной" степенью (p=0,039). При использовании опросника EQ5D также наблюдали изменения QOL на всем протяжении периода лечения.
[00197] ОБОБЩЕНИЕ РЕЗУЛЬТАТОВ
[00198] В часть DE включали 9 пациентов и не наблюдали дозолимитирующей токсичности. Таким образом, рекомендуемую дозу фазы 2 определяли как DL3. В часть EX включали 25 пациентов. Всего из 34 пациентов 25 (73,5%) и 9 пациентов (26,5%) находились в условиях терапии второй линии и третьей линии, соответственно. Доля 3-месячной PFS составляла 64,0%, и медиана PFS и общей выживаемости (OS) составляли 4,1 (95% CI, 2,8-5,7) и 7,8 месяцев (95% CI, 5,9-12,2), соответственно. Частота объективных ответов и частота контроля заболевания составляли 20,6% (95% CI, 7,0-34,2) и 76,5% (95% CI, 62,2-90,8), соответственно. 68,4% случаев стабильного заболевания являлись длительными (>12 недель). Кроме того, у пациентов с мутациями пути RAS/RAF/MEK/ERK (38,5%) наблюдали значимо лучший ответ опухоли (p=0,028), PFS (5,4 против 3,5 месяцев, p=0,010) и OS (10,8 против 5,9 месяцев, p=0,160), чем в случае дикого типа. Большинство нежелательных явлений имели степень 1/2 и являлись контролируемыми.
[00199] У шести пациентов (17,6%) и 20 пациентов (58,8%) наблюдали частичный ответ и стабильное заболевание (SD), соответственно. Частота ответов и частота контроля заболевания составляли 17,6% (95% CI, 4,8-30,4) и 76,5% (95% CI, 62,1-90,7), соответственно. Медиана PFS составляла 3,9 месяца (95% CI, 3,0-4,8), и медиана общей выживаемости (OS) составляла 8,0 месяцев (95% CI, 4,9-11,1). Трехмесячная выживаемость без прогрессирования (3m-PFSR) составляла 61,3%. У шестидесяти процентов пациентов с SD наблюдали пролонгированное SD (>12 недель). В исследовании биомаркеров у пациентов с активированным путем RAS/RAF/MEK/ERK наблюдали более длительную PFS (5,4 месяцев против 2,6 месяцев, p=0,031) и OS (10,8 месяцев против 5,3 месяцев, p=0,011), чем у пациентов с неактивированным путем.
[00200] RP2D комбинации биниметиниба и капецитабина представляет собой 1250 мг/м2 капецитабина и 30 мг биниметиниба дважды в сутки, 2 недели введения/1 неделя перерыва. Эта комбинация демонстрировала приемлемую переносимость и перспективную противоопухолевую эффективность, в частности, у пациентов с BTC, имеющих повышенную активность передачи сигнала RAS/RAF/MEK/ERK.
[00201] ОБСУЖДЕНИЕ
[00202] Настоящее исследование является первым исследованием проверки концепции для оценки безопасности и эффективности биниметиниба в комбинации с капецитабином в случае BTC, ранее подвергавшегося лечению гемцитабином, и обосновано доклиническими данными, позволяющими предполагать синергизм между биниметинибом и фторпиримидином. Эта комбинация демонстрировала перспективную противоопухолевую эффективность, в частности, у пациентов с BTC с мутациями пути RAS/RAF/MEK/ERK.
[00203] В предшествующем исследовании фазы Ib монотерапии биниметиниба на пациентах с BTC на поздней стадии или метастазирующим BTC определяли ORR 8% и DCR 51%, а также PFS 2,1 месяца и OS 4,8 месяца, соответственно (Finn RS, et al.,: Phase 1b investigation of the MEK inhibitor binimetinib in patients with advanced or metastatic biliary tract cancer. Invest New Drugs, May 22, 2018). В отличие от этого, в настоящем исследовании ORR, DCR, PFS и OS составляли 20,6%, 76,5%, 4,1 месяца и 7,8 месяцев. Учитывая, что настоящее исследование состояло из пациентов в условиях терапии второй линии (73,5%) и третьей линии (26,5%), эффективность настоящего исследования может являться более высокой, чем в указанном выше исследовании монотерапии биниметинибом, в котором более половины выборки пациентов ранее не подвергались химиотерапии и находились в условиях метастазирования (57%). Кроме того, в системном обзоре пациентов с BTC в условиях терапии второй линии и третьей линии описаны ORR и DCR менее 10% и менее 50%; PFS и OS составляли приблизительно 3 месяца и 6 месяцев (Lamarca A, et al., Ann Oncol 25:2328-38, 2014). Кроме того, предшествующее исследование, включавшее пациентов с BTC в условиях терапии второй линии и третьей линии, которых лечили с помощью комбинации на основе 5-FU (инфузионная схема лечения FAM), включало выборку, схожую с настоящим исследованием, и в нем регистрировали значения PFS и OS 2,4 месяца и 6,1 месяцев, соответственно (Lim KH, et al., Cancer Chemother Pharmacol 68:1017-26, 2011). Учитывая эти результаты, эффективность биниметиниба и капецитабина в настоящем исследовании является многообещающей, и, вероятно, ее можно приписать синергизму между биниметинибом и капецитабином. Фактически, доклинические эксперименты показали отрицательную регуляцию TS и PD-L1, индуцируемую 5-FU в ответ на биниметиниб. Примечательно, что в настоящем исследовании все пациенты, ранее не получившие пользу от химиотерапии на основе 5-FU, достигали частичного ответа (PR) или стабильного заболевания (SD) при использовании комбинации биниметиниба и капецитабина, что, вероятно, можно приписать синергизму.
[00204] Как описано, активация пути MEK, например, в результате мутаций RAS или BRAF, является прогностическим маркером успеха ингибиторов MEK (Horiuchi H, et al., Int J Oncol 23:957-63, 2003; Solit DB, et al., Nature 439:358-62, 2006). В настоящем исследовании генетические мутации пути RAS/RAF/MEK/ERK идентифицировали у 10 (38,5%) из 26 пациентов, для которых получены данные NGS. Это соответствовало результатам предыдущих исследований. Важно, что настоящее исследование показало, что стратегия выбора биомаркеров на основе ткани для лечения пациентов с BTC или включения пациентов с BTC в клинические испытания является возможной и выполнимой. Примечательно, что у пациентов с мутациями пути RAS/RAF/MEK/ERK наблюдали ассоциацию с более высокой ORR и более длительной выживаемостью, чем в случае дикого типа. Учитывая, что пациенты в настоящем исследовании находились в условиях терапии BTC второй или третьей линии, эти результаты ORR (40%), PFS (5,4 месяцев) и OS (10,8 месяцев) были многообещающими для пациентов с мутантным типом пути RAS/RAF/MEK/ERK. Таким образом, мутации пути RAS/RAF/MEK/ERK могут являться прогностическим биомаркером эффективного лечения BTC биниметинибом.
[00205] Иммуномодуляция является другим противоопухолевым механизмом ингибиторов MEK, т.к. описано, что ингибирование MEK снижало секрецию ИЛ-6, ассоциированную с ростом опухоли BTC (Tai YT, et al., Blood 110:1656-63, 2007; Park J, Tadlock L, et al., Hepatology 30:1128-33, 1999; Meng F, et al., J Hepatol 44:1055-65, 2006; Wehbe H, et al., Cancer Res 66:10517-24, 2006). В настоящем исследовании более высокие исходные концентрации ИЛ-6 ассоциированы с более плохим прогнозом. Кроме того, после второго цикла лечения у пациентов с более высоким повышением наблюдали более плохой прогноз. Таким образом, ранее сравнительное определение ИЛ-6 между исходным уровнем и временем после лечения может способствовать прогнозированию исхода заболевания при лечении биниметинибом.
[00206] В настоящем исследовании тестировали заранее определенные 4 DL и не наблюдали DLT. Наиболее высокую DL (биниметиниб 30 мг, капецитабин 1250 мг/м2, дважды в сутки в течение дней 1-14, каждые 3 недели) определяли как RP2D. Эта доза биниметиниба являлась относительно низкой по сравнению с исследованием монотерапии, и включали 1-недельный перерыв в введении лекарственного средства каждые 3 недели. Эта схема комбинированного лечения, позволяющая вводить капецитабин в полной дозе, являлась переносимой, и нежелательные явления являлись контролируемыми. В этом исследовании также не наблюдали офтальмологической токсичности. Комбинация лекарственных средств хорошо переносилась, была ассоциирована с контролируемыми нежелательными явлениями и демонстрировала перспективную противоопухолевую эффективность, особенно, в случае пациентов с мутациями пути RAS/RAF/MEK/ERK. Эти данные способствуют клинической разработке стратегий ингибирования MEK для лечения BTC в будущем.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[00207] Следует понимать, что, хотя настоящее изобретение представлено в сочетании с подробным описанием, изложенное выше описание предназначено для иллюстрирования, а не для ограничения объема изобретения, определяемого объемом формулы изобретения. Другие аспекты, преимущества и модификации входят в объем формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтические комбинации | 2017 |
|
RU2759669C2 |
| ТЕТРАГИДРОФОЛАТЫ В КОМБИНАЦИИ С ИНГИБИТОРАМИ EGFR | 2013 |
|
RU2619335C2 |
| ПРИМЕНЕНИЕ АЛЛОПУРИНОЛА ДЛЯ ЛЕЧЕНИЯ ЛАДОННО-ПОДОШВЕННОЙ ЭРИТРОДИЗЕСТЕЗИИ | 2007 |
|
RU2438673C2 |
| КОМБИНАЦИЯ ТРИФЛУРИДИНА/ТИПИРАЦИЛ ГИДРОХЛОРИДА, ПРОТИВООПУХОЛЕВОГО ПЛАТИНОВОГО КОМПЛЕКСА И МОДУЛЯТОРА КОНТРОЛЬНЫХ ТОЧЕК ИММУННОГО ОТВЕТА | 2018 |
|
RU2778887C2 |
| СПОСОБЫ ЛЕЧЕНИЕ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2011 |
|
RU2576609C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО РАПАМИЦИНА | 2013 |
|
RU2665138C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО РАПАМИЦИНА | 2013 |
|
RU2659725C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S, 4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2592231C2 |
| КОМБИНАЦИЯ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2002 |
|
RU2322981C2 |
| ЛЕЧЕНИЕ РАКА | 2005 |
|
RU2325906C2 |
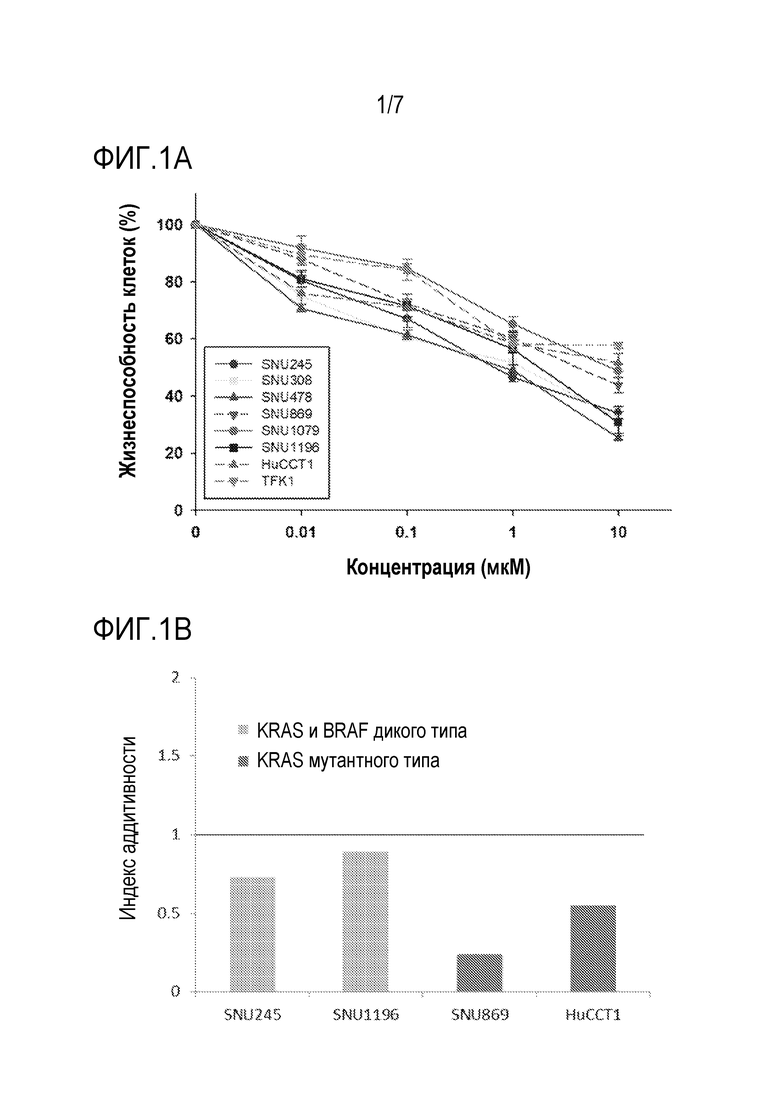

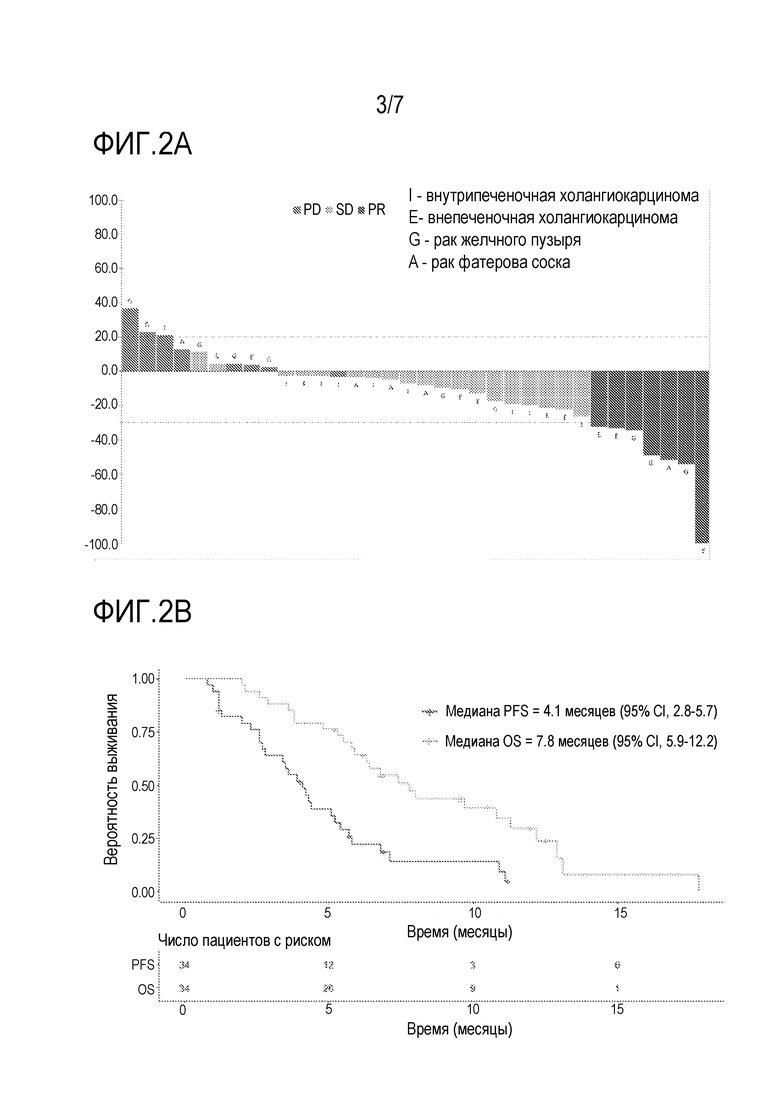
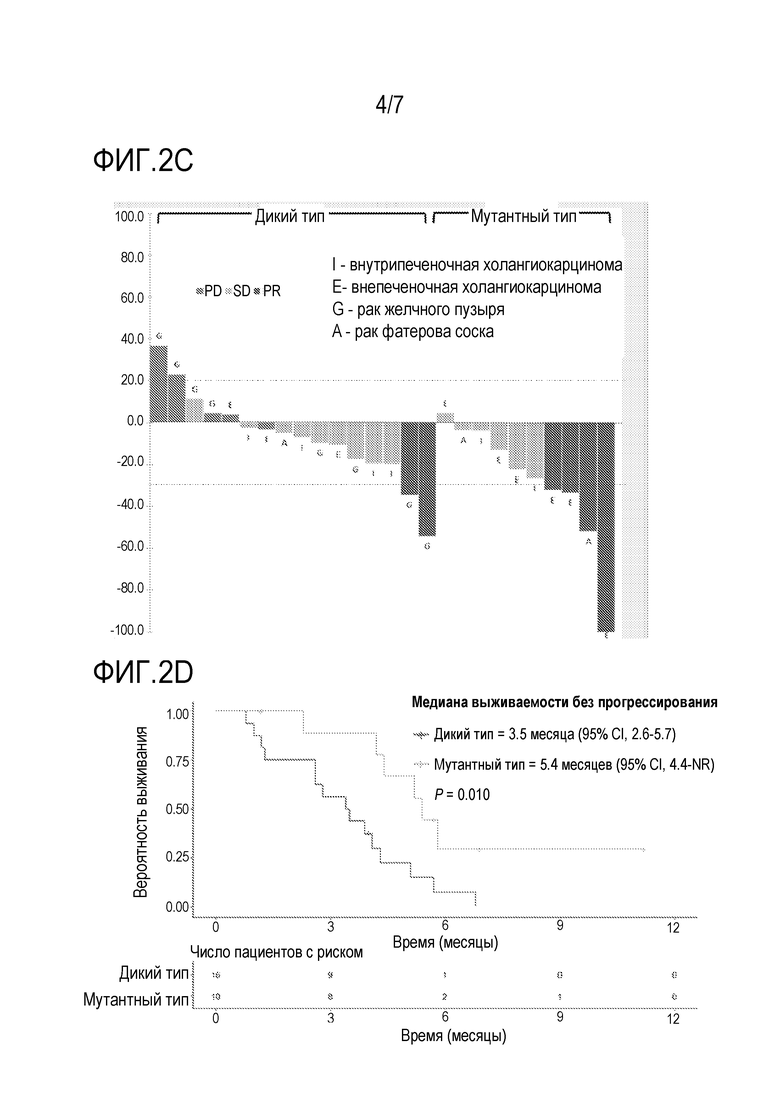
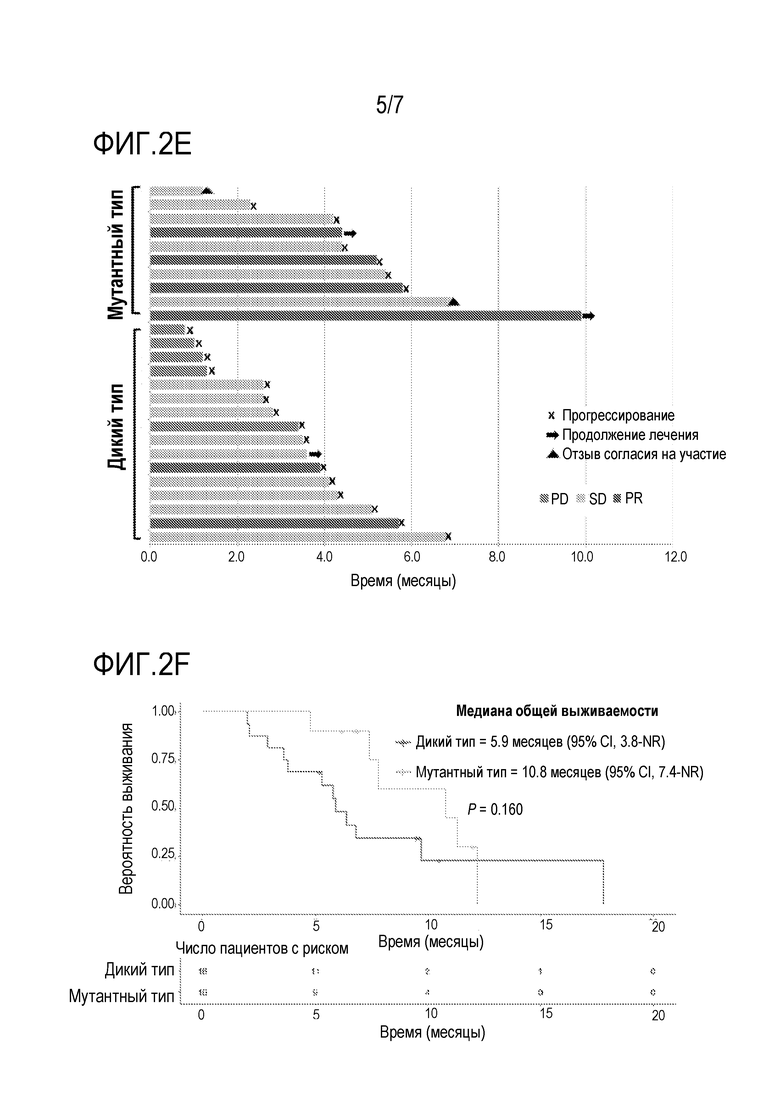
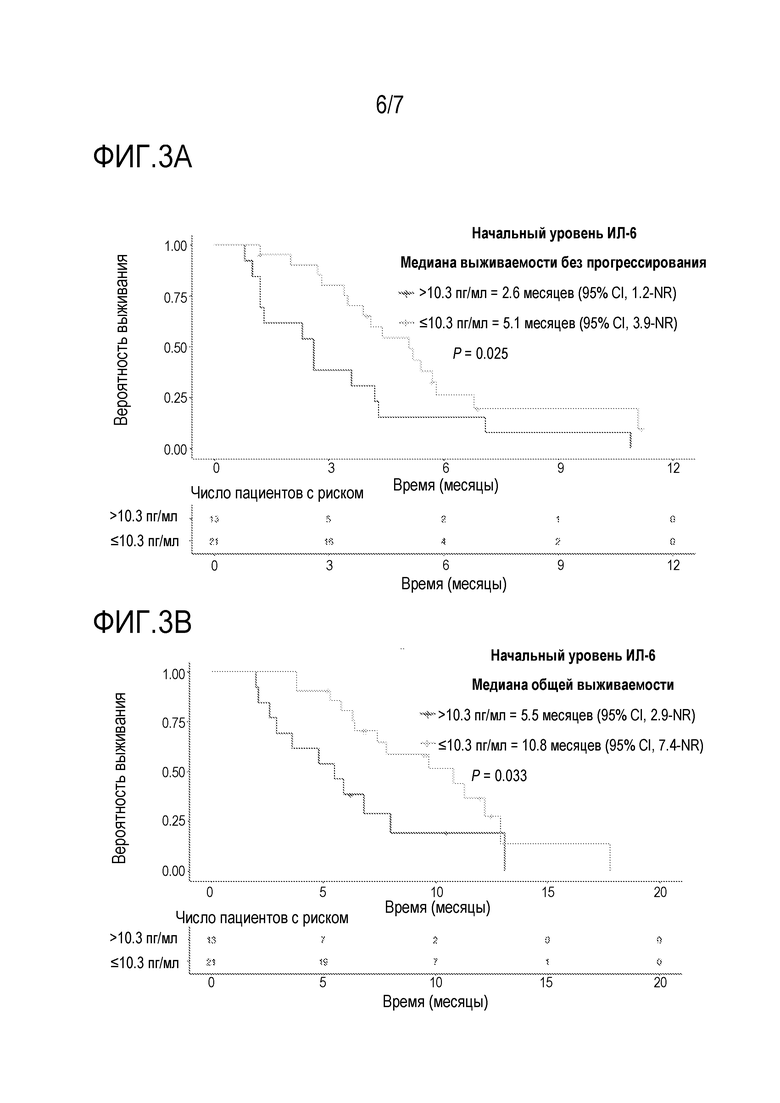
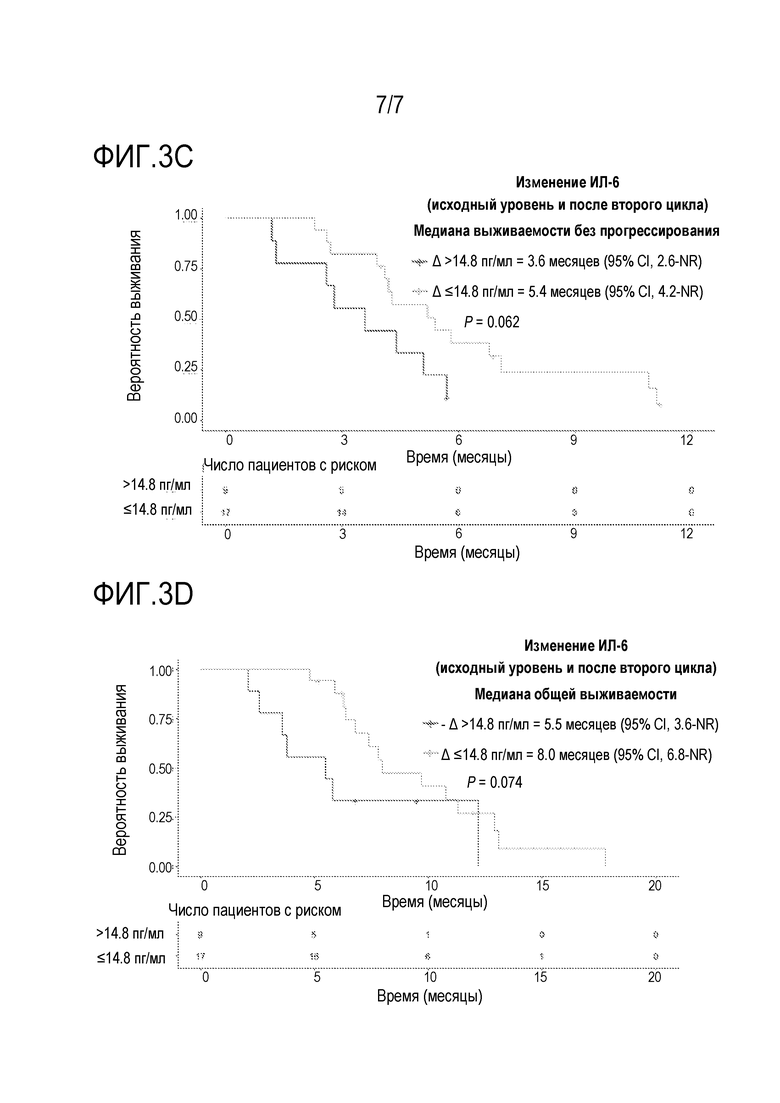
Группа изобретений относится к области медицины, а именно к онкологии и терапии, и предназначена для лечения рака желчных протоков на поздней стадии, который предварительно лечили. Для лечения рака желчных протоков вводят нуждающемуся в этом пациенту в течение периода времени терапевтические средства, содержащие количество фторпиримидин-содержащего терапевтического средства и количество ингибитора MEK, представляющего собой кристаллизованный биниметиниб, или его фармацевтически приемлемой соли. Указанные количества вместе являются эффективными при лечении рака желчных протоков. Использование группы изобретений обеспечивает лечение рака желчных протоков на поздней стадии, который предварительно лечили. 2 н. и 63 з.п. ф-лы, 3 ил., 3 табл., 2 пр.
1. Способ лечения рака желчных протоков на поздней стадии, который предварительно лечили, включающий введение нуждающемуся в этом пациенту в течение периода времени терапевтических средств, содержащих количество фторпиримидин-содержащего терапевтического средства и количество ингибитора MEK, который представляет собой кристаллизованный биниметиниб, или его фармацевтически приемлемой соли, где количества вместе являются эффективными при лечении рака желчных протоков.
2. Способ по п.1, где биниметиниб вводят перорально в количестве 30 мг дважды в сутки (BID) или 45 мг BID в течение периода времени.
3. Способ по п.1, где биниметиниб вводят перорально в количестве 30 мг BID или 45 мг BID с двумя неделями введения и одной неделей перерыва в по меньшей мере одном цикле лечения из трех недель в течение периода времени.
4. Способ по п.3, где биниметиниб вводят перорально в количестве 30 мг BID.
5. Способ по п.3, где фторпиримидин-содержащее терапевтическое средство является пролекарством 5-FU.
6. Способ по п.5, где фторпиримидин-содержащее терапевтическое средство является капецитабином.
7. Способ по п.6, где капецитабин вводят перорально в количестве 800 мг/м2, 825 мг/м2, или 950 мг/м2, или 1000 мг/м2, или 1250 мг/м2 дважды в сутки.
8. Способ по п.6 или 7, где капецитабин вводят перорально в количестве 800 мг/м2, 825 мг/м2, или 950 мг/м2, или 1000 мг/м2, или 1250 мг/м2 дважды в сутки с двумя неделями введения и одной неделей перерыва в по меньшей мере одном цикле лечения из трех недель в течение периода времени.
9. Способ по п.8, где капецитабин вводят перорально в количестве 1250 мг/м2 дважды в сутки.
10. Способ по любому из пп.1-9, где до периода времени пациента лечили с использованием предшествующей терапии.
11. Способ по п.10, где указанная предшествующая терапия выбрана из введения одного или более терапевтических средств, независимо выбранных из химиотерапевтических средств и таргетированных терапевтических средств.
12. Способ по п.11, где предшествующая терапия представляла собой введение гемцитабина в качестве монотерапии.
13. Способ по п.11, где предшествующая терапия представляла собой введение гемцитабина и цисплатина.
14. Способ по п.11, где предшествующая терапия представляла собой введение гемцитабина и оксалиплатина.
15. Способ по п.11, где предшествующая терапия представляла собой введение 5-фторурацила в качестве монотерапии.
16. Способ по п.11, где предшествующая терапия представляла собой введение 5-фторурацила и лейковорина.
17. Способ по п.11, предшествующая терапия представляла собой введение 5-фторурацила и цисплатина.
18. Способ по п.11, где предшествующая терапия представляла собой введение 5-фторурацила, эпирубицина и цисплатина.
19. Способ по п.11, где предшествующая терапия представляла собой введение 5-фторурацила и иринотекана.
20. Способ по п.11, где предшествующая терапия представляла собой введение капецитабина в качестве монотерапии.
21. Способ по п.11, где предшествующая терапия представляла собой введение гемцитабина.
22. Способ по п.11, где предшествующая терапия представляла собой введение гемцитабина и оксалиплатина.
23. Способ по п.11, где предшествующая терапия представляла собой введение лапатиниба.
24. Способ по п.11, где предшествующая терапия представляла собой введение эрлотиниба.
25. Способ по п.11, где предшествующая терапия представляла собой введение цетуксимаба или панитумумаба.
26. Способ по п.11, где предшествующая терапия представляла собой введение бевацизумаба.
27. Способ по п.11, где предшествующая терапия представляла собой введение бевацизумаба и mFOLFOX6.
28. Способ по п.11, где предшествующая терапия представляла собой введение бевацизумаба в комбинации с гемцитабином и капецитабином.
29. Способ по любому из пп.10-28, где определяли, что предшествующая терапия являлась неэффективной.
30. Способ по любому из пп.10-28, где пациент являлся резистентным к предшествующей терапии.
31. Способ по любому из пп.1-30, где способ дополнительно включает оценку эффективности лечения в течение периода времени посредством определения одного или более из ингибирования прогрессирования заболевания, ингибирования роста опухоли, уменьшения первичной опухоли, облегчения связанных с опухолью симптомов, ингибирования секретируемых опухолью факторов, задержки возникновения первичных или вторичных опухолей, замедления развития первичных или вторичных опухолей, уменьшения возникновения первичных или вторичных опухолей, замедления или снижения тяжести вторичных эффектов заболевания, задержки роста опухоли и регрессирования опухолей, повышения времени до прогрессирования (TTP), повышения выживаемости без прогрессирования (PFS), повышения общей выживаемости (OS) или повышения длительности ответа (DOR).
32. Способ по любому из пп.1-31, где рак желчных протоков имеет мутацию KRAS.
33. Способ по п.32, где рак желчных протоков имеет мутацию KRAS G12A.
34. Способ по п.32, где рак желчных протоков имеет мутацию KRAS G12C.
35. Способ по п.32, где рак желчных протоков имеет мутацию KRAS G12D.
36. Способ по п.32, где рак желчных протоков имеет мутацию KRAS G12V.
37. Способ по любому из пп.1-31, где рак желчных протоков имеет мутацию NRAS.
38. Способ по п.37, где рак желчных протоков имеет мутацию NRAS Q61L.
39. Способ по любому из пп.1-31, где рак желчных протоков имеет мутацию MAP2K1.
40. Способ по п.39, где рак желчных протоков имеет мутацию MAP2K1 E203K.
41. Способ по п.39, где рак желчных протоков имеет мутацию MAP2K1 E203V.
42. Способ по любому из пп.1-41, где рак желчных протоков выбран из внутрипеченочной холангиокарциномы, внепеченочной холангиокарциномы и рака фатерова соска.
43. Способ по любому из пп.1-42, где рак желчных протоков является неоперабельным.
44. Способ по любому из пп.1-42, где рак желчных протоков является рецидивирующим.
45. Способ комбинированного лечения, включающий введение пациенту, имеющему рак желчных протоков на поздней стадии, который предварительно лечили, в течение периода времени терапевтических средств, содержащих терапевтически эффективные количества, независимо или в комбинации:
ингибитора MEK, который представляет собой кристаллизованный биниметиниб, или его фармацевтически приемлемой соли; и
фторпиримидин-содержащего терапевтического средства.
46. Способ комбинированного лечения по п.45, где фторпиримидин-содержащее терапевтическое средство является капецитабином.
47. Способ комбинированного лечения по п.45, где биниметиниб вводят пациенту перорально в виде таблетки в течение периода времени.
48. Способ комбинированного лечения по п.47, где указанная таблетка содержит 15 мг биниметиниба.
49. Способ комбинированного лечения по любому из пп.46-48, где капецитабин вводят перорально в течение периода времени.
50. Способ комбинированного лечения по п.49, где капецитабин вводят в виде таблетки.
51. Способ комбинированного лечения по п.50, где указанная таблетка содержит 150 мг капецитабина.
52. Способ комбинированного лечения по п.50, где указанная таблетка содержит 300 мг капецитабина.
53. Способ комбинированного лечения по любому из пп.45-52, где рак желчных протоков имеет мутацию KRAS.
54. Способ комбинированного лечения по п.53, где рак желчных протоков имеет мутацию KRAS G12A.
55. Способ комбинированного лечения по п.53, где рак желчных протоков имеет мутацию KRAS G12C.
56. Способ комбинированного лечения по п.53, где рак желчных протоков имеет мутацию KRAS G12D.
57. Способ комбинированного лечения по п.53, где рак желчных протоков имеет мутацию KRAS G12V.
58. Способ комбинированного лечения по любому из пп.45-52, где рак желчных протоков имеет мутацию NRAS.
59. Способ комбинированного лечения по п.58, где рак желчных протоков имеет мутацию NRAS Q61L.
60. Способ комбинированного лечения по любому из пп.45-52, где рак желчных протоков имеет мутацию MAP2K1.
61. Способ комбинированного лечения по п.60, где рак желчных протоков имеет мутацию MAP2K1 E203K.
62. Способ комбинированного лечения по п.60, где рак желчных протоков имеет мутацию MAP2K1 E203V.
63. Способ по любому из пп.45-62, где рак желчных протоков выбран из внутрипеченочной холангиокарциномы, внепеченочной холангиокарциномы и рака фатерова соска.
64. Способ по любому из пп.45-63, где рак желчных протоков является неоперабельным.
65. Способ по любому из пп.45-63, где рак желчных протоков является рецидивирующим.
| US 2017027951 A1, 02.02.2017 | |||
| US 2006178387 A1, 10.08.2006 | |||
| Деревянное стыковое скрепление | 1920 |
|
SU162A1 |
| ClinicalTrials.gov, Identifier: NCT02041481, 17.01.2014-23.01.2018, [найдено в Интернет]: | |||
Авторы
Даты
2023-04-04—Публикация
2019-02-12—Подача