Изобретение относится к области медицины, в частности фармакологии, и может быть использовано для устранения судорог разного генеза и для лечения эпилепсии.
Противосудорожные средства объединяют большую группу химических веществ, обладающих способностью подавлять или предупреждать судороги, вызванные разными судорожными агентами. Они условно делятся на универсальные противосудорожные и противоэпилептические средства. С химической точки зрения эти группы представлены производными 3,4-бензодиазепина (диазепам, феназепам, клобазам), барбитуровой и тиобарбитуровой кислоты (фенобарбитал, тиобарбитал натрия, гексенал), вальпроевой кислоты (вальпроат натрия, вальпроат кальция) и представителями других классов (местные анестетики, наркозные средства и т.д.) [Шабанов П.Д. Психофармакология. СПб.: Н-Л, 2008. 368 с.]. Часто противосудорожные средства в своем спектре имеют и транквилизирующие (противотревожные) свойства, например, производные 3,4-бензодиазепина (диазепам, феназепам, тазепам, лоразепам). У некоторых производных 7-оксикумарина также описаны транквилизирующие и противосудорожные свойства [Денисенко П.П., Тарасенко А.А. Хлорпропоксипроизводные 7-оксикумарина, обладающие транквилизирующим и гепатопротекторным действием // Патент РФ №2452732 от 10.06.2012. БИ №16], хотя последние встречаются не часто и, как правило, слабо выражены.
Цель изобретения - поиск новых противосудорожных средств среди производных 7-оксикумарина (умбеллиферона).
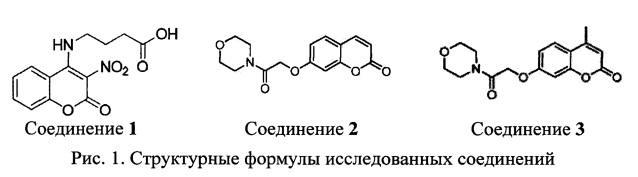
Задача решена с помощью синтетических соединений 1, 2 и 3, представляющих собой соответственно 4-((3-Нитро-2-оксо-2Н-хромен-4-ил)амино)бутановую кислоту (соединение 1), 7-(2-Морфолино-2-оксоэтокси)-2Н-хромен-2-он (соединение 2) и 4-Метил-7-(2-Морфолино-2-оксоэтокси)-2Н-хромен-2-он (соединение 3).
Синтез соединений описан ниже.
Соединение 1
4-((3-Нитро-2-оксо-2Н-хромен-4-ил)амино)бутановая кислота
1 г 3-нитро-4-хлоркумарина растворили в 50 мл ацетонитрила, добавили 1 мл триэтиламина и 0.46 г 4-аминобутановой кислоты. Реакционную массу перемешивали 3 суток при комнатной температуре, упарили под вакуумом. Остаток 4 раза перекристаллизовали из этанола, получили 0.24 г 4-((3-нитро-2-оксо-2Н-хромен-4-ил)амино)бутановой кислоты. Т. пл. 212-214°С. ИК спектр, ν, см-1: 750, 771, 789, 870, 914, 934, 948, 1069, 1102, 1123, 1179, 1219, 1229, 1259, 1290, 1329, 1353, 1389, 1412, 1433, 1445, 1473, 1487, 1529, 1556, 1564, 1609, 1681, 1708, 2543, 2578, 2637, 2947, 3000, 3041, 3096, 3346. Спектр ЯМР 1Н, δ, м. д.: 1.83-1.90 (2Н, квинтет), 2.28 (2Н, т), 3.14 (2Н, д), 7.34-7.42 (2Н, м), 7.67-7.69 (1Н, м), 8.26-8.38 (2Н, м), 12.17 (1Н, с уширенный). Элементный анализ, вычислено: С, 53.43; Н, 4.14; N, 9.59; О, 32.85. Найдено: С,53.49; Н, 4.07; N, 9.67
Соединение 2
7-(2-Морфолино-2-оксоэтокси)-2Н-хромен-2-он
Синтезировали аналогично. Т. пл. 180-181°С. ИК спектр, ν, см-1: 749, 760, 838, 852, 893, 954, 983,1013, 1029, 1070, 1101, 1118, 1140, 1151, 1165, 1202, 1244, 1279, 1299, 1373, 1409, 1424, 1434, 1474, 1512, 1555, 1621, 1651, 1665, 1724, 1731, 2875, 2915, 2994, 3081. Спектр ЯМР 1H, δ, м. д.: 3.34-3.59 (8Н, м), 4.96 (2Н, м), 6,25 (1H, д), 6.90-6.95 (2Н, м), 7.57 (1Н, д), 7.93 (1Н, д). Элементный анализ, вычислено: С, 62.28; Н, 5.23; N, 4.84; О, 27.65. Найдено: С, 62.05; Н, 5.34; N, 4.99.
Соединение 3
4-Метил-7-(2-Морфолино-2-оксоэтокси)-2Н-хромен-2-он
Синтезировали аналогично. Т. пл. 156-157°С. ИК спектр, ν, см-1: 749, 807, 825, 851, 889, 958, 1031, 1056, 1082, 1114, 1157, 1203, 1240, 1270, 1279, 1300, 1375, 1388, 1428, 1444, 1474, 1509, 1556, 1622, 1673, 1721, 2875, 2912, 2935, 2977, 3078, 3375, 3413. Спектр ЯМР 1Н, δ, м. д.: 2.34 (3Н, с), 342-3.43 (4Н, м), 3.53-3.59 (4Н, м), 6.16 (1Н, с), 6.91-6.93 (2Н, м), 7.60-7.63 (1H, д). Элементный анализ, вычислено: С, 63.36; Н, 5.65; N, 4.62; О, 26.37. Найдено: С, 63.46; Н, 5.51; N, 4.78.
Исследование активности синтезированных соединений
Эксперименты выполнены на беспородных белых мышах самцах массой 18-22 г, фармакологическую (противосудорожную) активность оценивали в тесте никотиновых и коразоловых (пентилентетразоловых) судорог.
1. Оценка противосудорожной активности в тесте никотиновых судорог.
Судороги индуцировали внутрибрюшинным введением никотина основания 14 мг/кг (LD50 для никотина). Оценивали наличие и проявления тремора, феномена Штрауба (напряженный вытянутый хвост), наступления стадии «дикого бега» и клонико-тонических судорог. Также регистрировали продолжительность судорог и процент животных, выживших и погибших после судорог. Отдельно отмечали наличие миорелаксации. Исследуемые соединения и препараты сравнения вводили за 20-30 мин до инъекции никотина [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под ред. Р.У. Хабриева. 2 изд., перераб. и доп. - М.: Медицина, 2005].
2. Оценка противосудорожной активности в тесте коразоловых (пентилентетразоловых) судорог.
Судороги индуцировали внутрибрюшинным введением коразола (пентилентетразола) 120 мг/кг. Исследуемые соединения и препарат сравнения вводили однократно внутрь или внутрибрюшинно за 40-60 минут до введения коразола. Сразу после введения животных помещали в стандартные прозрачные пластмассовые боксы, в которых наблюдали животных в течение 30 минут. Регистрировали латентные периоды клонических или тонических судорог, а также латентные периоды смертности. Животное считалось выжившим, если смертность не наблюдали в течение 30 минут после введения коразола. Препаратом сравнения был выбран вальпроат натрия (100-200 мг/кг), который вводили внутрибрюшинно [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. А.Н. Миронова. -М.: Гриф и К, 2012. - 944 с].
Результаты. Из таблицы 1 видно, что никотин 14 мг/кг при внутрибрюшинном введении вызывал клонико-тонические судороги у 100% мышей. При этом регистрировали все проявления судорог (тремор, позу Штрауба, фазу дикого бега, оцениваемые на три плюса) и в дальнейшем судороги, которые длились в среднем 2,2±0,3 мин и в 50% случаев заканчивались гибелью мышей (LD50 дозы никотина).
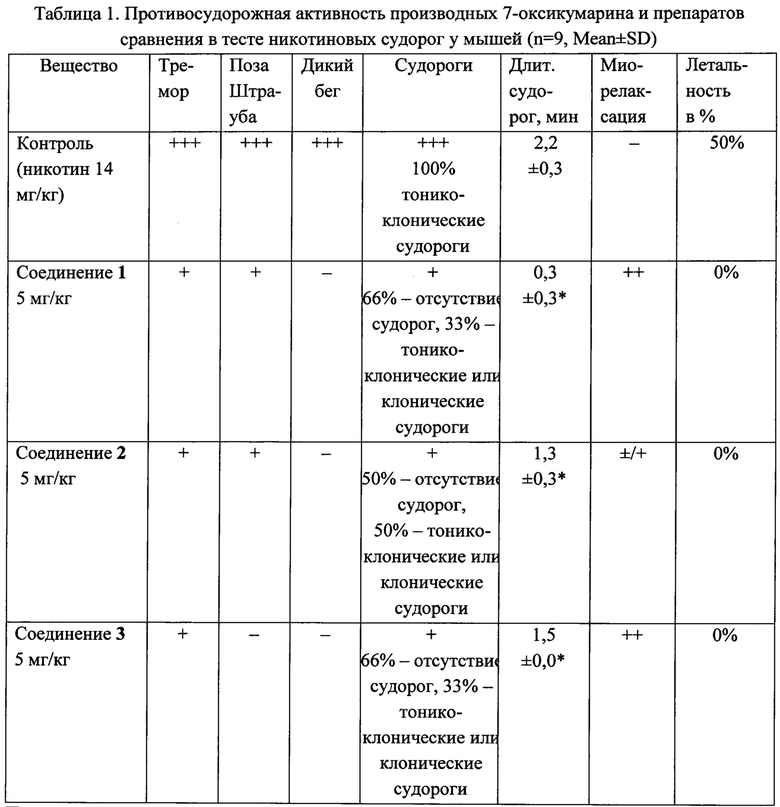
Примечание. «-» - отсутствие признака; «+» - слабо выраженный признак; «++» - умеренно выраженный признак; «+++» - выраженный признак; *р<0,05 в сравнении с группой активного контроля (получавшей никотин).
Все исследованные соединения 1-3 проявили противосудорожную активность, на 100% защищая животных от гибели после введения никотина. При введении соединений 1 и 3 у мышей отмечали отсутствие судорог у 66% и клонико-тонические судороги у 33%, которые не заканчивались гибелью животных. Соединение 2 вызывало противосудорожный эффект у 50% мышей, у 50% наблюдали судороги, не приводящие к гибели. Продолжительность судорог также варьировала: она была минимальной (0,3±0,3 мин) после введения соединения 1 и снижалась до 1,3±0,3 мин или 1,5±0 мин после введения соединений 2 и 3 соответственно (в контроле 2,2±0,3 мин). Соединения 1 и 3 вызывали умеренную миорелаксацию. Следовательно, все исследуемые соединения обладают противосудорожной активностью, механизм которой, по-видимому, заключается в блокаде центральных Н-холинорецепторов.
В тесте коразоловых судорог противосудорожную активность проявило соединение 2 в сравнительно больших дозах (200-300 мг/кг при внутрижелудочном введении), при этом процент выживших животных составил 50-57,1% против 9,1% в контроле. С увеличением дозы на 50% (с 200 до 300 мг/кг) противосудорожный эффект соединения 2 существенно не увеличивался. Соединение 1 проявило невысокую противосудорожную активность в дозе 20 мг/кг, но не в дозах 10 и 60 мг/кг, а соединение 3 вовсе не проявляло противосудорожной активности в данном тесте (табл. 2 и 3).

Примечание. *p<0,05 в сравнении с группой контроля.
Препарат сравнения вальпроат натрия, широко используемый в качестве противоэпилептического средства, также проявлял противосудорожную активность только в высоких дозах (100-200 мг/кг), при этом эффект соединения 1 в дозе 200 мг/кг был сопоставим с таковым вальпроата натрия в такой же дозе (200 мг/кг), хотя соединение 1 вводили внутрь (в желудок), а вольпроат натрия - внутрибрюшинно. При внутрибрюшинном введении действующие дозы веществ, как правило, снижаются на 30-50%. Анализ данных по латентному периоду наступления судорог продемонстрировал аналогичные результаты (табл. 3). Показательно, что при альтернативной оценке противосудорожного эффекта соединения 1 оно в дозе 20 мг/кг уменьшало смертность на 1/3, а по удлинению латентных периодов наступления смерти - данные были достоверными (табл. 3).
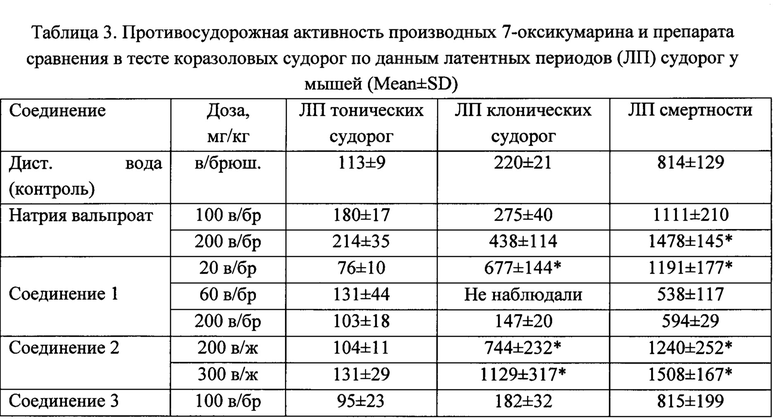
Примечание. *р<0,05 в сравнении с группой контроля.
Заключение. Исследованные соединения 1-3 проявили противосудорожную активность, на 100% защищая животных от гибели после введения LD50 никотина (14 мг/кг). Соединения 1 и 3 вызывали умеренную миорелаксацию. В тесте коразоловых судорог противосудорожную активность проявило соединение 2 в сравнительно больших дозах (200-300 мг/кг при внутрижелудочном введении), при этом процент выживших животных составил 50-57,1% против 9,1% в контроле. С увеличением дозы на 50% (с 200 до 300 мг/кг) противосудорожный эффект соединения 2 существенно не увеличивался. Соединение 1 проявило невысокую противосудорожную активность в дозе 20 мг/кг, но не в дозах 10 и 60 мг/кг, а соединение 3 вовсе не проявляло противосудорожной активности в данном тесте. Препарат сравнения вальпроат натрия также проявлял противосудорожную активность в тесте коразоловых судорог только в высоких дозах (100-200 мг/кг), при этом эффект соединения 1 200 мг/кг был сопоставим с таковым вальпроата натрия в такой же дозе (200 мг/кг), хотя соединение 1 вводили внутрь (в желудок), а вольпроат натрия - внутрибрюшинно.
Следовательно, исследуемые соединения обладают противосудорожной активностью, в различной степени выраженной в разных моделях. Максимальный противосудорожный эффект проявлял 7-(2-Морфолино-2-оксоэтокси)-2Н-хромен-2-он (соединение 2). Механизм противосудорожного действия соединения 2, по-видимому, заключается в блокаде центральных Н-холинорецепторов.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-ЗАМЕЩЕННЫЕ (1S,4aR,5S)-МЕТИЛ-5-[2-(2'-ОКСО-2',5'-ДИГИДРО-1Н-ПИРРОЛ-3'-ИЛ)ЭТИЛ]-1,4a-ДИМЕТИЛ-6-МЕТИЛЕНДЕКАГИДРОНАФТАЛИН-1-КАРБОКСИЛАТЫ, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2385863C2 |
| (1S,4aR,5S,6R)-МЕТИЛ-5{2-[1-(2-АМИНО-2-ОКСОЭТИЛ)-2-ОКСОПИРРОЛИДИН-3-ИЛ]ЭТИЛ}-1,4a, 6-ТРИМЕТИЛДЕКАГИДРОНАФТАЛИН-1-КАРБОКСИЛАТ, ОБЛАДАЮЩИЙ ПРОТИВОСУДОРОЖНОЙ И АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2385864C2 |
| ПРОТИВОСУДОРОЖНОЕ СРЕДСТВО | 2007 |
|
RU2355390C1 |
| N-АЛКИЛ-ТРОПИНЫ И N-АЛКИЛ-НОРТРОПИНЫ С н-ЛИТИЧЕСКОЙ, ПРОТИВОПАРКИНСОНИЧЕСКОЙ, ПРОТИВОЭПИЛЕПТИЧЕСКОЙ, АНАЛЬГЕЗИРУЮЩЕЙ И АНТИДЕПРЕССИВНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2597616C2 |
| 3-БЕНЗИЛАМИНОМЕТИЛЕНПИРРОЛИДИН-2,4-ДИОН И ПРОТИВОСУДОРОЖНОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 1997 |
|
RU2144918C1 |
| ПРОТИВОСУДОРОЖНОЕ СРЕДСТВО | 2008 |
|
RU2370260C1 |
| ПРОИЗВОДНОЕ БЕНЗОПЕНТАТИЕПИНА, ОБЛАДАЮЩЕЕ ПРОТИВОСУДОРОЖНОЙ И ПРОТИВОТРЕВОЖНОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2341521C1 |
| Гидробромид 11-(4-трет-бутилбензил)-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола, обладающий анксиолитической и противосудорожной активностью | 2017 |
|
RU2662242C1 |
| Анксиолитическое средство | 2017 |
|
RU2655929C1 |
| АМИНОАЛКИЛЬНЫЕ ПРОИЗВОДНЫЕ ОКСИМА ДИБЕНЗОФУРАНОНА, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 2020 |
|
RU2773021C2 |
Изобретение относится к области медицины, в частности фармакологии, и может быть использовано для устранения или предупреждения судорог при эпилепсии. Цель изобретения - поиск новых противосудорожных средств среди производных 7-оксикумарина. Задача решена с помощью синтетического соединения 7-(2-Морфолино-2-оксоэтокси)-2Н-хромен-2-она. В экспериментах на животных (мышах) доказано, что соединение проявляет противосудорожную активность, на 100% защищая животных от гибели после введения LD50 никотина (14 мг/кг). 3 табл.
Применение соединения 7-(2-Морфолино-2-оксоэтокси)-2Н-хромен-2-она формулы
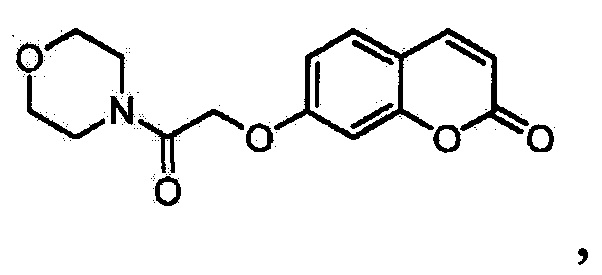
в качестве противосудорожного средства в дозе от 5 до 300 мг/кг у животных.
| ХЛОРПРОПОКСИПРОИЗВОДНЫЕ 7-ОКСИ-КУМАРИНА, ОБЛАДАЮЩИЕ ТРАНКВИЛИЗИРУЮЩИМ И ГЕПАТОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2452732C2 |
| Анксиолитическое средство | 2017 |
|
RU2655929C1 |
| US 5428038 A, 1995.06.27. 7-[2-(morpholin-4-yl)-2-oxoethoxy]-2H-chromen-2-one, Pubchem, найдено онлайн 26.06.2019, найдено в Интернет: https://pubchem.ncbi.nlm.nih.gov/substance/334074120.. | |||
Авторы
Даты
2019-11-12—Публикация
2018-12-28—Подача