Изобретение относится к новому химическому соединению, конкретно к (1S,4aR,5S,6R)-метил-5{2-[1-(2-амино-2-оксоэтил)-2-оксопирролидин-3-ил]этил}-1,4а,6-триметилдекагидронафталин-1-карбоксилату формулы (I):
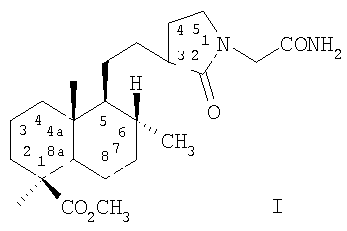
обладающему противосудорожной и анальгетической активностью.
Указанные свойства позволяют предполагать возможность использования соединения в медицине в качестве фармацевтического препарата.
Противосудорожное действие могут оказывать различные вещества, ослабляющие процессы возбуждения или усиливающие процессы торможения в ЦНС. Специальное значение имеют противосудорожные средства, эффективные при эпилепсии и применяемые для предупреждения или купирования судорог или соответствующих им эквивалентов. Используемые в настоящее время противосудорожные (противоэпилептические) агенты можно разделить на средства первой генерации («старые» противосудорожные средства), действие которых рассчитано на усиление центральных тормозных процессов [ГАМК-эргические противоэпилептические средства - пирацетам (ноотропил), фенобарбитал, карбамазепин и вальпроат натрия] и «новые» противосудорожные средства - блокаторы высвобождения центральных возбуждающих аминокислот - глутамата и аспартата (ламотриджин, вигабатрин, леветирацетам).
Основной целью терапии больных эпилепсией является снятие приступа. Однако возможность контроля приступов наблюдается для 60% больных, а 40% пациентов страдают от не поддающейся лечению фармакорезистентной эпилепсии, поэтому для достижения эффекта препараты обеих групп применяют комбинированно (одновременно или последовательно), а также непрерывно и длительно [1, 2]. При этом следует отметить, что клиническое использование «старых» противосудорожных средств часто затруднено из-за их плохой переносимости, выражающейся в общих неблагоприятных эффектах на ЦНС (ухудшение психического состояния), аллергических реакциях организма в виде кожной сыпи, а также токсических реакциях (лейкопения и др. гематологические расстройства) [3, 4]. Подающий надежды терапевтический потенциал «новых» противосудорожных средств, в частности леветирацетама, заключается в возможности их применения (положительном влиянии) при лечении других расстройств ЦНС (мигрень, нарушения мозгового кровообращения) [5], однако их применение в качестве противосудорожных средств также не дает полного контроля возникающих судорог, а приводит лишь к облегчению и укорочению времени припадков. Важным дополнительным свойством некоторых противосудорожных агентов является анальгезирующая активность некоторых соединений. Таким образом, разработка новых противосудорожных средств, обладающих дополнительными эффектами «церебральных протекторов», не оказывающих общего угнетающего влияния на ЦНС, не вызывающих снотворного эффекта и обладающих анальгетической активностью, является актуальной задачей.
Задачей, на решение которой направлено предлагаемое изобретение, является разработка противосу дорожного препарата с дополнительными свойствами (анальгетической активностью) на основе доступного растительного лабданоида ламбертиановой кислоты.
Поставленная задача решается новым химическим соединением (1S,4aR,5S,6R)-3-[2-(1,4,6-триметил-4-метоксикарбонилдекагидронафталин)этил]-2-оксо-1-пирролидинилацетамидом формулы (I), проявляющим выраженную противосудорожную и анальгетическую активность
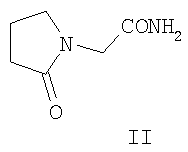
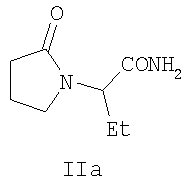
Аналогом по структуре заявляемого соединения является пирацетам (2-оксопирролидин ацетамид) формулы (II), получивший широкое применение в качестве средства, улучшающего функции центральной нервной системы при различных патологических нарушениях. Это соединение явилось «родоначальником» новой группы психотропных лекарственных средств - «ноотропов» [6]. Препарат назначают при разных заболеваниях ЦНС, связанных с сосудистыми нарушениями и патологией обменных процессов головного мозга, часто в комплексной терапии [4, 6]. Аналогом по структуре и свойствам заявляемого соединения является леветирацетам формулы (IIa) - производное пирацетама (II), обладающее противосудорожной (антиэпилептической) активностью [7]. Основным недостаткам фармакологического эффекта указанных препаратов группы пирролидина является развитие побочных эффектов в виде обострения коронарной недостаточности, повышенной раздражительности, беспокойства и нарушения сна [4, 6, 7]:
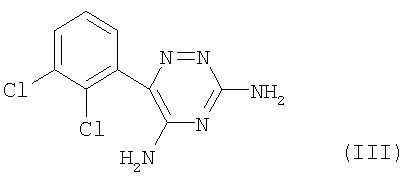
Аналогом по свойствам заявляемого соединения является ламотриджин формулы (III), применяемый в настоящее время противосудорожный (противоэпилептический) препарат [4]. При применении ламотриджина (III) для купирования судорог отмечается головная боль, раздражительность, беспокойство и аллергические реакции [4, 8]:
В настоящей работе нами предлагается модификация химической структуры вышеуказанного препарата (II) путем введения терпеноидного заместителя в положение С-3 и получения пирролидинолабданоида (I).
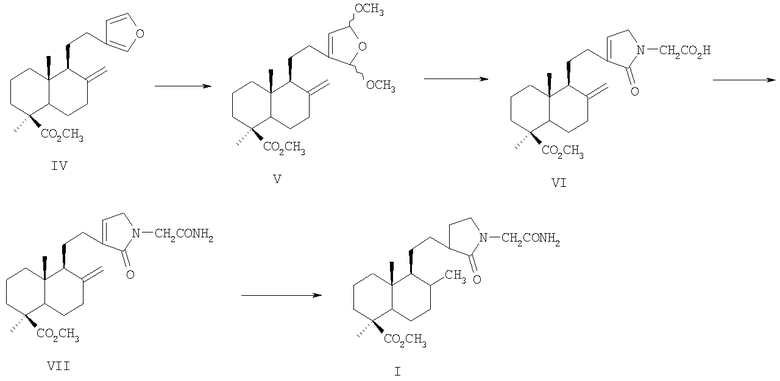
Способ получения соединения (I) из метилового эфира ламбертиановой кислоты (IV) реализуется по приведенной схеме 1. Взаимодействие глицина с терпеноидными ацеталями (V), легко образующимися путем окислительного метоксилирования метилового эфира ламбертиановой кислоты (IV) по методике, описанной нами в работе [9], приводит к лабданоидному N-(2-карбоксиэтил)-(5Н)-пиррол-2-ону (VI). Обработка аминокислоты (VI) триметилхлорсиланом в метаноле и последующая (без выделения) реакция с аммиаком в метаноле дает амид (VII). Гидрирование соединения (VII) на скелетном никеле сопровождается восстановлением экзометиленовой двойной связи и приводит к пирролидинолабданоиду (I). Общий выход агента (I) составляет 52% в расчете на исходный метиловой эфир ламбертиановой кислоты (IV).
Достоинством изобретения является способ получения соединения (I) путем химической модификации доступного растительного метаболита кедра сибирского Pinus sibirica R. Mayr. - метилового эфира ламбертиановой кислоты (IV). Последний, а также необходимая для получения эфира (IV) ламбертиановая кислота легко выделяются из лесопромышленного продукта - живицы или из хвои кедра сибирского [10]. Физико-химические константы новых, впервые полученных соединений приведены в примере 1.
Схема 1
Биологическая активность соединения (I) изучалась путем определения токсичности, противосудорожных свойств на моделях коразоловых и никотиновых судорог, а также анальгетической активности в тесте «уксусные корчи».
Острую токсичность определяли на беспородных мышах массой 18-23 г при однократном внутрижелудочном способе введения. Параметры токсичности рассчитывали по методу Кербера. Установлено, что LD50 соединения (I) превышает максимально возможную для разового введения дозу 1000 мг/кг. Соединение (I) относится к 3-му классу умеренно опасных веществ. LD50 аналога по свойствам ламотриджина (III) составляет 245 мг/кг [8].
Для исследования противосудорожного эффекта были использованы стандартные экспериментальные модели внутрибрюшинного введения конвульсантов коразола и никотина на фоне введения заявляемого соединения. Модели воспроизводились согласно методическим рекомендациям [11]. Результаты изучения биологической активности приведены в табл.1, 2.
Противосудорожную активность оценивали по проценту выживших животных после внутрибрюшинного введения коразола в токсической дозе 90 мг/кг. Исследуемое соединение вводили мышам внутрижелудочно в дозе 10 мг/кг за час до воспроизведения судорог. Результаты представлены в табл.1. Из данных табл.1 видно, что заявляемое соединение в дозе 10 мг/кг в значительной степени блокировало развитие клонических судорог и соответственно уменьшало процент наступления летальных исходов до 10%, тем самым проявляя противосудорожное действие в отношении вводимой дозы конвульсанта. Активность соединения в 2 раза выше, чем у препарата сравнения, введенного в той же дозе.
Противосудорожную активность оценивали по проценту выживших животных после внутрибрюшинного введения никотина в токсической дозе 20 мг/кг. Исследуемое соединение вводили мышам внутрижелудочно в дозе 10 мг/кг за час до воспроизведения судорог. Результаты представлены в табл.2. Из данных табл.2 видно, что заявляемое соединение в дозе 10 мг/кг полностью блокирует развитие судорог, вызванных Н-холиномиметиком никотином и проявляет высокую противосудорожную активность. Активность препарата сравнения ламотриджина (III) в выбранной дозе на модели "никотиновые судороги" значительно ниже.
Таким образом, можно сделать заключение, что заявляемое соединение проявляет противосудорожное действие в тестах «никотиновые» и «коразоловые» судороги. связанное с влиянием агента на нейромедиаторные (ГАМК-эргическую и Н-холинергическую) системы, вовлеченные в регуляцию судорожного ответа.
Анальгетическая активность соединения (I) изучалась на модели висцеральной боли «уксусные корчи» путем однократного введения в дозе 20 мг/кг.«Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0,1 мл на одно животное. Оценка активности осуществлялась по количеству корчей в течение 3 мин. Обезболивающее действие соединения сравнивали с активностью исходного N-ацетамидо-(5Н)-пиррол-2-она (VII) и аналога по структуре пирацетама (II), введенных в той же дозе. Результаты представлены в табл.3. Из полученных результатов видно, что соединение (I) обладает выраженной анальгетической активностью. Анальгетический эффект соединения (I) на порядок выше, чем у исходного N-ацетамидо-(5Н)-пиррол-2-она (VII), и в 8 раз выше, чем у аналога по структуре.
Изобретение иллюстрируется следующими примерами:
Пример 1. Синтез (1S,4aR,5S,6R)-метил-5{2-[1-(2-амино-2-оксоэтил)-2-оксопирролидин-3-ил]этил}-1,4а,6-триметилдекагидронафталин-1-карбоксилата (I)
1. Получение (1S,4aR,5S)-метил 1,4а-диметил-6-метилен-5-[2-(2,5-диметокси-2,5-дигидрофуран-3-ил)этил]декагидронафталин-1-карбоксилатов (V):
а) к раствору 3.3 г (10 ммоль) метилового эфира ламбертиановой кислоты (IV) и 1.5 мл АсОН в 25 мл метанола при температуре 0÷+5°С и перемешивании добавили порциями в течении 10 мин 4.7 г (21 ммоль) натриевой соли N-хлорбензолсульфамида. Перемешивание продолжали 30 мин при 5°С. По окончании реакции (контроль по ТСХ) к смеси добавили 1-2 мл 5%-ного Na2SO3 для разложения избытка хлорамина, затем 50 мл воды, продукт экстрагировали метил-трет-бутиловым эфиром (3×15 мл). Экстракт промыли 3%-ным водным NaOH (3×10 мл) для удаления PhSO2NH2, затем водой и упарили. Хроматографией остатка (петролейный эфир - t-BuOMe, 1:1) получили 3.5 г (90%) смеси цис- и транс-ацеталей (V);
б) раствор 1.2 г (3.6 ммоль) метилламбертианата (IV) в 15 мл метанола охладили до 0°С и добавили порциями при перемешивании 1.3 г (7.2 ммоль) N-бромсукцинимида. Реакционную массу перемешивали 10 мин, затем добавили раствор 1 мл 5%-ного Na2SO3 и 50 мл воды. Продукт реакции извлекли эфиром (3×20 мл), экстракт промыли водой и упарили. Хроматографией остатка выделили 1.2 г (85%) смеси ацеталей (V). Спектр ЯМР 1Н (CCl4), δ, м.д. (J, Гц): 0.47 с (3Н, C20H3), 0.83-1.29 м (3Н, H1,3,9), 1.14 с (3Н, С19Н3), 1.40-2.05 м (10Н, H1,2,2,3,5,6,6,7,11,11), 2.08-2.25 м (2Н, Н7,12), 2.33-2.40 м (1Н, Н12), 3.23 с, 3.24 с, 3.26 с, 3.27 с (соотношение 1:1:1:1) (6Н, 2-СН3О), 3.52 с (3Н, ОСН3), 4.47 с, 4.82 с (2Н, Н17), 5.23 с, 5.27 с, 5.38 д (1Н, Н16, для цис-изомеров J 1.7), 5.50 д, 5.59 д (2Н, Н14,15, J 1.7, 1.6, 1.6).
2. Получение (1S,4aR,5S)-2-{3-12-(1,4а-диметил-6-метилен-1-метоксикарбонилдекагидронафталин-5-ил)этил]-2-оксо-2,5-дигидро-1Н-пиррол-1-ил}уксусной кислоты (VI)
К горячему раствору 0.80 г (10.7 ммоль) глицина в 10 мл 80%-ной уксусной кислоты добавили 1.90 г (5 ммоль) ацеталей (V). Смесь выдерживали на кипящей водяной бане до полного растворения (10-15 мин), после чего охлаждали и разбавляли водой. Продукт извлекали эфиром, экстракт промывали водой, затем 3%-ным раствором соды. Растворитель упаривали, остаток хроматографировали на силикагеле (элюент - петролейный эфир-эфир, 2:1). Получили 1.6 г (82%) аминокислоты (VI) в виде аморфного порошка. Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 0.46 с (3Н, C20H3), 0.85-1.12 м (2Н, Н1,3), 1.15 с (3Н, С19Н3), 1.25 д.д (1Н, Н9, J 12.1, 1.8), 1.40-1,58 м (3Н, Н1,3,9), 1.69-2.11 м (9Н, H1,2,2,3,5,6,6,7,11), 2.36 м (2Н, Н11,12), 2.62 м (2Н, Н7,12), 3.58 с (3Н, ОСН3), 3.68 д.д (2Н, СН3, J 10.2, 1.9), 3.93 с (2Н, Н15), 4.56 с, 4.83 с (2Н, Н17). 6.59 у.с (1Н, Н14), 9.07 м (1Н, ОН). Найдено, %: С 68.22, Н 8.63, N 3.62. C23H33NO5. Вычислено, %: С 68.46, Н 8.24, N 3.47.
3. Получение (1S,4aR,5S)-метил-5-{2-[1-(2-амино-2-оксоэтил)-2-оксо-2,5-дигидро-1Н-пиррол-3-ил]этил}-1,4а-диметил-6-метилендекагидронафталин-1-карбоксилата (VII)
К раствору 1.52 г (3.85 ммоль) кислоты (VI) в 10 мл абсолютного метанола добавили по каплям при перемешивании 1.50 мл (~10 ммоль) триметилхлорсилана. Смесь выдерживали 2 ч при комнатной температуре (контроль ТСХ), после чего упаривали досуха. Остаток растворяли в 15 мл 10%-ного раствора NH3 в метаноле и оставили на 2 суток. По окончании реакции раствор выливали в воду, продукт извлекали эфиром, экстракт промывали водой 2 раза, остаток хроматографировали на окиси алюминия (МеОН). Растворитель упаривали, получили 1.1 г амида (VII) в виде светло-желтого аморфного порошка. Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 0.43 с (3Н, C20H3), 0.75-1.20 м (3Н, Н1,3,9), 1.11 с (3Н, C19H3), 1.40-1.99 м (10Н, H1,2,2,3,5,6,6,7,11,11), 2.08 м (1Н, Н12), 2.29 м (2Н, Н7,12), 3.55 с (3Н, ОСН3), 4.01 м (4Н, 2Н-СН2 и 2Н, Н15), 4.58 с, 4.80 с (2Н, Н17), 6.63 у.с (1Н, Н14), 6.80 м, 7.30 м (2Н, NH2). Найдено, %: С 68.32, Н 8.43, N 7.06. C23H34N2O4. Вычислено, %: С 68.63, Н 8.51, N 6.96.
4. Получение (1S,4aR,5S,6R)-метил-5{2-[1-(2-амино-2-оксоэтил)-2-оксопирролидин-3-ил]этил}-1,4а,6-триметилдекагидронафталин-1-карбоксилата (I)
Раствор 1.2 г (3.08 ммоль) амида (VII) в 10 мл метанола гидрировали при атмосферном давлении над никелем Ренея (из 4.0 г никель-алюминиевого сплава). После полного прекращения поглощения водорода (6-8 ч) катализатор отфильтровывали, растворитель упаривали. Остаток хроматографировали на окиси алюминия (элюент - МеОН). Растворитель упаривали, получили 1.1 г (1S,4aR,5S,6R-3-[2-(1,4а,6-триметил-1-метоксикарбонилдекагидронафталин)этил]-2-оксо-1-пирролидинилацетамида (I) в виде белого аморфного порошка. Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 0.48 с (3Н, C20H3), 0.80-1.20 м (3Н, Н1,3,9), 1.14 с (3Н, С19Н3), 1.22 д. 1.28 д (3Н, С17Н3, J 7.0), 1.40-1.99 м (10Н, H1,2,2,3,5,6,6,7,11,11), 2.08 м (1H, H12), 2.29 (2Н, Н7,12), 3.01 м (2H, H14), 3.59 с (3Н, ОСН3), 4.01 м (2Н, СН2), 4.12 м (2Н, Н15), 3.48 м (1Н, H13), 6.80 м, 7.30 м (2Н, NH2). Найдено, %: С 68.13, Н 9.30. N 6.61. C23H34N2O4. Вычислено, %: С 67.95, Н 9.42, N 6.89.
Общий выход агента (I) в расчете на исходный метиловой эфир ламбертиановой кислоты (IV) составляет 52%.
Пример 2. Исследование противосудорожной активности соединения (I) в тесте «коразоловые судороги».
Судороги вызывали у беспородных мышей самцов путем однократного внутрижелудочного введения коразола в токсической дозе 90 мг/кг. Соединение (I) вводили животным внутрижелудочно в дозе 10 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения судорог. Контрольным животным аналогично вводили водно-твиновую взвесь в эквивалентном объеме. Противосудорожную активность оценивали по проценту выживших животных. Экспериментальные группы были сформированы по 8 животных в каждой. Статистическую обработку данных осуществляли с помощью пакета программ «STATISTIKA 6». Результаты эксперимента представлены в табл.1. Установлено, что соединение (I) проявляет достоверный противосудорожный эффект в дозе 10 мг/кг. Агент (I) блокирует развитие клонических судорог и значительно снижает наступление летальных исходов по сравнению с контролем (табл.1).
Пример 3. Исследование противосудорожной активности соединения (I) в тесте «никотиновые судороги». Судороги вызывали у беспородных мышей-самцов путем однократного внутрижелудочного введения никотина в токсической дозе 20 мг/кг. Соединение (I) вводили животным внутрижелудочно в дозе 10 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения судорог. Контрольным животным аналогично вводили водно-твиновую взвесь в эквивалентном объеме. Противосудорожную активность оценивали по проценту выживших животных. Результаты обрабатывали статистически с помощью пакета программ «STATISTIKA 6». Результаты эксперимента представлены в табл.2. Установлено, что соединение (I) проявляет достоверный противосудорожный эффект в дозе 10 мг/кг. Агент (I) полностью блокирует развитие судорог, вызванных Н-холиномиметиком никотином, и проявляет высокую противосудорожную активность.
Пример 4. Исследование анальгетической активности соединения (I) в тесте «уксусные корчи». Эксперимент проводили на беспородных мышах-самцах массой 22-25 г.Экспериментальные группы были сформированы по 8 животных в каждой. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0,1 мл на одно животное. Исследуемый агент (I) в дозе 10 мг/кг вводился однократно внутрижелудочно за час до воспроизведения модели. Контролем являлись животные с введением только уксусной кислоты. Оценка активности осуществлялась по количеству корней в течение 3 мин. Результаты представлены в табл.3. Установлено, что соединение (I) проявляет достоверный анальгетический эффект на модели «уксусные корчи». Агент (I) блокирует развитие болевого эффекта, вызванного введением уксусной кислоты, и проявляет высокую анальгетическую активность.
Таким образом, предлагаемое изобретение обладает следующими преимуществами, а именно:
- высокая противосудорожная активность в тестах «никотиновые» и «коразоловые» судороги;
- анальгетическая активность в тесте «уксусные корчи»;
- пониженная токсичность по сравнению с эталонными препаратами;
- использование для получения заявляемого соединения доступного растительного сырья - хвои или живицы кедра сибирского.
Источники информации
1. Р.Kwan, M.J.Brodie. Early Identification of Refractory Epilepsy. N. Engl. J. Med. 2000. V.342. No 2. P.314-320.
2. W.Loscher, H.Potschka. Role of Multidrug Transporters in Pharmacoresistance to Antiepileptic Drugs. J. Pharmacol. Exp. Ther., 2002. V.301. No 1. P.7-14.
3. R.S.Greenwood. Adverse Effects of Antiepileptic Drugs. Epilepsia, 2000. В.41. S.42-52.
4. М.Д.Машковский. Лекарственные средства, изд. 15. Москва, Новая Волна, 2005, 31-38.
5. P.N.Patsalos. Antiepileptic Drugs: Newly Lecensed and Under Development. Curr. Opin. CPNS Invest. Drugs., 1999. V.5. P.549-562.
6. М.Д.Машковский. Лекарства XX века. Москва, Новая Волна, 1998, 118-120.
7. B.M.Kenda, A.C.Matagne. P.E.Talaga, P.M.Pasau, E.Differding, B.I.Lallemand, A.M.Frycia, F.G.Moureau, H.V.Klitgaard, M.R.Gillard, B.Fuks, P.Michel. Discovery of 4-Substituted Pyrrolidone Butanamides as New Agents with significant Antiepileptic Activity. J. Med. Chem., 2004. V.47. No 3. P.530-549.
8. Г.О.Бакунц, Г.С.Бурд, М.Я.Вайнтруб. Журнал неврол. и психиатр., 1995. №3. С.41-45.
9. Е.Е.Shults, J.Velder, H.-G.Schmalz, S.V.Chernov, T.V.Rubalova, Y.V.Gatilov, G.Henze, G.A.Tolstikov and A. Prokop. Gram-scale synthesis of pinusolide and evaluation of its antileukemic potential. Bioorg. Med. Chem. Lett. 2006, V.16. No 16. P.4228-4232.
10. Т.Г.Толстикова, И.В.Сорокина, М.П.Долгих, Ю.В.Харитонов, С.В.Чернов, Э.Э.Шульц, Г.А.Толстиков. Химико-фармацевтический журнал. 2004. Т.38, №10. С.13-15.
11. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.У.Хабриева. Москва, Медицина, 2005, 832 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-ЗАМЕЩЕННЫЕ (1S,4aR,5S)-МЕТИЛ-5-[2-(2'-ОКСО-2',5'-ДИГИДРО-1Н-ПИРРОЛ-3'-ИЛ)ЭТИЛ]-1,4a-ДИМЕТИЛ-6-МЕТИЛЕНДЕКАГИДРОНАФТАЛИН-1-КАРБОКСИЛАТЫ, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2385863C2 |
| 16-(1,2,4-ОКСАДИАЗОЛ-3-ИЛ)-15,16-ЭПОКСИЛАБДАНОИДЫ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2011 |
|
RU2473550C1 |
| АМИДЫ ЛАМБЕРТИАНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ И СТИМУЛИРУЮЩИМ ДЕЙСТВИЕМ | 2013 |
|
RU2534987C1 |
| 2-(4-ГИДРОКСИ-3-МЕТОКСИФЕНИЛ)-4,7-ДИМЕТИЛ-3,4,4а,5,8,8а-ГЕКСАГИДРО-2Н-ХРОМЕН-4,8-ДИОЛ - НОВОЕ АНАЛЬГЕЗИРУЮЩЕЕ СРЕДСТВО | 2010 |
|
RU2430100C1 |
| 16-{2-БЕНЗОИЛАМИНО-2-[(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИФЕНИЛ)-АЛКИЛКАРБАМОИЛ]ВИНИЛ}-ЛАБДАТРИЕНЫ С АНТИОКСИДАНТНЫМИ, ГЕПАТОПРОТЕКТОРНЫМИ И ГЕМОСТИМУЛИРУЮЩИМИ СВОЙСТВАМИ | 2007 |
|
RU2346940C1 |
| (E)-2-(4-{[3-(2,4-ДИМЕТОКСИФЕНИЛ)АКРИЛАМИДО]МЕТИЛ}-1H-1,2,3-ТРИАЗОЛ-1-ИЛ)-2-ИЗОПРОПИЛ-9-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-3,7-ДИОКСО-3,7-ДИГИДРО-2H-ФУРО[3,2-g]ХРОМЕН, ОБЛАДАЮЩИЙ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2549574C1 |
| ПРИМЕНЕНИЕ 4,7-ДИМЕТИЛ-2-(ПРОП-1-ЕНИЛ)-3,4,4a,5,8,8a-ГЕКСАГИДРО-2Н-ХРОМЕН-4,8-ДИОЛА В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2009 |
|
RU2418578C1 |
| ПРИМЕНЕНИЕ 2-ГИДРОКСИ-3-МЕТИЛ-6-(1-МЕТИЛЭТЕНИЛ)ЦИКЛОГЕКС-3-ЕНОНА В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2010 |
|
RU2421213C1 |
| 2-(3-ГИДРОКСИ-4-МЕТОКСИФЕНИЛ)-4,7-ДИМЕТИЛ-3,4,4а,5,8,8а-ГЕКСАГИДРО-2Н-ХРОМЕН-4,8-ДИОЛ В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2013 |
|
RU2506079C1 |
| 6-ГИДРОКСИНАФТОХИНОНЫ ЛАБДАНОВОГО ТИПА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2012 |
|
RU2479582C1 |
Изобретение относится к новому соединению (1S,4aR,5S,6R)-Метил-5{2-[1-(2-амино-2-оксоэтил)-2-оксопирролидин-3-ил]этил}-1,4а,6-триметилдекагидронафталин-1-карбоксилату формулы (I)

обладающему противосудорожной и анальгетической активностью. Соединение получают из растительного сырья - хвои или живицы кедра сибирского. 3 табл.
(1S,4aR,5S,6R)-Метил-5{2-[1-(2-амино-2-оксоэтил)-2-оксопирролидин-3-ил]этил}-1,4а,6-триметилдекагидронафталин-1-карбоксилат формулы (I)

обладающий противосудорожной и анальгетической активностью.
| J | |||
| Med | |||
| Chem., 2004, v.47, n.3, p.530-549 | |||
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Новая волна, 2005, с.31-38 | |||
| WO 00/32588, 08.06.2000. |
Авторы
Даты
2010-04-10—Публикация
2008-04-21—Подача