Изобретение относится к нейродегенеративным нарушениям и, в частности, к новым пептидам, композициям, терапиям и способам лечения таких состояний как, например, болезнь Альцгеймера.
Болезнь Альцгеймера в первую очередь поражает мужчин и женщин в возрасте старше 65 лет, и есть вероятность того, что диагностирование болезни значительно увеличивается с возрастом. Поскольку процент взрослых в возрасте старше 65 лет, как ожидается, будет расти во всем мире в течение следующих 40 лет, заболеваемость болезнью Альцгеймера, как ожидается, возрастет более чем в два раза, увеличившись с 21 миллиона случаев в 2010 году до 53 миллионов в 2050 году (статистика из www.alzheimersresearchuk.org и www.alz.org). Это экспоненциальное увеличение ожидаемого числа пациентов, страдающих болезнью Альцгеймера, не только представляет собой основную область неудовлетворенной медицинской потребности, но и предоставляет значительную рыночную возможность для терапии и диагностики, поскольку в настоящее время нет полностью эффективного метода лечения болезни.
В последние 10 лет не было нового препарата для борьбы с болезнью Альцгеймера или нейродегенерацией в более общем плане. Причина в том, что лежащий в основе механизм головного мозга до сих пор еще не идентифицирован, на что, следовательно, может быть нацелена фармацевтическая деятельность. Основным претендентом на объяснение процесса нейродегенерации является «амилоидная гипотеза», в которой смерть нейронов связана с нарушением клеточной мембраны токсичными отложениями амилоида, характерными для посмертного мозга Альцгеймера, и происходит в результате аномального расщепления белка предшественника амилоида. Однако эта «амилоидная гипотеза» не объясняет сопутствующую патологию, которая часто наблюдается при болезнях Альцгеймера и Паркинсона, а также характерную селективность клеток, уязвимых к дегенерации, несмотря на потенциальную повсеместность амилоида во всех клетках головного мозга или отсутствие амилоидных отложений у животных моделей деменции, а также появление амилоида в определенных областях мозга, где когнитивный дефицит не проявляется. Несмотря на популярность амилоидной структуры в качестве фармацевтической мишени в течение последних двух десятилетий, никакое лечение, основанное на этой теории, пока не оказалось эффективным. Более вероятно, что когда происходит нейродегенеративный процесс, тогда амилоид будет дополнительно генерироваться как вторичный, усугубляющий эффект, который является менее специфичным.
Один ключ к определению первичного механизма нейродегенерации может заключаться в том, что в первую очередь уязвимы только различные нейронные группы. Более того, разнообразные подгруппы клеток, склонные к болезням Альцгеймера, Паркинсона и болезни моторных нейронов, тем не менее, примыкают друг к другу и образуют непрерывное «ядро», простирающееся от ствола мозга до переднего мозга, которое посылает диффузные проекции вверх и наружу в более высокие церебральные центры. Следовательно, несмотря на свою гетерогенность в трансмиттерах, эти нейронные группы коллективно называются «глобальными» нейронами, чтобы отличить их от более известных и локализованных схем клеток в большинстве других частей мозга, таких как мозжечок, таламус, кора и т.д. Эти селективно уязвимые глобальные нейроны были ранее идентифицированы, хотя и с использованием другой терминологии («изодендритное ядро»), как ключевые в нейродегенерации, несколько десятилетий назад.
Подгруппы глобальных нейронов имеют общую особенность, которая может объяснить затруднительный и еще не имеющий ответа вопрос о том, почему только эти клетки поддаются прогрессивной смерти, в то время как их аналоги в других местах мозга, даже при повреждении от удара, нет: они сохраняют хорошую пластичность в и на протяжении всей взрослой жизни и сопровождаются особой чувствительностью к веществам, помогающим и поддерживающим рост - «трофическим факторам». В развивающемся мозге, трофические факторы работают, стимулируя приток кальция, который вызывает каскад событий в клетке, что в конечном итоге приводит к избирательной дифференциации и росту. Однако в более высоких дозах или при более длительном воздействии непрерывный вход кальция может быть токсичным для нейронов. Наиболее важно, что еще одним определяющим фактором в том, является ли вход кальция пусковым механизмом трофических или токсических эффектов, является возраст: по мере созревания нейронов прежний трофический уровень внутриклеточного кальция становится смертельным.
Изобретатели ранее предположили, что нейродегенеративный процесс фактически является аберрантно активированным процессом развития. В подтверждение этой гипотезы, гипертрофия нейронов «ядра» мозгового ствола на самом деле была зарегистрирована у пациентов с болезнью Альцгеймера (Bowser et al., 1997, Brain Pathol. 7:723-30). Если большие участки этого ядра повреждены, тогда будет представлено более одного нейродегенеративного заболевания, как это происходит в часто встречающихся, но еще не объясненных случаях сопутствующей патологии с болезнями Альцгеймера и Паркинсона. Интересно, что все нейроны в уязвимом ядре глобальных нейронов, несмотря на гетерогенность трансмиттеров, все содержат известный фермент ацетилхолинэстеразу (AChE). Таким образом, AChE присутствует в нейронах, где она не сможет выполнять свою нормальную функцию, поскольку такие подгруппы клеток, как норадренергические голубого пятна, дофаминергические черного вещества или серотонинергические ядер шва, ни в коем случае не содержат обычного субстрата ацетилхолина. Еще одно неожиданное отклонение от ее нормальной, ферментативной роли заключается в том, что AChE фактически высвобождается из глобальных нейронов, по-видимому, как какой-то межклеточный мессенджер сам по себе. В общем, AChE в настоящее время широко и хорошо зарекомендовала себя как сигнальная молекула, которая обладает трофической активностью в самых разных ситуациях, как в нервной, так и в не нервной ткани.
Изобретатели ранее продемонстрировали, что AChE, действующая в качестве трофического агента, не зависящего от ее ферментативного действия, действительно инициирует проникновение кальция в нейроны. Поэтому возможно, что внутри глобальных нейронов AChE имеет двойное неклассическое действие, которое колеблется вдоль трофическо-токсичной оси в зависимости от количества, продолжительности доступности и, самое главное, возраста. Если стандартные нейроны повреждены во взрослой жизни, то, как и при инсульте, другие будут функционально компенсироваться. Напротив, глобальные нейроны будут реагировать путем активации своих трофических ресурсов в попытке регенерации. Но поскольку последующий приток кальция будет смертельным в старших, зрелых клетках, то полученный урон вызовет дальнейшие попытки компенсировать губительный цикл, который характеризует нейродегенерацию.
Ацетилхолинэстераза (AChE) экспрессируется на разных стадиях развития в различных формах, все из которых обладают одинаковой ферментативной активностью, но имеют различный молекулярный состав. «Имеющая хвост» (T-AChE) экспрессируется в синапсах, и изобретатели ранее идентифицировали два пептида, которые могли быть отщеплены от С-конца, один из которых упоминается как «Т14», внутри другого, который известен как «Т30», и они оба имеют сильную гомологию последовательностей с сопоставимым участком β-амилоида. С-концевой пептид AChE «Т14» был идентифицирован как существенная часть молекулы AChE, ответственной за ее диапазон негидролитических действий. Синтетический аналог 14-аминокислотного пептида (т.е. «Т14»), и впоследствии более крупная, более стабильная и более мощная аминокислотная последовательность, в которую он встроен (т.е. «Т30») демонстрируют действия, сравнимые с показаниями для «нехолинергического» AChE, где инертный остаток в последовательности Т30 (т.е. «Т15») не имеет эффекта.
Острые эффекты Т14 и Т30 заключаются в том, что они: - (i) модулируют вхождение кальция в нейроны в срезах головного мозга во временных масштабах от миллисекунд до часов; (ii) компрометируют жизнеспособность клеток в PC12 клетках, а также в органотипических культурах нейронов in vitro; (iii) модулируют «компенсаторное» кальций-индуцированное высвобождение AChE из нейронов и клеток PC12; (iv) активируют поток кальция в ооцитах и нейронах в срезах мозга; (V) действуют синнергически с амилоидом при токсических эффектах; и (vi) участвуют в продуцировании белка-предшественника амилоида и высвобождении пептида бета-амилоида (Аβ). Хронические эффекты Т14 и Т30 заключаются в том, что они: - (i) уменьшают рост нейронов; (ii) индуцируют апоптоз; (iii) увеличитвают высвобождение AChE; (iv) связывают и модулируют α7 никотиновый рецептор; и (v) усиливают экспрессию α7-рецептора на поверхности клетки в течение 24 часов, тем самым обеспечивая механизм упреждающего нервного сигнала для дальнейшей токсичности.
Поскольку Т14 и Т30 более селективны, чем β-амилоид в индуцировании токсичности, а также синергичны с усугубляющей амилоидной токсичностью, было постулировано, что любой агент, который блокирует токсические эффекты Т14 или Т30, будет также уменьшать менее селективный и последующий токсический эффект амилоида. Изобретатель ранее показал, что пептиды Т30 и Т14 связываются с аллостерическим сайтом на α7-никотиновом рецепторе для индуцирования спектра трофическо-токсических эффектов. Этот рецептор ко-экспрессируется с AChE в критические периоды развития головного мозга, а также демонстрирует близко параллельное распределение во взрослом мозге и является одним из самых мощных ионофоров кальция в головном мозге. Он также может функционировать независимо от холинергической передачи, поскольку холин (полученный из питания) может служить альтернативным первичным лигандом. Более того, этот рецептор уже был вовлечен в болезнь Альцгеймера как одна из целей для текущей терапии галантамина (Reminyl (RTM)), а также связан с действиями амилоида.
Однако эффективность галантамина оказалась ограниченной, в то время как другие антагонисты α7 никотиновых ацетилхолиновых рецепторов все еще находятся в клинических испытаниях. Галантамин не только оказывает неспецифическое действие на другие рецепторы, но также ингибирует AChE, но он имеет низкую аффинность к α7-никотиновому рецептору (т.е. только 10 мкМ) по сравнению с Т30 и Т14, которые имеют гораздо более высокую аффинность для α7-никотинового рецептора (т.е. 5 нМ). Следовательно, если в мозге больного болезнью Альцгеймера эндогенный эквивалент пептида Т30 уже занимает соответствующий сайт рецептора, галантамин нужно будет давать в нефизиологических, высоких дозах с неизбежными побочными эффектами и, что наиболее важно, сомнительной эффективностью.
Изобретатели ранее показали, что циклические полипептиды, содержащие аминокислотную последовательность, полученную из С-конца ацетилхолинэстеразы (AChE), избирательно ингибируют неклассические эффекты AChE (то есть эффекты AChE, которые не зависят от его ферментативной активности) и/или его конечный пептид in vitro и, следовательно, может быть использован для лечения нейродегенеративных нарушений. Например, циклический пептид, обозначенный как «NBP14», который показан на Фиг. 2 и 3, является особенно активным, поскольку он действует как аллостерический модулятор α7-никотинового рецептора, антагонизируя эффектам пептидов AChE и бета-амилоида. Было показано, что он защищает клетки от токсичности линейных Т14, Т30 и β-амилоидов и блокирует компенсаторное высвобождение AChE, вызванное токсичностью линейных Т14 и Т30. Кроме того, они отметили, что только один циклический NBP14 не оказывает существенного влияния на концентрации Са2+ в срезах мозга крыс, но блокирует эффекты β-амилоида.
Однако, несмотря на активность, проявляемую циклическим NBP14, из-за его размера существуют некоторые проблемы его способности пересекать гематоэнцефалический барьер. Поэтому существует постоянная потребность в улучшенных лекарственных средствах для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона.
Как обсуждалось в примерах, изобретатели основывались на своей предыдущей работе, обращая свое внимание на небольшие линейные пептиды (т.е. длиной 4-14 аминокислот), полученные из С-конца ацетилхолинэстеразы (AChE) или их циклические варианты. Они продуцировали множество пептидов и обнаружили, что неожиданно можно классифицировать активные линейные пептиды, которые полезны для лечения нейродегенеративных нарушений, и отделяют их от неактивных линейных пептидов, которые не являются полезными. Эти активные и неактивные пептиды классифицируются на основе их нейропротекторной эффективности от Т30 или амилоида, что измеряется с помощью уменьшения потери клеток и сопутствующего компенсационного высвобождения AChE, то есть значением коэффициента, который определяется путем вычисления процента ацетилхолинэстеразы, высвобожденной из PC12 клеток, культивируемых в присутствии линейного пептида по сравнению с PC12 клетками в отсутствие пептида, и делением этого значения на процент жизнеспособности клеток PC12 в присутствии пептида.
Таким образом, согласно первому аспекту изобретения, предлагается пептид, его производное или его аналог, содержащий или состоящий из последовательности от 5 до 8 аминокислот, которые получены из С-конца ацетилхолинэстеразы (AChE), или циклического варианта или ее усечения, отличающийся тем, что пептид, его производное или его аналог имеет коэффициент х от 1,0 до 1,1,
где 
где «% выхода AChE» представляет собой процент ацетилхолинэстеразы, получаемой из препарата клеток PC12, культивируемых в присутствии токсичного пептида, выбранного из Т30 (SEQ ID No: 156) или Аβ (SEQ ID NO: 158), и пептида, его производного или его аналога, по сравнению с таковым в препарате клеток PC12, культивированных в отсутствие какого-либо пептида, его производного или его аналога (т.е. контроля), а «% жизнеспособности клеток PC12» представляет собой процент жизнеспособности препарата клеток PC12, культивируемых в присутствии токсичного пептида, выбранного из Т30 (SEQ ID No: 156) или Аβ (SEQ ID NO: 158), и пептида, его производного или его аналог, по сравнению с таковым в препарате клеток PC12, культивированных в отсутствие какого-либо пептида, его производного или его аналога (т.е. контроль).
Как описано в примерах, авторы неожиданно показали, что можно отделить активные пептиды от неактивных на основе их значений коэффициентов (X), которые представляют их защитную эффективность от токсичности Т30 и Аβ. Контрольное значение, т.е. отсутствие пептида составляет 1,0. Значение коэффициента представляет собой соотношение двух биологических параметров, где х=1,0-1,1 означает отсутствие токсичности или защитных свойств, и где х>1,1 означает токсичность. Значение для Т30 равно х=169,45/74,309=2,28, а для бета-амилоида (Аβ) х=124,19/87,42=1,42.
В таблицах 1 и 2 показано влияние линейных пептидов на активность AChE и жизнеспособность клеток PC12 против токсичности Т30 и Аβ. Как видно, некоторые пептиды являются защитными, тогда как другие не предотвращают токсичность. Нельзя было предсказать, что пептиды по изобретению будут нарушать эндогенный эквивалент пептида Т30, уже занимающего соответствующий сайт рецептора. Соответственно, пептид первого аспекта предотвращает ранее установленные токсические эффекты линейных Т30 (и Т14) пептидов, а также β-амилоида (Аβ). Другим критерием является то, что активный пептид имеет длину 5-8 аминокислот, поскольку считается, что соединения большего размера имеют меньшую вероятность получить доступ к мозгу с периферии, то есть пересечь гематоэнцефалический барьер. Соответственно, использование двух критериев (т.е. длины аминокислот и нейропротекторной активности) позволяет изолировать нейропротективные линейные пептиды, как по структуре, так и по функциям. Таким образом, изобретатели уверены в их эффективности in vivo и считают, что пептиды по изобретению будут иметь значительную полезность для лечения нейродегенеративных нарушений в стабилизации любой дальнейшей потери клеток.
Во втором аспекте изобретения предлагается один или более пептидов, их производных или аналогов в соответствии с первым аспектом для примененич в терапии или диагностике.
В третьем аспекте предоставляется один или более пептидов, их производных или аналогов в соответствии с первым аспектом, для использования в лечении, уменьшении интенсивности или предотвращении нейродегенеративного расстройства.
В четвертом аспекте предложен способ лечения, уменьшения интенсивности или предотвращения нейродегенеративного расстройства у субъекта, причем способ включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более пептидов, производных или аналогов в соответствии с первым аспектом.
Нейродегенеративное расстройство, которое лечат, предпочтительно по одному, характеризуется повреждением или гибелью «глобальных» нейронов. Например, нейродегенеративное расстройство может быть выбрано из группы, состоящей из болезни Альцгеймера; болезни Паркинсона; болезни Хантингтона; болезни моторных нейронов; спиноцеребеллярной атаксии типа 1, типа 2 и типа 3; бокового амиотрофического склероза (БАС); шизофрении; деменции с тельцами Леви; и лобно-височной деменции.
Предпочтительно, что нейродегенеративное расстройство, которое лечится, представляет собой болезнь Альцгеймера, болезнь Паркинсона или болезнь моторных нейронов. Наиболее предпочтительно, нейродегенеративное расстройство, которое лечится пептидом, его производным или его аналогом в соответствии с первым аспектом, представляет собой болезнь Альцгеймера.
Термин «производное или его аналог» может означать пептид, в котором аминокислотные остатки заменяются остатками (независимо от того, являются ли аминокислоты природными аминокислотами, неприродными аминокислотами или миметиками аминокислоты) с аналогичными боковыми цепями или свойствами пептидного остова. Кроме того, концы таких пептидов могут быть защищены с помощью N- и С-концевых защитных групп с аналогичными свойствами ацетильных или амидных групп.
Производные и аналоги пептидов согласно изобретению могут также включать те, которые увеличивают период полужизни пептида in vivo. Например, производное или аналог пептидов по изобретению может включать пептоидные и ретропептоидные производные пептидов, пептид-пептоидных гибридов и производные D-аминокислот пептидов.
Пептоиды или поли-N-замещенные глицины представляют собой класс пептидомиметиков боковые цепи которых присоединены к атому азота пептидного остова, а не к альфа-углеводам, так как они расположены в аминокислотах. Пептоидные производные пептидов по изобретению могут быть легко разработаны исходя из знания структуры пептида. Ретропептоиды (в которых все аминокислоты заменены пептоидными остатками в обратном порядке) также являются подходящими производными в соответствии с изобретением. Предполагается, что ретропептоид связывается в противоположном направлении в лиганд-связывающей борозде по сравнению с пептидным или пептоид-пептидным гибридом, содержащим один пептоидный остаток. В результате боковые цепи пептоидных остатков могут указывать в том же направлении, что и боковые цепи в исходном пептиде.
Термин «полученный из» может означать аминокислотную последовательность, которая представляет собой производное или модификацию аминокислотной последовательности, которая присутствует в или образует С-конец AChE и его части, или их циклический вариант, такой как NBP-14.
Термин «его усечение» может означать, что пептид, полученный из AChE, уменьшается в размерах путем удаления аминокислот. Редукция аминокислот может быть достигнута путем удаления остатков из С- или N-конца пептида или может быть достигнута путем делеции одной или более аминокислот внутри ядра пептида.
В одном варианте реализации изобретения, пептид, его производное или его аналог по первому аспекту может быть циклическим или зацикленным. Однако, наиболее предпочтительно, чтобы пептид, его производное или его аналог не был циклическим или зацикленным. Предпочтительно, пептид, его производное или его аналог являются линейными. Предпочтительно, пептид, его производное или его аналог очищают и/или выделяют, т.е. он не встречается в природе. Предпочтительно, пептид, его производное или его аналог по меньшей мере на 95% чистый или по меньшей мере на 99% чистый, т.е. свободный от примесей.
Ацетилхолинэстераза представляет собой сериновую протеазу, которая гидролизует ацетилхолин и будет хорошо известна специалисту. Основная форма ацетилхолинэстеразы, которая находится в головном мозге, известна как хвостовая ацетилхолинэстераза (Т-АХЕ). Учитывая, что изобретение в первую очередь касается лечения нейродегенеративных нарушений, предпочтительно, чтобы пептид, его производное или его аналог содержал или состоял из аминокислотной последовательности, полученной из С-конца хвостовой ацетилхолинэстеразы (Т-АХЕ), или циклического варианта или их усечения.
Белковая последовательность одного варианта реализации хвостовой ацетилхолинэстеразы человека (Gen Bank: ААА68151.1) составляет 614 аминокислот в длину и представляется в данном документе как SEQ ID NO: 157 следующим образом:

Следует принять во внимание, что первые 31 аминокислотных остатков SEQ ID No: 157 удаляются, в то время как белок высвобождается, тем самым оставляя последовательность 583 аминокислот. Соответственно, предпочтительно, чтобы пептид, его производное или его аналог содержал аминокислотную последовательность, полученную от С-конца ацетилхолинэстеразы, или циклического варианта или его усечения, причем ацетилхолинэстераза содержит аминокислотную последовательность, фактически, как указано в SEQ ID No: 157 или функциональный вариант или ее фрагмент. Предпочтительно, 31 аминокислота на N-конце исключена.
Предпочтительно, пептид, его производное или его аналог содержит или состоит из аминокислотной последовательности, полученной из последних 300, 200, 100 или 50 аминокислот, образующих С-конец ацетилхолинэстеразы, или циклического варианта или ее усечения, наиболее предпочтительно, ацетилхолинэстераза содержит аминокислотную последовательность, фактически, как указано в SEQ ID No: 157. Пептид, его производное или его аналог предпочтительно содержит или состоит из аминокислотной последовательности, полученной из последних 40 или 30 аминокислот, образующих С-конец ацетилхолинэстеразы, или циклического варианта или их усечения.
Как описано в примерах, и как продемонстрировано графически на Фиг. 7, изобретатели разработали набор критериев, по которым определяются активные пептиды. Первый критерий, используемый для установления активных пептидов, заключается в том, что коэффициент значения (х), который является мерой активности AChE и жизнеспособности клеток PC12, составляет от 1,0 до 1,1. Другим критерием было то, что активный пептид имел длину 5-8 аминокислот, так как считается, что соединения большего размера имеют меньшую вероятность получить доступ к мозгу с периферии, т.е. пересечь гематоэнцефалический барьер.
Другой критерий, используемый для определения активных пептидов, основывался на теоретической величине связывания пептида с аллостерическим сайтом α7-никотинового рецептора. Теоретическое значение связывания можно вычислить, используя алгоритм, опубликованный Trott и Olso (Ref: О. Trott, A. J. Olson, AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization and multithreading, Journal of Computational Chemistry 31 (2010) 455-461). Следовательно, предпочтительно, пептид, его производное или его аналог имееют теоретическую аффинность связывания с аллостерическим сайтом α7-никотинового рецептора равную менее чем -7,0 ккал.моль-1, более предпочтительно равную менее чем -7,1 ккал.моль-1 и наиболее предпочтительно равную менее чем -7,8 ккал.моль-1.
Конечным критерием, используемым для определения активных пептидов, является величина притока кальция в клетки PC12, вызванного пептидом. Значение притока кальция можно рассчитать, как описано в разделе «Методы». Значение кальция соответствует результатам эксперимента при применении Т30 или Аβ отдельно или в сочетании с небольшими пептидами. Контрольное значение для этих экспериментов основано на притоке кальция, индуцированном только ацетилхолином. Предпочтительно, пептид, его производное или его аналог имеет значение притока кальция менее чем 120 и, более предпочтительно, значение 97-120.
Предпочтительно, пептид, его производное или его аналог состоит из последовательности от 5 до 8 аминокислот, которые получены из С-конца ацетилхолинэстеразы (AChE) или их циклического варианта.
Поэтому особенно предпочтительно, чтобы пептид, его производное или его аналог имели: (i) 5-8 аминокислот в длину; (ii) имели значение коэффициента х, от 1,0 до 1,1; (iii) имели теоретическое значение связывания пептида с аллостерическим сайтом α7-никотинового рецептора равное менее чем -7,0; и имели значение притока кальция равное менее чем 120.
В наиболее предпочтительном варианте реализации изобретения, пептид, его производное или его аналог имеет: (i) 5-8 аминокислот в длину; (ii) имеет значение коэффициента, х, от 1,0 до 1,1; (iii) имеет теоретическое значение связывания пептида с аллостерическим сайтом α7-никотинового рецептора равное менее чем -7,1 или равное менее чем -780; и имеет значение притока кальция равное от 97 до 120.
Преимущественно и предпочтительно, чтобы пептид по изобретению, его производное или его аналог защищали от токсического действия пептида Т30 и/или Аβ. Более предпочтительно, пептид по изобретению, его производное или его аналог защищают от токсических эффектов пептида Т30 и Аβ. Параметры токсичности количественно оценивают как увеличение ацетилхолинэстеразы, снижение жизнеспособности клеток, увеличение притока кальция и снижение теоретической аффинности к α7-никотиновому рецептору. Изменения этих параметров будет определять защитные эффекты пептидов.
Молекулярная масса пептида по изобретению, его производного или его аналога предпочтительно составляет менее чем 1000 Да, более предпочтительно менее чем 900 Да.
Предпочтительно, пептид, его производное или его аналог содержит или состоит из 5 и 8 аминокислотных остатков, или 5 и 7 аминокислот, или 6 и 8 аминокислот.
В одном предпочтительном варианте реализации изобретения, пептид, его производное или его аналог содержит или состоит из шести аминокислот. Предпочтительно, пептид, его производное или аналог содержит или состоит из аминокислотной последовательности, фактически, как указано в SEQ ID No: 30, 32, 40 или 42.
Аминокислотная последовательность SEQ ID No: 30 (т.e. "NBP-601") представляет собой: HWKAEF.
Аминокислотная последовательность SEQ ID No: 32 (т.е. "NBP-603") представляет собой: KAEFHR.
Аминокислотная последовательность SEQ ID No: 40 (т.е. "NBP-611") представляет собой: SYMVHW.
Аминокислотная последовательность SEQ ID No: 42 (т.е. "NBP-613") представляет собой: MVHWKA.
Предпочтительно SEQ ID No: 40 защищает от токсического воздействия Аβ. Предпочтительно SEQ ID No: 30, 32 и 42 защищают от токсических эффектов Т30.
В другом предпочтительном варианте реализации изобретения, пептид, его производное или его аналог содержит или состоит из семи аминокислот. Предпочтительно, пептид, его производное или аналог содержит или состоит из аминокислотной последовательности, по существу, как указано в SEQ ID No: 48, 51, 40 или 53.
Аминокислотная последовательность SEQ ID No: 48 (т.е. "NBP-705") представляет собой: EFHRWSS.
Аминокислотная последовательность SEQ ID No: 51 (т.е. "NBP-708") представляет собой: RWSSYMV.
Аминокислотная последовательность SEQ ID No: 53 (т.е. "NBP-710") представляет собой: SSYMVHW.
Предпочтительно SEQ ID No: 53 защищает от токсического воздействия Аβ.
Предпочтительно SEQ ID No: 48 и 51 защищают от токсических эффектов Т30.
В другом предпочтительном варианте реализации изобретения, пептид, его производное или его аналог содержит или состоит из восьми аминокислот. Предпочтительно, пептид, его производное или аналог содержит или состоит из аминокислотной последовательности, фактически, как указано в SEQ ID No: 61.
Аминокислотная последовательность SEQ ID No: 61 (т.е. "NBP-804") представляет собой: AEFHRWSS.
Предпочтительно SEQ ID No: 61 защищает от токсических эффектов T30.
Понятно, что NPB-601, 603 и 804 все получены из циклического NBP-14 (SEQ ID No: 1), как показано на Фиг. 3, в котором терминальный аланин и лизин циклизируются вместе. NPB-601, 603 и 804 являются линейными пептидами и включают аминокислоты аланин и лизин (т.е. определяют точку, с которой лигируется NBP-14), соединенные вместе.
Понятно, что Аβ в настоящее время является наиболее распространенным механизмом токсичности для возникновения нейродегенеративных расстройств, таких как болезнь Альцгеймера. Соответственно, любой пептид, его производное или его аналог в соответствии с изобретением, которые защищают от токсичности Аβ, являются предпочтительными и, поэтому особенно полезны для лечения нейродегенеративных нарушений. Однако предыдущая работа изобретателя предполагает, что токсичность Т30 на самом деле является более вероятной причиной нейродегенеративных заболеваний, а не токсичность Аβ. Соответственно, любой пептид по изобретению, который защищен от токсичности Т30, является наиболее предпочтительным, и особенно полезен для лечения нейродегенеративных нарушений.
Изобретатели провели дозозависимые эксперименты с ответом для предпочтительных линейных пептидов в РС12 против Т30 и амилоида (пример 6). Они также тестировали эффект Т30 на ответы, вызванные в базальном отделе переднего мозга, и исследовали, способны ли циклические NBP14 или любые более короткие линейные варианты по первому аспекту отменить любые вызванные Т30 изменения. В примерах 6 и 7 показано, что NBP601, NBP603 и NBP613 защищают от эффектов Т30. Соответственно, эти пептиды являются наиболее предпочтительными.
В пятом аспекте представлен пептид, его производное или аналог, состоящий из аминокислотной последовательности, фактически, как указано в SEQ ID No: 30, 32, 40, 42, 48, 51, 53 или 61.
В шестом аспекте изобретения предоставлен один или более пептидов, их производных или аналогов в соответствии с пятым аспектом для применения в терапии или диагностировании.
В седьмом аспекте предоставлен один или более пептидов, их производных или аналогов в соответствии с пятым аспектом, для применения при лечении, уменьшении интенсивности или предотвращении нейродегенеративного расстройства.
В восьмом аспекте предложен способ лечения, облегчения или предотвращения нейродегенеративного расстройства у субъекта, причем способ включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более пептидов, производных или аналогов в соответствии с пятым аспектом.
В предпочтительном варианте реализации изобретения, для лечения нейродегенеративного заболевания используют один пептид, его производное или его аналог. Однако на основании результатов, в другом варианте реализации изобретения, используют более одного пептида, его производного или его аналога для лечения нейродегенеративного заболевания, т.е. в комбинированной терапии. Например, может быть использовано множество пептидов, которые, как было показано, защищают от токсичности Аβ. Альтернативно, предпочтительно можно использовать множество пептидов, которые, как было показано, защищают от токсичности Т30.
Однако, в предпочтительном варианте реализации изобретения, один или более пептидов, которые защищают от токсичности Т30, используют в комбинации с одним или более пептидами, которые защищают от токсичности Аβ, т.е. вводят два пептида, один из защитной группы Т30, продемонстрированной в таблице 1, и один из защитной группы Аβ, продемонстрированной в таблице 2. Например, NBP-601 (SEQ ID No: 30) можно вводить совместно с NBP-710 (SEQ ID No: 53), или NBP-804 (SEQ ID No: 61) можно вводить совместно с NBP-611 (SEQ ID No: 40) и так далее.
Понятно, что пептиды согласно изобретению могут быть использованы в лекарственном средстве, которое может быть использовано в монотерапии (т.е. применении одного или более пептидов, их производных или аналогов по первому аспекту) для лечения, уменьшения интенсивности или профилактики нейродегенеративного расстройства, такого как болезнь Альцгеймера. Альтернативно, пептид согласно изобретению может быть использован в качестве дополнения или в сочетании с известными способами лечения, уменьшения интенсивности или предотвращения болезни Альцгеймера, такими как ингибиторы ацетилхолинэстеразы.
Пептиды согласно изобретению могут быть объединены в композициях, имеющих несколько различных форм, в зависимости, в частности, от пути, которым должна использоваться композиция. Таким образом, например, композиция может быть в виде порошка, таблетки, капсулы, жидкости, мази, крема, геля, гидрогеля, аэрозоля, распыления, мицеллярного раствора, трансдермального пластыря, липосомной суспензии или любой другой подходящей формы, которая может быть введена человеку или животному, нуждающемуся в лечении. Понятно, что носителем медикаментов в соответствии с изобретением должен быть тот, который хорошо переносится субъектом, которому он предоставляется, и предпочтительно обеспечивает доставку пептида через гематоэнцефалический барьер.
Понятно, что эффективность любого лечения нарушений головного мозга зависит от способности терапевтического пептида-кандидата пересекать гематоэнцефалический барьер (ВВВ). Однако хорошо известно, что при болезни Альцгеймера гематоэнцефалический барьер увеличивает проницаемость, которая может позволить пептидам по изобретению достигать центральной нервной системы, действительно идеально только в местах дегенерации там, где это необходимо, т.е. где ВВВ скомпрометирован.
Для преодоления ВВВ пептидами по изобретению могут быть использованы две основные стратегии, в том числе: (1) использование наночастиц в качестве транспортеров для специфического нацеливания на мозг и доставки активного соединения. Этот метод успешно использовался для доставки пептидов, белков и противораковых препаратов в мозг; (2) использование грузовых пептидов. Добавление такого пептида, специально переносимого через ВВВ, позволяет облегчить передачу пептидов по изобретению.
Лекарственные средства, содержащие полипептиды согласно изобретению, могут быть использованы несколькими способами. Например, может потребоваться пероральное введение, и в этом случае полипептид может содержаться в композиции, которая может, например, попадать внутрь в виде таблетки, капсулы или жидкости. Альтернативным вариантом для введения пептидов может быть использование назального спрея, поскольку после введения пептида с помощью назального спрея он добирается до мозга быстрее и эффективнее, чем при пероральном или внутривенном способах введения (см. http://memoryzine.com/2010/07/26 / nose-sprays-cross-blood-brain-barrier-faster-and-safer/). Следовательно, композиции, содержащие полипептиды по изобретению, можно вводить путем ингаляции (например, интраназально). Композиции также могут быть сформированы для местного использования. Например, кремы или мази можно наносить на кожу, например, рядом с мозгом.
Полипептиды согласно изобретению также могут быть включены в устройство с медленным или замедленным высвобождением. Такие устройства могут быть, например, установлены на кожу или под кожу, и лекарство может выделяться в течение недель или даже месяцев. Устройство может быть расположено, по меньшей мере, вблизи участка обработки, например головы. Такие устройства могут быть особенно предпочтительными, когда требуется длительное лечение полипептидами, используемыми в соответствии с изобретением, и которые обычно требуют частого введения (например, по меньшей мере, ежедневная инъекция).
В предпочтительном варианте реализации изобретения, лекарственные средства в соответствии с изобретением могут вводиться субъекту путем инъекции в кровоток или непосредственно в участок, требующий лечения. Например, лекарственное средство может быть введено, по меньшей мере, рядом с мозгом. Инъекции могут быть внутривенными (болюс или инфузия) или подкожными (болюс или инфузия) или внутрикожными (болюс или инфузия).
Понятно, что количество требуемого полипептида определяется его биологической активностью и биодоступностью, которая, в свою очередь, зависит от способа введения, физиохимических свойств полипептида и от того, используется ли он в качестве монотерапии или в комбинированной терапии. На частоту введения будет также влиять период полужизни полипептида в отношении подлежащего лечению субъекта. Оптимальные дозировки, которые следует вводить, могут быть определены специалистами в данной области техники, и будут варьироваться в зависимости от конкретного используемого полипептида, прочности фармацевтической композиции, способа введения и развития нейродегенеративного заболевания. Дополнительные факторы, зависящие от конкретного подлежащего лечению субъекта, приведут к необходимости корректировки дозировок, включая возраст, вес, пол, диету и время введения.
Как правило, суточная доза полипептида согласно изобретению между 0,001 мкг/кг массы тела и 10 мг/кг массы тела может быть использована для лечения, уменьшения интенсивности или профилактики нейродегенеративного заболевания, в зависимости от того, какой полипептид используется. Более предпочтительно, суточная доза составляет между 0,01 мкг/кг массы тела и 1 мг/кг массы тела, и наиболее предпочтительно между примерно 0,1 мкг/кг до 10 мкг/кг массы тела.
Полипептид можно вводить до, во время или после начала нейродегенеративного заболевания. Ежедневные дозы могут назначаться в виде одного введения (например, однократная ежедневная инъекция или ингаляция спрея для носа). Альтернативно, полипептид может потребовать введения два или более раз в течение дня. В качестве примера, полипептиды можно вводить в виде двух (или более в зависимости от тяжести подлежащего лечению нейродегенеративного заболевания) суточных доз от 0,07 до 700 мг (т.е. при условии, что масса тела составляет 70 кг). Пациент, получающий лечение, может принимать первую дозу после пробуждения, а затем вторую дозу вечером (при режиме двух доз) или через 3- или 4-часовые интервалы после этого. Альтернативно, устройство медленного высвобождения может использоваться для обеспечения оптимальных доз полипептида в соответствии с изобретением для пациента без необходимости введения повторных доз.
Известные процедуры, такие как те, которые обычно применяются в фармацевтической промышленности (например, эксперименты in vivo, клинические испытания и т.д.), могут быть использованы для формирования конкретных лекарственных форм полипептида согласно изобретению и точных терапевтических режимов (таких как ежедневные дозы агентов и частоты введения). Изобретатели считают, что они первыми предлагают композицию против нейродегенеративных заболеваний, основанную на применении полипептида по изобретению.
Следовательно, в пятом аспекте изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество одного или более пептидов, их производных или аналогов в соответствии с первым аспектом и необязательного фармацевтически приемлемого носителя.
Фармацевтическая композиция предпочтительно представляет собой композицию против нейродегенеративных заболеваний, т.е. фармацевтическую композицию, используемую в терапевтическом улучшении состояния, профилактике или лечении нейродегенеративного расстройства у субъекта, такого как болезнь Альцгеймера.
Изобретение также предусматривает в шестом аспекте способ получения фармацевтической композиции в соответствии с пятым аспектом, причем способ включает объединение терапевтически эффективного количества пептида, его производного или его аналога в соответствии с первым аспектом, с фармацевтически приемлемым носителем.
Пептид, его производное или его аналог предпочтительно представляют собой NBP-601 (SEQ ID No: 30), NBP-603 (SEQ ID No: 32), NBP-613 (SEQ ID No: 42), NBP-705 (SEQ ID No: 48), NBP-708 (SEQ ID No: 51), NBP-804 (SEQ ID No: 61), NBP-611 (SEQ ID No: 40) или NBP-710 (SEQ ID No: 53).
«Субъект» может быть позвоночным, млекопитающим или домашним животным. Следовательно, лекарственные средства в соответствии с изобретением могут быть использованы для лечения любого млекопитающего, например, домашнего скота (например, лошади), домашних животных или могут использоваться в других ветеринарных применениях. Наиболее предпочтительно, однако, субъект представляет собой человека.
«Терапевтически эффективное количество» пептида представляет собой любое количество, которое при введении субъекту, представляет собой количество активного агента, которое необходимо для лечения состояния нейродегенеративного расстройства или получения желаемого эффекта.
Например, терапевтически эффективное количество используемого пептида может составлять от около 0,001 мг до около 800 мг и предпочтительно от около 0,01 мг до около 500 мг. Предпочтительно, чтобы количество пептида составляло от около 0,1 мг до около 100 мг.
«Фармацевтически приемлемый носитель», как указано в данном документе, представляет собой любое известное соединение или комбинацию известных соединений, которые известны специалистам в данной области техники для применения в составлении фармацевтических композиций.
В одном варианте реализации изобретения, фармацевтически приемлемый носитель может быть твердым, и композиция может быть в виде порошка или таблетки. Твердый фармацевтически приемлемый носитель может включать одно или более веществ, которые также могут действовать как ароматизаторы, смазывающие вещества, солюбилизаторы, суспендирующие агенты, красители, наполнители, глиданты, добавки для прессования, инертные связующие вещества, подсластители, консерванты, покрытия или вещества, дезинтегрирующие таблетку. Носитель также может быть инкапсулирующим материалом. В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченными активными веществами согласно изобретению. В таблетках активный агент можно смешивать с носителем, имеющим необходимые свойства сжатия, в подходящих пропорциях и уплотнять в желаемой форме и размере. Порошки и таблетки предпочтительно содержат до 99% активных агентов. Подходящие твердые носители включают, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, поливинилпирролидин, низкоплавкие воски и ионообменные смолы. В другом варианте реализации изобретения, фармацевтический носитель может представлять собой гель, и композиция может быть в виде крема или тому подобного.
Однако фармацевтический носитель может быть жидкостью, и фармацевтическая композиция находится в форме раствора. Жидкие носители используются для приготовления растворов, суспензий, эмульсий, сиропов, эликсиров и композиций под давлением. Активный агент согласно изобретению может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, смесь обоих или фармацевтически приемлемых масел или жиров. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, ароматизаторы, суспендирующие агенты, загустители, красители, регуляторы вязкости, стабилизаторы или осмо-регуляторы. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (частично содержащую добавки, как указано выше, например, производные целлюлозы, предпочтительно раствор натрия карбоксиметилцеллюлозы), спирты (включая одноатомные спирты и многоатомные спирты, например, гликоли) и их производные, и масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носителем может быть также масляный эфир, такой как этилолеат и изопропилмиристат. Стерильные жидкие носители полезны в композициях стерильной жидкой формы для парентерального введения. Жидкий носитель для композиций, находящихся под давлением, может представлять собой галогенированный углеводород или другой фармацевтически приемлемый пропеллент.
Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, могут быть использованы, например, внутримышечно, интратекально, эпидурально, внутрибрюшинно, внутривенно и особенно подкожно. Полипептид может быть получен в виде стерильной твердой композиции, которая может быть растворена или суспендирована во время введения с использованием стерильной воды, физиологического раствора или другой подходящей стерильной инъекционной среды.
Полипептид и композиции по изобретению можно вводить перорально в виде стерильного раствора или суспензии, содержащей другие растворенные вещества или суспендирующие агенты (например, достаточное количество солевого раствора или глюкозы, чтобы сделать раствор изотоническим), соли желчных кислот, аравийскую камедь, желатин, моноолеат сорбитана, полисорбат 80 (сложные эфиры олеинов сорбита и его ангидриды, сополимеризованные с этиленоксидом) и тому подобное. Полипептид, используемый в соответствии с изобретением, можно также вводить перорально либо в жидкой, либо в твердой форме. Композиции, подходящие для перорального введения, включают твердые формы, такие как пилюли, капсулы, гранулы, таблетки и порошки и жидкие формы, такие как растворы, сиропы, эликсиры и суспензии. Формы, используемые для парентерального введения, включают стерильные растворы, эмульсии и суспензии.
Понятно, что изобретение распространяется на любую нуклеиновую кислоту или пептид или вариант, производное или аналог, который содержит по существу аминокислотную или нуклеотидную последовательности любой из последовательностей, упомянутых в данном документе, включая функциональные варианты или их функциональные фрагменты. Термины «по существу последовательность аминокислот/нуклеотид/пептид», «функциональный вариант» и «функциональный фрагмент» могут быть последовательностью, которая имеет по меньшей мере 40% идентичность последовательности с аминокислотными/нуклеотидными/пептидными последовательностями любой из последовательностей, упомянутых в данном документе, например, идентичность 40% с последовательностью, идентифицированной как SEQ ID No: 1-157, и так далее.
Аминокислотные/полинуклеотидные/полипептидные последовательности с идентичностью последовательности, которая составляет более чем 65%, более предпочтительно более чем 70%, еще более предпочтительно более чем 75% и еще более предпочтительно более чем 80% идентичности последовательности с любой из последовательностей, также относящихся к предусмотренным. Предпочтительно, последовательность аминокислоты/полинуклеотида/полипептида имеет по меньшей мере 85% идентичности с любой из последовательностей, упомянутых, более предпочтительно по меньшей мере на 90% идентичности, еще более предпочтительно по меньшей мере на 92% идентичности, еще более предпочтительно по меньшей мере на 95% идентичности, Еще более предпочтительно по меньшей мере на 97% идентичности, еще более предпочтительно по меньшей мере на 98% идентичности и, наиболее предпочтительно, по меньшей мере на 99% идентичности с любой из последовательностей, упомянутых в данном документе.
Квалифицированный специалист оценит, как рассчитать процентное соотношение между двумя последовательностями аминокислоты/полинуклеотида/полипептида. Чтобы рассчитать процентное соотношение между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями, сначала необходимо подготовить выравнивание двух последовательностей с последующим вычислением значения идентичности последовательности. Процент идентичности для двух последовательностей может принимать разные значения в зависимости от: - (i) способа, используемого для выравнивания последовательностей, например ClustalW, BLAST, FASTA, Smith-Waterman (реализованных в разных программах) или структурного выравнивания из 3D-сравнения; и (ii) параметров, используемых методом выравнивания, например, локальное или глобальное выравнивание, используемая парная матрица вкладов (например, BLOSUM62, РАМ250, Gonnet и т.д.), и штраф за гэп, например функциональная форма и константы.
После выполнения выравнивание, существует множество различных способов вычисления процентной идентичности между двумя последовательностями. Например, можно разделить число идентичностей на: (i) длину самой короткой последовательности; (ii) длину выравнивания; (iii) среднюю длину последовательности; (iv) количество положений без гэпа; или (iv) количество эквивалентных положений, исключая выступы. Кроме того, будет понятно, что процент идентичности также сильно зависит от длины. Следовательно, чем короче пара последовательностей, тем выше идентичность последовательности, которая как можно ожидать произойдет случайно.
Следовательно, будет понятно, что точное выравнивание белковых или ДНК-последовательностей является сложным процессом. Популярная программа множественного выравнивания ClustalW (Thompson et al., 1994, Nucleic Acids Research, 22, 4673-4680, Thompson et al., 1997, Nucleic Acids Research, 24, 4876-4882) является предпочтительным способом для создания нескольких выравниваний белков или ДНК в соответствии с изобретением. Подходящими параметрами для ClustalW могут быть следующие: для выравнивания ДНК: Штраф за открытие гэпа = 15,0, Штраф за продление гэпа = 6,66 и Матрица = Идентичность. Для выравнивания белка: Штраф за открытие гэпа = 10,0, Штраф за продление гэпа = 0,2 и Матрица = матрица сравнения аминокислот по Gonnet. Для выравнивания ДНК и белка: ENDGAP=-1 и GAPDIST=4. Специалисты в данной области техники должны знать, что может быть необходимо изменить эти и другие параметры для оптимального выравнивания последовательности.
Предпочтительно вычисление процента идентичностей между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями затем может быть вычислено из такого выравнивания, как (N/T)*100, где N представляет собой число положений, в которых последовательности имеют одинаковый остаток, а Т представляет собой общее количество положений, включая гэпы, но исключая выступы. Следовательно, наиболее предпочтительный способ вычисления процента идентичности между двумя последовательностями включает (i) подготовку выравнивания последовательности с использованием программы ClustalW с использованием подходящего набора параметров, например, как указано выше; и (ii) вставку значений N и Т в следующую формулу: - Идентичность последовательности = (N/T)*100.
Специалистам в данной области техники будут известны альтернативные способы идентификации подобных последовательностей. Например, по существу подобная нуклеотидная последовательность кодируется последовательностью, которая гибридизуется с последовательностями ДНК или их комплементами в жестких условиях. Под жесткими условиями мы подразумеваем, что нуклеотид гибридизуется со связанной с фильтром ДНК или РНК в 3х хлориде натрия/цитрате натрия (SSC) при приблизительно 45°С, за которым следует, по крайней мере, одна промывка в 0,2х SSC/0,1% SDS при приблизительно 20-65°С. Альтернативно, по существу аналогичный полипептид может отличаться по меньшей мере на 1, но менее чем 5, 10, 20, 50 или 100 аминокислот из описанных в данном документе последовательностей.
Из-за вырождения генетического кода ясно, что любая последовательность нуклеиновой кислоты, описанная в данном документе, может быть отлична или изменена без существенного влияния на последовательность белка, кодируемого таким образом, для обеспечения его функционального варианта. Подходящими вариантами нуклеотидов являются те, которые имеют последовательность, измененную путем замещения различных кодонов, которые кодируют одну и ту же аминокислоту в последовательности, тем самым вызывая молчащее изменение. Другими подходящими вариантами являются те, которые имеют гомологичные нуклеотидные последовательности, но содержат всю, или части последовательности, которая изменяется путем замещения различных кодонов, которые кодируют аминокислоту с боковой цепью с аналогичными биофизическими свойствами с аминокислотой, которую она замещает, для получения консервативного изменения. Например, малые неполярные, гидрофобные аминокислоты содержат глицин, аланин, лейцин, изолейцин, валин, пролин и метионин. Большие неполярные, гидрофобные аминокислоты содержат фенилаланин, триптофан и тирозин. Полярные нейтральные аминокислоты содержат серии, треонин, цистеин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты содержат лизин, аргинин и гистидин. Отрицательно заряженные (кислотные) аминокислоты содержат аспарагиновую кислоту и глутаминовую кислоту. Поэтому следует понимать, какие аминокислоты могут быть заменены аминокислотой, имеющей сходные биофизические свойства, и квалифицированный специалист будет знать нуклеотидные последовательности, кодирующие эти аминокислоты.
В следующем аспекте, предлагается пептид, его производное или его аналог, включающий последовательность из 5-8 аминокислот, которые получены из С-конца ацетилхолинэстеразы (AChE) или ее усечения, где пептид, производное или аналог имеют значение коэффициента х от 1,0 до 1,1,
где 
где «% выхода AChE» представляет собой процент ацетилхолинэстеразы, получаемой из препарата клеток PC12, культивируемых в присутствии пептида, его производного или его аналога по сравнению с таковым в препарате клеток PC12, культивированных в отсутствие пептида, его производного или его аналога, а "% жизнеспособности клеток PC12" представляет собой процент жизнеспособности препарата клеток PC12, культивированных в присутствии пептида, его производного или его аналога по сравнению с таковым в препарате клеток PC12, культивируемых в отсутствие пептида, его производного или его аналога.
Все описанные в данном документе функции (включая любые сопроводительные формулы изобретения, реферат и чертежи) и/или все этапы любого раскрытого способа или процесса могут быть объединены с любым из вышеуказанных аспектов в любой комбинации, за исключением комбинаций, в которых, по меньшей мере, некоторые из таких функций и/или шагов являются взаимоисключающими.
Для лучшего понимания изобретения и для того, чтобы показать, как варианты реализации того же изобретения могут быть введены в действие, будет сделана ссылка на сопроводительные фигуры, на которых: -
Фиг. 1а демонстрирует связывание циклического полипептида NBP-14 (называемого в данном документе SEQ ID No: 1), связывающегося с α7-никотиновым рецептором, а Фиг. 1b демонстрирует увеличенный вид трехмерной структуры циклического NBP-14;
Фиг.2 демонстрирует последовательность NBP-14 с концевыми остатками аланина (А) и лизина (K), образующими сайты циклизации;
Фиг. 3 демонстрирует циклический пептид NBP-14, в котором концевые остатки аланина и лизина связаны между собой;
Фиг. 4а-4k демонстрирует таблицы, показывающие различные варианты реализации линейного пептида в соответствии с изобретением. Пептиды делят на соответствующие группы пептидов, которые имеют четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать или четырнадцать аминокислот;
Фиг. 5 демонстрирует графическое представление теоретической аффинности пептидов, составляющих различные варианты реализации линейных пептидов по изобретению с целевым сайтом α7-никотинового рецептора;
Фиг. 6 демонстрирует данные и соответствующие графики, показывающие взаимосвязь между высвобождением ацетилхолинэстеразы, притоком ионов кальция и жизнеспособностью клеток. Фиг. 6а демонстрирует зависимость между высвобождением ацетилхолинэстеразы и притоком ионов кальция (корреляция составляет 0,210), Фиг. 6b демонстрирует зависимость между притоком ионов кальция и жизнеспособностью клеток (корреляция составляет 0,026), а Фиг. 6в демонстрирует зависимость между высвобождением ацетилхолинэстеразы и жизнеспособностью клеток (корреляция составляет -0,550);
Фиг. 7 демонстрирует блок-схему, показывающую четыре фильтра или критерия, используемые при определении активных пептидов в соответствии с изобретением. Критерий 1 включает корреляцию между высвобождением AChE из клеток PC12 и жизнеспособностью клеток PC12; критерий 2 включает теоретическую аффинность связывания пептидов, оставшихся после применения критерия 1; критерий 3 включает в себя приток ионов кальция в клетках PC12, вызванный пептидами, оставшимися после применения критерия 2; и критерий 4 включает в себя размер пептида, т.е. исключая пептиды, оставшиеся после применения критерия 3 с более чем 8 аминокислотами;
На Фиг. 8 представлены графики, показывающие дозозависимые эффекты на потенцирование кальция линейного варианта NBP-601 или NBP-603 против Т30;
На Фиг. 9 представлены графики, показывающие дозозависимый эффект на потенцирование кальция линейного варианта NBP-613 против Т30;
На Фиг. 10 изображена фотография (верхняя вставка) и схематичное представление (нижняя вставка) корональных срезов мозга крысы, содержащих комплекс диагональный полосы (медиальное септальное ядро (MS), вентральный край диагональной полосы (VDB), горизонтальный край диагональной полосы (HDB); мозговые субучастки, которые составляют часть базальных отделов переднего мозга. Красные звездочки указывают приблизительное местоположение стимуляции для визуализации чувствительных к напряжению красителей (VSDI) и электрофизиологических экспериментов;
Фиг. 11 демонстрирует усредненные временные ряды VSDI, показывающие количество флуоресценции (dF/F0), излучаемое в интересующей области (ROI) (синяя линия), T30 (2 мкМ, зеленая линия) и Т30 (2 мкМ) и NBP14 (4 мкМ, красная линия) при исходных условиях перфузии. Профиль ответа в базальном отделе переднего мозга демонстрирует трехфазный ответ, причем фаза 1 является начальным пиковым ответом (0-15 мс после начальной стимуляции), фаза 2 - короткий период покоя, наблюдаемый непосредственно после пикового ответа (15-25 мс после первоначальной стимуляции), а фаза 3 рассматривается как отступление, активность длительного времени ожидания (повторяющаяся) непосредственно после фазы 2 (25 мс + после стимуляции). Данные были получены путем суммирования (Σ) излучаемой флуоресценции между 0 и 280 мс после начальной стимуляции;
Фиг. 12 демонстрирует скомпилированные графики необработанных данных (n=14), показывающие отдельные точки данных максимальной амплитуды пика (фаза 1) для исходных условий (синий), Т30 (зеленый) и Т30 и NBP14 (красный) - верхняя левая вставка; отдельные точки данных суммированных флуоресцентных (ΣdF/F0) ответов - нижняя левая вставка. Те же данные демонстрируют специфические для эксперимента тенденции в амплитуде пикового отклика (верхняя правая вставка) и суммарную флуоресценцию (нижняя правая вставка). Единицы оси Y для верхних вставок: зарегистрированная флуоресценция, dF/F0; нижние вставки: сумма зарегистрированной флуоресценции (0 → 280 мс после стимула), ΣdF/F0;
На Фиг. 13 показаны отдельные значения суммированной активности длительного времени, взятые из пула необработанных данных (см. Фиг. 12, нижние вставки), демонстрирующие иллюстративные эксперименты, где Т30 вызывал снижение общей активности базальной нервной сети переднего мозга (верхняя вставка), а также где Т30 вызвал увеличение активности сети (нижняя вставка). В обоих случаях изменение активности сети показывает как минимум 50%-ное изменение ответа (увеличение/уменьшение) от изначального уровня. В обоих случаях совместная перфузия Т30 с NBP14 (третье условие) всегда обращала изменение, вызванное перфузией Т30, обратно к исходному уровню;
Фиг. 14 демонстрирует график, показывающий отдельные точки данных суммированной излучаемой флуоресценции во время исходного ответа (ось х), нанесенного в виде зависимости от изменения, индуцированного перфузией T30 (ответ T30 - исходный ответ, ось Y). Корреляция может быть видна там, где чем выше уровень исходного ответа, тем больше изменение, вызванное T30; р=0,007;
Фиг. 15 демонстрирует график, показывающий отдельные точки данных изменения вызванного в суммированной излучаемой флуоресценции во время перфузии T30 (ответ T30 - исходный ответ, ось X), нанесенного в виде зависимости от изменения, индуцированного добавлением NBP14 к перфузату (ответ T30 и NBP14 - ответ T30; ось у). Корреляция может быть видна там, где, чем больше изменение, вызванное T30, тем больше изменение этого эффекта происходит при добавлении NBP14; р=0,015 - указывает, что NBP14 является эффективным блокатором действия T30;
Фиг. 16 демонстрирует усредненные временные ряды VSDI, показывающие количество флуоресценции (dF/F0), излучаемое в интересующей области (ROI) (синяя линия), T30 (2 мкМ, зеленая линия) и T30 (2 мкМ) и NBP -603 (4 мкМ, красная линия) при исходных условиях перфузии. Данные были получены путем суммирования (Σ) излучаемой флуоресценции между 0 и 280 мс после начальной стимуляции;
Фиг. 17 демонстрирует скомпилированные графики необработанных данных (n=5), показывающие отдельные точки данных максимальной амплитуды пика (фаза 1) для исходных условий (синий), T30 (зеленый) и T30 и NBP-603 (красный) - верхняя левая вставка; отдельные точки данных суммированных флуоресцентных (ΣdF/F0) ответов - нижняя левая вставка. Те же данные демонстрируют специфические для эксперимента тенденции в амплитуде пикового отклика (верхняя правая вставка) и суммарную флуоресценцию (нижняя правая вставка). Единицы оси Y для верхних вставок: зарегистрированная флуоресценция, dF/F0; нижние вставки: сумма зарегистрированной флуоресценции (0 → 280 мс после стимула), ΣdF/F0;
Фиг. 18 демонстрирует график, показывающий отдельные точки данных суммированной излучаемой флуоресценции во время исходного ответа (ось х), нанесенного в виде зависимости от изменения, индуцированного перфузией T30 (ответ T30 - исходный ответ, ось Y). Из-за низкого количества точек данных и высокой изменчивости между ними наблюдается нисходящая тенденция (как видно выше); р>0,05;
Фиг. 19 демонстрирует график, показывающий отдельные точки данных изменения, вызванного в суммированной излучаемой флуоресценции во время перфузии T30 (ответ T30 - исходный отклик, ось X), нанесенного в виде зависимости от изменения, индуцированного добавлением NBP-603 к перфузату (ответ T30 и NBP-603 - ответ T30, ось у). Корреляция может быть видна там, где более позитивное изменение, индуцированное перфузией T30, представляет собой большее обращение эффектов после добавления NBP-603 в перфузат; р=0,024;
Фиг. 20 демонстрирует связывание линейного пептида NBP-601 (упоминаемого в данном документе, как SEQ ID No: 30), связывающегося с α7-никотиновым рецептором (α7-nAChR); и
Фиг. 21 демонстрирует химическую структуру циклического NBP-14.
ПРИМЕРЫ
Материалы и способы
Культуры клеток РС12
Клетки PC12 представляют собой клонированную клеточную линию феохромоцитомы, полученную из мозгового вещества надпочечников (Greene and Tischler, 1976, Proc Natl Acad Sci USA 73: 2424-2428; Mizrachi et al., 1990, Proc Natl Acad Sci USA 87: 6161-6165). Они легко культивируются и легкодоступны для экспериментальных манипуляций. Поскольку хромаффиновые клетки получены из нервного гребня, но расположены в центре доступного периферического органа (мозговое вещество надпочечников), они были описаны как предлагаемое «окно» в мозг (Bornstein et al., 2012, Mol Psychiatry 17: 354-358). Эти клетки служат мощной, хотя и новой, моделью in vitro для изучения неизвестного первичного процесса нейродегенерации, и причинами, по которым они полезны для этого проекта, являются следующие: мозговое вещество надпочечников у пациентов с болезнью Альцгеймера демонстрирует различные патологические особенности, напоминающие наблюдаемые в ЦНС, например, множество включений типа телец Леви, нейрофибриллярный клубок и парные спиральные нити, а также экспрессию белка предшественника амилоида (АРР) (Takeda et al., 1994, Neurosci Lett 168: 57-60). Кроме того, Appleyard и Macdonald (1991, Lancet 338: 1085-1086) продемонстрировали селективное снижение только в растворимой (т.е. высвобождаемой) форме AChE из надпочечников в болезни Альцгеймера, возможно, из-за ее усиленной секреции в плазме, где она повышена у пациентов с болезнью Альцгеймера (Atack et al., 1985, J Neurol Sci 70: 1-12; Berson et al., 2008, Brain 131: 109-119).
Клетки PC12 дикого типа были предоставлены Sigma-Aldrich (Сент-Луис, Миссури). Культуру клеток PC12 или препарат обычно высевали в 100-миллиметровые чашки (Corning), покрытые коллагеном (2 мкг/см2), и поддерживали в ростовой среде с минимальной поддерживающей средой Игла (MEM), дополненной инактивированной нагреванием 10% лошадиной сывороткой (HS) и 5% фетальной бычьей сывороткой (FBS), 10 мМ HEPES, 2 мМ L-глутамина и 1:400 раствора пенициллина/стрептомицина. Клетки поддерживали при 37°С в увлажненной атмосфере 5% СО2 и среду заменяли каждые 2 дня. Для разделения клетки перемещали из чашки с помощью пипетки со средой, причем часть их была заменена на новые чашки культивирования. Клетки использовались между пассажами 12 и 25.
β-амилоидный препарат
β-амилоидные (1-42) фибриллы получали, как описано поставщиком (Abcam, Кэмбридж, Великобритания)). 1 мг β-амилоида (1-42) растворяли в 1 мл 100% 1,1,1,3,3,3-гексафтор-2-пропаноле (HFIP). Этот раствор инкубировали при комнатной температуре в течение 1 часа. Затем, раствор обрабатывали ультразвуком в течение 10 мин, а затем сушили в скоростной вакуумной сушилке (Thermo Fisher Scientific, Лафборо, Великобритания) и хранили при -80°С. Для экспериментов образцы разбавляли в 100% ДМСО и инкубировали в течение 2 ч при комнатной температуре для обеспечения образования фибрилл.
Анализ жизнеспособности клеток
Набор для подсчета клеток-8 (ССK-8) использовался как усовершенствование техники SRB, использованной ранее. Используя высоко растворимую в воде соль тетразолия WST-8, ССК-8 образует растворимый в воде краситель формазан при восстановлении в присутствии переносчиков электронов. WST-8 восстанавливают с помощью дегидрогеназ в клетках, получая продукт желтого цвета (формазан), который растворим в среде тканевой культуры. Количество красителя формазана, продуцируемого активностью дегидрогеназ в клетках, прямо пропорционально количеству живых клеток. Клетки PC12 высевают в 200 мкл полной ростовой среды за день до эксперимента в 96-луночных планшетах. Добавляли обработку только с T30 или Аβ, или в сочетании с NBP-14 или меньшими пептидами и инкубировали в течение 1 часа в инкубаторе. Затем, удаляли 100 мкл ростовой среды и добавляли 10 мкл раствора ССK-8 (Набор для подсчета клеток-8). Планшет инкубировали в течение 2 часов в инкубаторе и затем помещали в абсорбционный планшет-ридер. Абсорбцию необходимо измерять при 450 нм.
Анализ активности ацетилхолинэстеразы
Активность AChE измеряли с использованием реагента Ellman, который измеряет наличие тиоловых групп как результа активности AChE. Клетки высевали за день до эксперимента, как для анализа жизнеспособности клеток. Клетки обрабатывали только T30 или Аβ (5 мкМ) или комбинировали с NBP-14 или небольшими пептидами (0,5 мкМ). После обработки, надосадок (перфузат) каждой обработки собирали и добавляли по 25 мкл каждого состояния в новый 96-луночный планшет с плоским дном с последующим добавлением 175 мкл реагента Ellman (раствор А: КН2РО4 139 мМ и К2НРО4 79,66 мМ, рН 7,0; раствор В (субстрат): ацетилтиохолин йодид 11,5 мМ; Раствор С (реагент): 5, 5'-дитиобис (2-нитробензойная кислота) 8 мМ и NaHCO3 15 мМ). Реагент Ellman готовили в виде смеси 3 растворов в соотношении 33(А):3(В):4(С). Измерения абсорбции проводились через регулярные промежутки времени (3, 10, 30 и 60 мин) в экспериментах при 405 нм.
Флюорометрия кальция
Клетки PC12 высевают в 200 мкл полной ростовой среды за день до эксперимента в 96-луночных планшетах. В день эксперимента готовится раствор Fluo-8 (Abcam) (согласно протоколу поставщика). Затем, удаляли 100 мкл среды для роста и добавляли 100 мкл раствора Fluo-8. Добавляли обработку только с T30 или Аβ в сочетании с NBP-14 или небольшими пептидами и инкубировали в течение 30 минут в инкубаторе и 30 минут при комнатной температуре.
Через 1 час планшет помещали в флуоресцентный планшет-ридер (Fluostar). Перед считыванием флуоресценции получали ацетилхолин (ACh) 100 мкМ и помещали в инжектор Fluostar. Для каждой лунки показания будут формироваться базальной флуоресценцией с последующей инъекцией ацетилхолина, которая будет стимулировать увеличение кальция через никотиновые рецепторы. Затем оценивали эффекты пептидов.
Методология VSDI:
Подготовка срезов мозга и записей ex-vivo
Корональные срезы мозга крысы получали в соответствии с процедурой, описанной в Badin et al., 2013, но на этот раз включающей базальные отделы переднего мозга (+0,70 и -0,26 миллиметров (мм) от брегмы (Paxinos and Watson, 1998). Затем получали оптическое изображение с использованием чувствительных к напряжению красителей, как описано ранее (Badin et al., 2013, Neuropharmacology. 73C:10-18).
Анализ данных и статистика (VSDI)
Данные VSDI были записаны в двумерных изображениях 4×4 мм, что эквивалентно 100×100 пикселям - каждый пиксель составляет 40×40 микрометров (мкм), из которого были извлечены критические данные. Данные VSDI не были собраны во время экспериментального запуска, но фактически были записаны в отдельные периоды времени продолжительностью 15 минут. Межстимульный интервал (ISI) между стимуляциями составлял 28 секунд, и поэтому каждая эпоха записи состояла из 32 последовательных стимулов. Затем данные из всех 32 стимулов были затем усреднены в один файл для каждого экспериментального условия и проанализированы с использованием специальной утилиты для анализа данных VSDI, специально разработанной для MatLab (Bourgeois et al., 2014, PLoS One. 9:e108686). Короче говоря, этот набор инструментов позволил выбрать геометрию фиксированной области интереса (ROI), которая может быть применена к каждому срезу, чтобы извлекать и комбинировать данные из идентичного ROI по всем срезам и условиям эксперимента. ROI выбирали вдоль поверхности пиала септальной области срезов, чтобы охватить медиальное септальное ядро (MS), вентральную конечность диагональной полосы (VDB) и горизонтальную конечность диагональной полосы (HDB). Данные VSDI, взятые из ROI, были затем построены как один усредненный временной ряд (Фиг. 11). Однако для количественной оценки данных VSDI была подсчитана площадь под кривой (суммарное фракционное изменение флуоресценции, Фиг. 11-22) между моментом стимуляции (t=0) и 280 мс после этого; этот метод количественной оценки учитывает все компоненты немедленного и долговременного ответа. Все статистические тесты (дисперсионный анализ - ANOVA - если не указано иное) выполнялись с использованием GraphPad Prism 6 (v6.05; GraphPad Software Inc., Калифорния, США), данные все считались нормально распределенными (данные не показаны). Для всех статистических тестов, р<0,05 считалось стастистически значимым; данные выражаются как среднее±SEM
Лекарственные средства и реактивы
MEM, культуральные сыворотки, антибиотики, коллаген, набор подсчета клеток-8 и реагенты для буферов были предоставлены Sigma-Aldrich (Сент-Луис, Миссури). T30, пептид AChE и циклический Т14 были синтезированы Genosphere Biotechnologies (Франция). Amyloid Beta и Fluo-8 были предоставлены Abcam (Кембридж, Великобритания). Небольшие пептиды синтезировали с использованием стандартных методов синтеза пептидов. Исходный раствор пептидов разводили в дистиллированной воде.
Анализ данных
В каждом из различных методов, статистический анализ проводился со средним значением процентных значений 12 или более экспериментов. Сравнение между несколькими группами обработки и одним и тем же контролем выполнялось анализом дисперсии (ANOVA) и последующими тестами Тьюки с использованием GraphPAD Instat (программное обеспечение GraphPAD, Сан-Диего, Калифорния). Эти тесты сравнивают среднее каждой обработки со средним любой другой обработки; то есть применяют одновременно к множеству всех парных сравнений и определяют, где можно ожидать разницу между двумя средними, превышающую стандартную ошибку. Статистическое значение принималось при значении Р<0,05. Графики были построены с использованием GraphPAD Prism 6 (программное обеспечение GraphPAD, Сан-Диего, Калифорния).
Пример 1 - Циклический Т14 (т.е. NBP14)
«Хвостовая» ацетилхолинэстераза (T-AChE) экспрессируется в синапсах, и авторы изобретения ранее идентифицировали два пептида, которые могли быть отщеплены от ее С-конца, один из которых называется «Т14» (длиной 14 аминокислот), в другом, который известен как «T30» (длиной 30 аминокислот), и оба они имеют сильную гомологию последовательностей в сравнимом участке β-амилоида.
Аминокислотная последовательность линейного пептида Т14 представляет собой AEFHRWSSYMVHWK [SEQ ID NO: 1].
Аминокислотная последовательность линейного пептида T30 представляет собой KAEFHRWSSYMVHWKNQFDHYSKQDRCSDL [SEQ ID NO: 156].
С-концевой пептид AChE «Т14» был идентифицирован как существенная часть молекулы AChE, ответственная за ее диапазон негидролитических действий. Синтетический аналог 14-аминокислотного пептида (т.е. «Т14»), и, в последствии, более крупная, более стабильная и более мощная аминокислотная последовательность, в которую она встроена (т.е. «T30») демонстрируют действия, сравнимые с показаниями для «нехолинергического» AChE.
Ссылаясь сначала на Фиг. 1а и 20, было показано связывание 14-аминокислотного длинного циклического Т14-пептида (т.е. «NBP-14») на аллостерическом сайте на α7-никотиновом рецепторе, для конкурирования за связывание с линейными пептидами Т14 и T30, а также антагонизирование β-амилоиду. Циклический пептид, NBP-14, основан на аминокислотной последовательности Т14, то есть AEFHRWSSYMVHWK [SEQ ID NO: 1], но был циклизован через концевые остатки аланина (А) и лизина (K). На Фиг. 1b показан увеличенный вид трехмерной структуры циклического NBP-14, находящегося в кармане связывания α7-никотинового рецептора.
Обратимся теперь к Фиг. 2, где показана последовательность NBP-14 с концевыми остатками аланина (А) и лизина (K), образующими сайты циклизации, а на Фиг. 3 показан циклический пептид NBP-14, в котором терминальные остатки аланин и лизин связаны между собой. Циклизация может быть достигнута несколькими различными способами. Например, Genosphere Biotechnologies (Франция) выполнила циклизацию Т14, превратив линейный пептид в N-концевой до С-концевой лактам. Циклизация Т14 для создания циклического NBP14 соединяет оба конца, то есть HWK-AEF.
Изобретатели ранее показали, что циклический NBP-14 избирательно ингибирует неклассические эффекты AChE (т.е. эффекты AChE, которые не зависят от его ферментативной активности) и/или ее концевой пептид in vitro, и может быть использован для лечения нейродегенеративных расстройств. NBP14 действует как истинный антагонист α7-никотинового рецептора и, как было показано, защищает клетки от токсичности линейных Т14, T30 и β-амилоидов. Он также блокирует компенсаторное высвобождение AChE, вызванное токсичностью линейных Т14 и T30. Кроме того, когда его дают отдельно, циклический NBP14 не оказывает существенного влияния на концентрации Са2+ в срезах мозга крыс, но блокирует эффекты β-амилоида.
Пример 2. Получение ряда линейных пептидов, полученных из циклического NBP14 На основании своих предыдущих неожиданных наблюдений с NBP-14, обсуждавшихся в примере 1, авторы изобретения подготовили ряд линейных пептидов (длиной 4-14 аминокислот) на основе последовательности NBP14, в которой каждая линейная пептидная последовательность начинается или заканчивается в любом положении аминокислоты вдоль последовательности NBP14. Ряд линейных пептидов показан в большой таблице, охватывающей Фиг. 4а-4k (обозначенные как SEQ ID No: 2-155).
В таблице на Фиг. 4а приведены 14 линейных пептидов (SEQ ID No: 2-15), каждый из которых состоит из четырех аминокислот в длину. Каждому линейному пептиду дано название, например NBP-401, что означает, что он является первым пептидом с четырьмя аминокислотами, и NBP-402, является вторым пептидом с четырьмя аминокислотами и так далее. В таблице на Фиг. 4b перечислены 14 линейных пептидов (SEQ ID No: 16-29), каждый из которых имеет длину пять аминокислот. Каждому линейному пептиду в этой таблице дано название, например NBP-501, что означает, что это первый пептид с пятью аминокислотами, и NBP-502 является вторым пептидом с пятью аминокислотами и так далее. На Фиг. 4 с перечислены 14 шести аминокислотных в длину пептидов (SEQ ID No: 30-43), на Фиг. 4d перечислены 14, семи аминокислотных в длину пептидов (SEQ ID No: 44-57), на Фиг. 4е перечислены 14 восьми аминокислотных в длину пептиды (SEQ ID No: 58-71), на Фиг. 4f перечислены 14 девяти аминокислотных в длину пептидов (SEQ ID No: 72-85), на Фиг. 4g перечислены 14 десяти аминокислотных в длину пептидов (SEQ ID No: 86-99), на Фиг. 4h перечислены 14 одинадцати аминокислотных в длину пептидов (SEQ ID No: 100-113), на Фиг. 4i перечислены 14 двенадцати аминокислотных в длину пептидов (SEQ ID No: 114-127), Фиг. 4j перечислены 14 тринадцати аминокислотных в длину пептидов (SEQ ID No: 128-141), и на Фиг. 4k перечислены 14 четырнадцати аминокислотных в длину пептидов (SEQ ID No: 142-155).
Каждый из линейных пептидов был синтезирован, а затем проанализирован на их действия, как показано ниже.
Пример 3 - Влияние малых линейных пептидов, полученных из NBP-14 на токсичность T30 или Аβ и жизнеспособность клеток
Каждый из малых линейных пептидов, полученных из NBP-14 (SEQ ID No: 2-155), анализировали тремя системами in vitro против токсического линейного пептида T30 [SEQ ID NO: 156] и бета-амилоида дикого типа (1-42) (Аβ) (SEQ ID NO: 158), т.е. (i) высвобождением AChE из клеток PC 12, (ii) жизнеспособностью клеток PC12; и (iii) притоком кальция в клетки PC12.
Аминокислотная последовательность части β-амилоида (Аβ) представлена в данном документе как SEQ ID NO: 158, следующим образом: DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA [SEQ ID No:158].
Защитное или токсическое действие каждого линейного пептида на T30 и/или Аβ затем определяли на основе серии из четырех фильтров или критериев, как показано на Фиг. 7:
1. Высвобождение AChE и жизнеспособность клеток PC12 (для которых существует значительная отрицательная корреляция);
2. При связывании in silico с аллостерическим сайтом α7-никотинового рецептора;
3. Приток кальция в клетки PC12; и
4. Размер пептида.
Фильтр 1 - высвобождение AChE и жизнеспособность клеток PC12
Первоначально, из-за его корреляции, изобретатели комбинировали анализы (i) и (ii) с использованием приведенного ниже уравнения для получения «значения коэффициента (X)», который указывает на защитное или токсическое действие каждого линейного пептида на T30 и/или Аβ. Изобретатели определили коэффициент ЗНАЧЕНИЯ (X), который рассчитывается как:
КОЭФФИЦИЕНТ ЗНАЧЕНИЯ (X)=(% AChE) / (% Жизнеспособности клеток)
, где «% выхода AChE» представляет собой процент ацетилхолинэстеразы, получаемой из препарата клеток PC 12, культивируемых в присутствии токсичного пептида, выбранного из T30 (SEQ ID No: 156) или Аβ (SEQ ID NO: 158), и пептида, его производного или его аналога, по сравнению с таковым в препарате клеток PC12, культивированных в отсутствие какого-либо пептида, его производного или его аналога (т.е. контроля), а «% жизнеспособности клеток PC12» представляет собой процент жизнеспособности препарата клеток РС12, культивируемых в присутствии токсичного пептида, выбранного из T30 (SEQ ID No: 156) или Аβ (SEQ ID NO: 158), и пептида, его производного или его аналога, по сравнению с таковым в препарате клеток PC12, культивированных в отсутствие какого-либо пептида, производного или его аналога (т.е. контроль).
Как описано ниже, авторы неожиданно показали, что можно отделить активные пептиды от неактивных на основе их значений коэффициентов (X), которые представляют их защитную эффективность от токсичности T30 и Аβ.
Контроль (т.е. отсутствие какого-либо пептида) имеет значение 1. Как описано в разделе «Методы», контрольное значение получают из не обработанных клеток, токсическое значение из клеток, обработанных T30 или Аβ, и защитное значение из клеток, обработанных NBP-14 в сочетании с T30 или Аβ. Значение для T30 равно х=169,45 / 74,309=2,28, а для бета-амилоида (Аβ) х=124,19 / 87,42=1,42.
Следовательно, пептид со значением коэффициента (X) менее 1,0 и более 1,1 является токсичным, тогда как любой пептид со значением коэффициента от 1,0 до 1,1 считается активным и, следовательно, защитным. В таблицах 1 и 2 показано влияние линейных пептидов (в концентрации 0,5 мкМ) на активность AChE и жизнеспособность клеток PC12 от токсичности T30 и Аβ (при концентрации 5 мкМ). В столбце «Значение» показан защитный эффект каждого пептида.
Изобретатели показали, что два параметра - активность AChE в перфузате и жизнеспособность клеток PC12 - очень тесно взаимосвязаны с коэффициентом корреляции -0,55 (n=10), что статистически значимо при уровне Р<0,05 (см. Фиг. 6с). Эта исходная метрика высвобождения AChE против жизнеспособности клеток дала 55 удачных пептидов, которые были защитными либо от T30 (n=23 пептидов, как показано в таблице 1), либо от Аβ (n=32 пептида, как показано в таблице 2).




Фильтр 2 - Связывание in silico
Затем изобретатели исследовали теоретическую аффинность связывания in silico активных пептидов с аллостерическим сайтом α7-никотинового рецептора, и значения также показаны в таблицах 1 и 2. Анализ in silico был выполнен с использованием программного обеспечения Autodock Vina, опубликованного в журнале Journal of Computational Chemistry (О. Trott, A.J. Olson AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization and multithreading, Journal of Computational Chemistry 31 (2010) 455-461). Анализ проводился в соответствии с рекомендациями авторов. Анализ результатов и сравнение проводили вручную, сравнивая аминокислоты, связанные с рецептором, и расстояния между аминокислотами.
Они обнаружили, что теоретическая аффинность связывания ниже -7,0 соответствует более высокой аффинности между пептидом и аллостерическим сайтом α7-никотинового рецептора. Следовательно, общее количество активных пептидов было снижено с 55 на основе фильтра 1, до 28 пептидов после фильтра 2.
Фильтр 3 - Приток кальция
Изобретатели также исследовали взаимосвязь между жизнеспособностью клеток и третьим параметром (iii), рассмотренным выше, т.е. притоком кальция в клетки PC12. Однако они обнаружили, что эти параметры, имеющие очень разные временные масштабы, не связаны, имея коэффициент корреляции всего 0,026 (n=10), как показано на Фиг. 6b. Авторы также исследовали взаимосвязь между активностью AChE и притоком кальция в клетки PC12. Однако они обнаружили, что эти параметры снова находятся в разных временных масштабах и также не связаны, имея коэффициент корреляции всего 0,21 (n=10), как показано на Фиг. 6а.
Соответственно, авторы изобретения полагают, что высвобождение AChE, скорее всего, является прямой «компенсацией» из-за возможной гибели клеток и не вызвано неспецифическим непосредственным введением кальция, а вместо этого более медленным внутриклеточным каскадом.
Значения притока кальция для 28 пептидов, формирующихся фильтром 2, также показаны в таблицах 1 и 2. Авторы изобретения обнаружили, что значение притока кальция от 97 до 120 соответствует активным пептидам. Следовательно, общее количество активных пептидов было снижено с 28 на основе фильтра 2, до 12 пептидов после фильтра 3.
Фильтр 4 - Размер пептида
Наконец, изобретатели считают, что любой пептид, который превышает 8 аминокислот (теоретическая молекулярная масса выше 900 Да), не представляет собой реального подходящего претендента соединения-лидера для лечения нейродегенеративных нарушений. Соответственно, эти большие пептиды были уменьшены. Следовательно, общее количество активных пептидов было снижено с 12 на основе фильтра 3, до 8 пептидов после фильтра 4.
Выводы
Таким образом, когда учитываются все четыре фильтра, число возможных нейропротекторных агентов против T30 составляет шесть пептидов (т.е. NBP-601, 603, 613, 705, 708 и 804), а количество агентов против Аβ - это только два пептида (т.е. NBP-611 и 710). В таблицах 1 и 2 показаны зеленые значения, соответствующие защитным или активным пептидам, тогда как красные значения представляют собой токсичные или неактивные пептиды. Соответственно, использование комбинированных фильтров позволяет изолировать нейропротекторные линейные пептиды по структуре, а также по механизму или функции. Таким образом, изобретатели уверены в их эффективности in vivo.
Пример 4 - Комбинированная терапия с применением линейных пептидов Изобретатели ясно продемонстрировали, что небольшое подмножество линейных пептидов, полученных из циклического NBP-14, демонстрирует удивительную поразительную активность от токсичности T30, и что другой поднабор пептидов защищает от Аβ. Понятно, что Аβ в настоящее время является наиболее распространенным механизмом токсичности для возникновения нейродегенеративных расстройств, таких как болезнь Альцгеймера. Соответственно, один или более пептидов NBP-611 и 710 особенно полезны для лечения нейродегенеративных нарушений.
Однако предыдущая работа изобретателя предполагает, что токсичность T30 на самом деле является более вероятной причиной таких заболеваний, а не токсичность Аβ. Соответственно, один или более пептидов NBP-601, 603, 613, 705, 708 и 804 особенно полезны для лечения нейродегенеративных нарушений.
В некоторых вариантах реализации изобретения, изобретатели считают, что было бы полезно вводить два пептида, один из защитной группы T30, показанной в таблице 1, и один из защитной группы Аβ, продемонстрированных в таблице 2. Например, NBP-601 можно вводить совместно с NBP-611, или NBP-705 можно вводить совместно с NBP-710 и так далее.
Пример 5 - Анализ аффинности связывания
Ссылаясь на Фиг. 5 и 20, показано графическое представление теоретической аффинности связывания пептидов, составляющих различные варианты реализации линейных пептидов по изобретению, как показано в боксе с сайтом-целью α7-никотинового рецептора.
Пример 6 - Анализ предпочтительных пептидов в дозозависимом ответе в клетках PC12 против T30 и амилоида
Дозозависимые эксперименты проводились с выбранными малыми линейными вариантами циклического NBP-14 против T30, и результаты продемонстрированы на Фиг. 8 и 9. Полученные результаты показывают, что NBP601, NBP603 и NBP613 защищают от эффектов T30. Эти эксперименты подтверждают результаты, полученные на срезах мозга, рассмотренных в примере 7.
Пример 7 - Анализ предпочтительных пептидов (и контроля NBP-14) в экспериментах на срезе мозга против T30
Фиг. 10 иллюстрирует положение базального отдела переднего мозга, содержащего медиальную перегородку, вертикальную диагональную полосу и горизонтальную диагональную полосу. Цель экспериментов VSDI состояла в том, чтобы охарактеризовать реакции, вызываемые в базальном отделе переднего мозга электрической стимуляцией 30V, и посмотреть, как эти реакции были впервые модулированы добавлением высоких концентраций T30 (2 мкМ, Фиг. 11).
Действительно, вызванные ответы были модулированы с помощью T30, где большинство ответов продемонстрировало ингибирование, тогда как в некоторых ответах наблюдалась повышенная активность (Фиг. 12). Во всех случаях было обнаружено, что добавление NBP14 к перфузату значительно обращает любые изменения, вызванные T30 (Фиг. 13, 14 и 15).
Кроме того, вариант NBP14 NBP-603 (Фиг. 16) был испытан в такой же точно экспериментальной парадигме, что и NBP14. Было обнаружено, что вариант NBP-603 имел некоторое существенное влияние в реверсии изменений, вызванных T30 (Фиг. 17 и 19).
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО, КОТОРОЕ РАСПОЗНАЕТ ПЕПТИД Т14 АСНЕ | 2016 |
|
RU2729491C2 |
| МОДИФИЦИРОВАННЫЕ ПЕПТИДЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2756052C2 |
| РАК | 2017 |
|
RU2783416C2 |
| ЦИКЛИЧЕСКИЙ С-КОНЦЕВОЙ ПЕПТИД АЦЕТИЛХОЛИНЭСТЕРАЗЫ В ЛЕЧЕНИИ ИЛИ ПРЕДУПРЕЖДЕНИИ РАКА ИЛИ МЕТАСТАЗИРОВАНИЯ | 2015 |
|
RU2711161C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА-БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2571859C2 |
| СПОСОБ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ | 2010 |
|
RU2579659C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2542967C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2604181C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО | 2008 |
|
RU2538709C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2004 |
|
RU2385161C2 |
















































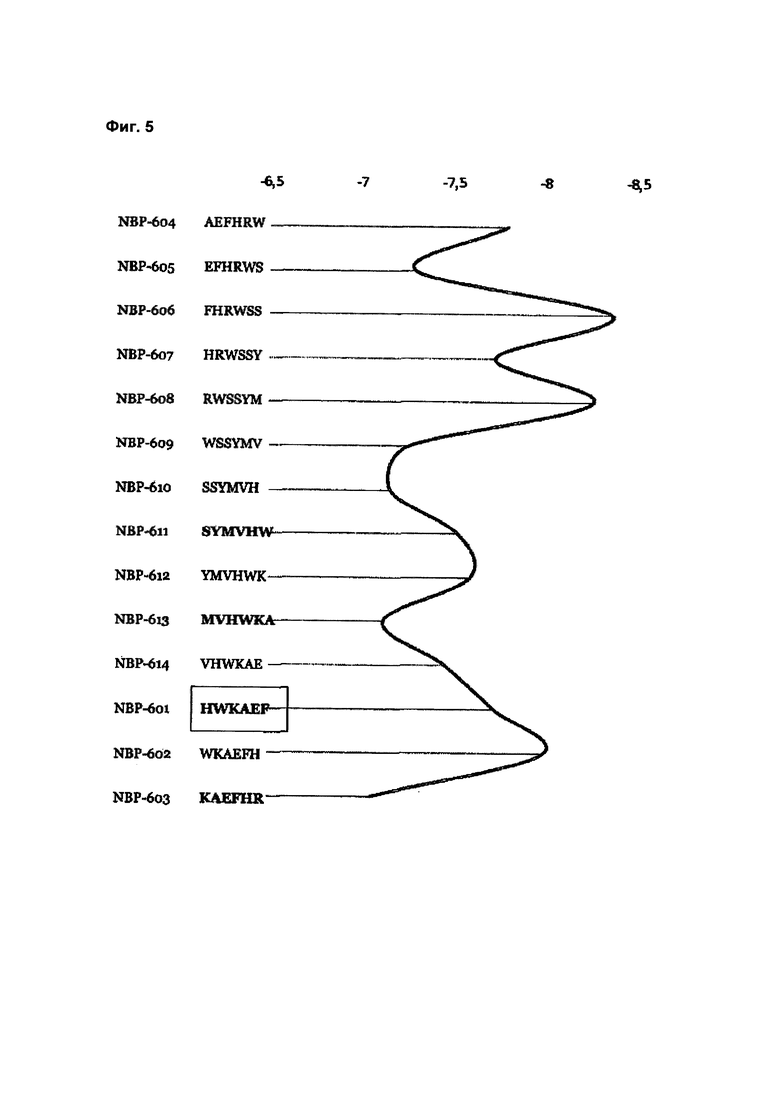
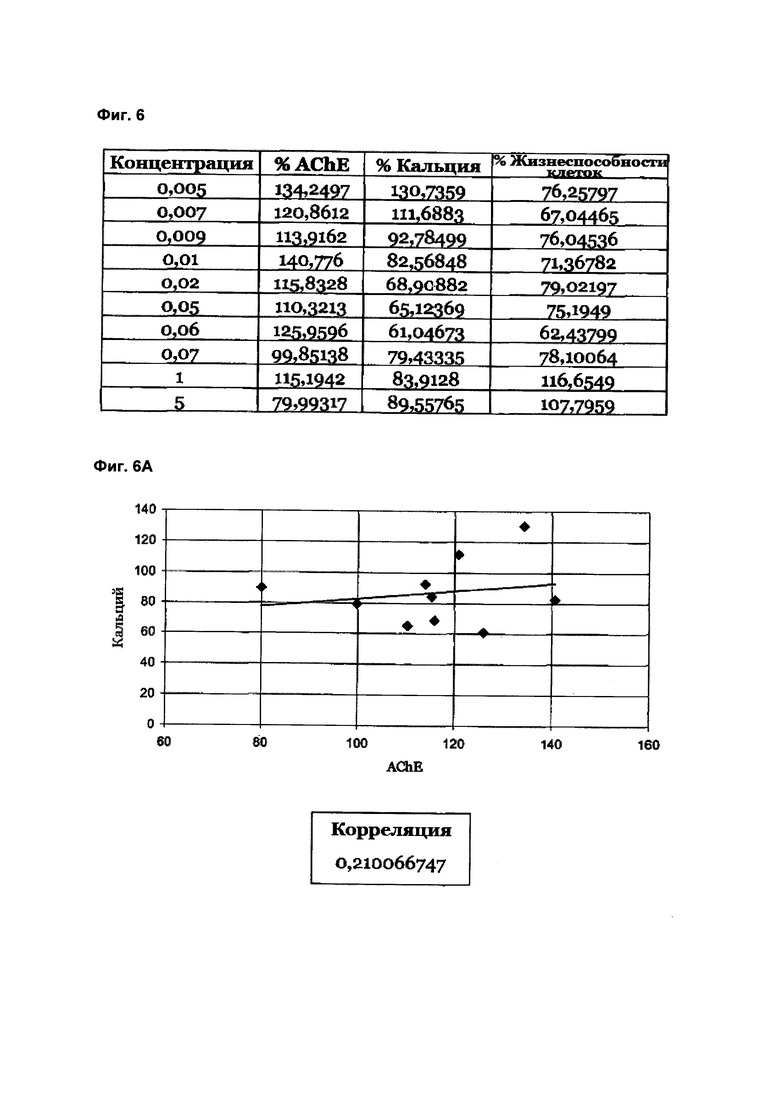
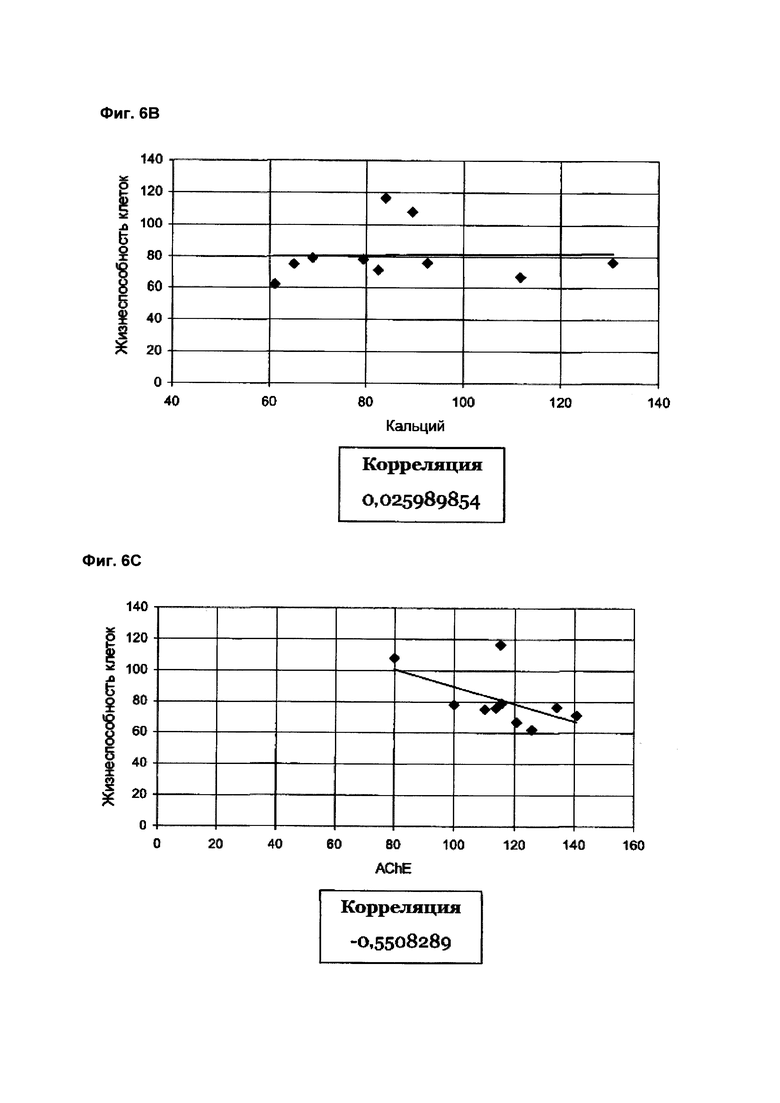


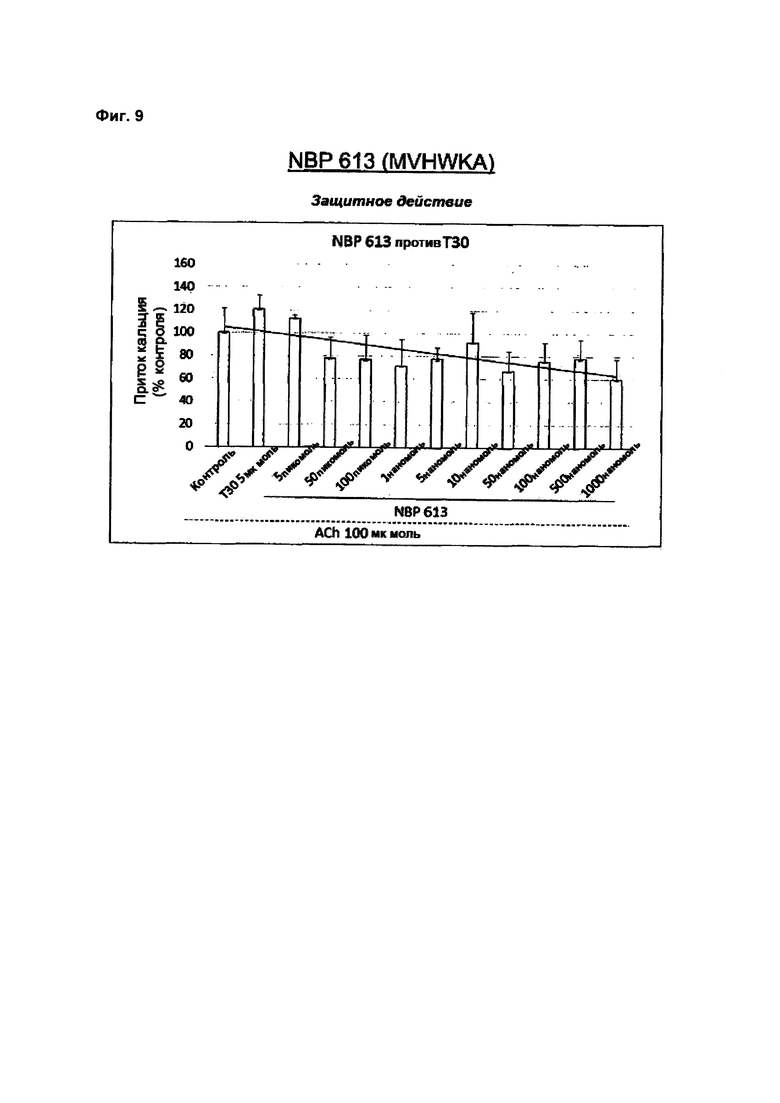
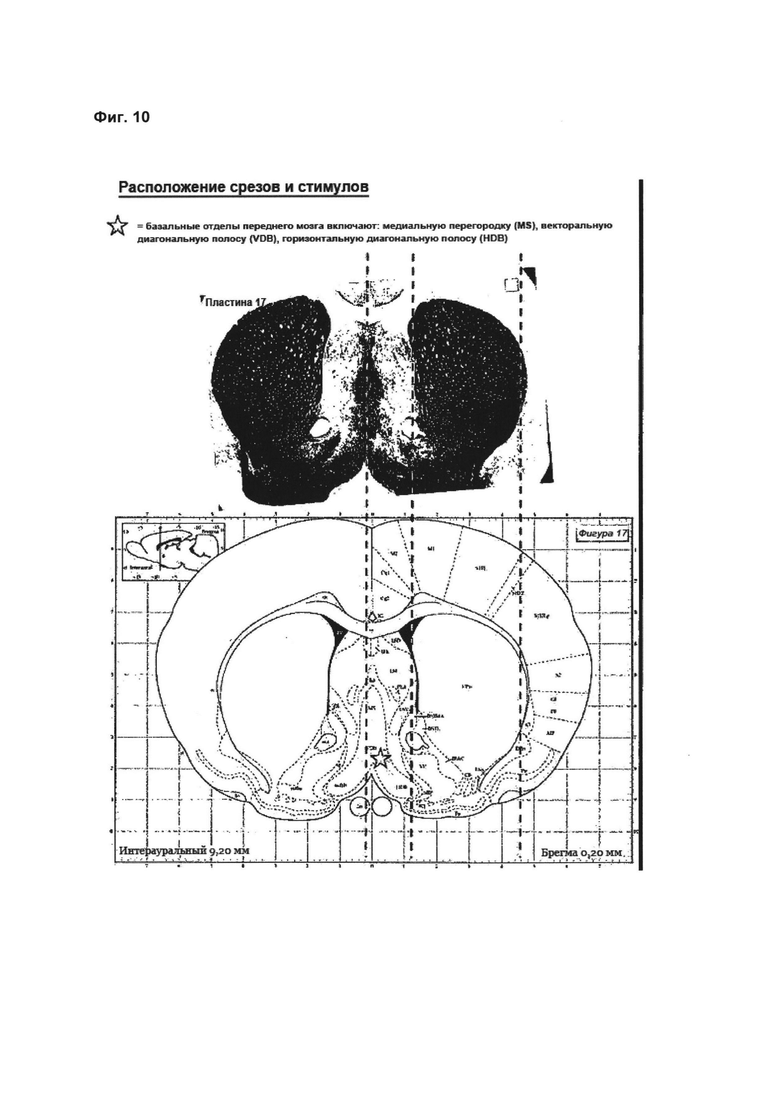






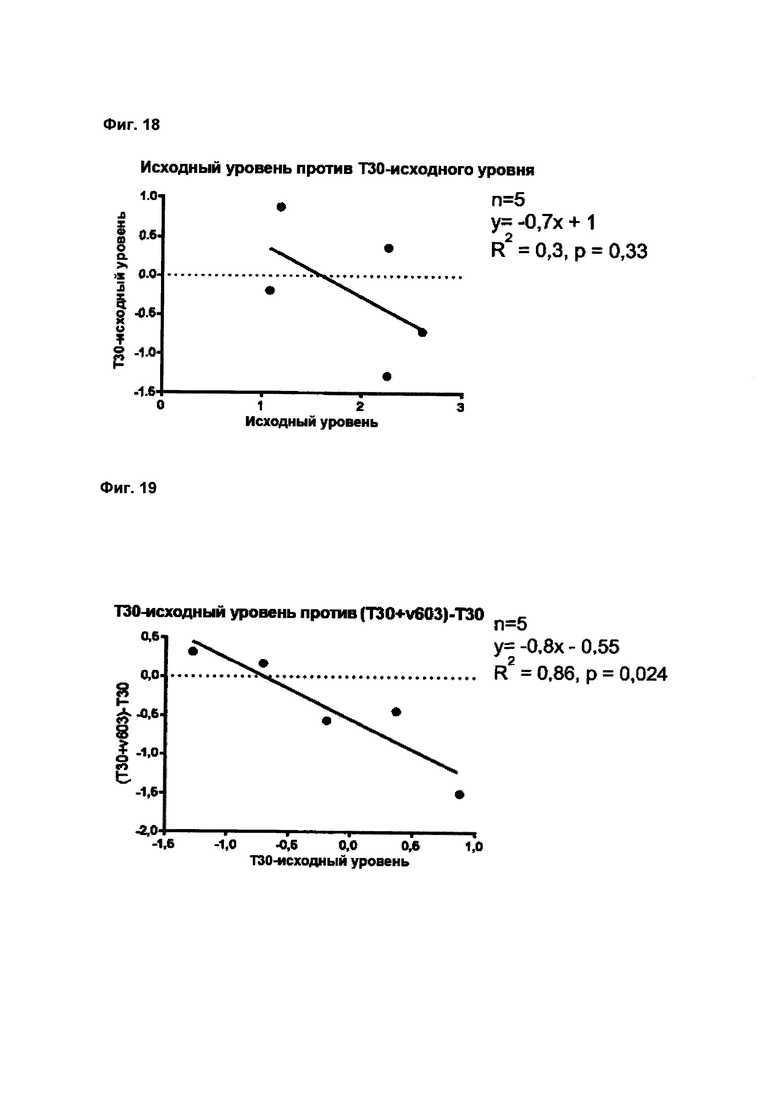
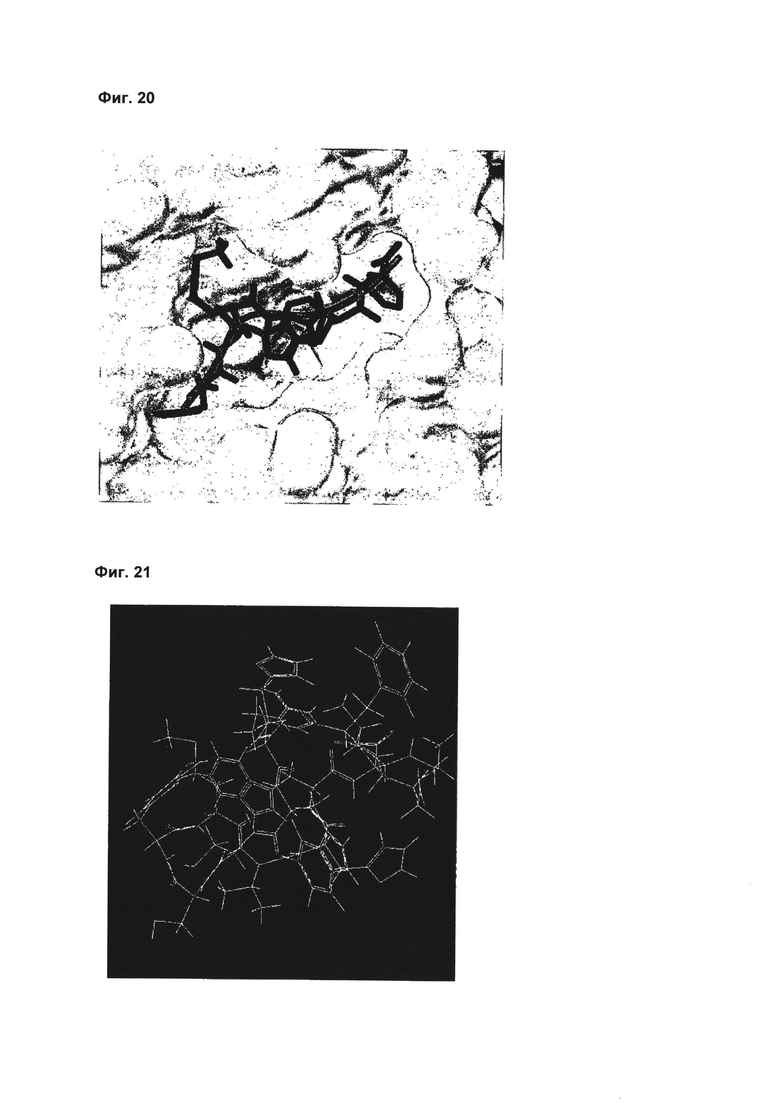
Изобретение относится к новым пептидам, композициям, которые предназначены для лечения нейродегенеративных заболеваний, например, болезни Альцгеймера. 5 н. и 6 з.п. ф-лы, 21 ил., 2 табл., 7 пр.
1. Пептид, состоящий из аминокислотной последовательности, как указано в SEQ ID No: 30, 32, 40, 42, 48, 51 или 53.
2. Фармацевтическая композиция для лечения или уменьшения интенсивности нейродегенеративного расстройства, содержащая терапевтически эффективное количество одного или более пептидов, состоящих из аминокислотной последовательности, как указано в SEQ ID No: 30, 32, 40, 42, 48, 51 или 53, и, необязательно, фармацевтически приемлемого носителя.
3. Способ получения фармацевтической композиции по п. 2, включающий объединение терапевтически эффективного количества одного или более пептидов, состоящих из аминокислотной последовательности, как указано в SEQ ID No: 30, 32, 40, 42, 48, 51 или 53, с фармацевтически приемлемым носителем.
4. Применение пептида, состоящего из аминокислотной последовательности, как указано в SEQ ID No: 30, 32, 40, 42, 48, 51 или 53, для лечения или уменьшения интенсивности нейродегенеративного расстройства.
5. Пептид, состоящий из аминокислотной последовательности, как указано в SEQ ID No: 30, 32, 40, 42, 48, 51 или 53, для применения в лечении или уменьшении интенсивности нейродегенеративного расстройства.
6. Пептид по п. 5, отличающийся тем, что нейродегенеративное расстройство, которое лечится, представляет собой нейродегенеративное расстройство, которое характеризуется повреждением или гибелью «глобальных» нейронов.
7. Пептид по п. 5 или 6, отличающийся тем, что нейродегенеративное расстройство выбрано из группы, состоящей из болезни Альцгеймера; болезни Паркинсона; болезни Хантингтона; болезни моторных нейронов; спиноцеребеллярной атаксии типа 1, типа 2 и типа 3; бокового амиотрофического склероза (БАС); шизофрении; деменции с тельцами Леви и лобно-височной деменции.
8. Пептид по п. 5 или 6, отличающийся тем, что нейродегенеративное расстройство, которое лечат, представляет собой болезнь Альцгеймера, болезнь Паркинсона или болезнь моторных нейронов.
9. Пептид по п. 5 или 6, отличающийся тем, что нейродегенеративное расстройство, которое лечат, представляет собой болезнь Альцгеймера.
10. Пептид по п. 5 или 6, отличающийся тем, что более чем один пептид используют для лечения нейродегенеративного заболевания в комбинированной терапии.
11. Пептид по п. 10, отличающийся тем, что один или более пептид, который является защитным от токсичности Т30, используют в комбинации с одним или более пептидами, которые являются защитными от токсичности Аβ.
| WO 2001073446 A1, 04.10.2001 | |||
| WO 1997035962 A1, 02.10.1997 | |||
| WO 2001049107 A1, 12.07.2001 | |||
| WO 2002042778 A2, 30.05.2002 | |||
| WO 2008135790 A1, 13.11.2008 | |||
| Накаливаемый катод | 1929 |
|
SU16040A1 |
| JEAN L ET AL, "Heterologous Amyloid Seeding: Revisiting the Role of Acetylcholinesterase in Alzheimer's Disease", PLOS ONE, 2007, vol | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
2019-11-25—Публикация
2015-11-26—Подача