Настоящее изобретение относится к антителам и, в частности, к антителам, применяемым в диагностике и лечении нейродегенеративных расстройств, таких как болезнь Альцгеймера и болезнь Паркинсона. Настоящее изобретение распространяется на способы диагностики и терапии нейродегенеративных расстройств, а также на анализы и тесты для выделения новых терапевтических соединений для лечения таких заболеваний.
Болезнь Альцгеймера в первую очередь поражает мужчин и женщин в возрасте старше 65 лет, и вероятность того, что болезнь будет диагностирована значительно возрастает с возрастом. Поскольку процент взрослых в возрасте старше 65 лет, как ожидается, будет расти во всем мире в течение следующих 40 лет, заболеваемость болезнью Альцгеймера, как ожидается, возрастет более чем в два раза, увеличившись с 21 миллиона случаев в 2010 году до 53 миллионов в 2050 году (статистика из www.alzheimersresearchuk.org и www.alz.org). Это экспоненциальное увеличение ожидаемого числа пациентов, страдающих болезнью Альцгеймера, не только представляет собой основную область неудовлетворенной медицинской необходимости, но и предоставляет значительную рыночную возможность для терапии и диагностики, поскольку в настоящее время нет полностью эффективного способа лечения болезни.
В последние 10 лет не было получено никакого нового препарата для борьбы с болезнью Альцгеймера, а также с нейродегенерацией в более общем плане. Причина в том, что до сих пор основной механизм головного мозга еще не определен, на который может быть, следовательно, нацелена фармацевтическая деятельность. Основным претендентом для объяснения процесса нейродегенерации является «амилоидная гипотеза, в которой гибель нейронов связана с нарушением клеточной мембраны токсическими отложениями амилоида, характерными для мозга больного Альцгеймером после вскрытия, и в результате аномального расщепления предшественника амилоида белка. Однако эта «амилоидная гипотеза» не объясняет совместную патологию, часто наблюдаемую при болезнях Альцгеймера и Паркинсона, а также характерную селективность клеток, уязвимых к дегенерации, несмотря на потенциальную повсеместность амилоида во всех клетках головного мозга или отсутствие амилоидных отложений в животных моделях деменции, а также появление амилоида в определенных областях мозга, где расстройства познавательных способностей не проявляются. Несмотря на популярность амилоидных образований в качестве фармацевтической мишени в течение последних двух десятилетий, никакое лечение, основанное на этой теории, пока не оказалось эффективным. Более вероятно, что когда происходит нейродегенеративный процесс, то амилоид дополнительно образуется как вторичный, усугубляющий эффект, который менее специфичен.
Один ключ к определению первичного механизма нейродегенерации может заключаться в том, что в первую очередь уязвимы только различные нейронные группы. Более того, разнообразные подгруппы клеток, склонные к болезням Альцгеймера, Паркинсона и двигательных нейронов, тем не менее, примыкают друг к другу и образуют непрерывный «хаб», простирающийся от ствола мозга до переднего мозга, который посылает все диффузные проекции вверх и наружу в более крупные церебральные центры. Следовательно, несмотря на свою гетерогенность в трансмиттерах, эти нейронные группы коллективно называются «глобальными» нейронами для того, чтобы отличить их от более знакомых и локализованных сетях клеток в большинстве других частей мозга, таких как мозжечок, таламус, кора и т.д. Эти селективно уязвимые глобальные нейроны были идентифицированы, хотя с использованием другой терминологии («изодендритное ядро»), как ключевые в нейродегенерации несколько десятилетий назад.
Подгруппы глобальных нейронов имеют общую особенность, которая может объяснить загадочный и еще не получивший ответа вопрос о том, почему только этим клеткам свойственна повышенная гибель, в то время как их антагонисты в других местах мозга даже при повреждении от инсульта не погибают: они сохраняют прочную пластичность в течение всей взрослой жизни, и имеют особую чувствительность к веществам, помогающим и поддерживающим рост - «трофическим факторам». В развивающемся мозге трофические факторы работают за счет стимуляции поступления кальция, который вызывает каскад событий внутри клетки, что в конечном итоге приводит к избирательной дифференциации и росту. Однако в более высоких дозах или при более длительном воздействии постоянное поступление кальция может быть токсичным для нейронов. Наиболее важно, что еще одним определяющим фактором вне зависимости от того, приводит или нет поступление кальция к трофическому или токсическому эффекту, является возраст: по мере созревания нейронов исходный трофический уровень внутриклеточного кальция становится смертельным.
Изобретатели ранее предположили, что нейродегенеративный процесс фактически является аберрантно активированным процессом развития. В подтверждение этой гипотезы гипертрофия нейронных «центров» ствола головного мозга фактически была зарегистрирована в мозге больного Альцгеймером (Bowser et al., 1997, Brain Pathol. 7: 723-30). Если большие участки этого центра повреждены, тогда будет представлено более одного нейродегенеративного заболевания, как это происходит в часто встречающихся, но еще не объясненных случаях сопутствующей патологии с болезнями Альцгеймера и Паркинсона. Интересно, что все нейроны в уязвимом центре глобальных нейронов, несмотря на неоднородность трансмиттеров, содержат знакомый фермент ацетилхолинэстеразы (AChE). Таким образом, AChE присутствует в нейронах, где она не может выполнять свою нормальную функцию, поскольку такие подгруппы клеток, как норадренергическое голубое пятно, дофаминергическое черное вещество или серотонинергические ядра шва, ни в коем случае не содержат обычного субстрата, ацетилхолина. Еще одно неожиданное отклонение от его нормальной, ферментативной роли заключается в том, что AChE фактически высвобождается из глобальных нейронов, предположительно, как своего рода отдельный межклеточный мессенджер. В общем, AChE в настоящее время широко и хорошо зарекомендовала себя как сигнальная молекула, которая обладает трофической активностью в разнообразных условиях как в нервной, так и не в нервной ткани.
Изобретатели ранее показали, что AChE, действующая в качестве трофического агента, не зависящего от его ферментативного действия, действительно вызывает поступление кальция в нейроны. Таким образом, в глобальных нейронах AChE имеет двойное нетипичное действие, которое колеблется вдоль трофически-токсической оси в зависимости от количества, периода доступности и, самое главное, возраста. Если стандартные нейроны повреждены в течение взрослой жизни, то, как и при инсульте, другие будут функционально компенсировать. В противоположность этому, глобальные нейроны будут реагировать, вызывая свои трофические ресурсы в попытке регенерировать. Но поскольку последующий поступления кальция будет смертельным в более старых, зрелых клетках, то полученное повреждение приведет к дальнейшим попыткам компенсировать пагубный цикл, который характеризует нейродегенерацию.
Ацетилхолинэстераза (АСЕ) экспрессируется на разных стадиях развития в различных формах, все из которых обладают одинаковой ферментативной активностью, но имеют очень различный молекулярный состав. «Концевая» (T-AChE) экспрессируется в синапсах, и изобретатели ранее идентифицировали два пептида, которые могли быть отщеплены от С-конца, один из которых упоминается как «Т14», в пределах другого, который известен как «Т30», и которые оба имеют сильную гомологию последовательностей в сравниваемой области β-амилоида. С-концевой пептид AChE «Т14» был идентифицирован как существенная часть молекулы AChE, ответственная за диапазон негидролитических действий. Синтетический аналог 14-аминокислотного пептида (т.е. «Т14»), и более крупная, более стабильная и более мощная аминокислотная последовательность, в которую он встроен (т.е. «Т30») демонстрируют действия, сравнимые с действием «нехолинергической» AChE, тогда как инертный остаток в последовательности Т30 (т.е. «Т15») не действует.
Немедленное действие Т14 и Т30 заключается в том, что они: - (i) модулируют поступление кальция в нейроны в срезах головного мозга с временными шкалами от миллисекунд до часов; (ii) компрометируют жизнеспособность клеток в клетках PC 12, а также в нейронных органотипических культурах in vitro; (iii) модулируют «компенсирующее» индуцированное кальцием высвобождение AChE из нейронов и клеток PC 12; (iv) активируют кальциевые токи в ооцитах и нейронах в срезах мозга; (v) действуют синергически с амилоидом при токсических эффектах; и (vi) участвуют в синтезе белка-предшественника амилоида и высвобождении пептида бета-амилоида (Аβ). Хронические эффекты Т14 и Т30 заключаются в том, что они: - (i) уменьшают рост нейронов; (ii) индуцируют апоптоз; (iii) увеличивают высвобождение AChE; (iv) связывают и модулируют α7 никотиновый рецептор; и (v) усиливают экспрессию α7-рецептора на поверхности клетки в течение 24 часов, тем самым обеспечивая механизм положительной прямой связи для дальнейшего токсического эффекта.
Поскольку Т14 и Т30 более селективны, чем β-амилоид в индуцирующей токсичности, а также синергичны с амилоид-усиливающей токсичностью, было предположено, что любой агент, который блокирует токсические эффекты Т14 или Т30, также уменьшает менее селективный и последующий токсический эффект амилоида.
Как обсуждается в примерах, изобретатели в ходе данной работы выделили новое антитело, которое связывается с пептидом Т14 (SEQ ID NO 3) с высокой специфичностью и которое не связывается с пептидом Т30 (SEQ ID NO 2) или с бета-амилоидом. Соответственно, это антитело будет иметь значительную полезность в диагностике и терапии нейродегенеративных расстройств, таких как болезнь Альцгеймера или болезнь Паркинсона.
Следовательно, согласно первому аспекту изобретения предлагается антитело или его антигенсвязывающий фрагмент, который специфически связывается с SEQ ID NO 3 или его вариантом или фрагментом.
Преимущественно данные, описанные в примерах, показывают, что антитело согласно изобретению, связывается с пептидом Т14 с очень высокой специфичностью. Любое антитело, которое связывается с Т30, повышает риск детектирования антигена, который на самом деле является инертным компонентом большего пептида, чего следует избегать. Однако антитело в соответствии с изобретением вместо этого связывается конкретно с Т14 или его вариантами, или их фрагментами, а не с Т30, и поэтому можно быть уверенным, что его биологически активные, токсичные эффекты будут изолированы и блокированы. Антитело неожиданно устойчиво в биологической ткани, даже ткани, которая была глубоко заморожена. Самое удивительное в том, что значительные различия могут быть обнаружены в образцах болезни Альцгеймера по сравнению с контрольными образцами мозга. Соответственно, эти данные показывают, что антитело согласно изобретению можно использовать в качестве диагностического средства, а также в терапевтическом воздействии.
Ацетилхолинэстераза представляет собой сериновую протеазу, которая гидролизует ацетилхолин, и хорошо известна специалисту. Основная форма ацетилхолинэстеразы, которая находится в головном мозге, известна как концевая ацетилхолинэстераза (T-AChE). Последовательность белка одного варианта человеческой концевой ацетилхолинэстеразы (Gen Bank: ААА68151.1) составляет 614 аминокислот в длину и предоставляется в данном документе как SEQ ID NO 1 следующим образом:

Аминокислотная последовательность Т30 (которая соответствует последним 30 аминокислотным остаткам SEQ ID NO 1) представлена в данном документе как SEQ ID NO 2, следующим образом: -

Предпочтительно, антитело или его антигенсвязывающий фрагмент не связывается с SEQ ID NO 2. Как обсуждалось выше, при помощи разработки антитела, которое нацелено на Т30, существует риск обнаружения антигена, который был фактически инертным компонентом более крупного пептида. Однако предпочтительно, чтобы антитело согласно изобретению вместо этого специфически связывалось с Т14, и поэтому можно быть уверенным, что он будет изолировать и блокировать биологически активные токсические действия только Т14.
Аминокислотная последовательность Т14 (которая соответствует 14 аминокислотным остаткам, расположенным к концу SEQ ID NO 1, и не содержит конечных 15 аминокислот, обнаруженных в Т30) представлена в данном документе как SEQ ID NO 3, следующим образом: -

Аминокислотная последовательность Т15 (которая соответствует последним 15 аминокислотным остаткам SEQ ID NO 1), представлена в данном документе как SEQ ID NO 4, следующим образом: -

Предпочтительно, антитело или его антигенсвязывающий фрагмент не связывается с SEQ ID NO 4. Т15 представляет собой инертный компонент Т30 и, как таковой, служит в качестве соответствующего контроля селективности антитела к Т14.
Аминокислотная последовательность части β-амилоида (Аβ) представлена в данном документе как SEQ ID NO 8, следующим образом: -
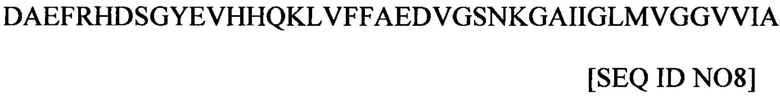
Предпочтительно, антитело или его антигенсвязывающий фрагмент не связывается с SEQ ID NO 8.
Настоящее изобретение распространяется на полные антитела (т.е. иммуноглобулины) с иммуноспецифичностью для SEQ ID NO 3, а также с антигенсвязывающими фрагментами или областями соответствующего полноразмерного антитела.
Антитело или его антигенсвязывающий фрагмент могут быть одновалентными, двухвалентными или поливалентными. Моновалентные антитела представляют собой димеры (HL), содержащие тяжелую цепь (Н), связанную дисульфидным мостиком с легкой цепью (L). Двухвалентные антитела представляют собой тетрамер (H2L2), содержащий два димера, связанных по меньшей мере одним дисульфидным мостиком. Поливалентные антитела также могут быть получены, например, путем связывания нескольких димеров. Основная структура молекулы антитела состоит из двух идентичных легких цепей и двух одинаковых тяжелых цепей, которые ассоциируют нековалентно и могут быть связаны дисульфидными связями. Каждая тяжелая и легкая цепь содержит аминоконцевую вариабельную область размером около 110 аминокислот и константные последовательности в остальной части цепи. Вариабельная область содержит несколько гипервариабельных областей или областей, определяющих комплементарность (CDR), которые образуют антигенсвязывающий сайт молекулы антитела и определяют его специфичность для антигена, то есть SEQ ID NO 3, или его вариант или его фрагмент (например, эпитоп). С обеих сторон CDR тяжелых и легких цепей представляет собой каркасную область, относительно консервативную последовательность аминокислот, которая закрепляет и ориентирует CDR. Фрагменты антитела могут включать биспецифическое антитело (BsAb) или химерный антигенный рецептор (CAR).
Константная область состоит из одной из пяти последовательностей тяжелой цепи (μ, γ, ζ, α или ε) и одной из двух последовательностей легкой цепи (κ или λ). Последовательности константной области тяжелой цепи определяют изотип антитела и эффекторные функции молекулы.
Предпочтительно антитело или его антигенсвязывающий фрагмент выделяют или очищают.
В одном предпочтительном варианте реализации изобретения антитело или его антигенсвязывающий фрагмент включает поликлональное антитело или его антигенсвязывающий фрагмент. Антитело или его антигенсвязывающий фрагмент могут быть получены в кролике, мыши или крысе.
Как описано в примерах, изобретатели получили высокоспецифическое поликлональное антитело из кролика. Предпочтительно антитело или его антигенсвязывающий фрагмент получают при помощи иммунизации животного-хозяина с использованием SEQ ID NO 3 или его варианта или фрагмента, а затем собирают антитело или его антигенсвязывающий фрагмент. Животное-хозяин наиболее предпочтительно является кроликом.
В другом предпочтительном варианте реализации изобретения антитело или его антигенсвязывающий фрагмент включает моноклональное антитело или его антигенсвязывающий фрагмент. Предпочтительно, антитело согласно настоящему изобретению представляет собой человеческое антитело. Используемый в данном документе термин «человеческое антитело» может означать антитело, такое как моноклональное антитело, которое содержит по существу одинаковые аминокислотные последовательности CDR тяжелой и легкой цепи, обнаруженные в конкретном человеческом антителе, проявляющем иммуноспецифичность к SEQ ID NO 3, или его варианту или его фрагменту. Аминокислотная последовательность, которая по существу подобна CDR тяжелой или легкой цепи, обладает значительной идентичностью последовательности с эталонной последовательностью. Такая идентичность определенно известна или распознается как представляющая аминокислотную последовательность конкретного человеческого антитела. По существу, одна и та же аминокислотная последовательность CDR тяжелой и легкой цепи может иметь, например, незначительные модификации или консервативные замены аминокислот. Такое человеческое антитело сохраняет свою функцию селективного связывания с SEQ ID NO 3 или его вариантом или фрагментом.
Термин «моноклональное антитело человека» может включать моноклональное антитело с по существу или полностью человеческими CDR-аминокислотными последовательностями, полученными, например, при помощи рекомбинантных способов, такими как продуцирование при помощи фаговой библиотеки, лимфоцитов или клеток гибридомы.
Термин «гуманизированное антитело» может означать антитело из нечеловеческих видов (например, мыши или кролика), белковые последовательности которых были модифицированы для увеличения их сходства с антителами, продуцируемыми естественным образом у людей.
Антитело может быть рекомбинантным антителом. Термин «рекомбинантное человеческое антитело» может включать человеческое антитело, полученное с использованием технологии рекомбинантной ДНК.
Термин «антигенсвязывающая область» может означать область антитела, имеющую специфическую аффинность связывания для его целевого антигена, например, пептида SEQ ID NO 3, или его варианта или его фрагмента. Предпочтительно, фрагмент представляет собой эпитоп. Область связывания может представлять собой гипервариабельную CDR или ее функциональную часть. Термин «функциональная часть» CDR может означать последовательность в пределах CDR, которая демонстрирует специфическую аффинность к целевому антигену. Функциональная часть CDR может содержать лиганд, который специфически связывается с SEQ ID NO 3 или его фрагментом.
Термин «CDR» может означать гипервариабельную область в тяжелых и легких цепях. В каждой из тяжелых и легких цепей антитела может быть один, два, три или более CDR. Как правило, по меньшей мере три CDR на каждой цепи, которые при конфигурировании вместе образуют антигенсвязывающий сайт, т.е. трехмерную антидетерминанту, с которой антиген связывается или специфически реагирует. Однако было предположено, что в тяжелых цепях некоторых антител могут быть четыре CDR.
Определение CDR также включает перекрывающиеся или подмножества аминокислотных остатков при сравнении друг с другом. Точные номера остатков, которые охватывают конкретный CDR или его функциональную часть, будут варьироваться в зависимости от последовательности и размера CDR. Специалисты в данной области техники могут обычно определять, какие остатки содержат конкретный CDR с учетом аминокислотной последовательности вариабельной области антитела.
Термин «функциональный фрагмент» антитела может означать часть антитела, которая сохраняет функциональную активность. Функциональной активностью может быть, например, антигенсвязывающая активность или специфичность. Функциональной активностью также может быть, например, эффекторная функция, обеспечиваемая при помощи константной области антитела. Термин «функциональный фрагмент» также предназначен для включения, например, фрагментов, продуцируемых путем протеазного расщепления или уменьшения количества человеческого моноклонального антитела, и способов рекомбинантной ДНК, известных специалистам в данной области техники. Функциональные фрагменты человеческого моноклонального антитела включают, например, отдельные тяжелые или легкие цепи и их фрагменты, такие как VL, VH и Fd; моновалентные фрагменты, такие как Fv, Fab и Fab'; двухвалентные фрагменты, такие как F (ab')2; одноцепочечная Fv (scFv); и фрагменты Fc.
Термин «фрагмент VL» может означать фрагмент легкой цепи человеческого моноклонального антитела, который содержит всю или часть вариабельной области легкой цепи, в том числе CDR. Фрагмент VL может дополнительно содержать последовательности константной области легкой цепи.
Термин «фрагмент VH» может означать фрагмент тяжелой цепи человеческого моноклонального антитела, который содержит весь или часть вариабельной области тяжелой цепи, в том числе CDR.
Термин «фрагмент Fd» может означать вариабельную область тяжелой цепи, связанную с первой константной областью тяжелой цепи, то есть VH и СН-1. «Фрагмент Fd» не содержит легкую цепь, или вторую и третью константные области тяжелой цепи.
Термин «фрагмент Fv» может означать моновалентный антигенсвязывающий фрагмент человеческого моноклонального антитела, содержащий все или часть вариабельных областей тяжелой и легкой цепей и не содержащий константные области тяжелой и легкой цепей. Вариабельные области тяжелой и легкой цепей включают, например, CDR. Например, фрагмент Fv содержит всю или часть аминоконцевой вариабельной области размером около 110 аминокислот как тяжелой, так и легкой цепей.
Термин «фрагмент Fab» может означать моновалентный антигенсвязывающий фрагмент человеческого моноклонального антитела, который больше, чем фрагмент Fv. Например, фрагмент Fab содержит вариабельные области и весь или часть первого константного домена тяжелой и легкой цепей. Таким образом, фрагмент Fab дополнительно содержит, например, аминокислотные остатки от около 110 до около 220 тяжелых и легких цепей.
Термин «фрагмент Fab» может означать моновалентный антигенсвязывающий фрагмент человеческого моноклонального антитела, который больше, чем фрагмент Fab. Например, фрагмент Fab'' содержит всю легкую цепь, всю вариабельную область тяжелой цепи и всю или часть первого и второго константных доменов тяжелой цепи. Например, фрагмент Fab'' может дополнительно содержать некоторые или все аминокислотные остатки от 220 до 330 тяжелой цепи.
Термин «фрагмент F(ab')2» может означать двухвалентный антигенсвязывающий фрагмент человеческого моноклонального антитела. Фрагмент F(ab')2 содержит, например, все или часть вариабельных областей двух тяжелых цепей и двух легких цепей и может дополнительно содержать все или часть первых константных доменов двух тяжелых цепей и двух легких цепей.
Термин «одноцепочечный Fv(scFv)» может означать слияние вариабельных областей тяжелой (VH) и легкой (VL) цепей, связанных коротким линкерным пептидом.
Термин «биспецифическое антитело (BsAb)» может означать биспецифическое антитело, содержащее два scFv, связанные друг с другом более коротким связанным пептидом.
Специалист в данной области техники знает, что точные границы фрагмента антитела не важны, если фрагмент поддерживает функциональную активность. Используя хорошо известные рекомбинантные способы, специалист в данной области техники может сконструировать полинуклеотидную последовательность для экспрессии функционального фрагмента с любыми конечными точками, необходимыми для конкретного применения. Функциональный фрагмент антитела может содержать или состоять из фрагмента с по существу одинаковыми вариабельными областями тяжелой и легкой цепей, как например, человеческого антитела.
Предпочтительно его антигенсвязывающий фрагмент по отношению к первому аспекту изобретения представляет собой SEQ ID NO 3-специфический или иммуноспецифический к эпитопу в SEQ ID NO 3. Его антигенсвязывающий фрагмент может содержать или состоять из любого из фрагментов, выбранных из группы, состоящей из VH, VL, Fd, Fv, Fab, Fab', scFv, F(ab')2 и фрагмента Fc.
Его антигенсвязывающий фрагмент может содержать или состоять из любой из последовательностей антигенсвязывающих областей VL, любой из последовательностей антигенсвязывающих областей VH или комбинации антигенсвязывающих областей VL и VH человеческого антитела. Соответствующее количество и комбинация последовательностей антигенсвязывающих областей VH и VL могут быть определены специалистами в данной области техники в зависимости от желаемой аффинности и специфичности и предполагаемого использования антигенсвязывающего фрагмента. Функциональные фрагменты или антигенсвязывающие фрагменты антител могут быть легко получены и выделены с использованием способов, хорошо известных специалистам в данной области техники. Такие способы включают, например, протеолитические способы, рекомбинантные способы и химический синтез. Протеолитические способы выделения функциональных фрагментов включают использование человеческих антител в качестве исходного материала. Ферменты, подходящие для протеолиза иммуноглобулинов человека, могут включать, например, папаин и пепсин. Соответствующий фермент может быть легко выбран специалистом в данной области техники, в зависимости, например, от того, необходимы ли моновалентные или двухвалентные фрагменты. Например, папаиновое расщепление приводит к образованию двух моновалентных Fab'-фрагментов, которые связывают антиген и фрагмент Fc. Например, пепсиновое расщепление приводит к получению двухвалентного фрагмента F(ab''). Фрагмент F(ab') 2 согласно изобретению может быть дополнительно уменьшен с использованием, например, ДТТ (дитиотреитола) или 2-меркаптоэтанола с получением двух моновалентных фрагментов Fab'.
Функциональные или антигенсвязывающие фрагменты антител, продуцируемых при помощи протеолиза, могут быть очищены при помощи процедур аффинной и колоночной хроматографии. Например, нерасщепленные антитела и фрагменты Fc могут быть удалены путем связывания с белком А. Кроме того, функциональные фрагменты могут быть очищены в силу их заряда и размера, используя, например, ионообменную и гель-фильтрационную хроматографию. Такие способы хорошо известны специалистам в данной области техники.
Антитело или его антигенсвязывающий фрагмент могут быть получены при помощи рекомбинантного метода. Предпочтительно один изначально изолирует полинуклеотид, кодирующий необходимые области тяжелой и легкой цепей антител. Такие области могут содержать, например, всю или часть вариабельной области тяжелой и легкой цепей. Предпочтительно такие области могут, в частности, содержать антигенсвязывающие области тяжелой и легкой цепей, предпочтительно антигенсвязывающие сайты, наиболее предпочтительно CDR.
Полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент в соответствии с изобретением, может быть получен с использованием способов, известных специалистам в данной области техники. Полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент, может быть непосредственно синтезирован с помощью способов синтеза олигонуклеотидов, известных в данной области техники. Альтернативно, небольшие фрагменты могут быть синтезированы и объединены с образованием более крупного функционального фрагмента с использованием рекомбинантных методов, известных в данной области техники.
Используемый в данном документе термин «иммуноспецифичность» может означать, что область связывания способна к иммунореакции с SEQ ID NO 3 или его вариантом или фрагментом, путем специфического связывания с ним. Антитело или его антигенсвязывающий фрагмент могут селективно взаимодействовать с антигеном (например, SEQ ID NO 3 или его вариантом или его фрагментом) с константой аффинности приблизительно от 10-5 до 10-13 М-1, предпочтительно от 10-6 до 10-9 М-1, еще более предпочтительно от 10-10 до 10-12 М-1. В разделе «Материалы и методы» приводятся детали, поясняющие, как определяются концентрации антител.
Термин «иммунореактивность» может означать, что область связывания способна вызывать иммунный ответ при связывании с SEQ ID NO 3 или его эпитопом.
Термин «эпитоп» может означать любую область антигена, обладающую способностью вызывать и комбинироваться с связывающей областью антитела или его антигенсвязывающего фрагмента.
Предпочтительно, антитело или его антигенсвязывающий фрагмент согласно изобретению специфически связывается с одной или несколькими аминокислотами на С-конце SEQ ID NO 3. Предпочтительно антитело или его антигенсвязывающий фрагмент согласно изобретению специфически связывается с одной или несколькими аминокислотами в SEQ ID NO 5 (т.е. SYMVHWK, которые являются 7-14 С-концевыми аминокислотами SEQ ID No 0,3). Предпочтительно, антитело или его антигенсвязывающий фрагмент специфически связывается с остатком С-концевого лизина (К) в эпитопе.
Как описано в примерах, изобретатели неожиданно обнаружили, что С-концевая аминокислотная последовательность VHWK в SEQ ID NO 3, которая описана в данном документе как SEQ ID NO 6 (то есть номера 10-14 С-концевых аминокислот SEQ ID No. 3) действует как эпитоп для антитела или его антигенсвязывающего фрагмента в соответствии с изобретением. Соответственно, более предпочтительно антитело или его антигенсвязывающий фрагмент специфически связывается с одной или более аминокислотами в SEQ ID No. 6. Наиболее предпочтительно антитело или его антигенсвязывающий фрагмент специфически связывается с SEQ ID No. 6. Следовательно, будет понятно, что эпитоп, с которым связано антитело, содержит или состоит из SEQ ID No. 6.
Поликлональное антитело, описанное в данном документе, продемонстрировало высокую специфичность к пептиду Т14 и особенно С-концевой последовательности -VHWK. Кроме того, распознавание полного белка AChE предполагает, что эта последовательность эпитопов подвергается воздействию и доступна в третичной структуре. Считается, что тот факт, что антитело не распознает линейный фрагмент пептида Т30 (в пределах которого находится Т14), обусловлено отсутствием открытого лизина (К) на С-конце последовательности Т30.
Основываясь на обнаружении эпитопа -VHWK в пептиде Т14, изобретатели считают, что эти последовательности могут быть использованы в качестве антигена для получения полезных антител. Как описано в примерах, пептид Т14 (SEQ ID NO 3) был перекрестно сшит цистеином с гемоцианином моллюска Megathura crenulata (KLH), действующем как белок-носитель, который стимулирует иммунный ответ у хозяина. Белок KLH, перекрестно сшитый с Т14, упоминается в данном документе как SEQ ID NO 7.
Следовательно, во втором аспекте обеспечивается SEQ ID NO 3 или SEQ ID NO 7 или его вариант или фрагмент для применения в качестве антигена.
Предпочтительно антиген действует как эпитоп, с которым связывается антитело. Предпочтительно вариант или фрагмент содержит или состоит из SEQ ID NO 6.
В третьем аспекте обеспечивается антитело или его антигенсвязывающий фрагмент, полученный при помощи способа, включающего:
(i) иммунизацию организма-хозяина с использованием SEQ ID NO 3 или SEQ ID NO 7 или их варианта или фрагмента; а также
(ii) сбор антитела или его антигенсвязывающего фрагмента из хозяина.
Хозяин может представлять собой млекопитающее и может представлять собой человека, кролика или мышь. Предпочтительно вариант или фрагмент содержит или состоит из SEQ ID NO 6. Предпочтительно, способ включает забор крови у животного-хозяина, а затем сбор антитела или его антигенсвязывающего фрагмента из сыворотки крови. Предпочтительно, сыворотку пропускают через колонку с гравитационным элюированием с ковалентно связанной пептидной подложкой. После промывки антитело или его антигенсвязывающий фрагмент предпочтительно элюируют в кислом буфере, и затем раствор можно нейтрализовать. Способ может дополнительно включать диализ против подходящего буфера (например, PBS) и, необязательно, лиофилизацию.
Преимущественно антитело или его антигенсвязывающий фрагмент в соответствии с первым аспектом изобретения имеет само по себе полезность терапевтического агента. Однако, кроме того, были оценены технологии для максимизации эффективности лекарственного средства, включая инженерию гликозилирования для повышения активности АЗКЦ (антителозависимая клеточноопосредованная цитотоксичность) и/или КЗЦ (комплементзависимая цитотоксичность) антитела или его антигенсвязывающего фрагмента, конъюгацию с цитотоксическим фрагментом, таким как радиоактивное вещество, цитотоксическое лекарственное средство или токсином.
Таким образом, в четвертом аспекте представлен конъюгат антитело-лекарственное средство (АЦП), содержащее антитело или его антигенсвязывающий фрагмент первого или третьего аспекта и цитотоксический фрагмент.
Конъюгаты антитело-лекарственное средство (ADC) могут быть использованы для доставки сильного цитотоксического лекарственного средства избирательно в клетку-мишень с помощью антитела. Одним из ключевых параметров развития ADC является то, что антитело может быть способно подвергаться эндоцитозу при связывании с целевым антигеном, то есть с SEQ ID NO 3 или SEQ ID NO 6. Следовательно, эндоцитированное антитело может доставлять конъюгированный препарат в клетки-мишени.
Цитотоксический фрагмент может представлять собой любой токсин, такой как описанный в Antibody-Drug Conjugates and Immunotoxins: From Pre-Clinical Development to therapeutic applications (см. стр. 118). Также конкретными примерами терапии антителами БА (болезнь Альцгеймера) являются: СОЛАНЕЗУМАБ (Lilly): http://www.alzforum.org/therapeutics/solanezumab ГАНТЕНЕРУМАБ (Roche): http://www.alzforum.org/therapeutics/solanezumab
Другие примеры (включает всю иммунотерапию для лечения больных Альцгеймером, которые находятся от фазы I до фазы III): http://www.alzforum.org/therapeutics/search?fda_statuses=&target_types%5B%5D=170&therapy_types%5B%5D=162&conditions%5B%5D=145&keywords-entry=&keywords=
Компонент лекарственного средства может представлять собой альфа-излучающий радионуклеотид, такой как метка 225Ас. Эти токсины могут быть связаны с антителом или его антигенсвязывающим фрагментом посредством расщепляемого линкера, такого как дисульфидная связь, гидразоновый линкер или пептидный линкер, или с помощью нерасщепляемых линкеров, таких как тиоэфирная связь с использованием SMCC (N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат).
Как описано в примерах, антитело согласно изобретению связывается с пептидом Т14 с очень высокой специфичностью. Антитело неожиданно устойчиво в биологической ткани, даже ткани, которая была глубоко заморожена. Данные также демонстрируют, что Т14-подобный пептид (то есть SEQ ID NO 3 или его вариант или фрагмент) существует как независимое биохимическое соединение, которое может быть обнаружено у пациентов, страдающих или предрасположенных к нейродегенеративному расстройству, такому как болезнь Альцгеймера. Соответственно, эти данные демонстрируют, что антитело согласно изобретению можно использовать в качестве диагностического средства, а также в терапевтическом воздействии для лечения нейродегенеративного расстройства.
Следовательно, согласно пятому аспекту обеспечивается антитело или его антигенсвязывающий фрагмент в соответствии с первым или третьим аспектом, или конъюгат антитело-лекарственное средство в соответствии с четвертым аспектом, каждый из которых необязательно дериватизирован для применения в терапии или в диагностике.
Антитело или его антигенсвязывающий фрагмент или конъюгат антитело-лекарственное средство можно использовать для лечения, улучшения или профилактики нейродегенеративного расстройства.
Следовательно, согласно шестому аспекту обеспечивается антитело или его антигенсвязывающий фрагмент в соответствии с первым или третьим аспектом или конъюгат антитело-лекарственное средство в соответствии с четвертым аспектом, каждый из которых необязательно дериватизирован для применения в лечении, профилактике или улучшении нейродегенеративного расстройства.
Согласно седьмому аспекту предложен способ лечения, профилактики или улучшения нейродегенеративного расстройства у субъекта, причем способ включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества антитела или антигенсвязывающего фрагмента в соответствии с первым или третьим аспектом, или конъюгата антитело-лекарственное средство в соответствии с четвертым аспектом, каждый из которых необязательно дериватизирован.
Термин «дериватизированный» может означать, что антитело или его антигенсвязывающий фрагмент или конъюгат могут быть модифицированы до применения, предпочтительно для получения его производного или варианта. Примеры получения производных могут включать пегилированные антитела или фрагменты пегилированного антитела или слитые белки антитело-цитокин. Однако в некоторых вариантах реализации изоберетения антитело или его антигенсвязывающий фрагмент, или конъюгат не могут быть дериватизированы.
Предпочтительно, что нейродегенеративное расстройство выбрано из группы, состоящей из болезни Альцгеймера; болезни Паркинсона; болезни Хантингтона; заболевания двигательных нейронов; спиноцеребеллярного типа 1, типа 2 и типа 3; амиотрофического боковогго склероза (БАС); и лобно-височной деменции. Наиболее предпочтительно, нейродегенеративное расстройство представляет собой болезнь Альцгеймера.
Понятно, что антитела, их фрагменты и конъюгаты согласно изобретению (в совокупности называемые в данном документы как «агенты») могут быть использованы в монотерапии (например, использование только антитела или его антигенсвязывающего фрагмента или использование только конъюгата антитело-лекарственное средство) для лечения, улучшения или профилактики нейродегенеративного расстройства. Альтернативно, агенты в соответствии с изобретением могут быть использованы в качестве дополнения к или в сочетании с известными способами лечения, улучшения или профилактики нейродегенеративного расстройства, такими как другие ингибиторы ацетилхолинэстеразы.
Агенты согласно изобретению могут комбинироваться в композициях, имеющих несколько различных форм, в зависимости, в частности, от способа, которым должна использоваться композиция. Так, например, композиция может быть в виде порошка, таблетки, капсулы, жидкости, мази, крема, геля, гидрогеля, аэрозоля, распыления, мицеллярного раствора, трансдермального пластыря, липосомной суспензии или любой другой подходящей формы, которая может быть введена человеку или животному, нуждающемуся в лечении. Понятно, что носитель медикаментов в соответствии с изобретением должен быть таким, который хорошо переносится субъектом, которому он предоставляется, и предпочтительно обеспечивает доставку агентов через гематоэнцефалический барьер.
Лекарственные средства, содержащие агенты согласно изобретению, могут быть использованы несколькими способами. Например, может потребоваться пероральное введение, и в этом случае агенты могут содержаться в композиции, которая может, например, поступать в организм в виде таблетки, капсулы или жидкости. Композиции, содержащие агенты и лекарственные средства согласно изобретению, можно вводить путем ингаляции (например, интраназально). Композиции также могут быть приготовлены для местного применения. Например, кремы или мази могут быть нанесены на кожу, например, на поверхность головы.
Агенты и лекарственные средства согласно изобретению также могут быть включены в устройство с медленным или замедленным высвобождением. Такие устройства могут быть, например, помещены на или под кожу, и лекарство может выделяться в течение недель или даже месяцев. Устройство может быть расположено по меньшей мере рядом с местом обработки, то есть головой. Такие устройства могут быть особенно полезными, когда требуется длительная обработка агентами, используемыми в соответствии с изобретением, и которые обычно требуют частого введения (например, по меньшей мере ежедневное введение).
В предпочтительном варианте реализации изобретения агенты и лекарственные средства в соответствии с изобретением могут вводиться субъекту путем инъекции в кровоток или непосредственно в место, требующее лечения. Например, лекарственное средство может быть введено по меньшей мере рядом с мозгом. Инъекции могут быть внутривенными (болюс или инфузия) или подкожными (болюс или инфузия) или внутрикожными (болюс или инфузия).
Понятно, что количество антител, фрагментов и конъюгата (то есть агента), которое требуется, определяется его биологической активностью и биодоступностью, которая, в свою очередь, зависит от способа введения, физиохимических свойств агента и от того, используется ли он в виде монотерапии или комбинированной терапии. На частоту введения также будет влиять период полувыведения агента внутри подлежащего лечению субъекта. Оптимальные дозы для введения могут быть определены специалистами в данной области и будут варьироваться в зависимости от конкретного используемого агента, эффективности фармацевтической композиции, способа введения и развития бактериальной инфекции. Дополнительные факторы, зависящие от конкретного субъекта, подлежащего лечению, приведут к необходимости корректировки дозы, включая возраст, вес, пол, диету и время введения.
Как правило, суточная доза от 0,001 мкг/кг массы тела до 10 мг/кг массы тела агента в соответствии с изобретением может быть использована для лечения, улучшения или профилактики нейродегенеративного расстройства, в зависимости от того, какой агент используется. Более предпочтительно, суточная доза агента составляет от 0,01 мкг/кг массы тела до 1 мг/кг массы тела, более предпочтительно от 0,1 мкг/кг до 100 мкг/кг массы тела и наиболее предпочтительно от около 0,1 мкг/кг до 10 мкг/кг массы тела.
Агент может вводиться до, во время или после начала нейродегенеративного расстройства. Суточные дозы могут назначаться как однократное введение (например, однократная ежедневная инъекция). Альтернативно, агент может потребовать введения дважды или более раз в течение суток. В качестве примера, агенты могут вводиться в виде двух (или более в зависимости от тяжести нейродегенеративного расстройства, которое подвергается лечению) суточных доз от 0,07 мкг до 700 мг (т.е. при условии, что масса тела составляет 70 кг). Пациент, получающий лечение, может принимать первую дозу после пробуждения, а затем вторую дозу вечером (если в двухдозовом режиме) или через 3- или 4-часовые интервалы после этого. Альтернативно, устройство для медленного высвобождения может использоваться для обеспечения оптимальных доз агентов в соответствии с изобретением пациенту без необходимости введения повторных доз. Известные процедуры, такие как те, которые обычно применяются в фармацевтической промышленности (например, эксперименты in vivo, клинические испытания и т.д.) могут быть использованы для получения конкретных лекарственных форм агентов согласно изобретению и точных терапевтических режимов (таких как суточные дозы агентов и частота введения).
В восьмом аспекте изобретения предложена фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент в соответствии с первым или третьим аспектом, или конъюгат антитело-лекарственное средство в соответствии с четвертым аспектом, каждый из которых необязательно дериватизирован; и необязательно фармацевтически приемлемый носитель.
Фармацевтическая композиция предпочтительно представляет собой композицию против нейродегенеративного заболевания, то есть фармацевтический состав, используемый в терапевтическом улучшении, профилактике или лечении нейродегенеративного расстройства у субъекта, такого как болезнь Альцгеймера.
Антитело или его функциональный фрагмент, пептид или нуклеиновая кислота могут не быть дериватизированы.
Настоящее изобретение также обеспечивает в девятом аспекте способ получения фармацевтической композиции в соответствии с восьмым аспектом, включающий объединение терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента, как определено в первом или третьем аспекте, или конъюгат антитело-лекарственное средство, как определено в четвертом аспекте, каждый из которых необязательно дериватизирован, с фармацевтически приемлемым носителем.
Антитело или его антигенсвязывающий фрагмент могут быть такими, как определено в отношении первого аспекта.
«Субъект» может быть позвоночным, млекопитающим или домашним животным. Следовательно, лекарственные средства в соответствии с изобретением могут быть использованы для лечения любого млекопитающего, например, домашнего скота (например, лошади), домашних животных или могут использоваться в других применениях в ветеринарной практике. Наиболее предпочтительно субъект представляет собой человека.
«Терапевтически эффективное количество» антитела или его антигенсвязывающего фрагмента представляет собой любое количество, которое при введении субъекту представляет собой количество агента, которое необходимо для лечения нейродегенеративного заболевания, или дает желаемый эффект.
Например, терапевтически эффективное количество используемого антитела или его фрагмента может составлять от около 0,001 нг до около 1 мг, и предпочтительно от около 0,01 нг до около 100 нг. Предпочтительно, чтобы количество антитела или фрагмента составляло от около 0,1 нг до около 10 нг и наиболее предпочтительно от около 0,5 нг до около 5 нг.
«Фармацевтически приемлемый носитель», как указано в данном документе, представляет собой любое известное соединение или комбинацию известных соединений, которые, как известно специалистам в данной области техники, могут быть полезны при составлении фармацевтических композиций.
В одном варианте реализации изобретения фармацевтически приемлемый носитель может быть твердым, и композиция может быть в виде порошка или таблетки. Твердый фармацевтически приемлемый носитель может содержать одно или более веществ, которые могут также действовать как ароматизаторы, смазывающие вещества, солюбилизаторы, суспендирующие агенты, красители, наполнители, скользящие вещества, добавки для прессования, инертные связующие вещества, подсластители, консерванты, красители, покрывающие вещества или вещества для улучшения распадаемости таблеток. Носитель также может быть материалом для инкапсулирования. В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченными активными веществами согласно изобретению. В таблетках активный агент можно смешивать с носителем, имеющим необходимые свойства сжатия, в подходящих пропорциях и уплотнять в желаемую форму и размер. Порошки и таблетки предпочтительно содержат до 99% активных агентов. Подходящие твердые носители включают, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, поливинилпирролидин, легкоплавкие воски и ионообменные смолы. В другом варианте реализации изобретения фармацевтический носитель может представлять собой гель, и композиция может быть в виде крема или тому подобного.
Однако фармацевтический носитель может быть жидкостью, и фармацевтическая композиция находится в форме раствора. Жидкие носители используются для приготовления растворов, суспензий, эмульсий, сиропов, эликсиров и композиций под давлением. Активный агент согласно изобретению может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, смеси обоих или фармацевтически приемлемых масел или жиров. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, ароматизаторы, суспендирующие агенты, загустители, красители, регуляторы вязкости, стабилизаторы или осмо-регуляторы. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (частично содержащие добавки, как указано выше, например, производные целлюлозы, предпочтительно раствор натрия карбоксиметилцеллюлозы), спирты (включая одноатомные спирты и многоатомные спирты, например, гликоли) и их производные и масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носитель может быть также жирным сложным эфиром, таким как этилолеат и изопропилмиристат. Стерильные жидкие носители применяются в композициях в виде стерильной жидкой формы для парентерального введения. Жидкий носитель для композиций под давлением может представлять собой галогенированный углеводород или другой фармацевтически приемлемый пропеллент.
Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, могут быть использованы, например, в виде внутримышечной, интратекальной, эпидуральной, внутрибрюшинной, внутривенной и особенно подкожной инъекции. Агент может быть приготовлен в виде стерильной твердой композиции, которая может быть растворена или суспендирована во время введения с использованием стерильной воды, физиологического раствора или другой подходящей стерильной инъекционной среды.
Агенты и композиции согласно настоящему изобретению могут вводиться перорально в виде стерильного раствора или суспензии, содержащей другие растворенные вещества или суспендирующие агенты (например, достаточное количество солевого раствора или глюкозы, чтобы сделать раствор изотоническим), желчные соли, аравийскую камедь, желатин, сорбитан моноолеат, полисорбат 80 (сложные эфиры сорбитола и его ангидридов, сополимеризованных с этиленоксидом) и тому подобное. Агенты, используемые в соответствии с настоящим изобретением, также могут вводиться перорально либо в жидкой, либо в твердой форме. Композиции, подходящие для перорального введения, включают твердые формы, такие как пилюли, капсулы, гранулы, таблетки и порошки и жидкие формы, такие как растворы, сиропы, эликсиры и суспензии. Формы, используемые для парентерального введения, включают стерильные растворы, эмульсии и суспензии.
Как обсуждалось в данном документе, антитело согласно настоящему изобретению является высокоспецифичным или селективным к пептиду Т14 (т.е. SEQ ID NO 3) и, в частности, С-концевой последовательности -VHWK (т.е. SEQ ID NO 6), которая функционирует как эпитоп. Антитело неожиданно устойчиво в биологической ткани, даже той, которая была глубоко заморожена. Кроме того, данные показывают, что Т14-подобный пептид существует как независимое биохимическое соединение. Эти данные свидетельствуют о том, что детектируемая последовательность (например, эпитоп -VHWK) может использоваться в качестве диагностического средства.
Следовательно, в десятом аспекте предложена SEQ ID NO 3 или ее вариант или ее фрагмент для применения в качестве биомаркера для детектирования или диагностики нейродегенеративного расстройства.
Предпочтительно SEQ ID NO 3 или его вариант или фрагмент функционирует как эпитоп, который может быть связан антителом или антигенсвязывающим фрагментом, предпочтительно антителом или антигенсвязывающим фрагментом в соответствии с первым аспектом или третьим аспектом.
Предпочтительно вариант или фрагмент SEQ ID NO 3, используемый в качестве биомаркера, содержит или состоит из SEQ ID NO 6.
Настоящее изобретение также представляет собой набор для диагностики пациентов, страдающих нейродегенеративным заболеванием.
Следовательно, согласно одиннадцатому аспекту изобретения предложен набор для диагностики субъекта, страдающего нейродегенеративным расстройством, или предрасположенности к нему, или для обеспечения прогноза состояния субъекта, причем набор содержит средство детекции для определения концентрации антигена, присутствующего в образце из испытуемого субъекта, причем средство обнаружения содержит антитело или его антигенсвязывающий фрагмент в соответствии с первым или третьим аспектом, является необязательно дериватизированным, причем наличие антигена в образце предполагает, что субъект страдает от нейродегенеративного расстройства.
В соответствии с двенадцатым аспектом предложен способ диагностики субъекта, страдающего нейродегенеративным расстройством, или предрасположенности к нему, или для обеспечения прогноза состояния субъекта, причем способ включает обнаружение концентрации антигена, присутствующего в полученном из субъекта образце, в котором обнаружение достигается за счет использования антитела или его антигенсвязывающего фрагмента в соответствии с первым или третьим аспектом, необязательно дериватизированного и причем присутствие антигена в образце предполагает, что субъект страдает от нейродегенеративного расстройства.
Преимущественно антитело согласно настоящему изобретению может быть использовано для определения того, имеет ли индивидуум более высокий риск развития нейродегенеративного расстройства (такого как болезнь Альцгеймера или Паркинсона) намного раньше, чем это возможно в настоящее время, так что может быть предложено раннее лечение или предоставлена информация, чтобы помочь ему принимать более обоснованные решения в отношении образа жизни и диеты. Кроме того, ранняя диагностика нейродегенеративного расстройства или раннее выявление риска того, что у субъекта может развиться нейродегенеративное расстройство, значительно помогла бы врачу в назначении лекарств.
Предпочтительно антиген содержит или состоит из SEQ ID NO 3, более предпочтительно SEQ ID NO 5 и наиболее предпочтительно SEQ ID NO 6.
Предпочтительно, образец содержит биологический образец. Образец может быть любым материалом, который можно получить из субъекта, из которого можно получить белок.
Образец может содержать мозг, например, кору больших полушарий головного мозга, голубое пятно или гиппокамп.
На фиг. 18-20 показано, что антитело неожиданно связывается с Т14 в CSF (спинномозговая жидкость). Поэтому предпочтительно, чтобы образец содержал спинномозговую жидкость (CSF).
Образец может содержать кровь, мочу, ткань и т.д.
На фиг. 23 показано, что антитело неожиданно связывается с Т14 в крови per se. Поэтому наиболее предпочтительно образец содержит образец крови. Кровь может быть венозной или артериальной кровью.
Набор может содержать контейнер для сбора проб для приема извлеченного образца. Образцы крови могут быть немедленно проанализированы на уровни Т14. Альтернативно, образец крови можно хранить при низких температурах, например, в холодильнике или даже замораживать до проведения анализа на Т14. Обнаружение Т14 может проводится в цельной крови. Предпочтительно, вместе с тем, если образец крови содержит сыворотку крови. Предпочтительно, образец крови содержит плазму крови.
Кровь может быть дополнительно обработана до проведения анализа на Т14. Например, можно добавить антикоагулянт, такой как цитрат (такой как цитрат натрия), гирудин, гепарин, PPACK или фторид натрия. Таким образом, контейнер для сбора проб может содержать антикоагулянт, чтобы предотвратить свертывание образца крови. Альтернативно, образец крови можно центрифугировать или фильтровать для получения фракции плазмы или сыворотки, которая может быть использована для анализа. Следовательно, предпочтительно, чтобы Т14 анализировали или исследовали в образце плазмы крови или сыворотки крови. Предпочтительно, чтобы концентрацию Т14 измеряли in vitro из образца сыворотки крови или образца плазмы, взятого у субъекта.
Предпочтительно, набор или способ используют для идентификации присутствия или отсутствия Т14-позитивных клеток (то есть клеток, содержащих SEQ ID NO 3 или ее вариант или фрагмент) в образце, или определения их концентрации в образце. Способ обнаружения может включать анализ, предназначенный для обнаружения присутствия и/или отсутствия Т14-положительных клеток в образце. Набор или способ может включать применение положительного контроля и/или отрицательного контроля, против которого можно проводить сравнение. Например, набор может содержать контрольный образец к концентрации Т14-положительных клеток в образце у индивидуума, который страдает (то есть положительный контроль) или не страдает (то есть отрицательный контроль) от нейродегенеративного расстройства.
Набор может дополнительно содержать метку, которая может быть обнаружена. Термин «метка» может означать фрагмент, который может быть присоединен к антителу или его фрагменту. Фрагменты могут использоваться, например, для терапевтических или диагностических процедур. Терапевтические метки включают, например, фрагменты, которые могут быть присоединены к антителу или фрагменту согласно настоящему изобретению и использованы для контроля связывания антитела с пептидом Т14 (т.е. SEQ ID NO 3) или его фрагментом, таким как SEQ ID NO 5 или SEQ ID NO 6. Как описано в данном документе, антитело или его антигенсвязывающий фрагмент связывается специфически с SEQ ID NO 3 или его вариантом или фрагментом. Предпочтительно, антитело или его антигенсвязывающий фрагмент не связывается с SEQ ID NO 2 (то есть Т30). Предпочтительно, антитело или его антигенсвязывающий фрагмент не связывается с SEQ ID NO 4 (т.е. Т15) или бета-амилоидом.
Диагностические метки включают, например, фрагменты, которые могут быть обнаружены при помощи аналитических методов. Аналитические методы включают, например, качественные и количественные методы. Качественные аналитические методы включают, например, иммуногистохимию и непрямую иммунофлуоресценцию. Количественные аналитические методы включают, например, иммуноаффинные методы, такие как радиоиммунологический анализ, анализ ИФА или проточной цитометрии. Аналитические методы также включают процедуры визуализации in vitro и in vivo. Конкретные примеры диагностических меток, которые могут быть обнаружены с помощью аналитических средств, включают ферменты, радиоизотопы, флуорохромы, хемилюминесцентные маркеры и биотин.
Метка может быть присоединена непосредственно к антителу согласно настоящему изобретению или его фрагменту, или присоединена к вторичному связывающему агенту, который специфически связывает молекулу согласно настоящему изобретению. Такой вторичный связывающий агент может быть, например, вторичным антителом. Вторичное антитело может быть или поликлональным, или моноклональным, и человеческого, из грызуна или химерного происхождения.
Изобретатели считают, что антитело согласно настоящему изобретению можно использовать в рамках скрининга новых терапевтических соединений в процессе поиска новых лекарственных средств. Например, способы и анализы для детектирования токсического пептида Т14 могут быть использованы для скрининга соединения-кандидата (например, высокопроизводительный скрининг и селективный скрининг библиотек и основанный на структуре дизайн), для определения совпадений, которые могут обеспечить эффективное лечение, а также вторичных анализов (например, вторичные анализы in vitro и ex vivo), в рамках «пристрелки по воротам» фармацевтического препарата.
Соответственно, в тринадцатом аспекте настоящего изобретения предложено применение антитела или его антигенсвязывающего фрагмента в соответствии с первым или третьим аспектом в поиске нового лекарственного средства для идентификации терапевтического соединения для использования в лечении, профилактике или улучшении нейродегенеративного расстройства.
В четырнадцатом аспекте предложено применение ex vivo колориметрически- или флуоресцентно-меченого Т14-пептида (SEQ ID NO 3) для идентификации агента, который ингибирует синтез или активность пептида Т14 (SEQ ID NO 3).
В пятнадцатом аспекте представлен способ идентификации агента-кандидата для использования в лечении, профилактике или улучшении нейродегенеративного расстройства, причем способ включает стадии:
(i) приведения в контакт in vitro или ex vivo клетки с тестируемым агентом в присутствии антитела или его антигенсвязывающего фрагмента в соответствии с первым или третьим аспектом; и
(ii) применения антитела или его антигенсвязывающего фрагмента для определения присутствия, концентрации или активности пептида Т14 (SEQ ID NO 3), причем отсутствие пептида Т14 или снижение синтеза, концентрации или активности пептида Т14, по сравнению с контролем, является показателем того, что агент является кандидатом на лечение, профилактику, улучшение заболевания, характеризующегося несоответствующей активацией комплемента.
В пятнадцатом аспекте представлен анализ для идентификации агента, который ингибирует синтез или активность пептида Т14 (SEQ ID NO 3), включающий:
(i) клеточная система экспрессии;
(ii) антитело или его антигенсвязывающий фрагмент в соответствии с первым или третьим аспектом; и
(iii) сосуд, сконфигурированный для обеспечения контакта по меньшей мере одного тестируемого агента с системой экспрессии.
В шестнадцатом аспекте представлен способ идентификации агента, который модулирует синтез или активность пептида Т14 (SEQ ID NO 3), включающий:
(i) приведение в контакт in vitro или ex vivo клетки с тестируемым агентом в присутствии антитела или его антигенсвязывающего фрагмента в соответствии с первым или третьим аспектом; и
(ii) использование антитела или его антигенсвязывающего фрагмента для определения присутствия, концентрации или активности пептида Т14 (SEQ ID NO 3), где изменение синтеза, концентрации или активности Т14 по сравнению с контролем является показателем того, что тестовый агент модулирует синтез Т14 пептида (SEQ ID NO 3) или активность.
Понятно, что антитело или его антигенсвязывающий фрагмент могут быть использованы для определения присутствия, концентрации или активности токсичного пептида Т14 (SEQ ID NO 3) в анализах и способах согласно настоящему изобретению. Следовательно, если антитело детектирует Т14 или увеличивает его концентрацию или активность в ответ на присутствие тестируемого соединения, это указывает на то, что тестируемое соединение не является приемлемым кандидатом в качестве терапии для лечения нейродегенеративных нарушений. И наоборот, если никакой токсический Т14 не обнаружен антителом или не обнаружено снижение его концентрации или активности в присутствии тестируемого соединения, это указывает на то, что испытуемое соединение является приемлемым терапевтическим средством для лечения нейродегенеративных нарушений. Предпочтительно, чтобы способы и анализы включали идентификацию агента, который уменьшает или предотвращает синтез или активность пептида Т14.
Любой из описанных в данном документе способов может быть выполнен in vitro или ex vivo. Приведение в контакт может осуществляться в практически бесклеточной системе. Любой из способов может включать скрининг агента, который демонстрирует положительный признак для той же активности в клеточной системе и/или in vivo у млекопитающего, не являющегося человеком.
Понятно, что настоящее изобретение распространяется на любую нуклеиновую кислоту или пептид или вариант, производное или аналог, который содержит или состоит по существу из последовательностей аминокислот или нуклеиновых кислот любой из последовательностей, упомянутых в данном документе, включая их варианты или фрагменты. Термины «по существу аминокислотная/нуклеотидная/пептидная последовательность», «вариант» и «фрагмент» могут представлять собой последовательность, которая имеет по меньшей мере 40% идентичность последовательности с аминокислотными/нуклеотидными/пептидными последовательностями любой одной из последовательностей, упомянутых в данном документе, например, 40% идентичности с последовательностью, идентифицированной как SEQ ID NO 3 (т.е. полипептидная последовательность Т14 или SEQ ID NO 6 (т.е. эпитоп VHWK) и так далее.
Аминокислотные/полинуклеотидные/полипептидные последовательности с идентичностью последовательности, которая составляет более 50%, более предпочтительно более 65%, 70%, 75% и еще более предпочтительно более 80% идентичности последовательности с любой из последовательностей, указанных выше, также предусмотрены. Предпочтительно, аминокислотная/полинуклеотидная/полипептидная последовательность имеет по меньшей мере 85% идентичности с любой из указанных последовательностей, более предпочтительно по меньшей мере 90%, 92%, 95%, 97%, 98% и наиболее предпочтительно по меньшей мере 99% идентичности с любой из последовательностей, упомянутых в данном документе.
Квалифицированному специалисту понятно, как рассчитать процентную идентичность между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями. Для расчета процентной идентичности между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями сначала необходимо подготовить выравнивание двух последовательностей с последующим вычислением значения идентичности последовательности. Процент идентичности для двух последовательностей может принимать разные значения в зависимости от: - (i) способа, используемого для выравнивания последовательностей, например, ClustalW, BLAST, FASTA, Smith-Waterman (реализованы в разных программах), или структурное выравнивание от 3D-сравнения; и (ii) параметров, используемых методом выравнивания, например локальное или глобальное выравнивание, используемая матрица парных байт (например, BLOSUM62, РАМ250, Gonnet и т.д.) и штрафы за пропуск в последовательности, например, функциональная форма и константы.
При выравнивании существует множество различных способов вычисления процентной идентичности между двумя последовательностями. Например, можно разделить число тождеств на: (i) длину самой короткой последовательности; (ii) длину выравнивания; (iii) среднюю длину последовательности; (iv) количество нелокальных позиций; или (iv) количество эквивалентных позиций, исключая концевые нуклеотиды. Кроме того, будет понятно, что процентная идентичность также сильно зависит от длины. Следовательно, чем короче пара последовательностей, тем выше идентичность последовательности, которую можно случайно ожидать.
Следовательно, будет понятно, что точное выравнивание последовательностей ДНК или белков является сложным процессом. Популярная программа множественного выравнивания ClustalW (Thompson et al., 1994, Nucleic Acids Research, 22, 4673-4680; Thompson et al., 1997, Nucleic Acids Research, 24, 4876-4882) является предпочтительным способом для генерирования множественных выравниваний белков или ДНК в соответствии с изобретением. Подходящими параметрами для ClustalW могут быть следующие: Для ДНК-выравниваний: Штраф на внесение делеции в выравнивание = 15,0, Штраф на продолжение делеции = 6,66 и Матрица = Identity. Для выравнивания белка: Штраф на внесение делеции в выравнивание = 10,0, Штраф на продолжение делеции = 0,2 и Матрица = Gonnet. Для выравнивания ДНК и белка: ENDGAP=-1, a GAPDIST=4. Специалисты в данной области техники должны знать, что может быть необходимо изменить эти и другие параметры для оптимального выравнивания последовательности.
Предпочтительно вычисление процентных идентичностей между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями затем может быть вычислено из такого выравнивания, как (N/T)*100, где N представляет собой число положений, в которых последовательности имеют одинаковый остаток, а Т - общее количество позиций, включая пробелы, но исключая концевые остатки. Следовательно, наиболее предпочтительный способ вычисления процентной идентичности между двумя последовательностями включает (i) подготовку выравнивания последовательности с использованием программы ClustalW с использованием подходящего набора параметров, например, как указано выше; и (ii) вставку значений N и Т в следующую формулу: - идентичность последовательности = (N/T)*100.
Специалистам в данной области техники будут известны альтернативные способы идентификации подобных последовательностей. Например, по существу подобная нуклеотидная последовательность будет кодироваться последовательностью, которая гибридизируется с любой из последовательностей нуклеиновых кислот, показанных в данном документе, или их комплементами в строгих условиях. Под жесткими условиями мы подразумеваем, что нуклеотид гибридизируется с фильтруемой ДНК или РНК в 3х хлориде натрия/цитрате натрия (SSC) при температуре приблизительно 45°С, за которой следует, по меньшей мере, одна промывка в 0,2х SSC/0,1% ДСН при приблизительно 20-65°С. Альтернативно, по существу аналогичный полипептид может отличаться по меньшей мере на 1, но менее 5, 10, 20, 50 или 100 аминокислот из последовательностей, показанных в данном документе.
Из-за вырождения генетического кода ясно, что любая последовательность нуклеиновой кислоты, описанная в данном документе, может быть изменена или изменена без существенного влияния на последовательность белка, кодируемого таким образом, для обеспечения ее функционального варианта. Подходящими вариантами нуклеотидов являются те, которые имеют последовательность, измененную путем замещения различных кодонов, которые кодируют одну и ту же аминокислоту в последовательности, тем самым вызывая молчаливое изменение. Другими подходящими вариантами являются те, которые имеют гомологичные нуклеотидные последовательности, но содержат все или части последовательности, которые изменяются путем замещения различных кодонов, которые кодируют аминокислоту с боковой цепью с аналогичными биофизическими свойствами с аминокислотой, которую она замещает, для получения консервативной замены. Например, малые неполярные, гидрофобные аминокислоты включают глицин, аланин, лейцин, изолейцин, Волин, пролин и метионин. Большие неполярные, гидрофобные аминокислоты включают фенилаланин, триптофан и тирозин. Полярно-нейтральные аминокислоты включают серии, треонин, цистеин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают лизин, аргинин и гистидин. Отрицательно заряженные (кислотные) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Поэтому следует понимать, какие аминокислоты могут быть заменены аминокислотой, имеющей сходные биофизические свойства, и квалифицированный специалист будет знать нуклеотидные последовательности, кодирующие эти аминокислоты.
Все описанные в данном документе функции (включая любые сопроводительные формулы изобретения, реферат и графические материалы) и/или все этапы любого раскрытого способа или процесса могут быть объединены с любым из вышеуказанных аспектов в любой комбинации, за исключением комбинаций, где по меньшей мере некоторые из таких функций и/или шагов являются взаимоисключающими.
Для лучшего понимания изобретения и для того, чтобы показать, как варианты реализации того же могут быть введены в действие, будет сделана ссылка, в качестве примера, на фигуры, в которых:
На фиг. 1 показана калибровочная кривая Рер4 (SEQ ID NO 7) при помощи ИФА;
На фиг. 2 показана калибровочная кривая Т14 (SEQ ID NO 3) при помощи ИФА;
На фиг. 3 показана калибровочная кривая Т30 (SEQ ID NO 2) при помощи ИФА;
На фиг. 4 показана калибровочная кривая Т15 (SEQ ID NO 4) при помощи ИФА;
На фиг. 5 показано ИФА-детектирование пептидов из 9, 10, 11, 12, 13 и 14 аминокислот с мотивом VHWK (SEQ ID NO 6) на С-конце;
На фиг. 6 показано ИФА-детектирование пептидов из 9, 10, 11, 12, 13 и 14 аминокислот без мотива VHWK на С-конце;
На фиг. 7 показано ИФА-детектирование пептидов из 11 аминокислот;
На фиг. 8 показано ИФА-детектирование пептидов из 12 аминокислот;
На фиг. 9 показано ИФА-детектирование пептидов из 13 аминокислот;
На фиг. 10 показано ИФА-детектирование пептидов из 14 аминокислот;
На фиг. 11 показано детектирование молекулы AChE при помощи ИФА с использованием одного варианта реализации антитела в соответствии с настоящим изобретением;
На фиг. 12 показана активность только AChE и в сочетании с одним вариантом реализации антитела в соответствии с настоящим изобретением, определяемая при помощи теста Эллмана;
На фиг. 13 показана активность только AChE и в сочетании с одним вариантом реализации антитела в соответствии с настоящим изобретением, определяемая при помощи теста Эллмана;
На фиг. 14 показана активность только AChE и в сочетании с одним вариантом реализации антитела в соответствии с настоящим изобретением, определяемая при помощи теста Эллмана;
На фиг. 15 показано обнаружение Т14-подобного пептида в разных разведениях гомогената крысы;
На фиг. 16 показан контрольный и с БА головный мозг человека, выраженный в виде мкг Т-14-подобного пептида на мг общего белка. Образцы БА демонстрируют значительно более высокую концентрацию при Р=0,03;
На фиг. 17 показано подтверждение специфичности антитела к Т14. На гистограмме показана реакция на 100 нмоль/л экзогенных Т14, Т30, Т15, амилоида и Т14 без добавления конечного остатка K. Во всех случаях n=3. Четкий ответ на антитело наблюдали только для Т14;
На фиг. 18 приведены данные вестерн-блоттинга (ВБ) для десяти равновозврастных пар контролей и пациентов с БА, демонстрирующие шифр пациента, пол, возраст, статус CERAD (Консорциум для разработки регистра болезни Альцгеймера) и стадии по Н. Braak (различные стадии прогрессирования болезни Альцгеймера). Уровни Т14 в CSF увеличиваются в большинстве случаев (80%) случаев БА у пациентов, протестированных с использованием вестерн-блоттинга, с использованием варианта реализации антитела согласно настоящему изобретению, что подтверждает гипотезу и идентифицирует Т14 в качестве биомаркера;
На фиг. 19 показаны уровни Т14, повышенные в CSF у пациентов с БА, с использованием варианта реализации антитела согласно настоящему изобретению, но уровни Аβ остаются неизменными. На фиг. 19 (А): Экспрессия Т14 в CSF после вскрытия контрольных пациентов и с БА в типичном вестерн-блоте. Из-за агрегации Т14 (Bond, Zimmerman et al., 2009, Cottingham, Hollingshead et al., 2002) наблюдается более медленная электрофоретическая подвижность (50 кДа). Контроль: Мужчина, 80 лет, CERAD - нормальный, Braak - I. БА: Мужчина, 81 лет, CERAD - четко выраженный, Braak - V; Фигура 19 (Б): Экспрессия Аβ в CSF после вскрытия контрольных пациентов и с БА в типичном вестерн-блоте. Контроль: Мужчина, 80 лет, CERAD - нормальный, Braak-I. БА: Мужчина, 81 лет, CERAD - четко выраженный, Braak-V. Слева направо: Контроль: Женщина, 82 лет, CERAD - нормальный; БА: Женщина, 81 лет, CERAD - четко выраженный, Braak - VI; Контроль: Мужчина, 83 лет, CERAD - нормальный, Braak - I/II; БА: Мужчина, 79 лет, CERAD - четко выраженный, Braak V/VI; Фиг. 19 (В): Количественная оценка экспрессии Т14; и фиг. 19 (Г): Экспрессия Аβ в CSF после вскрытия контрольных пациентов (n=10) и с БА (n=10). Уровни Т14 были нормированы к экспрессии общего белка, как было обнаружено при помощи BLOT-FastStain™ (Collins et al., 2015) и выражены в процентах от среднего количества контролей +/- СОС. Статистически значимая разница на уровне Р<0,0001, указана при помощи ****;
На фиг. 20 показано, что уровни Т14 стабильно выше в CSF в контроле и пациентов с БА, по сравнению с тремя областями мозга, при использовании варианта реализации антитела согласно изобретению. Однако это не относится к Аβ. Уровни Т14 были измерены в CSF и трех областях мозга (СС: кора головного мозга, LC: голубое пятно, НС: гиппокамп). Количество Т14 в областях головного мозга и CSF было выражено в % от количества Т14 в CSF как А) для контроля, так и для Б) пациентов с БА. Уровни Аβ измеряли и выражали так же, как указано выше для В) контроля, и Г) пациентов с БА. Д) Относительное количество Т14 и Аβ в CSF (черные полосы) затем отображали на графике вместе;
На фиг. 21 показано, что агрегация Т14 растет экспоненциально, причем пул мономеров Т14 остается неизменным. Исходный раствор экзогенного Т14 (20 ммоль/л) был создан при помощи ресуспендирования в дистиллированной воде. Затем исходный раствор разбавляли до рабочего раствора (400 мкмоль/л) с PBS (фосфатно-солевой буфер) (рН 10,5). Агрегацию инициировали нейтрализацией рабочего раствора путем добавления PBS (рН 5) для получения конечной концентрации 200 мкмоль/л, который инкубировали в течение 0, 1, 2, 3, 4 часов при 25°С. Кроме того, контроль мономера Т14 был получен путем разбавления рабочего вещества в PBS (рН 10,5) до 200 мкмоль/л и инкубации при 25°С в течение 4 часов. Дополнительно был получен неконтрольный пептид путем смешивания PBS с рН 5 и рН 10,5 и инкубации при 25°С в течение 4 часов. Затем проводили ВБ (А) и ИФА (Б) на вышеуказанных образцах агрегации Т14 и количественно определяли;
На фиг. 22 показано, что уровни Т14 в клинической ткани головного мозга (кора и гиппокамп) значительно повышены (на мг белка) в головном мозге с БА, с использованием варианта реализации антитела согласно настоящему изобретению;
На фиг. 23 показано, что фильтрованная человеческая сыворотка (30 кДа НОММ (Номинальное Отсечение по Молекулярной Массе)) демонстрирует наличие Т14 на детектируемом уровне, измеренном при помощи ИФА для Т14, с использованием варианта реализации изобретения антитела согласно настоящему изобретению;
На фиг. 24 показаны результаты иммуногистохимии с использованием антитела, демонстрирующие наличие Т14 в глобальных нейронах у пациента с болезнью Альцгеймера на поздней стадии; и
На фиг. 25 показано иммуногистохимическое окрашивание срезов человеческого среднего мозга антителом против Т14 как при не неврологическом контроле, так и при тяжелой БА.
ПРИМЕРЫ
«Концевая» ацетилхолинэстераза (Т-AChE) экспрессируется в синапсах, и авторы настоящего изобретения ранее идентифицировали два пептида, которые могли быть отщеплены от ее С-конца, один из которых называется «Т14» (длиной 14 аминокислот), а другой известен как «Т30» (длиной 30 аминокислот), и оба они имеют сильную гомологию последовательностей со сравнимой областью β-амилоида. Дополнительный пептид, называемый «Т15», соответствует последним 15 аминокислотным остаткам Т30.
Аминокислотная последовательность линейного пептида Т14 представляет собой AEFHRWSSYMVHWK [SEQ ID NO 3].
Аминокислотная последовательность линейного пептида Т30 представляет собой KAEFHRWSSYMVHWKNQFDHYSKQDRCSDL [SEQ ID NO 2]. Аминокислотная последовательность линейного пептида Т15, которая соответствует последним 15 аминокислотным остаткам Т30 NQFDHYSKQDRCSDL [SEQ ID NO 5].
С-концевой пептид АСЕ «Т14» был идентифицирован как существенная часть молекулы АСЕ, ответственная за диапазон негидролитических действий. Синтетический аналог 14-аминокислотного пептида (т.е. «Т14»), и более крупная, более стабильная и более мощная аминокислотная последовательность, в которую он встроен (т.е. "Т30") отображают действия, сопоставимые с теми, которые были представлены для «нехолинергических» AChE.
Изобретатели также предварительно подготовили 14-аминокислотный циклический пептид Т14 (т.е. «NBP-14»), который основан на аминокислотной последовательности Т14, то есть AEFHRWSSYMVHWK [SEQ ID NO 3], но был циклизован через концевые остатки аланина (А) и лизина (K). Циклизация может быть достигнута несколькими различными способами. Например, Genosphere Biotechnologies (Франция) выполнила циклизацию Т14, превратив линейный пептид в N-концевой-С-концевой лактам. Циклизация Т14 для создания циклического NBP14 объединяет оба конца, то есть HWK-AEF. Изобретатели ранее показали, что циклический NBP-14 избирательно ингибирует нетипичные свойства AChE (т.е. свойства AChE, которые не зависят от его ферментативной активности) и/или его концевой пептид in vitro, и может быть использован для лечения нейродегенеративных расстройств. NBP14 влияет на α7-никотиновый рецептор, чтобы защитить клетки от токсичности линейных Т14, Т30 и β-амилоида. Он также блокирует компенсаторный выброс AChE, вызванный токсичностью линейных Т14 и Т30. Кроме того, при использовании отдельно, циклический NBP14 не оказывает существенного влияния на концентрацию Са2+ в срезах мозга крыс, но блокирует эффекты Т30.
Основываясь на своей более ранней работе, изобретатели разработали антитело, которое связывается с очень высокой специфичностью с С-концевым пептидом AChE «Т14». Показано, что антитело можно использовать с высокой степенью уверенности в качестве диагностического средства для диагностики нейродегенеративного расстройства. Они также считают, что антитело можно использовать в терапии.
МАТЕРИАЛЫ И СПОСОБЫ

СИНТЕЗ ПОЛИКЛОНАЛЬНОГО АНТИТЕЛА
Антитело синтезировали по заказу у Genosphere Biotechnologies (Париж, Франция). Использовали два новозеландских кролика, которых четыре раза иммунизировали с использованием KLH-пептида («Рер4»: Т14-гаптен CAEFHRWSSYMVHWK - SEQ ID №7) в качестве иммуногена в течение 70 суток. У животных четыре раза производили забор крови, а кровь объединяли. Затем иммунную сыворотку пропускали через колонку с гравитационным элюированием с ковалентно связанной пептидной подложкой, после промывали, и элюировали антитела в кислом буфере и раствор нейтрализуют.
Дальнейшим диализом против буфера PBS и лиофилизацией завершали процесс.
ОПТИМИЗАЦИЯ УСЛОВИЙ АНТИТЕЛА Т14
Отчет изготовителя об антителе использовали для проведения экспериментов с ИФА в оптимальных условиях. В отчете производитель указывает оптическую плотность, связанную с концентрацией антитела (см. таблицу ниже) и протокол ИФА, используемый для этой процедуры (см. протокол ниже).
Протокол от производителя:
Антигены наносили на полоски для ИФА по 10 мкг на лунку. Лунки промывали с использование 200 мкл буфера PBS.
Иммунную сыворотку разводили последовательно, добавляли в отдельные лунки и инкубировали в течение 2 часов. Несвязанные антитела промывали и добавляли конъюгат анти-кроличьи IgG-HRP (пероксидаза хрена). Планшеты промывали и окрашивали в течение 15 минут с использованием субстрата ТМБ (тетраметилбензидиновый субстрат). Оптическую плотность считывали при 405 нм (2,00 AUFS (оптические единицы на всю шкалу)). Интенсивность цвета была прямо пропорциональна количеству антител. Антитело было положительным, если плотность поглощения была в >2 раза выше, чем у неиммунной сыворотки. Фоновое оптическое поглощение для неиммунной сыворотки может достигать от 0,1 до 0,3.
Выводы:
Для всех описанных в данном документе экспериментов, разбавление антитела было выбрано 1:1000.
ДЕТЕКТИРОВАНИЕ ПЕПТИДА В ОБРАЗЦЕ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ (ИФА)
Процедура анализа ИФА заключалась в следующем:
Калибровочные кривые и образцы выполняли в трех повторностях. Для детектирования Т14, Рер4, Т15 и амилоида, для ИФА использовали 8 наномолярных концентраций. С другой стороны, для эксперимента определения мотивов использовали только одну концентрацию каждого из пептидных вариантов в 100 нмоль/л. Для детектирования Т14 в образцах головного мозга крысы использовали различные разведения белка. Из-за ценности образцов гомогената человека, они использовались только при разведении 1:160. Калибровочную кривую для определения пептида Т14 в ткани головного мозга, образцы ткани мозга разбавляли в буфере PBS. Калибровочные кривые охватывали интервал от 8 до 100 нмоль/л Т14. Вкратце, 96-луночные планшеты для ИФА (NUNC) покрывали 100 мкл/лунку образца или стандартного Т14, далее покрывали парафильмом и инкубировали в течение ночи при температуре 4°С. На следующий день образец удаляли, перемещая планшет через раковину с проточной водой и добавляли 200 мкл блокирующего раствора, содержащего 2% альбумина бычьей сыворотки (БСА) в трис-буферном солевом растворе и Твин 20 (TBS-T), и инкубировали в течение 4 ч при комнатной температуре. Затем удаляли блокирующий раствор и добавляли 100 мкл антитела, разбавленного в блокирующем растворе до 1 мкг/мл, и инкубировали в течение ночи при температуре 4°С. Первичное антитело удаляли на следующий день, и лунки промывали 3 раза 200 мкл TBS-T. Затем добавляли 100 мкл вторичного антитела, разбавленного в блокирующем растворе до 0,1 мкг/мл, и инкубировали в течение 2 ч при комнатной температуре; планшет была покрыта парафильмом во время всех инкубаций. Через 2 часа планшет промывали 4 раза с использованием TBS-T. Добавление 3,3,5,5-тетраметилбензидина начинало цветную реакцию. Реакцию останавливали через 15-30 минут с помощью останавливающего раствора, содержащего 2 М H2SO4, и оптическую плотность измеряли при 450 нм в сканирующем спектрофотометре для прочтения планшетов VMax (Molecular devices, Уокингхем, Великобритания).
АНАЛИЗ ЭЛЛМАНА АКТИВНОСТИ AChE
Активность AChE измеряли с использованием реагента Эллмана, который измеряет присутствие тиоловых групп как результат активности AChE. В случае эксперимента G4, AChE (G4) анализировали отдельно или в комбинации с NBP-14 или в комбинации с галантамином. Клетки высевали за сутки до эксперимента для анализа жизнеспособности клеток. Клетки обрабатывали различными концентрациями NBP-14 (0,1-100 мкмоль/л) и Т30, Т14 и Аβ 10 мкмоль/л отдельно или в комбинации с NBP-14 (0,1 и 0,7 мкмоль/л). После обработки супернатант (перфузат) каждой обработки собирали и добавляли 25 мкл каждого варианта в новый плоскодонный 96-луночный планшет с последующим добавлением 175 мкл реагента Эллмана (раствор А: 139 ммоль/л KH2PO4 и 79,66 ммоль/л K2HPO4, рН 7,0; раствор В (субстрат): 11,5 ммоль/л ацетилтиохолина-иодида; раствор С (реагент): 8 ммоль/л 5,5'-дитиобис(2-нитробензойная кислота) и 15 ммоль/л NaHCO3). Реагент Эллмана готовили в виде смеси 3 растворов в соотношении 33 (А): 3 (В): 4 (С). Измерения поглощения проводили через равные промежутки времени (3, 10, 30 и 60 мин) в экспериментах при 405 нм.
ПОЛУЧЕНИЕ ГОМОГЕНАТОВ ГОЛОВНОГО МОЗГА (КРЫСЫ И ЧЕЛОВЕКА)
Образцы готовили следующим образом. Образец головного мозга взвешивали перед помещением в гомогенизатор Даунса и 1,5 мкл PBS добавляли на 1 мг материала мозга. Образец головного мозга в нижней части гомогенизатора Даунса был гомогенизирован, полностью погрузившись на дно гомогенизатор Даунса, с использованием свободного плунжера по меньшей мере в 10 раз. «Тугой» плунжер использовали для дальнейшей гомогенизации материала, обеспечивая минимум 10 полных погружений. Гомогенизированный образец собирали в 2-мл микропробирку эппендорфа и центрифугировали в течение 15 минут при 13000 g в центрифуге, охлажденной при температуре 4°С. После завершения центрифугирования супернатант собирали в подготовленные 0,5 мл 30 кДа НОММ-фильтры. Образцы центрифугировали в течение 30 минут при 13000 g и к фильтрату добавляли смесь ингибиторов протеаз (Roche complete PIC 04693116001). Это использовали для ИФА пептида Т14. Нефильтрованный концентрат образца (>30 кДа) собирали путем реверсирования фильтра в отдельную микроцентрифужную пробирку и использовали для определения концентрации белка в исходном образце с использованием анализа Pierce (как описано ниже).
ОПРЕДЕЛЕНИЕ БЕЛКА
Thermo Scientific Pierce 660 nm Protein Assay представляет собой готовый к использованию реагента для анализа, совместимый с детергентом и восстановителем, для быстрого измерения общей концентрации белка (А660 нм) по сравнению со стандартным белком альбумина бычьей сыворотки. Для анализа 10 микролитров каждого образца гомогената человеческого мозга, разведенного 1:10 в PBS, добавляли к микротитрационному 96-луночному планшету с последующим добавлением 150 мкл из анализа Pierce. После инкубации в течение 5 минут оптическую плотность измеряли при 660 нм в сканирующем спектрофотометре для прочтения планшетов VMax (Molecular devices, Уокингхем, Великобритания), а результаты оптической плотности экстраполировали на калибровочную кривую БСА для получения миллиграмм на микролитр.
АНАЛИЗ ДАННЫХ
Для всех экспериментов сравнения между несколькими группами лечения и одним и тем же контролем выполняли при помощи однофакторного дисперсионного анализа (ANOVA) и апостериорного критерия Тьюки с использованием GraphPAD Instat (GraphPAD software, Сан-Диего, Калифорния). Эти тесты сравнивают средства каждого лечения со средствами любого другого лечения; то есть одновременно применять к набору всех парных сравнений и определять, где разница между двумя средними превышает стандартную ошибку. Статистическая значимость при значении Р<0,05. Графики были построены с использованием Microsoft Excel.
Для экспериментов с мозгом человека анализ данных был представлен на фигурах как среднее значение 5 контрольных и 7 пациентов с болезнью Альцгеймера и стандартную ошибку от среднего применяли для поправки Бесселя (n-1). Для того чтобы преобразовать показания оптической плотности в микрограммы Т14 в каждом образце, использовали калибровочную кривую, в которой с помощью «экспоненциальной модели» были нанесены различные известные концентрации экзогенного Т14 против соответствующего значения. Наконец, значения были стандартизированы относительно содержания Т14, связанного с общим белком (мкг/мг).
ИСТОЧНИК ОБРАЗЦОВ МОЗГА
Крысы: Свежий гомогенизированный целый мозг у самцов крыс линии Wistar, в возрасте 35 суток, из Charles River.
Человек: Срезы среднего мозга из глубокозамороженной ткани, поставляемые Thomas Willis Oxford Brain Collection (профессором Маргарет Эсири). Заявка на этику была одобрена Банком человеческих тканей оксфордской клиники Рэдклиффа системы медицинского обслуживания населения, которая соответствовала закону о тканях человека, кодексам британской ассоциации по вопросам пересадки человеческих органов и другим законам, имеющим отношение к вскрытию и использованию тканей. В частности, фронтальный срез размером около 5 мм с околоводопроводным серым веществом выше и ножкой мозга и черным веществом ниже, содержащим дорзальное ядро шва, красное ядро и ядро третьего нерва.
ВЕСТЕРН-БЛОТТИНГ
Подготовка проб головного мозга
Срезы коры головного мозга, голубого пятна, гиппокампа и CSF из десяти пациентов с БА после вскрытия и их равновозрастных контролей были любезно предоставлены профессором Маргарет Эсири и д-ром Габриэле Делукой из Банка мозга клиники Джона Рэдклиффа в Оксфорде. Каждый образец головного мозга взвешивали и помещали в гомогенизатор Даунса. Для каждого 1 мкг материала головного мозга добавляли 2 мкл PBS (1X), содержащего мини-ЭДТА без смеси ингибиторов протеазы (Roche complete PIC 04693116001), и проводили гомогенизацию, используя сначала «свободный» плунжер, а затем «тугой» плунжер. Затем образцы центрифугировали при 13000 g в течение 30 минут при температуре 4°С и отбирали супернатанты. Для образцов CSF не требуется никаких препаратов. Все образцы хранили при температуре -80°С.
Измерение концентрации белка в образце
Концентрации белка из вышеуказанных образцов измеряли с использованием анализа Pierce™ 660 nm Protein Assay (Thermo Scientific). Коротко, серийное разведение (от 0 до 2 мг/мл) было получено из 10 мг/мл исходного раствора сывороточного альбумина крупного рогатого скота (БСА). Три повторности каждой концентрации БСА получали путем переноса 10 мкл белка в прозрачный 96-луночный планшет (Greiner). Затем образцы разбавляли тремя концентрациями (1:1, 1:2, 1:10) и три повторности каждой концентрации помещали в один и тот же 96-луночный планшет с каждой повторностью, содержащей 10 мкл образца. Затем к стандарту добавляли 150 мкл реагента Пирса и все образцы и смесь оставляли для инкубации в течение 5 мин при осторожном встряхивании. Наконец, планшет считывали на спектрофотометре (Molecular Devices) при 660 нм. Концентрацию белков в образцах определяли с помощью наклона и у-перехвата от калибровочной кривой БСА, рассчитанной с помощью Microsoft Excel.
Электрофорез образов белка в полиакриламидном геле
Полиакриламидные гели (гели mini-PROTEAN® TGX stain free™, BIO-RAD) помещали в резервуар для электрофореза (BIO-RAD, mini-PROTEAN tetra system) и подвижный буфер (25 ммоль/л трис-основания, рН 8,6, 192 ммоль/л глицина, 0,1% ДСН) добавляли в гель и резервуары (BioRad). Образцы белка готовили смешиванием с дистиллированной водой и 4-х буфером Лэммли для образцов (конечные концентрации: 69,5 ммоль/л Трис-HCl, рН 6,8, 1,1% ДСЛ (лития додецилсульфат), 11,1% (мас./об.) глицерина, 0,005% бромфенолового синего, BIO-RAD) и 2,5% меркаптоэтанола (BIO-RAD). Также была получена эквивалентная концентрация экзогенного Т14, которая выступала в роли положительного контроля для измерения уровня эндогенного пептида Т14. Смеси нагревали при температуре 95°С в течение 5 мин перед охлаждением на льду. Образцы и положительный контроль загружали в гели и проводили электрофорез с маркером молекулярной массы (Precision Plus ProteinTM Dual Xtra Standards, BIO-RAD) при 35 мВ в течение 90 мин. Ледяной блок был помещен внутри подвижного резервуара, чтобы предотвратить перегрев.
Перенос образцов белка на мембрану ПВДФ (поливинилиденфторид)
Концентрирующие гели были обрезаны, и разделяющие гели переносили на блоттинг-мембрану PVDF Transfer Membrane (Thermo Scientific) в Mini Transblot Cell (BIO-RAD). Вкратце, PVDF Transfer Membrane активировали путем впитывания метанола в течение 1 мин с последующим вымачиванием дистиллированной водой в течение 2 мин. Затем все слои насыщали буфером для блоттинга (20 ммоль/л трис-основания рН 8,6, 154 ммоль/л глицина, 0,8% мас./об. ДСН и 20% метанола). Сэндвич для блоттинга в порядке сверху вниз состоит из губки для переноса, фильтровальной бумаги, геля, PVDF Transfer Membrane, фильтровальной бумаги, губки для переноса, помещенных в переносную кассету, которая была вставлена в Mini Transblot Cell, заполненную буфером для блоттинга. Наконец, электрофоретический перенос проводили в течение 90 мин при 200 мА. Ледяной блок помещали в резервуар для переноса, чтобы предотвратить перегрев.
Окрашивание ПВДФ-мембраны
BLOT-Faststain™ (G-Biosciences, США) использовали для окрашивания общего белка, выстапая в роли контроля для нанесения (Colins et al 2015). Непосредственно после электрофоретического переноса ПВДФ-мембрану для переноса окрашивали разбавленным фиксирующим раствором BLOT-Faststain™ (10-кратно) в течение 2 мин при осторожном встряхивании. Затем мембрану инкубировали с разбавленным проявляющим раствором BLOT-Faststain™ (4-кратно) в течение 1 мин при осторожном встряхивании. Затем мембрану хранили при температуре 4°С в темноте в проявляющем растворе в течение 30 мин, чтобы полосы белков достигали максимальной интенсивности. Наконец, мембрану промывали холодной водой для устранения фонового окрашивания и визуализировали с использованием G:BOX (Syngene). Затем мембрану можно обесцвечивать с использованием теплой деионизированной воды (40-45°С) и готовить к стадии блокировки.
Обнаружение полос белка
ПВДФ-мембрану для переноса блокировали в TBS (забуференный Трис физиологический раствор, 20 ммоль/л Трис-основания рН 7,5, 0,5 ммоль/л NaCl), содержащий 5% сухого обезжиренного молока в течение 1 часа, затем дважды промывали в течение 7 минут каждый в TTBS (TBS, дополненный 0,05% об./об. Твин-20). Мембрану инкубировали в течение ночи при температуре 4°C с использованием первичного антитела, разбавленного в TTBS, содержащем 1% сухого обезжиренного молока (ТАБЛИЦА 1). На следующий день первичное антитело удалили. Мембрану промывали три раза в течение 5 мин каждый раз в TTBS, затем инкубировали в течение 1 часа при комнатной температуре с вторичным антителом. Выбор вторичного антитела зависит от типа используемого первичного антитела. Это может быть либо козье антимышиное вторичное антитело, конъюгированное с ПХ (перкосидазой хрена) (а9309, Sigma, разведенное в TTBS, содержащем 1% сухого обезжиренного молока (рабочая концентрация: 1:1000), или козье антикроличье вторичное антитело, конъюгированное с ПХ (ab6721, abcam), разведенное в TTBS, содержащем 1% сухого обезжиренного молока (рабочая концентрация: 1:5000). После инкубации с вторичными антителами мембраны промывали три раза в течение 5 мин в TTBS перед окончательной промывкой в течение 10 мин в TBS. Полосы белка были обнаружены с использованием G:box (Syngene).
Визуализация полос белков и анализ данных
ПВДФ-мембрану помещали в G:box (Syngene). Настройки фокусировки и масштабирования были скорректированы таким образом, чтобы обеспечить максимальную глубину мембраны в центре экрана. Растворы люминола и пероксида с субстратом ECL для вестерн-блоттинга Clarity™ (BIO-Rad) смешивали в равных пропорциях и наносили на мембрану. Изображения снимали в темноте с интервалом 1 мин в течение 5 мин, чтобы получить оптимальный сигнал для полос белка. После этого мембрану экспонировали в белом свете с использованием автоматических настроек, чтобы получить изображение для молекулярного лэддера. Затем изображения блотов анализировали с использованием программного обеспечения imageJ. Квадраты одинаковых размеров размещали вокруг полос белка к каждой полосе, что позволяло измерять интенсивность полосы белка. Затем фон был вычтен из интенсивности полосы, и результаты анализировали с использованием программного обеспечения Microsoft Excel и Graphpad.
Отшпаривание антител для повторной гибридизации
Белковый сигнал от мембраны ПВДФ для переноса можно отшпарить и повторно гибризидировать для другого белка. Вкратце, мембрану промывали слабым буфером для отшпаривания (200 ммоль/л глицина, 3,5 ммоль/л ДСН, 1% об./об. Твин-20, рН 2,2) дважды в течение 10 мин каждый. Затем мембрану промывали PBS дважды в течение 10 мин каждый раз, а затем промывали TTBS дважды в течение 5 мин каждый раз. Субстрат ECL для вестерн-блоттинга Clarity™ (BIO-Rad) добавляли к мембране и визуализировали с использованием G:Box (Syngene), чтобы проверить наличие остаточных сигналов белка. Если остаточный сигнал был слишком сильным, то весь процесс отшпаривания повторяли. Затем мембрана была готова к последующей стадии блокировки и гибридизации первичных антител (см. выше).
Приготовление человеческой сыворотки (ЧС)
ЧС брали из когорты пациентов контрольных и с БА, предоставленной профессором Найджелом Хупером в Институте молекулярной и клеточной биологии Университета Лидса. Образцы были отфильтрованы при помощи фильтра с номинальным отсечением по молекулярной массе (НОММ) от Amy Halliday, бывшего постдока, работающего в составе команды Сьюзен Гринфилд на кафедре фармакологии Оксфордского университета в 2008 году.
Сыворотку фильтровали, разделяя на фракции >30 кДа, 30-10 кДа и <10 кДа. Для этого исследования порции 30-10 кДа и <10 кДа были рекомбинированы в равных количествах, чтобы получить спектр Т14, присутствующего в <30 кДа ЧС.
ИФА антитела против пептида Т14
Калибровочные кривые и образцы выполняли в трех повторностях. Образцы гомогената человеческого мозга разбавляли 1:160 сывороткой человека. Калибровочную кривую для определения пептида Т14 в образцах ткани разбавляли в буфере PBS. Калибровочная кривая охватывала интервал от 8 до 100 нмоль/л Т14. Вкратце, 96-луночные планшеты для ИФА (NUNC) покрывали 100 мкл/лунку образца или стандартного Т14, покрывали парафильмом и инкубировали в течение ночи при температуре 4°С. На следующий день образец удаляли, перемещая планшет через раковину с проточной водой и добавляли 200 мкл блокирующего раствора, содержащего 2% альбумина бычьей сыворотки (БСА) в трис-буферном солевом растворе и Твин 20 (TBS-T), и инкубировали в течение 4 ч при комнатной температуре. Затем удаляли блокирующий раствор и добавляли 100 мкл антитела, разбавленного в блокирующем растворе до 1 мкг/мл, и инкубировали в течение ночи при температуре 4°С. Первичное антитело удаляли на следующий день, и лунки промывали 3 раза 200 мкл TBS-T. После добавляли 100 мкл вторичного фермент-конъюгированного антитела, разведенного в блокирующем растворе до 0,1 мкг/мл, и инкубировали в течение 2 ч при комнатной температуре; планшет был покрыт парафильмом во время всех инкубаций. Через 2 часа планшет промывали 4 раза с использованием TBS-T. Добавление 3,3,5,5-тетраметилбензидина начинало цветную реакцию. Реакцию останавливали через 30 мин с помощью останавливающего раствора, содержащего 2 М H2SO4, и оптическую плотность измеряли при 450 нм в сканирующем спектрофотометре для прочтения планшетов VMax (Molecular Devices, Уокингхем, Великобритания) для гомогената головного мозга и в сканирующем спектрофотометре для прочтения планшетов VersaMax (Molecular Devices, Уокингхем, Великобритания) для сыворотки человека.
Иммуногистохимическое окрашивание срезов мозга человека и крысы с использованием антитела, направленного против Т14
1. Фиксировали образцы мозга в 10% формалине.
2. Обезвоженную ткань блокировали и помещали в парафиновый воск.
3. 6 мкм срезы нарезали из каждого блока, помещенного в парафин.
4. Ткань депарафинировали на каждом предметном стекле путем нагревания при температуре 60 градусов в течение 20 мин.
5. Предметные стеклы инкубировали в гистокреине (3x5 минут), чтобы расплавить воск.
6. Предметные стекла дегидратировали с использованием градуированной серии этанола (10х погружений 100% ЕТоН, 10х погружений 100% ЕТоН, 10х погружений 100% ЕТоН, 10х погружений 90% ЕТоН, 10х погружений 70% ЕТоН).
7. Предметные стекла инкубировали в 3% перекиси водорода в течение 30 мин для подавления эндогенной активности пероксидазы.
8. Предметные стекла автоклавировали в буферном растворе рН9, содержащем ЭДТА (121 градус в течение 10 мин).
9. Предметные стекла устанавливали в кассеты и закрепляли последовательно.
10. Предметные стекла промывали с использованием Трис-буферного солевого раствора, содержащего 0,05% Твин-20 (TBS/T) (2x5 мин).
11. Первичное антитело против Т14 применяли в течение 1 часа.
12. Предметные стекла отмывали с использованием TBS/T (2x5 минут).
13. Применяли вторичные антитела, конъюгированные с пероксидазой хрена в течение 40 мин (предоставлены Dako, номер по каталогу K5007). Вторичное антитело распознает невариабельную область Т14-первичного антитела. Вторичное антитело конъюгировано с пероксидазой хрена, ферментом, который катализирует реакцию, которая позволяет обнаруживать хромоген, присоединенный к вторичному антителу, который связан с первичным антителом Т14. Таким образом, это позволяет обнаруживать иммуномеченные Т14 в срезах головного мозга.
14. Предметные стекла отмывали с использованием TBS/T (2x5 минут).
15. Субстрат пероксидазы Impact VIP применяли к предметным стеклам, которые выводятся по горизонтали, как указано в инструкциях производителя в течение 15 минут (предоставлены Vector Laboratories, номер по каталогу SK-4605).
16. Предметные стекла отмывали с использованием TBS/T (2x5 минут).
17. Предметные стекла устанавливали с помощью среды для заключения гистологических препаратов DPX.
Все инкубации проводили при комнатной температуре, если не указано иное.
РЕЗУЛЬТАТЫ
Пример 1 - распознавание пептидов
Изобретатели выделяли поликлональное антитело от кролика. На фиг. 1-4 показан дозозависимый эффект для антитела 1:1000 и указаны наномолярные концентрации различных пептидов (то есть РЕР4, Т14, Т30 и Т15).
Как показано на фиг. 1, антитело специфически обнаруживает антипептид, используемый для его синтеза, то есть РЕР4 (CAEFHRWSSYMVHWK - SEQ ID NO 7). Как показано на фиг. 2, антитело также специфически связывается с Т14 (AEFHRWSSYMVHWK - SEQ ID NO 3). Однако, как показано на фиг. 3 и 4, антитело не связывается с Т30 (KAEFHRWSSYMVHWKNQFDHYSKQDRCSDL - SEQ ID NO 2) или Т15 (NQFDHYSKQDRCSDL - SEQ ID NO 5). Это означает, что требование для обнаружения основано на конкретных концевых аминокислотах и возможной третичной структуре, которую они приобретают.
Кроме того, как показано на фиг. 17, антитело не распознает амилоид. Это означает, что, как упоминалось ранее, распознавание при помощи антитела зависит от различной комбинации открытых аминокислот.
Соответственно, изобретатели продемонстрировали удивительно высокую специфичность поликлонального антитела согласно настоящему изобретению.
Пример 2. Пептидсвязывающий участок
Авторы изобретения исследуют иммуноспецифичность антитела согласно настоящему изобретению, проводя эксперименты по связыванию с рядом различных линейных пептидов. Последовательности линейных пептидов, используемых для определения иммуноспецифичности антитела, показаны в таблицах 2 и 3.



Как показано на фиг. 5, антитело конкретно требует наличия моноклонального или эпитопа -VHWK-аминокислоты (то есть SEQ ID NO 6) на С-конце, чтобы иметь возможность обнаруживать пептид. Те пептиды, которые содержат мотив, но не содержат С-концевой аминокислоты К, не распознаются антителом, как показано на фиг. 6. Более того, те пептиды, которые содержат мотив -VHWK, но в которых он не находится в конце последовательности, также не распознаются антителом, как показано на фиг. 6.
На фиг. 7-10 представлены связывание антитела с различными 11, 12, 13 и 14-мерными линейными пептидами, некоторые с требуемым С-концевым -VHWK-мотивом, а некоторые без него. Как можно ясно видеть, каждый из пептидов 1107, 1206, 1305 и 1404 имеет С-концевой -VHWK-мотив, с которым антитело сильно связывается.
Пример 3 - распознавание AChE
Как показано на фиг. 11, антитело обнаруживает ацетилхолинэстеразу (AChE, т.е. «G4») и изменяет скорость гидролиза ацетилхолина, не влияя на конечную активность фермента, как показано на фиг. 12-14, и только значительно, когда активность AChE является низкой по сравнению с высокими концентрациями антител. Учитывая, что активность AChE в головном мозге и организме очень высока и что любое антитело в качестве терапии будет находиться в диапазоне более низких доз, любые побочные эффекты, возникающие в результате компрометации ферментативной активности, могут быть сведены к минимуму. Более того, антитело максимально блокирует AChE примерно на 15%, в отличие от галантамина, лекарственного средства, применяемого в клинической практике, которое ингибирует активность намного больше, то есть на 50% (см. WO 2015/004430).
Пример 4 - Обнаружение в ткани крысы и человека
При проведении обследований образцов крысы и человека, образцы отфильтровывали с использованием фильтра с НОММ 30 кДа для удаления AChE, предотвращая обнаружение фермента, и ложноположительного результата в образце. Результаты демонстрируют, как при помощи антитела обнаруживают пептид в обоих образцах. На фиг. 15 показаны результаты для гомогената головного мозга крысы, а на фиг. 16 показаны результаты для гомогената человеческого мозга в контроле и с болезнью Альцгеймера (БА).
ОБСУЖДЕНИЕ
Специфичность антитела
Поликлональное антитело продемонстрировало высокую специфичность к пептиду Т14 (в решающей степени к С-концевой последовательности -VHWK). Распознавание полного белка AChE предполагает, что эта последовательность подвергается воздействию и доступна в третичной структуре. Тот факт, что антитело не распознает линейный фрагмент пептида Т30 (в пределах которого находится Т14), как полагают, обусловлено отсутствием лизина (К) в конце последовательности Т30, которая не показана в приобретенной третичной структуре.
Способность к детектированию в сложных образцах подобных мозгу крысы и человека
Эти данные демонстрируют, что антитело является неожиданно устойчивой в биологической ткани, даже той, которая была глубоко заморожена, и что Т14-подобный пептид существует как независимое биохимическое соединение, как ранее предполагалось только по косвенным доказательствам (Garcia-Ayllon, MS et al. Altered levels of acetylcholinesterase in Alzheimer plasma. PloS one 5, e8701, doi: 10.1371/journal.pone.0008701 (2010); Arendt, Т., Bruckner, M.K., Lange, M. & Bigl, V. Changes in acetylcholinesterase and butyrylcholinesterase in Alzheimer's disease resemble embryonic development--a study of molecular forms. Neurochemistry international 21, 381-396 (1992). Наиболее заслуживающие внимание из всех отмеченных различий могут быть обнаружены в образцах с БА по сравнению с контрольными мозгами.
Важность обнаруженной последовательности
Эти данные свидетельствуют о том, что детектируемая последовательность (т.е. -VHWK-эпитоп) и, в частности, открытый остаток K на С-конце, может быть использован в качестве диагностического средства, а также для цели терапевтического воздействия, включая возможное использование самого антитела, если они связано с цитотоксическим фрагментом. Последнее применение может быть ограничено обнаружением того, что антитело может снизить скорость ферментативной реакции AChE, но скорости катализа для AChE настолько велики, что они могут быть выше порога и действительно объясняют, почему лекарственные средства, такие как галантамин и арисепт, тем не менее, до сих пор используется в клинической практике.
Пример 5 - Обнаружение Т14 в CSF, как продемонстрировано при помощи вестерн-блота (ВБ)
Используя антитело согласно настоящему изобретению, изобретатели затем сравнивали фибриллы Т14 и Аβ в цереброспинальной жидкости (CSF). Они обнаружили, что Т14 детектируется как полоса в 50 кДа с помощью вестерн-блоттинга, так как он образует фибриллы. Это дополнительно проявляется экзогенным Т14, который агрегирует с течением времени, о чем свидетельствует увеличение сигнала Т14 в вестерн-блоте (см. фиг. 21А).
Обращаясь далее к Фиг. 18, видим, что фибриллы Т14 в CSF увеличиваются в 8 из 10 (80%) случаев БА, которые были протестированы до настоящего времени с использованием вестерн-блоттинга. Когда все 10 случаев были объединены, это увеличение составляло около 24% у пациентов с БА по сравнению с контролем (p<0,0001, см. фиг. 19В). Интересно, что, когда все 10 случаев БА объединяли, изменения уровней Аβ в CSF между контрольными пациентами и с БА отсутствовали (см. фиг. 19Г). Как можно видеть, уровни Т14 и Аβ сравнимы в CSF у контрольных пациентов. Однако удивительно, что уровни Т14 увеличиваются у пациентов с БА, тогда как уровни Аβ остаются неизменными (см. фиг. 20Г). Поэтому изобретатели ясно показали, что Т14 в CSF является лучшим и более надежным диагностическим биомаркером БА, чем Аβ, и может использоваться для раннего выявления болезни.
Затем изобретатели сравнивали фибриллы Т14 и Аβ между CSF и 3 зонами головного мозга (кора головного мозга, голубое пятно и гиппокамп). Они показали, что уровни Т14 выше в CSF по сравнению с 3 областями головного мозга, испытанными как для контрольных пациентов, так и для пациентов с БА, что указывает на то, что Т14 высвобождается в CSF и агрегаты (см. фиг. 20А и 20Б). Напротив, они отметили, что уровни Аβ выше в трех областях головного мозга (кора головного мозга, голубое пятно, гиппокамп) по сравнению с CSF для контрольных пациентов (см. фиг. 20В) и что нет существенной разницы в уровнях Аβ между корой головного мозга, голубым пятном и CSF для контрольных пациентов (см. фиг. 20Г). Кроме того, уровни Аβ ниже в гиппокампе, чем у CSF для пациентов с БА (см. фиг. 20Г).
Понятно поэтому, что амилоид в CSF не отражает БА так же последовательно, как это делает Т14. Уровни Т14 намного выше в CSF, чем в ткани головного мозга, что указывает на то, что Т14 преимущественно высвобождается как свободная молекула для передачи сигналов дальнего действия, а не агрегирует, как и амилоид, в ткани головного мозга. Следовательно, Т14 является гораздо лучшим биомаркером, чем амилоид при БА, и очевидно, что Т14 является чувствительным индикатором болезни Паркинсона, а также болезни Альцгеймера.
Таким образом, антитело согласно настоящему изобретению может быть явно использовано для обнаружения Т14 в тестируемых областях головного мозга, а также в CSF, где уровни Т14 повышены и поэтому его легче обнаружить.
Пример 6 - Данные ИФА по мономерам Т14 в образцах головного мозга
Согласно примеру 5, изобретатели использовали поликлональное антитело, специфичное к С-концу Т14, для обнаружения мономеров Т14 в дополнительных образцах головного мозга. Они сравнивали уровни Т14 в коре головного мозга и гиппокампе. Образцы фильтровали с использованием фильтра с НОММ 30 кДа для удаления больших белков, таких как AChE и альбумин, тем самым уменьшая фоновый сигнал.
Как показано на фиг. 22, они обнаружили, что уровни Т14 значительно повышены (на мг белка) как в коре, так и гиппокампе головного мозга с БА в исследовании, сравнивающем 4 пары равновозврастных контролей и пациентов с БА. Таким образом, изобретатели показали, что уровни Т14 повышаются в областях мозга, которые, как известно, связаны с повреждением при болезни Альцгеймера.
Пример 7 - Сравнение уровней Т14 в контроле и человеческой сыворотке с БА
Хотя из примеров 5 и 6 ясно, что Т14 может быть легко обнаружен в головном мозге и CSF с использованием антитела согласно настоящему изобретению, получение образцов головного мозга и CSF у живых пациентов является очень инвазивной и рискованной процедурой. Соответственно, изобретатели исследовали потенциал использования антитела для определения Т14 в образцах сыворотки крови человека (ЧС), которые хранили при температуре -80°С в течение длительного периода времени. Целью исследования было использование этих образцов для оптимизации ИФА для использования с более свежими образцами ЧС, которые могут быть обработаны. Образцы фильтровали с использованием фильтра с НОММ 30 кДа для удаления больших белков, таких как AChE и альбумин, тем самым уменьшая фоновый сигнал.
Ссылаясь на фиг. 23, экспериментальное исследование ЧС 12 равновозврастных пар контролей и пациентов с БА, показало, что неожиданно можно обнаружить Т14 в отфильтрованной человеческой сыворотке с использованием антитела. Кроме того, Т14 повышается при БА по сравнению с контролем. Поэтому данные иллюстрируют, что можно обнаружить Т14 в ЧС и, следовательно, можно использовать в качестве простого неинвазивного диагностического инструмента, и было бы предпочтительнее получать образцы CSF (или головного мозга) у пациентов, имеющих или подозреваемых в наличии нейродегенеративного расстройства.
Пример 8 - Иммуноцитохимия
На фиг. 24 показана первая визуализация Т14, присутствующего в глобальных нейронах при прогрессирующей болезни Альцгеймера при помощи иммуноцитохимии. Поскольку эта конкретная область, как правило, уязвима при болезни Паркинсона, что подтверждает теорию о том, что два дегенеративных заболевания имеют общий механизм, основанный на токсическом Т14.
Пример 9 - Иммуногистохимическое окрашивание срезов головного мозга человека с использованием антитела против Т14
На фиг. 25 показано иммуноокрашивание Т14 черного вещества среднего мозга в контрольном образце и образце больного тяжелой формой болезни Альцгеймера (БА) с увеличением 40х и 200х. Показаны внеклеточные Т14-иммуномеченные отложения при тяжелых формах БА (стрелки), а также типичный дофаминергический нейрональный цитоплазматический образец с иммуноокрашиванием Т14 в контроле и при БА (треугольниики). Диапазон Т14 нейронных цитоплазматических структур окрашивания фиксировали в полях зрения. Как видно на фиг., Т14 высвобождается (стрелки) из клеток образца с БА, но не из контролей. Считается, что высвобождение или выделение Т14 из клеток с БА связано с утечкой из умирающих нейронов. Внеклеточные отложения Т14, по-видимому, сливаются с темным меланином, то есть допамином.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> НЕЙРО-БИО ЛТД
<120> АНТИТЕЛО, КОТОРОЕ РАСПОЗНАЕТ ПЕПТИД Т14 ACHE
<130> AXH/75695PCT1
<160> 31
<170> PatentIn версии 3.5
<210> 1
<211> 614
<212> Белок
<213> Homo sapiens
<400> 1
Met Arg Pro Pro Gln Cys Leu Leu His Thr Pro Ser Leu Ala Ser Pro
1 5 10 15
Leu Leu Leu Leu Leu Leu Trp Leu Leu Gly Gly Gly Val Gly Ala Glu
20 25 30
Gly Arg Glu Asp Ala Glu Leu Leu Val Thr Val Arg Gly Gly Arg Leu
35 40 45
Arg Gly Ile Arg Leu Lys Thr Pro Gly Gly Pro Val Ser Ala Phe Leu
50 55 60
Gly Ile Pro Phe Ala Glu Pro Pro Met Gly Pro Arg Arg Phe Leu Pro
65 70 75 80
Pro Glu Pro Lys Gln Pro Trp Ser Gly Val Val Asp Ala Thr Thr Phe
85 90 95
Gln Ser Val Cys Tyr Gln Tyr Val Asp Thr Leu Tyr Pro Gly Phe Glu
100 105 110
Gly Thr Glu Met Trp Asn Pro Asn Arg Glu Leu Ser Glu Asp Cys Leu
115 120 125
Tyr Leu Asn Val Trp Thr Pro Tyr Pro Arg Pro Thr Ser Pro Thr Pro
130 135 140
Val Leu Val Trp Ile Tyr Gly Gly Gly Phe Tyr Ser Gly Ala Ser Ser
145 150 155 160
Leu Asp Val Tyr Asp Gly Arg Phe Leu Val Gln Ala Glu Arg Thr Val
165 170 175
Leu Val Ser Met Asn Tyr Arg Val Gly Ala Phe Gly Phe Leu Ala Leu
180 185 190
Pro Gly Ser Arg Glu Ala Pro Gly Asn Val Gly Leu Leu Asp Gln Arg
195 200 205
Leu Ala Leu Gln Trp Val Gln Glu Asn Val Ala Ala Phe Gly Gly Asp
210 215 220
Pro Thr Ser Val Thr Leu Phe Gly Glu Ser Ala Gly Ala Ala Ser Val
225 230 235 240
Gly Met His Leu Leu Ser Pro Pro Ser Arg Gly Leu Phe His Arg Ala
245 250 255
Val Leu Gln Ser Gly Ala Pro Asn Gly Pro Trp Ala Thr Val Gly Met
260 265 270
Gly Glu Ala Arg Arg Arg Ala Thr Gln Leu Ala His Leu Val Gly Cys
275 280 285
Pro Pro Gly Gly Thr Gly Gly Asn Asp Thr Glu Leu Val Ala Cys Leu
290 295 300
Arg Thr Arg Pro Ala Gln Val Leu Val Asn His Glu Trp His Val Leu
305 310 315 320
Pro Gln Glu Ser Val Phe Arg Phe Ser Phe Val Pro Val Val Asp Gly
325 330 335
Asp Phe Leu Ser Asp Thr Pro Glu Ala Leu Ile Asn Ala Gly Asp Phe
340 345 350
His Gly Leu Gln Val Leu Val Gly Val Val Lys Asp Glu Gly Ser Tyr
355 360 365
Phe Leu Val Tyr Gly Ala Pro Gly Phe Ser Lys Asp Asn Glu Ser Leu
370 375 380
Ile Ser Arg Ala Glu Phe Leu Ala Gly Val Arg Val Gly Val Pro Gln
385 390 395 400
Val Ser Asp Leu Ala Ala Glu Ala Val Val Leu His Tyr Thr Asp Trp
405 410 415
Leu His Pro Glu Asp Pro Ala Arg Leu Arg Glu Ala Leu Ser Asp Val
420 425 430
Val Gly Asp His Asn Val Val Cys Pro Val Ala Gln Leu Ala Gly Arg
435 440 445
Leu Ala Ala Gln Gly Ala Arg Val Tyr Ala Tyr Val Phe Glu His Arg
450 455 460
Ala Ser Thr Leu Ser Trp Pro Leu Trp Met Gly Val Pro His Gly Tyr
465 470 475 480
Glu Ile Glu Phe Ile Phe Gly Ile Pro Leu Asp Pro Ser Arg Asn Tyr
485 490 495
Thr Ala Glu Glu Lys Ile Phe Ala Gln Arg Leu Met Arg Tyr Trp Ala
500 505 510
Asn Phe Ala Arg Thr Gly Asp Pro Asn Glu Pro Arg Asp Pro Lys Ala
515 520 525
Pro Gln Trp Pro Pro Tyr Thr Ala Gly Ala Gln Gln Tyr Val Ser Leu
530 535 540
Asp Leu Arg Pro Leu Glu Val Arg Arg Gly Leu Arg Ala Gln Ala Cys
545 550 555 560
Ala Phe Trp Asn Arg Phe Leu Pro Lys Leu Leu Ser Ala Thr Asp Thr
565 570 575
Leu Asp Glu Ala Glu Arg Gln Trp Lys Ala Glu Phe His Arg Trp Ser
580 585 590
Ser Tyr Met Val His Trp Lys Asn Gln Phe Asp His Tyr Ser Lys Gln
595 600 605
Asp Arg Cys Ser Asp Leu
610
<210> 2
<211> 30
<212> Белок
<213> Homo sapiens
<400> 2
Lys Ala Glu Phe His Arg Trp Ser Ser Tyr Met Val His Trp Lys Asn
1 5 10 15
Gln Phe Asp His Tyr Ser Lys Gln Asp Arg Cys Ser Asp Leu
20 25 30
<210> 3
<211> 14
<212> Белок
<213> Homo sapiens
<400> 3
Ala Glu Phe His Arg Trp Ser Ser Tyr Met Val His Trp Lys
1 5 10
<210> 4
<211> 15
<212> Белок
<213> Homo sapiens
<400> 4
Asn Gln Phe Asp His Tyr Ser Lys Gln Asp Arg Cys Ser Asp Leu
1 5 10 15
<210> 5
<211> 15
<212> Белок
<213> Homo sapiens
<400> 5
Asn Gln Phe Asp His Tyr Ser Lys Gln Asp Arg Cys Ser Asp Leu
1 5 10 15
<210> 6
<211> 4
<212> Белок
<213> Homo sapiens
<400> 6
Val His Trp Lys
1
<210> 7
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Белок гемоцианина моллюска Megathura crenulata (KLH) перекрестно сшитый с белком T14 (SEQ ID No: 3)
<400> 7
Cys Ala Glu Phe His Arg Trp Ser Ser Tyr Met Val His Trp Lys
1 5 10 15
<210> 8
<211> 42
<212> Белок
<213> Homo sapiens
<400> 8
Asp Ala Glu Phe Arg His Asp Ser Gly Tyr Glu Val His His Gln Lys
1 5 10 15
Leu Val Phe Phe Ala Glu Asp Val Gly Ser Asn Lys Gly Ala Ile Ile
20 25 30
Gly Leu Met Val Gly Gly Val Val Ile Ala
35 40
<210> 9
<211> 0
<212> ДНК
<213> Homo sapiens
<400> 9
000
<210> 10
<211> 9
<212> Белок
<213> Homo sapiens
<400> 10
Trp Ser Ser Tyr Met Val His Trp Lys
1 5
<210> 11
<211> 10
<212> Белок
<213> Homo sapiens
<400> 11
Arg Trp Ser Ser Tyr Met Val His Trp Lys
1 5 10
<210> 12
<211> 11
<212> Белок
<213> Homo sapiens
<400> 12
His Arg Trp Ser Ser Tyr Met Val His Trp Lys
1 5 10
<210> 13
<211> 12
<212> Белок
<213> Homo sapiens
<400> 13
Phe His Arg Trp Ser Ser Tyr Met Val His Trp Lys
1 5 10
<210> 14
<211> 13
<212> Белок
<213> Homo sapiens
<400> 14
Glu Phe His Arg Trp Ser Ser Tyr Met Val His Trp Lys
1 5 10
<210> 15
<211> 14
<212> Белок
<213> Homo sapiens
<400> 15
Ala Glu Phe His Arg Trp Ser Ser Tyr Met Val His Trp Lys
1 5 10
<210> 16
<211> 9
<212> Белок
<213> Homo sapiens
<400> 16
Arg Trp Ser Ser Tyr Met Val His Trp
1 5
<210> 17
<211> 10
<212> Белок
<213> Homo sapiens
<400> 17
His Arg Trp Ser Ser Tyr Met Val His Trp
1 5 10
<210> 18
<211> 11
<212> Белок
<213> Homo sapiens
<400> 18
Phe His Arg Trp Ser Ser Tyr Met Val His Trp
1 5 10
<210> 19
<211> 12
<212> Белок
<213> Homo sapiens
<400> 19
Glu Phe His Arg Trp Ser Ser Tyr Met Val His Trp
1 5 10
<210> 20
<211> 13
<212> Белок
<213> Homo sapiens
<400> 20
Ala Glu Phe His Arg Trp Ser Ser Tyr Met Val His Trp
1 5 10
<210> 21
<211> 14
<212> Белок
<213> Homo sapiens
<400> 21
Lys Ala Glu Phe His Arg Trp Ser Ser Tyr Met Val His Trp
1 5 10
<210> 22
<211> 11
<212> Белок
<213> Homo sapiens
<400> 22
Arg Trp Ser Ser Tyr Met Val His Trp Lys Ala
1 5 10
<210> 23
<211> 11
<212> Белок
<213> Homo sapiens
<400> 23
Trp Ser Ser Tyr Met Val His Trp Lys Ala Glu
1 5 10
<210> 24
<211> 11
<212> Белок
<213> Homo sapiens
<400> 24
Ser Ser Tyr Met Val His Trp Lys Ala Glu Phe
1 5 10
<210> 25
<211> 12
<212> Белок
<213> Homo sapiens
<400> 25
His Arg Trp Ser Ser Tyr Met Val His Trp Lys Ala
1 5 10
<210> 26
<211> 12
<212> Белок
<213> Homo sapiens
<400> 26
Arg Trp Ser Ser Tyr Met Val His Trp Lys Ala Glu
1 5 10
<210> 27
<211> 12
<212> Белок
<213> Homo sapiens
<400> 27
Trp Ser Ser Tyr Met Val His Trp Lys Ala Glu Phe
1 5 10
<210> 28
<211> 13
<212> Белок
<213> Homo sapiens
<400> 28
Phe His Arg Trp Ser Ser Tyr Met Val His Trp Lys Ala
1 5 10
<210> 29
<211> 13
<212> Белок
<213> Homo sapiens
<400> 29
Arg Trp Ser Ser Tyr Met Val His Trp Lys Ala Glu Phe
1 5 10
<210> 30
<211> 14
<212> Белок
<213> Homo sapiens
<400> 30
Glu Phe His Arg Trp Ser Ser Tyr Met Val His Trp Lys Ala
1 5 10
<210> 31
<211> 14
<212> Белок
<213> Homo sapiens
<400> 31
His Arg Trp Ser Ser Tyr Met Val His Trp Lys Ala Glu Phe
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| РАК | 2017 |
|
RU2783416C2 |
| АНТИТЕЛО ПРОТИВ БЕТА-АМИЛОИДА, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2777844C1 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С СОРТИЛИНОМ И ПОДАВЛЯЮТ СВЯЗЫВАНИЕ ПРОГРАНУЛИНА | 2016 |
|
RU2735639C2 |
| АМАТОКСИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2826004C2 |
| АНТИТЕЛА К ТАУ И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2787779C2 |
| СПОСОБЫ ОБНАРУЖЕНИЯ ФОЛАТНОГО РЕЦЕПТОРА 1 В ОБРАЗЦЕ ПАЦИЕНТА | 2018 |
|
RU2759410C2 |
| СВЯЗЫВАЮЩИЙ RGMa БЕЛОК И ЕГО ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2809500C2 |
| Моноклональные антитела к альфа-синуклеину для предотвращения агрегации тау-белка | 2017 |
|
RU2760334C2 |
| CD47-АНТИГЕНСВЯЗЫВАЮЩАЯ ЕДИНИЦА И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2780859C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |





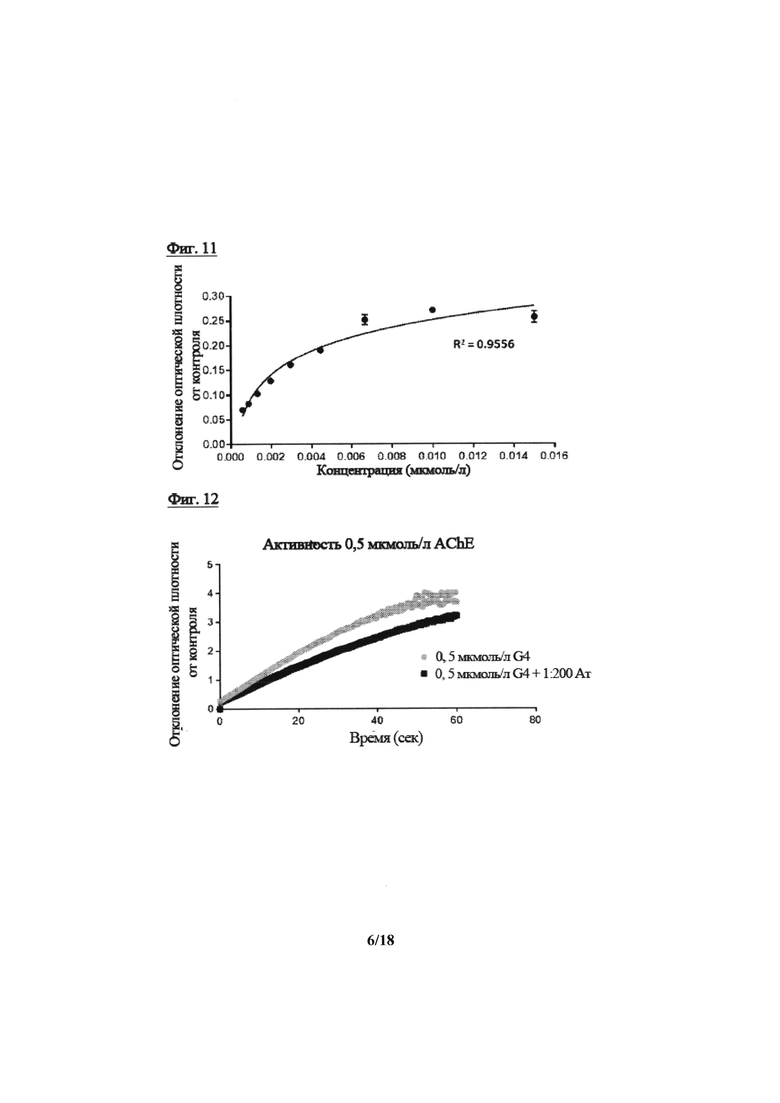


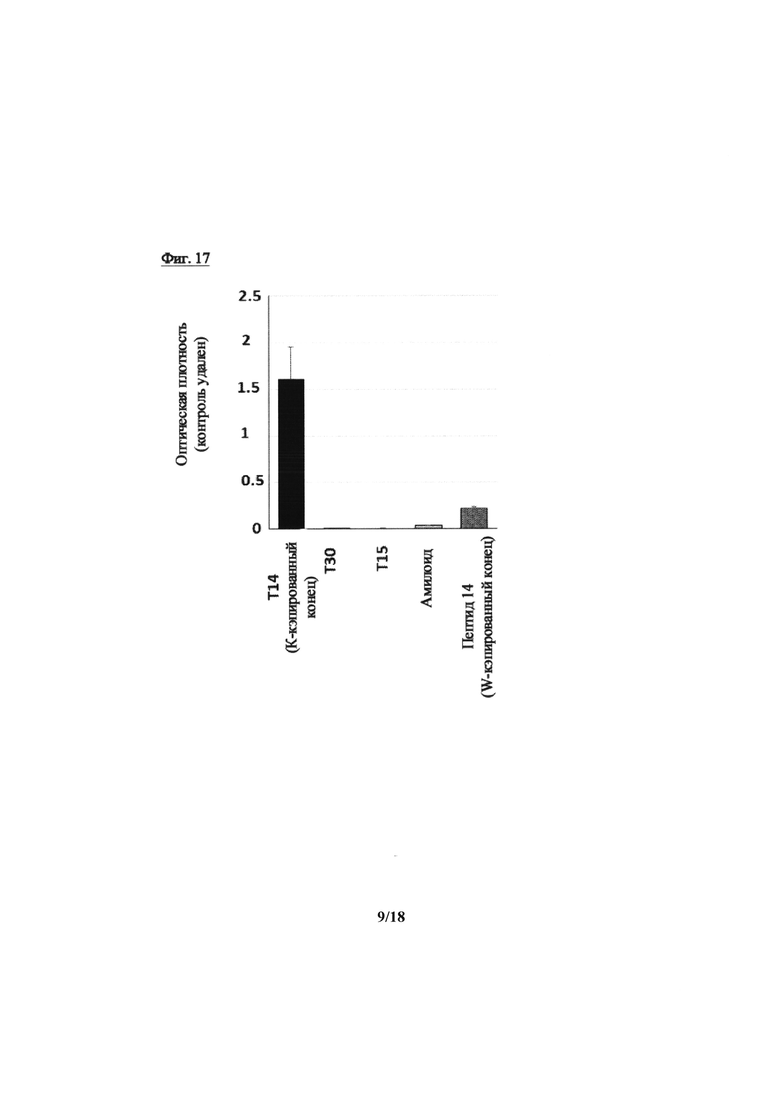
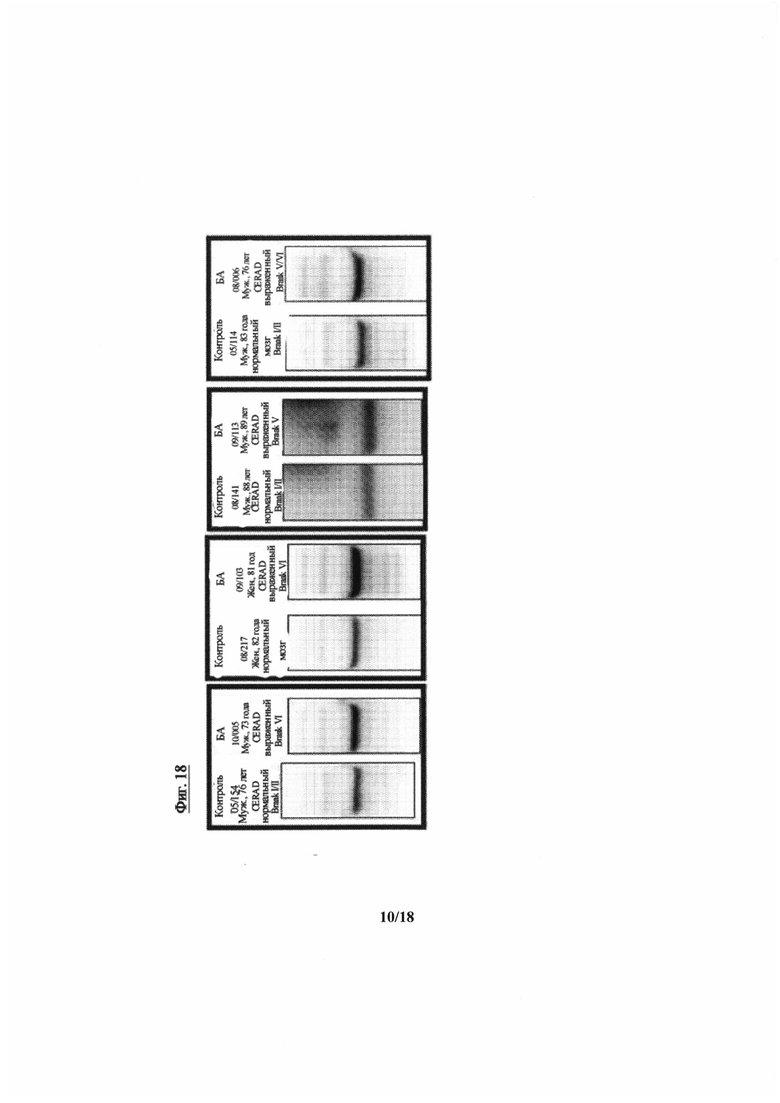








Изобретение относится к области биохимии, в частности к антителу или его антигенсвязывающему фрагменту, которое специфически связывается с полипептидом Т14. Также раскрыты набор для диагностики субъекта, страдающего нейродегенеративным расстройством, содержащее указанное антитело, а также способ диагностики субъекта, страдающего нейродегенеративным расстройством, с помощью указанного антитела. Изобретение позволяет эффективно диагностировать нейродегенеративное расстройство. 3 н. и 12 з.п. ф-лы, 25 ил., 3 табл., 9 пр.
1. Антитело или его антигенсвязывающий фрагмент, которое специфически связывается с полипептидом Т14 с последовательностью SEQ ID NO 3, содержащей открытый остаток С-концевого лизина, причем антитело или его антигенсвязывающий фрагмент специфически связывается с SEQ ID NO 6, и причем антитело или его антигенсвязывающий фрагмент не связывается с SEQ ID NO 2, SEQ ID NO 4 и/или SEQ ID NO 8,
причем антитело можно получить или получено способом, включающим:
(i) иммунизацию организма-хозяина последовательностью SEQ ID NO 7; и
(ii) получение антитела или его антигенсвязывающего фрагмента от хозяина.
2. Антитело или его антигенсвязывающий фрагмент по п. 1, которое представляет собой поликлональное или моноклональное антитело или его антигенсвязывающий фрагмент.
3. Антитело или его антигенсвязывающий фрагмент по п. 1 или 2 для применения в диагностике.
4. Набор для диагностики субъекта, страдающего нейродегенеративным расстройством, или предрасположенности к нему, или для обеспечения прогноза состояния субъекта, содержащий средство детекции для определения концентрации антигена, присутствующего в образце из тестируемого субъекта, и контейнер для сбора проб для приема извлеченного образца, средство обнаружения содержит антитело или его антигенсвязывающий фрагмент по любому из пп. 1 или 2, при этом наличие антигена в образце предполагает, что субъект страдает нейродегенеративным расстройством.
5. Набор по п. 4, отличающийся тем, что образец содержит спинномозговую жидкость (CSF).
6. Набор по п. 4, отличающийся тем, что образец содержит кровь, мочу или ткань.
7. Набор по п. 6, отличающийся тем, что образец содержит кровь.
8. Набор по любому из пп. 4-7, отличающийся тем, что нейродегенеративное расстройство выбрано из группы, состоящей из болезни Альцгеймера; болезни Паркинсона; болезни Хантингтона; заболевания двигательных нейронов; спиноцеребеллярной атаксии типа 1, типа 2 и типа 3; амиотрофического бокового склероза (БАС); и лобно-височной деменции.
9. Набор по п. 8, отличающийся тем, что нейродегенеративное расстройство является болезнью Альцгеймера.
10. Способ диагностики субъекта, страдающего нейродегенеративным расстройством, или предрасположенности к нему, или для обеспечения прогноза состояния субъекта, включающий определение концентрации антигена, присутствующего в полученном от субъекта образце, причем определение достигается за счет применения антитела или его антигенсвязывающего фрагмента по любому из пп. 1 или 2, и при этом присутствие антигена в образце предполагает, что субъект страдает нейродегенеративноым расстройством.
11. Способ по п. 10, отличающийся тем, что образец содержит спинномозговую жидкость (CSF).
12. Способ по п. 10, отличающийся тем, что образец содержит кровь, мочу или ткань.
13. Способ по п. 12, отличающийся тем, что образец содержит кровь.
14. Способ по любому из пп. 10-13, отличающийся тем, что нейродегенеративное расстройство выбрано из группы, состоящей из болезни Альцгеймера; болезни Паркинсона; болезни Хантингтона; заболевания двигательных нейронов; спиноцеребеллярной атаксии типа 1, типа 2 и типа 3; амиотрофического бокового склероза (БАС); и лобно-височной деменции.
15. Способ по п. 14, отличающийся тем, что нейродегенеративное расстройство является болезнью Альцгеймера.
| HALLIDAY A.C | |||
| and et.al., Evaluation of a technique to identify acetylcholinesterase C-terminal peptides in human serum samples, 2010, Chemico-Biological Interactions, V.187, pp.110-114 | |||
| УСТРОЙСТВО ДЛЯ ОЧИСТКИ ВНУТРЕННЕЙ ПОЛОСТИ ТРУБОПРОВОДА | 2001 |
|
RU2203746C1 |
| CN 101530162 B, 23.11.2011 | |||
| DE 602006021395 D1, 01.06.2011 | |||
| АНАЛИЗЫ И СПОСОБЫ ПРИМЕНЕНИЯ БИОМАРКЕРОВ | 2006 |
|
RU2409817C2 |
Авторы
Даты
2020-08-07—Публикация
2016-03-23—Подача