Изобретение относится к области биохимии, а именно к устройствам для определения органических веществ, в частности мочевины и может быть использовано как в клинико-диагностических, так и в научных целях.
Мочевина выделяется из организма через почки, вместе с мочой, поэтому содержание мочевины в крови и в моче позволяет судить о функции почек. По уровню мочевины в крови и моче можно судить не только о состоянии почек, но также печени и мышечной системы. Определение содержания мочевины в крови и в моче, таким образом, один из важнейших клинических анализов [1].
Определение мочевины в клинико-диагностических лабораториях проводится различными методами, однако все их многообразие можно разделить на три основные группы: газометрические; прямые фотометрические и ферментативные (уреазные) [2].
Известен ферментативный способ определения концентрации анализируемого вещества, в частности мочевины, основанный на ее гидролизе свободным ферментом - уреазой до ионов аммония и их дальнейшем определении в присутствии катализатора [3]. Способ основан на реакции взаимодействия аммиака с салицилатом и гипохлоритом натрия, которую катализирует в щелочной среде нитропруссид. Реакция протекает с образованием окрашенного соединения, интенсивность окраски которого прямо пропорциональна концентрации мочевины и измеряется фотометрически при длине волны 540 нм.
Набор готовых форм содержит салицилат, гипохлорид натрия, нитропруссид и уреазу.
Близким к этому способу является ферментативный способ [4] определения мочевины, также основанный на ее гидролизе ферментом - уреазой до ионов аммония и их дальнейшем определении в присутствии катализатора по их реакции со щелочным раствором гипохлорита натрия в присутствии акцептора аммиака - 4-оксикумарина и катализатора - феррицианида калия.
Набор готовых форм реактивов для определения мочевины в биологических жидкостях [4] содержит уреазу, нитропруссид натрия в качестве катализатора, щелочь, раствор гипохлорита натрия и дополнительно в качестве акцептора аммиака 4-оксикумарин в виде смеси с феррицианидом калия, являющимся дополнительным катализатором. Уреаза, нитропруссид натрия и смесь 4-оксикумарина и феррицианида калия содержатся в составе набора в таблетированном виде, а щелочь и гипохлорит натрия в виде их концентрированных растворов.
Известен набор реагентов [5] для определения концентрации пировиноградной кислоты в ферментированном дрожжами продукте, например "Саке", содержащий лактатдегидрогеназу, восстановленный никотинамид аденин динуклеотид (NADH), соль тетразолия, катализатор, и сравнительный агент, проявляющий цвет в том случае, когда пировиноградная кислота содержится в заданной концентрации. Способ [5] определения концентрации пировиноградной кислоты состоит в том, что указанный набор реагентов помещают в исследуемую жидкость, при этом реагенты берут в определенной концентрации, необходимой для измерения заданной концентрации пировиноградной кислоты.
Известен реагент [6] для ферментативного определения концентрации анализируемого вещества в пробе биологической жидкости субъекта по измерению степени окисления кофермента, стабилизированного против окисления при помощи системы восстановления кофермента.
В частности, для ферментативного определения мочевины [6] реагент содержит Глюкозо-6-фосфат-дегидрогеназу, как систему восстановления кофермента, D-глюкозу и уреазу - фермент, специфичный для анализируемого вещества, α-кетоглутарат субстрат, никотинамидадениндинуклеотид фосфат (NADPH) восстановленный кофермент, К2НРO4 и глутаматдегидрогеназу.
Известный ферментативный способ [6] определения концентрации анализируемого вещества в пробе биологической жидкости субъекта заключается в измерении степени окисления кофермента с помощью реагента, стабилизированного против окисления при помощи системы восстановления кофермента, состоящей из пары фермента и субстрата, подобранного для обеспечения постоянного восстановления соответствующего кофермента на протяжении всего срока хранения данного реагента.
Недостаток всех описанных выше средств ферментативного определения концентрации анализируемого вещества и способов, использующих эти средства, состоит в том, что в них использован фермент, незащищенный от действия протеаз, присутствующих практически во всех биологических жидкостях, и, таким образом, все вышеописанные ферментные средства являются средствами одноразового использования. Кроме того, такие средства плохо хранятся даже в условиях охлаждения, так как активность свободного фермента обычно исчезает в течение нескольких дней, что требует добавления к раствору фермента токсичных консервантов, например, азида натрия, и небезопасно для выполняющего анализы человека.
Решением данной проблемы является инкапсуляция фермента в полиэлектролитные микрокапсулы, изготавливаемые методом поочередной адсорбции противоположно заряженных полиэлектролитов [7]. Для сохранения активности биорецептора в течение длительного времени широкое применение нашел метод полиэлектролитного капсулирования ферментов (8). Ферментативная активность после включения в полиэлектролитную капсулу сохраняется, и в то же время повышается длительность хранения, термостабильность и устойчивость к агрессивным средам (9). Благодаря полупроницаемости капсул, т.е. проницаемости для низкомолекулярных соединений и мелких агрегатов и непроницаемости для высокомолекулярных веществ и крупных частиц, появляется возможность использования таких систем в качестве микрореакторов, в частности для применения в сенсорных системах (10). Полученный таким образом микродиагоностикум описан в [11] и представляет собой содержащие ферменты полиэлектролитные микрокапсулы, позволяющие определять содержание субстратов в среде. Главным недостатком такого диагностикума является трудоемкость его использования, в частности, выведение его из анализируемой среды. На устранение данного недостатка направлена предлагаемая нами диагностическая пластина, на которой закреплены содержащие уреазу полиэлектролитные микрокапсулы.
Наиболее близким к заявленному техническому решению является потенциометрический биосенсор на основе стеклянного рН-электрода и рН-ПТ, чувствительным элементом которого является микроячеистое полиэлектролитное покрытие, содержащее полиэлектролитные капсулы с уреазой [12, 13, 14].
Задача, на решение которой направлена заявляемое изобретение - создание устройства для быстрого и чувствительного, а также надежного определения мочевины, простого по конструкции и эксплуатации.
Технический результат, который может быть получен при использовании предлагаемого изобретения, заключается в том, что диагностическая пластина обеспечивает быстрое определение содержания мочевины без применения трудоемких операций по извлечению детектирующих агентов из реакционной среды и их подготовке к последующему анализу.
Сущность изобретения.
Предложена диагностическая пластина для определения мочевины, включающая кварцевую подложку, полимерное покрытие, состоящее из полиэтиленимина, полистиролсульфоната и полиаллиамина и содержащие уреазу полиэлектролитные микрокапсулы.
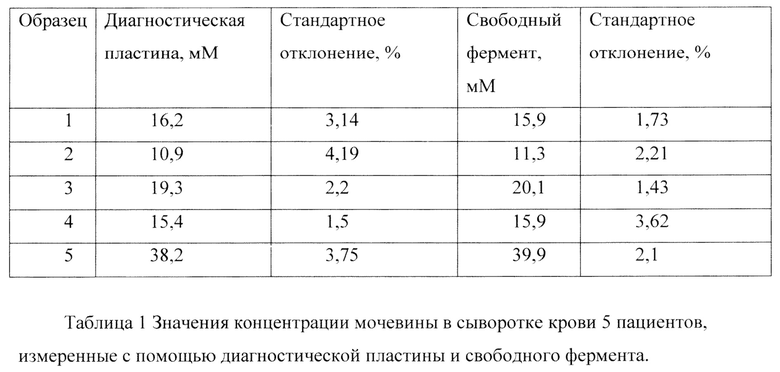
Формирование диагностической пластины осуществляли следующим образом (фиг. 1):
1) Кварцевую пластину инкубируют в водном растворе полиэтиленимина с концентрацией 2 мг/мл в течение 30 минут.
2) Пластину промывают 10 раз дистиллированной водой для удаления несвязавшегося полиэлектролита и сушат в течение 20 минут.
3) Пластину инкубируют в солевом растворе полистиролсульфоната с концентрацией 2 мг/мл, содержащего 0,5 М хлорид натрия.
4) Промывают пластину 10 раз 0,5 М раствором хлорида натрия для удаления несвязавшегося полиэлектролита.
5) Пластину инкубируют в солевом растворе полиаллиламина с концентрацией 2 мг/мл, содержащего 0,5 М хлорид натрия.
6) Промывают пластину 10 раз 0,5 М раствором хлорида натрия для удаления несвязавшегося полиэлектролита.
7) Повторяют пункты 3, 4.
8) На пластину наносят 100 мкл суспензии полиэлектролитных микрокапсул с титром 1,5 млрд. штук/мл и сушат ее в течении 1 часа.
9) Повторяют пункты 3-7.
10) Диагностическую пластину инкубируют в 0,2 М растворе ЭДТА в течение 1 часа для растворения и удаления карбонатной компоненты микрокапсул.
11) Промывают пластину 10 раз дистиллированной водой для удаления остатков растворения карбонатного ядра микрокапсул.
Формирование полиэлектролитных капсул с ферментом (фиг. 2):
1) Составные микросферолиты "СаСО3-уреаза" готовят по реакции ионного обмена при смешивании растворов хлористого кальция и карбоната натрия в присутствии фермента (8).
2) Полиэлектролитные микрокапсулы получают из полистиролсульфоната (ПСС) и полиаллиламина (ПАА) путем поочередной адсорбции их на поверхность составных микросферолитов СаСО3-уреаза в растворах полиэлектролитов с концентрацией 2 мг/мл. После нанесения четырех полиэлектролитных слоев (ПСС/ПАА)2.
Все стадии получения полиэлектролитных микрокапсул с ферментом проводят при температуре 15-25°С. Полученная суспензия содержит ~1,5*109/мл капсул с ферментом. При этом размер одной капсулы составлял ~ 3-4 мкм при количестве уреазы в капсуле, равном ~ 3 пг.
Диагностическая пластина работает следующим образом.
Уреаза катализирует гидролиз мочевины с образованием аммиака и углекислого газа. Нитропруссид в щелочной среде катализирует реакцию взаимодействия аммиака с салицилатом и гипохлоритом натрия с образованием окрашенного соединения, интенсивность окраски которого прямо пропорциональна концентрации мочевины и измеряется фотометрически при длине волны 540(490-600) нм. Измерение концентраций мочевины проводят с использованием набора «Мочевина КТ ДДС» фирмы «Диакон».
Состав набора:
Реагент 1: буферный раствор, содержащий:
калий фосфорнокислый однозамещенный, 121 ммоль/л
салицилат натрия, 62,4 ммоль/л
нитропруссид натрия, 5,07 ммоль/л
ЭДТА, 0,84 ммоль/л
Реагент 2: раствор, содержащий:
гидроокись натрия, 310 ммоль/л
гипохлорит натрия, 10 ммоль/л
1. Для измерений готовят рабочий раствор, содержащий 99% реагента 1 и 1% дистиллированной воды.
2. Смешивают 1 мл рабочего раствора и 10 мкл раствора мочевины известной концентрации.
3. Помещают в данную смесь диагностическую пластину так, чтобы раствор максимально соприкасался с ее рабочей поверхностью и инкубируют в течение 40 минут.
4. Извлекают пластину из рабочего раствора, промывают 10 раз дистиллированной водой и помещают в дистиллированную воду на хранение.
5. К смеси, из которой извлекли диагностическую пластину, добавляют 1 мл Реагента 2 и инкубируют 10 минут.
6. Измеряют оптическую плотность полученного раствора при длине волны 540 нм.
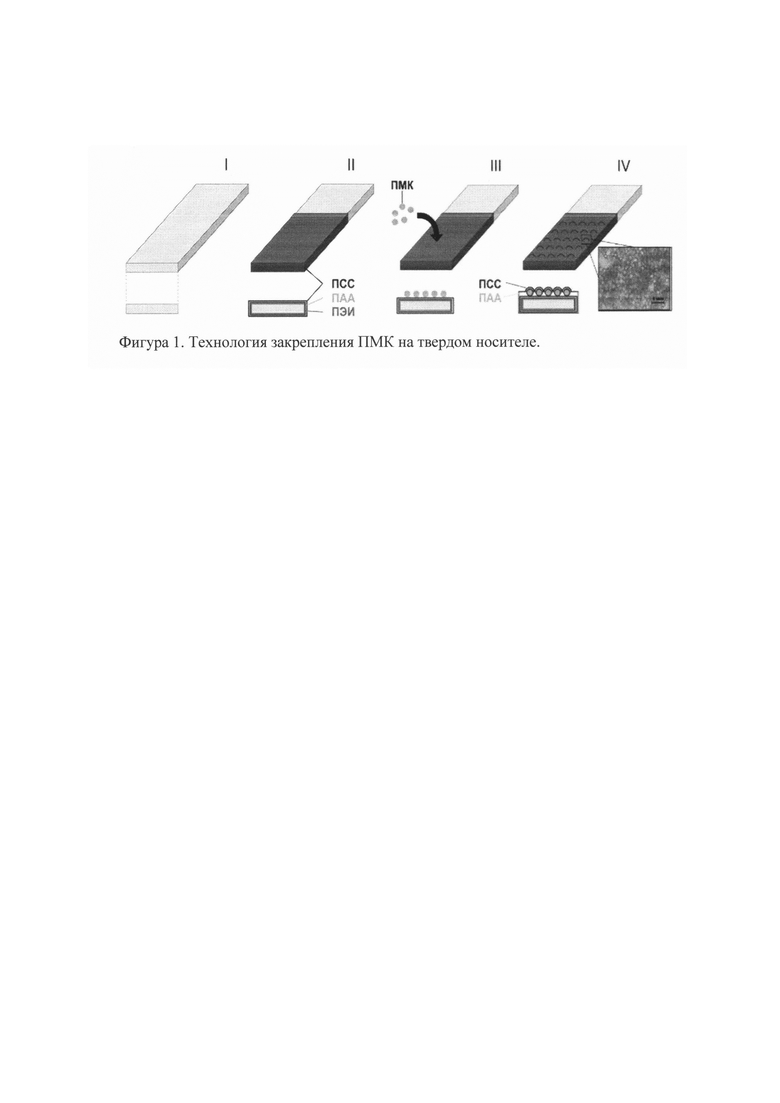
7. На основании полученных данных строят калибровочную кривую (Фиг. 3).
Для определения неизвестной концентрации мочевины добавляют раствор неизвестной концентрации и затем по калибровочной кривой (Фиг. 3), отражающей зависимость оптической плотности от концентрации мочевины, определяют концентрацию мочевины в анализируемом образце. В таблице 1 приведены результаты определения содержания мочевины в сыворотке крови 5 пациентов, проведенное с помощью диагностической пластины и набора КТ ДДС.
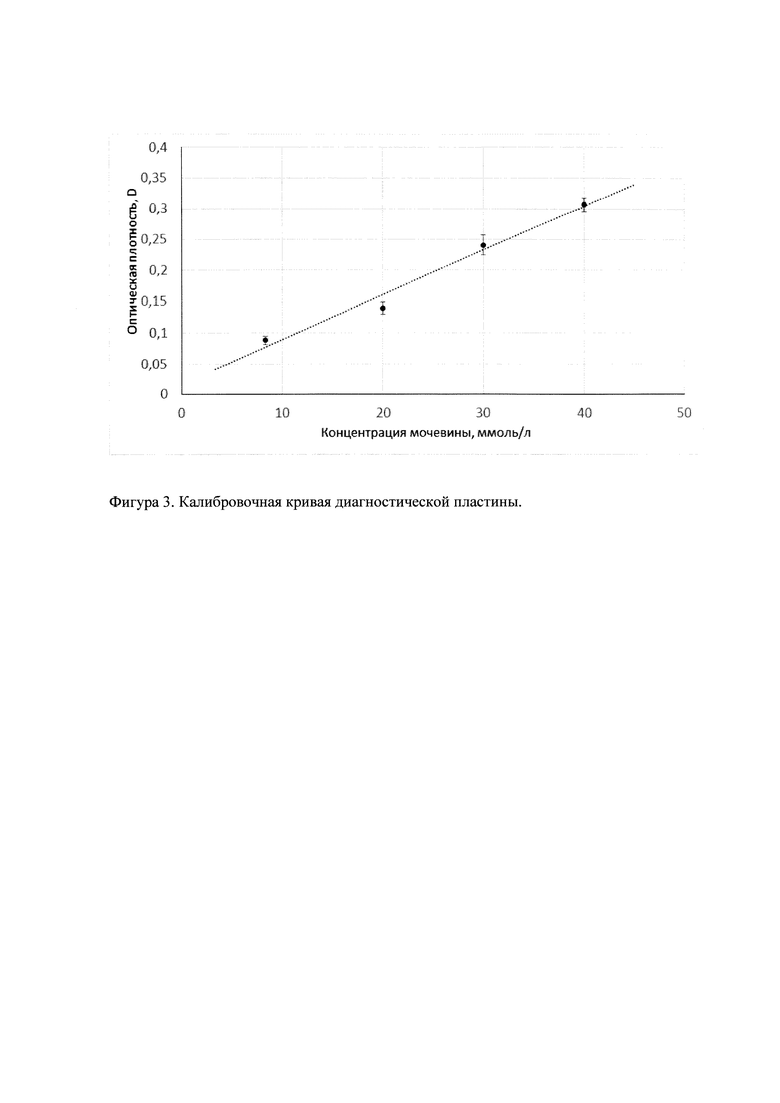
Особенностью данной диагностической пластины является ее способность многократно определять концентрацию мочевины в растворе. Для повторного использования диагностической пластины ее извлекают из анализируемого раствора и промывают, как описано выше в п. 4, после чего помещают в свежий раствор мочевины и повторяют п. 1-6. На фиг. 4 представлено двенадцатикратное измерение содержания мочевины в растворах одинаковой концентрации.
Принципиальными особенностями, отличающими предлагаемый биосенсор от известных устройств для определения мочевины, являются:
1) Иммобилизация содержащих уреазу полиэлектролитных микрокапсул на твердой подложке.
2) Многократное использование пластины без применения трудоемких операций для извлечения и промывки детектирующих компонентов.
3) Создание диагностической пластины, предназначенной для анализа мочевины состоит из двух этапов. Первый - изготовление полиэлектролитных микрокапсул с ферментом. Такие капсулы могут храниться при температуре 4°С без потери активности фермента по крайней мере в течение 3 месяцев. Второй этап - иммобилизация этих капсул на поверхности твердой подложки.
Диапазон количественного определения мочевины составил 5-50 ммоль/л линейностью до 40 ммоль/л, отклонение от линейности не превышает 10%, при этом коэффициент вариации не превышает 7,17%.
На фиг. 1 представлена схема процесса формирования диагностической пластины.
На фиг. 2 представлена схема процесса формирования микрокапсул с уреазой..
На фиг. 3 приведена калибровочная кривая диагностической пластины для определения мочевины.
На фиг. 4 представлены значения ответа диагностической пластины при многократном измерении растворов мочевины одинаковой концентрации.
В таблице 1 приведены значения концентрации мочевины в сыворотке крови 5 пациентов, измерненные с помощью диагностической пластины и свободного фермента.
Таким образом, разработана диагностическая пластина для определения мочевины, которая обеспечивает определение содержания мочевины в образце.
Список цитируемых источников:
1. Физиология. Основы и функциональные системы: Курс лекций / Под ред. К.В. Судакова. - М.: Медицина, 2000. - 784 с.
2. Слепышева В.В., Балябина М.Д., Козлов А.В. Методы определения мочевины // Terra Medica Nova. - 2007. - Т. 16. - №4.
3. Rhine E.D., Sims G.K., Mulvaney R.L., Pratt E.J. Improving the Berthelot reaction for determining ammonium in soil extracts and water. Soil Sci. Soc. Am. J. 1998; 62: 473-480
4. Родионов Ю.В., Язвовская С.С. Способ определения мочевины в биологических жидкостях и набор реактивов для его осуществления // Патент РФ №2122740 С1
5. Aoki Т., Kaneoke М., Nabekura Y., Sato K., Tsukioka М., Watanabe K. Kit for simply determining concentration of pyruvic acid and method for simply determining concentration of pyruvic acid // JP 2004065078
6. Де Джорджио Д., Дженсен В. Система восстановления конфермента, набор для ферментативного определения концентрации анализируемого вещества и ферментативный способ определения концентрации анализируемого вещества // Патент РФ №2184778 С2
7. Donath Е., Sukhorukov G.В., Caruso F., Davis S.A., Mohwald Н. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes, Angew. Chemie. 1998. V. 37, P. 2202-2205.
8. Petrov A.I., Volodkin D.V., Sukhorukov G.B. Protein calcium carbonate со-precipitation: a tool of protein encapsulation. Biotechnol. Prog. 2005. V. 21.(3). p. 918-925.
9. Tikhonenko S.A., Saburova E.A., Dubrovskii A.V., Shabarchina L.I., Dybovskaya Yu.N., Sukhorukov B.I. A technique for incorporating enzymes into polyelectrolyte microcapsules // Glass Physics and Chemistry, 2007, V. 33, Is. 3, P. 287-293.
10. Сухорукое Б.И., Тихоненко С.А., Сабурова E.A., Дубровский А.В., Дыбовская Ю.Н., Шабарчина Л.И. Инкапсулирование ферментов в полиэлектролитные нано- и микрокапсулы в связи с проблемой микродиагностикума. Биофизика, 2007, т. 52, вып. 6, С. 1041-1048.
11. Сухоруков Б.И., Сабурова Е.А., Шабарчина Л.И., Дубровский А.В., Тихоненко С.А. Микродиагностикум и способ ферментативного определения концентрации анализируемого вещества. // Патент РФ №2316769.
12. Терновский В.И., Чернохвостое Ю.В., Фомкина М.Г., Монтрель М.М. Потенциометрический сенсор на основе уреазы, иммобилизованной в полиэлектролитных микрокапсулах. // Биофизика. Т: 52, №5, 2007, С. 825-829.
13. Монтрель М.М., Петров А.И., Терновский В.И., Фомкина М.Г. Ультратонкое полимерное покрытие, способ его изготовления и ферментативный биосенсор на его основе // Патент РФ №02333231 С2. Действует с: 16.10.2006.
14. Решетилов А.Н., Плеханова Ю.В., Тихоненко С.А., Дубровский А.В. // Журнал аналитической химии. 2015. Т. 70. №11. С. 1186-1190.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОДИАГНОСТИКУМ И СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА | 2006 |
|
RU2316769C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАГРУЖЕННЫХ БЕЛКОМ ПОЛИЭЛЕКТРОЛИТНЫХ НАНО- И МИКРОКАПСУЛ | 2007 |
|
RU2369386C2 |
| УЛЬТРАТОНКОЕ ПОЛИМЕРНОЕ ПОКРЫТИЕ, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И ФЕРМЕНТАТИВНЫЙ БИОСЕНСОР НА ЕГО ОСНОВЕ | 2006 |
|
RU2333231C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МОЧЕВИНЫ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ И НАБОР РЕАКТИВОВ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1995 |
|
RU2122740C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОДЛОЖЕК С МНОНОСЛОЙНЫМ ПОКРЫТИЕМ НА ОСНОВЕ ПОЛИЭЛЕКТРОЛИТНЫХ МИКРОКАПСУЛ, СОДЕРЖАЩИХ БИОЛОГИЧЕСКИ АКТИВНЫЕ МАТЕРИАЛЫ | 2011 |
|
RU2567320C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОГЛОЩАЮЩИХ КИСЛОРОД ЭЛЕМЕНТОВ ЗАЩИТНОГО ПОКРЫТИЯ В ВИДЕ МИКРОКАПСУЛ | 2009 |
|
RU2422197C2 |
| СПОСОБ МОДИФИКАЦИИ ОБОЛОЧЕК ПОЛИЭЛЕКТРОЛИТНЫХ КАПСУЛ НАНОЧАСТИЦАМИ МАГНЕТИТА | 2011 |
|
RU2522204C2 |
| Способ получения полиэлектролитных микрокапсул | 2017 |
|
RU2641034C1 |
| СИСТЕМА ВОССТАНОВЛЕНИЯ КОНФЕРМЕНТА, НАБОР ДЛЯ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА И ФЕРМЕНТАТИВНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА | 1996 |
|
RU2184778C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ С ПОМОЩЬЮ МАГНИТНОЙ ГИПЕРТЕРМИИ И КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В УКАЗАННОМ СПОСОБЕ | 2020 |
|
RU2792161C2 |

Изобретение относится к области биохимии, а именно к устройствам для определения мочевины. Диагностическая пластина включает в себя кварцевую подложку, полимерное покрытие, состоящее из полиэтиленимина, полистиролсульфоната и полиаллиламина, и содержащие уреазу полиэлектролитные микрокапсулы. Изобретение обеспечивает быстрое определение содержания мочевины без применения трудоемких операций по извлечению детектирующих агентов из реакционной среды и их подготовке к следующему анализу. 4 ил., 1 табл.
Диагностическая пластина для определения мочевины, включающая кварцевую подложку, полимерное покрытие, состоящее из полиэтиленимина, полистиролсульфоната и полиаллиамина, и содержащие уреазу полиэлектролитные микрокапсулы.
| Муфта для тепловой изоляции фланцевого соединения трубопровода | 1928 |
|
SU10315A1 |
| RU 95121678 А, 27.12.1998 | |||
| ТЕРНОВСКИЙ В.И | |||
| и др | |||
| Потенциометрический сенсор на основе уреазы, иммобилизованной в полиэлектролитных микрокапсулах //Биофизика, 2007, Т | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Устройство для регистрации замерзания и оттаивания почвы | 1923 |
|
SU825A1 |
| TAYLOR A.J | |||
| et al | |||
| Analytical reviews in clinical biochemistry: the estimation of urea //Annals of Clinical Biochemistry, 1992, т | |||
| Солесос | 1922 |
|
SU29A1 |
Авторы
Даты
2019-12-25—Публикация
2018-04-27—Подача