Перекрестная ссылка на родственную заявку
По настоящей заявке испрашивается приоритет предварительной заявки на выдачу патента США с регистрационным номером №61/649146, поданной 18 мая 2012, указанная заявка включена в настоящее описание в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение относится к высококонцентрированным составам моноклональных антител, подходящим для подкожного введения, например, посредством предварительно заполняемого шприца. В частности, изобретение относится к составу, содержащему высушенное распылением моноклональное антитело в концентрации примерно 200 мг/мл или выше, суспендированное в неводном наполнителе для суспензии, где вязкость наполнителя для суспензии составляет менее примерно 20 сантипуаз. Изобретение также относится к устройству для подкожного введения с находящемся в нем составом, к способу получения суспензионного состава, способу получения изделия, содержащего суспензионный состав, к применению суспензионного состава в получении лекарственного средства и к способу лечения пациента с использованием суспензионного состава.
Уровень техники
Амбулаторное введение моноклональных антител в высоких дозах (несколько мг на кг) путем подкожной (п/к) инъекции является предпочтительной формой доставки при лечении хронических состояний (Stockwin and Holmes, Expert Opin. Biol. Ther. 3: 1133-1152 (2003); Shire et al., J. Pharm. Sci. 93: 1390-1402 (2004)). Подкожный путь введения, который требуется для проведения инъекций с использованием шприцов, шприцов для самостоятельных инъекций или других устройств, обычно накладывает ограничения на состав продукта в отношении объема инъекции и вязкости раствора, а также функциональных возможностей устройств с точки зрения усилия и времени инъекции. Для доставки высокой дозы моноклонального антитела в условиях ограниченного времени инъекции, объема и усилия, необходим высококонцентрированный состав моноклонального антитела (100 мг/мл или больше) для подкожного введения (Stockwin and Holmes, Expert Opin. Biol. Ther. 3: 1133-1152 (2003); Shire et al., J. Pharm. Sci. 93: 1390-1402 (2004)). Вероятной проблемой при разработке составов с высокой концентрацией белка является зависимая от концентрации вязкость раствора. Усилие инъекции (или сила трения скольжения) является сложным фактором, на который влияет вязкость раствора, размер иглы (т.е., толщина иглы) и поверхностное натяжение у стенок емкости/крышки. Иглы с маленьким размером, например, с толщиной ≥26G, будут причинять меньше болезненных ощущений у пациентов. Overcashier с соавторами установили взаимосвязь между вязкостью и силой трения скольжения как функции толщины иглы на базе уравнения Хагена-Пуазейля (Overcashier et al., Am. Pharm. Rev. 9(6): 77-83 (2006)). В случае использования иглы толщиной 27G с тонкими стенками (TW) (ID, мин: 0,241 мм), вязкость жидкости следует поддерживать ниже 20 сантипуаз, чтобы не превышать силы трения скольжения 20 ньютонов.
Если игла имеет толщину 27G с тонкими стенками (TW) иглы (ID, мин.: 0,241 мм), то вязкость жидкости следует поддерживать ниже 20 сантипуаз, с тем, чтобы не превышать скольжения силу 20 ньютонов. К сожалению, перед специалистами в области получения составов постоянно встает проблема, связанная с реальными противоречиями, обусловленными высокой концентрацией моноклональных антител и высокой вязкостью растворов (Shire et al., J Pharm Sci 93:1390-1402 (2004); Kanai et al., J Pharm Sci 97:4219-4227 (2005). Другой проблемой при использовании жидких составов с высокой концентрацией моноклональных антител является физическая стабильность белка. В высококонцентрированных жидких растворах моноклональных антител обычно наблюдают более высокую скорость агрегации и нежелательную опалесценцию (Alford et al., J Pharm Sci 97:3005-3021 (2008); Salinas et al., J Pharm Sci 99:82-93 (2010); Sukumar et al., Pharm Res 21:1087-1093 (2004)).
Были предприняты попытки использования различных методик получения составов для снижения вязкости высококонцентрированного жидкого раствора моноклональных антител за счет использования в составе соли, аминокислоты или сахара для того, чтобы сбалансировать силы отталкивания и притяжения посредством промежуточной ионной силы (Sukumar et al., Pharm. Res 21: 1087-1093 (2004); He et al., J. Pharm. Sci. 100: 1330-1340 (2011)). Однако эффективность таких способов может быть ограничена при концентрации моноклонального антитела за пределами 100 мг/мл или из-за конкретных характерных признаков некоторых моноклональных антител. Dani с соавторами использовали способ перерастворения высушенного распылением порошка моноклонального антитела для получения высококонцентрированного жидкого раствора моноклонального антитела перед подкожной инъекцией (Dani et al., J. Pharm. Sci. 96: 1504-1517 (2007)). Такой способ, конечно, может улучшить стабильность белка в твердом состоянии в течение всего срока годности, однако проблема высокой вязкости при этом сохраняется, поскольку высушенный распылением порошок моноклонального антитела необходимо перерастворять перед инъекций с получением высокой концентрации моноклонального антитела. Недавно появился способ, основанный на использовании порошка, при котором используют суспензии кристаллических частиц моноклонального антитела (Yang et al., Proc Natl Acad Sci 100:6934-6939 (2003); Trilisky et al., “Crystallization and liquid-liquid phase separation of monoclonal antibodies and Fc-fusion proteins: Screening results,” AICHE online publication DOI 10, 1002/btrp.621 (опубликовано в электронной библиотеке Уайли) (2011)). Способ основан на понимании того, что вязкость суспензии кристаллического моноклонального антитела может быть ниже, чем вязкость жидкого состава при той же самой концентрации моноклонального антитела. Однако в указанных публикациях не было представлено данных о вязкости или усилии при инъекции, и такая идея остается спекулятивной. Кроме того, кристаллизация моноклонального антитела еще не достаточно разработанная технологическая платформа, которую можно использовать в отношении широкого спектра моноклональных антител, хотя были представлены некоторые успешные примеры (Trilisky et al., “Crystallization and liquid-liquid phase separation of monoclonal antibodies and Fc-fusion proteins: Screening results,” AICHE online publication DOI 10, 1002/btrp.621 (опубликовано в электронной библиотеке Уайли) (2011)).
Настоящее изобретение относится к отличающейся концепции, основанной на использовании порошка, в которой используют суспензию порошка моноклонального антитела в высокой концентрации в неводном наполнителе для суспензии. Способ, основанный на применении суспензии, был всесторонне описан (Floyd and Jain, “Injectable emulsions and suspensions,” In: Pharmaceutical Dosage Forms: Disperse Systems Volume 2 (eds. Lieberman HA, Rieger MM, Banker GS). Dekker, NY, NY, p261-318 (1996); Akers et al., J Parent Sci & Techn 41:88-96 (1987)) и сообщалось о его применении в случае суспензий микросфера/эмульсия в растительных маслах, таких как кунжутное масло (Larsen et al., Eur J Pharm Sci 29:348-354 (2006); Hirano et al., J Pharm Sci 71:495-500 (1982)), соевое масло (Salmeron et al., Drug Dev. Ind. Pharm. 23: 133-136 (1997); Karasulu et al., Drug Dev. 14: 225-233 (2007)), и арахисовое масло (Santucci et al., J. Contr. Rel. 42: 157-164 (1996)) в качестве исходных инъекционных составов. Физические и химические силы, влияющие на свойства неводных суспензий, могут быть совершенно другими, отличающимися от сил, действующих на водную суспензию, из-за отсутствия электрических эффектов, связанных с теорией ДЛФО (притяжение Ван-дер-Ваальса и электростатическое отталкивание в результате наличия двойного слоя противоионов).
Pena с соавторами (Pena et al., Intl. J. Pharm. 113: 89-96 (1995)) сообщили о реологической характеристике не содержащей эксципиенты суспензии бычьего соматотропина (rbSt) (лиофилизированного или высушенного распылением) в каприловом/каприновом триглицеридном (MIGLYOL 812®) масле с полисорбатом 80 или без него. RbSt представляет собой 191-аминокислотный пептид с молекулярной массой 22000 дальтон. Pena с соавторами определили, что сеть, образуемая между частицами лекарственного средства, полисорбатом 80 и MIGLYOL 812®, и более высокая вязкость наблюдаются при возрастании концентраций полисорбата 80 и порошка. В указанных исследованиях также было обнаружено, что форма/морфология частиц играют важную роль в определении вязкости суспензии. Меньшие по размеру сферические (более плотно упакованные) высушенные распылением частицы давали в результате более вязкие суспензии, чем лиофилизированный аналог, в котором наблюдали более крупные хлопья неправильной формы.
Подход на основе использования неводных порошковых составов для получения высококонцентрированных суспензий моноклональных антител остается неисследованным. Исходя из исследований небольшого пептида rbSt в работе Pena с соавторами, невозможно прогнозировать возможность эффективного получения составов крупного тетрамерного моноклонального антитела (примерно 150000 дальтон). Кроме того, масляные наполнители, используемые Pena с соавторами, были слишком вязкими, чтобы их рассматривать для применения при введении с использованием предварительно заполняемого шприца. Вязкость MIGLYOL 812®, кунжутного масла, соевого масла, арахисового масла составляет ~30 сантипуаз (сП) при 25°C, 43 сП при 25°C, 50 сП при 25°C и 35 сП при 37°C, соответственно. Кроме того, Pena с соавторами определили, что характеристики суспензии высушенного распылением порошка были хуже, чем его лиофилизированного аналога.
Публикации, в которых описаны составы моноклональных антител, включают: патент США 6284282 (Maa et al.); патенты США №6267958 и 6685940 (Andya et al.); патент США №6171586 (Lam et al.); патенты США №6875432 и 7666413 (Liu et al.); WO 2006/044908 (Andya et al.); US-2011-0076273-A1 (Adler et al.); US 2011/0044977 и WO 2011/012637 (Adler et al.); US 2009/0226530A1 (Lassner et al.); US-A 2003/0190316 (Kakuta et al.); US-A 2005/0214278 и US-A 2005/0118163 (Mizushima et al.); US-A 2009/0291076 (Morichika et al.); и US-A 2010/0285011 (Imaeda et al.).
Сущность изобретения
Задачей настоящего исследования является: (1) идентифицировать параметры способа, которые обуславливает характеристики суспензии; (2) оценить возможность разработки суспензий из порошков моноклональных антител (т.е., ≥250 мг моноклонального антитела/мл) с подходящей способностью проходить через иглу при инъекции (т.е. усилие инъекции ≤20 N через иглу толщиной 27G с тонкими стенками (TW)) и физической стабильностью суспензий; и/или (3) понять механизм эффективности суспензии. Для получения порошков моноклонального антитела использовали распылительную сушку. Распылительная сушка представляет собой разработанный, масштабируемый и эффективный способ получения. Кратковременный эффект распылительной сушки на моноклональное антитело исследовали при повышенной температуре. Важным критерием при выборе наполнителя для суспензии было то, чтобы вязкость наполнителя для суспензии была ниже 10 сантипуаз (сП). Три модельных наполнителя для суспензий, дикаприлат/дикапрат пропиленгликоля, бензилбензоат и этиллактат, исследованных в этом тесте, имели низкую вязкость и удовлетворяли указанному требованию.
Обращенную газовую хроматографию (ОГХ) использовали для анализа поверхностной энергии (SEA) (Newell et al., Pharm Res 18:662-666 (2001); Grimsey et al., J Pharm Sci 91:571-583 (2002); Newell and Buckton, Pharm Res 21:1440-1444 (2004); Saleem and Smyth, Drug Devel & Ind Pharm 34:1002-1010 (2008); Panzer and Schreiber, Macromolecules 25:3633-3637 (1992)). При ОГХ зонд инъецируют на колонку, упакованную представляющим интерес порошком (стационарная фаза), и время, необходимое для того, чтобы зонд проходил через колонку (tr), является мерой величины взаимодействия между зондом и стационарной фазой. Поверхностная энергия обычно может быть разделена на полярные и дисперсионные (неполярные) компоненты. Таким образом, использование неполярных (алканы) и полярных (растворители акцепторы-доноры электронов или растворители на основе кислоты-основания) зондов позволило количественно оценить две указанных компоненты поверхностной энергии. Поверхностная энергия высушенных распылением частиц может служить в качестве более прямого и подходящего индикатора качества суспензии, чем другие характеристики частиц. Другим параметром является теплота сорбции, которая является прямой мерой силы взаимодействий между молекулами твердого вещества и газа, адсорбированными на поверхности (Thielmann F., “Inverse gas chromatography: Characterization of alumina and related surfaces,” In “Encyclopedia of Surface and Colloid Science Volume 4 (edit by P. Somasundaran). CRC Press, Boca Raton, FL., p3009-3031 (2006); Thielmann and Butler, “Heat of sorption on microcrystalline cellulose by pulse inverse gas chromatography at infinite dilution,” Surface Measurement Services Application Note 203 (http://www.thesorptionsolution.com/Information_Application_Notes_IGC.php#Aps) (2007)). Способ ОГХ использовали в данном исследовании для измерения теплоты сорбции между высушенными распылением частицами и наполнителем для суспензии.
Экспериментальные данные, представленные в настоящем описании, показывают, что задачи были решены, и были разработаны высококонцентрированные суспензионные составы моноклональных антител, подходящие для подкожного введения.
Таким образом, в первом аспекте изобретение относится к суспензионному составу, содержащему высушенные распылением моноклональные антитела в концентрации примерно 200 мг/мл или больше, суспендированные в неводном наполнителе для суспензии, при этом вязкость наполнителя для суспензии составляет менее примерно 20 сантипуаз.
В другом аспекте изобретение относится к суспензионному составу, содержащему высушенное распылением полноразмерное человеческое моноклональное IgG1-антитело в концентрации примерно от 200 мг/мл до примерно 400 мг/мл, суспендированное в неводном наполнителе для суспензии, с вязкостью менее чем примерно 20 сантипуаз, при этом состав имеет средний размер частиц примерно от 2 микрон до примерно 10 микрон и силу трения скольжения при инъекции менее чем примерно 15 ньютонов.
Кроме того, изобретение относится к устройству для подкожного введения (например, предварительно заполненному шприцу) с составом в указанном устройстве.
В другом аспекте изобретение относится к способу получения суспензионного состава, включающему суспендирование высушенного распылением моноклонального антитела в неводном наполнителе для суспензии с вязкостью менее чем примерно 20 сантипуаз, при этом концентрация антитела в суспензионном составе составляет примерно 200 мг/мл или больше.
Кроме того, изобретение относится к способу получения изделия, включающему заполнение устройства для подкожного введения составом.
В связанных аспектах изобретение относится к применению состава для получения лекарственного средства для лечения пациента моноклональным антителом в составе, а также к способу лечения пациента, включающему введение состава пациенту, при необходимости лечения, моноклональным антителом состава.
Краткое описание чертежей
Фигура 1: Стабильность антитела (в виде изменения количества мономера в % при эксклюзионной хроматографии по размеру (SEC), начиная сразу после сушки распылением) как функция времени хранения при 40°C в случае высушенного распылением (•) и высушенного вымораживанием (○) состава бевацизумаба/трегалозы, а также высушенного распылением (■) и высушенного вымораживанием (□) состава трастузумаба/трегалозы.
Фигура 2: Характеристики зависимости вязкости от концентрации порошка для суспензий в дикаприлате/дикапрате пропиленгликоля трех порошков моноклональных антител (мАт), высушенных распылением с использованием полупромышленной распылительной сушилки или лабораторной настольной распылительной сушилки: бевацизумаб в полупромышленном масштабе (◊), бевацизумаб в лабораторных условиях (♦), трастузумаб в полупромышленном масштабе (□), трастузумаб в лабораторных условиях (■), ритуксимаб в полупромышленном масштабе (Δ), ритуксимаб в лабораторном масштабе (▲), эмпирическая подгонка (сплошная линия) и теоретическая подгонка, исходя из уравнения 4 (пунктирная линия).
Фигура 3: Характеристики зависимости силы трения скольжения от концентрации мАт для суспензии порошка ритуксимаба в дикаприлате/дикапрате пропиленгликоля (Δ), этиллактате (◊), бензилбензоате (○), и прогнозируемая сила трения скольжения для жидкого раствора мАт, извлеченные с фигуры 4 из публикации Overcashier et al/ (Am. Pharm. Rev. 9(6): 77-83 (2006)) (■).
Фигура 4: Характеристики зависимости вязкости от концентрации мАт для суспензии порошка ритуксимаба в дикаприлате/дикапрате пропиленгликоля (Δ), в бензилбензоате (◊) и в этиллактате (○).
Фигура 5: Распределение частиц по размеру в суспензиях ритуксимаба в дикаприлате/дикапрате пропиленгликоля (◊), в бензилбензоате (□) и в этиллактате (Δ).
Фигуры 6A-C: Фотографии суспензии ритуксимаба в концентрации 150 мг/мл в этиллактате после 2-недельного хранения (6A), в этиллактате, подвергнутого встряхиванию после хранения в течение 1 дня (6B), и в дикаприлате/дикапрате пропиленгликоля после 2-недельного хранения (6C). (Примечание: лента не является частью суспензии, а используется для оптической фокусировки во время фотографирования).
Фигуры 7A и 7B: Суспензии ритуксимаба. Фигура 7A: Распределение частиц по размеру в суспензиях ритуксимаба в смесях дикаприлата/дикапрата пропиленгликоля и этиллактата 100/0 (◊), 75/25 (■), 50/50 (□), 25/75 (♦) и 0/100 (Δ). Фигура 7B: Фотография суспензии ритуксимаба в смеси 75/25 дикаприлата/дикапрата пропиленгликоля/этиллактата после 2-недельного хранения. (Примечание: лента не является частью суспензии, а используется для оптической фокусировки во время фотографирования).
На фигурах 8A и 8B представлены аминокислотные последовательности тяжелой цепи (SEQ ID NO: 1) и легкой цепи (SEQ ID NO: 2) антитела ритуксимаба. Указаны каждая из каркасных областей (FR) и каждая из определяющих комплементарность область (CDR) в каждой вариабельной области, также как последовательность константой области тяжелой цепи гамма 1 человека и последовательность константной области легкой цепи каппа человека. Вариабельная область тяжелой цепи (VH) представляет собой последовательность SEQ ID NO: 3. Вариабельная область легкой цепи (VL) представляет собой последовательность SEQ ID NO: 4. Последовательности CDR имеют следующие обозначения: CDR H1 (SEQ ID NO: 5), CDR H2 (SEQ ID NO: 6), CDR H3 (SEQ ID NO: 7), CDR L1 (SEQ ID NO: 8), CDR L2 (SEQ ID NO: 9) и CDR L3 (SEQ ID NO: 10).
На фигурах 9A и 9B представлены аминокислотные последовательности тяжелой цепи (SEQ ID NO: 11) и легкой цепи (SEQ ID NO: 12) антитела бевацизумаба. Конец каждой вариабельной области обозначен ⏐⏐. Вариабельная область тяжелой цепи (VH) представляет собой последовательность SEQ ID NO: 13. Вариабельная область легкой цепи (VL) представляет собой последовательность SEQ ID NO: 14. Последовательности CDR имеют следующие обозначения: CDR H1 (SEQ ID NO: 15), CDR H2 (SEQ ID NO: 16), CDR H3 (SEQ ID NO: 17), CDR L1 (SEQ ID NO: 18), CDR L2 (SEQ ID NO: 19) и CDR L3 (SEQ ID NO: 20).
На фигурах 10A и 10B представлены аминокислотные последовательности тяжелой цепи (SEQ ID NO: 21) и легкой цепи (SEQ ID NO: 22) антитела бевацизумаба. Конец каждой вариабельной области обозначен ⏐⏐. Вариабельная область тяжелой цепи (VH) представляет собой последовательность SEQ ID NO: 23. Вариабельная область легкой цепи (VL) представляет собой последовательность SEQ ID NO: 24. Последовательности CDR имеют следующие обозначения: CDR H1 (SEQ ID NO: 25), CDR H2 (SEQ ID NO: 26), CDR H3 (SEQ ID NO: 27), CDR L1 (SEQ ID NO: 28), CDR L2 (SEQ ID NO: 29) и CDR L3 (SEQ ID NO: 30).
Подробное описание предпочтительных вариантов
I. Определения
Термин «фармацевтический состав» относится к составу, который находится в такой форме, которая обеспечивает эффективную биологическую активность активного средства (например, моноклонального антитела) и которая не содержит дополнительных компонентов, которые являются неприемлемо токсичными для индивида, которому может быть введен состав. Такие составы являются стерильными. В одном из вариантов фармацевтический состав подходит для подкожного введения.
«Фармацевтически приемлемый» по отношению к эксципиенту в фармацевтическом составе означает, что эксципиент подходит для введения больному человеку.
«Стерильный» состав является асептическим или не содержит живых микроорганизмов или их спор.
«Подкожное введение» относится к введению (состава) под кожу индивида или пациента.
«Стабильный» состав представляет собой состав, в котором активное средство (например, моноклональное антитело) по существу сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность при суспендировании и/или хранении. Предпочтительно, состав по существу сохраняет свою физическую и химическую стабильность, а также биологическую активность при суспендировании и хранении. Период хранения обычно выбирают на основе предполагаемого срока годности состава. В данной области имеются различные аналитические способы измерения стабильности белка, и их обзор приведен, например, в публикациях Peptide and Белок Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, New York, Pubs. (1991); и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). В одном из вариантов стабильность суспензионного состава оценивают примерно в тот момент времени, когда высушенные распылением частицы суспендируют в наполнителе для получения суспензионного состава. В одном из вариантов стабильность можно оценивать на тот момент, когда состав выдерживают при выбранной температуре в течение выбранного периода времени. В одном из вариантов стабильность моноклонального антитела оценивают по распределению по размеру (процентное содержание мономера, агрегация и/или фрагментация) до и после распылительной сушки (например, до и после распылительной сушки в течение 3 месяцев хранения при повышенной температуре 40°C). В одном из вариантов распределение по размеру оценивают, используя эксклюзионную хроматографию по размеру - высокоэффективную жидкостную хроматографию (SEC-ВЭЖХ). В одном из вариантов потеря содержания мономера в процентах (которое измеряют с использованием SEC-ВЭЖХ) в течение 3 месяцев составляет менее чем примерно 10%, например, менее чем 5%, например, при повышенной температуре 40°C. В одном из вариантов стабильность оценивают, определяя физическую стабильность суспензии, например, посредством визуального осмотра осадка и/или определения скорости седиментации частиц.
«Распылительная сушка» относится к процессу распыления и сушки жидкости или взвеси, содержащей белок или моноклональное антитело, с использованием газа (обычно воздуха или азота) при температуре выше температуры окружающей среды, с получением частиц сухого порошка, содержащих белок или моноклональное антитело. В ходе процесса жидкость испаряется и образуются сухие частицы. В одном из вариантов распылительную сушку осуществляют с использованием распылительной сушилки, например, который имеет температуру воздуха на впуске примерно от 100°C до примерно 220°C и температуру воздуха на выпуске примерно от 50°C до примерно 100°C. Частицы могут быть отделены от газа различными способами, такими как способы с использованием циклона, газа под высоким давлением, электростатического заряда и т.д. Такое определение распылительной сушки в настоящем описании специально включает лиофильную сушку или кристаллизацию моноклонального антитела.
«Сухая» частица, белок или моноклональное антитело по настоящему изобретению подвергают процессу сушки так, чтобы содержание воды в нем было значимо уменьшено. В одном из вариантов частица, белок или моноклональное антитело имеет содержание воды менее чем примерно 10%, например, менее чем примерно 5%, например, в том случае, когда содержание воды измеряют способ химического титрования (например, способом Карла Фишера) или способом на основе определения потери массы (нагревание при высокой температуре).
Для целей настоящего изобретения «предварительно высушенный распылением состав» относится к составу моноклонального антитела (обычно рекомбинантно полученного моноклонального антитела, которое было подвергнуто одной или нескольким стадиям очистки) и одного или нескольких эксципиентов, таких как стабилизаторы (например, сахариды, поверхностно-активные вещества и/или аминокислоты) и необязательно буфера. В одном из вариантов состав имеет жидкую форму. В одном из вариантов состав замораживают.
«Суспензионный состав» представляет собой жидкий состав, содержащий твердые частицы (например, высушенные распылением частицы моноклонального антитела), диспергированные в жидкой фазе, в которой они не растворимы. В одном из вариантов твердые частицы в суспензионном составе имеют средний диаметр частиц примерно от 2 до примерно 30 микрон, например, примерно от 5 до примерно 10 микрон (например, судя по анализу с использованием лазерной дифракции). Необязательно, твердые частицы в суспензионном составе имеют пик (наибольше процентное содержание) размера частиц менее чем примерно 30 микрон, и необязательно менее чем примерно 10 микрон (например, судя по анализу с использованием лазерной дифракции). Суспензионный состав может быть получен объединением высушенных распылением частиц моноклонального антитела с неводным наполнителем для суспензии. В одном из вариантов суспензионный состав адаптирован или является подходящим для подкожного введения индивиду или пациенту.
Как используется в настоящем описании, «неводный наполнитель для суспензии» относится к фармацевтически приемлемой жидкости, которая не имеет водной основы и в которой высушенные распылением частицы моноклонального антитела могут быть суспендированы с получением суспензионного состава. В одном из вариантов наполнитель содержит жидкий липид или сложный эфир жирной кислоты или спирт (например, дикаприлат/дикапрат пропиленгликоля) или другое органическое соединение, такое как бензилбензоат или этиллактат. Наполнитель по изобретению включает смеси двух или более жидкостей, такие как смеси дикаприлата/дикапрата пропиленгликоля и этиллактата. Предпочтительно, неводный наполнитель для суспензии имеет вязкость (при 25°C) менее чем примерно 20 сантипуаз (сП), необязательно менее чем примерно 10 сП и в одном из вариантов менее чем примерно 5 сП. Примеры неводных наполнителей для суспензии по изобретению включают наполнители, указанные в таблице 1 ниже:
Примеры неводных наполнителей для суспензий и их вязкость
«Вязкость» относится к мере устойчивости жидкости, которая подвергается деформации либо под действием сдвигового напряжения, либо под действием напряжения растяжения; вязкость можно оценивать, используя вискозиметр или реометр. Если не указано иное, измерение вязкости (сантипуаз, сП) осуществляют примерно при 25°C. Вязкость, как используется в настоящем описании, может относиться к вязкости либо неводного наполнителя для суспензии как такового, либо вязкости суспензионного состава.
«Способность проходить через иглу при инъекции» относится к легкости, с которой суспензионный состав можно вводить индивиду. Согласно одному из вариантов осуществления изобретения способность проходить через иглу для инъекции суспензионного состава может превосходить способность проходить через иглу для инъекции жидкого состава, содержащего такую же концентрацию моноклонального антитела и такой же эксципиент(ты) и такую же его (их) концентрацию. В одном из вариантов способность проходить через иглу для инъекции относится к силе трения скольжения при инъекции.
«Сила трения скольжения при инъекции», как используется в настоящем описании, относится к усилию, необходимому для инъекции раствора с данной скоростью инъекции через иглу предварительно определяемой толщины и длины. В одном из вариантов оценку осуществляют, используя предварительно заполненный шприц (например, шприц на 1,0 мл с иглой с толщиной ≤25G или, предпочтительно, с иглой с толщиной ≤27), при этом силу трения скольжения анализируют и определяют как функцию расстояния штока поршня, перемещаемого внутри шприца при постоянной скорости при постоянной силе сжатия (например, используя «измерение силы трения скольжения в шприце», как описано в примере в настоящем описании). Время и усилие, необходимое для ручной инъекции (или время, необходимое для инъекции с использованием автоинжектора), могут влиять на удобство и простоту использования продукта непосредственным пользователем (и, следовательно, на соответствие предполагаемому применению продукта). В одном из вариантов используют формулу Хагена-Пуазейля для оценки усилия хода (или трения скольжения) (уравнение 1).
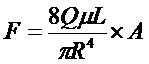
Q = объемная скорость потока;
μ = вязкость жидкости;
L = длина иглы;
R = внутренний диаметр иглы;
A = площадь поперечного сечения поршня шприца;
F = усилие хода без учета трения.
Согласно уравнению 1 сила трения скольжения зависит от нескольких параметров. Единственным параметром, на который может влиять специалист в области получения составов, является вязкость. Все другие параметры (внутренний диаметр иглы, длина иглы и площадь поперечного сечения поршня шприца) определяются самим предварительно заполняемым шприцем. Составы с высокой вязкостью могут приводить к высоким усилиям инъекции и длительному времени инъекции, так как оба параметра пропорциональны вязкости. Общепринятые пределы усилия инъекции и времени инъекции могут зависеть, например, от показания и ловкости пациентов в популяции. В варианте, приведенном в настоящем описании в качестве примера, параметры в уравнении 1 имели следующие значения:
Q = объемная скорость потока = 0,1 мл/секунду;
μ = вязкость жидкости = 20 сантипуаз;
L = длина иглы = 1,25 см;
R = внутренний диаметр иглы = 0,0105 см (игла толщиной 27G);
A = площадь поперечного сечения поршня шприца = 0,00316 см2;
F = усилие хода без учета трения = 16,6×105 дин = 16,6 ньютонов.
В одном из вариантов силу трения скольжения при инъекции определяют как функцию концентрации моноклонального антитела при инъекции 1 мл суспензионного состава с использованием шприца на 1 мл через несъемную иглу толщиной 27 с тонкими стенками (TW) за 10 секунд.
В одном из вариантов сила трения скольжения суспензионного состава при инъекции составляет примерно 20 ньютонов или меньше.
В одном из вариантов сила трения скольжения суспензионного состава при инъекции составляет примерно 15 ньютонов или меньше.
В одном из вариантов сила трения скольжения при инъекции составляет примерно от 2 ньютонов до примерно 20 ньютонов.
В одном из вариантов сила трения скольжения при инъекции составляет примерно от 2 ньютонов до примерно 15 ньютонов.
В одном из вариантов сила трения скольжения при инъекции составляет менее чем примерно 20 ньютонов.
В одном из вариантов сила трения скольжения при инъекции составляет меньше чем примерно 15 ньютонов.
Как используется в настоящем описании «буфер» относится к буферному раствору, который противостоит изменениям pH за счет действия своих сопряженных компонентов кислоты-основания. Буфер по изобретению (в случае его использования) обычно имеет pH приблизительно от 4,0 до приблизительно 8,0, например, приблизительно от 5,0 до приблизительно 7,0, например, приблизительно от 5,8 до приблизительно 6,2, и в одном из вариантов его pH составляет приблизительно 6,0. Примеры буферов, которые будут контролировать pH в данном диапазоне, включают ацетатный, сукцинатный, сукцинатный, глюконатный, гистидиновый, цитратный, глицилглициновый буфер и другие буферы на основе органических кислот. В одном из вариантов осуществления настоящего изобретения буфером является гистидиновый буфер. Буфер обычно включают в подвергаемый предварительной распылительной сушке состав и он может присутствовать в получаемом из него суспензионном составе (но обязательно присутствует в нем).
«Гистидиновый буфер» представляет собой буфер, содержащий ионы гистидина. Примеры гистидиновых буферов включают хлорид гистидина, ацетат гистидина, фосфат гистидина, сульфат гистидина. В одном из вариантов гистидиновый буфер представляет собой ацетат гистидина или гистидин-HCl. В одном из вариантов гистидиновый буфер имеет pH от 5,5 до 6,5, необязательно pH от 5,8 до 6,2, например, pH 6,0.
Термин «эксципиент» относится к средству, которое может быть добавлено в состав или композицию, например, в качестве стабилизатора, для достижения требуемой консистенции (например, изменения объемных свойств) и/или для корректировки осмоляльности. Примеры эксципиентов по изобретению включают, но ими не ограничиваются, стабилизаторы, сахара, полиолы, аминокислоты, поверхностно-активные вещества, хелатирующие средства и полимеры.
«Стабилизатор» по изобретению представляет собой эксципиент или смесь двух или более эксципиентов, которые стабилизируют фармацевтический состав. Например, стабилизатор может предотвращать нестабильность во время распылительной сушки при повышенной температуре. Примеры стабилизаторов по изобретению включают сахариды, поверхностно-активные вещества и аминокислоты.
«Сахарид» по изобретению включает соединения общего состава (CH2O)n и их производные, включая моносахариды, дисахариды, трисахариды, полисахариды, сахарные спирты, восстанавливающие сахара, не восстанавливающие сахара и т.д. Примеры сахаридов по изобретению включают глюкозу, сахарозу, трегалозу, лактозу, фруктозу, мальтозу, декстран, глицерин, декстран, эритрит, глицерин, арабит, силит, сорбит, маннит, меллибиозу, мелезитозу, раффмозу, маннотриозу, стахиозу, мальтозу, лактулозу, мальтулозу, глюцит, мальтит, лактит, изомальтулозу и т.д. Предпочтительным сахаридом солгано изобретению является не восстанавливающий дисахарид, такой как трегалоза или сахароза.
В настоящем описании «поверхностно-активное вещество» относится к поверхностно-активному веществу, предпочтительно, неионогенному поверхностно-активному веществу. Примеры поверхностно-активных веществ по изобретению включают полисорбат (например, полисорбат 20 и полисорбат 80); полоксамер (например, полоксамер 188); тритон; додецилсульфат натрия (SDS); лаурилсульфат натрия; октилгликозид натрия; лаурил-, миристил-, линолеил- или стеарилсульфобетаин; лаурил-, миристил-, линолеил- или стеарилсаркозин; линолеил-, миристил- или цетилбетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальамидопропил- или изостеарамидопропил-бетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил- или изостеарамидопропил-диметиламин; метилкокоилтартрат натрия или метилолеилтартрат динатрия; и серию MONAQUATTM (Mona Industries, Inc., Paterson, New Jersey); полиэтиленгликоль, полипропиленгликоль и сополимеры этилен- и пропиленгликоля (например, плюроники, PF68 и т.д.); и т.д. В одном из вариантов поверхностно-активным веществом является полисорбат 20 или полисорбат 80. Поверхностно-активное вещество может быть включено для предотвращения или снижения агрегации или денатурации моноклонального антитела в составе и/или композиции.
Термин «аминокислота», как используется в настоящем описании, означает фармацевтически приемлемую органическую молекулу, имеющую амино-группу, локализованную в α-положении по отношению к карбоксильной группе. Примеры аминокислот включают: аргинин, глицин, орнитин, лизин, гистидин, глутаминовую кислоту, аспарагиновую кислоту, изолейцин, лейцин, аланин, фенилаланин, тирозин, триптофан, метионин, серин и пролин. Используемая аминокислота необязательно находится в L-форме. Примеры аминокислот, которые можно включать в качестве стабилизаторов в составы и/или композиции по изобретению, включают: гистидин, аргинин, глицин и/или аланин.
Под «изотоническим» подразумевают, что представляющий интерес состав имеет по существу такое же осмотическое давление, как и кровь человека. Изотонические составы обычно могут иметь осмотическое давление примерно от 250 до 350 мОсм. Изотоничность можно измерить, используя, например, осмометр давления пара или криоскопический осмометр.
Как используется в настоящем изобретении «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов, которые могут возникать во время получения моноклонального антитела, таких как варианты, обычно присутствующие в минорных количествах. В отличие от составов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Кроме своей специфичности моноклональные антитела имеют преимущество, состоящее в том, что они не содержат примесей других иммуноглобулинов. Определение «моноклональное» указывает на природу антитела, как антитела, полученного, по существу, из гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые по настоящему изобретению, могут быть получены способом на основе гибридом, впервые описанным Kohler с соавторами (Nature, 256: 495 (1975)), или могут быть получены способами на основе рекомбинантной ДНК (см., например, патент США №4816567). «Моноклональные антитела» также могут быть выделены из фаговых библиотек антител с применением способов, описанных, например, Clackson et al. (Nature, 352: 624-628 (1991)) и Marks et al. (J. Mol. Biol, 222: 581-597 (1991). Конкретными примерами моноклональных антител по изобретению являются химерные антитела, гуманизированные антитела и антитела человека.
«Высушенное распылением» моноклональное антитело было подвергнуто распылительной сушке. Термин включает высушенное распылением моноклональное антитело в форме порошка (т.е. до суспендирования) и в форме жидкости (т.е. в случае суспендирования в неводном наполнителе для суспензии с образованием суспензионного состава).
Моноклональные антитела по настоящему изобретению специально включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида, или относящихся к конкретному классу или подклассу антител, при этом остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США No 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)). Представляющие интерес химерные антитела по изобретению включают «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельного домена, полученные от примата, отличного от человека (например, обезьян Старого Света, таких как, бабуин, макак-резус или макак-крабоед) и последовательности константной области человека (патент США №5693780). Примером химерного антитела по настоящему изобретению является ритуксимаб.
«Гуманизированные» формы антител животных, отличных от человека, (например, мышей) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. В большинстве случаев гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, обладающей требуемой специфичностью, аффинностью и/или емкостью. В некоторых случаях остатки каркаса (FR) иммуноглобулина человека заменяют соответствующими остатками животного, отличного от человека. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в донорном антителе. Такие модификации могут быть осуществлены для того, чтобы дополнительно повысить эффективность антитела. В общем, гуманизированное антитело будет содержать, по существу все из, по меньшей мере, одного и обычно двух вариабельных доменов, в которых все или в основном все гипервариабельные области соответствуют гипервариабельным областям иммуноглобулина животного, отличного от человека, и все или в основном все области FR являются областями FR из последовательности иммуноглобулина человека, за исключением замены (замен), которые казаны выше. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области иммуноглобулина, обычно константной области иммуноглобулина человека. Более подробное описание смотри в публикациях Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); and Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Примеры гуманизированных антител по изобретению включают трастузумаб и бевацизумаб.
«Антителом человека» по изобретению является антитело, имеющее структуру аминокислотной последовательности, которая соответствует структуре аминокислотной последовательности антитела, получаемого из B-клеток человека. Такие антитела могут быть идентифицированы или получены различными способами, включая, но ими не ограничиваясь, получение трансгенных животных (например, мышей), которые способны при иммунизации продуцировать антитела человека в отсутствие продукции эндогенных иммуноглобулинов (см., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); и патенты США №5591669, 5589369 и 5545807)); селекцию из библиотек в фаговом дисплее, экспрессирующих антитела человека (см., например, McCafferty et al., Nature 348:552-553 (1990); Johnson et al., Current Opinion in Structural Biology 3:564-571 (1993); Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Mol. Biol. 222:581-597 (1991); Griffith et al., EMBO J. 12:725-734 (1993); патенты США №5565332 и 5573905); образование с использованием активированных in vitro B-клеток (см. патенты США 5567610 и 5229275); и выделение из гибридом, продуцирующих антитела человека. Примером антитела человека по настоящему изобретению является офатумумаб.
«Полиспецифичным антителом» по изобретению является антитело, обладающее специфичностью связывания двух или более разных эпитопов.
«Биспецифичное антитело» представляет собой антитело со специфичностью связывания двух разных эпитопов. Примером биспецифичного антитела, специально рассматриваемого в настоящем описании, является Fab-молекула двойного действия (DAF) для HER3/EGFR, такая как DL11f, содержащая тяжелые цепи IgG1 человека (US 2010/0255010; WO 2010/108127).
Антитела по изобретению включают «варианты аминокислотной последовательности» с измененной антигенсвязывающей или биологической активностью. Примеры таких аминокислотных изменений включают антитела с повышенной аффинностью по отношению к антигену (например, антитела с «созревшей аффинностью»), и антитела с измененной Fc-областью, например, с измененной (повышенной или пониженной) зависимой от антител клеточной цитотоксичностью (ADCC) и/или зависимой от комплемента цитотоксичностью (CDC) (см., например, WO 00/42072, Presta, L. и WO 99/51642, Iduosogie et al.); и/или увеличенным или уменьшенным временем полужизни в сыворотке (см., например, WO 00/42072, Presta, L.).
«Вариант с созревшей аффинностью» имеет одну или несколько замен остатков в гипервариабельной области исходного антитела (например, исходного химерного антитела, гуманизированного антитела или антитела человека), которые улучшают связывание варианта с созревшей аффинностью.
Антитело по изобретению может быть конъюгировано с «гетерологичной молекулой», например, чтобы увеличить время полужизни или стабильность или иным образом улучшить антитело. Например, антитело может быть связано с одним из множества небелковых полимеров, например, полиэтиленгликолем (ПЭГ), полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля.
Антитело по изобретению может представлять собой «вариант гликозилирования», в котором любой из углеводов, связанных с его Fc-областью, изменен. Например, антитела со зрелой углеводной структурой, в которой отсутствует фукоза, связанная с Fc-областью антитела, описаны в заявке на выдачу патента США № US 2003/0157108 (Presta, L.). Также смотри US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Антитела с разветвленным N-ацетилглюкозамином (GlcNAc) в углеводе, связанном с Fc-областью антитела, упоминаются в WO 2003/011878, Jean-Mairet с соавторами, и в патенте США №6602684, Umana et al. Антитела по меньшей мере с одним остатком галактозы в олигосахариде, связанном с Fc-областью антитела, описаны в WO 1997/30087, Patel с соавторами. Также смотри публикации WO 1998/58964 (Raju, S.) и WO 1999/22764 (Raju, S.), касающиеся антител с измененным углеводом, связанным с их Fc-областью. См. также патент США 2005/0123546 (Umana et al.), в котором описаны антитела с модифицированным гликозилированием.
Термин «гипервариабельная область» при использовании в настоящем описании относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из «определяющей комплементарность области» или «CDR» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки из «гипервариабельной петли» (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196: 901-917 (1987)). «Каркасные» остатки или остатки «FR» представляют собой остатки вариабельного домена, отличные от остатков гипервариабельной области, которые определены в настоящем описании. CDR ритуксимаба, бевацизумаба и трастузумаба указаны на фигурах 8A-B, 9A-B и 10A-B, соответственно.
«Полноразмерное антитело» представляет собой антитело, которое содержит антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут представлять собой константные домены с нативной последовательностью (например, константные домены с нативной последовательностью человека) или их варианты по аминокислотной последовательности. Предпочтительно, полноразмерное антитело обладает одной или несколькими эффекторными функциями. В одном из вариантов Fc-область тяжелой цепи IgG человека простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако C-концевой лизин (Lys447) Fc-области может присутствовать или отсутствовать. Если не указано иное, нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации EU, также называемой индексом EU, которая описана Kabat с соавторами (Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Ритуксимаб, трастузумаб и бевацизумаб являются примерами полноразмерных антител.
«Голое антитело» означает моноклональное антитело, которое не конъюгировано с гетерологичной молекулой, такой как цитотоксический компонент, полимер или радиоактивная метка. Ритуксимаб, трастузумаб и бевацизумаб являются примерами голых антител.
Термин «эффекторные функции» антитела относится к биологическим активностям, которые свойственны для Fc-области (Fc-области с нативной последовательностью или Fc-области с вариантом аминокислотной последовательности) антитела. Примеры эффекторных функций антитела включают связывание C1q, зависимую от комплемента цитотоксичность (CDC), связывание Fc-рецептора, зависимую от антител опосредованную клетками цитотоксичность (ADCC) и т.д.
В зависимости от аминокислотной последовательности константного домена своих тяжелых цепей полноразмерные антитела можно отнести к разным классам. Существует пять основных классов полноразмерных антител: IgA, IgD, IgE, IgG, и IgM, и некоторые из них могут быть дополнительно разделены на «подклассы» (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам антител, называют альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации иммуноглобулинов разных классов хорошо известны. Антитело по изобретению представляет собой IgG1 согласно одному из вариантов осуществления изобретения.
«IgG1-антитело человека» в настоящем описании относится к полноразмерному антителу, содержащему константные домены тяжелой цепи IgG1 человека.
Термин «рекомбинантное антитело», как используется в настоящем описании, относится к моноклональному антителу (например, химерному, гуманизированному или человеческому моноклональному антителу), которое экспрессируется рекомбинантной клеткой-хозяином, содержащей нуклеиновую кислоту, кодирующую моноклональное антитело. Примеры «клеток-хозяев» для получения рекомбинантных антител включают: (1) клетки млекопитающих, например, клетки яичника китайского хомячка (CHO), COS, клетки миеломы (включая клетки Y0 и NS0), клетки почки сирийского хомячка (BHK), HeLa и Vero; (2) клетки насекомых, например, sf9, sf21 и Tn5; (3) клетки растений, например растений, относящихся к роду Nicotiana (например, Nicotiana tabacum); (4) клетки дрожжей, например, дрожжей, относящихся к роду Saccharomyces (например, Saccharomyces cerevisiae) или роду Aspergillus (например, Aspergillus niger); (5) бактериальные клетки, например, клетки Escherichia coli или клетки Bacillus subtilis, и т.д.
Как используются в настоящем описании, термины «специфичное связывание» или «связывается специфично» относятся к антителу, селективно или, предпочтительно, связывающемуся с антигеном. Предпочтительно, аффинность связывания с антигеном имеет значение Kd 10-9 моль/л или меньше (например, 10-10 моль/л), предпочтительно, значение Kd 10-10 моль/л или меньше (например, 10-12 моль/л). Аффинность связывания определяют, используя стандартный анализ связывания, такой как способ на основе резонанса поверхностного плазмона (BIACORE®).
«Терапевтическое моноклональное антитело» представляет собой моноклональное антитело, используемое для лечения больных людей. Терапевтические моноклональные антитела, раскрытые в изобретении, включают: антитела CD20 для терапии B-клеточных злокачественных новообразований (таких как неходжкинская лимфома или хронический лимфоцитарный лейкоз) или аутоиммунных заболеваний (таких как ревматоидный артрит и васкулит); HER2-антитела для лечения злокачественной опухоли (такой как рак молочной железы или рак желудка); VEGF-антитела для лечения злокачественной опухоли, возрастной макулярной дегенерации, макулярного отека и т.д.
В целях настоящего описания «ритуксимаб» относится к антителу, содержащему аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 3 и аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 4, и, необязательно, аминокислотную последовательность тяжелой цепи SEQ ID NO: 1 и аминокислотную последовательность легкой цепи SEQ ID NO: 2. Термин специально включает биологически сходный ритуксимаб.
В целях настоящего описания «бевацизумаб» относится к антителу, содержащему аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 13 и аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 14, и необязательно аминокислотную последовательность тяжелой цепи SEQ ID NO: 11 и аминокислотную последовательность легкой цепи SEQ ID NO: 12. Указанный термин специально включает биологически сходный бевацизумаб.
В целях настоящего описания «трастузумаб» относится к антителу, содержащему аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 23 и аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 24, и необязательно, аминокислотную последовательность тяжелой цепи SEQ ID NO: 21 и аминокислотную последовательность легкой цепи SEQ ID NO: 22. Указанный термин специально включает биологически сходный трастузумаб.
Моноклональное антитело, состав которого получают согласно изобретению, предпочтительно, по существу является чистым и желательно по существу гомогенным (т.е., не содержащим примесей белков и т.д.). «По существу чистое» антитело означает композицию, содержащую по меньшей мере примерно 90% масс. антитела от общей массы композиции, предпочтительно, по меньшей мере, примерно 95% масс. «По существу гомогенное» антитело означает композицию, содержащую по меньшей мере примерно 99% масс. антитела от общей массы композиции.
II. Моноклональные антитела, входящие в состав
Примеры методик получения моноклональных антител, которые могут быть получены в виде составов по настоящему изобретению, приведены далее. В одном из вариантов антиген, с которым связывается антитело, представляет собой биологически важный белок, и введение антитела млекопитающему, страдающему от заболевания или расстройства, может оказать полезный терапевтический эффект у такого млекопитающего. Однако также предусмотрены антитела, направленные против неполипептидных антигенов (таких как связанные с опухолями гликолипидные антигены; см. патент США 5091178).
В том случае, когда антиген является полипептидом, он может представлять собой трансмембранную молекулу (например, рецептор) или лиганд, такой как фактор роста. Примеры антигенов включают такие молекулы, как ренин; гормон роста, включая гормон роста человека и гормон роста быка; фактор высвобождения гормона роста; паратиреоидный гормон; тиреотропин; липопротеиды; альфа-1-антитрипсин; A-цепь инсулина; B-цепь инулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевой фактор (TF) и фактор фон Виллебранда; факторы, препятствующие свертыванию крови, такие как белок C; атриальный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназа или активатор плазминогена мочи человека или активатор плазминогена тканевого типа (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухолей альфа и бета; энкефалиназа; RANTES (регулируемый при активации, экспрессируемый и секретируемый нормальными T-клетками); воспалительный белок макрофагов человека (MIP-1-альфа); сывороточный альбумин, такой как сывороточный альбумин человека; мюллерова ингибирующая субстанция; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный гонадотропин-связанный пептид; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; связанный с цитотоксическими T-лимфоцитами антиген (CTLA), такой как CTLA-4; ингибин; активин; эндотелиальный фактор роста сосудов (VEGF); рецепторы для гормонов или факторов роста; белок A или D; ревматоидные факторы; нейротрофический фактор, такой как получаемый из костей нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, такой как NGF-b; полученный из тромбоцитов фактор роста (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-b1, TGF-b2, TGF-b3, TGF-b4 или TGF-b5; фактор некроза опухолей (TNF), такой как TNF-альфа или TNF-бета; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); дез(1-3)-IGF-I (IGF-I головного мозга), белки, связывающие инсулиноподобный фактор роста; CD-белки, такие как CD3, CD4, CD8, CD19, CD20, CD22 и CD40; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9 и IL-10; супероксиддисмутаза; T-клеточные рецепторы; поверхностные мембранные белки; стимулятор гемолиза; вирусный антиген, такой как, например, часть оболочки вируса СПИДа; транспортные белки; хоминг-рецепторы; адрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; связанный с опухолью антиген, такой как рецептор HER2, HER3 или HER4; и фрагменты любого из перечисленных выше полипептидов.
Примеры молекулярных мишеней для антител, которые входят в объем настоящего изобретения, включают CD-белки, такие как CD3, CD4, CD8, CD19, CD20, CD22, CD34 и CD40; представителей семейства рецепторов ErbB, таких как рецептор EGF, рецептор HER2, HER3 или HER4; B-клеточные поверхностные антигены, такие как CD20 или BR3; представителя надсемейства рецепторов некроза опухолей, включая DR5; антиген стволовых клеток простаты (PSCA); молекулы клеточной адгезии, такие как LFA-1, Mac1, p150.95, VLA-4, ICAM-1, VCAM, альфа4/бета7-интегрин и альфаv/бета3-интегрин, включая их альфа- или бета-субъединицы (например, анти-CD11a-, анти-CD18- или анти-CD11b-антитела); факторы роста, такие как VEGF, а также их рецепторы; тканевой фактор (TF); фактор некроза опухолей (TNF), такой как TNF-альфа или TNF-бета, альфа-интерферон (альфа-IFN); интерлейкин, такой как IL-8; IgE; антигены групп крови; flk2/flt3-рецептор; связанный с ожирением рецептор (OB); рецептор mpl; CTLA-4; белок C и т.д.
Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, можно использовать в качестве иммуногенов для создания антител. В случае трансмембранных молекул, таких как рецепторы, фрагменты таких молекул (например, внеклеточный домен рецептора) можно использовать в качестве иммуногена. Альтернативно в качестве иммуногена можно использовать клетки, экспрессирующие трансмембранную молекулу. Такие клетки могут быть получены из природного источника (например, линий злокачественных клеток) или могут представлять собой клетки, которые были трансформированы основанными на рекомбинации способами для экспрессии трансмембранной молекулы. Другие антигены и их формы, применимые для получения антител, будут очевидны для специалистов в данной области.
Примеры антител, которые могут быть получены в виде составов по настоящему изобретении, включают, но ими не ограничиваясь, следующие антитела: анти-ErbB-антитела, включая анти-HER2-антитела (например, трастузумаб или пертузумаб); антитела, которые связываются с маркером поверхности B-клеток, таким как CD20 (например, ритуксимаб и гуманизированный 2H7/окрелизумаб), CD22, CD40 или BR3; антитела, которые связываются с IgE, включая омализумаб (XOLAIR®), коммерчески доступный из Genentech, E26, HAE1, IgE-антитело с аминокислотной заменой в положении 265 его Fc-области (US 2004/0191244 A1), Hu-901, IgE-антитело, которое описано в WO 2004/070011, или антитело, которое связывает небольшой внеклеточный участок IgE, M1' (например, 47H4v5; смотри патент США №8071097), также см. публикацию Presta с соавторами (J. Immunol. 151 : 2623-2632 (1993)); международную публикацию № WO 95/19181; патент США №5714338, выданный 3 февраля 1998; патент США №5091313, выданный 25 февраля, 1992; публикацию WO 93/04173, опубликованную 4 марта 1993; WO 99/01556, опубликованную 14 января 1999; и патент США №5714338; антитела, которые связываются с эндотелиальным фактором роста сосудов (VEGF) (например, бевацизумаб) или VEGF-рецептором; анти-IL-8-антитела (St John с соавторами, Chest, 103: 932 (1993), и международная публикация № WO 95/23865); анти-PSCA-антитела (WO 01/40309); анти-CD40-антитела, включая S2C6 и его гуманизированные варианты (WO 00/75348); анти-CD11a-антитела, включая эфализумаб (раптива®) (патент США №5622700, WO 98/23761, Steppe с соавторами, Transplant Intl. 4: 3-7 (1991), и Hourmant с соавторами, Transplantation 58: 377-380 (1994)); анти-CD18 антитела (патент США №5622700, выданный 22 апреля 1997, или WO 97/26912, опубликованная 31 июля 1997); антитело против рецептора Apo-2 (WO 98/51793, опубликованная 19 ноября 1998); анти-TNF-альфа-антитела, включая cA2 (ремикад®) и адалимумаб (хумира®), CDP571 и MAK-195 (афелимомаб) (смотри патент США №5672347, выданный 30 сентября 1997, Lorenz с соавторами J. Immunol. 156(4): 1646-1653 (1996) и Dhainaut с соавторами Crit. Care Med. 23(9): 1461-1469 (1995)); антитело против тканевого фактора (TF) (европейский патент №0420937 B1, выданный 9 ноября 1994); антитело против α4β7-интегрина (WO 98/06248, опубликованная 19 февраля 1998); анти-EGFR-антитела, включая химеризованное или гуманизированное антитело 225, описанное в WO 96/40210, опубликованной 19 декабря 1996; анти-CD3-антитела, такие как OKT3 (патент США №4515893 выданный 7 мая 1985); анти-CD25- или анти-tac-антитела, такие как CHI-621 (симулект®) и (зенапакс®) (см. патент США №5693762, выданный 2 декабря 1997); анти-CD4-антитела, такие как cM-7412-антитело (Choy с соавторами, Arthritis Rheum. 39(1): 52-56 (1996)); анти-CD52-антитела, такие как алемтузумаб (кампат-1H®) (Riechmann с соавторами, Nature 332: 323-337 (1988)); антитела против Fc-рецептора, такие как антитело M22, направленное против FcγRI, описанное Graziano с соавторами (J. Immunol. 155(10): 4996-5002 (1995)); антитела против карциноэмбрионального антигена (CEA), такие как hMN-14 (Sharkey с соавторами, Cancer Res. 55 (23 Suppl.): 5935s-5945s (1995)); антитела, направленные против эпителиальных клеток молочной железы, включая huBrE-3, hu-Mc 3 и CHL6 (Ceriani с соавторами, Cancer Res. 55(23): 5852s-5856s (1995); и Richman с соавторами, Cancer Res. 55 (23 Supp.): 5916s-5920s (1995)); антитела, которые связываются с клетками карциномы ободочной кишки, такими как C242 (Litton с соавторами, Eur. J. Immunol. 26(1): 1-9 (1996)); анти-CD38-антитела, например, AT 13/5 (Ellis с соавторами, J. Immunol. 155(2): 925-937 (1995)); анти-CD33-антитела, такие как Hu M195 (Jurcic с соавторами, Cancer Res. 55 (23 Suppl.): 5908s-5910s (1995)) и CMA-676 или CDP771; анти-CD22-антитела, такие как LL2 или LymphoCide (Juweid с соавторами, Cancer Res. 55(23 Suppl.): 5899s-5907s (1995); анти-EpCAM-антитела, такие как 17-1A (панорекс®); анти-GpIIb/IIIa-антитела, такие как абциксимаб или c7E3 Fab (реопро®); анти-RSV-антитела, такие как MEDI-493 (синагис®); анти-CMV-антитела, такие как протовир®; анти-ВИЧ-антитела, такие как PR0542; антитела против вируса гепатита, такие как анти-Hep B-антитело оставир®; анти-CA125-антитело OvaRex; анти-идиотипическое антитело против GD3-эпитопа BEC2; анти-avP3-антитело витаксин®; антитело против почечноклеточной карциномы человека, такое как ch-G250; ING-1; антитело против 17-1A человека (3622W94); антитело против опухоли прямой и ободочной кишки (A33); антитело против меланомы человека R24, направленное против ганглиозида GD3; антитела против плоскоклеточной карциномы человека (SF-25); и антитела против лейкоцитарного антигена человека (HLA), такие как Smart ID10 и анти-HLA DR-антитело онколим (Lym-1); анти-CCR5 (PRO 140); ABT-325; ABT-308; ABT-147; анти-beta7 (этролизумаб); анти-HER3/EGFR DAF (DL11f); антитело против рецептора интерлейкина-6 (IL6R), такое как тоцилизумаб (актемра®); и анти-A-бета (см. WO 2003/070760 и WO 2008/011348) и т.д.
В одном из вариантов антитело, которое получают в виде состава по изобретению, связывает CD20 и выбрано из: ритуксимаба, окрелизумаба/гуманизированного 2H7 (Genentech), офатумумаба (WO 04/035607, Genmab, Denmark), имеющего составной каркас/гуманизированного 1F5 (WO 03/002607, Leung, S.), AME-133 (Applied Molecular Evolution) и гуманизированного A20-антитела (US 2003/0219433, Immunomedics).
В одном из вариантов антитело, которое получают в виде состава, связывает HER2 и представляет собой трастузумаб или пертузумаб.
В одном из вариантов антитело, которое получают в виде состава, связывает VEGF и представляет собой бевацизумаб.
В одном из вариантов антитело, которое получают в виде состава по изобретению, является гуманизированным антителом.
В одном из вариантов антитело, которое получают в виде состава, представляет собой рекомбинантное антитело.
В одном из вариантов антитело, которое получают в виде состава, было экспрессировано рекомбинантной клеткой яичника китайского хомячка (CHO).
В одном из вариантов антитело, которое получают в виде состава, является полноразмерным антителом.
В одном из вариантов антитело, которое получают в виде состава, является полноразмерным IgG1-антителом человека.
В одном из вариантов антитело, которое получают в виде состава, является полноразмерным гуманизированным IgG1-антителом.
В одном из вариантов антитело, которое получают в виде состава, является полноразмерным рекомбинантным гуманизированным IgG1-антителом.
В одном из вариантов антитело, которое получают в виде состава, является полноразмерным гуманизированным IgG1-антителом, которое было экспрессировано рекомбинантной клеткой яичника китайского хомячка (CHO).
В одном из вариантов антитело, которое получают в виде состава, связывает антиген, выбранный из: CD20 (например, ритуксимаб), HER2 (например, трастузумаб), VEGF (бевацизумаб), IL6R (тоцилизумаб), бета7 (этролизумаб), A-бета, HER3 и EGFR (DL11f) и M1' (47H4v5).
В одном из вариантов антителом, которое получают в виде состава, является ритуксимаб.
В одном из вариантов антителом, которое получают в виде состава, является трастузумаб.
В одном из вариантов антителом, которое получают в виде состава, является бевацизумаб.
III. Предварительно высушенный распылением состав
В настоящем изобретении обычно получают состав моноклонального антитела, который подвергают распылительной сушке, так называемый «предварительно высушенный распылением состав».
В одном из вариантов предварительно высушенный распылением состав содержит состав моноклонального антитела, который был подвергнут одной или нескольким стадиям предварительной очистки, такой как аффинная хроматография (например, хроматография на белке A), основанная на гидрофобном взаимодействии хроматография, ионообменная хроматография (анионо- и/или катионообменная хроматография), фильтрация вирусов и т.д. Таким образом, состав антитела может быть очищенным, по существу чистым и/или по существу гомогенным.
В одном из вариантов моноклональное антитело в предварительно высушенном распылением составе концентрируют. Примеры способов концентрирования антител включают фильтрацию (такую как тангенциальную проточную фильтрацию или ультрафильтрацию), диализ и т.д.
Предварительно высушенный распылением состав может быть жидким или замороженным.
Значение pH предварительно высушенного распылением состав необязательно корректируют буфером. Буфер может иметь, например, pH примерно от 4 до примерно 8, например, примерно от 5 до 7, например, от 5,8 до 6,2, и в одном из вариантов приблизительно 6,0. Гистидиновый буфер является приведенным в настоящем описании в качестве примера вариантом. Концентрация буфера диктуется, по меньшей мере, отчасти, требуемым pH. Примерные концентрации буфера составляют примерно от 1 мМ до примерно 200 мМ или примерно от 10 мМ до примерно 40 мМ.
Предварительно высушенный распылением состав необязательно также содержит один или несколько стабилизаторов, которые предотвращают денатурацию и/или агрегацию антитела в ходе процесса распылительной сушки. Примеры таких стабилизаторов включают сахариды (например, сахарозу или трегалозу) и/или поверхностно-активные вещества (например, полисорбат 20 или полисорбат 80) и/или аминокислоты (например, гистидин, аргинин, глицин и/или аланин). Стабилизаторы обычно добавляют в количестве(ах), которое защищает и/или стабилизирует моноклональное антитело при наименьшем возможном количестве стабилизатора, чтобы избежать повышения вязкости конечного состава.
Что касается сахаридных стабилизаторов, таких как дисахариды (например, трегалоза или сахароза), то молярное соотношение сахарид:моноклональное антитело (или дисахарид : моноклональное антитело) необязательно составляет примерно от 50 до примерно 400:1, например, примерно от 100 до примерно 250:1. Иначе говоря, примерные концентрации сахарида в предварительно высушенном распылением составе составляют, например, примерно от 10 мМ до примерно 1 М, например, примерно от 50 мМ до примерно 300 мМ.
Что касается поверхностно-активного вещества (если оно включено в предварительно высушенный распылением состав), то полисорбат 20 или полисорбат 80 являются примерами поверхностно-активных веществ, которые могут быть включены. Поверхностно-активное вещество обычно включают в количестве, которое снижает или предотвращает денатурацию и/или агрегацию моноклонального антитела в ходе процесса распылительной сушки. Концентрация поверхностно-активного вещества (например, полисорбата 20 или полисорбата 80) необязательно составляет примерно от 0,0001% до примерно 1,0%, например, примерно от 0,01% до примерно 0,1%.
Предварительно высушенный распылением состав может быть подвергнут распылительной сушке такими способами, которые описаны в следующем разделе.
IV. Распылительная сушка состава
Распылительная сушка по изобретению отличается от сушки вымораживанием, обычно используют для получения составов моноклональных антител, поскольку ее осуществляют при температурах выше температуры окружающей среды. Температуры распылительной сушки обычно указывают в виде температур «воздуха на впуске воздуха» и «воздуха на выпуске». В одном из вариантов распылительную сушку осуществляют при температуре воздуха на впуске примерно от 100°C до примерно 220°C (например, примерно от 120°C до примерно 160°C) и при температуре воздуха на выпуске примерно от 50°C до примерно 100°C (например, примерно от 60°C до примерно 80°C).
Способ распылительной сушки обычно включает: распыление исходного жидкого продукта; сушку капелек; и отделение или извлечение высушенного продукта.
Варианты распылителей по изобретению включают: роторные распылители, распылители с воздушным соплом, распылители с ультразвуковой форсункой, акустические форсунки и т.д.
Контакт между исходным жидким продуктом и осушающего воздуха может происходить двумя разными способами. В прямоточной системе осушающий воздух и частицы (капельки) движутся через сушильную камеру в одном и том же направлении. Когда осушающий воздух и капельки движутся в противоположных направлениях, такой способ называют противоточным способом. Частицы, получаемые в случае противоточного способа, обычно имеют более высокую температуру, чем отработанный воздух. Отработанный воздух может сам выходить из системы или может возвращаться в рециркуляцию. Выбирая различные конструкции распылительных сушилок (размер, распылитель, асептические условия и т.д.) и корректируя разные параметры процессов (поток осушающего воздуха, температура осушающего воздуха и т.д.), можно модифицировать свойства конечного порошка, такие как размер, форма и структура частиц. Если конечное содержание влаги в извлекаемом порошке не достаточно низкое, может требоваться последующая обработка, например, в форме сушилок с псевдоожиженным слоем и охладителей, контактных сушилок или даже микроволновых сушилок.
Когда распыляют исходный жидкий продукт, отношение его поверхности к массе увеличивается, теплообмен между воздухом и капельками ускоряется, и капельки могут быть высушены относительно быстро. В данный способ могут быть вовлечены два процесса конвекции: перенос тепла (от воздуха к капельке) и перенос массы влаги (от капелек к воздуху). В последнем случае влага проникает через пограничный слой, который окружает каждую капельку. На скорость переноса могут влиять температура, влажность, свойства подвижности окружающего воздуха, диаметр капелек и относительная скорость капелек и воздуха.
Последней стадией способа распылительной сушки обычно является отделение порошка от воздуха/газа и извлечение высушенного продукта. В некоторых вариантах эффективность такой стадии такова, что можно получать высокие выходы порошка и предотвращать загрязнение воздуха из-за выброса порошка в атмосферу. Для таких целей существуют различные способы, такие как способы с использованием циклонов, мешочных фильтров, электростатических устройств для осаждения, газа под высоким давлением, электростатического заряда и их сочетания.
Способ распылительной сушки позволяет получать частицы, содержащие моноклональное антитело.
В одном из вариантов характеристики высушенного распылением порошка включают любой один или несколько из следующих характеристик:
(a) средний размер частиц: примерно от 2 микрон до примерно 30 микрон; например, примерно от 2 микрон до примерно 10 микрон;
(b) морфология частиц: преимущественно сферические частицы, некоторые впадины или отверстия в частицах, форма «изюмины»;
(c) содержание воды: менее чем примерно 10%, например, менее чем примерно 5%, например, содержание воды измеряют способом химического титрования (например, способом Карла Фишера) или способом определения потери массы (нагревание при высокой температуре); и
(d) стабильность: например, оцениваемую с использованием суспендирования частиц в наполнителе и оценки физической стабильности и/или химической стабильности и/или биологической активности суспензионного состава. В одном из вариантов процентное содержание мономера в таком составе составляет от 95% до 100%, например, судя по оценке эксклюзионной хроматографией по размеру (SEC).
V. Суспензионный состав
Частицы высушенного распылением моноклонального антитела, полученные как описано в предыдущем разделе, объединяют с неводным наполнителем для суспензии для создания суспензионного состава. Такой состав подходит для введения индивиду. В общем, суспензионный состав не будет подвергаться лиофилизации или кристаллизации ни до ни после. В одном из вариантов устройство для подкожного введения (например, предварительно заполненный шприц) заполняют суспензионным составом и используют для введения состава (ниже смотри более подробное описание, имеющее отношение к устройствам и способам лечения).
Изобретение также относится к способу получения суспензионного состава, включающему суспендирование высушенного распылением моноклонального антитела в неводном наполнителе для суспензии.
В одном из вариантов концентрация антитела в суспензионном составе составляет примерно 200 мг/мл или больше.
В одном из вариантов концентрация антитела в суспензионном составе составляет примерно от 200 мг/мл до примерно 500 мг/мл.
В одном из вариантов концентрация антитела в суспензионном составе составляет примерно от 250 мг/мл до примерно 400 мг/мл.
В одном из вариантов концентрация антитела в суспензионном составе составляет примерно от 250 мг/мл до примерно 350 мг/мл.
Неводный наполнитель для суспензии, предпочтительно, имеет вязкость при 25°C, которая меньше чем примерно 20 сантипуаз, например, меньше чем примерно 10 сантипуаз и необязательно меньше чем примерно 5 сантипуаз.
Согласно одному из вариантов осуществления изобретения вязкость суспензионного состава составляет примерно от 5 до примерно 100 сантипуаз, например, примерно от 10 до примерно 70 сантипуаз при 25°C. В одном из вариантов вязкость суспензионного состава измеряют, используя реометр с системой «конус-плита» (например, реометр AR-G2 TA Instrument).
В одном из вариантов средний размер частиц в суспензионном составе составляет примерно от 2 микрон до примерно 30 микрон, например, примерно от 5 микрон до примерно 10 микрон.
В одном из вариантов суспензионный состав имеет силу трения скольжения при инъекции менее чем примерно 20 ньютонов, например, менее чем примерно 15 ньютонов. Такая сила трения скольжения при инъекции может быть определена как функция концентрации моноклонального антитела при инъекции 1 мл суспензии с использованием шприца на 1 мл через несъемную иглу толщиной 27G с тонкими стенками (TW) за 10 секунд.
В одном из вариантов неводный наполнитель для суспензии выбран из: дикаприлата/дикапрата пропиленгликоля, бензилбензоата, этиллактата или смесей двух или трех указанных наполнителей.
В одном из вариантов неводный наполнитель для суспензии содержит этиллактат.
В одном из вариантов неводный наполнитель для суспензии содержит смеси по меньшей мере двух неводных наполнителей для суспензии: наполнитель A плюс наполнитель B, при этом вязкость наполнителя A составляет меньше, чем вязкость наполнителя B, но стабильность моноклонального антитела в наполнителе B больше чем в наполнителе A. Примером варианта такой смеси является смесь этиллактата и дикаприлат/дикапрат пропиленгликоля (например).
В одном аспекте суспензионный состав содержит высушенное распылением полноразмерное моноклональное IgG1-антитело человека в концентрации примерно от 200 мг/мл до примерно 400 мг/мл, суспендированное в неводном наполнителе для суспензии с вязкостью менее чем примерно 20 сантипуаз, при этом состав имеет средний размер частиц примерно от 2 микрон до примерно 10 микрон, и силу трения скольжения при инъекции менее чем примерно 15 ньютонов.
Суспензионный состав необязательно дополнительно содержит один или несколько эксципиентов или стабилизаторов. Примеры таких стабилизаторов включают сахариды (например, сахарозу или трегалозу) и/или поверхностно-активные вещества (например, полисорбат 20 или полисорбат 80) и/или аминокислоты (например, гистидин, аргинин, глицин и/или аланин). Стабилизаторы обычно присутствуют в количестве, которое защищает и/или стабилизирует моноклональное антитело при наименьшем возможном количестве стабилизатора, чтобы избежать повышения вязкости суспензионного состава. В одном из вариантов стабилизаторы присутствуют в суспензионном составе как следствие добавления в предварительно высушенный распылением состав и/или, при желании, добавления в суспензионный состав.
Что касается сахаридных стабилизаторов, таких как дисахариды (например, трегалоза или сахароза), то молярное соотношение сахарид:моноклональное антитело (или дисахарид:моноклональное антитело) в суспензионном составе необязательно составляет примерно от 50 до примерно 400:1, например, примерно от 100 до примерно 250:1. Иначе говоря, примерные концентрации сахаридов в суспензионном составе составляют примерно от 10 мМ до примерно 1 М, например, примерно от 50 мМ до примерно 300 мМ.
Что касается поверхностно-активного вещества (если оно включено в предварительно высушенный распылением состав), то полисорбат 20 или полисорбат 80 являются примерами поверхностно-активных веществ, которые могут присутствовать в суспензионном составе. Концентрация поверхностно-активного вещества (например, полисорбата 20 или полисорбата 80) необязательно составляет примерно от 0,0001% до примерно 1,0%, например, примерно от 0,01% до примерно 0,1%.
Суспензионный состав обычно является стерильным, и стерильность может быть достигнута согласно способам, известным специалисту, для создания стерильных фармацевтических составов, подходящих для введения человеку, включая фильтрацию через стерильные мембраны для фильтрации до или после получения суспензионного состава.
Кроме того, желательно, чтобы состав представлял собой состав, который, как было показано, является стабильным при хранении. Различные анализы стабильности доступны специалисту для подтверждения стабильности состава. Стабильность можно проверить, оценивая физическую стабильность, химическую стабильность и/или биологическую активность антитела в суспензионном составе во время получения состава, а также после хранения при разных температурах и в разных временных точках. В одном из вариантов стабильность моноклонального антитела оценивают на основании распределения по размеру (процентное содержание мономера, агрегация и/или фрагментация) до и после распылительной сушки (например, до и после распылительной сушки на протяжении 3-месячного периода хранения при повышенной температуре 40°C). В одном из вариантов распределение по размеру оценивают, используя эксклюзионную хроматографию по размеру - высокоэффективную жидкостную хроматографию (SEC-ВЭЖХ). В одном из вариантов потеря содержания мономера в процентах в суспензионном составе (измеряемая с использованием SEC-ВЭЖХ) на протяжении 3 месяцев составляет менее чем примерно 10%, например, менее чем примерно 5%.
В одном из вариантов изобретение относится к способу получения фармацевтического состава, включающему получения суспензионного состава, как описано в настоящей публикации, и оценку любого одного или нескольких из следующих свойств состава:
(a) физическая стабильность, химическая стабильность и/или биологическая активность моноклонального антитела в суспензии (например, измерение процентного содержания мономера с использованием эксклюзионной хроматографии по размеру);
(b) вязкость суспензионного состава;
(c) способность проходить через иглу при инъекции или сила трения скольжения при инъекции суспензионного состава;
(d) анализ поверхностной энергии (SEA) или теплоты сорбции, например, с использованием обращенной газовой хроматографии (ОГХ), чтобы оценить взаимодействие между частицей и наполнителем для суспензии;
(e) размер частиц (например, средний размер частиц и/или размер частиц в пике, например, используя лазерный дифракционный анализатор); и/или
(e) физическая стабильность суспензии (осадок, гомогенность с течением времени, скорость седиментации частиц и т.д.).
Дополнительные подробности проведения примерных анализов указанных свойств приведены в примере ниже.
Один или несколько других дополнительных фармацевтически приемлемых носителей, эксципиентов или стабилизаторов, таких как описанные в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980), могут быть включены в состав, при условии, что они не оказывают неблагоприятного влияния на требуемые характеристики состава. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципентов в применяемых дозах и концентрациях и включают: дополнительные буферные средства; сорастворители; антиоксиданты, включая аскорбиновую кислоту и метионин; хелатирующие средства, такие как EDTA; комплексы с металлами (например, комплексы Zn-белок); биологически разрушаемые полимеры, такие как сложные полиэфиры; консерванты и/или солеобразующие противоионы, такие как натрий.
VI. Лекарственные средства и способы лечения с использованием суспензионного состава
В одном из вариантов изобретение относится к способу лечения заболевания или расстройства у индивида, включающему введение индивиду суспензионного состава, описанного в настоящей публикации, в количестве, эффективном для лечения заболевания или расстройства.
Таким образом, изобретение относится к: суспензионному составу, который описан в настоящей публикации, для лечения пациента, нуждающегося в лечении моноклональным антителом в суспензионном составе; и к применению суспензионного состава для получения лекарственного средства для лечения пациента, моноклональным антителом в суспензионном составе. В альтернативном варианте изобретение относится: к составу, который описан в настоящей публикации, для лечения заболевания или расстройства у пациента; и к применению состава для получения лекарственного средства для лечения заболевания или расстройства у пациента.
Кроме того, изобретение относится к способу лечения пациента, включающему введение состава, описанного в настоящей публикации, пациенту для лечения заболевания или расстройства у индивида. Предпочтительно, состав вводят подкожно индивиду или пациенту. В одном из вариантов состав вводят с использованием предварительно заполняемого шприца, содержащего состав.
В том случае, когда антитело в составе связывается с HER2, суспензионный состав, предпочтительно, используют для лечения злокачественной опухоли. Злокачественная опухоль обычно может содержать HER2-экспрессирующие клетки, так что HER2-антитело по изобретению может связываться со злокачественными клетками. Таким образом, изобретение в таком варианте относится к способу лечения HER2-экспрессирующей злокачественной опухоли у индивида, включающему введение фармацевтического состава HER2-антитела индивиду в количестве, эффективном для лечения злокачественной опухоли. Примерами злокачественных опухолей, подвергаемых лечению по изобретению с использованием HER2-антитела (например, трастузумаба или пертузумаба), являются HER2-позитивный рак молочной железы или рак желудка.
В том случае, когда антитело в составе связывается с маркером поверхности B-клеток, таким как CD20, состав можно применять для лечения B-клеточного злокачественного новообразования, такого как NHL или CLL, или аутоиммунного заболевания (например, ревматоидного артрита или васкулита).
В том случае, когда антитело в составе связывает VEGF (например, бевацизумаб), состав можно применять для ингибирования ангиогенеза, лечения злокачественной опухоли (например, рака прямой и ободочной кишки, немелкоклеточного рака легкого (NSCL), глиобластомы, рака молочной железы и почечноклеточной карциномы) или для лечения возрастной макулярной дегенерации (AMD) или макулярного отека.
В том случае, когда показанием является злокачественная опухоль, пациента можно лечить, используя сочетание суспензионного состава и химиотерапевтического средства. Комбинированное введение включает совместное введение или одновременное введение с использованием отдельных составов или одного фармацевтического состава и последовательное введение в любом порядке, при этом существует период времени, когда оба (или все) активные средства одновременно проявляют свои биологические активности. Таким образом, химиотерапевтическое средство можно вводить до или после введения композиции. В таком варианте период времени между по меньшей мере одним введением химиотерапевтического средства и по меньшей мере одним введением состава, предпочтительно, составляет примерно 1 месяц или меньше и, наиболее предпочтительно, примерно 2 недели или меньше. Альтернативно химиотерапевтическое средство и состав вводят пациенту одновременно в одном составе или отдельных составах.
Лечение суспензионным составом будет приводить к улучшению признаков или симптомов заболевания или расстройства. Кроме того, лечение сочетанием химиотерапевтического средства и состава антитела может приводить к синергетическому или более чем аддитивному полезному терапевтическому эффекту у пациента.
Состав вводят больному человеку известными способами, таким как внутривенное введение, например, в виде болюса или в виде непрерывной инфузии в течение определенного периода времени, путем внутримышечного, внутрибрюшинного, интрацереброспинального, подкожного, внутрисуставного, интрасиновиального или интратекального введения.
Внутримышечное или подкожное введение композиции антитела является предпочтительным, при этом подкожное введение является наиболее предпочтительным.
В случае подкожной доставки состав можно вводить через шприц (например, предварительно заполненный шприц); автоинжектор; устройство для инъекции (например, устройство INJECT-EASETM и GENJECTTM); шприц-ручку (такую как GENPENTM); или другое устройство, подходящее для введения суспензионного состава подкожно. Предпочтительным устройством по изобретению является предварительно заполненный шприц.
В случае профилактики или лечения заболевания подходящая доза моноклонального антитела будет зависеть от типа заболевания, подвергаемого лечению, которое определено выше, тяжести и хода течения заболевания, от того, вводят ли моноклональное антитело в профилактических или терапевтических целях, предыдущей терапии, истории болезни пациента и его ответа на моноклональное антитело и от выбора лечащего врача. Антитело вводят соответствующим образом пациенту один раз или на протяжении серии лечебных процедур. В зависимости от типа и тяжести заболевания примерно от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) антитела является начальной дозой, выбираемой для введения пациенту, при использовании, например, либо одного, либо нескольких отдельных введений, либо непрерывной инфузии. Доза антитела, как правило, будет составлять примерно от 0,05 мг/кг до примерно 10 мг/кг. Если вводят химиотерапевтическое средство, его обычно вводят в известных для него дозах или необязательно более низких дозах вследствие комбинированного действия лекарственных средств или негативных побочных эффектов, присущих введению химиотерапевтического средства. Можно использовать получение и схемы дозирования таких химиотерапевтических средств, соответствующие инструкциям производителя или определяемые эмпирически специалистом. Получение и схемы дозирования таких химиотерапевтических средств также описаны в Chemotherapy Service Ed., M.C. Perry, Williams and Wilkins, Baltimore, MD (1992).
VII. Изделия
Изобретение, описанное в настоящей публикации, также относится к устройству, содержащему суспензионный состав. Предпочтительно, устройство представляет собой устройство для подкожного введения, такое как предварительно заполненный шприц.
В связанном аспекте изобретение относится к получению изделия, включающему заполнение емкости суспензионным составом.
Варианты емкости в изделии включают: шприцы (такие как предварительно заполненный шприц), автоинжекторы, бутылки, флаконы (например, двухкамерные флаконы) и пробирки и т.д. В емкости находится суспензионный состав, и на ярлыке, находящемся на емкости или ассоциированном с емкостью, могут быть указаны направления применения. Изделие дополнительно может содержать другие материалы, необходимые с коммерческой точки зрения и с точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями по применению, которые указаны в предыдущем разделе.
Изобретение можно более полно понять при обращении к следующим примерам. Однако их не следует рассматривать как ограничивающие объем изобретения. Все указанные публикации и патенты включены в настоящее описание в виде ссылки.
ПРИМЕРЫ
При разработке высококонцентрированных жидких составов моноклональных антител (≥200 мг/мл) для подкожного (п/к) введения часто сталкиваются с проблемой повышенной вязкости, которая затрудняет инъекцию. Настоящее исследование предназначено для преодоления такой сложности с использованием способа, основанного на неводной суспензии порошка. Три моноклональных IgG1-антитела человека подвергали распылительной сушке и суспендировали в наполнителе для суспензии при разных концентрациях моноклонального антитела. Дикаприлат/дикапрат пропиленгликоля, бензилбензоат и этиллактат использовали в качестве модельных наполнителей для суспензии. Суспензии характеризовали в отношении вязкости, размера частиц и проходимости через шприц. Физическую стабильность исследовали визуально. Суспензии, в общем, превосходят жидкие растворы в отношении способности проходить через иглу при инъекции, несмотря на более высокую вязкость при одних и тех концентрациях моноклонального антитела. Получение порошков и свойства порошков, по-видимому, мало влияют на вязкость суспензии или ее способность проходить через иглу при инъекции. При сравнении трех наполнителей для суспензии содержащие этиллактат суспензии имели наименьшую вязкость, ниже 20 сантипуаз, и наименьшую силу трения скольжения при инъекции через шприц, ниже 15 ньютонов, при такой высокой концентрации моноклонального антитела как 333 мг/мл (общая концентрация порошка 500 мг/мл). Анализ суспензии с использованием обращенной газовой хроматографии (ОГХ) подтвердил вывод о том, что наполнитель для суспензии является наиболее важным фактором, влияющим на качество суспензии. Этиллактат обеспечивал большую теплоту сорбции, чем другие наполнители для суспензии. Не имея намерения быть связанными с какой-либо теорией, полагают, что полученные данные свидетельствуют о том, что сильное взаимодействие между частицами и наполнителем для суспензии может уменьшать самоассоциацию частиц (частица-частица), приводя к более низкой вязкости и силе трения скольжения суспензии. Однако содержащие этиллактат суспензии не имели такой физической стабильности суспензии, которую наблюдали в случае дикаприлата/дикапрата пропиленгликоля и бензилбензоата. Специальные смеси этиллактата и дикаприлата/дикапрата пропиленгликоля улучшали общее качество суспензии в случае высококонцентрированных суспензий моноклональных антител.
Наряду с прочим, приведенные примеры продемонстрировали приемлемость высокой концентрации моноклонального антитела (>300 мг/мл) в суспензионных составах для подкожного введения.
МАТЕРИАЛЫ И СПОСОБЫ
Три рекомбинантных химерных/гуманизированных моноклональных антитела человека IgG1-подкласса бевацизумаб, трастузумаб и ритуксимаб были произведены Genentech (South San Francisco, CA). Три антитела были экспрессированы в линиях клеток китайского хомячка (CHO). Все жидкие растворы лекарственной субстанции антитела концентрировали до 100 мг/мл, используя устройство для фильтрации в тангенциальном потоке (PELLICON3®, 10 Д, Millipore, Billerica, MA) и получали композиции с использованием дигидрата трегалозы. Все нефасованные объемы забуферивали до pH ~6,0. В случае суспензионного состава порошкового антитела использовали дикаприлат/дикапрат пропиленгликоля (партия №091125, SASOL, Hamburg, Germany), бензилбензоат (№ в каталоге B9550, Sigma-Aldrich, St. Loius, MO) и этиллактат (партия № BCBC7752, Sigma-Aldrich, St. Louis, MO) в качестве наполнителей для суспензии.
Распылительная сушка
В настоящем исследования использовали два типа распылительных сушилок, устройство полупромышленного масштаба (MS-35, SPX Flow Technology Systems, Inc., Elkridge, MD) и устройство лабораторного масштаба (B-191, Buchi Corp., New Castle, DE). MS-35 имеет приблизительно в 2 раза более высокую производительность, чем B-191, т.е. максимальную скорость испарения воды 2,5 против 1,6 кг/час и максимальная скорость расхода сжатого воздуха 35 против 20 кг/час. Устройство полупромышленного масштаба было сконструировано, главным образом, из нержавеющей стали с теплоизоляцией (сушильная камера, циклон и т.д.), тогда как лабораторное устройство было изготовлено из стекла. Полупромышленное устройство было оборудовано высокоэффективным циклоном. Чтобы рассчитать выход собираемого порошка, в случае полупромышленного устройства учитывали только порошок, собранный в приемнике, в случае лабораторного устройства включали порошок, собранный на циклоне и на крышке приемника. Условия распылительной сушки и характеристики сухих порошков, полученных с использованием обеих распылительных сушилок, перечислены в таблице 2.
Условия распылительной сушки в распылительных сушилках двух типов и результаты характеристики трех антител, полученных в виде композиций с трегалозой в массовом соотношении 1:2 антитело:трегалоза
Лиофильная сушка
Растворы моноклонального антитела также подвергали лиофильной сушке, чтобы сравнить стабильность в сухом состоянии с высушенными распылением образцами. Брали аликвоты жидких составов объемом 1 мл в стеклянные флаконы 2 см3 с бутиловыми пробками, затем помещали на предварительно охлажденные пробки при -50°C в лиофилизаторе (модель № LYOMAX2®, BOC Edward, Tewksbury, MA). Образцы сушили, понижая давление до 100 мТорр и увеличивая температуру на полке до -25°C в ходе первичной сушки с последующей вторичной сушкой при 35°C. Общее время цикла лиофилизации составляло приблизительно 60 часов.
Анализ размера частиц
Распределение по размеру частиц измеряли, используя лазерный дифракционный анализатор (LA-950, Horiba Instruments, Kyoto, Japan). LA-950 состоит из двух источников света (синего LAD, красного лазера), системы подачи пробы для регулирования взаимодействия частиц и падающего света и матрицы фотодиодов высокого качества для детекции рассеянного света в широком диапазоне углов. Рассеянный свет, собранный на детекторах, использовали для вычисления распределения по размеру частиц в образце, анализируемого с использованием теории Ми. В случае высушенных распылением образцов несколько миллиграмм сухих порошков диспергировали в 50 мл изопропилового спирта в ячейке MiniFlow, соединенной с LA-950 и обрабатывали ультразвуком, используя устройство для обработки ультразвуком, также соединенное с LA-950, в течение примерно одной минуты перед анализом. В случае частиц, суспендированных в наполнителях, их разбавляли в каждом наполнителе в FractionCell и перемешивали, используя мешалку, соединенную с LA-950, перед анализом.
Анализ плотности
Плотность порошка определяли, смешивая 500 мг порошка в 4 мл масла дикаприлата/дикапрата пропиленгликоля в мерном цилиндре и измеряя вытесняемый объем масла в качестве показателя объема порошка. Плотность порошка можно вычислить, используя массу и объем порошка.
Сканирующая электронная микроскопия
Морфологию поверхности высушенных распылением образцов исследовали, используя сканирующий электронный микроскоп с режимом естественной среды (XL30, FEL, Hillsboro, OR). Каждый образец устанавливали на алюминиевых стойках и покрывали путем напыления 10-нм слоем AuPd, и сканировали при напряжении 2 кВ, и фотографии делали при увеличениях 1000 и 2000.
Анализ содержания воды
Остаточную влагу в высушенных распылением образцах определяли, используя анализатор, основанный на волюметрическом титровании по Карлу Фишеру (DL31, Mettler-Toledo). Примерно 100 мг каждого образца инъецировали в ячейку титрования, которая содержала безводный метанол. Использовали реагент для волюметрического титрования гидранал композит 2 (№ в каталоге 34696, Hiedel-deHaen, Heidelberg, Germany) в качестве титранта.
Эксклюзионная хроматография по размеру
Количественную оценку вариантов по размеру проводили, используя эксклюзионную хроматографию по размеру. В таком анализе использовали колонку G3000SWXL, 7,8 мм (внутренний диаметр) × 30 см, 5 мкм (TOSOH Bioscience) в системе ВЭЖХ (1100, Agilent). Подвижные фазы представляли собой 0,2 М фосфат калия и 0,25 М хлорид калия, pH 6,2, в случае бевацизумаба, 0,1 М фосфат калия с pH 6,8 в случае трастузумаба и 0,2 М фосфат калия и 0,25 М хлорид калия с pH 7,0 в случае ритуксимаба. Хроматографию проводили в изократическом режиме с расходом 0,5 мл/мин в течение 30 минут. Температуру колонки поддерживали на уровне температуры окружающей среды в случае бевацизумаба и ритуксимаба и при 30°C в случае трастузумаба, и оптическую плотность элюента определяли при 280 нм. Каждое моноклональное антитело разбавляли соответствующим буфером для состава до 25 мг/мл в случае бевацизумаба и 10 мг/мл в случае трастузумаба и ритуксимаба. Инъецируемый объем составлял 10 мкл в случае бевацизумаба и 20 мкл в случае трастузумаба и ритуксимаба.
Физическая стабильность моноклональных антител в высушенных распылением и лиофильно высушенных порошковых составах
Отбирали аликвоты образцов высушенных распылением и лиофильно высушенных порошков в стеклянные флаконы объемом 2 см3, приблизительно 25 моноклонального антитела. Каждый флакон герметично закрывали резиновой пробкой и колпачком FLIP-OFF® и хранили при 40°C в течение периода времени до 3 месяцев. Во временных точках определения стабильности: нулевое время (сразу после сушки), 1, 2, 3 месяца, каждый сухой образец перерастворяли в 1 мл очищенной воды, и определяли физическую стабильность антител по распределению размера белка (% мономера, агрегация и фрагментация), используя SEC-ВЭЖХ.
Получение суспензионных составов
Порошок отвешивали во флакон объемом 2 мл. На основании определенной плотности порошка добавляли соответствующее количество наполнителя для суспензии, чтобы получить концентрацию порошка в единицах, выраженных в мг порошка в 1 мл объема суспензии. Затем образцы гомогенизировали в течение 2 минут при 7500 об./мин, используя 0,5-см зонд с наконечником, на гомогенизаторе Tempest Virtishear (Virits Corp, Gardiner, NY).
Измерение вязкости
Вязкость образцов растворов и суспензий измеряли, используя реометр с системой «конус-плита» (AR-G2 TA Instrument, New Castle, DE). Каждый образец загружали на нижнюю измерительную плиту и обеспечивали возможность для установления теплового равновесия при 25°C. Использовали ловушку для растворителя, которой был оборудован прибор AR-G2, чтобы предотвратить испарение раствора при измерении. Вязкость образца измеряли каждые 10 секунд в течение 2 минут, используя конус с диаметром 20 мм и углом 1 градус со скоростью сдвига 1000 в секунду.
Измерение силы трения скольжения в шприце
Один миллилитр суспензии набирали в шприц на 1,0 мл с несъемной TW-иглой с толщиной 27G ½” (BD, Franklin Lakes, NJ), герметично закрываемый ограничителем плунжера (W4023/FLT, West Pharmaceutical, Lionville, PA). Внутренний цилиндр шприца покрывали 0,5 мг силиконового масла (Dow 360 Medical Fluid, 1000 сСт). Использовали систему тестирования материалов (модель 5542, Instron, Grove City, PA) с датчиком напряжения для обеспечения постоянной скорости сжатия 190 мм/мин. Анализировали профиль силы трения скольжения и определяли как функцию расстояния штока плунжера, перемещаемого внутри цилиндра шприца.
Обращенная газовая хроматография (ОГХ)
Эксперимент, основанный на ОГХ, осуществляли, используя систему анализа поверхностной энергии (SEA) (MSM-ОГХ 2000, Surface Measurement Services Ltd, Allentown, PA). Примерно 200 мг образца порошка упаковывали в отдельные силанизированные стеклянные колонки и оба конца колонок герметично закрывали, используя силанизированную стекловату, чтобы предотвратить движение образца. Удельную площадь поверхности образцов порошка определяли, измеряя изотермы адсорбции из октана при 30°C и 0% относительной влажности в результате ОГХ-SEA. Затем вычисляли удельные площади поверхности образцов способом БЭТ на основании их соответствующих изотерм в октане в определенном диапазоне парциального давления (от 10% до 35% P/P0). Декан, нонан, октан и гептан использовали в качестве алкановых зондов для определения дисперсионной поверхностной энергии. Также измеряли удельную свободную энергию Гиббса по кислотно-основной составляющей, используя ацетон, ацетонитрил, этанол и этилацетат. В случае измерения теплоты сорбции наполнители для суспензии использовали в качестве газообразных зондов. Все образцы предварительно обрабатывали in-situ газом-носителем гелием при 30°C в течение 2 часов, и все измерения проводили при 30°C, используя расход газа-носителя 10 см3/сек.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Порошки высушенного распылением антитела/трегалозы
Три типа моноклональных антител получали в виде композиций в жидких растворах, содержащих трегалозу, служащую в качестве углеводного стабилизатора для моноклонального антитела, в массовом соотношении 1:2 трегалоза : антитело, перед распылительной сушкой. Такое низкое массовое соотношение эквивалентно молярному соотношению приблизительно 220:1 и использовано в целях минимизации ее вклада в объем, что было ниже минимального молярного соотношения 300:1, обычно используемого в случае сахара, применяемого с целью стабилизации белков в качестве лиопротектора (Shire с соавторами, J. Pharm. Sci. 93: 1390-1402 (2004)). Следует отметить, что суспензия 400 мг порошка/мл соответствует концентрации антитела 270 мг/мл даже при массовом соотношении 1:2 трегалоза : антитело, что является нижним пределом целевой концентрации антитела для данного исследования.
Три моноклональных антитела, полученных в концентрации 100 мг/мл с 50 мг/мл трегалозы, сушили распылением, используя лабораторную распылительную сушилку (B-191) и полупромышленную сушилку (MS-35). Условия распылительной сушки и результаты характеристики порошка суммированы в таблице 2. Сопоставимые температуры на выпуске, 87-89°C, использовали для всех образцов, так как температуру на выпуске считается ключевым параметром, определяющим производительность распылительной сушки (Maa et al., Pharm Dev Technol 2:213-223 (1997); Lee G. Spray Drying of Proteins, in "Rational Protein Formulation: Theory and Practice" (Eds. Carpenter J, Manning M), Pharmaceutical Biotechnology Series (Ed. Borchardt R). Plenum Press, pp. 135-158 (2002); Maury et al. Eur. J. Pharm. Biopharm. 59:566-573 (2005); Maa et al. Biotech. Bioeng. 60:301-309 (1998); and Maa et al. J. Pharm. Sci. 87:152-159 (1998)). Характеристики полупромышленной распылительной сушилки были лучше в отношении выхода собираемого порошка (>96%) и содержания воды 4-5%, тогда как образцы, высушенные в лабораторной сушилке имели выход 60% содержание воды 7-9%. Полупромышленная сушилка также была способна давать более крупные частицы 8-11 мкм (D50), тогда как лабораторная сушилка давал частицы 2-5 мкм (D50). Преимущества полупромышленной сушилки могут быть обусловлены эффективным использованием энергии и более высокой эффективностью сбора порошка. Форма и морфология частиц всех антител в большинстве случаев соответствовали сферической форме с углублениями, которые зависели от антитела. Тип распылительной сушки не влиял на морфологию частиц. В общем, характеристики сушилки и тип антитела в определенной степени приводили к вариациям свойств частиц. Хотя такие вариации не являются критическими, они позволили авторам оценить их влияние на характеристики суспензии.
Физическая стабильность антител в высушенных распылением и лиофильно высушенных порошковых составах
Основной вызывающей опасения проблемой при распылительной сушке биологических объектов был высокотемпературный стресс, особенно в случае полупромышленной сушки, которая имеет более высокую температуру на впуске >180°C. Физическую стабильность антител в сухих образцах определяли при перерастворении в очищенной воде по распределению размера белка (% мономера, агрегация и фрагментация), используя SEC-ВЭЖХ до и после распылительной сушки на протяжении 3-месячного периода хранения при повышенной температуре 40°C (фигура 1). Несмотря на высокую температуру сушки, используемую в полупромышленной распылительной сушилке, влияние процесса сушки на содержание (%) мономера было минимальным. Сравнивали физическую стабильность антител в случае высушенных распылением бевацизумаба и трастузумаба с лиофильно высушенными аналогами, наблюдая за изменением содержания (%) мономера при 40°C в течение 3 месяцев. Содержание (%) мономера в случае всех образцов снижалось в ускоренных условиях хранения, главным образом, вследствие агрегация, что не является неожиданным, учитывая субоптимальное количество трегалозы для защиты антитела в составе. Однако высушенные распылением образцы имели более высокую физическую стабильность антитела, чем лиофильно высушенные образцы. Содержание (%) мономера в случае высушенных распылением трастузумаба и бевацизумаба снижалось на ~2% и ~4%, соответственно, тогда как в случае обоих лиофильно высушенных антител наблюдали большую потерю содержания (%) мономера ~6,5% в течение 3 месяцев, несмотря на более низкое содержание воды в них ~0,8%. Таким образом, распылительная сушка является целесообразным способом, с точки зрения процесса и стабильности, для получения порошков антител для разработки суспензионных составов.
Выбор наполнителя для суспензий
Основным критерием для выбора наполнителя для суспензии была низкая вязкость, предпочтительно, <10 сП, так как вязкость наполнителя для суспензии может вносить вклад в вязкость суспензии линейным образом на основании уравнения Эйнштейна для вязкости растворов (Einstein, A., Annalen der Physik. 34: 591-92 (1911)).
η=η0(1+2,5ϕ) (уравнение 2)
где η означает вязкость суспензии, η0 означает вязкость чистого наполнителя для суспензии, и ϕ означает объемную долю растворенного вещества.
Три наполнителя для суспензии, выбранные для данного исследования, дикаприлат/дикапрат пропиленгликоля, бензилбензоат и этиллактат удовлетворяют такому критерию (таблица 3). Миглиол 840® представляет собой сложные диэфиры пропиленгликоля и каприловой и каприновой кислот из семейства нейтральных масел миглиол®. Миглиол 810® и миглиол 812® были одобрены для внутривенных и внутримышечных инъекций, но они являются вязкими, >30 сП, при температуре окружающей среды. Дикаприлат/дикапрат пропиленгликоля, наименее вязкий представитель в семействе (~9 сП), использовали в случае трансдермального применения (Mahjour et al., Intl. J. Pharm. 95: 161-169 (1999); Seniro, W., Intl. J. Toxicol. 18: 35-52 (1999)). Бензилбензоат сходен с дикаприлатом/дикапратом пропиленгликоля по вязкости, ~9 сП, и его часто использовали в качестве консерванта в жидких инъекционных составах в концентрации <10%. Этиллактат широко использовали в фармацевтических составах, пищевых добавках и ароматизаторах в связи с его относительно низкой токсичностью. Хотя этиллактат до сих пор не утвержден для парентерального применения, он обладал низкой токсичностью у мышей в случае внутримышечной и внутривенной инъекции (Spiegel and Noseworthy, J Pharm Sci 52:917-927 (1963); Mottu et al., PDA J. Pharm. Sci. Technol. 54:456-469 (2000)). Этиллактат имеет вязкость, сходную с вязкостью воды, ~2 сП.
Структура, вязкость и информация о фармацевтическом применении трех модельных наполнителей для суспензии, тестированных в данном исследовании
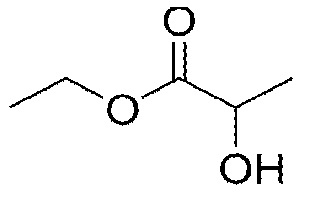
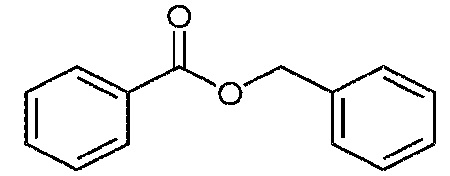
Влияние типа антитела и свойств порошка на вязкость суспензии
Все антитела, высушенные как с использованием лабораторной, так и с использованием полупромышленной сушилки (таблица 2), суспендировали в дикаприлате/дикапрате пропиленгликоля. Вязкость суспензии измеряли как функцию концентрации антитела и сравнивали с жидкими растворами антител (фигура 2). Вязкость суспензии всех антител была сходной в тестированном диапазоне концентраций антител, что свидетельствует о том, что варьирование типов антител и свойств порошков (размера частиц, морфологии и содержания влаги) мало влияло на вязкость суспензии. Вязкость суспензии возрастала с увеличением концентрации антитела в экспоненциальной зависимости, что можно выразить в виде:
ηмиглиол 840=8,24e0,0088(концентрация порошка) (уравнение 3)
Конечно оно сильно отличается от уравнения Эйнштейна (уравнения 2), которое, в основном, относится к разбавленным суспензиям. В уравнении 4, модифицированном варианте уравнения 2, принимают в расчет взаимодействия в случае более концентрированных суспензий (Kunitz, M., J. General Physiology pages 715-725 (July 1926)), однако оно все еще в значительной степени занижает эмпирические данные (см. пунктирную линию на фигуре 2).
η/η0=(1+0,5ϕ)/(1-ϕ)4 (уравнение 4)
Было интересно обнаружить, что вязкость суспензии фактически была выше, чем вязкость соответствующего жидкого раствора антитела при одной и той же концентрации антитела. Не наблюдали различия в вязкости суспензий среди разных антител, хотя тип антитела в значительной степени влиял на вязкость жидкости.
Поверхностная энергия высушенных распылением порошков по данным ОГХ
Kanai с соавторами (Kanai et al., J. Pharm. Sci. 97:4219-4227 (2005)) обнаружили обратимую самоассоциацию в результате Fab-Fab-взаимодействий в исследовании вязкости, в котором тестировали два антитела, полученные из одной и той же конструкции с разными аминокислотными последовательностями в определяющей комплементарность области (CDR), в водных растворах. Различий в вязкости из-за типа антитела в суспензиях порошков в неводных наполнителях не наблюдали (фигура 2). Такое наблюдение можно интерпретировать с точки зрения распределения поверхностной энергии частиц в суспензии порошка. Поверхностная энергия частиц, сочетание полярных и неполярных (дисперсионных) компонентов энергии, могут определять уровень взаимодействий с наполнителями для суспензии и частицами. ОГХ является широко используемым средством измерения поверхностной энергии. Измеряли дисперсионную поверхностную энергию частиц, используя декан, нонан, октан и гептан в качестве зондов, а также удельную свободную энергию Гиббса по кислотно-основной составляющей (полярной), используя ацетон, этилацетат, этанол и ацетонитрил в качестве зондов. Поверхностная энергия представлена распределением в ответ на распределение размера частиц в образце порошка, но в таблице 4 приведена только поверхностная энергия при значениях 50%. Дисперсионная поверхностная энергия, γ50, была в узком диапазоне от 36 до 38 мДж/м2 для всех трех антител. Различия в удельной свободной энергии Гиббса по кислотно-основной составляющей (полярной), ΔG50, таких антител при использовании четырех кислотно-основных зонда также были в узком диапазоне от 8 до 13 мДж/м2. Сравнимое распределение поверхностной энергии в трех порошках антител можно объяснить сходными взаимодействиями частицы и наполнителя для суспензии и взаимодействиями частица-частица, приводящими к сравнимой вязкости их суспензий в дикаприлате/дикапрате пропиленгликоля (фигура 2).
Дисперсионная поверхностная энергия (γ50), удельная свободная энергия Гиббса по кислотно-основной составляющей (ΔG50) и теплота сорбции высушенных распылением порошков моноклональных антител (все измерения с использованием ОГХ)
дикапрат пропиленгликоля
дикапрат пропиленгликоля
Способность суспензий в трех наполнителях проходить через иглу при инъекции
Способность проходить через иглу при инъекции можно оценивать на основе измерения силы трения скольжения, которая является более значимым показателем качества, чем измерение вязкости. Силу трения скольжения суспензии порошка ритуксимаба в трех наполнителях определяли в зависимости от концентрации антитела при инъекции 1 мл суспензии с использованием шприца на 1 мл через несъемную тонкостенную иглу толщиной 27G в течение 10 секунд (фигура 3). Сила трения скольжения всех суспензий возрастала с повышением концентрации антитела, однако она была ниже 20 N даже при концентрации антитела 200 мг/мл, несмотря на высокую вязкость (фигура 2). Рассчитанная сила трения скольжения для жидких растворов антител, взятая с фигуры 4 из публикации 3, была выше, чем сила трения скольжения суспензии. Сила трения скольжения суспензии в этиллактате была наименьшей среди трех тестированных наполнителей для суспензии. Сила трения скольжения суспензии в этиллактате при концентрации 333 мг антитела/мл была эквивалентна силе терния скольжения в двух других наполнителях для суспензии примерно при половинной концентрации антитела (167 мг/мл), которая все еще была ниже целевого порога 15 ньютонов, даже при высокой концентрации антитела 333 мг/мл. Причины несоответствия взаимосвязи вязкость-сила трения скольжения между жидким раствором и суспензией не ясны.
Влияние наполнителя для суспензии на вязкость суспензии
Вязкость суспензии тестировали в трех наполнителях, содержащих высушенный распылением порошок ритуксимаба (фигура 4). Вязкость в этиллактате была наименьшей среди трех наполнителей; вязкость суспензии в этиллактате при концентрации 333 мг антитела/мл была эквивалентна вязкости суспензии в дикаприлате/дикапрате пропиленгликоля и бензилбензоате примерно при половинной концентрации антитела (167 мг/мл).
Теплота сорбции по данным ОГХ и размер частиц
Теплота сорбции (ΔHсорбции) является непосредственной мерой силы взаимодействий между молекулами твердого вещества и молекулами газа, адсорбированными на поверхности (Thielmann F., “Inverse gas chromatography: Characterization of alumina and related surfaces,” In “Encyclopedia of Surface and Colloid Science Volume 4 (edit by P. Somasundaran) CRC Press, Boca Raton, FL., p3009-3031 (2006); Thielmann and Butler, “Heat of sorption on microcrystalline cellulose by pulse inverse gas chromatography at infinite dilution,” Surface Measurement Services Application Note 203 (http://www.thesorptionsolution.com/Information_Application_Notes_IGC.php#Aps) (2007)).
Применяли способ ОГХ для измерения теплоты сорбции между высушенными распылением частицами и наполнителями для суспензии (таблица 4). В случае бевацизумаба и ритуксимаба суспензии в этиллактате имели более высокую теплоту сорбции, чем в других двух наполнителях для суспензии. Размеры частиц в случае частиц в суспензии также были сравнимы в трех суспензиях (фигура 5). Размер частиц в пике (наибольшее процентное содержание) составлял 28, 25 и 7 мм в случае дикаприлата/дикапрата пропиленгликоля, бензилбензоата и этиллактата, соответственно. Данные о теплоте сорбции и размере частиц показывают, что более высокая теплота сорбции в суспензиях в этиллактате свидетельствует о более сильном взаимодействии между частицей и наполнителем для суспензии, чем взаимодействие частица-частица, и что степень самоассоциации частиц в этиллактате была ниже, чем в дикаприлате/дикапрате пропиленгликоля или бензилбензоате.
Физическая стабильность суспензии
Несмотря на низкую вязкость и силу трения скольжения в суспензии в этиллактате, он обеспечивает необычную физическую стабильность суспензии с течением времени. Порошок в суспензии в этиллактате оседал на дно и всплывал на поверхность суспензии после хранения в течение 1 дня в условиях окружающей среды (фигура 6A). Гомогенность суспензии в этиллактате может быть восстановлена посредством встряхивания (фигура 6B). Напротив, физическая стабильность суспензии в дикаприлате/дикапрате пропиленгликоля была намного более высокой и суспензия оставалась хорошо суспендированной в течение двух недель (фигура 6C).
В соответствии со скоростью седиментации частиц, определяемой согласно закону Стокса (уравнение 4 ниже), частицы в этиллактате могут оседать приблизительно в 4,5 раза быстрее, чем в дикаприлате/дикапрате пропиленгликоля, на основании плотности и вязкости этиллактата и дикаприлата/дикапрата пропиленгликоля, 1,03 г/см3 и 0,92 г/см3, и 2 сП и 9 сП, соответственно. Таким образом, только закон Стокса не может полностью объяснить наблюдаемое чрезвычайно быстрое оседание частиц в этиллактате, по сравнению с дикаприлатом/дикапратом пропиленгликоля, что свидетельствует о том, что могут играть роль другие механизмы, такие как поверхностный электрический заряд (т.е., дзета-потенциал). Однако явление всплывания некоторых частиц вверх на поверхность этиллактата трудно объяснить, так как плотность высушенных распылением частиц выше, чем этиллактата.
s=d(ρs-ρl)g/(18η) (уравнение 5)
где s означает скорость седиментации, d означает диаметр частицы, ρs означает плотность частицы, ρl означает плотность наполнителя для суспензии, g означает ускорение сводного падения, и η означает вязкость наполнителя для суспензии.
Смесь наполнителей для суспензии для улучшения качества суспензии
Смеси этиллактата и дикаприлата/дикапрата пропиленгликоля использовали в качестве наполнителей для суспензии для тестирования физической стабильности суспензии ритуксимаба. Определяли размер частиц в случае таких смешанных суспензий (фигура 7A). Размер частиц уменьшался с уменьшением вклада дикаприлата/дикапрата пропиленгликоля в смесь, при этом размер частиц в пике составлял 28, 13, 11, 8 и 7 мкм в случае смеси дикаприлат/дикапрат пропиленгликоля:этиллактат в соотношении 100:0, 75:25, 50:50, 25:75 и 0:100, соответственно. С точки зрения физической стабильности суспензии плохая стабильность в суспензии этиллактата была улучшена при смешивании с небольшим количеством дикаприлата/дикапрата пропиленгликоля, как показано на фигуре 7B, при этом гомогенная суспензия сохранялась в случае порошка ритуксимаба в смеси 25:75 дикаприлата/дикапрата пропиленгликоля:этиллактата после 2-недельного хранения в условиях окружающей среды. Было показано, что общие показатели суспензии могут быть улучшены с использованием смеси наполнителей для суспензии.
ЗАКЛЮЧЕНИЕ
Приведенные примеры показали, что неводную суспензию порошка можно применять для подкожного введения высокой концентрации моноклонального антитела. Получение сухого порошка с использованием распылительной сушки был масштабируемым при использовании высокоэффективного способа распылительной сушки. Было определено, что наиболее важным параметром общего качества суспензии является тип наполнителя для суспензии. Суспензия порошка в этиллактате имела превосходную способность проходить через иглу при инъекции с низкой силой трения скольжения < 15 N через несъемную тонкостенную иглу толщиной 27G в случае концентрации антитела до 333 мг/мл (общая концентрация порошка 500 мг/мл). Не имея намерения быть связанными с какой-либо теорией, полагают, что низкая вязкость и способность проходить через иглу при инъекции может быть обусловлена сильным взаимодействием между частицей и наполнителем для суспензии, которое предотвращает агломерацию частиц между собой с образованием частиц более крупного размера в суспензии. Однако такой механизм не поддерживает физическую стабильность суспензии. Сухие частицы антитела проявляли более высокую тенденцию к оседанию в суспензии в этиллактате, чем в дикаприлате/дикапрате пропиленгликоля. Способ, основанный на использовании смеси наполнителей для суспензии, оказался эффективным для улучшения общих показателей суспензии.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫСОКОКОНЦЕНТРИРОВАННЫЕ СОСТАВЫ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ | 2013 |
|
RU2827884C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕСЯ С ТИМУСНЫМ СТРОМАЛЬНЫМ ЛИМФОПОЭТИНОМ (TSLP), И СПОСОБЫ ПРИМЕНЕНИЯ ТАКИХ МОЛЕКУЛ | 2016 |
|
RU2731644C2 |
| НОВЫЕ РАДИОИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2560587C9 |
| ПРИМЕНЕНИЕ АНТИ-CD40-АНТИТЕЛ | 2006 |
|
RU2442606C2 |
| Новые радиоиммуноконъюгаты и их применения | 2011 |
|
RU2664475C1 |
| ПОРОШКОВЫЕ БЕЛКОВЫЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2537139C2 |
| Готовые к применению лекарственные формы для инъекций | 2020 |
|
RU2777360C1 |
| ОЧИСТКА АНТИТЕЛ С ПОМОЩЬЮ КАТИОНООБМЕННОЙ ХРОМАТОГРАФИИ | 2008 |
|
RU2498991C2 |
| АНТИ-CD40-АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2012 |
|
RU2609647C2 |
| СОСТАВЫ НА ОСНОВЕ АНТИТЕЛА | 2017 |
|
RU2769326C2 |



















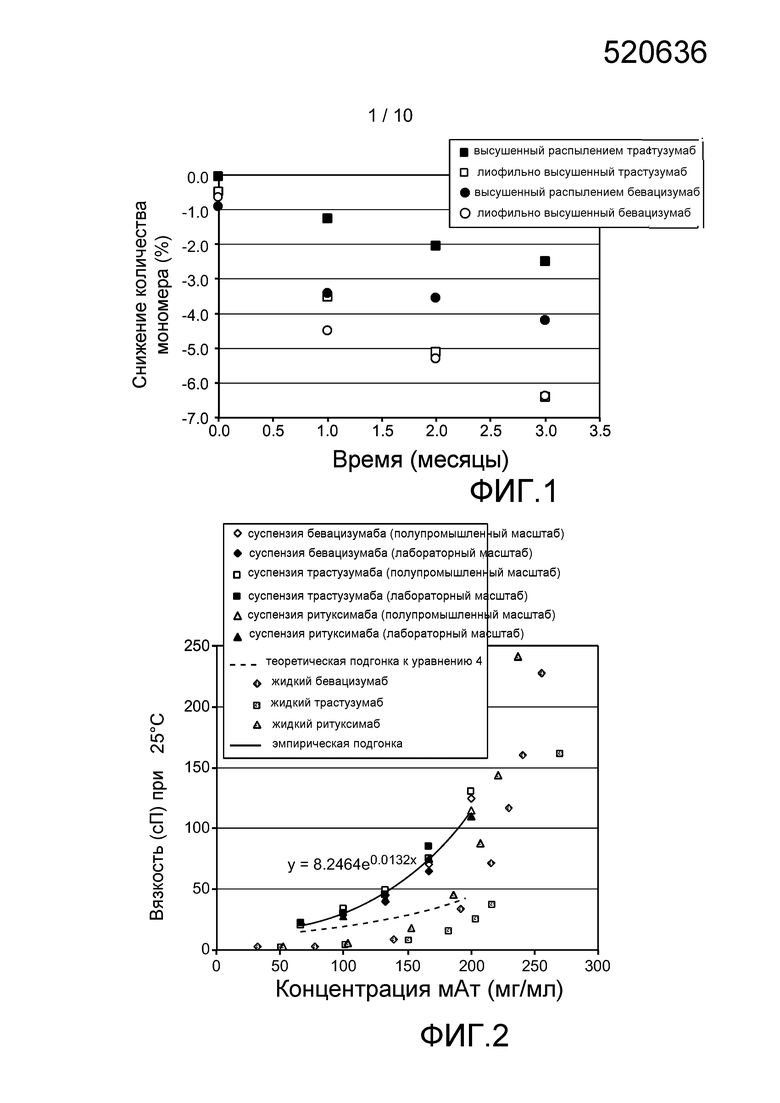
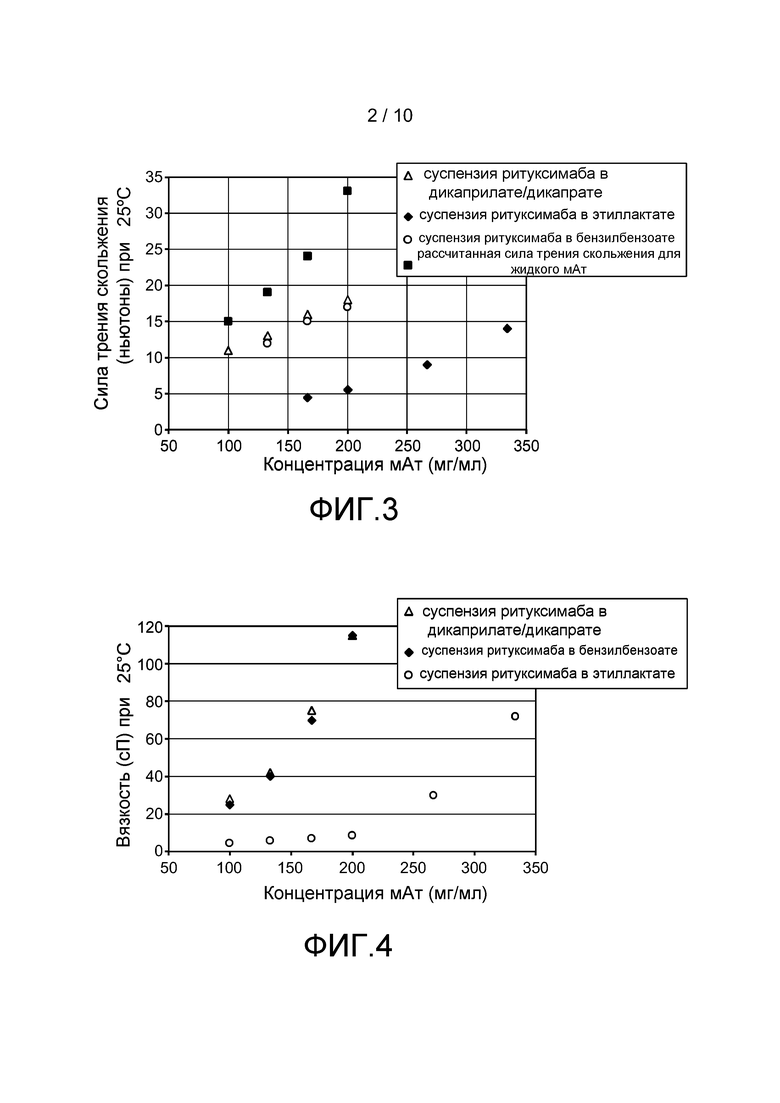
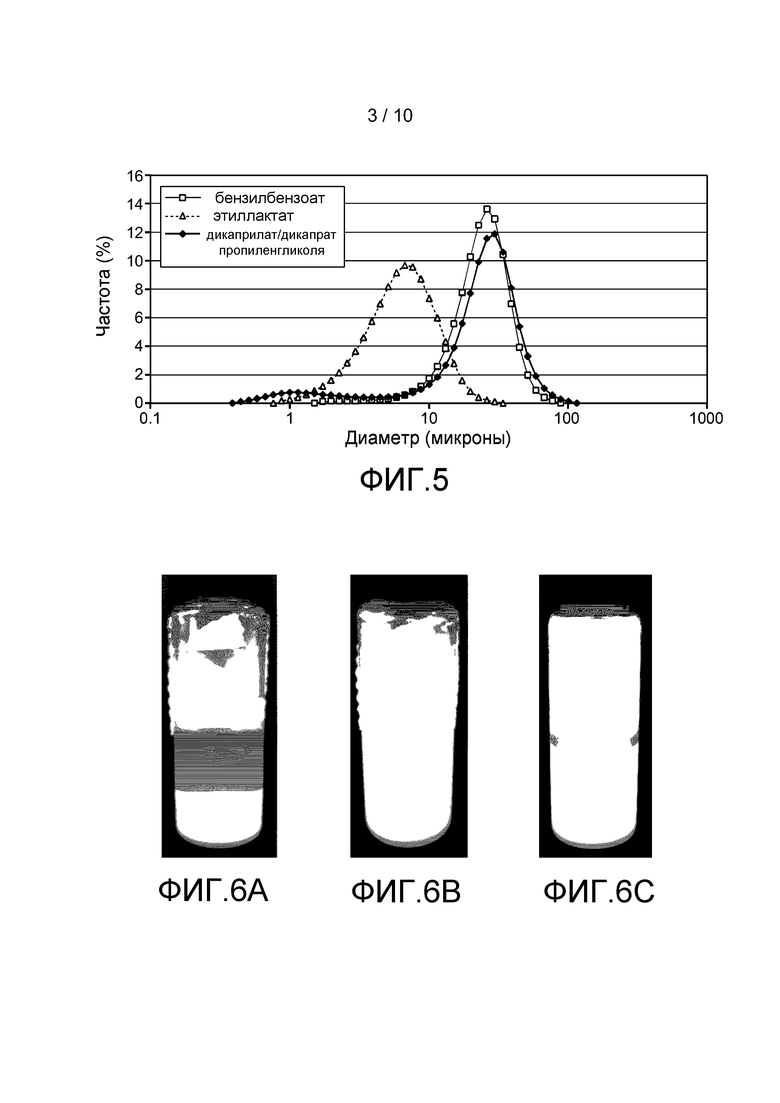
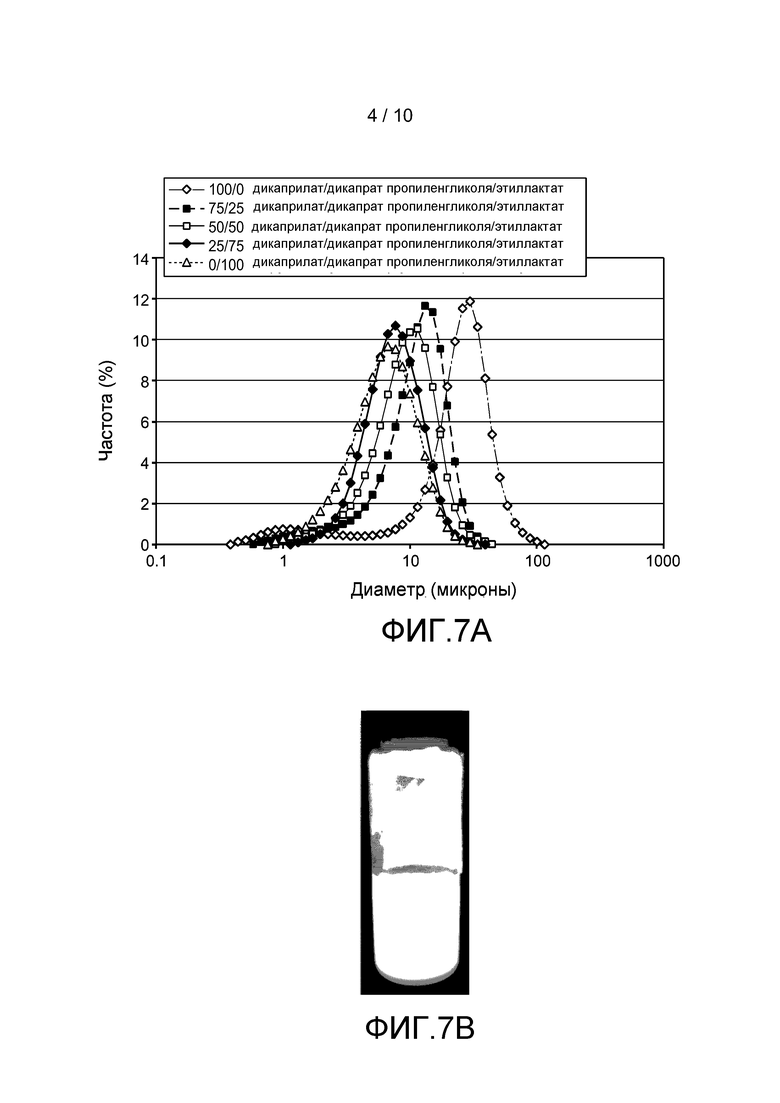




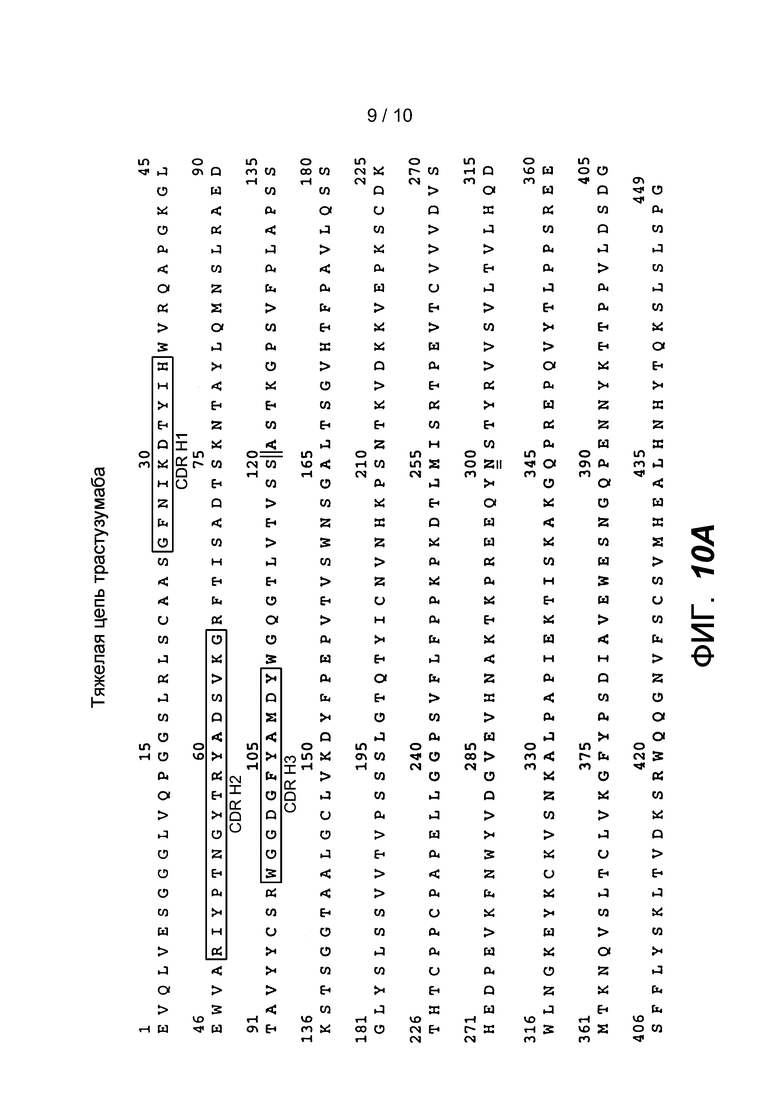
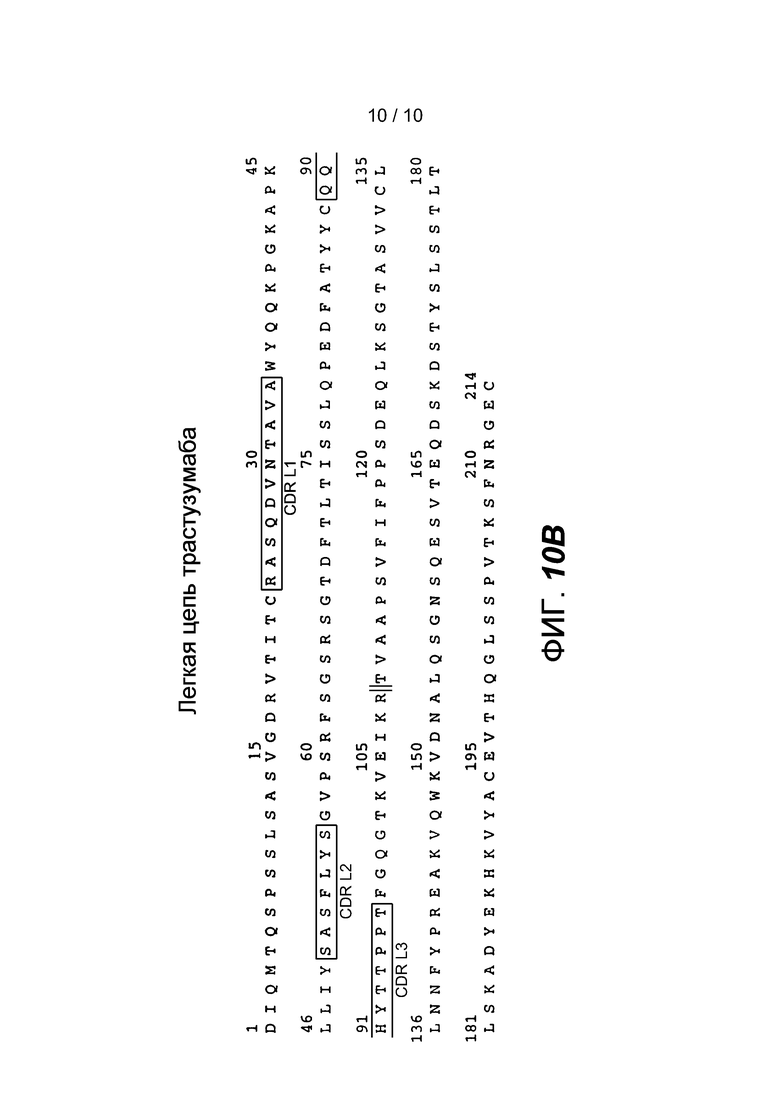
Группа изобретений относится к медицине и касается суспензионного состава для лечения заболевания или расстройства, содержащего высушенное распылением моноклональное антитело IgG1 человека в концентрации 200 мг/мл или больше, суспендированное в неводном наполнителе для суспензии, при этом вязкость наполнителя для суспензии меньше 20 сантипуаз при 25°C; где неводный наполнитель для суспензии содержит этиллактат, где заболеванием или расстройством является ангиогенез, злокачественная опухоль, аутоиммунное заболевание, возрастная дегенерация желтого пятна (AMD) или макулярный отек; и антитело связывается с антигеном, выбранным из группы, состоящей из CD20, HER2, VEGF, IL6R, бета7, A-бета, HER3, EGFR и M1’. Группа изобретений также касается устройства для подкожного введения указанного состава; способа получения суспензионного состава; применения указанного состава для лечения заболевания или расстройства у пациента, где заболеванием или расстройством является ангиогенез, злокачественная опухоль, аутоиммунное заболевание, возрастная дегенерация желтого пятна (AMD) или макулярный отек. Группа изобретений обеспечивает физическую стабильность суспензии моноклональных антител IgG1 человека. 8 н. и 24 з.п. ф-лы, 10 ил., 4 табл., 1 пр.
1. Суспензионный состав для лечения заболевания или расстройства, содержащий
высушенное распылением моноклональное антитело IgG1 человека в концентрации 200 мг/мл или больше, суспендированное в неводном наполнителе для суспензии,
где вязкость наполнителя для суспензии меньше 20 сантипуаз при 25°C;
где неводный наполнитель для суспензии содержит этиллактат;
где заболеванием или расстройством является ангиогенез, злокачественная опухоль, аутоиммунное заболевание, возрастная дегенерация желтого пятна (AMD) или макулярный отек и
где моноклональное антитело IgG1 человека связывается с антигеном, выбранным из группы, состоящей из CD20, HER2, VEGF, IL6R, бета7, A-бета, HER3, EGFR и M1’.
2. Состав по п.1, где вязкость наполнителя для суспензии меньше 10 сантипуаз.
3. Состав по п.2, где вязкость наполнителя для суспензии меньше 5 сантипуаз.
4. Состав по любому из предшествующих пунктов, где сила трения скольжения состава при инъекции составляет 20 ньютонов или меньше.
5. Состав по п.4, где сила трения скольжения состава при инъекции составляет 15 ньютонов или меньше.
6. Состав по п.1, где средний размер частиц в составе составляет от 2 микрон до 30 микрон.
7. Состав по п.6, где средний размер частиц в составе составляет от 2 микрон до 10 микрон.
8. Состав по п.1, где концентрация антитела в составе составляет от 200 мг/мл до 500 мг/мл.
9. Состав по п.8, в котором концентрация антитела в составе составляет от 200 мг/мл до 350 мг/мл.
10. Состав по п.1, дополнительно содержащий сахарид.
11. Состав по п.10, в котором сахаридом является трегалоза или сахароза.
12. Состав по п.10 или 11, в котором молярное соотношение сахарид:моноклональное антитело IgG1 человека составляет от 50 до 400:1.
13. Состав по п.12, в котором молярное соотношение сахарид:моноклональное антитело IgG1 человека составляет от 100 до 250:1.
14. Состав по п.1, дополнительно содержащий поверхностно-активное вещество.
15. Состав по п.14, в котором поверхностно-активным веществом является полисорбат 20 или полисорбат 80.
16. Состав по п.1, который подходит для подкожного введения.
17. Состав по п.1, в котором моноклональное антитело IgG1 человека представляет собой полноразмерное моноклональное антитело IgG1 человека.
18. Состав по п.1, в котором моноклональное антитело IgG1 человека является химерным или гуманизированным антителом.
19. Состав по п.1, в котором моноклональным антителом IgG1 человека является ритуксимаб, трастузумаб или бевацизумаб.
20. Состав по п.1, в котором неводный наполнитель для суспензии содержит смесь дикаприлата/дикапрата пропиленгликоля и этиллактата.
21. Устройство для подкожного введения, содержащее состав по любому из пп.1-20; где устройство представляет собой шприц, автоинжектор, инъекционное устройство или шприц-ручку.
22. Устройство по п.21, которое включает предварительно заполненный шприц.
23. Способ получения суспензионного состава, включающий
суспендирование высушенного распылением моноклонального антитела в неводном наполнителе для суспензии с вязкостью менее 20 сантипуаз при 25°C;
где неводный наполнитель для суспензии содержит этиллактат; и
где концентрация моноклонального антитела в суспензионном составе составляет 200 мг/мл или больше.
24. Способ получения изделия, включающий
заполнение устройства для подкожного введения составом по любому из пп.1-20,
где устройство представляет собой шприц, автоинжектор, инъекционное устройство или шприц-ручку.
25. Суспензионный состав для лечения заболевания или расстройства, содержащий
высушенное распылением полноразмерное моноклональное IgG1-антитело человека в концентрации от 200 мг/мл до 400 мг/мл, суспендированное в неводном наполнителе для суспензии с вязкостью менее 20 сантипуаз при 25°C;
где неводный наполнитель для суспензии содержит этиллактат;
где состав имеет средний размер частиц от 2 микрон до 10 микрон и силу трения скольжения при инъекции менее 15 ньютонов; и
где заболеванием или расстройством является ангиогенез, злокачественная опухоль, аутоиммунное заболевание, возрастная дегенерация желтого пятна (AMD) или макулярный отек и
где моноклональное антитело IgG1 человека связывается с антигеном, выбранным из группы, состоящей из CD20, HER2, VEGF, IL6R, бета7, A-бета, HER3, EGFR и M1’.
26. Состав по п.25, который дополнительно содержит сахарид,
где молярное соотношение сахарид:моноклональное антитело составляет от 100 до 250:1.
27. Состав по п.25 или 26, в котором антителом является ритуксимаб, трастузумаб или бевацизумаб.
28. Применение состава по любому из пп.1-20 для лечения заболевания или расстройства у пациента,
где заболеванием или расстройством является ангиогенез, злокачественная опухоль, аутоиммунное заболевание, возрастная дегенерация желтого пятна (AMD) или макулярный отек.
29. Применение состава по любому из пп.1-20 для получения лекарственного средства для лечения пациента моноклональным антителом в составе.
30. Способ лечения пациента с заболеванием или расстройством, включающий введение состава по любому из пп.1-20 пациенту для лечения моноклональным антителом в составе,
где заболеванием или расстройством является ангиогенез, злокачественная опухоль, аутоиммунное заболевание, возрастная дегенерация желтого пятна (AMD) или макулярный отек.
31. Способ по п.30, в котором состав вводят пациенту подкожно.
32. Способ по п.30 или 31, в котором состав вводят предварительно заполненным шприцем с находящимся в нем составом.
| US 20110223208 A1, 15.09.2011 | |||
| WO 2006119968 A2, 16.11.2006 | |||
| DUEVA-KOGANOV OV., et al., In vitro/in vivo and analytical evaluation of sunless tanning formulations containing different rheology modifiers | |||
| J Cosmet Sci | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| WO 2010056657 A2, 20.05.2010. | |||
Авторы
Даты
2020-01-15—Публикация
2013-05-17—Подача