ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки США №61/622,435, поданной 10 апреля 2012 года, и предварительной заявки США №61/480,863, поданной 29 апреля 2011 года, полное содержание которых включено в настоящий документ в качестве ссылки в полном объеме.
ЗАЯВЛЕНИЕ В ОТНОШЕНИИ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Список последовательностей, связанный с этой заявкой, приложен в текстовом формате вместо бумажной копии, и таким образом включен в настоящее описание путем ссылки. Имя текстового файла, содержащего перечень последовательностей, APEX-013_02US_ST25.txt. Размер текстового файла составляет 86 КБ, файл был создан 27 апреля 2012 года, и в настоящее время представлен в электронном виде через EFS-Web.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники
Настоящее изобретение в целом относится к анти-CD40 антителам, композициям и способам их применения. Такие антитела могут использоваться, например, в способах лечения различных онкологических заболеваний.
Описание предшествующего уровня техники
Большинство лейкозов и лимфом возникает в результате злокачественной трансформации В-клеток. Экспрессия на клеточной поверхности В-клеточных антигенов, таких как CD20, делает их привлекательной мишенью для терапии антителами. Терапевтические антитела радикально изменили ведение пациентов с неходжкинской лимфомой и хроническим лимфолейкозом. После разрешения клинического применения ритуксимаба, это антитело в отдельности или в комбинации с химиотерапией значительно улучшило ответ на лечение, долгосрочные результаты лечения и качество жизни пациентов (Chinn Р, Braslawsky G, White С, et al. Antibody therapy of non-Hodgkin’s B-cell lymphoma. Cancer Immunol Immunother 2003; 52:257-280.; Rastetter W, Molina A, White CA. Rituximab: Expanding role in therapy for lymphomas and autoimmune diseases. Annu Rev Med 2004; 55:477-503). Тем не менее, у значительного числа пациентов проявляется первичная или приобретенная резистентность к ритуксимабу, позволяя предположить, что текущие терапевтические подходы, направленные на CD20, имеют ограничения в клинических результатах, и необходимо их усовершенствование путем разработки новых иммунотерапевтических средств для лечения В-клеточных лимфом и лейкозов, имеющих другие механизмы действия (Stolz С, Schuler М. Molecular mechanisms of resistance to Rituximab and pharmacologic strategies for its circumvention. Leukemia and lymphoma. 2009; 50(6):873-885; Bello C, Sotomayor EM. Monoclonal antibodies for B-cell lymphomas: Rituximab and beyond. Hematology Am Soc Hematol Educ Program 2007; 233-242; Dupire S, Coiffier B. Targeted treatment and new agents in diffuse large В cell lymphoma. Int J Hematol 2010; Jun 18 (в сети Интернет)), такие как анти-CD40 mAb, АРХ005.
Роль CD40 в регуляции иммунного ответа
Полная активация Т-клеток требует двух отдельных, но синергетических сигналов. Первый сигнал, поступающий через Т-клеточный антигенный рецептор, обеспечивается антигеном и МНС-комплексом на АРС и отвечает за специфичность иммунного ответа. Вторичный или ко-стимулирующий сигнал поступает через взаимодействие CD28 с В7-1 (CD80)/B7-2 (CD86) и CD40 с CD40L, которые требуются для осуществления полноценного Т-клеточного ответа. В отсутствие ко-стимулирующих сигналов Т-клетки при антигенной стимуляции могут становиться невосприимчивыми (анергия) или входить в запрограммированную клеточную смерть (апоптоз).
CD40, член суперсемейства TNF-рецепторов (TNFR), экспрессируется преимущественно на В-клетках и других антиген-презентирующих клетках (АРС), таких как дендритные клетки и макрофаги. CD40-лиганд (CD40L) экспрессируется в основном активированными Т-клетками.
Взаимодействие CD40 и CD40L служит ко-стимулирующим сигналом для активации Т-клеток. Образование комплекса CD40-CD40L на покоящихся клетках индуцирует пролиферацию, переключение классов иммуноглобулинов, секрецию антител, а также играет роль в развитии зародышевых центров и выживании В-клеток памяти, которые все имеют важное значение для гуморального иммунного ответа (Kehry MR. J Immunol 1996; 156:2345-2348). Связывание CD40L с CD40 на дендритных клетках (DC) индуцирует созревание DC, о чем свидетельствует увеличение экспрессии ко-стимулирующих молекул, таких как молекулы семейства В7 (CD80, CD86), и увеличение продукции провоспалительных цитокинов, таких как интерлейкин 12. Это приводит к сильному Т-клеточному ответу (Stout, R.D., J. Suttles. 1996. Immunol. Today 17:487-492; Brendan O'Sullivan, Ranjeny Thomas. Critical Reviews in Immunology 2003; 23:83-107; Cella, M., D. Scheidegger, K. Palmer-Lehmann, P. Lane, A. Lanzavecchia, G. Alber. J. Exp. Med. 1996; 184:747-452).
Передача сигнала от CD40 активирует несколько путей, включая NFκB (ядерный фактор кВ), МАРК (митоген-активированную протеинкиназу) и STAT3 (преобразователь сигналов и активатор транскрипции-3) (Руре S, et al. J Biol Chem. 2000 Jun 16; 275(24):18586-93), которые регулируют экспрессию генов путем активации активирующих белков, c-Jun, ATF2 (фактор активации транскрипции-2) и транскрипционных факторов Rel (Dadgostar Н, et al. Proc Natl Acad Sci USA. 2002 Feb 5; 99 (3):1497-502). Адапторные белки - факторы, ассоциированные TNF-рецептором (TNFR) (например, TRAF1, TRAF2, TRAF3, TRAF5 и TRAF6), взаимодействуют с этим рецептором и служат посредниками передачи сигнала. В зависимости от конкретного типа клеток, активация CD40 приводит к экспрессии определенного набора генов. Гены, активируемые в ответ на передачу сигнала от CD40, включают многочисленные цитокины и хемокины (IL-1, IL-6, IL-8, IL-10, IL-12, TNF-альфа и воспалительный белок макрофагов-1 альфа (MIP1α)). В некоторых типах клеток активация CD40 может привести к продукции цитотоксичных радикалов (Dadgostar et al., выше), СОХ-2 (циклооксигеназы-2), а также продукции NO (оксида азота).
Роль CD40 в опухолях
CD40 экспрессируется не только нормальными иммунными клетками, но и многими злокачественными клетками. В частности, CD40 сверхэкспрессируется в В-клеточных неходжскинских лимфомах (NHL), хронических лимфоцитарных лейкозах (CLL), волосатоклеточных лейкозах (HCL), при болезни Ходжкина (Uckun FM, Gajl-Peczalska К, Myers DE, et al. Blood 1990; 76:2449-2456; O'Grady JT, Stewart S, Lowrey J, et al. Am J Pathol 1994; 144:21-26), множественной миеломе (Pellat-Deceunynck C, Bataille R, Robillard N, Harousseau JL, Rapp MJ, Juge-Morineau N, Wijdenes J, Amiot M. Blood. 1994; 84(8):2597-603), а также при карциноме мочевого пузыря, почек, яичников, шейки матки, молочных желез, легких, носоглотки и при злокачественной меланоме (Young LS, Eliopoulos AG, Gallagher NJ, et al. Immunol Today 1998; 19:502-6; Ziebold JL, Hixon J, Boyd A, et al. Arch Immunol Ther Exp (Warsz) 2000; 48:225-33; Gladue R, Cole S, Donovan C, et al. J Clin Oncol 2006; 24 (18S):103s).
Лигирование CD40 на поверхности опухолевых клеток, которое во многих случаях опосредует прямой цитотоксический эффект, приводит к регрессии опухоли в результате апоптоза и некроза (Grewal IS, Flavell RA. Annu Rev Immunol 1998; 16:111-35; van Kooten C, Banchereau J. J Leukoc Biol 2000; 67(1):2-17). Хотя точные функции CD40 в опухолевых клетках неясны (Tong AW, Stone MJ. Cancer Gene Ther. 2003 10(1):1-13), активация CD40 in vitro ингибирует рост клеток солидных опухолей и клеток недифференцированной В-клеточной лимфомы (Magi Khalil and Robert H. Vonderheide. Update Cancer Ther 2007; 2(2):61-65; Young LS, Eliopoulos AG, Gallagher NJ, Dawson CW. Immunol Today 1998; 19(11):502-6; Funakoshi S, Longo DL, Beckwith M, et al. Blood 1994; 83(10):2787-94; Hess S, Engelmann H. J Exp Med 1996; 183(1):159-67; Eliopoulos AG, Dawson CW, Mosialos G, et al. Oncogene 1996; 13(10):2243-54; von Leoprechting A, van der Bruggen P, Pahl HL, Aruffo A, Simon JC. Cancer Res 1999; 59(6):1287-94). Эти эффекты отличаются от пролиферации, индуцируемой активацией CD40 в неопухолевых клетках и дендритных клетках.
В дополнение к прямому ингибированию опухоли, активация CD40-сигнала восстанавливает функции антиген-презентирующих клеток у имеющих опухоли хозяев и запускает или восстанавливает активный иммунный ответ против опухолеассоциированных антигенов. Опубликовано, что CD40-агонисты преодолевают Т-клеточную толерантность у мышей с опухолями, вызывая эффективный цитотоксический Т-клеточный ответ против опухолеассоциированных антигенов, а также повышая эффективность противоопухолевых вакцин (Eliopoulos AG, Davies С, Knox PG, et al. Mol Cell Biol 2000; 20(15):5503-15; Tong AW, Papayoti MH, Netto G, et al. Clin Cancer Res 2001; 7(3):691-703).
CD40 в качестве молекулярной мишени
CD40 сверхэкспрессируется у широкого ряда злокачественных клеток. Роль CD40 в ингибировании опухолей и стимуляции иммунной системы делают CD40 привлекательной мишенью для иммунотерапии на основе антител (van Mierlo GJ, den Boer AT, Medema JP, et al. Proc Natl Acad Sci USA. 2002; 99(8):5561-5566; French RR, Chan HT, Tutt AL, Glennie MJ. Nat Med. 1999; 5(5):548-553). Анти-CD40-антитела могут действовать против опухолевых клеток через несколько механизмов: (i) эффекторную функцию антител, такую как ADCC, (ii) прямое цитотоксическое действие на опухолевые клетки и (iii) актирацию противоопухолевого иммунного ответа.
Разрабатываемые анти-CD40 терапевтические антитела
Опубликовано, что несколько анти-CD40 антител обладают потенциалом как противоопухолевые терапевтические средства. СР-870893 представляет собой полностью человеческое (IgG2) анти-CD40 агонистическое антитело, разработанное Pfizer. Оно связывает CD40 с KD, равной 3,48×10-10 М, но не блокирует связывание CD40L (см., например, патент США №7,338,660). Показано, что СР-870893 обладает ADCC-эффектом, возможно, из-за своего IgG2-изотипа. Таким образом, данное антитело действует в качестве агониста CD40 (т.е. не влияет на связывание CD40L), индуцирует проапоптотическую передачу сигнала и активирует DC и иммунологический надзор. Однако данное антитело не опосредует ADCC.
HCD122 представляет собой полностью человеческое (IgG1) анти-CD40 антагонистическое антитело, разработанное Novartis. Оно связывает CD40 с KD, равной 5,1×10-10 М, блокирует связывание CD40 с CD40L, ингибирует индуцируемую CD40L передачу сигнала и биологическое действие на В-клетки и некоторые первичные CLL- и ММ-клетки (Tai YT, et al. Cancer Res. 2005 Jul 1; 65(13):5898-906; Luqman M, Klabunde S, et al. Blood 112:711-720, 2008). Основным механизмом действия для его противоопухолевого эффекта in vivo является ADCC (Long L, et al. 2005 IMF Oral Presentation and Abstract No.3; Blood 2004, 104 (11, Part 1): Abst 3281).
Вследствие своей антагонистической природы данное антитело не может непосредственно вызывать CD40-опосредованный противоопухолевый иммунный ответ.
SGN-40 представляет собой гуманизированное IgG1 антитело, разработанное компанией Seattle Genetics из клона S2C6 мышиных антител, который был создан с использованием клеточной линии карциномы мочевого пузыря человека в качестве иммуногена. Оно связывает CD40 с KD, равной 10,0×10-9 М, и действует посредством усиления взаимодействия между CD40 и CD40L, демонстрируя тем самым частичный агонистический эффект (Francisco JA, et al., Cancer Res, 60:3225-31, 2000). SGN-40 ингибирует пролиферацию и вызывает апоптоз у панели линий В-клеточных лимфом, источником которых являлись клетки недифференцированной неходжкинской лимфомы и множественной миеломы (Tai YT, Catley LP, Mitsiades CS, et al. Cancer Res 2004; 64(8):2846-2852). Исследования in vitro и in vivo показали, что в противоопухолевую активность SGN-40 вносят вклад как апоптотический сигнал, так и эффекторная функция антитела через ADCC (Law CL, Gordon КА, Collier J, et al: Cancer Res 2005; 65:8331-8338). Последние исследования позволили предположить, что противоопухолевая активность SGN-40 во многом зависит от взаимодействия Fc с эффекторными клетками и что макрофаги являются основными эффекторными клетками, вносящими вклад в его терапевтическую активность (Oflazoglu Е, et al. Br J Cancer. 2009 Jan 13; 100(1):1 13-7. Epub 2008 Dec 9). Поскольку SGN-40 является частичным агонистом и требует CD40L, экспрессируемого на Т-клетках, способность SGN-40 в полной мере повышать противоопухолевый иммунный ответ может быть ограничена.
Соответственно, в данной области остается необходимость в новых иммуннотерапевтических средствах, мишенью которых является CD40, и которые действуют в качестве агонистов для данной мишени, активируют дендритные клетки и иммунологический надзор, и которые активируют ADCC, тем самым обеспечивая улучшенные противораковые свойства.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Один аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим: (i) вариабельную область тяжелой цепи, содержащую VHCDR1-область, приведенную в SEQ ID NO:3, VHCDR2 - область, приведенную в SEQ ID NO:4 и VHCDR3-область, приведенную в SEQ ID NO:5; и (ii) вариабельную область легкой цепи, содержащую VLCDR1-область, приведенную в SEQ ID NO:6, VLCDR2 - область, приведенную в SEQ ID NO:7, и VLCDR3-область, приведенную в SEQ ID NO:8; или относится к варианту указанного антитела или его антиген-связывающего фрагмента, содержащим вариабельные области тяжелой и легкой цепи, идентичные вариабельным областям тяжелой и легкой цепи (i) и (ii), за исключением до 8 аминокислотных замен в указанных CDR. В одном варианте антител, раскрытых в настоящем документе, вариабельная область тяжелой цепи содержит аминокислотную последовательность, приведенную в SEQ ID NO:1. В еще одном варианте вариабельная область легкой цепи содержит аминокислотную последовательность, приведенную в SEQ ID NO:2.
Еще один аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:1. В одном варианте осуществления этого аспекта, выделенное антитело или его антиген-связывающий фрагмент содержат вариабельную область легкой цепи, которая содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:2. В еще одном варианте осуществления этого аспекта, выделенное антитело или его антиген-связывающий фрагмент содержат вариабельную область легкой цепи, которая содержит аминокислотную последовательность, приведенную в SEQ ID NO:2.
Еще один дополнительный аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим вариабельную область легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:2. В одном варианте осуществления этого аспекта, выделенное антитело или его антиген-связывающий фрагмент содержат вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:1.
В некоторых вариантах осуществления настоящего изобретения выделенные антитела, раскрытые в настоящем документе, являются гуманизированными. Иллюстративные вариабельные области гуманизированных антител приведены в аминокислотной последовательности VH-области SEQ ID NO:9 и аминокислотной последовательности VL области SEQ ID NO:10.
В одном варианте осуществления изобретения выделенное антитело, раскрытое в настоящем документе, может быть одноцепочечным антителом, ScFv, одновалентным антителом, у которого отсутствует шарнирная область, миниантителом, Fab-фрагментом, Fab'-фрагментом или F(ab')2-фрагментом. В некоторых вариантах осуществления настоящего изобретения антитела являются полноразмерными антителами.
В другом варианте осуществления изобретения выделенные антитела, описанные в настоящем документе, содержат человеческий константный домен IgG, такой как, но не ограниченный этим, СН1-домен IgG1 или Fc-область IgG1.
В дополнительном варианте осуществления изобретение относится к выделенному антителу или его антиген-связывающему фрагменту, которые конкурируют с анти-CD40-антителами, описанными в настоящем документе, за связывание с CD40 человека.
В одном аспекте данного описания выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40, связываются с KD, равной 0,96 нМ или ниже. В дополнительном варианте осуществления изобретения выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40, связываются с KD, равной от 1,1 нМ до 0,90 нМ. В дополнительном варианте осуществления изобретения выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40, связываются с Kd, равной примерно 1,2, 1,1, 1,0, 0,99, 0,98, 0,97, 0,96, 0,95, 0,94, 0,93, 0,92, 0,91, 0,90, 0,85, или примерно 0,80 нМ. В другом варианте осуществления изобретения указанное антитело связывает CD40 с Kd равной примерно 2,5, 2,4, 2,3, 2,2, 2,1, 2,0, 1,9, 1,8, 1,7, 1,6, 1,5, 1,4 или 1,3 нМ.
В дополнительном аспекте настоящее изобретение относится к выделенному антителу или его антиген-связывающему фрагменту, описанным в настоящем документе, причем выделенное антитело или его антиген-связывающий фрагмент: блокируют связывание CD40 с CD40L; являются агонистами CD40; активируют антиген-презентирующие клетки; стимулируют высвобождение цитокинов из антиген-презентирующих клеток; вызывают апоптоз опухолевых клеток; ингибируют пролиферацию опухолевых клеток; убивают опухолевые клетки, индуцируя эффекторные функции, выбранные из группы, состоящей из антителозависимой клеточной цитотоксичности, комплемент - зависимой цитотоксичности и антителозависимого клеточного фагоцитоза; стимулируют противоопухолевые Т-клеточные ответы; уменьшают сформированные раковые опухоли; ингибируют рост резистентных к ритуксимабу опухолей; или обладают комбинацией любого одного или нескольких из вышеуказанных свойств.
Другой аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40, содержаим: (i) вариабельную область тяжелой цепи, содержащую VHCDR1, VHCDR2 и VHCDR3 любой одной из VH-областей, показанных на фиг.16; и (ii) вариабельную область легкой цепи, содержащую VLCDR1, VLCDR2 и VLCDR3 из соответствующей VL-области любой одной из VL-областей, показанных на фиг.16; или к варианту указанного антитела или к его антигенсвязывающего фрагмента, состоящим из вариабельных областей тяжелой и легкой цепей, идентичных вариабельным областям тяжелой и легкой цепей (I) и (ii), за исключением до 8 аминокислотных замен в указанных CDR.
Еще один аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40, содержащим вариабельную область тяжелой цепи, содержащую любую одну из VH-областей, показанных на фиг.16. В одном варианте осуществления изобретения такое антитело дополнительно содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с соответствующей VL-областью, показанной на фиг.16. В другом варианте осуществления изобретения такое антитело или его антиген-связывающий фрагмент дополнительно содержат соответствующую вариабельную область легкой цепи, показанную на фиг.16.
В еще одном аспекте настоящее изобретение относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40, содержащим вариабельную область легкой цепи, содержащую любую из VL-областей, показанных на фиг.16. В одном варианте осуществления изобретения такое антитело дополнительно содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с соответствующей VH-областью, показанной на фиг.16. В другом варианте осуществления изобретения такое антитело или его антиген-связывающий фрагмент дополнительно содержит соответствующую вариабельную область тяжелой цепи, показанную на фиг.16.
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим выделенные антитела или их антигенсвязывающие фрагменты, раскрытые в настоящем документе.
Настоящее изобретение также относится к композициям, содержащим физиологически приемлемый носитель и терапевтически эффективное количество анти-CD40 антитела или его антиген-связывающего фрагмента, раскрытых в настоящем документе.
Еще один аспект настоящего изобретения относится к способу лечения пациента, имеющего рак, включающему введение пациенту композиции, содержащей физиологически приемлемый носитель и терапевтически эффективное количество анти-CD40 антитела или его антиген-связывающего фрагмента, раскрытых в настоящем документе, посредством чего осуществляется лечение рака. В некоторых вариантах осуществления изобретения рак ассоциирован с нарушением экспрессии CD40. В других вариантах осуществления изобретения рак выбран из группы, состоящей из неходжкинских лимфом, Ходжкинской лимфомы, хронических лимфоцитарных лейкозов, волосатоклеточных лейкозов, острых лимфобластных лейкозов, множественной миеломы, карцином поджелудочной железы, толстой кишки, желудочно-кишечного тракта, предстательной железы, мочевого пузыря, почек, яичников, шейки матки, молочных желез, легких, носоглотки, злокачественной меланомы и резистентных к ритуксимабу NHL и лейкозов.
Еще один аспект настоящего изобретения относится к способу лечения пациента, имеющего рак и/или аутоиммунное заболевание, и/или воспалительное заболевание, включающему введение пациенту композиции, содержащей физиологически приемлемый носитель и терапевтически эффективное количество анти-CD40 антитела или его антиген-связывающего фрагмента, раскрытых в настоящем документе, посредством чего осуществляется лечение пациента, имеющего аутоиммунные и воспалительные заболевания.
Еще один аспект настоящего изобретения относится к способу ослабления симптомов у пациента, имеющего рак, и/или аутоиммунное заболевание, и/или воспалительное заболевание, включающему введение пациенту композиции, содержащей физиологически приемлемый носитель и терапевтически эффективное количество анти-CD40 антитела или его антиген-связывающего фрагмента, раскрытых в настоящем документе, посредством чего ослабляются симптомы у пациента, имеющего раковое, и/или аутоиммунное, и/или воспалительное заболевания.
Еще один аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11. В одном варианте осуществления изобретения выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40 человека, содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и содержат вариабельную область легкой цепи, которая содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:22, или легкой цепи, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:22. В некоторых вариантах осуществления изобретения выделенное антитело, описанное в настоящем документе, содержат легкую цепь, приведенную в SEQ ID NO:22, и включают вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:11.
Дополнительный аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:13. В одном варианте осуществления изобретения антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:13, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:24. В одном варианте осуществления изобретения легкая цепь содержит аминокислотную последовательность, приведенную в SEQ ID NO:24.
Дополнительный аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим вариабельную область легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:24. В одном варианте осуществления изобретения антитело содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:24, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:13.
В некоторых аспектах изобретения выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40, содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:17. В одном варианте осуществления изобретения выделенное антитело, которое связывается с CD40, содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:17, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:28. В одном варианте осуществления изобретения вариабельная область легкой цепи содержит аминокислотную последовательность, приведенную в SEQ ID NO:28.
Другой аспект изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим вариабельную область легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:28. В одном варианте осуществления изобретения выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40 человека, содержат вариабельную область легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:28, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:17.
Другой аспект изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:19. В одном варианте осуществления изобретения выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40 человека, содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:19, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:30. В одном конкретном варианте осуществления изобретения вариабельная область легкой цепи содержит аминокислотную последовательность, приведенную в SEQ ID NO:30.
Еще один дополнительный аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим вариабельную область легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:30. В одном варианте осуществления изобретения выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40 человека, включают вариабельную область легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:30, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью, приведенной в SEQ ID NO:19.
Еще один аспект настоящего изобретения относится к выделенному антителу или его антиген-связывающему фрагменту, которые связываются с CD40 человека, содержащим вариабельную область тяжелой цепи, которая содержит CDR вариабельной области тяжелой цепи и вариабельную область легкой цепи, которая содержит соответствующие CDR вариабельной области легкой цепи, причем CDR показаны на фиг.16.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 представляет собой аминокислотную последовательность VH-области кроличьего анти-CD40 антитела R-8.
SEQ ID NO:2 представляет собой аминокислотную последовательность VL-области кроличьего анти-CD40 антитела R-8.
SEQ ID NO:3 представляет собой аминокислотную последовательность VHCDR1-области кроличьего анти-CD40 антитела R-8.
SEQ ID NO:4 представляет собой аминокислотную последовательность VHCDR2-области кроличьего анти-CD40 антитела R-8.
SEQ ID NO:5 представляет собой аминокислотную последовательность VHCDR3-области кроличьего анти-CD40 антитела R-8.
SEQ ID NO:6 представляет собой аминокислотную последовательность VLCDR1-области кроличьего анти-CD40 антитела R-8.
SEQ ID NO:7 представляет собой аминокислотную последовательность VLCDR2-области кроличьего анти-CD40 антитела R-8.
SEQ ID NO:8 представляет собой аминокислотную последовательность VLCDR13-области кроличьего анти-CD40 антитела R-8.
SEQ ID NO:9 представляет собой аминокислотную последовательность VH-области АРХ005, гуманизированной версии кроличьего анти-CD40 антитела R-8 без сигнального пептида.
SEQ ID NO:10 представляет собой аминокислотную последовательность VL-области АРХ005, гуманизированной версии кроличьего анти-CD40 антитела R-8 без сигнального пептида.
SEQ ID NO:11-21 и 33-44 представляют собой аминокислотные последовательности тяжелых цепей предполагаемых кроличьих анти-CD40 антител, которые показывали функциональную активность (см. фиг.16).
SEQ ID NO:22-32 и 45-56 представляют собой аминокислотные последовательности легких цепей предполагаемых кроличьих анти-CD40 антител, которые показывали функциональную активность (см. фиг.16).
SEQ ID NO:57-79 представляют собой аминокислотные последовательности VHCDR1 для анти-CD40 антител, показанных на фиг.16.
SEQ ID NO:80-102 представляют собой аминокислотные последовательности VHCDR2 для анти-CD40 антител, показанных на фиг.16.
SEQ ID NO:103-125 представляют собой аминокислотные последовательности VHCDR3 для анти-CD40 антител, показанных на фиг.16.
SEQ ID NO:126-148 представляют собой аминокислотные последовательности VLCDR1 для анти-CD40 антител, показанных на фиг.16.
SEQ ID NO:149-171 представляют собой аминокислотные последовательности VLCDR2 для анти-CD40 антител, показанных на фиг.16.
SEQ ID NO:172-194 представляют собой аминокислотные последовательности VLCDR3 для анти-CD40 антител, показанных на фиг.16.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1А-1D показан результат скрининга на агонистические антитела посредством измерения созревания DC и активации Т-клеток, как описано в примере 1. 1А: экспрессия CD83; 1В: экспрессия CD80; 1С: экспрессия CD86; 1D: пролиферация Т-клеток в реакции смешанных лимфоцитов.
Фиг.2 представляет собой диаграмму, показывающую сравнения главных кандидатов по ингибированию пролиферации клеток Ramos.
Фиг.3 представляет собой столбиковую диаграмму, показывающую результаты ADCC анализа. Соотношение эффекторных клеток (РВМС человека) и клеток-мишеней (клетки Ramos) составляет 40:1.
Фиг.4А и 4В являются диаграммами, на которых показаны результаты in vivo скрининга противоопухолевой активности потенциальных анти-CD40.
Фиг.5 представляет собой диаграмму, на которой показаны результаты анализа методом ELISA, демонстрирующего, что АРХ005 избирательно связывается с CD40, но не другими членами семейства TNFR.
Фиг.6 представляет собой диаграмму, на которой показаны результаты анализа методом ELISA, демонстрирующего, что АРХ005 блокирует связывание CD40L с CD40.
Фиг.7 представляет собой диаграмму, на которой показано, что АРХ005 не интернализуется после связывания с CD40-положительными клетками.
Фиг.8А и 8В представляют собой диаграммы, на которых показана опосредованная АРХ005 ADCC CD40-положительных опухолевых клеток Ramos (А) и Daudi (В).
Фиг.9А и 9В представляют собой диаграммы, на которых показано in vitro ингибирование пролиферации опухолевых клеток Ramos в результате действия АРХ005. Панель А: без сшивания Fc; Панель В: с сшиванием Fc.
Фиг.10 представляет собой столбиковую диаграмму, на которой показано индукция активации DC под действием АРХ005.
На фиг.11А и 11В показано, что АРХ005 связывается с CD40 человека и обезьяны, но не с мышиным CD40.
Фиг.12А представляет собой диаграмму, на которой показано ингибирование роста опухоли под действием АРХ005 в модели на основе клеток Ramos. Фиг.12В представляет собой столбиковую диаграмму, на которой показаны уровни IgG человека в сыворотке на 34 день, через два дня после последнего введения.
Фиг.13А и 13В представляют собой диаграммы, на которых показано ингибирование предварительно обработанных ритуксимабом и резистентных к нему опухолей в мышиной модели.
Фиг.14 представляет собой диаграмму, на которой показано ингибирование роста опухоли под действием АРХ005 в мышиной модели на основе Raji.
Фиг.15 представляет собой диаграмму, на которой показана сильная противоопухолевая активность АРХ005 в отношении множественной миеломы человека в ксенографтной модели на основе клеток IM-9.
Фиг.16А-16L представляют собой выравнивание последовательностей тяжелых (16A-16F) и легких цепей (16G-16L) кроличьих анти-CD40 антител. CDR1-3 тяжелых и легких цепей подчеркнуты. SEQ ID NO указаны ниже: тяжелая цепь: R-3 и R-6: SEQ ID NO:11, 12; R-8: SEQ ID NO:1; R-9, -16, -18, -24, -33, -36, 19-21, -45, -59: SEQ ID NO:13-21, соответственно; R-2, R-5, R-7, R-10, R-12, R-20, R-26, R-30, R-35, 19-35, 19-41, 19-57: SEQ ID NO:33-44, соответственно. Легкая цепь: R-3 и R-6: SEQ ID NO:22 и 23; R-8: SEQ ID NO:2; R-9, -16, -18, -24, -33, -36, 19-21, -45, -59: SEQ ID NO:24-32, соответственно; R-2, R-5, R-7, R-10, R-12, R-20, R-26, R-30, R-35, 19-35, 19-41, 19-57: SEQ ID NO:45-56, соответственно. Аминокислотные последовательности включают сигнальные пептиды VH и VL. Аминокислотные последовательности VHCDR и VLCDR R-8 приведены в SEQ ID NO:3-8. Аминокислотные последовательности VHCDR и VLCDR для остальных антител приведены в SEQ ID NO:57-125 и SEQ ID NO:126-194, соответственно.
На фиг.17А и 17В показано ингибирование роста опухоли в модели на основе клеток Ramos под действием АРХ005 в сравнении с SGN-40 и ритуксимабом.
На фиг.18А и 18В показано ингибирование роста опухоли под действием АРХ005 в ксенографтной модели резистентной к ритуксимабу линии клеток Namalwa человеческой лимфомы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам и их антиген-связывающим фрагментам, которые специфично связываются с CD40, в частности, относится к антителам, обладающим специфичностью в отношении конкретных эпитопов и определенными функциональными свойствами. Один из вариантов осуществления изобретения охватывает конкретные гуманизированные антитела и их фрагменты, способные связываться с CD40 и действующие в качестве агонистов CD40, индуцируя/повышая CD40-опосредованную передачу сигнала и последующие биологические эффекты. В более конкретных вариантах осуществления изобретения, описанные в настоящем документе антитела специфично связываются с CD40 с очень высокой аффинностью, например, составляющей по меньшей мере 980-950 пМ, по меньшей мере 970-950 пМ, а в определенных вариантах осуществления изобретения - с аффинностью 960 пМ. Антитела, описанные в настоящем документе, среди прочих свойств, индуцируют CD40-сигнальный путь в опухолевых клетках, активируют дендритные клетки и иммунный надзор, активируют антителозависимую клеточную цитотоксичность (ADCC) против опухолевых клеток, блокируют связывание CD40 с CD40L, имеют CD40-агонистическую активность и активируют антиген-презентирующие клетки, стимулируют высвобождение цитокинов из антиген-презентирующих клеток, индуцируют апоптоз опухолевых клеток, ингибируют пролиферацию опухолевых клеток, убивают опухолевые клетки посредством индукции эффекторных функций, в том числе, но не ограничиваясь ими, ADCC, CDC и ADCP, стимулируют противоопухолевые Т-клеточные ответы, снижают размер развитых опухолей и ингибируют резистентные к ритуксимабу опухоли. Антитела, описанные в настоящем документе, могут иметь или индуцировать комбинацию любого одного или нескольких из этих признаков или функций.
Варианты осуществления изобретения относятся к применению анти-CD40-антител или их антиген-связывающих фрагментов для диагностики, оценки и лечения заболеваний и расстройств, связанных с CD40 или его аберрантной экспрессией. Данные антитела используются для лечения или профилактики рака, включая, но не ограничиваясь этим, неходжскинских лимфом, лимфомы Ходжкина, хронических лимфоцитарных лейкозов, волосатоклеточных лейкозов, острых лимфобластных лейкозов, множественной миеломы, карцином мочевого пузыря, почек, яичников, шейки матки, молочных желез, легких, носоглотки, злокачественной меланомы и резистентных к ритуксимабу NHL и лейкозов, аутоиммунных заболеваний и воспалительных заболеваний, среди прочих заболеваний.
При практическом примении настоящего изобретения будут использоваться, если специально не указано противоположное, общепринятые методы вирусологии, иммунологии, микробиологии, молекулярной биологии и технологии рекомбинантных ДНК в данной области, многие из которых описаны ниже для иллюстрации. Такие методики подробно описаны в литературе. См., например, Current Protocols in Molecular Biology or Current Protocols in Immunology, John Wiley & Sons, New York, N.Y. (2009); Ausubel et al., Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995; Sambrook and Russell, Molecular Cloning: A Laboratory Manual (3rd Edition, 2001); Maniatis et al. Molecular Cloning: A Laboratory Manual (1982); DNA Cloning: A Practical Approach, vol. I & II (D. Glover, ed.); Oligonucleotide Synthesis (N. Gait, ed., 1984); Nucleic Acid Hybridization (B. Hames & S. Higgins, eds., 1985); Transcription and Translation (B. Hames & S. Higgins, eds., 1984); Animal Cell Culture (R. Freshney, ed., 1986); Perbal, A Practical Guide to Molecular Cloning (1984) и другие подобные ссылки.
В контексте данного описания и приложенной формулы изобретения формы единственного числа включают ссылку на множественное число, если в контексте ясно не указано иное.
В данном описании, если контекст не требует иного, слово «содержать» или его вариации, такие как «содержит» или «содержащий», следует понимать, как включающие указанный элемент или целое число, или группу элементов или целых чисел, но не исключающие любой другой элемент или целое число, или группу элементов или целых чисел.
Каждый вариант осуществления изобретения в этой спецификации следует применять mutatis mutandis к каждому другому варианту осуществления, если явно не указано иное.
Для рекомбинантных ДНК, синтеза олигонуклеотидов, а также культивирования тканей и транформации (например, электропорации, липофекции) могут использоваться общепринятые методики. Ферментативные реакции и методики очистки могут осуществляться в соответствии с описанием производителя, или как это обычно принято в данной области, или как описано в настоящем документе. Эти и другие методики и процедуры в общем могут выполняться в соответствии с общепринятыми способами, хорошо известными в данной области и описанными в различных общих и более конкретных ссылках, которые цитируются и обсуждаются в настоящем описании. Если не приведены конкретные определения, то используемая номенклатура, а также лабораторные процедуры и методики молекулярной биологии, аналитической химии, химии органического синтеза и медицинской и фармацевтической химии, описанные в настоящем документе, являются хорошо известными и часто используемыми в данной области. Стандартные методики могут использоваться для рекомбинантной технологии, молекулярной биологии, микробиологии, химического синтеза, химического анализа, получения фармацевтических препаратов, составления фармакологических препаратов, а также их доставки и лечения пациентов.
Варианты осуществления настоящего изобретения относятся к антителам, которые связываются с CD40. В частности, описанные в настоящем документе антитела специфично связываются с CD40 с неожиданно высокой аффинностью, усиливают сигнальную активность CD40, активируют иммунную систему, активируют ADCC и имеют терапевтический потенциал в отношении лечения заболеваний, ассоциированных с аберрантной экспрессией CD40.
Последовательности иллюстративных антител или их антиген-связывающих фрагментов, или их определяющих комплементарность областей (CDR), приведены в SEQ ID NO:1-194.
Как хорошо известно в данной области, антитело представляет собой молекулу иммуноглобулина, способную специфично связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., по меньшей мере через один участок распознавания эпитопа, расположенный в вариабельной области молекулы иммуноглобулина. В контексте настоящего изобретения термин охватывает не только интактные поликлональные или моноклональные антитела, но также их фрагменты (такие как dAb, Fab, Fab', F(ab')2, Fv), одноцепочечные антитела (ScFv), их синтетические варианты, их встречающиеся в природе варианты, слитые белки, содержащие участок антитела с антиген-связывающим фрагментом требуемой специфичности, гуманизированные антитела, химерные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антиген-связывающий участок или фрагмент (участок распознавания эпитопа) требуемой специфичности. «Диантитела», поливалентные или полиспецифичные фрагменты, сконструированные путем слияния генов (WO94/13804; Р. Holliger et al., Proc. Natl. Acad. Sci. USA 90 6444-6448, 1993), также представляют собой особую форму антител, предусмотренную в настоящем изобретении. Миниантитела, содержащие ScFv, соединенный с СН3-доменом, также включены в настоящий документ (S. Hu et al., Cancer Res., 56, 3055-3061, 1996). См., например, Ward, Е.S. et al., Nature 341, 544-546 (1989); Bird et al., Science, 242, 423-426, 1988; Huston et al., PNAS USA, 85, 5879-5883, 1988); PCT/US92/09965; WO94/13804; P. Holliger et al., Proc. Natl. Acad. Sci. USA 90 6444-6448, 1993; Y. Reiter et al., Nature Biotech, 14, 1239-1245, 1996; S. Hu et al., Cancer Res., 56, 3055-3061, 1996.
Термин «антиген-связывающий фрагмент», используемый в настоящем документе, относится к полипептидному фрагменту, который содержит по меньшей мере одну CDR тяжелой и/или легкой цепей иммуноглобулина, которая связывается с представляющим интерес антигеном, в частности, с CD40. В этом отношении антиген-связывающий фрагмент описанных в настоящем документе антител может содержать 1, 2, 3, 4, 5 или все 6 CDR из VH и VL-последовательностей, приведенных в настоящем документе, из антител, связывающихся с CD40. Антиген-связывающий фрагмент специфичных к CD40 антител, описанных в настоящем документе, способен связываться с CD40. В некоторых вариантах осуществления изобретения антиген-связывающий фрагмент или антитело, содержащее антиген-связывающий фрагмент, предупреждают или ингибируют связывание CD40L с CD40. В некоторых вариантах осуществления изобретения антиген-связывающий фрагмент специфично связывается с и/или усиливает или модулирует биологическую активность человеческого CD40. Такая биологическая активность включает, но не ограничена этим, передачу сигнала в клетке, активацию дендритных клеток,
Термин «антиген» относится к молекуле или участку молекулы, способным к связыванию с избирательным связывающим агентом, таким как антитело, которые дополнительно можно использовать в животном для получения антител, способных связываться с эпитопом этого антигена. Антиген может иметь один или несколько эпитопов.
Термин «эпитоп» включает любую детерминанту, предпочтительно полипептидную детерминанту, способную специфично связываться с иммуноглобулином или Т-клеточным рецептором. Эпитоп представляет собой область антигена, которая связана с антителом. В некоторых осуществления изобретения эпитопные детерминанты включают химически активные поверхностные группировки молекул, таких как аминокислоты, боковые цепи сахаров, фосфорил или сульфонил, и может в некоторых вариантах осуществления изобретения иметь специфичные трехмерные структурные характеристики и/или специфичные зарядные характеристики. В некоторых вариантах осуществления изобретения указано, что антитело специфично связывается с антигеном, если оно преимущественно распознает свой целевой антиген в сложной смеси белков и/или макромолекул. Указано, что антитело специфично связывается с антигеном, если константа диссоциации ≤10-7 или 10-8 М. В некоторых вариантах осуществления изобретения константа диссоциации может быть ≤10-9 М или ≤10-10 М.
В некоторых вариантах осуществления изобретения антитела и их антигенсвязывающие фрагменты, описанные в настоящем документе, включают набор CDR тяжелой цепи и легкой цепи, соответственно находящихся между набором каркасных областей (FR) тяжелой цепи и легкой цепи, которые обеспечивают поддержку CDR и определяют пространственные расположение CDR относительно друг друга. В контексте настоящего документа термин «набор CDR» относится к трем гипервариабельным областям V-области тяжелой или легкой цепей. Начиная от N-конца тяжелой или легкой цепи, эти области обозначены как «CDR1», «CDR2» и «CDR3», соответственно. Таким образом, антиген-связывающий сайт включает шесть CDR, содержащих набор CDR из каждой V-области тяжелой и легкой цепей. Полипептид, содержащий одну CDR (например, CDR1, CDR2 или CDR3), упоминается в данном документе как «молекулярная единица распознавания». Кристаллографический анализ ряда комплексов антиген-антитело показал, что аминокислотные остатки CDR образуют протяженные контакты с связанным антигеном, причем самый протяженный контакт с антигеном имеет CDR3 тяжелой цепи. Таким образом, молекулярные единицы распознавания несут основную ответственность за специфичность антиген-связывающего участка.
В контексте настоящего документа термин «набор FR» относится к четырем фланкирующим аминокислотным последовательностям, которые окружают CDR из набора CDR V-области тяжелой или легкой цепи. Некоторые остатки FR могут контактировать со связанным антигеном, однако FR в основном ответственны за укладку V-области в антиген-связывающий участок, в частности, остатки FR, непосредственно прилегающие к CDR. В FR некоторые аминокислотные остатки и некоторые структурные признаки являются высококонсервативными. Например, все последовательности V-областей содержат внутреннюю дисульфидную петлю примерно из 90 аминокислотных остатков. При укладке V-областей в антиген-связывающий участок, CDR представлены в виде выступающих петель, которые образуют антигенсвязывающие поверхности. Общепризнанно, что существуют консервативные структурные области FR, которые влияют на форму укладки петель CDR в некоторые «канонические» структуры, независимо от точной аминокислотной последовательности CDR. Кроме того, некоторые остатки FR, как известно, участвуют в нековалентных междоменных контактах, которые стабилизируют взаимодействие тяжелой и легкой цепей антитела.
Структуры и расположение вариабельных доменов иммуноглобулина можно определить по Kabat, Е.A. et al., Sequences of Proteins of Immunological Interest. 4th Edition. US Department of Health and Human Services. 1987, и обновлениям этого издания, доступным в интернете (immuno.bme.nwu.edu).
«Моноклональное антитело» относится к гомогенной популяции антител, где моноклональное антитело состоит из аминокислот (природных и неприродных), которые участвуют в избирательном связывании эпитопа. Моноклональные антитела являются высокоспецифичными, направленными против одного эпитопа. Термин «моноклональное антитело» охватывает не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но также их фрагменты (например, Fab, Fab', F(ab')2, Fv), одноцепочечные антитела (ScFv), их варианты, слитые белки, содержащие антиген-связывающий участок, гуманизированные моноклональные антитела, химерные моноклональные антитела и любую другую модифицированную конфигурацию иммуноглобулиновой молекулы, которая содержит антиген-связывающий фрагмент (участок распознавания эпитопа) с требуемой специфичностью и способностью связываться с эпитопом. Подразумевается, что антитело не имеет ограничений в отношение своего источника или способа, с помощью которого оно получено (например, с использованием гибридомы, фаговой селекции, рекомбинантной экспрессии, трансгенных животных и т.д.). Этот термин включает полноразмерные иммуноглобулины, а также фрагменты и т.д., описанные выше в определении термина «антитело».
Протеолитический фермент папаин преимущественно расщепляет молекулы IgG с образованием нескольких фрагментов, два из которых (F(ab)-фрагменты), каждый, содержат ковалентный гетеродимер, включающий интактный антиген-связывающий участок. Фермент пепсин способен расщеплять молекулы IgG с образованием нескольких фрагментов, включая F (ab')2-фрагмент, который содержит оба антиген-связывающих участка. Fv-фрагмент для использования в соответствии с некоторыми вариантами осуществления настоящего изобретения можно получить предпочтительным протеолитическим расщеплением IgM, а в редких случаях - молекул иммуноглобулинов IgG или IgA. Однако Fv-фрагменты чаще получают с использованием рекомбинантных способов, известных в данной области. Fv-фрагмент включает нековалентный VH::VL-гетеродимер, включающий антиген-связывающий участок, который сохраняет большую часть Способностей нативной молекулы антитела по распознаванию и связыванию антигена. Inbar et al. (1972) Proc. Nat. Acad. Sci. USA 69:2659-2662; Hochman et al. (1976) Biochem 5:2706-2710; и Ehrlich et al. (1980) Biochem 9:4091-4096.
В некоторых вариантах осуществления изобретения предусмотрены одноцепочечные Fv или scFv-антитела. Например, каппа-антитела (III et al., Prot. Eng. 10:949-57 (1997), миниантитела (Martin et al., EMBO J 13:5305-9 (1994), диантитела (Holliger et al., PNAS 90:6444-8 (1993) или Janusins (Traunecker et al., EMBO J 10:3655-59 (1991) и Traunecker et al., Int. J. Cancer Suppl. 7:51-52 (1992)), могут быть получены с использованием стандартных методов молекулярной биологии, следуя идее настоящей заявки относительно отбора антитела с требуемой специфичностью. В других вариантах осуществления изобретения могут быть получены биспецифичные или химерные антитела, которые охватывают лиганды настоящего изобретения. Например, химерное антитело может содержать CDR и каркасные области из различных антител, тогда как можно получить биспецифичные антитела, которые специфично связываются с CD40 через один связывающий домен и со второй молекулой через второй связывающий домен. Эти антитела могут быть получены рекомбинантными методами молекулярной биологии или могут быть физически конъюгированы друг с другом.
Одноцепочечный Fv(sFV)-полипептид представляет собой ковалентно связанный VH::VL-гетеродимер, который экспрессируется со слитого гена, включающего гены, кодирующие VH и VL, связанные кодирующим пептид линкером. Huston et al. (1988) Proc. Nat. Acad. Sci. USA 85 (16):5879-5883. Описан ряд способов для распознавания химических структур с целью превращения естественно агрегированных, но химически разделенных, легкой и тяжелой полипептидных цепей из V-области антитела в sFV-молекулу, которая будет укладываться в трехмерную структуру, по существу аналогичную структуре антиген-связывающего участка. См., например, патенты США №№5,091,513 и 5,132,405 авторов Huston et al.; и патент США №4,946,778 авторов Ladner et al.
В некоторых вариантах осуществления изобретения связывающее CD40 антитело, описанное в настоящем документе, находится в виде диантитела. Диантитела представляют собой мультимеры полипептидов, в которых каждый полипептид содержит первый домен, содержащий связывающую область легкой цепи иммуноглобулина, и второй домен, содержащий связывающую область тяжелой цепи иммуноглобулина, причем два домена соединены (например, пептидным линкером), но не способны связываться друг с другом с образованием антиген-связывающего участка: антиген-связывающий участков образован связыванием первого домена одного полипептида в мультимере со вторым доменом из другого полипептида в мультимере (WO94/13804).
dAb-фрагмент антитела состоит из VH-домена (Ward, Е.S. et al., Nature 341, 544-546 (1989)).
Если необходимо использовать биспецифичные антитела, они могут представлять собой обычные биспецифичные антитела, которые могут быть получены различными путями (Holliger, P. and Winter G. Current Opinion Biotechnol. 4, 446-449 (1993)), например, получены химическим способом или из гибридных гибридом, или могут представлять собой любой из фрагментов биспецифичного антитела, указанных выше. Диантитела и scFv могут быть сконструированы без Fc-области с использованием только вариабельных доменов с возможным уменьшением эффектов анти-идиотипической реакции.
Биспецифичные диантитела, в отличие от биспецифичных полноразмерных антител, могут также быть особенно полезны, поскольку они могут быть легко сконструированы и экспрессированы в Е. coli. Диантитела (и многие другие полипептиды, такие как фрагменты антител) с соответствующей специфичностью связывания могут быть легко отобраны из библиотек с использованием фагового дисплея (WO94/13804). Если одно плечо диантитела должно оставаться постоянным, например, иметь специфичность в отношение антигена X, то может быть изготовлена библиотека, в которой изменяется другое плечо, и отобрано антитело соответствующей специфичности. Биспецифичные полноразмерные антитела могут быть созданы с использованием метода конструирования антител «выступа в отверстии» (J.В.В. Ridgeway et al., Protein Eng., 9, 616-621, 1996).
В некоторых вариантах осуществления антитела, описанные в настоящем документе, могут быть предоставлены в виде UniBody®. UniBody® представляет собой IgG4-антитело с удаленной шарнирной областью (см. GenMab Utrecht, Нидерланды, см. также, например, US20090226421). Эта запатентованная технология создает стабильные антитела меньшего размера с ожидаемым терапевтическим окном, большим, чем у современных форматов коротких антител. IgG4-антитела считаются инертными и, следовательно, не взаимодействуют с иммунной системой. Полностью человеческие IgG4 антитела могут быть модифицированы путем удаления шарнирной области антитела с образованием фрагментов, составляющих половину молекулы, имеющих стабильность, отличную от соответствующего интактного IgG4 (GenMab, Утрехт). Сокращение молекулы IgG4 наполовину оставляет только одну область на UniBody®, которая может связываться с родственными антигенами (например, целевыми патогенами), и поэтому UniBody® моновалентно связывается только с одним сайтом на клетках-мишенях. Для некоторых антигенов на поверхности раковых клеток это моновалентное связывание не может стимулировать рост раковых клеток, который можно наблюдать при использовании двухвалентных антител, имеющих такую же антигенную специфичность, и, следовательно, технология UniBody® может обеспечить варианты лечения некоторых видов рака, которые могут быть устойчивы к лечению обычными антителами. Меньший размер UniBody® может быть весьма полезным при лечении некоторых форм рака, обеспечивая лучшее распределение молекул в крупных солидных опухолях и потенциально повышая эффективность.
В некоторых вариантах осуществления изобретения антитела по настоящему изобретению могут принимать форму наноантител. Наноантитело кодируется одним геном и эффективно продуцируются почти во всех прокариотических и эукариотических хозяевах, например, в Е. coli (см., например, патент США №6,765,087), плесневых грибах (например, в Aspergillus и Trichoderma) и в дрожжах (например, Saccharomyces, Kluyvermyces, Hansenula или Pichia (см., например, патент США №6,838,254). Производственный процесс является масштабируемым, и уже были получены многокилограммовые количества наноантител. Наноантитела могут быть составлены в виде готового к использованию раствора, имеющего длительный срок хранения. Способ Nanoclone (см., например, WO 06/079372) является запатентованным способом создания наноантител к заданной мишени на основе автоматизированного высокопропускного отбора В-клеток.
В некоторых вариантах осуществления изобретения анти-CD40 антитела или их антиген-связывающие фрагменты, описанные в данном документе, являются гуманизированными. Это понятие относится к химерной молекуле, обычно получаемой рекомбинантными методами, которая имеет антиген-связывающий участок от иммуноглобулина, принадлежащего любому биологическому виду за исключением человека, а остальную иммуноглобулиновую структуру молекулы на основе структуры и/или последовательности иммуноглобулина человека. Антиген-связывающий участок может содержать либо полноразмерные вариабельные домены, слитые с константными доменами, либо только CDR, пересаженные в соответствующие каркасные области в вариабельных доменах. Участки связывания эпитопа могут быть дикого типа или модифицированы одной или несколькими аминокислотными заменами. Этот подход исключает константную область в качестве иммуногена у человека, но остается возможность иммунного ответа на чужеродную вариабельную область (LoBuglio, A.F. et al., (1989) Proc Natl Acad Sci USA 86:4220-4224; Queen et al., PNAS (1988) 86:10029-10033; Riechmann et al., Nature (1988) 332:323-327). Иллюстративные способы гуманизации анти-CD40 антител, раскрытые в настоящем документе, включают способы, описанные в патенте США №7,462,697. Иллюстративные гуманизированные антитела по некоторым вариантам осуществления настоящего изобретения включают гуманизированные последовательности, приведенные в SEQ ID NO:9 и 10.
Другой подход ориентирован не только на получение константных областей из антител человека, а также и на модификацию вариабельных областей, для того чтобы максимально приблизить их к форме антител человека. Известно, что вариабельные области тяжелой и легкой цепей содержат три определяющие комплементарность области (CDR), которые изменяются в ответ на эпитопы и определяют способность связывания, фланкированные по бокам четырьмя каркасными областями (FR), которые относительно консервативны для конкретного биологического вида и, предположительно, обеспечивают удерживающий каркас для CDR. Когда получают не принадлежащие человеку антитела к конкретному эпитопу, вариабельные области могут быть «реконструированы» или «гуманизированы» пересаживанием (переносом) CDR из не принадлежащего человеку антитела в FR человеческого антитела, подлежащего модификации. Применение этого подхода к различным антителам было опубликовано в Sato, К., et al., (1993) Cancer Res 53:851-856. Riechmann, L, et al., (1988) Nature 332:323-327; Verhoeyen, M., et al., (1988) Science 239:1534-1536; Kettleborough, C.A., et al., (1991) Protein Engineering 4:773-3783; Maeda, H., et al., (1991) Human Antibodies Hybridoma 2:124-134; Gorman, S.D., et al., (1991) Proc Natl Acad Sci USA 88:4181-4185; Tempest, P.R., et al., (1991) Bio/Technology 9:266-271; Co, M.S., et al., (1991) Proc Natl Acad Sci USA 88:2869-2873; Carter, P., et al., (1992) Proc Natl Acad Sci USA 89:4285-4289; и Co, M.S. et al., (1992) J Immunol 148:1149-1154. В некоторых вариантах осуществления изобретения гуманизированные антитела сохраняют все последовательности CDR (например, гуманизированное мышиное антитело, которое содержит все шесть CDR из мышиных антител). В других вариантах осуществления изобретения гуманизированные антитела имеют одну или несколько CDR (одну, две, три, четыре, пять, шесть), которые изменены относительно исходного антитела, которые также называют одной или несколькими CDR, «полученными из» одной или нескольких CDR из исходного антитела.
В некоторых вариантах осуществления антителами по настоящему изобретению могут быть химерные антитела. В данном случае химерное антитело состоит из антиген-связывающий фрагмента анти-CD40 антитела, функционально связанного или иным образом слитого с гетерологичным Fc-участком другого антитела. В некоторых вариантах осуществления изобретения гетерологичный Fc-домен имеет человеческое происхождение. В других вариантах осуществления изобретения гетерологичной Fc-домен может относиться к классу Ig, отличному от родительского антитела, включая IgA (включая подклассы IgA1 и IgA2), IgD, IgE, IgG (включая подклассы IgG1, IgG2, IgG3 и IgG4) и IgM. В других вариантах осуществления изобретения гетерологичный Fc-домен может содержать СН2- и СН3-домены из одного или нескольких различных классов Ig. Как было указано выше для гуманизированных антител, анти-CD40 антиген-связывающий фрагмент химерного антитела может содержать только одну или несколько CDR из антител, описанных в настоящем документе (например, 1, 2, 3, 4, 5 или 6 CDR из антител, описанных в настоящем документе), или может содержать полный вариабельный домен (VL, VH или обе области).
В некоторых вариантах осуществления изобретения CD40-связывающее антитело содержит одну или несколько CDR из антител, описанных в данном документе. В связи с этим в некоторых случаях было показано, что может быть выполнен перенос только VHCDR3 антитела с сохранением требуемого специфичного связывания (Barbas et al., PNAS (1995) 92:2529-2533). См. также McLane et al., PNAS (1995) 92:5214-5218, Barbas et al., J. Am. Chem. Soc. (1994) 116:2161-2162.
В статье Marks et al. (Bio/Technology, 1992, 10:779-783) описаны способы получения репертуаров вариабельных доменов антител, в которых консенсусные праймеры, направленные на или примыкающие к 5'-концу вариабельного домена, используются в сочетании с консенсусными праймерами в третьей каркасной области генов VH-области человека, чтобы обеспечить репертуар вариабельных доменов VH-области, в которых отсутствует CDR3. В статье Marks et al. дополнительно описано, как этот репертуар может быть объединен с CDR3 конкретного антитела. С помощью аналогичных методик, последовательности CDR3, полученные из описываемых антител, могут быть перетасованы с репертуаром VH-или VL-доменов, в которых отсутствует CDR3, и перетасованные полноразмерные VH- и VL-домены, объединенные с родственными им VL- или VH-доменами, дают антитело или его антиген-связывающий фрагмент, которые связывают CD40. Этот репертуар затем может быть представлен в подходящей хозяйской системе, такой как система фагового дисплея из WO92/01047, обеспечивая возможность отбора подходящих антитела или антиген-связывающих фрагментов. Репертуар может состоять по меньшей мере из примерно 104 индивидуальных членов и до большего на несколько порядков числа, например, от примерно 106 до 108 или до 1010, или большего числа членов. Аналогичные методики перетасовки или комбинаторные методики также раскрыты Stemmer (Nature, 1994, 370:389-391), который описывает методику в отношение гена β-лактамазы, но отмечает, что этот подход может быть использован для получения антител.
Дополнительной альтернативой является создание новых VH-или VL-областей, несущих одну или несколько полученных из CDR последовательностей из описанных в настоящем документе вариантов осуществления изобретения с использованием случайного мутагенеза одного или нескольких выбранных VH- и/или VL-генов для получения мутаций во всем вариабельном домене. Такая методика описана в Gram et al. (1992, Proc. Natl. Acad. Sci., USA, 89:3576-3580), где использовали подверженную ошибкам ПЦР. Другим способом, который может использоваться, является прямой мутагенез CDR-областей VH- или VL-генов. Такие методики раскрыты в Barbas et al. (1994, Proc. Natl. Acad. Sci., USA, 91:3809-3813) и Schier et al. (1996, J. Mol. Biol. 263:551-567).
В некоторых вариантах осуществления изобретения конкретные VH и/или VL антител, описанных в настоящем изобретении, могут использоваться для скрининга библиотеки комплементарных вариабельных доменов для идентификации антител с требуемыми свойствами, такими как повышенная аффинность к CD40. Такие способы описаны, например, в Portolano et al., J. Immunol. (1993) 150:880-887; Clarkson et al., Nature (1991) 352:624-628.
Также могут использоваться другие способы для смешивания и сопоставления CDR с целью идентификации антител, имеющих требуемую активность связывания, например, связывания с CD40. Например: Klimka et al., British Journal of Cancer (2000) 83:252-260 описывают процесс скрининга с использованием библиотеки VL мыши и VH человека с CDR3 и FR4, сохраняющимися от мышиной VH. После получения антител, VH скринировали против библиотеки VL человека для получения антител, которые связывают антиген. Beiboer et al., J. Mol. Biol. (2000) 296:833-849 описывают процесс скрининга с использованием библиотеки полноразмерных тяжелых цепей мышиных антител и легких цепей антител человека. После получения антител, одна VL была объединена с библиотекой VH человека с сохраненными мышиными CDR3. Были получены антитела, способные связывать антиген. Rader et al., PNAS (1998) 95:8910-8 915 описывают процесс, аналогично вышеописанному Beiboer et al.
Эти только что описанные методики сами по себе известны в данной области. Однако специалист в данной области будет способен использовать такие методики для получения антител или их антиген-связывающих фрагментов в соответствии с несколькими вариантами осуществления изобретения, описанными в настоящем документе, используя стандартную методологию в данной области.
Также в настоящем документе раскрыт способ получения антиген-связывающего домена антитела, специфичного к CD40-антигену, включающий: предоставление путем добавления, делеции, замены или инсерции одной или нескольких аминокислот в аминокислотной последовательности VH-домена, приведенного в данном документе, причем VH-домен является вариантом аминокислотной последовательности VH-домена; необязательно, объединение полученного таким образом VH-домена с одним или несколькими VL-доменами; и тестирование VH-домена или VH/VL-комбинации или комбинаций с целью идентификации специфичного связывающего элемента или антиген-связывающего домена антитела, специфичных к CD40 и необязательно с одним или несколькими требуемыми свойствами. VL домены могут иметь аминокислотную последовательность, которая по существу, соответствует приведенной в настоящем документе. Может использоваться аналогичный способ, в котором один или несколько вариантов последовательностей VL-домена, описанных в настоящем документе, объединены с одним или несколькими VH-доменами.
Эпитоп, который «специфично связывается» или «предпочтительно связывается» (эти термины используются в настоящем документе взаимозаменяемо) с антителом или полипептидом, представляет собой термин, хорошо известный в данной области, и способы определения такого специфичного или предпочтительного связывания также хорошо известны в данной области. Считается, что молекула проявляет «специфичное связывание» или «предпочтительное связывание», если она реагирует или ассоциирует более часто, более быстро, более продолжительное время и/или с большей аффинностью с конкретными клеткой или веществом, чем с альтернативными клеткой или веществом. Антитело «специфично связывается» или «предпочтительно связывается» с мишенью, если оно связывается с большей аффинностью, авидностью, более легко и/или на более длительное время, чем оно связывается с другими веществами. Например, антитело, которое специфично или предпочтительно связывается с CD40-эпитопом, представляет собой антитело, которое связывает один эпитоп CD40 с большей аффинностью, авидностью, более легко и/или на более продолжительное время, чем оно связывается с другими эпитопами CD40 или эпитопами не CD40. Читая это определение, также следует понимать, что, например, антитело (или элемент или эпитоп), которые специфично или предпочтительно связываются с первой мишенью может или нет специфично или предпочтительно связываться со второй мишенью. Как таковое, «специфичное связывание» или «предпочтительное связывание» не обязательно требуют (хотя могут включать) эксклюзивное связывание. Как правило, но не обязательно, ссылка на связывание означает предпочтительное связывание.
Иммунологические связывание обычно относится к нековалентным типам взаимодействий, которые происходят между молекулой иммуноглобулина и антигеном, к которой специфичен иммуноглобулин, например, в качестве иллюстрации, а не ограничения, в результате электростатического, ионного, гидрофильного и/или гидрофобного притяжения или отталкивания, стерических сил, водородных связей, ван-дер-Ваальсовых связей и других взаимодействий. Сила или аффинность взаимодействий при иммунологическом связывании могут быть выражены в виде константы диссоциации (Kd) взаимодействия, причем меньшая Kd представляет более высокую аффинность. Свойства иммунологического связывания отдельных полипептидов можно количественно оценить с использованием способов, хорошо известных в данной области. Один такой способ предусматривает измерение скорости образования и диссоциации комплекса между антиген-связывающим участком и антигеном, причем эти показатели зависят от концентрации образующих комплекс партнеров, аффинности взаимодействия и от геометрических параметров, которые в равной степени влияют на скорость в обоих направлениях. Таким образом, обе константы, «константа образования комплекса» (Kon) и «константа распада комплекса» (Koff), могут быть определены путем расчета концентраций и фактических показателей ассоциации и диссоциации. Соотношение Koff/Kon позволяет исключить все параметры, не связанные с аффинностью, и, таким образом, оно равно константе диссоциации Kd. См. для общего описания Davies et al. (1990) Annual Rev. Biochem. 59:439-473.
В некоторых вариантах осуществления изобретения, анти-CD40 антитела, описанные в настоящем документе, имеют аффинностью примерно 100, 150, 155, 160, 170, 175, 180, 185, 190, 191, 192, 193, 194, 195, 196, 197, 198 или 199 пМ, а в некоторых вариантах осуществления изобретения антитела могут иметь даже более высокую аффинность к CD40.
Термин «иммунологически активный» в отношение эпитопа, являющегося или «остающегося иммунологически активным», относится к способности антитела (например, анти-CD40-антитела) связываться с эпитопом в различных условиях, например, после того, как эпитоп находился в восстанавливающих и денатурирующих условиях.
Антитело или его антиген-связывающий фрагмент по некоторым предпочтительным вариантам осуществления настоящей заявки могут представлять собой конкурирующие за связывание с CD40 с любым описанным в настоящем документе антителом, которое как (i) специфично связывается с антигеном, так и (ii) содержит VH-и/или VL-домен, описанные в настоящем документе, или содержит VHCDR3, описанную в настоящем документе, или любой их вариант. Конкуренция между антителами может быть легко проанализирована in vitro, например, с помощью ELISA и/или путем присоединения определенной репортерной молекулы к одному антителу (мечения), которое может быть обнаружено в присутствии других немеченых антител, позволяя идентифицировать конкретные антитела, которые связывают один эпитоп или перекрывающеся эпитопы. Таким образом, изобретение относится к специфичному антителу или его антиген-связывающему фрагменту, содержащим антиген-связывающий участок человеческого антитела, который конкурирует с описанным в настоящем документе антителом, которое связывается с CD40.
В этом отношении в контексте настоящего документа термины «конкурирует с», «ингибирует связывание» и «блокирует связывание» (например, в отношении ингибирования/блокирования связывания CD40L с CD40 или в отношении ингибирования/блокирования связывания анти-CD40 антитела с CD40) являются взаимозаменяемыми и охватывают как частичное, так и полное ингибирование/блокирование. Ингибирование и блокирование также включают любое измеряемое снижение связывания CD40 с CD40L при контакте с анти-CD40-антителом, описанным в настоящем документе, по сравнению с лигандом, не контактирующим с анти-CD40-антителом, например, блокирование связывания CD40L с CD40 по меньшей мере на примерно 10%, 20%, 30%, 40%, 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
Константные области иммуноглобулинов более консервативны, чем последовательности вариабельных областей, и отвечают за связывание ряда природных белков, вызывая важные биохимические события. У людей существует пять различных классов антител, включая IgA (включая субклассы IgA1 и IgA2), IgD, IgE, IgG (включая субклассы IgG1, IgG2, IgG3 и IgG4) и IgM. Эти классы антител отличаются своими константными областями, хотя небольшие различия могут существовать и в V-области.
Fc-область антитела взаимодействует с рядом Fc-рецепторов и лигандов, обеспечивая ряд важных функциональных возможностей, называемых эффекторными функциями. В случае IgG, Fc-область содержит иммуноглобулиновые домены СН2 и СН3 и N-концевую шарнирную область, переходящую в СН2. Ключевым семейством Fc-рецепторов для IgG-класса являются гамма Fc-рецепторы (FcγR). Эти рецепторы опосредуют взаимодействие между антителами и клеточным иммунным ответом (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12:181-220; Ravetch et al., 2001, Annu Rev Immunol 19:275-290). В организме человека семейство этих белков включает FcγRI (CD64), включая изоформы FcγRIa, FcγRIb и FcγRIc; FcγRII (CD32), включая изоформы FcγRIIa (в том числе аллотипы Н131 и R131), FcγRIIb (в том числе FcγRIIb-1 и FcγRIIb-2), и FcγRIIc и FcγRIII (CD16), включая изоформы FcγRIIIa (в том числе аллотипы V158 и F158) и FcγRIIIb (в том числе аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2) (Jefferis и et al., 2002, Immunol Lett 82:57-65.). Эти рецепторы, как правило, имеют внеклеточный домен, который опосредует связывание с Fc, мембранный участок и внутриклеточный домен, который может опосредовать некоторые сигнальные события в клетке. Эти рецепторы экспрессируются в различных иммунных клетках, включая моноциты, макрофаги, нейтрофилы, дендритные клетки, эозинофилы, тучные клетки, тромбоциты, В-клетки, большие гранулярные лимфоциты, клетки Лангерганса, природные клетки-киллеры (NK) и Т-клетки. Образование комплекса Fc/FcγR привлекает эти эффекторные клетки к сайтам связывания антигена, как правило, приводя к сигнальным событиям в клетках и важным последующим иммунным ответам, таким как высвобождение медиаторов воспаления, активация В-клеток, эндоцитоз, фагоцитоз и цитотоксическая атака.
Способность опосредовать цитотоксические и фагоцитарные эффекторные функции является возможным механизмом, посредством которого антитела уничтожают клетки-мишени. Клеточно-опосредованная реакция, при которой неспецифичные цитотоксические клетки, экспрессирующие FcγR, распознают связанное антитело на клетке-мишени и впоследствии вызывают лизис клетки-мишени, называют антитело-зависимой клеточно-опосредованной цитотоксичностью (ADCC) (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12:181-220; Ghetie et al., 2000, Annu Rev Immunol 18:739-766; Ravetch et al., 2001, Annu Rev Immunol 19:275-290). Клеточно-опосредованная реакция, при которой неспецифичные цитотоксические клетки, экспрессирующие FcγR, распознают связанное антитело на клетке-мишени и затем вызывают фагоцитоз клетки-мишени, называют антитело-зависимым клеточным фагоцитозом (ADCP). Все FcγR связывают одну область Fc, на N-конце Cg2(СН2)-домена и предшествующей шарнирной области. Это взаимодействие хорошо охарактеризовано структурно (Sondermann et al., 2001, J Mol Biol 309:737-749), и были решены несколько структур человеческого Fc, связанного с внеклеточным доменом FcγRIIIb человека (код доступа в PDB - 1Е4К) (Sondermann et al., 2000, Nature 406:267-273.) (коды доступа в PDB - 1IIS и 1IIX) (Radaev et al., 2001, J Biol Chem 276:16469-16477.)
Различные субклассы IgG имеют различные аффинности к FcγR, причем IgG1 и IgG3, как правило, связываются с рецепторами значительно лучше, чем IgG2 и IgG4 (Jefferis et al., 2002, Immunol Lett 82:57-65). Bee FcγR связывают одну и ту же область на IgG Fc, но с различной аффинностью: FcγRI, связывающийся с высокой аффинностью, имеет Kd для IgG1 10-8 М-1, в то время как низкоаффинные рецепторы FcγRII и FcγRIII обычно связываются с Kd, равной 10-6 и 10-5, соответственно. Внеклеточные домены FcγRIILa и FcγRIIIb идентичны на 96%, однако FcγRIIIb не имеет внутриклеточного сигнального домена. Кроме того, хотя FcγRI, FcγRIIa/c и FcγRIIIa являются положительными регуляторами запускаемой иммунным комплексами активации, отличающимися тем, что они имеют внутриклеточный домен, который имеет иммунорецепторные тирозин-активируемый мотив (ITAM), FcγRIIb имеет иммунорецепторный тирозин-ингибируемый мотив (ITIM) и, следовательно, является ингибирующим. Поэтому, первые рецепторы называют активирующими рецепторами, a FcγRIIb называют ингибирующим рецептором. Рецепторы также отличаются по профилю и уровню экспрессии на различных иммунных клетках. Еще один уровень сложности добавляет наличие в протеоме человека ряда полиморфизмов в FcγR. Особенно актуальным полиморфизмом, имеющим клиническую значимость, является V158/F158 в FcγRIIIa. IgG1 человека имеет более высокую аффинность в отношении аллотипа V158, чем в отношении аллотипа F158. Было показано, что это различие в аффинности и, предположительно, его влияние на ADCC и/или ADCP являются существенным фактором в эффективности анти-CD20 антитела ритуксимаба (Rituxan®, зарегистрированная торговая марка компании IDEC Pharmaceuticals Corporation). Пациенты с аллотипом V158 положительно отвечают на лечение ритуксимабом, однако, у пациентов с низкоаффинным аллотипом F158 наблюдается плохой ответ (Cartron et al., 2002, Blood 99:754-758). Приблизительно 10-20% людей являются гомозиготами V158A/158, 45% - гетерозиготами V158/F158, а 35-45% людей являются гомозиготами F158/F158 (Lehrnbecher et al., 1999, Blood 94:4220-4232; Cartron et al., 2002, Blood 99:754-758). Таким образом, 80-90% людей имеют плохой ответ, так как они имеют по меньшей мере один аллель F158 FcγRIIIa.
Fc-область также участвует в активации каскада комплемента. В классическом пути активации системы комплемента, С1 связывается своими C1q-субъединицами с Fc-фрагментами IgG или IgM, которые образовали комплекс с антигеном(-ами). В некоторых вариантах осуществления изобретения, модификации Fc-области включают модификации, которые изменяют (либо усиливают, либо снижают) способность специфичного к CD40 антитела, описанного в настоящем документе, к активации системы комплемента (см., например, патент США 7,740,847). Для оценки активации комплемента можно провести анализ комплемент-зависимой цитотоксичности (CDC) (см., например, Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996)).
Таким образом, в некоторых вариантах осуществления настоящее изобретение относится к анти-CD40 антителам, имеющим модифицированную Fc-область с измененными функциональными свойствами, такими как уменьшение или увеличение CDC, ADCC, или ADCP-активности, или повышенную аффинность связывания с конкретным FcγR или увеличение времени полужизни в сыворотке. Другие модифицированные Fc-области, предусмотренные в настоящем документе, описаны, например, в выданных патентах США 7,317,091; 7,657,380; 7,662,925; 6,538,124; 6,528,624; 7,297,775; 7,364,731; опубликованных патентных заявках США US2009092599; US20080131435; US20080138344; и опубликованных международных патентных заявках WO2006/105338; WO2004/063351; WO2006/088494; WO2007/024249.
Таким образом, в некоторых вариантах осуществления изобретения вариабельные домены антитела с требуемой специфичностью связывания слиты с последовательностями константной области иммуноглобулина. В некоторых вариантах осуществления изобретения слияние осуществляют с константным доменом тяжелой цепи Ig, содержащим по меньшей мере часть шарнирной области, CH2- и CH3-области. Предпочтительно, чтобы по меньшей мере в одной из слитых конструкций присутствовала первая константная область тяжелой цепи (CH1), содержащая участок, необходимый для связывания легкой цепи. ДНК, кодирующую слитые конструкции тяжелой цепи иммуноглобулина и, если необходимо, легкую цепь иммуноглобулина, встраивают в отдельные экспрессирующие векторы и совместно трансфицируют в подходящую клетку-хозяина. Это обеспечивает большую гибкость при корректировке взаимных соотношений трех полипептидных фрагментов в вариантах осуществления, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, дают оптимальный выход требуемого биспецифичного антитела. Однако, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам, или когда соотношения не оказывают значительного влияния на выход требуемого сочетания цепей, можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один вектор экспрессии.
Антитела по изобретению (и их антигенсвязывающие фрагменты и варианты) также могут быть модифицированы для включения эпитопа-метки (тэга) или метки, например, для использования при очистке или для диагностики. Для получения конъюгатов антител существует большое число связывающих групп, известных в данной области, включая, например, описанные в патенте США №5,208,020 или европейском патенте ЕР0425235 В1, а также в статье Chari et al., Cancerc Research 52:127-131 (1992). Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, пептидазолабильные и эстеразолабильные группы, раскрытые в вышеуказанных патентах, причем дисульфидные и тиоэфирные группы являются предпочтительными.
В другом предусмотренном варианте осуществления изобретения, специфичное к CD40 антитело, описанное в настоящем документе, может быть конъюгировано или функционально связано с другим терапевтическим соединением, именуемым в настоящем документе конъюгатом. Конъюгат может представлять собой цитотоксический агент, химиотерапевтический агент, цитокин, анти-ангиогенный агент, ингибитор тирозинкиназы, токсин, радиоизотоп или другой терапевтически активный агент. Химиотерапевтические агенты, цитокины, антиангиогенные агенты, ингибиторы тирозинкиназ и другие терапевтические агенты были описаны выше, и все эти вышеуказанные терапевтические агенты могут применяться в качестве конъюгатов антител.
В альтернативном варианте осуществления изобретения антитело конъюгировано или функционально связано с токсином, включая, но не ограничиваясь этим, низкомолекулярные токсины и ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты. Низкомолекулярные токсины включают, но не ограничиваются этим, сапорин (Kuroda К, et al., The Prostate 70:1286-1294 (2010); Lip, WL. et al., 2007 Molecular Pharmaceutics 4:241-251; Quadros EV., et al., 2010 Mol Cancer Ther; 9(11); 3033-40; Polito L., et al. 2009 British Journal of Haematology, 147, 710-718), калихеамицин, майтанзин (патент США №5,2080,20), трихотен и СС1065. Токсины, включают, но не ограничиваются этим, РНКазы, гелонин, энедиины, рицин, абрин, дифтерийный токсин, холерный токсин, гелонин, экзотоксин Pseudomonas (РЕ40), токсин Shigella, токсин Clostridium perfringens и противовирусный белок из лаконоса.
В одном варианте осуществления изобретения антитело или его антиген-связывающий фрагмент по изобретению конъюгированы с одной или несколькими молекулами майтанзиноидов. Майтанзиноиды являются ингибиторами митоза, которые действуют, ингибируя полимеризацию тубулина. Майтанзин был впервые выделен из восточно-африканского кустарника Maytenus serrata (патент США №3,896,111). Впоследствии было обнаружено, что некоторые микроорганизмы также производят майтанзиноиды, такие как майтанзинол и сложные эфиры С-3 майтанзинола (патент США №4,151,042). Синтетический майтанзинол и его производные и аналоги раскрыты, например, в патентах США №№4,137,230; 4,248,870; 4,256,746; 4,260,608; 4,265,814; 4,294,757; 4,307,016; 4,308,268; 4,308,269; 4,309,428; 4,313,946; 4,315,929; 4,317,821; 4,322,348; 4,331,598; 4,361,650; 4,364,866; 4,424,219; 4,450,254; 4,362,663 и 4,371,533. Иммуноконъюгаты, содержащие майтанзиноиды, и их терапевтическое применение описаны, например, в патентах США №№5,208,020, 5,416,064 и в европейском патенте ЕР 0 425 235 В1. В статье Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описаны иммуноконъюгаты, содержащие майтанзиноид, названный DM1, связанный с моноклональным антителом С242, направленным против колоректального рака человека. Было обнаружено, что конъюгат является чрезвычайно цитотоксичным в отношении культуры клеток рака толстой кишки и показывал противоопухолевую активность в in vivo анализе роста опухоли.
Конъюгат антитело-майтанзиноид получают путем химического связывания антитела с молекулой майтанзиноида без существенного снижения биологической активности либо антитела, либо молекулы майтанзиноида. Показано, что в среднем 3-4 конъюгированных молекулы майтанзиноида на молекулу антитела эффективно повышают цитотоксичность в отношении клеток-мишеней без негативного влияния на функцию или растворимость антитела, хотя ожидается, что даже одна молекула токсина на антитело усиливает цитотоксичность по сравнению с использованием неконъюгированного антитела. Майтанзиноиды хорошо известны в данной области и могут быть синтезированы известными способами или выделены из природных источников. Подходящие майтанзиноиды описаны, например, в патенте США №5,208,020 и в других патентах и непатентных публикациях, указанных выше. Предпочтительными майтанзиноидами являются майтанзинол и аналоги майтанзинола, модифицированные по ароматическому кольцу или по другим позициям молекулы майтанзинола, такие как различные сложные эфиры майтанзинола.
Другой представляющий интерес конъюгат содержит антитело, конъюгированное с одной или несколькими молекулами калихеамицина. Калихеамициновое семейство антибиотиков способно генерировать разрывы в двухцепочечной ДНК при концентрациях ниже пикомолярных. Структурные аналоги калихеамицина, которые могут использоваться, приведены в Hinman et al., 1993, Cancer Research 53:3336-3342; Lode et al., 1998, Cancer Research 58:2925-2928; патенте США №5,714,586; патенте США №5,712,374; патенте США №5,264,586; патенте США №5,773,001. Аналоги доластатина 10, такие как ауристатин Е (АЕ) и монометилауристатин Е (ММАЕ), могут применяться в качестве конъюгатов для раскрытых в настоящем документе антител' или их вариантов (Doronina et al., 2003, Nat Biotechnol 21 (7):778-84; Francisco et al., 2003 Blood 102(4):1458-65). Ферментативно-активные токсины, которые могут использоваться, включают без ограничения А-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки лаконоса американского (Phytolaca americana) (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. См., например, РСТ WO93/21232. Настоящее изобретение дополнительно предусматривает варианты осуществления, в которых конъюгат или слияние получают между CD40-специфичным антителом, описанным в настоящем изобретении, и соединением, обладающим нуклеолитической активностью, например, рибонуклеазой или ДНК эндонуклеазой, такой как дезоксирибонуклеаза (ДНКаза).
В альтернативном варианте осуществления изобретения раскрытое в настоящем документе антитело может быть конъюгировано или функционально соединено с радиоактивным изотопом, образуя радиоконъюгат. Для получения конъюгированных с радиоактивным изотопами антител доступны различные радиоактивные изотопы. Примеры включают, но не ограничены ими, 90Y, 123I, 125I, 131I, 186Re, 188Re, 211At и 212Bi.
В некоторых других вариантах осуществления изобретения антитела, описанные в настоящем документе, могут быть конъюгированы с терапевтической группой, такой как цитотоксин (например, цитостатическим или цитоцидным агентом), терапевтический агент или радиоактивный элемент (например, альфа-излучатели, гамма-излучатели и т.д.). Цитотоксин или цитотоксический агент представляет собой любой агент, который является пагубным для клеток. Примеры цитотоксинов включают паклитаксел/паклитаксол, цитохалазин В, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин и их аналоги и гомологи. Один предпочтительный примерный цитотоксин представляет собой сапорин (доступный от Advanced Targeting Systems, San Diego, CA). Терапевтические агенты, включают, но не ограничены этим, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил, декарбазин), алкилирующие агенты (например, мехлорэтамин, тиотепу, хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромоманитол, стрептозотоцин, митомицин С и цис-дихлордиаминплатину (II) (DDP) цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин), блеомицин, митрамицин и антрамицин (АМС)), а также антимитотические агенты (например, винкристин и винбластин).
Более того, специфичное к CD40 антитело (включая его функциональный фрагмент, указанный в настоящем документе, такой как антиген-связывающий фрагмент) может в некоторых вариантах осуществления изобретения быть конъюгирован с терапевтическими группами, такими как радиоактивные материалы или макроциклические хелатирующие соединения, пригодные для конъюгирования ионов радиоактивных металлов. В некоторых вариантах осуществления изобретения макроциклическим хелатирующим соединением является 1,4,7,10-тетраазациклсдодекан-N,N',N",N"'-тетрауксусная кислота (DOTA), которая может быть присоединена к антителу через линкерную молекулу. Такие линкерные молекулы известны в данной области и описаны в Denardo et al., 1998, Clin Cancer Res. 4:2483-90; Peterson et al., 1999, Bioconjug. Chem. 10:553; и Zimmerman et al., 1999, Nucl. Med. Biol. 26:943-50.
В еще одном варианте осуществления изобретения антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) для предварительного «мечения» опухоли, когда конъюгат антитела с рецептором вводят пациенту с последующим удалением несвязанного конъюгата из кровотока, используя очищающий агент, а затем вводят «лиганд» (например, авидин), который конъюгирован с цитотоксическим агентом (например, радионуклидом). В альтернативном варианте осуществления изобретения антитело конъюгировано или функционально соединено с ферментом для использования антителозависимой фермент-опосредованной пролекарственной терапии (ADEPT). ADEPT можно использовать для конъюгирования или функционального связывания антитела с активирующим пролекарственное соединение ферментом, который превращает пролекарственное соединение (например, пептидильный химиотерапевтический агент, см. РСТ WO 81/01 145) в активное противораковое лекарственное соединение. См., например, РСТ WO 88/07378 и патент США №4,975,278. Ферментный компонент иммуноконъюгата, подходящий для использования в ADEPT, включает любой фермент, способный таким образом действовать на пролекарственное соединение, чтобы превратить его в более активную цитотоксичную форму. Ферменты, которые подходят для применения в этом способе и родственных вариантах осуществления, включают, но не ограничены этим, щелочную фосфатазу, которая пригодна для превращения фосфатсодержащих пролекарств в свободные лекарственные средства; арилсульфатазу, которая пригодна для превращения сульфатсодержащих пролекарств в свободные лекарственные средства; цитозиндезаминазу, которая пригодна для превращения нетоксичного 5-фторцитозина в противораковое лекарственное средство, 5-фторурацил; протеазы, такие как протеаза из Serratia, термолизин, субтилизин, карбоксипептидазы и катепсины (такие, как катепсины В и L), которые пригодны для превращения пептидсодержащих пролекарств в свободные лекарственные средства; D-аланилкарбоксипептидазы, которые пригодны для превращения пролекарств, которые содержат D-аминокислотные заместители; расщепляющие углеводы ферменты, такие как β-галактозидаза и нейраминидаза, которые пригодны для превращения гликозилированных пролекарств в свободные лекарственные средства; β-лактамазу, которая пригодна для превращения лекарственных средств, модифицированных с помощью β-лактамов, в свободные лекарственные средства; и пенициллинамидазы, такие как пенициллин-V-амидаза и пеницилин-G-амидаза, которые пригодны для превращения лекарственных средств, модифицированных по атомам азота аминогруппы с помощью феноксиацетильных или фенилацетильных групп, соответственно, в свободные лекарственные средства. В альтернативном варианте для превращения пролекарственных средств в свободные лекарственные средства можно использовать антитела с ферментативной активностью, также известные как «абзимы» (см, например, Massey, 1987, Nature 328:457-458). Конъюгаты антитело-абзим можно получить для доставки абзима в популяцию опухолевых клеток.
Иммуноконъюгаты могут быть созданы с использованием множества бифункциональных агентов для сшивания белков, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (таких как диметиладипимидат-HCl), активные эфиры (такие как дисукцинимидил суберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис-(п-азидобензоил)гександиамин), бис-диазониевые производные (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бифункциональные фторсодержащие соединения (такие как 1,5-дифторо-2,4-динитробензол). Особо предпочтительные связывающие агенты включают N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 [1978]) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для создания дисульфидной связи. Линкер может представлять собой «расщепляемый линкер», способствующий высвобождению одного или нескольких расщепляемых компонентов. Например, можно использовать кислотолабильный линкер (Cancer Research 52:127-131 (1992); патент США №5,208,020).
Другие модификации антител (и полипептидов) по настоящему изобретению, также предусмотрены в данном документе. Например, антитело может быть присоединено к разнообразным небелковым молекулам, например, полиэтиленгликолю, полипропиленгликолю, полиоксиалкиленам или сополимерам полиэтиленгликоля и полипропиленгликоля. Антитело также может быть заключено в микрокапсулы, полученные, например, методами коацервации или путем межфазной полимеризации (например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы, и полиметилметакрилатные микрокапсулы, соответственно) в коллоидных системах доставки лекарственных средств (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980).
«Носители» в контексте настоящего изобретения включают фармацевтически приемлемые носители, эксципиенты или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, подвергаемых их воздействию в используемых дозах и концентрациях. Часто физиологически приемлемый носитель представляет собой водный раствор с подведенным с помощью буфера pH. Примеры физиологически приемлемых носителей включают буферы, такие как фосфатный, цитратный и на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (менее 10 аминокислотных остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахарные спирты, такие как маннит и сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как полисорбат 20 (TWEEN™), полиэтиленгликоль (ПЭГ) и полоксамеры (PLURONICS™), и т.п.
Как указано в настоящем документе, антитела по настоящему изобретению активируют CD40-сигнальный путь в опухолевых клетках, активируют дендритные клетки и иммунный надзор, активируют антителозависимую клеточную цитотоксичность (ADCC) против опухолевых клеток, блокируют связывание CD40 с CD40L, имеют CD40-агонистическую активность, активируют антиген-презентирующие клетки, стимулируют высвобождение цитокинов из антиген-презентирующих клеток, индуцируют апоптоз опухолевых клеток, ингибируют пролиферацию опухолевых клеток, убивают опухолевые клетки посредством индукции эффекторных функций, в том числе, но не ограничиваясь этим, ADCC, CDC и ADCP, стимулируют противоопухолевые Т-клеточные ответы, снижают размер развитых опухолей и ингибируют резистентные к ритуксимабу опухоли. Антитела, описанные в настоящем документе, могут иметь или индуцировать комбинацию любого одного или нескольких из этих признаков или функций. Требуемые функциональные свойства анти-CD40-антител могут быть оценены с использованием различных способов, известных специалистам, таких как методы анализа аффинности/связывания (например, поверхностный плазмонный резонанс, методы анализа конкурентного ингибирования); методы анализа цитотоксичности, методы анализа жизнеспособности клеток, методы анализа пролиферации, активации или дифференцировки клеток, методы анализа ADCC и CDC, методы анализа другой клеточной активности, являющейся результатом событий CD40-сигнального пути (например, фосфорилирование STAT3, продукция цитокинов, включая IL-1, IL-6, IL-8, IL-10, IL-12, TNF-альфа и MIP1-альфа) и методы анализа ингибирования роста раковых клеток и/или опухоли с использованием in vitro или in vivo моделей. В других методах анализа может исследоваться способность антител, описанных в настоящем документе, блокировать нормальное связывание CD40L с CD40 или CD40-опосредованные ответы, такие как передача сигнала в клетке, активация клеток (например, активация иммунных клеток, пролиферация; активация антиген-презентирующих клеток (например, дендритных клеток, В-клеток, макрофагов) и методы анализа созревания клеток), иммунные реакции (в том числе клеточный и гуморальный ответ) и т.д. Также может быть проверено воздействие антител, описанных в настоящем документе, на интернализацию CD40, in vitro и in vivo эффективность и т.д. Такие методы анализа могут быть выполнены с использованием хорошо отработанных протоколов, известных опытному специалисту (см., например, Current Protocols in Molecular Biology (Greene Publ. Assoc. Inc. & John Wiley & Sons, Inc., NY, NY); Current Protocols in Immunology (Edited by: John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober 2001 John Wiley & Sons, NY, NY), или доступных в продаже наборов.
Настоящее изобретение дополнительно относится в некоторых вариантах осуществления к выделенной нуклеиновой кислоте, кодирующей антитело или его антиген-связывающий фрагмент, описанные в настоящем документе, например, к нуклеиновой кислоте, которая кодирует CDR или VH- или VL-домены, описанные в настоящем документе. Нуклеиновые кислоты включают ДНК и РНК. Эти и другие варианты осуществления изобретения могут включать полинуклеотиды, кодирующие антитела, которые связываются c CD40, описанные в настоящем документе. Термин «выделенный полинуклеотид» в контексте настоящего изобретения означает полинуклеотид геномного, кДНК или синтетического происхождения или их комбинацию, причем в силу своего происхождения выделенный полинуклеотид (1) не ассоциирован со всем или с частью полинуклеотида, в котором выделенный полинуклеотид находится в природе, (2) связан с полинуклеотидом, с которым он не связан в природе, или (3) не встречается в природе как часть более крупной последовательности.
Термин «функционально связанный» означает, что компоненты, к которым термин применяется, взаимосвязаны таким образом, который позволяет им выполнять присущие им функции в соответствующих условиях. Например, регулирующие транскрипцию последовательности, «функционально связанные» с последовательностью, кодирующей белок, лигированы с ней таким образом, что экспрессия последовательности, кодирующей белок, достигается в условиях, совместимых с транскрипционной активностью регуляторных последовательностей.
Термин «регуляторная последовательность» в контексте настоящего изобретения относится к полинуклеотидным последовательностям, которые могут влиять на экспрессию, процессинг или внутриклеточную локализацию кодирующих последовательностей, с которыми они лигированы или функционально связаны. Природа таких регуляторных последовательностей может зависеть от организма-хозяина. В конкретных вариантах осуществления изобретения, последовательности, регулирующие транскрипцию у прокариот, могут включать промотор, сайт связывания рибосомы, и последовательность терминации транскрипции. В других конкретных вариантах осуществления изобретения последовательности, регулирующие транскрипцию у эукариот, могут включать промоторы, содержащие один или несколько сайтов распознавания факторами транскрипции, последовательности энхансеров транскрипции, последовательности терминации транскрипции и полиаденилирования. В некоторых вариантах осуществления изобретения «регуляторные последовательности» могут включать лидерные последовательности и/или последовательности слитого партнера.
Термин «полинуклеотид» в контексте настоящего изобретения означает одноцепочечные или двухцепочечные полимеры нуклеиновых кислот. В некоторых вариантах осуществления изобретения нуклеотиды, содержащиеся в полинуклеотиде, могут быть рибонуклеотидами или дезоксирибонуклеотидами, или модифицированной формой любого типа нуклеотида. Эти изменения включают модификации основания, такие как, бромуридин, модификации рибозы, такие как арабинозид и 2',3’-дидезоксирибоза, и модификации межнуклеотидной связи, такие как фосфоротиоат, фосфородитиоат, фосфороселеноат, фосфородиселеноат, фосфороанилотиоат, фосфораниладат и фосфорамидат. Термин «полинуклеотид», в частности, включает одно- и двухцепочечные формы ДНК.
Термин «природные нуклеотиды» включает дезоксирибонуклеотиды и рибонуклеотиды. Термин «модифицированные нуклеотиды» включает нуклеотиды с модифицированными или замещенными сахарными группами и т.п. Термин «олигонуклеотидные связи» включает олигонуклеотидные связи, такие как фосфоротиоатная, фосфородитиоатная, фосфороселеноатная, фосфородиселеноатная, фосфороанилотиоатная, фосфоранилидатная, фосфорамидатная и т.п. См., например, LaPlanche et al., 1986, Nucl. Acids Res., 14:9081; Stec et al., 1984, J. Am. Chem. Soc, 106:6077; Stein et al., 1988, Nucl. Acids Res., 16:3209; Zon et al., 1991, Anti-Cancer Drug Design, 6:539; Zon et al., 1991, OLIGONUCLEOTIDES AND ANALOGUES: A PRACTICAL APPROACH, pp.87-108 (F. Eckstein, Ed.), Oxford University Press, Oxford England; Stec et al., патент США №5,151,510; Uhlmann and Peyman, 1990, Chemical Reviews, 90:543, содержание которых таким образом включено путем ссылки для любых целей. Олигонуклеотид может включает детектируемую метку для возможности обнаружения олигонуклеотида или его гибридизации.
Термин «вектор» используется для обозначения любой молекулы (например, нуклеиновой кислоты, плазмиды или вируса), используемой для передачи кодирующей информации в клетку-хозяина. Термин «экспрессирующий вектор» относится к вектору, который подходит для трансформации клетки-хозяина, и содержит последовательности нуклеиновых кислот, которые управляют и/или регулируют экспрессию вставленных гетерологичных последовательностей нуклеиновых кислот. Экспрессия включает, но не ограничена ими, такие процессы, как транскрипция, трансляция и РНК-сплайсинг, если присутствуют интроны.
Как будет понятно специалистам в данной области, полинуклеотиды могут включать геномные последовательности, внегеномные и плазмидные последовательности, и меньшие по размеру сконструированные сегменты генов, которые экспрессируют или могут быть адаптированы для экспрессии белков, полипептидов, пептидов и т.п. Такие сегменты могут быть природными или модифицированными синтетически специалистом в данной области.
Специалисту в данной области также будет очевидно, что полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными, и могут быть ДНК (геномной, кДНК или синтетической) или РНК. Молекулы РНК могут включать HnRNA молекулы, которые содержат интроны и полностью соответствуют молекуле ДНК, и молекулы мРНК, которые не содержат интроны. Дополнительные кодирующие или некодирующие последовательности могут, но не обязательно, присутствовать в полинуклеотиде по изобретению, и полинуклеотид может, но не обязательно, быть связанным с другими молекулами и/или вспомогательными веществами. Полинуклеотиды могут содержать нативную последовательность или могут содержать последовательность, кодирующую вариант или производное такой последовательности.
Таким образом, в соответствии с этими и родственными вариантами осуществления настоящее изобретение также относится к полинуклеотидам, кодирующим анти-CD40 антитела, описанные в настоящем документе. Некоторые варианты осуществления изобретения относятся к полинуклеотидам, содержащим некоторые или все полинуклеотидные последовательности, кодирующие антитело, описанное в настоящем документе, и последовательности, комплементарные таким полинуклеотидам.
В других родственных вариантах осуществления изобретения полинуклеотидные варианты могут иметь высокую идентичность с полинуклеотидной последовательностью, кодирующей анти-CD40 антитело, описанное в данном документе. Например, полинуклеотид может представлять собой полинуклеотид, имеющий по меньшей мере 70% идентичности по последовательности, предпочтительно, по меньшей мере 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% или выше идентичности по последовательности по сравнению с эталонной полинуклеотидной последовательностью, такой как последовательность, кодирующая антитело, описанное в настоящем документе, с использованием способов, описанных в настоящем документе (например, BLAST-анализа с использованием стандартных параметров, как описано ниже). Специалисту в данной области будет очевидно, что эти значения могут быть соответствующим образом изменены, для того чтобы определить соответствующую идентичность белков, кодируемых двумя нуклеотидными последовательностями с учетом вырожденности кодонов, сходства аминокислот, положения рамки считывания и т.п.
Как правило, полинуклеотидные варианты будут содержать одну или несколько замен, добавлений, делеций и/или инсерций, предпочтительно таким образом, чтобы связывающая аффинность антитела, кодируемого полинуклеотидным вариантом, по существу не уменьшалась относительно антитела, кодируемого полинуклеотидной последовательностью, приведенной в настоящем документе.
В некоторых других родственных вариантах осуществления изобретения полинуклеотидные фрагменты могут содержать или состоять по существу из соприкасающихся участков последовательности различной длины, идентичных или комплементарных последовательности, кодирующей антитело, описанное в настоящем документе. Например, изобретение относится к полинуклеотидам, содержащим или состоящим по существу по меньшей мере примерно из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 200, 300, 400, 500 или 1000 или большего числа соприкасающихся нуклеотидов из последовательностей, кодирующих антитело или его антиген-связывающий фрагмент, раскрытых в настоящем документе, а также все промежуточные отрезки между ними. Будет очевидно, что «промежуточные отрезки» в данном контексте означают любую длину между указанными значениями, такую как 50, 51, 52, 53 и т.д.; 100, 101, 102, 103 и т.д.; 150, 151, 152, 153 и т.д., в том числе все целые числа от 200 до 500, от 500 до 1000, и т.п. Полинуклеотидная последовательность, описанная в настоящем документе, может быть увеличена на одном или обоих концах за счет дополнительных нуклеотидов, не найденных в нативной последовательности. Эта дополнительная последовательность может состоять из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 нуклеотидов на любом конце полинуклеотида, кодирующего антитело, описанное в настоящем документе, или на обоих концах полинуклеотида, кодирующего антитело, описанное в настоящем документе.
В другом варианте осуществления изобретение относится к полинуклеотидам, способным гибридизоваться в умеренно-жестких условиях с полинуклеотидной последовательностью, кодирующей антитело или его антиген-связывающий фрагмент, приведенные в настоящем документе, или с ее фрагментом, или комплементарной ей последовательностью. Методы гибридизации хорошо известны в данной области молекулярной биологии. Для иллюстративных целей, подходящие умеренно-жесткие условия для проверки гибридизации полинуклеотида, приведенного в настоящем документе, с другими полинуклеотидами включают предварительную промывку в растворе 5× SSC, 0,5% SDS, 1,0 мМ ЭДТА (pH 8,0); гибридизацию при 50°C-60°C в 5× SSC в течение ночи; последующую двукратную промывку при 65°C в течение 20 минут в каждом из 2×, 0,5× и 0,2× SSC, содержащих 0,1% SDS. Специалисту в данной области техники будет понятно, что жесткость условий гибридизации можно легко контролировать, например, путем изменения содержания соли в гибридизационном растворе и/или температуры, при которой происходит гибридизация. Например, в другом варианте осуществления изобретения подходящие высокожесткие условия гибридизации включают описанные выше, за исключением повышения температуры гибридизации, например, до 60°C-65°C или 65°C-70°C.
В некоторых вариантах осуществления изобретения полинуклеотиды, описанные выше, например, полинуклеотидные варианты, фрагменты и гибридизующиеся последовательности, кодируют антитела, которые связываются с CD40, или антиген-связывающие фрагменты. В других вариантах осуществления изобретения такие полинуклеотиды кодируют антитела или их антигенсвязывающие фрагменты или CDR, которые связываются с CD40 по меньшей мере на примерно 50%, по меньшей мере на примерно 70%, а в некоторых вариантах осуществления изобретения, по меньшей мере на примерно 90% также хорошо, как последовательность антитела, приведенная в настоящем документе. В других вариантах осуществления изобретения такие полинуклеотиды кодируют антитела или их антигенсвязывающие фрагменты или CDR, которые связываются с CD40 с большей аффинностью, чем антитела, приведенные в настоящем документе, например, которые связываются количественно по меньшей мере на примерно 105%, 106%, 107% 108%, 109% или на 110% также хорошо, как последовательность ' антитела, приведенная в; настоящем документе.
Как описано в настоящем документе, определение трехмерной структуры типичных полипептидов (например, вариантов CD40-специфичных антител, приведенных в настоящем документе, например, антитела, имеющего антигенсвязывающий фрагмент, приведенный в настоящем документе) может осуществляться с помощью обычных методик, так что замена, добавление, делеция или инсерция одной или нескольких аминокислот выбранными природными или неприродными аминокислотами фактически могут быть смоделированы, для того чтобы определить, сохраняет ли полученный таким образом структурный вариант пространственные свойства описанных в настоящем документе молекул. Опытным специалистам в данной области известно множество компьютерных программ для определения соответствующих аминокислотных замен (или соответствующих полинуклеотидов, кодирующих аминокислотную последовательность) в антителе, чтобы, например, сохранить или получить более высокую аффинность.
Полинуклеотиды, описанные в настоящем документе, или их фрагменты, независимо от длины самой кодирующей последовательности, могут быть объединены с другими последовательностями ДНК, такими как промоторы, сигналы полиаденилирования, дополнительные сайты ферментов рестрикции, множественные сайты клонирования, другие кодирующие сегменты и т.п., так что их общая длина может значительно варьироваться. Поэтому предполагается, что можно использовать фрагмент нуклеиновой кислоты практически любой длины, при этом общая длина предпочтительно ограничена простотой получения и применения в планируемом протоколе рекомбинантной ДНК. Например, предполагается, что иллюстративные полинуклеотидные сегменты общей длиной примерно 10000, примерно 5000, примерно 3000, примерно 2000, примерно 1000, примерно 500, примерно 200, примерно 100, примерно 50 пар оснований в длину, и т.п. (включая все промежуточные длины) предполагаются для использования.
При сравнении полинуклеотидных последовательностей считается, что две последовательности являются «идентичными», если последовательность нуклеотидов в двух последовательностях является одной и той же при выравнивании для максимального соответствия, как описано ниже. Сравнения между двумя последовательностями, как правило, выполняют посредством сравнения последовательностей на протяжении окна сравнения, чтобы идентифицировать и сравнить локальные области сходства последовательностей. «Окно сравнения» в контексте настоящего изобретения относится к сегменту, состоящему по меньшей мере из примерно 20 непрерывно следующих друг за другом позиций, обычно от 30 до примерно 75, от 40 до примерно 50, на протяжении которого последовательность можно сравнить с эталонной последовательностью, состоящей из такого же числа непрерывно следующих друг за другом позиций, после оптимального выравнивания двух последовательностей.
Оптимальное выравнивание последовательностей для сравнения можно провести с использованием программы Megalign в пакете биоинформатических программ, Lasergene (DNASTAR, Inc., Madison, WI), с использованием параметров по умолчанию. Эта программа выполняет несколько схем выравнивания, описанных в следующих ссылках: Dayhoff, М.О. (1978) A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol.5, Suppl.3, pp.345-358; Hein J., Unified Approach to Alignment and Phylogenes, pp.626-645 (1990); Methods in Enzymology vol.183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., CABIOS 5:151-153 (1989); Myers, E.W. and Muller W., CABIOS 4:11-17 (1988); Robinson, E.D., Comb. Theor 11:105 (1971); Santou, N. Nes, M., Mol. Biol. Evol. 4:406-425 (1987); Sneath, P.H.A. and Sokal, R.R., Numerical Taxonomy - the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA (1973); Wilbur, W.J. and Lipman, D.J., Proc. Natl. Acad., Sci. USA 80:726-730 (1983).
В альтернативном варианте, оптимальное выравнивание последовательностей для сравнения можно провести посредством алгоритма локальной идентичности (Smith and Waterman (1981) Add. APL. Math 2:482), с помощью алгоритма выравнивания по идентичности (Needleman and Wunsch (1970) J. Mol. Biol. 48:443), с помощью способов поиска сходства (Pearson and Lipman (1988) Proc. Natl. Acad. Sci. USA 85:2444), с помощью компьютеризированной реализации указанных алгоритмов (GAP, BESTFIT, BLAST, FASTA и TFASTA в пакете компьютерных программ Wisconsin Genetics, Genetics Computer Group (GCG), 575 Science Dr., Madison, WI) или с помощью визуального анализа.
Одним предпочтительным примером алгоритмов, которые подходят для определения идентичности последовательностей и сходства последовательностей в процентах, являются алгоритмы BLAST и BLAST 2.0, которые описаны в Altschul et al., Nucl. Acids Res. 25:3389-3402 (1977) и Altschul et al., J Mol. Biol. 215:403-410 (1990), соответственно. BLAST и BLAST 2.0 можно, например, использовать с описанными здесь параметрами, чтобы определить процентную идентичность последовательностей двух или нескольких полинуклеотидов. Компьютерная программа для выполнения BLAST-анализов находится в открытом доступе через Национальный центр биотехнологической информации (США). В одном иллюстративном примере суммарное количество очков можно подсчитать, используя для нуклеотидных последовательностей параметры М (очки вознаграждения за пару совпадающих остатков; всегда >0) и N (штрафные очки за несовпадающие остатки; всегда <0). Продолжение поиска совпадений слов в каждом направлении прекращают в том случае, когда: суммарное количество очков выравнивания уменьшается на количество X по сравнению с его достигнутым максимальным значением; суммарное количество очков опускается до нуля или ниже, вследствие накопления одного или нескольких отрицательно оцениваемых выравниваний остатков; или достигается конец какой-либо последовательности. Параметры W, Т и X алгоритма BLAST определяют чувствительность и скорость выравнивания. В программе BLAST (для нуклеотидных последовательностей) по умолчанию используется длина слов (W), равная 11, и ожидание (Е) - 10, и выравнивание по матрице подсчета очков BLOSUM62 (см. Henikoff and Henikoff (1989) Proc. Natl. Acad. Sci. USA 89:10915), (B) - 50, ожидание (E) - 10, M=5, N=-4 и сравнение по обеим цепям.
В некоторых вариантах осуществления изобретения «процент идентичности последовательностей» определяют путем сравнения двух оптимально выравненных последовательностей на протяжении окна сравнения из по меньшей мере 20 позиций, причем участок полинуклеотидной последовательности в окне сравнения может содержать добавления или делеции (т.е. пропуски), составляющие 20 процентов или меньше, обычно от 5 до 15 процентов, или от 10 до 12 процентов, по сравнению с эталонными последовательностями (которые не содержат добавлений или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывают путем определения количества позиций, в которых в обеих последовательностях присутствуют идентичные основания нуклеиновых кислот, чтобы получить количество совпадающих позиций, делением количества совпадающих позиций на общее количество позиций в эталонной последовательности (т.е. на размер окна) и умножением результатов на 100, чтобы получить процент идентичности последовательностей.
Специалисту в данной области будет очевидно, что, в результате вырожденности генетического кода, существует множество нуклеотидных последовательностей, кодирующих антитело, описанное в настоящем документе. Некоторые из этих полинуклеотидов имеют минимальную идентичность с последовательностью нативной или исходной полинуклеотидной последовательности, кодирующей антитела, которые связываются с CD40. Тем не менее, полинуклеотиды, которые меняются из-за различий в частоте встречаемости кодонов, ясно предусмотрены настоящим изобретением. В некоторых вариантах осуществления изобретения специально предусмотрены последовательности, кодоны которых были оптимизированы для экспрессии в клетках млекопитающих.
Таким образом, в другом варианте осуществления изобретения для получения вариантов и/или производных антител, описанных в настоящем документе, может использоваться мутагенез, такой как, например, сайт-специфичный мутагенез. С помощью такого подхода, конкретные модификации в полипептидной последовательности могут быть осуществлены путем мутагенеза кодирующих ее полинуклеотидов. Эти методики обеспечивают прямой подход для получения и проверки вариантов последовательности, например, включающих один или несколько из указанных выше признаков, путем введения одной или нескольких нуклеотидных замен в последовательность полинуклеотида.
Сайт-специфичный мутагенез позволяет получать мутанты посредством использования специфичных олигонуклеотидных последовательностей, которые кодируют последовательность ДНК с требуемой мутацией, а также достаточное количество близлежащих нуклеотидов, чтобы получить последовательность праймера достаточной длины и сложности последовательности для того, чтобы сформировать стабильный дуплекс с обеих сторон делетируемого участка. Мутации можно использовать в выбранной нуклеотидной последовательности для того, чтобы улучшить, изменить, снизить, модифицировать или иным образом изменить свойства самого полинуклеотида, и/или чтобы изменить свойства, активность, структуру, стабильность или первичную последовательность кодируемого полипептида.
В некоторых вариантах настоящего изобретения авторы предусматривают мутагенез полинуклеотидных последовательностей, которые кодируют антитело, раскрытое в настоящем документе, или его антиген-связывающий фрагмент, для того, чтобы изменить одно или несколько свойств кодируемого полипептида, таких как аффинность связывания антитела или антиген-связывающего фрагмента, или функцию определенной Fc-области или аффинность Fc-области к конкретному FcγR. Методики сайт-специфичного мутагенеза хорошо известны в данной области и широко используются для создания вариантов как полипептидов, так и полинуклеотидов. Например, сайт-специфичный мутагенез часто используют для того, чтобы изменить конкретный участок молекулы ДНК. В таких вариантах осуществления изобретения используют праймер, как правило, содержащий от примерно 14 до примерно 25 нуклеотидов или около этого в длину, и при этом от примерно 5 до примерно 10 остатков с обеих сторон от места изменения последовательности.
Как будет очевидно специалистам в данной области, в методиках сайт-специфичного мутагенеза часто используется фаговый вектор, который существует как в одноцепочечной, так и в двухцепочечной форме. Обычные векторы, пригодные для сайт-специфичного мутагенеза, включают такие векторы, как фаг М13. Этот фаг легко приобрести, а его применение обычно хорошо известно специалистам в данной области. Также в сайт-специфичном мутагенезе часто используются двухцепочечные пдазмиды, благодаря чему исключается стадия переноса представляющего интерес гена из плазмиды в фаг.
В общем, сайт-направленный мутагенез по данному изобретению выполняют, получая сначала одноцепочечный вектор или расплавляя на отдельные две цепи двухцепочечный вектор, который содержит в своей последовательности ДНК-последовательность, кодирующую требуемый пептид. Получают олигонуклеотидный праймер, несущий требуемую мутантную последовательность, обычно синтетическим образом. Затем указанный праймер отжигают с одноцепочечным вектором и подвергают воздействию ДНК-полимеризующих ферментов, таких как фрагмент Кленова полимеразы I из Е. coli, для того чтобы завершить синтез цепи, несущей мутацию. Таким образом, образуется гетеродуплекс, в котором одна цепь кодирует исходную немутированную последовательность, а вторая цепь несет требуемую мутацию. Затем этот гетеродуплексный вектор используют для трансформации соответствующих клеток, таких как клетки Е. coli, и отбирают клоны, которые содержат рекомбинантные векторы, несущие последовательность с мутантным расположением нуклеотидов.
Получение вариантов последовательности выбранных сегментов ДНК, кодирующих пептиды, с использованием сайт-направленного мутагенеза обеспечивает средство получения потенциально полезных вариантов и не предполагает ограничение изобретения, поскольку существуют другие способы, с помощью которых можно получить варианты последовательностей пептидов и кодирующих их последовательностей ДНК. Например, рекомбинантные векторы, кодирующие требуемую пептидную последовательность, можно обработать мутагенными агентами, такими как гидроксиламин, чтобы получить варианты последовательности. Конкретные подробности, относящиеся к указанным способам и протоколам, можно найти в руководствах Maloy et al., 1994; Segal, 1976; Prokop and Bajpai, 1991; Kuby, 1994; и Maniatis et al., 1982, каждое из которых с этой целью включено в настоящий документ путем ссылки.
В контексте настоящего изобретения термин «процедура направленного мутагенеза с использованием олигонуклеотидов» относится к процессам, зависимым от матрицы, и опосредованному вектором воспроизведению, результатом которых является увеличение концентрации молекулы специфичной нуклеиновой кислоты относительно ее исходной концентрации, или увеличение концентрации регистрируемого сигнала, такие как амплификация. В контексте настоящего изобретения подразумевается, что термин «процедура направленного мутагенеза с использованием олигонуклеотидов» относится к процессу, который включает зависимое от матрицы удлинение молекулы праймера. Термин «процесс, зависимый от матрицы» относится к синтезу нуклеиновых кислот РНК- или ДНК-молекулы, при котором последовательность новосинтезированной цепи нуклеиновой кислоты определяется хорошо известными правилами комплементарного спаривания оснований (см., например, Watson, 1987). Как правило, опосредованные векторами методы включают введение фрагмента нуклеиновой кислоты в ДНК- или РНК-вектор, клональную амплификацию вектора и выделение амплифицированного фрагмента нуклеиновой кислоты. Примеры таких методов даны в патенте США №4,237,224, специально включенном в настоящий документ путем ссылки в полном объеме.
В другом подходе для получения вариантов полипептидов по настоящему изобретению можно использовать рекурсивную рекомбинацию последовательностей, описанную в патенте США №5,837,458. В этом подходе, повторяющиеся циклы рекомбинации и скрининга или селекции проводят для «возникновения» индивидуальных полинуклеотидных вариантов, имеющих, например, повышенную аффинность связывания. Некоторые варианты осуществления изобретения также относятся к конструкциям в форме плазмид, векторов, транскрипционных или экспрессионных кассет, которые содержат по меньшей мере один полинуклеотид, описанный в настоящем документе.
Во многих вариантах осуществления изобретения нуклеиновые кислоты, кодирующие данное моноклональное антитело, вводят непосредственно в клетку-хозяина, и клетку инкубируют в условиях, достаточных для индукции экспрессии кодируемого антитела. Антитела по изобретению получают с использованием стандартных методик, хорошо известных специалистам в данной области, в комбинации с полипептидными и нуклеотидными последовательностями, приведенными в настоящем документе. Полипептидные последовательности могут использоваться для определения соответствующих нуклеотидных последовательностей, кодирующих конкретное антитело, раскрытое таким образом. Нуклеотидная последовательность может быть оптимизирована с учетом конкретных «предпочтений» кодонов для различных систем экспрессии в соответствии со стандартными способами, хорошо известными специалистам в данной области.
В соответствии с некоторыми родственными вариантами осуществления изобретение относится к рекомбинантной клетке-хозяину, которая содержит одну или несколько конструкций, описанных в настоящем документе; к нуклеиновой кислоте, кодирующей любое антитела, CDR, VH- или VL-домен, или их антиген-связывающий фрагмент; и к способу получения кодируемого продукта, который включает экспрессию с кодирующей их нуклеиновых кислот. Экспрессию может легко получить путем культивирования в соответствующих условиях рекомбинантных клеток-хозяев, содержащих нуклеиновую кислоту. После получения с помощью экспрессии, антитело или его антиген-связывающий фрагмент могут быть выделены и/или очищены с использованием любого подходящего способа, а затем использованы по назначению.
Антитела или их антиген-связывающие фрагменты по изобретению, а также молекулы, кодирующие нуклеиновые кислоты, и векторы, могут быть выделенными и/или очищенными, например, из их природной среды, в по существу чистой или гомогенной форме, или, в случае нуклеиновой кислоты, свободной или по существу свободной от нуклеиновых кислот или генов, не относящихся к последовательности, кодирующей полипептид с требуемой функцией. Нуклеиновая кислота может содержать ДНК или РНК и может быть полностью или частично синтетической. Ссылка на нуклеотидную последовательность, приведенную в настоящем документе, охватывает молекулу ДНК с указанной последовательностью и охватывает молекулу РНК с указанной последовательностью, в которой Т заменен на U, если контекст не требует иного.
Системы клонирования и экспрессии полипептида во различных клетках-хозяевах хорошо известны. Подходящие клетки-хозяева включают бактерии, клетки млекопитающих, клетки растений, дрожжевые и бакуловирусные системы. Линии клеток млекопитающих, доступные в данной области для экспрессии гетерологичного полипептида, включают клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почки детенышей хомячка, клетки меланомы мышей NSO и многие другие. Общеизвестным предпочтительным бактериальным хозяином является Е. coli.
Экспрессия антител и антиген-связывающих фрагментов в прокариотических клетках, таких как Е. coli, хорошо разработана в данной области. Обзор см., например, в Pluckthun, А. Bio/Technology 9:545-551 (1991). Экспрессия в эукариотических клетках в культуре также доступна для специалистов в данной области в качестве опции получения антител или их антиген связывающих фрагментов; см., например, недавние обзоры: Ref, М.Е. (1993) Curr. Opinion Biotech. 4:573-576; Trill J. J. et al. (1995) Curr. Opinion Biotech 6:553-560.
Могут быть выбраны или сконструированы подходящие векторы, содержащие соответствующие регуляторные последовательности, включая промоторные последовательности, последовательности терминаторов, последовательности полиаденилирования, энхансерные последовательности, маркерные гены или другие необходимые последовательности. Векторы могут представлять собой плазмиды, вирусные векторы, например фаг или фагмиду, при необходимости. Более подробное описание см., например, в Molecular Cloning: а Laboratory Manual: 2nd edition, Sambrook et al., 1989, Cold Spring Harbor Laboratory Press. Многие известные методики и протоколы манипуляций с нуклеиновыми кислотами, например получение конструкций нуклеиновых кислот, мутагенез, секвенирование, введение ДНК в клетки и экспрессия генов, а также анализ белков, подробно описаны в Current Protocols in Molecular Biology, Second Edition, Ausubel et al. eds., John Wiley & Sons, 1992, или последующих изданиях.
Термин «клетка-хозяин» используется для обозначения клетки, в которую была введена или которая подходит для введения последовательности нуклеиновой кислоты, кодирующей одно или несколько из описанных в настоящем документе антител, и которая дополнительно экспрессирует или способна экспрессировать выбранный ген, представляющий интерес, такой как ген, кодирующий любое описанное в настоящем документе антитело. Этот термин включает потомство родительской клетки, вне зависимости от того, является ли потомство идентичным по морфологии или генетически исходной родительской клетке, при условии присутствия выбранного гена. Соответственно, также предусмотрен способ, включающий введение такой нуклеиновой кислоты в клетку-хозяина. При введении можно использовать любую доступную методику. Для эукариотических клеток подходящие методики могут включать трансфекцию, опосредованную фосфатом кальция, DEAE-декстраном, электропорацию, опосредованную липосомами трансфекцию и трансдукцию с использованием ретровирусов и других вирусов, например, вируса осповакцины, или, для клеток насекомых, бакуловирусов. Для бактериальных клеток подходящие методики могут включать опосредованную хлоридом кальция трансформацию, электропорацию и трансфекцию с использованием бактериофага. Введение может сопровождаться индукцией или разрешением экспрессии нуклеиновой кислоты, например, путем культивирования хозяйской клетки при условиях, подходящих для экспрессии гена. В одном варианте осуществления изобретения нуклеиновая кислота может быть интегрирована в геном (например, в хромосому) клетки-хозяина. Интеграцию можно усилить путем включения последовательности, которая способствует рекомбинации в геном, согласно стандартным методикам.
Настоящее изобретение также относится, в некоторых вариантах осуществления, к способу, который включает использование конструкции, указанной выше, в экспрессионной системе для экспрессии конкретного полипептида, такого как CD40-специфичное антитело, описанное в настоящем документе. Термин «трансдукция» используется для обозначения переноса генов из одной бактерии в другую, как правило, с помощью фага. «Трансдукция» также относится к захвату и переносу эукариотических клеточных последовательностей ретровирусами. Термин «трансфекция» используют для обозначения захвата чужеродной или экзогенной ДНК клеткой, а клетка является «трансфицированной», когда экзогенная ДНК была введена внутрь клеточной мембраны. Целый ряд методик трансфекции хорошо известен в данной области и раскрыт в настоящем документе. См., например, Graham et al., 1973, Virology 52:456; Sambrook et al., 2001, MOLECULAR CLONING, LABORATORY MANUAL, Cold Spring Harbor Laboratories; Davis et al., 1986, BASIC METHODS IN MOLECULAR BIOLOGY, Elsevier; и Chu et al., 1981, Gene 13:197. Такие способы могут использоваться для введения одной или нескольких молекул экзогенной ДНК в подходящие клетки-хозяева.
Используемый в настоящем документе термин «трансформация» относится к изменению в генетических характеристиках клетки, и клетка является трансформированной, когда она была модифицирована так, чтобы содержать новую ДНК. Например, клетка является трансформированной, когда она генетически модифицирована по сравнению с ее нативным состоянием. После трансфекции или трансдукции трансформирующая ДНК может рекомбинировать с ДНК клетки посредством физической интеграции в хромосому клетки, или может поддерживаться временно в виде эписомного элемента без репликации, или может реплицироваться независимо как плазмида. Клетку считают стабильно трансформированной, когда такая ДНК реплицируется одновременно с делением клетки. Термин «природный» или «нативный» при использовании применительно к биологическим веществам, таким как молекулы нуклеиновых кислот, полипептиды, клетки-хозяева и т.п., обозначает вещества, которые встречаются в природе и не подвергнуты манипуляциям со стороны человека. Аналогичны образом, используемый в настоящем документе термин «неприродный» или «ненативный» относится к веществу, которое не обнаружено в природе или которое было структурно модифицировано или синтезировано человеком.
Термины «полипептид», «белок» и «пептид», а также «гликопротеин», используются взаимозаменяемо и означают аминокислотный полимер, не ограниченный какой-либо конкретной длиной. Этот термин не исключает модификации, такие как миристилирование, сульфатирование, гликозилирование, фосфорилирование и добавление или удаление сигнальных последовательностей. Термины «полипептид» или «белок» означают одну или несколько аминокислотных цепей, где каждая цепь содержит аминокислоты, ковалентно связанные пептидными связями, и указанный полипептид или белок может содержать множество цепей, нековалентно и/или ковалентно связанных вместе пептидными связями, имеющих последовательности нативных белков, то есть белков, продуцируемых природными и, в частности, нерекомбинантными клетками, или генетически модифицированными или рекомбинантными клетками, и может содержать молекулы, имеющие аминокислотную последовательность нативного белка, или молекулы, имеющие делеции, добавления и/или замены одной или нескольких аминокислот нативной последовательности. Термины «полипептид» и «белок», в частности, включают антитела, которые связываются с CD40 по настоящему изобретению, или последовательности, которые имеют делеции, добавления и/или замены одной или нескольких аминокислот в анти-CD40 антителе. Таким образом, «полипептид» или «белок» может содержать одну (называется «мономер») или множество (называется «мультимер») аминокислотных цепей.
Термин «выделенный белок» в контексте настоящего изобретения означает, что данный белок (1) свободен по меньшей мере от некоторых других белков, с которыми он обычно встречается в природе, (2) по существу свободен от других белков из того же источника, например, из того же вида, (3) экспрессируется клеткой из другого биологического вида, (4) отделен по меньшей мере от примерно 50 процентов полинуклеотидов, липидов, углеводов, или других веществ, с которыми он ассоциирован в природе, (5) не связан (путем ковалентного или нековалентного взаимодействия) с участками белка, с которым «выделенный белок» связан в природе, (6) функционально связан (ковалентными или нековалентными взаимодействиями) с полипептидом, с которым он не связан в природе, или (7) не встречается в природе. Такой выделенный белок может кодироваться геномной ДНК, кДНК, мРНК или другой РНК, или может иметь синтетическое происхождение, или может представлять собой любую комбинацию вышеперечисленного. В некоторых вариантах выделенный белок по существу свободен от белков или полипептидов, или других примесей, которые встречаются в его природном окружении, которые будут мешать его применению (терапевтическому, диагностическому, профилактическому, исследовательскому или какому-либо еще).
Термин «полипептидный фрагмент» относится к полипептиду, который может быть мономерным или мультимерным и имеет аминоконцевую делецию, карбоксиконцевую делецию и/или внутреннюю делецию или замену в природном или рекомбинантном полипептиде. В некоторых вариантах осуществления изобретения полипептидный фрагмент может содержать аминокислотную цепь длиной по меньшей мере от 5 до примерно 500 аминокислот. Очевидно, что в некоторых вариантах осуществления изобретения фрагменты составляют по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 150, 200, 250, 300, 350, 400 или 450 аминокислот в длину. Особенно полезные полипептидные фрагменты включают функциональные домены, в том числе антиген-связывающие домены или фрагменты антител. В случае анти-CD40 антитела, подходящие фрагменты включают, но не ограничены этим: CDR-область, особенно, CDR3-область тяжелой или легкой цепи; вариабельную область тяжелой или легкой цепи; участок цепи антитела или только его вариабельной области, включающей 2 CDR; и т.п.
Полипептиды могут содержать сигнальную (или лидерную) последовательность на N-конце белка, которая во время или после трансляции управляет транспортом белка. Любые полипептидные аминокислотные последовательности по настоящему изобретению, которые включают сигнальный пептид, также предусмотрены для любых способов применения, описанных в настоящем документе, без такого сигнального или лидерного пептида. Как должно быть очевидно специалисту, сигнальный пептид обычно отщепляется в ходе процессинга белка и не входит в функциональное антитело. Полипептид также может быть слит или конъюгирован с линкерной или другой последовательностью для облегчения синтеза, очистки или идентификации полипептида (например, с поли-His), или для усиления связывания полипептида с твердым носителем.
Пептидную линкерную/спейсерную последовательность также можно использовать для разделения нескольких полипептидных компонентов на расстояние, достаточное для гарантии того, что каждый полипептид укладывается в свою вторичную и/или третичную структуру, если это необходимо. Такая пептидная линкерная последовательность может быть включена в слитый полипептид с использованием стандартных методик, хорошо известных в данной области.
Некоторые последовательности пептидных спейсеров могут быть выбраны, например, на основе: (1) своей способности принимать гибкую вытянутую конформацию; (2) своей неспособности принимать вторичную структуру, которая может взаимодействовать с функциональными эпитопами на первом и втором полипептидах/ и/или (3) отсутствия гидрофобных или заряженных остатков, которые могут вступать в реакцию с функциональными эпитопами полипептидов.
В одном иллюстративном варианте осуществления изобретения пептидные спейсерные последовательности содержат, например, остатки Gly, Asn и Ser. В последовательность спейсера также могут быть включены другие, близкие к нейтральным аминокислоты, такие как Thr и Ala.
Другие аминокислотные последовательности, которые могут быть успешно использованы в качестве спейсеров, включают описанные в Maratea et al., Gene 40:39 46 (1985); Murphy et al., Proc. Natl. Acad. Sci. USA 83:8258 8262 (1986); патенте США №4,935,233 и патенте США №4,751,180.
Другие иллюстративные спейсеры могут включать, например, Glu-Gly-Lys-Ser-Ser-Gly-Ser-Gly-Ser-Glu-Ser-Lys-Val-Asp (Chaudhary et al., 1990, Proc. Natl. Acad. Sci. U.S.A. 87:1066-1070) и Lys-Glu-Ser-Gly-Ser-Val-Ser-Ser-Glu-Gln-Leu-Ala-Gln-Phe-Arg-Ser-Leu-Asp (Bird et al., 1988, Science 242:423-426).
В некоторых вариантах осуществления изобретения спейсерная последовательность не требуется, когда первый и второй полипептиды имеют несущественные N-концевые аминокислотные области, которые могут использоваться для разделения функциональных доменов и предупреждать стерические помехи. Две кодирующие последовательности могут быть слиты непосредственно, без какого-либо спейсера или с использованием гибкого полилинкера, состоящего, например, из пентамера Gly-Gly-Gly-Gly-Ser, повторяемого от 1 до 3 раз. Такой спейсер использовали при конструировании одноцепочечных антител (ScFv), вставляя его между VH и VL (Bird et al., 1988, Science 242:423-426; Huston et al., 1988, Proc. Natl. Acad. Sci. U.S.A. 85:5979-5883).
Пептидный спейсер в некоторых вариантах осуществления изобретения предназначен для обеспечения правильного взаимодействия двух бета-листов, образующих вариабельную область одноцепочечного антитела.
В некоторых иллюстративных вариантах осуществления изобретения пептидный спейсер составляет от 1 до 5 аминокислот, от 5 до 10 аминокислот, от 5 до 25 аминокислот, от 5 до 50 аминокислот, от 10 до 25 аминокислот, от 10 до 50 аминокислот, от 10 до 100 аминокислот, или любые промежуточное количество аминокислот.
В других иллюстративных вариантах осуществления изобретения пептидный спейсер содержит примерно 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50 или большее количество аминокислот в длину.
Предусмотрены модификации аминокислотной последовательности антител, описанных в настоящем документе. Например, может быть желательно улучшить аффинность связывания и/или другие биологические свойства антитела. Например, варианты аминокислотной последовательности антитела можно получить путем введения соответствующих нуклеотидных замен в полинуклеотид, который кодирует антитело или его цепь, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или инсерции, и/или замены остатков в аминокислотной последовательности антитела. Любая комбинация делеции, инсерции и замены может быть осуществлена для получения конечного антитела, при условии, что конечная конструкция обладает требуемыми характеристиками (например, высокой аффинностью связывания с CD40). Аминокислотные замены также могут изменять посттрансляционный процессинг антитела, например, изменять количество или положение сайтов гликозилирования. Любые вариации и модификации, описанные выше для полипептидов по настоящему изобретению, могут быть включены в антитела настоящего изобретения.
Настоящее изобретение относится к вариантам антител, раскрытым в настоящем документе. В некоторых вариантах осуществления изобретения такие варианты антител или их антигенсвязывающих фрагментов или CDR связываются с CD40 по меньшей мере на примерно 50%, по меньшей мере на примерно 70%, а в некоторых вариантах осуществления изобретения по меньшей мере на примерно 90% также хорошо, как последовательность антитела, приведенная в настоящем документе. В дополнительных вариантах осуществления изобретения такие варианты антител или их антигенсвязывающих фрагментов или CDR связываются с CD40 с большей аффинностью, чем антитела, приведенные в настоящем документе, например, связываются количественно по меньшей мере на примерно 105%, 106%, 107% 108%, 109% или 110% также хорошо, как последовательность антитела, специально приведенная в настоящем документе.
В конкретных вариантах осуществления изобретения данное антитело может иметь: а) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая по меньшей мере на 80% идентична, по меньшей мере на 95% идентична, по меньшей мере на 90%, по меньшей мере 95% или по меньшей мере на 98% или на 99% идентична вариабельной области тяжелой цепи анти-CD40 антитела, описанного в настоящем документе; и b) вариабельную область легкой цепи, имеющую аминокислотную последовательность, которая по меньшей мере на 80% идентична, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% или на 99% идентична вариабельной области легкой цепи анти-CD40 антитела, описанного в настоящем документе. Аминокислотные последовательности иллюстративных областей тяжелой и легкой цепи приведены в SEQ ID NO:1-56.
В конкретных вариантах осуществления изобретения антитело может содержать: а) вариабельную область тяжелой цепи, содержащую: i. CDR1, которая идентична аминокислотной последовательности области CDR1 тяжелой цепи выбранного антитела, описанного в настоящем документе; ii. CDR2, которая идентична аминокислотной последовательности области CDR2 тяжелой цепи выбранного антитела; и iii. CDR3, которая идентична аминокислотной последовательности области CDR3 тяжелой цепи выбранного антитела; и b) вариабельный домен легкой цепи, содержащий: i. CDR1, которая идентична аминокислотной последовательности области CDR1 легкой цепи выбранного антитела; ii. CDR2, которая идентична аминокислотной последовательности области CDR2 легкой цепи выбранного антитела; и iii. CDR3, которая идентична, аминокислотной последовательности области CDR3 легкой цепи выбранного антитела, где антитело специфично связывается с выбранной мишенью (например, CD40). В дополнительном варианте осуществления антитело или его антиген-связывающий фрагмент являются вариантом антитела, причем вариант содержит тяжелую и легкую цепи, идентичные выбранному антителу за исключением до 8, 9, 10, 11, 12, 13, 14, 15 или большего числа аминокислотных замен в CDR-областях VH- и VL-областей. В этом случае в CDR-областях выделенного антитела может присутствовать 1, 2, 3, 4, 5, 6, 7, 8, или в некоторых вариантах осуществления - 9, 10, 11, 12, 13, 14, 15 или большее число аминокислотных замен. Замены могут быть в CDR, либо в VH- и/или VL-областях. (См., например, Muller, 1998, Structure 6:1153-1167).
Определение трехмерных структур эталонных полипептидов (например, вариантов CD40-специфичных антител, приведенных в настоящем документе, например, антитела, имеющего антиген-связывающий фрагмент, приведенный в настоящем документе) может быть осуществлено с помощью обычных методик, так что замена, добавление, делеция или инсерция одной или нескольких аминокислот выбранными природными или неприродными аминокислотами могут быть фактически смоделированы, для того чтобы определить, сохраняет ли полученный таким образом структурный вариант пространственные свойства описанных в настоящем документе молекул. См., например, Donate et al., 1994 Prot. Sci. 3:2378; Bradley et al., Science 309:1868-1871 (2005); Schueler-Furman et al., Science 310:638 (2005); Dietz et al., Proc. Nat. Acad. Sci. USA 103:1244 (2006); Dodson et al., Nature 450:176 (2007); Qian et al., Nature 450:259 (2007); Raman et al. Science 327:1014-1018 (2010). Некоторые дополнительные неограничивающие примеры компьютерных алгоритмов, которые могут быть использованы для этих и родственных вариантов осуществления изобретения, например, для рационального конструирования антиген-связывающих доменов CD40-специфичных антител, приведенных в настоящем документе, включают VMD, которая представляет собой программу молекулярной визуализации для отображения, анимации и анализа больших биомолекулярных систем с использованием 3-D графики и встроенными скриптами (см. веб-сайт Theoretical and Computational Biophysics Group, University of Illinois at Urbana-Champagne, имеющий адрес ks.uiuc.edu/Research/vmd/). В данной области известны и доступны специалистам многие другие компьютерные программы, которые позволяют определить атомные расстояния из пространственных моделей (Ван-дер-ваальсовых радиусов) конформаций с минимизированной энергией; GRID, с помощью которой определяют области высокой аффинности для различных химических групп, тем самым повышая связывание, поиск с использованием метода Монте-Карло, которым рассчитывают математическое выравнивание, и CHARMM (Brooks et al. (1983) J. Comput. Chem. 4:187-217) и AMBER (Weiner et al (1981) J. Comput. Chem. 106:765), с помощью которых оценивают расчеты и анализ силовых полей (см. также Eisenfield et al. (1991) Am. J. Physiol. 261:C376-386; Lybrand (1991) J. Pharm. Belg. 46:49-54; Froimowitz (1990) Biotechniques 8:640-644; Burbam et al. (1990) Proteins 7:99-111; Pedersen (1985) Environ. Health Perspect. 61:185-190; и Kini et al. (1991) J. Biomol. Struct. Dyn. 9:475-488). Разнообразные соответствующие вычислительные компьютерные программы также являются коммерчески доступными, например, от Schrödinger (Munich, Germany).
В другом варианте осуществления изобретения, анти-CD40 антитела и их гуманизированные варианты получены из кроличьих моноклональных антител, в частности, созданы с использованием технологии RabMAb®. Эти антитела являются предпочтительными, поскольку они требуют минимальной модификации последовательности, облегчая тем самым сохранение функциональных свойств после гуманизации с использованием мутационной линейно-направленной (MLG) технологии гуманизации (см., например, патент США №7,462,697). Таким образом, иллюстративные способы получения анти-CD40 антител по настоящему изобретению включают технологию получения кроличьих моноклональных антител, RabMab®, описанную, например, в патентах США №№5,675,063 и 7,429,487. В этом случае, в некоторых вариантах осуществления изобретения анти-CD40 антитела по изобретению получают в кроликах. В конкретных вариантах осуществления изобретения используются кроличьи иммортализованные В-лимфоциты, способные к слиянию с кроличьими спленоцитами для создания гибридной клетки, которая продуцирует антитело. Бессмертные В-лимфоциты не экспрессируют на детектируемом уровне эндогенную тяжелую цепь иммуноглобулина и могут содержать, в некоторых вариантах осуществления изобретения, измененный ген, кодирующий тяжелую цепь иммуноглобулина.
Композиции и способы применения
Настоящее изобретение относится к композициям, содержащим CD40-специфичные антитела, их антиген-связывающие фрагменты, и к введению такой композиции в различных терапевтических схемах.
Введение CD40-специфичных антител, описанных в настоящем документе, в чистом виде или в соответствующей фармацевтической композиции можно осуществить с помощью любых приемлемых способов введения агентов, служащих для подобных целей. Фармацевтические композиции могут быть получены путем объединения антитела или содержащей антитело композиции с соответствующим физиологически приемлемым носителем, разбавителем или эксципиентом, и могут быть составлены в препараты в твердой, полутвердой, жидкой или газообразной формах, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, инъекции, ингаляторы, гели, микросферы и аэрозоли. Кроме того, в композиции могут присутствовать, но не обязательно, другие фармацевтически активные ингредиенты (включая другие противораковые агенты, описанные в другом разделе настоящего документа) и/или подходящие вспомогательные вещества, такие как соли, буферы и стабилизаторы. Введение можно провести различными путями, включая пероральный, парентеральный, назальный, внутривенный, внутрикожный, подкожный или местный. Предпочтительные способы введения зависят от природы состояния, в отношении которого проводится лечение или профилактика. Количество, которое после введения, снижает, ингибирует, предупреждает или замедляет развитие и/или метастазирование рака, считается эффективным.
В некоторых вариантах осуществления изобретения вводимое количество является достаточным для регрессии опухоли, о чем свидетельствует статистически значимое уменьшение жизнеспособной опухоли, например, по меньшей мере 50% снижение массы опухоли или изменение (например, статистически значимое уменьшение) размеров. В других вариантах осуществления изобретения вводимое количество является достаточным для получения клинически значимого уменьшения симптомов показателей конкретного заболевания, известных специалистам-клиницистам.
Точная дозировка и длительность лечения зависят от заболевания, против которого проводится лечение, и могут определяться эмпирически с использованием известных протоколов испытаний или при тестировании композиций в модельных системах, известных в данной области и их экстраполяции. Также могут быть проведены контролируемые клинические испытания. Дозировки могут также варьировать в зависимости от тяжести состояния, подлежащего лечению. Фармацевтическую композицию обычно составляют и вводят, чтобы получить терапевтический полезный эффект при минимизации нежелательных побочных эффектов. Композицию можно вводить однократно или разделенной на несколько меньших доз для периодического введения. Для каждого отдельного индивидуума схема приема лекарственного средства может быть скорректирована с течением времени в соответствии с индивидуальными потребностями.
Композиции, содержащие CD40-специфичные антитела, могут вводиться отдельно или в комбинации с другими известными методами лечения рака, такими как лучевая терапия, химиотерапия, трансплантация, иммунотерапия, гормональная терапия, фотодинамическая терапия и т.д. Композиции могут также вводиться в комбинации с антибиотиками.
Типичные пути введения этих и других фармацевтических композиций, таким образом, включают, без ограничений, пероральный, местный, трансдермальный, ингаляционный, парентеральный, сублингвальный, буккальный, ректальный, вагинальный и интраназальный. Термин "парентеральный" в контексте настоящего изобретения включает подкожные инъекции, внутривенные, внутримышечные, внутригрудинные инъекции или инфузии. Фармацевтические композиции в соответствии с некоторыми вариантами осуществления настоящего изобретения составлены таким образом, чтобы при введении композиции пациенту обеспечить биодоступность действующих ингредиентов, содержащихся в ней. Композиции, которые будут введены субъекту или пациенту, могут иметь однодозовую или многодозовые формы, когда, например, таблетка может представлять собой единичную дозу, а контейнер описанных в настоящем документе CD40-специфичных антител в форме аэрозоля может содержать множество доз. Существующие способы получения таких лекарственных форм известны или будут очевидны для специалистов в данной области; например, см. Remington: The Science and Practice of Pharmacy, 20th Edition (Philadelphia College of Pharmacy and Science, 2000). Композиция для введения будет, в любом случае, содержать терапевтически эффективное количество антитела по настоящему изобретению, для лечения заболевания или состояния, представляющих интерес, в соответствии с замыслом настоящего изобретения.
Фармацевтическая композиция может быть твердой или жидкой. В одном варианте осуществления изобретения носитель(-и) представляют собой частицы, так что композиции, например, представляют собой таблетки или порошок. Носитель(-и) могут быть жидкими, при этом композиции могут представлять собой, например, пероральное масло, жидкость для инъекций или аэрозоль, который подходит, например, для введения с помощью ингаляций. Если фармацевтическая композиция предназначена для перорального введения, то она, предпочтительно, находится в твердой или жидкой форме, причем полутвердые, полужидкие, суспензионные и гелевые формы включены в формы, рассматриваемые в настоящем документе, как твердые или жидкие.
В качестве твердой композиции для перорального введения фармацевтическая композиция может быть составлена в виде порошка, гранул, прессованной таблетки, пилюли, капсулы, жевательной резинки, облатки или т.п. Такие твердые композиции обычно содержат один или несколько инертных разбавителей или съедобных носителей. Кроме того, могут присутствовать одно или несколько из следующих веществ: связующие вещества, такие как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза, камедь трагаканта или желатин; эксципиенты, такие как крахмал, лактоза или декстрины; дезинтегранты, такие как альгиновая кислота, альгинат натрия, Примогель, кукурузный крахмал и т.п.; смазывающие вещества, такие как стеарат магния или Стеротекс; вещества, способствующие скольжение, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин; вкусо-ароматическая добавка, такая как мята перечная, метилсалицилат или апельсиновый ароматизатор; и краситель. Когда фармацевтическая композиция имеет форму капсулы, например желатиновой капсулы, она может содержать, в дополнение к веществам вышеуказанного типа, жидкий носитель, такой как полиэтиленгликоль или масло.
Фармацевтическая композиция может иметь жидкую форму, например, представлять собой эликсир, сироп, раствор, эмульсию или суспензию. Жидкость, например, может быть предназначена для перорального введения или для доставки путем инъекции. Предназначенная для перорального введения предпочтительная композиция содержит, в дополнение к соединениям по настоящему изобретению, один или несколько подсластителей, консервантов, красителей/красящих соединений и усилителей вкуса. В композиции, предназначенной для введения путем инъекции, могут быть включены одно или несколько поверхностно-активных веществ, консервантов, смачивающих агентов, диспергирующих агентов, суспендирующих агентов, буферов, стабилизаторов и изотонических агентов.
Жидкие фармацевтические композиции, будь то растворы, суспензии или другие аналогичные формы, могут включать один или несколько из следующих адъювантов: стерильные разбавители, такие как вода для инъекций, солевой раствор, предпочтительно физиологический раствор, раствор Рингера, изотонический хлорид натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения может быть заключен в ампулы, одноразовые шприцы или многодозовые флаконы, изготовленные из стекла или пластика. Физиологический раствор является предпочтительным адъювантом. Инъекционная фармацевтическая композиция предпочтительно является стерильной.
Жидкая фармацевтическая композиция, предназначенная либо для парентерального, либо для перорального введения, должна содержать такое количество CD40-специфичных антител, раскрытых в настоящем документе, чтобы получить подходящую дозу. Как правило, это количество составляет по меньшей мере 0,01% антитела в композиции. В случае перорального введения, это количество может варьировать в пределах от 0,1 до примерно 70% от веса композиции. Некоторые пероральные фармацевтические композиции содержат от примерно 4% до примерно 75% антитела. В некоторых вариантах осуществления изобретения, фармацевтические композиции и препараты по настоящему изобретению получают таким образом, чтобы парентеральная лекарственная форма содержит от 0,01 до 10% по весу антитела до разбавления.
Фармацевтическая композиция может быть предназначена для местного введения, и в этом случае носитель может соответственно содержать основу раствора, эмульсии, мази или геля. Основа, например, может содержать одно или несколько из следующего: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, и эмульгаторы и стабилизаторы. В фармацевтической композиции для местного введения могут присутствовать загустители. Если композиция предназначена для трансдермального введения, то она может включать трансдермальный пластырь или устройство для ионофореза. Фармацевтическая композиция может быть предназначена для ректального введения в форме, например, суппозитория, который будет плавиться в прямой кишке и высвобождать лекарственное средство. Композиция для ректального введения может содержать масляную основу в качестве подходящего нераздражающего эксципиента. Такие основы включают, без ограничения, ланолин, масло какао и полиэтиленгликоль.
Фармацевтическая композиция может включать различные вещества, которые модифицируют физическую форму твердой или жидкой лекарственной формы. Так, например, композиция может включать вещества, которые образуют оболочку вокруг действующих ингредиентов. Материалы, которые образуют оболочку, как правило, являются инертными и могут быть выбраны, например, из сахара, шеллака и других кишечных покрытий. В альтернативном варианте, действующие ингредиенты могут быть заключены в желатиновую капсулу. Фармацевтическая композиция в твердой или жидкой форме может включать агент, который связывается с антителом по изобретению и тем самым способствует доставке соединения. Подходящие агенты, которые могут выступать в этом качестве, включают другие моноклональные или поликлональные антитела, один или несколько белков, или липосому. Фармацевтическая композиция может состоять по существу из лекарственных форм, которые могут быть введены в виде аэрозоля. Термин "аэрозоль" используется для обозначения различных систем, начиная от систем коллоидной природы, до систем, состоящих из упаковок под давлением. Доставка может осуществляться с помощью сжиженного или сжатого газа или с помощью подходящей нагнетающей системы, которая распределяет действующие ингредиенты. Аэрозоли могут вводиться пациенту в однофазной, двухфазной или трехфазной системах для доставки действующего(-их) ингредиента(-ов). Доставка аэрозоля включает необходимый контейнер, активаторы, клапаны, субконтейнеры, и т.п., которые вместе могут образовывать набор. Средний специалист в данной области без проведения излишних экспериментов может определить предпочтительные аэрозоли.
Фармацевтические композиции могут быть получены с помощью методологии, хорошо известной в фармацевтике. Например, фармацевтическую композицию, предназначенную для введения путем инъекции, можно изготовить путем объединения композиции, содержащей CD40-специфичные антитела, описанные в настоящем документе, и необязательно, одной или нескольких из солей, одного или нескольких буферов и/или стабилизаторов, стерильной дистиллированной воды с образованием раствора. Для облегчения образования однородного раствора или суспензии может быть добавлено поверхностно-активное вещество. Поверхностно-активные вещества являются соединениями, которые нековалентно взаимодействуют с композицией антитела таким образом, что способствуют растворению или образованию гомогенной суспензии антитела в водной системе доставки.
Композиции можно вводить в терапевтически эффективном количестве, которое будет варьировать в зависимости от множества факторов, включающих активность конкретного используемого соединения (например, CD40-специфичных антител); метаболическую стабильность и продолжительность действия соединения; возраст, вес тела, общее состояние здоровья, пол и диету пациента; схему и время введения; скорость экскреции; комбинацию лекарственных соединений; тяжесть конкретного заболевания или состояния и субъекта, проходящего лечение. Обычно терапевтически эффективная суточная доза составляет (для 70-килограммового млекопитающего) от примерно 0,001 мг/кг (т.е. 0,07 мг) до примерно 100 мг/кг (т.е. 7,0 г); предпочтительно, терапевтически эффективная доза составляет (для 70-килограммового млекопитающего) от примерно 0,01 мг/кг (то есть, 0,7 мг) до примерно 50 мг/кг (т.е. 3,5 г); более предпочтительно, терапевтически эффективная доза составляет (для 70-килограммового млекопитающего) от примерно 1 мг/кг (то есть, 70 мг) до примерно 25 мг/кг (то есть, 1,75 г).
Композиции, содержащие CD40-специфичные антитела по настоящему изобретению, могут также вводиться одновременно, до или после введения одного или нескольких других терапевтических агентов. Такая комбинированная терапия может включать введение единого фармацевтического дозированного состава, который содержит соединение по изобретению и один или несколько дополнительных действующих агентов, а также введение композиций, содержащих антитела по изобретению и каждый действующий агент в его собственном отдельном фармацевтическом дозированном составе. Например, антитело, описанное в настоящем документе, и другой действующий агент можно вводить пациенту совместно в одной пероральной дозированной композиции, такой как таблетка или капсула, или каждый агент вводят в отдельных пероральных дозированных составах. Аналогичным образом, антитело, описанное в настоящем документе, и другой действующий агент можно вводить пациенту совместно в одной парентеральной дозированной композиции, например, в солевом растворе или другом физиологически приемлемом растворе, или каждый агент вводят в отдельных парентеральных дозированных составах. При использовании отдельных дозированных составов, композиции, содержащие антитела и один или несколько дополнительных действующих агентов, могут вводиться по существу в одно и то же время, т.е. одновременно, или в разное время, т.е. последовательно и в любом порядке; очевидно, что комбинированная терапия включает все эти схемы.
Таким образом, в некоторых вариантах осуществления изобретения также предусмотрено введение композиций анти-CD40 антитела по настоящему изобретению в комбинации с одним или несколькими другими терапевтическими агентами. Такие терапевтические агенты могут быть приняты в этой области в качестве стандарта лечения состояния конкретного заболевания, описанного в настоящем документе, такого как, ревматоидный артрит, воспаление или рак. Иллюстративные терапевтические агенты, предусмотренные в изобретении, включают цитокины, факторы роста, стероиды, NSAID, DMARD, противовоспалительные средства, химиотерапевтические средства, радиотерапию или другие действующие и вспомогательные агенты.
В некоторых вариантах осуществления изобретения анти-CD40 антитела, раскрытые в настоящем документе, могут вводиться вместе с любым числом химиотерапевтических агентов. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембицин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, циностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадренергические средства, такие как аминоглютетимид, митотан, трилостан; заменители фолиевой кислоты, такие как фролиновая кислота; ацеглатон; альдофосфамидный гликозид; аминолевулиновую кислоту; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элформитин; ацетат эллиптиния; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK.RTM; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2’,2"-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); циклофосфамид; тиотепу; таксоиды, например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Принстон, Нью-Джерси) и доксетаксел (TAXOTERE®, Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселоду; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); производные ретиноевой кислоты, такие как Targretin™ (бексаротен), Panretin™ (алитретиноин); ONTAK™ (денилейкин дефтитокс); эсперамицины; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных соединений. Также, в это определение включены анти-гормональные средства, которые регулируют или ингибируют действие гормонов на опухоли: такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 5-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Fareston); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных соединений.
Различные другие терапевтические агенты могут использоваться вместе с анти-CD40 антителами, описанными в настоящем документе. В одном варианте осуществления изобретения антитело вводят с противовоспалительным агентом. Противовоспалительные агенты или лекарственные средства включают, но не ограничиваются ими, стероиды и глюкокортикоиды (включая бетаметазон, будесонид, дексаметазон, гидрокортизона ацетат, гидрокортизон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон), нестероидные противовоспалительные средства (NSAID), включая аспирин, ибупрофен, напроксен, метотрексат, сульфасалазин, лефлуномид, анти-TNF препараты, циклофосфамид и микофенолят.
Типичные NSAID выбраны из группы, состоящей из ибупрофена, напроксена, напроксена натрия, ингибиторов Сох-2, таких как VIOXX® (рофекоксиб) и CELEBREX® (целекоксиб) и сиалилатов. Типичные анальгетики выбраны из группы, состоящей из ацетаминофена, оксикодона, трамадола или пропоксифена гидрохлорида. Типичные глюкокортикоиды выбраны из группы, состоящей из кортизона, дексаметазона, гидрокортизона, метилпреднизолона, преднизолона или преднизона. Типичные модификаторы биологических ответов включают молекулы, направленные против маркеров клеточной поверхности (например, CD4, CD5 и т.д.), ингибиторы цитокинов, такие как антагонисты TNF (например, этанерцепт (ENBREL®), адалимумаб (HUMIRA®) и инфликсимаб (REMICADE®)), ингибиторы хемокинов и адгезии. Модификаторы биологического ответа включают моноклональные антитела, а также рекомбинантные формы молекул. Типичные DMARD включают азатиоприн, циклофосфамид, циклоспорин, метотрексат, пеницилламин, лефлуномид, сульфасалазин, гидроксихлороквин, золото (пероральное (ауранофин) и внутримышечное) и миноциклин.
В некоторых вариантах осуществления изобретения описанные в настоящем документе антитела вводят в комбинации с цитокином. Термин «цитокин» в контексте настоящего изобретения означает общий термин для белков, высвобождаемых одной популяцией клеток, которые действуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. В число цитокинов входят гормоны роста, такие как человеческий гормон роста, N-метионильный человеческий гормон роста и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреотропный гормон (TSH) и лютеинизирующий гормон (LH); фактор роста гепатоцитов; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-альфа и -бета; ингибирующее вещество Мюллера; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; фактор роста сосудистого эндотелия; интегрин; тромбопоэтин (ТРО), факторы роста нервов, такие как NGF-бета; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулин-подобный фактор роста-I и-II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, бета и -гамма; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF), гранулоцитарно-макрофагальный CSF (GM-CSF) и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, TL-1альфа, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-15; фактор некроза опухолей, такой как TNF-альфа и TNF-бета, и другие полипептидные факторы, включая LIF и лиганд Kit (KL). В контексте настоящего изобретения термин "цитокин" включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с природной последовательностью.
Композиции, содержащие описанные в настоящем документе CD40-специфичные антитела, могут быть введены индивидууму, страдающему заболеванием, описанным в настоящем документе, включая, но не ограничиваясь этим, неходжскинские лимфомы, лимфому Ходжкина, хронический лимфоцитарный лейкоз, волосатоклеточные лейкозы, острые лимфобластные лейкозы, множественную миелому, карциномы поджелудочной железы, толстой кишки, желудка, кишечника, предстательной железы, мочевого пузыря, почек, яичников, шейки матки, молочной железы, легких, носоглотки, злокачественную меланому и устойчивые к ритуксимабу NHL и лейкозы, аутоиммунные и воспалительные заболевания. Аутоиммунные заболевания включают, но не ограничиваются ими, артрит (включая ревматоидный артрит, реактивный артрит), системную красную волчанку (SLE), псориаз и воспалительное заболевание кишечника (IBD), энцефаломиелит, увеит, миастению гравис, рассеянный склероз, инсулинзависимый сахарный диабет, болезнь Аддисона, целиакию, синдром хронической усталости, аутоиммунный гепатит, аутоиммунную алопецию, анкилозирующий спондилит, неспецифический язвенный колит, болезнь Крона, фибромиалгию, обыкновенную пузырчатку, синдром Шегрена, болезнь Кавасаки, гипертиреоз/болезнь Грейвса, гипотиреоз/болезнь Хашимото, эндометриоз, склеродермию, пернициозную анемию, синдром Гудпасчера, синдром Гийена-Барре, болезнь Вегенера, гломерулонефрит, апластическую анемию (включая пациентов с апластической анемией после многократных переливаний крови), пароксизмальную ночную гемоглобинурию, миелодиспластический синдром, идиопатическую тромбоцитопеническую пурпуру, аутоиммунную гемолитическую анемию, синдром Эванса, синдром ингибиторов фактора VIII, системный васкулит, дерматомиозит, полимиозит и ревматоидную лихорадку, аутоиммунный лимфопролиферативный синдром (ALPS), аутоиммунный буллезный пемфигоид, болезнь Паркинсона, саркоидоз, витилиго, первичный билиарный цирроз и аутоиммунный миокардит.
Воспалительные заболевания включают, но не ограничиваются ими, болезнь Крона, колит, дерматит, псориаз, дивертикулит, гепатит, синдром раздраженного кишечника (IBS), красную волчанку, нефрит, болезнь Паркинсона, неспецифический язвенный колит, рассеянный склероз (MS), болезнь Альцгеймера, артрит, ревматоидный артрит, астму и различные сердечно-сосудистые заболевания, такие как атеросклероз и васкулит. В некоторых вариантах осуществления изобретения воспалительное заболевание выбрано из группы, состоящей из ревматоидного артрита, сахарного диабета, подагры, криопирин-ассоциированного периодического синдрома и хронического обструктивного легочного расстройства. В этом отношении один вариант осуществления изобретения обеспечивает способ лечения, уменьшения тяжести или профилактики воспаления или воспалительного заболевания путем введения нуждающемуся в этом пациенту терапевтически эффективного количества раскрытых в настоящем документе композиций, содержащих анти-CD40 антитела.
Для применения in vivo при лечении болезней человека описанные в настоящем документе антитела перед введением обычно включают в фармацевтическую композицию. Фармацевтическая композиция содержит одно или несколько из антител, описанных в настоящем документе, в комбинации с физиологически приемлемым носителем или вспомогательным веществом, описанными в настоящем документе в другом разделе. Для получения фармацевтической композиции эффективное количество одного или нескольких соединений смешивают с любым фармацевтическим носителем(-ями) или эксципиентами, известными специалистам в данной области, как подходящие для конкретного способа введения. Фармацевтический носитель может быть жидким, полужидким или твердым. Растворы или суспензии, используемые для парентерального, внутрикожного, подкожного или местного применения могут включать, например, стерильный разбавитель (например, воду), физиологический раствор, нелетучие масла, полиэтиленгликоль, глицерин, пропиленгликоль или другой синтетический растворитель; противомикробные агенты (такие как бензиловый спирт и метилпарабены); антиоксиданты (такие как аскорбиновая кислота и бисульфит натрия) и хелатирующие агенты (такие как этилендиаминтетрауксусная кислота (EDTA)); буферы (такие как ацетаты, цитраты и фосфаты). В случае внутривенного введения, подходящие носители включают физиологический раствор или фосфатно-солевой буфер (PBS), и растворы, содержащие загустители и солюбилизирующие агенты, такие как глюкоза, полиэтиленгликоль, полипропиленгликоль и их смеси.
Композиции, содержащие CD40-антитела, описанные выше, могут быть получены с носителями, которые защищают антитело от быстрого выведения из организма, например, в составах с замедленным высвобождением или в оболочках. Такие носители включают композиции с контролируемым высвобождением, такие как, но не ограниченные этим, имплантаты и микроинкапсулированные системы доставки, и биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, ПЭГ, полиортоэфиры, полимолочная кислота и другие, известные специалисту в данной области.
Изобретение относится к способам лечения с использованием антител, которые связываются с CD40. В одном варианте осуществления изобретения антитела по настоящему изобретению вводят пациенту, имеющему заболевание, включающее несоответствующую экспрессию CD40, что подразумевает в контексте настоящего описания включение заболеваний и расстройств, отличающихся аберрантной экспрессией или активностью CD40, обусловленной, например, изменениями (например, статистически значимым увеличением или уменьшением) количества присутствующего белка, или присутствием мутантного белка, или этими двумя причинами. Избыток белка может возникнуть по любой причине, включая, но не ограничиваясь этим, сверхэкспрессию на молекулярном уровне, повышенное или накопленное присутствие на месте действия, или увеличенная (например, статистически значимым образом) активность CD40 по сравнению с обнаруживаемой в норме. Такой переизбыток CD40 может быть измерен относительно нормальной экспрессии, присутствия или активности сигнальных событий CD40, и указанное измерение может играть важную роль при разработке и/или клинических испытаниях антител, описанных в настоящем документе.
Настоящие антитела применимы для лечения различных видов рака. В некоторых вариантах осуществления изобретения описанные в настоящем документе антитела проявляют противоопухолевую активность путем активации противоопухолевых иммунных ответов. В некоторых вариантах осуществления изобретения настоящие антитела применимы для лечения различных видов рака, связанных с аберрантной экспрессией CD40. В одном варианте осуществления настоящее изобретение относится к способу лечения рака, включая, но не ограничиваясь этим, неходжскинские лимфомы, лимфому Ходжкина, хронические лимфоцитарные лейкозы, волосатоклеточные лейкозы, острые лимфобластные лейкозы, множественную миелому, карциномы поджелудочной железы, толстой кишки, желудка, кишечника, предстательной железы, мочевого пузыря, почек, яичников, шейки матки, молочной железы, легких, носоглотки, злокачественную меланому и устойчивые к ритуксимабу NHL и лейкозы, путем введения раковому пациенту терапевтически эффективного количества раскрытого в настоящем документе CD40-специфичного антитела. Эффективным считается количество, которое после введения ингибирует, предупреждает или задерживает развитие и/или метастазирование рака статистически значимым образом (то есть, относительно соответствующего контроля, как известно опытным специалистам в данной области).
Другой вариант осуществления изобретения относится к способу предупреждения метастазирования рака, включая, но не ограничиваясь этим, неходжскинские лимфомы, лимфому Ходжкина, хронические лимфоцитарные лейкозы, волосатоклеточные лейкозы, острые лимфобластные лейкозы, множественную миелому, карциномы поджелудочной железы, толстой кишки, желудка, кишечника, предстательной железы, мочевого пузыря, почек, яичников, шейки матки, молочной железы, легких, носоглотки, злокачественную меланому и устойчивые к ритуксимабу NHL и лейкозы, путем введения раковому пациенту терапевтически эффективного количества раскрытого в настоящем документе CD40-специфичного антитела (например, в количестве, которое после введения ингибирует, предупреждает или задерживает метастазирование рака статистически значимым образом, то есть, относительно соответствующего контроля, как известно опытным специалистам в данной области).
Другой вариант осуществления изобретения относится к способу предупреждения рака, включая, но не ограничиваясь этим, неходжскинские лимфомы, лимфому Ходжкина, хронические лимфоцитарные лейкозы, волосатоклеточные лейкозы, острые лимфобластные лейкозы, множественную миелому, карциномы поджелудочной железы, толстой кишки, желудка, кишечника, предстательной железы, мочевого пузыря, почек, яичников, шейки матки, молочной железы, легких, носоглотки, злокачественную меланому и устойчивые к ритуксимабу NHL и лейкозы, путем введения раковому пациенту терапевтически эффективного количества раскрытого в настоящем документе CD40-специфичного антитела.
Другой вариант осуществления изобретения относится к способу лечения, уменьшения симптомов, ингибирования развития или предупреждения неходжскинских лимфом, лимфомы Ходжкина, хронических лимфоцитарных лейкозов, волосатоклеточных лейкозов, острых лимфобластных лейкозов, множественной миеломы, карцином поджелудочной железы, толстой кишки, желудка, кишечника, предстательной железы, мочевого пузыря, почек, яичников, шейки матки, молочной железы, легких, носоглотки, злокачественной меланомы, и устойчивых к ритуксимабу NHL и лейкозов путем введения пациенту, страдающему от одного или нескольких из этих заболеваний, терапевтически эффективного количества раскрытого в настоящем документе CD40-специфичного антитела.
Другой вариант осуществления изобретения относится к способу лечения, облегчения симптомов, ингибирования развития или предупреждения аутоиммунного заболевания путем введения пациенту, страдающему от одного или нескольких из этих заболеваний, терапевтически эффективного количества раскрытого в настоящем документе CD40-специфичного антитела. В этом отношении, аутоиммунные заболевания включают, но не ограничены этим, артрит (включая ревматоидный артрит, реактивный артрит), системную красную волчанку (SLE), псориаз и воспалительное заболевание кишечника (IBD), энцефаломиелит, увеит, миастению гравис, рассеянный склероз, инсулинозависимый сахарный диабет, болезнь Аддисона, целиакию, синдром хронической усталости, аутоиммунный гепатит, аутоиммунную алопецию, анкилозирующий спондилит, неспецифический язвенный колит, болезнь Крона, фибромиалгию, обыкновенную пузырчатку, синдром Шегрена, болезнь Кавасаки, гипертиреоз/болезнь Грейвса, гипотиреоз/болезнь Хашимото, эндометриоз, склеродермию, пернициозную анемию, синдром Гудпасчера, синдром Гийена-Барре, болезнь Вегенера, гломерулонефрит, апластическую анемию (включая пациентов с апластической анемией после многократных переливаний крови), пароксизмальную ночную гемоглобинурию, миелодиспластический синдром, идиопатическую тромбоцитопеническую пурпуру, аутоиммунную гемолитическую анемию, синдром Эванса, синдром ингибиторов фактора VIII, системный васкулит, дерматомиозит, полимиозит и ревматоидную лихорадку, аутоиммунный лимфопролиферативный синдром (ALPS), аутоиммунный буллезный пемфигоид, болезнь Паркинсона, саркоидоз, витилиго, первичный билиарный цирроз и аутоиммунный миокардит.
Другой вариант осуществления изобретения относится к способу лечения, облегчения симптомов, ингибирования развития или предупреждения воспалительного заболевания путем введения пациенту, страдающему от одного или нескольких из этих заболеваний, терапевтически эффективного количества раскрытого в настоящем документе CD40-специфичного антитела. Воспалительные заболевания включают, но не ограничиваются этим, болезнь Крона, колит, дерматит, псориаз, дивертикулит, гепатит, синдром раздраженного кишечника (IBS), красную волчанку, нефрит, болезнь Паркинсона, неспецифический язвенный колит, рассеянный склероз (MS), болезнь Альцгеймера, артрит, ревматоидный артрит, астму и различные сердечно-сосудистые заболевания, такие как атеросклероз и васкулит. В некоторых вариантах осуществления изобретения воспалительное заболевание выбрано из группы, состоящей из ревматоидного артрита, сахарного диабета, подагры, криопирин-ассоциированного периодического синдрома и хронического обструктивного легочного расстройства.
В другом варианте осуществления изобретения анти-CD40 антитела по настоящему изобретению используют для определения структуры связанного антигена, например конформационных эпитопов, чью структуру можно затем использовать для разработки соединений, обладающих этой структуру или имитирующих ее, например, с помощью способов химического моделирования и SAR («Взаимосвязь стуктуры и активности»).
Различные другие варианты осуществления настоящего изобретения относятся, в частности, к диагностическому применению для обнаружения присутствия клеток или тканей, экспрессирующих CD40. Таким образом, настоящее изобретение относится к способам обнаружения CD40 в образце, например, обнаружения клеток или тканей, экспрессирующих CD40. Такие способы могут применяться в различных известных форматах обнаружения, включающих, но не ограниченных ими, иммуногистохимию (IHC), иммуноцитохимию (ICC), гибридизацию in situ (ISH), полнотканевую гибридизацию in situ (WISH), гибридизацию in situ с флуоресцентной ДНК (FISH), проточную цитометрию, иммуноферментный анализ (EIA) и твердофазный иммуноферментный анализ (ELISA).
ISH представляет собой тип гибридизации, в которой используется меченая комплементарная ДНК- или РНК-цепь (т.е. первичный связывающий агент) для локализации конкретной ДНК- или РНК-последовательности на участке или фрагменте клетки или ткани (in situ), или, если ткань достаточно мала, то всей ткани (полнотканевая ISH). Специалисту в данной области должно быть понятно, что этот метод отличается от иммуногистохимии, с помощью которого локализуют белок в срезах тканей с использованием антитела в качестве первичного связывающего агента. ДНК ISH может использоваться на геномной ДНК для определения структуры хромосом. ISH с флуоресцентной ДНК (FISH) может, например, использоваться в медицинской диагностике для оценки целостности хромосом. ISH РНК (гибридизационная гистохимия) используется для измерения и локализации мРНК- и других транскриптов в срезах тканей или целой ткани.
В различных вариантах осуществления изобретения антитела, описанные в настоящем документе, конъюгированы с детектируемой меткой, которая может быть обнаружена прямо или косвенно. В этом случае «конъюгат» антитела относится к анти-CD40 антителу, ковалентно связанному с детектируемой меткой. В настоящем изобретении зонды ДНК, РНК-зонды, моноклональные антитела, их антиген-связывающие фрагменты и их производные, такие как одноцепочечный фрагмент вариабельной области или меченное эпитопом антитело, все могут быть ковалентно связаны с детектируемой меткой. При «прямом обнаружении» используется только одно детектируемое антитело, т.е. первичное детектируемое антитело. Таким образом, прямое обнаружение означает, что антитело, конъюгированное с детектируемой меткой, может быть обнаружено per se без необходимости добавления второго антитела (вторичного антитела).
«Детектируемая метка» представляет собой молекулу или вещество, которые могут производить детектируемый (например, визуальный, электронный или иной) сигнал, который указывает на наличие и/или концентрацию метки в образце. При конъюгации с антителами, детектируемая метка может использоваться для обнаружения и/или количественного определения мишени, против которой направлено специфичное антитело. Таким. образом, присутствие и/или концентрация мишени в образце могут быть обнаружены путем обнаружения сигнала, испускаемого детектируемой меткой. Детектируемая метка может быть обнаружена прямо или косвенно, и для обнаружения одной или нескольких мишеней могут использоваться совместно несколько различных детектируемых меток конъюгированных с антителами, имеющими различную специфичность.
Примеры детектируемых меток, которые могут быть обнаружены напрямую, включают флуоресцентные красители и радиоактивные вещества и частицы металлов. В отличие от этого, косвенное обнаружение требует использования одного или нескольких дополнительных антител, т.е. вторичных антител, после применения первичного антитела. Таким образом, обнаружение выполняется путем обнаружения связывания вторичного антитела или связывающего агента с первичным детектируемым антителом. Примеры первичных детектируемых связывающих агентов или антител, требующие добавления вторичного связывающего агента или антитела, включают ферментативные детектируемые связывающие агенты и гаптеновые детектируемые связывающие агенты или антитела.
В некоторых вариантах осуществления изобретения детектируемая метка конъюгирована с нуклеотидным полимером, который содержит первый связывающий агент {например, в ISH, WISH или FISH процессах). В других вариантах осуществления изобретения детектируемую метку конъюгируют с антителом, которое содержит первый связывающий агент (например, в IHC).
Примеры детектируемых меток, которые могут быть конъюгированы с антителами, используемыми в способах по настоящему изобретению, включают флуоресцентные метки, ферментативные метки, радиоизотопы, хемилюминесцентные метки, электрохемилюминесцентные метки, биолюминесцентные метки, полимеры, полимерные частицы, частицы металлов, гаптены и красители.
Примеры флуоресцентных меток включают 5-(и 6)-карбоксифлуоресцеин, 5- или 6-карбоксифлуоресцеин, 6-(флуоресцеин)- 5 -(и 6)-карбоксамидогексановую кислоту, флуоресцеинизотиоцианат, родамин, тетраметилродамин и красители, такие как Cy2, Cy3, Cy5 и необязательно замещенный кумарин, включая АМСА, PerCP, фикобилипротеины, включая R-фикоэритрин (RPE) и аллофикоэритрин (АРС), Texas Red, Princeton Red, зеленый флуоресцентный белок (GFP) и его аналоги, и конъюгаты R-фикоэритрина или аллофикоэритрина, неорганические флуоресцентные метки, такие как частицы на основе полупроводниковых материалов, таких как нанокристаллы CdSe, покрытые оболочкой.
Примеры меток на основе полимерных частиц включают микрочастицы или латексные частицы полистирола, РМАА (полиметилметакрилата) или диоксида кремния, в которые могут быть введены флуоресцентные красители, или мицеллы или капсулы полимера, которые содержат красители, ферменты или субстраты.
Примеры меток на основе частиц металлов включают частицы золота и покрытые оболочкой частицы золота, которые могут быть проявлены окрашиванием серебром. Примеры гаптенов включают DNP, флуоресцеинизотиоцианат (FITC), биотин и дигоксигенин. Примеры ферментативных меток включают пероксидазу хрена (HRP), щелочную фосфатазу (ALP или АР), β-галактозидазу (GAL), глюкозо-6-фосфатдегидрогеназу, β-N-ацетилглюкозаминидазу, β-глюкуронидазу, инвертазу, ксантиноксидазу, люциферазу светляка и глюкозооксидазу (GO). Примеры обычно используемых субстратов для пероксидазы хрена включают 3,3'-диаминобензидин (DAB), диаминобензидин с усилением никелем, 3-амино-9-этилкарбазол (АЕС), бензидиндигидрохлорид (BDHC), реагент Ханкера-Ята (HYR), индофан синий (IB), тетраметилбензидин (ТМВ), 4-хлор-1-нафтол (CN), альфа-нафтолпиронин (Альфа-NP), о-дианизидин (OD), 5-бром-4-хлор-3-индолилфосфат (BCIP), нитротетразолий синий (NBT), 2-(п-иодфенил)-3-п-нитрофенил-5-фенилтетразолия хлорид (INT), тетранитротетразолий синий (TNBT), 5-бром-4-хлор-3-индоксил-бета-D-галактозид/ферро-феррицианид (BCIG/FF).
Примеры наиболее часто используемых субстратов щелочной фосфатазы включают Нафтол-AS-B1-фосфат/быстрый красный TR (NABP/FR), Нафтол-AS-МХ-фосфат/быстрый красный TR (NAMP/FR), нафтол-AS-В1-фосфат/быстрый красный TR (NABP/FR), Нафтол-AS-MX-фосфат/быстрый красный TR (NAMP/FR), Нафтол-AS-В1-фосфат/новый фуксин (NABP/NF), бромхлориндолилфосфат/нитротетразолий синий (BCIP/NBT), 5-бром-4-хлор-3-индолил-β-D-галактопиранозид (BCIG).
Примеры люминесцентных меток включают люминол, изолюминол, акридиновые эфиры, 1,2-диоксетаны и пиридопиридазины. Примеры электрохемилюминесцентных меток включают производные рутения. Примеры радиоактивных меток включают радиоактивные изотопы йода, кобальта, селена, трития, углерода, серы и фосфора.
Детектируемые метки могут быть связаны с антителами, описанными в настоящем документе, или любой другой молекулой, которая специфично связывается с представляющим интерес биологическим маркером, например, антителом, нуклеотидным зондом или полимером. Кроме того, специалисту в данной области техники будет очевидно, что детектируемые метки также могут быть конъюгированы с вторым, и/или третьим, и/или четвертым, и/или пятым связывающим агентом или антителом, и т.д. Более того, опытному специалисту в данной области будет понятно, что каждый дополнительный связывающий агент или антитело, используемые для характеристики биологического маркера, представляющего интерес, могут служить в качества стадии амплификации сигнала. Биологический маркер можно обнаружить визуально, с использованием, например, световой микроскопии, флуоресцентной микроскопии, электронной микроскопии, когда обнаруживаемое вещество представляет собой, например, краситель, коллоидные частицы золота, люминесцентный реагент. Визуально детектируемые вещества, связанные с биологическим маркером, могут также быть обнаружены с помощью спектрофотометра. Если детектируемое вещество является радиоактивным изотопом, то обнаружение можно осуществлять визуально с помощью авторадиографии или невизуально с помощью сцинтилляционного счетчика. См., например, Larsson, 1988, Immunocytochemistry: Theory and Practice, (CRC Press, Boca Raton, Fla.); Methods in Molecular Biology, vol.80 1998, John D. Pound (ed.) (Humana Press, Totowa, N.J.).
Изобретение дополнительно относится к наборам для обнаружения CD40, или клеток или тканей, экспрессирующих CD40, в образце, причем наборы содержат по меньшей мере одно антитело, полипептид, полинуклеотид, вектор или клетку-хозяина, описанные в настоящем документе. В некоторых вариантах осуществления изобретения набор может содержать буферы,. ферменты, метки, субстраты, шарики или другие поверхности, к которым присоединены антитела по изобретению, и т.п., и инструкции по применению.
ПРИМЕРЫ
ПРИМЕР 1
ПОЛУЧЕНИЕ И ГУМАНИЗАЦИЯ АНТИ-CD40 АНТИТЕЛ
Четыре новозеландских белых кролика были имммунизированы рекомбинантным кроличьим Fc-hCD40. Кролик с наивысшим титром специфичного связывания с CD40 человека был отобран для слияния клеток. Всего было идентифицировано 172 гибридомы, имеющие положительное связывание с растворимым Fc-hCD40, из которых 44 клона положительно связывали CD40 на клеточной поверхности. После группировки по эпитопам были отобраны 24 репрезентативные гибридомы для проведения рекомбинантной экспрессии и дополнительной характеристики. Вторичный функциональный скрининг был проведен, как описано далее, и включал: 1) индукцию созревания DC, измеряемую по повышению экспрессии CD80, CD83, CD86 (агонистическая активность); 2) индукцию прямого ингибирования роста опухоли (агонистическая активность); и 3) ADCC-эффекторная функция антитела. Кандидаты были выбраны на основе двойного функционального скрининга, который включал два раздела: 1) аффинность связывания, интернализацию антитела, антитело-зависимую клеточную цитотоксичность (ADCC), комплемент-зависимую цитотоксичность (CDC) и антитело-зависимый клеточный фагоцитоз (ADCP); и 2) функцию агонистической активации/созревания DC, взаимодействие рецептора с лигандом, реакцию смешанных лимфоцитов (MLR), клеточную пролиферацию и апоптоз.
Скрининг агонистических антител по созреванию дендритных клеток
Для дополнительного выяснения агонистического или антагонистического эффекта исходной панели анти-CD40 антител, в качестве показателя при скрининге функциональных антител использовали анализ созревания DC. Анти-CD40 или контрольные антитела добавляли на два дня к раствору культуры моноцитарных DC человека. Повышение экспрессии CD83, одного из наиболее известных маркеров дендритных клеток человека, измеряли для отбора агонистических антител. В качестве положительного контроля использовали 5С11, мышиное моноклональное антитело, которое индуцирует созревание дендритных клеток. Антитела R-3, R-6, R-8, R-9, R-16, R-18, R-24, R-33, R-36, 19-21, 19-45 и 19-59 увеличивали более чем на 50% экспрессию CD83 по сравнению с контрольным иммуноглобулином (фиг.1А). Созревание DC дополнительно определяли путем измерения индуцируемого антителами повышения экспрессии ко-стимулирующих молекул CD80 и CD86 для отдельных антител. Как показано на фиг.1В и фиг.1С, антитела R-3, R-8, R-9, R-33 и 19-21 повышали экспрессию как CD80, так и CD86, тогда как другие антитела имели только слабые эффекты. Эти результаты согласуются с эффектами этих антител на экспрессию CD83, Следует отметить, что среди антител, способных индуцировать созревание DC, только клон 19-21 сильно усиливал пролиферацию Т-клеток в реакции смешанных лимфоцитов (фиг.1D).
Скрининг по прямому ингибированию роста опухоли
Панель агонистических анти-CD40 антител дополнительно оценивали по способности вызывать ингибирование роста опухолевых клеток, экспрессирующих CD40. Все протестированные анти-CD40 антитела ингибировали пролиферацию опухолевых клеток. Антитело 19-21 показывало наибольшую эффективность (фиг.2).
Скрининг по ADCC-активности
Кроме индукции активации АРС и ингибирования роста опухоли, эффекторную функцию антител, ADCC, использовали в качестве важного критерия для скрининга и оценки потенциальных антител. Для проведения анализа ADCC с использованием РВМС человека, все отобранные антитела превращали из кроличьих mAb в химерные mAb с кроличьим Fab и IgG1 человека. Как показано на фиг.3, все отобранные кандидаты показывали значительную ADCC-активность по сравнению с контрольным IgG1. Исходя из максимальной ADCC-активности, лидирующие антитела можно было расположить следующим образом cR-8>cR-3>cR-33>С19-21>cR-9>с19-59.
Исходя из функционального скрининга in vitro были отобраны четыре кандидата (с19-21, cR-8, cR-3, cR-33). Их характеристики из экспериментов in vitro приведены в таблице 1. Антитело с19-21 сильно увеличивает активацию DC и ингибирует рост опухоли, тогда как антитела cR-8 и cR-3 демонстрировали более сильную ADCC-активность.
Скрининг по противоопухолевой активности in vivo
Поскольку лучшие 4 кандидата имели разную активность в различных анализах in vitro, для поиска потенциального терапевтического средства авторы: изобретения провели исследования in vivo и сравнили их противоопухолевую активность. Использовали модель ксенографтной опухоли из клеток Ramos. Мыши с опухолями получали внутрибрюшинно по 5 мг/кг химерных антител cR-3, cR-8, cR-33 или с19-21 по 3 раза в недели, всего 9 доз (по 8 животных на группу). Противоопухолевую активность ритуксимаба с такой же схемой введения использовали в качестве эталона. Как показано на фиг.4А, cR-8 и cR-3 показали наивысший противоопухолевый эффект. В отличие от этого, 19-21 имело меньшую противоопухолевую активность и более быстрое восстановление опухоли после прекращения введения. Противоопухолевый эффект cR-33 находился в середине, но все еще превышал in vivo эффективность ритуксимаба. Силу действия антител cR-3 и cR-8 in vivo дополнительно оценивали в исследовании зависимости эффекта от дозы. Как показано на фиг.4В, cR-8 имело более сильную противоопухолевую эффективность, чем cR-3, и поэтому было идентифицировано как потенциально терапевтическое анти-CD40 антитело.
Аминокислотные последовательности вариабельных областей тяжелой и легкой цепей клона R-8 приведены в SEQ ID NO:1 и 2. Аминокислотные последовательности CDR VH и VL приведены в SEQ ID NO:3-5 и 6-8, соответственно. Аминокислотные последовательности тяжелой и легкой цепей нескольких других потенциальных антител, которые показывали функциональную активность, приведены в SEQ ID NO:11-56. Аминокислотные последовательности VHCDR и VLCDR для этих антител приведены в SEQ ID NO:57-194. На фиг.16 показано выравнивание этих последовательностей, включая клон R-8 с подчеркнутыми CDR.
R-8 было гуманизировано с использованием запатентованной мутационной линейно-направленной (MLG) технологии гуманизации (см., например, патент США №7,462,697). Каркасные области легкой и тяжелой цепей гуманизированного R-8 (АРХ005) на 95% идентичны последовательностям из зародышевой линии человека. Аминокислотные последовательности гуманизированных VH- и VL-областей приведены в SEQ ID NO:9 и 10, соответственно. Было найдено, что связывание АРХ005 с CD40 аналогично его родительскому клону R-8.
ПРИМЕР 2
IN VITRO ХАРАКТЕРИСТИКА ГУМАНИЗИРОВАННОГО АНТИ-CD40 АНТИТЕЛА, АРХ005
Для дальнейшей характеристики гуманизированного антитела, АРХ005, были проведены многочисленные эксперименты in vitro.
АРХ005 селективно связывается с CD40
Селективность сязывамия АРХ005 оценивали с помощью прямого анализа ELTSA с панелью белков TNFR-семества. Планшеты для ELISA покрывали общим количеством 1 г/мл слитого белка, состоящего из кроличьей Fc-области и CD40, RANK, TweakR, ОХ40, DR5 и 4-1ВВ. Связанное АРХ005 детектировали с использованием конъюгированных с HRP козьих антител против IgG человека. Как показано на фиг.5, APX005 селективно связывается с CD40 человека, но не с другими протестированными белками из TNFR-семейства.
АРХ005 блокирует связывание CD40L с CD40
Для оценки эффекта АРХ005 на связывание CD40L с CD40 проводили ELISA. В частности, CD40L (с конечной концентрацией 4 мкг/мл) использовали для связывания иммобилизованного CD40 человека на планшете ELISA, и изменения в количестве CD40L, связанного с CD40, измеряли после предварительной инкубации иммобилизованного CD40 с АРХ005. Связывание CD40L с иммобилизованным CD40 обнаруживали с использованием мышиного анти-CD40L моноклонального антитела. Как показано на фиг.6, АРХ005 блокирует связывание CD40L с CD40. В отличие от этого SGN-40 повышает связывание.
Комплекс АРХ005/CD40 не интернализуется
Для исследования мишень-опосредованной интернализации АРХ005 с целью оценки ее влияния на ADCC-активность, клетки Ramos инкубировали с АРХ005 с течение 4 ч при 37°C, температура, разрешающая интернализацию, или при 4°C в течение 30 мин, температура при которой интернализация минимальна. Клетки промывали буфером для окрашивания, и далее инкубировали с меченными Alexa 488 козьими антителами к IgG человека в течение дополнительных 30 мин при 4°C. FACS-анализ проводили для исследования уровня АРХ005 на клеточной поверхности. Как показано на фиг.7, не наблюдалось снижения (небольшое повышение) уровня АРХ005 на клеточной поверхности после инкубации при 37°C. Эти данные позволяют предположить, что после связывания с CD40 комплекс APX005/CD40 не интернализуется опухолевыми клетками, таким образом обеспечивая оптимальные условия для привлечения эффекторных клеток для ADCC.
АРХ005 опосредует ADCC
С целью оценки ADCC-активности АРХ005 в отношении экспрессирующих CD40 опухолевых клеток, в качестве клеток-мишеней использовали экспрессирующие CD40 клетки Ramos и Daudi, а свежие мононуклеарные клетки периферической крови человека (РВМС) использовали в качестве эффекторных клеток. ADCC измеряли по высвобождению кальцеина-AM. Клетки-мишени метили кальцеином-АМ (15 мкМ на 106 клеток), промывали и высевали в трех повторах по 5×103 клеток в круглодонные 96-луночные планшеты. Увеличивающиеся концентрации (0,0001-10 мкг/мл) АРХ005 или контрольного антитела сначала инкубировали с высеянными клетками 30 мин при 4°C, после чего добавляли эффекторные клетки РВМС от здоровых доноров до конечного соотношения эффекторных клеток к клеткам-мишеням 40:1, в конечном объеме 200 мкл на лунку. Эксперименты проводились с использованием РВМС по меньшей мере от трех разных доноров. После 4-часовой инкубации 100 мкл культуральных супернатантов переносили в планшет Black View Plate-96, и произвольные единицы флуоресценции (AFU) измеряли на планшетном флуориметре Victor II (возбуждение 485 нм/эмиссия 535 нм). Удельный лизис (%)=(среднее AFU для экспериментального высвобождения - среднее AFU для спонтанного высвобождения)/(среднее AFU для максимального высвобождения среднее AFU для спонтанного высвобождения). Как показано на фиг.8, АРХ005 индуцировало ADCC дозозависимым образом. Аналогичный эффект наблюдался для SGN-40. Различная чувствительность клеток Ramos и Daudi к ADCC может быть следствием различного уровня экспрессии CD40 (Cancer Res 2005; 65:8331-8338).
АРХ005 ингибирует пролиферацию опухолевых клеток
Для оценки способности АРХ005 ингибировать пролиферацию опухолевых клеток, клетки Ramos высевали в плоскодонные 96-луночные планшеты в количестве 50000 клеток на лунку в 200 мкл RPMI 1640 с 10% FBS, содержащей различные концентрации АРХ005, SGN-40 или контрольных IgG человека. Для перекрестного сшивания перед добавлением к клеткам АРХ005, SGN-40 или контрольные IgG предварительно инкубировали в течение 30 мин с F(ab')2-фрагментом козьего антитела, специфичного к Fc-фрагменту IgG человека, в среде при комнатной температуре. Клетки обрабатывали всего в течение 72 часов. Затем в каждую лунку добавляли 10% AlamarBlue® (Serotec, Oxford, UK) и инкубировали еще в течение 24 часов. Жизнеспособность клеток измеряли с использованием планшетного флуориметра CytoFluor при длине возбуждения 530 нм и длине волны испускания 590 нм. Все исследования проводили дважды в трех повторах для каждой концентрации образца. Как показано на фиг.9, мономер АРХ005 ингибировал пролиферацию клеток Ramos (фиг.9А). Когда АРХ005 было сшито вторичным антителом, оно имело более высокий и дозозависимый эффект ингибирования пролиферации (фиг.9В). Перекрестная сшивка АРХ005 может осуществляться in vivo клетками, экспрессирующими Fc рецептор.
АРХ005 вызывает активацию DC
С целью оценки способности АРХ005 стимулировать созревание DC, получали РВМС центрифугированием в градиенте плотности, используя раствор для выделения лимфоцитов. Прикрепленные моноциты собирали после инкубации в течение 2 ч при 37°C. Выделенные моноциты культивировали с 100 нг/мл рекомбинантного человеческого GM-CSF и 100 нг/мл рекомбинантного человеческого IL-4 в среде RPMI 1640 в 10% FCS в 24-луночном планшете. Половину среды заменяли каждые 3 дня. На 5 день культивирования к дендритным клеткам добавляли 1,3 нМ анти-CD40 антитела, CD40L или контрольного антитела и дополнительно культивировали в течение 48 ч в 24-луночном планшете. Для окрашивания маркеров активации DC использовали конъюгированные с РЕ анти-CD83, анти-CD86 и анти-CD80 антитела. Анализ проводили с использованием FACS. Приведены данные из одного репрезентативного исследования. Как показано на фиг.10, АРХ005 вызывало усиленное созревание DC, и его эффект был более сильным относительно SGN-40 и CD40L. Увеличенная активация DC может приводит к более сильным противоопухолевым Т-клеточным ответам.
АРХ005 имеет перекрестную реактивность с CD40 обезьяны, но не с мышиным CD40
Перекрестную реактивность оценивали прямым ELISA. Всего по 1 г/мл CD40 человека, CD40 обезьяны или CD40 мыши наносили на планшеты для ELISA и далее инкубировали с 1 мкг/мл АРХ005 или контрольного IgG1. Антитела, связанные с CD40, обнаруживали, используя конъюгированные с HRP козьи антитела против IgG человека. АРХ005 явно имел перекрестную реактивность с CD40 обезьяны, но не с мышиным CD40 (фиг.11А).
Перекрестная реактивность АРХ005 с мышиным CD40 была дополнительно определена с помощью FACS для связывания с мышиной клеточной линией А20, которая экспрессирует мышиный CD40. Аликвоту 0,5×106 клеток А20 добавляли в 96-луночные планшеты и инкубировали с 100 мкл разведенного крысиного антитела к мышиному CD40, конъюгированного с РЕ, АРХ005 или контрольным антителом IgG1. После промывки, к образцам добавляли по 100 мкл козьих антител к человеческим IgG (H+L), конъюгированных с R-PE (Southern Biotech САТ#2040-09), в разведении 1:200 в PBS и инкубировали для обнаружения АРХ005 и контрольных человеческих IgG1. В качестве положительного контроля использовали крысиное антитело к мышиному CD40, конъюгированное с РЕ. Образцы ресуспендировали в 0,5 мл PBS и анализировали на FACS. Данные FACS показали, что АРХ005 не вступает в перекрестную реакцию с мышиным CD40 (фиг.11В).
В общем, эксперименты в этом примере показали, что АРХ005 представляет собой гуманизированное IgG1-антитело, которое связывает CD40. АРХ005 специфично связывается с CD40 с Kd, равной 9,6×10-10 М, и блокирует связывание CD40L с CD40. Это отличает его от анти-CD40 антитела SGN40, которое усиливает взаимодействие CD40 и CD40L. Эти данные позволяют предположить, что эти два антитела связываются с разными эпитопами. В экспериментах in vitro АРХ005 показало сильную ADCC-активность в отношении CD40-положительных лимфомных клеток (Ramos и Daudi), а также способность прямо ингибировать пролиферацию опухолевых клеток (Ramos) при перекрестной сшивке. АРХ005 также стимулировало созревание дендритных клеток, усиливая клеточный иммунный ответ. Дополнительно было показано, что АРХ005 имеет перекрестную реактивность с CD40 обезьяны.
ПРИМЕР 3
IN VIVO ХАРАКТЕРИСТИКА ГУМАНИЗИРОВАННОГО АНТИ-CD40 АНТИТЕЛА АРХ005
Для дополнительной характеристики гуманизированного антитела АРХ005 были проведены различные эксперименты in vivo.
АРХ005 ингибирует рост опухолей в модели на основе клеток Ramos
Для того чтобы оценить эффект АРХ005 на ксенографтную модель человеческой В-клеточной лимфомы, использовали 6-8-недельных nu/nu самок мышей BALB/c для подсаживания опухолевых клеток. Ксенографты получали подкожным введение 1×107 опухолевых клеток на мышь в нижнюю часть спины. Животных распределяли по группам, когда опухоли достигали среднего объема примерно 100 мм3 (50-200 мм3). Антитела вводили внутрибрюшинно в количестве 3 мг/кг, начиная с 13 дня (см. фиг.12). Антитела вводили 3 раза в неделю, всего 9 доз. (восемь животных на группу). Перпендикулярные размеры опухоли измеряли, используя штангенциркуль. Объем опухоли вычисляли по формуле: объем=(длина×ширина2)/2. Как показано на фиг.12А, АРХ005 обладает мощным и продолжительным противоопухолевым' действием. Сыворотку отбирали на 34 день, через два дня после последнего введения антитела, для определения содержания лекарственного средства in vivo путем изменения концентраций человеческого IgG (см. фиг.12В). Противоопухолевая активность, опосредованная АРХ005, была выше опосредованной SGN-40 и сохранялась в течение более длительного времени после введения. Одноточечный фармакокинетический анализ показал, что более высокая противоопухолевая активность АРХ005 не являлась следствием различий в фармакокинетике.
АРХ005 ингибирует предварительно обработанные ритуксимабом и резистентные к нему опухоли
Целью этого эксперимента была оценка эффекта АРХ005 предварительно обработанную ритуксимабом и резистентную к нему В-клеточную лимфому. Бестимусным мышам, несущим сформированные опухоли Ramos, сначала вводили 5 доз ритуксимаба по 3 мг/кг. Рост опухолей частично ингибировался ритуксимабом (фиг.13А). Когда эти опухоли достигали размера 700 мм3, мышей рандомизировали по 4 группам (по 7 животных на группу) и вводили внутрибрюшинно АРХ005, ритуксимаб, аналог SGN40 в количестве 3 мг/кг или физиологический раствор в качестве контроля в течение 3 недель (фиг.13В). Как показано на фиг.13, предварительно обработанные опухоли были неспособны отвечать на повторное введение ритуксимаба, позволяя предположить, что эти опухоли резистентны к ритуксимабу (фиг.13В). АРХ005 обладал способностью ингибировать рост резистентных к ритуксимабу опухолей.
АРХ005 ингибирует рост опухолей в модели на основе клеток Raji
Целью этого эксперимента было определение взаимодействия дозы и эффективности для АРХ005 in vivo. Бестимусным мышам со сформированными опухолями из CD40-положительных клеток Raji, вводили АРХ005, начиная с 15 дня. Дозы АРХ005 в диапазоне 0,1 мг/кг-10 мг/кг вводили внутрибрюшинно 3 раза в неделю в течение 2 недель (8 животных на группу) (см. фиг.14). В качестве контроля использовали физиологический раствор. Объем опухолей измеряли каждый раз при введении дозы. Уровень АРХ005 в сыворотке для каждой группы также измеряли через 3 дня после последнего введения, для того чтобы определить корреляцию действия in vivo с уровнем АРХ005 в кровотоке. Наблюдалась явное дозозависимое противоопухолевое действие (см. фиг.14). Различия в объемах опухолей были достоверные (Р≤0,05) между контрольной группой и группами, получавшими антитела, при уровне дозировок ≥1 мг/кг с 29 по 33 день. Минимальная эффективная доза была определена как 1 мг/кг, что соответствовало медианной концентрации в сыворотке 0,49 мкг/мл в 36 день. Различия в объемах опухолей между группами с дозировками 3, 5 и 10 мг/кг не были статистически достоверными. Таким образом, максимальное противоопухолевое действие достигалось при дозировках ≥3 мг/кг с медианной концентрацией в сыворотке ≥1,6 мкг/мл.
Ингибирование роста опухолей антителом АРХ005 в модели на основе клеток IM-9 множественной миеломы человека
Для оценки противоопухолевой активности АРХ005 в модели множественной миеломы человека, бестимусным мышам со сформированными опухолями из CD40-положительных клеток множественной миеломы IM-9 вводили внутрибрюшинно АРХ005 или SGN40, начиная с 15 дня. АРХ005 вводили в количестве 3 мг/кг, 3 раза в неделю в течение 3 недель (5 животных на группу). Объем опухолей измеряли при каждом введении.
АРХ005 демонстрировало сильное противоопухолевое действие в отношение множественной миеломы человека на ксенографтной модели IM-9 (см. фиг.15). Противоопухолевая эффективность, опосредованная АРХ005, была значительно выше, чем у SGN-40 (Р<0,05).
Ингибирование роста опухолей антителом АРХ005 в модели на основе клеток Ramos по сранению с SGN-40 и ритуксимабом
Целью данного эксперимента было сравнению противоопухолевой активности АРХ005, ритуксимаба и SGN-40 в ксенографтной модели человеческой В-клеточной лимфомы Ramos. Ксенографты получали подкожным введением клеток Ramos в нижнюю часть спины самок мышей SCID С.В-17. Животных распределяли по 6 группам, когда опухоли достигали среднего объема примерно 200-300 мм3. Антитела вводили внутрибрюшинно в количестве, указанном на фиг.17. Антитела вводили 3 раза в неделю, всего 9 доз (10 животных на группу). Перпендикулярные размеры опухоли измеряли, используя штангенциркуль. Объем опухоли вычисляли по формуле: объем=(длина×ширина2)/2. Выживаемость мышей определяли и регистрировали.
АРХ005 демонстрировало дозозависимую противоопухолевую активность. Введение высокой дозы АРХ005 (10 мг/кг) приводило к полной регрессии опухоли, в то время как ритуксимаб в той же дозировке (10 мг/кг) только замедлял рост опухоли, позволяя предположить, что АРХ005 является более эффективным, чем ритуксимаб в этой модели. АРХ005 является также более сильным, чем SGN-40 (фиг.17А). АРХ005 не только ингибировало рост опухоли, но также повышало выживаемость животных с опухолями (фиг.17В).
Ингибирование роста опухолей в резистентной к ритуксимабу ксенографтной модели на основе клеток Namalwa лимфомы человека
Целью этого эксперимента было сравнение противоопухолевой активности АРХ005, ритуксимаба и SGN-40 в резистентной к ритуксимабу ксенографтной модели на основе клеток Namalwa лимфомы человека. Ксенографты получали подкожным введением клеток Namalwa в нижнюю части спины самок мышей SCID С.В-17. Животных распределяли по 6 группам, когда опухоли достигали среднего объема примерно 200-300 мм3. Антитела вводили внутрибрюшинно в количестве, указанном на фиг.18. Антитела вводили 3 раза в неделю, всего 9 доз (10 животных на группу). Перпендикулярные размеры опухоли измеряли, используя штангенциркуль. Объем опухоли вычисляли по формуле: объем=(длина×ширина2)/2. Выживаемость мышей также определяли и записывали.
АРХ005 демонстрировало противоопухолевую активность в резистентной к ритуксимабу ксенографтной модели на основе клеток Namalwa лимфомы человека (фиг.18А). АРХ005 также повышало выживаемость мышей с резистентными к ритуксимабу опухолями (фиг.18В).
В итоге, эксперименты в этом примере показали, что эффективность АРХ005 была исследована на множестве ксенографтных моделей опухолей. АРХ005 значительно ингибировало рост опухолей в модели на основе клеток Ramos. Следует отметить, что терапевтический эффект сохранялся долго после введения. Введение АРХ005 приводило к ингибированию предварительно получавших воздействие ритуксимаба и резистентных к нему опухолей. На модели на основе клеток Raji было проведено исследование диапазона доз и найдено, что минимальная доза была определена как 1 мг/кг, а максимальная противоопухолевая активность наблюдалась при дозировках ≥3 мг/кг. Кроме В-клеточных лимфом, АРХ005 также проявляло достоверную сильную противоопухолевую активность в модели на основе клеток IM-9 множественной миеломы человека.
Таким образом, приведенные выше примеры показывают, что АРХ005 может использоваться для улучшения лечения пациентов с NHL, CLL, множественной миеломы и некоторых солидных опухолей, которые экспрессируют CD40. После связывания с CD40, АРХ005 рекрутирует цитотоксические клетки для уничтожения опухолевых клеток посредством ADCC. АРХ005 также может напрямую ингибировать пролиферацию опухолевых клеток и активировать АРС за счет своей агонистической активности. In vivo АРХ005 заметно ингибировало рост множества экспрессирующих CD40 ксенографтов опухолей человека и имело продолжительные противоопухолевые эффекты. АРХ005 также способно ингибировать множественную миелому человека и предварительно обработанные ритуксимабом и резистентные к нему опухоли.
Различные варианты осуществления изобретения, описанные выше, могут быть объединены, чтобы обеспечить дополнительные варианты. Все патенты США, публикации заявки на патент США, заявки на патент США, иностранные патенты, иностранные заявки на патент и непатентные публикации, указанные в данном описании и/или перечисленные в спецификации заявки включены в настоящий документ путем ссылки в полном объеме. При необходимости, аспекты вариантов осуществления изобретения могут быть модифицированы для использования концепций различных патентов, заявок и публикаций, чтобы обеспечить дополнительные варианты осуществления.
Эти и другие изменения могут быть проведены в вариантах осуществления изобретения в свете вышеприведенного подробного описания. В общем, в нижеследующей формуле изобретения термины не следует истолковывать как ограничивающие изобретение конкретными вариантами осуществления, раскрытыми в настоящем описании и в формуле изобретения, а они должны истолковываться как включающие все возможные варианты осуществления вместе с полным объемом эквивалентов, на которые распространяется формула изобретения. Соответственно, формула изобретения не ограничена описанием изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЯ АНТИ-CD40-АНТИТЕЛ | 2008 |
|
RU2491095C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-CD40-АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2407544C2 |
| АНТИТЕЛА ПРОТИВ CD40 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2796413C2 |
| АНТИ-CD40-АНТИТЕЛА, ПРИМЕНЕНИЕ И МЕТОДЫ | 2012 |
|
RU2649055C2 |
| АНТИТЕЛА К CD40 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2715597C2 |
| GP41-НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2624046C2 |
| ПРИМЕНЕНИЕ АНТИ-CD40-АНТИТЕЛ | 2006 |
|
RU2442606C2 |
| АНТИИДИОТИПИЧЕСКИЕ АНТИТЕЛА И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2017 |
|
RU2773355C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2013 |
|
RU2599417C2 |
| АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ КЛЕТОЧНОЙ СМЕРТИ 1 | 2018 |
|
RU2812915C2 |




























































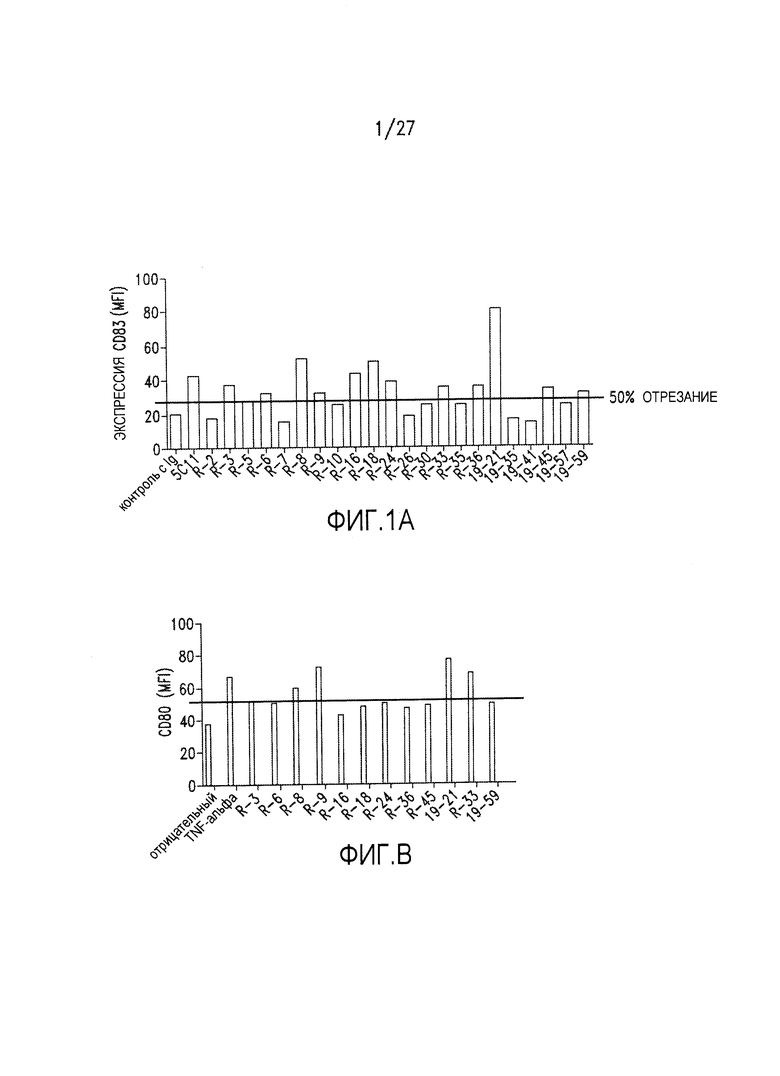
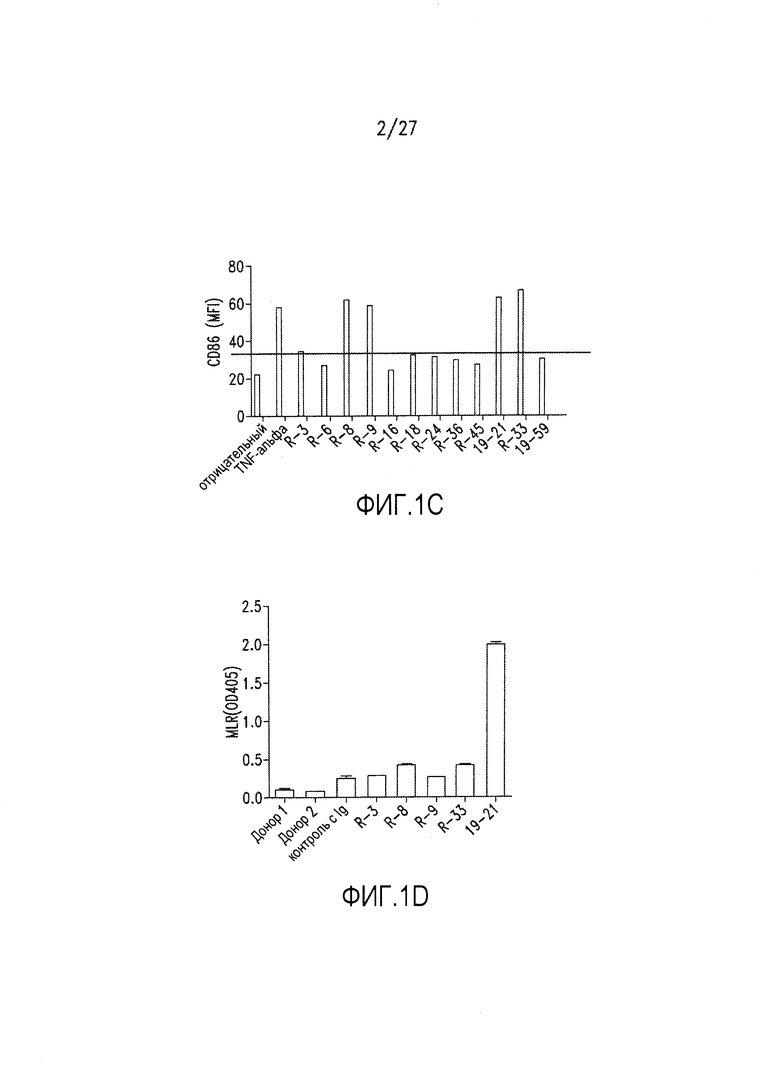


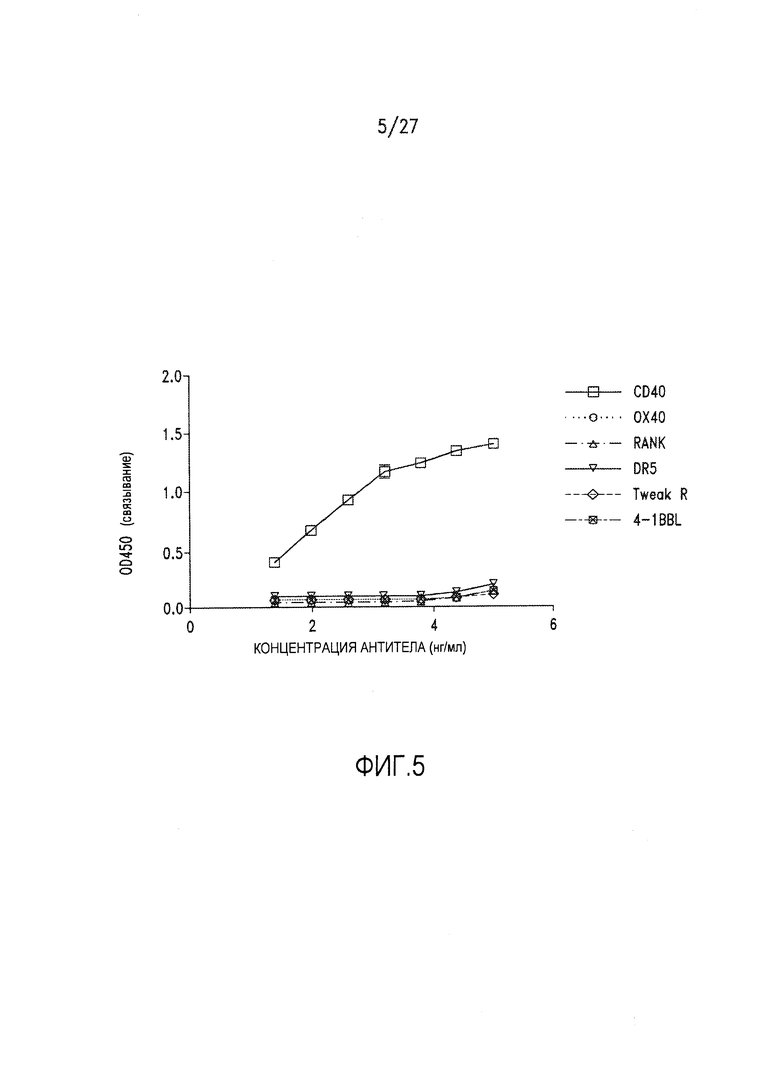
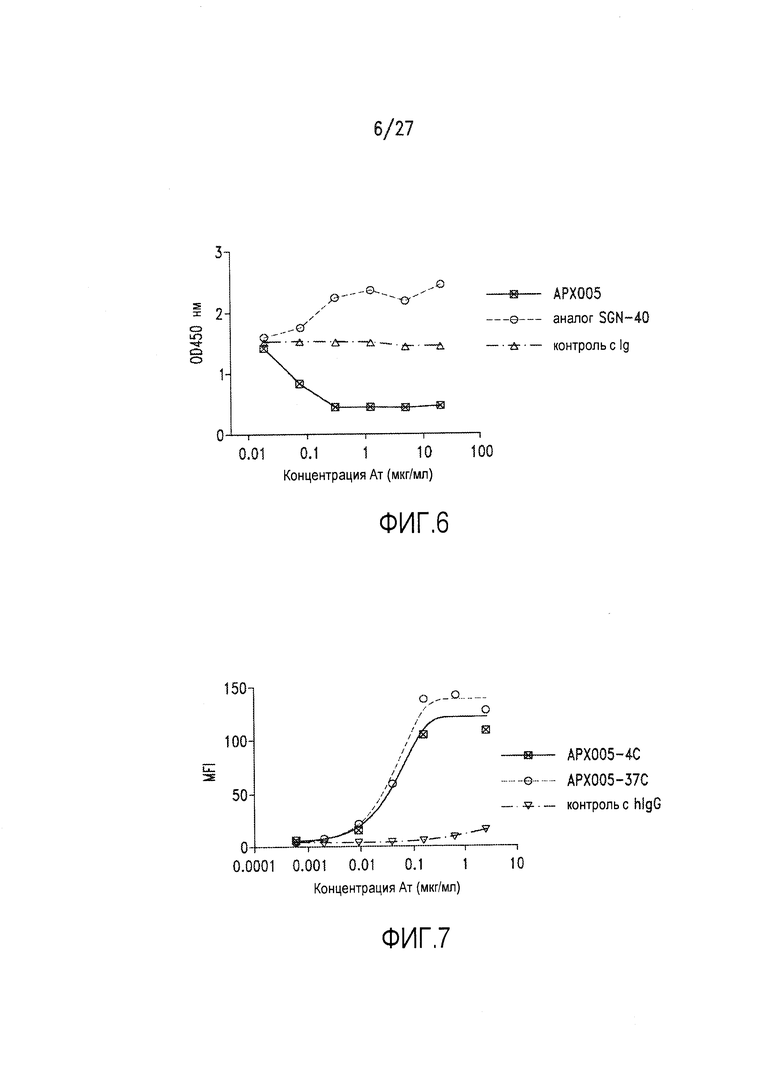

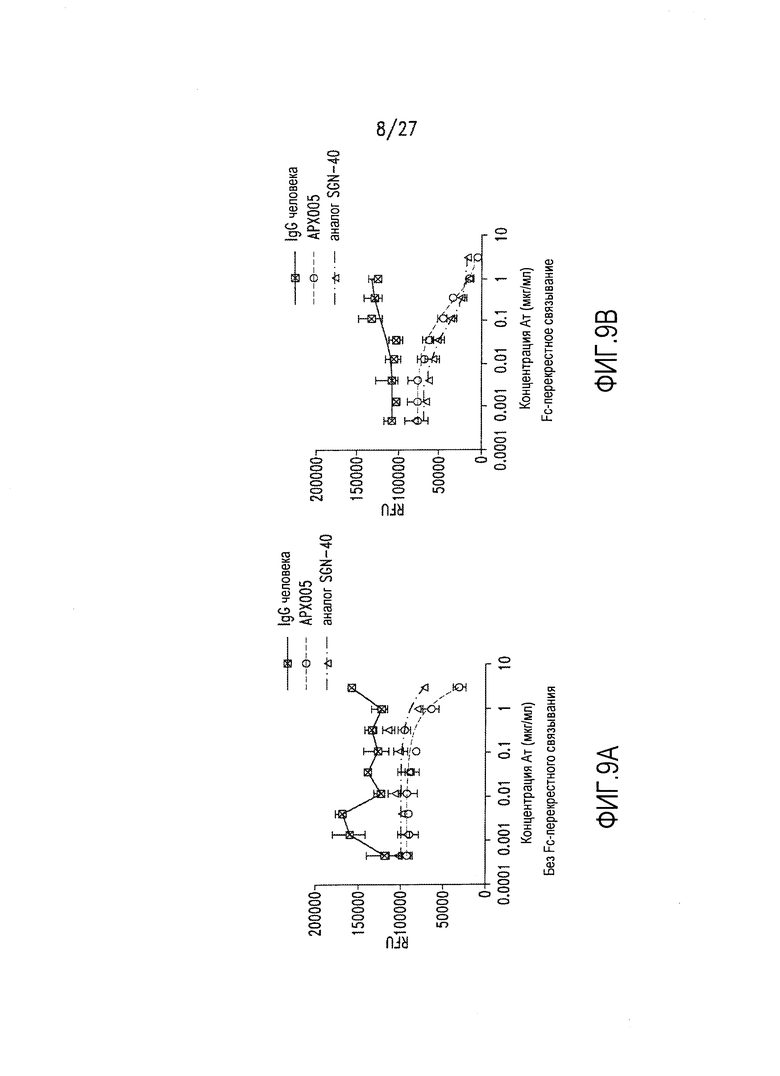
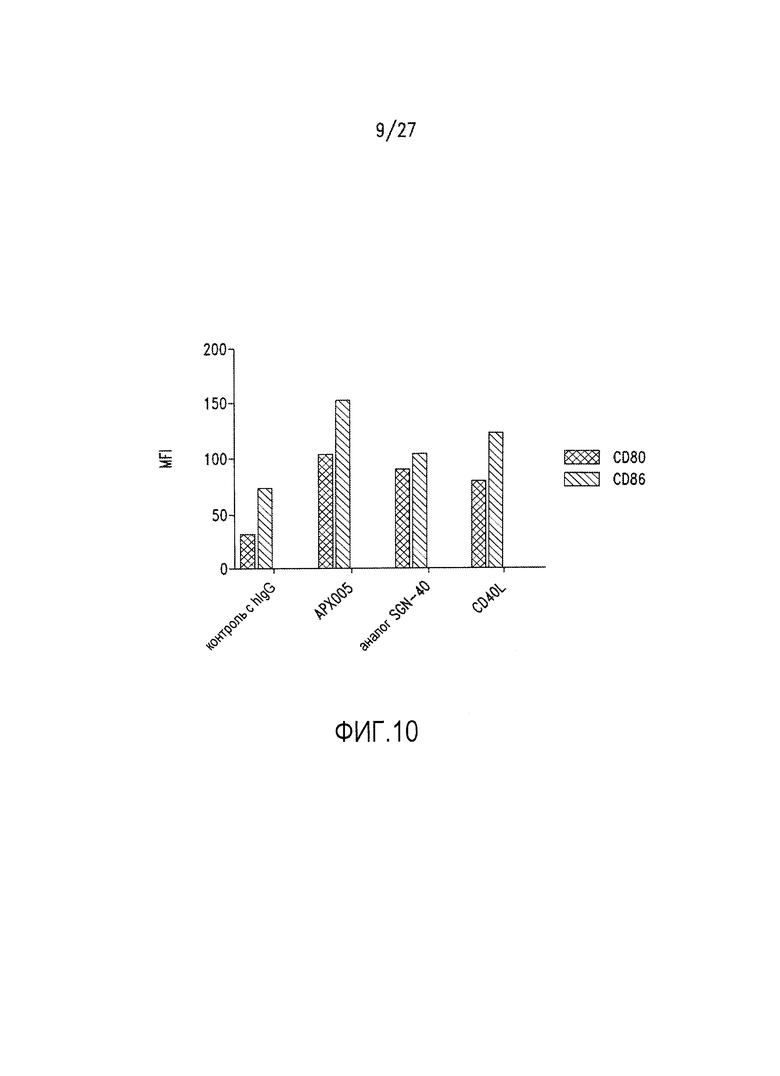
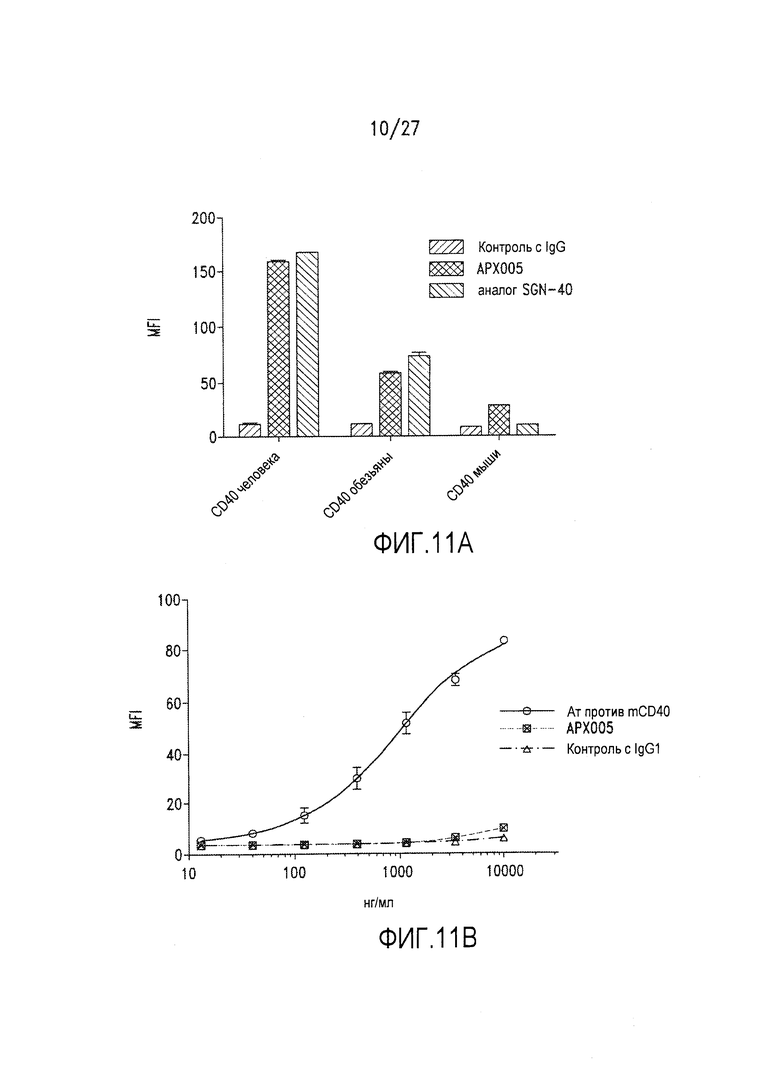

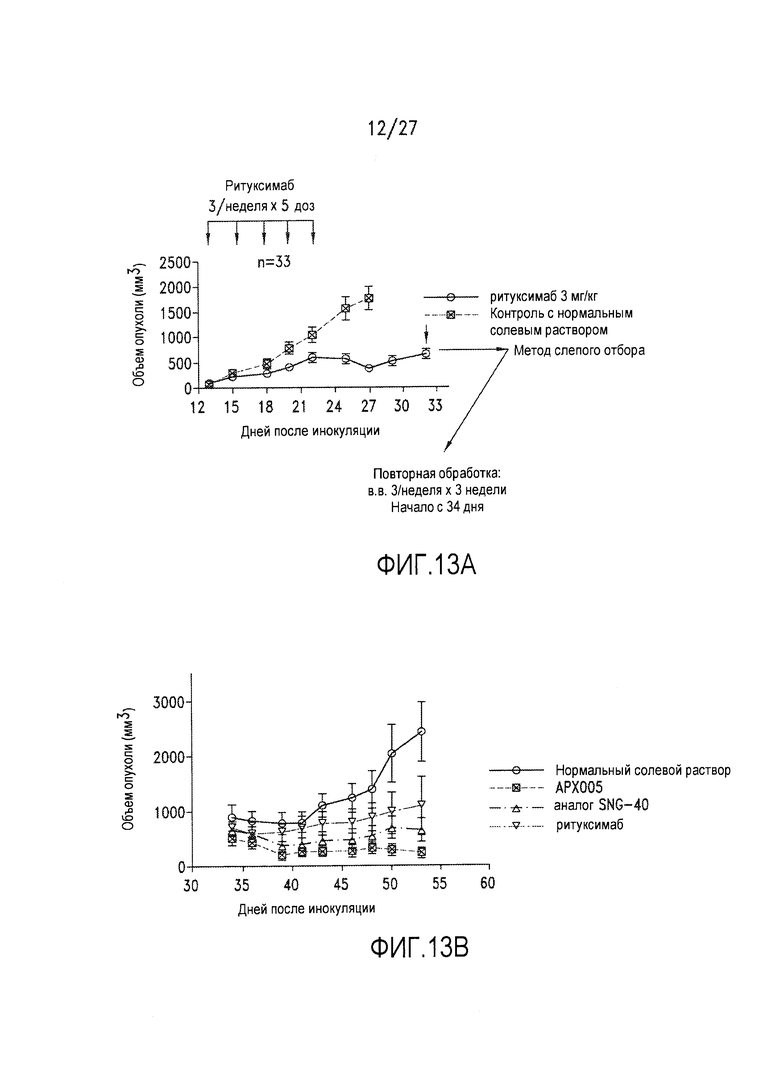
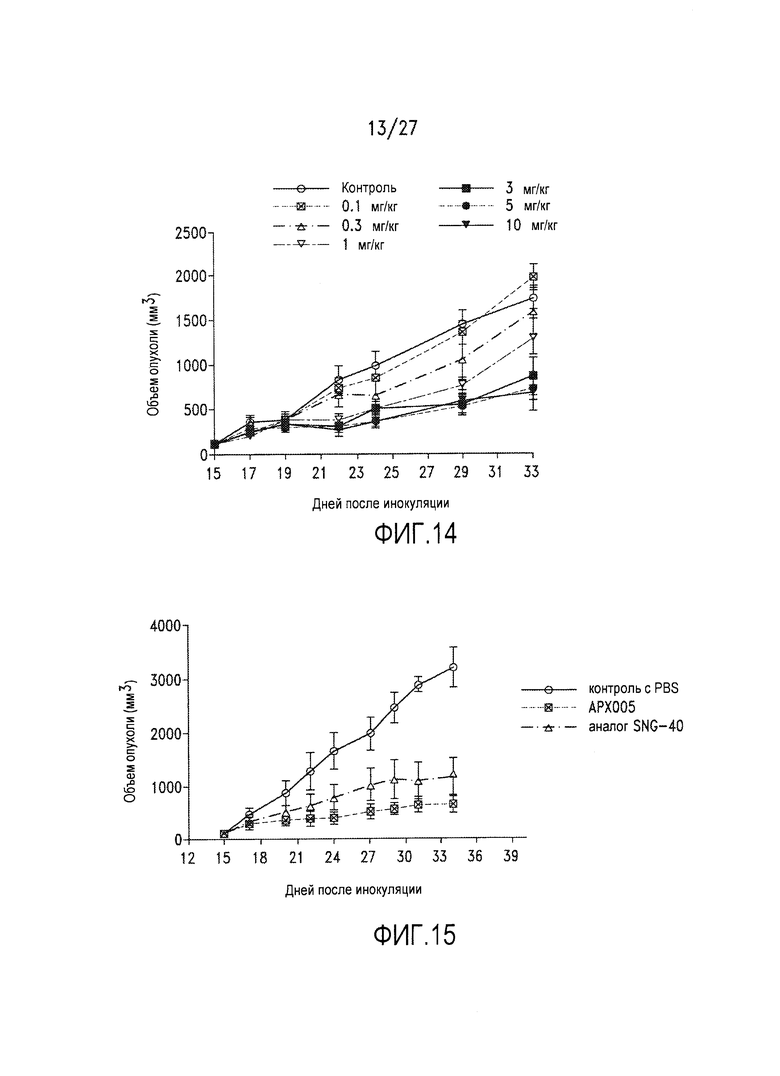












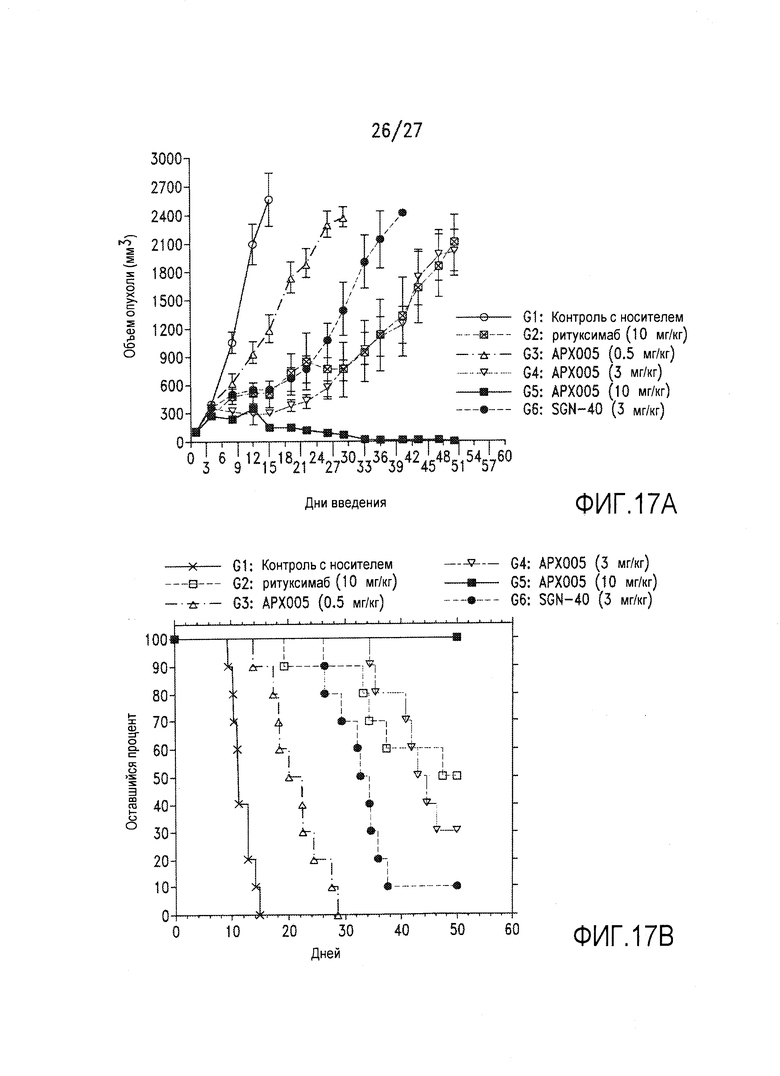
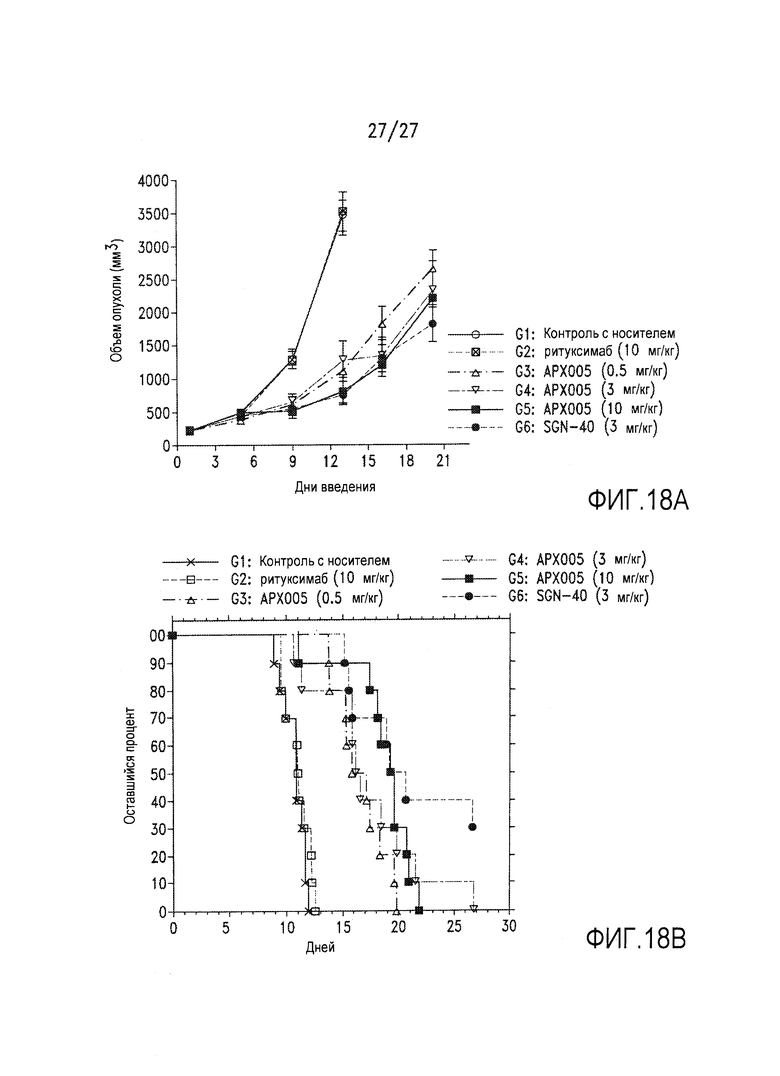
Изобретение относится к биохимии. Описано выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40 человека и являются агонистами CD40. Описан выделенный полинуклеотид, кодирующий выделенное антитело или его антиген-связывающий фрагмент, экспрессирующий вектор, содержащий выделенный полинуклеотид, выделенная клетка-хозяин для получения антитела или его антиген-связывающего фрагмента. Представлена композиция для лечения или облегчения симптомов заболевания или расстройства, связанного с CD40, содержащая физиологически приемлемый носитель и терапевтически эффективное количество выделенного антитела или его антиген-связывающего фрагмента. Представлены способы лечения или ослабления симптомов у пациента, имеющего рак, ослабления симптомов у пациента, имеющего аутоиммунное заболевание, ослабления симптомов у пациента, имеющего воспалительное заболевание, включающие введение пациенту композиции. Изобретение увеличивает разнообразие антагонистов CD40. 12 н. и 17 з.п. ф-лы, 18 ил., 1 табл., 3 пр.
1. Выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40 человека и являются агонистами CD40, содержащие: (i) вариабельную область тяжелой цепи, содержащую VHCDR1-область с SEQ ID NO: 3, VHCDR2-область с SEQ ID NO: 4 и VHCDR3-область с SEQ ID NO: 5; и (ii) вариабельную область легкой цепи, содержащую VLCDR1-область с SEQ ID NO: 6, VLCDR2-область с SEQ ID NO: 7 и VLCDR3-область с SEQ ID NO: 8;
или вариант указанного антитела или его антиген-связывающего фрагмента, содержащие вариабельные области тяжелой и легкой цепи, идентичные вариабельным областям тяжелой и легкой цепи из подпунктов (i) и (ii), за исключением до 8 аминокислотных замен в указанных CDR.
2. Выделенное антитело или его антиген-связывающий фрагмент по п. 1, где вариабельная область тяжелой цепи содержит аминокислотную последовательность с SEQ ID NO: 1.
3. Выделенное антитело или его антиген-связывающий фрагмент по п. 1, где вариабельная область легкой цепи содержит аминокислотную последовательность с SEQ ID NO: 2.
4. Выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40 и являются агонистами CD40, содержащие вариабельную область тяжелой цепи, содержащую аминокислотную последовательность с SEQ ID NO: 9, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью с SEQ ID NO: 10.
5. Выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40 и являются агонистами CD40, содержащие вариабельную область легкой цепи, содержащую аминокислотную последовательность с SEQ ID NO: 10, и вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью с SEQ ID NO: 9.
6. Выделенное антитело по п. 1, где антитело является гуманизированным.
7. Выделенное антитело по п. 6, где VH-область содержит аминокислотную последовательность с SEQ ID NO: 9, а VL-область содержит аминокислотную последовательность с SEQ ID NO: 10.
8. Выделенное антитело по п. 1, где антитело выбрано из группы, состоящей из одноцепочечного антитела, ScFv, моновалентного антитела без шарнирной области и миниантитела.
9. Выделенное антитело по п. 1, где антитело является Fab- или Fab'-фрагментом.
10. Выделенное антитело по п. 1, где антитело является F(ab')2-фрагментом.
11. Выделенное антитело по п. 1, где антитело является полноразмерным антителом.
12. Выделенное антитело по п. 1, содержащее константный домен IgG человека.
13. Выделенное антитело по п. 12, где константный домен IgG человека содержит СН1-домен из IgG1.
14. Выделенное антитело по п. 12, где константный домен IgG человека содержит Fc-область из IgG1.
15. Выделенное антитело или его антиген-связывающий фрагмент по п. 1, которые связывают CD40 с KD, равной 0,96 нМ или ниже.
16. Выделенное антитело или его антиген-связывающий фрагмент по любому одному из пп. 1-15, где выделенное антитело или его антиген-связывающий фрагмент:
a. блокируют связывание CD40 с CD40L;
b. активируют антиген-презентирующие клетки;
c. стимулируют высвобождение цитокинов из антиген-презентирующих клеток;
d. вызывают апоптоз опухолевых клеток;
e. ингибируют пролиферацию опухолевых клеток;
f. убивают опухолевые клетки посредством индукции эффекторных функций, выбранных из группы, состоящей из антителозависимой клеточной цитотоксичности, комплемент-зависимой цитотоксичности и антителозависимого клеточного фагоцитоза;
g. стимулируют противоопухолевые Т-клеточные ответы;
h. уменьшают сформированные опухоли;
i. ингибируют рост резистентных к ритуксимабу опухолей; или
j. обладают комбинацией двух или более из подпунктов a.-i.
17. Выделенный полинуклеотид, кодирующий выделенное антитело или его антиген-связывающий фрагмент по п. 1 или 7.
18. Экспрессирующий вектор, содержащий выделенный полинуклеотид по п. 17.
19. Выделенная клетка-хозяин для получения антитела или его антиген-связывающего фрагмента по п. 1, где клетка-хозяин содержит вектор по п. 18.
20. Композиция для лечения или облегчения симптомов заболевания или расстройства, связанного с CD40, у пациента, нуждающегося в этом, причем композиция содержит физиологически приемлемый носитель и терапевтически эффективное количество выделенного антитела или его антиген-связывающего фрагмента по п. 1 или 7.
21. Способ лечения или ослабления симптомов у пациента, имеющего рак, включающий введение пациенту композиции по п. 20, посредством чего осуществляется лечение или ослабление симптомов у пациента, имеющего рак.
22. Способ по п. 21, где рак выбран из группы, состоящей из неходжкинских лимфом, Ходжкинской лимфомы, хронических лимфоцитарных лейкозов, волосатоклеточных лейкозов, острых лимфобластных лейкозов, множественной миеломы, карцином мочевого пузыря, почек, яичников, шейки матки, молочных желез, легких, носоглотки, злокачественной меланомы и резистентных к ритуксимабу NHL и лейкозов.
23. Способ ослабления симптомов у пациента, имеющего аутоиммунное заболевание, включающий введение пациенту композиции по п. 20, посредством чего осуществляется ослабление симптомов у пациента, имеющего аутоиммунное заболевание.
24. Способ ослабления симптомов у пациента, имеющего воспалительное заболевание, включающий введение пациенту композиции по п. 20, посредством чего осуществляется ослабление симптомов у пациента, имеющего воспалительное заболевание.
25. Выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40 и являются агонистами CD40, содержащие:
(а) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 58, VHCDR2, содержащую SEQ ID NO: 81, и VHCDR3, содержащую SEQ ID NO: 104; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 127, VLCDR2, содержащую SEQ ID NO: 150, и VLCDR3, содержащую SEQ ID NO: 173;
(b) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 60, VHCDR2, содержащую SEQ ID NO: 83, и VHCDR3, содержащую SEQ ID NO: 106; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 129, VLCDR2, содержащую SEQ ID NO: 152, и VLCDR3, содержащую SEQ ID NO: 175;
(c) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 62, VHCDR2, содержащую SEQ ID NO: 85, и VHCDR3, содержащую SEQ ID NO: 108; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 131, VLCDR2, содержащую SEQ ID NO: 154, и VLCDR3, содержащую SEQ ID NO: 177;
(d) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 65, VHCDR2, содержащую SEQ ID NO: 88, и VHCDR3, содержащую SEQ ID NO: 111; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 134, VLCDR2, содержащую SEQ ID NO: 157, и VLCDR3, содержащую SEQ ID NO: 180;
(e) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 66, VHCDR2, содержащую SEQ ID NO: 89, и VHCDR3, содержащую SEQ ID NO: 112; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 135, VLCDR2, содержащую SEQ ID NO: 158, и VLCDR3, содержащую SEQ ID NO: 181;
(f) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 68, VHCDR2, содержащую SEQ ID NO: 91, и VHCDR3, содержащую SEQ ID NO: 114; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 137, VLCDR2, содержащую SEQ ID NO: 160, и VLCDR3, содержащую SEQ ID NO: 183;
(g) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 71, VHCDR2, содержащую SEQ ID NO: 94, и VHCDR3, содержащую SEQ ID NO: 117; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 140, VLCDR2, содержащую SEQ ID NO: 163, и VLCDR3, содержащую SEQ ID NO: 186;
(h) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 73, VHCDR2, содержащую SEQ ID NO: 96, и VHCDR3, содержащую SEQ ID NO: 119; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 142, VLCDR2, содержащую SEQ ID NO: 165, и VLCDR3, содержащую SEQ ID NO: 188;
(i) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 74, VHCDR2, содержащую SEQ ID NO: 97, и VHCDR3, содержащую SEQ ID NO: 120; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 143, VLCDR2, содержащую SEQ ID NO: 166, и VLCDR3, содержащую SEQ ID NO: 189;
(j) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 77, VHCDR2, содержащую SEQ ID NO: 100, и VHCDR3, содержащую SEQ ID NO: 123; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 146, VLCDR2, содержащую SEQ ID NO: 169, и VLCDR3, содержащую SEQ ID NO: 192; или
(k) вариабельную область тяжелой цепи, содержащую VHCDR1, содержащую SEQ ID NO: 79, VHCDR2, содержащую SEQ ID NO: 102, и VHCDR3, содержащую SEQ ID NO: 125; и вариабельную область легкой цепи, содержащую VLCDR1, содержащую SEQ ID NO: 148, VLCDR2, содержащую SEQ ID NO: 171, и VLCDR3, содержащую SEQ ID NO: 194.
26. Выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40, содержащие вариабельную область тяжелой цепи, содержащую одну из аминокислотных последовательностей, представленных в SEQ ID NO: 11-21, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с соответствующей областью VL с одной из SEQ ID NO: 22-32, соответственно.
27. Выделенное антитело или его антиген-связывающий фрагмент по п. 26, где вариабельная область легкой цепи содержит соответствующую область VL с одной из SEQ ID NO: 22-32 соответственно.
28. Выделенное антитело или его антиген-связывающий фрагмент, которые связываются с CD40, содержащие вариабельную область легкой цепи с одной из аминокислотных последовательностей SEQ ID NO: 22-32, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с соответствующей VH с одной из SEQ ID NO: 11-21 соответственно.
29. Выделенное антитело или его антиген-связывающий фрагмент по п. 1, содержащие (i) вариабельную область тяжелой цепи, содержащую VHCDR1-область с SEQ ID NO: 3, VHCDR2-область с SEQ ID NO: 4 и VHCDR3-область с SEQ ID NO: 5; и (ii) вариабельную область легкой цепи, содержащую VLCDR1-область с SEQ ID NO: 6, VLCDR2-область с SEQ ID NO: 7 и VLCDR3-область с SEQ ID NO: 8.
| Прибор для определения вязкости жидкости | 1928 |
|
SU11449A1 |
| OHNO et al., Antigen-binding specificities of antibodies are primarily determined by seven residues of VH, Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA, 1985, vol.82, реферат | |||
| RUDIKOFF S | |||
| et al., Single amino acid substitution altering antigen-binding specificity, Proc | |||
| Natl | |||
| Acad | |||
| Sci., 1982, 79(6), реферат. | |||
Авторы
Даты
2017-02-02—Публикация
2012-04-27—Подача