Изобретение относится к биотехнологии и может быть использовано в химико-фармацевтической и пищевой промышленности, медицинской практике, косметологии и исследовательских целях. Изобретение может применяться при создании лекарственных препаратов в виде гелей ранозаживляющего и противоожогового назначения, а также для предотвращения образования шрамов и келоидных рубцов.
Папаин (КФ 3.4.22.2) - растительный протеолитический фермент, осуществляющий расщепление белков до аминокислот. В значительных количествах он содержится в дынном дереве - папайе (Carica papaya). Папаин состоит из 212 аминокислотных остатков, на N-конце молекулы находится изолейцин, на С-конце - аспарагин. Фермент хорошо растворим в воде, водных солевых растворах и в 70% метиловом и этиловом спиртах. Папаин принадлежит к группе сульфгидрильных протеиназ. Он активен не только в кислых, но и в нейтральных и щелочных средах (диапазон рН 3-12). Папаин сохраняет каталитическую способность в широком температурном диапазоне (до 50-60°С). При рН 5.0-7.5 фермент гидролизует амиды, пептиды, белки и эфиры основных аминокислот с незамещенной аминогруппой. Изучение гидролиза белков папаином показало, что он обеспечивает более высокую степень расщепления молекул субстратов, чем большинство ферментов животного и бактериального происхождения. Широкая субстратная специфичность делает папаин перспективным инструментом в белковой химии. Фермент можно использовать для дальнейшего расщепления пептидов, образующихся при триптическом или химотриптическом гидролизе белков, с целью получения более мелких фрагментов, удобных для анализа их аминокислотной последовательности [Structure of papain refi ned at 1.65  resolution / I.G. Kamphuis [et al.] // J. Mol. Biol. - 1984. - Vol. 179. - P. 233-256].
resolution / I.G. Kamphuis [et al.] // J. Mol. Biol. - 1984. - Vol. 179. - P. 233-256].
Папаин обладает противовоспалительными свойствами. Не действуя напрямую на очаг воспаления, он стимулирует метаболические процессы, что оказывает влияние на ускорение процессов регенерации воспаленных тканей. Папаин увеличивает приток крови и разрушает токсичные вещества в очаге воспаления. Кроме того, фермент разрушает токсины, выделяемые многими болезнетворными микроорганизмами, участвует в синтезе аргинина, аминокислоты, стимулирующей гормон роста, который, в свою очередь, очень важен для регенерации клеток печени. Папаин ускоряет заживление ран, трофических язв и пролежней [Биотехнология растений: культура клеток / под ред. Р.Г. Бутенко. - М.: Агропромиздат, 1989. - 279 с., Мосолов В.В. Протеолитические ферменты / В.В. Мосолов - М.: Наука, 1971. - 404 с.].
Существует ряд практических проблем при использовании ферментных препаратов. К ним относятся: высокая стоимость выделения и очистки ферментов, нестабильность их структур в условиях, отличных от оптимальных. Кроме того, в отличие от обычных гетерогенных химических катализаторов, большинство ферментов работают только в растворенном состоянии - в системах гомогенного катализа, поэтому они загрязняют продукт и, как правило, не могут быть восстановлены в активной форме из реакционных смесей для повторного использования. Существует несколько подходов, чтобы преодолеть эти ограничения. Одним из них является иммобилизация ферментов. Иммобилизация достигается путем фиксации белковой глобулы на поверхности или внутри нерастворимых носителей, в результате чего получаются гетерогенные ферментные системы. Таким образом, по сравнению со свободными энзимами в растворе иммобилизованные ферменты более стабильны и более устойчивы к изменениям окружающей среды. Что еще более важно, гетерогенность иммобилизованных ферментных систем позволяет осуществлять восстановление как фермента, так и продукта, многократное повторное использование катализатора обеспечивает непрерывную работу ферментативных процессов, быстрое прекращение реакций и большее разнообразие биореакторов. Иммобилизацию ферментов можно проводить на природных и синтетических носителях. В своей работе мы использовали природные носители для иммобилизации, такие как пищевой хитозан с молекулярной массой менее 100 кДа и сукцинат хитозана.
Свойства иммобилизованных ферментов определяются характеристиками как самого фермента, так и носителя. Хитозан является природным аминосахаридом, производным хитина. В линейных полиглюкозаминовых цепях с высокой молекулярной массой хитозан имеет активные аминогруппы и гидроксильные группы, поддающиеся химической модификации. Кроме того, аминогруппы превращают хитозан в катионный полиэлектролит (pKa≈6.5), один из немногих, который встречается в природе и обладает особыми свойствами: он растворим в водных кислых средах при рН<6.5 и при растворении обладает высоким положительным зарядом за счет наличия большого количества -NH3+ групп; хитозан адсорбируется на отрицательно заряженных поверхностях, агрегирует с полианионными соединениями и хелатами, ионами тяжелых металлов. Как растворимость в кислых растворах, так и агрегация с полианионами придает хитозану гелеобразующие свойства. Кроме того, он обладает уникальными биологически значимыми характеристиками: биосовместимостью, биоразлагаемостью, нетоксичностью, высоким сродством к белкам, кровоостанавливающими, фунгистатическими, противоопухолевыми и антихолестеринемическими свойствами [Barbara Krajewska Application of chitin- and chitosan-based materials for enzyme immobilizations: a review // Enzyme and Microbial Technology. - 2004. - V. 35 - P. 126-139].
Ранее был создан препарат для заживления ран и предотвращения адгезии повязки к ране, содержащий фармакологически приемлемый хитозан-глюкановый комплекс или его соль в комбинации с одним или несколькими полисахаридами или их соответствующими солями и антисептиком. Препарат поддерживает процесс заживления раны и дренирует избыточную секрецию вместе с медиаторами ткани и энзимами, которые способствуют заживлению. Это обеспечивает необходимую гидратацию раны и окружающих ее тканей без размягчения или высушивания окружающей кожи и адгезии к ране [Патент RU 2455995, A61K 31/716, опубл. 20.07.2012].
В качестве прототипа служил способ получения гетерогенного препарата различной дисперсности на основе бромелайна и хитозана. Способ включает иммобилизацию бромелайна на матрицу кислоторастворимого хитозана среднемолекулярного (200 кДа) или высокомолекулярного (350 кДа) в соотношении 20 мл раствора фермента в концентрации 5 мг/мл на 1 г указанной матрицы; при этом в качестве буферного раствора для иммобилизации используют 50 мМ трис-глициновый буфер с рН 8.5-9.0 для среднемолекулярного и с рН 8.5 для высокомолекулярного хитозана; инкубацию при комнатной температуре в течение 4 часов для среднемолекулярного и 5 часов для высокомолекулярного хитозана; промывание образовавшегося осадка 50 мМ трис-HCl буфером с рН 7.5 до отсутствия в промывных водах белка [Патент RU 2677232, A61K 38/48, A61K 47/36, A61P 17/02, опубл. 16.01.2019].
Недостатком прототипа является получение порошкового средства, не позволяющего проводить ферментативные реакции на твердых субстратах.
Технический результат заявленного изобретения заключается в получении папаина, иммобилизованного на природном носителе - пищевом хитозане с молекулярной массой менее 100 кДа и его производном - сукцинате хитозана путем включения в гель, благодаря чему возможно проводить ферментативные реакции с большими скоростями в растворах и на твердых поверхностях, а фермент при этом становится более стабильным и обладает пролонгированным действием.
Технический результат достигается тем, что в способе получения гетерогенного препарата в виде гелей на основе папаина и пищевого хитозана или сукцината хитозана, включающем иммобилизацию папаина в буферном растворе на матрицу хитозана в соотношении 20 мл раствора фермента в концентрации 1 мг/мл на 1 г носителя; инкубацию при комнатной температуре с периодическим перемешиванием; промывку образовавшегося осадка 50 мМ трис-HCl буфером (рН 7.5) до отсутствия в промывных водах белка, согласно изобретению, иммобилизацию проводят на матрицу пищевого хитозана с молекулярной массой менее 100 кДа или сукцината хитозана; в качестве буферного раствора для иммобилизации используют соответственно 0.05 М глициновый буфер с рН 10.0 или 0.05 М ацетатный буфер с рН 5.8; инкубация проводится в течение 2 часов.
Применение хитозана с меньшей молекулярной массой позволило получить гелеобразный препарат, и кроме того, сократило необходимое время инкубации фермента с носителем на 3 часа. Гелеобразный препарат, в отличие от порошкового, позволяет проводить ферментативные реакции не только в растворах, но и на твердых субстратах, что, в свою очередь, облегчает нанесение препарата в область раны или ожога, увеличивает эффективность лечения.
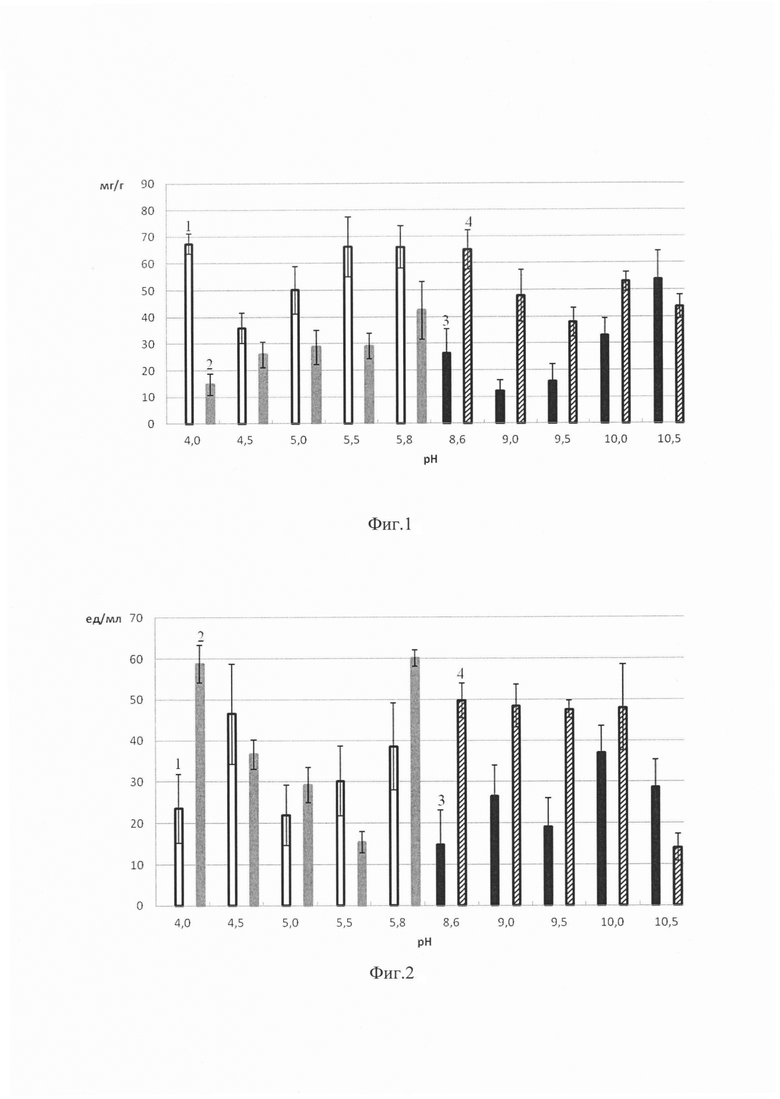
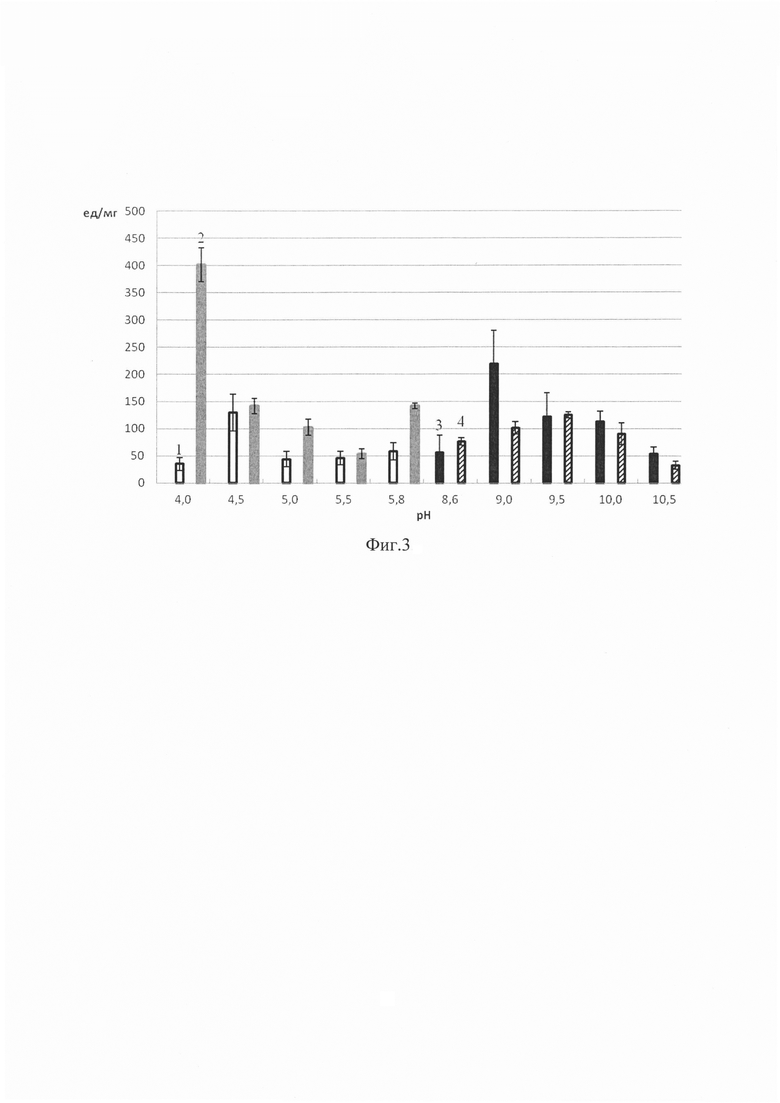
Фиг. 1. Диаграмма значений содержания белка (в мг на 1 г носителя) в препаратах иммобилизованного папаина; Фиг. 2. Диаграмма значений общей активности (в ед на 1 мл раствора) препаратов иммобилизованного папаина; Фиг. 3. Диаграмма значений удельной активности (в ед на 1 мг белка в пробе) препаратов иммобилизованного папаина, где 1 - папаин, иммобилизованный на пищевом хитозане с использованием ацетатного буфера; 2 - папаин, иммобилизованный на сукцинате хитозана с использованием ацетатного буфера; 3 - папаин, иммобилизованный на пищевом хитозане с использованием глицинового буфера; 4 - папаин, иммобилизованный на сукцинате хитозана с использованием глицинового буфера.
Пример реализации способа.
В качестве объекта исследования был выбран папаин фирмы «Sigma-Aldrich», субстратом для гидролиза служил азоказеин фирмы «Sigma-Aldrich». В качестве носителей для иммобилизации применяли два вида хитозана (ЗАО «Биопрогресс»): хитозан пищевой с молекулярной массой менее 100 кДа и сукцинат хитозана.
Иммобилизацию папаина на матрице хитозана осуществляли путем включения в гель. К 1 г хитозана добавляли 20 мл раствора фермента (в концентрации 1 мг/мл), инкубировали в течение 2 часов. После окончания инкубации образовавшийся осадок (в виде геля) промывали 50 мМ трис-HCl буфером (рН 7.5) до отсутствия в промывных водах белка (контроль осуществляли на спектрофотометре СФ-2000 при λ=280 нм).
Содержание белка в иммобилизованных препаратах папаина определяли методом Лоури [Lowry О.Н., Rosebrough N.J., Faar A.L., Randall R.J. Protein measurement with folin-phenol reagent // J. Biol. Chem. - 1951. - V. 193. - P. 265-275]. Измерение уровня протеолитической активности фермента проводили на субстрате азоказеине (Fluka). К 50 мг образца добавляли 200 мкл трис-HCl буфера (рН 7.5), 800 мкл азоказеина (0.5% в 50 мМ трис-HCl буфере, рН 7.5) и инкубировали 2 часа при 37°С. Далее добавляли 800 мкл ТХУ (5%), инкубировали 10 минут при -4°С, затем центрифугировали в течение 3 мин при 13000 об/мин для удаления негидролизованного азоказеина. К 1200 мкл супернатанта добавляли 240 мкл 3% NaOH для нейтрализации кислоты, после чего измеряли оптическую плотность опытной пробы при 410 нм в 1 см кювете. Контрольная проба содержала 800 мкл азоказеина, 800 мкл ТХУ, 50 мг образца и 200 мкл трис-HCl буфера. За единицу каталитической активности принимали количество фермента, которое в условиях эксперимента гидролизует 1 мкМ субстрата за 1 мин. Удельную протеолитическую активность папаина рассчитывали по формуле:
ПА=D* 1000/120/200/Ср,
где ПА - протеолитическая активность, мкМ/мин на 1 мг белка,
D - оптическая плотность пробы при 410 нм,
Ср - концентрация белка в пробе, мг/мл, измеренная по методу Лоури,
120 - время инкубации в минутах,
200 - объем пробы в мкл
1000 - пересчет в мкМ.
Статистическую обработку полученных результатов проводили при уровне значимости 5% с использованием t-критерия Стьюдента.
Для получения гетерогенных биокатализаторов на основе папаина, иммобилизованного путем включения в гель на основе сукцината хитозана и пищевого хитозана с молекулярной массой менее 100 кДа, в качестве иммобилизационной среды мы использовали 0.05 М ацетатный буфер с рН в диапазоне от 4.0 до 5.8 и 0.05 М глициновый буфер с рН в диапазоне от 8.6 до 10.5. Результаты для наиболее подходящих буферных систем отражены на фиг. 1-3.
Анализ содержания белка в гетерогенных препаратах показал, что наибольшее количество папаина (в мг на г носителя), иммобилизованного путем включения в гель на основе пищевого хитозана с молекулярной массой менее 100 кДа, наблюдается при использовании 0.05 М глицинового буфера с рН 10.5 и 0.05 М ацетатного буфера с рН 4.0, 5.5, 5.8. При иммобилизации на сукцинате хитозана количество папаина оказалось выше при использовании 0.05 М глицинового буфера с рН 8.6 и 0.05 М ацетатного буфера с рН 5.8 (фиг. 1).
Общая активность (в ед на мл раствора) папаина, иммобилизованного путем включения в гель на основе пищевого хитозана с молекулярной массой менее 100 кДа, оказалась выше при использовании следующих буферов: 0.05 М глициновый с рН 9.0, 10.0, 10.5, 0.05 М ацетатный с рН 4.5, 5.8. При иммобилизации на сукцинате хитозана наибольшая общая активность папаина была выявлена при использовании 0.05 М глицинового буфера с диапазоном рН 8.6-10.0 и 0.05 М ацетатного буфера с рН 4.0, 5.8 (фиг. 2).
Наибольшую удельную активность показали препараты папаина, иммобилизованные путем включения в гель на основе пищевого хитозана с молекулярной массой менее 100 кДа при использовании 0.05 М глицинового буфера с рН 9.0. Наибольшая удельная активность при иммобилизации папаина путем включения в гель на основе сукцината хитозана была выявлена при использовании 0.05 М ацетатного буфера с рН 4.0 (фиг. 3).
Метод иммобилизации путем включения папаина в гель имеет свои преимущества. Благодаря иммобилизации фермент защищен от неблагоприятных условий среды, препарату можно придавать различные конфигурации, возможна его адресная доставка в организм.
При использовании препаратов в медицине или аналитической практике необходим компромисс между высокой активностью и стабильностью катализатора, поэтому мы сопоставили полученные результаты по определению каталитической активности и содержания белка для препаратов папаина, иммобилизованного на матрицах сукцината хитозана и пищевого хитозана. Оптимальное, на наш взгляд, соотношение содержания белка (мг на г носителя), общей активности (в ед на мл раствора) и удельной активности (в ед на мг белка) выявлено при иммобилизации папаина путем включения в гель на основе пищевого хитозана с молекулярной массой менее 100 кДа и сукцината хитозана при использовании 0.05 М глицинового буфера с рН 10.0 и 0.05 М ацетатного буфера с рН 5.8 соответственно.
Несмотря на то, что наибольшую удельную активность показали препараты папаина, иммобилизованные путем включения в гель на основе пищевого хитозана при использовании 0.05 М глицинового буфера с рН 9.0 и в гель на основе сукцината хитозана при применении 0.05 М ацетатного буфера с рН 4.0, содержание папаина в этих препаратах было в 3 и 4 раза ниже, чем при использовании в качестве иммобилизационной среды соответственно 0.05 М глицинового буфера с рН 10.0 и 0.05 М ацетатного буфера с рН 5.8.
Из вышеизложенного материала следует, что среди апробированных нами вариантов иммобилизации для создания гетерогенных препаратов на основе папаина и хитозана наиболее перспективным является включение фермента в гель на основе сукцината хитозана и пищевого хитозана с молекулярной массой менее 100 кДа при использовании 0.05 М глицинового буфера с рН 10.0 и 0.05 М ацетатного буфера с рН 5.8 соответственно.
Таким образом, была разработана методика получения гетерогенного биокатализатора на основе папаина, иммобилизованного на матрице пищевого хитозана с молекулярной массой менее 100 кДа и сукцината хитозана путем включения в гель.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БРОМЕЛАЙНА В ГЕЛЕ НА ОСНОВЕ ПИЩЕВОГО ХИТОЗАНА И СУКЦИНАТА ХИТОЗАНА | 2018 |
|
RU2691611C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА КОЛЛАГЕНАЗЫ В ГЕЛЕ НА ОСНОВЕ ПИЩЕВОГО ХИТОЗАНА И СУКЦИНАТА ХИТОЗАНА | 2018 |
|
RU2712528C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ПРЕПАРАТА РАЗЛИЧНОЙ ДИСПЕРСНОСТИ НА ОСНОВЕ БРОМЕЛАЙНА И ХИТОЗАНА | 2017 |
|
RU2677232C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ФИЦИНА И НИЗКОМОЛЕКУЛЯРНОГО ХИТОЗАНА | 2021 |
|
RU2769243C1 |
| Способ получения гибридного препарата папаина и аскорбата хитозана в виде густого раствора | 2023 |
|
RU2822736C1 |
| Способ получения гибридного препарата бромелайна и аскорбата хитозана в виде густого раствора | 2023 |
|
RU2819793C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ПРЕПАРАТА НА ОСНОВЕ КОЛЛАГЕНАЗЫ И ХИТОЗАНА | 2017 |
|
RU2678435C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ПАПАИНА, ГИАЛУРОНОВОЙ КИСЛОТЫ И ПОЛИСАХАРИДОВ, МОДИФИЦИРОВАННЫХ ВИНИЛОВЫМИ МОНОМЕРАМИ | 2020 |
|
RU2750378C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА ПАПАИНА И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2795425C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИОННОГО ПРЕПАРАТА ПАПАИНА И АЛЬГИНАТА НАТРИЯ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2788455C1 |
Изобретение относится к биотехнологии. Способ получения гетерогенного папаина в геле включает иммобилизацию папаина на матрицу пищевого хитозана с молекулярной массой менее 100 кДа или сукцината хитозана в соотношении 20 мл раствора фермента в концентрации 1 мг/мл на 1 г носителя, в качестве буферного раствора для иммобилизации используют 0,05 М глициновый буфер с рН 10,0 или 0,05 М ацетатный буфер с рН 5,8; инкубация проводится в течение 2 часов при комнатной температуре с периодическим перемешиванием, образовавшийся осадок промывают 50 мМ трис-HCl буфером (рН 7,5) до отсутствия в промывных водах белка. Изобретение позволяет увеличить скорость ферментативной реакции и повысить эффективность использования препарата на основе папаина и хитозана, в том числе при осуществлении реакции на твердых поверхностях. 3 ил., 1 пр.
Способ получения гетерогенного препарата папаина в геле на основе пищевого хитозана с молекулярной массой менее 100 кДа или сукцината хитозана, включающий иммобилизацию папаина в буферном растворе на матрицу хитозана в соотношении 20 мл раствора фермента в концентрации 1 мг/мл на 1 г носителя; инкубацию при комнатной температуре с периодическим перемешиванием; промывку образовавшегося осадка 50 мМ трис-HCl буфером (рН 7,5) до отсутствия в промывных водах белка, отличающийся тем, что иммобилизацию проводят на матрицу пищевого хитозана с молекулярной массой менее 100 кДа или сукцината хитозана; в качестве буферного раствора для иммобилизации используют 0,05 М глициновый буфер с рН 10,0 или 0,05 М ацетатный буфер с рН 5,8; инкубация проводится в течение 2 часов.
| КОРОЛЕВА В.А | |||
| и др | |||
| Разработка методики иммобилизации цистеиновых и сериновых протеаз на матрице кислоторастворимого среднемолекулярного хитозана, Акутальная биотехнология, 2016, N 3 (18), C.68-70 | |||
| SILVA D | |||
| et al | |||
| Immobilization of Papain om Chitin and Chitosan and Recycling of Soluble Enzyme for Deflocculation of Saccharomyces cerevisiae from |
Авторы
Даты
2020-01-30—Публикация
2019-03-07—Подача