Изобретение относится к биотехнологии, в частности, к способу получения иммобилизованных ферментов, и может быть использовано в химико-фармацевтической промышленности, медицинской и лабораторной практике при изготовлении лекарственных средств, обладающих регенерирующим и ранозаживляющим действием. Препараты можно получить в виде порошков различной дисперсности, пленок, гелей. Они стабильны при хранении, обладают пролонгированным антимикробным и адсорбирующим действием.
Ферментные лекарственные средства, применяемые при лечении гнойных ран, на российском рынке представлены незначительной группой фармацевтических препаратов. Использование многих энзимов в свободном состоянии (в растворе) не дает высокого эффекта, т.к. белок нестабилен в таких условиях и может подвергаться протеолизу. Все большее применение в медицине и промышленности находят иммобилизованные биопрепараты. В широком смысле иммобилизация означает любое ограничение числа степеней свободы молекулы фермента или ее фрагментов. Иммобилизованными называют энзимы, искусственно связанные с нерастворимым носителем посредством физических или химических взаимодействий и сохраняющие частично или полностью каталитические свойства.
Известно, что иммобилизация фермента на нерастворимом носителе позволяет решить несколько важных задач для медицины: 1) получение препаратов пролонгированного действия, благодаря стабилизации и увеличению времени полужизни фермента, 2) решение проблемы диффузии вещества в организме, 3) направленное регулирование оптимумов функционирования препарата (температурный оптимум, оптимум рН). Наиболее эффективными композициями являются гели, мази и повязки, позволяющие при локальном воздействии на рану одновременно влиять на патогенную микрофлору и стимулировать процессы заживления.
На сегодняшний день для воздействия на многообразие микроорганизмов, которые вызывают гнойно-воспалительный процесс, используют средства с антибиотиками и антисептиками. Однако порой бесконтрольное их применение приводит сначала к появлению, а затем к преобладанию в ране резистентной к ним микрофлоры [Патент RU 2542373, МПК А61K 31/14, А61K 31/4164, А61K 47/34, А61K 47/48, А61K 9/06, А61Р 31/04, А61Р 17/02, опубл. 20.02.2015].
Применение протеолитических ферментов в лекарственных средствах способствует очищению пораженных тканей от детрита, экссудата, увеличению контакта между патогенным микробом и антибиотиком или другим противомикробным средством. С этой целью применяются различные протеазы, такие как химопсин, трипсин, фибринолизин, папаин, террилитин, стрептокиназа; нуклеазы - дезоксирибонуклеаза и рибонуклеаза; другие энзимы - гиалуронидаза, лизоамидаза. Однако с их помощью невозможно решить все вопросы, связанные с очищением ран, т.к. эти ферменты не способны воздействовать на коллаген [Вольф М., Рансбергер К. Лечение ферментами. - М.: Мир. - 1976; Машковский М.Д. Лекарственные средства. - М.: Медицина. - 1988].
Коллагеназа (3.4.24.7) является уникальным ферментом, который способен избирательно гидролизовать коллаген, входящий в состав соединительной ткани живого организма. Расщепляя крайне устойчивые к действию других протеаз коллагеновые волокна, коллагеназа выполняет в организме человека и животных важнейшие функции, участвует в превращениях соединительной ткани при росте и морфогенезе, а также в устранении некоторых патологических процессов. Среди коллагеназ микробного происхождения наиболее изученными и хорошо известными являются коллагеназы, синтезируемые бактерией Clostridium histolyticum, которые характеризуются высокой специфичностью действия на коллагеновые волокна. Они широко используются в биотехнологии и для лабораторных целей. К настоящему времени уже разработан ряд фармацевтических композиций на основе коллагеназы [Патент RU 2166950, МПК А61K 35/74, C12Q 1/37, опубл. 20.05.2001; Патент RU 2129862, МПК А61K 9/06, А61K 47/36; Патент RU 2174389, МПК А61K 9/06, А61K 38/43, А61Р 17/02, опубл. 10.10.2001; Патент RU 2139044, МПК А61K 9/06, А61K 38/48; опубл. 10.10.1999; Патент RU 2127128, МПК A61L 15/32, опубл. 10.03.1999; Патент RU 2149644, МПК А61K 38/48, опубл. 27.05.2000]. Выявлено ее литическое действие на струп ожоговой раны. При гнойных ранах фермент способствует быстрому удалению нежизнеспособных тканей и эксудата, раннему появлению грануляционной ткани, эпителизации. Применение коллагеназы предупреждает развитие грубых рубцов, при этом сохраняется подвижность кожи и мягких тканей [Патент RU 2093166, МПК А61K 35/39, опубл. 20.10.1997].
Описан способ получения пористого ранозаживляющего материала, содержащего раствор коллагеназы, который выполняет функцию очистки раневой поверхности от некротической ткани, не обладает антисептическими свойствами и не освобождает раны от гноя и экссудата [Патент RU 2033805, МПК А61K 38/43, C12N 11/04, опубл. 30.04.1995].
Довольно близким к предлагаемой нами композиции является препарат «Ируксол» (Германия), который содержит коллагеназу в смеси с протеазами, выделенными из бактериальной культуры Clostridium histolyticum. «Ируксол» является комбинированным препаратом с протеолитическим и противомикробным действием для наружного применения, используется для энзиматического очищения ран, в том числе при варикозных язвах, пролежнях, при гангрене конечностей, в особенности у больных сахарным диабетом, а также при отморожениях, при длительно незаживающих послеоперационных ранах, после лучевой терапии, при подготовке к трансплантации кожи. Недостатком «Ируксола» является содержание в его составе антибиотика левомицетина, который может вызывать аллергическую реакцию и в настоящее время слабо действует на адаптировавшуюся к нему патогенную микрофлору. Кроме того, недостатком «Ируксола» является то, что липофильная основа препарата не обладает дегидратирующей способностью, что особенно важно при лечении гнойных ран в первой фазе раневого процесса [Susagawara R., Harper Е. Publication and characterization of three forms of collagenase from Clostridium histolyticum // Biochemistry. - 1984. - V. 23. - P. 5175-5182].
Непосредственное введение нативных ферментов в рану приводит к их быстрой инактивации, что снижает лечебный эффект, поэтому известны многочисленные методы иммобилизации различных энзимов, включая коллагеназу. Использование физической иммобилизации для получения комплекса сополимера и протеазы способствует пролонгированию ее лизирующего действия за счет депо-эффекта путем медленного высвобождения фермента в рану [Патент RU 2014086, МПК A61L 15/12, опубл. 15.06.1994].
Поликатионный полисахарид хитозан, продукт деацетилирования хитина, широко применяется в различных отраслях промышленности, биотехнологии, медицине и косметологии. Обнаружение биостимулирующего и ранозаживляющего действия хитозана способствовало созданию на его основе новых способов получения защитных и противораневых покрытий, шовных материалов, а также препаратов для ухода за кожей [Патент RU 2197971, МПК А61K 31/722, А61K 33/38, А61Р 17/02, A23L 1/054, опубл. 10.02.2003; Патент RU 2193895, МПК A61L 15/28, A61L 15/30, A61L 15/32, опубл. 10.12.2002; Патент RU 2080126, МПК A61L 17/00, опубл. 09.08.1994]. В частности, разработано средство для наружного применения «Полимед», содержащее хитозан, которое обладает антибактериальным, противогрибковым, противозудным, противоожоговым действием [Патент RU 2140264, МПК А61K 31/00, А61K 31/18, А61K 38/02, опубл. 27.10.1999]. Кроме того, хитозан применяют в качестве консерванта для стабилизации фармацевтических и косметических средств [Патент RU 2028138, МПК А61K 7/00, опубл; 09.02.1995; Патент RU 2136265, МПК А61K 7/00, А61K 7/48, А61K 9/06, опубл. 10.09.1999].
Сочетание коллагеназы и хитозана в одном препарате уже применялось при создании косметического крема, однако, в этом случае фермент не был иммобилизован на матрице полисахарида, а использовалась смесь компонентов. Авторами было продемонстрировано стимулирующее влияние их крема на пролиферацию клеток эпидермиса и ускорение его регенерации, на обменные процессы кожи. Такие показатели, как цвет кожи, ее тургор, эластичность, толщина кожной складки не менялись по сравнению с интактными животными, т.е. раздражающее и аллергизирующее действия отсутствовали. Образцы крема обладали выраженным антиоксидантным эффектом [Патент RU 2110987, МПК А61K 7/48, опубл. 20.05.1998].
В качестве прототипа служил СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОЙ КОЛЛАГЕНАЗЫ (RU 2389794, МПК C12N 11/12, C12N 9/48, опубл. 20.05.2010), включающий растворение пищевой карбоксиметилцеллюлозы в подщелоченной дистиллированной воде с рН 9,5-10, добавление к фильтрату полученного раствора коллагеназы, выделенной из панкреаса крабов, или микробной коллагеназы, выделенной из Clostridium histolyticum с коллагеназной активностью не ниже 750-1000 ед./мг в виде порошка в присутствии 1-1,5%-ного раствора поверностно-активного вещества, интенсивное перемешивание со скоростью 3000-5000 об/мин в течение 40 мин, охлаждение образовавшейся эмульсии до 5-10°С, уменьшение рН реакционной смеси до 3-3,5, суточную инкубацию в холодильнике, отделение выпавших частиц из раствора, неоднократное добавление к оставшимся частицам ацетатного буфера с рН 4-4,5 при перемешивании, отделение выпавших частиц, содержащих коллагеназу, и их высушивание.
Основным недостатком этого способа является использование поверхностно активных веществ для активации природного соединения (карбоксиметилцеллюлозы), которые невозможно применять в фармацевтической промышленности.
Технический результат заключается в разработке способа получения гетерогенного препарата на основе коллагеназы и хитозана, который позволит сократить расход ранозаживляющего средства благодаря высокой стабильности препарата и его пролонгированному действию.
Действующим веществом предлагаемого нами средства является коллагеназа, которая обладает противовоспалительным и ранозаживляющим действием. Кроме того, в качестве носителя для иммобилизации коллагеназы (основы повязки) нами был выбран хитозан различной молекулярной массы и степени дисперсности, который как носитель для иммобилизации ферментов способен не только повысить их стабильность по отношению к действию различных денатурирующих факторов (что необходимо для достижения возможности пролонгированного действия лекарственных средств), но и сам обладает ранозаживляющими свойствами, что может повысить клиническую эффективность действия препаратов. Введение хитозана в основу лекарственного или косметического средства придает ему бактерицидные свойства и позволяет снизить в готовых формах препарата концентрацию химических консервантов, обеспечивая тем самым снижение токсичности и увеличение биосовместимости.
Поставленная задача решается синтезированием препаратов иммобилизованной на матрице хитозана коллагеназы в виде порошков [Гамзазаде А.И. Производные хитина/хитозана контролируемой структуры в качестве потенциально новых биоматериалов // Дис д. хим. н. - Москва. 2005. - 363 с.], гелей [Патент RU 2172325, МПК С08В 37/08, А61K 31/722, A23L 1/056, опубл. 20.08.2001; Патент RU 2099352, МПК С08В 37/08, опубл. 20.12.1997], пленок [Патент RU 2458077, МПК C08J 5/18, C08L 5/06, C08L 5/08, C08L 101/16; Патент RU 2461575, МПК С08В 37/08, C08J 5/18, опубл. 20.09.2012], что позволяет получать на ее основе биокатализаторы для самых различных целей, включая пищевую, химико-фармацевтическую, медицинскую и сельскохозяйственную отрасли промышленности.
Технический результат достигается тем, что в способе получения гетерогенного препарата различной дисперсности на основе коллагеназы и хитозана, включающем иммобилизацию ферментного препарата в буферном растворе, инкубирование и промывку, согласно изобретению, иммобилизацию коллагеназы проводят на матрицу кислоторастворимого хитозана среднемолекулярного (200 кДа) или высокомолекулярного (350 кДа) в соотношении 20 мл раствора фермента в концентрации 1 мг/мл на 1 г носителя; в качестве буферного раствора для иммобилизации используют 0,05 М глициновый буфер с рН 8,6 для среднемолекулярного и с рН 10,5 для высокомолекулярного хитозана; инкубация проводится в течение 5 часов при комнатной температуре с периодическим перемешиванием; образовавшийся осадок промывают 50 мМ трис-HCl буфером (рН 7.5) до отсутствия в промывных водах белка.
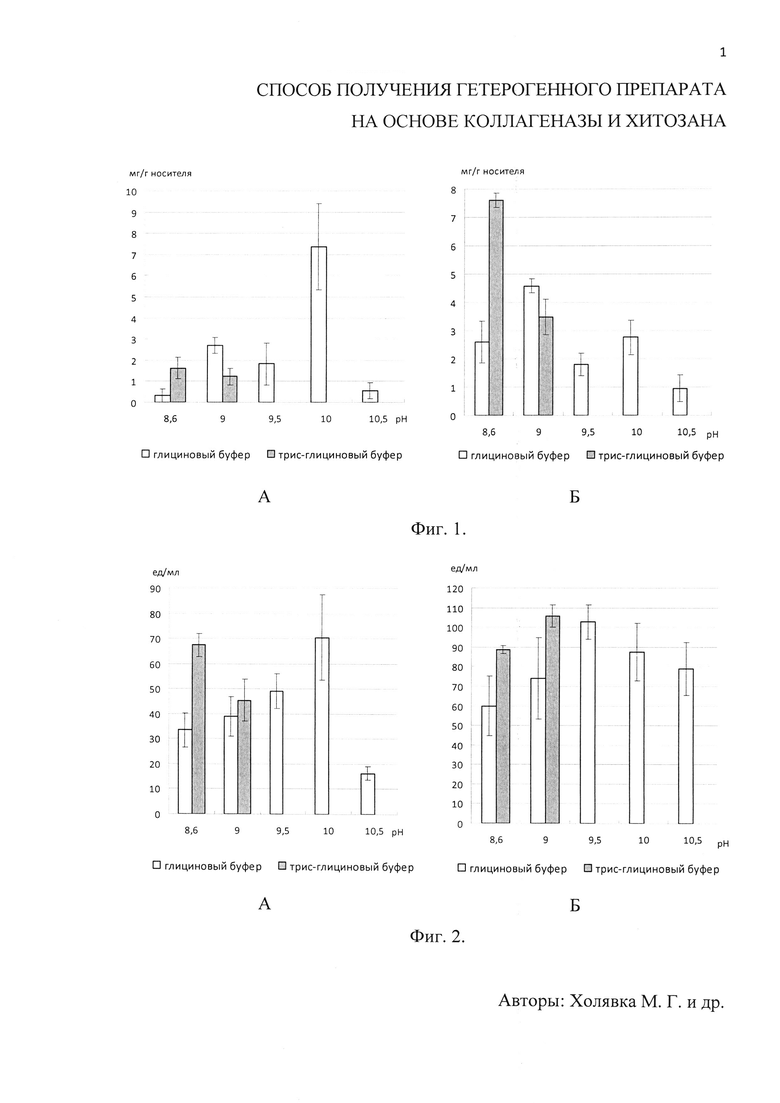
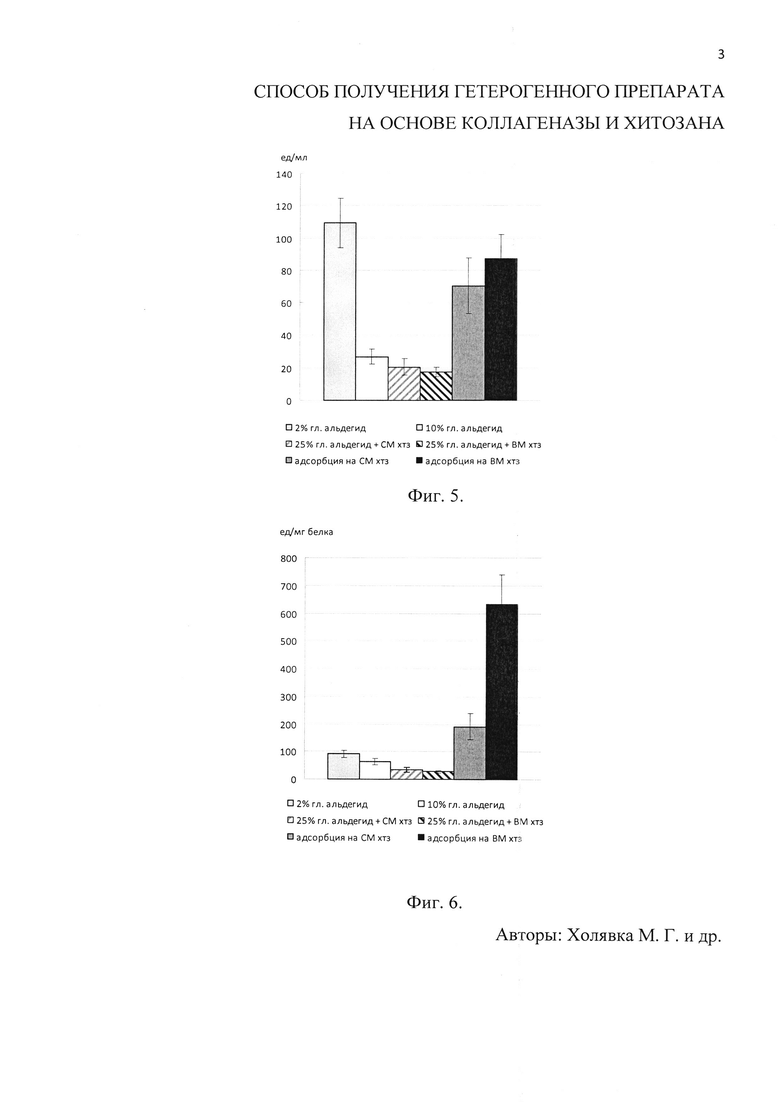
Фиг. 1. Приведены диаграммы содержания белка (в мг на 1 г носителя) в препаратах коллагеназы, адсорбционно иммобилизованной на матрице среднемолекулярного (А) и высокомолекулярного (Б) хитозанов. Фиг. 2. Приведены диаграммы общей активности (в ед на 1 мл раствора) препаратов коллагеназы, адсорбционно иммобилизованной на матрице среднемолекулярного (А) и высокомолекулярного (Б) хитозанов. Фиг. 3. Приведены диаграммы удельной активности (в ед на 1 мг белка в пробе) препаратов коллагеназы, адсорбционно иммобилизованной на матрице среднемолекулярного (А) и высокомолекулярного (Б) хитозанов. Фиг. 4. Приведена диаграмма содержания белка (в мг на 1 г носителя) в препаратах коллагеназы, иммобилизованной различными способами: сополимеризация фермента (с применением 2% и 10% глутарового альдегида), ковалентная (на средне- и высокомолекулярном хитозанах с применением 25% глутарового альдегида) и сорбционная иммобилизация. Фиг. 5. Приведена диаграмма общей активности (в ед. на 1 мл раствора) препаратов коллагеназы, иммобилизованной различными способами: сополимеризация фермента (с применением 2% и 10% глутарового альдегида), ковалентная (на средне- и высокомолекулярном хитозанах с применением 25% глутарового альдегида) и сорбционная иммобилизация. Фиг. 6. Приведена диаграмма удельной активности (в ед. на 1 мг белка в пробе) препаратов коллагеназы, иммобилизованной различными способами: сополимеризация фермента (с применением 2% и 10% глутарового альдегида), ковалентная (на средне- и высокомолекулярном хитозанах с применением 25% глутарового альдегида) и сорбционная иммобилизация.
В качестве объекта исследования была выбрана коллагеназа из Clostridium histolyticum фирмы «Sigma-Aldrich», субстратом для гидролиза служил азоказеин фирмы «Sigma-Aldrich». В качестве носителей для иммобилизации тестировали четыре вида хитозана (ЗАО «Биопрогресс»): хитозан пищевой кислоторастворимый среднемолекулярный (Mr=200 кДа), хитозан кислоторастворимый высокомолекулярный (Mr=350 кДа), хитозан пищевой и сукцинат хитозана водорастворимый.
Для иммобилизации коллагеназы на матрице хитозана использовали различные методики.
Вариант 1. Сорбционная иммобилизация. К 50 мг хитозана добавляли 1 мл буферного раствора фермента в концентрации 1 мг/мл (применяли различные буферные системы, изменяя их рН и ионную силу), инкубировали с периодическим перемешиванием в течение 4 часов для среднемолекулярного хитозана и 5 часов для высокомолекулярного хитозана.
Вариант 2. Ковалентная иммобилизация. К 900 мг хитозана добавляли 18 мл раствора фермента в глициновом буфере с рН 10,0 в концентрации 1 мг/мл и 10 мл 25% глутарового альдегида, инкубировали с периодическим перемешиванием в течение 1 часа.
Вариант 3. Сополимеризация фермента. 5 мг фермента растворяли в 5 мл глицинового буфера с рН 10,0, затем добавляли 5 мл глутарового альдегида различной концентрации и оставляли в чашке Петри до образования пленки.
Во всех трех вариантах после окончания инкубации образовавшийся осадок (или пленку) промывали 50 мМ трис-HCl буфером (рН 7,5) до отсутствия в промывных водах белка (контроль осуществляли на спектрофотометре СФ-2000 при λ=280 нм).
Содержание белка в иммобилизованных препаратах коллагеназы определяли методом Лоури [Lowry О.Н., Rosebrough N.J., Faar A.L., Randall R.J. Protein measurement with folin-phenol reagent // J. Biol. Chem. - 1951. - V. 193. - P. 265-275]. Метод определения протеолитической активности фермента проводили на субстрате азоказеине (Fluka). К 50 мг образца добавляли 200 мкл трис-HCl, рН 7,5, 800 мкл азоказеина (0,5% в 50 мМ трис-HCl буфере, рН 7,5) и инкубировали 2 часа при 37°С. Далее добавляли 800 мкл ТХУ (5%), инкубировали 10 минут при -4°С, затем центрифугировали в течение 3 мин при 13000 об/мин для удаления негидролизованного азоказеина. К 1200 мкл супернатанта добавляли 240 мкл 3% NaOH для нейтрализации кислоты, после чего измеряли оптическую плотность опытной пробы при 410 нм в 1 см кювете. Контрольная проба содержала 800 мкл азоказеина, 800 мкл ТХУ, 50 мг образца и 200 мкл буфера. За единицу каталитической активности принимали количество фермента, которое в условиях эксперимента гидролизует 1 мкМ субстрата за 1 мин. Удельную протеолитическую активность коллагеназы рассчитывали по формуле:
ПА=D*1000/120/200/Ср,
где ПА - протеолитическая активность, мкМ/мин на 1 мг белка, D - оптическая плотность при 410 нм, Ср - концентрация белка в пробе, мг/мл, измеренная по методу Лоури, 120 - время инкубации в минутах, 200 - объем пробы, 1000 - пересчет в мкМ.
Статистическую обработку полученных результатов проводили при уровне значимости 5% с использованием t-критерия Стьюдента.
На первом этапе экспериментов для получения гетерогенных биокатализаторов на основе коллагеназы, иммобилизованной методом адсорбции на матрице хитозанов различной молекулярной массы, в качестве иммобилизационной среды мы использовали различные буферные растворы с рН 8,6-10,5. Результаты для наиболее подходящих буферных систем отражены на фиг. 1-3.
В ходе выполнения эксперимента по определению содержания белка (в мг на 1 г носителя) было выявлено, что сорбция коллагеназы на матрице средне- и высокомолекулярного хитозанов максимальна при использовании глицинового буфера с рН 10,0 и трис-глицинового буфера с рН 8,6 соответственно (фиг. 1). Для пищевого хитозана и сукцината хитозана подобрать удовлетворительные условия сорбции на удалось (степень сорбции в наших экспериментах не превышала 20%).
Высокую общую активность (в ед на мл раствора) показали препараты коллагеназы, иммобилизованные на матрице среднемолекулярного хитозана, приготовленные в среде глицинового буфера с рН 10,0 и трис-глицинового буфера с рН 8,6. При сорбции на высокомолекулярном хитозане оптимальными оказались глициновый буфер с рН 9,5 и трис-глициновый буфер с рН 9,0 (фиг. 2).
Максимальная удельная активность (в ед на мг белка) гетерогенного биокатализатора на основе коллагеназы, сорбированной на матрице среднемолекулярного хитозана, наблюдалась при использовании глицинового буфера с рН 8,6. Для высокомолекулярного хитозана оптимальным оказался глициновый буфер с рН 10,5 (фиг. 3).
Адсорбционная иммобилизация часто является обратимой из-за участия в этом процессе только водородных связей и слабых физических взаимодействий (электростатических, гидрофобных, ван-дер-ваальсовых), поэтому мы использовали также другие методы получения гетерогенных препаратов коллагеназы (ковалентную иммобилизацию с применением глутарового альдегида в качестве сшивающего агента и сополимеризацию фермента (без носителя) в присутствии глутарового альдегида в различных концентрациях) и сравнили полученные результаты с экспериментом по сорбции энзима на средне- и высокомолекулярном хитозанах (фиг. 4-6). Согласно полученным данным, метод адсорбции позволяет сохранить удельную каталитическую активность коллагеназы в большей степени, чем ковалентная иммобилизация и сополимеризация фермента в присутствии глутарового альдегида. Наиболее высокие значения общей и удельной каталитической активности были характерны для образцов, иммобилизованных путем адсорбции на высоко- (350 кДа) и среднемолекулярном (200 кДа) хитозанах при использовании в качестве иммобилизационной среды 0,05 М глицинового буфера с рН 10,5 и 8,6 соответственно. В связи с этим при использовании препаратов в медицине или аналитической практике необходим компромисс между высокой активностью и стабильностью катализатора.
Из вышеизложенного материала следует, что среди апробированных нами вариантов иммобилизации (сорбционная, ковалентная иммобилизация и сополимеризация фермента) для создания гетерогенных препаратов на основе коллагеназы и хитозана наиболее перспективным является адсорбция фермента на высокомолекулярном и среднемолекулярном хитозанах:
Пример 1. К 50 мг высокомолекулярного (350 к Да) хитозана добавляли 1 мл раствора фермента (в концентрации 1 мг/мл) в 0,05 М глициновом буфере с рН 10,5, инкубировали с периодическим перемешиванием в течение 5 часов с суспензией высокомолекулярного хитозана (350 к Да). После окончания инкубации образовавшийся осадок промывали 50 мМ трис-HCl буфером (рН 7,5) до отсутствия в промывных водах белка (контроль этого факта осуществляли на спектрофотометре СФ-2000 при λ=280 нм).
Пример 2. К 50 мг среднемолекулярного (200 кДа) хитозана добавляли 1 мл раствора фермента (в концентрации 1 мг/мл) в 0,05 М глициновом буфере с рН 8,6, инкубировали с периодическим перемешиванием в течение 5 часов с суспензией среднемолекулярного хитозана (350 кДа). После окончания инкубации образовавшийся осадок промывали 50 мМ трис-HCl буфером (рН 7,5) до отсутствия в промывных водах белка (контроль этого факта осуществляли на спектрофотометре СФ-2000 при λ=280 нм).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ПРЕПАРАТА РАЗЛИЧНОЙ ДИСПЕРСНОСТИ НА ОСНОВЕ БРОМЕЛАЙНА И ХИТОЗАНА | 2017 |
|
RU2677232C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИОННОГО ПРЕПАРАТА БРОМЕЛАЙНА И АЛЬГИНАТА НАТРИЯ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2792785C1 |
| Способ получения гибридного препарата бромелайна и аскорбата хитозана в виде густого раствора | 2023 |
|
RU2819793C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ПРЕПАРАТА БРОМЕЛАЙНА, КОВАЛЕНТНО СВЯЗАННОГО С МАТРИЦЕЙ ХИТОЗАНА | 2018 |
|
RU2711786C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА БРОМЕЛАЙНА И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2788454C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ КОЛЛАГЕНАЗЫ, ГИАЛУРОНОВОЙ КИСЛОТЫ И ПОЛИСАХАРИДОВ, МОДИФИЦИРОВАННЫХ ВИНИЛОВЫМИ МОНОМЕРАМИ | 2020 |
|
RU2750382C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ФИЦИНА И НИЗКОМОЛЕКУЛЯРНОГО ХИТОЗАНА | 2021 |
|
RU2769243C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ФИЦИНА, ОБЛАДАЮЩЕГО РАНОЗАЖИВЛЯЮЩИМИ И РЕГЕНЕРИРУЮЩИМИ СВОЙСТВАМИ | 2017 |
|
RU2677858C2 |
| Способ получения гибридного препарата папаина и аскорбата хитозана в виде густого раствора | 2023 |
|
RU2822736C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БРОМЕЛАЙНА В ГЕЛЕ НА ОСНОВЕ ПИЩЕВОГО ХИТОЗАНА И СУКЦИНАТА ХИТОЗАНА | 2018 |
|
RU2691611C1 |

Изобретение относится к области медицины и биотехнологии, а именно к способу получения средства на основе коллагеназы и хитозана, обладающего регенерирующим и ранозаживляющим действием, согласно которому осуществляют иммобилизацию коллагеназы в буферном растворе на матрицу кислоторастворимого среднемолекулярного или высокомолекулярного хитозана в соотношении 20 мл буферного раствора коллагеназы в концентрации 1 мг/мл на 1 г указанной матрицы, при этом в качестве буферного раствора для иммобилизации используют 0,05 М глициновый буфер с рН 8,6 для среднемолекулярного хитозана и с рН 10,5 для высокомолекулярного хитозана; далее проводят инкубирование в течение 5 часов при комнатной температуре с периодическим перемешиванием; затем промывают образовавшийся осадок 50 мМ трис-HCl буфером с рН 7,5 до отсутствия в промывных водах коллагеназы. Изобретение обеспечивает сокращение расхода ранозаживляющего средства за счет его высокой стабильности и пролонгированного действия. 6 ил., 2 пр.
Способ получения средства, обладающего регенерирующим и ранозаживляющим действием, на основе коллагеназы и хитозана, включающий иммобилизацию коллагеназы в буферном растворе на матрицу кислоторастворимого среднемолекулярного или высокомолекулярного хитозана в соотношении 20 мл буферного раствора коллагеназы в концентрации 1 мг/мл на 1 г указанной матрицы, при этом в качестве буферного раствора для иммобилизации используют 0,05 М глициновый буфер с рН 8,6 для среднемолекулярного хитозана и с рН 10,5 для высокомолекулярного хитозана; инкубирование в течение 5 часов при комнатной температуре с периодическим перемешиванием; промывание образовавшегося осадка 50 мМ трис-HCl буфером с рН 7,5 до отсутствия в промывных водах коллагеназы.
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОЙ КОЛЛАГЕНАЗЫ | 2008 |
|
RU2389794C2 |
| Королева В.А | |||
| и др | |||
| Исследование сорбционной емкости кислоторастворимых хитозанов по отношению к бычьему сывороточному альбумину / Вестник ВГУ | |||
| Серия: Химия | |||
| Биология | |||
| Фармация, 2015, N.4, с.85-89 | |||
| Белов А.А | |||
| и др | |||
| Текстильные материалы, содержащие хитозан и протеолитический комплекс из гепатопанкреаса краба, для медицинских целей / Биомедицинская химия, Т.55, N.1, с.61-67 | |||
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОЙ ГЛЮКОАМИЛАЗЫ | 2001 |
|
RU2204600C2 |
| SLOVAKOVA Marcela et al | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
Авторы
Даты
2019-01-29—Публикация
2017-07-03—Подача