Изобретение относится к области экспериментальной биологии и медицины, и касается моделирования метаболических нарушений, осложненных хронической обструктивной болезнью легких, для поиска и разработки лекарственных средств для профилактики и лечения легочных осложнений, развивающихся при метаболическом синдроме.
Все чаще признается, что метаболический синдром и хроническая обструктивная болезнь легких (ХОБЛ) являются основными причинами заболеваемости и смертности во всем мире [1]. Считается, что развитие ХОБЛ и метаболического синдрома, включает общие факторы риска, которые могут быть перекрестно связаны у отдельного пациента [2]. Существует негативное влияние метаболических нарушений и сахарного диабета на функцию легких [3]. Однако взаимосвязь механизмов развития метаболического синдрома и ХОБЛ по-прежнему неизвестна, что затрудняет лекарственную терапию [4]. В этой связи создание новой экспериментальной модели, охватывающей симптоматику метаболического синдрома и ХОБЛ, на наш взгляд, необходимо.
Для разработки эффективных технологий лечения пациентов с метаболическим синдромом, осложненным хронической обструктивной болезнью легких, нацеленных на регенерацию травмированных тканей необходимо использовать адекватную экспериментальную модель, сочетающую в себе симптоматику метаболического синдрома (дислипидемия, гипергликемия) и хронической обструктивной болезни легких (эмфизема, разрушение альвеолярного эпителия и эндотелия). Адекватного прототипа в проанализированной патентной и научно-медицинской литературе не обнаружено.
Задачей, решаемой данным изобретением, является создание модели метаболического синдрома, осложненного хронической обструктивной болезнью легких, в основе которого лежат метаболические нарушения и патоморфологические изменения в поджелудочной железе и ткани легких.
Поставленная задача решается тем, что моделируют сочетанную патологию метаболического синдрома и хронической обструктивной болезни легких, характеризующийся тем, что мышам-самкам линии C57B L/6 через сутки после рождения подкожно вводят глутамат натрия курсом течение 10 суток в дозе 2,2 мг/кг, а затем на 126 сутки после рождения, на фоне развившегося у животных метаболического синдрома, определяемого по индексу Ли, гипергликемии и дислипидемии, индуцируют хроническую обструктивную болезнь легких интратрахеальным введением липолисахарида в дозе 3 мкг на мышь на 126 и 129 сутки после рождения и курсовым интратрахеальным введением экстракта сигаретного дыма в дозе 50 мкл на мышь на 127, 130, 133, 136, 139, 142, 149, 156, 163, 170 сутки после рождения, определяемую по воспалению, эмфиземе легких, разрушению микроциркуляторного русла и альвеолярного эпителия.
Новым в предполагаемом способе является исследование сочетанного воздействия метаболических нарушений, индуцированных глутаматом натрия, и хронической обструктивной болезни легких, индуцированной липополисахаридом и экстрактом экстракта сигаретного дыма.
Предлагаемый способ моделирования метаболического синдрома и хронической обструктивной болезни легких наиболее полно раскрывает клиническую картину нарушений, свойственных метаболическому синдрому, осложненному хронической обструктивной болезнью легких.
Глутамат натрия (лат. natrii glutamas, англ. monosodium glutamate, глютаминат натрия [5]) - мононатриевая соль глутаминовой кислоты, популярная пищевая добавка Е621 (в этом качестве также называется «усилитель вкуса») представляет собой белый кристаллический порошок, хорошо растворимый в воде. Исследования последних лет на животных показали, что глутамат натрия, введенный новорожденным животным, может использоваться для индукции экспериментальной модели ожирения. У таких животных развивается тяжелое ожирение и сахарный диабет, клиническое течение которых схоже с развитием метаболического синдрома у человека. [6, 7]. Ожирение является ключевым компонентом метаболического синдрома, состояния, определяемого совокупностью клинических характеристик, в том числе, таких как абдоминальное ожирение, гипергликемия, гипертриглицеридемия, гипертония и низкий уровень липопротеинов высокой плотности [6].
Хроническая обструктивная болезнь легких (ХОБЛ) представляет собой прогрессирующее заболевание легких с хроническим воспалением альвеолярной ткани и формированием эмфиземы. Курение сигарет было признано основным фактором риска развития ХОБЛ [8, 9] Для индукции эмфиземы и хронической обструктивной болезни легких в экспериментальных исследованиях используют различные методы: путем воздействия курения, интраназальной инсталляции эластазы, интраназальной инсталляции липополисахарида, воздействия диоксида серы, вдыхания сухого порошка овальбумина т.д. [9]. Сигаретный дым - это смесь более 4000 различных химических соединений, таких как свободные радикалы, токсины и т.д. Экстракт сигаретного дыма содержит почти все соединения, вдыхаемые курильщиками [9]. Важным критерием оценки модели эмфиземы и ХОБЛ является гистологическая оценка ткани легкого. По данным Американского торакального общества, эмфизема определятся как «ненормальное, постоянное расширение воздушных пространств, дистальнее конечной бронхиолы, сопровождающееся разрушением их стенок» [10]. Поэтому проведение гистологической оценки ткани легкого является обязательным критерием подтверждения развития ХОБЛ.
На сегодняшний день понимание метаболического синдрома и ХОБЛ эволюционировало от понятия болезнь, ограниченная нарушением жирового обмена и дыхательными путями соответственно, к более «сложным заболеваниям» часто связанным другими хроническими заболеваниями. В качестве наиболее вероятных механизмов развития осложнений предлагаются системное воспаление, способствующее развитию, как метаболического синдрома, так и ХОБЛ [11]. Поэтому в клиническом ведении таких пациентов пытаются лечить все эти потенциальные сопутствующие заболевания и их недействующие механизмы. Однако, лекарственных препаратов, успешно используемых в лечении хронических заболеваний, таких как метаболические нарушения, осложненные хронической обструктивной болезнью легких нет. Во многом, сложившаяся ситуация связана с отсутствием адекватных экспериментальных моделей индуцированных метаболических нарушений, осложненных хронической обструктивной болезнью легких, которые позволили бы произвести отбор препаратов, эффективных в условиях обеих патологий.
Отличительные признаки проявили в заявляемой совокупности новые свойства явным образом не вытекающие из уровня техники в данной области и неочевидные для специалиста.
Идентичной совокупности признаков не обнаружено в проанализированной патентной и научно-медицинской литературе.
Способ может быть использован для поиска эффективных лекарственных средств, способных влиять на метаболических синдром и хроническую обструктивную болезнь легких. Исходя из вышеизложенного, заявляемое изобретение соответствует критериям патентоспособности изобретения «Новизна» и «Изобретательский уровень» и «Промышленная применимость».
Предлагаемый способ изучен в экспериментах на 40 мышах-самках линии C57B L/6. Животные поступили из отдела экспериментальных биологических моделей НИИФиРМ им. Е.Д. Гольдберга (ветеринарное удостоверение имеется). Содержание животных и экспериментальный дизайн одобрены Этическим комитетом НИИФиРМ им. Е.Д. Гольдберга и соответствуют международным правилам, принятым Европейской Конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей.
С целью исключения сезонных колебаний изучаемых показателей все эксперименты проведены в осенне-зимний период. Забор материала осуществляют в утренние часы. Мышей умерщвляют передозировкой СО2. Количество животных в каждой группе не менее 20 особей.
Способ будет понятен из следующего описания и приложенных к нему фигур 1 и 2.
На фиг. 1 изображено легкое мыши на 188 сутки эксперимента, при окрашивании ткани легкого гематоксилином и эозином: а, б, в - интактной, где а - верхнее легочное поле, б - среднее легочное поле, в - нижнее легочное поле; г, д, е - получавшей глутамат натрия и с индуцированной хронической обструктивной болезнью легкого, где г - верхнее легочное поле, д - среднее легочное поле, е - нижнее легочное поле. Увеличение × 100.
На фиг. 2 изображено легкое мыши на 188 сутки эксперимента, при иммуногистохимическом окрашивании ткани легкого для следующих маркеров: CD31 (а, д), α1-антитрипсин (A1AT) (б, е), инсулин (в, ж), пан-цитокератин (АЕ1 / АЕ3) (г, з):.а, б, в, г - интактной; д, е, ж, з - получавшей глутамат натрия и с индуцированной хронической обструктивной болезнью легкого. Увеличение × 100.
Способ осуществляют следующим образом:
Экспериментальный метаболический синдром вызывают введением глутамата натрия (с 1 по 10 день жизни, ежедневно, подкожно в дозе 2,2 мг/г) [12]. Дату рождения животных считают 1 днем эксперимента. На 124-е сутки эксперимента проводят вычисления индекса Ли (индекс массы тела) [12]. Этот индекс рассчитывают как кубический корень из массы тела (г) * 10 / носоанальная длина (мм). У животных самок со значениями индекса Ли более 0,300, нарушениями глюкозотолерантного теста, на 126 сутки эксперимента индуцируют эмфизему легких.
Предварительно получают экстракт сигаретного дыма из сигарет марки L&M REDLABEL 2 сигареты на/мл (состав 1 сигареты: смола 10 мг/сиг, никотин 0,8 мг/сиг, СО10 мг/сиг). Перед получением экстракта удаляют сигаретный фильтр, длина сигареты с фильтром 80 мм, при удалении фильтра 55 мм. Экстракцию производят путем протягивания дыма зажженной сигареты через фосфатный буфер с постоянной скоростью, при помощи вакуумного насоса, сигарета сжигается до длины 5 мм. Время сжигания одной сигареты составляет 180 секунд. Для удаления частиц полученный экстракт фильтруют через бактериальный фильтр с величиной поры 45 нм. Для стандартизации полученного экстракта перед и после фильтрации раствора проводят измерение рН (рН~7) и оптической плотности на длинах волн 405 и 540 нм (D405~237, D540~123).
Для инициации острой фазы воспаления используют липополисахарид (ЛПС). Липополисахарид - компонент клеточной стенки грамотрицательных бактерий Е. coli О111: В4 («Lipopolysaccharides from Escherichia coli О111:B4», «Sigma», США). ЛПС стимулирует клетки врожденной иммунной системы Toll-подобным рецептором 4, являющимся членом семейства Toll-подобных рецепторных белков, который распознает общие связанные с патогенами молекулярные структуры (PAMPs), вызывая тем самым усиление воспалительной реакции [13].
Хроническую обструктивную болезнь легких вызывают курсовым интратрахеальным введением липополисахарида и экстракта сигаретного дыма [9, 14, 15]. ЛПС в дозе 3 мкг/мышь в 50 мкл фосфатного буфера и 50 мкл экстракта сигаретного дыма вводят интратрахеально [16]. При введении ЛПС и экстракта сигаретного дыма применяют общую анестезию (пентобарбитал, золетил и ксилазин). Введение ЛПС производится на 126 и 129 сутки эксперимента. Экстракт сигаретного дыма вводят на 127, 130, 133, 136, 139, 142, 149, 156, 163, 170 сутки эксперимента.
Контролируется модель по показателям уровня глюкозы, измерения липидного профиля в крови и проведением стандартных гистологических исследований легких с подсчетом площади эмфиземы [14]. Уровень глюкозы в крови определяют при помощи глюкометра (Accu-Chek Performa Nanu ("Roche Diagnostes GmbH", Germany). Измерение исходного уровня глюкозы в крови у животных проводят после 16-и часовой депривации корма, все последующие измерения уровня глюкозы также производят после 12-и часовой депривации еды. Оценку липидного профиля (ЛПНП, ЛПВП, триглицериды) проводят стандартными биохимическими методами.
На 124 и 186 сутки эксперимента проводят глюкозотолерантный тест. На первом этапе проводят забор образца крови для оценки исходного уровня глюкозы у экспериментальных животных. Через 1 ч после этого производят внутрижелудочную инъекцию глюкозы (D-глюкоза, Sigma-Aldrich, США) в дозе 2 г/кг. Согласно данным литературы, ответ организма животных на низкие дозы глюкозы при ее внутрижелудочном введении слабый, поэтому используется доза глюкозы 2 г/кг [17]. Первый забор крови для исследования уровня глюкозы проводят через 30 мин после инъекции глюкозы, далее исследование содержания глюкозы производят с интервалом в 30 мин, продолжительность исследования составила 90 мин.
Для морфологических исследований правую долю легкого фиксируют в 10% растворе нейтрального формалина, проводят через спирты восходящих концентраций до ксилола и заливают в парафин по стандартной методике. Депарафинизированные срезы толщиной 5 мкм окрашивают гематоксилин-эозином [17]. Микропрепараты от каждого экспериментального животного исследуются под световым микроскопом Axio Lab.A1 («Carl Zeiss», Germany) на 100- и 400-кратном увеличениях. Оцениваются нарушения гистоархитектоники ткани легких, наличие отека и воспалительной инфильтрации, венозного застоя, утолщения стенок сосудов и бронхов [18, 19].
Для каждого экспериментального животного делается минимум 5 микрофотографий без перекрытия по всей поверхности среза легочной ткани при 100-кратном увеличении. Использованная система состоит из микроскопа Axio Lab.A1 («Carl Zeiss», Germany) с видеокамерой AxioCam ERc5s («Carl Zeiss», Germany), подключенной к персональному компьютеру. Полученные изображения обрабатываются с помощью программного обеспечения AxioVision Rel.4.8.2. Площадь эмфизематозно-расширенных альвеол в легких определяется с использованием специальной функции для подсчета площади объекта на изображении. Срезы бронхов и кровеносных сосудов изымаются из анализируемых областей.
Расчет относительной площади эмфиземы производится по формуле 1:
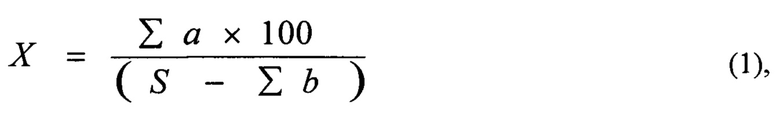
где ∑а - сумма пикселей, занимаемых эмфизематозно-расширенными альвеолами, во всех снимках одного препарата, S - количество пикселей соответствующее полной площади снимка (при использовании данной фотокамеры и программы - 4423680), b - сумма пикселей, занимаемых пустой частью предметного стекла, во всех снимках одного препарата [20-22].
Иммуногистохимическое исследование легких проводят на 188 сутки эксперимента. Срезы легочной ткани помещаются на предметные стекла с адгезивным полилизиновым покрытием (Leica biosystems, Германия). Перед окрашиванием проводят депарафинизацию срезов ткани, с последующей демаскировкой антигена в цитратном буфере (рН=6) в течение 20 минут. Инкубирование с первичными антителами проводят во влажной камере при 37°С. Для выявления специфических клеточных маркеров используют следующие первичные антитела: поликлональные антитела к инсулину (ab63820, Abcam, США), поликлональные антитела к мембранному белку CD31 (ab28364, Abcam, США), поликлональные антитела к α1-антитрипсину (ab9373, Abcam, США), моноклональные антитела к пан-цитокератину (АЕ1/АЕ3) (ab80826, Abcam, США). Для детекции антител используется система визуализации в соответствии с инструкцией производителя (Spring bioscience, USA). Контрастирование срезов производится при помощи гематоксилина. После окраски срезы дегидрируются в ксилоле и заключаются в монтирующую среду. Для получения микрофотографий используется микроскоп Axio Lab.A1 (Carl Zeiss, Germany) с камерой AxioCam ERc5s (Carl Zeiss, Germany). Анализ изображений и подсчет клеток экспрессирующих детектируемые антигены производится при помощи программы ImageJ. Для каждого экспериментального животного делается минимум 10 микрофотографий без перекрытия по всей поверхности среза легочной ткани при 100-кратном увеличении. Процент окрашенных клеток оценивают, подсчитывая количество окрашенных клеток по отношению к общему количеству клеток ткани легких.
Статистическую обработку полученных результатов проводят методами вариационной статистики с использованием пакета статистической обработки данных SPSS 12,0. Вычисляют среднее арифметическое (М), ошибку среднего арифметического (m), значение вероятности (Р). Различие двух сравниваемых величин считают достоверным в том случае, если вероятность их тождества была меньше 5% (Р<0,05). Используя выборочные коэффициенты асимметрии и эксцесса, оценивают степень приближения закона распределения исследуемого признака к нормальному. В случаях нормального распределения признаков для статистической оценки применяют параметрический t-критерий Стьюдента. При больших отклонениях распределений признака от нормального вида для независимых выборок используют непараматрический критерий U-критерий Уилкоксона. Для выявления достоверности различий качественных показателей используют критерий углового преобразования Фишера.
Пример 1.
Проведенные эксперименты позволяют показать, что моделирование метаболических нарушений приводит к достоверному увеличению индекса Ли у мышей самок линии C57BL/6 к 124 суткам эксперимента (Таблица 1).

Примечание. * - различия статистически достоверны по сравнению с интактным контролем (р<0,05);
Критерием выраженности нарушения метаболизма глюкозы является глюкозотолерантный тест. У животных интактного контроля и у мышей с метаболическими нарушениями проводится глюкозотолерантный тест. В ответ на инъекцию глюкозы у интактных животных регистрируется достоверное повышение уровня глюкозы в крови на протяжении 30 минут наблюдения (Таблица 2). У животных с метаболическими нарушениями регистрируется более выраженное увеличение уровня глюкозы и наблюдается увеличение площади под кривой (AUC) (Таблица 2).
Моделирование метаболических нарушений вызывает повышение концентрации ЛПНП в сыворотке крови на 124 сутки эксперимента (Таблица 3). Изменения со стороны ЛПВП, триглицеридов направлены в сторону снижения показателей.

Примечание. * - различия статистически достоверны по сравнению с интактным контролем (р<0,05); # - различия статистически достоверны по сравнению с исходным уровнем (р<0,05).

Примечание. * - различия статистически достоверны по сравнению с интактным контролем (р<0,05)
Таким образом, введение глутамата натрия с 1 по 10 день жизни, ежедневно, подкожно в дозе 2,2 мг/г вызывает метаболический синдром мышей самок линии C57BL/6 к 124 суткам эксперимента, о чем свидетельствует увеличение индекса Ли у животных, нарушения при проведении глюкозотолерантном тесте и нарушения со стороны липидного обмена.
У мышей самок линии C57BL/6 со значениями индекса Ли более 0,300, нарушениями толерантности к глюкозе на 126 сутки эксперимента индуцируют ХОБЛ.
На фоне развития сочетанной патологии метаболических нарушений и ХОБЛ у животных регистрируют показатели, позволяющие подтвердить развитие метаболических нарушений и ХОБЛ.
Индекс Ли увеличивается во всех группах в течение жизни, и, как и ожидается, группа с метаболическим синдромом и ХОБЛ показывает значительно более высокое значение, чем контрольные интактные мыши, к 188 суткам эксперимента (Таблица 4).

Примечание. * - различия статистически достоверны по сравнению с интактным контролем (р<0,05)
Важным критерием подтверждения метаболических нарушений являются изменения в метаболизме глюкозы. Проведенный на 186 сутки эксперимента глюкозотолерантный тест демонстрирует снижение уровня гомеостаза глюкозы у мышей с метаболическим синдромом и ХОБЛ (Таблица 5). Кроме того, к 188 суткам эксперимента в этой группе мышей наблюдаются достоверно более высокие показатели уровня глюкозы в крови (Таблица 6).

Примечание. * - различия статистически достоверны по сравнению с интактным контролем (р<0,05);

Примечание. * - различия статистически достоверны по сравнению с интактным контролем (р<0,05)
Далее у животных оцениваются показатели, свидетельствующие о развитии хронической обструктивной болезни легких. При предварительной макроскопической оценке легких выявляется увеличение органа в объеме у мышей контрольной группы, отмечается мягкость его консистенции и потеря эластичности ткани по сравнению с интактными животными, при этом ткань органа спадается и легко повреждается. Кроме этого, наблюдается гиперемия ткани легкого, при разрезе выделяется геморрагический экссудат, обнаруживается увеличение правого желудочка сердца и расширение крупных сосудов. Гистологическое исследование показывает, что в условиях введения ЛПС и экстракта сигаретного дыма на фоне развития метаболического синдрома в просвете отдельных альвеол обнаруживаются скопления макрофагов, имеет место перибронхиальный отек, отмечается умеренное растяжение бронхиол, альвеолярных ходов и альвеол. Кроме этого наблюдается разрывы альвеолярных перегородок, отмечаются единичные ателектазы, происходит истончение альвеолярных капилляров и их запустевание (фиг. 1, таблица 7). В результате действия ЛПС и экстракта сигаретного дыма на эластические волокна в паренхиме легких мышей развивается диффузная эмфизема. Наиболее выраженная эмфизема регистрируется в нижнем легочном поле, затем по интенсивности поражения следует среднее легочное поле и замыкает ряд верхнее легочное поле (таблица 7).

Примечание: * - различия достоверны по сравнению с интактным контролем (р<0,05; U - критерий Манна-Уитни).
При иммуогистохимическом исследовании ткани легкого у мышей Введение экстракта сигаретного дыма достоверно уменьшает количество клеток, экспрессирующих CD31, α1-антитрипсин и пан-цитокератин (АЕ1/АЕ3), в легочной ткани мышей метаболическим нарушениями и ХОБЛ по сравнению с интактным контролем на 188 сутки эксперимента (фиг. 2, таблица 8). Изучение экспрессии инсулина в легочной ткани мышей не выявляет различий между группами.

Примечание: * - различия достоверны по сравнению с интактным контролем (р<0,05; U - критерий Манна-Уитни).
Таким образом, введение глутамата натрия, подкожно в дозе 2,2 мг/г в течение 10 дней начиная через сутки после рождения, мышам-самкам линии C57BL/6 и последующее двукратное интратрахеальное введение липолисахарида на 126 и 129 сутки эксперимента в дозе 3 мкг на мышь и курсовое интратрахеальное введение экстракта сигаретного дыма на 127, 130, 133, 136, 139, 142, 149, 156, 163, 170 сутки эксперимента в дозе 50 мкл на мышь, вызывает к 188 суткам эксперимента формирование метаболических нарушений (гипергликемия, нарушения глюкозотолерантного теста, гиперхолистеринемия) и патоморфологических изменений в легких (деструктивные изменения легочной ткани).
Литература:
1. Wouters EFM Obesity and Metabolic Abnormalities in Chronic Obstructive Pulmonary Disease. //Ann Am Thorac Soc. 2017 Nov;14 (Supplement_5) :S389-S394. doi: 10.1513/AnnalsATS.201705-371 AW
2. Clini E., Crisafulli E., Radaeli A., Malerba M. COPD and the metabolic syndrome: an intriguing association // Intern Emerg Med. 2013. 8:283-289. doi: 10.1007/s11739-011-0700-x
3. Ehrlich SF, Quesenberry JrCP, Van Den Eeden SK, Shan J, Ferrara A. Patients diagnosed with diabetes are at increased risk for asthma, COPD, pulmonary fibrosis, and pneumonia but not lung cancer. // Diabetes Care. 2010; 33(1):55-60.
4. Dixon AE, Suratt ВТ. Chair's Summary: Obesity and Associated Changes in Metabolism, Implications for Lung Diseases. // Ann Am Thorac Soc. 2017 Nov; 14(Supplement_5):S314-S315. doi: 10.1513/AnnalsATS.201702-116AW.
5. ГОСТ 18487-80 «Блюда консервированные обеденные для спецпотребителя. Технические условия»; ГОСТ 50847-96 «Концентраты пищевые первых и вторых обеденных блюд быстрого приготовления. Технические условия»; ГОСТ 7457 «Консервы рыбные. Паштеты. Технические условия».
6. Sasaki Y., Suzuki W., Shimada Т. at all. Dose dependent development of diabetes mellitus and non-alcoholic steatohepatitis in monosodium glutamate-induced obese mice // Life Sciences. 2009. 85 490-498.
7. Salisu N, Aliyu FS, Garba H, Garba MH. Anaemogenic, Obesogenic And Thermogenic Potentials Of Graded Doses Of Monosodium Glutamate Sub-Acutely Fed To Experimental Wistar Rats. // Curr Clin Pharmacol. 2018. Oct 2. doi: 10.2174/1574884713666181002120657.
8. Kratzer A., Wei Chu H., Salys J., Moumen Z., Leberl M., at all. Endothelial cell adhesion molecule CD146: implications for its role in the pathogenesis of COPD // Journal of Pathology J Pathol. 2013; 230: 388-398 DOI: 10.1002/path.4197
9. He Z.H., Chen P., Chen Y., He S.D., Ye J.R., Zhang H.L., Cao J. Comparison between cigarette smoke-induced emphysema and cigarette smoke extract-induced emphysema. // Tob Induc Dis. 2015. Mar 25; 13(1):6. doi: 10.1186/s12971-015-0033-z.
10. Delzell JE Jr. Common lung conditions: chronic obstructive pulmonary disease. // P Essent. 2013 Jun; 409:23-31.
11. Clini E., Crisafulli E., Radaeli A., Malerba M. COPD and the metabolic syndrome: an intriguing association // Intern Emerg Med (2013) 8:283-289. doi: 10.1007/s11739-011-0700-x.
12. Cameron D.P., Poon T. K.-Y., Smith G.C. Effects of Monosodium Glutamate Administration in the Neonatal Period on the Diabetic Syndrome in KK Mice // Diabetologia. 1976. 12, 621-626.
13. Wu, K.-C. Huang SS, Kuo YH, Ho YL, Yang CS, Chang YS, Huang GJ. Ugonin M, a Helminthostachys zeylanica constituent, prevents LPS-induced acute lung injury through TLR4-mediated MAPK and NF-kB signaling pathways // Molecules. 2017. Vol. 22 (573). P. 1-15.
14. Chen Y., Hanaoka M., Chen P. Protective effect of beraprost sodium, a stable prostacyclin analog, in the development of cigarette smoke extract-induced // American Journal of Physiology-Lung Cellular and Molecular Physiology. 2009. V. 296(4). P. 648-656.
15. Hanaoka M., Hanaoka P., Chen Y. Carbocisteine protects against emphysema induced by cigarette smoke extract in rats // Chest. 2011. V. 139(5). P. 1101-1108.
16.  G, Looney MR. Non-invasive Intratracheal Instillation in Mice. // Bio Protoc. 2015;5(12). pii: e1504. PMID: 27390765
G, Looney MR. Non-invasive Intratracheal Instillation in Mice. // Bio Protoc. 2015;5(12). pii: e1504. PMID: 27390765
17. Pacini G.,  M.,
M.,  B. Reappraisal of the intravenous glucose tolerance index for a simple assessment of insulin sensitivity in mice. // Am J Physiol Regul Integr Comp Physiol. 2009 May; 296(5):R1316-24. doi: 10.1152/ajpregu.90575.2008.
B. Reappraisal of the intravenous glucose tolerance index for a simple assessment of insulin sensitivity in mice. // Am J Physiol Regul Integr Comp Physiol. 2009 May; 296(5):R1316-24. doi: 10.1152/ajpregu.90575.2008.
18. Клатт Э.К. Атлас патологии Роббинса и Котрана. Пер. с англ. под ред. О.Д. Мишнёва, А.И. Щёголева. М.: Логосфера, 2010. 544 с.: ил.
19. Черняев А.Л., Самсонова М.В. Патологическая анатомия легких: атлас. М.: Издательство «Атмосфера», 2004. 112 с.
20. Parameswaran Н., Majumdar A., Ito S., Alencar A.M., Suki В. Quantitative characterization of airspace enlargement in emphysema // The journal of applied physiology. 2006. V. 100. P. 186-193.
21. Munoz-Barrutia A., Ceresa M., Artaechevarria X., Montuenga L.M., Ortiz-de-Solorzano C. Quantification of lung damage in an elastase-induced mouse model of emphysema // International Journal of Biomedical Imaging. 2012. V. 2012. P. 1-11.
22. Sato S.,  E., Parameswaran H., Hamakawa1 H., Suki B. Scale dependence of stracture-function relationship in the emphysematous mouse lung // Frontiers in Physiology. 2015. V. 6(146). P. 1-10.
E., Parameswaran H., Hamakawa1 H., Suki B. Scale dependence of stracture-function relationship in the emphysematous mouse lung // Frontiers in Physiology. 2015. V. 6(146). P. 1-10.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство для стимуляции регенерации эндотелия легких при сочетании метаболического синдрома и хронической обструктивной болезни легких | 2019 |
|
RU2712761C1 |
| Способ стимуляции регенерации эндотелия легких при сочетании метаболического синдрома и хронической обструктивной болезни легких у женщин | 2020 |
|
RU2759231C1 |
| Лекарственное средство, стимулирующее регенерацию эндотелия легких при хронической обструктивной болезни легких | 2020 |
|
RU2740378C1 |
| БИСАМИДНОЕ ПРОИЗВОДНОЕ ДИКАРБОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ СРЕДСТВА, СТИМУЛИРУЮЩЕГО РЕГЕНЕРАЦИЮ ТКАНЕЙ И ВОССТАНОВЛЕНИЕ СНИЖЕННЫХ ФУНКЦИЙ ТКАНЕЙ | 2016 |
|
RU2727142C2 |
| Способ лечения болезней легких ингаляционным введением мезенхимальных стромальных клеток и гексапептида | 2022 |
|
RU2770364C1 |
| НОВЫЙ ИНГИБИТОР ГЛУТАМИНИЛЦИКЛАЗ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЛЕГКИХ И ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2017 |
|
RU2662559C1 |
| Пептидное соединение, восстанавливающее функцию органов дыхания и обладающее иммуномодулирующим действием | 2017 |
|
RU2667466C1 |
| НОВОЕ СОЕДИНЕНИЕ, ВЫДЕЛЕННОЕ ИЗ PSEUDOLYSIMACHION ROTUNDUM VAR. SUBINTEGRUM, С ВЫСОКИМ СОДЕРЖАНИЕМ АКТИВНОГО ИНГРЕДИЕНТА, КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННОЕ СОЕДИНЕНИЕ, ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКОГО ЗАБОЛЕВАНИЯ, ВОСПАЛИТЕЛЬНОГО ЗАБОЛЕВАНИЯ, АСТМЫ ИЛИ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2685732C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ОБСТРУКТИВНОГО ЗАБОЛЕВАНИЯ ЛЕГКИХ | 2008 |
|
RU2451507C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЛЕГКИХ, СОДЕРЖАЩАЯ ГИАЛУРОНАН/ПРОТЕОГЛИКАН-СВЯЗЫВАЮЩИЙ БЕЛОК 1 | 2021 |
|
RU2810732C1 |


Изобретение относится к экспериментальной медицине, а именно к способу моделирования сочетанной патологии метаболического синдрома и хронической обструктивной болезни легких. Способ моделирования сочетанной патологии метаболического синдрома и хронической обструктивной болезни легких, где мышам-самкам линии C57BL/6 через сутки после рождения подкожно вводят глутамат натрия курсом в течение 10 суток в дозе 2,2 мг/кг, а затем на 126 сутки после рождения, на фоне развившегося у животных метаболического синдрома, определяемого по индексу Ли, гипергликемии и дислипидемии, индуцируют хроническую обструктивную болезнь легких интратрахеальным введением липолисахарида в дозе 3 мкг на мышь на 126 и 129 сутки после рождения и курсовым интратрахеальным введением экстракта сигаретного дыма в дозе 50 мкл на мышь на 127, 130, 133, 136, 139, 142, 149, 156, 163, 170 сутки после рождения, далее проводят гистологическое исследование для определения воспаления, эмфиземы легких, разрушения микроциркуляторного русла и альвеолярного эпителия, где в просвете отдельных альвеол обнаруживаются скопления макрофагов, имеет место перибронхиальных отек, отмечается умеренное растяжение бронхиол, альвеолярных ходов и альвеол. Предложенный способ является эффективным для поиска лекарственных средств, влияющих на метаболический синдром и хроническую обструктивную болезнь легких. 2 ил., 8 табл., 1 пр.
Способ моделирования сочетанной патологии метаболического синдрома и хронической обструктивной болезни легких, характеризующийся тем, что мышам-самкам линии C57BL/6 через сутки после рождения подкожно вводят глутамат натрия курсом в течение 10 суток в дозе 2,2 мг/кг, а затем на 126 сутки после рождения, на фоне развившегося у животных метаболического синдрома, определяемого по индексу Ли, гипергликемии и дислипидемии, индуцируют хроническую обструктивную болезнь легких интратрахеальным введением липолисахарида в дозе 3 мкг на мышь на 126 и 129 сутки после рождения и курсовым интратрахеальным введением экстракта сигаретного дыма в дозе 50 мкл на мышь на 127, 130, 133, 136, 139, 142, 149, 156, 163, 170 сутки после рождения, далее проводят гистологическое исследование для определения воспаления, эмфиземы легких, разрушения микроциркуляторного русла и альвеолярного эпителия, где в просвете отдельных альвеол обнаруживаются скопления макрофагов, имеет место перибронхиальных отек, отмечается умеренное растяжение бронхиол, альвеолярных ходов и альвеол.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ | 2008 |
|
RU2360296C1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| US 8883144 B2, 11.11.2014 | |||
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЧАСТОТЫ ОБОСТРЕНИЯ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ | 2011 |
|
RU2484770C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНЫХ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ЛЕГКИХ | 2008 |
|
RU2375758C1 |
| RU 2005134470 A, 27.05.2007. | |||
Авторы
Даты
2020-02-19—Публикация
2019-03-21—Подача