Изобретение относится к области медицины, в частности к экспериментальной хирургии, и может быть использовано в научных исследованиях для моделирования отграниченного гнойно-воспалительного процесса в брюшной полости у лабораторных животных и поиска новых способов лечения местного отграниченного перитонита (МОП).
Известны различные способы моделирования перитонита. В настоящее время, все существующие модели по воспроизведению экспериментального перитонита можно подразделить на три основные группы.
К первой группе можно отнести модели местного перитонита, для воспроизведения которых в брюшную полость животным вводили инородные тела: куски дерева, пробки, марли. Вероятность развития местного перитонита при данной методике маловероятна, так как инородные тела инкапсулировались, ограничивались от брюшной полости [Сельцовский П.Л., / Разлитые гнойные перитониты. - 1963. - 212 с.], либо развивался спаечные процесс и кишечная непроходимость с последующей гибелью животного (Агаларов П.М Стрижова К.А. / Моделирование отграниченного перитонита//Bulletin of Medical Internet Conferences (ISSN 2224-6150). - 2017. - Volume 7. - C. 1388).
Недостатками данных способов является невозможность моделирования отграниченной полости при введении в брюшную полость инородных тел.
Во второй группе экспериментов моделирование МОП проводят путем перфорации какого-либо отдела желудочно-кишечного тракта по С.А. Шалимову (Шалимов С.А., Радзиховский А.П., Кейсевйч Л.В. Руководство по экспериментальной хирургии - М.: Медицина, 1989. 272 с.), путем рассечения стенки кишки разрезом в 1-2 см. Острый распространенный перитонит развивается через 24-36 часов после операции, а на третий день животные погибают. Аналогично у 80,4% подопытных животных развитие острого перитонита возникало через 8 часов после внутри брюшного введения 1 мл диметилсульфоксида (Р.Д. Магалашвили, Шалимов С.А., Радзиховский А.П., Кейсевич Л.В. Руководство по экспериментальной хирургии - М.: Медицина, 1989. - 272 с.
Недостатком данных способов моделирования является то, что во всех группах животных развивался острый распространенный перитонит с последующей скорой гибелью животных. МОП моделировать не удалось.
К третьей группе моделей экспериментального МОП относятся комбинированные способы, при которых кроме введения в брюшную полость патогенного объекта, создают те или иные деструктивные процессы или фоновые заболевания организма с целью его «сенсибилизации». Так, известно введение калово-скипидарной смеси на высоте асептического воспаления брюшины с последующим введением смеси монокультур или каловой взвеси [Шалимов С.А., Радзиховский А.П., Кейсевич Л.В. Руководство по экспериментальной хирургии - М.: Медицина, 1989. 272 с. Известна также модель Глухова А.А. [Пат. 2151427 РФ МПК G09B 23/28, A61M 25/01, при которой развитие перитонита заключалось во введении через катетер, установленный в брюшную полость лабораторным животным, аутокрови и микробной взвеси стафилококка, кишечной палочки, сине-зеленого гноя и стрептококка в равных соотношениях.
Недостатками моделей третьей группы является развитие распространенного, а не отграниченного перитонита брюшной полости. Как следует из вышеизложенного, существующие модели экспериментального перитонита, не способны вызвать локальное воспаление брюшины, что обусловлено вариабельностью показателей патогенности и вирулентности микрофлоры, а также не совершенством механизма, клинически и морфологически схожего с местным перитонитом у человека.
Известен способ моделирования перитонита, предложенный Ю.Ю. Блинковым и соавт. (Патент RU 2338265, G09B 23/28, 10.11.2008. - Способ моделирования острого перитонита), который заключается в инъекционном введении в брюшную полость предварительно наркотизированных крыс каловой взвеси, приготовленной из содержимого слепой кишки.
Недостатком данного способа является то, что используется инъекционный способ введения, при котором каловую взвесь вводят в брюшную полость через одну точку вкола путем перемещения иглы в правое и левое подреберья и в правую и левую подвздошные области. При таком способе возрастает риск травмирования органов брюшной полости. Это в значительной степени влияет на то, что создается острый распространенный перитонит, что приводит к преждевременной гибели животных.
Наиболее близким является способ моделирования отграниченного перитонита у лабораторных нелинейных мышей (Акулова А.П. Способ моделирования отграниченного перитонита у лабораторных нелинейных мышей Пат. 2567602. - 10.11.2015). Для этого нелинейным лабораторным мышам массой 20-22 г производят однократное внутрибрюшинное введение 10% каловой взвеси из свежих крысиных фекалий через одну точку вкола по средней линии в пупочной области живота на глубину 2 мм. Взвесь готовят на изотоническом растворе хлорида натрия и однократно фильтруют через двойной слой марли. Для использования модели более 13 дней взвесь вводят в дозе 0,3-0,4 мл, а для использования модели не более 13 дней - в дозе 0,5 мл.
Главным недостатком предложенного способа является образование к шестым суткам эксперимента множества отграниченных абсцессов в нескольких анатомических областях брюшной полости и вовлечение в воспалительный процесс всех отделов брюшной полости с развитием распространенного перитонита, не МОП,
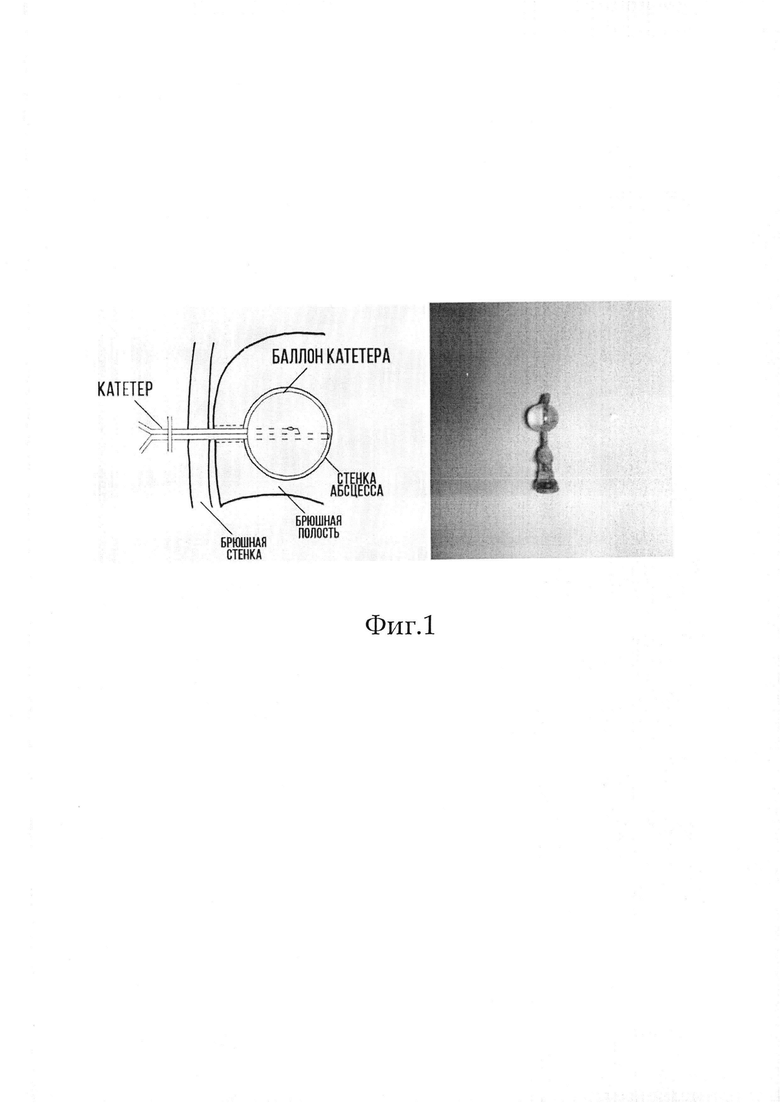
Нами впервые предложен способ формирования МОП в эксперименте, отличающегося наличием сформированной отграниченной полости, окруженной фиброзной капсулой. Настоящее исследование выполнено на базе кафедры оперативной хирургии и топографической анатомии СГМУ им. В.И. Разумовского. В эксперименте на 20 белых лабораторных крысах массой 190±20 г под комбинированным обезболиваем (рометар, золетил) минилапаротомным доступом в правой подвздошной области использовали разработанную на кафедре методику формирования отграниченной гнойной полости. В брюшную полость, после депиляции и антисептической обработки участка кожи размером 3×3 см., транскутанно, под контролем УЗИ, в полость живота вводили троакар диаметром 3 мм. Далее через троакар проводили модифицированный (укороченный до 3 см) катетер Фолея и после заполнения баллона в дистальной части катетера 2,0 мл физиологического раствора (NaCl 0,9%), производили перевязку катетера проксимальнее баллона и фиксацию дистальной части его при помощи кожной дупликатуры, проводили контрастное и УЗ-исследование, при которых установлено, что в подвздошной области определяется сформированная округлая полость диаметром 2 см3 с четкими стенками и подпаянными к ним петлями кишечника, Катетер опорожняли и удаляли. Смотреть Фиг 1.
Моделирование МОП заключалось в инфицировании созданной отграниченной полости. Для этого одному из животных выполняли лапаротомию, вскрывали просвет слепой кишки и из ее содержимого готовили 15% взвесь фекалий в изотоническом растворе хлорида натрия. Далее смесь дважды фильтровали через двойной слой марли и вводили животным второй группы в созданную кистозную полость через пункционную иглу под контролем УЗИ из расчета 1 миллилитр на 100 граммов массы животных.
Картину развития отграниченного гнойника и местного перитонита после выведения животных из эксперимента, подтверждали клиническими, инструментальными, микробиологическими и морфологическими исследованиями через 6 суток после инфицирования полости и развития классических клинических признаков МОП: животные принимали лежащее положение, плохо реагировали на болевой и звуковой раздражители, отказывались пить и принимать пищу, отмечались выраженная болезненность при пальпации, отечность кожи и местная гипертермия. Первые признаки гнойной интоксикации и органной недостаточности отмечены также уже к шестым суткам эксперимента.
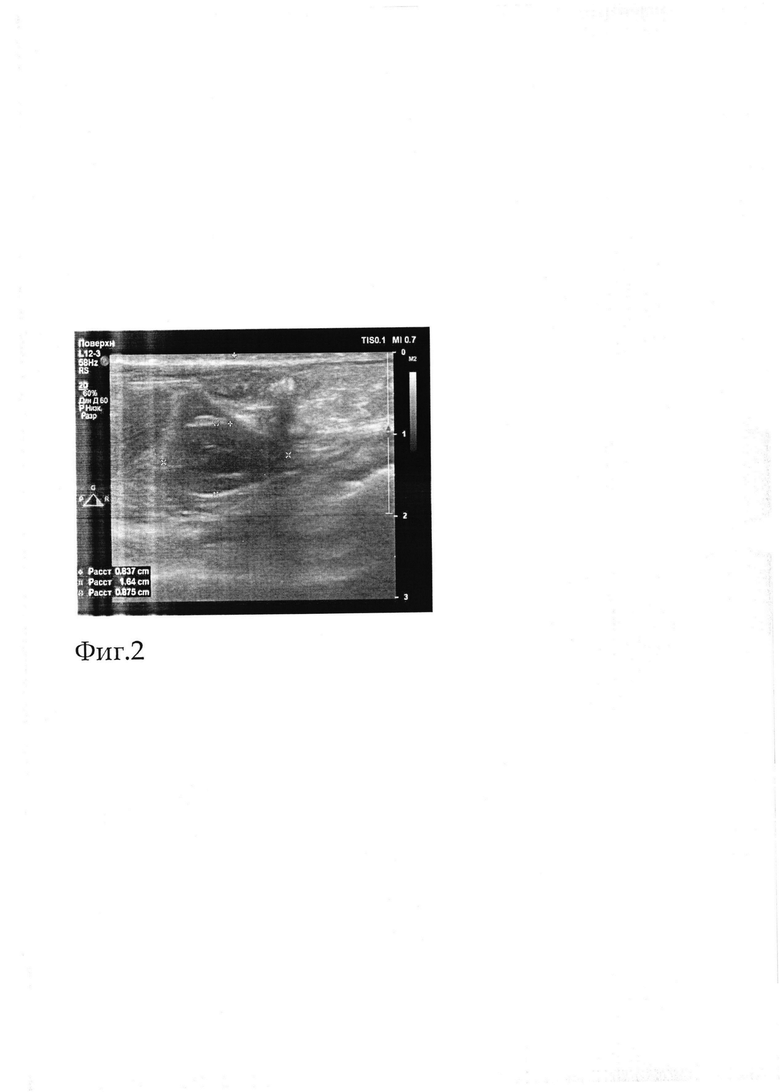
Для комплексной планиметрической оценки полости отграниченного перитонита выполняли исследования с использованием формулы объема шара и использовали ультразвуковой аппарат производства экспертного класса Philips EpiQ7 (США) с конвексными датчиками, работающими с частотой 3,5 МГц. В ходе проведенного УЗИ определяли следующие параметры: диаметр сформированной полости и толщину фиброзной капсулы. Полученные экспериментально планиметрические показатели с применением шприца и результаты ультразвукового исследования показали, что внутренний диаметр полости сформированной полости после опорожнения баллона составлял 2,06±0,7 мл, что соответствует 2,0±0,25 см. При УЗ-исследовании сформированного МОП установлено, что на глубине 9-10 мм от поверхности кожи (граница верхнего края образования) в правой подвздошной области лоцируется образование с четкими гиперэхогенными контурами 16-17 мм на в диаметре овальной формы. Образование умеренно-выражено васкуляризируется с преобладанием артериального кровотока. Линейная скорость кровотока (ЛСК) артерий центрального звена - 5-6 см/сек. Венозная ЛСК - не более 4,3 см/сек. Питающий сосуд отчетливо не лоцируется. Смотреть Фиг 2.
При микробиологических исследованиях МОП оценивали количество микробных клеток в полученном отделяемом смоделированной полости, для чего содержимое полости эвакуировали и 0,1 мл его использовали для приготовления трех последовательных десятикратных разведений в стерильном физиологическом растворе хлорида натрия. Из последнего разведения 0,1 мл засевали на чашки Петри с МПА и через сутки инкубации в термостате при температуре 37°С подсчитывали количество выросших колоний. Исходя из полученных значений, рассчитывали количество колоний образующих единиц (КОЕ) в 1 мл содержимого полости. Анализ микробиологических данных показал, что через 6 суток после инфицирования полости у животных высевается моноштамм Staphylococcus aureus и кишной палочки со средним количеством бактериальных клеток 5,2±0,6*109 КОЕ/мл.
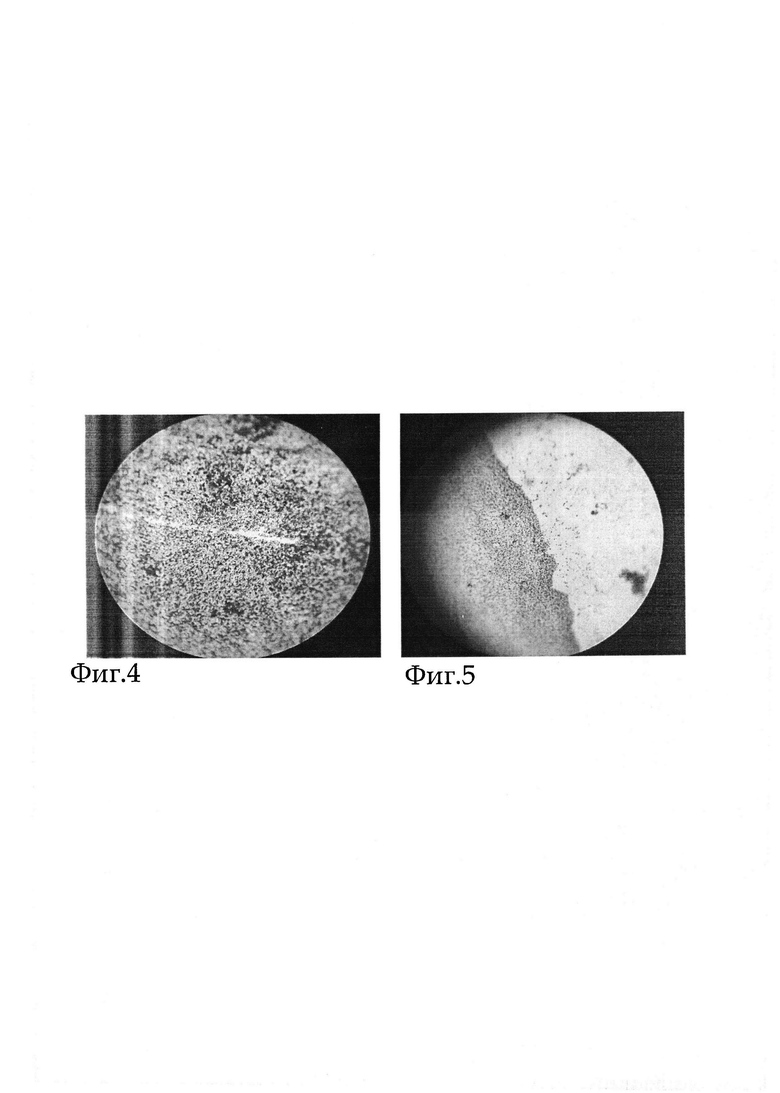
Морфологическое исследование проводили после выведения животных из эксперимента на шестые сутки исследования. У животных иссекали стенки и перифокальные ткани в области МОП. Полученные биоптаты ткани фиксировали в растворе 10% нейтрального формалина. Готовили парафиновые блоки по общепринятой методике после обезвоживания в серии спиртов возрастающей концентрации. Срезы препаратов толщиной 3-5 мкм депарафинизировали, окрашивали гематоксилином и эозином. Морфологический анализ препаратов тканей при МОП показал, что у животных сформирована плотная стенка отграниченной полости толщиной до 540 мкм. Перифокально, на границе стенки, выявлялась клеточная инфильтрация, представленная макрофагами, клетками инородных тел. К зоне клеточной инфильтрации прилежала грануляционная ткань, переходящая в рыхлую соединительную ткань. Смотреть Фиг 3, Фиг 4, Фиг 5.
Пример. В эксперименте на белой лабораторной крысе массой 198 г под комбинированным обезболиваем (рометар, золетил) после депиляции и антисептической обработки участка кожи размером 3×3 см в правой подвздошной области, транскутанно, под контролем УЗИ, в полость живота введен троакар диаметром 3 мм. Далее через троакар проведен катетер Фолея и после заполнения баллона в дистальной части катетера 2,0 мл физиологического раствора (NaCl 0,9%), произведена перевязка катетера проксимальнее баллона и фиксация дистальной части его при помощи кожной дупликатуры. Через 6 суток после проведения манипуляции, катетер опорожнен, проведено контрастное и УЗ-исследование, после чего катетер удален. Инструментальные исследования показали, что в подвздошной области определяется сформированная полость округлой формы диаметром 2 см с четкими стенками и подпаянными к ним петлями кишечника. К 6-м суткам эксперимента, после инфицирования полости 15%-ной взвесью фекалий в изотоническом растворе хлорида натрия, получена модель МОП. Смотреть Фиг 1.
При оценке планиметрических данных и результатов ультразвукового исследования выявлено, что внутренний диметр полости сформированной полости после опорожнения баллона составлял 2,0±0,6 мл. По данным УЗИ на глубине 10 мм от поверхности кожи в правой подвздошной области определяется образование с четкими гиперэхогенными контурами 17 мм × 10 мм × 8 мм овальной формы. Анализ микробиологических данных показал, из полости высевается моноштамм Staphylococcus aureus и кишечной палочки 5,0±0,1*109 КОЕ/мл, а при морфологическом исследовании к 6-м суткам у животного в созданной отграниченной полости отмечалось незначительное количество мутного экссудата и сформированная стенка тол щиной 510 мкм. Смотреть Фиг 2.
Таким образом, к 6-м суткам после введения в сформированную отграниченную полость в правой подвздошной области животных 15%-ной взвеси фекалий в изотоническом растворе хлорида натрия во всех проведенных экспериментах формировался МОП со всеми характерными его клиническими признаками, что подтверждено планиметрическими, инструментальными, микробиологическими и морфологическими исследованиями. Как видно из описания и приведенного примера, предложенный способ является экономически и технически выгодным, минимально травматичным, обеспечивающим гарантированное формирование абсцесса в кратчайший срок, позволяет моделировать именно местный отграниченный перитонит, что не приводит к ранней гибели крыс и позволяет разрабатывать новые способы эффективного лечения МОП.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ комбинированного лечения местного отграниченного перитонита в эксперименте | 2023 |
|
RU2822708C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОГО ВОЗДЕЙСТВИЯ ПРИ ЛЕЧЕНИИ МЕСТНОГО ОТГРАНИЧЕННОГО ПЕРИТОНИТА В ЭКСПЕРИМЕНТЕ | 2023 |
|
RU2834555C1 |
| Способ моделирования отграниченного острого гнойного мастита в эксперименте | 2021 |
|
RU2772397C1 |
| Способ моделирования распространенного гнойного перитонита у кроликов | 2018 |
|
RU2688707C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОТГРАНИЧЕННОГО ПЕРИТОНИТА У ЛАБОРАТОРНЫХ НЕЛИНЕЙНЫХ МЫШЕЙ | 2014 |
|
RU2567602C1 |
| СПОСОБ СОЗДАНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ ВОСПАЛЕННОЙ ТОЛСТОЙ КИШКИ В УСЛОВИЯХ ПЕРИТОНИТА | 2020 |
|
RU2740942C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТРОГО ПЕРИТОНИТА | 2007 |
|
RU2338265C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ АБСЦЕССА МЯГКИХ ТКАНЕЙ | 2015 |
|
RU2601378C1 |
| Способ моделирования перитонита | 1987 |
|
SU1545243A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПЕРИТОНИТА У КРЫС | 2008 |
|
RU2376648C1 |

Изобретение относится к области медицины, а именно к экспериментальной хирургии, и может быть использовано в научных исследованиях для моделирования отграниченного гнойно-воспалительного процесса в брюшной полости у крыс. Способ включает введение в брюшную полость животного 15%-ной взвеси фекалий в изотоническом растворе хлорида натрия из расчета 1 миллилитр на 100 граммов массы животного. Предварительно под контролем УЗИ в правую подвздошную область живота крысы через троакар проводят модифицированный катетер Фолея. После заполнения его баллона производят перевязку и фиксацию дистальной части катетера при помощи кожной дупликатуры. В образовавшуюся полость вводят возбудитель инфекционного процесса. Способ обеспечивает минимальную травматичность, гарантированное формирование местного отграниченного перитонита (МОП) в кратчайший срок, не приводит к ранней гибели животных, что позволяет разрабатывать новые способы эффективного лечения МОП за счет введения в брюшную полость взвеси фекалий в изотоническом растворе хлорида натрия. 5 ил.
Способ моделирования местного отграниченного перитонита у крыс, включающий введение в брюшную полость животного 15%-ной взвеси фекалий в изотоническом растворе хлорида натрия из расчета 1 миллилитр на 100 граммов массы животного, отличающийся тем, что предварительно под контролем УЗИ в правую подвздошную область живота животного через троакар проводят модифицированный катетер Фолея и после заполнения его баллона производят перевязку и фиксацию дистальной части катетера при помощи кожной дупликатуры, затем в образовавшуюся полость вводят возбудитель инфекционного процесса.
| СПОСОБ МОДЕЛИРОВАНИЯ ОТГРАНИЧЕННОГО ПЕРИТОНИТА У ЛАБОРАТОРНЫХ НЕЛИНЕЙНЫХ МЫШЕЙ | 2014 |
|
RU2567602C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТРОГО ПЕРИТОНИТА | 1998 |
|
RU2151427C1 |
| УСТРОЙСТВО ПИРСОВ, МОСТОВ И Т. П. СООРУЖЕНИЙ | 1944 |
|
SU64941A1 |
| JP 2008278830 A, 20.11.2008 | |||
| Шалимов С | |||
| А | |||
| и др., Руководство по экспериментальной хирургии | |||
| М., 1989, 272 с. | |||
Авторы
Даты
2020-02-21—Публикация
2018-07-11—Подача