Область техники, к которой относится изобретение
Настоящее изобретение относится к способу детекции и измерения присутствия мононуклеосом и олигоуклеосом, а также нуклеосом, которые содержат определенные гистоновые варианты, и к применению таких измерений для детекции и диагностики заболевания. Настоящее изобретение также относится к способу идентификации биомаркеров гистоновых вариантов для детекции и диагностики заболевания и к биомаркерам, идентифицируемым указанным выше способом.
Уровень техники
Организм человека включает несколько сотен клеточных типов. Все эти клеточные типы содержат одинаковый геном, но имеют весьма разнообразные фенотипы и выполняют различные функции в организме. Их фенотипическое разнообразие обусловлено дифференциальной экспрессией генома в различных клеточных типах. Регулирование дифференциальной экспрессии генов не является полностью понятным, но основные механизмы включают регулирование генов рядом взаимосвязанных эпигенетических сигналов, связанных с генами, включая регулирование укладки хроматина в форме эухроматина или гетерохроматина, регулирование расположения нуклеосом и доступных для нуклеазы центров, метилирование ДНК и видоизменение структуры нуклеосом, вокруг которых обертывается ДНК.
Нуклеосома представляет собой основную единицу структуры хроматина и состоит из белкового комплекса восьми высококонсервативных центральных гистонов (включая пару каждого из гистонов H2A, H2B, H3 и H4). Вокруг этого комплекса обертываются приблизительно 146 пар оснований ДНК. Другой гистон, H1 или H5, выступает в качестве линкера и принимает участие в уплотнении хроматина. Часто говорят, что ДНК, которая обертывается вокруг последовательных нуклеосом в структуре, напоминает «бусины на нити», и таким образом образует основную структуру открытого хроматина или эухроматина. В уплотненном хроматине или гетерохроматине эта нить свертывается в закрытую и сложную структуру (Herranz и Esteller, 2007).
Структуру нуклеосом может изменять посттранскрипционная модификация (ПТМ) гистоновых белков и включение вариантов гистоновых белков. ПТМ гистоновых белков, как правило, происходит на концах центральных гистонов, причем обычные модификации включают ацетилирование, метилирование или убиквитинирование лизиновых остатков, а также метилирование аргининовых остатков, фосфорилирование сериновых остатков и многие другие реакции. Как известно, гистоновые модификации принимают участие в эпигенетическом регулировании экспрессии генов (Herranz и Esteller, 2007). Структуру нуклеосомы может также изменять включение альтернативных гистоновых изоформ или вариантов, которые представляют собой различные гены или продукты сплайсинга и имеют различные аминокислотные последовательности. Гистоновые варианты можно классифицировать по ряду семейств, которые подразделяются на индивидуальные типы. Нуклеотидные последовательности большого числа гистоновых вариантов являются известными и общедоступными; их представляют, например, гистоновая база данных Национального института исследования генома человека (NHGRI) (см. L. Marino-Ramirez, K.M. Levine, M. Morales, S. Zhang, R.T. Moreland, A.D. Baxevanis и D. Landsman, «Гистоновая база данных: интегрированный ресурс по гистонам и содержащим складки гистоновым белкам», база данных, т. 2011. (Депонированный) и http://genome.nhgri.nih.gov/histione/complete.shtml), база данных генетических последовательностей GenBank® Национального института здравоохранения (NIH), база данных нуклеотидных последовательностей Европейской лаборатории молекулярной биологии (EMBL) и банк данных ДНК Японии (DDBJ).
Нормальный клеточный оборот у взрослого человека включает образование приблизительно 1011 клеток в сутки посредством клеточного деления и смерть приблизительно такого же числа клеток, главным образом, посредством апоптоза. В течение процесса апоптоза хроматин разрушается, образуя мононуклеосомы и олигонуклеосомы, которые высвобождаются из клеток. При нормальных условиях, согласно сообщениям, у здоровых субъектов обнаруживается низкий уровень циркулирующих нуклеосом. Повышенные уровни обнаруживаются у субъектов, имеющих разнообразные состояния, включающие многочисленные типы рака, аутоиммунные заболевания, воспалительные состояния, инсульт и инфаркт миокарда (Holdenreider и Stieber, 2009).
Мононуклеосомы и олигонуклеосомы можно детектировать, используя иммуноферментный твердофазный анализ (ELISA), и в сообщениях описан ряд методов (Salgame et al., 1997; Holdenrieder et al., 2001; van Nieuwenhuijze et al., 2003). В этих анализах, как правило, используют антигистоновое антитело (например, анти-H2B, анти-H3 или анти-H1, H2A, H2B, H3 и H4) в качестве иммобилизованного антитела и комплексное антитело анти-ДНК или анти-H2A-H2B-ДНК в качестве идентифицирующего антитела. Используя эти анализы, исследователи в данной области сообщают, что уровень нуклеосом в сыворотке выше (на целый порядок), чем в образцах плазмы, взятых у тех же самых пациентов. Это также действительно для измерений ДНК в сыворотке и плазме, осуществленных методом ПЦР (Holdenrieder et al., 2005). Причина этого остается неизвестной, но авторы данной работы предполагают, что она может быть обусловлена дополнительным выделением ДНК в течение процесса свертывание. Однако авторы настоящего изобретения обнаружили, что результаты нуклеосомных анализов методом ELISA предшествующего уровня техники не согласуются друг с другом. Кроме того, хотя, согласно сообщениям, основная масса циркулирующей ДНК в сыворотке или плазме существует в форме мононуклеосом и олигоуклеосом (Holdenrieder et al., 2001), измеряемые уровни нуклеосом и ДНК в сыворотке или плазме не согласуются удовлетворительным образом. Коэффициент корреляции r между результатами ELISA в отношении уровней циркулирующих внеклеточных нуклеосом и уровней циркулирующей ДНК, который измеряются в реальном времени с помощью полимеразной цепной реакции (ПЦР), согласно сообщениям, составляет 0,531 в сыворотке и 0,350 в плазме (Holdenrieder et al., 2005).
В настоящее время методы нуклеосомного ELISA используют в клеточной культуре, главным образом, в качестве метода детекции апоптоза (Salgame et al., 1997; Holdenrieder et al., 2001; van Nieuwenhuijze et al., 2003), и их также используют для измерения циркулирующих внеклеточных нуклеосом в сыворотке и плазме (Holdenrieder et al., 2001). Уровни внеклеточных нуклеосом в сыворотке и плазме, которые высвобождаются в систему кровообращения из умирающих клеток, измеряют методами ELISA в исследованиях ряда различных типов рака, для оценки их использования в качестве потенциального биомаркера (Holdenrieder et al., 2001). Согласно сообщениям, средние уровни циркулирующих нуклеосом являются максимально высокими, но не для всех исследуемых типов рака. Наиболее высокие уровни циркулирующих нуклеосом наблюдали у страдающих раком легкого субъектов. В случае рака предстательной железы наблюдали минимальные уровни, которые находились в пределах нормального интервала для здоровых субъектов. Однако пациенты, имеющие злокачественные опухоли, согласно сообщениям, имеют концентрации нуклеосом в сыворотке, которые значительно отличались, и у некоторых пациентов, имеющих прогрессирующее опухолевое заболевание, обнаружены низкие уровни циркулирующих нуклеосом, которые находились в пределах интервала, измеряемого для здоровых субъектов (Holdenrieder et al., 2001). Вследствие этого, а также разнообразных нераковых причин повышенных уровней нуклеосом уровни циркулирующих нуклеосом не используют в клинической практике в качестве биомаркера рака (Holdenrieder и Stieber, 2009). Неожиданно авторы обнаружили, что многие страдающие раком субъекты, у которых уровни циркулирующих нуклеосом являются низкими или не обнаруживаются при измерении данными методами нуклеосомного ELISA предшествующего уровня техники, на самом деле имеют повышенные уровни циркулирующих внеклеточных нуклеосом. Авторы разработали и продемонстрировали для нуклеосом новые методы ELISA, которыми обнаруживаются нуклеосомы, не обнаруживаемые методами ELISA предшествующего уровня техники.
В данной области также известны методы ELISA для детекции гистоновых ПТМ. Методы ELISA для детекции ПТМ в свободных гистоновых белках (не присоединенных к другим гистонам и ДНК в нуклеосомном комплексе) используют для детекции ПТМ в экстрагированных гистонах, получаемых обычно посредством кислотной экстракции из клеточных лизатов. Описан иммунологический анализ для детекции ПТМ в циркулирующих внеклеточных нуклеосомах (Bawden et al., 2005). Недавно было описано применение метода ELISA для детекции гистоновых ПТМ в очищенных нуклеосомах, нанесенных непосредственно на лунки микропланшета (Dai et al., 2011). Согласно данному методу, нуклеосомы, полученные путем гидролиза хроматиновых экстрактов из культивируемых клеток, нанесены непосредственно на лунки микропланшета и реагируют с антителами анти-ПТМ. Как очевидно специалистам в данной области техники, для данного метода требуются относительно чистые нуклеосомные образцы, и он не является подходящим для непосредственного измерения гистоновых ПТМ в сложных биологических средах, таких как кровь или сыворотка.
Описан метод модифицированной иммунопреципитации хроматина (ИПХ) для детекции в плазме гистоновых ПТМ (H3K9Me, гистон H3, монометилированный в лизиновом остатке K9) во внеклеточных нуклеосомах, связанных с определенной последовательностью ДНК. Согласно описанию, уровень метилирования последовательности определенных гистонов не зависит от концентрации циркулирующих нуклеосом (Deligezer et al., 2008).
Помимо эпигенетического сигнала, опосредованного положением нуклеосомы и структурой нуклеосомы (в отношении составляющего гистонового белкового варианта и структур ПТМ), регулирование экспрессии генов в клетках также опосредовано модификациями нуклеотидов ДНК, включая состояние метилирования цитозина ДНК. Как известно в данной области, ДНК можно метилировать в положении 5 цитозиновых нуклеотидов с образованием 5-метилцитозина. Согласно сообщениям, метилирование ДНК в форме 5-метилцитозина происходит в положениях последовательности ДНК, где цитозиновый нуклеотид присутствует после гуанинового нуклеотида. Эти положения обозначаются для краткости термином «CpG». Согласно сообщениям, у позвоночных более чем 70% положений CpG являются метилированными (Pennings et al., 2005). Области генома, которые содержат в высокой пропорции центры CpG, часто называются термином «островки CpG», и приблизительно 60% последовательностей промоторов генов человека связаны с такими островками CpG (Rodriguez-Paredes и Esteller, 2011). В активных генах эти островки CpG, как правило, являются гипометилированными. Метилирование последовательностей промоторов генов связано с инактивацией стабильного гена. Метилирование ДНК также обычно происходит в повторяющихся элементах, включающих повторяющиеся элементы Alu и длинные рассеянные нуклеотидные элементы (Herranz и Esteller, 2007; Allen et al., 2004).
Сообщение об изменении метилирования ДНК в случае рака было опубликовано еще в 1983 году (Feinberg и Vogelstein, 1983). Уровни метилирования ДНК, наблюдаемые в раковых клетках, отличаются от уровней метилирования здоровых клеток. Согласно сообщениям, повторяющиеся элементы, в частности, вокруг перицентромерных областей, являются гипометилированными в случае рака по сравнению со здоровыми клетками, но промоторы специфических генов, согласно сообщениям, являются гиперметилированными в случае рака. Согласно сообщениям, баланс этих двух эффектов приводит к глобальному гипометилированию ДНК в раковых клетках (Rodriguez-Paredes и Esteller, 2007).
Гиперметилирование определенных специфических генов можно использовать в качестве диагностического биомаркера рака. Например, описанный метод детекции гиперметилирования гена септина 9 методом ПЦР-амплификации ДНК, экстрагированной из плазмы, согласно сообщениям, обнаруживал 72% случаев рака ободочной кишки, причем относительное число ложноположительных заключений составляло 10% (Grutzmann et al., 2008). Состояние метилирования ДНК специфических генов или локусов обычно обнаруживается посредством селективного бисульфитного деаминирования цитозина, но не 5-метилцитозина, до урацила, вызывая изменение первичной последовательности ДНК, которое можно детектировать, используя секвенирование или другие методы (Allen et al., 2004).
Глобальное гипометилирование ДНК представляет собой признак раковых клеток (Esteller, 2007; Hervouet et al., 2010). Глобальное метилирование ДНК можно исследовать в клетках с использованием методом иммуногистохимии (ИГХ). Альтернативно, ДНК экстрагируют из клеток для анализа. Описаны многочисленные способы детекции глобального метилирования ДНК, экстрагированной из клеток, такие как рестрикционное картирование и анализ ближайшего окружения, флуоресцентный анализ с использованием хлорацетальдегида, обратное определение путем метилирования всех островков CpG с использованием ДНК-метилтрансферазы в сочетании с меченным тритием S-аденозилметионином для вычисления количества неметилированного CpG и гидролиз ДНК на отдельные нуклеотиды для анализа методом высокоэффективной жидкостной хроматографии, тонкослойной хроматографии или жидкостной хроматографии в последующей масс-спектрометрией. Недостатки этих методов заключаются в том, что они являются трудоемкими, и/или для них требуются большие количества экстрагированной ДНК хорошего качества (Allen et al., 2004). Основанные на ПЦР методы, в которых используют бисульфитное деаминирование, устраняют необходимость больших количеств ДНК, но должны усиливать специфические геномные области, как правило, повторяющиеся последовательности, как показатель суммарного геномного содержания 5-метилцитозина (Allen et al., 2004). Эти методы измерения глобального метилирования ДНК использовались для исследования ДНК, экстрагированной из разнообразных клеток и тканей. Некоторые авторы исследовали ДНК, экстрагированную из лейкоцитов цельной крови, потому что их легче получать минимально инвазивным способом (Moore et al., 2008; Ting Hsiung et al., 2007; Mansour et al., 2010). Жидкостная хроматография в сочетании с масс-спектрометрией рассматривается в качестве золотого стандарта для измерения глобального метилирования ДНК, но она имеет высокую стоимость, и ДНК необходимо гидролизовать до уровня отдельных нуклеотидов перед анализом (Vasser et al., 2009).
Современные методы оценки глобального метилирования ДНК включают жидкостную хроматографию ультравысокого давления в сочетании с масс-спектрометрией гидролизованной ДНК, экстрагированной из ткани (Zhang et al., 2011), и метод специфического к метилированию цифрового секвенирования (MSDS) (Ogoshi et al. 2011). Описан классический конкурентный иммунологический анализ глобального метилирования ДНК (а также аналогичный анализ глобального метилирования 5-гидроксиметилцитозина). Согласно этому методу, экстрагированную из клеток или тканей ДНК помещают в лунку микропланшета, которую покрывает 5-метилированный цитидинконъюгат, добавляют анти-5-метилцитидиновое антитело, и распределение связывания антитела между нанесенным 5-метилцитидинконъюгатом и метилированной ДНК в экстрагированном образце сравнивают с распределением известных стандартных образцов для оценки присутствующего в образце уровня глобального метилирования ДНК (Cell Biolabs, 2011). Согласно еще одному способу, подобно иммунологическому анализу, ДНК, экстрагированную из образцов тканей, плазмы или сыворотки, наносят на лунку микропланшета, и метилированную ДНК детектируют, используя анти-5-метилцитозиновое антитело (Vasser, et al., 2009; Epigentek, 2009). Недостаток этих методов заключается в том, что для них требуется экстракция ДНК, включающая денатурацию и удаление всей нуклеосомной и хроматиновой структуры из ДНК. Эти методы не являются пригодными, например, для непосредственного измерения глобального метилирования ДНК в биологических жидкостях, таких как лизат ткани, кровь, плазма или сыворотка, без стадии экстракции ДНК.
Кроме того, описана модификация путем 5-гидроксиметилирования цитозиновых оснований в ДНК. Роль 5-гидроксиметилирования еще не является вполне понятной, но считается, что она принимает участие в генном регулировании (Stroud et al., 2011).
Существующие в настоящее время методы детекции глобального метилирования ДНК включают экстракцию или очистку ДНК и не являются подходящими в качестве быстрых, высокопроизводительных, дешевых и минимально инвазивных методов диагностики. Аналогичным образом, исследование ДНК в отношении других модифицированных или необычных оснований (например, урацила, инозина, ксантина и гипоксантина) можно осуществлять только посредством анализа по существу чистой или экстрагированной ДНК. Такой анализ невозможно осуществлять непосредственно в сложной биологической среде, такой как лизат ткани, кровь, плазма или сыворотка.
Также известно, что гистоновые варианты (также известные как гистоновые изоформы) представляют собой эпигенетические регуляторы экспрессии генов (Herranz и Esteller, 2007). Гистоновые варианты были исследованы in vivo и in vitro с использованием разнообразных технологий, таких как исследования нокдауна гена, кодирующего определенный вариант (например, использование нокдауна РНК-интерференции), иммунопреципитация хроматина, стабильные изотопные метки аминокислот и количественная масс-спектрометрическая протеомика, иммуногистохимия и вестерн-блоттинг (Whittle et al., 2008; Boulard et al., 2010; Sporn et al., 2009; Kapoor et al., 2010; Zee et al., 2010; Hua et al., 2008).
Описаны иммуногистохимические исследования экспрессии гистоновых вариантов в образцах тканей, удаленных в процессе хирургической операции или биопсии у субъектов, имеющих диагностированный рак легкого, рак молочной железы и меланому. Эти иммуногистохимические исследования показывают, что окрашивание гистоновых вариантов макроH2A (mH2A) и H2AZ в резецированных образцах раковых тканей может иметь прогностическое применение в отношении этих типов рака (Sporn et al., 2009; Hua et al., 2008; Kapoor et al., 2010). Один недостаток клинического применения иммуногистохимических методов заключается в том, что сбор образцов тканей является инвазивным и представляет собой хирургическую операцию или биопсию. Еще одним из недостатков иммуногистохимических методов является то, что они не являются пригодными для ранней диагностики или для диагностики в массовом обследовании, поскольку обоснованное предположение заболевания обычно должно уже существовать перед тем, как осуществляется биопсия или резекция ткани. Минимально инвазивные анализы крови методом ELISA являются подходящими для широкого круга применений, преодолевают эти недостатки и являются предпочтительными для пациента, а также отличаются повышенной скоростью, меньшей стоимостью и увеличенной пропускной способностью для медицинских учреждений.
Однако внеклеточные нуклеосомы, содержащие определенные нуклеотиды, модифицированные нуклеотиды или гистоновые варианты, не были измерены в крови или другой среде, и не было предложено и не предусмотрено таких измерений. Отсутствуют сообщения об исследованиях присутствия или отсутствия нуклеотидов, модифицированных нуклеотидов или гистоновых вариантов во внеклеточных нуклеосомах крови, а также их значения в качестве содержащихся в крови биомаркеров заболевания. В настоящее время отсутствуют способы детекции или измерения нуклеотидов, модифицированных нуклеотидов или гистоновых вариантов в неизмененных внеклеточных нуклеосомах. Авторы настоящего изобретения сообщают о способах таких исследований и их применении в отношении образцов плазмы и сыворотки, взятых у здоровых и больных субъектов. Неожиданно авторы обнаружили, что высокие уровни неизмененных нуклеосом, содержащих специфические гистоновые варианты, можно определять в образцах плазмы и сыворотки, для которых ни нуклеосомы, ни низкие уровни не детектируются существующими в данной области методами ELISA для определения нуклеосом.
Сущность изобретения
Согласно первому аспекту, настоящее изобретение относится к внеклеточной нуклеосоме, включающей гистоновый вариант или гистоновую изоформу, для применения в качестве биомаркера в диагностике рака, кардиомиопатии, системной красной волчанки, колита, хронического обструктивного заболевания легких, болезни Крона (Crohn) и ревматоидного артрита.
Согласно второму аспекту, настоящее изобретение относится к способу детекции присутствия в образце нуклеосомы, содержащей гистоновый вариант или гистоновую изоформу, включающему следующие стадии:
(i) контакт образца со связующим веществом, которое связывается с гистоновым вариантом или гистоновой изоформой;
(ii) детекцию или количественное определение связывания указанного связующего вещества с гистоновым вариантом или гистоновой изоформой в образце; и
(iii) использование присутствия или степени такого связывания в качестве меры присутствия в образце нуклеосом, содержащих гистоновый вариант или гистоновую изоформу.
Согласно третьему аспекту, настоящее изобретение относится к способу детекции присутствия в образце нуклеосомы, содержащей гистоновый вариант или гистоновую изоформу, включающему следующие стадии:
(i) контакт образца с первым связующим веществом, которое связывается с нуклеосомами;
(ii) контакт нуклеосом или образца со вторым связующим веществом, которое связывается с гистоновым вариантом или гистоновой изоформой;
(iii) детекцию или количественное определение связывания указанного второго связующего вещества с гистоновым вариантом или гистоновой изоформой в образце; и
(iv) использование присутствия или степени такого связывания в качестве меры присутствия в образце нуклеосом, содержащих гистоновый вариант или гистоновую изоформу.
Согласно четвертому аспекту, настоящее изобретение относится к способу детекции присутствия в образце нуклеосомы, содержащей гистоновый вариант или гистоновую изоформу, включающему следующие стадии:
(i) контакт образца с первым связующим веществом, которое связывается с гистоновым вариантом или гистоновой изоформой;
(ii) контакт нуклеосом или образца со вторым связующим веществом, которое связывается с нуклеосомами;
(iii) детекцию или количественное определение связывания указанного второго связующего вещества с нуклеосомами в образце; и
(iv) использование присутствия или степени такого связывания в качестве меры присутствия в образце нуклеосом, содержащих гистоновый вариант или гистоновую изоформу.
Согласно следующему аспекту, настоящее изобретение относится к способу детекции присутствия нуклеосомы, содержащей гистоновый вариант или гистоновую изоформу, в образце крови, сыворотки или плазмы, включающему следующие стадии:
(i) удаление, выделение или экстрагирование гистонового варианта или изоформы из нуклеосомного комплекса для получения свободного компонента гистонового варианта или изоформы;
(ii) детекцию или количественное определение свободного гистонового варианта или изоформы в образце; и
(iii) использование присутствия или количества свободного гистонового варианта или изоформы в качестве меры присутствия в образце нуклеосом, содержащих гистоновый вариант или гистоновую изоформу.
Согласно следующему аспекту, настоящее изобретение относится к способу детекции присутствия в клетке нуклеосомы, содержащей гистоновый вариант или гистоновую изоформу, включающему следующие стадии:
(i) выделение хроматина из клетки;
(ii) гидролитическое, ультразвуковое или другое разрушение хроматина для образования мононуклеосом и/или олигоуклеосом; и
(iii) детекцию или измерение присутствия гистонового варианта или гистоновой изоформы в указанных нуклеосомах согласно способу настоящего изобретения.
Согласно следующему аспекту, настоящее изобретение относится к способу детекции или диагностики состояния заболевания у животного субъекта или человека, включающему следующие стадии:
(i) детекцию или измерение нуклеосом, содержащих гистоновый вариант или гистоновую изоформу, в биологической жидкости субъекта; и
(ii) использование уровня связанного с нуклеосомами гистонового варианта или гистоновой изоформы, измеренного для определения состояния заболевания у субъекта.
Согласно следующему аспекту, настоящее изобретение, относится к способу оценки животного субъекта или человека в отношении пригодности для терапевтического лечения включающему следующие стадии:
(i) детекцию или измерение нуклеосом, содержащих гистоновый вариант или гистоновую изоформу, в биологической жидкости субъекта; и
(ii) использование уровня связанного с нуклеосомами гистонового варианта или гистоновой изоформы, определяемого в качестве параметра при выборе подходящего лечения для субъекта.
Согласно следующему аспекту, настоящее изобретение относится к способу наблюдения лечения животного субъекта или человека, включающему следующие стадии:
(i) детекцию или измерение нуклеосом, содержащих гистоновый вариант или гистоновую изоформу, в биологической жидкости субъекта;
(ii) повторную детекцию или измерение нуклеосом, содержащих гистоновый вариант или гистоновую изоформу в биологической жидкости субъекта в один или несколько моментов времени; и
(iii) использование любых изменений уровня связанного с нуклеосомами гистонового варианта или гистоновой изоформы, определяемого в качестве параметра любых изменений состояния субъекта.
Согласно следующему аспекту, настоящее изобретение относится к способу идентификации биомаркера гистонового варианта или гистоновой изоформы для детекции или диагностики состояния заболевания животного субъекта или человека, включающему следующие стадии:
(i) детекцию или измерение нуклеосом, содержащих гистоновый вариант или гистоновую изоформу, в биологической жидкости субъекта;
(ii) детекцию или измерение нуклеосом, содержащих гистоновый вариант или гистоновую изоформу, в биологической жидкости здорового субъекта или контрольного субъекта; и
(iii) использование разности между уровнями, обнаруженными у больных и контрольных субъектов, для определения возможности применения гистонового варианта или гистоновой изоформы в качестве биомаркера для оценки состояния заболевания.
Согласно следующему аспекту, настоящее изобретение относится к биомаркеру, идентифицируемому указанным выше способом согласно настоящему изобретению.
Согласно следующему аспекту, настоящее изобретение относится к набору для детекции связанного с нуклеосомами гистонового варианта или гистоновой изоформы, который включает специфический лиганд или связующее вещество для гистонового варианта или гистоновой изоформы, или их составляющей части, или имитатор структуры/формы гистонового варианта или гистоновой изоформы, или их составляющей части, вместе с инструкциями для применения набора.
Краткое описание фигур
Фиг.1. Кривая доза-ответ для детекции методом ELISA внеклеточных нуклеосом человека, полученных опубликованным способом (*Holdenrieder et al., 2001), содержащих гистоновый вариант макроH2A1.1 и разведенных телячьей сывороткой.
Фиг.2. Кривая доза-ответ для детекции методом ELISA гистонового варианта макроH2A2 во внеклеточных нуклеосомах перекрестно-сшитого гидролизованного хроматина, экстрагированного из клеток MCF7 и разведенного телячьей сывороткой.
Фиг.3. Кривая доза-ответ для детекции методом ELISA гистонового варианта H2AZ во внеклеточных нуклеосомах перекрестно-сшитого гидролизованного хроматина, экстрагированного из клеток MCF7 и разведенного телячьей сывороткой.
Фиг.4. Уровни нуклеосом, обнаруженные в образцах сыворотки и содержащей EDTA плазмы, взятых у 20 здоровых добровольцев, с использованием нуклеосомных методов ELISA известного уровня техники.
Фиг.5. Уровни связанного с внеклеточными нуклеосомами гистонового варианта mH2A1.1, детектированные в образцах сыворотки и содержащей EDTA плазмы, взятых у 20 здоровых добровольцев, с использованием методов ELISA согласно настоящему изобретению.
Фиг.6. Уровни связанного с внеклеточными нуклеосомами гистонового варианта mH2A2, детектированные в образцах сыворотки и содержащей EDTA плазмы, взятых у 20 здоровых добровольцев, с использованием методов ELISA согласно настоящему изобретению.
Фиг.7. Уровни связанного с внеклеточными нуклеосомами гистонового варианта H2AZ, детектированные в образцах сыворотки и содержащей EDTA плазмы, взятых у 20 здоровых добровольцев, с использованием методов ELISA согласно настоящему изобретению.
Фиг.8. Уровни связанного с внеклеточными нуклеосомами P-H2AX (Ser139), детектированные в образцах сыворотки и содержащей EDTA плазмы, взятых у 20 здоровых добровольцев, с использованием методов ELISA согласно настоящему изобретению.
Фиг.9. Уровни связанной с внеклеточными нуклеосомами 5-метилцитозинметилированной ДНК, детектированные в образцах сыворотки и содержащей EDTA плазмы, взятых у 20 здоровых добровольцев, с использованием методов ELISA согласно настоящему изобретению.
Фиг.10. Уровни связанной с внеклеточными нуклеосомами 5-гидроксиметилцитозинметилированной ДНК, детектированные в образцах сыворотки, взятых у 20 здоровых добровольцев, с использованием методов ELISA согласно настоящему изобретению.
Фиг.11. Уровни связанных с внеклеточными нуклеосомами типов гистонов и нуклеотидов, детектированные в содержащих EDTA образцах плазмы, взятых у трех страдающих раком ободочной кишки субъектов, с использованием методов ELISA согласно настоящему изобретению.
Фиг.12. Уровни связанного с внеклеточными нуклеосомами типов гистонов и нуклеотидов, детектированные в содержащих EDTA образцах плазмы, взятых у 13 страдающих раком легкого субъектов, с использованием методов ELISA согласно настоящему изобретению.
Фиг.13. Уровни связанного с внеклеточными нуклеосомами типов гистонов и нуклеотидов, детектированные в содержащих EDTA образцах плазмы, взятых у двух страдающих раком поджелудочной железы субъектов, с использованием методов ELISA согласно настоящему изобретению.
Фиг.14. Уровни связанного с внеклеточными нуклеосомами типов гистонов и нуклеотидов, детектированные в содержащем EDTA образце плазмы, взятом у одного страдающего раком полости рта субъекта, с использованием методов ELISA согласно настоящему изобретению.
Фиг.15. Уровни связанного с внеклеточными нуклеосомами типов гистонов и нуклеотидов, детектированные в содержащих EDTA образцах плазмы, взятых у четырех страдающих различными раковыми заболеваниями субъектов, нормированные по отношению к уровням связанной с нуклеосомами 5-метилцитозинметилированной ДНК, детектированными с использованием методов ELISA согласно настоящему изобретению. Для сравнения представлены нормированные уровни для образца, содержащего нуклеосомы, взятые у здоровых добровольцев и полученные известным способом (*Holdenrieder et al., 2001).
Фиг.16. Уровни связанного с внеклеточными нуклеосомами гистона H2AZ человека в содержащих EDTA образцах плазмы, взятых у страдающих раком пациентов, измеренные с использованием биотинилированного анти-H2AZ идентифицирующего антитела с двумя различными моноклональными анти-гистоновыми иммобилизованными антителами.
Фиг.17. Уровни связанного с внеклеточными нуклеосомами mH2A1.1, H2AZ, P-H2AX (Ser139) и 5-метилцитозина (5mc), детектированные в образцах содержащей EDTA плазмы, содержащей цитрат плазмы и содержащей гепарин плазмы, взятых у здоровых добровольцев, с использованием методов ELISA согласно настоящему изобретению.
Фиг.18. Уровни связанного с внеклеточными нуклеосомами 5-метилцитозина, детектированные в образцах сыворотки, взятых у трех здоровых добровольцев и 10 страдающих раком ободочной кишки субъектов, с использованием методов ELISA согласно настоящему изобретению.
Фиг.19. Уровни связанного с внеклеточными нуклеосомами гистонового варианта H2AZ, детектированные в содержащих EDTA образцах плазмы, взятых у 13 здоровых добровольцев и 55 страдающих раком пациентов. Представленные уровни отсечки определены как среднее значение для здоровых образцов плюс одно или удвоенное среднеквадратическое отклонение от среднего значения.
Фиг.20. Уровни связанного с внеклеточными нуклеосомами гистонового варианта H2AZ, детектированные в содержащих EDTA образцах плазмы, взятых у 10 здоровых добровольцев и 61 страдающего раком пациента. Представленный уровень отсечки определен как среднее значение для здоровых образцов плюс удвоенное среднеквадратическое отклонение от среднего значения.
Фиг.21. Уровни связанного с внеклеточными нуклеосомами гистонового варианта H2AZ, детектированные в образцах сыворотки, взятых у четырех здоровых добровольцев и 20 страдающих раком поджелудочной железы пациентов. Представленный уровень отсечки определен как среднее значение для здоровых образцов плюс удвоенное среднеквадратическое отклонение от среднего значения.
Фиг.22. Уровни связанного с внеклеточными нуклеосомами гистонового варианта H2AZ, детектированные в содержащих EDTA образцах плазмы, взятых у страдающих раком легкого пациентов с увеличивающимся размером опухоли, стадией и узловым развитием заболевания:
N1: метастазы в расположенных на той же стороне перибронхиальных и/или расположенный на той же стороне прикорневых лимфатических узлах и внутрилегочных лимфатических узлах, включая метастазы в результате прямого продолжения;
N2: метастазы в расположенных на той же стороне средостенных и/или трахеобронхиальных лимфатических узлах;
N3: метастазы в расположенных на противоположной стороне средостенных, расположенных на противоположной стороне прикорневых, расположенных на той же стороне или расположенных на противоположной стороне лестничных или надключичных лимфатических узлах;
T1: опухоль менее 3 см;
T2: опухоль более 3 см и менее 7 см;
T3: опухоль более 7 см;
T4: опухоль любого размера, которая проникает в другой орган или ткань;
M0: отсутствие распространения заболевания за пределы регионарных лимфатических узлов;
M1: распространение заболевания на удаленные метастазы.
Фиг.23. Средние уровни связанных с внеклеточными нуклеосомами нуклеотидов и типов гистонов, детектированные с использованием методов ELISA согласно настоящему изобретению в содержащих EDTA образцах плазмы, взятых у 10 страдающих различными раковыми заболеваниями пациентов, нормированные по отношению у уровням связанной с нуклеосомами 5-метилцитозинметилированной (5mc) ДНК и выраженные по отношению к средним уровням, обнаруженным у 11 здоровых субъектов.
Фиг.24. Средние уровни связанных с внеклеточными нуклеосомами нуклеотидов и типов гистонов, детектированные с использованием методов ELISA согласно настоящему изобретению в содержащих EDTA образцах плазмы, взятых у двух страдающих кардиомиопатией пациентов, 10 страдающих системной красной волчанкой пациентов, 12 страдающих язвенным колитом пациентов, 10 страдающих хроническим обструктивным заболеванием легких (ХОЗЛ) пациентов, 8 страдающих болезнью Крона пациентов и 10 страдающих ревматоидным артритом (РА) пациентов, нормированные по отношению к уровням связанной с нуклеосомами 5-метилцитозинметилированной (5mc) ДНК и выраженные по отношению к средним уровням, обнаруженным у 11 здоровых субъектов.
Подробное описание изобретения
Согласно первому аспекту, настоящее изобретение относится к внеклеточной нуклеосоме, включающей гистоновый вариант или гистоновую изоформу, для применения в качестве биомаркера в диагностике рака, кардиомиопатии, системной красной волчанки, колита, хронического обструктивного заболевания легких, болезни Крона и ревматоидного артрита.
Согласно одному варианту осуществления, нуклеосома представляет собой мононуклеосому или олигонуклеосому.
Согласно одному частному аспекту настоящего изобретения, который можно привести, изобретение относится к применению гистонового варианта или гистоновой изоформы в качестве биомаркера в диагностике рака.
Согласно одному варианту осуществления, рак представляет собой рак мочевого пузыря, молочной железы, ободочной кишки, шейки матки, пищевода, почки, толстой кишки, легкого, полости рта, яичника, поджелудочной железы, предстательной железы, прямой кишки, кожи или желудка. Согласно одному частному варианту осуществления, который можно привести, рак представляет собой рак ободочной кишки, легкого, полости рта или поджелудочной железы.
Авторы разработали исследования методом ELISA для детекции и измерения нуклеосом, содержащих гистоновые варианты макроH2A1.1 (mH2A1.1), макроH2A2 (mH2A2) и H2AZ. Авторы использовали антигистоновое антитело в качестве иммобилизованного антитела для этих исследований в комбинации с соответствующим антителом, специфическим для анти-гистонового варианта, в качестве идентифицирующего антитела. Авторы показали, что эти методы ELISA работают в случае альтернативных анти-нуклеосомных иммобилизованных антител. Авторы также использовали анализы для демонстрации того, что нуклеосомы, содержащие специфические гистоновые варианты, можно измерять в образцах крови, взятых у больных субъектов, и они являются подходящими для применения в качестве неинвазивных или минимально инвазивных биомаркеров. Уровни гистоновых вариантов, детектированные в нуклеосомах образцов сыворотки и плазмы, взятых у больных субъектов, по сравнению с уровнями других нуклеосомных эпитопов, отличаются от уровней, обнаруженных в образцах, взятых у здоровых субъектов. Кроме того, обнаружено, что картина уровней нуклеосом, содержащих различные гистоновые варианты, детектированные в нуклеосомах образцов для различных заболеваний, отличается при различных заболеваниях, в частности, когда картины связанных с нуклеосомами гистоновых вариантов исследовали в комбинации с картинами, определенными для нуклеосом, содержащих различные нуклеотиды и ПТМ, таким образом, что оказалась возможной дифференциальная диагностика заболевания. Для специалистов в данной области техники будет очевидным, что включение в исследования нуклеосом, содержащих различные или дополнительные гистоновые варианты или гистоновые модификации, или нуклеотиды, должно, вероятно, повысить разрешающую способность дифференциальной диагностики с использованием таких картин.
Для исследования уровней нуклеосом, которые обнаруживаются у здоровых субъектов, с использованием способов известного уровня техники авторы измеряли нуклеосомы в образцах сыворотки и плазмы, взятых у 20 здоровых субъектов. Оба способа известного уровня техники демонстрировали более высокие сигналы для образцов сыворотки, взятых у здоровых субъектов, чем для образцов плазмы. Результаты представлены на фиг.4. Это согласуется с опубликованными данными о том, что уровни нуклеосом являются более высокими в сыворотке, чем в плазме (*Holdenrieder et al., 2001).
Для исследования уровней нуклеосом, которые обнаруживаются у здоровых субъектов, с применением способов согласно настоящему изобретению авторы измеряли нуклеосомы, содержащие три гистоновых варианта, в образцах сыворотки 20 здоровых субъектов и здоровой бычьей сыворотки. Результаты всех трех исследований образцов сыворотки методом ELISA оказались низкими или неопределяемыми для всех 20 здоровых субъектов. Авторы также проводили аналогичные исследования содержащих EDTA образцов плазмы, взятых у 20 здоровых субъектов, тремя методами ELISA согласно настоящему изобретению и неожиданно наблюдали более высокие сигналы. Высокие уровни внеклеточных нуклеосом, содержащих гистоновые варианты mH2A1.1, mH2A2, H2AZ, а также гистон P-H2AX (Ser139), можно было детектировать способами согласно настоящему изобретению в содержащей EDTA плазме здорового человека, но меньшие уровни обнаруживали в сыворотке здорового человека, как представлено на фиг.5-8. На фиг.9 и 10 показано, что аналогичные результаты были получены для других нуклеосомных структур. Это открытие является неожиданным и одновременно отличается от опубликованных результатов (*Holdenrieder et al., 2001) и результатов, обнаруженных авторами с использованием нуклеосомных методов ELISA известного уровня техники. Таким образом, способы согласно настоящему изобретению неожиданно приводят к противоположным результатам по сравнению со способами известного уровня техники для относительных уровней нуклеосом, которые присутствуют в образцах сыворотки и содержащей EDTA плазмы.
Авторы исследовали возможность детекции нуклеосомных структур во всем разнообразии обычных типов плазмы, которые могут быть собраны. Авторы обнаружили, что высокие уровни связанных с внеклеточными нуклеосомами H2AZ, mH2A1.1 и P-H2AX (Ser139) можно было детектировать способом согласно настоящему изобретению в содержащей EDTA плазме и, в меньшей степени, в содержащей цитрат плазме, взятой у здоровых субъектов, но что связанные с нуклеосомами H2AZ, mH2A1.1 и P-H2AX (Ser139) невозможно было детектировать на фоне сигналов буфера или лошадиной сыворотки в содержащей гепарин плазме, взятой у здоровых субъектов. Оказалось, что некоторые содержащие гепарин образцы плазмы (2 из 5) содержат достаточные для детекции уровни связанного с нуклеосомами 5-метилцитозина. Результаты представлены на фиг.17. Таким образом, внеклеточные нуклеосомы обнаруживаются в относительно высоких концентрациях в большинстве или всех образцах содержащей EDTA плазмы и содержащей цитрат плазмы, взятых у здоровых субъектов, с использованием способа согласно настоящему изобретению, но присутствуют в низких концентрациях или отсутствуют в образцах содержащей гепарин плазмы или сыворотки, взятых у здоровых субъектов. Таким образом, оказывается очевидным, что точный выбор типа образца будет иметь определяющее значение для различных применений.
Авторы показали, что выбор образца для детекции внеклеточных нуклеосом, содержащих определенные гистоновые структуры, включает несколько параметров. Эти параметры включают уровни внеклеточных нуклеосом, которые, как правило, присутствуют в образцах сыворотки и содержащей гепарин плазмы, взятых у здоровых субъектов, причем повышенные уровни, как правило, присутствуют в образцах содержащей EDTA и цитрат плазмы, взятых у здоровых субъектов, при этом рекомендуется, чтобы образцы сыворотки, содержащей внеклеточные нуклеосомы, были стабилизированы посредством добавления EDTA после отделения сыворотки от свернувшейся крови (*Holdenreider et al., 2001), и протокол получения образцов сыворотки. Можно также использовать и другие стабилизирующие вещества (например, ингибиторы протеазы). Насколько это возможно, авторы использовали образцы сыворотки, которые центрифугировали в течение одного часа после венепункции, и затем добавляли раствор 10 мМ EDTA, и образцы замораживали.
Выбор типа образца крови для клинических исследований необходимо осуществлять на основании оптимальной клинической разрешающей способности для определенного исследования. После детекции авторами достаточно низких уровней нуклеосом способом согласно настоящему изобретению в сыворотке здоровых субъектов авторы измеряли нуклеосомы, содержащие гистоновые варианты mH2A1.1 и H2AZ, в образцах сыворотки, взятых у субъектов, страдающих разнообразными раковыми заболеваниями. Наблюдаемые уровни клинической чувствительности составляли вплоть до 75% для рака легкого и 80% для рака поджелудочной железы (фиг.21). Авторы также исследовали образцы сыворотки, взятые у страдающих раком пациентов, определяя нуклеосомы, содержащие 5-метилцитозин, и наблюдаемые уровни клинической чувствительности составляли вплоть до 100%, как представлено на фиг.18, для образцов рака ободочной кишки.
Авторы также измеряли относительные уровни внеклеточных нуклеосом, содержащих разнообразные гистоновые варианты и другие нуклеосомные структуры, в образцах содержащей EDTA плазмы, взятых у субъектов, страдающих разнообразными заболеваниями. Уровни внеклеточных нуклеосом являются высокими в образцах содержащей EDTA плазмы, взятых у здоровых субъектов и больных субъектов, и, таким образом, оказывается маловероятным, что выбор содержащих EDTA образцов представляет собой наилучший выбор образца для чувствительного различия больных и здоровых субъектов. Однако авторы показали, что уровни и состав циркулирующих внеклеточных нуклеосом, в отношении относительных уровни нуклеосом, содержащих различные гистоновые варианты (а также другие нуклеосомные структуры), различается между больными и здоровыми субъектами, а также между различными заболеваниями. Таким образом, авторы впервые сообщили, что (i) высокие уровни циркулирующих нуклеосом присутствуют во всех или большинстве содержащих EDTA образцов плазмы, взятых у здоровых и больных субъектов, но это не является верным для всех типов образцов крови; а также, неожиданно, что (ii) детекцию заболевания и идентификацию типа заболевания можно, тем не менее, осуществлять посредством анализа этих нуклеосом в содержащей EDTA плазме на основании уровней и структурного профиля одного или нескольких относительных типов нуклеосомных структур, которые присутствуют в плазме больных и здоровых субъектов.
Авторы измеряли внеклеточные нуклеосомы в содержащей EDTA плазме, взятой у здоровых субъектов и 117 субъектов, страдающих разнообразными типами рака, в двух экспериментах с участием 55 и 62 страдающих раком субъектов, соответственно. В итоге, 90% (105 из 117) раковых образцов правильно идентифицировали как положительные в отношении рака с использованием способа согласно настоящему изобретению для связанного с нуклеосомами гистонового варианта H2AZ, используя в качестве уровня отсечки средний результат для здоровых субъектов плюс удвоенное среднеквадратическое отклонение от среднего значения.
В первом из этих двух экспериментов авторы измеряли внеклеточные нуклеосомы в содержащей EDTA плазме, взятой у 13 здоровых субъектов и 55 субъектов, страдающих раком желудка, толстой кишки, прямой кишки, легкого (мелкоклеточная карцинома и разнообразные немелкоклеточные карциномы), молочной железы, яичника, предстательной железы, почки и различных органов полости рта (полость рта, небо, глотка и гортань). Все из образцов, взятых у здоровых субъектов и страдающих раком пациентов, оказались положительными в отношении внеклеточных нуклеосом. Однако уровни, обнаруженные в образцах, взятых у страдающих раком субъектов, оказались выше, чем было обнаружено в образцах, взятых у здоровых субъектов, и результаты продемонстрировали, что можно различать здоровых и страдающих раком субъектов. Например, нормальный интервал оптической плотности, вычисленный как среднее значение плюс/минус удвоенное среднеквадратическое отклонение от среднего значения, для анализа нуклеосом H2AZ составлял от 0 до 0,95. При использовании данного уровня отсечки, составляющего 0,95, все 13 здоровых субъектов оказались отрицательными в отношении повышенных уровней нуклеосом H2AZ. С другой стороны, положительный результат в отношении повышенных уровней нуклеосом H2AZ был обнаружен для 46 из 55 раковых образцов (итоговая клиническая чувствительность составляла 84%), включая 100% (8 из 8) в отношении рака желудка, 100% (5 из 5) в отношении рака толстой кишки, 67% (2 из 3) в отношении рака прямой кишки, 83% (5 из 6) в отношении мелкоклеточного рака легкого, 79% в отношении немелкоклеточного рака легкого, 50% (3 из 6) в отношении рака молочной железы, 100% (1 из 1) в отношении рака яичника, 83% (5 из 6) в отношении рака предстательной железы, 100% (1 из 1) в отношении рака почки и 100% (5 из 5) в отношении рака полости рта. Результаты представлены на фиг.19.
Согласно одному варианту осуществления настоящего изобретения, предложен контрольный образец, и определен уровень отсечки для анализа в целях различия между положительными и отрицательными результатами по отношению к результату для контрольного образца. Это может быть любая пропорция, которая равна или находится выше или ниже уровня результата для контрольного образца. Результаты у пациентов ниже данного уровня рассматриваются как отрицательные, и результаты у пациентов выше данного уровня рассматриваются как положительные. Может существовать также «область неопределенности», соответствующая интервалу результатов у пациентов, которые являются очень близкими к уровню отсечки, и для которых решение рассматривается как неопределенное, и/или требуется повтор исследований.
Аналогичным образом, для анализа связанного с нуклеосомами mH2A1.1 нормальный интервал составлял 0-0,91. При использовании данного уровня отсечки все 13 здоровых образцов оказались отрицательными, и 64% (35 из 55) раковых образцов оказались положительными. Для анализа связанного с нуклеосомами P-H2AX (Ser139) нормальный интервал составлял 0-1,08. При использовании данного уровня отсечки все 13 здоровых образцов оказались отрицательными и 60% (33 из 55) раковых образцов оказались положительными. Кроме того, измеряли связанный с нуклеосомами 5-метилцитозин, и нормальный интервал составлял 0-1,41. При использовании данного уровня отсечки все 13 здоровых образцов оказались отрицательными и 55% (30 из 55) раковых образцов оказались положительными. Таким образом, некоторые нуклеосомные анализы проявляют более высокую клиническую чувствительность, чем другие.
Кроме того, можно использовать картину нуклеосомных структур для повышения клинической применимости настоящего изобретения. Это можно осуществлять, например, посредством снижения уровня отсечки при анализе связанного с нуклеосомами H2AZ до среднего значения плюс среднеквадратическое отклонение от среднего значения, что дает интервал до 0,69. В данном случае, число ложноотрицательных результатов уменьшается до 3, обеспечивая повышенную клиническую чувствительность, составляющую 95% (52 из 55) за счет увеличения ложноположительных результатов для образцов, взятых у здоровых субъектов, от 0% до 23% (3 из 13). Результаты представлены на фиг.19.
Образцы, оказавшиеся положительными для связанных с H2AZ нуклеосомами или любыми нуклеосомами, можно исследовать в отношении нуклеосомного структурного профиля. Нуклеосомный профиль можно использовать для различия между здоровыми и больными субъектами, как проиллюстрировано на фиг.23 и 24, где относительные пропорции разнообразных нуклеосомных структур у больных пациентов представлены по сравнению с пропорциями, обнаруженными у здоровых субъектов и пациентов, страдающих другими нераковыми заболеваниями. Это показывает, что исследование многочисленных нуклеосомных структур в исследуемой группе может способствовать повышению клинической разрешающей способности.
Аналогичным образом, диагностическую специфичность и/или чувствительность согласно настоящему изобретению можно увеличивать путем объединения данных более чем одного исследования в форме соотношений. Например, можно использовать соотношение, связанное с нуклеосомами H2AZ и mH2A1.1.
Таким образом, способы согласно настоящему изобретению являются пригодными для детекции рака с использованием образцов плазмы и сыворотки, взятых у страдающих раком пациентов.
Авторы измеряли уровни циркулирующих внеклеточных нуклеосом, содержащих три различных гистоновых варианта, в образцах содержащей EDTA плазмы, взятых у трех пациентов, страдающих раком ободочной кишки, 13 пациентов, страдающих раком легкого, двух пациентов, страдающих раком поджелудочной железы, и одного пациента, страдающего раком полости рта, и сравнивали эти уровни с уровнями, присутствующими в образцах крови, взятых у 20 здоровых субъектов, а также с искусственно полученным препаратом нуклеосом от здоровых субъектов, полученным согласно описанию в литературе (*Holdenreider et al., 2001). Авторы также представляли наблюдаемые уровни в нормированной форме как соотношения уровня нуклеосом, содержащих различные эпитопы, и показали, что такие соотношения или картины соотношений можно использовать в общей диагностике рака и в дифференциальной диагностике специфических типов рака. Авторы также исследовали, изменяется ли уровень связанного с нуклеосомами гистона H2AZ при прогрессировании заболевания. Авторы наблюдали, что средний уровень внеклеточных нуклеосом, содержащих гистоновые варианты, увеличивается со степенью тяжести заболевания и возрастает при увеличении распространения заболевания в лимфатические узлы и при увеличении размера опухоли и стадии. Это обеспечивает доказательство того, что детектированные нуклеосомы связаны с опухолью.
Авторы также измеряли нуклеосомы, присутствующие в этих 19 раковых образцах, используя два нуклеосомных метода ELISA известного уровня техники. Среди 19 страдающие раком субъектов, принимавших участие в исследовании, у большинства обнаружены низкие уровни нуклеосом в содержащей EDTA плазме, которые определяли нуклеосомными методами ELISA 1 и 2 известного уровня техники. Данный результат иллюстрирует одну причину, по которой анализы известного уровня техники не используются в обычных клинических целях.
Авторы использовали методы ELISA согласно настоящему изобретению для измерения нуклеосом, содержащих гистоновые варианты mH2A1.1, mH2A2 и H2AZ, в тех же 19 образцах. Нуклеосомы, содержащие гистоновые варианты, в частности, mH2A2 и H2AZ, можно было детектировать в 16 из 19 образцов. Таким образом, согласно одному варианту осуществления настоящего изобретения, предложен новый способ нуклеосомного ELISA, которым можно детектировать нуклеосомы, не обнаруживаемые нуклеосомными анализами предшествующего уровня техники.
Авторы также измеряли уровни нуклеосом, содержащих два различных нуклеотида и гистоновую ПТМ, в тех же 19 образцах, взятых у страдающих раком субъектов, а также образец нуклеосом, полученный у здоровых субъектов способом, описанным в литературе (*Holdenrieder et al., 2001). Авторы использовали эти измерения вместе с измерениями связанного с нуклеосомами гистонового варианта, описанного в настоящем описании, в качестве группы разнообразных внеклеточных нуклеосом, присутствующих в биологических жидкостях, взятых у субъектов, страдающих раком четырех различных типов, и с измерениями нуклеосом, взятых у здоровых субъектов. Неожиданно картина нуклеосом, обнаруженных при исследовании рака четырех типов (рак легкого, ободочной кишки, поджелудочной железы и полости рта) полностью отличалась от картины нуклеосом, обнаруженных в образце, полученном от здоровых субъектов. Кроме того, различные типы рака также отличались друг от друга, как показывает картина внеклеточных нуклеосом, детектируемых в крови субъектов. Таким образом, согласно одному варианту осуществления настоящего изобретения, предложен способ детекции или диагностики присутствия, типа, рецидива или степени тяжести заболевания или оценки оптимального лекарственного средства или других способов лечения посредством исследования образца в отношении группы различных нуклеосомных эпитопов, которую составляют два или более измерений нуклеосом, содержащих различные гистоновые варианты или комбинацию одного или нескольких гистоновых вариантов ДНК и одного или нескольких гистоновых оснований ДНК, и/или одной или нескольких гистоновых модификаций, и/или измерения нуклеосом в чистом виде, или любую комбинацию или соотношение любых из данных вариантов, в качестве показателя состояния здоровья или заболевания субъекта.
Аналогичным образом, авторы использовали методы ELISA согласно настоящему изобретению для детекции изменчивости в гистоновых и нуклеотидных структурах циркулирующих внеклеточных нуклеосом в случаях разнообразных раковых и нераковых заболеваний и сравнивали эти результаты со структурой нуклеосом, обнаруженных у 11 здоровых субъектов. Обнаружено, что нуклеосомы присутствуют во всех исследованных случаях раковых и нераковых заболеваний, и обнаружено, что они имеют профили, которые отличаются от профилей здоровых субъектов.
Авторы исследовали содержащие EDTA образцы плазмы, взятые у двух страдающих кардиомиопатией пациентов, 10 страдающих системной красной волчанкой пациентов, 12 страдающих язвенным колитом пациентов, 10 страдающих хроническим обструктивным заболеванием легких (ХОЗЛ) пациентов, 8 страдающих болезнью Крона пациентов и 10 страдающих ревматоидным артритом (РА) пациентов, и нормированные уровни разнообразных нуклеосомных структур, в отношении пропорции уровней связанного с нуклеосомами 5-метилцитозина и представляли в сравнении с уровнями, обнаруженными у здоровых субъектов. Авторы обнаружили, что заболевания были связаны с нуклеосомными структурными профилями, которые отличались от профилей здоровых или страдающих раком субъектов. Таким образом, нуклеосомные структурные профили можно использовать в качестве диагностического средства для детекции, прогностического предсказания, наблюдения и предсказания терапевтической эффективности широкого разнообразия нераковых заболеваний. Результаты представлены на фиг.24.
Авторы также исследовали изменчивость структуры внеклеточных нуклеосом в отношении типов гистонов и нуклеотидов, обнаруженных с использованием методов ELISA согласно настоящему изобретению в содержащих EDTA образцах плазмы, взятых у 55 пациентов, страдающих десятью различными раковыми заболеваниями, нормированный в форме пропорции уровней связанной с нуклеосомами 5-метилцитозинметилированной (5mc) ДНК и представляли по отношению к средним пропорциям, обнаруженным у 11 здоровых субъектов. Авторы обнаружили нуклеосомы, присутствующие у всех субъектов, и нуклеосомные структурные профили, которые различались у пациентов, страдающих раковыми заболеваниями и нераковыми заболеваниями, и здоровых субъектов. Таким образом, нуклеосомные структурные профили можно использовать в качестве диагностического средства для детекции, прогностического предсказания, наблюдения и предсказания терапевтической эффективности в случае раковых и других заболеваний. Результаты представлены на фиг.23 и 24.
Описаны многочисленные изоформы или варианты гистонов H2A, H2B и H3. С другой стороны, согласно сообщениям, гистон H4 существует в единственной форме (Tachiwana et al., 2011). Для специалистов в данной области будет очевидным, что метод ELISA согласно настоящему изобретению с использованием антитела или связующего вещества, которое предназначено для связывания гистона H4, будет обеспечивать связывание практически всех нуклеосом в образце. Таким образом, согласно одному варианту осуществления настоящего изобретения, предложен новый способ детекции нуклеосом в чистом виде, в котором нуклеосомы, содержащие обычный гистоновый вариант, измеряют таким путем, который обеспечивает детекцию всех или большинства нуклеотидов. Кроме того, как должно быть очевидным для специалистов в данной области, подходящие антитела или лиганды, получаемые для данного применения, могут быть предназначены для областей гистона H4, которые не подвергаются модификации ПТМ. Это дополнительно увеличивает универсальность выбранного эпитопа в качестве эпитопа, общего для всех или большинства нуклеосом. Аналогичным образом, для специалистов в данной области будет очевидным, что аналогичные подходящие антитела могут быть предназначены для связывания областей других гистоновых компонентов, выбранных таким образом, что данные области являются общими для всех или большинства гистоновых вариантов или изоформ указанного гистонового компонента, и что они не подвергаются ПТМ (например, но без ограничения, общие области гистонов H2A, H2B или H3). Таким образом, настоящее изобретение относится к способу детекции всех или большинства нуклеосом в образце, несмотря на видоизменение составляющих гистоновых изоформ и посттранскрипционные модификации.
Авторы делают вывод, что способ согласно настоящему изобретению представляет собой успешный способ детекции и измерения нуклеосом, содержащих специфические гистоновые изоформы или варианты, что данный способ можно также использовать в качестве способа детекции нуклеосом в чистом виде, и что он представляет собой превосходный способ детекции нуклеосом в чистом виде по сравнению со способами известного уровня техники. Таким образом, способы согласно настоящему изобретению имеют преимущества по сравнению со способами измерения нуклеосом известного уровня техники. Для специалистов в данной области будет очевидным, что способы согласно настоящему изобретению можно использовать для детекции и измерения нуклеосом непосредственно в любых образцах, где они присутствуют, например, в образцах, полученных путем гидролиза хроматина, экстрагированного из клеток, или в биологических жидкостях, таких как образцы крови, сыворотки или плазмы. Кроме того, очевидно, что способы, описанные в настоящем описании, можно разрабатывать в отношении любого гистонового варианта или модифицированного гистонового варианта, для которого можно продуцировать антитело или другое связующее вещество.
Настоящее изобретение было проверено в отношении многочисленных раковых и нераковых заболеваний, и оно оказалось эффективным для детекции всех исследованных заболеваний. Это включает детекцию случаев рака предстательной железы, который не обнаруживается посредством нуклеосомных исследований методом ELISA известного уровня техники (Holdenrieder, 2001). Очевидно, что настоящее изобретение является эффективным для детекции всех или большинства типов рака. Для специалистов в данной области будет очевидным, что клиническую эффективность согласно настоящему изобретению можно дополнительно повышать посредством включения дополнительных исследований нуклеосомных структур и посредством исследования соотношений различных присутствующих нуклеосомных структур.
Согласно одному аспекту настоящего изобретения, предложен способ детекции и измерения в образце внеклеточных нуклеосом, содержащих специфические гистоновые варианты или изоформы, посредством иммунологического анализа, включающий следующие стадии:
(i) контакт образца с антителом или другим связующим веществом, которое связывается с гистоновым вариантом;
(ii) детекцию и/или количественное определение связывания указанного антитела или другого связующего вещества с частицами гистонового варианта в образце; и
(iii) использование присутствия или степени такого связывания в качестве меры присутствия связанного с нуклеосомами гистонового варианта в образце.
Согласно следующему аспекту настоящего изобретения, предложен способ иммунометрического или многослойного иммунологического анализа двойных антител, для детекции и измерения в образце внеклеточных нуклеосом, содержащих специфические гистоновые варианты или изоформы. Один вариант осуществления данного аспекта представляет собой иммунологический анализ, который включает следующие стадии:
(i) контакт образца, в котором могут содержаться нуклеосомы, с первым антителом или другим связующим веществом, которое связывается с нуклеосомами;
(ii) контакт нуклеосом или образца со вторым антителом или другим связующим веществом, которое связывается с гистоновым вариантом;
(iii) детекцию и/или количественное определение связывания указанного второго антитела или другого связующего вещества с частицами гистонового варианта в образце; и
(iv) использование присутствия или степени такого связывания в качестве меры присутствия связанного с нуклеосомами гистонового варианта в образце.
Согласно еще одному варианту осуществления, предложен способ детекции и измерения в образце внеклеточных нуклеосом, содержащих специфические гистоновые варианты или изоформы, посредством иммунологического анализа, который включает следующие стадии:
(i) контакт образца, в котором могут содержаться нуклеосомы, с первым антителом или другим связующим веществом, которое связывается с гистоновым вариантом;
(ii) контакт нуклеосом или образца со вторым антителом или другим связующим веществом, которое связывается с нуклеосомами;
(iii) детекцию и/или количественное определение связывания указанного второго антитела или другого связующего вещества с нуклеосомами в образце; и
(iv) использование присутствия или степени такого связывания в качестве меры присутствия связанного с нуклеосомами гистонового варианта в образце.
Согласно настоящему изобретению, разнообразные антитела или другие связующие вещества можно использовать в качестве связующего вещества, которое связывается с нуклеосомами. Эти вещества включают связующие вещества, предназначенные для связывания с эпитопами, которые присутствуют в неизмененных нуклеосомах и отсутствуют в свободных гистонах (например, эпитоп находится на соединении между двумя гистонами в нуклеосоме), а также связующие вещества, присоединяющиеся к какому-либо нуклеосомному компоненту, включая обычный нуклеосомный белок, гистон или эпитопы нуклеиновой кислоты. Авторы исследовали образцы способом согласно настоящему изобретению с использованием двух различных иммобилизованных антител и продемонстрировали, что определенное используемое иммобилизованное антитело существенно не влияет на результаты способа согласно настоящему изобретению. Результаты представлены на фиг.16.
Для специалистов в данной области будет очевидным, что описанные способы согласно настоящему изобретению включают разнообразные варианты осуществления, включающие классические конкурентные иммунологические анализы, а также анализы биосенсорного типа и безиндикаторные анализы таких типов, которые поставляет, например, компания ForteBio Incorporated (США), которые могут быть иммунометрическими по своей природе.
Согласно одному варианту осуществления настоящего изобретения, предложен способ детекции и измерения в образце гистоновой изоформы или варианта, или связанной с нуклеосомами гистоновой изоформы или варианта посредством безиндикаторного иммунометрического иммунологического анализа, который включает следующие стадии:
(i) контакт образца с антителом или другим связующим веществом, которое связывается с гистоновой изоформой или вариантом;
(ii) детекцию и/или количественное определение связывания указанного антитела или другого связующего вещества с гистоновой изоформой или вариантом в образце; и
(iii) использование присутствия или степени такого связывания в качестве меры присутствия гистоновой изоформы или варианта, или связанной с нуклеосомами гистоновой изоформы или варианта в образце.
Согласно следующему варианту осуществления настоящего изобретения, предложен способ детекции и измерения внеклеточной гистоновой изоформы или варианта, или связанной с нуклеосомами гистоновой изоформы или варианта в образце посредством конкурентного иммунологического анализа, который включает следующие стадии:
(i) контакт образца с антителом или другим связующим веществом, которое связывается с гистоновой изоформой или вариантом;
(ii) детекцию и/или количественное определение связывания указанного антитела или другого связующего вещества с гистоновой изоформой или вариантом в образце; и
(iii) использование присутствия или степени такого связывания в качестве меры присутствия гистоновой изоформы или варианта в образце.
Согласно следующему аспекту настоящего изобретения, предложен способ детекции в образце пропорции нуклеосом, которые включают гистоновую изоформу, включающий следующие стадии:
(i) детекцию или измерение уровня нуклеосом в образце;
(ii) детекцию или измерение уровня связанной с нуклеосомами гистоновой изоформы способом согласно настоящему изобретению; и
(iii) использование двух измерений для определения пропорции нуклеосом, в которых содержится гистоновая изоформа.
Согласно одному варианту осуществления данного аспекта настоящего изобретения, суммарный уровень нуклеосом в образце и уровень исследуемого связанного с нуклеосомами гистонового варианта измеряют с использованием способа настоящего изобретения. Согласно еще одному варианту осуществления, нуклеосомные методы ELISA известного уровня техники используют для определения суммарного уровня нуклеосом. Согласно еще одному варианту осуществления, измерение суммарного содержания ДНК используют в качестве подтверждения суммарного уровня нуклеосом.
Авторы показали, что детекция и измерение нуклеосом, содержащих гистоновые варианты, в крови, взятой у субъектов, можно использовать в качестве диагностического способа для определения субъектов, страдающих раком, и для отличия их от здоровых субъектов. Кроме того, авторы показали, что картины нуклеосом, содержащих группу различных гистоновых вариантов, нуклеотидов и гистоновых ПТМ, можно использовать для установления отличия между различными типами рака. Для специалистов в данной области будет очевидным, что это обеспечивает основу для исследования крови в отношении рака, с помощью которого можно детектировать рак у субъектов, и которое можно использовать для различия между типами рака у имеющих положительный диагноз рака субъектов. Согласно еще одному аспекту настоящего изобретения, предложен способ детекции или диагностики присутствия заболевания посредством измерения или детекции присутствия и/или уровня или концентрации внеклеточных нуклеосом, содержащих гистоновый вариант, в биологической жидкости, и использования обнаруженного уровня в качестве биомаркера состояния заболевания субъекта, включая, но без ограничения, клиническую диагностику заболевания, дифференциальную диагностику типа или подтипа заболевания, или прогноз заболевания, или рецидив заболевания, или диагностику чувствительности субъекта к схеме лечения. Специалистам в данной области будет понятно, что биологические жидкости, используемые для диагностических исследований, включают, но без ограничения, кровь, сыворотку, плазму, мочу, спинномозговую жидкость и другие жидкости. Согласно предпочтительному варианту осуществления, биологическая жидкость, выбранная в качестве образца, представляет собой кровь, сыворотку или плазму. Уровень аналитического сигнала, концентрации или количества связанного с нуклеосомами гистонового варианта в биологической жидкости можно выражать в абсолютных значениях или в относительных значениях, например, но без ограничения, как присутствующую долю суммарного уровня нуклеосом или суммарного уровня ДНК, или как отношение к уровню нуклеосом, содержащих еще один гистоновый вариант или нуклеотид, или ПТМ.
Согласно следующему аспекту настоящего изобретения, предложен способ детекции или измерения присутствия в клетке и/или уровня нуклеосом, содержащих определенный гистоновый вариант, включающий следующие стадии:
(i) выделение хроматина из клетки;
(ii) разрушение хроматина с образованием мононуклеосом и/или олигонуклеосом; и
(iii) детекцию или измерение присутствия гистонового варианта в мононуклеосомах и/или олигоуклеосомах с использованием способа иммунологического анализа, который описан в настоящем описании.
Способы получения мононуклеосом и/или олигоуклеосом из хроматина хорошо известны в данной области и включают ферментативный гидролиз и ультразвуковую обработку (Dai et al., 2011). Авторы получали внеклеточные нуклеосомы из клеток MCF7, используя стандартные методики, а также применяли способ согласно настоящему изобретению, демонстрируя, что эти нуклеосомы из клеток MCF7 действительно включают нуклеосомы, содержащие гистоновые варианты mH2A1.1, H2AZ, а также P-H2AX (Ser139).
Согласно одному варианту осуществления, гистоновый вариант, выбранный для детекции данным способом, представляет собой обычную распространенную изоформу, которая встречается во всех или большинстве неизмененных нуклеосом, и, таким образом, обеспечивая способ детекции или измерения нуклеосом в чистом виде. Согласно еще одному варианту осуществления, эпитоп на гистоновой изоформе, выбранной для детекции данным способом, расположен в области гистоновой изоформы, которая является обычной и встречается во всех или большинстве изоформ указанного гистона и, следовательно, во всех или большинстве неизмененных нуклеосом и дополнительно не подвергается ПТМ, обеспечивая способ детекции или измерения нуклеосом в чистом виде.
Специалистам в данной области будет понятно, что описанный способ детекции связанных с нуклеосомами гистоновых вариантов в клетках или тканях является более простым, быстрым, дешевым, количественным и/или воспроизводимым, чем используемые до настоящего времени способы, включающие иммуногистохимию (ИГХ), вестерн-блоттинг или сортировку флуоресцентно-активированных клеток (FACS). Уровень, концентрацию или количество определенного связанного с нуклеосомами гистонового варианта можно выражать в абсолютных значениях или в относительных значениях, например, как долю от присутствующего суммарного количества нуклеосом или суммарного количества ДНК, или как отношение к уровню нуклеосом, содержащих еще один гистоновый вариант или ПТМ или нуклеотид.
Для специалистов в данной области будет очевидным, что термины «антитело», «связующее вещество» или «лиганд» по отношению к любому аспекту настоящего изобретения не являются ограничительными, но используются для обозначения любого связующего вещества, способного присоединяться к специфическим молекулам или частицам, и что любое подходящее связующее вещество можно использовать в способе согласно настоящему изобретению. Кроме того, является очевидным, что термин «нуклеосомы» используется для обозначения мононуклеосом и олигонуклеосом, а также любых таких хроматиновых фрагментов, которые можно анализировать в жидкой среде.
Согласно еще одному аспекту настоящего изобретения, предложен набор для детекции или измерения нуклеосом, который включает специфический лиганд или связующее вещество для гистонового варианта или его составляющей части, или имитатор структуры/формы нуклеосомы или ее составляющей части, вместе с инструкциями для применения набора в соответствии с любым из способов, определенных в настоящем описании.
Согласно следующему аспекту, настоящее изобретение относится к набору для детекции или измерения нуклеосом, содержащих определенный гистоновый вариант, который включает специфический лиганд или связующее вещество для гистонового варианта или его составляющей части, или имитатор структуры/формы нуклеосомы или ее составляющей части, вместе с инструкциями для применения набора в соответствии с любым из способов, определенных в настоящем описании.
Согласно еще одному аспекту, настоящее изобретение относится к способу идентификации биомаркера гистонового варианта для детекции или диагностики состояния заболевания животного или человека, включающему следующие стадии:
(i) детекцию или измерение уровня внеклеточных нуклеосом, содержащих гистоновый вариант, в биологической жидкости больных субъектов;
(ii) детекцию или измерение уровня внеклеточных нуклеосом, содержащих гистоновый вариант, в биологической жидкости контрольных субъектов; и
(iii) использование разности между уровнями, обнаруженными у больных и контрольных субъектов, для установления возможности использования определенного гистонового варианта в качестве биомаркера в отношении данного заболевания.
Для специалистов в данной области будет очевидным, что контрольных субъектов можно выбирать на различной основе, которая может включать, например, субъектов с заведомым отсутствием заболевания, или можно выбирать субъектов, страдающих различными заболеваниями (например, для исследования дифференциальной диагностики).
Согласно следующему аспекту, настоящее изобретение относится к способу идентификации биомаркера гистонового варианта для оценки прогноза в отношении больного животного субъекта или человека, включающему следующие стадии:
(i) детекцию или измерение уровня внеклеточных нуклеосом, содержащих гистоновый вариант, в биологической жидкости больных субъектов; и
(ii) корреляцию уровня содержащих гистоновый вариант внеклеточных нуклеосом, обнаруженных в биологической жидкости больных субъектов, с исходом заболевания субъектов.
Согласно следующему аспекту, настоящее изобретение относится к способу идентификации биомаркера гистонового варианта для применения в выборе схемы лечения больного животного субъекта или человека, нуждающегося в лечении, включающему следующие стадии:
(i) детекцию или измерение уровня внеклеточных нуклеосом, содержащих гистоновый вариант в биологической жидкости больных субъектов; и
(ii) корреляцию уровня содержащих гистоновый вариант внеклеточных нуклеосом, обнаруженных в биологической жидкости больных субъектов, с наблюдаемой эффективностью схемы лечения данных субъектов.
Согласно следующему аспекту, настоящее изобретение относится к способу идентификации биомаркера гистонового варианта для применения в наблюдении лечения больного животного субъекта или человека, включающему следующие стадии:
(i) детекцию или измерение уровня внеклеточных нуклеосом, содержащих гистоновый вариант, в биологической жидкости больного субъекта;
(ii) повтор указанной детекции или измерения в один или несколько моментов времени в течение прогрессирующего заболевания субъекта; и
(iii) корреляцию уровня содержащих гистоновый вариант внеклеточных нуклеосом, обнаруженных в биологической жидкости больного субъекта, при прогрессировании заболевания субъекта.
Согласно следующему аспекту, настоящее изобретение относится к биомаркеру, идентифицируемого способом, который определен в настоящем описании.
Для специалистов в данной области будет очевидным, что внеклеточные нуклеосомы, содержащие гистоновый вариант, можно также детектировать в биологической жидкости, включая кровь, плазму, сыворотку и мочу, используя методику, которая включает экстракцию белка гистонового варианта из нуклеосомного комплекса, с последующим осуществлением способа детекции или количественного определения экстрагированного свободного белка гистонового варианта. Подходящие методы экстракции включают обычно используемые методы кислотной экстракции в отношении гистонов, где используется основная природа белков гистонов. Детекцию свободного гистонового варианта можно осуществлять, например, применяя иммунологический анализ в отношении свободного гистонового компонента. Таким образом, согласно одному варианту осуществления настоящего изобретения, гистоновый вариант экстрагируют из биологической жидкости, включая кровь, плазму, сыворотку и мочу, и экстракт исследуют в отношении присутствия гистонового варианта.
В данной области известно, что можно детектировать присутствие белка, который составляет часть комплекса, содержащего другие частицы, применяя способы иммунологического анализа. Для специалистов в данной области будет очевидным, что внеклеточные нуклеосомы, содержащие гистоновый вариант, можно детектировать в биологической жидкости, включая кровь, плазму, сыворотку и мочу, используя методику, включающую непосредственный иммунологический анализ самого гистонового варианта в жидкости. Согласно данной методике, одностадийный иммунологический анализ с использованием одного антитела, соответствующего эпитопу, который присутствует на гистоновом варианте, или двухстадийный иммунологический анализ с использованием двух антител, соответствующих двум эпитопам, которые присутствуют на гистоновый вариант, используют для детекции присутствия гистонового варианта в нуклеосоме. Таким образом, согласно еще одному варианту осуществления настоящего изобретения, гистоновый вариант, содержащийся в нуклеосоме, детектируют непосредственно в биологической жидкости, включая кровь, плазму, сыворотку и мочу, путем применения способа иммунологического анализа в отношении гистонового варианта.
Таким образом, согласно одному варианту осуществления настоящего изобретения, гистоновый вариант экстрагируют из биологической жидкости, включая кровь, плазму, сыворотку и мочу, и экстракт исследуют на присутствие гистонового варианта.
Согласно следующему аспекту настоящего изобретения, предложены лиганды или связующие вещества, такие как встречающиеся в природе или химически синтезируемые соединения, способные осуществлять специфическое связывание биомаркера. Лиганд или связующее вещество согласно настоящему изобретению может включать пептид, антитело или его фрагмент, или синтетический лиганд, такой как пластичное антитело, или аптамер или олигонуклеотид, способный осуществлять специфическое связывание биомаркера. Антитело может представлять собой моноклональное антитело или его фрагмент, способный осуществлять специфическое связывание биомаркера. Лиганд согласно настоящему изобретению можно маркировать, используя обнаруживаемый маркер, такой как люминесцентный, флуоресцентный, ферментативный или радиоактивный маркер; альтернативно или дополнительно, лиганд согласно настоящему изобретению можно маркировать, используя аффинный маркер, например, биотиновый, авидиновый, стрептавидиновый или гистидиновый (например, гексагистидиновый) маркер. Альтернативно, связывание лиганда можно определять с использованием безиндикаторной технологии, например, технологии компании ForteBio Inc.
Биосенсор согласно настоящему изобретению может включать биомаркер или соответствующий имитатор структуры/формы, способный осуществлять специфическое связывание антитела, относящемуся к биомаркеру. Кроме того, предложена матрица, включающая лиганд или имитатор, который описан в настоящем описании.
Кроме того, согласно настоящему изобретению, предложено применение одного или нескольких лигандов, как описано в настоящем описании, и которые могут представлять собой встречающиеся в природе или химически синтезируемые соединения, и они предпочтительно представляют собой пептид, антитело или его фрагмент, аптамер или олигонуклеотид, или применение биосенсора согласно настоящему изобретению, или матрицы согласно настоящему изобретению, или набора согласно настоящему изобретению для детекции и/или количественного определения биомаркера. Для этих целей детекцию и/или количественное определение можно осуществлять, используя биологический образец, который определен в настоящем описании.
Предложены наборы для диагностики или наблюдения, чтобы осуществлять способы согласно настоящему изобретению. Такие наборы предпочтительно включают лиганд согласно настоящему изобретению для детекции и/или количественного определения биомаркера, и/или биосенсора, и/или матрицы, как описано в настоящем описании, необязательно вместе с инструкциями для применения данного набора.
Следующий аспект настоящего изобретения представляет собой набор для детекции присутствия состояния заболевания, включающий биосенсор, способный осуществлять детекцию и/или количественное определение одного или нескольких биомаркеров, как определено в настоящем описании.
Биомаркеры для детекции присутствия заболевания представляют собой важные мишени для открытия новых мишеней и молекул лекарственных средств, которые замедляют или останавливают прогрессирующее заболевание. Поскольку уровень биомаркера представляет собой показатель заболевания и эффективности лекарственного средства, биомаркер можно использовать для идентификации новых применяемых в терапии соединений, осуществляя анализы in vitro и/или in vivo. Биомаркеры согласно настоящему изобретению можно использовать в способах обследования в отношении соединений, которые модулируют активность биомаркера.
Таким образом, согласно следующему аспекту, настоящее изобретение относится к применению связующих веществ или лигандов, описанных выше, которые могут представлять собой пептид, антитело или его фрагмент, или аптамер, или олигонуклеотид согласно настоящему изобретению; или применению биосенсора согласно настоящему изобретению, или матрицы согласно настоящему изобретению, или набора согласно настоящему изобретению, для определения вещества, способного усиливать и/или подавлять образование биомаркера.
Кроме того, предложен способ идентификации вещества, способного усиливать или подавлять образование биомаркера у субъекта, включая введение исследуемого вещества животному субъекту и детекцию и/или количественное определение уровня биомаркера, присутствующего в исследуемом образце, взятом у субъекта.
Термин «биомаркер» означает определенный биологический или биологически полученный маркер процесса, явления или состояния. Биомаркеры можно использовать в способах диагностики, например, для клинического массового обследования, для прогностической оценки и наблюдения результатов терапии, для выявления пациентов, реагирующих с наибольшей вероятностью на определенное терапевтическое лечение, а также для исследования и разработки лекарственных средств. Биомаркеры и их приложения представляют собой ценность для идентификации новых лекарственных средств и для детекции новых мишеней при использовании лекарственных средств.
Термины «детекция» и «диагностика» при использовании в настоящем описании означают определение, подтверждение и/или описание состояния заболевания. Способы детекции, наблюдения и диагностики согласно настоящему изобретению можно применять для подтверждения существования заболевания, наблюдения за развитием заболевания посредством определения его начала и прогрессирования, или оценки ослабления или рецидива заболевания. Способы детекции, наблюдения и диагностики также можно использовать в способах оценки клинического обследования, прогноза, выбора терапии, оценки терапевтической пользы, т.е. для исследования лекарственных средств и разработки лекарственных средств.
Эффективные способы диагностики и наблюдения представляют собой очень мощные «решения для пациентов», которые имеют возможность улучшенного прогноза за счет установления правильной диагностики, обеспечивая быстрое определение основных соответствующих видов лечения (таким образом, снижая нежелательное воздействие лекарственных средств, вызывающих вредные побочные эффекты) и сокращая вероятность рецидива.
Согласно одному варианту осуществления, указанный биомаркер высвобождается из клеток опухоли. Таким образом, согласно следующему аспекту настоящего изобретения, предложен способ детекции роста опухоли, включающий следующие стадии: (i) измерение биомаркера в биологическом образце, который связан с опухолью или высвобождается из ее клеток, и (ii) демонстрацию того, что с уровнем указанного биомаркера связаны размер, стадия, агрессивность или распространение опухоли.
Известно, что увеличение клеточного оборота, смерти клеток и апоптоза приводит к увеличению уровней циркулирующих внеклеточных нуклеосом (Holdenrieder et al., 2001). Уровень циркулирующих внеклеточных нуклеосом представляет собой неспецифический индикатор, который используется в разнообразных состояниях, включая воспалительные заболевания, большое разнообразие доброкачественных и злокачественных состояний, аутоиммунные заболевания, а также последующую травму или ишемию (Holdenrieder et al. 2001). Для специалистов в данной области будет очевидным, что настоящее изобретение находит применение в лечении разнообразных состояний, в которых у субъектов обнаруживаются циркулирующие нуклеосомы. Они включают, но без ограничения, травмы (например, в результате серьезного повреждения или хирургической операции), чрезмерные физические нагрузки (например, марафонский бег), инсульт, сердечный приступ, сепсис или другие серьезные инфекции. Авторы использовали способ иммунологического анализа согласно настоящему изобретению для измерения уровней нуклеосом и исследовали изменчивость их гистоновой и нуклеотидной структуры в случаях разнообразных заболеваний, в число которых входят кардиомиопатия, системная красная волчанка, язвенный колит, хроническое обструктивное заболевание легких, болезнь Крона и ревматоидный артрит, и сравнивали результаты с результатами для здоровых субъектов. Авторы смогли детектировать нуклеосомы и определить их относительные структуры (в отношении гистонового и нуклеотидного состава) для всех данных заболеваний. Поскольку способы согласно настоящему изобретению являются пригодными для детекции более широкого круга нуклеосом, чем существовавшие до настоящего времени методы ELISA для детекции нуклеосом, способы согласно настоящему изобретению находят применение в широкой области раковых и нераковых заболеваний.
Иммунологические анализы согласно настоящему изобретению включают иммунометрические анализы с применением ферментативных способов детекции (например, ELISA), иммунометрические анализы с флуоресцентной маркировкой, иммунометрические анализы с флуоресцентной маркировкой и временным разрешением, хемилюминесцентные иммунометрические анализы, иммунотурбидиметрические анализы, иммунометрические анализы с крупнодисперсной маркировкой и иммунорадиометрические анализы, а также и конкурентные способы иммунологического анализа, включая конкурентные способы иммунологического анализа с меченым антигеном и меченым антителом, в которых используются разнообразные типы маркировки, включая радиоактивные, ферментативные, флуоресцентные, флуоресцентные с временным разрешением и крупнодисперсные метки. Все указанные выше способы иммунологического анализа хорошо известны в данной области, см., например, работы Salgame et al. (1997) и van Nieuwenhuijze et al. (2003).
Согласно одному варианту осуществления, указанный биологический образец представляет собой биологическую жидкость. Например, биологические образцы, которые можно исследовать способом согласно настоящему изобретению, включают спинномозговую жидкость (СМЖ), цельную кровь, сыворотку крови, плазму, менструальную кровь, эндометриальную жидкость, мочу, слюну или другие биологические жидкости (стул, слезная жидкость, синовиальная жидкость, мокрота), выделяемый при дыхании пар, например, в форме сконденсированного пара, или экстракт или продукт очистки, или соответствующий продукт разведения. Биологические образцы также включают образцы, взятые у живых субъектов, или образцы, взятые посмертно. Образцы можно готовить, насколько это необходимо, например, разводить или концентрировать, и хранить обычным способом.
Согласно одному варианту осуществления настоящего изобретения, способ повторяют несколько раз. Данный вариант осуществления предоставляет преимущество возможности наблюдения результатов детекции в течение заданного периода времени. Такая возможность обеспечивает преимущество наблюдения или оценки эффективности лечения состояния заболевания. Такие способы наблюдения согласно настоящему изобретению можно использовать для наблюдения начала, развития, стабилизации, ослабления, рецидива и/или ремиссии.
Таким образом, настоящее изобретение относится к способу наблюдения эффективности терапии в отношении состояния заболевания субъекта, подозреваемого в присутствии такого заболевания, включающему детекцию и/или количественное определение биомаркера, который присутствует в биологическом образце, взятом у указанного субъекта. Согласно способам наблюдения, исследуемые образцы можно отбирать дважды или большее число раз. Способ может дополнительно включать сопоставление уровня биомаркера(ов), который(е) присутствует(ют) в исследуемом образце с одним контрольным образцом или несколькими контрольными образцами, и/или с одним или несколькими предшествующими исследуемыми образцами, взятыми ранее у того же исследуемого субъекта, например, до начала терапии, и/или у того же исследуемого субъекта на предшествующей стадии терапии. Способ может включать детекцию изменения природы или количества биомаркера(ов) в исследуемых образцах, взятых в различные сроки.
Таким образом, согласно следующему аспекту настоящего изобретения, предложен способ наблюдения эффективности терапии в отношении состояния заболевания у субъекта человека или животного, включающий:
(i) количественное определение количество биомаркера, как описано в настоящем описании; и
(ii) сопоставление количества указанного биомаркера в исследуемом образце с количеством, которое присутствует в одном контрольном образце или в нескольких контрольных образцах, и/или в одном или нескольких предшествующих исследуемых образцах, взятых ранее у того же исследуемого субъекта.
Изменение уровня биомаркера исследуемом образце по сравнению с его уровнем в предшествующем исследуемом образце, взятом ранее у того же исследуемого субъекта, может представлять собой показатель полезного эффекта, например, стабилизации или улучшения при использовании указанной терапии в отношении заболевания или подозреваемого заболевания. Кроме того, после завершения лечения способ согласно настоящему изобретению можно периодически повторять для предотвращения рецидива заболевания.
Способы наблюдения эффективности терапии можно применять для наблюдения терапевтической эффективности существующих типов терапии и новых типов терапии в отношении субъекта человека и животного другого вида (например, животного, служащего в качестве модели). Эти способы наблюдения можно внедрять в исследования новых лекарственных веществ и комбинаций веществ.
Согласно следующему варианту осуществления, наблюдение более быстрых изменений, обусловленных быстродействующими типами терапии, можно осуществлять с менее продолжительными интервалами, составляющими несколько часов или суток.
Согласно следующему аспекту настоящего изобретения, предложен способ идентификации биомаркера для детекции присутствия состояния заболевания. Термин «идентификация» при использовании в настоящем описании означает подтверждение присутствия биомаркера, который содержится в биологическом образце. Количественное определение количества биомаркера, присутствующего в образце, может включать определение концентрации биомаркера, присутствующего в образце. Идентификацию и/или количественное определение можно осуществлять, непосредственно используя образец или косвенно используя полученный из него экстракт или продукт его разведения.
Согласно альтернативным аспектам настоящего изобретения, присутствие биомаркера оценивают посредством детекции и/или количественного определения антитела или его фрагмента, способного осуществлять специфическое связывание биомаркера, и производимого организмом субъекта при воздействии биомаркера и, таким образом, присутствующего в биологическом образце, взятом у субъекта, находящегося в состоянии заболевания.
Идентификацию и/или количественное определение можно осуществлять, используя любой способ, подходящий для определения присутствия и/или количества специфического белка в биологическом образце, взятом у пациента, или в продукте очистки или экстракте биологического образца или продукта его разведения. Используя способы согласно настоящему изобретению, количественное определение можно осуществлять посредством измерения концентрации биомаркера в образце или образцах. Биологические образцы, которые можно исследовать способом согласно настоящему изобретению, включают образцы, которые описаны выше в настоящем описании. Данные образцы можно готовить, насколько это целесообразно, посредством разведения или концентрирования и хранить обычным образом.
Идентификацию и/или количественное определение биомаркеров можно осуществлять посредством детекции биомаркера или его фрагмента, например, фрагмента, содержащего разветвление у концевого атома C или разветвление у концевого атома N. Длина этих фрагментов предпочтительно составляет более чем 4 аминокислоты, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот. Следует отметить, в частности, что пептиды, содержащие такую же последовательность, как гистоновые хвосты, представляют собой особенно полезные фрагменты гистоновых белков.
Биомаркер можно детектировать непосредственно, например, используя методы усиленной поверхностью лазерной десорбции/ионизации (SELDI) или времяпролетной ионизации лазерной десорбции с использованием матрицы (MALDI-TOF). Альтернативно, биомаркер можно детектировать непосредственно или косвенно путем взаимодействия с лигандом или лигандами, такими как антитело или его связывающий биомаркер фрагмент, или с другим пептидом, или лигандом, например, аптамером, или олигонуклеотидом, способным осуществлять специфическое связывание биомаркера. Лиганд или связующее вещество может содержать обнаруживаемый индикатор, такой как люминесцентный, флуоресцентный или радиоактивный индикатор, и/или аффинный маркер.
Например, детекция и/или количественное определение можно осуществлять, используя один способ или несколько способов, выбранных из группы, состоящей из: (времяпролетной) усиленной поверхностью лазерной десорбции/ионизации (SELDI(-TOF)), (времяпролетной) ионизации лазерной десорбции с использованием матрицы (MALDI(-TOF)), одномерного (1-D) анализа на основе геля, двумерного (2-D) анализа на основе геля, масс-спектрометрии (МС), жидкостной хроматографии (с обращенной фазой) ((ОФ)ЖХ), гель-хроматографии (гель-фильтрация), ионообменной хроматографии, аффинной хроматографии, высокоэффективной жидкостной хроматографии (ВЭЖХ), жидкостной хроматографии ультравысокого давления (УДЖХ) и других методов, основу которых составляет ЖХ или сочетание ЖХ и МС. Соответствующие методы ЖХ-МС включают кодированный изотопом аффинный индикатор (ICAT®) от компании Applied Biosystems (штат Калифорния, США) или изобарический индикатор для относительного и абсолютного количественного определения (iTRAQ®) от компании Applied Biosystems (штат Калифорния, США). Могут быть также использованы жидкостная хроматография (например, высокоэффективная жидкостная хроматография (ВЭЖХ) или жидкостная хроматография низкого давления (НДЖХ)), тонкослойная хроматография и ЯМР (ядерный магнитный резонанс) спектроскопия.
Способы диагностики или наблюдения согласно настоящему изобретению могут включать анализ образца методами времяпролетной усиленной поверхностью лазерной десорбции/ионизации (SELDI TOF) или времяпролетной ионизации лазерной десорбции с использованием матрицы (MALDI TOF) для детекции присутствия или уровня биомаркера. Эти способы являются также подходящими, чтобы осуществлять клиническое обследование, прогноз, наблюдение результатов терапии, определение пациентов, реагирующих с наибольшей вероятностью на определенное терапевтическое лечение, исследования и разработки лекарственных средств и определение новых мишеней для применения лекарственных средств.
Идентификацию и/или количественное определение анализируемых биомаркеров можно осуществлять, применяя иммунологический способ с использованием антитела или его фрагмента, способного осуществлять специфическое связывание биомаркера. Подходящие иммунологические способы включают многослойные иммунологические анализы, такие как многослойный ELISA, в котором детекцию анализируемых биомаркеров осуществляют с использованием двух антител, которые распознают различные эпитопы на анализируемом биомаркере; радиоиммунологические анализы (РИА), непосредственные, косвенные или конкурентные твердофазные иммуноферментные анализы (ELISA), иммунологические ферментативные анализы (ИФА), флуоресцентные иммунологические анализы (ФИА), вестерн-блоттинг, иммунопреципитация и любой иммунологический анализ на основе частиц (например, с использованием частиц золота, серебра или латекса, магнитных частиц или квантовых точек). Иммунологические способы можно осуществлять, например, в формате микропланшета или микрополоски.
Согласно одному варианту осуществления, один или несколько биомаркеров может заменять молекула или пригодный для измерения фрагмент молекулы, которая предшествует биомаркеру или следует за ним на пути биологического процесса.
Идентификация ключевых биомаркеров, специфических по отношению к заболеванию, представляет собой основную задачу для интеграции диагностических процедур и терапевтических схем. Используя прогностические биомаркеры, можно разрабатывать соответствующие диагностические средства, такие как биосенсоры; соответственно, в способах и применениях согласно настоящему изобретению для осуществления идентификации и количественного определения могут применяться биосенсоры, микроаналитические системы, микротехнологические системы, микроразделительные системы, иммунохроматографические системы или другие подходящие аналитические устройства. Биосенсор может включать иммунологический способ детекции биомаркера (биомаркеров), электрические, термические, магнитные, оптические (например, голографические) или акустические технологии. С использованием таких биосенсоров становится возможным детекция целевого биомаркера(ов) в предполагаемых концентрациях, которые присутствуют в биологических образцах.
При использовании в настоящем описании термин «биосенсор» означает любое средство, которое способно осуществлять детекцию присутствия биомаркера. Примеры биосенсоров описаны в настоящем описании.
Согласно настоящему изобретению, биосенсоры могут включать лигандные связующие вещества или лиганды, как описано в настоящем описании, и способны осуществлять специфическое связывание биомаркера. Такие биосенсоры можно использовать для детекции и/или количественного определения биомаркера согласно настоящему изобретению.
Согласно настоящему изобретению, биомаркер(ы) можно детектировать с применением включающих биосенсоры технологий, основу которых составляют сканируемые голограммы или высокочастотные акустические системы, причем такие системы являются особенно приспособленными для конфигураций штриховых кодов или матриц.
В сенсорах на основе сканируемых голограмм от компании Smart Holograms Ltd. (Кембридж, Великобритания) голографическое изображение сохраняется на тонкой полимерной пленке, которая сенсибилизирована для специфической реакции с биомаркером. При облучении биомаркер реагирует с полимером, вызывая изменение изображения, которое представляет голограмма. Считываемый результат исследования может представлять собой изменение оптической яркости, изображения, цвета и/или положения изображения. Для качественных и полуколичественных приложений сенсорную голограмму можно считывать невооруженным глазом, устраняя, таким образом, необходимость в аналитическом оборудовании. Можно использовать простой цветовой сенсор для считывания сигнала, когда требуются количественные измерения. Работе сенсора не мешают ни матовость, ни цвет образца. Формат сенсора допускает мультиплексирование для одновременной детекции нескольких веществ. Можно разрабатывать обратимые и необратимые сенсоры для выполнения различных требований, и становится возможным непрерывное наблюдение определенных исследуемых биомаркеров.
Предпочтительно биосенсоры для детекции одного или нескольких биомаркеры согласно настоящему изобретению сочетают биомолекулярное распознавание и соответствующее приспособление, которое преобразует в сигнал обнаруженное присутствие или количественное определение биомаркера в образце. Биосенсоры можно приспосабливать для диагностических исследований в различных точках, например, в больнице, амбулаторном отделении, в хирургическом отделении, на дому, в полевых условиях и по месту работы.
Согласно настоящему изобретению, биосенсоры для детекции одного или нескольких биомаркеров включают акустические, плазмонные резонансные, голографические, биослойные интерферометрические (БСИ) и микротехнологические сенсоры. Впечатанные распознающие элементы, тонкопленочные транзисторные технологии, магнитоакустические резонансные устройства и другие новые акустоэлектрические системы можно использовать в биосенсорах для детекции одного или нескольких биомаркеров согласно настоящему изобретению.
Способы, включающие идентификацию и/или количественное определение одного или нескольких биомаркеров согласно настоящему изобретению, можно осуществлять, используя стационарные измерительные приборы, или их можно применять в мобильных диагностических или измерительных устройствах, которые можно устанавливать вне лабораторного помещения, например, в кабинете врача или у койки пациента. Подходящие биосенсоры для осуществления способов согласно настоящему изобретению включают пластиковые карты с оптическими или акустическими считывающими устройствами. Биосенсоры могут осуществлять функцию электронной передачи собранных данных врачу для интерпретации, и, таким образом, они могут представлять собой основу для электронного обмена медицинской информацией.
В настоящем описании описаны диагностические наборы для определения и наблюдения присутствующего состояния заболевания. Согласно одному варианту осуществления, эти наборы дополнительно содержат биосенсор, способный производить идентификацию и/или количественное определение биомаркера. Предпочтительно набор согласно настоящему изобретению может содержать один или несколько компонентов выбранных из группы, включающей лигандные связующие вещества или лиганды, специфические для биомаркера, или имитаторы структуры/формы биомаркера, один или несколько контрольных стандартов, один или несколько реагентов и один или несколько расходных материалов; необязательно вместе с инструкциями для применения набора в соответствии с любым из способов, как описано в настоящем описании.
Идентификация биомаркеров для состояния заболевания позволяет интегрировать диагностические процедуры и терапевтические схемы. Детекцию биомаркера согласно настоящему изобретению можно использовать для обследования субъектов перед их участием в клинических исследованиях. Биомаркеры представляют собой средства, показывающие терапевтический эффект, отсутствие эффекта, профиль неблагоприятных побочных эффектов, степень соответствия лекарственного средства и достижение достаточных уровней лекарственных средств в сыворотке. Биомаркеры можно использовать в качестве средства предупреждения о неблагоприятной реакции на лекарственное средство. Биомаркеры можно использовать для разработки персонализированных типов терапии, поскольку оценку реакции можно использовать для тонкого регулирования дозировки, сведения к минимуму числа выписываемых лекарственных средств, сокращения задержки в достижении эффективности терапии и предотвращения неблагоприятных реакций на лекарственные средства. Таким образом, посредством наблюдения за биомаркерами согласно настоящему изобретению можно точно регулировать лечение пациента в соответствии с требованиями, определяемыми заболеванием и фармакогеномным профилем пациента; таким образом, биомаркер можно использовать для установления оптимальной дозы, прогноза положительной терапевтической реакции и определения пациентов, подверженных высокому риску серьезных побочных эффектов.
Тестирования на основе биомаркеров обеспечивают первоочередную оценку новых пациентов и представляют собой объективные средства для точной и быстрой диагностики, которая является недостижимой с использованием средств, существовавших до настоящего времени.
Кроме того, диагностические исследования на основе биомаркеров можно использовать для определения членов семьи или пациентов, которые имеют легкое или бессимптомное заболевание, или которые могут быть подвергнуты высокому риску развития симптоматического заболевания. Это позволяет предпринимать соответствующие терапевтические или профилактические меры, например, снижающие факторы риска. Признано, что такие подходы улучшают результативность лечения и могут предотвращать явное возникновение заболевания.
Биомаркерные способы наблюдения, биосенсоры и наборы также являются актуальными в качестве средств для наблюдения пациентов, дающие возможность врачу определить, обусловлен ли рецидив ухудшением заболевания. Если фармакологическое лечение оказывается недостаточным, то терапию можно возобновлять или усиливать; изменение терапии можно осуществлять, если это целесообразно. Поскольку биомаркеры обладают чувствительностью к состоянию заболевания, они представляют собой показатель эффективности лекарственной терапии.
Далее настоящее изобретение будет проиллюстрировано со ссылкой на следующие неограничивающие примеры.
Пример 1
Образцы крови человека, содержащие внеклеточные нуклеосомы, взятые у здоровых субъектов и изготовленные способом согласно описанию Holdenrieder (*Holdenrieder et al., 2001), исследовали методом ELISA, чтобы определить связанный с нуклеосомами гистоновый вариант макроH2A1.1, используя твердофазное анти-гистоновое иммобилизованное антитело, которое связывает неизмененные нуклеосомы, и биотинилированное аффинное очищенное поликлональное идентифицирующее антитело анти-гистонового варианта макроH2A1.1. Образец крови человека последовательно разводили фетальной телячьей сывороткой и исследовали в двух повторах методом ELISA без разведения и при разведениях 1:2, 1:4 и 1:8. Чистую фетальную телячью сыворотку также исследовали методом ELISA в качестве контрольного образца, в котором не содержались внеклеточные нуклеосомы. Анализ осуществляли следующим образом: раствор антигистонового антитела в 0,1М фосфатном буфере, pH 7,4, добавляли в лунки микропланшета (100 мкл/лунка) и инкубировали в течение ночи при 4°C для покрытия лунки иммобилизованным антителом. Избыток антигистонового антитела декантировали. Раствор бычьего сывороточного альбумина (20 г/л) добавляли в лунки (150 мкл/лунка) и инкубировали в течение 60 минут при комнатной температуре, для блокировки избыточных областей связывания белка на лунках. Избыток раствора бычьего сывороточного альбумина декантировали, и лунки промывали два раза буфером (200 мкл/лунка, 0,05М буфер TRIS/HCl pH 7,5, содержащий 1% Tween 20). Образец (10 мкл/лунка) и аналитический буфер (50 мкл/лунка), 0,05М TRIS/HCl pH 7,5, содержащий 0,9% NaCl, 0,05% деоксихолат натрия и 1% заменитель Nonidet P40) добавляли в лунки и инкубировали в течение 90 минут при комнатной температуре при умеренном перемешивании. Смесь образца и аналитического буфера декантировали, и лунки промывали три раза промывочным буфером (200 мкл/лунка). Раствор биотинилированного аффинного очищенного поликлонального идентифицирующего антитела анти-гистонового варианта макроH2A1.1 добавляли по 50 мкл/лунка и инкубировали в течение 90 минут при комнатной температуре при умеренном перемешивании. Избыток идентифицирующего антитела декантировали, и лунки снова промывали три раза промывочным буфером (200 мкл/лунка). Раствор, содержащий конъюгат стрептавидина и пероксидазы хрена, добавляли по 50 мкл/лунка и инкубировали в течение 30 минут при комнатной температуре при умеренном перемешивании. Избыток конъюгата декантировали, и лунки снова промывали три раза промывочным буфером (200 мкл/лунка). Окрашенный раствор субстрата (100 мкл/лунка, диаммониевая соль 2,2’-азинобис-3-этилбензотиазолин-6-сульфоновой кислоты) добавляли (100 мкл/лунка) и инкубировали в течение 30 минут при комнатной температуре при умеренном перемешивании. Добавляли STOP раствор, содержащий 1% додецилсульфат натрия (100 мкл/лунка), и оптическую плотность (OD) лунок измеряли при длине волны 405 нм, используя стандартный микропланшет-ридер. Воспроизводимую кривую доза-ответ с усилением цвета при увеличении концентрации связанного с нуклеосомами гистонового варианта макроH2A1.1 наблюдали при низком фоновом сигнале, измеренном при отсутствии связанного с нуклеосомами гистонового варианта макроH2A1.1 (фетальная телячья сыворотка). Положительный сигнал ELISA показывает, что гистоновый вариант макроH2A1.1, детектированный методом ELISA, внедряется в нуклеосому, поскольку используемое иммобилизованное антитело связывается с гистонами в неизмененных нуклеосомах и не связывается с гистоном H2. Результаты представлены на фиг.1.
Пример 2
Коммерчески доступный нуклеосомный препарат, полученный гидролизом хроматина, экстрагированного из клеток MCF7, в котором ДНК и белки в нуклеосоме являются перекрестно-сшитыми для стабильности (для гарантии того, что все гистоны, которые присутствуют в препарате, внедрены в неизмененные нуклеосомы), анализировали с помощью метода ELISA для связанного с нуклеосомами гистонового варианта макроH2A2, используя твердофазное анти-гистоновое иммобилизованное антитело, которое связывает неизмененные нуклеосомы, и идентифицирующее антитело биотинилированного аффинного очищенного поликлонального анти-гистонового варианта макроH2A2. Нуклеосомный образец последовательно разводили фетальной телячьей сывороткой и исследовали в двух повторах методом ELISA. Чистую фетальную телячью сыворотку также исследовали методом ELISA в качестве контрольного образца, в котором не содержались внеклеточные нуклеосомы. Анализ осуществляли следующим образом: раствор антигистонового антитела в 0,1М фосфатном буфере, pH 7,4, добавляли в лунки микропланшета (100 мкл/лунка) и инкубировали в течение ночи при 4°C, для покрытия лунки иммобилизованным антителом. Избыток антигистонового антитела декантировали. Раствор бычьего сывороточного альбумина (20 г/л) добавляли в лунки (200 мкл/лунка) и инкубировали в течение 30 минут при комнатной температуре, для блокировки избыточных областей связывания белка на лунках. Избыток раствора бычьего сывороточного альбумина декантировали, и лунки промывали три раза промывочным буфером (200 мкл/лунка, 0,05М буфер TRIS/HCl, pH 7,5, содержащий 1% Tween 20). Образец (10 мкл/лунка) и аналитический буфер (50 мкл/лунка, 0,05М TRIS/HCl, pH 7,5, содержащий 0,9% NaCl, 0,05% деоксихолат натрия и 1% заменитель Nonidet P40) добавляли в лунки и инкубировали в течение ночи при 4°C. Смесь образца и аналитического буфера декантировали, и лунки промывали три раза промывочным буфером (200 мкл/лунка). Раствор биотинилированного аффинного очищенного поликлонального идентифицирующего антитела анти-гистонового варианта макроH2A1.1 добавляли (50 мкл/лунка) и инкубировали в течение 90 минут при комнатной температуре при умеренном перемешивании. Избыток идентифицирующего антитела декантировали, и лунки снова промывали три раза промывочным буфером (200 мкл/лунка). Раствор, содержащий конъюгат стрептавидина и пероксидазы хрена, добавляли (50 мкл/лунка) и инкубировали в течение 30 минут при комнатной температуре при умеренном перемешивании. Избыток конъюгата декантировали, и лунки снова промывали три раза промывочным буфером (200 мкл/лунка). Окрашенный раствор субстрата (100 мкл/лунка, диаммониевая соль 2,2’-азинобис-3-этилбензотиазолин-6-сульфоновой кислоты) добавляли и инкубировали в течение 20 минут при комнатной температуре при умеренном перемешивании. Оптическую плотность (OD) лунок измеряли при длине волны 405 нм, используя стандартный микропланшет-ридер. Кривую доза-ответ с усилением цвета при увеличении концентрации связанного с нуклеосомами гистонового варианта макроH2A2 наблюдали при низком фоновом сигнале, измеренном при отсутствии гистонового варианта макроH2A2 (фетальная телячья сыворотка). Положительный сигнал ELISA показывает, что гистоновый вариант макроH2A2, детектированный методом ELISA, внедряется в нуклеосому, поскольку (i) какие-либо свободные гистоны не присутствуют в образце, и (ii) используемое иммобилизованное антитело связывается с гистонами в неизмененных нуклеосомах и не связывается с гистоном H2. Результаты представлены на фиг. 2.
Пример 3
Коммерчески доступный нуклеосомный препарат, полученный гидролизом хроматина, экстрагированного из клеток MCF7, в котором ДНК и белки являются перекрестно-сшитыми для стабильности (для гарантии того, что все гистоны, которые присутствуют в препарате, внедрены в неизмененные нуклеосомы), анализировали с помощью метода ELISA для связанного с нуклеосомами гистонового варианта H2AZ при использовании твердофазного анти-гистонового иммобилизованного антитела, которое связывает неизмененные нуклеосомы и не связывает гистон H2, и идентифицирующего антитела биотинилированного аффинного очищенного поликлонального анти-гистонового варианта H2AZ. Подробности аналитической процедуры аналогичны описанным выше в примере 2. Воспроизводимую кривую доза-ответ с усилением цвета при увеличении концентрации связанного с нуклеосомами гистонового варианта H2AZ наблюдали при низком фоновом сигнале, измеряемом при отсутствии связанного с нуклеосомами гистонового варианта H2AZ (фетальная телячья сыворотка). Положительный сигнал ELISA показывает, что детектированный гистоновый вариант макроH2A2 внедряется в нуклеосому, поскольку (i) какие-либо свободные гистоны не присутствуют в образце, и (ii) используемое иммобилизованное антитело связывается с гистонами в неизмененных нуклеосомах и не связывается с гистоном H2. Результаты представлены на фиг.3.
Пример 4
Авторы использовали два нуклеосомных метода ELISA предшествующего уровня техники для измерения содержания циркулирующих внеклеточных нуклеосом в образцах сыворотки и плазмы крови, взятых у 20 здоровых субъектов. Первый существующий метод ELISA (ELISA 1) представлял собой метод ELISA от компании Roche для определения клеточной смерти, и в другом методе ELISA (ELISA 2) использовали анти-гистоновое иммобилизованное антитело и идентифицирующее антитело комплекса анти-гистон-ДНК. Уровни нуклеосом, детектированные обоими существующими нуклеосомными методами ELISA, одновременно оказались ниже в нормальной плазме, чем в нормальной сыворотке. Нормальный интервал (выраженный в единицах оптической плотности) вычисляли для уровня нуклеосом в сыворотке (как среднее±удвоенное среднеквадратическое отклонение от среднего значения результатов исследования сыворотки 20 здоровых субъектов) и он составил 0-4,3 единиц оптической плотности для ELISA 1 и 0-1,4 для ELISA 2. Соответствующие интервалы для плазмы составляли от 0 до 0,95 и от 0 до 0,96. Результаты представлены на фиг.4.
Авторы также измеряли уровни нуклеосом, содержащих гистоновую ПТМ и два нуклеотида, а также три связанных с нуклеосомами гистоновых варианта mH2A1.1, mH2A2 и H2AZ, в тех же образцах. Результаты показывают, что образцы сыворотки, взятые у здоровых субъектов, имеют одинаково низкие уровни нуклеосом, содержащих гистоновые варианты или ПТМ или нуклеотиды. Нормальные интервалы (выраженные в единицах оптической плотности) для уровня нуклеосом, содержащих гистоновые варианты, ПТМ или нуклеотиды, в сыворотке, составляли: (a) 0-0,36 для mH2A1.1, (b) 0,05-0,78 для mH2A2, (c) 0,11-0,58 для H2AZ, (d) 0,06-0,61 для P-H2AX (Ser139), (e) 0,06-0,36 для 5-метилцитозина и (f) 0,03-0,36 для 5-гидроксиметилцитозина. Результаты измерений содержащей EDTA плазмы оказались выше для всех 20 здоровых субъектов. Результаты представлены на фиг.5, 6, 7, 8, 9 и 10.
Пример 5
Авторы измеряли внеклеточные нуклеосомы в содержащей EDTA плазме, взятой у 13 здоровых субъектов и 55 субъектов, страдающих раком желудка, толстой кишки, прямой кишки, легкого (мелкоклеточная карцинома и разнообразные немелкоклеточные карциномы), молочной железы, яичника, предстательной железы, почки и различных органов полости рта (полость рта, небо, глотка и гортань). Все из образцов, взятых у здоровых субъектов и страдающих раком пациентов, оказались положительными в отношении внеклеточных нуклеосом. Однако уровни, обнаруженные в образцах, взятых у страдающих раком субъектов, оказались выше, чем было обнаружено в образцах, взятых у здоровых субъектов, и результаты продемонстрировали, что можно различать здоровых и страдающих раком субъектов. Например, нормальный интервал оптической плотности, вычисленный как среднее значение±удвоенное среднеквадратическое отклонение от среднего значения, для анализа нуклеосом H2AZ составлял 0-0,95. При использовании данного уровня отсечки, составляющего 0,95, все 13 здоровых субъектов оказались отрицательными в отношении повышенных уровней нуклеосом H2AZ. С другой стороны, положительный результат в отношении повышенных уровней нуклеосом H2AZ был обнаружен для 46 из 55 раковых образцов (итоговая клиническая чувствительность составляла 84%), включая 100% (8 из 8) в отношении рака желудка, 100% (5 из 5) в отношении рака толстой кишки, 67% (2 из 3) в отношении рака прямой кишки, 83% (5 из 6) в отношении мелкоклеточного рака легкого, 79% в отношении немелкоклеточного рака легкого, 50% (3 из 6) в отношении рака молочной железы, 100% (1 из 1) в отношении рака яичника, 100% (1 из 1) отношении рака поджелудочной железы, 80% (4 из 5) в отношении рака предстательной железы, 100% (1 из 1) в отношении рака почки и 100% (5 из 5) в отношении рака полости рта. Результаты представлены на фиг.19.
Аналогичным образом, для анализа связанного с нуклеосомами mH2A1.1 нормальный интервал составлял 0-0,91. При использовании данного уровня отсечки все 13 здоровых образцов оказались отрицательными, и 64% (35 из 55) раковых образцов оказались положительными. Для связанного с нуклеосомами P-H2AX (Ser139) анализа нормальный интервал составлял 0-1,08. При использовании данного уровня отсечки все 13 здоровых образцов оказались отрицательными и 60% (33 из 55) раковых образцов оказались положительными. Связанный с нуклеосомами 5-метилцитозин также измеряли, нормальный интервал для этого анализа составлял 0-1,41. При использовании данного уровня отсечки все 13 здоровых образцов оказались отрицательными, и 55% (30 из 55) раковых образцов оказались положительными.
Авторы также использовали способы согласно настоящему изобретению для измерения других разнообразных связанных с нуклеосомами структур в тех же образцах. Результаты этих иммунологических анализов компилировали, для получения профиля нуклеосомных структур в образцах, взятых у страдающих раком пациентов, нормированных по отношению к обнаруженным уровням нуклеосом, содержащих 5-метилцитозин. Авторы сравнивали полученные в результате профили с нуклеосомной структурой образцов, взятых у здоровых субъектов. Профиль нуклеосомной структуры внеклеточных нуклеосом оказался отличающимся от профилей здоровых субъектов. Результаты представлены на фиг. 23. Аналогичным образом, авторы компилировали нуклеосомные структурные профили для образцов, взятых у страдающих разнообразными нераковыми заболеваниями пациентов, и сравнивали их с профилями нуклеосом в образцах, взятых у страдающих раком пациентов и у здоровых субъектов. Результаты представлены на фиг.24.
Затем авторы осуществили еще один аналогичный эксперимент с исследованием образцов, взятых у 10 здоровых субъектов, а также у 62 пациентов, страдающих раком разнообразных типов. Результаты оказались аналогичными результатам первого эксперимента. Например, при использовании результатов для связанного с нуклеосомами гистонового варианта H2AZ и уровня отсечки, составляющего среднее значение+удвоенное среднеквадратическое отклонение от среднего значения результатов для здоровых субъектов, отрицательные результаты были получены для всех 10 здоровых субъектов, и положительные результаты были получены для 95% (59 из 62) страдающих раком пациентов, включая 9 из 9 страдающих раком предстательной железы пациентов, 5 из 5 страдающих раком кожи пациентов, 6 из 8 страдающих раком пищевода пациентов, 12 из 13 страдающих раком мочевого пузыря пациентов, 2 из 2 страдающих раком шейки матки пациенток, 1 из 1 страдающего раком ободочной кишки пациента, 4 из 4 страдающих раком молочной железы пациенток, 7 из 7 страдающих раком яичника пациенток, 7 из 7 страдающих раком гортани пациентов, 3 из 3 страдающих раком легкого пациентов и 3 из 3 страдающих раком почки пациентов. Этот результат показывает, что связанные с нуклеосомами гистоновые варианты представляют собой клинически чувствительные биомаркеры для рака. Результаты представлены на фиг.20.
Пример 6
Авторы использовали два нуклеосомных метода ELISA известного уровня техники для измерения содержания циркулирующих внеклеточных нуклеосом в содержащих EDTA образцах плазмы, взятых у трех субъектов, страдающих раком ободочной кишки, 13 субъектов, страдающих раком легкого, двух субъектов, страдающих раком поджелудочной железы, одного субъекта, страдающего раком полости рта, и в нуклеосомном образце, взятом у здоровых субъектов, согласно способу Holdenrieder (*Holdenrieder et al., 2001). Первый существующий метод ELISA (ELISA 1) представлял собой метод ELISA от компании Roche для определения клеточной смерти, и в другом методе ELISA (ELISA 2) использовали анти-гистоновое иммобилизованное антитело и идентифицирующее антитело комплекса анти-гистон-ДНК.
Авторы также измеряли уровни нуклеосом, содержащих три гистоновых варианта, гистоновую ПТМ и два нуклеотида. Результаты показывают, что, несмотря на низкое количество нуклеосом, детектированных методами ELISA известного уровня техники для большинства субъектов, особенно для страдающих раком поджелудочной железы и раком полости рта пациентов, большинство из этих образцов имеют повышенные достаточные для детекции уровни нуклеосом, которые содержат один или несколько связанных с нуклеосомами гистоновых вариантов. Результаты для образцов, взятых у трех субъектов, страдающих раком ободочной кишки, 13 субъектов, страдающих раком легкого, двух субъектов, страдающих раком поджелудочной железы, и одного субъекта, страдающего раком полости рта, представлены на фиг.11, 12, 13 и 14, соответственно. Значительные уровни связанных с нуклеосомами гистоновых вариантов детектировали в 16 из 19 раковых образцов (всех, кроме трех образцов рака легкого). Кроме того, связанный с нуклеосомами 5-гидроксиметилцитозин был детектирован в 12 из 19 раковых образцов, и связанный с нуклеосомами 5-метилцитозин был детектирован во всех 19 раковых образцах.
Кроме того, картина уровней нуклеосом, содержащих различные уровни гистоновых вариантов, не является одинаковой для всех субъектов, но различные картины выявляются для различных исследованных типов рака. Чтобы упростить сравнение между результатами для субъектов, страдающих раком одинаковых или различных типов, результаты для исследования нуклеосом (для нуклеосом, содержащих макроH2A1.1, макроH2A2, H2AZ, P-H2AX (Ser139), 5-метилцитозин и 5-гидроксиметилцитозин) нормировали в форме пропорции к сигналу оптической плотности, который наблюдали для нуклеосом, содержащих 5-метилцитозин. Нормированные результаты (с планками погрешностей, которые показывают среднеквадратическое отклонение от среднего значения результатов в тех случаях, где исследовали образцы от более чем одного субъекта) представлены для каждого типа рака на фиг.15 вместе с соответствующими результатами для нуклеосомных образцов, взятых у здоровых субъектов (mH2A2 и 5-гидроксиметилцитозин не измеряли для этого образца). На фиг.15 показано, что картина распределения нуклеосом, содержащих различные нормированные гистоновые варианты, нуклеотиды или ПТМ, для всех исследованных типов рака достаточно заметно отличается от картины распределения нуклеосом в образцах, взятых у здоровых субъектов. Таким образом, настоящее изобретение можно использовать в качестве способа детекции в массовом обследовании на основе анализа крови. Для специалистов в данной области будет очевидным, что настоящее изобретение включает исследование нуклеосом, содержащих другие дополнительные гистоновые варианты, нуклеотиды и/или гистоновые модификации, чтобы дополнительно или лучше устанавливать различие между циркулирующими внеклеточными нуклеосомами, возникающими в результате опухолевого или другого заболевания.
Кроме того, наблюдаемая картина типов нуклеосом отличается при различных типах рака. Например, образец, взятый у субъекта, страдающего раком полости рта, имеет меньшие нормированные уровни обеих нуклеосом, содержащих mH2A2 или P-H2AX (Ser139), чем образец любого из трех других типов рака. Аналогичным образом, образцы, взятые у субъектов, страдающих раком поджелудочной железы, можно отличить от образцов, взятых у субъектов, страдающих раком ободочной кишки, на основании различных нормированных уровней нуклеосом, содержащих вариант макроH2A1.1. Таким образом, настоящее изобретение может быть использовано в качестве способа общей диагностики рака, а также чтобы различать определенные типы рака. Для специалистов в данной области будет очевидным, что настоящее изобретение включает исследование нуклеосом, содержащих другие дополнительные гистоновые варианты и/или гистоновые модификации и/или нуклеотиды, чтобы дополнительно или лучше устанавливать различие между циркулирующими внеклеточными нуклеосомами, возникающими в результате различных специфических опухолей или в результате других заболеваний.
Пример 7
Авторы измеряли уровни связанных с нуклеосомами гистоновых вариантов в образцах сыворотки, взятых у 4 здоровых субъектов, и в образцах сыворотки, взятых у 20 субъектов, страдающих раком поджелудочной железы, с использованием описанного выше способа согласно настоящему изобретению. При использовании уровня отсечки, составляющего 0,27 (среднее значение+удвоенное среднеквадратическое отклонение от среднего значения уровней, обнаруженных у здоровых субъектов), уровни связанного с нуклеосомами H2AZ оказались повышенными в 80% (16 из 20) образцов, взятых у страдающих раком поджелудочной железы пациентов, и ни у одного из здоровых субъектов. Результаты представлены на фиг.21.
Пример 8
Авторы измеряли уровни связанного с нуклеосомами гистона H2AZ человека в некоторых образцах, взятых у страдающих раком пациентов, с использованием идентифицирующего антитела биотинилированного анти-H2AZ, как описано в примере 3. Данный способ осуществляли дважды с использованием двух различных моноклональных анти-гистоновых иммобилизованных антител для определения воспроизводимости результатов в отношении H2AZ для различных иммобилизованных антител. Результаты на фиг.16 показывают, что уровни связанного с нуклеосомами гистона H2AZ в двух анализах линейно связаны с линией наилучшего соответствия, которая проходит приблизительно через ноль. Единицы представляют собой просто показания оптической плотности.
Пример 9
Авторы измеряли уровни связанного с нуклеосомами гистона H2AZ человека в содержащих EDTA образцах плазмы, взятых у страдающих раком легкого пациентов, согласно описанию в примере 3. Обнаруженные уровни показывают корреляцию с прогрессирующим заболеванием пациентов. Результаты, представленные на фиг.22, показывают, что уровни связанного с нуклеосомами гистона H2AZ увеличиваются с повышением степени тяжести заболевания в отношении размера, стадии, распространения узлов и распространения удаленных метастаз, и уровни связанного с нуклеосомами гистона H2AZ можно использовать, в том числе отдельно или как часть диагностической группы, в качестве маркеров узлов, размера, стадии или прогрессирующих метастаз.
Список литературы
Allen et al, A simple method for estimating global DNA methylation using bisulfite PCR of repetitive DNA elements. Nucleic Acids Research: 32(3) e38DOI: 10.1093/nar/gnh032.
Bawden et al, Detection of histone modification in cell-free nucleosomes. WO 2005/019826, 2005.
Boulard et al, Histone variant macroH2A1 deletion in mice causes female-specific steatosis. Epigenetics & Chromatin: 3(8), 1-13, 2010 Cell Biolabs, Inc. Product Manual for "Global DNA Methylation ELISA Kit (5'-methyl-2'-deoxycytidine Quantitation", 2011.
Dai et al, Detection of Post-translational Modifications on Native Intact Nucleosomes by ELISA. http://www.jove.com/details.php?id=2593 doi: 10.3791/2593. J Vis Exp. 50 (2011).
Deligezer et al, Sequence-Specific Histone Methylation Is Detectable on Circulating Nucleosomes in Plasma. Clinical Chemistry 54(7), 1125-1131, 2008.
Epigentek Group Inc, Methylamp™ Global DNA Methylation Quantification Kit, User Guide, Version 2.0802, 2009.
Esteller, Cancer epigenomics: DNA methylomes and histone-modification maps Nature Reviews Genetics: 8, 286-298, 2007.
Feinberg and Vogelstein, Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature: 301, 89-92, 1983.
Grutzmann et al, Sensitive Detection of Colorectal Cancer in Peripheral Blood by Septin 9 DNA Methylation Assay. PLoS ONE 3(11): e3759. doi:10.1371/journal.pone.0003759, 2008.
Hervouet et al, Disruption of Dnmt1/PCNA/UHRF1 Interactions Promotes Tumorigenesis from Human and Mice Glial Cells PLoS ONE 5(6): e11333. doi:10.1371/journal.pone.0011333, 2010.
Hua et al, Genomic analysis of estrogen cascade reveals histone variant H2A.Z associated with breast cancer progression. Molecular Systems Biology 4; Article number 188; doi:10.1038/msb.2008.25, 2008.
Herranz and Esteller, DNA methylation and histone modifications in patients with cancer: potential prognostic and therapeutic targets. Methods Mol Biol.361:25-62, 2007.
Holdenrieder et al, Nucleosomes in serum of patients with benign and malignant diseases. Int. J. Cancer (Pred. Oncol.): 95, 114-120, 2001.
*Holdenrieder et al, Nucleosomes in Serum as a Marker for Cell Death. Clin Chem Lab Med; 39(7), 596-605, 2001.
Holdenrieder et al, Cell-Free DNA in Serum and Plasma: Comparison of ELISA and Quantitative PCR. Clinical Chemistry: 51(8), 1544-1546, 2005.
Holdenreider and Stieber, Clinical use of circulating nucleosomes. Critical Reviews in Clinical Laboratory Sciences; 46(1): 1-24, 2009.
Kapoor et al, The histone variant macroH2A suppresses melanoma progression through regulation of CDK8. Nature: 468, 1105-1111, 2010.
Mansour et al, The Prognostic Significance of Whole Blood Global and Specific DNA Methylation Levels in Gastric Adenocarcinoma. PLoS ONE 5(12): e15585. doi:10.1371/journal.pone.0015585, 2010.
Moore et al, Genomic DNA hypomethylation as a biomarker for bladder cancer susceptibility in the Spanish Bladder Cancer Study: a case-control study. The Lancet Oncology: 9(4), 359-366, 2008.
Ogoshi et al, Genome-wide profiling of DNA methylation in human cancer cells. Genomics: In Press, 2011.
Pennings et al, DNA methylation, nucleosome formation and positioning. Briefings in functional genomics and proteomics: 3(4), 351-361, 2005.
Rodriguez-Paredes and Esteller, Cancer epigenetics reaches mainstream oncology. Nature Medicine: 17(3), 330-339, 2011.
Salgame et al, An ELISA for detection of apoptosis. Nucleic Acids Research, 25(3), 680-681, 1997.
Sporn et al, Histone macroH2A isoforms predict the risk of lung cancer recurrence. Oncogene: 28(38), 3423-8, 2009.
Stroud et al, 5-Hydroxymethylcytosine is associated with enhancers and gene bodies in human embryonic stem cells. Genome Biology: 12:R54, 2011.
Tachiwana et al, Structures of human nucleosomes containing major histone H3 variants. Acta Cryst: D67, 578-583, 2011.
Ting Hsiung et al, Global DNA Methylation Level in Whole Blood as a Biomarker in Head and Neck Squamous Cell Carcinoma. Cancer Epidemiology, Biomarkers & Prevention: 16(1), 108-114, 2007.
van Nieuwenhuijze et al, Time between onset of apoptosis and release of nucleosomes from apoptotic cells: putative implications for sysytemic lupus erythematosus. Ann Rheum Dis; 62: 10-14, 2003.
Vasser et al, Measurement of Global DNA Methylation. Genetic Engineering and Biotechnology News: 29(7), 2009.
Whittle et al, The Genomic Distribution and Function of Histone Variant HTZ-1 during C. elegans Embryogenesis. PLoS Genet 4(9): 1-17, 2008.
Zee et al, Global turnover of histone post-translational modifications and variants in human cells Epigenetics & Chromatin. 3(22): 1-11, 2010.
Zhang et al, Analysis of global DNA methylation by hydrophilic interaction ultra high-pressure liquid chromatography tandem mass spectrometry. Analytical Biochemistry: 413(2), 164-170, 2011.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДЕТЕКЦИИ НУКЛЕОСОМ, СОДЕРЖАЩИХ НУКЛЕОТИДЫ | 2012 |
|
RU2687483C2 |
| СПОСОБ ДЕТЕКЦИИ АДДУКТОВ НУКЛЕОСОМ | 2012 |
|
RU2634266C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОЧИСТКИ КРОВИ ОТ ЦИРКУЛИРУЮЩЕЙ ВНЕКЛЕТОЧНОЙ ДНК | 2018 |
|
RU2779220C2 |
| СПОСОБ СКРИНИНГА ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ - ИНГИБИТОРОВ PARP1 НА ОСНОВЕ БИОХИМИЧЕСКИХ МЕТОДОВ АНАЛИЗА | 2015 |
|
RU2639535C2 |
| ТЕСТ-СИСТЕМА ДЛЯ СКРИНИНГА ХИМИЧЕСКИХ СОЕДИНЕНИЙ НА НАЛИЧИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТИ В ОТНОШЕНИИ PARP-1 | 2016 |
|
RU2649767C1 |
| СПОСОБ ТЕСТИРОВАНИЯ ВЕЩЕСТВ, ВЛИЯЮЩИХ НА ПРОЦЕСС СТАРЕНИЯ | 2011 |
|
RU2497950C2 |
| ГИСТОНЫ И/ИЛИ PROADM В КАЧЕСТВЕ МАРКЕРОВ, СВИДЕТЕЛЬСТВУЮЩИХ ОБ ОРГАННОЙ ДИСФУНКЦИИ | 2017 |
|
RU2764766C2 |
| ГИСТОНЫ И/ИЛИ PROADM В КАЧЕСТВЕ МАРКЕРОВ, СВИДЕТЕЛЬСТВУЮЩИХ О НЕБЛАГОПРИЯТНОМ СОБЫТИИ | 2017 |
|
RU2765212C2 |
| ПРОАДРЕНОМЕДУЛЛИН В КАЧЕСТВЕ МАРКЕРА, УКАЗЫВАЮЩЕГО НА НЕБЛАГОПРИЯТНОЕ СОБЫТИЕ | 2018 |
|
RU2775090C2 |
| ИНГИБИТОРЫ EZH2 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2618475C2 |
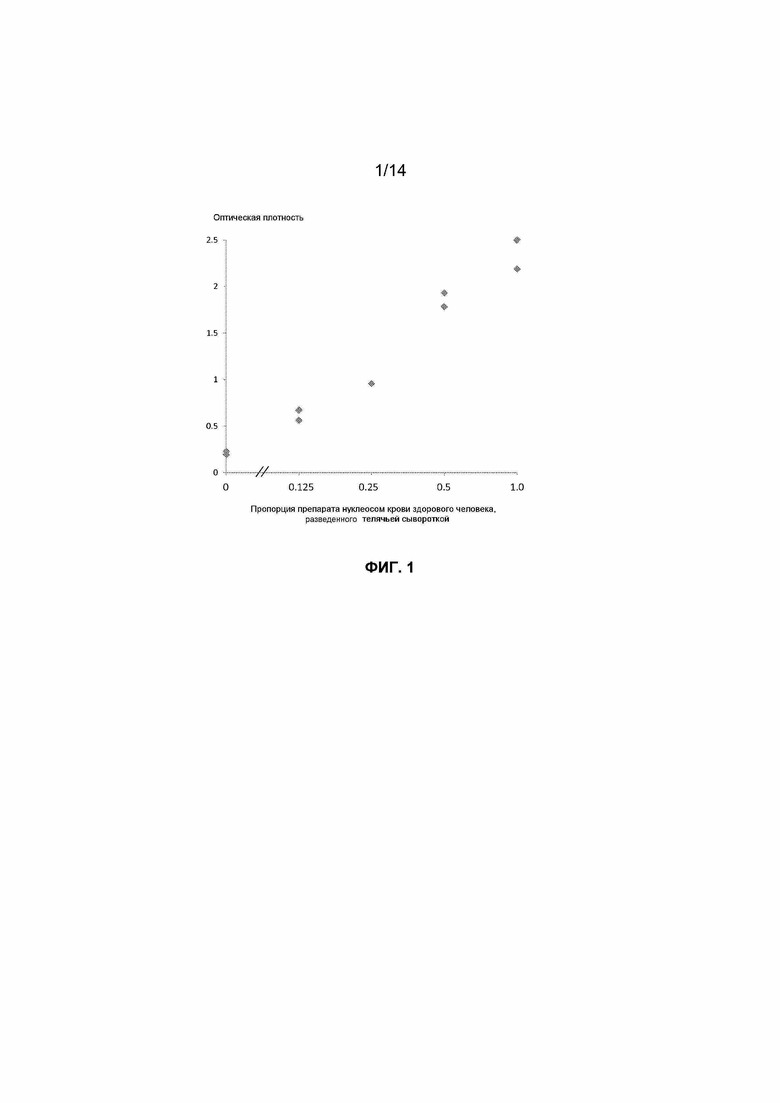
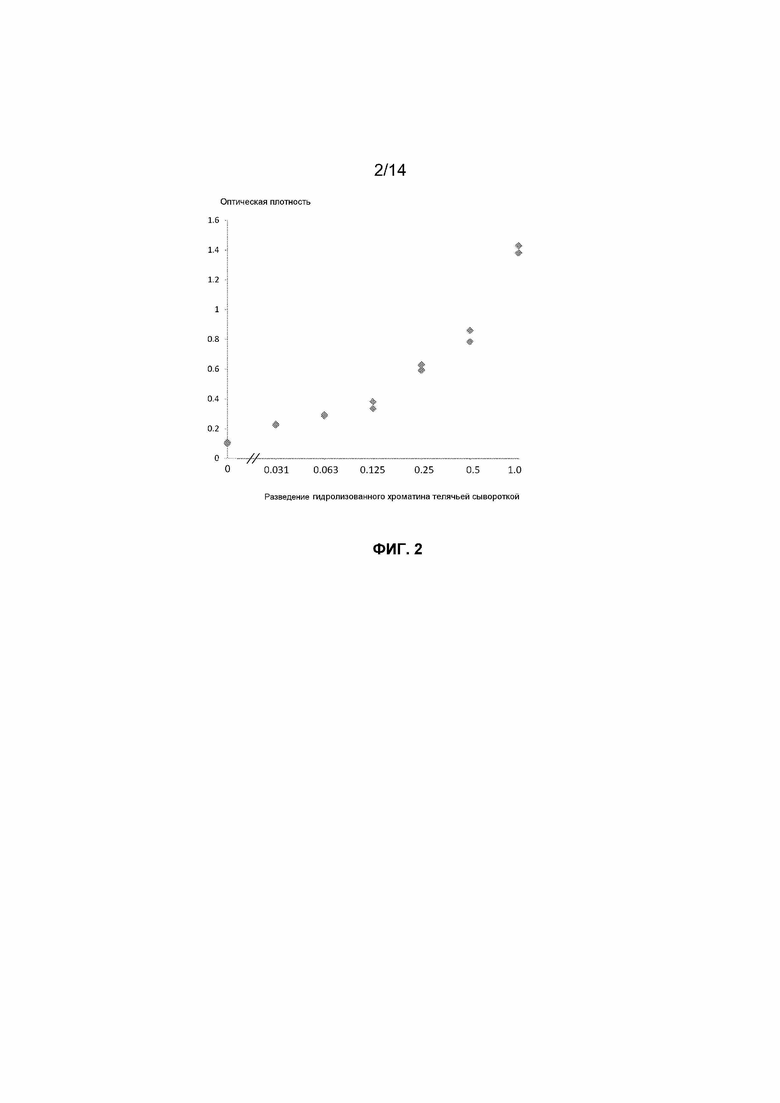
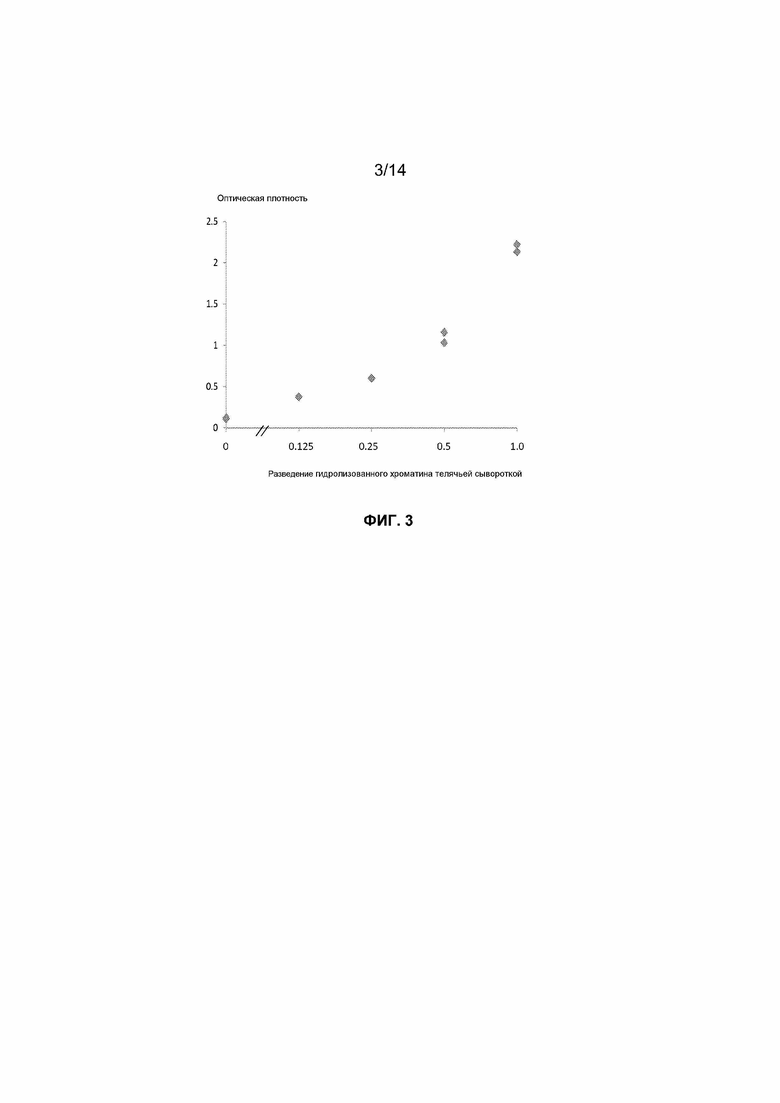
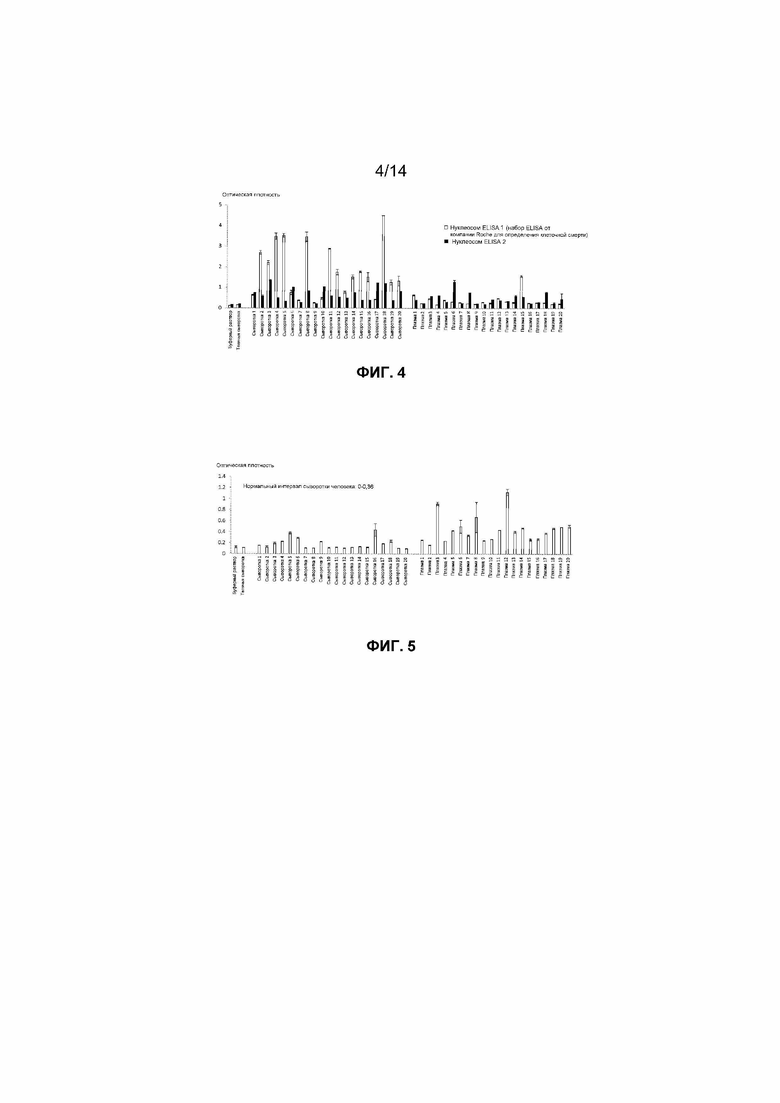

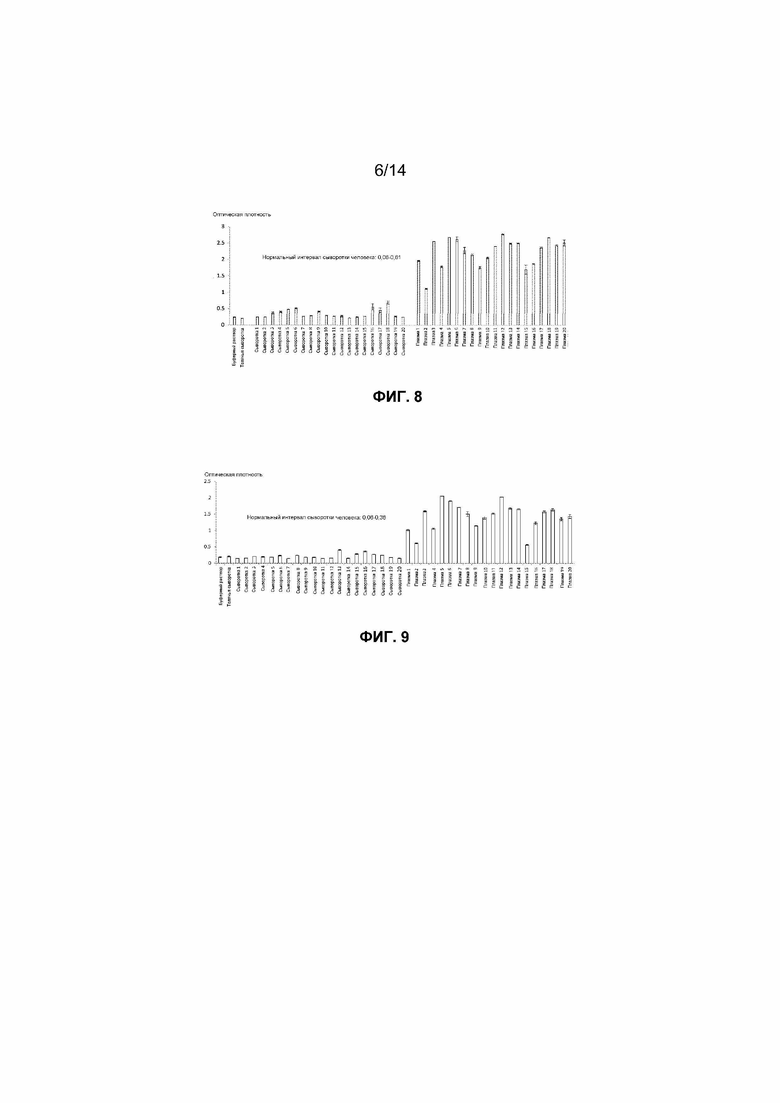
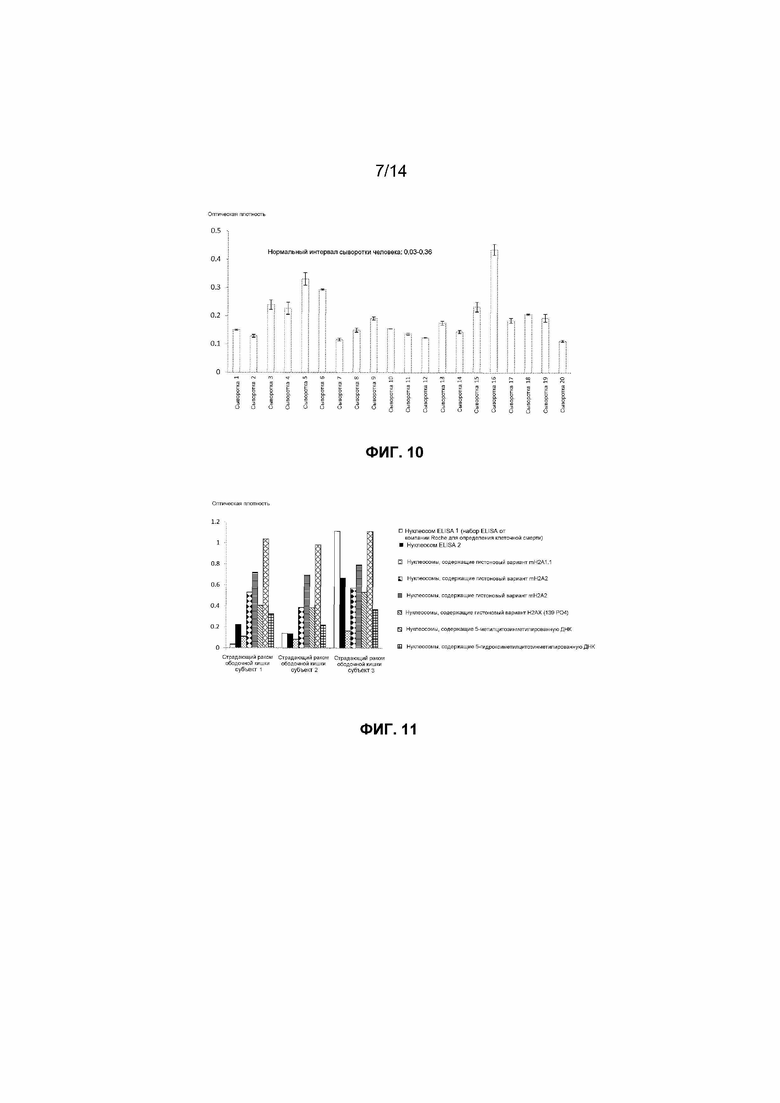


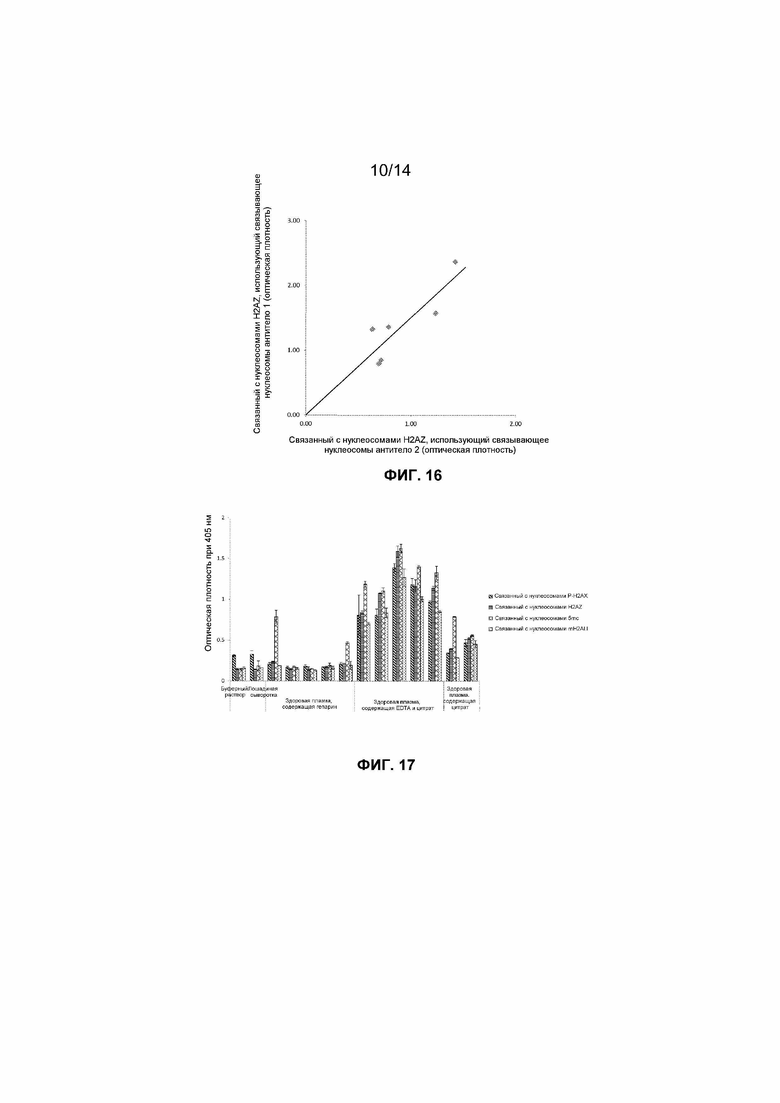
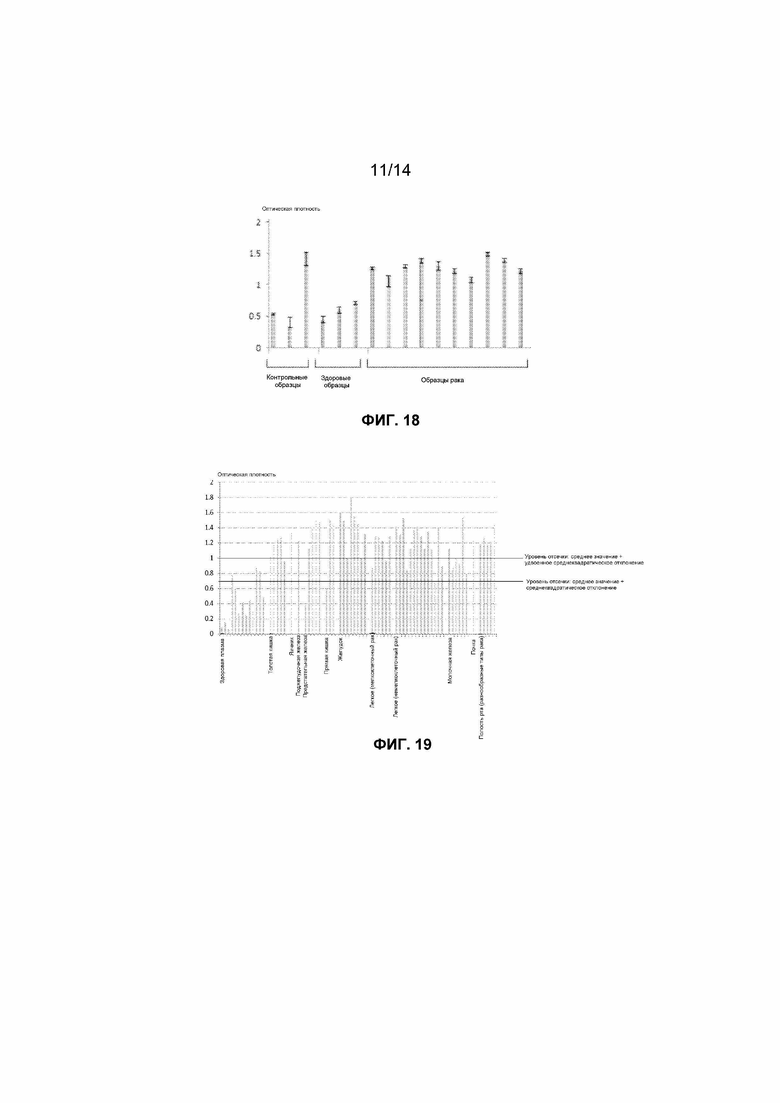
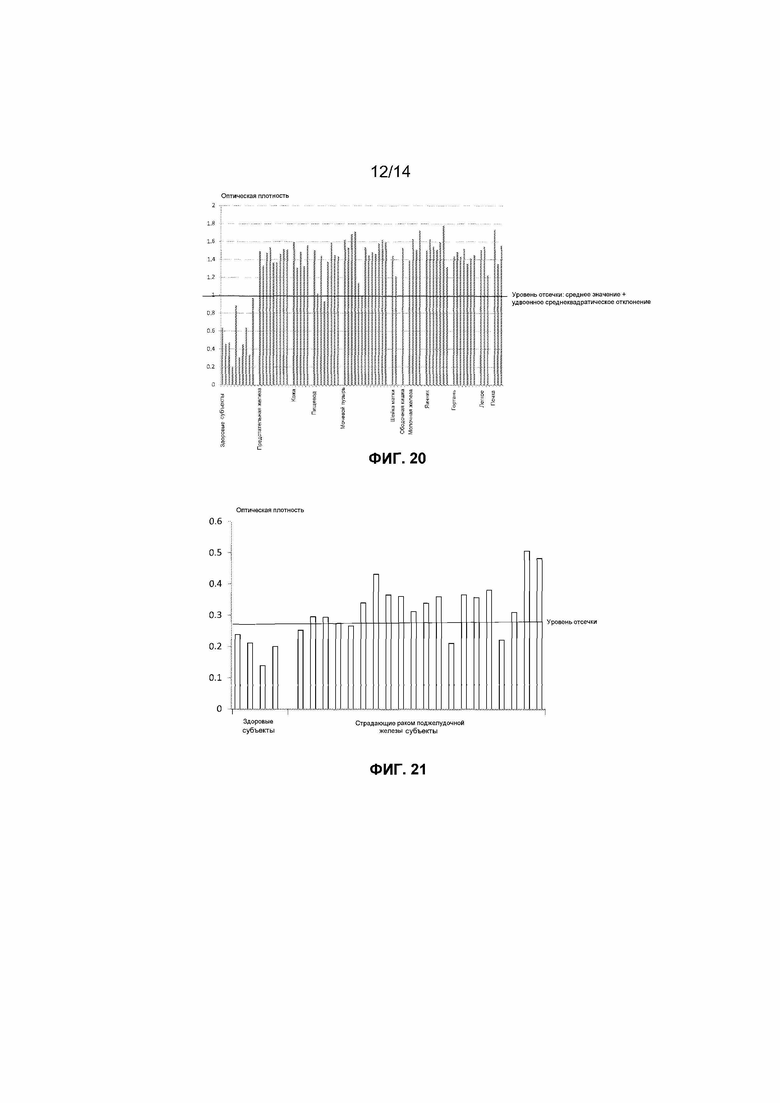
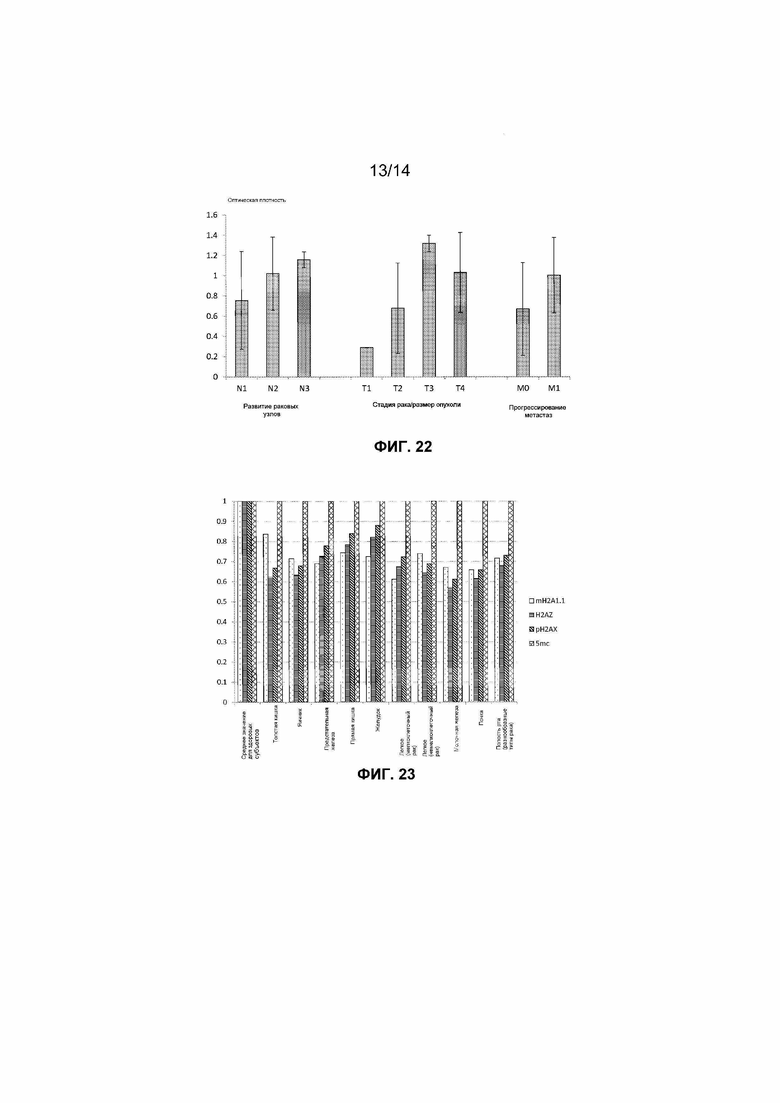

Предложенная группа изобретений относится к области медицины. Предложено применение изоформы гистона H2A, связанной с внеклеточной нуклеосомой, в качестве биомаркера в пробе биологической жидкости для диагностики рака. Предложены способы детекции присутствия в образце биологической жидкости изоформы гистона H2A, связанной с внеклеточной нуклеосомой, для диагностики рака. Предложены способ детекции рака, способ идентификации животного субъекта или человека в отношении вероятности ответа на лечение рака и способ мониторинга лечения рака. Предложенная группа изобретений обеспечивает специфическое обнаружение циркулирующих нуклеосом. 7 н. и 13 з.п. ф-лы, 24 ил., 9 пр.
1. Применение изоформы гистона H2A, связанной с внеклеточной нуклеосомой, в качестве биомаркера в пробе биологической жидкости для диагностики рака.
2. Применение по п. 1, где внеклеточная нуклеосома представляет собой мононуклеосому или олигонуклеосому.
3. Применение по п. 1, где изоформу гистона H2A, связанную с внеклеточной нуклеосомой, измеряют в образце крови.
4. Применение по п. 1, где рак представляет собой рак мочевого пузыря, молочной железы, ободочной кишки, шейки матки, пищевода, почки, толстой кишки, легкого, полости рта, яичника, поджелудочной железы, предстательной железы, прямой кишки, кожи или желудка.
5. Применение по п. 4, где рак представляет собой рак ободочной кишки, легкого, полости рта или поджелудочной железы.
6. Применение по любому из пп. 1-5, в котором изоформа гистона H2A выбрана из: макроH2A1.1, макроH2A2 и H2AZ.
7. Способ детекции присутствия в образце биологической жидкости изоформы гистона H2A, связанной с внеклеточной нуклеосомой, для диагностики рака, включающий следующие стадии:
(i) контакт образца биологической жидкости со связующим веществом, которое связывается с изоформой гистона H2A;
(ii) детекцию или количественное определение связывания указанного связующего вещества с изоформой гистона H2A в образце биологической жидкости; и
(iii) использование присутствия или повышения такого связывания в качестве меры присутствия изоформы гистона H2A, или нуклеосом, содержащих изоформу гистона H2A, в образце биологической жидкости.
8. Способ детекции присутствия в образце биологической жидкости изоформы гистона H2A, связанной с внеклеточной нуклеосомой, для диагностики рака, включающий следующие стадии:
(i) контакт образца биологической жидкости с первым связующим веществом, которое связывается с нуклеосомами;
(ii) контакт нуклеосом или образца биологической жидкости со вторым связующим веществом, которое связывается с изоформой гистона H2A;
(iii) детекцию или количественное определение связывания указанного второго связующего вещества с изоформой гистона H2A в образце биологической жидкости; и
(iv) использование присутствия или повышения такого связывания в качестве меры присутствия в образце биологической жидкости нуклеосом, содержащих изоформу гистона H2A.
9. Способ по п. 8, в котором связующее вещество представляет собой антитело.
10. Способ по п. 8, в котором образец биологической жидкости представляет собой кровь, сыворотку или плазму.
11. Способ детекции присутствия в образце биологической жидкости изоформы гистона H2A, связанной с внеклеточной нуклеосомой, для диагностики рака, включающий следующие стадии:
(i) контакт образца биологической жидкости с первым связующим веществом, которое связывается с изоформой гистона H2A;
(ii) контакт нуклеосом или образца биологической жидкости со вторым связующим веществом, которое связывается с нуклеосомами;
(iii) детекцию или количественное определение связывания указанного второго связующего вещества с нуклеосомами в образце биологической жидкости; и
(iv) использование присутствия или повышения такого связывания в качестве меры присутствия в образце биологической жидкости нуклеосом, содержащих изоформу гистона H2A.
12. Способ по п. 11, где связующее вещество представляет собой антитело.
13. Способ по п. 11, где образец биологической жидкости представляет собой кровь, сыворотку или плазму.
14. Способ детекции рака у животного субъекта или человека, включающий следующие стадии:
(i) детекцию или измерение изоформы гистона H2A, связанной с внеклеточной нуклеосомой, в биологической жидкости субъекта; и
(ii) использование повышения связанной с нуклеосомами изоформы гистона H2A, измеренного для определения рака у субъекта.
15. Способ по п. 14, в котором изоформу гистона H2A, связанную с внеклеточной нуклеосомой, определяют или измеряют как один из параметров измерений.
16. Способ идентификации животного субъекта или человека в отношении вероятности ответа на терапевтическое лечение, включающий следующие стадии:
(i) детекцию или измерение изоформы гистона H2A, связанной с внеклеточной нуклеосомой, в биологической жидкости субъекта; и
(ii) использование повышения связанной с нуклеосомами изоформы гистона H2A, определяемого в качестве параметра при выборе подходящего лечения для субъекта,
причем лечение предназначено для лечения рака.
17. Способ по п. 16, в котором изоформу гистона H2A, связанную с внеклеточной нуклеосомой, определяют или измеряют как один из параметров измерений.
18. Способ мониторинга лечения животного субъекта или человека, включающий следующие стадии:
(i) детекцию или измерение изоформы гистона H2A, связанной с внеклеточной нуклеосомой, в биологической жидкости субъекта;
(ii) повторную детекцию или измерение изоформы гистона H2A, связанную с внеклеточной нуклеосомой, в биологической жидкости субъекта в один или несколько моментов времени; и
(iii) использование любого повышения уровня связанной с нуклеосомами изоформы гистона H2A, определяемого в качестве параметра любого увеличения тяжести заболевания у субъекта,
причем лечение предназначено для лечения рака.
19. Способ по п. 18, где изоформу гистона H2A, связанную с внеклеточной нуклеосомой, определяют или измеряют как один из параметров измерений.
20. Способ по любому из пп. 7-19, в котором изоформа гистона H2A выбрана из: макроH2A1.1, макроH2A2 и H2AZ.
| WO 2005019826 A1, 03.03.2005 | |||
| WO 2011000573 A1, 06.01.2011 | |||
| DELIGESER U | |||
| et al | |||
| Sequence-Specific Histone Methylation Is Detectable on Circulating Nucleosomes in Plasma | |||
| Clinical Chemistry | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| ВЕЙКО Н.Н | |||
| и др | |||
| Фрагменты | |||
Авторы
Даты
2020-03-12—Публикация
2012-08-31—Подача