Область техники, к которой относится изобретение
Изобретение относится к способу детекции и измерению содержания аддуктов нуклеосома-белок и применению таких измерений для детекции и диагностики заболевания. Изобретение также относится к способу идентификации биомаркеров аддуктов нуклеосом для детекции и диагностики заболевания и к биомаркерам, идентифицируемым указанным способом.
Уровень техники, предшествующий изобретению
В организме человека содержится несколько сот типов клеток. Все эти типы клеток имеют одинаковый геном, но очень различные фенотипы и различные функции в организме. Такое фенотипическое разнообразие обусловлено дифференциальной экспрессией генома в различных типах клеток. Контроль дифференциальной экспрессии генов полностью не ясен, но основные механизмы включают регуляцию генов многими взаимосвязанными эпигенетическими сигналами, ассоциированными геном, включая регуляцию упаковки хроматина в виде эухроматина или гетерохроматина, регуляцию локализации хромосом и доступные для нуклеаз участки, метилирование ДНК и вариации структуры нуклеосом, вокруг которых обернута ДНК.
Нуклеосома представляет собой основную единицу структуры хроматина и состоит из белкового комплекса из восьми высококонсервативных коровых гистонов (содержащих пару каждого из гистонов H2A, H2B, H3 и H4). Вокруг этих комплексов обернуто приблизительно 146 пар оснований ДНК. Другой гистон H1 или H5 действует как линкер и участвует в уплотнении хроматина. ДНК оборачивается вокруг последовательных нуклеосом в структуре, для которой, как правило, говорят, что она похожа на «бусинки на нити», и это образует основную структуру открытого хроматина или эухроматина. В конденсированном хроматине или гетерохроматине эта нить спирально скручена и очень плотно спирально скручена в закрытую и сложную структуру (Herranz and Esteller, 2007).
Нормальная скорость обновления клеток у взрослых людей включает ежесуточное образование путем клеточного деления приблизительно 1011 клеток и гибель аналогичного числа, в основном путем апоптоза. Во время такого процесса апоптоза хроматин разрушается до мононуклеосом и олигонуклеосом, которые выделяются клетками. В нормальных условиях они удаляются, и уровень циркулирующих нуклеосом, выявляемый у здоровых индивидуумов, является низким. Повышенные уровни выявляют у индивидуумов с рядом патологических состояний, включая многие злокачественные опухоли, аутоиммунные заболевания, воспалительные состояния, инсульт и инфаркт миокарда (Holdenrieder & Stieber, 2009).
Мононуклеосомы и олигонуклеосомы можно детектировать твердофазным иммуноферментным анализом (ELISA), и опубликовано несколько способов (Salgame et al., 1997; Holdenrieder et al., 2001; van Nieuwenhuijze et al., 2003). В таких анализах, как правило, применяют антитело против гистона (например, против H2B, против H3 или против H1, H2A, H2B, H3 и H4) в качестве иммобилизованного антитела и антитело против ДНК или комплекса H2A-H2B-ДНК в качестве идентифицирующего антитела. Однако авторы обнаружили, что результаты таких анализов не согласуются друг с другом. Кроме того, хотя опубликовано, что большая часть циркулирующей ДНК в сыворотке или плазме существует в виде мононуклеосом и олигонуклеосом (Holdenrieder et al., 2001), измеряемые уровни нуклеосомы и ДНК в сыворотке или плазме согласуются плохо. Опубликовано, что коэффициент корреляции между результатами ELISA для клеточных уровней циркулирующих свободных нуклеосом и уровней циркулирующей ДНК, как определено ПЦР (полимеразной цепной реакцией) в реальном времени составляет r=0,531 в сыворотке и r=0,350 в плазме (Holdenrieder et al., 2005).
Способы определения нуклеосом ELISA используют на культурах клеток, преимущественно в качестве способа детекции апоптоза (Salgame et al., 1997; Holdenrieder et al., 2001; van Nieuwenhuijze et al., 2003), а также используют для измерения циркулирующих в клетках свободных нуклеосом в сыворотке и плазме (Holdenrieder et al., 2001). Уровни свободных нуклеосом в клетках сыворотки и плазмы, выделяемых в циркуляцию в результате деления клеток измеряли способами ELISA в исследованиях ряда различных злокачественных опухолей для оценки их использования в качестве потенциального биомаркера (Holdenrieder et al., 2001). Опубликовано, что средние уровни циркулирующих нуклеосом являлись повышенными в большинстве, но не во всех исследованиях злокачественных опухолей. Наиболее высокие уровни циркулирующих нуклеосом наблюдали у индивидуумов с раком легких. Самые низкие уровни наблюдали при раке предстательной железы, которые находились в нормальном диапазоне как у здоровых индивидуумов. Кроме того, было опубликовано, что у индивидуумов со злокачественными опухолями концентрации нуклеосом в сыворотке значительно варьируют, и было выявлено, что у некоторых индивидуумов с опухолевым заболеванием на поздней стадии уровни циркулирующих нуклеосом являются низкими в диапазоне, измеряемом у здоровых индивидуумов (Holdenrieder et al, 2001). Вследствие этого и ряда не относящихся к ракам причин повышения уровней нуклеосом уровни циркулирующих нуклеосом не используют в клинике в качестве биомаркера рака (Holdenrieder and Stieber, 2009).
Структура нуклеосом может изменяться в результате посттранскрипционной модификации (PTM) гистоновых белков и в результате включения вариантов гистоновых белков. PTM гистоновых белков, как правило, возникают на хвосте восьми коровых гистонов, и общераспространенные модификации включают ацетилирование, метилирование или убиквитинилирование остатков лизина, а также метилирование остатков аргинина и фосфорилирование остатков серина. Известно, что модификации гистонов вовлечены в эпигенетическую регуляцию экспрессии генов (Herranz and Esteller, 2007). Структура нуклеосомы также может изменяться путем включения альтернативным изоформ или вариантов гистонов, которые представляют собой различные продукты генов или продукты сплайсинга и содержат различные аминокислотные последовательности. Варианты гистонов можно классифицировать в ряд семейств, которые подразделяются на отдельные типы. Нуклеотидные последовательности большого числа вариантов гистонов известны и общедоступны, например, в базе данных гистонов NHGRI National Human Genome Research Institute (Marino-Ramfrez, L., Levine, K.M., Morales, М., Zhang, S., Moreland, R.T., Baxevanis, A.D., and Landsman, D. The Histone Database: an integrated resource for histones and histone fold-containing proteins. Database Vol. 2011. (подданный) и http://genome.nhgri.nih.gov/histones/complete.shtml), базе данных GenBank (генетическая последовательность NIH), базе данных нуклеотидных последовательностей EMBL и банке данных ДНК Японии (DDBJ).
Продемонстрировано, что вариант гистона и профили модификации гистонов, представленных в здоровых и пораженных клетках, различаются во многих (в основном иммуногистохимических) исследованиях (Herranz and Esteller, 2007). Один из недостатков иммуногистохимических способов для клинического применения заключается в том, что сбор образцов ткани является инвазивным, включая хирургическую операцию или биопсию.
В дополнение к эпигенетическому пути передачи сигналов, опосредованному структурой и локализацией нуклеосом, регуляция экспрессии генов в клетках также опосредована статусом метилирования ДНК (Herranz and Esteller, 2007). На протяжении некоторого времени в данной области известно, что ДНК может быть метилированной в 5 положении нуклеотидов цитозина с образованием 5-метилцитозина.
Еще в 1983 г. была опубликовано вовлеченность метилирования ДНК в развитие рака (Feinberg and Vogelstein, 1983). Паттерны метилирования ДНК, наблюдаемые в злокачественных клетках, отличаются от паттернов здоровых клеток. Опубликовано, что повторяющиеся элементы, в частности вкруг перицентромерных областей, при злокачественной опухоли являются гипометилированными по сравнению со здоровыми клетками, но также опубликовано, что промоторы конкретных генов являются гиперметилированными при злокачественной опухоли. Опубликовано, что равновесие этих двух эффектов приводит к общему снижению уровня метилирования ДНК в злокачественных клетках (Rodriguez-Paredes & Esteller, 2011).
Гиперметилирование определенных конкретных генов можно использовать в качестве диагностического биомаркера для злокачественных опухолей. Например, было опубликовано, что способом, описанным для детекции гиперметилирования гена Septin 9 ПЦР-амплификацией ДНК, выделяемой из плазмы, детектируют 72% случаев рака толстого кишечника с относительным числом ложно позитивных заключений 10% (Grutzmann et al, 2008). Статус метилирования ДНК конкретных генов или локусов, как правило, детектируют избирательным дезаминированием цитозина бисульфитом, но не 5-метилцитозина, до урацила, приводящим к изменению первичной последовательности ДНК, которое можно детектировать посредством секвенирования или другими способами (Allen et al., 2004).
Общее гипометилирование ДНК является признаком злокачественных клеток (Esteller, 2007 и Hervouet et al., 2010). Общее метилирование ДНК можно исследовать в клетках способами иммуногистохимии. Альтернативно, ДНК выделяют из клетки для анализа.
Многие годы известно, что наряду с нуклеиновой кислотой и гистоновыми белками хроматин содержит большое число негистоновых белков, связанных с составляющими его ДНК и/или гистонами (Yoshida and Shimura, 1972). Эти ассоциированные с хроматином белки относятся к широкому спектру типов и имеют различные функции, включая факторы транскрипции, факторы усиления транскрипции, факторы подавления транскрипция, ферменты модификации гистонов, белки репарации повреждений ДНК и многие другие. Исследование связанных с хроматином белков проводили преимущественно способами иммунопреципитации хроматина (ChIP). Эти способы хорошо известны в данной области, но являются сложными, трудновыполнимыми и дорогостоящими.
В характерном способе ChIP клеточный хроматин сшивают таким образом, что все компоненты белков и нуклеиновых кислот являются ковалентно связанными друг с другом. Затем хроматин расщепляют для получения препарата мононуклеосом и олигонуклеосом. К расщепленному хроматину добавляют антитело к представляющему интерес белку для иммунопреципитации таких фрагментов хроматина, содержащих белок. Антитело обычно присоединяют к твердой фазе (пример, пластиковым гранулам) для облегчения выделения комплекса хроматина, содержащего представляющий интерес белок. Затем обращают поперечные связи и удаляют белок расщеплением протеиназой. Выделяют связанный с ДНК комплекс хроматина и анализируют для определения последовательности ДНК, гена или локуса, ассоциированного со связыванием конкретного белка любым из ряда способов, включая ПЦР с последующим электрофорезом в геле, секвенированием ДНК (ChlP-Seq) или с использованием микропанелей ДНК (ChlP-на микропанеле).
Этими способами ChIP выявляют последовательности ДНК, ассоциированные с хроматином, связанным с гистоновыми белками. Для облегчения исследований ассоциации негистоновых белков с гистонами и нуклеосомами разработаны модифицированные варианты способа ChIP, включая, например, анализы ассоциаций гистонов (Ricke and Bielinsky, 2005). Многие белки, которые связываются с хроматином, вовлечены в механизмы развития злокачественной опухоли и другого заболевания, тем не менее, ранее не исследовали их относительное содержание в форме аддукта нуклеосом в кровотоке. Примеры включают белок Box 1 группы с высокой подвижностью (HMGB1), белок семейства polycomb Enhancer of Zeste Homolog 2 (EZH2) и белки группы ядерных рецепторов.
Белки группы с высокой подвижностью представляют собой компонент хроматина, составляющий приблизительно 3% от массы ДНК или гистонов. Они представляют собой структурные белки, которые связываются с нуклеосомами без какой-либо известной специфичности к лежащей в основе последовательности ДНК (Gerlitz et al., 2009). HMGB1 представляет собой архитектурный хромосомный белок и провоспалительный медиатор. Он участвует в гибели клеток, апоптозе и в различных заболеваниях, включая различные воспалительные и аутоиммунные патологические состояния, сепсис, менингит и нейродегенерацию. Сверхэкспрессия HMGB1 ассоциирована со всеми основными признаками злокачественной опухоли (Tang et al., 2010). HMGB1 плотно прикрепляется к хроматину апоптотических клеток. Исследования комплексов нуклеосома-HMGB1 выявили, что эти аддукты находят в кровотоке у индивидуумов, страдающих аутоиммунным заболеванием системной красной волчанкой (SLE), и что аддукты участвуют в индукции антиядерных антител, которые являются ключевым признаком SLE. Нуклеосомы, не связанные с HMGB1, не индуцируют иммунный ответ. Связывание HMGB1 с нуклеосомами в таких аддуктах было продемонстрировано иммунопреципитацией нуклеосом антителом, направленным к ДНК или гистонам, с последующим вестерн-блоттингом с использованием антитела против HMGB1 для демонстрации наличия HMGB1 в иммунопреципитированных нуклеосомамх (Urbonaviciute et al., 2008).
Белки HMGB взаимодействуют со многими другими белками, для которых известно, что они влияют на функцию хроматина, и было продемонстрировано, что возникают комплексы хроматина, содержащие белки HMGB плюс дополнительные белки (Gerlitz et al., 2009). Таким образом, в дополнение к простым аддуктам нуклеосома-белок в хроматине появляются аддукты нуклеосома-белок-комплекс, в которых 2 или многие белки ассоциированы с нуклеосомами.
EZH2 является представителем семейство группы Polycomb (PcG), которые образуют мультимерные белковые комплексы, участвующие в поддержании транскрипционно-репрессивного состояния генов. EZH2 представляет собой фермент модификации гистонов (N-метилтрансферазу лизинов гистонов), который метилирует лизин 27 аминокислотного остатка 3 гистона нуклеосом. Такая модификация гистона ассоциирована с конденсацией хроматина и подавлением экспрессии генов (Cao et al., 2002).
Ядерные рецепторы представляют собой молекулы, которые регулируют экспрессию гена под контролем гормонов или лигандов, например, эстрогеновый рецептор (ER) регулирует экспрессию эстроген-зависимых генов. Многие из этих белков вовлечены в патологические процессы, например, ER участвует в прогрессировании рака молочной железы, и терапия многих типов рака молочной железы направлена на ER и/или предназначена предотвращать взаимодействие ER с его лигандом эстрадиолом.
Наряду с аддуктами нуклеосома-белок, которые появляются в клетке, существуют другие аддукты нуклеосома-белок, которые могут образовываться после высвобождения нуклеосом из клетки после гибели клеток. Такие аддукты нуклеосом включают аддукты нуклеосома-иммуноглобулин, которые являются ключевым признаком SLE.
Ниже авторы описывают простые способы иммунологического анализа для прямой оценки аддуктов белок-нуклеосома в биологических образцах. Авторы разработали простые способы детекции связанных с нуклеосомой EZH2, HMGB1 и нескольких ядерных рецепторов и продемонстрировали, что такие аддукты нуклеосом можно детектировать в образцах сыворотки, и что их можно использовать в качестве биомаркеров при заболевании.
Сущность изобретения
В первом аспекте изобретение относится к применению аддукта нуклеосома-белок в качестве биомаркера в крови для диагностики рака, аутоиммунного заболевания или воспалительного заболевания.
Во втором аспекте изобретение относится к способу детекции наличия аддукта нуклеосома-белок в образце, который включает этапы:
(i) приведения образца в контакт с первым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(ii) приведение нуклеосом или образца в контакт со вторым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(iii) детекции или количественного определения связывания указанного второго связывающего средства со связанным белком в образце и
(iv) использования наличия или степени такого связывания, как показателя наличия аддуктов нуклеосом в образце.
В третьем аспекте изобретение относится к способу детекции наличия аддуктов нуклеосом в образце, который включает этапы:
(i) приведения образца в контакт с первым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(ii) приведения нуклеосомы или образца в контакт со вторым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(iii) детекции или количественного определения связывания указанного второго связывающего средства с нуклеосомами или их компонентом в образце и
(iv) использования наличия или степени такого связывания в качестве показателя наличия аддуктов нуклеосом в образце.
В дополнительном аспекте изобретение относится к способу детекции аддукта нуклеосомы в клетке, который включает этапы:
(i) выделения хроматина из клетки;
(ii) расщепления, обработки ультразвуком или иным образом разрушения хроматина с образованием мононуклеосом и/или олигонуклеосом и
(iii) детекции или измерения присутствия аддукта нуклеосомы способом ELISA по изобретению, описанным в указанных выше втором или третьем аспектах.
В дополнительном аспекте изобретение относится к способу детекции или диагностики статуса заболевания у индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкости организма индивидуума и
(ii) применения обнаруженного уровня аддукта нуклеосом для идентификации статуса заболевания индивидуума.
В дополнительном аспекте изобретение относится к способу оценки индивидуума, являющегося животным или человеком, в отношении целесообразности медицинского лечения, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкостях организма индивидуума и
(ii) применения обнаруженного уровня аддукта нуклеосом в качестве параметра для выбора подходящего лечения для индивидуума.
В дополнительном аспекте изобретение относится к способу мониторинга лечения индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкости организма индивидуума;
(ii) повторения детекции или измерения аддукта нуклеосом в жидкостях организма индивидуума в одном или более случаях;
(iii) применение любых изменений обнаруженного уровня аддукта нуклеосом в качестве параметра любого изменения состояния индивидуума.
В дополнительном аспекте изобретение относится к способу идентификации биомаркера аддукта нуклеосом для детекции или диагностики статуса заболевание у индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкости организма индивидуума;
(ii) детекции или измерения аддукта нуклеосом в жидкости организма здорового индивидуума или контрольного индивидуума и
(iii) применения разницы обнаруженных уровней у больных и контрольных индивидуумов для идентификации, является ли аддукт нуклеосом пригодным в качестве биомаркера статуса заболевания.
В дополнительном аспекте изобретение относится к биомаркеру, идентифицируемому способами, определяемыми в настоящем описании.
В дополнительном аспекте изобретение относится к набору для детекции аддукта нуклеосом, который содержит лиганд или связывающее средство, специфичное к аддукту нуклеосом или части его компонента, или средству, имитирующему структуру/форму основания ДНК, нуклеотиду или нуклеозиду или части его компонента совместно с инструкциями по использованию набора.
Краткое описание чертежей
Фигура 1: кривая доза-ответ ELISA для детекции уровней аддукта нуклеосома-EZH2 в расщепленном хроматине, выделяемом из клеток Hela, разбавленных лошадиной сывороткой.
Фигура 2: результаты ELISA аддукта нуклеосома-EZH2 для образцов сыворотки, полученных у 5 здоровых индивидуумов и 11 индивидуумов с опухолями.
Фигура 3: кривая доза-ответ ELISA для детекции уровней аддукта нуклеосома-HMGB1 в расщепленном хроматине, выделяемом из клеток Hela, разбавленных лошадиной сывороткой.
Фигура 4: результаты ELISA аддукта нуклеосома-HMGB1 для образцов сыворотки, получаемых у 5 здоровых индивидуумов и 11 индивидуумов с опухолями.
Фигура 5: результаты ELISA аддукта нуклеосома-HMGB1 для образцов сыворотки, получаемых у 31 здорового индивидуума и 74 индивидуумов с (A) раком толстого кишечника, (B) раком молочной железы или (C) раком легких.
Фигура 6: кривая доза-ответ ELISA для детекции уровней аддукта нуклеосома-прогестероновый рецептор во внеклеточных нуклеосомах, получаемых способом *Holdenrieder et al., 2001.
Фигура 7: результаты ELISA детекции уровней аддукта нуклеосома-андрогеный рецептор в 2 случаях рака предстательной железы и образце внеклеточных нуклеосом, получаемом способом *Holdenrieder et al., 2001.
Фигура 8: кривая доза-ответ ELISA детекции уровней аддукта нуклеосома-эстрогеновый рецептор альфа (ERα) во внеклеточных нуклеосомах, получаемых способом *Holdenrieder et al., 2001.
Фигура 9: результаты ELISA детекции уровней аддукта нуклеосома-ERβ в расщепленном хроматине MCF7. Анализ проводили в двух различных форматах. В первом формате антителом против нуклеосомы покрывали лунки, и антитело против ERβ подвергали биотинилированию. Во втором формате антителом против ERβ покрывали лунки, и антитело против нуклеосомы подвергали биотинилированию.
Фигура 10: результаты ELISA аддукта нуклеосома H2AZ-ERβ.
Фигура 11: результаты ELISA аддукта нуклеосома-ERβ для образцов сыворотки, получаемых у 12 здоровых индивидуумов и 16 индивидуумов с опухолями.
Подробное описание изобретения
В первом аспекте изобретение относится к использованию аддукта нуклеосома-белок в качестве биомаркера в крови для диагностики рака, аутоиммунного заболевания или воспалительного заболевания. В одном из вариантов осуществления биомаркер используют для диагностики рака. Авторы продемонстрировали, что два таких аддукта, содержащие HMGB1 и EZH2, присутствуют в кровотоке индивидуумов со злокачественной опухолью, но не детектируются в кровотоке здоровых индивидуумов.
В данной области хорошо известно, что злокачественные опухоли могут являться гормонально зависимыми, и для роста им необходимо наличие гормона. Также хорошо известно, что ядерные гормоны функционируют посредством ядерной локализации рецептора, связанного с гормональным комплексом, и связывания с конкретными элементами гормонального ответа в геноме. Экспрессия генов, ассоциированных с элементами, регулируется связыванием рецептора, связанного с гормональным комплексом, с геномными элементами ответа. В одном из вариантов осуществления изобретение относится к биомаркерам аддукта гормональный рецептор-нуклеосома и аддукта комплекса гормон-гормональный рецептор-нуклеосома для характеристики статуса опухоли индивидуума. Такие аддукты могут представлять собой циркулирующие аддукты, содержащиеся в крови или другой жидкости организма, или их можно получать расщеплением хроматина из образца ткани опухоли.
В данной области хорошо известно, что ядерные гормональные рецепторы регулируют экспрессию гена под контролем гормонов или лигандов. Например, эстрогеновый рецептор функционирует посредством связывания со своим субстратом (стероидным гормоном эстрогеном) на поверхности клеточной мембраны. Связывание сопровождается интернализацией комплекса гормон-рецептор и внутриклеточной локализацией, в случае, когда рецептор связывается с конкретными элементами гормонального ответа в геноме. Конкретная последовательность гена, с которой связывается эстрогеновый рецептор, известна как эстрогеновый ответный элемент (ERE). Экспрессия генов, ассоциированных с ERE, может регулироваться рецептором, и, таким образом, присутствием или уровнем эстрогена в кровотоке индивидуума. Также в данной области хорошо известно, что рост злокачественной опухоли молочной железы, как правило, находится под контролем эстрогена, и такую злокачественную опухоль, как правило, называют эстроген-зависимой. Вследствие того, что такие опухоли сверхэкспрессируют эстрогеновый рецептор (ER), их часто называют ER+ опухолями. Рост эстроген-зависимых опухолей можно замедлять или предотвращать посредством терапевтических вмешательств, направленных на предотвращение связывания эстрогена с эстрогеновым рецептором, и это представляет собой общепринятый способ лечения рака молочной железы. Примеры таких видов лечения включают лекарственное средство тамоксифен, которое действует как антагонист эстрогена при эстроген-зависимом раке молочной железы, и ингибиторы ароматазы, которые замедляют или предотвращают продукцию эстрогена. Однако со временем злокачественные опухоли развиваются в эстроген-независимые опухоли, которые растут даже при отсутствии стимуляции эстрогеном и требуют других видов лечения. В настоящее время диагностику эстроген-зависимых и эстроген-независимых опухолей общепринято проводят иммуноокрашиванием ткани биопсии опухоли для определения относительного содержания или иным образом эстрогенового рецептора в опухолевых клетках. Клиницистам, возможно, потребуется неоднократное повторное тестирование эстрогеновой зависимости опухоли в течение курса лечения опухоли для определения, является ли подходящим эстроген-зависимое лечение или уже не является таковым, или следует ли изменять схему лечения индивидуума для отражения изменяющегося характера опухоли по мере прогрессирования заболевания. К сожалению, существующие в настоящее время тесты не являются оптимальными и требуют проведения повторной болезненной биопсии при каждом случае проведения теста. В одном из вариантов осуществления изобретения для облечения выбора подходящего лечения и для предиктивной прогностической информации используют детекцию аддуктов эстрогеновый рецептор-нуклеосама в кровотоке у пациентов с раком молочной железы в качестве показателя связывания эстрогенового рецептора с ERE в ядре опухолевых клеток в качестве показателя эстрогеновой зависимости опухоли. Такой способ обладает преимуществами, которые заключаются в том, что он является показателем связывания ERE-эстрогенового рецептора в опухоли, а не простым показателем наличия или отсутствия эстрогенового рецептора, и его можно повторять с желаемой частотой посредством простого тестирования крови без необходимости биопсии. Авторы разработали простые способы ELISA детекции и количественного определения аддуктов нуклеосома-ER, содержащих ERα и ERβ формы рецептора. Неожиданно, такие аддукты содержатся в кровотоке пациентов со злокачественными опухолями.
Специалистам в данной области будет понятно, что аналогичный принцип можно применять для детекции аддуктов эстрогеновый рецептор-нуклеосома в гидролизатах хроматина клеток, получаемых из самой ткани опухоли. Такой способ оценки эстрогеновой зависимости опухоли превосходит существующие способы, т.к. является показателем связывания ERE-эстрогенового рецептора в опухоли, а не простым показателем наличия или отсутствия эстрогенового рецептора.
В другом варианте осуществления изобретения детекция наличия самого стероидного эстрогена в аддукте комплекса эстроген-эстрогеновый рецептор-нуклеосома в кровотоке или другой жидкости организма или в нуклеосомах, получаемых в виде гидролизата хроматина из опухолевой ткани, используют в качестве показателя статуса эстрогеновой зависимости опухоли.
Опубликовано, что циркулирующие нуклеосомы повышаются при эндометриозе (Holdenrieder et al., 2001) и, вследствие того, что эндометриоидная ткань является чувствительной к эстрогену, связывание эстрогенового рецептора в хроматине эндометриоидных клеток может приводить к появлению к аддуктам эстрогеновый рецептор-нуклеосама или аддуктам комплекса эстроген-эстрогеновый рецептор-нуклеосома в кровотоке. В дополнительном варианте осуществления изобретения аддукты эстрогеновый рецептор-нуклеосама или аддукты комплекса эстроген-эстрогеновый рецептор-нуклеосома детектируют в жидкости организма в качестве биомаркера наличия эстроген-зависимого гинекологического патологического состояния, включая например, эндометриоз.
Аналогичным образом как в случае эстроген-зависимого рака молочной железы, для роста андроген-зависимой опухоли предстательной железы требуется андроген, или ее рост ускоряется андрогеном. Андроген-зависимые опухоли предстательной железы аналогично лечат способами, которыми предотвращают связывание андрогена с андрогенным рецептором (AR). Андроген-зависимые опухоли предстательной железы также могут развиваться и становится андроген-независимыми и, таким образом, устойчивыми к видам лечения, включая физическую или химическую кастрацию лекарственными средствами, для предотвращения связывания андрогена с его рецептором. Статус андрогенной зависимости опухоли можно определять по уровню связывания андрогенного рецептора с андрогенными ответными элементами (ARE) в геноме, и его можно определять анализом уровней аддуктов андрогенный рецептор-нуклеосома, содержащихся в кровотоке индивидуума или в гидролизатах хроматина из ткани предстательной железы. Варианты осуществления изобретения для этой цели включают детекцию аддуктов андрогенный рецептор-нуклеосома или аддуктов комплекса андроген-андрогеный рецептор-нуклеосома в кровотоке или в жидкости организма индивидуума, или в нуклеосомах, получаемых расщеплением хроматина из ткани опухоли индивидуума. В настоящее время авторы разработали простые способы ELISA детекции и количественного определения аддуктов нуклеосома-AR и продемонстрировали их пригодность. Авторы также разработали простые способы ELISA для детекции и количественного определения аддуктов нуклеосома-прогестероновый рецептор. Другие зависимые от гормонов заболевания можно разрешать аналогичными вариантами осуществления способа по изобретению. Такие варианты осуществления включают детекцию других аддуктов рецептор-нуклеосома, включая, например, аддукты глюкокортикоидого рецептора, рецептора гормона щитовидной железы и рецептора ретиноевой кислоты с нуклеосомой для детекции опухолей, включая, например, различные типы лейкозов, в которые вовлечен рецептор ретиноевой кислоты.
В дополнительном аспекте изобретения, способы, описываемые выше в настоящем описании, можно использовать для детекции аддуктов комплекса гормон-рецептор гормона-нуклеосома. В одном из вариантов осуществления аддукты комплекса гормон-рецептор гормона-нуклеосома содержат аддукт комплекса тироксин-рецептор гормона щитовидной железы-нуклеосома, аддукт комплекса трийодтиронин-рецептор гормона щитовидной железы-нуклеосома, аддукт комплекса ретиноевая кислота-рецептор ретиноевой кислоты-нуклеосома, аддукт комплекса андроген-андрогенный рецептор-нуклеосома или аддукт комплекса эстроген-эстрогеновый рецептор-нуклеосома. Этот аспект изобретения обладает преимуществом, которое заключается в определении активируемых гормоном аддуктов, а также аддуктов, содержащих рецептор гормона дикого типа или нормального типа, из рецептора гормона, который не связывается со своим лигандом, например, вследствие мутации во время прогрессирования заболевания (например, при эстроген-независимом раке молочной железы). Этот аспект изобретения можно воплощать многими способами. В одном из вариантов осуществления используют антитело или другое связывающее средство, направленное, чтобы связываться с самим гормоном, вместо антитела, направленного, чтобы связываться с рецептором гормона. В альтернативном варианте осуществления гормон выделяют из захваченного антителом аддукта комплекса гормон-рецептор гормона-нуклеосома и количественно определяют общепринятыми способами, например, способами иммунологического анализа, спектральными способами или хроматографическими способами, включая высокоэффективную жидкостную хроматографию (ВЭЖХ), жидкостную хроматографию с последующей масс-спектроскопией (LC/MS) или газовую хроматографию с последующей масс-спектроскопией (GC/MS). Например, аддукт комплекса андроген-андрогенный рецептор-нуклеосома захватывается иммобилизованными антителами, направленными для связывания с эпитопом, содержащимся в аддукте (например, в андрогенном рецепторе или в нуклеосоме). Затем, гормон экстрагируют из связанного с твердой фазой аддукта в органический растворитель (например, простой диэтиловый эфир). Растворитель переносят, сушат и андроген повторно растворяют в буфере для анализа и измеряют его концентрацию (например, конкурентным иммунологическим анализом). Специалистам в данной области будет понятно, что этот вариант осуществления имеет конкретное применение для низкомолекулярных гормонов, таких как стероидные гормоны и гормоны щитовидной железы.
Целью настоящего изобретения является детекция белков, которые являются связанными с нуклеосомами. Это можно проводить тестом ELISA с двойным антителом, в котором одно антитело направлено, чтобы связываться с нуклеосомами, а другое направлено, чтобы связываться с белком, связанным с нуклеосомой. Однако антитело, направленное, чтобы связываться с нуклеосомой, необязательно является направленным на целый комплекс нуклеосомы, а может быть направлено на часть белкового компонента или компонента нуклеиновой кислоты нуклеосомы. В этом варианте осуществления изобретения антитело, применяемое для связывания с нуклеосомой, может быть направлено, чтобы связываться с любой частью компонента нуклеосомы, включая, например, с конкретным гистоном, модификацией гистона, вариантом или изоформой гистона или с конкретным нуклеотидом или модифицированным нуклеотидом. Авторы продемонстрировали, что такая схема анализа хорошо работает с использованием, например, антитела, направленного, чтобы связываться с вариантом гистона H2AZ, в качестве связывающего средства нуклеосом. Специалистам в данной области будет понятно, что этот способ имеет дополнительное преимущество селективного связывания только с такими нуклеосомами, которые содержат представляющий интерес белок в аддукте и H2AZ. Такая схема обеспечивает способ анализа для тестирования любой комбинации белка аддукта с любым конкретным гистоном, модификацией гистона, вариантом гистона, нуклеотида, модифицированного нуклеотида или другой нуклеосомной структуры.
Во втором аспекте изобретение относится к способу детекции наличия аддукта нуклеосома-белок в образце, который включает этапы:
(i) приведения образца в контакт с первым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(ii) приведения нуклеосом или образца в контакт со вторым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(iii) детекции или количественного определения связывания указанного второго связывающего средства со связанным белком в образце и
(iv) использования наличия или степени такого связывания в качестве показателя наличия аддуктов нуклеосом в образце.
Специалистам в данной области будет понятно, что связывающее средство, которое необходимо детектировать, можно выбирать так, чтобы оно являлось антителом, направленным на связанный белок или на нуклеосому или часть компонента нуклеосомы.
В третьем аспекте изобретение относится к способу детекции наличия аддукта нуклеосом в образце, который включает этапы:
(i) приведения образца в контакт с первым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(ii) приведения нуклеосом или образца в контакт со вторым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(iii) детекции или количественного определения связывания указанного второго связывающего средства с нуклеосомами или их компонентом в образце и
(iv) использования наличия или степени такого связывания в качестве показателя наличия аддуктов нуклеосом в образце.
В одном из вариантов осуществления аддукт нуклеосом содержит провоспалительный белок, белок группы с высокой подвижностью, белок polycomb, модифицирующий хроматин фермент, ядерный рецептор или гормон. В альтернативном варианте осуществления аддукт нуклеосом содержит белок группы с высокой подвижностью, белок polycomb, модифицирующий хроматин фермент, рецептор гормона или гормон. В дополнительном варианте осуществления аддукт нуклеосом содержит модифицирующий хроматин фермент, ядерный рецептор или гормон. В дополнительном варианте осуществления белок группы с высокой подвижностью представляет собой HMGB1. В одном из вариантов осуществления, когда биомаркер используют для диагностики рака, аддукт нуклеосома-белок содержит белок группы с высокой подвижностью.
В одном из вариантов осуществления модифицирующий хроматин фермент представляет собой фермент ацетилирования, деацетилирования, метилирования, деметилирования, фосфорилирования, дефосфорилирования, убиквитинилирования, деубиквитинилирования, сумоилирования, десумоилирование гистона или ДНК- метилтрансферазу. В альтернативном варианте осуществления модифицирующий хроматин фермент представляет собой EZH2.
В одном из вариантов осуществления, когда аддукт нуклеосома-белок содержит ядерный рецептор, указанный ядерный рецептор представляет собой эстрогеновый рецептор, андрогенный рецептор, прогестероновый рецептор, рецептор гормона щитовидной железы, рецептор глюкокортикоидов или рецептор ретиноевой кислоты. В альтернативном варианте осуществления, когда аддукт нуклеосома-белок содержит ядерный рецептор, указанный ядерный рецептор представляет собой эстрогеновый рецептор, андрогенный рецептор или рецептор ретиноевой кислоты.
В одном из вариантов осуществления, когда аддукт нуклеосома-белок содержит гормон, указанный гормон представляет собой гормон щитовидной железы, глюкокортикоидный гормон или стероидный гормон, включая эстроген, андроген, прогестаген, кортикостероид или ретиноевую кислоту. В альтернативном варианте осуществления, когда аддукт нуклеосома-белок, содержит гормон, указанный гормон представляет собой стероидный гормон, включая эстроген, андроген, кортикостероид или ретиноевую кислоту.
В одном из вариантов осуществления, когда аддукт нуклеосома-белок содержит рецептор гормона, указанный рецептор гормона представляет собой эстрогеновый рецептор, андрогенный рецептор, прогестероновый рецептор, рецептор гормона щитовидной железы или рецептор ретиноевой кислоты.
Авторы продемонстрировали, что способ можно проводить с использованием антитела, направленного на саму нуклеосому, в комбинации с антителом, направленным, чтобы связываться с белком, связанным с нуклеосомой, или с использованием антитела, направленного на компонент нуклеосомы, снова в комбинации с антителом, направленным, чтобы связываться с белком, связанным с нуклеосомой. В одном из вариантов осуществления антитело или связывающее средство нуклеосомы или компонента нуклеосомы направлено, чтобы связываться с конкретным эпигенетическим эпитопом нуклеосомы, например, любым вариантом гистона (например, H2AZ), любой модификацией гистона (например, триметил H3K9) или любым нуклеотидом или модифицированным нуклеотидом (например, 5-метилцитозином). В альтернативном варианте осуществления связывающее средство нуклеосомы или компонента нуклеосомы направлено, чтобы связываться с конкретной структурой передачи эпигенетического сигнала, таким образом, что детектируют только конкретную подгруппу аддуктов нуклеосом, содержащих указанную структурой передачи эпигенетического сигнала.
В одном из вариантов осуществления используемое связывающее средство представляет собой антитело, фрагмент антитела или аптамер. В дополнительном варианте осуществления используемое связывающее средство представляет собой антитело.
В одном из вариантов осуществления образец представляет собой биологическую жидкость. В дополнительном варианте осуществления образец представляет собой кровь или сыворотку или плазму. Специалистам в данной области будет понятно, что детекция аддуктов нуклеосом в жидкости организма имеет преимущество, которое заключается в том, что она является минимально инвазивным способом, для которого не требуется биопсия.
Однако в некоторых случаях предпочтительной может являться оценка статуса аддукта нуклеосом непосредственно клетки путем получения нуклеосом из такой клетки и анализом нуклеосомом на наличие конкретных аддуктов нуклеосом.
В дополнительном аспекте изобретение относится к способу детекции аддукта нуклеосом в клетке, который включает этапы:
(i) выделения хроматина из клетки;
(ii) расщепления, обработки ультразвуком или иным образом разрушения хроматина с образованием мононуклеосом и/или олигонуклеосом и
(iii) детекции или измерения содержания аддукта нуклеосом способом ELISA по изобретению, описанному в любом из указанных выше аспектов со второго по шестой.
В дополнительном аспекте изобретение относится к способу детекции или диагностики статуса заболевания у индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкости организма индивидуума и
(ii) использования обнаруженного уровня аддукта нуклеосом для идентификации статуса заболевания индивидуума.
В одном из вариантов осуществления изобретения наличие аддукта нуклеосом в образце используют для определения оптимальной схемы лечения для нуждающегося в таком лечении индивидуума. Один из примеров такого варианта осуществления представляет собой детекцию аддукта ядерный рецептор гормона-нуклеосома или аддукта комплекса гормон-рецептор гормона-нуклеосома для оценки гормональной зависимости опухоли.
В дополнительном аспекте изобретение относится к способу оценки индивидуума, являющегося животным или человеком, в отношении пригодности медицинского лечения, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкости организма индивидуума и
(ii) использования обнаруженного уровня аддукта нуклеосом в качестве параметра для выбора подходящего лечения для индивидуума.
В дополнительном аспекте изобретение относится к способу мониторинга лечения индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкости организма индивидуума;
(ii) повторения детекции или измерения аддукта нуклеосом в жидкости организма индивидуума в одном или более случаев;
(iii) использования любых изменений обнаруженного уровня аддукта нуклеосом в качестве параметра для любого изменения состояния индивидуума.
В одном из вариантов осуществления аддукт нуклеосом детектируют или определяют в качестве одной панели измерений.
В дополнительном аспекте изобретение относится к способу детекции или измерению аддукта нуклеосом отдельно или в качестве части панели измерений для детекции или диагностики статуса заболевания, или для оценки индивидуума, являющегося животным или человеком, в отношении пригодности для него медицинского лечения, или для мониторинга лечения индивидуума, являющегося животным или человеком, для применения у индивидуумов, страдающих злокачественной опухолью, доброкачественными опухолями, воспалительным заболеванием, аутоиммунным заболеванием, эндометриозом, инфекционным заболеванием, сепсисом, инсультом или инфарктом миокарда или с подозрением на него.
В дополнительном аспекте изобретение относится к способу идентификации биомаркера аддукта нуклеосом для детекции или диагностики статуса заболевания у индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или определения аддукта нуклеосом в жидкости организма индивидуума;
(ii) детекции или измерения аддукта нуклеосом в жидкости организма здорового индивидуума или контрольного индивидуума и
(iii) использования различия обнаруженных уровней у больных и контрольных индивидуумов для идентификации, является ли аддукт нуклеосом пригодным в качестве биомаркера статуса заболевания.
В дополнительном аспекте изобретение относится к набору для детекции аддукта нуклеосом, который содержит лиганд или связывающее средство, специфичное к аддукту нуклеосом или части его компонента, или средству, имитирующему структуру/форму основания ДНК, нуклеотиду или нуклеозиду или части его компонента совместно с инструкциями по использованию набора.
Наряду с компонентами гистонов и нуклеиновых кислот известно, что хроматин содержит широкий спектр белков, которые выполняют широкий диапазон функций. Авторы выбрали HMGB1, EZH2 и несколько ядерных рецепторов в качестве примеров таких белков и разработали простые способы ELISA детекции аддуктов мононуклеосом и олигонуклеосом этих белков. Авторы проводили такие способы ELISA непосредственно на образцах сыворотки, получаемой у здоровых и больных индивидуумов, и в способах не требуется экстракция образца или другая предварительная обработка образца. Неожиданно авторы выявили, что эти аддукты нуклеосом можно детектировать в сыворотке индивидуумов со злокачественной опухолью, и что анализы ELISA аддукта нуклеосом являются пригодными для детекции и диагностики состояния болезни.
HMGB1 представляет собой белок с молекулярными паттернами, ассоциированными с повреждением (DAMP), ассоциированный с гибелью клеток, апоптозом и рядом заболеваний, включая различные воспалительные и аутоиммунные патологические состояния, сепсис, менингит, нейродегенерация, SLE и злокачественную опухоль (Tang et al., 2010). Повышенная экспрессия HMGB1 возникает при многих злокачественных опухолях, и полагают, что она ассоциирована с инвазией и метастазами (Sims et al., 2010). Повышенные уровни HMGB1 также наблюдают в крови пациентов со злокачественными опухолями, а также при ряде других патологических состояний (Stoetzer et al., 2012). Циркулирующий HMGB1 можно измерять ELISA, но такие измерения не используют в общепринятой клинической практике, т.к. циркулирующий HMGB1 существует в связанной и свободной формах, и доступные в настоящее время способы вестерн-иммуноблотинга для их различия не являются подходящими для рутинного использования. Таким образом, существует необходимость в надежном способе различия свободного HMGB1 от HMGB1 в комплексах (Urbonaviciute and Voll, 2011). Один из важных классов циркулирующих комплексом HMGB1 представляет собой аддукты HMGB1-нуклеосома, и один из вариантов осуществления настоящего изобретения относится к детекции аддуктов HMGB1-нуклеосома и других аддуктов HMG-нуклеосома. Авторы продемонстрировали, что аддукты HMG-нуклеосома можно измерять в крови пациентов со злокачественными опухолями быстрым и простым способом ELISA.
HMGB1 плотно присоединен к хроматину апоптотических клеток. Исследования комплексов нуклеосома-HMGB1 выявили, что эти аддукты обнаруживают в кровотоке индивидуумов, страдающих аутоиммунным заболеванием SLE, и что аддукты участвуют в индукции антиядерных антител, которые являются ключевым признаком SLE. Наличие этих аддуктов в кровотоке использовали с целью клинической диагностики, т.к. способы вестерн-блоттинга, используемые для их детекции, являются дорогостоящими, медленными и трудоемкими и не подходят для рутинного клинического применения. Настоящее изобретение устраняет эти недостатки.
EZH2 представляет собой фермент модификации хроматина (N-метилтрансферазу лизинов гистона), который метилирует лизин 27 аминокислотного остатка 3 гистона нуклеосом, приводя к конденсации хроматина и подавлению экспрессии гена (Cao et al., 2002). Известно, что этот белок связывается с хроматином в ядре жизнеспособных клеток. Неожиданно авторы выявили, что EZH2 остается связанным с нуклеосомами после гибели клеток, и аддукты мононуклеосома-EZH2 и олигонуклеосома-EZH2 можно детектировать в сыворотке у индивидуумов со злокачественной опухолью новым способом ELISA по настоящему изобретению.
Известно, что модифицирующие хроматин ферменты вовлечены в развитие злокачественной опухоли (Fullgrabe et al., 2011), и ингибирование активности этих ферментов путем использования лекарственных средств с направленной доставкой представляет собой основную форму противоопухолевой терапии. Такие лекарственные средства включают, например, и без ограничения, ингибиторы комплекса деацетилирования гистонов (HDACi), ингибиторы метилтрансферазы гистонов (HMTi) и ингибиторы ДНК-метилтрансферазы (DNMTi). Несмотря на то, что известно, что наличие аддуктов HMGB1 в кровотоке является патологическим и ассоциировано с антиядерными антителами, открытие, что аддукты модифицирующий хроматин фермент-нуклеосома содержатся в кровотоке не было опубликовано ранее. Анализы на аддукты модифицирующий хроматин фермент-нуклеосома находят широкое применение при злокачественной опухоли, включая, например, при оценке состояний злокачественного заболевания и при определении эффективности лекарственных средств на основе ингибитора модифицирующего хроматин фермента, например, для определения, изменяется ли уровень циркулирующего аддукта модифицирующий хроматин фермент-нуклеосома в результате лечения конкретными лекарственными средствами. Способ по изобретению можно использовать для определения уровней циркулирующего аддукта модифицирующий хроматин фермент-нуклеосома в целях диагностики широкого спектра заболевании, включая детекцию, мониторинг, прогноз, дифференциальный диагноз заболевание и выбор схем лечения. Авторы продемонстрировали, что аддукты нуклеосом, содержащие фермент HMT EZH2, можно детектировать в кровотоке пациентов со злокачественными опухолями. Специалистам в данной области будет понятно, что способ по изобретению можно применять для других модифицирующих хроматин ферментов, включая указанные выше ферменты HDAC и DNMT, а также многие другие ферменты, включая, например, ферменты ацетилирования, деметилирования, фосфорилирования, дефосфорилирования, убиквитинилирования, деубиквитинилирования, сумоилирование и десумоилирование гистонов.
Ядерные рецепторы выполняют свое регуляторное действие в отношении генов в ядре под контролем гормона лиганда. Примеры включают рецепторы стероидных гормонов, рецептор гормонов щитовидной железы, рецептор глюкокортикоидов и рецептор ретиноевой кислоты и витамина D. Эти рецепторы участвуют в механизмах развития ряда злокачественных опухолей и других заболеваний. Некоторые примеры включают вовлеченность рецептора ретиноевой кислоты (RAR) в лейкозе, эстрогенового рецептора (ER) в раке молочной железы и эндометриоз, андрогенного рецептора (AR) в раке предстательной железы и рецептора гормона щитовидной железы в заболевании и злокачественной опухоли щитовидной железы.
Неожиданно авторы выявили, что аддукты ядерный рецептор-нуклеосома можно детектировать в кровотоке пациентов со злокачественными опухолями.
Таким образом, все внутриклеточные белки, ассоциированные с хроматином, выбранные авторами для исследования, можно найти в сыворотке пациентов со злокачественной опухолью в форме аддуктов нуклеосом. Эти открытия указывают на то, что такие аддукты не могут являться необычными, и что многие такие аддукты внутриклеточной нуклеосомы и белка, включая многие различные ассоциированные с хроматином белки, могут сохранять свою целостность после гибели клеток, и являться пригодными для детекции в сыворотке у пациентов со злокачественной опухолью, аутоиммунным и воспалительным заболеванием способом по настоящему изобретению.
Авторы использовали антитело к гистону в качестве иммобилизованного антитела для таких анализов в комбинации с подходящим специфическим антителом против белков хроматина (антителом против HMGB1, EZH2 или против ядерного рецептора). Авторы использовали анализы для демонстрации, что такие аддукты нуклеосом, содержащие специфические белки, можно измерять в образцах крови, получаемых у индивидуумов со злокачественной опухолью, и они являются характеристическими для применения в качестве неинвазивных или минимально инвазивных биомаркеров. Уровни аддукт нуклеосом, обнаруженные в образцах сыворотки, получаемых у больных индивидуумов, отличаются от уровней, обнаруженных в сыворотке у здоровых индивидуумов.
Авторы измеряли уровни циркулирующих внеклеточных аддуктов нуклеосома-HMGB1 и нуклеосома-EZH2 в образцах крови, получаемых у 3 индивидуумов с раком толстого кишечника, 6 индивидуумов с раком легких и 2 индивидуумов с раком поджелудочной железы, и сравнивали их с уровнями, наблюдаемыми в образцах крови у 5 здоровых индивидуумов, а также с получаемым искусственный путем препаратом нуклеосом сыворотки у здоровых индивидуумов, получаемых как описано в литературе (*Holdenrieder et al., 2001) и с коммерчески доступным препаратом нуклеосом, получаемых расщеплением хроматина, выделяемого из клеток Hela.
Нормальные диапазоны рассчитывали на основании результатов для 5 здоровых индивидуумов (среднее значение ±2 стандартных отклонения от среднего значения) для аддуктов нуклеосома-HMBG1 и нуклеосома-EZH2 и анализировали результаты для индивидуумов со злокачественной опухолью, чтобы посмотреть находятся ли они в соответствующем нормальном диапазоне или вне его. Данные демонстрируют, что в 2 из 3 образцов рака толстого кишечника, 4 из 6 образцов рака легких и 1 из 2 образцов рака поджелудочной железы уровни аддукта нуклеосома-HMBG1 являлись повышенными, и аналогично, что в 2 из 3 образцов рака толстого кишечника, 4 из 6 образцов рака легких и 1 из 2 образцов рака поджелудочной железы уровни аддукта нуклеосома-EZH2 являлись повышенными (результаты оптической плотности выше, верхняя граница нормального диапазона).
Аналогично, авторы измерили уровни аддуктов ядерный рецептор-нуклеосома у здоровых и больных пациентов и выявили, что они содержатся в сыворотке у пациентов со злокачественными опухолями.
Белки, которые связываются с хроматином включают без ограничения ядерные рецепторы, белки группы с высокой подвижностью (такие как HMGB1), белки polycomb, ферменты модификации хроматина (такие как EZH2), ферменты модификации ДНК, ядерные рецепторы, факторы транскрипции, архитектурные или структурные белки, факторы усиления транскрипции, факторы подавления транскрипции, белки репликации, белки репарации повреждений ДНК и любые другие белки, участвующие в контроле экспрессии генов, упаковки или репликации хроматина.
Аддукты нуклеосом также могут возникать вследствие связывания нуклеосом, содержащихся в биологической жидкости после гибели клеток. Пример такого аддукта представляет собой аддукт нуклеосома-антитело, образующийся при аутоиммунном заболевании, таком как SLE.
Таким образом, один из вариантов осуществления изобретения относится к способу детекции или измерения содержания комплекса или аддукт нуклеосома-белок. Подлежащие измерению аддукты нуклеосом могут являться любого происхождения, включая без ограничения, природные аддукты нуклеосом. содержащиеся в биологических жидкостях вследствие нормального или патологического состояния, или аддукты нуклеосом можно получать расщепление хроматина, выделяемого из клеток, или их можно получать индуцированным апоптозом или некрозом клеток (например, способом *Holdenrieder et al., 2001). Неожиданно, авторы выявили, что аддукты нуклеосом возникают во всех этих случаях и их можно детектировать способом по изобретению.
В другом варианте осуществления изобретение относится к способу детекции или измерения содержания аддукта нуклеосома-белок в биологической жидкости.
В дополнительном варианте осуществления изобретение относится к способу детекции или диагностики наличия, типа, рецидива или тяжести заболевания или оценки оптимального лекарственного средства или других видов лечения посредством тестирования образца индивидуума на наличие или уровень одного или более комплексов или аддуктов нуклеосома-белок.
В дополнительном варианте осуществления изобретение относится к способу детекции или диагностики наличия, типа, рецидива или тяжести заболевания или оценки оптимального лекарственного средства или других видов лечения путем тестирования образца, получаемого у индивидуума, на наличие или уровень комплекса или аддукта нуклеосома-белок в качестве панели тестов. Опубликован способ ELISA детекции внеклеточных нуклеосом, содержащих различные модификации гистона (Bawden et al., 2005).
Таким образом, такая панель тестов может состоять, например, из двух или более измерений нуклеосом, содержащих различные эпитопы нуклеосом, включая без ограничения, различные аддукты и/или модификации гистона и/или варианты гистонов, и/или модифицированные нуклеотиды, и/или измерения по существу нуклеосом, или любой комбинации или отношения любого из этих и любых других эпитопов нуклеосом в качестве показателя нормального статуса здоровья или заболевания индивидуума.
Авторы делают вывод, что способ по настоящему изобретению представляет собой эффективный способ детекции и измерения аддуктов нуклеосом, содержащих конкретные белки, и что такой способ является превосходным способом детекции аддуктов нуклеосом по сравнению со способами существующего уровня техники. Способ является быстрым, низкозатратным и пригодным для использования в сложных биологических средах и жидкостях, включая кровь и ее производные. Авторы продемонстрировали, что способ по настоящему изобретению можно использовать для детекции аддуктов нуклеосом в крови и что их можно использовать в качестве биомаркера злокачественной опухоли. Специалистам в данной области будет понятно, что биомаркер, содержащийся в крови, представляет ценность для широкого спектра диагностических целей и целей скрининга заболевания для злокачественной опухоли и других заболеваний, которые ассоциированы с повышенными уровнями циркулирующих нуклеосом (Holdenrieder et al., 2001).
В одном из аспектов изобретение относится к способу количественного иммунного или сэндвич-иммунологического анализа двойных антител для детекции и измерения внеклеточных аддуктов нуклеосом в образце. Один из вариантов осуществления этого аспекта представляет собой иммунологический анализ, который включает этапы:
(i) приведения образца, который может содержать аддукты нуклеосом, в контакт с первым антителом или другим связывающим средством, которое связывается с нуклеосомами или их компонентом;
(ii) приведения нуклеосом или образца в контакт со вторым антителом или другим связывающим средством, которое связывается с белком, который может содержаться в виде аддукта нуклеосома-белок;
(iii) детекции и/или количественного определения связывания указанного второго антитела или другого связывающего средства с аддуктом нуклеосома-белок в образце и
(iv) использования наличия или степени такого связывания в качестве показателя наличия аддукта нуклеосома-белок в образце.
По другому аспекту изобретение относится к способу детекции и измерению внеклеточных аддуктов нуклеосом в образце количественным иммунологическим анализом, который включает этапы:
(i) приведения образца, который может содержать аддукты нуклеосом, содержащих конкретный белок, в контакт с первым антителом или другим связывающим средством, которое связывается с представляющим интерес белком;
(ii) приведения нуклеосом или образца в контакт со вторым антителом или другим связывающим средством, которое связывается с нуклеосомами или их компонентом;
(iii) детекции и/или количественного определения связывания указанного второго антитела или другого связывающего средства с образцом нуклеосом, где второе антитело или другое связывающее средство связывается с нуклеосомами или их компонентом в образце, и
(iv) использования наличия или степени такого связывания в качестве показателя наличия аддукта нуклеосом в образце.
Специалистам в данной области будет понятно, что антитело или другое связывающее средство, используемое для связывания нуклеосом или их компонента на этапе (i) указанного выше первого аспекта и на этапе (ii) указанного выше второго аспекта, может представлять собой антитело (или другое связывающее средство), направленное против интактных нуклеосом или против любой части компонента нуклеосомы, включая без ограничения, против гистона, варианта гистона, модификации гистона, нуклеотида, модифицированного нуклеотида или другой части компонента ДНК нуклеосомы. Таким образом, в дополнительном аспекте изобретение относится к способу детекции (только) тех аддуктов нуклеосома-белок, которые дополнительно обладают другим признаком, к которому направлено такое связывающее средство, включая без ограничения, конкретную модификацию гистона, вариант гистона или нуклеотид. Преимущество этой схемы заключается в том, что эпитопный компонент нуклеосомы и эпитоп связанного белка анализа можно выбирать так, чтобы они являлись эпитопами, уровни которых значительно различаются у здоровых или больных пациентов, или для другого исследуемого статуса пациента. Таким образом, вероятнее всего снизится доля нуклеосом, обнаруженных анализом, но повысится клиническая избирательность или специфичность анализа.
Авторы выполняли такую схему анализа с использованием антитела, направленного на компонент нуклеосомы H2AZ, в качестве антитела против нуклеосомы в сочетании с антителами против EZH2 и выявили, что аддукты нуклеосома-EZH2, конкретно ассоциированные с H2AZ, можно детектировать такими анализами, и что такие анализы можно использовать для проведения различий между образцами, получаемыми у здоровых и больных индивидуумов.
В дополнительном аспекте изобретения подлежащий детекции аддукт нуклеосом может содержать более одного белка. Дополнительные белки в аддукте могут быть прямо или опосредованно связаны с нуклеосомой. Например, нуклеосома может быть связана с белком HMGB и дополнительно с дополнительным белком или белками. Дополнительный белок(и) может быть прямо связан с нуклеосомой или может быть связан с белком HMGB, и таким образом опосредованно связан с нуклеосомой. Аддукты нуклеосом могут содержать крупные белковые комплексы, состоящие из многих беловых компонентов, где связывание конкретного белка в аддукте комплекса с нуклеосомой может происходить через многие промежуточные связи. Специалистам в данной области будет понятно, что белок, прямо или опосредованно связанный с нуклеосомой в аддукте нуклеосом, можно детектировать способом по настоящему изобретению.
Специалистам в данной области будет понятно, что способы по описываемому изобретению включают ряд вариантов осуществления, включая анализы типа биосенсора и безметочные анализы типа, доступного на рынке, например, от ForteBio Incorporated, USA.
В дополнительном аспекте изобретение относится к способу детекции доли нуклеосом, которые содержат конкретный аддукт нуклеосом, в образце, включающему этапы:
(i) детекции или измерения уровня нуклеосом в образце;
(ii) детекции или измерения уровня аддукта нуклеосом способом по настоящему изобретению и
(iii) использования двух измерений для детекции доли нуклеосомы, которые содержат аддукт нуклеотида.
Авторы продемонстрировали, что детекцию и измерение аддуктов нуклеосом в крови, получаемой у индивидуумов, можно использовать в качестве способа диагностики для идентификации индивидуумов со злокачественной опухолью и отличия их от здоровых индивидуумов. В дополнительном аспекте изобретение относится к способу детекции или диагностики наличия заболевания путем измерения или детекции наличия и/или уровня или концентрации внеклеточных аддуктов нуклеосом в жидкости организма и использования обнаруженного уровня в качестве биомаркера статуса заболевания индивидуума, включая без ограничения клиническую диагностику заболевания, дифференциальную диагностику типа или подтипа заболевания или прогноз заболевания или рецидива заболевания, или диагностику у индивидуума, восприимчивого к схемам лечения. Специалистам в данной области понятно, что жидкости организма, используемые для диагностического тестирования, включают без ограничения кровь, сыворотку, плазму, мочу, цереброспинальную жидкость и другие жидкости. В предпочтительном варианте осуществления жидкость организма, выбираемая в качества образца, представляет собой кровь, сыворотку или плазму. Результат анализа, уровень, концентрацию или количество аддукта нуклеосом в жидкости организма можно выражать в абсолютных величинах или относительных величинах, например, без ограничения в виде доли от общего уровня содержащихся нуклеосом или в виде отношения к уровню нуклеосом, содержащих другую нуклеосомную структуру, такую как модификация гистона, или к уровню общей ДНК.
В одном из вариантов осуществления изобретения измерение аддукта нуклеосом используют в качестве представителя диагностической панели тестов или измерений для детекции или диагностики статуса заболевания индивидуума, включая без ограничения клиническую диагностику заболевания, дифференциальную диагностику типа или подтипа заболевания или прогноза заболевания, или рецидива заболевания, или диагностики у индивидуума, восприимчивого к схемам лечения.
По другому аспекту изобретение относится к способу детекции или измерению содержания и/или уровня связывания хроматина белка в клетке, который включает этапы:
(i) выделения хроматина из клетки;
(ii) разрушения хроматина с образованием мононуклеосом и/или олигонуклеосом и
(iii) детекции или измерения содержания аддукта нуклеосом в мононуклеосомах и/или олигонуклеосомах способом иммунологического анализа по изобретению.
Способы получения мононуклеосом и/или олигонуклеосом из хроматина хорошо известны в данной области и включают ферментативное расщепление и обработку ультразвуком (Dai et al., 2011). Авторы продемонстрировали этот аспект для нуклеосом, получаемых из клеток Hela и MCF7.
Специалистам в данной области будет понятно, что термины антитело, связывающее средство или лиганд по отношению к любому аспекту изобретения не ограничены и предназначены включать фрагменты антител, аптамеры или любое связывающее средство, способное связываться с конкретными молекулами или соединениями, и что в способе по изобретению можно использовать любое подходящее связывающее средство. Также будет понятно, что термин нуклеосомы предназначен включать мононуклеосомы и олигонуклеосомы и любые такие фрагменты хроматина, которые можно анализировать в жидких средах.
По другому аспекту изобретение относится к набору для детекции или измерения аддуктов нуклеосом, который содержит лиганд или связывающее средство, специфическое к аддукту нуклеосом или части его компонента, или средству, имитирующему структуру/форму аддукта нуклеосом или части его компонента, совместно с инструкциями по использованию набора в соответствии с любым из способов, определяемых в настоящем описании.
По другому аспекту изобретение относится к способу идентификации биомаркера аддукта нуклеосом для детекции или диагностики статуса заболевания у животных или людей, который включает этапы:
(i) детекции или измерения уровня внеклеточного аддукта нуклеосом в жидкости организма больных индивидуумов;
(ii) детекции или измерения уровня неклеточного аддукта нуклеосом в жидкости организма контрольных индивидуумов и
(iii) использования разницы между уровнями, обнаруженными у больных и контрольных индивидуумов, для идентификации, является ли аддукт нуклеосом пригодным в качестве биомаркера для этого заболевания.
Специалистам в данной области будет понятно, что контрольных индивидуумов можно выбирать по различным принципам, которые могут включать, например, индивидуумов, для которых известно, что они не страдают заболеванием, или они могут представлять собой индивидуумов с другим заболеванием (например, для исследования дифференциальной диагностики).
В дополнительном аспекте изобретение относится к способу идентификации биомаркера аддукта нуклеосом для оценки прогноза у больного индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения уровня внеклеточного аддукта нуклеосом в жидкости организма больных индивидуумов и
(ii) корреляции уровня внеклеточного аддукта нуклеосом, обнаруженного в жидкости организма больных индивидуумов, с исходом заболевания индивидуумов.
В дополнительном аспекте изобретение относится к способу идентификации биомаркера аддукта нуклеосом, чтобы использовать его для выбора схемы лечения для нуждающегося в лечении больного индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения уровня внеклеточного аддукта нуклеосом в жидкости организма больных индивидуумов и
(ii) корреляции уровня внеклеточного аддукта нуклеосом, обнаруженного в жидкости организма больных индивидуумов, с наблюдаемой эффективностью схемы лечения у таких индивидуумов.
В дополнительном аспекте изобретение относится к способу идентификации биомаркера аддукта нуклеосом, чтобы использовать его для мониторинга лечения больного индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения уровня внеклеточного аддукта нуклеосом в жидкости организма больного индивидуума;
(ii) повторения указанной детекции или измерения в одном или более случаях во время прогрессирования заболевания у индивидуума и
(iii) корреляции уровня внеклеточного аддукта нуклеосом, обнаруженного в жидкости организма, больного индивидуума с прогрессированием заболевания у индивидуума.
В дополнительном аспекте изобретение относится к биомаркеру, идентифицируемому способом, как определено в настоящем описании.
Дополнительный аспект изобретения относится к лигандам или связывающим средствам, таким как природные или химически синтезированные соединения, способные специфически связываться с биомаркером. Лиганд или связывающее средство по изобретению может включать пептид, антитело или его фрагмент, или синтетический лиганд, такой как искусственное антитело на основе пластика или аптамер, или олигонуклеотид, способный специфически связываться с биомаркером. Антитело может представлять собой моноклональное антитело или его фрагмент, способный специфически связываться с биомаркером. Лиганд по изобретению можно метить обнаруженным маркером, таким как люминесцентный, флуоресцентный фермент или радиоактивный маркер, альтернативно или дополнительно лиганд по изобретению можно метить аффинной меткой, например, биотином, авидином, стрептавидином или His-меткой (например, гекса-His). Альтернативно, связывание лиганда можно определять с использованием безметочной технологии, например, технологии от ForteBio Inc.
Биосенсор по изобретению может содержать биомаркер или имитирующее его структуру/форму средство, способное специфически связываться с антителом против биомаркера. Также предоставлена матрица, содержащая лиганд или имитирующее средство, как описано в настоящем описании.
Изобретение также относится к использованию одного или более лигандов, как описано в настоящем описании, которые могут быть природными или химически синтезированными, и соответственно к пептиду, антителу или его фрагменту, аптамеру или олигонуклеотиду, или к использованию биосенсора по изобретению или матрицы по изобретению, или набора по изобретению для детекции и/или количественного определения биомаркера. При таких видах использования детекцию и/или количественное определение можно проводить в биологическом образце, как определено в настоящем описании.
Предоставлены наборы для диагностики или мониторинга для проведения способов по изобретению. Такие наборы соответственно содержат лиганд по изобретению для детекции и/или количественного определения биомаркера, и/или биосенсор, и/или матрицу, как описано в настоящем описании, необязательно совместно с инструкциями по использованию набора.
Дополнительный аспект изобретения представляет собой набор для детекции наличия состояния болезни, содержащий биосенсор, способный детектировать и/или количественно определять один или более биомаркеров, как определено в настоящем описании.
Биомаркеры для детекции наличия заболевания представляют собой основные мишени для открытия новых мишеней и лекарственных молекул, которые замедляют или останавливают прогрессирование нарушения. Вследствие того, что уровень биомаркера является показателем нарушения и реакции на лекарственное средство, биомаркер является пригодным для идентификации новых терапевтических соединений в анализах in vitro и/или in vivo. Биомаркеры по изобретению можно применять в способах скрининга для соединений, которые модулируют активность биомаркера.
Таким образом, в дополнительном аспекте изобретение относится к использованию связывающего средства или лиганда, как описано, который может представлять собой пептид, антитело или его фрагмент или аптамер, или олигонуклеотид по изобретению, или к использованию биосенсора по изобретению или матрицы по изобретению, или к набору по изобретению для идентификации вещества, способного улучшать и/или подавлять образование биомаркера.
Также предоставлен способ идентификации вещества, способного улучшать или подавлять образование биомаркера у индивидуума, включающий введение тестируемого вещества индивидууму, являющемуся животным, и детектирования и/или количественного определения уровня биомаркера, содержащегося в тестируемом образце у индивидуума.
Термин «биомаркер» означает характерный биологический или биологически получаемый показатель процесса, события или состояния. Биомаркеры можно использовать в способах диагностики, например, клинического скрининга и прогностической оценки и при мониторинге результатов терапии, идентифицируя индивидуумов, которые наиболее вероятно отвечают конкретному терапевтическому лечению, скрининге и разработке лекарственных средств. Биомаркеры и их применение являются ценными для идентификации новых видов лекарственного лечения и для открытия новых мишеней для лекарственного лечения.
Термины «детекция» и «диагностика», как используют в настоящем описании, включают идентификацию, подтверждение и/или характеризацию состояния болезни. Способы детекции, мониторинга и диагностики по изобретению являются пригодными для подтверждения существования заболевания, для мониторинга развития заболевания посредством оценки начала и прогрессирования, или для оценки улучшения состояния или регрессии заболевания. Способы детекции, мониторинга и диагностики также являются пригодными в способах оценки клинического скрининга, прогнозирования, выбора терапии, оценки терапевтической пользы, т.е. для скрининга лекарственных средств и разработки лекарственных средств.
Эффективные способы диагностики и мониторинга обеспечивают очень эффективные «решения для индивидуума» с возможностью улучшенного прогнозирования посредством постановки правильного диагноза, обеспечивающего быструю идентификацию наиболее подходящего лечения (таким образом, уменьшая ненужное воздействие вредных побочных эффектов лекарственного средства) и снижая частоту рецидивов.
В одном из вариантов осуществления указанный биомаркер выделяется клетками опухоли. Таким образом, в дополнительном аспекте изобретение относится к способу детекции роста опухоли, который включает этапы: (i) измерения биомаркера в биологическом образце, который ассоциирован или выделяется клетками опухоли, и (ii) демонстрации того, что уровень указанного биомаркера ассоциирован с размером, стадией, агрессивностью или распространением опухоли.
Известно, что повышенная скорость обновления клеток, гибель клеток и апоптоз приводят к повышенным уровням в кровотоке внеклеточных нуклеосом (Holdenrieder et al., 2001). Уровень циркулирующих внеклеточных нуклеосом является неспецифическим показателем и возникает при ряде патологических состояний, включая воспалительные заболевания, целый ряд доброкачественных и злокачественных патологических состояний, аутоиммунные заболевания, а также после травмы или ишемии (Holdenrieder et al., 2001). Специалистам в данной области будет понятно, что изобретение находит применение в различных областях заболеваний, где у индивидуумов обнаруживают циркулирующие нуклеосомы. Они включают без ограничения травму (например, тяжелое повреждение или хирургическую операцию), экстремальную физическую нагрузку (например, бег марафона), инсульт и инфаркт миокарда, сепсис или другую серьезную инфекцию и эндометриоз.
Иммунологические анализы по изобретению включают количественные иммунологические анализы, в которых применяют способы ферментативной детекции (например, ELISA), флуоресцентно-меченые количественные иммунологические анализы, флуоресцентно-меченые количественные иммунологические анализы с режимом временного разрешения, хемилюминесцентные количественные иммунологические анализы, иммунотурбидиметрические анализы, количественные иммунологические анализы с мечеными микрочастицами и иммунорадиометрические анализы и способы конкурентного иммунологического анализа, включая способы иммунологического анализа с меченым антигеном и меченым антителом с различными типами меток, включая радиоактивные, ферментативные, флуоресцентные, флуоресцентные в режиме временного разрешения метки и метки на основе микрочастиц. Все указанные способы иммунологического анализа хорошо известны в данной области, см. например, Salgame et al., 1997 и van Nieuwenhuijze et al., 2003.
В одном из вариантов осуществления указанный биологический образец содержит жидкость организма. Например, биологические образцы, которые можно тестировать в способе по изобретению включают цереброспинальную жидкость (CSF), цельную кровь, сыворотку крови, плазму, менструальную кровь, эндометриоидную жидкость, мочу, слюну или другие жидкости организма (кал, слезную жидкость, синовиальную жидкость, мокроту), выдыхаемый пар, например, такой как конденсированный выдыхаемый пар или его экстракт или очищенная фракция, или его разведение. Биологические образцы также включают образцы от живых индивидуумов или получаемых посмертно. Образцы можно получать, например, при необходимости разбавлять или концентрировать и хранить обычным способом.
В одном из вариантов осуществления способ по изобретению повторяют по несколько раз. Такой вариант осуществления обеспечивает преимущество, которое заключается в том, что он обеспечивает возможность проводить мониторинг результатов детекции в течение длительного периода времени. Такой порядок обеспечивает преимущество мониторинга или оценки эффективность лечения состояния болезни. Такие способы мониторинга по изобретению можно использовать для мониторинга начала заболевания, прогрессирования, стабилизации, улучшение состояния, рецидива и/или ремиссии.
Таким образом, изобретение также относится к способу мониторинга эффективности терапии состояния болезни у индивидуума с подозрением на такое заболевание, включающему детекцию и/или количественное определение биомаркера, содержащегося в биологическом образце у указанного индивидуума. В способах мониторинга тестируемые образцы можно получать два или более раз. Способ может дополнительно включать сравнение уровня биомаркера(ов), содержащихся в тестируемом образце с одним или более контролей и/или с одним или более ранее тестируемых образцов, получаемых ранее у того же самого тестируемого индивидуума, например, до начала терапии, и/или у того же самого тестируемого индивидуума на раннем этапе терапии. Способ может включать детекцию изменения природы или количества биомаркера(ов) в тестируемых образцах, получаемых в разных случаях.
Таким образом, в дополнительном аспекте изобретение относится к способу мониторинга эффективности терапии состояния болезни у являющегося человеком или животным индивидуума, включающему:
(a) определение количества биомаркера, как определено в настоящем описании, и
(b) сравнение количества указанного биомаркера в тестируемом образце с количеством, содержащимся в одном или более контролей и/или одном или более ранее тестируемых образцов, получаемых ранее у одного и того же тестируемого индивидуума.
Измерение уровня биомаркера в тестируемом образце относительной уровня в тестируемом ранее образце, получаемом ранее у одного и того же тестируемого индивидуума, может являться показателем положительного действия, например, стабилизации или улучшения, указанной терапии на нарушение или предполагаемое нарушение. Кроме того, после окончания лечения способ по изобретению можно периодически повторять с целью мониторинга рецидива заболевания.
Способы мониторинга эффективности терапии можно использовать для мониторинга терапевтической эффективности существующих видов терапии и новых видов терапии у являющегося человеком индивидуумов и у не являющихся человеком животных (например, на модели на животных). Эти способы мониторинга можно вводить в скрининг новых лекарственных веществ и комбинаций веществ.
В дополнительном варианте осуществления мониторинг наиболее быстрых изменений, обусловленных быстро действующими видами терапии, можно проводить в короткие интервалы часов или суток.
В дополнительном аспекте изобретение относится к способу идентификации биомаркера для детекции наличия состояния болезни. Термин «идентификация», как используют в настоящем описании, означает подтверждение наличия биомаркера, содержащегося в биологическом образце. Определение количества биомаркера, содержащегося в образце, может включать определение концентрации биомаркера, содержащегося в образце. Идентификацию и/или количественное определение можно проводить непосредственно в образце или опосредованно в его экстракте, или в его разведении.
В альтернативных аспектах изобретения содержание биомаркера оценивают детекцией и/или количественным определением антитела или его фрагментов, способных специфически связываться с биомаркером, которые индуцируются в организме индивидуума в ответ на биомаркер, и таким образом, присутствуют в биологическом образце у индивидуума в состоянии болезни.
Идентификацию и/или количественное определение можно проводить любым способом, подходящим для идентификации содержания и/или количества конкретного белка в биологическом образце у индивидуума или в очищенном состоянии или экстракте биологического образца или в его разведении. В способах по изобретению количественное определение можно проводить, измеряя концентрацию биомаркера в образце или образцах. Биологические образцы, которые можно тестировать в способах по изобретению, включают такие, как определено ранее в настоящем описании. Образцы можно получать, например, при необходимости разбавлять или концентрировать, и хранят обычным способом.
Идентификацию и/или количественное определение биомаркеров можно проводить детекцией биомаркера или его фрагмента, например, фрагмента с усеченным С-концом, или с усеченным N-концом. Соответствующая длина фрагментов составляет более 4 аминокислот, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот. В частности, отмечают, что пептиды аналогичной или родственной последовательности с последовательностью хвостов гистона представляют собой особенно пригодные фрагменты гистоновых белков.
Биомаркер можно непосредственно детектировать, например, SELDI или MALDI-TOF. Альтернативно, биомаркер можно детектировать непосредственно или опосредованно через взаимодействие с лигандом или лигандами, такими как антитело или связывающийся с биомаркером его фрагмент, или другим пептидом или лигандом, например, аптамером или олигонуклеотидом, способным специфически связываться с биомаркером. Лиганд или связывающее средство может содержать обнаруженную метку, такую как люминесцентная, флуоресцентная или радиоактивная метка и/или аффинная метка.
Например, детекцию и/или количественное определение можно проводить одним или более способов, выбранных из группы, состоящей из: SELDI(-TOF), MALDI (-TOF), анализа на основе 1-D геля, анализа на основе 2-D геля, масс-спектрального анализа (MS), LC с обращенной фазой (RP), гель-проникающей, ионобменной, аффинной хроматографии, ВЭЖХ, СЭЖХ и других LC или LC способах на основе MS. Подходящие способы LC MS включают ICAT® (Applied Biosystems, CA, USA), или iTRAQ® (Applied Biosystems, CA, USA). Также можно использовать жидкостную хроматографию (например, высокоэффективную жидкостную хроматографию (ВЭЖХ) или жидкостную хроматографию низкого давления (LPLC)), тонкослойную хроматографию, ЯМР-спектроскопию (ядерный магнитный резонанс).
Способы диагностики или мониторинга по изобретению могут включать анализ образца посредством SELDI TOF или MALDI TOF для детекции содержания или уровня биомаркера. Эти способы также являются подходящими для клинического скрининга, прогнозирования, мониторинга результатов терапии, идентификации индивидуумов, которые, наиболее вероятно, отвечают на конкретное терапевтическое лечение, для скрининга и разработки лекарственных средств и идентификации новых мишеней для лекарственного лечения.
Идентификацию и/или количественное определение биомаркеров аналита можно проводить иммунологическим способом, включающим антитело или его фрагмент, способный специфически связываться с биомаркером. Подходящие иммунологические способы включают иммунологические сэндвич-анализы, такие как сэндвич-ELISA, в которых детекцию биомаркеров аналита проводят с использованием двух антител, которые распознают различные эпитопы на биомаркере аналита, радиоиммунологические анализы (RIA), прямые, опосредованные или конкуретные твердофазные иммуноферментные анализы (ELISA), ферментативные иммунологические анализы (EIA), флуоресцентные иммунологические анализы (FIA), вестерн-блоттинг, иммунопреципитацию и любой иммунологический анализ на основе частиц (например, с использованием частиц золота, серебра или латекса, магнитных частиц, или Q-точек). Иммунологические способы можно проводить, например, в формате микротитрационного планшета или стрипа.
В одном из вариантов осуществления один или более биомаркеров можно замещать молекулой, или измеряемым фрагментом молекулы, выявляемой до или после биомаркера в биологическом пути.
Идентификация ключевых биомаркеров, специфических к заболеванию, является основным для интеграции диагностических способов и схем лечения. С использованием прогностических биомаркеров можно разрабатывать подходящие диагностические средства, таких как биосенсоры, таким образом, в способах и применениях по изобретению, идентификацию и количественное определение можно проводить с использованием биосенсора, микроаналитической системы, сконструированной в микроформате системы, микроразделительной системы, иммунохроматографической системы или других подходящих аналитических устройств. Биосенсор может включать иммунологический способ детекции биомаркера(ов), электрические, термические, магнитные, оптические (например, голограмма) или акустические способы. С использованием таких биосенсоров возможно детектировать биомаркер(ы)-мишень при предполагаемых концентрациях, выявляемых в биологических образцах.
Как используют в настоящем описании, термин «биосенсор» означает все, что способно детектировать наличие биомаркера. Примеры биосенсоров описаны в настоящем описании.
Биосенсоры по изобретению могут содержать связывающее средство лиганда или лигандов, как описано в настоящем описании, способное специфически связываться с биомаркером. Такие биосенсоры являются пригодными для детекции и/или количественного определения биомаркера по изобретению.
Биомаркер(ы) по изобретению можно детектировать с использованием биосенсора, включающего технологии, основанные на «умных» голограммах или высокочастотных акустически системах, такие системы, в частности, можно выполнять в конфигурациях «штрихкода» или матрицы.
В сенсорах на основе умных голограмм (Smart Holograms Ltd, Cambridge, UK) голографическое изображение хранят в тонкой полимерной пленке, которую сенсибилизируют для взаимодействия с биомаркером. При воздействии биомаркер взаимодействует с полимером, приводя к изменению изображения, отображаемого голограммой. Считывание результатов тестирования может представлять собой изменение яркости в оптическом диапазоне, изображение, окраску и/или положение изображения. Для количественных и полуколичественных применений голограмму сенсора можно считывать невооруженным глазом, таким образом, устраняя необходимость оборудования для детекции. Для прочтения сигнала можно использовать простой цветовой сенсор, когда необходимы количественные измерения. Мутность или окраска образца не мешает функционированию сенсора. Формат сенсора обеспечивает многоканальное использование для одновременной детекции нескольких веществ. Можно конструировать обратимые и необратимые сенсоры, чтобы они соответствовали различным требованиям, и возможным являлось непрерывное измерение конкретного представляющего интерес биомаркера.
Соответственно биосенсоры для детекции одного или более биомаркеров по изобретению сочетают бимолекулярное распознавание с подходящими средствами для конвертирования в сигнал детекции наличия или количественного определения биомаркера в образце. Биосенсоры можно адаптировать для диагностического тестирования «альтернативного участка», например, в палате, амбулаторно, приемной врача, дома, в поле и на рабочем месте.
Биосенсоры для детекции одного или более биомаркеров по изобретению включают акустические, биосенсоры на основе плазмонного резонанса, голографические, биосенсоры на основе интерферометрии биослоя (BLI) и сконструированные в микроформате сенсоры. Для детекции одного или более биомаркеров по изобретению в биосенсорах можно применять отпечатанные элементы распознавания, технологию тонкопленочного транзистора, устройства магнитно-акустического резонатора и другие новые акустико-электрические системы.
Способы, включающие идентификацию и/или количественное определение одного или более биомаркеров по изобретению, можно проводить на стендовых измерительных устройствах или их можно вводить в одноразовые диагностические или мониторинговые платформы, которые можно использовать вне лаборатории, например, в кабинете врача или на месте у постели индивидуума. Подходящие биосенсоры для проведения способов по изобретению включают «пластиковые» карточки с оптическими или акустическими средствами считывания. Биосенсоры можно конструировать таким образом, чтобы обеспечивать электронную передачу получаемых данных врачу для интерпретации, и, таким образом, можно закладывать основу для электронной медицины.
Диагностические наборы для диагностики и мониторинга наличия состояния болезни описаны в настоящем описании. В одном из вариантов осуществления наборы дополнительно содержат биосенсор, выполненный с возможностью идентификации и/или количественного определения биомаркера. Соответственно набор по изобретению может содержать один или более компонентов, выбранных из группы: связывающего средства для лиганда или лигандов, специфичного для биомаркера или средства, имитирующего структура/форму биомаркера, одного или более контролей, одного или более реагентов и одного или более расходных материалов, необязательно совместно с инструкциями по использованию набора в соответствии с любым из способов, определяемых в настоящем описании.
Идентификация биомаркеров для состояния болезни обеспечивает возможность интеграции диагностических способов и схем лечения. Детекцию биомаркера по изобретению можно использовать для скрининга индивидуумов перед их участием в клинических испытаниях. Биомаркеры обеспечивают средства для обозначения терапевтического ответа, отсутствия ответа, профиля неблагоприятного побочного действия, степени соблюдения схемы лечения и получения соответствующих уровней лекарственного средства в сыворотке. Биомаркеры можно использовать для обеспечения предупреждения неблагоприятной реакции на лекарственное средство. Биомаркеры пригодны для разработки персонализированных видов терапии, их можно использовать в качестве оценки ответа на оптимизированное дозирование, для сведения к минимуму числа выписываемых лекарственных препаратов, уменьшения задержки при получении эффективной терапии и устранения неблагоприятных реакций на лекарственное средство. Таким образом, посредством мониторинга биомаркера по изобретению, можно точно оптимизировать ведение индивидуума, чтобы оно соответствовало потребностям, определяемым нарушением и фармакогеномным профилем индивидуума, таким образом, биомаркер можно использовать для титрования оптимальной дозы, прогнозирования положительного терапевтического ответа и идентификации таких индивидуумов, подвергающихся высокому риску тяжелых побочных эффектов.
Тесты на основе биомаркера обеспечивают первую линию оценки «новых» индивидуумов и обеспечивают объективные измерения для точной и быстрой диагностики, не достижимой с использованием существующих в настоящее время измерений.
Кроме того, диагностические тесты на основе биомаркера являются пригодными для идентификации членов семьи или индивидуумов с умеренным или бессимптомным заболеванием, или которые могут подвергаться высокому риску развития симптоматического заболевания. Это обеспечивает возможность начала подходящей терапии или превентивных мер, например, регулирование факторов риска. Признано, что такие подходы улучшают исход и могут предотвращать явное начало нарушения.
Как и средства мониторинга для индивидуума способы мониторинга биомаркера, биосенсоры и наборы также являются важными для обеспечения возможности врача определять, обусловлен ли рецидив усугублением нарушения. Если оценивают, что фармакологическое лечение является неподходящим, то терапию можно восстанавливать или повышать, при необходимости можно проводить изменение терапии. Вследствие того, что биомаркеры являются чувствительными к состоянию нарушения, они представляют собой показатель влияния лекарственной терапии.
Ниже изобретение проиллюстрировано со ссылкой на следующие ниже неограничивающие примеры.
ПРИМЕР 1
Образцы сыворотки получали у 5 здоровых индивидуумов, 3 индивидуумов с раком толстого кишечника, 6 индивидуумов с раком легких и 2 индивидуумов с раком поджелудочной железы. Коммерчески доступный препарат нуклеосом, получаемый расщеплением хроматина, выделяемого из клеток Hela, в которых ДНК и белки в нуклеосоме являются сшитыми с целью стабильности, подвергали серийному разведению в лошадиной сыворотке. Препарат нуклеосом в крови человека получали способом Holdenrieder (*Holdenrieder et al., 2001). Эти образцы и препараты анализировали в двух повторениях для аддукта нуклеосома-EZH2 способом по изобретению. Чистую коммерчески доступную лошадиную сыворотку, производимую для применения в тканевой культуре, также оценивали в качестве образца отрицательного контроля, не содержащего нуклеосом или аддуктов нуклеосом.
В способе ELISA использовали иммобилизованное на твердой фазе антитело против гистона, которое связывается с интактными нуклеосомами, и биотинилированное моноклональное идентифицирующее антитело против EZH2, как указано ниже. Раствор антитела против гистона в 0,1 M фосфатном буфере pH 7,4 добавляли в лунки микротитрационного планшета (100 мкл/лунку) и инкубировали в течение ночи при 4°C для покрытия лунок иммобилизованным антителом. Избыток антитела против гистона сливали. В луки добавляли раствор бычьего сывороточного альбумина (20 г/л) (200 мкл/лунку) и инкубировали в течение 30 минут при комнатной температуре для блокирования избытка участков связывания белка в луках. Избыток раствора бычьего сывороточного альбумина сливали и промывали лунки три раза буфером для промывания (200 мкл/лунку, 0,05M буфером TRIS/HCl pH 7,5, содержащим 1% Tween 20). Образец сыворотки (10 мкл/лунку) и буфер для анализа (50 мкл/лунку, 0,05M TRIS/HCl pH 7,5, содержащий 0,9% NaCl, 0,05% дезоксихолата натрия и заместитель 1% нонидета P40) добавляли в лунки, инкубируемые в течение ночи при 4°C. Смесь сыворотки и буфера для анализа сливали и промывали лунки три раза буфером для промывания (200 мкл/лунку). Добавляли раствор биотинилированного идентифицирующего антитела против EZH2 (50 мкл/лунку) и инкубировали в течение 90 минут при комнатной температуре при легком перемешивании. Избыток идентифицирующего антитела сливали и снова промывали лунки три раза буфером для промывания (200 мкл/лунку). Добавляли раствор, содержащий конъюгат стрептавидин-пероксидаза хрена (50 мкл/лунку) и инкубировали в течение 30 минут при комнатной температуре при легком перемешивании. Избыток конъюгата сливали и снова промывали лунки три раза буфером для промывания (200 мкл/лунку). Добавляли окрашенный раствор субстрата (100 мкл/лунку, 2,2'-азинобис[3-этилбензотиазолин-6-сульфоновая кислота]диаммонийную соль) и инкубировали в течение 20 минут при комнатной температуре при легком перемешивании. Измеряли оптическую плотность (OD) лунок при длине волны 405 нм с использованием стандартного спектрофотометра для микротитрационных планшетов. Наблюдали кривую доза-ответ увеличения окраски при увеличении концентрации аддукта нуклеосома-EZH2, где сигнал с низкой интенсивностью наблюдали при отсутствии аддукта нуклеосом (лошадиная сыворотка). Положительный сигнал ELISA свидетельствует о том, что обнаруженный ELISA EZH2 входит в состав аддукта нуклеосома-EZH2, содержащего гистоновый белок и EZH2, т.к. (i) иммобилизованное антитело связывается с гистонами в образце, и (ii) идентифицирующее антитело связывается с компонентом EZH2 аддукта. Результаты представлены на фигурах 1 и 2.
ПРИМЕР 2
Образцы сыворотки получали у 5 здоровых индивидуумов, 3 индивидуумов с раком толстого кишечника, 6 индивидуумов с раком легких и 2 индивидуумов с раком поджелудочной железы. Коммерчески доступный препарат нуклеосом, получаемый расщеплением хроматина, выделяемого из клеток Hela, подвергали серийному разведению в лошадиной сыворотке. Препарат нуклеосом из крови человека получали способом Holdenrieder (*Holdenrieder et al., 2001). Эти образцы и препараты анализировали в двух повторениях для аддукта нуклеосома-HMGB1 способом по изобретению. Также анализировали чистую лошадиную сыворотку в качестве образца отрицательного контроля, не содержащего нуклеосом или аддуктов нуклеосом.
В способе ELISA использовали иммобилизованное на твердой фазе антитело против гистона, которое связывается с интактными нуклеосомами, и биотинилированное моноклональное идентифицирующее антитело против HMGB1, как указано ниже. Добавляли раствор антитела против гистона в 0,1 M фосфатном буфере pH 7,4 в лунки микротитрационного планшета (100 мкл/лунку) и инкубировали в течение ночи при 4°C для покрытия лунок иммобилизованным антителом. Избыток антитела против гистона сливали. Добавляли раствор бычьего сывороточного альбумина (20 г/л) в лунки (200 мкл/лунку) и инкубировали в течение 30 минут при комнатной температуре для блокирования избытка участков связывания белка в лунках. Избыток раствора бычьего сывороточного альбумина сливали и промывали лунки три раза буфером для промывания (200 мкл/лунку, 0,05M TRIS/HCl буфером pH 7,5, содержащим 1% Tween 20). Добавляли образец сыворотки (10 мкл/лунку) и буфер для анализа (50 мкл/лунку, 0,05M TRIS/HCl pH 7,5, содержащий 0,9% NaCl, 0,05% дезоксихолата натрия и заместителя 1% нонидета P40) к лункам, инкубируемым в течение ночи при 4°C. Смесь сыворотки и буфера для анализа сливали и промывали лунки три раза буфером для промывания (200 мкл/лунку). Добавляли раствор биотинилированного идентифицирующего антитела против HMGB1 (50 мкл/лунку) и инкубировали в течение 90 минут при комнатной температуре при легком перемешивании. Избыток идентифицирующего антитела сливали и снова промывали лунки три раза буфером для промывания (200 мкл/лунку). Добавляли раствор, содержащий конъюгат стрептавидин-пероксидаза хрена (50 мкл/лунку) и инкубировали в течение 30 минут при комнатной температуре при легком перемешивании. Избыток конъюгата сливали и снова промывали лунки три раза буфером для промывания (200 мкл/лунку). Добавляли окрашенный раствор субстрата (100 мкл/лунку, 2,2'-азинобис[3-этилбензотиазолин-6-сульфоновая кислота]диаммонийную соль) и инкубировали в течение 20 минут при комнатной температуре при легком перемешивании. Измеряли в лунках оптическую плотность (OD) при длине волны 405 нм с использованием стандартного спектрофотометра для микротитрационных планшетов. Наблюдали кривую доза-ответ увеличения окраски при увеличении концентрации аддукта нуклеосома-HMGB1, где сигнал с низкой интенсивностью наблюдали при отсутствии аддукта нуклеосом (лошадиная сыворотка). Положительный сигнал ELISA свидетельствует о том, что обнаруженный ELISA HMGB1 входит в состав аддукта нуклеосома-HMGB1, содержащего гистоновый белок и HMGB1, т.к. (i) иммобилизованное антитело связывается с гистонами в образце, и (ii) идентифицирующее антитело связывается с компонентом HMGB1 аддукта. Результаты представлены на фигурах 3 и 4.
В более крупном эксперименте получали образцы сыворотки у 25 пациентов с раком толстого кишечника, 25 пациентов с раком молочной железы и 24 пациентов с раком легких, а также образцы у 31 здорового индивидуума. Образцы тестировали на уровень нуклеосома-HMGB1 и с использованием среднего результата для здоровых индивидуумов плюс 2 стандартных отклонения в среднем в виде границы пропускания, следующие ниже результаты получали для рака толстого кишечника, молочной железы и легких:
- Толстый кишечник: детектировали 76% злокачественных опухолей (19 из 25 пациентов) и с 90% специфичностью (3 ложноположительных результата из 31 образца здоровых индивидуумов);
- Молочная железа: детектировали 96% злокачественных опухолей (24 из 25 пациентов) и с 90% специфичностью (3 ложноположительных результата из 31 образца здоровых индивидуумов) и
- Легкое: детектировали 100% злокачественных опухолей (24 из 24 пациентов) и с 86% специфичностью (4 ложноположительных результата из 28 образцов здоровых индивидуумов),
где измеряемый уровень аддукта нуклеосома-HMGB1 выше уровня границы пропускания считают положительным результатом и более низкий уровень считают отрицательным результатом. Результаты представлены на фигуре 5.
Так же проводили анализ уровня аддукта нуклеосома-HMGB1 в обратном формате, где лунки покрывали антителом против HMGB1 в качестве иммобилизованного антитела, и антитело против нуклеосомы являлось биотинилированным, и его использовали в качестве идентифицирующего антитела. В таком формате анализа также успешно детектировали аддукты нуклеосома-HMGB1 в используемых положительных контролях (OD405 нм = 1,15), но не в лошадиной сыворотке или буфере (оба OD406 нм = 0,13).
ПРИМЕР 3
Анализ ELISA нуклеосома-PR проводили способом из указанного выше примера 1, за исключением того, что используемое биотинилированное антитело являлось направленным, чтобы связываться с прогестероновым рецептором (PR). Результаты представлены на фигуре 6.
ПРИМЕР 4
Образцы сыворотки, получаемые у двух пациентов с раком предстательной железы, а также положительные и отрицательные контроли анализировали анализом ELISA аддукта нуклеосома-AR, проводимым способом, из указанного выше примера 1, за исключением того, что используемое биотинилированное антитело являлось направленным, чтобы связываться с андрогенным рецептором (AR). Результаты приведены на фигуре 7.
ПРИМЕР 5
Анализ ELISA аддукта нуклеосома-ERα проводили с использованием образца нуклеосомы, получаемого способом *Holdenrieder et al., 2001, способом из указанного выше примера 1, за исключением того, что используемое биотинилированное антитело являлось направленным, чтобы связываться с альфа-формой эстрогенового рецептора (ERα). Результаты представлены на фигуре 8.
ПРИМЕР 6
Образец нуклеосом получали расщеплением хроматина, выделяемого из клеток MCF7, и анализировали в отношении аддукта нуклеосома-ERβ ELISA. Анализ проводили способом, аналогичным способу указанного выше примера 1, за исключением того, что анализ проводили с использованием другого антитела против нуклеосомы и антитела, направленного, чтобы связываться с бета-формой эстрогенового рецептора (ERβ). Анализ проводили в двух различных форматах. В первом формате антителом против нуклеосомы покрывали лунки, и антитело против ERβ являлось биотинилированным. Во втором формате антителом против ERβ покрывали лунки, и антитело против нуклеосомы являлось биотинилированным. Анализ являлся успешным в обоих форматах. Следует отметить, что выявляли, что анализ проходил в меньшем количестве лунок, когда хроматин MCF7 являлся сшитым, как часто происходит в способах ChIP. Результаты представлены на фигуре 9.
ПРИМЕР 7
Анализ ELISA аддукта нуклеосома H2AZ-ERβ проводили с использованием образца нуклеосом, получаемого способом *Holdenrieder et al., 2001, способом из указанного выше примера 6, где антителом против ERβ покрывали лунки, за исключение того, что используемое биотинилированное антитело являлось направленным, чтобы связываться с вариантом гистона H2AZ, таким образом, что детектировали только подгруппу аддуктов нуклеосома-ERβ, содержащих H2AZ. Таким способом, где связывающее средство для нуклеосомы или компонента нуклеосомы направлено, чтобы связываться с конкретной эпигенетической сигнальной структурой, можно детектировать конкретную подгруппу аддуктов нуклеосом, содержащих только эпигенетический сигнал. Результаты приведены на фигуре 10.
ПРИМЕР 8
Образцы сыворотки получали у 12 здоровых индивидуумов, 3 индивидуумов с раком толстого кишечника, 6 индивидуумов с раком молочной железы, 3 индивидуумов с раком легких и 4 индивидуумов с раком поджелудочной железы. Препарат нуклеосом в крови человека получали способом Holdenrieder (*Holdenrieder et al., 2001) и подвергали серийному разведению в лошадиной сыворотке. Эти образцы и препараты анализировали в двух повторениях для аддукта нуклеосома-ERβ способом по изобретению. Также анализировали чистую коммерчески доступную лошадиную сыворотку, получаемую для применения в тканевой культуре, в качестве образца отрицательного контроля, не содержащего нуклеосомы или аддукты нуклеосом. Анализ проводили способом из указанного выше примера 1, за исключением того, что используемое идентифицирующее антитело являлось направленным против эстрогенового рецептора (ERβ). С использованием границы пропускания, рассчитываемой как средний результат для здоровых индивидуумов плюс 2 стандартных отклонения от среднего, 2 из 3 образцов рака толстого кишечника, 3 из 6 образцов рака молочной железы, 2 из 3 образцов рака легких и 4 из 4 образцов рака поджелудочной железы выявляли положительными в отношении аддукта нуклеосома-ERβ. Результаты приведены на фигуре 11.
ПРИМЕР 9
Анализ ELISA нуклеосома-эстрогеновый рецептор-стероидный эстроген проводили способом из указанного выше пример 6, за исключением того, что используемое идентифицирующее антитело являлось направленным против стероидного эстрогена. Этот анализ детектировал только аддукты нуклеосома-эстрогеновый рецептор, которые дополнительно содержали стероидный гормон.
ПРИМЕР 10
Анализ ELISA аддукта нуклеосома-эстрогеновый рецептор-эстроген проводили способом, аналогичным способу указанного выше примера, за исключением того, что анализ проводят в микротитрационном планшете или пробирке, которая является устойчивой к органическим растворителям, и после захвата антителом против нуклеосом аддуктов нуклеосома-эстрогеновый рецептор на поверхности лунки жидкое содержимое лунки сливают и добавляют диэтилэфир для растворения любого стероида, содержащегося в захваченном аддукте. Простой эфир переносят в другую лунку или пробирку и сушат. Сухой экстракт повторно растворяют в буфере для анализа и определяют концентрацию эстрогена способом классического конкурентного иммунологического анализа на эстроген. Таким образом, этим анализом детектируют только аддукты нуклеосома-эстрогеновый рецептор, который дополнительно содержит эстроген.
ПРИМЕР 11
Анализ ELISA нуклеосома-рецептор ретиноевой кислоты-ретиноевая кислота проводят способом указанного выше примера 10, за исключением того, что используемый конкурентный иммунологический анализ на стероиды являлся направленным против ретиноевой кислоты. Этим анализом детектируют только аддукты нуклеосома-рецептор ретиноевой кислоты, которые дополнительно содержат стероид/ретиноевую кислоту.
ПРИМЕР 12
Проводят анализы аддукта нуклеосом, аналогичные анализам, описанным в примерах 1-10, за исключением того, что используемое иммобилизованной на твердой фазе антитело являлось направленным против 5-метилцитидина. Этими анализами детектировали только аддукты нуклеосома-рецептор гормона и комплексы нуклеосома-рецептор гормона-гормон, которые дополнительно ассоциированы с метилированной ДНК.
Список ссылочной литературы
Allen et al, A simple method for estimating global DNA methylation using bisulfite PCR of repetitive DNA elements. Nucleic Acids Research: 32(3) e38DOI: 10.1093/nar/gnh032, 2004.
Bawden et al, Detection of histone modification in cell-free nucleosomes. WO 2005/019826, 2005.
Cao et al, Role of Histone H3 Lysine 27 Methylation in Polycomb-Group Silencing SCIENCE 298, 1039-1043, 2002.
Dai et al, Detection of Post-translational Modifications on Native Intact Nucleosomes by ELISA. http://www.jove.com/details.php?id=2593 doi: 10.3791/2593. J Vis Exp. 50 (2011).
Esteller, Cancer epigenomics: DNA methylomes and histone-modification maps Nature Reviews Genetics: 8, 286-298, 2007.
Feinberg and Vogelstein, Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature: 301, 89-92, 1983.
Fullgrabe et al, Histone onco-modifications. Oncogene: 30, 3391-3403, 2011.
Gerlitz et al, The dynamics of HMG protein-chromatin interactions in living cells. Biochem Cell Biol, 87, 127-137, 2009.
Grutzmann et al, Sensitive Detection of Colorectal Cancer in Peripheral Blood by Septin 9 DNA Methylation Assay. PLoS ONE 3(11): e3759. doi: 10.1371/journal.pone.0003759, 2008.
Herranz and Esteller, DNA methylation and histone modifications in subjects with cancer: potential prognostic and therapeutic targets. Methods Mol Biol.361:25-62, 2007.
Hervouet et al, Disruption of Dnmt1/PCNA/UHRF1 Interactions Promotes Tumorigenesis from Human and Mice Glial Cells PLoS ONE 5(6): e11333. doi:10.1371/journal.pone.0011333,2010.
Holdenrieder et al, Nucleosomes in serum of subjects with benign and malignant diseases. Int. J. Cancer (Pred. Oncol.): 95, 114-120, 2001.
*Holdenrieder et al, Nucleosomes in Serum as a Marker for Cell Death. Clin Chem Lab Med; 39(7), 596-605, 2001.
Holdenrieder et al, Cell-Free DNA in Serum and Plasma: Comparison of ELISA and Quantitative PCR. Clinical Chemistry: 51(8), 1544-1546, 2005.
Holdenrieder and Stieber, Clinical use of circulating nucleosomes. Critical Reviews in Clinical Laboratory Sciences; 46(1): 1-24, 2009.
Ricke and Bielinsky, Easy detection of chromatin binding proteins by the histone association assay. Biol Proced Online; 7(1), 60-69, 2005.
Rodriguez-Paredes and Esteller, Cancer epigenetics reaches mainstream oncology. Nature Medicine: 17(3), 330-339, 2011.
Salgame et al, An ELISA for detection of apoptosis. Nucleic Acids Research, 25(3), 680-681, 1997.
Sims et al, HMGB1 and RAGE in inflammation and cancer. Annu. Rev. Immunol. 28, 367-388, 2010.
Stoetzer et al, Circulating nucleosomes and biomarkers of immunogenic cell death as predictive and prognostic markers in cancer patients undergoing cytotoxic therapy. Expert Opin Biol Ther. 12(Suppl. 1): S217-S224, 2012.
Tang et al, High-mobility Group Box 1 [HMGB1] and Cancer. Biochim Biophys Acta. 1799(1-2) 131, 2010.
Urbonaviciute etal, Induction of inflammatory and immune responses by HMGB1 - nucleosome complexes: implications for the pathogenesis of SLE. J Exp Med, 205(13), 3007-3018, 2008.
Urbonaviciute and Voll, High-mobility group box 1 represents a potential marker of disease and novel therapeutic target in systemic lupus erythematosus. J Internal Medicine, 270, 309-318, 2011.
van Nieuwenhuijze etal, Time between onset of apoptosis and release of nucleosomes from apoptotic cells: putative implications for sysytemic lupus erythematosus. Ann Rheum Dis; 62: 10-14, 2003.
Yoshida and Shimura, Isolation of nonhistone chromosomal protein from calf thymus. Biochimica et Biophysica Acta (BBA) - Protein Structure; 263(3), 690-695, 1972.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДЕТЕКЦИИ НУКЛЕОСОМ, СОДЕРЖАЩИХ ГИСТОНОВЫЕ ВАРИАНТЫ | 2012 |
|
RU2716494C2 |
| СПОСОБ ДЕТЕКЦИИ НУКЛЕОСОМ, СОДЕРЖАЩИХ НУКЛЕОТИДЫ | 2012 |
|
RU2687483C2 |
| ИНГИБИТОРЫ EZH2 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2618475C2 |
| ИНГИБИТОРЫ EZH2 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2765155C2 |
| ТЕСТ-СИСТЕМА ДЛЯ СКРИНИНГА ХИМИЧЕСКИХ СОЕДИНЕНИЙ НА НАЛИЧИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТИ В ОТНОШЕНИИ PARP-1 | 2016 |
|
RU2649767C1 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОЧИСТКИ КРОВИ ОТ ЦИРКУЛИРУЮЩЕЙ ВНЕКЛЕТОЧНОЙ ДНК | 2018 |
|
RU2779220C2 |
| СПОСОБ ТЕСТИРОВАНИЯ ВЕЩЕСТВ, ВЛИЯЮЩИХ НА ПРОЦЕСС СТАРЕНИЯ | 2011 |
|
RU2497950C2 |
| СПОСОБ СКРИНИНГА ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ - ИНГИБИТОРОВ PARP1 НА ОСНОВЕ БИОХИМИЧЕСКИХ МЕТОДОВ АНАЛИЗА | 2015 |
|
RU2639535C2 |
| БИОМАРКЕРЫ РАКА | 2007 |
|
RU2460075C2 |
| КОМБИНАЦИИ СПЕЦИФИЧНЫХ ИНГИБИТОРОВ ГИСТОНОВЫХ ДЕАЦЕТИЛАЗ КЛАССА I С ИНГИБИТОРАМИ ПРОТЕАСОМ | 2007 |
|
RU2456990C2 |
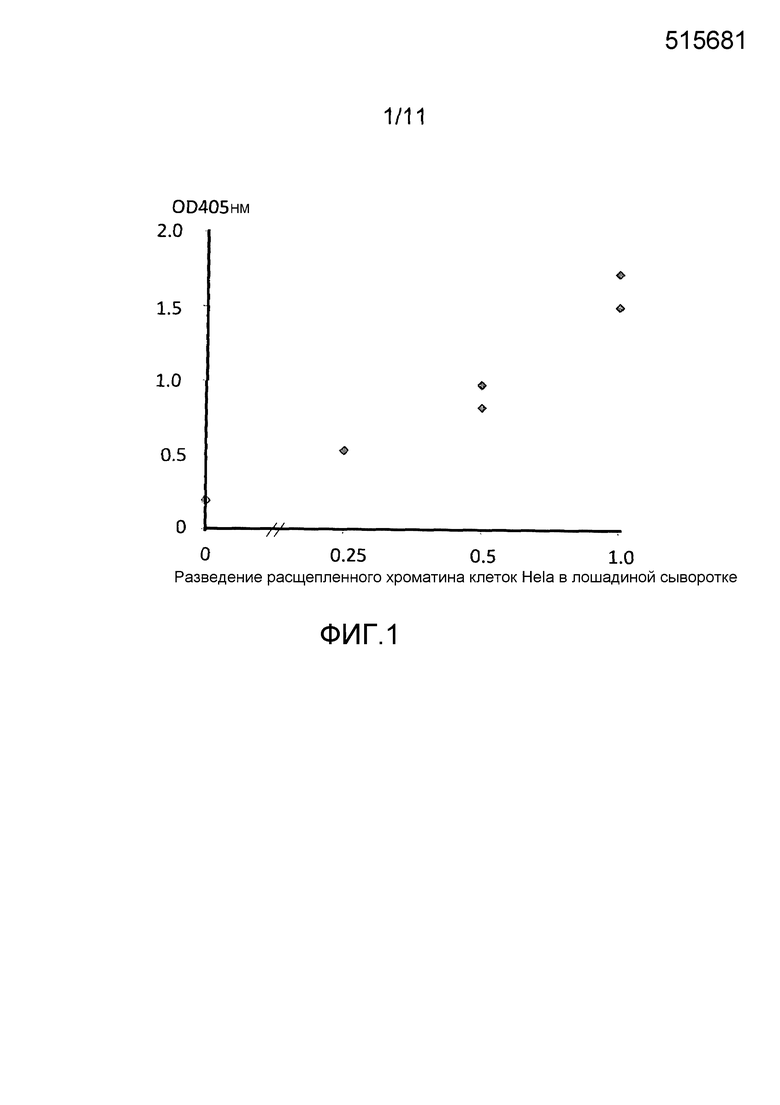

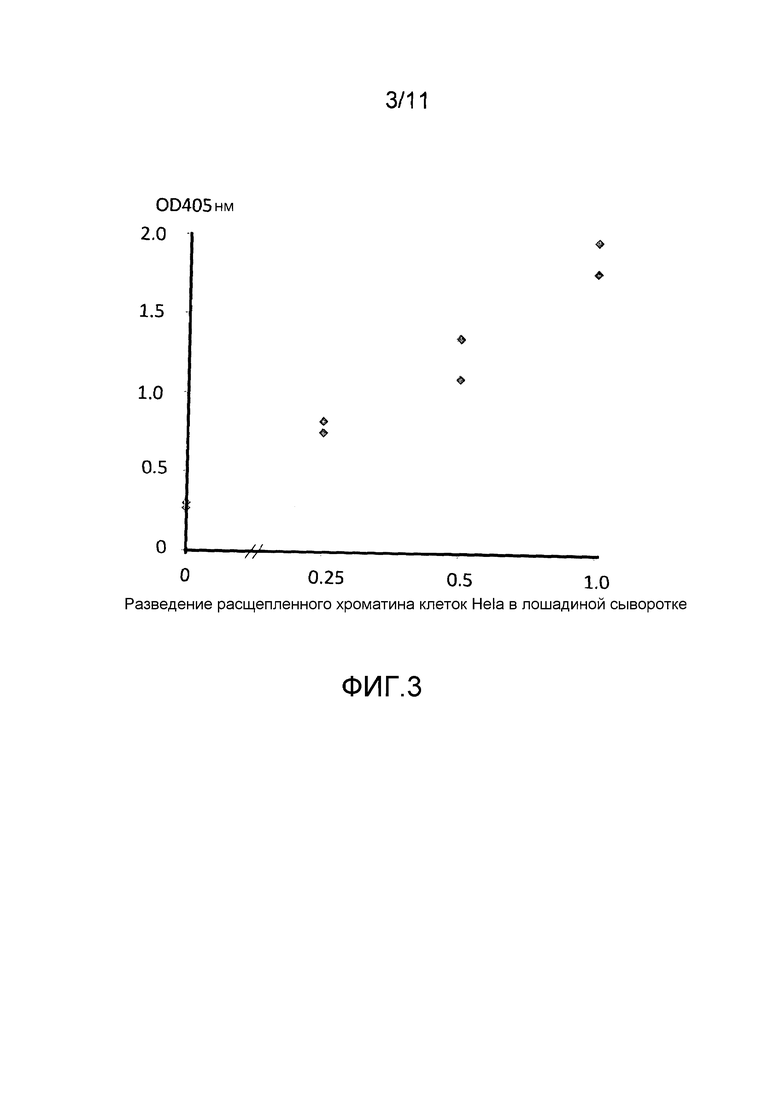
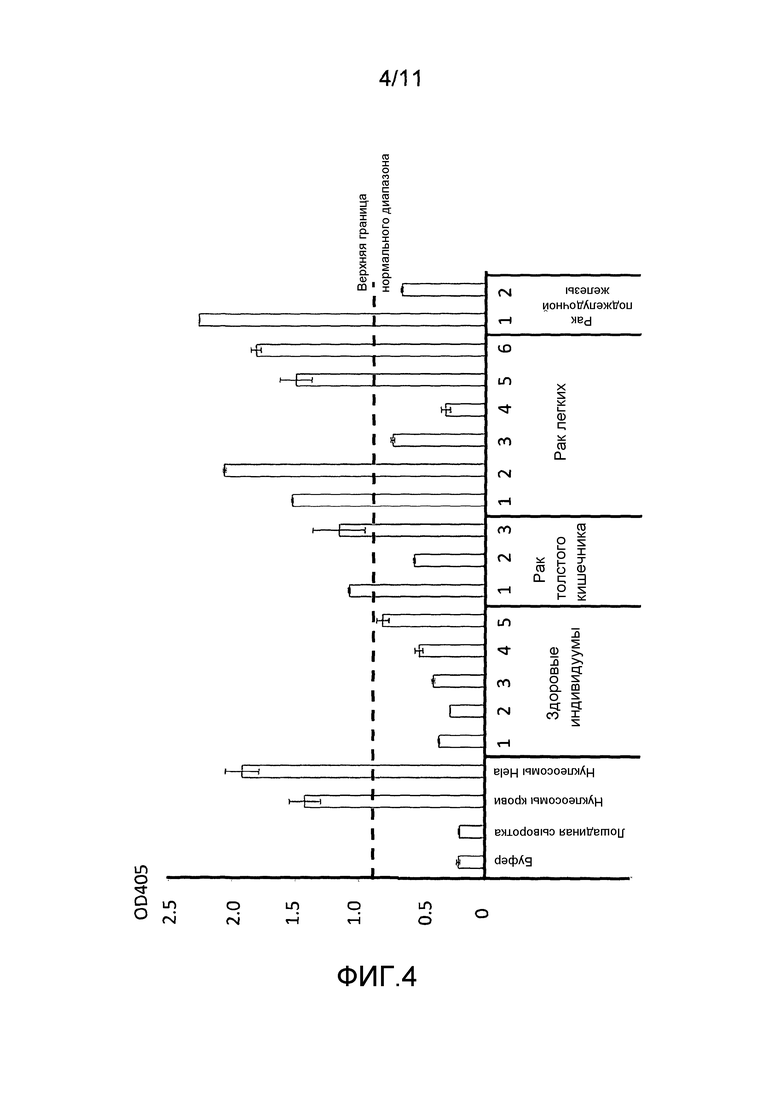
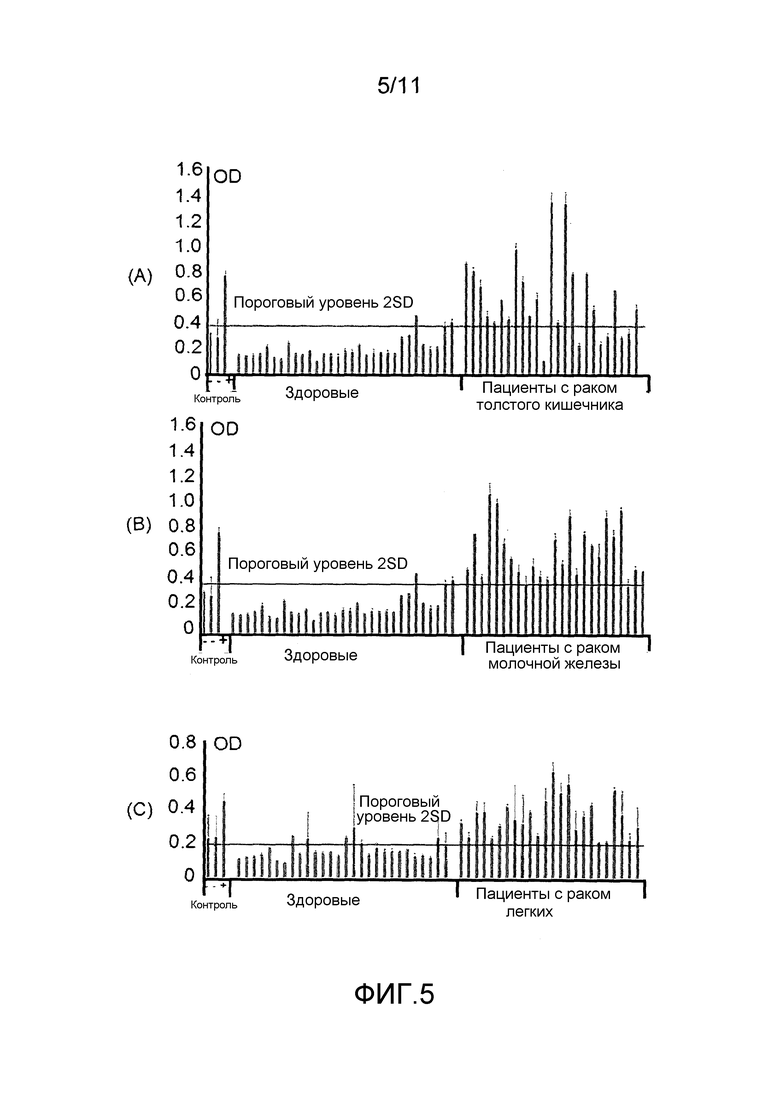
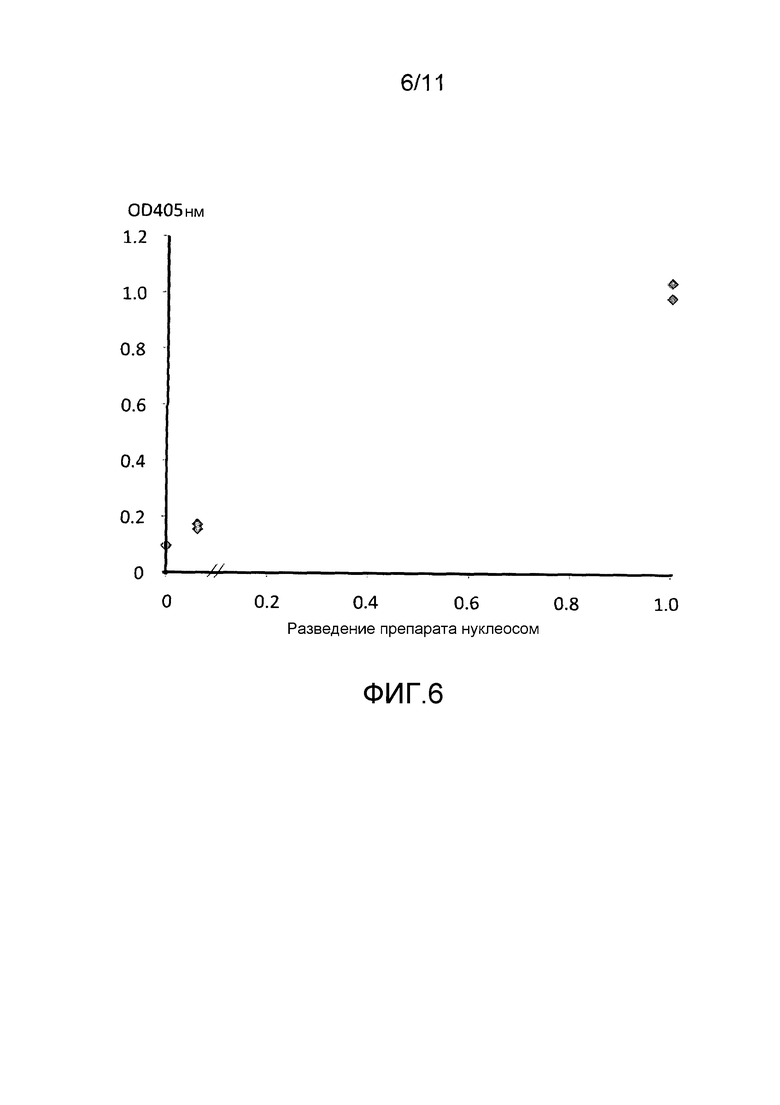

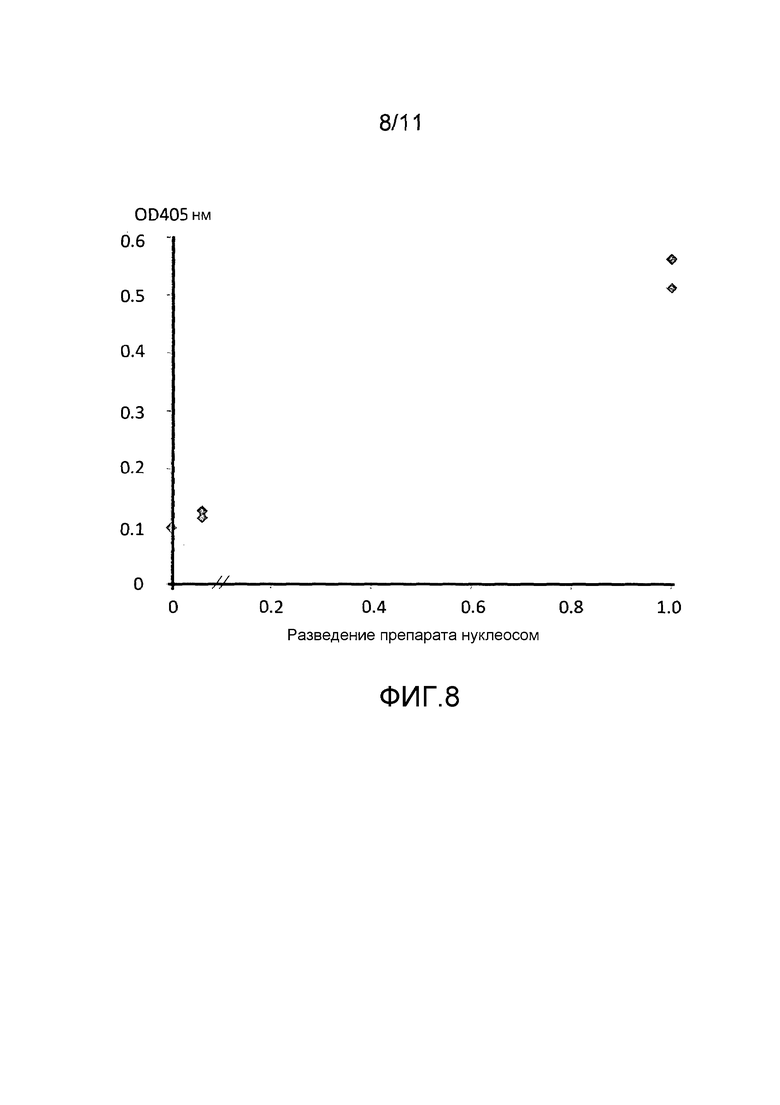

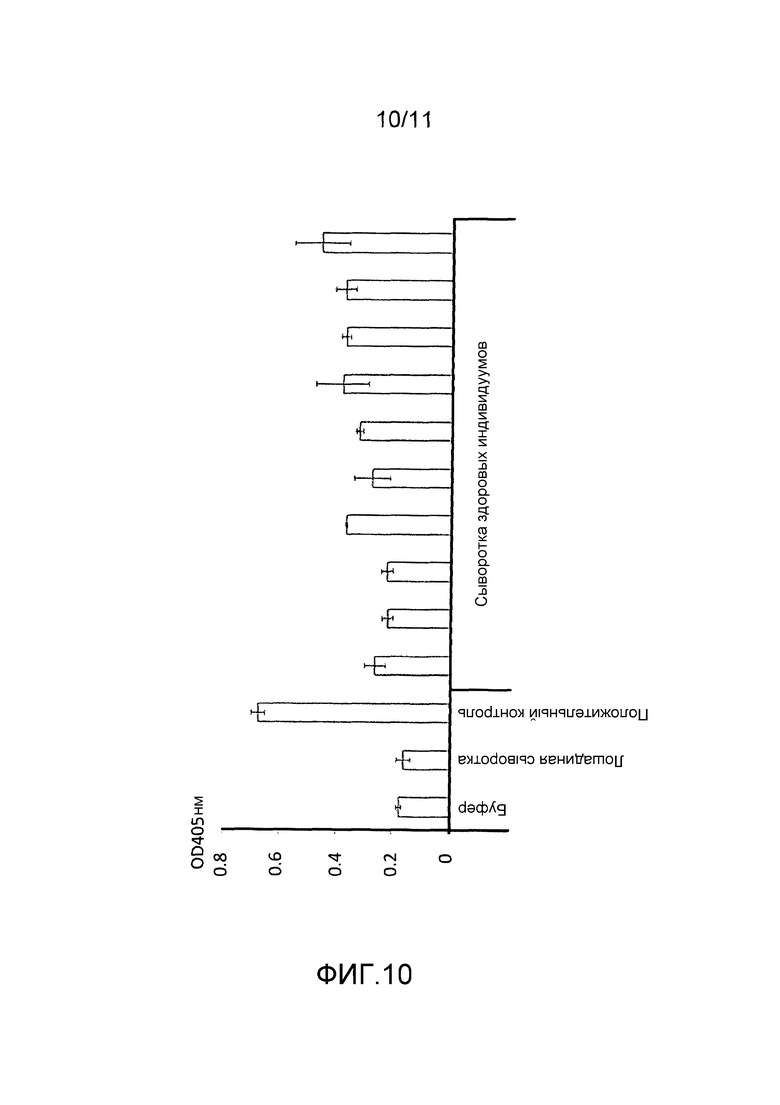
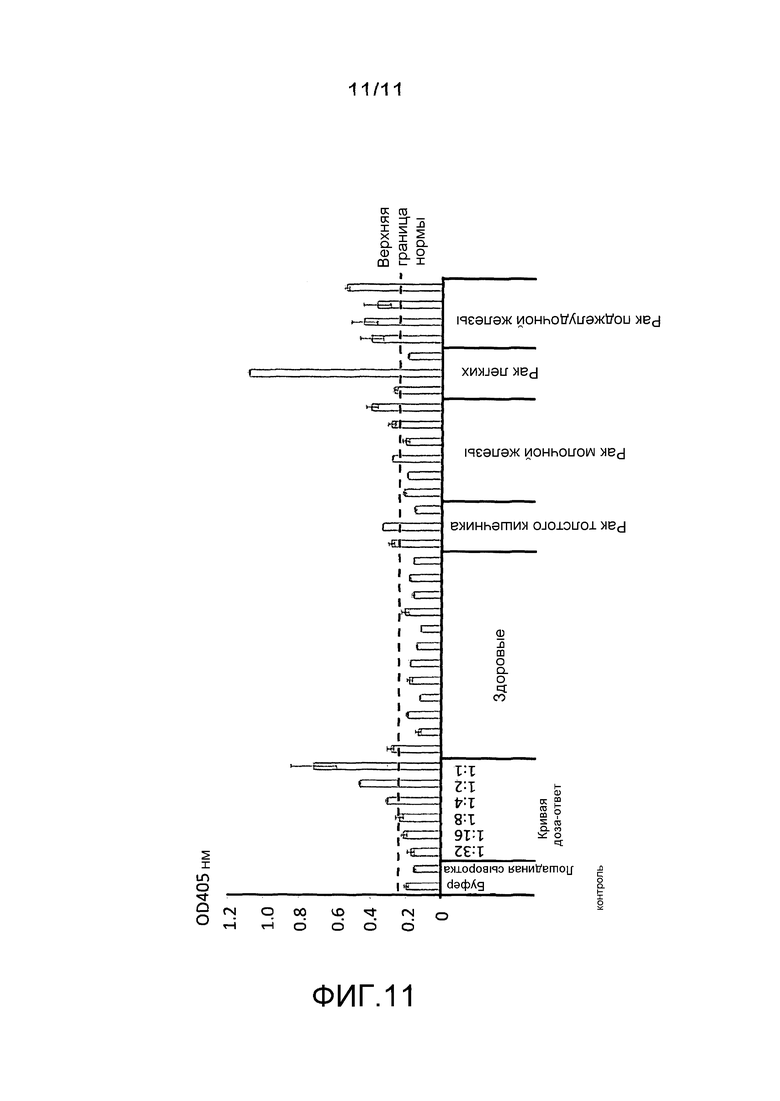
Группа изобретений относится к медицине, а именно к лабораторной диагностике онкологических заболеваний. Предложено применение аддукта нуклеосома-белок в качестве биомаркера в образце крови, сыворотки или плазмы для диагностики рака, где белок, связанный с нуклеосомой, содержит фактор транскрипции или модифицирующий хроматин фермент. Также предложены возможность детекции или диагностирования рака у индивидуума, оценка индивидуума в отношении применимости медицинского лечения и мониторинг лечения индивидуума. Группа изобретений обеспечивает возможность диагностирования онкологических заболеваний, таких как: рак толстого кишечника, рак легких, рак поджелудочной железы, рак молочной железы, рак предстательной железы, за счет измерения уровня циркулирующих внеклеточных аддуктов нуклеосома-HMGB-1 и нуклеосома-EZH2 в биологическом образце крови, сыворотки или плазмы, полученном от индивидуума. 5 н. и 15 з.п. ф-лы, 11 ил., 12 пр.
1. Применение аддукта нуклеосома-белок в качестве биомаркера в образце крови, сыворотки или плазмы для диагностики рака, где белок, связанный с нуклеосомой, содержит фактор транскрипции или модифицирующий хроматин фермент.
2. Применение по п. 1, где белок, связанный с нуклеосомой, представляет собой фактор транскрипции.
3. Применение по п. 1 или 2, где фактор транскрипции представляет собой ядерный гормональный рецептор.
4. Применение по п. 1, где модифицирующий хроматин фермент представляет собой фермент ацетилирования, деацетилирования, метилирования, деметилирования, фосфорилирования, дефосфорилирования, убиквитинилирования, деубиквитинилирования, сумоилирования, десумоилирования гистона или ДНК-метилтрансферазу.
5. Применение по п. 1 или 4, где модифицирующий хроматин фермент представляет собой EZH2.
6. Применение по п. 3, где ядерный гормональный рецептор представляет собой эстрогеновый рецептор, андрогенный рецептор, прогестероновый рецептор, рецептор гормона щитовидной железы, рецептор глюкокортикоидов или рецептор ретиноевой кислоты.
7. Применение по п. 3, где ядерный гормональный рецептор является дополнительно связанным с гормоном, который выбирают из следующих: гормон щитовидной железы, глюкокортикоидный гормон или стероидный гормон, включая эстроген, андроген, прогестаген, кортикостероид или ретиноевую кислоту.
8. Способ детекции или диагностирования рака у индивидуума,
являющегося животным или человеком, который включает этапы:
(i) приведения образца крови, сыворотки или плазмы, полученных от индивидуума, в контакт с первым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(ii) приведения нуклеосом или образца в контакт со вторым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(iii) детектирования или количественного определения связывания указанного второго связывающего средства со связанным белком в образце; и
(iv) использования детектированного уровня аддукта нуклеосома-белка для детектирования или диагностирования рака у ундивидуума, где белок, связанный с нуклеосомой, содержит фактор транскрипции или модифицирующий хроматин фермент.
9. Способ детекции или диагностирования рака у индивидуума, являющегося животным или человеком, который включает этапы:
(i) приведения образца крови, сыворотки или плазмы, полученных от индивидуума, в контакт с первым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(ii) приведения нуклеосом или образца в контакт со вторым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(iii) детектирования или количественного определения связывания указанного второго связывающего средства с нуклеосомами или их компонентом в образце; и
(iv) использования детектированного уровня аддукта нуклеосома-белка для детектирования или диагностирования рака у ундивидуума, где белок, связанный с нуклеосомой, содержит фактор транскрипции или модифицирующий хроматин фермент.
10. Способ по п. 8 или 9, где белок, связанный с нуклеосомой, представляет собой фактор транскрипции.
11. Способ по п. 10, где фактор транскрипции представляет собой ядерный гормональный рецептор.
12. Способ по п. 8 или 9, где модифицирующий хроматин фермент представляет собой EZH2.
13. Способ по п. 11, где ядерный гормональный рецептор представляет собой эстрогеновый рецептор, андрогенный рецептор, прогестероновый рецептор, рецептор гормона щитовидной железы или рецептор ретиноевой кислоты.
14. Способ по п. 10, где ядерный гормональный рецептор является дополнительно связанным с гормоном, который выбирают из следующих: гормон щитовидной железы, глюкокортикоидный гормон или стероидный гормон, включая эстроген, андроген, прогестаген или ретиноевую кислоту.
15. Способ по п. 8 или 9, где связывающее средство для нуклеосомы или компонента нуклеосомы направлено, чтобы связываться с конкретной эпигенетической сигнальной структурой, таким образом, что детектируют только конкретную подгруппу аддуктов нуклеосом, содержащих указанную эпигенетическую сигнальную структуру.
16. Способ по п. 8 или 9, где связывающее средство представляет собой антитело, фрагмент антитела или аптамер.
17. Способ по п. 8 или 9, где образец представляет собой кровь.
18. Способ оценки индивидуума, являющегося животным или человеком, в отношении применимости медицинского лечения, который включает этапы:
(i) детекции или измерения аддукта нуклеосома-белок в образце крови, сыворотки или плазмы, полученных от индивидуума, как определено в любом из способов по п. 8 или 9, и
(ii) использования обнаруженного уровня аддукта нуклеосом в качестве параметра для выбора подходящего лечения для индивидуума.
19. Способ мониторинга лечения индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения аддукта нуклеосома-белок в образце крови, сыворотки или плазмы, полученных от индивидуума, как определено в любом из способов по п. 8 или 9;
(ii) повторения детекции или измерения аддукта нуклеосома-белок в образце крови, сыворотки или плазмы индивидуума один или более раз;
(iii) использования любых изменений обнаруженного уровня аддукта нуклеосома-белок в качестве параметра любого изменения состояния индивидуума.
20. Способ по п. 18 или 19, где аддукт нуклеосом детектируют или измеряют в виде одной из панелей измерений.
| Устройство для регулирования процесса полимеризации изопрена | 1987 |
|
SU1668368A2 |
| WO2005040814 A1, 06.05.2005 | |||
| RU 2009140759 A, 10.05.2011 | |||
| J FÜLLGRABE et al | |||
| Histone onco-modifications// ONCOGENE, (20110804), vol | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| V | |||
| URBONAVICIUTE et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Автоматическая акустическая блокировка | 1921 |
|
SU205A1 |
| Насос | 1917 |
|
SU13A1 |
Авторы
Даты
2017-10-24—Публикация
2012-12-07—Подача