Настоящее изобретение относится к комбинации вакцина/ингибитор, содержащей РНК-вакцину, которая содержит по меньшей мере одну РНК, содержащую открытую рамку считывания (ORF), которая кодирует по меньшей мере один антиген, и композицию, которая содержит по меньшей мере один ингибитор пути PD-1, предпочтительно направленный против рецептора PD-1 или его лигандов PD-L1 и/или PD-L2. Кроме того, настоящее изобретение относится к фармацевтической композиции и набору компонентов, содержащей/содержащему указанную комбинацию вакцина/ингибитор. Кроме того, настоящее изобретение относится к применению в медицине указанной комбинации вакцина/ингибитор, фармацевтической композиции и набора компонентов, содержащей/содержащего указанную комбинацию вакцина/ингибитор, прежде всего для предупреждения или лечения опухолевых или раковых заболеваний или инфекционных заболеваний. Кроме того, настоящее изобретение относится к применению РНК-вакцины в терапии в комбинации с ингибитором пути PD-1 и к применению ингибитора пути PD-1 в терапии в комбинации с РНК-вакциной.
Традиционно иммунотерапия рака была сфокусирована на стимуляции иммунной системы путем вакцинации или на адаптивной клеточной иммунотерапии с целью вызывания противоопухолевого ответа. Этот подход основан на предположении о том, что опухолевые клетки экспрессируют антигены-мишени, но противоопухолевые Т-клетки являются недостаточно активированными. Поэтому для преодоления указанной проблемы, как правило, предпринимались попытки повысить распознавание указанных антигенов-мишеней путем стимулирования имеющих решающее значение позитивных костимуляторных путей и путей врожденной иммунной системы (таких как пути, опосредуемые рецепторами CD28, CD154 и TLR).
Позднее стало очевидно, что иммунная система распознает опухолевые антигены, но остается в бездействии, несмотря на присутствие опухолевых антигенов. Эти данные привели к появлению гипотезы о том, что существуют специфические ингибирующие механизмы, которые ограничивают или даже «выключают» противоопухолевый ответ. Эта гипотеза нашла подтверждение, когда были открыты присутствующие на Т-клеточной поверхности молекулы, являющиеся негативными регуляторами, которые подвергаются повышающей регуляции на активированных Т-клетках, снижая их активность, что приводит к менее эффективному уничтожению опухолевых клеток. Такие ингибирующие молекулы были названы негативными костимуляторными молекулами на основе их гомологии с Т-клеточной костимуляторной молекулой CD28. Эти белки, которые называют также белками иммунных чекпойнтов, участвуют во многих путях, включая ослабление сигналов ранней активации, конкуренцию с позитивными костимуляторами и непосредственное ингибирование антигенпрезентирующих клеток (Bour-Jordan и др., Immunol Rev. 241(1), 2011, сс. 180-205; PMID: 21488898). Одним из представителей этого семейства белков является белок программированной смерти клеток-1 (PD-1) и его лиганды В7-H1/PD-L1 (CD274) и B7-DC/PD-L2 (CD273).
PD-1 экспрессируется на активированных Т- и В-клетках, а также на моноцитах, участвующих в регулировании баланса между иммунной активацией и толерантностью. Главная роль PD-1 заключается в ограничении активности периферических Т-клеток при воспалительном ответе на инфекцию и в ограничении аутоиммунитета. Такая регуляции базируется на том, что лиганды PD-1 B7-H1/PD-L1 и B7-DC/PD-L2 подвергаются повышающей регуляции в ответ на различные провоспалительные цитокины и могут связываться с PD-1 на активированных Т-клетках в воспаленных тканях, ограничивая тем самым иммунный ответ. Делеция гена PD-1 приводит к аутоиммунным осложнениям, например, напоминающим волчанку симптомам (Nishimura и др., Immunity 11(2), 1999, сс. 141-151; PMID: 10485649).
Кроме того, было установлено, что B7-H1/PD-L1 часто подвергаются повышающей регуляции на многих различных типах опухолевых клеток, при этом они ингибируют местные противоопухолевые Т-клеточные ответы путем связывания с PD-1 на инфильтрующих опухоль лимфоцитах. Например, было продемонстрировано, что PD-L1 играет роль в ускользании опухоли от механизмов иммунологического надзора при плоскоклеточных карциномах головы и шеи (Dong и др., Nat Med. 8(8), 2002, сс. 793-800). Авторы продемонстрировали, что принудительная экспрессия B7-H1/PD-L1 в опухолях, которые в норме являются B7-H1/PD-L1-негативными, приводит к ингибированию их элиминации иммунной системой и что блокада антителом восстанавливает противоопухолевые ответы. Кроме того, было продемонстрировано, что во многих человеческих опухолях, таких как карциномы легкого, яичника и ободочной кишки, имеет место повышающая регуляция B7-H1/PD-L1 по сравнению с их копиями в здоровой ткани. В целом, эти данные служат предпосылкой для применения блокады пути PD-1 при иммунотерапии рака (Zitvogel и Kroemer, Oncoimmunology 1, 2012, сс. 1223-1125).
В этом контексте в US 2010/0055102 описано применение антагонистов PD-1 для повышения Т-клеточного иммунного ответа у млекопитающего.
В последнее время были опубликованы данные о первых клинических исследованиях ингибиторов иммунных чекпойнтов (ICI), направленных против рецептора PD-1 и его лиганда PD-L1. Была проведена первая фаза I опыта с применением моноклонального антитела к PD-1 BMS-936558 на пациентах с рефракторными к лечению метастатическими солидными опухолями. Была выявлена клиническая активность для пациентов с меланомой, карциномой почки, колоректальным раком и немелкоклеточным раком легкого (NSCLC). Оказалось возможным продемонстрировать, что сверхэкспрессия PD-L1 имеет место при многих типах рака и часто ассоциирована с плохим прогнозом. Кроме того, выяснилось, что экспрессия PD-L1 на поверхности опухолевых клеток, выявленная в образцах биопсии перед началом лечения, может являться потенциальным биомаркером ответа, что согласуется с биологией его пути (Brahmer и др., J Clin Oncol. 28(19), 2010, сс. 3167-3175; PMID: 20516446).
В другом клиническом исследовании антитела BMS-936558 были выявлены объективные ответы примерно у одного из пяти пациентов с немелкоклеточным раком легкого, меланомой или почечно-клеточным раком; профиль нежелательных явлений, по-видимому, не препятствует его применению. Предварительные данные позволяют предположить, что имеет место связь между экспрессией PD-L1 на опухолевых клетках и объективным ответом (Topalian и др., N Engl J Med. 366(26), 2012, сс. 2443-2454; PMID: 22658127).
Кроме того, на фазе I исследования антитела к PD-L1 BMS-936559 было установлено, что оно индуцировало продолжительный регресс опухоли (коэффициент объективного ответа составлял от 6 до 17%) и пролонгированную стабилизацию заболевания (коэффициенты составляли от 12 до 41% в течение 24 недель) у пациентов с запущенными видами рака, включая немелкоклеточный рак легкого, меланому и почечно-клеточный рак. Более конкретно, объективный ответ (полный или частичный ответ) был выявлен у 9 из 52 пациентов с меланомой, у 2 из 17 с почечно-клеточным раком, у 5 из 49 с немелкоклеточным раком легкого и у 1 из 17 с раком яичника (Brahmer и др., N Engl J Med. 366(26), 2012, сс. 2455-2465; PMID: 22658128).
Тем не менее, для некоторых видов рака (например, для рака легкого и рака предстательной железы) в этих исследованиях оказалось возможным выявить лишь относительно низкие ответы к ингибиторам чекпойнтов пути PD-1. В более поздних исследованиях была проведена оценка комбинаций ингибиторов чекпойнтов пути PD-1 на доклинических моделях.
Опубликованы данные, например, о создании вакцины на основе дендритных клеток (DC) с использованием комбинации siРНК лиганда PD-1 и мРНК опухолевого антигена. Указанные DC с «выключенным» PD-L1, загруженные мРНК антигена, повышали ex vivo антигенспецифические CD8+-T-клеточные ответы у подвергнутых трансплантации раковых пациентов (Hobo и др., Cancer Immunol Immunother. 62(2), 2013, сс. 285-297; PMID: 22903385).
Аналогично этому, Dai с соавторами продемонстрировали, что направленная на дендритные клетки система на основе лентивирусного вектора (DCLV), кодирующая белок Gag вируса иммунодефицита человека (ВИЧ)-1, в комбинации с блокированием ингибирующего сигнала лиганда PD-1/PD-1 (PD-L) с помощью антитела к PD-L1 вызывала усиленный ВИЧ-1 Gag-специфический иммунный CD8+-ответ после иммунизации с использованием DCLV (Dai и др., Mol Ther. 20(9), 2012, сс. 1800-1809; PMID: 22588271).
В другом исследовании оценивали комбинацию вакцинации с использованием рекомбинантного лентивируса (rLV) и блокирующих PD-1 и PD-L1 антител. Объединение блокирующих антител с rLV-вакцинацией позволяло замедлять рост опухоли, но оказалось недостаточным для индукции полного отторжения развитых опухолей (Sierro и др., Eur J Immunol.; 41(8), 2011, сс. 2217-2228; PMID: 21538347).
Кроме того, в WO 2008/11344 описана модуляция иммунного ответа с помощью комбинации рекомбинантной аденовирусной конструкции (rAAV) на основе ДНК, кодирующей антиген или терапевтический белок, и нуклеиновой кислоты, кодирующей модулятор передачи сигнала PD-1, прежде всего siРНК, антисмысловой РНК или рибозима, специфического в отношении гена PD-L1.
В этом контексте было проведено также изучение слияния растворимого белка PD-1 и фрагментов антигенного белка (WO 2012/062218).
В другом доклиническом исследовании продемонстрировано, что комбинация блокады CTLA-4- и PD-1-негативных костимуляторных рецепторов приводит к синергетическому действию в отношении отторжения опухоли при применении пригодной вакцины (Curran и др., Proc Natl Acad Sci USA 107(9), 2010, сс. 4275-4280; PMID: 20160101). Мышей, которым предварительно имплантировали клетки меланомы линии В16, вакцинировали обработанными излучением клетками меланомы линии В16, экспрессирующими либо GM-CSF (Gvax), либо Flt3-лиганд (Fvax), в сочетании с осуществлением блокады антителом негативного Т-клеточного костимуляторного рецептора, представляющего собой антиген-4 цитотоксических Т-лимфоцитов (CTLA-4), рецептора программированной смерти-1 (PD-1) и его лиганда PD-L1. При использовании Gvax ни блокада любого отдельного коингибиторного рецептора, ни любой их комбинации, не обеспечивала более чем 20%-ную выживаемость. При использовании Fvax блокада либо PD-L1 (8%-ная выживаемость), либо CTLA-4 (10%-ная выживаемость), либо PD-1 (25%-ная выживаемость) приводила к небольшому терапевтическому благоприятному действию. Однако только комбинированная блокада и CTLA-4, и PD-1, приводила к отторжению опухолей у 50% мышей, а дополнительное добавление антитела к PD-L1 повышало этот уровень до 65%. В целом, только блокада CTLA-4 в комбинации с блокадой PD-1 оказывала значимое воздействие на стимулирование отторжения меланомы линии В16 при ее применении в сочетании с вакциной на основе клеток меланомы линии В16. Блокирование одного ингибиторного рецептора (PD-1 или CTLA-4) приводило к повышающей регуляции неблокированного пути. Таким образом, данное исследование позволяет предположить, что для эффективного действия инфильтрующих опухоль Т-клеток может требоваться одновременная блокада нескольких негативных костимуляторных рецепторов. Кроме того, на основе данных доклинических исследований, полученных на модели меланомы линии В-16, авторы предположили, что указанные агенты могут характеризоваться синергетическим действием в отношении стимуляции отторжения опухоли, но они отметили, что объединение нескольких коингибиторных блокирующих антител в клинических условиях следует осуществлять с большой осторожностью.
Кроме того, Mkrtichya с соавторами опубликовали данные о том, что имеют место синергетические антигенспецифические иммунные ответы при использовании антитела к PD-1 (СТ-011) с истощением Treg-клеток с помощью применяемого в низкой дозе циклофосфамида (СРМ) в комбинации с противоопухолевой вакциной (вакцина на основе пептида HPV16-E7). При этом только комбинация указанных 3 обработок приводила к полному регрессу опухолей (Mkrtichya и др., Eur J Immunol. 41(10), 2011, сс. 2977-2986; PMID: 21710477).
Еще в одной публикации, в которой исследовали воздействие ингибирования PD-L1 на рост опухоли, продемонстрировано, что системное введение антитела к PD-L1 и дендритных клеток (DC), импульсно нагруженных пептидом меланомы, приводило к повышению количества специфических в отношении пептида меланомы CD8+-Т-клеток, однако указанная комбинация оказалась недостаточно эффективной для задержки роста развитой меланомы линии В16. Хотя дополнительное облучение организма задерживало рост опухоли, требовался дополнительный адаптивный перенос антигенспецифических CD8+-Т-клеток для достижения регресса опухоли и обеспечения продолжительной выживаемости обработанных мышей (Pilon-Thomas и др., J Immunol. 1; 184(7), 2010, сс. 3442-3449; PMID: 20194714).
В доклиническом исследовании Fotin-Mleczek с соавторами продемонстрирована оказывающая благоприятное действие комбинация противоопухолевой вакцины на основе мРНК и антитела к рецептору CTLA4, которая ослабляла передачу сигналов Т-клеток (Fotin-Mleczek и др., J Gene Med. 14(6), 2012, сс. 428-439; PMID: 22262664).
В целом, применение ингибиторов иммунных чекпойнтов, по-видимому, представляет собой перспективный подход к совершенствованию иммунотерапии рака. Однако комбинация вакцин с индивидуальными ICI часто не приводит к ожидаемому улучшению иммунотерапии, а комбинированное клиническое применение ICI, направленных на несколько негативных костимуляторных рецепторов, или комбинация ICI с другими видами обработки может вызывать клинические осложнения, такие, например, как индукция аутоиммунного заболевания.
Таким образом, в основу настоящего изобретения была положена задача разработать безопасные и эффективные средства терапии на основе ICI, прежде всего на основе ингибиторов пути PD-1, прежде всего для терапии опухоли, рака и/или инфекционных заболеваний.
Задача, положенная в основу настоящего изобретения, решается с помощью объекта изобретения, представленного в формуле изобретения. В частности, задача изобретения решается путем создания комбинации вакцина/ингибитор, содержащей в качестве вакцины РНК-вакцину, которая содержит по меньшей мере одну РНК, содержащую по меньшей мере одну открытую рамку считывания, которая кодирует по меньшей мере один антиген, и в качестве ингибитора ингибитор пути PD-1, предпочтительно направленный против рецептора PD-1 или его лигандов PD-L1 и/или PD-L2. Кроме того, задача решается с помощью фармацевтической композиции или набора компонентов, содержащей/содержащего комбинацию вакцина/ингибитор или соответствующие ее компоненты. Кроме того, задача решается с помощью комбинации РНК-вакцины и ICI, прежде всего ингибиторов пути PD-1, предназначенной для применения в способе лечения опухолевых или раковых заболеваний или инфекционных заболеваний.
Для целей ясности и удобочитаемости представлены указанные ниже определения. Все технические особенности, упомянутые в этих определениях, могут истолковываться во всех до единого вариантах осуществления изобретения. В контексте указанных вариантов осуществления изобретения могут быть специально даны дополнительные определения и пояснения.
Иммунный ответ: Иммунный ответ, как правило, можем представлять собой либо специфическую реакцию адаптивной иммунной системы на конкретный антиген (так называемый специфический или адаптивный иммунный ответ), либо неспецифическую реакцию врожденной иммунной системы (так называемый неспецифический или врожденный иммунный ответ). По существу, изобретение касается специфических реакций (адаптивные иммунные ответы) адаптивной иммунной системы. Однако указанный специфический ответ может подкрепляться дополнительной неспецифической реакцией (врожденный иммунный ответ). Таким образом, изобретение относится также к соединению, композиции или комбинации, предназначенному(ой) для одновременной стимуляции врожденной и адаптивной иммунной системы с целью вызывания эффективного адаптивного иммунного ответа.
Иммунная система: Иммунная система может защищать организмы от инфекции. Если патогену удалось пройти через физический барьер организма и попасть в указанный организм, то врожденная иммунная система обеспечивает немедленный, но неспецифический ответ. На тот случай, если патоген ускользает от этого врожденного ответа, у позвоночных имеется второй уровень защиты, представляющий собой адаптивную иммунную систему. В этом случае иммунная система адаптирует свой ответ в процессе инфекции для улучшения распознавания патогена. Затем этот улучшенный ответ сохраняется после элиминации патогена в форме иммунологической памяти и позволяет адаптивной иммунной системе организовывать более быстрые и сильные атаки каждый раз при проникновении указанного патогена. Таким образом, иммунная система включает врожденную и адаптивную иммунную систему. Каждая из этих двух частей, как правило, включает так называемые гуморальный и клеточный компоненты.
Адаптивный иммунный ответ: Как правило, под адаптивным иммунным ответом понимают антигенспецифический ответ иммунной системы. Специфичность в отношении антигена позволяет вырабатывать ответы, приспособленные к специфическим патогенам или инфицированным патогеном клеткам. Способность создавать такие приспособленные ответы, как правило, поддерживается в организме «клетками памяти». Если патоген инфицирует организм более одного раза, то указанные специфические клетки памяти используются для его быстрой элиминации. В этом контексте первая стадия адаптивного иммунного ответа представляет собой активацию наивных антигенспецифических Т-клеток или различных иммунных клеток, способных индуцировать антигенспецифический иммунный ответ, антигенпрезентирующими клетками. Это происходит в лимфоидных тканях и органах, через которые постоянно проходят наивные Т-клетки. Три типа клеток, которые могут служить в качестве антигенпрезентирующих клеток, представляют собой дендритные клетки, макрофаги и В-клетки. Каждая из указанных клеток выполняем отдельную функцию при вызывании иммунных ответов. Дендритные клетки могут поглощать антигены посредством фагоцитоза и макропиноцитоза, и они могут стимулироваться при контакте, например, с чужим антигеном, к миграции в местную лимфоидную ткань, где может происходить их дифференцировка в зрелые дендритные клетки. Макрофаги поглощают находящиеся в форме частиц антигены, такие как бактерии, и могут индуцироваться инфекционными агентами или другими соответствующими стимулами и экспрессировать в результате этого молекулы ГКГС. Уникальная способность В-клеток к связыванию и интернализации растворимых белковых антигенов посредством своих рецепторов также может иметь важное значение для индукции Т-клеток. ГКГС-молекулы, как правило, ответственны за презентацию антигена Т-клеткам. При этом презентация антигена на молекулах ГКГС приводит к активации Т-клеток, что индуцирует их пролиферацию и дифференцировку в «вооруженные» эффекторные Т-клетки. Наиболее важной функцией эффекторных Т-клеток является уничтожение инфицированных клеток CD8+-цитотоксическими Т-клетками и активация макрофагов Th1-клетками, что в совокупности создает опосредованный клетками (клеточный) иммунитет, и активация В-клеток и Th2-, и Th1-клетками, приводящая к образованию различных классов антител, в результате чего создается гуморальный иммунный ответ. Т-клетки распознают антиген посредством своих Т-клеточных рецепторов, которые не распознают антиген и не связываются с ним непосредственно, но вместо этого распознают короткие пептидные фрагменты, например, выведенных из патогена белковых антигенов, например, так называемые эпитопы, которые связываются с молекулами ГКГС на поверхностях других клеток.
Адаптивная иммунная система: Адаптивная иммунная система в основном предназначена для устранения или предупреждения роста патогенов. Как правило, она регулирует адаптивный иммунный ответ, придавая иммунной системе позвоночных способность распознавать и запоминать специфические патогены (для создания иммунитета), и организовывать более сильную атаку в каждом случае при обнаружении патогена. Система обладает высокой способностью к адаптации вследствие соматической гипермутации (процесс ускоренных соматических мутаций) и V(D)J-рекомбинации (необратимая генетическая рекомбинация сегментов гена рецептора антигена). Этот механизм позволяет небольшому количеству генов создавать огромное количество различных рецепторов антигена, которые затем уникальным образом экспрессируются на каждом индивидуальном лимфоците. Поскольку реаранжировка гена приводит к необратимому изменению ДНК каждой клетки, то все потомство такой клетки должно затем наследовать гены, кодирующие ту же самую рецепторную специфичность, включая В-клетки памяти и Т-клетки памяти, которые имеют решающее значение для долговременного специфического иммунитета.
Клеточный иммунитет/клеточный иммунный ответ: Клеточный иммунитет относится, как правило, к активации макрофагов, естественных клеток-киллеров (NK), антигенспецифических цитотоксических Т-лимфоцитов и высвобождению различных цитокинов в ответ на антиген. В более общем смысле клеточный иммунитет основан не на антителах, а на активации клеток иммунной системы. Как правило, клеточный иммунный ответ может характеризоваться, например, активацией антигенспецифических цитотоксических Т-лимфоцитов, которые способны индуцировать апоптоз клеток, например, специфических иммунных клеток типа дендритных клеток или других клеток, экспонирующих эпитопы чужих генов на своей поверхности. Такие клетки могут представлять собой инфицированные вирусом или инфицированные внутриклеточными бактериями, или раковые клетки, экспонирующие опухолевые антигены. Другими характеристиками могут являться активация макрофагов и естественных клеток-киллеров, позволяющая им разрушать патогены, и стимуляция клеток к секреции различных цитокинов, которые влияют на функцию других клеток, участвующих в адаптивных иммунных ответах и врожденных иммунных ответах.
Гуморальный иммунитет/гуморальный иммунный ответ: Гуморальный иммунитет, как правило, относится к производству антител и необязательно к второстепенным процессам, сопровождающим производство антител. Гуморальный иммунный ответ, как правило, может характеризоваться, например, активацией Th2 и производством цитокинов, образованием зародышевого центра и переключением изотипа, созреванием аффинности и образованием клеток памяти. Гуморальный иммунитет, как правило, может относиться также к эффекторным функциям антител, включая нейтрализацию патогенов и токсинов, классическую активацию комплемента и стимулирование опсонинами фагоцитоза и элиминации патогенов.
Врожденная иммунная система: Врожденная иммунная система, которую называют также неспецифической иммунной системой, как правило, включает клетки и механизмы, которые неспецифически защищают хозяина от инфекции другими организмами. Это означает, что клетки врожденной системы могут распознавать патогены и реагировать на них обычным путем, но, в отличие от адаптивной иммунной системы, она не обеспечивает долговременный или защитный иммунитет хозяину. Врожденная иммунная система может, например, активироваться лигандами Toll-подобных рецепторов (TLR) или другими вспомогательными субстанциями, такими как липополисахариды, TNF-альфа, лиганд CD40 или цитокины, монокины, лимфокины, интерлейкины или хемокины, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, IFN-альфа, IFN-бета, IFN-гамма, GM-CSF, G-CSF, M-CSF, LT-бета, TNF-альфа, факторы роста и hGH, лиганд человеческого Toll-подобного рецептора TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, лиганд мышиного Toll-подобного рецептора TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13, лиганд NOD-подобного рецептора, лиганд RIG-I-подобного рецептора, иммуностимуляторная нуклеиновая кислота, иммуностимуляторная РНК (isPHK), CpG-ДНК, антибактериальный агент или противовирусный агент. Комбинация вакцина/ингибитор, фармацевтическая композиция или набор компонентов, предлагаемая/предлагаемый в настоящем изобретении, могут содержать одну или несколько из указанных субстанций. Как правило, ответ врожденной иммунной системы включает рекрутинг иммунных клеток к областям заражения посредством производства химических факторов, включая специализированные химические медиаторы, которые называют цитокинами; активацию каскада комплемента; идентификацию и удаление чужих субстанций, присутствующих в органах, тканях, крови и лимфе, специализированными лейкоцитами; активацию адаптивной иммунной системы; и/или функционирование в качестве физического и химического барьера для инфекционных агентов.
Адъювант/адъювантный компонент: Адъювант или адъювантный компонент в наиболее широком смысле, как правило, представляет собой фармакологический и/или иммунологический агент, который может модифицировать, например, усиливать, действие других агентов, таких как лекарственное средство или вакцина. Это понятие следует рассматривать в широком смысле, и оно относится к широкому спектру субстанций. Как правило, указанные субстанции обладают способностью повышать иммуногенность антигенов. Например, адъюванты могут распознаваться врожденными иммунными системами и, например, могут вызывать врожденный иммунный ответ. «Адъюванты», как правило, не вызывают адаптивный иммунный ответ. Таким образом, «адъюванты» нельзя квалифицировать как антигены. Механизм их действия отличен от механизма действий, запускаемых антигенами, приводящими к адаптивному иммунному ответу.
Антиген: В контексте настоящего изобретения понятие «антиген» относится, как правило, к субстанции, которая может распознаваться иммунной системой, предпочтительно адаптивной иммунной системой, и которая обладает способностью запускать антигенспецифический иммунный ответ, например, посредством образования антител и/или антигенспецифических Т-клеток, в качестве компонента адаптивного иммунного ответа. Как правило, антиген может представлять собой или содержать пептид или белок, который содержит по меньшей мере один эпитоп и который ГКГС может презентировать Т-клеткам. В контексте настоящего изобретения антиген может представлять собой продукт трансляции соответствующей РНК, предпочтительно мРНК, как указано в настоящем описании. В этом контексте, фрагменты, варианты и производные пептидов и белков, содержащие по меньшей мере один эпитоп, также рассматриваются как антигены. В контексте настоящего изобретения наиболее предпочтительными являются опухолевые антигены и антигены патогенов.
Эпитоп: Эпитопы (которые называют также «антигенными детерминантами») можно подразделить на Т-клеточные эпитопы и В-клеточные эпитопы. В контексте настоящего изобретения Т-клеточные эпитопы или части белков могут содержать фрагменты, предпочтительно имеющие длину от примерно 6 до примерно 20 аминокислот или даже более, например, фрагменты, процессируемые и презентируемые молекулами ГКГС класса I, предпочтительно имеют длину от примерно 8 до примерно 10 аминокислот, например, 8, 9 или 10, (или даже 11 или 12 аминокислот), или фрагменты, процессируемые и презентируемые молекулами ГКГС класса II, предпочтительно имеют длину примерно 13 аминокислот или более, например, 13, 14, 15, 16, 17, 18, 19, 20 или даже большее количество аминокислот, при этом указанные фрагменты можно выбирать из любой части аминокислотной последовательности. Указанные фрагменты, как правило, распознаются Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекулы ГКГС, т.е. фрагменты, как правило, не распознаются в их нативной форме. В-клеточные эпитопы, как правило, представляют собой фрагменты, локализованные на внешней поверхности (нативных) белковых или пептидных антигенов, указанных в настоящем описании, предпочтительно состоящих из 5-15 аминокислот, более предпочтительно состоящих из 5-12 аминокислот, еще более предпочтительно состоящих из 6-9 аминокислот, которые могут распознаваться антителами, т.е. в их нативной форме.
Такие эпитопы белков или пептидов можно, кроме того, выбирать из любых указанных вариантов таких белков или пептидов. В этом контексте антигенные детерминанты могут представлять собой конформационные или прерывистые эпитопы, состоящие из сегментов указанных в настоящем описании белков или пептидов, которые расположены с перерывами в аминокислотной последовательности белков или пептидов, указанных в настоящем описании, но которые находятся вблизи друг от друга в трехмерной структуре, или непрерывные или линейные эпитопы, состоящие из одной полипептидной цепи.
Вакцина: Под вакциной, как правило, понимают предназначенный для профилактики или терапии продукт, содержащий по меньшей мере один антиген, предпочтительно иммуноген. «Содержащий по меньшей мере один антиген» означает, например, что вакцина содержит антиген или что вакцина содержит молекулу, которая, например, кодирует антиген или молекулу, содержащую антиген. Например, вакцина может содержать нуклеиновую кислоту, такую как РНК (например, РНК-вакцина), которая кодирует пептид или белок, содержащий антиген. Антиген или иммуноген может быть выведен из любого материала, пригодного для вакцинации. Например, антиген или иммуноген может быть выведен из патогена, такого как бактерия или вирусные частицы и т.д., или из опухолевой или раковой ткани. Антиген или иммуноген стимулирует адаптивную иммунную систему организма для вырабатывания адаптивного иммунного ответа. В контексте настоящего изобретения вакцина предпочтительно не содержит клетки, такие как дендритные клетки или раковые клетки, например, клетки меланомы линии В16. Кроме того, в контексте настоящего изобретения вакцина предпочтительно не состоит из пептидных антигенов, таких как пептидные опухолевые антигены. В контексте настоящего изобретения вакцина предпочтительно представляет собой РНК-вакцину.
РНК-вакцина: В контексте настоящего описания под РНК-вакциной понимают вакцину, содержащую по меньшей мере одну молекулу РНК, которая содержит по меньшей мере одну открытую рамку считывания (ОРС), кодирующую по меньшей мере один антиген. В контексте настоящего изобретения по меньшей мере одна молекула РНК, содержащаяся в вакцине, предпочтительно представляет собой выделенную молекулу РНК. Указанная по меньшей мере одна РНК предпочтительно представляет собой вирусную РНК, самореплицирующуюся РНК (репликон) или наиболее предпочтительно мРНК. Под объем изобретения подпадают также гибриды РНК/ДНК, это означает, что по меньшей мере одна молекула РНК РНК-вакцины состоит частично из рибонуклеотидов и частично из дезоксирибонуклеотидов. В этом контексте по меньшей мере одна РНК, содержащаяся в РНК-вакцине, состоит по меньшей мере на 50% из рибонуклеотидов, более предпочтительно по меньшей мере на 60%, 70%, 80%, 90% и наиболее предпочтительно на 100%. В этом контексте по меньшей мере одна РНК, содержащаяся в РНК-вакцине, может находиться также в форме комплексной РНК или мРНК, в форме вирусной частицы и в форме репликоновой частицы как указано в настоящем описании. В контексте настоящего изобретения по меньшей мере одна РНК, содержащаяся в РНК-вакцине, предпочтительно не присутствует в клетках, таких как дендритные клетки или раковые клетки, например, клетки меланомы линии В16. Кроме того, наиболее предпочтительно, чтобы РНК-вакцина, предлагаемая в изобретении, не содержала или не состояла из лентивирусного вектора, прежде всего направленного к дендритным клеткам лентивирусного вектора, или (рекомбинантного) аденовирусного/аденоассоциированного вектора ((r)AAV-вектор). Предпочтительно РНК-вакцина, предлагаемая в изобретении, не представляет собой вакцину против ВИЧ. В частности, предпочтительно, чтобы РНК-вакцина, предлагаемая в изобретении, не содержала AAV или лентивирусный вектор, кодирующий один или несколько антигенов. Предпочтительно также РНК-вакцина, предлагаемая в изобретении, не должна кодировать ВИЧ-специфические антигены, например, белок Gag, прежде всего не должна содержать лентивирусный вектор, кодирующий ВИЧ-специфические антигены, такие как Gag. Предпочтительно РНК-вакцина, предлагаемая в изобретении, не содержит слитый белок, содержащий белок PD1 и антигенный белок, или слитый белок, содержащий белок PD1 и иммуноглобулин или его часть, и не кодирует такой слитый содержащий PD1 белок.
Генетическая вакцинация: Как правило, под генетической вакцинацией понимают вакцинацию, которую осуществляют путем введения молекулы нуклеиновой кислоты, кодирующей антиген или иммуноген, или его фрагменты. Молекулу нуклеиновой кислоты можно вводить в организм индивидуума или в выделенные из индивидуума клетки. После трансфекции организма или после трансфекции выделенных клеток определенными клетками указанные клетки могут экспрессировать антиген или иммуноген, и затем он может презентироваться иммунной системе, вызывая адаптивной, т.е. антигенспецифический иммунный ответ. Следовательно, генетическая вакцинация, как правило, включает по меньшей мере одну из следующих стадий: а) введение нуклеиновой кислоты, предпочтительно (выделенной) РНК, указанной в настоящем описании, индивидууму, предпочтительно пациенту, или в клетки, выделенные из организма индивидуума, предпочтительно пациента, что обычно приводит к трансфекции клеток индивидуума либо in vivo, либо in vitro; б) транскрипцию и/или трансляцию интродуцированной молекулы нуклеиновой кислоты; и необязательно в) повторное введение выделенных трансфектированных клеток индивидууму, предпочтительно пациенту, если нуклеиновая кислота не была введена непосредственно пациенту.
Нуклеиновая кислота: Понятие «нуклеиновая кислота» обозначает либо ДНК-, либо РНК-молекулу и является синонимом понятия «полинуклеотид». Кроме того, под общее понятие «нуклеиновая кислота» подпадают модификации или производные нуклеиновой кислоты, как она определена в настоящем описании. Например, ПНК также подпадает под понятие «нуклеиновая кислота».
Моноцистронная РНК: Моноцистронная РНК, как правило, может представлять собой РНК, предпочтительно мРНК, которая содержит только одну открытую рамку считывания. В этом контексте открытая рамка считывания представляет собой последовательность, состоящую из нескольких нуклеотидных триплетов (кодонов), которые могут транслироваться в пептид или белок.
Би-/мультицистронная РНК: РНК, предпочтительно мРНК, которая, как правило, может иметь две (бицистронная) или большее количество (мультицистронная) открытые рамки считывания (ОРС). В этом контексте открытая рамка считывания представляет собой последовательность, состоящую из нескольких нуклеотидных триплетов, (кодонов), которые могут транслироваться в пептид или белок.
5'-Кэп-структура: 5'-Кэп представляет собой, как правило, модифицированный нуклеотид, прежде всего гуаниновый нуклеотид, добавленный к 5'-концу молекулы РНК. Предпочтительно 5'-кэп добавляют с использованием 5'-5'-трифосфатной связи.
Поли(C)-последовательность: Поли(С)-последовательность, как правило, представляет собой длинную последовательность, состоящую из цитозиновых нуклеотидов, как правило, содержащую от примерно 10 до примерно 200 цитидиновых нуклеотидов, предпочтительно от примерно 10 до примерно 100 цитидиновых нуклеотидов, более предпочтительно от примерно 10 до примерно 70 цитидиновых нуклеотидов или еще более предпочтительно от примерно 20 до примерно 50 или даже от примерно 20 до примерно 30 цитидиновых нуклеотидов. Поли(С)-последовательность предпочтительно может располагаться в 3'-направлении относительно кодирующей области, содержащейся в нуклеиновой кислоте.
Поли(А)-хвост: Поли(А)-хвост, который называют также «3'-поли(А)-хвостом», как правило, представляет собой длинную последовательность адениновых нуклеотидов, содержащую вплоть до примерно 400 аденозиновых нуклеотидов, например, от примерно 25 до примерно 400, предпочтительно от примерно 50 до примерно 400, более предпочтительно от примерно 50 до примерно 300, еще более предпочтительно от примерно 50 до примерно 250, наиболее предпочтительно от примерно 60 до примерно 250 аденозиновых нуклеотидов, добавленную к 3'-концу нуклеотидной последовательности, предпочтительно мРНК. Поли(А)-хвост предпочтительно может располагаться в 3'-направлении относительно кодирующей области, содержащейся в нуклеиновой кислоте, например, мРНК.
Стабилизированная нуклеиновая кислота: Стабилизированная нуклеиновая кислота, как правило, может быть практически устойчивой к расщеплению in vivo (например, расщеплению экзо- или эндонуклеазой) и/или расщеплению ех vivo (например, в процессе производства до введения вакцины, например, в процессе приготовления раствора РНК-вакцины, предназначенного для введения). Стабилизацию РНК, прежде всего мРНК, можно, например, обеспечивать с использованием 5'-кэп-структуры, поли(А)-хвоста, поли(С)-хвоста и/или любой другой модификации UTR. Ее можно обеспечивать также путем модификации каркаса, модификации сахаров, модификации оснований и/или модификации G/C-содержания в нуклеиновой кислоте. В контексте настоящего изобретения можно рассматривать и различные другие методы.
Модификация нуклеиновой кислоты (модифицированная нуклеиновая кислота): Модификация молекулы нуклеиновой кислоты, прежде всего РНК или мРНК, может включать модификации каркаса, модификации сахаров или модификации оснований. Модификация каркаса в контексте настоящего изобретения представляет собой модификацию, при которой химически модифицируют фосфаты каркаса нуклеотидов, присутствующих в молекуле нуклеиновой кислоты. Модификация сахаров в контексте настоящего изобретения представляет собой химическую модификацию сахара в нуклеотидах нуклеиновой кислоты. Кроме того, модификация оснований в контексте настоящего изобретения представляет собой химическую модификацию основного фрагмента в нуклеотидах нуклеиновой кислоты. Следовательно, в контексте настоящего описания под модифицированной нуклеиновой кислотой понимают также молекулу нуклеиновой кислоты, которая может включать нуклеотидные аналоги. Кроме того, модификация молекулы нуклеиновой кислоты может содержать липидную модификацию. Такая модифицированная липидами нуклеиновая кислота, как правило, содержит указанную в настоящем описании нуклеиновую кислоту. Такая модифицированная липидами молекула нуклеиновой кислоты, как правило, дополнительно содержит по меньшей мере один линкер, ковалентно связанный с указанной молекулой нуклеиновой кислоты, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером. Альтернативно этому модифицированная липидами молекула нуклеиновой кислоты содержит по меньшей мере одну молекулу нуклеиновой кислоты, указанную в настоящем описании, и по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с указанной молекулой нуклеиновой кислоты. Согласно третьей альтернативе модифицированная липидами молекула нуклеиновой кислоты содержит молекулу нуклеиновой кислоты, указанную в настоящем описании, по меньшей мере один линкер, ковалентно связанный с указанной молекулой нуклеиновой кислоты, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером, и также по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с указанной молекулой нуклеиновой кислоты.
Модификация нуклеиновой кислоты может содержать также модификацию содержания G/C в кодирующей области молекулы нуклеиновой кислоты, прежде всего по меньшей мере одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере один антиген, в предлагаемой в изобретении комбинации вакцина/ингибитор. В этом контексте наиболее предпочтительно, чтобы содержание G/C в кодирующей области молекулы нуклеиновой кислоты повышалось по сравнению с содержанием G/C в кодирующей области соответствующей ей кодирующей последовательности дикого типа, т.е. немодифицированной РНК. Аминокислотную последовательность, кодируемую нуклеотидной последовательностью, предпочтительно не модифицируют по сравнению с аминокислотной последовательностью, кодируемой конкретной мРНК дикого типа. Модификация G/C-содержания в молекуле нуклеиновой кислоты, прежде всего в том случае, если молекула нуклеиновой кислоты находится в форме мРНК или кодирует мРНК, основана на том факте, что последовательность любой области мРНК, подлежащей трансляции, является важной для эффективной трансляции указанной мРНК. Таким образом, важными являются состав и последовательность различных нуклеотидов. В частности, последовательности, имеющие повышенное содержание G (гуанозин)/С (цитозин), являются более стабильными, чем последовательности, имеющие повышенное содержание А (аденозин)/U (урацил). Таким образом, кодоны кодирующей последовательности или мРНК изменяют по сравнению с соответствующей ей кодирующей последовательностью или мРНК дикого типа таким образом, чтобы они содержали большее количество G/C-нуклеотидов, с сохранением транслируемой аминокислотной последовательности. Учитывая тот факт, что несколько кодонов кодируют одну и ту же аминокислоту (так называемая вырожденность генетического кода), можно определять наиболее предпочтительные с точки зрения стабильности кодоны (так называемые альтернативные наиболее часто встречающиеся кодоны). Предпочтительно содержание G/C в кодируемой области молекулы нуклеиновой кислоты, прежде всего по меньшей мере одной РНК, входящей в РНК-вакцину, кодирующей по меньшей мере один антиген, в предлагаемой в изобретении комбинации вакцина/ингибитор, повышают по меньшей мере на 7%, более предпочтительно по меньшей мере на 15%, наиболее предпочтительно по меньшей мере на 20%, по сравнению с содержанием G/C в кодируемой области мРНК дикого типа. В конкретном варианте осуществления изобретения заменяют по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90%, 95% или даже 100% пригодных для замены кодонов в области, кодирующей белок или пептид, указанный в настоящем описании, или его фрагмент, вариант и/или производное, или всю последовательность мРНК дикого типа или кодирующую последовательность, повышая тем самым содержание G/C в указанной последовательности. В этом контексте наиболее предпочтительно повышать содержание G/C в молекуле нуклеиновой кислоты, прежде всего по меньшей мере в одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор, до максимума (т.е. до 100% пригодных для замещения кодонов), прежде всего в области, кодирующей белок, по сравнению с последовательностью дикого типа. Кроме того, модификация нуклеиновой кислоты, прежде всего по меньшей мере одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор, основана на открытии того факта, что эффективность трансляции определяется также различной частотой встречаемости тРНК в клетках. Частота встречаемости тРНК в клетке и, следовательно, наиболее предпочтительные кодоны в указанной клетке, зависят от видов, из которых выведена клетка. Следовательно, для дрожжевой клетки характерны наиболее предпочтительные кодоны, отличные от тех, которые характерны для клетки млекопитающего, такой как клетка человека. Таким образом, если в молекуле нуклеиновой кислоты присутствуют в повышенном количестве так называемые «редкие кодоны» (в контексте соответствующей экспрессионной системы), прежде всего в том случае, если нуклеиновая кислота находится в форме мРНК или кодирует мРНК, то уровень трансляции соответствующей модифицированной молекулы нуклеиновой кислоты является значимо более низким, чем в том случае, когда присутствуют кодоны, кодирующие относительно «часто встречающуюся» тРНК. Следовательно, кодирующую область модифицированной нуклеиновой кислоты, прежде всего по меньшей мере одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор, предпочтительно модифицируют по сравнению с соответствующей областью мРНК или кодирующей последовательностью дикого типа таким образом, чтобы по меньшей мере один кодон в последовательности дикого типа, кодирующей тРНК, которая встречается относительно редко в клетке, был заменен на кодон, кодирующий тРНК, которая встречается относительно часто в клетке и «несет» ту же самую аминокислоту, что и относительно редко встречающаяся тРНК. Путем такой модификации последовательности молекулы нуклеиновой кислоты, прежде всего по меньшей мере одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор, модифицируют таким образом, чтобы встраивать кодоны, для которых доступны часто встречающиеся тРНК. Другими словами, с помощью такой модификации все кодоны последовательности дикого типа, которые кодируют тРНК, являющуюся относительно редкой в клетке, в каждом случае заменяют на кодоны, которые кодируют тРНК, относительно часто встречающуюся в клетке, и которая в каждом случае «несет» такую же аминокислоту, что и относительно редкая тРНК. В контексте настоящего описания такую модифицированную нуклеиновую кислоту предпочтительно обозначают как «нуклеиновая кислота или РНК с оптимизированными кодонами». тРНК, встречающиеся относительно часто в клетке, и наоборот, встречающиеся относительно редко, известны специалистам в данной области, см., например, Akashi, Curr. Opin. Genet. Dev., 11(6), 2001, сс. 660-666. Наиболее предпочтительно, чтобы нуклеотидная последовательность, кодирующая белок, прежде всего по меньшей мере одна РНК, кодирующая по меньшей мере один антиген, входящий в РНК-вакцину, предлагаемую в настоящем изобретении, была оптимизирована с использованием наиболее предпочтительных для человека кодонов. Кодоны, которые применяют для наиболее часто встречающейся тРНК конкретной аминокислоты, например кодон Gly, который использует тРНК, встречающуюся наиболее часто в (человеческой) клетке, являются наиболее предпочтительными. В этом контексте наиболее предпочтительным является объединение повышения, предпочтительно до максимума, содержания G/C в последовательности, в модифицированной молекуле нуклеиновой кислоты, прежде всего по меньшей мере одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор, с «часто встречающимися» кодонами без модификации аминокислотой последовательности белка, кодируемого кодирующей областью молекулы нуклеиновой кислоты. Этот предпочтительный вариант осуществления изобретения позволяет наиболее эффективно транслировать и стабилизировать (модифицированную) нуклеиновую кислоту, прежде всего, по меньшей мере одну РНК, входящую в РНК-вакцину, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор.
Производное молекулы нуклеиновой кислоты: В контексте настоящего описания определение «производное молекулы нуклеиновой кислоты» полностью соответствует представленному выше определению «модифицированная нуклеиновая кислота».
Нуклеотидные аналоги: Нуклеотидные аналоги представляют собой нуклеотиды, структурно сходные (аналогичные) встречающимся в естественных условиях нуклеотидам, которые включают фосфатные модификации каркаса, модификации Сахаров или модификации нуклеотидного основания.
Модификация UTR: Молекула нуклеиновой кислоты, прежде всего в том случае, когда нуклеиновая кислота находится в форме молекулы кодирующей нуклеиновой кислоты, прежде всего по меньшей мере одна РНК, входящая в предлагаемую в настоящем изобретении РНК-вакцину, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один антиген, предпочтительно имеет по меньшей мере одну модифицированную 5'- и/или 3'-UTR-последовательность (модификация UTR). Указанные 5'- и/или 3'-нетранслируемые области (UTR) включают последовательности, которые могут оказывать влияние на увеличение времени полужизни нуклеиновой кислоты в цитозоле или могут повышать трансляцию кодируемого белка или пептида. Указанные UTR-последовательности могут быть идентичными на 100% встречающимся в естественных условиях последовательностям, присутствующим в вирусах, бактериях и эукариотах, но могут быть также и частично или полностью синтетическими. В качестве примера стабилизирующих последовательностей, которые можно применять для стабилизации нуклеиновой кислоты, можно отметить нетранслируемые последовательности (UTR) гена (альфа)глобина, например, из Homo sapiens или Xenopus laevis. Другим примером стабилизирующей последовательности является последовательность общей формулы
(C/U)CCANxCCC(U/A)PyxUC(C/U)CC, которая содержится в 3'UTR обладающей очень высокой стабильностью РНК, которая кодирует (альфа)глобин, коллаген типа I, 15-липоксигеназу или тирозингидроксилазу (см. Holcik и др., Proc. Natl. Acad. Sci. USA, 94, 1997, сс. 2410-2414). В контексте настоящего изобретения наиболее предпочтительной является мутантная UTR (альфа)глобина, содержащая следующую последовательность GCCCGaTGGG CCTCCCAACG GGCCCTCCTC CCCTCCTTGC ACCG (SEQ ID NO: 1) (подчеркнутый нуклеотид обозначает мутацию по сравнению с последовательностью дикого типа), которая в настоящем описании обозначена также как muag. Такие интродуцированные последовательности UTR, естественно, можно применять индивидуально или в комбинации друг с другом и также в сочетании с другими модификациями последовательности, известными специалисту в данной области.
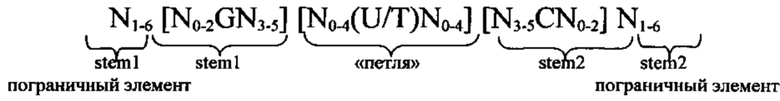
Гистоновая структура стебель-петля: В контексте настоящего изобретения последовательность гистоновой структуры стебель-петля предпочтительно выбирают по меньшей мере из одной из следующих формул (I) или (II):
формула (I) (последовательность структуры типа «стебель-петля» без пограничных элементов «стебля»):

формула (II) (последовательность структуры типа «стебель-петля» с пограничными элементами):
 ,
,
в которых:
в которой N0-2 обозначает непрерывную последовательность, состоящую из 0-2, предпочтительно 0-1, более предпочтительно 1 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, Т, G и С или их нуклеотидных аналогов;
в которой N3-5 обозначает непрерывную последовательность, состоящую из 3-5, предпочтительно 4-5, более предпочтительно 4 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, Т, G и С или их нуклеотидных аналогов, и в которой G обозначает гуанозин или его аналог и необязательно может быть заменен на цитидин или его аналог при условии, что комплементарный ему нуклеотид цитидин в stem2 заменен на гуанозин;
в которой N0-4 каждый независимо друг от друга обозначает непрерывную последовательность, состоящую из 0-4, предпочтительно 1-3, более предпочтительно 1-2 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, Т, G и С или их нуклеотидных аналогов; и в которой U/T обозначает уридин или необязательно тимидин;
в которой N3-5 обозначает непрерывную последовательность, состоящую из 3-5, предпочтительно 4-5, более предпочтительно 4 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, Т, G и С или их нуклеотидных аналогов;
в которой N0-2 обозначает непрерывную последовательность, состоящую из 0-2, предпочтительно 0-1, более предпочтительно 1 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, Т, G или С или их нуклеотидных аналогов; и
в которой С обозначает цитидин или его аналог и необязательно может быть заменен на гуанозин или его аналог при условии, что комплементарный ему нуклеотид гуанозин в stem1 заменен на цитидин;
где
у элементов stem1 и stem2 может происходить спаривание оснований друг с другом с образованием обратно комплементарной последовательности, где спаривание оснований может иметь место между stem1 и stem2, например, посредством спаривания оснований по Уотсону-Крику нуклеотидов А и U/T или G и С, или посредством спаривания оснований не по Уотсону-Крику, например, посредством спаривания «качающихся» оснований («качающегося» спаривания оснований), обратного спариванию оснований по Уотсону-Крику, посредством хугстиновского спаривания оснований, посредством обратного хугстиновскому спаривания оснований, или у них может происходить спаривание оснований друг с другом с образованием частично обратно комплементарной последовательности, при этом неполное спаривание оснований может иметь место между stem1 и stem2, вследствие того, что для одного или нескольких оснований в одном стебле не имеется комплементарного основания в обратно комплементарной последовательности другого стебля.
Синтез нуклеиновых кислот: Указанные в настоящем описании молекулы нуклеиновых кислот, применяемые согласно изобретению, можно получать с помощью любого метода, известного в данной области, включая методы синтеза, такие, например, как метод твердофазного синтеза, размножение in vivo (например, размножение вирусов in vivo), а также методов in vitro, таких, как реакции транскрипции in vitro.
Для получения молекулы нуклеиновой кислоты, прежде всего в том случае, когда нуклеиновая кислота находится в форме РНК или мРНК, соответствующую молекулу ДНК можно, например, транскрибировать in vitro. Указанная ДНК-матрица предпочтительно содержит пригодный промотор, например, промотор Т7 или SP6, для транскрипции in vitro, за которым располагается требуемая нуклеотидная последовательность, кодирующая молекулу нуклеиновой кислоты, например, мРНК, которую нужно получить, и сигнал терминации для транскрипции in vitro. Молекулу ДНК, которая служит матрицей по меньшей мере для одной представляющей интерес РНК, можно получать путем ферментативной пролиферации и последующего выделения в виде части плазмиды, которая может реплицироваться в бактериях. Плазмиды, которые можно рассматривать в качестве приемлемых для осуществления настоящего изобретения, представляют собой, например, плазмиды рТ7Т (GenBank, регистрационный номер U26404; Lai и др., Development, 121, 1995, сс. 2349-2360), серии pGEM®, например, pGEM®-1 (GenBank, регистрационный номер Х65300; фирма Promega) и pSP64 (GenBank, регистрационный номер Х65327); ср. также Mezei и Storts, Purification of PCR Products в: PCR Technology: Current Innovation, под ред. Griffin и Griffin, изд-во CRC Press, Boca Raton, FL, 2001.
РНК: РНК является общепринятым сокращением для рибонуклеиновой кислоты. Она представляет собой молекулу нуклеиновой кислоты, т.е. полимер, состоящий из нуклеотидов. Указанные нуклеотиды представляют собой, как правило, мономеры аденозинмонофосфата, уридинмонофосфата, гуанозинмонофосфата и цитидинмонофосфата, соединенные друг с другом вдоль так называемого каркаса. Каркас формируется с помощью фосфодиэфирных связей между сахаром, т.е. рибозой, первого и фосфатным фрагментом второго смежного мономера. Конкретную последовательность мономеров называют РНК-последовательностью.
Матричная РНК (мРНК): В эукариотических клетках транскрипция, как правило, происходит в ядре или в митохондрии. In vivo транскрипция ДНК, как правило, приводит к образованию так называемой незрелой РНК, которая в результате процессинга должна превратиться в так называемую матричную РНК, которую сокращенно обозначают как мРНК. Процессинг незрелой РНК, например, в эукариотических организмах, включает ряд различных посттранскрипционных модификаций, таких как сплайсинг, 5'-кэпирование, полиаденилирование, экспорт из ядра или митохондрии и т.п. Совокупность указанных процессов называют также созреванием РНК. Зрелая матричная РНК, как правило, представляет собой нуклеотидную последовательность, которая может быть транслирована в аминокислотную последовательность конкретного пептида или белка. Как правило, зрелая мРНК содержит 5'-кэп, 5'UTR, открытую рамку считывания, 3'UTR и поли(А)-последовательность. В контексте настоящего изобретения мРНК может представлять собой также искусственную молекулу, т.е. молекулу, не встречающуюся в естественных условиях. Это означает, что в контексте настоящего изобретения мРНК может, например, содержать комбинацию 5'UTR, открытой рамки считывания, 3'UTR и поли(А)-последовательность, которая не встречается в естественных условиях в указанной комбинации.
Ретровирус: Ретровирус представляет собой РНКовый вирус, который дуплицируется в клетке-хозяине с помощью фермента обратной транскриптазы с образованием ДНК из его геномной РНК. Затем ДНК встраивается в геном хозяина с помощью фермента интегразы. После этого вирус размножается в виде части ДНК клетки-хозяина и затем подвергается обычным процессам транскрипции и трансляции для экспрессии генов, которые несет вирус. Для целей генной терапии часто применяют лентивирусы. Из соображений безопасности лентивирусные векторы, как правило, не несут гены, необходимые для их репликации. Для получения лентивируса несколькими плазмидами трансфектируют так называемую линию упаковочных клеток, обычно линию HEK 293. Одна или несколько плазмид, обычно называемых упаковочными плазмидами, кодируют вирионные белки, такие как капсид и обратная транскриптаза. Другая плазмида содержит генетический материал, предназначенный для доставки вектором. Он транскрибируется с получением вирусного генома на основе одноцепочечной РНК, упакованный в вирион, который применяют для заражения клеток для целей генной терапии или генетической вакцинации.
Вирион: Вирусные частицы (известные как вирионы) состоят из двух или трех частей: I) генетического материала (содержащего вирусные гены и необязательно замещенные гетерологичные гены), состоящего либо из ДНК, либо из РНК; II) белковой оболочки, защищающей указанные гены; и в некоторых случаях III) оболочки из липидов, которая окружает белковую оболочку при ее нахождении вне клетки.
Самореплицирующиеся РНК (репликоны): Самореплицирующиеся РНК представляют собой обеспечивающие доставку векторы на основе альфавирусов, которые были выведены из вируса леса Семлики (SFV), вируса Синдбис (SIN) и вируса венесуэльского энцефалита лошадей (VEE). Альфавирусы представляют собой одноцепочечные РНКовые вирусы, в которых представляющие интерес гетерологичные гены могут быть замещены структурными генами альфавируса. Располагая структурные гены в транс-положении, РНК репликона упаковывают в частицы репликона (RP), которые можно применять для целей генной терапии или генетической вакцинации (см., например, Vander Veen и др., alphavirus replicon vaccines, Animal Health Research Reviews 13(1), 2012, cc. 1-9). После проникновения в клетку-хозяина геномная вирусная РНК сначала служит в качестве мРНК для трансляции вирусных неструктурных белков (nsP), необходимых для инициации амплификации вирусной РНК. Репликация РНК происходит в результате синтеза промежуточного продукта, представляющего собой полноразмерную минус-цепь, который служит в качестве матрицы для синтеза дополнительных полноразмерных геномных РНК и для транскрипции плюс-цепи субгеномной РНК с использованием внутреннего промотора. После этого такую РНК можно рассматривать как самореплицирующуюся РНК, поскольку в таком репликоне все еще присутствуют неструктурные белки, ответственные за репликацию (и транскрипцию гетерологичных генов). Такие альфавирусные векторы обозначают как «репликоны».
Репликоновая частица: Репликоновая частица состоит из двух или трех частей: I) генетического материала (т.е. репликона) (содержащего вирусные гены и необязательно замещенные гетерологичные гены), состоящего либо из ДНК, либо из РНК; II) белковой оболочки, защищающей указанные гены; и в некоторых случаях III) оболочки из липидов, которая окружает белковую оболочку при ее нахождении вне клетки.
Выделенная РНК: В контексте настоящего описания выделенная РНК представляет собой РНК, которая не является частью клетки, облученной клетки или клеточного лизата. Выделенную РНК можно получать путем выделения и/или очистки из клеток или клеточных лизатов, или из систем транскрипции in vitro.
В контексте настоящего изобретения понятие «выделенная РНК» определяют как РНК, которая не является частью клеток, облученных клеток или клеточных лизатов, включая РНК, входящую в РНК-вакцину, или которая не является частью клеток, трансфектированных РНК, входящей в РНК-вакцину. Другими словами, понятие «выделенная РНК» исключает (ex vivo) трансфектированные или модулированные клетки, применяемые в качестве РНК-вакцины, прежде всего, исключает ex vivo трансфектированные или модулированные иммунные клетки, такие как дендритные клетки (DC), например, DC, трансфектированные/трансдуцированные РНК, применяемой в качестве РНК-вакцины. Кроме того, понятие «выделенная РНК» исключает РНК, содержащуюся в клетках, облученных клетках или клеточных лизатах, которые в норме содержат по меньшей мере одну кодирующую антиген РНК, применяемую в качестве РНК-вакцины. Следовательно, РНК-вакцина, входящая в предлагаемую в изобретении комбинацию, предпочтительно не содержит модулированные или трансфектированные клетки, прежде всего, не содержит трансфектированные или модулированные иммунные клетки (например, антигенпрезентирующие клетки), более конкретно, не содержит трансфектированные или модулированные DC, облученные клетки или клеточные лизаты, содержащие в норме по меньшей мере одну РНК, входящую в РНК-вакцину. При такой интерпретации становится очевидным, что РНК-вакцина, применяемая согласно настоящему изобретению, предпочтительно не соответствует вакцине на основе клеток или вакцине на основе DC, или в более общем плане, предпочтительно не соответствует вакцине на основе клеток, или, в более общем плане, РНК-вакцина, применяемая согласно настоящему изобретению, предпочтительно не содержит клетки, и предлагаемая в изобретении комбинация, которая предназначена для введения, содержит РНК-вакцину в форме РНК, более предпочтительно в форме мРНК, необязательно в сочетании с компонентом, представляющим собой носитель и/или адъювант. Понятие «выделенная РНК» включает также РНК, входящую в комплекс с другими компонентами, например, пептидами, белками, носителями и т.д., РНК, упакованную в частицы, такие, например, как репликоновые частицы или вирусные частицы (вирионы), и РНК, содержащуюся в растворе, который может содержать помимо РНК другие компоненты, например, буфер, стабилизаторы, ингибиторы РНКазы и т.д.
Последовательность молекулы нуклеиновой кислоты: Под последовательностью молекулы нуклеиновой кислоты, как правило, понимают конкретный и индивидуальный порядок расположения, т.е. непрерывный ряд входящих в нее нуклеотидов.
Последовательность белка или пептида: Под последовательностью белка или пептида, как правило, понимают порядок расположения, т.е. непрерывный ряд входящих в него аминокислот.
Идентичность последовательности: Две или большее количество последовательностей являются идентичными, если они имеют одинаковую длину и порядок расположения нуклеотидов или аминокислот. Процент идентичности, как правило, характеризует степень идентичности двух последовательностей, т.е. он, как правило, характеризует процент нуклеотидов, которые соответствуют по своему положению идентичным нуклеотидам референс-последовательности. Для определения степени идентичности считается, что подлежащие сравнению последовательности имеют одну и ту же длину, т.е. длину наиболее длинной последовательности из подлежащих сравнению последовательностей. Это означает, что первая последовательность, состоящая из 8 нуклеотидов, идентична на 80% второй последовательности, состоящей из 10 нуклеотидов, содержащих первую последовательность. Другими словами, в контексте настоящего изобретения идентичность последовательностей предпочтительно относится к проценту нуклеотидов в последовательности, которые находятся в одних и тех же положениях в двух или большем количестве последовательностей, имеющих одинаковую длину. При сравнительном анализе первичной структуры последовательностей бреши обычно рассматривают как неидентичные положения безотносительно к их действительному положению.
Фрагмент последовательности: фрагмент последовательности, как правило, представляет собой укороченный участок последовательности, например, нуклеотидной последовательности или аминокислотной последовательности. Следовательно, фрагмент последовательности, как правило, состоит из последовательности, которая идентична соответствующему сегменту или соответствующим сегментам полноразмерной последовательности. В контексте настоящего изобретения предпочтительный фрагмент последовательности состоит из непрерывного сегмента, содержащего такие элементы, как нуклеотиды или аминокислоты, который соответствует непрерывному состоящему из указанных элементов сегменту молекулы, из которой выведен фрагмент, длина которого составляет по меньшей мере 5%, предпочтительно по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, и наиболее предпочтительно по меньшей мере 80% от всей (т.е. полноразмерной) молекулы, из которой выведен фрагмент. Так, например, фрагмент белкового или пептидного антигена предпочтительно соответствует непрерывному сегменту элементов белкового или пептидного антигена, из которого выведен фрагмент, длина которого составляет по меньшей мере 5%, предпочтительно по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, и наиболее предпочтительно по меньшей мере 80% от всего (т.е. полноразмерного) белкового или пептидного антигена. Наиболее предпочтительно фрагмент последовательности представляет собой функциональный фрагмент, т.е. фрагмент, обладающий одной или несколькими функциями, которыми обладает последовательность, из которой выведен фрагмент. Например, фрагмент белкового или пептидного антигена предпочтительно обладает по меньшей мере одной антигенной функцией (например, обладает способностью вызывать специфическую иммунную реакцию против по меньшей мере одной антигенной детерминанты в указанном белковом или пептидном антигене), которой обладает белковый или пептидный антиген, из которого выведен фрагмент.
Фрагменты белков: В контексте настоящего изобретения «фрагменты» белков или пептидов, т.е. фрагменты аминокислотных последовательностей, как правило, могут содержать последовательность белка или пептида, как она определена в настоящем описании, которая касательно ее аминокислотной последовательности (или кодирующей ее молекулы нуклеиновой кислоты), укорочена на N-конце, С-конце и/или внутри последовательности по сравнению с аминокислотной последовательностью исходного (нативного) белка (или кодирующей его молекулой нуклеиновой кислоты). Таким образом, указанное укорочение может иметь место либо на аминокислотном уровне, либо соответственно на уровне нуклеиновой кислоты. Следовательно, идентичность последовательности применительно к такому фрагменту, как он определен в настоящем описании, предпочтительно может относиться к полному белку или пептиду, как они определены в настоящем описании, или к полной (кодирующей) молекуле нуклеиновой кислоты, соответствующей указанному белку или пептиду.
Аналогично этому, «фрагменты» нуклеотидных последовательностей в контексте настоящего изобретения могут содержать последовательность нуклеиновой кислоты, как она определена в настоящем описании, которая касательно ее молекулы нуклеиновой кислоты укорочена на 5'-, 3'-конце и/или внутри последовательности по сравнению с молекулой нуклеиновой кислоты, представляющей собой исходную (нативную) молекулу нуклеиновой кислоты. Таким образом, идентичность последовательности касательно такого фрагмента, как он определен в настоящем описании, предпочтительно может относиться к полной нуклеиновой кислоте, как она определена в настоящем описании.
Трансфекция: Понятие «трансфекция» относится к интродукции молекул нуклеиновой кислоты, таких как молекулы ДНК или РНК (например, мРНК), в клетки, предпочтительно в эукариотические клетки. В контексте настоящего изобретения под понятие «трансфекция» подпадает любой известный специалисту в данной области метод интродукции молекул нуклеиновой кислоты, предпочтительно молекул РНК, в клетки, предпочтительно в эукариотические клетки, такие как клетки млекопитающих. Такие методы включают, например, электропорацию, липофекцию, например, на основе катионных липидов и/или липосом, преципитацию фосфатом кальция, трансфекцию на основе наночастиц, трансфекцию на основе вирусов или трансфекцию на основе катионных полимеров, таких как DEAE-декстран или полиэтиленимин, и т.д.
Носитель: В контексте изобретения носитель, как правило, может представлять собой соединение, которое облегчает транспорт и/или включение в комплекс другого соединения (карго, полезный груз). Носитель может быть связан со своим полезным грузом посредством ковалентного или нековалентного взаимодействия. Носитель может транспортировать нуклеиновые кислоты, например, РНК или ДНК, к клеткам-мишеням. Носитель может (в некоторых вариантах осуществления изобретения) представлять собой катионное или поликатионное соединение или полимерный носитель, как он определен в настоящем описании. В контексте настоящего изобретения носитель предпочтительно пригоден в качестве носителя для молекул нуклеиновой кислоты, например, для того, чтобы опосредовать растворение в физиологически приемлемых жидкостях, транспорт и поглощение клетками молекул нуклеиновой кислоты или вектора. Следовательно, в контексте настоящего изобретения носитель может представлять собой компонент, который можно применять для запасания и доставки молекулы нуклеиновой кислоты или вектора. Такие носители могут представлять собой, например, катионные или поликатионные носители или соединения, которые могут служить в качестве агентов для трансфекции или комплексообразования. В этом контексте наиболее предпочтительными носителями или полимерными носителями являются поликатионные соединения.
Катионное или поликатионное соединение/компонент:
Понятие «катионное или поликатионное соединение/компонент», как правило, относится к заряженной молекуле, которая является положительно заряженной (катион) при значении pH, составляющем, как правило, от 1 до 9, предпочтительно при значении pH, равном или ниже 9 (например, от 5 до 9), равном или ниже 8 (например, от 5 до 8), равном или ниже 7 (например, от 5 до 7), наиболее предпочтительно при физиологическом значении pH, например, от 7,3 до 7.4. Таким образом, катионное или поликатионное соединение/компонент может представлять собой любое положительно заряженное соединение или полимер, предпочтительно катионный или поликатионный пептид или белок, который является положительно заряженным в физиологических условиях, прежде всего в физиологических условиях in vivo. «Катионный пептид или белок» может содержать по меньшей мере одну положительно заряженную аминокислоту, или более чем одну положительно заряженную аминокислоту, например, выбранную из Arg, His, Lys или Orn. Следовательно, «поликатионные» соединения также подпадают под указанное определение, если они несут более чем один положительный заряд в указанных условиях. В этом контексте катионный пептид или белок содержит 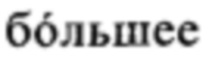 количество катионных аминокислот, например,
количество катионных аминокислот, например, 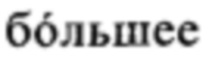 количество Arg, His, Lys или Orn, чем отрицательно заряженных аминокислот. В предпочтительном варианте осуществления изобретения катионный пептид или белок в контексте настоящего изобретения содержит
количество Arg, His, Lys или Orn, чем отрицательно заряженных аминокислот. В предпочтительном варианте осуществления изобретения катионный пептид или белок в контексте настоящего изобретения содержит 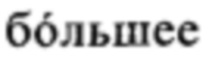 количество катионных аминокислот, например,
количество катионных аминокислот, например, 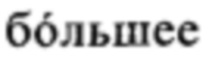 количество Arg, His, Lys или Orn, чем других остатков.
количество Arg, His, Lys или Orn, чем других остатков.
В контексте настоящего изобретения понятие «катионное или поликатионное соединение» предпочтительно относится к соединениям, которые можно применять в качестве трансфектирующих или комплексообразующих агентов, прежде всего, для нуклеиновых кислот, предлагаемых в изобретении.
Катионные или поликатионные соединения, предлагаемые в изобретении, которые являются наиболее предпочтительными агентами в указанном контексте, включают протамин, нуклеолин, спермин или спермидин, или другие катионные пептиды или белки, такие как поли-L-лизин (PLL), полиаргинин, 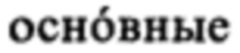 полипептиды, обладающие способностью проникать в клетку пептиды (СРР), такие как ВИЧ-связывающие пептиды, Tat ВИЧ-1 (ВИЧ), выведенные из Tat пептиды, пенетратин, полученные из VP22 пептиды или аналоги, VP22 HSV (вирус герпеса простого), MAP, KALA или домены трансдукции белков (PTD), РрТ620, богатые пролином пептиды, богатые аргинином пептиды, богатые лизином пептиды, MPG-пептид(ы), Рер-1, L-олигомеры, пептид(ы) кальцитонина, выведенные из Antennapedia пептиды (прежде всего, выведенные из Drosophila antennapedia), pAntp, pIsl, FGF, лактоферрин, транспортан, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, выведенные из hCT пептиды, SAP или гистоны. Наиболее предпочтительным является протамин.
полипептиды, обладающие способностью проникать в клетку пептиды (СРР), такие как ВИЧ-связывающие пептиды, Tat ВИЧ-1 (ВИЧ), выведенные из Tat пептиды, пенетратин, полученные из VP22 пептиды или аналоги, VP22 HSV (вирус герпеса простого), MAP, KALA или домены трансдукции белков (PTD), РрТ620, богатые пролином пептиды, богатые аргинином пептиды, богатые лизином пептиды, MPG-пептид(ы), Рер-1, L-олигомеры, пептид(ы) кальцитонина, выведенные из Antennapedia пептиды (прежде всего, выведенные из Drosophila antennapedia), pAntp, pIsl, FGF, лактоферрин, транспортан, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, выведенные из hCT пептиды, SAP или гистоны. Наиболее предпочтительным является протамин.
Кроме того, предпочтительные катионные или поликатионные белки или пептиды, применяемые в качестве трансфектирующего или комплексообразующего агента, можно выбирать из следующих белков или пептидов, которые имеют следующую общую формулу:
(Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x, в которой l+m+n+o+x обозначают 8-15 и l, m, n или o каждый независимо друг от друга могут представлять собой любые числа, выбранные из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по меньшей мере 50% от общего содержания аминокислот в олигопептиде; а Хаа может обозначать любую аминокислоту, выбранную из нативных (т.е. встречающихся в естественных условиях) или не встречающихся в естественных условиях аминокислот за исключением Arg, Lys, His или Orn; и x может обозначать любое число, выбранное из 0, 1, 2, 3 или 4, при условии, что общее содержание Хаа не превышает 50% от общего содержания аминокислот в олигопептиде. В этом контексте наиболее предпочтительными катионными пептидами являются, например, Arg7, Arg8, Arg9, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.д.
Другие предпочтительные катионные или поликатионные соединения, которые можно применять в качестве трансфектирующего или комплексообразующего агента, могут представлять собой катионные полисахариды, например, хитозан, полибрен, катионные полимеры, например, полиэтиленимин (PEI), катионные липиды, например, DOTMA: хлорид [1-(2,3-сиолеилокси)пропил)]-N,N,N-триметиламмония, DMRIE, ди-С14-амидин, DOTIM, SAINT, DC-Chol, BGTC, СТАР, DOPC, DODAP, DOPE: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, DOGS: диоктадециламидоглицилспермин, DIMRI: бромид димиристооксипропилдиметилгидроксиэтиламмония, DOTAP: диолеоилокси-3-(триметиламмонио)пропан, DC-6-14: хлорид O,O-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина, CLIP1: хлорид рац-[(2,3-диоктадецилоксипропил)(2-гидроксиэтил)]диметиламмония, CLIP6: рац-[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац-[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, например, модифицированные полиаминокислоты, такие как полимеры β-аминокислот, или обратимые полиамиды и т.д., модифицированные полиэтилены, такие как PVP (бромид поли(N-этил-4-винилпиридиния)) и т.д. модифицированные акрилаты, такие как pDMAEMA (поли(диметиламиноэтилметилакрилат)) и т.д., модифицированные амидоамины, такие как рАМАМ (поли(амидоамин)) и т.д., модифицированный сложный полибетааминоэфир (РВАЕ), например, с модифицированным диаминовым концом сополимеры 1,4-бутандиолдиакрилата и 5-амино-1-пентанола, и т.д. дендримеры, например, дендримеры полипропиламина или дендримеры на основе рАМАМ, и т.д. полиимин(ы), например, PEI: поли(этиленимин), поли(пропиленимин) и т.д., полиаллиламин, полимеры на основе сахарного каркаса, такие как полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.д. полимеры на основе силанового каркаса, например, сополимеры PMOXA-PDMS и т.д., блок-сополимеры, состоящие из комбинации одного или несколько катионных блоков (например, выбранных из катионного полимера, указанного выше) и одного или нескольких гидрофильных или гидрофобных блоков (например, полиэтиленгликоль); и т.д.
Полимерный носитель: Полимерный носитель, как правило, представляет собой носитель, сформированный из полимера. В контексте настоящего изобретения полимерный носитель, применяемый в качестве трансфектирующего или комплексообразующего агента, может представлять собой полимерный носитель, состоящий из сшитых дисульфидами катионных компонентов. Сшитые дисульфидами катионные компоненты могут быть одинаковыми или отличными друг от друга. Полимерный носитель может содержать также другие компоненты. Наиболее предпочтительно также, чтобы полимерный носитель содержал смеси катионных пептидов, белков или полимеров и необязательно другие компоненты, указанные в настоящем описании, которые сшиты с помощью дисульфидных связей, как указано в настоящем описании.
В этом контексте катионные компоненты, которые в результате сшивания дисульфидами формируют основу полимерного носителя, как правило, выбирают из любых пригодных катионных или поликатионных пептидов, белков или полимеров, которые можно применять для этой цели, прежде всего из любых катионных или поликатионных пептидов, белков или полимеров, которые обладают способностью образовывать комплекс с нуклеиновой кислотой, указанный в настоящем изобретении, и тем самым предпочтительно конденсировать нуклеиновую кислоту. Катионный или поликатионный пептид, белок или полимер предпочтительно представляет собой линейную молекулу, однако можно применять также разветвленные катионные или поликатионные пептиды, белки или полимеры.
Каждый сшитый дисульфидами катионный или поликатионный белок, пептид или полимер полимерного носителя, который можно применять для образования комплекса, например, по меньшей мере с одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере одну нуклеиновую кислоту антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, содержит по меньшей мере одну -SH-группу, наиболее предпочтительно по меньшей мере один цистеиновый остаток или любую другую химическую группу, несущую -SH-группу, которая способна образовывать дисульфидную связь при конденсации по меньшей мере с одним другим катионным или поликатионным белком, пептидом или полимером в качестве катионного компонента полимерного носителя, указанного в настоящем описании.
Как указано выше, полимерный носитель, который можно применять для образования комплекса, например, по меньшей мере с одной РНК, входящей в РНК-вакцину, которая кодирует нуклеиновую кислоту по меньшей мере одного антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, может быть образован из сшитых дисульфидами катионных (или поликатионных) компонентов.
Согласно первой альтернативе, по меньшей мере один катионный (или поликатионный) компонент полимерного носителя, который можно применять в данном контексте, можно выбирать из катионных или поликатионных пептидов или белков. Такие катионные или поликатионные пептиды или белки предпочтительно имеют длину примерно от 3 до 100 аминокислот, предпочтительно длину примерно от 3 до 50 аминокислот, более предпочтительно длину примерно от 3 до 25 аминокислот, например, длину примерно от 3 до 10, от 5 до 15, от 10 до 20 или от 15 до 25 аминокислот. Альтернативно этому или дополнительно такие катионные или поликатионные пептиды или белки могут иметь молекулярную массу от примерно 0,01 до примерно 100 кДа, включая молекулярную массу от примерно 0,5 до примерно 100 кДа, предпочтительно от примерно 10 до примерно 50 кДа, еще более предпочтительно от примерно 10 до примерно 30 к Да.
В конкретном случае, когда катионный компонент полимерного носителя, который можно применять для образования комплекса, например, по меньшей мере с одной РНК, входящей в РНК-вакцину, которая кодирует нуклеиновую кислоту по меньшей мере одного антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, содержит катионный или поликатионный пептид или белок, катионные свойства катионного или поликатионного пептида или белка, или всего полимерного носителя, если полимерный носитель полностью состоит из катионных или поликатионных пептидов или белков, можно определять на основе содержания в них катионных аминокислот. Предпочтительно содержание катионных аминокислот в катионном или поликатионном пептиде или белке, и/или в полимерном носителе составляет по меньшей мере 10%, 20% или 30%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, 60% or 70%, но также предпочтительно по меньшей мере 80%, 90% или даже 95%, 96%, 97%, 98%, 99% или 100%, наиболее предпочтительно по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100%, или может находиться в диапазоне примерно от 10% до 90%, более предпочтительно в диапазон примерно от 15% до 75%, еще более предпочтительно в диапазоне примерно от 20% до 50%, например, составлять 20, 30, 40 или 50%, или находиться в диапазоне, определяемом любыми двумя из вышеуказанных значений, при условии, что содержание всех аминокислот, например, катионных, липофильных, гидрофильных, ароматических и других аминокислот в катионном или поликатионном пептиде или белке, или во всем полимерном носителе, если полимерный носитель полностью состоит из катионных или поликатионных пептидов или белков, составляет 100%.
Предпочтительно такие катионные или поликатионные пептиды или белки полимерного носителя, которые содержат или которые дополнительно модифицированы так, чтобы они содержали по меньшей мере один -SH-фрагмент, выбирают из (но, не ограничиваясь только ими) катионных пептидов или белков, таких как протамин, нуклеолин, спермин или спермидин, олиго- или поли-L-лизин (PLL), 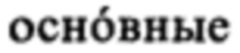 полипептиды, олиго- или поли-аргинин, обладающие способностью проникать в клетку пептиды (СРР), химерные СРР, такие как транспортан, или MPG-пептиды, ВИЧ-связывающие пептиды, Tat, Tat ВИЧ-1 (ВИЧ), выведенные из Tat пептиды, представители семейства пенетратина, например, пенетратин, выведенные из Antennapedia пептиды (прежде всего, выведенные из Drosophila antennapedia), pAntp, pIsl и т.д., выведенные из антимикробных пептидов СРР, например, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, выведенные из hCT пептиды, SAP, MAP, KALA, PpTG20, L-олигомер, FGF, лактоферрин, гистоны, полученные из VP22 пептиды или аналоги, HSV, VP22 (вирус герпеса простого), MAP, KALA или домены трансдукции белков (PTD), РрТ620, богатые пролином пептиды, богатые аргинином пептиды, богатые лизином пептиды, Pep-1, L-олигомеры, пептид(ы) кальцитонина и т.д.
полипептиды, олиго- или поли-аргинин, обладающие способностью проникать в клетку пептиды (СРР), химерные СРР, такие как транспортан, или MPG-пептиды, ВИЧ-связывающие пептиды, Tat, Tat ВИЧ-1 (ВИЧ), выведенные из Tat пептиды, представители семейства пенетратина, например, пенетратин, выведенные из Antennapedia пептиды (прежде всего, выведенные из Drosophila antennapedia), pAntp, pIsl и т.д., выведенные из антимикробных пептидов СРР, например, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, выведенные из hCT пептиды, SAP, MAP, KALA, PpTG20, L-олигомер, FGF, лактоферрин, гистоны, полученные из VP22 пептиды или аналоги, HSV, VP22 (вирус герпеса простого), MAP, KALA или домены трансдукции белков (PTD), РрТ620, богатые пролином пептиды, богатые аргинином пептиды, богатые лизином пептиды, Pep-1, L-олигомеры, пептид(ы) кальцитонина и т.д.
В альтернативном или дополнительном варианте указанные катионные или поликатионные пептиды или белки полимерного носителя, которые содержат или дополнительно модифицированы так, что они содержат по меньшей мере одну -SH-группу, выбирают из ряда, включающего (но, не ограничиваясь только ими) следующие катионные пептиды, которые имеют общую формулу (IV):
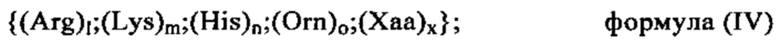
в которой l+m+n+o+x=3-100, и l, m, n или o каждый независимо друг от друга обозначает любое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21-30, 31-40, 41-50, 51-60, 61-70, 71-80, 81-90 и 91-100, при условии, что общее содержание Arg (аргинин), Lys (лизин), His (гистидин) и Orn (орнитин) составляет по меньшей мере 10% от всех аминокислот олигопептида; и Хаа обозначает любую аминокислоту, выбранную из нативных (т.е. встречающихся в естественных условиях) или не встречающихся в естественных условиях аминокислот за исключением Arg, Lys, His или Orn; и x обозначает любое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21-30, 31-40, 41-50, 51-60, 61-70, 71-80, 81-90, при условии, что общее содержание Хаа не превышает 90% от всех аминокислот олигопептида. Любая из аминокислот Arg, Lys, His, Orn и Хаа может находиться в пептиде в любом положении. В этом контексте наиболее предпочтительными являются катионные пептиды или белки, состоящие из 7-30 аминокислот. Еще более предпочтительными пептидами указанной формулы являются олигоаргинины, такие, например, как Arg7, Arg8, Arg9, Arg12; His3Arg9, Arg9His3, His3Arg9His3, His6Arg9His6, His3Arg4His3, His6Arg4His6, TyrSer2Arg9Ser2Tyr, (ArgLysHis)4, Tyr(ArgLysHis)2Arg, и т.д.
Согласно другому наиболее предпочтительному варианту осуществления изобретения катионные или поликатионные пептиды или белки полимерного носителя, когда они описываются формулой {(Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x} (формула (IV)), представленной выше, и которые содержат или дополнительно модифицированы так, что они содержат по меньшей мере одну -SH-группу, можно выбирать из подформулы (IVa) (но, не ограничиваясь только ею):
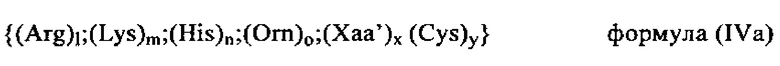 ,
,
в которой (Arg)l;(Lys)m;(His)n;(Orn)o и x имеют значения, указанные в настоящем описании, Хаа' обозначает любую аминокислоту, выбранную из нативных (т.е. встречающихся в естественных условиях) или не встречающихся в естественных условиях аминокислот за исключением Arg, Lys, His, Orn или Cys, и y обозначает любое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21-30, 31-40, 41-50, 51-60, 61-70, 71-80 и 81-90, при условии, что общее содержание Arg (аргинин), Lys (лизин), His (гистидин) и Orn (орнитин) составляет по меньшей мере 10% от всех аминокислот олигопептида.
Этот вариант осуществления изобретения можно применять к ситуациям, когда катионный или поликатионный пептид или белок полимерного носителя, например, подпадающий под эмпирическую формулу
(Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x (формула (IV)), представленную выше, содержит или модифицирован так, что содержит по меньшей мере один остаток цистеина в качестве -SH-группы, указанной выше, в результате чего указанный катионный или поликатионный пептид в качестве катионного компонента несет по меньшей мере один остаток цистеина, который может образовывать дисульфидную связь с другими компонентами полимерного носителя.
Согласно другому наиболее предпочтительному варианту осуществления изобретения катионные или поликатионные пептиды или белки полимерного носителя, когда они описываются формулой {(Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x} (формулы (IV)), представленной выше, можно выбирать из подформулы (Ib) (но, не ограничиваясь только ею):
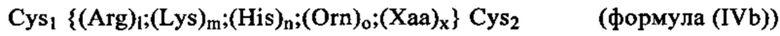 ,
,
в которой эмпирическая формула {(Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x} (формула (IV)) определена в настоящем описании и образует ядро аминокислотной последовательности, соответствующей (полуэмпирической) формуле (IV), и в которой Cys1 и Cys2 представляют собой остатки цистеина, расположенные проксимально или терминально относительно (Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x. Этот вариант осуществления изобретения можно применять к ситуациям, когда катионный или поликатионный пептид или белок полимерного носителя, который можно применять для образования комплекса по меньшей мере с одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере одну нуклеиновую кислоту антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, например, описываемый эмпирической формулой (Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x (формула (IV)), которая представлена выше, модифицирован с помощью по меньшей мере двух остатков цистеина в качестве -SH-групп, как указано выше, в результате чего катионный или поликатионный пептид, который входит в предлагаемый в изобретении полимерный носитель, несет по меньшей мере два остатка (терминальных) цистеина, которые могут образовывать дисульфидную связь с другими компонентами полимерного носителя.
Согласно второму варианту по меньшей мере один катионный (или поликатионный) компонент полимерного носителя можно выбирать, например, из любого (непептидного) катионного или поликатионного полимера, пригодного для указанной цели, при условии, что этот (непептидный) катионный или поликатионный полимер содержит или модифицирован так, что содержит по меньшей мере одну -SH-группу, которая пригодна для образования дисульфидной связи, соединяющей катионный или поликатионный полимер с другим компонентом полимерного носителя, указанного выше. Таким образом, согласно настоящему изобретению полимерный носитель может содержать одинаковые или различные катионные или поликатионные полимеры.
В конкретном варианте, когда катионный компонент полимерного носителя содержит (непептидный) катионный или поликатионный полимер, то катионные свойства (непептидного) катионного или поликатионного полимера можно определять на основе содержания катионных зарядов по сравнению с общим содержанием зарядов компонентов катионного полимера. Предпочтительно содержание катионных зарядов в катионном полимере при (физиологическом) значении pH, указанном в настоящем описании, составляет по меньшей мере 10%, 20% или 30%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, 60% или 70%, но также предпочтительно по меньшей мере 80%, 90% или даже 95%, 96%, 97%, 98%, 99% или 100%, наиболее предпочтительно по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100%, или может находиться в диапазоне примерно от 10% до 90%, более предпочтительно в диапазоне примерно от 30 до 100%, еще более предпочтительно в диапазоне примерно от 50 до 100%, например, 50, 60, 70, 80%, 90% или 100%, или в диапазоне, границами которого являются любые два из указанных выше значений, при условии, что содержание всех зарядов, например, положительных и отрицательных зарядов при (физиологическом) значении pH, указанном в настоящем описании, во всем катионном полимере составляет 100%.
Предпочтительно (непептидный) катионный компонент полимерного носителя представляет собой катионный или поликатионный полимер, как правило, имеющий молекулярную массу примерно от 0,1 или 0,5 кДа до примерно 100 кДа, предпочтительно от примерно 1 до примерно 75 кДа, более предпочтительно от примерно 5 до примерно 50 к Да, еще более предпочтительно от примерно 5 до примерно 30 кДа, или молекулярную массу от примерно 10 до примерно 50 кДа, еще более предпочтительно от примерно 10 до примерно 30 кДа. Кроме того, (непептидный) катионный или поликатионный полимер, как правило, несет по меньшей мере одну -SH-группу, которая может образовывать дисульфидную связь при конденсации либо с любыми другими катионными компонентами, либо с другими компонентами полимерного носителя, указанного в настоящем описании.
В вышеуказанном контексте (непептидный) катионный компонент полимерного носителя, который можно применять для включения в комплекс по меньшей мере одной РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген, или адъювантной нуклеиновой кислоты, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, можно выбирать из группы, включающей акрилаты, модифицированные акрилаты, такие как pDMAEMA (поли(диметиламиноэтилметилакрилат)), хитозаны, азиридины или 2-этил-2-оксазолин (образующий олигоэтиленимины или модифицированные олигоэтиленимины), полимеры, получаемые взаимодействием бисакрилатов с аминами, которые образуют олиго-бета-аминоэфиры или полиамидоамины, или другие полимеры типа сложных полиэфиров, поликарбонатов и т.д. Каждая молекула указанных (непептидных) катионных или поликатионных полимеров, как правило, несет по меньшей мере одну -SH-группу, при этом по меньшей мере одну -SH-группу можно интродуцировать в (непептидный) катионный или поликатионный полимер посредством химических модификаций, например, с использованием иминотиолана, 3-тиопропионовой кислоты, или интродуцировать содержащие -SH-группы аминокислоты, такие как цистеин, или любую другую (модифицированную) аминокислоту. Указанные -SH-группы предпочтительно представляют собой уже описанные выше группы.
Согласно наиболее предпочтительному варианту осуществления изобретения дополнительный компонент, который может входить в состав полимерного носителя или который можно применять для модификации различных (коротких) катионных или поликатионных пептидов или (непептидных) полимеров, которые образуют основу полимерного носителя или биофизических/биохимических свойств полимерного носителя, указанного в настоящем описании, представляет собой аминокислотный компонент (АА). Согласно настоящему изобретению количество аминокислот в аминокислотном компоненте (АА) составляет примерно от 1 до 100, предпочтительно примерно от 1 до 50, более предпочтительно оно выбрано из ряда, включающего 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15-20 аминокислот, или его можно выбирать из диапазона, границами которого являются любые два из вышеуказанных значений. В этом контексте аминокислоты аминокислотного компонента (АА) можно выбирать независимо друг от друга. Например, если в полимерном носителе присутствуют два или большее количество (АА)-компонентов, то они могут быть одинаковыми или отличаться друг от друга.
Аминокислотный компонент (АА) может содержать или может быть фланкирован (например, терминально) содержащим -SH-группу фрагментом, что позволяет интродуцировать этот компонент (АА) посредством образования дисульфидной связи в полимерном носителе, указанном в настоящем описании. В конкретном варианте, в котором содержащий -SH-группу фрагмент представляет собой цистеин, аминокислотный компонент (АА) может тоже представлять собой -Cys-(АК)-Cys-, в котором Cys обозначает цистеин, и он является источником необходимой для образования дисульфидной связи -SH-группы. Содержащий -SH-группу фрагмент можно интродуцировать также в аминокислотный компонент (АА) с помощью любых модификаций или реакций, указанных выше для катионного компонента или любых его компонентов.
Кроме того, аминокислотный компонент (АА) может нести две (или даже большее количество) -SH-групп, например, в форме, описываемой формулой HS-(АК)-SH, что обеспечивает связывание с двумя функциональностями через дисульфидные мостики, например, если аминокислотный компонент (АА) применяют в качестве линкера между двумя дополнительными компонентами (например, в качестве линкера между двумя катионными полимерами).
В альтернативном варианте аминокислотный компонент (АА) может нести другие функциональности, описанные выше для других компонентов полимерного носителя, что позволяет связывать аминокислотный компонент (АА) с любыми компонентами полимерного носителя.
Таким образом, согласно настоящему изобретению аминокислотный компонент (АА) полимерного носителя можно связывать с другими компонентами полимерного носителя, который можно применять для образования комплекса, например, по меньшей мере с одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере одну нуклеиновую кислоту антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, с помощью дисульфидной связи или без нее.
Согласно альтернативному и наиболее предпочтительному варианту аминокислотный компонент (АА) можно применять для модификации полимерного носителя, прежде всего содержания катионных компонентов в полимерном носителе, указанном выше.
В контексте настоящего изобретения аминокислотный компонент (АА) можно выбирать из следующих альтернатив: компонент, представляющий собой ароматическую аминокислоту, компонент, представляющий собой гидрофильную (и предпочтительно незаряженную полярную) аминокислоту, компонент, представляющий собой липофильную аминокислоту или компонент, представляющий собой слабоосновную аминокислоту.
Согласно следующему варианту аминокислотный компонент (АА) может представлять собой сигнальный пептид или сигнальную последовательность, сигнал или последовательность локализации, сигнал или последовательность ядерной локализации (NLS), антитело, обеспечивающий проникновение в клетку пептид (например, ТАТ) и т.д. Кроме того, согласно другому альтернативному варианту аминокислотный компонент (АА) может представлять собой функциональный пептид или белок, который может соответственно модулировать функциональность полимерного носителя. Такие функциональные пептиды или белки в качестве аминокислотного компонента (АК) предпочтительно содержат любые пептиды или белки, указанные в настоящем описании, например, указанные в настоящем описании, в качестве антигенов. Согласно одному из вариантов указанные дополнительные функциональные пептиды или белки могут содержать так называемые пептиды, обладающие способностью проникать в клетку (СРР), или катионные пептиды для транспортирования.
Согласно последнему варианту аминокислотный компонент (АА) может состоять из любых пептидов или белков, которые могут осуществлять любую важную функцию в клетке, или содержать их. Наиболее предпочтительными являются пептиды или белки, выбранные из терапевтически активных белков или пептидов, из антигенов, например, опухолевых антигенов, патогенных антигенов (например, антигены животных, вирусные антигены, антигены простейших, бактериальные антигены), из антител, из иммуностимулирующих белков или пептидов, из антигенспецифических Т-клеточных рецепторов или из любого другого белка или пептида, пригодного для конкретного (терапевтического) применения. Наиболее предпочтительными являются пептидные эпитопы указанного(ых) антигена(ов), кодируемого(ых) по меньшей мере одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор.
Полимерный носитель, который можно применять для образования комплекса по меньшей мере с одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере одну нуклеиновую кислоту антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, может содержать по меньшей мере один из вышеуказанных катионных или поликатионных пептидов, белков или полимеров, или других компонентов, например (АА), при этом любой из вышеуказанных вариантов можно объединять друг с другом, и их можно получать путем полимеризации с помощью реакции конденсирующей полимеризации с участием их -SH-групп.
Кроме того, полимерный носитель можно выбирать из молекул полимерных носителей общей формулы (V):
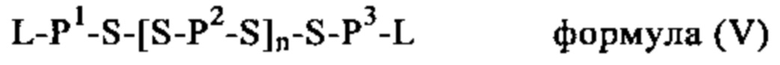
в которой
Р1 и Р3 являются различными или идентичными друг другу и представляют собой линейную или разветвленную гидрофильную полимерную цепь, каждый Р1 и Р3 несет по меньшей мере одну -SH-группу, способную образовывать дисульфидную связь при конденсации с компонентом Р2, или альтернативно этому с (АА), (АА)x или [(AA)x]z, если указанные компоненты используют в качестве линкера между Р1 и Р2 или Р3 и Р2) и/или с другими компонентами (например, (АА), (АА)x, [(AA)x]z или L), линейную или разветвленную гидрофильную полимерную цепь, выбранную независимо друг от друга из полиэтиленгликоля (ПЭГ), поли-N-(2-гидроксипропил)метакриламида, поли-2-(метакрилоилокси)этилфосфорилхолинов, поли(гидроксиалкил-L-аспарагина), поли(2-(метакрилоилокси)этилфосфорилхолина), гидроксиэтилкрахмала или поли(гидроксиалкид-L-глутамина), где гидрофильная полимерная цепь имеет молекулярную массу от примерно 1 до примерно 100 кДа, предпочтительно от примерно 2 до примерно 25 кДа или более предпочтительно от примерно 2 до примерно 10 кДа, например, от примерно 5 до примерно 25 кДа или от 5 до примерно 10 кДа;
Р2 обозначает катионный или поликатионный пептид или белок, например, указанный выше для полимерного носителя, сформированного сшитыми дисульфидами катионными компонентами, и предпочтительно имеющий длину от примерно 3 до примерно 100 аминокислот, более предпочтительно имеющий длину от примерно 3 до примерно 50 аминокислот, еще более предпочтительно имеющий длину от примерно 3 до примерно 25 аминокислот, например, имеющий длину примерно от 3 до 10, от 5 до 15, от 10 до 20 или от 15 до 25 аминокислот, более предпочтительно имеющий длину от примерно 5 до примерно 20 и еще более предпочтительно имеющий длину от примерно 10 до примерно 20 аминокислот; или
обозначает катионный или поликатионный полимер, например, указанный выше для полимерного носителя, сформированного сшитыми дисульфидами катионными компонентами, как правило, имеющий молекулярную массу от примерно 0,5 до примерно 30 к Да, включая молекулярную массу от примерно 1 до примерно 20 кДа, еще более предпочтительно от примерно 1,5 до примерно 10 кДа, или имеющий молекулярную массу от примерно 0,5 до примерно 100 кДа, включая молекулярную массу от примерно 10 до примерно 50 кДа, еще более предпочтительно от примерно 10 до примерно 30 кДа;
каждый Р2 несет по меньшей мере две -SH-группы, способные образовывать дисульфидную связь при конденсации с другими компонентами Р2 или с компонентом(ами) Р1 и/или Р3, или альтернативно этому с другими компонентами (например, (АА), (АА)x или [(AA)x]z);
-S-S- обозначает (обратимую) дисульфидную связь (для удобочитаемости скобки опущены), в которой S предпочтительно представляет собой серу или несущую -SH группу, которая образует (обратимую) дисульфидную связь. (Обратимую) дисульфидную связь предпочтительно получают путем конденсации -SH-групп либо компонентов Р1 и Р2, либо Р2 и Р2, либо Р2 и Р3, либо необязательно других компонентов, указанных в настоящем описании (например, L, (АА), (АА)x, [(AA)x]z и т.д.); -SH-группа может представлять собой часть структуры указанных компонентов или может быть добавлена путем модификации, как указано ниже;
L обозначает необязательный лиганд, который может присутствовать или отсутствовать, и его можно выбирать независимо друг от друга из RGD, трансферрина, фолата, сигнального пептида или сигнальной последовательности, сигнала или последовательности локализации, сигнала или последовательности ядерной локализации (NLS), антитела, проникающего в клетку пептида (например, ТАТ или KALA), лиганда рецептора (например, цитокинов, гормонов, факторов роста и т.д.), малых молекул (например, углеводов типа маннозы или галактозы, или синтетических лигандов), агонистов малых молекул, ингибиторов или антагонистов рецепторов (например, аналогов RGD-пептидомиметиков) или любых других белков, указанных в настоящем описании, и т.д.;
N обозначает целое число, как правило выбранное из диапазона примерно от 1 до 50, предпочтительно из диапазона примерно от 1, 2 или 3 до 30, более предпочтительно из диапазона примерно от 1, 2, 3, 4 или 5 до 25, или диапазона примерно от 1, 2, 3, 4 или 5 до 20, или диапазона примерно от 1, 2, 3, 4 или 5 до 15, или диапазона примерно от 1, 2, 3, 4 или 5 до 10, включая, например, диапазон примерно от 4 до 9, от 4 до 10, от 3 до 20, от 4 до 20, от 5 до 20 или от 10 до 20, или диапазон примерно от 3 до 15, от 4 до 15, от 5 до 15 или от 10 до 15, или диапазон примерно от 6 до 11 или от 7 до 10. Наиболее предпочтительно n находится в диапазоне примерно от 1, 2, 3, 4 или 5 до 10, более предпочтительно в диапазоне примерно от 1, 2, 3 или 4 до 9, в диапазоне примерно от 1, 2, 3 или 4 до 8, или в диапазоне примерно от 1, 2 или 3 до 7.
Каждый из гидрофильных полимеров Р1 и Р3, как правило, несет по меньшей мере одну -SH-группу, где по меньшей мере одна -SH-группа может образовывать дисульфидную связь при взаимодействии с компонентом Р2 или с компонентом (АА) или (АА)x, если его используют в качестве линкера между Р1 и Р2 или Р3 и Р2, как указано ниже, и необязательно с другим компонентом, например, L и/или (АА) или (АА)x, например, если он несет две или большее количество -SH-групп. Следующие подформулы «Р1-S-S-P2» и «Р2-S-S-P3» в представленной выше общей формуле (V) (для большей удобочитаемости скобки опущены), в которой все S, Р1 и Р3 имеют указанные выше значения, как правило, описывают ситуацию, когда одна -SH-группа гидрофильных полимеров Р1 и Р3 сконденсирована с одной -SH-группой компонента Р2 в представленной выше общей формуле (V), где оба атома серы в указанных -SH-группах образуют дисульфидную связь -S-S-, как указано в формуле (V). Указанные -SH-группы, как правило, присутствуют в каждом из гидрофильных полимеров Р1 и Р3, например, присутствуют в локализованном внутри него цистеине или любой другой (модифицированной) аминокислоте или соединении, которая/которое несет -SH-группу. Следовательно, подформулы «Р1-S-S-P2» и «Р2-S-S-P3» можно записать также в виде «Р1-Cys-Cys-P2» и «Р2-Cys-Cys-P3», если -SH-группа присутствует в цистеине, где понятие Cys-Cys обозначает два цистеина, сцепленных дисульфидной связью, но не пептидной связью. В этом случае понятие «-S-S-» в указанных формулах можно записать также в виде «-S-Cys», в виде «-Cys-S» или в виде «-Cys-Cys-». В этом контексте понятие «-Cys-Cys-» описывает не пептидную связь, а сцепление двух цистеинов через их -SH-группы с образованием дисульфидной связи. Таким образом, понятие «-Cys-Cys-» можно записать также в общем виде как «-(Cys-S)-(S-Cys)-», где в рассматриваемом конкретном случае S обозначает атом серы -SH-группы цистеина. Аналогично этому понятия «-S-Cys» и «-Cys-S» обозначают дисульфидную связь между содержащим -SH-группу фрагментом и цистеином, которые можно записать также как «-S-(S-Cys)» и «-(Cys-S)-S». Альтернативно этому гидрофильные полимеры Р1 и Р3 можно модифицировать -SH-группой, предпочтительно посредством химического взаимодействия с соединением, несущим -SH-группу, так, чтобы каждый из гидрофильных полимеров Р1 и Р3 нес по меньшей мере одну -SH-группу. Такое соединение, несущее -SH-группу, может представлять собой, например, (дополнительный) цистеин или любую другую (модифицированную) аминокислоту, которая несет -SH-группу. Такое соединение может представлять собой также отличное от аминокислоты соединение или группу, которое/которая содержит или дает возможность интродуцировать -SH-группу в гидрофильные полимеры Р1 и Р3, представленные в настоящем описании. Такие отличные от аминокислот соединения можно присоединять к гидрофильным полимерам Р1 и Р3 полимерного носителя формулы (VI), предлагаемого в настоящем изобретении, посредством химических взаимодействий или путем связывания с соединениями, например, путем связывания с 3-тиопропионовой кислотой или тиоимоланом, путем образования амида (например, карбоновые кислоты, сульфоновые кислоты, амины и т.д.), путем реакции присоединения по Михаэлю (например, малеимидные группы, α,β-ненасыщенные карбонилы и т.д.), с помощью клик-химии (например, азиды или алкины), с помощью метатезиса алкенов/алкинов (например, алкены или алкины), формирования иминов или гидрозонов (альдегиды или кетоны, гидразины, гидроксиламины, амины), реакций комплексообразования (авидин, биотин, белок G) или с компонентами, которые допускают реакции замещения Sn-типа (например, галогеналканы, тиолы, спирты, амины, гидразины, гидразиды, эфиры сульфоновых кислот, соли оксифосфония) или другими химическими группами, которые можно использовать для присоединения других компонентов. В этом контексте наиболее предпочтительным производным ПЭГ является альфа-метокси-омега-меркапто-поли(этиленгликоль). В каждом случае SH-группа, например, цистеина или любой другой (модифицированной) аминокислоты или соединения, может присутствовать на концах или в любом положении внутри гидрофильных полимеров Р1 и Р3. Как указано в настоящем описании, каждый из гидрофильных полимеров Р1 и Р3, как правило, несет по меньшей мере одну -SH-группу, предпочтительно на одном конце, но может содержать также две или даже большее количество -SH-групп, которые можно использовать для дополнительного присоединения других компонентов, указанных в настоящем описании, предпочтительно других функциональных пептидов или белков, например, лиганда, аминокислотного компонента (АА) или (АА)x, антител, проникающих в клетку пептидов или энхансерных пептидов (например, ТАТ, KALA) и т.д.
В контексте общей формулы (V) предлагаемого в изобретении полимерного носителя предпочтительный носитель может определяться следующей формулой:
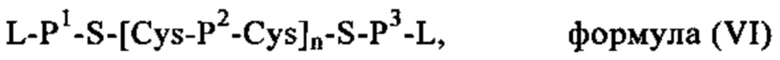
в которой L, Р1, Р2, Р3 и n имеют указанные в настоящем описании значения, S обозначает атом серы и каждый Cys несет одну -SH-группу для образования дисульфидной связи.
Аминокислотный компонент (АА) или (АА)x в полимерном носителе формулы (V или VI), например, как указано выше для полимерного носителя, сформированного сшитыми дисульфидами катионными компонентами, может находиться также в форме смешанного повторяющегося аминокислотного компонента [(AA)x]z, в котором количество аминокислотных компонентов (АА) или (АА)x определяется целым числом z. В этом контексте z может быть выбрано из диапазона примерно от 1 до 30, предпочтительно из диапазона примерно от 1 до 15, более предпочтительно от 1 до 10 или от 1 до 5 и еще более предпочтительно выбрано из чисел 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или может быть выбрано из диапазона, границы которого определяются любыми двумя из указанных выше величин.
В конкретном и наиболее предпочтительном варианте аминокислотный компонент (АА) или (АА)x, который предпочтительно обозначают как S-(AA)x-S или [S-(AA)x-S], можно применять для модификации компонента Р2, прежде всего содержания компонента S-P2-S в повторяющемся компоненте [S-P2-S]n полимерного носителя представленной выше формулы (V). Это можно представить в контексте всего полимерного носителя формулы (VI), например, с помощью следующей формула (VIa):
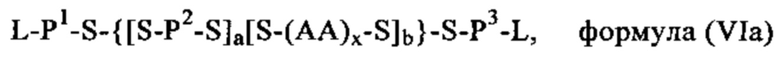
в которой х, S, L, АА, Р1, Р2 и Р3 предпочтительно имеют значения, указанные в настоящем описании. В представленной выше формуле (VIa) любой из индивидуальных компонентов [S-P2-S] и [S-(AA)x-S] может присутствовать в любом порядке в подформуле {[S-P2-S]a[S-(AA)x-S]b}. Количества индивидуальных компонентов [S-P2-S] и [S-(AA)x-S] в подформуле {[S-P2-S]a[S-(AA)x-S]b} определяются целыми числами a и b, где а+b=n. n обозначает целое число и его определяют, как указано выше для формулы (V).
Согласно другому варианту осуществления изобретения полимерный носитель, который можно применять для образования комплекса по меньшей мере с одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере одну нуклеиновую кислоту антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, или его индивидуальные компоненты, например, указанные выше катионные или поликатионные пептиды, белки или полимеры, или другие компоненты, например, (АА), можно дополнительно модифицировать с помощью лиганда, предпочтительно углевода, более предпочтительно сахара, еще более предпочтительно маннозы.
Согласно одному из конкретных вариантов осуществления изобретения весь полимерный носитель можно получать путем полимеризации и конденсации (по меньшей мере одного) из указанных выше катионных или поликатионных пептидов, белков или полимеров, или других компонентов, например, (АА), с помощью их -SH-групп на первой стадии и образования комплекса, например, по меньшей мере одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере одну нуклеиновую кислоту антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, с указанным полимерным носителем на второй стадии. Так, полимерный носитель может содержать определенное количество, т.е. по меньшей мере один или даже несколько одинаковых или различных указанных выше катионных или поликатионных пептидов, белков или полимеров, или других компонентов, например, (АА), где указанное количество предпочтительно находится в указанном выше диапазоне.
Согласно одному из альтернативных конкретных вариантов осуществления изобретения полимерный носитель, который можно применять для образования комплекса, например, по меньшей мере с одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере одну нуклеиновую кислоту антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, получают путем осуществления полимеризации и конденсации по меньшей мере одного из указанных выше катионных или поликатионных пептидов, белков или полимеров, или других компонентов, например, (АА), с помощью их -SH-групп одновременно с образованием комплекса, например, по меньшей мере одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере одну нуклеиновую кислоту антигена или адъюванта в предлагаемой в изобретении комбинации вакцина/ингибитор, с (полученным in situ) полимерным носителем. И в этом случае также полимерный носитель может содержать определенное количество, т.е. по меньшей мере один или даже несколько одинаковых или различных указанных выше катионных или поликатионных пептидов, белков или полимеров, или других компонентов, например, (АА), где указанное количество предпочтительно находится в указанном выше диапазоне.
Отношение N/P: Отношение N/P является мерой ионного заряда катионного (боковая цепь) компонента катионного или поликатионного соединения или полимерного носителя, применяемого в качестве носителя или комплексообразующего агента, указанного в настоящем описании. В частности, если катионные свойства катионного компонента обусловлены атомами азота (например, боковых цепей аминокислот), то величина отношения N/P отражает соотношение между основными атомами азота и остатками фосфата в нуклеотидном каркасе, с учетом того, что атомы азота (боковой цепи) в катионном компоненте катионного или поликатионного соединения или полимерного носителя вносят вклад в положительные заряды, а фосфат фосфатного каркаса нуклеиновой кислоты-полезного груза, например, по меньшей мере одной РНК, кодирующей по меньшей мере один антиген, содержащийся в РНК-вакцине, или адъювантной нуклеиновой кислоте, вносит вклад в отрицательный заряд. Как правило, один фосфат дает один отрицательный заряд, например, один нуклеотид в нуклеиновой кислоте-полезном грузе дает один отрицательный заряд. Указанное отношение можно рассчитывать на основе того, что, например, 1 мкг РНК, как правило, содержит примерно 3 нмоля остатков фосфата, при условии, что для РНК характерно статистическое распределение оснований. Кроме того, 1 нмоль пептида, как правило, содержит примерно x нмолей остатков азота в зависимости от молекулярной массы и количества его (катионных) аминокислот.
Дзета-потенциал: «Дзета-потенциал» представляет собой широко применяемый параметр, характеризующий поверхностный электрический заряд частицы. Его, как правило, определяют путем перемещения заряженной частицы в электрическом поле. В контексте настоящего изобретения дзета-потенциал является предпочтительным параметром для характеризации заряда частицы, например, комплекса, содержащего в качестве носителя или комплексообразующего агента катионное или поликатионное соединение и/или полимерный носитель и в качестве нуклеиновой кислоты-полезного груза по меньшей мере одну РНК, кодирующую по меньшей мере один антиген, входящий в РНК-вакцину, или адъювантную нуклеиновую кислоту. Так, в контексте настоящего изобретения заряд частицы предпочтительно определяют путем измерения дзета-потенциала с помощью метода лазерного доплеровского электрофореза с использованием инструмента Zetasizer Nano (фирма Malvern Instruments, Малверн, Великобритания) при 25°С и угле рассеяния 173°. Поверхностный заряд рассматриваемой частицы зависит также от ионной силы применяемого матрикса (например, содержащего соль буфера) и значения pH раствора. Таким образом, фактический дзета-потенциал рассматриваемого комплекса при определенном отношении зарядов (N/P) может слегка варьироваться в зависимости от буферов, применяемых для инъекции. Для осуществления измерений частицы, такие как комплексы, содержащие в качестве носителя или комплексообразующего агента катионное или поликатионное соединение и/или полимерный носитель и в качестве нуклеиновой кислоты-полезного груза по меньшей мере одну РНК, кодирующую по меньшей мере один антиген, входящий в РНК-вакцину, или адъювантную нуклеиновую кислоту, предлагаемые в изобретении, предпочтительно суспендируют в растворе Рингера лактата. Конкретный вариант осуществления настоящего изобретения относится к применению отрицательно заряженного комплекса в условиях рассматриваемого буфера для инъекции, предпочтительно в условиях лактированного раствора Рингера, у которого оценен его дзета-потенциал. Лактированный раствор Рингера, применяемый в настоящем изобретении, предпочтительно содержит 130 ммолей/л ионов натрия, 109 ммолей/л ионов хлорида, 28 ммолей/л лактата, 4 ммоля/л ионов калия и 1,5 ммоля/л ионов кальция. Натрий, хлор, калий и лактат, как правило, получают из следующих источников: NaCl (хлорид натрия), NaC3H5O3 (лактат натрия), CaCl2 (хлорид кальция) и KCl (хлорид калия). Осмолярность лактированного раствора Рингера составляет 273 мосмолей/л и значение pH доводят до 6,5.
Иммуностимулирующая композиция: В контексте изобретения под иммуностимулирующей композицией следует, как правило, понимать композицию, содержащую по меньшей мере один компонент, обладающий способностью индуцировать иммунный ответ, или из которого можно выводить компонент, обладающий способностью индуцировать иммунный ответ. Такой иммунный ответ может представлять собой предпочтительно врожденный иммунный ответ или комбинацию адаптивного и врожденного иммунного ответа. Предпочтительно иммуностимулирующая композиция в контексте изобретения содержит по меньшей мере одну молекулу иммуностимулирующей/адъювантной нуклеиновой кислоты, более предпочтительно РНК, например, молекулу мРНК. Иммуностимулирующий компонент, такой как мРНК, может быть включен в комплекс с пригодным носителем. Таким образом, иммуностимулирующая композиция может содержать комплекс мРНК/носитель. Кроме того, иммуностимулирующая композиция может содержать адъювант и/или пригодный носитель для иммуностимулирующего компонента, такого как мРНК.
Адъювантная нуклеиновая кислота: В контексте настоящего описания адъювантную нуклеиновую кислоту предпочтительно выбирают из нуклеиновых кислот, в отношении которых известно, что они связываются с рецепторами TLR. Такая адъювантная нуклеиновая кислота может находиться в форме (иммуностимулирующей(их)) несущей CpG-мотив нуклеиновой кислоты (CpG-нуклеиновая кислота), прежде всего CpG-РНК или CpG-ДНК, которая предпочтительно индуцирует врожденный иммунный ответ. Применяемая согласно изобретению CpG-РНК или CpG-ДНК может представлять собой одноцепочечную CpG-ДНК (ss CpG-ДНК), двухцепочечную CpG-ДНК (dsДНК), одноцепочечную CpG-PHK (ss CpG-РНК) или двухцепочечную CpG-РНК (ds CpG-РНК). CpG-нуклеиновая кислота, применяемая согласно изобретению, предпочтительно находится в форме CpG-РНК, более предпочтительно в форме одноцепочечной CpG-РНК (ss CpG-РНК). Предпочтительно также указанные CpG-нуклеиновые кислоты имеют указанную выше длину. Предпочтительно CpG-мотивы являются неметилированными. Кроме того, адъювантная нуклеиновая кислота, применяемая согласно настоящему изобретению, может представлять собой иммуностимулирующую РНК (isРНК), которая предпочтительно вызывает врожденный иммунный ответ.
Предпочтительно, адъювантная нуклеиновая кислота, предпочтительно иммуностимулирующая РНК (isРНК), применяемая согласно настоящему изобретению, может содержать любую нуклеотидную последовательность, в отношении которой известно, что она является иммуностимулирующей, включая, например, нуклеотидные последовательности, представляющие собой и/или кодирующие лиганды TLR, предпочтительно выбранные из представителей семейства человеческих TLR1-TLR10 или представителей семейства мышиных TLR1-TLR13, более предпочтительно выбранные из представителей семейства (человеческих) TLR1-TLR10, еще более предпочтительно из TLR7 и TLR8, лигандов внутриклеточных рецепторов РНК (таких как RIG-I или MDA-5, и т.д.) (см., например, Meylan, Е., Tschopp, J., Toll-like receptors и RNA helicases: two parallel ways to trigger antiviral responces. Mol. Cell 22, 2006, cc. 561-569), или любых других иммуностимулирующих последовательностей РНК. Такая адъювантная нуклеиновая кислота может содержать от 1000 до 5000, от 500 до 5000, от 5 до 5000 или от 5 до 1000, от 5 до 500, от 5 до 250, от 5 до 100, от 5 до 50 или от 5 до 30 нуклеотидов.
Согласно наиболее предпочтительному варианту осуществления изобретения последовательность адъювантной нуклеиновой кислоты, прежде всего isРНК, применяемой согласно настоящему изобретению, может состоять из нуклеиновой кислоты формулы (VII) или (VIII) или содержать ее:
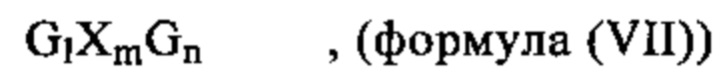
в которой:
G обозначает гуанозин, урацил или аналог гуанозина или урацила;
X обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог указанных выше нуклеотидов;
l обозначает целое число от 1 до 40,
где
когда l=1, G обозначает гуанозин или его аналог,
когда l>1, то по меньшей мере 50% нуклеотидов представляют собой гуанозин или его аналог;
m обозначает целое число и составляет по меньшей мере 3;
где
когда m=3, то X обозначает урацил или его аналог,
когда m>3, то встречаются по меньшей мере 3 последовательно расположенных урацила или аналога урацила;
n обозначает целое число от 1 до 40,
где
когда n=1, то G обозначает гуанозин или его аналог,
когда n>1, то по меньшей мере 50% нуклеотидов представляют собой гуанозин или его аналог.
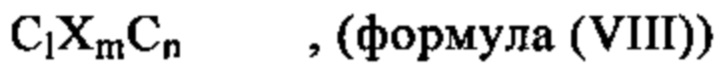
в которой:
С обозначает цитозин, урацил или аналог цитозина или урацила;
X обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог указанных выше нуклеотидов;
l обозначает целое число от 1 до 40, где
когда l=1, то С обозначает цитозин или его аналог,
когда l>1, то по меньшей мере 50% нуклеотидов представляют собой цитозин или его аналог;
m обозначает целое число и составляет по меньшей мере 3;
где
когда m=3, то X обозначает урацил или его аналог,
когда m>3, то встречаются по меньшей мере 3 последовательно расположенных урацила или аналога урацила;
n обозначает целое число от 1 до 40,
где
когда n=1, то С обозначает цитозин или его аналог,
когда n>1, то по меньшей мере 50% нуклеотидов представляют собой цитозин или его аналог.
Нуклеиновые кислоты формулы (VII) или (VIII), которые можно применять в качестве адъювантной нуклеотидной последовательности, прежде всего isРНК, могут представлять собой относительно короткие молекулы нуклеиновых кислот, состоящие, как правило, примерно из 5-100 (но в конкретных вариантах осуществления изобретения они могут состоять более чем из 100 нуклеотидов, например, вплоть до 200 нуклеотидов), из 5-90 или из 5-80 нуклеотидов, предпочтительно могут иметь длину примерно от 5 до 70, более предпочтительно длину примерно от 8 до 60 и более предпочтительно длину примерно от 15 до 60 нуклеотидов, более предпочтительно от 20 до 60, наиболее предпочтительно от 30 до 60 нуклеотидов. Если нуклеиновая кислота формулы (VII) или (VIII) имеет максимальную длину, например, 100 нуклеотидов, то m, как правило, ≤98. Количество нуклеотидов G в нуклеиновой кислоте формулы (I) определяется величиной l или n. Символ l и n каждый независимо друг от друга обозначает целое число от 1 до 40, при этом, когда l или n=1, то G обозначает гуанозин или его аналог, и когда l или n>1, то по меньшей мере 50% нуклеотидов представляют собой гуанозин или его аналог. Например (но, не ограничиваясь только указанным), когда 1 или n=4, то G1 или Gn может обозначать, например, GUGU, GGUU, UGUG, UUGG, GUUG, GGGU, GGUG, GUGG, UGGG or GGGG и т.д.; когда l или n=5, то G1 или Gn может обозначать, например, GGGUU, GGUGU, GUGGU, UGGGU, UGGUG, UGUGG, UUGGG, GUGUG, GGGGU, GGGUG, GGUGG, GUGGG, UGGGG или GGGGG и т.д. Нуклеотид, примыкающий к Xm в нуклеиновой кислоте формулы (VII), согласно изобретению предпочтительно не представляет собой урацил. Аналогично этому, количество нуклеотидов С в нуклеиновой кислоте формулы (VIII) согласно изобретению определяется величиной l или n. Символ l и n каждый независимо друг от друга обозначает целое число от 1 до 40, при этом, когда l или n=1, то С обозначает цитозин или его аналог, и когда l или n>1, то по меньшей мере 50% нуклеотидов представляют собой цитозин или его аналог. Например (но, не ограничиваясь только указанным), когда l или n=4, то С1 или Cn может обозначать, например, CUCU, CCUU, UCUC, UUCC, CUUC, CCCU, CCUC, CUCC, UCCC или СССС и т.д.; когда l или n=5, то C1 или Cn может обозначать, например, CCCUU, CCUCU, CUCCU, UCCCU, UCCUC, UCUCC, UUCCC, CUCUC, CCCCU, CCCUC, CCUCC, CUCCC, UCCCC или ССССС и т.д. Нуклеотид, примыкающий к Xm в нуклеиновой кислоте формулы (VIII), согласно изобретению предпочтительно не представляет собой урацил. Предпочтительно в формуле (VII), когда l или n>1, то по меньшей мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов представляют собой гуанозин или его аналог, как указано выше. Остальные нуклеотиды, необходимые до достижения 100% (когда на долю составляющих, представляющий собой гуанозин, приходится менее 100% от всех нуклеотидов), во фланкирующих последовательностях G1 и/или Gn представляют собой урацил или его аналог, как указано выше. Предпочтительно также l и n каждый независимо друг от друга обозначает целое число от 2 до 30, более предпочтительно целое число от 2 до 20 и еще более предпочтительно целое число от 2 до 15. Нижний предел l или n при необходимости можно варьировать, и он представляет собой по меньшей мере 1, предпочтительно по меньшей мере 2, более предпочтительно по меньшей мере 3, 4, 5, 6, 7, 8, 9 или 10. Вышесказанное применимо соответствующим образом и к формуле (VIII).
Согласно другому наиболее предпочтительному варианту осуществления изобретения адъювантные нуклеотидные последовательности, прежде всего isРНК, применяемые согласно настоящему изобретению, могут представлять собой или содержать нуклеиновую кислоту формулы (IX) или (X):
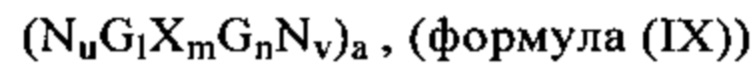 ,
,
в которой:
G обозначает гуанозин (гуанин), уридин (урацил) или аналог гуанозина (гуанин) или уридина (урацил), предпочтительно гуанозин (гуанин) или его аналог;
X обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналог указанных нуклеотидов (нуклеозиды), предпочтительно уридин (урацил) или его аналог;
N обозначает нуклеотидную последовательность, состоящую примерно из 4-50, предпочтительно примерно из 4-40, более предпочтительно примерно из 4-30 или 4-20 нуклеиновых кислот, при этом каждый N независимо друг от друга выбран из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или аналога этих нуклеотидов (нуклеозидов);
а обозначат целое число от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно от 1 до 10;
l обозначает целое число от 1 до 40,
где
когда l=1, то G обозначает гуанозин (гуанин) или его аналог,
когда l>1, то по меньшей мере 50% указанных нуклеотидов (нуклеозидов) представляют собой гуанозин (гуанин) или его аналог;
m обозначает целое число и обозначает по меньшей мере 3;
где
когда m=3, то X обозначает уридин (урацил) или его аналог, и
когда m>3, то присутствуют по меньшей мере 3 последовательно неположенных уридина (урацила) или аналогов уридина (урацила);
n обозначает целое число от 1 до 40,
где когда n=1, то G обозначает гуанозин (гуанин) или его аналог,
когда n>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) представляют собой гуанозин (гуанин) или его аналог;
u, v могут независимо друг от друга обозначать целое число от 0 до 50,
предпочтительно при этом, когда u=0, то v≥1 или
когда v=0, то u≥1;
при этом молекула нуклеиновой кислоты формулы (IV) состоит по меньшей мере из 50 нуклеотидов, предпочтительно по меньшей мере 100 нуклеотидов, более предпочтительно по меньшей мере 150 нуклеотидов, еще более предпочтительно по меньшей мере 200 нуклеотидов и наиболее предпочтительно по меньшей мере 250 нуклеотидов;
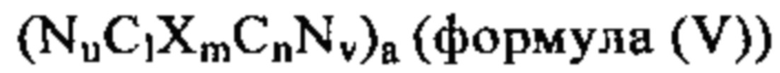 ,
,
в которой:
С обозначает цитидин (цитозин), уридин (урацил) или аналог цитидина (цитозина) или уридина (урацила), предпочтительно цитидин (цитозин) или его аналог;
X обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналог вышеуказанных нуклеотидов (нуклеозидов), предпочтительно уридин (урацил) или его аналог;
N обозначает нуклеотидную последовательность, состоящую примерно из 4-50, предпочтительно примерно из 4-40, более предпочтительно примерно из 4-30 или 4-20 нуклеиновых кислот, при этом N каждый независимо друг от друга выбран из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или аналога указанных нуклеотидов (нуклеозидов);
А обозначает целое число от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно o 1 до 10;
l обозначает целое число от 1 до 40,
где
когда l=1, то С обозначает цитидин (цитозин) или его аналог,
когда l>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) представляют собой цитидин (цитозин) или его аналог;
m обозначает целое число и обозначает по меньшей мере 3;
где
когда m=3, то X обозначает уридин (урацил) или его аналог,
когда m>3, то присутствуют по меньшей мере 3 последовательно расположенных уридина (урацила) или аналогов уридина (урацила);
n обозначает целое число от 1 до 40,
где
когда n=1, то С обозначает цитидин (цитозин) или его аналог,
когда n>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) представляют собой цитидин (цитозин) или его аналог;
u, v могут независимо друг от друга обозначать целое число от 0 до 50,
предпочтительно при этом, когда u=0, то v≥1 или
когда v=0, то u≥1;
при этом молекула нуклеиновой кислоты формулы (V) состоит по меньшей мере из 50 нуклеотидов, предпочтительно по меньшей мере 100 нуклеотидов, более предпочтительно по меньшей мере 150 нуклеотидов, еще более предпочтительно по меньшей мере 200 нуклеотидов и наиболее предпочтительно по меньшей мере 250 нуклеотидов.
В формулах (VII) и (VIII) любое из определений, указанных выше для элементов N (т.е. Nu и Nv) и X(Xm), прежде всего указанная выше коровая структура, а также для целых чисел a, l, m, n, u и v, применимо также к элементам формулы (IX) и (X) соответственно. Определение пограничных элементов Nu и Nv в формуле (X) идентично определениям, указанным выше для Nu и Nv в формуле (IX).
Иммуностимулирующая РНК: Иммуностимулирующая РНК (isРНК) в контексте изобретения, как правило, может представлять собой РНК, которая обладает способностью индуцировать врожденный иммунный ответ. Обычно она не имеет открытой рамки считывания и, таким образом, не кодирует пептид-антиген или иммуноген, но вызывает врожденный иммунный ответ, например, посредством связывания со специфическим типом Толл-подобного рецептора (TLR) или другими пригодными рецепторами. Однако, естественно, также и мРНК, имеющие открытую рамку считывания и кодирующие пептид/белок, могут индуцировать врожденный иммунный ответ и, следовательно, могут являться иммуностимулирующими РНК. Предпочтительно иммуностимулирующая РНК может представлять собой одноцепочечную, двухцепочечную или частично двухцепочечную РНК, более предпочтительно одноцепочечную РНК и/или кольцевую или линейную РНК, более предпочтительно линейную РНК. Более предпочтительно иммуностимулирующая РНК может представлять собой (линейную) одноцепочечную РНК. Еще более предпочтительно иммуностимулирующая РНК может представлять собой (длинную) (линейную) одноцепочечную некодирующую РНК. В этом контексте наиболее предпочтительным является, если isРНК несет трифосфат на своем 5'-конце, как в случае транскрибируемой in vitro РНК. Иммуностимулирующая РНК может также иметь форму короткого РНК-олигонуклеотида, указанного в настоящем описании. Иммуностимулирующую РНК, применяемую согласно настоящему изобретению, можно выбирать также из любого класса молекул РНК, встречающихся в естественных условиях или полученных путем синтеза, которые могут индуцировать врожденный иммунный ответ и могут поддерживать адаптивный иммунный ответ, индуцируемый антигеном. Кроме того, (классы) иммуностимулирующие молекулы РНК, применяемые в качестве дополнительного соединения в предлагаемой в изобретении комбинации вакцина/ингибитор, могут включать любую другую РНК, обладающую способностью вызывать врожденный иммунный ответ. Например, к таким иммуностимулирующим РНК могут относиться рибосомальная РНК (рРНК), транспортная РНК (тРНК), матричная РНК (мРНК) и вирусная РНК (вРНК). Такая иммуностимулирующая РНК может содержать от 1000 до 5000, от 500 до 5000, от 5 до 5000 или от 5 до 1000, от 5 до 500, от 5 до 250, от 5 до 100, от 5 до 50 или от 5 до 30 нуклеотидов.
siРНК: Малая интерферирующая РНК (siРНК) siРНК представляет наибольший интерес в связи с явлением РНК-интерференции. Метод in vitro РНК-интерференции (РНКi) основан на двухцепочечных молекулах РНК (dsРНК), которые «запускают» специфическую для последовательности супрессию генной экспрессии (Zamore, Nat. Struct. Biol. 9, 2001, сс. 746-750; Sharp, Genes Dev. 5, 2001. cc. 485-490: Hannon, Nature 41, 2002, cc. 244-251). При трансфекции клеток млекопитающих длинной dsРНК активация протеинкиназы R и RНКазыL приводит к неспецифическим воздействиям, таким, например, как интерфероновый ответ (Stark и др., Annu. Rev. Biochem. 67, 1998, сс. 227-264; He и Katze, Viral Immunol. 15, 2002, сс. 95-119). Эти неспецифические явления не происходят, когда используют более короткую, например, 21-23-мерную так называемую siРНК (малая интерферирующая РНК), поскольку неспецифические явления не «запускаются» siРНК, которая состоит менее чем из 30 пар оснований (Elbashir и др., Nature 411, 2001, сс. 494-498).
Таким образом, в контексте настоящего изобретения siРНК, направленные против PD-1, PD-L1 или PD-L2, могут представлять собой двухцепочечные РНК (dsРНК), состоящие из 17-29, предпочтительно из 19-25 нуклеотидов и предпочтительно по меньшей мере 90%, более предпочтительно 95% и наиболее предпочтительно 100% (нуклеотидов dsРНК) комплементарны сегменту встречающейся в естественных условиях последовательности мРНК, кодирующей PD-1, PD-L1 или PD-L2, либо кодирующего, либо некодирующего сегмента, предпочтительно кодирующего сегмента. Указанный сегмент встречающейся в естественных условиях последовательности мРНК можно обозначать как «последовательность-мишень», и он может представлять собой любой сегмент встречающейся в естественных условиях мРНК, кодирующей PD-1, PD-L1 или PD-L2. Фраза «комплементарна на 90%» означает, что при длине dsРНК, указанной в настоящем описании, например, составляющей 20 нуклеотидов, dsРНК содержит не более 2 нуклеотидов, не являющихся комплементарными соответствующему сегменту последовательности-мишени. Однако последовательность двухцепочечной РНК, которую применяют согласно изобретению, предпочтительно полностью комплементарна по своей общей структуре сегменту последовательности-мишени. В этом контексте молекула нуклеиновой кислоты, указанная в настоящем описании, которая входит в комплекс, может представлять собой dsРНК, имеющую общую структуру 5'-(N17-29)-3', предпочтительно имеющую общую структуру 5'-(N19-25)-3', более предпочтительно имеющую общую структуру 5'-(N19-24)-3' или еще более предпочтительно имеющую общую структуру 5'-(N21-23)-3', где в каждой общей структуре каждый N обозначает (предпочтительно различный) нуклеотид сегмента последовательности-мишени, предпочтительно выбранный из непрерывно следующих друг за другом 17-29 нуклеотидов сегмента последовательности-мишени, и присутствует в общей структуре 5'-(N17-29)-3' в присущем ему в естественных условиях порядке. В принципе, все сегменты длиной 17-29, предпочтительно 19-25 пар оснований, которые присутствуют в последовательности-мишени, можно применять для получения dsРНК, указанной в настоящем описании. Аналогично этому, dsРНК, применяемые в качестве siRNA, могут также быть направлены против последовательностей мРНК, которые не находятся в кодирующей области, в частности в 5'-некодирующей области последовательности-мишени, так, например, они могут быть направлены против некодирующих областей последовательности-мишени, которая обладает регуляторной функцией. Таким образом, последовательность-мишень dsРНК, применяемой в качестве siRNA, может находиться в транслируемой и нетранслируемой области последовательности-мишени и/или в области контролирующих элементов последовательности мРНК. Последовательность-мишень для dsРНК, применяемой в качестве siRNA, направленной против PD-1, PD-L1 или PD-L2, может находиться также в перекрывающейся области нетранслируемой и транслируемой последовательности; в частности, последовательность-мишень может нести по меньшей мере один нуклеотид, расположенный против хода транскрипции относительно стартового триплета кодирующей области последовательности мРНК.
Открытая рамка считывания: Открытая рамка считывания (ОРС) в контексте изобретения, как правило, может представлять собой состоящую из нескольких нуклеотидных триплетов последовательность, которая может транслироваться в пептид или белок. Открытая рамка считывания предпочтительно содержит на своем 5'-конце стартовый кодон, т.е. комбинацию трех последовательно расположенных нуклеотидов, кодирующих, как правило, аминокислоту метионин (ATG или AUG), и следующую за ним область, длина которой, как правило, кратна 3 нуклеотидам. ОРС предпочтительно оканчивается стоп-кодоном (например, ТАА, TAG, TGA). Как правило, в открытой рамке считывания имеется только один стоп-кодон. Таким образом, открытая рамка считывания в контексте настоящего изобретения предпочтительно представляет собой нуклеотидную последовательность, состоящую из кратного трем количества нуклеотидов, которая начинается стартовым кодоном (например, ATG или AUG), и которая предпочтительно заканчивается стоп-кодоном (например, ТАА, TGA или TAG, или UAA, UAG, UGA соответственно). Открытая рамка считывания может быть выделена или она может быть встроена в более длинную нуклеотидную последовательность, например, в вектор или мРНК. Открытую рамку считывания можно называть также «кодирующей белок областью» или «кодирующей областью».
Последовательность IRES (внутренний сайт связывания (посадки) рибосом): IRES может функционировать в качестве единственного сайта связывания рибосом, но он может служить также для получения би- или даже мультицистронных РНК, как указано в настоящем описании, кодирующих несколько белков или пептидов, которые должны транслироваться рибосомами независимо друг от друга. Примерами последовательностей IRES, которые можно применять согласно изобретению, являются соответствующие последовательности из пикорнавирусов (например, FMDV), пестивирусов (CFFV), полиовирусов (PV), вирусов энцефаломиокардита (ECMV), вирусов ящура (FMDV), вирусов гепатита С (HCV), вирусов классической лихорадки свиней (CSFV), вируса мышиного лейкоза (MLV), вирусов обезьяньего иммунодефицита (SIV) или вирусов паралича сверчка (CrPV).
Фрагмент или часть (белка/пептида) антигена: Под фрагментами или частями (белка/пептида) антигена в контексте настоящего изобретения, как правило, понимают пептиды, соответствующие непрерывной части аминокислотной последовательности (белка/пептида) антигена, предпочтительно имеющие длину от примерно 6 до примерно 20 или даже более аминокислот, например, части, процессированные и презентируемые молекулами ГКГС класса I, предпочтительно имеющие длину от примерно 8 до примерно 10 аминокислот, например, 8, 9 или 10 (или даже 11 или 12 аминокислот), или фрагменты, процессированные и презентируемые молекулами ГКГС класса II, предпочтительно имеющие длину примерно 13 или более аминокислот, например, 13, 14, 15, 16, 17, 18, 19, 20 или даже более аминокислот, при этом указанные фрагменты могут быть выбраны из любой части аминокислотной последовательности. Указанные фрагменты, как правило, распознаются Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекулы ГКГС, т.е. фрагменты, как правило, не распознаются в их нативной форме. Фрагменты или части (белка/пептида) антигенов, как указано в настоящем описании, могут содержать также эпитопы или функциональные сайты указанных (белков/пептидов) антигенов. Предпочтительно фрагменты или части (белка/пептида) антигена в контексте изобретения представляют собой или содержат эпитопы, или обладают антигенными характеристиками, вызывая адаптивной иммунный ответ. Таким образом, фрагменты (белков/пептидов) антигенов могут содержать по меньшей мере один эпитоп указанных (белков/пептидов) антигенов. Кроме того, следует понимать, что также и домены (белка/пептида) антигена, типа внеклеточного домена, внутриклеточного домена или трансмембранного домена, и укороченные или усеченные версии (белка/пептида) антигена могут содержать фрагмент (белка/пептида) антигена.
Варианты белков: Как следует из контекста настоящего изобретения, можно создавать «варианты» белков или пептидов, имеющие аминокислотную последовательность, которая отличается от исходной последовательности наличием одной или большего количества мутации(й), например, замен, инсерций и/или делеций одной или большего количества аминокислот. Предпочтительно указанные варианты обладают той же самой биологической функцией или специфической активностью, что и полноразмерный нативный белок, например, присущей ему специфической антигенной характеристикой. Как следует из контекста настоящего изобретения, «варианты» белков или пептидов, могут содержать консервативную(ые) аминокислотную(ые) замену(ы) по сравнению с их нативной, т.е. не подвергнутой мутации физиологической последовательностью. Такие аминокислотные последовательности, а также, в частности, кодирующие их нуклеотидные последовательности, подпадают под указанное в настоящем описании понятие «варианты». Замены, при которых заменяют друг на друга аминокислоты, относящиеся к одному и тому же классу, называют консервативными заменами. В частности, такими классами являются аминокислоты, имеющие алифатические боковые цепи, положительно или отрицательно заряженные боковые цепи, ароматические группы в боковых цепях, или аминокислоты, боковые цепи которых могут входить в водородные мостики, например, боковые цепи которых несут гидроксильную функцию. Это означает, например, что аминокислоту, имеющую полярную боковую цепь, заменяют на другую аминокислоту, также имеющую полярную боковую цепь, или, например, аминокислоту, характеризующуюся гидрофобной боковой цепью, заменяют на другую аминокислоту, также имеющую гидрофобную боковую цепь (например, серин (треонин) на треонин (серин) или лейцин (изолейцин) на изолейцин (лейцин)). Можно осуществлять инсерций и замены, прежде всего, в тех положениях в последовательности, которые не приводят к модификации трехмерной структуры или не влияют на связывающую область. Модификации в трехмерной структуре, обусловленные инсерцией(ями) или делецией(ями) можно легко определять, например, с использованием CD-спектров (спектры кругового дихроизма) (Urry, Absorption, Circular Dichroism и ORD of Polypeptides, в: Modern Physical Methods in Biochemistry, под ред. Neuberger и др., изд-во Elsevier, Amsterdam, 1985).
Кроме того, варианты белков или пептидов, как указано в настоящем описании, которые могут кодироваться молекулой нуклеиновой кислоты, могут содержать также такие последовательности, в которых нуклеотиды нуклеиновой кислоты обменены в соответствии с вырожденностью генетического кода, что не приводит к изменению соответствующей аминокислотной последовательности белка или пептида, т.е. аминокислотная последовательность или по меньшей мере ее часть могут не отличаться от исходной последовательности одной мутацией или большим количеством мутаций в указанном выше смысле.
Для определения процента идентичности двух последовательностей, например, нуклеотидных последовательностей или аминокислотных последовательностей, указанных в настоящем описании, предпочтительно аминокислотных последовательностей, кодируемых молекулой нуклеиновой кислоты, которая входит в полимерный носитель как указано в настоящем описании, или самих аминокислотных последовательностей, последовательности можно выравнивать для последующего сравнения друг с другом. Так, например, положение в первой последовательности можно сравнивать с соответствующим положением во второй последовательности. Если положение в первой последовательности занято тем же компонентом (остатком), который находится в этом положении во второй последовательности, то две последовательности являются идентичными в этом положении. Если это не имеет места, то последовательности различаются в этом положении. Если во второй последовательности присутствуют инсерций по сравнению с первой последовательностью, то можно встраивать бреши в первую последовательность, что позволяет продолжать осуществление сравнительного анализа. Если во второй последовательности имеются делеций по сравнению с первой последовательностью, то можно встраивать бреши во вторую последовательность, что позволяет продолжать осуществление сравнительного анализа. Таким образом, процент идентичности двух последовательностей является функцией количества идентичных положений, деленной на общее количество положений, включая те положения, которые заняты только в одной последовательности. Процент идентичности двух последовательностей можно определять с помощью математического алгоритма. Предпочтительным примером математического алгоритма, который можно применять, является (но, не ограничиваясь только им) алгоритм, предложенный Karlin и др., PNAS USA, 90, 1993, сс. 5873-5877 или Altschul и др., Nucleic Acids Res., 25, 1997, сс. 3389-3402. Указанный алгоритм входит в программу BLAST. С помощью этой программы можно идентифицировать последовательности, обладающие конкретной степенью идентичности с последовательностями, предлагаемыми в настоящем изобретении. «Вариант» белка или пептида может обладать аминокислотной идентичностью, составляющей по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%, по длине состоящего из 10, 20, 30, 50, 75 или 100 аминокислот сегмента указанного белка или пептида, предпочтительно по всей длине последовательности, из которой выведен рассматриваемый вариант. Аналогично этому «вариант» нуклеотидной последовательности может обладать нуклеотидной идентичностью, составляющей по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%, по длине состоящего из 10, 20, 30, 50, 75 или 100 нуклеотидов сегмента указанной нуклеотидной последовательности, предпочтительно по всей длине последовательности, из которой выведен рассматриваемый вариант.
Производное белка или пептида: Под производным пептида или белка, как правило, понимают молекулу, которая выведена из другой молекулы, такой как указанный пептид или белок. Под понятие «производное» пептида или белка подпадают также слияния, содержащие пептид или белок, применяемые согласно настоящему изобретению. Например, слияние содержит метку, такую, например, как эпитоп, например, эпитоп FLAG или эпитоп V5. Например, эпитоп представляет собой эпитоп FLAG. Такую метку используют, например, для очистки слитого белка.
Фармацевтически эффективное количество: Под фармацевтически эффективном количестве в контексте изобретения, как правило, понимают количество, достаточное для того, чтобы индуцировать фармацевтическое действие, такое как иммунный ответ, изменить патологический уровень экспрессируемого пептида или белка, или заменить недостающий генный продукт, например, в случае наличия патологической ситуации.
Носитель: Под носителем, как правило, понимают материал, который пригоден для хранения, транспортировки и/или введения соединения, такого как фармацевтически активное соединение. Например, он может представлять собой физиологически приемлемую жидкость, которая пригодна для хранения, транспортировки и/или введения фармацевтически активного соединения.
PD-1-путь: Представителями PD-1-пути являются все белки, которые ассоциированы с передачей сигнала PD-1. С одной стороны, они могут представлять собой белки, которые индуцируют передачу сигнала PD-1 в обратном направлении относительно PD-1, как, например, лиганды PD-1 PD-L1 и PD-L2 и рецептор трансдукции сигнала PD-1. С другой стороны они могут представлять собой белки трансдукции сигнала в прямом направлении относительно рецептора PD-1. Наиболее предпочтительными представителями PD-1-пути в контексте настоящего изобретения являются PD-1, PD-L1 и PD-L2.
Ингибитор PD-1-пути: В контексте настоящего изобретения ингибитор PD-1-пути предпочтительно определяют как соединение, обладающее способностью нарушать путь передачи сигнала PD-1, предпочтительно передачу сигнала, опосредуемую рецептором PD-1. Таким образом, ингибитор PD-1-пути может представлять собой любой ингибитор, направленный против любого представителя PD-1-пути, который способен оказывать антагонистическое действие на путь передачи сигнала PD-1. В этом контексте ингибитор может представлять собой антагонистическое антитело, указанное в настоящем описании, мишенью которого является любой представительно PD-1-пути, предпочтительно направленное против рецептора PD-1 PD-L1 или PD-L2. Это антагонистическое антитело может также кодироваться нуклеиновой кислотой. Такие кодируемые антитела обозначают согласно настоящему изобретению также как «интрабоди». Ингибитор PD-1-пути может представлять собой также фрагмент рецептора PD-1 или лигандов PD1-рецептора, блокирующий активность PD1. В7-1 или его фрагменты могут действовать также в качестве ингибирующих PD-1 лигандов. Кроме того, ингибитор PD-1-пути может представлять собой siРНК (малая интерферирующая РНК) или антисмысловую РНК, направленную против представителя PD-1-пути, предпочтительно PD-1, PD-L1 или PD-L2. Кроме того, ингибитор PD-1-пути может представлять собой белок (или кодирующую его нуклеиновую кислоту), содержащий аминокислотную последовательность, обладающую способностью связываться с PD-1, но препятствующую передаче сигнала PD-1, например, путем ингибирования взаимодействия PD-1 и В7-Н1 или B7-DL. Кроме того, ингибитор PD-1-пути может представлять собой низкомолекулярный ингибитор, обладающий способностью ингибировать путь передачи сигнала PD-1, например, PD-1-связывающий пептид или малую органическую молекулу.
Анититело: Антитело можно выбирать из любых антител, например, любых полученных рекомбинантно или встречающихся в естественных условиях антител, известных в данной области, в частности антител, пригодных для терапевтических, диагностических или научных целей, прежде всего направленных против PD-1, PD-L1 or PD-L2. В контексте настоящего описания понятие «антитело» используется в его наиболее широком смысле и относится, в частности, к моноклональным и поликлональным антителам (включая антагонистические и блокирующие или нейтрализующие антитела) и к видам антител с полиэпитопной специфичностью. Согласно изобретению «антитело», как правило, включает любые антитела, известные в данной области (например, антитела типа IgM, IgD, IgG, IgA и IgE), в том числе встречающиеся в естественных условиях антитела, антитела, полученные иммунизацией организма-хозяина, антитела, которые выделены и идентифицированы из встречающегося в естественных условиях антитела, или антитела, полученные иммунизацией организма-хозяина и полученные рекомбинантным путем с помощью методов молекулярной биологии, известных в данной области, а также химерные антитела, человеческие антитела, гуманизированные антитела, биспецифические антитела, интрабоди, т.е. антитела, экспрессирующиеся в клетках и необязательно локализованные в специфических клеточных компартментах, и фрагменты и варианты указанных выше антител. В целом, антитело состоит из легкой цепи и тяжелой цепи, которые обе имеют вариабельные и константные домены. Легкая цепь состоит из N-концевого вариабельного домена, VL, и С-концевого константного домена, CL. В отличие от этого, тяжелая цепь антитела типа IgG, например, состоит из N-концевого вариабельного домена, VH, и трех константных доменов, CH1, CH2 и CH3. Согласно настоящему изобретению можно применять также одноцепочечные антитела.
Антитела могут предпочтительно представлять собой полноразмерные антитела, т.е. антитела, состоящие из полных тяжелых и полных легких цепей, описанных выше. Однако можно применять также производные антител, такие как фрагменты, варианты или аддукты, в качестве ингибитора PD-1-пути, предлагаемого в изобретении. Фрагменты антитела можно выбирать из Fab-, Fab'-, F(ab')2-, Fc-, Facb-, pFc'-, Fd- и Fv-фрагментов вышеуказанных (полноразмерных) антител. В целом, фрагменты антител известны в данной области. Например, Fab-фрагмент («антигенсвязывающий фрагмент» (fragment, antigen binding) состоит из одного константного и одного вариабельного домена каждой тяжелой и легкой цепи. Два вариабельных домена связываются с эпитопом на специфических антигенах. Две цепи связаны через дисульфидный мостик. Например, scFv-фрагмент (одноцепочечный фрагмент вариабельного домена (single chain variable fragment)), как правило, состоит из вариабельных доменов легкой и тяжелой цепей. Домены связаны искусственной связью, как правило, полипептидной связью, такой как пептид, состоящий из 15-25 остатков глицина, пролина и/или серина.
Поликлональное антитело: Понятие «поликлональное антитело», как правило, обозначает смеси антител, направленных против конкретных антигенов или иммуногенов, или эпитопов белка, которые получают путем иммунизации организма-хозяина, такого как млекопитающее, включая, например, коз, коров, свиней, собак, кошек, ослов, обезьян, человекообразных обезьян, грызунов, таких как мыши, хомяки и кролики. Поликлональные антитела, в целом, не являются идентичными и, таким образом, как правило, распознают различные эпитопы или области в одном и том же антигене. Таким образом, в этом случае, следует применять, как правило, смесь (композицию) различных антител, в которой каждое антитело направлено к конкретным антигенам или иммуногенам, или эпитопам белка, прежде всего, направлено к PD-1, PD-L1 или PD-L2.
Моноклональное антитело: В контексте настоящего описания понятие «моноклональное антитело», как правило, относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, содержащиеся в популяции, являются идентичными за исключением возможных встречающихся в естественных условиях мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высоко специфическими, направленными к одному антигенному центру. Кроме того, в отличие от препаратов канонических (поликлональных) антител, которые, как правило, включают различные антитела, направленные к различным детерминантам (эпитопам), каждое моноклональное антитело направлено к одной детерминанте на антигене. Моноклональные антитела, указанные выше, можно получать, например, методом гибридомы, впервые описанным у Kohler и Milstein, Nature, 256, 1975, с. 495, или их можно создавать методами рекомбинантной ДНК, например, как описано в U.S. №4816567. «Моноклональные антитела» можно выделять также из фаговых библиотек, созданных с помощью методов, описанных у McCafferty и др., Nature, 348, 1990, сс. 552-554, например, согласно методу Kohler и Milstein представляющий интерес иммуноген (антиген) вводят с помощью инъекции хозяину, такому как мышь, и по истечении определенного периода времени собирают В-клеточные лимфоциты, образовавшиеся в ответ на иммуноген. В-клетки объединяют с клетками миеломы, полученными из мыши, и вносят в среду, позволяющую В-клеткам сливаться с клетками миеломы с образованием гибридом. Затем указанные слитые клетки (гибридомы) помещают в отдельные лунки титрационных микропланшетов и выращивают с получением моноклональных антител. Моноклональные антитела тестируют для определения того, какие из них пригодны для обнаружения представляющего интерес антигена. После отбора моноклональные антитела можно выращивать в клеточных культурах или путем инъекции гибридом мышам. В контексте настоящего изобретения наиболее предпочтительными являются моноклональные антитела, направленные против PD-1, PD-L1 и PD-L2.
Химерные антитела: Химерные антитела, которые можно применять в качестве ингибитора PD-1-пути согласно изобретению, предпочтительно представляют собой антитела, в которых константные домены антитела, описанного выше, заменены последовательностями антител из других организмов, предпочтительно человеческими последовательностями.
Гуманизированные антитела: Гуманизированные (нечеловеческие) антитела, которые можно применять в качестве ингибитор PD-1-пути согласно изобретению, представляют собой антитела, в которых константные и вариабельные домены (за исключением гипервариабельных доменов) заменены человеческими последовательностями.
Человеческие антитела: Человеческие антитела можно выделять из человеческих тканей или из иммунизированных организмов-хозяев, отличных от человека, являющихся трансгенными по локусу человеческого гена IgG. Кроме того, человеческие антитела можно получать с использованием фагового дисплея.
Биспецифические антитела: В контексте настоящего изобретения биспецифические антитела предпочтительно представляют собой антитела, которые функционируют в качестве адаптора между эффектором и соответствующей мишенью благодаря двум различным Fa/b-доменам, например, для целей рекрутинга эффекторных молекул, таких как токсины, лекарственные субстанции, цитокины и т.д., нацеливающих эффекторные клетки, такие как CTL, NK-клетки, макрофаги, гранулоциты и т.д. (см. обзор Kontermann R.E., Acta Pharmacol. Sin, 26(1), 2005, cc. 1-9). Биспецифическим антителам, представленным в настоящем описании, как правило, придают такую конфигурацию, чтобы они распознавали последовательности двух различных Fa/b-доменов, например, два/две различных антигена, иммуногена, эпитопа, лекарственные субстанции, клетки (или рецептора на клетках), или другие молекулы (или структуры), описанные выше. В данном случае биспецифичность означает, что антигенсвязывающие области антител обладают специфичностью в отношении двух различных эпитопов. Таким путем различные антигены, иммуногены или эпитопы и т.д. можно сближать друг с другом, что необязательно позволяет осуществлять непосредственное взаимодействие двух компонентов. Например, различные клетки, такие как эффекторные клетки и клетки-мишени можно соединять с помощью биспецифического антитела. Согласно настоящему изобретению под это определение подпадают (но, не ограничиваясь только ими) антитела или их фрагменты, которые связываются, с одной стороны, с растворимым антигеном, и, с другой стороны, с антигеном или рецептором, например, PD-1 или его лигандами PD-L1 и PD-L2 на поверхности клетки, например, опухолевой клетки.
Интрабоди: Интрабоди могут представлять собой антитела, определенные выше. Указанные антитела представляют собой антитела, экспрессируемые внутри клетки, и, следовательно, эти антитела могут кодироваться нуклеиновыми кислотами, которые можно применять для экспрессии кодируемых антител. Следовательно, нуклеиновые кислоты, кодирующие антитело, предпочтительно указанное выше, прежде всего антитело, направленное против представителя PD-1-пути, например, PD-1, PD-L1 или PD-L2, можно применять в качестве ингибитора PD-1-пути, согласно настоящему изобретению.
Согласно первому объекту изобретения задача, положенная в основу настоящего изобретения, решают с помощью комбинации вакцина/ингибитор, которая содержит:
(I) в качестве вакцины РНК-вакцину, содержащую по меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания (ОРС), кодирующую по меньшей мере один антиген, и
(II) в качестве ингибитора композицию, содержащую по меньшей мере один ингибитор PD-1-пути.
В контексте настоящего изобретения понятие «комбинация вакцина/ингибитор» предпочтительно означает комбинацию РНК-вакцины, содержащей меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания (ОРС), кодирующую по меньшей мере один антиген, и композиции, содержащей по меньшей мере один ингибитор PD-1-пути. Таким образом, указанная комбинация вакцина/ингибитор может находиться в виде одной композиции, содержащей все указанные компоненты в составе одной и той же смеси (например, в виде фармацевтической композиции), или может находиться в виде набора компонентов, в котором различные компоненты представляют собой различные части такого набора компонентов. Указанная предлагаемая в изобретении комбинация вакцина/ингибитор предпочтительно позволяет вызывать адаптивной иммунный ответ (и необязательно врожденный иммунный ответ) у пациента, подлежащего лечению, предпочтительно млекопитающего, при применении в качестве первого компонента РНК-вакцины, содержащей по меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один антиген, предпочтительно кодирующую опухолевый антиген или патогенный антиген. Ингибитор в предлагаемой в изобретении комбинации вакцина/ингибитор, предпочтительно ингибитор PD-1-пути может оказывать антагонистическое действие на путь передачи сигнала PD-1 предпочтительно посредством ингибирования или супрессии трансдукции сигнала, опосредуемого рецептором PD-1. Так, введение вакцины и ингибитора можно осуществлять либо одновременно, либо с определенными временными интервалами, либо в одно и то же место введения, либо в различные места введения, как будет дополнительно описано ниже. Такая комбинация вакцина/ингибитор может индуцировать активный иммунный ответ и тем самым предупреждать, например, рост опухоли или индуцировать регресс опухоли. Таким образом, предлагаемая в изобретении комбинация вакцина/ингибитор пригодна для эффективной стимуляции антигенспецифических иммунных ответов против раковых и инфицированных патогеном клеток. Более конкретно, предлагаемая в изобретении комбинация вакцина/ингибитор наиболее пригодна для лечения опухолевых заболеваний и инфекционных заболеваний, которые могут быть ассоциированы со сверхэкспрессией PD-1, PD-L1 или PD-L2, и для дополнительного усиления иммунного ответа против таких опухолевых клеток и инфицированных клеток.
Таким образом, изобретение основано на неожиданном открытии того, что комбинация РНК-вакцины и ингибитора PD-1 -пути обладает очень выгодным преимуществом с позиций ингибирования роста опухоли, что приводит к повышенной выживаемости, которое нельзя было предвидеть на основе данных, известных из существующего уровня техники. Так, комбинированная обработка РНК-вакциной, например, кодирующей конкретный антиген (активная вакцинация), такой как опухолевый антиген, и ингибитором, направленным на представителя PD-1-пути, прежде всего рецептор PD-1 или его лиганды PD-L1 и PD-L2, может приводить к очень сильному снижению вредного действия заболевания, подлежащего лечению, например, скорости роста опухоли. В этом контексте при создании изобретения неожиданно было установлено, что обработка РНК-вакциной, содержащей РНК, которая кодирует опухолевый антиген, в комбинации с ингибитором PD-1-пути, неожиданно ингибирует рост опухоли, приводя к повышенной выживаемости мышей, которым имплантировали опухоли, что характеризуется синергетическим действием, проявляющимся в достижении 50% полных ответов.
В качестве первого компонента предлагаемая в изобретении комбинация вакцина/ингибитор включает в качестве вакцины РНК-вакцину, содержащую по меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания (ОРС), кодирующую по меньшей мере один антиген, предпочтительно опухолевый антиген или патогенный антиген.
Согласно изобретению РНК-вакцина, входящая предлагаемую в изобретении комбинацию вакцина/ингибитор, предпочтительно содержит по меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один антиген, указанный в настоящем описании.
По меньшей мере одну РНК, входящую в РНК-вакцину, можно выбирать из любых РНК, пригодных для кодирования аминокислотной последовательности, предпочтительно из матричных РНК (мРНК).
Однако при осуществлении настоящего изобретения можно применять аналогичным образом и другие формы РНК. Например, РНК может представлять собой выведенную из вируса РНК, такую как РНК ретровируса, или указанный в настоящем описании РНК-репликон, например, выведенный из альфавируса.
В конкретных вариантах осуществления изобретения по меньшей мере одна РНК, входящая в РНК-вакцину, не содержит или не состоит из лентивирусного вектора или аденовирусного/аденоассоциированного вектора.
В конкретном варианте осуществления изобретения РНК-вакцина содержит или состоит из выделенной РНК, указанной в настоящем описании.
Кроме того, по меньшей мере одна РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, может представлять собой одноцепочечную или двухцепочечную РНК (которую можно рассматривать также как РНК (молекулу), образованную в результате нековалентной ассоциации двух одноцепочечных РНК (молекул)), или частично двухцепочечную или частично одноцепочечную РНК, которые по меньшей мере частично являются самокомплементарными (обе указанные частично двухцепочечные или частично одноцепочечные молекулы РНК, как правило, образованы из более длинной и более короткой одноцепочечной молекулы РНК или из двух одноцепочечных молекул РНК примерно одинаковой длины, где одна одноцепочечная молекула РНК частично комплементарна другой одноцепочечной молекуле РНК, и, таким образом, обе образуют в указанной области двухцепочечную молекулу РНК, т.е. частично двухцепочечную или частично одноцепочечную РНК. Предпочтительно по меньшей мере одна РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, может представлять собой одноцепочечную РНК. Кроме того, по меньшей мере одна РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, может представлять собой кольцевую или линейную РНК, предпочтительно линейную РНК. Более предпочтительно по меньшей мере одна РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, может представлять собой (линейную) одноцепочечную РНК.
Предпочтительно по меньшей мере одна РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, имеет длину от примерно 5 до примерно 20000 или от 100 до примерно 20000 нуклеотидов, предпочтительно от примерно 250 до примерно 20000 нуклеотидов, более предпочтительно от примерно 500 до примерно 10000, еще более предпочтительно от примерно 500 до примерно 5000.
В наиболее предпочтительном варианте осуществления первого объекта изобретения по меньшей мере одна РНК в РНК-вакцине содержит по меньшей мере одну открытую рамку считывания, которая кодирует по меньшей мере один опухолевый антиген. В этом контексте опухолевые антигены предпочтительно локализованы на поверхности (опухолевой) клетки. Опухолевые антигены можно выбирать также из белков, для которых характерна сверхэкспрессия в опухолевых клетках по сравнению со здоровыми клетками (например, не относящимися к опухолевым клетками). Кроме того, опухолевые антигены включают также антигены, экспрессируемые в клетках, которые сами не являются (не были) (или исходно не были сами) перерожденными, но ассоциированы с предполагаемой опухолью. Антигены, связанные с сосудами, которые поставляют кровь в опухоль, или с их (ре)форматированием, в частности антигены, которые ассоциированы с неоваскуляризацией, например, факторы роста, такие как VEGF, bFGF и т.д. подпадают также под объем настоящего изобретения. К антигенам, ассоциированным с опухолью, относятся также антигены из клеток или тканей, как правило, окружающих опухоль. Кроме того, некоторые субстанции (как правило, белки или пептиды) экспрессируются у пациентов, страдающих (установленным или неустановленным) раковым заболеванием, и они присутствуют в повышенных концентрациях в общей воде организма у таких пациентов. Эти субстанции также подпадают под понятие «опухолевые антигены», однако в строгом смысле они не являются антигенами, т.е. индуцирующими иммунный ответ субстанциями. Класс опухолевых антигенов можно подразделять также на специфические для опухоли антигены (TSA) и ассоциированные с опухолью антигены (ТАА). TSA могут презентироваться только опухолевыми клетками и никогда нормальными «здоровыми» клетками. Они, как правило, образуются в результате специфической для опухоли мутации. ТАА, которые являются более общими, как правило, презентируются как опухолевыми, так и здоровыми клетками. Эти антигены распознаются, в результате чего антигенпрезентирующая клетка может разрушаться цитотоксическими Т-клетками. Кроме того, опухолевые антигены могут присутствовать также на поверхности опухоли в форме, например, мутантного рецептора. В этом случае они могут распознаваться антителами.
Кроме того, ассоциированные с опухолью антигены можно классифицировать как тканеспецифичные антигены, которые называют также меланоцит-специфическими антигенами, антигенами рака яичек и опухоль-специфическими антигены. Под антигенами рака яичек, как правило, понимают пептиды или белки ассоциированных с зародышевой линией генов, которые могут активироваться в широком разнообразии опухолей. Человеческие антигены рака яичек можно подразделять также на антигены, которые колируются Х-хромосомой, так называемые СТ-Х-антигены, и антигены, которые не кодируются Х-хромосомой, так называемые (не-Х-СТ-антигены). Антигены рака/яичка, которые кодируются Х-хромосомой, включают, например, семейство генов антигенов меланомы, так называемое MAGE-семейство. Гены MAGE-семейства можно охарактеризовать по наличию домена гомологии MAGE (MHD). Каждый из указанных антигенов, т.е. меланоцит-специфических антигенов, антигенов рака яичка и опухоль-специфических антигенов, может вызывать аутологичные клеточные и гуморальные иммунные ответы. Следовательно, опухолевый антиген, кодируемый РНК, содержащейся в РНК-вакцине, применяемой согласно настоящему изобретению, предпочтительно представляет собой меланоцит-специфический антиген, антиген рака яичка или опухоль-специфический антиген, предпочтительно он может представлять собой СТ-Х-антиген, не-Х-СТ-антиген, партнер, связывающий СТ-Х-антиген или партнер, связывающий не-Х-СТ-антиген, или опухоль-специфический антиген, более предпочтительно СТ-Х-антиген, партнер, связывающий не-Х-СТ-антиген или опухоль-специфический антиген.
Наиболее предпочтительные согласно настоящему изобретению опухолевые антигены выбирают из группы, включающей 5Т4, 707-АР, 9D7, AFP, AlbZIP HPG1, альфа-5-бета-1-интегрин, альфа-5-бета-6-интегрин, альфа-актинин-4/m, альфа-метилацил-кофермент А-рацемазу, ART-4, ARTC1/m, В7Н4, BAGE-1, BCL-2, bcr/abl, бета-катенин/m, BING-4, BRCA1/m, BRCA2/m, CA 15-3/CA 27-29, CA 19-9, CA72-4, CA125, калретикулин, CAMEL, CASP-8/m, катепсин В, катепсин L, CD19, CD20, CD22, CD25, CDE30, CD33, CD4, CD52, CD55, CD56, CD80, CDC27/m, CDK4/m, CDKN2A/m, CEA, CLCA2, CML28, CML66, COA-1/m, коактозин-подобный белок, коллаген XXIII, COX-2, CT-9/BRD6, Cten, циклин B1, циклин D1, cyp-B, CYPB1, DAM-10, DAM-6, DEK-CAN, EFTUD2/m, EGFR, ELF2/m, EMMPRIN, EpCam, EphA2, EphA3, Erb3, ETV6-AML1, EZH2, FGF-5, FN, Frau-1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE7b, GAGE-8, GDEP, GnT-V, gp100, GPC3, GPNMB/m, HAGE, HAST-2, гепсин, Her2/neu, HERV-K-MEL, HLA-A*0201-R17I, HLA-A11/m, HLA-A2/m, HNE, гомеобокс NKX3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPV-E7, HSP70-2M, HST-2, hTERT, iCE, IGF-1R, IL-13Ra2, IL-2R, IL-5, незрелый ламининовый рецептор, каллекреин-2, каллекреин-4, Ki67, KIAA0205, KIAA0205/m, KK-LC-1, K-Ras/m, LAGE-A1, LDLR-FUT, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-A10, MAGE-А12, MAGE-B1, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-B10, MAGE-B16, MAGE-B17, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2, маммоглобин A, MART-1/мелан-А, MART-2, MART-2/m, матриксный белок 22, MC1R, M-CSF, ME1/m, мезотелин, MG50/PXDN, MMP11, MN/CA IX-антиген, MRP-3, MUC-1, MUC-2, MUM-1/m, MUM-2/m, MUM-3/m, миозин класса I/m, NA88-A, N-ацетилглюкозаминилтрансферазу-V, Neo-PAP, Neo-PAP/m, NFYC/m, NGEP, NMP22, NPM/ALK, N-Ras/m, NSE, NY-ESO-1, NY-ESO-B, OA1, OFA-iLRP, OGT, OGT/m, OS-9, OS-9/m, остеокальцин, остеопонтин, p15, p190 минорный bcr-abl, p53, p53/m, PAGE-4, PAI-1, PAI-2, PART-1, PATE, PDEF, Pim-1-киназу, Pin-1, Pml/PARaльфa, POTE, PRAME, PRDX5/m, простеин, протеиназу-3, PSA, PSCA, PSGR, PSM, PSMA, PTPRK/m, RAGE-1, RBAF600/m, RHAMM/CD168, RU1, RU2, S-100, SAGE, SART-1, SART-2, SART-3, SCC, SIRT2/m, Sp17, SSX-1, SSX-2/HOM-MEL-40, SSX-4, STAMP-1, STEAP, сурвивин, сурвивин-2В, SYT-SSX-1, SYT-SSX-2, TA-90, TAG-72, TARP, TEL-AML1, TGFбета, TGFбетаRII, TGM-4, TPI/m, TRAG-3, TRG, TRP-1, TRP-2/6b, TRP/INT2, TRP-p8, тирозиназу, UPA, VEGF, VEGFR-2/FLK-1 и WT1. Указанные опухолевые антигены предпочтительно можно выбирать из группы, включающей р53, СА125, EGFR, Her2/neu, hTERT, PAP, MAGE-A1, MAGE-А3, мезотелин, MUC-1, GP100, MART-1, тирозиназу, PSA, PSCA, PSMA, STEAP-1, VEGF, VEGFR1, VEGFR2, Ras, CRA или WT1, и наиболее предпочтительно из PAP, MAGEA-3, WT1 и MUC-1. Указанные опухолевые антигены предпочтительно можно выбирать из группы, включающей MAGE-A1 (например, MAGE-A1, имеющий регистрационный номер М77481), MAGE-A2, MAGE-A3, MAGE-A6 (например, MAGE-A6, имеющий регистрационный номер NM_005363), MAGE-C1, MAGE-C2, мелан-А (например, мелан-А, имеющий регистрационный номер NM_005511), GP100 (например, GP100, имеющий регистрационный номер М77348), тирозиназу (например, тирозиназу, имеющую регистрационный номер NM_000372), сурвивин (например, сурвивин, имеющий регистрационный номер AF077350), СЕА (например, СЕА, имеющий регистрационный номер NM_004363), Her-2/neu (например, Her-2/neu, имеющий регистрационный номер M11730), WT1 (например, WT1, имеющий регистрационный номер NM_000378), PRAME (например, PRAME, имеющий регистрационный номер NM_006115), EGFRI (рецептор эпидермального фактора роста-1) (например, EGFRI (рецептор эпидермального фактора роста-1), имеющий регистрационный номер AF288738), MUC1, муцин-1 (например, муцин-1, имеющий регистрационный номер NM_002456), SEC61G (например, SEC61G, имеющий регистрационный номер NM_014302), hTERT (например, hTERT, имеющий регистрационный номер NM_198253), 5Т4 (например, 5Т4, имеющий регистрационный номер NM_006670), TRP-2 (например, TRP-2, имеющий регистрационный номер NM_001922), STEAP, PCA, PSA, PSMA и т.д.
В этом контексте наиболее предпочтительно, когда по меньшей мере одна РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, кодирует опухолевые антигены, выбранные из РСА, PSA, PSMA, STEAP и необязательно MUC-1 или их фрагментов, вариантов или производных.
В другом наиболее предпочтительном варианте осуществления изобретения РНК-вакцина, входящая в предлагаемую в изобретении комбинацию вакцина/ингибитор, содержит по меньшей мере одну РНК, кодирующую опухолевые антигены, выбранные из NY-ESO-1, MAGE-C1, MAGE-C2, сурвивина, необязательно 5Т4 и необязательно MUC-1, или их фрагментов, вариантов или производных.
Кроме того, опухолевые антигены могут включать также идиотипические антигены, ассоциированные с раковым или опухолевым заболеванием, прежде всего с лимфомой или ассоциированным с лимфомой заболеванием, где указанный идиотипический антиген представляет собой идиотип иммуноглобулина лимфоидной кровяной клетки или идиотип Т-клеточного рецептора лимфоидной кровяной клетки.
В следующем наиболее предпочтительном варианте осуществления первого объекта изобретения по меньшей мере одна РНК в РНК-вакцине содержит по меньшей мере одну открытую рамку считывания, которая кодирует по меньшей мере один патогенный антиген. Патогенные антигены представляют собой пептидные или белковые антигены, выведенные из патогена, ассоциированного с инфекционным заболеванием, который предпочтительно выбирают из антигенов, выведенных из патогенов Acinetobacter baumannii, рода Anaplasma, Anaplasma phagocytophilum, Ancylostoma braziliense, Ancylostoma duodenale, Arcanobacterium haemolyticum, Ascaris lumbricoides, рода Aspergillus, Astroviridae, рода Babesia, Bacillus anthracis, Bacillus cereus, Bartonella henselae, вируса BK, Blastocystis hominis, Blastomyces dermatitidis, Bordetella pertussis, Borrelia burgdorferi, рода Borrelia, Borrelia spp, рода Brucella, Brugia malayi, семейства Bunyaviridae, Burkholderia cepacia и других видов Burkholderia, Burkholderia mallei, Burkholderia pseudomallei, семейства Caliciviridae, рода Campylobacter, Candida albicans, Candida spp, Chlamydia trachomatis, Chlamydophila pneumoniae, Chlamydophila psittaci, приона CJD, Clonorchis sinensis, Clostridium botulinum, Clostridium difficile, Clostridium perfringens, Clostridium perfringens, Clostridium spp, Clostridium tetani, Coccidioides spp, коронавирусов, Corynebacterium diphtheriae, Coxiella burnetii, вируса геморрагической лихорадки Крым-Конго, Cryptococcus neoformans, рода Cryptosporidium, Cytomegalovirus (CMV), вирусов Денге (DEN-1, DEN-2, DEN-3 и DEN-4), Dientamoeba fragilis, вируса Эбола (EBOV), рода Echinococcus, Ehrlichia chaffeensis, Ehrlichia ewingii, рода Ehrlichia, Entamoeba histolytica, рода Enterococcus, рода Enterovirus, энтеровирусов, прежде всего вируса Коксаки А и энтеровируса 71 (EV71), Epidermophyton spp, вируса Эпштейна-Барра (EBV), Escherichia coli O157:Н7, O111 и О104:Н4, Fasciola hepatica и Fasciola gigantica, приона FFI, суперсемейства Filarioidea, флавивирусов, Francisella tularensis, рода Fusobacterium, Geotrichum candidum, Giardia intestinalis, Gnathostoma spp, приона GSS, вируса Гуанарито, Haemophilus ducreyi, Haemophilus influenzae, Helicobacter pylori, генипавируса (вирус Гендра и вирус Нипа), вируса гепатита A, вируса гепатита В (HBV), вируса гепатита С (HCV), вируса гепатита D, вируса гепатита, вируса герпеса простого 1 и 2 (HSV-1 и HSV-2), Histoplasma capsulatum, HIV (вирус иммунодефицита человека), Hortaea werneckii, человеческого бокавируса (HBoV), человеческого вируса герпеса 6 (HHV-6) и человеческого вируса герпеса 7 (HHV-7), человеческого вируса метапенвмонии (hMPV), вируса папилломы человека (HPV), человеческих вирусов парагриппа (HPIV), вируса японского энцефалита, вируса JC, вируса Джунин, Kingella kingae, Klebsiella granulomatis, приона Куру, вируса Ласса, Legionella pneumophila, рода Leishmania, рода Leptospira, Listeria monocytogenes, вируса лимфоцитарного хориоменингита (LCMV), вируса Мачупо, Malassezia spp, вируса Марбурга, вируса кори, Metagonimus yokagawai, Microsporidia phylum, вируса контагиозного моллюска (MCV), вируса паротита, Mycobacterium leprae и Mycobacterium lepromatosis, Mycobacterium tuberculosis, Mycobacterium ulcerans, Mycoplasma pneumoniae, Naegleria fowleri, Necator americanus, Neisseria gonorrhoeae, Neisseria meningitidis, Nocardia asteroides, Nocardia spp, Onchocerca volvulus, Orientia tsutsugamushi, семейства Orthomyxoviridae (грипп), Paracoccidioides brasiliensis, Paragonimus spp, Paragonimus westermani, парвовируса В19, рода Pasteurella, рода Plasmodium, Pneumocystis jirovecii, полиовируса, вируса бешенства, респираторно-синтициального вируса (RSV), риновируса, риновирусов, Rickettsia akari, рода Rickettsia, Rickettsia prowazekii, Rickettsia rickettsii, Rickettsia typhi, вируса долины Рифта, ротавируса, вируса краснухи, вируса Сабиа, рода Salmonella, Sarcoptes scabiei, коронавируса SARS, рода Schistosoma, рода Shigella, вируса Син Номбре, хантавируса, Sporothrix schenckii, рода Staphylococcus, Streptococcus agalactiae, Streptococcus pneumoniae, Streptococcus pyogenes, Strongyloides stercoralis, рода Taenia, Taenia solium, вируса клещевого энцефалита (TBEV), Toxocara canis или Toxocara cati, Toxoplasma gondii, Treponema pallidum, Trichinella spiralis, Trichomonas vaginalis, Trichophyton spp, Trichuris trichiura, Trypanosoma brucei, Trypanosoma cruzi, Ureaplasma urealyticum, вируса ветряной оспы (VZV), Variola major или Variola minor, приона vCJD, вируса венесуэльского энцефалита лошадей, Vibrio cholerae, вируса Западного Нила, вируса западного энцефалита лошадей, Wuchereria bancrofti, вируса желтой лихорадки, Yersinia enterocolitica, Yersinia pestis и Yersinia pseudotuberculosis.
В этом контексте наиболее предпочтительными являются антигены из патогенов, выбранных из вируса гриппа, респираторно-синтициального вируса (RSV), вируса герпеса простого (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (HIV), Plasmodium, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки.
Согласно первому объекту настоящего изобретения по меньшей мере одна РНК в РНК-вакцине, содержащая по меньшей мере одну открытую рамку считывания, которая кодирует по меньшей мере один антиген, может находиться в форме моно-, би- или даже мультицистронной РНК, т.е. РНК, которая содержит открытую рамку считывания одного, двух или большего количества белков или пептидов. Такие открытые рамки считывания в моно-, би- или даже мультицистронных РНК, могут быть разделены по меньшей мере одной последовательностью внутреннего сайта связывания рибосом (IRES), например, указанной в настоящем описании, или сигнальными пептидами, которые индуцируют расщепление образовавшегося полипептида, содержащего несколько белков или пептидов.
По меньшей мере одна РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, может быть стабилизирована с помощью нескольких подходов для предупреждения нестабильности (быстрого) расщепления ферментами. Указанная нестабильность РНК, как правило, обусловлена РНК-расщепляющими ферментами, «РНКазами» (рибонуклеазами), при этом загрязнение такими рибонуклеазами иногда может приводить к полному расщеплению РНК в растворе. Поэтому имеющее место в естественных условиях расщепление РНК в цитоплазме клеток очень строго регулируется, и загрязняющие РНКазы, как правило, можно удалять путем специальной обработки перед применением указанных композиций, в частности, с помощью диэтилпирокарбоната (DEPC). Из существующего уровня техники известны многие механизмы расщепления, имеющие место в естественных условиях, которые также можно использовать в данном контексте. Например, как правило, решающее значение имеет концевая структура, прежде всего для мРНК. Например, на 5'-конце встречающихся в естественных условиях мРНК обычно присутствует так называемая кэп-структура, представляющая собой модифицированный гуанозиновый нуклеотид, которую называют также 5'-кэп-структурой, а на 3'-конце, как правило, присутствует последовательность, состоящая из вплоть до 200 аденозиновых нуклеотидов (так называемый поли-А-хвост). В другом варианте осуществления изобретения по меньшей мере одна РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, содержит по меньшей мере один из следующих структурных элементов: 5'- и/или 3'-UTR-последовательность, предпочтительно 5'- и/или 3'-UTR-модификацию, 5'-кэп-структуру, поли(С)-последовательность, поли-А-хвост и/или сигнал полиаденилирования, предпочтительно указанные в настоящем описании.
В другом варианте осуществления изобретения по меньшей мере РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, предпочтительно содержит по меньшей мере два из следующих структурных элементов: 5'- и/или 3'-UTR-последовательность, предпочтительно 5'- и/или 3'-UTR-модификацию (например, мутантную последовательность 3'-UTR гена (альфа)глобина (muag)); гистоновую структуру стебель-петля, предпочтительно гистоновую структуру стебель-петля в его 3'-нетранслируемой области; 5'-кэп-структуру; поли(С)-последовательность; поли-А-хвост; или сигнал полиаденилирования, например, содержит 5'-кэп-структуру и гистоновую структуру стебель-петля и возможно поли-А-хвост.
В этом контексте наиболее предпочтительно, когда по меньшей мере одна РНК в РНК-вакцине, содержащейся в предлагаемой в изобретении комбинации вакцина/ингибитор, которая кодирует по меньшей мере один антиген, имеет следующую структуру в 5'→3'-направлении:
а) необязательная 5'-UTR-последовательность, содержащая UTR-модификацию;
б) открытая рамка считывания, кодирующая антиген, указанный выше;
в) 3'-UTR-последовательность, содержащая UTR-модификацию;
г) по меньшей мере одна гистоновая структура стебель-петля, необязательно без расположенного в прямом направлении относительно гистонового элемента, т.е. в 3'-направлении относительно гистоновой структуры стебель-петля;
д) поли(А)-последовательность или необязательно сигнал полиаденилирования; и
е) поли(С)-последовательность.
В другом наиболее предпочтительном варианте осуществления изобретения по меньшей мере по меньшей мере одна РНК в РНК-вакцине, содержащейся в предлагаемой в изобретении комбинации вакцина/ингибитор, которая кодирует по меньшей мере один антиген, имеет следующую структуру в 5'→3'-направлении:
необязательная 5'-UTR-последовательность, содержащая UTR-модификацию;
б) открытая рамка считывания, кодирующая антиген, указанный выше;
в) 3'-UTR-последовательность, содержащая UTR-модификацию;
г) поли(А)-последовательность;
д) поли(С)-последовательность; и
е) по меньшей мере одна гистоновая структура стебель-петля.
Для дополнительного повышения устойчивости, например, к расщеплению in vivo (например, экзо- или эндонуклеазой), по меньшей мере одна РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, которая кодирует по меньшей мере один антиген, должна находиться в форме стабилизированной нуклеиновой кислоты, например, в форме модифицированной нуклеиновой кислоты, как указано в настоящем описании. Таким образом, согласно другому варианту осуществления изобретения по меньшей мере одну РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, которая кодирует по меньшей мере один антиген, стабилизируют предпочтительно посредством модификаций каркаса, модификаций сахаров и/или модификаций оснований, более предпочтительно стабилизируют посредством модификации G/C-содержания как указано в настоящем описании. Все такие модификации можно интродуцировать по меньшей мере в одну РНК без ухудшения функции РНК, такой как трансляция в антиген, обратная транскрипция или репликация.
Согласно другому варианту осуществления изобретения по меньшей мере одну РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, которая кодирует по меньшей мере один антиген, можно модифицировать и тем самым стабилизировать путем модификации содержания G (гуанозин)/С (цитозин) в мРНК, предпочтительно в ее открытой рамке считывания.
В этом случае содержание G/C по меньшей мере в одной РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, которая кодирует по меньшей мере один антиген, прежде всего повышают по сравнению с содержанием G/C в открытой рамке считывания соответствующей ей открытой рамки считывания дикого типа, т.е. в немодифицированной РНК, указанной в настоящем описании. Однако аминокислотную последовательность, кодируемую открытой рамкой считывания по меньшей мере одной РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, которая кодирует по меньшей мере один антиген, предпочтительно не модифицируют по сравнению с аминокислотной последовательностью, кодируемой конкретной открытой рамкой считывания дикого типа.
Согласно следующему предпочтительному варианту осуществления изобретения по меньшей мере одну РНК в РНК-вакцине, кодирующую по меньшей мере один антиген, в предлагаемой в изобретении комбинации вакцина/ингибитор, оптимизируют для трансляции (оптимизация кодонов) как указано в настоящем описании, предпочтительно оптимизируют для трансляции путем замены кодонов менее часто встречающихся тРНК рассматриваемой аминокислоты на кодоны более часто встречающихся тРНК соответствующей аминокислоты.
В этом контексте наиболее предпочтительно объединять повышение, предпочтительно до максимума, содержания G/C в последовательности по меньшей мере в одной РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор, с «часто встречающимися» кодонами без модификации аминокислотой последовательности белка, кодируемого открытой рамкой считывания, содержащейся по меньшей мере в одной РНК в РНК-вакцине.
В контексте настоящего изобретения по меньшей мере одну РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор, можно получать с помощью любого известного в данной области метода, включая методы синтеза, такие, например, как твердофазный синтез, а также размножение in vivo, например, получение вирусоподобных частиц или репликоновых частиц в клетках, или методов in vitro, таких как реакции транскрипции in vitro. Репликоны, представляющие собой самоамплифицирующуюся РНК на основе генома альфавируса, можно получать путем конструирования ДНК-плазмид, кодирующих самоамплифицирующуюся РНК, с помощью стандартных методов молекулярной биологии. Линеаризованную ДНК транскрибируют in vitro с использованием, например, РНК-полимеразы Т7, и полученную РНК интродуцируют в клетки, например, путем электропорации. Производство репликоновых частиц можно оценивать с помощью анализов упаковывания, в которых клетки котрансфектируют транскрибированным in vitro репликоном и дефектной хэлперной РНК (Perri и др., J. Virol. 77(19), 2003, сс. 10394-10403; 12970424).
Еще в одном варианте осуществления изобретения РНК-вакцина, входящая в предлагаемую в изобретении комбинацию вакцина/ингибитор, содержит несколько или более чем одну, предпочтительно от 2 до 10, более предпочтительно от 2 до 5, наиболее предпочтительно от 2 до 4 молекул РНК, указанных в настоящем описании. Эти РНК-вакцины содержат более одной молекулы РНК, которые предпочтительно кодируют различные пептиды или белки, предпочтительно содержащие различные опухолевые антигены или патогенные антигены.
В этом контексте наиболее предпочтительно, чтобы РНК-вакцина, которая входит в предлагаемую в изобретении комбинацию вакцина/ингибитор, содержащая несколько (что, как правило, означает более чем 1, 2, 3, 4, 5, 6 или более чем 10 нуклеиновых кислот, например, от 2 до 10, предпочтительно от 2 до 5 нуклеиновых кислот) молекул РНК, прежде всего предназначенная для лечения рака предстательной железы (РСа), содержала по меньшей мере:
а) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген PSA или его фрагмент, вариант или производное; и
б) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген PSMA или его фрагмент, вариант или производное; и
в) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген PSCA или его фрагмент, вариант или производное; и
г) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген STEAP-1 или его фрагмент, вариант или производное; и необязательно
д) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген MUC-1 или его фрагмент, вариант или производное.
В другом предпочтительном варианте осуществления изобретения РНК-вакцина, которая входит в предлагаемую в изобретении комбинацию вакцина/ингибитор, содержащая несколько (что, как правило, означает более чем 1, 2, 3, 4, 5, 6 или более чем 10 нуклеиновых кислот, например, от 2 до 10, предпочтительно от 2 до 5 нуклеиновых кислот) молекул РНК, прежде всего предназначенная для лечения немелкоклеточного рака легкого (NSCLC), содержит по меньшей мере:
а) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген NY-ESO-1 или его фрагмент, вариант или производное; и
г) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген MAGE-C1 или его фрагмент, вариант или производное; и
д) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген MAGE-C2 или его фрагмент, вариант или производное; и PSCA или его фрагмент, вариант или производное; и
е) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген сурвивин или его фрагмент, вариант или производное; и необязательно
ж) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген 5Т4 или его фрагмент, вариант или производное и необязательно
з) молекулу РНК, кодирующую по меньшей мере один пептид или белок, где указанный кодируемый пептид или белок содержит опухолевый антиген MUC-1 или его фрагмент, вариант или производное.
Согласно одному из вариантов осуществления настоящего изобретения по меньшей мере одну РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, можно вводить в незащищенной форме без ассоциации с каким-либо дополнительным носителем, способствующим трансфекции или комплексообразованию агентом для повышения эффективности трансфекции и/или иммуностимулирующих свойств по меньшей мере одной РНК.
В предпочтительном варианте осуществления изобретения по меньшей мере одну РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, можно объединять вместе с катионным или поликатионным соединением и/или с полимерным носителем, указанным в настоящем описании. Следовательно, в конкретном варианте осуществления изобретения предпочтительно, чтобы по меньшей мере одна РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, была ассоциирована или включена в комплекс с катионным или поликатионным соединением или полимерным носителем, указанным в настоящем описании, необязательно в массовом соотношении РНК к катионному или поликатионному соединению и/или к полимерному носителю, выбранном из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас), и наиболее предпочтительно в соотношении, составляющем от примерно 3:1 до примерно 2:1 (мас./мас); или необязательно в соотношении N/P, составляющем по меньшей мере 0,1, 0,2, 0,3, 0,4, 0,5, 0,75, 1, 1,5 или 2. Предпочтительно соотношение N/P находится в пределах от примерно 0,1, 0,3, 0,4, 0,5, 0,75, 1,0, 15 или 2 до 20, предпочтительно в пределах от примерно 0,2 (0,5 или 0,75, или 1,0) до 12, более предпочтительно в соотношении N/P, составляющем от примерно 0,4 (0,75 или 1,0) до 10, и еще более предпочтительно в соотношении N/P, составляющем от 0,4 (0,75 или 1,0) до 5. Наиболее предпочтительно соотношение N/P находится в пределах от 0,1 до 0,9.
В этом контексте предпочтительно, чтобы катионное или поликатионное соединение или полимерный носитель, используемое/используемый в качестве носителя или комплексообразующего агента, и по меньшей мере одна РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, указанную в настоящем описании, находились в соотношении N/P, составляющем по меньшей мере примерно 1, или предпочтительно в пределах от примерно 1 до 20 для применений in vitro (например, в том случае, когда клетки, выделенные из организма пациента, должны быть обработаны in vitro предлагаемой в изобретении фармацевтической композицией и затем введены пациенту).
Для применений in vivo предпочтительным является соотношение N/P, составляющее по меньшей мере 0,1 (0,2, 0,3, 0,4, 0,5, 0,6), предпочтительно находящееся в пределах от примерно 0,1 (0,2, 0,3, 0,4, 0,5 или 0,6) до 1,5. Еще более предпочтительным является соотношение N/P, находящееся в пределах от 0,1 или 0,2 до 0,9 или соотношение N/P в пределах от 0,5 до 0.9.
Соотношение N/P оказывает значительное влияние на поверхностный заряд полученного комплекса, состоящего из катионных или поликатионных соединений или полимерного носителя и нуклеиновой кислоты-полезного груза, например, по меньшей мере одной РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген, или адъювантной нуклеиновой кислоты. Так, предпочтительно, чтобы полученный комплекс полимерный носитель-полезный груз был положительно заряжен для применений in vitro и был отрицательно или нейтрально заряжен для применений in vivo. Поверхностный заряд полученного комплекса полимерный носитель-полезный груз можно характеризовать в виде дзета-потенциала, который можно измерять методом доплеровского электрофореза с использованием устройства Zetasizer Nano (фирма Malvern Instruments, Малверн, Великобритания).
По меньшей мере одна РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген в предлагаемой в изобретении комбинации вакцина/ингибитор, может быть также ассоциирована с наполнителем, способствующим трансфекции, или комплексообразующим агентом для повышения эффективности трансфекции и/или иммуностимулирующих свойств по меньшей мере одной РНК.
В этом контексте наиболее предпочтительно, чтобы по меньшей мере одна РНК в РНК-вакцине, которая кодирует по меньшей мере один антиген, содержащейся в предлагаемой в изобретении комбинации вакцина/ингибитор, по меньшей мере входила в комплекс с катионным или поликатионным соединением и/или полимерным носителем, предпочтительно катионными белками или пептидами. «Частично» означает, что в комплекс с катионным соединением входит только часть по меньшей мере одной РНК и что остальная часть по меньшей мере одной РНК в РНК-вакцине, присутствующей в предлагаемой в изобретении комбинации вакцина/ингибитор, не входит в состав комплекса (т.е. находится в «свободной» или «оголенной» форме). Предпочтительно соотношение входящая в комплекс РНК : не входящая в комплекс РНК в РНК-вакцине, содержащейся в предлагаемой в изобретении комбинации вакцина/ингибитор, выбирают из диапазона от примерно 5:1 до примерно 1:10 (мас./мас), более предпочтительно из диапазона от примерно 4:1 до примерно 1:8 (мас./мас), еще более предпочтительно из диапазона от примерно 3:1 до примерно 1:5 (мас./мас.) или 1:3 (мас./мас), и наиболее предпочтительно соотношение входящая в комплекс РНК : не входящая в комплекс РНК в РНК-вакцине, содержащейся в предлагаемой в изобретении комбинации вакцина/ингибитор, выбирают равным примерно 1:1 (мас./мас).
По меньшей мере одну входящую в комплекс РНК в РНК-вакцине, содержащейся в предлагаемой в изобретении комбинации вакцина/ингибитор, предпочтительно получают, формируя на первой стадии комплекс по меньшей мере одной РНК с катионным или поликатионным соединением и/или с полимерным носителем, предпочтительно указанным в настоящем описании, в определенном соотношении для создания стабильного комплекса. В этом контексте наиболее предпочтительно, чтобы после включения в комплекс РНК не оставалось свободного катионного или поликатионного соединения, или полимерного носителя или оно/он присутствовал лишь в незначительном количестве в компоненте, содержащем включенную в комплекс РНК. Следовательно, соотношение между РНК и катионным или поликатионным соединением и/или полимерным носителем в компоненте, представляющем собой включенную в комплекс РНК, выбирают таким образом, чтобы РНК была полностью включена в комплекс, и в композиции не оставалось свободного катионного или поликатионного соединения, или полимерного носителя или оно/он присутствовал лишь в незначительном количестве.
Предпочтительно соотношение между по меньшей мере одной РНК (например, мРНК), содержащей по меньшей мере одну открытую рамку считывания, которая кодирует по меньшей мере один антиген, и катионным или поликатионным соединением и/или полимерным носителем, предпочтительно указанным в настоящем описании, выбирают из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас), и наиболее предпочтительно соотношение составляет от примерно 3:1 до примерно 2:1 (мас./мас). Альтернативно этому соотношение между РНК и катионным или поликатионным соединением и/или полимерным носителем, предпочтительно, как указано в настоящем описании, в компоненте, содержащем включенную в комплекс РНК, можно рассчитывать также на основе соотношения азот/фосфат (N/P-соотношение) для всего комплекса. В контексте настоящего изобретения N/P-соотношение предпочтительно находится в диапазоне примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 и наиболее предпочтительно диапазоне примерно 0,5-2 или 0,7-2 касательно соотношения катионное или поликатионное соединение и/или полимерный носитель: РНК в комплексе, предпочтительно, указанном в настоящем описании, и наиболее предпочтительно в диапазоне примерно 0,7-1,5, 0,5-1 или 0,7-1, и еще наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9, предпочтительно при условии, что катионное или поликатионное соединение в комплексе представляет собой катионный или поликатионный белок или пептид и/или полимерный носитель, указанный выше. В этом конкретном варианте осуществления изобретения включенная в комплекс РНК подпадает также под понятие «адъювантный компонент».
В другом варианте осуществления изобретения по меньшей мере одна кодирующая антиген РНК в РНК-вакцине, входящей в предлагаемую в изобретении комбинацию вакцина/ингибитор, указанную выше, можно объединять вместе с адъювантом. Такой адъювант предпочтительно может представлять собой другую нуклеиновую кислоту, которая не кодирует другой антиген, но обладает способностью стимулировать неспецифический иммунный ответ, т.е. врожденный иммунный ответ, путем взаимодействия с какой-либо частью врожденной иммунной системы. Такую нуклеиновую кислоту, стимулирующую неспецифический иммунный ответ, обозначают в настоящем описании как «адъювантная нуклеиновая кислота».
В этом контексте адъювантная нуклеиновая кислота предпочтительно содержит или состоит из олиго- или полинуклеотида; более предпочтительно адъювантная нуклеиновая кислота содержит или состоит из РНК или ДНК; еще более предпочтительно такая адъювантная нуклеиновая кислота, содержащая или состоящая из РНК или ДНК, входит в комплекс с катионным или поликатионным соединением и/или с полимерным носителем, указанным в настоящем описании; необязательно в массовом соотношении адъювантной нуклеиновой кислоты к катионному или поликатионному соединению и/или полимерному носителю, выбранном из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас) или от примерно 3:1 до примерно 1:1 (мас./мас), и наиболее предпочтительно в соотношении от примерно 3:1 до примерно 2:1 (мас./мас); или необязательно в соотношении азот/фосфат в катионном или поликатионном соединении и/или полимерном носителе и в адъювантной нуклеиновой кислоте в диапазоне примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4, наиболее предпочтительно в диапазоне примерно 0,7-1 или 0,5-1, и еще более предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9. Такая включенная в комплекс адъювантная нуклеиновая кислота также подпадает под понятие «адъювантный компонент».
В конкретном случае, когда предполагается осуществлять индукцию IFN-α, предпочтительным является соотношение N/P, составляющее по меньшей мере 0,1 (0,2, 0,3, 0,4, 0,5 или 0,6), или диапазон соотношений N/P от 0,1 до 1, или более предпочтительным является диапазон соотношений N/P от 0,1 или 0,2 до 0,9, или диапазон соотношений N/P от 0,5 до 0.9. В другом случае, когда предполагается осуществлять индукцию TNFα, то наиболее предпочтительно соотношение N/P составляет от 1 до 20.
Иными словами РНК-вакцина, входящая в комбинацию вакцина/ингибитор, предлагаемую в изобретении, может содержать по меньшей мере одну РНК, кодирующую по меньшей мере один антиген, и другую нуклеиновую кислоту, действующую в качестве адъюванта, которую называют адъювантной нуклеиновой кислотой. Естественно, РНК-вакцина, входящая в комбинацию вакцина/ингибитор, предлагаемую в изобретении, может содержать не только одну адъювантную нуклеиновую кислоту, но она может содержать несколько различных указанных нуклеиновых кислот. Оба вида нуклеиновых кислот, т.е. кодирующая антиген РНК и адъювантная нуклеиновая кислота, могут быть независимо друг от друга включены в комплекс с носителем, указанным в настоящем описании. Следовательно, катионное или поликатионное соединение и/или полимерный носитель, применяемые для формирования комплекса с по меньшей мере одной РНК, входящей в РНК-вакцину, которая кодирует по меньшей мере один антиген, или адъювантной нуклеиновой кислотой, можно выбирать из любых катионных или поликатионных соединений и/или полимерных носителей, указанных в настоящем описании.
В том случае, когда РНК-вакцина, входящая в предлагаемую в изобретении комбинацию вакцина/ингибитор (или предлагаемая в изобретении комбинация вакцина/ингибитор) содержит кодирующую антиген РНК и дополнительно адъювантную нуклеиновую кислоту, иммунный ответ, вызываемый введением такой вакцины, включает активацию обеих составляющих иммунной системы, т.е. адаптивной иммунной системы, а также врожденной иммунной системы.
Существенным фактором для получения соответствующего адаптивного иммунного ответа является стимулирование различных Т-клеточных субпопуляций. Т-лимфоциты, как правило, подразделяют на две субпопуляции, Т-клетки-хелперы типа 1, далее обозначаемые как Th1-клетки, и Т-клетки-хелперы типа 2, далее обозначаемые как Th2-клетки, с помощью которых иммунная система способна разрушать внутриклеточные и внеклеточные патогены (например, антигены). При этом Th1-клетки ответственны за разрушение внутриклеточного патогена, способствуя клеточному иммунному ответу путем активации макрофагов и цитотоксических Т-клеток. С другой стороны, Th2-клетки предназначены в основном для элиминации внеклеточного патогена, и они усиливают гуморальный иммунный ответ путем стимулирования В-клеток к их конверсии в плазматические клетки и путем образования антител (например, направленных против антигенов). Две популяции Т-клеток-хелперов различаются схемой продуцируемых ими эффекторных белков (цитокинов).
Соотношение Th1-клеток/Th2-клеток имеет очень важное значение для индукции и поддержания адаптивного иммунного ответа. В контексте настоящего изобретения соотношение Th1-клетки/Th2-клетки при (адаптивном) иммунном ответе предпочтительно сдвигается в сторону клеточного ответа (Th1-ответ) и тем самым индуцируется клеточный иммунный ответ. Стимулирование этого ответа адаптивной иммунной системой в основном индуцируется трансляцией кодирующей антиген РНК и обусловленного этим присутствия пептидных или белковых антигенов в организме.
Врожденную иммунную систему, которая может поддерживать указанный адаптивный иммунный ответ и которая может индуцировать или поддерживать сдвиг в сторону Th1-ответа, можно активировать с помощью лигандов Толл-подобных рецепторов (TLR). TLR представляют собой семейство высококонсервативных полипептидов паттернраспознающих рецепторов (PRR), которые распознают ассоциированные с патогеном молекулярные паттерны (РАМР) и имеют решающее значение для врожденного иммунитета у млекопитающих. В настоящее время идентифицированы по меньшей мере 13 представителей семейства, которые обозначены как TLR1-TLR13 (Толл-подобные рецепторы: TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13). Кроме того, идентифицирован ряд специфических лигандов TLR. Установлено, например, что неметилированная бактериальная ДНК и ее синтетические аналоги (CpG-ДНК) являются лигандами TLR9 (Hemmi Н. и др., Nature 408, 2000, сс. 740-745; Bauer S. и др., Proc NatlAcadSci USA 98, 2001, сс. 9237-9242). Кроме того, опубликованы данные о том, что лиганды для определенных TLR включают определенные молекулы нуклеиновых кислот и что определенные типы РНК являются иммуностимуляторами, которые действуют независимым от последовательности или зависимым от последовательности образом, при этом указанные различные иммуностимулирующие РНК могут, например, стимулировать TLR3, TLR7 или TLR8 или внутриклеточные рецепторы, такие как RIG-I, MDA-5 и т.д.
В контексте изобретения активация врожденной иммунной системы может обеспечиваться адъювантной нуклеиновой кислотой, предпочтительно иммуностимулирующей РНК (isРНК), указанной в настоящем описании, содержащейся в предлагаемой в изобретении комбинации вакцина/ингибитор, предпочтительно содержащейся в РНК-вакцине.
В соответствии с вышеизложенным в следующем предпочтительном варианте осуществления изобретения РНК-вакцину, входящую в предлагаемую в изобретении комбинацию вакцина/ингибитор, создают таким образом, чтобы она содержала:
а) указанную по меньшей мере одну РНК, содержащую по меньшей мере одну открытую рамку считывания, которая кодирует по меньшей мере один антиген; предпочтительно в форме моно-, би- или мультицистронной РНК, необязательно стабилизированную, необязательно оптимизированную в отношении трансляции и/или необязательно включенную в комплекс с катионным или поликатионным соединением или полимерным носителем;
б) необязательно адъювантный компонент, содержащий или состоящий из указанной по меньшей мере одной РНК, содержащей по меньшей мере одну открытую рамку считывания, которая кодирует по меньшей мере один антиген и/или из по меньшей мере одной адъювантной нуклеиновой кислоты, включенный в комплекс с катионным или поликатионным соединением или полимерным носителем, и
в) необязательно фармацевтически приемлемый носитель, указанный в настоящем описании.
В этом контексте наиболее предпочтительно, чтобы необязательно содержащий адъювант компонент содержал ту же самую РНК, что и содержащаяся в РНК-вакцине, которая входит в предлагаемую в изобретении комбинацию вакцина/ингибитор в качестве кодирующей антиген РНК, например, мРНК, кодирующей по меньшей мере один антиген.
Кроме того, РНК-вакцина, входящая в предлагаемую в изобретении комбинацию вакцина/ингибитор, может содержать и другие компоненты для облегчения введения и поглощения компонентов РНК-вакцины. Такими другими компонентами могут являться соответствующий носитель или наполнитель, или, например, дополнительные адъюванты для поддержания любого иммунного ответа, указанные в настоящем описании.
Согласно одному из следующих вариантов осуществления изобретения компоненты РНК-вакцины например, по меньшей мере одну РНК, кодирующую по меньшей мере один антиген, и адъювантный компонент, входящие в предлагаемую в изобретении комбинацию вакцина/ингибитор, можно включать вместе друг с другом или по отдельности в одну и ту же или разные композиции.
В качестве второго компонента предлагаемая в изобретении комбинация вакцина/ингибитор включает в качестве ингибитора композицию, содержащую ингибитор PD-1-пути, мишенью которого является любой представитель пути передачи сигнала PD-1, предпочтительно мишенью которого является PD-1, PD-L1 ил PD-L2.
Белок программированной смерти-1 (PD-1, PDCD1) представляет собой трансмембранный белок типа I, относящийся к большому семейству CD28 Т-клеточных регуляторов. В PD-1 отсутствует остаток цистеина в мембрано-проксимальной области, который требуется для гомодимеризации других представителей семейства CD28. Структурный и биохимический анализ показал, что PD-1 является мономерным в растворе, а также на клеточной поверхности (Okazaki и Honjo, Int Immunol. 19(7), 2007, сс. 813-824). PD-1 экспрессируется на активированных Т-клетках, В-клетках и моноцитах. Более выраженная экспрессия PD-1 на Т-клетках контрастирует с ограниченной экспрессией других представителей семейства CD28, это позволяет предположить, что PD-1 регулирует более широкий спектр иммунных ответов по сравнению с другими представителями семейства CD28.
PD-1 осуществляет понижающую регуляцию передачи сигнала антигенного рецептора посредством рекрутинга белка тирозинфосфатазы SHP-2 при взаимодействии с любым из двух лигандов, PD-L1 или PD-L2.
PD-L1 (В7-Н1, CD274) и PD-L2 (B7-DC, CD273) представляют собой трансмембранные гликопротеины типа I, состоящие из внеклеточных доменов IgC- и IgV-типа. PD-L1 и PD-L2 характеризуются 40%-ной идентичностью на уровне аминокислот, в то время как человеческие и мышиные ортологи PD-L1 и PD-L2 характеризуются 70%-ной идентичностью на уровне аминокислот. И PD-L1, и PD-L2 имеют короткие цитоплазматические хвосты, в которых не обнаружено известного мотива трансдукции сигнала, это позволяет предположить, что указанные лиганды не осуществляют трансдукцию никакого сигнала при взаимодействии с PD-1.
Взаимодействие PD-L1 и PD-1 приводит к передаче имеющего решающее значение негативного костимулирующего сигнала Т-клеткам и служит в качестве индуктора клеточной смерти. Взаимодействие PD-1 и PD-L1 при низких концентрациях приводит к трансмиссии ингибирующего сигнала, который ингибирует пролиферацию антигенспецифических CD8+-клеток. При более высоких концентрациях указанное взаимодействие не ингибирует пролиферацию Т-клеток, но снижает производство многих цитокинов. Так, связывание с PD-L1 может оказывать антагонистическое действие на B7-CD28-сигнал при слабой антигенной стимуляции и играет очень важную роль в понижающей регуляции Т-клеточных ответов.
Роль PD-1 и лигандов PD-1 в ингибировании активации и пролиферации Т-клеток позволяет предположить, что указанные белки могут служить терапевтическими мишенями при лечении воспаления, рака или инфекционных заболеваний. В зависимости от требуемого терапевтического результата может требоваться как повышающая, так и понижающая модуляция PD-1-пути. Повышающая модуляция иммунной системы особенно необходима при лечении различных видов рака и хронических инфекций. Ее можно достигать, например, посредством блокады PD-1 или ингибирования PD-1-пути. Ингибирование PD-1-пути можно обеспечивать, например, с помощью антитела, направленного против PD-1 или лиганда PD-1. В этом контексте ингибитор PD-1-пути может устранять Т-клеточную дисфункцию, обусловленную передачей сигнала PD-1, и тем самым восстанавливать или усиливать Т-клеточную функцию (например, пролиферацию, производство цитокинов, уничтожение клеток-мишеней). Кроме того, могут реактивироваться анергические Т-клетки, которые не реагируют на стимуляцию антигеном.
В контексте настоящего изобретения ингибитор PD-1 -пути может представлять собой в конкретных вариантах осуществления изобретения антитело, прежде всего антагонистическое антитело или кодируемое нуклеиновой кислотой антитело (интрабоди), siРНК, антисмысловую РНК, белок (или кодирующую его нуклеиновую кислоту), содержащий аминокислотную последовательность, способную связываться с PD-1, но препятствующую передаче сигнала PD-1 (например, слитый белок, включающий фрагмент PD-L1 или PD-L2 и Fc-фрагмент иммуноглобулина), растворимый белок (или нуклеиновую кислоту, кодирующую растворимый белок), конкурирующий со связанным с мембраной PD-1 за связывание с его лигандами PD-L1 и PD-L2; или низкомолекулярный ингибитор, способный ингибировать путь передачи сигнала PD-1.
Таким образом, в предпочтительном варианте осуществления настоящего изобретения ингибитор PD-1-пути представляет собой антитело (или нуклеиновую кислоту, кодирующую антитело), направленное против PD-1, предпочтительно антитело, специфически связывающееся с внеклеточным доменом PD-1, и тем самым ингибирующее передачу сигнала PD-1. Предпочтительно такое антагонистическое антитело связывается вблизи сайта связывания PD-L1 на PD-1, тем самым ингибируя связывание PD-L1 с PD-1.
Наиболее предпочтительными являются антитела к PD1 ниволумаб (MDX-1106/BMS-936558/ONO-4538), (Brahmer и др., J Clin Oncol. 28(19), 2010, сс. 3167-3175; PMID: 20516446); пидилизумаб (СТ-011), (Berger и др., Clin Cancer Res. 14(10), 2008, сс. 3044-3051; PMID: 18483370); и MK-3475 (SCH 900475).
В другом предпочтительном варианте осуществления изобретения ингибитор PD-1-пути представляет собой антитело (или нуклеиновую кислоту, кодирующую антитело), направленное против лиганда PD-1, предпочтительно антитело, специфически связывающееся с внеклеточным доменом лиганда PD-1 или PD-2. Предпочтительно, такое антитело связывается вблизи сайта связывания PD-1 или PD-2 на лиганде и разрушает его.
Наиболее предпочтительными являются антитела к PD-L1 MDX-1105/BMS-936559 (Brahmer и др., N Engl J Med. 366(26), 2012, сс. 2455-2465; PMID: 22658128); MPDL3280A/RG7446 или MEDI4736.
В другом предпочтительном варианте осуществления изобретения ингибитор PD-1-пути представляет собой белок (или кодирующую его нуклеиновую кислоту), содержащий аминокислотную последовательность, способную связываться с PD-1, но препятствующую передаче сигнала PD-1-путем, наиболее предпочтительным в этом контексте является слитый белок, содержащий фрагмент лиганда PD-L1 или PD-L2.
В этом контексте наиболее предпочтительным вариантом является слитый белок, содержащий внеклеточный домен PD-L1 или PD-L2, или его фрагмент, способный связываться с PD-1, и Fc-область иммуноглобулина. Примером такого слитого белка является АМР-224 (внеклеточный домен мышиного PD-L2/B7-DC, слитый с немодифицированной Fc-областью мышиного белка IgG2a; Mkrtichyan и др., J Immunol. 189(5), 2012, сс. 2338-2347; PMID: 22837483).
В контексте настоящего изобретения введение вакцины и ингибитора можно осуществлять либо одновременно, либо с определенными временными интервалами, либо в одно и то же место введения, либо в различные места введения, как будет дополнительно описано ниже.
Для того чтобы гарантировать, что различные механизмы действия, вызываемые РНК-вакциной и ингибитором PD-1-пути не будут оказывать негативного влияния друг на друга, ингибитор PD-1-иути и РНК-вакцину предпочтительно вводят в различные моменты времени (с определенными интервалами времени), т.е. последовательно, и/или вводят в различные области введения. Это означает, что РНК-вакцину можно вводить, например, до, одновременно или после введения ингибитора PD-1-пути или наоборот. Альтернативно или дополнительно РНК-вакцину и ингибитор PD-1-пути можно вводить в различные области введения или в одну и ту же область введения, предпочтительно в том случае, когда их вводят с определенными интервалами времени. Согласно наиболее предпочтительному варианту осуществления изобретения РНК-вакцину следует вводить первой, а ингибитор PD-1-пути следует вводить после РНК-вакцины. Такая процедура гарантирует, что иммунные клетки, такие как антигенпрезентирующие клетки и Т-клетки уже встретятся с антигеном до того, как иммунная система будет подвергнута стимуляции путем ингибирования PD-1-пути, хотя даже конкурентное введение или введение, при котором ингибитор PD-1-пути вводят до введения РНК-вакцины, может приводить к таким же или по меньшей мере сопоставимым результатам.
Согласно следующему варианту осуществления изобретения предлагаемая в изобретении комбинация вакцина/ингибитор содержит, кроме того, фармацевтически приемлемый носитель и/или наполнитель.
Такой фармацевтически приемлемый носитель, как правило, включает жидкую или нежидкую основу композиции, содержащей компоненты предлагаемой в изобретении комбинации вакцина/ингибитор. Если композиция находится в жидкой форме, то носитель, как правило, может представлять собой свободную от пирогенов воду; изотонический соляной раствор или забуференные (водные) растворы, например, растворы, забуференные фосфатом, цитратом и т.д. Предназначенный для инъекции буфер может быть гипертоническим, изотоническим или гипотоническим относительно конкретной референс-среды, т.е. содержание в буфере солей может быть выше, идентичным или ниже их содержания в конкретной референс-среде, при этом предпочтительно можно применять такие концентрации вышеуказанных солей, которые не приводят к повреждению клеток в результате осмоса или других связанных с концентрацией воздействий. Референс-среды могут представлять собой, например, жидкости, применяемые в методах «in vivo», такие как кровь, лимфа, цитозольные жидкости или другие жидкости организма, или, например, жидкости, которые можно использовать в качестве референс-сред в методах «in vitro», такие как обычные буферы или жидкости. Указанные обычные буферы или жидкости известны специалисту в данной области. Наиболее предпочтительной жидкой основой является лактированный раствор Рингера.
Однако в предлагаемой в изобретении комбинации вакцина/ингибитор можно использовать также один или несколько совместимых твердых или жидких наполнителей или разбавителей или капсулирующих соединений, которые можно применять для введения пациенту, подлежащему лечению. Понятие «совместимые» в контексте настоящего описания означает, что указанные компоненты предлагаемой в изобретении комбинации вакцина/ингибитор можно смешивать с РНК-вакциной и ингибитором PD-1-пути таким образом, чтобы не происходило взаимодействия, которое могло бы существенно снижать фармацевтическую эффективность комбинации вакцина/ингибитор в обычных условиях применения.
Кроме того, предлагаемая в изобретении комбинация вакцина/ингибитор может содержать один или несколько дополнительных адъювантов, пригодных для инициации или усиления иммунного ответа врожденной иммунной системы, т.е. неспецифического иммунного ответа, прежде всего посредством связывания с патоген-ассоциированными молекулярными паттернами (РАМР). Иными словами, при введении РНК-вакцина предпочтительно вызывает врожденный иммунный ответ благодаря адъюванту, который необязательно содержится в ней. Тем не менее, адъювант может представлять собой также часть другого компонента предлагаемой в изобретении комбинации вакцина/ингибитор, отличного от РНК-вакцины. Предпочтительно такой адъювант можно выбирать из адъювантов, известных специалисту в данной области, и пригодных для рассматриваемого случая, т.е. поддерживающих индукцию врожденного иммунного ответа у млекопитающего, например, адъювантной нуклеиновой кислоты или адъювантного компонента, указанного выше, или адъюванта, указанного ниже.
Таким образом, такой адъювант можно выбирать также из адъювантов, известных специалисту в данной области, и пригодных для рассматриваемого случая, т.е. поддерживающих индукцию врожденного иммунного ответа у млекопитающего и/или пригодных для запасания и доставки компонентов предлагаемой в изобретении комбинации вакцина/ингибитор. Предпочтительными в качестве пригодных для запасания и доставки адъювантов, являются катионные или поликатионные соединения, указанные выше. Аналогично этому, адъювант можно выбирать из группы, состоящей, например, из катионных или поликатионных соединений, указанных выше, таких как хитозан, TDM, MDP, мурамилдипептид, плюроники, раствор квасцов, гидроксид алюминия, ADJUMER™ (полифосфазен); гель фосфата алюминия; глюканы, выделенные из водорослей; алгаммулин; гель гидроксида алюминия (квасцы); высокоадсорбирующий белки гель гидроксида алюминия; обладающий низкой вязкостью гель гидроксида алюминия; AF или SPT (эмульсия, содержащая сквалан (5%), Твин 80 (0.2%), плюроник L121 (1,25%), забуференный фосфатом физиологический раствор, pH 7,4); AVRIDINE™ (пропандиамин); BAY R1005™ ((N-(2-дезокси-2-L-леуциламиноб-D-глюкопиранозил)-N-октадециламида гидроацетат); CALCITRIOL™ (1-альфа,25-дигидрокси-витамин D3); гель фосфата кальция; САР™ (наночастицы фосфата кальция); холерный голотоксин, слитый белок холерный токсин-А1-белок-A-D-фрагмент, субъединица В холерного токсина; CRL 1005 (блок-сополимер Р1205); содержащие цитокин липосомы; DDA (диметилдиоктадециламмония бромид); DHEA (дегидроэпиандростерон); DMPC (димиристоилфосфатидилхолин); DMPG (димиристоилфосфатидилглицерин); комплекс DOC/квасцы (натриевая соль дезоксихолиновой кислоты); полный адъювант Фрейнда; неполный адъювант Фрейнда; инулин-гамма; адъювант Гербу (смесь, содержащая: I) N-ацетилглюкозаминил-(Р1-4)-N-ацетилмурамоил-L-аланил-D35 глутамин (GMDP), II) диметилдиоктадециламмония хлорид (DDA), III) комплекс цинк-соль L-пролина (ZnPro-8); GM-CSF); GMDP (N-ацетилглюкозаминил-(b1-4)-N-ацетилмурамил-L47 аланил-D-изоглутамин); имиквимод (1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин); ImmTher™ (N-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-изоGlu-L-Ala-глицерина дипальмитат); DRV (иммунолипосомы, приготовленные из везикул, полученных методом гидратации-регидратации); интерферон-гамма; интерлейкин-1бета; интерлейкин-2; интерлейкин-7; интерлейкин-12; ISCOMSTM; ISCOPREP 7.0.3. ТМ; липосомы; LOXORIBINE™ (7-аллил-8-оксогуанозин); оральный адъювант LT 5 (лабильный энтеротоксин-протоксин из E. coli); микросферы и микрочастицы любого состава; MF59TM; (водная эмульсия сквалена); MONTANIDE ISA 51™ (очищенный неполный адъювант Фрейнда); MONTANIDE ISA 720™ (метаболизируемый масляный адъювант); MPL™ (3-Q-дезацил-4'-монофосфорил-липид А); липосомы МТР-РЕ и МТР-РЕ ((N-ацетил-L-аланил-D-изоглутаминил-L-аланин-2-(1,2-дипальмитоил-sn-глицеро-3-(гидроксифосфорилокси))этиламид, однонатриевая соль); MURAMETIDE™ (Nac-Mur-L-Ala-D-Gln-OCH3); MURAPALMITINE™ и DMURAPALMITINE™ (Nac-Mur-L-Thr-D-изоGIn-sn-глицериндипальмитоил); NAGO (нейраминидаза-галактозооксидаза); наносферы или наночастицы любого состава; NISV (везикулы из неионогенного поверхностно-активного вещества); PLEURAN™ (β-глюкан); PLGA, PGA и PLA (гомо- и сополимеры молочной кислоты и гликолевой кислоты; микросферы/наносферы); ПЛЮРОНИК L121™; РММА (полиметилметакрилат); PODDS (протеноидные микросферы); полиэтиленкарбаматные производные; поли-rA : поли-rU (комплекс полиадениловая кислота-полиуридиновая кислота); полисорбат 80 (Твин 80); белковые кохлеаты (фирма Avanti Polar Lipids, Inc., Алабастер, шт. Алабама); STIMULON™ (QS-21); Quil-A (сапонин Quil-A); S-28463 (4-аминоотекдиметил-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-1-этанол); SAF-1™ («композиция адъювантов фирмы Syntex»); протеолипосомы вируса Сендаи и липидные матрицы, содержащие вирус Сендаи; Спан-85 (сорбитантриолеат); Specol (эмульсия Marcol 52, Спан 85 и Твин 85); сквален или Robane® (2,6,10,15,19,23-гексаметилтетракозан и 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексан); стеарилтирозин (октадецилтирозина гидрохлорид); Theramid® (М-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-isoGlu-L-Ala-дипальмитоксипропиламид); Theronyl-MDP (Termurtide™ или [thr 1]-MDP; N-ацетилмурамил-L-треонил-D-изоглутамин); Ty-частицы (Ty-ВПЧ или вирусоподобные частицы); липосомы Уолтера-Рида (липосомы, содержащие липид А, адсорбированный на гидроксиде алюминия) и липопептиды, включая Pam3Cys, прежде всего соли алюминия, такие как адъю-фос (Adju-phos), алгидрогель, регидрагель и т.д., эмульсии, такие как CFA, SAF, IFA, MF59, провакс, TiterMax, монтанид, ваксфектин и т.д., сополимеры, такие как оптивакс (Optivax, CRL1005), L121, полоксамер 4010) и т.д., липосомы, такие как «липосомы-невидимки (Stealth)» и т.д., кохлеаты, такие как BIORAL, и т.д., адъюванты растительного происхождения, такие как QS21, Quil A, Iscomatrix, ISCOM; адъюванты, пригодные для костимуляции, включая томатин, биополимеры, такие как PLG, РММ, инулин и т.д., адъюванты микробного происхождения, такие как ромуртид, DETOX, MPL, CWS, манноза, нуклеотидные последовательности CpG, CpG7909, лиганды человеческого TLR 1-13, ISS-1018, 35 IC31, имидазохинолины, амплиген, Ribi529, IMOxine, IRIV, ВПЧ, холерный токсин, термолабильный токсин, Pam3Cys, флагеллин, GPI (гликозилфосфатидилинозитол)-якорь, LNFPIII/Lewis X, противомикробные пептиды, UC-1V150, слитый белок RSV, cdiGMP; и адъюванты, пригодные в качестве антагонистов, включая нейропептид CGRP.
Адъювант предпочтительно выбирают из адъювантов, которые поддерживают индукцию Th1-иммунного ответа или созревание наивных Т-клеток, таких как GM-CSF, IL-12, IFNg, любой адъювантной нуклеиновой кислоты, указанной выше, предпочтительно иммуностимулирующей РНК, ДНК CpG и т.д.
Согласно другому предпочтительному варианту осуществления изобретения предлагаемая в изобретении комбинация вакцина/ингибитор может содержать помимо кодирующей антиген РНК и ингибитора PD-1-пути также другие компоненты, которые выбирают из группы, включающей: другие антигены или другие кодирующие антиген нуклеиновые кислоты; другой иммунотерапевтический агент; одну или несколько вспомогательных субстанций; или любое другое соединение, в отношении которого известно, что оно обладает иммуностимулирующим действием благодаря его аффинности связывания (как лиганда) с человеческими Толл-подобными рецепторами; и/или адъювантную нуклеиновую кислоту, предпочтительно иммуностимулирующую РНК (isРНК).
Таким образом, в другом предпочтительном варианте осуществления изобретения предлагаемая в изобретении комбинация вакцина/ингибитор содержит кроме того по меньшей мере один адъювант, вспомогательную субстанцию, выбранную из липополисахаридов, TNF-альфа, лиганда CD40 или цитокинов, монокинов, лимфокинов, интерлейкинов или хемокинов, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, IFN-альфа, IFN-бета, IFN-гамма, GM-CSF, G-CSF, M-CSF, LT-бета, TNF-альфа, факторов роста и hGH, лиганда человеческого Толл-подобного рецептора TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, лиганда мышиного Толл-подобного рецептора TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13, лиганда NOD-подобного рецептора, лиганда RIG-I-подобного рецептора, адъювантной нуклеиновой кислоты, иммуностимулирующей РНК (isРНК), CpG-ДНК, антибактериального агента или противовирусного агента.
Комбинация вакцина/ингибитор, предлагаемая в настоящем изобретении, может, кроме того, содержать другие добавки или дополнительные соединения. Другие добавки, которые можно включать в предлагаемую в изобретении комбинацию вакцина/ингибитор, например, в РНК-вакцину и/или в композицию, содержащую ингибитор PD-1-пути, представляют собой эмульгаторы, такие, например, как Tween®; смачивающие агенты, такие, например, как лаурилсульфат натрия; красители; улучшающие вкус вещества, фармацевтические носители; формирующие таблетки агенты; стабилизаторы; антиоксиданты; консерванты, ингибиторы РНКазы и/или антибактериальный агент или противовирусный агент.
Предлагаемая в изобретении комбинация вакцина/ингибитор, как правило, содержит в «безопасном и эффективном количестве» компоненты предлагаемой в изобретении комбинации вакцина/ингибитор, указанной в настоящем описании. В контексте настоящего описания под «безопасным и эффективным количеством» предпочтительно подразумевается количество компонентов, предпочтительно по меньшей мере одной РНК, кодирующей по меньшей мере один антиген, и ингибитора PD-1-пути, которое является достаточным для значимой индукции положительной модификации или предупреждения заболевания или нарушения, указанного в настоящем описании. Однако в то же время «безопасное и эффективное количество» является достаточно небольшим, чтобы избегать серьезных побочных действий, другими словами, обеспечивать разумное соотношение между преимуществом и риском. Определение этих пределов, как правило, находится в компетенции осуществляющего лечение врача.
Предлагаемую в изобретении комбинацию вакцина/ингибитор можно вводить орально, парентерально, с помощью спрея для ингаляции, местно, ректально, назально, трансбуккально, вагинально или с помощью имплантируемого резервуара. Понятие «парентеральный» в контексте настоящего описания включает подкожную, внутривенную, внутримышечную, внутрисуставную, интронодальную, интрасиновиальную, надчревную, внутриоболочечную, внутрипеченочную, в пораженный участок, внутричерепную, трансдермальную, внутрикожную, внутрилегочную, внутрибрюшинную, внутрисердечную, внутриартериальную и подъязычную инъекцию или инфузию. Предпочтительно РНК-вакцину вводят путем внутрикожного или внутримышечного введения, а ингибитор PD-1-пути предпочтительно вводят путем внутримышечной или внутрибрюшинной инъекции, более предпочтительно путем внутривенной инфузии, в том случае, когда он находится в форме антитела.
Согласно следующему объекту изобретения задача, положенная в основу настоящего изобретения, решается с помощью фармацевтической композиции, содержащей вакцину и ингибитор, прежде всего в качестве вакцины РНК-вакцину, содержащую по меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один антиген, и в качестве ингибитора композицию, содержащую ингибитор PD-1-пути, где оба компонента предпочтительно представляют собой описанные выше компоненты. Аналогично этому, фармацевтическую композицию предпочтительно приготавливают и вводят так, как это описано выше для компонентов предлагаемой в изобретении комбинации вакцина/ингибитор. Такая фармацевтическая композиция может дополнительно содержать любой ингредиент, указанный выше для предлагаемой в изобретении комбинации вакцина/ингибитор.
Таким образом, указанная комбинация РНК-вакцины и ингибитора PD-1-пути, как указано в настоящем описании, может находиться в виде одной композиции, например, фармацевтической композиции, предлагаемой в настоящем изобретении, или может находиться в виде набора компонентов, в котором различные компоненты представляют собой различные части такого набора компонентов. Указанные различные компоненты, такие как вакцина и ингибитор, могут быть приготовлены каждый в виде фармацевтической композиции или в виде композиции, указанной выше. Предпочтительно каждая из различных частей набора содержит отдельный компонент, например, одна часть содержит РНК-вакцину, указанную в настоящем описании, а другая часть содержит ингибитор PD-1-пути, указанный в настоящем описании, и т.д.
Таким образом, следующим объектом настоящего изобретения являются наборы, прежде всего, наборы компонентов. Такие наборы, прежде всего наборы компонентов, как правило, содержат в качестве компонентов индивидуально или в комбинации с другими компонентами, указанными в настоящем описании, РНК-вакцину, содержащую по меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один антиген, и, предпочтительно в другом компоненте набора, ингибитор PD-1-пути, указанный в настоящем описании. Предлагаемая в изобретении комбинация вакцина/ингибитор, указанная в настоящем описании, необязательно в сочетании с другими компонентами, указанными в настоящем описании, такими как дополнительный адъювант, может находиться в одном и том же или в различных компонентах набора. Например, по меньшей мере один компонент набора может содержать РНК-вакцину, содержащую по меньшей мере одну РНК, которая кодирует по меньшей мере один антиген, указанный в настоящем описании, по меньшей мере один другой компонент набора может содержать ингибитор PD-1-пути, указанный в настоящем описании, и необязательно по меньшей мере еще один компонент набора может содержать дополнительный адъювант, указанный в настоящем описании. Набор или состоящий из компонентов набор может, кроме того, содержать технические инструкции с информацией о введении и дозах предлагаемой в изобретении комбинации вакцина/ингибитор, предлагаемой в изобретении фармацевтической композиции или любого из ее компонентов или частей.
Предлагаемую в изобретении комбинацию вакцина/ингибитор, предлагаемую в изобретении фармацевтическую композицию или предлагаемый в изобретении набор компонентов, содержащий РНК-вакцину и ингибитор PD-1-пути, можно применять в медицинских целях для человека, а также в ветеринарии, предпочтительно в медицинских целях для человека.
Таким образом, следующий объект настоящего изобретения относится к первому медицинскому применению предлагаемой в изобретении комбинации вакцина/ингибитор, предлагаемой в изобретении фармацевтической композиции и предлагаемого в изобретении набора компонентов, содержащих РНК-вакцину и ингибитор PD-1-пути, как указано в настоящем описании. Следовательно, предлагаемую в изобретении комбинацию вакцина/ингибитор, предлагаемую в изобретении фармацевтическую композицию и предлагаемый в изобретении набор компонентов, который содержит РНК-вакцину и ингибитор PD-1-пути, указанные в настоящем описании, можно применять в качестве лекарственного средства.
Другой объект настоящего изобретения относится ко второму медицинскому применению предлагаемой в изобретении комбинации вакцина/ингибитор, предлагаемой в изобретении фармацевтической композиции и предлагаемого в изобретении набора компонентов, который содержит РНК-вакцину и ингибитор PD-1-пути, указанные в настоящем описании. Так, предлагаемую в изобретении комбинацию вакцина/ингибитор, предлагаемую в изобретении фармацевтическую композицию и предлагаемый в изобретении набор компонентов, который содержит РНК-вакцину и ингибитор PD-1-пути, указанные в настоящем описании, можно применять для лечения и/или ослабления различных заболеваний, прежде всего раковых и опухолевых заболеваний и инфекционных заболеваний, указанных в настоящем описании.
В этом контексте раковые или опухолевые заболевания, предпочтительно включают, например, меланомы, злокачественные меланомы, карциномы ободочной кишки, лимфомы, саркомы, бластомы, почечные карциномы, опухоли желудочно-кишечного тракта, глиомы, опухоли предстательной железы, рак мочевого пузыря, ректальные опухоли, рак желудка, эзофагеальный рак, рак поджелудочной железы, рак печени, карциномы молочной железы (или рак молочной железы), рак матки, рак шейки матки, острый миелолейкоз (AML), острый лимфолейкоз (ALL), хронический миелолейкоз (CML), хронический лимфолейкоз (CLL), гепатомы, различные индуцируемые вирусами опухоли, такие, например, как карцинома, вызываемая вирусом папилломы (например, карцинома шейки матки или рак шейки матки), аденокарциномы, опухоли, вызываемые вирусом герпеса (например, лимфома Беркитта, В-клеточная лимфома, индуцируемая вирусом Эпштейна-Барра (EBV)), опухоли, индуцируемые вирусом гепатита В (печеночно-клеточная карцинома), лимфомы, индуцируемые HTLV-1 и HTLV-2, невриному слухового нерва, карциномы легкого (т.е. рак легкого или бронхиальная карцинома), мелкоклеточные карциномы легкого, рак глотки, анальную карциному, глиобластому, ректальную карциному, астроцитому, опухоли головного мозга, ретинобластому, базалиому, метастазы в головной мозг, медуллобластомы, вагинальный рак, рак поджелудочной железы, рак яичек, синдром Ходжкина, менингиомы, болезнь Шнеебергера, опухоль гипофиза, грибовидный микоз, карциноиды, невриномы, спиналиому, лимфому Беркитта, рак гортани, рак почки, тимому, карциному тела матки, рак кости, не-ходжкинские лимфомы, рак мочеиспускательного канала, CUP-синдром (синдром рака с невыявленным первичным очагом), опухоли головы/шеи, олигодендроглиому, рак вульвы, рак кишечника, карциному ободочной кишки, эзофагеальную карциному (т.е. эзофагеальный рак), связанные с бородавками состояния, опухоли тонкого кишечника, краниофарингеомы, карциному яичника, опухоли гениталий, рак яичника (т.е. карцинома яичника), карциному поджелудочной железы (т.е. рак поджелудочной железы), карциному эндометрия, метастазы в печень, рак полового члена, рак языка, рак желчного пузыря, лейкозы, плазмоцитому, опухоль века, рак предстательной железы (т.е. опухоли предстательной железы) и т.д.
В конкретных вариантах осуществления изобретения наиболее предпочтительным является лечение рака легкого (например, немелкоклеточного рака легкого или мелкоклеточного рака легкого) или рака предстательной железы.
В этом контексте инфекционные заболевания предпочтительно включают инфекционные заболевания, вызываемые вирусами, бактериями или простейшими. Такие инфекционные заболевания, предпочтительно инфекционные заболевания, вызываемые вирусами, бактериями или простейшими, как правило, выбирают из группы, включающей инфекции, вызываемые Acinetobacter, африканскую сонная болезнь (африканский трипаносомоз), СПИД (синдром приобретенного иммунодефицита), амебиаз, анаплазмоз, сибирскую язву, аппендицит, инфекции, вызываемые Arcanobacterium haemolyticum, аргентинскую геморрагическую лихорадку, аскариоз, аспергиллез, астровирусные инфекции, эпидермофитию стопы, бабезиоз, инфекции, вызываемые Bacillus cereus, бактериальный менингит, бактериальную пневмонию, бактериальный вагиноз (BV), бактероидные инфекции, балантидиоз, байлисаскаридозные инфекции, билхарзиоз, инфекции, вызываемые полиомавирусом BK, черную пьедру, инфекции, вызываемые Blastocysts hominis, бластомикоз, боливийскую геморрагическую лихорадку, инфекции, вызываемые Borrelia (боррелиоз), ботулизм (и детский ботулизм), бычий цепень, бразильскую геморрагическую лихорадку, бруцеллез, инфекции, вызываемые Burkholderia, язву Бурули, инфекции, вызываемые калицивирусами (норовирусом и саповирусом), кампилобактериоз, кандидоз (кандидоз), инфекции, вызываемые собачьим цепнем, болезнь кошачьей царапины, болезнь Шагаса (американский трипаносомоз), шанкроид, ветрянку, хламидийные инфекции, инфекции, вызываемые Chlamydia trachomatis, инфекции, вызываемые Chlamydophila pneumoniae, холеру, хромобластомикоз, паховый лимфогранулематоз, клоноршиоз, инфекции, вызываемые Clostridium difficile, коккидиоидомикоз, простуду, колорадскую клещевую лихорадку (CTF), обычную простуду (насморк) (острый вирусный ринофарингит; острый ринит), остроконечные кондиломы, конъюнктивит, болезнь Крейтсфельдта-Якоба (CJD), геморрагическую лихорадку Крым-Конго (CCHF), криптококкоз, криптоспоридиоз, кожные мигрирующие личинки (CLM), кожный лейшманиоз, циклоспориоз, цистицеркоз, инфекции, вызываемые цитомегаловирусом, лихорадку Денге, дерматофитоз, диентамебиоз, дифтерию, дифиллоботриоз, донаваноз, дракункулез, весенне-летний менингоэнцефалит (FSME), геморрагическую лихорадку Эбола, эхинококкоз, эрлихиоз, энтеробиоз (инфекции, вызываемые острицами), инфекции, вызываемые Enterococcus, инфекции, вызываемые энтеровирусами, эпидемический тиф, эпиглоттис, инфекционный мононуклеоз, вызываемый вирусом Эпштейна-Барра, инфекционную эритему (пятая болезнь), внезапную экзантему, фасциолопсиоз, фасциолоз, фатальную семейную бессонницу (FFI), пятую болезнь, филариоз, пищевое отравление рыбами (сигуатера), рыбий цепень, грипп, пищевое отравление, вызываемое Clostridium perfringens, лисий солитер, инфекции, вызываемые свободноживущими амебами, инфекции, вызываемые Fusobacterium, газовую гангрену, геотрихоз, синдром Герстманна-Штросслера-Шейнкера (GSS), гиардиоз, сап, гнатостомиоз, гонорею, паховую гранулему (донованоз), стрептококковые инфекции группы А, стрептококковые инфекции группы В, инфекции, вызываемые Haemophilus influenzae, ящур (HFMD), хантавирусный легочный синдром (HPS), инфекции, вызываемые Helicobacter pylori, гемолитическо-уремический синдром (HUS), геморрагическую лихорадку, сопровождающуюся почечным синдромом (HFRS), генипавирусные инфекции, гепатит А, гепатит В, гепатит С, гепатит D, гепатит Е, герпес простой, герпес простой типа I, герпес простой типа II, опоясывающий лишай, гистоплазмоз, полые бородавки, инфекции, вызываемые нематодами, инфекции, вызываемые человеческим бокавирусом, гранулоцитарный элихиоз человека, гранулоцитарный анаплазмоз человека (HGA), инфекции, вызываемые человеческим метапневмовирусом, моноцитарный элихиоз человека, инфекции, вызываемые человеческим папилломавирусом (HPV), инфекции, вызываемые человеческим вирусом парагриппа, гименолепиоз, грипп, изоспориоз, японский энцефалит, болезнь Кавасаки, кератит, инфекции, вызываемые Kingella kingae, болезнь Куру, лямблиоз (гиардиоз), лихорадку Ласса, легионеллез (болезнь легионеров, лихорадку Понтиак), лейшманиоз, лепру, лептоспироз, вши, листериоз, боррелиоз Лайма, болезнь Лайма, лимфатический филяриоз (элефантиаз), лимфоцитарный хориоменингит, малярию, геморрагическую лихорадку Марбург (MHF), вирус Марбург, корь, мелиоидоз (болезнь Уайтмора), менингит, менингококковую болезнь, метагонимиоз, микроспоридиоз, миниатюрный цепень, выкидыш (воспаление предстательной железы), контагиозный моллюск (МС), мононуклеоз, свинку, мышиный тиф (эндемический тиф), мицетому, заболевание, вызываемое Mycoplasma hominis, микоплазменную пневмонию, миаз, мокрый/пеленочный дерматит, неонатальный конъюнктивит (офтальмия новорожденных), неонатальный сепсис (хориоамнионит), нокардиоз, влажную гангрену, инфекции, вызываемые вирусом Норвалк, онхоцеркоз (речная слепота), остеомиелит, отит среднего уха, паракокцидиоидомикоз (Южно-Американский бластомикоз), парагонимиоз, паратиф, пастереллез, педикулез головы (головные вши), педикулез тела (платяная вошь), лобковый педикулез (лобковые вши, крабовые вши), воспаление тазовых органов (PID), коклюш (воющий кашель), железистую лихорадку Пфейффера, чуму, пневмококковые инфекции, пневмоцистозную пневмонию (РСР), пневмонию, полиомиелит (детская хромота), полиомиелит, свиной цепень, инфекции, вызываемые превотеллами, первичный амебный менингоэнцефалит (РАМ), прогрессирующую многоочаговую лейкоэнцефалопатию, псевдокруп, пситтакоз, Q-лихорадку, кроличью лихорадку, бешенство, лихорадку от крысиного укуса, синдром Рейтера, респираторные синцитиальные вирусные инфекции (RSV), риноспоридиоз, риновирусные инфекции, инфекции, вызванные риккетсиями, осповидный риккетсиоз, лихорадку долины Рифт (RVF), пятнистую лихорадку Скалистых гор (RMSF), ротавирусные инфекции, краснуху, сальмонеллезный паратиф, сальмонеллезный тиф, сальмонеллез, SARS (тяжелый острый респираторный синдром), чесотку, скарлатину, шистосомиоз (билхарциоз), японскую речную лихорадку, сепсис, шигеллоз (бактериальная дизентерия), опоясывающий герпес, оспу натуральную (вариола), мягкий шанкр, споротрихоз, стафилококковое пищевое отравление, стафилококковые инфекции, стронгилоидоз, сифилис, тениоз, столбняк, трехдневную лихорадку, клещевой энцефалит, лишай подбородка (паразитарный сикоз), лишай головы (опоясывающий лишай головы), лишай тела (опоясывающий лишай тела), лишай в паховой области (зуд жокея), лишай ладоней и рук (опоясывающий лишай рук), черный лишай, лишай ступней ног (стопа атлета), лишай на ногтях рук и ног (онихомикоз), лишай разноцветный (питириоз разноцветный), токсокариоз (синдром «блуждающей личинки» глазной (OLM) и синдром «блуждающей личинки» висцеральный (VLM)), токсоплазмоз, трихинеллез, трихомоноз, трихуроз (инфекции, вызываемые нематодами волосоглавами), триппер, трипаносомоз (сонная болезнь), лихорадка тсутсугамуши (цуцугамуши), туберкулез, туляремия, тиф, сыпной тиф, инфекции, вызываемые Ureaplasma urealyticum, вагинит (кольпит), вариантная болезнь Крейтсфельдта-Якоба (vCJD, nvCJD), венесуэльский энцефалит лошадей, венесуэльскую геморрагическую лихорадку, вирусную пневмонию, индийский висцеральный лейшманиоз, бородавки, лихорадку Западного Нила, западный энцефалит лошадей, белую пьедру (лишай белый), лающий кашель, дрожжевую пятнистость, желтую лихорадку, инфекции, вызываемые Yersinia pseudotuberculosis, иерсиниоз и зигомикоз.
Наиболее предпочтительными являются заболевания, прежде всего раковые или опухолевые заболевания, которые ассоциированы со сверхэкспрессией по меньшей мере одного представителя PD-1 -пути, предпочтительно рецептора PD-1 и/или его лигандов PD-L1 и PD-L2.
В этом контексте наиболее предпочтительным является лечение меланомы, глиобластомы и карцином поджелудочной железы, легкого, молочной железы, ободочной кишки, яичника и клеток почек, уротелиальных видов рака, плоскоклеточных карцином головы и шеи и гепатоклеточной карциномы, которые ассоциированы со сверхэкспрессией PD-L1. Наиболее предпочтительным является лечение немелкоклеточного рака легкого (NSCLC) или мелкоклеточного рака легкого, ассоциированного со сверхэкспрессией любого представителя PD-1-пути, прежде всего PD-1 или PD-L1.
В другом варианте осуществления изобретения наиболее предпочтительным является лечение раковых или опухолевых заболеваний, ассоциированных с отсутствием или низким уровнем экспрессии по меньшей мере одного представителя PD-1-пути, предпочтительно рецептора PD-1 и/или его лигандов PD-L1 и PD-L2. В этом контексте РНК-вакцина, входящая в предлагаемую в изобретении комбинацию вакцина/ингибитор, обладает способностью индуцировать экспрессию по меньшей мере одного представителя PD-1-пути, например, PD-L1, в организме подлежащего лечению пациента и тем самым обеспечивать терапевтическую активность ингибитора PD-1.
Другой объект настоящего изобретения относится к ингибитору PD-1-пути, указанному выше, который предназначен для применения в терапии в комбинации с РНК-вакциной, содержащей по меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один антиген, указанный выше, например, для применения в способе лечения или предупреждения опухолевых и/или раковых заболеваний, или инфекционных заболеваний, указанных в настоящем описании.
Следующий объект настоящего изобретения относится к РНК-вакцине, содержащей по меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один антиген, указаной выше, например, для применения в способе лечения или предупреждения опухолевых и/или раковых заболеваний, или инфекционных заболеваний, указанных в настоящем описании.
Кроме того, еще одним объектом настоящего изобретения является способ трансфектирования и/или обработки клеток, ткани или организма, в котором применяют или вводят предлагаемую в изобретении комбинацию вакцина/ингибитор, прежде всего для терапевтических целей. В этом контексте, как правило, после получения предлагаемой в изобретении комбинации вакцина/ингибитор предлагаемую в изобретении комбинацию вакцина/ингибитор предпочтительно вводят в клетку, ткань или организм, предпочтительно используя любые из указанных в настоящем описании форм введения. Способ трансфектирования и/или обработки клетки можно осуществлять in vitro, in vivo или ex vivo.
Таким образом, в изобретение предложен также способ лечения, заключающийся в том, что вводят индивидууму, нуждающемуся в этом, в терапевтически эффективном количестве РНК-вакцину, содержащую по меньшей мере одну РНК, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один антиген, которая указана в настоящем описании, в комбинации с композицией, содержащей ингибитор PD-1-пути, как указано выше.
В предпочтительном варианте осуществления изобретения способ включает in vitro трансфекцию выделенных клеток. Клетки, применяемые в этом случае, предпочтительно представляют собой человеческие клетки или клетки животных, прежде всего, клетки первичной клеточной культуры, которые затем повторно переносят в организм человека или животного. Перед осуществлением трансфекции указанные клетки, как правило, выделяют из организма пациента, подлежащего лечению, и культивируют.
В другом предпочтительном варианте осуществления изобретения способ лечения не включает in vitro трансфекцию выделенных клеток. В этом случае РНК-вакцина, указанная выше, которую вводят индивидууму, нуждающемуся в этом, не содержит выделенные клетки, трансфектированные по меньшей мере одной РНК, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один антиген, содержащейся в РНК-вакцине.
В настоящем изобретении, если не указано иное, различные отличительные признаки альтернатив и вариантов осуществления изобретения можно объединять друг с другом. В контексте настоящего изобретения понятие «содержащий» можно заменять понятием «состоящий из», в тех случаях, когда это применимо.
Краткое описание чертежей
Чертежи представлены исключительно в качестве иллюстрации и служат для дополнительного описания настоящего изобретения. Указанные чертежи не следует рассматривать как ограничивающие объем настоящего изобретения.
На чертежах показано:
на фиг. 1 - результаты, демонстрирующие, что РНК-вакцина (OVA-RNActive R1710) обладает синергетическим действием при применении с антителом к PD-1. Мышей линии С57 BL/6 подвергали контрольному заражению путем подкожного введения 3×105 сингенных клеток опухоли E.G7-OVA в день 0 и затем обрабатывали либо только вакциной OVA RNActive (32 мкг), либо в комбинации с антителом к PD-1 или контрольным IgG (100 мкг i.p.) согласно указанной схеме;
на фиг. 2 - данные о пропорциях выживаемости мышей, несущих опухоли E.G7-OVA, которых подвергали различным терапиям. Как описано в примере 2, мышей обрабатывали либо только вакциной OVA-RNActive, либо только антителом к PD-1, либо их комбинацией;
на фиг. 3 - последовательность мРНК R1710 с оптимизированным G/C-содержанием, кодирующая овальбумин Gallus gallus, содержащаяся в вакцине OVA-RNActive.
Примеры
Примеры представлены исключительно в качестве иллюстрации и служат для дополнительного описания настоящего изобретения. Указанные примеры не следует рассматривать как ограничивающие объем настоящего изобретения.
Пример 1: Получение мРНК-вакцины
1. Получение конструкций ДНК и мРНК
Для рассматриваемых примеров получали последовательность ДНК, кодирующую мРНК (R1710) овальбумина Gallus gallus, и применяли для последующих реакций транскрипции in vitro.
Согласно первой процедуре получения получали последовательность ДНК, кодирующую указанную выше мРНК. Конструкцию получали путем модификации кодирующей последовательности дикого типа посредством интродукции последовательности с оптимизированным для стабилизации содержанием GC, за которой следовала стабилизирующая последовательность, выведенная из альфа-глобин-3'-UTR (muag (мутантная альфа-глобин-3'-UTR)), сегмент, состоящий из 64 аденозиновых остатков (поли-А-последовательность), сегмент, состоящий из 30 цитозиновых остатков (поли-С-последовательность) и гистоновая структура стебель-петля. Последовательность соответствующей мРНК представлена в SEQ ID NO: 2 (см. фиг. 3).
2. Транскрипция in vitro
Соответствующую ДНК-плазмиду, полученную согласно процедуре, описанной в примере 1, транскрибировали in vitro с помощью полимеразы Т7. Затем мРНК очищали с помощью PureMessenger® (фирма Cure Vac, Тюбинген, Германия).
3. Реагенты
Комплексообразующий реагент: протамин
4. Получение вакцины
мРНК R1710 включали в комплекс с протамином путем добавления протамина к мРНК в соотношении 1:2 (мас./мас.) (адъювантный компонент). После инкубации в течение 10 мин добавляли в таком же количестве свободную мРНК R1710, используемую в качестве кодирующей антиген РНК.
Вакцина OVA-RNActive (R1710): содержащий адъювант компонент, состоящий из мРНК, кодирующей овальбумин Gallus gallus (R1710), имеющий SEQ ID NO: 2, включали в комплекс с протамином в соотношении 2:1 (мас./мас.) и кодирующей антиген свободной мРНК, кодирующей овальбумин Gallus gallus (R1710), имеющий SEQ ID NO: (соотношение 1:1; включенная в комплекс РНК : свободная РНК).
Пример 2: Комбинация антитела к PD1 и РНК-вакцины
В день 0 мышам линии C57BL/6 подкожно имплантировали (в правый бок) 3×105 клеток E.G7-OVA/мышь (в объеме 100 мкл в ЗФР). E.G7-OVA представляет собой клеточную линию мышиной Т-клеточной лимфомы, стабильно экспрессирующую овальбумин (OVA) Gallus gallus. Внутрикожную вакцинацию с использованием РНК-вакцины, содержащей мРНК OVA R1720 (32 мкг/мышь/день вакцинации) (согласно примеру 1) или лактированный раствор Рингера (RiLa) в качестве буфера-контроля и обработку с использованием моноклонального антитела CD279 к PD-1 (100 мкг i.p.) или контроля изотипа, указанных в таблице 1, начинали в день 4 и повторяли в дни 7, 11, 14, 18 и 21. Животным вводили утром путем инъекции антитело и вакцинировали после обеда с интервалом между обработками, составлявшим как минимум четыре часа.

Антитело к PD-1/CD279 (клон RMP1-14, крысиный IgG2a) и антитело, применяемое в качестве контроля изотипа (клон 2A3, крысиный IgG2a), получали от фирмы BioXCell (Уэст-Лебанон, шт. Нью-Джерси, США).
Мониторинг роста опухоли осуществляли путем измерения размера опухоли в двух направлениях (длина и ширина) с помощью кронциркуля (начиная со дня 4). Объем опухоли рассчитывали с помощью следующей формулы:
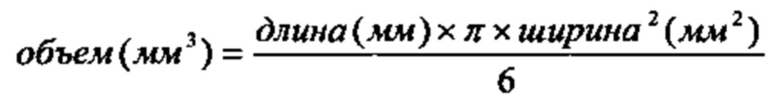
Результаты представлены на фиг. 1 и 2.
Как можно видеть на фиг. 1, вакцина на основе мРНК OVA (OVA-RNActive R1710) при ее применении индивидуально или в комбинации с применяемым в качестве контроля IgG замедляла рост опухоли примерно на 5 дней по сравнению с контрольной обработанной буфером группой. Результаты обработки только одним антителом к PD-1 оказались сопоставимыми с результатами только одной вакцинации, в то время как одновременное применение комбинации РНК-вакцина/антитело к PD-1 приводило к значимому ингибированию роста опухоли, что свидетельствовало о синергетическом действии. Линиями представлено развитие среднего объема опухоли, а «усами» показаны величины С.К.О.. Статистический анализ проводили на основе двухстороннего дисперсионного анализа с использованием апостериорного критерия Бонферрони.
Как можно видеть на фиг. 2, введение только одной OVA мРНК-вакцины (OVA-RNActive R1710) или только одного антитела к PD-1 уже оказывало значимое действие на выживаемость, в то время как одновременное введение комбинации РНК-вакцина/антитело к PD-1 приводило к 50%-ной выживаемости (3 из 6 животных), что свидетельствовало о синергетическом действии.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> КУРЕВАК ГмБХ
<120> Комбинация вакцинации и ингибирования пути PD-1
<130> CU01P138WO1
<160> 18
<170> PatentIn, версия 3.5
<210> 1
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<223> muag (мутантная 3'-UTR (альфа-)глобина)
<400> 1
gcccgatggg cctcccaacg ggccctcctc ccctccttgc accg 44
<210> 2
<211> 1378
<212> РНК
<213> Искусственная последовательность
<220>
<223> мРНК, соответствующая конструкции искусственной ДНК
<400> 2
gggagaaagc uuaccauggg cagcaucggg gccgcgucga uggaguucug cuucgacgug 60
uucaaggagc ugaaggucca ccacgccaac gagaacaucu ucuacugccc gaucgccauc 120
augagcgcgc ucgccauggu guaccugggc gccaaggaca gcacccggac gcagaucaac 180
aagguggucc gcuucgacaa gcugcccggc uucggggacu cgaucgaggc gcagugcggc 240
accagcguga acgugcacag cucgcuccgg gacauccuga accagaucac caagccgaac 300
gacgucuaca gcuucagccu ggccucgcgg cucuacgccg aggagcgcua cccgauccug 360
cccgaguacc ugcagugcgu gaaggagcuc uaccggggcg ggcuggagcc gaucaacuuc 420
cagacggcgg ccgaccaggc ccgggagcug aucaacagcu ggguggagag ccagaccaac 480
ggcaucaucc gcaacguccu ccagccgucg agcguggaca gccagaccgc gauggugcug 540
gucaacgcca ucguguucaa gggccugugg gagaagacgu ucaaggacga ggacacccag 600
gccaugcccu uccgggugac cgagcaggag ucgaagccgg uccagaugau guaccagauc 660
gggcucuucc ggguggcgag cauggccagc gagaagauga agauccugga gcugccguuc 720
gccucgggca cgaugagcau gcucgugcug cugcccgacg aggucagcgg ccucgagcag 780
cuggagucga ucaucaacuu cgagaagcug accgagugga ccagcagcaa cgugauggag 840
gagcgcaaga ucaaggugua ccucccgcgg augaagaugg aggagaagua caaccugacg 900
ucgguccuga uggcgauggg gaucaccgac guguucagca gcucggccaa ccucagcggc 960
aucagcucgg ccgagagccu gaagaucagc caggcggugc acgccgccca cgcggagauc 1020
aacgaggccg gccgggaggu cguggggucg gccgaggcgg gcguggacgc cgccagcguc 1080
agcgaggagu uccgcgcgga ccacccguuc cuguucugca ucaagcacau cgccaccaac 1140
gccgugcucu ucuucggccg gugcgugucg cccugaccac uaguuauaag acugacuagc 1200
ccgaugggcc ucccaacggg cccuccuccc cuccuugcac cgagauuaau aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaugcauc 1320
cccccccccc cccccccccc cccccccccc aaaggcucuu uucagagcca ccagaauu 1378
<210> 3
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 3
Arg Arg Arg Arg Arg Arg Arg
1 5
<210> 4
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 4
Arg Arg Arg Arg Arg Arg Arg Arg
1 5
<210> 5
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 5
Arg Arg Arg Arg Arg Arg Arg Arg Arg
1 5
<210> 6
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 6
His His His Arg Arg Arg Arg Arg Arg Arg Arg Arg
1 5 10
<210> 7
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 7
Arg Arg Arg Arg Arg Arg Arg Arg Arg His His His
1 5 10
<210> 8
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 8
His His His Arg Arg Arg Arg Arg Arg Arg Arg Arg His His His
1 5 10 15
<210> 9
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 9
Tyr Ser Ser Arg Arg Arg Arg Arg Arg Arg Arg Arg Ser Ser Tyr
1 5 10 15
<210> 10
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 10
Arg Lys His Arg Lys His Arg Lys His Arg Lys His
1 5 10
<210> 11
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 11
Tyr Arg Lys His Arg Lys His Arg
1 5
<210> 12
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 12
Arg Arg Arg Arg Arg Arg Arg Arg Arg Arg Arg Arg
1 5 10
<210> 13
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 13
His His His His His His Arg Arg Arg Arg Arg Arg Arg Arg Arg His
1 5 10 15
His His His His His
20
<210> 14
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 14
His His His Arg Arg Arg Arg His His His
1 5 10
<210> 15
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 15
His His His His His His Arg Arg Arg Arg His His His His His His
1 5 10 15
<210> 16
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 16
Tyr Ser Ser Arg Arg Arg Arg Arg Arg Arg Arg Arg Ser Ser Tyr
1 5 10 15
<210> 17
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 17
Arg Lys His Arg Lys His Arg Lys His Arg Lys His
1 5 10
<210> 18
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> катионный пептид
<400> 18
Tyr Arg Lys His Arg Lys His Arg
1 5
<---
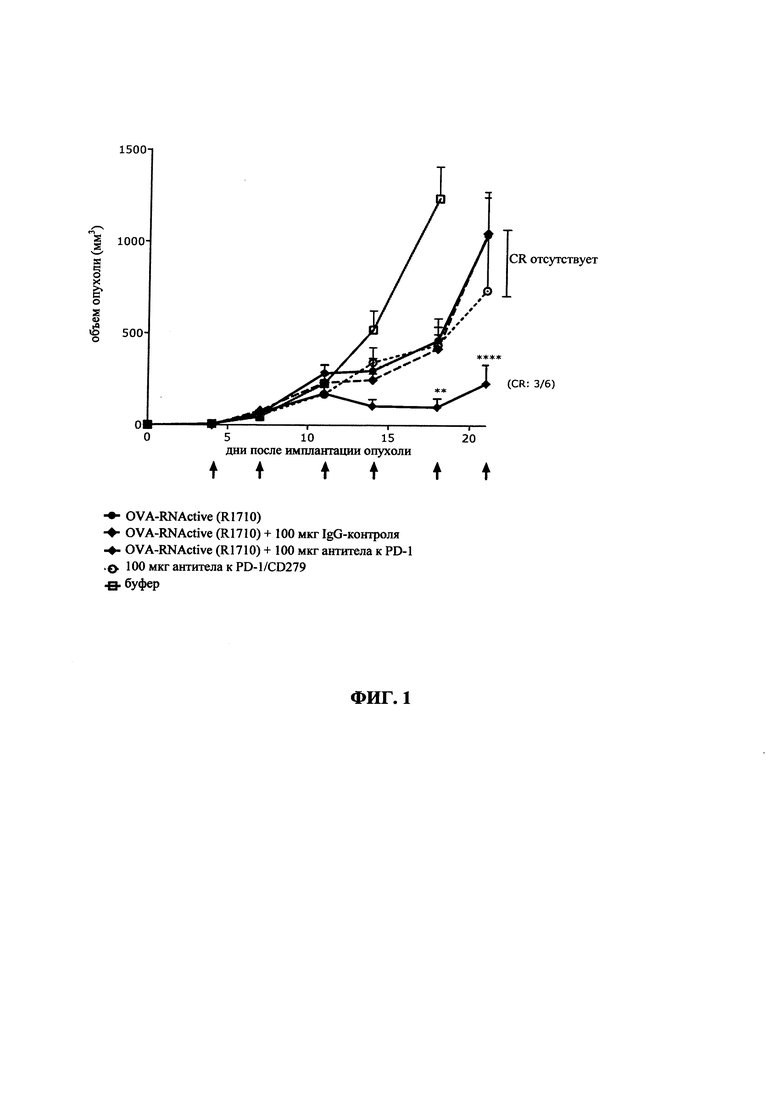
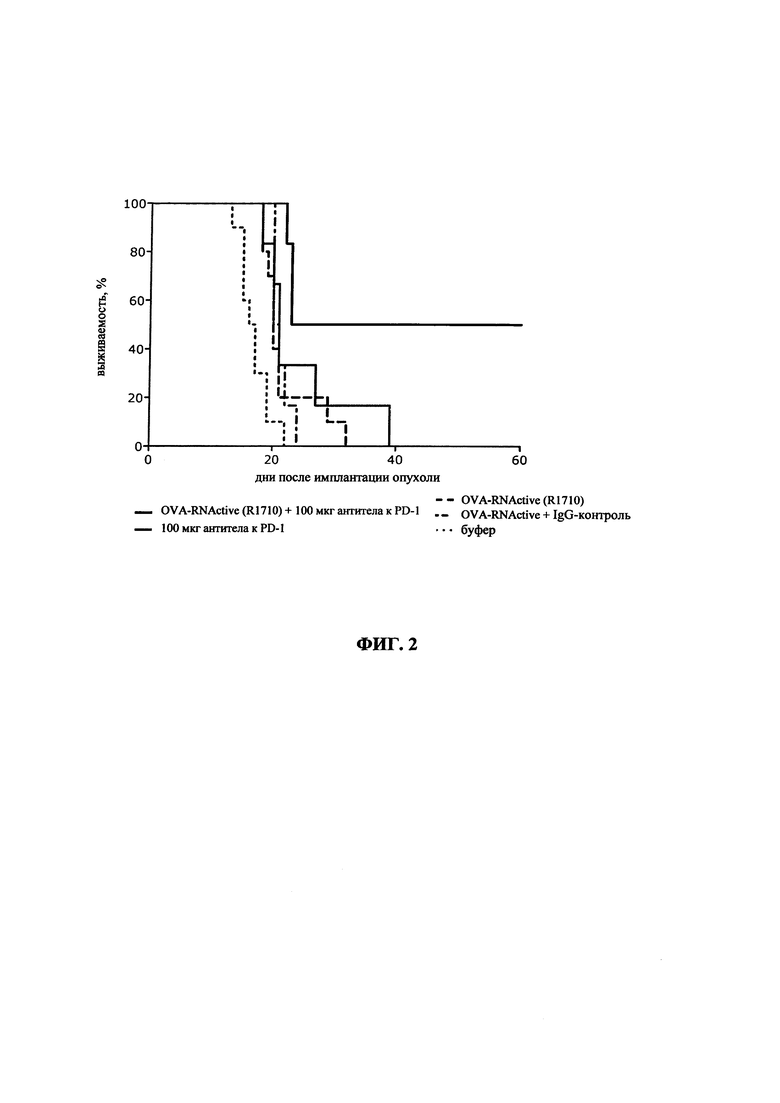

Группа изобретений относится к комбинации вакцина/ингибитор, содержащей противораковую РНК-вакцину, которая содержит по меньшей мере одну РНК, содержащую по меньшей мере одну открытую рамку считывания (ОРС), которая кодирует по меньшей мере один опухолевый антиген, и композицию, содержащую по меньшей мере один ингибитор PD-1-пути, где ингибитор PD-1-пути представляет собой антагонистическое антитело, направленное против PD-1 или PD-L1. Также предложено применение ингибитора PD-1-пути в комбинации с РНК-вакциной в составе фармацевтической композиции, наборе и способе для терапии онкологического заболевания. Одновременное применение комбинации РНК-вакцина/антагонистическое антитело к PD-1 приводит к значимому ингибированию роста опухоли и характеризуется синергетическим действием. 6 н. и 9 з.п. ф-лы, 3 ил., 1 табл., 2 пр.
1. Комбинация для лечения онкологического заболевания включающая:
(I) противораковую РНК-вакцину, содержащую по меньшей мере одну РНК, где по меньшей мере одна РНК представляет собой мРНК, содержащую по меньшей мере одну открытую рамку считывания (ОРС), кодирующую по меньшей мере один опухолевый антиген, и
(II) композицию, содержащую ингибитор PD-1-пути, где ингибитор PD-1-пути представляет собой антагонистическое антитело, направленное против PD-1 или PD-L1.
2. Комбинация по п. 1, в которой антитело, мишенью которого является PD-1, представляет собой ниволумаб (BMS-936558/MDX1106), СТ-011 или МК-3475 (SCH 900475).
3. Комбинация по п. 1, в которой антитело, мишенью которого является PD-L1, представляет собой MDX-1105/BMS-936559, MPDL3280A/RG7446 или MEDI4736.
4. Комбинация по одному из пп. 1-3, в которой по меньшей мере одна мРНК, входящая в противораковую РНК-вакцину, представляет собой выделенную мРНК.
5. Комбинация по одному из пп. 1-3, в которой по меньшей мере одна мРНК, входящая в противораковую РНК-вакцину, представляет собой стабилизированную мРНК.
6. Комбинация по одному из пп. 1-3, в которой по меньшей мере одна мРНК, входящая в противораковую РНК-вакцину, является по меньшей мере частично G/C-модифицированной, в которой предпочтительно содержание G/C по меньшей мере в одной открытой рамке считывания по меньшей мере одной мРНК, входящей в противораковую РНК-вакцину, увеличено по сравнению с открытой рамкой считывания дикого типа.
7. Комбинация по одному из пп. 1-3, в которой по меньшей мере одна мРНК, входящая в противораковую РНК-вакцину, содержит область с оптимизированными кодонами, предпочтительно в которой по меньшей мере одна открытая рамка считывания по меньшей мере одной мРНК, входящей в противораковую РНК-вакцину, имеет оптимизированные кодоны.
8. Комбинация по одному из пп. 1-3, в которой по меньшей мере одна мРНК, входящая в противораковую РНК-вакцину, включена в комплекс с носителем.
9. Комбинация по п. 8, в которой носитель представляет собой катионное или поликатионное соединение, или полимерный носитель, предпочтительно протамин.
10. Фармацевтическая композиция для лечения онкологического заболевания, содержащая эффективное количество комбинации по любому из пп. 1-9.
11. Набор для лечения онкологического заболевания, содержащий:
(I) противораковую РНК-вакцину, содержащую по меньшей мере одну РНК, где по меньшей мере одна РНК представляет собой мРНК, содержащую по меньшей мере одну открытую рамку считывания (ОРС), кодирующую по меньшей мере один опухолевый антиген,
(II) композицию, содержащую ингибитор PD-1-пути, где ингибитор PD-1-пути представляет собой антагонистическое антитело, направленное против PD-1 или PD-L1, и
(III) техническую инструкцию.
12. Применение комбинации по любому из пп. 1-9, фармацевтической композиции по п. 10 или набора по п. 11 в способе предупреждения или лечения онкологического заболевания.
13. Применение композиции, содержащей ингибитор PD-1-пути, в комбинации с противораковой РНК-вакциной по любому из пп. 1-9 в терапии онкологического заболевания.
14. Способ лечения онкологического заболевания, включающий введение индивидууму, нуждающемуся в этом, в терапевтически эффективном количестве противораковой РНК-вакцины в комбинации с композицией, содержащей ингибитор PD-1-пути, определенной в любом из пп. 1-9.
15. Способ по п. 14, в котором противораковую РНК-вакцину и композицию, содержащую ингибитор PD-1-пути, вводят последовательно и/или с помощью различных путей введения.
| US 2010040614 A1, 18.02.2010 | |||
| US 20100291156, 18.11.2010 | |||
| US 2010055102 A1, 04.03.2010 | |||
| WO 2012006634 A2, 12.01.2012 | |||
| RU 2009128686 A, 10.02.2011 | |||
| SIERRO S | |||
| R | |||
| ET AL | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2020-04-15—Публикация
2014-02-21—Подача