Настоящее изобретение относится к обладающей признаками изобретения молекуле полимерного носителя общей формулы (I) и к ее вариантам, которые позволяют эффективно осуществлять трансфекцию нуклеиновых кислот в клетки in vivo и in vitro, к комплексу полимерного носителя и груза, сформированному нуклеиновой кислотой и обладающей признаками изобретения молекулой полимерного носителя, а также к способам получения такой обладающей признаками изобретения молекулы полимерного носителя и комплекса обладающего признаками изобретения полимерного носителя с грузом. Настоящее изобретение относится к способам применения такой обладающей признаками изобретения молекулы полимерного носителя и комплекса обладающего признаками изобретения полимерного носителя с грузом в качестве лекарственного средства для лечения различных заболеваний и для получения фармацевтической композиции для лечения таких заболеваний.
В настоящее время различные заболевания требуют лечения, которое включает введение лекарственных средств на основе пептида, белка и нуклеиновой кислоты, в частности трансфекцию нуклеиновых кислот в клетки или ткани. В полной мере терапевтическая эффективность лекарственных средств на основе пептидов, белков и нуклеиновых кислот зачастую оказывается неоправданной из-за их ограниченной способности пересекать плазматическую мембрану клеток млекопитающих, приводя к плохому проникновению в клетки и недостаточной терапевтической эффективности. В настоящее время это препятствие представляет большую помеху для биомедицинского развития и коммерческого успеха многих биофармацевтических агентов (см., например, Foerg и Merkle, Journal of Pharmaceutical Sciences, , 97(1), 2008, cc. 144-162).
Для некоторых заболеваний и расстройств были разработаны подходы на основе генной терапии в качестве специфической формы подобного лечения. В таких методах лечения обычно используют трансфекцию нуклеиновых кислот или генов в клетки или ткани, и подходы на основе генной терапии дополнительно включают инсерцию одной или нескольких таких нуклеиновых кислот или генов в отдельные клетки или ткани для лечения заболевания, например, наследственных заболеваний, в которых дефектный мутантный аллель замещен на функциональный аллель.
Перенос или инсерция одной или нескольких из этих нуклеиновых кислот или генов в клетки индивидуума, однако, в настоящее время по-прежнему представляют большую проблему и абсолютно необходима для обеспечения хорошего терапевтического эффекта лекарственных средств, основанных на нуклеиновых кислотах, особенно в области генной терапии.
Для осуществления успешного транспорта нуклеиновых кислот или генов в клетки индивидуума следует преодолеть несколько препятствий. Транспорт нуклеиновых кислот обычно происходит через соединение нуклеиновой кислоты с клеточной мембраной с последующим поглощением эндосомами. Находясь в эндосомах, интродуцированные нуклеиновые кислоты обособляются от цитозоля. Поскольку экспрессия происходит в цитозоле, эти нуклеиновые кислоты должны покинуть цитозоль. Если нуклеиновые кислоты не покидают цитозоль, либо эндосома сливается с лизосомой, приводя к разрушению ее содержимого, либо эндосома сливается с мембраной, приводя к возвращению ее содержимого во внеклеточную среду. Таким образом, для эффективного переноса нуклеиновых кислот вывод с помощью эндосом представляется одной из наиболее важных стадий помимо эффективности стадии самой трансфекции. До сих пор имеются разные подходы, направленные на достижение такого результата. Однако каких-либо успешных в этом отношении подходов не было.
К агентам трансфекции, применяемым в настоящее время, обычно относятся пептиды, разные полимеры, липиды, а также нано- и микрочастицы (см., например, Gao X., К.S.Kim и др., Aaps J 9(1), 2007, сс.Е92-104). Такие агенты трансфекции обычно успешно применяют только в реакциях in vitro. При трансфекции нуклеиновых кислот в клетки животных in vivo в полной мере должны соблюдаться дополнительные условия. Например, комплекс должен быть стабильным в физиологических солевых растворах в плане агломерации. Кроме того, он не взаимодействует с частями системы комплемента хозяина. Дополнительно комплекс должен защищать нуклеиновую кислоту от раннего внеклеточного разрушения повсеместно присутствующими нуклеазами. Для применения в генной терапии кроме того крайне важно, чтобы носитель не распознавался системой приобретенного иммунитета (не обладал иммуногенностью) и не стимулировал неспецифическую атаку цитокинов (острый иммунный ответ) (см. Gao Kim и др., (2007, выше); Martin М.Е. и К.G.Rice, Aaps J, 9(1), 2007, сс.El8-29; Foerg и Merkle, (2008, выше)).
Foerg и Merkle (2008, выше) рассматривают терапевтическое значение лекарственных средств, основанных на пептидах, белках или нуклеиновых кислотах. В полной мере терапевтическая эффективность таких лекарственных средств зачастую оказывается неоправданной из-за их ограниченной способности пересекать плазматическую мембрану клеток млекопитающих, приводя к плохому проникновению в клетки и недостаточной терапевтической эффективности. В настоящее время это препятствие представляет большую помеху для биомедицинского развития и коммерческого успеха многих биофармацевтических агентов.
В этом контексте Gao и др. (Gao и др. The AAPS Journal, 9(1), 2007, статья 9) видят основное препятствие для применения генной терапии для разработки способа, который доставляет терапевтический ген в отдельные клетки, в которых должным образом протекающая генная экспрессия может быть достигнута. Однако доставка гена и особенно успешная трансфекция нуклеиновых кислот в клетки или ткани представляют сложную задачу и обычно зависят от многих факторов. Для успешной доставки, например, высвобождения нуклеиновых кислот или генов в клетки или ткани, следует преодолеть много барьеров. По мнению Gao и др. (2007), идеальный способ генной доставки должен соответствовать трем основным критериям: (1) он должен защищать трансген от разрушения нуклеазами во внутриклеточных матриксах, (2) он должен переносить трансген через плазматическую мембрану и (3) он не должен иметь вредных побочных эффектов.
Такие цели могут быть достигнуты применением комбинации разных соединений или векторов. В особенности имеется несколько соединений или векторов, которые преодолевают по меньшей мере некоторые из перечисленных барьеров.
В большинстве случаев трансфекцию, например, нуклеиновых кислот, проводят с помощью вирусных или невирусных векторов. Для успешной доставки такие вирусные или невирусные векторы должны быть способны к преодолению указанных выше препятствий. Имеющиеся в настоящее время наиболее успешные стратегии генной терапии основаны на применении вирусных векторов, например, аденовирусных, аденоассоциированных вирусов, ретровирусов и вирусов герпеса. Вирусные векторы способны опосредовать перенос гена с высокой эффективностью и возможностью длительной генной экспрессии, причем они соответствуют 2 из 3 критериев. Однако острый иммунный ответ, иммуногенность и инсерционный мутагенез, изученные в клинических исследованиях по генной терапии, выдвинули серьезную проблему безопасности, касающуюся некоторых обычно используемых вирусных векторов.
Решением этой проблемы может стать применение невирусных векторов. Хотя невирусные векторы не столь эффективны по сравнению с вирусными векторами, многие невирусные векторы были разработаны в качестве альтернативы генной терапии. Способы невирусной доставки генов исследовали с помощью физических (генная доставка без носителя) и химических (генная доставка на основе синтетического вектора) подходов. Физические подходы обычно включают инъекцию иглой, электропорацию, генную пушку, ультразвуковую и гидродинамическую доставку, применение физической силы, которые преодолевают клеточную мембрану и облегчают перенос гена внутрь клетки. В химических подходах обычно применяют синтетические или природные соединения (катионные липиды, катионные полимеры, гибридные системы липид-полимер) в качестве носителей для доставки трансгена в клетки. Хотя существенный прогресс был достигнут на научной основе и исходя из опыта применения различных невирусных систем генной доставки, по-прежнему большинство невирусных подходов не столь эффективно по сравнению с подходами на основе вирусных векторов, особенно для генной доставки in vivo (см., например, Gao et al. The AAPS Journal, 9(1), 2007, статья 9).
За последнее десятилетие были объявлены привлекательные результаты по существенному улучшению, касающемуся доставки в клетку нуклеиновых кислот, на основе результатов физической сборки нуклеиновых кислот или их химического лигирования с так называемыми проникающими в клетку пептидами (ПКП), которые также называют доменами белковой трансдукции (protein-transduction domain - PTD) (см. Foerg и Merkle, (2008, выше)). ПКП - это короткие пептидные последовательности примерно из 10-30 аминокислот, которые могут пересекать плазматическую мембрану клеток млекопитающих и таким образом могут предоставить беспрецедентные возможности для доставки лекарственного средства в клетку. Почти все эти пептиды включают серии катионных аминокислот в комбинации с последовательностью, которая формирует α-спираль при низком значении рН. Поскольку рН in vivo постоянно снижается за счет протонных насосов, конформационное изменение пептида обычно быстро инициируется. Такой отрезок спирали опосредует инсерцию в мембрану эндосомы, что приводит к высвобождению ее содержимого в цитоплазму (см. Foerg и Merkle, (2008, выше); E.Vives, P.Brodin и др., J Biol Chem, 272(25), 1997, сс.16010-7). Несмотря на такие преимущества, предполагают, что серьезное препятствие к опосредованной ПКП доставке лекарственного средства заключается зачастую в быстром метаболическом клиренсе пептидов при контакте с ферментными барьерами эпителия и эндотелия или при их прохождении. Таким образом, метаболическая стабильность ПКП представляет важный биофармацевтический фактор для их клеточной биодоступности. Однако в данной области нет доступных ПКП, которые с одной стороны достаточно стабильны, чтобы нести свой груз к мишени до своего метаболического расщепления, и с другой стороны, чтобы удаляться и не накапливаться в ткани, достигая токсичных уровней.
Еще один подход в данной области, касающийся доставки в клетки молекул с грузом, например, для генной терапии, включает пептидные лиганды (см. Martin и Rice (см. Martin и Rice, The AAPS Journal, 9 (1), 2007, статья 3)). Пептидные лиганды могут быть короткими последовательностями, взятыми от более крупных белков, которые предоставляют важные аминокислоты, требуемые для распознавания рецептора, например, пептид EGF применяют для раковых клеток-мишеней. Были выявлены другие пептидные лиганды, включая лиганды, применяемые для нацеливания на лектиноподобный рецептор-1 окисленных липопротеинов низкой плотности (lectin-like oxidized LDL receptor -LOX-1). Повышенная регуляция LOX-1 в клетках эндотелия ассоциирована с дисфункциональными состояниями, например, гипертонией и атеросклерозом. Однако такие пептидные лиганды непригодны для многих геннотерапевтических подходов, поскольку они не могут связываться с нагрузочными молекулами за счет комплексообразования или адгезии, но требуются ковалентные связи, например, перекрестные сшивки, которые обычно оказывают цитотоксическое воздействие на клетку.
Синтетические векторы также могут применяться в данной области для доставки нагрузочных молекул в клетки, например, для генной терапии. Однако главным недостатком многих синтетических векторов является их плохая эффективность, связанная с трансфекцией, по сравнению с вирусными векторами, и требуются существенные улучшения для возможности дальнейшего клинического исследования. Несколько препятствий, ограничивающих перенос нуклеиновых кислот и in vitro, и in vivo, было установлено - к ним относятся плохая доставка внутрь клеток, токсичность и нестабильность векторов в физиологических условиях (см., например, М.L.Read, К.Н.Bremner и др., J Gene Med 2003, 5(3), cc. 232-245).
Один из подходов в генной терапии заключается в применении катионных липидов. Однако хотя многие катионные липиды чрезвычайно эффективны в плане осуществления трансфекции в культуре клеток, их эффективность не наблюдается в присутствии сыворотки и лишь незначительно проявляется in vivo. Резкое изменение размера, заряда на поверхности и липидного состава происходит при воздействии на липоплексы огромного количества отрицательно заряженных и часто амфотерных белков и полисахаридов, имеющихся в крови, слизистой эпителиальной выстилке или в тканевом матриксе. При введении in vivo липоплексы проявляют тенденцию к взаимодействию с отрицательно заряженными компонентами крови и формируют крупные агрегаты, которые могут адсорбироваться на поверхности циркулирующих красных кровяных клеток, замкнутых в толстом слизистом слое или эмболизированных в микроциркуляторных частях сосудистого русла, предупреждая их от достижения требуемых клеток-мишеней отдаленной локализации. Кроме того, может наблюдаться токсичность, связанная с переносом генов липоплексами. К симптомам inter alia относится индукция воспалительных цитокинов. У людей в разной степени проявляются побочные воспалительные реакции, включая симптомы, напоминающие грипп, которые были отмечены у субъектов, получавших липоплексы. Поэтому возникает вопрос, насколько вообще безопасно липоплексы могут применяться людьми.
Еще одним, более обещающим, подходом в генной терапии является применение катионных полимеров. Катионные полимеры оказываются эффективными в трансфекции нуклеиновых кислот, поскольку они образуют плотный комплекс и конденсируют отрицательно заряженные нуклеиновые кислоты. Поэтому ряд катионных полимеров был исследован в качестве носителей для доставки генов in vitro и in vivo. К ним относятся полиэтилениминные (ПЭИ), полиамидоаминные и полипропиламинные дендримеры, полиаллиламин, катионный декстран, хитозан, катионные белки и катионные пептиды. Хотя большинство катионных полимеров разделяют функцию конденсирования ДНК в мелкие частицы и облегчения поступления в клетку через эндоцитоз за счет взаимодействия зарядов с анионными сайтами на поверхности клетки, они резко различаются по действию, обеспечивающему трансфекцию, и по токсичности. Интересно отметить, что катионные полимеры лучше проявляют действие, обеспечивающее трансфекцию, по мере увеличения молекулярной массы из-за более прочного комплексообразования с нагруженной отрицательно заряженной нуклеиновой кислотой. Однако возрастающая молекулярная масса также приводит к возрастанию токсичности катионного полимера. Возможно ПЭИ является наиболее действенным и наиболее изученным полимером для генной доставки, но основное препятствие для его применения в качестве реагента для трансфекции связано с отсутствием биоразрушения и токсичностью. Кроме того, даже полиплексы, сформированные высокомолекулярными полимерами, проявляют повышенную стабильность в физиологических условиях, и результаты показывают, что такие полимеры могут затруднять распаковку вектора. Например, показано, что поли(L-лизин) (PLL) из 19 и 36 остатков диссоциирует от ДНК быстрее, чем PLL из 180 остатков, приводя к существенному повышению краткосрочной генной экспрессии. Требуется минимальная длина из 6 или 8 катионных аминокислот для компановки ДНК в структуры, действующие при рецептор-опосредованной доставки гена. Однако полиплексы, сформированные короткими поликатионами, нестабильны в физиологических условиях и обычно быстро агрегируют в физиологических солевых растворах. Для преодоления такого отрицательного воздействия Read и др. (М.L.Read, К.Н.Bremner и др., J Gene Med 5(3), 2003, cc. 232-245; M.L.Read, S.Singh и др., Nucleic Acids Res 33(9), 2005, c. e86) разработали новый тип синтетического вектора, основанного на линейном уменьшаемом поликатионе (УПК), полученном окислительным поликонденсированием пептида Cys-Lys10-Cys, который может быть расщеплен под действием внутриклеточной среды для облегчения высвобождения нуклеиновых кислот. Они могут показать, что полиплексы, сформированные УПК, дестабилизируются за счет восстановительных условий, допускающих эффективное высвобождение ДНК и иРНК. Расщепление УПК также снижает токсичность поликатиона до уровней, сопоставимых с уровнями низкомолекулярных пептидов. Недостаток такого подхода Read и др. (2003, выше) находят в том, что эндосомолитический агент хлорохин или катионный липид DOTAP дополнительно требуются для повышения эффективности трансфекции до приемлемых уровней. Поэтому Read и др. (2005, выше) включили остатки гистидина в УПК, поскольку они обладают известной эндосомальной буферной емкостью. Они смогли показать, что обогащенные гистидином УПК могут расщепляться в условиях внутриклеточной восстанавливающей среды, допускающей эффективную цитоплазматическую доставку разнообразных нуклеиновых кислот, включая плазмидную ДНК, молекулы иРНК и миРНК, без потребности в эндосомолитическом агенте хлорохине.
К сожалению, Read и др. (2005, выше) не сообщают, можно ли обогащенные гистидином УПК использовать непосредственно in vivo. В их исследовании трансфекцию проводят в отсутствии сыворотки, чтобы избежать маскирования способности остатков гистидина повышать перенос гена, которое может возникнуть от связывания сывороточных белков с полиплексами, ограничивая поступление в клетку. Предварительные эксперименты показывают, что на способность к трансфекции обогащенных гистидином УПК полиплексов может повлиять наличие сывороточных белков с 50% снижением в GFP-положительных клетках, наблюдаемое при 10% ФСТ (ФСТ - фетальная сыворотка теленка). Для применения in vivo были предложены модификации с гидрофильным полимером поли-[N-(2гидроксипропил)метакриламидом]. К сожалению Read и др. (2005, выше) не предотвратили агрегирования полиплексов поликатионных белков с сывороточными белками. Кроме того, из-за большого избытка полимера, отличающегося высоким соотношением N/P, формируются прочные катионные комплексы при комплексообразовании с нуклеиновой кислотой, которая лишь ограниченно применяется in vivo из-за выраженной тенденции соли к агломерации и взаимодействиям с содержимым сыворотки (опсонизация). Дополнительно комплексы могут стимулировать острый иммунный ответ при применении для целей генной терапии. Read и др. (2003, выше) также не предоставили данных in vivo по комплексам на основе УПК, указанным в публикации. Также было установлено, что эти сильные катионные на основе УПК комплексы полностью неактивны после местного применения на коже. Кроме того, Read и др. (2005, выше) применяют жесткие окислительные условия (30% ДМСО) для индукции выработки высокомолекулярных полимеров с максимально возможной длиной цепей («поэтапно возрастающей полимеризацией») чтобы убедиться, что полностью произошло комплексообразование с грузом нуклеиновой кислоты.
В подходе, близком к подходу Read и др., McKenzie и др. (McKenzie D.L., К.Y.Kwok и др., J Biol Chem 275(14), 2000, cc. 9970-9977; McKenzie D. L., E.Smiley и др., Bioconjug Chem 11(6), 2000, cc. 901-909, US 6770740 B1) разработали пептиды с собственными перекрестными сшивками в качестве агентов доставки генов путем инсерции большого количества цистеинов в короткие синтетические пептиды для снижения токсичности, что наблюдается у высокомолекулярных поликатионов. Для комплексообразования с ДНК смешивали пептиды с собственными перекрестными сшивками с ДНК для индукции межпептидных дисульфидных связей одновременно с комплексообразованием с нагружаемой ДНК. В качестве подходов по доставке гена in vivo они предлагают дериватизацию пептидов с собственными перекрестными сшивками с обманывающим (например, полиэтиленгликолем) или нацеливающим агентом, оперативно связанным с пептидом по месту, отдаленному от каждого из концов. В другом подходе те же авторы разработали с целью маскирования ДНК пептидные конденсаты, за счет которых понижается взаимодействие с компонентами крови, дериватизацию катионного пептида CWK18 без поперечных сшивок с полиэтиленгликолем путем восстанавливаемых или невосстанавливаемых связей (Kwok К.Y., D.L.McKenzie и др., J Pharm Sci 88(10), 1999, cc. 996-1003).
Из вышесказанного следует, что в предшествующем уровне техники сложилось неблагоприятное положение. В частности недостаток пептидов с поперечными сшивками, согласно описанному Read и др. (2003, выше) или McKenzie и др., (2000 I и II, выше, и US 6770740 B1), касается высокого положительного заряда на поверхности сформированных частиц. Из-за высокого положительного заряда частицы проявляют высокую нестабильность в плане агломерации при воздействии на эти частицы in vivo повышенных концентраций солей. Однако такие концентрации солей обычно имеются в клетках in vivo или во внеклеточных средах. Кроме того, комплексы с высоким положительным зарядом показывают выраженную тенденцию к опсонизации. Это приводит к повышенному поглощению макрофагами и, кроме того, к быстрой инактивации комплекса из-за разрушения. Особенно поглощение этих комплексов клетками иммунной системы в общем приводит к последующей стимуляции разных цитокинов. Однако эта неспецифическая активация врожденной иммунной системы представляет тяжелый вред для этих систем и ее следует избегать, особенно для некоторых объектов генной терапии, когда острого иммунного ответа (цитокинового шторма) с очевидностью следует избегать. Дополнительно в биологических системах положительно заряженные комплексы могут быть легко связаны или иммобилизованы отрицательно заряженными компонентами внеклеточного матрикса или сыворотки. Нуклеиновые кислоты из комплекса также могут высвободиться слишком рано, приводя к пониженной эффективности переноса и периоду полураспада этих комплексов in vivo. Кроме того, обратимая дериватизация носителей с маскирующим агентом благоприятствует доставке гена in vivo, например, с полиэтиленгликолем (ПЭГ), возможна только для пептидных мономеров, но не для пептидов с собственными перекрестными сшивками, или предпочтительнее для полимерного носителя с определенной длиной полимерной цепи. В частности, такая обратимая дериватизация была невозможна по концам катионного пептидного носителя с поперечными сшивками. Дополнительно в предшествующем уровне техники были описаны только высокомолекулярные полимеры с длинными полимерными цепями или с неопределенной длиной полимерной цепи, состоящие из пептидов с поперечными сшивками, которые к сожалению так упаковывают свой груз, что высвобождение груза в клетке становится ограниченным. Крайне неопределенная длина цепи полимера дополнительно усложняет применение лекарственного средства, основанного на УПК. Одно из предварительных условий для одобрения лекарственного средства заключается в том, что каждый препарат лекарственного средства всегда имеет один и тот же состав, структуру и свойства. Этого нельзя добиться для комплексов, основанных на УПК из предшествующего уровня техники. Кроме того, полимеры на основе УПК или комплексы, предусмотренные в предшествующем уровне техники, сложно описать из-за их неопределенной структуры или длины цепи полимера. Но описание получаемого комплекса или полимерного носителя абсолютно необходимы для улучшения лекарственного средства.
Таким образом, до настоящего времени нет реального способа или носителя, которые позволили бы и уплотнить, и стабилизировать нуклеиновую кислоту для целей генной терапии и для других терапевтических назначений, демонстрируя в результате хорошую трансфекцию в комбинации с хорошим высвобождением груза нуклеиновой кислоты, особенно in vivo, и низкую токсичность или даже отсутствие токсичности, например, из-за комбинации восстанавливаемого маскирования и восстанавливаемого комплексообразования нуклеиновой кислоты с полимерами с собственными перекрестными сшивками. Таким образом, в данной области остается острая потребность в носителях для переноса гена, которые с одной стоны достаточно стабильны, чтобы донести груз к мишени до их метаболического расщепления, и с другой стороны могут быть удалены из ткани до их накопления и достижения высоких токсических уровней.
Таким образом, задача, решаемая в настоящем изобретении, заключается в обеспечении носителя или агента для комплексообразования, особенно для трансфекции нуклеиновых кислот для целей генной терапии или для других терапевтических применений, которые позволяют компоновать нуклеиновые кислоты, предпочтительно кодирующую ДНК или кодирующую РНК, например, иРНК, и позволяют осуществлять эффективную трансфекцию нуклеиновой кислоты в разные линии клеток in vitro, а также трансфекцию in vivo. Поскольку поглощение клетками происходит через эндосомы, такой носитель или агент для комплексообразования также может допустить или обеспечить эффективное освобождение нуклеиновой кислоты. Дополнительно является предпочтительным, чтобы комплекс обладающего признаками изобретения полимерного носителя с грузом, сформированный грузом нуклеиновой кислоты и такого носителя или агента для комплексообразования, проявлял повышенную устойчивость к агломерации. Такой комплекс также предпочтительно должен обеспечить повышенную стабильность к грузу нуклеиновой кислоты относительно сред, содержащих сыворотку. Наиболее важно получить действие in vivo, тем самым подавляя по меньшей мере частично острую иммунную реакцию. Кроме того, следует подтвердить воспроизводимую выработку и свойства носителя.
Указанная задача решается в настоящем изобретении, сущность которого представлена в формуле изобретения. В частности в первом варианте осуществления настоящего изобретения указанная выше задача решается с помощью молекулы полимерного носителя общей формулы (I):
L-P1-S-[S-P2-S]n-S-P3-L
где
Р1 и Р3 отличны или идентичны по отношению друг к другу и представляют линейную или разветвленную цепь гидрофильного полимера, каждый компонент Р1 и Р3, предоставляющий по меньшей мере одну -SH-часть молекулы, способен к формированию дисульфидной связи при конденсации с компонентом Р2 или в другом варианте с (АА)x, или [(AA)x]z, если такие компоненты применяют в качестве линкера между Р и Р или Р и Р, и/или с другими компонентами (например, (АА)x, [(AA)x]z или L), линейная или разветвленная цепь гидрофильного полимера выбрана независимо друг от друга из полиэтиленгликоля (ПЭГ), поли-N-(2-гидроксипропил)метакриламида, поли-2-(метакрилоилокси)этилфосфорилхолинов, поли(гидроксиалкил-L-аспарагина), поли(2-(метакрилоилокси)этилфосфорилхолина), гидроксиэтилкрахмала или поли(гидроксиалкил-L-глутамина), где гидрофильная полимерная цепь имеет молекулярную массу примерно от 1 кДа до примерно 100 кДа, предпочтительно примерно от 2 кДа до примерно 25 кДа, или более предпочтительно примерно от 2 кДа до примерно 10 кДа, например, от 5 кДа до примерно 25 кДа или от 5 кДа до примерно 10 кДа;
Р2 является катионным или поликатионным пептидом или белком и предпочтительно его длина составляет примерно от 3 до примерно 50 аминокислот, еще более предпочтительно примерно от 3 до примерно 25 аминокислот, например, примерно от 3 до 10, от 5 до 15, от 10 до 20 или от 15 до 25 аминокислот, более предпочтительно длина составляет примерно от 5 до примерно 20, еще более предпочтительно примерно от 10 до примерно 20;
является катионным или поликатионным полимером с молекулярной массой примерно от 0,5 кДа до примерно 30 кДа, в том числе с молекулярной массой примерно от 1 кДа до примерно 20 кДа, еще более предпочтительно примерно от 1,5 кДа до примерно 10 кДа, или молекулярная масса составляет примерно от 0,5 кДа до примерно 100 кДа, включая молекулярную массу примерно от 10 кДа до примерно 50 кДа, еще более предпочтительно примерно от 10 кДа до примерно 30 кДа;
каждый компонент Р2, обладающий по меньшей мере двумя частями молекулы SH-, способен сформировать дисульфидную связь при конденсации с другими компонентами Р2 или компонентом (компонентами) Р1 и/или Р3, или в другом варианте с другими компонентами (например, (АА)x, или [(AA)x]z)
«-S-S-» означает (обратимую) дисульфидную связь (квадратные скобки опускают, чтобы было понятнее), где S предпочтительно означает серу или -SH-несущую часть молекулы, которая сформировала (обратимую) дисульфидную связь. (Обратимая) дисульфидная связь предпочтительно формируется путем конденсации -SH-частей молекулы или компонентов Р1 и Р2, Р2 и Р2 или Р2 и Р3, или необязательно дополнительных компонентов, описанных в настоящем изобретении (например, L, (АА)x, [(AA)x]z, и т.д.); -SH-часть молекулы может быть частью структуры этих компонентов или ее добавляют путем модификации согласно описанному ниже;
«L» означает дополнительный лиганд, который может иметься или отсутствовать и может быть выбран независимо от других компонентов из RGD, трансферрина, фолата, сигнального пептида или сигнальной последовательности, сигнала или последовательности локализации, сигнала или последовательности ядерной локализации (nuclear localization signal sequence -NLS), антитела, проникающего в клетку пептида (например, ТАТ или KALA), лиганда рецептора (например, цитокина, гормонов, факторов роста и т.д.), низкомолекулярных соединений (например, углеводов, маннозы, или галактозы, или синтетических лигандов), низкомолекулярных агонистов, ингибиторов или антагонистов рецепторов (например, аналогов пептидомиметиков RGD) и т.д.;
«n» означает целое число, обычно выбранное из диапазона примерно от 1 до 50, предпочтительно из диапазона примерно от 1, 2 или 3 до 30, более предпочтительно из диапазона примерно от 1, 2, 3, 4 или 5 до 25, или из диапазона примерно от 1, 2, 3, 4 или 5 до 20, или из диапазона примерно от 1, 2, 3, 4 или 5 до 15, или из диапазона примерно от 1, 2, 3, 4 или 5 до 10, включая, например, диапазон примерно от 4 до 9, от 4 до 10, от 3 до 20, от 4 до 20, от 5 до 20, или от 10 до 20, или диапазон примерно от 3 до 15, от 4 до 15, от 5 до 15, или от 10 до 15, или диапазон примерно от 6 до 11 или от 7 до 10. Наиболее предпочтительно n находится в диапазоне примерно от 1, 2, 3, 4 или 5 до 10, более предпочтительно в диапазоне примерно от 1, 2, 3 или 4 до 9, в диапазоне примерно от 1, 2, 3 или 4 до 8, или в диапазоне примерно от 1, 2 или 3 до 7.
Молекулу обладающего признаками изобретения полимерного носителя общей формулы (I) получают с помощью новой стратегии синтеза и преимущественно позволяет устанавливать длину полимерной цепи и для комбинирования требуемых свойств разных (коротких) полимеров в одном полимере, например, для эффективной компановки нуклеиновые кислоты с целью эффективной трансфекции нуклеиновых кислот для генной терапии или других терапевтических применений без потери активности, особенно эффективной трансфекции нуклеиновой кислоты в разные линии клеток in vitro, а также трансфекции in vivo. Молекула обладающего признаками изобретения полимерного носителя, кроме того, является нетоксичной для клеток и обеспечивает эффективное высвобождение своего груза нуклеиновой кислоты. В итоге, она показывает улучшенную устойчивость к агломерации из-за обратимого добавления гидрофильных полимерных цепей (например, ПЭГ-мономеров) особенно по концам молекулы обладающего признаками изобретения полимерного носителя общей формулы (I), которые дополнительно обусловливают повышенную стабильность груза нуклеиновой кислоты в отношении сред, содержащих сыворотку, и предупреждает распознавание иммунной системой комплекса полимерного носителя с грузом.
Еще более предпочтительно, если молекула обладающего признаками изобретения полимерного носителя общей формулы (I) позволяет существенно варьировать его пептидное или полимерное содержимое и таким образом модулировать его биофизические/биохимические свойства, особенно катионные свойства компонента [S-P2-S]n, очень легко и быстро, например, путем включения в качестве компонентов Р2 тот же или другой катионный пептид (пептиды), белок (белки) или полимер (полимеры) и необязательно добавление других компонентов, например, аминокислотного компонента (компонентов) (АА)x, в повторяющемся компоненте [S-P2-S] для формирования модифицированного повторяющегося компонента, например, {[S-P2-S]a/[S-(AA)\x-S]b}, в качестве сердцевинного мотива полимерного носителя, обладающего признаками изобретения, (где a+b=n, см. ниже). Даже несмотря на включение чрезвычайно малотоксичных мономерных единиц, молекула обладающего признаками изобретения полимерного носителя формирует катионную связывающую последовательность с установленной длиной цепи, обеспечивая сильную конденсацию груза нуклеиновой кислоты и общую стабильность. В восстанавливающих условиях цитозоля (например, цитозольный глютатион (GSH)) комплекс быстро разрушается на составляющие его мономеры, которые дополнительно разрушаются (например, олигопептиды) или секретируются (например, ПЭГ). Это способствует высвобождению груза нуклеиновой кислоты в цитозоле. Из-за разрушения на малые олигопептиды в цитозоле не наблюдают токсичности, свойственной высокомолекулярным олигопептидам, например, вызванной высокомолекулярным олигоаргинином. ПЭГ-«покрытие» также позволяет каким-либо образом «покрыть» полимерный носитель гидрофильным покрытием по концам, которое предупреждает опосредуемую солями агломерацию и нежелательные взаимодействия с содержимым сыворотки. В цитозоле такое «покрытие» легко удаляется в восстанавливающих условиях клетки. Кроме того, этот эффект индуцирует высвобождение груза нуклеиновой кислоты в цитозоль.
Выше было указано, что лиганды (L) могут необязательно применяться в молекуле полимерного носителя общей формулы (I), обладающей признаками изобретения, например, для направления обладающего признаками изобретения полимерного носителя и его присоединенной нуклеиновой кислоты в определенные клетки. Они могут быть выбраны независимо друг от друга из RGD, трансферрина, фолата, сигнального пептида или сигнальной последовательности, сигнала или последовательности локализации, сигнала или последовательности ядерной локализации (nuclear localization signal sequence -NLS), антитела, проникающего в клетку пептида (например, ТАТ), лиганда рецептора (например, цитокинов, гормонов, факторов роста и т.д.), низкомолекулярных соединений (например, углеводов, например, маннозы, или галактозы, или синтетических лигандов), низкомолекулярных агонистов, ингибиторов или антагонистов рецепторов (например, аналогов пептидомиметиков RGD) и т.д. Особенно предпочтительной в этом контексте является манноза в качестве лиганда для нацеливания на антиген-презентирующие клетки, которые несут на своей клеточной мембране рецепторы маннозы. В другом предпочтительном объекте первого варианта осуществления настоящего изобретения может применяться галактоза в качестве необязательного лиганда для гепатоцитов-мишеней. Такие лиганды могут быть присоединены к компоненту Р1 и/или Р3 с помощью обратимых дисульфидных связей, согласно указанному ниже, или путем другого возможного химического присоединения, например, за счет формирования амида (например, карбоновых кислот, сульфоновых кислот, аминов и т.д.), реакцией Михаэля (например, малеинимидных частей молекулы, αβ-ненасыщенных карбонилов и т.д.), методом click-химии (например, азидов или алкинов), перемещением алкенов/алкинов (например, алкенов или алкинов), формированием имина или гидрозона (альдегидов или кетонов, гидразинов, гидроксиламинов, аминов), реакциями комплексообразования (с авидином, биотином, белком G) или компонентами, которые допускают реакции замещения Sn-THna (например, галогеналканами, тиолами, спиртами, аминами, гидразинами, гидразидами, эфирами сульфоновых кислот, солями оксифосфония) или другими химическими частями молекулы, которые могут применяться для присоединения дополнительных компонентов.
В составе формулы (I) настоящего изобретения компоненты Р1 и Р3 представляют линейную и разветвленную гидрофильную полимерную цепь, содержащую по меньшей мере одну -SH-часть молекулы, каждый из компонентов Р1 и Р3 выбран независимо друг от друга, например, из полиэтиленгликоля (ПЭГ), поли-N-(2-гидроксипропил)метакриламида, поли-2-(метакрилоилокси)этилфосфорилхолинов, поли(гидроксиалкил L-аспарагина) или поли(гидроксиалкил L-глутамина). Компоненты Р1 и Р3 могут быть одинаковыми или разными по отношению друг к другу. Предпочтительно каждый из гидрофильных полимеров Р1 и Р3 обладает молекулярной массой примерно от 1 кДа до примерно 100 кДа, предпочтительно примерно от 1 кДа до примерно 75 кДа, более предпочтительно примерно от 5 кДа до примерно 50 кДа, еще более предпочтительно примерно от 5 кДа до примерно 25 кДа. Дополнительно каждый из гидрофильных полимеров Р1 и Р3 обычно проявляет по меньшей мере одну -SH-часть молекулы, причем по меньшей мере одна -SH-часть молекулы способна формировать дисульфидную связь при конденсации с компонентом Р2 или с компонентом (АА)x, при использовании в качестве линкера между компонентами Р1 и Р2 или Р3 и Р2 согласно описанному ниже и необязательно с другим компонентом, например, L и/или (АА)x, например, если содержатся две или более -SH-частей молекулы. Приводимые подформулы «Р1-S-S-P2» и «Р2-S-S-P3» приведенной выше общей формулы (I) (квадратные скобки опущены, чтобы было понятнее), где какой-либо компонент из описанных выше компонентов S, Р1 и Р3 обычно отражает то состояние, при котором одна -SH-часть молекулы гидрофильных полимеров Р1 и Р3 конденсируется с одной -SH-частью молекулы компонента Р2 приведенной выше общей формулы (I), где обе серы таких -SH-частей молекулы формируют дисульфидную связь -S-S-согласно описанному в настоящем изобретении в формуле (I). Эти -SH-части молекулы обычно предоставлены каждым из гидрофильных полимеров Р1 и Р3, например, через внутренний цистеин или какую-либо дополнительную (модифицированную) аминокислоту или соединение, несущее часть молекулы-SH. Таким образом, подформулы «Р1-S-S-P2» и «Р2-S-S-P3» также могут быть записаны в виде «Р1-Cys-Cys-P2» и «Р2-Cys-Cys-P3», если -SH-часть молекулы представлена цистеином, где обозначение «Cys-Cys» представляет два цистеина, соединенных через дисульфидную связь, но не через пептидную связь. В этом случае обозначение «-S-S-» в этих формулах также может быть записано в виде «-S-Cys», «-Cys-S» или «-Cys-Cys-». В этом контексте обозначение «-Cys-Cys-» представляет не пептидную связь, а связь двух цистеинов через их -SH-части молекулы для формирования дисульфидной связи. Соответственно, обозначение «Cys-Cys» также можно в общем рассматривать в виде «-(Cys-S)-(S-Cys)-», если в этом конкретном случае S обозначает серу в -SH-части молекулы цистеина.
Подобным образом «-S-Cys» и «-Cys-S» обозначают дисульфидную связь между частью молекулы, содержащей -SH, и цистеином, которая также может быть записана в виде «-S-(S-Cys)» и «-(Cys-S)-S». В другом варианте гидрофильные полимеры Р1 и Р3 могут быть модифицированы -SH-частью молекулы, предпочтительно за счет химической реакции с соединением, несущим -SH-часть молекулы таким образом, что каждый из гидрофильных полимеров Р1 и Р3 несет по меньшей мере одну такую -SH-часть молекулы. Таким соединением, несущим -SH-часть молекулы, может быть, например, (дополнительный) цистеин или какая-либо (модифицированная) аминокислота, которая несет -SH-часть молекулы. Такое соединение также могут быть каким-либо неаминным соединением или частью молекулы, которая содержит или позволяет включить -SH-часть молекулы в гидрофильные полимеры Р1 и Р3 согласно описанному в настоящем изобретении. Такие неаминные соединения могут быть присоединены к гидрофильным полимерам Р1 и Р3 формулы (I) по настоящему изобретению за счет химических реакций или связывания соединений, например, за счет связывания 3-тио-пропионовой кислоты или тиоимолана, формирования амида (например, карбоновых кислот, сульфоновых кислот, аминов и т.д.), реакцией Михаэля (например, части молекулы малеинимид, αβ-ненасыщенных карбонилов и т.д.), методом click-химии (например, азидов или алкинов), перемещением алкенов/алкинов (например, алкенов или алкинов), формированием имина или гидрозона (альдегидов или кетонов, гидразинов, гидроксиламинов, аминов), реакциями комплексообразования (с авидином, биотином, белком G) или компонентами, которые допускают реакции замещения Sn-THna (например, галогеналканами, тиолами, спиртами, аминами, гидразинами, гидразидами, эфирами сульфоновых кислот, солями оксифосфония) или другими химическими частями молекулы, которые могут применяться для присоединения дополнительных компонентов. Особенно предпочтительным производным ПЭГ в этом контексте является альфа-метокси-омега-меркапто-полиэтиленгликоль. В каждом случае SH-часть молекулы, например, цистеина или какой-либо другой (модифицированной) аминокислоты или соединения, может быть представлена по концам или внутри в каком-либо положении гидрофильных полимеров Р1 и Р3. В настоящем изобретении каждый гидрофильный полимер из Р1 и Р3 обычно предоставляет по меньшей мере одну -SH-часть молекулы, предпочтительно с одного конца, но также может содержать две или даже более -SH-частей молекулы, которые могут применяться для дополнительно присоединения компонентов, согласно описанному в настоящем изобретении, например, лиганда, аминокислотного компонента (АА)x, антител, проникающих в клетки пептидов (например, ТАТ) и т.д.
По другому предпочтительному объекту первого варианта осуществления настоящего изобретения каждый из гидрофильных полимеров Р1 и Р3 также может содержать по меньшей мере одну дополнительную функциональную часть молекулы, которая позволяет присоединять другие компоненты, согласно описанному в настоящем изобретении, например, лиганд, аминокислотный компонент (АА)x и т.д. Такие функциональные части молекулы могут быть выбраны из выполняемых функций, которые позволяют присоединять другие компоненты, например, описанные в настоящем изобретении выполняемые функции, например, формирования амида (например, карбоновых кислот, сульфоновых кислот, аминов и т.д.), реакцией Михаэля (например, части молекулы малеинимид, αβ-ненасыщенных карбонилов и т.д.), методом click-химии (например, азидов или алкинов), перемещением алкенов/алкинов (например, алкенов или алкинов), формированием имина или гидрозона (альдегидов или кетонов, гидразинов, гидроксиламинов, аминов), реакциями комплексообразования (с авидином, биотином, белком G) или компонентами, которые допускают реакции замещения Sn-типа (например, галогеналканами, тиолами, спиртами, аминами, гидразинами, гидразидами, эфирами сульфоновых кислот, солями оксифосфония) или другими химическими частями молекулы, которые могут применяться для присоединения дополнительных компонентов.
Компонент Р2 в составе формулы (I) настоящего изобретения предпочтительно представляет катионный или поликатионный пептид или белок или в другом варианте катионный или поликатионный полимер. Каждый компонент Р2 обычно экспонирует по меньшей мере две -SH-части молекулы, способные формировать дисульфидную связь при конденсации с дополнительными компонентами Р2, компонентом (компонентами) Р1 и/или Р3 или в другом варианте с дополнительными компонентами, например, аминокислотными компонентами (АА)x. Компонент Р2 обычно содержится в повторяющемся компоненте [-S-P2-S-]n формулы (I) настоящего изобретения. Понятие «катионный или поликатионный» обычно относится к заряженной молекуле, которая положительно заряжена (катион) при величине рН примерно от 1 до 9, предпочтительно от 4 до 9, от 5 до 8 или даже от 6 до 8, более предпочтительно рН 9 или ниже, 8 или ниже, 7 или ниже, наиболее предпочтительно при физиологических значениях рН, например, примерно от 7,3 до 7,4. Соответственно, катионный или поликатионный пептид или белок в качестве компонента Р2 или в другом варианте катионный или поликатионный полимер в качестве компонента Р2 по настоящему изобретению положительно заряжен в физиологических условиях, особенно в условиях физиологических солей клетки in vivo.
В том случае, когда компонент Р формулы (I) настоящего изобретения представляет катионный или поликатионный пептид или белок, катионные свойства компонента [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b (согласно указанному ниже) могут быть определены по содержанию катионных аминокислот в целом
компоненте [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b}. Предпочтительно содержание катионных аминокислот в компоненте [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b} составляет по меньшей мере 10%, 20% или 30%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, 60% или 70%, но также предпочтительно по меньшей мере 80%, 90% или даже 95%, 96%, 97%, 98%, 99% или 100%, наиболее предпочтительно по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100%, или может быть в диапазоне примерно от 10% до 90%, более предпочтительно в диапазоне примерно от 15% до 75%, еще более предпочтительно в диапазоне примерно от 20% до 50%, например, 20, 30, 40 или 50%, или в диапазоне, сформированном какими-либо двумя указанными выше величинами, предусматривая, что содержание всех аминокислот, например, катионных, липофильных, гидрофильных, ароматических и других аминокислот, во всем компоненте [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b} составляет 100%.
В определенном случае компонент Р2 формулы (I) по настоящему изобретению представляет катионный или поликатионный полимер, катионные свойства компонента [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b} могут быть определены по содержимому катионных зарядов в целом компоненте [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b} при сравнении с общими зарядами компонента [S-Р2-S]n или {[S-P2-S]a/[S-(AA)x-S]b}. Предпочтительно содержание катионных зарядов в компоненте [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b} при (физиологической) величине рН согласно описанию настоящего изобретению составляет по меньшей мере 10%, 20% или 30%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, 60% или 70%, но также предпочтительно по меньшей мере 80%, 90% или даже 95%, 96%, 97%, 98%, 99% или 100%, наиболее предпочтительно по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100%, или могут быть в диапазоне примерно от 10% до 90%, более предпочтительно в диапазоне примерно от 15% до 75%, даже предпочтительно в диапазоне примерно от 20% до 50%, например, 20, 30, 40 или 50%, или в диапазоне, сформированном какими-либо двумя из указанных выше величин, обеспечивая состояние, при котором содержание всех зарядов, например, положительных и отрицательных зарядов при (физиологической) величине рН согласно описанию настоящего изобретению в целом компоненте [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b} составляет 100%.
В определенном составе комплекса обладающего признаками изобретения полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I) L-P1-S-[S-P2-S]n-S-P3-L согласно описанию настоящего изобретения (или какой-либо из приведенных в настоящем изобретении ее подформул), особенно предпочтительно, что по меньшей мере 10% всех зарядов в целом повторяющемся компоненте [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b} являются катионными, что позволяет образовывать комплекс с отрицательно заряженным грузом нуклеиновой кислоты.
Катионный или поликатионный пептид или белок в качестве компонента Р2 или катионный или поликатионный полимер в качестве компонента Р2 предпочтительно является линейной молекулой, однако также могут применяться разветвленные катионные или поликатионные пептиды или белки в качестве компонента Р2 или разветвленные катионные или поликатионные полимеры в качестве компонента Р2.
Обычно компонент Р2, например, катионный или поликатионный пептид или белок или катионный или поликатионный полимер, согласно описанному в настоящем изобретении, связан с соседними компонентами, например, компонентами Р1 и Р3, и/или в качестве повторяющегося компонента [S-P2-S]n с другими компонентами Р2 через дисульфидные связи (-S-S-) или с (АА)x компонентами в качестве части {[S-P2-S]a/[S-(AA)x-S]b}. В этом контексте, атомы серы, расположенные рядом с компонентом Р2 в повторяющемся компоненте [S-P2-S]n и, согласно описанному, в общей формуле (I) L-P1-S-[S-P2-S]n-S-P3-L, необходимые для обеспечения дисульфидной связи, могут быть обеспечены самим компонентом Р2 за счет -SH-части молекулы, согласно описанному в настоящем изобретении, или могут быть обеспечены модифицирующим компонентом Р2, согласно наличию -SH-части молекулы в указанном выше определении повторяющегося компонента [S-P2-S]n. Части молекулы -SH для компонента Р2 предпочтительно те, которые описаны в настоящем изобретении, для компонентов Р1 и Р3. Если такие -SH-части молекулы, необходимые для формирования дисульфидной связи (-S-S-), в указанном выше значении, обеспечиваются самим компонентом Р2, и могут быть обеспечены, например, по меньшей мере двумя цистеинами или какими-либо другими (модифицированными) аминокислотами или химическими соединениями, которые несут-SH-часть молекулы, уже имеющуюся в аминокислотной последовательности компонента Р2, в любом положении аминокислотной последовательности компонента Р2. В другом варианте компонент Р2 может быть модифицирован соответствующим образом за счет химического соединения, например, цистеина или какой-либо другой (модифицированной) аминокислоты или химического соединения, которое несет (свободную) часть молекулы -SH. Таким образом, компонент Р2 предпочтительно несет по меньшей мере две -SH-части молекулы, атомы серы в которых способны формировать дисульфидную связь при конденсации с -SH-частью молекулы компонентов Р1 и Р3 согласно описанию настоящего изобретения, или между первым компонентом Р и другим компонентом Р2, и т.д. Такие -SH-части молекулы предпочтительно описаны в настоящем изобретении. Предпочтительно по меньшей мере две SH-части молекулы расположены на концах или около концов компонента Р2.
Согласно одному специфическому объекту первого варианта осуществления настоящего изобретения компонент Р2 в повторяющемся компоненте [S-P2-S]n указанной выше общей формулы (I) может включать цистеин в качестве -SH-части молекулы. Таким образом, в этом контексте повторяющийся компонент [S-P2-S]n может быть записан следующим образом:
[Cys-P2-Cys]n
где обозначения n и Р2 являются описанными в настоящем изобретении и каждый Cys предусмотрен для -SH-части молекулы для дисульфидной связи. «Cys» означает аминокислоту цистеин, выраженную с помощью трехбуквенного кода. (Для иллюстративных целей в настоящем описании дисульфидная связь -S-S- обычно также может быть записана в виде «-(Cys-S)-(S-Cys)-», где Cys-S представляет цистеин с естественной частью молекулы -SH, где такая часть молекулы -SH формирует дисульфидную связь с частью молекулы -SH второго цистеина. Таким образом, повторяющийся компонент [Cys-P2-Cys]n также может быть записан в виде «[(S-Cys)-P2-(Cys-S)]n», где -SH-часть молекулы обеспечивается цистеином и сам цистеин обеспечивает серу в дисульфидной связи).
Таким образом, в составе приведенной выше целой формулы (I) такой специфический объект первого варианта осуществления настоящего изобретения может быть выражен следующим образом:
L-P1-S-[Cys-P2-Cys]n-S-P3-L
где обозначения L, Р1, Р2, Р3 и n являются описанными в настоящем изобретении, S означает серу и каждый Cys предусмотрен для одной -SH-части молекулы для дисульфидной связи.
В каждом случае -SH-часть молекулы, например, цистеина или какой-либо другой (модифицированной) аминокислоты или другого соединения, из числа использованных для модификации компонента Р2, может содержаться в катионном или поликатионном пептиде, или белке, или катионном, или поликатионном полимере в качестве компонента Р2 внутри или с одного или с обоих концов, например, если катионный или поликатионный пептид или белок применяют в качестве компонента Р2 с N-конца или с С-конца, с обоих концов и/или внутри в каком-либо положении катионного или поликатионного пептида или белка в качестве компонента Р2. Предпочтительно -SH-часть молекулы может содержаться в компоненте Р2 по меньшей мере с одного конца, более предпочтительно с обоих концов, например, с N-конца и/или с С-конца, более предпочтительно по обоим концам, N-концу и С-концу, катионного или поликатионного пептида или белка в качестве компонента Р2.
Из-за повторяющегося характера компонента [S-P2-S]n может быть ситуацию, в которой одна по меньшей мере из двух -SH-частей компонента Р2 конденсируется с -SH-частью другого компонента Р2 представленной выше общей формулы (I), где оба атома серы таких -SH-частей молекулы формируют дисульфидную связь (-S-S-) между первым компонентом Р2 и по меньшей мере одним дополнительным компонентом Р2.
В этом контексте число повторов компонента Р2 в формуле (I) по настоящему изобретению выражено целым числом n. Целое число n означает, обычно выбранное из диапазона примерно от 1 до 50, предпочтительно из диапазона примерно от 1, 2 или 3 до 30, более предпочтительно из диапазона примерно от 1, 2, 3, 4 или 5 до 25, или из диапазона примерно от 1, 2, 3, 4 или 5 до 20, или из диапазона примерно от 1, 2, 3, 4 или 5 до 15, или из диапазона примерно от 1, 2, 3, 4 или 5 до 10, включая например, диапазон примерно от 3 до 20, от 4 до 20, от 5 до 20, или от 10 до 20, или диапазон примерно от 3 до 15, от 4 до 15, от 5 до 15, или от 10 до 15, или диапазон примерно от 6 до 11 или от 7 до 10. Если, например, в повторяющемся компоненте [S-P2-S]n целое число n означает 5, повторяющийся компонент [S-P2-S]n предпочтительно выглядит следующим образом:
[S-P2-S-S-P2-S-S-P2-S-S-P2-S-S-P2-S].
В приведенном выше примере компонент Р2 встречается 5 раз (предпочтительно в линейном порядке), где каждый компонент Р связан с соседним компонентом дисульфидной связью, в указанном выше определении повторяющегося компонента [S-P2-S]n. Какие-либо компоненты Р2 могут быть одинаковыми или разными по отношению друг к другу.
В одном из определенных объектов этого варианта осуществления настоящего изобретения компонент Р2 представляет катионный или поликатионный пептид или белок, длина которого составляет примерно от 3 до примерно 100 аминокислот, более предпочтительно примерно от 3 до примерно 50 аминокислот, еще более предпочтительно примерно от 3 до примерно 25 аминокислот, например, примерно от 3 до 10, от 5 до 15, от 10 до 20 или от 15 до 25 аминокислот, более предпочтительно примерно от 5 до примерно 20 и еще более предпочтительно примерно от 10 до примерно 20 аминокислот.
Катионный или поликатионный пептид или белок в качестве компонента Р2 может быть каким-либо белком или пептидом, применимым для этой цели и предоставляющим по меньшей мере две -SH-части молекулы, особенно каким-либо катионным или поликатионным пептидом или белком, способным к комплексообразованию с нуклеиновой кислотой, согласно описанному в настоящем изобретении, и таким образом предпочтительно конденсируя нуклеиновую кислоту.
Особенно предпочтительными, катионными или поликатионными пептидами или белками в качестве компонента Р, проявляющего по меньшей мере две -SH-части молекулы, могут быть выбраны из протамина, нуклеолина, спермина или спермидина, поли-L-лизина, основных полипептидов, полиаргинина, проникающих в клетку пептидов (ПКП), химерных ПКП, например, транспортана, или пептидов MPG, ВИЧ-связывающих пептидов, Tat, ВИЧ-1 Tat (ВИЧ), Tat-производных пептидов, олигоаргининов, представителей семейства пенетратина, пенетратина, Antennapedia-производных пептидов (особенно из Drosophila antennapedia), pAntp, pIs1, и т.д., производных от микроорганизмов ПКП, буфорина-2, Вас715-24, SynB, SynB(1), pVEC, hCT-производных пептидов, SAP, MAP, KALA, PpTG20, обогащенных пролином пептидов, олигомера, обогащенных аргинином пептидов, кальцитонивовых пептидов, FGF, лактоферрина, гистонов, производных от VP22 пептидов или аналогов VP22, HSV, VP22 {Herpes simplex), MAP, KALA или доменов белковой трансдукции (доменов PTD, РрТ620, обогащенных пролином пептидов, обогащенных лизином пептидов, Рер-1, L-олигомеров, кальцитонинового пептида (пептидов)).
В одном из определенных предпочтительных объектов первого варианта осуществления настоящего изобретения компонент Р2 представляет катионные или поликатионные пептиды или белки, которые в качестве компонента Р2 выбраны из следующих катионных пептидов общей формулы (II), предпочтительно при условии, что они предоставляют дополнительно по меньшей мере две -SH-части молекулы:

где 1+m+n+о+х=8-15, и 1, m, n или о независимо друг от друга могут быть каким-либо числом, выбранным из О, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по меньшей мере 10% всех аминокислот олигопептида; и Хаа может быть какой-либо аминокислотой, выбранной из природной или отличной от природной аминокислоты, за исключением Arg, Lys, His или От; и x может быть каким-либо числом, выбранным из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14, при условии, что общее содержание Хаа не превышает 90% всех аминокислот олигопептида. Любая из аминокислот, Arg, Lys, His, От и Хаа, может быть расположена в любом месте пептида. Особенно предпочтительными пептидами этой формулы являются олигоаргинины, например, Arg7, Arg8, Arg9, Arg7, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.д. (SEQ ID NO: 1-9).
В одном из определенных предпочтительных объектов первого варианта осуществления настоящего изобретения катионные или поликатионные пептиды или белки в качестве компонента Р2, имеющего эмпирическую формулу (И), согласно указанному выше, и дополнительно проявляющие по меньшей мере две -SH-части молекулы, могут быть выбраны из подгруппы следующих формул (но ими перечень не ограничивается):
Arg8, Arg9, Arg10, Arg11, Arg12, Arg13, Arg14, Arg15; (SEQ ID NO: 2-3, 10-15);
Lys8, Lys9, Lys10, Lys11, Lys12, Lys13, Lys14, Lys15; (SEQ ID NO: 16-23);
His8, His9, His10, His11, His12, His13, His14, His15; (SEQ ID NO: 24-31);
Orn8, Orn9, Orn10, Orn11, Orn12, Orn13, Orn14, Orn15; (SEQ ID NO: 32-39).
В другом, особенно предпочтительном объекте первого варианта осуществления настоящего изобретения катионные или поликатионные пептиды или белки в качестве компонента Р2, имеющего эмпирическую формулу (II), согласно указанному выше, и дополнительно проявляющие по меньшей мере две -SH-части молекулы, могут быть выбраны из подгруппы формул (но ими перечень не ограничивается), причем следующие формулы (подобно эмпирической формуле (II)) не определяют порядок аминокислот, но призваны отражать эмпирические формулы исключительно путем определения числа аминокислот в качестве компонентов соответствующего пептида.
Соответственно, в качестве примера, эмпирическая формула Arg(7-14)Lys1 предназначена для обозначения того, что пептиды, подпадающие под эту формулу, содержат от 7 до 14 остатков Arg и 1 остаток Lys в любом порядке. Если пептиды содержат 7 остатков Arg и 1 остаток Lys, то охватываются все варианты с 7 остатками Arg и 1 остатком Lys. Таким образом, остаток Lys может быть расположен в любом месте последовательности длиной 8 аминокислот, ссотоящей из 7 Arg и 1 Lys. Подгруппа предпочтительно включает:
Arg(7-14)Lys1, Arg(7-14)His1, Arg(7-14)Orn1 Lys(7-14)His1, Lys(7-14)Orn1, His(7-14)Orn1;
Arg(6-13)Lys2, Arg(6-13)His2, Arg(6-13)Orn2, Lys(6-13)His2, Lys(6-13)Orn2, His(6-13)Orn2,;
Arg(5-12)Lys3, Arg(5-12)His3, Arg(5-12)Orn3, Lys(5-12)His3, Lys(5-12)Orn3, His(5-12)Orn3,;
Arg(4-11)Lys4, Arg(4-11)His4, Arg(4-11)Orn4, Lys(4-11)His4, Lys(4-11)Orn4, His(4-11)Orn4,;
Arg(3-10)Lys5, Arg(3-10)His5, Arg(3-10)Orn5, Lys(3-10)His5, Lys(3-10)Orn5, HiS(3-10)Orn5,;
Arg(2-9)Lys6, Arg(2-9)His6, Arg(2-9)Orn6, Lys(2-9)His6, Lys(2-9)Orn6, HiS(2-9)Orn6,;
Arg(1-S)Lys7, Arg(1-S)His7, Arg(1-S)Orn7, Lys(1-S)His7, Lys(1-S)Orn7, His(1-S)Orn7,;
Arg(6-13)Lys1His1 Arg(6-13)Lys1Orn1, Arg(6-13)His1Orn1, Arg1Lys(6-13)His1, Arg1Lys(6-13)Orn1 Lys(6-13)His1Orn1 Arg1Lys1His(6-13), Arg1His(6-13)Orn1, Lys1His(6-13)Orn1;
Arg(5-12)Lys2His1, Arg(5-12)Lys1His2, Arg(5-12)Lys2Orn1, Arg(5-12)Lys1Orn2, Arg(5-12)His2Orn1, Arg(5-12)His1Orn2, Arg2Lys(5-12)His1, Arg1Lys(5-12)His2, Arg2Lys(5-12)Orn1, Arg1Lys(5-12)Orn2, Lys(5-12)His2Orn1, Lys(5-12)His1Orn2, Arg2Lys1His(5-12), Arg1Lys2His(5-12), Arg2His(5-12)Orn1, Arg1His(5-12)Orn2, Lys2His(5-12)Orn1, Lys1His(5-12)Orn2;
Arg(4-11)Lys3His1, Arg(4-11)Lys2His2, Arg(4-11)Lys1His3, Arg(4-11)Lys3Orn1, Arg(4-11)Lys2Orn2, Arg(4-11)Lys1Orn3, Arg(4-11)His3Orn1 Arg(4-11)His2Orn2, Arg(4-11)His1Orn3, Arg3Lys(4-11)HiSb Arg2Lys(4-11)His2, Arg4Lys(4-11)His3, Arg3Lys(4-11)Orn1 Arg2Lys(4-11)Orn2, Arg1Lys(4-11)Orn3, Lys(4-11)His3Orn1 Lys(4-11)His2Orn2, Lys(4-11)His1Orn3, Arg3Lys1HiS(4-11), Arg2Lys2His(4-11), Arg1Lys3His(4-11), Arg3His(4-11)Orn1 Arg2His(4.ii)Orn2, Arg1His(4-11)Orn3, Lys3His(4-11)Orn1, Lys2His(4-11)Orn2, Lys1His(4-11)Orn3;
Arg(3-10)Lys4His1 Arg(3-10)Lys3His2, Arg(3-10)Lys2His3, Arg(3-10)Lys1His4, Arg(3-10)Lys4Orn1 Arg(3-10)Lys3Orn2, Arg(3-10)Lys2Orn3, Arg(3-10)Lys1Orn4, Arg(3-10)His4Orn1 Arg(3-10)His3Orn2, Arg(3-10)His2Orn3, Arg(3-10)His1Orn4, Arg4Lys(3-10)HiS1 Arg3Lys(3-10)His2, Arg2Lys(3-10)His3, Arg1Lys(3-10)His4, Arg4Lys(3-10)Orn1, Arg3Lys(3-10)Orn2, Arg2Lys(3-10)Orn3, Arg1Lys(3-10)Orn4, Lys(3-10)His4Orn1 Lys(3-10)His3Orn2, Lys(3-10)His2Orn3, Lys(3-10)His1Orn4, Arg4Lys1His(3-10), Arg3Lys2His(3-10), Arg2Lys3His(3-10), Arg1Lys4His(3-10), Arg4His(3-10)Orn1 Arg3His(3-10)Orn2, Arg2His(3-10)Orn3, Arg1His(3-10)Orn4, Lys4His(3-10)Orn1, Lys3His(3-10)Orn2, Lys2His(3-10)Orn3, Lys1His(3-10)Orn4;
Arg(2-9)Lys5His1 Arg(2-9)Lys4His2, Arg(2-9)Lys3His3, Arg(2-9)Lys2His4, Arg(2-9)Lys1His5, Arg(2-9)Lys5Orn1 Arg(2-9)Lys4Orn2, Arg(2-9)Lys3Orn3, Arg(2-9)Lys2Orn4, Arg(2-9)Lys1Orn5, Arg(2-9)His5Orn1 Arg(2-9)His4Orn2, Arg(2-9)His3Orn3, Arg(2-9)His2Orn4, Arg(2-9)His1Orn5, Arg5Lys(2-9)His1 Arg4Lys(2-9)His2, Arg3Lys(2-9)His3, Arg2Lys(2-9)His4, Arg1Lys(2-9)His5, Arg5Lys(2-9)Orn1, Arg4Lys(2-9)Orn2, Arg3Lys(2-9)Orn3, Arg2Lys(2-9)Orn4, Arg1Lys(2-9)Orn5, Lys(2-9)His5Orn1 Lys(2-9)His4Orn2, Lys(2-9)His3Orn3, Lys(2-9)His2Orn4, Lys(2-9)His1Orn5, Arg5Lys1His(2-9), Arg4Lys2His(2-9), Arg3Lys3His(2-9), Arg2Lys4HiS(2-9), Arg1Lys5HiS(2-9), Arg5HiS(2-9)Orn1 Arg4His(2-9)Orn2, Arg3His(2-9)Orn3, Arg2His(2-9)Orn4, Arg1HiS(2-9)Orn5, Lys5HiS(2-9)Orn1, Lys4HiS(2-9)Orn2, Lys3His(2-9)Orn3, Lys2HiS(2-9)Orn4, Lys1His(2-9)Orn5;
Arg(1-S)Lys6Hisb Arg(1-S)Lys5His2, Arg(1-S)Lys4His3, Arg(1-S)Lys3His4, Arg(1-S)Lys2His5, Arg(1-S)Lys1His6, Arg(1-S)Lys6Orn1, Arg(1-S)Lys5Orn2, Arg(1-S)Lys4Orn3, Arg(1-S)Lys3Orn4, Arg(1-S)Lys2Orn5, Arg(1-S)Lys1Orn6, Arg(1-S)His6Orn1 Arg(1-S)His5Orn2, Arg(1-S)His4Orn3, Arg(1-S)His3Orn4, Arg(1-S)His2Orn5, Arg(1-S)His1Orn6, Arg6Lys(1-S)His1 Arg5Lys(1-S)His2, Arg4Lys(1-S)His3, Arg3Lys(1-S)His4, Arg2Lys(1-S)His5, Arg1Lys(1-S)His6, Arg6Lys(1-S)Orn1 Arg5Lys(1-S)Orn2, Arg4Lys(1-S)Orn3, Arg3Lys(1-S)Orn4, Arg2Lys(1-S)Orn5, Arg1Lys(1-S)Orn6, Lys(1-S)His6Orn1 Lys(1-S)His5Orn2, Lys(1-S)His4Orn3, Lys(1-S)His3Orn4, Lys(1-S)His2Orn5, Lys(1-S)His1Orn6, Arg6Lys1His(1-S), Arg5Lys2His(1-S), Arg4Lys3His(1-S), Arg3Lys4His(1-S), Arg2Lys5His(1-S), Arg1Lys6His(1-S), Arg6His(1-S)Orn1 Arg5His(1-S)Orn2, Arg4His(1-S)Orn3, Arg3His(1-S)Orn4, Arg2His(1-S)Orn5, Arg1His(1-S)Orn6, Lys6His(1-S)Orn1, Lys5His(1-S)Orn2, Lys4His(1-S)Orn3, Lys3His(1-S)Orn4, Lys2His(1-S)Orn5, Lys1His(1-S)Orn6;
Arg(5-12)Lys1His1Orn1 Arg1Lys(5-12)His1Orn1 Arg1Lys1His(5-12)Orn1 Arg1Lys1His1Orn(5-12);
Arg(4-11)Lys2His1Orn1, Arg(4-11)Lys1His2Orn1, Arg(4-11)Lys1His1Orn2, Arg2Lys(4-11)His1Orn1, Arg1Lys(4-11)His2Orn1, Arg1Lys(4-11)His1Orn2, Arg2Lys1His(4-11)Orn1, Arg1Lys2His(4-11)Orn1, Arg1Lys1His(4-11)Orn2, Arg2Lys1His1Orn(4-11), Arg1Lys2His1Orn(4-11), Arg1Lys1His2Orn(4-11);
Arg(3-10)Lys3His1Orn1, Arg(3-10)Lys2His2Orn1, Arg(3-10)Lys2His1Orn2, Arg(3-10)Lys1His2Orn2, Arg(3-10)Lys1His1Orn3, Arg3Lys(3-10)His1Orn1, Arg2Lys(3-10)His2Orn1, Arg2Lys(3-10)His1Orn2, Arg1Lys(3-10)His2Orn2, Arg1Lys(3-10)His1Orn3, Arg3Lys1His(3-10)Orn1, Arg2Lys2His(3-10)Orn1, Arg2Lys1His(3-10)Orn2, Arg1Lys2His(3-10)Orn2, Arg1Lys1His(3-10)Orn3, Arg3Lys1His1Orn(3-10), Arg2Lys2His1Orn(3-10), Arg2Lys1His2Orn(3-10), Arg1Lys2His2Orn(3-10), Arg1Lys1His3Orn(3-10);
Arg(2-9)Lys4His1Orn1, Arg(2-9)Lys1His4Orn1, Arg(2-9)Lys1His1Orn4, Arg(2-9)Lys3His2Orn1, Arg(2-9)Lys3His1Orn2, Arg(2-9)Lys2His3Orn,, Arg(2-9)Lys2His1Orn3, Arg(2-9)Lys1His2Orn3, Arg(2-9)Lys1His3Orn2, Arg(2-9)Lys2His2Orn2, Arg4Lys(2-9)His1Orn1, Arg1Lys(2-9)His4Orn1, Arg1Lys(2-9)His1Orn4, Arg3Lys(2-9)His2Orn1, Arg3Lys(2-9)His1Orn2, Arg2Lys(2-9)His3Orn1, Arg2Lys(2-9)His1Orn3, Arg1Lys(2-9)His2Orn3, Arg1Lys(2-9)His3Orn2, Arg2Lys(2-9)His2Orn2, Arg4Lys1His(2-9)Orn1, Arg1Lys4His(2-9)Orn1, Arg1Lys1His(2-9)Orn4, Arg3Lys2His(2-9)Orn1, Arg3Lys1His(2-9)Orn2, Arg2Lys3His(2-9)Orn1, Arg2Lys1His(2-9)Orn3, Arg1Lys2His(2-9)Orn3, Arg1Lys3His(2-9)Orn2, Arg2Lys2His(2-9)Orn2, Arg4Lys1His1Orn(2-9), Arg1Lys4His1Orn(2-9), Arg1Lys1His4Orn(2-9), Arg3Lys2His1Orn(2-9), Arg3Lys1His2Orn(2-9), Arg2Lys3His1Orn(2-9), Arg2Lys1His3Orn(2-9), Arg1Lys2His3Orn(2-9), Arg1Lys3His2Orn(2-9), Arg2Lys2His2Orn(2-9);
Arg(1-S)Lys5His1Orn1, Arg(1-S)Lys1His5Orn1, Arg(1-S)Lys1His1Orn5, Arg(1-S)Lys4His2Orn1 Arg(1-S)Lys2His4Orn1, Arg(1-S)Lys2His1Orn4, Arg(1-S)Lys1His2Orn4, Arg(1-S)Lys1His4Orn2, Arg(1-S)Lys4His1Orn2, Arg(1-S)Lys3His3Orn1, Arg(1-S)Lys3His1Orn3, Arg(1-S)Lys1His3Orn3, Arg5Lys(1-S)His1Orn1 Arg1Lys(1-S)His5Orn1 Arg1Lys(1-S)His1Orn5, Arg4Lys(1-S)His2Orn1, Arg2Lys(1-S)His4Orn1, Arg2Lys(1-S)His1Orn4, Arg1Lys(1-S)His2Orn4, Arg1Lys(1-S)His4Orn2, Arg4Lys(1-S)His1Orn2, Arg3Lys(1-S)His3Orn1, Arg3Lys(1-S)His1Orn3, Arg1Lys(1-S)His3Orn3, Arg5Lys1His(1-S)Orn1, Arg1Lys5His(1-S)Orn1, Arg1Lys1His(1-S)Orn5, Arg4Lys2His(1-S)Orn1, Arg2Lys4His(1-S)Orn1, Arg2Lys1His(1-S)Orn4, Arg1Lys2His(1-S)Orn4, Arg1Lys4His(1-S)Orn2, Arg4Lys1His(1-S)Orn2, Arg3Lys3His(1-S)Orn1 Arg3Lys1His(1-S)Orn3, Arg1Lys3His(1-S)Orn3, Arg5Lys1His1Orn(1-S), Arg1Lys5His1Orn(1-S), Arg1Lys1His5Orn(1-S), Arg4Lys2His1Orn(1-S), Arg2Lys4His1Orn(1-S), Arg2Lys1His4Orn(1-S), Arg1Lys2His4Orn(1-S), Arg1Lys4His2Orn(1-S), Arg4Lys1His2Orn(1-S), Arg3Lys3His1Orn(1-S), Arg3Lys1His3Orn(1-S), Arg1Lys3His3Orn(1-S);
В другом, особенно предпочтительном объекте первого варианта осуществления настоящего изобретения катионные или поликатионные пептиды или белки в качестве компонента Р2, имеющего эмпирическую формулу (II), согласно указанному выше, и дополнительно проявляющие по меньшей мере две -SH-части молекулы, могут быть выбраны из подгруппы формул (но ими перечень не ограничивается): Arg8, Arg9, Arg10, Arg11, Arg12, Arg13, Arg14, Arg15; Lys8, Lys9, Lys10, Lys11, Lys12, Lys13, Lys14, Lys15; His8, His9, His10, His11, His12, His13, His14, His15; Orn8, Orn9, Orn10, Orn11, Orn12, Orn13, Orn14, Orn15; (SEQ ID NO: 2-3, 10-39, см. выше).
В другом, особенно предпочтительном объекте первого варианта осуществления настоящего изобретения катионные или поликатионные пептиды или белки в качестве компонента Р2, имеющего эмпирическую формулу (II), согласно указанному выше, и дополнительно проявляющие по меньшей мере две -SH-части молекулы, могут быть выбраны из подгруппы формул (но ими перечень не ограничивается), состоящей из общих формул Arg9 (также обозначают R9), Arg9His3 (также обозначают R9H3), His3Arg9His3 (также обозначают H3R9H3), TyrSerSerArg9SerSerTyr (также обозначают YSSR9SSY), His3Arg9SerSerTyr (также обозначают H3R9SSY), (ArgLysHis)4 (также обозначают (RKH)4), Tyr(ArgLysHis)2Arg (также обозначают Y(RKH)2R); (SEQ ID NO: 2,5-9,40, см. выше). Еще более предпочтительно эти общие формулы выражают следующим образом:
В еще одном особенно предпочтительном объекте первого варианта осуществления настоящего изобретения катионный или поликатионный пептид или белок в качестве компонента Р2, формулы {(Arg)1;(Lys)m;(His)n;(Orn)o;(Xaa)x} (формула (II)), согласно указанному выше, и дополнительно проявляющий по меньшей мере две -SH-части молекулы, могут быть выбраны по формуле (IIa), но ими не ограничиваются, предпочтительно при условии, что по меньшей мере одна -SH-часть молекулы предусмотрена остатком цистеина:
{(Arg)1;(Lys)m;(His)n;(Orn)o;(Cys)x} (формула (IIa))
где (Arg)1;(Lys)m;(His)n;(Orn)o; и x соответствуют значениям, описанным в настоящем изобретении выше.
В другом варианте катионный или поликатионный пептид или белок в качестве компонента Р2, если выражен по формуле
{(Arg)1;(Lys)m;(His)n;(Orn)o;(Xaa)x} (формула (II)), согласно указанному выше, и дополнительно проявляющий по меньшей мере две -SH-части молекулы, может быть выбран по формуле (Iia'), но ими не ограничиваются, предпочтительно при условии, что по меньшей мере одна -SH-часть молекулы предусмотрена остатком цистеина:

где (Arg)1;(Lys)m;(His)n;(Orn)o; и x соответствуют значениям, описанным в настоящем изобретении выше, Хаа' обозначает аминокислоту, выбранную из природной или неприродной аминокислоты, за исключением Arg, Lys, His, Orn или Cys, и у обозначает какое-либо число, выбранное из 1,2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21-30, 31-40, 41-50, 51-60, 61-70, 71-S0 и 81-90, при условии, что общее содержание Arg (аргинина), Lys (лизина), His (гистидина) и Orn (орнитина) представляет по меньшей мере 10% от всех аминокислот олигопептида.
Такие объекты первого варианта осуществления настоящего изобретения могут относиться к таким ситуациям, в которых компонент Р2 выбран из катионного или поликатионного пептида или белка, соответствующего эмпирической формуле (Arg)1;(Lys)m;(His)n;(Orn)o;(Xaa)x (формуле (II)), описанной выше, и включает или является модифицированным по меньшей мере одним цистеином в качестве -SH-части молекулы в указанном выше значении таким образом, что катионный или поликатионный пептид в качестве компонента Р2 несет по меньшей мере один цистеин, способный формировать дисульфидную связь с другими компонентами формулы (I).
В другом, особенно предпочтительном объекте первого варианта осуществления настоящего изобретения катионный или поликатионный пептид или белок в качестве компонента Р2, выраженный формулой {(Arg)1;(Lys)m;(His)n;(Orn)o;(Xaa)x} (формула (II)), согласно указанному выше, и предпочтительно дополнительно проявляющий по меньшей мере две -SH-части молекулы, может быть выбран по формуле (IIb), но ею не ограничивается, и предпочтительно при условии, что по меньшей мере две -SH-части молекулы предусмотрены двумя концевыми остатками цистеина:
Cys {(Arg)1;(Lys)m;(His)n;(Orn)o;(Xaa)x} Cys (формула (IIb)) где (Arg)1;(Lys)m;(His)n;(Orn)o;(Xaa)x соответствуют значениям, описанным в настоящем изобретении, и формируют сердцевину из аминокислот, соответствующих (полуэмпирической) формуле (II). К примерам могут относиться какие-либо из указанных выше последовательностей, фланкированных двумя Cys, и следующими последовательностями:
Cys(Arg8)Cys, Cys(Arg9)Cys, Cys(Arg10)Cys, Cys(Arg11)Cys, Cys(Arg12)Cys, Cys(Arg13)Cys, Cys(Arg14)Cys, Cys(Arg15)Cys; Cys(Lys8)Cys, Cys(Lys9)Cys, Cys(Lys10)Cys, Cys(Lys11)Cys, Cys(Lys12)Cys, Cys(Lys13)Cys, Cys(Lys14)Cys, Cys(Lys15)Cys; Cys(His8)Cys, Cys(His9)Cys, Cys(His10)Cys, Cys(His11)Cys, Cys(His12)Cys, Cys(His13)Cys, Cys(His14)Cys, Cys(His15)Cys; Cys(Orn8)Cys, Cys(Orn9)Cys, Cys(Orn10)Cys, Cys(Orn11)Cys, Cys(Orn12)Cys, Cys(Orn13)Cys, Cys(Orn14)Cys, Cys(Orn15)Cys, (SEQ ID NO: 41-72), более предпочтительно следующими последовательностями (SEQ ID NO: 73-S4):
CysArg9Cys: Cys-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Cys-Cys
CysArg9His3Cys: Cys-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-His-His-His-Cys
CysHis3Arg9His3Cys: Cys-His-His-His-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-His-His-His-Cys
CysTyrSerSerArg9SerSerTyrCys: Cys-Tyr-Ser-Ser-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Ser-Ser-Tyr-Cys
CysHis3Arg9SerSerTyrCys: Cys-His-His-His-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Ser-Ser-Tyr-Cys
Cys(ArgLysHis)4Cys: Cys-Arg-Lys-His-Arg-Lys-His-Arg-Lys-His-Arg-Lys-His-Cys
CysTyr(ArgLysHis)2ArgCys: Cys-Tyr-Arg-Lys-His-Arg-Lys-His-Arg-Cys
CysHis3Arg9His3Cys: Cys-His-His-His-Arg-Arg-Arg-Arg-His-His-His-Cys
CysHis6Arg9His6Cys: Cys-His-His-His-His-His-His-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-Arg-His-His-His-His-His-His-Cys
CysHis3Arg4His3Cys: Cys-His-His-His-Arg-Arg-Arg-Arg-His-His-His-Cys
CysHis6Arg4His6Cys Cys-His-His-His-His-His-His-Arg-Arg-Arg-Arg-His-His-His-His-His-His-Cys
CysArg12Cys: Cys-Arg-Arg-Arg-Arg-Arg Arg-Arg-Arg-Arg-Arg-Arg-Arg-Cys.
Такие объекты первого варианта осуществления настоящего изобретения могут относиться к тем ситуациям, при которых поликатионный пептид или белок в качестве компонента Р2, например, соответствующего эмпирической формуле (Arg)1;(Lys)m;(His)n;(Orn)o;(Xaa)x (формула (II)), описанной выше, модифицирован по меньшей мере двумя (концевыми) цистеинами в качестве -SH-части молекулы в указанном выше значении таким образом, что компонент Р2 несет по меньшей мере два (концевых) цистеина, способных формировать дисульфидные связи с другими компонентами формулы (I).
В другом предпочтительном объекте первого варианта осуществления настоящего изобретения компонент Р представляет катионный или поликатионный полимер, выбранный, например, из какого-либо катионного полимера, применимого в этом контексте, при условии, что такой катионный полимер предоставляет по меньшей мере две -SH-части молекулы, которые обеспечивают для дисульфидной связи связывающий компонент Р2 с компонент Р1 или Р3, или с другим компонентом (компонентами) Р2 или аминокислотными компонентами (АА)x. Таким образом, согласно описанному в настоящем изобретении компонент Р2 может присутствовать в качестве повторяющегося компонента согласно описанию настоящего изобретения, представленного подформулой [S-P2-S]n или {[S-P2-S]a/[S-(AA)x-S]b}, где те же или другие катионные или поликатионные полимеры Р могут применяться в указанном повторяющемся компоненте.
Предпочтительно компонент Р2 представляет катионный или поликатионный полимер, обычно с молекулярной массой примерно от 0,5 кДа до примерно 100 кДа, примерно от 1 кДа до примерно 75 кДа, примерно от 5 кДа до примерно 50 кДа, примерно от 5 кДа до примерно 30 кДа, или с молекулярной массой примерно от 10 кДа до примерно 50 кДа, или примерно от 10 кДа до примерно 30 кДа, предпочтительно примерно от 0,5 кДа до примерно 30 кДа, более предпочтительно примерно от 1 кДа до примерно 20 кДа, и еще более предпочтительно примерно от 1,5 кДа до примерно 10 кДа. Дополнительно катионный или поликатионный полимер в качестве компонента Р2 обычно проявляет по меньшей мере две -SH-части молекулы, которые способны формировать дисульфидную связь при конденсации с компонентами или P1 или Р3, или с другими компонентами Р2, или аминокислотными компонентами (АА)x согласно описанию настоящего изобретения.
Если компонент Р2 представляет катионный или поликатионный полимер, такой полимер может быть выбран из акрилатов, модифицированных акрилатов, например, pDMAEMA (поли(диметиламиноэтилметакрилата)), хитозанов, азиридинов или 2-этил-2-оксазалина (формируя олигоэтиленимины или модифицированные олигоэтиленимины), полимеров, полученных реакцией бисакрилатов с аминами, формирующей олигобетааминоэфиры или полиамидоамины, или другие полимеры типа полиэфиров, поликарбонатов и т.д. Каждая молекула из таких катионных или поликатионных полимеров обычно предоставляет по меньшей мере две -SH-части молекулы, причем эти по меньшей мере две -SH-части молекулы могут быть интродуцированы в катионный или поликатионный полимер путем химических модификаций, например, используя имонотиолан, 3-тиопропионовую кислоту, или внедрением -SH-частей молекул, содержащих аминокислоты, например, цистеин, метионин или какую-либо другую (модифицированную) аминокислоту. Такие -SH-части молекулы предпочтительно являются уже описанными выше для компонентов Р1, Р2 или Р3.
Компонент Р2 формулы (I) настоящего изобретения предпочтительно присутствует в качестве повторяющегося компонента [-S-P2-S-]n. Такой повторяющийся компонент [S-P2-S]n может быть получен, используя по меньшей мере один или даже более одинаковых или разных из указанных выше компонентов Р2 и полимеризуя их в реакции поликонденсации через их -SH-части молекулы.
В одном из конкретных объектов первого варианта осуществления настоящего изобретения такой повторяющийся компонент [S-P2-S]n может быть получен, используя по меньшей мере один или даже более одинаковых или разных из указанных выше катионных или поликатионных пептидов или белков, и полимеризуя их в реакции поликонденсации через их -SH-части молекулы.
Таким образом, указанный повторяющийся компонент [S-P2-S]n содержит ряд по меньшей мере из одного или даже более одинаковых или разных из указанных выше катионных или поликатионных белков или пептидов, определенных целым числом n.
В другом конкретном объекте первого варианта осуществления такой повторяющийся компонент [S-P2-S]n может быть получен, используя по меньшей мере один или даже более одинаковых или разных из указанных выше катионных или поликатионных полимеров, и полимеризуя их в реакции поликонденсации через их -SH-части молекулы. Соответственно такой повторяющийся компонент [S-P2-S]n содержит мере один или даже более одинаковых или разных из указанных выше катионных или поликатионных полимеров, выраженных целым числом n.
В другом конкретном объекте первого варианта осуществления такой повторяющийся компонент [S-P2-S]n может быть получен, используя по меньшей мере один или даже более одинаковых или разных из указанных выше катионных или поликатионных полимеров и по меньшей мере один или даже более одинаковых или разных из указанных выше катионных или поликатионных белков или пептидов, и полимеризуя их в реакции поликонденсации через их -SH-части молекулы. Таким образом, такой повторяющийся компонент [S-P2-S]n содержит по меньшей мере один или даже более одинаковых или разных из указанных выше катионных или поликатионных полимеров и по меньшей мере один или даже более одинаковых или разных из указанных выше катионных или поликатионных белков или пептидов, которые оба вместе выражены целым числом n.
В другом конкретном объекте первого варианта осуществления настоящего изобретения молекула обладающего признаками изобретения полимерного носителя по приведенной выше формуле (I) может включать по меньшей мере один аминокислотный компонент (АА)x, в котором АА предпочтительно обозначает аминокислоту согласно описанному ниже, которая при наличии в качестве аминокислотного компонента (АА)x, позволяет (существенно) модифицировать биофизические/биохимические свойства обладающего признаками изобретения полимерного носителя формулы (I), согласно описанному в настоящем изобретении. По настоящему изобретению число аминокислот в таком аминокислотном компоненте (АА)x (повторы) обозначают «x». В контексте вышесказанного х предпочтительно означает целое число и может быть выбран из диапазона примерно от 1 до 100, предпочтительно из диапазона примерно от 1 до 50, более предпочтительно от 1 до 30, и еще более предпочтительно выбран из чисел 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15-30, например, из диапазона примерно от 1 до 30, из диапазона примерно от 1 до 15, или из чисел 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или может быть выбран из диапазона, сформированного какими-либо двумя из указанных выше значений.
Такие компоненты (АА)x могут содержаться во всех частях обладающего признаками изобретения полимерного носителя указанной выше формулы (I) и таким образом могут быть присоединены ко всем компонентам обладающего признаками изобретения полимерного носителя формулы (I). Особенно предпочтительно, что (АА)x присутствует в качестве лиганда или части повторяющегося компонента [S-P2-S]n.
В таком контексте особенно предпочтительно, что аминокислотный компонент (АА)x содержит или фланкирован (например, с концов) по меньшей мере одной -SH-содержащей частью молекулы, которая позволяет внедрять этот компонент (АА)x через дисульфидную связь в полимерный носитель формулы (I), согласно описанному в настоящем изобретении. В таком контексте аминокислотный компонент (АА)x также может быть прочтен в виде компонента -S-(AA)x- или -S-(AA)x-S-, где S представляет -SH-содержащую часть молекулы (или, безусловно, один атом серы дисульфидной связи), например, остаток цистеина. В том конкретном случае, когда -SH-содержащая часть молекулы представляет цистеин, аминокислотный компонент (АА)x также может быть прочтен -Cys-(AA)x- или -Cys-(AA)x-Cys-, где Cys представляет цистеин и предусматривает -SH-часть молекулы для дисульфидной связи. (Таким образом, -Cys-(AA)x-Cys- также может быть представлен записью -(S-Cys)-(AA)x-(Cys-S)-и -Cys-(AA)x- также может быть представлен записью -(S-Cys)-(AA)x-).) Также -SH-содержащая часть молекулы может быть внедрена в аминокислотный компонент (АА)x, используя какую-либо из модификаций или реакций согласно указанному выше для компонентов Р1, Р2 или Р3. В том конкретном случае, когда аминокислотный компонент (АА)x связан с двумя компонентами обладающего признаками изобретения полимерного носителя формулы (I), предпочтительно, если (АА)x содержит по меньшей мере две -SH-части молекулы, например, по меньшей мере два цистеина, предпочтительно по концам. Особенно предпочтительно, если (АА)x представляет часть повторяющегося компонента [S-P2-S]n.
В другом варианте аминокислотный компонент (АА)x внедряют в обладающий признаками изобретения полимерный носитель формулы (I) согласно описанному в настоящем изобретении через какую-либо химически допустимую реакцию присоединения. Таким образом, аминокислотный компонент (АА)x содержит по меньшей мере одну дополнительную функциональную часть молекулы, которая позволяет присоединяться к другому компоненту согласно описанному в настоящем изобретении, например, компоненту Р1 или Р3, Р2, L, или дополнительному аминокислотному компоненту (АА)x, и т.д. Такие функциональные части молекулы могут быть выбраны из функциональных возможностей, позволяющих присоединять другие компоненты, например, функциональных возможностей, согласно описанному в настоящем изобретении, например, путем формирования амида (например, карбоновых кислот, сульфоновых кислот, аминов и т.д.), реакцией Михаэля (например, малеинимидных частей молекулы, αβ-ненасыщенных карбонилов и т.д.), методом click-химии (например, азидов или алкинов), перемещением алкенов/алкинов (например, алкенов или алкинов), формированием имина или гидрозона (альдегидов или кетонов, гидразинов, гидроксиламинов, аминов), реакциями комплексообразования (с авидином, биотином, белком G) или компонентами, которые допускают реакции замещения Sn-типа (например, галогеналканами, тиолами, спиртами, аминами, гидразинами, гидразидами, эфирами сульфоновых кислот, солями оксифосфония) или другими химическими частями молекулы, которые могут применяться для присоединения дополнительных компонентов.
Аминокислотный компонент (АА)x также может быть в виде смешанного повторяющегося аминокислотного компонента [(AA)x]z, в котором число аминокислотных компонентов (АА)x дополнительно обозначают буквой z. В этом контексте z означает целое число и может быть выбрано из диапазона примерно от 1 до 30, предпочтительно из диапазона примерно от 1 до 15, более предпочтительно от 1 до 10 или от 1 до 5 и еще более предпочтительно может быть выбрано из ряда чисел 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или может быть выбрано из диапазона, сформированного какими-либо двумя из указанных выше величин. Такой смешанный повторяющийся аминокислотный компонент [(AA)x]z может применяться для интеграции нескольких таких же или отличных аминокислотных компонентов (АА)x согласно описанному в настоящем изобретении в обладающий признаками изобретения полимерный носитель. Предпочтительно в смешанном повторяющемся аминокислотном компоненте [(AA)x]z аминокислотный компонент (АА)x может содержать или может быть фланкирован (например, с концов) по меньшей мере одной -SH-содержащей частью молекулы, предпочтительно по меньшей мере двумя -SH-содержащими частями молекулы, уже описанными выше, которые позволяют соединять разные аминокислотные компоненты (АА)x, используя дисульфидную связь через реакцию поликонденсации. Подобно указанному выше смешанный повторяющийся аминокислотный компонент [(AA)x]z также может быть прочтен в виде [S-(AA)x-S]z, где S представляет -SH-содержащую часть молекулы, например, остаток цистеина. В том случае, когда -SH-содержащая часть молекулы представляет цистеин, смешанный повторяющийся аминокислотный компонент [(AA)x]z также может быть прочтен как [Cys-(AA)x-Cys]z, где Cys представляет цистеин и предусмотрен для необходимой -SH-части молекулы для дисульфидной связи. Часть молекулы, содержащая -SH, также может быть внедрена в аминокислотный компонент (АА)x, используя какую-либо из модификаций или реакций, указанных выше, для компонентов Р1, Р2 или Р3.
Аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может быть предусмотрен по меньшей мере с одной -SH-частью молекулы, например, в форме, представленной формулой (AA)x-SH. Затем компонент (АА)x по формуле (AA)x-SH или смешанный повторяющийся аминокислотный компонент [(AA)x]z по формуле [(AA)x]z-SH может быть связан с каким-либо из компонентов L, Р1, Р2 и/или Р3 или другим компонентом (АА)x через дисульфидную связь. Если связь с компонентом Р1 и/или компонентом Р3, компонентами Р1 и/или Р3 предпочтительно представляет по меньшей мере две -SH-части молекулы для осуществления дальнейшего
связывания компонентов Р1 и/или Р3 с компонентом Р2 через -SH-часть молекулы, формируя дисульфидную связь (см. выше). Аминокислотный компонент (АА)x в форме, обозначаемой формулой (AA)x-SH, или смешанный повторяющийся аминокислотный компонент [(AA)x]z по формуле [(AA)x]z-SH также может быть применен для прекращения реакции конденсации благодаря его одной -SH части молекулы. В этом случае аминокислотный компонент (АА)x в форме, представленной формулой (AA)x-SH, предпочтительно соединен по концам с компонентами Р1 и/или Р3. Аминокислотный компонент (АА)x в форме, представленной формулой (AA)x-SH, или смешанный повторяющийся аминокислотный компонент [(AA)x]z по формуле [(AA)x]z-SH также может быть применен для связывания внутри с каким-либо из компонентов L, Р1, Р2 и/или Р3 или с дополнительным компонентом (АА)x через дополнительную внутреннюю -SH-часть молекулы какого-либо из компонентов L, Р1, Р2 и/или Р3 или (АА)x.
Кроме того, аминокислотный компонент (АА)x может быть предусмотрен с двумя -SH-частями молекулы (или даже более), например, в форме, обозначенной формулой HS-(AA)x-SH. Дополнительно смешанный повторяемый аминокислотный компонент [(АА)x]z может быть предусмотрен с двумя -SH-частями молекул (или даже более), например, в форме, представленной формулой HS-[(AA)x]z-SH, для осуществления связывания с двумя функциональными возможностями через дисульфидные связи, например, если аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z применяют в качестве линкера между двумя другими компонентами (например, в качестве линкера между компонентами L и Р1, между компонентами Р1 и Р2, в составе или в качестве
части повторяющегося компонента [S-P2-S]n, между компонентами Р2 и Р3 и/или между компонентами Р3 и L). В этом случае одну -SH часть молекулы предпочтительно защищают на первой стадии, используя защитную группу, известную в данной области, приводя к аминокислотному компоненту (АА)x формулы HS-(АА)х-S-защитная группа или к смешанному повторяющемуся аминокислотному компоненту [(AA)x]z формулы HS-[(АА)x]z-S-защитная группа. Кроме того, аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может быть связан с компонентом L, Р1, Р2 и/или Р3 для формирования первой дисульфидной связи через незащищенную часть молекулы -SH. Затем с защищенной-SH-части молекулы снимают защиту и связывают с другой свободной-SH-частью молекулы другого компонента L, Р1, Р2 и/или Р3 для формирования второй дисульфидной связи. В том случае, когда аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z является частью повторяющегося компонента [S-P2-S]n, предпочтительно, что формирование дисульфидных связей между (АА)x и Р2 одновременно
происходит с реакцией поликонденсации повторяющегося компонента [S-P2-S]n и таким образом нет необходимости в защите по меньшей мере двух концевых -SH-частей молекулы.
В другом варианте аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может быть получен с другими функциональными возможностями согласно описанному выше для компонентов Р1 и Р2 и/или Р3, что допускает связывание аминокислотного компонента (АА)x или связывание смешанного повторяющегося
аминокислотного компонента [(АА)x]z с каким-либо из компонентов Р1, Р2 и/или Р3 или (АА)x и необязательно с компонентом L.
Таким образом, по настоящему изобретению аминокислотный компонент (АА)x и/или смешанный повторяющийся аминокислотный компонент [(AA)x]z может быть связан с Р1, Р2, Р3, (АА)x и/или L с применением дисульфидной связи или без такого применения. Связывание без применения дисульфидной связи может дополняться какой-либо из описанных выше реакций, предпочтительно связыванием аминокислотного компонента (АА)x или смешанного повторяющегося аминокислотного компонента [(AA)x]z с Р1, Р2, Р3, (АА)x и/или L, используя химию амидов, описанную в настоящем изобретении. При желании или необходимости другой конец аминокислотного компонента (АА)x или смешанного повторяющегося аминокислотного компонента [(AA)x]z, например, N- или С-конец, может применяться для соединения другого компонента, например, лиганда L. Для этой цели другой конец аминокислотного компонента (АА)x или смешанного повторяющегося аминокислотного компонента [(AA)x]z предпочтительно включает или модифицирован для включения дополнительной функциональной возможности, например, алкин-разновидностей (см. выше), что можно применять для добавления другого компонента, например, через метод click-химии. Такая конструкция, например, L-(AA)x-P1-S-or L-[(AA)x]z-P'-S-, может применяться для терминации поликонденсации повторяющегося компонента [S-P2-S]n. Если лиганд связан через неустойчивую к кислотам связь, эта связь может быть расщеплена в эндосоме и обладающий признаками изобретения полимерный носитель представляет аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z на ее поверхности.
Аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может присутствовать в качестве дополнительного компонента приведенной выше общей формулы (I), например, в качестве линкера между компонентами Р1 или Р3 и Р2, в качестве линкера между компонентами L и Р1 или Р2 или в качестве дополнительного компонента повторяющегося компонента [S-P2-S]n.
По первому иному варианту такой аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может быть представлен в качестве линкера между компонентами Р1 или Р3 и компонентом Р2. Он предпочтительно представлен в составе целого обладающего признаками изобретения полимерного носителя формулы (I) следующими формулами:
L-P1-S-S-(AA)x-S-[S-P2-S]n-S-(AA)x-S-S-P3-L или
L-P1-S-[S-(AA)x-S]z-[S-P2-S]n-[S-(AA)x-S]z-S-P3-L,
где n, x, z, S, L, AA, P1, P2 и P3 предпочтительно соответствуют значениям, описанным в настоящем изобретении выше. В указанной выше формуле обозначение «-S-S-» представляет дисульфидную связь, в которой по меньшей мере один атом серы в дисульфидной связи также может быть представлен цистеином. В этом случае обозначение «-S-S-» в указанных формулах также может быть обозначен в виде «-S-Cys», а именно «-Cys-S» или «-Cys-Cys-». В таком контексте обозначение «-Cys-Cys-» отображает не пептидную связь, а связь двух цистеинов через их -SH-части молекулы для формирования дисульфидной связи. Таким образом, обозначение «-Cys-Cys-» также можно в общем виде представлять как «-(Cys-S)-(S-Cys)-», и в этом случае S обозначает атом серы в -SH-части молекулы цистеина. Соответственно, обозначения «-S-Cys» и «-Cys-S» отражают дисульфидную связь между -SH-содержащей частью молекулы и цистеином, и также могут быть записаны в виде «-S-(S-Cys)» и «-(Cys-S)-S».
В соответствии со вторым другим вариантом такой аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может присутствовать в качестве линкера между компонентами Р1 или Р3 и компонентом L. Он предпочтительно представлен в составе целого обладающего признаками изобретения полимерного носителя формулы (I) следующими формулами:
L-CAA^V-S-tS-P^SJn-S-P^AAVL, или
L-[(AA)x]z-P'-S-[S-P2-S]n-S-P3-[(AA)x]z-L,
или в другом варианте
L-(AA)x-S-S-P1-S-[S-P2-S]n-S-P3-S-S-(AA)x-S-S-L, или
L-S-S-(AA)x-S-S-P1-S-[S-P2-S]n-S-P3-S-S-(AA)x-S-S-L, или
L-S-[S-(AA)x-S]z-S-P1-S-[S-P2-S]n-S-P3-S-[S-(AA)x-S]z-S- и т.д.
где n, x, z, S, L, AA, Р1, Р2 и Р3 предпочтительно соответствуют значениям, описанным в настоящем изобретении выше. В указанной выше формуле обозначение «-S-S-» представляет дисульфидную связь, уже описанную выше.
В третьем варианте такой аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может присутствовать в качестве компонентов Р1 и/или Р3, где аминокислотный компонент (АА)x может быть непосредственно связан с компонентом Р1 и/или Р3 (например, с концом) без дополнительного лиганда L. В этом случае компонент (АА)x может быть в форме лиганда, описанного выше. Предпочтительно он представлен в контексте целого обладающего признаками изобретения полимерного носителя формулы (I) в виде формул:
(AA)x-P1-S-[S-P2-S]n-S-P3-(AA)x, или
[(AA)x]z-P1-S-[S-P2-S]n-S-P3[(AA)x]z или
или в другом варианте
(AA)x-S-S-P1-S-[S-P2-S]n-S-P3-S-S-(AA)x, или
H-[S-(AA)x-S]z-S-P1-S-[S-P2-S]n-S-S-P3-S-[S-(AA)x-S]z-H,
где n, x, z, S, АА, Р1, Р2 и Р3 предпочтительно соответствуют значениям, описанным в настоящем изобретении выше. В приведенных выше формулах обозначение «-S-S-» представляет дисульфидную связь, уже описанную выше. Свободная часть молекулы -SH по концам в последней формуле также может быть терминирована с помощью монотиольного соединения согласно описанному в настоящем изобретении.
Согласно четвертому и особенно предпочтительному другому варианту аминокислотный компонент (АА)x, предпочтительно записанный в виде «S-(AA)x-S» или «[S-(AA)x-S]», может применяться для модификации компонента Р2, особенно состава компонента S-P2-S в представленном выше повторяющемся компоненте [S-P2-S]n формулы (I). Он может быть представлен в остове целого полимерного носителя формулы (I) например, формулы (Ia):
L-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-L,
где x, S, L, АА, Р1, Р2 и Р3 предпочтительно являются описанными в настоящем изобретении. В приведенной выше формула (Ia) какой-либо из отдельных компонентов [S-P2-S] и [S-(AA)x-S] может присутствовать в каком-либо порядке в подформуле {[S-P2-S]a[S-(AA)x-S]b}. Число отдельных компонентов [S-P2-S] и [S-(AA)x-S] в подформуле {[S-P2-S]a[S-(AA)x-S]b} выражено a и b, где a+b=n.Обозначение «n» означает целое число, значение которого то же, что и для указанной выше формулы (I).
Обозначение «а» означает целое число, обычно выбранное независимо из целого числа b из диапазона примерно от 1 до 50, предпочтительно из диапазона примерно от 1, 2 или 3 до 30, более предпочтительно из диапазона примерно от 1, 2, 3, 4 или 5 до 25, или из диапазона примерно от 1, 2, 3, 4 или 5 до 20, или из диапазона примерно от 1, 2, 3, 4 или 5 до 15, или из диапазона примерно от 1, 2, 3, 4 или 5 до 10, включая например, диапазон примерно от 3 до 20, от 4 до 20, от 5 до 20, или от 10 до 20, или диапазон примерно от 3 до 15, от 4 до 15, 5 до 15, или от 10 до 15, или диапазон примерно от 6 до 11 или от 7 до 10. Наиболее предпочтительно а находится в диапазоне примерно от 1, 2, 3, 4 или 5 до 10, более предпочтительно в диапазоне примерно от 1, 2, 3 или 4 до 9, в диапазоне примерно от 1, 2, 3 или 4 до 8, или в диапазоне примерно от 1, 2 или 3 до 7.
Обозначение «b» означает целое число, обычно независимо выбранное из целых чисел в диапазоне примерно от 0 до 50 или от 1 до 50, предпочтительно в диапазоне примерно от 0, 1,2 или 3 до 30, более предпочтительно в диапазоне примерно от 0, 1, 2, 3, 4 или 5 до 25, или в диапазоне примерно от 0, 1, 2, 3, 4 или 5 до 20, или в диапазоне примерно от 0, 1, 2, 3, 4 или 5 до 15, или в диапазоне примерно от 0, 1, 2, 3, 4 или 5 до 10, включая, например, диапазон примерно от 3 до 20, от 4 до 20, от 5 до 20, или от 10 до 20, или в диапазоне примерно от 3 до 15, от 4 до 15, от 5 до 15 или от 10 до 15, или в диапазоне примерно от 6 до 11 или от 7 до 10. Наиболее предпочтительно b находится в диапазоне примерно от 1, 2, 3, 4 или 5 до 10, более предпочтительно в диапазоне примерно от 1, 2, 3 или 4 до 9, в диапазоне примерно от 1, 2, 3 или 4 до 8, или в диапазоне примерно от 1, 2 или 3 до 7.
В указанной выше формуле обозначение «-S-S-» (квадратные скобки опускают, чтобы было понятнее) означает дисульфидную связь, описанную выше.
Модификация компонента Р2, предпочтительно компонента S-P2-S повторяющегося компонента [S-P2-S]n, путем «разбавления» аминокислотными компонентами (АА)x также может быть осуществлен в контексте какого-либо из указанных выше вариантов целого полимерного носителя формулы (I),
L-P1-S-S-(AA)x-S-{[S-P2-S]a[S-(AA)x-S]b}-S-(AA)x-S-S-P3-L, или
L-P1-S-[S-(AA)x-S]z-{[S-P2-S]a[S-(AA)x-S]b}-[S-(AA)x-S]z-S-P3-L, или
L-(AA)-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-(AA)x-L, или
L-[(AA)x]z-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-[(AA)x]z-L, или
L-(AA)x-S-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-S-S-(AA)x-S-S-L, или
L-S-S-(AA)x-S-S-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-S-S-(AA)x-S-S-L, или
L-S-[S-(AA)x-S]z-S-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-S-[S-(AA)x-S]z-S-L, или
(AA)x-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-(AA)x, или
[(AA)x]z-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-[(AA)x]z, или
(AA)x-S-S-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-S-S-(AA)x, или
H-[S-(AA)x-S]z-S-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-S-[S-(AA)x-S]z-H,
где n, x, z, a, b, S, L, АА, P1, P2 и P3 предпочтительно те же, что и описанные выше в настоящем изобретении. Кроме того, обозначение «-S-S-» представляет дисульфидную связь и предпочтительно соответствуют значениям, описанным в настоящем изобретении выше.
В указанных выше разных вариантах, в которых компонент [S-P2-S] предпочтительно «разбавлен» аминокислотными компонентами [S-(AA)x-S], соотношение выражают целыми числами а и b, где a+b=n. Предпочтительно целые числа а и b выбраны таким образом, что катионные связывающие свойства компонента [S-P2-S] не утрачены, но сохраняются в минимальной степени в подформуле/компоненте {[S-P2-S]a[S-(AA)x-S]b}. Это позволяет ослаблять («разбавлять») катионную связывающую силу компонента [S-P2-S] в повторяющемся компоненте [S-P2-S]n обладающего признаками изобретения полимерного носителя формулы (I) до требуемой степени.
В таком специфическом контексте (требуемая) катионная связывающая сила подформулы/компонента {[S-P2-S]a[S-(AA)x-S]b} может быть определена разными методами.
По первому другому варианту компонент Р формулы (I) настоящего изобретения является наиболее предпочтительным катионным или поликатионным пептидом, согласно описанию настоящего изобретения. Кроме того, аминокислотный компонент (АА)x, предпочтительно обозначаемый [S-(AA)x-S], обычно представляет пептидную последовательность. В этом конкретном случае катионные свойства подформулы/компонента {[S-P2-S]a[S-(AA)x-S]b} могут быть определены по содержанию катионных аминокислот в целой подформуле/компоненте. Предпочтительно содержание катионных амнокислот в подформуле/компоненте {[S-P2-S]a[S-(AA)x-S]b} составляет по меньшей мере 10%, 20% или 30%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, 60% или 70%, но также предпочтительно по меньшей мере 80%, 90% или даже 95%, 96%, 97%, 98%, 99% или 100%, наиболее предпочтительно по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100%, или может быть в диапазоне примерно от 10% до 90%, более предпочтительно в диапазоне примерно от 15% до 75%, еще предпочтительнее в диапазоне примерно от 20% до 50%, например, 20, 30, 40 или 50%, или в диапазоне, сформированном двумя из указанных выше величин, при условии, что содержание всех аминокислот, например, катионных, липофильных, гидрофильных, ароматических и других аминокислот, в целой подформуле/компоненте {[S-P2-S]a[S-(AA)x-S]b} составляет 100%.
Согласно второму другому варианту компонент Р формулы (I) по настоящему изобретению особенно предпочтительно является катионным или поликатионным полимером, согласно описанию настоящего изобретения. Аминокислотный компонент (АА)x, предпочтительно обозначенный [S-(AA)x-S], обычно представляет пептидную последовательность. В определенном случае катионные свойства подформулы/компонента {[S-P2-S]a[S-(AA)x-S]b} могут быть определены по содержанию катионных зарядов в целой подформуле/компоненте. Предпочтительно содержание катионных зарядов в подформуле/компоненте {[S-Р2-S]a[S-(AA)x-S]b} при (физиологической) величине рН согласно описанию настоящего изобретения составляют по меньшей мере 10%, 20% или 30%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, 60% или 70%, но также предпочтительно по меньшей мере 80%, 90%, или даже 95%, 96%, 97%, 98%, 99% или 100%, наиболее предпочтительно по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100%, или может быть в диапазоне примерно от 10% до 90%, более предпочтительно в диапазоне примерно от 15% до 75%, еще предпочтительнее в диапазоне примерно от 20% до 50%, например, 20, 30, 40 или 50%, или в диапазоне, сформированном какими-либо двумя из указанных выше величин, при условии, что содержание всех зарядов, например, положительных и отрицательных зарядов при (физиологической) величине рН согласно описанному в настоящем изобретении, в целой подформуле/компоненте {[S-P2-S]a[S-(AA)x-S]b} составляет 100%.
В контексте настоящего изобретения аминокислотный компонент (АА)x может быть выбран из приводимых ниже других вариантов.
По первому варианту аминокислотный компонент (АА)x может быть компонентом ароматической аминокислотой (АА)x. Включение ароматических аминокислот или последовательностей в виде компонента (АА)x в обладающий признаками изобретения полимерного носителя формулы (I) по настоящему изобретению способствует другому (второму) связыванию обладающего признаками изобретения полимерного носителя с нуклеиновой кислотой из-за взаимодействий ароматических аминокислот с основаниями груза нуклеиновых кислот в отличие от их связывания катионными заряженными последовательностями молекулы полимерного носителя с фосфатным скелетом. Взаимодействие может быть, например, за счет интеркаляций или связывания малой или большой бороздки. Такой тип взаимодействия не склонен к разуплотнению анионными партнерами по комплексообразованию (например, гепарином, гиалуроновыми кислотами), которые обнаруживаются преимущественно во внеклеточном матриксе in vivo, а также мало чувствительны к солевым эффектам.
Для этой цели аминокислотная составляющая АА в ароматическом аминокислотном компоненте (АА)x может быть выбрана или из тех же, или из других ароматических аминокислот, например, из Trp, Tyr или Phe. В другом варианте аминокислотная составляющая АА (или целый ароматический аминокислотный компонент (АА)x) может быть выбрана из следующих пептидных комбинаций: Trp-Tyr, Tyr-Trp, Trp-Trp, Tyr-Tyr, Trp-Tyr-Trp, Tyr-Trp-Tyr, Trp-Trp-Trp, Tyr-Tyr-Tyr, Trp-Tyr-Trp-Tyr, Tyr-Trp-Tyr-Trp, Trp-Trp-Trp-Trp, Phe-Tyr, Tyr-Phe, Phe-Phe, Phe-Tyr-Phe, Tyr-Phe-Tyr, Phe-Phe-Phe, Phe-Tyr-Phe- Tyr, Tyr-Phe-Tyr-Phe, Phe-Phe-Phe-Phe, Phe-Trp, Trp-Phe, Phe-Phe, Phe-Trp-Phe, Trp-Phe-Trp, Phe-Trp-Phe-Trp, Trp-Phe-Trp-Phe или Tyr-Tyr-Tyr-Tyr и т.д. (SEQ ID NO: 85-112) или из их комбинаций.
Дополнительно ароматический аминокислотный компонент (АА)x может содержать или может быть фланкирован -SH-содержащей частью молекулы, которая позволяет внедрять этот компонент через дисульфидную связь в качестве дополнительной части приведенной выше общей формулы (I), например, в качестве линкера или более предпочтительно в качестве составляющей повторяющегося компонента [S-P2-S]n. Такая -SH-содержащая часть молекулы может быть какой-либо частью молекулы, описанной в настоящем изобретении, применимой для соединения одного компонента, согласно описанию в настоящем изобретении, с другим компонентом, согласно описанному в настоящем изобретении. В качестве примера такая -SH-содержащая часть молекулы может быть цистеином. Кроме того, например, ароматический аминокислотный компонент (АА)x может быть выбран, например, из пептидных комбинаций Cys-Tyr-Cys, Cys-Trp-Cys, Cys-Trp-Tyr-Cys, Cys-Tyr-Trp-Cys, Cys-Trp-Trp-Cys, Cys-Tyr-Tyr-Cys, Cys-Trp-Tyr-Trp-Cys, Cys-Tyr-Trp-Tyr-Cys, Cys-Trp-Trp-Trp-Cys, Cys-Tyr-Tyr-Tyr-Cys, Cys-Trp-Tyr-Trp-Tyr-Cys, Cys-Tyr-Trp-Tyr-Trp-Cys, Cys-Trp-Trp-Trp-Trp-Cys, Cys-Tyr-Tyr-Tyr-Tyr-Cys, Cys-Phe-Cys, Cys-Phe-Tyr-Cys, Cys-Tyr-Phe-Cys, Cys-Phe-Phe-Cys, Cys-Tyr-Tyr-Cys, Cys-Phe-Tyr-Phe-Cys, Cys-Tyr-Phe-Tyr-Cys, Cys-Phe-Phe-Phe-Cys, Cys-Tyr-Tyr-Tyr-Cys, Cys-Phe-Tyr-Phe-Tyr-Cys, Cys-Tyr-Phe-Tyr-Phe-Cys, или Cys-Phe-Phe-Phe-Phe-Cys, Cys-Phe-Trp-Cys, Cys-Trp-Phe-Cys, Cys-Trp-Trp-Cys, Cys-Phe-Trp-Phe-Cys, Cys-Trp-Phe-Trp-Cys, Cys-Phe-Trp-Phe-Trp-Cys, Cys-Trp-Phe-Trp-Phe-Cys и т.д. (SEQ ID NO: 113-145) или их комбинаций. Каждый указанный выше Cys может быть замещен каким-либо модифицированным пептидом или химическим соединением, несущим свободную -SH-часть молекулы, описанную в настоящем изобретении.
Дополнительно ароматический аминокислотный компонент (АА)x может содержать по меньшей мере один пролин, который может служить в качестве нарушителя более длинных повторяющихся последовательностей Trp, Tyr и Phe в ароматическом аминокислотном компоненте (АА)x, предпочтительно два, три или более пролинов.
По второму другому варианту аминокислотный компонент (АА)x может быть гидрофильным (и предпочтительно незаряженным полярным) аминокислотным компонентом (АА)x. Включение гидрофильных (и предпочтительно незаряженных полярных) аминокислот или последовательностей в качестве аминокислотного гидрофильного (и предпочтительно незаряженного полярного) компонента (АА)x в обладающий признаками изобретения полимерный носитель формулы (I) настоящего изобретения способствует более гибкому связыванию с грузом нуклеиновой кислоты. Это приводит к более эффективному уплотнению груза нуклеиновой кислоты и поэтому к лучшей защите от нуклеаз и нежелательного разуплотнения. Также обеспечивается (длинный) обладающий признаками изобретения полимерный носитель формулы (I), который проявляет сниженный катионный заряд по целому носителю или предпочтительно в повторяющемся компоненте [S-P2-S]n и в этом контексте к лучшим налаженным связывающим свойствам при желании или необходимости.
Для этой цели аминокислотный компонент АА в гидрофильном (и предпочтительно незаряженном полярном) аминокислотном компоненте (АА)x может быть выбран из той же или из другой гидрофильной (и предпочтительно незаряженной полярной) аминокислоты, например, выбранной из Thr, Ser, Asn или Gin. В другом варианте аминокислотный компонент АА (или целый гидрофильный (и предпочтительно незаряженный полярный) аминокислотный компонент (АА)x) может быть выбран из следующих пептидных комбинаций: Ser-Thr, Thr-Ser, Ser-Ser, Thr-Thr, Ser-Thr-Ser, Thr-Ser-Thr, Ser-Ser-Ser, Thr-Thr-Thr, Ser-Thr-Ser-Thr, Thr-Ser-Thr-Ser, Ser-Ser-Ser-Ser, Thr-Thr-Thr-Thr, Gln-Asn, Asn-Gln, Gln-Gln, Asn-Asn, Gln-Asn-Gln, Asn-Gln-Asn, Gln-Gln-Gln, Asn-Asn-Asn, Gln-Asn-Gln-Asn, Asn-Gln-Asn-Gln, Gln-Gln-Gln-Gln, Asn-Asn-Asn-Asn, Ser-Asn, Asn-Ser, Ser-Ser, Asn-Asn, Ser-Asn-Ser, Asn-Ser-Asn, Ser-Ser-Ser, Asn-Asn-Asn, Ser-Asn-Ser-Asn, Asn-Ser-Asn-Ser, Ser-Ser-Ser-Ser или Asn-Asn-Asn-Asn и т.д. (SEQ ID NO: 146-181) или их комбинаций.
Дополнительно гидрофильный (и предпочтительно незаряженный полярный) аминокислотный компонент (АА)x может содержать или может быть фланкирован -SH-содержащей частью молекулы, которая позволяет интродуцировать этот компонент через дисульфидную связь в качестве другой части указанной выше общей формулы (I), например, в качестве линкера или более предпочтительно в качестве составляющего элемента повторяющегося компонента [S-P2-S]n. Такая -SH-содержащая часть молекулы может быть какой-либо частью молекулы согласно описанию настоящего изобретения, применимой для соединения одного компонента согласно описанию настоящего изобретения с другим компонентом согласно описанию настоящего изобретения. В качестве примера такая -SH-содержащая часть молекулы может быть цистеином. Кроме того, например, гидрофильный (и предпочтительно незаряженный полярный) аминокислотный компонент (АА)x может быть выбран, например, из пептидных комбинаций Cys-Thr-Cys, Cys-Ser-Cys, Cys-Ser-Thr-Cys, Cys-Thr-Ser-Cys, Cys-Ser-Ser-Cys, Cys-Thr-Thr-Cys, Cys-Ser-Thr-Ser-Cys, Cys-Thr-Ser-Thr-Cys, Cys-Ser-Ser-Ser-Cys, Cys-Thr-Thr-Thr-Cys, Cys-Ser-Thr-Ser-Thr-Cys, Cys-Thr-Ser-Thr-Ser-Cys, Cys-Ser-Ser-Ser-Ser-Cys, Cys-Thr-Thr-Thr-Thr-Cys, Cys-Asn-Cys, Cys-Gln-Cys, Cys-Gln-Asn-Cys, Cys-Asn-Gln-Cys, Cys-Gln-Gln-Cys, Cys-Asn-Asn-Cys, Cys-Gln-Asn-Gln-Cys, Cys-Asn-Gln-Asn-Cys, Cys-Gln-Gln-Gln-Cys, Cys-Asn-Asn-Asn-Cys, Cys-Gln-Asn-Gln-Asn-Cys, Cys-Asn-Gln-Asn-Gln-Cys, Cys-Gln-Gln-Gln-Gln-Cys, Cys-Asn-Asn-Asn-Asn-Cys, Cys-Asn-Cys, Cys-Ser-Cys, Cys-Ser-Asn-Cys, Cys-Asn-Ser-Cys, Cys-Ser-Ser-Cys, Cys-Asn-Asn-Cys, Cys-Ser-Asn-Ser-Cys, Cys-Asn-Ser-Asn-Cys, Cys-Ser-Ser-Ser-Cys, Cys-Asn-Asn-Asn-Cys, Cys-Ser-Asn-Ser-Asn-Cys, Cys-Asn-Ser-Asn-Ser-Cys, Cys-Ser-Ser-Ser-Ser-Cys, или Cys-Asn-Asn-Asn-Asn-Cys и т.д. (SEQ ID NO: 182-223) или их комбинаций. Каждый указанный выше Cys может быть замещен каким-либо модифицированным пептидом или химическим соединением, несущим свободную -SH-часть молекулы, согласно описанию настоящего изобретения.
Дополнительно гидрофильный (и предпочтительно незаряженный полярный) аминокислотный компонент (АА)x может содержать по меньшей мере один пролин, который может служить в качестве разрушителя структуры более длинных повторяющихся последовательностей Ser, Thr и Asn в гидрофильном (и предпочтительно незаряженном полярном) аминокислотном компоненте (АА)x, предпочтительно два, три или более пролинов.
По третьему другому варианту аминокислотный компонент (АА)x может быть липофильным аминокислотным компонентом (АА)x. Включение липофильных аминокислот или последовательностей в качестве липофильного аминокислотного компонента (АА)x в обладающий признаками изобретения полимерный носитель формулы (I) настоящего изобретения способствует повышенному уплотнению груза нуклеиновой кислоты и/или полимерному носителю формулы (I) и его грузу нуклеиновой кислоты при формировании комплекса. Это в частности происходит из-за взаимодействий одной или более полимерных цепей обладающего признаками изобретения полимерного носителя, особенно липофильных частей липофильного аминокислотного компонента (АА)x, предпочтительно в контексте подформулы/компонента {[S-Р2-S]a[S-(AA)x-S]b}, и груза нуклеиновой кислоты. Это взаимодействие предпочтительно может придать дополнительной стабильности комплексу между полимерным носителем по формуле (I) и его грузом - нуклеиновой кислотой. Такая стабилизация может так или иначе быть сопоставлена с типом некбвалентных перекрестных сшивок между разными цепями полимера. Особенно в водной среде такое взаимодействие обычно сильное и обеспечивает существенный эффект.
Для этой цели аминокислотная составляющая АА в липофильном аминокислотном компоненте (АА)x может быть выбрана из той же, или других липофильных аминокислот, например, выбранных из Leu, Val, lie, Ala, Met. В, другом варианте аминокислотная составляющая АА (или целый липофильный аминокислотный компонент (АА)x) может быть выбрана из следующих пептидных комбинаций: Leu-Val, Val-Leu, Leu-Leu, Val-Val, Leu-Val-Leu, Val-Leu-Val, Leu-Leu-Leu, Val-Val-Val, Leu-Val-Leu-Val, Val-Leu-Val-Leu, Leu-Leu-Leu-Leu, Val-Val-Val-Val, Ile-Ala, Ala-Ile, Ile-Ile, Ala-Ala, Ile-Ala-Ile, Ala-Ile-Ala, Ile-Ile-Ile, Ala-Ala-Ala, Ile-Ala-Ile-Ala, Ala-Ile-Ala-Ile, Ile-Ile-Ile-Ile, Ala-Ala-Ala-Ala, Met-Ala, Ala-Met, Met-Met, Ala-Ala, Met-Ala-Met, Ala-Met-Ala, Met-Met-Met, Ala-Ala-Ala, Met-Ala-Met-Ala, Ala-Met-Ala-Met или Met-Met-Met-Met и т.д. (SEQ ID NO: 224-258) или их комбинаций.
Дополнительно липофильный аминокислотный компонент (АА)x может содержать -SH-содержащую часть молекулы или может быть фланкирован ею, что позволяет интродуцировать этот компонент через дисульфидную связь в качестве дополнительной части приведенной выше общей формулы (I), например, в качестве линкера или более предпочтительно в качестве составляющей повторяющегося компонента [S-P2-S]n. Такая -SH-содержащая часть молекулы может быть какой-либо частью молекулы, описанной в настоящем изобретении, пригодной для соединения одного компонента, согласно описанию настоящего изобретения, с другим компонентом, согласно описанию настоящего изобретения. В качестве примера такая -SH-содержащая часть молекулы может быть цистеином. Затем, например, липофильный аминокислотный компонент (АА)x может быть выбран, например, из пептидных комбинаций: Cys-Val-Cys, Cys-Leu-Cys, Cys-Leu-Val-Cys, Cys-Val-Leu-Cys, Cys-Leu-Leu-Cys, Cys-Val-Val-Cys, Cys-Leu-Val-Leu-Cys, Cys-Val-Leu-Val-Cys, Cys-Leu-Leu-Leu-Cys, Cys-Val-Val-Val-Cys, Cys-Leu-Val-Leu-Val-Cys, Cys-Val-Leu-Val-Leu-Cys, Cys-Leu-Leu-Leu-Leu-Cys, Cys-Val-Val-Val-Val-Cys, Cys-Ala-Cys, Cys-Ile-Cys, Cys-Ile-Ala-Cys, Cys-Ala-Ile-Cys, Cys-Ile-Ile-Cys, Cys-Ala-Ala-Cys, Cys-Ile-Ala-Ile-Cys, Cys-Ala-Ile-Ala-Cys, Cys-Ile-Ile-Ile-Cys, Cys-Ala-Ala-Ala-Cys, Cys-Ile-Ala-Ile-Ala-Cys, Cys-Ala-Ile-Ala-Ile-Cys, Cys-Ile-Ile-Ile-Ile-Cys, или Cys-Ala-Ala-Ala-Ala-Cys, Cys-Met-Cys, Cys-Met-Ala-Cys, Cys-Ala-Met-Cys, Cys-Met-Met-Cys, Cys-Ala-Ala-Cys, Cys-Met-Ala-Met-Cys, Cys-Ala-Met-Ala-Cys, Cys-Met-Met-Met-Cys, Cys-Ala-Ala-Ala-Cys, Cys-Met-Ala-Met-Ala-Cys, Cys-Ala-Met-Ala-Met-Cys, Cys-Met-Met-Met-Met-Cys, или Cys-Ala-Ala-Ala-Ala-Cys и т.д. (SEQ ID NO: 289-299) или их комбинаций. Каждый указанный выше Cys также может быть замещен каким-либо модифицированным пептидом или химическим соединением, несущим свободную -SH-содержащую часть молекулы согласно описанию настоящего изобретения.
Дополнительно липофильный аминокислотный компонент (АА)x может содержать по меньшей мере один пролин, который может служить в качестве разрушителя структуры более длинных повторяющихся последовательностей Leu, Val, Не, Ala и Met в липофильном аминокислотном компоненте (АА)x, предпочтительно два, три или более пролинов.
Согласно четвертому другому варианту аминокислотный компонент (АА)x может быть слабым основным аминокислотным компонентом (АА)x. Включение слабых основных аминокислот или последовательностей в качестве слабого основного аминокислотного компонента (АА)x в обладающий признаками изобретения полимерный носитель формулы (I) по настоящему изобретению может служить в качестве протонной губки и облегчать эндосомальный выход (также называемый эндосомальным высвобождением) (эффект протонной губки). Включение такого слабого основного аминокислотного компонента (АА)x предпочтительно повышает эффективность трансфекции.
Для этой цели аминокислотная составляющая АА в слабо щелочном аминокислотном компоненте (АА)x может быть выбрана из той же, или других слабо щелочных аминокислот, например, выбранных из гистидина или аспартата (аспарагиновой кислоты). В другом варианте слабо щелочная аминокислотная составляющая АА (или целый слабо щелочной аминокислотный компонент (АА)x) может быть выбран из следующих пептидных комбинаций: Asp-His, His-
Asp, Asp-Asp, His-His, Asp-His-Asp, His-Asp-His, Asp-Asp-Asp, His-His-His, Asp-His-Asp-His, His-Asp-His-Asp, Asp-Asp-Asp-Asp или His-His-His-His и т.д. (SEQ ID NO: 300-311) или их комбинаций.
Дополнительно слабо щелочной аминокислотный компонент (АА)x может содержать -SH-содержащую часть молекулы или может быть фланкирован ею, что позволяет интродуцировать этот компонент через дисульфидную связь в качестве дополнительной части приведенной выше общей формулы (I), например, в качестве линкера или более предпочтительно в качестве составляющей повторяющегося компонента [S-P2-S]n. Такая -SH-содержащая часть молекулы может быть какой-либо частью молекулы, описанной в настоящем изобретении, пригодной для соединения одного компонента, согласно описанию настоящего изобретения, с другим компонентом, согласно описанию настоящего изобретения. В качестве примера такая -SH-содержащая часть молекулы может быть цистеином. Затем, например, слабо щелочной аминокислотный компонент (АА)x может быть выбран, например, из пептидных комбинаций: Cys-His-Cys, Cys-Asp-Cys, Cys-Asp-His-Cys, Cys-His-Asp-Cys, Cys-Asp-Asp-Cys, Cys-His-His-Cys, Cys-Asp-His-Asp-Cys, Cys-His-Asp-His-Cys, Cys- Asp-Asp-Asp-Cys, Cys-His-His-His-Cys, Cys-Asp-His-Asp-His-Cys, Cys-His-Asp-His-Asp-Cys, Cys-Asp-Asp-Asp-Asp-Cys, или Cys-His-His-His-His-Cys, и т.д. (SEQ ID NOs: 312-325) или их комбинаций. Каждый приведенный выше Cys также может быть замещен каким-либо модифицированным пептидом или химическим соединением, несущим свободную -SH-часть молекулы, согласно описанному в настоящем изобретении.
Дополнительно слабо основной аминокислотный компонент (АА)x может содержать по меньшей мере один пролин, который может служить в качестве разрушителя структуры удлиненных повторяющихся последовательностей гистидина или аспартата (аспарагиновой кислоты) в слабо основном аминокислотном компоненте (АА)x, предпочтительно два, три или более пролинов.
Дополнительно обладающий признаками изобретения полимерный носитель по приведенной выше формуле (I) (или по какой-либо из приведенной в настоящем изобретении ее подформул), может включать дополнительный компонент, предпочтительно в качестве лиганда L или в качестве аминокислотного компонента (АА)x, сигнальный пептид, сигнал или последовательность локализации, или сигнал или последовательность ядерной локализации (nuclear localization signal sequence - NLS), который допускает транслокацию обладающего признаками изобретения полимерного носителя по приведенной выше формуле (I) к специфической мишени, например, в клетке, в ядре, в компартменте эндосомы, последовательности для митохондриального матрикса, последовательности локализации для плазматической мембраны, последовательности локализации для аппарата Гольджи, ядра, цитоплазмы и цитоскелета и т.д. Такой сигнальный пептид, сигнал или последовательность локализации или сигнал ядерной локализации может применяться для транспорта какой-либо из описанных в настоящем изобретении нуклеиновых кислот, предпочтительно РНК или ДНК, более предпочтительно коротких шпилечных РНК (кшРНК) или плазмидной ДНК (пДНК), например, в ядро. Не ограничиваясь ими, такой сигнальный пептид, сигнал или последовательность локализации или сигнал ядерной локализации могут включать, например, последовательности локализации для эндоплазматической сети. К отдельным сигналам или последовательностям локализации или сигналам ядерной локализации могут относиться, например, KDEL (SEQ ID NO: 326), DDEL (SEQ ID NO: 327), DEEL (SEQ ID NO: 328), QEDL (SEQ ID NO: 329), RDEL (SEQ ID NO: 330), и GQNLSTSN (SEQ ID NO: 331), последовательности ядерной локализации, включая PKKKRKV (SEQ ID NO: 332), PQKKIKS (SEQ ID NO: 333), QPKKP (SEQ ID NO: 334), RKKR (SEQ ID NO: 335), RKKRRQRRRAHQ (SEQ ID NO: 336), RQARRNRRRRWRERQR (SEQ ID NO: 337), MPLTRRRPAASQALAPPTP (SEQ ID NO: 338), GAALTILV (SEQ ID NO: 339) и GAALTLLG (SEQ ID NO: 340), последовательности локализации для эндосомального компартмента, включая MDDQRDLISNNEQLP (SEQ ID NO: 341), последовательности локализации для митохондриального матрикса, включая MLFNLRXXLNNAAFRHGHNFMVRNFRCGQPLX (SEQ ID NO: 342), последовательности локализации для плазматической мембраны: GCVCSSNP (SEQ ID NO: 343), GQTVTTPL (SEQ ID NO: 344), GQELSQHE (SEQ ID NO: 345), GNSPSYNP (SEQ ID NO: 346), GVSGSKGQ (SEQ ID NO: 347), GQTITTPL (SEQ ID NO: 348), GQTLTTPL (SEQ ID NO: 349), GQIFSRSA (SEQ ID NO: 350), GQIHGLSP (SEQ ID NO: 351), GARASVLS (SEQ ID NO: 352) и GCTLSAEE (SEQ ID NO: 353), последовательности локализации для эндоплазматической сети и ядра, включая GAQVSSQK (SEQ ID NO: 354) и GAQLSRNT (SEQ ID NO: 355), последовательности локализации для аппарата Гольджи, ядра, цитоплазмы и цитоскелета, включая GNAAAAKK (SEQ ID NO: 356), последовательности локализации для цитоплазмы и цитоскелета, включая GNEASYPL (SEQ ID NO: 357), последовательности локализации для плазматической мембраны и цитоскелета, включая GSSKSKPK (SEQ ID NO: 358), и т.д. К примерам секреторных сигнальных пептидных последовательностей, описанных в настоящем изобретении, относятся, но ими не ограничиваются, сигнальные последовательности классических или неклассических молекул главного комплекса гистосовместимости (ГКГ) (например, сигнальные последовательности молекул ГКГ I и II, например, молекулы ГКГ класса I HLA-А*0201), сигнальные последовательности цитокинов или иммуноглобулинов, согласно описанному в настоящем изобретении, сигнальные последовательности инвариантной цепи иммуноглобулинов или антител, согласно описанному в настоящем изобретении, сигнальные последовательности Lamp1, тапазин, Erp57, калретикулин, калнексин и другие ассоциированные с мембраной белки или белки, ассоциированные с эндоплазматической сетью (ЭС) или эндосомально-лизосомальным компартментом. Особенно предпочтительно по настоящему изобретению могут быть применены сигнальные последовательности молекулы HLA-A*0201 I класса ГКГ. Наиболее предпочтительно такой дополнительный компонент может быть компонентом L, описанным в настоящем изобретении. В другом варианте такой дополнительный компонент также может быть связан, например, с компонентом L, Р1, Р2, Р3 или (АА)x согласно описанному в настоящем изобретении, например, с боковой цепью какого-либо из компонентов L, Р1, Р2, Р3 или (АА)x, предпочтительно через боковую цепь компонента Р2, или необязательно в качестве линкера между компонентами L и Р1 или Р3 и L. Связывание с каким-либо из компонентов L, Р1, Р2 или Р3 также может быть осуществлено, используя неустойчивую к кислотам связь, предпочтительно через боковую цепь какого-либо из компонентов L, Р1, Р2, Р3 что позволяет отсоединить или высвободить дополнительный компонент при пониженных величинах рН, например, при физиологических величинах рН согласно описанному в настоящем изобретении.
Дополнительно обладающий признаками изобретения полимерный носитель по приведенной выше формуле (I) (или по какой-либо из приведенных в настоящем изобретении ее подформул) может включать дополнительные функциональные пептиды или белки, предпочтительно в качестве лиганда или аминокислотного компонента (АА)x, которые соответственно могут модулировать функциональность обладающего признаками изобретения полимерного носителя. В другом варианте такие дополнительные функциональные пептиды или белки могут включать так называемые проникающие в клетку пептиды (ПКП) или катионные пептиды для транспортировки. Особенно предпочтительными являются пептиды ПКП, которые индуцируют рН-опосредованное конформационное изменение в эндосоме и приводят к улучшенному высвобождению обладающего признаками изобретения полимерного носителя (в комплексе с нуклеиновой кислотой) из эндосомы путем инсерции в липидный слой липосомы. Так называемые проникающие в клетку пептиды (ПКП) или катионные пептиды для транспортировки могут включать, но ими перечень не ограничивается, протамин, нуклеолин, спермин или спермидин, поли-Ь-лизин (PLL), основные полипептиды, полиаргинин, проникающие в клетку пептиды (ПКП), химерные пептиды ПКП, например, транспортан, или пептиды MPG, ВИЧ-связывающие пептиды, Tat, ВИЧ-1 Tat (ВИЧ), Tat-производные пептиды, олигоаргинины, представителей семейства пенетратина, например, пенетратин, Antennapedia-производные пептиды (в частности из Drosophila antennapedia), pAntp, pIs1, и т.д., антимикробные производные ПКП, например, буфорин-2, Вас715-24, SynB, SynB(l), pVEC, hCT-производные пептиды, SAP, MAP, KALA, PpTG20, обогащенные пролином пептиды, олигомеры, обогащенные аргинином пептиды, кальцитониновые пептиды, FGF, лактоферрин, поли-L-лизин, поли-аргинин, гистоны, УР22-производные пептиды или аналоги, HSV, VP22 {Herpes simplex), MAP, KALA или домены белковой трансдукции (домены PTD, РрТ620, обогащенные пролином пептиды, обогащенные аргинином пептиды, обогащенные лизином пептиды, Рер-1, L-олигомеры, кальцитониновый пептид (пептиды) и др. Таким образом, такой дополнительный компонент может присутствовать в качестве компонента L или (АА)x, согласно описанному в настоящем изобретении. В другом варианте такой дополнительный компонент также может быть связан с компонентом L, Р1, Р2, Р3 или (АА)x согласно описанному в настоящем изобретении, например, с боковой цепью какого-либо из компонентов L, Р1, Р2, Р3 или (АА)x, предпочтительно через боковую цепь компонента Р2, или необязательно в качестве линкера между компонентами L и Р1 или Р3 и L. Связывание какого-либо из компонентов L, Р1, Р2, Р3 или (АА)x также может быть достигнуто, используя неустойчивую к кислотам связь, предпочтительно через боковую какого-либо из компонентов L, Р1, Р2, Р3 или (АА)x, что позволяет отсоединить или высвободить дополнительный компонент при пониженных значениях рН, например, при физиологических значениях рН, согласно описанному в настоящем изобретении. В этом контексте особенно предпочтительно, что такой дополнительный компонент присутствует в качестве лиганда L или аминокислотного компонента (АА)x повторяющегося компонента [S-P2-S]n формулы (I).
Согласно последнему другому варианту обладающий признаками изобретения полимерный носитель указанной выше формулы (I) (или по какой либо из приведенных в настоящем изобретении подформул) может включать дополнительный компонент, предпочтительно аминокислотный компонент (АА)x, какой-либо пептид или белок, способный выполнять какую-либо необходимую функцию в клетке. Особенно предпочтительны пептиды или белки, выбранные из белков или пептидов терапевтического действия, из антигенов, например, опухолевых антигенов, патогенных антигенов (животных антигенов, вирусных антигенов, антигенов простейших, бактериальных антигенов, аллергических антигенов), аутоиммунных антигенов или других антигенов, от аллергенов, от антител, от иммуностимулирующих белков или пептидов, от антиген-специфичных Т-клеточных рецепторов или от какого-либо другого белка или пептида, пригодного для специфического (терапевтического) применения, согласно описанному ниже, для кодирующих нуклеиновых кислот.Особенно предпочтительны пептидные эпитопы от антигенов, согласно описанному в настоящем изобретении. Таким образом, например дополнительным компонентом предпочтительно может быть, например, такой компонент (АА)x, который описан в настоящем изобретении. В другом варианте, такой дополнительный компонент также может быть связан с компонентом L, Р1, Р2, Р3 или (АА)x, согласно описанному в настоящем изобретении, например, с боковой цепью какого-либо из компонентов L, Р1, Р2, Р3 или (АА)x, предпочтительно через боковую цепь компонента Р2, или необязательно в качестве линкера между компонентами L и Р1 или Р3 и L. Связывание с каким-либо из компонентов L, Р1, Р2, Р3 или (АА)x также может быть осуществлено, используя неустойчивую к кислотам связь, предпочтительно через боковую цепь какого-либо из компонентов L, Р1, Р2, Р3 или (АА)x, что позволяет отсоединить или высвободить дополнительный компонент при пониженных значениях рН, например, при физиологических величинах рН, согласно описанному в настоящем изобретении. В этом контексте особенно предпочтительно, что такой дополнительный компонент присутствует в качестве аминокислотной составляющей (АА)x повторяющегося компонента [S-P2-S]n формулы (I).
Обладающий признаками изобретения полимерный носитель формулы (I) может включать по меньшей мере один из указанных выше катионных или поликатионных пептидов, белков или полимеров или других компонентов, например, (AA), причем какой-либо из указанных выше отличающихся вариантов можно комбинировать друг с другом и может быть сформирован полимеризацией в реакции поликонденсации через их -SH-части молекулы.
Основополагающая задача настоящего изобретения также связана с решением, изложенным во втором варианте осуществления настоящего изобретения с помощью комплекса обладающего признаками изобретения полимерного носителя с грузом и молекулы полимерного носителя общей формулы (I) L-P1-S-[S-P2-S]n-S-P3-L, согласно описанному в настоящем изобретении (или по какой-либо из приведенных в настоящем изобретении ее подформул). Такой комплекс для целей настоящего описания также может быть назван «комплексной нуклеиновой кислотой».
В комплексе обладающего признаками изобретения полимерного носителя с грузом молекула полимерного носителя общей формулы (I) L-P1-S-[S-P2-S]n-S-P3-L, согласно описанному в настоящем изобретении, (или какой-либо из приведенных в настоящем изобретении подформул) и груз нуклеиновой кислоты обычно предусмотрены в мольном соотношении примерно от 5 до 10000, предпочтительно в мольном соотношении примерно от 5 до 5000, более предпочтительно в мольном соотношении примерно от 5 до 2500, еще более предпочтительно в мольном соотношении примерно от 5 до 2000, и наиболее предпочтительно в мольном соотношении примерно от 5 до 1000 молекулы обладающего признаками изобретения полимерного носителягнуклеиновой кислоты, или в мольном соотношении примерно от 50 до 1000 молекулы обладающего признаками изобретения полимерного носителя: нуклеиновой кислоты, например, в мольном соотношении примерно от 10 до 5000, в мольном соотношении примерно от 20 до 2500, в мольном соотношении примерно от 25 до 2000 молекулы обладающего признаками изобретения полимерного носителя: нуклеиновой кислоты.
Кроме того, в комплексе обладающего признаками изобретения полимерного носителя с грузом молекула полимерного носителя общей формулы (I) L-P1-S-[S-P2-S]n-S-P3-L, согласно описанному в настоящем изобретении (или какой-либо из приведенных в настоящем изобретении подформул), и груз нуклеиновой кислоты предпочтительно предусматривают в N/P-соотношении примерно от 0,1 до 20, предпочтительно в N/P-соотношении примерно от 0,2 до 12, и еще более предпочтительно в N/P-соотношении примерно от 0,4 до 10 или от 0,6 до 5. В этом контексте, N/P-соотношение выражают в виде соотношения азота/фосфата (N/P-соотношение) целого комплекса обладающего признаками изобретения полимерного носителя с грузом. Обычно это является показателем содержания/количества пептидов, если применяют пептиды, у обладающего признаками изобретения полимерного носителя и показателем содержания/количества связанных нуклеиновых кислот или объединенных в комплекс с обладающим признаками изобретения полимерным носителем с грузом. Расчет может быть произведен, например, исходя из того, что 1 мкг РНК обычно содержит примерно 3 нмоля остатков фосфата, при условии, что РНК демонстрирует статистическое распределение оснований. Дополнительно 1 мкг пептида обычно содержит примерно х*1 мкг/М (пептида) нмолей остатков азота в зависимости от молекулярной массы и числа x его (катионных) аминокислот.
В контексте настоящего изобретения такой груз нуклеиновой кислоты в комплексе обладающего признаками изобретения полимерного носителя, сформированного грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I) (или какой-либо из приведенных в настоящем изобретении ее подформул), может быть какой-либо соответствующей нуклеиновой кислотой, выбранной, например, из какой-либо ДНК, предпочтительно, например, геномной ДНК, молекул одноцепочечной ДНК, молекул двухцепочечной ДНК, кодирующей ДНК, ДНК праймеров, ДНК зондов, пДНК, иммуностимулирующей ДНК, но ими перечень не ограничивается, или выбранной, например, из какой-либо ПНК (пептидной нуклеиновой кислоты) или может быть выбранной, например, из какой-либо РНК, предпочтительно, но ими перечень не ограничивается, кодирующей РНК, информационной РНК (иРНК), миРНК, shPHK, антисмысловой РНК, или рибопереключателей, иммуностимулирующей РНК (исРНК) рибозимов или аптамеров; и т.д. Нуклеиновая кислота также может быть рибосомальной РНК (рРНК), транспортной РНК (тРНК), информационной РНК (иРНК) или вирусной РНК (вРНК). Предпочтительно нуклеиновой кислотой является РНК, более предпочтительно кодирующая РНК. Еще более предпочтительно нуклеиновая кислота может быть (линейная) одноцепочечной РНК, еще более предпочтительно иРНК. В контексте настоящего изобретения иРНК обычно является РНК, которая состоит из нескольких структурных элементов, например, необязательной области 5'-UTR, расположенного выше по цепи сайта связывания рибосомы с последующей расположенной кодирующей областью, необязательной областью З'-UTR, за которой может быть поли-А хвост (и/или поли-С-хвост). иРНК может быть в виде моно-, ди- или даже полицистронной РНК, т.е. РНК, которая несет кодирующие последовательности одного, двух или более (одинаковых или разных) белков и пептидов, согласно описанному в настоящем изобретении. Такие кодирующие последовательности в ди- или даже полицистронной иРНК могут быть разделены по меньшей мере одной последовательностью внутреннего сайта связывания рибосомы (internal ribosome entry site - IRES).
Кроме того, нуклеиновая кислота из комплекса обладающего признаками изобретения полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и молекулой обладающего признаками изобретения полимерного носителя общей формулы (I) (или какой-либо из приведенных в настоящем изобретении ее подформул), может быть одно- или двухцепочечной нуклеиновой кислотой (молекулой) (которая также может рассматриваться в качестве нуклеиновой кислоты (молекулы) из-за нековалентной ассоциации двух молекул одноцепочечных нуклеиновых кислот) или частично двухцепочечной или частично одноцепочечной нуклеиновой кислотой, которые по меньшей мере частично самокомплементарны (обе указанные частично двухцепочечные или частично одноцепочечные молекулы нуклеиновой кислоты обычно сформированы более длинной и более короткой одноцепочечной молекулой нуклеиновой кислоты или двумя одноцепочечными молекулами нуклеиновой кислоты, которые примерно равны по длине, где одноцепочечная молекула нуклеиновой кислоты частично комплементарна другой одноцепочечной молекуле нуклеиновой кислоты, и оба таким образом формируют двухцепочечную молекулу нуклеиновой кислоты в этой области, т.е. частично двухцепочечную или частично одноцепочечную нуклеиновую кислоту (молекулу)). Предпочтительно нуклеиновая кислота (молекула) может быть одноцепочечной молекулой нуклеиновой кислоты. Кроме того, нуклеиновая кислота (молекула) может быть кольцевой или линейной молекулой нуклеиновой кислоты, предпочтительно линейной молекулой нуклеиновой кислоты.
Кодирующие нуклеиновые кислоты:
Молекула нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом может кодировать белок или пептид, который может быть выбран, но ими перечень не ограничивается, например, из белков и пептидов терапевтического действия, выбранных, например, из адъювантных белков, из антигенов, например, опухолевых антигенов, патогенных антигенов (например, выбранных из животных антигенов, вирусных антигенов, антигенов простейших, бактериальных антигенов), аллергических антигенов, аутоиммунных антигенов или других антигенов, от аллергенов, от антител, от иммуностимулирующих белков или пептидов, от антиген-специфичных Т-клеточных рецепторов или от какого-либо другого белка или пептида, пригодного для специфического (терапевтического) применения, где кодирующая нуклеиновая кислота может быть транспортирована в клетку, ткань или организм и затем белок может быть экспрессирован в такой клетке, ткани или организме.
Кодирующая область молекулы нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом может присутствовать в качестве моно-, ди- или даже полицистронной нуклеиновой кислоты, т.е. нуклеиновой кислоты, которая несет кодирующие последовательности одного, двух или более белков или пептидов. Такие кодирующие последовательности в ди- или даже полицистронных нуклеиновых кислотах могут быть разделены по меньшей мере одной последовательностью внутреннего сайта связывания рибосомы (internal ribosome entry site - IRES) или сигнальными пептидами, которые индуцируют расщепление получаемого полипептида, включающего несколько белков или пептидов.
В особенно предпочтительных объектах кодирующие пептиды или белки выбраны из пептидов или белков человека, вирусов, бактерий, простейших.
а) Белки терапевтического действия
В контексте настоящего изобретения пептиды или белки терапевтического действия могут кодироваться молекулой нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом. Белками терапевтического действия являются описанные в настоящем изобретении белки, которые влияют на лечение, профилактическое предупреждение или терапевтическое лечение заболевания, предпочтительно согласно описанному в настоящем изобретении, или белками, в которых нуждается индивидуум. Они могут быть выбраны из каких-либо природных или искусственно разработанных рекомбинантных или выделенных белков, известных специалистам в данной области.
К белкам терапевтического действия могут относиться, но ими перечень не ограничивается, белки, способные стимулировать или ингибировать сигнальную трансдукцию в клетке, например, цитокины, лимфокины, монокины, факторы роста, рецепторы, молекулы сигнальной трансдукции, факторы транскрипции и т.д.; антикоагулянты; антитромбозные агенты; антиаллергические белки; факторы апоптоза или белки, связанные с апоптозом, ферменты терапевтического действия и какой-либо белок, связанный с каким-либо приобретенным или врожденным заболеванием.
Белок терапевтического действия, который может кодироваться молекулой нуклеиновой кислоты из описанного в настоящем изобретении комплекса обладающего признаками изобретения полимерного носителя с грузом, также может быть адъювантным белком. В этом контексте адъювантный белок предпочтительно рассматривают в качестве какого-либо белка, способного вызвать врожденный иммунный ответ, согласно описанному в настоящем изобретении. Предпочтительно такой врожденный иммунный ответ включает активирование паттернраспознающих рецепторов, например, рецептора, выбранного из семейства Toll-подобного рецептора (TLR), включая, например, Toll-подобный рецептор, выбранный из рецепторов от TLR1 до TLR10, или из Toll-подобных рецепторов мыши или крысы от TLR1 до TLR13. Более предпочтительно адъювантный белок выбран из адъювантных белков человека или из патогенных адъювантных белков, выбранных из группы, состоящей, но ими не ограничивающейся, из бактериальных белков, протозойных белков, вирусных белков или грибных белков, белков животных, в частности из бактериальных адъювантных белков. Кроме того, могут применяться нуклеиновые кислоты, кодирующие белки человека, которые участвуют в адъювантных эффектах (например, лигандах паттернраспознающих рецепторов, белков метаболических путей сигнальной трансдукции, факторов транскрипции или цитокинов).
б) Антигены
Молекула нуклеиновой кислоты, описанного в настоящем изобретении комплекса обладающего признаками изобретения полимерного носителя с грузом может в другом варианте кодировать антиген. По настоящему изобретению понятие «антиген» относится к веществу, которое распознается иммунной системой и способно индуцировать антиген-специфичный иммунный ответ, например, путем формирования антител или антиген-специфичных Т-клеток в качестве части приобретенного иммунного ответа. В этом контексте антигенный эпитоп, фрагмент пептида или белка особенно означают В-клеточные и Т-клеточные эпитопы, которые могут быть распознаны В-клетками, антителами или Т-клетками, соответственно.
В контексте настоящего изобретения к антигенам, которые кодируются молекулой нуклеиновой кислотой в комплексе описанного в настоящем изобретении полимерного носителя с грузом, обычно относится какой-либо антиген, антигенный эпитоп или антигенный пептид, подпадающий под указанное выше определение, более предпочтительно белковые и пептидные антигены, например, опухолевые антигены, аллергические антигены, аутоиммунные аутоантигены, патогенные антигены и т.д. В частности, к антигенам, которые кодируются молекулой нуклеиновой кислотой в комплексе описанного в настоящем изобретении полимерного носителя с грузом, могут относиться антигены, выработанные вне клетки, чаще антигены, не происходящие от самого организма хозяина (например, от человека, т.е. не являющиеся аутоантигенами), но скорее происходящие от клеток хозяина вне организма хозяина, например, вирусные антигены, бактериальные антигены, грибные антигены, протозойные антигены, антигены животных, аллергические антигены, и т.д. Аллергические антигены (аллергические антигены) являются типичными антигенами, которые вызывают аллергию у людей и могут быть производными или от человека, или от других источников. Дополнительно антигены, которые кодируются молекулой нуклеиновой кислотой в комплексе описанного в настоящем изобретении полимерного носителя с грузом, могут быть также антигены, выработанные внутри клетки, ткани или организма. К таким антигенам относятся антигены, производные от самого организма хозяина (например, человека), например, опухолевые антигены, самоантигены или аутоантигены, например, аутоиммунные самоантигены, и т.д., но также антигены (не самоантигены), согласно описанному в настоящем изобретении, которые первоначально были получены из клеток-хозяев, находящихся вне организма хозяина, но которые фрагментируются или разрушаются в теле, ткани или клетке, например, путем (протеазного) разрушения, метаболизма и т.д.
К одному их классов антигенов, которые кодируются молекулой нуклеиновой кислоты в комплексе описанного в настоящем изобретении полимерного носителя с грузом, относятся опухолевые антигены. «Опухолевые антигены» предпочтительно локализованы на поверхности (опухолевых) клеток. Опухолевые антигены также могут быть выбраны из белков, которые свехэкспрессируются в опухолевых клетках по сравнению со здоровыми клетками. Кроме того, опухолевые антигены также включают антигены, эксрессированные в клетках, которые не сами (или первоначально не сами) вырождаются (вырождались), но ассоциированы с предполагаемой опухолью. Антигены, которые связаны с сосудами, снабжающими опухоль, или с их переформированием, в частности те антигены, которые ассоциированы с неоваскуляризацией, например, факторы роста, например, VEGF, bFGF и т.д., также относятся к антигенам по настоящему изобретению. Антигены, связанные с опухолью, кроме того включают антигены из клеток или тканей, обычно погруженных в опухоль. Кроме того, некоторые вещества (обычно белки или пептиды) экспрессируются у пациентов (намеренно или неосознанно) в связи с раковым заболеванием и они присутствуют в повышенных концентрациях в жидкостях тела указанных пациентов. Эти вещества также относятся к «опухолевым антигенам», однако они не являются антигенами в строгом смысле, применимом по отношению к веществу, индуцирующему иммунный ответ. Класс опухолевых антигенов может быть дополнительно поделен на опухоль-специфичные антигены (tumour-specific antigens - TSA) и опухоль-ассоциированные антигены (tumour-associated-antigens - ТАА). TSA могут предоставляться только опухолевыми клетками, но никогда нормальными «здоровыми» клетками. Обычно они возникают в результате специфической опухолевой мутации. ТАА, которые более распространены, обычно предоставляются и опухолевыми, и здоровыми клетками. Эти антигены распознаются и антиген-презентирующие клетки могут быть разрушены цитотоксическими Т-клетками. Дополнительно опухолевые антигены также могут присутствовать на поверхности опухоли в форме, например, мутировавшего рецептора. В этом случае они могут распознаваться антителами.
Согласно предпочтительному объекту настоящего изобретения такие опухолевые антигены, кодируемые нуклеиновой кислотой комплекса обладающего признаками изобретения полимерного носителя с грузом, выбраны из группы, состоящей из 5Т4, 707-АР, 9D7, AFP, AlbZIP HPG1, альфа-5-бета-1-интегрина, альфа-5-бета-6-интегрина, альфа-актинина-4/m, рацемазы альфа-метилацил-коэнзима A, ART-4, ARTC1/m, В7Н4, BAGE-1, BCL-2, bcr/abl, бета-катенина/m, BING-4, BRCA1/m, BRCA2/m, СА 15-3/СА 27-29, СА 19-9, СА72-4, СА125, калретикулина, CAMEL, CASP-S/m, катепсина В, катепсина L, CD 19, CD20, CD22, CD25, CDE30, CD33, CD4, CD52, CD55, CD56, CD80, CDC27/m, CDK4/m, CDKN2A/m, CEA, CLCA2, CML28, CML66, COA-1/m, коактозин-подобного белка, коллагена XXIII, СОХ-2, CT-9/BRD6, Cten, циклина В1, циклина Dl, сур-В, CYPB1, DAM-10, DAM-6, DEK-CAN, EFTUD2/m, EGFR, ELF2/m, EMMPRIN, EpCam, EphA2, EphA3, ЕгЬВЗ, ETV6-AML1, EZH2, FGF-5, FN, Frau-1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE7b, GAGE-S, GDEP, GnT-V, gplOO, GPC3, GPNMB/m, HAGE, HAST-2, гепсина, Her2/neu, HERV-K-MEL, HLA-A*0201-R17I, HLA-A11/m, HLA-A2/m, HNE, гомеобокса NKX3.1, HOM-TES-14/SCP-1, HOM-TES-S5, HPV-E6, HPV-E7, HSP70-2M, HST-2, hTERT, iCE, IGF-1R, IL-13Ra2, IL-2R, IL-5, незрелого рецептора ламинина, калликреина-2, калликреина-4, Ki67, KIAA0205, KIAA0205/m, KK-LC-1, K-Ras/m, LAGE-A1, LDLR-FUT, MAGE-A1, MAGE-A2, MAGE-АЗ, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-A10, MAGE-A12, MAGE-B1, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-B10, MAGE-B16, MAGE-B17, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-HI, MAGEL2, маммаглобина A, MART-1/melan-A, MART-2, MART-2/m, матриксного белка 22, MC1R, M-CSF, ME 1/m, мезотелина, MG50/PXDN, MMP11, MN/CA IX-антигена, MRP-3, MUC-1, MUC-2, MUM-1/m, MUM-2/m, MUM-3/m, класса I/m миозина, NA88-A, N-ацетилглюкозаминилтрансферазы -V, Neo-PAP, Neo-PAP/m, NFYC/m, NGEP, NMP22, NPM/ALK, N-Ras/m, NSE, NY-ESO-1, NY-ESO-B, OA1, OFA-iLRP, OGT, OGT/m, OS-9, OS-9/m, остеокальцина, остеопонтина, pi5, минорного белка Ьсг-abl формы pl90, p53, p53/m, PAGE-4, PAI-1, PAI-2, PART-1, PATE, PDEF, Pim-1-киназы, Pin-1, Pml/PARaльфa, POTE, PRAME, PRDX5/m, простеина, протеиназы-3, PSA, PSCA, PSGR, PSM, PSMA, PTPRK/m, RAGE-1, RBAF600/m, RHAMM/CD168, RU1, RU2, S-100, SAGE, SART-1, SART-2, SART-3, SCC, SIRT2/m, Spl7, SSX-1, SSX-2/HOM-MEL-40, SSX-4, STAMP-1, STEAP, сурвивина, сурвивина-2 В, SYT-SSX-1, SYT-SSX-2, TA-90, TAG-72, TARP, TEL-AML1, TGF6eTa, TGF6eTaRII, TGM-4, TPI/m, TRAG-3, TRG, TRP-1, TRP-2/6b, TRP/INT2, TRP-p8, тирозиназы, UPA, VEGF, VEGFR-2/FLK-1, WT1, или их фрагмента, варианта или эпитопа. Эпитопы обычно включают от 5 до 15, предпочтительно от 5 до 12, более предпочтительно от 6 до 9 аминокислот антигена, предпочтительно в нативной форме.
Согласно еще одному другому варианту другой класс антигенов, которые кодируются молекулой нуклеиновой кислотой в комплексе описанного в настоящем изобретении обладающего признаками изобретения полимерного носителя с грузом, включает аллергические антигены. Такие аллергические антигены могут быть выбраны из антигенов, производных от разных источников, например, от животных, растений, грибов, бактерий и т.д. В этом контексте аллергены включают, например, травы, пыльцу, плесени, лекарственные средства или многочисленные стимулы из окружающей среды и т.д. Аллергические антигены обычно принадлежат к разным классам соединений, например, к нуклеиновым кислотам и их фрагментам, белкам или пептидам и их фрагментам, углеводам, полисахаридам, сахарам, липидам, фосфолипидам и т.д. Особый интерес в контексте настоящего изобретения представляют антигены, которые могут кодироваться молекулой нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом, т.е. белковые или пептидные антигены и их фрагменты или эпитопы, или нуклеиновые кислоты и их фрагменты, кодирующие такие белковые или пептидные антигены и их фрагменты или эпитопы.
в) Антитела
Согласно еще одному другому варианту молекула нуклеиновой кислоты комплекса описанного в настоящем изобретении полимерного носителя с грузом, может кодировать антитело или фрагмент антитела. По настоящему изобретению такое антитело может быть выбрано из какого-либо антитела, например, какого-либо рекомбинантно получаемого антитела или природного антитела, известного в данной области, в частности из антител, пригодных для терапевтических, диагностических или научных целей, или антител, которые были идентифицированы в связи с опухолевыми заболеваниями. В контексте настоящего изобретения понятие «антитело» применяют в самом широком смысле и конкретно оно относятся к моноклональным и поликлональным антителам (включая агонистов, антагонистов и блокирующие или нейтрализующие антитела) и типам антител с полиэпитопной специфичностью. В настоящем изобретении понятие «антитело» обычно включает какое-либо антитело, известное в данной области (например, антитела IgM, IgD, IgG, IgA и IgE), например, природные антитела, антитела, выработанные путем иммунизации в организме хозяина, антитела, которые были выделены и идентифицированы из природных антител или антител, выработанных в организме хозяина и рекомбинантно полученных биомолекулярными методами, известными в данной области, а также химерные антитела, антитела человека, гуманизированные антитела, биспецифические антитела, интратела, т.е. антитела, экспрессированные в клетках и необязательно локализованные в специфических компартментах клетки, и фрагменты и варианты указанных выше антител. В целом антитело состоит из легкой цепи и тяжелой цепи, которые обе содержат вариабельные и константные домены. Легкая цепь состоит из N-концевого вариабельного домена, VL и С-концевого константного домена, CL. Напротив, тяжелая цепь антитела IgG, например, состоит из N-концевого вариабельного домена, VH, и трех константных доменов, CH1, CH2 и CH3.
В контексте настоящего изобретения к антителам, которые кодируются молекулой нуклеиновой кислотой в комплексе описанного в настоящем изобретении обладающего признаками изобретения полимерного носителя с грузом, предпочтительно могут относиться антитела полной длины, т.е. антитела, состоящие из тяжелых цепей полной длины и легких цепей полной длины, согласно описанному выше. Однако производные антител, например, фрагменты антител, варианты или аддукты, также могут кодироваться молекулой нуклеиновой кислоты в комплексе описанного в настоящем изобретении обладающего признаками изобретения полимерного носителя с грузом. Фрагменты антител предпочтительно выбраны из фрагментов Fab, Fab', F(ab')2, Fc, Facb, pFc', Fd и Fv описанных выше антител (полной длины). В общем фрагменты антител известны в данной области. Например, фрагмент Fab («антигенсвязывающий антиген») состоит из одного константного и одного вариабельного домена каждой тяжелой и легкой цепи. Два вариабельных домена связывают эпитоп на специфических антигенах. Две цепи соединены через дисульфидную связь. Фрагмент scFv («одноцепочечный вариабельный фрагмент»), например, обычно состоит из вариабельных доменов легкой и тяжелой цепей. Домены связаны искусственной связью, обычно полипептидной связью, например, пептидом, состоящим из 15-25 остатков глицина, пролина и/или серина.
В данном контексте предпочтительно, чтобы разные цепи антитела или фрагмента антитела кодировались молекулой полицистронной нуклеиновой кислотой. В другом варианте разные типы антитела или фрагмента антитела кодируются несколькими моноцистронными нуклеиновыми кислотами (последовательностями).
Малые интерферирующие РНК (миРНК)
Согласно еще одному другому варианту осуществления настоящего изобретения нуклеиновая кислота в обладающем признаками изобретения комплексе полимерного носителя с грузом, сформированным грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I) (или по какой-либо из приведенных в настоящем изобретении ее подформул) может быть в форме дцРНК, предпочтительно миРНК. Молекулы дцРНК или миРНК представляют интерес особенно в связи с феноменом РНК интерференции. Метод РНК интерференции (РНКи) in vitro основан на молекулах двухцепочечных РНК (дцРНК), которые индуцируют специфическую в отношении последовательности супрессию генной экспрессии (Zamore, Nat. Struct. Biol. 9, 2001, cc. 746-750; Sharp, Genes Dev. 5, 2001, cc. 485-490, Hannon, Nature 41, 2002, cc. 244-251). При трансфекции клеток млекопитающих длинной дцРНК, активация протеинкиназы R и RnaseL вызывает неспецифические эффекты, например, ответ в виде выработки интерферона (Stark и др., Annu. Rev. Biochem. 67, 1998, cc. 227-264; He и Katze, Viral Immunol. 15, 2002, cc. 95-119). Такие неспецифические эффекты удается избежать при применении более короткой, например, от 21 до 23 мономеров, так называемой миРНК (малая интерферирующая РНК), поскольку неспецифические эффекты не индуцируются миРНК, которая короче, чем 30 п. о. (Elbashir и др., Nature 411, 2001, сс.494-498).
Нуклеиновая кислота комплекса обладающего признаками изобретения полимерного носителя с грузом может, таким образом, быть двухцепочечной РНК (дцРНК), обладающей длиной от 17 до 29, предпочтительно от 19 до 25, и предпочтительно являющейся по меньшей мере на 90%, более предпочтительно на 95% и особенно на 100% (от нуклеотидов дцРНК), комплементарной отрезку последовательности нуклеиновой кислоты (терапевтически значимого) белка или антигена, описанного выше в настоящем изобретении (в качестве действующего ингредиента), или кодирующему, или некодирующему отрезку, предпочтительно кодирующему отрезку. Комплементарность 90% означает, что при длине описанной в настоящем изобретении дцРНК, например, состоящей из 20 нуклеотидов, содержится не более 2 нуклеотидов без соответствующей комплементарности с соответствующим отрезком иРНК. Последовательность двухцепочечной РНК, применяемой по настоящему изобретению в качестве нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом, однако, предпочтительно полностью комплементарна в своей общей структуре отрезку нуклеиновой кислоты терапевтически значимого белка или антигена, описанных выше в настоящем изобретении. В этом контексте нуклеиновая кислота комплекса обладающего признаками изобретения полимерного носителя с грузом, сформированным грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I), может быть дцРНК, имеющей общую структуру 5'-(N17-29)-3', предпочтительно имеющей общую структуру 5'-(N19-25)-3', более предпочтительно имеющей общую структуру 5'-(N19-24)-3', или еще более предпочтительно имеющей общую структуру 5'-(N21-23)-3', где в каждой общей структуре каждое обозначение «N» означает (предпочтительно другой) нуклеотид отрезка иРНК терапевтически значимого белка или антигена, описанных выше в настоящем изобретении, предпочтительно выбранный из непрерывного ряда 17-29 нуклеотидов иРНК терапевтически значимого белка или антигена и находящийся в общей структуре 5'-(N17-29)-3' в их естественном порядке. В принципе все отрезки длиной от 17 до 29, предпочтительно от 19 до 25 пар оснований, имеющихся в кодирующей области иРНК, могут служить в качестве последовательности-мишени для дцРНК настоящего изобретения. В равной степени молекулы дцРНК, используемые в качестве нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом, также могут быть направлены против нуклеотидных последовательностей (терапевтически значимого) белка или антигена, описанных (в качестве действующего ингредиента) в настоящем изобретении выше, которые не лежат в кодирующей области, в частности, в 5' некодирующей области иРНК, например, таким образом, против некодирующих областей иРНК, имеющих регуляторную функцию. Последовательность-мишень дцРНК, используемой в качестве нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом, таким образом может лежать в транслируемой и нетранслируемой области иРНК и/или в области контрольных элементов белка или антигена, описанных выше в настоящем изобретении. Последовательность-мишень дцРНК, используемой в качестве нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом также могут лежать в перекрывающейся области нетранслируемой и транслируемой последовательности; в частности, последовательность-мишень может включать по меньшей мере один нуклеотид, расположенный выше по цепи от стартового триплета кодирующей области иРНК.
Иммуностимулирующие нуклеиновые кислоты
а) Иммуностимулирующие нуклеиновые кислоты CpG
Согласно еще одному другому варианту осуществления настоящего изобретения, нуклеиновая кислота комплекса обладающего признаками изобретения полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I) (или какой-либо из приведенных в настоящем изобретении ее подформул), может быть в форме (иммуностимулирующей) нуклеиновой кислоты CpG, в частности CpG-PHK или CpG-ДНК, которая предпочтительно индуцирует врожденный иммунный ответ. Применяемая по настоящему изобретению CpG-РНК или CpG-ДНК может быть одноцепочечной CpG-ДНК (оцСрС-ДНК), двухцепочечной CpG-ДНК (дцДНК), одноцепочечной CpG-PHK (onCpG-PHK) или двухцепочечной CpG-PHK (дцСрв-РИК). Применяемая по настоящему изобретению нуклеиновая кислота CpG предпочтительно представлена в форме CpG-PHK, более предпочтительно в форме одноцепочечной CpG-PHK (ouCpG-РНК). Также предпочтительно такие нуклеиновые кислоты CpG имеют длину, согласно описанному выше. Предпочтительно мотивы CpG неметилированы.
б) Иммуностимулирующая РНК (исРНК)
Подобным образом, согласно еще одному другому варианту осуществления настоящего изобретения, нуклеиновая кислота комплекса обладающего признаками изобретения полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I) (или по какой-либо из приведенных в настоящем изобретении ее подформул), может быть в форме иммуностимулирующей РНК (исРНК), которая предпочтительно вызывает врожденный иммунный ответ. Такая иммуностимулирующая РНК может быть какой-либо (двухцепочечной или одноцепочечной) РНК, например, кодирующей РНК, согласно описанному в настоящем изобретении. Предпочтительно иммуностимулирующая РНК может быть одноцепочечной, двухцепочечной или частично двухцепочечной РНК, более предпочтительно одноцепочечной РНК, и/или кольцевой или линейной РНК, более предпочтительно линейной РНК. Более предпочтительно иммуностимулирующая РНК может быть (линейной) одноцепочечной РНК. Еще более предпочтительно иммуностимулирующая РНК может быть (длинной) (линейной) (одноцепочечной) некодирующей РНК. В этом контексте особенно предпочтительно, что исРНК несет трифосфат с 5'-конца, которая является транскрибированной in vitro РНК. Иммуностимулирующая РНК также может быть в виде короткого РНК олигонуклеотида, согласно описанному в настоящем изобретении. Иммуностимулирующая РНК, применяемая в настоящем изобретении, кроме того может быть выбрана из какого-либо класса молекул РНК, обнаруженных в природе или полученных путем синтеза, и которые могут индуцировать врожденный иммунный ответ и могут поддержать приобретенный иммунный ответ, индуцированный антигеном. В этом контексте иммунный ответ может возникнуть разными путями. Важным фактором соответствующего (приобретенного) иммунного ответа является стимуляция разных субпопуляций Т-клеток. Т-лимфоциты обычно делят на две субпопуляции, клеток Т-хэлперов 1 (Th1) и клеток Т-хэлперов 2 (Th2), с помощью которых иммунная система способна разрушить внутриклеточных (Th1) и внеклеточных (Th2) патогенов (например, антигенов). Две популяции клеток Th отличаются паттерном вырабатываемых ими эффекторных белков (цитокинов). Таким образом, клетки Th1 способствуют клеточному иммунному ответу путем активации макрофагов и цитотоксических Т-клеток. Клетки Th2, с одной стороны, индуцируют гуморальный иммунный ответ путем стимуляции В-клеток для конверсии в клетки плазмы и формированием антител (например, против антигенов). Соотношение Th1/Th2 таким образом имеет большое значение для индукции и поддержания приобретенного иммунного ответа. По настоящему изобретению соотношение Th1/Th2 (приобретенного) иммунного ответа предпочтительно смещено в направлении клеточного ответа (ответа Th1) и клеточный иммунный ответ таким образом индуцируется. По одному из примеров система врожденного иммунитета, которая может поддерживать врожденный иммунный ответ, может быть активирована лигандами Toll-подобных рецепторов (Toll-like receptor - TLR). Рецепторы TLR представляют семейство высоко консервативных полипептидов паттерн-распознающих рецепторов (pattern recognition receptor - PRR), которые распознают патоген-ассоциированные молекулярные паттерны (pathogen-associated molecular pattern - РАМР) и играют ключевую роль во врожденном иммунитете у млекопитающих. В настоящее время идентифицировано по меньшей мере тринадцать представителей семейства, обозначаемых TLR1 - TLR13 (Toll-подобные рецепторы: TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13). Кроме того, идентифицирован ряд специфических лигандов TLR. Например, установлено, что неметилированная бактериальная ДНК и ее синтетические аналоги (CpG ДНК) являются лигандами TLR9 (Hemmi Н и др., Nature 408, 2000, сс.740-745; Bauer S и др., Proc NatlAcadSci USA 98, 2001, сс.9237-9242). Кроме того, установлено, что лиганды определенных TLR индуцируют определенные молекулы нуклеиновой кислоты, и что определенные типы РНК являются иммуностимулирующими, действующими по типу зависимости от последовательности и независимости от последовательности, причем такие разные иммуностимулирующие РНК могут, например, стимулировать TLR3, TLR7, или TLR8, или внутриклеточные рецепторы, например, RIG-I, MDA-5 и т.д. Например, Lipford и др. выявили определенные 0,и-содержащие олигорибонуклеотиды в качестве иммуностимулирующих, действующих через TLR7 и TLR8 (см. WO 03/086280). Иммуностимулирующие 0,и-содержащие олигорибонуклеотиды, описанные Lipford и др., предположительно являются производными от источников РНК, включая рибосомальную РНК, транспортную РНК, информационную РНК и вирусную РНК.
Иммуностимулирующую РНК (исРНК), применяемую в качестве молекулы нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I) (или какой-либо из приведенных в настоящем изобретении ее подформул), также может включать последовательность какой-либо РНК, о которой известно, что она иммуностимулирующая, включая, но ими не ограничиваясь, последовательности РНК, представляющие и/или кодирующие лиганды TLR, предпочтительно выбранные из представителей семейства TLR1-TLR10 человека или из представителей семейства TLR1-TLR13 мыши или крысы, более предпочтительно выбранные из представителей семейства TLR1-TLR10 (человека), еще более предпочтительно из TLR7 и TLR8, лиганды внутриклеточных рецепторов для РНК (например, R1G-1 или MDA-5 и т.д.) (см., например, Meylan Е., Tschopp J. Mol. Cell 22, 2006, cc. 561-569), или из каких-либо других иммуностимулирующих последовательностей РНК. Кроме того, классы молекул иммуностимулирующих РНК, применяемых в качестве молекулы нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом, может включать какую-либо иную РНК, способную вызвать иммунный ответ. К таким иммуностимулирующим РНК могут относиться, но ими перечень не ограничивается, рибосомальная РНК (рРНК), транспортная РНК (тРНК), информационная РНК (иРНК) и вирусная РНК (вРНК). Такая иммуностимулирующая РНК может включать от 1000 до 5000, от 500 до 5000, от 5 до 5000, или от 5 до 1000, от 5 до 500, от 5 до 250, от 5 до 100, от 5 до 50 или от 5 до 30 нуклеотидов в длину.
В одном из предпочтительных вариантов осуществления настоящего изобретения такие иммуностимулирующие последовательности нуклеиновых кислот, особенно исРНК, состоят из нуклеиновой кислоты формулы (III) или (IV) или включают ее:
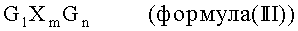
где:
G означает гуанозин, урацил или аналог гуанозина или урацила; X означает гуанозин, урацил, аденозин, тимидин, цитозин или аналог упомятутых нуклеотидов;
1 означает целое число от 1 до 40,
где
если 1=1, G означает гуанозин или его аналог,
если 1>1, то по меньшей мере 50% нуклеотидов являются гуанозином или его аналогом;
m означает целое число, составляющее по меньшей мере 3;
где
если m=3, X означает урацил или его аналог,
если m>3, то содержится по меньшей мере 3 последовательно расположенных урацила или аналога урацила;
n означает целое число от 1 до 40,
где
если n=1, G означает гуанозин или его аналог,
если n>1, то по меньшей мере 50% нуклеотидов являются гуанозином или его аналогом.

где:
С означает цитозин, урацил или аналог цитозина или урацила; X означает гуанозин, урацил, аденозин, тимидин, цитозин или аналог упомятутых нуклеотидов;
1 означает целое число от 1 до 40,
где
если 1=1, С означает цитозин или его аналог,
если 1>1, то по меньшей мере 50% нуклеотидов являются цитозином или его аналогом;
m означает целое число, составляющее по меньшей мере 3;
где
если m=3, X означает урацил или его аналог,
если m>3, то содержится по меньшей мере 3 последовательно расположенных урацила или аналога урацила;
n означает целое число от 1 до 40,
где
если n=1, С означает цитозин или его аналог,
если n>1, то по меньшей мере 50% нуклеотидов являются цитозином или его аналогом.
Нуклеиновые кислоты формулы (III) или (IV), которые могут применяться в качестве груза нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом, могут быть относительно короткими молекулами нуклеиновой кислоты с типичной длиной примерно от 5 до 100 (но могут быть также длиннее 100 нуклеотидов для определенных вариантов осуществления настоящего изобретения, например, длиной до 200 нуклеотидов), от 5 до 90 или от 5 до 80 нуклеотидов, предпочтительно длиной примерно от 5 до 70, более предпочтительно длиной примерно от 8 до 60 и более предпочтительно длиной примерно от 15 до 60 нуклеотидов, более предпочтительно от 20 до 60, наиболее предпочтительно от 30 до 60 нуклеотидов. Если длина нуклеиновой кислоты комплекса обладающего признаками изобретения полимерного носителя с грузом максимально составляет, например, 100 нуклеотидов, m обычно может быть<=98. Число нуклеотидов G в нуклеиновой кислоты формулы (III) определяют с помощью 1 или п. Обозначения 1 и n независимо друг от друга каждое означает целое число от 1 до 40, где 1 или n=1, G обозначает гуанозин или его аналог, и если 1 или n>1, по меньшей мере 50% нуклеотидов представлено гуанозином или его аналогом. Например, но ими возможности не исчерпываются, если 1 или n=4 Gi или Gn могут представлять, например, GUGU, GGUU, UGUG, UUGG, GUUG, GGGU, GGUG, GUGG, UGGG или GGGG, и т.д.; если 1 или n=5 G] или Gn могут представлять, например, GGGUU, GGUGU, GUGGU, UGGGU, UGGUG, UGUGG, UUGGG, GUGUG, GGGGU, GGGUG, GGUGG, GUGGG, UGGGG или GGGGG, и т.д. Нуклеотид, расположенный рядом с Xm в нуклеиновой кислоте формулы (III) по настоящему изобретению, предпочтительно не является урацилом. Сходным образом числом нуклеотидов С в нуклеотидной кислоте формулы (IV) по настоящему изобретению определяют с помощью I или п. Обозначения 1 и n, независимо друг от друга, каждое обозначает целое число от 1 до 40, где если 1 или n=1, С означает цитозин или его аналог, и если 1 или n>1, то по меньшей мере 50% нуклеотидов представлено цитозином или его аналогом. Например, не применяя каких-либо ограничений, если 1 или n=4, С1 или Cn может быть, например, CUCU, CCUU, UCUC, UUCC, CUUC, CCCU, CCUC, CUCC, UCCC или СССС и т.д.; если I или n=5, С1 или Cn может быть, например, CCCUU, CCUCU, CUCCU, UCCCU, UCCUC, UCUCC, UUCCC, CUCUC, CCCCU, CCCUC, CCUCC, CUCCC, UCCCC, или ССССС, и т.д.; и т.д. Соседний с Xm нуклеотид в формуле нуклеиновой кислоты (IV) по настоящему изобретению предпочтительно не является урацилом. Предпочтительно для формулы (III), если 1 или n>1, по меньшей мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов представлено гуанозином или его аналогом, согласно описанному выше. Оставшиеся до 100% нуклеотиды (если гуанозин составляет менее 100% нуклеотидов) во фланкирующих последовательностях G1 и/или Gn являются урацилом или его аналогом, согласно указанному выше. Также предпочтительно, 1 и n, независимо друг от друга, представляют целые числа от 2 до 30, более предпочтительно целые числа от 2 до 20 и еще более предпочтительно целые числа от 2 до 15. Нижний предел 1 или n может варьировать при необходимости и составляет по меньшей мере 1, предпочтительно по меньшей мере 2, более предпочтительно по меньшей мере 3, 4, 5, 6, 7, 8, 9 или 10. Это определение соответственно относится к формуле (IV).
В одном из других предпочтительных вариантов осуществления настоящего изобретения такие иммуностимулирующие последовательности нуклеиновых кислот, особенно исРНК, состоят из нуклеиновой кислоты формулы (V) или (VI) или включают ее:

где:
G означает гуанозин (гуанин), уридин (урацил) или аналог гуанозина (гуанина), уридина (урацила), предпочтительно гуанозин (гуанин) или его аналог;
X означает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналог этих нуклеотидов (нуклеозидов), предпочтительно уридин (урацил) или его аналог;
N означает последовательность нуклеиновой кислоты, длиной примерно от 4 до 50, предпочтительно примерно от 4 до 40, более предпочтительно примерно от 4 до 30 или от 4 до 20 нуклеиновых кислот, каждый N независимо выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или аналога этих нуклеотидов (нуклеозидов);
а означает целое число от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно от 1 до 10;
1 означает целое число от 1 до 40,
где
если 1=1, G означает гуанозин (гуанин) или его аналог,
если 1>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) являются гуанозином (гуанином) или их аналогом;
m означает целое число, составляющее по меньшей мере 3;
где
если m=3, X означает уридин (урацил) или его аналог,
и если m>3, то содержится по меньшей мере 3 последовательно расположенных уридина (урацила) или аналога уридина (урацила); п означает целое число от 1 до 40,
где
если n=1, С означает цитозин или его аналог,
n означает целое число от 1 до 40,
где
если 1=1, G означает гуанозин (гуанин) или его аналог,
если 1>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) являются гуанозином (гуанином) или его аналогом;
u, v независимо друг от друга могут означать целое число от 0 до 50, предпочтительно если u=0, то v≥1, или если v=0, то u≥1;
где длина молекулы нуклеиновой кислоты формулы (V) составляет по меньшей мере 50 нуклеотидов, предпочтительно по меньшей мере 100 нуклеотидов, более предпочтительно по меньшей мере 150 нуклеотидов, еще более предпочтительно по меньшей мере 200 нуклеотидов, и наиболее предпочтительно по меньшей мере 250 нуклеотидов.

где:
С означает цитидин (цитозин), уридин (урацил) или аналог цитидина (цитозина) или уридина (урацила), предпочтительно цитидин (цитозин) или их аналог;
X означает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналог указанных нуклеотидов (нуклеозидов), предпочтительно уридин (урацил) или их аналог;
N означает, что каждая последовательность нуклеиновой кислоты независимо от других последовательностей имеет длину примерно от 4 до 50, предпочтительно примерно от 4 до 40, более предпочтительно примерно от 4 до 30 или от 4 до 20 нуклеиновых кислот, каждую величину N независимо выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или аналогов этих нуклеотидов (нуклеозидов);
а означает целое число от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно от 1 до 10;
1 означает целое число от 1 до 40,
где
если 1=1, С означает цитидин (цитозин) или их аналог,
если 1>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) представлено цитидином (цитозином) или их аналогом;
m означает целое число, составляющее по меньшей мере 3;
где
если m=3, X означает уридин (урацил) или его аналог, и
если m>3, то содержится по меньшей мере 3 последовательно расположенных уридина (урацила) или аналога уридина (урацила);
n означает целое число от 1 до 40,
где
если n=1, С означает цитидин (цитозин) или его аналог, n означает целое число от 1 до 40,
если n>1, то по меньшей мере 50% этих нуклеотидов (нуклеозидов) представлены цитидином (цитозином) или их аналогом.
u,v независимо друг от друга могут означать целое число от 0 до 50,
предпочтительно если u=0, то v≥1, или если v=0, то u≥1;
где длина молекулы нуклеиновой кислоты формулы (VI) по настоящему изобретению составляет по меньшей мере 50 нуклеотидов, предпочтительно по меньшей мере 100 нуклеотидов, более предпочтительно по меньшей мере 150 нуклеотидов, еще более предпочтительно по меньшей мере 200 нуклеотидов, и наиболее предпочтительно по меньшей мере 250 нуклеотидов.
Для формулы (VI) любое из определений, приведенных выше для элементов N (т.е. Nu и Nv) и X (Xm), в частности для сердцевинной структуры, согласно указанному выше, а также для целых чисел а, 1, m, n, и u v, аналогичным образом применяют для элементов формулы (V), соответственно, где в формуле (VI) сердцевинную структуру выражают формулой CiXmCn. Определение краевых элементов Nu и Nv такое же, что и приведенное выше для Nu и Nv.
В соответствии с определенным предпочтительным вариантом осуществления настоящего изобретения обладающая признаками изобретения молекула нуклеиновой кислоты по формуле (V) может быть выбрана, например, в виде какой-либо из следующих последовательностей:



В другом весьма предпочтительном варианте осуществления настоящего изобретения молекула нуклеиновой кислоты формулы (VI) может быть выбрана, например, в виде какой-либо из следующих последовательностей: UAGCGAAGCUCUUGGACCUACCUUUUUUUUUUUUUUCCCUGCGUUCCUAG AAGUACACG (SEQ ID NO: 367)
или
UAGCGAAGCUCUUGGACCUACCUUUUUUUUUUUUUUUCCCUGCGUUCCUAGAAGUACACGAUCGCUUCGAGAACCUGGAUGGAAAAAAAAAAAAAAAGGGACGCAAGGAUCUUCAUGUGC (SEQ ID NO: 368).
В другом предпочтительном варианте осуществления настоящего изобретения молекула нуклеиновой кислоты описанного в настоящем изобретении и обладающего признаками изобретения комплекса полимерного носителя с грузом также может присутствовать в форме модифицированной нуклеиновой кислоты.
В другом объекте настоящего изобретения молекула нуклеиновой кислоты описанного в настоящем изобретении и обладающего признаками изобретения комплекса полимерного носителя с грузом может быть предусмотрен в качестве «стабилизированной нуклеиновой кислоты», предпочтительно в качестве стабилизированной РНК или ДНК, более предпочтительно в качестве РНК, которая в существенной степени устойчива к разрушению in vivo (например, под действием экзо- или эндонуклеаз).
В контексте настоящего изобретения молекула нуклеиновой кислоты описанного в настоящем изобретении и обладающего признаками изобретения комплекса полимерного носителя с грузом может содержать модификации каркаса молекулы, модификации Сахаров или модификации оснований.
Модификация каркаса молекулы по настоящему изобретению означает модификацию, в которой фосфаты каркаса молекулы нуклеотидов, содержащихся в молекуле нуклеиновой кислоты обладающего признаками изобретения комплекса полимерного носителя с грузом, химически модифицированы. Модификация Сахаров по настоящему изобретению означает химическую модификацию сахара в составе нуклеотидов молекулы нуклеиновой кислоты обладающего признаками изобретения комплекса полимерного носителя с грузом. Кроме того, основная модификация по настоящему изобретению означает химическую модификацию основания - части молекулы нуклеотидов в молекуле нуклеиновой кислоты обладающего признаками изобретения комплекса полимерного носителя с грузом.
Согласно другому объекту настоящего изобретения молекула нуклеиновой кислоты описанного в настоящем изобретении обладающего признаками изобретения комплекса полимерного носителя с грузом может включать липидную модификацию.
Нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом, описанного в настоящем изобретении, также может быть в форме модифицированной нуклеиновой кислоты, причем какая-либо модификация, подобная описанной в настоящем изобретении, может быть интродуцирована в нуклеиновую кислоту. Модификации, согласно описанному в настоящем изобретении, предпочтительно приводят к дополнительно стабилизированной нуклеиновой кислоте.
В одном из объектов настоящего изобретения нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом, согласно описанному в настоящем изобретении, таким образом, может быть предусмотрена в виде «стабилизированной нуклеиновой кислоты», предпочтительно в виде стабилизированной иРНК, более предпочтительно в виде иРНК, которая чрезвычайно устойчива к разрушению in vivo (например, под действием экзо- или эндонуклеаз). Такая стабилизация может быть достигнута, например, за счет модифицированного фосфата, причем фосфаты каркасов молекул нуклеотидов в нуклеиновой кислоте химически модифицированы. Нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом может дополнительно или в другом варианте также включать модификации Сахаров или оснований. Нуклеиновой кислоте обладающего признаками изобретения комплекса полимерного носителя с грузом, особенно представленной иРНК, также может быть придана устойчивость от разрушения РНКазами путем добавления так называемой «5' кэп-структуры». В этой связи особое предпочтение отдается m7G(5')ppp (5'(A,G(5')ppp(5')A или G(5')ppp(5')G в качестве 5' кэп-структуры. Согласно другому объекту настоящего изобретения нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом может включать, особенно если нуклеиновая кислота в форме иРНК, поли-А-хвост с 3'-конца, содержащий примерно от 10 до 200 нуклеотидов (аденозинов), предпочтительно примерно от 10 до 100 нуклеотидов (аденозинов), более предпочтительно примерно от 20 до 100 нуклеотидов (аденозинов) или еще более предпочтительно примерно от 40 до 80 нуклеотидов (аденозинов). В другом объекте настоящего изобретения нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом может содержать, особенно если нуклеиновая кислота представлена в форме иРНК, поли-С хвост на 3'-конце, обычно состоящий из примерно от 10 до 200 нуклеотидов (цитозинов), предпочтительно примерно от 10 до 100 нуклеотидов (цитозинов), более предпочтительно примерно от 20 до 70 нуклеотидов (цитозинов), или даже более предпочтительно примерно от 20 до 60 или даже от 10 до 40 нуклеотидов (цитозинов). В другом объекте настоящего изобретения нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом может быть модифицирована и таким образом стабилизирована, особенно если нуклеиновая кислота представлена в форме иРНК, путем модификации содержания G/C нуклеиновой кислоты, особенно иРНК, предпочтительно их кодирующей области.
В особенно предпочтительном объекте настоящего изобретения содержание G/C кодирующей области нуклеиновой кислоты обладающего признаками изобретения комплекса полимерного носителя с грузом, особенно если нуклеиновая кислота представлена в форме иРНК, модифицировано, особенно повышено, по сравнению с содержанием G/C в кодирующей области определенной иРНК дикого типа, т.е. немодифицированной иРНК. Кодируемая аминокислотная последовательность по меньшей мере одной иРНК предпочтительно не модифицирована по сравнению с кодируемой аминокислотной последовательностью определенной иРНК дикого типа. Предпочтительно содержание G/C в кодирующей области нуклеиновой кислоты обладающего признаками изобретения комплекса полимерного носителя с грузом, особенно если нуклеиновая кислота представлена в форме иРНК, повышено по меньшей мере на 7%, более предпочтительно по меньшей мере на 15%, особенно предпочтительно по меньшей мере на 20%, по сравнению с содержанием G/C в кодирующей области иРНК дикого типа, которая кодирует антиген, антигенный белок или антигенный пептид, согласно определению, приведенному в настоящем изобретении, или его фрагмент, или его вариант.В одном из вариантов осуществления настоящего изобретения замещено по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90%, 95% или даже 100% замещаемых кодонов в области, кодирующей белок или пептид, согласно определению, приведенному в настоящем изобретении, или ее фрагмента, или ее варианта, или целой последовательности иРНК дикого типа, в результате чего повышается содержание G/C в указанной последовательности. В этом контексте особенно предпочтительно повысить содержание G/C нуклеиновой кислоты обладающего признаками изобретения комплекса полимерного носителя с грузом, особенно если нуклеиновая кислота представлена в форме иРНК, до максимума (т.е. до 100% замещаемых кодонов), в частности в области, кодирующей белок, по сравнению с последовательностью дикого типа. По настоящему изобретению другой предпочтительной модификацией нуклеиновой кислоты обладающего признаками изобретения комплекса полимерного носителя с грузом, особенно если нуклеиновая кислота представлена в форме иРНК, область, которая кодирует адъювантный белок, является модифицированной по сравнению с соответствующей областью иРНК дикого типа таким образом, что по меньшей мере один кодон последовательности дикого типа, которая кодирует тРНК, относительно редкую в клетке, заменяют на кодон, который кодирует тРНК, которая относительно часто встречается в клетке и несет ту же аминокислоту, что и относительно редкая тРНК. С помощью такой модификации последовательности нуклеиновой кислоты, особенно если нуклеиновая кислота представлена в форме иРНК, модифицируют таким образом, что инсертируют кодоны, для которых доступны часто встречающиеся тРНК. Иначе говоря, по настоящему изобретению с помощью такой модификации всех кодонов последовательности дикого типа, которая кодирует тРНК, относительно редкую в клетке, могут в каждом случае быть заменены на кодон, который кодирует тРНК, относительно часто встречающуюся в клетке, и которая в каждом случае несет ту же аминокислоту, что и относительно редкая тРНК.
Те тРНК, которые встречаются относительно часто в клетке, и те, которые, напротив, встречаются относительно редко, известны специалистам в данной области; см., например, Akashi, Curr. Opin. Genet. Dev. 11(6), 2001, cc. 660-666. Кодоны, применяемые для тРНК определенных аминокислот, которые присутствуют наиболее часто, например, кодон Gly, который применяет тРНК, присутствующую наиболее часто в клетках (людей), особенно предпочтительны.
Молекулы нуклеиновой кислоты, применяемые по настоящему изобретению, согласно описанному в настоящем изобретении, могут быть получены, используя какой-либо метод, известный в данной области, включая методы синтеза, например, твердофазного синтеза, а также методы in vitro, например, реакции транскрипции in vitro или реакции in vivo, например, размножения in vivo ДНК плазмид в бактериях.
Согласно еще одному другому особенно предпочтительному варианту осуществления настоящего изобретения, нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом, особенно если нуклеиновая кислота представлена в форме кодирующей нуклеиновой кислоты, предпочтительно иРНК, может дополнительно или в другом варианте кодировать секретируемый сигнальный пептид. Длина последовательностей таких сигнальных пептидов обычно составляет примерно от 15 до 30 аминокислот, которые предпочтительно локализованы с N-конца кодируемого пептида, но ими перечень не ограничивается. Сигнальные пептиды, согласно описанному в настоящем изобретении, предпочтительно позволяют транспортировать белок или пептид, подобный кодируемым нуклеиновой кислотой настоящего изобретения, особенно если нуклеиновая кислота представлена в форме иРНК, в определенный клеточный компартмент, предпочтительно на клеточную поверхность, в эндоплазматическую сеть (ЭС) или в эндосомальный-лизосомальный компартмент.
Какая-либо из указанных выше модификаций может быть применена в отношении нуклеиновой кислоты обладающего признаками изобретения комплекса полимерного носителя с грузом, особенно если нуклеиновая кислота представлена в форме иРНК, и дополнительно в отношении какой-либо нуклеиновой кислоты, подобной применяемой в контексте настоящего изобретения, и которые могут быть объединены, если это удобно или необходимо, друг с другом в какой-либо комбинации, при условии, что такие комбинации модификаций не интерферируют друг с другом в соответствующей нуклеиновой кислоте. Специалист в данной области способен сделать соответствующий выбор.
Белки или пептиды, которые кодируются нуклеиновой кислотой обладающего признаками изобретения комплекса полимерного носителя с грузом, согласно описанному в настоящем изобретении, могут включать фрагменты или варианты таких последовательностей. Дополнительно нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом может включать фрагменты или варианты таких кодирующих последовательностей. Обычно такие фрагменты или варианты могут включать последовательность, идентичную последовательности одного из указанных выше белков или пептидов, или последовательностей кодирующих их последовательностей нуклеиновых кислот по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 80%, равным образом более предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90% и наиболее предпочтительно по меньшей мере на 95% или даже на 97% относительно целой последовательности дикого типа, или на уровне нуклеиновой кислоты, или на уровне аминокислоты.
Понятие «фрагментов» белков или пептидов в контексте настоящего изобретения может относиться к последовательности белка или пептида, подобного описанному в настоящем изобретении, которая по аминокислотной последовательности (или кодирующей ее последовательности нуклеиновой кислоты) усечена с N-конца, С-конца и/или внутри последовательности по сравнению с аминокислотной последовательностью исходного (нативного) белка (или кодирующей ее последовательности нуклеиновой кислоты). Такое усечение таким образом может быть на аминокислотном уровне или соответственно на уровне нуклеиновой кислоты. Идентичность последовательности в отношении такого фрагмента, подобного описанному в настоящем изобретении, может таким образом предпочтительно относиться к целому белку или пептиду, согласно описанному в настоящем изобретении, или к целой (кодирующей) последовательности нуклеиновой кислоты такого белка или пептида. То же применимо к нуклеиновым кислотам.
Такие фрагменты белков или пептидов в контексте настоящего изобретения кроме того могут включать последовательность белка или пептида, согласно описанному в настоящем изобретении, длина которой содержит примерно от 6 до примерно 20 или даже большего числа аминокислот, например, фрагменты, процессированные и презентированные молекулами I класса ГКГ, предпочтительно длиной примерно от 8 до примерно 10 аминокислот, например, 8, 9 или 10 (или даже 6, 7, 11 или 12 аминокислот), или фрагменты, подобные процессированным и презентированным молекулам II класса ГКГ, предпочтительно длиной примерно от 13 или более аминокислот, например, 13, 14, 15, 16, 17, 18, 19, 20 или даже более аминокислот, где эти фрагменты могут быть выбраны из какой-либо части аминокислотной последовательности. Эти фрагменты обычно распознаются Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекулы ГКГ, т.е. фрагменты обычно не распознаются в их нативной форме.
Фрагменты белков или пептидов в контексте настоящего изобретения кроме того могут включать эпитопы таких белков или пептидов. Эпитопы (также называемые «антигенными детерминантами») в контексте настоящего изобретения обычно представляют фрагменты, локализованные на внутренней поверхности (нативных) белков или пептидов, согласно описанному в настоящем изобретении, которые предпочтительно содержат от 5 до 15 аминокислот, более предпочтительно от 5 до 12 аминокислот, еще более предпочтительно от 6 до 9 аминокислот, которые могут быть распознаны антителами или рецепторами В-клеток, т.е. в их нативной форме. Такие эпитопы белков или пептидов кроме того могут быть выбраны из каких-либо указанных в настоящем изобретении вариантов таких белков или пептидов. В этом контексте антигенные детерминанты могут быть конформационными или прерывистыми эпитопами, состоящими из сегментов белков или пептидов, согласно описанному в настоящем изобретении, которые прерывисты в аминокислотной последовательности белков или пептидов, согласно описанному в настоящем изобретении, но которые составлены вместе в трехмерную структуру, или непрерывные или линейные эпитопы, которые состоят из единственной полипептидной цепи.
Понятие «вариантов» белков или пептидов, согласно описанному в настоящем изобретении, могут кодироваться нуклеиновой кислотой обладающего признаками изобретения комплекса полимерного носителя с грузом, где нуклеотиды нуклеиновой кислоты, кодирующей белок или пептид, согласно описанному в настоящем изобретении, заменены. Таким образом, может быть получен белок или пептид с аминокислотной последовательность, которая отличается от исходной последовательности одной или большим числом мутаций, например, одной или большим числом замещенных, инсертированных и/или делетированных аминокислот.Предпочтительно эти фрагменты и/или варианты обладают той же биологической функцией или специфической активностью по сравнению с нативным белком полной длины, например, специфическим антигенным свойством.
Настоящее изобретение также предусматривает способ получения молекулы обладающего признаками изобретения полимерного носителя
формулы (I) L-P1-S-[S-P2-S]n-S-P3-L, согласно описанному в настоящем изобретении, или согласно какой-либо из ее подформул, согласно описанному в настоящем изобретении (например, (Ia), и т.д.). Настоящее изобретение также предусматривает продукт, полученный или получаемый с помощью такого обладающего признаками изобретения способа (способа получения продукта). Указанный способ обычно включает следующие стадии:
а) получения по меньшей мере одного катионного или поликатионного белка или пептида в качестве компонента Р2, согласно описанному в настоящем изобретении, и/или по меньшей мере одного катионного или поликатионного полимера в качестве компонента Р, согласно описанному в настоящем изобретении, и необязательно по меньшей мере одного дополнительного компонента (например, (AA)x, [(AAx)]z и т.д., предпочтительно в соотношениях, определенных выше по формуле (I), перемешивания этих компонентов, предпочтительно в щелочной среде согласно описанному в настоящем изобретении, предпочтительно в присутствии кислорода или другой затравки, согласно описанному в настоящем изобретении, что приводит к условиям умеренного окисления, предпочтительно при величине pH, температуре и времени, указанных в настоящем изобретении, и тем самым конденсируя, и таким образом полимеризуя эти компоненты друг с другом через дисульфидные связи (в реакции поликонденсации) для получения повторяющегося компонента H-[S-P2-S]n-H или H{[S-P2-S]a[S-(AA)x-S]b}H, и т.д.
б) получения гидрофильного полимера Р1 и/или Р3, согласно описанному в настоящем изобретении, необязательно модифицированного лигандом L и/или аминокислотным компонентом (АА)x, согласно описанному в настоящем изобретении;
в) перемешивания гидрофильного полимера Ρ1 и/или Ρ3, полученного на стадии б), с повторяющимся компонентом H-[S-P2-S]n-H или H{[S-P2-S]a[S-(AA)x-S]b}H и т.д., полученных на стадии а), обычно в соотношении примерно от 2:1 (и таким образом обычно останавливая реакцию поликонденсации), и получения обладающего признаками изобретения полимерного носителя, предпочтительно формулы (I) согласно описанному в настоящем изобретении, или какой-либо ее подформулы, согласно описанному в настоящем изобретении;
г) необязательно очищения обладающего признаками изобретения полимерного носителя, полученного на стадии в), предпочтительно используя способ, описанный в настоящем изобретении;
д) необязательно добавления нуклеиновой кислоты, согласно описанному в настоящем изобретении, к обладающему признаками изобретения полимерному носителю, полученному на стадии в) или г), предпочтительно в указанных выше соотношениях, и комплексообразования нуклеиновой кислоты с полимерным носителем, полученным на стадии в) или г), для получения комплекса обладающего признаками изобретения полимерного носителя с грузом, согласно описанному в настоящем изобретении.
Обладающий признаками изобретения способ получения обладающего признаками изобретения полимерного носителя формулы (I), согласно описанному в настоящем изобретении, представляет многостадийную реакцию конденсирующей полимеризации или поликонденсации через -SH части составляющих молекулы, например, компонента (компонентов) Р2 согласно описанному в настоящем изобретении, других компонентов Р1 и/или Р3 и необязательно других компонентов (АА)x. Реакция конденсирующей полимеризации или реакция поликонденсации предпочтительно приводит к обладающему признаками изобретения полимерному носителю в виде сконденсированного полимера, где отдельные компоненты связаны дисульфидными связями. Такая поликонденсация приводит к обладающему признаками изобретения полимерному носителю формулы (I), полученному на первой стадии а) реакции конденсации обладающего признаками изобретения повторяющегося компонента H-[S-P2-S]n-H или его варианта в качестве типа «сердцевины» или «центрального мотива» обладающего признаками изобретения полимерного носителя. На второй стадии б) получают компоненты Р1 и/или Р3, которые позволяют терминировать или каким-либо образом «покрывать» обладающий признаками изобретения повторяющийся компонент H-[S-P2-S]n-H или его вариант на третьей стадии в) добавлением компонентов Р1 и/или Р3, согласно описанному в настоящем изобретении (необязательно модифицированных лигандом L и/или аминокислотным компонентом (АА)x согласно описанному в настоящем изобретении), к продукту конденсации, полученному на стадии а). На последующей стадии г) этот продукт может быть очищен и дополнительно применен для комплекса груза нуклеиновой кислоты, согласно описанному в настоящем изобретении, для получения обладающего признаками изобретения комплекса.
Важно понимать, что обладающий признаками изобретения способ основан на равновесной реакции в условиях умеренного окисления на стадиях а), б) и в), который, при поддержании стадии равновесия, позволяет получать обладающий признаками изобретения полимерный носитель по представленной выше формуле (I) или какой-либо из приведенных в настоящем изобретении подформул, включающих выбранные компоненты в требуемых мольных соотношениях. Для этой цели предусматривают длительное время проведения реакции для достижения равновесного состояния на стадиях а), б) и в). Например, если конденсационную полимеризацию проводят, используя мольное соотношение 5 компонентов Р2 на стадии а), равновесие неожиданно устанавливается при длине полимера примерно от 5 после обоснованного времени, предпочтительно, например >12 ч. Однако из-за равновесия длина полимера (обозначаемая «n») не фиксирована на определенной величине, например, на 5, а может варьировать соответственно в рамках равновесной реакции. Соответственно, 5 примерно может быть средней величиной примерно от 4 до 6, или даже примерно от 3 до 7. Предпочтительно длина полимера и соответственно целое число n (и таким образом a, b и a+b) варьирует в пределах примерн ±1 или ±2.
Согласно описанному в настоящем изобретении на стадии а) обладающего признаками изобретения способа получения обладающего признаками изобретения полимерного носителя по формуле (I) предусмотрены по меньшей мере один катионный или поликатионный белок или пептид в качестве компонента Р2 согласно описанному в настоящем изобретении и/или по меньшей мере один катионный или поликатионный полимер в качестве компонента Р2 согласно описанному в настоящем изобретении, предпочтительно в соотношениях, указанных выше в формуле (I). Эти компоненты перемешивают, предпочтительно в основной среде, согласно описанному в настоящем изобретении, предпочтительно в присутствии кислорода или другой затравки, согласно описанному в настоящем изобретении, которая приводит к условиям умеренного окисления, предпочтительно при величине рН, температуре и времени, согласно описанному в настоящем изобретении, и тем самым конденсируя и таким образом полимеризуя эти компоненты друг с другом через дисульфидные связи (при полимеризующей конденсации или поликонденсации) для получения повторяющегося компонента H-[S-P2-S]n-H.
В другом варианте осуществления настоящего изобретения на стадии а) в обладающем признаками изобретения способе получения обладающего признаками изобретения полимерного носителя предусматривают по меньшей мере один катионный или поликатионный белок или пептид и/или по меньшей мере один катионный или поликатионный полимер и применяют в качестве компонента (компонентов) Р2 согласно описанному в настоящем изобретении, и дополнительно предусматривают по меньшей мере один аминокислотный компонент (АА)x согласно описанному в настоящем изобретении, и компоненты Р2 и (АА)x применяют для полимеризующей конденсации или поликонденсации по стадии а). Предпочтительно все компоненты предусматривают в соотношениях, указанных выше, по формуле (Ia), смешивают, предпочтительно в щелочной среде, согласно описанному в настоящем изобретении, предпочтительно в присутствии кислорода или другой затравки, согласно описанному в настоящем изобретении, в результате чего получают умеренные окислительные условия, предпочтительно при величине рН, температуре и времени, указанных в настоящем изобретении. При смешивании и начале реакции компоненты конденсируют и таким образом полимеризуют друг с другом через дисульфидные связи (при полимеризующей конденсации или поликонденсации) для получения повторяющегося компонента H-{[S-P2-S]a[S-(AA)x-S]b}-H.
В обоих указанных выше разных вариантах другой компонент (компоненты) Р2, особенно разные пептиды и/или разные полимеры в качестве компонента Р2, может быть выбран при конденсирующей полимеризации согласно описанному в настоящем изобретении выше. В этом контексте отбор другого компонента (компонентов) Р2 обычно зависит от требуемых свойств итогового обладающего признаками изобретения полимерного носителя и требуемой катионной силы итогового обладающего признаками изобретения полимерного носителя или его центрального корового мотива. Соответственно, повторяющийся компонент [S-P2-S]n, кроме того, может быть «разбавлен» или модифицирован в описанном выше другом варианте стадии а), например, путем внедрения аминокислотного компонента (АА)x согласно описанному в настоящем изобретении, предпочтительно в указанных выше соотношениях. Таким образом, может быть получен модифицированный центральный сердцевинный мотив {[S-P2-S]a[S-(AA)x-S]b}, в котором катионные свойства (модифицированного) повторяющегося компонента [S-P2-S]n обычно сохраняются ограниченно, согласно описанному в настоящем изобретении. Свойства итогового обладающего признаками изобретения полимерного носителя таким образом могут быть отрегулированы исходя из потребностей по свойствам компонентов (АА)x путем внедрения аминокислотного компонента (АА)x согласно описанному в настоящем изобретении на стадиях а), б) и/или в).
Во всех случаях стадия а) основана на равновесных условиях умеренного окисления, которая при поддержании равновесного состояния позволяет получить или обладающий признаками изобретения повторяющийся компонент H-[S-P2-S]n-H, или обладающий признаками изобретения повторяющийся компонент H-{[S-P2-S]a[S-(AA)x-S]b}-H в требуемых мольных соотношениях. В равновесном состоянии n составляет предпочтительно величину от 1, 2, 3, 4 или 5 до 10, более предпочтительно от 4 до 9, и a+b=n согласно описанному выше, предпочтительно a+b=1, 2, 3, 4 или 5 до 10, более предпочтительно от 4 до 9. Для этой цели предусматривают длительное проведение реакции для достижения равновесного состояния на стадии а), наиболее предпочтительно например, >12 ч. Соответственно, стадия а) обладающего признаками изобретения способа получения полимерного носителя обычно требует по меньшей мере примерно 5 ч, еще более предпочтительно по меньшей мере примерно 7,5 ч или даже 10 ч, наиболее предпочтительно по меньшей мере примерно 12 ч, например, время проведения реакции составляет примерно от 12 до 60 ч, проведения реакции составляет примерно от 12 до 48 ч, проведения реакции составляет примерно от 12 до 36 ч или проведения реакции составляет примерно от 12 до 24 ч, и т.д., где нижняя граница, составляющая 12 ч, последних указанных диапазонов может быть доведена до 10, 7,5 или даже 5 ч. Преимущественно состояние равновесия может подвергаться балансированию, используя обладающий признаками изобретения способ.
На стадии а) по меньшей мере один катионный или поликатионный белок или пептид в качестве компонента Р согласно описанному в настоящем изобретении и/или по меньшей мере один катионный или поликатионный полимер в качестве компонента Р согласно описанному в настоящем изобретении, и необязательно по меньшей мере один аминокислотный компонент (АА)x согласно описанному в настоящем изобретении, предпочтительно содержатся в основной среде на стадии а) обладающегопризнаками изобретения способа получения обладающего признаками изобретения полимерного носителя формулы (I) (или какой-либо из приведенных в настоящем изобретении подформул, например, (Ia)). Такая основная среда обычно проявляет диапазон рН примерно от 6 до примерно 12, предпочтительно диапазон рН примерно от 7 до примерно 10, более предпочтительно диапазон рН примерно от 8 до примерно 10, например, примерно 8, 8,5, 9, 9,5 или 10 или какой-либо диапазон, выбран из каких-либо двух из этих или указанных выше величин.
Кроме того, температура раствора на стадии а) предпочтительно находится в диапазоне примерно от 5°С до примерно 60°С, более предпочтительно в диапазоне примерно от 15°С до примерно 40°С, еще более предпочтительно в диапазоне примерно от 20°С до примерно 30°С, и наиболее предпочтительно в диапазоне примерно от 20°С до примерно 25°С, например, примерно 25°С.
На стадии а) обладающий признаками изобретения способ получения обладающего признаками изобретения полимерного носителя формулы (I) (или какой-либо из приведенных в настоящем изобретении подформул, например, (Ia)) согласно описанному в настоящем изобретении могут применяться соответствующие буферы. Предпочтительные буферы могут включать, но ими перечень не ограничивается, карбонатные буферы, боратные буферы, буфер Bicine, буфер CHES, буфер CAPS, буферы с этаноламином, HEPES, буфер MOPS, фосфатный буфер, буфер PIPES, Tris буфер, буфер Tricine, буфер TAPS и/или TES буфер в качестве буферных агентов. Особенно предпочтителен карбонатный буфер.
При смешивании компонентов, предпочтительно в присутствии кислорода, предпочтительно в основной среде, согласно описанному в настоящем изобретении, начинается реакция конденсирующей полимеризации или реакция поликонденсации. Для этой цели смесь на стадии а) предпочтительно подвергается воздействию кислорода или реакция может начаться с другой затравкой, например, каталитическим количеством окислительного агента, например, ДМСО и т.д. Для определения необходимой длины цепи полимера реакцию конденсации проводят в условиях умеренного окисления, предпочтительно в присутствии менее чем 30% ДМСО, более предпочтительно в присутствии менее чем 20% ДМСО и наиболее предпочтительно в присутствии менее чем 10% ДМСО. При начале реакции конденсирующей полимеризации или реакции поликонденсации по меньшей мере один катионный или поликатионный белок или пептид и/или по меньшей мере один катионный или поликатионный полимер в качестве компонента Р2 и необязательно по меньшей мере один аминокислотный компонент (АА)x согласно описанному в настоящем изобретении, конденсируются и таким образом полимеризуются друг с другом через дисульфидные связи (реакция конденсирующей полимеризации или поликонденсации). На этой стадии реакции а) предпочтительно создаются линейные полимеры, используя мономеры по меньшей мере с двумя реакционно способными -SH-частями молекулы, т.е. по меньшей мере одним катионным или поликатионным белком или пептидом и/или по меньшей мере одним катионным или поликатионным полимером в качестве компонента Р2 согласно описанному в настоящем изобретении, каждый компонент Р2 проявляет по меньшей мере две свободные -SH-части молекулы согласно описанному в настоящем изобретении, например, с концов. Однако могут применяться компоненты Р2 с более чем двумя свободными -SH-частями молекулы, которые могут привести к разветвленным полимерам.
Согласно еще одному специфическому варианту осуществления настоящего изобретения продукт конденсации, полученный на стадии а), может быть модифицирован (например, на стадии a1)) добавлением аминокислотного компонента (АА)x или смешанного повторяющегося аминокислотного компонента [(AA)x]z согласно описанному в настоящем изобретении, например, по концам продукта конденсации стадии а). Это может происходить через какую-либо функциональную часть, описанную в настоящем изобретении, например, -SH-часть молекулы или какую-либо другую функциональную часть, описанную в настоящем изобретении, предпочтительно а -SH-часть молекулы. Для этой цели аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может быть предусмотрен с двумя (или даже более) -SH-частями молекулы, например, в форме, представленной формулой «H(S-AA-S)xH» или «H[S-(AA)x-S]ZH». Затем реакцию поликонденсации можно проводить с продуктами стадии а), т.е. с обладающим признаками изобретения повторяющимся компонентом H-[S-P2-S]n-Н или с обладающим признаками изобретения повторяющимся компонентом Н-{[S-P2-S]a[S-(AA)x-S]b}-H, получая промежуточные компоненты
H(S-AA-S)x-[S-P2-S]n-(S-AA-S)xH, или
H[S-(AA)x-S]z-[S-P2-S]n-[S-(AA)x-S]zH, или
H(S-AA-S)x-{[S-P2-S]a[S-(AA)x-S]b}-(S-AA-S)xH, или
H[S-(AA)x-S]z-{[S-P2-S]a[S-(AA)x-S]b}-[S-(AA)x-S]zH. Какой-либо один или все промежуточные компоненты или обладающий признаками изобретения повторяющийся компонент
H-[S-P2-S]n-H
или обладающий признаками изобретения повторяющийся компонент
H-{[S-P2-S]a[S-(AA)x-S]b}-H
полученные на стадии а), могут применяться для соединения с полимерами, полученными на стадии б) обладающего признаками изобретения способа.
На второй стадии б) обладающего признаками изобретения способа получения обладающего признаками изобретения полимерного носителя формулы (I) согласно описанному в настоящем изобретении (или какой-либо из приведенных в настоящем изобретении ее подформул), гидрофильный полимер Р1 и/или Р3 согласно описанному в настоящем изобретении добавляют к продукту конденсации, полученному на стадии а). В этом контексте гидрофильные полимеры Р1 и/или Р3 согласно описанному в настоящем изобретении, предпочтительно проявляют по меньшей мере одну -SH-часть молекулы, более предпочтительно только одну -SH-часть молекулы на гидрофильные полимеры Р1 и/или Р3 согласно описанному в настоящем изобретении, тем самым прекращая по краю полимеризующую конденсацию или поликонденсацию по стадии а) на стадии в). Гидрофильные полимеры Р1 и/или Р3 согласно описанному в настоящем изобретении могут быть одинаковыми или разными, причем эти полимеры могут быть выбраны, исходя из требуемых свойств. Обычно гидрофильные полимеры Р1 и/или Р3 в целом могут быть добавлены к продукту конденсации, полученному на стадии а), в соотношении примерно от 2: 1 гидрофильного полимера Р1 и/или Р3: продукту конденсации, полученному на стадии а).
В еще одном другом варианте гидрофильный полимер (полимеры) Р1 и/или Р3 дополнительно могут быть модифицированы или с компонентом L (лигандом) согласно описанному в настоящем изобретении, или с компонентом (АА)x или [(AA)x]z согласно описанному в настоящем изобретении, или с обоими компонентами, и компонентом L (лигандом) согласно описанному в настоящем изобретении, и компонентом (АА)x или [(AA)x]z согласно описанному в настоящем изобретении.
По первому примеру лиганд присоединен к компоненту (компонентам) Р1 и/или Р3 в качестве компонента L перед получением компонента (компонентов) Р1 и/или Р3 на стадии б) через какую-либо функциональную часть согласно описанному в настоящем изобретении, например, -SH-часть молекулы. Этот лиганд предпочтительно присоединен к гидрофильному полимеру (полимерам) Р1 и/или Р3 с одного конца этих полимеров. Если присоединение проводят через -SH-связи, гидрофильный полимер (полимеры) Р1 и/или Р3 предпочтительно предусмотрены с двумя (или даже более) -SH-частями молекулы, например, в форме, представленной формулой HS-P1-SH или HS-P3-SH. Лиганд L предпочтительно несет только одну -SH-часть молекулы. В этом случае одна -SH-часть молекулы гидрофильного полимера (полимеров) Р1 и/или Р3 предпочтительно защищена на первой стадии, используя защитную группу, известную в данной области. Затем гидрофильный полимер (полимеры) Р1 и/или Р3 могут быть связаны с компонентом L для формирования первой дисульфидной связи через незащищенную -SH-часть молекулы. С защищенной -SH-части молекулы гидрофильного полимера (полимеров) Р1 и/или Р3 затем обычно снимают защиту для последующих реакций. Это предпочтительно приводит к следующим промежуточным компонентам
L-S-S-P1-SH или
HS-P3-S-S-L.
В другом варианте указанные выше промежуточные компоненты могут быть получены сходным образом без необходимости в блокировании свободной -SH-части молекулы. Такие промежуточные компоненты могут применяться на стадии в) для соединения с продуктами конденсации, полученными согласно описанному выше на стадии а), например, для формирования второй дисульфидной связи с обладающим признаками изобретения повторяющимся компонентом H-[S-P2-S]n-H или с обладающим признаками изобретения смешанным повторяющимся компонентом H-{[S-P2-S]a[S-(AA)x-S]b}-H, полученным на стадии а), или какой-либо из его модификаций, например, по стадии a1). Если присоединение производят через другие части молекулы, соответственно может применяться какая-либо из соответствующих реакций, согласно описанному в настоящем изобретении.
В другом примере аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z согласно описанному в настоящем изобретении может быть присоединен к компоненту (компонентам) Р1 и/или Р3 перед присоединением компонента (компонентов) Р1 и/или Р3 через какую-либо функциональную часть согласно описанному в настоящем изобретении, например, -SH-часть молекулы. Аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может быть присоединен к гидрофильному полимеру (полимерам) Р1 и/или Р3 в каком-либо положении в этих полимерах или с одного или обоих концов этих полимеров. В одном определенном случае аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z могут быть обеспечены в виде линкера между компонентом (компонентами) Р1 и/или Р3 и продуктом конденсации, полученным на указанной выше стадии а), или в виде линкера между компонентом (компонентами) Р1 и/или Р3 и другим компонентом, например, линкером L, или, в другом варианте, в виде терминирующего компонента с одного конца компонента (компонентов) Р1 и/или Р3. В каком-либо из этих случаев предпочтительно присоединение осуществляют через -SH-связи, где гидрофильный полимер (полимеры) Р1 и/или Р3 предпочтительно обеспечены с двух (или даже более) -SH-частей молекулы, например, в форме, представленной формулой ((HS-P1-SH)) или «HS-P3-SH», причем предпочтительно одна из -SH-частей молекулы защищена, например, в форме, представленной формулой «HS-P1-S-защитная группа» или «защитная группа-S-P3-SH». Кроме того, аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z также предпочтительно предусмотрены с двух (или даже более) -SH-частей молекулы, например, в форме, представленной формулой «H(S-AA-S)x-H» или «H[S-(AA)x-S]ZH», где предпочтительно одна из этих -SH-частей молекулы защищена, например, в форме, представленной формулой «защитная группа-(S-AA-S)x-SH» или «H[S-(АА)х-S]z-защитная группа». Затем реакция поликонденсации может быть выполнена с полимерами «HS-Р1-S-защитная группа» или «защитная группа-S-P3-SH», приводя к промежуточным компонентам
«защитная группа-S-P1-S-(S-AA-S)x-S-3aniHTHaH группа»,
«защитная группа-(S-AA-S)x-S-S-P3-S-защитная группа»,
«защитная группа-S-Р1-S-[8-(АА)х-S]2-защитная группа» или
«защитная группа-[S-(AA)x-S]z-S-P3-S-защитная группа».
Какой-либо один или все промежуточные компоненты затем могут применяться на стадии в) обладающего признаками изобретения способа соединения с продуктом конденсации со стадии а).
Для этой цели, по меньшей мере у одной или обеих защитных групп (выбранных в требуемом направлении компонента в итоговом носителе) в каждом промежуточном соединении могут быть сняты защитные группы перед их применением на стадии б), приводя к следующим промежуточным компонентам
«HS-P1-S-(S-AA-S)x-SH»,
«H(S-AA-S)x-S-S-P3-SH»,
«HS-P1-S-[S-(AA)x-S]zH» или
«H[S-(AA)x-S]Z-S-P3-SH». В другом варианте указанные выше промежуточные компоненты могут быть получены сходным образом без необходимости блокировать свободные -SH-части молекулы. Какой-либо один или все из указанных промежуточных компонентов затем могут быть предусмотрены на стадии б) обладающего признаками изобретения способа соединения с продуктом конденсации по стадии а).
Если какой-либо из указанных выше промежуточных компонентов предусмотрен на стадии б), такая реакция конденсации может быть терминирована на стадии в) добавлением линкерного компонента согласно описанному в настоящем изобретении с одной -SH-частью молекулы (например, L-SH) или какого-либо другого компонента с одной -SH-частью молекулы, например, согласно описанному в настоящем изобретении. В одном другом определенном случае аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z может применяться в
качестве терминирующего компонента с одного конца компонента (компонентов) Р1 и/или Р3 без добавления дополнительного компонента к аминокислотному компоненту (АА)x или смешанному повторяющемуся аминокислотному компоненту [(AA)x]z.
В другом примере аминокислотный компонент (АА)x или смешанный повторяющийся аминокислотный компонент [(AA)x]z согласно описанному в настоящем изобретении может быть присоединен к компоненту (компонентам) Р1 и/или Р3 перед стадией в), причем компонент (компоненты) Р1 и/или Р3 уже модифицированы за счет линкера. Для этой цели компонент (компоненты) Р1 и/или Р3 предпочтительно несут (по меньшей мере) две -SH части молекулы согласно описанному в настоящем изобретении, причем поликонденсацию проводят с линкером, несущим, например, одну -SH-часть молекулы. Эту реакцию можно проводить, применяя защитные группы, согласно описанному в настоящем изобретении, или, предпочтительно, без защитных групп. В другом варианте какие-либо функциональные части, согласно описанному в настоящем изобретении, за исключением -SH части молекулы, могут применяться для соединения. Таким образом, вторая-SH-часть молекулы компонента (компонентов) Р1 и/или Р3 может применяться для соединения аминокислотного компонента (АА)x или смешанного повторяющегося аминокислотного компонента [(AA)x]z согласно описанному в настоящем изобретении через -SH-части молекулы, например, в форме, представленной формулой «H(S-AA-S)x-H» или «H[S-(AA)x-S]ZH». Эта реакция предпочтительно приводит к следующим промежуточным соединениям
«L-S-S-P1-S-CS-AA-SVSH»,
«L-S-S-P1-S-fS-CAAJx-SJzH», или
«HS-(S-AA-S)x-S-S-P3-S-S-L», или
«HS-[S-(AA)x-S]Z-S-P3-S-S-L»;
или, если компонент L связан через дисульфидные связи со следующими промежуточными продуктами
«L-P1-S-(S-AA-S)x-SH»,
«L-P1-S-tS-CAAJx-SlzH», или
«HS-(S-AA-S)x-S-S-P3-L», или
«HS-[S-(AA)x-S]Z-S-P3-L»; На стадии в) гидрофильные полимеры Р1 и/или Р3 (или какой-либо из промежуточных компонентов, предусмотренных на стадии б)) согласно описанному в настоящем изобретении, предусматривают и смешивают с повторяющимся компонентом H-[S-P2-S]n-H, со смешанным повторяющимся компонентом H-{[S-P2-S]a[S-(AA)x-S]b}-H, или каким-либо из промежуточных компонентов, полученных на стадии а), особенно в соотношении примерно от 2: 1. Реакцию обычно начинают и проводят в условиях, описанных выше на стадии а) (рН, температура, время реакции, буферы и т.д.). Стадия в) позволяет терминировать реакцию конденсирующей полимеризации или поликонденсации и получить обладающий признаками изобретения полимерный носитель формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул, предпочтительно обладающего признаками изобретения полимерного носителя формулы (I)
L-P1-S-[S-P2-S]n-S-P3-L
или формулы (Ia)
L-P1-S-{[S-P2-S]a[S-(AA)x-S]b}-S-P3-L.
По другой стадии, стадии г), обладающего признаками изобретения способа получения обладающего признаками изобретения полимерного носителя формулы (I) или (Ia) согласно описанному в настоящем изобретении, или по какой-либо из приведенных в настоящем изобретении их подформул, обладающий признаками изобретения полимерный носитель, полученный на стадии в), необязательно очищают. Очистка может проводиться методами хроматографии, например, высокоэффективной жидкостной хроматографии (ВЭЖХ), жидкостной хроматографии быстрого разрешения (ЖХБР), GPS, диализа и т.д.
На заключительной стадии д) обладающего признаками изобретения способа получения обладающего признаками изобретения полимерного носителя формулы (I) или (Ia), согласно описанному в настоящем изобретении, или по какой-либо из приведенных в настоящем изобретении их подформул, нуклеиновую кислоту согласно описанному в настоящем изобретении необязательно добавляют к обладающему признаками изобретения полимерному носителю, полученному на стадии в) или г), предпочтительно в указанных выше соотношениях. Обычно в обладающем признаками изобретения комплексе молекула полимерного носителя общей формулы (I) или (Ia) или по какой-либо из приведенных в настоящем изобретении их подформул, согласно описанному в настоящем изобретении, предусмотрена в мольном соотношении примерно от 5 до 10000, предпочтительно в мольном соотношении примерно от 5 до 5000, более предпочтительно в мольном соотношении примерно от 5 до 2500, еще более предпочтительно в мольном соотношении примерно от 5 до 1000 полимерного носителя: нуклеиновой кислоты, например, в мольном соотношении примерно от 10 до 10000, в мольном соотношении примерно от 10 до 5000, в мольном соотношении примерно от 25 до 2500, или в мольном соотношении примерно от 50 до 1000 полимерного носителя: нуклеиновой кислоты. Предпочтительными соотношениями N/P являются те соотношения, которые указаны выше.
Обладающий признаками изобретения способ получения обладающего признаками изобретения полимерного носителя формулы (I) или (Ia) или по какой-либо из приведенных в настоящем изобретении их подформул, согласно описанному в настоящем изобретении, особенно применимы для адаптации химических свойств требуемого обладающего признаками изобретения полимерного носителя из-за специфического выбора его компонентов Р2, L, (АА)x или [(AA)x]z, тем самым избегая агломерации и токсичности in vivo.
Кроме того, специалисты не ожидали получить обладающий признаками изобретения полимерный носитель, используя указанный выше обладающий признаками изобретения способ, поскольку специалисты всегда ожидают, что полимер, полученный по обладающему признаками изобретения способу из-за общих правил равновесных реакций содержит мономерное содержимое» компонента Р2, фланкированного мономерными компонентами Р1 и/или Р3, где соединения сформированы дисульфидными связями. Напротив, в настоящем изобретении неожиданно было установлено, что при применении специфического соотношения полимеров и стадий способа, согласно описанному в настоящем изобретении, особенно умеренных условий окисления во время реакции полимеризации, конденсирующая полимеризация может быть направлена на специфическое получение требуемого распределения полимеров и требуемой средней длины и требуемого обладающего признаками изобретения полимерного носителя общей формулы (I) или (Ia) или по какой-либо из приведенных в настоящем изобретении их подформул без необходимости блокировать свободные -SH-части молекулы. Это неожиданно для специалиста.
В еще одном варианте осуществления настоящего изобретения также предусматривают фармацевтическую композицию, включающую обладающий признаками изобретения комплекс полимерного носителя с грузом, сформированный грузом нуклеиновой кислоты, согласно описанному в настоящем изобретении, и молекулой полимерного носителя общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул и необязательно фармацевтически приемлемый носитель и/или растворитель.
В качестве первого ингредиента обладающая признаками изобретения фармацевтическая композиция включает комплекс полимерного носителя с грузом, сформированный грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулой (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул.
В качестве второго ингредиента обладающая признаками изобретения фармацевтическая композиция может включать по меньшей мере один дополнительный компонент фармацевтического действия. Компонент фармацевтического действия в этой связи является соединением, обладающим терапевтическим эффектом, позволяющим лечить, облегчать или предупреждать определенные состояния, предпочтительно раковые заболевания, аутоиммунное заболевание, аллергии или инфекционные заболевания. К таким соединениям относятся, но ими не ограничиваются, пептиды или белки, предпочтительно подобные описанным в настоящем изобретении для кодирующих нуклеиновых кислот, нуклеиновые кислоты, предпочтительно согласно описанному в настоящем изобретении, низкомолекулярные органические и неорганические соединения (терапевтического действия) (с молекулярной массой менее 5000, предпочтительно меньше 1000), сахара, антигены или антитела, предпочтительно согласно описанному в настоящем изобретении, терапевтические агенты, уже известные в предшествующем уровне техники, антигенные клетки, антигенные клеточные фрагменты, клеточные фракции; компоненты клеточных стенок (например, полисахариды), модифицированные, аттенуированные или деактивированные (например, химически или с помощью радиации) патогены (вирусы, бактерии и т.д.), адъюванты, предпочтительно согласно описанному в настоящем изобретении, и т.д.
Кроме того, обладающая признаками изобретения фармацевтическая композиция может включать фармацевтически приемлемый носитель и/или растворитель. В контексте настоящего изобретения фармацевтически приемлемый носитель обычно включает жидкую или плотную основу для обладающей признаками изобретения фармацевтической композиции. Если обладающая признаками изобретения фармацевтическая композиция предусмотрена в жидкой форме, носителем обычно может быть апирогенная вода, изотонические солевые или буферные (водные) растворы, например, фосфатные, цитратные и др. буферные растворы. Особенно для инъекции обладающей признаками изобретения фармацевтической композиции можно применять воду или предпочтительно буфер, более предпочтительно водный буфер, содержащий натриевую соль, предпочтительно по меньшей мере 50 мМ соль натрия, соль кальция, предпочтительно по меньшей мере 0,01 мМ соль кальция, и необязательно соль калия, предпочтительно по меньшей мере 3 мМ соль калия. В предпочтительном варианте осуществления настоящего изобретения соли натрия, кальция и необязательно калия могут быть в форме галогенидов, например, хлоридов, иодидов или бромидов, в форме их гидроксидов, карбонатов, гидрокарбонатов или сульфатов и т.д. К примерам солей натрия относятся, но ими не ограничиваются, например, NaCl, NaI, NaBr, Na2CO3, NaHCO3, Na2SO4, к примерам необязательных солей калия относятся, например, KC1, KI, KBr, K2CO3, KHCO3, K2SO4, и к примерам солей кальция относятся, например, CaCl2, CaI2, CaBr2, CaCO3, CaSO4, Са(ОН)2. Кроме того, органические анионы указанных выше катионов могут присутствовать в буфере. В более предпочтительном варианте осуществления настоящего изобретения буфер, пригодный для инъекций, согласно описанному в настоящем изобретении, может включать соли, выбранные из натрия хлорида (NaCl), кальция хлорида (СаС1 г) и необязательно калия хлорида (KC1), где дополнительные аниона могут присутствовать дополнительно к хлоридам. CaCl2 также может быть замещен другой солью, например, KC1. Обычно соли в инъекционном буфере содержатся в концентрации по меньшей мере 50 мМ натрия хлорида (NaCl), по меньшей мере 3 мМ калия хлорида (KC1) и по меньшей мере 0,01 мМ кальция хлорида (CaCl2). Инъекционный буфер может быть гипертоническим, изотоничным или гипотоничным относительно определенной контрольной среды, т.е. буфер может содержать повышенную, равную или пониженную концентрацию солей относительно определенной контрольной среды, где предпочтительно такие концентрации указанных выше солей могут применяться, которые не приводят к разрушению клеток из-за осмоса или других эффектов, связанных с концентрацией. Контрольными средами являются, например, жидкости в способах «in vivo», например, кровь, лимфа, жидкости цитозоля или другие жидкости тела, или например, жидкости, которые могут применяться в качестве контрольной среды в способах «in vitro», например, общие буферы или жидкости. Такие общие буферы или жидкости известны специалистам в данной области. Раствор лактата Рингера особенно предпочтителен в качестве жидкой основы.
В другом варианте осуществления настоящего изобретения обладающая признаками изобретения фармацевтическая композиция может включать адъювант. В этом контексте адъювантом является какое-либо соединение, способное инициировать или повысить иммунный ответ врожденной иммунной системы, т.е. неспецифический иммунный ответ. Иначе говоря, при введении обладающая признаками изобретения фармацевтическая композиция обычно вызывает врожденный иммунный ответ из-за адъюванта, необязательно содержащегося в ней. Такой адъювант может быть выбран из какого-либо адъюванта, известного специалисту и пригодного для данного случая, т.е. поддерживая индукцию врожденного иммунного ответа у млекопитающих.
Обладающая признаками изобретения фармацевтическая композиция может вводиться перорально, парентерально, путем ингаляции, местно, ректально, назально, буккально, вагинально или через имплантированный резервуар. Понятие «парентерально» в контексте настоящего изобретения означает подкожное, внутривенное, внутримышечное, внитрисуставное, внутрисиновиальное, в надчревную ямку, подоболочечное, внутрипеченочное, внутрираневое, внутричерепное и подъязычное путем инъекции или инфузии.
Обладающая признаками изобретения фармацевтическая композиция может применяться для медицинских, а также ветеринарных, целей, предпочтительно для медицинских целей, в качестве фармацевтической композиции в целом или в качестве вакцины.
В особенно предпочтительном варианте осуществления настоящего изобретения обладающая признаками изобретения фармацевтическая композиция (или обладающий признаками изобретения комплекс полимерного носителя с грузом) может быть предусмотрена или применена в качестве иммуностимулирующего агента. В этом контексте обладающая признаками изобретения фармацевтическая композиция предпочтительно является композицией, описанной выше. Более предпочтительно нуклеиновая кислота комплекса обладающего признаками изобретения полимерного носителя с грузом, которая предпочтительно содержится в фармацевтической композиции, является типично иммуностимулирующей нуклеиновой кислотой согласно описанному в настоящем изобретении, например, CpG-ДНК или иммуностимулирующей РНК (исРНК). В другом варианте или дополнительно, нуклеиновой кислотой обладающего признаками изобретения комплекса полимерного носителя с грузом, предпочтительно содержащегося в фармацевтической композиции, является кодирующая нуклеиновая кислота согласно описанному в настоящем изобретении, предпочтительно кДНК или иРНК, более предпочтительно кодирующая адъювантный белок, предпочтительно согласно описанному в настоящем изобретении.
В другом конкретном варианте осуществления настоящего изобретения в этом контексте предпочтительно, если адъювантным белком является компонент полимерного носителя, предпочтительно в виде компонента (АА)x.
В еще одном более предпочтительном варианте осуществления настоящего изобретения обладающая признаками изобретения фармацевтическая композиция (или обладающий признаками изобретения комплекс полимерного носителя с грузом) может быть предусмотрена или применена в качестве адъюванта. В этом контексте адъювант предпочтительно определяют в качестве указанной выше обладающей признаками изобретения фармацевтической композиции. Более предпочтительно нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом, предпочтительно помещенного в адъювант, обычно представляет иммуностимулирующую нуклеиновую кислоту согласно описанному в настоящем изобретении, например, CpG-ДНК или иммуностимулирующую РНК (исРНК). В другом варианте или дополнительно нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом, предпочтительно помещенного в адъювант, является кодирующей нуклеиновой кислотой, согласно описанному в настоящем изобретении, предпочтительно кДНК или иРНК, более предпочтительно кодирующей адъювантный белок, предпочтительно согласно описанному в настоящем изобретении. Обладающий признаками изобретения комплекс полимерного носителя с грузом, предпочтительно помещенный в адъювант, обычно инициирует врожденный иммунный ответ у пациента, подвергаемого обработке. Такой адъювант может быть применен в какой-либо сопутствующей терапии с какой-либо известной вакциной или каким-либо другим (известным) терапевтическим агентом, предпочтительно перед, одновременно или после введения основного терапевтического средства, перед, одновременно или после введения другой (известной) вакцины или (известного) другого терапевтического агента.
Обладающий признаками изобретения комплекс полимерного носителя с грузом или обладающая признаками изобретения фармацевтическая композиция, согласно описанному в настоящем изобретении, предусматриваемые или используемые в качестве адъюванта, предпочтительно способны индуцировать неспецифичную в отношении антигена (врожденную) иммунную реакцию (обеспечиваемую врожденной иммунной системой), предпочтительно путем иммуностимуляции. Иммунная реакция может в целом может быть достигнута разными путями. Важным фактором соответствующего иммунного ответа является стимуляция разных Т-клеточных субпопуляций. Т-лимфоциты обычно дифференцируют на две суб-популяции клеток: Т-хэлперов (Th1) и Т-хэлперов 2 (Th2), с помощью которых иммунная система способна к разрушению внутриклеточных (Th1) и внеклеточных (Th2) патогенов (например, антигенов). Две популяции клеток Th отличаются паттерном вырабатываемых ими эффекторных белков (цитокинов). Таким образом, клетки Th1 способствуют клеточному иммунному ответу путем активирования макрофагов и цитотоксических Т-клеток. С другой стороны, клетки Th2 индуцируют гуморальный иммунный ответ путем стимуляции В-клеток для конверсии в клетки плазмы и путем формирования антител (например, против антигенов). Соотношение Th1/Th2 таким образом имеет большое значение для иммунного ответа. По настоящему изобретению соотношение Th1/Th2 иммунного ответа предпочтительно смещается под действием иммуностимулирующего агента, а именно обладающего признаками изобретения комплекса полимерного носителя с грузом в направлении клеточного ответа, называемого ответом Th1, и преимущественно клеточный иммунный ответ таким образом индуцируется. Согласно описанному выше, обладающий признаками изобретения комплекс полимерного носителя с грузом сам приводит в действие неспецифический врожденный иммунный ответ, который позволяет применять обладающий признаками изобретения комплекс полимерного носителя с грузом (без добавления другого компонента терапевтического действия) в качестве иммуностимулирующего агента. При совместном введении вместе с другим компонентом фармацевтического действия, предпочтительно специфическим иммуногенным компонентом, предпочтительно антигеном, нуклеиновая кислота по настоящему изобретению служит в качестве адъюванта, поддерживающего специфический приобретенный иммунный ответ, вызываемый другим компонентом фармацевтического действия, например, антигеном.
Согласно другому особенно предпочтительному варианту осуществления настоящего изобретения обладающая признаками изобретения фармацевтическая композиция (или обладающий признаками изобретения комплекс полимерного носителя с грузом) могут быть предусмотрены или применены в качестве вакцины.
Такая обладающая признаками изобретения вакцина обычно представляет обладающую признаками изобретения фармацевтическую композицию и предпочтительно поддерживает или вызывает иммунный ответ иммунной системы пациента, подвергаемого лечению, например, врожденный иммунный ответ, если РНК или иРНК применяют в качестве молекулы нуклеиновой кислоты обладающего признаками изобретения комплекса полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул. Кроме того, или в другом варианте, обладающая признаками изобретения вакцина может вызывать приобретенный иммунный ответ, предпочтительно если нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I) или (Ia) или по какой-либо из приведенных в настоящем изобретении их подформул, согласно описанному в настоящем изобретении кодирует какой-либо из указанных выше антигенов или белков, которые индуцируют приобретенный иммунный ответ.
В этом контексте вакцина предпочтительно означает адъювант или обладающую признаками изобретения фармацевтическую композицию, согласно описанному выше. Более предпочтительно нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом, содержащегося в такой вакцине, может быть какой-либо нуклеиновой кислотой, описанной выше, предпочтительно иммуностимулирующей нуклеиновой кислотой, описанной в настоящем изобретении, например, CpG-ДНК или иммуностимулирующей РНК (исРНК). В другом варианте или дополнительно нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом, предпочтительно содержащегося в вакцине, является кодирующей нуклеиновой кислотой, согласно описанному в настоящем изобретении, предпочтительно кДНК или иРНК, более предпочтительно кодирующей адъювантный белок, предпочтительно описанный выше. В другом варианте или дополнительно нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом, предпочтительно содержащегося в вакцине, является кодирующей нуклеиновой кислотой, согласно описанному в настоящем изобретении, предпочтительно кДНК или иРНК, более предпочтительно кодирующей антиген, предпочтительно описанный в настоящем изобретении. Кроме того, особенно если нуклеиновая кислота обладающего признаками изобретения комплекса полимерного носителя с грузом не кодирует антиген, обладающая признаками изобретения вакцина может содержать антиген, предпочтительно согласно описанному выше, в качестве или белка, или пептида, или кодирующей нуклеиновой кислоты, или антигенных клеток, антигенных клеточных фрагментов, клеточных фракций, компонентов клеточной стенки (например, полисахаридов), модифицированных, аттеннуированных или деактивированных (например, химически или путем обработки радиацией) патогенов (вирусов, бактерий и т.д.).
В другом варианте осуществления настоящего изобретения обладающая признаками изобретения вакцина может содержать пептидный или белковый антиген в виде компонента (АА)x обладающего признаками изобретения полимерного носителя, согласно описанному в настоящем изобретении, предпочтительно в качестве части повторяющегося компонента [S-P2-S]n.
Обладающая признаками изобретения вакцина также может включать фармацевтически приемлемый носитель, адъювант и/или растворитель, согласно описанному в настоящем изобретении для обладающей признаками изобретения фармацевтической композиции.
Обладающая признаками изобретения вакцина может дополнительно включать одно или более вспомогательных веществ для повышения при необходимости иммуногенности. За счет этого предпочтительно достигается синергическое действие обладающего признаками изобретения комплекса полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и молекулой полимерного носителя общей формулы (I) или (Ia) или по какой-либо из приведенных в настоящем изобретении их подформул, согласно описанному в настоящем изобретении, и вспомогательным веществом, которое может необязательно содержаться в обладающей признаками изобретения вакцине согласно описанному в настоящем изобретении. В зависимости от разных типов вспомогательных веществ могут рассматриваться разные механизмы. Например, соединения, которые допускают созревание дендровидных клеток (ДК), например, липополисахариды, лиганды TNF-альфа или CD40, составляют первый класс соответствующих вспомогательных веществ. В целом возможно применение в качестве вспомогательного вещества какого-либо агента, влияющего на иммунную систему по типу «сигнала опасности» (LPS, GP96 и т.д.) или цитокины, например, GM-CFS, которые позволяют повысить иммунный ответ и/или воздействовать на него направленным способом. Особенно предпочтительными вспомогательными веществами являются цитокины, например, монокины, лимфокины, интерлейкины или хемокины, которые дополнительно индуцируют врожденный иммунный ответ, например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-S, IL-9, IL-10, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, IFN-альфа, IFN-бета, IFN-гамма, GM-CSF, G-CSF, M-CSF, LT-бета или TNF-альфа, факторы роста, например, hGH.
Дополнительными вспомогательными веществами, которые могут быть включены в обладающую признаками изобретения вакцину, являются
эмульгаторы, например, Tween®, увлажняющие агенты, например, натрий лаурилсульфат, красители, усилители вкуса, фармацевтические носители, агенты формирования таблеток, стабилизаторы, антиоксиданты, консерванты.
Обладающая признаками изобретения вакцина также может дополнительно или в другом варианте может содержать какое-либо дополнительное соединение, о котором известно, что оно стимулирует иммунитет благодаря способности к связывающему сродству (в качестве лиганда) с Toll-подобными рецепторами человека TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, или благодаря способности к связывающему сродству (в качестве лиганда) с Toll-подобными рецепторами мыши или крысы TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13.
К другому классу соединений, которые можно добавлять к обладающей признаками изобретения вакцине, могут относиться нуклеиновые кислоты CpG, в частности CpG-PHK или CpG-ДНК. CpG-PHK или CpG-ДНК могут быть одноцепочечными CpG-ДНК (оцСрС-ДНК), двухцепочечными CpG-ДНК (дцДНК), одноцепочечными CpG-PHK (ouCpG-PHK) или двухцепочечными CpG-PHK (дцСрС-РНК). Нуклеиновая кислота CpG предпочтительно представлена в форме CpG-PHK, более предпочтительно в форме одноцепочечной CpG-PHK (ouCpG-PHK). Нуклеиновая кислота CpG предпочтительно содержит по меньшей мере одну или более (митогенных) цитозин/гуаниновых динуклеотидных последовательностей (мотив (мотивы) CpG). По первому предпочтительному варианту по меньшей мере один мотив CpG, содержащийся в этих последовательностях, которые представляют С (цитозин) и G (гуанин) мотива CpG, неметилирован. Все другие цитозины или гуанины, необязательно содержащиеся в этих последовательностях, могут быть или метилированными или неметилированными. Однако в другом предпочтительном варианте С (цитозин) и G (гуанин) мотива CpG также может быть в метилированной форме.
Обладающая признаками изобретения вакцина также может дополнительно или в другом варианте содержать иммуностимулирующую РНК, т.е. РНК, производную от иммуностимулирующей РНК, которая индуцирует или повышает (врожденный) иммунный ответ.Предпочтительно такая РНК может в целом соответствовать указанному в настоящем изобретении для РНК. В данном контексте такие классы молекул РНК, которые могут индуцировать врожденный иммунный ответ, могут быть выбраны, например, из лигандов Toll-подобных рецепторов (TLR), особенно из последовательностей РНК, представляющих и/или кодирующих лигандов рецепторов TLR, предпочтительно выбранных из представителей семейства TLR1-TLR10 человека или представителей семейства TLR1-TLR13 мыши или крысы, более предпочтительно из TLR7 и TLR8, лигандов для внутриклеточных рецепторов для РНК (например, RIG-I или MDA-5 и т.д.) (см., например, Meylan Е., Tschopp J., Mol. Cell 22, 2006, cc. 561-569), или последовательность какой-либо другой иммуностимулирующей РНК. Такая иммуностимулирующая РНК может быть длиной от 1000 до 5000, от 500 до 5000, от 5 до 5000, или от 5 до 1000, от 5 до 500, от 5 до 250, от 5 до 100, от 5 до 50 или от 5 до 30 нуклеотидов.
Настоящее изобретение кроме того предусматривает несколько применений и использует обладающую признаками изобретения молекулу полимерного носителя общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул, обладающий признаками изобретения комплекс полимерного носителя, сформированный грузом нуклеиновой кислоты, и обладающую признаками изобретения молекулу полимерного носителя, фармацевтическую композицию, включающую их, или наборы, включающие их.
В одном из вариантов осуществления настоящее изобретение направлено на первое медицинское применение обладающей признаками изобретения молекулы полимерного носителя общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул, обладающего признаками изобретения комплекса полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и обладающей признаками изобретения молекулой полимерного носителя, или наборов, включающих их, в качестве лекарственного средства, предпочтительно для генной терапии или лечения заболевания, описанных в настоящем изобретении. Лекарственное средство может быть в форме фармацевтической композиции или в форме адъюванта или вакцины в качестве специфической формы фармацевтических композиций. Фармацевтическая композиция в контексте настоящего изобретения обычно включает обладающую признаками изобретения молекулу полимерного носителя общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул согласно описанному в настоящем изобретении, или обладающий признаками изобретения комплекс полимерного носителя с грузом, сформированный грузом нуклеиновой кислоты и обладающей признаками изобретения молекулой полимерного носителя, необязательно дополнительные ингредиенты, например, согласно описанному в настоящем изобретении, обладающую признаками изобретения нуклеиновую кислоту, и необязательно фармацевтически приемлемый носитель и/или растворитель, предпочтительно согласно описанному в настоящем изобретении.
В другом варианте осуществления настоящее изобретение направлено на применение обладающей признаками изобретения молекулы полимерного носителя общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул, согласно описанному в настоящем изобретении, предпочтительно с грузом нуклеиновой кислоты, согласно описанному в настоящем изобретении, или обладающего признаками изобретения комплекса полимерного носителя с грузом, сформированным грузом нуклеиновой кислоты, и обладающей признаками изобретения молекулы полимерного носителя для профилактики, лечения и/или облегчения заболеваний согласно описанному в настоящем изобретении. Предпочтительно заболевания, указанные в настоящем изобретении, выбраны из раковых и опухолевых заболеваний, инфекционных заболеваний, предпочтительно (вирусных, бактериальных или протозойных) инфекционных заболеваний, аутоиммунных заболеваний, аллергий или аллергических заболеваний, моногенетических заболеваний, т.е. (наследственных) заболеваний, или генетических заболеваний в целом, заболеваний с генетическим наследуемым фоном и тех, которые обычно вызваны определенным генетическим дефектом, наследуемым по законам Менделя, сердечнососудистых заболеваний, нейронных заболеваний, заболеваний дыхательной системы, заболеваний пищеварительной системы, заболеваний кожи, костно-мышечных расстройств, расстройств соединительной ткани, неоплазм, иммунной недостаточности, эндокринных, пищевых и метаболических заболеваний, глазных заболеваний, слуховых заболеваний и каких-либо заболеваний, на которые может повлиять настоящее изобретение.
В другом варианте осуществления настоящее изобретение направлено на второе медицинское применение обладающей признаками изобретения молекулы полимерного носителя общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул, согласно описанному в настоящем изобретении, или обладающего признаками изобретения комплекса полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и обладающей признаками изобретения молекулой полимерного носителя, для лечения заболеваний согласно описанию настоящего изобретения, предпочтительно на применение молекулы обладающего признаками изобретения полимерного носителя общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул, или обладающего признаками изобретения комплекса полимерного носителя с грузом, сформированным грузом нуклеиновой кислоты и молекулой полимерного носителя, с обладающей признаками изобретения фармацевтической композицией, включающей их, или наборов, включающих их, для получения лекарственного средства для профилактики, лечения и/или облегчения различных заболеваний, согласно описанному в настоящем изобретении.
Другой вариант осуществления настоящего изобретения направлен на применение молекулы полимерного носителя с признаками изобретения общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул, предпочтительно с грузом нуклеиновой кислоты согласно описанному в настоящем изобретении, или обладающего признаками изобретения комплекса полимерного носителя с грузом, сформированного грузом нуклеиновой кислоты и обладающей признаками изобретения молекулой полимерного носителя, для иммунотерапии, для генной терапии, для вакцинации или для их применения в качестве адъюванта.
Другой вариант осуществления настоящего изобретения направлен на лечение заболеваний, согласно описанному в настоящем изобретении, особенно профилактическое, лечение и/или облегчение различных заболеваний, определенных в настоящем изобретении, предпочтительно используя или вводя пациенту, нуждающемуся в этом, комплекс обладающего признаками изобретения полимерного носителя с грузом, сформированный грузом нуклеиновой кислоты и молекулой обладающего признаками изобретения полимерного носителя общей формулы (I) или (Ia) или какой-либо из приведенных в настоящем изобретении их подформул, или обладающей признаками изобретения фармацевтической композиции или вакцины, определенных в настоящем изобретении.
Настоящее изобретение также представляет лечение заболеваний, которые не являются наследственными или которые не могут быть отнесены к указанным выше категориям. Такие заболевания включают, например, лечение пациентов, которые нуждаются в специфическом белковом факторе, например, в специфическом белке, согласно указанному выше. Они могут, например, включать пациентов, находящихся на диализе, например, пациентов, которые (регулярно) претерпевают почечный диализ и которые могут нуждаться в специфических белках терапевтического действия, согласно описанному в настоящем изобретении, например, в эритропоэтине (erythropoietin - ЕРО) и т.д.
В последнем варианте осуществления настоящего изобретения также предусматривают наборы частей, включающие в качестве компонентов отдельно или в комбинации с другими ингредиентами по меньшей мере одну обладающую признаками изобретения молекулу полимерного носителя общей формулы (I) или (la) или какой-либо из приведенных в настоящем изобретении их подформул, по меньшей мере один комплекс обладающего признаками изобретения полимерного носителя с грузом, сформированный грузом нуклеиновой кислоты и обладающей признаками изобретения молекулой полимерного носителя, по меньшей мере одну нуклеиновую кислоту, согласно описанному в настоящем изобретении, по меньшей мере одну фармацевтическую композицию, включающую их, и/или наборы, включающие их, и необязательно технические инструкции с информацией по введению и дозированию обладающей признаками изобретения молекулы полимерного носителя, нуклеиновой кислоты, комплекса обладающего признаками изобретения полимерного носителя и/или обладающей признаками изобретения фармацевтической композиции. Такие наборы, предпочтительно наборы частей, могут применяться, например, для какого-либо из указанных выше применений. Такие наборы, представленные в виде набора частей, могут дополнительно включать каждый компонент в другой части набора. Фигуры
Приводимые ниже фигуры предназначены для иллюстрации настоящего изобретения. Они не предназначены для ограничения сущности настоящего изобретения.
Фиг. 1 иллюстрирует продукты, сформированные в ходе реакции, гель-электрофорезом SDS PAGE в условиях без восстановления. Левая панель геля окрашена кумасси по протоколу, в результате которого окрашивается пептидное содержимое, правая панель окрашена растворами бария хлорида/йода, в результате которого окрашивается ПЭГ. На фигуре четко виден только один продукт, содержащий ПЭГ и пептид, сформированный в диапазоне обозначенной массы.
Фиг. 2 показывает результаты конфокальной микроскопии клеток L929 через 5 мин после трансфекции флуоресцентно меченой РНК, объединенной в комплекс с обладающим признаками изобретения полимерным носителем РВ19 в мольном соотношении 1:500. В результате некоторые комплексы выявляются в клетках уже через 5 мин после трансфекции, указывая на хорошую степень трансфекции.
Фиг.3 показывает результаты конфокальной микроскопии клеток L929 через 1 ч после трансфекции флуоресцентно меченой РНК, объединенной в комплекс с обладающим признаками изобретения полимерным носителем РВ19 в мольном соотношении 1:500. В результате большинство частиц поглощается клетками через 1 ч после трансфекции, указывая на хорошую степень трансфекции.
Фиг. 4 иллюстрирует эксперименты по стабильности, касающиеся электростатического смещения связанной нуклеиновой кислоты от комплекса. Можно видеть, что добавление анионного полимерного гепарина не может смещать РНК из комплекса, потому что она по-прежнему мигрирует в геле. Это показывает, что связывание в комплексе настолько сильно, что конкурирующий по комплексу партнер не может сместить РНК из комплекса.
Фиг. 5 представляет анализ сдвига в геле для оценки силы связывания комплекса. Следует показать, что добавление анионного полимера гепарина или восстанавливающего агента ДТТ отдельно не может обнаружить РНК из комплекса с полимером по настоящему изобретению (РВ19). Только вместе они способны сместить РНК из комплекса (дорожка 7). Это свидетельствует о том, что связывание в комплексе настолько сильное, что ни конкурирующий по комплексу партнер, ни восстанавливающий агент не могут вытеснить РНК из комплекса.
Фиг. 6 представляет анализ сдвига в геле для оценки силы связывания комплекса. Можно видеть, что добавление только одного анионного полимерного гепарина не может вытеснить РНК из комплекса с полимером по настоящему изобретению (РВ22). Напротив, иРНК может быть легко вытеснена гепарином из комплексов с ПЭИ.
Фиг. 7 показывает результаты экспериментов по экспрессии иРНК, кодирующей люциферазу последовательности SEQ ID NO: 369, в клетках HeLa. Можно видеть, что составы иРНК, кодирующей люциферазу (luc-RNActive) по последовательности SEQ ID NO: 369, с полимером РВ19 (мольное соотношение РНК:РВ19 1:1000, 1:500, 1:100) приводят к экспрессии люциферазы независимо от наличия среды, содержащей сыворотку. Эти результаты неожиданны, поскольку среда, содержащая сыворотку, приводит в целом к утрате результативности трансфекции.
Фиг.8 показывает результаты экспериментов по экспрессии с иРНК, кодирующей люциферазу по последовательности SEQ ID NO: 369, в клетках HeLa. Можно видеть, что составы иРНК, кодирующей люциферазу (luc-RNActive) по последовательности SEQ ID NO: 369, с полимером РВ83 (мольное соотношение РНК:РВ83 1:50) приводят к экспрессии люциферазы на существенно более высоком уровне по сравнению со свободным пептидом, объединенным с РНК в мольном соотношении 1:50 (например, матричная полимеризация in situ Rice и др.) с непэгелированным продуктом полимеризации РВ83 без ПЭГ в мольном соотношении 1:50 (например, согласование УПК), полимеризации РВ83 без пептидного компонента (например, димеризованный ПЭГ^-ПЭГ) и необратимо ПЭГелированного производного РВ83, которое было синтезировано путем терминации реакции полимеризации малеимид-содержащим ПЭГ.
Фиг. 9А иллюстрирует результаты экспериментов по экспрессии иРНК, кодирующей люциферазу последовательности SEQ ID NO: 369, в мышах BALB/c после внутрикожной инъекции. В результате переработка иРНК, кодирующей люциферазу (luc-RNActive) по последовательности SEQ ID NO: 369, с полимером РВ19 приводит к экспрессии люциферазы в дерме самок мышей BALB/c. Другие реагенты для трансфекции, известные в этой области (ПЭИ и липофектамин 2000), не проявляют какой-либо экспрессии белка люциферазы.
Фиг. 9Б иллюстрирует результаты экспериментов по экспрессии иРНК, кодирующей люциферазу последовательности SEQ ID NO: 369, в мышах BALB/c после внутримышечной инъекции. В результате переработка иРНК, кодирующей люциферазу (luc-RNActive) по последовательности SEQ ID NO: 369, с полимером РВ19 приводит к экспрессии люциферазы в болыдеберцовой мышце (m. tibialis) самок мышей BALB/c. Другие реагенты для трансфекции, известные в этой области (ПЭИ и липофектамин 2000), не проявляют какой-либо экспрессии белка люциферазы.
Фиг. 10 показывает экспрессию люциферазы у мышей линии BALB/c после внутрикожной инъекции разных составов иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, с двумя разными полимерами по настоящему изобретению [РВ19 и РВ48]. Эти составы иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, с двумя разными полимерами по настоящему изобретению [РВ19 и РВ48] приводят к экспрессии люциферазы в дерме самок мышей линии BALB/c. Комплекс полимерного носителя с грузом, сформированный пептидом по УПК CH6R4H6C (без ПЭГелирования) и иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, в мольном соотношении 2500:1 не проявляет экспрессии люциферазы после внутрикожной инъекции комплекса с иРНК.
Фиг. 11 показывает экспрессию люциферазы у мышей линии BALB/c после внутрикожной инъекции разных составов иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, с тремя разными полимерами по настоящему изобретению [РВ124, РВ117 и РВ83]. Все эти составы иРНК приводят к экспрессии люциферазы в дерме самок мышей линии BALB/c.
Фиг. 12 представляет результаты экспериментов по экспрессии иРНК, кодирующей люциферазу последовательности SEQ ID NO: 369, в клетках СНО. Можно видеть, что все составы иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, с разными полимерами по настоящему изобретению (мольное соотношение РНК:РВ 1:250) приводят к высоким уровням экспрессии люциферазы в среде, содержащей сыворотку. Также легко можно увидеть полезное воздействие гидрофильного компонента ААХ (в этом случае пептид CAS3PS3AC) в полимере.
Фиг. 13 представляет секрецию цитокина hIL-б в МКПК человека. Следует отметить, что комплексы, состоящие из полимеров по настоящему изобретению (РВ19 и РВ22) и иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, не индуцируют секреции цитокинов в МКПК человека в отличие от комплексов, состоящих из иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, и катионных пептидов (H3R9H3), или комбинации катионных пептидов (H3R9H3) и ПЭГелированных катионных пептидов (что в общем обеспечивает последующее гидрофильное покрытие предварительно сформированных конденсатов нуклеиновых кислот). Применяют следующие полимеры:
Е9-ПЭГ5k: НО-ПЭГ5000-ЕЕЕЕЕЕЕЕЕ
Е9-ПЭГ3k: НО-ПЭГ3000-ЕЕЕЕЕЕЕЕЕ
R9-ПЭГЗк: НО-ПЭГ3000-RRRRRRRRR
РВ19: HO-ПЭГ5000-S-(S-CHHHRRRRHHHC-S)5-S-ПЭГ5000-OH
РВ22: HO-ПЭГ5000-S-(S-CHHHHHHRRRRHHHHHHC-S)5-S-ПЭГ5000-OH.
Фиг. 14 иллюстрирует секрецию цитокина hTNFa в МКПК человека. Следует отметить, что комплексы, состоящие из полимеров по настоящему изобретению (РВ19 и РВ22) и иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, не индуцируют секреции цитокинов в г МКПК человека в отличие от комплексов, состоящих из иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, и катионных пептидов (H3R9H3), или таких комплексов, покрытых ПЭГелированными пептидами (что в общем обеспечивает последующее гидрофильное покрытие предварительно сформированных конденсатов нуклеиновых кислот). Применяют следующие полимеры:
Е9-ПЭГ5k: НО-ПЭГ5000-ЕЕЕЕЕЕЕЕЕ
Е9-ПЭГ3k: НО-ПЭГ3000-ЕЕЕЕЕЕЕЕЕ
R9-ПЭГ3k: НО-ПЭГ3000-RRRRRRRRR
РВ 19: HO-ПЭГ5000-S-(S-CHHHRRRRHHHC-S)5-S-ПЭГ5000-OH
РВ22: HO-ПЭГ5000-S-(S-CHHHHHHRRRRHHHHHHC-S)5-S-ПЭГ5000-OH
Фиг. 15 показывает секрецию цитокина hTFNa в МКПК человека. Следует отметить, что комплексы, состоящие из иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, и полимеров по настоящему изобретению (РВ19), не индуцируют секрецию hTFNa в МКПК человека в отличие от комплексов, состоящих из иРНК, кодирующей люциферазу (luc-RNActive) последовательности SEQ ID NO: 369, и утвержденных в настоящем уровне техники реагенты для трансфекции типа липофектамина 2000.
Фиг. 16 показывает последовательность иРНК, кодирующую люциферазу Photinuspyralis (SEQ ID NO: 369) в иРНК конструкции pCV19-Pp luc(GC)-muag-A70-C30, которая имеет длину 1857 нуклеотидов. Последовательность иРНК содержит следующие элементы последовательности:
- кодирующую последовательность, которая кодирует люциферазу Photinus pyralis;
- стабилизирующие последовательности, производные от альфа-глобин-3'-UTR (muag (мутантный альфа-глобин-3'-UTR));
- 70 × аденозинов с 3'-конца (поли-А-хвост);
- 30 × цитозинов с 3'- конца (поли-С-хвост).
Открытая рамка считывания (ORF) отмечена курсивом, область muag (мутантный альфа-глобин-3'-UTR) отмечена пунктирной линией, поли-А-хвост подчеркнут одной линией и поли-С-хвост подчеркнут двойной линией.
Примеры
Приводимые ниже примеры дополнительно иллюстрируют настоящее изобретение. Они никоим образом не ограничивают сущности настоящего изобретения.
1. Получение конструкций ДНК и иРНК, кодирующих люциферазу Рр (Photinus pyralis)
Для настоящих примеров последовательности ДНК, кодирующие люциферазу Photinus pyralis, получают и применяют для последующих реакций транскрипции in vitro.
Для первого препарата получают последовательность ДНК, обозначаемую «pCV19-Ppluc(GC)-muag-A70-C30», которая соответствует кодирующей последовательности люциферазы Photinus pyralis. Конструкцию получают путем модификации последовательности ДНК, кодирующей люциферазу Photinus pyralis дикого типа, за счет интродукции GC-оптимизированной последовательности для лучшего применения кодонов и стабилизации, стабилизирующие последовательности, производные от альфа-глобина-3'-UTR (muag (мутантный альфа-глобин-3'-UTR)), отрезок 70 × аденозинов с 3'-конца (поли-А-хвост) и отрезок 30 × цитозинов с 3'-конца (поли-С-хвост), получая последовательность SEQ ID NO: 369 (см. фиг. 16). Последовательность итоговой конструкции ДНК имеет в длину 1857 нуклеотидов и обозначается «pCV19-Ppluc(GC)-muag-A70-C30». Последовательность соответствующей иРНК показана в виде последовательности SEQ ID NO: 369 (см. фиг. 16). Последовательность содержит элементы в следующем порядке:
- кодирующую последовательность люциферазы Photinus pyralis,
- стабилизирующие последовательности, производные от альфа-глобина-3'-UTR (muag (мутантный альфа-глобин-3'-UTR)),
- 70 × аденозин с 3'-конца (поли-А-хвоста),
- 30 × цитозин с 3'-конца (поли-С-хвоста).
2. Транскрипция in vitro:
Соответствующую плазмидную ДНК, полученную согласно примеру 1, транскрибируют in vitro, используя Т7-полимеразу. Затем иРНК очищают, используя PureMessenger® (фирма Cure Vac, Tubingen, Германия).
3. Реагенты:
Пептиды: следующие пептиды применяют в настоящих экспериментах:
РВ19: HO-ПЭГ5000-S-(S-CHHHRRRRHHHC-S)5-S-ПЭГ5000-OH
(ПЭГелированный CH3R4H3C пептидный полимер)
РВ22: HO-ПЭГ5000-S-(S-CHHHHHHRRRRHHHHHHC-S)5-S-ПЭГ5000-OH
(ПЭГелированный CH6R4H6C пептидный полимер)
РВ48: HO-ПЭГ5000-S-(S-CHHHRRRRHHHC-S)3-S-ПЭГ5000-OH
РВ83: HO-ПЭГ5000-S-(S-CHHHHHHRRRRHHHHHHC-S-)7-S-ПЭГ5000-ОН
РВ86: HO-ПЭГ5000-S-(S-CHHHHHHRRRRHHHHHHC-S-)5(S-CAS3PS3AC-S)5-S-ПЭГ5000-ОН
РВ117 HO-ПЭГ5000-S-(S-CHKKKKKKHC-S-)7-S-ПЭГ5000-ОН
PB124 HO-ПЭГ2000-S-(S-CHHHHHHRRRRHHHHHHC-S-)7-S-ПЭГ2000-ОН
PB83 свободный пептид HS-(CHHHHHHRRRRHHHHHHC)-SH, свежерастворенный в воде перед переработкой
РВ83 без пептида ПЭГ-SS-ПЭГ
РВ83 без ПЭГ HS-(CHHHHHHRRRRHHHHHHC)n-SH
РВ83malПЭГ ПЭГ-mal-(S-CHHHHHHRRRRHHHHHHC-S-)x-mal-ПЭГ
H3R9H3: HHHRRRRRRRRRHHH
CH6R4H6C: H-(S-CHHHHHHRRRRHHHHHHC-S)5-H
Применяют дополнительные реагенты для трансфекции:
Липофектамин 2000 (фирма Invitrogen)
ПЭИ 25кДа (разветвленный) (фирма Aldrich)
4. Синтез обладающего признаком изобретения полимерного носителя Реакцию конденсации проводят с рассчитанным количеством пептида (компонент Р2), который растворен в матриксе буферного водного раствора при рН 8,5 с необязательной добавкой 5 об.% диметилсульфоксида (ДМСО) (который представляет умеренные окисляющие условия и таким образом позволяют установить равновесие) и перемешивают в течение 18 ч при температуре окружающей среды. Затем рассчитанное количество производного ПЭГ, содержащего тиольную группу (альфа-метокси-омега-меркапто-поли(этиленгликоль)) (компонент Р1) (растворенный в воде), добавляют и получаемый раствор перемешивают еще в течение 18 ч. В результате последующей лиофилизации и очистки получают требуемый полимер. Соотношение ПЭГ компонента Р1 к пептидному компоненту Р2 определяет длину цепи полимера Р2.
Реакция конденсации в такой реакционной среде обратима, таким образом длину цепи полимера определяют по количеству монотиолового соединения, которое терминирует реакцию полимеризации. Вкратце, длину полимерной цепи определяют по соотношению олигопептида и монотиольного компонента. Такая реакция поддерживается выбором условий умеренного окисления. В условиях более сильного окисления (30% ДМСО) индуцируется выработка высокомолекулярных полимеров (с длинной цепью).
4.1.1. Стадия: характерный пример реакции полимеризации
n HS-CHHHRRRHHHC-SH→H-(S-CHHHRRRRHHHC-S)n-H
4.2.2. Стадия: характерный пример остановки реакции
H-(S-CHHHRRRRHHHC-S)n-H+2 ПЭГ-SH→ПЭГ-S-(S-CHHHRRRRHHHC-S)n-S-ПЭГ
4.3. Характерные примеры реакций синтеза
Стадия 1)
5 x HS-CHHHRRRHHHC-SH→H-(S-CHHHRRRRHHHC-S)5-H
Стадия 2)
H-(S-CHHHRRRRHHHC-S)5-H+2x ПЭГ5000-SH→ПЭГ5000-S-(S-CHHHRRRRHHHC-S)5-S-ПЭГ5000
Для достижения длины полимера 5 (n=5) используют мольное соотношение пептида: ПЭГ=5:2.
Некоторые вариации реакции синтеза проводят, чтобы показать влияние цепей ПЭГ и воздействия обратимого присоединения цепей ПЭГ.
4.4. Реакция синтеза полимерных носителей без цепей ПЭГ
Условия реакции те же, что и приведенные выше, но стадию добавления производного сульфгидрил-содержащего ПЭГ не проводят/пропускают.
4.5. Реакция синтеза необратимо присоединенных цепей ПЭГ
Условия реакции те же, что и приведенные выше, но вместо сульфгидрил-содержащего производного ПЭГ используют производное малеимид-содержащего ПЭГ. Малеимидная часть молекулы быстро реагирует со свободными сульфгидрильными группами, формируя ковалентную связь. Таким образом терминация полимеризации находится не в условиях динамического равновесия, как для сульфгидрил-содержащих производных ПЭГ, а в необратимых условиях, которые приводят к «замороженному» паттерну полимеризации продуктов в высокой степени разнообразных и неопределенных продуктов реакции, полученных в реакции динамического равновесия.
5. Комплексообразование РНК
Конструкцию иРНК, описанную выше в примере 1 и полученную согласно описанному в примере 2, подвергают комплексообразованию для целей настоящего изобретения с полимерами, предпочтительно выраженными в примере 4. Таким образом, 4 мкг РНК, кодирующей люциферазу pCV19-Ppluc(GC)-muag-A70-C30 (Luc-RNActive) последовательности SEQ ID NO: 85, смешивают в мольных соотношениях согласно указанному с обладающим признаками изобретения полимерным носителем (по формуле I) или контролем, тем самым, формируя комплекс.Затем получаемый раствор доводят водой до конечного объема 50 мкл и инкубируют в течение 30 мин при комнатной температуре.
Различные обладающие признаками изобретения полимерные носители и разные соотношения полимерных носителей/РНК, примененных в настоящем изобретении, представлены в табл.1.
Соотношение - мольное соотношение РНК: пептида.
Катионные АК=катионные аминокислоты, которые положительно заряжены при физиологической величине рН (т.е. не гистидин (Н), а, например, аргинин (R)).
Несмотря не то, что РВ83 и РВ86 содержат катионный инсерт, являющийся двойным по размеру по сравнению с РВ19, таким образом имеет двойное количество катионных аминокислотных остатков. РВ48 содержит более короткий катионный инсерт по сравнению с РВ19, таким образом имея меньше катионных аминокислотных остатков на молекулу полимера.
N/P=означает отношение основных атомов азота в полимерном носителе к остаткам фосфата в нуклеиновой кислоте, принимая во внимание, что атомы азота обеспечивают положительные заряды и фосфаты каркаса молекулы фосфата нуклеиновой кислоты обеспечивают отрицательные заряды. Остатки гистидина в пересчете нейтральны, поскольку формирование комплекса происходит при физиологической величине рН, таким образом остаток имидазола является незаряженным.
N/P рассчитывают по следующей формуле:
N/P=пмоли [РНК] × соотношение × катионные АК
мкгРНК × 3 × 1000
Для расчетов РНК, кодирующую люциферазу pCV19-Ppluc(GC)-muag-A70-С30 (Luc-RNActive), применяют последовательность SEQ ID NO: 369, которая обладает молекулярной массой 660 кДа. Таким образом, 1 мкг pCV19-Ppluc(GC)-muag-A70-C30 РНК последовательности SEQ ID NO: 369 соответствует 1,67 пмолям pCV19-Ppluc(GC)-muag-A70-C30 РНК последовательности SEQ ID NO: 369.
6. Измерения размера и дзета-потенциала
Гидродинамические диаметры полиплексов, описание получения которых приведено выше, измеряют по динамическому рассеянию света, используя Zetasizer Nano (фирма Malvern Instruments, Malvern, Великобритания) по стандартному порядку действия, определенному фирмой Malvern. Измерения проводят при 25°С в определенном буфере, анализируют кумулянтным методом для получения гидродинамических диаметров и точных показателей полидисперсности полиплексов.
Дзета-потенциал полиплексов оценивают методом лазерного доплеровского электрофореза, используя Zetasizer Nano (фирма Malvern Instruments, Malvern, Великобритания). Измерения проводят при 25°С и применяют угол рассеивания 173°.
7. Анализ подвижности в геле
Кроме того, иРНК, кодирующую люциферазу (Luc-RNActive) последовательности SEQ ID NO: 369, перерабатывают с полимерами согласно указанному и аликвоты инкубируют или с гепарином (100 мкг), или с дитиотриэтолом (ДТТ) в течение 15 мин при 37°С. После электрофореза в агарозном геле нуклеиновые кислоты визуализируют окрашиванием этидиум бромидом.
8. Конфокальная лазерная сканирующая микроскопия Конфокальную лазерную сканирующую микроскопию проводят на
инвертированном лазерном сканирующем микроскопе LSM510 (фирма Carl Zeiss, Германия), используя линзы Plan-Apochromat 63х/1.4 N.A. Все анализы проводят с живыми нефиксированными клетками, выращенными в 8-луночных камерах с покровными стеклами (фирма Nunc, Германия). Для обнаружения иРНК, меченной Alexa Fluor 647, применяют только свет гелиево-неонового лазера с длиной волны 633 нм, направленный поверх расщепителя луча UV/488/543/633 в комбинации с фильтром LP 650 длительного прохождения. Микроскопирование живых клеток проводят при комнатной температуре.
Для этой цели клетки L929 (25×103/лунку) высевают за 1 сутки до трансфекции в 24-луночные планшеты для микротитрования, получая 70% слияние при проведении трансфекции. Клетки переносят из составов, содержащих 2 мкг иРНК, меченой Alexa Fluor 647, в 8-луночные камеры на стекла непосредственно перед проведением исследования методом микроскопии.
8. Стимуляция цитокином в мононуклеарных клетках периферической крови (МКПК) человека
Клетки МКПК выделяют из периферической крови здоровых доноров, используя градиент Ficoll, и затем промывают в 1×ФСБ (фосфатно-солевом буфере). Затем клетки высевают в 96-луночные планшеты для микротитрований (200×103/лунку). Клетки МКПК человека инкубируют в течение 24 ч с 10 мкл комплекса РНК/носителя в среде X-VIVO 15 (фирма BioWhittaker). В качестве РНК применяют последовательность SEQ ID NO: 369. Носители соответствуют представленной выше общей формуле (I). Иммуностимулирующее действие на МКПК человека измеряют путем определения выработки цитокина (интерлейкина-6, фактора некроза опухоли альфа, интерферона альфа). Таким образом, планшеты для микротитрования ELISA (фирма Nunc Maxisorb) инкубируют в течение ночи со связывающим буфером (0,02% NaN3, 15 мМ Na2CO3, 15 мМ NaHCO3, рН 9,7), дополнительно содержащим специфическое антитело против цитокина. Затем клетки блокируют с помощью 1хФСБ, содержащим 1% БСА (бычий сывороточный альбумин). Добавляют клеточный супернатант и инкубируют в течение 4 ч при 37°С. Затем планшет для микротитрования промывают 1×ФСБ, содержащим 0,05% Tween-20, и затем инкубируют с Biotin-меченым вторым антителом (фирма BD Pharmingen, Гейдельберг, Германия). Стрептавидин, соединенный с пероксидазой хрена, добавляют в планшет. Затем планшет опять промывают с помощью 1хФСБ, содержащего 0,05% Tween-20 и АБТС (2,2'-азино-бис(3-этил-бензтиазолин-6-сульфоновую кислоту), добавленную в качестве субстрата. Количество цитокина определяют по измерению поглощения при 405 нм (оптическая плотность при 405 нм), используя стандартную кривую с рекомбинантными цитокинами (фирма BD Pharmingen, Гейдельберг, Германия) и Sunrise ELISA-ридер фирмы Тесап (Crailsheim, Германия).
9. Трансфекция клеток HeLa
4 мкг РНК стабилизированно иРНК люциферазы (Luc-RNActive) последовательности SEQ ID NO: 85 смешивают в молярных соотношениях согласно указанному для соответствующего полимера (по формуле I), в результате формируя комплекс. Затем получаемый раствор доводят водой до конечного объема 50 мкл и инкубируют в течение 30 мин при комнатной температуре. Применяемые соотношения указаны выше в табл.1.
Клетки Hela (в количестве 150×103/лунку) высевают за 1 сутки до трансфекции в 24-луночные планшеты для микротитрований, получая 70% слияние на момент выполнения трансфекции. Для трансфекции 50 мкл раствора комплекса РНК/носителя перемешивают с 250 мкл среды без сыворотки или среды, содержащей ФСТ (согласно указанному в прилагаемой таблице), и добавляют к клеткам (конечная концентрация РНК составляет 13 мкг/мл). Перед добавлением раствора для трансфекции без сыворотки клетки HeLa осторожно и тщательно промывают дважды с помощью Optimen (фирма Invitrogen) в количестве 1 мл/лунку. Затем раствор для трансфекции (300 мкл/лунку) добавляют к клеткам и клетки инкубируют в течение 4 ч при 37°С. Затем 300 мкл среды RPMI (фирма Camprex), содержащей 10% ФСТ, вносят в лунку и клетки инкубируют в течение дополнительных 20 ч при 37°С. Раствор для трансфекции отсасывают через 24 h после трансфекции и клетки лизируют в 300 мкл лизирующего буфера (25 мМ Tris-PO4, 2 мМ EDTA, 10% глицерин, 1% Triton-X 100, 2 мМ ДТТ). Затем супернатанты смешивают с люцифериновым буфером (25 мМ глицилглицин, 15 мМ MgSO4, 5 мМ АТР, 62,5 мкМ люциферин) и люминесценцию определяют, используя люминометр (Lumat LB 9507 (фирма Berthold Technologies, Bad Wildbad, Германия)).
10. Экспрессия люциферазы in vivo
10 мкг иРНК, кодирующей люциферазу (Luc-RNActive) последовательности SEQ ID NO: 369, перемешивают в мольном соотношении 1:250 (РНК: полимерный носитель) с соответствующим носителем (по формуле I), тем самым формируя комплекс. Позднее получаемый раствор доводят раствором лактата Рингера до конечного объема 100 мкл и инкубируют в течение 30 мин при комнатной температуре, получая раствор с концентрацией комплексной РНК 0,1 г/л.
100 мкл (20 мкл) этого раствора вводят внутрикожно (в ушную раковину или спину) или внутримышечно (m. tibialis) мышам линии BALB/c в возрасте 7 недель. Через 24 ч мышей умерщвляют и отбирают образцы (уха, кожи со спины или мышцы), замораживают при -78°С и лизируют в течение 3 мин в тканевом гомогенизаторе на полной скорости (фирма Qiagen, Hilden, Германия). Позднее добавляют 600 мкл лизирующего буфера и получаемые растворы обрабатывают еще 6 мин в тканевом гомогенизаторе на полной скорости. Через 10 мин центрифугирования в режиме 13500 об/мин при 4°С супернатанты перемешивают с люцифериновым буфером (25 мМ глицилглицин, 15 мМ MgS04, 5 мМ АТР, 62,5 мкМ люциферин) и определяют люминесценцию, используя люминометр (Lumat LB 9507 (фирма Berthold Technologies, Bad Wildbad, Германия)).
11. Результаты
11.1. Определения методом динамического лазерного рассеяния/анализатором Zetasizer
Размер и ζ-потенциал комплексов полимерного носителя с грузом по настоящему изобретению оценивают в трех повторах методом динамического лазерного рассеяния и методом лазерного доплеровского электрофореза и сравнивают с разными комплексами полимерного носителя с грузом, известными в настоящее время в данной области. В табл.1 суммированы кумулянтные диаметры и ζ-потенциал комплексов полимерного носителя с грузом.
Кумулянтные диаметры комплексов полимерного носителя с грузом, сформированные полимерами по настоящему изобретению и иРНК, кодирующей люциферазу (Luc-RNActive) последовательности SEQ ID NO: 369, показывают, что формируются малые однородные комплексы. Эти комплексы стабильны, устойчивы к агломерации в солевом буфере и их размер составляет менее 100 нм. Напротив, комплексы полимерного носителя с грузом по методу УПК нестабильны в солевых буферах, формируя крупные агрегаты. Комплексы полимерного носителя с грузом по настоящему изобретению также формируют комплексы низкого ζ-потенциала, который связан с низким стремлением к связыванию компонентов сыворотки, и таким образом проявляют низкую тенденцию к опсонизации.
11.2. Конфокальная микроскопия:
Трансфекцию клеток L929 AlexaFlour647 аминоаллил-меченой РНК, объединенной с обладающим признаками изобретения полимером РВ19, через 5 мин уже приводит к обнаруживаемым в клетке комплексам. Результаты показаны на фиг. 2 и 3. Из фиг. 2 следует, что по данным конфокальной микроскопии клеток L929 через 5 мин после трансфекции флуоресцентно меченой РНК (SEQ ID NO: 369), объединенной с обладающим признаками изобретения полимером РВ19 в мольном соотношении 1:500, уже через 5 мин после трансфекции некоторые комплексы обнаруживают в клетках. Через 1 ч после трансфекции клеток L929 флуоресцентно меченой РНК, объединенной с обладающим признаками изобретения полимером РВ19 в соотношении 1:500, по данным конфокальной микроскопии следует, что после трансфекции наибольшее число частиц поглощено клетками (см. фиг. 3).
11.3. Стабильность по отношению к электростатическому смещеникА Поскольку комплексы по настоящему изобретению, особенно полимеры формулы (I), уникальны в плане композиции и поверхностного заряда, можно было наблюдать неожиданные результаты, полученные методами подвижности в геле. Установлено, что в норме поскольку полимер уплотняет нуклеиновую кислоту, он таким образом препятствует миграции нуклеиновой кислоты в электрическом поле. Если добавляют партнера по комплексу, который проявляет более сильное сродство в отношении катионного полимера по сравнению с нуклеиновой кислотой, нуклеиновая кислота смещается из комплекса и опять может мигрировать в электрическом поле. Для этой цели можно применять ПЭИ, о котором известно, что он демонстрирует чрезвычайно прочные комплексы с нуклеиновой кислотой.
Методом анализа подвижности в геле для оценки прочности связывания комплекса (см. фиг. 4) можно показать, что добавление анионного полимерного гепарина не может сместить РНК из комплекса обладающего признаками изобретения полимерного носителя с грузом, поскольку он по-прежнему мигрирует в геле. Это означает, что связывание комплекса настолько прочное, что конкурентный партнер по комплексу не может сместить РНК из комплекса обладающего признаками изобретения полимерного носителя с грузом.
В дальнейшем методом анализа подвижности в геле для оценки прочности связывания комплекса (см. фиг. 5) можно показать, что добавление одного анионного полимерного гепарина или восстанавливающего агента ДТТ не может сместить РНК из комплекса обладающего признаками изобретения полимерного носителя с грузом с полимером по настоящему изобретению (РВ19). Только вместе они способны вытеснить РНК из комплекса (дорожка 7). Это свидетельствует о том, что связывание в комплексе настолько прочное, что ни конкурентный агент, ни восстанавливающий агент, не могут вытеснить РНК из комплекса обладающего признаками изобретения полимерного носителя с грузом.
В отличие от комплексов с ПЭИ, РНК не высвобождается из комплекса обладающего признаками изобретения полимерного носителя с грузом при добавлении гепарина. Только комбинация гепарина и ДТТ высвобождает РНК. Следует отметить, что ДТТ ослабляет дисульфидные связи и таким образом разрушает конъюгат. Таким образом, имитируются условия in vivo, при которых восстанавливающие условия в клетке высвобождают РНК из комплекса.
Для сравнения анализы подвижности в геле с комплексами ПЭИ для оценки прочности связывания комплекса показывают, что добавление только одного анионного полимерного гепарина не может сместить РНК из комплекса с полимером, применяемым по настоящему изобретению (РВ22). Напротив, иРНК может быть легко вытеснена гепарином из комплексов ПЭИ (см. фиг. 6).
11.4. Экспрессия люциферазы в клетках HeLa:
Экспрессию люциферазы в клетках HeLa определяют, используя комплекс полимера формулы (I) по настоящему изобретению и иРНК с последовательностью SEQ ID NO: 369 (иРНК, кодирующая люциферазу (luc-RNActive), с носителем РВ19 (мольное соотношение РНК:РВ19 1:1000, 1:500, 1:100). Эти составы иРНК, кодирующей люциферазу (luc-RNActive), с носителем РВ19 (мольное соотношение РНК: РВ19 1:1000, 1:500, 1:100) приводят к экспрессии люциферазы независимо от наличия среды, содержащей сыворотку. Эти результаты неожиданны, потому что среда, содержащая сыворотку, приводит в целом к утрате эффективности трансфекции.
11.5. Экспрессия люциферазы in vivo
Экспрессию люциферазы у мышей BALB/c определяют после внутрикожной инъекции. На фиг. 9а показано, что составы иРНК, кодирующей люциферазу (luc-RNActive) (SEQ ID NO: 369), с полимером РВ19 приводят к экспрессии люциферазы в дерме самок мышей BALB/c. Другие реагенты для трансфекции, известные в данной области (ПЭИ и липофектамин 2000), не показывают какой-либо экспрессии белка люциферазы.
Кроме того, определяют экспрессию люциферазы у мышей BALB/c после внутримышечной инъекции. В результате (см. фиг. 96) составы иРНК, кодирующей люциферазу (luc-RNActive) (SEQ ID NO: 369), с полимером РВ19 приводят к экспрессии люциферазы в m. tibialis самок мышей BALB/c. Другие реагенты для трансфекции, известные в данной области (ПЭИ и липофектамин 2000), не показывают какой-либо экспрессии белка люциферазы.
Дополнительно определяют экспрессию люциферазы у мышей BALB/c после чрезкожной инъекции разных составов. В результате (см. фиг. 10) составы иРНК, кодирующей люциферазу (luc-RNActive) (SEQ ID NO: 369) с двумя разными полимерами по настоящему изобретению (полимерами РВ19 и РВ48) приводят к экспрессии люциферазы в дерме самок мышей BALB/c. Комплекс полимерного носителя с грузом, сформированный пептидом с УПК CH6R4H6C (без ПЭГелирования) и РНК в мольном соотношении 2500:1 не показывает экспрессии люциферазы после внутрикожной инъекции объединенной в комплекс РНК.
11.6 Стимуляция цитокина в МКПК человека
Измеряют стимуляцию цитокина, особенно секрецию цитокина hIL-б в клетках МКПК человека. В результате (см. фиг. 13) может быть показано, что комплексы по настоящему изобретению, состоящие из РНК (SEQ ID NO: 369) и полимеров по настоящему изобретению (РВ19 и РВ22), не индуцируют секрецию hIL-б в МКПК человека в отличие от комплексов, состоящих из РНК (SEQ ID NO: 369) и катионных пептидов (H3R9H3), или комбинации катионных пептидов (H3R9H3) и ПЭГелированных пептидов (Е9 или R9) (что в общем обеспечивает последующее гидрофильное покрытие предварительно сформированных конденсатов нуклеиновых кислот).
Е9-ПЭГ5k: НО-ПЭГ5000-ЕЕЕЕЕЕЕЕЕ
Е9-ПЭГ3k: НО-ПЭГ3000-ЕЕЕЕЕЕЕЕЕ
К9-ПЭГ3k: НО-ПЭГ3000-RRRRRRRRR
РВ19: HO-ПЭГ5000-S-(S-CHHHRRRRHHHC-S)5-S-ПЭГ5000-OH
РВ22: HO-ПЭГ5000-S-(S-CHHHHHHRRRRHHHHHHC-S)5-S-ПЭГ5000-OH
Кроме того, измеряют секрецию цитокина hTNFa в клетках МКПК человека. Результаты показывают (см. фиг. 14), что комплексы по настоящему изобретению, состоящие из РНК (SEQ ID NO: 369) и полимеров по настоящему изобретению (РВ19 и РВ22), не индуцируют секрецию hTNFa в клетках МКПК человека в отличие от комплексов, состоящих из РНК (SEQ ID NO: 369) и катионных пептидов (H3R9H3), или такие комплексы, покрытые ПЭГелированными пептидами (Е9 или R9) (что в общем обеспечивает последующее гидрофильное покрытие предварительно сформированных конденсатов нуклеиновых кислот).
Е9-ПЭГ5k: НО-ПЭГ5000-ЕЕЕЕЕЕЕЕЕ
Е9-ПЭГ3k: НО-ПЭГ3000-ЕЕЕЕЕЕЕЕЕ
R9-n3T3k: НО-ПЭГ3000-RRRRRRRRR
РВ19: HO-ПЭГ5000-S-(S-CHHHRRRRHHHC-S)5-S-ПЭГ5000-OH
РВ22: HO-ПЭГ5000-S-(S-CHHHHHHRRRRHHHHHHC-S)5-S-ПЭГ5000-ОН
Кроме того, секрецию цитокина hTNFa клетками МКПК человека определяют в сравнении свойств по стимулированию цитокина у комплексов по настоящему изобретению, состоящих из РНК (SEQ ID NO: 369) и полимеров по настоящему изобретению (РВ19), с имеющимися в данной области реагентами, например, липофектамином 2000 или ПЭИ. В результате оба комплекса, с липофектамином 2000 и ПЭИ, приводят к секреции на высоком уровне hTNFa, а комплекс по настоящему изобретению, состоящий из РНК (SEQ ID NO: 369) и полимеров по настоящему изобретению (РВ19 500), не приводит.
Кроме того, секрецию цитокина hTNFa клетками МКПК человека измеряют по сравнению свойств комплексов по настоящему изобретению, состоящих из РНК (SEQ ID NO: 369) и полимеров по настоящему изобретению (РВ19), с имеющимися в данной области реагентами для трансфекции, например, липофектамин 2000 или ПЭИ. В результате (см. фиг. 15) комплексообразование с липофектамином 2000 приводит к секреции на высоком уровне hTNFa, а комплексообразование с ПЭИ или полимерами по настоящему изобретению (РВ19 500) не приводит.








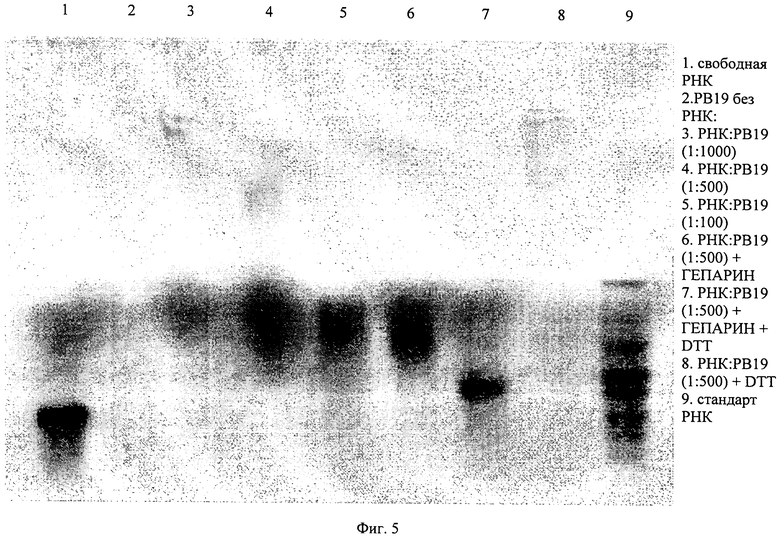

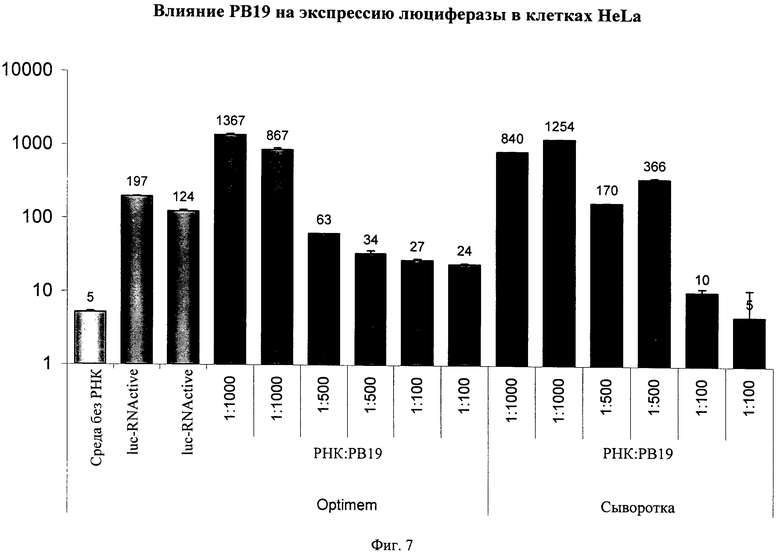
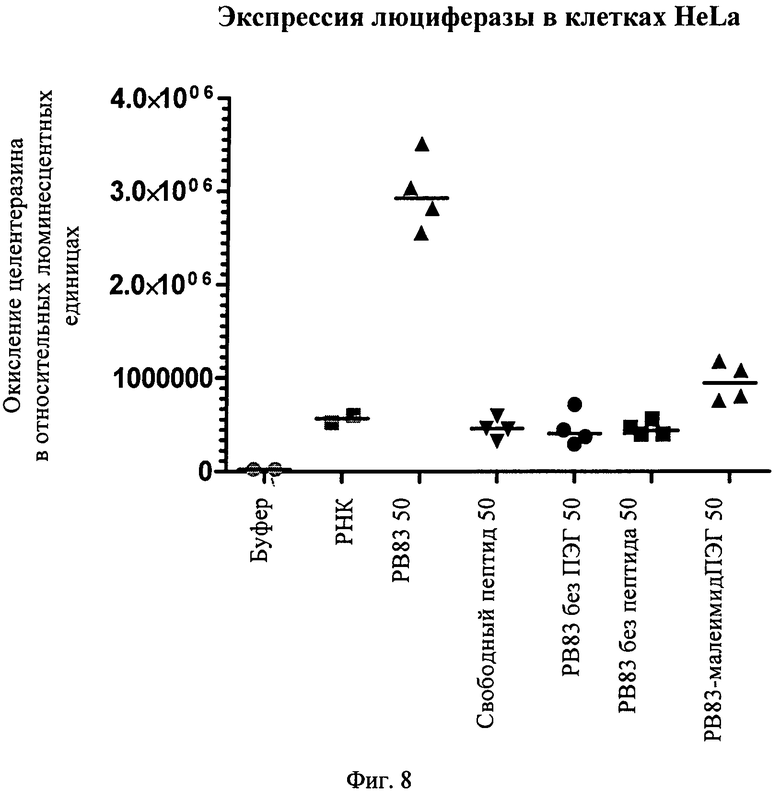
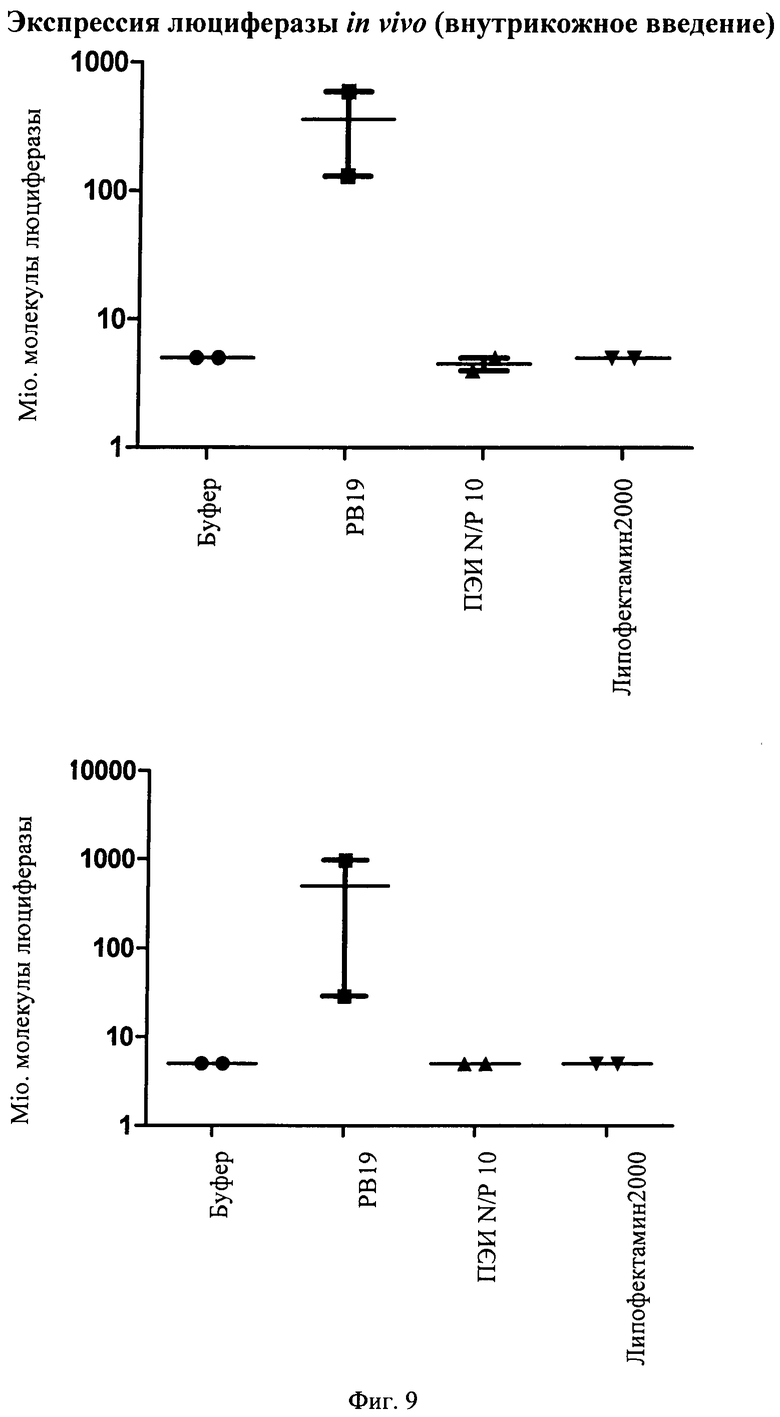







Изобретение относится к вариантам молекулы полимерного носителя, к комплексу полимерного носителя с грузом, к способу получения молекулы полимерного носителя, а также к фармацевтической композиции и вакцине. В одном из вариантов молекула полимерного носителя имеет следующую формулу (I): L-P1-S-[S-P2-S]n-S-P3-L и дополнительно содержит в структуре по меньшей мере один аминокислотный компонент (АА)x. При этом АА является аминокислотой, x означает целое число, выбранное из диапазона от 1 до 100. Если аминокислотный компонент (ΑΑ)x присутствует в структуре, то он является линкером между Р1 или Р3 и компонентом L. Если компонент L отсутствует, то по меньшей мере один аминокислотный компонент (АА)x является частью Ρ1 или Ρ3. Компоненты Р1 и Р3 различны или идентичны по отношению друг к другу и представляют линейную или разветвленную цепь гидрофильного полимера полиэтиленгликоля (ПЭГ); Р2 является катионным или поликатионным пептидом или белком длиной от 3 до 100 аминокислот, или катионным или поликатионным полимером с молекулярной массой от 0,5 кДа до 30 кДа; -S-S является дисульфидной связью; L означает необязательный лиганд, n означает целое число, выбранное из диапазона от 1 до 50. По второму варианту молекула полимерного носителя имеет формулу (Ia)

где а+b=n, где n имеет значение 1, 2, 3, 4 или 5 до 10; а означает целое число, выбранное независимо от целого числа b из диапазона от 1 до 50, b означает целое число, выбранное независимо от целого числа а из диапазона от 1 до 50. Отдельные компоненты [S-P2-S] и [S-(AA)x-S] присутствуют в каком-либо порядке в подформуле {[S-P2-S]a[S-(AA)x-S]b}. Комплекс полимерного носителя с грузом сформирован молекулой полимерного носителя и нуклеиновой кислотой. Фармацевтическая композиция и вакцина включает комплекс полимерного носителя с грузом и необязательно фармацевтически приемлемый носитель и/или растворитель. Молекулы полимерного носителя и комплекс полимерного носителя с грузом применяют в качестве лекарственного средства для лечения различных заболеваний. Изобретение позволяет получить стабильный полимерный носитель, который позволяет эффективно осуществлять трансфекцию нуклеиновых кислот в клетки in vivo и in vitro. 8 н. и 12 з.п. ф-лы, 16 ил., 2 табл., 4 пр.
1. Молекула полимерного носителя формулы (I)
L-P1-S-[S-P2-S]n-S-P3-L
в которой
компоненты Р1 и Р3 различны или идентичны по отношению друг к другу и представляют линейную или разветвленную цепь гидрофильного полимера полиэтиленгликоля (ПЭГ), причем гидрофильная полимерная цепь обладает молекулярной массой от 1 кДа до 100 кДа,
Р2 является катионным или поликатионным пептидом или белком длиной от 3 до 100 аминокислот, или катионным или поликатионным полимером с молекулярной массой от 0,5 кДа до 30 кДа,
каждый Ρ2 представляет по меньшей мере две -SH-части молекулы, способные формировать дисульфидную связь при конденсации с дополнительными компонентами Р2 или компонентом (компонентами) Ρ1 и/или Ρ3,
-S-S является дисульфидной связью,
L означает необязательный лиганд, который может присутствовать или отсутствовать и может быть выбран независимо от других компонентов из RGD, трансферрина, фолата, сигнального пептида или сигнальной последовательности, сигнала или последовательности ядерной локализации, антитела, проникающего в клетку пептида (ПКП), ТАТ, лиганда рецептора, цитокинов, гормонов, факторов роста, низкомолекулярных соединений, углеводов, маннозы, галактозы, синтетических лигандов, низкомолекулярных агонистов, ингибиторов или антагонистов рецепторов или аналогов RGD-пептидомиметиков: и
n означает целое число, выбранное из диапазона от 1 до 50, предпочтительно из диапазона от 1, 2, 3, 4 или 5 до 10, более предпочтительно из диапазона от 1, 2, 3 или 4 до 9, и где по меньшей мере один дополнительный аминокислотный компонент (АА)x присутствует или отсутствует в полимерной молекуле носителя, причем АА является аминокислотой, а x означает целое число, выбранное из диапазона от 1 до 100, и
если (ΑΑ)x присутствует,
то по меньшей мере один дополнительный аминокислотный компонент (АА)x является линкером между Р1 или Р3 и компонентом L
или
если компонент L отсутствует,
то по меньшей мере один дополнительный аминокислотный компонент (АА)x является частью Ρ1 или Ρ3.
2. Молекула полимерного носителя по п. 1, причем аминокислотный компонент (АА)x включает компонент ароматической аминокислоты, компонент гидрофильной аминокислоты, компонент липофильной аминокислоты, компонент слабоосновной аминокислоты, сигнальный пептид, сигнал или последовательность локализации, сигнал или последовательность ядерной локализации, проникающий в клетку пептид, белок или пептид терапевтического действия, антиген или антигенный эпитоп, раковый антиген, патогенный антиген или аутоиммунный антиген, аллерген, антитело, иммуностимулирующий белок или пептид, или антиген-специфичный Т-клеточный рецептор.
3. Молекула полимерного носителя по п. 2, где патогенный антиген является антигеном животного, вирусным антигеном, антигеном простейшего, бактериальным антигеном или аллергическим антигеном.
4. Молекула полимерного носителя по одному из пп. 1-3, в которой аминокислотный компонент (АА)x содержится в качестве смешанного повторяющегося аминокислотного компонента [(ΑΑ)x]z, где z означает целое число, выбранное из диапазона от 1 до 30.
5. Молекула полимерного носителя формулы (Ia)

где x, z, S, L, АА, Ρ1, Ρ2 и Ρ3 имеют указанные выше значения и
а+b=n,
где n имеет указанное выше значение и выбран предпочтительно из диапазона от 1, 2, 3, 4 или 5 до 10;
а означает целое число, выбранное независимо от целого числа b из диапазона от 1 до 50, предпочтительно из диапазона от 1, 2, 3, 4 или 5 до 10, и
b означает целое число, выбранное независимо от целого числа а из диапазона от 1 до 50, предпочтительно из диапазона от 1, 2, 3, 4 или 5 до 10,
и где отдельные компоненты [S-P2-S] и [S-(AA)x-S] присутствуют в каком-либо порядке в подформуле {[S-P2-S]a[S-(AA)x-S]b}.
6. Молекула полимерного носителя по одному из пп. 1-3, в которой компонент Р2 является катионным или поликатионным пептидом, выбранным из протамина, нуклеолина, спермина или спермидина, поли-L-лизина, основных полипептидов, полиаргинина, проникающих в клетку пептидов (ПКП), химерных ПКП, транспортана, или пептидов MPG, ВИЧ-связывающих пептидов, Tat, ВИЧ-1 Tat (ВИЧ), Tat-производных пептидов, олигоаргининов, представителей семейства пенетратина, пенетратина, Antennapedia-производных пептидов, pAntp, pIsl, антимикробных производных ПКП, буфорина-2, Вас715-24, SynB, SynB(l), pVEC, hCT-производных пептидов, SAP, MAP, KALA, PpTG20, обогащенных пролином пептидов, олигомера, обогащенных аргинином пептидов, кальцитониновых пептидов, FGF, лактоферрина, гистонов, VP22-производных пептидов или аналогов, HSV, VP22 (Herpes simplex), MAP, KALA или доменов белковой трансдукции (доменов PTD, РрТ620, обогащенных лизином пептидов, Рер-1).
7. Молекула полимерного носителя по одному из пп. 1-3, в которой -SH-часть молекулы компонента (компонентов) Р2 представлена цистеином.
8. Молекула полимерного носителя по п. 7, где компонент Р2 имеет последовательность CysHis6Arg4His6Cys.
9. Молекула полимерного носителя по п. 7, в которой компонент Р2 выбран из пептида, включая катионный пептид формулы (IIб)
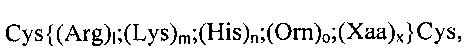
где
l+m+n+o+x=8-15, и l, m, n или о независимо друг от друга могут быть каким-либо числом, выбранным из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn представляет по меньшей мере 10% от всех аминокислот олигопептида; и Хаа может быть какой-либо аминокислотой, выбранной из нативных или измененных аминокислот, за исключением Arg, Lys, His или Orn; и x может быть каким-либо числом, выбранным из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14, при условии, что общее содержание Хаа не превышает 90% от всех аминокислот олигопептида.
10. Комплекс полимерного носителя с грузом, сформированный молекулой полимерного носителя по одному из пп. 1-3 и нуклеиновой кислотой.
11. Комплекс полимерного носителя с грузом по п.10, в котором нуклеиновая кислота предусмотрена в мольном соотношении от 5 до 10000 молекул полимерного носителя: нуклеиновой кислоты.
12. Комплекс полимерного носителя с грузом по п. 10, в котором нуклеиновой кислотой является ДНК или РНК, кодирующая нуклеиновая кислота, кодирующая ДНК, кодирующая РНК, кодирующая иРНК, малая интерферирующая РНК (миРНК), иммуностимулирующая нуклеиновая кислота, иммуностимулирующая нуклеиновая кислота CpG или иммуностимулирующая РНК (исРНК).
13. Комплекс полимерного носителя с грузом по п. 10, в котором нуклеиновая кислота кодирует белок или пептид терапевтического действия, антиген, включая опухолевые антигены, патогенные антигены, антигены животных, вирусные антигены, протозойные антигены, бактериальные антигены, аллергические антигены, аутоиммунные антигены, аллергены, антитела, иммуностимулирующие белки и пептиды или антиген-специфические рецепторы Т-клеток.
14. Способ получения молекулы полимерного носителя, описанной в одном из пп. 1-9, включающий следующие стадии:
а) обеспечения по меньшей мере одного катионного или поликатионного белка или пептида в качестве компонента Р2, определенного в настоящем изобретении, и/или по меньшей мере одного катионного или поликатионного полимера в качестве компонента Р2, по определению в одном из пп. 1-9, и необязательно по меньшей мере одного компонента (АА)x, перемешивания этих компонентов, предпочтительно в щелочной среде, предпочтительно в присутствии кислорода или дополнительного стартера, что приводит к мягким окислительным условиям, и тем самым конденсируя, и таким образом полимеризуя эти компоненты друг с другом через дисульфидные связи при полимеризующей конденсации или поликонденсации для получения повторяющегося компонента H-[S-P2-S]n-H или H{[S-P2-S]a[S-(AA)x-S]b}H;
б) обеспечения гидрофильного полимера Ρ1 и/или Ρ3, как определено в одном из пп. 1-9, необязательно модифицированных лигандом L и/или аминокислотным компонентом (АА)x, определенных в одном из пп. 1-9;
в) смешивания гидрофильного полимера Р1 и/или Р3 со стадии б) с повторяющимся компонентом H-[S-P2-S]n-H или H{[S-P2-S]a[S-(AA)x-S]b}H, полученным на стадии а), в соотношении примерно от 2:1 и посредством этого типичного прекращения реакции полимеризующей конденсации или поликонденсации и получения обладающей признаками изобретения молекулы полимерного носителя формулы (I) или (Ia);
г) необязательной очистки молекулы полимерного носителя, полученного на стадии в).
15. Фармацевтическая композиция, включающая комплекс полимерного носителя с грузом по одному из пп. 10-13 и необязательно фармацевтически приемлемый носитель и/или растворитель.
16. Вакцина, включающая комплекс полимерного носителя с грузом по одному из пп. 10-13 и необязательно фармацевтически приемлемый носитель и/или растворитель.
17. Молекула полимерного носителя по одному из пп. 1-3 для применения в качестве лекарственного средства.
18. Комплекс полимерного носителя с грузом по одному из пп. 10-13 для применения в качестве лекарственного средства.
19. Молекула полимерного носителя по одному из пп. 1-3 с нуклеиновой кислотой, согласно описанному в одном из пп. 10-13, для применения в профилактике, лечении и/или облегчении заболеваний, выбранных из раковых или опухолевых заболеваний, инфекционных заболеваний, предпочтительно (вирусных, бактериальных или протозойных) инфекционных заболеваний, аутоиммунных заболеваний, аллергий или аллергических заболеваний, моногенетических заболеваний, т.е. (наследственных) заболеваний, или генетических заболеваний в целом, заболеваний с генетически наследуемой средой, которые обычно вызваны определенным генным дефектом и наследуются по законам Менделя, сердечно-сосудистых заболеваний, нервных заболеваний, заболеваний дыхательной системы, заболеваний пищеварительной системы, заболеваний кожи, костно-мышечных расстройств, заболеваний соединительной ткани, новообразований, иммунного дефицита, эндокринных, пищевых и обменных заболеваний, заболеваний глаз и заболеваний ушей.
20. Комплекс полимерного носителя с грузом по одному из пп. 10-13 для применения в профилактике, лечении и/или облегчении заболеваний, выбранных из раковых или опухолевых заболеваний, инфекционных заболеваний, предпочтительно (вирусных, бактериальных или протозойных) инфекционных заболеваний, аутоиммунных заболеваний, аллергий или аллергических заболеваний, моногенетических заболеваний, т.е. (наследственных) заболеваний, или генетических заболеваний в целом, заболеваний с генетически наследуемой средой, которые обычно вызваны определенным генным дефектом и наследуются по законам Менделя, сердечно-сосудистых заболеваний, нервных заболеваний, заболеваний дыхательной системы, заболеваний пищеварительной системы, заболеваний кожи, костно-мышечных расстройств, заболеваний соединительной ткани, новообразований, иммунного дефицита, эндокринных, пищевых и обменных заболеваний, заболеваний глаз и заболеваний ушей.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Seiji Takae et | |||
| al | |||
| PEG-detachable polyplex micelles based on disulfide-linked block catiomers as bioresponsive nonviral gene vectors | |||
| J | |||
| Am.Chem.Soc., 2008, v | |||
| Реверсивный дисковый культиватор для тросовой тяги | 1923 |
|
SU130A1 |
| ПЛИТА С ДУХОВЫМ ШКАФОМ, ОБСЛУЖИВАЕМАЯ ПРИМУСОМ | 1927 |
|
SU6001A1 |
| David Oupicky et | |||
| al | |||
| Laterally stabilized complexes of DNA with linear reducible polycations: strategy for triggered intracellular | |||
Авторы
Даты
2015-06-10—Публикация
2010-09-03—Подача