Настоящее изобретение относится к последовательности мРНК, содержащей кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное. Кроме того, настоящее изобретение относится к композиции, содержащей несколько последовательностей мРНК, содержащих кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное.
Кроме того, описано также применение последовательности мРНК или композиции, содержащей несколько последовательностей мРНК, для приготовления фармацевтической композиции, прежде всего вакцины, например, для применения для профилактики или лечения вызываемых РСВ инфекций. В настоящем изобретении описан также способ лечения или профилактики вызываемых РСВ инфекцией с использованием последовательности мРНК.
Общее медицинское значение и экономическая роль РСВ являются очень большими. Этот вирус является наиболее важным причинным фактором острых инфекций нижней части дыхательных путей (ALRI), приводящих к необходимости посещения медицинских учреждений в период младенчества и раннего детского возраста. Например, в Соединенных Штатах более 60% младенцев заражаются РСВ в течение их первого РСВ-сезона, и практически все заражались к возрасту 2-3 года. В США примерно 2,1 миллиона детей возрастом менее 5 лет каждый год проходят лечение от вызываемого РСВ заболевания: 3% в стационаре, 25% в отделении неотложной помощи и 73% у практикующих педиаторов. В целом, среди детей возрастом менее 5 лет случаи ALRI, вызываемые РСВ, составляют 33,8 миллиона каждый год (более 22% всех случаев ALRI), приводя к 66000-199000 смертям, из которых 99% приходится на развивающиеся страны. RSV является также обычной причиной респираторного заболевания у пожилых людей, приводя к такому же количеству госпитализаций, что и грипп в популяции, интенсивно иммунизированной против гриппа. РСВ распространяется воздушно-капельным путем и путем непосредственного контакта с инфицированными людьми или загрязненными предметами. В умеренном климате существуют ежегодные зимние эпидемии. Младенцы имеют наиболее высокий риск серьезного связанного с РСВ заболевания в течение первых 6 месяцев их жизни, и пики госпитализации приходятся на 2-3-месячный возраст. Преждевременные роды и наличие сердечно-легочного заболевания являются факторами риска серьезного связанного с РСВ заболевания. Заражение РСВ младенцев вызывает частичный защитный иммунитет, который, вероятно, снижается быстрее, чем иммунитет против большинства других респираторных вирусов. Большинство младенцев, зараженных РСВ в течение первого года их жизни, повторно инфицируются на следующий год, что, как правило, приводит к менее серьезному заболеванию. Повторяющиеся заражения продолжаются в течение всей жизни, часто с проявлением симптомов в верхней части дыхательных путей, а иногда с вовлечением более низкой части дыхательных путей и синуса. Рекомендованные для лечения РСВ бронхолитические средства обеспечивают в основном поддержание дыхания и гидратацию. Отсутствуют рекомендации по осуществлению какой-либо специфической противовирусной терапии. Для профилактики младенцев с наиболее высоким риском серьезной инфекции применяют нейтрализующее моноклональное антитело паливизумаб, но оно является слишком дорогим и непригодным для универсального практического применения. В настоящее время отсутствует лицензированная вакцина против РСВ, и создание безопасной и эффективной вакцины против РСВ является общей приоритетной задачей здравоохранения.
При испытании вакцины в 1960-ых годах младенцев и детей младшего возраста иммунизировали препаратом инактивированного формалином (FI) полного вириона РСВ (FI-PCB) или эквивалентным препаратом на основе парамиксовируса (FI-PIV). Пять процентов индивидуумов, которых иммунизировали FI-PIV и которые затем в течение следующего сезона РСВ заражались встречающимся в естественных условиях РСВ, были госпитализированы; 80% индивидуумов, которых иммунизировали FI-PCB, и которые затем заражались РСВ, были госпитализированы, а два ребенка умерли. Указанное усиление вызываемой РСВ инфекции в результате вакцинации представляет собой конкретную проблему при разработке вакцин против вызываемых РСВ инфекций (см. обзор Shaw и др., Curr Opin Virol. 3(3), июнь 2013 г., сс. 332-342. doi: 10.1016/j.coviro.2013.05.003. Epub 30 мая 2013 г.).
Таким образом, самой большой нерешенной проблемой, связанной с вызываемыми респираторно-синцитиальным вирусом (РСВ) инфекциями у детей в развитых странах, остается разработка вакцины для младенцев, важным является также отсутствие вакцины для младенцев во всех мире. Более чем 40-летние усилия пока не дали результатов и не привели к разработке лицензированной вакцины против РСВ для людей.
В целом, следует отметить, что РСВ, который принадлежит к вирусам семейства Paramyxoviridae, является одним из наиболее контагиозных патогенов и вносит значительный вклад в серьезные инфекции дыхательных путей у младенцев, пожилых людей и пациентов с ослабленным иммунитетом.
Как указано выше, в настоящее время на рынке имеется гуманизированное моноклональное антитело к белку F вирусной поверхности, которое представляет собой единственный профилактический продукт, рекомендованный для младенцев, которые относятся к группе высокого риска, включая преждевременно родившихся младенцев и младенцев с хроническим легочным заболеванием (The IMpact-RSV Study Group. Palivizumab, a Humanized Respiratory Syncytial Virus Monoclonal Antibody, Reduces Hospitalization From Respiratory Syncytial Virus Infection in High-risk Infants. Pediatrics, 102(3), 1998, cc. 531-537, Tablan и др., Guidelines for preventing health-care--associated pneumonia, 2003: recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee. MMWR. Recommendations and Reports: Morbidity and Mortality Weekly Report. Recommendations and Reports / Centers for Disease Control, 53(RR-3), 2003, cc. 1-36).
Современные исследования, проведенные на животных моделях, продемонстрировали, что при применении в достаточных количествах нейтрализующие антитела, мишенью которых является F-белок РСВ, ограничивают вирусную репликацию, что приводит к менее серьезному течению болезни (Singh S.R. и др., Immunogenicity and efficacy of recombinant RSV-F vaccine in a mouse model. Vaccine, 25(33), 2007, cc. 6211-6223, Zhan X. и др., Respiratory syncytial virus (RSV) F protein expressed by recombinant Sendai virus elicits B-cell and T-cell responses in cotton rats and confers protection against RSV subtypes A and B. Vaccine, 25(52), 2007, cc. 8782-8793., Vaughan K. и др., DNA immunization against respiratory syncytial virus (RSV) in infant rhesus monkeys. Vaccine, 23(22), 2005, cc. 2928-2942).
Кроме того, удалось установить, что для клиренса вируса и снижения серьезности заболевания требуется сбалансированная функция регуляторных и эффекторных Т-клеток (Liu J. и др., Epitope-specific regulatory CD4 Т cells reduce virus-induced illness while preserving CD8 T-cell effector function at the site of infection. Journal of Virology, 84(20), 2010, cc. 10501-10509).
Помимо указанного выше гуманизированного моноклонального антитела разработана вакцина на основе живого ослабленного вируса, которая вызывает сильный иммунный ответ, но которая не рекомендована для применения на определенных целевых группах (младенцы, дети, пожилые люди и пациенты с ослабленным иммунитетом). Кроме того, ДНК-векторы, экспрессирующие F-белок РСВ, которые несут В-клеточные эпитопы, применяли для индукции производства нейтрализующих антител. В этом контексте в WO 2008/077527 и WO 96/040945 описаны векторы, которые содержат последовательности ДНК, кодирующие F-белок РСВ, предназначенные для применения в качестве вакцин. Однако применение ДНК в качестве вакцины может быть опасным из-за нежелательного встраивания в геном, что может приводить к нарушению функциональных генов и раку или образованию антител к ДНК.
Таким образом, в основу настоящего изобретения положена задача создать последовательность мРНК, кодирующую антигенные пептиды или белки респираторно-синцитиального вируса (РСВ), для применения в качестве вакцины для профилактики или лечения вызываемых РСВ инфекцией, прежде всего у младенцев, пожилых людей и пациентов с ослабленным иммунитетом.
Указанные задачи решаются с помощью объектов изобретения, представленных в прилагаемой формуле изобретения. Задачи, положенные в основу настоящего изобретения решаются, прежде всего, согласно первому объекту изобретения с помощью предлагаемой в изобретении последовательности мРНК, содержащей кодирующую последовательность, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное.
Для целей ясности и удобочитаемости представлены указанные ниже определения. Все технические особенности, упомянутые в этих определениях, могут относиться ко всем до единого вариантам осуществления изобретения. В контексте указанных вариантов осуществления изобретения могут быть специально даны дополнительные определения и пояснения.
Иммунная система: Иммунная система может защищать организмы от инфекции. Если патогену удалось преодолеть физический барьер организма и попасть в указанный организм, то врожденная иммунная система обеспечивает немедленный, но неспецифический ответ. Если патоген ускользает от этого врожденного ответа, у позвоночных имеется второй уровень защиты, представляющий собой адаптивную иммунную систему. В этом случае иммунная система адаптирует свой ответ в процессе инфекции для улучшения распознавания патогена. Затем этот улучшенный ответ сохраняется после элиминации патогена в форме иммунологической памяти и позволяет адаптивной иммунной системе организовывать более быстрые и сильные атаки каждый раз при проникновении указанного патогена. Таким образом, иммунная система включает врожденную и адаптивную иммунную систему. Каждая из этих двух частей, как правило, включает так называемые гуморальный и клеточный компоненты.
Иммунный ответ: Иммунный ответ может, как правило, представлять собой либо специфическую реакцию адаптивной иммунной системы на конкретный антиген (так называемый специфический или адаптивный иммунный ответ), либо неспецифическую реакцию врожденной иммунной системы (так называемый неспецифический или врожденный иммунный ответ). Изобретение относится, прежде всего, к специфическим реакциям (адаптивные иммунные ответы) адаптивной иммунной системы. В частности, оно относится к адаптивным иммунным ответам на инфекции, вызываемые вирусами, например, такие, как вызываемые РСВ инфекции. Однако указанная специфическая реакция может поддерживаться дополнительной неспецифической реакцией (врожденный иммунный ответ). Таким образом, изобретение относится также к соединению, предназначенному для одновременной стимуляции врожденной и адаптивной иммунной системы для инициации эффективного адаптивного иммунного ответа.
Адаптивная иммунная система: Адаптивная иммунная система состоит из высокоспециализированных системных клеток и процессов, которые элиминируют или предупреждают рост патогенов. Адаптивная иммунная система придает иммунной системе позвоночных способность распознавать и запоминать специфические патогены (для создания иммунитета) и организовывать более сильную атаку в каждом случае при обнаружении патогена. Система обладает высокой способностью к адаптации вследствие соматической гипермутации (процесс ускоренных соматических мутаций) и V(D)J-рекомбинации (необратимая генетическая рекомбинация сегментов гена рецептора антигена). Этот механизм позволяет небольшому количеству генов создавать огромное количество различных рецепторов антигенов, которые затем уникальным образом экспрессируются на каждом индивидуальном лимфоците. Поскольку перестройка гена приводит к необратимому изменению ДНК каждой клетки, то все потомство такой клетки должно затем наследовать гены, кодирующие ту же самую рецепторную специфичность, включая В-клетки памяти и Т-клетки памяти, которые имеют решающее значение для долговременного специфического иммунитета. Теория иммунной сети представляет собой теорию, описывающую работу адаптивной иммунной системы, которая базируется на взаимодействиях между вариабельными областями рецепторов Т-клеток, В-клеток и молекул, образованных Т-клетками и В-клетками, которые имеют вариабельные области.
Адаптивный иммунный ответ: Как правило, под адаптивным иммунным ответом понимают антигенспецифический ответ иммунной системы. Специфичность в отношении антигена позволяет вырабатывать ответы, приспособленные к специфическим антигенам, патогенам или инфицированным патогеном клеткам. Способность создавать такие приспособленные ответы, как правило, поддерживается в организме «клетками памяти». Если патоген инфицирует организм более одного раза, то указанные специфические клетки памяти используются для его быстрой элиминации. В этом контексте первая стадия адаптивного иммунного ответа представляет собой активацию наивных антигенспецифических Т-клеток или различных иммунных клеток, способных индуцировать антигенспецифический иммунный ответ, антигенпрезентирующими клетками. Это происходит в лимфоидных тканях и органах, через которые постоянно проходят наивные Т-клетки. К типам клеток, которые могут служить в качестве антигенпрезентирующих клеток, относятся, среди прочего, дендритные клетки, макрофаги и В-клетки. Каждая из указанных клеток выполняет отдельную функцию при вызывании иммунных ответов. Дендритные клетки могут поглощать антигены посредством фагоцитоза и макропиноцитоза, и они могут стимулироваться при контакте, например, с чужим антигеном, к миграции в местную лимфоидную ткань, где может происходить их дифференцировка в зрелые дендритные клетки. Макрофаги поглощают находящиеся в форме частиц антигены, такие как бактерии, и могут индуцироваться инфекционными агентами или другими соответствующими стимулами и экспрессировать в результате этого молекулы ГКГС. Уникальная способность В-клеток к связыванию и интернализации растворимых белковых антигенов посредством своих рецепторов также может иметь важное значение для индукции Т-клеток. ГКГС-молекулы, как правило, ответственны за презентацию антигена Т-клеткам. При этом презентация антигена на молекулах ГКГС приводит к активации Т-клеток, что индуцирует их пролиферацию и дифференцировку в «вооруженные» эффекторные Т-клетки. Наиболее важной функцией эффекторных Т-клеток является уничтожение инфицированных клеток цитотоксическими CD8+-Т-клетками и активация макрофагов Th1-клетками, что в совокупности создает опосредованный клетками (клеточный) иммунитет, и активация В-клеток и Th2-, и Th1-клетками, приводящая к образованию различных классов антител, в результате чего создается гуморальный иммунный ответ. Т-клетки распознают антиген посредством своих Т-клеточных рецепторов, которые не распознают антиген и не связываются с ним непосредственно, но вместо этого распознают короткие пептидные фрагменты, например, происходящих из патогена белковых антигенов, которые связываются с молекулами ГКГС на поверхностях других клеток.
Клеточный иммунитет/клеточный иммунный ответ: Клеточный иммунитет относится, как правило, к активации макрофагов, естественных клеток-киллеров (NK), антигенспецифических цитотоксических Т-лимфоцитов и высвобождению различных цитокинов в ответ на антиген. В более общем смысле клеточный иммунитет основан не на антителах, а на активации клеток иммунной системы. Как правило, клеточный иммунный ответ может характеризоваться, например, активацией антигенспецифических цитотоксических Т-лимфоцитов, которые способны индуцировать апоптоз клеток организма, экспонирующих эпитопы антигенов на своей поверхности, таких как инфицированные вирусом клетки, клетки с внутриклеточными бактериями или раковые клетки, экспонирующие опухолевые антигены; активацией макрофагов и естественных клеток-киллеров, позволяющей им разрушать патогены; и стимуляцией клеток к секреции различных цитокинов, которые влияют на функцию других клеток, участвующих в адаптивных иммунных ответах и врожденных иммунных ответах.
Гуморальный иммунитет/гуморальный иммунный ответ: Гуморальный иммунитет, как правило, относится к производству антител и необязательно к второстепенным процессам, которые могут сопровождать его. Гуморальный иммунный ответ, как правило, может характеризоваться, например, активацией Th2 и производством цитокинов, образованием зародышевого центра и переключением изотипа, созреванием аффинности и образованием клеток памяти. Гуморальный иммунитет, как правило, может относиться также к эффекторным функциям антител, включая нейтрализацию патогенов и токсинов, классическую активацию комплемента и стимулирование опсонинами фагоцитоза и элиминации патогенов.
Врожденная иммунная система: Врожденная иммунная система, которую называют также неспецифической иммунной системой, как правило, включает клетки и механизмы, которые неспецифически защищают хозяина от заражения другими организмами. Это означает, что клетки врожденной системы могут распознавать патогены и реагировать на них обычным путем, но, в отличие от адаптивной иммунной системы, она не обеспечивает долговременный или защитный иммунитет хозяину. Врожденная иммунная система может, например, активироваться лигандами патоген-ассоциированных распознающих молекулярные паттерны (РАМР) рецепторов, например, Толл-подобных рецепторов (TLR), или другими вспомогательными субстанциями, такими как липополисахариды, TNF-альфа, лиганд CD40 или цитокины, монокины, лимфокины, интерлейкины или хемокины, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, IFN-альфа, IFN-бета, IFN-гамма, GM-CSF, G-CSF, M-CSF, LT-бета, TNF-альфа, факторы роста и hGH, лиганд человеческого Толл-подобного рецептора TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, лиганд мышиного Толл-подобного рецептора TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13, лиганд NOD-подобного рецептора, лиганд RIG-I-подобного рецептора, иммуностимулирующая нуклеиновая кислота, иммуностимулирующая РНК (isPHK), CpG-ДНК, антибактериальный агент или противовирусный агент. Как правило, ответ врожденной иммунной системы включает рекрутинг иммунных клеток к областям заражения посредством производства химических факторов, включая специализированные химические медиаторы, которые называют цитокинами; активацию каскада комплемента; идентификацию и удаление чужих субстанций, присутствующих в органах, тканях, крови и лимфе, специализированными лейкоцитами; активацию адаптивной иммунной системы посредством процесса, известного как презентация антигена; и/или функционирование в качестве физического и химического барьера для инфекционных агентов.
Адъювант/адъювантный компонент: Адъювант или адъювантный компонент в наиболее широком смысле, как правило, представляет собой (например, фармакологический или иммунологический) агент или композицию, который/которая может модифицировать, например, усиливать, действие других агентов, таких как лекарственное средство или вакцина. Как правило, понятие в контексте изобретения относится к соединению или композиции, которое/которая служит в качестве носителя или вспомогательной субстанции для иммуногенов и/или других фармацевтических действующих веществ. Это понятие следует рассматривать в широком смысле, и оно относится к широкому спектру субстанций, которые могут повышать иммуногенность антигенов, включенных или вводимых совместно с рассматриваемым адъювантом. В контексте настоящего изобретения адъювант предпочтительно должен повышать специфический иммунногенный ответ действующих веществ, предлагаемых в настоящем изобретении. Как правило, «адъювант» или «адъювантный компонент» имеют одинаковое значение и их можно применять одновременно. Адъюванты можно подразделять, например, на вещества, усиливающие иммунный ответ, системы для введения антигенов или даже их комбинации.
Как правило, считается, что понятие «адъювант» не относится к агентам, которые сами обусловливают иммунитет. Адъюванты помогают иммунной системе неспецифически усиливать антигенспецифический иммунный ответ, например, путем повышения презентации антигена иммунной системе или индукции неспецифического врожденного иммунного ответа. Кроме того, адъювант может предпочтительно, например, модулировать антигенспецифический иммунный ответ путем сдвига, например, доминирующего антигенспецифического ответа на основе Th2 в сторону более антигенспецифического ответа на основе Th1 или наоборот. Таким образом, адъювант может успешно модулировать экспрессию/секрецию цитокинов, презентацию антигена, тип иммунного ответа и т.д.
Иммуностимулирующая РНК: Иммуностимулирующая РНК (isPHK) в контексте изобретения, как правило, может представлять собой РНК, которая обладает способностью индуцировать врожденный иммунный ответ. Обычно она не имеет открытой рамки считывания и, таким образом, не кодирует пептид-антиген или иммуноген, но вызывает врожденный иммунный ответ, например, посредством связывания со специфическим типом Толл-подобного рецептора (TLR) или другими приемлемыми рецепторами. Однако, очевидно, что и мРНК, имеющие открытую рамку считывания и кодирующие пептид/белок (например, антигенную функцию), также могут индуцировать врожденный иммунный ответ.
Антиген: В контексте настоящего изобретения понятие «антиген» относится, как правило, к субстанции, которая может распознаваться иммунной системой и которая обладает способностью запускать антигенспецифический иммунный ответ, например, посредством образования антител и/или антигенспецифических Т-клеток, в качестве компонента адаптивного иммунного ответа. Антиген может представлять собой белок или пептид. В этом контексте первая стадия адаптивного иммунного ответа представляет собой активацию наивных антигенспецифических Т-клеток антигенпрезентирующими клетками. Это происходит в лимфоидных тканях и органах, через которые постоянно проходят наивные Т-клетки. Три типа клеток, которые могут служить в качестве антигенпрезентирующих клеток, представляют собой дендритные клетки, макрофаги и В-клетки. Каждая из указанных клеток выполняет отдельную функцию при вызывании иммунных ответов. Присутствующие в ткани дендритные клетки поглощают антигены посредством фагоцитоза и макропиноцитоза, и они могут стимулироваться инфекцией к миграции в местную лимфоидную ткань, где может происходить их дифференцировка в зрелые дендритные клетки. Макрофаги поглощают находящиеся в форме частиц антигены, такие как бактерии, и индуцируются инфекционными агентами к экспрессии молекул ГКГС класса II. Уникальная способность В-клеток к связыванию и интернализации растворимых белковых антигенов посредством своих рецепторов также может иметь важное значение для индукции Т-клеток. Презентация антигена на молекулах ГКГС приводит к активации Т-клеток, что индуцирует их пролиферацию и дифференцировку в «вооруженные» эффекторные Т-клетки. Наиболее важной функцией эффекторных Т-клеток является уничтожение инфицированных клеток цитотоксическими CD8+-T-клетками и активация макрофагов ТН1-клетками, что в совокупности создает опосредованный клетками (клеточный) иммунитет, и активация В-клеток и ТН-2, и ТН1-клетками приводит к образованию различных классов антител, в результате чего создается гуморальный иммунный ответ. Т-клетки распознают антиген посредством своих Т-клеточных рецепторов, которые не распознают антиген и не связываются с ним непосредственно, но вместо этого распознают короткие пептидные фрагменты, например, происходящих из патогена белковых антигенов, которые связываются с молекулами ГКГС на поверхностях других клеток.
Т-клетки подразделяют на два основных класса, которые обладают различными эффекторными функциями. Два класса различаются по экспрессии расположенных на клеточной поверхности белков CD4 и CD8. Эти два типа Т-клеток отличаются по распознаваемому ими классу молекул ГКГС. Известно два класса молекул ГКГС, а именно, молекулы ГКГС класса I и ГКГС класса II, которые отличаются по их структуре и схеме экспрессии в тканях организма. CD4+-Т-клетки связываются с молекулой ГКГС класса II, а CD8+-Т-клетки с молекулой ГКГС класса I. Молекулы ГКГС класса I и ГКГС класса II имеют разное распределение среди клеток, что отражает различные эффекторные функции Т-клеток, которые их распознают. Молекулы ГКГС класса I презентуют пептиды цитозольного и ядерного происхождения, например, из патогенов, прежде всего вирусов, CD8+-Т-клеткам, которые дифференцируются в цитотоксичные Т-клетки, специализирующиеся в уничтожении любой клетки, которую они специфически распознают. Почти все клетки экспрессируют молекулы ГКГС класса I, хотя уровень конститутивной экспрессии варьируется от одного типа клеток к другому. Но молекулами ГКГС класса I презентуются не только патогенные пептиды из вирусов, ими презентуются также аутоантигены типа опухолевых антигенов. Молекулы ГКГС класса I связывают пептиды из белков, расщепляемых в цитозоле, и транспортируют в эндоплазматический ретикулум. CD8+-Т-клетки, которые распознают комплексы: ГКГС класса I : пептид на поверхности инфицированных клеток, специализируются в уничтожении любых клеток, презентирующих чужеродные пептиды и тем самым избавляют организм от клеток, зараженных вирусами и другими цитозольными патогенами. Основной функцией CD4+-Т-клеток (CD4+-Т-клеток-хелперов), которые распознают молекулы ГКГС класса II, является активация других эффекторных клеток иммунной системы. При этом молекулы ГКГС класса II в норме присутствуют на В-лимфоцитах, дендритных клетках и макрофагах, т.е. клетках, которые принимают участие в иммунных ответах, но отсутствуют на других типах клеток тканей. Макрофаги, например, обладают активностью в отношении уничтожения интравезикулярных патогенов, которых они несут, а В-клетки секретируют иммуноглобулины против чужеродных молекул. Молекулы ГКГС класса II не могут связываться с пептидами в эндоплазматическом ретикулуме, и при этом молекулы ГКГС класса II связывают пептиды из белков, расщепляемых в эндосомах. Они могут захватывать пептиды из патогенов, которые проникли в везикулярную систему макрофагов, или из антигенов, интернализованных незрелыми дендритными клетками, или иммуноглобулиновыми рецепторами В-клеток. Патогены, которые накапливаются в больших количествах внутри пузырьков макрофагов и дендритных клеток, имеют тенденцию стимулировать дифференцировку ТН1-клеток, в то время как внеклеточные антигены имеют тенденцию стимулировать производство ТН2-клеток. ТН1-клетки активируют бактерицидные свойства макрофагов и индуцируют производство В-клетками антител типа IgG, которые являются очень эффективными в отношении опсонизации внеклеточных патогенов, что приводит к их поглощению фагоцитами, в то время как ТН2-клетки инициируют гуморальный ответ, активируя секрецию IgM наивными В-клетками, и индуцируют производство обладающих слабой опсонизирующей способностью антител, таких как IgG1 и IgG3 (мышиные) и IgG2 и IgG4 (человеческие), а также IgA и IgE (мышиные и человеческие).
Эпитоп (который называют также «антигенной детерминантой»): В контексте настоящего изобретения Т-клеточные эпитопы или части белков могут содержать фрагменты, предпочтительно имеющие длину от примерно 6 до примерно 20 аминокислот или даже более, например, фрагменты, процессируемые и презентируемые молекулами ГКГС класса I, предпочтительно имеют длину от примерно 8 до примерно 10 аминокислот, например, 8, 9 или 10, (или даже 11 или 12 аминокислот), или фрагменты, процессируемые и презентируемые молекулами ГКГС класса II, предпочтительно имеют длину примерно 13 аминокислот или более, например, 13, 14, 15, 16, 17, 18, 19, 20 или даже большее количество аминокислот, при этом указанные фрагменты можно выбирать из любой части аминокислотной последовательности. Указанные фрагменты, как правило, распознаются Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекулы ГКГС.
В-клеточные эпитопы, как правило, представляют собой фрагменты, локализованные на внешней поверхности (нативных) белковых или пептидных антигенов, указанных в настоящем описании, предпочтительно состоящих из 5-15 аминокислот, более предпочтительно состоящих из 5-12 аминокислот, еще более предпочтительно состоящих из 6-9 аминокислот, которые могут распознаваться антителами, т.е. в их нативной форме.
Такие эпитопы белков или пептидов можно, кроме того, выбирать из любых указанных вариантов таких белков или пептидов. В этом контексте антигенные детерминанты могут представлять собой конформационные или прерывистые эпитопы, состоящие из сегментов указанных в настоящем описании белков или пептидов, которые расположены с перерывами в аминокислотной последовательности белков или пептидов, указанных в настоящем описании, но которые находятся вблизи друг от друга в трехмерной структуре, или непрерывные или линейные эпитопы, состоящие из одной полипептидной цепи.
Вакцина: Под вакциной, как правило, понимают предназначенный для профилактики или терапии продукт, содержащий по меньшей мере один антиген или антигенную функцию. Антиген или антигенная функция может стимулировать адаптивную иммунную систему организма вырабатывать адаптивный иммунный ответ.
Образующая антиген мРНК: Образующая антиген мРНК в контексте изобретения может, как правило, представлять собой мРНК, имеющую по меньшей мере одну открытую рамку считывания, которая может транслироваться клеткой или организмом, образованной/образованным указанной мРНК. Продуктом указанной трансляции является пептид или белок, который может действовать в качестве антигена, предпочтительно иммуногена. Продукт может представлять собой также слитый белок, состоящий более чем из одного иммуногена, например, слитый белок, который состоит из двух или большего количества эпитопов, пептидов или белков, происходящих из одинаковых или различных вирусных белков, при этом эпитопы, пептиды или белки могут быть связаны линкерными последовательностями.
Би-/полицистронная мРНК: мРНК, как правило, может иметь две (бицистронная) или большее количество (полицистронная) открытых рамок считывания (ОРС). В этом контексте открытая рамка считывания представляет собой последовательность, состоящую из нескольких нуклеотидных триплетов (кодонов), которые могут транслироваться в пептид или белок. Трансляция указанной мРНК приводит к образованию двух (бицистронная мРНК) или большего количества (полицистронная мРНК) различных продуктов трансляции (при условии, что ОРС не являются идентичными). Для экспрессии в эукариотических организмах указанные мРНК могут, например, содержать последовательность участка внутренней посадки (связывания) рибосомы (IRES).
Структура 5'-кэпа: 5'-кэп, как правило, представляет собой модифицированный нуклеотид, прежде всего гуаниновый нуклеотид, добавленный к 5'-концу молекулы мРНК. Предпочтительно 5'-кэп добавляют, используя 5'-5'-трифосфатную связь (его обозначают также как m7GpppN).
Другими примерами структур 5'-кэпа являются глицерил, инвертированная дезоксигруппа (фрагмент), лишенная азотистого основания, 4',5'-метиленовой нуклеотид, 1-(бета-D-эритрофуранозильный)нуклеотид, 4'-тионуклеотид, карбоциклический нуклеотид, 1,5-ангидрогекситольный нуклеотид, L-нуклеотиды, альфа-нуклеотид, нуклеотид с модифицированным основанием, треопентофуранозильный нуклеотид, ациклический 3',4'-секонуклеотид, ациклический 3,4-дигидроксибутильный нуклеотид, ациклический 3,5-дигидроксипентильный нуклеотид, 3'-3'-инвертированный нуклеотидный фрагмент, 3'-3'-инвертированный лишенный азотистого основания фрагмент, 3'-2'-инвертированный нуклеотидный фрагмент, 3'-2'-инвертированный лишенный азотистого основания фрагмент, 1,4-бутандиолфосфатный, 3'-фосфороамидатный, гексилфосфатный, аминогексилфосфатный, 3'-фосфатный, 3'-фосфоротиоатный, фосфородитиоатный или связанный мостиком или несвязанный мостиком метилфосфонатный фрагмент. Указанные модифицированные структуры 5'-кэпа в контексте настоящего изобретения можно применять для модификации последовательности мРНК, предлагаемой в настоящем изобретении. Другие модифицированные структуры 5' кэпа, которые можно применять в контексте настоящего изобретения, представляют собой САР1 (метилирование рибозы соседнего с m7GpppN нуклеотида), САР2 (метилирование рибозы 2-ого нуклеотида, расположенного по ходу транскрипции относительно m7GpppN), САР3 (метилирование рибозы 3-его нуклеотида, расположенного по ходу транскрипции относительное m7GpppN), САР4 (метилирование рибозы 4-ого нуклеотида, расположенного по ходу транскрипции относительно m7GpppN), ARCA (аналог кэп-структуры с правильной ориентацией, модифицированный ARCA (например, модифицированный фосфотиоатом ARCA), инозин, N1-метилгуанозин, 2'-фторгуанозин, 7-деазагуанозин, 8-оксогуанозин, 2-аминогуанозин, ЗНК-гуанозин и 2-азидогуанозин.
Фрагменты белков: «Фрагменты» белков или пептидов в контексте настоящего изобретения могут, как правило, содержать последовательность белка или пептида, указанного в настоящем описании, которая касательно ее аминокислотной последовательности (или кодирующей ее молекулы нуклеиновой кислоты) укорочена на N-конце и/или С-конце по сравнению с аминокислотной последовательностью исходного (нативного) белка (или кодирующей ее молекулой нуклеиновой кислоты). Таким образом, указанное укорочение может иметь место либо на аминокислотном уровне или соответственно на уровне нуклеиновой кислоты. Таким образом, понятие «идентичность последовательности» касательно такого указанного в настоящем описании фрагмента может предпочтительно относиться к полному белку или пептиду, указанному в настоящем описании, или к полной (кодирующей) молекуле нуклеиновой кислоты указанного белка или пептида.
Кроме того, фрагменты белков или пептидов в контексте настоящего изобретения могут содержать последовательность белка или пептида, указанного в настоящем описании, которая состоит, например, по меньшей мере из 5 аминокислот, предпочтительно по меньшей мере из 6 аминокислот, предпочтительно по меньшей мере из 7 аминокислот, более предпочтительно по меньшей мере из 8 аминокислот, еще более предпочтительно по меньшей мере из 9 аминокислот, еще более предпочтительно по меньшей мере из 10 аминокислот, еще более предпочтительно по меньшей мере из 11 аминокислот, еще более предпочтительно по меньшей мере из 12 аминокислот, еще более предпочтительно по меньшей мере из 13 аминокислот, еще более предпочтительно по меньшей мере из 14 аминокислот, еще более предпочтительно по меньшей мере из 15 аминокислот, еще более предпочтительно по меньшей мере из 16 аминокислот, еще более предпочтительно по меньшей мере из 17 аминокислот, еще более предпочтительно по меньшей мере из 18 аминокислот, еще более предпочтительно по меньшей мере из 19 аминокислот, еще более предпочтительно по меньшей мере из 20 аминокислот, еще более предпочтительно по меньшей мере из 25 аминокислот, еще более предпочтительно по меньшей мере из 30 аминокислот, еще более предпочтительно по меньшей мере из 35 аминокислот, еще более предпочтительно по меньшей мере из 50 или наиболее предпочтительно по меньшей мере из 100 аминокислот. Например, указанный фрагмент может состоять из от примерно 6 до примерно 20 или даже более аминокислот, например, фрагменты, которые процессируются и презентуются молекулами ГКГС класса I, предпочтительно имеют от примерно 8 до примерно 10 аминокислот, например, 8, 9 или 10, (или даже 6, 7, 11 или 12 аминокислот), или фрагменты, которые процессируются и презентуются молекулами ГКГС класса II, предпочтительно имеют примерно 13 аминокислот или более, например, 13, 14, 15, 16, 17, 18, 19, 20 или даже большее количество аминокислот, при этом указанные фрагменты можно выбирать из любой части аминокислотной последовательности. Указанные фрагменты, как правило, распознаются Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекулы ГКГС, т.е. фрагменты, как правило, не распознаются в их нативной форме. Фрагменты белков или пептидов могут содержать по меньшей мере один эпитоп указанных белков или пептидов. Кроме того, под фрагментами белка можно понимать также домены белка, типа внеклеточного домена, внутриклеточного домена или трансмембранного домена, и укороченные или усеченные версии белка.
Варианты белков: Как следует из контекста настоящего изобретения, можно создавать «варианты» белков или пептидов, имеющие аминокислотную последовательность, которая отличается от исходной последовательности наличием одной или большего количества мутации(й), например, замен, инсерций и/или делеций одной или большего количества аминокислот. Предпочтительно указанные фрагменты и/или варианты обладают той же самой биологической функцией или специфической активностью, что и полноразмерный нативный белок, например, присущей ему специфической антигенной характеристикой. Как следует из контекста настоящего изобретения, «варианты» белков или пептидов, могут содержать консервативную(ые) аминокислотную(ые) замену(ы) по сравнению с их нативной, т.е. не подвергнутой мутации физиологической последовательностью. Такие аминокислотные последовательности, а также, в частности, кодирующие их нуклеотидные последовательности, подпадают под указанное в настоящем описании понятие «варианты». Замены, при которых заменяют друг на друга аминокислоты, относящиеся к одному и тому же классу, называют консервативными заменами. В частности, такими классами являются аминокислоты, имеющие алифатические боковые цепи, положительно или отрицательно заряженные боковые цепи, ароматические группы в боковых цепях, или аминокислоты, боковые цепи которых могут входить в водородные мостики, например, боковые цепи которых несут гидроксильную функцию. Это означает, например, что аминокислоту, имеющую полярную боковую цепь, заменяют на другую аминокислоту, также имеющую полярную боковую цепь, или, например, аминокислоту, характеризующуюся гидрофобной боковой цепью, заменяют на другую аминокислоту, также имеющую гидрофобную боковую цепь (например, серин (треонин) на треонин (серин) или лейцин (изолейцин) на изолейцин (лейцин)). Можно осуществлять инсерции и замены, прежде всего, в тех положениях в последовательности, которые не приводят к модификации трехмерной структуры или не влияют на связывающую область. Модификации в трехмерной структуре, обусловленные инсерцией(ями) или делецией(ями) можно легко определять, например, с использованием CD-спектров (спектры кругового дихроизма) (Urry, Absorption, Circular Dichroism и ORD of Polypeptides, в: Modern Physical Methods in Biochemistry, под ред. Neuberger и др., изд-во Elsevier, Amsterdam, 1985).
«Вариант» белка или пептида может иметь по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичных аминокислот на сегменте, состоящем из 10, 20, 30, 50, 75 или 100 аминокислот такого белка или пептида.
Кроме того, варианты белков или пептидов, как указано в настоящем описании, которые могут кодироваться молекулой нуклеиновой кислоты, могут содержать также такие последовательности, в которых нуклеотиды кодирующей нуклеотидной последовательности обменены в соответствии с вырожденностью генетического кода, что не приводит к изменению соответствующей аминокислотной последовательности белка или пептида, т.е. аминокислотная последовательность или по меньшей мере ее часть могут не отличаться от исходной последовательности одной мутацией или большим количеством мутаций в указанном выше смысле.
Идентичность последовательностей: Для определения процента идентичности двух последовательностей, например, нуклеотидных последовательностей или аминокислотных последовательностей, указанных в настоящем описании, предпочтительно аминокислотных последовательностей, кодируемых молекулой нуклеиновой кислоты, которая входит в полимерный носитель как указано в настоящем описании, или самих аминокислотных последовательностей, последовательности можно выравнивать для последующего сравнения друг с другом. Так, например, положение в первой последовательности можно сравнивать с соответствующим положением во второй последовательности. Если положение в первой последовательности занято тем же компонентом (остатком), который находится в этом положении во второй последовательности, то две последовательности являются идентичными в этом положении. Если это не имеет места, то последовательности различаются в этом положении. Если во второй последовательности присутствуют инсерции по сравнению с первой последовательностью, то можно встраивать бреши в первую последовательность, что позволяет продолжать осуществление сравнительного анализа. Если во второй последовательности имеются делеции по сравнению с первой последовательностью, то можно встраивать бреши во вторую последовательность, что позволяет продолжать осуществление сравнительного анализа. Таким образом, процент идентичности двух последовательностей является функцией количества идентичных положений, деленной на общее количество положений, включая те положения, которые заняты только в одной последовательности. Процент идентичности двух последовательностей можно определять с помощью математического алгоритма. Предпочтительным примером математического алгоритма, который можно применять, является (но, не ограничиваясь только им) алгоритм, предложенный Karlin и др., PNAS USA, 90, 1993, cc. 5873-5877 или Altschul и др., Nucleic Acids Res., 25, 1997, cc. 3389-3402. Указанный алгоритм входит в программу BLAST. С помощью этой программы можно идентифицировать последовательности, обладающие конкретной степенью идентичности с последовательностями, предлагаемыми в настоящем изобретении.
Производное белка или пептида: Под производным пептида или белка, как правило, понимают молекулу, которую получают из другой молекулы, такой как указанный пептид или белок. Под понятие «производное» пептида или белка подпадают также слияния, содержащие пептид или белок, применяемые согласно настоящему изобретению. Например, слияние содержит метку, такую, например, как эпитоп, например, эпитоп FLAG или эпитоп V5. Например, эпитоп представляет собой эпитоп FLAG. Такую метку используют, например, для очистки слитого белка.
Моноцистронная мРНК: Моноцистронная мРНК, как правило, может представлять собой мРНК, предпочтительно мРНК, которая содержит только одну открытую рамку считывания. В этом контексте открытая рамка считывания представляет собой последовательность, состоящую из нескольких нуклеотидных триплетов (кодонов), которые могут транслироваться в пептид или белок.
Нуклеиновая кислота: Понятие «нуклеиновая кислота» обозначает либо ДНК-, либо РНК-молекулу и является синонимом понятия «полинуклеотид». В контексте настоящего описания, если понятие относится к нуклеиновой кислоте или нуклеотидной последовательности, кодирующей конкретный белок и/или пептид, то указанная нуклеиновая кислота или нуклеотидная последовательность соответственно предпочтительно содержит также регуляторные последовательности, обеспечивающие в соответствующем хозяине, например, человеке, ее экспрессию, т.е. транскрипцию и/или трансляцию нуклеотидной последовательности, кодирующей конкретный белок или пептид.
Пептид: Пептид представляет собой полимер, состоящий из аминокислотных мономеров. Как правило, мономеры сцеплены пептидными связями. Понятие «пептид» не ограничено длиной полимерной цепи аминокислот. В некоторых вариантах осуществления настоящего изобретения пептид может, например, содержать менее 50 мономерных звеньев. Более длинные пептиды, которые называют также полипептидами, как правило, имеют от 50 до 600 мономерных звеньев, более конкретно от 50 до 300 мономерных звеньев.
Фармацевтически эффективное количество: Под фармацевтически эффективном количеством в контексте изобретения, как правило, понимают количество, достаточное для того, чтобы индуцировать иммунный ответ.
Белок: Белок, как правило, состоит из одного или нескольких пептидов и/или полипептидов, уложенных в 3-мерную структуру, облегчающую биологическую функцию.
Поли(С)-последовательность: Поли (С)-последовательность, как правило, представляет собой длинную последовательность, состоящую из цитозиновых нуклеотидов, как правило, содержащую от примерно 10 до примерно 200 цитозиновых нуклеотидов, предпочтительно от примерно 10 до примерно 100 цитозиновых нуклеотидов, более предпочтительно от примерно 10 до примерно 70 цитозиновых нуклеотидов или еще более предпочтительно от примерно 20 до примерно 50 или даже от примерно 20 до примерно 30 цитозиновых нуклеотидов. Поли(С)-последовательность предпочтительно может располагаться в 3'-направлении относительно кодирующей области, содержащейся в нуклеиновой кислоте.
Поли(А)-хвост: Поли(А)-хвост, который называют также «3'-поли(А)-хвостом», как правило, представляет собой длинную последовательность аденозиновых нуклеотидов, содержащую вплоть до примерно 400 аденозиновых нуклеотидов, например, от примерно 25 до примерно 400, предпочтительно от примерно 50 до примерно 400, более предпочтительно от примерно 50 до примерно 300, еще более предпочтительно от примерно 50 до примерно 250, наиболее предпочтительно от примерно 60 до примерно 250 аденозиновых нуклеотидов, добавленную к 3'-концу РНК.
Стабилизированная нуклеиновая кислота: Стабилизированная нуклеиновая кислота, как правило, содержит модификацию, повышающую устойчивость к расщеплению in vivo (например, расщеплению экзо- или эндонуклеазой) и/или расщеплению ex vivo (например, в процессе производства до введения вакцины, например, в процессе приготовления раствора вакцины, предназначенного для введения). Стабилизацию РНК можно обеспечивать, например, с использованием 5'-кэп-структуры, поли(А)-хвоста или любой другой модификации UTR. Ее можно обеспечивать также путем модификации каркаса или модификации содержания G/C в нуклеиновой кислоте. В контексте настоящего изобретения можно рассматривать и различные другие методы, известные в данной области.
Носитель/полимерный носитель: В контексте изобретения носитель, как правило, может представлять собой соединение, которое облегчает транспорт и/или включение в комплекс другого соединения. Указанный носитель может образовывать комплекс с указанным другим соединением. Полимерный носитель, как правило, представляет собой носитель, образующий полимер.
Катионный компонент: Понятие «катионный компонент», как правило, относится к заряженной молекуле, которая является положительно заряженной (катион) при значении pH, составляющем, как правило, от 1 до 9, предпочтительно при значении pH, равном или ниже 9 (например, от 5 до 9), равном или ниже 8 (например, от 5 до 8), равном или ниже 7 (например, от 5 до 7), наиболее предпочтительно при физиологических значениях pH, например, от 7,3 до 7.4. Таким образом, катионный пептид, белок или полимер, который является положительно заряженным в физиологических солевых условиях в клетке, прежде всего в физиологических условиях in vivo. Катионный пептид или белок предпочтительно содержит большее количество катионных аминокислот, например, большее количество Arg, His, Lys или Orn, чем других аминокислотных остатков (в частности больше катионных аминокислот, чем анионных аминокислотных остатков типа Asp или Glu), или содержит блоки, образованные главным образом катионными аминокислотными остатками. Понятие «катионный» может обозначать также «поликатионные» компоненты.
Наполнитель: Агент, например, носитель, который можно, как правило, применять в фармацевтической композиции или вакцине для облегчения введения индивидууму компонентов фармацевтической композиции или вакцины.
3'-нетранслируемая область (3'UTR): 3'UTR, как правило, является частью мРНК, локализованной между кодирующей белок областью (т.е. открытой рамкой считывания) и поли(А)-последовательностью мРНК. 3'UTR мРНК не транслируется в аминокислотную последовательность. Последовательность 3'UTR, как правило, кодируется геном, который транскрибируется в соответствующую мРНК в процессе экспрессии гена. Геномная последовательность сначала транскрибируется в незрелую мРНК, которая содержит необязательные интроны. Незрелая мРНК затем дополнительно процессируется с образованием зрелой мРНК в процессе созревания. Указанный процесс созревания включает стадии 5'-кэпирования, сплайсинга незрелой мРНК с вырезанием необязательных интронов и модификаций 3'-конца, таких как подиаденилирование 3'-конца незрелой мРНК, и необязательные расщепления эндо-/или экзонуклеазами и т.д. В контексте настоящего изобретения 3'UTR соответствует последовательности зрелой мРНК, которая расположена с 3'-стороны стоп-кодона кодирующей белок области, предпочтительно непосредственно примыкает с 3'-стороны к стоп-кодону кодирующей белок области, и которая простирается до 5'-стороны поли(А)-последовательности, предпочтительно до нуклеотида, непосредственно примыкающего к 5'-концу поли(А)-последовательности. Понятие «соответствует» означает, что последовательность 3'UTR может представлять собой последовательность РНК, такую как последовательность мРНК, указанную при определении последовательности 3'UTR, или последовательность ДНК, которая соответствует указанной последовательности РНК. В контексте настоящего изобретения понятие «3'UTR гена», например, «3'UTR гена альбумина», означает последовательность, которая соответствует 3'UTR зрелой мРНК, полученной из указанного гена, т.е. мРНК, полученной путем транскрипции гена и созревания незрелой мРНК. Понятие «3'UTR гена» включает последовательность ДНК и последовательность РНК 3'UTR.
5'-нетранслируемая область (5'UTR): Под 5'UTR, как правило, понимают конкретный сегмент матричной РНК (мРНК). Она локализована на 5'-конце открытой рамки считывания мРНК. Как правило, 5'UTR начинается с сайта инициации транскрипции и закачивается одним нуклеотидом, расположенным непосредственно перед стартовым ко доном открытой рамки считывания. 5'UTR может содержать элементы, предназначенные для контроля генной экспрессии, так называемые регуляторные элементы. Указанные регуляторные элементы могут представлять собой, например, сайты связывания рибосом или 5'-концевой олигопиримидиновый тракт. 5'UTR может подвергаться посттранскрипционным модификациям, например, путем добавления 5'-кэпа. В контексте настоящего изобретения 5'UTR соответствует последовательности зрелой мРНК, локализованной между 5'-кэпом и стартовым кодоном. Предпочтительно 5'UTR соответствует последовательности, которая простирается от нуклеотида, расположенного с 3'-стороны 5'-кэпа, предпочтительно от нуклеотида, непосредственно примыкающего с 3'-стороны к 5'-кэпу, до нуклеотида, расположенного с 5'-стороны стартового кодона кодирующей белок области, предпочтительно до нуклеотида, непосредственно примыкающего с 5'-стороны к стартовому кодону кодирующей белок области. Нуклеотид, непосредственно примыкающий с 3'-стороны к 5'-кэпу зрелой мРНК, как правило, соответствует сайту инициации транскрипции. Понятие «соответствует» означает, что последовательность 5'UTR может представлять собой последовательность РНК, такую как последовательность мРНК, указанная при определении последовательности 5'UTR, или последовательность ДНК, которая соответствует указанной последовательности РНК. В контексте настоящего изобретения понятие «5'UTR гена», например, «5'UTR ТОР-гена», обозначает последовательность, которая соответствует 5'UTR зрелой мРНК, полученной из этого гена, т.е. мРНК, полученной путем транскрипции гена и созревания незрелой мРНК. Понятие «5'UTR гена» включает последовательность ДНК и последовательность РНК 5'UTR.
5'-концевой олигопиримидиновый тракт (ТОР): 5'-концевой олигопримидиновый транкт (ТОР), как правило, обозначает сегмент пиримидиновых нуклеотидов, локализованный в 5'-концевой области молекулы нуклеиновой кислоты, например, в 5'-концевой области некоторых молекул мРНК или в 5'-концевой области функционального элемента, например, транскрибируемой области некоторых генов. Последовательность начинается с цитидина, который, как правило, соответствует сайту инициации транскрипции, и за которым следует сегмент, как правило, состоящий примерно из 3-30 пиримидиновых нуклеотидов. Например, ТОР может содержать 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или даже большее количество нуклеотидов. Пиримидиновый сегмент и, следовательно, 5'-ТОР, заканчивается одним нуклеотидом, примыкающим с 5'-стороны к первому пуриновому нуклеотиду, расположенному в прямом направлении относительно ТОР. Матричную РНК, которая содержит 5'-концевой олигопримидиновый тракт, часто обозначают как ТОР-мРНК. Таким образом, гены, из которых получают указанные матричные РНК, обозначают как ТОР-гены. Последовательности ТОР, например, обнаружены в генах и мРНК, кодирующих пептидные факторы элонгации и рибосомные белки.
ТОР-мотив: В контексте настоящего изобретения ТОР-мотив обозначает нуклеотидную последовательность, которая соответствует 5'-ТОР, описанному выше. Таким образом, ТОР-мотив в контексте настоящего изобретения предпочтительно обозначает состоящий из пиримидиновых нуклеотидов сегмент длиной 3-30 нуклеотидов. Предпочтительно ТОР-мотив состоит по меньшей мере из 3 пиримидиновых нуклеотидов, предпочтительно по меньшей мере 4 пиримидиновых нуклеотидов, предпочтительно по меньшей мере 5 пиримидиновых нуклеотидов, более предпочтительно по меньшей мере 6 нуклеотидов, более предпочтительно по меньшей мере 7 нуклеотидов, наиболее предпочтительно по меньшей мере 8 пиримидиновых нуклеотидов, при этом сегмент пиримидиновых нуклеотидов предпочтительно начинается на его 5'-конце с цитозинового нуклеотида. В ТОР-генах и ТОР-мРНК ТОР-мотив предпочтительно начинается на его 5'-конце с сайта инициации транскрипции и заканчивается одним нуклеотидом, примыкающим с 5'-стороны к первому пуриновому остатку в указанном гене или мРНК. В контексте настоящего изобретения ТОР-мотив предпочтительно локализован на 5'-конце последовательности, которая представляет собой 5'UTR, или на 5'-конце последовательности, которая кодирует 5'UTR. Таким образом, в контексте настоящего изобретения сегмент из 3 или большего количества пиримидиновых нуклеотидов предпочтительно называют «ТОР-мотивом», если сегмент локализован на 5'-конце соответствующей последовательности, такой как мРНК, предлагаемая в изобретении, 5'UTR-элемент мРНК, предлагаемой в изобретении, или нуклеотидная последовательность, которая происходит из 5'UTR ТОР-гена, указанного в настоящем описании. Другими словами, сегмент, состоящий из 3 или большего количества пиримидиновых нуклеотидов, который не локализован на 5'-конце 5'UTR или 5'UTR-элемента, но локализован где-либо внутри 5'UTR или 5'UTR-элемента, предпочтительно не обозначают как «ТОР-мотив».
ТОР-ген: ТОР-гены, как правило, характеризуются присутствием 5'-концевого олигопримидинового тракта. Кроме того, большинство ТОР-генов характеризуются связанной с ростом регуляцией трансляции. Однако известны также ТОР-гены с тканеспецифической регуляцией трансляции. Как указано выше, 5'UTR ТОР-гена соответствует последовательности 5'UTR зрелой мРНК, происходящей из ТОР-гена, которая предпочтительно простирается от нуклеотида, примыкающего с 3'-стороны к 5'-кэпу, до нуклеотида, примыкающего с 5'-стороны к стартовому ко дону. 5'UTR ТОР-гена, как правило, не содержит никаких стартовых кодонов, предпочтительно не содержит расположенных в обратном направлении AUG (uAUG) или расположенных в обратном направлении открытых рамок считывания (uOPC). В данном контексте под расположенными в обратном направлении AUG и расположенными в обратном направлении открытыми рамками считывания, как правило, понимают AUG и открытые рамки считывания, которые находятся в 5'-направлении относительно стартового кодона (AUG) открытой рамки считывания, которая должна транслироваться. 5'UTR ТОР-генов, как правило, являются относительно короткими. Длины 5'UTR ТОР-генов могут варьироваться от 20 нуклеотидов вплоть до 500 нуклеотидов и, как правило, они содержат менее чем примерно 200 нуклеотидов, предпочтительно менее чем примерно 150 нуклеотидов, более предпочтительно менее чем примерно 100 нуклеотидов. Примерами 5'UTR ТОР-генов в контексте настоящего изобретения являются нуклеотидные последовательности, простирающиеся от нуклеотида в положении 5 до нуклеотида, непосредственно примыкающего с 5'-стороны к стартовому кодону (например, ATG), указанные последовательности представлены в SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 14221-1363 заявки на патент PCT/EP 2012/002448 WO 2013/143700 или представляют собой их гомологи или варианты, описание указанных документов включено в настоящее описание в качестве ссылки. В этом контексте наиболее предпочтительным фрагментом 5'UTR ТОР-гена является 5'UTR ТОР-гена без 5'ТОР-мотива. Понятие «5'UTR ТОР-гена» предпочтительно относится к 5'UTR встречающегося в естественных условиях ТОР-гена.
Фрагмент нуклеотидной последовательности, прежде всего мРНК: Фрагмент нуклеотидной последовательности состоит из непрерывного сегмента нуклеотидов, который соответствует непрерывному сегменту нуклеотидов в полноразмерной нуклеотидной последовательности, которая является основой для нуклеотидной последовательности фрагмента, который соответствует по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90% полноразмерной нуклеотидной последовательности. В контексте настоящего изобретения указанный фрагмент предпочтительно представляет собой функциональный фрагмент полноразмерной нуклеотидной последовательности.
Вариант нуклеотидной последовательности, прежде всего мРНК: Вариант нуклеотидной последовательности относится к варианту нуклеотидной последовательности, которая образует основу нуклеотидной последовательности. Например, вариант нуклеотидной последовательности может характеризоваться одной или несколькими нуклеотидными делециями, инсерциями, добавлениями и/или заменами по сравнению с нуклеотидной последовательностью, из которой вариант происходит. Предпочтительно вариант нуклеотидной последовательности идентичен по меньшей мере на 40%, предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80%,еще более предпочтительно по меньшей мере 90%, наиболее предпочтительно по меньшей мере 95% нуклеотидной последовательности, из которой вариант происходит. Предпочтительно вариант представляет собой функциональный вариант. «Вариант» нуклеотидной последовательности может иметь по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичных нуклеотидов в сегменте, состоящем из 10, 20, 30, 50, 75 или 100 нуклеотидов указанной нуклеотидной последовательности.
Гомолог нуклеотидной последовательности: Понятие «гомолог» нуклеотидной последовательности относится к последовательностям других видов относительно конкретной последовательности. Наиболее предпочтительно нуклеотидная последовательность представляет собой последовательность человеческого происхождения и поэтому предпочтительно, чтобы гомолог представлял собой гомолог человеческой нуклеотидной последовательности.
Струйная инъекция: Понятие «струйная инъекция» в контексте настоящего описания относится к методу безыгольной инъекции, при котором жидкость, содержащая по меньшей мере одну предлагаемую в изобретения последовательность мРНК и необязательно дополнительные приемлемые эксципиенты, принудительно пропускают через отверстие, создавая тем самым ультратонкую жидкую струю под высоким давлением, которая обладает способностью проникать через кожу млекопитающего и, в зависимости от условий инъекции, в подкожную ткань или мышечную ткань. В принципе жидкая струя образует отверстие в коже, через которую жидкая струя проходит в ткань-мишень. Предпочтительно струйную инъекцию применяют для внутрикожной, подкожной или внутримышечной инъекции мРНК, предлагаемой в изобретении. В предпочтительном варианте осуществления изобретения струйную инъекцию применяют для внутримышечной инъекции последовательности мРНК, предлагаемой в изобретении. В более предпочтительном варианте осуществления изобретения струйную инъекцию применяют для внутрикожной инъекции последовательности мРНК, предлагаемой в изобретении.
В основу настоящего изобретения положены неожиданно установленные данные о том, что последовательность мРНК, содержащая кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ), индуцирует антигенспецифические иммунные ответы и тем самым предупреждает или по меньшей мере минимизирует инфекции, вызываемые респираторно-синцитиальным вирусом (РСВ). При создании изобретения совершенно неожиданно было установлено, что последовательность мРНК индуцирует по меньшей мере такие же иммунные ответы, что и вакцины на основе инактивированного РСВ, которые состоят из цельного вируса. Еще более неожиданно при создании изобретения было установлено, что предлагаемая в изобретении последовательность мРНК, кодирующая антигенный белок РСВ, индуцирует антигенспецифические CD8+-Т-клетки в отличие от вакцины на основе инактивированного РСВ. Кроме того, на модели контрольного заражения РСВ хлопковых крыс установлено, что вирусные титры в носу и легких вакцинированных мРНК животных оказались существенно более низкими по сравнению с животными, которых вакцинировали вакцинами на основе инактивированного РСВ-вируса. Касательно безопасности при создании изобретения было продемонстрировано, что при применении вакцины на основе мРНК РСВ не обнаружено никакого опосредуемого вакциной усиления заболевания в плане легочной патологии по сравнению с вакциной на основе инактивированного формалином вируса. Кроме того, при создании изобретения неожиданно было установлено, что уже только одной единичной вакцинации предлагаемой в изобретении последовательности мРНК оказалось достаточно для вызывания иммунного ответа против вводимого(ых) антигена(ов). В частности, было установлено, что одно единственное введение, предпочтительно путем внутрикожной или внутримышечной инъекции предлагаемой в изобретении мРНК, обладало высокой эффективностью в отношении снижения вирусных титров в легких после контрольного заражения РСВ-вирусом.
В целом, предлагаемая в изобретении последовательность мРНК, содержащая кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ), может представлять собой эффективную и безопасную вакцину, прежде всего для младенцев, пожилых людей и пациентов с ослабленным иммунитетом.
В этом контексте наиболее предпочтительно, чтобы предлагаемая в изобретении последовательность мРНК содержала кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок, происходящий из слитого белка F, гликопротеина G, короткого гидрофобного белка SH, матричного белка М, нуклеопротеина N, большой субъединицы полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное.
Согласно первому объекту настоящего изобретения кодирующая область предлагаемой в изобретении мРНК может присутствовать в виде моно-, би- или даже полицистронной мРНК, т.е. мРНК, которая несет кодирующую(ие) последовательность(и) одного, двух или большего количества белков или пептидов. Указанные кодирующие последовательности би- или даже полицистронных мРНК могут разделяться по меньшей мере одной последовательностью участка внутренней посадки (связывания) рибосомы (IRES), например, указанной в настоящем описании, или сигнальными пептидами, которые индуцируют расщепление образовавшегося полипептида, который содержит несколько белков или пептидов.
Согласно первому объекту настоящего изобретения кодирующая область предлагаемой в изобретении мРНК содержит кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок, происходящий из слитого белка F, гликопротеина G, короткого гидрофобного белка SH, матриксного белка М, нуклеопротеина N, большой субъединицы полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 респираторно-синцитиального вируса (РСВ), или его фрагмент, вариант или производное. В наиболее предпочтительном варианте осуществления первого объекта изобретения предлагаемая в изобретении последовательность мРНК содержит кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок, происходящий из слитого белка F, нуклеопротеина N или белка М2-1 респираторно-синцитиального вируса (РСВ) или его фрагмента, варианта или производного.
В этом контексте аминокислотную последовательность по меньшей мере одного антигенного пептида или белка можно выбирать из любого пептида или белка, происходящего из слитого белка F, гликопротеина G, короткого гидрофобного белка SH, матриксного белка М, нуклеопротеина N, большой субъединицы полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 любого изолята РСВ или из любого созданного с помощью синтеза пептида или белка РСВ, или из любого его фрагмента, варианта или производного.
В наиболее предпочтительном варианте осуществления изобретения полноразмерный белок слитого белка F, гликопротеина G, короткого гидрофобного белка SH, матриксного белка М, нуклеопротеина N, большой субъединицы полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 респираторно-синцитиального вируса (РСВ) кодируется кодирующей областью, содержащейся в предлагаемой в изобретении мРНК.
В этом контексте наиболее предпочтительными являются полноразмерный белок из слитого белка F и нуклеопротеина N. Кроме того, наиболее предпочтительным является мутант белка F с делецией цитоплазматического хвоста. Примером такого делеционного мутанта является белок «длинного» штамма RSV-Fdel 554-574, описанный у Oomens и др., J. Virol. 80(21), 2006, cc. 10465-10477).
В другом наиболее предпочтительном варианте осуществления фрагмент, содержащий по меньшей мере один эпитоп слитого белка F, гликопротеина G, короткого гидрофобного белка SH, матриксного белка М, нуклеопротеина N, большой субъединицы полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 респираторно-синцитиального вируса (РСВ) кодируется кодирующей областью, содержащейся в предлагаемой в изобретении мРНК.
Наиболее предпочтительными являются аминокислотные последовательности «длинного» штамма РСВ (АТСС VR-26), имеющие регистрационный номер NCBI № AY911262:
Слитый белок F «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 1:

Гликопротеин G «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 2:

Короткий гидрофобный белок SH «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 3:
Матриксный белок М «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 4:

Нуклепротеин N «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 5:

Большая субъединица полимеразы L «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 6:


Белок М2-1 «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 7:

Белок М2-2 «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 8:

Фосфопротеин Р «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 9:

Неструктурный белок NS1 «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 10:

Неструктурный белок NS2 «длинного» штамма РСВ АТСС VR-26:
Аминокислотная последовательность SEQ ID NO: 11:

В контексте изобретения помимо представленных в настоящем описании последовательностей SEQ ID NO: 1-11 согласно изобретению можно применять аминокислотные последовательности различных изолятов респираторно-синцитиального вируса (РСВ), и они подпадают под объем изобретения. Эти изоляты респираторно-синцитиального вируса (РСВ) характеризуются предпочтительно по меньшей мере 70%-ной, более предпочтительно по меньшей мере 80%-ной и наиболее предпочтительно по меньшей мере 90%-ной идентичностью с аминокислотными последовательностями SEQ ID NO: 1-11.
Кроме того, в этом контексте кодирующую последовательность, которая кодирует по меньшей мере один антигенный пептид или белок, происходящий из слитого белка F, гликопротеина G, короткого гидрофобного белка SH, матриксного белка М, нуклеопротеина N, большой субъединицы полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 респираторно-синцитиального вируса (РСВ) или любого его фрагмента, варианта или производного, можно выбирать из любой нуклеотидной последовательности, которая содержит кодирующую область, происходящую из любого изолята респираторно-синцитиального вируса (РСВ) или его фрагмента или варианта.
Наиболее предпочтительными являются последовательности мРНК кодирующих областей «длинного» штамма РСВ дикого типа (АТСС VR-26), имеющие регистрационный номер NCBI № AY911262:
мРНК, кодирующая слитый белок F «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 12:

мРНК, кодирующая гликопротеин G «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 13

мРНК, колирующая короткий гидрофобный белок SH «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 14:
мРНК, кодирующая матриксный белок М «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 15:

мРНК, кодирующая нуклеопротеин N «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 16:

мРНК, кодирующая большую субъединицу полимеразы L «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 17:



мРНК, кодирующая белок М2-1 «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 18:

мРНК, кодирующая белок М2-2 «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 19:

мРНК, кодирующая фосфопротеин Р «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 20:

мРНК, кодирующая неструктурный белок NS1 «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEQ ID NO: 21:
мРНК, кодирующая неструктурный белок NS2 «длинного» штамма РСВ АТСС VR-26:
Последовательность мРНК SEP ID NO: 22:
В контексте изобретения помимо представленных в настоящем описании нуклеотидных последовательностей, изобретение относится также к нуклеотидным последовательностям различных изолятов респираторно-синцитиального вируса (РСВ). Эти различные изоляты респираторно-синцитиального вируса (РСВ) предпочтительно идентичны по меньшей мере на 50%, 60%, 70%, более предпочтительно по меньшей мере на 80% и наиболее предпочтительно по меньшей мере на 90% нуклеотидным последовательностям SEQ ID NO: 12-22 или их фрагментам.
В предпочтительном варианте осуществления последовательность мРНК, предлагаемая в изобретении, не содержит репортерный ген или маркерный ген. Предпочтительно мРНК, предлагаемая в изобретении, не кодирует, например, люциферазу; зеленый флуоресцентный белок (GFP) и его варианты (такие как eGFP, RFP или BFP); α-глобин; гипоксантин : гуанинфосфорибозилтрансферазу (HGPRT); β-галактозидазу; галактокиназу; щелочную фосфатазу; секретируемую эмбриональную щелочную фосфатазу (SEAP)) или ген, обусловливающий устойчивость (такой как ген, обусловливающий устойчивость к неомицину, пуромицину, гигромицину и зеоцину). В предпочтительном варианте осуществления изобретения мРНК, предлагаемая в изобретении, не кодирует люциферазу. В другом варианте осуществления изобретения мРНК, предлагаемая в изобретении, не кодирует GFP или его вариант.
В другом предпочтительном варианте осуществления изобретения последовательность мРНК, предлагаемая в изобретении, не кодирует белок (или фрагмент белка), происходящий из вируса, который принадлежит к семейству Orthomyxoviridae. Предпочтительно последовательность мРНК не кодирует белок, происходящий из вируса гриппа, более предпочтительно вируса гриппа А. Предпочтительно последовательность мРНК, предлагаемая в изобретении, не кодирует белок вируса гриппа А, выбранный из группы, состоящей из гемагглютинина (НА), нейраминидазы (NA), нуклеопротеина (NP), M1, М2, NS1, NS2 (NEP: белок ядерного экспорта), PA, РВ1 (основная полимераза 1), PB1-F2 и РВ2. В другом предпочтительном варианте осуществления изобретения мРНК, предлагаемая в изобретении, не кодирует овальбумин (OVA) или его фрагмент. Предпочтительно последовательность мРНК, предлагаемая в изобретении, не кодирует белок вируса гриппа А или овальбумин.
В другом варианте осуществления изобретения предлагаемая в изобретении мРНК предпочтительно содержит по меньшей мере один из следующих структурных элементов: элемент 5'- и/или 3'-нетранслируемой области (UTR-элемент), прежде всего 5'UTR-элемент, который содержит или состоит из нуклеотидной последовательности, происходящей из 5'UTR ТОР-гена или из его фрагмента, гомолога или варианта, или элемент, представляющий собой 5'-/или 3'UTR, который может иметь происхождение из гена, из которого получают стабильную мРНК, или из его гомолога, фрагмента или варианта; гистоновую структуру типа «стебель-петля», предпочтительно гистоновую структуру типа «стебель-петля» в ее 3'-нетранслируемой области; 5'-кэп-структуру; поли-А-хвост или поли(С)-последовательность.
В предпочтительном варианте осуществления первого объекта настоящего изобретения мРНК, предлагаемая в изобретении, содержит по меньшей мере один 5'- или 3'UTR-элемент. В этом контексте UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из 5'- или 3'UTR любого встречающегося в естественных условиях гена, или которую получают из фрагмента, гомолога или варианта 5'- или 3'UTR гена. Предпочтительно 5'- или 3'UTR-элемент, применяемый согласно настоящему изобретению, является гетерологичным относительно кодирующей области мРНК, предлагаемой в изобретении. Хотя предпочтительными являются 5'- или 3'UTR-элементы, полученные из встречающихся в естественных условиях генов, в контексте настоящего изобретения можно применять также созданные путем синтеза UTR-элементы.
В наиболее предпочтительном варианте осуществления первого объекта настоящего изобретения последовательность мРНК, предлагаемая в изобретении, содержит по меньшей мере один элемент, представляющий собой 5'-нетранслируемую область (5'UTR-элемент), который содержит или состоит из нуклеотидной последовательности, которую получают из 5'UTR ТОР-гена, или которую получают из фрагмента, гомолога или варианта 5'UTR ТОР-гена.
Наиболее предпочтительно, чтобы 5'UTR-элемент не содержал ТОР-мотив или 5'ТОР, указанный выше.
В некоторых вариантах осуществления изобретения нуклеотидная последовательность 5'UTR-элемента, которую получают из 5'UTR ТОР-гена, оканчивается на ее 3'-конце нуклеотидом, локализованным в положении 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 в обратном направлении относительно стартового кодона (например, A(U/T)G) гена или полученной из него мРНК. Таким образом, 5'UTR-элемент не содержит никакой части кодирующей белок области. Таким образом, предпочтительно только кодирующий белок участок мРНК, предлагаемой в изобретении, представляет собой кодирующую область. Нуклеотидную последовательность, имеющую происхождение из 5'UTR ТОР-гена, получают из эукариотического ТОР-гена, предпочтительно ТОР-гена растений или животных, более предпочтительно ТОР-гена хордовых животных, еще более предпочтительно ТОР-гена позвоночных животных, наиболее предпочтительно ТОР-гена млекопитающих, например, ТОР-гена человека.
Например, 5'UTR-элемент предпочтительно выбирают из 5'UTR-элементов, содержащих или состоящих из нуклеотидной последовательности, которая происходит из нуклеотидной последовательности, выбранной из группы, которая состоит из SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, содержание которой включено в настоящее описание в качестве ссылки, из гомологов SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из ее вариантов, или предпочтительно из соответствующей РНК-последовательности. Понятие «гомологи SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700» относится к последовательностям из видов, отличных от человека (Homo sapiens), которые являются гомологами последовательностей SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700.
В предпочтительном варианте осуществления изобретения 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, которая происходит из нуклеотидной последовательности, простирающейся от нуклеотидного положения 5 (т.е. нуклеотида, локализованного в положении 5 в последовательности) до нуклеотидного положения, непосредственно примыкающего с 5'-стороны к стартовому кодону (локализованному на 3'-конце последовательностей), например, до нуклеотидного положения, непосредственно примыкающего с 5'-стороны к ATG-последовательности, нуклеотидной последовательности, выбранной из SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из гомологов SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из ее вариантов или соответствующей РНК-последовательности. Наиболее предпочтительным является, если 5' UTR-элемент получают из нуклеотидной последовательности, простирающейся от нуклеотидного положения, непосредственно примыкающего с 3'-стороны к 5'ТОР, до нуклеотидного положения, непосредственно примыкающего с 5'-стороны к стартовому кодону (локализованному на 3'-конце последовательностей), например, до нуклеотидного положения, непосредственно примыкающего с 5'-стороны к ATG-последовательности нуклеотидной последовательности, выбранной из SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из гомологов SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из ее вариантов или соответствующей РНК-последовательности.
В наиболее предпочтительном варианте осуществления изобретения 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, которая имеет происхождение из 5'UTR ТОР-гена, кодирующего рибосомный белок, или из варианта 5'UTR ТОР-гена, кодирующего рибосомный белок. Например, 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, которая имеет происхождение из 5'UTR нуклеотидной последовательности, представленной в любой из SEQ ID NO: 67, 170, 193, 244, 259, 554, 650, 675, 700, 721, 913, 1016, 1063, 1120, 1138 и 1284-1360, указанных в заявке на патент WO 2013/143700, соответствующей РНК-последовательности, ее гомолога или варианта, указанного в настоящем описании, предпочтительно лишенного 5'ТОР-мотива. Как описано выше, последовательность, простирающаяся от положения 5 до нуклеотида, непосредственно примыкающего с 5'-стороны к ATG (локализованному на 3'-конце последовательностей), соответствует 5'UTR указанных последовательностей.
Предпочтительно 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL), или из гомолога или варианта 5'UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL). Например, 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, которая имеет происхождение из 5'UTR нуклеотидной последовательности, представленной в любой из SEQ ID NO: 67, 259, 1284-1318, 1344, 1346, 1348-1354, 1357, 1358, 1421 и 1422, указанных в заявке на патент WO 2013/143700, соответствующей РНК-последовательности, ее гомолога или варианта, указанного в настоящем описании, предпочтительно лишенного 5'ТОР-мотива.
В наиболее предпочтительном варианте осуществления изобретения 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, которая имеет происхождение из 5'UTR, имеющей происхождение из 5'UTR гена белка большой субъединицы рибосомы 32, предпочтительно из гена белка большой субъединицы рибосомы 32 (L32) позвоночных животных, более предпочтительно из гена белка большой субъединицы рибосомы 32 (L32) млекопитающих, наиболее предпочтительно из гена белка большой субъединицы рибосомы 32 (L32) человека, или из варианта 5'UTR гена белка большой субъединицы рибосомы 32, предпочтительно гена белка большой субъединицы рибосомы 32 (L32) позвоночных животных, более предпочтительно гена белка большой субъединицы рибосомы 32 (L32) млекопитающих, наиболее предпочтительно гена белка большой субъединицы рибосомы 32 (L32) человека, при этом предпочтительно 5'UTR-элемент не содержит 5'ТОР указанного гена.
Таким образом, согласно наиболее предпочтительному варианту осуществления изобретения 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 23 (5'UTR человеческого белка большой субъединицы рибосомы 32, лишенного 5'-концевого олигопримидинового тракта: GGCGCTGCCTACGGAGGTGGCAGCCATCTCCTTCTCGGCATC; которая соответствует SEQ ID NO: 1368 в заявке на патент WO 2013/143700) или предпочтительно соответствующей РНК-последовательности, или в которой по меньшей мере один 5'UTR-элемент содержит или состоит из фрагмента нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 23, или более предпочтительно соответствующей РНК-последовательности, при этом предпочтительно описанный выше фрагмент представляет собой непрерывный сегмент нуклеотидов, на долю которого приходится по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90% полноразмерной 5'UTR. Предпочтительно фрагмент состоит по меньшей мере примерно из 20 нуклеотидов или более, предпочтительно по меньшей мере примерно из 30 нуклеотидов или более, более предпочтительно по меньшей мере примерно из 40 нуклеотидов или более. Предпочтительно фрагмент представляет собой функциональный фрагмент, указанный в настоящем описании.
В некоторых вариантах осуществления изобретения мРНК, предлагаемая в изобретении, содержит 5'UTR-элемент, который содержит или состоит из нуклеотидной последовательности, которая имеет происхождение из 5'UTR ТОР-гена позвоночных животных, таких как млекопитающие, например, человеческого ТОР-гена, выбранного из RPSA, RPS2, RPS3, RPS3A, RPS4, RPS5, RPS6, RPS7, RPS8, RPS9, RPS10, RPS11, RPS12, RPS13, RPS14, RPS15, RPS15A, RPS16, RPS17, RPS18, RPS19, RPS20, RPS21, RPS23, RPS24, RPS25, RPS26, RPS27, RPS27A, RPS28, RPS29, RPS30, RPL3, RPL4, RPL5, RPL6, RPL7, RPL7A, RPL8, RPL9, RPL10, RPL10A, RPL11, RPL12, RPL13, RPL13A, RPL14, RPL15, RPL17, RPL18, RPL18A, RPL19, RPL21, RPL22, RPL23, RPL23A, RPL24, RPL26, RPL27, RPL27A, RPL28, RPL29, RPL30, RPL31, RPL32, RPL34, RPL35, RPL35A, RPL36, RPL36A, RPL37, RPL37A, RPL38, RPL39, RPL40, RPL41, RPLP0, RPLP1, RPLP2, RPLP3, RPLP0, RPLP1, RPLP2, EEF1A1, EEF1B2, EEF1D, EEF1G, EEF2, EIF3E, EIF3F, EIF3H, EIF2S3, EIF3C, EIF3K, EIF3EIP, EIF4A2, РАВРС1, HNRNPA1, ТРТ1, TUBB1, UBA52, NPM1, ATP5G2, GNB2L1, NME2, UQCRB, или из их гомолога или варианта, в которых предпочтительно 5'UTR-элемент не содержит ТОР-мотива, или 5'ТОР указанных генов и в которых необязательно 5'-конец 5'UTR-элемента начинается с нуклеотида, локализованного в положении 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 в прямом направлении относительно 5'-концевого олигопримидинового тракта (ТОР), и в которых также необязательно 5'UTR-элемент, происходящий из 5'UTR ТОР-гена, оканчивается на его 3'-конце нуклеотидом, локализованным в положении 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 в обратном направлении относительно стартового кодона (A(U/T)G) гена, из которого он получен.
В наиболее предпочтительном варианте осуществления изобретения 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, которая имеет происхождение из 5'UTR гена белка большой субъединицы рибосомы 32 (RPL32), гена белка большой субъединицы рибосомы 35 (RPL35), белка большой субъединицы рибосомы 21 (RPL21), гена АТФ-синтазы, Н+-транспортирующей, митохондриального комплекса F1, альфа-субъединицы 1, сердечной мышцы (АТР5А1), гена гидроксистероид(17-бета)дегидрогеназы 4 (HSD17B4), индуцируемого андрогеном гена 1 (AIG1), гена субъединицы VIc оксидазы цитохрома с (СОХ6С) или гена N-ацилсфингозин-амидогидролазы (кислая церамидаза) 1 (ASAH1), или из их варианта, предпочтительно из гена белка большой субъединицы рибосомы 32 (RPL32) позвоночных животных, гена белка большой субъединицы рибосомы 35 (RPL35) позвоночных животных, гена белка большой субъединицы рибосомы 21 (RPL21) позвоночных животных, гена АТФ-синтазы, Н+-транспортирующей, митохондриального комплекса F1, альфа-субъединицы 1, сердечной мышцы (АТР5А1) позвоночных животных, гена гидроксистероид(17-бета)дегидрогеназы 4 (HSD17B4) позвоночных животных, индуцируемого андрогеном гена 1 (AIG1) позвоночных животных, гена субъединицы VIc оксидазы цитохрома с (СОХ6С) позвоночных животных или гена N-ацилсфингозин-амидогидролазы (кислая церамидаза) 1 (ASAH1) позвоночных животных, или из их варианта, более предпочтительно из гена белка большой субъединицы рибосомы 32 (RPL32) млекопитающих, гена белка большой субъединицы рибосомы 35 (RPL35) млекопитающих, гена белка большой субъединицы рибосомы 21 (RPL21) млекопитающих, гена АТФ-синтазы, Н+-транспортирующей, митохондриального комплекса F1, альфа-субъединицы 1, сердечной мышцы (АТР5А1) млекопитающих, гена гидроксистероид(17-бета)дегидрогеназы 4 (HSD17B4) млекопитающих, индуцируемого андрогеном гена 1 (AIG1) млекопитающих, гена субъединицы VIc оксидазы цитохрома с (СОХ6С) млекопитающих или гена N-ацилсфингозин-амидогидролазы (кислая церамидаза) 1 (ASAH1) млекопитающих, наиболее предпочтительно из гена белка большой субъединицы рибосомы 32 (RPL32) человека, гена белка большой субъединицы рибосомы 35 (RPL35) млекопитающих, гена белка большой субъединицы рибосомы 21 (RPL21) человека, гена АТФ-синтазы, Н+-транспортирующей, митохондриального комплекса F1, альфа-субъединицы 1, сердечной мышцы (АТР5А1) человека, гена гидроксистероид(17-бета)дегидрогеназы 4 (HSD17B4) человека, индуцируемого андрогеном гена 1 (AIG1) человека, гена субъединицы VIc оксидазы цитохрома с (СОХ6С) человека или гена N-ацилсфингозин-амидогидролазы (кислая церамидаза) 1 (ASAH1) человека, или из их варианта, в которых предпочтительно 5'UTR-элемент не содержит 5'ТОР указанного гена.
Согласно наиболее предпочтительному варианту осуществления изобретения 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 1368 или SEQ ID NO: 1412-1420, которые указаны в заявке на патент WO 2013/143700, или соответствующей РНК-последовательности, или в которых по меньшей мере один 5'UTR-элемент содержит или состоит из фрагмента нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 1368 или SEQ ID NO: 1412-1420, которые указаны в заявке на патент WO 2013/143700, при этом предпочтительно фрагмент представляет собой описанный выше фрагмент, т.е. является непрерывным состоящим из нуклеотидов сегментом, на долю которого приходится по меньшей мере 20% и т.д. от полноразмерной 5'UTR. Предпочтительно фрагмент состоит по меньшей мере примерно из 20 нуклеотидов или более, предпочтительно по меньшей мере примерно из 30 нуклеотидов или более, более предпочтительно по меньшей мере примерно из 40 нуклеотидов или более. Предпочтительно фрагмент представляет собой функциональный фрагмент, указанный в настоящем описании.
Согласно наиболее предпочтительному варианту осуществления изобретения 5'UTR-элемент содержит или состоит из нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 36 (5'UTR АТР5А1, лишенная 5'-концевого олигопиримидинового тракта: GCGGCTCGGCCATTTTGTCCCAGTCAGTCCGGAGGCTGCGGCTGCAGAAGTACCGCCTGCG-GAGTAACTGCAAAG; соответствует SEQ ID NO: 1414 в заявке на патент WO 2013/143700), или предпочтительно соответствующей РНК-последовательности, или в которой по меньшей мере один 5'UTR-элемент содержит или состоит из фрагмента нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 26, или более предпочтительно соответствующей РНК-последовательности, в которой предпочтительно фрагмент представляет собой описанный выше фрагмент, т.е. является непрерывным состоящим из нуклеотидов сегментом, на долю которого приходится по меньшей мере 20% и т.д. от полноразмерной 5'UTR. Предпочтительно фрагмент состоит по меньшей мере примерно из 20 нуклеотидов или более, предпочтительно по меньшей мере примерно из 30 нуклеотидов или более, более предпочтительно по меньшей мере примерно из 40 нуклеотидов или более. Предпочтительно фрагмент представляет собой функциональный фрагмент, указанный в настоящем описании.
В другом предпочтительном варианте осуществления изобретения мРНК, предлагаемая в изобретении, содержит также по меньшей мере один 3'UTR-элемент, который содержит или состоит из нуклеотидной последовательности, происходящей из 3'UTR гена хордовых животных, предпочтительно гена позвоночных животных, более предпочтительно гена млекопитающих, наиболее предпочтительно человеческого гена, или из варианта 3'UTR гена хордовых животных, предпочтительно гена позвоночных животных, более предпочтительно гена млекопитающих, наиболее предпочтительно человеческого гена.
Понятие «3'UTR-элемент» относится к нуклеотидной последовательности, которая содержит или состоит из нуклеотидной последовательности, происходящей из 3'UTR или из варианта 3'UTR. 3'UTR-элемент в контексте настоящего изобретения может представлять собой 3'UTR мРНК. Таким образом, в контексте настоящего изобретения предпочтительно 3'UTR-элемент может представлять собой 3'UTR мРНК, предпочтительно искусственной мРНК, или может представлять собой матрицу для транскрипции 3'UTR мРНК. Таким образом, 3'UTR-элемент предпочтительно представляет собой нуклеотидную последовательность, которая соответствует 3'UTR мРНК, предпочтительно 3'UTR искусственной мРНК, такой как мРНК, полученная путем транскрипции созданной с помощью генной инженерии векторной конструкции. Предпочтительно 3'UTR-элемент выполняет функцию 3'UTR или кодирует последовательность, которая выполняет функцию 3'UTR.
Предпочтительно предлагаемая в изобретении мРНК содержит 3'UTR-элемент, который может происходить из гена, который соответствует мРНК с удлиненным временем полужизни (представляющей собой стабильную мРНК), например, 3'UTR-элемент указанный и описанный ниже.
В наиболее предпочтительном варианте осуществления изобретения 3'UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из 3'UTR гена, выбранного из группы, состоящей из гена альбумина, гена α-глобина, гена β-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена, такого как ген альфа-1-цепи коллагена типа (I), или из варианта 3'UTR гена, выбранного из группы, состоящей из гена альбумина, гена α-глобина, гена β-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена альфа, такого как ген альфа-1-цепи коллагена типа (I), последовательности которых представлены в SEQ ID NO: 1369-1390 в заявке на патент WO 2013/143700, содержание которой включено в настоящее описание в качестве ссылки. В наиболее предпочтительном варианте осуществления изобретения 3'UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из 3'UTR гена альбумина, предпочтительно гена альбумина позвоночных животных, более предпочтительно гена альбумина млекопитающих, наиболее предпочтительно человеческого гена альбумина, которая имеет SEQ ID NO: 24.
3'UTR человеческого альбумина, имеющая SEQ ID NO: 24:

 (соответствует SEQ ID NO: 1369 в заявке на патент WO 2013/143700).
(соответствует SEQ ID NO: 1369 в заявке на патент WO 2013/143700).
В этом контексте наиболее предпочтительно, когда предлагаемая в изобретении мРНК содержит 3'UTR-элемент, который содержит соответствующую РНК-последовательность, происходящую из SEQ ID NO: 1369-1390, которые указаны в заявке па патент WO 2013/143700, или ее фрагмент, гомолог или вариант.
Наиболее предпочтительно 3'UTR-элемент содержит нуклеотидную последовательность, происходящую из фрагмента гена человеческого альбумина, которая представлена в SEQ ID NO: 25:
3'UTR альбумина7

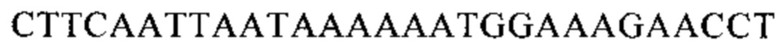 (SEQ ID NO: 25 соответствует SEQ ID NO: 1376 в заявке на патент WO 2013/143700).
(SEQ ID NO: 25 соответствует SEQ ID NO: 1376 в заявке на патент WO 2013/143700).
В этом контексте наиболее предпочтительно, когда 3'UTR-элемент предлагаемой в изобретении мРНК содержит или состоит из РНК-последовательности, соответствующей нуклеотидной последовательности SEQ ID NO: 25.
В другом наиболее предпочтительном варианте осуществления изобретения 3'UTR-элемент содержит или состоит из нуклеотидной последовательности, происходящей из 3'UTR гена α-глобина, предпочтительно гена α- или β-глобина, более предпочтительно гена α- или β-глобина млекопитающих, наиболее предпочтительно человеческого гена α- или β-глобина, которая имеет SEQ ID NO: 26-28:
3'UTR альфа-цепи гемоглобина 1 Homo sapiens (НВА1)
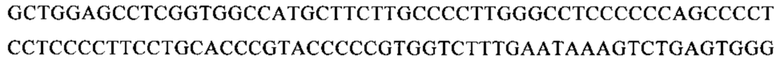
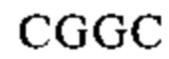 (SEQ ID NO: 26 соответствует SEQ ID NO: 1370 заявки на патент WO 2013/143700),
(SEQ ID NO: 26 соответствует SEQ ID NO: 1370 заявки на патент WO 2013/143700),
3'UTR альфа-цепи гемоглобина 2 Homo sapiens (HBA2)
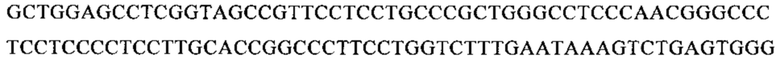
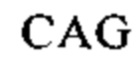 (SEQ ID NO: 27 соответствует SEQ ID NO: 1371 заявки на патент WO 2013/143700),
(SEQ ID NO: 27 соответствует SEQ ID NO: 1371 заявки на патент WO 2013/143700),
3'UTR бета-цепи гемоглобина Homo sapien (HBB)
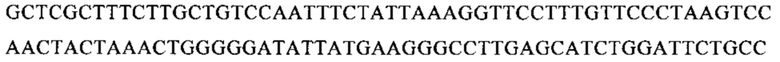
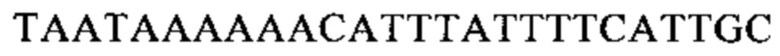 (SEQ ID NO: 28 соответствует SEQ ID NO: 1372 заявки на патент WO 2013/143700).
(SEQ ID NO: 28 соответствует SEQ ID NO: 1372 заявки на патент WO 2013/143700).
Например, 3'UTR-элемент может содержать или состоять из центральной, связывающей α-комплекс области 3'UTR гена α-глобина, такого как ген человеческого α-глобина, которая предпочтительно имеет SEQ ID NO: 29:
центральная связывающая α-комплекс область 3'UTR гена α-глобина (которую в контексте настоящего описания обозначают также как «muag») GCCCGATGGGCCTCCCAACGGGCCCTCCTCCCCTCCTTGCACCG (SEQ ID NO: 29 соответствует SEQ ID NO: 1393 заявки на патент WO 2013/143700).
В этом контексте наиболее предпочтительно, когда 3'UTR-элемент мРНК, предлагаемой в изобретении, содержит или состоит из РНК-последовательности, соответствующей нуклеотидной последовательности SEQ ID NO: 29, или ее гомолога, фрагмента или варианта.
Понятие «нуклеотидная последовательность, происходящая из 3'UTR […]-гена» предпочтительно относится к нуклеотидной последовательности, основой которой является 3'UTR-последовательность […]-гена или ее часть, например, 3'UTR гена альбумина, гена α-глобина, гена β-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена, такого как ген альфа-1-цепи коллагена типа (I), предпочтительно гена альбумина или его части. Указанное понятие включает последовательности, соответствующие полной 3'UTR-последовательности, т.е. полноразмерной 3'UTR-последовательности гена, и последовательности, соответствующие фрагменту 3'UTR-последовательности гена, например, гена альбумина, гена α-глобина, гена β-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена, такого как ген альфа-1-цепи коллагена типа (I), предпочтительно гена альбумина.
Понятие ««нуклеотидная последовательность, происходящая из варианта 3'UTR […]-гена» предпочтительно относится к нуклеотидной последовательности, основой которой является вариант 3'UTR-последовательности гена, например, вариант 3'UTR гена альбумина, гена α-глобина, гена β-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена, такого как ген альфа-1-цепи коллагена типа (I), или его части, как указано выше. Указанное понятия включают последовательности, соответствующие полной последовательности варианта 3'UTR гена, т.е. полноразмерной 3'UTR-последовательности варианта гена, и последовательности, соответствующие фрагменту варианта 3'UTR-последовательности гена. Фрагмент в этом контексте предпочтительно состоит из непрерывного нуклеотидного сегмента, соответствующего непрерывному нуклеотидному сегменту полноразмерного варианта 3'UTR, на долю которого приходится по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90% полноразмерного варианта 3'UTR. Указанный фрагмент варианта в контексте настоящего изобретения предпочтительно представляет собой функциональный фрагмент варианта, указанного в настоящем описании.
Предпочтительно по меньшей мере один 5'UTR-элемент и по меньшей мере один 3'UTR-элемент действуют синергетически в отношении повышения производства белка указанной выше мРНК, предлагаемой в изобретении.
В наиболее предпочтительном варианте осуществления изобретения предлагаемая в изобретении мРНК, содержащая кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, содержит гистоновую последовательность/структуру типа «стебель-петля». Указанные последовательности гистоновой структуры типа «стебель-петля» предпочтительно выбирают из последовательностей гистоновой структуры типа «стебель-петля», которые представлены в WO 2012/019780, содержание которой включено в настоящее описание в качестве ссылки.
Последовательность гистоновой структуры типа «стебель-петля», которую можно применять в настоящем изобретении, предпочтительно выбирают по меньшей мере из одной из следующих формул (I) или (II):
формула (I) (последовательность структуры типа «стебель-петля» без пограничных элементов стебля):
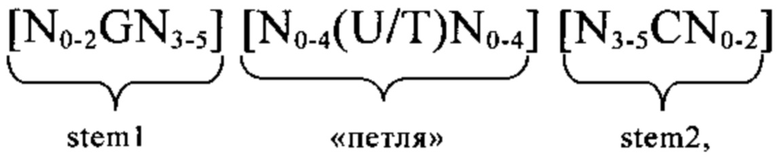
формула (II) (последовательность структуры типа «стебель-петля» с пограничными элементами стебля):
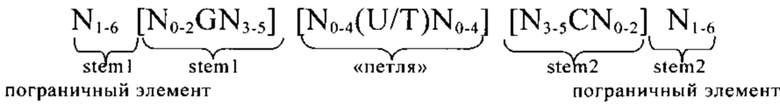 ,
,
в которых:
где
у элементов stem1 и stem2 может происходить спаривание оснований друг с другом с образованием обратно комплементарной последовательности, где спаривание оснований может иметь место между stem1 и stem2, например, посредством спаривания оснований по Уотсону-Крику нуклеотидов А и U/T или G и С, или посредством спаривания оснований не по Уотсону-Крику, например, посредством спаривания «качающихся» оснований («качающегося» спаривания оснований), обратного спариванию оснований по Уотсону-Крику, посредством хугстиновского спаривания оснований, посредством обратного хугстиновскому спаривания оснований, или у них может происходить спаривание оснований друг с другом с образованием частично обратно комплементарной последовательности, при этом неполное спаривание оснований может иметь место между stem1 и stem2, вследствие того, что для одного или нескольких оснований в одном стебле не имеется комплементарного основания в обратно комплементарной последовательности другого стебля.
Согласно другому предпочтительному варианту осуществления изобретения мРНК, предлагаемая в настоящем изобретении, может содержать или кодировать по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», соответствующую по меньшей мере одной из следующих конкретных формул (Ia) или (IIa):
формула (Ia) (последовательность структуры типа «стебель-петля» без пограничных элементов стебля):

формула (IIa) (последовательность структуры типа «стебель-петля» с пограничными элементами стебля):
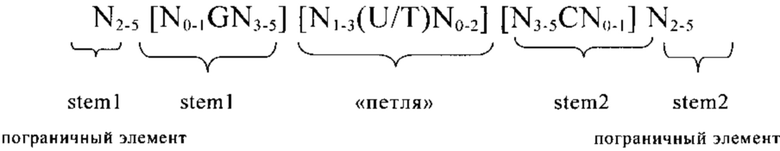 ,
,
в которой:
N, С, G, T и U имеют указанные выше значения.
Согласно другому предпочтительному варианту осуществления изобретения мРНК, предлагаемая в настоящем изобретении, может содержать или кодировать по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», соответствующую по меньшей мере одной из следующих конкретных формул (Ib) или (IIb):
формула (Ib) (последовательность структуры типа «стебель-петля» без пограничных элементов стебля):
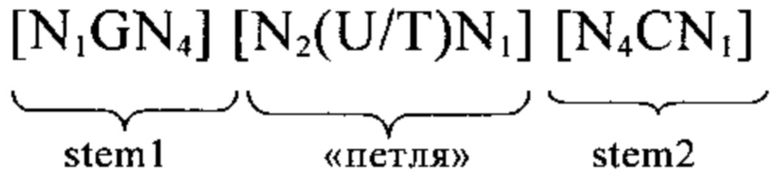
формула (IIb) (последовательность структуры типа «стебель-петля» с пограничными элементами стебля):

в которой:
N, С, G, T и U имеют указанные выше значения.
Наиболее предпочтительной последовательностью гистоновой структуры типа «стебель-петля» является последовательность, представленная в SEQ ID NO: 30 CAAAGGCTCTTTTCAGAGCCACCA, или более предпочтительно последовательность РНК, соответствующая нуклеотидной последовательности, представленной в SEQ ID NO: 30 (CAAAGGCUCUUUUCAGAGCCACCA SEQ ID NO: 37).
В конкретном предпочтительном варианте осуществления первого объекта настоящего изобретения мРНК, предлагаемая в изобретении, содержит помимо кодирующей области, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, поли(А)-последовательность, которую называют также поли-А-хвостом, предпочтительно на 3'-конце предлагаемой в изобретении мРНК. Когда она присутствует, то указанная поли(А)-последовательность содержит последовательность, содержащую от примерно 25 до примерно 400 аденозиновых нуклеотидов, предпочтительно последовательность, содержащую от примерно 50 до примерно 400 аденозиновых нуклеотидов, более предпочтительно последовательность, содержащую от примерно 50 до примерно 300 аденозиновых нуклеотидов, еще более предпочтительно последовательность, содержащую от примерно 50 до примерно 250 аденозиновых нуклеотидов, наиболее предпочтительно последовательность, содержащую от примерно 60 до примерно 250 аденозиновых нуклеотидов. В этом контексте понятие «примерно» относится к отклонению, составляющему ±10% от величины(н), к которой(ым) оно относится. Указанная поли(А)-последовательность предпочтительно локализована на 3'-конце кодирующей области, которая входит в предлагаемую в изобретении мРНК, указанную в первом объекте настоящего изобретения. Согласно другому предпочтительному варианту осуществления изобретения предлагаемую в изобретении мРНК можно модифицировать с помощью последовательности, состоящей по меньшей мере из 10 цитозинов, предпочтительно по меньшей мере из 20 цитозинов, более предпочтительно по меньшей мере из 30 цитозинов (так называемая «поли(С)-последовательность»). В частности, мРНК может содержать поли(С)-последовательность, которая, как правило, содержит примерно от 10 до 200 цитозиновых нуклеотидов, предпочтительно примерно от 10 до 100 цитозиновых нуклеотидов, более предпочтительно примерно от 10 до 70 цитозиновых нуклеотидов или еще более предпочтительно примерно от 20 до 50 или даже от 20 до 30 цитозиновых нуклеотидов. Указанная поли(С)-последовательность предпочтительно локализована на 3'-конце кодирующей области, более предпочтительно на 3'-конце необязательной поли(А)-последовательности, которая входит в предлагаемую в изобретении мРНК, указанную в первом объекте настоящего изобретения.
В этом контексте в конкретном варианте осуществления изобретения предлагаемая в изобретении последовательность мРНК может содержать:
а.) структуру 5'-кэпа, предпочтительно m7GpppN;
б.) кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ), предпочтительно происходящий из слитого белка F респираторно-синцитиального вируса (РСВ);
в.) поли(А)-последовательность, предпочтительно содержащую 64 аденозина; и
г.) необязательно поли(С)-последовательность, предпочтительно содержащую 30 цитозинов.
В наиболее предпочтительном варианте первого объекта настоящего изобретения предлагаемая в настоящем изобретении мРНК, содержащая кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, содержит предпочтительно в 5'→3'-направлении:
а.) структуру 5'-кэпа, предпочтительно m7GpppN;
б.) кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ), предпочтительно происходящий из слитого белка F респираторно-синцитиального вируса (РСВ);
в.) поли(А)-последовательность, предпочтительно содержащую 64 аденозина;
г.) необязательно поли(С)-последовательность, предпочтительно содержащую 30 цитозинов; и
д.) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 30.
В другом наиболее предпочтительном варианте первого объекта настоящего изобретения предлагаемая в настоящем изобретении мРНК, содержащая кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, содержит предпочтительно в 5'→3'-направлении:
а.) структуру 5'-кэпа, предпочтительно m7GpppN;
б.) кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ), предпочтительно происходящий из слитого белка F респираторно-синцитиального вируса (РСВ);
в.) необязательно 3'UTR-элемент, происходящий из гена альфа-глобина, предпочтительно содержащий последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO. 29, ее гомолог, фрагмент или вариант;
г.) поли(А)-последовательность, предпочтительно содержащую 64 аденозина;
д.) необязательно поли(С)-последовательность, предпочтительно содержащую 30 цитозинов; и
е.) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 30.
В другом наиболее предпочтительном варианте осуществления изобретения предлагаемая в настоящем изобретении мРНК, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, содержит предпочтительно в 5'→3'-направлении:
а.) структуру 5'-кэпа, предпочтительно m7GpppN;
б.) необязательно 5'UTR-элемент, происходящий из гена ТОР, предпочтительно происходящий из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 23, ее гомолога, фрагмента или варианта;
в.) кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ), предпочтительно происходящий из слитого белка F респираторно-синцитиального вируса (РСВ);
г.) необязательно 3'UTR-элемент, происходящий из гена, из которого получают стабильную мРНК, предпочтительно происходящий из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 25, ее гомолога, фрагмента или варианта;
д.) поли(А)-последовательность, предпочтительно содержащую 64 аденозина;
е.) необязательно поли(С)-последовательность, предпочтительно содержащую 30 цитозинов; и
ж.) гистоновую структуру типа «стебель-петля», предпочтительно содержащую соответствующую последовательность РНК нуклеотидной последовательности SEQ ID NO: 30.
Кодирующая область может кодировать по меньшей мере частично одну из аминокислотных последовательностей SEQ ID NO: 1-11 или ее фрагменты, варианты или производные. Кроме того, кодирующая область предлагаемой в изобретении мРНК может кодировать комбинацию по меньшей мере двух указанных аминокислотных последовательностей или комбинацию их фрагментов, вариантов или производных. В этом контексте наиболее предпочтительной является комбинация слитого белка F с нуклеопротеином N и комбинация слитого белка F с белком М2-1.
Кроме того, кодирующая область может представлять собой или может содержать по меньшей мере частично одну из последовательностей SEQ ID NO: 12 - SEQ ID NO: 22 или ее фрагменты, гомологи или варианты. Кроме того, мРНК может содержать комбинацию по меньшей мере двух указанных аминокислотных последовательностей или комбинацию их фрагментов, гомологов или вариантов.
Для дополнительного повышения устойчивости, например, к расщеплению in vivo (например, экзо- или эндонуклеазой), предлагаемую в изобретении мРНК можно получать в виде стабилизированной нуклеиновой кислоты, например, в форме модифицированной нуклеиновой кислоты. Таким образом, согласно дополнительному варианту осуществления изобретения предпочтительно стабилизируют предлагаемую в изобретении мРНК, предпочтительно с помощью модификаций каркаса, модификаций сахара и/или модификаций оснований, более предпочтительно путем модификации содержания G/C. Все указанные модификации можно интродуцировать в предлагаемую в изобретению мРНК без нарушения функции мРНК, которая должна транслироваться в антигенную функцию происходящего из респираторно-синцитиального вируса (РСВ) пептида или белка.
В контексте настоящего изобретения модификация каркаса предпочтительно представляет собой модификацию, при которой фосфаты каркаса нуклеотидов, входящих в предлагаемую в изобретении мРНК, химически модифицируют, например, с помощью анионной межнуклеозидной связи, N3'→P5'-модификаций, замены несвязанных мостиками атомов кислорода на бораны, нейтральной межнуклеозидной связи, амидной связи нуклеозидов, метиленовых (метиленимино) связей, формацетальных или тиоформацетальных связей, интродукции сульфонильных групп или т.п.
В контексте настоящего изобретения модификация сахара предпочтительно представляет собой химическую модификацию сахара нуклеотидов предлагаемой в изобретении мРНК, например, метилирование рибозного остатка или т.п.
Согласно другому варианту осуществления изобретения предлагаемую в изобретении мРНК можно модифицировать и тем самым стабилизировать путем модификации содержания G (гуанозин)/С (цитозина) в мРНК, предпочтительно в ее кодирующей области.
При этом содержание G/C в предлагаемой в изобретении мРНК, предпочтительно в кодирующей области, значительно повышают по сравнению с содержанием G/C в кодирующей области ее конкретной кодирующей последовательности дикого типа, т.е. в немодифицированной мРНК. Однако кодируемую аминокислотную последовательность предлагаемой в изобретении мРНК предпочтительно не модифицируют по сравнению кодируемой аминокислотной последовательностью конкретной мРНК дикого типа/немодифицированной мРНК.
Модификация содержания G/C в предлагаемой в изобретении мРНК основана на том факте, что последовательности РНК, имеющие повышенное содержание G (гуанозин)/С (цитозин), являются более стабильными, чем последовательности мРНК, имеющие повышенное содержание А (аденозин)/U (урацил). Таким образом, кодоны кодирующей области полной РНК можно изменять по сравнению с кодирующей областью дикого типа или мРНК так, чтобы они содержали большее количество G/C-нуклеотидов, с сохранением транслируемой аминокислотной последовательности. Учитывая тот факт, что несколько кодонов кодируют одну и ту же аминокислоту (так называемая вырожденность генетического кода), можно определять наиболее предпочтительные с точки зрения стабильности кодоны (так называемые альтернативные наиболее часто встречающиеся кодоны). Предпочтительно содержание G/C в кодирующей области предлагаемой в изобретении мРНК повышают по меньшей мере на 7%, более предпочтительно по меньшей мере на 15%, наиболее предпочтительно по меньшей мере на 20%, по сравнению с содержанием G/C в кодирующей области мРНК дикого типа. В конкретном варианте осуществления изобретения заменяют по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90%, 95% или даже 100% пригодных для замены кодонов в области, кодирующей белок или пептид, указанный в настоящем описании, или его фрагмент, вариант и/или производное, или всю последовательность мРНК дикого типа или кодирующую последовательность, повышая тем самым содержание G/C в указанной последовательности. В этом контексте наиболее предпочтительно повышать содержание G/C в предлагаемой в изобретении мРНК до максимума (т.е. до 100% пригодных для замещения кодонов), прежде всего в кодирующей области, по сравнению с последовательностью дикого типа.
Согласно другому предпочтительному варианту осуществления изобретения предлагаемую в изобретении мРНК оптимизируют для трансляции, предпочтительно оптимизируют для трансляции путем замены менее часто встречающихся тРНК данной аминокислоты на кодоны более часто встречающихся тРНК соответствующей аминокислоты. Это основано на открытии того факта, что эффективность трансляции определяется также различной частотой встречаемости тРНК в клетках. Так, если так называемые «менее часто встречающиеся кодоны» присутствуют в предлагаемой в изобретении мРНК в более высоком уровне, то соответствующая модифицированная РНК транслируется в существенно худшей степени, чем в случае, если присутствуют кодоны более часто встречающихся тРНК. Предпочтительно кодирующую область предлагаемой в изобретении мРНК модифицируют по сравнению с соответствующей областью РНК дикого типа или кодирующей последовательностью так, чтобы по меньшей мере один кодон последовательности дикого типа, который кодирует тРНК, которая является редкой или менее часто встречается в клетке, заменять на кодон, который кодирует тРНК, которая более или наиболее часто встречается в клетке и «несет» ту же самую аминокислоту, что и относительно редкая или менее часто встречающаяся тРНК. Путем такой модификации последовательности предлагаемой в изобретении мРНК можно модифицировать таким образом, чтобы встраивать кодоны, для которых доступны более часто встречающиеся тРНК. Другими словами, согласно изобретению с помощью такой модификации все кодоны последовательности дикого типа, которые кодируют тРНК, являющуюся относительно редкой в клетке, можно в каждом случае заменять на кодоны, которые кодируют тРНК, относительно часто встречающуюся в клетке, и которая в каждом случае «несет» такую же аминокислоту, что и относительно редкая тРНК. Кроме того, наиболее предпочтительно объединять повышение G/C-содержания в последовательности, прежде всего до максимума, в предлагаемой в изобретении мРНК с «часто встречающимися» кодонами без модификации аминокислотной последовательности белка, кодируемого кодирующей областью предлагаемой в изобретении мРНК или кодирующей области. Указанный предпочтительный вариант осуществления изобретения позволяет получать наиболее эффективно транслируемую и стабилизированную (модифицированную) предлагаемую в изобретении мРНК.
Замены, добавления или элиминации оснований предпочтительно осуществляют с использованием ДНК-матрицы для получения молекулы нуклеиновой кислоты с помощью хорошо известных методик сайтнаправленного мутагенеза или олигонуклеотидного лигирования. В указанном процессе для получения по меньшей мере одной РНК в предлагаемой в изобретении комбинированной вакцине, указанной в настоящем описании, соответственную молекулу ДНК можно транскрибировать in vitro. Указанная ДНК-матрица предпочтительно содержит пригодный промотор, например, промотор Т7 или SP6, для транскрипции in vitro, за которым располагается требуемая нуклеотидная последовательность, кодирующая по меньшей мере одну мРНК, которую нужно получить, и сигнал терминации для транскрипции in vitro. Молекулу ДНК, которая служит матрицей по меньшей мере для одной представляющей интерес РНК, можно получать путем ферментативной пролиферации и последующего выделения в виде части плазмиды, которая может реплицироваться в бактериях. Плазмиды, которые можно рассматривать в качестве приемлемых для осуществления настоящего изобретения, представляют собой, например, плазмиды рТ7Т (GenBank, регистрационный номер U26404; Lai и др., Development, 121, 1995, сс. 2349-2360), серии pGEM®, например, pGEM®-1 (GenBank, регистрационный номер Х65300; фирма Promega) и pSP64 (GenBank, регистрационный номер Х65327); ср. также Mezei и Storts, Purification of PCR Products в: PCR Technology: Current Innovation, под ред. Griffin и Griffin, изд-во CRC Press, Boca Raton, FL, 2001.
В наиболее предпочтительном варианте осуществления изобретения предлагаемая в изобретении последовательность мРНК согласно первому объекту настоящего изобретения содержит, предпочтительно в 5'→3' направлении:
а) структуру 5'-кэпа, указанную в настоящем описании, предпочтительно m7GpppN;
б) кодирующую область, предпочтительно с повышенным или даже максимальным содержанием G/C по сравнению с содержанием G/C в кодирующей области мРНК дикого типа, которая кодирует по меньшей мере один антигенный пептид или белок, происходящий из слитого белка F, гликопротеина G, короткого гидрофобного белка SH, матриксного белка М, нуклеопротеина N, большой субъединицы полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 респираторно-синцитиального вируса (РСВ), или его фрагмент, вариант или производное;
в) 3'UTR-элемент, указанный в настоящем описании, предпочтительно происходящий из гена, образующего стабильную мРНК, наиболее предпочтительно РНК-последовательности, соответствующей нуклеотидной последовательности SEQ ID NO: 29, или ее гомолога, фрагмента или варианта;
г) поли(А)-последовательность, предпочтительно состоящую из 64 аденозинов;
д) необязательно поли(С)-последовательность, состоящую из 30 цитозинов;
е) по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», предпочтительно РНК-последовательность, соответствующую нуклеотидной последовательности SEQ ID NO: 30.
Наиболее предпочтительно предлагаемая в изобретении последовательность мРНК, указанная в этом конкретном варианте осуществления изобретения, содержит модификации последовательности, представленные на фиг. 1 (SEQ ID NO: 31), приведенной в качестве примера предлагаемой в изобретении мРНК, кодирующей слитый белок F «длинного» штамма РСВ.
В другом наиболее предпочтительном варианте осуществления изобретения предлагаемая в изобретении последовательность мРНК согласно первому объекту настоящего изобретения содержит, предпочтительно в 5'→3' направлении:
а) структуру 5'-кэпа, указанную в настоящем описании, предпочтительно m7GpppN;
б) 5'UTR-элемент, указанный в настоящем описании, предпочтительно 5'UTR-элемент, который содержит или состоит из нуклеотидной последовательности, происходящей из 5'UTR ТОР-гена, предпочтительно 5'UTR человеческого белка большой субъединицы рибосомы 32, без 5'-концевого олигопиримидинового тракта, имеющего SEQ ID NO: 23, или соответствующей РНК-последовательности; или ее фрагмента, гомолога или варианта;
в) кодирующую область, предпочтительно с повышенным или даже максимальным содержанием G/C по сравнению с содержанием G/C в кодирующей области мРНК дикого типа, которая кодирует по меньшей мере один антигенный пептид или белок, происходящий из слитого белка F, гликопротеина G, короткого гидрофобного белка SH, матриксного белка М, нуклеопротеина N, большой субъединицы полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное;
г) 3'UTR-элемент, предпочтительно 3'UTR-элемент человеческого альбумина, имеющий SEQ ID NO: 24 или соответствующую РНК, или ее гомолог, фрагмент или вариант;
д) поли(А)-последовательность, предпочтительно состоящую из 64 аденозинов;
е) необязательно поли(С)-последовательность, состоящую из 30 цитозинов;
ж) по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», предпочтительно РНК-последовательность, соответствующую нуклеотидной последовательности SEQ ID NO: 30.
Наиболее предпочтительно предлагаемая в изобретении последовательность мРНК, указанная в этом конкретном варианте осуществления изобретения, содержит модификации последовательности, представленные на фиг. 2 (SEQ ID NO: 32), приведенной в качестве примера предлагаемой в изобретении мРНК, кодирующей слитый белок F «длинного» штамма РСВ.
В еще более предпочтительном варианте осуществления изобретения предлагаемая в изобретении последовательность мРНК содержит или состоит из последовательностей, представленных на фиг. 1-5. которые соответствуют SEQ ID NO: 31 и 35.
В других конкретных вариантах осуществления изобретения мРНК, предлагаемая в изобретении, может содержать также последовательность участка внутренней посадки (связывания) рибосомы (IRES) или IRES-мотива, которая может разделять несколько открытых рамок считывания, например, если предлагаемая в изобретении мРНК кодирует два или большее количество антигенных пептидов или белков. IRES-последовательность может оказаться особенно ценной, если мРНК представляет собой би- или полицистронную мРНК.
Кроме того, предлагаемую в изобретении мРНК можно получать с помощью любого метода, известного в данной области, включая методы синтеза, такие как твердофазный синтез, а также методы in vitro, такие как реакции транскрипции in vitro.
Согласно одному из вариантов осуществления настоящего изобретения мРНК, содержащую кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, можно вводить в «оголенном» виде без ассоциации с каким-либо дополнительным наполнителем, трансфектирующим или комплексообразующим агентом, предназначенным для повышения эффективности трансфекции и/или иммуностимулирующих свойств предлагаемой в изобретении мРНК, или дополнительно включенной нуклеиновой кислотой.
В предпочтительном варианте осуществления изобретения предлагаемую в изобретении мРНК можно объединять вместе с катионным или поликатионным соединением и/или с полимерным носителем. Следовательно, в конкретном варианте осуществления изобретения предпочтительно, чтобы предлагаемая в изобретении мРНК или любая другая нуклеиновая кислота, входящая в предлагаемую в изобретении фармацевтическую композицию или вакцину, была ассоциирована или включена в комплекс с катионным или поликатионным соединением или полимерным носителем, необязательно в массовом соотношении мРНК или нуклеиновой кислоты к катионному или поликатионному соединению и/или к полимерному носителю, выбранном из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас.), и наиболее предпочтительно в соотношении, составляющем от примерно 3:1 до примерно 2:1 (мас./мас.); или необязательно в соотношении азот/фосфат мРНК или нуклеиновой кислоты к катионному или поликатионному соединению и/или к полимерному носителю, в диапазоне, примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 или 0,3-1, и наиболее предпочтительно в диапазоне примерно 0,5-1 или 0,7-1, и еще более предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9. Таким образом, предлагаемая в изобретении мРНК или любая другая нуклеиновая кислота, входящая в предлагаемую в изобретении фармацевтическую композицию или вакцину, может быть ассоциирована с наполнителем, трансфектирующим или комплексообразующим агентом, предназначенным для повышения эффективности трансфекции и/или иммуностимулирующих свойств предлагаемой в изобретении мРНК, или с необязательно дополнительно включенными нуклеиновыми кислотами.
В этом контексте наиболее предпочтительными агентами для трансфекции или комплексообразования являются катионные или поликатионные соединения, включая протамин, нуклеолин, спермин или спермидин, или другие катионные пептиды или белки, такие как поли-L-лизин (ПЛЛ), полиаргинин, основные полипептиды, проникающие в клетки пептиды (СРР), включая ВИЧ-связывающие пептиды, Tat, ВИЧ-1 Tat (ВИЧ), полученные из Tat пептиды, пенетратин, полученные из VP22 пептиды или аналогичные пептиды, VP22 HSV (вирус герпеса простого), MAP, KALA или домены белковой трансдукции (PTD), РрТ620, богатые пролином пептиды, богатые аргинином пептиды, богатые лизином пептиды, MPG-пептид(ы), Рер-1, L-олигомеры, пептид(ы) кальцитонина, пептиды, полученные из Antennapedia (прежде всего, из Drosophila antennapedia), pAntp, pIsl, FGF, лактоферрин, транспортан, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, полученные из hCT пептиды, SAP или гистоны.
В этом контексте наиболее предпочтительным является протамин.
Кроме того, предпочтительные катионные или поликатионные белки или пептиды, можно выбирать из следующих белков или пептидов, которые имеют следующую общую формулу (III):
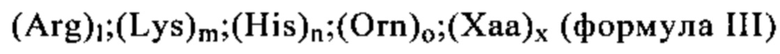 ,
,
в которой l+m+n+o+x обозначают 8-15 и l, m, n или o каждый независимо друг от друга могут представлять собой любые числа, выбранные из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по меньшей мере 50% от общего содержания аминокислот в олигопептиде; а Хаа может обозначать любую аминокислоту, выбранную из нативных (т.е. встречающихся в естественных условиях) или не встречающихся в естественных условиях аминокислот за исключением Arg, Lys, His или Orn; и x может обозначать любое число, выбранное из 0, 1, 2, 3 или 4, при условии, что общее содержание Хаа не превышает 50% от общего содержания аминокислот в олигопептиде. В этом контексте наиболее предпочтительными катионными пептидами являются, например, Arg7, Arg8, Arg9, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.д., которые описаны в WO 2009/030481, которая включена в настоящее описание в качестве ссылки.
Кроме того, предпочтительные катионные или поликатионные соединения, которые можно применять в качестве агентов для трансфекции или комплексообразования, могут включать катионные полисахариды, например, хитозан, полибрен, катионные полимеры, например, полиэтиленимин (ПЭИ), катионные липиды, например, DOTMA: хлорид [1-(2,3-сиолеилокси)пропил)]-N,N,N-триметиламмония, DMRIE, ди-С14-амидин, DOTIM, SAINT, DC-Chol, BGTC, СТАР, DOPC, DODAP, DOPE: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, DOGS: диоктадециламидоглицилспермин, DIMRI: бромид димиристооксипропилдиметилгидроксиэтиламмония, DOTAP: диолеоилокси-3-(триметиламмоний)пропан, DC-6-14: хлорид O,O-дитетрадеканоил-N-(α-триметиламмонийацетил)диэтаноламина, CLIP1: хлорид рац[(2,3-диоктадецилоксипропил)(2-гидроксиэтил)]диметиламмония, CLIP6: рац[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, например, модифицированные полиаминокислоты, такие как полимеры |3-аминокислот или обращенные полиамиды и т.п., модифицированные полиэтилены, такие как ПВП (поли-N-этил-4-винилпириднийбромид)) и т.п., модифицированные акрилаты, такие как пДМАЭМА (поли(диметиламиноэтилметилакрилат)) и т.п., модифицированные амидоамины, такие как пАМАМ (поли(амидоамин)) и т.п., модифицированные сложные поли-β-аминоэфиры (ПБАЭ), такие как модифицированные в диаминоконцевом фрагменте сополимеры 1,4-бутандиолдиакрилата и 5-амино-1-пентанола и т.п., дендримеры, такие как дендримеры полипропиламина или дендримеры на основе пАМАМ и т.п., полиимин(ы), такие как полиэтиленимин (ПЭИ), полипропиленимин и т.п., полиаллиламин, полимеры на основе сахарного каркаса, такие как полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.п., силановые полимеры, такие как сополимеры PMOXA-PDMS и т.п., блокполимеры, включающие комбинацию одного или более катионных блоков (например, выбранных из катионных полимеров, указанных выше) и одного или нескольких гидрофильных или гидрофобных блоков (таких, например, как полиэтиленгликоль) и т.п.
Полимерный носитель, применяемый согласно изобретению, может представлять собой полимерный носитель, состоящий из сшитых дисульфидами катионных компонентов. Сшитые дисульфидами катионные компоненты могут быть одинаковыми или отличными друг от друга. Полимерный носитель может содержать также другие компоненты. Наиболее предпочтительно также, чтобы полимерный носитель, применяемый согласно настоящему изобретению, содержал смеси катионных пептидов, белков или полимеров и необязательно другие компоненты, указанные в настоящем описании, которые сшиты с помощью дисульфидных связей, как указано в настоящем описании. В этом контексте содержание WO 2012/013326 включено в настоящее описание в качестве ссылки.
В этом контексте катионные компоненты, которые в результате сшивания дисульфидами формируют основу полимерного носителя, как правило, выбирают из любых пригодных катионных или поликатионных пептидов, белков или полимеров, которые можно применять для этой цели, прежде всего из любых катионных или поликатионных пептидов, белков или полимеров, которые обладают способностью образовывать комплекс с мРНК или нуклеиновой кислотой, указанной в настоящем изобретении, и тем самым предпочтительно конденсировать мРНК или нуклеиновую кислоту. Катионный или поликатионный пептид, белок или полимер предпочтительно представляет собой линейную молекулу, однако можно применять также разветвленные катионные или поликатионные пептиды, белки или полимеры.
Каждый сшитый дисульфидами катионный или поликатионный белок, пептид или полимер полимерного носителя, который можно применять для образования комплекса с предлагаемой в изобретении мРНК или любой другой нуклеиновой кислотой, входящей в предлагаемую в изобретении фармацевтическую композицию или вакцину, содержит по меньшей мере одну -SH-группу, наиболее предпочтительно по меньшей мере один цистеиновый остаток или любую другую химическую группу, несущую -SH-группу, которая способна образовывать дисульфидную связь при конденсации по меньшей мере с одним другим катионным или поликатионным белком, пептидом или полимером в качестве катионного компонента полимерного носителя, указанного в настоящем описании.
Как указано выше, полимерный носитель, который можно применять для образования комплекса с предлагаемой в изобретении мРНК или любой другой нуклеиновой кислотой, входящей в предлагаемую в изобретении фармацевтическую композицию или вакцину, может быть образован из сшитых дисульфидами катионных (или поликатионных) компонентов.
Предпочтительно указанные катионные или поликатионные пептиды или белки или полимеры полимерного носителя, которые содержат или дополнительно модифицированы так, что они содержат по меньшей мере одну -SH-группу, выбирают из белков, пептидов и полимеров, указанных выше в качестве комплексообразующего агента.
В другом конкретном варианте осуществления изобретения полимерный носитель, который можно применять для образования комплекса с предлагаемой в изобретении мРНК или любой другой нуклеиновой кислотой, входящей в предлагаемую в изобретении фармацевтическую композицию или вакцину, можно выбирать из молекулы полимерного носителя, имеющей общую форму (IV):
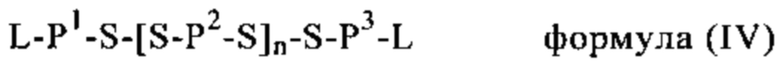 ,
,
в которой
Р1 и Р3 являются различными или идентичными друг другу и представляют собой линейную или разветвленную гидрофильную полимерную цепь, каждый Р1 и Р3 несет по меньшей мере одну -SH-группу, способную образовывать дисульфидную связь при конденсации с компонентом Р2, или альтернативно этому с (АА), (АА)x или [(AA)x]z, если указанные компоненты используют в качестве линкера между Р1 и Р2 или Р3 и Р2) и/или с другими компонентами (например, (АА), (АА)x, [(AA)x]z или L), линейную или разветвленную гидрофильную полимерную цепь, выбранную независимо друг от друга из полиэтиленгликоля (ПЭГ), поли-N-(2-гидроксипропил)метакриламида, поли-2-(метакрилоилокси)этилфосфорилхолинов, поли(гидроксиалкил-L-аспарагина), поли(2-(метакрилоилокси)этилфосфорилхолина), гидроксиэтилкрахмала или поли(гидроксиалкид-L-глутамина), где гидрофильная полимерная цепь имеет молекулярную массу от примерно 1 до примерно 100 кДа, предпочтительно от примерно 2 до примерно 25 кДа или более предпочтительно от примерно 2 до примерно 10 кДа, например, от примерно 5 до примерно 25 кДа или от 5 до примерно 10 кДа;
Р2 обозначает катионный или поликатионный пептид или белок, например, указанный выше для полимерного носителя, сформированного сшитыми дисульфидами катионными компонентами, и предпочтительно имеющий длину от примерно 3 до примерно 100 аминокислот, более предпочтительно имеющий длину от примерно 3 до примерно 50 аминокислот, еще более предпочтительно имеющий длину от примерно 3 до примерно 25 аминокислот, например, имеющий длину примерно от 3 до 10, от 5 до 15, от 10 до 20 или от 15 до 25 аминокислот, более предпочтительно имеющий длину от примерно 5 до примерно 20 и еще более предпочтительно имеющий длину от примерно 10 до примерно 20 аминокислот; или
обозначает катионный или поликатионный полимер, например, указанный выше для полимерного носителя, сформированного сшитыми дисульфидами катионными компонентами, как правило, имеющий молекулярную массу от примерно 0,5 до примерно 30 кДа, включая молекулярную массу от примерно 1 до примерно 20 кДа, еще более предпочтительно от примерно 1,5 до примерно 10 кДа, или имеющий молекулярную массу от примерно 0,5 до примерно 100 кДа, включая молекулярную массу от примерно 10 до примерно 50 кДа, еще более предпочтительно от примерно 10 до примерно 30 кДа;
каждый Р2 несет по меньшей мере две -SH-группы, способные образовывать дисульфидную связь при конденсации с другими компонентами Р2 или с компонентом(ами) Р1 и/или Р3, или альтернативно этому с другими компонентами (например, (АА), (АА)x или [(AA)x]z);
-S-S- обозначает (обратимую) дисульфидную связь (для удобочитаемости скобки опущены), в которой S предпочтительно представляет собой серу или несущую -SH группу, которая образует (обратимую) дисульфидную связь. (Обратимую) дисульфидную связь предпочтительно получают путем конденсации -SH-групп либо компонентов Р1 и Р2, либо Р2 и Р2, либо Р2 и Р3, либо необязательно других компонентов, указанных в настоящем описании (например, L, (АА), (АА)x, [(AA)x]z и т.д.); -SH-группа может представлять собой часть структуры указанных компонентов или может быть добавлена путем указанной модификации;
L обозначает необязательный лиганд, который может присутствовать или отсутствовать, и его можно выбирать независимо друг от друга из RGD, трансферрина, фолата, сигнального пептида или сигнальной последовательности, сигнала или последовательности локализации, сигнала или последовательности ядерной локализации (NLS), антитела, проникающего в клетку пептида (например, ТАТ или KALA), лиганда рецептора (например, цитокинов, гормонов, факторов роста и т.д.), малых молекул (например, углеводов типа маннозы или галактозы, или синтетических лигандов), агонистов малых молекул, ингибиторов или антагонистов рецепторов (например, аналогов RGD-пептидомиметиков) или любого другого белка, указанного в настоящем описании, и т.д.;
n обозначает целое число, как правило выбранное из диапазона примерно от 1 до 50, предпочтительно из диапазона примерно от 1, 2 или 3 до 30, более предпочтительно из диапазона примерно от 1, 2, 3, 4 или 5 до 25, или диапазона примерно от 1, 2, 3, 4 или 5 до 20, или диапазона примерно от 1, 2, 3, 4 или 5 до 15, или диапазона примерно от 1, 2, 3, 4 или 5 до 10, включая, например, диапазон примерно от 4 до 9, от 4 до 10, от 3 до 20, от 4 до 20, от 5 до 20 или от 10 до 20, или диапазон примерно от 3 до 15, от 4 до 15, от 5 до 15 или от 10 до 15, или диапазон примерно от 6 до 11 или от 7 до 10. Наиболее предпочтительно n находится в диапазоне примерно от 1, 2, 3, 4 или 5 до 10, более предпочтительно в диапазоне примерно от 1, 2, 3 или 4 до 9, в диапазоне примерно от 1, 2, 3 или 4 до 8, или в диапазоне примерно от 1, 2 или 3 до 7.
В этом контексте содержание WO 2011/026641 включено в настоящее описание в качестве ссылки. Каждый из гидрофильных полимеров Р1 и Р3, как правило, несет по меньшей мере одну -SH-группу, где по меньшей мере одна -SH-группа может образовывать дисульфидную связь при взаимодействии с компонентом Р2 или с компонентом (АА) или (АА)x, если его используют в качестве линкера между Р1 и Р2 или Р3 и Р2, как указано ниже, и необязательно с другим компонентом, например, L и/или (АА) или (АА)x, например, если он несет две или большее количество -SH-групп. Следующие подформулы «P1-S-S-Р2» и «Р2-S-S-P3» в представленной выше общей формуле (V) (для большей удобочитаемости скобки опущены), в которой все S, Р1 и Р3 имеют указанные выше значения, как правило, описывают ситуацию, когда одна -SH-группа гидрофильных полимеров Р1 и Р3 сконденсирована с одной -SH-группой компонента Р2 в представленной выше общей формуле (V), где оба атома серы в указанных -SH-группах образуют дисульфидную связь -S-S-, как указано в формуле (V). Указанные -SH-группы, как правило, присутствуют в каждом из гидрофильных полимеров Р1 и Р3, например, присутствуют в локализованном внутри него цистеине или любой другой (модифицированной) аминокислоте или соединении, которая/которое несет -SH-группу. Следовательно, подформулы «Р1-S-S-P2» и «Р2-S-S-P3» можно записать также в виде «Р1-Cys-Cys-P2» и «Р2-Cys-Cys-P3», если -SH-группа присутствует в цистеине, где понятие Cys-Cys обозначает два цистеина, сцепленных дисульфидной связью, но не пептидной связью. В этом случае понятие «-S-S-» в указанных формулах можно записать также в виде «-S-Cys», в виде «-Cys-S» или в виде «-Cys-Cys-». В этом контексте понятие «-Cys-Cys-» описывает не пептидную связь, а сцепление двух цистеинов через их -SH-группы с образованием дисульфидной связи. Таким образом, понятие «-Cys-Cys-» можно записать также в общем виде как «-(Cys-S)-(S-Cys)-», где в рассматриваемом конкретном случае S обозначает атом серы -SH-группы цистеина. Аналогично этому понятия «-S-Cys» и «-Cys-S» обозначают дисульфидную связь между содержащим -SH-группу фрагментом и цистеином, которые можно записать также как «-S-(S-Cys)» и «-(Cys-S)-S». Альтернативно этому, гидрофильные полимеры Р1 и Р3 можно модифицировать -SH-группой, предпочтительно посредством химического взаимодействия с соединением, несущим -SH-группу, так, чтобы каждый из гидрофильных полимеров Р1 и Р3 нес по меньшей мере одну -SH-группу. Такое соединение, несущее -SH-группу, может представлять собой, например, (дополнительный) цистеин или любую другую (модифицированную) аминокислоту, которая несет -SH-группу. Такое соединение может представлять собой также отличное от аминокислоты соединение или группу, которое/которая содержит или дает возможность интродуцировать -SH-группу в гидрофильные полимеры Р1 и Р3, представленные в настоящем описании. Такие отличные от аминокислот соединения можно присоединять к гидрофильным полимерам Р1 и Р3 полимерного носителя формулы (VI), предлагаемого в настоящем изобретении, посредством химических взаимодействий или путем связывания с соединениями, например, путем связывания с 3-тиопропионовой кислотой или тиоимоланом, путем образования амида (например, карбоновые кислоты, сульфоновые кислоты, амины и т.д.), путем реакции присоединения по Михаэлю (например, малеимидные группы, α,β-ненасыщенные карбонилы и т.д.), с помощью клик-химии (например, азиды или алкины), с помощью метатезиса алкенов/алкинов (например, алкены или алкины), формирования иминов или гидрозонов (альдегиды или кетоны, гидразины, гидроксиламины, амины), реакций комплексообразования (авидин, биотин, белок G) или с компонентами, которые допускают реакции замещения Sn-типа (например, галогеналканы, тиолы, спирты, амины, гидразины, гидразиды, эфиры сульфоновых кислот, соли оксифосфония) или другими химическими группами, которые можно использовать для присоединения других компонентов. В этом контексте наиболее предпочтительным производным ПЭГ является альфа-метокси-омега-меркапто-поли(этиленгликоль). В каждом случае SH-группа, например, цистеина или любой другой (модифицированной) аминокислоты или соединения, может присутствовать на концах или в любом положении внутри гидрофильных полимеров Р1 и Р3. Как указано в настоящем описании, каждый из гидрофильных полимеров Р1 и Р3, как правило, несет по меньшей мере одну -SH-группу, предпочтительно на одном конце, но может содержать также две или даже большее количество -SH-групп, которые можно использовать для дополнительного присоединения других компонентов, указанных в настоящем описании, предпочтительно других функциональных пептидов или белков, например, лиганда, аминокислотного компонента (АА) или (АА)x, антител, проникающих в клетку пептидов или энхансерных пептидов (например, ТАТ, KALA) и т.д.
В этом контексте наиболее предпочтительно, если предлагаемая в изобретении мРНК образует комплекс по меньшей мере частично с катионным или поликатионным соединением и/или полимерным носителем, предпочтительно катионными белками или пептидами. В этом контексте содержание WO 2010/037539 и содержание WO 2012/113513 включены в настоящее описание в качестве ссылки. «Частично» означает, что только часть предлагаемой в изобретении мРНК входит в состав комплекса с катионным соединением и что остальная предлагаемая в изобретении мРНК (входящая в предлагаемую в изобретении фармацевтическую композицию или вакцину) не входит в состав комплекса (т.е. находится в «свободной» форме). Предпочтительно соотношение входящая в комплекс мРНК : свободная мРНК (в предлагаемой в изобретении фармацевтической композиции или вакцине) выбирают из диапазона от примерно 5:1 до примерно 1:10 (мас./мас.), более предпочтительно из диапазона от примерно 4:1 до примерно 1:8 (мас./мас.), еще более предпочтительно из диапазона от примерно 3:1 до примерно 1:5 (мас./мас.) или 1:3 (мас./мас.), и наиболее предпочтительно соотношение входящая в комплекс мРНК : свободная мРНК в предлагаемой в изобретении фармацевтической композиции или вакцине, выбирают из соотношения, составляющего примерно 1:1 (мас./мас.).
Входящую в комплекс мРНК, предлагаемую в изобретении, содержащуюся в предлагаемой в изобретении фармацевтической композиции или вакцине, предпочтительно получают, формируя на первой стадии комплекс предлагаемой в изобретении мРНК с катионным или поликатионным соединением и/или с полимерным носителем, предпочтительно указанным в настоящем описании, в определенном соотношении для создания стабильного комплекса. В этом контексте наиболее предпочтительно, чтобы после включения в комплекс мРНК не оставалось свободного катионного или поликатионного соединения, или полимерного носителя или чтобы оно/он присутствовал лишь в незначительном количестве в компоненте, содержащем включенную в комплекс мРНК. Следовательно, соотношение между мРНК и катионным или поликатионным соединением и/или полимерным носителем в компоненте, представляющем собой включенную в комплекс мРНК, как правило, выбирают таким образом, чтобы мРНК была полностью включена в комплекс и чтобы в композиции не оставалось свободного катионного или поликатионного соединения, или полимерного носителя, или чтобы оно/он присутствовал лишь в незначительном количестве.
Предпочтительно соотношение между мРНК и катионным или поликатионным соединением и/или полимерным носителем, предпочтительно указанным в настоящем описании, выбирают из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас.), и наиболее предпочтительно соотношение составляет от примерно 3:1 до примерно 2:1 (мас./мас.). Альтернативно этому соотношение между мРНК и катионным или поликатионным соединением и/или полимерным носителем, предпочтительно, указанным в настоящем описании, в компоненте, содержащем включенную в комплекс мРНК, можно рассчитывать также на основе соотношения азот/фосфат (N/P-соотношение) для всего комплекса. В контексте настоящего изобретения N/P-соотношение предпочтительно находится в диапазоне примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 и наиболее предпочтительно диапазоне примерно 0,5-2 или 0,7-2 касательно соотношения катионное или поликатионное соединение и/или полимерный носитель: мРНК в комплексе, предпочтительно, указанном в настоящем описании, и наиболее предпочтительно в диапазоне примерно 0,7-1,5, 0,5-1 или 0,7-1, и еще наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9, предпочтительно при условии, что катионное или поликатионное соединение в комплексе представляет собой катионный или поликатионный белок, или пептид и/или полимерный носитель, указанный выше. В этом конкретном варианте осуществления изобретения включенная в комплекс мРНК подпадает также под понятие «адъювантный компонент».
Другим объектом изобретения является композиция, содержащая несколько или больше одной, предпочтительно от 2 до 10, более предпочтительно от 2 до 5, наиболее предпочтительно от 2 до 4 предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании. Такие указанные в изобретении композиции содержат более одной предлагаемой в изобретении последовательности мРНК, которые предпочтительно кодируют различные пептиды или белки, содержащие предпочтительно различные патогенные антигены или их фрагменты, варианты или производные. Наиболее предпочтительным в этом контексте является то, что по меньшей мере одна последовательность мРНК кодирует по меньшей мере один антигенный пептид или белок, происходящий из слитого белка F респираторно-синцитиального вируса (РСВ) и что по меньшей одна последовательность мРНК кодирует по меньшей мере один антигенный пептид или белок, происходящий из другого антигена респираторно-синцитиального вируса (РСВ), прежде всего нуклеопротеина N или белка М2-1.
В этом контексте наиболее предпочтительными комбинациями антигенов являются:
- F+G (серотип А) + G (серотип В)
- F+G (серотип А) + G (серотип В) + М2-1
- F+G (серотип А) + G (серотип В) + N
- F+G (серотип А) + G (серотип В) + N + М2-1
- F + М2-1 + N
- F + М2-1
- F+N
- F+G (серотип А) + G (серотип В) + N + М2-1 + Р + М2-2 + М+L
- F+G (серотип А) + G (серотип В) + N + М2-1 + Р + М2-2 + М
- F+G (серотип А) + G (серотип В) + N + М2-1 + Р + М2-2 + L
- F+G (серотип А) + G (серотип В) + N + М2-1 + Р + М+L
- F+G (серотип А) + G (серотип В) + N + М2-1 + М2-2 + М+L
- F+G (серотип А) + G (серотип В) + N + Р + М2-2 + М+L
- F+G (серотип А) + G (серотип В) + М2-1 + Р + М2-2 + М+L.
Таким образом, следующим наиболее предпочтительным объектом настоящего изобретения является также фармацевтическая композиция, которая содержит по меньшей мере одну предлагаемую в изобретении последовательность мРНК, указанную в настоящем описании, или предлагаемую в изобретении композицию, содержащую несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании, и необязательно фармацевтически приемлемый носитель и/или наполнитель.
В качестве первого ингредиента предлагаемая в изобретении фармацевтическая композиция содержит по меньшей мере одну предлагаемую в изобретении последовательность мРНК, указанную в настоящем описании.
В качестве второго ингредиента предлагаемая в изобретении фармацевтическая композиция может необязательно содержать по меньшей мере один дополнительный фармацевтически активный компонент. В этом контексте фармацевтически активный компонент представляет собой соединение, которое обладает терапевтическим действием с позиций лечения, облегчения или предупреждения конкретного показания или заболевания, указанного в настоящем описании, предпочтительно вызываемых РСВ инфекций. Указанные соединения включают (но, не ограничиваясь только ими) пептиды или белки, предпочтительно указанные в настоящем описании, нуклеиновые кислоты, предпочтительно указанные в настоящем описании, (терапевтически активные) низкомолекулярные органические или неорганические соединения (с молекулярной массой менее 5000, предпочтительно менее 1000), сахара, антигены или антитела, предпочтительно указанные в настоящем описании, терапевтические средства, уже известные из существующего уровня техники, антигенные клетки, антигенные клеточные фрагменты, клеточные фракции; компоненты клеточной оболочки (например, полисахариды), модифицированные, ослабленные или деактивированные (например, химически или путем облучения) патогены (вирус, бактерии и т.д.), адъюванты, предпочтительно указанные в настоящем описании, и т.д. Наиболее предпочтительными в этом контексте являются вакцины на основе РСВ или иммуноглобулинов против РСВ, например, паливизумаб (Synagis®).
Предлагаемую в изобретении фармацевтическую композицию можно вводить орально, парентерально, с помощью спрея для ингаляции, местно, ректально, назально, трансбуккально, вагинально или с помощью имплантируемого резервуара. Понятие «парентеральный» в контексте настоящего описания включает подкожную, внутривенную, внутримышечную, внутрисуставную, интрасиновиальную, надчревную, внутриоболочечную, внутрипеченочную, в пораженный участок, внутричерепную, трансдермальную, внутрикожную, внутрилегочную, внутрибрюшинную, внутрисердечную, внутриартериальную и подъязычную инъекцию или инфузию.
Наиболее предпочтительной является внутрикожная и внутримышечная инъекция. Стерильные инъецируемые формы предлагаемых в изобретении фармацевтических композиций могут представлять собой водную или масляную суспензию. Такие суспензии можно приготавливать с помощью методов, известных в данной области, с использованием пригодных диспергирующих или смачивающих агентов или суспендирующих агентов.
В предпочтительном варианте осуществления изобретения предлагаемую в изобретении фармацевтическую композицию вводят с помощью внутрикожной или внутримышечной инъекции, предпочтительно с использованием общепринятой техники на основе игольной инъекции или с использованием безыгольной системы, например, струйной инъекции. В другом предпочтительном варианте осуществления изобретения предлагаемую в изобретении фармацевтическую композицию можно вводить с помощью струйной инъекции, представленной в настоящем описании. Предпочтительно предлагаемую в изобретении фармацевтическую композицию можно вводить внутримышечно с помощью струйной инъекции. Согласно другому варианту осуществления изобретения фармацевтическую композицию вводят внутрикожно с помощью струйной инъекции.
В предпочтительном варианте осуществления изобретения фармацевтическую композицию можно вводить один, два или три раза, предпочтительно с помощью внутрикожной или внутримышечной инъекции, предпочтительно струйной инъекции. Согласно конкретному варианту осуществления изобретения одного введения предлагаемой в изобретении фармацевтический композиции, предпочтительно с использованием внутрикожной или внутримышечной инъекции, предпочтительно с помощью струйной инъекции, достаточно для вызывания иммунного ответа против по меньшей мере одного антигена, кодируемого последовательностью мРНК, предлагаемой в изобретении. В предпочтительном варианте осуществления изобретения одно введение фармацевтической композиции вызывает иммунный ответ, который приводит к нейтрализации вируса. В этом контексте наиболее предпочтительной является одна единичная внутрикожная или внутримышечная инъекция фармацевтической композиции. Предпочтительно необязательно можно осуществлять дополнительные введения фармацевтической композиции для повышения и/или пролонгирования иммунного ответа.
Согласно конкретному варианту осуществления изобретения предлагаемая в изобретении фармацевтическая композиция может содержать адъювант. В этом контексте под адъювантом можно понимать любое соединение, которое может инициировать или повышать иммунный ответ врожденной иммунной системы, т.е. неспецифический иммунный ответ. Другими словами, предлагаемая в изобретении фармацевтическая композиция, когда ее вводят, предпочтительно вызывает врожденный иммунный ответ благодаря адъюванту, который необязательно содержится в ней. Предпочтительно указанный адъювант можно выбирать из адъювантов, известных специалисту в данной области и пригодных для рассматриваемого случая, т.е. для поддержания индукции врожденного иммунного ответа у млекопитающего, например, выбирать из адъювантного белка, описанного выше, или адъюванта, указанного ниже.
Наиболее предпочтительными в качестве адъювантов, пригодных для запасания и доставки являются катионные или поликатионные соединения, описанные выше в качестве наполнителя, агента для трансфекции или комплексообразования для предлагаемой в изобретении последовательности мРНК.
Кроме того, предлагаемая в изобретении фармацевтическая композиция может содержать один или несколько дополнительных адъювантов, пригодных для инициации или усиления иммунного ответа врожденной иммунной системы, т.е. неспецифического иммунного ответа, прежде всего посредством связывания с патоген-ассоциированными молекулярными паттернами (РАМР). Другими словами, при введении фармацевтическая композиция или вакцина предпочтительно вызывает врожденный иммунный ответ благодаря адъюванту, который необязательно содержится в ней. Предпочтительно указанный адъювант можно выбирать из адъювантов, известных специалисту в данной области и пригодных для рассматриваемого случая, т.е. для поддержания индукции врожденного иммунного ответа у млекопитающего, например, из адъювантного белка, описанного выше, или адъюванта, указанного ниже. Согласно одному из вариантов осуществления изобретения указанный адъювант можно выбирать из указанного ниже адъюванта.
Кроме того, указанный адъювант можно выбирать из адъюванта, известного специалисту в данной области и пригодного для рассматриваемого случая, т.е. для поддержания индукции врожденного иммунного ответа у млекопитающего и/или пригодного для запасания и доставки компонентов предлагаемой в изобретении фармацевтической композиции или вакцины. Предпочтительными в качестве пригодных для запасания и доставки адъювантов, являются катионные или поликатионные соединения, указанные выше. Аналогично этому, адъювант можно выбирать из группы, состоящей, например, из катионных или поликатионных соединений, указанных выше, таких как хитозан, TDM, MDP, мурамилдипептид, плюроники, раствор квасцов, гидроксид алюминия, ADJUMER™ (полифосфазен); гель фосфата алюминия; глюканы, выделенные из водорослей; алгаммулин; гель гидроксида алюминия (квасцы); высокоадсорбирующий белки гель гидроксида алюминия; обладающий низкой вязкостью гель гидроксида алюминия; AF или SPT (эмульсия, содержащая сквалан (5%), Твин 80 (0.2%), плюроник L121 (1,25%), забуференный фосфатом физиологический раствор, pH 7,4); AVRIDINE™ (пропандиамин); BAY R1005™ ((N-(2-дезокси-2-L-леуциламиноб-D-глюкопиранозил)-N-октадециламида гидроацетат); CALCITRIOL™ (1-альфа,25-дигидрокси-витамин D3); гель фосфата кальция; САР™ (наночастицы фосфата кальция); холерный голотоксин, слитый белок холерный токсин-А1-белок-A-D-фрагмент, субъединица В холерного токсина; CRL 1005 (блок-сополимер Р1205); содержащие цитокин липосомы; DDA (диметилдиоктадециламмония бромид); DHEA (дегидроэпиандростерон); DMPC (димиристоилфосфатидилхолин); DMPG (димиристоилфосфатидилглицерин); комплекс DOC/квасцы (натриевая соль дезоксихолиновой кислоты); полный адъювант Фрейнда; неполный адъювант Фрейнда; инулин-гамма; адъювант Гербу (смесь, содержащая: I) N-ацетилглюкозаминил-(Р1-4)-N-ацетилмурамоил-L-аланил-D35 глутамин (GMDP), II) диметилдиоктадециламмония хлорид (DDA), III) комплекс цинк-соль L-пролина (ZnPro-8); GM-CSF); GMDP (N-ацетилглюкозаминил-(b1-4)-N-ацетилмурамил-L47 аланил-D-изоглутамин); имиквимод (1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин); ImmTher™ (N-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-изоGlu-L-Ala-глицерина дипальмитат); DRV (иммунолипосомы, приготовленные из везикул, полученных методом гидратации-регидратации); интерферон-гамма; интерлейкин-1бета; интерлейкин-2; интерлейкин-7; интерлейкин-12; ISCOMSTM; ISCOPREP 7.0.3. ТМ; липосомы; LOXORIBINE™ (7-аллил-8-оксогуанозин); оральный адъювант LT 5 (лабильный энтеротоксин-протоксин из E. coli); микросферы и микрочастицы любого состава; MF59TM; (водная эмульсия сквалена); MONTANIDE ISA 51™ (очищенный неполный адъювант Фрейнда); MONTANIDE ISA 720™ (метаболизируемый масляный адъювант); MPL™ (3-Q-дезацил-4'-монофосфорил-липид А); липосомы МТР-РЕ и МТР-РЕ ((N-ацетил-L-аланил-D-изоглутаминил-L-аланин-2-(1,2-дипальмитоил-sn-глицеро-3-(гидроксифосфорилокси))этиламид, однонатриевая соль); MURAMETIDE™ (Nac-Mur-L-Ala-D-Gln-OCH3); MURAPALMITINE™ и DMURAPALMITINE™ (Nac-Mur-L-Thr-D-изoGIn-sn-глицериндипальмитоил); NAGO (нейраминидаза-галактозооксидаза); наносферы или наночастицы любого состава; NISV (везикулы из неионогенного поверхностно-активного вещества); PLEURAN™ (β-глюкан); PLGA, PGA и PLA (гомо- и сополимеры молочной кислоты и гликолевой кислоты; микросферы/наносферы); ПЛЮРОНИК L121™; РММА (полиметилметакрилат); PODDS™ (протеноидные микросферы); полиэтиленкарбаматные производные; поли-rA : поли-rU (комплекс полиадениловая кислота-полиуридиновая кислота); полисорбат 80 (Твин 80); белковые кохлеаты (фирма Avanti Polar Lipids, Inc., Алабастер, шт. Алабама); STIMULON™ (QS-21); Quil-A (сапонин Quil-A); S-28463 (4-аминоотекдиметил-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-1-этанол); SAF-1™ («композиция адъювантов фирмы Syntex»); протеолипосомы вируса Сендаи и липидные матрицы, содержащие вирус Сендаи; Спан-85 (сорбитантриолеат); Specol (эмульсия Marcol 52, Спан 85 и Твин 85); сквален или Robane® (2,6,10,15,19,23-гексаметилтетракозан и 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексан); стеарилтирозин (октадецилтирозина гидрохлорид); Theramid® (N-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-isoGlu-L-Ala-дипальмитоксипропиламид); Theronyl-MDP (Termurtide™ или [thr 1]-MDP; N-ацетилмурамил-L-треонил-D-изоглутамин); Ту-частицы (Ту-ВПЧ или вирусоподобные частицы); липосомы Уолтера-Рида (липосомы, содержащие липид А, адсорбированный на гидроксиде алюминия) и липопептиды, включая Pam3Cys, прежде всего соли алюминия, такие как адъю-фос (Adju-phos), алгидрогель, регидрагель и т.д., эмульсии, такие как CFA, SAF, IFA, MF59, провакс, TiterMax, монтанид, ваксфектин и т.д., сополимеры, такие как оптивакс (Optivax, CRL1005), L121, полоксамер 4010) и т.д., липосомы, такие как «липосомы-невидимки (Stealth)» и т.д., кохлеаты, такие как BIORAL, и т.д., адъюванты растительного происхождения, такие как QS21, Quil A, Iscomatrix, ISCOM; адъюванты, пригодные для костимуляции, включая томатин, биополимеры, такие как PLG, РММ, инулин и т.д., адъюванты микробного происхождения, такие как ромуртид, DETOX, MPL, CWS, манноза, нуклеотидные последовательности CpG, CpG7909, лиганды человеческого TLR 1-13, ISS-1018, 35 IC31, имидазохинолины, амплиген, Ribi529, IMOxine, IRIV, ВПЧ, холерный токсин, термолабильный токсин, Pam3Cys, флагеллин, GPI (гликозилфосфатидилинозитол)-якорь, LNFPIII/Lewis X, противомикробные пептиды, UC-1V150, слитый белок RSV, cdiGMP; и адъюванты, пригодные в качестве антагонистов, включая нейропептид CGRP.
Адъювант наиболее предпочтительно выбирают из адъювантов, которые поддерживают индукцию Th1-иммунного ответа или созревание наивных Т-клеток, таких как GM-CSF, IL-12, IFNg, любой иммуностимулирующей нуклеиновой кислоты, указанной выше, предпочтительно иммуностимулирующей РНК, ДНК CpG и т.д.
Согласно другому предпочтительному варианту осуществления изобретения предлагаемая в изобретении фармацевтическая композиция может содержать помимо образующей антиген мРНК также другие компоненты, которые выбирают из группы, включающей: другие антигены или другие образующие антиген нуклеиновые кислоты; другой иммунотерапевтический агент; одну или несколько вспомогательных субстанций; или любое другое соединение, в отношении которого известно, что оно обладает иммуностимулирующим действием благодаря его аффинности связывания (как лиганда) с человеческими Толл-подобными рецепторами; и/или адъювантную нуклеиновую кислоту, предпочтительно иммуностимулирующую РНК (isРНК).
Предлагаемая в изобретении фармацевтическая композиция может дополнительно содержать одну или несколько вспомогательных субстанций, предназначенных для повышения при необходимости иммуногенности или иммуностимулирующей способности. Тем самым предпочтительно достигается синергетическое действие предлагаемой в изобретении последовательности мРНК, представленной в настоящем описании, и вспомогательной субстанции, которая необязательно может содержаться в предлагаемой в изобретении фармацевтической композиции. В зависимости от различных типов вспомогательных субстанций в этом контексте можно рассматривать различные механизмы. Например, соединения, ускоряющие созревание дендритных клеток (ДК), например липополисахариды, TNF-альфа или лиганд CD40, образуют первый класс пригодных вспомогательных веществ. В целом, в качестве вспомогательного вещества можно использовать любой агент, который оказывает влияние на иммунную систему, по механизму «сигнала опасности» (LPS, GP96, и т.п.), или можно использовать цитокины, такие как GM-CSF, которые позволяют целенаправленно усиливать иммунный ответ или целенаправленно влиять на него. Наиболее предпочтительными вспомогательными веществами являются цитокины, такие как монокины, лимфокины, интерлейкины или хемокины, которые дополнительно стимулируют врожденный иммунный ответ, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, INF-альфа, IFN-бета, INF-гамма, GM-CSF, G-CSF, M-CSF, LT-бета или TNF-альфа, факторы роста, такие как hGH.
Другими добавками, которые можно включать в состав фармацевтической композиции, предлагаемой в изобретении, являются эмульгаторы, такие, например, как Tween®; смачивающие вещества, такие, например, как лаурилсульфат натрия; красители; улучшающие вкус вещества; фармацевтические носители; наполнители для приготовления таблеток; стабилизаторы; антиоксиданты; консерванты.
Предлагаемая в изобретении фармацевтическая композиция может содержать также любое дополнительное соединение, у которого известна способность оказывать иммуностимулирующее действие в результате его аффинности связывания (в качестве лиганда) с человеческими Толл-подобными рецепторами TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10 или в результате его аффинности связывания (в качестве лиганда) с мышиными Толл-подобными рецепторами TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13.
В этом контексте наиболее предпочтительно, чтобы необязательно входящий в ее состав адъювантный компонент содержал такую же предлагаемую в изобретении мРНК, которая входит в предлагаемую в изобретении фармацевтическую композицию в качестве образующей антиген мРНК, например, мРНК, которая кодирует антигенный пептид или белок, который присутствует при заражении респираторно-синцитиальным вирусом (РСВ), или его фрагменты, варианты или производные.
Кроме того, предлагаемая в изобретении фармацевтическая композиция может дополнительно содержать компоненты, которые ускоряют введение и поглощение компонентов фармацевтической композиции. Указанные дополнительные компоненты могут представлять собой соответствующий носитель или наполнитель, дополнительные адъюванты, поддерживающие любой иммунный ответ, антибактериальные и/или противовирусные агенты.
Таким образом, в другом варианте осуществления изобретения предлагаемая в изобретении фармацевтическая композиция содержит также фармацевтически приемлемый носитель и/или наполнитель.
Указанный фармацевтически приемлемый носитель, как правило, включает жидкую или нежидкую основу композиции, содержащую компоненты предлагаемой в изобретении фармацевтической композиции. Если композиция находится в жидкой форме, то носитель, как правило, может представлять собой свободную от пирогенов воду; изотонический соляной раствор или забуференные (водные) растворы, например, растворы, забуференные фосфатом, цитратом и т.д. Предназначенный для инъекции буфер может быть гипертоническим, изотоническим или гипотоническим относительно конкретной референс-среды, т.е. содержание в буфере солей может быть выше, идентичным или ниже их содержания в конкретной референс-среде, при этом предпочтительно можно применять такие концентрации вышеуказанных солей, которые не приводят к повреждению клеток в результате осмоса или других связанных с концентрацией воздействий. Референс-среды могут представлять собой, например, жидкости, применяемые в методах «in vivo», такие как кровь, лимфа, цитозольные жидкости или другие жидкости организма, или, например, жидкости, которые можно использовать в качестве референс-сред в методах «in vitro», такие как обычные буферы или жидкости. Указанные обычные буферы или жидкости известны специалисту в данной области. Наиболее предпочтительной жидкой основой является лактированный раствор Рингера.
Однако в предлагаемой в изобретении фармацевтической композиции можно использовать также один или несколько совместимых твердых или жидких наполнителей или разбавителей или капсулирующих соединений, которые можно применять для введения пациенту, подлежащему лечению. Понятие «совместимые» в контексте настоящего описания означает, что указанные компоненты предлагаемой в изобретении фармацевтической композиции можно смешивать с компонентами предлагаемой в изобретении фармацевтической композиции таким образом, чтобы не происходило взаимодействие, которое могло бы существенно снижать фармацевтическую эффективность фармацевтической композиции в обычных условиях применения.
Дополнительным компонентом предлагаемой в изобретении фармацевтической композиции может быть иммунотерапевтический агент, который можно выбирать из иммуноглобулинов, предпочтительно IgG-типа, моноклональных или поликлональных антител, поликлональной сыворотки или сывороток и т.д., наиболее предпочтительно из иммуноглобулинов против респираторно-синцитиального вируса (РСВ), например, пализимумаба. Предпочтительно указанный дополнительный иммунотерапевтический агент может находиться в виде пептида/белка или может кодироваться нуклеиновой кислотой, предпочтительно ДНК или РНК, наиболее предпочтительно мРНК. Указанный иммунотерапевтический агент позволяет осуществлять пассивную вакцинацию в дополнение к активной вакцинации, которая запускается предлагаемой в изобретении образующей антиген мРНК.
Кроме того, согласно конкретному варианту осуществления изобретения помимо образующей антиген мРНК в предлагаемую в изобретении фармацевтическую композицию можно включать дополнительные антигены, и они, как правило, представляют собой такие субстанции как клетки, клеточные лизаты, вирусы, ослабленные вирусы, инактивированные вирусы, белки, пептиды, нуклеиновые кислоты или другие био- или макромолекулы или их фрагменты. Предпочтительно антигены могут представлять собой белки и пептиды или их фрагменты, такие как эпитопы указанных белков или пептидов, предпочтительно содержащие от 5 до 15, более предпочтительно от 6 до 9 аминокислот. В частности, указанные белки, пептиды или эпитопы могут происходить из слитого белка F, гликопротеина G, гидрофобного белка SH, матриксного белка М, нуклеопротеина N, большой полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 респираторно-синцитиального вируса (РСВ) или из их фрагментов, вариантов или производных. Кроме того, антигены могут содержать также любую другую биомолекулу, например, липиды, углеводы и т.д. Предпочтительно антиген представляет собой белок или (поли-)пептидный антиген, нуклеиновую кислоту, нуклеиновую кислоту, которая кодирует белковый или (поли-)пептидный антиген, полисахаридный антиген, конъюгат полисахаридного антигена, липидный антиген, гликолипидный антиген, углеводный антиген, бактерию, клетку (вакцина) или убитый или ослабленный вирус.
Предлагаемая в изобретении фармацевтическая композиция или вакцина, указанная в настоящем описании, может содержать также другие добавки или дополнительные соединения. Другие добавки, которые можно включать в фармацевтическую композицию, представляют собой эмульгаторы, такие, например, как Iween®; смачивающие вещества, такие, например, как лаурилсульфат натрия; красители; улучшающие вкус вещества; фармацевтические носители; наполнители для приготовления таблеток; стабилизаторы; антиоксиданты; консерванты; ингибиторы РНКазы и/или противобактериальный или антивирусный агент. Кроме того, предлагаемая в изобретении фармацевтическая композиция может содержать малую интерферирующую РНК (siРНК), мишенью которой являются гены респираторно-синцитиального вируса (РСВ), например, siРНК, мишенью которой являются гены, которые кодируют слитый белок F, гликопротеин G, гидрофобный белок SH, матриксный белок М, нуклеопротеин N, большую полимеразу L, белок М2-1, белок М2-2, фосфопротеин Р, неструктурный белок NS1 или неструктурный белок NS2 респираторно-синцитиального вируса (РСВ). Предлагаемая в изобретении фармацевтическая композиция, как правило, содержит в «безопасном и эффективном количестве» компоненты предлагаемой в изобретении фармацевтической композиции, прежде всего предлагаемую(ые) в изобретении последовательность(и) мРНК, указанной(ых) в настоящем описании. В контексте настоящего описания под «безопасным и эффективным количеством» подразумевается количество предлагаемой(ых) в изобретении последовательности(ей) мРНК, указанной(ых) в настоящем описании, которое является достаточным для значимой индукции положительной модификации или предупреждения заболевания или нарушения, указанного в настоящем описании. Однако в то же время «безопасное и эффективное количество» является достаточно небольшим, чтобы избегать серьезных побочных действий и обеспечивать разумное соотношение между преимуществом и риском. Определение этих пределов, как правило, находится в компетенции осуществляющего лечение врача.
Предлагаемую в изобретении фармацевтическую композицию можно применять для лечения человека, а также для целей медицинской ветеринарии, предпочтительно в медицине для лечения человека в общем случае в виде фармацевтической композиции или в виде вакцины.
Согласно другому наиболее предпочтительному объекту изобретения предлагаемую в изобретении фармацевтическую композицию (или предлагаемую в изобретении последовательность мРНК, указанную в настоящем описании, или предлагаемую в изобретении композицию, содержащую несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании) можно получать или применять в качестве вакцины. Как правило, указанная вакцина представляет собой вакцину, указанную выше при описании фармацевтической композиции. Кроме того, указанная вакцина, как правило, содержит предлагаемую в изобретении последовательность мРНК, указанную в настоящем описании, или предлагаемую в изобретении композицию, которая содержит несколько предлагаемых в изобретении последовательностей мРНК, предлагаемых в настоящем описании.
Предлагаемая в изобретении вакцина может содержать также фармацевтически приемлемый носитель, адъювант и/или наполнитель, указанные в настоящем описании для предлагаемой в изобретении фармацевтической композиции. В конкретном варианте предлагаемой в изобретении вакцины выбор фармацевтически приемлемого носителя определяют в основном в зависимости от пути введения предлагаемой в изобретении вакцины. Предлагаемую в изобретении вакцину можно применять, например, системно или локально. Пути системного введения в целом включают, например, трансдермальный, оральный, парентеральный пути, включая подкожные, внутривенные, внутримышечные, внутриартериальные, внутрикожные и внутрибрюшинные инъекции и/или интраназальный путь введения. Пути локального применения в целом включают, например, местные пути нанесения, но также и внутрикожные, чрескожные, подкожные или внутримышечные инъекции или инъекции в область повреждения, внутричерепную, внутрилегочную, внутрисердечную и подъязычную инъекции. Более предпочтительно вакцины можно применять внутрикожным, подкожным или внутримышечным путем. Таким образом, предлагаемые в изобретении вакцины предпочтительно приготавливать в форме жидкости (или иногда в твердой форме).
В предпочтительном варианте осуществления изобретения предлагаемую в изобретении вакцину вводят посредством внутрикожной или внутримышечной инъекции, предпочтительно с использованием общепринятой техники на основе игольной инъекции или с использованием безыгольной системы, например, струйной инъекции. В другом предпочтительном варианте осуществления изобретения предлагаемую в изобретении вакцину можно вводить с помощью струйной инъекции, представленной в настоящем описании. Предпочтительно предлагаемую в изобретении вакцину вводят внутримышечно с помощью струйной инъекции. Согласно другому варианту осуществления изобретения вакцину вводят внутрикожно с помощью струйной инъекции.
В предпочтительном варианте осуществления изобретения вакцину можно вводить один, два или три раза, предпочтительно с помощью внутрикожной или внутримышечной инъекции, предпочтительно струйной инъекции. Согласно конкретному варианту осуществления изобретения одного введения предлагаемой в изобретении вакцины, предпочтительно с использованием внутрикожной или внутримышечной инъекции, предпочтительно с использованием струйной инъекции, достаточно для вызывания иммунного ответа против по меньшей мере одного антигена, кодируемого последовательностью мРНК, предлагаемой в изобретении. В предпочтительном варианте осуществления изобретения одно введение вакцины вызывает иммунный ответ, который приводит к нейтрализации вируса. В этом контексте наиболее предпочтительной является одна единичная внутрикожная или внутримышечная инъекция вакцины. Предпочтительно необязательно можно осуществлять дополнительные введения вакцины для повышения и/или пролонгирования иммунного ответа.
Предлагаемая в изобретении вакцина может дополнительно содержать одну или несколько вспомогательных субстанций, предназначенных для повышения при необходимости иммуногенности или иммуностимулирующей способности. Наиболее предпочтительными в качестве вспомогательных субстанций или добавок являются адъюванты, описанные для фармацевтической композиции.
Следующим объектом изобретения является набор или набор компонентов, содержащий компоненты в виде предлагаемой в изобретении последовательности мРНК, предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, предлагаемой в изобретении фармацевтической композиции или вакцины, и необязательно технические инструкции с информацией о введении и дозировании компонентов.
Помимо компонентов, представляющих собой предлагаемую в изобретении последовательность мРНК, предлагаемую в изобретении композицию, содержащую несколько предлагаемых в изобретении последовательностей мРНК, предлагаемую в изобретении фармацевтическую композицию или вакцину, набор может дополнительно содержать фармацевтически приемлемый наполнитель, адъювант и по меньшей мере один дополнительный компонент, указанный в настоящем описании, а также средства для введения и технические инструкции. Компоненты в виде предлагаемой в изобретении последовательности мРНК, предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, предлагаемой в изобретении фармацевтической композиции или вакцины и, например, адъювант, могут находиться в лиофилизированной форме. В предпочтительном варианте осуществления изобретения перед применением набора для вакцинации к лиофилизированным компонентам добавляют указанный наполнитель в предварительно определенном количестве, которое прописано, например, в прилагаемых технических инструкциях. Путем осуществления указанной процедуры получают предлагаемую в изобретении последовательность мРНК, предлагаемую в изобретении композицию, содержащую несколько предлагаемых в изобретении последовательностей мРНК, предлагаемую в изобретении фармацевтическую композицию или вакцину, которые описаны в представленных выше объектах изобретения, которые после этого можно применять также в описанном выше способе.
В настоящем изобретении предложено также несколько вариантов применения предлагаемой в изобретении последовательности мРНК, указанной в настоящем описании, предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании, предлагаемой в изобретении фармацевтической композиции или вакцины, которые все содержат предлагаемую в изобретении последовательность мРНК, указанную в настоящем описании, или содержащих их наборов.
Следующим объектом изобретения является последовательность мРНК, кодирующая по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, и композиция, фармацевтическая композиция, вакцина и набор, которые все содержат последовательность мРНК, предназначенные для применения в способе профилактического и/или терапевтического лечения инфекций, вызываемых РСВ. Следовательно, следующим объектом настоящего изобретения является первое медицинское применение предлагаемой в изобретении последовательности мРНК, предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, предлагаемой в изобретении фармацевтической композиции или вакцины и предлагаемого в изобретении набора, которые указаны в настоящем описании, в качестве лекарственного средства. В частности, в изобретении предложено применение последовательности мРНК, кодирующей по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, которые указаны выше, для приготовления лекарственного средства.
Другим объектом настоящего изобретения является второе медицинское применение последовательности мРНК, кодирующей по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, которые указаны выше, необязательно в форме композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, фармацевтической композиции или вакцины, набора или набора компонентов, для лечения вызываемых РСВ инфекций, указанных в настоящем описании. В частности, последовательность мРНК, кодирующая по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, подлежащая применению в способе, указанном выше, представляет собой последовательность мРНК, приготовленную в сочетании с фармацевтически приемлемым наполнителем и необязательно дополнительным адъювантом и необязательным дополнительным другим компонентом, которые указаны выше, например, дополнительным антигеном или иммуноглобулином против РСВ. В этом контексте наиболее предпочтительным является (профилактическое) лечение младенцев, пожилых людей и пациентов с ослабленным иммунитетом. И еще более предпочтительным является (профилактическое) лечение преждевременно родившихся младенцев и младенцев с хроническим легочным заболеванием.
Предлагаемую в изобретении последовательность мРНК в альтернативном варианте можно получать в такой форме, которая позволяет вводить ее для предупреждения или лечения вызываемых РСВ инфекций с использованием нескольких доз, где каждая доза содержит предлагаемую в изобретении последовательность мРНК, кодирующую по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ) или его фрагмент, вариант или производное, например, первая доза содержит по меньшей мере одну мРНК, кодирующую по меньшей мере один антигенный пептид или белок, происходящий из слитого белка F (или его фрагменты, варианты или производные), а вторая доза содержит по меньшей мере одну последовательность мРНК, кодирующую по меньшей мере один антигенный пептид или белок, происходящий из другого антигена респираторно-синцитиального вируса (РСВ), предпочтительно из нуклеопротеина N (или его фрагменты, варианты или производные), из белка М2-1 или гликопротеина G (или его фрагментов, вариантов или производных). Согласно этому варианту осуществления изобретения обе дозы вводят поочередно, т.е. последовательно, через короткий промежуток времени один за другим, например, в пределах менее 10 мин, предпочтительно менее 2 мин, и в одну и ту же область организма для достижения такого же иммунологического действия, которое достигается при однократном введении одной композиции, которая содержит обе мРНК, например, мРНК, которая кодирует слитый белок F, и мРНК, которая кодирует нуклеопротеин N.
Согласно конкретному варианту осуществления изобретения предлагаемую в изобретении последовательность мРНК или предлагаемую в изобретении фармацевтическую композицию или вакцину можно вводить пациенту в виде единичной дозы. В некоторых вариантах осуществления изобретения предлагаемую в изобретении последовательность мРНК или предлагаемую в изобретении фармацевтическую композицию или вакцину можно вводить пациенту в виде единичной дозы с последующим введением второй дозы и необязательно даже третьей, четвертой (или еще большего количества) последующих доз и т.д. Согласно этому варианту осуществления изобретения бустерные инокуляции предлагаемой в изобретении последовательности мРНК или предлагаемой в изобретении фармацевтической композиции или вакцины можно вводить пациенту через конкретные интервалы времени, предпочтительно указанные ниже, после второй (или третьей, четвертой и т.д.) инокуляции. В этом контексте особенно предпочтительным является, если несколько доз содержат такую же последовательность мРНК, которая кодирует такой же антигенный пептид или белок респираторно-синцитиального вируса (РСВ), например, слитый белок F. В указанном варианте осуществления изобретения дозы вводят в течение определенного периода времени, например, составляющего 20-30 дней. Например, для постконтактной профилактики можно вводить в течение 20-30 дней по меньшей мере 5 доз предлагаемой в изобретении последовательности мРНК или предлагаемой в изобретении фармацевтической композиции или вакцины.
В предпочтительном варианте осуществления изобретения предлагаемую в изобретении последовательность мРНК или предлагаемую в изобретении фармацевтическую композицию или вакцину вводят посредством внутрикожной или внутримышечной инъекции, предпочтительно с использованием общепринятой техники на основе игольной инъекции или с использованием безыгольной системы, например, струйной инъекции. В другом предпочтительном варианте осуществления изобретения предлагаемую в изобретении последовательность мРНК или предлагаемую в изобретении фармацевтическую композицию или вакцину можно вводить с помощью струйной инъекции, указанной в настоящем описании. Предпочтительно предлагаемую в изобретении последовательность мРНК или предлагаемую в изобретении фармацевтическую композицию или вакцину вводят внутримышечно с помощью струйной инъекции. Согласно другому варианту осуществления изобретения предлагаемую в изобретении последовательность мРНК или предлагаемую в изобретении фармацевтическую композицию или вакцину вводят внутрикожно с помощью струйной инъекции.
В предпочтительном варианте осуществления изобретения предлагаемую в изобретении последовательность мРНК или предлагаемую в изобретении фармацевтическую композицию или вакцину можно вводить один, два или три раза, предпочтительно с помощью внутрикожной или внутримышечной инъекции, предпочтительно струйной инъекции. Согласно конкретному варианту осуществления изобретения одного введения предлагаемой в изобретении последовательности мРНК или предлагаемой в изобретении фармацевтической композиции или вакцины, предпочтительно с использованием внутрикожной или внутримышечной инъекции, предпочтительно с использованием струйной инъекции, достаточно для вызывания иммунного ответа против по меньшей мере одного антигена, кодируемого последовательностью мРНК, предлагаемой в изобретении. В предпочтительном варианте осуществления изобретения одно введение предлагаемой в изобретении последовательности мРНК или предлагаемой в изобретении фармацевтической композиции или вакцины вызывает иммунный ответ, который приводит к нейтрализации вируса. В этом контексте наиболее предпочтительной является одна единичная внутрикожная или внутримышечная инъекция предлагаемой в изобретении последовательности мРНК или предлагаемой в изобретении фармацевтической композиции или вакцины. Предпочтительно необязательно можно осуществлять дополнительные введения предлагаемой в изобретении последовательности мРНК или предлагаемой в изобретении фармацевтической композиции или вакцины для повышения и/или пролонгирования иммунного ответа.
В некоторых вариантах осуществления изобретения в указанных бустерных инокуляциях предлагаемой в изобретении последовательности мРНК или предлагаемой в изобретении фармацевтической композиции или вакцины можно применять дополнительное соединение или компонент, описанный для предлагаемой в изобретении последовательности мРНК или предлагаемой в изобретении фармацевтической композиции или вакцины, которые указаны в настоящем описании.
Следующим объектом настоящего изобретения является также способ экспрессии кодируемого антигенного пептида или белка, происходящего из слитого белка F, гликопротеина G, гидрофобного белка SH, матриксного белка М, нуклеопротеина N, большой субъединицы полимеразы L, белка М2-1, белка М2-2, фосфопротеина Р, неструктурного белка NS1 или неструктурного белка NS2 респираторно-синцитиального вируса (РСВ), заключающийся в том, что осуществляют стадии, на которых а) получают предлагаемую в изобретении последовательность мРНК, указанную в настоящем описании, или предлагаемую в изобретении композицию, содержащую несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании, б) интродуцируют или вносят предлагаемую в изобретении последовательность мРНК, указанную в настоящем описании, или предлагаемую в изобретении композицию, содержащую несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании, в экспрессионную систему, например, бесклеточную экспрессионную систему, клетку (например, обеспечивающую экспрессию клетку-хозяина или соматическую клетку), ткань или организм. Способ можно применять для лабораторных опытов, в исследовательских целях, для диагностики, для коммерческого получения пептидов или белков и/или для терапевтических целей. В этом контексте, как правило, после получения предлагаемой в изобретении последовательности мРНК, указанной в настоящем описании, или предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании, их, как правило, интродуцируют или вносят в бесклеточную экспрессионную систему, клетку (например, обеспечивающую экспрессию клетку-хозяина или соматическую клетку), ткань или организм, например, в оголенной или входящей в комплекс форме или в виде фармацевтической композиции или вакцины, указанной в настоящем описании, предпочтительно путем трансфекции или с использованием любого из путей введения, указанных в настоящем описании. Способ можно осуществлять in vitro, in vivo или ex vivo. Способ можно осуществлять также в контексте лечения конкретного заболевания, прежде всего лечения инфекционных болезней, предпочтительно вызываемых РСВ инфекций, указанных в настоящем описании.
В этой связи в контексте настоящего описания к методу in vitro относится трансфекция или трансдукция предлагаемой в изобретении последовательности мРНК, указанной в настоящем описании, или предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании, в клетки в культуре вне организма; в контексте настоящего описания к методу in vivo относится трансфекция или трансдукция предлагаемой в изобретении последовательности мРНК, указанной в настоящем описании, или предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании, в клетки путем введения предлагаемой в изобретении последовательности мРНК или предлагаемой в изобретении композиции, в целый организм или в индивидуума, и в контексте настоящего описания к методу ex vivo относится трансфекция или трансдукция предлагаемой в изобретении последовательности мРНК, или предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, в клетки, находящиеся вне организма или индивидуума, и последующее введение трансфектированных клеток в организм или в индивидуума.
Аналогично этому, другим объектом настоящего изобретения является также применение предлагаемой в изобретении последовательности мРНК, указанной в настоящем описании, или предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании, предпочтительно для диагностических или терапевтических целей, для экспрессии кодируемого антигенного пептида или белка, например, путем интродукции или внесения в бесклеточную экспрессионную систему, клетку (например, обеспечивающую экспрессию клетку-хозяина или соматическую клетку), ткань или организм. Применение может включать лабораторные опыты, исследовательские цели, диагностику, коммерческое получение пептидов или белков и/или терапевтическое применение. В этом контексте, как правило, после получения предлагаемой в изобретении последовательности мРНК, указанной в настоящем описании, или предлагаемой в изобретении композиции, содержащей несколько предлагаемых в изобретении последовательностей мРНК, указанных в настоящем описании, их, как правило, интродуцируют или вносят в бесклеточную экспрессионную систему, клетку (например, обеспечивающую экспрессию клетку-хозяина или соматическую клетку), ткань или организм, например, в оголенной или входящей в комплекс форме или в виде фармацевтической композиции или вакцины, указанной в настоящем описании, предпочтительно путем трансфекции или с использованием любого из путей введения, указанных в настоящем описании. Применение можно осуществлять in vitro, in vivo или ex vivo. Применение можно осуществлять также в контексте лечения конкретного заболевания, прежде всего для лечения инфекций, вызываемых РСВ.
Другим объектом изобретения является способ лечения или профилактики вызываемых РСВ инфекций, заключающийся в том, что осуществляют стадии, на которых:
а) получают предлагаемую в изобретении последовательность мРНК, композицию, содержащую несколько предлагаемых в изобретении последовательностей мРНК, фармацевтическую композицию или набор, или набор компонентов, содержащий предлагаемую в изобретении последовательность мРНК, указанную выше;
б) вносят или интродуцируют последовательность мРНК, композицию, фармацевтическую композицию или набор, или набор компонентов в ткань или организм;
в) необязательно вводят иммуноглобулин против РСВ.
В целом, некоторыми объектами изобретения является последовательность мРНК, содержащая кодирующую область, которая кодирует по меньшей мере один антигенный пептид или белок респираторно-синцитиального вируса (РСВ). Предлагаемая в изобретении последовательность мРНК предназначена для применения в способе профилактического и/или терапевтического лечения инфекций, вызываемых респираторно-синцитиальным вирусом (РСВ). Таким образом, изобретение относится к последовательности мРНК, указанной в настоящем описании, предназначенной для применения в способе профилактического и/или терапевтического лечения вызываемых РСВ инфекций.
В настоящем изобретении, если не указано иное, то, если это возможно, различные особенности альтернатив и вариантов осуществления изобретения можно объединять друг с другом. Кроме того, понятие «содержащий» не должно ограничиваться значением «состоящий из», если специально не указано иное. Однако в контексте настоящего изобретения понятие «состоящий из» является вариантом, который в данном изобретении рассматривается как подпадающий под понятие «содержащий», когда в контексте настоящего описания используется понятие «содержащий».
Все публикации, патенты и заявки на патент, процитированные в настоящем описании, включены в настоящее описание в качестве ссылки, как если бы каждая индивидуальная публикация или заявка на патент была специально и индивидуально включена в качестве ссылки. Хотя вышеуказанное изобретение было достаточно подробно описано для целей более ясного понимания с помощью иллюстраций и примера, обычным специалистам в данной области должно быть очевидно в свете доктрины настоящего изобретения, что могут быть сделаны определенные изменения и модификации без отклонения от сущности или объема, которые определяются прилагаемой формулой изобретения.
Краткое описание чертежей
Приведенные ниже чертежи представлены исключительно в качестве иллюстрации и служат для дополнительного описания настоящего изобретения. Указанные чертежи не следует рассматривать как ограничивающие объем настоящего изобретения.
На чертежах показано:
на фиг. 1 - последовательность мРНК R1691 с оптимизированным содержанием G/C, кодирующая PCB-F-белок «длинного» штамма РСВ (PCB-F «длинный»), которая включена в мРНК-вакцину на основе «длинного» PCB-F (SEQ ID NO: 31);
на фиг. 2 - последовательность мРНК R2510 с оптимизированным содержанием G/C, кодирующая PCB-F-белок «длинного» штамма РСВ (PCB-F «длинный»), которая включена в мРНК-вакцину на основе «длинного» PCB-F (SEQ ID NO: 32);
на фиг. 3 - последовательность мРНК R2821 с оптимизированным содержанием G/C, кодирующая мутантный белок PCB-F del554-574 «длинного» штамма РСВ (PCB-F «длинный») (SEQ ID NO: 33);
на фиг. 4 - последовательность мРНК R2831 с оптимизированным содержанием G/C, кодирующая PCB-N-белок «длинного» штамма РСВ (PCB-F «длинный») (SEQ ID NO: 34);
на фиг. 5 - последовательность мРНК R2833 с оптимизированным содержанием G/C, кодирующая РСВ-М2-1-белок «длинного» штамма РСВ (PCB-F «длинный») (SEQ ID NO: 35);
на фиг. 6 - данные, демонстрирующие, что мРНК-вакцина на основе «длинного» PCB-F индуцировала титры антител против PCB-F-белка, сопоставимые с титрами антитела против инактивированного РСВ.
Самкам мышей линии BALB/c инъецировали внутрикожно (i.d.) мРНК-вакцину на основе штамма PCB-F «длинный» (160 мкг R1691) или лактат Рингена (RiLa-буфер) в качестве применяемого для контроля буфера. Одной группе инъецировали внутримышечно (i.m.) по 10 мкг вакцины на основе инактивированного «длинного» штамма РСВ. У всех животных, которые получали бустерные инъекции в дни 21 и 35, собирали образцы крови в день 49 для определения титров антител в объединенной сыворотке согласно методу, описанному в примере 2. Обнаружено, что мРНК-вакцина на основе «длинного» PCB-F индуцировала образование антител против белка F подклассов IgG1 и IgG2a. На графике приведены титры антител (n=5 мышей/группу);
на фиг. 7 - данные, демонстрирующие, что мРНК-вакцина на основе «длинного» PCB-F (R1691) индуцировала долговременный иммунный ответ у мышей.
Эксперимент осуществляли согласно методу, описанному в примере 3, и общие титры антитела в виде IgG определяли с помощью ELISA.
Обнаружено, что титры антител оказались стабильными в течение 11 месяцев после последней бустерной вакцинации;
на фиг. 8 - данные, демонстрирующие, что мРНК-вакцина на основе «длинного» PCB-F (R1691) индуцировала специфические в отношении слитого (F)-белка РСВ многофункциональные CD8+-Т-клетки у мышей.
Эксперимент осуществляли согласно методу, описанному в примере 4, и Т-клетки анализировали в отношении антигенспецифической индукции цитокинов по окрашиванию внутриклеточных цитокинов. Клетки стимулировали PCB-F-пептидом (stim. F; KYKNAVTEL) или контрольным НА-пептидом вируса гриппа (stim. НА; IYSTVASSL). Линия на графике соответствует медианному значению (n=5 мышей/группу).
Обнаружено, что мРНК-вакцина на основе «длинного» PCB-F индуцировала специфические для слитого (F) белка РСВ многофункциональные CD8+-Т-клетки в отличие от вакцины на основе инактивированного РСВ, которая не обладала способностью индуцировать специфические в отношении F-белка CD8+-Т-клетки;
на фиг. 9 - данные, демонстрирующие, что мРНК-вакцина на основе PCB-N (R2831) индуцировала специфические в отношении нуклеопротеина (N) многофункциональные CD8+-Т-клетки у мышей.
Эксперимент осуществляли согласно методу, описанному в примере 5, и Т-клетки анализировали в отношении антигенспецифической индукции цитокинов по окрашиванию внутриклеточных цитокинов после стимуляции ProMix PCB-N (15-мерные пептиды). Линия на графике соответствует медианному значению (n=5 мышей/группу).
Обнаружено, что мРНК-вакцина на основе PCB-N индуцировала специфические в отношении нуклеопротеина (N) РСВ многофункциональные CD8+-Т-клетки в отличие от вакцины на основе инактивированного РСВ, которая не обладала способностью индуцировать специфические в отношении N-белка CD8+-Т-клетки;
на фиг. 10 - данные, демонстрирующие, что мРНК-вакцина на основе РСВ-N (R2831) индуцировала специфические в отношении нуклеопротеина (N) многофункциональные CD4+-Т-клетки у мышей.
Эксперимент осуществляли согласно методу, описанному в примере 5, и Т-клетки анализировали в отношении антигенспецифической индукции цитокинов по окрашиванию внутриклеточных цитокинов после стимуляции ProMix PCB-N (15-мерные пептиды). Линия на графике соответствует медианному значению (n=5 мышей/группу).
Обнаружено, что мРНК-вакцина на основе PCB-N индуцировала специфические в отношении нуклеопротеина (N) РСВ многофункциональные CD4+-Т-клетки в отличие от вакцины на основе инактивированного РСВ, которая не обладала способностью индуцировать специфические в отношении N-белка CD4+-Т-клетки;
на фиг. 11 - данные, демонстрирующие, что мРНК-вакцина на основе РСВ-М2-1 (R2833) индуцировала специфические в отношении М2-1 многофункциональные CD8+-Т-клетки у мышей.
Эксперимент осуществляли согласно методу, описанному в примере 5, и Т-клетки анализировали в отношении антигенспецифической индукции цитокинов по окрашиванию внутриклеточных цитокинов после стимуляции М2-1-специфическим 9-мерным белком. Линия на графике соответствует медианному значению (n=5 мышей/группу).
Обнаружено, что мРНК-вакцина на основе PCB-M2-1 индуцировала специфические в отношении РСВ-М2-1 многофункциональные CD8+-Т-клетки в отличие от вакцины на основе инактивированного РСВ, которая не обладала способностью индуцировать специфические в отношении M2-1-белка CD8+-T-клетки;
на фиг. 12 - данные, демонстрирующие, что мРНК-вакцины на основе РСВ-F либо индивидуально (PCB-F=R2510; мутант PCB-Fdel554-574=R2821), либо в сочетании с мРНК, которые кодируют другие белки РСВ (PCB-N=R2831; РСВ-М2-1=R2833), индуцировали гуморальные иммунные ответы у хлопковых крыс.
Эксперимент осуществляли согласно методу, описанному в примере 6, и общие титры специфических в отношении PCB-F антител в виде IgG определяли с помощью ELISA в день 49. Сыворотку анализировали в различных разведениях, которые представлены в нижней части графика;
на фиг. 13 - данные, демонстрирующие, что мРНК-вакцины на основе РСВ-F либо индивидуально (PCB-F=R2510; мутант PCB-Fdel554-574=R2821), либо в сочетании с мРНК, которые кодируют другие белки РСВ (PCB-N=R2831; РСВ-М2-1=R2833), индуцировали образование функциональных антител у хлопковых крыс, что продемонстрировано на основе титров вирус-нейтрализующих антител (VNT).
Эксперимент осуществляли согласно методу, описанному в примере 6, и титры вирус-нейтрализующих антител в день 49 определяли с помощью с помощью анализа уменьшения бляшек;
на фиг. 14 - данные, демонстрирующие, что мРНК-вакцины на основе РСВ-F либо индивидуально (PCB-F=R2510; мутант PCB-Fdel554-574=R2821), либо в сочетании с мРНК, которые кодируют другие белки РСВ (PCB-N=R2831; РСВ-М2-1=R2833), снижали титры в легких и носу хлопковых крыс, подвергнутых контрольному заражению РСВ-вирусом.
Эксперимент осуществляли согласно методу, описанному в примере 6.
(А) Титры в легких в день 5 после контрольного заражения РСВ. У всех групп животных, которых вакцинировали мРНК-вакцинами, обнаружены титры вируса ниже предела обнаружения при осуществлении титрации вируса, что демонстрирует наличие защиты вакцинированных хлопковых крыс при оценке на основе титров вируса в легких. В отличие от мРНК-вакцин вакцина на основе инактивированного формалином вируса не обладала способностью предупреждать появление титров вируса в легких.
(Б) Титры в носу в день 5 после контрольного заражения РСВ. Титр вируса в ткани носа также сильно снижался в группах, вакцинированных мРНК. В отличие от мРНК-вакцин вакцина на основе инактивированного формалином вируса не обладала способностью снижать титры вируса в носу;
на фиг. 15 - представлены результаты гистопатологического анализа легких подвергнутых контрольному заражению РСВ хлопковых крыс, которых применяли в опыте, описанном в примере 6;
на фиг. 16 - представлены результаты количественной полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) количества копий вирусного генома (по измерению количества копий NS-1-гена РСВ) или экспрессированных цитокинов из ткани легких зараженных РСВ животных (или контрольных животных) у подвергнутых контрольному заражения РСВ хлопковых крыс, которых применяли в опыте, описанном в примере 6;
на фиг. 17 - данные, демонстрирующие, что мРНК-вакцины на основе РСВ-F (PCB-F=R2510; RSV F* (мутант PCB-Fdel554-574)=R2821) снижали титры в легких у хлопковых крыс, подвергнутых контрольному заражению РСВ-вирусом хлопковых крыс.
Эксперимент осуществляли согласно методу, описанному в примере 7.
(А) Титры в легких в день 5 после контрольного заражения РСВ. У всех групп животных, которых вакцинировали внутрикожно мРНК-вакцинами, обнаружено пониженные титры вируса по сравнению с обработанной буфером контрольной группой, что демонстрирует наличие защиты вакцинированных хлопковых крыс при оценке на основе титров вируса в легких. Уже одна единичная доза мРНК-вакцин на основе PCB-F эффективно снижала титры вируса в легких.
(Б) Титры в легких в день 5 после контрольного заражения РСВ. Титр вируса в легких также сильно снижались в группах, которых вакцинировали мРНК путем внутримышечной инъекции.
Примеры
Приведенные ниже примеры представлены исключительно в качестве иллюстрации и служат для дополнительного описания настоящего изобретения. Указанные примеры не следует рассматривать как ограничивающие объем настоящего изобретения.
Пример 1: Получение мРНК-вакцины
1. Получение конструкций ДНК и мРНК
Для рассматриваемых примеров получали последовательности ДНК, кодирующие белок PCB-F (R1691 и R2510), мутантный белок PCB-F del554-574 (R2821), белок РСВ N (R2831) и белок РСВ М2-1 (R2833) «длинного» штамма РСВ, и применяли для последующих реакций транскрипции in vitro. Мутантный белок PCB-Fdel554-574 описан ранее (Oomens и др., J. Virol. 80(21), 2006, сс. 10465-10477).
Согласно первой процедуре получения создавали последовательности ДНК, кодирующие указанные выше мРНК. Конструкцию R1691 получали путем модификации кодирующей последовательности дикого типа посредством интродукции последовательности с оптимизированным для стабилизации содержанием GC, за которой следовала стабилизирующая последовательность, происходящая из альфа-глобин-3'UTR (muag (мутантная альфа-глобин-3'UTR) представленная в SEQ ID NO: 29), сегмент, состоящий из 64 аденозинов (поли-А-последовательность), сегмент, состоящий из 30 цитозинов (поли-С-последовательность) и гистоновая структура стебель-петля, представленная в SEQ ID NO: 30. В SEQ ID NO: 31 (см. фиг.1) представлена последовательность соответствующей мРНК. Конструкции R2510, R2821, R2831 и R2833 получали путем интродукции 5'-TOP-UTR, происходящей из рибосомального белка 32L, который имеет SEQ ID NO 23, модификации кодирующей последовательности дикого типа посредством интродукции последовательности с оптимизированным для стабилизации содержанием GC, за которой следовала стабилизирующая последовательность, происходящая из альбумин-3'UTR (альбумин7, согласно SEQ ID NO: 25), сегмент, состоящий из 64 аденозинов (поли-А-последовательность), сегмент, состоящий из 30 цитозинов (поли-С-последовательность) и гистоновая структура стебель-петля, представленная в SEQ ID NO: 30. В SEQ ID NO: 32-35 (см. фиг. 2-5) представлены последовательности соответствующих мРНК.
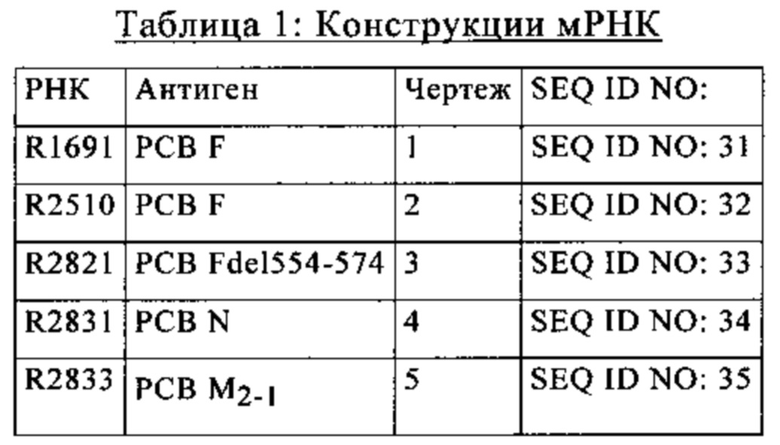
2. Транскрипция in vitro
Соответствующие ДНК-плазмиды, полученные согласно процедуре, описанной в разделе 1, транскрибировали in vitro с помощью полимеразы Т7 в присутствии аналога кэпа (m7 GpppG). Затем мРНК очищали с помощью PureMessenger® (фирма CureVac, Тюбинген, Германия: WO 2008/077592 А1).
3. Реагенты
Комплексообразующий реагент: протамин
4. Получение вакцины
мРНК включали в комплекс с протамином путем добавления протамина к мРНК в соотношении 1:2 (мас./мас.) (адъювантный компонент). После инкубации в течение 10 мин добавляли в таком же количестве свободную мРНК R1710, используемую в качестве образующей антиген РНК.
Например, получали вакцину на основе «РСВ-F «длинного» (R1691), содержащую адъювантный компонент, состоящий из мРНК, которая кодирует F-белок «длинного» штамма РСВ (R1691), представленный в SEQ ID NO: 31, в комплексе с протамином в соотношении 2:1 (мас./мас.), и свободную образующую антиген мРНК, которая кодирует F-белок «длинного» штамма РСВ (R1691), представленный в SEQ ID NO: 31 (соотношение 1:1; входящая в комплекс РНК : свободная РНК).
Пример 2: Индукция гуморального иммунного ответа у мышей мРНК-вакциной на основе РСВ-F «длинного»
Иммунизация
В день ноль мышам линии BALB/c инъецировали внутрикожно (i.d.) мРНК-вакцину на основе РСВ-F «длинного» (R1691 согласно примеру 1; 25 мкг/мышь/в день вакцинации) или лактат Рингера (RiLa) в качестве применяемого для контроля буфера, как указано в таблице 2. Контрольной группе инъецировали внутримышечно (i.m.) 10 мкг вакцины на основе инактивированного штамма РСВ «длинный». Инактивированный «Respiratory Syncytial Virus Antigen» (антиген респираторно-синцитиального вируса) (инактивированный РСВ «длинный») покупали у фирмы INSTITUT VIRION/SERION GmbH-SERION IMMUNDIAGNOSTICA GmbH. Инактивированный вирус разводили в стерильном ЗФР с получением конечной концентрации 0,2 мкг/мкл. Всем животным осуществляли бустерные инъекции в день 14 и день 28. Образцы крови собирали в день 42 для определения титров антител к PCB-F.
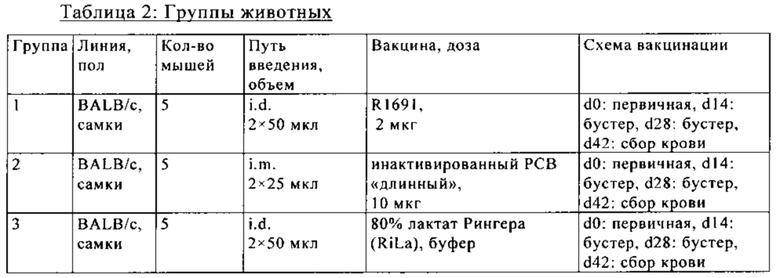
Определение антител к белку РСВ-F с помощью ELISA
Планшеты для ELISA сенсибилизировали рекомбинантным человеческим слитым гликопротеином РСВ (rec.hu F-белок, конечная концентрация: 5 мкг/мл) (фирма Sino Biological Inc.). Сенсибилизированные планшеты инкубировали, используя указанные разведения сыворотки, и определяли связывание специфических антител к F-белку с ABTS-субстратом, используя биотинилированные изотипспецифические антимышиные антитела в комбинации со стрептавидином-HRP (пероксидаза из хрена).
Результаты
Как продемонстрировано на фиг. 6, мРНК-вакцина на основе PCB-F «длинного» индуцировала титры антител (в целом, IgG, IgG1 и IgG2a) против F-белка РСВ, сопоставимые с титрами против инактивированного РСВ.
Пример 3: Индукция долговременного иммунного ответа у мышей мРНК-вакциной на основе РСВ-F «длинного»
Иммунизация
Мышам линии BALB/c инъецировали внутрикожно (i.d.) мРНК-вакцину на основе РСВ-F «длинного» (R1691) или лактат Рингера (RiLa) в качестве применяемого для контроля буфера согласно схеме вакцинации, представленной в таблице 3.
Образцы крови собирали через 2 недели, 4 месяца и 11 месяцев после последней иммунизации.
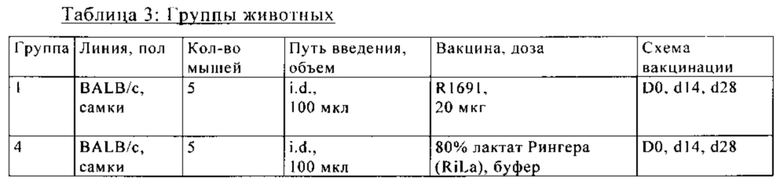
Результаты
Как продемонстрировано на фиг. 7, мРНК-вакцина на основе PCB-F «длинного» индуцировала долговременный иммунный ответ, о чем свидетельствовали стабильные титры антител в течение по меньшей мере 11 месяцев после последней бустер-вакцинации.
Пример 4: Индукция клеточного иммунного ответа у мышей мРНК-вакциной на основе РСВ-F «длинного»
Иммунизация
В день ноль мышам линии BALB/c инъецировали внутрикожно (i.d.) мРНК-вакцину на основе РСВ-F «длинного» R1691 (20 мкг/мышь/в день вакцинации) или лактат Рингера (RiLa) в качестве применяемого для контроля буфера, как указано в таблице 4. Контрольной группе инъецировали внутримышечно (i.m.) 10 мкг вакцины на основе инактивированного штамма РСВ «длинный». Инактивированный «Respiratory Syncytial Virus Antigen» (инактивированный РСВ «длинный») покупали у фирмы INSTITUT VIRION/SERION GmbH-SERION IMMUNDIAGNOSTICA GmbH. Инактивированный вирус разводили в стерильном ЗФР с получением конечной концентрации 0,2 мкг/мкл.
Всем животным осуществляли бустерные инъекции в день 14 и день 28. В день 34 изымали селезенки для анализа антигенспецифических Т-клеток.
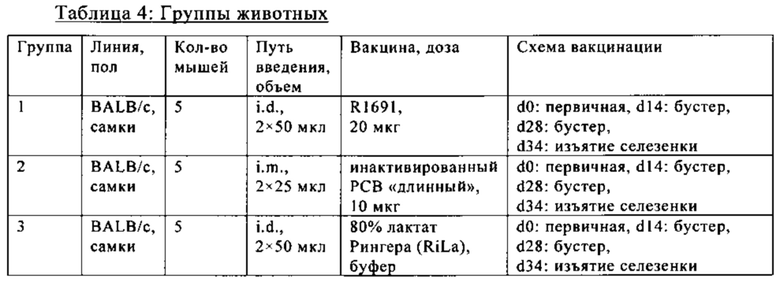
Окрашивание внутриклеточных цитокинов
Спленоциты из вакцинированных и контрольных мышей выделяли согласно стандартному протоколу. В целом, метод состоял в следующем: выделенные селезенки измельчали, пропуская через клеточное сито, и промывали ЗФР/1% FBS с последующим лизисом эритроцитов. После стадии интенсивной промывки ЗФР/1% FBS спленоциты высевали в 96-луночные планшеты (2×106 клеток/лунку). На следующий день клетки стимулировали PCB-F-пептидом (KYKNAVTEL; 5 мкл; Н-2 кДа-ограниченный Т-клеточный эпитоп) или неродственным контрольным пептидом, полученным из НА-белка вируса гриппа (IYSTVASSL; 5 мкг/мл; покупали у фирмы EMC Microcollections) и антителом к CD28 (фирма BD Biosciences) в концентрации 2,5 мкг/мл в течение 6 ч при 37°С в присутствии смеси GolgiPlug™/GolgiStop™ (ингибиторы транспорта белков, содержащие брефелдин А и монензин соответственно; фирма BD Biosciences). После стимуляции клетки промывали и окрашивали для выявления внутриклеточных цитокинов, используя реагент Cytofix/Cytoperm (фирма BD Biosciences) согласно инструкциям производителя. Для окрашивания применяли следующие антитела: CD8-PECy7 (1:200), CD3-ФИТС (1:200), IL2-PerCP-Cy5.5 (1:100), TNFα-PE (1:100), IFNγ-APC (1:100) (фирма eBioscience), CD4-BD Horizon V450 (1:200) (фирма BD Biosciences) и инкубировали с Fcγ-блокатором, разведенным в соотношении 1:100. Водный краситель (Aqua Dye) применяли для того, чтобы отличать живые клетки от мертвых (фирма Invitrogen). Клетки собирали с помощью проточного цитометра Canto II (фирма Beckton Dickinson). Результаты, полученные с помощью проточного цитометра, анализировали с использованием программы FlowJo (фирма Tree Star, Inc.). Статистический анализ осуществляли с использованием программы GraphPad Prism, версия 5.01. Статистические различия между группами оценивали с помощью критерия Манна-Уитни.
Результаты
Как продемонстрировано на фиг. 8, мРНК-вакцина на основе PCB-F «длинного» (R1691) индуцировала IFNγ-позитивные, TNFα-позитивные и дважды IFNγ/TNFα-позитивные многофункциональные CD8+-Т-клетки, направленные против F-белка РСВ. При создании изобретения неожиданно было установлено, что вакцина на основе инактивированного РСВ не обладала способностью индуцировать антигенспецифические CD8+-Т-клетки.
Пример 5: Индукция клеточных иммунных ответом у мышей мРНК-вакцинами на основе PCB-N и PCB-M2-1
Иммунизация
В день ноль мышам линии BALB/c инъецировали внутрикожно (i.d.) в различных дозах мРНК-вакцину на основе PCB-N R2831, мРНК-вакцину на основе РСВ-М2-1 R2833 или лактат Рингера (RiLa) в качестве применяемого для контроля буфера, как указано в таблице 5. Контрольной группе инъецировали внутримышечно (i.m.) 10 мкг вакцины на основе инактивированного штамма РСВ «длинный». Инактивированный «Respiratory Syncytial Virus Antigen» (инактивированный РСВ «длинный») покупали у фирмы INSTITUT VIRION/SERION GmbH-SERION IMMUNDIAGNOSTICA GmbH. Инактивированный вирус разводили в стерильном ЗФР с получением конечной концентрации 0,2 мкг/мкл.
Все животные получали бустерные инъекции в дни 7 и 21. В день 27 изымали селезенки для анализа антигенспецифических Т-клеток

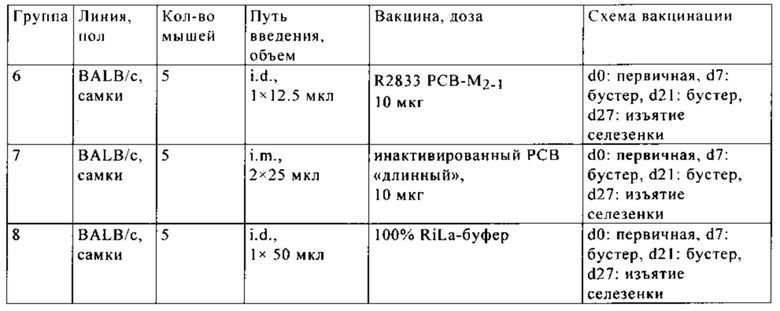
Окрашивание внутриклеточных цитокинов осуществляли согласно методу, описанному в примере 4, за исключением того, что клетки обрабатывали следующими стимуляторами:
М2-1-пептид (5 мкг/мл), группы 4-8; (SYIGSINNI фирмы ProImmune); ProMix N (1 мкг/мл) 1-3, группа 7 и группа 8; (РХ39 фирма Proimmune); контроль: среда + ДМСО + антитело к CD28, группы 1-8, описанные выше.
Результаты
Как продемонстрировано на фиг. 9, мРНК-вакцина на основе PCB-N (R2831) индуцировала IFNγ-позитивные, TNFα-позитивные и дважды IFNγ/TNFα-позитивные многофункциональные CD8+-Т-клетки, направленные против N-белка РСВ у мышей.
При создании изобретения неожиданно было установлено, что вакцина на основе инактивированного РСВ не обладала способностью индуцировать антигенспецифические CD8+-Т-клетки.
Как продемонстрировано на фиг. 10, мРНК-вакцина на основе PCB-N (R2831) индуцировала IFNγ-позитивные, TNFα-позитивные и дважды IFNγ/TNFα-позитивные многофункциональные CD4+-Т-клетки, направленные против N-белка РСВ у мышей.
При создании изобретения неожиданно было установлено, что вакцина на основе инактивированного РСВ не обладала способностью индуцировать антигенспецифические CD4+-Т-клетки.
Как продемонстрировано на фиг. 11, мРНК-вакцина на основе РСВ-М2-1 (R2833) индуцировала IFNγ-позитивные, TNFα-позитивные и дважды IFNγ/TNFα-позитивные многофункциональные CD8+-Т-клетки, направленные против белка М2-1 РСВ у мышей.
При создании изобретения неожиданно было установлено, что вакцина на основе инактивированного РСВ не обладала способностью индуцировать антигенспецифические СВ8+-Т-клетки.
Пример 6: Опыт I по контрольному заражению хлопковых крыс РСВ
Для разработки вакцин против РСВ хлопковые крысы являются приемлемой животной моделью, прежде всего для контрольного заражения. Хлопковые крысы отвечают на препараты вакцин на основе инактивированного формалином РСВ повышением легочной патологией. Это позволяет оценивать безопасность вакцинации на основе феномена обострения заболевания.
Для расширения и оптимизации РСВ-специфического иммунного ответа получали мРНК-вакцины, кодирующие различные белки РСВ (белки РСВ F, мутант PCB-Fdel554-574, N и М2-1), согласно методу, описанному в примере 1. Для оценки воздействия единичных или комбинированных вакцин эти вакцины вводили либо индивидуально, либо в комбинации (смешенная вакцина), как указано в таблице 6. Вакцины в объемах 2×50 мкл инъецировали внутрикожно (i.d.) в кожу спины хлопковых крыс. Дополнительные группы иммунизировали внутримышечно (i.m.) инактивированным β-пропиолактоном РСВ (фирма INSTITUT VIRION/SERION GmbH-SERION IMMUNDIAGNOSTICA GmbH), инактивированным формалином РСВ (FI-PCB) (фирма Sigmovir) или живым РСВ/А2 (фирма Sigmovir) (105 бляшкообразующих единиц, БОЕ) для сравнения их иммуногенности с мРНК-вакцинами. Другую группу обрабатывали с помощью i.m.-инъекций моноклональными антителом к РСВ SYNAGIS® (паливизумаб) в качестве пассивной иммунизации. SYNAGIS® вводили в дозе 15 мг/кг за один день до контрольного заражения РСВ. Для этого животных взвешивали и рассчитывали соответствующее количество SYNAGIS® в зависимости от веса животного. Максимальный объем для i.m.-инъекции составлял 200 мкл на 100 г веса крысы. После иммунизации хлопковых крыс подвергали контрольному заражению путем интраназального (i.n.) введения вируса РСВ/А2 (105 БОЕ в 100 мкл; фирма Sigmovir).
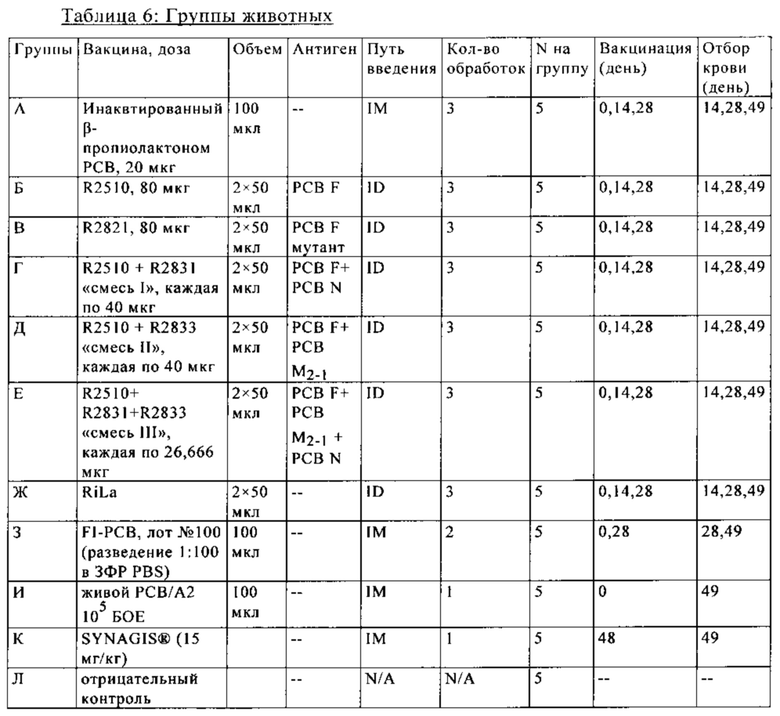
Для оценки иммунных ответов осуществляли следующие анализы: ELISA для оценки IgG против F-белка РСВ в сыворотке, определение титров нейтрализующих вирус РСВ антител (VNT), титрование вируса РСВ и гистопатологический анализ легких.
ELISA для оценки IgG против F-белка РСВ в сыворотке
Индукцию антител к белку F РСВ определяли с помощью ELISA согласно методу, описанному в примере 2.
Титры нейтрализующих вирус РСВ антител (VNT)
Сыворотки анализировали с помощью теста нейтрализации вируса (VNT). В целом, метод состоял в следующем: образцы сыворотки разводили в соотношении 1:10 инактивированной тепловой обработкой средой ЕМЕМ и дополнительно серийно разводили в соотношении 1:4. Разведенные образцы сыворотки инкубировали с РСВ (25-50 БОЕ) в течение 1 ч при комнатной температуре и инокулировали с дублированием монослои конфлюэнтных НЕр-2-клеток в 24-луночных планшетах. После 1 ч инкубации при 37°С в инкубаторе в атмосфере с 5% CO2 на лунки наслаивали среду, содержащую 0,75% метилцеллюлозы. После инкубации в течение 4 дней дополнительный слой удаляли и клетки фиксировали с использования окрашивания с помощью 0,1% кристаллического фиолетового в течение 1 ч и затем отмывали и сушили на воздухе. Соответствующие величины, обратные титрам нейтрализующих антител, определяли в конечной точке, соответствующей 60%-ному снижению количества вирусов.
Титрования вируса РСВ и гистопатология легких
В день 54 получали образцы ткани из носа и гомогенизировали для осуществления титрования вируса. Легкие изымали целиком и разделяли на три секции для титрования вируса (левая секция), гистопатологического обследования (правая секция), и ПЦР-анализа (лингвальная доля). Кроме того, определяли количество геномных копий вируса РСВ (путем измерения количества копий гена NS-1 РСВ) и уровни мРНК цитокинов с помощью количественной полимеразной цепной реакции с обратной транскрипцией (кОТ-ПЦР).
Результаты
Как продемонстрировано на фиг. 12, мРНК-вакцины на основе РСВ-F либо индивидуально (PCB-F=R2510; мутант PCB-Fdel554-574=R2821), либо в сочетании с мРНК, кодирующими другие белки РСВ (PCB-N=R2831; РСВ-М2-1=R2833), индуцировали специфические в отношении РСВ F гуморальные иммунные ответы у хлопковых крыс, о чем свидетельствуют общие титры антител в виде IgG в день 49.
Как продемонстрировано на фиг. 13, мРНК-вакцины на основе РСВ-F либо индивидуально (PCB-F=R2510; мутант PCB-Fdel554-574=R2821), либо в сочетании с мРНК, кодирующими другие белки РСВ (PCB-N=R2831; РСВ-М2-1=R2833), индуцировали образование РСВ-специфических функциональных антител у хлопковых крыс, о чем свидетельствуют титры вирус-нейтрализующих антител.
Как продемонстрировано на фиг. 14, мРНК-вакцины на основе РСВ-F либо индивидуально (PCB-F=R2510; мутант PCB-Fdel554-574=R2821), либо в сочетании с мРНК, кодирующими другие белки РСВ (PCB-N=R2831; РСВ-М2-1=R2833), снижали вирусные титры в легких и носу хлопковых крыс, подвергнутых контрольному заражению РСВ.
Как продемонстрировано на фиг. 14А, у всех животных, обработанных мРНК-вакцинами, титры вируса находились ниже предела обнаружения при осуществлении титрации вируса, что демонстрирует наличие защиты вакцинированных хлопковых крыс при оценке на основе титров вируса в легких. В отличие от мРНК-вакцин вакцина на основе инактивированного формалином вируса лишь минимально снижала титр вируса в легких по сравнению с контрольной группой, обработанной буфером RiLa. Воздействие инактивированной β-пропиолактоном вакцины против РСВ оказалось более выраженным, но не приводило к снижению титра вируса в легких ниже предела обнаружения у всех животных в этой группе. Как продемонстрировано на фиг. 14Б, титр вируса в ткани носа также значительно снижался в группах, вакцинированных мРНК. Титры вируса в носу инактивированного формалином вируса оказались сопоставимыми с титром вируса в вакцинированной RiLa группе. Инактивированная β-пропиолактоном вакцина оказалась более эффективной (по меньшей мере для двух из пяти животных). В отличие от этого, во всех группах, вакцинированных мРНК, обнаружен пониженный титр вируса в носу по сравнению с группой, вакцинированной RiLa.
Как продемонстрировано на фиг. 15, гистопатологический анализ легких хлопковых крыс, на которых проводили опыт по контрольному заражению РСВ, позволил установить патологию, описываемую различными баллами, в различных группах животных. Из гистопатологического анализа можно заключить, что ни в одной из вакцинированных мРНК групп не обнаружено повышенная патология легких, что имело место в случае группы, которую вакцинировали с использованием вакцины на основе инактивированного формалином РСВ. Средние баллы таких патологий, как перибронхиолит (РВ), периваскулит (PV), интерстициальная пневмония (IP) и альвеолит (А), оказались существенно более низкими во всех группах, вакцинированных мРНК, по сравнению с группой 3 (инактивированный формалином РСВ). В дополнительных группах, вакцинированных R2510 (группа Б; РСВ-F) или R2821 (группа В; мутант РСВ-F), что, вероятно, свидетельствует о снижении легочной патологии по сравнению с группой, вакцинированной RiLa-буфером, и затем зараженной РСВ (Ж).
Как продемонстрировано на фиг. 16, результаты, полученные с помощью количественной ОТ-ПЦР, свидетельствуют о различных схемах экспрессии в различных группах животных. Данные оценки количества геномных копий РСВ, измеренная на основе гена NS-1 РСВ, приведены на фиг. 16А. Количества геномных копий снижалось после вакцинации с использованием мРНК-вакцин по сравнению с контрольной обработанной RiLa-буфером группой (группа Ж). Это не имело места в группе, вакцинированной инактивированным формалином РСВ (группа 3). Как продемонстрировано на фиг. 16Б, вакцинация с использованием вакцины на основе инактивированного формалином РСВ (группа 3) индуцировала повышенную экспрессию ТН2-цитокина IL-4 по сравнению с контрольной группой, которую вакцинировали RiLa-буфером (группа Ж). В противоположность этому, вакцинация с использованием мРНК R2821, которая кодирует мутант РСВ-F, существенно снижала экспрессию мРНК IL-4 по сравнению с обработанной RiLa контрольной группой в легких после контрольного заражения РСВ. На фиг 16В представлены данные об экспрессии мРНК INF-γ. На фиг. 16Г представлены данные об экспрессии мРНК IL-5. Экспрессия IL-5 существенно снижалась в группах, вакцинированных с использованием R2510 или R2821, по сравнению с вакцинированными RiLa-буфером животными. Экспрессию вирусной РНК NS-1 или мРНК цитокинов, которые выделяли из ткани легкого, измеряли в день 5 после контрольного заражения. Статистический анализ осуществляли с помощью Т-критерия Стьюдента (* p<0,05 по сравнению группой Ж (RiLa-контроль)).
Пример 7: Опыт II по контрольному заражению хлопковых крыс РСВ
мРНК-вакцины, кодирующие F-белок РСВ (F) или мутантный белок PCB-F (F*) (РСВ F del554-574), получали согласно методу, описанному в примере 1. Для оценки воздействия единичной или нескольких вакцинаций (первичная и бустерные вакцинации) указанные вакцины вводили один, два или три раза (как показано в таблице 7). Вакцины в объемах 2×50 мкл инъецировали внутрикожно (i.d.) в кожу спины хлопковых крыс. Дополнительные группы иммунизировали внутримышечно (i.m.), используя объемы вакцин 1×100 мкл, в правую заднюю лапу. В качестве контроля одной группе инъецировали внутрикожно буферный раствор лактата Рингера (буфер). После иммунизации хлопковых крыс подвергали контрольному заражению путем интратназального (i.n.) введения вируса РСВ/А2 (105 БОЕ в 100 мкл; фирма Sigmovir). В качестве контроля одну группу не обрабатывали и не подвергали контрольному заражению (необработанная группа).
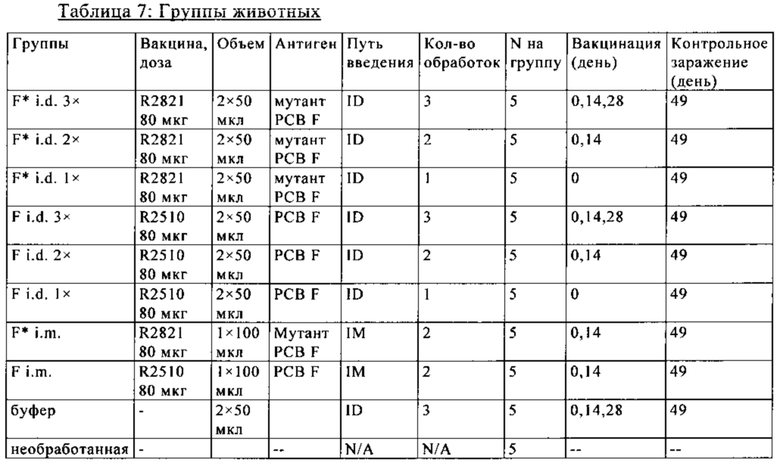
Титрования вируса РСВ
Определение титров вируса РСВ проводили согласно методу, описанному в примере 6.
Результаты
Как продемонстрировано на фиг. 17А, уже одна единичная внутрикожная вакцинация мРНК-вакцинами, которые кодируют белок PCB-F (F) или мутантный белок PCB-F (F*) (РСВ F del554-574), оказалась высокоэффективной в отношении снижения титра вируса в легком по сравнению с обработанной буфером контрольной группой. Вторая и третья вакцинации («бустер-вакцинации) снижали вирусные титры до уровня, находящегося ниже предела обнаружения.
Как продемонстрировано на фиг. 17Б, уже две внутримышечные вакцинации мРНК-вакцинами, которые кодируют белок PCB-F (F) или мутантный белок PCB-F (F*) (РСВ F del554-574), значительно снижали вирусный титр в легких по сравнению с обработанной буфером контрольной группой.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> КуреВак ГмбХ
<120> Вакцина против респираторно-синцитиального вируса (РСВ)
<130> CU01P151WO1
<160> 37
<170> PatentIn, версия 3.5
<210> 1
<211> 574
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 1
Met Glu Leu Pro Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Ala
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Ser Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Asn
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Thr Ala Ala Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Thr Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Arg Lys Arg Arg Phe Leu Gly Phe Leu Leu Gly Val
130 135 140
Gly Ser Ala Ile Ala Ser Gly Ile Ala Val Ser Lys Val Leu His Leu
145 150 155 160
Glu Gly Glu Val Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys
165 170 175
Ala Val Val Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val
180 185 190
Leu Asp Leu Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn
195 200 205
Lys Gln Ser Cys Arg Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln
210 215 220
Gln Lys Asn Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn
225 230 235 240
Ala Gly Val Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu
245 250 255
Leu Leu Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys
260 265 270
Leu Met Ser Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile
275 280 285
Met Ser Ile Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro
290 295 300
Leu Tyr Gly Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro
305 310 315 320
Leu Cys Thr Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg
325 330 335
Thr Asp Arg Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe
340 345 350
Pro Gln Ala Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp
355 360 365
Thr Met Asn Ser Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Val
370 375 380
Asp Ile Phe Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr
385 390 395 400
Asp Val Ser Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys
405 410 415
Tyr Gly Lys Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile
420 425 430
Lys Thr Phe Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp
435 440 445
Thr Val Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly
450 455 460
Lys Ser Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro
465 470 475 480
Leu Val Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn
485 490 495
Glu Lys Ile Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu
500 505 510
Leu His His Val Asn Ala Gly Lys Ser Thr Thr Asn Ile Met Ile Thr
515 520 525
Thr Ile Ile Ile Val Ile Ile Val Ile Leu Leu Ser Leu Ile Ala Val
530 535 540
Gly Leu Leu Leu Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser
545 550 555 560
Lys Asp Gln Leu Ser Gly Ile Asn Asn Ile Ala Phe Ser Asn
565 570
<210> 2
<211> 298
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 2
Met Ser Lys Asn Lys Asp Gln Arg Thr Ala Lys Thr Leu Glu Lys Thr
1 5 10 15
Trp Asp Thr Leu Asn His Leu Leu Phe Ile Ser Ser Gly Leu Tyr Lys
20 25 30
Leu Asn Leu Lys Ser Ile Ala Gln Ile Thr Leu Ser Ile Leu Ala Met
35 40 45
Ile Ile Ser Thr Ser Leu Ile Ile Thr Ala Ile Ile Phe Ile Ala Ser
50 55 60
Ala Asn His Lys Val Thr Leu Thr Thr Ala Ile Ile Gln Asp Ala Thr
65 70 75 80
Ser Gln Ile Lys Asn Thr Thr Pro Thr Tyr Leu Thr Gln Asp Pro Gln
85 90 95
Leu Gly Ile Ser Phe Ser Asn Leu Ser Glu Ile Thr Ser Gln Thr Thr
100 105 110
Thr Ile Leu Ala Ser Thr Thr Pro Gly Val Lys Ser Asn Leu Gln Pro
115 120 125
Thr Thr Val Lys Thr Lys Asn Thr Thr Thr Thr Gln Thr Gln Pro Ser
130 135 140
Lys Pro Thr Thr Lys Gln Arg Gln Asn Lys Pro Pro Asn Lys Pro Asn
145 150 155 160
Asn Asp Phe His Phe Glu Val Phe Asn Phe Val Pro Cys Ser Ile Cys
165 170 175
Ser Asn Asn Pro Thr Cys Trp Ala Ile Cys Lys Arg Ile Pro Asn Lys
180 185 190
Lys Pro Gly Lys Lys Thr Thr Thr Lys Pro Thr Lys Lys Pro Thr Phe
195 200 205
Lys Thr Thr Lys Lys Asp Leu Lys Pro Gln Thr Thr Lys Pro Lys Glu
210 215 220
Val Pro Thr Thr Lys Pro Thr Glu Glu Pro Thr Ile Asn Thr Thr Lys
225 230 235 240
Thr Asn Ile Thr Thr Thr Leu Leu Thr Asn Asn Thr Thr Gly Asn Pro
245 250 255
Lys Leu Thr Ser Gln Met Glu Thr Phe His Ser Thr Ser Ser Glu Gly
260 265 270
Asn Leu Ser Pro Ser Gln Val Ser Thr Thr Ser Glu His Pro Ser Gln
275 280 285
Pro Ser Ser Pro Pro Asn Thr Thr Arg Gln
290 295
<210> 3
<211> 64
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 3
Met Glu Asn Thr Ser Ile Thr Ile Glu Phe Ser Ser Lys Phe Trp Pro
1 5 10 15
Tyr Phe Thr Leu Ile His Met Ile Thr Thr Ile Ile Ser Leu Leu Ile
20 25 30
Ile Ile Ser Ile Met Thr Ala Ile Leu Asn Lys Leu Cys Glu Tyr Asn
35 40 45
Val Phe His Asn Lys Thr Phe Glu Leu Pro Arg Ala Arg Val Asn Thr
50 55 60
<210> 4
<211> 256
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 4
Met Glu Thr Tyr Val Asn Lys Leu His Glu Gly Ser Thr Tyr Thr Ala
1 5 10 15
Ala Val Gln Tyr Asn Val Leu Glu Lys Asp Asp Asp Pro Ala Ser Leu
20 25 30
Thr Ile Trp Val Pro Met Phe Gln Ser Ser Met Pro Ala Asp Leu Leu
35 40 45
Ile Lys Glu Leu Ala Asn Val Asn Ile Leu Val Lys Gln Ile Ser Thr
50 55 60
Pro Lys Gly Pro Ser Leu Arg Val Met Ile Asn Ser Arg Ser Ala Leu
65 70 75 80
Leu Ala Gln Met Pro Ser Lys Phe Thr Ile Cys Ala Asn Val Ser Leu
85 90 95
Asp Glu Arg Ser Lys Leu Ala Tyr Asp Val Thr Thr Pro Cys Glu Ile
100 105 110
Lys Ala Cys Ser Leu Thr Cys Leu Lys Ser Lys Asn Met Leu Thr Thr
115 120 125
Val Lys Asp Leu Thr Met Lys Thr Leu Asn Pro Thr His Asp Ile Ile
130 135 140
Ala Leu Cys Glu Phe Glu Asn Ile Val Thr Ser Lys Lys Val Ile Ile
145 150 155 160
Pro Thr Tyr Leu Arg Ser Ile Ser Val Arg Asn Lys Asp Leu Asn Thr
165 170 175
Leu Glu Asn Ile Thr Thr Thr Glu Phe Lys Asn Ala Ile Thr Asn Ala
180 185 190
Lys Ile Ile Pro Tyr Ser Gly Leu Leu Leu Val Ile Thr Val Thr Asp
195 200 205
Asn Lys Gly Ala Phe Lys Tyr Ile Lys Pro Gln Ser Gln Phe Ile Val
210 215 220
Asp Leu Gly Ala Tyr Leu Glu Lys Glu Ser Ile Tyr Tyr Val Thr Thr
225 230 235 240
Asn Trp Lys His Thr Ala Thr Arg Phe Ala Ile Lys Pro Met Glu Asp
245 250 255
<210> 5
<211> 391
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 5
Met Ala Leu Ser Lys Val Lys Leu Asn Asp Thr Leu Asn Lys Asp Gln
1 5 10 15
Leu Leu Ser Ser Ser Lys Tyr Thr Ile Gln Arg Ser Thr Gly Asp Ser
20 25 30
Ile Asp Thr Pro Asn Tyr Asp Val Gln Lys His Ile Asn Lys Leu Cys
35 40 45
Gly Met Leu Leu Ile Thr Glu Asp Ala Asn His Lys Phe Thr Gly Leu
50 55 60
Ile Gly Met Leu Tyr Ala Met Ser Arg Leu Gly Arg Glu Asp Thr Ile
65 70 75 80
Lys Ile Leu Arg Asp Ala Gly Tyr His Val Lys Ala Asn Gly Val Asp
85 90 95
Val Thr Thr His Arg Gln Asp Ile Asn Gly Lys Glu Met Lys Phe Glu
100 105 110
Val Leu Thr Leu Ala Ser Leu Thr Thr Glu Ile Gln Ile Asn Ile Glu
115 120 125
Ile Glu Ser Arg Lys Ser Tyr Lys Lys Met Leu Lys Glu Met Gly Glu
130 135 140
Val Ala Pro Glu Tyr Arg His Asp Ser Pro Asp Cys Gly Met Ile Ile
145 150 155 160
Leu Cys Ile Ala Ala Leu Val Ile Thr Lys Leu Ala Ala Gly Asp Arg
165 170 175
Ser Gly Leu Thr Ala Val Ile Arg Arg Ala Asn Asn Val Leu Lys Asn
180 185 190
Glu Met Lys Arg Tyr Lys Gly Leu Leu Pro Lys Asp Ile Ala Asn Ser
195 200 205
Phe Tyr Glu Val Phe Glu Lys His Pro His Phe Ile Asp Val Phe Val
210 215 220
His Phe Gly Ile Ala Gln Ser Ser Thr Arg Gly Gly Ser Arg Val Glu
225 230 235 240
Gly Ile Phe Ala Gly Leu Phe Met Asn Ala Tyr Gly Ala Gly Gln Val
245 250 255
Met Leu Arg Trp Gly Val Leu Ala Lys Ser Val Lys Asn Ile Met Leu
260 265 270
Gly His Ala Ser Val Gln Ala Glu Met Glu Gln Val Val Glu Val Tyr
275 280 285
Glu Tyr Ala Gln Lys Leu Gly Gly Glu Ala Gly Phe Tyr His Ile Leu
290 295 300
Asn Asn Pro Lys Ala Ser Leu Leu Ser Leu Thr Gln Phe Pro His Phe
305 310 315 320
Ser Ser Val Val Leu Gly Asn Ala Ala Gly Leu Gly Ile Met Gly Glu
325 330 335
Tyr Arg Gly Thr Pro Arg Asn Gln Asp Leu Tyr Asp Ala Ala Lys Ala
340 345 350
Tyr Ala Glu Gln Leu Lys Glu Asn Gly Val Ile Asn Tyr Ser Val Leu
355 360 365
Asp Leu Thr Ala Glu Glu Leu Glu Ala Ile Lys His Gln Leu Asn Pro
370 375 380
Lys Asp Asn Asp Val Glu Leu
385 390
<210> 6
<211> 2165
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 6
Met Asp Pro Ile Ile Asn Gly Asn Ser Ala Asn Val Tyr Leu Thr Asp
1 5 10 15
Ser Tyr Leu Lys Gly Val Ile Ser Phe Ser Glu Cys Asn Ala Leu Gly
20 25 30
Ser Tyr Ile Phe Asn Gly Pro Tyr Leu Lys Asn Asp Tyr Thr Asn Leu
35 40 45
Ile Ser Arg Gln Asn Pro Leu Ile Glu His Met Asn Leu Lys Lys Leu
50 55 60
Asn Ile Thr Gln Ser Leu Ile Ser Lys Tyr His Lys Gly Glu Ile Lys
65 70 75 80
Leu Glu Glu Pro Thr Tyr Phe Gln Ser Leu Leu Met Thr Tyr Lys Ser
85 90 95
Met Thr Ser Leu Glu Gln Ile Ala Thr Thr Asn Leu Leu Lys Lys Ile
100 105 110
Ile Arg Arg Ala Ile Glu Ile Ser Asp Val Lys Val Tyr Ala Ile Leu
115 120 125
Asn Lys Leu Gly Leu Lys Glu Lys Asp Lys Ile Lys Ser Asn Asn Gly
130 135 140
Gln Asp Glu Asp Asn Ser Val Ile Thr Thr Ile Ile Lys Asp Asp Ile
145 150 155 160
Leu Ser Ala Val Lys Asp Asn Gln Ser His Leu Lys Ala Asp Lys Asn
165 170 175
His Ser Thr Lys Gln Lys Asp Thr Ile Lys Thr Thr Leu Leu Lys Lys
180 185 190
Leu Met Cys Ser Met Gln His Pro Pro Ser Trp Leu Ile His Trp Phe
195 200 205
Asn Leu Tyr Thr Lys Leu Asn Asn Ile Leu Thr Gln Tyr Arg Ser Asn
210 215 220
Glu Val Lys Asn His Gly Phe Ile Leu Ile Asp Asn Gln Thr Leu Ser
225 230 235 240
Gly Phe Gln Phe Ile Leu Asn Gln Tyr Gly Cys Ile Val Tyr His Lys
245 250 255
Glu Leu Lys Arg Ile Thr Val Thr Thr Tyr Asn Gln Phe Leu Thr Trp
260 265 270
Lys Asp Ile Ser Leu Ser Arg Leu Asn Val Cys Leu Ile Thr Trp Ile
275 280 285
Ser Asn Cys Leu Asn Thr Leu Asn Lys Ser Leu Gly Leu Arg Cys Gly
290 295 300
Phe Asn Asn Val Ile Leu Thr Gln Leu Phe Leu Tyr Gly Asp Cys Ile
305 310 315 320
Leu Lys Leu Phe His Asn Glu Gly Phe Tyr Ile Ile Lys Glu Val Glu
325 330 335
Gly Phe Ile Met Ser Leu Ile Leu Asn Ile Thr Glu Glu Asp Gln Phe
340 345 350
Arg Lys Arg Phe Tyr Asn Ser Met Leu Asn Asn Ile Thr Asp Ala Ala
355 360 365
Asn Lys Ala Gln Lys Asn Leu Leu Ser Arg Val Cys His Thr Leu Leu
370 375 380
Asp Lys Thr Val Ser Asp Asn Ile Ile Asn Gly Arg Trp Ile Ile Leu
385 390 395 400
Leu Ser Lys Phe Leu Lys Leu Ile Lys Leu Ala Gly Asp Asn Asn Leu
405 410 415
Asn Asn Leu Ser Glu Leu Tyr Phe Leu Phe Arg Ile Phe Gly His Pro
420 425 430
Met Val Asp Glu Arg Gln Ala Met Asp Ala Val Lys Val Asn Cys Asn
435 440 445
Glu Thr Lys Phe Tyr Leu Leu Ser Ser Leu Ser Met Leu Arg Gly Ala
450 455 460
Phe Ile Tyr Arg Ile Ile Lys Gly Phe Val Asn Asn Tyr Asn Arg Trp
465 470 475 480
Pro Thr Leu Arg Asn Ala Ile Val Leu Pro Leu Arg Trp Leu Thr Tyr
485 490 495
Tyr Lys Leu Asn Thr Tyr Pro Ser Leu Leu Glu Leu Thr Glu Arg Asp
500 505 510
Leu Ile Val Leu Ser Gly Leu Arg Phe Tyr Arg Glu Phe Arg Leu Pro
515 520 525
Lys Lys Val Asp Leu Glu Met Ile Ile Asn Asp Lys Ala Ile Ser Pro
530 535 540
Pro Lys Asn Leu Ile Trp Thr Ser Phe Pro Arg Asn Tyr Met Pro Ser
545 550 555 560
His Ile Gln Asn Tyr Ile Glu His Glu Lys Leu Lys Phe Ser Glu Ser
565 570 575
Asp Lys Ser Arg Arg Val Leu Glu Tyr Tyr Leu Arg Asp Asn Lys Phe
580 585 590
Asn Glu Cys Asp Leu Tyr Asn Cys Val Val Asn Gln Ser Tyr Leu Asn
595 600 605
Asn Pro Asn His Val Val Ser Leu Thr Gly Lys Glu Arg Glu Leu Ser
610 615 620
Val Gly Arg Met Phe Ala Met Gln Pro Gly Met Phe Arg Gln Val Gln
625 630 635 640
Ile Leu Ala Glu Lys Met Ile Ala Glu Asn Ile Leu Gln Phe Phe Pro
645 650 655
Glu Ser Leu Thr Arg Tyr Gly Asp Leu Glu Leu Gln Lys Ile Leu Glu
660 665 670
Leu Lys Ala Gly Ile Ser Asn Lys Ser Asn Arg Tyr Asn Asp Asn Tyr
675 680 685
Asn Asn Tyr Ile Ser Lys Cys Ser Ile Ile Thr Asp Leu Ser Lys Phe
690 695 700
Asn Gln Ala Phe Arg Tyr Glu Thr Ser Cys Ile Cys Ser Asp Val Leu
705 710 715 720
Asp Glu Leu His Gly Val Gln Ser Leu Phe Ser Trp Leu His Leu Thr
725 730 735
Ile Pro His Val Thr Ile Ile Cys Thr Tyr Arg His Ala Pro Pro Tyr
740 745 750
Ile Arg Asp His Ile Val Asp Leu Asn Asn Val Asp Glu Gln Ser Gly
755 760 765
Leu Tyr Arg Tyr His Met Gly Gly Ile Glu Gly Trp Cys Gln Lys Leu
770 775 780
Trp Thr Ile Glu Ala Ile Ser Leu Leu Asp Leu Ile Ser Leu Lys Gly
785 790 795 800
Lys Phe Ser Ile Thr Ala Leu Ile Asn Gly Asp Asn Gln Ser Ile Asp
805 810 815
Ile Ser Lys Pro Val Arg Leu Met Glu Gly Gln Thr His Ala Gln Ala
820 825 830
Asp Tyr Leu Leu Ala Leu Asn Ser Leu Lys Leu Leu Tyr Lys Glu Tyr
835 840 845
Ala Gly Ile Gly His Lys Leu Lys Gly Thr Glu Thr Tyr Ile Ser Arg
850 855 860
Asp Met Gln Phe Met Ser Lys Thr Ile Gln His Asn Gly Val Tyr Tyr
865 870 875 880
Pro Ala Ser Ile Lys Lys Val Leu Arg Val Gly Pro Trp Ile Asn Thr
885 890 895
Ile Leu Asp Asp Phe Lys Val Ser Leu Glu Ser Ile Gly Ser Leu Thr
900 905 910
Gln Glu Leu Glu Tyr Arg Gly Glu Ser Leu Leu Cys Ser Leu Ile Phe
915 920 925
Arg Asn Val Trp Leu Tyr Asn Gln Ile Ala Leu Gln Leu Lys Asn His
930 935 940
Ala Leu Cys Asn Asn Lys Leu Tyr Leu Asp Ile Leu Lys Val Leu Lys
945 950 955 960
His Leu Lys Thr Phe Phe Asn Leu Asp Asn Ile Asp Thr Ala Leu Thr
965 970 975
Leu Tyr Met Asn Leu Pro Met Leu Phe Gly Gly Gly Asp Pro Asn Leu
980 985 990
Leu Tyr Arg Ser Phe Tyr Arg Arg Thr Pro Asp Phe Leu Thr Glu Ala
995 1000 1005
Ile Val His Ser Val Phe Ile Leu Ser Tyr Tyr Thr Asn His Asp
1010 1015 1020
Leu Lys Asp Lys Leu Gln Asp Leu Ser Asp Asp Arg Leu Asn Lys
1025 1030 1035
Phe Leu Thr Cys Ile Ile Thr Phe Asp Lys Asn Pro Asn Ala Glu
1040 1045 1050
Phe Val Thr Leu Met Arg Asp Pro Gln Ala Leu Gly Ser Glu Arg
1055 1060 1065
Gln Ala Lys Ile Thr Ser Glu Ile Asn Arg Leu Ala Val Thr Glu
1070 1075 1080
Val Leu Ser Thr Ala Pro Asn Lys Ile Phe Ser Lys Ser Ala Gln
1085 1090 1095
His Tyr Thr Thr Thr Glu Ile Asp Leu Asn Asp Ile Met Gln Asn
1100 1105 1110
Ile Glu Pro Thr Tyr Pro His Gly Leu Arg Val Val Tyr Glu Ser
1115 1120 1125
Leu Pro Phe Tyr Lys Ala Glu Lys Ile Val Asn Leu Ile Ser Gly
1130 1135 1140
Thr Lys Ser Ile Thr Asn Ile Leu Glu Lys Thr Ser Ala Ile Asp
1145 1150 1155
Leu Thr Asp Ile Asp Arg Ala Thr Glu Met Met Arg Lys Asn Ile
1160 1165 1170
Thr Leu Leu Ile Arg Ile Leu Pro Leu Asp Cys Asn Arg Asp Lys
1175 1180 1185
Arg Glu Ile Leu Ser Met Glu Asn Leu Ser Ile Thr Glu Leu Ser
1190 1195 1200
Lys Tyr Val Arg Glu Arg Ser Trp Ser Leu Ser Asn Ile Val Gly
1205 1210 1215
Val Thr Ser Pro Ser Ile Met Tyr Thr Met Asp Ile Lys Tyr Thr
1220 1225 1230
Thr Ser Thr Ile Ala Ser Gly Ile Ile Ile Glu Lys Tyr Asn Val
1235 1240 1245
Asn Ser Leu Thr Arg Gly Glu Arg Gly Pro Thr Lys Pro Trp Val
1250 1255 1260
Gly Ser Ser Thr Gln Glu Lys Lys Thr Met Pro Val Tyr Asn Arg
1265 1270 1275
Gln Val Leu Thr Lys Lys Gln Arg Asp Gln Ile Asp Leu Leu Ala
1280 1285 1290
Lys Leu Asp Trp Val Tyr Ala Ser Ile Asp Asn Lys Asp Glu Phe
1295 1300 1305
Met Glu Glu Leu Ser Ile Gly Thr Leu Gly Leu Thr Tyr Glu Lys
1310 1315 1320
Ala Lys Lys Leu Phe Pro Gln Tyr Leu Ser Val Asn Tyr Leu His
1325 1330 1335
Arg Leu Thr Val Ser Ser Arg Pro Cys Glu Phe Pro Ala Ser Ile
1340 1345 1350
Pro Ala Tyr Arg Thr Thr Asn Tyr His Phe Asp Thr Ser Pro Ile
1355 1360 1365
Asn Arg Ile Leu Thr Glu Lys Tyr Gly Asp Glu Asp Ile Asp Ile
1370 1375 1380
Val Phe Gln Asn Cys Ile Ser Phe Gly Leu Ser Leu Met Ser Val
1385 1390 1395
Val Glu Gln Phe Thr Asn Val Cys Pro Asn Arg Ile Ile Leu Ile
1400 1405 1410
Pro Lys Leu Asn Glu Ile His Leu Met Lys Pro Pro Ile Phe Thr
1415 1420 1425
Gly Asp Val Asp Ile His Lys Leu Lys Gln Val Ile Gln Lys Gln
1430 1435 1440
His Met Phe Leu Pro Asp Lys Ile Ser Leu Thr Gln Tyr Val Glu
1445 1450 1455
Leu Phe Leu Ser Asn Lys Thr Leu Lys Ser Gly Ser His Val Asn
1460 1465 1470
Ser Asn Leu Ile Leu Ala His Lys Ile Ser Asp Tyr Phe His Asn
1475 1480 1485
Thr Tyr Ile Leu Ser Thr Asn Leu Ala Gly His Trp Ile Leu Ile
1490 1495 1500
Ile Gln Leu Met Lys Asp Ser Lys Gly Ile Phe Glu Lys Asp Trp
1505 1510 1515
Gly Glu Gly Tyr Ile Thr Asp His Met Phe Ile Asn Leu Lys Val
1520 1525 1530
Phe Phe Asn Ala Tyr Lys Thr Tyr Leu Leu Cys Phe His Lys Gly
1535 1540 1545
Tyr Gly Lys Ala Lys Leu Glu Cys Asp Met Asn Thr Ser Asp Leu
1550 1555 1560
Leu Cys Val Leu Glu Leu Ile Asp Ser Ser Tyr Trp Lys Ser Met
1565 1570 1575
Ser Lys Val Phe Leu Glu Gln Lys Val Ile Lys Tyr Ile Leu Ser
1580 1585 1590
Gln Asp Ala Ser Leu His Arg Val Lys Gly Cys His Ser Phe Lys
1595 1600 1605
Leu Trp Phe Leu Lys Arg Leu Asn Val Ala Glu Phe Thr Val Cys
1610 1615 1620
Pro Trp Val Val Asn Ile Asp Tyr His Pro Thr His Met Lys Ala
1625 1630 1635
Ile Leu Thr Tyr Ile Asp Leu Val Arg Met Gly Leu Ile Asn Ile
1640 1645 1650
Asp Arg Ile His Ile Lys Asn Lys His Lys Phe Asn Asp Glu Phe
1655 1660 1665
Tyr Thr Ser Asn Leu Phe Tyr Ile Asn Tyr Asn Phe Ser Asp Asn
1670 1675 1680
Thr His Leu Leu Thr Lys His Ile Arg Ile Ala Asn Ser Glu Leu
1685 1690 1695
Glu Asn Asn Tyr Asn Lys Leu Tyr His Pro Thr Pro Glu Thr Leu
1700 1705 1710
Glu Asn Ile Leu Ala Asn Pro Ile Lys Ser Asn Asp Lys Lys Thr
1715 1720 1725
Leu Asn Asp Tyr Cys Ile Gly Lys Asn Val Asp Ser Ile Met Leu
1730 1735 1740
Pro Leu Leu Ser Asn Lys Lys Leu Val Lys Ser Ser Ala Met Ile
1745 1750 1755
Arg Thr Asn Tyr Ser Lys Gln Asp Leu Tyr Asn Leu Phe Pro Thr
1760 1765 1770
Val Val Ile Asp Arg Ile Ile Asp His Ser Gly Asn Thr Ala Lys
1775 1780 1785
Ser Asn Gln Leu Tyr Thr Thr Thr Ser His Gln Ile Ser Leu Val
1790 1795 1800
His Asn Ser Thr Ser Leu Tyr Cys Met Leu Pro Trp His His Ile
1805 1810 1815
Asn Arg Phe Asn Phe Val Phe Ser Ser Thr Gly Cys Lys Ile Ser
1820 1825 1830
Ile Glu Tyr Ile Leu Lys Asp Leu Lys Ile Lys Asp Pro Asn Cys
1835 1840 1845
Ile Ala Phe Ile Gly Glu Gly Ala Gly Asn Leu Leu Leu Arg Thr
1850 1855 1860
Val Val Glu Leu His Pro Asp Ile Arg Tyr Ile Tyr Arg Ser Leu
1865 1870 1875
Lys Asp Cys Asn Asp His Ser Leu Pro Ile Glu Phe Leu Arg Leu
1880 1885 1890
Tyr Asn Gly His Ile Asn Ile Asp Tyr Gly Glu Asn Leu Thr Ile
1895 1900 1905
Pro Ala Thr Asp Ala Thr Asn Asn Ile His Trp Ser Tyr Leu His
1910 1915 1920
Ile Lys Phe Ala Glu Pro Ile Ser Leu Phe Val Cys Asp Ala Glu
1925 1930 1935
Leu Pro Val Thr Val Asn Trp Ser Lys Ile Ile Ile Glu Trp Ser
1940 1945 1950
Lys His Val Arg Lys Cys Lys Tyr Cys Ser Ser Val Asn Lys Cys
1955 1960 1965
Thr Leu Ile Val Lys Tyr His Ala Gln Asp Asp Ile Asp Phe Lys
1970 1975 1980
Leu Asp Asn Ile Thr Ile Leu Lys Thr Tyr Val Cys Leu Gly Ser
1985 1990 1995
Lys Leu Lys Gly Ser Glu Val Tyr Leu Val Leu Thr Ile Gly Pro
2000 2005 2010
Ala Asn Ile Phe Pro Val Phe Asn Val Val Gln Asn Ala Lys Leu
2015 2020 2025
Ile Leu Ser Arg Thr Lys Asn Phe Ile Met Pro Lys Lys Ala Asp
2030 2035 2040
Lys Glu Ser Ile Asp Ala Asn Ile Lys Ser Leu Ile Pro Phe Leu
2045 2050 2055
Cys Tyr Pro Ile Thr Lys Lys Gly Ile Asn Thr Ala Leu Ser Lys
2060 2065 2070
Leu Lys Ser Val Val Ser Gly Asp Ile Leu Ser Tyr Ser Ile Ala
2075 2080 2085
Gly Arg Asn Glu Val Phe Ser Asn Lys Leu Ile Asn His Lys His
2090 2095 2100
Met Asn Ile Leu Lys Trp Phe Asn His Val Leu Asn Phe Arg Ser
2105 2110 2115
Thr Glu Leu Asn Tyr Asn His Leu Tyr Met Val Glu Ser Thr Tyr
2120 2125 2130
Pro Tyr Leu Ser Glu Leu Leu Asn Ser Leu Thr Thr Asn Glu Leu
2135 2140 2145
Lys Lys Leu Ile Lys Ile Thr Gly Ser Leu Leu Tyr Asn Phe His
2150 2155 2160
Asn Glu
2165
<210> 7
<211> 194
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 7
Met Ser Arg Arg Asn Pro Cys Lys Phe Glu Ile Arg Gly His Cys Leu
1 5 10 15
Asn Gly Lys Arg Cys His Phe Ser His Asn Tyr Phe Glu Trp Pro Pro
20 25 30
His Ala Leu Leu Val Arg Gln Asn Phe Met Leu Asn Arg Ile Leu Lys
35 40 45
Ser Met Asp Lys Ser Ile Asp Thr Leu Ser Glu Ile Ser Gly Ala Ala
50 55 60
Glu Leu Asp Arg Thr Glu Glu Tyr Ala Leu Gly Val Val Gly Val Leu
65 70 75 80
Glu Ser Tyr Ile Gly Ser Ile Asn Asn Ile Thr Lys Gln Ser Ala Cys
85 90 95
Val Ala Met Ser Lys Leu Leu Thr Glu Leu Asn Ser Asp Asp Ile Lys
100 105 110
Lys Leu Arg Asp Asn Glu Glu Leu Asn Ser Pro Lys Ile Arg Val Tyr
115 120 125
Asn Thr Val Ile Ser Tyr Ile Glu Ser Asn Arg Lys Asn Asn Lys Gln
130 135 140
Thr Ile His Leu Leu Lys Arg Leu Pro Ala Asp Val Leu Lys Lys Thr
145 150 155 160
Ile Lys Asn Thr Leu Asp Ile His Lys Ser Ile Thr Ile Asn Asn Pro
165 170 175
Lys Glu Leu Thr Val Ser Asp Thr Asn Asp His Ala Lys Asn Asn Asp
180 185 190
Thr Thr
<210> 8
<211> 90
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 8
Met Thr Met Pro Lys Ile Met Ile Leu Pro Asp Lys Tyr Pro Cys Ser
1 5 10 15
Ile Thr Ser Ile Leu Ile Thr Ser Arg Cys Arg Val Thr Met Tyr Asn
20 25 30
Arg Lys Asn Thr Leu Tyr Phe Asn Gln Asn Asn Pro Asn Asn His Met
35 40 45
Tyr Ser Pro Asn Gln Thr Phe Asn Glu Ile His Trp Thr Ser Gln Asp
50 55 60
Leu Ile Asp Thr Ile Gln Asn Phe Leu Gln His Leu Gly Val Ile Glu
65 70 75 80
Asp Ile Tyr Thr Ile Tyr Ile Leu Val Ser
85 90
<210> 9
<211> 241
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 9
Met Glu Lys Phe Ala Pro Glu Phe His Gly Glu Asp Ala Asn Asn Arg
1 5 10 15
Ala Thr Lys Phe Leu Glu Ser Ile Lys Gly Lys Phe Thr Ser Pro Lys
20 25 30
Asp Pro Lys Lys Lys Asp Ser Ile Ile Ser Val Asn Ser Ile Asp Ile
35 40 45
Glu Val Thr Lys Glu Ser Pro Ile Thr Ser Asn Ser Thr Ile Ile Asn
50 55 60
Pro Thr Asn Glu Thr Asp Asp Asn Ala Gly Asn Lys Pro Asn Tyr Gln
65 70 75 80
Arg Lys Pro Leu Val Ser Phe Lys Glu Asp Pro Ile Pro Ser Asp Asn
85 90 95
Pro Phe Ser Lys Leu Tyr Lys Glu Thr Ile Glu Thr Phe Asp Asn Asn
100 105 110
Glu Glu Glu Ser Ser Tyr Ser Tyr Glu Glu Ile Asn Asp Gln Thr Asn
115 120 125
Asp Asn Ile Thr Ala Arg Leu Asp Arg Ile Asp Glu Lys Leu Ser Glu
130 135 140
Ile Leu Gly Met Leu His Thr Leu Val Val Ala Ser Ala Gly Pro Thr
145 150 155 160
Ser Ala Arg Asp Gly Ile Arg Asp Ala Met Val Gly Leu Arg Glu Glu
165 170 175
Met Ile Glu Lys Ile Arg Thr Glu Ala Leu Met Thr Asn Asp Arg Leu
180 185 190
Glu Ala Met Ala Arg Leu Arg Asn Glu Glu Ser Glu Lys Met Ala Lys
195 200 205
Asp Thr Ser Asp Glu Val Ser Leu Asn Pro Thr Ser Glu Lys Leu Asn
210 215 220
Asn Leu Leu Glu Gly Asn Asp Ser Asp Asn Asp Leu Ser Leu Glu Asp
225 230 235 240
Phe
<210> 10
<211> 139
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 10
Met Gly Ser Asn Ser Leu Ser Met Ile Lys Val Arg Leu Gln Asn Leu
1 5 10 15
Phe Asp Asn Asp Glu Val Ala Leu Leu Lys Ile Thr Cys Tyr Thr Asp
20 25 30
Lys Leu Ile His Leu Thr Asn Ala Leu Ala Lys Ala Val Ile His Thr
35 40 45
Ile Lys Leu Asn Gly Ile Val Phe Val His Val Ile Thr Ser Ser Asp
50 55 60
Ile Cys Pro Asn Asn Asn Ile Val Val Lys Ser Asn Phe Thr Thr Met
65 70 75 80
Pro Val Leu Gln Asn Gly Gly Tyr Ile Trp Glu Met Met Glu Leu Thr
85 90 95
His Cys Ser Gln Pro Asn Gly Leu Ile Asp Asp Asn Cys Glu Ile Lys
100 105 110
Phe Ser Lys Lys Leu Ser Asp Ser Thr Met Thr Asn Tyr Met Asn Gln
115 120 125
Leu Ser Glu Leu Leu Gly Phe Asp Leu Asn Pro
130 135
<210> 11
<211> 124
<212> PRT
<213> Респираторно-синцитиальный вирус
<400> 11
Met Asp Thr Thr His Asn Asp Thr Thr Pro Gln Arg Leu Met Ile Thr
1 5 10 15
Asp Met Arg Pro Leu Ser Leu Glu Thr Thr Ile Thr Ser Leu Thr Arg
20 25 30
Asp Ile Ile Thr His Arg Phe Ile Tyr Leu Ile Asn His Glu Cys Ile
35 40 45
Val Arg Lys Leu Asp Glu Arg Gln Ala Thr Phe Thr Phe Leu Val Asn
50 55 60
Tyr Glu Met Lys Leu Leu His Lys Val Gly Ser Thr Lys Tyr Lys Lys
65 70 75 80
Tyr Thr Glu Tyr Asn Thr Lys Tyr Gly Thr Phe Pro Met Pro Ile Phe
85 90 95
Ile Asn His Asp Gly Phe Leu Glu Cys Ile Gly Ile Lys Pro Thr Lys
100 105 110
His Thr Pro Ile Ile Tyr Lys Tyr Asp Leu Asn Pro
115 120
<210> 12
<211> 1725
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 12
auggaguugc caauccucaa agcaaaugca auuaccacaa uccucgcugc agucacauuu 60
ugcuuugcuu cuagucaaaa caucacugaa gaauuuuauc aaucaacaug cagugcaguu 120
agcaaaggcu aucuuagugc ucuaagaacu gguugguaua cuaguguuau aacuauagaa 180
uuaaguaaua ucaaggaaaa uaaguguaau ggaacagaug cuaagguaaa auugauaaac 240
caagaauuag auaaauauaa aaaugcugua acagaauugc aguugcucau gcaaagcaca 300
acagcagcaa acaaucgagc cagaagagaa cuaccaaggu uuaugaauua uacacucaac 360
aauaccaaaa aaaccaaugu aacauuaagc aagaaaagga aaagaagauu ucuugguuuu 420
uuguuaggug uuggaucugc aaucgccagu ggcauugcug uaucuaaggu ccugcacuua 480
gaaggagaag ugaacaagau caaaagugcu cuacuaucca caaacaaggc cguagucagc 540
uuaucaaaug gaguuagugu cuuaaccagc aaaguguuag accucaaaaa cuauauagau 600
aaacaauugu uaccuauugu gaauaagcaa agcugcagaa uaucaaauau agaaacugug 660
auagaguucc aacaaaagaa caacagacua cuagagauua ccagggaauu uaguguuaau 720
gcagguguaa cuacaccugu aagcacuuac auguuaacua auagugaauu auugucauua 780
aucaaugaua ugccuauaac aaaugaucag aaaaaguuaa uguccaacaa uguucaaaua 840
guuagacagc aaaguuacuc uaucaugucc auaauaaaag aggaagucuu agcauaugua 900
guacaauuac cacuauaugg ugugauagau acaccuuguu ggaaauuaca cacauccccu 960
cuauguacaa ccaacacaaa agaaggguca aacaucuguu uaacaagaac ugacagagga 1020
ugguacugug acaaugcagg aucaguaucu uucuucccac aagcugaaac auguaaaguu 1080
caaucgaauc gaguauuuug ugacacaaug aacaguuuaa cauuaccaag ugaaguaaau 1140
cucugcaaug uugacauauu caaucccaaa uaugauugua aaauuaugac uucaaaaaca 1200
gauguaagca gcuccguuau cacaucucua ggagccauug ugucaugcua uggcaaaacu 1260
aaauguacag cauccaauaa aaaucgugga aucauaaaga cauuuucuaa cgggugugau 1320
uauguaucaa auaaaggggu ggacacugug ucuguaggua acacauuaua uuauguaaau 1380
aagcaagaag gcaaaagucu cuauguaaaa ggugaaccaa uaauaaauuu cuaugaccca 1440
uuaguauucc ccucugauga auuugaugca ucaauaucuc aagucaauga gaagauuaac 1500
cagaguuuag cauuuauucg uaaauccgau gaauuauuac aucauguaaa ugcugguaaa 1560
ucaaccacaa auaucaugau aacuacuaua auuauaguga uuauaguaau auuguuauca 1620
uuaauugcug uuggacugcu ccuauacugu aaggccagaa gcacaccagu cacacuaagc 1680
aaggaucaac ugagugguau aaauaauauu gcauuuagua acuga 1725
<210> 13
<211> 897
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 13
auguccaaaa acaaggacca acgcaccgcu aagacacuag aaaagaccug ggacacucuc 60
aaucauuuau uauucauauc aucgggcuua uauaaguuaa aucuuaaauc uauagcacaa 120
aucacauuau ccauucuggc aaugauaauc ucaacuucac uuauaauuac agccaucaua 180
uucauagccu cggcaaacca caaagucaca cuaacaacug caaucauaca agaugcaaca 240
agccagauca agaacacaac cccaacauac cucacucagg auccucagcu uggaaucagc 300
uucuccaauc ugucugaaau uacaucacaa accaccacca uacuagcuuc aacaacacca 360
ggagucaagu caaaccugca acccacaaca gucaagacua aaaacacaac aacaacccaa 420
acacaaccca gcaagcccac uacaaaacaa cgccaaaaca aaccaccaaa caaacccaau 480
aaugauuuuc acuucgaagu guuuaacuuu guacccugca gcauaugcag caacaaucca 540
accugcuggg cuaucugcaa aagaauacca aacaaaaaac caggaaagaa aaccaccacc 600
aagccuacaa aaaaaccaac cuucaagaca accaaaaaag aucucaaacc ucaaaccacu 660
aaaccaaagg aaguacccac caccaagccc acagaagagc caaccaucaa caccaccaaa 720
acaaacauca caacuacacu gcucaccaac aacaccacag gaaauccaaa acucacaagu 780
caaauggaaa ccuuccacuc aaccuccucc gaaggcaauc uaagcccuuc ucaagucucc 840
acaacauccg agcacccauc acaacccuca ucuccaccca acacaacacg ccaguag 897
<210> 14
<211> 195
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 14
auggaaaaua cauccauaac aauagaauuc ucaagcaaau ucuggccuua cuuuacacua 60
auacacauga ucacaacaau aaucucuuug cuaaucauaa ucuccaucau gacugcaaua 120
cuaaacaaac uuugugaaua uaacguauuc cauaacaaaa ccuuugaguu accaagagcu 180
cgagucaaca cauag 195
<210> 15
<211> 771
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 15
auggaaacau acgugaacaa gcuucacgaa ggcuccacau acacagcugc uguucaauac 60
aauguccuag aaaaagacga ugacccugca ucacuuacaa uaugggugcc cauguuccaa 120
ucaucuaugc cagcagauuu acuuauaaaa gaacuagcua augucaacau acuagugaaa 180
caaauaucca cacccaaggg accuucacua agagucauga uaaacucaag aagugcauug 240
cuagcacaaa ugcccagcaa auuuaccaua ugugcuaaug uguccuugga ugaaagaagc 300
aaacuggcau augauguaac cacacccugu gaaaucaagg cauguagucu aacaugccua 360
aaaucaaaaa auauguuaac uacaguuaaa gaucucacua ugaagacacu caaccccaca 420
caugauauua uugcuuuaug ugaauuugaa aacauaguaa caucaaaaaa agucauaaua 480
ccaacauacc uaagauccau cagugucaga aauaaagauc ugaacacacu ugaaaauaua 540
acaaccacug aauucaaaaa ugccaucaca aaugcaaaaa ucaucccuua cucaggauua 600
cuauuaguca ucacagugac ugacaacaaa ggagcauuca aauacauaaa gccgcaaagu 660
caauucauag uagaucuugg agcuuaccua gaaaaagaaa guauauauua uguuaccaca 720
aauuggaagc acacagcuac acgauuugca aucaaaccca uggaagauua a 771
<210> 16
<211> 1176
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 16
auggcucuua gcaaagucaa guugaaugau acacucaaca aagaucaacu ucugucaucu 60
agcaaauaca ccauccaacg gagcacagga gauaguauug auacuccuaa uuaugaugug 120
cagaaacaca ucaauaaguu auguggcaug uuauuaauca cagaagaugc uaaucauaaa 180
uucacugggu uaauagguau guuauaugcu augucuaggu uaggaagaga agacaccaua 240
aaaauacuca gagaugcggg auaucaugua aaagcaaaug gaguagaugu aacaacacau 300
cgucaagaca ucaaugggaa agaaaugaaa uuugaagugu uaacauuggc aagcuuaaca 360
acugaaauuc aaaucaacau ugagauagaa ucuagaaaau ccuacaaaaa aaugcuaaaa 420
gaaaugggag agguagcucc agaauacagg caugauucuc cugauugugg gaugauaaua 480
uuauguauag cagcauuagu aauaaccaaa uuggcagcag gggauagauc uggucuuaca 540
gccgugauua ggagagcuaa uaauguccua aaaaaugaaa ugaaacguua caaaggcuua 600
cuacccaagg auauagccaa cagcuucuau gaaguguuug aaaaacaucc ccacuuuaua 660
gauguuuuug uucauuuugg uauagcacaa ucuuccacca gagguggcag uagaguugaa 720
gggauuuuug caggauuguu uaugaaugcc uauggugcag ggcaaguaau gcuacggugg 780
ggagucuuag caaaaucagu uaaaaauauu auguuaggac augcuagugu gcaagcagaa 840
auggaacaag uuguugaggu uuaugaauau gcccaaaaau uggguggaga agcaggauuc 900
uaccauauau ugaacaaccc aaaagcauca uuauuaucuu ugacucaauu uccucacuuu 960
uccaguguag uauuaggcaa ugcugcuggc cuaggcauaa ugggagagua cagagguaca 1020
ccgaggaauc aagaucuaua ugaugcagca aaggcauaug cugaacaacu caaagaaaau 1080
ggugugauua acuacagugu auuagacuug acagcagaag aacuagaggc uaucaaacau 1140
cagcuuaauc caaaagauaa ugauguagag cuuuga 1176
<210> 17
<211> 6498
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 17
auggauccca uuauuaaugg aaauucugcu aauguuuauc uaaccgauag uuauuuaaaa 60
gguguuaucu cuuucucaga guguaaugcu uuaggaaguu acauauucaa ugguccuuau 120
cucaaaaaug auuauaccaa cuuaauuagu agacaaaauc cauuaauaga acacaugaau 180
cuaaagaaac uaaauauaac acaguccuua auaucuaagu aucauaaagg ugaaauaaaa 240
uuagaagagc cuacuuauuu ucagucauua cuuaugacau acaagaguau gaccucguug 300
gaacagauug cuaccacuaa uuuacuuaaa aagauaauaa gaagagcuau agaaauaagu 360
gaugucaaag ucuaugcuau auugaauaaa cuagggcuua aagaaaagga caagauuaaa 420
uccaacaaug gacaggauga agacaacuca guuauuacga ccauaaucaa agaugauaua 480
cuuucagcug uuaaggauaa ucaaucucau cuuaaagcag acaaaaauca cucuacaaaa 540
caaaaagaca caaucaaaac aacacucuug aagaaauuaa uguguucaau gcagcauccu 600
ccaucauggu uaauacauug guuuaauuua uacacaaaau uaaacaacau auuaacacag 660
uaucgaucaa augagguuaa aaaccauggg uuuauauuga uagauaauca aacucuuagu 720
ggauuucaau uuauuuugaa ucaauauggu uguauaguuu aucauaagga acucaaaaga 780
auuacuguga caaccuauaa ucaauucuug acauggaaag auauuagccu uaguagauua 840
aauguuuguu uaauuacaug gauuaguaac ugcuugaaca cauuaaauaa aagcuuaggc 900
uuaagaugcg gauucaauaa uguuaucuug acacaacuau uccuuuaugg ugauuguaua 960
cuaaagcuau uucacaauga gggguucuac auaauaaaag agguagaggg auuuauuaug 1020
ucucuaauuu uaaauauaac agaagaagau caauucagaa aacgauuuua uaauaguaug 1080
cucaacaaca ucacagaugc ugcuaauaaa gcucagaaaa aucugcuauc aagaguaugu 1140
cauacauuau uagauaagac aguauccgau aauauaauaa auggcagaug gauaauucua 1200
uuaaguaagu uccuuaaauu aauuaagcuu gcaggugaca auaaccuuaa caaucugagu 1260
gaacuauauu uuuuguucag aauauuugga cacccaaugg uagaugaaag acaagccaug 1320
gaugcuguua aaguuaauug caaugagacc aaauuuuacu uguuaagcag uuugaguaug 1380
uuaagaggug ccuuuauaua uagaauuaua aaaggguuug uaaauaauua caacagaugg 1440
ccuacuuuaa gaaaugcuau uguuuuaccc uuaagauggu uaacuuacua uaaacuaaac 1500
acuuauccuu cuuuguugga acuuacagaa agagauuuga uuguguuauc aggacuacgu 1560
uucuaucgug aguuucgguu gccuaaaaaa guggaucuug aaaugauuau aaaugauaaa 1620
gcuauaucac ccccuaaaaa uuugauaugg acuaguuucc cuagaaauua uaugccguca 1680
cacauacaaa acuauauaga acaugaaaaa uuaaaauuuu ccgagaguga uaaaucaaga 1740
agaguauuag aguauuauuu aagagauaac aaauucaaug aaugugauuu auacaacugu 1800
guaguuaauc aaaguuaucu caacaacccu aaucaugugg uaucauugac aggcaaagaa 1860
agagaacuca guguagguag aauguuugca augcaaccgg gaauguucag acagguucaa 1920
auauuggcag agaaaaugau agcugaaaac auuuuacaau ucuuuccuga aagucuuaca 1980
agauauggug aucuagaacu acaaaaaaua uuagaauuga aagcaggaau aaguaacaaa 2040
ucaaaucgcu acaaugauaa uuacaacaau uacauuagua agugcucuau caucacagau 2100
cucagcaaau ucaaucaagc auuucgauau gaaacgucau guauuuguag ugaugugcug 2160
gaugaacugc augguguaca aucucuauuu uccugguuac auuuaacuau uccucauguc 2220
acaauaauau gcacauauag gcaugcaccc cccuauauaa gagaucauau uguagaucuu 2280
aacaauguag augaacaaag uggauuauau agauaucaca ugggugguau ugaagggugg 2340
ugucaaaaac uauggaccau agaagcuaua ucacuauugg aucuaauauc ucucaaaggg 2400
aaauucucaa uuacugcuuu aauuaauggu gacaaucaau caauagauau aagcaaacca 2460
gucagacuca uggaagguca aacucaugcu caagcagauu auuugcuagc auuaaauagc 2520
cuuaaauuac uguauaaaga guaugcaggc auaggucaca aauuaaaagg aacugagacu 2580
uauauaucac gagauaugca auuuaugagu aaaacaauuc aacauaacgg uguauauuac 2640
ccugcuagua uaaagaaagu ccuaagagug ggaccgugga uaaacacuau acuugaugau 2700
uucaaaguga gucuagaauc uauagguagu uugacacaag aauuagaaua uagaggugaa 2760
agucuauuau gcaguuuaau auuuagaaau guaugguuau auaaucaaau ugcucuacaa 2820
uuaaaaaauc augcguuaug uaacaauaaa uuauauuugg acauauuaaa gguucugaaa 2880
cacuuaaaaa ccuuuuuuaa ucuugauaau auugauacag cauuaacauu guauaugaau 2940
uuacccaugu uauuuggugg uggugauccc aacuuguuau aucgaaguuu cuauagaaga 3000
acuccugauu uccucacaga ggcuauaguu cacucugugu ucauacuuag uuauuauaca 3060
aaccaugacu uaaaagauaa acuucaagau uugucagaug auagauugaa uaaguucuua 3120
acaugcauaa ucacguuuga caaaaacccu aaugcugaau ucguaacauu gaugagagau 3180
ccucaagcuu uagggucuga gagacaagcu aaaauuacua gugaaaucaa uagacuggca 3240
guuacagagg uuuugaguac agcuccaaac aaaauauucu ccaaaagugc acaacauuau 3300
accacuacag agauagaucu aaaugauauu augcaaaaua uagaaccuac auauccucac 3360
gggcuaagag uuguuuauga aaguuuaccc uuuuauaaag cagagaaaau aguaaaucuu 3420
auaucaggua caaaaucuau aacuaacaua cuggaaaaga cuucugccau agacuuaaca 3480
gauauugaua gagccacuga gaugaugagg aaaaacauaa cuuugcuuau aaggauacuu 3540
ccauuggauu guaacagaga uaaaagagaa auauugagua uggaaaaccu aaguauuacu 3600
gaauuaagca aauauguuag ggaaagaucu uggucuuuau ccaauauagu ugguguuaca 3660
ucacccagua ucauguauac aauggacauc aaauauacaa caagcacuau agcuaguggc 3720
auaauuauag agaaauauaa uguuaacagu uuaacacgug gugagagagg accaacuaaa 3780
ccauggguug guucaucuac acaagagaaa aaaacaaugc caguuuauaa uagacaaguu 3840
uuaaccaaaa aacaaagaga ucaaauagau cuauuagcaa aauuggauug gguguaugca 3900
ucuauagaua acaaggauga auucauggaa gaacucagca uaggaacccu uggguuaaca 3960
uaugaaaagg ccaaaaaauu auuuccacaa uauuuaagug ucaacuauuu gcaucgccuu 4020
acagucagua guagaccaug ugaauucccu gcaucaauac cagcuuauag aacaacaaau 4080
uaucacuuug acacuagccc uauuaaucgc auauuaacag aaaaguaugg ugaugaagau 4140
auugacauag uauuccaaaa cuguauaagc uuuggccuua gcuuaauguc aguaguagaa 4200
caauuuacua auguaugucc uaacagaauu auucucauac cuaagcuuaa ugagauacau 4260
uugaugaaac cucccauauu cacaggugau guugauauuc acaaguuaaa acaagugaua 4320
caaaaacagc auauguuuuu accagacaaa auaaguuuga cucaauaugu ggaauuauuc 4380
uuaaguaaca aaacacucaa aucuggaucu cauguuaauu cuaauuuaau auuggcacau 4440
aaaauaucug acuauuuuca uaauacuuac auuuuaagua cuaauuuagc uggacauugg 4500
auucuaauua uacaacuuau gaaagauucu aaagguauuu uugaaaaaga uuggggagag 4560
ggauauauaa cugaucauau guuuauuaau uugaaaguuu ucuucaaugc uuauaagacc 4620
uaucucuugu guuuucauaa agguuauggc aaagcaaaac uggaguguga uaugaacacu 4680
ucagaucuuc uauguguauu ggaauuaaua gacaguaguu auuggaaguc uaugucuaag 4740
guauuuuuag aacaaaaagu uaucaaauac auucuuagcc aagaugcaag uuuacauaga 4800
guaaaaggau gucauagcuu caaauuaugg uuucuuaaac gucuuaaugu agcagaauuu 4860
acaguuugcc cuuggguugu uaacauagau uaucauccaa cacauaugaa agcaauauua 4920
acuuauauag aucuuguuag aaugggauug auaaauauag auagaauaca cauuaaaaau 4980
aaacacaaau ucaaugauga auuuuauacu ucuaaucucu uuuacauuaa uuauaacuuc 5040
ucagauaaua cucaucuauu aacuaaacau auaaggauug cuaauucaga auuagaaaau 5100
aauuacaaca aauuauauca uccuacacca gaaacccuag agaauauacu agccaauccg 5160
auuaaaagua augacaaaaa gacacugaac gacuauugua uagguaaaaa uguugacuca 5220
auaauguuac cauuguuauc uaauaagaag cuuguuaaau cgucugcaau gauuagaacc 5280
aauuacagca aacaagaccu guacaaucua uucccuacgg uugugaucga uagaauuaua 5340
gaucauucag guaauacagc caaauccaac caacuuuaca cuacuacuuc ccaucaaaua 5400
ucuuuagugc acaauagcac aucacuuuau ugcaugcuuc cuuggcauca uauuaauaga 5460
uucaauuuug uauuuaguuc uacagguugu aaaauuagua uagaguauau uuuaaaagac 5520
cuuaaaauua aagauccuaa uuguauagca uucauaggug aaggagcagg gaauuuauua 5580
uugcguacag ugguggaacu ucauccugac auaagauaua uuuacagaag ucugaaagau 5640
ugcaaugauc auaguuuacc uauugaguuu uuaaggcuau acaauggaca uaucaacauu 5700
gauuauggug aaaauuugac cauuccugcu acagaugcaa ccaacaacau ucauuggucu 5760
uauuuacaua uaaaguuugc ugaaccuauc agucuuuuug uaugugaugc cgaauugccu 5820
guaacaguca acuggaguaa aauuauaaua gaauggagca agcauguaag aaaaugcaag 5880
uacuguuccu caguuaauaa auguacguua auaguaaaau aucaugcuca agaugauauu 5940
gauuucaaau uagacaauau aacuauauua aaaacuuaug uaugcuuagg caguaaguua 6000
aagggaucgg agguuuacuu aguccuuaca auagguccug caaauauauu uccaguauuu 6060
aauguaguac aaaaugcuaa auugauacua ucaagaacca aaaauuucau caugccuaag 6120
aaagcugaua aagagucuau ugaugcaaau auuaaaaguu ugauacccuu ucuuuguuac 6180
ccuauaacaa aaaaaggaau uaauacugca uugucaaaac uaaagagugu uguuagugga 6240
gauauacuau cauauucuau agcuggacgg aaugaaguuu ucagcaauaa acuuauaaau 6300
cauaagcaua ugaacaucuu aaagugguuc aaucauguuu uaaauuucag aucaacagaa 6360
cuaaacuaua accauuuaua uaugguagaa ucuacauauc cuuaccuaag ugaauuguua 6420
aacagcuuga caacuaauga acuuaaaaaa cugauuaaaa ucacagguag ucuguuauac 6480
aacuuucaua augaauaa 6498
<210> 18
<211> 585
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 18
augucacgaa ggaauccuug caaauuugaa auucgagguc auugcuugaa ugguaagaga 60
ugucauuuua gucauaauua uuuugaaugg ccaccccaug cacugcucgu aagacaaaac 120
uuuauguuaa acagaauacu uaagucuaug gauaaaagua uagauaccuu aucagaaaua 180
aguggagcug cagaguugga cagaacagaa gaguaugcuc uugguguagu uggagugcua 240
gagaguuaua uaggaucaau aaauaauaua acuaaacaau cagcaugugu ugccaugagc 300
aaacuccuca cugaacucaa uagugaugau aucaaaaaac ugagagacaa ugaagagcua 360
aauucaccca agauaagagu guacaauacu gucauaucau auauugaaag caacaggaaa 420
aacaauaaac aaacuaucca ucuguuaaaa agauugccag cagacguauu gaagaaaacc 480
aucaaaaaca cauuggauau ccacaagagc auaaccauca acaacccaaa agaauuaacu 540
guuagugaua caaaugacca ugccaaaaau aaugauacua ccuga 585
<210> 19
<211> 273
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 19
augaccaugc caaaaauaau gauacuaccu gacaaauauc cuuguaguau aacuuccaua 60
cuaauaacaa guagauguag agucacuaug uauaaucgaa agaacacacu auauuucaau 120
caaaacaacc caaauaacca uauguacuca ccgaaucaaa cauucaauga aauccauugg 180
accucacaag acuugauuga cacaauucaa aauuuucuac agcaucuagg uguuauugag 240
gauauauaua caauauauau auuaguguca uaa 273
<210> 20
<211> 726
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 20
auggaaaagu uugcuccuga auuccaugga gaagaugcaa acaacagggc uacuaaauuc 60
cuagaaucaa uaaagggcaa auucacauca ccuaaagauc ccaagaaaaa agauaguauc 120
auaucuguca acucaauaga uauagaagua accaaagaaa gcccuauaac aucaaauuca 180
accauuauua acccaacaaa ugagacagau gauaaugcag ggaacaagcc caauuaucaa 240
agaaaaccuc uaguaaguuu caaagaagac ccuauaccaa gugauaaucc cuuuucaaaa 300
cuauacaaag aaaccauaga gacauuugau aacaaugaag aagaaucuag cuauucauau 360
gaagaaauaa augaucagac gaacgauaau auaacugcaa gauuagauag gauugaugaa 420
aaauuaagug aaauacuagg aaugcuucac acauuaguag uagcaagugc aggaccuaca 480
ucugcuaggg augguauaag agaugccaug guugguuuaa gagaagaaau gauagaaaaa 540
aucagaacug aagcauuaau gaccaaugac agauuagaag cuauggcaag acucaggaau 600
gaggaaagug aaaagauggc aaaagacaca ucagaugaag ugucucucaa uccaacauca 660
gagaaauuga acaaccuguu ggaagggaau gauagugaca augaucuauc acuugaagau 720
uucuga 726
<210> 21
<211> 420
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 21
augggcagca auucguugag uaugauaaaa guuagauuac aaaauuuguu ugacaaugau 60
gaaguagcau uguuaaaaau aacaugcuau acugacaaau uaauacauuu aacuaaugcu 120
uuggcuaagg cagugauaca uacaaucaaa uugaauggca uuguguuugu gcauguuauu 180
acaaguagug auauuugccc uaauaauaau auuguaguaa aauccaauuu cacaacaaug 240
ccagugcuac aaaauggagg uuauauaugg gaaaugaugg aauuaacaca uugcucucaa 300
ccuaaugguc uaauagauga caauugugaa auuaaauucu ccaaaaaacu aagugauuca 360
acaaugacca auuauaugaa ucaauuaucu gaauuacuug gauuugaucu uaauccauaa 420
<210> 22
<211> 375
<212> РНК
<213> Респираторно-синцитиальный вирус
<400> 22
auggacacaa cccacaauga uaccacacca caaagacuga ugaucacaga caugagaccg 60
uugucacuug agacuacaau aacaucacua accagagaca ucauaacaca cagauuuaua 120
uacuuaauaa aucaugaaug cauagugaga aaacuugaug aaagacaggc cacauuuaca 180
uuccugguca acuaugaaau gaaacuauug cacaaaguag gaagcacuaa auauaaaaaa 240
uauacugaau acaacacaaa auauggcacu uucccuaugc cgauauucau caaucaugau 300
ggguucuuag aaugcauugg cauuaagccu acaaagcaua cucccauaau auacaaguau 360
gaucucaauc cauag 375
<210> 23
<211> 42
<212> ДНК
<213> Homo sapiens
<400> 23
ggcgctgcct acggaggtgg cagccatctc cttctcggca tc 42
<210> 24
<211> 186
<212> ДНК
<213> Homo sapiens
<400> 24
catcacattt aaaagcatct cagcctacca tgagaataag agaaagaaaa tgaagatcaa 60
aagcttattc atctgttttt ctttttcgtt ggtgtaaagc caacaccctg tctaaaaaac 120
ataaatttct ttaatcattt tgcctctttt ctctgtgctt caattaataa aaaatggaaa 180
gaatct 186
<210> 25
<211> 186
<212> ДНК
<213> Homo sapiens
<400> 25
catcacattt aaaagcatct cagcctacca tgagaataag agaaagaaaa tgaagatcaa 60
tagcttattc atctcttttt ctttttcgtt ggtgtaaagc caacaccctg tctaaaaaac 120
ataaatttct ttaatcattt tgcctctttt ctctgtgctt caattaataa aaaatggaaa 180
gaacct 186
<210> 26
<211> 110
<212> ДНК
<213> Homo sapiens
<400> 26
gctggagcct cggtggccat gcttcttgcc ccttgggcct ccccccagcc cctcctcccc 60
ttcctgcacc cgtacccccg tggtctttga ataaagtctg agtgggcggc 110
<210> 27
<211> 108
<212> ДНК
<213> Homo sapiens
<400> 27
gctggagcct cggtagccgt tcctcctgcc cgctgggcct cccaacgggc cctcctcccc 60
tccttgcacc ggcccttcct ggtctttgaa taaagtctga gtgggcag 108
<210> 28
<211> 132
<212> ДНК
<213> Homo sapiens
<400> 28
gctcgctttc ttgctgtcca atttctatta aaggttcctt tgttccctaa gtccaactac 60
taaactgggg gatattatga agggccttga gcatctggat tctgcctaat aaaaaacatt 120
tattttcatt gc 132
<210> 29
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<223> центральная связывающая альфа-комплекс область 3’UTR гена альфа-глобина (muag)
<400> 29
gcccgatggg cctcccaacg ggccctcctc ccctccttgc accg 44
<210> 30
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> наиболее предпочтительная последовательность гистоновой структуры типа «стебель-петля»
<400> 30
caaaggctct tttcagagcc acca 24
<210> 31
<211> 1942
<212> РНК
<213> Искусственная последовательность
<220>
<223> РСВ-F «длинный» (GC) R1691
<400> 31
gggagaaagc uuaccaugga gcugcccauc cucaaggcca acgccaucac caccauccug 60
gcggccguga cguucugcuu cgccagcucc cagaacauca ccgaggaguu cuaccagagc 120
accugcuccg ccgucagcaa gggcuaccug uccgcccucc ggaccgggug guacacgagc 180
gugaucacca ucgagcuguc caacaucaag gagaacaagu gcaacggcac cgacgcgaag 240
gugaagcuga ucaaccagga gcucgacaag uacaagaacg ccgucaccga gcugcagcug 300
cucaugcaga gcacgaccgc cgccaacaac cgcgcgcggc gcgagcugcc gcgguucaug 360
aacuacaccc ugaacaacac caagaagacg aacgugaccc ucuccaagaa gcgcaagcgg 420
cgcuuccugg gguuccugcu cggcgugggg agcgccaucg ccuccggcau cgccgucagc 480
aaggugcugc accuggaggg cgaggugaac aagaucaagu ccgcccuccu gagcaccaac 540
aaggcggucg ugucccugag caacggggug uccguccuca ccagcaaggu gcuggaccug 600
aagaacuaca ucgacaagca gcuccugccc aucgugaaca agcaguccug ccggaucagc 660
aacaucgaga cggucaucga guuccagcag aagaacaacc gccugcucga gaucacccgg 720
gaguucagcg ugaacgccgg cgugaccacc cccgucucca cguacaugcu gaccaacagc 780
gagcugcucu cccugaucaa cgacaugccc aucaccaacg accagaagaa gcugaugagc 840
aacaacgugc agaucgugcg ccagcagucc uacagcauca uguccaucau caaggaggag 900
guccucgccu acguggugca gcugccgcug uacgggguca ucgacacccc cugcuggaag 960
cuccacacga gcccccugug caccaccaac accaaggagg gcuccaacau cugccugacg 1020
cggaccgacc gcggguggua cugcgacaac gccggcagcg uguccuucuu cccccaggcc 1080
gagaccugca agguccagag caaccgggug uucugcgaca ccaugaacuc ccucacgcug 1140
ccgagcgagg ugaaccugug caacgucgac aucuucaacc ccaaguacga cugcaagauc 1200
augaccucca agaccgacgu gagcuccagc gugaucaccu cccucggcgc gaucgucagc 1260
ugcuacggga agacgaagug caccgccagc aacaagaacc gcggcaucau caagaccuuc 1320
uccaacgggu gcgacuacgu gagcaacaag ggcguggaca ccgucuccgu gggcaacacc 1380
cuguacuacg ugaacaagca ggaggggaag agccuguacg ucaagggcga gcccaucauc 1440
aacuucuacg acccccucgu guucccgucc gacgaguucg acgccagcau cucccaggug 1500
aacgagaaga ucaaccagag ccuggccuuc auccggaagu ccgacgagcu gcugcaccac 1560
gucaacgccg ggaagagcac gaccaacauc augaucacca ccaucaucau cgugaucauc 1620
gugauccucc ugucccugau cgcggucggc cuccugcugu acugcaaggc ccgcagcacg 1680
cccgugaccc ucuccaagga ccagcugagc gggaucaaca acaucgccuu cuccaacuga 1740
ggacuaguua uaagacugac uagcccgaug ggccucccaa cgggcccucc uccccuccuu 1800
gcaccgagau uaauaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaug cauccccccc cccccccccc cccccccccc ccccaaaggc 1920
ucuuuucaga gccaccagaa uu 1942
<210> 32
<211> 2107
<212> РНК
<213> Искусственная последовательность
<220>
<223> РСВ-F «длинный» (GC) R2510
<400> 32
ggggcgcugc cuacggaggu ggcagccauc uccuucucgg caucaagcuu accauggagc 60
ugcccauccu caaggccaac gccaucacca ccauccuggc ggccgugacg uucugcuucg 120
ccagcuccca gaacaucacc gaggaguucu accagagcac cugcuccgcc gucagcaagg 180
gcuaccuguc cgcccuccgg accggguggu acacgagcgu gaucaccauc gagcugucca 240
acaucaagga gaacaagugc aacggcaccg acgcgaaggu gaagcugauc aaccaggagc 300
ucgacaagua caagaacgcc gucaccgagc ugcagcugcu caugcagagc acgaccgccg 360
ccaacaaccg cgcgcggcgc gagcugccgc gguucaugaa cuacacccug aacaacacca 420
agaagacgaa cgugacccuc uccaagaagc gcaagcggcg cuuccugggg uuccugcucg 480
gcguggggag cgccaucgcc uccggcaucg ccgucagcaa ggugcugcac cuggagggcg 540
aggugaacaa gaucaagucc gcccuccuga gcaccaacaa ggcggucgug ucccugagca 600
acgggguguc cguccucacc agcaaggugc uggaccugaa gaacuacauc gacaagcagc 660
uccugcccau cgugaacaag caguccugcc ggaucagcaa caucgagacg gucaucgagu 720
uccagcagaa gaacaaccgc cugcucgaga ucacccggga guucagcgug aacgccggcg 780
ugaccacccc cgucuccacg uacaugcuga ccaacagcga gcugcucucc cugaucaacg 840
acaugcccau caccaacgac cagaagaagc ugaugagcaa caacgugcag aucgugcgcc 900
agcaguccua cagcaucaug uccaucauca aggaggaggu ccucgccuac guggugcagc 960
ugccgcugua cggggucauc gacacccccu gcuggaagcu ccacacgagc ccccugugca 1020
ccaccaacac caaggagggc uccaacaucu gccugacgcg gaccgaccgc gggugguacu 1080
gcgacaacgc cggcagcgug uccuucuucc cccaggccga gaccugcaag guccagagca 1140
accggguguu cugcgacacc augaacuccc ucacgcugcc gagcgaggug aaccugugca 1200
acgucgacau cuucaacccc aaguacgacu gcaagaucau gaccuccaag accgacguga 1260
gcuccagcgu gaucaccucc cucggcgcga ucgucagcug cuacgggaag acgaagugca 1320
ccgccagcaa caagaaccgc ggcaucauca agaccuucuc caacgggugc gacuacguga 1380
gcaacaaggg cguggacacc gucuccgugg gcaacacccu guacuacgug aacaagcagg 1440
aggggaagag ccuguacguc aagggcgagc ccaucaucaa cuucuacgac ccccucgugu 1500
ucccguccga cgaguucgac gccagcaucu cccaggugaa cgagaagauc aaccagagcc 1560
uggccuucau ccggaagucc gacgagcugc ugcaccacgu caacgccggg aagagcacga 1620
ccaacaucau gaucaccacc aucaucaucg ugaucaucgu gauccuccug ucccugaucg 1680
cggucggccu ccugcuguac ugcaaggccc gcagcacgcc cgugacccuc uccaaggacc 1740
agcugagcgg gaucaacaac aucgccuucu ccaacugagg acuagugcau cacauuuaaa 1800
agcaucucag ccuaccauga gaauaagaga aagaaaauga agaucaauag cuuauucauc 1860
ucuuuuucuu uuucguuggu guaaagccaa cacccugucu aaaaaacaua aauuucuuua 1920
aucauuuugc cucuuuucuc ugugcuucaa uuaauaaaaa auggaaagaa ccuagaucua 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaugcaucc cccccccccc cccccccccc ccccccccca aaggcucuuu ucagagccac 2100
cagaauu 2107
<210> 33
<211> 2044
<212> РНК
<213> Искусственная последовательность
<220>
<223> РСВ-Fdel554-574 «длинный» (GC) R2821
<400> 33
ggggcgcugc cuacggaggu ggcagccauc uccuucucgg caucaagcuu accauggagc 60
ugcccauccu caaggccaac gccaucacca ccauccuggc ggccgugacg uucugcuucg 120
ccagcuccca gaacaucacc gaggaguucu accagagcac cugcuccgcc gucagcaagg 180
gcuaccuguc cgcccuccgg accggguggu acacgagcgu gaucaccauc gagcugucca 240
acaucaagga gaacaagugc aacggcaccg acgcgaaggu gaagcugauc aaccaggagc 300
ucgacaagua caagaacgcc gucaccgagc ugcagcugcu caugcagagc acgaccgccg 360
ccaacaaccg cgcgcggcgc gagcugccgc gguucaugaa cuacacccug aacaacacca 420
agaagacgaa cgugacccuc uccaagaagc gcaagcggcg cuuccugggg uuccugcucg 480
gcguggggag cgccaucgcc uccggcaucg ccgucagcaa ggugcugcac cuggagggcg 540
aggugaacaa gaucaagucc gcccuccuga gcaccaacaa ggcggucgug ucccugagca 600
acgggguguc cguccucacc agcaaggugc uggaccugaa gaacuacauc gacaagcagc 660
uccugcccau cgugaacaag caguccugcc ggaucagcaa caucgagacg gucaucgagu 720
uccagcagaa gaacaaccgc cugcucgaga ucacccggga guucagcgug aacgccggcg 780
ugaccacccc cgucuccacg uacaugcuga ccaacagcga gcugcucucc cugaucaacg 840
acaugcccau caccaacgac cagaagaagc ugaugagcaa caacgugcag aucgugcgcc 900
agcaguccua cagcaucaug uccaucauca aggaggaggu ccucgccuac guggugcagc 960
ugccgcugua cggggucauc gacacccccu gcuggaagcu ccacacgagc ccccugugca 1020
ccaccaacac caaggagggc uccaacaucu gccugacgcg gaccgaccgc gggugguacu 1080
gcgacaacgc cggcagcgug uccuucuucc cccaggccga gaccugcaag guccagagca 1140
accggguguu cugcgacacc augaacuccc ucacgcugcc gagcgaggug aaccugugca 1200
acgucgacau cuucaacccc aaguacgacu gcaagaucau gaccuccaag accgacguga 1260
gcuccagcgu gaucaccucc cucggcgcga ucgucagcug cuacgggaag acgaagugca 1320
ccgccagcaa caagaaccgc ggcaucauca agaccuucuc caacgggugc gacuacguga 1380
gcaacaaggg cguggacacc gucuccgugg gcaacacccu guacuacgug aacaagcagg 1440
aggggaagag ccuguacguc aagggcgagc ccaucaucaa cuucuacgac ccccucgugu 1500
ucccguccga cgaguucgac gccagcaucu cccaggugaa cgagaagauc aaccagagcc 1560
uggccuucau ccggaagucc gacgagcugc ugcaccacgu caacgccggg aagagcacga 1620
ccaacaucau gaucaccacc aucaucaucg ugaucaucgu gauccuccug ucccugaucg 1680
cggucggccu ccugcuguac ugcaaggccc gcugaggacu agugcaucac auuuaaaagc 1740
aucucagccu accaugagaa uaagagaaag aaaaugaaga ucaauagcuu auucaucucu 1800
uuuucuuuuu cguuggugua aagccaacac ccugucuaaa aaacauaaau uucuuuaauc 1860
auuuugccuc uuuucucugu gcuucaauua auaaaaaaug gaaagaaccu agaucuaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
ugcauccccc cccccccccc cccccccccc ccccccaaag gcucuuuuca gagccaccag 2040
aauu 2044
<210> 34
<211> 1558
<212> РНК
<213> Искусственная последовательность
<220>
<223> РСВ-N (GC) R2831
<400> 34
ggggcgcugc cuacggaggu ggcagccauc uccuucucgg caucaagcuu accauggccc 60
ugagcaaggu gaagcucaac gacacccuga acaaggacca gcugcucucc agcuccaagu 120
acaccaucca gcgcagcacg ggcgacucca ucgacacccc caacuacgac guccagaagc 180
acaucaacaa gcugugcggg augcugcuca ucaccgagga cgccaaccac aaguucaccg 240
gccugaucgg gaugcuguac gcgaugagcc ggcucggccg cgaggacacg aucaagaucc 300
ugcgggacgc cggguaccac gugaaggcca acggcgugga cgucaccacc caccgccagg 360
acaucaacgg caaggagaug aaguucgagg ugcugacccu cgccucccug acgaccgaga 420
uccagaucaa caucgagauc gagagccgga aguccuacaa gaagaugcug aaggagaugg 480
gggagguggc cccggaguac cgccacgaca gccccgacug cggcaugauc auccucugca 540
ucgcggcccu ggucaucacc aagcuggccg ccggggaccg guccggccuc accgcgguga 600
uccgccgggc caacaacgug cugaagaacg agaugaagcg cuacaagggg cugcucccca 660
aggacaucgc caacagcuuc uacgaggucu ucgagaagca cccccacuuc aucgacgugu 720
ucgugcacuu cggcaucgcc caguccagca cgcggggcgg gucccgcguc gagggcaucu 780
ucgccgggcu guucaugaac gcguacggcg ccggccaggu gaugcugcgg uggggcgugc 840
ucgccaagag cgucaagaac aucaugcugg ggcacgccuc cgugcaggcc gagauggagc 900
agguggucga gguguacgag uacgcgcaga agcugggcgg cgaggccggg uucuaccaca 960
uccucaacaa cccgaaggcc agccugcugu cccucaccca guucccgcac uucagcagcg 1020
ugguccuggg gaacgccgcc ggccugggga ucaugggcga guaccgcggg accccgcgga 1080
accaggaccu cuacgacgcg gccaaggccu acgccgagca gcugaaggag aacggcguga 1140
ucaacuacuc cgugcuggac cucaccgccg aggagcugga ggcgaucaag caccagcuga 1200
accccaagga caacgacguc gagcucugag gacuagugca ucacauuuaa aagcaucuca 1260
gccuaccaug agaauaagag aaagaaaaug aagaucaaua gcuuauucau cucuuuuucu 1320
uuuucguugg uguaaagcca acacccuguc uaaaaaacau aaauuucuuu aaucauuuug 1380
ccucuuuucu cugugcuuca auuaauaaaa aauggaaaga accuagaucu aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaugcauc 1500
cccccccccc cccccccccc cccccccccc aaaggcucuu uucagagcca ccagaauu 1558
<210> 35
<211> 967
<212> РНК
<213> Искусственная последовательность
<220>
<223> РСВ-M2-1 (GC) R2833
<400> 35
ggggcgcugc cuacggaggu ggcagccauc uccuucucgg caucaagcuu accaugagcc 60
gccggaaccc cugcaaguuc gagauccgcg gccacugccu gaacgggaag cggugccacu 120
ucucccacaa cuacuucgag uggccgcccc acgcccuccu ggugcgccag aacuucaugc 180
ugaaccggau ccucaagagc auggacaagu ccaucgacac ccugagcgag aucuccggcg 240
ccgcggagcu ggaccgcacc gaggaguacg cccucggggu cgugggcgug cuggagagcu 300
acaucggguc caucaacaac aucacgaagc agagcgccug cgucgccaug uccaagcugc 360
ucaccgagcu gaacagcgac gacaucaaga agcugcggga caacgaggag cucaacuccc 420
ccaagauccg cguguacaac accgugauca gcuacaucga guccaaccgg aagaacaaca 480
agcagaccau ccaccugcug aagcgccucc ccgccgacgu ccugaagaag acgaucaaga 540
acacccugga cauccacaag agcaucacca ucaacaaccc gaaggagcuc accguguccg 600
acacgaacga ccacgcgaag aacaacgaca ccaccugagg acuagugcau cacauuuaaa 660
agcaucucag ccuaccauga gaauaagaga aagaaaauga agaucaauag cuuauucauc 720
ucuuuuucuu uuucguuggu guaaagccaa cacccugucu aaaaaacaua aauuucuuua 780
aucauuuugc cucuuuucuc ugugcuucaa uuaauaaaaa auggaaagaa ccuagaucua 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaugcaucc cccccccccc cccccccccc ccccccccca aaggcucuuu ucagagccac 960
cagaauu 967
<210> 36
<211> 75
<212> ДНК
<213> Homo sapiens
<400> 36
gcggctcggc cattttgtcc cagtcagtcc ggaggctgcg gctgcagaag taccgcctgc 60
ggagtaactg caaag 75
<210> 37
<211> 24
<212> РНК
<213> Искусственная последовательность
<220>
<223> последовательность гистоновой структуры типа «стебель-петля»
<400> 37
caaaggcucu uuucagagcc acca 24
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ПРОТИВ БЕШЕНСТВА | 2014 |
|
RU2712743C2 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2783313C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2021 |
|
RU2761879C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2760301C1 |
| ВАКЦИНЫ НА ОСНОВЕ ИНФОРМАЦИОННОЙ РНК ПРОТИВ ШИРОКОГО СПЕКТРА ВАРИАНТОВ КОРОНАВИРУСА | 2022 |
|
RU2826172C2 |
| Искусственные гены, кодирующие белки-иммуногены EV.CTL и EV.Th, рекомбинантные плазмидные ДНК pEV.CTL и pEV.Th, обеспечивающие экспрессию искусственных генов, и искусственные Т-клеточные полиэпитопные белки-иммуногены EV.CTL и EV.Th, содержащие эпитопы антигенов вируса Эбола, используемые для создания вакцины против вируса Эбола | 2018 |
|
RU2713723C1 |
| ИММУНОГЛОБУЛИН С ОДНИМ ВАРИАБЕЛЬНЫМ ДОМЕНОМ ПРОТИВ F-БЕЛКА PCB | 2016 |
|
RU2730671C2 |
| ВАКЦИНЫ НА ОСНОВЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ (VLP) СОБАЧЬЕГО ПАРВОВИРУСА (CPV) И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2710854C1 |
| РЕКОМБИНАНТНЫЕ ВАКЦИНЫ ОТ FMDV И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2745373C2 |
| НОВЫЕ ЭУКАРИОТИЧЕСКИЕ КЛЕТКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ ДЛЯ РЕКОМБИНАНТНОЙ ЭКСПРЕССИИ ПРЕДСТАВЛЯЮЩЕГО ИНТЕРЕС ПРОДУКТА | 2014 |
|
RU2720525C2 |





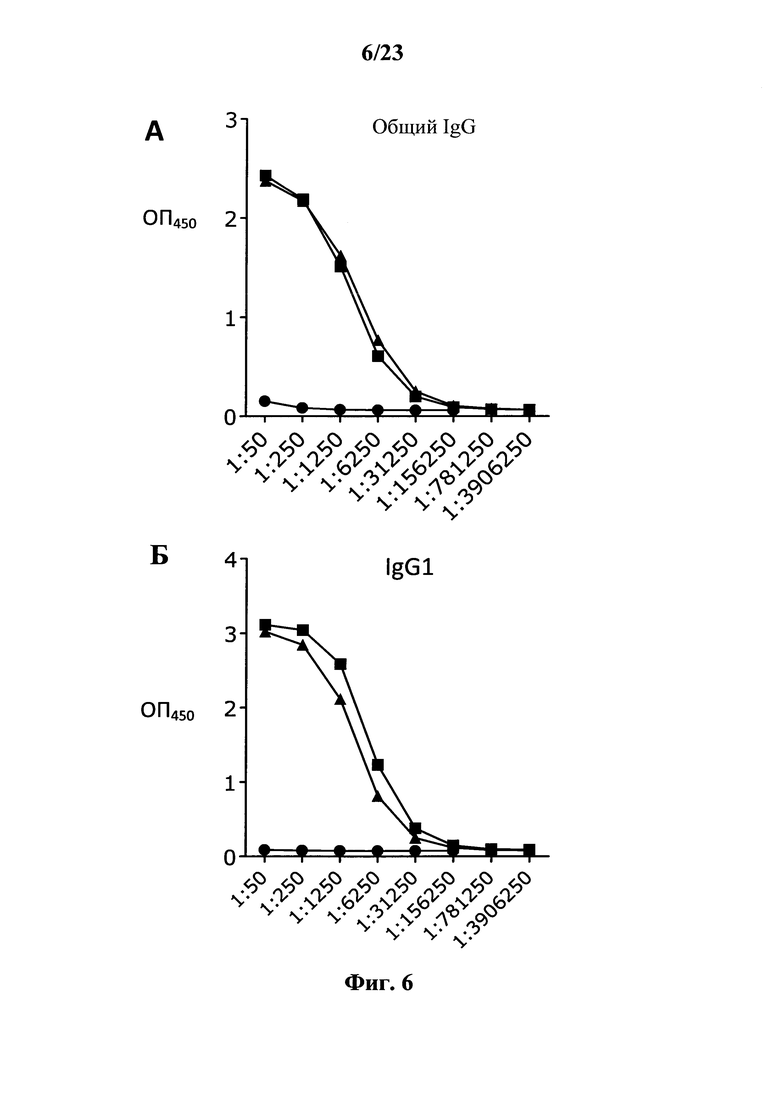
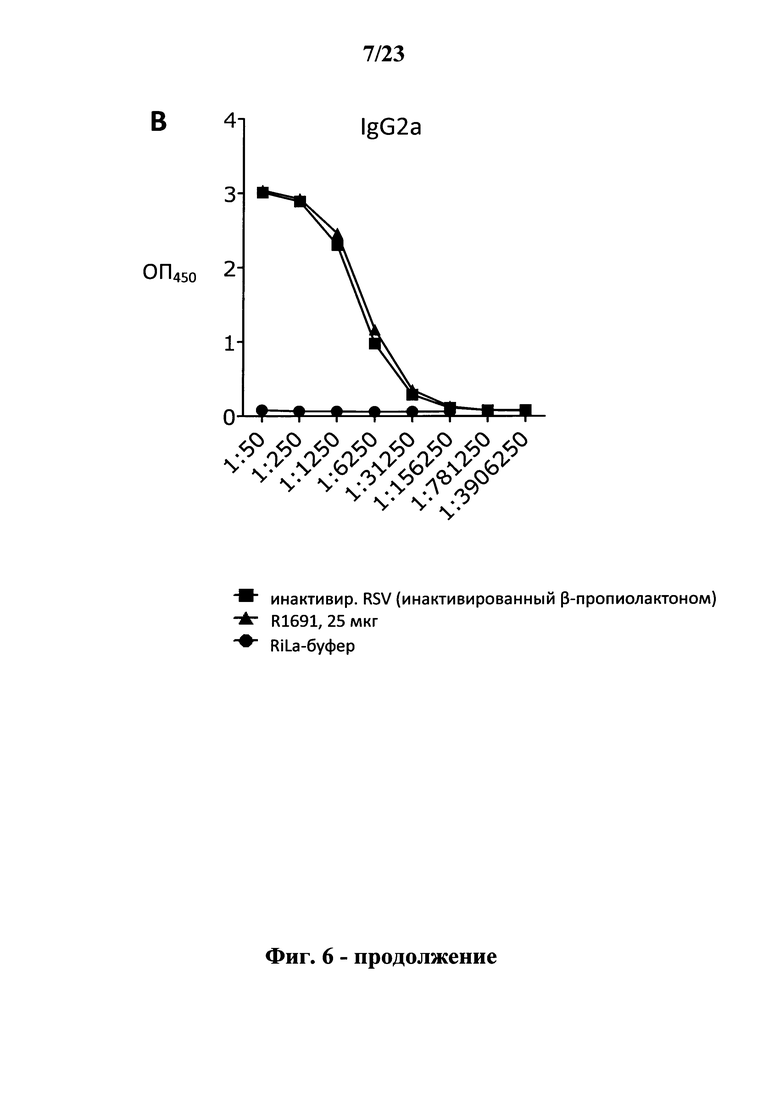
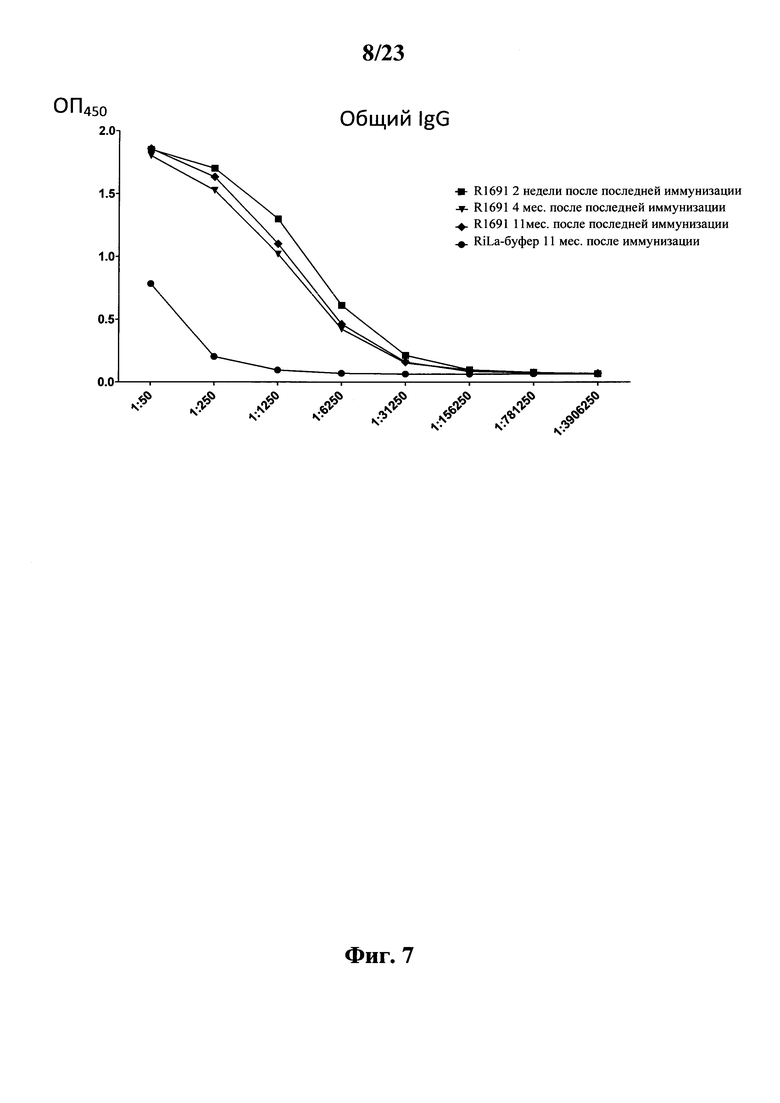
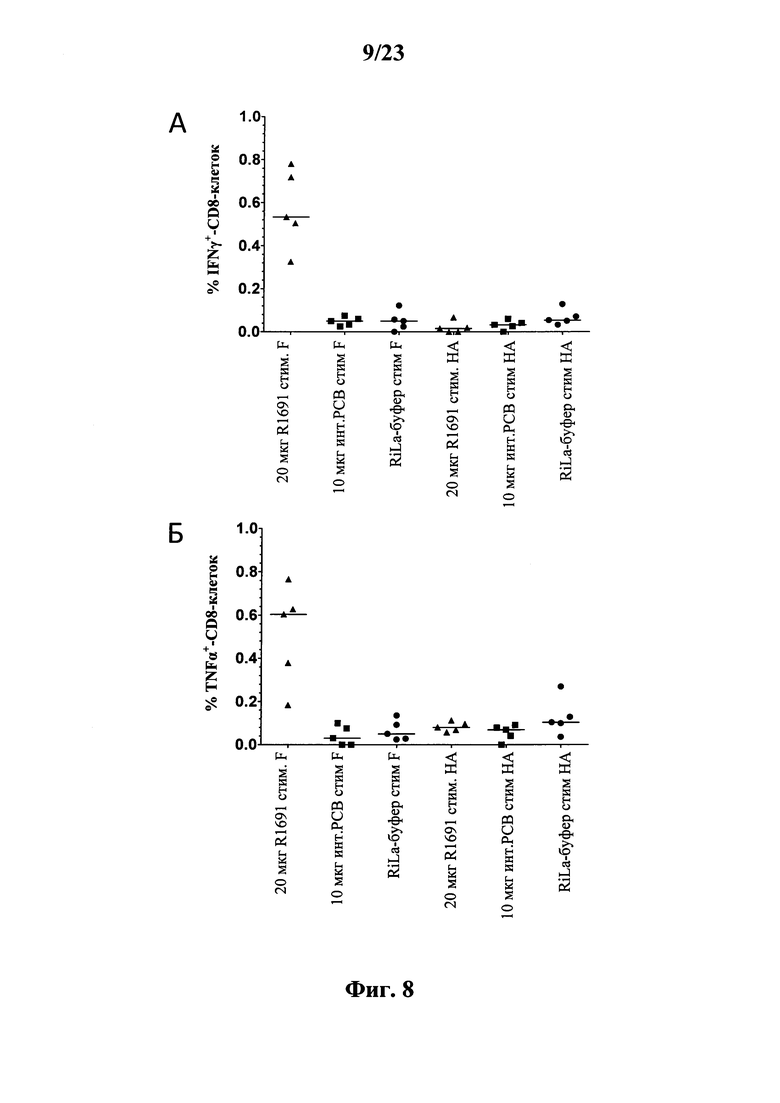
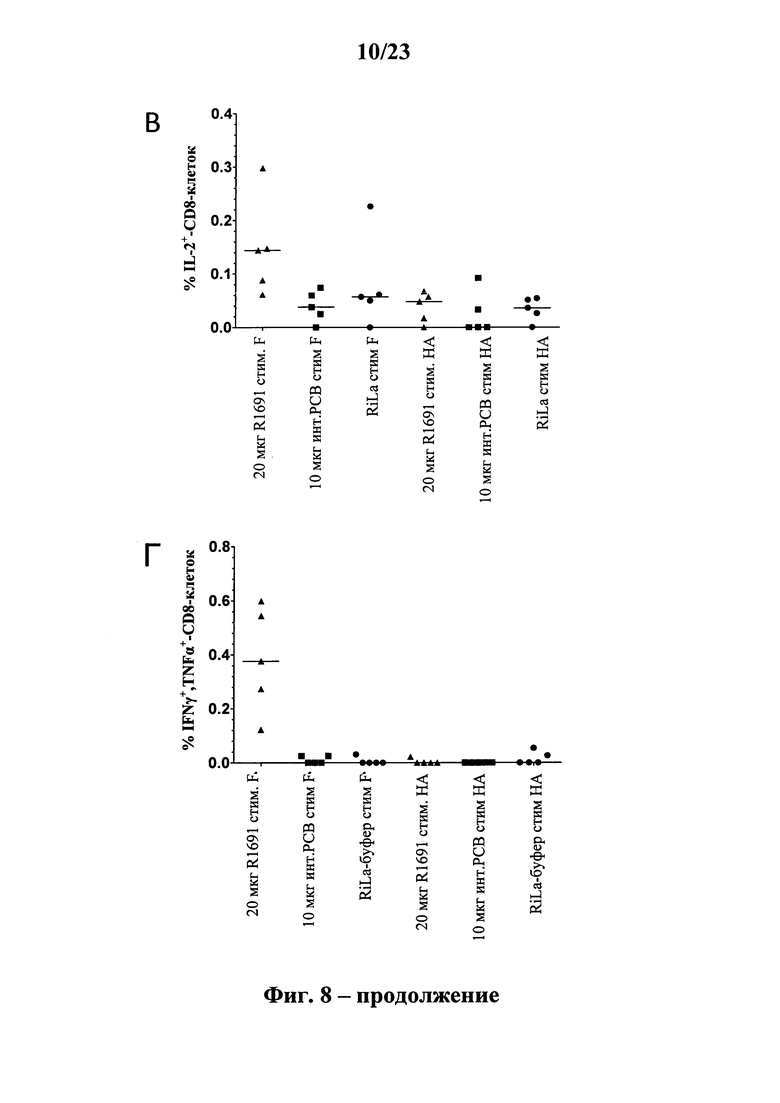
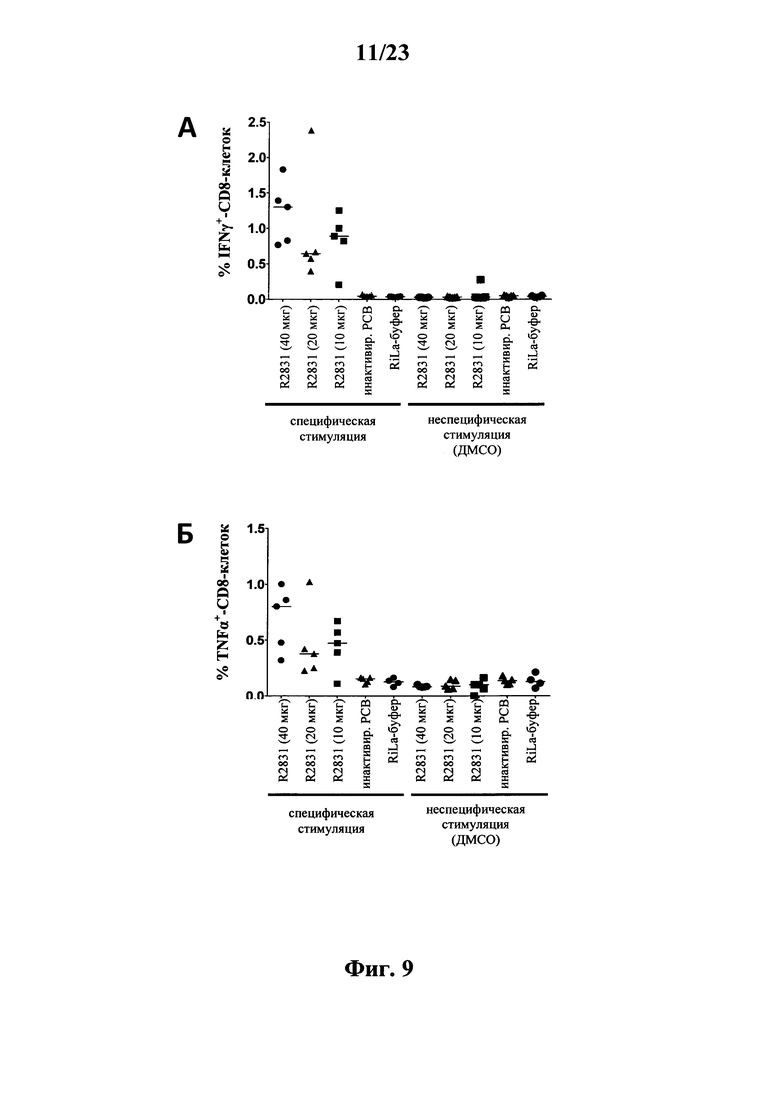

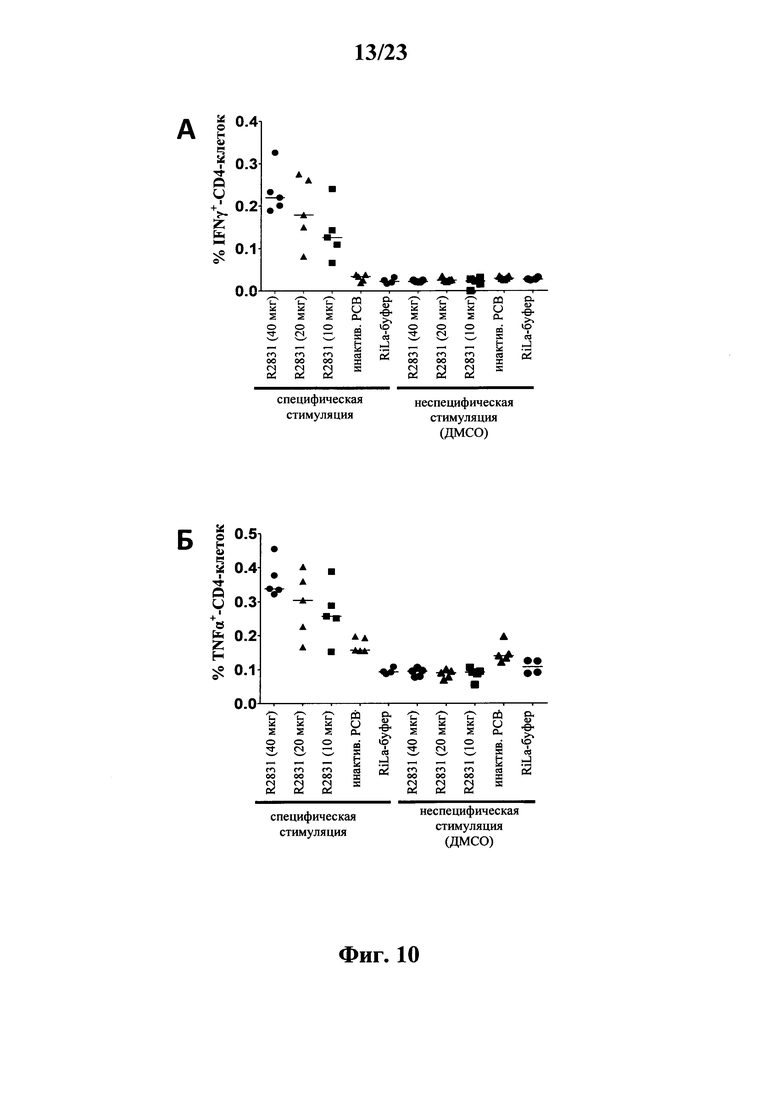
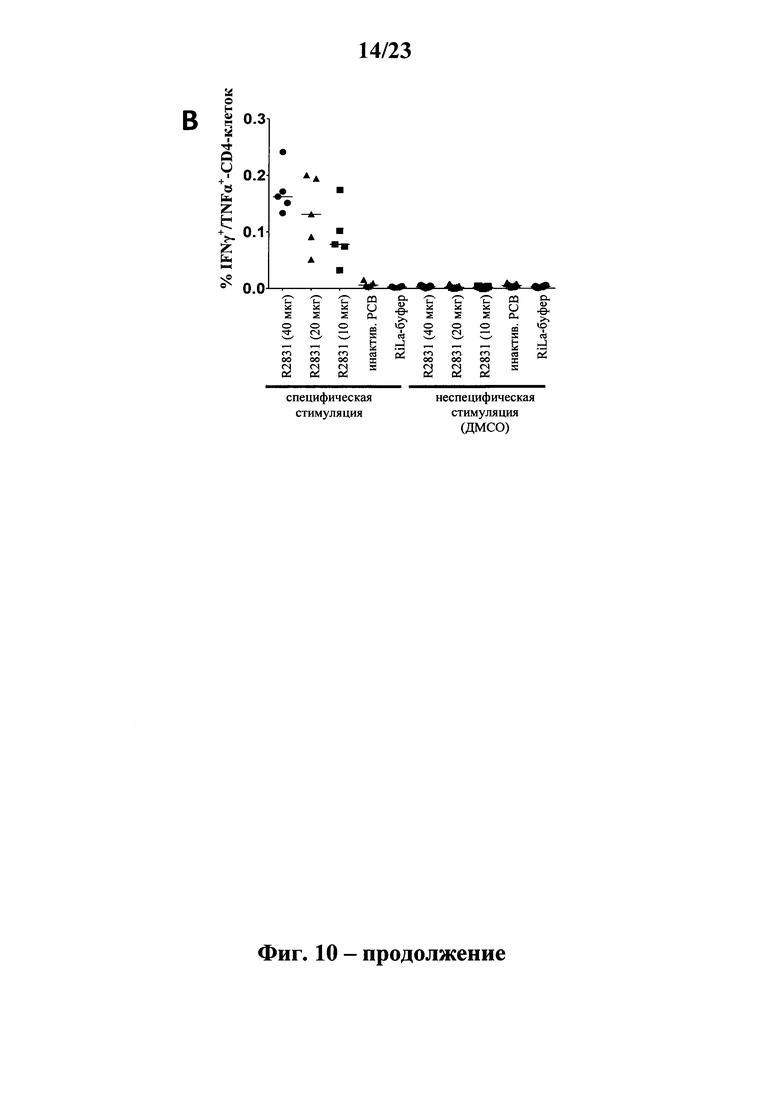
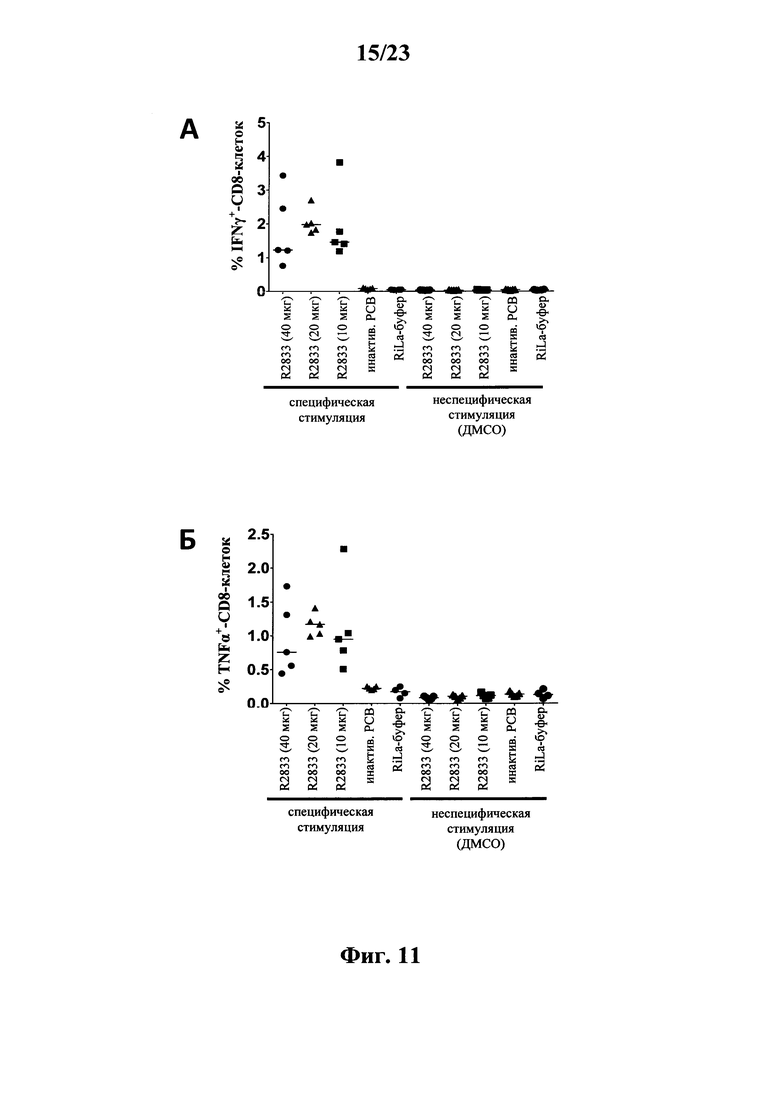
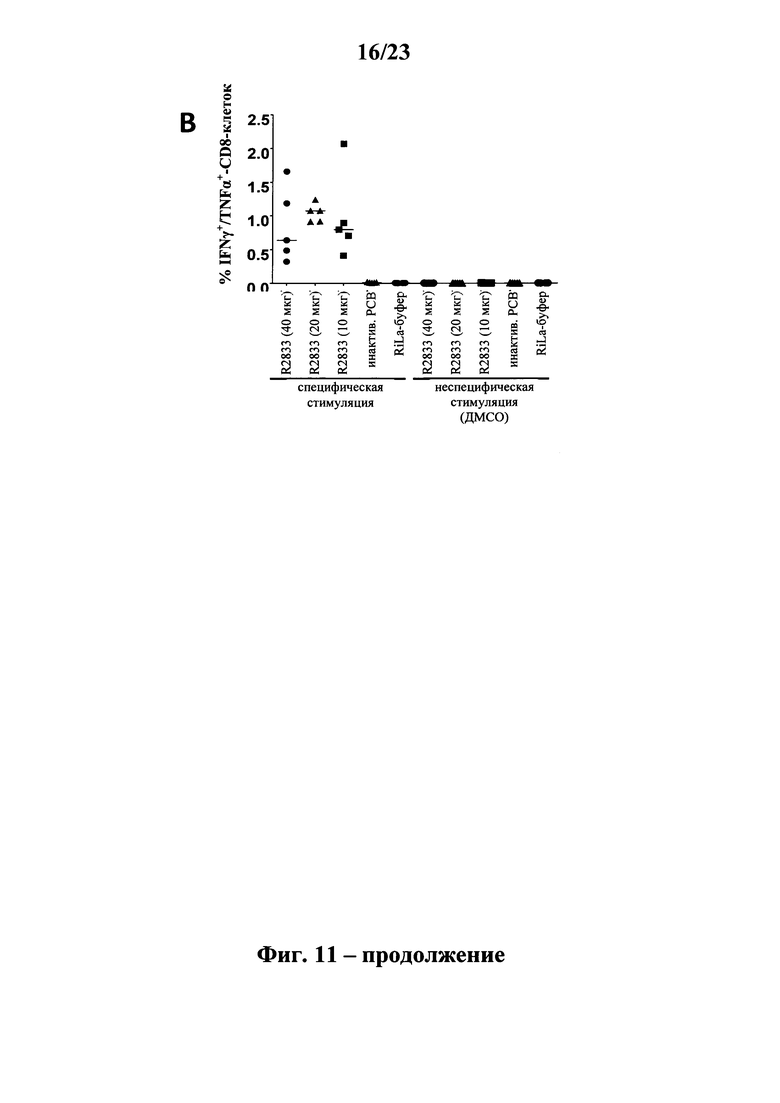
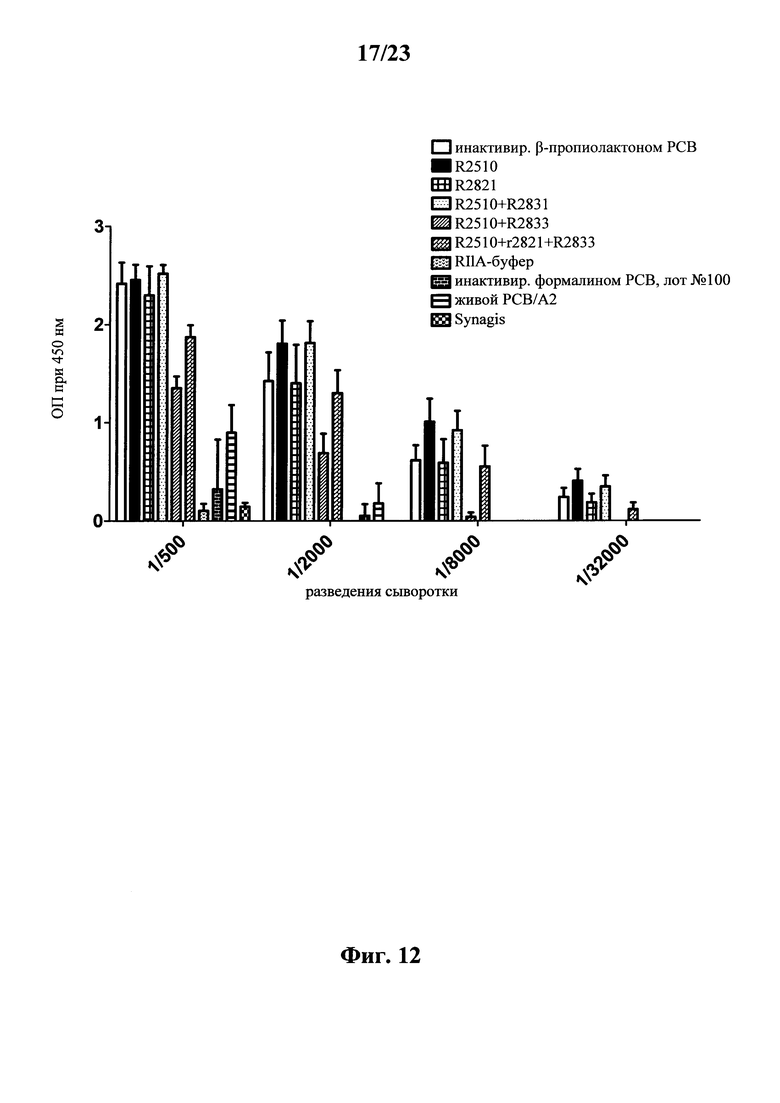
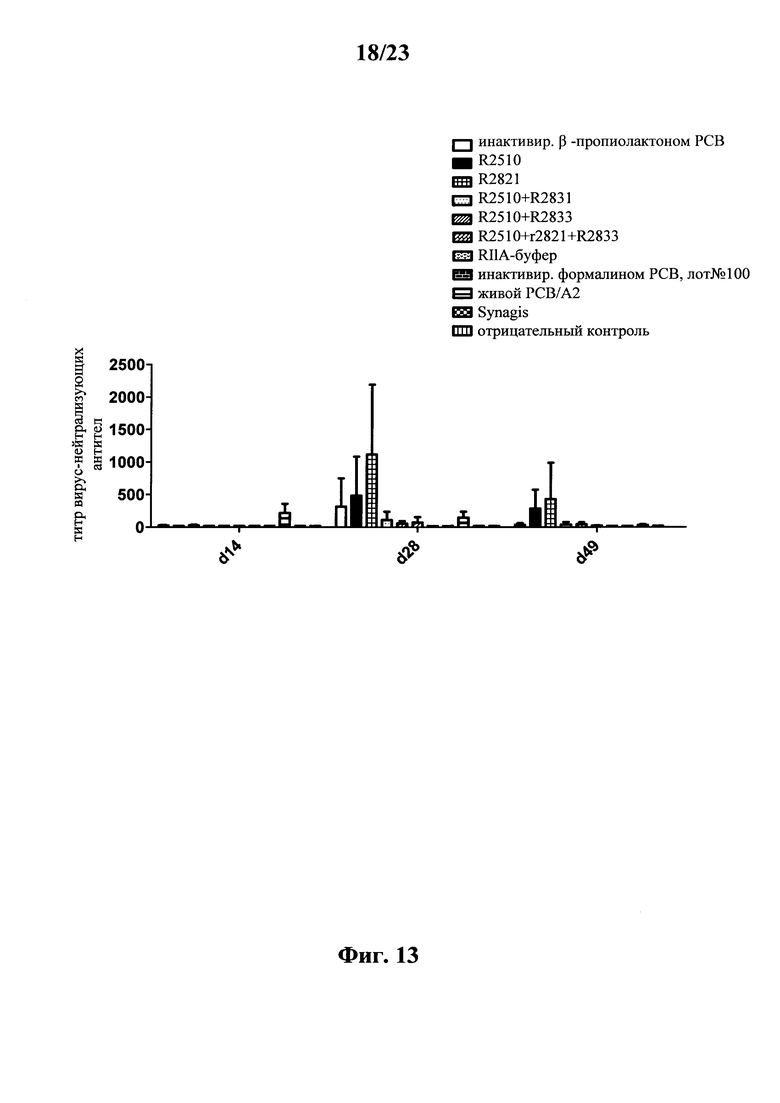
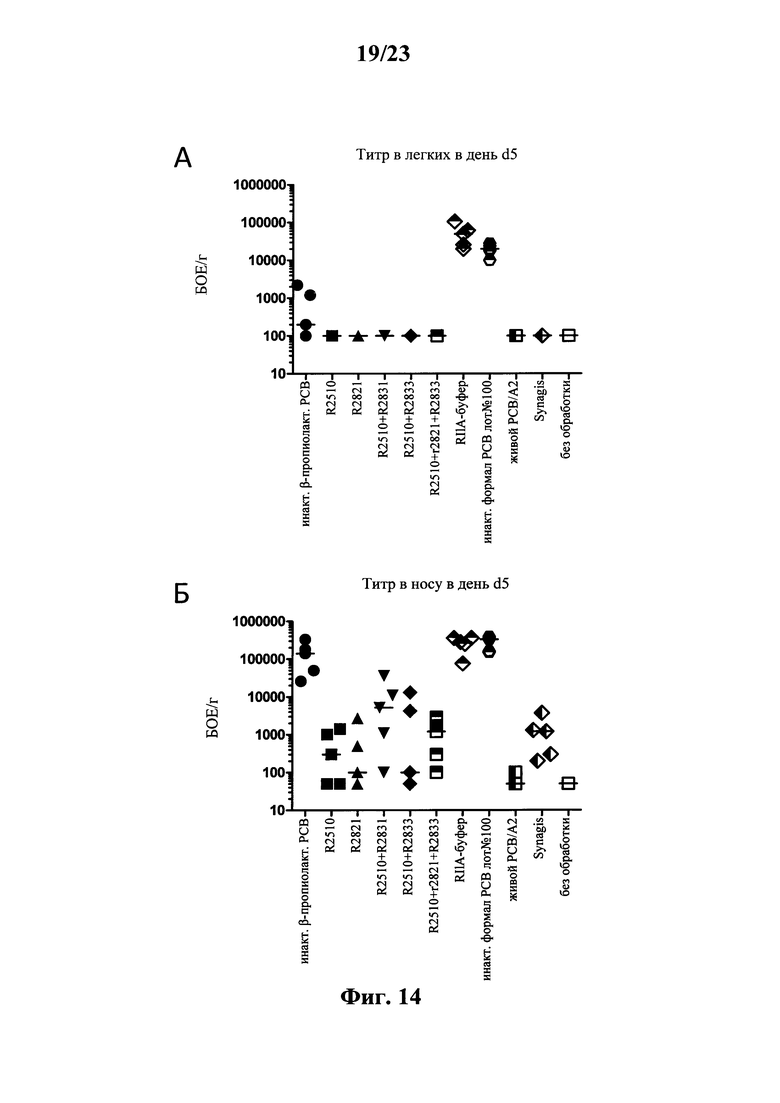
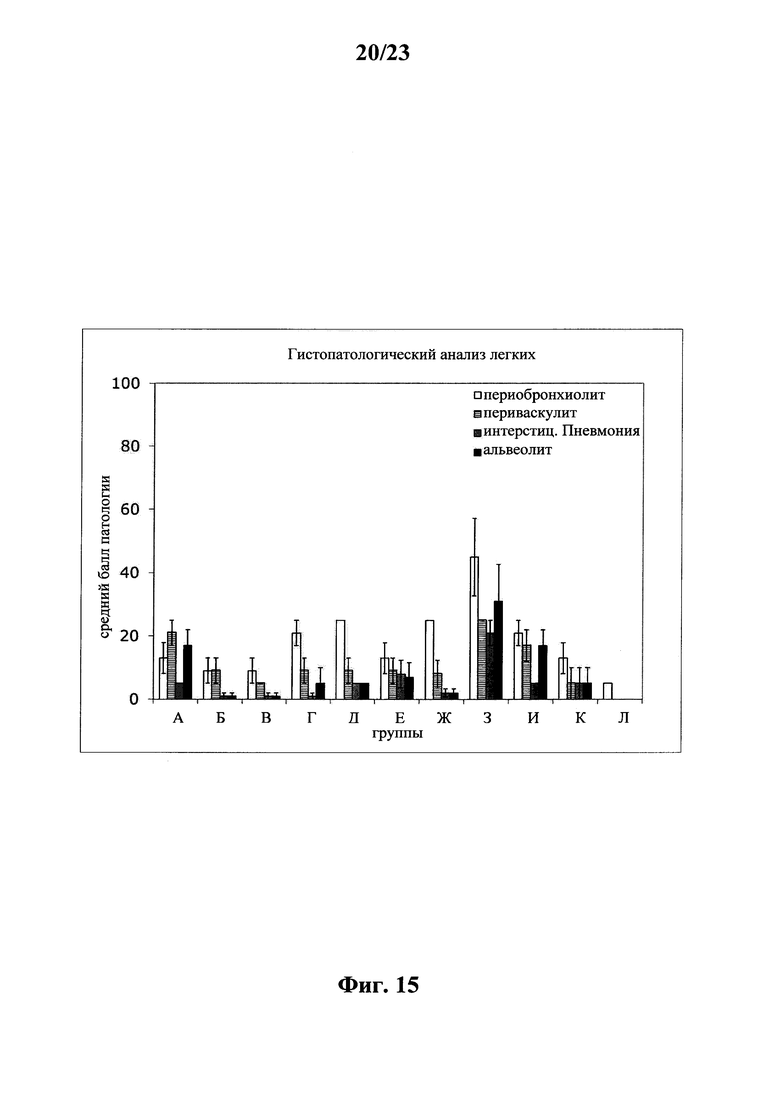
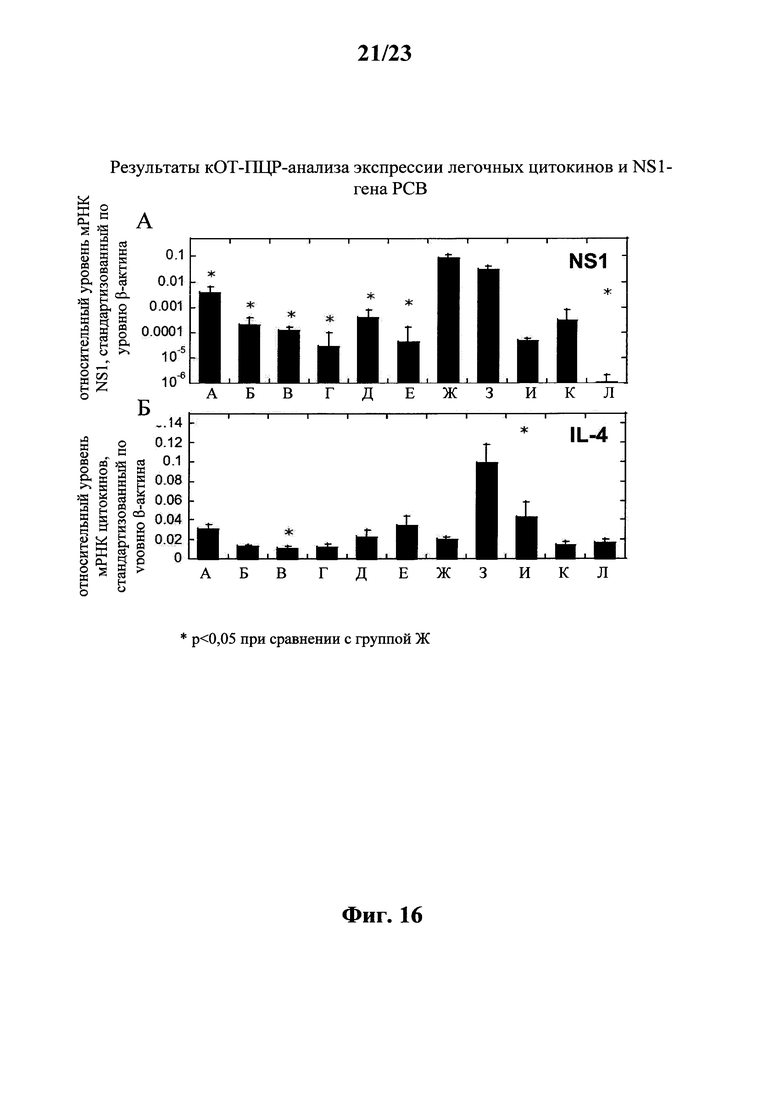
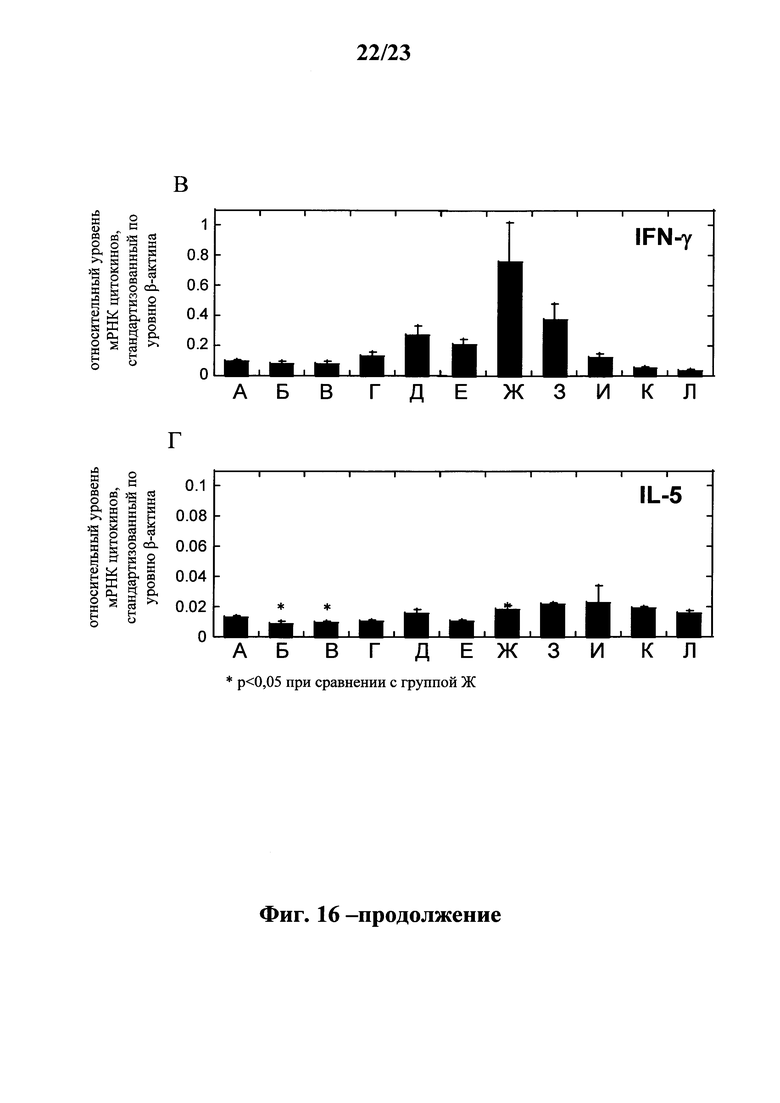
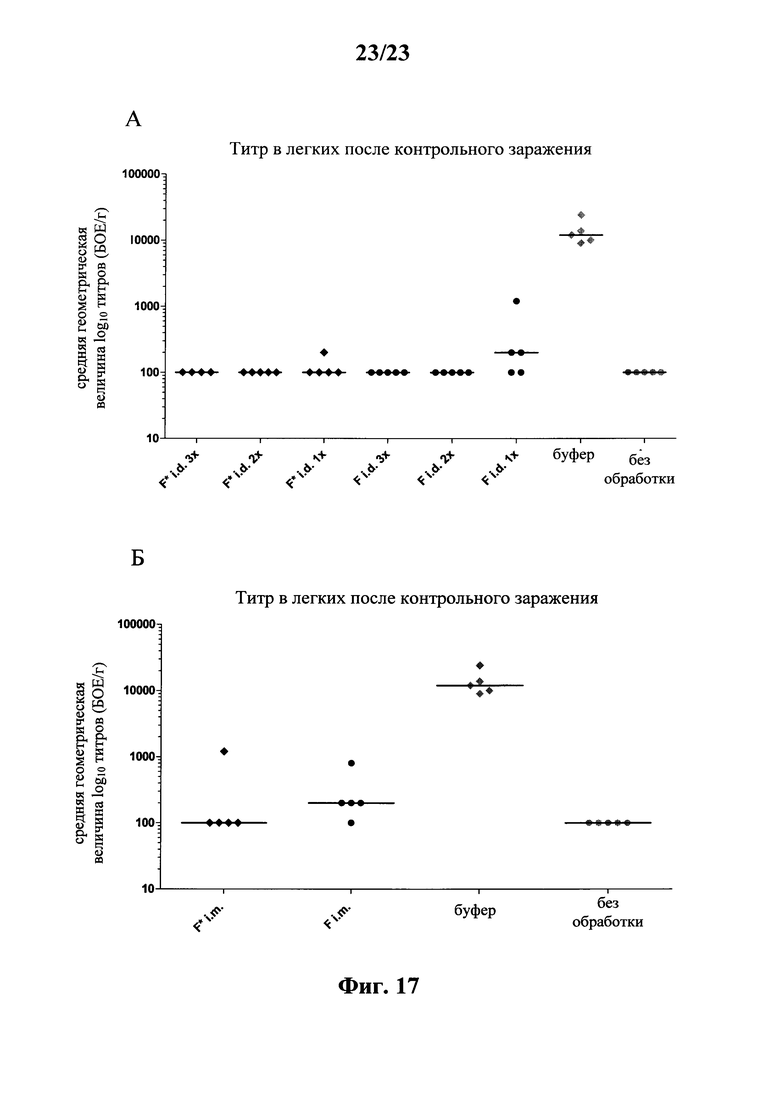
Изобретение относится к области биотехнологии, конкретно к последовательности мРНК, содержащей кодирующую область, которая кодирует мутантный белок респираторно-синцитиального вируса (РСВ), и может быть использовано в медицине. Описанное изобретение может применяться для получения фармацевтической композиции, прежде всего вакцины, для профилактики или лечения РСВ-инфекций, вызываемых респираторно-синцитиальным вирусом. 7 н. и 19 з.п. ф-лы, 17 ил., 7 табл., 7 пр.
1. мРНК для лечения или профилактики инфекций, вызываемых респираторно-синцитиальным вирусом (РСВ), содержащая кодирующую область, структуру 5’-кэпа, 5'-нетранслируемую область и/или 3'-нетранслируемую область, поли(А)-последовательность, где кодирующая область кодирует мутант слитого белка (F)PCB, аминокислотная последовательность которого по меньшей мере на 80% идентична SEQ ID NO: 1, и в которой аминокислотные остатки 554-574 последовательности слитого белка F удалены из мутанта слитого белка F;
в которой содержание G/C в кодирующей области повышено при замещении по меньшей мере на 70% замещаемых кодонов в кодирующей области по сравнению с содержанием G/C в кодирующей области мРНК дикого типа.
2. мРНК по п. 1, в которой мутант слитого белка F происходит из штамма РСВ АТСС VR-26.
3. мРНК по п. 1 или 2, дополнительно содержащая поли(С)-последовательность.
4. мРНК по п. 1, в которой поли(А)-последовательность содержит последовательность из 25-400 аденозиновых нуклеотидов.
5. мРНК по любому из пп. 1-4, дополнительно содержащая по меньшей мере одну гистоновую структуру типа «стебель-петля».
6. мРНК по п. 5, в которой по меньшей мере одну гистоновую структуру типа «стебель-петля» выбирают из формулы (I) или (II):
формула (I) (последовательность структуры типа «стебель-петля» без пограничных элементов стебля):
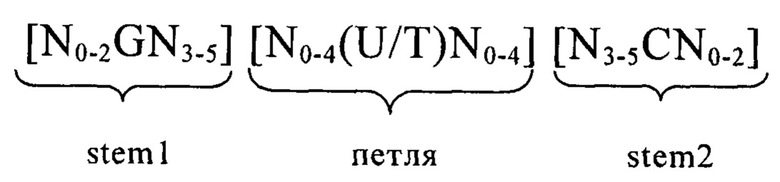
формула (II) (последовательность структуры типа «стебель-петля» с пограничными элементами стебля):
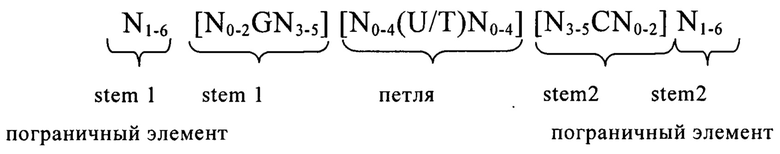
в которых:


где у элементов stem1 и stem2 может происходить спаривание оснований друг с другом с образованием обратно комплементарной последовательности, при этом между stem1 и stem2 может иметь место спаривание оснований, или с образованием частично обратно комплементарной последовательности, при этом между stem1 и stem2 может иметь место неполное спаривание оснований.
7. мРНК по п. 6, в которой по меньшей мере одну гистоновую структуру типа «стебель-петля» выбирают из формулы (Iа) или (IIa):
формула (Ia) (последовательность структуры типа «стебель-петля» без пограничных элементов стебля):

формула (Ia) (последовательность структуры типа «стебель-петля» с пограничными элементами стебля):
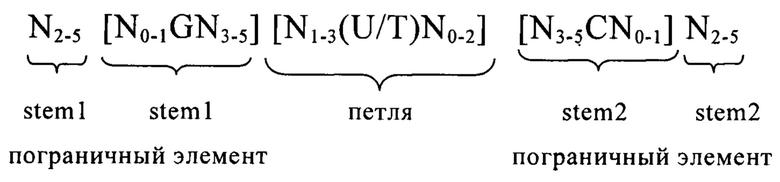
8. мРНК по п. 1, в которой 3’UTR-элемент содержит или состоит из нуклеотидной последовательности, которая происходит из 3’UTR гена, образующего стабильную мРНК, где 3'UTR-элемент предпочтительно содержит или состоит из нуклеотидной последовательности, которая происходит из 3’UTR гена, выбранного из группы, состоящей из гена альбумина, гена α-глобина, гена β-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена коллагена альфа, где 3’UTR-элемент более предпочтительно содержит или состоит из нуклеотидной последовательности, которая происходит из 3’UTR гена α-глобина, наиболее предпочтительно содержащего РНК-последовательность, соответствующую нуклеотидной последовательности, представленной в SEQ ID NO: 29.
9. мРНК по любому из пп. 1-8, содержащая предпочтительно в 5’→3’-направлении:
а) структуру 5’-кэпа, предпочтительно m7GpppN;
б) кодирующую область, которая кодирует мутант слитого белка F РСВ;
в) 3’UTR-элемент, содержащий или состоящий из нуклеотидной последовательности, которая происходит из гена альфа-глобина, предпочтительно содержащего РНК-последовательность, соответствующую нуклеотидной последовательности, представленной в SEQ ID NO: 29;
г) поли(А)-последовательность, предпочтительно содержащую 64 аденозина;
д) поли(С)-последовательность, предпочтительно содержащую 30 цитозинов;
и
е) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности, представленной в SEQ ID NO: 30.
10. мРНК по п. 1, в которой 3’UTR-элемент содержит или состоит из нуклеотидной последовательности, которая происходит из 3’UTR гена альбумина человека.
11. мРНК по п. 10, в которой 3’UTR-элемент происходит из нуклеотидной последовательности SEQ ID NO: 25, предпочтительно из соответствующей последовательности РНК.
12. мРНК по любому из пп. 1-11, в которой 5’UTR-элемент содержит или состоит из нуклеотидной последовательности, которая происходит из 5’UTR ТОР-гена, предпочтительно из соответствующей последовательности РНК, предпочтительно лишенной 5’ТОР-мотива.
13. мРНК по п. 12, в которой 5’UTR-элемент содержит или состоит из нуклеотидной последовательности, которая происходит из 5’UTR ТОР-гена, кодирующего рибосомальный белок, предпочтительно из соответствующей последовательности РНК, предпочтительно лишенной 5’ТОР-мотива.
14. мРНК по п. 13, в которой 5’UTR-элемент содержит или состоит из нуклеотидной последовательности, которая происходит из 5’UTR ТОР-гена, кодирующего белок большой рибосомной субъединицы (RPL), предпочтительно лишенного 5’ТОР-мотива, и более предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 23.
15. мРНК по п. 14, содержащая предпочтительно в 5’→3’-направлении:
а) структуру 5’-кэпа, предпочтительно m7GpppN;
б) 5’UTR-элемент, который содержит или состоит из нуклеотидной последовательности, которая происходит из 5’UTR ТОР-гена, предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 23;
в) кодирующую область, которая кодирует мутант слитого белка F РСВ;
г) 3’UTR-элемент, содержащий или состоящий из нуклеотидной последовательности, которая происходит из гена, образующего стабильную мРНК, предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 18;
д) поли(А)-последовательность, предпочтительно содержащую 64 аденозина;
е) поли(С)-последовательность, предпочтительно содержащую 30 цитозинов; и
ж) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 30.
16. мРНК по п. 15, содержащая последовательность SEQ ID NO: 33.
17. Комплекс для лечения или профилактики вызываемых РСВ инфекций, содержащий мРНК по любому из пп. 1-16 и катионное или поликатионное соединение или полимерный носитель в массовом соотношении, выбранном из диапазона от 6:1 до 0,25:1 между мРНК и катионным или поликатионным соединением или полимерным носителем; или в соотношении между азотом/фосфатом мРНК и катионным или поликатионным соединением или полимерным носителем в диапазоне 0,1-10.
18. Комплекс по п. 17, где в котором катионным соединением является катионный белок или пептид, предпочтительно протамин, или катионный липид.
19. Композиция для получения лекарственного средства для лечения или профилактики вызываемых РСВ инфекций, содержащая эффективное количество по меньшей мере двух мРНК по любому из пп. 1-16 и вспомогательные вещества.
20. Фармацевтическая композиция для лечения или профилактики вызываемых РСВ инфекций, содержащая эффективное количество мРНК по любому из пп. 1-16 или композицию по п. 19 и фармацевтически приемлемый носитель.
21. Фармацевтическая композиция по п. 20 в виде комплекса по любому из пп. 17, 18.
22. Фармацевтическая композиция по любому из пп. 20, 21, которая используется в качестве вакцины.
23. Набор для лечения или профилактики вызываемых РСВ инфекций, содержащий мРНК по любому из пп. 1-16, композицию по п. 19, фармацевтическую композицию по любому из пп. 20-22 и необязательно технические инструкции с информацией о введении и дозировке компонентов.
24. Применение мРНК по любому из пп. 1-16, композиции по п. 19, фармацевтической композиции по одному из пп. 20-22 и набора по п. 23 для получения лекарственного средства для лечения или профилактики вызываемых РСВ инфекций.
25. Применение мРНК по любому из пп. 1-16, композиции по п. 19, фармацевтической композиции по любому из пп. 20-22 и набора по п. 23 для лечения или профилактики вызываемых РСВ инфекций.
26. Применение по п. 25, в котором лечение предполагает дополнительное введение иммуноглобулина против РСВ, прежде всего паливизумаба.
| WO 2012116714 A1, 07.09.2012 | |||
| WO 2012116715 A1, 07.09.2012 | |||
| PETSCH B | |||
| et al., Protective efficacy of in vitro synthesized, specific mRNA vaccines against influenza A virus infection, NAT.BIOTECH., 2012, v | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| WO 2006050280 A2, 11.05.2006 | |||
| WO 2012019630 A1, 16.02.2012 | |||
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ И СПОСОБ РАЗРАБОТКИ ВАКЦИНЫ, ОСНОВАННОЙ НА СЛИТОМ БЕЛКЕ | 2004 |
|
RU2407749C2 |
| RU 2010135630 A1, 10.03.2012. | |||
Авторы
Даты
2020-06-09—Публикация
2014-08-21—Подача