ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет по предварительной заявке США номер 61/937,472, поданной 8 февраля 2014, предварительной заявке США номер 61/971,499, поданной 27 марта 2014, предварительной заявке США номер 62/010,265, поданной 10 июня 2014 и предварительной заявке США номер 62/082,013, поданной 19 ноября 2014, содержание которых включено в настоящий документ посредством ссылки во всей свой полноте.
ОБЛАСТЬ ТЕХНИКИ
Описаны способы лечения пациентов, страдающих болезнью Альцгеймера от легкой до умеренной степени, с использованием антител, направленных против бета-амилоида. Также предусмотрены способы выбора и определения пациентов для лечения антителами, направленными против β-амилоида. Способы включают использование прогностических и/или предиктивных биомаркеров.
УРОВЕНЬ ТЕХНИКИ
Болезнь Альцгеймера (AD) является наиболее распространенной причиной деменции, заболеваемость в Соединенных Штатах Америки составляет 4,5 миллионов человек, в мире - 26,6 миллионов человек (Hebert et al, Arch. Neurol. 2003; 60: 1119-22; Brookmeyer et al., Alzheimers Dement. 2007; 3: 186-91). Заболевание характеризуется патологическим накоплением внеклеточных бета-амилоидных («Аβ») бляшек и внутриклеточных нейрофибриллярных клубков в головном мозге. Диагностика проводится с помощью клинической оценки неврологических и психоневрологических признаков и симптомов AD и путем исключения других причин деменции. В соответствии с классификацией AD традиционно выделяют легкую, умеренную и тяжелую стадии AD, которые определяют путем короткого скринингового обследования для выявления когнитивных нарушений с помощью краткой шкалы оценки психического статуса («MMSE»). Одобренные медицинские методы лечения, основанные на ингибировании активности ацетилхолинэстеразы («AChE») или антагонизме в отношении рецепторов N-метил-D-аспартата в головном мозге, способны временно улучшать симптомы AD у некоторых пациентов, но не могут изменить течение заболевания (Cummings, N. Engl. J. Med. 2004; 351: 56-67).
На сегодняшний день хорошо изучены генетические факторы семейной формы AD с ранним и поздним началом. Аллель АроЕ4 тесно ассоциирован с семейной формой AD с поздним началом и спорадической формой AD, при этом частота встречаемости этого аллеля у пациентов с AD составляет 50%-65%, что приблизительно в три раза выше, чем в среднем в популяции и в случае других неврологических расстройств (Saunders et al., Neurology 1993; 43: 1467-72,; Prekumar et al., Am. J. Pathol. 1996; 148: 2083-95). Помимо AD, аллель ApoE4 участвует в других расстройствах, связанных с формированием амилоидов, включая церебральную амилоидную ангиопатию («САА») (Prekumar et al., Am. J. Pathol. 1996; 148: 2083-95). Таким образом, пациенты, несущие аллель АроЕ4, могут составлять этиологически отдельную популяцию пациентов с AD.
Отложение внеклеточных амилоидных бляшек в головном мозге является отличительным патологическим признаком AD, впервые отмеченным Алоисом Альцгеймером в 1906 году. Эти амилоидные бляшки в основном состоят из пептидов Abeta (Haass and Selkoe, Nature 2007; 8: 656-67), образующихся путем последовательного расщепления белка-предшественника бета-амилоида («АРР») при участии β- и γ-секретаз. Abeta, особенно в форме олигомеров, является токсичным для нейронов и считается одним из факторов развития AD. С помощью методов лечения, нацеленных на снижение уровеней Abeta в головном мозге, можно уменьшить когнитивную дисфункцию, предотвратить дальнейшую потерю синапсов, дегенерацию аксонов и гибель нейронов. Abeta может активно траспортироваться через гематоэнцефалический барьер (Deane et al., Stroke 2004; 35(Suppl I): 2628-31). В моделях AD на мышах было показано, что в результате системной доставки антител против Abeta повышается уровень Abeta в плазме и снижается его уровень в центральной нервной системе (ЦНС), что, как предполагается, происходит по механизмам, включающим растворение бляшек Abeta в головном мозге, фагоцитарное удаление опсонизированного Abeta и, в конечном итоге, отток Abeta из головного мозга вследствие сдвига равновесия для Abeta из-за циркулирующих антител (Morgan, Neurodegener. Dis. 2005; 2: 261-6).
Разработка терапевтических антител для лечения AD отмечена значительными неудачами. Крупномасштабная третья фаза клинических исследований антитела бапинейзумаба, специфически связывающегося с N-концевой частью Abeta, была прекращена, поскольку введение лекарственного средства не оказало влияния на снижение когнитивных способностей у пациентов, получавших данное лечение (Miles et al., Scientific Reports 2013; 3: 1-4, официальное сообщение компании Johnston & Johnson, датированное 6 августа 2012, озаглавленное «Johnson & Johnson Announces Discontinuation of Phase 3 Development of Bapineuzumab Intravenous (IV) in Mild-To-Moderate Alzheimer's Disease»). Важно отметить, что бапинейзумаб, по-видимому, действительно стабилизировал уровень бляшек и снижал уровень фосфорилированного тау белка в спинномозговой жидкости, из чего можно сделать вывод, что изменение только этих биомаркеров не обязательно является показателем клиничекой эффективности лекарственного средства (Miles et al., Scientific Reports 2013; 3: 1-4). Аналогично, антитело соланезумаб, специфичное к мономерному Abeta и связывающееся с центральной частью этого пептида, не прошло третью фазу клинических исследований, поскольку не удовлетворило первичным когнитивным и функциональным конечным точкам (официальное сообщение компании Eli Lilly and Company, датированное 24 августа 2012 года, «Eli Lilly and Company Anounces Top-Line Results on Solanezumab Phase 3 Clinical Trials in Patients with Alzheimer's Disease»). В процессе исследования некоторых вариантов иммунотерапии AD также возникали проблемы безопасности; например, во второй фазе клинических исследований бапинейзумаба частота связанных с амилоидом аномалий, диагностируемых с помощью методов визуализации (ARIA-E и ARIA-H), у пациентов, получавших лекарственное средство, составляла более 20% (Sperling et al., The Lancet 2012; 11: 241-249). По оценкам, один человек из девяти в возрасте старше 65 лет болен AD - совокупные ежегодные затраты на медицинское обслуживание, долгосрочную медицинскую помощь и уход в хосписе за людьми, страдающими от AD, составили более 200 миллионов долларов США в 2013 году и предположительно составят 1,2 триллиона долларов США к 2050 году (средства пораженных заболеванием индивидуумов и средства, потраченные от их имени) (Alzheimer's Association 2013 Alzheimer's Disease Facts and Figures, Alzheimer's and Dementia 9: 2). AD находится на шестом месте в списке основных причин смерти в Соединенных Штатах Америки по данным на 2013 (там же). Одобренные к настоящему моменту методы лечения оказывают влияние только на некоторые симптомы AD и никак не влияют не лежащую в основе заболевания дегенерацию. Существует огромная неудовлетворенная потребность в терапевтическом средстве для лечения AD, которое будет менять течение заболевания, а также в способах определения пациентов, которые с высокой вероятностью будут отвечать на терапию данным терапевтическим средством, изменяющим течение AD.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Кренезумаб (crenezumab) (также известное как МАВТ5102А) представляет собой полностью гуманизированное моноклональное антитело IgG4 к Abeta, отобранное благодаря его способности связываваться с мономерными и олигомерными формами Abeta in vitro. Кренезумаб связывается как с Abeta1-40, так и с Abeta 1-42, ингибирует агрегацию Abeta и способствует дезагрегации Abeta. Поскольку кренезумаб имеет каркас человеческого антитела IgG4, он обладает более низкой аффинностью связывания с рецептором Fcγ («FcλR») по сравнению с человеческими IgG1 или IgG2, в соответствии с чем можно ожидать снижение эффекторного иммунного ответа. Исходя из этих свойств в сочетании со способностью кренезумаба, доставляемого системно, снижать уровень Abeta в ЦНС в модели AD на мышах, можно предположить, что терапевтический подход, основанный на использовании данного антитела против Abeta, может быть клинически эффективным и иметь пониженный риск токсичности, а также потенциально может изменять течение AD с меньшим риском возникновения вредных побочных эффектов, таких как вазогенный отек мозга или кровоизлияние в мозг, которые ранее наблюдались в клинических исследованиях других антител против Abeta.
Результаты второй фазы клинических исследований на пациентах с AD, описанные в настоящем документе, демонстрируют, что кренезумаб действительно замедляет прогрессирование от легкой до умеренной AD, оказывает еще более сильное влияние на пациентов, несущих аллель АроЕ4 (с положительным статусом по АроЕ4), и на пациентов, страдающих легкой формой AD, а также обладает наибольшим терапевтическим эффектом в отношении пациентов с более легкой формой AD. Кроме того, также отмечен терапевтический эффект в отношении пациентов, у которых в головном мозге обнаруживаются отложения амилоида, что является типичным признаком, диагностируемым у пациентов с AD. Помимо этого, из результатов также следует, что этим терапевтическим эффектам не сопутствуют значительные нежелательные явления, такие как ARIA-E и ARIA-H. Таким образом, данная заявка предусматривает способы лечения и наблюдения пациентов с диагнозом AD от легкой до умеренной стадии, особенно пациентов с легкой стадией AD, и пациентов, имеющих положительный статус по АроЕ4, а также пациентов, у которых в головном мозге есть отложения амилоида, что является типичным признаком, диагностируемым у пациентов с AD. Как указано в примерах в настоящем документе, было обнаружено, что гуманизированное моноклональное антитело против бета-амилоида с конформационным эпитопом, специфичное к центральному участку пептида бета-амилоида (Аβ) (т.е. аминокислоты 13-24 в случае кренезумаба) является эффективным для лечения от легкой до умеренной стадий AD, особенно у пациентов с положительным статусом по АроЕ4 и у пациентов с более легкой формой AD, например, легкой формой AD без увеличения частоты возникновения ARIA-E или ARIA-H, но не ограничиваясь ими. Соотвественно, данная заявка предусматривает терапевтические агенты для снижения тяжести AD и улучшенные способы применения этих терапевтических агентов.
Следовательно, настоящая заявка предусматривает способы лечения пациентов, страдающих от AD и других амилоидозов, включающие введение гуманизированного моноклонального антитела против бета-амилоида (Аβ или Abeta) или его антигенсвязывающего фрагмента, который связывается с участком между аминокислотными остатками 13 и 24 бета-амилоида (1-42) (SEQ ID NO: 1). В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент способны связывать фибриллярные, олигомерные и мономерные формы Abeta. В некоторых вариантах воплощения антитело представляет собой антитело IgG4. В конкретных вариантах воплощения антитело или его антигенсвязывающий фрагмент включает шесть гипервариабельных областей (HVR), где HVR-H1 представляет собой SEQ ID NO: 2, HVR-H2 представляет собой SEQ ID NO: 3, HVR-H3 представляет собой SEQ ID NO: 4, HVR-L1 представляет собой SEQ ID NO: 6, HVR-L2 представляет собой SEQ ID NO: 7 и HVR-L3 представляет собой SEQ ID NO: 8. В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, включающую вариабельную область тяжелой цепи, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9, включающую вариабельную область легкой цепи. В конкретном примере антитело представляет собой кренезумаб.
Способы лечения, предусмотренные в настоящем документе, могут быть применены к пациентам, страдающим от AD иди других амилоидозов, как описано далее в настоящем документе. Подходящие пациенты включают пациентов, страдающих от легкой до умеренной AD, пациентов, набравших от 18 до 26 баллов по шкале MMSE, пациентов, страдающих от легкой AD, пациентов, набравших 20 баллов или выше по шкале MMSE (например, 20-30, 20-26, 24-30, 21-26, 22-26, 22-28, 23-26, 24-26 или 25-26), пациентов, страдающих от ранней стадии AD (включая пациентов с умеренными когнитивными нарушениями вследствие AD и пациентов с доклинической AD), пациентов, положительных по амилоиду (или пациентов, у которых в головном мозге обнаруживаются отложения амилоида, соответствующие тем, которые диагностируются у пациентов с AD) и пациентов с положительным статусом по АроЕ4, страдающих от легкой до умеренной AD или легкой AD.
В некоторых аспектах способы, предусмотренные в настоящем документе, представляют собой способы замедления ухудшения состояния, вызванного AD, у пациентов, страдающих ранней, легкой или от легкой до умеренной AD. В некоторых вариантах воплощения ухудшение состояния соответствует одному или нескольким ухудшениям, выбранным из клиничекого ухудшения, когнитивного ухудшения и функционального ухудшения. В некоторых вариантах воплощения ухудшение представляет собой клиническое ухудшение. В некоторых вариантах воплощения ухудшение представляет собой снижение когнитивных способностей или когнитивное ухудшение. В некоторых вариантах воплощения ухудшение включает снижение функциональных способностей или функциональное ухудшение. Были разработаны различные тесты и шкалы для измерения когнитивных способностей (в том числе памяти) и/или функциональных способностей. В различных вариантах воплощения используется один или несколько тестов для измерения клинического, функционального или когнитивного ухудшения. Стандартным тестом для измерения когнитивных способностей является тест для оценки когнитивных нарушений из шкалы оценки тяжести болезни Альцгеймера (ADAS-Cog), например, 12-пунктный ADAS-Cog или ADAS-Cog12. Таким образом, в некоторых вариантах воплощения снижение или замедление ухудшений когнитивных способностей (или когнитивных ухудшений) у пациентов, получающих лечение антителами в соответствии с настоящим изобретением, определяют, используя тест ADAS-Cog12. Увеличение показателя ADAS-Cog12 свидетельствует об ухудшении состояния пациента. В некоторых вариантах воплощения снижение или замедление когнитивных ухудшений (или ухудшение когнитивных способностей) у пациентов, получающих лечение антителами в соответствии с настоящим изобретением, определяют, используя Клиническую шкалу оценки деменции с помощью суммы боксированных баллов (CDR-SOB). В некоторых вариантах воплощения снижение или замедление функциональных ухудшений (или ухудшение функциональных способностей) у пациентов, получающих лечение антителами в соответствии с настоящим изобретением, определяют, используя шкалу инструментальной активности в повседневной жизни (или iADL). В некоторых вариантах воплощения оценивают один или несколько типов ухудшений и для измерения снижения или замедления ухудшений используют один или несколько из указанных выше тестов или шкал.
Согласно данному изобретению антитело или его антигенсвязывающий фрагмент вводят в дозе, которая является эффективной для лечения AD или других амилоидозов, как описано в настоящем документе. Подходящие дозировки описаны в настоящем документе и могут варьировать от примерно 0,3 мг/кг до 100 мг/кг. В варианте воплощения, приведенном в качестве примера, дозировка составляет 15 мг/кг. В другом варианте воплощения, приведенном в качестве примера, дозировка составляет 30 мг/кг. В другом варианте воплощения, приведенном в качестве примера, дозировка составляет 45 мг/кг. В некоторых вариантах воплощения дозировка составляет от 500 мг до 1000 мг, например, 500 мг, 700 мг, 720 мг, 750 мг, 800 мг, 820 мг, 900 мг, или от 1000 мг до 2500 мг, например, 1050 мг, 1500 мг или 2100 мг. В способах, предусмотренных в настоящем документе, предусмотрены разнообразные режимы дозирования, включая режимы дозирования, в которых антитело вводят повторно, например, по недельному или месячному графику, в течение длительного периода времени, например, от нескольких месяцев до лет.
Дополнительное преимущество гуманизированного моноклонального антитела против Abeta по настоящему раскрытию состоит в том, что оно не вызывает увеличение частоты возникновения нежелательных явлений, таких как ARIA-E и ARIA-H. Как показано в настоящем документе, в группе пациентов, получавших лечение антителом, не происходило увеличения частоты этих нежелательных явлений по сравнению с группой пациентов, получавших плацебо. Таким образом, настоящее раскрытие также предусматривает способы лечения пациентов, страдающих от легкой до умеренной AD или легкой AD, без увеличения частоты возникновения нежелательных явлений, таких как ARIA-E и/или ARIA-H.
Проведенный поисковый анализ генетических вариантов выявил связь между однонуклеотидным полиморфизмом (SNP) в гене кластерина (CLU или CLUSTERIN) и эффектом от лечения. Как показано в настоящем документе, эффект от лечения кренезумабом больше, чем эффект от лечения плацебо, у пациентов, имеющих, по меньшей мере, один аллель CLU с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т, по сравнению с пациентами, не имеющими аллелей CLU с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т. Данный эффект наблюдался у пациентов с легкой AD, а также у пациентов с положительным статусом по АроЕ4.
Соотвественно, в одном аспекте, настоящая заявка предусматривает способы лечения пациентов с ранней AD, от легкой до умеренной AD или легкой AD, включающие введение пациенту, страдающему от ранней AD, легкой AD или от легкой до умеренной AD, гуманизированного моноклонального антитела против бета-амилоида (Аβ) в количестве, эффективном для лечения AD, где пациент имеет, по меньшей мере, один аллель гена CLUSTERIN с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т, или эквивалентный аллель гена CLUSTERIN. В некоторых вариантах воплощения аллель CLUSTERIN представляет собой эквивалентный аллель.
В некоторых вариантах воплощения аллель гена CLUSTERIN находится в неравновесном сцеплении с rs1532278. В некоторых вариантах воплощения эквивалентный аллель включает SNP в неравновесном сцеплении с rs1532278. В некоторых вариантах воплощения неравновесное сцепление представляет собой величину D' или величину r2. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет 1,0. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет 1,0.
Как предусмотрено в настоящем документе, способы лечения пациентов, страдающих от AD и других амилоидозов, включают введение гуманизированного моноклонального антитела против бета-амилоида (Аβ или Abeta) или его антигенсвязывающего фрагмента, которые связываются с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1). В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент способны связывать фибриллярные, олигомерные и мономерные формы Abeta. В некоторых вариантах воплощения антитело представляет собой антитело IgG4. В конкретных вариантах воплощения антитело или его антигенсвязывающий фрагмент включает шесть гипервариабельных областей (HVR), где HVR-H1 представляет собой SEQ ID NO: 2, HVR-H2 представляет собой SEQ ID NO: 3, HVR-H3 представляет собой SEQ ID NO: 4, HVR-L1 представляет собой SEQ ID NO: 6, HVR-L2 представляет собой SEQ ID NO: 7 и HVR-L3 представляет собой SEQ ID NO: 8. В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент включает тяжелую цепь, имеющую последовательность аминокислот SEQ ID NO: 5, включающую вариабельную область тяжелой цепи, и легкую цепь, имеющую последовательность аминокислот SEQ ID NO: 9, включающую вариабельную область легкой цепи. В конкретном примере антитело представляет собой кренезумаб.
Антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению вводят в дозе, которая является эффективной для лечения AD или других амилоидозов, как описано в настоящем документе. Подходящие дозировки описаны в настоящем документе и могут варьировать примерно от 0,3 мг/кг до 100 мг/кг. В варианте воплощения, приведенном в качестве примера, дозировка составляет 15 мг/кг. В другом варианте воплощения, приведенном в качестве примера, дозировка составляет 30 мг/кг. В другом варианте воплощения, приведенном в качестве примера, дозировка составляет 45 мг/кг. В некоторых вариантах воплощения дозировка составляет от 500 мг до 1000 мг, например, 500 мг, 700 мг, 720 мг, 750 мг, 800 мг, 820 мг, 900 мг, или от 1000 мг до 2500 мг, например, 1050 мг, 1500 мг или 2100 мг. В способах, предусмотренных в настоящем документе, предусмотрены разнообразные режимы дозирования, включая режимы дозирования, в которых антитело вводят повторно, например, по недельному или месячному графику, в течение длительного периода времени, например, от нескольких месяцев до лет.
Предусмотренные в настоящем документе способы лечения могут быть применены к пациентам, страдающим от AD или других амилоидозов, как описано далее в настоящем документе. Подходящие пациенты включают пациентов, страдающих от легкой до умеренной AD, пациентов, набравших от 18 до 26 баллов по шкале MMSE, пациентов, страдающих от легкой AD, пациентов, набравших 20 баллов или выше по шкале MMSE (например, 20-30, 20-26, 24-30, 21-26, 22-26, 22-28, 23-26, 24-26 или 25-26), пациентов, страдающих от ранней AD (включая пациентов с умеренными когнитивными нарушениями вследствие AD и пациентов с доклинической AD), пациентов, положительных по амилоиду (или пациентов, у которых в головном мозге обнаруживаются отложения амилоида, соответствующие тем, которые диагностируются у пациентов с AD), и пациентов с положительным статусом по АроЕ4, страдающих от легкой до умеренной AD или легкой AD.
Также в настоящем документе предусмотрены способы определения пациентов, которые с высокой вероятностью будут получать пользу от лечения гуманизированным моноклональным антителом против бета-амилоида (Аβ), а также способы выбора пациентов для лечения гуманизированным моноклональным антителом против бета-амилоида (Аβ) или его антигенсвязывающим фрагментом. В некоторых вариантах воплощения способы включают обнаружение наличия или отсутствия в образце, полученном от пациента, аллеля гена CLUSTERIN с однонуклеотидным полиморфизом (SNP) rs1532278, содержащим Т, или его эквивалентного аллеля. В некоторых вариантах воплощения способы определения пациента включают обнаружение в образце, полученном от пациента, наличия аллеля гена CLUSTERIN с полиморфизмом, предсказывающим ответ на лечение гуманизированным моноклональным антителом против бета-амилоида (Аβ). В некоторых вариантах воплощения способы включают выбор пациента, который с большей вероятностью будет отвечать на указанное лечение, в том случае, когда однонуклеотидный полиморфизм (SNP) rs1532278, содержащий Т, присутствует в образце, полученном от пациента.
В некоторых вариантах воплощения аллель гена CLUSTERIN представляет собой эквивалентный аллель. В некоторых вариантах воплощения аллель гена CLUSTERIN находится в неравновесном сцеплении с rs1532278. В некоторых вариантах воплощения эквивалентный аллель включает SNP в неравновесном сцеплении с rs1532278. В некоторых вариантах воплощения неравновесное сцепление представляет собой величину D' или величину r2. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет 1,0. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет 1,0.
В некоторых вариантах воплощения гуманизированное моноклональное антитело против бета-амилоида (Аβ или Abeta) или его антигенсвязывающий фрагмент связываются с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1). В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент способны связывать фибриллярные, олигомерные и мономерные формы Abeta. В некоторых вариантах воплощения антитело представляет собой антитело IgG4. В конкретных вариантах воплощения антитело или его антигенсвязывающий фрагмент включает шесть гипервариабельных областей (HVR), где HVR-H1 представляет собой SEQ ID NO: 2, HVR-H2 представляет собой SEQ ID NO: 3, HVR-H3 представляет собой SEQ ID NO: 4, HVR-L1 представляет собой SEQ ID NO: 6, HVR-L2 представляет собой SEQ ID NO: 7 и HVR-L3 представляет собой SEQ ID NO: 8. В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент включает тяжелую цепь, имеющую последовательность аминокислот SEQ ID NO: 5, включающую вариабельную область тяжелой цепи, и легкую цепь, имеющую последовательность аминокислот SEQ ID NO: 9, включающую вариабельную область легкой цепи. В конкретном примере антитело представляет собой кренезумаб. В некоторых вариантах воплощения антитело выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба (aducanumab) и гантенерумаба (gantenerumab).
В одном аспекте раскрытие предусматривает способы предсказания вероятности ответа индивидуума, страдающего от AD, на лечение, включающее антитело против Abeta или его антигенсвязывающий фрагмент. В некоторых вариантах воплощения способы включают определение идентичности нуклеотида в SNP rs1532278 в образце, полученном от индивидуума, и предсказание повышенной вероятности ответа на лечение, включающее антитело против Abeta или его антигенсвязывающий фрагмент, в том случае, если образец содержит, по меньшей мере, один аллель с SNP rs1532278, содержащим нуклеотид Т, или его эквивалентный аллель. В некоторых вариантах воплощения эквивалентный аллель включает SNP в неравновесном сцеплении с rs1532278. В некоторых вариантах воплощения неравновесное сцепление представляет собой величину D' или величину r2. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет 1,0. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет 1,0.
В некоторых вариантах воплощения антитело против Abeta представляет собой гуманизированное моноклональное антитело против бета-амилоида (Аβ или Abeta) или его антигенсвязывающий фрагмент. В некоторых вариантах воплощения гуманизированное моноклональное антитело против бета-амилоида (Аβ или Abeta) или его антигенсвязывающий фрагмент связываются с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1). В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент способны связывать фибриллярные, олигомерные и мономерные формы Abeta. В некоторых вариантах воплощения антитело представляет собой антитело IgG4. В конкретных вариантах воплощения антитело или его антигенсвязывающий фрагмент включает шесть гипервариабельных областей (HVR), где HVR-H1 представляет собой SEQ ID NO: 2, HVR-H2 представляет собой SEQ ID NO: 3, HVR-H3 представляет собой SEQ ID NO: 4, HVR-L1 представляет собой SEQ ID NO: 6, HVR-L2 представляет собой SEQ ID NO: 7 и HVR-L3 представляет собой SEQ ID NO: 8. В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент включает тяжелую цепь, имеющую последовательность аминокислот SEQ ID NO: 5, включающую вариабельную область тяжелой цепи, и легкую цепь, имеющую последовательность аминокислот SEQ ID NO: 9, включающую вариабельную область легкой цепи. В конкретном примере антитело представляет собой кренезумаб. В некоторых вариантах воплощения антитело выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба и гантенерумаба (gantenerumab).
В одном аспекте настоящее раскрытие предусматривает способы оптимизации терапевтической эффективности для лечения AD, включающие определение генотипа пациента, где пациент, для которого было определено, что он является носителем, по меньшей мере, одного аллеля гена CLUSTERIN с SNP rs1532278, содержащим нуклеотид Т, или его эквивалентного аллеля, с большей вероятность будет отвечать на лечение антителом против Abeta или его антигенсвязывающим фрагментом. В некоторых вариантах воплощения аллель гена CLUSTERIN представляет собой эквивалентный аллель. В некоторых вариантах воплощения аллель гена CLUSTERIN находится в неравновесном сцеплении с rs1532278. В некоторых вариантах воплощения эквивалентный аллель включает SNP в неравновесном сцеплении с rs1532278. В некоторых вариантах воплощения неравновесное сцепление представляет собой величину D' или величину r2. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет 1,0. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет 1,0.
В некоторых вариантах воплощения антитело против Abeta представляет собой гуманизированное моноклональное антитело против бета-амилоида (Аβ или Abeta) или его антигенсвязывающий фрагмент. В некоторых вариантах воплощения гуманизированное моноклональное антитело против бета-амилоида (Аβ или Abeta) или его антигенсвязывающий фрагмент связываются с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1). В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент способны связывать фибриллярные, олигомерные и мономерные формы Abeta. В некоторых вариантах воплощения антитело представляет собой антитело IgG4. В конкретных вариантах воплощения антитело или его антигенсвязывающий фрагмент включает шесть гипервариабельных областей (HVR), где HVR-H1 представляет собой SEQ ID NO: 2, HVR-H2 представляет собой SEQ ID NO: 3, HVR-H3 представляет собой SEQ ID NO: 4, HVR-L1 представляет собой SEQ ID NO: 6, HVR-L2 представляет собой SEQ ID NO: 7 и HVR-L3 представляет собой SEQ ID NO: 8. В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент включает тяжелую цепь, имеющую последовательность аминокислот SEQ ID NO: 5, включающую вариабельную область тяжелой цепи, и легкую цепь, имеющую последовательность аминокислот SEQ ID NO: 9, включающую вариабельную область легкой цепи. В конкретном примере антитело представляет собой кренезумаб. В некоторых вариантах воплощения антитело выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба и гантенерумаба (gantenerumab).
Способы, предусмотренные в настоящем документе, включают обнаружение наличия и/или определение идентичности аллеля гена CLUSTERIN или его эквивалентного аллеля. В некоторых вариантах воплощения наличие аллеля гена CLUSTERIN у индивидуума включает определение идентичности нуклеотида в полиморфизме нуклеиновой кислоты, содержащейся в образце, полученном от индивидуума. В некоторых вариантах воплощения образец нуклеиновой кислоты включает ДНК. В некоторых вариантах воплощения образец нуклеиновой кислоты включает РНК. В некоторых вариантах воплощения образец нуклеиновой кислоты представляет собой амплифицированный образец нуклеиновой кислоты. В некоторых вариантах воплощения образец нуклеиновой кислоты амплифицирован с помощью полимеразной цепной реакции. В некоторых вариантах воплощения полиморфизм обнаруживают с помощью полимеразной цепной реакции или с помощью секвенирования. В некоторых вариантах воплощения полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации. В некоторых вариантах воплощения полиморфизм обнаруживают методами, выбранными из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, MassArray (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART. В некоторых вариантах воплощения идентичность нуклеотида в полиморфизме у пациента определяют посредством генотипирования. В некоторых вариантах воплощения генотипирование осуществляют с помощью ПЦР-анализа, секвенирования или LCR анализа.
Для осуществления способов, раскрытых в настоящем документе, предусмотрены подходящие образцы. Таким образом, в некоторых вариантах воплощения образец представляет собой любой биологический образец, из которого может быть выделена геномная ДНК, например, образец ткани, образец слюны, образец буккального мазка, образец крови или другой биологической жидкости, которая содержит геномную ДНК, но не ограничиваясь этим. В некоторых вариантах воплощения образец включает ДНК. В некоторых вариантах воплощения образец включает РНК.
Настоящее раскрытие также предусматривает фармацевтические композиции, подходящие для применения в способах лечения, раскрытых в настоящем документе. Фармацевтические композиции могут быть составлены для любого подходящего способа введения, например, для парентеральной или внутривенной инъекции и, как правило, будут включать помимо антитела против Abeta в соответствии с натоящим раскрытием один или несколько приемлемых носителей, эксципиентов и/или разбавителей, подходящих для желаемого способа введения. В некоторых вариантах воплощения антитело из настоящего изобретения может быть составлено для внутривенного введения. В некоторых вариантах воплощения антитело из настоящего изобретения может быть составлено в буфере, содержащем аргинин, например, в буфере, содержащем сукцинат аргинина. Буфер может содержать один или несколько сурфактантов, например, полисорбат. В некоторых вариантах воплощения концентрация буфера составляет 50 мМ или выше. В некоторых вариантах воплощения рН находится в диапазоне между 4,5 и 7,0, например, рН 5,5. Другие варианты воплощения также описаны в настоящем документе. Фармацевтические композиции могут быть упакованы в виде единичных лекарственных форм для простоты применения.
Лечение антителами против Abeta для лечения AD или других амилоидозов, как описано в настоящем документе, может быть комбинировано с другой терапией, в том числе с одним или несколькими антителами против Abeta, отличными от кренезумаба. Неограничивающие примеры других видов терапии включают неврологические лекарственные средства, кортикостероиды, антибиотики и противовирусные агенты. Неограничивающие примеры антител против Abeta, отличных от кренезумаба, включают соланезумаб, бапинейзумаб, адуканумаб и гантенерумаб (gantenerumab).
Также в настоящем документе предусмотрены наборы для определения наличия аллеля гена CLUSTERIN. В одном аспекте настоящее раскрытие предусматривает набор для определения наличия, по меньшей мере, одного полиморфизма в биологическом образце, включающий реагенты и инструкции для обнаружения наличия, по меньшей мере, одного полиморфизма в гене CLUSTERIN, где полиморфизм представляет собой аллель, включающий SNP rs1532278, или эквивалентный аллель. Реагенты и способы применения набора также описаны в настоящем документе.
В другом аспекте настоящее раскрытие предусматривает агенты и применение in vitro таких агентов для определения пациента, имеющего раннюю AD или от легкой до умеренной AD, который с высокой вероятностью будет отвечать на терапию, включающую антитело против Abeta или его антигенсвязывающий фрагмент, где наличие указанного полиморфизма, например, в гене CLUSTERIN, свидетельствует о том, что пациент с большей вероятностью будет отвечать на терапию. Соответственно, агенты для применения в таких способах включают агенты, которые способны обнаруживать аллель гена CLUSTERIN с SNP rs1532278, содержащим нуклеотид Т, или его эквивалентный аллель.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 представлена аминокислотная последовательность Abeta(l-42) (SEQ ID NO: 1), аминокислоты 13-24 подчеркнуты.
На Фиг. 2 представлена аминокислотная последовательность трех гипервариабельных областей тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3, соответственно) и амиокислотная последовательность гипервариабельных областей легкой цепи (HVR-L1, HVR-L2, HVR-L3, соответственно).
На Фиг. 3 представлена аминокислотная последовательность тяжелой цепи кренезумаба (SEQ ID NO: 5), включающая вариабельную область тяжелой цепи, охватывающую аминокислоты с 1 по 112 в SEQ ID NO: 5, и легкой цепи кренезумаба (SEQ ID NO: 9), включающая вариабельную область легкой цепи, охватывающую аминокислоты с 1 по 112 в SEQ ID NO: 9. Подчеркиванием в SEQ ID NO: 5 и 9 выделены аминокислотные последовательности трех HVR тяжелой цепи, соответствующие SEQ ID NO: 2-4, и трех HVR легкой цепи, соответствующие SEQ ID NO: 6-8, соответственно.
На Фиг. 4А-В приведена краткая характеристика пациентов, участвующих в клиническом исследовании, описанном в Примере 1, в таблице приведена информация о количестве пациентов в каждой группе (получающие лечение по сравнению с получающими плацебо), их статусу по АроЕ4 (отрицательные по АроЕ4 / положительные по АроЕ4), стадии AD (легкая или умеренная) и количестве баллов, набранных пациентами по шкале MMSE, наличии и типе сопутствующей терапии в отношении симптомов AD.
Фиг. 5 приведена схема клинических исследований, описанных в Примере 1, на которой отражены схема дозирования, количество и способ дозирования.
На Фиг. 6А-В приведены таблицы, содержащие информацию об изменении количества баллов по шкале ADAS-Cog12 через 73 недели от начала исследования в группе пациентов, получавших лечение, и в группе пациентов, получавших плацебо. На Фиг. 6А приведены данные для пациентов с легкой до умеренной AD, легкой AD, умеренной AD и пациентов с положительным и отрицательным статусом по АроЕ4. На Фиг. 6В приведены данные для пациентов в соответствии со шкалой MMSE.
На Фиг. 7 приведена диаграмма изменения количества баллов по шкале ADAS-Cog12 у пациентов с легкой AD, которые набрали от 20 до 26 баллов по шкале MMSE, получавших лечение кренезумабом (черная сплошная линия) или плацебо (светлая сплошная линия).
На Фиг. 8 приведена диаграмма изменения количества баллов по шкале ADAS-Cog12 у пациентов с легкой до умеренной AD, которые набрали от 18 до 26 баллов по шкале MMSE, получавших лечение кренезумабом (черная сплошная линия) или плацебо (светлая сплошная линия).
На Фиг. 9 приведена диаграмма изменения количества баллов по шкале ADAS-Cog12 у пациентов с положительным статусом по АроЕ4 с легкой до умеренной AD, получавших лечение кренезумабом (черная сплошная линия) или плацебо (светлая сплошная линия).
На Фиг. 10 приведена диаграмма изменения количества баллов по шкале ADAS-Cog12 у всех пациентов с положительным статусом по АроЕ4, и пациентов с легкой AD, получавших лечение кренезумабом (черная сплошная линия) или плацебо (светлая сплошная линия).
На Фиг. 11 приведена диаграмма изменения количества баллов по шкале ADAS-Cog12 у пациентов с легкой AD, которые набрали от 22 до 26 баллов по шкале MMSE, получавших лечение кренезумабом или плацебо.
На Фиг. 12А-В приведены таблицы, содержащие информацию об изменении количества баллов по шкале CDR-SOB через 73 недели от начала исследования у пациентов в группе, получавших лечение, и в группе, получавших плацебо. На Фиг. 12А приведена информация об изменении количества баллов по шкале CDR-SOB у пациентов в соответствии со шкалой MMSE. На Фиг. 12В приведена информация о количестве баллов по шкале CDR-SOB, а также по шкалам CDR «Принятие решений и решение задач» и CDR «Память» у пациентов, которые набрали по шкале MMSE 18-26, 20-26 и 22-26 баллов.
На Фиг. 13 приведена диаграмма изменения количества баллов по шкале CDR-SOB у пациентов с легкой AD, которые набрали 25 или 26 баллов по шкале MMSE, получавших лечение кренезумабом или плацебо, как указано на фигуре.
На Фиг. 14А-В приведена краткая характеристика пациентов, участвующих в клиническом исследовании, описанном в Примере 2, до начала лечения и после лечения, включающая информацию о нежелательных явлениях (А) и временной график, на котором отмечены моменты проведения PET сканирования, MRI сканирования и забора образцов CSF в ходе клинического исследования (В).
На Фиг. 15А-В приведены диаграммы, показывающие уровни амилоида у пациентов, получающих плацебо (пунктирная линия) или кренезумаб (сплошная линия), измеренные визуализацией с флорбетапиром (florbetapir) с помощью PET (А), и уровни Abeta в CSF у пациентов, получающих плацебо или кренезумаб (В).
На Фиг. 16 приведены сравнительные диаграммы, демонстрирующие изменение количества баллов по тесту ADAS-Cog12 у пациентов с легкой до умеренной AD в группе пациентов, получающих лечение, и в группе пациентов, получающих плацебо. Диаграмма (А) приведена для пациентов, которые были отрицательны по SNP (т.е. пациентов, у которых отсутствует аллель гена CLUSTERIN с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т), диаграмма (В) приведена для пациентов, которые были положительны по SNP (т.е. пациенты, по меньшей мере, с одним аллелем гена CLUSTERIN с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т).
На Фиг. 17 приведены сравнительные диаграммы, демонстрирующие изменение количества баллов по тесту ADAS-Cog12 у пациентов с положительным статусом по АроЕ4 с легкой до умеренной AD в группе пациентов, получающих лечение, и в группе пациентов, получающих плацебо. Диаграмма (А) приведена для пациентов, которые были отрицательны по SNP (т.е. пациентов, у которых отсутствует любой аллель гена CLUSTERIN с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т), диаграмма (В) приведена для пациентов, которые были положительны по SNP (т.е. пациенты, по меньшей мере, с одним аллелем гена CLUSTERIN с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т).
На Фиг. 18 приведены сравнительные диаграммы, демонстрирующие изменение количества баллов по тесту ADAS-Cog12 у пациентов с легкой AD в группе пациентов, получающих лечение, и в группе пациентов, получающих плацебо. Диаграмма (А) приведена для пациентов, которые были отрицательны по SNP (т.е. пациентов, у которых отсутствует аллель гена CLUSTERIN с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т), диаграмма (В) приведена для пациентов, которые были положительны по SNP (т.е. пациенты, по меньшей мере, с одним аллелем гена CLUSTERIN с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не определено иначе, технические и научные термины, использованные в настоящем документе, имеют то же значение, которое обычно понимается специалистом в области, к которой относится это изобретение. Singleton et al. et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, N.Y. 1994) и March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4th ed., John Wiley & Sons (New York, N.Y. 1992) являются для специалиста в данной области техники общим руководством для многих терминов, использованных в настоящей заявке.
Некоторые определения и аббревиатуры
С целью интерпретации этого описания будут применяться нижеследующие определения, и всякий раз, когда это уместно, термины, используемые в единственном числе, будет также включать множественное число, и наоборот. В том случае, если любое определение, приведенное ниже, не соответствует таковому в любом из документов, включенных в настоящий документ посредством ссылки, определение, приведенное ниже, должно рассматриваться как основное.
Использованные в этом описании и прилагаемой формуле изобретения формы единственного числа включают указания множественного числа, если в контексте явно не указано иное. Таким образом, например, ссылка на «белок» или «антитело» включает множество белков или антител, соответственно; ссылка на «клетку» включает смесь клеток и тому подобное.
Диапазоны, предусмотренные в данном описании и прилагаемой формуле изобретения, включают обе конечные точки и все точки между конечными точками. Таким образом, например, диапазон от 2,0 до 3,0 включает 2,0, 3,0 и все точки между 2,0 и 3,0.
Фраза «по существу аналогичные» или «по существу одинаковые», использованная в настоящем документе, обозначает достаточно высокую степень сходства между двумя числовыми значениями (обычно одно связано с антителом по настоящему изобретению, а другое связано с антителом сравнения), так что специалист в данной области техники будет считать различие между двумя значениями маленьким или не имеющим биологической и/или статистической значимости в контексте биологической характеристики, измеренной указанными значениями (например, значения Kd). Различие между указанными двумя значениями составляет примерно меньше 50%, примерно меньше 40%, примерно меньше 30%, примерно меньше 20%, примерно меньше 10% в зависимости от значения для антитела сравнения.
Термин «образец» или «тестируемый образец», использованный в настоящем документе, относится к композиции, которая получена из интересующего субъекта, которая содержит клеточный и/или другой молекулярный компонент, который должен быть охарактеризован и/или идентифицирован, например, на основе его физических, биохимических, химических и/или физиологических характеристик. В одном из вариантов воплощения определение включает кровь и другие жидкие образцы биологического происхождения, и образцы ткани, такие как биопсийный материал или культуры тканей, или клетки, полученные из биопсийного материала. Источником образца ткани могут быть твердая ткань из свежего, замороженного и/или фиксированного образца органа или ткани, или биоптат, или аспират; кровь или любой компонент крови; биологические жидкости; и клетки на любой стадии созревания или развития субъекта, или плазма. Термин «биологический образец», использованный в настоящем документе, включает кровь, сыворотку, плазму, мокроту, образцы биопсии ткани (например, образцы легких) и образцы из носа, в том числе мазок из носа или носовые полипы, но не ограничиваясь этим.
Термин «образец», «биологический образец» или «тестируемый образец» включает биологические образцы, которые были обработаны каким-либо образом после их получения, например, подвергнуты обработке реагентами, солюбилизации или обогащению определенных компонентов, таких как белки или полинуклеотиды, или фиксации (заливке) в полутвердой или твердой матрице с целью изготовления срезов. Для целей настоящего документа «срез» образца ткани означает отдельную часть или кусок образца ткани, например, тонкий слой ткани или клетки, вырезанный из образца ткани. Образцы включают цельную кровь, клетки, полученные из крови, сыворотку, плазму, лимфатическую жидкость, синовиальную жидкость, клеточные экстракты и их комбинации, но не ограничиваясь этим. В одном из вариантов воплощения образец представляет собой клинический образец. В другом варианте воплощения образец используется в диагностическом анализе.
В одном из вариантов воплощения образец получен из субъекта или пациента до лечения антителом против Abeta. В другом варианте воплощения образец получен из субъекта или пациента после, по меньшей мере, одного лечения антителом против Abeta.
Термин «образец сравнения», использованный в настоящем документе, относится к любому образцу, стандарту или уровню, которые используют для сравнения. В одном из вариантов воплощения образец сравнения получен из здоровой и/или непораженной заболеванием части тела (например, ткани или клетки) того же самого субъекта или пациента. В другом варианте воплощения образец сравнения получен из необработанной ткани и/или клетки тела того же самого субъекта или пациента. В еще одном варианте воплощения образец сравнения получен из здоровой и/или непораженной заболеванием части тела (например, ткани или клетки) индивидуума, который не является субъектом или пациентом. В еще одном варианте воплощения образец сравнения получен из необработанной ткани и/или клетки тела индивидуума, который не является субъектом или пациентом.
В некоторых вариантах воплощения образец сравнения представляет собой одиночный образец или комбинацию множества образцов из того же самого субъекта или пациента, которые получены в один или несколько моментов времени, которые отличаются от времени, когда был получен тестируемый образец. Например, образец сравнения получен из того же самого субъекта или пациента в более ранний момент времени, чем тестируемый образец. В некоторых вариантах воплощения образец сравнения включает все типы биологических образцов в соответствии с приведенным выше определением термина «образец», которые получены от одного или нескольких индивидуумов, не являющихся субъектом или пациентом. В некоторых вариантах воплощения образец сравнения получен от одного или нескольких индивидуумов с амилоидозами, например, болезнью Альцгеймера, которые не являются субъектами или пациентами.
В некоторых вариантах воплощения образец сравнения представляет собой комбинацию множества образцов из одного или нескольких здоровых индивидуумов, которые не являются субъектом или пациентом. В некоторых вариантах воплощения образец сравнения представляет собой комбинацию множества образцов от одного или нескольких индивидуумов с заболеванием или расстройством (например, амилоидозом, таким как, например, болезнь Альцгеймера), которые не являются субъектом или пациентом. В некоторых вариантах воплощения образец сравнения представляет собой образцы РНК из нормальных тканей или объединенные образцы плазмы или сыворотки от одного или нескольких индивидуумов, которые не являются субъектом или пациентом.
Образец нуклеиновой кислоты выделен из биологического образца, полученного от субъекта. Образец нуклеиновой кислоты может быть выделен из биологического образца с использованием стандартных методов. Образец нуклеиновой кислоты может использоваться в способе для определения наличия полиморфного варианта. Наличие или отсутствие полиморфного варианта можно определить, используя один или оба хромосомных набора, представленных в образце нуклеиновой кислоты. Определение наличия или отсутствия полиморфного варианта в обоих хромосомных наборах, представленных в образце нуклеиновой кислоты, используется для определения зиготности индивидуума по полиморфному варианту.
Термин «низкомолекулярное соединение» относится к органической молекуле, имеющей молекулярную массу от 50 Дальтон до 2500 Дальтон.
Термины «антитело» и «иммуноглобулин» («Ig») используются взаимозаменяемо в самом широком смысле и включают моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, антитела с полиэпитопной специфичностью, одноцепочечные антитела, мультиспецифические антитела (например, биспецифические антитела, триспецифические антитела, тетраспецифические антитела) и фрагменты антител, при условии, что они обладают желаемой биологической активностью. Такие антитела могут быть химерными, гуманизированными, человеческими, синтетическими и/или с созревшей аффинностью. Такие антитела и способы их создания более подробно описаны в настоящем документе.
«Фрагменты антитела» включают только часть интактного антитела, где часть преимущественно сохраняет, по меньшей мере, одну и, как правило, большинство или все функции, обычно связанные с этой частью в интактном антителе. В одном из вариантов воплощения, фрагмент антитела включает антигенсвязывающий сайт интактного антитела и, таким образом, сохраняет способность связываться с антигеном. В другом варианте воплощения фрагмент антитела, например, такой фрагмент, который включает Fc область, сохраняет, по меньшей мере, одну биологическую функцию, обычно связанную с Fc областью, когда она присутствует в интактном антителе, такую как связывание FcRn, модуляция периода полужизни антител, функция ADCC и связывание комплемента. В одном из вариантов воплощения фрагмент антитела представляет собой моновалентное антитело, которое имеет период полужизни in vivo, по существу аналогичный периоду полужизни интактного антитела. Например, такой фрагмент антитела может включать антигенсвязывающее плечо, связанное с последовательностью Fc, что придает фрагменту стабильность in vivo. Примеры фрагментов антител включают Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и мультиспецифические антитела, образованные фрагментами антител, но не ограничиваясь этим.
Термин «мишень», использованный в настоящем документе, относится к любой нативной молекуле из любого позвоночного животного, включая млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы), если не указано иное. Термин включает «полноразмерную» непроцессированную мишень, а также любую форму мишени, полученную в результате процессинга в клетке. Термин также включает встречающиеся в природе варианты мишеней, например, варианты сплайсинга или аллельные варианты.
Термины «бета-амилоид», «Abeta», «β-амилоид» и «Аβ», использованные в настоящем документе взаимозаменяемо, относятся к фрагменту белка-предшественника амилоида («АРР»), который образуется в результате расщепления АРР β-секретазой 1 («ВАСЕ1»), а также к его модификациям, фрагментам и любым функциональным эквивалентам, в том числе Аβ 1-40 и Аβ 1-42, но не ограничиваясь этим. Известно, что Аβ существует в мономерной форме, а также образует олигомеры и фибриллярные структуры, которые могут быть обнаружены в амилоидных бляшках. Структура и последовательности таких пептидов Аβ хорошо известны специалисту в данной области техники, и способы получения указанных пептидов или их экстракции из головного мозга и других тканей описаны, например, в Glenner and Wong, Biochem Biophys Res. Comm. 129: 885-890 (1984). Более того, пептиды Аβ также коммерчески доступны в разных формах. Примером аминокислотной последовательности человеческого Аβ1-42 является DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA (SEQ ID NO: 1).
Термины «антитело против мишени» и «антитело, которое связывается с мишенью» относятся к антителу, которое способно связываться с мишенью с достаточной аффинностью, так что это антитело можно использовать в качестве диагностического и/или терапевтического агента для специфического связывания с мишенью. В одном из вариантов воплощения степень связывания антитела против мишени с неродственным, нецелевым белком составляет примерно меньше 10% от связывания антитела с мишенью, например, по данным измерений с помощью радиоиммунологического анализа (РИА) или анализа Biacore. В некоторых вариантах воплощения антитело, которое связывается с мишенью, имеет константу диссоциации (Kd), составляющую ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или меньше, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В некоторых вариантах воплощения антитело против мишени связывается с эпитопом мишени, являющимся консервативным между разными видами.
Термины «анти-Abeta иммуноглобулин», «антитело против Abeta» и «антитело, которое связывается с Abeta» используются в настоящем документе взаимозаменяемо и относятся к антителу, которое специфически связывается с человеческим Abeta. Неограничивающим примером антитела против Abeta является кренезумаб. Другими неограничивающими примерами антител против Abeta являются соланезумаб, бапинейзумаб, адуканумаб и гантенерумаб (gantenerumab).
Термины «кренезумаб» и «МАВТ5102А» используются в настоящем документе взаимозаменяемо и относятся к специфическому антителу против Abeta, которое связывается с мономерной, олигомерной и фибриллярной формами Abeta и которое имеет регистрационный номер СAS 1095207. В одном из вариантов воплощения такое антитело включает последовательности областей HVR, приведенные на Фиг. 2. В другом таком варианте воплощения такое антитело включает: (1) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 2; (2) последовательность HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 3; (3) последовательность HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 4; (4) последовательность HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 6; (5) последовательность HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 7; и (6) последовательность HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 8. В другом варианте воплощения специфическое антитело против Abeta включает домены VH и VL, имеющие аминокислотные последовательности, приведенные на Фиг. 3. В другом таком варианте воплощения такое специфическое антитело против Abeta включает домен VH, включающий аминокислотную последовательность SEQ ID NO: 5, и домен VL, включающий аминокислотную последовательность SEQ ID NO: 9. В другом варианте воплощения антитело представляет собой антитело IgG4. В другом таком варианте воплощения антитело IgG4 включает мутацию в своем константном домене, такую как замена пролина в положении 228 на серии.
Термин «амилоидоз», использованный в настоящем документе, относится к группе заболеваний и расстройств, вызванных амилоидом или амилоид-подобными белками или связанных с амилоидом или амилоид-подобными белками, и включают заболевания и расстройства, вызыванные наличием или активностью амилоид-подобных белков в мономерном, фибриллярном или полимерном состоянии или любой их комбинацией, включая амилоидные бляшки, но не ограничиваясь этим. Такие заболевания включают, без ограничения, вторичный амилоидоз и старческий амилоидоз, например, неврологические расстройства, такие как болезнь Альцгеймера («AD»), заболевания или состояния, характеризующиеся потерей когнитивных способностей памяти, такие как, например, умеренные когнитивные нарушения (MCI), деменция с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландский тип), комплекс паркинсонизм-деменция Гуама и другие заболевания, обусловленные амилоид-подобными белками или связанные с амилоид-подобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз, болезнь Крейтцфельдта-Якоба, болезнь Паркинсона, ВИЧ-ассоциированная деменция, ALS (боковой амиотрофический склероз), миозит с включенными тельцами (IBM), диабет зрелого возраста, эндокринная опухоль и старческий амилоидоз сердца, а также различные глазные заболевания, в том числе макулодистрофия, оптическая нейропатия, связанная с друзами, глаукома и катаракта вследствие отложения бета-амилоида, но не ограничиваясь этим.
Глаукома - группа заболеваний оптического нерва, которые объединяет характерная для оптической нейропатии картина утраты ганглионарных клеток сетчатки (RGC). RGC представляют собой нервные клетки, которые передают визуальные сигналы от глаза к головному мозгу. В процессе, приводящем к апоптозу RGC, активируются каспаза-3 и каспаза-8, два основных фермента апоптотического процесса. Каспаза-3 расщепляет белок-предшественник амилоида (АРР) с образованием нейротоксичных фрагментов, в том числе Abeta. Без защитного эффекта АРР накопление Abeta в слое ганглионарных клеток сетчатки приводит к гибели RGC и необратимой потере зрения.
Глаукома часто, но не всегда, сопровождается повышением глазного давления, которое может быть следствием блокировки циркуляции водянистой влаги или ее оттока. Несмотря на то, что повышенное внутриглазное давление является фактором значительного риска развития глаукомы, пороговое значение глазного давления, которое окажется решающим для развития глаукомы, определить нельзя. Повреждения также могут быть вызваны слабым кровоснабжением жизненно важных волокон зрительного нерва, слабостью в структуре нерва и/или проблемой с состоянием самих нерных волокон. При отсутствии лечения глаукома приводит к необратимому повреждению зрительного нерва и дефектам поля зрения, при этом ситуация может прогрессировать вплоть до слепоты.
Разные типы глауком классифицируют как открытоугольную глаукому, если состояние является хроническим, или закрытоугольную глаукому, если острая глаукома возникает внезапно. Глаукома обычно поражает оба глаза, но заболевание может быстрее прогрессировать в одном глазу, чем в другом.
Хроническая открытоугольная глаукома (COAG), также известная как первичная открытоугольная глаукома (POAG), является наиболее распространенным типом глаукомы. COAG вызвана микроскопической блокировкой в трабекулярной сети, что приводит к снижению оттока внутриглазной жидкости в канал Шлемма и повышению внутриглазного давления (IOP). POAG обычно поражает оба глаза и тесно связана с возрастом и отягощенным семейным анамнезом. Частота заболевания увеличивается у пожилых людей, поскольку пути оттока в глазе могут постепенно закупориваться с возрастом. Увеличение внутриглазного давления у субъктов, страдающих хронической открытоугольной глаукомой, не сопровождается какими-либо симптомами, пока не проявляется потеря зрения в центральной зрительной области.
Острая закрытоугольная глаукома (AACG) или закрытоугольная глаукома представляет собой относительно редкий тип глаукомы, который характеризуется внезапным резким повышением внутриглазного даления до 35-80 мм.рт.ст., которое сопровождается сильной болью и приводит к необратимой потере зрения. Резкое повышение давления вызвано закрытием угла фильтрации и блокированием каналов оттока. У индивидуумов с узким углом риск внезапного закрытия угла повышен. AACG обычно развивается в одном глазе, но существует риск развития AACG в обоих глазах. Возраст, катаракта и псевдоэксфолиация также являются факторами риска, поскольку они связаны с удлинением хрусталика и сдавливанием или сужением угла. Внезапный приступ глаукомы может сопровождаться сильной болью в глазе, головной болью, покраснением глаза, тошнотой, рвотой и затуманиванием зрения.
Смешанная глаукома или глаукома со смешанным механизмом развития представляет собой комбинацию открытоугольной и закрытоугольной глаукомы. Она поражает пациентов с острой ACG, у которых угол открыт после лазерной иридотомии, но которые продолжают принимать лекарственные средства для контроля IOP, а также пациентов с POAG или превдоэксфолиативной глаукомой, у которых постепенно сужается угол.
Глаукома с нормальным давлением (NTG), также называемая глаукомой низкого давления (LTG), характеризуется прогрессирующим повреждением зрительного нерва и потерей периферического зрения, как и другие типы глаукомы; но при этом значение внутриглазного давления находится в нормальном диапазоне или даже ниже нормального значения.
Врожденная (инфантильная) глаукома представляет собой относительно редкий наследственный тип открытоугольной глаукомы. Недостаточное развитие системы оттока приводит к повышению глазного давления, что, в свою очередь, может приводить к потере зрения из-за повреждения зрительного нерва и к увеличению глазного яблока. Ранняя диагностика и лечение имеют решающее значение для сохранения зрения у младенцев и детей, пораженных заболеванием.
Вторичная глаукома может быть следствием травмы глаза, воспаления радужной оболочки глаза (ирита), диабета, катаракты или употребления стероидов чувствительными к ним индивидуумами. Вторичная глаукома может быть связана с отслоением сетчатки или окклюзией или блокадой вен сетчатки.
Пигментная глаукома характеризуется отделением гранул пигмента от радужной оболочки глаза. Гранулы блокируют систему оттока внутриглазной жидкости в глазе, что приводит к повышению внутриглазного давления и повреждению зительного нерва. Эксфолиативная глаукома (псевдоэксфолиация) характеризуется отложением чешуйчатого материала на передней капсуле и в углу глаза. Накопление чешуйчатого материала блокирует систему оттока внутриглазной жидкости и приводит к повышению глазного давления.
Диагностику глаукомы можно осуществить с помощью разных тестов. С помощью тонометрии можно определить давление в глазу путем измерения тонуса или твердости его поверхности. Для проведения этого теста доступны несколько типов тонометров, наиболее распространенным из которых является аппланационный тонометр. С помощью пахиметрии определяют толщину роговицы, с учетом которой, в свою очередь, измеряют внутриглазное давление. Гониоскопия позволяет обследовать область угла фильтрации и систему оттока глаза. С помощью гониоскопии также можно определить, блокируют ли аномальные кровеносные сосуды отток внутриглазной жидкости из глаза. С помощью офтальмоскопии можно обследовать зрительный нерв и обнаружить истончение нервного волокна или изменения в диске зрительного нерва или вдавливание (образования углубления) этой структуры, которые могут быть вызваны повышением внутриглазного давления или повреждением аксона. Гониоскопия также используется для оценки повреждения нерва, вызванного слабым кровоснабжением или повышенным внутриглазным давлением. Благодаря тестированию зрительного поля и субъективному отображению поля зрения можно обнаружить признаки глаукоматозного повреждения зрительного нерва. Они представлены специфическими картинами потери поля зрения. С помощью глазной когеренной томографии, объективного измерения истончения нервных волокон, благодаря разнице в пропускании света поврежденной аксональной тканью можно наблюдать за толщиной слоя волокон зрительного нерва (изменяется при глаукоме).
«Антитело, которое связывается с тем же самым эпитопом», что и антитело сравнения, относится к антителу, которое на 50% или больше блокирует связывание антитела сравнения с его антигеном в конкурентном анализе связывания и, наоборот, антитело сравнения на 50% или больше блокирует связывание антитела с его антигеном в конкурентном анализе. Пример конкурентного анализа связывания предусмотрен в настоящем документе.
Термин «биомаркер», использованный в настоящем документе, обычно относится к молекуле, в том числе к однонуклеотидному полиморфизму (SNP), белку, углеводной структуре или гликолипиду, экспрессия которой в ткани или клетке млекопитающих может быть обнаружена стандартными способами (или способами, раскрытыми в настоящем документе), и которая является предиктивным, диагностическим и/или прогностическим показателем чувствительности клетки или ткани млекопитающих, например, к режимам лечения, основанным на ингибировании комплемента, например, альтернативного пути активации комплемента. Необязательно, биомаркер SNP определяют, когда на основе SNP (два варианта) удается выделить группы индивидуумов, отвечающих и не отвечающих на лечение. Например, в случае SNP с двумя нуклеотидами, G и А, где А представляет собой аллель риска, носители аллеля А (например, индивидуумы АА или GA) отвечают на лечение, тогда как индивидуумы, не имеющие аллеля А (например, индивидуумы GG), не отвечают на лечение.
Термин «предиктивный биомаркер», использованный в настоящем документе, позволяет определить субпопуляцию пациентов, которые с высокой вероятностью будут отвечать на данное лечение.
Термин «прогностический биомаркер», использованный в настоящем документе, представляет собой маркер, который указывает на вероятное течение заболевания у индивидуума, не подвергнутого лечению.
Термин «однонуклеотидный полиморфизм», использованный в настоящем документе и также обозначаемый как «SNP», относится к замене одного основания в последовательности ДНК, которая приводит к возникновению генетической изменчивости. Положение нуклеотида в геноме, в котором возможно существование более одного варианта последовательности в популяции, называется в настоящем документе «полиморфным сайтом» или «полиморфизмом». Полиморфный сайт может представлять собой, например, нуклеотидную последовательность из двух или нескольких нуклеотидов, вставленный нуклеотид или вставленную нуклеотидную последовательность, делетированный нуклеотид или делегированную нуклеотидную последовательность или микросателлит. Полиморфный сайт длиной два или более нуклеотидов может иметь длину 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более нуклеотидов, 20 или более, 30 или более, 50 или более, 75 или более, 100 или более, 500 или более или примерно 1000 нуклеотидов, где все или некоторые нуклеотидные последовательности отличаются в пределах области. Полиморфный сайт длиной в один нуклеотид называется в настоящем документе SNP. Когда существуют две, три или четыре альтернативные нуклеотидные последовательности в полиморфном сайте, каждая нуклеотидная последовательность называется «полиморфным вариантом» или «вариантом нуклеиновой кислоты». Каждый возможный вариант в последовательности ДНК называется «аллелем». Если существуют два полиморфных варианта, полиморфный вариант, который представлен в большинстве образцов в популяции, называется «преобладающим аллелем» или «основным аллелем», а полиморфный вариант, который менее распространен в популяции, называется «редким аллелем» или «минорным аллелем». Индивидуум, который несет два преобладающих аллеля или два редких аллеля, является «гомозиготным» в отношении этого полиморфизма. Индивидуум, который несет один преобладающий аллель и один редкий аллель является «гетерозиготным» в отношении этого полиморфизма. Аллели, содержащие SNP типа C/G или А/Т, являются неоднозначными и зависят от того, какая цепь используется для экстракции данных с платформы для генотипирования. В случае SNP типа C/G или А/Т, нуклеотид С или G или нуклеотид А или Т, соответственно, могут быть аллелем риска или защитным аллелем и их определяют корреляцией частот аллелей. Аллель, который коррелирует с повышенным риском заболевания, или ассоциирован с отношением рисков или относительным риском >1, называется «аллель риска» или «аллель эффекта». Аллель риска или аллель эффекта могут являться минорным аллелем или основным аллелем. Аллель, который коррелирует с пониженным риском (или повышенной вероятностью получения пользы от терапии), называется «защитным аллелем». Защитный аллель может являться минорным или основным аллелем.
Термины «эквивалентный аллель» или «суррогатный аллель», использованные в настоящем документе, относятся к аллелю, который, как ожидается, ведет себя аналогично опубликованному аллелю и выбран на основе частоты аллелей и высокого значения r2 (≥0,6) и/или высокого значения D' (≥0,6) между ним и опубликованными аллелями и/или выбранным SNP, как это определено в настоящем документе. В одном из вариантов воплощения высокое значение r2 составляет ≥0,6, 0,7, 0,8, 0,9 или 1,0. В одном из вариантов воплощения высокое значение D' составляет ≥0,6, 0,7, 0,8, 0,9 или 1,0.
Термин «неравновесное сцепление» или «LD», использованный в настоящем документе, относится к аллелям, находящимся в разных локусах, которые не связаны друг с другом случайным образом, т.е. не связаны пропорционально их частотам. Если аллели находятся в положительном неравновесном сцеплении, тогда аллели встречаются вместе чаще, чем это было бы в случае их статистической независимости. Наоборот, если аллели находятся в отрицательном неравновесном сцеплении, тогда аллели встречаются вместе реже, чем это было бы в случае их статистической независимости.
Термин «отношение рисков» или «OR», использованный в настоящем документе, относится к отношению рисков заболевания у индивидуумов с маркером (аллель или полиморфизм) к рискам заболевания у индивидуумов без маркера (аллель или полиморфизм). Термин «гаплотип», использованный в настоящем документе, относится к группе аллелей на одной хромосоме, которые достаточно тесно свзаны друг с другом, чтобы обычно наследоваться как единое целое.
Полиморфный вариант может быть обнаружен либо в одной, либо в обоих цепях двухцепочечной нуклеиновой кислоты. Также полиморфные варианты могут быть расположены в пределах интрона или экзона гена или части регуляторной области, такой как промотор, 5' нетранслируемая область (UTR), 3'UTR, и в ДНК (например, геномная ДНК (гДНК) и комплементарная ДНК (кДНК)), РНК (например, мРНК, тРНК и рРНК) или полипептиде. Полиморфные варианты могут приводить или могут не приводить к обнаруживаемым различиям в экспрессии генов, структуре полипептида или функции полипептида.
Термин «альтернативный SNP», использованный в настоящем документе, относится к SNP, который, как ожидается, ведет себя аналогично выбранному SNP, и выбран на основе аналогичных частот аллелей и находится в неравновесном сцеплении с выбранным SNP, как продемонстрировано показателями r2 ≥ 0,6 и/или D' ≥ 0,6.
Термин «терапевтический агент» относится к любому агенту, который используется для лечения заболевания, в том числе к агенту, который лечит симптом заболевания, но не ограничиваясь этим.
Использованный в настоящем документе термин «лечение» относится к клиническому вмешательству, которое направлено на изменение естественного течения заболевания у индивидуума, подвергающегося лечению, которое может быть осуществлено в ходе клинической патологии. Желаемые эффекты лечения включают облегчение или улучшение одного или нескольких симптомов, уменьшение или задержку возникновения или ухудшения любых прямых или косвенных патологических последствий заболевания, уменьшение скорости прогрессирования заболевания и улучшение или временное облегчение течения заболевания, но не ограничиваясь этим. В некоторых вариантах воплощения антитела используют для задержки развития заболевания или для замедления прогрессирования заболевания.
Термин «возникший за время лечения», использованный в настоящем документе, относится к явлению, которое возникло после введения первой дозы терапевтического агента. Например, «нежелательное явление, возникшее за время лечения» представляет собой явление, которое регистрируется во время или после первой дозы лечения в клиническом исследовании.
Термин «режим лечения» относится к комбинации дозировок, частоте введения или продолжительности лечения с добавлением второго лекарственного средства или без добавления второго лекарственного средства.
Термин «эффективный режим лечения» относится к режиму лечения, который предполагает благоприятный ответ пациента, получающего лечение.
Термин «изменение лечения» относится к изменению режима лечения, в том числе изменению дозировки, частоты введения или продолжительности лечения и/или добавлению второго лекарственного средства.
Термины «эффективное количество» или «эффективная доза» агента относятся к количеству или дозе, которые являются эффективными в течение периодов времени, требуемых для достижения желаемого результата. Например, «терапевтически эффективное количество» представляет собой количество, являющееся эффективным в течение периода времени, требуемого для лечения указанного заболевания, состояния, клинической патологии или симптома, т.е. для изменения хода прогрессирования AD и/или для облегчения и/или предотвращения одного или нескольких симптомов AD.
Настоящее изобретение предусматривает способы использования SNP или других генетических механизмов в качестве предиктивного биомаркера для предсказания ответа на лечение и в качестве прогностического биомаркера для оценки прогрессирования AD, способы использования SNP или других генетических механизмов для выбора стратегии лечения и способы использования SNP или других генетических механизмов для стратификации пациентов, включая выбор пациентов для клинических исследований или для принятия решений о клиническом лечении, но не ограничиваясь этим. Термин «стратификация пациентов», использованный в настоящем документе, относится к генотипированию индивидуумов для определения вероятности ответа на лечение. Генотипирование проводят для определения, является ли индивидуум носителем SNP. Существует много способов измерения генотипов со специфичными SNP. Индивидуумы, которые имеют мутации в одном или нескольких SNP, могут быть выявлены на уровне ДНК различными методами, включая анализ SNP, Taqman, флуоресцентную поляризацию, Sequenom (или другие способы анализа SNP, описанные в настоящем документе), но не ограничиваясь этим. Нуклеиновые кислоты для диагностики могут быть получены из клеток пациентов, например, из крови, мочи, слюны и аутопсийного материала.
Геномная ДНК может быть непосредственно использована для обнаружения или может быть амплифицирована с использованием PCR до анализа геномной ДНК или транскриптов. Например, фрагментированная одноцепочечная ДНК из индивидуума гибридизуется с чипом, содержащим от сотен до тысяч иммобилизованных уникальных последовательностей нуклеотидных зондов. Последовательности нуклеотидных зондов подобраны таким образом, чтобы связываться с целевой последовательностью ДНК (например, в случае SNP, аллель-специфический зонд используется для выявления и анализа наличия или отсутствия SNP). Для регистрации и интерпретации сигнала, возникающего в результате гибридизации иммобилизованного зонда и ДНК индивидуума (либо зонд, либо ДНК мечены флуорофором, сигнал от которого обнаруживается и измеряется) используется система обнаружения. Определенную последовательность ДНК можно обнаружить способами, которые включают гибридизацию, защиту от РНКазы, химическое расщепление, прямое секвенирование ДНК или использование ферментов рестрикции, Саузерн блоттинга геномной ДНК, анализ in situ, гибридизацию нуклеиновой кислоты образца с контрольной нуклеиновой кислотой на микрочипах с высокой плотностью, содержащих сотни или тысячи олигонуклеотидных зондов (Cronin et al., Hum Mutat, 7(3): 244-55 (1996) (или другие способы анализа SNP, описанные в настоящем документе), но не ограничиваясь этим. Например, генетические мутации могут быть определены с использованием микрочипов (Shen et al., Mutat Res,573(l-2): 70-82 (2005))). Генетические тесты используются для стратификации популяции индивидуумов на субпопуляции, по-разному отвечающие на лечение антителами против Abeta.
Термин «генотипирование», использованный в настоящем документе, относится к способам выявления различий в генетическом строении («генотип») индивидуума, включая обнаружение наличия вставок или делеций ДНК, полиморфизмов (SNP или другие), аллелей (в том числе минорных, или основных аллелей, или аллелей риска в форме SNP путем изучения последовательности ДНК индивидуума с использованием аналитических или биологических анализов (или других способов анализа SNP, описанных в настоящем документе)), но не ограничиваясь этим. Например, последовательность ДНК индивидуума, полученную путем секвенирования или с использованием других технологий (например, других способов анализа SNP, описанных в настоящем документе), можно сравнить с последовательностью ДНК другого индивидуума или последовательностью ДНК сравнения. Способы генотипирования обычно известны в данной области техники (например, другие способы анализа SNP, описанные в настоящем документе) и включают определение полиморфизма длины рестрикционных фрагментов (RFLP) геномной ДНК, обнаружение полиморфизма случайно амплифицированной (RAPD) геномной ДНК, обнаружение полиморфизма длины амплифицированных фрагментов (AFLPD), полимеразную цепную реакцию (PCR), секвенирование ДНК, аллель-специфические олигонуклеотидные (ASO) зонды и гибридизацию на ДНК-микрочипе или шариках, но не ограничиваясь этим. Аналогичным образом эти методы могут быть применены для анализа транскриптов, которые кодируют SNP, или других генетических факторов. Образцы могут быть легко проанализированы на наличие SNP с использованием полимеразной цепной реакции (PCR), анализа гибридизации или с использованием ДНК-микрочипов на SNP, являющихся коммерчески доступными, включая анализ на ДНК-микрочипах. Анализ на микрочипах может быть использован для определения наличия или отсутствия SNP в образце нуклеиновой кислоты. Микрочип может включать олигонуклеотиды, и способы создания и использования олигонуклеотидных микрочипов, подходящих для диагностического применения, раскрыты в патентах США номер 5,492,806; 5,525,464; 5,589, 330; 5,695,940; 5,849,483; 6,018,041; 6,045,996; 6,136,541; 6,152,681; 6,156, 501; 6,197,506; 6,223,127; 6,225,625; 6,229, 911; 6,239,273; WO 00/52625; WO 01/25485 и WO 01/29259.
В некоторых вариантах воплощения генотипирование может быть использовано клиническими врачами для назначения соответствующего лечения тем индивидуумам, которые в большей степени нуждаются в нем. Например, субъектов в исследовании генотипируют и распределяют на (1) популяцию, которая благоприятно отвечает на лечение, и (2) популяцию, которая заметно не отвечает на лечение, и (3) популяцию, которая неблагоприятно отвечает на лечение. На основе этих результатов субъектов генотипируют для предсказания, будет ли субъект отвечать на лечение благоприятно или неблагоприятно. Потенциальные участники клинического исследования варианта лечения могут быть подвергнуты скринингу для определения тех участников, которые с высокой вероятностью будут благоприятно отвечать на лечение. Таким образом, эффективность лечения лекарственным средством может быть измерена у индивидуума, который положительно отвечает на лекарственное средство. Таким образом, один из вариантов воплощения представляет собой способ выбора индивидуума для включения в клиническое исследование варианта лечения, включающий стадии: (а) получения образца нуклеиновой кислоты из индивидуума, (b) определения наличия полиморфного варианта, который ассоциирован с положительным ответом на лечение, или полиморфного варианта, который ассоциирован с отсутствием ответа на лечение или сниженным ответом на лечение. В другом варианте воплощения изобретение включает способ выбора индивидуума для лечения, включающий стадии: (а) получения образца нуклеиновой кислоты из индивидуума, (b) определения наличия полиморфного варианта, который ассоциирован с положительным ответом на лечение, и (с) лечения индивидуума путем введения лекарственного средства.
Термин «аллель-специфический праймер» или «AS праймер» относится к праймеру, который гибридизуется с более чем одним вариантом целевой последовательности, но при этом праймер эффективно удлиняется полимеразой нуклеиновых кислот только с одним из вариантов, тем самым позволяя различить варианты целевой последовательности между собой. В случае других вариантов целевой последовательности удлинение менее эффективно или неэффективно. Когда удлинение менее эффективно или неэффективно, образуется сигнал значительно меньшей интенсивности или, преимущественно, с интенсивностью ниже предела обнаружения.
Термин «аллель-специфический зонд» или «AS зонд» относится к зонду, который гибридизуется с более чем одним вариантом целевой последовательности, но только с одним из вариантов дает обнаруживаемый сигнал, тем самым позволяя различить варианты целевой последовательности между собой. В случае других вариантов целевой последовательности образуется сигнал значительно меньшей интенсивности или, преимущественно, сигнал с интенсивностью ниже предела обнаружения.
Термин «первичная последовательность» относится к последовательности нуклеотидов в полинуклеотиде или олигонуклеотиде. Модификации нуклеотидов, такие как модификации азотистых оснований, модификации сахара или другие модификации остова не являются частью первичной последовательности. Метки, такие как хромофоры, конъюгированные с олигонуклеотидами, также не являются частью первичной последовательности. Таким образом, два олигонуклеотида могут иметь одинаковую первичную последовательность, но отличаться модификациями и метками.
«Жесткость» реакции гибридизации легко определяется специалистом в данной области техники и обычно вычисляется эмпирическим путем в зависимости от длины зонда, температуры отмывки и концетрации соли. В целом, для надлежащего отжига более длинных зондов нужны более высокие температуры, тогда как для отжига более коротких праймеров нужны более низкие температуры. Гибридизация обычно зависит от способности денатурированной ДНК вторично отжигаться, когда комплементарные цепи присутствуют в среде при температуре ниже их температуры плавления. Чем выше степень желаемой гомологии меду зондом и гибридизуемой последовательностью, тем выше относительная температура, которую можно использовать. В результате, отсюда следует, что более высокие относительные температуры будут характеризовать условия реакции как более жесткие, в то кремя как более низкие темпетатуры будут характеризовать условия реакции как менее жесткие. Дополнительные подробности и объяснения жесткости реакций гибридизации можно найти в Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers, (1995).
«Жесткие условия» или «условия высокой жесткости» в соответствии с определением, приведенным в настоящем документе, могут быть следующими: (1) использование низкой ионной силы и высокой температуры для отмывки, например, 0,015 М хлорид натрия / 0,0015 М цитрат натрия / 0,1% додецилсульфат натрия при 50°С; (2) использование в процессе гибридизации денатурирующего агента, такого как формамид, например, 50% (объем/объем) формамид с 0,1% бычьим сывороточным альбумином / 0,1% Фиколлом / 0,1% поливинилпирролидоном / 50 мМ натрий-фосфатным буфером при рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С; или (3) гибридизация в течение ночи в растворе с 50% формамидом, 5 × SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфатом натрия (рН 6,8), 0,1% пирофосфатом натрия, 5 × раствором Денхардта, фрагментированной ультразвуком ДНК из молок лососевых (50 мкг/мл), 0,1% SDS и 10% сульфатом декстрана при 42°С, с 10 минутной отмывкой при 42°С в 0,2 × SSC (хлорид натрия/цитрат натрия) с последующей 10 минутной отмывкой в условиях высокой жесткости 0,1 × SSC, содержащим ЭДТА, при 55°С.
«Умеренно жесткие условия» могут быть определены, как это описано в Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989, и включают использование менее жесткого отмывочного раствора и условий гибридизации (например, температура, ионная сила и % SDS) по сравнению с описанными ранее в настоящем документе. Примером умеренно жестких условий является инкубация в течение ночи при 37°С в растворе, содержащим: 20%) формамид, 5 × SSC (150 мМ NaCl, 15 мМ цитрат натрия трехзамещенный), 50 мМ фосфат натрия (рН 7,6), 5 × расвтор Денхардта, 10% сульфат декстрана и 20 мг/мкл фрагментированной ультразвуком ДНК из молок лососевых, с последующей отмывкой фильтров в 1 × SSC при примерно 37-50°С. Специалисту в данной области техники будет понятно, как регулировать температуру, ионную силу и т.д, если это необходимо для приспобления к таким факторам как длина зонда и тому подобное.
Термины «аффинность» или «аффинность связывания» относятся к силе суммы всех нековалентных взаимодействий между одним участком связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иное, использованный в настоящем документе термин «аффинность связывания» относится к истинной аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X к своему партнеру Y можно представить в виде константы диссоциации (Kd). Аффинность можно измерить обычными способами, известными в данной области техники, в том числе способами, которые описаны в настоящем документе, любые из которых могут быть использованы для целей настоящего изобретения. Конкретные иллюстративные примеры вариантов воплощения для измерения аффинности связывания описаны в настоящем документе.
Термин антитело «с созревшей аффинностью» относится к антителу с одним или несколькими изменениями в одной или нескольких гипервариабельных областях (HVR) по сравнению с исходным антителом, которое не имеет таких изменений, где такие изменения приводят к улучшению аффинности антитела в отношении антигена.
Использованный в настоящем документе термин «пациент» относится к любому отдельному субъекту, для которого лечение является желательным. В некоторых вариантах воплощения паицентом в настоящем документе является человек.
«Субъектом» в настоящем документе обычно является человек. В некоторых вариантах воплощения субъектом является млекопитающее, не относящееся к человеку. Примеры млекопитающих, не относящихся к человеку, включают лабораторных, одомашенных, домашних, спортивных и сельскохозяйственных животных, например, мышей, кошек, собак, лошадей и коров. Как правило, субъект имеет показания для лечения, например, у него наблюдаются один или несколько признаков заболевания. Обычно, такой субъект или пациент имеет показания для лечения амилоидоза, например, AD. В одном из вариантов воплощения таким субъектом или пациентом является субъект или пациент, у которого наблюдаются или наблюдались один или несколько признаков, симптомов или других показателей AD, или у которого была диагностирован AD, например, AD была диагностирована впервые, или была диагностирована ранее, или был установлен риск развития AD. Диагностика AD может быть осуществлена на основе клинической истории, клинического обследования и установленных методов визуализации. «Пациент» или «субъект» в настоящем документе включает любого отдельного человеческого субъекта, который имеет показания для лечения и у которого наблюдаются или наблюдались один или несколько признаков, симптомов или других показателей AD. Термин «субъект» охватывает также любых субъектов, участвующих в клинических исследованиях, или субъектов, участвующих в эпидемиологических исследованиях, или субъектов, которые однажды выступали в качестве контрольных субъектов. Субъект мог ранее подвергаться лечению антителом против Abeta или его антигенсвязывающим фрагментом или другим лекарственным средством или мог не подвергаться такому лечению. Субъект может быть «наивным» в отношении дополнительного лекарственного средства (лекарственных средств), когда начинается лечение в соответствии с настоящим документом, т.е. субъект мог ранее не подвергаться, например, терапии, отличной от терапии антителами против Abeta, на «момент начала лечения» (т.е. в заданный момент времени до введения первой дозы антитела против Abeta в способе лечения в соответствии с настоящим документом, например, в день скрининга субъекта до начала лечения). Такие «наивные» субъекты обычно считаются кандидатами для лечения таким дополнительным лекарственным средством (лекарственными средствами).
Использованный в настоящем документе термин «продолжительность жизни» субъекта относится к оставшейся части жизни субъекта после начала лечения.
Термин «моноклональное антитело», использованный в настоящем документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигена. Более того, в отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене.
Моноклональные антитела в настоящем документе включают, в частности, «химерные» антитела, в которых часть тяжелой цепи и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих к конкретному классу или подклассу антител, тогда как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они обладают желаемой биологической активностью (патент США номер 4,816,567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)).
Термин «класс» антитела относится к типу константного домена или константной области тяжелой цепи антитела. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы («изотипы»), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно.
«Гуманизированные» формы не человеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из не человеческого иммуноглобулина. В большинстве случаев, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из гипервариабельной области реципиента замещены на остатки из гипервариабельной области антител видов, не относящихся к человеку (донорное антитело), таких как мышь, крыса, кролик или примат, не относящийся к человеку, имеющие желаемую специфичность, аффинность и емкость. В некоторых случаях, остатки каркасной области (FR) человеческого иммуноглобулина замещены на соответствующие не человеческие остатки. Более того, гуманизированные антитела могут включать остатки, которые отсутствуют в реципиентном или в донорном антителе. Эти модификации сделаны для дальнейшего улучшения активности антитела. В общем, гуманизированное антитело будет содержать по существу все из, по меньшей мере, одного и, как правило, двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют таковым из нечеловеческого иммуноглобулина, а все или по существу все FR представляют собой последовательности иммуноглобулина человека. Гуманизированное антитело необязательно будет также включать, по меньшей мере, часть константной области иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. Дополнительную информацию смотрите в Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992). Смотрите также следующие обзорные статьи и ссылки, приведенные в них: Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1: 105-115 (1998); Harris, Biochem. Soc. Transactions 23: 1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5: 428-433 (1994).
«Человеческое антитело» представляет собой антитело, которое включает аминокислотную последовательность, соответствующую таковой в антителе, продуцируемом человеком или человеческой клеткой, и/или которое было получено из не человеческого источника, использующего репертуары человеческих антител или другие человеческие последовательности, кодирующие антитела, например, которое было создано с использованием любых методов создания человеческих антител, как раскрыто в настоящем документе. Такие методы включают скрининг комбинаторных библиотек, полученных из человека, таких как библиотеки фагового дисплея (смотрите, например, Marks et al., J. Mol. Biol, 222: 581-597 (1991) и Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991)); использование клеточных линий человеческой миеломы и мышиной-человеческой гетеромиеломы для получения человеческих моноклональных антител (смотрите, например, Kozbor J. Immunol, 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 55-93 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol, 147: 86 (1991)); и получение моноклональных антител в трансгенных животных (например, мышах), которые способны продуцировать полный репертуар человеческих антител в отсутствие продукции эндогенных иммуноглобулинов (смотрите, например, Jakobovits et al., Proc. Natl. Acad. Sci USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255 (1993); Bruggermann et al., Year in Immunol, 7: 33 (1993)), но не ограничиваясь этим. Это определение человеческого антитела специально исключает гуманизированное антитело, включающее антигенсвязывающие остатки из животного, не относящегося к человеку.
«Выделенное» антитело представляет собой такое антитело, которое было идентифицировано и выделено и/или очищено от компонентов его природной среды. Загрязняющие компоненты его природной среды представляют собой вещества, которые будут мешать диагностическим или терапевтическим применениям антитела и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах воплощения антитело очищено до степени чистоты выше 95% или 99%, определенной, например, электрофоретическим методом (например, SDS-PAGE, изоэлектрическое фокусирование (IEF), капиллярный электрофорез) или хроматографическим методом (например, ионообменной или обращено-фазовой HPLC). Обзор способов оценки чистоты антитела можно найти, например, в Flatman et al., J. Chromatogr. В 848: 79-87 (2007).
Термины «вариабельная область» или «вариабельный домен» относятся к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют аналогичные структуры, где каждый домен включает четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR). (Смотрите, например, Kindt et al Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007)). Одного домена VH или VL может быть достаточно для обеспечения антигенсвязывающей специфичности. Более того, антитела, которые связываются с конкретным антигеном, могут быть выделены с использованием домена VH или VL из антитела, связывающегося с антигеном, для скрининга библиотеки комплементарных доменов VL или VH, соответственно. Смотрите, например, Portolano et al., J. Immunol. 150: 880-887 (1993); Clarkson et al., Nature 352: 624-628 (1991).
Термин «гипервариабельная область», «HVR» или «HV», использованный в настоящем документе, относятся к областям вариабельного домена антитела, являющимся гипервариабельными в последовательности и/или образующим структурно определяемые петли. Обычно, антитела включают шесть гипервариабельных областей; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). Используется ряд способов разграничения гипервариабельных областей, и они включены в настоящий документ. Номенклатура Kabat для определяющих комплементарность областей (CDR) основана на вариабельности последовательности и является наиболее часто используемой (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Номенклатура Chothia относится вместо этого к расположению структурных петель (Chothia and Lesk J. Mol. Biol. 196: 901-917 (1987)). Номенклатура AbM для гипервариабельных областей представляет собой компромисс между Kabat для CDR и Chothia для структурных петель и используется программным обеспечением для моделирования антител Oxford Molecular's AbM. Выделение области «Contact» гипервариабельных областей основано на анализе имеющихся кристаллических структур комплекса. Остатки для каждого из этих HVR приведены ниже.
Гипервариабельные области могут включать следующие «удлиненные гипервариабельные области»: 24-36 или 24-34 (L1), 46-56, или 49-56, или 50-56, или 52-56 (L2) и 89-97 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3) в VH. Остатки вариабельного домена нумеруются в соответствии с Kabat et al., см. выше, для каждого из этих определений.
«Каркасные» или «FR» остатки представляют собой остатки вариабельного домена, отличные от остатков гипервариабельной области, как это определено в настоящем документе. FR вариабельного домена обычно состоят из четырех FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно встречаются в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
«Акцепторная человеческая каркасная область» для целей настоящего документа представляет собой каркасную область, включающую аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), полученную из каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, определение которой дано ниже. Акцепторная человеческая каркасная область, «полученная из» каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, может иметь такую же аминокислотную последовательность или может содержать изменения в аминокислотной последовательности. В некоторых вариантах воплощения число аминокислотных изменений равно 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше или 2 или меньше. В некоторых вариантах воплощения акцепторная человеческая каркасная область VL идентична по последовательности каркасной области VL человеческого иммуноглобулина или последовательности человеческой консенсусной каркасной области.
«Человеческая консенсусная каркасная область» представляет собой каркасную область, в которой представлены наиболее часто встречающиеся аминокислотные остатки, если выбирать из последовательностей карскасных областей VL или VH человеческого иммуноглоублина. Обычно, последовательности VL или VH человеческого иммуноглобулина выбирают из подгруппы последовательностей вариабельного домена. Обычно, подгруппа последовательностей представляет собой подгруппу, как описано в Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3.
Термин «связанные с амилоидом аномалии, диагностируемые с помощью методов визуализации, - отек» или «ARIA-Е» включает церебральный вазогенный отек и бороздковый экссудат.
Термин «связанные с амилоидом аномалии, диагностируемые с помощью методов визуализации, - геморрагия» или «ARIA-Н» включает микрогеморрагию и поверхностный сидероз центральной нервной системы.
Термины «носитель аполипопротеина Е4» или «носитель АроЕ4» и «с положительным статусом по аполипопротеину Е4» или «с положительным статусом по АроЕ4» используются в настоящем документе взаимозаменяемо и относятся к индивидууму, имеющему, по меньшей мере, один аллель гена аполипопротеина Е4 (или «АроЕ4»). Индивидуум, у которого нет аллелей АроЕ4, называется в настоящем документе «с отрицательным статусом по АроЕ4» или «не является носителем АроЕ4». Смотрите также Prekumar, et al., 1996, Am. J Pathol. 148: 2083-95.
Термин «церебральный вазогенный отек» относится к избыточному накоплению внутрисосудистой жидкости или белка во внутриклеточных или внеклеточных пространствах головного мозга. Церебральный вазогенный отек удается обнаружить, например, с помощью MRI головного мозга, в том числе FLAIR MRI, но не ограничиваясь этим, также он может быть асимптоматичным («асимптоматичный вазогенный отек») или может быть ассоциирован с неврологическими симптомами, такими как спутанность сознания, головокружение, рвота и сонливость («симптоматический вазогенный отек») (смотрите Sperling et al. Alzheimer's & Dementia, 7: 367, 2011).
Термин «церебральная макрогеморрагия» относится к внутричерепному кровоизлиянию (геморрагии) или кровотечению в головном мозге в области, диаметр которой больше примерно 1 см. Церебральную макрогеморрагию удается обнаружить, например, с помощью MRI головного мозга, в том числе Т2*-взвешенной GRE MRI, но не ограничиваясь этим, также она может быть асимптоматичной («асимптоматичная макрогеморрагия») или может быть ассоциирована с симптомами, такими как временные или необратимые фокальные моторные или сенсорные нарушения, атаксия, афазия и дизартрия («симптоматичная макрогеморрагия») (смотрите, например, Chalela JA, Gomes J. Expert Rev. Neurother. 2004 4: 267, 2004 и Sperling et al. Alzheimer's & Dementia, 7: 367, 2011).
Термин «церебральная микрогеморрагия» относится к внутричерепному кровоизлиянию (геморрагии) или кровотечению в головном мозге в области, диаметр которой меньше примерно 1 см. Церебральную микрогеморрагию удается обнаружить, например, с помощью MRI головного мозга, в том числе Т2*-взвешенной GRE MRI, но не ограничиваясь этим, также она может быть асимптоматичной («асимптоматичная микрогеморрагия») или потенциально может быть ассоциирована с симптомами, такими как временные или необратимые фокальные моторные или сенсорные нарушения, атаксия, афазия и дизартрия («симптоматичная макрогеморрагия»). Смотрите, например, Greenberg, et al., 2009, Lancet Neurol. 8: 165-74.
Термин «бороздковый экссудат» относится к выпоту (экссудату) жидкости в борозды или бороздки головного мозга. Бороздковый экссудат удается обнаружить, например, с помощью MRI головного мозга, в том числе FLAIR MRI, но не ограничиваясь этим. Смотрите Sperling et al. Alzheimer's & Dementia, 7: 367, 2011.
Термин «поверхностный сидероз центральной нервной системы» относится к кровотечению или кровоизлиянию (геморрагии) в субарахноидальное пространство головного мозга, которое удается обнаружить, например, с помощью MRI головного мозга, в том числе Т2*-взвешенной GRE MRI, но не ограничиваясь этим. Симптомы, свидетельствующие о поверхностном сидерозе центральной нервной системы, включают нейросенсорную глухоту, мозжечковую атаксию и пирамидные симптомы. Смотрите Kumara-N, Am J Neuroradiol. 31: 5, 2010.
Термин «прогрессирование», использованный в настоящем документе, относится к ухудшению заболевания с течением времени. Термины «скорость прогрессирования» или «скорость прогрессии» заболевания относятся к тому, как быстро или медленно развивается заболевание с течением времени у пациента, у которого диагностировано это заболевание. Скорость прогрессирования заболевания может быть выражена в измеряемых изменениях с течением времени конкретных характеристик заболевания. Говорят, что пациент, имеющий конкретный генетический признак, имеет «повышенную скорость прогрессирования» или с большей вероятностью имеет «повышенную скорость прогрессирования», если стадия его заболевания прогрессирует быстрее по сравнению с пациентами, не имеющими такого генетического признака. С другой стороны, говорят, что пациент, отвечающий на терапию, имеет «пониженную скорость прогрессирования» или с большей вероятностью имеет «пониженную скорость прогрессирования», если прогрессирование заболевания замедляется после терапии по сравнению со стадией заболевания до лечения или другими пациентами, не подвергнутыми лечению.
Фраза «с более высокой вероятностью будет отвечать», использованная в настоящем документе, относится к пациентам, у которых с высокой вероятностью будет наблюдаться замедление или предотвращение прогрессирования амилоидоза, например, AD. В отношении AD фраза «с более высокой вероятностью будет отвечать» относится к пациентам, у которых с высокой вероятностью будет наблюдаться замедление потери функциональных или когнитивных способностей в ходе лечения. Фраза «отвечающий на» в контексте настоящего изобретения указывается на то, что у пациента, страдающего от расстройства, или пациента с подозрением на расстройством, или пациента, склонного к расстройству, или у пациента с диагностированным расстройством, как описано в настоящем документе, наблюдается ответ на лечение антителами против Abeta.
Фраза «выбор пациента» или «определение пациента», использованная в настоящем документе, относится к использованию полученной информации или данных о наличии аллеля в образце, полученном из пациента, для определения или выбора пациента, который с большей вероятностью будет получать пользу от лечения, включающего антитело против Abeta. Информация или данные могут использоваться или могут быть получены в любой форме, письменной, устной или электронной. В некоторых вариантах воплощения использование полученной информации или данных включает общение, презентации, отчеты, хранение, отсылку, передачу, обеспечение, распространение, распределение или их комбинации. В некоторых вариантах воплощения общение, презентации, отчеты, хранение, отсылку, передачу, обеспечение, распространение, распределение или их комбинации осуществляют с помощью компьютерного устройства, блока анализатора или их комбинации. В некоторых других вариантах воплощения общение, презентации, отчеты, хранение, отсылку, передачу, обеспечение, распространение, распределение или их комбинации проводит лабраторный или медицинский специалист. В некоторых вариантах воплощения информация или данные включают указание, что специфический аллель присутствует или отсутствует в образце. В некоторых вариантах воплощения информация или данные включают указание, что пациент с большей вероятностью будет отвечать на терапию, включающую антитело против Abeta.
Термин «эффекторные функции» относится к тем биологическим активностям, которые связаны с Fc областью антитела, которая варьирует в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают связывание C1q и комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора); и активацию В клеток. В данной области техники известно, что антитела IgG4 дикого типа обладают более слабыми эффекторными функциями по сравнению с антителами IgG1 дикого типа.
Термин «Fc область» используется в настоящем документе для обозначения С-концевой области тяжелой цепи иммуноглобулина, которая содержит, по меньшей мере, часть константной области. Термин включает нативную последовательность Fc области и варианты Fc области. В одном из вариантов воплощения Fc область тяжелой цепи человеческого IgG начинаетмя с Cys226 или с Pro230 и продолжается до карбоксильного конца тяжелой цепи. Тем не менее, С-концевой лизин (Lys447) Fc области может присутствовать, а может не присутствовать. Если не указано иное, нумерация аминокислотных остатков в Fc области или константной области соответствует системе нумерации EU, также называемой EU индекс, описанной в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Термины «полноразмерное антитело», «интактное антитело» и «целое антитело» используются в настоящем документе взаимозаменяемо для обозначения антитела, имеющего структуру, по существу аналогичную структуре нативного антитела, или имеющего тяжелые цепи, содержащие Fc область, как определено в настоящем документе.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомков таких клеток. Клетки-хозяева включают «трансформантов» и «трансформированные клетки», которые включают первичную трансформированную клетку и ее потомков, независимо от числа пассажей. Состав нуклеиновой кислоты потомков может не быть полностью идентичным составу нуклеиновой кислоты исходной клетки, а может содержать мутации. Мутантные потомки, имеющие те же функции или биологическую активность, на которые производился скрининг или по которым были выбраны исходные трансформированные клетки, включены в настоящий документ.
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или несколькими гетерологичными молекулами, включая другой терапевтический агент, но не ограничиваясь этим.
«Выделенная» нуклеиновая кислота относится к молекуле нуклеиновой кислоты, которая была отделена от компонента ее природной среды. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует экстрахромосомно или расположена на хромосоме в другом месте, отличающемся от ее природного месторасположения на хромосоме.
«Выделенная нуклеиновая кислота, кодирующая антитело против Abeta», относится к одной или нескольким молекулам нуклеиновой кислоты, кодирующим тяжелую и легкую цепи антитела (или их фрагменты), включая такую молекулу нуклеиновой кислоты (молекулы нуклеиновой кислоты) в одном векторе или в отдельных векторах, и такую молекулу нуклеиновой кислоты (молекулы нуклеиновой кислоты), присутствующую (присутствующие) в одном или нескольких местах в клетке-хозяине.
Термин «ранняя болезнь Альцгеймера» или «ранняя AD», использованный в настоящем документе (например, «пациент с диагностированной ранней AD» или «пациент, страдающий от ранней AD»), включает пациентов с умеренными когнитивными нарушениями, такими как дефицит памяти, вследствие AD, и пациентов, у которых обнаруживаются биомаркеры AD, например, пациентов, положительных по амилоиду.
Термин «легкая болезнь Альцгеймера» или «легкая AD», использованный в настоящем документе (например, «пациент с диагностированной легкой AD»), относится к стадии AD, которой соответствуют 20-26 баллов по шкале MMSE.
Термин «болезнь Альцгеймера от легкой до умеренной» или «AD от легкой до умеренной», использованный в настоящем документе, включает как легкую, так и умеренную AD и относится к стадии AD, которой соответствуют 18-26 баллов по шкале MMSE.
Термин «умеренная болезнь Альцгеймера» или «умеренная AD», использованный в настоящем документе (например, «пациент с диагностированной умеренной AD»), относится к стадии AD, которой соответствуют 18-19 баллов по шкале MMSE.
Термин «голое антитело» относится к антителу, которое не конъюгировано с гетерологичным фрагментом (например, другой терапевтический фрагмент) или радиоактивной меткой. Голое антитело может быть представлено в фармацевтической композиции.
Термин «нативные антитела» относится к встречающимся в природе молекулам иммуноглобулинов, имеющих различные структуры. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые соединены между собой дисульфидными связями. В направлении от N- к С-концу каждая тяжелая цепь содержит вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следуют три константных домена тяжелой цепи (CH1, СН2 и СН3). Аналогично, в направлении от N- к С-концу каждая легкая цепь содержит вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL). Легкая цепь антитела может принадлежать к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности своего константного домена.
Термин «вкладыш в упаковку», использованный в настоящем документе, относится к инструкциям, обычно включенным в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предостережениях, касающихся применения таких терапевтических продуктов. Термин «вкладыш в упаковку» также относится в настоящем документе к инструкциям, обычно включенным в коммерческие упаковки диагностических продуктов, которые содержат информацию о предполагаемом применении, принципе проведения тестирования, приготовлении и работе с реагентами, сборе и подготовке образцов, калибровке анализа и процедуры анализа, производительности и точности данных, например, о чувствительности и специфичности анализа.
«Процент идентичности аминокислотных последовательностей» относительно последовательности полипептида сравнения определяют как процент аминокислотных остатков в исследуемой последовательности, идентичных аминокислотным остаткам в последовательности полипептида сравнения, после выравнивания последовательнотей и введения разрывов, если необходимо, чтобы достичь максимального процента идентичности последовательностей, и без учета любых консервативных замен как части идентичности последовательностей. Выравнивание с целью определения процента идентичности аминокислотных последовательностей можно осуществить разными способами, что находится в пределах компетентности специалиста в данной области техники, например, используя общедоступное программное обеспечение, такое как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей настоящего документа, тем не менее, значения % идентичности аминокислотных последовательностей получают, используя компьютерную программу для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 разработана Genentech, Inc., и программный код был подан с документацией пользователя в Бюро регистрации авторских прав США, Washington D.C., 20559, где был зарегистрирован под регистрационным номером TXU510087. Программа ALIGN-2 является общедоступной от Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть скомпилирована из программного кода. Программа ALIGN-2 должна быть установлена для пользования на операционную систему UNIX, в том числе цифровую UNIX V4.0D. Все параметры сравнения последовательностей утсанавливаются программой ALIGN-2 и не изменяются.
В случаях, когда ALIGN-2 используется для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей данной аминокислотной последовательности А относительно данной аминокислотной последовательности В, по сравнению с данной аминокислотной последовательностью В или против данной аминокислотной последовательности В (альтернативно можно сформулировать так: данная аминокислотная последовательность А, которая имеет или обладает некоторым % идентичности аминокислотных последовательностей относительно данной аминокислотной последовательности В, по сравнению с данной аминокислотной последовательностью В или против данной аминокислотной последовательности В) рассчитывается следующим образом:
100 умножить на отношение (X/Y)
где X представляет собой число аминокислотных остатков, определенных программой для выравнивания ALIGN-2 как идентичные совпадения при выравнивании А и В, и где Y представляет собой общее число аминокислотных остатков в B. Следует учитывать, что, если длина аминокислотной последовательности А не совпадает с длиной аминокислотной последовательности В, то % идентичности аминокислотных последовательностей А и В не будет совпадать с % аминокислотных последовательностей В и А. Если специально не указано иное, все значения % идентичности аминокислотных последовательностей, приведенные в настоящем документе, получены, как описано в предшествующем параграфе с использованием компьютерной программы ALIGN-2.
Термин «фармацевтическая композиция» относится к препарату в такой форме, которая обеспечивает эффективную биологическую активность активного ингредиента, содержащегося в нем, и который не содержит дополнительных компонентов, являющихся неприемлемо токсичными для субъекта, которому будут вводить композицию.
Термин «фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает буфер, эксципиент, стабилизатор или консервант, но не ограничиваясь этим.
Термин «вектор», использованный в настоящем документе, относится к молекуле нуклеиновой кислоты, способной воспроизводить другую нуклеиновую кислоту, с которой она связана. Термин включает вектор как самореплицирующуюся структуру нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называются в настоящем документе «экспрессирующими векторами».
«Визуализирующий агент» представляет собой соединение, которое обладает одним или несколькими свойствами, которые можно обнаруживать напрямую или не напрямую для определения его наличия и/или расположения. Примеры таких визуализирующих агентов включают белки и низкомолекулярные соединения, включающие меченый фрагмент, который может быть обнаружен.
«Метка» представляет собой маркер, соединенный с молекулой, используемой для обнаружения или визуализации. Примеры таких меток включают радиоактивную метку, флуорофор, хромофор или аффинную метку. В одном из вариантов воплощения метка представляет собой радиоактивную метку, используемую для визуализации в медицине, например, Tc99m или I123, или спиновую метку для визуализации с помощью ядерного магнитного резонанса (ЯМР) (также называется визуализацией с помощью магнитного резонанса, MRI), такую как йод-123, йод-131, йод-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец, железо и т.п.
СПОСОБЫ И КОМПОЗИЦИИ
Настоящее раскрытие предусматривает композиции и способы лечения, прогнозирования, выбора и/или определения пациентов, имеющих риск возникновения амилоидоза, в том числе AD, которые будут хорошими кандидатами для лечения антителами против Abeta. В одном аспекте изобретение основано, частично, на улучшенных способах лечения.
В некоторых вариантах воплощения предусмотрены антитела, которые связываются с Abeta. Антитела по настоящему изобретению используют, например, для диагностики или лечения болезни Альцгеймера («AD») и других заболеваний.
Примеры антител
В одном из аспектов изобретение предусматривает выделенные антитела, которые связываются с Abeta. В некоторых вариантах воплощения изобретение предусматривает антитело против Abeta, которое связывается с мономерными, олигомерными и фибриллярными формами человеческого Abeta с хорошей аффинностью. В одном из вариантов воплощения антитело против Abeta представляет собой антитело, которое связывается с эпитопом Abeta в пределах остатков 13-24 в Abeta. В одном из таких вариантов воплощения антитело представляет собой кренезумаб.
В одном из вариантов воплощения антитело включает аминокислотную последовательность тяжелой цепи, приведенную в SEQ ID NO: 5, и аминокислотную последовательность легкой цепи, приведенную в SEQ ID NO: 9. В другом варианте воплощения антитело включает аминокислоты 1-112 вариабельной области тяжелой цепи из аминокислотной последовательности, приведенной в SEQ ID NO: 5, аминокислоты 1-112 вариабельной области легкой цепи из аминокислотной последовательности, приведенной в SEQ ID NO: 9. В другом варианте воплощения антитело включает последовательности HVR из SEQ ID NO: 5 и SEQ ID NO: 9. В другом варианте воплощения антитело включает последовательности HVR, которые имеют 95%, 96%, 97%, 98% или 99% идентичности последовательностей с последовательностями HVR из SEQ ID NO: 5 и SEQ ID NO: 9.
В любом из указанных выше вариантов воплощения антитело против Abeta является гуманизированным. В одном из вариантов воплощения антитело против Abeta включает HVR в соответствии с любыми из указанных выше вариантов воплощения и также включает акцепторную человеческую каркасную область, например каркасную область человеческого иммуноглобулина или человеческую консенсусную каркасную область.
В другом аспекте антитело против Abeta включает последовательность вариабельного домена тяжелой цепи (VH), имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательностей с аминокислотами 1-112 в аминокислотной последовательности SEQ ID NO: 5. В некоторых вариантах воплощения последовательность VH, имеющая, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательностей, содержит замены (например, консервативные замены), вставки или делеции по сравнению с последовательностью сравнения, но антитело против Abeta, включающее эту последовательность, сохраняет способность связываться с Abeta. В некоторых вариантах воплощения всего от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 5. В некоторых вариантах воплощения замены, вставки или делеции присутствуют в областях за пределами HVR (т.е. в FR). Необязательно, антитело против Abeta включает последовательность VH из SEQ ID NO: 5, включая посттрансляционные модификации этой последовательности.
В другом аспекте предусмотрено антитело против Abeta, где антитело включает последовательность вариабельного домена легкой цепи (VL), имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательностей с аминокислотами 1-112 в аминокислотной последовательности SEQ ID NO: 9. В некоторых вариантах воплощения последовательность VL, имеющая, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательностей, содержит замены (например, консервативные замены), вставки или делеции по сравнению с последовательностью сравнения, но антитело против Abeta, включающее эту последовательность, сохраняет способность связываться с Abeta. В некоторых вариантах воплощения всего от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 9. В некоторых вариантах воплощения замены, вставки или делеции присутствуют в областях за пределами HVR (т.е. в FR). Необязательно, антитело против Abeta включает последовательность VL из SEQ ID NO: 9, включая посттрансляционные модификации этой последовательности.
В другом аспекте предусмотрено антитело против Abeta, где антитело включает VH в соответствии с любым из приведенных выше вариантов воплощения и VL в соответствии с любым из приведенных выше вариантов воплощения.
В еще одном аспекте изобретение предусматривает антитело, которое связывается с тем же самым эпитопом, что и предусмотренное в настоящем документе антитело против Abeta. Например, в некоторых вариантах воплощения предусмотрено антитело, которое связывается с тем же самым эпитопом, что и антитело против Abeta, включающее последовательность VH из SEQ ID NO: 5 и последовательность VL из SEQ ID NO: 9.
В еще одном аспекте настоящего изобретения антитело против Abeta в соответствии с любым из приведенных выше вариантов воплощения представляет собой моноклональное антитело, включая химерное, гуманизированное или человеческое антитело. В одном из вариантов воплощения антитело против Abeta представляет собой фрагмент антитела, например, фрагмент Fv, Fab, Fab', scFv, диатело или F(ab')2. В другом варианте воплощения антитело представляет собой полноразмерное антитело, например, интактное антитело IgG4 или антитело другого класса или изотипа, в соответствии с определением, данным в настоящем документе. В другом варианте воплощения антитело представляет собой биспецифическое антитело.
В еще одном аспекте антитело против Abeta в соответствии с любым из приведенных выше вариантов воплощения может включать любые признаки, по отдельности или в комбинации, как описано в Разделах 1-7 ниже.
В одном из вариантов воплощения антитело против Abeta включает HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 6; HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 7; HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 8; HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 2; HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 3; и HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 4.
В другом варианте воплощения антитело включает последовательности тяжелой и легкой цепей SEQ ID NO: 5 и SEQ ID NO: 9.
В другом варианте воплощения антитело включает последовательности вариабельной области из SEQ ID NO: 5 и SEQ ID NO: 9.
В любом из указанных выше вариантов воплощения антитело против Abeta может быть гуманизированным. В одном из вариантов воплощения антитело против Abeta включает HVR в соответствии с любыми из указанных выше вариантов воплощения и также включает акцепторную человеческую каркасную область, например каркасную область человеческого иммуноглобулина или человеческую консенсусную каркасную область.
1. Аффинность антитела
В некоторых вариантах воплощения предусмотренное в настоящем документе антитело имеет константу диссоциации (Kd), составляющую ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или меньше, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
В одном из вариантов воплощения Kd измеряют с помощью анализа связывания радиоактивно меченого антигена (RIA), который проводят с использованием Fab варианта интересующего антитела и его антигена, как описано в нижеследующем анализе. Аффинность связывания в растворе Fab с антигеном измеряют, приводя в равновесие Fab с минимальной концентрацией (125I)-меченого антигена в присутствии титрационных серий немеченого антигена, далее связывая связанный антиген с планшетом, покрытым анти-Fab антителом (смотрите, например, Chen et al., J. Mol. Biol. 293: 865-881 (1999)). Чтобы установить условия для анализа, многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи 5 мкг/мл связывающего анти-Fab антитела (Cappel Labs) в 50 мМ карбоната натрия (рН 9,6) и далее блокируют 2% (масса/объем) бычьим сывороточным альбумином в PBS в течение двух-пяти часов при комнатной температуре (приблизительно 23°С). В неабсорбирующем планшете (Nunc #269620) 100 пМ или 26 пМ [125I]-антигена смешивают с серийными разведениями исследуемого Fab (например, в соответствии с оценкой антитела против VEGF, Fab-12, в Presta et al., Cancer Res. 57: 4593-4599 (1997)). Исследуемый Fab далее инкубируют в течение ночи, но инкубацию можно осуществлять в течение более длительного периода времени (например, примерно 65 часов), чтобы гарантировать, что равновесие достигнуто. После этого смеси переносят в планшет для связывания и инкубируют при комнатной температуре (например, в течение одного часа). Раствор затем удаляют и планшет промывают восемь раз 0,1% полисорбатом 20 (TWEEN-20®) в PBS. После высыхания планшетов добавляют 150 мкл/лунку сцинтиллятора (MICROSCINT-20™; Packard) и планшеты анализируют с помощью счетчика гамма-излучения TOPCOUNT™ (Packard) в течение 10 минут. Концентрации каждого Fab, которые дают 20% или меньше от максимального связывания, выбирают для использования в конкурентных анализах связывания.
В соответствии с другим вариантом воплощения Kd измеряют с помощью анализа поверхностного плазмонного резонанса, используя прибор BIACORE®-2000 или BIACORE ®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с антигеном, иммобилизованным на чипах СМ5 при ~10 единицах ответа (RU). Кратко, карбоксиметилированные декстрановые чипы для биосенсора (СМ5, BIAcore Inc.) активируют N-этил-N-(3-диметиламинопропил)-карбодиимид гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антиген разбавляют в 10 мМ ацетате натрия, рН 4,8, до концентрации 5 мкг/мл (~0,2 мкМ) и далее осуществляют инжекцию при скорости потока 5 мкл/минуту для достижения приблизительно 10 единиц ответа (RU) связанного белка. После инжекции антигена осуществляют инжекцию 1 М этаноламина для блокирования непрореагировавших групп. Для измерения кинетики осуществляют инжекцию серийных двукратных разведений Fab (от 0,78 нМ до 500 нМ) в PBS с 0,05% сурфактанта TWEEN 20™ (PBST) при 25°С и скорости потока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую модель связывания Лэнгмюра «один-к-одному» (BIACORE ® Evaluation Software version 3.2), одновременно аппроксимируя сенсограммы ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как соотношение koff/kon. Смотрите, например, Chen et al., J. Mol. Biol. 293: 865-881 (1999). Если скорость ассоциации превышает 106 М-1 с-1 по данным измерения с помощью поверхностного плазмонного резонанса, описанного выше, то скорость ассоциации можно определить, используя метод тушения флуоресценции, с помощью которого можно измерить увеличение или уменьшение интенсивности эмиссии флуоресценции (экстинция = 295 нм; эмиссия = 340 нм, полоса пропускания 16 нм) при 25°С раствора 20 нМ антитела против антигена (Fab форма) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена с помощью спектрофотометра, такого как спектрофотометр с остановкой потока (Aviv Instruments) или спектрофотометр серии 8000 SLM-AMINCO™ (ThermoSpectronic) с кюветой с перемешиванием.
2. Фрагменты антител
В некоторых вариантах воплощения предусмотренное в настоящем документе антитело представляет собой фрагмент антитела. Фрагменты антитела вклюают фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv и другие фрагменты, описанные ниже, но не ограничиваясь этим. Обзор некоторых фрагментов антитела приведен в Hudson et al. Nat. Med. 9: 129-134 (2003). Обзор scFv фрагментов приведен, например, в  , The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); смотрите также WO 93/16185 и патенты США номер 5,571,894 и 5,587,458. Обсуждение Fab и F(ab')2 фрагментов, включающих остатки эпитопа связывания рецептора реутилизации и имеющих увеличенный период полужизни in vivo можно найти в патенте США номер 5,869,046.
, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); смотрите также WO 93/16185 и патенты США номер 5,571,894 и 5,587,458. Обсуждение Fab и F(ab')2 фрагментов, включающих остатки эпитопа связывания рецептора реутилизации и имеющих увеличенный период полужизни in vivo можно найти в патенте США номер 5,869,046.
Диатела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть бивалентными или биспецифическими. Смотрите, например, ЕР 404,097; WO 1993/01161; Hudson et al., Nat. Med. 9: 129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела и тетратела также описаны в Hudson et al., Nat. Med. 9: 129-134 (2003).
Однодоменные антитела представляют собой фрагменты антител, включающие весь вариабельный домен тяжелой цепи или его часть или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах воплощения однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; смотрите, например, патент США номер 6,248,516 В1). В некоторых вариантах воплощения два или больше однодоменных антител могут быть соединены вместе с образованием иммуноглобулиновой конструкции с поливалентной аффинностью (т.е. N- или С-конец первого одноцепочечного антитела может быть слит или иным образом соединен с N- или С-концом второго однодоменного антитела).
Фрагменты антител могут быть получены разными методами, включая протеолитическое расщепление интактного антитела, а также продукцию в рекомбинантных клетках-хозяевах (например Е.coli или фаги), как описано в настоящем документе, но не ограничиваясь этим.
3. Химерные и гуманизированные антитела
В некоторых вариантах воплощения предусмотренное в настоящем документе антитело представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в патенте США номер 4,816,567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). В одном из примеров химерное антитело включает не человеческую вариабельную область (например, вариабельную область, полученную из мыши, крысы, хомячка, кролика или не человеческого примата, такого как обезьяна) и человеческую константную область. В еще одном примере химерное антитело представляет собой антитело с «переключенным классом», класс или подкласс которого был изменен по сравнению с исходным антителом. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых вариантах воплощения химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизирует, чтобы снизить иммуногенность для человека, сохраняя при этом специфичность и аффинность исходного нечеловеческого антитела. Обычно, гуманизированное антитело включает один или несколько вариабельных доменов, в которых HVR, например, CDR (или их части) происходят из нечеловеческого антитела, и FR (или их части) происходят из последовательностей человеческого антитела. Гуманизированное антитело необязательно будет также включать, по меньшей мере, часть человеческой константной области. В некоторых вариантах воплощения некоторые остатки FR в гуманизированном антителе замещены на соответствующие остатки из нечеловеческого антитела (например, антитело, из которого происходят остатки HVR), например, чтобы восстановить или улучшить специфичность или аффинность антитела.
Гуманизированные антитела и способы их создания подробно рассмотрены, например, в Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008), и также описаны, например, в Riechmann et al., Nature 332: 323-329 (1988); Queen et al., Proc. Nat'l Acad. Sci. USA 86: 10029-10033 (1989); патентах США номер 5,821,337, 7,527,791, 6,982,321 и 7,087,409; Kashmiri et al., Methods 36: 25-34 (2005) (описывается перенос определяющей специфичность области SDR (a-CDR)); Padlan, Mol. Immunol. 28: 489-498 (1991) (описывается «изменение поверхности»); Dall'Acqua et al., Methods 36: 43-60 (2005) (описывается «перетасовка FR»); и Osbourn et al., Methods 36: 61-68 (2005) и Klimka et al., Br. J. Cancer, 83: 252-260 (2000) (описывается подход «направляемой селекции» к перетасовке FR).
Человеческие каркасные области, которые могут быть использованы для гуманизации, включают каркасные области, выбранные с использованием способа «наилучшего соответствия» (смотрите, например, Sims et al. J. Immunol. 151: 2296 (1993)); каркасные области, полученные из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных областей легкой или тяжелой цепей (смотрите, например, Carter et al. Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); и Presta et al. J. Immunol., 151: 2623 (1993)); человеческие зрелые (соматически мутировавшие) каркасные области или человеческие зародышевые каркасные области (смотрите, например, Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008)); и каркасные области, полученные из скрининга библиотек FR (смотрите, например, Васа et al., J. Biol. Chem. 272: 10678-10684 (1997) и Rosok et al., J. Biol. Chem. 271: 22611-22618 (1996)), но не ограничиваясь этим.
4. Человеческие антитела
В некоторых вариантах воплощения предусмотренное в настоящем документе антитело представляет собой человеческое антитело. Человеческие антитела могут быть получены с использованием различных методов, известных в данной области техники. Человеческие антитела описаны в общем в van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) и Lonberg, Curr. Opin. Immunol. 20: 450-459 (2008).
Человеческие антитела могут быть получены путем введения иммуногена в трансгенное животное, которое было модифицировано, чтобы продуцировать интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на стимуляцию антигеном. Такие животные обычно содержат весь человеческий иммуноглобулиновый локус или его часть, которые заменяют эндогенный иммуноглобулиновый локус, или которые находятся вне хромосомы или произвольно интегрированы в хромосомы животного. В таких трансгенных мышах эндогенный иммуноглобулиновый локус, как правило, инактивирован. Обзор способов получения человеческих антител из трансгенных животных смотрите в Lonberg, Nat. Biotech. 23: 1117-1125 (2005). Смотрите, также, например, патенты США номер 6,075,181 и 6,150,584, описывающие технологию XENOMOUSE™; патент США номер 5,770,429, описывающий технологию HUMAB®; патент США номер 7,041,870, описывающий технологию K-М MOUSE®, и опубликованную заявку на патент США номер US 2007/0061900, описывающую технологию VELOCIMOUSE®. Человеческие вариабельные области из интактных антител, полученные с помощью таких животных, могут быть дальше модифицированы, например, путем комбинации с разными человеческими константными областями.
Человеческие антитела также могут быть созданы способами на основе гибридом. Были описаны линии клеток человеческой миеломы и мышиной-человеческой гетеромиеломы для продукции человеческих моноклональных антител. (Смотрите, например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991)). Человеческие антитела, полученные с помощью технологии человеческой В-клеточной гибридомы также описаны в Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Дополнительные способы включают способы, описанные, например, в патенте США номер 7,189,826 (описывает получение моноклональных человеческих антител IgM из линий клеток гибридомы) и Ni, Xiandai Mianyixue, 26(4): 265-268 (2006) (описаны человеческие-человеческие гибридомы). Технология человеческой гибридомы (технология Trioma) также описана в Vollmers and Brandlein, Histology and Histopathology, 20(3): 927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91 (2005).
Человеческие антитела также могут быть получены путем выделения последовательностей вариабельных доменов клона Fv, выбранных из библиотеки фагового дисплея, происходящей из человека. Такие последовательности вариабельных доменов могут далее быть комбинированы с желаемым человеческим константным доменом. Методы отбора человеческих антител из библиотек антител описаны ниже.
5. Антитела, полученные из библиотек
Антитела по настоящему изобретению могут быть выделены путем скрининга комбинаторных библиотек антител с желаемой активностью или активностями. Например, в данной области техники известно множество способов создания библиотек фагового дисплея и скрининга таких библиотек для получения антител с желаемыми характеристиками связывания. Такие способы обобщены, например, в Hoogenboom et al., Methods in Molecular Biology 178: 1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001) и также описаны, например, в McCafferty et al., Nature 348: 552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, Methods in Molecular Biology 248: 161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004).
В некоторых способах фагового дисплея репертуары VH и VL генов отдельно клонируют с помощью полимеразной цепной реакции (PCR) и в произвольном порядке рекомбинируют в фаговые библиотеки, которые далее могут быть подвергнуты скринингу на антигенсвязывающий фаг, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Фаг обычно экспонирует фрагменты антител либо в виде одноцепочечных Fv (scFv) фрагментов, либо в виде Fab фрагментов. Библиотеки из иммунизированных источников обеспечивают антитела с высокой аффинностью к иммуногену без необходимости конструирования гибридом. Альтернативно, чтобы обеспечить единый источник антител для широкого спектра чужеродных и также собственных антигенов без иммунизации, можно клонировать наивный репертуар (например, из человека), как описано Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, наивные библиотеки также могут быть созданы синтетическим способом, путем клонирования неперестроенных V-генных сегментов из стволовых клеток и использования PCR праймеров, содержащих случайную последовательность, кодирующую высоко вариабельные CDR3 области для осуществления перестройки in vitro, как описано Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Опубликованные заявки на патент, описывающие библиотеки человеческих антител на основе фагового дисплея включают, например, патент США номер 5,750,373 и опубликованные заявки на патент США номер 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, считаются в настоящем документе человеческими антителами или фрагментами человеческих антител.
6. Мультиспецифические антитела
В некоторых вариантах воплощения предусмотренное в настоящем документе антитело представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые специфично связываются, по меньшей мере, с двумя разными участками. В некоторых вариантах воплощения антитело может быть специфично к Abeta и к любому другому антигену. В некоторых вариантах воплощения биспецифические антитела могут связываться с двумя разными эпитопами Abeta. Биспецифические антитела также могут использоваться для локализации цитотоксичных агентов в клетках. Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител.
Способы создания мультиспецифических антител включают рекомбинантную совместную экспрессию двух пар тяжелой цепи и легкой цепи иммуноглобулинов, имеющих разную специфичность (смотрите Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829 и Traunecker et al., EMBO J. 10: 3655 (1991)) и конструирование по принципу «выступ-во-впадину» (смотрите, например, патент США номер 5,731,168), но не ограничиваясь этим. Мультиспецифические антитела также могут быть созданы с использованием эффекта электростатического взаимодействия для создания Fc-гетеродимерных молекул антител (WO 2009/089004 А1); перекрестного связывания двух или более антител или фрагментов (смотрите, например, патент США номер 4,676,980 и Brennan et al., Science, 229: 81 (1985)); с использованием лейциновых застежек для получения биспецифических антител (смотрите, например, Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992)); с использованием технологии «диател» для создания биспецифических фрагментов антител (смотрите, например, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993)); и с использованием димеров одноцепочечных Fv (sFv) (смотрите, например Gruber et al., J. Immunol., 152: 5368 (1994)); и за счет получения триспецифических антител, как описано, например, в Tutt et al. J. Immunol. 147: 60 (1991).
Сконструированные антитела с тремя или более функциональными антигенсвязывающими сайтами, в том числе «антитела-осьминоги», также включены в настоящий документ (смотрите, например, US 2006/0025576 А1).
Антитело или фрагмент в настоящем документе также включает «FAb двойной специфичности» или «DAF», включающий антигенсвязывающий сайт, который связывается с Abeta, а также с другим, отличным от Abeta антигеном (смотрите, например, US 2008/0069820).
7. Варианты антител
В некоторых вариантах воплощения предусмотрены варианты аминокислотной последовательности предусмотренного в настоящем документе антитела. Например, может быть желательно улучшить аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела могут быть получены путем введения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или вставки и/или замены остатков в аминокислотных последовательностях антитела. В конечной конструкции могут быть сделаны любые комбинации делеций, вставок и замен, при условии, что конечная конструкция обладает желаемыми характеристиками, например, связыванием с антигеном.
Варианты замен, вставок и делеций
В некоторых вариантах воплощения предусмотрены варианты антитела, имеющие одну или несколько аминокислотных замен. Интересующие сайты для мутагенеза заменами включают HVR и FR. Консервативные замены показаны в Таблице 1 под заголовком «консервативные замены». Другие замены приведены в Таблице 1 под заголовком «примеры замен» и также описаны ниже с учетом классов боковых цепей аминокислот. Аминокислотные замены могут быть введены в интересующее антитело, и полученные продукты могут быть подвергнуты скринингу на желаемую активность, например, сохраненное/улучшенное связывание с антигеном, пониженную иммуногенность или улучшенные ADCC или CDC.
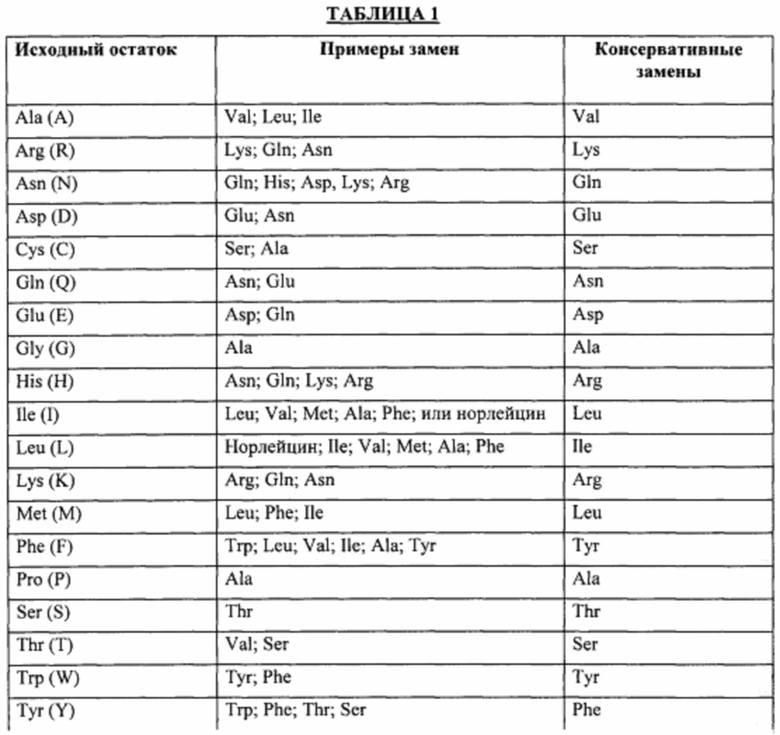

Аминокислоты могут быть сгруппированы в соответствии с общими свойствами их боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые вылияют на ориентацию боковой цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены приведут к замене представителя одного из этих классов на представителя другого класса.
Один из типов вариантов с заменами включает замену одного или нескольких остатков гипервариабельной области исходного антитела (например, гуманизированного или человеческого антитела). Обычно, полученный вариант (полученные варианты), выбранный (выбранные) для дальнейшего исследования, будут иметь модификации (например, улучшения) некоторых биологических свойств (например, увеличенная аффинность, пониженная иммуногенность) по сравнению с исходным антителом и/или будут по существу сохранять некоторые биологические свойства исходного антитела. Примером варианта с заменами является антитело с созревшей аффинностью. В некоторых вариантах воплощения антитела с созревшей аффинностью будут иметь наномолярную или даже пикомолярную аффинность связывания с целевым антигеном. Антитела с созревшей аффинностью получают методами, известными в данной области техники, включая, например, использование методов созревания аффинности на основе фагового дисплея, таких как методы, описанные в настоящем документе. Кратко, один или несколько остатков HVR подвергают мутагенезу, и варианты антител экспонируют на фаге и далее подвергают скринингу в отношении конкретной биологической активности (например, аффинности связывания). Другие методы также известны. В Marks et al. Bio/Technology 10: 779-783 (1992) описано созревание аффинности путем перетасовки доменов VH и VL. Случайный мутагенез остатков HVR и/или каркасной области описан в Barbas et al. Proc Nat. Acad. Sci, USA 91: 3809-3813 (1994); Schier et al. Gene 169: 147-155 (1996); Yelton et al. J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7): 3310-9 (1995); и Hawkins et al. J. Mol. Biol. 226: 889-896(1992).
Изменения (например, замены) могут быть введены в HVR, например, с целью улучшения аффинности антитела. Такие изменения могут быть введены в «горячие точки» HVR, т.е. остатки, кодируемые кодоном, который с высокой частотой мутирует во время процесса соматического созревания (смотрите, например, Chowdhury, Methods Mol. Biol. 207: 179-196 (2008)), и/или в SDR (a-CDR), а полученные варианты VH или VL тестируют на аффинность связывания. Созревание аффинности, осуществляемое путем конструирования и повторного отбора из вторичных библиотек было описано, например, в Hoogenboom et al. in Methods in Molecular Biology 178: 1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, (2001)). В некоторых вариантах воплощения созревания аффинности в вариабельные гены, выбранные для созревания, вносят разнообразие любым из множества способов (например, с помощью ПЦР с внесением ошибок, перетасовки цепей или сайт-специфического мутагенеза с использованием олигонуклеотидов). Далее создают вторичную библиотеку. Библиотеку далее подвергают скринингу для идентификации вариантов антител с желаемой аффинностью. Другой способ внесения разнообразия включает HVR-направленный подход, в котором рандомизируют несколько остатков HVR (например, 4-6 остатков за раз). Остатки HVR, участвующие в связывании антигена, могут быть специфично идентифицированы, например, с использованием сканирующего аланином мутагенеза или путем моделирования. В частности, мишенями часто становятся CDR-H3 и CDR-L3.
В некоторых вариантах воплощения замены, вставки или делеции могут быть в пределах одной или нескольких HVR, при условии, что такие изменения значительно не снижают способность антитела связываться с антигеном. Например, в HVR могут быть введены консервативные изменения (например, консервативные замены, как предусмотрено в настоящем документе), которые значительно не снижают аффинность связывания. Такие изменения могут быть введены за пределами «горячих точек» HVR или SDR. В некоторых вариантах воплощения вариантов последовательностей VH и VL, предусмотренных в настоящем документе, каждая HVR либо остается неизменной, либо содержит не более одной, двух или трех аминокислотных замен.
Полезный способ для идентификации остатков или областей антитела, которые могут быть подвергнуты мутагенезу, называется «сканирующий аланином мутагенез», как описано в Cunningham and Wells (1989) Science, 244: 1081-1085. В этом способе идентифицируют остаток или группу целевых остатков (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu), которые замещают на нейтральные или отрицательно заряженные аминокислоты (например, аланин или полиаланин) с целью определения, влияет ли эта замена на взаимодействие антитела с антигеном. Дальнейшие замены могут быть введены в аминокислотные положения, демонстрирующие функциональную чувствительность к изначальным заменам. Альтернативно или дополнительно, для идентификации точек контакта между антителом и антигеном анализируют кристаллическую структуру комплекса антиген-антитело. Такие остатки контакта и соседние остатки могут считаться кандидатами для замен. Полученные варианты могут быть подвергнуты скринингу, чтобы определить, обладают ли они желаемыми свойствами.
Вставки аминокислотных последовательностей включают слияние с амино- и/или карбоксильным концами одного остатка и фрагментов вплоть до полипептидов, содержащих сотни или больше остатков, а также вставки в последовательность одного или множества аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым остатком метионина. Другие варианты вставок в молекулу антитела включают слияние с N- или С-концом антитела фермента (например, для ADEPT) или полипептида, который увеличивает период полужизни антитела в сыворотке.
Варианты гликозилирования
В некоторых вариантах воплощения предусмотренное в настоящем документе антитело изменено с целью увеличения или уменьшения степени гликозилирования антитела. Добавление или делеция сайтов гликозилирвоания в антителе могут быть легко осуществлены путем изменения аминокислотной последовательности, так что создаются или удаляются один или несколько сайтов гликозилирования.
Если антитело включает Fc область, может быть изменен присоединенный к ней углевод. Нативные антитела, продуцируемые клетками млекопитающих, как правило, включают разветвленные, двухантенные олигосахариды, которые обычно присоединяются N-связью к Asn297 в СН2 домене Fc области. Смотрите, например, Wright et al. TIBTECH 15: 26-32 (1997). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стволе» двухантенной олигосахаридной структуры. В некоторых вариантах воплощения могут быть осуществлены модификации олигосахарида в антителе по настоящему изобретению с целью создания вариантов антител с некоторыми улучшенными свойствами.
В одном из вариантов воплощения предусмотрены варианты антител, имеющие углеводную структуру, которая не содержит фукозы, присоединенной (напрямую или ненапрямую) к Fc области. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяют, рассчитывая среднее количество фукозы на цепь в Asn297 относительно суммы всех гликоструктур, присоединенных к Asn 297 (например, сложные, гибридные и богатые маннозой), основываясь на данных MALDI-TOF масс-спектрометрии, как описано, например, в WO 2008/077546. Asn297 обозначает остаток аспарагина, расположенный примерно в положении 297 в Fc области (нумерация остатков Fc области по Eu); тем не менее, Asn297 может также располагаться в области примерно ± 3 аминокислот до или после положения 297, т.е. между положениями 294 и 300, из-за минорных вариаций в последовательностях антител. Такие варианты фукозилирования могут улучшать функцию ADCC. Смотрите, например, опубликованные заявки на патент США номер US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры опубликованных заявок, связанных с «дефукозилированными» или «дефицитными по фукозе» вариантами антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki et al. J. Mol. Biol. 336: 1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают клетки Lec13 СНО, дефицитные по фукозилированию белков (Ripka et al. Arch. Biochem. Biophys. 249: 533-545 (1986); заявка на патент США номер US 2003/0157108 A1, Presta, L; и WO 2004/056312 Al, Adams et al., в особенности в Примере 11) и нокаутированные клеточные линии, такие как клетки СНО, нокаутированные по гену альфа-1,6-фукозилтрансферазы, FUT8 (смотрите, например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4): 680-688 (2006); и WO 2003/085107).
Также предусмотрены варианты антител с разветвляющимися надвое олигосахаридами, например, в которых двухантенный олигосахарид, присоединенный к Fc области антитела, разделен надвое GlcNAc. Такие варианты антител могут быть менее фукозилированными и/или обладать улучшенной функцией ADCC. Примеры таких вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet et al.); патенте США номер 6,602,684 (Umana et al.); и US 2005/0123546 (Umana et al.). Также предусмотрены варианты антител, по меньшей мере, с одним остатком галактозы в олигосахариде, присоединенном к Fc области. Такие варианты антител могут обладать улучшенной функцией CDC. Такие варианты антител описаны, например, в WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.) и WO 1999/22764 (Raju, S.).
Варианты Fc области
В некоторых вариантах воплощения одна или несколько модификаций могут быть введены в Fc область предусмотренного в настоящем документе антитела, в результате чего образуется вариант Fc области. Вариант Fc области может включать последовательность человеческой Fc области (например, человеческую Fc область IgG1, IgG2, IgG3 или IgG4), включающую аминокислотную модификацию (например, замену) в одном или нескольких аминокислотных положениях.
В некоторых вариантах воплощения изобретение предполагает вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, которые делают его желаемым кандидатом для применения в тех случаях, когда важен период полужизни антитела in vivo, а некоторые эффекторные функции (например, активация комплемента и ADCC) не являются необходимыми или являются вредными. С целью подтверждения снижения/исчезновения активностей CDC и/или ADCC могут быть проведены анализы цитотоксичности in vitro и/или in vivo. Например, чтобы убедиться в отсутствии связывания антитела с FcγR (и как следствие, вероятном отсутствии активности ADCC), но сохранении способности связываться с FcRn, могут быть осуществлены анализы связывания с Fc рецептором (FcR). Первичные клетки, которые опосредуют ADCC, NK клетки, экспрессируют только FcλRIII, тогда как моноциты экспрессируют FcλRI, FcλRII и FcλRIII. Экспрессия FcR на гематопоэтических клетках суммирована в Таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-492 (1991). Неограничивающие примеры анализов in vitro для оценки активности ADCC интересующей молекулы описаны в патенте США номер 5,500,362 (смотрите, например Hellstrom, I. et al. Proc. Nat'l Acad. Sci. USA 83: 7059-7063 (1986)) и Hellstrom, I et al., Proc. Nat'l Acad. Sci. USA 82: 1499-1502 (1985); 5,821,337 (смотрите Bruggemann, M. et al., J. Exp. Med. 166: 1351-1361 (1987)). Альтернативно, могут быть использованы нерадиоактивные способы анализа (смотрите, например, нерадиоактивный анализ цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. Mountain View, CA; и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI). Подходящие эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и естественные киллеры (NK). Альтернативно или дополнительно, активность ADCC интересующей молекулы можно оценить in vivo, например, в модели на животных, такой как модель, раскрытая в Clynes et al. Proc. Nat'l Acad. Sci. USA 95: 652-656 (1998). Для подтверждения того, что антитело не может связываться с C1q и поэтому не обладает активностью CDC, также могут быть проведены анализы связывания C1q. Смотрите, например, анализ связывания C1q и С3с на основе ELISA в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента может быть проведен анализ CDC (смотрите, например, Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996); Cragg, M.S. et al., Blood 101: 1045-1052 (2003); и Cragg, M.S. and M.J. Glennie, Blood 103: 2738-2743 (2004)). Анализ связывания с FcRn и определение клиренса in vivo/периода полужизни антитела могут быть осуществлены с использованием способов, известных в данной области техники (смотрите, например, Petkova, S.B. et al., Int'l. Immunol. 18(12): 1759-1769 (2006)).
Антитела со сниженной эффекторной функцией включают антитела с заменой одного или нескольких остатков 238, 265, 269, 270, 297, 327 и 329 в Fc области (патент США номер 6,737,056). Такие мутанты Fc включают мутантов Fc с заменами в двух или более аминокислотных положениях, выбранных их 265, 269, 270, 297 и 327, включая так называемый «DANA» мутант Fc с заменами остатков 265 и 297 на аланин (патент США номер 7,332,581).
Описаны некоторые варианты антител с улучшенным или ослабленным связыванием с FcR. (Смотрите, например, патент США номер 6,737,056; WO 2004/056312 и Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001)).
В некоторых вариантах воплощения вариант антитела включает Fc область с одной или несколькими аминокислотными заменами, которые улучшают ADCC, например, заменами в положениях 298, 333 и/или 334 Fc области (нумерация остатков по EU).
В некоторых вариантах воплощения изменения, сделанные в Fc области, приводят к изменению (т.е. либо улучшению, либо ослаблению) связывания C1q и/или комплементзависимой цитотоксичности (CDC), например, как описано в патенте США номер 6,194,551, WO 99/51642 и Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
Антитела с увеличенным периодом полужизни и улучшенным связыванием с неонатальным Fc рецептором (FcRn), который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)), описаны в US 2005/0014934 A1 (Hinton et al.). Такие антитела включают Fc область с одной или несколькими заменами, которые улучшают связывание Fc области с FcRn. Такие варианты Fc включают варианты с заменами одного или нескольких остатков в Fc области, выбранных из 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, с заменой остатка 434 в Fc области (патент США номер 7,371,826). Смотрите также Duncan & Winter, Nature 322: 738-40 (1988); патент США номер 5,648,260; патент США номер 5,624,821; и WO 94/29351 в отношении других примеров вариантов Fc области.
Цистеин-генно-инженерные варианты антител
В некоторых вариантах воплощения может быть желательным получить цистеин-генно-инженерные антитела, например, «тиоMAb», в которых один или несколько остатков антитела замещены на остатки цистеина. В конкретных вариантах воплощения замещенные остатки находятся в доступных участках антитела. В результате замены этих остатков на цистеин реакционно-способные тиольные группы оказываются помещенными в доступные участки антитела и могут быть использованы для конъюгации антитела с другими фрагментами, такими как фрагменты лекарственных средств или фрагменты линкер-антибиотик, с целью получения иммуноконъюгата, как описано далее в настоящем документе. В некоторых вариантах воплощения любой один или несколько из следующих остатков могут быть замещены на цистеин: V205 (нумерация по Kabat) легкой цепи; А118 (нумерация EU) тяжелой цепи; и S400 (нумерация EU) Fc области тяжелой цепи. Цистеин-генно-инженерные антитела могут быть получены, как описано, например, в патенте США номер 7,521,541.
Производные антител
В некоторых вариантах воплощения предусмотренное в настоящем документе антитело может быть дополнительно модифицировано для включения дополнительных небелковых фрагментов, которые хорошо известны в данной области техники и легко доступны. Фрагменты, подходящие для дериватизации антитела, включают водорастворимые полимеры, но не ограничиваются ими. Неограничивающие примеры водорастворимых полимеров включают полиэтиленгликоль (PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена и малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо статистические сополимеры) и декстран или поли(н-винил-пирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида и этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси, но не ограничиваясь этим. Полимер полиэтиленгликоля с пропионовым альдегидом может создавать преимущества при производстве, поскольку он стабилен в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать и, если присоединен более чем один полимер, полимеры могут представлять собой одинаковые или разные молекулы. В общем, количетво и/или тип полимеров, используемых для дериватизации, можно определить, основываясь на следующих соображениях: конкретные свойства или функции антитела, подлежащие улучшению, предполагаемое использование производного антитела в терапии в определенных условиях и т.п., но не ограничиваясь этим.
В другом варианте воплощения предусмотрены конъюгаты антитела и небелковых фрагментов, которые могут селективно нагреваться под воздействием излучения. В одном из вариантов воплощения небелковые фрагменты представляют собой углеродные нанотрубки (Kam et al., Proc. Natl. Acad. Sci. USA 102: 11600-11605 (2005)). Длина волны излучения может быть любой и включает, но не ограничивается длинами волн, которые не повреждают обычные клетки, но которые нагревают небелковые фрагменты до температуры, при которой гибнут клетки, находящиеся вблизи конъюгатов антитело-небелковый фрагмент.
Рекомбинантные способы и композиции
Антитела могут быть получены с использованием рекомбинантных способов и композиций, например, как описано в патенте США номер 4,816,567. В одном из вариантов воплощения предусмотрена выделенная нуклеиновая кислота, кодирующая антитело против Abeta, описанное в настоящем документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, включающую VL, и/или аминокислотную последовательность, включающую VH антитела (например, легкую и/или тяжелые цепи антитела). В еще одном варианте воплощения предусмотрены один или несколько векторов (например, экспрессирующих векторов), включающих такую нуклеиновую кислоту. В еще одном варианте воплощения предусмотрена клетка-хозяин, включающая такую нуклеиновую кислоту. В одном из таких вариантов воплощения клетка-хозяин включает (например, была трансформирована ими): (1) вектор, включающий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, включающую VL антитела, и аминокислотную последовательность, включающую VH антитела, или (2) первый вектор, включающий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, включающую VL антитела, и второй вектор, включающий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, включающую VH антитела. В одном из вариантов воплощения клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (СНО) или лимфоидную клетку (например, клетку Y0, NS0, Sp20). В одном из вариантов воплощения предусмотрен способ создания антитела против Abeta, где способ включает культивирование клетки-хозяина, включающей нуклеиновую кислоту, кодирующую антитело, как это предусмотрено выше, в условиях, подходящих для экспрессии антитела, и необязательно выделение антитела из клетки-хозяина (или из культуральной среды клетки-хозяина).
Для рекомбинантной продукции антитела против Abeta, нуклеиновую кислоту, кодирующую антитело, например, описанное в настоящем документе, выделяют и вставляют в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такая нуклеиновая кислота может быть легко выделена и секвенирована с использованием обычных методик (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелую и легкую цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии в них векторов, кодирующих антитела, включают прокариотические или эукариотические клетки, описанные в настоящем документе. Например, антитела могут продуцироваться в бактериях, в частности, когда не требуется гликозилирование и эффектораня функция Fc. Экспрессия фрагментов антител и полипептидов в бактериях описана, например, в патентах США номер 5,648,237, 5,789,199 и 5,840,523. (Смотрите также Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, где описана экспрессия фрагментов антител в Е.coli.) После экспрессии антитело может быть выделено из пасты бактериальных клеток в растворимой фракции и может быть очищено.
В дополнение к прокариотам для клонирования или экспрессии векторов, кодирующих антитела, в качестве хозяев подходят эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, в том числе штаммы грибов и дрожжей, в которых были «гуманизированы» пути гликозилирования, в результате чего продуцируемое антитело частично или полностью гликозилировано по человеческому типу. Смотрите Gerngross, Nat. Biotech. 22: 1409-1414 (2004) и Li et al., Nat. Biotech. 24: 210-215 (2006).
Подходящие клетки-хозяева для экспрессии гликозилированных антител также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые могут быть использованы вместе с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также могут быть использованы культуры растительных клеток. Смотрите, например, патенты США номер 5,959,177, 6,040,498, 6,420,548, 7,125,978 и 6,417,429 (описывающие технологию PLANTIBODIES™ для продукции антител в трансгенных растениях).
Клетки позвоночных также могут быть использованы в качестве хозяев. Например, могут быть использованы линии клеток млекопитающих, адаптированные для роста в суспензии. Другими примерами используемых в качестве хозяев линий клеток млекопитающих являются линия клеток почек обезьяны CV1, трансформированная SV40 (COS-7); линия человеческих эмбриональных клеток почек (клетки 293 или 293, описанные, например, в Graham et al., J. Gen Virol. 36: 59 (1977)); клетки почки новорожденного хомяка (BHK); клетки Сертоли мышей (клетки ТМ4, описанные, например, в Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почек обезьяны (CV1); клетки почек африканской зеленой мартышки (VERO-76); человеческие клетки карциномы шейки матки (HELA); клетки почек собаки (MDCK); клетки печени серой крысы Buffalo (BRL 3А); человеческие клетки легких (W138); человеческие клетки печени (Hep G2); клетки опухоли молочной железы мышей (ММТ 060562); клетки TRI, описанные, например, в Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1982); клетки MRC 5 и клетки FS4. Другие используемые в качестве хозяев линии клеток млекопитающих включают клтеки яичника китайского хомячка (СНО), в том числе клетки DHFR- СНО (Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); и линии клеток миеломы, такие как Y0, NS0 и Sp2/0. Обзор некоторых линий клеток млекопитающих, подходящих для продукции ими антител, смотрите, например, в Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp. 255-268 (2003).
Анализы
Предусмотренные в настоящем документе антитела против Abeta могут быть идентифицированы, подвергнуты скринингу или охарактеризованы в отношении их физических/химических свойств и/или биологических активностей с помощью различных анализов, известных в данной области техники.
Анализы связывания и другие анализы
В одном из аспектов антитело по настоящему изобретению тестируют на его активность связывания с антигеном, например, с помощью известных способов, таких как ELISA, вестерн блоттинг и т.п.
В другом аспекте для идентификации антитела, которое конкурирует с антителом против Abeta по настоящему изобретению за связывание с Abeta, могут использоваться конкурентные анализы. В некоторых вариантах воплощения такое конкурирующее антитело связывается с тем же самым эпитопом (например, линейным или конформационным эпитопом), с которым связывается кренезумаб или другое антитело против Abeta в соответствии с настоящим документом. Подробные примеры способов картирования эпитопа, с которым связывается антитело, предусмотрены в Morris (1996) «Epitope Mapping Protocols,» in Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ).
В приведенном в качестве примера конкурентном анализе, иммобилизированный в желаемой форме (например, мономерной, олигомерной или фибриллярной) Abeta инкубируют в растворе, содержащем первое меченое антитело, которое связывается с Abeta (например, кренезумаб), и второе немеченое антитело, которое тестируют в отношении его способности конкурировать с первым антителом за связывание с Abeta. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля, иммобилизированный Abeta инкубируют в растворе, содержащем первое меченое антитело, но не содержащем второе немеченое антитело. После инкубации в условиях, обеспечивающих связывание первого антитела с Abeta, изыток несвязавшегося антитела удаляют и измеряют количество метки, связанной с иммобилизированным Abeta. Если количество метки, связанной с иммобилизированным Abeta значительно снижено в тестируемом образце по сравнению с контрольным образцом, то это свидетельствует о том, что второе антитело конкурирует с первым антителом за связывание с Abeta. Смотрите Harlow and Lane (1988) Antibodies: A Laboratory Manual ch. 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
Анализы активности
В одном из аспектов предусмотрены анализы для идентификации антител против Abeta, обладающих биологической активностью, например, биологической активностью кренезумаба. Биологическая активность может включать например, предотвращение агрегации мономерной формы Abeta с образованием олигомерной формы Abeta или дезагрегацию олигомерной формы Abeta с образованием мономерной формы Abeta, но не ограничиваясь этим. Также предусмотрены антитела, обладающие такой биологической активностью in vivo и/или in vitro.
В некоторых вариантах воплощения антитело по настоящему изобретению тестируют на такую биологическую активность.
Способы и композиции для определения и выбора пациента с использованием CLUSTERIN
Настоящее раскрытие основано на открытии, что полиморфизм в гене CLUSTERIN (также называемый аполипопротеин J или ApoJ, номер в GenPept NP_001822.2) коррелирует с эффективностью лечения антителом против Abeta (например, антитело против Abeta или его антигенсвязывающий фрагмент). Как показано в Примерах в настоящем документе, наличие нуклеотида Т в SNP rs1532278, SNP в гене CLUSTERIN, ассоциировано с благоприятным исходом у пациентов с легкой до умеренной AD и их конкретной субпопуляцией. Следовательно, настоящее раскрытие предусматривает способы и инструменты, в том числе способы и инструменты для определения и выбора пациентов, которые с высокой вероятностью будут получать пользу от лечения AD, включающего антитело против Abeta.
В одном из аспектов настоящее раскрытие предусматривает способ выбора пациента для лечения антителом против Abeta, где пациент страдает от ранней AD или от легкой до умеренной AD. Способ включает обнаружение наличия или отсутствия аллеля гена CLUSTERIN, в частности, наличие аллеля гена CLUSTERIN, содержащего нуклеотид Т в SNP rs1532278, или его эквивалентного аллеля, в образце, полученном от пациента. Способ также включает выбор пациента, у которого обнаружен аллель гена CLUSTERIN, содержащий нуклеотид Т в SNP rs1532278, или его эквивалентный аллель, что свидетельствует о том, что этот пациент с большей вероятностью будет отвечать на лечение антителом против Abeta.
В другом аспекте настоящее раскрытие предусматривает способ предсказания того, будет ли индивидуум, страдающий от ранней или от легкой до умеренной AD, с большей вероятностью отвечать на лечение AD, включающее антитело против Abeta. В некоторых вариантах воплощения способ включает определение идентичности нуклеотида в SNP rs1532278 в образце, полученном от индивидуума, при этом индивидуум, имеющий нуклеотид Т в SNP rs1532278, с большей вероятностью отвечает на лечение, включающее антитело против Abeta. В некоторых вариантах воплощения способ включает обнаружение наличия или отсутствия аллеля гена CLUSTERIN, в частности, наличия аллеля гена CLUSTERIN, содержащего нуклеотид Т в SNP rs1532278, или его эквивалентного аллеля, в образце от пациента.
В другом аспекте настоящее раскрытие предусматривает способ оптимизации терапевтической эффективности лечения AD, включающий определение генотипа пациента, при этом пациент, для которого определено, что он является носителем, по меньшей мере, одного аллеля гена CLUSTERIN, в частности, аллеля гена CLUSTERIN, содержащего нуклеотид Т в SNP rs1532278, или его эквивалентного аллеля, с большей вероятностью будет отвечать на лечение антителом против Abeta.
В другом аспекте настоящее раскрытие предусматривает способ определения вероятности того, что пациент, страдающий от AD, будет получать пользу от лечения AD, включающего антитело против Abeta. В одном из вариантов воплощения, если пациент имеет нуклеотид Т в CLUSTERIN SNP rs1532278, то пациент с высокой вероятностью будет получать пользу от лечения с применением терапии, включающей антитело против Abeta (например, кренезумаб или его антигенсвязывающий фрагмент).
Раскрытые способы предусматривают удобные, эффективные и потенциально экономически эффективные способы получения данных и информации, полезных для оценки пригодности или эффективности терапии, для определения, выбора и/или лечения пациентов. В некоторых вариантах воплощения образец может быть получен от пациента и далее исследован различными способами in vitro для определения наличия или отсутствия аллеля, ассоциированного с эффектом от лечения у пациентов, страдающх от AD, которые подвергались лечению антителом против Abeta. Подходящие образцы описаны в настоящем документе ниже и могут представлять собой кровь, слюну, буккальный мазок, ткань тела или биологическую жидкость.
Наличие биомаркера или SNP можно определить на основе подходящих критериев, известных в данной области техники, включая мРНК, кДНК, белки, фрагменты белков и/или число копий гена, но не ограничиваясь этим.
В некоторых вариантах воплощения аллель гена CLUSTERIN представляет собой аллель rs1532278:T или его эквивалентный аллель или включает Т в SNP rs1532278. Альтернативные SNP, находящиеся в неравновесном сцеплении с rs1532278, также могут быть использованы в способах по настоящему раскрытию. В некоторых вариантах воплощения неравновесное сцепление представляет собой величину D' или величину r2, величина D' между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина D' между выбранным SNP и альтернативным SNP составляет 1,0. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,60. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет ≥0,70, 0,80 или 0,90. В некоторых вариантах воплощения величина r2 между выбранным SNP и альтернативным SNP составляет 1,0. В некоторых вариантах воплощения альтернативный SNP расположен в пределах 500000 пар оснований до или после выбранного SNP.
Анализ SNP в образцах может быть осуществлен в крови, ткани или других биологических жидкостях различными методами, многие из которых известны и понятны специалисту в данной области техники, в том числе путем секвенирования ДНК, секвенирования РНК, анализа ДНК с помощью полимеразной цепной реакции, анализа РНК с помощью полимеразной цепной реакции, гибридизации на основе олигонуклеотидов, гибридизации in situ, удлинения праймеров на основе олигонуклеотидов, электрофореза и HPLC, но не ограничиваясь этим. Дополнительные методы обнаружения SNP включают следующие методы: секвенирование ДНК со сканирующим зондом и нанопоровое секвенирование ДНК, пиросеквенирование, денатурирующий градиентный гель-электрофорез (DGGE), гель-электрофорез с временным градиентом температуры (TTGE), электрофорез в полиакриламидном геле с Zn(II)-цикленом, гомогенный флуоресцентный анализ однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинный электрофорез в полиакриламидном геле, высопроизводительную платформу для генотипирования SNP, молекулярные маяки, 5'-нуклеазную реакцию, анализ Taqman, Mass Array (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловые массовые метки, платформы для генотипирования (таких как Invader Assay®), анализ методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификацию (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционный анализ ПЦР-продуктов (RFLP), аллель-специфическую ПЦР, анализ методом многократного удлинения праймера (МРЕХ) и изотермическую амплификацию SMART (Methods in Molecular Biology, Single nucleotide polymorphisms, 2nd edition, editor Anton Komar, Humana Press 2009; Chapters 7-28), ПЦР-амплификацию полиморфизмов длин простых последовательностей (SSLP), лигазную цепную реакцию (LCR), расщепление РНКазой, химическое расщепление гетеродуплекса ДНК, анализ одноцепочечного конформационного полиморфизма (SSCP) (Warren et al., Current Protocol in Human Genetics, Supp 15: 7.4.1-7.4.23 (2001), микрочипы в виде шариков (Lambert et al., Current Protocol in Human Genetics, Supp 78: 2.9.1-2.9.3(2013)), анализ одноцепочечного конформационного полиморфизма, анализ методом удлинения праймеров на одно основание (SBE) (Deshpande et al., Current Protocol in Human Genetics, Supp 34: 13.4.1-13.4.11 (2005)), анализ методом удлинения праймеров (Kwok et al., Current Protocol in Human Genetics, Supp 39: 2.11.1-2.11.10 (2003), но не ограничиваясь этим. Наличие SNP также можно определить с помощью анализа, проведенного с помощью белковых методов (например, исследование уровней экспрессии или функции белков), включая иммунологический анализ (например, ELISA, ELIFA, иммуногистохимический анализ и/или вестерн блоттинг, иммунопреципитация, анализы молекулярного связывания, сортировка клеток с возбуждением флуоресценции (FACS) и тому подобное, количественные анализы крови (например, ELISA в сыворотке), гибридизация in situ или функциональные анализы, в том числе биохимические анализы ферментативной активности или клеточные системы, а также любой из множества анализов, которые могут быть проведены путем анализа генетических чипов и/или тканевых панелей. Стандартные протоколы для оценки статуса генов и продуктов генов можно найти, например, в Ausubel et al. eds., 1995, Current Protocols In Molecular Biology, Units 2 (Northern Blotting), 4 (Southern Blotting), 15 (Immunoblotting) и 18 (PCR Analysis). Также могут быть использованы мультиплексные иммунологические анализы, такие как анализы, которые доступны от Rules Based Medicine, иммунологические анализы на основе частиц, например, Luminex, ELISA или Meso Scale Discovery (MSD).
Один из методов, который является чувствительным и подходящим для анализа SNP в соответствии с настоящим изобретением, представляет собой аллель-специфическую ПЦР (AS-PCR), описанную, например, в патенте США номер 6,627,402. С помощью этого метода можно обнаруживать мутации или полиморфизмы в последовательностях нуклеиновых кислот в присутствии вариантов последовательностей дикого типа. В случае успешной аллель-специфической ПЦР нужный вариант целевой нуклеиновой кислоты амплифицируется, тогда как другие варианты не амплифицируются или, по меньшей мере, амплифицируются не до обнаруживаемого уровня.
Одним из показателей избирательности аллель-специфической ПЦР является различие между значениями Ct (ΔCt) в реакциях амплификации, включающих два аллеля. Каждая реакция амплификации характеризуется «кривой роста» или «кривой амплификации» в контексте амплификационного анализа нуклеиновых кислот, которая представляет собой график функции, где независимой переменной является число циклов амплификации, а зависимой переменной является измеряемый параметр, зависящий от амплификации, измеряемый при каждом цикле амплификации, например, флуоресценция, испускаемая флуорофором. Как правило, измеряемый параметр, зависящий от амплификации, представляет собой количество флуоресценции, испускаемой зондом при гибридизации или при гидролизе зонда с участием нуклеазной активности полимеразы нуклеиновых кислот, смотрите Holland et al., (1991) Proc. Natl. Acad. Sci. 88: 7276-7280 и патент США номер 5,210,015. Кривая роста характеризуется «пороговым значением» (или значением Ct), которое представляет собой число циклов, при котором достигается заданная величина измеряемого параметра. Более низкие значения Ct соответствуют более быстрой амплификации, тогда как более высокие значения Ct соответствуют более низкой амплификации. В контексте аллель-специфической реакции различие между значениями Ct двух матриц представляет собой избирательность в отношении аллелей в реакции.
В аллель-специфической ПЦР, по меньшей мере, один праймер является аллель-специфическим, благодаря чему удлинение праймера происходит только (или предпочтительно), когда присутствует специфический вариант последовательности, и не происходит (или происходит менее эффективно, т.е. со значительным ΔCt), когда присутствует другой вариант. Как правило, дискриминирующий нуклеотид в праймере, т.е. нуклеотид, совпадающий только с одним вариантом целевой последовательности, представляет собой 3'-концевой нуклеотид. Тем не менее, 3'-конец праймера является только одним из многих факторов, определяющих специфичность. Например, дополнительные ошибочные спаривания основания также могут влиять на избирательность. Смотрите заявку на патент США номер 12/582,068, поданную 20 октября 2009 (опубликована как US 20100099110). Другой подход включает неприродные или модифицированные нуклеотиды, которые изменяют спаривание оснований между праймером и целевой последовательностью (патент США номер 6,001,611, включенный в настоящий документ посредством ссылки во всей своей полноте). На снижение кинетики удлинения праймеров и, таким образом, на специфичность праймера влияет много факторов, в том числе общий контекст последовательности ошибочно спаренных оснований и присутствие других нуклеиновых кислот в реакции. Влияние этих внешних факторов на каждую дополнительную ошибку спаривания оснований, а также каждый дополнительный неприродный нуклеотид, либо по отдельности, либо в комбинации, не может быть предсказано. В одном из вариантов воплощения настоящее раскрытие предусматривает олигонуклеотиды, специфичные к обнаруживаемому полиморфизму в гене CLUSTERIN, в частности, олигонуклеотиды, специфичные к rs1532278 в гене CLUSTERIN.
В одном варианте воплощения наличие полиморфизма обнаруживают с помощью зонда. Зонд может быть меченным радиоактивной меткой или хромофором (флуорофором), например, меткой, включающей красители семейства FAM, JA270, CY5 или красители HEX. В качестве примера обнаружения с использованием флуоресцентно меченого зонда мутацию можно обнаружить с помощью полимеразной цепной реакции (rt-PCR), в которой гибридизация зондов приводит к ферментативному расщеплению зонда и обнаружению возникающей флуоресценции (способ с зондом TaqMan™, Holland et al. (1991) P.N.A.S. USA 88: 7276-7280). Альтернативно, наличие полиморфизма и продукта амплификации можно обнаружить с помощью гель-электрофореза с последующим окрашиванием или с помощью блоттинга и гибридизации, как описано, например, в Sambrook, J. and Russell, D.W. (2001) Molecular Cloning, 3rd ed. CSHL Press, Chapters 5 и 9.
«Флуоресцентный краситель» или «флуорофор» представляет собой соединение или фрагмент, присоединенный, например, к нуклеиновой кислоте, который способен испускать световое излучение при возбуждении светом с подходящей длиной волны. Стандартные флуоресцентные красители включают родаминовые красители, цианиновые красители, флуоресцеиновые красители и красители BODIPY®. Флуорофор представляет собой флуоресцентный хромофор. «FRET», или «резонансный перенос энергии флуоресценции», или «Ферстеровский резонансный перенос энергии» представляет собой перенос энергии между, по меньшей мере, двумя хромофорами, донорным хромофором и акцепторным хромофором (называется гасителем). Донор, как правило, переносит энергию на акцептор, когда донор возбуждается световым излучением с подходящей длиной волны. Когда акцептор представляет собой «черный» гаситель, он рассеивает перенесенную энергию в другой, не световой форме. Обычно используемые черные гасители представляют собой BlackHole Quenchers™ (BHQ), Biosearch Technologies, Inc. (Novato, Cal.), Iowa Black™, Integrated DNA Tech., Inc. (Coralville, Iowa), BlackBerry™ Quencher 650 (BBQ-650), Berry & Assoc., (Dexter, Mich.). Обычно используемые пары донор-гаситель включают пару FAM-BHQ, пару CY5-BHQ и пару HEX-BHQ.
Образец, включающий биомаркер или SNP, может быть получен способами, хорошо известными в данной области техники. Смотрите раздел Определения. Дополнительно, тестируя такие образцы на SNP, можно проще контролировать прогресс от терапии.
Генотипирование может быть использовано для анализа ДНК или РНК с целью обнаружения наличия SNP. Одним из таких примеров является технология Illumina на основе чипов, которая представляет собой коммерчески доступную систему микрочипов с >700K локусов (Oliphant et al., Biotechniques, Supp: 56-8, 60-1 (2002)) и является распространенным способом для анализа ДНК и РНК (например, идентификации SNP в образцах нуклеиновых кислот). В технологии микрочипов Illumina используются кремниевые шарики размером 3 микрона, которые самостоятельно собираются в микролунки на любом из двух субстратов: волоконно-оптических пучках или плоских кремниевых пластинках. Каждый шарик покрыт сотнями или тысячями копий специфических олигонуклеотидов, которые выступают в качестве захватывающих последовательностей.
Экспрессия выбранного гена или биомаркера в образце ткани или клетки также может быть исследована с помощью функциональных анализов или анализов активности. Например, если биомаркер представляет собой фермент, можно провести анализы, известные в данной области техники, чтобы определить или обнаружить наличие данной ферментативной активности в образце ткани или клетки.
Информация о статусе пациента по SNP по результатам тестирования может быть предусмотрена в отчете. Отчет может быть в форме любых письменных материалов (например, в бумажном или цифровом виде или в интернете) или в форме устного сообщения (устных сообщений) (например, либо личного (живого), либо в записи). В отчете также может содержаться информация для медицинского работника (например, врача) о том, что пациент может получить пользу от лечения антителами против Abeta или с высокой вероятностью будет отвечать на такое лечение.
Также в настоящем документе предусмотрены наборы для обнаружения наличия полиморфизма или определения генотипа пациента по образцу. Наборы по настоящему изобретению имеют ряд вариантов воплощений. В некоторых вариантах воплощения набор включает контейнр, этикетку на упомянутом контейнере и композицию, содержащуюся в упомянутом контейнере, где композиция включает одно или несколько первичных антител, которые связываются с одной или несколькими целевыми полипептидными последовательностями, соответствующими аутоантителу к SNP, а этикетка на контейнере указывает на то, что композиция может быть использована для оценки наличия одного или нескольких целевых белков, по меньшей мере, в одном типе клеток млекопитающих, и инструкции по применению антител для оценки наличия одного или нескольких целевых белков, по меньшей мере, в одном типе клеток млекопитающих. Набор также может дополнительно включать ряд инструкций и материалов по подготовке образца ткани и применению антитела и зонда к одному и тому же срезу образца ткани. Набор может включать как первичные, так и вторичные антитела, где вторичное антитело конъюгировано с меткой, например, ферментативной меткой.
Способы и композиции для диагностики и обнаружения
В некоторых вариантах воплощения любые антитела против Abeta, предусмотренные в настоящем документе, используются для обнаружения наличия Abeta в биологическом образце. Термин «обнаружение», использованный в настоящем документе, включает качественное или количественное обнаружение. В некоторых вариантах воплощения биологический образец включает клетку или ткань, например, сыворотку, плазму, назальный мазок, мокроту, спинномозговую жидкость, водянистую влазу глаза и тому подобное, или образцы ткани или клеток, полученные из организма, например, образцы, содержащие нервную ткань или ткань головного мозга.
В одном из вариантов воплощения предусмотрено антитело против Abeta для применения в способе диагностики или обнаружения. В еще одном аспекте предусмотрен способ обнаружения наличия Abeta в биологическом образце. В некоторых вариантах воплощения способ включает контакт биологического образца с антителом против Abeta, как это описано в настоящем документе, в жестких условиях, подходящих для связывания антитела против Abeta с Abeta, и обнаружение образования комплекса между антителом против Abeta и Abeta. Такой способ может представлять собой способ in vitro или in vivo.
Примерами расстройств, которые могут быть диагностированы с использованием антитела по настоящему изобретению, являются заболевания и расстройства, вызванные амилоидом или амилоид-подобными белками или ассоциированные с амилоидом или амилоид-подобными белками. Такие заболевания и расстройства включают заболевания и расстройства, вызыванные наличием или активностью амилоид-подобных белков в мономерном, фибриллярном или полимерном состоянии или любой их комбинацией, включая амилоидные бляшки, но не ограничиваясь этим. Примеры заболеваний включают вторичный амилоидоз и старческий амилоидоз, но не ограничиваются ими, например, примеры заболеваний включают неврологические расстройства, такие как болезнь Альцгеймера («AD»), заболевания или состояния, характеризующиеся потерей когнитивных способностей памяти, такие как, например, умеренные когнитивные нарушения (MCI), деменция с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом (голландский тип), комплекс паркинсонизм-деменция Гуама и другие заболевания, обусловленные амилоид-подобными белками или связанные с амилоид-подобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз, болезнь Крейтцфельдта-Якоба, болезнь Паркинсона, ВИЧ-ассоциироанная деменция, ALS (боковой амиотрофический склероз), миозит с включенными тельцами (IBM), диабет зрелого возраста, эндокринная опухоль и старческий амилоидоз сердца, и различные глазные заболевания, в том числе макулодистрофию, оптическую нейропатию, связанную с друзами, глаукому и катаракту вследствие отложения бета-амилоида, но не ограничиваясь этим.
В некоторых вариантах воплощения предусмотрены меченые антитела против Abeta. Метки включают, но не ограничиваются ими, метки или фрагменты, которые обнаруживают напрямую (такие как флуоресцентные, хромофорные, электронноплотные, хемилюминесцентные и радиоактивные метки), а также фрагменты, такие как ферменты или лиганды, которые обнаруживают ненапрямую, например, с помощью ферментативной реакции или молекулярного взаимодействия. Примеры меток включают, но не ограничиваются ими, радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светляков и бактериальную люциферазу (патент США номер 4,737,456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы Сахаров, например, глюкооксидазу, галактооксидазу и глюкозо-6-фосфат дегидрогеназу, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, связанные с ферментом, который использует перикись водорода для окисления предшественника красителя, таким как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, метки бактериофаги, стабильные свободные радикалы и тому подобное.
Настоящее раскрытие также предусматривает применения агента для обнаружения полиморфизма в аллеле гена CLUSTERIN in vitro. В некоторых вариантах воплощения предусмотрен агент для обнаружения аллеля гена CLUSTERIN для определения пациента, имеющего раннюю AD, легкую AD или от легкой до умеренной AD, который с высокой вероятностью будет отвечать на лечение, включающее антитело против Abeta. В некоторых вариантах воплощения с помощью агента можно обнаруживать наличие аллеля гена CLUSTERIN с нуклеотидом Т в SNP rs1532278 или его эквивалентного аллеля.
Фармацевтические композиции
Фармацевтические композиции антител против Abeta, описанные в настоящем документе, получают смешиванием такого антитела или молекулы, имеющей желаемую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)) в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители обычно являются нетоксичными для реципиентов в применяемых дозировках и концентрациях и включают буферы, такие как фосфатный, цитратный и другие буферы на основе органических кислот; антиоксиданты, в том числе аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмоний хлорид; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метилпарабен или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (меньше примерно 10 остатков) полипептиды; белки, такие как альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные сурфактанты, такие как полиэтиленгликоль (PEG), но не ограничиваясь этим. Примеры фармацевтически приемлемых носителей в настоящем документе дополнительно включают агенты для диспергирования лекарственных средств в интерстициальном пространстве, такие как растворимые гликопротеины гиалуронидазы, активные в нейтральных условиях (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые примеры sHASEGP и способы их применения, включая rHuPH20, описаны в опубликованных заявках на патент США номер 2005/0260186 и 2006/0104968. В одном из аспектов sHASEGP комбинируют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
В одном из вариантов воплощения антитело по настоящему изобретению может быть составлено в буфере, содержащем аргинин. В одном из аспектов буфер, содержащий аргинин, может представлять собой буфер на основе сукцината аргинина. В одном из таких аспектов концентрация буфера на основе сукцината аргинина может составлять 50 мМ или выше. В другом таком аспекте концентрация буфера на основе сукцината аргинина может составлять 100 мМ или больше. В другом таком аспекте концентрация буфера на основе сукцината аргинина может составлять 150 мМ или больше. В другом таком аспекте концентрация буфера на основе сукцината аргинина может составлять 200 мМ или больше. В другом аспекте композиция с буфером, содержащим аргинин, может дополнительно включать сурфактант. В другом таком аспекте сурфактант представляет собой полисорбат. В другом таком аспекте полисорбат представляет собой полисорбат 20. В другом таком аспекте концентрация полисорбата 20 в композиции составляет 0,1% или меньше. В другом таком аспекте концентрация полисорбата 20 в композиции составляет 0,05% или меньше. В другом аспекте рН композиции с буфером, содержащим аргинин, находится в диапазоне между 4,5 и 7,0. В другом аспекте рН композиции с буфером, содержащим аргинин, находится в диапазоне между 5,0 и 6,5. В другом аспекте рН композиции с буфером, содержащим аргинин, находится в диапазоне между 5,0 и 6,0. В другом аспекте рН композиции с буфером, содержащим аргинин, составляет 5,5. В любых нижеследующих вариантах воплощения и аспектах антитело по настоящему изобретению может представлять собой кренезумаб.
Примеры лиофилизированных композиций антител описаны в патенте США номер 6,267,958. Водные композиции антител включают композиции, которые описаны в патенте США номер 6,171,586 и WO2006/044908, где последние композиции включают гистидин-ацетатный буфер.
Композиция в настоящем документе может также содержать больше одного активного ингредиента, если это необходимо в случае конкретного показания, подвергающегося лечению, предпочтительно, активные ингредиенты представляют собой активные ингредиенты с комплементарными активностями, которые не оказывают отрицательного влияния друг на друга. Например, может быть желательно дополнительно предусмотреть одно или несколько соединений для предотвращения или лечения симптомов болезни Альцгеймера. Такие активные ингредиенты присутствует в комбинации в надлежащих количествах, которые являются эффективными для конкретной цели.
Активные ингредиенты могут быть заключены в микрокапсулы, полученные, например, методами коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилатные) микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, при этом матрицы имеют вид формованных изделий, например, пленок или микрокапсул.
Лекарственные формы для введения in vivo обычно являются стерильными. Стерильность легко может быть достигнута, например, путем фильтрации через стерильные фильтрационные мембраны.
Способы лечения и композиции
Как показано в настоящем документе, внутривенное введение кренезумаба приводит к снижению прогрессирования заболевания у пациентов, страдающих от AD. В частности, было показано, что у пациентов с легкой до умеренной AD, в том числе у пациентов с легкой AD и пациентов с положительным статусом по АроЕ4, а также у пациентов, у которых в головном мозге наблюдались отложения амилоида, типичные для пациентов с диагностированной AD, происходит снижение скорости когнитивных ухудшений в случае лечения кренезумабом по сравнению с лечением плацебо. Чем легче форма заболевания по оценке баллов по шкале MMSE, тем более сильное замедление ухудшений наблюдается в группе пациентов, получающих лечение, по сравнению с группой пациентов, получающих плацебо. Эти результаты были дополнительно подтвеждены другими свидетельствами действия кренезумаба на мишень, в том числе увеличением уровней Abeta, обнаруживаемых в спинномозговой жидкости, и снижением накопления амилоида в головном мозге. Более того, сравнительно высокая доза антитела - 15 мг/кг - не приводила к увеличению частоты возникновения нежелательных явлений по типу ARIA, которое наблюдалось в ходе исследований других антител против Abeta.
Поэтому в одном из вариантов воплощения антитело по настоящему изобретению используется для лечения AD, в том числе от легкой до умеренной AD, легкой AD и ранней AD. В другом варианте воплощения антитело по настоящему изобретению используется для лечения амилоидоза. В одном из таких вариантов воплощения амилоидоз представляет собой умеренные когнитивные нарушения. В другом таком варианте воплощения амилоидоз представляет собой синдром Дауна. В другом таком варианте воплощения амилоидоз представляет собой наследственную церебральную геморрагию с амилоидозом (голландского типа). В другом таком варианте воплощения амилоидоз представляет собой комплекс паркинсонизм-деменция Гаума. В другом таком варианте воплощения амилоидоз представляет собой глазное заболевание, связанное с друзами или другими отложениями амилоида в глазу. В одном из аспектов глазное заболевание представляет собой макулодистрофию. В другом аспекте глазное заболевание представляет собой оптическую нейропатию, связанную с друзами. В другом аспекте глазное заболевание представляет собой глаукому. В другом аспекте глазное заболевание представляет собой катаракту. В любых нижеследующих вариантах воплощения и аспектах антитело по настоящему изобретению может представлять собой кренезумаб.
Пациента, как правило, в первую очередь оценивали на наличие одного или нескольких амилоидозов до определения пригодности антитела по настоящему изобретению для лечения такого пациента. В качестве одного неограничивающего примера AD может быть диагностирована у пациента с использованием шкалы нейропсихологических диагностических критериев «NINCDS-ADRDA» (разработанной Национальными институтами неврологических и коммуникативных нарушений и инсульта (National Institutes of Neurological and Communicative Disorders and Stroke, NINCDS) и Ассоциацией болезни Альцгеймера и родственных нарушений (Alzheimer's disease and Related Disoders Association, ADRDA)). Смотрите McKhann, et al., 1984, Neurology 34: 939-44. Пациент, которому потенциально будет вводиться одно или несколько антител по настоящему изобретению, также может быть протестирован на наличие или отсутствие одного или нескольких генетических маркеров, на основании чего такой пациент может либо (i) иметь более высокую или более низкую вероятность возникновения одного или нескольких амилоидозов, либо (ii) иметь более высокую или более низкую вероятность возникновения нежелательных явлений или побочных эффектов в процессе введения антитела по настоящему изобретению. В качестве одного неограничивающего примера, известно, что пациенты, несущие аллель гена ароЕ4, имеют значительно более высокий риск развития AD, чем те пациенты, у которых отсутствует этот аллель (Saunders et al., Neurology 1993; 43: 1467-72; Prekumar et al., Am. J. Pathol. 1996; 148: 2083-95), и что для таких пациентов непропорционально часто регестрировались нежелательные явления по типу ARIA, наблюдаемые в ходе клинического исследования бапинейзумаба, другого антитела против Abeta (Sperling et al., Alzheimer's & Dementia 2011, 7: 367-385; Salloway et al., N. Engl. J. Med. 2014, 370: 322-333).
В некоторых вариантах воплощения антитело по настоящему изобретению используют для лечения от легкой до умеренной AD у пациента. Пациент может иметь положительный статус по АроЕ4 или отрицательный статус по АроЕ4. В некоторых вариантах воплощения антитело по настоящему изобретению используют для лечения легкой AD. В некоторых вариантах воплощения антитело по настоящему изобретению используют для лечения пациента с положительным статусом по АроЕ4, страдающего от легкой до умеренной AD или легкой AD. В некоторых вариантах воплощения антитело по настоящему изобретению используют для лечения пациента, страдающего от легкой AD.
В некоторых вариантах воплощения антитело по настоящему изобретению используют для лечения пациента, который набрал по шкале MMSE от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов. В некоторых вариантах воплощения пациент набрал по шкале MMSE от 22 до 26 баллов. Использованные в настоящем документе диапазоны баллов по шкале MMSE между двумя числами включают числа на обоих концах диапазонов. Например, диапазон баллов по шкале MMSE от 22 до 26 включает 22 и 26 баллов по шкале MMSE.
В некоторых вариантах воплощения антитела по настоящему изобретению используют для лечения пациента, который является «положительным по амилоиду», например, пациента, у которого в головном мозге наблюдаются отложения амилоида, типичные для пациента с диагностированной AD, или пациента с положительными результатами PET сканирования с флорбетапиром. В некоторых вариантах воплощения антитела по настоящему изобретению используют для снижения накопления отложений амилоида в головном мозге или нейритических бляшек (т.е. для снижения увеличения отложения амилоида в головном мозге).
Более того, антитела по настоящему изобретению используют для лечения от легкой до умеренной AD без увеличения частоты возникновения ARIA-E или ARIA-H. В некоторых вариантах воплощения пациенты страдают от легкой AD. В некоторых вариантах воплощения пациенты имеют положительный статус по АроЕ4. В некоторых вариантах воплощения пациенты имеют положительный статус по АроЕ4 и страдают от легкой формы AD.
Как видно из Примеров, приведенных в настоящем документе, терапевтический эффект увеличивается у пациентов с более легкими формами AD. Следовательно, в некоторых вариантах воплощения антитело по настоящему изобретению используют для лечения пациента с ранней AD. В некоторых вариантах воплощения пациент, подлежащий лечению, имеет одну или несколько из следующих характеристик: (а) умеренные когнитивные нарушения (MCI) вследствие AD; (b) один или несколько биомаркеров, свидетельствующих о болезни Альцгеймера без клинически регистрируемых дефицитов; (с) объективная потеря памяти, оцененная в 27 баллов или выше с помощью теста на селективное запоминание с подсказками и без подсказок (FCSRT); 24-30 баллов по шкале MMSE; (d) суммарное значение по клинической шкале оценки деменции (CDR), равное 0,5; и (е) положительное заключение PET сканирования о наличии амилоида (сделанное квалифицированным специалистом).
В другом аспекте в настоящем документе предусмотрены способы лечения AD у пациентов, страдающих от ранней, легкой или от легкой до умеренной AD, включающие введение указанному пациенту антитела против Abeta в количестве, которое является эффективным для лечения AD, где пациент имеет, по меньшей мере, один аллель гена CLUSTERIN с SNP rs1532278, содержащим Т, или его эквивалентный аллель. В настоящем документе предусмотрены способы, композиции и инструменты для обнаружения или определения наличия или отсутствия определенного SNP, см. ниже.
Антитела по настоящему изобретению получают в виде композиций, дозируют и вводят способами, соответствующими надлежащей медицинской практике. Факторы, которые следует учитывать в этом контексте, включают конкретное расстройство, подвергаемое лечению, конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельного субъекта, причину расстройства, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам.
Способы введения
Антитело по настоящему изобретению (и любой дополнительный терапевтический агент) можно вводить любым подходящим способом, включая парентеральное, внутрилегочное и интраназальное и, если желательно местное лечение, внутриочаговое введение. Парентеральная инфузия включает внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может быть осуществлено любым подходящим способом, например, путем инъекций, таких как внутривенные или подкожные инъекции, частично, в зависимости от того, является ли введение однократным или хроническим. В одном из вариантов воплощения антитело инъецируют подкожно. В другом варианте воплощения антитело инъецируют внутривенно. В другом варианте воплощения антитело вводят с использованием шприца (например, предварительно наполненного шприца или не предварительно наполненного шприца) или автоинъектора. В другом варианте воплощения антитело вводят путем ингаляции.
Дозирование
Для лечения амилоидоза подходящяя дозировка антитела по настоящему изобретению (используемого как такового или в комбинации с одним или несколькими другими дополнительными терапевтическими агентами) будет зависеть от конкретного типа заболевания, подлежащего лечению, типа антитела, тяжести и течения заболевания, предшествующей терапии, клинической истории пациента и ответа на антитело и назначений лечащего врача. Антитело подходит для однократного или многократного введения пациенту. В настоящем документе предусмотрены различные схемы дозирования, в том числе однократное или многократное введение в разные моменты времени, болюсное введение и импульсная инфузия, но не ограничиваясь этим.
В зависимости от типа и тяжести заболевания начальная дозировка антитела для введения пациенту, например, путем одного или нескольких введений или путем нерерывной инфузии может составлять примерно от 0,3 мг/кг до 100 мг/кг (например, 15 мг/кг-100 мг/кг или любая дозировка в пределах этого диапазона). Одна типичная ежедневная доза может составлять от примерно 15 мг/кг до 100 мг/кг или больше, в зависимости от факторов, упомянутых выше. Доза может быть введена в виде однократной дозы или в виде раздельных доз (например, две дозы 15 мг/кг составляют суммарную дозу 30 мг/кг). Для повторных введений на протяжении нескольких недель или дольше, в зависимости от состояния, лечение обычно будет продолжаться до достижения желаемого подавления симптомов заболевания. В одном из примеров дозировка антитела будет находиться в диапазоне от примерно 10 мг/кг до примерно 50 мг/кг. Таким образом, пациенту может быть введена одна или несколько доз, составляющих примерно 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2,0 мг/кг, 3 мг/кг, 4,0 мг/кг, 5 мг/кг, 10 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг, 40 мг/кг, 50 мг/кг, 60 мг/кг, 70 мг/кг, 80 мг/кг, 90 мг/кг или 100 мг/кг (или любая их комбинация). В некоторых вариантах воплощения суммарная вводимая доза находится в диапазоне от 50 мг до 2500 мг. Примером дозы, которая может быть введена пациенту, является доза примерно 50 мг, примерно 100 мг, 200 мг, 300 мг, 400 мг, примерно 500 мг, примерно 600 мг, примерно 700 мг, примерно 720 мг, примерно 1000 мг, примерно 1050 мг, примерно 1100 мг, примерно 1200 мг, примерно 1300 мг, примерно 1400 мг, примерно 1500 мг, примерно 1600 мг, примерно 1700 мг, примерно 1800 мг, примерно 1900 мг, примерно 2000 мг, примерно 2050 мг, примерно 2100 мг, примерно 2200 мг, примерно 2300 мг, примерно 2400 мг или примерно 2500 мг (или любая их комбинация). Такие дозы могут вводиться периодически, например, каждую неделю, каждые две недели, каждые три недели, каждые четыре недели, каждый месяц, каждые два месяца, каждые три месяца или каждые шесть месяцев. В некоторых вариантах воплощения пациент получает от одной до тридцати пяти доз (например, примерно восемнадцать доз антитела). Тем не менее, могут использоваться другие режимы дозирования. Прогресс этой терапии можно контролировать с помощью обычных методов и анализов.
В некоторых вариантах воплощения антитело по настоящему изобретению вводят в дозе 15 мг/кг, 30 мг/кг, 40 мг/кг, 45 мг/кг, 50 мг/кг, 60 мг/кг или в постоянной дозе, например, 300 мг, 500 мг, 700 мг, 800 мг или выше. В некоторых вариантах воплощения дозу вводят путем внутривенной инъекции каждые 2 недели или каждые 4 недели на протяжении периода времени. В некоторых вариантах воплощения дозу вводят путем подкожной инъекции каждые 2 недели или каждые 4 недели на протяжении периода времени. В некоторых вариантах воплощения период времени составляет 6 месяцев, один год, восемнадцать месяцев, два года, пять лет, десять лет, 15 лет, 20 лет или равен времи жизни пациента.
Контроль /оценка ответа на терапевтическое лечение
В соответствии со способами согласно настоящему раскрытию антитело или его антигенсвязывающий фрагмент предусматривает терапевтический эффект или пользу для пациента. В некоторых вариантах воплощения терапевтическая польза представляет собой снижение или ингибирование прогрессирования AD или замедление клинического, функционального или когнитивного ухудшения. В некоторых вариантах воплощения терапевтический эффект или польза находят отражение в «ответе пациента» или «ответе» (и грамматические варианты этих терминов). Ответ пациента можно оценить, используя любую конечную точку, свидетельствующую о пользе для пациента, включая, без ограничения, (1) ингибирование, до некоторой степени, прогрессирования заболевания, включая замедление и полную остановку прогрессирования заболевания; (2) снижение количества бляшек или снижение накопления амилоида в головном мозге; (3) улучшение одного или нескольких показателей оценки, включая шкалы ADAS-Cog, iADL и CDR-SOB, но не ограничиваясь ими; (4) улучшение ежедневного функционирования пациента; (5) увеличение концентрации одного или нескольких биомаркеров, например, Abeta, в спинномозговой жидкости; и (6) уменьшение уровня одного или нескольких биомаркеров, свижетельствующих о наличии AD. Оценка ответа пациента также может включать оценку любых нежелательных явлений, которые могут возникать и которые могут коррелировать с лечением.
В одном из вариантов воплощения когнитивные способности и ежедневные функции пациента оценивают до, во время и/или после курса терапии антителом по настоящему изобретению. Для оценки, диагностики и балльной оценки психической функции, когнитивнвх способностей и неврологического дефицита был разработан ряд инструментов когнитивной и функциональной оценки. Эти инструменты включают ADAS-Cog, в том числе 12-пунктный ADAS-Cog (ADAS-Cog12), 13-пунктный ADAS-Cog (ADAS-Cog13), 14-пунктный ADAS-Cog (ADAS-Cog14); CDR-SOB, включая компоненты CDR «Принятие решений и решение задач» и CDR «Память»; шкалу инструментальной активности в повседневной жизни (iADL); и MMSE, но не ограничиваются ими.
«ADAS-Cog» относится к шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений, комплексному анализу когнитивных способностей. Смотрите Rosen et al., 1984, Amer. J. Psych. 141: 1356-1364; Mohs et al., 1997, Alzheimer's Disease Assoc. Disorders 11(2): S13-S21. Чем выше число баллов по шкале ADAS-Cog, тем сильнее у тестируемого пациента наблюдается дефицит или нарушение по сравнению с другим индивидуумом, набравшим меньше баллов. ADAS-Cog может быть использована в качестве единственного измерения, позволяющего оценить, является от лечение AD терапевтически эффективным. Увеличение числа набранных баллов по шкале ADAS-Cog может свидетельствовать об ухудшении состояния пациента, тогда как уменьшение числа набранных баллов по шкале ADAS-Cog может указывать на улудшение состояния пациента. Использованные в настоящем документе «ухудшение в выполнении ADAS-Cog» или «увеличение числа баллов по шкале ADAS-Cog» указывают на ухудшение состояния пациента, и могут отражать прогрессирование AD. ADAS-Cog представляет собой набор тестов, проводимых экзаменатором, для оценки множества когнитивных составляющих, включая память, понимание, праксис, ориентирование и спонтанную речь (Rosen et al. 1984, Am J Psychiatr 141: 1356-64; Mohs et al. 1997, Alzheimer Dis Assoc Disord 11(S2): S13-S21). ADAS-Cog представляет собой стандартную первичную конечную точку в исследованиях лечения AD (Mani 2004, Stat Med 23: 305-14). ADAS-Cog12 представляет собой 70-пунктную версию ADAS-Cog плюс 10-пунктный тест на отсроченное припоминание, оценивающий припоминание списка выученных слов. Другие шкалы ADAS-Cog включают ADAS-Cog13 и ADAS-Cog14.
В некоторых вариантах воплощения предусмотренные в настоящем документе способы лечения предусматривают замедление ухудшения когнитивных способностей, измеряемого с помощью шкалы ADAS-Cog, где ухудшение замедлено, по меньшей мере, примерно на 30%, по меньшей мере, примерно на 35%, по меньшей мере, примерно на 40% или, по меньшей мере, примерно на 45% относительно плацебо.
«MMSE» относится к краткой шкале оценки психического статуса, которая предусматривает шкалу в диапазоне от 1 до 30. Смотрите Folstein, et al., 1975, J. Psychiatr. Res. 12: 189-98. Баллы 26 и ниже обычно свидетельствуют о дефиците. Чем ниже число баллов по шкале MMSE, тем сильнее у тестируемого пациента наблюдается дефицит или нарушение по сравнению с другим индивидуумом с более низкой оценкой. Увеличение числа набранных баллов по шкале MMSE может свидетельствовать об улучшении состояния пациента, тогда как уменьшение числа набранных баллов по шкале MMSE может указывать на ухудшение состояния пациента.
«CDR-SOB» относится к клинической шкале оценки деменции с помощью суммы боксированных баллов. Смотрите Hughes et al., 1982. В CDR оцениваются 6 компонентов: память, ориентирование, принятие решений/решение проблем, социальные связи, работа по дому и хобби и личная гигиена. Тест проходят как пациент, так и опекун, и каждый компонент (или каждый «бокс») оценивается по шкале от 0 до 3. Полная шкала CDR-SOB основана на сумме баллов для всех 6 боксов. Также могут быть получены свои баллы для каждого из боксов или компонентов по отдельности, например, CDR/ Память или CDR/ Принятие решений и решение проблем. Использованные в настоящем документе термины «ухудшение в выполнении CDR-SOB» или «увеличение числа баллов по шкале CDR-SOB» указывают на ухудшение состояния пациента, и могут отражать прогрессирование AD. В некоторых вариантах воплощения предусмотренные в настоящем документе способы лечения предусматривают замедление ухудшения в выполнении CDR-SOB, по меньшей мере, примерно на 30%, по меньшей мере, примерно на 35%) или, по меньшей мере, примерно на 40% относительно плацебо.
«iADL» относится к шкале инструментальной активности в повседневной жизни. Смотрите Lawton, М.Р. и Brody, Е.М., 1969, Gerontologist 9: 179-186. Эта шкала измеряет способность справляться с обычными ежедневными действиями, такими как ведение домашнего хозяйства, стирка, пользование телефоном, совершение покупок, приготовление пищи и т.п. Чем ниже количество баллов, тем больше у индивидуума нарушена активность в повседневной жизни. В некоторых вариантах воплощения предусмотренные в настоящем документе способы лечения предусматривают замедление ухудшения, по меньшей мере, примерно на 10%, по меньшей мере, примерно на 15% или, по меньшей мере, примерно на 20% по шкале iADL относительно плацебо.
Отложение амилоида в головном мозге можно определить, используя методы и инструменты неврологической визуализации, например, используя PET (позитронно-эмиссионную томографию) сканирование. Серии PET сканирований пациента, сделанные в течение периода времени, например, до и после применения лечения (или с одним или несколькими интервалами на протяжении курса лечения), могут помочь обнаружить увеличение, уменьшение отложения амилоида в головном мозге или отсутствие изменений в отложении амилоида в головном мозге. Этот метод также может быть использован для определения увеличения или уменьшения накопления амилоида. В некоторых вариантах воплощения обнаружение отложений амилоида в головном мозге осуществляют с использованием флорбетапира (florbetapir) 18F. В некоторых вариантах воплощения результаты PET сканирования с флорбетапиром считают положительными, если на центрированном визуальном изображении результата сканирования определяется наличие от умеренно до часто встречающихся нейритических бляшек.
Совместное введение
Антитело не обязательно должно, но может быть получено в виде композиции с одним или несколькими агентами, используемыми в настоящее время для предотвращения или лечения рассматриваемого расстройства или одного или нескольких его симптомов. Эффективное количество таких агентов зависит от количества антитела, присутствующего в композиции, типе расстройства или лечения и других факторов, обсуждаемых выше. Обычно они используются в тех же самых дозировках и с примением тех же способов введения, которые описаны в настоящем документе, или в дозировках, составляющих примерно от 1 до 99% от дозировок, описанных в настоящем документе, или в любых дозировках и с применеием любых способов введения, которые эмпирическим/клиническим путем были определены как подходящие. Специалисту в данной области техники будет понятно, что антитело по настоящему изобретению может совместно вводиться одновременно с любым упомянутым ниже соединением или может вводиться до или после введения любых упомянутых ниже соединений.
При лечении амилоидоза антителом по настоящему изобретению может совместно вводиться неврологическое лекарственное средство. Такое неврологическое лекарственное средство может быть выбрано из группы, включающей, но не ограничивающейся антителом или другой связывающей молекулой (в том числе низкомолекулярным соединением, пептидом, аптамером или другой белковой связывающей молекулой, но не ограничиваясь этим), которая специфически связывается с мишенью, выбранной из бета-секретазы, тау-белка, пресенилина, белка-предшественника амилоида или его частей, пептидов бета-амилоида или их олигомеров или фибрилл, рецептора смерти 6 (DR6), рецептора для конечных продуктов гликирования (RAGE), паркина и гентингтина; ингибитора холинэстеразы (т.е. галантамина, донепезила, ривастигмина и такрина); антагониста NMDA-рецептора (т.е. мемантина), деплетора моноамина (т.е. тетрабеназина); эрголоид мезилата; антихолинергического агента против паркинсонизма (т.е. проциклидина, дифенгидрамина, тригексилфенидила, бензатропина, биперидена и тригексифенидила); дофаминергического агента против паркинсонизма (т.е. энтакапона, селегилина, прамипексола, бромокриптина, ротиготина, селегилина, ропинирола, разагилина, апоморфина, карбидопы, леводопы, перголида, толкапона и амантадина); тетрабеназина; противовоспалительного агента (в том числе нестероидного противовоспалительного препарата (т.е. индометацина и других соединений, перечисленных выше), но не ограничиваясь этим); гормона (т.е. эстрогена, прогестерона и лейпролида); витамина (т.е. фолата и никотинамида); димеболина (dimebolin); гомотаурина (т.е. 3-аминопропансульфоновой кислоты; 3APS); модулятора активности серотонинового рецептора (т.е. ксалипродена (xaliproden)); интерферона и глюкокортикоида или кортикостероида. В некоторых вариантах воплощения совместно вводятся одно или несколько антител против Abeta, отличных от кренезумаба. Неограничивающие примеры таких антител против Abeta включают соланезумаб, бапинейзумаб, адуканумаб и гантенерумаб (gantenerumab). Термин «кортикостероид» включает флутиказон (в том числе флутиказона пропионат (FP)), беклометазон, будесонид, циклезонид, мометазон, флунизолид, бетаметазон и триамцинолон, но не ограничиваясь этим. Термин «ингаляционный кортикостероид» означает кортикостероид, который подходит для доставки с помощью ингаляции. Примерами ингаляционных кортикостероидов являются флутиказон, беклометазон дипропионат, будесонид, мометазона фуроат, циклезонид, флунизолид и триамцинолона ацетонид.
При лечении амилоидоза, который представляет собой глазное заболевание или расстройство, антителом по настоящему изобретению может быть выбрано неврологическое лекарственное средство, которое является анти-ангиогенным офтальмологическим агентом (т.е. бевацизумаб, ранибизумаб и пегаптаниб), офтальмологическим агентом против глаукомы (т.е. карбахол, эпинефрин, демекарий бромид, апраклонидин, бримонидин, бринзоламид, левобунолол, тимолол, бетаксолол, дорзоламид, биматопрост, картеолол, метипранолол, дипивефрин, травопрост и латанопрост), ингибитором карбоангидразы (т.е. метазоламид и ацетазоламид), офтальмологическим антигистаминовым агентом (т.е. нафазолин, фенилэфрин и тетрагидрозолин), офтальмологическим смазывающим агентом, офтальмологическим стероидом (т.е. флуорометолон, преднизолон, лотопреднол (loteprednol), дексаметазон, дифлупреднат, римексолон, флуоцинолон, медризон и триамцинолон), офтальмологическим обезболивающим агентом (т.е. лидокаин, пропаракаин и тетракаин), офтальмологическим противоинфекционным агентом (т.е. левофлоксацин, гатифлоксацин, ципрофлоксацин, моксифлоксацин, хлорамфеникол, бацитрацин/полимиксин b, сульфацетамид, тобрамицин, азитромицин, безифлоксацин, норфлоксацин, сульфизоксазол, гентамицин, идоксуридин, эритромицин, натамицин, грамицидин, неомицин, офлоксацин, трифлуридин, ганцикловир, видарабин), офтальмологическим противовоспалительным агентом (т.е. непафенак, кеторолак, флурбипрофен, супрофен, циклоспорин, триамцинолон, диклофенак и бромфенак) и офтальмологическим антигистаминовым агентом или противозастойным агентом (т.е. кетотифен, олопатадин, эпинастин, нафазолин, кромолин, тетрагидрозолин, пемироласт (pemirolast), бепотастин, нафазолин, фенилэфрин, недокромил, лодоксамид, фенилэфрин, эмедастин и азеластин). Понятно, что любые из перечисленных выше композиций или терапевтических способов могут быть осуществлены с использованием иммуноконъюгата по настоящему изобретению вместо антитела против Abeta или в дополнение к антителу против Abeta.
Изделия
В другом аспекте настоящего изобретения, предусмотрено изделие, содержащее материалы, используемые для лечения, предотвращения и/или диагностики расстройств, описанных выше. Изделие включает контейнер и этикетку или вкладыш в упаковку, помещенные в контейнер или связанные с контейнером. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы, мешки для растворов для внутривенных инъекций и т.п. Контейнеры могут быть сделаны из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая сама по себе или в комбинации с другой композицией является эффективной для лечения, предотвращения и/или диагностики состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой мешок с раствором для внутривенного введения или флакон, имеющий пробку, поддающуюся прокалыванию иглой для подкожной инъекции). По меньшей мере, один активный агент в композиции представляет собой антитело по настоящему изобретению. На этикетке или вкладыше в упаковку указано, что композиция используется для лечения выбранного состояния. Более того, изделие может включать (а) первый контейнер с помещенной в него композицией, где композиция включает антитело по настоящему изобретению; и (b) второй контейнер с помещенной в него композицией, где композиция включает другой цитотоксический или другой терапевтический агент. Изделие в этом варианте воплощения настоящего изобретения может дополнительно включать вкладыш в упаковку, на котором указано, что композиции могут использоваться для лечения конкретного состояния. Альтернативно или в дополнительно, изделие может необязательно включать второй (или третий) контейнер, включающий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Он может дополнительно включать другие материалы, желательные с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
Понятно, что любые из указанных выше изделий могут включать иммуноконъюгат в соответствии с настоящим изобретением вместо антитела против Abeta или в дополнение к нему.
ПРИМЕРЫ ВАРИАНТОВ ВОПЛОЩЕНИЯ
В настоящем документе в иллюстративных целях предусмотрены примеры вариантов воплощения.
1. Способ замедления ухудшения функциональных или когнитивных способностей у пациента с диагностированной ранней болезнью Альцгеймера (AD) или от легкой до умеренной болезнью Альцгеймера (AD), включающий введение пациенту, страдающему от ранней AD или от легкой до умеренной AD, гуманизированного моноклонального антитела против бета-амилоида (Аβ), которое связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, которое является эффективным для замедления ухудшения функциональных и когнитивных способностей у пациента.
2. Способ в соответствии с вариантом воплощения 1, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
3. Способ по пункту 1, в котором антитело представляет собой антитело IgG4.
4. Способ в соответствии с вариантом воплощения 2 или 3, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
5. Способ в соответствии с вариантом воплощения 4, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
6. Способ в соответствии с вариантом воплощения 5, в котором антитело представляет собой кренезумаб.
7. Способ в соответствии с любым из предыдущих вариантов воплощения, в котором ухудшение когнитивных способностей оценивают, определяя, сколько баллов набирает пациент по 12-пунктной шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений (ADAS-Cog12), 13-пунктной шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений (ADAS-Cog13) или 14-пунктной шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений (ADAS-Cog12), до и после введения указанного антитела, где замедление когнитивных ухудшений, измеренное с помощью ADAS-Cog, необязательно составляет, по меньшей мере, 30%, по меньшей мере, 35%, по меньшей мере, 40% или, по меньшей мере, 45% относительно плацебо.
8. Способ в соответствии с вариантом воплощения 7, в котором пациент имеет положительный статус по АроЕ4.
9. Способ в соответствии с вариантом воплощения 7, в котором пациент страдает от легкой AD.
10. Способ в соответствии с вариантом воплощения 7, в котором пациент страдает от ранней AD.
11. Способ по любому из вариантов воплощения 1-8, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
12. Способ в соответствии с вариантом воплощения 11, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
13. Способ по любому из предыдущих вариантов воплощения, в котором антитело вводят в дозе от 10 мг/кг до 100 мг/кг массы тела пациента.
14. Способ в соответствии с вариантом воплощения 13, в котором антитело вводят в дозе, составляющей, по меньшей мере, 15 мг/кг.
15. Способ в соответствии с вариантом воплощения 14, в котором антитело вводят в дозе, составляющей 15 мг/кг, 30 мг/кг, 45 мг/кг, 50 мг/кг или 60 мг/кг.
16. Способ в соответствии с вариантом воплощения 13 или 14, в котором антитело вводят путем внутривенной инъекции.
17. Способ по любому из вариантов воплощения 13-16, в котором антитело вводят каждые 2 недели, каждые 4 недели, каждый месяц, каждые два месяца или каждые шесть месяцев.
18. Способ лечения ранней AD или от легкой до умеренной AD без увеличения риска нежелательных явлений, включающий введение пациенту с диагностированной ранней AD или от легкой до умеренной AD количества гуманизированного моноклонального антитела против Аβ, которое связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1), которое является эффективным для лечения AD без увеличения риска возникновения нежелательных явлений, связанных с лечением, в котором нежелательные явления выбраны из (i) связанных с амилоидом аномалий, диагностируемых с помощью методов визуализации, - отека (ARIA-E) и (ii) связанных с амилоидом аномалий, диагностируемых с помощью методов визуализации, - геморрагии (ARIA-H).
19. Способ в соответствии с вариантом воплощения 18, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
20. Способ в соответствии с вариантом воплощения 18, в котором антитело представляет собой антитело IgG4.
21. Способ в соответствии с вариантом воплощения 18, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
22. Способ в соответствии с вариантом воплощения 20, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
23. Способ в соответствии с вариантом воплощения 22, в котором антитело представляет собой кренезумаб.
24. Способ по любому из вариантов воплощения 18-23, в котором пациент имеет положительный статус по АроЕ4.
25. Способ по любому из вариантов воплощения 18-23, в котором нежелательные явления представляют собой ARIA-E.
26. Способ в соответствии с вариантом воплощения 25, в котором, если в процессе лечения обнаруживают ARIA-E, введение антитела останавливают и, необязательно, применяют лечение против ARIA-E.
27. Способ в соответствии с вариантом воплощения 26, дополнительно включающий возобновление введения указанного антитела после устранения ARIA-E, при этом антитело вводят в более низкой дозе, чем до остановки лечения.
28. Способ в соответствии с вариантом воплощения Error! Reference source not found., в котором, если в процессе лечения указанным антителом у пациента обнаруживают один или несколько новых ARIA-E, введение антитела далее не проводят и, необязательно, пациенту вводят кортикостероид.
29. Способ в соответствии с вариантом воплощения 28, в котором пациент имеет положительный статус по АроЕ4.
30. Способ замедления ухудшения функциональных или когнитивных способностей у пациента с диагностированной ранней болезнью Альцгеймера (AD) или от легкой до умеренной болезнью Альцгеймера (AD), включающий введение пациенту, имеющему положительный статус по АроЕ4, страдающему от ранней AD или от легкой до умеренной AD, гуманизированного моноклонального антитела против бета-амилоида (Аβ), которое связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, которое является эффективным для замедления ухудшения функциональных и когнитивных способностей у пациента.
31. Способ в соответствии с вариантом воплощения 30, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
32. Способ в соответствии с вариантом воплощения 30, в котором антитело представляет собой антитело IgG4.
33. Способ в соответствии с вариантом воплощения 31 или 32, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
34. Способ в соответствии с вариантом воплощения 33, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
35. Способ в соответствии с вариантом воплощения 34, в котором антитело представляет собой кренезумаб.
36. Способ по любому из вариантов воплощения 30-36, в котором ухудшение когнитивных способностей оценивают, определяя, сколько баллов набирает пациент по шкале ADAS-Cog12, ADAS-Cog13 или ADAS-Cog14 до и после введения указанного антитела, где замедление когнитивных ухудшений, измеренное с помощью ADAS-Cog, необязательно составляет, по меньшей мере, 30%, по меньшей мере, 35%, по меньшей мере, 40% или, по меньшей мере, 45% относительно плацебо.
37. Способ в соответствии с вариантом воплощения 36, в котором пациент имеет легкую AD.
38. Способ в соответствии с вариантом воплощения 36, в котором пациент имеет раннюю AD.
39. Способ по любому из вариантов воплощения 30-37, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
40. Способ в соответствии с вариантом воплощения 39, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
41. Способ по любому из вариантов воплощения 30-39, в котором антитело вводят в дозе от 10 мг/кг до 100 мг/кг массы тела пациента.
42. Способ в соответствии с вариантом воплощения 41, в котором антитело вводят в дозе, составляющей, по меньшей мере, 15 мг/кг.
43. Способ в соответствии с вариантом воплощения 42, в котором антитело вводят в дозе, составляющей 15 мг/кг, 30 мг/кг, 45 мг/кг, 50 мг/кг или 60 мг/кг.
44. Способ в соответствии с вариантом воплощения 41 или 42, в котором антитело вводят путем внутривенной инъекции.
45. Способ по любому из вариантов воплощения 41-44, в котором антитело вводят каждые 2 недели, каждые 4 недели, каждый месяц, каждые два месяца или каждые шесть месяцев.
46. Способ лечения ранней AD или от легкой до умеренной AD без увеличения риска нежелательных явлений, включающий введение пациенту, имеющему положительный статус по АроЕ4, с диагностированной ранней AD или от легкой до умеренной AD количества гуманизированного моноклонального антитела против Аβ, которое связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1), которое является эффективным для лечения AD без увеличения риска возникновения нежелательных явлений, связанных с лечением, в котором нежелательные явления выбраны из (i) связанных с амилоидом аномалий, диагностируемых с помощью методов визуализации, - отека (ARIA-E) и (ii) связанных с амилоидом аномалий, диагностируемых с помощью методов визуализации, - геморрагии (ARIA-H).
47. Способ в соответствии с вариантом воплощения 46, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
48. Способ в соответствии с вариантом воплощения 46, в котором антитело представляет собой антитело IgG4.
49. Способ в соответствии с вариантом воплощения 46, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
50. Способ в соответствии с вариантом воплощения 48, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
51. Способ в соответствии с вариантом воплощения 50, в котором антитело представляет собой кренезумаб.
52. Способ по любому из вариантов воплощения 46-51, в котором нежелательные явления представляют собой ARIA-E.
53. Способ в соответствии с вариантом воплощения 52, в котором при обнаружении ARIA-E, возникших в результате лечения, введение антитела останавливают и, необязательно, применяют лечение против ARIA-E.
54. Способ в соответствии с вариантом воплощения 53, дополнительно включающий возобновление введения указанного антитела после устранения ARIA-E, необязательно включающий возобновление введения указанного антитела в более низкой дозе, чем до остановки введения.
55. Способ в соответствии с вариантом воплощения 46, в котором, если в процессе лечения указанным антителом у пациента обнаруживают один или несколько новых ARIA-E, введение антитела далее не проводят и, необязательно, пациенту вводят кортикостероид.
56. Способ по любому из предыдущих вариантов воплощения, в котором пациента параллельно лечат одним или несколькими агентами, выбранными из группы, состоящей из терапевтического агента, который специфически связывается с мишенью; ингибитора холинэстеразы; антагониста NMDA-рецептора; деплетора моноамина; эрголоид мезилата; антихолинергического агента против паркинсонизма; дофаминергического агента против паркинсонизма; тетрабеназина; противовоспалительного агента; гормона; витамина; димеболина (dimebolin); гомотаурина; модулятора активности серотонинового рецептора; интерферона и глюкокортикоида; антитела против Abeta, отличного от кренезумаба; антибиотика; противовирусного агента.
57. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой ингибитор холинэстеразы.
58. Способ в соответствии с вариантом воплощения 57, в котором ингибитор холинэстеразы выбран из группы, состоящей из галантамина, донепезила, ривастигмина и такрина.
59. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой антагонист NMDA-рецептора.
60. Способ в соответствии с вариантом воплощения 58, в котором антагонист NMDA-рецептора представляет собой мемантин или его соль.
61. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой терапевтический агент, который специфически связывается с мишенью, и мишень выбрана из группы, состоящей из бета-секретазы, тау белка, пресенилина, белка-предшественника амилоида или его фрагмента, пептида бета-амилоида или его олигомеров или фибрилл, рецептора смерти 6 (DR6), рецептора для конечных продуктов гликирования (RAGE), паркина и гентингтина.
62. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой деплетор моноамина, необязательно, представляющий собой тетрабеназин.
63. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой антихолинергический агент против паркинсонизма, выбранный из группы, состоящей из проциклидина, дифенгидрамина, тригексилфенидила, бензатропина, биперидена и тригексифенидила.
64. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой дофаминергический агент против паркинсонизма, выбранный из группы, состоящей из энтакапона, селегилина, прамипексола, бромокриптина, ротиготина, селегилина, ропинирола, разагилина, апоморфина, карбидопы, леводопы, перголида, толкапона и амантадина.
65. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой противовоспалительный агент, выбранный из группы, состоящей из нестероидного противовоспалительного препарата и индометацина.
66. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой гормон, выбранный из группы, состоящей из эстрогена, прогестерона и лейпролида.
67. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой витамин, выбранный из группы, состоящей из фолата и никотинамида.
68. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой гомотаурин, который представляет собой 3-аминопропансульфоновую кислоту или 3APS.
69. Способ в соответствии с вариантом воплощения 56, в котором агент представляет собой ксалипроден (xaliproden).
70. Способ замедления клинического ухудшения у пациента с диагностированной ранней болезнью Альцгеймера (AD) или от легкой до умеренной болезнью Альцгеймера (AD), включающий введение пациенту, страдающему от ранней AD или от легкой до умеренной AD, гуманизированного моноклонального антитела против бета-амилоида (Аβ), которое связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, которое является эффективным для замедления ухудшения у пациента.
71. Способ в соответствии с вариантом воплощения 70, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
72. Способ в соответствии с вариантом воплощения 70, в котором антитело представляет собой антитело IgG4.
73. Способ в соответствии с вариантом воплощения 71 или 72, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
74. Способ в соответствии с вариантом воплощения 73, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
75. Способ в соответствии с вариантом воплощения 74, в котором антитело представляет собой кренезумаб.
76. Способ по любому из вариантов воплощения 70-75, дополнительно включающий оценку ухудшения когнитивных способностей путем определения, сколько баллов набирает пациент по 12-пунктной шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений (ADAS-Cog12), 13-пунктной шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений (ADAS-Cog13) или 14-пунктной шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений (ADAS-Cog12) до и после введения указанного антитела, где замедление когнитивных ухудшений, измеренное с помощью ADAS-Cog, необязательно составляет, по меньшей мере, 30%, по меньшей мере, 35%, по меньшей мере, 40% или, по меньшей мере, 45% относительно плацебо.
77. Способ в соответствии с вариантом воплощения 76, в котором пациент имеет положительный статус по АроЕ4.
78. Способ в соответствии с вариантом воплощения 76, в котором пациент страдает от легкой AD.
79. Способ в соответствии с вариантом воплощения 76, в котором пациент страдает от ранней AD.
80. Способ по любому из вариантов воплощения 70-78, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
81. Способ в соответствии с вариантом воплощения 80, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
82. Способ по любому из вариантов воплощения 70-80, в котором антитело вводят в дозе от 10 мг/кг до 100 мг/кг массы тела пациента.
83. Способ в соответствии с вариантом воплощения 82, в котором антитело вводят в дозе, составляющей, по меньшей мере, 15 мг/кг.
84. Способ в соответствии с вариантом воплощения 83, в котором антитело вводят в дозе, составляющей 15 мг/кг, 30 мг/кг, 45 мг/кг, 50 мг/кг или 60 мг/кг.
85. Способ в соответствии с вариантом воплощения 82 или 83, в котором антитело вводят путем внутривенной инъекции.
86. Способ по любому из вариантов воплощения 82-85, в котором антитело вводят каждые 2 недели, каждые 4 недели, каждый месяц, каждые два месяца или каждые шесть месяцев.
87. Способ лечения ранней или легкой AD у субъекта, включающий введение пациенту, страдающему ранней или легкой AD, гуманизированного моноклонального антитела против бета-амилоида (Аβ), которое связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, эффективном для лечения AD.
88. Способ в соответствии с вариантом воплощения 87, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
89. Способ в соответствии с вариантом воплощения 87, в котором антитело представляет собой антитело IgG4.
90. Способ в соответствии с вариантом воплощения 88 или 89, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
91. Способ в соответствии с вариантом воплощения 90, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
92. Способ в соответствии с вариантом воплощения 91, в котором антитело представляет собой кренезумаб.
93. Способ по любому из вариантов воплощения 87-92, в котором количество является эффективным для замедления ухудшения когнитивных способностей, которое оценивают, определяя, сколько баллов набирает пациент по 12-пунктной шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений (ADAS-Cog12), 13-пунктной шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений (ADAS-Cog13) или 14-пунктной шкале оценки тяжести болезни Альцгеймера с подшкалой для оценки когнитивных нарушений (ADAS-Cog12) до и после введения указанного антитела, где замедление когнитивных ухудшений, измеренное с помощью ADAS-Cog, необязательно составляет, по меньшей мере, 30%, по меньшей мере, 35%, по меньшей мере, 40%) или, по меньшей мере, 45% относительно плацебо.
94. Способ в соответствии с вариантом воплощения 93, в котором пациент имеет положительный статус по АроЕ4.
95. Способ по любому из вариантов воплощения 87-94, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
96. Способ в соответствии с вариантом воплощения 95, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
97. Способ по любому из вариантов воплощения 87-95, в котором антитело вводят в дозе от 10 мг/кг до 100 мг/кг массы тела пациента.
98. Способ в соответствии с вариантом воплощения 97, в котором антитело вводят в дозе, составляющей, по меньшей мере, 15 мг/кг.
99. Способ в соответствии с вариантом воплощения 98, в котором антитело вводят в дозе, составляющей 15 мг/кг, 30 мг/кг, 45 мг/кг, 50 мг/кг или 60 мг/кг.
100. Способ в соответствии с вариантом воплощения 97 или 98, в котором антитело вводят путем внутривенной инъекции.
101. Способ по любому из вариантов воплощения 97-100, в котором антитело вводят каждые 2 недели, каждые 4 недели, каждый месяц, каждые два месяца или каждые шесть месяцев.
102. Способ по любому из вариантов воплощения 70-101, в котором пациента параллельно лечат одним или несколькими агентами, выбранными из группы, состоящей из: терапевтического агента, который специфически связывается с мишенью; ингибитора холинэстеразы; антагониста NMDA-рецептора; деплетора моноамина; эрголоид мезилата; антихолинергического агента против паркинсонизма; дофаминергического агента против паркинсонизма; тетрабеназина; противовоспалительного агента; гормона; витамина; димеболина (dimebolin); гомотаурина; модулятора активности серотонинового рецептора; интерферона и глюкокортикоида; антитела против Abeta; антибиотика; противовирусного агента.
103. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой ингибитор холинэстеразы.
104. Способ в соответствии с вариантом воплощения 103, в котором ингибитор холинэстеразы выбран из группы, состоящей из галантамина, донепезила, ривастигмина и такрина.
105. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой антагонист NMDA-рецептора.
106. Способ в соответствии с вариантом воплощения 105, в котором антагонист NMDA-рецептора представляет собой мемантин или его соль.
107. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой терапевтический агент, который специфически связывается с мишенью, и мишень выбрана из группы, состоящей из бета-секретазы, тау белка, пресенилина, белка-предшественника амилоида или его фрагмента, пептида бета-амилоида или его олигомеров или фибрилл, рецептора смерти 6 (DR6), рецептора для конечных продуктов гликирования (RAGE), паркина и гентингтина.
108. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой деплетор моноамина, необязательно представляющий собой тетрабеназин.
109. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой антихолинергический агент против паркинсонизма, выбранный из группы, состоящей из проциклидина, дифенгидрамина, тригексилфенидила, бензатропина, биперидена и тригексифенидила.
110. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой дофаминергический агент против паркинсонизма, выбранный из группы, состоящей из энтакапона, селегилина, прамипексола, бромокриптина, ротиготина, селегилина, ропинирола, разагилина, апоморфина, карбидопы, леводопы, перголида, толкапона и амантадина.
111. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой противовоспалительный агент, выбранный из группы, состоящей из нестероидного противовоспалительного препарата и индометацина.
112. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой гормон, выбранный из группы, состоящей из эстрогена, прогестерона и лейпролида.
113. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой витамин, выбранный из группы, состоящей из фолата и никотинамида.
114. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой гомотаурин, который представляет собой 3-аминопропансульфоновую кислоту или 3APS.
115. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой ксалипроден (xaliproden).
116. Способ в соответствии с вариантом воплощения 102, в котором агент представляет собой антитело против Abeta, отличное от кренезумаба.
117. Способ лечения болезни Альцгеймера (AD) у пациента, страдающего от ранней AD или от легкой до умеренной AD, включающий введение пациенту, страдающему от ранней AD или от легкой до умеренной AD, гуманизированного моноклонального антитела против бета-амилоида (Аβ) в количестве, которое является эффективным для лечения AD, где пациент имеет, по меньшей мере, один аллель гена CLUSTERIN с однонуклеотидным полиморфизмом (SNP) rs1532278, содержащим Т.
118. Способ в соответствии с вариантом воплощения 117, в котором аллель гена CLUSTERIN представляет собой его эквивалентный аллель.
119. Способ в соответствии с вариантом воплощения 117, включающий обнаружение полиморфизма в образце, полученном от пациента, где обнаруживаемый полиморфизм находится в неравновесном сцеплении с SNP rs1532278.
120. Способ в соответствии с вариантом воплощения 119, в котором образец представляет собой образец крови, слюны, буккального мазка, образец ткани или образец биологической жидкости.
121. Способ по любому из вариантов воплощения 117-120, в котором полиморфизм обнаруживают с помощью полимеразной цепной реакции.
122. Способ по любому из вариантов воплощения 117-120, в котором полиморфизм обнаруживают с помощью секвенирования.
123. Способ в соответствии с вариантом воплощения 121 или 122, в котором полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, MassArray (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
124. Способ по любому из вариантов воплощения 117-120, в котором полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
125. Способ в соответствии с вариантом воплощения 117, в котором пациент страдает от легкой AD.
126. Способ в соответствии с вариантом воплощения 117, в котором пациент страдает от ранней AD.
127. Способ в соответствии с вариантом воплощения 125 или 126, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
128. Способ в соответствии с вариантом воплощения 127, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
129. Способ по любому из вариантов воплощения 117-128, в котором пациент имеет положительный статус по АроЕ4.
130. Способ в соответствии с вариантом воплощения 117, в котором антитело против бета-амилоида связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1).
131. Способ в соответствии с вариантом воплощения 130, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
132. Способ в соответствии с вариантом воплощения 131, в котором антитело представляет собой антитело IgG4.
133. Способ в соответствии с вариантом воплощения 131 или 132, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
134. Способ в соответствии с вариантом воплощения 133, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
135. Способ в соответствии с вариантом воплощения 133, в котором антитело представляет собой кренезумаб.
136. Способ в соответствии с вариантом воплощения 117, в котором антитело против бета-амилоида выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба и гантенерумаба (gantenerumab).
137. Способ выбора пациента, страдающего от ранней AD или от легкой до умеренной AD для лечения гуманизированным моноклональным антителом против бета-амилоида (Аβ), включающий:
(a) обнаружение в образце, полученном от пациента, наличия или отсутствия аллеля гена CLUSTERIN с однонуклеотидным полиморфизом (SNP) rs1532278, содержащим Т, и
(b) выбор пациента как пациента, который с большей вероятностью будет отвечать на лечение гуманизированным моноклональным антителом против Ар, в том случае, если в образце присутствует однонуклеотидный полиморфизм (SNP) rs1532278, содержащий Т.
138. Способ в соответствии с вариантом воплощения 137, в котором аллель гена CLUSTERIN представляет собой его эквивалентный аллель.
139. Способ в соответствии с вариантом воплощения 138, в котором эквивалентный аллель находится в неравновесном сцеплении с SNP rs1532278.
140. Способ в соответствии с вариантом воплощения 137 или 138, в котором образец представляет собой образец крови, слюны, буккального мазка, образец ткани или образец биологической жидкости.
141. Способ по любому из вариантов воплощения 137-140, в котором полиморфизм обнаруживают с помощью полимеразной цепной реакции.
142. Способ по любому из вариантов воплощения 137-140, в котором полиморфизм обнаруживают с помощью секвенирования.
143. Способ в соответствии с вариантом воплощения 141 или 142, в котором полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, Mass Array (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
144. Способ по любому из вариантов воплощения 137-140, в котором полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
145. Способ в соответствии с вариантом воплощения 137, в котором пациент страдает от легкой AD.
146. Способ в соответствии с вариантом воплощения 137, в котором пациент страдает от ранней AD.
147. Способ в соответствии с вариантом воплощения 138, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
148. Способ в соответствии с вариантом воплощения 147, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
149. Способ по любому из вариантов воплощения 137-147, в котором пациент имеет положительный статус по АроЕ4.
150. Способ в соответствии с вариантом воплощения 137, в котором антитело против бета-амилоида связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1).
151. Способ в соответствии с вариантом воплощения 150, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
152. Способ в соответствии с вариантом воплощения 151, в котором антитело представляет собой антитело IgG4.
153. Способ в соответствии с вариантом воплощения 150 или 151, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
154. Способ в соответствии с вариантом воплощения 153, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
155. Способ в соответствии с вариантом воплощения 153, в котором антитело представляет собой кренезумаб.
156. Способ в соответствии с вариантом воплощения 137, в котором антитело против бета-амилоида выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба и гантенерумаба (gantenerumab).
157. Способ определения пациента, страдающего от ранней AD или легкой до умеренной формами AD, который с большей вероятностью будет отвечать на лечение гуманизированным моноклональным антителом против бета-амилоида (Аβ), включающий обнаружение в образце, полученном из пациента, наличия аллеля гена CLUSTERIN, включающего полиморфизм, который предсказывает ответ на лечение гуманизированным моноклональным антителом против бета-амилоида (Аβ).
158. Способ в соответствии с вариантом воплощения 157, в котором полиморфизм представляет собой однонуклеотидный полиморфизм (SNP) rs1532278, содержащий Т.
159. Способ в соответствии с вариантом воплощения 157, в котором аллель гена CLUSTERIN представляет собой эквивалентный аллель аллеля, включающего SNP rs1532278.
160. Способ в соответствии с вариантом воплощения 159, в котором эквивалентный аллель находится в неравновесном сцеплении с SNP rs1532278.
161. Способ в соответствии с вариантом воплощения 157 или 158, в котором образец представляет собой образец крови, слюны, буккального мазка, образец ткани или образец биологической жидкости.
162. Способ по любому из вариантов воплощения 157-161, в котором полиморфизм обнаруживают с помощью полимеразной цепной реакции.
163. Способ по любому из вариантов воплощения 157-161, в котором полиморфизм обнаруживают с помощью секвенирования.
164. Способ в соответствии с вариантом воплощения 162 или 163, в котором полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, Mass Array (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
165. Способ по любому из вариантов воплощения 157-161, в котором полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
166. Способ в соответствии с вариантом воплощения 157, в котором пациент страдает от легкой AD.
167. Способ в соответствии с вариантом воплощения 157, в котором пациент страдает от ранней AD.
168. Способ в соответствии с вариантом воплощения 166, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
169. Способ в соответствии с вариантом воплощения 168, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
170. Способ по любому из вариантов воплощения 157-168, в котором пациент имеет положительный статус по АроЕ4.
171. Способ в соответствии с вариантом воплощения 157, в котором антитело против бета-амилоида связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1).
172. Способ в соответствии с вариантом воплощения 171, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
173. Способ в соответствии с вариантом воплощения 172, в котором антитело представляет собой антитело IgG4.
174. Способ в соответствии с вариантом воплощения 172 или 173, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
175. Способ в соответствии с вариантом воплощения 174, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
176. Способ в соответствии с вариантом воплощения 175, в котором антитело представляет собой кренезумаб.
177. Способ в соответствии с вариантом воплощения 157, в котором антитело против бета-амилоида выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба и гантенерумаба (gantenerumab).
178. Способ предсказания, будет ли индивидуум, страдающий от AD, отвечать на лечение, включающее антитело против Abeta или его антигенсвязывающий фрагмент, включающий:
(a) определение идентичности нуклеотида в SNP rs1532278 в образце, полученном от индивидуума, и
(b) предсказание повышенной вероятности ответа на лечение, включающее антитело против Abeta или его антигенсвязывающий фрагмент, где образец содержит, по меньшей мере, один аллель с SNP rs1532278, содержащий нуклеотид Т.
179. Способ в соответствии с вариантом воплощения 178, в котором пациент страдает от легкой AD.
180. Способ в соответствии с вариантом воплощения 178, в котором пациент страдает от ранней AD.
181. Способ в соответствии с вариантом воплощения 178, в котором пациент набрал по шкале MMSE от 20 до 26 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
182. Способ по любому из вариантов воплощения 178-181, в котором пациент имеет положительный статус по АроЕ4.
183. Способ в соответствии с вариантом воплощения 178, в котором антитело против бета-амилоида связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1).
184. Способ в соответствии с вариантом воплощения 183, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
185. Способ в соответствии с вариантом воплощения 184, в котором антитело представляет собой антитело IgG4.
186. Способ в соответствии с вариантом воплощения 184 или 185, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
187. Способ в соответствии с вариантом воплощения 186, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
188. Способ в соответствии с вариантом воплощения 187, в котором антитело представляет собой кренезумаб.
189. Способ в соответствии с вариантом воплощения 178, в котором антитело против бета-амилоида выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба и гантенерумаба (gantenerumab).
190. Способ оптимизации терапевтической эффективности лечения AD, включающий определение генотипа пациента, при этом пациент, который имеет, по меньшей мере, один аллель гена CLUSTERIN с SNP rs1532278, содержащим нуклеотид Т, с большей вероятностью будет отвечать на лечение антителом против Abeta или его антигенсвязывающим фрагментом.
191. Способ в соответствии с вариантом воплощения 190, в котором пациент страдает от ранней или легкой AD.
192. Способ в соответствии с вариантом воплощения 190, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
193. Способ в соответствии с вариантом воплощения 192, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
194. Способ по любому из вариантов воплощения 190-192, в котором пациент имеет положительный статус по АроЕ4.
195. Способ в соответствии с вариантом воплощения 190, в котором антитело против бета-амилоида связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1).
196. Способ в соответствии с вариантом воплощения 195, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
197. Способ в соответствии с вариантом воплощения 196, в котором антитело представляет собой антитело IgG4.
198. Способ в соответствии с вариантом воплощения 196 или 197, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
199. Способ в соответствии с вариантом воплощения 198, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
200. Способ в соответствии с вариантом воплощения 199, в котором антитело представляет собой кренезумаб.
201. Способ в соответствии с вариантом воплощения 190, в котором антитело против бета-амилоида выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба и гантенерумаба (gantenerumab).
202. Способ определения вероятности того, что пациент, страдающий от AD, будет получать пользу от лечения, включающего антитело против Abeta или его антигенсвязывающий фрагмент, где способ включает определение генотипа пациента, при этом пациент, который имеет, по меньшей мере, один аллель гена CLUSTERIN с SNP rs1532278, содержащим нуклеотид Т, с большей вероятностью будет отвечать на лечение антителом против Abeta, чем пациент, который не имеет аллеля с SNP rs1532278, содержащим нуклеотид Т.
203. Способ в соответствии с вариантом воплощения 202, в котором пациент страдает от ранней или легкой AD.
204. Способ в соответствии с вариантом воплощения 202, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
205. Способ по любому из вариантов воплощения 202-204, в котором пациент имеет положительный статус по АроЕ4.
206. Способ в соответствии с вариантом воплощения 202, в котором антитело против бета-амилоида связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1).
207. Способ в соответствии с вариантом воплощения 206, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
208. Способ в соответствии с вариантом воплощения 207, в котором антитело представляет собой антитело IgG4.
209. Способ в соответствии с вариантом воплощения 207 или 208, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
210. Способ в соответствии с вариантом воплощения 209, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
211. Способ в соответствии с вариантом воплощения 210, в котором антитело представляет собой кренезумаб.
212. Способ в соответствии с вариантом воплощения 202, в котором антитело против бета-амилоида выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба и гантенерумаба (gantenerumab).
213. Способ по любому из вариантов воплощения 190-212, в котором аллель гена CLUSTERIN представляет собой эквивалентный аллель аллеля, включающего SNP rs1532278.
214. Способ в соответствии с вариантом воплощения 213, в котором эквивалентный аллель находится в неравновесном сцеплении с SNP rs1532278.
215. Способ в соответствии с вариантом воплощения 213 или 214, в котором образец представляет собой образец крови, слюны, буккального мазка, образец ткани или образец биологической жидкости.
216. Способ по любому из вариантов воплощения 213-215, в котором полиморфизм обнаруживают с помощью полимеразной цепной реакции.
217. Способ по любому из вариантов воплощения 213-215, в котором полиморфизм обнаруживают с помощью секвенирования.
218. Способ в соответствии с вариантом воплощения 216 или 217, в котором полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, Mass Array (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
219. Способ по любому из вариантов воплощения 213-215, в котором полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
220. Набор для определения наличия, по меньшей мере, одного полиморфизма в биологическом образце, включающий реагенты и инструкции для обнаружения наличия, по меньшей мере, одного полиморфизма в гене CLUSTERIN, где полиморфизм представляет собой аллель, содержащий SNP rs1532278 или эквивалентный аллель.
221. Набор в соответствии с вариантом воплощения 220, где набор используют для обнаружения наличия Т в SNP rs1532278.
222. Набор в соответствии с вариантом воплощения 220, в котором реагенты включают набор олигонуклеотидов, специфичный для обнаружения специфического полиморфизма в CLUSTERIN.
223. Применение агента, который специфически связывается с полиморфизмом в гене CLUSTERIN, где полиморфизм представляет собой аллель, включающий SNP rs1532278, содержащий Т, для создания средства диагностики для выбора пациентов, которые с высокой вероятностью будут получать пользу от терапии антителом против Abeta.
224. Применение в соответствии с вариантом воплощения 223, в котором, по меньшей мере, один полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, MassArray (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
225. Применение в соответствии с вариантом воплощения 223, в котором, по меньшей мере, один полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
226. Применение в соответствии с вариантом воплощения 223, в котором наличие SNP rs1532278, содержащего Т, свидетельствует о повышенной вероятности того, что пациент, страдающей от ранней или легкой AD, будет получать пользу от терапии антителом против Abeta.
227. Применение in vitro агента, который связывается, по меньшей мере, с одним полиморфизмом, где полиморфизм представляет собой аллель гена CLUSTERIN, для определения пациента, имеющего раннюю AD или от легкой до умеренной AD, который будет с высокой вероятностью отвечать на терапию, включающую антитело против Abeta или его антигенсвязывающий фрагмент, где наличие указанного полиморфизма свидетельствует о том, что пациент с большей вероятностью будет отвечать на терапию.
228. Применение в соответствии с вариантом воплощения 227, в котором аллель гена CLUSTERIN представляет собой аллель, содержащий SNP rs1532278, или его эквивалентный аллель.
229. Применение в соответствии с вариантом воплощения 228, в котором пациент имеет легкую AD.
230. Применение в соответствии с вариантом воплощения 228, в котором пациент имеет раннюю AD.
231. Применение в соответствии с вариантом воплощения 228, в котором пациент до начала лечения набрал, по меньшей мере, 20 баллов по шкале MMSE, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
232. Применение в соответствии с вариантом воплощения 228, в котором, по меньшей мере, один полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, MassArray (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
233. Применение в соответствии с вариантом воплощения 228, в котором, по меньшей мере, один полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
ПРИМЕРЫ
ПРИМЕР 1 - Клиническое исследование Кренезумаба, гуманизированного моноклонального антитела против Аβ, в лечении от легкой до умеренной болезни Альцгеймера
Дизайн и цели исследования
Фазу II рандомизированного двойного слепого клинического исследования проводили, используя плацебо в качестве контроля, для оценки влияния гуманизированного моноклонального антитела против бета-амилоида («Аβ») кренезумаба на пациентов с диагностированной от легкой до умеренной болезнью Альцгеймера (AD). Пациенты, включенные в исследование, на момент скрининга были в возрасте от 50 до 80 и имели предположительный диагноз AD в соответствии с критерием NINCDS-ADRDA: по Краткой шкале оценки психическего статуса (MMSE) набрали от 18 до 26 баллов, по Гериартрической шкале депрессии (GDS-15) набрали меньше 6 баллов, имели законченное 6-летнее образование (или хорошую трудовую биографию, что соответствует отсутствию умственной отсталости или других первазивных расстройств развития). Дополнительно, для тех пациентов, которые получали сопутствующее лечение AD (например, ингибиторы ацетилхолинэстеразы или мемантин), было подтверждено, что пациенты принимали лекарственные препараты на протяжении, по меньшей мере, 3 месяцев и принимали лекарственные препараты в стабильной дозе на протяжении, по меньшей мере, 2 месяцев до рандомизации. По меньшей мере, 50% включенных в исследование пациентов имели положительный статус по АроЕ4 (были носителями, по меньшей мере, одного аллеля АроЕ4). Пациенты, получающие также одно или несколько неисключенных лекарственных средств или безрецептурных лекарственных средств, таких как не антихолинергический антидепрессант (не антихолинергические антидепрессанты), атипичное антипсихотическое средство (атипиные антипсихотические средства), не бензодиазепиновое анксиолитическое средство (не бензодиазепиновые анксиолитические средства), снотворное средство (снотворные средства), антихолинергическое антигистаминовое средство центрального действия (антихолинергические антигистаминовые средства центрального действия) и антихолинергическое антиспазматическое средство центрального действия (антихолинергические антиспазматические средства центрального действия), также были включены в исследование, при условии, что вводимая им доза была постоянной на протяжении, по меньшей мере, 1 месяца до рандомизации и оставалась такой же на протяжении исследования.
Индивидуумы были исключены из исследования, если они страдали от тяжелого или нестабильного клинического состояния, которое, по мнению исследователя или спонсора, оказывало бы влияние на способность пациента закончить процедуру оценивания в исследовании или требовало бы эквивалента стационарной помощи или больничного ухода; в медицинской истории присутствует клинически подтвержденное сосудистое заболевание, которое потенциально может влиять на головной мозг; в медицинской истории присутствует тяжелая, клинически подтвержденная травма центральной нервной системы (например, постоянный неврологический дефицит или структурные повреждения головного мозга); индивидуумы были госпитализированы за 4 недели до скрининга; индивидуумы ранее подвергались лечению кренезумабом или любым другим агентом, который направленно действует на Ар; или если индивидуумы получали лечение любым другим вариантом биологической терапии (кроме обычных вакцинаций) не позднее 5 периодов полужизни терапевтического агента в биологической терапии или 3 месяцев до скрининга.
Исследование имело три периода - период скрининга продолжительностью до 35 дней, период лечения продолжительностью 68 недель (в настоящем документе обозначается как неделя 1, неделя 2, и так далее до недели 69) и период последующей оценки безопасности, который длится еще 16 недель (в настоящем документе обозначается как неделя 70, и так далее до недели 85). Лечение (или плацебо) вводили путем внутривенной инфузии.
Пациентов, включенных в исследование, случайным образом распределяли в одну из двух групп, группу пациентов, получающих лечение (т.е. кренезумаб) и группу пациентов, получающих плацебо, в соотношении 2:1 (группа пациентов, получающих лечение : группа пациентов, получающих плацебо). В исследование были включены 249 пациентов, набравших по шкале MMSE от 18 до 26 баллов (считаются пациентами с легкой до умеренной AD), из которых 165 получали лечение и 84 получали плацебо. 121 пациент в группе пациентов, получающих лечение, и 61 пациент в группе пациентов, получающих плацебо, набрали по шкале MMSE от 20 до 26 баллов (считаются пациентами с легкой AD). В группе пациентов, получающих лечение, 117 (или 70,9%) имели положительный статус по АроЕ4. В группе пациентов, получающих плацебо, 60 пациентов (или 71,4%) имели положительный статус по АроЕ4. Смотрите Фиг. 4А-В (в форме таблицы приведена информация о распределении пациентов в исследовании).
Вводный период оценки безопасности продолжительностью 43 дня проводили с целью определения безопасности и переносимости внутривенной дозы 15 мг/кг в сравнении с внутривенной дозой 10 мг/кг, в результате этого была выбрана доза 15 мг/кг. Пациентам в обеих группах исследования вводили внутривенные инъекции в слепом режиме каждые четыре недели на протяжении 68 недель; на основании результатов вводного периода оценки безопасности, пациенты в группе пациентов, получающих лечение, получали 15 мг/кг, в то время как пациенты в группе пациентов, получающих плацебо, получали внутривенную инъекцию плацебо. Смотрите Фиг. 5 (Схема протокола).
К 72 недели у пациентов оценивали (а) изменение по шкале ADAS-Cog12 и шкале CDR-SOB на 25 неделе, 49 неделе и 73 неделе от начала исследования по сравнению с исходным значением с целью оценки ингибирования прогрессирования заболевания и (b) безопасность и переносимость кренезумаба по сравнению с плацебо. Чтобы оценить статистическую значимость любых измеряемых изменений, были посчитаны значения ковариации, доверительные интервалы и проведена оценка отличий средних изменений от исходных значений по методу наименьших квадратов.
Безопасность и переносимость кренезумаба оценивали путем измерения частоты и тяжести нежелательных явлений, возникающих в процессе исследования, особенно случаев возникновения симптоматических или бессимптомных ARIA-E (включая церебральный вазогенный отек), симптоматических или бессимптомных ARIA-H (включая церебральную микрогеморрагию) и церебральной макрогеморрагии. Наличие и/или число случаев возникновения церебрального вазогенного отека в период скрининга (до начала дозирования) или на протяжении периода лечения (после начала дозирования плацебо или кренезумаба) оценивали с помощью магнитно-резонансной визуализации в режиме инверсия-восстановление с ослаблением сигнала от жидкости (FLAIR MRI). Смотрите, например, Sperling et al., 2011, Alzheimer's & Dementia 7: 367-385. Наличие и/или число случаев возникновения церебральной микрогеморрагии в период скрининга (до начала дозирования) или на протяжении периода лечения (после начала дозирования плацебо или кренезумаба) оценивали с помощью магнитно-резонансной томографии времени релаксации поперечной намагниченности с дополнительным негомогенным дефазированным градиентным эхом (Т2*-взвешенная GRE MRI).
Результаты
Измерения по шкале ADAS-Cog12 на 73 неделе демонстрирует, что для пациентов, получающих кренезумаб, наблюдается замедление прогрессирования заболевания по сравнению с пациентами, получающими плацебо. В таблице на Фиг. 6А-В и в виде столбцов на Фиг. 7-8 суммировано, что изменение по шкале ADAS-Cog12 было примерно на 24% (р=0,12) меньше в группе пациентов, получающих лечение, чем в группе пациентов, получающих плацебо, для пациентов с легкой AD, и было примерно на 16%) (р=0,19) меньше в группе пациентов, получающих лечение, чем в группе пациентов, получающих плацебо, для пациентов с легкой до умеренной AD. Этот эффект также наблюдался для пациентов с положительным статусом по АроЕ4 в группе пациентов, получающих лечение, по сравнению с группой, получающих плацебо: в этом случае увеличение по шкале ADAS-Cog12 (при этом увеличение по шкале ADAS-Cog12 свидетельствует о прогрессирование заболевания) было меньше на 24,4% (р=0,08, без поправки на множественность) у пациентов, получающих кренезумаб, по сравнению с пациентами, получающими плацебо. Смотрите Фиг. 6А и Фиг. 9. Пациенты, имеющие положительный статус по АроЕ4, включали пациентов как с легкой, так и с умеренной AD. Эффект был даже более выраженным, когда результаты для пациентов с легкой AD и пациентов с положительным статусом по АроЕ4 объединялись: у пациентов в группе пациентов, получающих лечение, наблюдалось снижение на 32,4% (р=0,05, без поправки на множественность) относительно группы пациентов, получающих плацебо. Смотрите Фиг. 6А и Фиг. 10. Эффективность лечения увеличивалась с увеличением оценки участников по шкале MMSE на момент включения в исследование. Как показано на Фиг. 6В, чем выше набранное число баллов по шкале MMSE, тем выше процент снижения по шкале ADAS-Cog12 в группе пациентов, получающих лечение, по сравнению с группой, получающих плацебо, составляющий диапазон от примерно 16% для пациентов, набравших 18-26 баллов по шкале MMSE, до 49% снижения у пациентов, набравших от 25 до 26 баллов по шкале MMSE. Смотрите также Фиг. 11. Для пациентов, набравших от 22 до 26 баллов по шкале MMSE, процент снижения по шкале ADAS-Cog12 в группе пациентов, получающих лечение, по сравнению с группой, получающих плацебо, составил примерно 35%.
Изменение в тесте CDR-SOB имело аналогичную тенденцию в эффективности лечения. Как показано на Фиг. 12А, снижение изменений на 19% по шкалам CDR-SOB наблюдали в группе пациентов, получающих лечение, по сравнению с группой, получающих плацебо, для тех пациентов, которые набрали 22-26 баллов по шкале MMSE, и этот эффект был еще более выраженным у пациентов, набравших 25-26 баллов по шкале MMSE, для которых процент снижения изменений составлял примерно 63% (смотрите также Фиг. 13). На Фиг. 12В показано, что если рассматривать шкалы для составляющих компонентов «Память» или «Принятие решений и Решение проблем», то для пациентов, набравших 22-26 баллов по шкале MMSE, процент снижения изменений составил примерно 42% и 30%, соответственно.
Дальнейшее исследование продемонстрировало, что кренезумаб не увеличивает частоту возникновения нежелательных явлений по типу ARIA при введении в дозе 15 мг/кг. В этом исследовании наблюдали единственный случай бессимптомного ARIA-E у пациента, получающего кренезумаб. Число случаев возникновения ARIA-H было одинаковым в группе пациентов, получающих лечение, и в группе пациентов, получающих плацебо.
Эти данные демонстрируют, что кренезумаб ингибирует прогрессирование заболевания без увеличения числа нежелательных явлений, возникающих в процессе лечения, таких как ARIA-E или ARIA-H, при введении в дозе 15 мг/кг у пациентов, страдающих от легкой до умеренной AD, в особенности у пациентов с легкой AD и/или пациентов с положительным статусом по АроЕ4.
ПРИМЕР 2. Клиническое исследование Кренезумаба, гуманизированного моноклонального антитела против Аβ, в лечении от легкой до умеренной болезни Альцгеймера и оценка влияния на накопление амилоида
Дизайн и цели исследования
Фазу II рандомизированного двойного слепого клинического исследования проводили, используя плацебо в качестве контроля, для оценки влияния гуманизированного моноклонального антитела против бета-амилоида («Аβ») кренезумаба на пациентов с диагностированной от легкой до умеренной болезнью Альцгеймера (AD). Пациенты, включенные в исследование, на момент скрининга были в возрасте от 50 до 80 и имели предположительный диагноз AD в соответствии с критерием NINCDS-ADRDA: по Краткой шкале оценки психическего статуса (MMSE) набрали от 18 до 26 баллов, по Гериартрической шкале депрессии (GDS-15) набрали меньше 6 баллов, имели законченное 6-летнее образование (или хорошую трудовую биографию, что соответствует отсутствию умственной отсталости или других первазивных расстройств развития). В исследование были включены только пациенты, имеющие положительные по флорбетапиру результаты сканирования PET («положительные по амилоиду») на момент скрининга, свидетельствующие о повышенном отложении амилоида в головном мозге, причем в диапазоне, характерном для пациентов с диагностированной AD, которую оценивали по сканированию флорбетапир-РЕТ. Дополнительно, по меньшей мере, 50% включенных в исследование пациентов имели положительный статус по АроЕ4.
Пациентов, включенных в исследование, случайным образом распределяли в одну из двух групп, группу пациентов, получющих лечение (т.е. кренезумаб), и группу пациентов, получающих плацебо, в соотношении 2:1 (группа пациентов, получающих лечение: группа пациентов, получающих плацебо). 52 пациента в двух группах исследований получали слепые внутривенные инъекции каждые четыре недели на протяжении 73 недель. В группе пациентов, получающих лечение, пациенты получали дозу кренезумаба 15 мг/кг. Пациентов стратифицировали в соответствии со статусом по АроЕ4 (носитель по сравнению с не носителем) и оценкой по шкале MMSE.
Собирали информацию об изменениях ADAS-Cog12, отложения амилоида, измеренного с использованием PET с флорбетапиром, и уровней Abeta в спинномозговой жидкости (CSF). Сканирование PET с флорбетапиром проводили в период скрининга, во время визита на 12 месяц и 18 месяц, используя флорбетапир 10 мКи с 50-минутным периодом поглощения и 30 минутным периодом эмиссионного сканирования. Изображения для 6×5 минутных окон (или 1×15 минутного окна для сканнеров, не имеющих возможности сканировать в динамике) нормировали на стандартное пространство, где для экстракции средних сигналов из разных интересующих областей (ROI) использовалась матрица. Т1-взвешенные сканированные изображения MRI, сделанные в начальный момент, использовали для оптимизации объемов ROI матрицы. Анализы проводили с использованием коры мозжечка или подкоркового белого вещества для сравнения. CSF собирали в период скрининга и до дозирования на 18 месяц. Измеряли уровень Abeta, тау-белка и р-тау(181)-белка в CSF. Для статистического анализа различий в лечении в конечных точках исследования использовали ANCOVA или смешанную модель для повторных измерений.
Характеристики пациентов, нежелательные явления и моменты времени, в которые проводили сканирование PET, MRI и осуществляли забор CSF, приведены на Фиг. 14А-В.
Результаты. Измерения по шкале ADAS-Cog12 в конце периода лечения демонстрируют, что у пациентов, получающих кренезумаб, наблюдается меньшее прогрессирование заболевания, чем у пациентов, получающих плацебо. У пациентов, изначально набравших от 20 до 26 (р=0,2) баллов по шкале MMSE, наблюдалось замедление когнитивных ухудшений на 54,3%. В соответствии с этим наблюдаемым замедлением прогрессирования заболевания у пациентов, подвергаемых лечению кренезумабом, также наблюдалось уменьшение накопления отложений амилоида по данным PET анализа (для сравнения использовалась область подкоркового белого вещества) по сравнению с пациентами, получающими плацебо. Смотрите Фиг. 15А. Более того, в группе пациентов, получающих лечение, наблюдалось увеличение концентрации Abeta в спинномозговой жидкости, что согласуется с действием кренезумаба на мишень. Смотрите Фиг. 15В. Аналогичное увеличение концентрации Abeta в спинномозговой жидкости наблюдалось у пациентов, подвергаемых лечению путем подкожного введения 300 мг кренезумаба каждые две недели, по сравнению с пациентами, получающими плацебо.
Эти данные демонстрируют, что кренезумаб действует на свою мишень, бета-амилоид, и ингибирует прогрессирование заболевания при введении в дозе 15 мг/кг у пациентов, страдающих от легкой до умеренной AD, в особенности, у пациентов с легкой AD, включая пациентов, у которых наблюдаются отложения амилоида в головном мозге, типичные для пациентов с диагностированной AD.
ПРИМЕР 3. Исследование однонуклеотидных полиморфизмов в клиническом исследовании Кренезумаба, гуманизированного моноклонального антитела против Аβ, ассоциированных с ответом на лечение от легкой до умеренной болезни Альцгеймера
Дизайн и цели исследования
Фазу II рандомизированного двойного слепого клинического исследования проводили, используя плацебо в качестве контроля, для оценки влияния гуманизированного моноклонального антитела против бета-амилоида («Аβ») кренезумаба на пациентов с диагностированной от легкой до умеренной болезнью Альцгеймера (AD). Пациенты, включенные в исследование, на момент скрининга были в возрасте от 50 до 80 и имели предположительный диагноз AD в соответствии с критерием NINCDS-ADRDA: по Краткой шкале оценки психическего статуса (MMSE) набрали от 18 до 26 баллов, по Гериартрической шкале депрессии (GDS-15) набрали меньше 6 баллов, имели законченное 6-летнее образование (или хорошую трудовую биографию, что соответствует отсутствию умственной отсталости или других первазивных расстройств развития). Дополнительно, для тех пациентов, которые получали сопутствующее лечение AD (например, ингибиторы ацетилхолинэстеразы или мемантин), было подтверждено, что пациенты принимали лекарственные препараты на протяжении, по меньшей мере, 3 месяцев и принимали лекарственные препараты в стабильной дозе на протяжении, по меньшей мере, 2 месяцев до рандомизации. По меньшей мере, 50% включенных в исследование пациентов имели положительный статус по АроЕ4 (были носителями, по меньшей мере, одного аллеля АроЕ4). Пациенты, получающие также одно или несколько неисключенных лекарственных средств или безрецептурных лекарственных средств, таких как не антихолинергический антидепрессант (не антихолинергические антидепрессанты), атипичное антипсихотическое средство (атипиные антипсихотические средства), не бензодиазепиновое анксиолитическое средство (не бензодиазепиновые анксиолитические средства), снотворное средство (снотворные средства), антихолинергическое антигистаминовое средство центрального действия (антихолинергические антигистаминовые средства центрального действия) и антихолинергическое антиспазматическое средство центрального действия (антихолинергические антиспазматические средства центрального действия), также были включены в исследование, при условии, что вводимая им доза была постоянной на протяжении, по меньшей мере, 1 месяца до рандомизации и оставалась такой же на протяжении исследования.
Исследование имело три периода - период скрининга продолжительностью до 35 дней, период лечения продолжительностью 68 недель (в настоящем документе обозначается как неделя 1, неделя 2, и так далее до недели 69) и период последующей оценки безопасности, который длится еще 16 недель (в настоящем документе обозначается как неделя 70 и так далее до недели 85). Лечение (или плацебо) вводили путем внутривенной инфузии.
Пациентов, включенных в исследование, случайным образом распределяли в одну из двух групп, группу пациентов, получющих лечение (т.е. кренезумаб), и группу пациентов, получающих плацебо, в соотношении 2:1 (группа пациентов, получающих лечение: группа пациентов, получающих плацебо). В исследование были включены 249 пациентов, набравших по шкале MMSE от 18 до 26 баллов (считаются пациентами с легкой до умеренной AD), из которых 165 получали лечение и 84 получали плацебо. 121 пациент в группе пациентов, получающих лечение, и 61 пациент в группе пациентов, получающих плацебо, набрали по шкале MMSE от 20 до 26 баллов (считаются пациентами с легкой AD). В группе пациентов, получающих лечение, 117 (или 70,9%) имели положительный статус по АроЕ4. В группе пациентов, получающих плацебо, 60 пациентов (или 71,4%) имели положительный статус по АроЕ4е. Смотрите Фиг. 4А-В (в форме таблицы приведена информация о распределении пациентов в исследовании).
Пациентам в обеих группах исследования вводили внутривенные инъекции в слепом режиме каждые четыре недели на протяжении 68 недель; пациенты в группе пациентов, получающих лечение, получали 15 мг/кг, в то время как пациенты в группе пациентов, получающих плацебо, получали внутривенную инъекцию плацебо.
К 72 недели у пациентов оценивли (а) изменение по шкале ADAS-Cog12 на 25 неделе, 49 неделе и 73 неделе от начала исследования по сравнению с исходным значением с целью оценки ингибирования прогрессирования заболевания по сравнению с плацебо. Чтобы оценить статистическую значимость любых измеряемых изменений, были посчитаны значения ковариации, доверительные интервалы и проведена оценка отличий средних изменений от исходных значений по методу наименьших квадратов.
Из 224 индивидуумов, включенных в исследование, для которых были проведены измерения по ADAS-Cog12 в исходный момент и на 73 неделе, 156 индивидуумов дали информированное согласие на проведение исследований генетических связей. 55 индивидуумов были в группе пациентов, получающих плацебо, и 101 индивидуум был в группе пациентов, получающих лечение. От этих индивидуумов собирали образцы ДНК и подвергали их генотипированию и контролю качества. Генотипирование проводили с использованием Illumina HumanOmni 2.5-8 BeadChip (http://support.illumina.com/array/array_kits/humanomni2_5-8_beadchip_kit.ilmn) в соответствии со стандартными протоколами.
С целью контроля ошибок генотипирования и качества данные генотипирования анализировали нижеследующим образом. Однонуклеотидные полиморфизмы (SNP) с ≥50% уровнем генотипирования использовали для дальнейшего анализа. SNP, не удовлетворявшие стандартам контроля качества, исключали из рассмотрения, наряду с подгруппами, которые не составляли от 25% до 75%) исследуемой популяции по результатам SNP. С целью контроля качества исключали образцы с >10% отсутствующих данных (суммарно). Индивидуальные варианты с >5% отсутствующих данных исключали из последующего анализа. Оставшиеся варианты тестировали на скрытую связь (путем оценки IBD) (Laurie et al., 2010, Genet Epidemiology 34(6): 591-602) и контаминацию образцов (путем избыточного тестирования гетерозиготности в представительном подмножестве вариантов), как описано в Turner et al., 2011, Curr Protoc Hum Genet Chapter 1: Unitl.19.
С целью определения наличия доказательств потенциально увеличенного лечебного эффекта, связанного с терапией, включающей антитело против амилоида бета («Аβ»), были проведены пробные анализы 21 предварительно определенных генетических вариантов. Варианты были выбраны из кандидатных локусов, определенных по данным полногеномного скрининга у AD (смотрите Lambert et al., 2013) или ассоциированных с множеством заболеваний. Если вариант не возможно было исследовать на Illumina HumanOmni 2.5-8 BeadChip, находили заменяющий вариант, подбирая сильно коррелирующие варианты в пределах 500 kb (попарное неравновесное сцепление расчитывали используя величину r2). Чтобы рассчитать замещающий вариант с r2 ≥ 0,80 для 21 предварительно определенных вариантов использовали данные сравнения, включая 1 пилотное исследование 1000 геномов 1 (1000 Genomes Pilot 1), НарМар3 (2 версия). Для двух интересующих предварительно определенных вариантов не удалось подобрать замещающий вариант, который бы удовлетворял критерию r2, поэтому они были исключены из дальнейшего анализа. В анализ связей были отобраны девятнадцать предварительно определенных вариантов или замещающих вариантов.
Для того чтобы проверить наличие связи между выбранными вариантами и терапевтическим эффектом, оценивали среднее изменение в количестве баллов по ADAS-Cog12 на 73 неделе в группе пациентов, получающих лечение, по сравнению с группой, получающих плацебо, используя две генетические модели наследования. В первой модели среднее изменение количества баллов по ADAS-Cog12 с течением времени сопоставляли между группой, состоящей из гомозигот по аллелю риска и гетерозиготных носителей, в группе пациентов, получающих лечение, по сравнению со всеми индивидуумами в группе пациентов, получающих плацебо, используя линейную регрессионную модель (как описано в Lynch, et al., Genetics and Analysis of Quantitative Traits (Sunderland, MA, Sinauer, 1998)). Во второй модели среднее изменение количества баллов по ADAS-Cog12 с течением времени сопоставляли между группой, состоящей из гомозигот по защитному аллелю и гетерозиготных носителей, в группе пациентов, получающих лечение, по сравнению со всеми индивидуумами в группе пациентов, получающих плацебо, используя линейную регрессионную модель. Для обеих генетических моделей изменение количества баллов по ADAS-Cog12 с течением времени считали результатом исследования, а статус группы считали предсказываемой переменной. Значение статуса группы как предсказываемой переменной оценивали, используя t-статистику и двустороннюю р-величину.
Анализ смешанной модели повторных исследований (MMRM) проводили, используя SAS™ версии 9.2 на субпопуляции носителей защитного аллеля, а также на популяции не носителей, с целью анализа лонгитудинальных данных для ADAS-Cog12. Эти модели имели фиксированные эффекты для исходных значений результатов измерений в зависимости от MMSE (<22 по сравнению с >22), статуса по АроЕ4, влияния статуса по АроЕ4 на MMSE, визита, лечения и влияния визита на лечение, если использовать неструктурированные матрицы ковариаций.
Результаты. В общей сложности на наличие предсказывающего эффекта в ответ на лечение кренезумабом было протестировано 19 раннее ассоциированных с риском развития AD вариантов. Были выявлены несколько SNP, в случае которых р-величина для ассоциации либо аллеля риска, либо защитного аллеля с эффектом от лечения составляла 0,06 или меньше, основываясь на оцененной разнице в количестве баллов по ADAS-Cog12 на 73 неделе между группой пациентов, получающих лечение, и группой пациентов, получающих плацебо. Был выявлен один SNP, rs1532278 в гене CLUSTERTN (CLU, также называемый ApoJ), для которого в случае носителя защитного аллеля, содержащего Т, отмечалась связь с потенциально увеличенным лечебным эффектом. Основываясь на анализе MMRM, оцененная разница в количестве баллов по ADAS-Cog12 на 73 неделе между группами лечения составила 3,45 у популяции, положительной по SNP (индивидуумы, имеющие, по меньшей мере, один защитный аллель), по сравнению с -0,78 у популяции, отрицательной по SNP (индивидуумы, не имеющие защитного аллеля). Это отражает процент снижения в группе пациентов, получающих кренезумаб, относительно группы пациентов, получающих плацебо, на 35,9% для положительных по SNP пациентов по сравнению с -7,4% для отрицательных по SNP пациентов. Смотрите Фиг. 16. Дальнейший анализ SNP гена CLUSTERIN в популяции пациентов с положительным статусом по АроЕ4 (Фиг. 17) и популяцией с легкой формой заболевания (MMSE 20-26) (Фиг. 18) показал аналогичные результаты.
Несмотря на то, что настоящее изобретение было описано в некоторых деталях с помощью иллюстраций и примеров в целях ясности понимания, описания и примеры не должны быть истолкованы как ограничивающие объем настоящего изобретения. Раскрытия всех патентных заявок и опубликованных заявок и научная литература, цитируемые в настоящем документе, специально включены в настоящий документ посредством ссылки во всей своей полноте для любых целей.
Описание к Перечню последовательностей
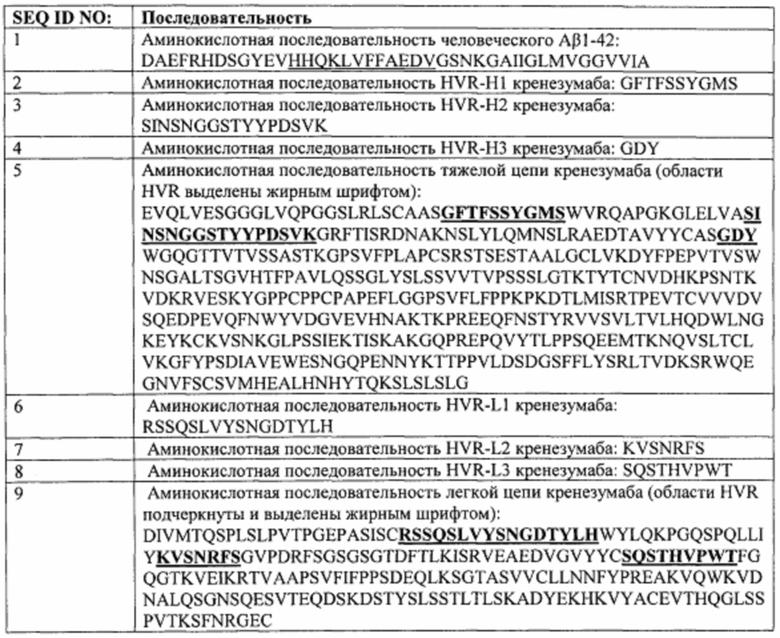
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЖЕНЕНТЕК, ИНК., И ДР.
<120> СПОСОБЫ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
<130> P5696R2-WO
<140>
<141>
<150> 62/082,013
<151> 2014-11-19
<150> 62/010,265
<151> 2014-06-10
<150> 61/971,499
<151> 2014-03-27
<150> 61/937,472
<151> 2014-02-08
<160> 9
<170> PatentIn version 3.5
<210> 1
<211> 42
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Asp Ala Glu Phe Arg His Asp Ser Gly Tyr Glu Val His His Gln Lys
1 5 10 15
Leu Val Phe Phe Ala Glu Asp Val Gly Ser Asn Lys Gly Ala Ile Ile
20 25 30
Gly Leu Met Val Gly Gly Val Val Ile Ala
35 40
<210> 2
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 2
Gly Phe Thr Phe Ser Ser Tyr Gly Met Ser
1 5 10
<210> 3
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 3
Ser Ile Asn Ser Asn Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
<210> 4
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 4
Gly Asp Tyr
1
<210> 5
<211> 438
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Ser Ile Asn Ser Asn Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
115 120 125
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
180 185 190
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
305 310 315 320
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
340 345 350
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Leu Gly
435
<210> 6
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 6
Arg Ser Ser Gln Ser Leu Val Tyr Ser Asn Gly Asp Thr Tyr Leu His
1 5 10 15
<210> 7
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 7
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 8
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 8
Ser Gln Ser Thr His Val Pro Trp Thr
1 5
<210> 9
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 9
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asn Gly Asp Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<---
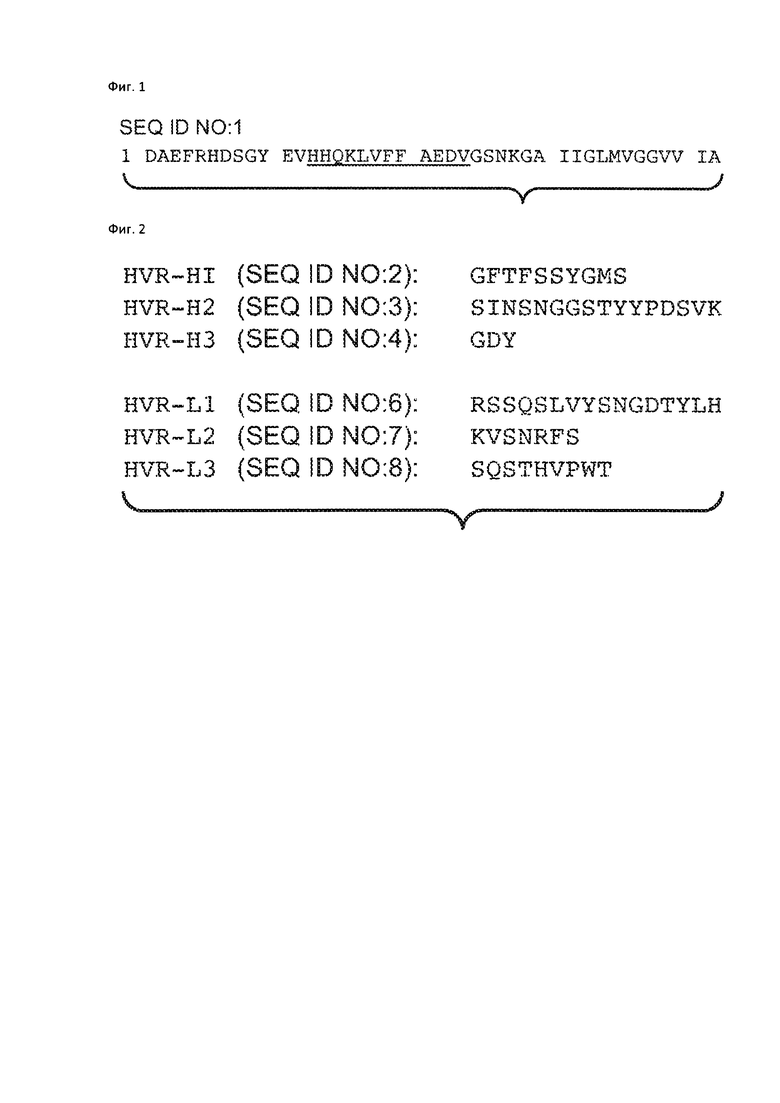


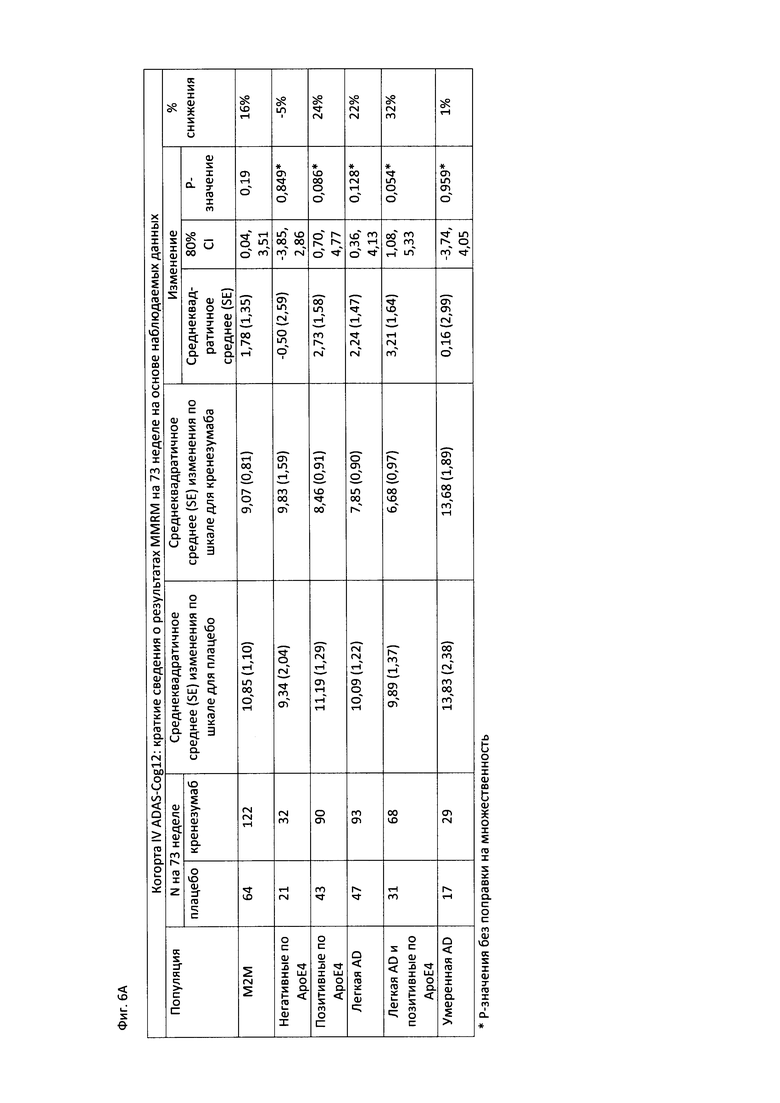
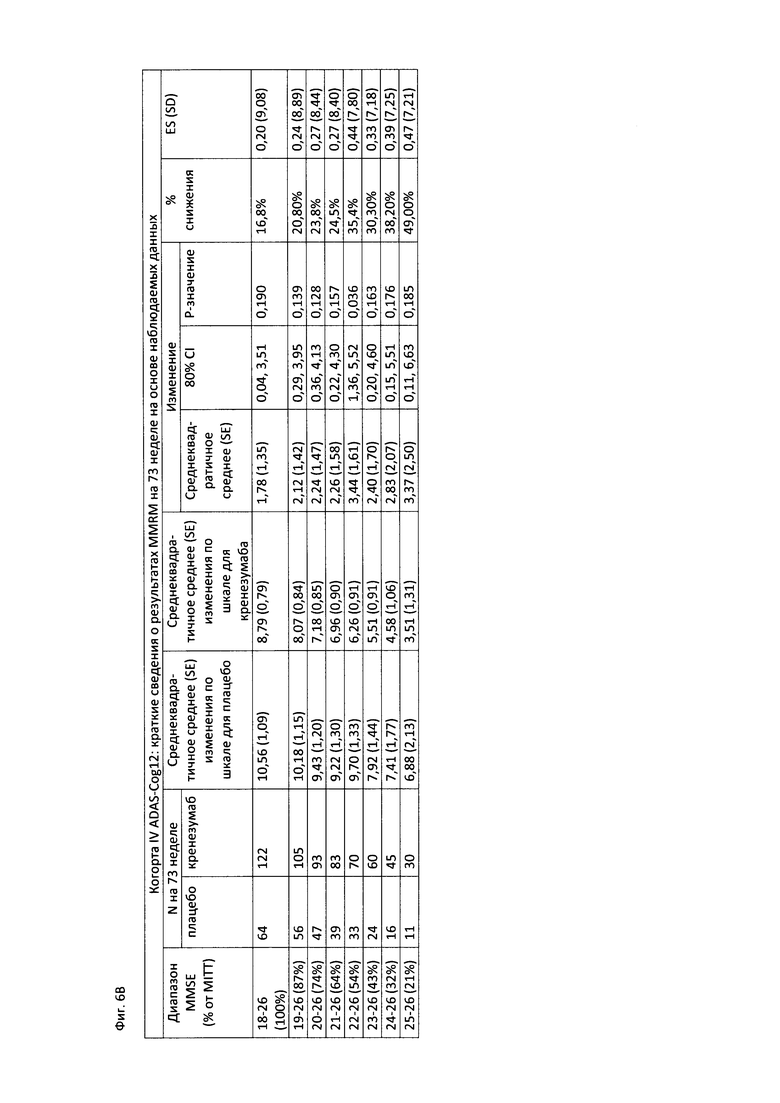
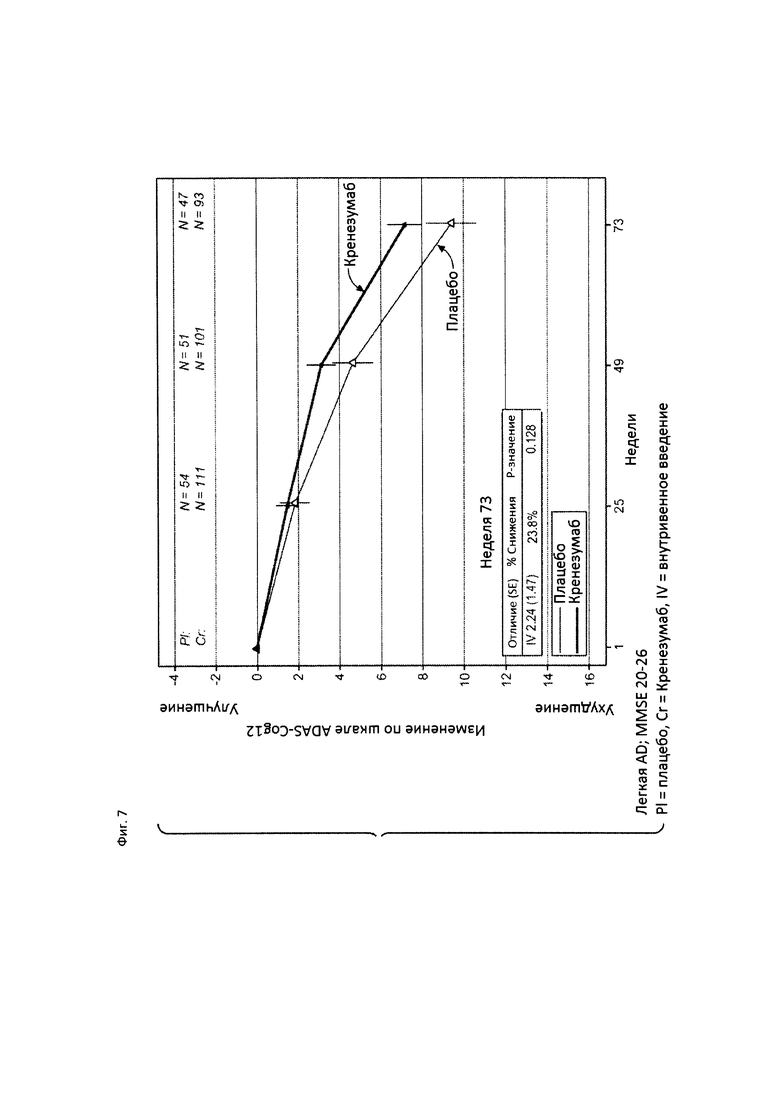
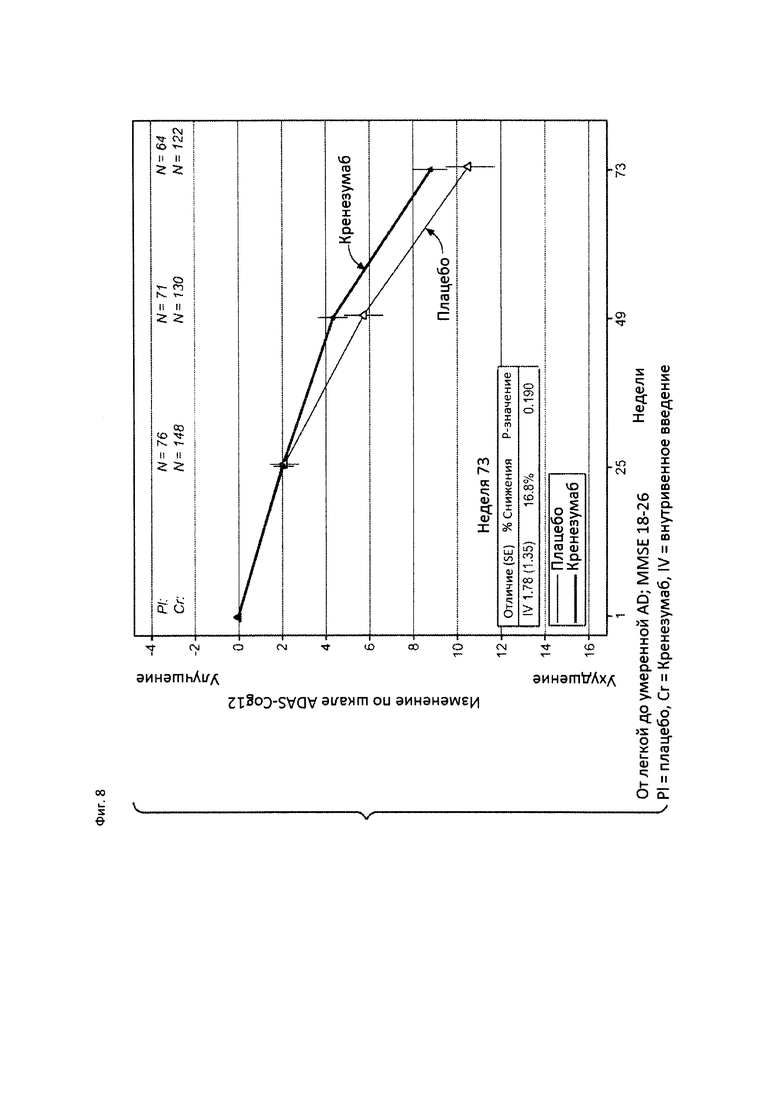
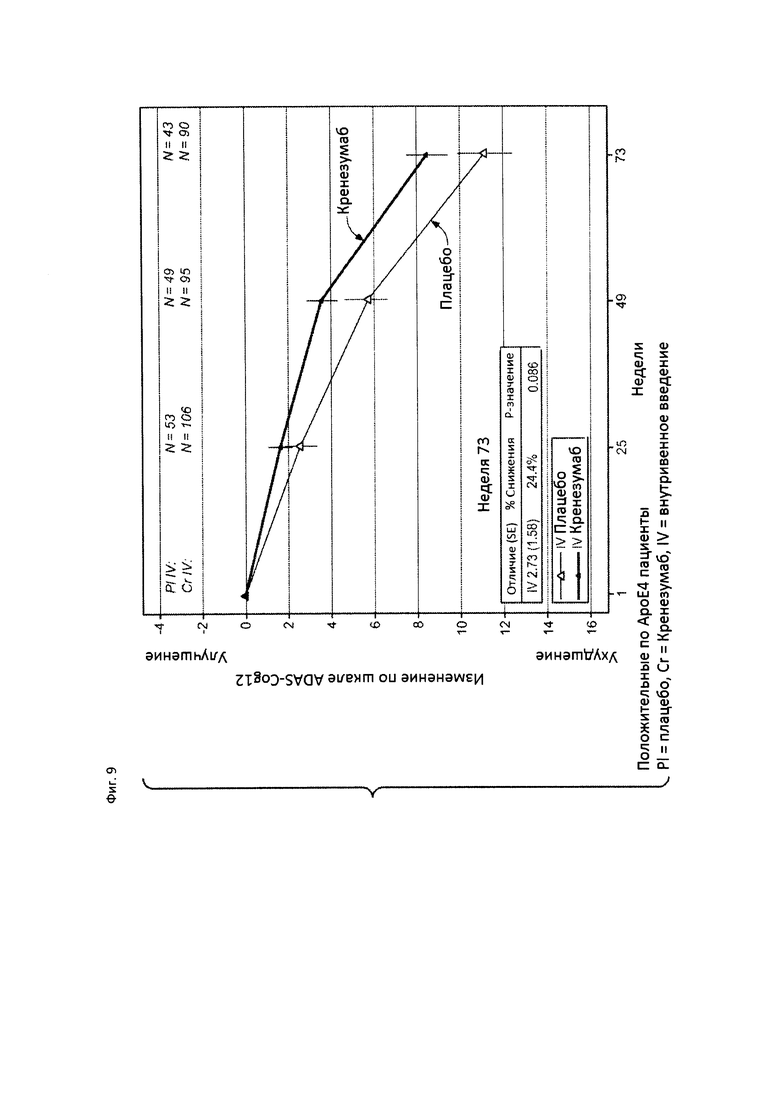
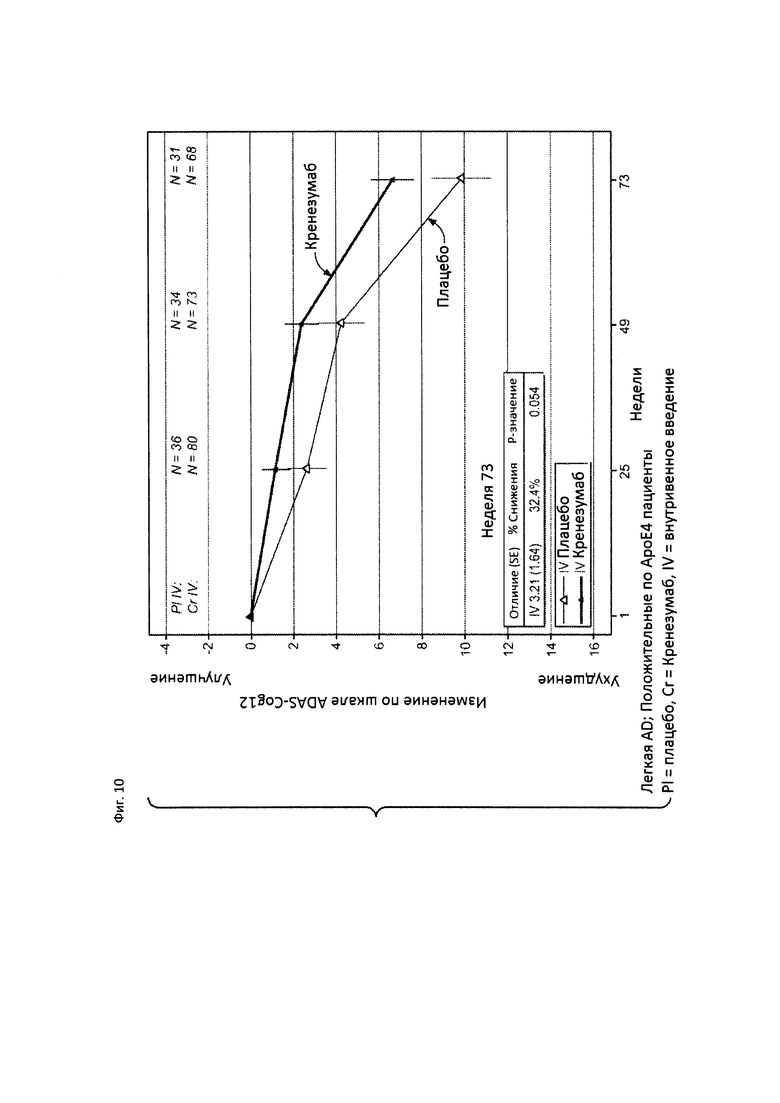
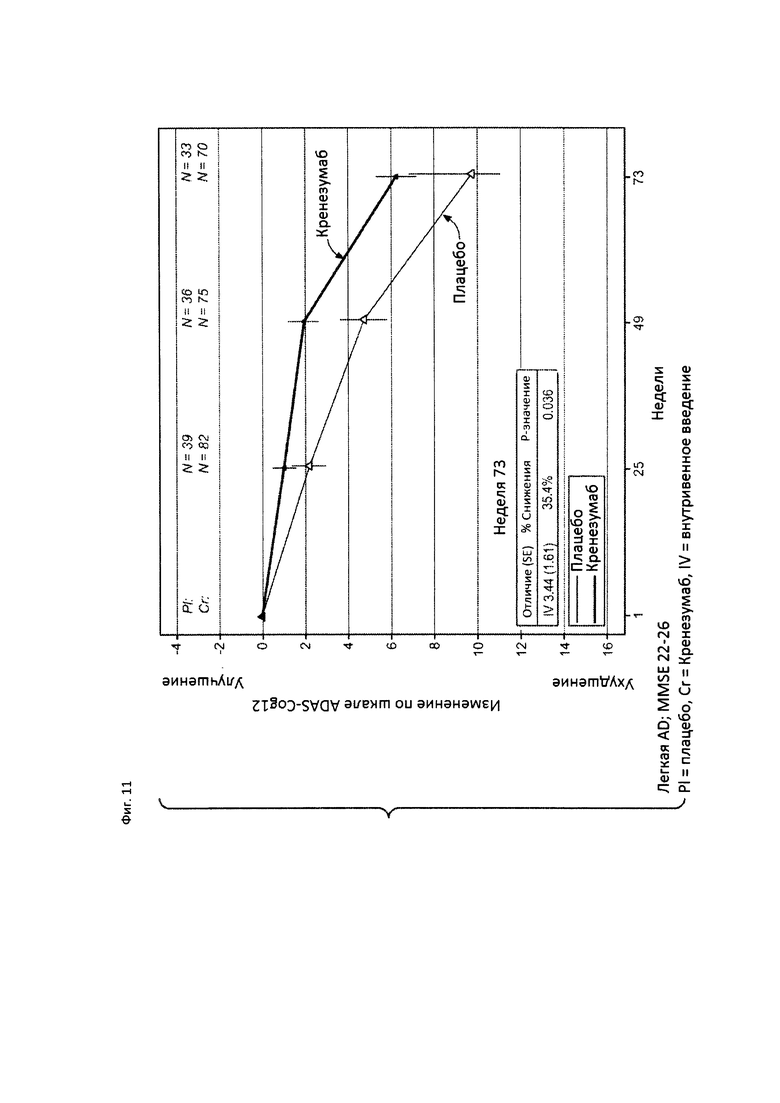
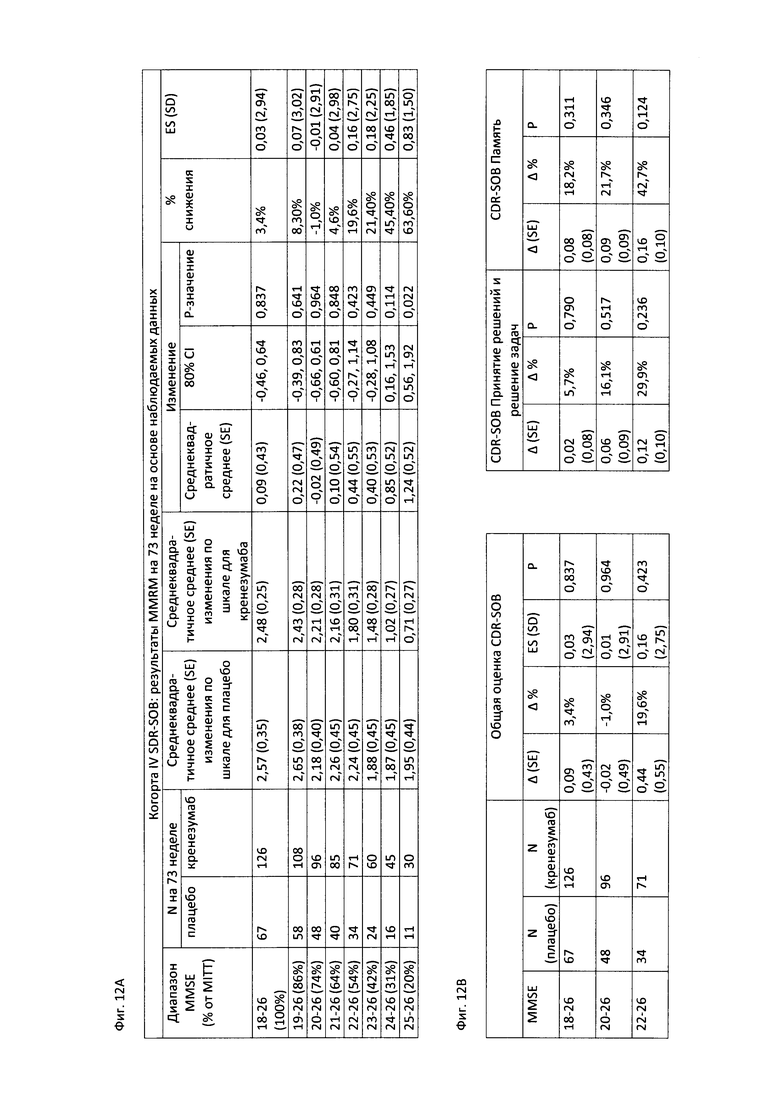
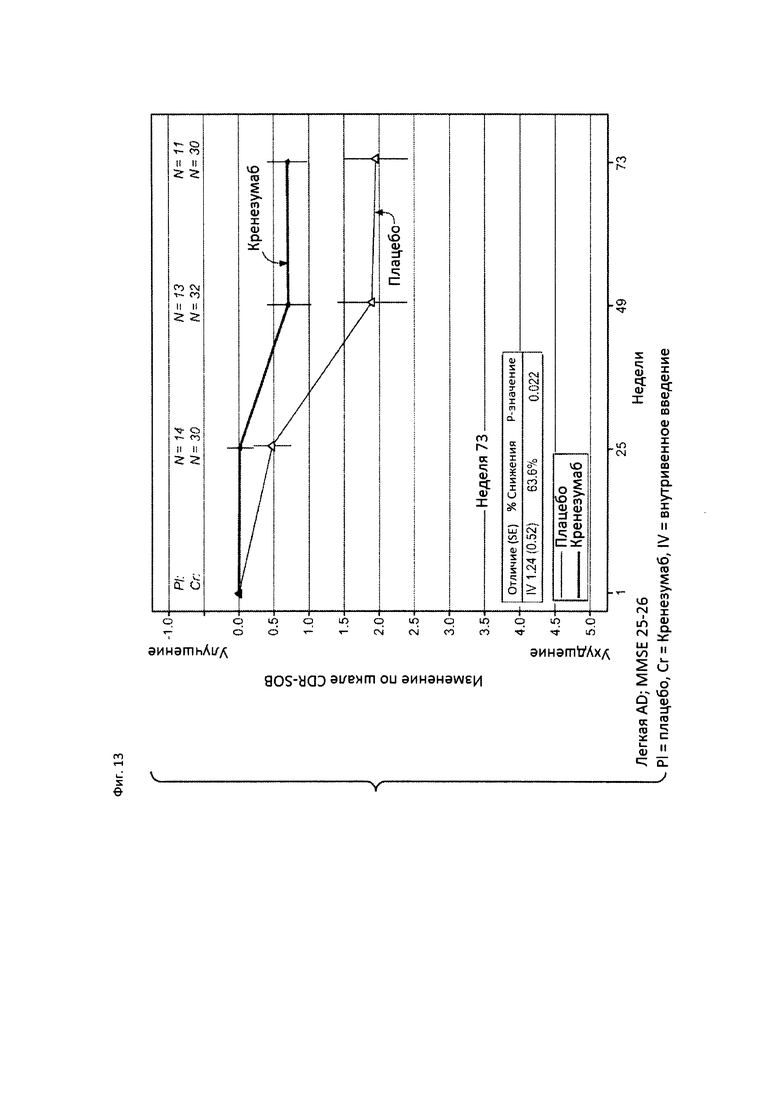
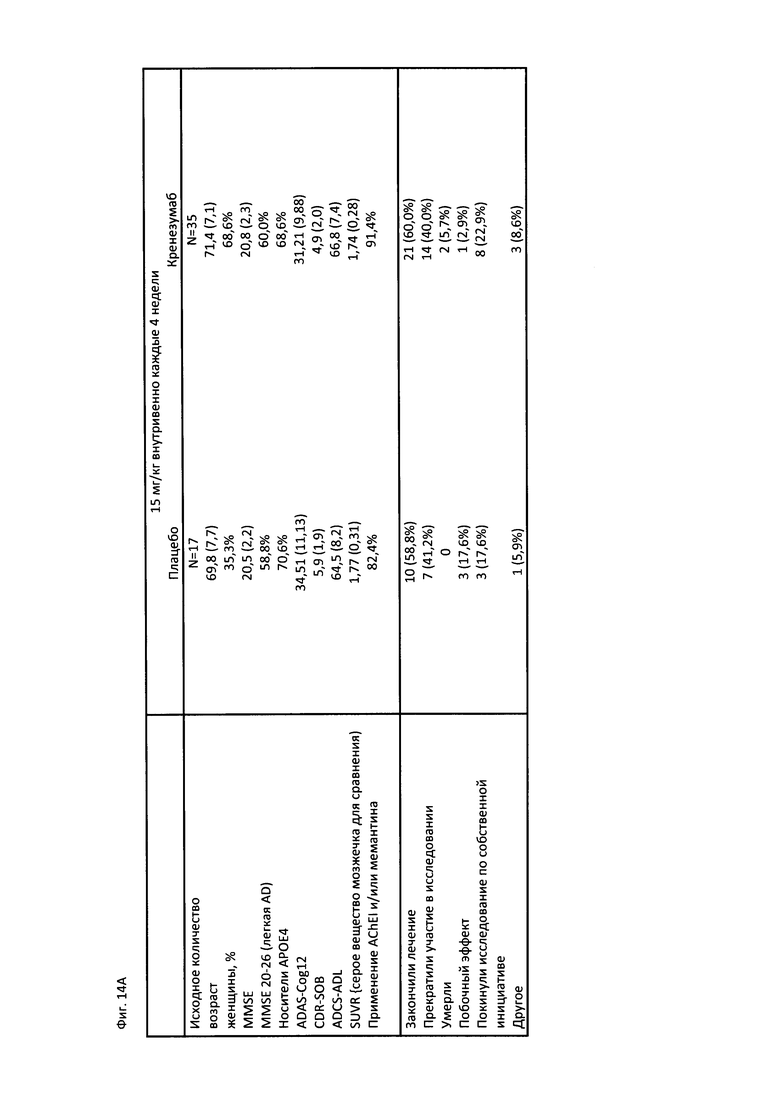
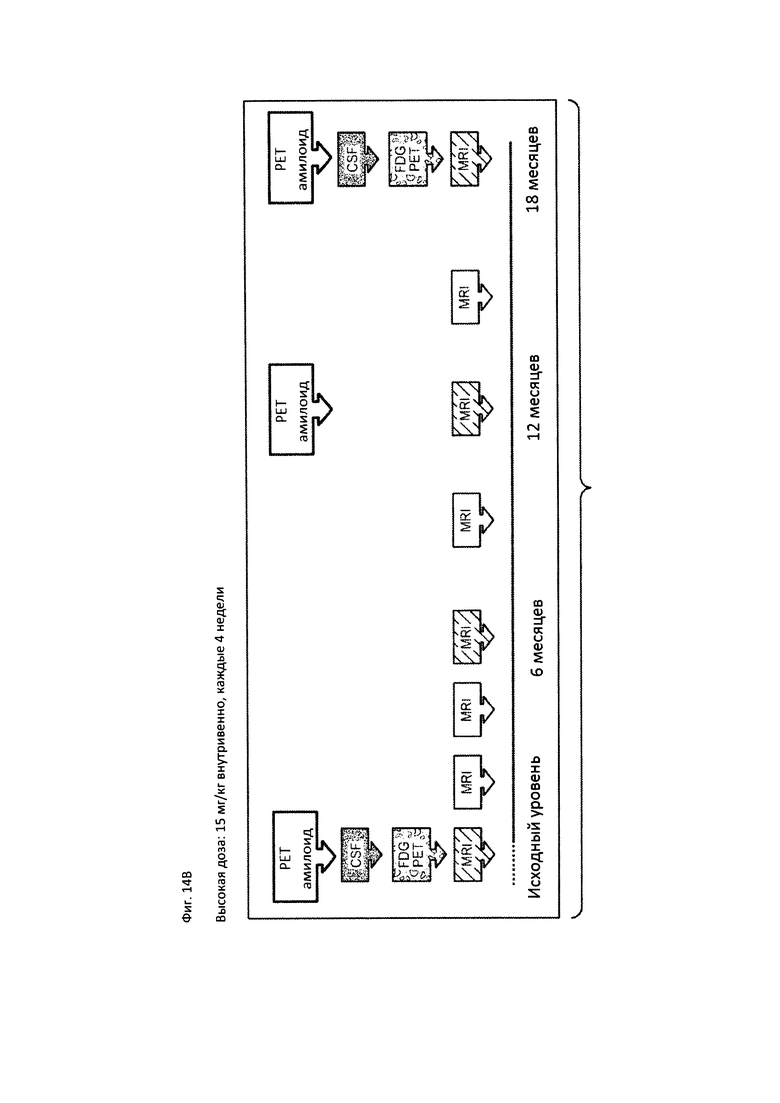
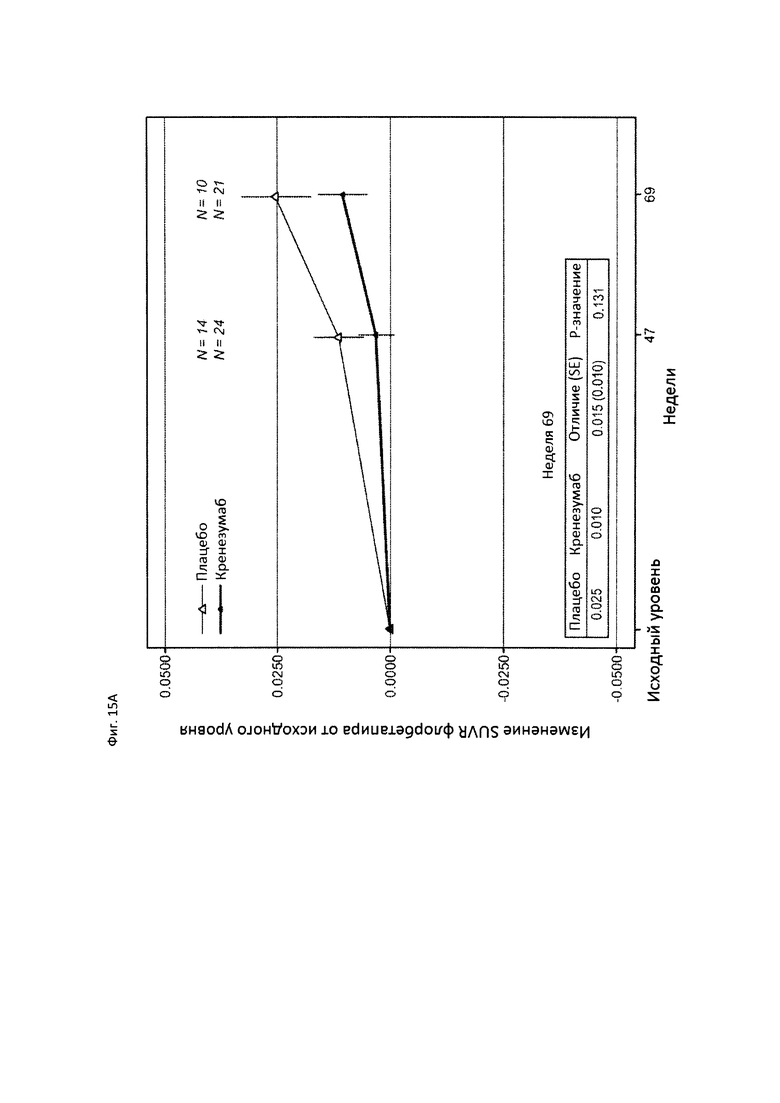
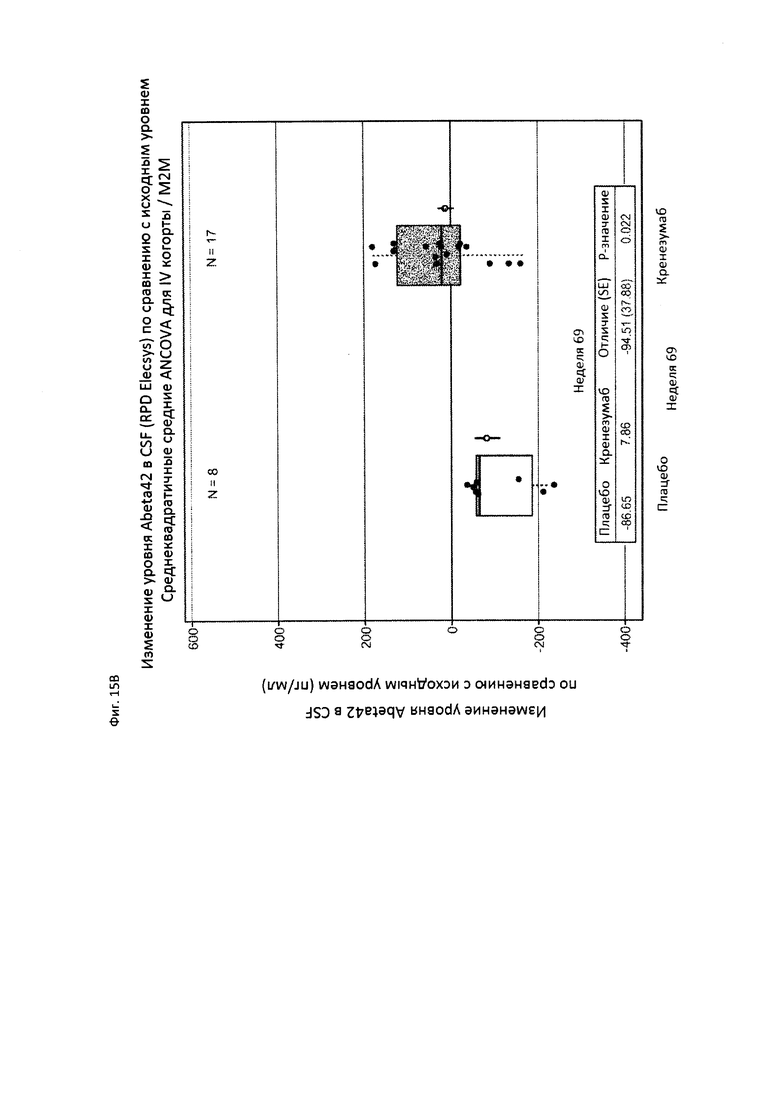
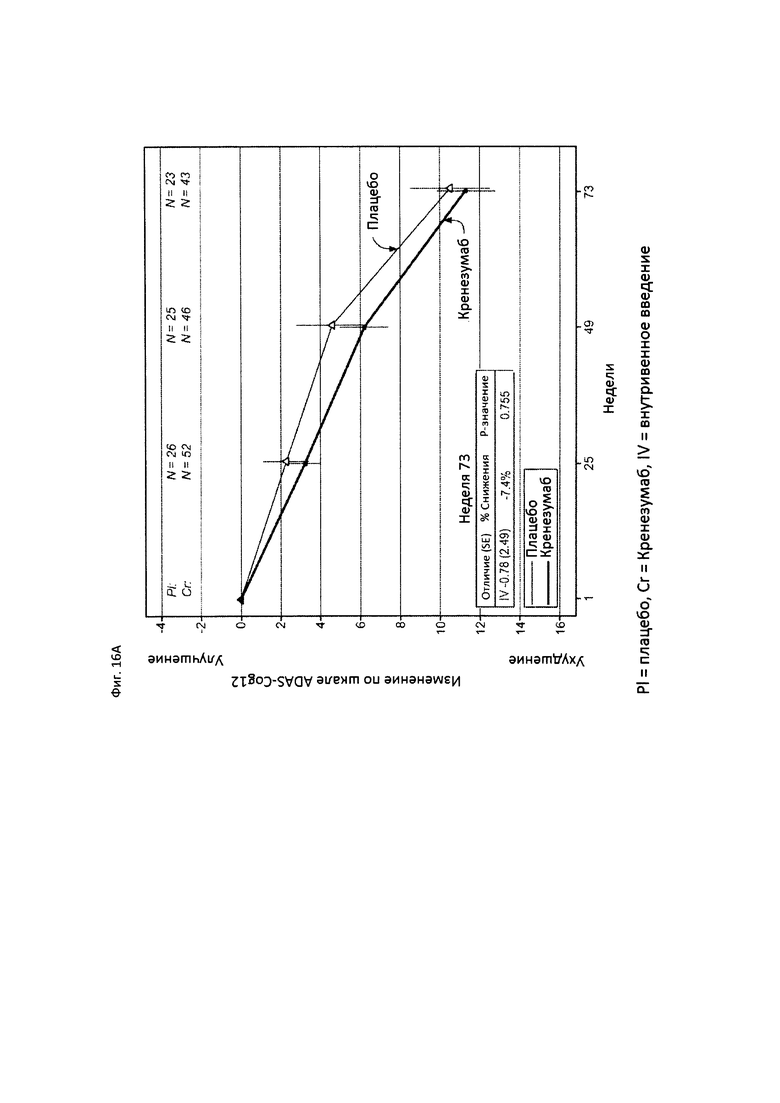
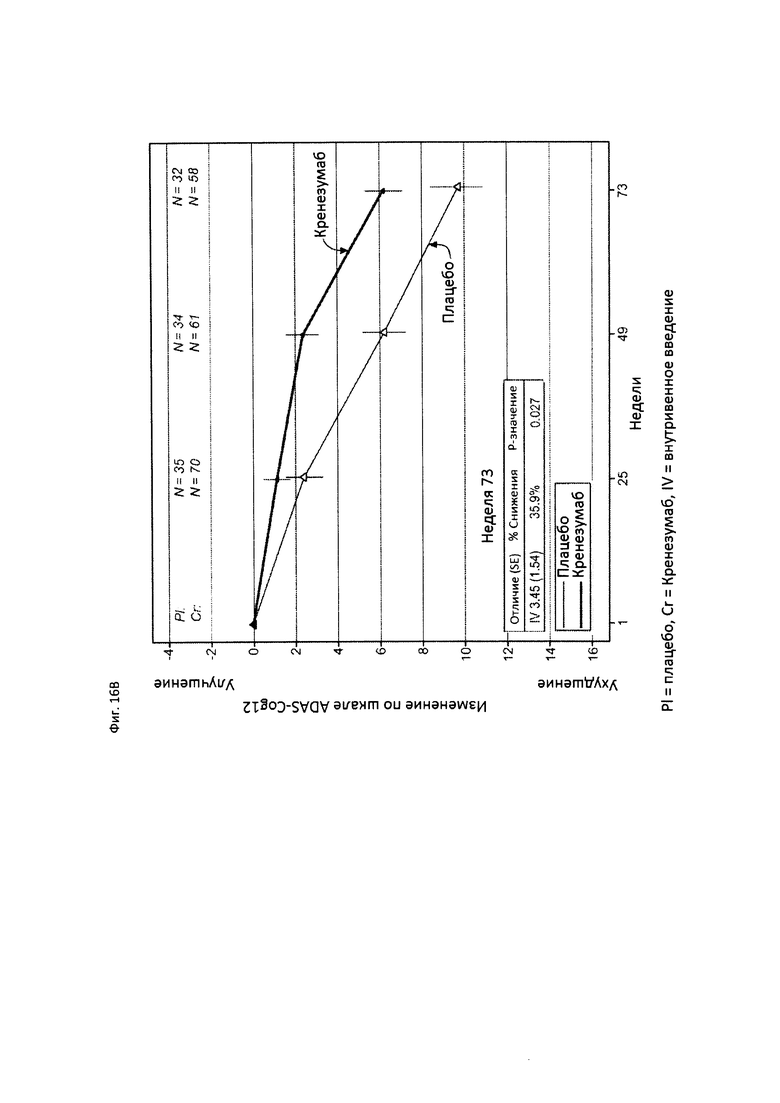
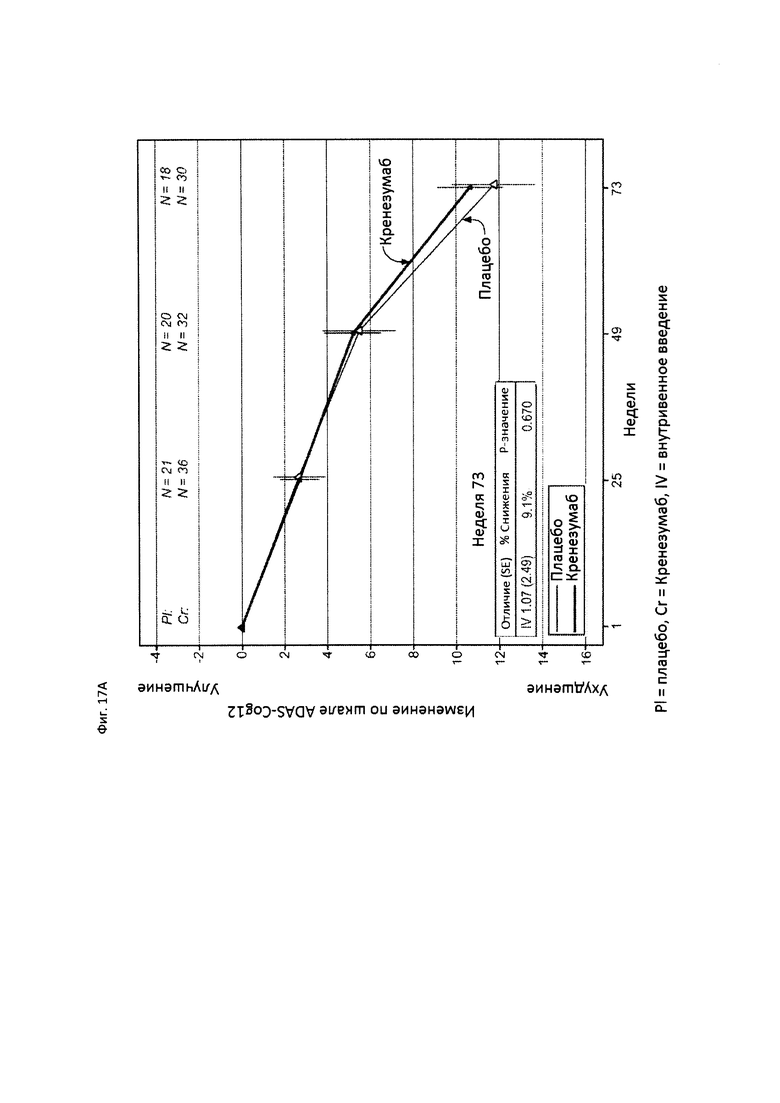
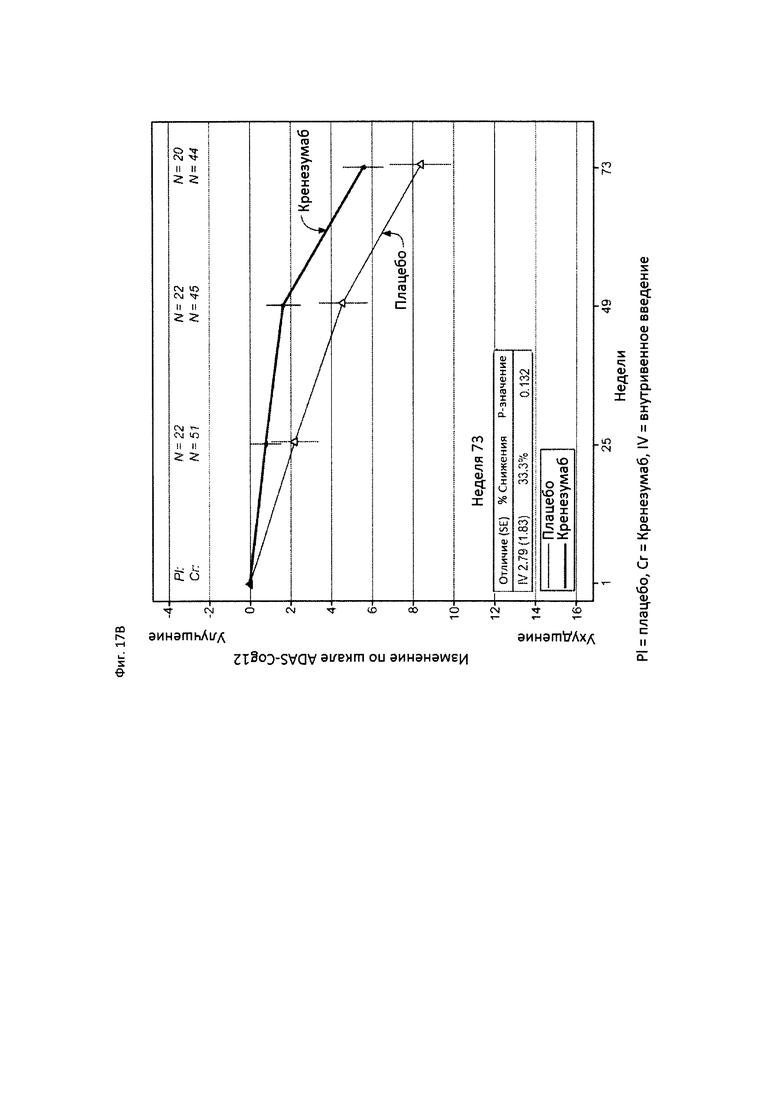
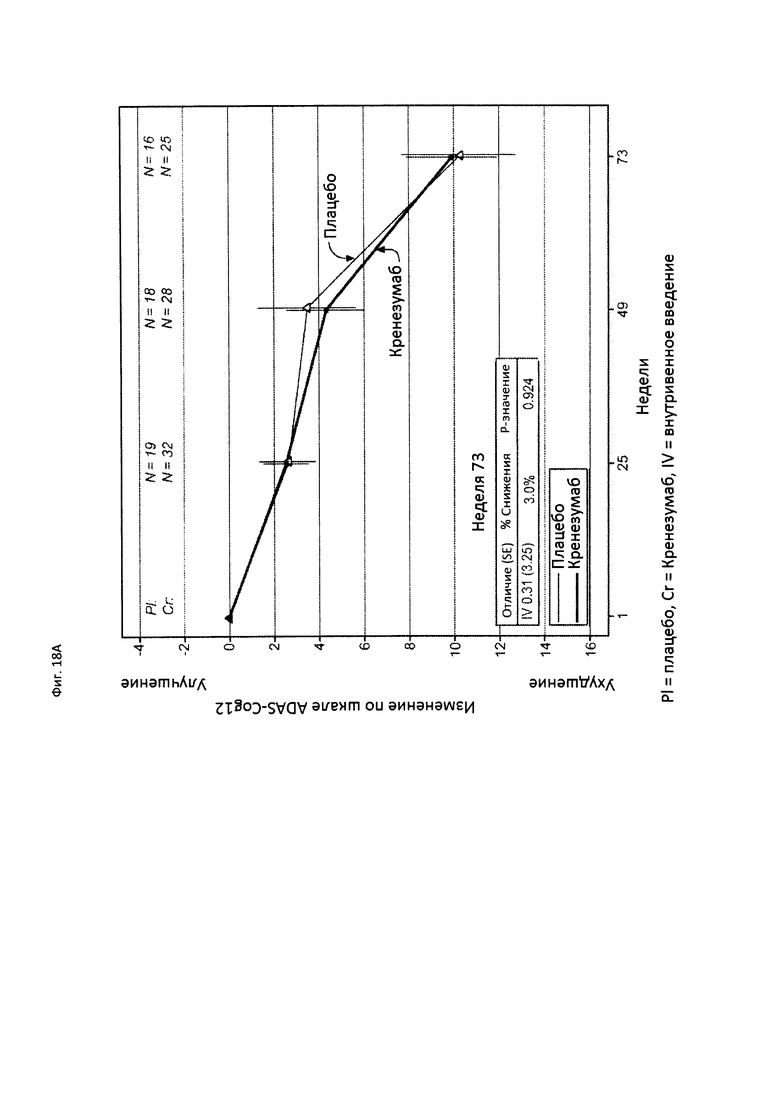
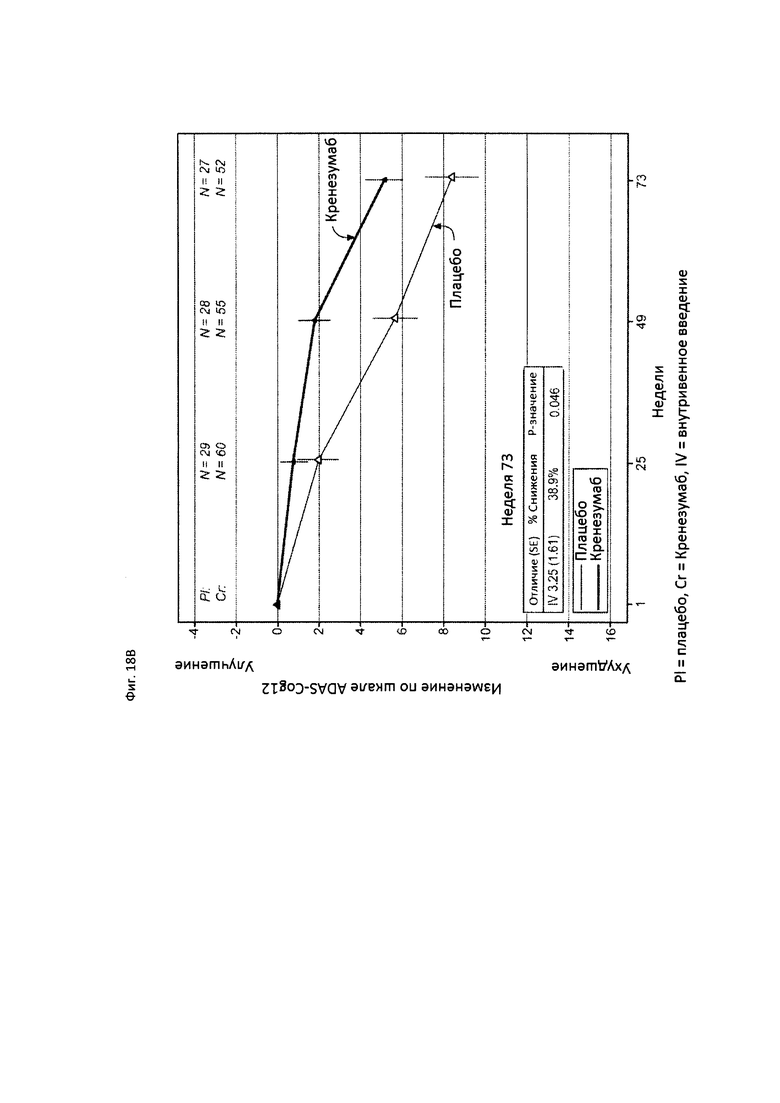
Изобретение относится к биотехнологии. Описаны способы лечения болезни Альцгеймера (AD) у пациентов, страдающих от легкой до умеренной AD, в том числе у пациентов положительным статусом по АроЕ4, и пациентов, страдающих от легкой AD. Также предусмотрены способы выбора пациентов для лечения антителом против Abeta. Способы включают применение прогностических и/или предиктивных биомаркеров. 6 н. и 62 з.п. ф-лы, 18 ил., 1 табл., 3 пр.
1. Способ лечения болезни Альцгеймера (AD) у пациента, страдающего от ранней болезни Альцгеймера (AD) или от легкой до умеренной болезни Альцгеймера (AD), включающий введение пациенту, страдающему от ранней или от легкой до умеренной AD, гуманизированного моноклонального антитела против бета-амилоида (Аβ) в количестве, которое является эффективным для лечения AD, причем пациент имеет, по меньшей мере, один аллель кластерина, который содержит Т в однонуклеотидном полиморфизме (SNP) rs1532278, где антитело представляет собой кренезумаб.
2. Способ по п. 1, в котором аллель кластерина представляет собой его эквивалентный аллель.
3. Способ по п. 1, включающий обнаружение полиморфизма в образце, полученном от пациента, где обнаруживаемый полиморфизм находится в неравновесном сцеплении с SNP rs1532278.
4. Способ по п. 3, в котором образец представляет собой образец крови, слюны, буккального мазка, образец ткани или образец биологической жидкости.
5. Способ по любому из пп. 1-4, в котором полиморфизм обнаруживают с помощью полимеразной цепной реакции.
6. Способ по любому из пп. 1-4, в котором полиморфизм обнаруживают с помощью секвенирования.
7. Способ по п. 5, в котором полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПНР, фосфат-аффинного электрофореза в полиакриламидном геле, высокопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, MassArray (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
8. Способ по любому из пп. 1-4, в котором полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
9. Способ по п. 1, в котором пациент страдает от легкой AD.
10. Способ по п. 1, в котором пациент страдает от ранней AD.
11. Способ по п. 9 или 10, в котором пациент набрал, по меньшей мере, 20 баллов, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
12. Способ по п. 11, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
13. Способ по любому из пп. 1-4, 7, 9-10, 12, в котором пациент имеет положительный статус по АроЕ4.
14. Способ выбора пациента, страдающего от ранней AD или от легкой до умеренной AD для лечения гуманизированным моноклональным антителом против бета-амилоида (АР), включающий:
(a) обнаружение в образце, полученном от пациента, наличия или отсутствия аллеля кластерина с однонуклеотидным полиморфизом (SNP) rs1532278, содержащим Т, и
(b) выбор пациента, который с большей вероятностью будет отвечать на лечение гуманизированным моноклональным антителом против Аβ, в том случае, если в образце присутствует однонуклеотидный полиморфизм (SNP) rs1532278, содержащий Т, где антитело представляет собой кренезумаб.
15. Способ по п. 14, в котором аллель кластерина представляет собой его эквивалентный аллель.
16. Способ по п. 15, в котором эквивалентный аллель находится в неравновесном сцеплении с SNP rs1532278.
17. Способ по п. 14 или 15, в котором образец представляет собой образец крови, слюны, буккального мазка, образец ткани или образец биологической жидкости.
18. Способ по любому из пп. 14-16, в котором полиморфизм обнаруживают с помощью полимеразной цепной реакции.
19. Способ по любому из пп. 14-16, в котором полиморфизм обнаруживают с помощью секвенирования.
20. Способ по п. 18, в котором полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высокопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, MassArray (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
21. Способ по любому из пп. 14-16, в котором полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
22. Способ по п. 14, в котором пациент страдает от легкой AD.
23. Способ по п. 14, в котором пациент страдает от ранней AD.
24. Способ по п. 15, в котором пациент набрал, по меньшей мере, 20 баллов, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
25. Способ по п. 24, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
26. Способ по любому из пп. 14-16, 20, 22-24, в котором пациент имеет положительный статус по АроЕ4.
27. Способ определения пациента, страдающего от ранней AD или легкой до умеренной формами AD, который с большей вероятностью будет отвечать на лечение гуманизированным моноклональным антителом против бета-амилоида (Аβ), включающий обнаружение в образце, полученном из пациента, наличия аллеля кластерина, включающего полиморфизм, который предсказывает ответ на лечение гуманизированным моноклональным антителом против бета-амилоида (Аβ), где антитело представляет собой кренезумаб.
28. Способ по п. 27, в котором полиморфизм представляет собой однонуклеотидный полиморфизм (SNP) rs1532278, содержащий Т.
29. Способ по п. 27, в котором аллель кластерина представляет собой эквивалентный аллель аллеля, включающего SNP rs1532278.
30. Способ по п. 29, в котором эквивалентный аллель находится в неравновесном сцеплении с SNP rs1532278.
31. Способ по п. 27 или 28, в котором образец представляет собой образец крови, слюны, буккального мазка, образец ткани или образец биологической жидкости.
32. Способ по любому из пп. 27-30, в котором полиморфизм обнаруживают с помощью полимеразной цепной реакции.
33. Способ по любому из пп. 27-30, в котором полиморфизм обнаруживают с помощью секвенирования.
34. Способ по п. 32, в котором полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высокопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, MassArray (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
35. Способ по любому из пп. 27-30, в котором полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
36. Способ по п. 27, в котором пациент страдает от легкой AD.
37. Способ по п. 27, в котором пациент страдает от ранней AD.
38. Способ по п. 36, в котором пациент набрал, по меньшей мере, 20 баллов, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
39. Способ по п. 38, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
40. Способ по любому из пп. 27-30, 34, 36-38, в котором пациент имеет положительный статус по АроЕ4.
41. Способ предсказания, будет ли индивидуум, страдающий от AD, отвечать на лечение, включающее антитело против Abeta или его антигенсвязывающий фрагмент, включающий:
(a) определение идентичности нуклеотида в SNP rs1532278 в образце, полученном от индивидуума, и
(b) предсказание повышенной вероятности ответа на лечение, включающее антитело против Abeta или его антигенсвязывающий фрагмент, если образец содержит, по меньшей мере, один аллель с SNP rs1532278, содержащим нуклеотид Т, где антитело представляет собой кренезумаб.
42. Способ по п. 41, в котором пациент страдает от легкой AD.
43. Способ по п. 41, в котором пациент страдает от ранней AD.
44. Способ по п. 41, в котором пациент набрал от 20 до 26 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
45. Способ по любому из пп. 41-44, в котором пациент имеет положительный статус по АроЕ4.
46. Способ оптимизации терапевтической эффективности для лечения AD, включающий определение генотипа пациента, где пациент, который имеет, по меньшей мере, один аллель кластерна с SNP rs1532278, содержащий нуклеотид Т, с большей вероятностью будет отвечать на лечение антителом против Abeta или его антигенсвязывающим фрагментом, в котором антитело представляет собой кренезумаб.
47. Способ по п. 46, в котором пациент страдает от ранней или легкой AD.
48. Способ по п. 46, в котором пациент набрал, по меньшей мере, 20 баллов, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
49. Способ по п. 48, в котором пациент набрал от 22 до 26 баллов по шкале MMSE.
50. Способ по любому из пп. 46-48, в котором пациент имеет положительный статус по АроЕ4.
51. Способ определения вероятности того, что пациент, страдающий от AD, будет получать пользу от лечения, включающего антитело против Abeta или его антигенсвязывающий фрагмент, где способ включает определение генотипа пациента, при этом пациент, который имеет, по меньшей мере, один аллель кластерина с SNP rs1532278, содержащий нуклеотид Т, с большей вероятностью будет отвечать на лечение антителом против Abeta, чем пациент, который не имеет аллелей с SNP rs1532278, содержащим нуклеотид Т.
52. Способ по п. 51, в котором пациент страдает от ранней или легкой AD.
53. Способ по п. 51, в котором пациент набрал, по меньшей мере, 20 баллов, от 20 до 30 баллов, от 20 до 26 баллов, от 24 до 30 баллов, от 21 до 26 баллов, от 22 до 26 баллов, от 22 до 28 баллов, от 23 до 26 баллов, от 24 до 26 баллов или от 25 до 26 баллов по шкале MMSE.
54. Способ по любому из пп. 51-53, в котором пациент имеет положительный статус по АроЕ4.
55. Способ по п. 51, в котором антитело против бета-амилоида связывается с остатками 13-24 β-амилоида (1-42) (SEQ ID NO: 1).
56. Способ по п. 55, в котором антитело способно связывать олигомерные и мономерные формы β-амилоида.
57. Способ по п. 56, в котором антитело представляет собой антитело IgG4.
58. Способ по п. 56 или 57, в котором антитело включает шесть гипервариабельных областей (HVR), где:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
59. Способ по п. 58, в котором антитело включает тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
60. Способ по п. 59, в котором антитело представляет собой кренезумаб.
61. Способ по п. 51, в котором антитело против бета-амилоида выбрано из группы, состоящей из соланезумаба, бапинейзумаба, адуканумаба и гантенерумаба.
62. Способ по любому из пп. 46-49, 51-53, 55-57, 59-61, в котором аллель кластерина представляет собой эквивалентный аллель аллеля, включающего SNP rs1532278.
63. Способ по п. 62, в котором эквивалентный аллель находится в неравновесном сцеплении с SNP rs1532278.
64. Способ по п. 62, в котором образец представляет собой образец крови, слюны, буккального мазка, образец ткани или образец биологической жидкости.
65. Способ по п. 62, в котором полиморфизм обнаруживают с помощью полимеразной цепной реакции.
66. Способ по п. 62, в котором полиморфизм обнаруживают с помощью секвенирования.
67. Способ по п. 65 или 66, в котором полиморфизм обнаруживают методом, выбранным из группы, состоящей из секвенирования ДНК со сканирующим зондом и нанопорового секвенирования ДНК, пиросеквенирования, денатурирующего градиентного гель-электрофореза (DGGE), гель-электрофореза с временным градиентом температуры (TTGE), электрофореза в полиакриламидном геле с Zn(II)-цикленом, гомогенного флуоресцентного анализа однонуклеотидного полиморфизма на основе ПЦР, фосфат-аффинного электрофореза в полиакриламидном геле, высокопроизводительных платформ для генотипирования SNP, молекулярных маяков, 5'-нуклеазной реакции, анализа Taqman, MassArray (удлинение праймера на одно основание в сочетании с времяпролетной масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией), тритиловых массовых меток, платформ для генотипирования (таких как Invader Assay®), анализа методом удлинения праймера на один нуклеотид (SBE), ПЦР-амплификации (например, ПЦР-амплификация на магнитных наночастицах (MNP)), рестрикционного анализа ПЦР-продуктов (RFLP), аллель-специфической ПЦР, анализа методом многократного удлинения праймера (МРЕХ) и изотермической амплификации SMART.
68. Способ по п. 62, в котором полиморфизм обнаруживают путем амплификации целевой области, содержащей, по меньшей мере, один полиморфизм, и гибридизации, по меньшей мере, с одним олигонуклеотидом, специфичным в отношении последовательности, который гибридизуется в жестких условиях, по меньшей мере, с одним полиморфизмом, и обнаружения гибридизации.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| US 7892544 B2, 22.02.2011 | |||
| Родин Д.И., Современные подходы к терапии при болезни Альцгеймера: от амилоида к поиску новых мишеней, Ученые записки СПбГМУ им | |||
| И.П | |||
| Павлова, 2014 г., том XXI, номер 1. | |||
Авторы
Даты
2020-04-30—Публикация
2015-02-06—Подача