Область техники
Изобретение в целом относится к способам и композициям для прогнозирования терапевтической эффективности лечения онкологических заболеваний и прогноза онкологических заболеваний. Изобретение раскрывает маркеры, которые связаны с благоприятными и неблагоприятными результатами, соответственно, при некоторых способах лечения злокачественных новообразований и полезны в качестве прогностических маркеров злокачественных новообразований. Способы, связанные с этими маркерами, раскрываются для прогнозирования эффективности лечения злокачественных новообразований и прогнозирования клинических исходов для пациентов с онкологическими заболеваниями.
Предшествующий уровень техники
Рак желудка и пищевода (гастроэзофагеальный, ГЭ) относится к числу злокачественных новообразований с наивысшей неудовлетворенной медицинской востребованностью. Рак желудка — вторая ведущая причина смерти во всем мире. Заболеваемость раком пищевода увеличилось в последние десятилетия, и общая пятилетняя выживаемость ЖК-раком составляет 20-25%, несмотря на агрессивность признанного стандартного лечения, связанного с существенными побочными эффектами. Востребованность в медицинской помощи у пациентов, страдающих этим типом злокачественных новообразований, высока, и требуются инновационные препараты.
Молекула плотного контакта клаудин 18, изотип 2 (CLDN18.2) представляет собой ассоциированный с злокачественным новообразованием вариант сплайсинга клаудина 18 [Niimi, T., et al., Mol Cell Biol, 2001. 21 (21): p. 7380-90; Tureci, O., et al., Gene, 2011. 481(2): p. 83-92]. CLDN18.2 представляет собой трансмембранный белок 27,8 кДа, содержащий четыре трансмембранных домена с двумя небольшими внеклеточными петлями (петля 1, охваченная гидрофобной областью 1 и гидрофобной областью 2, петля 2, охваченная гидрофобными областями 3 и 4). CLDN18.2 представляет собой высокоселективный антиген желудочного происхождения, исключительно экспрессируемый на короткоживущих дифференцированных желудочных эпителиальных клетках и не обнаруживаемый в любой другой нормальной ткани человека. Антиген эктопически экспрессируется на значительных уровнях в разнообразных злокачественных новообразованиях человека, включая гастроэзофагеальный рак и рак поджелудочной железы [Sahin, U., et al., Clin Cancer Res, 2008. 14 (23): p. 7624-34]. Белок CLDN18.2 также часто обнаруживается в метастазах в лимфатических узлах рака желудка и в отдаленных метастазах. CLDN18.2, по-видимому, участвует в пролиферации CLDN18.2-положительных опухолевых клеток, поскольку отрицательная регуляция мишени с помощью технологии siRNA приводит к ингибированию пролиферации клеток рака желудка.
IMAB362 представляет собой химерное моноклинальною антитело подтипа IgG1, направленное против CLDN18.2. IMAB362 распознает первый внеклеточный домен CLDN18.2 с высокой аффинностью и специфичностью и не связывается с каким-либо другим членом семейства Клаудио, включая близкородственный вариант сплайсинга 1 клаудина 18 (CLDN18.1).
У мышей, несущих ксенотрансплантаты человека, экспрессирующие CLDN18.2, после введения IMAB362 наблюдались повышение выживаемости и регрессия опухолей. При внутривенном введении релевантным видам животных токсичность в желудочной ткани не наблюдалась, поскольку целевой эпитоп недоступен. Однако опухолевая мишень становится доступной для IMAB362 во время злокачественной трансформации. IMAB362 объединяет четыре независимых сильнодействующих механизма действия: (i) антителозависимую клеточную цитотоксичность (ADCC), (ii) комплементарно-зависимую цитотоксичность (CDC), (iii) индукцию апоптоза, вызванную сшиванием мишени на поверхности опухоли и (iv) прямое ингибирование пролиферации.
Предыдущее исследование фазы I оценило IMAB362 в качестве монотерапии в разовой дозе у пациентов с гастроэзофагеальным раком в поздней стадии. В этом исследовании в качестве монотерапии применяли пять доз IMAB362 (33, 100, 300, 600 и 1000 мг/м²). Это исследование показывает, что однократное введение этого антитела является безопасным и хорошо переносимым в дозе до 1000 мг/м², так как не было выявлено каких-либо существенных различий в профиле AE и других параметрах безопасности между группами доз (AE = неблагоприятное событие). Лучшие результаты в отношении противоопухолевой активности были получены для групп 300 мг/м² и 600 мг/м². У двух пациентов группы 300 мг/м² заболевание контролировалось и, поскольку у них были только нецелевые поражения, они оценивались как не-CR, не-PD (CD = полный ответ, PD = прогрессирующее заболевание). Продолжительность не-CR, не-PD составляла около двух месяцев и шесть недель, соответственно. Уровни опухолевых маркеров этих трех пациентов оставались стабильными. У одного пациента в группе 600 мг/м² наблюдалось стабилизация заболевания (SD). Продолжительность SD составляла около 2 месяцев.
На основании сильнодействующих механизмов действия для индуцированного IMAB362 клеточного убийства, преимущества выживания IMAB362-обработанных мышей, несущих CLDN18.2-положительные опухоли, отсутствия каких-либо признаков токсичности, связанной с IMAB362, и многообещающих результатов исследования фазы I было инициализировано исследование фазы IIa. Это клиническое исследование фазы IIa проводилось для определения безопасности, переносимости и противоопухолевой активности повторных доз IMAB362 у пациентов с метастатическим, рефрактерным или рецидивирующим заболеванием прогрессирующей аденокарциномы желудка или нижнего пищевода, доказанного гистологией.
В этом исследовании фазы IIa исследуемое лекарственное средство применялось в трех когортах, которые были рекрутированы последовательно. Первая когорта из трех пациентов получала повторные дозы IMAB362 при более низком уровне дозы (300 мг/м² площади поверхности тела). Антитело вводили в виде внутривенной инфузии в течение 2 ч. Поскольку в первой когорте не было обнаружено признаков токсичности, связанной с IMAB362, дозу IMAB362 второй когорты (три пациента) увеличивали до 600 мг/м² площади поверхности тела. В третьей когорте 19 пациентов были распределены с той же дозой (повторяющееся применение 600 мг/м² площади поверхности тела). Образцы пациентов из этой когорты анализировали на предмет нескольких сопутствующих анализов, например ADCC, CDC, иммунофенотипирования и генетических иммунных полиморфизмов. Все пациенты всех когорт получали повторные дозы IMAB362 каждые две недели при 2, 5, 6, 7 и 8 посещении (5 применений).
Расхождение антиген-положительных опухолей (сверхэкспрессирование целевого антигена до такой же степени) в отношении респонсивности на вмешательство терапевтическими моноклональными антителами, такими как IMAB362, указывает на наличие дополнительных факторов, связанных с результатом терапии. Это требует тщательного отбора пациентов, которые могут получить пользу от антительной терапии.
Поэтому необходимо разработать тест для оценки приемлемости пациентов для антительной терапии. Настоящее изобретение удовлетворяет эту потребность, предоставляя маркеры, которые связаны с благоприятными и неблагоприятными результатами, соответственно, при антительной терапии. Кроме того, настоящее изобретение демонстрирует, что эти маркеры полезны в качестве маркеров для прогнозирования клинических исходов для пациентов с онкологическими заболеваниями.
Представленные в данном документе результаты могут быть использованы для выбора подходящего лечения для пациента с онкологическим заболеванием и, в частности, для принятия решения о том, следует ли назначать антительную терапию пациенту с онкологическим заболеванием.
Сущность изобретения
Настоящее изобретение относится к способам генотипирования SNP (однонуклеотидных полиморфизмов), например, для применения при оценке вероятности индивидуума реагировать на терапевтическое лечение злокачественного новообразования, при выборе режима лечения или профилактики (например, при принятии решения о том, следует ли вводить конкретный терапевтический агент индивидууму, имеющему злокачественное новообразование, или у которого есть повышенный риск развития злокачественного новообразования в будущем), или при оценке прогноза у индивидуума серьезности заболевания и восстановления.
Настоящее изобретение основано на том, что определенные генотипы SNP ассоциированы с чувствительностью/нечувствительностью злокачественного новообразования к обработке антителами, такими как лечение CLDN18.2-положительного злокачественного новообразования, в частности CL1318.2-положительного гастроэзофагеального рака с помощью IMAB362. Настоящее изобретение также основано на том, что определенные генотипы SNP связаны с клиническим исходом для пациентов с онкологическими заболеваниями и, таким образом, полезны для прогнозирования злокачественных новообразований.
В одном аспекте изобретение относится к способу оценки
(i) если пациент с онкологическим заболеванием, имеющий положительную по опухолевому антигену опухоль, является респондером на лечение антителом против опухолевого антигена и/или
(ii) если пациент с онкологическим заболеванием, предпочтительно пациент с онкологическим заболеванием, имеющий положительную по опухолевому антигену опухоль, будет иметь выживаемость без прогрессии,
причем указанный способ включает определение генотипа для одного или нескольких однонуклеотидных полиморфизмов, выбранных из группы, состоящей из FCGR2A rs1801274, MUC1 rs4072037, IL-10 rs1800896, DNMT3A rs1550117, SMAD4 rs12456284, EGF rs4444903, CDH1 rs16260, ERCC1 rs11615 и FCGR3A rs396991 в образце, полученном из пациента.
В одном воплощении присутствие гетерозиготного генотипа FCGR2A rs1801274 [CT] указывает на снижение риска того, что пациент с онкологическим заболеванием не будет респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа FCGR2A rs1801274 [TT] и/или гомозиготного генотипа FCGR2A rs1801274 [CC] указывает на повышение риска того, что пациент с онкологическим заболеванием не будет респондером на лечение антителом и/или повышение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа MUC1 rs4072037 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа MUC1 rs4072037 [GG] указывает на повышение риска того, что пациент с онкологическим заболеванием не будет респондером на лечение антителом и/или повышенный риск того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа IL-10 rs1800896 [GG] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гетерозиготного генотипа DNMT3A rs1550117 [GA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гетерозиготного генотипа SMAD4 rs12456284 [GA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа EGF rs4444903 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа CDH1 rs16260 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа ERCC1 rs11615 [TT] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гетерозиготного генотипа FCGR3A rs396991 [TG] и/или гомозиготного генотипа FCGR3A rs396991 [TT] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа FCGR3A rs396991 [GG] указывает на повышение риска того, что пациент с онкологическим заболеванием не будет респондером на лечение антителом и/или повышенный риск того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении опухолевый антиген представляет собой белок CLDN18.2.
В одном аспекте изобретение относится к способу оценки
(i) если пациент с онкологическим заболеванием, имеющий CLDN18.2-положительную опухоль, является респондером на лечение антителом против белка CLDN18.2 и/или
(ii) если пациент с онкологическим заболеванием, предпочтительно пациент с онкологическим заболеванием, имеющий CLDN18.2-положительную опухоль, будет испытывать выживаемость без прогрессии,
причем указанный способ включает определение генотипа для одного или нескольких однонуклеотидных полиморфизмов, выбранных из группы, состоящей из FCGR2A rs1801274, MUC1 rs4072037, IL-10 rs1800896, DNMT3A rs1550117, SMAD4 rs12456284, EGF rs4444903, CDH1 rs16260, ERCC1 rs11615 и FCGR3A rs396991 в образце, полученном из пациента.
В одном воплощении присутствие гетерозиготного генотипа FCGR2A rs1801274 [CT] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа FCGR2A rs1801274 [TT] и/или гомозиготный генотип FCGR2A rs1801274 [CC] указывает на повышение риска того, что пациент с онкологическим заболеванием не будет отвечать на лечение антителом и/или повышенный риск того, что пациент с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа MUC1 rs4072037 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа MUC1 rs4072037 [GG] указывает на повышение риска того, что пациент с онкологическим заболеванием не будет респондером на лечение антителом и/или повышенный риск того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа IL-10 rs1800896 [GG] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гетерозиготного генотипа DNMT3A rs1550117 [GA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гетерозиготного генотипа SMAD4 rs12456284 [GA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа EGF rs4444903 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа CDH1 rs16260 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа ERCC1 rs11615 [TT] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гетерозиготного генотипа FCGR3A rs396991 [TG] и/или гомозиготного генотипа FCGR3A rs396991 [TT] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении присутствие гомозиготного генотипа FCGR3A rs396991 [GG] указывает на повышение риска того, что пациент с онкологическим заболеванием не будет респондером на лечение антителом и/или повышенный риск того, что пациент с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
В одном воплощении всех аспектов изобретения антитело действует путем рекрутирования иммунной системы пациента для уничтожения опухолевых клеток. В одном воплощении антитело действует через антителозависимую клеточно-опосредованную цитотоксичность (ADCC) и/или комплементзависимую цитотоксичность (CDC). В одном воплощении антитело представляет собой моноклональное антитело. В одном воплощении всех аспектов изобретения антитело включает тяжелую цепь, содержащую аминокислотную последовательность, представленную SEQ ID NO: 17 или 51, или ее фрагмент, и легкую цепь, содержащую аминокислотную последовательность, представленную SEQ ID NO: 24 или ее фрагмент.
В одном воплощении всех аспектов изобретения невосприимчивость к лечению антителом включает относительное снижение одного или нескольких из числа выживаемости, выживаемости без прогрессирования, безрецидивной выживаемости, отдаленной безрецидивной выживаемости и стабильного заболевания.
В одном аспекте изобретение относится к способу лечения пациента с онкологическим заболеванием, причем указанный способ включает
а. оценку, является ли пациент с онкологическим заболеванием респондером на лечение антителом по способу изобретения, и
b. (i) лечение пациента с онкологическим заболеванием антителом, если у пациента снижен риск не быть респондером на лечение антителом или (ii) не лечение пациента с онкологическим заболеванием антителом и/или лечение пациента с онкологическим заболеванием схемой лечения, которая включает лечение, которое отличается от лечения антителом, если у пациента повышен риск того, что он не ответит на лечение антителом.
В одном воплощении схема лечения включает лечение, не зависящее от иммунной системы пациента. В одном воплощении схема лечения не включает обработку антителом, действующим посредством рекрутирования иммунной системы пациента для уничтожения опухолевых клеток. В одном воплощении схема лечения включает хирургическое вмешательство, химиотерапию и/или облучение. В одном воплощении схема лечения включает обработку низкомолекулярным ингибитором опухолевого антигена и/или конъюгата антитело-лекарственное средство, где антитело направлено против опухолевого антигена. В одном воплощении конъюгат антитело-лекарственное средство представляет собой антитело, связанное с радиоактивной, химиотерапевтической или токсичной группой. В одном воплощении конъюгат антитело-лекарственное средство представляет собой антитело, связанное с цитостатическим или цитотоксическим соединением.
В одном аспекте изобретение относится к способу оценки клинического исхода для пациент с онкологическим заболеванием, причем указанный способ включает определение генотипа для одного или нескольких однонуклеотидных полиморфизмов, выбранных из группы, состоящей из FCGR2A rs1801274, MUC1 rs4072037, IL-10 rs1800896, DNMT3A rs1550117, SMAD4 rs12456284, EGF rs4444903, CDH1 rs16260, ERCC1 rs11615 и FCGR3A rs396991 в образце, полученном от пациента.
В одном воплощении присутствие гетерозиготного генотипа FCGR2A rs1801274 [CT] указывает на снижение риска неблагоприятного клинического исхода.
В одном воплощении наличие гомозиготного генотипа FCGR2A rs1801274 [TT] и/или гомозиготного генотипа FCGR2A rs1801274 [CC] указывает на повышение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гомозиготного генотипа MUC1 rs4072037 [AA] указывает на снижение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гомозиготного генотипа MUC1 rs4072037 [GG] указывает на повышение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гомозиготного генотипа IL-10 rs1800896 [GG] указывает на снижение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гетерозиготного генотипа DNMT3A rs1550117 [GA] указывает на снижение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гетерозиготного генотипа SMAD4 rs12456284 [GA] указывает на снижение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гомозиготного генотипа EGF rs4444903 [AA] указывает на снижение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гомозиготного генотипа CDH1 rs16260 [AA] указывает на снижение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гомозиготного генотипа ERCC1 rs11615 [TT] указывает на снижение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гетерозиготного генотипа FCGR3A rs396991 [TG] и/или гетерозиготного генотипа FCGR3A rs396991 [TT] указывает на снижение риска неблагоприятного клинического исхода.
В одном воплощении присутствие гомозиготного генотипа FCGR3A rs396991 [GG] указывает на повышение риска неблагоприятного клинического исхода.
В одном воплощении оценка клинического исхода для пациента с онкологическим заболеванием включает прогнозирование вероятности одного или нескольких из числа выживаемости, выживаемости без прогрессирования, безрецидивной выживаемости, отдаленной безрецидивной выживаемости и стабильного заболевания. В одном воплощении неблагоприятный клинический исход включает относительное уменьшение одного или нескольких из числа выживаемости, выживаемости без прогрессирования, безрецидивной выживаемости, отдаленной безрецидивной выживаемости и стабильного заболевания.
В одном воплощении пациент имеет положительную по опухолевому антигену опухоль и получает лечение антителом против опухолевого антигена.
В одном воплощении всех аспектов изобретения образец представляет собой образец, содержащий ДНК. В одном воплощении ДНК была извлечена из образца организма пациента. В одном варианте ДНК извлекали из крови.
В одном воплощении всех аспектов изобретения опухоль представляет собой солидную опухоль. В одном воплощении опухоль представляет собой гастроэзофагеальную опухоль. В одном воплощении опухоль представляет собой прогрессирующую аденокарциному желудка или нижнего пищевода. В одном воплощении злокачественное новообразование представляет собой гастроэзофагеальный рак. В одном воплощении злокачественное новообразование представляет собой прогрессирующую аденокарциному желудка или нижнего пищевода.
В следующем аспекте настоящее изобретение относится к набору, содержащему средство для определения генотипа одного или нескольких однонуклеотидных полиморфизмов, выбранных из группы, состоящей из FCGR2A rs1801274, MUC1 rs4072037, IL-10 rs1800896, DNMT3A rs1550117, SMAD4 rs12456284, EGF Rs4444903, CDH1 rs16260, ERCC1 rs11615 и FCGR3A rs396991 в образце, полученном из пациента. В одном воплощении указанный набор полезен для проведения способов по всем аспектам настоящего изобретения. В одном воплощении указанный набор дополнительно содержит носитель данных. В одном предпочтительном воплощении указанный носитель данных является электронным или неэлектронным носителем данных. В одном воплощении упомянутый носитель данных содержит инструкции о том, как выполнять способы всех аспектов изобретения.
Другие цели, преимущества и особенности настоящего изобретения станут очевидными из последующего подробного описания при рассмотрении в сочетании с прилагаемыми чертежами.
Краткое описание чертежей
Фиг. 1: Однонуклеотидные полиморфизмы со статистически значимым сдвигом частоты генотипа между пациентом и контрольной популяцией (χ2-тест, р<0,05).
Генотипы SNP указаны в разделах столбиков. Pat. Популяция пациентов, Co. Контрольная популяция.
Фиг. 2: Относительная частота гомозиготных рисковых генотипов на одного пациента по отношению к числу исследованных факторов риска SNP на пациента. Пациенты сортируются по возрастающей частоте накопленных гомозиготных факторов риска.
Фиг. 3: Выживаемость без прогрессии PP-пациентов, дифференцированных по генотипу rs1801274 (FCGR2A) (кривая Каплана-Мейера)
Фиг. 4: Выживаемость без прогрессии FAS-пациентов, дифференцированных по генотипу rs1801274 (FCGR2A) (кривая Каплана-Мейера)
Фиг. 5: Выживаемость без прогрессии PP-пациентов, дифференцированных по генотипу rs1800896 (IL-10) (кривая Каплана-Мейера)
Фиг. 6: Выживаемость без прогрессии FAS-пациентов, дифференцированных по генотипу rs1800896 (IL-10) (кривая Каплана-Мейера)
Фиг. 7: Выживаемость без прогрессии FAS-пациентов, дифференцированных по генотипу rs1550117 (DNMT3A) (кривая Каплана-Мейера)
Фиг. 8: Выживаемость без прогрессии PP-пациентов, дифференцированных по генотипу rs12456284 (SMAD4) (кривая Каплана-Мейера)
Фиг. 9: Выживаемость без прогрессии PP-пациентов, дифференцированных по генотипу rs4072037 (MUC1) (кривая Каплана-Мейера)
Фиг. 10: Выживаемость без прогрессии FAS-пациентов, дифференцированных по генотипу rs4072037 (MUC1) (кривая Каплана-Мейера)
Фиг. 11: Выживаемость без прогрессии FAS-пациентов, дифференцированных по генотипу rs4444903 (EGF) (кривая Каплана-Мейера)
Фиг. 12: Выживаемость без прогрессии FAS-пациентов, дифференцированных по генотипу rs16260 (CDH1) (кривая Каплана-Мейера)
Фиг. 13: Выживаемость без прогрессии PP-пациентов, дифференцированных по генотипу rs11615 (ERCC1) (кривая Каплана-Мейера)
Фиг. 14: Выживаемость без прогрессии PP-пациентов, дифференцированных по генотипу rs396991 (FCGR3A) (кривая Каплана-Мейера).
Подробное описание изобретения
Хотя настоящее изобретение подробно описано ниже, следует понимать, что это изобретение не ограничено конкретными методологиями, протоколами и реагентами, описанными в данном документе, поскольку они могут различаться. Кроме того, следует понимать, что терминология, используемая в настоящем документе, предназначена для целей описания только конкретных воплощений, и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничен только прилагаемой формулой изобретения. Если не указано иное, все технические и научные термины, используемые в данном документе, имеют те же значения, которые обычно понимаются специалистом в данной области техники.
Ниже будут описаны элементы настоящего изобретения. Эти элементы перечислены в конкретных воплощениях, однако следует понимать, что они могут быть объединены любым способом и любым числом для создания дополнительных воплощений. Различные описанные примеры и предпочтительные воплощения не должны толковаться как ограничивающие настоящее изобретение только явно описанными воплощениями. Это описание следует понимать как поддерживающее и охватывающее воплощения, которые объединяют явно описанные воплощения с любым количеством раскрытых и/или предпочтительных элементов. Кроме того, любые перестановки и комбинации всех описанных элементов в этой заявке должны рассматриваться как раскрытые описанием настоящей заявки, если контекст не указывает иное.
Предпочтительно термины, используемые в данном документе, определяются в соответствии с описанием «A multilingual glossary of biotechnological terms: (IUPAC Recommendations)», HGW Leuenberger, B. Nagel и H. Kölbl, Eds., Helvetica Chimica Acta, CH-4010 Basel, Switzerland, (1995).
Практическое осуществление настоящего изобретения будет использовать, если не оговорено иное, традиционные способы химии, биохимии, клеточной биологии, иммунологии и рекомбинантных ДНК, которые объясняются в литературе в данной области (см., например, Molecular Cloning: A Laboratory Manual, 2nd Edition, J. Sambrook et al. eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1989).
Всюду по этому описанию и последующей формуле изобретения, если контекст не требует иного, слово «содержать», и варианты, такие как «содержит» и «содержащий», будут подразумеваться как включение заявленного элемента, целого или стадии или группы членов, целых или стадий, но не исключение любого члена, целого или стадии или группы членов, целых или стадий, хотя в некоторых воплощениях может быть исключен такой другой элемент, целое или стадию или группу членов, целые или стадии, т.е. объект изобретения заключается во включении указанного члена, целого или стадии или группы членов, целых или стадий. Термины «a» и «an» и «the» и аналогичные ссылки, используемые в контексте описания изобретения (особенно в контексте формулы изобретения), должны толковаться как охватывающие как единственное, так и множественное число, если иное не указано в данном документе или нет явного противоречия контексту. Изложение диапазонов значений в данном документе просто предназначено для использования в качестве сокращенного способа обращения индивидуально к каждому отдельному значению, входящему в диапазон. Если не указано иное, каждое индивидуальное значение включается в описание, как если бы оно было индивидуально описано в данном документе. Все описанные в данном документе способы могут быть выполнены в любом подходящем порядке, если в данном документе не указано иное или иное явно противоречит контексту. Использование любых и всех примеров или примерной формулировки (например, «такой как»), приведенных в данном документе, предназначено просто для лучшей иллюстрации изобретения и не представляет собой ограничение объема изобретения, заявленного иным образом. Ни одна формулировка в описании не должна быть истолкована как указание на любой незаявленный элемент как существенный при практическом осуществлении изобретения.
В тексте этого описания приводятся несколько документов. Каждый из документов, процитированных здесь (включая все патенты, заявки на патент, научные публикации, спецификации производителей, инструкции и т.д.), независимо от того, находятся они выше или ниже, полностью включены в настоящее описание ссылкой. Никакую часть настоящего документа не следует считать признанием того, что изобретение не может претендовать на более раннюю дату настоящего описания в силу предшествующего изобретения.
Авторы настоящего изобретения предоставляют тесты для оценки приемлемости пациентов для определенных способов лечения злокачественных новообразований, в частности антительной терапии, и для выводов о прогнозе пациента с онкологическим заболеванием. Результаты, полученные с использованием этих тестов, позволяют врачу выбрать подходящее лечение для пациента с онкологическим заболеванием и, в частности, решить, следует ли вводить антительную терапию конкретному пациенту с онкологическим заболеванием.
Термин «одиночный нуклеотидный полиморфизм» или «SNP» относится к вариации последовательности ДНК, обычно встречающейся в популяции, в которой один нуклеотид в геноме (или другой общей последовательности) отличается между представителями биологического вида или парными хромосомами. SNP могут встречаться в кодирующих последовательностях генов, некодирующих областях генов или в межгенных областях (области между генами). SNP внутри кодирующей последовательности могут, но необязательно, изменять аминокислотную последовательность продуцируемого белка из-за вырожденности генетического кода. Таким образом, SNP в кодирующей области имеют два типа: синонимичные и несинонимичные SNP. Синонимичные SNP не влияют на последовательность белка, тогда как несинонимичные SNP изменяют аминокислотную последовательность белка. Несинонимичные SNP имеют два типа: с утратой смысла (миссенс) и бессмысленный (нонсенс). SNP, которые не входят в кодирующие белок области, могут по-прежнему влиять на сплайсинг генов, связывание с транскрипционным фактором, деградацию информационной РНК или последовательность некодирующей РНК. Экспрессия генов, которую затрагивает этот тип SNP, упоминается как eSNP (SNP экспрессии) и такие SNP могут находиться выше или ниже гена по последовательности.
Различные способы, известные в данной области, могут быть использованы для определения генотипа SNP. Аналитические способы обнаружения новых SNP и детекции известных SNP включают, например, секвенирование ДНК, капиллярный электрофорез, масс-спектрометрию, одноцепочечный конформационный полиморфизм (SSCP), электрохимический анализ, денатурирующую ВЭЖХ и гель-электрофорез, полиморфизм длины рестрикционных фрагментов и анализ гибридизации.
Процесс определения того, какой нуклеотид присутствует в конкретном положении SNP, описанном в данном документе, для одного или обоих аллелей, можно называть такими фразами, как «определение генотипа SNP» или «генотипирование SNP». Таким образом, эти фразы могут относиться к обнаружению единственного аллеля (нуклеотида) в положении SNP или могут охватывать обнаружение обоих аллелей (нуклеотидов) в положении SNP (например, для определения гомозиготного или гетерозиготного состояния положения SNP). Кроме того, эти фразы могут также относиться к обнаружению аминокислотного остатка, кодируемого SNP (такого как альтернативные аминокислотные остатки, которые кодируются различными кодонами, созданными альтернативными нуклеотидами в положении SNP).
Реагент, который специфически обнаруживает конкретное положение целевого SNP, раскрытое в данном документе, и который предпочтительно специфичен для конкретного нуклеотида (аллеля) положения целевого SNP (то есть реагент предпочтительно может различать различные альтернативные нуклеотиды в положении целевого SNP, тем самым позволяя определить идентичность нуклеотида, присутствующего в заданном положении SNP) может быть использован для обнаружения SNP. Как правило, такой детектирующий реагент гибридизуется с молекулой нуклеиновой кислоты, содержащей целевой SNP, путем комплементарного спаривания оснований специфичным образом и различает целевую вариантную последовательность из других последовательностей нуклеиновых кислот, таких как известная в данной области форма в тестируемом образце. Примером реагента для обнаружения является неприродный нуклеотидный праймер или зонд, который гибридизуется с нуклеиновой кислотой-мишенью, содержащей SNP, раскрытый в данном документе. В предпочтительном воплощении такой праймер или зонд может различать нуклеиновые кислоты, имеющие конкретный нуклеотид (аллель) в положении целевого SNP, от других нуклеиновых кислот, которые имеют другой нуклеотид в том же положении целевого SNP. Кроме того, реагент обнаружения может гибридизоваться с конкретной областью 5' и/или 3' относительно положения SNP. Специалисту в данной области техники будет очевидно, что такие реагенты обнаружения, например, праймеры и зонды, напрямую пригодны в качестве реагентов для генотипирования одного или нескольких описанных в данном документе SNP и могут быть включены в любой формат набора.
Для анализа SNP может быть целесообразным использовать олигонуклеотиды, специфичные для альтернативных SNP-аллелей. Такие олигонуклеотиды, которые обнаруживают одиночные нуклеотидные вариации в целевых последовательностях, могут быть упомянуты такими терминами, как «аллельспецифические олигонуклеотиды», «аллельспецифические зонды» или «аллельспецифические праймеры».
Реагент обнаружения SNP может быть помечен репортером, таким как флуорографический репортерный краситель, который испускает детектируемый сигнал. В то время как предпочтительный репортерный краситель представляет собой флуоресцентный краситель, любой репортерный краситель, который может быть присоединен к реагенту обнаружения, такой как олигонуклеотидный зонд или праймер, является подходящим согласно изобретению. В еще одном воплощении реагент обнаружения может быть дополнительно помечен гасящим красителем, особенно когда реагент используется в качестве самозатухающего зонда, такого как зонд TaqMan. Реагенты обнаружения SNP, описанные в данном документе, могут также содержать другие метки, включая, без ограничения указанным, биотин для связывания стрептавидина, гаптен для связывания антитела и олигонуклеотид для связывания с другим комплементарным олигонуклеотидом.
В соответствии с настоящим изобретением также рассматриваются реагенты, которые не содержат (или которые не являются комплементарными) нуклеотид SNP, подлежащего идентификации, но которые используются для анализа одного или нескольких SNP, раскрытых в данном документе. Например, праймеры, которые фланкируют, но не гибридизуются непосредственно в месте расположения SNP-мишени, полезны в реакциях достройки праймеров, в которых праймеры гибридизуются с областью, смежной с целевым положением SNP (то есть в пределах одного или нескольких нуклеотидов от целевого сайта SNP). Во время реакции достройки праймера, праймер обычно не может достраиваться через целевой сайт SNP, если конкретный нуклеотид (аллель) присутствует в этом целевом сайте SNP, и продукт достройки праймера может быть детектирован для того, чтобы определить, какой SNP-аллель присутствует на целевом сайте SNP. Например, конкретные ddNTP обычно используются в реакции достройки праймера для терминации достройки праймера, в момент включения ddNTP в продукт достройки. Таким образом, реагенты, которые связываются с молекулой нуклеиновой кислоты в области, прилегающей к сайту SNP, и которые используются для анализа сайта SNP, даже несмотря на то, что связанные последовательности не обязательно включают сам сайт SNP, также рассматриваются в соответствии с изобретением.
Термин «FCGR2A» относится к гену FCGR2A человека. Этот ген кодирует низкоаффинный рецептор II-a Fc-области иммуноглобулина гамма (CD32) и является одним из членов семейства генов Fc-рецептора иммуноглобулинов. Белок, кодируемый этим геном, представляет собой рецептор клеточной поверхности, обнаруженный на фагоцитарных клетках, таких как макрофаги и нейтрофилы, и участвует в процессе фагоцитоза и очистки иммунных комплексов. Альтернативный сплайсинг дает множество транскрипционных вариантов.
Предпочтительно, термин «FCGR2A» относится к нуклеиновой кислоте, содержащей, предпочтительно состоящей из нуклеотидной последовательности SEQ ID NO: 61 перечня последовательностей или варианта указанной нуклеотидной последовательности и к белку, кодируемому этой нуклеиновой кислотой, предпочтительно к белку, предпочтительно состоящему из аминокислотной последовательности SEQ ID NO: 62 перечня последовательностей или варианта указанной аминокислотной последовательности.
Rs1801274 является SNP в гене FCGR2A. Rs1801274 (C) кодирует аллель аргинин (R), а (T) аллель кодирует вариант гистидин (H). Этот SNP представляет собой внутригенную транзицию с последующим изменением кодонов: CAT, CGT и приводит к миссенс-мутации. SNP известна в литературе под многими названиями, в том числе A519C и R131H. Контекстная последовательность выглядит следующим образом:
TGGGATGGAGAAGGTGGGATCCAAA[C/T]GGGAGAATTTCTGGGATTTTCCATT
Термин «MUC1» относится к гену MUC1 человека. Этот ген кодирует муцин 1, связанный с клеточной поверхностью (MUC1) или полиморфный эпителиальный муцин (PEM), который является членом семейства муцинов и представляет собой связанный с мембраной гликозилированный фосфопротеин. Белок прикреплен к апикальной поверхности многих эпителиев трансмембранным доменом. За трансмембранным доменом находится домен SEA, который содержит сайт расщепления для высвобождения большого внеклеточного домена. Белок выполняет защитную функцию путем связывания с патогенами, а также функционирует в клеточной передаче сигналов.
Предпочтительно термин «MUC1» относится к нуклеиновой кислоте, содержащей, предпочтительно состоящей из нуклеотидной последовательности SEQ ID NO: 63 перечня последовательностей или варианта указанной нуклеотидной последовательности и к белку, кодируемому этой нуклеиновой кислотой, предпочтительно к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности SEQ ID NO: 64 перечня последовательностей или варианта указанной аминокислотной последовательности.
Rs4072037 является SNP в гене MUC1. Этот SNP представляет собой внутригенную транзицию со следующим изменением кодонов: ACA, ACG и приводит к молчащей мутации. Контекстная последовательность выглядит следующим образом:
CCCCTAAACCCGCAACAGTTGTTAC[A/G]GGTTCTGGTCATGCAAGCTCTACCC
Термин «IL-10» относится к гену IL-10 человека. Этот ген кодирует интерлейкин-10 (IL-10), также известный как ингибирующий фактор синтеза цитокинов человека (CSIF), который является противовоспалительным цитокином.
Предпочтительно, термин «IL-10» относится к нуклеиновой кислоте, содержащей, предпочтительно состоящей из нуклеотидной последовательности SEQ ID NO: 65 перечня последовательностей или варианта указанной нуклеотидной последовательности и к белку, кодируемому этой нуклеиновой кислотой, предпочтительно к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности SEQ ID NO: 66 перечня последовательностей или варианта указанной аминокислотной последовательности.
Rs1800896 представляет собой SNP в гене IL-10. Этот SNP представляет собой межгенную/неизвестную внутригенную транзицию. Контекстная последовательность выглядит следующим образом:
CAACACTACTAAGGCTTCTTTGGGA[A/G]GGGGAAGTAGGGATAGGTAAGAGGA
Термин «DNMT3A» относится к гену DNMT3A человека. Этот ген кодирует ДНК (цитозин-5)-метилтрансферазу 3А. Белок, кодируемый этим геном, представляет собой фермент, который катализирует перенос метильных групп на специфические CpG-структуры в ДНК.
Предпочтительно, термин «DNMT3A» относится к нуклеиновой кислоте, содержащей, предпочтительно состоящей из нуклеотидной последовательности SEQ ID NO: 67 перечня последовательностей или варианта указанной нуклеотидной последовательности и к белку, кодируемому этой нуклеиновой кислотой, предпочтительно к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности SEQ ID NO: 68 перечня последовательностей или варианта указанной аминокислотной последовательности.
Rs1550117 является SNP в гене DNMT3A. Этот SNP представляет собой внутригенную транзицию в промоторной области DNMT3A. Контекстная последовательность выглядит следующим образом:
AATTCCACCAGCACAGCCACTCACT[A/G]TGTGCTCATCTCACTCCTCCAGCAG
Термин «SMAD4» относится к гену SMAD4 человека. Этот ген кодирует 4-й гомолог Mothers against decapentaplegic. Белок, кодируемый этим геном, участвует в клеточной передаче сигналов и принадлежит к семейству белков Дарвина, которые модулируют членов белкового суперсемейства TGFβ. Белок связывает рецептор-регулируемые SMAD, такие как SMAD1 и SMAD2, и образует комплекс, который связывается с ДНК и служит фактором транскрипции. Это единственный известный ко-SMAD млекопитающих.
Предпочтительно термин «SMAD4» относится к нуклеиновой кислоте, содержащей, предпочтительно состоящей из нуклеотидной последовательности SEQ ID NO: 69 перечня последовательностей или варианта указанной нуклеотидной последовательности и к белку, кодируемому этой нуклеиновой кислотой, предпочтительно к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности SEQ ID NO: 70 перечня последовательностей или варианта указанной аминокислотной последовательности.
Rs12456284 является SNP в гене SMAD4. Этот SNP представляет собой внутригенную транзицию в 3'-UTR. Контекстная последовательность выглядит следующим образом:
AGGTCCAGAGCCAGTGTTCTTGTTC[A/G]ACCTGAAAGTAATGGCTCTGGGTTG
Термин «EGF» относится к гену EGF человека. Этот ген кодирует эпидермальный фактор роста. EGF является фактором роста, который стимулирует рост, пролиферацию и дифференцировку клеток путем связывания с его рецептором EGFR.
Предпочтительно термин «EGF» относится к нуклеиновой кислоте, содержащей, предпочтительно состоящей из нуклеотидной последовательности SEQ ID NO: 71 перечня последовательностей или варианта указанной нуклеотидной последовательности и к белку, кодируемому этой нуклеиновой кислотой, предпочтительно к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности SEQ ID NO: 72 перечня последовательностей или варианта указанной аминокислотной последовательности.
Rs4444903 представляет собой SNP в гене EGF. Этот SNP представляет собой внутригенную транзицию в 5'-UTR. Контекстная последовательность выглядит следующим образом:
CTTTCAGCCCCAATCCAAGGGTTGT[A/G]GCTGGAACTTTCCATCAGTTCTTCC
Термин «CDH1» относится к гену CDH1 человека. Этот ген кодирует кадгерин-1, также известный как CAM 120/80 или эпителиальный кадгерин (E-кадгерин) или увоморулин. Белок является классическим членом суперсемейства кадгеринов. Белок представляет собой гликопротеин зависимой от кальция межклеточной адгезии, состоящий из пяти внеклеточных кадгериновых повторов, трансмембранной области и высококонсервативного цитоплазматического хвоста. Считается, что потеря функции способствует прогрессированию рака, усиливая пролиферацию, инвазию и/или метастазирование.
Предпочтительно, термин «CDH1» относится к нуклеиновой кислоте, содержащей, предпочтительно состоящей из нуклеотидной последовательности SEQ ID NO: 73 перечня последовательностей или варианта указанной нуклеотидной последовательности и к белку, кодируемому этой нуклеиновой кислотой, предпочтительно к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности SEQ ID NO: 74 перечня последовательностей или варианта указанной аминокислотной последовательности.
Rs16260 является SNP в гене CDH1. Этот SNP представляет собой внутригенную транзицию, расположенную в промоторной области гена CDH1. Контекстная последовательность выглядит следующим образом:
CTAGCAACTCCAGGCTAGAGGGTCA[A/C]CGCGTCTATGCGAGGCCGGGTGGGC
Термин «ERCC1» относится к гену ERCC1 человека. Этот ген кодирует репарационный белок ERCC-1. Функция белка ERCC1 преимущественно заключается в эксцизионной репарации поврежденной ДНК.
Предпочтительно, термин «ERCC1» относится к нуклеиновой кислоте, содержащей, предпочтительно состоящей из нуклеотидной последовательности SEQ ID NO: 75 перечня последовательностей или варианта указанной нуклеотидной последовательности и к белку, кодируемому этой нуклеиновой кислотой, предпочтительно к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности SEQ ID NO: 76 перечня последовательностей или варианта указанной аминокислотной последовательности.
Rs11615 является SNP в гене ERCC1. Этот SNP - это молчащая внутригенная транзиция. Контекстная последовательность выглядит следующим образом:
ATCCCGTACTGAAGTTCGTGCGCAA[C/T]GTGCCCTGGGAATTTGGCGACGTAA
Термин «FCGR3A» относится к гену FCGR3A человека. Этот ген кодирует низкоаффинный Fc-рецептор-области иммуноглобулина гамма, тип III-A. Белок, кодируемый этим геном, является частью кластера молекул поверхности дифференцирующихся клеток.
Предпочтительно термин «FCGR3A» относится к нуклеиновой кислоте, содержащей, предпочтительно состоящей из нуклеотидной последовательности SEQ ID NO: 77 перечня последовательностей или варианта указанной нуклеотидной последовательности и к белку, кодируемому этой нуклеиновой кислотой, предпочтительно к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности SEQ ID NO: 78 перечня последовательностей или варианта указанной аминокислотной последовательности.
Rs396991 является SNP в гене FCGR3A. Этот SNP представляет собой внутригенную трансверсию со следующим изменением кодонов: GTT, TTT и приводит к миссенс-мутации. Rs396991 (T) кодирует аллель фенилаланина (F), с (G) аллелем, кодирующим вариант валина (v). Контекстная последовательность выглядит следующим образом:
CGGCTCCTACTTCTGCAGGGGGCTT[G/T]TTGGGAGTAAAAATGTGTCTTCAGA
Клаудины - это семейство белков, которые являются наиболее важными компонентами плотных контактов, в которых они устанавливают парацеллюлярный барьер, контролирующий поток молекул в межклеточном пространстве между клетками эпителия. Клаудины-трансмембранные белки, пересекающие мембрану 4 раза, с N- и C-концом, расположенным в цитоплазме. Первая внеклеточная петля или домен состоит в среднем из 53 аминокислот, а вторая внеклеточная петля или домен состоит из около 24 аминокислот. Белки клеточной поверхности семейства клаудинов, такие как CLDN18.2, экспрессируются в опухолях различного происхождения и особенно подходят в качестве целевых структур в случае антитело-опосредуемой иммунотерапии злокачественных новообразований из-за их избирательной экспрессии (отсутствие экспрессии в релевантной к токсичности нормальной ткани) и локализации в плазматической мембране.
Используемый в данном документе термин «CLDN» означает клаудин и включает CLDN18.2. Предпочтительно клаудин является человеческим клаудином.
Термин «CLDN18» относится к клаудину 18 и включает любые варианты, включая вариант сплайсинга 1 клаудина 18 (клаудин 18.1 (CLDN18.1)) и вариант сплайсинга 2 клаудина 18 (клаудин18.2 (CLDN18.2)).
Термин «CLDN18.2» предпочтительно относится к человеческому CLDN18.2 и, в частности, к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности в соответствии с SEQ ID NO: 1 перечня последовательностей или варианта указанной аминокислотной последовательности. Первая внеклеточная петля или домен CLDN18.2 предпочтительно содержит аминокислоты с 27 по 81, более предпочтительно аминокислоты 29-78 аминокислотной последовательности, показанной в SEQ ID NO: 1. Вторая внеклеточная петля или домен CLDN18.2 предпочтительно содержит аминокислоты 140-180 аминокислотной последовательности, показанной в SEQ ID NO: 1. Указанные первая и вторая внеклеточные петли или домены предпочтительно образуют внеклеточную часть CLDN18.2.
CLDN18.2 избирательно экспрессируется в нормальных тканях в дифференцированных эпителиальных клетках слизистой оболочки желудка. CLDN18.2 экспрессируется в злокачественных новообразованиях различного происхождения, таких как карцинома поджелудочной железы, карцинома пищевода, карцинома желудка, бронхиальная карцинома, карцинома молочной железы и ЛОР-опухоли. CLDN18.2 является ценной мишенью для профилактики и/или лечения первичных опухолей, таких как рак желудка, рак пищевода, рак поджелудочной железы, рак легкого, такой как немелкоклеточный рак легкого (NSCLC), рак яичников, рак толстой кишки, рак печени, рак головы и шеи, рак желчного пузыря и метастазы, в частности метастазы рака желудка, такие как опухоли Крукенберга, перитонеальные метастазы и метастазы в лимфатические узлы.
Термин « CLDN18.1» предпочтительно относится к человеческому CLDN18.1 и, в частности, к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности в соответствии с SEQ ID NO: 2 перечня последовательностей или варианта указанной аминокислотной последовательности.
«Прогноз», при использовании в данном документе, относится к прогнозу результата и, в частности, к вероятности выживаемости без прогрессирования (progression-free survival, PFS) или выживаемости без признаков заболевания (disease-free survival, DFS). Выживание обычно рассчитывается как среднее число месяцев (или лет), в течение которых выживают 50% пациентов, или процент пациентов, которые остаются живыми через 1, 5, 15 и 20 лет. Прогноз важен для принятия решений о лечении, потому что пациентам с хорошим прогнозом обычно предлагают менее инвазивные методы лечения, тогда как пациентам с плохим прогнозом обычно предлагают более агрессивное лечение, например, более обширные химиотерапевтические препараты.
«Предсказание», при использовании в данном документе, относится к предоставлению информации о возможном ответе заболевания на определенное терапевтическое воздействие.
Фраза «указывает на риск» относится к указанию определенной степени вероятности или правдоподобности. Фраза «указывает на снижение риска» относится к низкой степени вероятности или правдоподобности. Фраза «указывает на повышение риска» относится к определенной, большей или высокой степени вероятности или правдоподобности.
Если событие «указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом», указанное событие указывает на то, что пациент с онкологическим заболеванием является респондером на лечение антителом, то есть, вероятно, что пациент является респондером на лечение антителом и, необязательно, более вероятно, что пациент является респондером на лечение антителом, чем что пациент, не является респондером на лечение антителом.
Если событие «указывает на повышение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом», указанное событие указывает на то, что пациент с онкологическим заболеванием не является респондером на лечение антителом, то есть, вероятно, что пациент не является респондером на лечение антителом и, необязательно, более вероятно, что пациент не является респондером на лечение антителом, чем что пациент является респондером на лечение антителом.
Если событие «указывает на снижение риска неблагоприятного клинического исхода», указанное событие указывает на благоприятный клинический исход, то есть, вероятно, что будет благоприятный клинический исход, и, возможно, более вероятно, что будет благоприятный клинический исход, чем что будет неблагоприятный клинический исход.
Если событие «указывает на повышение риска неблагоприятного клинического исхода», указанное событие свидетельствует о неблагоприятном клиническом исходе, то есть, вероятно, что будет неблагоприятный клинический исход, и, возможно, более вероятно, что будет неблагоприятный клинический исход, чем благоприятный клинический исход.
Если событие «указывает на сниженный риск того, что пациент с онкологическим заболеванием не столкнется с выживаемостью без прогрессии», указанное событие указывает на то, что пациент с онкологическим заболеванием столкнется с выживаемостью без прогрессии, то есть, вероятно, что пациент столкнется с выживаемостью без прогрессии и, необязательно, более вероятно, что столкнется с выживаемостью без прогрессии, чем что пациент не столкнется с выживаемостью без прогрессии.
Если событие «указывает на повышение риска того, что пациент с онкологическим заболеванием не столкнется с выживаемостью без прогрессии», то указанное событие указывает на то, что пациент с онкологическим заболеванием не столкнется с выживаемостью без прогрессии, то есть, вероятно, что пациент не столкнется с выживаемостью без прогрессии, и, необязательно, более вероятно, что пациент не столкнется с выживаемостью без прогрессии, чем что пациент столкнется с выживаемостью без прогрессии.
Используемый в данном документе термин «образец» относится к любому материалу, который получен от объекта и который может быть использован для аналитических целей, в частности для определения генотипа одного или нескольких однонуклеотидных полиморфизмов. В некоторых воплощениях описанные в данном документе образцы могут представлять собой или могут быть получены из любых тканей, клеток и/или клеток в биологических жидкостях, например, из млекопитающего или человека, подлежащего тестированию. Образец может быть выделен из пациента, например, из организма человека. Образец может быть фракционированным и/или очищенным образцом. Например, образцы, охватываемые настоящим изобретением, могут представлять собой или могут быть получены из образцов ткани (например, среза или эксплантата), одноклеточных образцов, образцов колонии клеток, образцов клеточной культуры, крови (например, цельной крови или фракции крови, такой как фракция клеток крови, сыворотки или плазмы), образцов мочи или образцов из других периферийных источников. В одном особенно предпочтительном воплощении образец представляет собой образец ткани (например, биопсию объекта с подозрением на наличие злокачественной опухолевой ткани). Например, образец может представлять собой биопсию опухоли. Образец может быть получен от пациента до начала терапевтического воздействия, во время терапевтического воздействия и/или после терапевтического воздействия, например до, во время или после введения противоопухолевой терапии.
Образцы могут быть использованы для получения экстрактов нуклеиновой кислоты (включая ДНК и/или РНК), белков или мембранных экстрактов из любых жидкостей организма (таких как кровь, сыворотка, плазма, моча, слюна, мокрота, желудочные соки, сперма, слезы, пот и т.д.), кожи, волос, клеток (особенно зародышевых клеток), биопсий, буккальных мазков или тканей или опухолевых образцов.
Настоящее изобретение также относится к набору, содержащему средства, такие как реагенты для определения генотипа одного или нескольких однонуклеотидных полиморфизмов, как описано в данном документе. В контексте настоящего изобретения под термином «составный набор (вкратце: набор)» понимается любая комбинация, по меньшей мере, некоторых из числа компонентов, обозначенных в данном документе, которые объединены, сосуществуют пространственно, в функциональной единице и которые могут содержать дополнительные компоненты. Например, набор может включать предварительно выбранные праймеры или зонды, специфичные для последовательностей нуклеиновых кислот, содержащие один или несколько однонуклеотидных полиморфизмов, генотип которых должен быть определен. Набор может также содержать ферменты, подходящие для амплификации нуклеиновых кислот (например, полимеразы, такие как Taq), и дезоксинуклеотиды и буферы, необходимые для амплификационной реакционной смеси. Набор может также содержать зонды, специфичные для одного или нескольких однонуклеотидных полиморфизмов. В некоторых воплощениях упомянутые средства детектируемо метятся.
Набор по изобретению может содержать (i) контейнер и/или (ii) носитель данных. Указанный контейнер может быть заполнен одним или несколькими вышеупомянутыми средствами или реагентами. Указанный носитель данных может быть неэлектронным носителем данных, например графическим носителем данных, таким как информационная брошюра, информационный лист, штрих-код или код доступа или электронный носитель данных, таким как гибкий диск, компакт-диск (CD), цифровой универсальный диск (DVD), микрочип или другой электронный носитель на основе полупроводников. Код доступа может разрешать доступ к базе данных, например, к интернет-базе данных, централизованной или децентрализованной базе данных. Указанный носитель данных может содержать команды для обеспечения анализа результатов, полученных с указанным набором, и, в частности, для применения набора в способах по изобретению.
Дополнительно или альтернативно, указанный набор может содержать материалы, желательные с коммерческой и пользовательской точек зрения, включая буфер(ы), реагент(ы) и/или разбавитель(и).
На основании полученных результатов (т.е. на основании генотипа для одного или нескольких однонуклеотидных полиморфизмов) врач может выбрать противоопухолевую терапию, к которой пациент прогнозируется как респонсивный, в частности, терапию антителами. Предпочтительно, противоопухолевая терапия, к которой пациент прогнозируется как нечувствительный, не вводится пациенту.
Исходя из того, что пациент прогнозируется как нечувствительный к антительной терапии, в частности, антительной терапии, действующей посредством рекрутирования иммунной системы пациента для уничтожения опухолевых клеток, врач может выбрать применение противоопухолевой терапии, которая отличается от антительной терапии, в частности, антительной терапии, действующей посредством рекрутирования иммунной системы пациента для уничтожения опухолевых клеток. В частности, врач может выбрать химиотерапию.
Исходя из того, что пациент прогнозируется как реагирующий на антительную терапию, в частности, антительную терапию, действующую посредством рекрутирования иммунной системы пациента для уничтожения опухолевых клеток, врач может выбрать лечение антителом, в частности, антительную терапию, действующую посредством рекрутирования иммунной системы пациента для уничтожения опухолевых клеток, необязательно в сочетании с химиотерапией.
Термин «терапевтическое лечение», в частности в связи с лечением злокачественного новообразования, при использовании в данном документе, относится к любому лечению, которое направлено на улучшение состояния здоровья и/или продление (увеличение) продолжительности жизни пациента. Указанное лечение может устранить злокачественное новообразование, уменьшить размер или количество опухолей у пациента, остановить или замедлить развитие злокачественного новообразования у пациента, ингибировать или замедлять развитие нового злокачественного новообразования у пациента, уменьшать частоту или тяжесть симптомов у пациента и/или уменьшить рецидивы у пациента, который в настоящее время страдает от или у которого ранее было злокачественное новообразование. (Терапевтическое) воздействие на злокачественное новообразование может быть выбрано из группы, состоящей из хирургического вмешательства, химиотерапии, лучевой терапии и таргетной терапии. Одним из особенно предпочтительных способов лечения в соответствии с изобретением является лечение злокачественного новообразования с использованием терапевтических моноклональных антител против опухолевых антигенов, таких как CLDN18.2, экспрессированных на клетках-мишенях.
Адъювантная терапия - это лечение, которое проводится в дополнение к первичному, основному или начальному лечению. Хирургическое вмешательство и комплексные режимы лечения, используемые при лечении злокачественных новообразований, приводят к тому, что термин использовался в основном для описания адъювантного лечения злокачественного новообразования. Пример адъювантной терапии представляет собой дополнительное лечение обычно предоставляемое после хирургического вмешательства, когда все обнаруженное заболевание было удалено, но при котором сохраняется статистический риск рецидива в связи с невыявленным заболеванием.
Такие термины, как «респонсивный» или «респондер», относятся в терапевтической обстановке к тому факту, что пациент имеет терапевтическое преимущество от данного способа лечения и, в частности, к наблюдению ослабления, предотвращения или устранения заболевания, включающее сокращение продолжительности заболевания, остановку или замедление прогрессирования или ухудшения заболевания, ингибирование или замедление развития нового заболевания и/или рецидивов, предотвращение или задержку начала заболевания или его симптомов, снижение частоты или тяжести симптомов у пациента, который в настоящее время страдает от или у которого ранее было заболевание, и/или к продлению продолжительности жизни пациента. В частности, они относятся к наблюдению уменьшения массы опухоли или к увеличению периода без опухоли, безрецидивного периода или общему периоду выживания.
Такие термины, как «нереспонсивный» или «нереспондер», относятся в терапевтической обстановке к тому факту, что пациент не имеет терапевтической пользы от данного способа лечения и, в частности, не наблюдается ослабление, предотвращение или устранение болезни, то есть пациент устойчив к лечению.
Полный ответ определяется как отсутствие каких-либо остаточных заболеваний, таких как злокачественное новообразование, и обычно оценивается путем патологического анализа извлеченных образцов тканей. В этом контексте часто используется термин «полный патологический ответ» (pCR). В частности, pCR определяется как отсутствие каких-либо остаточных инвазивных опухолевых клеток в исходном ложе опухоли. Однако определение pCR может варьировать между различными системами классификации. Было показано, что полный патологический ответ является прогностическим фактором для общей лучшей выживаемости, но также и для выживаемости без признаков заболевания и безрецидивной выживаемости.
Безрецидивная выживаемость определяется как время от рандомизации до любого первого из числа рецидивов или возвратов заболевания, второй злокачественной опухоли или смерти.
Выживаемость без прогрессии (PFS) - это тип выживаемости, который измеряет длительность времени во время и после лечения или лечения, при котором заболевание, которое лечится (как правило, злокачественная опухоль), не ухудшается. Термин иногда используют в качестве показателя для изучения здоровья человека с заболеванием, чтобы попытаться определить, насколько хорошо работает новое лечение, и его часто используют в качестве клинической конечной точки в рандомизированных контролируемых исследованиях для лечения злокачественных новообразований.
Согласно изобретению термин «пациент с онкологическим заболеванием, испытывающий выживаемость без прогрессии», относится к пациенту с онкологическим заболеванием, у которого в течение длительного периода времени нет прогрессии заболевания, в частности, по сравнению со средним периодом у пациентов и/или по сравнению с периодом у пациентов, которые являются нереспондерами на данный режим лечения. Предпочтительно указанный длительный период времени составляет, по меньшей мере, 4, предпочтительно, по меньшей мере, 5, более предпочтительно, по меньшей мере, 6 месяцев, например, по меньшей мере, 7 месяцев или, по меньшей мере, 8 месяцев, причем указанный период времени начинается, например, с момента первого введения лечения.
Термин «клинический исход» определяется как клинический результат заболевания, например, уменьшение или облегчение симптомов, в частности, после лечения.
Термин «рецидив» по отношению к злокачественной опухоли включает появление опухолевых клеток в том же месте и в органе происхождения заболевания, отдаленных метастазах, которые могут появиться спустя много лет после первоначального диагноза и противоопухолевой терапии, или в местных событий, таких как инфильтрация опухолевых клеток в региональные лимфатические узлы.
Термины «индивидуум» и «объект» используются в данном документе взаимозаменяемо. Они относятся к людям, не являющихся человеком приматам или другим млекопитающим (например, мышам, крысам, кроликам, собакам, кошкам, коровам, свиньям, овцам, лошадям или приматам), которые могут быть затронуты или восприимчивы к заболеванию или расстройству (например, злокачественному новообразованию), но могут иметь или не иметь заболевание или расстройство. Во многих воплощениях индивидуум является человеком. Если не указано иное, термины «индивидуум» и «объект» не обозначают определенный возраст и, следовательно, охватывают взрослых, пожилых людей, детей и новорожденных. В предпочтительных воплощениях настоящего изобретения «индивидуум» или «объект» является «пациентом». Термин «пациент» означает в соответствии с изобретением объект для лечения, в частности больной объект.
В одном особенно предпочтительном воплощении способ по изобретению выполняется по отношению к пациенту, который уже диагностирован как страдающий от злокачественного новообразования.
«Клетка-мишень» означает любую нежелательную клетку, такую как клетка злокачественной опухоли. В предпочтительных воплощениях клетка-мишень экспрессирует CLDN18.2.
В контексте настоящего изобретения такие термины, как «защита», «предотвращение» или «профилактика», относятся к предотвращению возникновения и/или распространения заболевания у объекта и, в частности, к минимизации вероятности того, что у объекта будет развиваться заболевание или к задержке развития заболевания. Например, объект, имеющий риск развития злокачественного новообразования, будет кандидатом на терапию для профилактики злокачественной новообразования.
Под «находящимся под угрозой» подразумевается объект, который идентифицируется как имеющий более высокий, чем обычно, шанс развития заболевания, в частности злокачественного новообразования, по сравнению с общей популяцией. Кроме того, объект, который имел или у которого в настоящее время есть заболевание, в частности злокачественное новообразование, представляет собой объект, у которого повышен риск развития заболевания, поскольку у такого объекта может продолжить развиваться заболевание. Объекты, которые в настоящее время имеют или у которых было злокачественное новообразование, также имеют повышенный риск развития метастазов злокачественного новообразования.
Используемый в данном документе термин «комбинация» в контексте введения терапии относится к применению более чем одного терапевтического средства или терапевтического агента. Использование термина «в комбинации» не ограничивает порядок, в котором терапевтические средства или терапевтические агенты вводятся объекту. Терапевтические средства или терапевтические агенты можно вводить до, одновременно с или после введения второй терапии или терапевтического агента объекту. Предпочтительно, терапии или терапевтические агенты вводят объекту в последовательности, количестве и/или в течение временного интервала, так чтобы терапевтические средства или терапевтические агенты могли действовать вместе. В конкретном воплощении терапевтические средства или терапевтические агенты вводят объекту в последовательности, количестве и/или в течение временного интервала, так что они обеспечивают увеличенное преимущество, чем если бы они вводились иначе, в частности, независимо друг от друга. Предпочтительно, увеличенное преимущество является синергетическим эффектом.
Термин «заболевание» относится к аномальному состоянию, которое влияет на организм человека. Заболевание часто истолковывается как медицинское состояние, связанное со специфическими симптомами и симптомами. Заболевание может быть вызвана факторами, происходящими из внешнего источника, такими как инфекционное заболевание, или может быть вызвано внутренними дисфункциями, такими как аутоиммунные заболевания. У людей «заболевание» часто используется более широко, чтобы ссылаться на любое состояние, которое вызывает боль, дисфункцию, дистресс, социальные проблемы или смерть для отдельных страдающих или подобных проблем для тех, кто находится в контакте с человеком. В этом более широком смысле заболевание иногда включает травмы, инвалидности, расстройства, синдромы, инфекции, выделенные симптомы, девиантное поведение и атипичные вариации структуры и функции, тогда как в других контекстах и для других целей они могут рассматриваться как отличимые категории. Заболевания обычно затрагивают людей не только физически, но и эмоционально, поскольку приобретение и жизнь со многими заболеваниями могут изменить точку зрения на жизнь и личность индивидуума. Согласно изобретению термин «заболевание» включает злокачественное новообразование, в частности те формы злокачественных новообразований, которые описаны в данном документе. Любая ссылка в данном документе на злокачественное новообразование или конкретные формы злокачественных новообразований также включает метастазы злокачественных новообразований. В предпочтительном воплощении заболевание, подлежащее лечению в соответствии с настоящей заявкой, включает клетки, экспрессирующие опухолевый антиген, такой как CLDN18.2.
«Заболевание, связанное с клетками, экспрессирующими опухолевый антиген» означает в соответствии с изобретением, что опухолевый антиген, такой как CLDN18.2, экспрессируется в клетках больной ткани или органа. В одном варианте экспрессия опухолевого антигена в клетках больной ткани или органа увеличивается по сравнению с состоянием в здоровой ткани или органе. Увеличение относится к увеличению, по меньшей мере, на 10%, в частности, по меньшей мере, на 20%, по меньшей мере, на 50%, по меньшей мере, на 100%, по меньшей мере, на 200%, по меньшей мере, на 500%, по меньшей мере, на 1000%, по меньшей мере, на 10000% или даже больше. В одном воплощении экспрессия обнаруживается только в пораженной ткани, тогда как экспрессия в соответствующей здоровой ткани репрессируется. Согласно изобретению заболевания, связанные с клетками, экспрессирующими опухолевый антиген, включают онкологические заболевания. Кроме того, согласно изобретению, онкологические заболевания предпочтительно представляют собой заболевания, в которых клетки злокачественных опухолей экспрессируют опухолевый антиген.
Термины «онкологическое заболевание» или «злокачественное новообразование» относятся к физиологическому состоянию индивидуума или описывают его физиологическое состояние, которое обычно характеризуется нерегулируемым ростом клеток. Примеры злокачественных новообразований включают, без ограничения указанным, карциному, лимфому, бластому, саркому и лейкоз. В частности, примеры таких злокачественных новообразований включают злокачественные новообразования кости, крови, легких, печени, поджелудочной железы, кожи, головы или шеи, кожную или внутриглазную меланому, рак матки, рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак молочной железы, рак предстательной железы, рак матки, карциному половых и репродуктивных органов, болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечников, саркому мягких тканей, рак мочевого пузыря, рак почек, почечно-клеточную карциному, карциному почечной лоханки, неоплазии центральной нервной системы (ЦНС), нейроэктодермальный рак, опухоли оси позвоночника, глиому, менингиому и аденому гипофиза. Термин «злокачественное новообразование» в соответствии с изобретением также включает метастазы злокачественных новообразований. Предпочтительно «онкологическое заболевание» характеризуется клетками, экспрессирующими опухолевый антиген, такой как CLDN18.2, и клетка злокачественной опухоли экспрессирует такой опухолевой антиген. Клетка, экспрессирующая опухолевый антиген, такой как CLDN18.2, предпочтительно представляет собой клетку злокачественной опухоли, предпочтительно из злокачественных новообразований, описанных в данном документе.
Согласно изобретению термин «опухоль» или «опухолевое заболевание» относится к аномальному росту клеток (называемых неопластическими клетками, туморогенными клетками или опухолевыми клетками), предпочтительно образующими опухоль или лезию. Под «опухолевой клеткой» подразумевается аномальная клетка, которая растет быстрой, неконтролируемой клеточной пролиферацией и продолжает расти после того, как стимулы, которые положили начало новому росту, прекратились. Опухоли проявляют частичное или полное отсутствие структурной организации и функциональной координации с нормальной тканью и обычно образуют отчетливую массу ткани, которая может быть либо доброкачественной, предзлокачественной, либо злокачественной.
В одном воплощении злокачественное новообразование в соответствии с изобретением включает клетки злокачественных опухолей, экспрессирующих опухолевый антиген, такой как CLDN18.2. В одном воплощении рак представляет собой опухолевый антиген, такой как CLDN18.2 положительный. В одном воплощении, экспрессия антигена опухоли, такого как CLDN18.2, находится на поверхности клеток. В одном воплощении, по меньшей мере, 50%, предпочтительно 60%, 70%, 80% или 90% клеток злокачественных опухолей являются положительными по опухолевому антигену, например, положительными по CLDN18.2 и/или, по меньшей мере, 40%, предпочтительно, по меньшей мере, 50% клеток злокачественных опухолей положительны по поверхностной экспрессии опухолевого антигена, такого как CLDN18.2. В одном воплощении, по меньшей мере, 95% или, по меньшей мере, 98% клеток злокачественных опухолей являются положительными по опухолевому антигену, такому как CLDN18.2. В одном воплощении, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80% или, по меньшей мере, 90% клеток злокачественных опухолей являются положительными по поверхностной экспрессии опухолевого антигена, такого как CLDN18.2.
В одном воплощении злокачественное новообразование включающее клетки злокачественных опухолей, экспрессирующих CLDN18.2 или положительное по CLDN18.2 злокачественное новообразование, выбрано из группы, включающей рак желудка, рак пищевода, рак поджелудочной железы, рак легкого, такой как немелкоклеточный рак легкого (NSCLC), рак яичника, рак толстой кишки, рак печени, рак головы и шеи, рак желчного пузыря и метастазы, в частности метастазы рака желудка, такие как опухоли Крукенберга, перитонеальный метастаз и метастазы в лимфатические узлы. В одном воплощении рак представляет собой аденокарциному, в частности прогрессирующую аденокарциному. Особенно предпочтительными онкологическими заболеваниями являются аденокарциномы желудка, пищевода, протоков поджелудочной железы, желчных протоков, легких и яичника. В одном воплощении злокачественное новообразование выбирают из группы, состоящей из рака желудка, рака пищевода, в частности нижнего пищевода, рака пищеводно-желудочного перехода и гастроэзофагеального рака. В особенно предпочтительном воплощении злокачественное новообразование представляет собой гастроэзофагеальный рак, такой как метастатический, рефрактерный или рецидивирующий прогрессирующий гастроэзофагеальный рак. В одном воплощении положительная по CLDN18.2 опухоль является опухолью вышеуказанных типов злокачественных новообразований.
Воплощения, включающие положительную по CLDN18.2 опухоль или клетки злокачественных опухолей, экспрессирующих CLDN18.2, предпочтительно включают применение антитела, имеющего способность связываться с CLDN18.2. В одном воплощении антитело, обладающее способностью связываться с CLDN18.2, представляет собой моноклональное, химерное или гуманизированное антитело или фрагмент антитела.
Согласно изобретению, «карцинома» представляет собой злокачественную опухоль, полученную из эпителиальных клеток. Эта группа представляет собой наиболее распространенные виды злокачественных новообразований, включая распространенные формы рака молочной железы, предстательной железы, легких и толстой кишки.
«Аденокарцинома» - это злокачественное новообразование, который возникает в железистой ткани. Эта ткань также является частью более широкой категории тканей, известной как эпителиальная ткань. Эпителиальная ткань включает кожу, железы и множество других тканей, которые выстилают полости и органы тела. Эпителий получается эмбриологически из эктодермы, эндодермы и мезодермы. Чтобы быть классифицированным как аденокарцинома, клетки не обязательно должны быть частью железы, если они обладают секреторными свойствами. Эта форма карциномы может встречаться у некоторых высших млекопитающих, включая людей. Хорошо дифференцированные аденокарциномы имеют тенденцию напоминать железистую ткань, из которой они происходят, тогда как плохо дифференцированные могут не напоминать. Путем окрашивания клеток биопсии патологоанатом определит, является ли опухоль аденокарциномой или другим типом злокачественной опухоли. Аденокарциномы могут возникать во многих тканях тела из-за вездесущей природы желез в организме. Хотя каждая железа не может выделять одно и то же вещество, при условии экзокринной функции в клетке, она считается железистой, поэтому ее злокачественная форма называется аденокарциномой. Злокачественные аденокарциномы вторгаются в другие ткани и часто метастазируют, если у них достаточно времени. Аденокарцинома яичников является наиболее распространенным типом карциномы яичников. Она включает серозную и муциновую аденокарциному, почечно-клеточную карциному и эндометриоидную аденокарциному.
Под «метастазами» подразумевается распространение клеток злокачественных опухолей с исходного места в другую часть организма. Образование метастазов является очень сложным процессом и зависит от отрыва злокачественных клеток от первичной опухоли, инвазии внеклеточного матрикса, проникновения через эндотелиальные базальные мембраны в полость тела и сосудов, а затем, после транспортировки кровью, инфильтрации органов-мишеней. Наконец, рост новой опухоли на целевом участке зависит от ангиогенеза. Опухолевые метастазы часто возникают даже после удаления первичной опухоли, потому что опухолевые клетки или компоненты могут оставаться и развивать метастатический потенциал. В одном воплощении термин «метастаз» в соответствии с изобретением относится к «отдаленному метастазированию», которая относится к метастазированию, удаленному от первичной опухоли и региональной системы лимфатических узлов. В одном воплощении термин «метастаз» в соответствии с изобретением относится к метастазированию в лимфатические узлы. Одна конкретная форма метастазов, которая поддается лечению с использованием терапии по изобретению, представляет собой метастаз, происходящий из рака желудка в качестве первичного сайта. В предпочтительных вариантах такой метастаз рака желудка представляет собой опухоли Крукенберга, перитонеальный метастаз и/или метастаз в лимфатические узлы.
Рефрактерное злокачественное новообразование - это злокачественная опухоль, для которой конкретное лечение неэффективно, либо которая изначально не отвечает на лечение, либо со временем становится невосприимчивым. Термины «рефрактерный», «нереспонсивный» или «устойчивый» используются в данном документе взаимозаменяемо.
Опухоль Крукенберга — необычная метастатическая опухоль яичника, составляющая от 1% до 2% всех опухолей яичников. Прогноз опухоли Крукенберга по-прежнему очень плохой, и нет никакого лечения опухолей Крукенберга. Опухоль Крукенберга представляет собой метастазирующую аденокарциному перстевидных клеток яичника. Желудок является основным участком в большинстве случаев опухолей Крукенберга (70%). Карциномы толстой кишки, аппендикса и молочной железы (преимущественно инвазивная дольковая карцинома) являются наиболее распространенными первичными участками. Сообщалось о редких случаях опухоли Крукенберга, происходящих от карцином желчного пузыря, желчных путей, поджелудочной железы, тонкой кишки, фатеровой ампулы, шейки матки и мочевого пузыря/урахуса.
Термин «хирургическое вмешательство», используемый в данном документе, включает удаление опухолей при операции. Это распространенное лечение злокачественных новообразований. Хирург может удалить опухоли, используя местное иссечение.
Используемый в данном документе термин «химиотерапия» относится к применению химиотерапевтических агентов или комбинаций химиотерапевтических агентов, предпочтительно для остановки роста клеток злокачественных опухолей, либо путем уничтожения клеток, либо путем прекращения их деления. Когда химиотерапию принимают внутрь или вводят в вену или мышцу, препараты поступают в кровоток и могут проникать в клетки злокачественных опухолей по всему организму (системная химиотерапия). Когда химиотерапия помещается непосредственно в спинномозговую жидкость, орган или полость тела, такую как брюшная полость, препараты в основном воздействуют на клетки злокачественных опухолей в этих областях (региональная химиотерапия).
Химиотерапевтические агенты согласно изобретению включают цитостатические соединения и цитотоксические соединения. Традиционные химиотерапевтические агенты действуют путем убийства клеток, которые быстро делятся, что является одним из основных свойств большинства клеток злокачественных опухолей. Это означает, что химиотерапия также вредит клеткам, которые быстро делятся при нормальных обстоятельствах, таких как клетки в костном мозге, пищеварительном тракте и волосяных фолликулах. Это приводит к наиболее частым побочным эффектам химиотерапии. В соответствии с изобретением термин «химиотерапия» предпочтительно не включает антитела, которые нацелены на белки, которые аномально экспрессируются в клетках злокачественных новообразований (опухолевые антигены), и действуют путем рекрутирования иммунной системы пациента для уничтожения опухолевых клеток. Однако антитела, которые нацелены на белки, которые аномально экспрессируются в клетках злокачественных новообразований (опухолевые антигены) и действуют через терапевтический фрагмент или агент, конъюгированный с антителом, могут рассматриваться как одна из форм химиотерапии. Однако в строгом смысле термин «химиотерапия» в соответствии с изобретением не включает таргетную терапию.
В соответствии с изобретением термин «химиотерапевтический агент» включает таксаны, соединения платины, аналоги нуклеозидов, аналоги камптотецина, антрациклины, этопозид, блеомицин, винорелбин, циклофосфамид и их комбинации. Согласно изобретению ссылка на химиотерапевтическое средство включает любое пролекарство, такое как сложный эфир, соль или производное, такое как конъюгат указанного агента. Примерами являются конъюгаты указанного агента с носителем, например связанный с белками паклитаксел, такой как паклитаксел, связанный с альбумином. Предпочтительно, соли указанного агента являются фармацевтически приемлемыми.
Таксаны представляют собой класс соединений дитерпена, которые сначала были получены из природных источников, таких как растения рода Taxus, но некоторые из них были синтезированы искусственно. Основным механизмом действия лекарств таксанового класса является нарушение функции микротрубочек, что препятствует процессу деления клеток. Таксаны включают доцетаксел (таксотер) и паклитаксел (таксол).
Согласно изобретению термин «доцетаксел» относится к соединению, имеющему следующую формулу:
В частности, термин «доцетаксел» относится к соединению 1,7β, 10β-тригидрокси-9-оксо-5β,20-эпокситакс-11-ен-2α,4,13α-триил-4-ацетат 2-бензоат 13-{(2R,3S)-3-[(трет-бутоксикарбонил) амино] -2-гидрокси-3-фенилпропаноат}.
Согласно изобретению термин «паклитаксел» относится к соединению, имеющему следующую формулу:
В частности, термин «паклитаксел» относится к соединению (2α, 4α, 5β, 7β, 10β, 13α)-4,10-бис-(ацетилокси)-13-{[(2R,3S)-3-(бензоиламино))-2-гидрокси-3-фенилпропаноил] окси}-1,7-дигидрокси-9-оксо-5,20-эпокситакс-11-ен-2-илбензоат.
В соответствии с изобретением термин «соединение платины» относится к соединениям, содержащим платину в своей структуре, таким как комплексы платины, и включает такие соединения, как цисплатин, карбоплатин и оксалиплатин.
Термин «цисплатин» или «цисплатина» относится к соединению цис- диаммедихлорплатина (ii) (CDDP) следующей формулы:
Термин «карбоплатин» относится к соединению цис-диамин (1,1-циклобутандикарбоксилато) платины (ii) следующей формулы:
Термин «оксалиплатин» относится к соединению, которое представляет собой соединение платины, которое комплексовано с лигандом несущим диаминоциклогексан следующей формулы:
В частности, термин «оксалиплатин» относится к соединению [(1R, 2R)-циклогексан-1,2-диамин] (этандиоато-O,O') платина (ii). Оксалиплатин для инъекций также продается под торговой маркой Элоксатин.
Термин «нуклеозидный аналог» относится к структурному аналогу нуклеозида, категории, которая включает как пуриновые аналоги, так и пиримидиновые аналоги.
Термин «гемцитабин» представляет собой соединение, которое является аналогом нуклеозида следующей формулы:
В частности, этот термин относится к соединению 4-амино-1- (2-дезокси-2,2-дифтор-β-D-эритро-пентофуранозил) пиримидин-2 (1Н)-она или 4-амино-1- [ (2R,4R,5R)-3,3-дифтор-4-гидрокси-5-(гидроксиметил) оксолан-2-ил]-1,2-дигидропиримидин-2-он.
Термин «нуклеозидный аналог» включает производные фторпиримидина, такие как фторурацил и его пролекарства. Термин «фторурацил» или «5-фторурацил» (5-FU или f5U) (продаваемый под торговыми названиями Adrucil, Carac, Efudix, Efudex и Fluoroplex) представляет собой соединение, которое является пиримидиновым аналогом следующей формулы:
В частности, этот термин относится к соединению 5-фтор-1Н-пиримидин-2,4-дион.
Термин «капецитабин» (Xeloda, Roche) относится к химиотерапевтическому агенту, который является пролекарством, которое превращается в 5-FU в тканях. Капецитабин, который может вводиться перорально, имеет следующую формулу:
В частности, этот термин относится к соединению пентил[1-(3,4-дигидрокси-5-метилтетрагидрофуран-2-ил)-5-фтор-2-оксо-1Н-пиримидин-4-ил] карбамат.
Термин «фолиновая кислота» или «лейковорин» относится к соединению, полезному в синергической комбинации с химиотерапевтическим агентом 5-фторурацилом. Таким образом, если в данном документе делается ссылка на введение 5-фторурацила или пролекарства, указанное введение в одном воплощении может включать введение в сочетании с фолиновой кислотой. Фолиновая кислота имеет следующую формулу:

В частности, этот термин относится к соединению (2S)-2-{[4-[(2-амино-5-формил-4-оксо-5,6,7,8-тетрагидро-1Н-птеридин-6-ил))метиламино]бензоил]амино}пентандиовой кислоты.
В соответствии с изобретением термин «аналог камптотецина» относится к производным соединения камптотецина (CPT; (S)-4-этил-4-гидрокси-1Н-пирано [3',4':6,7] индолизино[1,2-b]хинолин-3,14-(4H,12H)-дион). Предпочтительно термин «аналог камптотецина» относится к соединениям, включающим следующую структуру:
В соответствии с изобретением предпочтительными аналогами камптотецина являются ингибиторы ДНК-топоизомеразы I (topo I). Предпочтительными аналогами камптотецина в соответствии с изобретением являются иринотекан и топотекан.
Иринотекан является лекарственным средством, препятствующим разрушению ДНК путем ингибирования топоизомеразы I. В химических терминах он представляет собой полусинтетический аналог натурального алкалоидного камптотецина, имеющего следующую формулу:
В частности, термин «иринотекан» относится к соединению (S)-4,11-диэтил-3,4,12,14-тетрагидро-4-гидрокси-3,14-диоксо-1Н-пирано[3',4':6,7]-индолизино-[1,2-b] хинолин-9-ил-[1,4'-бипиперидин]1'-карбоксилат.
Топотекан является ингибитором топоизомеразы формулы:
В частности, термин «топотекан» относится к соединению (S)-10-[(диметиламино) метил] -4-этил-4,9-дигидрокси-1Н-пирано [3', 4': 6,7] индолизино [1,2-b] хинолин-3,14 (4H, 12H)-дион.
Антрациклины - это класс лекарственных средств, обычно используемых при противоопухолевой химиотерапии, которые также являются антибиотиками. Структурно все антрациклины имеют общую 4-кольцевую структуру 7,8,9,10-тетрагидротетрацен-5,12-хинона и обычно требуют гликозилирования в определенных местах.
Антрациклины предпочтительно приводят к одному или нескольким из следующих механизмов действия: 1. Ингибирование синтеза ДНК и РНК путем интеркалирования между парами оснований ДНК/РНК-цепи, что предотвращает репликацию быстрорастущих клеток злокачественных опухолей. 2. Ингибирование фермента топоизомеразы II, предотвращение релаксации суперспирализованной ДНК и, таким образом, блокирование транскрипции и репликации ДНК. 3. Создание опосредованных железом свободных радикалов кислорода, которые повреждают ДНК и клеточные мембраны.
Согласно изобретению термин «антрациклин» предпочтительно относится к агенту, предпочтительно противоопухолевому агенту для индукции апоптоза, предпочтительно путем ингибирования повторного связывания ДНК в топоизомеразе II.
Примеры анатрациклинов и аналогов антрациклинов включают, без ограничения указанным, даунорубицин (дауномицин), доксорубицин (адриамицин), эпирубицин, идарубицин, родомицин, пирарубицин, валрубицин, N-трифтор-ацетил доксорубицин-14-валерат, аклациномицин, морфолинодоксорубицин (морфолино -DOX), цианоморфолино-доксорубицин (цианоморфолино-DOX), 2-пирролино-доксорубицин (2-PDOX), 5-иминодуномицин, митоксантрон и аклациномицин A (акларубицин). Митоксантрон является членом класса соединений антрацендионов, являющихся аналогами антрациклинов, которые не имеют сахарной составляющей антрациклинов, но сохраняют плоскую полициклическую структуру ароматических колец, которая позволяет интеркалировать ДНК.
Конкретно рассматриваемый в качестве антрациклина в контексте настоящего изобретения представляет собой эпирубицин. Эпирубицин является антрациклиновым лекарственным средством, которое имеет следующую формулу:

и продается под торговым названием Ellence в США и Pharmorubicin или Epirubicin Ebewe в других местах. В частности, термин «эпирубицин» относится к соединению (8R, 10S)-10-[(2S, 4S, 5R, 6S)-4-амино-5-гидрокси-6-метил-оксан-2-ил] окси -6,11-дигидрокси-8-(2-гидроксиацетил)-1-метокси-8-метил-9,10-дигидро-7Н-тетрацен-5,12-дион. Эпирубицин предпочтительней доксорубицина, и представляет собой самый популярный антрациклин в некоторых схемах химиотерапии, поскольку он, по-видимому, вызывает меньше побочных эффектов.
Термин «этопозид» относится к полусинтетическому производному подофиллотоксина, проявляющему противоопухолевую активность. Этопозид ингибирует синтез ДНК путем образования комплекса с топоизомеразой II и ДНК. Этот комплекс индуцирует разрывы в двухцепочечной ДНК и предотвращает восстановление связыванием топоизомеразы II. Накопленные разрывы ДНК предотвращают проникновение в митотическую фазу деления клеток и приводят к гибели клеток. Этопозид имеет следующую формулу:
В частности, этот термин относится к соединению 4'-деметил-эпиподофиллотоксин 9- [4,6-O- (R)-этилиден-бета-D-глюкопиранозид], 4'- (дигидрофосфат).
Термин «блеомицин» относится к гликопептидному антибиотику, продуцируемому бактерией Streptomyces verticillus. При использовании в качестве противоопухолевого средства он работает, вызывая разрывы в ДНК. Блеомицин предпочтительно включает соединение, имеющее следующую формулу:
Термин «винорелбин» относится к антимитотическому химиотерапевтическому препарату, который является полусинтетическим алкалоидом барвинка и предоставляется в качестве лечения некоторых видов злокачественных новообразований, включая рак молочной железы и немелкоклеточный рак легкого. Винорелбин предпочтительно включает соединение, имеющее следующую формулу:
Циклофосфамид представляет собой ипритный алкилирующий агент из группы оксазофоринов. Основное применение циклофосфамида связано с другими химиотерапевтическими средствами при лечении некоторых форм злокачественных новообразований. Циклофосфамид предпочтительно включает соединение, имеющее следующую формулу:
В контексте настоящего изобретения термин «лучевая терапия» относится к использованию высокоэнергетических рентгеновских лучей или других видов излучения для уничтожения клеток злокачественных опухолей или для предотвращения их роста. Существует два типа лучевой терапии. Внешняя лучевая терапия использует аппарат снаружи тела для передачи излучения на злокачественную опухоль. Внутренняя лучевая терапия использует радиоактивное вещество, запечатанное в иглах, зернах, проволоках или катетерах, которые помещаются непосредственно в злокачественную опухоль или рядом с ней. Способ лучевой терапии зависит от типа и стадии лечения злокачественных новообразований.
В соответствии с изобретением термин «таргетная терапия» относится к любой терапии, которая может быть использована для нацеливания преимущественно на пораженные клетки, такие как клетки злокачественных опухолей, и которая не нацеливается или нацеливается в меньшей степени на не затронутые заболеванием клетки. Нацеливание на больные клетки предпочтительно приводит к убийству и/или ухудшению пролиферации или жизнеспособности пораженных клеток. Такая терапия включает: i) антитела, фрагменты антител и белки, которые являются либо непокрытыми, либо конъюгированными с терапевтическим фрагментом, которые нацелены на определенные мишени клеточной поверхности на пораженных клетках, такие как опухолевые антигены, например CLDN18.2 (например, антитела или конъюгаты антител против CLDN18.2, как описано в данном документе) или ii) небольшие молекулы, которые нарушают пролиферацию или жизнеспособность пораженных клеток. В конкретном воплощении агент связывается с антигеном, который экспрессируется на большем уровне на больных, чем на нормальных стволовых клетках. В конкретном воплощении агент связывается специфически с опухолевым антигеном. Традиционная химиотерапия или лучевая терапия не считаются «таргетной терапией», несмотря на то, что их часто нацеливают на опухоли. Кроме того, термин «антительная терапия» согласно изобретению предпочтительно не включает терапию антителами, их фрагментами или производными, которые конъюгированы с терапевтической группой, но просто относится к терапии антителами, фрагментами или их производными, действующими посредством рекрутирования иммунной системы пациента для уничтожения опухолевых клеток.
Термин «антиген» относится к агенту, содержащему эпитоп, против которого должен быть создан иммунный ответ и/или направлен иммунный ответ. Термин «антиген» включает, в частности, белки, пептиды, полисахариды, нуклеиновые кислоты, особенно РНК и ДНК, и нуклеотиды. Термин «антиген» также включает агенты, которые становятся антигенными (и сенсибилизирующими) только посредством трансформации (например, промежуточно в молекуле или достройкой с помощью корпуса белка). Антиген или продукт его процессирования предпочтительно распознаются с помощью рецептора Т- или В-клеток или молекулы иммуноглобулина, такой как антитело. В предпочтительном воплощении антиген является ассоциированным с заболеванием антигеном, таким как опухолевый антиген, такой как CLDN18.2.
В контексте настоящего изобретения термин «опухолевый антиген» или «ассоциированный с опухолью антиген» относится к антигену, который присутствует в опухолевых клетках. Предпочтительно антиген присутствует в опухолевых клетках, например, на поверхности опухолевых клеток. Предпочтительно «опухолевый антиген» экспрессируется опухолевыми клетками. В одном воплощении термин «опухолевый антиген» относится к белкам, которые аберрантно экспрессируются в опухолевых клетках по сравнению с нормальными, то есть неопухолевыми клетками. Например, экспрессия может быть обнаружена только в опухолевых клетках, но не в нормальных, то есть неопухолевых клетках, или уровень экспрессии может быть выше в опухолевых клетках по сравнению с нормальными, то есть неопухолевыми клетками. В одном воплощении термин «опухолевый антиген» относится к белкам, которые находятся в нормальных условиях, специфически экспрессированных в ограниченном числе тканей и/или органов или на специфических стадиях развития, и экспрессируются или аберрантно экспрессируются в одной или нескольких опухолевых или злокачественных опухолевых тканях. В контексте настоящего изобретения опухолевый антиген предпочтительно ассоциируется с клеточной поверхностью клетки злокачественной опухоли и предпочтительно не только, либо редко, либо на более низком уровне, экспрессируется в нормальных тканях и клетках. Предпочтительно, согласно изобретению, опухолевый антиген не экспрессируется в клетке, если уровень экспрессии ниже предела обнаружения и/или если уровень экспрессии слишком мал, чтобы обеспечить связывание антител, специфичных к опухолевым антигенам, добавленных к клеткам. Особенно предпочтительным антигеном опухоли в соответствии с изобретением является CLDN18.2.
Согласно изобретению термин «злокачественное новообразование, положительное по опухолевому антигену» или «опухоль, положительная по опухолевому антигену» или аналогичные термины означают злокачественное новообразование или опухоль, включающую злокачественные опухолевые или опухолевые клетки, экспрессирующие опухолевый антиген, предпочтительно на поверхности указанных злокачественных опухолевых клеток или опухолевых клеток. Опухолевый антиген экспрессируется на поверхности клеток, если он расположен на поверхности указанных клеток и доступен для связывания с опухолевыми антигенспецифическими антителами, добавленными к клеткам.
В одном предпочтительном воплощении изобретения «злокачественное новообразование, положительное по опухолевому антигену» или «опухоль, положительная по опухолевому антигену» представляет собой «CLDN18.2-положительное злокачественное новообразование» или «CLDN18.2-положительную опухоль». Согласно изобретению термин «CLDN18.2-положительное злокачественное новообразование» или «CLDN18.2-положительная опухоль» означает злокачественное новообразование или опухоль, включающие злокачественные опухолевые или опухолевые клетки, экспрессирующие CLDN18.2, предпочтительно на поверхности указанных злокачественных опухолевых клеток или опухолевых клеток.
«Клеточная поверхность» используется в соответствии с ее нормальным значением в данной области техники и, таким образом, включает внешнюю поверхность клетки, которая доступна для связывания белками и другими молекулами.
Термин «внеклеточная часть» в контексте настоящего изобретения относится к части молекулы, такой как белок, которая обращена к внеклеточному пространству клетки и предпочтительно доступна извне указанной клетки, например, антигенсвязывающим молекулам, таким как антитела, расположенные вне клетки. Предпочтительно, термин относится к одной или нескольким внеклеточным петлям или доменам или их фрагменту.
Согласно изобретению CLDN18.2 существенно не экспрессируется в клетке, если уровень экспрессии ниже по сравнению с экспрессией в клетках желудка или ткани желудка. Предпочтительно уровень экспрессии составляет менее 10%, предпочтительно менее 5%, 3%, 2%, 1%, 0,5%, 0,1% или 0,05% от экспрессии в клетках желудка или в тканях желудка или даже ниже. Предпочтительно, CLDN18.2 существенно не экспрессируется в клетке, если уровень экспрессии превышает уровень экспрессии в незлокачественной ткани, отличной от желудка, не более чем в 2 раза, предпочтительно в 1,5 раза, и предпочтительно не превышает уровень экспрессии в указанной незлокачественной ткани. Предпочтительно CLDN18.2 по существу не экспрессируется в клетке, если уровень экспрессии ниже предела обнаружения и/или если уровень экспрессии слишком мал, чтобы позволить связывание CLDN18.2-специфическими антителами, добавленными к клеткам.
Согласно изобретению CLDN18.2 экспрессируется в клетке, если уровень экспрессии превышает уровень экспрессии в незлокачественной ткани, отличной от желудка, предпочтительно более чем в 2 раза, предпочтительно в 10 раз, в 100 раз, 1000 или 10000 раз. Предпочтительно CLDN18.2 экспрессируется в клетке, если уровень экспрессии выше предела обнаружения и/или если уровень экспрессии достаточно высок, чтобы позволить связывание с CLDN18.2-специфическими антителами, добавленными к клеткам. Предпочтительно CLDN18.2, экспрессируемый в клетке, экспрессируется или экспонируется на поверхности указанной клетки.
Термин «эпитоп» относится к антигенной детерминанте в молекуле, т.е. к части молекулы, которая распознается иммунной системой, например, которая распознается антителом. Например, эпитопы представляют собой дискретные трехмерные участки на антигене, которые распознаются иммунной системой. Эпитопы обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты или сахарные боковые цепи, и обычно имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Конформационные и неконформационные эпитопы отличаются тем, что связывание с первым, но не с последним, теряется в присутствии денатурирующих растворителей. Эпитоп белка предпочтительно содержит непрерывную или прерывистую часть указанного белка и предпочтительно составляет от 5 до 100, предпочтительно от 5 до 50, более предпочтительно от 8 до 30, наиболее предпочтительно от 10 до 25 аминокислот в длину, например, эпитоп может быть предпочтительно 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот в длину.
Термин «антитело» включает гликопротеин, содержащий, по меньшей мере, две тяжелые (H) цепи и две легкие цепи (L), связанные между собой дисульфидными связями, и любую молекулу, содержащую антигенсвязывающую часть такого гликопротеина. Термин «антитело» включает моноклональные антитела, рекомбинантные антитела, человеческие антитела, гуманизированные антитела, химерные антитела, фрагменты или производные антител, включая, без ограничения перечисленным, одноцепочечные антитела, например scFv и антигенсвязывающие фрагменты антитела, такие как Fab и Fab' фрагменты, а также включает все рекомбинантные формы антител, например антитела, экспрессированные в прокариотах, негликозилированные антитела и любые антигенсвязывающие фрагменты и производные антител, описанные в данном документе. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначенной в данном документе как VH) и константной области тяжелой цепи. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначенной в данном документе как VL) и константной области легкой цепи. Области VH и VL можно далее подразделить на области гипервариабельности, которые называются областями определения комплементарности (CDR), чередующимися с областями, которые более консервативны, и называются каркасными областями (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенных от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (Clq) классической системы комплемента.
Используемый в данном документе термин «моноклональное антитело» относится к препарату молекул антител с одним молекулярным составом. Моноклональное антитело проявляет единственную связывающую специфичность и аффинность. В одном воплощении моноклональные антитела получают гибридомой, которая включает В-клетку, полученную от не являющегося человеком животного, например мыши, слитую с иммортализованной клеткой.
Используемый в данном документе термин «рекомбинантное антитело» включает все антитела, которые были получены, экспрессированы, созданы или выделены рекомбинантными средствами, такими как (а) антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомным в отношении генов иммуноглобулинов, или полученной из них гибридомы, (b) антитела, выделенные из клетки-хозяина, трансформированной для экспрессии антитела, например, из трансфектомы, (с) антитела, выделенные из библиотеки рекомбинантных комбинаторных антител, и (d) антитела, полученные, экспрессированные, созданные или выделенные любыми другими способами, которые включают сплайсинг последовательностей генов иммуноглобулинов с другими последовательностями ДНК.
Используемый в данном документе термин «человеческое антитело» предназначен для включения антител, имеющих вариабельные и постоянные области, полученные из последовательностей иммуноглобулина человека зародышевой линии. Человеческие антитела могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина человека зародышевой линии (например, мутации, введенные случайным или сайтоспецифическим мутагенезом in vitro или соматической мутацией in vivo ).
Термин «гуманизированное антитело» относится к молекуле, имеющей сайт связывания антигена, который по существу получен из иммуноглобулина не являющихся человеком видов, в которой оставшаяся структура иммуноглобулина молекулы основана на структуре и/или последовательности человеческого иммуноглобулина. Участок связывания антигена может либо содержать полные вариабельные домены, слитые с константными доменами, либо только области, определяющие комплементарность (CDR), привитые в соответствующие каркасные области в вариабельных доменах. Сайты связывания антигена могут быть дикого типа или модифицированы одной или несколькими аминокислотными заменами, например модифицированными, чтобы более точно напоминать человеческие иммуноглобулины. Некоторые формы гуманизированных антител сохраняют все последовательности CDR (например, гуманизированное мышиное антитело, которое содержит все шесть CDR из мышиного антитела). Другие формы имеют одну или несколько CDR, которые изменяются относительно исходного антитела.
Термин «химерное антитело» относится к тем антителам, где одна часть каждой из аминокислотных последовательностей тяжелых и легких цепей гомологична соответствующим последовательностям в антителах, полученных из одного вида или принадлежащих к определенному классу, тогда как оставшийся сегмент цепи гомологичен соответствующим последовательностям в другом виде или классе. Обычно вариабельная область как легкой, так и тяжелой цепей имитирует вариабельные области антител, полученных от одного вида млекопитающих, тогда как константные части гомологичны последовательностям антител, полученных из другого организма. Одним явным преимуществом таких химерных форм является то, что вариабельный участок может быть удобно получен из известных в настоящее время источников с использованием легко доступных В-клеток или гибридом из организмов-хозяев не являющихся человеком в комбинации с постоянными областями, полученными, например, из препаратов клеток человека. Хотя вариабельная область имеет преимущество легкости получения, и на специфичность не оказывает влияние источник, константная область их человека с меньшей вероятностью вызывает иммунный ответ у человека при введении антитела, чем постоянная область из источника, не являющегося человеком. Однако это определение не ограничивается этим конкретным примером.
Антитела могут быть получены из разных видов, включая, без ограничения указанным, мышей, крыс, кроликов, морских свинок и человека.
Антитела, описанные в данном документе, включают IgA, такие как IgA1 или IgA2, IgG1, IgG2, IgG3, IgG4, IgE, IgM и IgD антитела. В различных воплощениях изобретения антитело представляет собой антитело IgG1, более конкретно IgG1, каппа или IgG1, лямбда-изотипа (то есть IgG1, κ, λ), IgG2a антитела (например, IgG2a, κ, λ), антитело IgG2b (например, IgG2b, κ, λ), IgG3, антитело (например, IgG 3, κ, λ) или IgG4-антитело (например, IgG4, κ, λ).
Используемый в данном документе термин «гетерологичное антитело» определяется по отношению к трансгенному организму, продуцирующему такое антитело. Этот термин относится к антителу, имеющему аминокислотную последовательность или кодирующую последовательность нуклеиновой кислоты, соответствующую той, которая обнаружена в организме, не совпадающем с трансгенным организмом, и обычно получена из вида, отличного от трансгенного организма.
Используемый в данном документе термин «гетерогибридное антитело» относится к антителу, имеющему легкие и тяжелые цепи с происхождением из различных организмов. Например, антитело, имеющее тяжелую цепь человека, связанную с легкой цепью мыши, представляет собой гетерогибридное антитело.
Описанные в данном документе антитела предпочтительно выделяют. «Выделенное антитело», при использовании в данном документе, предназначено для обозначения антитела, которое по существу не содержит других антител, имеющих разные антигенные специфичности (например, выделенное антитело, которое специфически связывается с опухолевым антигеном, по существу не содержит антител, которые специфически связывают антигены другого опухолевого антигена). Выделенное антитело, которое специфически связывается с эпитопом, изоформой или вариантом опухолевого антигена человека, может, однако, иметь перекрестную реактивность по отношению к другим родственным антигенам, например, от других видов (например, гомологов опухолевых антигенов). Кроме того, выделенное антитело может быть по существу свободным от другого клеточного материала и/или химических веществ. В одном воплощении изобретения комбинация «выделенных» моноклональных антител относится к антителам, имеющим разную специфичность, и сочетающихся в четко определенной композиции или смеси.
Термины «антигенсвязывающая часть» антитела (или просто «связывающая часть») или «антигенсвязывающий фрагмент» антитела (или просто «связывающий фрагмент») или сходные термины относятся к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может быть выполнена фрагментами полноразмерного антитела. Примеры связывающих фрагментов, включенных в термин «антигенсвязывающая часть» антитела, включают (i) Fab-фрагменты, моновалентные фрагменты, состоящие из доменов VL, VH, CL и CH; (ii) фрагменты F(ab')2, двухвалентные фрагменты, содержащие два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирной области; (iii) фрагменты Fd, состоящие из доменов VH и CH; (iv) фрагменты Fv, состоящие из доменов VL и VH одного плеча антитела, (v) фрагменты dAb (Ward et al., (1989) Nature 341: 544-546), которые состоят из домена VH; (vi) выделенные области определения комплементарности (CDR) и (vii) комбинации двух или более выделенных CDR, которые могут быть необязательно соединены синтетическим линкером. Кроме того, хотя две области фрагмента Fv, VL и VH кодируются отдельными генами, их можно объединить, используя рекомбинантные способы, синтетическим линкером, который позволяет получить одиночную белковую цепь, в которой VL И VH-пары образуют одновалентные молекулы (известные как одноцепочечные Fv (scFv), см., например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также предназначены для включения в термин «антигенсвязывающий фрагмент» антитела. Другим примером являются слитые белки иммуноглобулина и связывающего домена, содержащие (i) полипептид связывающего домена, который слит с полипептидом шарнирной области иммуноглобулина, (ii) константную область CH2 тяжелой цепи иммуноглобулина, слитую с шарнирной областью, и (iii) константная область CH3 тяжелой цепи иммуноглобулина, слитую с константной областью CH2. Полипептид связывающего домена может быть вариабельной областью тяжелой цепи или вариабельной областью легкой цепи. Слитые белки связывающего домена и иммуноглобулина далее описаны в US 2003/0118592 и US 2003/0133939. Эти фрагменты антител получают обычными методами, известными специалистам в данной области, и фрагменты подвергают скринингу на предмет полезности таким же образом, как и интактные антитела.
Термин «связывающий домен» характеризует в связи с настоящим изобретением структуру, например антитела, которая связывается/взаимодействует с данной целевой структурой/антигеном/эпитопом. Таким образом, домен связывания в соответствии с изобретением обозначает «сайт взаимодействия антигена».
Все антитела и производные антител, таких как фрагменты антител, как описано в данном документе для целей изобретения, охватываются термином «антитело». Термин «производные антитела» относится к любой модифицированной форме антитела, например, к конъюгату антитела и другого агента или антитела или к фрагменту антитела.
Естественно встречающиеся антитела, как правило, моноспецифичны, то есть они связываются с одним антигеном. Настоящее изобретение включает антитела, связывающиеся с клеткой-мишенью (путем взаимодействия с опухолевым антигеном) и второй сущностью, такой как цитотоксическая клетка (например, путем взаимодействия с CD3-рецептором). Антитела по настоящему изобретению могут быть биспецифическими или мультиспецифическими, такими как триспецифические, тетраспецифические и так далее.
Термин «биспецифическая молекула» предназначен для включения агента, который имеет две различные специфичности связывания. Например, молекула может связываться с (а) клеточным поверхностным антигеном или (b) рецептором, таким как Fc-рецептор на поверхности эффекторной клетки. Термин «мультиспецифическая молекула» предназначен для включения агента, который имеет более чем две различные специфичности связывания. Например, молекула может связываться с или взаимодействовать с (а) клеточным антигеном, (b) рецептором, таким как Fc-рецептор на поверхности эффекторной клетки, и (c) по меньшей мере, с одним другим компонентом. Соответственно, термин «антитело против опухолевого антигена» включает, без ограничения указанным, биспецифические, триспецифические, тетраспецифические и другие мультиспецифические молекулы, которые направлены на опухолевый антиген, и на другие мишени, такие как Fc-рецепторы на эффекторных клетках. Термин «биспецифические антитела» также включает диатела. Диатела являются двухвалентными, биспецифическими антителами, в которых VH и VL-домены экспрессируются в одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы обеспечить спаривание между двумя доменами в одной и той же цепи, тем самым заставляя домены спариваться с комплементарными доменами другой цепи и создавать два сайта связывания антигена (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R. J., et al. (1994) Structure 2: 1121-1123).
В соответствии с изобретением антитело может оказывать терапевтическое действие путем рекрутирования иммунной системы пациента для уничтожения опухолевых клеток и/или через терапевтический фрагмент или агент, связанный с антителом. Для целей настоящего изобретения такие конъюгаты антител можно рассматривать как охватываемые термином «химиотерапевтический агент», в то время как антитела, оказывающие терапевтический эффект путем рекрутирования иммунной системы пациента для уничтожения опухолевых клеток, нельзя рассматривать таким образом.
В контексте настоящего изобретения антитело предпочтительно способно воздействовать посредством рекрутирования иммунной системы пациента для уничтожения опухолевых клеток, то есть антитело, в частности, когда оно связано с его мишенью, такой как опухолевой антиген на пораженной клетке, вызывает иммунный эффект, описанный в данном документе. Предпочтительно указанные иммунные эффекторные функции направлены против клеток, таких как клетки злокачественных опухолей, несущие опухолевый антиген, такой как CLDN18.2, на их поверхности.
Термин «функции иммунного эффектора» в контексте настоящего изобретения включает любые функции, опосредованные компонентами иммунной системы, которые приводят, например, к ингибированию роста опухоли и/или ингибированию развития опухоли, включая ингибирование распространения опухолей и метастазов. Предпочтительно, функции иммунного эффектора приводят к уничтожению клеток злокачественных опухолей. Такие функции включают комплементарно-зависимую цитотоксичность (CDC), антителозависимую клеточно-опосредованную цитотоксичность (ADCC), антителозависимый клеточно-опосредованный фагоцитоз (ADCP), индукцию апоптоза в клетках, несущих опухолевый антиген, цитолиз клеток, несущих опухолевый антиген и/или ингибирование пролиферации клеток, несущих опухолевый антиген. Связывающие агенты могут также оказывать действие просто путем связывания с опухолевыми антигенами на поверхности клетки злокачественной опухоли. Например, антитела могут блокировать функцию опухолевого антигена или индуцировать апоптоз только путем связывания с опухолевым антигеном на поверхности клетки злокачественной опухоли.
Антителозависимая клеточно-опосредованная цитотоксичность
ADCC описывает способность эффекторных клеток, в частности лимфоцитов, которые предпочтительно требуют, чтобы клетка-мишень была отмечена антителом, убивать клетки.
ADCC предпочтительно возникает, когда антитела связываются с антигенами на опухолевых клетках, а Fc-домены антитела взаимодействуют с Fc-рецепторами (FcR) на поверхности иммунных эффекторных клеток. Было идентифицировано несколько семейств Fc-рецепторов, а специфические клеточные популяции характерно экспрессируют определенные Fc-рецепторы. ADCC можно рассматривать как механизм, позволяющий непосредственно индуцировать вариабельную степень немедленного разрушения опухоли, что приводит к представлению антигена и индукции опухоль-индуцируемых Т-клеточных реакций. Предпочтительно in vivo индукция ADCC приведет к опухоль-индуцируемым Т-клеточным ответам и ответам хозяйских антител.
Цитотоксичность, зависящая от комплемента
CDC-еще один способ уничтожения клеток, который может быть управляться антителами. IgM является наиболее эффективным изотипом активации комплемента. IgG1 и IgG3 также очень эффективны при управлении CDC через классический путь активации комплемента. Предпочтительно в этом каскаде образование комплексов антиген-антитело приводит к оголению множественных сайтов связывания C1q в непосредственной близости от доменов CH2 участвующих молекул антитела, таких как молекулы IgG (C1q является одним из трех подкомпонентов комплемента C1). Предпочтительно, эти оголенные сайты связывания C1q превращают ранее низкоаффинное взаимодействие C1q-IgG во взаимодействие с высокой авидностью, которая запускает каскад событий, включающих ряд других белков комплемента, и приводит к протеолитическому высвобождению хемотаксисических/активирующих агентов эффекторной клетки C3a и C5a. Предпочтительно каскад комплемента заканчивается образованием комплекса мембранной атаки, который создает поры в клеточной мембране, облегчающих свободный проход воды и растворенных веществ в клетку и из нее.
Для того, чтобы ингибировать рост опухоли и/или развитие опухоли, согласно изобретению антитело может быть конъюгировано с терапевтическим фрагментом или агентом, таким как цитотоксин, лекарственное средство (например, иммунодепрессант) или радиоизотоп. Цитотоксин или цитотоксический агент включает любой агент, который вреден для клетки и, в частности, убивает клетки. Примеры включают таксол, цитохалазин В, грамицидин D, этидиумбромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, аманитин, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин, а также их аналоги или гомологи. Подходящие терапевтические агенты для образования конъюгатов антител включают, без ограничения указанным, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, флударабин, 5-фторурацилдекарбазин), алкилирующие агенты (например, мехлорэтамин, тиоэпа хлорамбуцил, мелфалан, Кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнитол, стрептозотоцин, митомицин С и цисплатин цисплатина (ii) (DDP)), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (Например, дактиномицин (ранее актиномицин), блеомицин, митрамицин и антрамицин (АМС) и антимитотические агенты (например, винкристин и винбластин). В предпочтительном варианте терапевтический агент представляет собой цитотоксический агент или радиотоксический агент. В другом воплощении терапевтический агент представляет собой иммунодепрессант. В еще одном варианте терапевтический агент представляет собой GM-CSF. В предпочтительном варианте терапевтический агент представляет собой доксорубицин, цисплатин, блеомицин, сульфат, кармустин, хлорамбуцил, циклофосфамид или рицин А.
Антитела также могут быть конъюгированы с радиоизотопом, например иодом-131, иттрием-90 или индием-111, для получения цитотоксических радиофармацевтических препаратов.
Конъюгаты антител по изобретению могут быть использованы для модификации данного биологического ответа, и часть лекарственного средства не должна истолковываться как ограниченная классическими химическими терапевтическими агентами. Например, лекарственный фрагмент может представлять собой белок или полипептид, обладающий искомой биологической активностью. Такие белки могут включать, например, ферментативно активный токсин или его активный фрагмент, такой как абрин, рицин А, экзотоксин синегнойной палочки или дифтерийный токсин; белок, такой как фактор некроза опухоли или интерферон γ; или, модификаторы биологического ответа, такие как, например, лимфокины, интерлейкин-1 («IL-1»), интерлейкин-2 («IL-2»), интерлейкин-6 («IL-6»), гранулоцитарно-макрофагиальный колониестимулирующий фактор («GM-CSF»), гранулоцитарный колониестимулирующий фактор («G-CSF») или другие факторы роста.
Способы конъюгирования такого терапевтического фрагмента с антителами хорошо известны, см., например, Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", in Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds. ), pp. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery", in Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", in Monoclonal Antibodies '84: Biological And Clinical Applications, Pincheraet al. (eds. ), pp. 475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", in Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds.), pp. 303-16 (Academic Press 1985), и Thorpe et al., "The Preparation And Cytotoxic Properties Of Antibody-Toxin Conjugates", Immunol. Rev., 62: 119-58 (1982).
Термин «антитело против опухолевого антигена» или аналогичные термины относится к антителу, направленному или обладающему способностью связываться с опухолевым антигеном. Термин «связывание» согласно изобретению предпочтительно относится к специфическому связыванию.
В соответствии с настоящим изобретением антитело способно связываться с предопределенной мишенью, если оно имеет значительную аффинность к указанной заданной мишени и связывается с указанной заданной мишенью в стандартных анализах. «Аффинность» или «аффинность связывания» часто измеряется константой равновесной диссоциации (KD). Предпочтительно термин «значительная аффинность» относится к связыванию с заданной мишенью с константой диссоциации (KD) 10-5 М или ниже, 10-6 М или ниже, 10-7 М или ниже, 10-8 М или ниже, 10-9 М или ниже, 10-10 М или ниже, 10-11 М или ниже, или 10-12 М или ниже.
Антитело не является (по существу) способным связываться с мишенью, если оно не имеет значительного аффинности к указанной мишени и не связывается значительно, в частности, не связывается детектируемым образом с указанной мишенью в стандартных анализах. Предпочтительно антитело не обнаруживает связи с указанной мишенью, если оно присутствует в концентрации до 2, предпочтительно 10, более предпочтительно 20, в частности 50 или 100 мкг/мл или выше. Предпочтительно, если антитело не имеет существенной аффинности к мишени, если он связывается с указанной мишенью с KD, которая, по меньшей мере, в 10 раз, 100 раз, 103 раз, 104 раз, 105 раз, или 106 раз выше, чем KD для связывания с предопределенной мишенью, к которой антитело способно связываться. Например, если KD для связывания антитела с мишенью, с которой антитело способно связываться, составляет 10-7 М, KD для связывания с мишенью, для которой антитело не имеет значимой аффинности, будет, по меньшей мере, 10-6 М, 10-5 М, 10-4 М, 10-3 М, 10-2 М или 10-1 М.
Антитело специфично для заданной мишени, если оно способно связываться с указанной предопределенной мишенью, в то время как оно не способно связываться с другими мишенями, то есть не имеет существенного аффинности к другим мишеням и не может существенно связываться с другими мишенями в стандартных анализах. Согласно изобретению антитело специфично для опухолевого антигена, если оно способно связываться с опухолевым антигеном, но не (по существу) способно связываться с другими мишенями. Предпочтительно антитело является специфичным для опухолевого антигена, если аффинность к связыванию с такими другими мишенями и связывание с такими другими мишенями не значительно превышает аффинность к или связывание с несвязанными с опухолевым антигеном белками, такими как бычий сывороточный альбумин (BSA), казеин, человеческий сывороточный альбумин (HSA) или с несвязанными с опухолевым антигеном трансмембранными белками, таких как молекулы MHC или рецептор трансферрина или любой другой определенный полипептид. Предпочтительно, антитело является специфическим для предварительно определенной мишени, если он связывается с указанным объектом с KD, которая, по меньшей мере, в 10 раз, 100 раз, 10 3 раз, 104 раз, 105 раз или 106 раз меньше, чем KD связывания с мишенью, для которой оно не является специфическим. Например, если KD для связывания антитела с мишенью, для которой он специфичен, составляет 10-7 M, KD для связывания с мишенью, для которой оно не является специфической, будет составлять, по меньшей мере, 10-6 М, 10-5 М, 10-4 М, 10-3 М, 10-2 М или 10-1 М.
Связывание антитела с мишенью может быть определено экспериментально с использованием любого подходящего способа; см., например, Berzofsky et al., "Antibody-Antigen Interactions" In Fundamental Immunology, Paul, W. E., Ed., Raven Press New York, N Y (1984), Kuby, Janis Immunology, W. H. Freeman and Company New York, N Y (1992), и способы, описанные в данном документе. Аффинности могут быть легко определены с использованием обычных методов, таких как равновесный диализ; с помощью прибора BIAcore 2000, используя общие процедуры, указанные производителем; путем радиоиммунологического анализа с использованием радиоактивно меченного антигена; или другим способом, известным специалисту в данной области техники. Данные о аффинности могут быть проанализированы, например, способом Scatchard et al., Ann NY Acad. ScL, 51:660 (1949). Измеренная аффинность конкретного взаимодействия антитело-антиген может изменяться, если измерять ее в разных условиях, например, концентрации соли, рН. Таким образом, измерения аффинности и других антигенсвязывающих параметров, например KD, IC50, предпочтительно производятся со стандартизованными растворами антител и антигена и стандартизованным буфером.
Используемый в данном документе термин «изотип» относится к классу антител (например, IgM или IgG1), который кодируется генами константной области тяжелой цепи.
Используемый в данном документе термин «переключение изотипа» относится к феномену, с помощью которого класс или изотип антитела изменяется от одного класса Ig к одному из других классов Ig.
Термин «встречающийся в природе», используемый в данном документе для применения к объекту, относится к тому факту, что объект можно найти в природе. Например, полипептидная или полинуклеотидная последовательность, присутствующая в организме (включая вирусы), которая может быть выделена из источника в природе и которая не была намеренно модифицирована человеком в лаборатории является встречающейся в природе.
Используемый в данном документе термин «перегруппированный» относится к конфигурации локуса иммуноглобулина тяжелой цепи или легкой цепи, где V-сегмент расположен непосредственно рядом с сегментом D-J или J в конформации, кодирующей, по существу, полный домен VH или VL, соответственно. Перестроенный локус гена иммуноглобулина (антитела) может быть идентифицирован путем сравнения с ДНК зародышевой линии; перестроенный локус будет иметь, по меньшей мере, один рекомбинированный элемент гомологии гептамера/нонамера.
Термин «неперестроенный» или «конфигурация зародышевой линии», при использовании в данном документе в отношении V-сегмента, относится к конфигурации, в которой V-сегмент не рекомбинирован, чтобы быть непосредственно смежным с сегментом D или J.
Предпочтительно, связывание антитела против опухолевого антигена с клетками, экспрессирующими опухолевый антиген, индуцирует или опосредует убийство клеток, экспрессирующих опухолевый антиген. Клетки, экспрессирующие опухолевый антиген, предпочтительно являются клетками злокачественных опухолей и представляют собой, в частности, клетки описанных в данном документе онкологических заболеваний. Предпочтительно, антитело индуцирует или опосредует убийство клеток путем индуцирования одного или нескольких из числа лизиса, опосредованного комплементзависимой цитотоксичности (CDC), лизиса, опосредованного антителозависимой клеточной цитотоксичности (ADCC), апоптоза и ингибирования пролиферации клеток, экспрессирующих опухолевый антиген. Предпочтительно, опосредованный ADCC лизис клеток происходит в присутствии эффекторных клеток, которые в конкретных воплощениях выбраны из группы, состоящей из моноцитов, мононуклеарных клеток, NK-клеток и PMN. Ингибирование пролиферации клеток можно измерить in vitro путем определения пролиферации клеток в анализе с использованием бромдезоксиуридина (5-бром-2'-дезоксиуридина, BrdU). BrdU представляет собой синтетический нуклеозид, который является аналогом тимидина и может быть включен во вновь синтезированную ДНК реплицирующихся клеток (во время S-фазы клеточного цикла), заменяя тимидин во время репликации ДНК. Обнаружение включенного химического вещества с использованием, например, антител, специфичных для BrdU, указывает на клетки, которые активно реплицируют свою ДНК.
В предпочтительных воплощениях антитела, описанные в данном документе, могут быть охарактеризованы одним или несколькими из следующих свойств:
a) специфичность опухолевого антигена;
b) аффинность связывания с опухолевым антигеном около 100 нМ или менее, предпочтительно около 5-10 нМ или менее и, более предпочтительно, около 1-3 нМ или менее,
c) способность индуцировать или опосредовать CDC на клетках, положительных по опухолевому антигену;
d) способность индуцировать или опосредовать ADCC на клетках, положительных по опухолевому антигену;
e) способность ингибировать рост клеток, положительных по опухолевому антигену;
f) способность индуцировать апоптоз клеток, положительных по опухолевому антигену.
В одном воплощении антитело против опухолевого антигена обладает способностью связываться с эпитопом, присутствующим в опухолевом антигене, предпочтительно эпитопом, находящимся в пределах внеклеточных доменов опухолевого антигена. Предпочтительно антитело против опухолевого антигена является специфичным к опухолевому антигену. Предпочтительно антитело против опухолевого антигена связывается с опухолевым антигеном, экспрессируемым на поверхности клетки. В особенно предпочтительных воплощениях антитело против опухолевого антигена связывается с нативными эпитопами опухолевого антигена, присутствующего на поверхности живых клеток.
Согласно изобретению антитело, обладающее способностью связываться с CLDN18.2 или антитело против CLDN18.2, представляет собой антитело, способное связываться с эпитопом, присутствующим в CLDN18.2, предпочтительно эпитопом, находящимся во внеклеточных доменах CLDN18.2, в частности, первом внеклеточном домене, предпочтительно в аминокислотных положениях 29-78 в CLDN18.2. В конкретных воплощениях антитело, обладающее способностью связываться с CLDN18.2, является антителом, которое способно связываться с (i) эпитопом на CLDN18.2, который отсутствует на CLDN18.1, предпочтительно SEQ ID NO: 3, 4 и 5, (ii) эпитопом, локализованном в CLDN18.2-петле 1, предпочтительно SEQ ID NO: 8, (iii) эпитопом, локализованном в CLDN18.2-петле 2, предпочтительно SEQ ID NO: 10, (iv) эпитопом, локализованном в CLDN18.2- петле D3, предпочтительно SEQ ID NO: 11, (v) эпитопом, который охватывает CLDN18.2-петлю 1 и CLDN18.2-петлю D3, или (vi) негликозилированным эпитопом, локализованным на CLDN18.2 – петле D3, предпочтительно SEQ ID NO: 9.
Согласно изобретению антитело, обладающее способностью связываться с CLDN18.2, предпочтительно представляет собой антитело, имеющее способность связываться с CLDN18.2, но не с CLDN18.1. Предпочтительно, антитело, обладающее способностью связываться с CLDN18.2, является специфичным к CLDN18.2. Предпочтительно, антитело, обладающее способностью связываться с CLDN18.2, представляет собой антитело, имеющее способность связываться с CLDN18.2, экспрессируемым на поверхности клетки. В предпочтительных воплощениях антитело, обладающее способностью связываться с CLDN18.2, связывается с нативными эпитопами CLDN18.2, присутствующими на поверхности живых клеток. Предпочтительно антитело, обладающее способностью связываться с CLDN18.2, связывается с одним или несколькими пептидами, выбранными из группы, состоящей из SEQ ID NO: 1, 3-11, 44, 46 и 48-50. Предпочтительно антитело, обладающее способностью связываться с CLDN18.2, является специфичным для вышеупомянутых белков, пептидов или иммуногенных фрагментов или их производных. Антитело, обладающее способностью связываться с CLDN18.2, может быть получено способом, включающим стадию иммунизации животного белком или пептидом, содержащим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 3-11, 44, 46 и 48-50, или нуклеиновой кислотой или клеткой-хозяином, экспрессирующей указанный белок или пептид. Предпочтительно антитело связывается с клетками злокачественных опухолей, в частности с клетками указанных выше типов злокачественных новообразований, и предпочтительно не связывается по существу с клетками, которые не являются клетками злокачественных опухолей.
Предпочтительно, связывание антитела, обладающего способностью связываться с CLDN18.2, с клетками, экспрессирующими CLDN18.2, индуцирует или опосредует убийство клеток, экспрессирующих CLDN18.2. Клетки, экспрессирующие CLDN18.2, предпочтительно являются клетками злокачественных опухолей и, в частности, выбраны из группы, включающей клетки рака желудка, пищевода, поджелудочной железы, легкого, яичника, толстой кишки, печени, головы и шеи и желчного пузыря. Предпочтительно антитело индуцирует или опосредует убийство клеток путем индуцирования одного или нескольких из числа лизиса, опосредованного комплементзависимой цитотоксичности (CDC), лизиса, опосредованного антителозависимой клеточной цитотоксичности (ADCC), апоптоза и ингибирования пролиферации клеток, экспрессирующих CLDN18.2. Предпочтительно, опосредованный ADCC лизис клеток происходит в присутствии эффекторных клеток, которые в конкретных воплощениях выбраны из группы, состоящей из моноцитов, мононуклеарных клеток, NK-клеток и PMN.
В предпочтительных воплощениях антитело, обладающее способностью связываться с CLDN18.2, может быть охарактеризовано одним или несколькими из следующих свойств:
a) специфичность к CLDN18.2;
b) аффинность связывания с CLDN18.2 примерно 100 нМ или менее, предпочтительно примерно 5-10 нМ или менее и, более предпочтительно, около 1-3 нМ или менее,
c) способность индуцировать или опосредовать CDC в положительных по CLDN18.2 клетках;
d) способность индуцировать или опосредовать ADCC в положительных по CLDN18.2 клетках;
e) способность ингибировать рост положительных по CLDN18.2 клеток;
f) способность индуцировать апоптоз положительных по CLDN18.2 клеток.
В особенно предпочтительном воплощении антитело, обладающее способностью связываться с CLDN18.2, получают с помощью гибридомы, депонированной в DSMZ (Mascheroder Weg 1b, 31824 Braunschweig, Germany; new address: Inhoffenstr. 7B, 31824 Braunschweig, Germany) и имеет следующее обозначение и учетный номер:
а. 182-D1106-055, учетный номер DSM ACC2737, депонированное 19 октября 2005 года
b. 182-D1106-056, учетный номер DSM ACC2738, депонированное 19 октября 2005 года
c. 182-D1106-057, учетный номер DSM ACC2739, депонированное 19 октября 2005 года
d. 182-D1106-058, учетный номер DSM ACC2740, депонированное 19 октября 2005 года
e. 182-D1106-059, учетный номер DSM ACC2741, депонированное 19 октября 2005 года
f. 182-D1106-062, учетный номер DSM ACC2742, депонированное 19 октября 2005 года,
g. 182-D1106-067, учетный номер DSM ACC2743, депонированное 19 октября 2005 года
h. 182-D758-035, учетный номер DSM ACC2745, депонированное 17 ноября 2005 г.
i. 182-D758-036, учетный номер DSM ACC2746, депонированное 17 ноября 2005 г.
j. 182-D758-040, учетный номер DSM ACC2747, депонированное 17 ноября 2005 г.
k. 182-D1106-061, учетный номер DSM ACC2748, депонированное 17 ноября 2005 года
l. 182-D1106-279, учетный номер DSM ACC2808, депонированное 26 октября 2006 г.
m. 182-D1106-294, учетный номер DSM ACC2809, депонированное 26 октября 2006 года,
n. 182-D1106-362, учетный номер DSM ACC2810, депонированное 26 октября 2006 года.
Предпочтительными антителами в соответствии с изобретением являются те, которые получены и получаются из вышеописанных гибридом; т.е. 37G11 в случае 182-D1106-055, 37H8 в случае 182-D1106-056, 38G5 в случае 182-D1106-057, 38H3 в случае 182-D1106-058, 39F11 в случае 182-D1106-059, 43A11 в случае 182-D1106-062, 61C2 в случае 182-D1106-067, 26B5 в случае 182-D758-035, 26D12 в случае 182-D758-036, 28D10 в случае 182-D758-040, 42E12 в случае 182-D1106-061, 125E1 в случае 182-D1106-279, 163E12 в случае 182-D1106-294 и 175D10 в случае 182-D1106-362; и их химеризированные и гуманизированные формы.
В одном воплощении антитело, обладающее способностью связываться с CLDN18.2, является антителом, выбранным из группы, состоящей из (i) антитела, продуцируемого и/или получаемого из клона, депонированного под учетным номером DSM ACC2737, DSM ACC2738, DSM ACC2739, DSM ACC2740, DSM ACC2741, DSM ACC2742, DSM ACC2743, DSM ACC2745, DSM ACC2746, DSM ACC2747, DSM ACC2748, DSM ACC2808, DSM ACC2809 или DSM ACC2810, (ii) антитело, которое является химеризированной или гуманизированной формой антитела (i), (iii) антитело, имеющее специфичность антитела (i), и (iv) антитело, содержащее антигенсвязывающую часть или антигенсвязывающий сайт, в частности вариабельный участок, антитела (i) и предпочтительно со специфичностью антитела (i).
Предпочтительные химеризированные антитела и их последовательности показаны в следующей таблице.
В предпочтительных воплощениях антитела, в частности, химеризированные формы антител в соответствии с изобретением, включают антитела, содержащие константную область тяжелой цепи (CH), содержащую аминокислотную последовательность, полученную из константной области тяжелой цепи человека, такую как аминокислотная последовательность, представленная в SEQ ID NO: 13 или ее фрагмент. В других предпочтительных воплощениях антитела, в частности химеризированные формы антител в соответствии с изобретением, включают антитела, содержащие константную область легкой цепи (CL), содержащую аминокислотную последовательность, полученную из константной области легкой цепи человека, такую как аминокислотная последовательность, представленная в SEQ ID NO: 12 или ее фрагмент. В конкретном предпочтительном воплощении антитела, в частности химеризированные формы антител в соответствии с изобретением, включают антитела, которые содержат CH, содержащую аминокислотную последовательность, полученную из человеческой CH, такую как аминокислотная последовательность, представленная в SEQ ID NO: 13 ее или фрагменте, и которые включают CL, содержащую аминокислотную последовательность, полученную из человеческой CL, такую как аминокислотная последовательность, представленная в SEQ ID NO: 12, или ее фрагменте.
В одном воплощении антитело, обладающее способностью связываться с CLDN18.2, представляет собой химерное мышиное/человеческое IgG1 моноклональное антитело, содержащее вариабельную область легкой цепи каппа мыши, константную область легкой цепи каппа человека аллотипа Km(3), вариабельную область тяжелой цепи мыши, константную область IgG1 человека, аллотипа G1m (3).
В некоторых предпочтительных воплощениях химеризированные формы антител включают антитела, содержащие тяжелую цепь, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 14, 15, 16, 17, 18, 19, 51 и ее фрагмента и/или содержащие легкую цепь, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 20, 21, 22, 23, 24, 25, 26, 27, 28 и ее фрагмента.
В некоторых предпочтительных воплощениях химеризированные формы антител включают антитела, содержащие комбинацию тяжелых цепей и легких цепей, выбранных из следующих вариантов (i)-(ix):
(i) тяжелая цепь включает аминокислотную последовательность, представленную SEQ ID NO: 14 или ее фрагмент, а легкая цепь содержит аминокислотную последовательность, представленную в SEQ ID NO: 21, или ее фрагмент,
(ii) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 15 или ее фрагмент, а легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 20, или ее фрагмент,
(iii) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 16 или ее фрагмент, а легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 22, или ее фрагмент,
(iv) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 18 или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 25, или его фрагмент,
(v) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 17 или ее фрагмент, а легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 24, или ее фрагмент,
(vi) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 19 или ее фрагмент, а легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 23, или ее фрагмент,
(vii) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 19 или ее фрагмент, а легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 26, или ее фрагмент,
(viii) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 19 или ее фрагмент, а легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 27, или ее фрагмент,
(ix) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 19 или ее фрагмент, а легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 28 или ее фрагментом, и
(x) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 51 или ее фрагмент, а легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 24, или ее фрагмент.
Особенно предпочтительным является антитело согласно (v) или (x).
«Фрагмент» или «фрагмент аминокислотной последовательности», используемые выше, относится к части последовательности антитела, то есть к последовательности, которая представляет последовательность антитела, укороченную на N- и/или С-конце, которая при замене последовательности указанного антитела в антителе сохраняет связывание указанного антитела с CLDN18.2 и предпочтительно функции указанного антитела, описанной в данном документе, например, лизис, опосредуемый CDC, или лизис, опосредованный ADCC. Предпочтительно, фрагмент аминокислотной последовательности содержит, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, 95%, 96%, 97%, 98% или 99% аминокислотных остатков из указанной аминокислотной последовательности. Фрагмент аминокислотной последовательности, выбранный из группы, состоящей из SEQ ID NO: 14, 15, 16, 17, 18, 19, 51, 20, 21, 22, 23, 24, 25, 26, 27 и 28, предпочтительно относится к указанной последовательности, где 17, 18, 19, 20, 21, 22 или 23 аминокислоты на N-конце удаляются.
В предпочтительном воплощении антитело, обладающее способностью связываться с CLDN18.2, включает вариабельный участок тяжелой цепи (VH), содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 29, 30, 31, 32, 33, 34 и их фрагментов.
В предпочтительном воплощении антитело, обладающее способностью связываться с CLDN18.2, включает вариабельный участок легкой цепи (VL), содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 35, 36, 37, 38, 39, 40, 41, 42, 43 и их фрагмента.
В некоторых предпочтительных воплощениях антитело, обладающее способностью связываться с CLDN18.2, включает комбинацию вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), выбранной из следующих вариантов (i)-(ix):
(i) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 29 или ее фрагментом, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 36 или ее фрагментом,
(ii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 30 или ее фрагментом, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 35 или ее фрагментом,
(iii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 31 или ее фрагментом, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 37 или ее фрагментом,
(iv) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 33, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 40 или ее фрагментом,
(v) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 32 или ее фрагментом, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 39 или ее фрагментом,
(vi) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 34 или ее фрагментом, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 38 или ее фрагментом,
(vii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 34 или ее фрагментом, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 41 или ее фрагментом,
(viii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 34 или ее фрагментом, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 42 или ее фрагментом,
(ix) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 34 или ее фрагментом, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 43 или ее фрагментом.
Особенно предпочтительным является антитело согласно (v).
В соответствии с изобретением термин «фрагмент» относится, в частности, к одной или нескольким областям, определяющим комплементарность (CDR), предпочтительно, по меньшей мере, к вариабельной области CDR3 вариабельной области тяжелой цепи (VH) и/или вариабельной области легкой цепи (VL). В одном воплощении указанная одна или несколько областей, определяющих комплементарность (CDR), выбираются из набора областей, определяющих комплементарность CDR1, CDR2 и CDR3. В особенно предпочтительном воплощении термин «фрагмент» относится к областям, определяющим комплементарность CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи (VH) и/или вариабельной области легкой цепи (VL).
В предпочтительном воплощении антитело, обладающее способностью связываться с CLDN18.2, содержит VH, содержащий набор областей, определяющих комплементарность CDR1, CDR2 и CDR3, выбранных из следующих вариантов (i)-(vi):
(i) CDR1: положения 45-52 SEQ ID NO: 14, CDR2: положения 70-77 SEQ ID NO: 14, CDR3: положения 116-125 SEQ ID NO: 14,
(ii) CDR1: положения 45-52 SEQ ID NO: 15, CDR2: положения 70-77 SEQ ID NO: 15, CDR3: положения 116-126 SEQ ID NO: 15,
(iii) CDR1: положения 45-52 SEQ ID NO: 16, CDR2: положения 70-77 SEQ ID NO: 16, CDR3: положения 116-124 SEQ ID NO: 16,
(iv) CDR1: положения 45-52 SEQ ID NO: 17, CDR2: положения 70-77 SEQ ID NO: 17, CDR3: положения 116-126 SEQ ID NO: 17,
(v) CDR1: положения 44-51 SEQ ID NO: 18, CDR2: положения 69-76 SEQ ID NO: 18, CDR3: положения 115-125 SEQ ID NO: 18 и
(vi) CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19.
В предпочтительном воплощении антитело, имеющее способность связываться с CLDN18.2, включает VL, содержащий набор областей, определяющих комплементарность CDR1, CDR2 и CDR3, выбранных из следующих воплощений (i)-(ix):
(i) CDR1: положения 47-58 SEQ ID NO: 20, CDR2: положения 76-78 SEQ ID NO: 20, CDR3: положения 115-123 SEQ ID NO: 20,
(ii) CDR1: положения 49-53 SEQ ID NO: 21, CDR2: положения 71-73 SEQ ID NO: 21, CDR3: положения 110-118 SEQ ID NO: 21,
(iii) CDR1: положения 47-52 SEQ ID NO: 22, CDR2: положения 70-72 SEQ ID NO: 22, CDR3: положения 109-117 SEQ ID NO: 22,
(iv) CDR1: положения 47-58 SEQ ID NO: 23, CDR2: положения 76-78 SEQ ID NO: 23, CDR3: положения 115-123 SEQ ID NO: 23,
(v) CDR1: положения 47-58 SEQ ID NO: 24, CDR2: положения 76-78 SEQ ID NO: 24, CDR3: положения 115-123 SEQ ID NO: 24,
(vi) CDR1: положения 47-58 SEQ ID NO: 25, CDR2: положения 76-78 SEQ ID NO: 25, CDR3: положения 115-122 SEQ ID NO: 25,
(vii) CDR1: положения 47-58 SEQ ID NO: 26, CDR2: положения 76-78 SEQ ID NO: 26, CDR3: положения 115-123 SEQ ID NO: 26,
(viii) CDR1: положения 47-58 SEQ ID NO: 27, CDR2: положения 76-78 SEQ ID NO: 27, CDR3: положения 115-123 SEQ ID NO: 27 и
(ix) CDR1: положения 47-52 SEQ ID NO: 28, CDR2: положения 70-72 SEQ ID NO: 28, CDR3: положения 109-117 SEQ ID NO: 28.
В предпочтительном воплощении антитело, обладающее способностью связываться с CLDN18.2, содержит комбинацию VH и VL, каждая из которых содержит набор областей, определяющих комплементарность CDR1, CDR2 и CDR3, выбранных из следующих воплощений (i)-(ix):
(i) VH: CDR1: положения 45-52 SEQ ID NO: 14, CDR2: положения 70-77 SEQ ID NO: 14, CDR3: положения 116-125 SEQ ID NO: 14, VL: CDR1: положения 49 -53 SEQ ID NO: 21, CDR2: положения 71-73 SEQ ID NO: 21, CDR3: положения 110-118 SEQ ID NO: 21,
(ii) VH: CDR1: положения 45-52 SEQ ID NO: 15, CDR2: положения 70-77 SEQ ID NO: 15, CDR3: положения 116-126 SEQ ID NO: 15, VL: CDR1: положения 47 -58 SEQ ID NO: 20, CDR2: положения 76-78 SEQ ID NO: 20, CDR3: положения 115-123 SEQ ID NO: 20,
(iii) VH: CDR1: положения 45-52 SEQ ID NO: 16, CDR2: положения 70-77 SEQ ID NO: 16, CDR3: положения 116-124 SEQ ID NO: 16, VL: CDR1: положения 47 -52 SEQ ID NO: 22, CDR2: положения 70-72 SEQ ID NO: 22, CDR3: положения 109-117 SEQ ID NO: 22,
(iv) VH: CDR1: положения 44-51 SEQ ID NO: 18, CDR2: положения 69-76 SEQ ID NO: 18, CDR3: положения 115-125 SEQ ID NO: 18, VL: CDR1: положения 47 -58 SEQ ID NO: 25, CDR2: положения 76-78 SEQ ID NO: 25, CDR3: положения 115-122 SEQ ID NO: 25,
(v) VH: CDR1: положения 45-52 SEQ ID NO: 17, CDR2: положения 70-77 SEQ ID NO: 17, CDR3: положения 116-126 SEQ ID NO: 17, VL: CDR1: положения 47 -58 SEQ ID NO: 24, CDR2: положения 76-78 SEQ ID NO: 24, CDR3: положения 115-123 SEQ ID NO: 24,
(vi) VH: CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19, VL: CDR1: положения 47 -58 SEQ ID NO: 23, CDR2: положения 76-78 SEQ ID NO: 23, CDR3: положения 115-123 SEQ ID NO: 23,
(vii) VH: CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19, VL: CDR1: положения 47 -58 SEQ ID NO: 26, CDR2: положения 76-78 SEQ ID NO: 26, CDR3: положения 115-123 SEQ ID NO: 26,
(viii) VH: CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19, VL: CDR1: положения 47 -58 SEQ ID NO: 27, CDR2: положения 76-78 SEQ ID NO: 27, CDR3: положения 115-123 SEQ ID NO: 27 и
(ix) VH: CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19, VL: CDR1: положения 47 -52 SEQ ID NO: 28, CDR2: положения 70-72 SEQ ID NO: 28, CDR3: положения 109-117 SEQ ID NO: 28.
В других предпочтительных воплощениях антитело, обладающее способностью связываться с CLDN18.2, предпочтительно включает одну или несколько областей, определяющих комплементарность (CDR), предпочтительно, по меньшей мере, вариабельную область CDR3 вариабельной области тяжелой цепи (VH) и/или вариабельной области легкой цепи (VL) моноклонального антитела против CLDN18.2, предпочтительно моноклонального антитела против CLDN18.2, описанного в данном документе, и предпочтительно содержит одну или несколько областей, определяющих комплементарность (CDR), предпочтительно, по меньшей мере, вариабельную область CDR3 вариабельных областей тяжелой цепи (VH) и/или вариабельных областей легкой цепи (VL), описанных в данном документе. В одном воплощении упомянутая одна или несколько областей, определяющих комплементарность (CDR), выбираются из набора областей, определяющих комплементарность CDR1, CDR2 и CDR3, описанных в данном документе. В особенно предпочтительном воплощении антитело, обладающее способностью связываться с CLDN18.2, предпочтительно содержит области CDR1, CDR2 и CDR3 комплементарности вариабельной области тяжелой цепи (VH) и/или вариабельной области легкой цепи (VL) моноклонального антитела против CLDN18.2, предпочтительно моноклонального антитела против CLDN18.2, описанного в данном документе, и предпочтительно содержит области комплементарности CDR1, CDR2 и CDR3 вариабельных областей тяжелой цепи (VH) и/или вариабельных областей легкой цепи (VL), описанных в данном документе.
В одном воплощении антитело, содержащее один или несколько CDR, набор CDR или комбинацию наборов CDR, как описано в данном документе, содержит упомянутые CDR вместе с их промежуточными каркасными областями. Предпочтительно, эта часть также будет включать, по меньшей мере, около 50% одной или обеих из первой и четвертой каркасных областей, причем 50% являются С-концевой 50% первой каркасной области и N-концевой 50% четвертой каркасной области. Конструирование антител, полученных методами рекомбинантной ДНК, может привести к введению остатков N- или С-концов в вариабельные области, кодируемые линкерами, введенными для облегчения клонирования или других манипуляций, включая введение линкеров для присоединения вариабельных областей изобретения к дополнительные белковые последовательности, включая тяжелые цепи иммуноглобулина, другие вариабельные домены (например, при производстве диател) или белковые метки.
В одном воплощении антитело, содержащее один или несколько CDR, набор CDR или комбинацию наборов CDR, как описано в данном документе, содержит указанные CDR в каркасе человеческого антитела.
Ссылка в данном документе на антитело, содержащее по отношению к его тяжелой цепи конкретную цепь или конкретную область или последовательность, предпочтительно относится к ситуации, когда все тяжелые цепи указанного антитела содержат указанную конкретную цепь, область или последовательность. Это применимо, соответственно, к легкой цепи антитела.
Следует понимать, что описанные в данном документе антитела могут быть доставлены пациенту путем введения нуклеиновой кислоты, такой как РНК, кодирующая антитело, и/или путем введения клетки-хозяина, содержащей нуклеиновую кислоту, такую как РНК, кодирующую антитело. Таким образом, нуклеиновая кислота, кодирующая антитело при введении пациенту, может присутствовать в непокрытой форме или в подходящем носителе для доставки, например, в форме липосом или вирусных частиц, или внутри клетки-хозяина. Предоставляемая нуклеиновая кислота может продуцировать антитело в течение длительных периодов времени устойчивым образом, уменьшая нестабильность, по меньшей мере, частично, наблюдаемую для терапевтических антител. Нуклеиновые кислоты, которые должны быть доставлены пациенту, могут быть получены рекомбинантными средствами. Если нуклеиновую кислоту вводят пациенту без присутствия в клетке-хозяине, то она предпочтительно захватывается клетками пациента для экспрессии антитела, кодируемого нуклеиновой кислотой. Если нуклеиновую кислоту вводят пациенту в клетке-хозяине, она предпочтительно экспрессируется клеткой-хозяином внутри пациента, с получением антитела, кодируемого нуклеиновой кислотой.
Используемый в данном документе термин «нуклеиновая кислота» предназначен для включения ДНК и РНК, таких как геномная ДНК, кДНК, мРНК, рекомбинантно продуцируемые и химически синтезированные молекулы. Нуклеиновая кислота может быть одноцепочечной или двухцепочечной. РНК включает транскрибированную in vitro РНК (IVT RNA) или синтетическую РНК.
Нуклеиновые кислоты могут быть включены в вектор. Используемый в данном документе термин «вектор» включает любые векторы, известные специалисту в данной области, включая плазмидные векторы, космидные векторы, фаговые векторы, такие как лямбда-фаг, вирусные векторы, такие как аденовирусные или бакуловирусные векторы, или векторы-искусственные хромосомы, такие как бактериальные искусственные хромосомы (BAC), дрожжевые искусственные хромосомы (YAC) или искусственные хромосомы P1 (PAC). Указанные векторы экспрессирующие, а также клонирующие векторы. Экспрессирующие векторы содержат плазмиды, а также вирусные векторы и обычно содержат искомую кодирующую последовательность и соответствующие последовательности ДНК, необходимые для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине (например, бактерии, дрожжах, растении, насекомом или млекопитающем) или в системах экспрессии in vitro. Клонирующие векторы обычно используются для обработки и амплификации определенного искомого фрагмента ДНК и могут не иметь функциональных последовательностей, необходимых для экспрессии искомых фрагментов ДНК.
В контексте настоящего изобретения термин «РНК» относится к молекуле, которая содержит рибонуклеотидные остатки и предпочтительно полностью или по существу состоит из рибонуклеотидных остатков. «Рибонуклеотид» относится к нуклеотиду с гидроксильной группой в 2'-положении β-D-рибофуранозильной группы. Термин включает двухцепочечную РНК, одноцепочечную РНК, выделенную РНК, такую как частично очищенная РНК, по существу очищенная РНК, синтетическая РНК, рекомбинантно продуцируемая РНК, а также модифицированная РНК, которая отличается от естественной РНК добавлением, делецией, замещением и/или заменой одного или нескольких нуклеотидов. Такие изменения могут включать добавление ненуклеотидного материала, например, к концу(концам) РНК или внутрь, например, в одном или нескольких нуклеотидах РНК. Нуклеотиды в молекулах РНК могут также содержать нестандартные нуклеотиды, такие как неприродные нуклеотиды или химически синтезированные нуклеотиды или дезоксинуклеотиды. Эти измененные РНК можно назвать аналогами или аналогами природной РНК.
Согласно настоящему изобретению термин «РНК» включает и предпочтительно относится к «мРНК», что означает «информационную РНК» и относится к «транскрипту», который может быть получен с использованием ДНК в качестве матрицы и который кодирует пептид или белок. мРНК обычно включает 5'-нетранслируемую область (5'-UTR), область кодирования белка или пептида и 3'-нетранслируемую область (3'-UTR). мРНК имеет ограниченный период полужизни в клетках и in vitro. Предпочтительно, мРНК получают путем транскрипции in vitro с использованием матрицы ДНК. В одном воплощении изобретения РНК получают путем транскрипции in vitro или химического синтеза. Методология транскрипции in vitro известна специалисту. Например, существует множество наборов транскрипции in vitro, имеющихся в продаже.
Чтобы увеличить экспрессию и/или стабильность РНК, используемой согласно настоящему изобретению, она может быть модифицирована, предпочтительно без изменения последовательности экспрессированного пептида или белка.
Термин «модификация» в контексте РНК, который используется согласно настоящему изобретению, включает любую модификацию РНК, которая в природе отсутствует в указанной РНК. Такая модифицированная РНК охватывает в данном документе термин «РНК».
Например, РНК согласно изобретению может иметь модифицированные природные или синтетические рибонуклеотиды, чтобы повысить ее стабильность и/или уменьшить цитотоксичность. Например, в одном воплощении в РНК, используемой согласно изобретению, 5-метилцитидин замещен частично или полностью, предпочтительно полностью, для цитидина. Альтернативно или дополнительно в одном воплощении в РНК, используемой согласно изобретению, псевдоуридин замещает частично или полностью, предпочтительно полностью, уридин.
В одном воплощении термин «модификация» относится к обеспечению РНК структурой 5'-кэп или аналогом 5'-кэп структуры. Термин «5'-кэп» относится к кэп-структуре, обнаруживаемой на 5'-конце молекулы мРНК, и обычно состоит из нуклеотида гуанозина, связанного с мРНК, посредством необычной 5'-5'-трифосфатной связи. В одном воплощении этот гуанозин метилирован в 7-положении. Термин «традиционный 5'-кэп» относится к природной 5'-кэп РНК, предпочтительно к кэпу из 7-метилгуанозина (m7G). В контексте настоящего изобретения термин «5'-кэп» включает аналог 5'-кэп, который напоминает структуру РНК-кэп и модифицирован для того, чтобы была способность стабилизировать РНК, при присоединении к ней, предпочтительно in vivo и/или в клетке.
Предпочтительно, чтобы РНК, если она доставляется, т.е. трансфицируется в клетку, в частности клетку, присутствующую in vivo, экспрессировала белок или пептид, который она кодирует.
Термин «трансфекция» относится к введению нуклеиновых кислот, конкретно РНК, в клетку. Для целей настоящего изобретения термин «трансфекция» также включает введение нуклеиновой кислоты в клетку или поглощение нуклеиновой кислоты такой клеткой, в которой клетка может присутствовать у объекта, например пациента. Таким образом, согласно настоящему изобретению клетка для трансфекции нуклеиновой кислоты, описанная в данном документе, может присутствовать in vitro или in vivo, например, клетка может составлять часть органа, ткани и/или организма пациента. Согласно изобретению трансфекция может быть транзиторной или стабильной. Для некоторых применений трансфекции достаточно, чтобы трансфецированный генетический материал был экспрессирован лишь транзиторно. Так как нуклеиновая кислота, вводимая в процесс трансфекции, обычно не интегрируется в ядерный геном, то чужеродная нуклеиновая кислота будет разведена в ходе митоза или деградирована. Клетки, допускающие эписомную амплификацию нуклеиновых кислот, значительно снижают степень разведения. Если желательно, чтобы трансфецированная нуклеиновая кислота фактически оставалась в геноме клетки и в ее дочерних клетках, то должна иметь место стабильная трансфекция. РНК может быть трансфецирована в клетки для транзиторной экспрессии кодируемого белка.
Термин «стабильность» РНК относится к «периоду полужизни» РНК. «Период полужизни» относится к периоду времени, который необходим для устранения половины активности, количества или количества молекул. В контексте настоящего изобретения период полужизни РНК является показателем стабильности указанной РНК. Период полужизни РНК может влиять на «продолжительность экспрессии» РНК. Можно ожидать, что РНК, имеющая длительный период полужизни, будет экспрессироваться в течение длительного периода времени.
В контексте настоящего изобретения термин «транскрипция» относится к процессу, в котором генетический код в последовательности ДНК транскрибируется в РНК. Впоследствии РНК может быть транслирована в белок. Согласно настоящему изобретению термин «транскрипция» включает «транскрипцию in vitro», где термин «транскрипция in vitro» относится к способу, в котором РНК, конкретно, мРНК, синтезируется in vitro в бесклеточной системе, предпочтительно, с использованием подходящих клеточных экстрактов. Предпочтительно векторы клонирования применяются для генерации транскриптов. Эти векторы клонирования обычно обозначаются как векторы транскрипции и согласно настоящему изобретению охватываются термином «вектор».
Термин «трансляция» согласно изобретению относится к процессу в рибосомах клетки, посредством которого цепь матричной РНК направляет сборку последовательности аминокислот с получением пептида или белка.
Термин «экспрессия» используется согласно изобретению в его наиболее общем значении и включает продуцирование РНК и/или пептидов или белков, например, путем транскрипции и/или трансляции. Что касается РНК, то термин «экспрессия» или «трансляция» относится, в частности, к образованию пептидов или белков. Он также включает частичную экспрессию нуклеиновых кислот. Более того, экспрессия может быть транзиторной или стабильной. Согласно изобретению термин экспрессия также включает «аберрантную экспрессию» или «аномальную экспрессию».
«Аберрантная экспрессия» или «аномальная экспрессия» означает согласно изобретению, что экспрессия изменяется, предпочтительно повышается, по сравнению с эталонной, например, при состоянии объекта, не имеющего заболевания, связанного с аберрантной или аномальной экспрессией определенного белка, например, опухолевого антигена. Повышение экспрессии относится к повышению, по меньшей мере, на 10%, конкретно, по меньшей мере, на 20%, по меньшей мере, на 50% или, по меньшей мере, на 100% или более. В одном воплощении экспрессия обнаруживается только в пораженной ткани, тогда как экспрессия в здоровой ткани репрессируется.
Термин «специфично экспрессированный» означает, что белок по существу экспрессируется только в определенной ткани или органе. Например, опухолевый антиген, специфично экспрессированный в слизистой оболочке желудка, означает, что указанный белок в основном экспрессируется в слизистой оболочке желудка и не экспрессируется в других тканях или не экспрессируется в значительной степени в других тканях или органах. Таким образом, белок, который экспрессируется исключительно в клетках слизистой оболочки желудка и в значительно меньшей степени в любой другой ткани, такой как яичко, будет специфично экспрессироваться в клетках слизистой оболочки желудка. В некоторых воплощениях опухолевый антиген может быть также специфично экспрессирован в нормальных условиях более чем в одном типе ткани или органе, как например, в 2 или 3 типах тканей или органов, но предпочтительно не более чем в 3 разных типах тканей или органов. В этом случае опухолевый антиген затем специфично экспрессируется в этих органах. Например, если опухолевый антиген экспрессируется в нормальных условиях, предпочтительно примерно в равной степени в легких и желудке, то указанный опухолевый антиген специфически экспрессируется в легких и желудке.
Согласно изобретению термин «РНК, кодирующая» означает, что РНК, если она присутствует в соответствующей среде, предпочтительно внутри клетки, может быть экспрессирована для получения белка или пептида, который она кодирует.
Некоторые аспекты изобретения основаны на адоптивном переносе клеток-хозяев, которые трансфецируются in vitro нуклеиновой кислотой, такой как РНК, кодирующая антитело, описанное в данном документе, и переносятся реципиентам, таким как пациенты, предпочтительно после ex vivo наработки, начиная от низко представленных предшественников до клинически значимых количеств клеток. Клетки-хозяева, используемые для лечения согласно изобретению, могут быть аутологичными, аллогенными или сингенными для подвергнутого лечению реципиента.
Термин «аутологичный» используется для описания всего, что происходит от одного и того же объекта. Например, «аутологичная трансплантация» относится к трансплантации ткани или органов, полученных от одного и того же объекта. Такие процедуры являются выгодными, поскольку они преодолевают иммунологический барьер, который в противном случае приводит к отторжению.
Термин «аллогенный» используется для описания всего, что происходит от разных особей одного и того же вида. Говорят, что два или более индивидуумов являются аллогенными по отношению друг к другу, когда гены в одном или нескольких локусах не идентичны.
Термин «сингенный» используется для описания всего, что происходит от индивидуумов или тканей, имеющих идентичные генотипы, т.е. идентичных близнецов или животных одного и того же инбредного штамма или их тканей.
Термин «гетерологичный» используется для описания того, что состоит из нескольких разных элементов. В качестве примера перенос костного мозга одного человека другому человеку представляет собой гетерологичную трансплантацию. Гетерологичный ген представляет собой ген, полученный из источника, отличного от объекта.
Термин «пептид» согласно изобретению включает олиго- и полипептиды и относится к веществам, содержащим два или более, предпочтительно 3 или более, предпочтительно 4 или более, предпочтительно 6 или более, предпочтительно 8 или более, предпочтительно 9 или более, предпочтительно 10 или более, предпочтительно 13 или более, предпочтительно еще 16, предпочтительно 21 или более и предпочтительно до 8, 10, 20, 30, 40 или 50, в частности 100 аминокислот, ковалентно соединенных пептидными связями. Термин «белок» относится к большим пептидам, предпочтительно к пептидам с более чем 100 аминокислотными остатками, но в целом термины «пептиды» и «белки» являются синонимами и используются в данном документе взаимозаменяемо.
Руководство, приведенное в данном документе в отношении конкретных аминокислотных последовательностей, например, представленных в списке последовательностей, должно быть истолковано так, что оно также относится к вариантам указанных конкретных последовательностей, приводя к получению последовательностей, которые функционально эквивалентны указанным конкретным последовательностям, например аминокислотные последовательности, обладающие свойствами, идентичными или сходными с характеристиками конкретных аминокислотных последовательностей.
Одним из важных свойств является сохранение связывания антитела с его мишенью или поддержание эффекторных функций антитела. Предпочтительно, последовательность, которая является вариантом по отношению к определенной последовательности, при заменен конкретной последовательности в антителе, сохраняет связывание указанного антитела с его мишенью и предпочтительно функции указанного антитела, описанные в данном документе, например, лизис, опосредованный CDC, или лизис, опосредованный ADCC.
Специалистам в данной области техники будет понятно, что, в частности, последовательности CDR, гипервариабельные и вариабельные области могут быть модифицированы без потери способности антитела связываться с его мишенью. Например, области CDR будут либо идентичными, либо высоко гомологичными областям антител, указанных в данном документе. Под «высоко гомологичным» подразумевается, что в CDR могут быть проведены замены в количестве от 1 до 5, предпочтительно от 1 до 4, например, от 1 до 3 или 1 или 2 замены. Кроме того, гипервариабельные и вариабельные области могут быть модифицированы так, чтобы они демонстрировали существенную гомологию с областями антител, конкретно раскрытых в данном документе.
Термин «вариант» согласно изобретению относится, в частности, к мутантам, вариантам сплайсинга, конформациям, изоформам, аллельным вариантам, видам и гомологам видов, в частности к тем, которые встречаются в природе. Аллельный вариант относится к изменению нормальной последовательности гена, значение которого часто неясно. Секвенирование полного гена часто идентифицирует многочисленные аллельные варианты для данного гена. Гомолог вида представляет собой нуклеиновую кислоту или аминокислотную последовательность вида другого происхождения, полученным из данной последовательности нуклеиновой кислоты или аминокислотной последовательности. Термин «вариант» должен охватывать любые посттрансляционно модифицированные варианты и конформационные варианты.
Для целей настоящего изобретения «варианты» аминокислотной последовательности включают варианты с аминокислотными вставками, варианты с добавлением аминокислот, варианты с делецией аминокислот и/или варианты с заменой аминокислот. Варианты делеции аминокислот, которые включают делецию на N-конце и/или С-конце белка, также называются N-концевыми и/или С-концевыми укороченными вариантами.
Варианты аминокислотных вставок включают вставки одной или двух или более аминокислот в конкретной аминокислотной последовательности. В случае вариантов аминокислотной последовательности, имеющих вставку, один или несколько аминокислотных остатков вводят в конкретный участок в аминокислотной последовательности, хотя также возможна случайная вставка с соответствующим скринингом полученного продукта.
Варианты добавления аминокислот включают амино- и/или карбокси-концевые слияния одной или нескольких аминокислот, например, 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислот.
Варианты аминокислотных делеций характеризуются удалением одной или нескольких аминокислот из последовательности, например, удаление 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислот. Делеции могут быть в любом положении белка.
Варианты аминокислот характеризуются, по меньшей мере, одним остатком в удаляемой последовательности и другим остатком, вставленным на его место. Предпочтение отдается модификациям, которые находятся в положениях аминокислотной последовательности, которые не консервативны между гомологичными белками или пептидами и/или заменам аминокислот на другие, обладающие сходными свойствами. Предпочтительно, аминокислотные замены в вариантах белка представляют собой консервативные аминокислотные замены, то есть замены одинаково заряженных или незаряженных аминокислот. Консервативная аминокислотная замена включает замену на одну из семейства аминокислот, которые родственны по их боковым цепям. Природные аминокислоты обычно делятся на четыре семейства: кислотные (аспартат, глутамат), основные (лизин, аргинин, гистидин), неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан) и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин) аминокислоты. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты.
Предпочтительно, степень сходства, предпочтительно идентичности между данной аминокислотной последовательностью и аминокислотной последовательностью, которая является вариантом указанной аминокислотной последовательности, будет составлять, по меньшей мере, около 60%, 65%, 70%, 80%, 81%, 82 %, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%. Степень сходства или идентичности дается предпочтительно для аминокислотной области, которая составляет, по меньшей мере, около 10%, по меньшей мере, около 20%, по меньшей мере, около 30%, по меньшей мере, около 40%, по меньшей мере, около 50%, по меньшей мере, около 60% %, по меньшей мере, около 70%, по меньшей мере, около 80%, по меньшей мере, около 90% или около 100% всей длины эталонной аминокислотной последовательности. Например, если эталонная аминокислотная последовательность состоит из 200 аминокислот, степень сходства или идентичности дается предпочтительно для, по меньшей мере, около 20, по меньшей мере, для около 40, по меньшей мере, для около 60, по меньшей мере, для около 80, по меньшей мере, для около 100, по меньшей мере, для около 120, по меньшей мере, для около 140, по меньшей мере, для около 160, по меньшей мере, для около 180 или для около 200 аминокислот, предпочтительно непрерывных аминокислот. В предпочтительных воплощениях степень сходства или идентичности дается для всей длины эталонной аминокислотной последовательности. Выравнивание для определения сходства последовательностей, предпочтительно идентичности последовательности, может быть выполнено с помощью известных инструментов, предпочтительно с использованием наилучшего выравнивания последовательностей, например, с использованием Align, с использованием стандартных настроек, предпочтительно EMBOSS :: needle, Матрица: Blosum62, штраф за открытие разрыва 10,0, штраф за удлинение разрыва 0,5.
«Сходство последовательностей» обозначает процент аминокислот, которые либо идентичны, либо представляют собой консервативные аминокислотные замены. «Идентификация последовательности» между двумя аминокислотными последовательностями обозначает процент аминокислот, которые идентичны между последовательностями.
Термин «процентная идентичность» предназначен для обозначения процента аминокислотных остатков, которые идентичны между двумя последовательностями, которые следует сравнить, полученного после наилучшего выравнивания, причем этот процент является чисто статистическим, а различия между двумя последовательностями распределяются случайным образом и по всей длине. Сравнения последовательностей между двумя аминокислотными последовательностями обычно выполняются путем сравнения этих последовательностей после их оптимального выравнивания, причем указанное сравнение проводят с помощью сегмента или «окна сравнения» для идентификации и сравнения локальных областей сходства последовательностей. Оптимальное выравнивание последовательностей для сравнения может быть получено, кроме того, вручную с помощью алгоритма локальной гомологии Smith and Waterman, 1981, Ads App. Math. 2, 482, с помощью локального алгоритма гомологии Neddleman and Wunsch, 1970, J. Mol. Biol. 48, 443, с помощью метода поиска подобия Pearson и Lipman, 1988, Proc. Natl. Acad. Sci. USA 85, 2444 или с помощью компьютерных программ, которые используют эти алгоритмы (GAP, BESTFIT, FASTA, BLAST P, BLAST N и TFASTA в программном пакете Wisconsin Genetics, Genetics Computer Group, 575 Science Drive, Мэдисон, штат Висконсин).
Процент идентичности вычисляется путем определения количества идентичных положений между двумя сравниваемыми последовательностями, деля это количество на количество сравниваемых положений и умножая полученный результат на 100, с получением процентного выражения идентичности между этими двумя последовательностями.
Термин «клетка» или «клетка-хозяин» предпочтительно относится к интактной клетке, то есть к клетке с интактной мембраной, которая не высвобождает ее нормальные внутриклеточные компоненты, такие как ферменты, органеллы или генетический материал. Интактная клетка предпочтительно представляет собой жизнеспособную клетку, то есть живую клетку, способную выполнять свои нормальные метаболические функции. Предпочтительно указанный термин относится в соответствии с изобретением к любой клетке, которая может быть трансфецирована экзогенной нуклеиновой кислотой. Предпочтительно клетка, трансфецированная экзогенной нуклеиновой кислотой и переносимая реципиенту, может экспрессировать нуклеиновую кислоту у реципиента. Термин «клетка» включает бактериальные клетки; другими полезными клетками являются дрожжевые клетки, грибные клетки или клетки млекопитающих. Подходящие бактериальные клетки включают клетки из грамотрицательных бактериальных штаммов, таких как штаммы Escherichia coli, Proteus и Pseudomonas, и грамположительные бактериальные штаммы, такие как штаммы Bacillus, Streptomyces, Staphylococcus и Lactococcus. Подходящие грибные клетки включают клетки из видов Trichoderma, Neurospora и Aspergillus. Подходящие дрожжевые клетки включают клетки из видов Saccharomyces (например, Saccharomyces cerevisiae), Schizosaccharomyces (например, Schizo saccharomyces pombe), Pichia (например, Pichia pastoris и Pichia methanolica) и Hansenula. Подходящие клетки млекопитающих включают, например, клетки СНО, клетки BHK, клетки HeLa, клетки COS, 293 HEK и тому подобное. Однако также можно использовать клетки амфибий, клетки насекомых, растительные клетки и любые другие клетки, используемые в данной области для экспрессии гетерологичных белков. Клетки млекопитающих особенно предпочтительны для адоптивного переноса, такие как клетки людей, мышей, хомяков, свиней, коз и приматов. Клетки могут быть получены из большого количества типов тканей и включают первичные клетки и клеточные линии, такие как клетки иммунной системы, в частности, антиген-презентирующие клетки, такие как дендритные клетки и Т-клетки, стволовые клетки, такие как гемопоэтические стволовые клетки и мезенхимальные стволовые клетки и другие типы клеток. Антиген-презентирующая клетка представляет собой клетку, которая презентирует антиген в контексте главного комплекса гистосовместимости на его поверхности. Т-клетки могут распознавать этот комплекс, используя их Т-клеточный рецептор (TCR).
Термин «трансгенное животное» относится к животному, имеющему геном, содержащий один или несколько трансгенов, предпочтительно трансгены тяжелой и/или легкой цепи, или трансхромосомы (либо интегрированные, либо неинтегрированные в естественную геномную ДНК животного) и которые предпочтительно способны экспрессировать трансгены. Например, трансгенная мышь может иметь трансген легкой цепи человека и либо трансген тяжелой цепи человека, либо трансхромосому тяжелой цепи человека, так что мышь продуцирует антитела против опухолевого антигена человека при иммунизации опухолевым антигеном и/или клетками, экспрессирующими опухолевый антиген. Трансген тяжелой цепи человека может быть интегрирован в хромосомную ДНК мыши, как это имеет место для трансгенных мышей, например мышей HuMAb, таких как мыши HCo7 или HCol2, или трансген тяжелой цепи человека может поддерживаться внехромосомно, как в случае трансхромосомных (например, KM) мышей, как описано в WO 02/43478. Такие трансгенные и трансхромосомные мыши могут быть способны продуцировать множественные изотипы человеческих моноклональных антител к опухолевому антигену (например, IgG, IgA и/или IgE) путем рекомбинации VDJ и переключения изотипа.
«Снизить», «уменьшить» или «ингибировать», при использовании в данном документе, означает общее уменьшение или способность вызвать общее уменьшение, предпочтительно на 5% или более, на 10% или более, на 20% или более, более предпочтительно на 50% или более и наиболее предпочтительно на 75% или более, уровня, например, уровня экспрессии или уровня пролиферации клеток.
Такие термины, как «увеличение» или «повышение», предпочтительно относятся к увеличению или повышению на около 10%, предпочтительно, по меньшей мере, на 20%, предпочтительно, по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 50%, еще более предпочтительно, по меньшей мере, на 80% и наиболее предпочтительно, по меньшей мере, на 100%, по меньшей мере, на 200%, по меньшей мере, на 500%, по меньшей мере, на 1000%, по меньшей мере, на 10000% или даже более.
Антитела, описанные в данном документе, могут быть получены различными способами, включая обычную методологию моноклональных антител, например, стандартную методику гибридизации соматических клеток Kohler and Milstein, Nature 256: 495 (1975). Хотя предпочтительны процедуры гибридизации соматических клеток, в принципе могут быть использованы другие способы получения моноклональных антител, например, вирусная или онкогенная трансформация B-лимфоцитов или методы фагового дисплея с использованием библиотек генов антител.
Предпочтительной животной системой для продуцирования гибридом, которые секретируют моноклональные антитела, является мышиная система. Продуцирование гибридомы в мышах - очень хорошо зарекомендовавшая себя процедура. Протоколы иммунизации и способы выделения иммунизированных спленоцитов для слияния известны в данной области. Также известны партнеры по слиянию (например, мышиные клетки миеломы) и процедуры слияния.
Другими предпочтительными животными системами для получения гибридом, которые секретируют моноклональные антитела, являются крысиная и кроличья система (например, описанная в Spieker-Polet et al., Proc. Natl. Acad. Sci. U.S.A. 92:9348 (1995), см. также Rossi et al., Am. J. Clin. Pathol. 124: 295 (2005)).
В еще одном предпочтительном воплощении человеческие моноклональные антитела могут быть получены с использованием трансгенных или трансхромосомных мышей, несущих части иммунной системы человека, а не системы мыши. Эти трансгенные и трансхромосомные мыши включают мышей, известных как мышей HuMAb и мышей KM, соответственно, и в совокупности упоминаются в данном документе как «трансгенные мыши». Получение человеческих антител в таких трансгенных мышах может быть выполнено, как подробно описано для CD20 в WO2004 035607 .
Еще одна стратегия получения моноклональных антител заключается в прямом выделении генов, кодирующих антитела из лимфоцитов, продуцирующих антитела определенной специфичности, например, см. Babcock et al., 1996; Новая стратегия получения моноклональных антител из одиночных выделенных лимфоцитов, продуцирующих антитела определенных специфичностей. Подробные сведения о разработке рекомбинантных антител см. также в Welschof and Kraus, Recombinant antibodes for cancer therapy ISBN-0-89603-918-8 и Benny K.C. Lo Antibody Engineering ISBN 1-58829-092-1.
Для получения антител мыши могут быть иммунизированы конъюгированными с носителем пептидами, полученными из последовательности антигена, то есть последовательности, против которой должны быть направлены антитела обогащенного препарата рекомбинантно экспрессированного антигена или его фрагментов и/или клеток, экспрессирующих антиген, как описано. В ином случае, мыши могут быть иммунизированы с помощью ДНК, кодирующей антиген или его фрагменты. В том случае, если иммунизация с использованием очищенного или обогащенного препарата антигена не приводит к получению антител, мышей также можно иммунизировать клетками, экспрессирующими антиген, например клеточной линией, для стимулирования иммунных реакций.
Иммунный ответ можно контролировать в течение курса иммунизации с помощью образцов плазмы и сыворотки, получаемых из хвостовой вены или ретроорбитальными кровопусканиями. Мыши с достаточным титром иммуноглобулина могут быть использованы для слияния. Мышей можно стимулировать внутрибрюшинно или внутривенно с помощью клеток, экспрессирующих антиген, за 3 дня до умерщвления и удаления селезенки, чтобы увеличить процент гибридом, секретирующих специфические антитела.
Для получения гибридом, продуцирующих моноклональные антитела, спленоциты и клетки лимфатических узлов могут быть выделены из иммунизированных мышей и слиты с соответствующей иммортализованной клеточной линией, такой как клеточная линия мышиной миеломы. Полученные гибридомы затем могут быть подвергнуты скринингу для получения антигенспецифических антител. Затем индивидуальные лунки можно подвергать скринингу с помощью ИФА на предмет гибридом, секретирующих антитела. При анализе иммунофлуоресценции и FACS с использованием клеток, экспрессирующих антиген, можно идентифицировать антитела со специфичностью к антигену. Гибридомы, секретирующие антитела, могут быть реплицированы, снова подвергнуты скринингу и, если они еще положительны по моноклональным антителам, то могут быть субклонированы методом предельных разведений. Затем стабильные субклоны можно культивировать in vitro для получения антител в тканевой культуральной среде для характеризации.
Антитела также могут быть получены в трансфектоме клетки-хозяина, используя, например, комбинацию методов рекомбинантной ДНК и методов трансфекции генов, которые хорошо известны в данной области (Morrison, S. (1985) Science 229: 1202).
Например, в одном воплощении представляющий интерес ген (гены), например гены антитела, можно лигировать в экспрессирующий вектор, такой как эукариотическая экспрессирующая плазмида, такая как используемая системой экспрессии гена GS, раскрытая в WO 87/04462, WO 89/01036 и ЕР 338 841 или другие системы экспрессии, хорошо известные в данной области. Очищенную плазмиду с клонированными генами антитела можно вводить в эукариотические клетки-хозяева, такие как клетки СНО, NS/0 клетки, клетки HEK293T или клетки HEK293 или, альтернативно, другие эукариотические клетки, такие как клетки, полученные из растений, грибные или дрожжевые клетки. Способ, используемый для введения этих генов, может быть способом, описанным в данной области, таким как электропорация, использование липофектина, липофектамина или другим. После введения этих генов антител в клетки-хозяева, клетки, экспрессирующие антитело, могут быть идентифицированы и отобраны. Эти клетки представляют собой трансфектомы, которые затем могут быть амплифицированы для их уровня экспрессии и наработаны для получения антител. Рекомбинантные антитела можно выделить и очистить из этих культуральных надосадочных жидкостей и/или клеток.
В ином случае, клонированные гены антитела могут быть экспрессированы в других экспрессирующих системах, включая прокариотические клетки, такие как микроорганизмы, например E. coli. Кроме того, антитела могут быть получены в трансгенных животных, не относящихся к человеку, например, в молоке овец и кроликов или в яйцах кур или в трансгенных растениях; См., например, Verma, R., et al. (1998) J. Immunol. Meth. 216: 165-181; Pollock, et al. (1999) J. Immunol. Meth. 231: 147-157; and Fischer, R., et al. (1999) Biol. Chem. 380: 825-839.
Химеризация
Мышиные антитела являются высокоиммуногенными у человека при повторном применении, что приводит к снижению терапевтического эффекта. Основная иммуногенность опосредована константными областями тяжелой цепи. Иммуногенность мышиных антител у человека может быть уменьшена или полностью исключена, если соответствующие антитела подвергаются химеризации или гуманизации. Химерные антитела представляют собой антитела, различные части которых получены из разных видов животных, например, которые имеют вариабельную область, полученную из мышиного антитела, и константные области иммуноглобулина человека. Химеризация антител достигается путем соединения вариабельных областей тяжелой и легкой цепи мышиного антитела с константной областью тяжелой и легкой цепи человека (например, как описано Kraus et al., in Methods in Molecular Biology series, Recombinant antibodies for cancer therapy ISBN-0-89603-918-8). В предпочтительном воплощении химерные антитела образуются путем соединения константной области легкой цепи каппа человека с вариабельной областью легкой цепи мыши. В также предпочтительном воплощении химерные антитела могут быть получены путем соединения константной области цепи легкой цепи лямбда человека с вариабельной областью легкой цепи мыши. Предпочтительными константными областями тяжелой цепи для получения химерных антител являются IgG1, IgG3 и IgG4. Другими предпочтительными константными областями тяжелой цепи для получения химерных антител являются IgG2, IgA, IgD и IgM.
Гуманизация
Антитела взаимодействуют с целевыми антигенами преимущественно через аминокислотные остатки, которые расположены в шести областях, определяющих комплементарность, тяжелой и легкой цепей (CDR). По этой причине аминокислотные последовательности внутри CDR более разнообразны между индивидуальными антителами, чем последовательности вне CDR. Поскольку последовательности CDR отвечают за большинство взаимодействий антитело-антиген, можно экспрессировать рекомбинантные антитела, которые имитируют свойства специфических встречающихся в природе антител, путем конструирования экспрессирующих векторов, которые включают CDR-последовательности из специфического встречающегося в природе антитела, привитого на каркасные последовательности из другого антитела с другими свойствами (см., например, Riechmann, L. et al. (1998) Nature 332: 323-327; Jones, P. et al. (1986) Nature 321: 522-525; и Queen, C. et al. (1989) Proc. Natl. Acad. Sci. U. S. A. 86: 10029-10033). Такие каркасные последовательности могут быть получены из общедоступных баз данных ДНК, которые включают в себя зародышевые последовательности генов антител. Эти зародышевые последовательности будут отличаться от последовательностей генов зрелого антитела, поскольку они не будут включать полностью собранные вариабельные гены, которые образуются путем соединения V (D) J во время созревания В-клеток. Зародышевые генные последовательности также будут отличаться от последовательностей высокоаффинных антител вторичного репертуара при индивидуальном равномерном распределении по вариабельной области.
Способность антител связывать антиген может быть определена с использованием стандартных анализов связывания (например, ИФА, Вестерн-блот, иммунофлуоресценция и проточный цитометрический анализ).
Для очистки антител выбранные гибридомы можно выращивать в двухлитровых вращающихся колбах для очистки моноклональных антител. В ином случае, антитела могут быть получены в биореакторах на основе диализа. Надосадочные жидкости могут быть отфильтрованы и, при необходимости, сконцентрированы перед аффинной хроматографией на сефарозе с протеином G или на сефарозе с протеином А. Элюированный IgG можно проверить с помощью гель-электрофореза и высокоэффективной жидкостной хроматографии для обеспечения чистоты. Буферный раствор можно заменить на PBS, и концентрацию можно определить с помощью OD280 с использованием коэффициента поглощения 1,43. Моноклональные антитела можно разделить на аликвоты и хранить при -80°С.
Для того, чтобы определить, могут ли выбранные моноклональные антитела связываться с уникальными эпитопами, можно использовать сайт-направленный или мультисайт-направленный мутагенез.
Для определения изотипа антител могут быть выполнены изотипные ИФА с различными коммерческими наборами (например, Zymed, Roche Diagnostics). Лунки микропланшетов могут быть покрыты Ig к мышиному белку. После блокировки планшеты реагируют с моноклональными антителами или очищенными изотипическими контролями при температуре окружающей среды в течение двух часов. Затем содержимое лунок может реагировать с IgG1, IgG2a, IgG2b или IgG3, IgA или с мышиными IgM-специфическими конъюгированными с пероксидазой зондами. После промывки планшеты могут быть проявлены с субстратом ABTS (1 мг/мл) и проанализированы при OD 405-650. В качестве альтернативы, может быть использован набор изотипирования мышиных моноклональных антител IsoStrip (Roche, кат. № 1493027), как описано изготовителем.
Чтобы продемонстрировать присутствие антител в сыворотке иммунизированных мышей или связывание моноклональных антител с живыми клетками, экспрессирующими антиген, можно использовать проточную цитометрию. Клеточные линии, экспрессирующие естественно или после трансфекции антиген, и отрицательные контроли, лишенные экспрессии антигена (выращенные в стандартных ростовых условиях), могут смешиваться с различными концентрациями моноклональных антител в надосадочных жидкостях гибридомы или в PBS, содержащем 1% FBS, и их можно инкубировать при 4°С в течение 30 минут. После промывания APC- или Alexa647-меченное антитело к IgG может связываться с антигенсвязанным моноклональным антителом в тех же условиях, что и условия окрашивания первичных антител. Образцы могут быть проанализированы с помощью проточной цитометрии с помощью прибора FACS с использованием свойств света и бокового рассеяния с пропусканием одиночных живых клеток. Чтобы отличить антигенспецифические моноклональные антитела от неспецифических связующих компонентов при единичном измерении, можно использовать способ котрансфекции. Клетки, транзиторно трансфецированные плазмидами, кодирующими антиген и флуоресцентный маркер, могут быть окрашены, как описано выше. Трансфицированные клетки могут быть обнаружены в другом канале флуоресценции, чем клетки, окрашенные антителами. Поскольку большинство трансфецированных клеток экспрессируют оба трансгена, антигенспецифические моноклональные антитела связываются преимущественно с клетками, экспрессирующими маркер флуоресценции, тогда как неспецифические антитела связываются в сопоставимом соотношении с нетрансфецированными клетками. Альтернативный анализ с использованием флуоресцентной микроскопии может быть использован в дополнение или вместо анализа проточной цитометрии. Клетки могут быть окрашены точно так, как описано выше, и исследованы с помощью флуоресцентной микроскопии.
Чтобы продемонстрировать присутствие антител в сыворотке иммунизированных мышей или связывание моноклональных антител с живыми клетками, экспрессирующими антиген, можно использовать анализ иммунофлуоресцентной микроскопии. Например, клеточные линии, экспрессирующие либо спонтанно, либо после трансфекции антиген и отрицательные контрольные образцы, лишенные экспрессии антигена, выращивают в камерных слайдах при стандартных условиях роста в среде DMEM/F12, дополненной 10% фетальной телячьей сывороткой (FCS), 2 мМ L-глутамином, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина. Затем клетки могут быть зафиксированы метанолом или параформальдегидом или оставлены необработанными. Затем клетки могут вступать в реакцию с моноклональными антителами против антигена в течение 30 мин. при 25°С. После промывания клетки могут вступать в реакцию с Alexa555-меченным антителом против мышиного IgG (Molecular Probes) в тех же условиях. Затем клетки могут быть исследованы с помощью флуоресцентной микроскопии.
Клеточные экстракты из клеток, экспрессирующих антиген, и соответствующие отрицательные контрольные образцы, могут быть получены и подвергнуты электрофорезу в полиакриламидном геле с додецилсульфатом натрия (SDS). После электрофореза разделенные антигены переносят на нитроцеллюлозные мембраны, блокируют и исследуют моноклональные антитела, подлежащие тестированию. Связывание IgG может быть детектировано с использованием пероксидазы IgG против мышиного белка и проявлено с помощью ECL-субстрата.
Антитела могут быть дополнительно протестированы на реакционную способность с антигеном методом иммуногистохимии, хорошо известным специалисту, например, с использованием фиксированных криосрезов параформальдегида или ацетона или залитых парафином срезов, закрепленных параформальдегидом, из образцов неопухолевой ткани или опухолевой ткани, полученных от пациентов во время обычной хирургической процедуры, или от мышей, несущих ксенотрансформированные опухоли, инокулированные клеточными линиями, экспрессирующими антиген спонтанно или после трансфекции .Для иммуноокрашивания антитела, реакционноспособные к антигену, могут быть затем инкубированы с козьими антимышиными антителами или козьими антикроличьими антителами, конъюгированными с пероксидазой хрена (DAKO), в соответствии с инструкциями поставщика.
Антитела могут быть протестированы на их способность опосредовать фагоцитоз и уничтожение клеток, экспрессирующих опухолевый антиген. Тестирование активности моноклональных антител in vitro обеспечит первоначальный скрининг перед тестированием моделей in vivo.
Антителозависимая клеточно-опосредованная цитотоксичность (ADCC)
Вкратце, полиморфноядерные клетки (PMN), NK-клетки, моноциты, мононуклеарные клетки или другие эффекторные клетки от здоровых доноров могут быть очищены центрифугированием в плотности Ficoll Hypaque с последующим лизисом контаминирующих эритроцитов. Промытые эффекторные клетки можно суспендировать в RPMI, дополненной 10% инактивированной нагреванием фетальной телячьей сывороткой, или, в ином случае, с 5% инактивированной человеческой сывороткой и смешивать с клетками-мишенями меченными 51Cr, экспрессирующими опухолевый антиген, при различных соотношениях эффекторных клеток и клеток-мишеней. В ином случае, клетки-мишени могут быть помечены лигандом, усиливающим флуоресценцию (BATDA). Высоко флуоресцентный хелат европия с усиливающим лигандом, который высвобождается из мертвых клеток, может быть измерен флуорометром. Другой альтернативный метод может использовать трансфекцию клеток-мишеней с люциферазой. Добавленный люцифер желтый может затем окисляться только жизнеспособными клетками. Затем очищенные IgG против опухолевых антигенов могут быть добавлены в различных концентрациях. Посторонний человеческий IgG можно использовать в качестве отрицательного контроля. Анализы могут проводиться в течение 4-20 часов при 37 °C в зависимости от используемого типа эффекторных клеток. Образцы могут быть проанализированы для цитолиза путем измерения высвобождения 51Cr или присутствия хелата EuTDA в надосадочной жидкости культуры. В ином случае, люминесценция, возникающая в результате окисления люцифера желтого, может быть мерой жизнеспособных клеток.
Моноклональные антитела против опухолевого антигена также могут быть протестированы в различных комбинациях для определения того, усиливается ли цитолиз с использованием множества моноклональных антител.
Комплементарно-зависимая цитотоксичность (CDC)
Моноклональные антитела опухолевых антигенов можно тестировать на их способность опосредовать CDC с использованием множества известных способов. Например, сыворотка для комплемента может быть получена из крови способом, известным специалисту. Для определения активности CDC mAb могут быть использованы различные методы. Например, можно измерить высвобождение 51Cr, или повышенную мембранную проницаемость, используя анализ исключения пропидий йодида (PI). Вкратце, клетки-мишени можно промыть и 5×105/мл можно инкубировать с различными концентрациями mAb в течение 10-30 мин. При комнатной температуре или при 37°С. Затем сыворотку или плазму можно добавить до конечной концентрации 20% (об./об.), и клетки инкубировали при 37°С в течение 20-30 мин. Все клетки из каждого образца могут быть добавлены к раствору PI в пробирке FACS. Затем смесь может быть немедленно проанализирована с помощью анализа проточной цитометрии с использованием FACSArray.
В альтернативном анализе индукцию CDC можно определить на прикрепленных клетках. В одном из воплощений этого анализа клетки высевают за 24 часа до анализа с плотностью 3×104/на лунку в культуральные плоскодонные микропланшеты. На следующий день ростовую среду удаляют и клетки инкубируют в трех экземплярах с антителами. Контрольные клетки инкубируют с культуральной средой или ростовой средой, содержащей 0,2% сапонина, для определения фонового лизиса и максимального лизиса, соответственно. После инкубации в течение 20 мин при комнатной температуре надосадочную жидкость удаляют, и к клеткам добавляют 20% (об./об.) плазмы человека или сыворотки в DMEM (предварительно нагретой до 37°C) и инкубируют еще 20 мин при 37°С. Все клетки из каждого образца добавляют к раствору иодида пропидия (10 мкг/мл). Затем надосадочные жидкости заменяют PBS, содержащим 2,5 мкг/мл бромида этидия, и излучение флуоресценции при возбуждении при 520 нм измеряют при 600 нм с использованием Tecan Safire. Процент удельного лизиса рассчитывается следующим образом: процент специфического лизиса = (фон флуоресценции флуоресценции)/(флуоресцентный максимальный фон флуоресценции флуоресценции) × 100.
Индукция апоптоза и ингибирование клеточной пролиферации моноклональными антителами
Чтобы протестировать способность инициировать апоптоз, моноклональные антитела к опухолевым антигенам можно, например, инкубировать с опухолевыми клетками, положительными по опухолевым антигенам, или с опухолевыми клетками, трансфецированными опухолевым антигеном, при 37°С в течение примерно 20 часов. Клетки можно собирать, промывать в связывающем буфере для аннексина V (BD biosciences) и инкубировать с аннексином V, конъюгированным с FITC или APC (BD biosciences) в течение 15 мин в темноте. Все клетки из каждого образца могут быть добавлены к раствору PI (10 мкг/мл в PBS) в пробирку FACS и сразу же оценены проточной цитометрией (как указано выше). В ином случае, общее ингибирование клеточной пролиферации моноклональными антителами может быть обнаружено коммерчески доступными наборами. Набор для пролиферации клеток DELFIA (Perkin-Elmer, Кат. No. AD0200) представляет собой неизотопный иммуноанализ на основе измерения включения 5-бром-2'-дезоксиуридина (BrdU) во время синтеза ДНК пролиферирующих клеток в микропланшетах. Инкорпорированный BrdU детектируют с использованием моноклонального антитела, меченного европием. Чтобы обеспечить детектирование антител, клетки фиксируют и денатурируют ДНК с использованием раствора Fix. Несвязанное антитело смывают и добавляют индуктор DELFIA для диссоциации ионов европия из меченого антитела в раствор, где они образуют высоко флуоресцентные хелаты с компонентами индуктора DELFIA. Измеренная флуоресценция-использование флуорометрии с временным разрешением при детектировании-пропорционально синтезу ДНК в ячейке каждой лунки.
Доклинические исследования
Антитела, описанные в данном документе, также могут быть протестированы на модели in vivo (например, у иммунодефицитных мышей, несущих ксенотрансплантированные опухоли, инокулированные с использованием клеточных линий, экспрессирующих опухолевый антиген, для определения их эффективности в контроле роста опухолевых клеток, экспрессирующих опухолевый антиген.
Исследования in vivo после ксенотрансплантации опухолевых клеток, экспрессирующих опухолевый антиген, мышам с ослабленным иммунитетом или другим животным, могут быть выполнены с использованием описанных в данном документе антител. Антитела могут вводиться мышам без опухолей с последующей инъекцией опухолевых клеток для измерения эффектов антител по предотвращению образования опухолей или связанных с опухолями симптомов. Антитела могут вводиться мышам, несущим опухоль, для определения терапевтической эффективности соответствующих антител для снижения роста опухоли, метастазов или связанных с опухолями симптомов. Применение антител можно комбинировать с применением других веществ в качестве цистостатических лекарственных средств, ингибиторов факторов роста, блокаторов клеточного цикла, ингибиторов ангиогенеза или других антител для определения синергетической эффективности и потенциальной токсичности комбинаций. Для анализа токсических побочных эффектов, опосредованных антителами, животных можно инокулировать антителами или контрольными реагентами и тщательно исследовать на наличие симптомов, которые могут быть связаны с терапией опухолевым антигеном. Возможные побочные эффекты применения антител против опухолевых антигенов in vivo, в частности, включают токсичность в тканях, экспрессирующих опухолевые антигены. Антитела, распознающие опухолевый антиген у человека и других видов, например у мышей, особенно полезны для прогнозирования потенциальных побочных эффектов, опосредованных применением моноклональных антител к опухолевым антигенам у людей.
Картирование эпитопов, распознаваемых антителами, может быть выполнено, как подробно описано в "Epitope Mapping Protocols (Methods in Molecular Biology) by Glenn E. Morris ISBN-089603-375-9 и в "Epitope Mapping: A Practical Approach" Practical Approach Series, 248 by Olwyn M. R. Westwood, Frank C. Hay.
Соединения и агенты, описанные в данном документе, могут вводиться в форме любой подходящей фармацевтической композиции.
Фармацевтические композиции предпочтительно являются стерильными и содержат эффективное количество антител, описанных в данном документе, и необязательно дополнительных агентов, обсуждаемых в данном документе, для получения искомой реакции или искомого эффекта.
Фармацевтические композиции обычно предоставляются в единой лекарственной форме и могут быть приготовлены известным образом. Фармацевтическая композиция может быть, например, представлена в форме раствора или суспензии.
Фармацевтическая композиция может содержать соли, буферные вещества, консерванты, носители, разбавители и/или вспомогательные вещества, каждое из которых предпочтительно является фармацевтически приемлемым. Термин «фармацевтически приемлемый» относится к нетоксичности материала, который не взаимодействует с действием активного компонента фармацевтической композиции.
Соли, которые не являются фармацевтически приемлемыми, могут быть использованы для получения фармацевтически приемлемых солей и включены в изобретение. Фармацевтически приемлемые соли этого типа включают в себя неограниченно такие, которые получены из следующих кислот: соляной, бромистоводородной, серной, азотной, фосфорной, малеиновой, уксусной, салициловой, лимонной, муравьиной, малоновой, янтарной кислот и тому подобных. Фармацевтически приемлемые соли также могут быть получены в виде солей щелочных металлов или солей щелочноземельных металлов, таких как соли натрия, соли калия или соли кальция.
Подходящие буферные вещества для использования в фармацевтической композиции включают уксусную кислоту в соли, лимонную кислоту в соли, борную кислоту в соли и фосфорную кислоту в соли.
Подходящие консерванты для применения в фармацевтической композиции включают хлорид бензалкония, хлорбутанол, парабен и тимеросал.
Состав для инъекций может содержать фармацевтически приемлемое вспомогательное вещество, такое как лактат Рингера.
Термин «носитель» относится к органическому или неорганическому компоненту природного или синтетического характера, в котором активный компонент комбинирован для облегчения, усиления или возможности применения. Согласно изобретению термин «носитель» также включает один или несколько совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, которые подходят для введения пациенту.
Возможными веществами-носителями для парентерального введения являются, например, стерильная вода, раствор Рингера, Рингер-лактат, стерильный раствор хлорида натрия, полиалкиленгликоли, гидрированные нафталины и, в частности, биосовместимые лактидные полимеры, лактид-гликолидные сополимеры или полиоксиэтилен/полиоксипропиленовые сополимеры.
Используемый в данном документе термин «вспомогательное вещество» предназначен для обозначения всех веществ, которые могут присутствовать в фармацевтической композиции и которые не являются активными ингредиентами, такие как, например, носители, связующие, смазывающие вещества, загустители, поверхностно-активные агенты, консерванты, эмульгаторы, буферы, ароматизаторы или красители.
Агенты и композиции, описанные в данном документе, могут вводиться любым обычным способом, таким как парентеральное введение, в том числе путем инъекции или инфузии. Введение предпочтительно является парентеральным, например, внутривенным, внутриартериальным, подкожным, внутрикожным или внутримышечным.
Композиции, подходящие для парентерального введения, обычно содержат стерильный водный или неводный препарат активного соединения, которое предпочтительно является изотоническим по отношению к крови реципиента. Примерами совместимых носителей и растворителей являются раствор Рингера и изотонический раствор хлорида натрия. Кроме того, обычно в качестве раствора или суспензионной среды используются стерильные, жирные масла.
Агенты и композиции, описанные в данном документе, вводят в эффективных количествах. «Эффективное количество» относится к количеству, которое достигает искомой реакции или искомого эффекта индивидуально или вместе с дополнительными дозами. В случае лечения конкретного заболевания или конкретного состояния искомая реакция предпочтительно относится к ингибированию течения заболевания. Это включает замедление прогресса заболевания и, в частности, прекращение или отмену прогресса заболевания. Искомая реакция при лечении заболевания или состояния может также представлять собой задержку начала или предотвращения начала заболевания или указанного состояния. В частности, термин «эффективное количество» относится к количеству терапевтического средства, которое является достаточным для предотвращения развития, рецидива или возникновения онкологического заболевания и одного или нескольких его симптомов, снижения тяжести, продолжительности онкологического заболевания, ослабления одного или нескольких симптомов злокачественного новообразования, предотвращения развития онкологического заболевания, регресса онкологического заболевания и/или предотвращения метастазирования злокачественного новообразования. В воплощении изобретения количество терапии является эффективным для достижения стабилизации, уменьшения или устранения популяции опухолевых стволовых клеток и/или уничтожения, удаления или контроля первичного злокачественного новообразования, метастатического злокачественного новообразования и/или рецидивирующего злокачественного новообразования.
Эффективное количество агента или композиции, описанных в данном документе, будет зависеть от состояния, подлежащего лечению, тяжести заболевания, индивидуальных параметров пациента, включая возраст, физиологическое состояние, размер и массу, продолжительность лечения, типа сопутствующей терапии (если имеется), конкретного пути введения и аналогичных факторов. Соответственно, вводимые дозы агентов, описанные в данном документе, могут зависеть от нескольких таких параметров. В случае, если реакция у пациента недостаточна при использовании начальной дозы, могут использоваться более высокие дозы (или эффективные более высокие дозы, достигаемые другим, более локализованным способом введения).
Агенты и композиции, представленные в данном документе, могут использоваться индивидуально или в комбинации с традиционными терапевтическими схемами, такими как операция, облучение, химиотерапия и/или трансплантация костного мозга (аутологичная, изогенная, аллогенная или неродственная).
Лечение злокачественного новообразования представляет собой область, где комбинированные стратегии особенно желательны, поскольку часто комбинированное действие двух, трех, четырех или даже большего количества противоопухолевых лекарственных/терапевтических средств создает синергические эффекты, которые значительно сильнее, чем воздействие монотерапевтического подхода. Таким образом, в другом воплощении настоящего изобретения лечение онкологического заболевания может эффективно сочетаться с различными другими лекарственными средствами. К ним относятся, например, комбинации с обычными противоопухолевыми терапиями, стратегиями множественных эпитопов, дополнительной иммунотерапией и подходами к лечению, нацеленными на ангиогенез или апоптоз (обзор см., например, Andersen et al. 2008: Cancer treatment: the combination of vaccination with other therapies. Cancer Immunology Immunotherapy, 57(11): 1735-1743). Последовательное введение различных агентов может ингибировать рост опухолевых клеток в разных контрольных точках, тогда как другие агенты могут, например, ингибировать неоангиогенез, выживаемость злокачественных клеток или метастазов, потенциально превращая злокачественное новообразование в хроническое заболевание.
Настоящее изобретение дополнительно иллюстрируется следующими примерами, которые не могут быть истолкованы как ограничивающие объем изобретения.
Примеры
Пример 1. Описательный анализ генетических иммунных полиморфизмов
Индивидуальный профиль однонуклеотидных полиморфизмов (SNP) в геноме пациента может быть прогнозом скорости реакции на терапевтическое антитело IMAB362. С целью исследования таких образцов SNP, всех пациентов генотипировали по ряду SNP с известной или предполагаемой ролью в иммунном ответе и восприимчивости к раку желудка.
В частности, были рассмотрены следующие вопросы:
- SNP-генотипы каждого пациента в отношении изучаемых полиморфизмов.
- Частота SNP-генотипов в популяции пациентов.
- Идентификация пациентов с полиморфизмами, которые могут прямо препятствовать действию IMAB362 (полиморфизмы Fc-рецептора и системы комплемента).
- Накопление SNP-генотипов на одного пациента, описанное как факторы риска для восприимчивости к раку желудка, прогрессирования или лечения злокачественного новообразования.
- Корреляция SNP-генотипов с клиническим исходом.
- Корреляция SNP-генотипов с периодом выживаемости без прогрессирования (PFS).
Все пациенты когорты 1, 2 и 3 были проанализированы на предмет генетических полиморфизмов. Образцы крови пациентов собирали в день 1 (V2a, преинфузия).
Образцы цельной крови (9 мл, EDTA-Monovette) собирали у всех пациентов. EDTA-кровь хранили в аликвотах по 1 мл сразу после забора образцов в центре исследования при -20°С. Образцы EDTA-крови помещали на сухой лед (-70°C) и хранили при -20°C. По прибытии образцы крови хранили сразу при -20°C до выделения ДНК.
Представляющие интерес SNP отбирали с помощью литературного поиска, фокусируясь на SNP, которые, как известно, влияют на функционирование иммунной системы, и особенно на SNP, которые, как было описано, влияют на механизм действия терапевтических антител, такие как полиморфизмы Fc-рецептора и системы комплемента. Были отобраны и изучены SNP, которые, как описано, влияют на выживаемость пациентов с раком желудка, восприимчивость к (желудочному) злокачественному новообразованию или на прогрессирование рака желудка.
Генетические полиморфизмы анализировали с помощью анализов SNP Genotyping TaqMan™ (46 стандартных, 5 изготовленных на заказ, Life Technologies) на платформе анализа ПЦР Fluidigm Biomark™ в реальном времени. Выделение ДНК проводили в соответствии со стандартными протоколами для выделения геномной ДНК из цельной крови. Платформа для анализа ПЦР Fluidigm Biomark™ в реальном времени позволяет генотипировать до 96 образцов пациентов с 96 SNP в одном измерении, так как образцы пациентов и специфические праймеры SNP применяются к лабораторному чипу с 96 каналами для образцов ДНК пациента и 96 ортогональных каналов для SNP-анализов. Геномную ДНК пациента предварительно амплифицировали с помощью Амплификации Специфической Мишени (STA). Преамплифицированную ДНК подвергали анализу ПЦР в реальном времени TaqMan™ в стандартных условиях на платформе для анализа ПЦР в реальном времени Fluidigm Biomark™. Аллельное определение SNP проводили для каждого пациента и каждого анализа с использованием проприетарного программного обеспечения Fluidigm и программного обеспечения для статистического анализа «R».Подмножество SNP подтверждали классическим секвенированием по Сенгеру, поскольку результаты Fluidigm были неоднозначными.
Генетические полиморфизмы 51 однонуклеотидных полиморфизмов (SNP) были определены у 53 пациентов. Образец крови от 1 пациента не позволял осуществить экстракцию ДНК в достаточном количестве для анализа SNP. 6 SNP-генотипов были определены только для подгруппы из 20 пациентов. Генотип для MDM2 SNP rs2279744 не был определен у 9 пациентов из-за технических проблем. Результат генотипирования PTGS2 rs20417 для 1 пациента был неоднозначным и не исследовался далее.
Определение матрицы SNP-генотипов для тестируемых пациентов позволяет осуществить статистическое тестирование популяции пациентов на частотные сдвиги генотипов по сравнению с частотой генотипа в контрольных популяциях европейцев. Частоты SNP-генотипов в контрольных популяциях европейцев основаны на данных, собранных международными проектами SNP-генотипирования (HapMap-CEU, PGA-EUROPEAN-PANEL, CAUC1, pilot_1_CEU_low_coverage_panel, CEU_GENO_PANEL, PDR-90), которые депонированы в публичной базе данных dbSNP (Национальный центр биотехнологической информации, Бетезда (Мэриленд, США). Количество пациентов на генотип данного SNP сравнивали с количеством пациентов на генотип в контрольных популяциях европейцев. Количество пациентов на генотип контрольных популяций рассчитывали путем умножения предоставленной относительной частоты SNP-генотипа в популяции на сообщенное количество исследуемых образцов. Это позволило провести прямую проверку на соответствие по критерию хи-квадрата для идентификации статистически значимых различий между популяцией пациентов и соответствующей контрольной популяцией.
Тест хи-квадрата проводили для 48 из 51 исследованных SNP. Данные о частотах SNP-генотипов не депонированы в публичных базах данных, кроме SNP C1QA (rs1044378), FCGR2C (Q57X (C→T)), и MDM2 (rs2279744). SNP со статистически значимым сдвигом частоты генотипов между популяцией пациентов и контрольной популяцией (5 из 48 SNP, p<0,05) показаны на фиг. 1.
Было показано, что 4 из этих 5 SNP играют роль в восприимчивости к злокачественному новообразованию/раку желудка. Все 4 SNP злокачественного новообразования/рака желудка действительно демонстрируют сверхпредставленность соответствующего генотипа, ассоциированного со злокачественным новообразованием, в популяции пациентов, как и ожидалось для пациентов с раком желудка (таблица 1).
До настоящего времени не было показано, что 1 из этих 5 SNP (rs12146727 (C1S)) является фактором риска/восприимчивости злокачественного новообразования или рака желудка. Этот SNP до сих пор только один раз был описан как предполагаемый фактор риска сердечно-сосудистых заболеваний.
Таблица 1. SNP, ассоциированные с восприимчивостью к раку желудка со статистически значимыми различиями в частоте генотипа между популяцией пациентов и контрольной популяцией
генотип
49 из 51 изученных SNP в популяции пациентов демонстрируют вариантный аллельный паттерн в исследуемой популяции пациентов. Это позволяет тестировать сдвиги аллельной частоты SNP между субпопуляциями пациентов, что в идеале может помочь в определении предполагаемой популяции респондеров. Только 2 SNP, C1QA (rs1044378) и FCGR2C (AHN1ME8) демонстрируют инвариантный SNP-генотип у всех пациентов, что не дает провести какой-любой тип дифференциального анализа. Для 5 SNP статистический значимый сдвиг аллельной частоты можно было определить в этом исследовании по сравнению с контрольными популяциями, обеспечивая доказательство того принципа, что аллельная частота SNP зависит от состава данной популяции. Таким образом, отбор тестируемых SNP хорошо подходит для будущей идентификации SNP как кандидатов в биомаркеры.
Полиморфизмы Fc-рецептора и системы комплемента могут прямо влиять на способ действия IMAB362. Пациентов генотипировали по аллелям SNP в генах, которые могут влиять на эффективность терапии на основе антител, таких как FCGR3A (F176V[T→G], rs396991), FCGR2A (H131R [T→C], rs1801274), и C1QA ([276A→G], rs172378) (таблица 2).
Пациентов дополнительно генотипировали по опубликованным аллелям SNP гена FCGR2C (Q57X [C→T], нет номера rs) и по факторам системы комплемента C1S (R119H [G→A], rs12146727) и C1QA (rs292001, rs1044378). Ранее не демонстрировалось, что эти SNP влияют на антительную терапию, но они были включены в качестве интересных SNP-кандидатов.
Таблица 2. Пациенты с полиморфизмами Fc-рецептора и системы комплемента. Приведены SNP-генотипы пациентов с хорошо известными полиморфизмами Fc-рецептора и системы комплемента. FCGR3A Val/Val полиморфизмы с предполагаемым положительным воздействием на терапию антителами выделены жирным шрифтом и подчеркнуты. Полиморфизмы в FCGR2A (Arg/Arg) и C1QA [G/G] с предполагаемым негативным воздействием на антительную терапию окрашены в серый цвет и выделены жирным шрифтом.
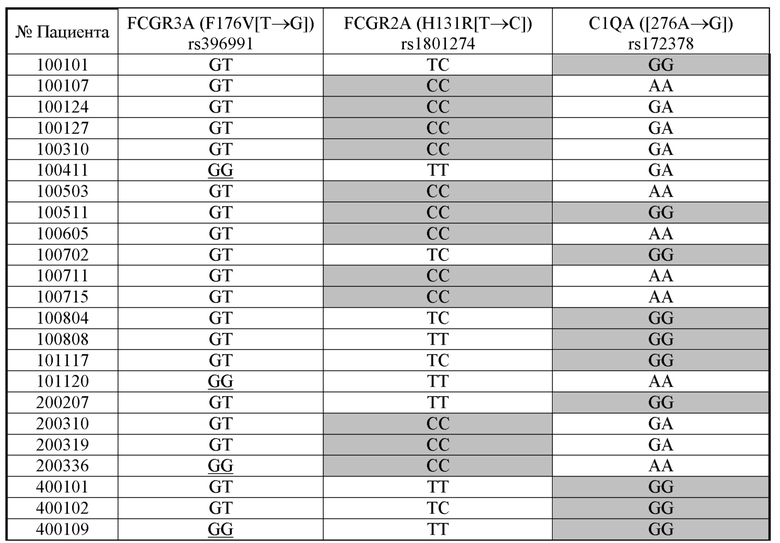
В общей сложности 23 пациента демонстрируют, по меньшей мере, один из хорошо документированных полиморфизмов Fc-рецептора и комплемента. 4 пациента (100411, 101120, 200336 и 400109) были гомозиготными по аллелю FCGR3A (F176V [T→G]), который, как сообщается, увеличивал частоту ответа и выживаемость без прогрессии при антительной терапии. 12 пациентов гомозиготны по аллелю FCGR2A (H131R [T→C]), еще 10 пациентов гомозиготы по аллелю C1QA ([276A→G]). Показано, что оба эти SNP оказывают отрицательное влияние на антительную терапию. В общей сложности 21 пациент гомозиготен как по аллелю FCGR2A (H1 31R [T→C]), так и по аллелю C1QA ([276A→G] (пациент 100511 гомозиготен по обоим аллелям SNP).
Корреляция данных, приведенных выше, с прогрессированием заболевания пациентов может дать представление о роли полиморфизмов Fc-рецептора и системы комплемента для лечения с использованием IMAB362.
Прогрессирование заболевания и эффективность лечения антителами у пациентов могут быть затронуты накоплением SNP, описанным как факторы риска для предрасположенности к раку желудка, прогрессирования или лечения злокачественных новообразований. Среди исследованных 51 SNP до 43 SNP позволяют провести классификацию соответствующих SNP-генотипов как генотипы «с риском» против генотипов «без риска». Подсчитывали количество гомозиготных SNP-генотипов, являющихся факторами риска, на одного пациента, поскольку они описаны в целом как наиболее важные аллели риска. Относительная частота количества гомозиготных генотипов с риском на одного пациента по отношению к количеству исследуемых SNP, являющихся факторами риска, на пациента показана на фиг. 2.
Наблюдали накопление 14-46% исследованных генотипов риска на одного пациента. Это широкое распределение позволяет исследовать, коррелирует ли накопление SNP-генотипов риска на одного пациента с клиническим исходом пациента.
Таким образом, 53 из 54 пациентов были успешно генотипированы по 51 SNP. 49 из 51 SNP демонстрируют вариант аллеля SNP, позволяющий анализировать субпопуляции пациентов на предмет значительного изменения частоты SNP-генотипа. Гомозиготные полиморфизмы Fc-рецепторов и системы комплемента, описанные в качестве модуляторов терапии с использованием антител, обнаружены у 23 из 53 пациентов. Наблюдали накопление от 14 до 46% исследуемых генотипов риска на одного пациента.
Пример 2. Корреляция SNP-генотипирования с клиническими результатами
Целью корреляции клинических исходов с генотипами генетических полиморфизмов является идентификация предполагаемых кандидатов биомаркеров SNP, прогнозирующих клинические исходы пациентов. Предполагаемые кандидаты биомаркеров, идентифицированные в этом анализе, будут проверены в последующих исследованиях фазы IIb и фазы III. Проверка предполагаемых кандидатов биомаркеров в Фазе IIb позволит дифференцировать предполагаемые прогностические и предиктивные SNP-кандидаты.
Корреляционный анализ для каждого SNP с клиническим исходом проводили независимо для двух определенных популяций пациентов клинических испытаний фазы IIa: популяция «группы полного анализа» (FAS) с 40 пациентами и популяция «группы по протоколу» с 21 пациентом.
Абсолютные частоты генотипов соответствующего SNP для каждой группы клинического исхода («респондер», «нереспондер») популяции пациентов оценивали количественно с помощью SAS Enterprise Guide 6.1. Абсолютные частоты генотипов были организованы в таблицах статистической структуры изучаемой популяции (3×2 или 2×2), структурированных по клиническим исходам и SNP-генотипу. В качестве стандартного статистического теста использовали критерий хи-квадрата Пирсона. Точный критерий Фишера применяли в некоторых случаях для таблиц 2×2 статистической структуры изучаемой популяции, если числовая структура набора данных запрещала использование критерия хи-квадрата Пирсона. Уровень статистической значимости составил р<0,05. Корреляционный анализ реализовали с помощью программного обеспечения для статистического анализа SAS Enterprise Guide 6.1.
Чтобы исследовать влияние SNP-генотипов на выживаемость без прогрессирования, кривые Каплана-Мейера вычисляли для каждой группы, а затем формально сравнивали с использованием статистического теста Логранка. Уровень статистической значимости составил р<0,05. Статистику Логранка реализовали с помощью программного обеспечения для статистического анализа SAS Enterprise Guide 6.1.
Корреляцию клинического результата с SNP-генотипированием выполняли для определения предполагаемых прогнозных или прогностических кандидатов биомаркеров SNP. Корреляцию изучали на двух группах пациентов, популяции FAS и популяции PP.
Популяция FAS включает 40 пациентов, 12 пациентов, определяемых как «респондер» (клинический исход «частичная ремиссия» или «стабильное заболевание»), и 28 пациентов как «нереспондер» (клинический исход «прогрессирование заболевания»). Один образец пациента (100801, нереспондер) популяции FAS не был доступен для анализа SNP, как описано выше, поэтому максимальное количество пациентов FAS, проанализированных для поиска корреляций, было уменьшено до 39. Популяция PP включает 21 пациента с 10 пациентами-респондерами и 11 пациентами нереспондерами.
Количество пациентов, подвергшихся обследованию на SNP, различается от 20 до 39 (в популяции FAS) и от 20 до 21 (в популяции PP).
Корреляционный анализ проводили, как описано выше. В целом, из изученных 51 SNP 2 продемонстрировали статистически значимую корреляцию с клиническим исходом в популяции FAS, а также в популяции PP.
2 SNP, продемонстрировавшими статистическую корреляцию между клиническим исходом и соответствующим SNP-генотипом в обеих популяциях являются FCGR2A rs1801274 (p = 0,0004 [PP], p = 0,008 [FAS]) и IL-10 rs1800896 (p = 0,042 [PP], p = 0,022 [FAS]) (таблица 3). Количество пациентов, прошедших статистическую проверку на SNP, составило 21 (PP) и 39 (FAS) для каждого из этих 2 SNP.
Таблица 3. SNP, демонстрирующие статистическую корреляцию между клиническим исходом и генотипом SNP в популяции PP, а также в популяции FAS.
(Критерий хи-квадрат, статистически значимый: р <0,05)
5 SNP демонстрируют корреляцию с клиническим исходом в одной популяции пациентов (FAS или PP), что может быть продемонстрировано для DNMT3A rs1550117 [PP, p = 0.035], SMAD4 rs12456284 [FAS, p = 0,02], MUC1 rs4072037 (FAS, p = 0,03), EGF rs4444903 [FAS, p = 0,049] и CDH1 rs16260 [FAS p = 0,049]) (таблица 4).
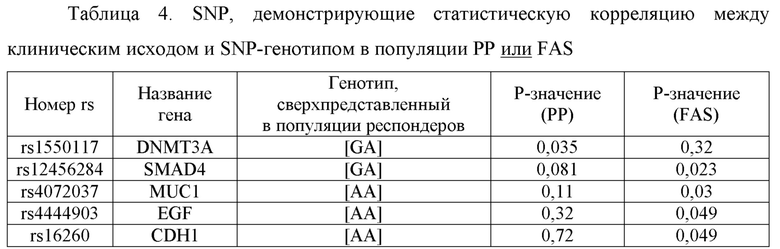
(Критерий хи-квадрат, статистически значимый: р <0,05)
Изучение сверхпредставленности или недостаточной представленности SNP-генотипов у пациентов-респондеров/нереспондеров может дать научное объяснение статистически значимых различий по частоте.
Генотипы двух SNP, rs11615 (ERCC1) и rs396991 (FCGR3A), коррелируют с пролонгированной выживаемостью без прогрессирования (PFS) в популяции PP (таблица 5).
Таблица 5. SNP, демонстрирующие статистическую корреляцию между пролонгированной PFS и SNP-генотипами в популяции PP
с PFS
Число пациентов, прошедших статистическую проверку на SNP, составило 21 (PP) и 39 (FAS) для каждого из перечисленных 9 SNP.
FCGR2A rs1801274 [C/T]: В PP все пациенты, несущие гетерозиготный генотип rs1801274 [CT], действительно являются респондерами (8), что отражается в высокозначимом p-значении (0,0004) статистического теста. Все пациенты с PR (4 из 4) имеют этот генотип. Большинство нереспондеров (73%, 8 из 11) демонстрируют гомозиготный генотип [TT] (таблица 6). Этот паттерн распределения генотипов также может быть обнаружен в популяции FAS, хотя и без такого разброса, как в популяции PP (таблица 7). Довольно много пациентов-нереспондеров в популяции FAS также поддерживают генотип [CT] (30%), что приводит к менее выраженному, но все же статистически высокозначимому р-значению.
Таблица 6. Список генотипов rs1801274 (FCGR2A) у пациентов PP и соответствующие частоты у пациентов респондеров (PR и SD) и нереспондеров (PD)
[Дни]
RESP: респондер, NONRESP: нереспондер, PFS: выживаемость без прогрессирования, абс. частота: абсолютная частота, отн. частота: относительная частота.
Таблица 7. Список генотипов rs1801274 (FCGR2A)
[Дни]
RESP: респондер, NONRESP: нереспондер, PFS: выживаемость без прогрессирования, абс. частота: абсолютная частота, отн. частота: относительная частота.
Анализ выживаемости FCGR2A rs1801274 [C/T]: Ожидалось, что значительная сверхпредставленность генотипа rs1801274 [CT] в популяции респондеров будет отражаться в корреляции с пролонгированной выживаемостью без прогрессирования (PFS). Действительно, в обеих популяциях PP (фиг. 3) и FAS (фиг. 4) генотип [CT] также существенно коррелирует с пролонгированной PFS (PP p = 0,0007, FAS p = 0,03). Интересно, однако, что в течение первых 60 дней лечения пациенты FAS с генотипом [TT] демонстрируют тенденцию к более высокой степени PFS, чем пациенты с генотипом [CC] или [ CT].Таким образом, анализ выживаемости подтверждает, что rs1801274 (FCGR2A) представляет собой очень интересный предполагаемый кандидат-биомаркер предиктивного или прогностического характера.
IL-10 rs1800896 [A/G]: В PP ни у одного из пациентов-нереспондеров нет гомозиготного генотипа rs1800896 [GG] (таблица 8). Этот генотип встречается с повышенной частотой (40%) у пациентов-респондеров (4 из 10). Только 1 из 10 респондеров (10%) демонстрирует генотип [AA], остальные респондеры демонстрируют гетерозиготный генотип [GA]. В FAS можно наблюдать сравнимое распределение частоты генотипов (таблица 9), хотя в этой популяции можно наблюдать генотип [GG] у пациентов-нереспондеров с низкой частотой (11%, 3 из 27).
Таблица 8. Список генотипов rs1800896 (IL-10) у пациентов PP и соответствующие частоты у пациентов-респондеров (PR и SD) и пациентов-нереспондеров (PD)
[Дни]
RESP: Респондер, NONRESP: нереспондер, PFS: выживаемость без прогрессирования, абс. частота: абсолютная частота, отн. частота: относительная частота.
Таблица 9. Список генотипов rs1800896 (IL-10) у пациентов FAS и соответствующие частоты у пациентов-респондеров (PR и SD) и пациентов-нереспондеров (PD)
[Дни]
RESP: Респондер, NONRESP: Нереспондер, PFS: выживаемость без прогрессирования, абс. частота: абсолютная частота, отн. частота: относительная частота.
Анализ выживаемости rs1800896 (IL-10) [A/G]: генотип rs1800896 [GG] существенно сверхпредставлен у пациентов-респондеров. Статистическая корреляция генотипа [GG] с PFS демонстрирует, что в популяции PP и FAS генотип [GG] незначительно коррелирует с PFS (PP p = 0,27 (фиг. 5), FAS p = 0,08 (фиг. 6)).Однако p-значение для корреляции выживаемости FAS граничит со значимостью, что может свидетельствовать о том, что в более крупных популяциях с пониженным статистическим шумом значимость вполне может быть достигнута. В целом, rs1800896 (IL-10) является интересным предполагаемым кандидатом биомаркера.
DNMT3A rs1550117 [G/A]: В PP, 4 респондера (40%) демонстрируют генотип [GA], тогда как все нереспондеры демонстрируют генотип [GG] (p = 0,03, таблица 10).
Таблица 10. Список генотипов rs1550117 (DNMT3A) у пациентов PP и соответствующие частоты у пациентов-респондеров (PR и SD) и пациентов-нереспондеров (PD)
[Дни]
RESP: Респондер, NONRESP: нереспондер, PFS: выживаемость без прогрессирования, абс. частота: абсолютная частота, отн. частота: относительная частота.
Анализ выживаемости rs1550117 (DNMT3A) [G/A]: генотип rs1550117 [GA] существенно сверхпредставлен у пациентов-респондеров популяции PP. В популяции FAS разница в PFS между носителями [GA] и [GG] имеет пограничную значимость (FAS p = 0,058) (фиг. 7).
В популяции FAS только один пациент является носителем генотипа [АА].
SMAD4 rs12456284 [G/A]: В FAS можно наблюдать статистически значимую сверхпредставленность генотипа [GA] (7 из 12 пациентов, 58%) по сравнению с генотипами [AA] и [GG] в популяции респондеров (p = 0,023, таблица 11). В популяции нереспондеров FAS можно наблюдать частоту генотипа [GA], составляющую 19% (5 из 27 нереспондеров). В популяции PP эта связь обозначена значимостью тренда (р = 0,081, данные не показаны).
Таблица 11. Список генотипов rs12456284 (SMAD4)
[Дни]
RESP: респондер, NONRESP: нереспондер, PFS: выживаемость без прогрессирования, абс. частота: абсолютная частота, отн. частота: относительная частота.
Анализ выживаемости rs12456284 (SMAD4) [G/A]: генотип rs12456284 [GA] существенно сверхпредставлен у пациентов-респондеров FAS и демонстрирует ту же тенденцию у респондеров PP. Статистическая корреляция генотипов rs12456284 с PFS демонстрирует, что в популяции PP генотип [GA] достоверно коррелирует с PFS (PP p = 0,048) с использованием теста Гехана-Брелоу-Вилкоксона (Gehan-Brelow-Wilcoxon) (фиг. 8), тогда как значимость с использованием логрангового критерия составляет p = 0,35. Тест Гехана-Брелоу-Вилкоксона дает больший вес событиям PFS в ранние моменты времени, чем логранговый критерий, и действительно, разница между носителями [GA] и [AA] наиболее выражена в течение первых 100 дней этой фазы IIa клинического испытания. В популяции FAS нет существенной корреляции генотипа [GA] с PFS (p = 0,20 (логранговый критерий), p = 0,23 (Гехана-Брелоу-Вилкоксона)), хотя визуальный осмотр указывает на тенденцию носителей [GA] к пролонгированной PFS.
MUC1 rs4072037 [A/G]: В FAS генотип rs4072037 с наибольшей частотой 67% в популяции респондеров представляет собой [AA] (8 из 12), тогда как среди нереспондеров этот генотип проявляется только у 26% пациентов (7 из 27 ).Ни один из пациентов-респондеров не демонстрирует гомозиготный генотип [GG] (таблица 12), тогда как нереспондеры демонстрируют генотип [GG] с частотой 22% (6 из 27). Это дифференциальное распределение генотипов у пациентов-респондеров и пациентов-нереспондеров является статистически значимым (p = 0,03). Сравнимый профиль распределения генотипов обнаружен в популяции PP (данные не показаны), где респондер демонстрирует примерно такую же относительную частоту генотипа [АА] 70% (7 из 10), как и в популяции FAS (тенденция значимости р = 0,11) ,
Таблица 12. Список генотипов rs4072037 (MUC1) у пациентов FAS и соответствующие частоты у пациентов-респондеров (PR и SD) и пациентов-нереспондеров (PD)
[Дни]
RESP: респондер, NONRESP: нереспондер, PFS: выживаемость без прогрессии, абс. частота: абсолютная частота, отн. частота: относительная частота.
Анализ выживаемости rs4072037 (MUC1) [A/G]: Значимая сверхпредставленность генотипа rs4072037 [AA] у пациентов-респондеров может свидетельствовать о корреляции этого генотипа с PFS. Статистическое тестирование обнаружило, что в популяции PP и FAS генотип [AA] значимо коррелирует с PFS (PP p = 0,001, (фиг. 9), FAS p = 0,02 (фиг. 10 )).Этот анализ выживаемости подтверждает rs4072037 (MUC1) как очень интересный предполагаемый прогнозный или прогностический кандидат биомаркеров.
EGF rs4444903 [G/A]: в FAS генотип rs4444903 [AA] значим сверхпредставлен (p = 0,049) в популяции респондеров (5 из 12; 42%) по сравнению с популяцией нереспондеров (3 из 27, 11%) (таблица 13). В популяции PP это асимметричное распределение не является статистически значимым (p = 0,32, данные не показаны).
Таблица 13. Список генотипов rs4444903 (EGF) у пациентов FAS и соответствующие частоты у пациентов-респондеров (PR и SD) и пациентов-нереспондеров (PD)
[Дни]
RESP: респондер, NONRESP: нереспондер, PFS: выживаемость без прогрессии, абс. частота: абсолютная частота, отн. частота: относительная частота.
Анализ выживаемости rs4444903 (EGF) [G/A]: корреляция генотипа rs4444903 [AA] с PFS в популяции PP или FAS не является статистически значимой (FAS p = 0,1, PP p = 0,16). Однако, тенденция к пролонгированной PFS наблюдается как в популяции PP, так и в FAS (фиг. 11).
CDH1 rs16260 [C/A]: В FAS генотип rs16260 [AA] встречается со значительно более высокой частотой в популяции респондеров (5 из 12; 42%), чем в популяции-нереспондеров (3 из 27, 11%) (P = 0,049, таблица 14 ). В PP это асимметричное распределение между обеими группами пациентов незначительно (р = 0,72, данные не показаны).
Таблица 14. Список генотипов rs16260 (CDH1) у пациентов FAS и соответствующие частоты у пациентов-респондеров (PR и SD) и пациентов-нереспондеров (PD)
[Дни]
RESP: респондер, NONRESP: нереспондер, PFS: выживаемость без прогрессии, абс. частота: абсолютная частота, отн. частота: относительная частота.
Анализ выживаемости rs16260 (CDH1) [C/A]: корреляция генотипа rs16260 (CDH1) с PFS граничит со статистической значимостью в популяции FAS (логранговый критерий p = 0,065, критерий Гехана-Брелоу-Вилкоксона p = 0,032) (фиг. 12).
ERCC1 rs11615 [C/T]: в PP обнаружена тенденция к более высокой частоте генотипа rs11615 [TT] в популяции респондеров (3 из 10, 30%) (p = 0,068, популяция-нереспондеров (0% )).И наоборот, гомозиготный генотип [CC] встречается только в популяции-нереспондеров (2 пациента) (таблица 15).
Таблица 15. Список генотипов rs11615 (ERCC1) у пациентов PP и соответствующие частоты у пациентов-респондеров (PR и SD) и пациентов-нереспондеров (PD)
[Дни]
RESP: респондер, NONRESP: нереспондер, PFS: выживаемость без прогрессии, абс. частота: абсолютная частота, отн. частота: относительная частота.
Анализ выживаемости rs11615 (ERCC1) [C/T]: генотип rs11615 [TT] обнаружен исключительно в популяции респондеров в популяции PP. Статистическая корреляция генотипов rs11615 с PFS демонстрирует, что генотип rs11615 в PP в значимой степени коррелирует с PFS, причем носители [CT] и [TT] проявляют пролонгированную выживаемость по сравнению с носителями [CC] (PP p = 0,0001) (фиг. 13). Несмотря на эту поразительную величину значимости, следует отметить, что было только 2 пациента с генотипом [CC] и 3 пациента с генотипом [TT] в PP. Однако в популяции FAS такой же эффект можно наблюдать как тенденцию (FAS p = 0,13, данные не показаны), что свидетельствует о том, что эффект также действителен для более крупных популяций пациентов.
Анализ выживаемости FCGR3A rs396991 [T/G]: ни в PP, ни в FAS генотип SNP rs396991 не коррелировал с клиническим исходом (FAS p = 0,49, PP p = 0,29, данные не показаны).Однако анализ выживаемости в популяции PP показывает с высокой статистической значимостью, что пациенты с генотипами [TG] и [ТТ] демонстрируют улучшенную PFS по сравнению с [GG] (p = 0,0007, фиг. 14).Этот эффект также можно наблюдать и в популяции FAS (р = 0,25, данные не показаны). Несмотря на значимость, полученную для популяции PP, следует отметить, что только 3 пациента PP являются носителями [GG].
Пример 3. Обсуждение сопутствующих анализов иммунного полиморфизма
Первичной целью данного клинического испытания фазы IIa была оценка безопасности и эффективности терапевтического моноклонального антитела IMAB362 к CLDN18.2 у пациентов с гастроэзофагеальными аденокарциномами. Кроме того, для оценки параметров, которые могут служить потенциальными прогнозными или прогностическими биомаркерами в корреляции с IMAB362-терапией, проводили сопутствующие анализы полиморфизма генетического иммунного ответа.
Обсуждение описательного анализа иммунного полиморфизма
Показано, что генетические полиморфизмы в геноме пациента изменяют скорость ответа терапевтических антител. Для того, чтобы исследовать влияние индивидуальной генетической вариации на скорость ответа, у пациентов определяли генотипы 51 одиночного нуклеотидного полиморфизма (SNP) с известной или предполагаемой ролью в иммунном ответе и предрасположенностью к раку желудка или с его прогрессированием.
В данном исследовании 51 SNP были успешно генотипированы для 53 из 54 исследованных пациентов. Статистически значимый сдвиг частоты генотипов в популяции пациентов по сравнению с контрольными популяциями может быть обнаружен для 5 SNP. Ранее было показано, что 4 из этих SNP связаны с предрасположенностью к злокачественному новообразованию/раку желудка. Соответствующие генотипы этих SNP, ассоциированные со злокачественным новообразованием/раком желудка, сверхпредставлены в исследуемой популяции, как и следовало ожидать, в популяции пациентов с преобладанием GC. Сверхпредставленность соответствующего гомозиготного генотипа может указывать на рецессивный способ действия, предполагающий нарушенную функцию гена, в отличие от усиленной активности генов. Это подтверждается опубликованными данными, например, ассоциированный с раком желудка генотип SNP rs16260 в CDH1, как сообщается, вызывает отрицательную регуляцию экспрессии CDH1 из-за его положения в промоторе CDH1 при -160.
Было проведено исследование полиморфизмов в генах, участвующих в иммунной сигнализации, даже если эти полиморфизмы ранее не были описаны как факторы риска развития рака желудка. Было показано, что генетические полиморфизмы в генах, кодирующих факторы иммунной сигнализации, существенно модулируют риск развития рака желудка. Таким образом, частота ответа на терапию на основе антител может подвергаться влиянию этими SNP.
Сверхпредставленный генотип IL-2 GG (SNP rs2069762) в популяции пациентов ассоциирован с повышенным риском атрофии желудка, вызванным инфекцией H.pylori, и может предрасполагать к раку желудка. Генотипы CTLA4 SNP rs231775 и rs2274223 (PLCE1) были описаны как факторы риска предрасположенности к GC. По причине того, что опубликованные исследования в отношении rs231775 противоречивы по последовательности генотипа, в данном документе никаких выводов не сделано не будет.
В этом исследовании были исследованы полиморфизмы Fcγ-рецептора и системы комплемента. Возможный полезный генотип FCGR3A, кодирующий Val/Val [GG], обнаружен у 4 пациентов с APT, генотип FCGR2A с потенциально негативным воздействием (Arg/Arg) [CC] может быть обнаружен у 12 пациентов с APT.
Было показано, что CDC, в качестве второго эффекторного механизма, подвержен влиянию полиморфизмов SNP: аллельные носители полиморфизма в компоненте комплемента C1qA ([276A→G], rs172378) демонстрируют пролонгированный ответ после терапии фолликулярной лимфомы с помощью ритуксимаба. Полиморфизм системы комплемента в C1QA с генотипом ‘GG’ детектировали у 10 пациентов, возможно, с отрицательным влиянием на ответ. Однако полиморфизм SNP rs12146727 в компоненте комплемента C1S до сих пор описывали только в виде, не связанном с антительной терапией или с онкологическим заболеванием.
Идентификация значительных сдвигов частоты генотипов между пациентами и контрольными популяциями демонстрирует, что сдвиги частоты генотипов SNP могут служить прогностическими и предиктивными маркерами в клинических исследованиях.
Накопление аллелей рисковых SNP может также повлиять на клинический исход пациентов. Чтобы обеспечить такой анализ, количество гомозиготных генотипов с рисковым SNP подсчитывали из расчета на одного пациента. Корреляция этих количеств с ответом на терапию может дать представление о роли накопления SNP фактора риска.
Обсуждение корреляции генотипирования SNP с клиническим исходом
FCGR2A rs1801274:
Исследование генотипов FCGR2A, сверх- или недостаточно представленных, показало, что в популяции PP все пациенты с гетерозиготным генотипом rs1801274 [CT] являются пациентами-респондерами и что пациенты с частичным ответом (PR) поддерживают исключительно этот генотип. Сверхпредставленный гомозиготный генотип в популяции нереспондеров-[TT]. Простое наблюдение этих частотных распределений не позволяет сделать вывод о том, является ли генотип [CT] полезным или о том, является ли генотип [TT] невыгодным. В большинстве исследований, изучающих влияние SNP-генотипов, соответствующие гомозиготные генотипы проявляют самые сильные биологические эффекты, что часто указывает на рецессивный способ действия, отражающий нарушенную генную функцию обоих аллелей в отличие от усиленной активности генов. В случае, если аллели SNP приводят к повышенной генетической активности, часто можно наблюдать ступенчатый эффект биологического действия: один аллель (т.е. гетерозиготный) увеличивает активность генов, два аллеля (т.е. гомозиготные) увеличивают активность генов еще больше. В обоих случаях, усиление функции или потеря функции, самые сильные биологические/клинические эффекты обычно наблюдаются у пациентов с гомозиготными генотипами. При этом предположении сверхпредставленность гомозиготного генотипа [TT] в популяции нереспондеров в популяции PP и FAS может вызвать неблагоприятный эффект.
Однако это неожиданно, поскольку генотип rs1801274 FCGR2A [TT] был описан в ряде клинических исследований как фактор, имеющий пролонгирующий эффект в отношении PFS. В нашем клиническом испытании фазы IIa более тщательное исследование ассоциации между генотипом и PFS у пациентов-нереспондеров выявила, что пациенты FAS PD с генотипом [TT] демонстрируют в течение первых 60 дней терапии действительную тенденцию к более продолжительным периодам PFS, в отличие от пациентов FAS PD с генотипом [CT] (сравните таблицу 7 и фиг. 4). Интерпретация для приведения этого наблюдения в соответствие с недостаточной представленностью [TT] у респондеров с пролонгированной PFS, может представлять собой наложение двух разных молекулярных механизмов: во-первых, генотип rs1801274 [CT] может быть маркером для пациентов-респондеров. Это новое наблюдение, которое пока не описано в литературе, и можно предположить, что этот генотип является прогностическим маркером для лечения с помощью IMAB362. Молекулярный механизм, лежащий в основе этого нового наблюдения, еще не ясен.
Второе наблюдение, уже описанное в литературе для других терапевтических противоопухолевых антител, представляет собой пролонгированную PFS пациентов, несущих генотип FCGR2A [TT]. В нашем исследовании фазы IIa этот эффект обусловлен наложением постулированного первого механизма, наблюдаемого только в виде тенденции у пациентов-нереспондеров. Механистически, второе наблюдение можно объяснить увеличением аффинности связывания IgG1-антитела с аллелем его рецептора FCGR2A 131 His/His (кодируется генотипом [TT]) в отличие от более слабой аффинности связывания с гомозиготным аллелем рецептора ArgGRGA 131 Arg/Arg (кодируется генотипом [CC]). В исследованиях, изучающих влияние полиморфизмов Fcγ-рецепторов систематически, недавно было показано, что антитела изотипа IgG1 действительно связываются с различной аффинностью с двумя аллельными формами рецептора Fc2 IIA, H131 с более высокой аффинностью, чем R131. Обычно считается, что дифференциальная аффинность IgG-антител к аллелям рецептора FCGR2A влияет на скорость запуска эффекторных механизмов и, следовательно, на пролонгированную PFS у пациентов, несущих аллель с высокоаффинным рецептором. Данные, подтверждающие эту гипотезу, были предоставлены сообщениями, показывающими, что полиморфизмы Fcγ-рецепторов FCGR2A H131R и FCGR3A F176V (Phe> Val, rs396991) могут влиять на клиническую эффективность антительной терапии против IgG1 на основе Трастузумаба у пациентов с метастатическим раком молочной железы. Пациенты с генотипами FCGR3A 176 Val/Val и FCGR2A 131 His/His показали значительно более высокую скорость ответа и выживаемость без прогрессирования. Те же самые полиморфизмы также были ассоциированы со скоростью ответа пациентов, получавших ритуксимаб (IgG1) при В-клеточной лимфоме. В другом исследовании пролонгированная PFS после терапии Цетуксимабом (IgG1) может быть ассоциирована с генотипом FCGR3A 176 Val/Val.
Это вступает в противоречие с тем, что недавно были проведены хорошо обоснованные исследования, сообщающие об отсутствии связи между полиморфизмами Fcγ-рецептора и выживаемостью, скоростью ответа или выживаемостью без прогрессирования для обсуждаемых антител. В исследовании BCIRG-006 Международной исследовательской группы рака молочной железы (BCIRG) 1218 пациентов лечили в рандомизированном исследовании с использованием двух групп с обработкой Трастузумабом, и контрольной группы без Трастузумаба. Связи, описанные выше, между полиморфизмами Fcγ-рецептора и эффективностью Трастузумаба, не могут быть подтверждены. Долгосрочное исследование с 460 пациентами, использующими ритуксимаб в сочетании с химиотерапией при фолликулярной лимфоме, не выявило ассоциации полиморфизмов Fcγ-рецептора с выживаемостью без прогрессирования. В исследовании REACH с 419 пациентами, где пациенты получали флударабин и циклофосфамид (FC) или ритуксимаб плюс FC, полиморфизмы FCGR2A и FCGR3A не имели существенного влияния на клинический исход. Недавние испытания Цетуксимаба также дали противоречивые результаты, не рекомендующие использование полиморфизмов Fcγ-рецептора в качестве полезных биомаркеров. Это может отражать различия в факторах внутри популяции или влияние одновременных режимов химиотерапии.
MUC1 rs4072037:
MUC1 представляет собой трансмембранный гликопротеин семейства муцинов. Муцины представляют собой высокомолекулярные белки, которые O-гликозилированы в N-концевом внеклеточном домене преимущественно с олигосахаридами и n-гликановыми цепями. Мукины экспрессируются на апикальной поверхности эпителиальной оболочки респираторных и желудочно-кишечных трактов и протоков в печени, поджелудочной железе и почках. Трансмембранные муцины охватывают мембрану одной α-спиралью и обеспечивают с помощью своих сахарных цепей защитную подкладку для внеклеточного пространства. Муцины, секретируемые во внеклеточное пространство, создают слой слизистого геля, служащий дополнительной физической защитой для эпителия.
Трансмембранный MUC1 и секретируемые муцины MUC5C и MUC6 являются главными муцинами, экспрессируемыми в желудке. MUC1 транслируется в виде одной полипептидной цепи, которая подвержена саморасщеплению. N-концевой внеклеточный домен (MUC1-N) остается первоначально нековалентно связанным с трансмембранным/внутрицитоплазматическим доменом (MUC1-C). Этот внутрицитоплазменный домен служит в качестве сигнального домена, который может проникать в ядро и ассоциироваться с рядом факторов транскрипции, чтобы непосредственно активировать экспрессию гена. Клеточный стресс может приводить к протеолитическому расщеплению домена MUC1-N и MUC1-C через второй протеолитический сайт. Это можно наблюдать и в клетках злокачественных новообразований, где MUC1 больше не экспрессируется упорядоченным образом на апикальной мембране клетки, но может быть обнаружен сверхэкспрессированным и локализованным по всей клетке. Отщепление внеклеточного домена (также известного как CA15-3) во внеклеточном пространстве и внутриклеточная локализация MUC1-C является следствием. Интрацитоплазматическая сигнальная область действует как онкоген, например, путем активации сигнализации Wnt/β-катенина и блокирования апоптотических путей.
Однако внеклеточный домен MUC1 является не только статическим структурным компонентом, но и играет важную роль во время событий сигнализации на клеточной мембране. Было продемонстрировано, что состояние гликозилирования и экспрессии внеклеточного домена MUC1 регулирует взаимодействие мембранных сигнальных молекул и внеклеточного матрикса. Сообщается, что недостаточно гликозилированный MUC1-N в опухолевых клетках увеличивает передачу сигналов между мембранными молекулами, типа ICAM-1 или E-селектин и ядерным белком MUC1. Кроме того, по-видимому, экспрессия муцина и состояние гликозилирования маскируют молекулы, ассоциированные с мембраной. В клетках злокачественных новообразований маскировка белков HER2 экспрессией муцина было описано как возможный механизм резистентности к терапии Трастузумабом.
Полиморфизм 'A' аллеля MUC1 rs4072037 был описан как фактор риска для предрасположенности к раку желудка. Этот полиморфизм представляет собой замену G-> A в экзоне 2, что приводит к альтернативному сплайсингу MUC1 точно в предсказанном сайте расщепления сигнального пептида MUC1. Дефицитное расщепление сигнального пептида может приводить к аберрантной локализации белка MUC1 или аберрантному паттерну гликозилирования и, как следствие, к дефицитной функции белка.
В этой фазе IIa клинического исследования было обнаружено, что генотип rs4072037 [AA] статистически связан с популяцией респондеров. Можно предположить, что недостаточно гликозилированная или недостаточно экспрессированная [АА] аллельная форма MUC1 обеспечивает лучший доступ IMAB362 к мембранной молекуле-мишени CLDN18.2, экспрессируемой на клетках злокачественных новообразований, что способствует повышению эффективности лечения. Это сделало бы rs4072037 предиктивным биомаркером.
IL-10 rs1800896:
IL-10 является ключевым регулятором иммунной системы с плейотропными функциями. Известно, что IL-10 действует как противовоспалительный, иммуноподавляющий цитокин, ингибирующий макрофаг-зависимую антигенспецифичную пролиферацию Т-клеток и макрофаг-зависимое продуцирование цитокинов Т-клетками. Однако IL-10 был описан также как иммуностимулирующий цитокин, улучшающий дифференцировку и рост B-клеток, гранулоцитов и тучных клеток, а также активацию NK-клеток и CD8 + T-клеток. Плейотропный потенциал IL-10 также отражается по широкой экспрессии IL-10 во многих типах иммунных клеток, включая клетки Th2, клетки Treg, клетки Th3, NK-клетки, B-клетки, макрофаги и дендритные клетки. Эта двойная роль IL-10 отражается в потенциале, способствующем развитию опухолей, а также потенциале ингибирования опухоли: IL-10, секретируемый опухолевыми клетками или опухолевыми инфильтрирующими иммунными клетками типа макрофагов, позволяет опухолевым клеткам ускользать от иммунного надзора с помощью механизмов, которые были выяснены только частично. Один из описанных механизмов включает клетки Treg, способствующие индукции периферической толерантности посредством экспрессии иммунорегуляторных цитокинов, таких как IL-10. Другим описанным механизмом является ингибирование перекрестной презентации опухолеспецифических антигенов дендритными клетками и, следовательно, предотвращение Т-клеток от начала эффективного иммунного ответа против опухолевых клеток. С другой стороны, экспонирование злокачественных опухолевых клеток IL-10 приводит к отрицательной регуляции белков класса I HLA, что приводит к повышенной чувствительности к цитотоксичности NK-клеток.
Полиморфизм промотора IL-10 rs1800896 в положении (-1082) представляет интерес, поскольку аллель «G» известен как фактор риска развития рака желудка и фактор риска развития рака почек. Сообщалось, что аллель «G» этого полиморфизма связан с in vitro с уменьшением экспрессии IL-10 по сравнению с аллелем «A». У пациентов-респондеров этого клинического испытания фазы IIa генотип [GG] rs1800896 сверхпредставлен, что, возможно, указывает на более низкий уровень относительной экспрессии IL-10. Можно предположить, что пациенты, несущие генотип [GG], имеют более низкую экспрессию IL-10, которая, в свою очередь, может затруднить ускользание опухолевых клеток из под иммунного надзора с помощью одного из механизмов, описанных выше. Действительно, ни один из 12 пациентов-респондеров FAS, не показал повышенного уровня IL-10 в сыворотке, в отличие от 22% пациентов-нереспондеров FAS (6 из 27 обследованных). Однако другие авторы заявляют, что аллель «А» связан с уменьшением экспрессии IL-10.
Следует также отметить, что IL-10 передает сигнал через внутриклеточный медиатор Stat3 и что активация Stat3 зависит от MUC1-C. Таким образом, функциональное взаимодействие MUC1 и IL-10 может быть причиной того, что эти молекулы оказались статистически значимыми кандидатами в биомаркеры в этом клиническом исследовании фазы IIa. Наконец, FCGR2A экспрессируется на макрофагах, которые часто являются основным источником IL-10 в микроокружении опухоли. Если эти предполагаемые кандидаты биомаркеров преобладают в текущих и будущих исследованиях, исследование функционального взаимодействия этих факторов может представлять значительный интерес.
Rs1550117 (DNMT3A):
Rs1550117 представляет собой SNP в гене DNMT3A, кодирующем фермент ДНК (цитозин-5)-метилтрансферазу 3A, который катализирует передачу метильных групп в специфические CpG-структуры в ДНК, индуцирующие эпигенетическую модификацию. Было показано, что генотип [AA] повышает риск развития рака желудка по сравнению с [GG] или [GA]. В этом исследовании [AA] обнаружили только у одного пациента в популяции FAS и ни у одного из пациентов популяции PP. Это может указывать на то, что [AA] также является рисковым в отношении выживания, что не позволяет провести третий и четвертый курс лечения носителей [AA] в этой фазе IIa клинических испытаний. Данные о том, что [GA] значительно коррелирует с клиническим исходом в PP, предполагает, что этот маркер обладает потенциалом в качестве предиктивного биомаркера для лечения с помощью IMAB362.
Rs12456284 (SMAD4):
Rs12456284 представляет собой SNP в гене SMAD4, кодирующем внутриклеточный копреобразователь сигналов TGFβ/BMP, 4 гомолог Mothers against decapentaplegic. Было опубликовано, что генотип [GG] значительно снижал риск развития рака желудка. Статистически значимая сверхпредставленность гетерозиготного генотипа [GA] по отношению к генотипу [AA] в популяции респондеров FAS предполагает, что этот генотип может служить в качестве предиктивного биомаркера. Пролонгированная PFS пациентов популяции PP, несущих [GA], является подтверждающим фактом.
Rs4444903 (EGF):
Было обнаружено, что функциональный полиморфизм rs4444903 в промоторной области гена EGF модулирует уровни белка EGF, и что более высокое количество фактора EGF детектируется в сыворотке носителей [GG]. G-аллель и [GG] генотип этого полиморфизма продемонстрировали значительные корреляции с повышенным риском развития злокачественных опухолей желудочно-кишечного тракта в метаанализе.
В этом клиническом исследовании фазы IIa генотип [AA] значительно сверхпредставлен у респондеров FAS, и пациенты с этим генотипом демонстрируют тенденцию к пролонгированной PFS в популяции FAS и PP.Это может указывать на то, что генотип rs4444903 [AA] является прогнозирующим или прогностическим биомаркером.
Rs16260 (CDH1):
Клеточный адгезивный белок Кадгерин (E-кадгерин) является членом зависимого от кальция суперсемейства кадгеринов. Потеря функции была связана с прогрессированием онкологического заболевания. Было продемонстрировано, что аллель rs16260 [A] в промоторе CDH1 снижает эффективность транскрипции кадгерина 1. Кроме того, аллель -160A CDH1 был описан как фактор предрасположенности к развитию рака желудка.
В этом исследовании носители генотипа rs16260 [AA] статистически сверхпредставлены в популяции респондеров FAS. На основании этого можно предположить, что генотип [AA] является предполагаемым предиктивным биомаркером.
Rs11615 (ERCC1) и rs396991 (FCGR3A):
Два SNP rs11615 (ERCC1, белок репарации ДНК «группы 1 кросс-комплементирующей эксцизионной репарации») и rs396991 (FCGR3A, низкоаффинный Fc-рецептор иммуноглобулина гамма, тип III-A) демонстрируют корреляцию генотипов (ERCC1 [TT], FCGR3A [ TG] и [TT]) с пролонгированной PFS. Предположительно, эти SNP являются прогностическими или предиктивными биомаркерами.
УКАЗАНИЯ, КАСАЮЩИЕСЯ ДЕПОНИРОВАННОГО МИКРООРГАНИЗМА ИЛИ ДРУГИХ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ
(Правило РСТ 13 бис)
A. Сделанные ниже указания относятся к депонированному микроорганизму или другому биологическому материалу, указанному в описании на стр. 56, в строке 26.
B. ИДЕНТИФИКАЦИЯ ДЕПОЗИТА Дальнейшие депозиты указаны на дополнительном листе
Название депозитарного учреждения
DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH
Адрес депозитарного учреждения (включая почтовый индекс и страну)
Mascheroder Weg 1b
38124 Braunschweig
DE
Дата депозита - Номер доступа
19 октября 2005 г. - DSM ACC2737
С. ДОПОЛНИТЕЛЬНЫЕ УКАЗАНИЯ (оставьте поле пустым, если это не применимо)
Эта информация продолжается на дополнительном листе
- Мышиная (Mus musculus) миелома P3X63Ag8U. 1, слитая с мышиными (Mus musculus), спленоцитами
- Секретируемое гибридомой антитело против клаудина-18A2 человека
II УКАЗАННЫЕ ГОСУДАРСТВА, ДЛЯ КОТОРЫХ ДАНЫ УКАЗАНИЯ (если указания не относятся ко всем указанным государствам)
E. ОТДЕЛЬНЫЙ РАЗДЕЛ УКАЗАНИЙ (оставьте поле пустым, если не применимо)
Нижеуказанные указания будут представлены позднее в Международное бюро (укажите общий характер указаний, например, «номер депозита»)
Только для получающего ведомства - Только для Международного бюро
Этот лист был получен с международной заявкой - Этот лист был получен международным бюро
Уполномоченный сотрудник - Уполномоченный сотрудник
Форма PCT / RO / 134 (июль 1998 г., перепечатка в январе 2004 г.)
Новая международная патентная заявка
Ganymed Pharmaceuticals AG, et al.
«Способы и композиции для прогнозирования терапевтической эффективности лечения ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ и прогноза ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ»
Наша ссылка: 342-85 PCT
_Дополнительный лист для биологического материала
Идентификация дальнейших депозитов:
1) Название и адрес депозитария для депозитов (DSM ACC2738, DSM ACC2739, DSM ACC2740, DSM ACC2741, DSM ACC2742, DSM ACC2743, DSM ACC2745, DSM ACC2746, DSM ACC2747, DSM ACC2748):
DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH
Mascheroder Weg 1b
38124 Braunschweig
DE
2) Название и адрес депозитария для депозитов (DSM ACC2808, DSM ACC2809, DSM ACC2810):
DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH
Inhoffenstr. 7 B
38124 Braunschweig
DE
Дополнительные указания по всем вышеперечисленным депозитам:
- Мышиная (Mus musculus) миелома P3X63Ag8U.1, слитая с мышиными (Mus musculus) спленоцитами
-Гибридома, секретирующая антитело против клаудина-18A2 человека
3) Депонент:
Все вышеупомянутые депозиты были сделаны:
Ganymed Pharmaceuticals AG
Freiligrathstraße 12
55131 Mainz
DE
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ganymed Pharmaceuticals AG
<120> METHODS AND COMPOSITIONS FOR PREDICTION OF THERAPEUTIC EFFICACY
OF CANCER TREATMENTS AND CANCER PROGNOSIS
<130> 342-85 PCT
<150> PCT/EP2015/058212
<151> 2015-04-15
<160> 78
<170> PatentIn version 3.5
<210> 1
<211> 261
<212> PRT
<213> Homo sapiens
<400> 1
Met Ala Val Thr Ala Cys Gln Gly Leu Gly Phe Val Val Ser Leu Ile
1 5 10 15
Gly Ile Ala Gly Ile Ile Ala Ala Thr Cys Met Asp Gln Trp Ser Thr
20 25 30
Gln Asp Leu Tyr Asn Asn Pro Val Thr Ala Val Phe Asn Tyr Gln Gly
35 40 45
Leu Trp Arg Ser Cys Val Arg Glu Ser Ser Gly Phe Thr Glu Cys Arg
50 55 60
Gly Tyr Phe Thr Leu Leu Gly Leu Pro Ala Met Leu Gln Ala Val Arg
65 70 75 80
Ala Leu Met Ile Val Gly Ile Val Leu Gly Ala Ile Gly Leu Leu Val
85 90 95
Ser Ile Phe Ala Leu Lys Cys Ile Arg Ile Gly Ser Met Glu Asp Ser
100 105 110
Ala Lys Ala Asn Met Thr Leu Thr Ser Gly Ile Met Phe Ile Val Ser
115 120 125
Gly Leu Cys Ala Ile Ala Gly Val Ser Val Phe Ala Asn Met Leu Val
130 135 140
Thr Asn Phe Trp Met Ser Thr Ala Asn Met Tyr Thr Gly Met Gly Gly
145 150 155 160
Met Val Gln Thr Val Gln Thr Arg Tyr Thr Phe Gly Ala Ala Leu Phe
165 170 175
Val Gly Trp Val Ala Gly Gly Leu Thr Leu Ile Gly Gly Val Met Met
180 185 190
Cys Ile Ala Cys Arg Gly Leu Ala Pro Glu Glu Thr Asn Tyr Lys Ala
195 200 205
Val Ser Tyr His Ala Ser Gly His Ser Val Ala Tyr Lys Pro Gly Gly
210 215 220
Phe Lys Ala Ser Thr Gly Phe Gly Ser Asn Thr Lys Asn Lys Lys Ile
225 230 235 240
Tyr Asp Gly Gly Ala Arg Thr Glu Asp Glu Val Gln Ser Tyr Pro Ser
245 250 255
Lys His Asp Tyr Val
260
<210> 2
<211> 261
<212> PRT
<213> Homo sapiens
<400> 2
Met Ser Thr Thr Thr Cys Gln Val Val Ala Phe Leu Leu Ser Ile Leu
1 5 10 15
Gly Leu Ala Gly Cys Ile Ala Ala Thr Gly Met Asp Met Trp Ser Thr
20 25 30
Gln Asp Leu Tyr Asp Asn Pro Val Thr Ser Val Phe Gln Tyr Glu Gly
35 40 45
Leu Trp Arg Ser Cys Val Arg Gln Ser Ser Gly Phe Thr Glu Cys Arg
50 55 60
Pro Tyr Phe Thr Ile Leu Gly Leu Pro Ala Met Leu Gln Ala Val Arg
65 70 75 80
Ala Leu Met Ile Val Gly Ile Val Leu Gly Ala Ile Gly Leu Leu Val
85 90 95
Ser Ile Phe Ala Leu Lys Cys Ile Arg Ile Gly Ser Met Glu Asp Ser
100 105 110
Ala Lys Ala Asn Met Thr Leu Thr Ser Gly Ile Met Phe Ile Val Ser
115 120 125
Gly Leu Cys Ala Ile Ala Gly Val Ser Val Phe Ala Asn Met Leu Val
130 135 140
Thr Asn Phe Trp Met Ser Thr Ala Asn Met Tyr Thr Gly Met Gly Gly
145 150 155 160
Met Val Gln Thr Val Gln Thr Arg Tyr Thr Phe Gly Ala Ala Leu Phe
165 170 175
Val Gly Trp Val Ala Gly Gly Leu Thr Leu Ile Gly Gly Val Met Met
180 185 190
Cys Ile Ala Cys Arg Gly Leu Ala Pro Glu Glu Thr Asn Tyr Lys Ala
195 200 205
Val Ser Tyr His Ala Ser Gly His Ser Val Ala Tyr Lys Pro Gly Gly
210 215 220
Phe Lys Ala Ser Thr Gly Phe Gly Ser Asn Thr Lys Asn Lys Lys Ile
225 230 235 240
Tyr Asp Gly Gly Ala Arg Thr Glu Asp Glu Val Gln Ser Tyr Pro Ser
245 250 255
Lys His Asp Tyr Val
260
<210> 3
<211> 10
<212> PRT
<213> Homo sapiens
<400> 3
Asp Gln Trp Ser Thr Gln Asp Leu Tyr Asn
1 5 10
<210> 4
<211> 11
<212> PRT
<213> Homo sapiens
<400> 4
Asn Asn Pro Val Thr Ala Val Phe Asn Tyr Gln
1 5 10
<210> 5
<211> 14
<212> PRT
<213> Homo sapiens
<400> 5
Ser Thr Gln Asp Leu Tyr Asn Asn Pro Val Thr Ala Val Phe
1 5 10
<210> 6
<211> 13
<212> PRT
<213> Homo sapiens
<400> 6
Thr Asn Phe Trp Met Ser Thr Ala Asn Met Tyr Thr Gly
1 5 10
<210> 7
<211> 13
<212> PRT
<213> Homo sapiens
<400> 7
Asp Ser Ala Lys Ala Asn Met Thr Leu Thr Ser Gly Ile
1 5 10
<210> 8
<211> 55
<212> PRT
<213> Homo sapiens
<400> 8
Met Asp Gln Trp Ser Thr Gln Asp Leu Tyr Asn Asn Pro Val Thr Ala
1 5 10 15
Val Phe Asn Tyr Gln Gly Leu Trp Arg Ser Cys Val Arg Glu Ser Ser
20 25 30
Gly Phe Thr Glu Cys Arg Gly Tyr Phe Thr Leu Leu Gly Leu Pro Ala
35 40 45
Met Leu Gln Ala Val Arg Ala
50 55
<210> 9
<211> 24
<212> PRT
<213> Homo sapiens
<400> 9
Phe Ala Leu Lys Cys Ile Arg Ile Gly Ser Met Glu Asp Ser Ala Lys
1 5 10 15
Ala Asn Met Thr Leu Thr Ser Gly
20
<210> 10
<211> 40
<212> PRT
<213> Homo sapiens
<400> 10
Ala Asn Met Leu Val Thr Asn Phe Trp Met Ser Thr Ala Asn Met Tyr
1 5 10 15
Thr Gly Met Gly Gly Met Val Gln Thr Val Gln Thr Arg Tyr Thr Phe
20 25 30
Gly Ala Ala Leu Phe Val Gly Trp
35 40
<210> 11
<211> 153
<212> PRT
<213> Homo sapiens
<400> 11
Met Asp Gln Trp Ser Thr Gln Asp Leu Tyr Asn Asn Pro Val Thr Ala
1 5 10 15
Val Phe Asn Tyr Gln Gly Leu Trp Arg Ser Cys Val Arg Glu Ser Ser
20 25 30
Gly Phe Thr Glu Cys Arg Gly Tyr Phe Thr Leu Leu Gly Leu Pro Ala
35 40 45
Met Leu Gln Ala Val Arg Ala Leu Met Ile Val Gly Ile Val Leu Gly
50 55 60
Ala Ile Gly Leu Leu Val Ser Ile Phe Ala Leu Lys Cys Ile Arg Ile
65 70 75 80
Gly Ser Met Glu Asp Ser Ala Lys Ala Asn Met Thr Leu Thr Ser Gly
85 90 95
Ile Met Phe Ile Val Ser Gly Leu Cys Ala Ile Ala Gly Val Ser Val
100 105 110
Phe Ala Asn Met Leu Val Thr Asn Phe Trp Met Ser Thr Ala Asn Met
115 120 125
Tyr Thr Gly Met Gly Gly Met Val Gln Thr Val Gln Thr Arg Tyr Thr
130 135 140
Phe Gly Ala Ala Leu Phe Val Gly Trp
145 150
<210> 12
<211> 107
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 12
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 13
<211> 326
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 13
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
1 5 10 15
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
20 25 30
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
35 40 45
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
50 55 60
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
65 70 75 80
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
85 90 95
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
100 105 110
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
165 170 175
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 14
<211> 466
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 14
Met Glu Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys
20 25 30
Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe
35 40 45
Ser Ser Tyr Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Leu Pro Gly Ser Gly Ser Thr Asn Tyr Asn
65 70 75 80
Glu Lys Phe Lys Gly Lys Ala Thr Phe Thr Ala Asp Thr Ser Ser Asn
85 90 95
Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Tyr Asp Tyr Pro Trp Phe Ala Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
225 230 235 240
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
245 250 255
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
260 265 270
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
275 280 285
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
290 295 300
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
305 310 315 320
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
325 330 335
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
340 345 350
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
355 360 365
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
370 375 380
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
385 390 395 400
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
420 425 430
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
435 440 445
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
450 455 460
Gly Lys
465
<210> 15
<211> 467
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 15
Met Asp Trp Leu Trp Asn Leu Leu Phe Leu Met Ala Ala Ala Gln Ser
1 5 10 15
Ile Gln Ala Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys
20 25 30
Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asn Tyr Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu
50 55 60
Lys Trp Met Gly Trp Ile Asn Thr Asn Thr Gly Glu Pro Thr Tyr Ala
65 70 75 80
Glu Glu Phe Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser
85 90 95
Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr
100 105 110
Tyr Phe Cys Ala Arg Leu Gly Phe Gly Asn Ala Met Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 16
<211> 465
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 16
Met Glu Trp Ile Trp Ile Phe Leu Phe Ile Leu Ser Gly Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg
20 25 30
Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asp Tyr Tyr Ile Asn Trp Val Lys Gln Arg Thr Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Tyr Pro Gly Ser Gly Asn Thr Tyr Tyr Asn
65 70 75 80
Glu Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Phe Cys Ala Arg Ser Tyr Gly Ala Phe Asp Tyr Trp Gly Gln Gly
115 120 125
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
130 135 140
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
145 150 155 160
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
165 170 175
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
180 185 190
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
195 200 205
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
210 215 220
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
225 230 235 240
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
245 250 255
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
260 265 270
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
275 280 285
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
290 295 300
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
305 310 315 320
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
325 330 335
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
340 345 350
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
355 360 365
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
370 375 380
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
385 390 395 400
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
405 410 415
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
420 425 430
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
435 440 445
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
450 455 460
Lys
465
<210> 17
<211> 467
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 17
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg
20 25 30
Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser Trp Arg Gly Asn Ser Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 18
<211> 466
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 18
Met Glu Trp Arg Ile Phe Leu Phe Ile Leu Ser Gly Thr Ala Gly Val
1 5 10 15
His Ser Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr
35 40 45
Asp Tyr Val Ile Ser Trp Val Lys Gln Arg Thr Gly Gln Gly Leu Glu
50 55 60
Trp Ile Gly Glu Ile Tyr Pro Gly Ser Gly Ser Thr Tyr Tyr Asn Glu
65 70 75 80
Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Asn Thr
85 90 95
Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Phe Cys Ala Arg Gly Val Leu Leu Arg Ala Met Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
225 230 235 240
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
245 250 255
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
260 265 270
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
275 280 285
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
290 295 300
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
305 310 315 320
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
325 330 335
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
340 345 350
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
355 360 365
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
370 375 380
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
385 390 395 400
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
420 425 430
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
435 440 445
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
450 455 460
Gly Lys
465
<210> 19
<211> 469
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 19
Met Asp Trp Ile Trp Ile Met Leu His Leu Leu Ala Ala Ala Thr Gly
1 5 10 15
Ile Gln Ser Gln Val His Leu Gln Gln Ser Gly Ser Glu Leu Arg Ser
20 25 30
Pro Gly Ser Ser Val Lys Leu Ser Cys Lys Asp Phe Asp Ser Glu Val
35 40 45
Phe Pro Phe Ala Tyr Met Ser Trp Ile Arg Gln Lys Pro Gly His Gly
50 55 60
Phe Glu Trp Ile Gly Asp Ile Leu Pro Ser Ile Gly Arg Thr Ile Tyr
65 70 75 80
Gly Glu Lys Phe Glu Asp Lys Ala Thr Leu Asp Ala Asp Thr Val Ser
85 90 95
Asn Thr Ala Tyr Leu Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala
100 105 110
Ile Tyr Tyr Cys Ala Arg Gly Glu Gly Tyr Gly Ala Trp Phe Ala Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly
130 135 140
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
145 150 155 160
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
165 170 175
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
180 185 190
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
195 200 205
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
210 215 220
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
225 230 235 240
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
245 250 255
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
260 265 270
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
275 280 285
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
290 295 300
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
305 310 315 320
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
325 330 335
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
340 345 350
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
355 360 365
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
370 375 380
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
385 390 395 400
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
405 410 415
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
420 425 430
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
435 440 445
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
450 455 460
Leu Ser Pro Gly Lys
465
<210> 20
<211> 240
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 20
Met Glu Ser Gln Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser
1 5 10 15
Gly Thr Cys Gly Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr
20 25 30
Val Thr Ala Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln
50 55 60
Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg
65 70 75 80
Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr
100 105 110
Tyr Cys Gln Asn Asp Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr
115 120 125
Lys Leu Glu Leu Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
130 135 140
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
145 150 155 160
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
165 170 175
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
180 185 190
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
195 200 205
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
210 215 220
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235 240
<210> 21
<211> 235
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 21
Met His Phe Gln Val Gln Ile Phe Ser Phe Leu Leu Ile Ser Ala Ser
1 5 10 15
Val Ile Met Ser Arg Gly Gln Ile Val Leu Thr Gln Ser Pro Ala Ile
20 25 30
Met Ser Ala Ser Pro Gly Glu Lys Val Thr Ile Thr Cys Ser Ala Ser
35 40 45
Ser Ser Val Ser Tyr Met His Trp Phe Gln Gln Lys Pro Gly Thr Ser
50 55 60
Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile
85 90 95
Ser Arg Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Arg
100 105 110
Ser Ser Tyr Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
115 120 125
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
130 135 140
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
145 150 155 160
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
165 170 175
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
180 185 190
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
195 200 205
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
210 215 220
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 22
<211> 234
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 22
Met Glu Phe Gln Thr Gln Val Phe Val Phe Val Leu Leu Trp Leu Ser
1 5 10 15
Gly Val Asp Gly Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser
20 25 30
Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn
35 40 45
Val Arg Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
50 55 60
Lys Ala Leu Ile Tyr Leu Ala Ser Asn Arg His Thr Gly Val Pro Asp
65 70 75 80
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Leu Gln His Trp
100 105 110
Asn Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 23
<211> 240
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 23
Met Asp Ser Gln Ala Gln Val Leu Met Leu Leu Leu Leu Trp Val Ser
1 5 10 15
Gly Thr Cys Gly Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala
20 25 30
Val Ser Val Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Tyr Ser Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln
50 55 60
Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg
65 70 75 80
Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Val Lys Ala Glu Asp Leu Ala Val Tyr
100 105 110
Tyr Cys Gln Gln Tyr Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr
115 120 125
Lys Leu Glu Leu Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
130 135 140
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
145 150 155 160
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
165 170 175
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
180 185 190
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
195 200 205
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
210 215 220
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235 240
<210> 24
<211> 240
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 24
Met Glu Ser Gln Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser
1 5 10 15
Gly Thr Cys Gly Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr
20 25 30
Val Thr Ala Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln
50 55 60
Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg
65 70 75 80
Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr
100 105 110
Tyr Cys Gln Asn Asp Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr
115 120 125
Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
130 135 140
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
145 150 155 160
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
165 170 175
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
180 185 190
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
195 200 205
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
210 215 220
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235 240
<210> 25
<211> 239
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 25
Met Asp Ser Gln Ala Gln Val Leu Ile Leu Leu Leu Leu Trp Val Ser
1 5 10 15
Gly Thr Cys Gly Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala
20 25 30
Val Ser Ala Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Asn Ser Arg Thr Arg Lys Asn Tyr Leu Ala Trp Tyr Gln Gln
50 55 60
Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg
65 70 75 80
Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr
100 105 110
Tyr Cys Lys Gln Ser Tyr Asn Leu Tyr Thr Phe Gly Gly Gly Thr Lys
115 120 125
Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
130 135 140
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
145 150 155 160
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
165 170 175
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
180 185 190
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
195 200 205
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
210 215 220
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 26
<211> 240
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 26
Met Asp Ser Gln Ala Gln Val Leu Met Leu Leu Leu Leu Trp Val Ser
1 5 10 15
Gly Thr Cys Gly Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala
20 25 30
Val Ser Val Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Tyr Ser Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln
50 55 60
Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg
65 70 75 80
Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Ala Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Asp Tyr
100 105 110
His Cys Gly Gln Gly Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr
115 120 125
Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
130 135 140
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
145 150 155 160
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
165 170 175
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
180 185 190
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
195 200 205
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
210 215 220
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235 240
<210> 27
<211> 240
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 27
Met Asp Ser Gln Ala Gln Val Leu Met Leu Leu Leu Leu Trp Val Ser
1 5 10 15
Gly Thr Cys Gly Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala
20 25 30
Val Ser Val Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Tyr Ser Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln
50 55 60
Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg
65 70 75 80
Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Val Lys Ala Glu Asp Leu Ala Val Tyr
100 105 110
Tyr Cys Gln Gln Tyr Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr
115 120 125
Lys Leu Glu Leu Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
130 135 140
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
145 150 155 160
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
165 170 175
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
180 185 190
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
195 200 205
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
210 215 220
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235 240
<210> 28
<211> 234
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: chimeric monoclonal antibody
<400> 28
Met Glu Ser Gln Thr Leu Val Phe Ile Ser Ile Leu Leu Trp Leu Tyr
1 5 10 15
Gly Ala Asp Gly Asn Ile Val Met Thr Gln Ser Pro Lys Ser Met Ser
20 25 30
Met Ser Val Gly Glu Arg Val Thr Leu Thr Cys Lys Ala Ser Glu Asn
35 40 45
Val Val Thr Tyr Val Ser Trp Tyr Gln Gln Lys Pro Glu Gln Ser Pro
50 55 60
Lys Leu Leu Ile Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp
65 70 75 80
Arg Phe Thr Gly Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Val Lys Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr
100 105 110
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 29
<211> 117
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 29
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Ser Gly Ser Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Phe Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Pro Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 30
<211> 118
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 30
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Asn Thr Gly Glu Pro Thr Tyr Ala Glu Glu Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Leu Gly Phe Gly Asn Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 31
<211> 116
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 31
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Arg Thr Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Gly Ser Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Tyr Gly Ala Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser
115
<210> 32
<211> 118
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 32
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Trp Arg Gly Asn Ser Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 33
<211> 118
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 33
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Val Ile Ser Trp Val Lys Gln Arg Thr Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Gly Ser Gly Ser Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Val Leu Leu Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 34
<211> 120
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 34
Gln Val His Leu Gln Gln Ser Gly Ser Glu Leu Arg Ser Pro Gly Ser
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Asp Phe Asp Ser Glu Val Phe Pro Phe
20 25 30
Ala Tyr Met Ser Trp Ile Arg Gln Lys Pro Gly His Gly Phe Glu Trp
35 40 45
Ile Gly Asp Ile Leu Pro Ser Ile Gly Arg Thr Ile Tyr Gly Glu Lys
50 55 60
Phe Glu Asp Lys Ala Thr Leu Asp Ala Asp Thr Val Ser Asn Thr Ala
65 70 75 80
Tyr Leu Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr
85 90 95
Cys Ala Arg Gly Glu Gly Tyr Gly Ala Trp Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 35
<211> 113
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 35
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 36
<211> 106
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 36
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Trp Ile Tyr
35 40 45
Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Ser Tyr Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 37
<211> 107
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 37
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Arg Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Ala Leu Ile
35 40 45
Tyr Leu Ala Ser Asn Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Leu Gln His Trp Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 38
<211> 113
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 38
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Val Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Lys Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 39
<211> 113
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 39
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 40
<211> 112
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 40
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Arg Thr Arg Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Lys Gln
85 90 95
Ser Tyr Asn Leu Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 41
<211> 113
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 41
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Val Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Asp Tyr His Cys Gly Gln
85 90 95
Gly Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 42
<211> 113
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 42
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Val Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Lys Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 43
<211> 107
<212> PRT
<213> Artificial
<220>
<223> Description of artificial sequence: Translation of PCR product
<400> 43
Asn Ile Val Met Thr Gln Ser Pro Lys Ser Met Ser Met Ser Val Gly
1 5 10 15
Glu Arg Val Thr Leu Thr Cys Lys Ala Ser Glu Asn Val Val Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Glu Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Lys Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 44
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Epitope
<400> 44
Met Asp Gln Trp Ser Thr Gln Asp Leu Tyr Asn Asn Pro Val Thr
1 5 10 15
<210> 45
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Epitope
<400> 45
Ser Thr Gln Asp Leu Tyr Asn Asn Pro Val Thr Ala Val Phe Asn
1 5 10 15
<210> 46
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Epitope
<400> 46
Leu Tyr Asn Asn Pro Val Thr Ala Val Phe Asn Tyr Gln Gly Leu
1 5 10 15
<210> 47
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Epitope
<400> 47
Pro Val Thr Ala Val Phe Asn Tyr Gln Gly Leu Trp Arg Ser Cys
1 5 10 15
<210> 48
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Epitope
<400> 48
Val Phe Asn Tyr Gln Gly Leu Trp Arg Ser Cys Val Arg Glu Ser
1 5 10 15
<210> 49
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Epitope
<400> 49
Gln Gly Leu Trp Arg Ser Cys Val Arg Glu Ser Ser Gly Phe Thr
1 5 10 15
<210> 50
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Epitope
<400> 50
Arg Ser Cys Val Arg Glu Ser Ser Gly Phe Thr Glu Cys Arg Gly
1 5 10 15
<210> 51
<211> 467
<212> PRT
<213> Artificial Sequence
<220>
<223> chimeric monoclonal antibody
<400> 51
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg
20 25 30
Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser Trp Arg Gly Asn Ser Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 52
<211> 51
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<222> (26)..(26)
<223> n may be C or T
<400> 52
tgggatggag aaggtgggat ccaaanggga gaatttctgg gattttccat t 51
<210> 53
<211> 51
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<222> (26)..(26)
<223> n may be A or G
<400> 53
cccctaaacc cgcaacagtt gttacnggtt ctggtcatgc aagctctacc c 51
<210> 54
<211> 51
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<222> (26)..(26)
<223> n may be A or G
<400> 54
caacactact aaggcttctt tgggangggg aagtagggat aggtaagagg a 51
<210> 55
<211> 51
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<222> (26)..(26)
<223> n may be A or G
<400> 55
aattccacca gcacagccac tcactntgtg ctcatctcac tcctccagca g 51
<210> 56
<211> 51
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<222> (26)..(26)
<223> n may be A or G
<400> 56
aggtccagag ccagtgttct tgttcnacct gaaagtaatg gctctgggtt g 51
<210> 57
<211> 51
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<222> (26)..(26)
<223> n may be A or G
<400> 57
ctttcagccc caatccaagg gttgtngctg gaactttcca tcagttcttc c 51
<210> 58
<211> 51
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<222> (26)..(26)
<223> n may be A or C
<400> 58
ctagcaactc caggctagag ggtcancgcg tctatgcgag gccgggtggg c 51
<210> 59
<211> 51
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<222> (26)..(26)
<223> n may be C or T
<400> 59
atcccgtact gaagttcgtg cgcaangtgc cctgggaatt tggcgacgta a 51
<210> 60
<211> 51
<212> DNA
<213> Homo sapiens
<220>
<221> misc_feature
<222> (26)..(26)
<223> n may be G or T
<400> 60
cggctcctac ttctgcaggg ggcttnttgg gagtaaaaat gtgtcttcag a 51
<210> 61
<211> 2429
<212> DNA
<213> Homo sapiens
<400> 61
ctcttttcta agcttgtctc ttaaaaccca ctggacgttg gcacagtgct gggatgacta 60
tggagaccca aatgtctcag aatgtatgtc ccagaaacct gtggctgctt caaccattga 120
cagttttgct gctgctggct tctgcagaca gtcaagctgc agctccccca aaggctgtgc 180
tgaaacttga gcccccgtgg atcaacgtgc tccaggagga ctctgtgact ctgacatgcc 240
agggggctcg cagccctgag agcgactcca ttcagtggtt ccacaatggg aatctcattc 300
ccacccacac gcagcccagc tacaggttca aggccaacaa caatgacagc ggggagtaca 360
cgtgccagac tggccagacc agcctcagcg accctgtgca tctgactgtg ctttccgaat 420
ggctggtgct ccagacccct cacctggagt tccaggaggg agaaaccatc atgctgaggt 480
gccacagctg gaaggacaag cctctggtca aggtcacatt cttccagaat ggaaaatccc 540
agaaattctc ccatttggat cccaccttct ccatcccaca agcaaaccac agtcacagtg 600
gtgattacca ctgcacagga aacataggct acacgctgtt ctcatccaag cctgtgacca 660
tcactgtcca agtgcccagc atgggcagct cttcaccaat ggggatcatt gtggctgtgg 720
tcattgcgac tgctgtagca gccattgttg ctgctgtagt ggccttgatc tactgcagga 780
aaaagcggat ttcagccaat tccactgatc ctgtgaaggc tgcccaattt gagccacctg 840
gacgtcaaat gattgccatc agaaagagac aacttgaaga aaccaacaat gactatgaaa 900
cagctgacgg cggctacatg actctgaacc ccagggcacc tactgacgat gataaaaaca 960
tctacctgac tcttcctccc aacgaccatg tcaacagtaa taactaaaga gtaacgttat 1020
gccatgtggt catactctca gcttgctgag tggatgacaa aaagagggga attgttaaag 1080
gaaaatttaa atggagactg gaaaaatcct gagcaaacaa aaccacctgg cccttagaaa 1140
tagctttaac tttgcttaaa ctacaaacac aagcaaaact tcacggggtc atactacata 1200
caagcataag caaaacttaa cttggatcat ttctggtaaa tgcttatgtt agaaataaga 1260
caaccccagc caatcacaag cagcctacta acatataatt aggtgactag ggactttcta 1320
agaagatacc tacccccaaa aaacaattat gtaattgaaa accaaccgat tgcctttatt 1380
ttgcttccac attttcccaa taaatacttg cctgtgacat tttgccactg gaacactaaa 1440
cttcatgaat tgcgcctcag atttttcctt taacatcttt tttttttttg acagagtctc 1500
aatctgttac ccaggctgga gtgcagtggt gctatcttgg ctcactgcaa acccgcctcc 1560
caggtttaag cgattctcat gcctcagcct cccagtagct gggattagag gcatgtgcca 1620
tcatacccag ctaatttttg tattttttat tttttttttt tagtagagac agggtttcgc 1680
aatgttggcc aggccgatct cgaacttctg gcctctagcg atctgcccgc ctcggcctcc 1740
caaagtgctg ggatgaccag catcagcccc aatgtccagc ctctttaaca tcttctttcc 1800
tatgccctct ctgtggatcc ctactgctgg tttctgcctt ctccatgctg agaacaaaat 1860
cacctattca ctgcttatgc agtcggaagc tccagaagaa caaagagccc aattaccaga 1920
accacattaa gtctccattg ttttgccttg ggatttgaga agagaattag agaggtgagg 1980
atctggtatt tcctggacta aattcccctt ggggaagacg aagggatgct gcagttccaa 2040
aagagaagga ctcttccaga gtcatctacc tgagtcccaa agctccctgt cctgaaagcc 2100
acagacaata tggtcccaaa tgactgactg caccttctgt gcctcagccg ttcttgacat 2160
caagaatctt ctgttccaca tccacacagc caatacaatt agtcaaacca ctgttattaa 2220
cagatgtagc aacatgagaa acgcttatgt tacaggttac atgagagcaa tcatgtaagt 2280
ctatatgact tcagaaatgt taaaatagac taacctctaa caacaaatta aaagtgattg 2340
tttcaaggtg atgcaattat tgatgaccta ttttattttt ctataatgat catatattac 2400
ctttgtaata aaacattata accaaaaca 2429
<210> 62
<211> 317
<212> PRT
<213> Homo sapiens
<400> 62
Met Thr Met Glu Thr Gln Met Ser Gln Asn Val Cys Pro Arg Asn Leu
1 5 10 15
Trp Leu Leu Gln Pro Leu Thr Val Leu Leu Leu Leu Ala Ser Ala Asp
20 25 30
Ser Gln Ala Ala Ala Pro Pro Lys Ala Val Leu Lys Leu Glu Pro Pro
35 40 45
Trp Ile Asn Val Leu Gln Glu Asp Ser Val Thr Leu Thr Cys Gln Gly
50 55 60
Ala Arg Ser Pro Glu Ser Asp Ser Ile Gln Trp Phe His Asn Gly Asn
65 70 75 80
Leu Ile Pro Thr His Thr Gln Pro Ser Tyr Arg Phe Lys Ala Asn Asn
85 90 95
Asn Asp Ser Gly Glu Tyr Thr Cys Gln Thr Gly Gln Thr Ser Leu Ser
100 105 110
Asp Pro Val His Leu Thr Val Leu Ser Glu Trp Leu Val Leu Gln Thr
115 120 125
Pro His Leu Glu Phe Gln Glu Gly Glu Thr Ile Met Leu Arg Cys His
130 135 140
Ser Trp Lys Asp Lys Pro Leu Val Lys Val Thr Phe Phe Gln Asn Gly
145 150 155 160
Lys Ser Gln Lys Phe Ser His Leu Asp Pro Thr Phe Ser Ile Pro Gln
165 170 175
Ala Asn His Ser His Ser Gly Asp Tyr His Cys Thr Gly Asn Ile Gly
180 185 190
Tyr Thr Leu Phe Ser Ser Lys Pro Val Thr Ile Thr Val Gln Val Pro
195 200 205
Ser Met Gly Ser Ser Ser Pro Met Gly Ile Ile Val Ala Val Val Ile
210 215 220
Ala Thr Ala Val Ala Ala Ile Val Ala Ala Val Val Ala Leu Ile Tyr
225 230 235 240
Cys Arg Lys Lys Arg Ile Ser Ala Asn Ser Thr Asp Pro Val Lys Ala
245 250 255
Ala Gln Phe Glu Pro Pro Gly Arg Gln Met Ile Ala Ile Arg Lys Arg
260 265 270
Gln Leu Glu Glu Thr Asn Asn Asp Tyr Glu Thr Ala Asp Gly Gly Tyr
275 280 285
Met Thr Leu Asn Pro Arg Ala Pro Thr Asp Asp Asp Lys Asn Ile Tyr
290 295 300
Leu Thr Leu Pro Pro Asn Asp His Val Asn Ser Asn Asn
305 310 315
<210> 63
<211> 1193
<212> DNA
<213> Homo sapiens
<400> 63
cgctccacct ctcaagcagc cagcgcctgc ctgaatctgt tctgccccct ccccacccat 60
ttcaccacca ccatgacacc gggcacccag tctcctttct tcctgctgct gctcctcaca 120
gtgcttacag ctaccacagc ccctaaaccc gcaacagttg ttacgggttc tggtcatgca 180
agctctaccc caggtggaga aaaggagact tcggctaccc agagaagttc agtgcccagc 240
tctactgaga agaatgcttt taattcctct ctggaagatc ccagcaccga ctactaccaa 300
gagctgcaga gagacatttc tgaaatgttt ttgcagattt ataaacaagg gggttttctg 360
ggcctctcca atattaagtt caggccagga tctgtggtgg tacaattgac tctggccttc 420
cgagaaggta ccatcaatgt ccacgacgtg gagacacagt tcaatcagta taaaacggaa 480
gcagcctctc gatataacct gacgatctca gacgtcagcg tgagtgatgt gccatttcct 540
ttctctgccc agtctggggc tggggtgcca ggctggggca tcgcgctgct ggtgctggtc 600
tgtgttctgg ttgcgctggc cattgtctat ctcattgcct tggctgtctg tcagtgccgc 660
cgaaagaact acgggcagct ggacatcttt ccagcccggg atacctacca tcctatgagc 720
gagtacccca cctaccacac ccatgggcgc tatgtgcccc ctagcagtac cgatcgtagc 780
ccctatgaga aggtttctgc aggtaatggt ggcagcagcc tctcttacac aaacccagca 840
gtggcagcca cttctgccaa cttgtagggg cacgtcgccc gctgagctga gtggccagcc 900
agtgccattc cactccactc aggttcttca gggccagagc ccctgcaccc tgtttgggct 960
ggtgagctgg gagttcaggt gggctgctca cagcctcctt cagaggcccc accaatttct 1020
cggacacttc tcagtgtgtg gaagctcatg tgggcccctg agggctcatg cctgggaagt 1080
gttgtggtgg gggctcccag gaggactggc ccagagagcc ctgagatagc ggggatcctg 1140
aactggactg aataaaacgt ggtctcccac tgcgccaaaa aaaaaaaaaa aaa 1193
<210> 64
<211> 264
<212> PRT
<213> Homo sapiens
<400> 64
Met Thr Pro Gly Thr Gln Ser Pro Phe Phe Leu Leu Leu Leu Leu Thr
1 5 10 15
Val Leu Thr Ala Thr Thr Ala Pro Lys Pro Ala Thr Val Val Thr Gly
20 25 30
Ser Gly His Ala Ser Ser Thr Pro Gly Gly Glu Lys Glu Thr Ser Ala
35 40 45
Thr Gln Arg Ser Ser Val Pro Ser Ser Thr Glu Lys Asn Ala Phe Asn
50 55 60
Ser Ser Leu Glu Asp Pro Ser Thr Asp Tyr Tyr Gln Glu Leu Gln Arg
65 70 75 80
Asp Ile Ser Glu Met Phe Leu Gln Ile Tyr Lys Gln Gly Gly Phe Leu
85 90 95
Gly Leu Ser Asn Ile Lys Phe Arg Pro Gly Ser Val Val Val Gln Leu
100 105 110
Thr Leu Ala Phe Arg Glu Gly Thr Ile Asn Val His Asp Val Glu Thr
115 120 125
Gln Phe Asn Gln Tyr Lys Thr Glu Ala Ala Ser Arg Tyr Asn Leu Thr
130 135 140
Ile Ser Asp Val Ser Val Ser Asp Val Pro Phe Pro Phe Ser Ala Gln
145 150 155 160
Ser Gly Ala Gly Val Pro Gly Trp Gly Ile Ala Leu Leu Val Leu Val
165 170 175
Cys Val Leu Val Ala Leu Ala Ile Val Tyr Leu Ile Ala Leu Ala Val
180 185 190
Cys Gln Cys Arg Arg Lys Asn Tyr Gly Gln Leu Asp Ile Phe Pro Ala
195 200 205
Arg Asp Thr Tyr His Pro Met Ser Glu Tyr Pro Thr Tyr His Thr His
210 215 220
Gly Arg Tyr Val Pro Pro Ser Ser Thr Asp Arg Ser Pro Tyr Glu Lys
225 230 235 240
Val Ser Ala Gly Asn Gly Gly Ser Ser Leu Ser Tyr Thr Asn Pro Ala
245 250 255
Val Ala Ala Thr Ser Ala Asn Leu
260
<210> 65
<211> 1629
<212> DNA
<213> Homo sapiens
<400> 65
acacatcagg ggcttgctct tgcaaaacca aaccacaaga cagacttgca aaagaaggca 60
tgcacagctc agcactgctc tgttgcctgg tcctcctgac tggggtgagg gccagcccag 120
gccagggcac ccagtctgag aacagctgca cccacttccc aggcaacctg cctaacatgc 180
ttcgagatct ccgagatgcc ttcagcagag tgaagacttt ctttcaaatg aaggatcagc 240
tggacaactt gttgttaaag gagtccttgc tggaggactt taagggttac ctgggttgcc 300
aagccttgtc tgagatgatc cagttttacc tggaggaggt gatgccccaa gctgagaacc 360
aagacccaga catcaaggcg catgtgaact ccctggggga gaacctgaag accctcaggc 420
tgaggctacg gcgctgtcat cgatttcttc cctgtgaaaa caagagcaag gccgtggagc 480
aggtgaagaa tgcctttaat aagctccaag agaaaggcat ctacaaagcc atgagtgagt 540
ttgacatctt catcaactac atagaagcct acatgacaat gaagatacga aactgagaca 600
tcagggtggc gactctatag actctaggac ataaattaga ggtctccaaa atcggatctg 660
gggctctggg atagctgacc cagccccttg agaaacctta ttgtacctct cttatagaat 720
atttattacc tctgatacct caacccccat ttctatttat ttactgagct tctctgtgaa 780
cgatttagaa agaagcccaa tattataatt tttttcaata tttattattt tcacctgttt 840
ttaagctgtt tccatagggt gacacactat ggtatttgag tgttttaaga taaattataa 900
gttacataag ggaggaaaaa aaatgttctt tggggagcca acagaagctt ccattccaag 960
cctgaccacg ctttctagct gttgagctgt tttccctgac ctccctctaa tttatcttgt 1020
ctctgggctt ggggcttcct aactgctaca aatactctta ggaagagaaa ccagggagcc 1080
cctttgatga ttaattcacc ttccagtgtc tcggagggat tcccctaacc tcattcccca 1140
accacttcat tcttgaaagc tgtggccagc ttgttattta taacaaccta aatttggttc 1200
taggccgggc gcggtggctc acgcctgtaa tcccagcact ttgggaggct gaggcgggtg 1260
gatcacttga ggtcaggagt tcctaaccag cctggtcaac atggtgaaac cccgtctcta 1320
ctaaaaatac aaaaattagc cgggcatggt ggcgcgcacc tgtaatccca gctacttggg 1380
aggctgaggc aagagaattg cttgaaccca ggagatggaa gttgcagtga gctgatatca 1440
tgcccctgta ctccagcctg ggtgacagag caagactctg tctcaaaaaa taaaaataaa 1500
aataaatttg gttctaatag aactcagttt taactagaat ttattcaatt cctctgggaa 1560
tgttacattg tttgtctgtc ttcatagcag attttaattt tgaataaata aatgtatctt 1620
attcacatc 1629
<210> 66
<211> 178
<212> PRT
<213> Homo sapiens
<400> 66
Met His Ser Ser Ala Leu Leu Cys Cys Leu Val Leu Leu Thr Gly Val
1 5 10 15
Arg Ala Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His
20 25 30
Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe
35 40 45
Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu
50 55 60
Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys
65 70 75 80
Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro
85 90 95
Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu
100 105 110
Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg
115 120 125
Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn
130 135 140
Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu
145 150 155 160
Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile
165 170 175
Arg Asn
<210> 67
<211> 4324
<212> DNA
<213> Homo sapiens
<400> 67
cggcggcggc gagagcagag gacgagccgg gacgcggcgc cgcggcacca gggcgcgcag 60
ccgggccggc ccgaccccac cggccatacg gtggagccat cgaagccccc acccacaggc 120
tgacagaggc accgttcacc agagggctca acaccgggat ctatgtttaa gttttaactc 180
tcgcctccaa agaccacgat aattccttcc ccaaagccca gcagcccccc agccccgcgc 240
agccccagcc tgcctcccgg cgcccagatg cccgccatgc cctccagcgg ccccggggac 300
accagcagct ctgctgcgga gcgggaggag gaccgaaagg acggagagga gcaggaggag 360
ccgcgtggca aggaggagcg ccaagagccc agcaccacgg cacggaaggt ggggcggcct 420
gggaggaagc gcaagcaccc cccggtggaa agcggtgaca cgccaaagga ccctgcggtg 480
atctccaagt ccccatccat ggcccaggac tcaggcgcct cagagctatt acccaatggg 540
gacttggaga agcggagtga gccccagcca gaggagggga gccctgctgg ggggcagaag 600
ggcggggccc cagcagaggg agagggtgca gctgagaccc tgcctgaagc ctcaagagca 660
gtggaaaatg gctgctgcac ccccaaggag ggccgaggag cccctgcaga agcgggcaaa 720
gaacagaagg agaccaacat cgaatccatg aaaatggagg gctcccgggg ccggctgcgg 780
ggtggcttgg gctgggagtc cagcctccgt cagcggccca tgccgaggct caccttccag 840
gcgggggacc cctactacat cagcaagcgc aagcgggacg agtggctggc acgctggaaa 900
agggaggctg agaagaaagc caaggtcatt gcaggaatga atgctgtgga agaaaaccag 960
gggcccgggg agtctcagaa ggtggaggag gccagccctc ctgctgtgca gcagcccact 1020
gaccccgcat cccccactgt ggctaccacg cctgagcccg tggggtccga tgctggggac 1080
aagaatgcca ccaaagcagg cgatgacgag ccagagtacg aggacggccg gggctttggc 1140
attggggagc tggtgtgggg gaaactgcgg ggcttctcct ggtggccagg ccgcattgtg 1200
tcttggtgga tgacgggccg gagccgagca gctgaaggca cccgctgggt catgtggttc 1260
ggagacggca aattctcagt ggtgtgtgtt gagaagctga tgccgctgag ctcgttttgc 1320
agtgcgttcc accaggccac gtacaacaag cagcccatgt accgcaaagc catctacgag 1380
gtcctgcagg tggccagcag ccgcgcgggg aagctgttcc cggtgtgcca cgacagcgat 1440
gagagtgaca ctgccaaggc cgtggaggtg cagaacaagc ccatgattga atgggccctg 1500
gggggcttcc agccttctgg ccctaagggc ctggagccac cagaagaaga gaagaatccc 1560
tacaaagaag tgtacacgga catgtgggtg gaacctgagg cagctgccta cgcaccacct 1620
ccaccagcca aaaagccccg gaagagcaca gcggagaagc ccaaggtcaa ggagattatt 1680
gatgagcgca caagagagcg gctggtgtac gaggtgcggc agaagtgccg gaacattgag 1740
gacatctgca tctcctgtgg gagcctcaat gttaccctgg aacaccccct cttcgttgga 1800
ggaatgtgcc aaaactgcaa gaactgcttt ctggagtgtg cgtaccagta cgacgacgac 1860
ggctaccagt cctactgcac catctgctgt gggggccgtg aggtgctcat gtgcggaaac 1920
aacaactgct gcaggtgctt ttgcgtggag tgtgtggacc tcttggtggg gccgggggct 1980
gcccaggcag ccattaagga agacccctgg aactgctaca tgtgcgggca caagggtacc 2040
tacgggctgc tgcggcggcg agaggactgg ccctcccggc tccagatgtt cttcgctaat 2100
aaccacgacc aggaatttga ccctccaaag gtttacccac ctgtcccagc tgagaagagg 2160
aagcccatcc gggtgctgtc tctctttgat ggaatcgcta cagggctcct ggtgctgaag 2220
gacttgggca ttcaggtgga ccgctacatt gcctcggagg tgtgtgagga ctccatcacg 2280
gtgggcatgg tgcggcacca ggggaagatc atgtacgtcg gggacgtccg cagcgtcaca 2340
cagaagcata tccaggagtg gggcccattc gatctggtga ttgggggcag tccctgcaat 2400
gacctctcca tcgtcaaccc tgctcgcaag ggcctctacg agggcactgg ccggctcttc 2460
tttgagttct accgcctcct gcatgatgcg cggcccaagg agggagatga tcgccccttc 2520
ttctggctct ttgagaatgt ggtggccatg ggcgttagtg acaagaggga catctcgcga 2580
tttctcgagt ccaaccctgt gatgattgat gccaaagaag tgtcagctgc acacagggcc 2640
cgctacttct ggggtaacct tcccggtatg aacaggccgt tggcatccac tgtgaatgat 2700
aagctggagc tgcaggagtg tctggagcat ggcaggatag ccaagttcag caaagtgagg 2760
accattacta cgaggtcaaa ctccataaag cagggcaaag accagcattt tcctgtcttc 2820
atgaatgaga aagaggacat cttatggtgc actgaaatgg aaagggtatt tggtttccca 2880
gtccactata ctgacgtctc caacatgagc cgcttggcga ggcagagact gctgggccgg 2940
tcatggagcg tgccagtcat ccgccacctc ttcgctccgc tgaaggagta ttttgcgtgt 3000
gtgtaaggga catgggggca aactgaggta gcgacacaaa gttaaacaaa caaacaaaaa 3060
acacaaaaca taataaaaca ccaagaacat gaggatggag agaagtatca gcacccagaa 3120
gagaaaaagg aatttaaaac aaaaaccaca gaggcggaaa taccggaggg ctttgccttg 3180
cgaaaagggt tggacatcat ctcctgattt ttcaatgtta ttcttcagtc ctatttaaaa 3240
acaaaaccaa gctcccttcc cttcctcccc cttccctttt ttttcggtca gaccttttat 3300
tttctactct tttcagaggg gttttctgtt tgtttgggtt ttgtttcttg ctgtgactga 3360
aacaagaagg ttattgcagc aaaaatcagt aacaaaaaat agtaacaata ccttgcagag 3420
gaaaggtggg agagaggaaa aaaggaaatt ctatagaaat ctatatattg ggttgttttt 3480
ttttttgttt tttgtttttt ttttttgggt tttttttttt actatatatc ttttttttgt 3540
tgtctctagc ctgatcagat aggagcacaa gcaggggacg gaaagagaga gacactcagg 3600
cggcagcatt ccctcccagc cactgagctg tcgtgccagc accattcctg gtcacgcaaa 3660
acagaaccca gttagcagca gggagacgag aacaccacac aagacatttt tctacagtat 3720
ttcaggtgcc taccacacag gaaaccttga agaaaatcag tttctagaag ccgctgttac 3780
ctcttgttta cagtttatat atatatgata gatatgagat atatatataa aaggtactgt 3840
taactactgt acaacccgac ttcataatgg tgctttcaaa cagcgagatg agtaaaaaca 3900
tcagcttcca cgttgccttc tgcgcaaagg gtttcaccaa ggatggagaa agggagacag 3960
cttgcagatg gcgcgttctc acggtgggct cttccccttg gtttgtaacg aagtgaagga 4020
ggagaacttg ggagccaggt tctccctgcc aaaaaggggg ctagatgagg tggtcgggcc 4080
cgtggacagc tgagagtggg attcatccag actcatgcaa taaccctttg attgttttct 4140
aaaaggagac tccctcggca agatggcaga gggtacggag tcttcaggcc cagtttctca 4200
ctttagccaa ttcgagggct ccttgtggtg ggatcagaac taatccagag tgtgggaaag 4260
tgacagtcaa aaccccacct ggagcaaata aaaaaacata caaaacgtac tggtgctttc 4320
ctgt 4324
<210> 68
<211> 912
<212> PRT
<213> Homo sapiens
<400> 68
Met Pro Ala Met Pro Ser Ser Gly Pro Gly Asp Thr Ser Ser Ser Ala
1 5 10 15
Ala Glu Arg Glu Glu Asp Arg Lys Asp Gly Glu Glu Gln Glu Glu Pro
20 25 30
Arg Gly Lys Glu Glu Arg Gln Glu Pro Ser Thr Thr Ala Arg Lys Val
35 40 45
Gly Arg Pro Gly Arg Lys Arg Lys His Pro Pro Val Glu Ser Gly Asp
50 55 60
Thr Pro Lys Asp Pro Ala Val Ile Ser Lys Ser Pro Ser Met Ala Gln
65 70 75 80
Asp Ser Gly Ala Ser Glu Leu Leu Pro Asn Gly Asp Leu Glu Lys Arg
85 90 95
Ser Glu Pro Gln Pro Glu Glu Gly Ser Pro Ala Gly Gly Gln Lys Gly
100 105 110
Gly Ala Pro Ala Glu Gly Glu Gly Ala Ala Glu Thr Leu Pro Glu Ala
115 120 125
Ser Arg Ala Val Glu Asn Gly Cys Cys Thr Pro Lys Glu Gly Arg Gly
130 135 140
Ala Pro Ala Glu Ala Gly Lys Glu Gln Lys Glu Thr Asn Ile Glu Ser
145 150 155 160
Met Lys Met Glu Gly Ser Arg Gly Arg Leu Arg Gly Gly Leu Gly Trp
165 170 175
Glu Ser Ser Leu Arg Gln Arg Pro Met Pro Arg Leu Thr Phe Gln Ala
180 185 190
Gly Asp Pro Tyr Tyr Ile Ser Lys Arg Lys Arg Asp Glu Trp Leu Ala
195 200 205
Arg Trp Lys Arg Glu Ala Glu Lys Lys Ala Lys Val Ile Ala Gly Met
210 215 220
Asn Ala Val Glu Glu Asn Gln Gly Pro Gly Glu Ser Gln Lys Val Glu
225 230 235 240
Glu Ala Ser Pro Pro Ala Val Gln Gln Pro Thr Asp Pro Ala Ser Pro
245 250 255
Thr Val Ala Thr Thr Pro Glu Pro Val Gly Ser Asp Ala Gly Asp Lys
260 265 270
Asn Ala Thr Lys Ala Gly Asp Asp Glu Pro Glu Tyr Glu Asp Gly Arg
275 280 285
Gly Phe Gly Ile Gly Glu Leu Val Trp Gly Lys Leu Arg Gly Phe Ser
290 295 300
Trp Trp Pro Gly Arg Ile Val Ser Trp Trp Met Thr Gly Arg Ser Arg
305 310 315 320
Ala Ala Glu Gly Thr Arg Trp Val Met Trp Phe Gly Asp Gly Lys Phe
325 330 335
Ser Val Val Cys Val Glu Lys Leu Met Pro Leu Ser Ser Phe Cys Ser
340 345 350
Ala Phe His Gln Ala Thr Tyr Asn Lys Gln Pro Met Tyr Arg Lys Ala
355 360 365
Ile Tyr Glu Val Leu Gln Val Ala Ser Ser Arg Ala Gly Lys Leu Phe
370 375 380
Pro Val Cys His Asp Ser Asp Glu Ser Asp Thr Ala Lys Ala Val Glu
385 390 395 400
Val Gln Asn Lys Pro Met Ile Glu Trp Ala Leu Gly Gly Phe Gln Pro
405 410 415
Ser Gly Pro Lys Gly Leu Glu Pro Pro Glu Glu Glu Lys Asn Pro Tyr
420 425 430
Lys Glu Val Tyr Thr Asp Met Trp Val Glu Pro Glu Ala Ala Ala Tyr
435 440 445
Ala Pro Pro Pro Pro Ala Lys Lys Pro Arg Lys Ser Thr Ala Glu Lys
450 455 460
Pro Lys Val Lys Glu Ile Ile Asp Glu Arg Thr Arg Glu Arg Leu Val
465 470 475 480
Tyr Glu Val Arg Gln Lys Cys Arg Asn Ile Glu Asp Ile Cys Ile Ser
485 490 495
Cys Gly Ser Leu Asn Val Thr Leu Glu His Pro Leu Phe Val Gly Gly
500 505 510
Met Cys Gln Asn Cys Lys Asn Cys Phe Leu Glu Cys Ala Tyr Gln Tyr
515 520 525
Asp Asp Asp Gly Tyr Gln Ser Tyr Cys Thr Ile Cys Cys Gly Gly Arg
530 535 540
Glu Val Leu Met Cys Gly Asn Asn Asn Cys Cys Arg Cys Phe Cys Val
545 550 555 560
Glu Cys Val Asp Leu Leu Val Gly Pro Gly Ala Ala Gln Ala Ala Ile
565 570 575
Lys Glu Asp Pro Trp Asn Cys Tyr Met Cys Gly His Lys Gly Thr Tyr
580 585 590
Gly Leu Leu Arg Arg Arg Glu Asp Trp Pro Ser Arg Leu Gln Met Phe
595 600 605
Phe Ala Asn Asn His Asp Gln Glu Phe Asp Pro Pro Lys Val Tyr Pro
610 615 620
Pro Val Pro Ala Glu Lys Arg Lys Pro Ile Arg Val Leu Ser Leu Phe
625 630 635 640
Asp Gly Ile Ala Thr Gly Leu Leu Val Leu Lys Asp Leu Gly Ile Gln
645 650 655
Val Asp Arg Tyr Ile Ala Ser Glu Val Cys Glu Asp Ser Ile Thr Val
660 665 670
Gly Met Val Arg His Gln Gly Lys Ile Met Tyr Val Gly Asp Val Arg
675 680 685
Ser Val Thr Gln Lys His Ile Gln Glu Trp Gly Pro Phe Asp Leu Val
690 695 700
Ile Gly Gly Ser Pro Cys Asn Asp Leu Ser Ile Val Asn Pro Ala Arg
705 710 715 720
Lys Gly Leu Tyr Glu Gly Thr Gly Arg Leu Phe Phe Glu Phe Tyr Arg
725 730 735
Leu Leu His Asp Ala Arg Pro Lys Glu Gly Asp Asp Arg Pro Phe Phe
740 745 750
Trp Leu Phe Glu Asn Val Val Ala Met Gly Val Ser Asp Lys Arg Asp
755 760 765
Ile Ser Arg Phe Leu Glu Ser Asn Pro Val Met Ile Asp Ala Lys Glu
770 775 780
Val Ser Ala Ala His Arg Ala Arg Tyr Phe Trp Gly Asn Leu Pro Gly
785 790 795 800
Met Asn Arg Pro Leu Ala Ser Thr Val Asn Asp Lys Leu Glu Leu Gln
805 810 815
Glu Cys Leu Glu His Gly Arg Ile Ala Lys Phe Ser Lys Val Arg Thr
820 825 830
Ile Thr Thr Arg Ser Asn Ser Ile Lys Gln Gly Lys Asp Gln His Phe
835 840 845
Pro Val Phe Met Asn Glu Lys Glu Asp Ile Leu Trp Cys Thr Glu Met
850 855 860
Glu Arg Val Phe Gly Phe Pro Val His Tyr Thr Asp Val Ser Asn Met
865 870 875 880
Ser Arg Leu Ala Arg Gln Arg Leu Leu Gly Arg Ser Trp Ser Val Pro
885 890 895
Val Ile Arg His Leu Phe Ala Pro Leu Lys Glu Tyr Phe Ala Cys Val
900 905 910
<210> 69
<211> 8789
<212> DNA
<213> Homo sapiens
<400> 69
atgctcagtg gcttctcgac aagttggcag caacaacacg gccctggtcg tcgtcgccgc 60
tgcggtaacg gagcggtttg ggtggcggag cctgcgttcg cgccttcccg ctctcctcgg 120
gaggcccttc ctgctctccc ctaggctccg cggccgccca gggggtggga gcgggtgagg 180
ggagccaggc gcccagcgag agaggccccc cgccgcaggg cggcccggga gctcgaggcg 240
gtccggcccg cgcgggcagc ggcgcggcgc tgaggagggg cggcctggcc gggacgcctc 300
ggggcggggg ccgaggagct ctccgggccg ccggggaaag ctacgggccc ggtgcgtccg 360
cggaccagca gcgcgggaga gcggactccc ctcgccaccg cccgagccca ggttatcctg 420
aatacatgtc taacaatttt ccttgcaacg ttagctgttg tttttcactg tttccaaagg 480
atcaaaattg cttcagaaat tggagacata tttgatttaa aaggaaaaac ttgaacaaat 540
ggacaatatg tctattacga atacaccaac aagtaatgat gcctgtctga gcattgtgca 600
tagtttgatg tgccatagac aaggtggaga gagtgaaaca tttgcaaaaa gagcaattga 660
aagtttggta aagaagctga aggagaaaaa agatgaattg gattctttaa taacagctat 720
aactacaaat ggagctcatc ctagtaaatg tgttaccata cagagaacat tggatgggag 780
gcttcaggtg gctggtcgga aaggatttcc tcatgtgatc tatgcccgtc tctggaggtg 840
gcctgatctt cacaaaaatg aactaaaaca tgttaaatat tgtcagtatg cgtttgactt 900
aaaatgtgat agtgtctgtg tgaatccata tcactacgaa cgagttgtat cacctggaat 960
tgatctctca ggattaacac tgcagagtaa tgctccatca agtatgatgg tgaaggatga 1020
atatgtgcat gactttgagg gacagccatc gttgtccact gaaggacatt caattcaaac 1080
catccagcat ccaccaagta atcgtgcatc gacagagaca tacagcaccc cagctctgtt 1140
agccccatct gagtctaatg ctaccagcac tgccaacttt cccaacattc ctgtggcttc 1200
cacaagtcag cctgccagta tactgggggg cagccatagt gaaggactgt tgcagatagc 1260
atcagggcct cagccaggac agcagcagaa tggatttact ggtcagccag ctacttacca 1320
tcataacagc actaccacct ggactggaag taggactgca ccatacacac ctaatttgcc 1380
tcaccaccaa aacggccatc ttcagcacca cccgcctatg ccgccccatc ccggacatta 1440
ctggcctgtt cacaatgagc ttgcattcca gcctcccatt tccaatcatc ctgctcctga 1500
gtattggtgt tccattgctt actttgaaat ggatgttcag gtaggagaga catttaaggt 1560
tccttcaagc tgccctattg ttactgttga tggatacgtg gacccttctg gaggagatcg 1620
cttttgtttg ggtcaactct ccaatgtcca caggacagaa gccattgaga gagcaaggtt 1680
gcacataggc aaaggtgtgc agttggaatg taaaggtgaa ggtgatgttt gggtcaggtg 1740
ccttagtgac cacgcggtct ttgtacagag ttactactta gacagagaag ctgggcgtgc 1800
acctggagat gctgttcata agatctaccc aagtgcatat ataaaggtct ttgatttgcg 1860
tcagtgtcat cgacagatgc agcagcaggc ggctactgca caagctgcag cagctgccca 1920
ggcagcagcc gtggcaggaa acatccctgg cccaggatca gtaggtggaa tagctccagc 1980
tatcagtctg tcagctgctg ctggaattgg tgttgatgac cttcgtcgct tatgcatact 2040
caggatgagt tttgtgaaag gctggggacc ggattaccca agacagagca tcaaagaaac 2100
accttgctgg attgaaattc acttacaccg ggccctccag ctcctagacg aagtacttca 2160
taccatgccg attgcagacc cacaaccttt agactgaggt cttttaccgt tggggccctt 2220
aaccttatca ggatggtgga ctacaaaata caatcctgtt tataatctga agatatattt 2280
cacttttgtt ctgctttatc ttttcataaa gggttgaaaa tgtgtttgct gccttgctcc 2340
tagcagacag aaactggatt aaaacaattt tttttttcct cttcagaact tgtcaggcat 2400
ggctcagagc ttgaagatta ggagaaacac attcttatta attcttcacc tgttatgtat 2460
gaaggaatca ttccagtgct agaaaattta gccctttaaa acgtcttaga gccttttatc 2520
tgcagaacat cgatatgtat atcattctac agaataatcc agtattgctg attttaaagg 2580
cagagaagtt ctcaaagtta attcacctat gttattttgt gtacaagttg ttattgttga 2640
acatacttca aaaataatgt gccatgtggg tgagttaatt ttaccaagag taactttact 2700
ctgtgtttaa aaagtaagtt aataatgtat tgtaatcttt catccaaaat attttttgca 2760
agttatatta gtgaagatgg tttcaattca gattgtcttg caacttcagt tttatttttg 2820
ccaaggcaaa aaactcttaa tctgtgtgta tattgagaat cccttaaaat taccagacaa 2880
aaaaatttaa aattacgttt gttattccta gtggatgact gttgatgaag tatacttttc 2940
ccctgttaaa cagtagttgt attcttctgt atttctaggc acaaggttgg ttgctaagaa 3000
gcctataaga ggaatttctt ttccttcatt catagggaaa ggttttgtat tttttaaaac 3060
actaaaagca gcgtcactct acctaatgtc tcactgttct gcaaaggtgg caatgcttaa 3120
actaaataat gaataaactg aatattttgg aaactgctaa attctatgtt aaatactgtg 3180
cagaataatg gaaacattac agttcataat aggtagtttg gatatttttg tacttgattt 3240
gatgtgactt tttttggtat aatgtttaaa tcatgtatgt tatgatattg tttaaaattc 3300
agtttttgta tcttggggca agactgcaaa cttttttata tcttttggtt attctaagcc 3360
ctttgccatc aatgatcata tcaattggca gtgactttgt atagagaatt taagtagaaa 3420
agttgcagat gtattgactg taccacagac acaatatgta tgctttttac ctagctggta 3480
gcataaataa aactgaatct caacatacaa agttgaattc taggtttgat ttttaagatt 3540
ttttttttct tttgcacttt tgagtccaat ctcagtgatg aggtaccttc tactaaatga 3600
caggcaacag ccagttctat tgggcagctt tgtttttttc cctcacactc taccgggact 3660
tccccatgga cattgtgtat catgtgtaga gttggttttt ttttttttta atttttattt 3720
tactatagca gaaatagacc tgattatcta caagatgata aatagattgt ctacaggata 3780
aatagtatga aataaaatca aggattatct ttcagatgtg tttacttttg cctggagaac 3840
ttttagctat agaaacactt gtgtgatgat agtcctcctt atatcacctg gaatgaacac 3900
agcttctact gccttgctca gaaggtcttt taaatagacc atcctagaaa ccactgagtt 3960
tgcttatttc tgtgatttaa acatagatct tgatccaagc tacatgactt ttgtctttaa 4020
ataacttatc taccacctca tttgtactct tgattactta caaattcttt cagtaaacac 4080
ctaattttct tctgtaaaag tttggtgatt taagttttat tggcagtttt ataaaaagac 4140
atcttctcta gaaattgcta actttaggtc cattttactg tgaatgagga ataggagtga 4200
gttttagaat aacagatttt taaaaatcca gatgatttga ttaaaacctt aatcatacat 4260
tgacataatt cattgcttct tttttttgag atatggagtc ttgctgtgtt gcccaggcag 4320
gagtgcagtg gtatgatctc agctcactgc aacctctgcc tcccgggttc aactgattct 4380
cctgcctcag cctccctggt agctaggatt acaggtgccc gccaccatgc ctggctaact 4440
tttgtagttt tagtagagac ggggttttgc ctgttggcca ggctggtctt gaactcctga 4500
cctcaagtga tccatccacc ttggcctccc aaagtgctgg gattacgggc gtgagccact 4560
gtccctggcc tcattgttcc cttttctact ttaaggaaag ttttcatgtt taatcatctg 4620
gggaaagtat gtgaaaaata tttgttaaga agtatctctt tggagccaag ccacctgtct 4680
tggtttcttt ctactaagag ccataaagta tagaaatact tctagttgtt aagtgcttat 4740
atttgtacct agatttagtc acacgctttt gagaaaacat ctagtatgtt atgatcagct 4800
attcctgaga gcttggttgt taatctatat ttctatttct tagtggtagt catctttgat 4860
gaataagact aaagattctc acaggtttaa aattttatgt ctactttaag ggtaaaatta 4920
tgaggttatg gttctgggtg ggttttctct agctaattca tatctcaaag agtctcaaaa 4980
tgttgaattt cagtgcaagc tgaatgagag atgagccatg tacacccacc gtaagacctc 5040
attccatgtt tgtccagtgc ctttcagtgc attatcaaag ggaatccttc atggtgttgc 5100
ctttattttc cggggagtag atcgtgggat atagtctatc tcatttttaa tagtttaccg 5160
cccctggtat acaaagataa tgacaataaa tcactgccat ataaccttgc tttttccaga 5220
aacatggctg ttttgtattg ctgtaaccac taaataggtt gcctatacca ttcctcctgt 5280
gaacagtgca gatttacagg ttgcatggtc tggcttaagg agagccatac ttgagacatg 5340
tgagtaaact gaactcatat tagctgtgct gcatttcaga cttaaaatcc atttttgtgg 5400
ggcagggtgt ggtgtgtaaa ggggggtgtt tgtaatacaa gttgaaggca aaataaaatg 5460
tcctgtctcc cagatgatat acatcttatt atttttaaag tttattgcta attgtaggaa 5520
ggtgagttgc aggtatcttt gactatggtc atctggggaa ggaaaatttt acattttact 5580
attaatgctc cttaagtgtc tatggaggtt aaagaataaa atggtaaatg tttctgtgcc 5640
tggtttgatg gtaactggtt aatagttact caccatttta tgcagagtca cattagttca 5700
caccctttct gagagccttt tgggagaagc agttttattc tctgagtgga acagagttct 5760
ttttgttgat aatttctagt ttgctccctt cgttattgcc aactttactg gcattttatt 5820
taatgatagc agattgggaa aatggcaaat ttaggttacg gaggtaaatg agtatatgaa 5880
agcaattacc tctaaagcca gttaacaatt attttgtagg tggggtacac tcagcttaaa 5940
gtaatgcatt tttttttccc gtaaaggcag aatccatctt gttgcagata gctatctaaa 6000
taatctcata tcctcttttg caaagactac agagaatagg ctatgacaat cttgttcaag 6060
cctttccatt tttttccctg ataactaagt aatttctttg aacataccaa gaagtatgta 6120
aaaagtccat ggccttattc atccacaaag tggcatccta ggcccagcct tatccctagc 6180
agttgtccca gtgctgctag gttgcttatc ttgtttatct ggaatcactg tggagtgaaa 6240
ttttccacat catccagaat tgccttattt aagaagtaaa acgttttaat ttttagcctt 6300
tttttggtgg agttatttaa tatgtatatc agaggatata ctagatggta acatttcttt 6360
ctgtgcttgg ctatctttgt ggacttcagg ggcttctaaa acagacagga ctgtgttgcc 6420
tttactaaat ggtctgagac agctatggtt ttgaattttt agtttttttt ttttaaccca 6480
cttcccctcc tggtctcttc cctctctgat aattaccatt catatgtgag tgttagtgtg 6540
cctcctttta gcattttctt cttctctttc tgattcttca tttctgactg cctaggcaag 6600
gaaaccagat aaccaaactt actagaacgt tctttaaaac acaagtacaa actctgggac 6660
aggacccaag acactttcct gtgaagtgct gaaaaagacc tcattgtatt ggcatttgat 6720
atcagtttga tgtagcttag agtgcttcct gattcttgct gagtttcagg tagttgagat 6780
agagagaagt gagtcatatt catattttcc cccttagaat aatattttga aaggtttcat 6840
tgcttccact tgaatgctgc tcttacaaaa actggggtta caagggttac taaattagca 6900
tcagtagcca gaggcaatac cgttgtctgg aggacaccag caaacaacac acaacaaagc 6960
aaaacaaacc ttgggaaact aaggccattt gttttgtttt ggtgtcccct ttgaagccct 7020
gccttctggc cttactcctg tacagatatt tttgacctat aggtgccttt atgagaattg 7080
agggtctgac atcctgcccc aaggagtagc taaagtaatt gctagtgttt tcagggattt 7140
taacatcaga ctggaatgaa tgaatgaaac tttttgtcct ttttttttct gttttttttt 7200
ttctaatgta gtaaggacta aggaaaacct ttggtgaaga caatcatttc tctctgttga 7260
tgtggatact tttcacaccg tttatttaaa tgctttctca ataggtccag agccagtgtt 7320
cttgttcaac ctgaaagtaa tggctctggg ttgggccaga cagttgcact ctctagtttg 7380
ccctctgcca caaatttgat gtgtgacctt tgggcaagtc atttatcttc tctgggcctt 7440
agttgcctca tctgtaaaat gagggagttg gagtagatta attattccag ctctgaaatt 7500
ctaagtgacc ttggctacct tgcagcagtt ttggatttct tccttatctt tgttctgctg 7560
tttgaggggg ctttttactt atttccatgt tattcaaagg agactaggct tgatatttta 7620
ttactgttct tttatggaca aaaggttaca tagtatgccc ttaagactta attttaacca 7680
aaggcctagc accaccttag gggctgcaat aaacacttaa cgcgcgtgcg cacgcgcgcg 7740
cgcacacaca cacacacaca cacacacaca cacaggtcag agtttaaggc tttcgagtca 7800
tgacattcta gcttttgaat tgcgtgcaca cacacacgca cgcacacact ctggtcagag 7860
tttattaagg ctttcgagtc atgacattat agcttttgag ttggtgtgtg tgacaccacc 7920
ctcctaagtg gtgtgtgctt gtaatttttt ttttcagtga aaatggattg aaaacctgtt 7980
gttaatgctt agtgatatta tgctcaaaac aaggaaattc ccttgaaccg tgtcaattaa 8040
actggtttat atgactcaag aaaacaatac cagtagatga ttattaactt tattcttggc 8100
tctttttagg tccattttga ttaagtgact tttggctgga tcattcagag ctctcttcta 8160
gcctaccctt ggatgagtac aattaatgaa attcatattt tcaaggacct gggagccttc 8220
cttggggctg ggttgagggt ggggggttgg ggagtcctgg tagaggccag ctttgtggta 8280
gctggagagg aagggatgaa accagctgct gttgcaaagg ctgcttgtca ttgatagaag 8340
gactcacggg cttggattga ttaagactaa acatggagtt ggcaaacttt cttcaagtat 8400
tgagttctgt tcaatgcatt ggacatgtga tttaagggaa aagtgtgaat gcttatagat 8460
gatgaaaacc tggtgggctg cagagcccag tttagaagaa gtgagttggg ggttggggac 8520
agatttggtg gtggtatttc ccaactgttt cctcccctaa attcagagga atgcagctat 8580
gccagaagcc agagaagagc cactcgtagc ttctgctttg gggacaactg gtcagttgaa 8640
agtcccagga gttcctttgt ggctttctgt atacttttgc ctggttaaag tctgtggcta 8700
aaaaatagtc gaacctttct tgagaactct gtaacaaagt atgtttttga ttaaaagaga 8760
aagccaacta aaaaaaaaaa aaaaaaaaa 8789
<210> 70
<211> 552
<212> PRT
<213> Homo sapiens
<400> 70
Met Asp Asn Met Ser Ile Thr Asn Thr Pro Thr Ser Asn Asp Ala Cys
1 5 10 15
Leu Ser Ile Val His Ser Leu Met Cys His Arg Gln Gly Gly Glu Ser
20 25 30
Glu Thr Phe Ala Lys Arg Ala Ile Glu Ser Leu Val Lys Lys Leu Lys
35 40 45
Glu Lys Lys Asp Glu Leu Asp Ser Leu Ile Thr Ala Ile Thr Thr Asn
50 55 60
Gly Ala His Pro Ser Lys Cys Val Thr Ile Gln Arg Thr Leu Asp Gly
65 70 75 80
Arg Leu Gln Val Ala Gly Arg Lys Gly Phe Pro His Val Ile Tyr Ala
85 90 95
Arg Leu Trp Arg Trp Pro Asp Leu His Lys Asn Glu Leu Lys His Val
100 105 110
Lys Tyr Cys Gln Tyr Ala Phe Asp Leu Lys Cys Asp Ser Val Cys Val
115 120 125
Asn Pro Tyr His Tyr Glu Arg Val Val Ser Pro Gly Ile Asp Leu Ser
130 135 140
Gly Leu Thr Leu Gln Ser Asn Ala Pro Ser Ser Met Met Val Lys Asp
145 150 155 160
Glu Tyr Val His Asp Phe Glu Gly Gln Pro Ser Leu Ser Thr Glu Gly
165 170 175
His Ser Ile Gln Thr Ile Gln His Pro Pro Ser Asn Arg Ala Ser Thr
180 185 190
Glu Thr Tyr Ser Thr Pro Ala Leu Leu Ala Pro Ser Glu Ser Asn Ala
195 200 205
Thr Ser Thr Ala Asn Phe Pro Asn Ile Pro Val Ala Ser Thr Ser Gln
210 215 220
Pro Ala Ser Ile Leu Gly Gly Ser His Ser Glu Gly Leu Leu Gln Ile
225 230 235 240
Ala Ser Gly Pro Gln Pro Gly Gln Gln Gln Asn Gly Phe Thr Gly Gln
245 250 255
Pro Ala Thr Tyr His His Asn Ser Thr Thr Thr Trp Thr Gly Ser Arg
260 265 270
Thr Ala Pro Tyr Thr Pro Asn Leu Pro His His Gln Asn Gly His Leu
275 280 285
Gln His His Pro Pro Met Pro Pro His Pro Gly His Tyr Trp Pro Val
290 295 300
His Asn Glu Leu Ala Phe Gln Pro Pro Ile Ser Asn His Pro Ala Pro
305 310 315 320
Glu Tyr Trp Cys Ser Ile Ala Tyr Phe Glu Met Asp Val Gln Val Gly
325 330 335
Glu Thr Phe Lys Val Pro Ser Ser Cys Pro Ile Val Thr Val Asp Gly
340 345 350
Tyr Val Asp Pro Ser Gly Gly Asp Arg Phe Cys Leu Gly Gln Leu Ser
355 360 365
Asn Val His Arg Thr Glu Ala Ile Glu Arg Ala Arg Leu His Ile Gly
370 375 380
Lys Gly Val Gln Leu Glu Cys Lys Gly Glu Gly Asp Val Trp Val Arg
385 390 395 400
Cys Leu Ser Asp His Ala Val Phe Val Gln Ser Tyr Tyr Leu Asp Arg
405 410 415
Glu Ala Gly Arg Ala Pro Gly Asp Ala Val His Lys Ile Tyr Pro Ser
420 425 430
Ala Tyr Ile Lys Val Phe Asp Leu Arg Gln Cys His Arg Gln Met Gln
435 440 445
Gln Gln Ala Ala Thr Ala Gln Ala Ala Ala Ala Ala Gln Ala Ala Ala
450 455 460
Val Ala Gly Asn Ile Pro Gly Pro Gly Ser Val Gly Gly Ile Ala Pro
465 470 475 480
Ala Ile Ser Leu Ser Ala Ala Ala Gly Ile Gly Val Asp Asp Leu Arg
485 490 495
Arg Leu Cys Ile Leu Arg Met Ser Phe Val Lys Gly Trp Gly Pro Asp
500 505 510
Tyr Pro Arg Gln Ser Ile Lys Glu Thr Pro Cys Trp Ile Glu Ile His
515 520 525
Leu His Arg Ala Leu Gln Leu Leu Asp Glu Val Leu His Thr Met Pro
530 535 540
Ile Ala Asp Pro Gln Pro Leu Asp
545 550
<210> 71
<211> 5477
<212> DNA
<213> Homo sapiens
<400> 71
aaaaagagaa actgttggga gaggaatcgt atctccatat ttcttctttc agccccaatc 60
caagggttgt agctggaact ttccatcagt tcttcctttc tttttcctct ctaagccttt 120
gccttgctct gtcacagtga agtcagccag agcagggctg ttaaactctg tgaaatttgt 180
cataagggtg tcaggtattt cttactggct tccaaagaaa catagataaa gaaatctttc 240
ctgtggcttc ccttggcagg ctgcattcag aaggtctctc agttgaagaa agagcttgga 300
ggacaacagc acaacaggag agtaaaagat gccccagggc tgaggcctcc gctcaggcag 360
ccgcatctgg ggtcaatcat actcaccttg cccgggccat gctccagcaa aatcaagctg 420
ttttcttttg aaagttcaaa ctcatcaaga ttatgctgct cactcttatc attctgttgc 480
cagtagtttc aaaatttagt tttgttagtc tctcagcacc gcagcactgg agctgtcctg 540
aaggtactct cgcaggaaat gggaattcta cttgtgtggg tcctgcaccc ttcttaattt 600
tctcccatgg aaatagtatc tttaggattg acacagaagg aaccaattat gagcaattgg 660
tggtggatgc tggtgtctca gtgatcatgg attttcatta taatgagaaa agaatctatt 720
gggtggattt agaaagacaa cttttgcaaa gagtttttct gaatgggtca aggcaagaga 780
gagtatgtaa tatagagaaa aatgtttctg gaatggcaat aaattggata aatgaagaag 840
ttatttggtc aaatcaacag gaaggaatca ttacagtaac agatatgaaa ggaaataatt 900
cccacattct tttaagtgct ttaaaatatc ctgcaaatgt agcagttgat ccagtagaaa 960
ggtttatatt ttggtcttca gaggtggctg gaagccttta tagagcagat ctcgatggtg 1020
tgggagtgaa ggctctgttg gagacatcag agaaaataac agctgtgtca ttggatgtgc 1080
ttgataagcg gctgttttgg attcagtaca acagagaagg aagcaattct cttatttgct 1140
cctgtgatta tgatggaggt tctgtccaca ttagtaaaca tccaacacag cataatttgt 1200
ttgcaatgtc cctttttggt gaccgtatct tctattcaac atggaaaatg aagacaattt 1260
ggatagccaa caaacacact ggaaaggaca tggttagaat taacctccat tcatcatttg 1320
taccacttgg tgaactgaaa gtagtgcatc cacttgcaca acccaaggca gaagatgaca 1380
cttgggagcc tgagcagaaa ctttgcaaat tgaggaaagg aaactgcagc agcactgtgt 1440
gtgggcaaga cctccagtca cacttgtgca tgtgtgcaga gggatacgcc ctaagtcgag 1500
accggaagta ctgtgaagat gttaatgaat gtgctttttg gaatcatggc tgtactcttg 1560
ggtgtaaaaa cacccctgga tcctattact gcacgtgccc tgtaggattt gttctgcttc 1620
ctgatgggaa acgatgtcat caacttgttt cctgtccacg caatgtgtct gaatgcagcc 1680
atgactgtgt tctgacatca gaaggtccct tatgtttctg tcctgaaggc tcagtgcttg 1740
agagagatgg gaaaacatgt agcggttgtt cctcacccga taatggtgga tgtagccagc 1800
tctgcgttcc tcttagccca gtatcctggg aatgtgattg ctttcctggg tatgacctac 1860
aactggatga aaaaagctgt gcagcttcag gaccacaacc atttttgctg tttgccaatt 1920
ctcaagatat tcgacacatg cattttgatg gaacagacta tggaactctg ctcagccagc 1980
agatgggaat ggtttatgcc ctagatcatg accctgtgga aaataagata tactttgccc 2040
atacagccct gaagtggata gagagagcta atatggatgg ttcccagcga gaaaggctta 2100
ttgaggaagg agtagatgtg ccagaaggtc ttgctgtgga ctggattggc cgtagattct 2160
attggacaga cagagggaaa tctctgattg gaaggagtga tttaaatggg aaacgttcca 2220
aaataatcac taaggagaac atctctcaac cacgaggaat tgctgttcat ccaatggcca 2280
agagattatt ctggactgat acagggatta atccacgaat tgaaagttct tccctccaag 2340
gccttggccg tctggttata gccagctctg atctaatctg gcccagtgga ataacgattg 2400
acttcttaac tgacaagttg tactggtgcg atgccaagca gtctgtgatt gaaatggcca 2460
atctggatgg ttcaaaacgc cgaagactta cccagaatga tgtaggtcac ccatttgctg 2520
tagcagtgtt tgaggattat gtgtggttct cagattgggc tatgccatca gtaatgagag 2580
taaacaagag gactggcaaa gatagagtac gtctccaagg cagcatgctg aagccctcat 2640
cactggttgt ggttcatcca ttggcaaaac caggagcaga tccctgctta tatcaaaacg 2700
gaggctgtga acatatttgc aaaaagaggc ttggaactgc ttggtgttcg tgtcgtgaag 2760
gttttatgaa agcctcagat gggaaaacgt gtctggctct ggatggtcat cagctgttgg 2820
caggtggtga agttgatcta aagaaccaag taacaccatt ggacatcttg tccaagacta 2880
gagtgtcaga agataacatt acagaatctc aacacatgct agtggctgaa atcatggtgt 2940
cagatcaaga tgactgtgct cctgtgggat gcagcatgta tgctcggtgt atttcagagg 3000
gagaggatgc cacatgtcag tgtttgaaag gatttgctgg ggatggaaaa ctatgttctg 3060
atatagatga atgtgagatg ggtgtcccag tgtgcccccc tgcctcctcc aagtgcatca 3120
acaccgaagg tggttatgtc tgccggtgct cagaaggcta ccaaggagat gggattcact 3180
gtcttgactc tactccaccc cctcacctca gggaagatga ccaccactat tccgtaagaa 3240
atagtgactc tgaatgtccc ctgtcccacg atgggtactg cctccatgat ggtgtgtgca 3300
tgtatattga agcattggac aagtatgcat gcaactgtgt tgttggctac atcggggagc 3360
gatgtcagta ccgagacctg aagtggtggg aactgcgcca cgctggccac gggcagcagc 3420
agaaggtcat cgtggtggct gtctgcgtgg tggtgcttgt catgctgctc ctcctgagcc 3480
tgtggggggc ccactactac aggactcaga agctgctatc gaaaaaccca aagaatcctt 3540
atgaggagtc gagcagagat gtgaggagtc gcaggcctgc tgacactgag gatgggatgt 3600
cctcttgccc tcaaccttgg tttgtggtta taaaagaaca ccaagacctc aagaatgggg 3660
gtcaaccagt ggctggtgag gatggccagg cagcagatgg gtcaatgcaa ccaacttcat 3720
ggaggcagga gccccagtta tgtggaatgg gcacagagca aggctgctgg attccagtat 3780
ccagtgataa gggctcctgt ccccaggtaa tggagcgaag ctttcatatg ccctcctatg 3840
ggacacagac ccttgaaggg ggtgtcgaga agccccattc tctcctatca gctaacccat 3900
tatggcaaca aagggccctg gacccaccac accaaatgga gctgactcag tgaaaactgg 3960
aattaaaagg aaagtcaaga agaatgaact atgtcgatgc acagtatctt ttctttcaaa 4020
agtagagcaa aactataggt tttggttcca caatctctac gactaatcac ctactcaatg 4080
cctggagaca gatacgtagt tgtgcttttg tttgctcttt taagcagtct cactgcagtc 4140
ttatttccaa gtaagagtac tgggagaatc actaggtaac ttattagaaa cccaaattgg 4200
gacaacagtg ctttgtaaat tgtgttgtct tcagcagtca atacaaatag atttttgttt 4260
ttgttgttcc tgcagcccca gaagaaatta ggggttaaag cagacagtca cactggtttg 4320
gtcagttaca aagtaatttc tttgatctgg acagaacatt tatatcagtt tcatgaaatg 4380
attggaatat tacaataccg ttaagataca gtgtaggcat ttaactcctc attggcgtgg 4440
tccatgctga tgattttgca aaatgagttg tgatgaatca atgaaaaatg taatttagaa 4500
actgatttct tcagaattag atggcttatt ttttaaaata tttgaatgaa aacattttat 4560
ttttaaaata ttacacagga ggcttcggag tttcttagtc attactgtcc ttttccccta 4620
cagaattttc cctcttggtg tgattgcaca gaatttgtat gtattttcag ttacaagatt 4680
gtaagtaaat tgcctgattt gttttcatta tagacaacga tgaatttctt ctaattattt 4740
aaataaaatc accaaaaaca taaacatttt attgtatgcc tgattaagta gttaattata 4800
gtctaaggca gtactagagt tgaaccaaaa tgatttgtca agcttgctga tgtttctgtt 4860
tttcgttttt tttttttttc cggagagagg ataggatctc actctgttat ccaggctgga 4920
gtgtgcaatg gcacaatcat agctcagtgc agcctcaaac tcctgggctc aagcaatcct 4980
cctgcctcag cctcccgagt aactaggacc acaggcacag gccaccatgc ctggctaagg 5040
tttttatttt tattttttgt agacatgggg atcacacaat gttgcccagg ctggtcttga 5100
actcctggcc tcaagcaagg tcgtgctggt aattttgcaa aatgaattgt gattgacttt 5160
cagcctccca acgtattaga ttataggcat tagccatggt gcccagcctt gtaactttta 5220
aaaaaatttt ttaatctaca actctgtaga ttaaaatttc acatggtgtt ctaattaaat 5280
atttttcttg cagccaagat attgttacta cagataacac aacctgatat ggtaacttta 5340
aattttgggg gctttgaatc attcagttta tgcattaact agtccctttg tttatctttc 5400
atttctcaac cccttgtact ttggtgatac cagacatcag aataaaaaga aattgaagta 5460
aaaaaaaaaa aaaaaaa 5477
<210> 72
<211> 1166
<212> PRT
<213> Homo sapiens
<400> 72
Met Leu Leu Thr Leu Ile Ile Leu Leu Pro Val Val Ser Lys Phe Ser
1 5 10 15
Phe Val Ser Leu Ser Ala Pro Gln His Trp Ser Cys Pro Glu Gly Thr
20 25 30
Leu Ala Gly Asn Gly Asn Ser Thr Cys Val Gly Pro Ala Pro Phe Leu
35 40 45
Ile Phe Ser His Gly Asn Ser Ile Phe Arg Ile Asp Thr Glu Gly Thr
50 55 60
Asn Tyr Glu Gln Leu Val Val Asp Ala Gly Val Ser Val Ile Met Asp
65 70 75 80
Phe His Tyr Asn Glu Lys Arg Ile Tyr Trp Val Asp Leu Glu Arg Gln
85 90 95
Leu Leu Gln Arg Val Phe Leu Asn Gly Ser Arg Gln Glu Arg Val Cys
100 105 110
Asn Ile Glu Lys Asn Val Ser Gly Met Ala Ile Asn Trp Ile Asn Glu
115 120 125
Glu Val Ile Trp Ser Asn Gln Gln Glu Gly Ile Ile Thr Val Thr Asp
130 135 140
Met Lys Gly Asn Asn Ser His Ile Leu Leu Ser Ala Leu Lys Tyr Pro
145 150 155 160
Ala Asn Val Ala Val Asp Pro Val Glu Arg Phe Ile Phe Trp Ser Ser
165 170 175
Glu Val Ala Gly Ser Leu Tyr Arg Ala Asp Leu Asp Gly Val Gly Val
180 185 190
Lys Ala Leu Leu Glu Thr Ser Glu Lys Ile Thr Ala Val Ser Leu Asp
195 200 205
Val Leu Asp Lys Arg Leu Phe Trp Ile Gln Tyr Asn Arg Glu Gly Ser
210 215 220
Asn Ser Leu Ile Cys Ser Cys Asp Tyr Asp Gly Gly Ser Val His Ile
225 230 235 240
Ser Lys His Pro Thr Gln His Asn Leu Phe Ala Met Ser Leu Phe Gly
245 250 255
Asp Arg Ile Phe Tyr Ser Thr Trp Lys Met Lys Thr Ile Trp Ile Ala
260 265 270
Asn Lys His Thr Gly Lys Asp Met Val Arg Ile Asn Leu His Ser Ser
275 280 285
Phe Val Pro Leu Gly Glu Leu Lys Val Val His Pro Leu Ala Gln Pro
290 295 300
Lys Ala Glu Asp Asp Thr Trp Glu Pro Glu Gln Lys Leu Cys Lys Leu
305 310 315 320
Arg Lys Gly Asn Cys Ser Ser Thr Val Cys Gly Gln Asp Leu Gln Ser
325 330 335
His Leu Cys Met Cys Ala Glu Gly Tyr Ala Leu Ser Arg Asp Arg Lys
340 345 350
Tyr Cys Glu Asp Val Asn Glu Cys Ala Phe Trp Asn His Gly Cys Thr
355 360 365
Leu Gly Cys Lys Asn Thr Pro Gly Ser Tyr Tyr Cys Thr Cys Pro Val
370 375 380
Gly Phe Val Leu Leu Pro Asp Gly Lys Arg Cys His Gln Leu Val Ser
385 390 395 400
Cys Pro Arg Asn Val Ser Glu Cys Ser His Asp Cys Val Leu Thr Ser
405 410 415
Glu Gly Pro Leu Cys Phe Cys Pro Glu Gly Ser Val Leu Glu Arg Asp
420 425 430
Gly Lys Thr Cys Ser Gly Cys Ser Ser Pro Asp Asn Gly Gly Cys Ser
435 440 445
Gln Leu Cys Val Pro Leu Ser Pro Val Ser Trp Glu Cys Asp Cys Phe
450 455 460
Pro Gly Tyr Asp Leu Gln Leu Asp Glu Lys Ser Cys Ala Ala Ser Gly
465 470 475 480
Pro Gln Pro Phe Leu Leu Phe Ala Asn Ser Gln Asp Ile Arg His Met
485 490 495
His Phe Asp Gly Thr Asp Tyr Gly Thr Leu Leu Ser Gln Gln Met Gly
500 505 510
Met Val Tyr Ala Leu Asp His Asp Pro Val Glu Asn Lys Ile Tyr Phe
515 520 525
Ala His Thr Ala Leu Lys Trp Ile Glu Arg Ala Asn Met Asp Gly Ser
530 535 540
Gln Arg Glu Arg Leu Ile Glu Glu Gly Val Asp Val Pro Glu Gly Leu
545 550 555 560
Ala Val Asp Trp Ile Gly Arg Arg Phe Tyr Trp Thr Asp Arg Gly Lys
565 570 575
Ser Leu Ile Gly Arg Ser Asp Leu Asn Gly Lys Arg Ser Lys Ile Ile
580 585 590
Thr Lys Glu Asn Ile Ser Gln Pro Arg Gly Ile Ala Val His Pro Met
595 600 605
Ala Lys Arg Leu Phe Trp Thr Asp Thr Gly Ile Asn Pro Arg Ile Glu
610 615 620
Ser Ser Ser Leu Gln Gly Leu Gly Arg Leu Val Ile Ala Ser Ser Asp
625 630 635 640
Leu Ile Trp Pro Ser Gly Ile Thr Ile Asp Phe Leu Thr Asp Lys Leu
645 650 655
Tyr Trp Cys Asp Ala Lys Gln Ser Val Ile Glu Met Ala Asn Leu Asp
660 665 670
Gly Ser Lys Arg Arg Arg Leu Thr Gln Asn Asp Val Gly His Pro Phe
675 680 685
Ala Val Ala Val Phe Glu Asp Tyr Val Trp Phe Ser Asp Trp Ala Met
690 695 700
Pro Ser Val Met Arg Val Asn Lys Arg Thr Gly Lys Asp Arg Val Arg
705 710 715 720
Leu Gln Gly Ser Met Leu Lys Pro Ser Ser Leu Val Val Val His Pro
725 730 735
Leu Ala Lys Pro Gly Ala Asp Pro Cys Leu Tyr Gln Asn Gly Gly Cys
740 745 750
Glu His Ile Cys Lys Lys Arg Leu Gly Thr Ala Trp Cys Ser Cys Arg
755 760 765
Glu Gly Phe Met Lys Ala Ser Asp Gly Lys Thr Cys Leu Ala Leu Asp
770 775 780
Gly His Gln Leu Leu Ala Gly Gly Glu Val Asp Leu Lys Asn Gln Val
785 790 795 800
Thr Pro Leu Asp Ile Leu Ser Lys Thr Arg Val Ser Glu Asp Asn Ile
805 810 815
Thr Glu Ser Gln His Met Leu Val Ala Glu Ile Met Val Ser Asp Gln
820 825 830
Asp Asp Cys Ala Pro Val Gly Cys Ser Met Tyr Ala Arg Cys Ile Ser
835 840 845
Glu Gly Glu Asp Ala Thr Cys Gln Cys Leu Lys Gly Phe Ala Gly Asp
850 855 860
Gly Lys Leu Cys Ser Asp Ile Asp Glu Cys Glu Met Gly Val Pro Val
865 870 875 880
Cys Pro Pro Ala Ser Ser Lys Cys Ile Asn Thr Glu Gly Gly Tyr Val
885 890 895
Cys Arg Cys Ser Glu Gly Tyr Gln Gly Asp Gly Ile His Cys Leu Asp
900 905 910
Ser Thr Pro Pro Pro His Leu Arg Glu Asp Asp His His Tyr Ser Val
915 920 925
Arg Asn Ser Asp Ser Glu Cys Pro Leu Ser His Asp Gly Tyr Cys Leu
930 935 940
His Asp Gly Val Cys Met Tyr Ile Glu Ala Leu Asp Lys Tyr Ala Cys
945 950 955 960
Asn Cys Val Val Gly Tyr Ile Gly Glu Arg Cys Gln Tyr Arg Asp Leu
965 970 975
Lys Trp Trp Glu Leu Arg His Ala Gly His Gly Gln Gln Gln Lys Val
980 985 990
Ile Val Val Ala Val Cys Val Val Val Leu Val Met Leu Leu Leu Leu
995 1000 1005
Ser Leu Trp Gly Ala His Tyr Tyr Arg Thr Gln Lys Leu Leu Ser
1010 1015 1020
Lys Asn Pro Lys Asn Pro Tyr Glu Glu Ser Ser Arg Asp Val Arg
1025 1030 1035
Ser Arg Arg Pro Ala Asp Thr Glu Asp Gly Met Ser Ser Cys Pro
1040 1045 1050
Gln Pro Trp Phe Val Val Ile Lys Glu His Gln Asp Leu Lys Asn
1055 1060 1065
Gly Gly Gln Pro Val Ala Gly Glu Asp Gly Gln Ala Ala Asp Gly
1070 1075 1080
Ser Met Gln Pro Thr Ser Trp Arg Gln Glu Pro Gln Leu Cys Gly
1085 1090 1095
Met Gly Thr Glu Gln Gly Cys Trp Ile Pro Val Ser Ser Asp Lys
1100 1105 1110
Gly Ser Cys Pro Gln Val Met Glu Arg Ser Phe His Met Pro Ser
1115 1120 1125
Tyr Gly Thr Gln Thr Leu Glu Gly Gly Val Glu Lys Pro His Ser
1130 1135 1140
Leu Leu Ser Ala Asn Pro Leu Trp Gln Gln Arg Ala Leu Asp Pro
1145 1150 1155
Pro His Gln Met Glu Leu Thr Gln
1160 1165
<210> 73
<211> 4815
<212> DNA
<213> Homo sapiens
<400> 73
agtggcgtcg gaactgcaaa gcacctgtga gcttgcggaa gtcagttcag actccagccc 60
gctccagccc ggcccgaccc gaccgcaccc ggcgcctgcc ctcgctcggc gtccccggcc 120
agccatgggc ccttggagcc gcagcctctc ggcgctgctg ctgctgctgc aggtctcctc 180
ttggctctgc caggagccgg agccctgcca ccctggcttt gacgccgaga gctacacgtt 240
cacggtgccc cggcgccacc tggagagagg ccgcgtcctg ggcagagtga attttgaaga 300
ttgcaccggt cgacaaagga cagcctattt ttccctcgac acccgattca aagtgggcac 360
agatggtgtg attacagtca aaaggcctct acggtttcat aacccacaga tccatttctt 420
ggtctacgcc tgggactcca cctacagaaa gttttccacc aaagtcacgc tgaatacagt 480
ggggcaccac caccgccccc cgccccatca ggcctccgtt tctggaatcc aagcagaatt 540
gctcacattt cccaactcct ctcctggcct cagaagacag aagagagact gggttattcc 600
tcccatcagc tgcccagaaa atgaaaaagg cccatttcct aaaaacctgg ttcagatcaa 660
atccaacaaa gacaaagaag gcaaggtttt ctacagcatc actggccaag gagctgacac 720
accccctgtt ggtgtcttta ttattgaaag agaaacagga tggctgaagg tgacagagcc 780
tctggataga gaacgcattg ccacatacac tctcttctct cacgctgtgt catccaacgg 840
gaatgcagtt gaggatccaa tggagatttt gatcacggta accgatcaga atgacaacaa 900
gcccgaattc acccaggagg tctttaaggg gtctgtcatg gaaggtgctc ttccaggaac 960
ctctgtgatg gaggtcacag ccacagacgc ggacgatgat gtgaacacct acaatgccgc 1020
catcgcttac accatcctca gccaagatcc tgagctccct gacaaaaata tgttcaccat 1080
taacaggaac acaggagtca tcagtgtggt caccactggg ctggaccgag agagtttccc 1140
tacgtatacc ctggtggttc aagctgctga ccttcaaggt gaggggttaa gcacaacagc 1200
aacagctgtg atcacagtca ctgacaccaa cgataatcct ccgatcttca atcccaccac 1260
gtacaagggt caggtgcctg agaacgaggc taacgtcgta atcaccacac tgaaagtgac 1320
tgatgctgat gcccccaata ccccagcgtg ggaggctgta tacaccatat tgaatgatga 1380
tggtggacaa tttgtcgtca ccacaaatcc agtgaacaac gatggcattt tgaaaacagc 1440
aaagggcttg gattttgagg ccaagcagca gtacattcta cacgtagcag tgacgaatgt 1500
ggtacctttt gaggtctctc tcaccacctc cacagccacc gtcaccgtgg atgtgctgga 1560
tgtgaatgaa gcccccatct ttgtgcctcc tgaaaagaga gtggaagtgt ccgaggactt 1620
tggcgtgggc caggaaatca catcctacac tgcccaggag ccagacacat ttatggaaca 1680
gaaaataaca tatcggattt ggagagacac tgccaactgg ctggagatta atccggacac 1740
tggtgccatt tccactcggg ctgagctgga cagggaggat tttgagcacg tgaagaacag 1800
cacgtacaca gccctaatca tagctacaga caatggttct ccagttgcta ctggaacagg 1860
gacacttctg ctgatcctgt ctgatgtgaa tgacaacgcc cccataccag aacctcgaac 1920
tatattcttc tgtgagagga atccaaagcc tcaggtcata aacatcattg atgcagacct 1980
tcctcccaat acatctccct tcacagcaga actaacacac ggggcgagtg ccaactggac 2040
cattcagtac aacgacccaa cccaagaatc tatcattttg aagccaaaga tggccttaga 2100
ggtgggtgac tacaaaatca atctcaagct catggataac cagaataaag accaagtgac 2160
caccttagag gtcagcgtgt gtgactgtga aggggccgct ggcgtctgta ggaaggcaca 2220
gcctgtcgaa gcaggattgc aaattcctgc cattctgggg attcttggag gaattcttgc 2280
tttgctaatt ctgattctgc tgctcttgct gtttcttcgg aggagagcgg tggtcaaaga 2340
gcccttactg cccccagagg atgacacccg ggacaacgtt tattactatg atgaagaagg 2400
aggcggagaa gaggaccagg actttgactt gagccagctg cacaggggcc tggacgctcg 2460
gcctgaagtg actcgtaacg acgttgcacc aaccctcatg agtgtccccc ggtatcttcc 2520
ccgccctgcc aatcccgatg aaattggaaa ttttattgat gaaaatctga aagcggctga 2580
tactgacccc acagccccgc cttatgattc tctgctcgtg tttgactatg aaggaagcgg 2640
ttccgaagct gctagtctga gctccctgaa ctcctcagag tcagacaaag accaggacta 2700
tgactacttg aacgaatggg gcaatcgctt caagaagctg gctgacatgt acggaggcgg 2760
cgaggacgac taggggactc gagagaggcg ggccccagac ccatgtgctg ggaaatgcag 2820
aaatcacgtt gctggtggtt tttcagctcc cttcccttga gatgagtttc tggggaaaaa 2880
aaagagactg gttagtgatg cagttagtat agctttatac tctctccact ttatagctct 2940
aataagtttg tgttagaaaa gtttcgactt atttcttaaa gctttttttt ttttcccatc 3000
actctttaca tggtggtgat gtccaaaaga tacccaaatt ttaatattcc agaagaacaa 3060
ctttagcatc agaaggttca cccagcacct tgcagatttt cttaaggaat tttgtctcac 3120
ttttaaaaag aaggggagaa gtcagctact ctagttctgt tgttttgtgt atataatttt 3180
ttaaaaaaaa tttgtgtgct tctgctcatt actacactgg tgtgtccctc tgcctttttt 3240
ttttttttaa gacagggtct cattctatcg gccaggctgg agtgcagtgg tgcaatcaca 3300
gctcactgca gccttgtcct cccaggctca agctatcctt gcacctcagc ctcccaagta 3360
gctgggacca caggcatgca ccactacgca tgactaattt tttaaatatt tgagacgggg 3420
tctccctgtg ttacccaggc tggtctcaaa ctcctgggct caagtgatcc tcccatcttg 3480
gcctcccaga gtattgggat tacagacatg agccactgca cctgcccagc tccccaactc 3540
cctgccattt tttaagagac agtttcgctc catcgcccag gcctgggatg cagtgatgtg 3600
atcatagctc actgtaacct caaactctgg ggctcaagca gttctcccac cagcctcctt 3660
tttatttttt tgtacagatg gggtcttgct atgttgccca agctggtctt aaactcctgg 3720
cctcaagcaa tccttctgcc ttggcccccc aaagtgctgg gattgtgggc atgagctgct 3780
gtgcccagcc tccatgtttt aatatcaact ctcactcctg aattcagttg ctttgcccaa 3840
gataggagtt ctctgatgca gaaattattg ggctctttta gggtaagaag tttgtgtctt 3900
tgtctggcca catcttgact aggtattgtc tactctgaag acctttaatg gcttccctct 3960
ttcatctcct gagtatgtaa cttgcaatgg gcagctatcc agtgacttgt tctgagtaag 4020
tgtgttcatt aatgtttatt tagctctgaa gcaagagtga tatactccag gacttagaat 4080
agtgcctaaa gtgctgcagc caaagacaga gcggaactat gaaaagtggg cttggagatg 4140
gcaggagagc ttgtcattga gcctggcaat ttagcaaact gatgctgagg atgattgagg 4200
tgggtctacc tcatctctga aaattctgga aggaatggag gagtctcaac atgtgtttct 4260
gacacaagat ccgtggtttg tactcaaagc ccagaatccc caagtgcctg cttttgatga 4320
tgtctacaga aaatgctggc tgagctgaac acatttgccc aattccaggt gtgcacagaa 4380
aaccgagaat attcaaaatt ccaaattttt ttcttaggag caagaagaaa atgtggccct 4440
aaagggggtt agttgagggg tagggggtag tgaggatctt gatttggatc tctttttatt 4500
taaatgtgaa tttcaacttt tgacaatcaa agaaaagact tttgttgaaa tagctttact 4560
gtttctcaag tgttttggag aaaaaaatca accctgcaat cactttttgg aattgtcttg 4620
atttttcggc agttcaagct atatcgaata tagttctgtg tagagaatgt cactgtagtt 4680
ttgagtgtat acatgtgtgg gtgctgataa ttgtgtattt tctttggggg tggaaaagga 4740
aaacaattca agctgagaaa agtattctca aagatgcatt tttataaatt ttattaaaca 4800
attttgttaa accat 4815
<210> 74
<211> 882
<212> PRT
<213> Homo sapiens
<400> 74
Met Gly Pro Trp Ser Arg Ser Leu Ser Ala Leu Leu Leu Leu Leu Gln
1 5 10 15
Val Ser Ser Trp Leu Cys Gln Glu Pro Glu Pro Cys His Pro Gly Phe
20 25 30
Asp Ala Glu Ser Tyr Thr Phe Thr Val Pro Arg Arg His Leu Glu Arg
35 40 45
Gly Arg Val Leu Gly Arg Val Asn Phe Glu Asp Cys Thr Gly Arg Gln
50 55 60
Arg Thr Ala Tyr Phe Ser Leu Asp Thr Arg Phe Lys Val Gly Thr Asp
65 70 75 80
Gly Val Ile Thr Val Lys Arg Pro Leu Arg Phe His Asn Pro Gln Ile
85 90 95
His Phe Leu Val Tyr Ala Trp Asp Ser Thr Tyr Arg Lys Phe Ser Thr
100 105 110
Lys Val Thr Leu Asn Thr Val Gly His His His Arg Pro Pro Pro His
115 120 125
Gln Ala Ser Val Ser Gly Ile Gln Ala Glu Leu Leu Thr Phe Pro Asn
130 135 140
Ser Ser Pro Gly Leu Arg Arg Gln Lys Arg Asp Trp Val Ile Pro Pro
145 150 155 160
Ile Ser Cys Pro Glu Asn Glu Lys Gly Pro Phe Pro Lys Asn Leu Val
165 170 175
Gln Ile Lys Ser Asn Lys Asp Lys Glu Gly Lys Val Phe Tyr Ser Ile
180 185 190
Thr Gly Gln Gly Ala Asp Thr Pro Pro Val Gly Val Phe Ile Ile Glu
195 200 205
Arg Glu Thr Gly Trp Leu Lys Val Thr Glu Pro Leu Asp Arg Glu Arg
210 215 220
Ile Ala Thr Tyr Thr Leu Phe Ser His Ala Val Ser Ser Asn Gly Asn
225 230 235 240
Ala Val Glu Asp Pro Met Glu Ile Leu Ile Thr Val Thr Asp Gln Asn
245 250 255
Asp Asn Lys Pro Glu Phe Thr Gln Glu Val Phe Lys Gly Ser Val Met
260 265 270
Glu Gly Ala Leu Pro Gly Thr Ser Val Met Glu Val Thr Ala Thr Asp
275 280 285
Ala Asp Asp Asp Val Asn Thr Tyr Asn Ala Ala Ile Ala Tyr Thr Ile
290 295 300
Leu Ser Gln Asp Pro Glu Leu Pro Asp Lys Asn Met Phe Thr Ile Asn
305 310 315 320
Arg Asn Thr Gly Val Ile Ser Val Val Thr Thr Gly Leu Asp Arg Glu
325 330 335
Ser Phe Pro Thr Tyr Thr Leu Val Val Gln Ala Ala Asp Leu Gln Gly
340 345 350
Glu Gly Leu Ser Thr Thr Ala Thr Ala Val Ile Thr Val Thr Asp Thr
355 360 365
Asn Asp Asn Pro Pro Ile Phe Asn Pro Thr Thr Tyr Lys Gly Gln Val
370 375 380
Pro Glu Asn Glu Ala Asn Val Val Ile Thr Thr Leu Lys Val Thr Asp
385 390 395 400
Ala Asp Ala Pro Asn Thr Pro Ala Trp Glu Ala Val Tyr Thr Ile Leu
405 410 415
Asn Asp Asp Gly Gly Gln Phe Val Val Thr Thr Asn Pro Val Asn Asn
420 425 430
Asp Gly Ile Leu Lys Thr Ala Lys Gly Leu Asp Phe Glu Ala Lys Gln
435 440 445
Gln Tyr Ile Leu His Val Ala Val Thr Asn Val Val Pro Phe Glu Val
450 455 460
Ser Leu Thr Thr Ser Thr Ala Thr Val Thr Val Asp Val Leu Asp Val
465 470 475 480
Asn Glu Ala Pro Ile Phe Val Pro Pro Glu Lys Arg Val Glu Val Ser
485 490 495
Glu Asp Phe Gly Val Gly Gln Glu Ile Thr Ser Tyr Thr Ala Gln Glu
500 505 510
Pro Asp Thr Phe Met Glu Gln Lys Ile Thr Tyr Arg Ile Trp Arg Asp
515 520 525
Thr Ala Asn Trp Leu Glu Ile Asn Pro Asp Thr Gly Ala Ile Ser Thr
530 535 540
Arg Ala Glu Leu Asp Arg Glu Asp Phe Glu His Val Lys Asn Ser Thr
545 550 555 560
Tyr Thr Ala Leu Ile Ile Ala Thr Asp Asn Gly Ser Pro Val Ala Thr
565 570 575
Gly Thr Gly Thr Leu Leu Leu Ile Leu Ser Asp Val Asn Asp Asn Ala
580 585 590
Pro Ile Pro Glu Pro Arg Thr Ile Phe Phe Cys Glu Arg Asn Pro Lys
595 600 605
Pro Gln Val Ile Asn Ile Ile Asp Ala Asp Leu Pro Pro Asn Thr Ser
610 615 620
Pro Phe Thr Ala Glu Leu Thr His Gly Ala Ser Ala Asn Trp Thr Ile
625 630 635 640
Gln Tyr Asn Asp Pro Thr Gln Glu Ser Ile Ile Leu Lys Pro Lys Met
645 650 655
Ala Leu Glu Val Gly Asp Tyr Lys Ile Asn Leu Lys Leu Met Asp Asn
660 665 670
Gln Asn Lys Asp Gln Val Thr Thr Leu Glu Val Ser Val Cys Asp Cys
675 680 685
Glu Gly Ala Ala Gly Val Cys Arg Lys Ala Gln Pro Val Glu Ala Gly
690 695 700
Leu Gln Ile Pro Ala Ile Leu Gly Ile Leu Gly Gly Ile Leu Ala Leu
705 710 715 720
Leu Ile Leu Ile Leu Leu Leu Leu Leu Phe Leu Arg Arg Arg Ala Val
725 730 735
Val Lys Glu Pro Leu Leu Pro Pro Glu Asp Asp Thr Arg Asp Asn Val
740 745 750
Tyr Tyr Tyr Asp Glu Glu Gly Gly Gly Glu Glu Asp Gln Asp Phe Asp
755 760 765
Leu Ser Gln Leu His Arg Gly Leu Asp Ala Arg Pro Glu Val Thr Arg
770 775 780
Asn Asp Val Ala Pro Thr Leu Met Ser Val Pro Arg Tyr Leu Pro Arg
785 790 795 800
Pro Ala Asn Pro Asp Glu Ile Gly Asn Phe Ile Asp Glu Asn Leu Lys
805 810 815
Ala Ala Asp Thr Asp Pro Thr Ala Pro Pro Tyr Asp Ser Leu Leu Val
820 825 830
Phe Asp Tyr Glu Gly Ser Gly Ser Glu Ala Ala Ser Leu Ser Ser Leu
835 840 845
Asn Ser Ser Glu Ser Asp Lys Asp Gln Asp Tyr Asp Tyr Leu Asn Glu
850 855 860
Trp Gly Asn Arg Phe Lys Lys Leu Ala Asp Met Tyr Gly Gly Gly Glu
865 870 875 880
Asp Asp
<210> 75
<211> 3328
<212> DNA
<213> Homo sapiens
<400> 75
ccggaagtgc tgcgagccct gggccacgct ggccgtgctg gcagtgggcc gcctcgatcc 60
ctctgcagtc tttcccttga ggctccaaga ccagcaggtg aggcctcgcg gcgctgaaac 120
cgtgaggccc ggaccacagg ctccagatgg accctgggaa ggacaaagag ggggtgcccc 180
agccctcagg gccgccagca aggaagaaat ttgtgatacc cctcgacgag gatgaggtcc 240
ctcctggagt ggccaagccc ttattccgat ctacacagag ccttcccact gtggacacct 300
cggcccaggc ggcccctcag acctacgccg aatatgccat ctcacagcct ctggaagggg 360
ctggggccac gtgccccaca gggtcagagc ccctggcagg agagacgccc aaccaggccc 420
tgaaacccgg ggcaaaatcc aacagcatca ttgtgagccc tcggcagagg ggcaatcccg 480
tactgaagtt cgtgcgcaat gtgccctggg aatttggcga cgtaattccc gactatgtgc 540
tgggccagag cacctgtgcc ctgttcctca gcctccgcta ccacaacctg cacccagact 600
acatccatgg gcggctgcag agcctgggga agaacttcgc cttgcgggtc ctgcttgtcc 660
aggtggatgt gaaagatccc cagcaggccc tcaaggagct ggctaagatg tgtatcctgg 720
ccgactgcac attgatcctc gcctggagcc ccgaggaagc tgggcggtac ctggagacct 780
acaaggccta tgagcagaaa ccagcggacc tcctgatgga gaagctagag caggacttcg 840
tctcccggtc tctggaacag ctcatcgccg catcaagaga agatctggcc ttatgcccag 900
gcctgggccc tcagaaagcc cggaggctgt ttgatgtcct gcacgagccc ttcttgaaag 960
taccctgatg accccagctg ccaaggaaac ccccagtgta ataataaatc gtcctcccag 1020
gccaggctcc tgctggctgc gctggtgcag tctctgggga gggattctgg gggtgtcacc 1080
ttctggtggc ccaggtgggc accttcagct ttctttagtt cctcagtttc ccgggggcag 1140
actacacagg ctgctgctgc tgctgcttcc gcttcttgtc ccggcctgtg ggagcctcct 1200
ccccagactc tgaattcagt ggcggccctg gcatctcctc ttggggcact gtctctggca 1260
tccggctttc ctgactctgc ttcttcctct tcttggtgga tcccggagtt gccctggctt 1320
caggctgtcc ctcccctggc agttcaggct ctagtggctg aattggctca gtcactgtgt 1380
gacctctctc tttcttcttc ttcttcttct tggtggatgt gggagctgcc tgaggctcaa 1440
ggtcatccgg cagctcaggc cccaccacct ctgtctctgg ctccactgtg gcatcttgct 1500
gtttttcttt cttcgtcttc tttttgggag ctgccagagc tgcctgggcc tgaggcttcg 1560
ctccttctgg ctgttgaggc gccatggtcc cccctgggga ctccagaggc ttcatctccg 1620
gctccactgg ctccatcgcc tccgtccctg gctccatcat tgccatctgt cccttttctt 1680
ttttcctctt cttcgtaggg ggcagaggga tggcttcctc cagtggctcc accttcacct 1740
gtggctgaga ctcaactgtc accccctcct ctggctccat cccttccgtc cccttttgcc 1800
tctttctctt tttggtcggg gacaggactg tgtcttctag aggctcagtg ttaatctgtt 1860
cctgcttcac tgtcttgtct tctggctcga aggtttcttt ccctttgggc ttcttcctct 1920
tcttggtggt ggacgggaac agcactccca gaggctccag tgtctccact gtgggctctg 1980
tccccacagg ccctgctgcc tctggttctt tcagctgctg attttttttc ttcttcttct 2040
tccgcacatc catttctggc gaccccaaag ccatgtccac ctccagggcc ccgtgcccat 2100
tcactgcctc ctgagtgact ggggcctctg tcacctgcat ctcctttttc ttcttccctg 2160
aggtgagcag gttgggggcc aaggctgacc taggccctgt gactggtggg ttgcccccaa 2220
aggcacagaa ccgaggcctc aggccaggag ggatctgtgg tgggggactt gctgggatgg 2280
gctgcagagg gctccctgac agggattgct ggggaccctc aaggatcctt agggtgccct 2340
ggggggctga ggcacaggtg agtccacctc ctgcctccgt tgagggggcc agcagggtcg 2400
cttctccagc ttggggacag ctgctgagga ctcgatagcg gtgccgcttg cctgccaatt 2460
tgcccttgac gatctgggag ccagagagag gcacatgccg cccattgaag ctacagagag 2520
aaacagggag ggcagaggct taagtggaac aggagaggga aggttttttg attttttttt 2580
tgtttttttt tgagagagtc ttgctctgtt gcctaggctg gagtgcagtg gcatgatctc 2640
ggctcactgc aatgtccacc tcctgggttc aagcgattct cctgcctcag cctctcaagt 2700
agctgggatt acaggcacct gccaccacgc ccagccaatt tttgtatttt tagtagagac 2760
aatttcacta tgttggccag gctggtcttg aactcctgac ctcaagtgat ctgctcgcct 2820
cggcctccca aaggatggga ttacaggcac cagccactgc gcctggctgg cctctggttt 2880
ttaataaaac atgactagag tgactccatc ttaaagtgag tagctaggca cttacaaggt 2940
tcatgcttat ggcctgaaaa taaccacatc ccaggctgac caccaattat aattacagaa 3000
tatttatggc catacagaac atgttccacc aagcctgcag aatgtccaaa tgtcctaaga 3060
atgcagcccc cattacttaa atataacata aatgagcaag cttaggttgc aggattaatg 3120
gtcgtggata acaccaatag cccctacctt tagtgagctt atctgcacac tccaagttta 3180
actatagttc cttatagttt cttataagta gaaatactaa caaagggctg tgggtttctc 3240
cccctgcttt ctgaggacac tctactctgt aaaggagtag tttccaataa acttgtttct 3300
ttcactgtgc aaaaaaaaaa aaaaaaaa 3328
<210> 76
<211> 273
<212> PRT
<213> Homo sapiens
<400> 76
Met Asp Pro Gly Lys Asp Lys Glu Gly Val Pro Gln Pro Ser Gly Pro
1 5 10 15
Pro Ala Arg Lys Lys Phe Val Ile Pro Leu Asp Glu Asp Glu Val Pro
20 25 30
Pro Gly Val Ala Lys Pro Leu Phe Arg Ser Thr Gln Ser Leu Pro Thr
35 40 45
Val Asp Thr Ser Ala Gln Ala Ala Pro Gln Thr Tyr Ala Glu Tyr Ala
50 55 60
Ile Ser Gln Pro Leu Glu Gly Ala Gly Ala Thr Cys Pro Thr Gly Ser
65 70 75 80
Glu Pro Leu Ala Gly Glu Thr Pro Asn Gln Ala Leu Lys Pro Gly Ala
85 90 95
Lys Ser Asn Ser Ile Ile Val Ser Pro Arg Gln Arg Gly Asn Pro Val
100 105 110
Leu Lys Phe Val Arg Asn Val Pro Trp Glu Phe Gly Asp Val Ile Pro
115 120 125
Asp Tyr Val Leu Gly Gln Ser Thr Cys Ala Leu Phe Leu Ser Leu Arg
130 135 140
Tyr His Asn Leu His Pro Asp Tyr Ile His Gly Arg Leu Gln Ser Leu
145 150 155 160
Gly Lys Asn Phe Ala Leu Arg Val Leu Leu Val Gln Val Asp Val Lys
165 170 175
Asp Pro Gln Gln Ala Leu Lys Glu Leu Ala Lys Met Cys Ile Leu Ala
180 185 190
Asp Cys Thr Leu Ile Leu Ala Trp Ser Pro Glu Glu Ala Gly Arg Tyr
195 200 205
Leu Glu Thr Tyr Lys Ala Tyr Glu Gln Lys Pro Ala Asp Leu Leu Met
210 215 220
Glu Lys Leu Glu Gln Asp Phe Val Ser Arg Ser Leu Glu Gln Leu Ile
225 230 235 240
Ala Ala Ser Arg Glu Asp Leu Ala Leu Cys Pro Gly Leu Gly Pro Gln
245 250 255
Lys Ala Arg Arg Leu Phe Asp Val Leu His Glu Pro Phe Leu Lys Val
260 265 270
Pro
<210> 77
<211> 2204
<212> DNA
<213> Homo sapiens
<400> 77
ggagccccgg ctcctaggct gacagaccag cccagatcca gtggcccgga ggggcctgag 60
ctaaatccgc aggacctggg taacacgagg aagtcggttt ggtcccttta gggctccgga 120
tatctttggt gacttgtcca ctccagtgtg gcatcatgtg gcagctgctc ctcccaactg 180
ctctgctact tctagtttca gctggcatgc ggactgaaga tctcccaaag gctgtggtgt 240
tcctggagcc tcaatggtac agggtgctcg agaaggacag tgtgactctg aagtgccagg 300
gagcctactc ccctgaggac aattccacac agtggtttca caatgagagc ctcatctcaa 360
gccaggcctc gagctacttc attgacgctg ccacagtcga cgacagtgga gagtacaggt 420
gccagacaaa cctctccacc ctcagtgacc cggtgcagct agaagtccat atcggctggc 480
tgttgctcca ggcccctcgg tgggtgttca aggaggaaga ccctattcac ctgaggtgtc 540
acagctggaa gaacactgct ctgcataagg tcacatattt acagaatggc aaaggcagga 600
agtattttca tcataattct gacttctaca ttccaaaagc cacactcaaa gacagcggct 660
cctacttctg cagggggctt tttgggagta aaaatgtgtc ttcagagact gtgaacatca 720
ccatcactca aggtttggca gtgtcaacca tctcatcatt ctttccacct gggtaccaag 780
tctctttctg cttggtgatg gtactccttt ttgcagtgga cacaggacta tatttctctg 840
tgaagacaaa cattcgaagc tcaacaagag actggaagga ccataaattt aaatggagaa 900
aggaccctca agacaaatga cccccatccc atgggggtaa taagagcagt agcagcagca 960
tctctgaaca tttctctgga tttgcaaccc catcatcctc aggcctctct acaagcagca 1020
ggaaacatag aactcagagc cagatccctt atccaactct cgacttttcc ttggtctcca 1080
gtggaaggga aaagcccatg atcttcaagc agggaagccc cagtgagtag ctgcattcct 1140
agaaattgaa gtttcagagc tacacaaaca ctttttctgt cccaaccgtt ccctcacagc 1200
aaagcaacaa tacaggctag ggatggtaat cctttaaaca tacaaaaatt gctcgtgtta 1260
taaattaccc agtttagagg ggaaaaaaaa acaattattc ctaaataaat ggataagtag 1320
aattaatggt tgaggcagga ccatacagag tgtgggaact gctggggatc tagggaattc 1380
agtgggacca atgaaagcat ggctgagaaa tagcaggtag tccaggatag tctaagggag 1440
gtgttcccat ctgagcccag agataagggt gtcttcctag aacattagcc gtagtggaat 1500
taacaggaaa tcatgagggt gacgtagaat tgagtcttcc aggggactct atcagaactg 1560
gaccatctcc aagtatataa cgatgagtcc tcttaatgct aggagtagaa aatggtccta 1620
ggaaggggac tgaggattgc ggtggggggt ggggtggaaa agaaagtaca gaacaaaccc 1680
tgtgtcactg tcccaagttg ctaagtgaac agaactatct cagcatcaga atgagaaagc 1740
ctgagaagaa agaaccaacc acaagcacac aggaaggaaa gcgcaggagg tgaaaatgct 1800
ttcttggcca gggtagtaag aattagaggt taatgcaggg actgtaaaac caccttttct 1860
gcttcaatat ctaattcctg tgtagctttg ttcattgcat ttattaaaca aatgttgtat 1920
aaccaatact aaatgtacta ctgagcttcg ctgagttaag ttatgaaact ttcaaatcct 1980
tcatcatgtc agttccaatg aggtggggat ggagaagaca attgttgctt atgaaagaaa 2040
gctttagctg tctctgtttt gtaagcttta agcgcaacat ttcttggttc caataaagca 2100
ttttacaaga tcttgcatgc tactcttaga tagaagatgg gaaaaccatg gtaataaaat 2160
atgaatgata aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaa 2204
<210> 78
<211> 254
<212> PRT
<213> Homo sapiens
<400> 78
Met Trp Gln Leu Leu Leu Pro Thr Ala Leu Leu Leu Leu Val Ser Ala
1 5 10 15
Gly Met Arg Thr Glu Asp Leu Pro Lys Ala Val Val Phe Leu Glu Pro
20 25 30
Gln Trp Tyr Arg Val Leu Glu Lys Asp Ser Val Thr Leu Lys Cys Gln
35 40 45
Gly Ala Tyr Ser Pro Glu Asp Asn Ser Thr Gln Trp Phe His Asn Glu
50 55 60
Ser Leu Ile Ser Ser Gln Ala Ser Ser Tyr Phe Ile Asp Ala Ala Thr
65 70 75 80
Val Asp Asp Ser Gly Glu Tyr Arg Cys Gln Thr Asn Leu Ser Thr Leu
85 90 95
Ser Asp Pro Val Gln Leu Glu Val His Ile Gly Trp Leu Leu Leu Gln
100 105 110
Ala Pro Arg Trp Val Phe Lys Glu Glu Asp Pro Ile His Leu Arg Cys
115 120 125
His Ser Trp Lys Asn Thr Ala Leu His Lys Val Thr Tyr Leu Gln Asn
130 135 140
Gly Lys Gly Arg Lys Tyr Phe His His Asn Ser Asp Phe Tyr Ile Pro
145 150 155 160
Lys Ala Thr Leu Lys Asp Ser Gly Ser Tyr Phe Cys Arg Gly Leu Phe
165 170 175
Gly Ser Lys Asn Val Ser Ser Glu Thr Val Asn Ile Thr Ile Thr Gln
180 185 190
Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln
195 200 205
Val Ser Phe Cys Leu Val Met Val Leu Leu Phe Ala Val Asp Thr Gly
210 215 220
Leu Tyr Phe Ser Val Lys Thr Asn Ile Arg Ser Ser Thr Arg Asp Trp
225 230 235 240
Lys Asp His Lys Phe Lys Trp Arg Lys Asp Pro Gln Asp Lys
245 250
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ ЭКСПРЕССИРУЮЩИХ КЛАУДИН РАКОВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2798990C2 |
| ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩАЯ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2014 |
|
RU2832015C2 |
| КОНЪЮГАТЫ ЛЕКАРСТВЕННЫХ СРЕДСТВ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2016 |
|
RU2841168C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ЛЕЧЕНИЯ РАКА | 2014 |
|
RU2792932C2 |
| БИСПЕЦИФИЧЕСКИЕ ТРЕХВАЛЕНТНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С КЛАУДИНОМ 6 ИЛИ КЛАУДИНОМ 18.2, И CD3, ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ С ЭКСПРЕССИЕЙ КЛАУДИНА | 2017 |
|
RU2798988C2 |
| АНТИ-CLDN АНТИТЕЛО, ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕГО ОБНАРУЖЕНИЯ | 2020 |
|
RU2801315C2 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18A2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811431C2 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
| Композиция для предупреждения и лечения заболевания кожи, содержащая вещество, специфично связывающееся с пептидом, имеющим происхождение из виментина | 2018 |
|
RU2751486C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С C5 ЗАБОЛЕВАНИЯ, И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С C5 ЗАБОЛЕВАНИЯ | 2019 |
|
RU2832946C2 |
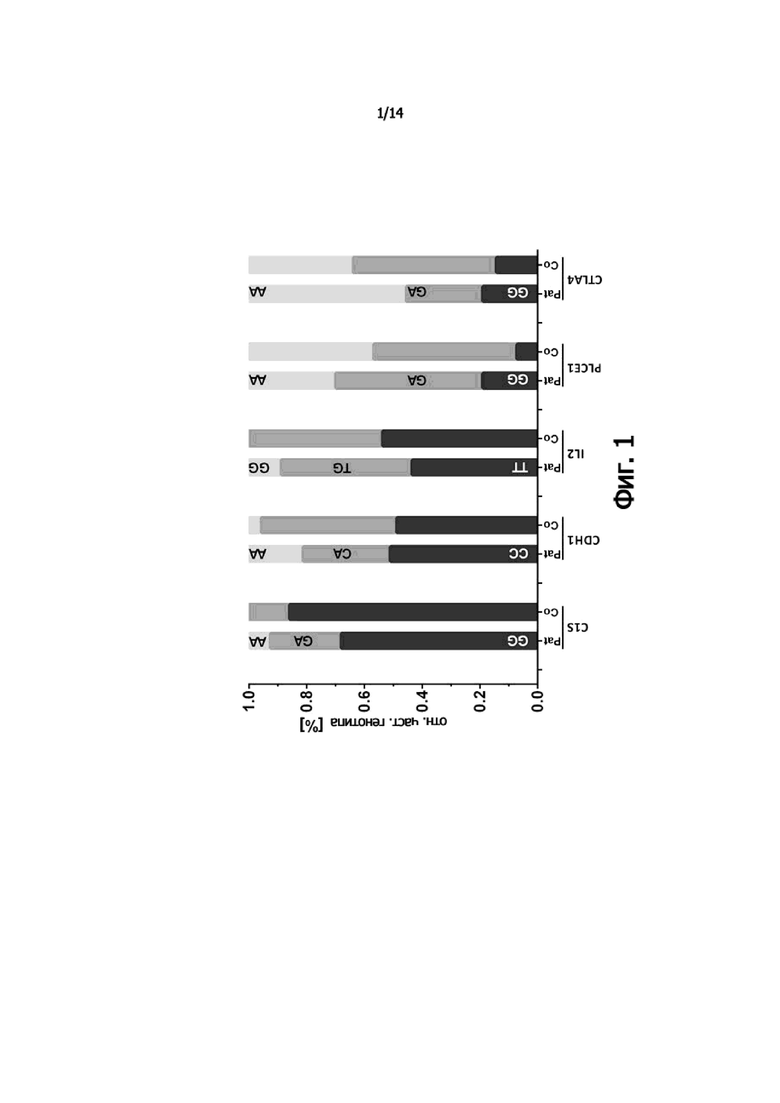
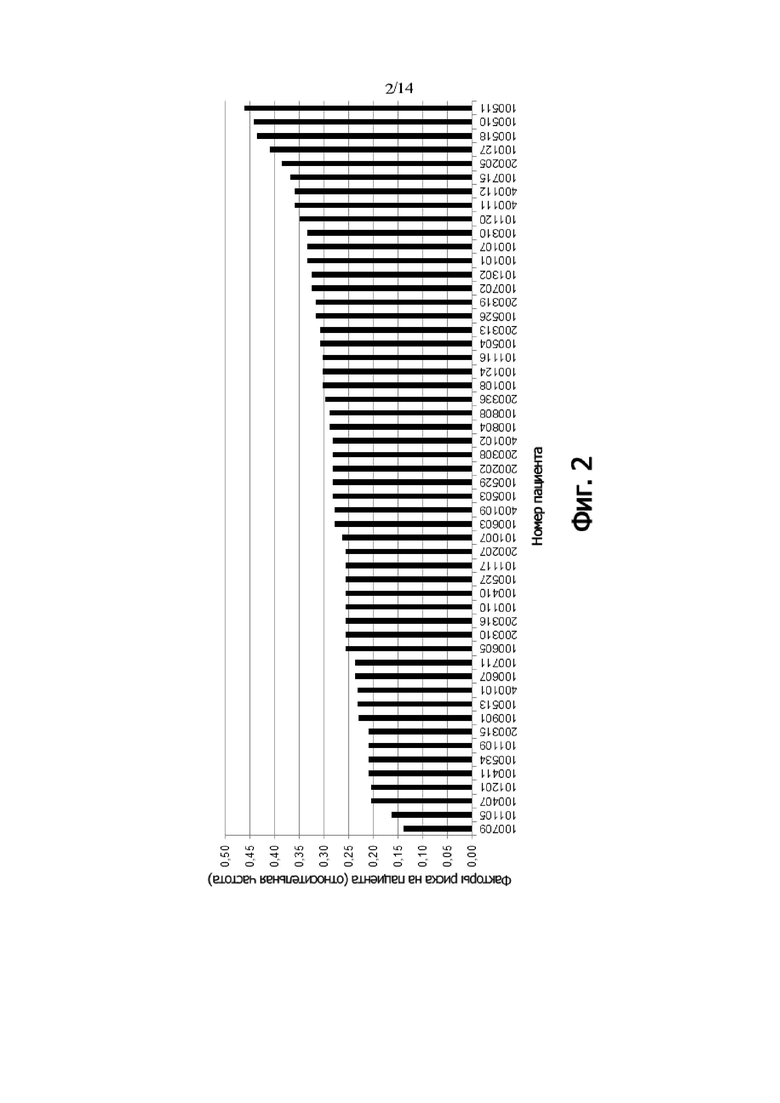
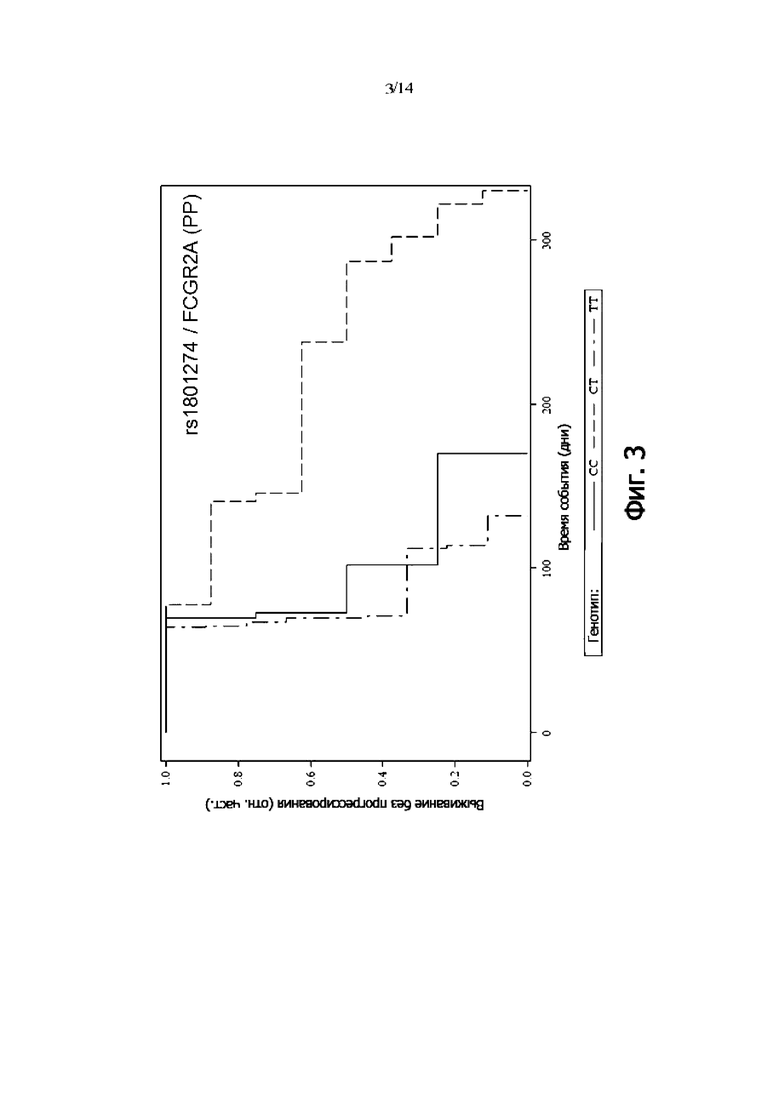
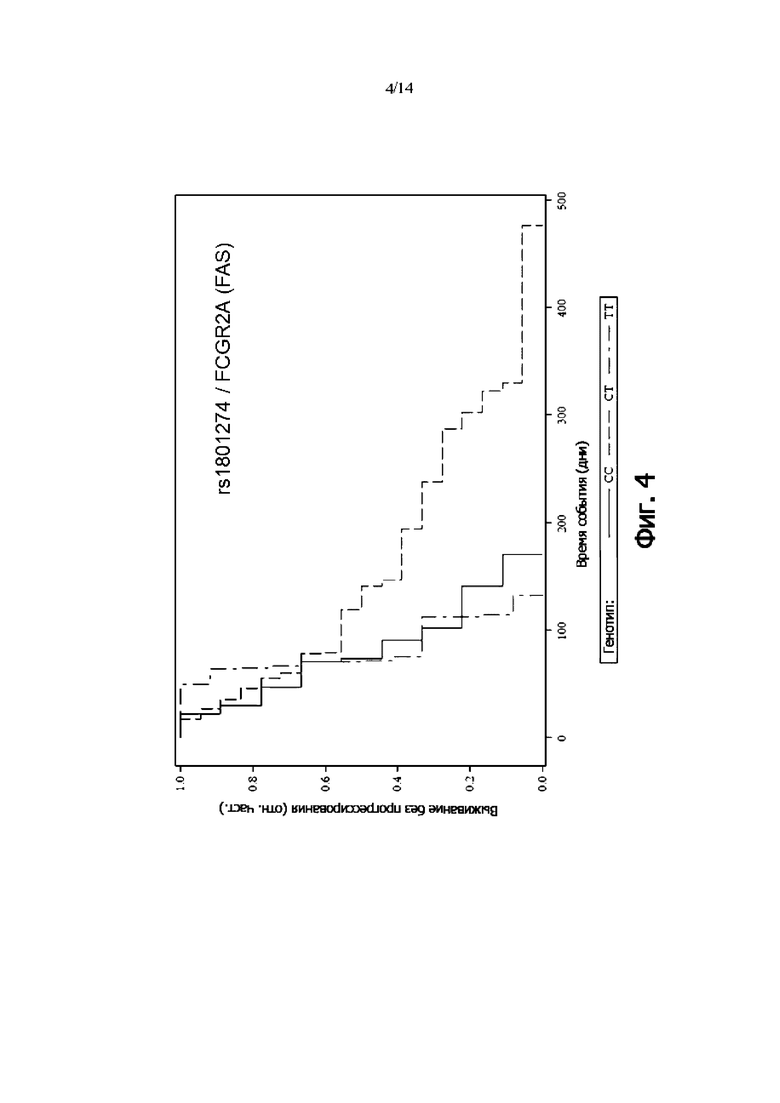
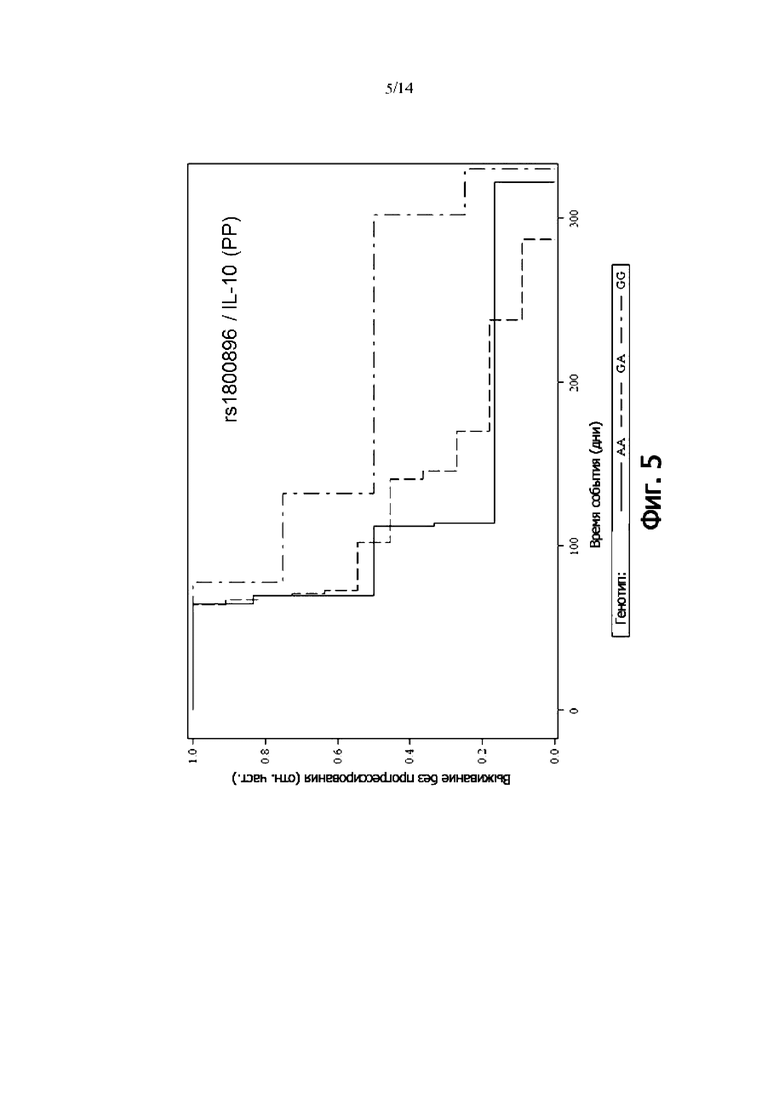
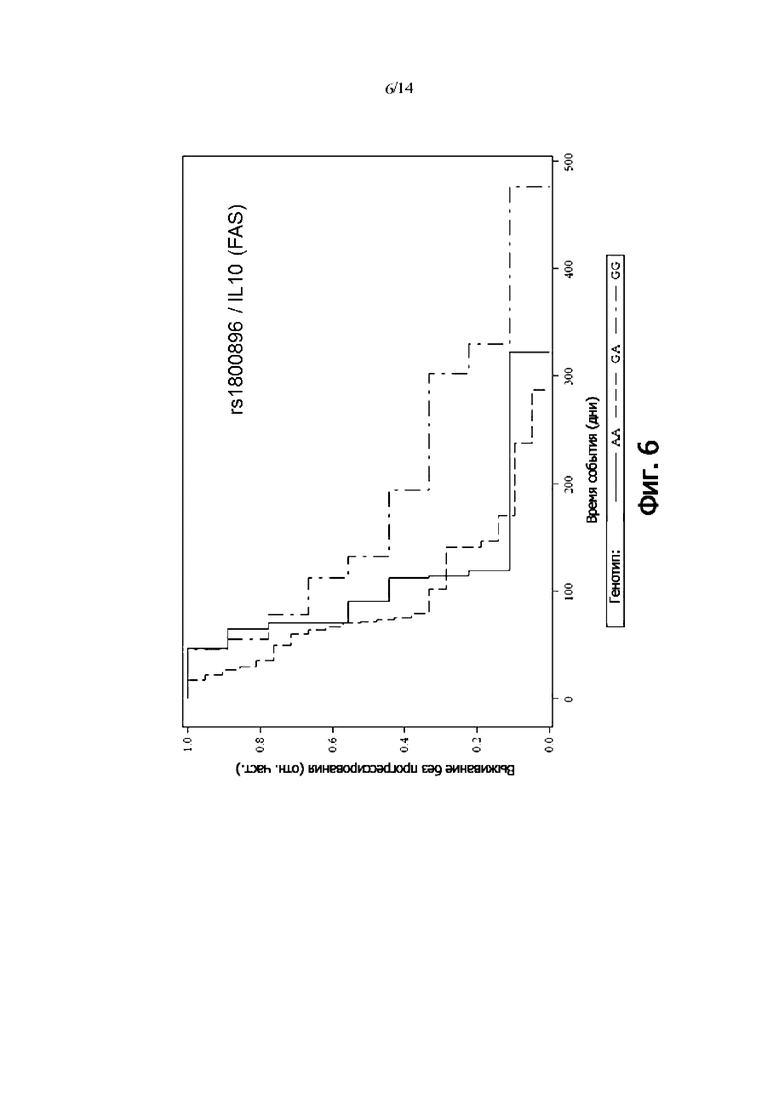
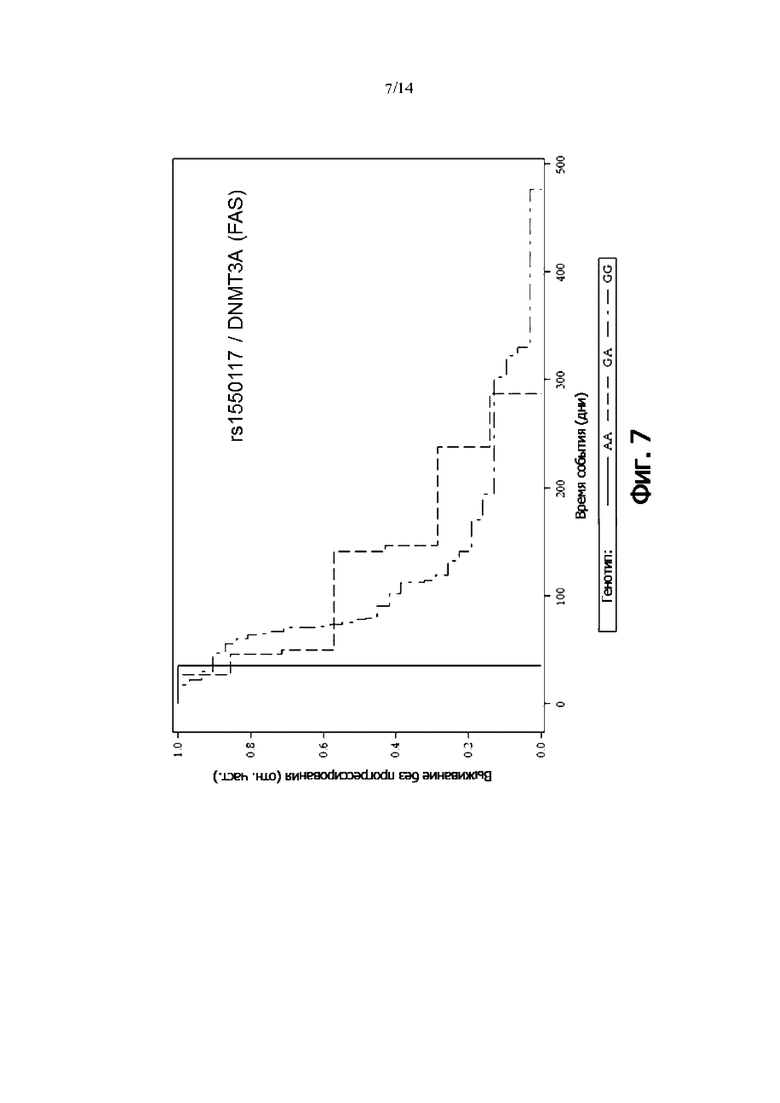
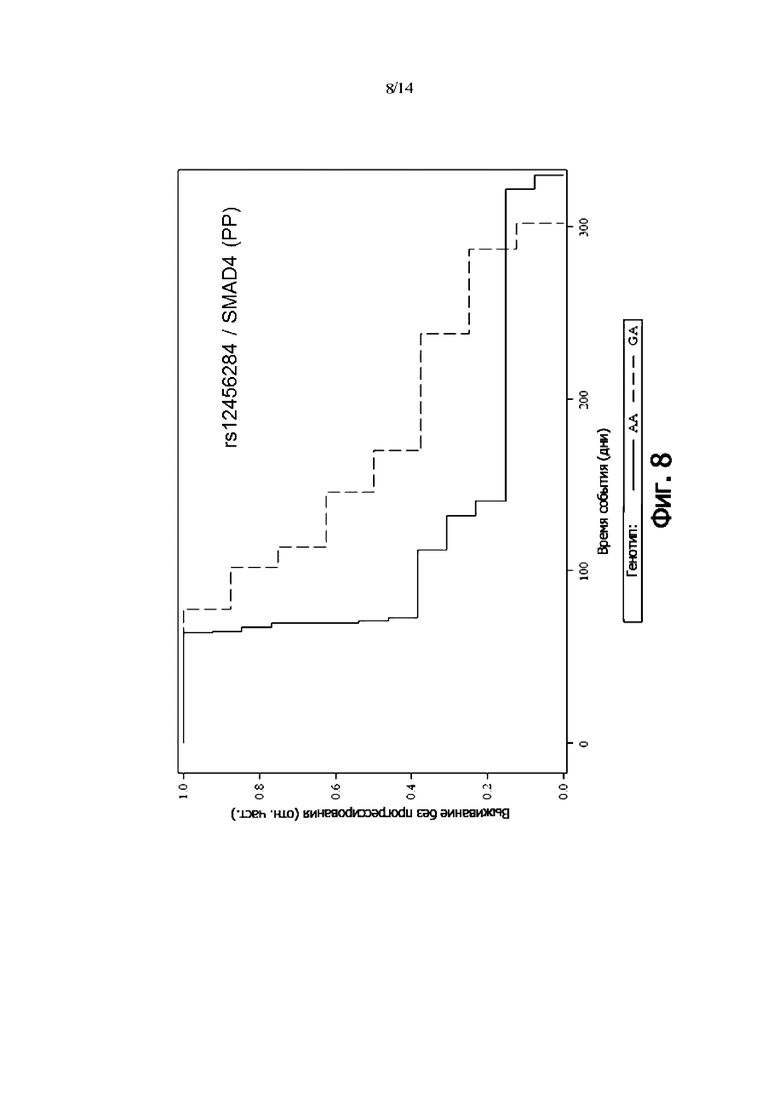
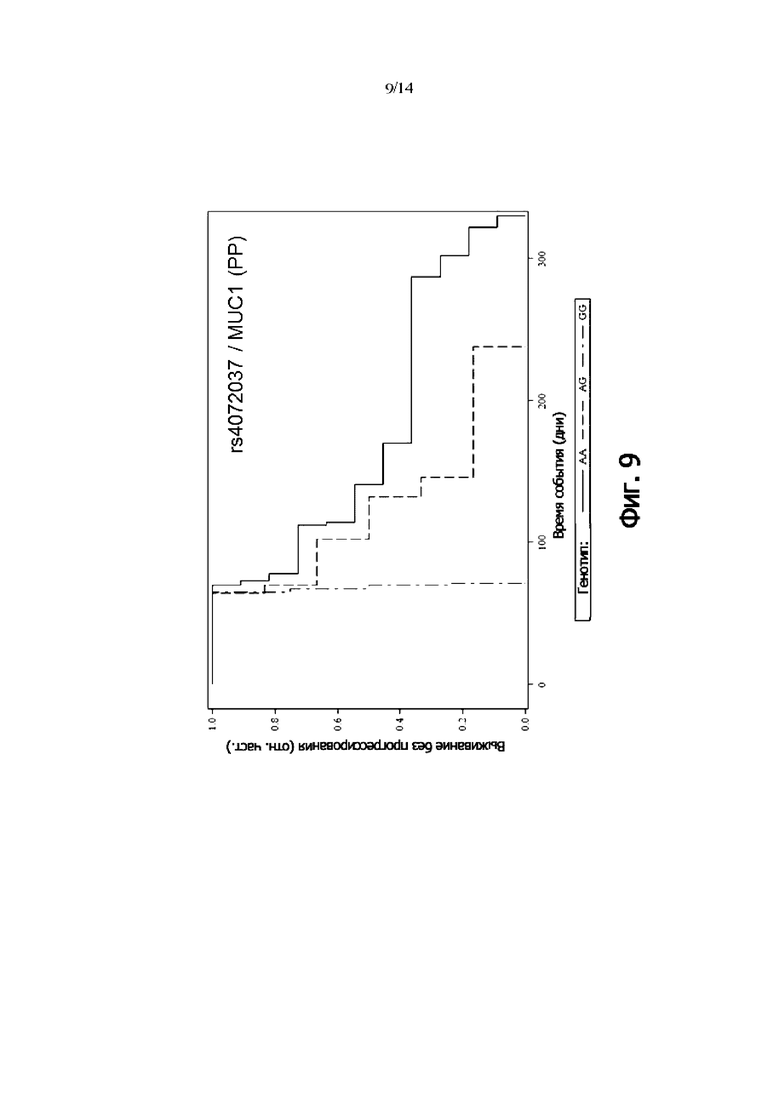
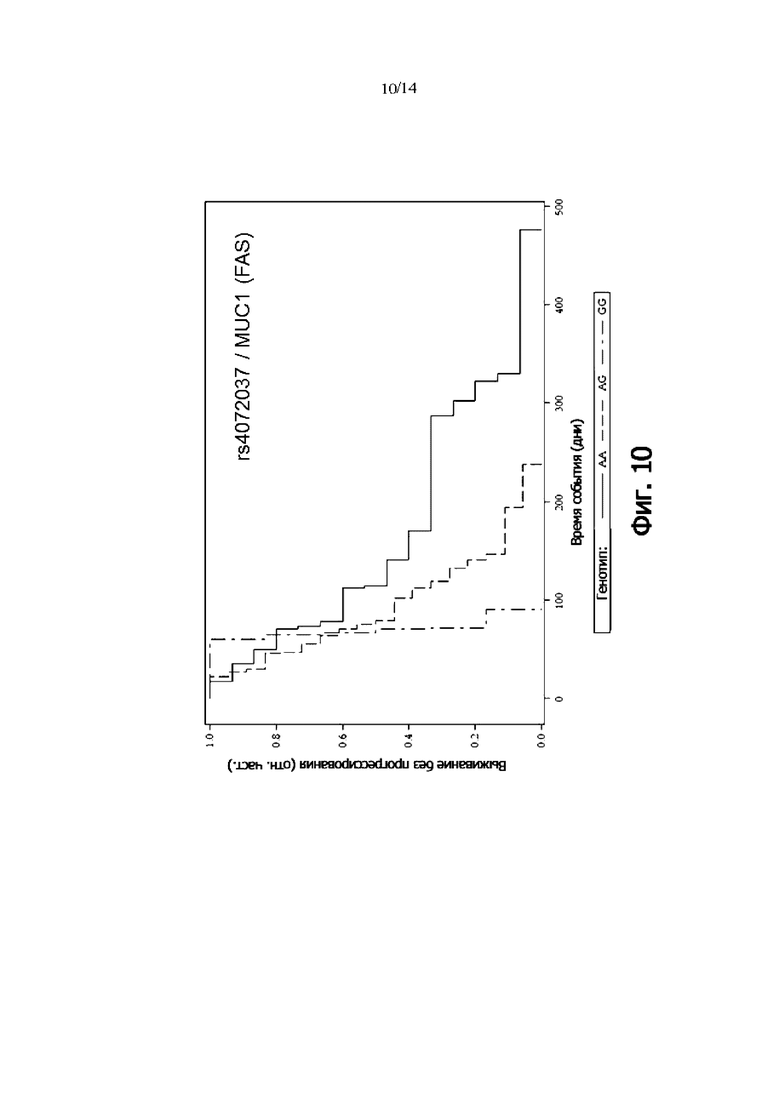
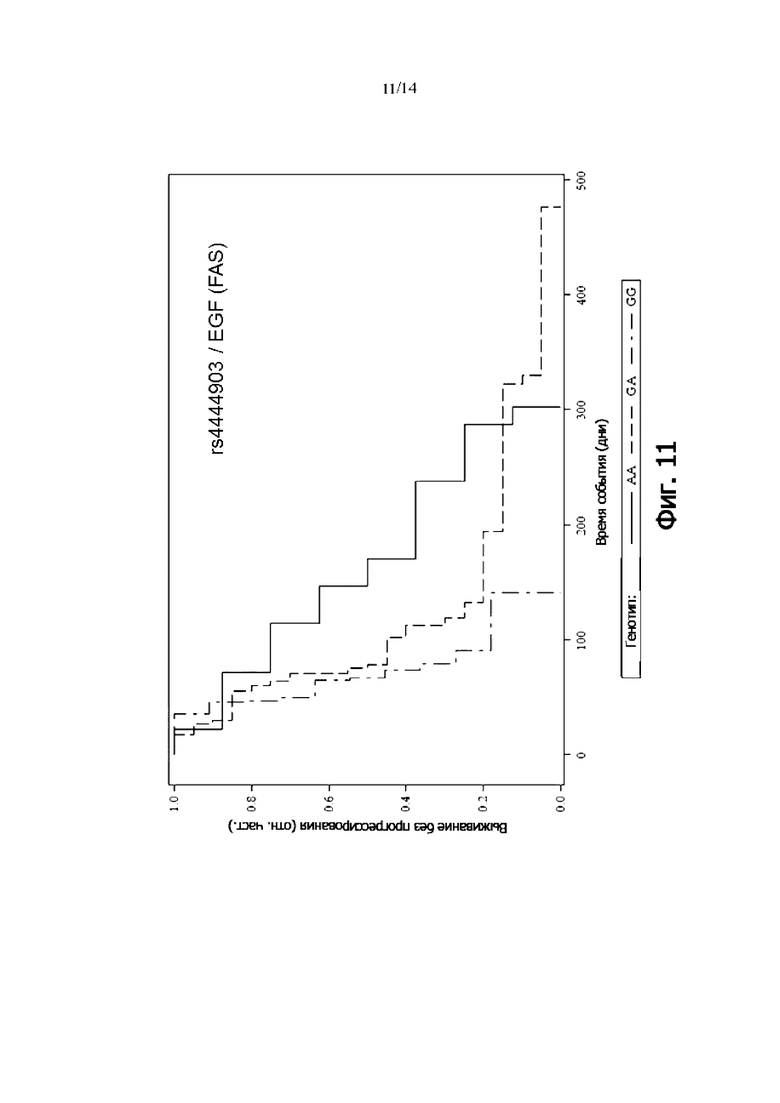
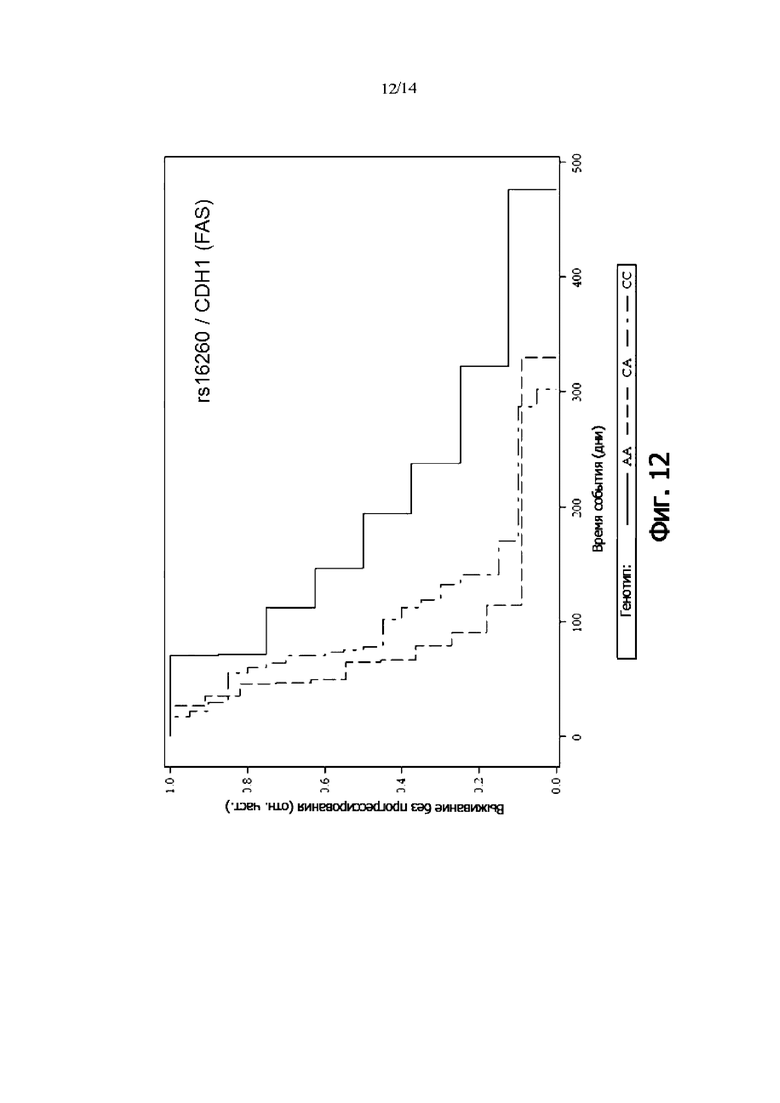
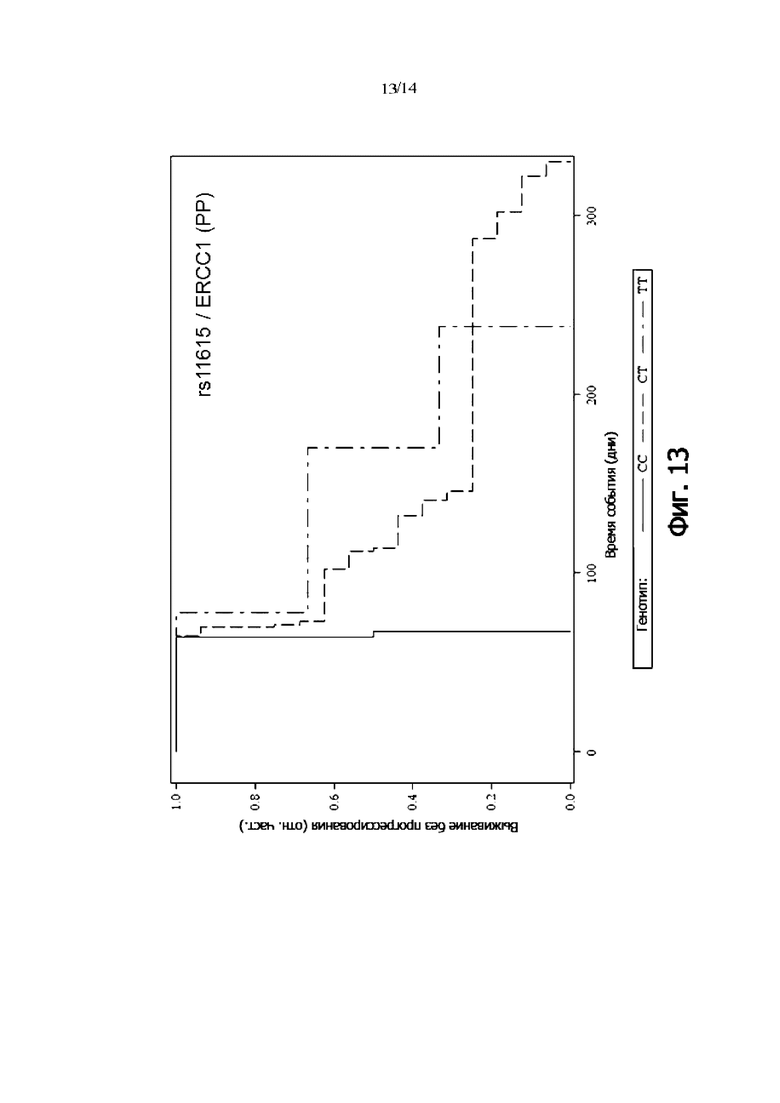
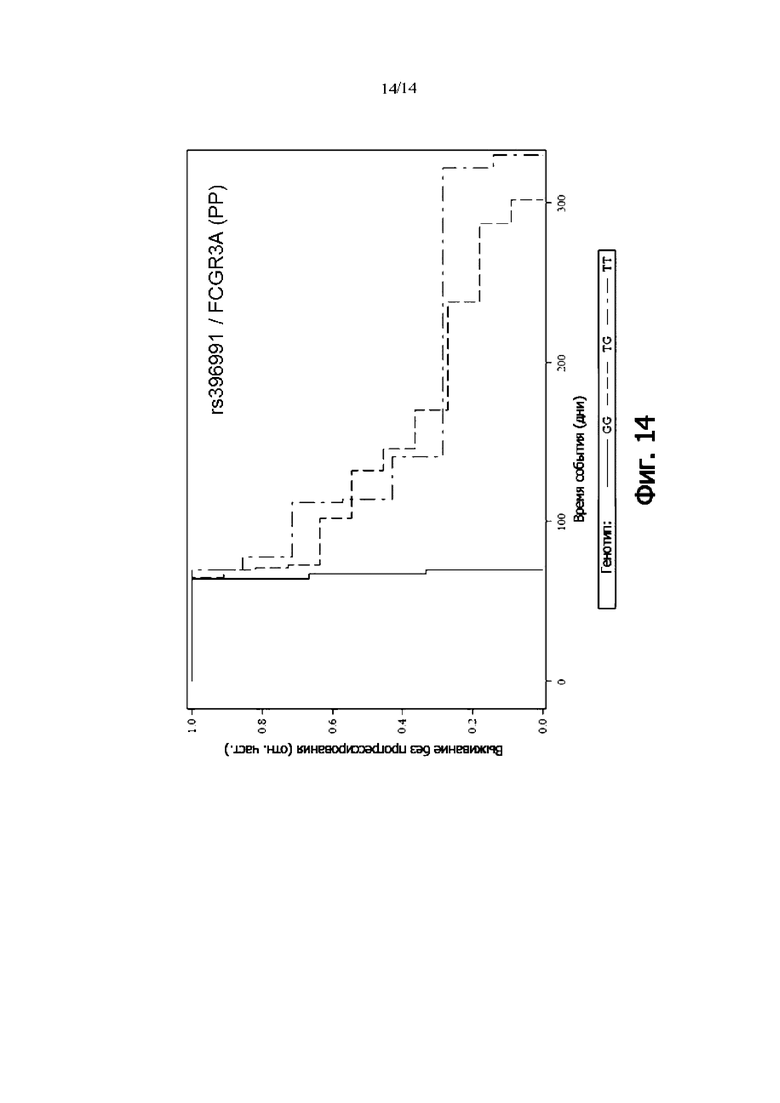
Группа изобретений относится к биотехнологии. Представлены: способы для определения, отвечает ли пациент с онкологическим заболеванием, имеющий опухоль, положительную по опухолевому антигену, на лечение с применением антитела против опухолевого антигена, и способы определения, будет ли период выживаемости без прогрессирования у пациента с онкологическим заболеванием, имеющего опухоль, положительную по опухолевому антигену. При этом опухолевый антиген представляет собой белок CLDN18.2. Также представлен способ лечения пациента с онкологическим заболеванием, имеющим опухоль, положительную по антигену. Изобретение позволяет эффективно применять его для прогнозирования эффективности лечения злокачественных новообразований и прогнозирования клинических исходов для пациентов с онкологическими заболеваниями. 4 н. и 12 з.п. ф-лы, 14 ил., 16 табл., 3 пр.
1. Способ определения, отвечает ли пациент с онкологическим заболеванием, имеющий опухоль, положительную по опухолевому антигену, на лечение с применением антитела против опухолевого антигена
где опухолевый антиген представляет собой белок CLDN18.2;
причем указанный способ включает определение генотипа для одного или нескольких однонуклеотидных полиморфизмов, выбранных из группы, состоящей из MUC1 rs4072037, IL-10 rs1800896, DNMT3A rs1550117, SMAD4 rs12456284, EGF rs4444903, CDH1 rs16260 и ERCC1 rs11615 в образце, полученном из пациента,
отличающийся тем, что
(a) присутствие гомозиготного генотипа MUC1 rs4072037 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером лечения антителом;
(b) присутствие гомозиготного генотипа MUC1 rs4072037 [GG] указывает на повышение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом;
(с) присутствие гомозиготного генотипа IL-10 rs1800896 [GG] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом;
(d) присутствие гетерозиготного генотипа DNMT3A rs1550117 [GA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом;
(e) присутствие гетерозиготного генотипа SMAD4 rs12456284 [GA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом;
(f) присутствие гомозиготного генотипа EGF rs4444903 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом;
(g) присутствие гомозиготного генотипа CDH1 rs16260 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом; и
(h) присутствие гомозиготного генотипа ERCC1 rs11615 [TT] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом.
2. Способ определения, будет ли период выживаемости без прогрессирования у пациента с онкологическим заболеванием, имеющего опухоль, положительную по опухолевому антигену,
где опухолевый антиген представляет собой белок CLDN18.2;
указанный способ включает определение генотипа для одного или нескольких однонуклеотидных полиморфизмов, выбранных из группы, состоящей из MUC1 rs4072037, IL-10 rs1800896, DNMT3A rs1550117, SMAD4 rs12456284, EGF rs4444903, CDH1 rs16260 и ERCC1 rs11615 в образце, полученном из пациента,
где
(а) наличие гомозиготного генотипа MUC1 rs4072037 [AA] указывает на снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(b) наличие гомозиготного генотипа MUC1 rs4072037 [GG] указывает на повышение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(c) наличие гомозиготного генотипа IL-10 rs1800896 [GG] указывает на снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(d) наличие гетерозиготного генотипа DNMT3A rs1550117 [GA] указывает на снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(e) наличие гетерозиготного генотипа SMAD4 rs12456284 [GA] указывает на снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(f) наличие гомозиготного генотипа EGF rs4444903 [AA] указывает на снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(g) наличие гомозиготного генотипа CDH1 rs16260 [AA] указывает на снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования; и
(h) наличие гомозиготного генотипа ERCC1 rs11615 [TT] указывает на снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования заболевания.
3. Способ определения
(i) отвечает ли пациент с онкологическим заболеванием, имеющий опухоль, положительную по опухолевому антигену, на лечение с применением антитела против опухолевого антигена, и
(ii) будет ли период выживаемости без прогрессирования у пациента с онкологическим заболеванием, имеющего опухоль, положительную по опухолевому антигену,
при этом опухолевый антиген представляет собой белок CLDN18.2;
указанный способ включает определение генотипа для одного или более однонуклеотидных полиморфизмов, выбранных из группы, состоящей из MUC1 rs4072037, IL-10 rs1800896, DNMT3A rs1550117, SMAD4 rs12456284, EGF rs4444903, CDH1 rs16260 и ERCC1 rs11615 в образце, полученном из пациента,
где
(a) наличие гомозиготного генотипа MUC1 rs4072037 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(b) наличие гомозиготного генотипа MUC1 rs4072037 [GG] указывает на повышение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или повышение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(c) наличие гомозиготного генотипа IL-10 rs1800896 [GG] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(d) наличие гетерозиготного генотипа DNMT3A rs1550117 [GA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(e) наличие гетерозиготного генотипа SMAD4 rs12456284 [GA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(f) наличие гомозиготного генотипа EGF rs4444903 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования;
(g) наличие гомозиготного генотипа CDH1 rs16260 [AA] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования; и
(h) наличие гомозиготного генотипа ERCC1 rs11615 [TT] указывает на снижение риска того, что пациент с онкологическим заболеванием не является респондером на лечение антителом и/или снижение риска того, что у пациента с онкологическим заболеванием не будет периода выживаемости без прогрессирования.
4. Способ по любому из пп. 1-3, отличающийся тем, что антитело действует путем рекрутирования иммунной системы пациента для уничтожения опухолевых клеток.
5. Способ по любому из пп. 1-4, отличающийся тем, что антитело действует через антителозависимую клеточно-опосредованную цитотоксичность (ADCC) и/или комплементарно-зависимую цитотоксичность (CDC).
6. Способ по любому из пп. 1-5, отличающийся тем, что антитело содержит тяжелую цепь, содержащую аминокислотную последовательность, представленную с помощью SEQ ID NO: 17 или 51, или ее фрагмент, и легкую цепь, содержащую аминокислотную последовательность, представленную с помощью SEQ ID NO: 24, или ее фрагмент.
7. Способ лечения пациента с онкологическим заболеванием, имеющим опухоль, положительную по антигену, где опухолевый антиген представляет собой белок CLDN18.2, причем указанный способ включает
а. оценку того, является ли пациент с онкологическим заболеванием респондером на лечение антителом с помощью способа по любому из пп. 1 и 3-6, и
b. (i) лечение пациента с онкологическим заболеванием антителом, если пациент имеет сниженный риск отсутствия ответа на лечение антителом или (ii) отсутствие лечения пациента с онкологическим заболеванием антителом и/или лечение пациента с онкологическим заболеванием с использованием схемы лечения, которая включает лечение, которое отличается от лечения антителом, если пациент имеет повышенный риск того, что он не будет отвечать на лечение антителом.
8. Способ по п. 7, отличающийся тем, что схема лечения включает лечение, не зависящее от иммунной системы пациента.
9. Способ по п. 7 или 8, отличающийся тем, что схема лечения не включает лечение антителом, действующим посредством рекрутирования иммунной системы пациента для уничтожения опухолевых клеток.
10. Способ по любому из пп. 7-9, отличающийся тем, что схема лечения включает хирургическую операцию, химиотерапию и/или радиацию.
11. Способ по любому из пп. 7-10, отличающийся тем, что схема лечения включает лечение низкомолекулярным ингибитором опухолевого антигена и/или конъюгатом антитело-лекарственное средство, где антитело направлено против опухолевого антигена.
12. Способ по п. 11, отличающийся тем, что конъюгат антитело-лекарственное средство представляет собой антитело, связанное с радиоактивным, химиотерапевтическим или токсиновым компонентом.
13. Способ по п. 11 или 12, отличающийся тем, что конъюгат антитело-лекарственное средство представляет собой антитело, связанное с цитостатическим или цитотоксическим соединением.
14. Способ по любому из пп. 1-13, отличающийся тем, что опухоль представляет собой солидную опухоль.
15. Способ по любому из пп. 1-14, отличающийся тем, что опухоль представляет собой гастроэзофагеальную опухоль.
16. Способ по любому из пп. 1-15, отличающийся тем, что опухоль представляет собой прогрессирующую аденокарциному желудка или нижнего пищевода.
| MELLOR et al., "A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer", Journal of Hematology & Oncology, 2013, vol.6, no.1 | |||
| ZHANG et al., "FCGR2A and FCGR3A polymorphisms associated with clinical outcome of epidermal growth factor receptor expressing metastatic colorectal cancer |
Авторы
Даты
2022-12-06—Публикация
2016-04-13—Подача