ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] - Настоящая заявка заявляет приоритет но предварительной заявке США, серийный №62/031302, поданной 31 июля 2014 года, полное описание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[2] Настоящее изобретение относится к фармацевтическим составам, содержащим вещество, полученное из клостридий, и способам их применения. В частности, настоящее изобретение относится к фармацевтическим составам, содержащим вещество, полученное из клостридий, для инсталляции в мочевой пузырь.
УРОВЕНЬ ТЕХНИКИ
[3] Препараты нейротоксинов, в частности, токсинов ботулизма, используются в лечении различных заболеваний, включая урологические патологии, такие как гиперактивный мочевой пузырь (ГМП) и гиперактивность детрузора.
[4] С целью лечения патологий мочевого пузыря, ассоциированных с неврологическими нарушениями, таких как гиперактивный мочевой пузырь (ГМП) и гиперактивность детрузора, препарат, содержащий ботулинический токсин, обычно вводят путем инъекции через стенки мочевого пузыря и в ослабленные мышечные ткани, окружающие мочевой пузырь. Такой подход требует введения от около тридцати до сорока инъекций через стенку мочевого пузыря, как показано на Фигуре 1. Фармацевтическое введение путем инъекции может вызывать локальный болевой синдром и подвергать пациентов потенциальной опасности инфекций, передающихся через кровь. Среди альтернативных путей введения, внутрипузырная инстилляция позволяет препарату непосредственно попасть в мочевой пузырь через стенку мочевого пузыря.
[5] Стенка мочевого пузыря является непроницаемой для большинства веществ. Как показано на Фигуре 2, многослойный уротелий состоит из трех клеточных слоев: зонтичные клетки, промежуточные клетки и базальные клетки. Базальные клетки представляют собой зародышевые клетки, которые в результате деления заменяют промежуточные клетки, являющиеся частично дифференцированными. Высоко дифференцированные и поляризованные зонтичные клетки расположены в просвет мочевого пузыря и являются основным физическим барьером для перемещения веществ между кровью и мочой. Апикальная мембрана из зонтичных клеток покрыта бляшками, состоящими из белков, называемых уроплакинами, что придает апикальной мембране утолщенный внешний вид. Зонтичной клетки также содержат плотные соединения, которые ограничивают парацеллюлярное движение мочи и больших молекул через эпителий.
[6] Таким образом, сохраняется потребность в фармацевтических составах, которые могут улучшить доставку препарата через стенки мочевого пузыря по сранению с парентеральным введением.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[7] В некоторых аспектах настоящего изобретения предлагаются фармацевтические составы для внутрипузырного введения в мочевой пузырь, содержащие вещество, полученное из клостридий, и по меньшей мере один пермеабилизирующий агент, который может проникать через стенку мочевого пузыря пациента и сохранять биологическую активность вещества, полученного из клостридий, с целью получения желаемого терапевтического эффекта.
[8] В одном аспекте настоящего изобретения предлагается фармацевтическая композиция, содержащая терапевтически эффективное количество вещества, полученного из клостридий, и по меньшей мере один пермеабилизирующий агент, причем по меньшей мере один пермеабилизирующий агент присутствует в количестве, эффективном для существенного и обратимого повышения проницаемости стенки мочевого пузыря для вещества, полученного из клостридий.
[9] В другом аспекте настоящего изобретения предлагается способ получения фармацевтического состава, пригодного для внутрипузырного введения в мочевой пузырь, причем указанный способ включает получение раствора, содержащего по меньшей мере один пермеабилизирующий агент; добавление раствора к композиции, содержащей вещество, полученное из клостридий. В некоторых вариантах реализации изобретения способ включает добавление от около 50 мл до около 100 мл раствора к веществу, полученному из клостридий. В некоторых вариантах реализации изобретения вещество, полученное из клостридий, представляет собой ботулинический токсин. В одном варианте реализации изобретения способ включает добавление от около 50 мл до около 100 мл водного раствора, содержащего около 1% (масс./об.) хитозана, аналогов или производных, и около 0,1% (масс./об.) Тритона™Х-100, аналогов или производных, к ботулиническому токсину типа А. В одном варианте реализации изобретения способ включает добавление 50 мл водного раствора, содержащего около 1% (масс./об.) хитозана и 0,1% (масс./об.) Тритона™Х-100, во флакон, содержащий около 100 единиц или 200 единиц лиофилизированного ботулинического токсина типа А; и аккуратное смешивание с целью разведения лиофилизированного ботулинического токсина типа А.
[10] В другом аспекте указанный фармацевтический состав увеличивает биодоступность вещества, полученного из клостридий, путем предотвращения или минимизации адсорбции вещества, полученного из клостридий, катетерами, поверхностями устройств доставки (шприц, пластырь, микроигла, сконструированный инжектор (Bioject, и т.д.), трубками и контейнерами.
[11] Согласно другому аспекту в настоящем изобретении предлагаются способы лечения нарушений состояния здоровья пациента, при этом способы включают этап введения фармацевтической композиции, полученной в соответствии с настоящим изобретением, таким образом, осуществляя лечение нарушений состояния здоровья. В одном варианте реализации изобретения указанные способы облегчают один или более симптомов нарушений состояния здоровья пациента. В одном варианте реализации изобретения нарушения состояния здоровья включают нейрогенную идиопатическую дисфункцию мочевого пузыря или боль в мочевом пузыре. В некоторых аспектах предлагается способ лечения пациента с нейрогенной или идиопатической дисфункцией мочевого пузыря или болью в мочевом пузыре, включающий: внутрипузырную инсталляцию в мочевой пузырь пациента фармацевтической композиции, содержащей терапевтически эффективное количество вещества, полученного из клостридий, и по меньшей мере один пермеабилизирующий агент в количестве, эффективном для существенного повышения проницаемости стенки мочевого пузыря для вещества, полученного из клостридий, в терапевтически эффективной степени.
[12] Также предусматриваются другие аспекты и варианты предлагаемых фармацевтических составов и способов, изложенных выше, которые будут более понятны при ознакомлении с последующим описанием изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[13] На Фиг. 1 проиллюстрировано известную из уровня техники внутрипузырную инъекцию ботулинического токсина в стенку мочевого пузыря;
[14] На Фиг. 2А-2С проиллюстрировано схематическое изображение уротелия, на котором:
A) Уротелий состоит из трех слоев клеток: базальные, промежуточные и поверхностные зонтичные клетки.
B) Зонтичные клетки имеют бляшки на своей апикальной мембране и сеть цитоплазматических везикул, содержащих фибриллы, соединенные плотными связями и десмосомами на гладкой базальной мембране.
C) На апикальной мембране уротелия, если смотреть на просвет, видны бляшки и шарнирные области.
[15] На Фиг. 3 проиллюстрировано наглядное изображение, задающее базис для оценки степени проникновения в мочевой пузырь анализируемой композиции; при этом расщепленный SNAP 25 использовали в качестве биомаркера активности БОТОКСА® на синаптических окончаниях, а экспрессию синаптофизина использовали для идентификации синаптических окончаний и для подтверждения специфичности локализации расщепленного SNAP 25. Степень проникновения коррелировала со степенью окрашивания SNAP25-197;
[16] На Фиг. 4 проиллюстрировано наглядное изображение типичных результатов иммуногистохимии двух мочевых пузырей с баллом ИГХ "4" и "0"; при этом расщепленный SNAP 25 использовали в качестве биомаркера активности БОТОКСА® на синаптических окончаниях, а экспрессию синаптофизина использовали для идентификации синаптических окончаний и для подтверждения специфичности локализации расщепленного SNAP 25.
[17] На Фиг. 5A-5D проиллюстрированы иллюстративные микрофотографии, показывающие различные состояния ткани мочевого пузыря после инстилляции; и
[18] На Фиг. 6 проиллюстрирован график, отображающий балл иммуногистохимии (ИГХ) некоторых типовых составов в соответствии с аспектами настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[19] Ботулинические нейротоксины (BoNT), например, BoNT/A, BoNT/B и т.д., действуют на нервную систему, блокируя высвобождение нейросекреторных веществ, в том числе нейромедиаторов. Действие BoNT инициируется его связыванием с молекулой-рецептором на поверхности клетки. Образованный в результате этого комплекс "токсин-рецептор" затем подвергается эндоцитозу. Оказавшись внутри клетки, BoNT расщепляет экзоцитотические специфические белки, ответственные за нейромедиаторную стыковку и высвобождает из клетки белки, известные как SNARE-белки (растворимый N-этилмалеимид-чувствительный рецептор фактора связывания белка). Полученная в результате этих процессов динамическая хемоденервация используется в практической медицине для блокирования двигательной нейропередачи в нервно-мышечном соединении, что пригодно для различных терапевтических применений.
[20] В аспектах настоящего изобретения предлагается, в частности, фармацевтический состав для внутрипузырного введения в мочевой пузырь, содержащий вещество, полученное из клостридий, и по меньшей мере один пермеабилизирующий агент.
[21] В одном аспекте настоящего изобретения предлагается, в частности, фармацевтическая композиция, содержащая терапевтически эффективное количество вещества, полученного из клостридий, и по меньшей мере один пермеабилизирующий агент, причем по меньшей мере один пермеабилизирующий агент присутствует в количестве, эффективном для существенного и обратимого повышения проницаемости стенки мочевого пузыря для вещества, полученного из клостридий. В некоторых вариантах реализации изобретения вещество, полученное из клостридий, представляет собой ботулинический токсин. В некоторых вариантах реализации изобретения по меньшей мере один пермеабилизирующий агент содержит поверхностно-активное и мукоадгезивное вещество.
Определения
[22] Используемые в настоящем описании слова или термины, изложенные ниже, имеют следующие определения.
[23] В данном контексте термин "около" или "приблизительно" означает пределы приемлемого диапазона ошибок для конкретного значения, определяемые обычным специалистом в данной области техники, что будет частично зависеть от того, как измеряется или определяется значение (то есть, ограничения измерительной системы). Например, термин "около" может означать значения в пределах 1 или более чем 1 стандартного отклонения, на практике в данной области техники. В случаях, когда конкретные значения описаны в заявке и в формуле изобретения, если не указано иное, термин "около" означает пределы приемлемого диапазона ошибок для конкретного значения.
[24] Термином "активный фармацевтический ингредиент" (АФИ) обозначают ингредиент, который оказывает влияние на субъекта или пациента при введении или после введения. АФИ могут включать, например, нативный или рекомбинантный, клостридиальный нейротоксин, например ботулинический токсин, рекомбинантные модифицированные токсины, их фрагменты, ТЕМ, а также их комбинации.
[25] Термин "введение", или "вводить" означает этап доставки (т.е., введение) фармацевтической композиции субъекту, или альтернативное получение субъектом фармацевтической композиции. Фармацевтические композиции, описанные в настоящем документе, могут быть локально введены с помощью различных способов. Например, внутримышечное, внутрикожное, подкожное введение, интратекальное введение, интраперитонеальное введение, топическое (через кожу) введение, инсталляция и имплантация (например, устройство с медленным высвобождением, такое как полимерный имплантат или миниосмотический насос) - все из перечисленных способов могут быть пригодными для осуществления введения.
[26] Термин "ослабление" означает уменьшение проявления боли, головной боли, мышечной гиперактивности или какого-либо симптома или причины патологического состояния или нарушения. Таким образом, ослабление включает некоторое уменьшение, значительное уменьшение, почти полное уменьшение и полное уменьшение.
[27] Термин "не содержащий животный белок" означает отсутствие производных из крови, взятых из крови и других продуктов или соединений животного происхождения. Термин "животное" означает млекопитающее (например, человека), птицу, рептилию, рыбу, насекомое, паука или других видов животных. Термин "животное" не включает микроорганизмы, такие как бактерии. Таким образом, фармацевтическая композиция, не содержащая животный белок, может включать ботулинический нейротоксин, рекомбинантный модифицированный токсин, или ТЕМ. Например, "не содержащая животный белок" фармацевтическая композиция означает фармацевтическую композицию, которая либо по существу не содержит, либо практически не содержит, либо совершенно не содержит сывороточный альбумин, желатин и другие белки животного происхождения, такие как иммуноглобулины. Примером такой фармацевтической композиции, не содержащей животный белок, является фармацевтическая композиция, которая включает или состоит из ботулинического токсина, ТЕМ или рекомбинантного модифицированного токсина (в качестве активного ингредиента) и пригодного полисахарида в качестве стабилизатора или вспомогательного вещества.
[28] "Биологическая активность" описывает положительные или нежелательные эффекты препарата на живую материю. Когда препарат представляет собой комплексную химическую смесь, указанная активность характерна для активного ингредиента определенного вещества, но может быть модифицирована другими компонентами. Биологическая активность может быть оценена как эффективность или токсичность с помощью анализов in vivo LD50 или ED50 или посредством анализов in vitro, таких как, например, анализы количественного определения активного вещества, как описано в публикациях США №20100203559, 20100233802, 20100233741 и патенте США 8198034, полное содержание которых включено в настоящий документ посредством ссылки.
[29] "Ботулинический токсин" означает нейротоксин, произведенный Clostridium botulinum, а также ботулинический токсин (или его легкую цепь или тяжелую цепь), изготовленный рекомбинантным путем с помощью видов, не принадлежащим к клостридиям. В данном контексте фраза "ботулинический токсин" охватывает серотипы ботулинического токсина А, В, С, D, Е, F и G, и их подтипы и любые другие типы их подтипов или любые модифицированные белки, их аналоги, производные, гомологи, составные части, подчасти, варианты или версии, во всех случаях, любого из вышеперечисленных. В данном контексте термин "ботулинический токсин" охватывает также "модифицированный ботулинический токсин". Дополнительно термин "ботулинический токсин" в данном контексте также включает комплекс ботулинического токсина (например, комплексы 300, 500 и 900 кДа), а также нейротоксический компонент ботулинического токсина (150 кДа), который не ассоциирован с комплексными белками.
[30] Термин "вещество, полученное из клостридий" относится к молекуле, которая содержит любую часть токсина клостридий. В данном контексте термин "вещество, полученное из клостридий" охватывает нативные или рекомбинантиые нейротоксины, рекомбинантные модифицированные токсины, их фрагменты, модуляторы нацеленного везикулярного экзоцитоза (ТЕМ) или их комбинации.
[31] Термин "клостридиальный токсин" относится к любому токсину, продуцируемому токсигенным штаммом клостридий, который может осуществлять полный клеточный механизм, тем самым вызывать интоксикацию клетки, и охватывает связывание клостридиального токсина с рецептором клостридиального токсина с низкой или высокой аффинностью, интернализацию комплекса токсин/рецептор, транслокацию легкой цепи клостридиального токсина в цитоплазму и ферментативную модификацию субстрата клостридиального токсина. Не ограничивающие примеры клостридиальных токсинов включают ботулинический токсин типа BoNT/A, BoNT/B, BoNT/C1, BoNT/D, BoNT/E, BoNT/F, BoNT/G, столбнячный токсин (TeNT), токсин Baratii (BaNT), а также токсин Butyricum (BuNT). Цитотоксин BoNT/С2 и цитотоксин BoNT/С3, не будучи нейротоксинами, не охватываются термином "клостридиальный токсин". Клостридиальный токсин, описанный в настоящем документе, включает, без ограничения, встречающиеся в природе варианты клостридиального токсина, такие как, например, изоформы клостридиального токсина и подтипы клостридиального токсина; не встречающиеся в природе варианты клостридиального токсина, такие как, например, консервативные варианты клостридиального токсина, неконсервативные варианты клостридиального токсина, химерные варианты клостридиального токсина и активные фрагменты клостридиального токсина, или любые их комбинации. Клостридиальный токсин, описанный в настоящем документе, также включает комплекс клостридиального токсина. В данном контексте термин "комплекс клостридиального токсина" относится к комплексу, содержащему клостридиальный токсин и нетоксинные белки (NAP), такие как, например, комплекс ботулинического токсина, комплекс столбнячного токсина, комплекс токсина Baratii и комплекс токсина Butyricum. Не ограничивающие примеры комплексов клостридиального токсина включают те, которые продуцированы Clostridium botulinum, такие как, например, комплекс BoNT/A 900-кДа, комплекс BoNT/A 500-кДа, комплекс BoNT/A 300-кДа, комплекс BoNT/B 500-кДа, комплекс BoNT/C1 500-кДа, комплекс BoNT/D 500-кДа, комплекс BoNT/D 300-кДа, комплекс BoNT/E 300-кДа, и комплекс BoNT/F 300-кДа.
[32] "Эффективное количество" применительно к биологически активному ингредиенту означает количество ингредиента, которое, как правило, является достаточным для индуцирования желаемого изменения состояния субъекта. Например, если желаемым эффектом является ослабление симптома аутоиммунного нарушения, эффективное количество ингредиента представляет собой такое количество, которое приводит по меньшей мере к существенному ослаблению симптома аутоиммунного нарушения без проявлений выраженной токсичности.
[33] "Эффективное количество" применительно к неактивному ингредиенту компонента фармацевтической композиции (например, стабилизатору, используемому для смешивания с ботулиническим токсином), относится к такому количеству компонента, не являющегося активным ингредиентом, которого достаточно, чтобы положительно влиять на высвобождение и/или активность активного ингредиента при введении в организм человека. Такое "эффективное количество" может быть определено после ознакомления с настоящим описанием и на основании общих знаний в данной области техники.
[34] Термин "совсем не содержит" (т.е., в терминологии "состоящий из") означает, что при использовании существующего диапазона обнаружения прибора или процесса, вещество не может быть обнаружено или его наличие не может быть подтверждено.
[35] Термин "в основном не содержит" (или "состоящий в основном из") означает, что могут быть обнаружены только следовые количества вещества.
[36] "Легкая цепь" означает легкую цепь клостридиального нейротоксина. Такая цепь имеет молекулярную массу около 50 кДа и может упоминаться в настоящем документе как "L-цепь", "L", либо как протсолитический домен (аминокислотная последовательность) ботулинического нейротоксина.
[37] "Тяжелая цепь" означает тяжелую цепь ботулинического нейротоксина. Такая цепь имеет молекулярную массу около 100 кДа, и может упоминаться в настоящем документе как "Н-цепь" или как "Н".
[38] НС означает фрагмент (около 50 кДа), полученный из Н-цепи ботулинического нейротоксина, который примерно эквивалентен карбоксильному концевому сегменту H-цепи, или части, соответствующей такому фрагменту в интактной, H-цепи. Полагают, что такой фрагмент содержит часть ботулинического нейротоксина природного или дикого типа, участвующую в пресинаптическом связывании с моторными нейронами с высокой аффинностью.
[39] HN означает фрагмент (около 50 кДа), полученный из H-цепи ботулинического нейротоксина, который примерно эквивалентен аминному концевому сегменту H-цепи, или части, соответствующей такому фрагменту. Полагают, что такой фрагмент содержит часть ботулинического нейротоксина природного или дикого типа, участвующую в транслокации L-цепи через внутриклеточную эндосомальную мембрану.
[40] LHN или L-HN означает фрагмент, полученный из клостридиального нейротоксина, который содержит L-цепь, или функциональный ее фрагмент, соединенный с HN-доменом. Такой фрагмент может быть получен из интактного клостридиального нейротоксина путем протеолиза, чтобы обеспечить удаление или модификацию НС-домена.
[41] Термин "имплантат" означает контролируемое высвобождение композиции или системы доставки препарата (например, пульсирующее или непрерывное). Имплантат может быть, например, введен, вставлен или имплантирован в человеческое тело.
[42] "Внутрипузырное введение" относится к инъекции данного вещества непосредственно в мочевой пузырь через уретральный катетер.
[43] "Местное введение" означает прямое введение фармацевтического препарата на тот участок на поверхности или внутри тела животного или в непосредственной близости от него, на который желательно получить биологический эффект фармацевтического препарата, например, посредством, внутримышечной или внутри- или подкожной инъекции или топического введения. Местное введение исключает системные пути введения, такие как внутривенное или пероральное введение Топическое введение является одним из видов местного введения, при котором фармацевтический агент наносят на кожу пациента.
[44] Термин "модифицированный ботулинический токсин" означает ботулинический токсин, у которого по меньшей мере одна из его аминокислот удалена, модифицирована или заменена по сравнению с нативным ботулиническим токсином. Кроме того, модифицированный ботулинический токсин может быть нейротоксином, полученным рекомбинантным способом, или быть производным или фрагментом нейротоксина, полученного рекомбинантным способом. Модифицированный ботулинический токсин сохраняет по меньшей мере один вид биологической активности нативного ботулинического токсина, такой как способность связываться с рецептором ботулинического токсина, или способность ингибировать высвобождение нейротрансмиттера из нейрона. Одним из примеров модифицированного ботулинического токсина является ботулинический токсин, который имеет легкую цепь от одного серотипа ботулинического токсина (такого как серотип А) и тяжелую цепь от другого серотипа ботулинического токсина (такого как серотип В). Другим примером модифицированного ботулинического токсина является ботулинический токсин, соединенный с нейромедиатором, таким как вещество Р.
[45] Термин "мутация" означает структурную модификацию природного белка или последовательности нуклеиновой кислоты. Например, в случае мутации нуклеиновых кислот, мутация может представлять собой удаление, добавление или замену одного или более нуклеотидов в последовательности ДНК. В случае мутации последовательности белка, мутация может представлять собой удаление, добавление или замену одной или более аминокислот в последовательности белка. Например, конкретная аминокислота, содержащая последовательность белка, может быть заменена на другую аминокислоту, например, аминокислоту, выбранную из группы, которая включает аминокислоты: аланин, аспарагин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан, тирозин или любую другую природную или не встречающуюся в природе аминокислоту или химически модифицированные аминокислоты. Мутации в последовательности белка могут быть результатом мутаций в ДНК-последовательности, которые при транскрипции, и в результате трансляции мРНК, продуцируют мутированную последовательность белка. Мутации в последовательности белка также могут быть созданы путем слияния пептидной последовательности, содержащей желаемую мутацию, с желаемой последовательностью белка.
[46] Термин "пациент" означает человека или субъекта, не являющегося человеком, получающего медицинскую или ветеринарную помощь. Соответственно, как описано в настоящем документе, композиции и способы могут быть использованы для лечения любого животного, такого как, например, млекопитающие, или тому подобное.
[47] Термин "периферическое введение" или "введение с использованием периферического пути" означает субдермальное, внутрикожное, введение через кожу или подкожное введение, но исключает внутримышечное введение. "Периферическое" означает местное субдермальное введение и исключает введение в висцеральные участки.
[48] Термин "пермеабилизирующий агент" относится к любому природному или синтетическому соединению, веществу или молекуле, которые обладают способностью усиливать проницаемость поверхности, включая, но не ограничиваясь этим, кожи, стенки мочевого пузыря и тому подобное, для выбранного соединения, такого как АФИ (активный фармацевтический ингредиент).
[49] Термин "проникающе-эффективное количество" относится к количеству, эффективному для существенного увеличения проницаемости поверхности для терапевтического агента в терапевтически эффективной степени. При введении препарата внутрь мочевого пузыря проникающе-эффективное количество относится к количеству, достаточному для существенного повышения проницаемости стенки мочевого пузыря для вещества, полученного из клостридий, в течение требуемого временного интервала без необратимого повреждения стенки мочевого пузыря, после чего первичная селективная непроницаемость стенки мочевого пузыря может быть восстановлена.
[50] Термин "фармацевтическая композиция" означает композицию, содержащую активный фармацевтический ингредиент, такой как, например, ботулинический токсин, а также по меньшей мере один дополнительный ингредиент, такой как, например, стабилизатор или вспомогательное вещество или тому подобное. Поэтому фармацевтическая композиция представляет собой композицию, которая пригодна для введения с диагностической или терапевтической целью субъекту, такому как пациент-человек. Фармацевтическая композиция может быть, например, в лиофилизированном или высушенном вакуумом состоянии, в виде раствора, полученного после восстановления лиофилизированной или высушенной вакуумом фармацевтической композиции, или в виде раствора или твердого вещества, которое не требует восстановления.
[51] Составляющие ингредиенты фармацевтической композиции могут быть включены в одну композицию (то есть, все составляющие компоненты присутствуют в исходной рецептуре фармацевтической композиции, за исключением любой необходимой восстанавливающей жидкости) или в двухкомпонентную систему, например, высушенную вакуумом композицию восстановленную с помощью восстанавливающего наполнителя, который может, например, содержать ингредиент, не присутствующий в исходной рецептуре фармацевтической композиции. Двухкомпонентная система может обеспечить ряд преимуществ, в том числе возможность включения ингредиентов, которые не являются в достаточной степени совместимыми с первым компонентом двухкомпонентной системы при длительном хранении. Например, восстанавливающий наполнитель может включать консервант, который обеспечивает достаточную защиту от микробного роста на период применения, например, в течение одной недели при хранении в холодильнике, но не будет эффективным в течение двухлетнего периода хранения в морозильной камере, во время которого токсин может разложиться. Другие ингредиенты, которые могут быть не совместимы с ботулиническим токсином или другими ингредиентами в течение длительного периода времени, могут быть включены таким же способом; то есть, добавлены во второй наполнитель (например, в восстанавливающий наполнитель) в приблизительное время использования. Фармацевтическая композиция может также включать консерванты, такие как бензиловый спирт, бензойная кислота, фенол, парабены и сорбиновая кислота. Фармацевтические композиции могут включать, например, вспомогательные вещества, такие как поверхностно-активные агенты; диспергаторы; инертные разбавители; гранулирующие и дезинтегрирующие агенты; связывающие агенты; смазывающие агенты; консерванты; физиологически разлагаемые композиции, такие как желатин; водные разбавители и растворители; масляные разбавители и растворители; суспендирующие агенты; диспергирующие или смачивающие агенты; эмульгаторы, смягчающие агенты; буферы; соли; загустители; наполнители; антиоксиданты; стабилизирующие агенты; и их фармацевтически приемлемые полимерные или гидрофобные материалы и другие ингредиенты, известные в данной области техники и описаны, например, в работе Genaro, ed., 1985, Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., содержание которой включено в настоящий документ посредством ссылки.
[52] Термин "рекомбинантный модифицированный токсин" означает рекомбинантный токсин, который имеет некоторые или большинство доменов, общие с ботулиническим токсином, по может быть нацелен или может быть не нацелен на тс же самые клетки, что и нативный ботулинический нейротоксин.
[53] Термин "стабилизирующий", "стабилизируется", или "стабилизация" означает сохранение по меньшей мере около 20% от биологической активности активного фармацевтического ингредиента ("АФИ"), который был восстановлен, по сравнению с АФИ до восстановления. Например, при (1) приготовлении серийных разведенных растворов из нерасфасованного или маточного раствора, или (2) при восстановлении лиофилизованной или высушенной вакуумом фармацевтической композиции, содержащей ботулинический токсин, которая хранилась при температуре около -2°С или ниже в течение от шести месяцев до четырех лет, или (3) в водном растворе фармацевтической композиции, содержащей ботулинический токсин, которая хранилась при температуре от около 2°С до около 8°С в течение от шести месяцев до четырех лет, ботулинический токсин, присутствующий в восстановленном или водном растворе фармацевтической композиции, характеризуется (в присутствии соединения, которое является стабилизирующим, стабилизирует или обеспечивает стабилизацию АФИ) показателями активности или токсичности больше, чем около 20% и до около 100% по сравнению с показателями биологически активного ботулинического токсина до включения в фармацевтическую композицию.
[54] Термин "стабилизирующий агент", "агент стабилизации" или "стабилизатор" означает вещество, которое функционирует для стабилизации АФИ таким образом, что эффективность фармацевтической композиции повышается относительно нестабилизированной композиции.
[55] "Стабилизаторы" могут включать вспомогательные вещества, и могут включать белковые и небелковые молекулы.
[56] Термин "по существу не содержащий" означает наличие на уровне менее одного процента в расчете на массу фармацевтической композиции.
[57] В данном контексте "ТЕМ" является синонимом "модулятора нацеленного экзоцитоза" или "перенацеленной эндопептидазы". Учитывая его многочисленные характеристики, "ТЕМ" будет описан более подробно в конце раздела "Определения".
[58] Термин "терапевтический состав" означает состав, который может применяться для лечения и, таким образом, облегчения нарушения или заболевания, такого как, например, нарушение или заболевание, характеризующееся гиперактивностью (т.е. спастичностыо) периферических мышц.
[59] Термин "терапевтически эффективное количество" относится к количеству, достаточному для достижения желаемого терапевтического эффекта.
[60] Термин "топическое введение" исключает системное введение нейротоксина. Другими словами и в отличие от обычных терапевтических путей введения, через кожу топическое введение, ботулинического токсина не приводит к поступлению значительных количеств нейротоксина, например, его большей части, в кровеносную систему пациента.
[61] Термин "лечение" означает временное или постоянное облегчение (или исключение) по меньшей мере одного симптома патологического состояния или нарушения, такого как, например, морщины, спастичность, депрессия, боль (такая как, например, головная боль), гиперактивность мочевого пузыря и т.п.
[62] Термин "вариант" означает клостридиальный нейротоксин, например, серотип А, В, С, D, Е, F или G ботулинического токсина дикого типа, который был модифицирован путем замены, модификации, добавления или удаления по меньшей мере одной аминокислоты, по сравнению с ботулиническим токсином дикого типа, который распознается целевой клеткой, поглощается целевой клеткой и каталитически расщепляет белок SNARE (SNAP (растворимый рецептор присоединения белка NSF)) в целевой клетке.
[63] Пример варианта компонента нейротоксина может включать вариант легкой цепи ботулинического токсина, имеющий одну или более замещенных, модифицированных, удаленных и/или добавленных аминокислот. Этот вариант легкой цепи может иметь аналогичную или более высокую способность предотвращать экзоцитоз, например, выделение везикул нейротрансмиттера. Кроме того, биологический эффект варианта может быть уменьшен по сравнению с исходным химическим соединением. Например, вариант легкой цепи ботулинического токсина типа А, имеющий удаленную аминокислотную последовательность, может иметь меньшую биологическую устойчивость, по сравнению с исходной (или нативной) легкой цепью ботулинического токсина типа А.
[64] Термин "наполнитель" или "восстанавливающий наполнитель" означает жидкую композицию, которую можно использовать для восстановления твердого ботулинического состава в жидкую ботулиническую фармацевтическую композицию.
[65] "Нейрональный связывающий фрагмент дикого типа" означает ту часть нейротоксина, которая является нативной для нейротоксина и проявляет специфическую аффинность связывания с рецептором на нейроне. Таким образом, нативный нейрональный связывающий фрагмент или нейрональный связывающий фрагмент дикого типа исключает связывающий фрагмент, не являющийся нативным для нейротоксина.
[66] ТЕМ
[67] Как правило, ТЕМ включают ферментативный домен из легкой цепи клостридиального токсина, транслокационный домен из тяжелой цепи клостридиального токсина и нацеливающий домен. Нацеливающий домен ТЕМ обеспечивает изменение способности нацеливания клетки, которая направляет молекулу к рецептору, за исключением нативного рецептора клостридиального токсина, взаимодействующего с природным клостридиальным токсином. Эта способность перенацеливания достигается путем замены природного связывающего домена клостридиального токсина на нацеливающий домен, характеризующийся связывающей активностью для рецептора неклостридиального токсина. Несмотря на связывание рецептора неклостридиального токсина, ТЕМ проходит все остальные этапы интоксикационного процесса, включая поглощение комплекса ТЕМ/рецептора в цитоплазму, формирование пор в везикулярной мембране и двухцепочечной молекуле, транслокацию ферментативного домена в цитоплазму и проявление протеолитического эффекта на компонент комплекса SNARE клетки-мишени.
[68] В данном контексте термин "ферментативный домен клостридиального токсина" относится к полипептиду клостридиального токсина, расположенного в легкой цепи клостридиального токсина, который осуществляет этап ферментативной целевой модификации интоксикационного процесса. Ферментативный домен клостридиального токсина включает область металлопротеазы, содержащую цинк-зависимую эндопептидазу, которая специфически нацелена на основные компоненты аппарата высвобождения нейротрансмиттеров. Таким образом, ферментативный домен клостридиального токсина специфически нацеливается и протеолитически расщепляет субстрат клостридиального токсина, такой как, например, субстрат SNARE-белков типа SNAP-25, субстрат VAMP и синтаксиновый субстрат.
[69] Ферментативный домен клостридиального токсина включает, без ограничения, природные варианты ферментативного домена клостридиального токсина, такие как, например, изоформы ферментативного домена клостридиального токсина и подтипы ферментативного домена клостридиального токсина; не встречающиеся в природе варианты ферментативного домена клостридиального токсина, такие как, например, консервативные варианты ферментативного домена клостридиального токсина, неконсервативные варианты ферментативного домена клостридиального токсина, химерные варианты ферментативного домена клостридиального токсина и активные фрагменты ферментативного домена клостридиального токсина, или любую их комбинацию. Не ограничивающие примеры ферментативного домена клостридиального токсина включают, например, ферментативный домен BoNT/А, ферментативный домен BoNT/B, ферментативный домен BoNT/Cl, ферментативный домен BoNT/D, ферментативный домен BoNT/E, ферментативный домен BoNT/F, ферментативный домен BoNT/G, ферментативный домен TeNT, ферментативный домен BaNT, а также ферментативный домен BuNT.
[70] В данном контексте термин "транслокационный домен клостридиального токсина" относится к полипептиду клостридиального токсина, расположенного в аминоконцевой половине тяжелой цепи клостридиального токсина, который осуществляет транслокационный этап интоксикационного процесса. На этапе транслокации, по-видимому, происходит аллостерическое изменение конформации транслокационного домена, вызванное снижением рН в пределах внутриклеточной везикулы. Это конформационное изменение приводит к образованию пор в везикулярной мембране, что позволяет перемещаться легкой цени из везикул в цитоплазму.
[71] Транслокационный домен клостридиального токсина включает, без ограничения, природные варианты транслокационного домена клостридиального токсина, такие как, например, изоформы транслокационного домена клостридиального токсина и подтипы транслокационного домена клостридиального токсина; не встречающиеся в природе варианты транслокационного домена клостридиального токсина, такие как, например, консервативные варианты транслокационного домена клостридиального токсина, неконсервативные варианты транслокационного домена клостридиального токсина, химерные варианты транслокационного домена клостридиального токсина и активные фрагменты транслокационного домена клостридиального токсина, или любую их комбинацию. Не ограничивающие примеры ферментативного домена клостридиального токсина включают, например, транслокационный домен BoNT/A, транслокационный домен BoNT/B, транслокационный домен BoNT/Cl, транслокационный домен BoNT/D, транслокационный домен BoNT/E, транслокационный домен BoNT/F, транслокационный домен BoNT/G, транслокационный домен TeNT, транслокационный домен BaNT, а также транслокационный домен BuNT.
[72] В данном контексте термин "нацеливающий домен" является синонимом терминам "связывающий домен" или "нацеливающий фрагмент" и относится к пептиду или полипептиду, который осуществляет связывание рецептора и/или этапы комплексного поглощения в интоксикационном процессе, при условии, что связывающий домен не идентичен связывающему домену клостридиального токсина, обнаруживаемого в карбоксильно-концевой половине тяжелой цепи клостридиального токсина. Нацеливающий домен включает область, связывающую рецептор, которая придаст нацеливающему домену свойство связывающей активности и/или специфичности относительно его родственного рецептора. В данном контексте термин "родственный рецептор" относится к рецептору, с которым преимущественно взаимодействует нацеливающий домен в физиологических условиях или в условиях in vitro, по существу приближающихся к физиологическим условиям. В данном контексте термин "преимущественно взаимодействует" является синонимом "преимущественно связывающийся" и относится к взаимодействию, которое проявляется в статистически значимо большей степени по сравнению с контролем. Применительно к нацеливающему домену, описанному в настоящем документе, нацеливающий домен связывается с родственным рецептором в статистически значимо большей степени по сравнению с неродственным рецептором. Иначе говоря, проявляется избирательное связывание нацеливающего домена с родственным рецептором по сравнению с неродственным рецептором. Таким образом, нацеливающий домен направляет связывание к ТЕМ-специфическому рецептору, расположенному на поверхности плазматической мембраны клетки-мишени.
[73] Нацеливающим доменом, описанным в настоящем документе, может быть тот домен, который преимущественно взаимодействует с рецептором, расположенным на сенсорном нейроне. В другом варианте реализации изобретения нацеливающим доменом, описанным в настоящем документе, может быть тот домен, который преимущественно взаимодействует с рецептором, расположенным на симпатическом нейроне или на парасимпатическом нейроне.
[74] В другом варианте реализации изобретения нацеливающим доменом, описанным в настоящем документе, является нацеливающий домен опиоидного пептида, нацеливающий домен галанинового пептида, нацеливающий домен PAR-пептида, нацеливающий домен соматостатинового пептида, нацеливающий домен нейротенсинового пептида, нацеливающий домен SLURP-пептида, нацеливающий домен ангиотензинового пептида, нацеливающий домен тахикининового пептида, нацеливающий домен пептида, родственного с нейропептидом Y, нацеливающий домен кининового пептида, нацеливающий домен меланокортинового пептида или нацеливающий домен гранинового пептида, нацеливающий домен глюкагоноподобного гормонального пептида, нацеливающий домен секретинового пептида, нацеливающий домен пептида, активирующего аденилатциклазу гипофиза (РАСАР), нацеливающий домен пептида гормона, высвобождающего гормон роста (GHRH), нацеливающий домен вазоактивного кишечного пептида (VIP), нацеливающий домен желудочного ингибирующего пептида (GIP), нацеливающий домен кальцитонинового пептида, нацеливающий домен висцерального пептида кишечника, нацеливающий домен нейротрофинового пептида, нацеливающий домен пептида основного активатора (НА), нацеливающий домен пептида семейства лигандов (GFL) нейротрофического фактора из глиальной клеточной линии (GDNF), нацеливающий домен пептида, относящегося к RF-амидам (RFRP), нацеливающий домен нейрогормонального пептида, или нацеливающий домен нейрорегуляторного цитокинового пептида, нацеливающий домен интерлейкииа (IL), нацеливающий домен сосудистого эндотелиального фактора роста (VEGF), нацеливающий домен инсулиноподобного фактора роста (IGF), нацеливающий домен эпидермальный фактор роста (EGF), нацеливающий домен трансформационного фактора роста-β (TGFβ), нацеливающий домен костного морфогенетического белка (BMP), нацеливающий домен фактора роста и дифференцировки (GDF), нацеливающий домен активина или нацеливающий домен фактор роста фибробластов (FGF), или нацеливающий домен фактора роста тромбоцитов (PDGF).
[75] Нацеливающий домен опиоидного пептида может включать энкефалиновый пептид, бычий адреномедуллярный пептид 22 (ВАМ22), эндоморфиновый пептид, эндорфиновый пептид, динорфиновый пептид, ноцицептиновый пептид или геморфиновый пептид.
[76] Таким образом, ТЕМ может содержать нацеливающий домен в любом и во всех местах, при условии, что ТЕМ способен осуществлять интоксикационный процесс. Не ограничивающие примеры включают определение местоположения нацеливающего домена на амино-конце ТЕМ; определение местоположения нацеливающего домена между ферментативным доменом клостридиального токсина и транслокационным доменом клостридиального токсина ТЕМ; и определение местоположения направляющего домена на карбоксильном конце ТЕМ. Другие не ограничивающие примеры включают определение местоположения направляющего домена между ферментативным доменом клостридиального токсина и транслокационным доменом клостридиального токсина ТЕМ. Ферментативный домен природных клостридиальных токсинов содержит нативный начальный метионин. Таким образом, в доменных организациях, в которых ферментативный домен не содержится в аминоконцевом месте, аминокислотную последовательность, содержащую начальный метионин, следует поместить перед аминоконцевым доменом. Точно так же, если направляющий домен находится в аминоконцевом положении, аминокислотная последовательность, содержащая начальный метионин и сайт протеазного расщепления, могут быть функционально связанными в ситуациях, в которых для направляющего домена необходим свободный аминоконец, см., например, Shengwen Li et al., Degradable Clostridial Toxins, заявка на патент США 11/572,512 (23 января 2007 г.), полное содержание которой включено в настоящий документ посредством ссылки. Кроме того, в данной области техники известно, что при добавлении полипептида, который является функционально-связанным с аминоконцом другого полипептида, содержащего начальный метионин, исходный остаток метионина может быть удален.
[77] ТЕМ, описанный в настоящем документе, может в некоторых случаях содержать экзогенный сайт протеазного расщепления, что позволяет использовать экзогенную протеазу для преобразования одноцепочечной полипептидной формы ТЕМ в его более активную двухцепочечную форму. В данном описании термин "сайт расщепления экзогенной протеазой" является синонимом термина "сайт расщепления не встречающейся в природе протеазой" или "сайт расщепления ненативной протеазой" и означает то, что сайт расщепления не встречающейся в природе протеазой обнаруживается в области двухцепочечной петли природного клостридиального токсина.
[78] Несмотря на то, что ТЕМ различаются по своей общей молекулярной массе, размер нацеливающего домена, процесс активации и его зависимость от экзогенного сайта расщепления, по существу, аналогичны клостридиальным токсинам, полученным рекомбинантным способом. См., например, Steward, el al., Activatable Clostridial Toxins, US 2009/0081730; Steward, et al., Modified Clostridial Toxins with Enhanced Translocation Capabilities and Altered Targeting Activity For Non-Clostridial Toxin Target Cells, заявка на патент США №11/776,075; Steward, et al., Modified Clostridial Toxins with Enhanced Translocation Capabilities and Altered Targeting Activity for Clostridial Toxin Target Cells, US 2008/0241881; Steward, et al., Degradable Clostridial Toxins, US 2011/0287517, каждая из которых включена в настоящий документ посредством ссылки. В общем случае, процесс активации, который преобразует одноцепочечный полипептид в его двухцепочечную форму с использованием экзогенных протеаз, может быть использован для обработки ТЕМ, имеющих нацеливающий домен, организованный в расстановке аминогруппы, центральной группы или карбоксильной группы. Это происходит потому, что для большинства нацеливающих доменов аминоконец фрагмента не участвует в связывании рецептора. Таким образом, широкий диапазон сайтов протеазного расщепления может быть использован для получения активной двухцепочечной формы ТЕМ. Тем не менее, нацеливающие домены, для которых необходим свободный аминоконец для связывания рецептора, требуют сайт протеазного расщепления, неустойчивая связь которого расположена на карбоксильном конце. Использование сайта протеазного расщепления в конструкции ТЕМ описаны, например, в работах Steward, et al., Activatable Clostridial toxins, US 2009/0069238; Ghanshani, et al., Modified Clostridial Toxins Comprising an Integrated Protease Cleavage Site-Binding Domain, US 2011/0189162; и Ghanshani, et al., Methods of Intracellular Conversion of Single-Chain Proteins into their Di-chain Form, международная заявка на патент с серийным номером PCT/US 2011/22272, полное содержание каждой из которых включено в настоящий документ посредством ссылки.
[79] Фармацевтические композиции
[80] В аспектах настоящего изобретения предлагается, в частности, фармацевтическая композиция для внутрипузырного введения в мочевой пузырь, содержащая вещество, полученное из клостридий, и по меньшей мере один пермеабилизирующий агент.
[81] Вещество, полученное из клостридий:
[82] В данном контексте фраза "вещество, полученное из клостридий" охватывает нативные или рекомбинантные нейротоксины, рекомбинантные модифицированные токсины, их фрагменты, модуляторы нацеленного везикулярного экзоцитоза (ТЕМ) или их комбинации. В некоторых вариантах реализации изобретения вещество, полученное из клостридий, представляет собой нативный или модифицированный ботулинический токсин. В одном варианте реализации изобретения вещество, полученное из клостридий, представляет собой ботулинический токсин типа А. В некоторых вариантах реализации изобретения вещество, полученное из клостридий, представляет собой ботулинический токсин типа В, С1, D, Е или F. В альтернативных вариантах реализации изобретения вещество, полученное из клостридий, содержит ТЕМ.
[83] В некоторых вариантах реализации изобретения указанная фармацевтическая композиция содержит терапевтически эффективное количество вещества, полученного из клостридий. Термин "терапевтически эффективное количество" относится к количеству вещества, полученного из клостридий, которое вводят индивидууму в одной схеме лечения. Таким образом, эффективное количество вещества, полученного из клостридий, и/или ТЭМ не относится к количеству вводимого в определенное место. Например, эффективное количество клостридиального токсина, такого как ботулинический токсин, вводимого индивидууму, может составлять 10 Ед, в то время как количество токсина, вводимое в определенное место введения, может составлять 2 Ед, т.е., 2 Ед в пять различных мест. В некоторых вариантах реализации изобретения терапевтически эффективное количество ботулинического токсина находится в пределах от 10 Ед до 1000 Ед, более предпочтительно от около 50 Ед до около 500 Ед.
[84] Применительно к комбинированной терапии, включающей клостридиальный токсин и ТЕМ, эффективное количество клостридиального токсина представляет собой то количество, которое в комбинации с ТЕМ обеспечивает достижение желаемого терапевтического эффекта, но при введении в качестве монотерапии такое количество может оказаться неэффективным. Например, как правило, около 75-125 Ед БОТОКСа® (Allergan, Inc., Ирвин, Калифорния), BoNT/A, вводят путем внутримышечной инъекции в мышцу с диатоническими спазмами с целью лечения дистонии мышц шеи. При комбинированной терапии субоптимальное эффективное количество BoNT/A будет вводиться для лечения дистонии мышц шеи, если такой токсин используется в схеме комбинированной терапии вместе с ТЕМ.
[85] Пермеабилизирующие агенты
[86] Примеры пермеабилизирующих агентов включают, но не ограничиваются ими, анионные поверхностно-активные вещества, катионные поверхностно-активные вещества, неионогенные поверхностно-активные вещества, гликоли, хелатирующие агенты, катионные полимеры, мукоадгезивы, полипептиды или их смеси.
[87] В некоторых вариантах реализации изобретения пермеабилизирующий агент селективно связывается с веществом, полученным из клостридий, таким как ботулинический токсин, с образованием комплекса. В альтернативных вариантах реализации изобретения пермеабилизирующий агент не связывается с ботулиническим токсином. В альтернативных вариантах реализации изобретения пермеабилизирующий агент взаимодействует с веществом, полученным из клостридий, посредством Ван-дер-Ваальсовых сил.
[88] В определенных вариантах реализации изобретения пермеабилизирующий агент может представлять собой анионные поверхностно-активные вещества. Примеры анионных поверхностно-активных веществ, пригодных для указанного состава, включают, но не ограничиваются ими, SDS, лаурилсульфат натрия, а также их аналоги, производные или любые их комбинации.
[89] В определенных вариантах реализации изобретения пермеабилизирующий агент может представлять собой катионные поверхностно-активные вещества. Примеры катионных поверхностно-активных веществ, пригодных для указанного состава, включают, но не ограничиваются ими, сульфат протамина, бромид бензалкония, соли четвертичного аммония, такие как поли(диметилимино)-2-бутен-1,4-диилхлорид, α-[4-трис(2-гидроксиэтил)аммоний-2-бутенил-ω-трис(2-гидроксиэтил)аммоний) дихлорид (CAS номер 75345-27-6), как правило, коммерчески доступен как polyquaternium I® от ONYX Corporation, галогениды и бигуаниды бензалкония, такие как соли алексидина, свободное основание алексидина, соли хлоргексидина, бигуаниды гексаметилена и их полимеры, аналоги и производные. Соли алексидина и хлоргексидина могут быть либо органическими, либо неорганическими и обычно представляют собой нитраты, ацетаты, фосфаты, сульфаты, галогениды и т.п., или любую их комбинацию и т.п.
[90] В некоторых вариантах реализации изобретения пермеабилизирующий агент может представлять собой другие катионные агенты, включая, но не ограничиваясь ими, поли(этиленимин) (PEI), олеиламин, диолеил-фосфатидилэтаноламин (DOPE) и диолеоил-триметиламмоний-пропан (DOTAP), их аналоги, производные или их комбинации.
[91] В определенных вариантах реализации изобретения пермеабилизирующий агент может содержать полиэтиленгликоль (ПЭГ) или полиэтиленоксид (ПЭО). ПЭГ может включать, например, ПЭГ с молекулярной массой в диапазоне от около 200 грамм на моль (г/моль) до около 20000 грамм на моль (г/моль). В одном варианте реализации изобретения пермеабилизирующий агент содержит полиэтиленгликоль 3350.
[92] В определенных вариантах реализации изобретения пермеабилизирующий агент может содержать полоксамер. Полоксамер может содержать, например, Р80, P124, P188, Р237, Р338 и Р407, их аналоги, производные или их комбинации. В определенных вариантах реализации изобретения пермеабилизирующий агент может содержать повидон (ПВП). ПВП может содержать, например, ПВП-полимеры, а также их аналоги или производные.
[93] В определенных вариантах реализации изобретения пермеабилизирующий агент может содержать L- или D-полипептиды с молекулярной массой в диапазоне от около 1000 до около 100000 дальтон. В одном варианте реализации изобретения пермеабилизирующий агент представляет собой поли-L-лизин. В другом варианте реализации изобретения пермеабилизирующий агент включает проникающие в клетку пептиды.
[94] В определенных вариантах реализации изобретения пермеабилизирующий агент может содержать бензиловый спирт и тому подобное, полигексаметилен бигуанид (с высокой и/или низкой молекулярной массой) и тому подобное, белки, включая, но не ограничиваясь ими, нативный или рекомбинантный человеческий сывороточный альбумин, полимиксин В и тому подобное, или их смеси.
[95] В определенных вариантах реализации изобретения пермеабилизирующий агент включает неионогенные поверхностно-активные вещества. Примеры неионогенных поверхностно-активных веществ, пригодных для указанного состава, включают, по не ограничиваются ими, алкилариловые полиэфиры, их аналоги и производные (например, ТХ-100, аналоги или производные), полоксамеры, полиоксиэтилированные эфиры (например, семейства Brij), Tween, Big CHAPS, Deoxy Big CHAPS, тилоксапол, сорбитанмоноолеат (SPAN) 20, 40, 60, кремофор EL, альфа-токоферол TPGS, полиоксилстеарат 40, их аналоги, производные или комбинации.
[96] В некоторых вариантах реализации изобретения пермеабилизирующий агент содержит алкилариловый полиэфир, его аналоги или производные. В одном варианте реализации изобретения пермеабилизирующий агент содержит октилфенол этоксилат, его аналоги или производные. Октилфенол этоксилат также известен как полиоксиэтиленоктилфениловый эфир, 4-октилфенол полиэтоксилат, Моно 30, ТХ-100, t-октилфеноксиполэтоксиэнанол, октоксинол-9 или более широко известный под торговым названием Тритон™ Х-100. В альтернативных вариантах реализации изобретения пермеабилизирующий агент содержит ноноксинол 9, его аналоги или производные.
[97] В определенных вариантах реализации изобретения пермеабилизирующий агент содержит катионный полимер. В некоторых вариантах реализации изобретения катионный полимер представляет собой мукоадгезив. В некоторых вариантах реализации изобретения катионный полимер включает хитозан, хондроитин, аналоги хитозана, аналоги хондроитина, производные хитозана или производные хондроитина.
[98] В некоторых вариантах реализации изобретения указанная фармацевтическая композиция содержит вещество, полученное из клостридий, и по меньшей мере один пермеабилизирующий агент. В одном варианте реализации изобретения вещество, полученное из клостридий, представляет собой ботулинический токсин. В одном варианте реализации изобретения вещество, полученное из клостридий, включает ботулинический токсин. В некоторых вариантах реализации изобретения по меньшей мере один пермеабилизирующий агент содержит хитозан, аналог хитозана или производное хитозана и ТХ-100, аналоги ТХ-100 или производные ТХ-100. В некоторых вариантах реализации изобретения указанная фармацевтическая композиция содержит ботулинический токсин, хитозан, аналог хитозана или производное хитозана, а также ноноксинол-9, аналоги ноноксинола-9 или производные ноноксинола-9. В альтернативных вариантах реализации изобретения вещество, полученное из клостридий, представляет собой ТЕМ. В альтернативных вариантах реализации изобретения состав содержит ботулинический токсин и ТЕМ.
[99] В некоторых вариантах реализации изобретения пермеабилизирующий агент может содержать хелатирующие агенты, включая, но не ограничиваясь ими, ЭДТА, EGTA (этиленгликоль тетрауксусная кислота), циклогександиамин тетраацетат (CDTA), гидроксиэтилэтилендиамин триацетат (HEDTA), диэтилентриамин пентаацетат (DTPA), 1,2-диаминоциклогексан тетраацетат и гексаметафосфат. Эти агенты предпочтительно используют в виде солей, обычно натриевых солей, таких как двунатриевая соль EDTA, три натриевая соль HEDTA, гексаметафосфат натрия, или любые их комбинации и тому подобное.
[100] Таким образом, в одном аспекте указанная фармацевтическая композиция содержит вещество, полученное из клостридий, и по меньшей мере один пермеабилизирующий агент, при этом фармацевтический состав пригоден для внутрипузырного введения в мочевой пузырь. В некоторых вариантах реализации изобретения вещество, полученное из клостридий, является ботулиническим токсином, а пермеабилизирующий агент содержит мукоадгезивное и поверхностно-активное вещество. В некоторых вариантах реализации изобретения мукоадгезивный агент включает хитозан, аналоги хитозана, производные хитозана, хондроитин, аналоги хондроитина или производные хондроитина. В некоторых вариантах реализации изобретения поверхностно-активное вещество включает неионогенные поверхностно-активные вещества. В одном варианте реализации изобретения указанная фармацевтическая композиция содержит ботулинический токсин типа А, хитозан, аналоги хитозана или производные хитозана, а также ТХ-100, аналоги ТХ-100 или производные ТХ-100. В некоторых вариантах реализации изобретения поверхностно-активное вещество содержит ноноксинол-9, аналоги ноноксинола-9 или производные ноноксинола-9. В альтернативных вариантах реализации изобретения вещество, полученное из клостридий, представляет собой ТЕМ.
[101] В некоторых вариантах реализации изобретения пермеабилизирующий агент присутствует в проникающе-эффективном количестве. В одном варианте реализации изобретения проникающе-эффективное количество относится к количеству, эффективному для существенного увеличения проницаемости поверхности стенки моченого пузыря при ограниченном повреждении целостности мочевого пузыря. В одном варианте реализации изобретения проникающе-эффективное количество относится к количеству, эффективному для получения возможности проникновения терапевтически эффективного количества ботулинического нейротоксина через стенку мочевого пузыри в терапевтически эффективной степени. В одном варианте реализации изобретения проникающе-эффективное количество относится к количеству, эффективному для существенного увеличения проницаемости поверхности стенки мочевого пузыря в течение желаемого временного интервала для терапевтически эффективного количества токсина в терапевтически эффективной степени без необратимого повреждения стенки мочевого пузыря. В некоторых вариантах реализации изобретения повышенная проницаемость является обратимой после желаемого интервала времени, по истечении которого стенка мочевого пузыря может полностью или частично восстановить свою первоначальную непроницаемость или избирательную проницаемость. В некоторых вариантах реализации изобретения стенка мочевого пузыря восстанавливает свою первоначальную непроницаемость или избирательную проницаемость но истечении интервала времени от около 1 часа до около 24 часов после внутрипузырной инстилляции. В некоторых вариантах реализации изобретения временной интервал находится в диапазоне от около 3 часов до около 18 часов. В некоторых вариантах реализации изобретения временной интервал находится в диапазоне от около 4 часов до около 12 часов. Скорость восстановления, при которой стенка мочевого пузыря восстанавливает свою первоначальную избирательную проницаемость или непроницаемость, может зависеть от характеристик выбранного пермеабилизирующего агента, количества, характеристик поверхности проникания, времени экспозиции и условий, окружающих поверхность проникания. В одном из вариантов реализации изобретения целостность мочевого пузыря после введения указанной фармацевтической композиции может быть оценена по степени иммунного ответа, например, по наличию специфических иммунных клеток.
[102] Проникающе-эффективное количество варьирует в зависимости от ряда факторов, включая, но не ограничиваясь этим, характеристики вещества, полученного из клостридий, характеристики поверхности проникания (например, стойки мочевого пузыря), тип пермеабилизирующего агента и среду, окружающую поверхность проникания.
[103] В некоторых вариантах реализации изобретения проникающе-эффективное количество пермеабилизирующего агента составляет от около 0,005% до около 10% (масс./об.), более предпочтительно, от около 0,025% до около 5% (масс./об.), и наиболее предпочтительно, от около 0,05% до около 0,5% (масс./об.). В некоторых вариантах реализации изобретения указанная фармацевтическая композиция содержит проникающе-эффективное количество Тритона™ Х-100, аналогов или производных Тритона™ Х-100 от 0,005% до около 10% (масс./об.), более предпочтительно, от около 0,025% до около 5% (масс./об.), и наиболее предпочтительно, от около 0,1% до около 0,5% (масс./об.). В одном конкретном варианте реализации изобретения проникающе-эффективное количество Тритона™ Х-100 составляет около 0,1% (масс./об.).
[104] В некоторых вариантах реализации изобретения пермеабилизирующий агент используется в комбинации с мукоадгезивным агентом. В некоторых вариантах реализации изобретения мукоадгезивный агент представляет собой катионный полимер. В некоторых вариантах реализации изобретения мукоадгезивный агент включает хитозан, аналоги хитозана, производные хитозана, хондроитин, аналоги хондроитина или производные хондроитина. В некоторых вариантах реализации изобретения проникающе-эффективное количество мукоадгезивного агента составляет от около 0,005%) до 10% (масс./об.), более предпочтительно, от около 0,02% до около 5% (масс./об.), и наиболее предпочтительно, от около 0,05% до около 2% (масс./об.). В одном варианте реализации изобретения проникающе-эффективное количество хитозана, аналогов хитозана или производных хитозана составляет около 1% (масс./об.). В некоторых вариантах реализации изобретения состав содержит: (1) ботулинический токсин, (2) Тритон™ Х-100, аналог Тритона™ Х-100, производные Тритона™ Х-100 или их смеси; и (3) хитозан, аналоги хитозана, производные хитозана или их смеси. В некоторых вариантах реализации изобретения состав содержит: (1) ботулинический токсин типа А, (2) Тритон™ Х-100, аналоги Тритона™ Х-100, производные Тритона™ Х-100 или их смеси; и (3) хитозан, аналоги хитозана, производные хитозана или их смеси. В некоторых вариантах реализации изобретения состав содержит от около 20 единиц до около 300 единиц ботулинического токсина типа А, от около 0,5% до около 2% (масс./об.) хитозана, аналогов хитозана, производных хитозана; или их смесей, и от около 0,05% до около 1% (масс./об.) Тритона Х-100, аналогов Тритона Х-100, производных Тритона Х-100 или их смесей. В одном варианте реализации изобретения состав содержит от около 100 единиц до 200 единиц ботулинического токсина типа А, около 1% хитозана и около 0,1% (масс./об.) Тритона™ X-100.
[105] В некоторых вариантах реализации изобретения пермеабилизирующий агент представляет собой ноноксинол 9. В некоторых вариантах реализации изобретения проникающе-эффективное количество ноноксинола 9 составляет от около 0,005% до около 10% (масс./об.), более предпочтительно, от около 0,025% до около 5% (масс./об.), и наиболее предпочтительно, от около 0,05% до около 0,5% (масс./об.). В одном конкретном варианте реализации изобретения указанная фармацевтическая композиция содержит проникающе-эффективное количество ноноксинола 9, которое составляет около 0,1% (масс./об.). В одном конкретном варианте реализации изобретения указанная фармацевтическая композиция содержит проникающе-эффективное количество ноноксинола 9, которое составляет около 0,5% (масс./об.). В некоторых вариантах реализации изобретения ноноксинол 9 используется в комбинации с мукоадгезивным агентом. В некоторых вариантах реализации изобретения мукоадгезивный агент включает хитозан, аналоги хитозана, производные хитозана, хондроитин, аналоги хондроитина или производные хондроитина. В некоторых вариантах реализации изобретения проникающе-эффективное количество мукоадгезивного агента находится в пределах от около 0,005% до 10% (масс./об.), более предпочтительно, от около 0,02% до около 5% (масс./об.), и наиболее предпочтительно, от около 0,1% до около 2% (масс./об.). В некоторых вариантах реализации изобретения проникающе-эффективное количество хитозана и производных хитозана составляет от около 0,005% до 10% (масс./об.), более предпочтительно, от около 0,02% до около 5% (масс./об.), и наиболее предпочтительно, от около 0,1% до около 2% (масс./об.). В одном варианте реализации изобретения проникающе-эффективное количество хитозана или производных хитозана составляет около 1% (масс./об.).
[106] В некоторых вариантах реализации изобретения пермеабилизирующий агент может содержать рекомбинантный или нативный человеческий сывороточный альбумин.
[107] В некоторых вариантах реализации изобретения указанная композиция не содержит каких-либо белков животного происхождения. В одном варианте реализации изобретения указанная композиция содержит ботулинический токсин, ТЕМ или рекомбинантный модифицированный токсин (в качестве активного ингредиента) и пригодный полисахарид в качестве стабилизатора или вспомогательного вещества.
[108] Таким образом, в аспектах настоящего изобретения предлагается фармацевтическая композиция, содержащая вещество, полученное из клостридий, и один или более пермеабилизирующих агентов, при этом фармацевтическая композиция пригодна для внутрипузырного введения в мочевой пузырь, причем один или более пермеабилизирующих агентов присутствуют в проникающе-эффективном количестве, как описано в настоящем документе. Варианты состава указанной композиции включают терапевтические агенты и/или вспомогательные вещества, которые будут либо вызывать, либо усиливать фармакологические эффекты веществ, полученных из клостридий.
[109] Вспомогательные вещества могут также быть добавлены для увеличения стабильности состава, усиления действия пермеабилизирующих агентов (пример: EDTA или другие хелатирующие агенты), или для увеличения удержания состава за счет увеличения вязкоупругих свойств, которые будут проявляться сразу же (пример: карбоксиметилцеллюлоза (CMC), гидроксипропилцеллюлоза (НРС), альгинат) или при изменении температуры (пример: полоксамер 407), рН (карбопол Р-934, Р940) и/или ионного окружения (пример: Гельрит геллановая камедь, альгинат).
[110] Вспомогательные вещества могут также быть добавлены, чтобы модулировать тоничность и/или рН мочи и кожи с целью повышения доставки, стабильности, биодоступности и/или терапевтической активности составов.
[111] В другом аспекте настоящего изобретения предлагается способ получения фармацевтического состава, пригодного для внутрипузырного введения в мочевой пузырь, причем указанный способ включает получение раствора, содержащего по меньшей мере один пермеабилизирующий агент, описанный в настоящем документе; добавление раствора к композиции, содержащей вещество, полученное из клостридий и описанное в настоящем документе. В некоторых вариантах реализации изобретения способ включает добавление от около 50 мл до около 100 мл раствора к композиции, содержащей вещество, полученное из клостридий. В некоторых вариантах реализации изобретения вещество, полученное из клостридий, представляет собой ботулинический токсин. В одном варианте реализации изобретения способ включает добавление от около 50 мл до около 100 мл водного раствора, содержащего около 1% (масс./об.) хитозана, аналогов или производных хитозана, и около 0,1% (масс./об.) Тритона ™Х-100, аналогов или производных Тритона ™Х-100, к ботулиническому токсину типа А. В одном варианте реализации изобретения способ включает добавление 50 мл водного раствора, содержащего около 1% (масс./об.) хитозана и около 0,1% (масс./об.) Тритона™Х-100, во флакон, содержащий около 100 единиц или 200 единиц лиофилизированного ботулинического токсина типа А; и аккуратное смешивание с целью разведения лиофилизированного ботулинического токсина типа А.
[112] В некоторых вариантах реализации изобретения также могут быть добавлены вспомогательные вещества, чтобы выступать в качестве носителей для вещества, полученного из клостридий. В одном варианте реализации изобретения в качестве носителя добавляют поли-L-лизин.
[113] Композицию, описанную в настоящем документе, как правило, вводят в виде фармацевтически приемлемой композиции. В данном описании термин "фармацевтически приемлемый" означает любую молекулярную структуру или композицию, которая не вызывает вредной, аллергической или другой неблагоприятной или нежелательной реакции при введении в организм человека. В данном контексте термин "фармацевтически приемлемая композиция" является синонимом "фармацевтической композиции" и означает терапевтически эффективную концентрацию активного ингредиента, такого как, например, любой из клостридиальных токсинов и/или ТЕМ, описанных в настоящем документе. Фармацевтическая композиция, описанная в настоящем документе, пригодна как для лечения человека, так и для применения в ветеринарии. Фармацевтическая композиция может вводиться индивидууму в качестве монотерапии или в комбинации с другими дополнительными активными ингредиентами, агентами, лекарственными средствами или гормонами. Фармацевтические композиции могут быть изготовлены с использованием любого из множества процессов, включая, без ограничения, обычное смешивание, растворение, гранулирование, изготовление драже, растирание в порошок, эмульгирование, инкапсулирование, включение - и лиофилизацию. Фармацевтическая композиция может принимать любую из множества форм, включая, без ограничения, стерильный раствор, суспензию, эмульсию, лиофилизат, таблетку, пилюлю, пеллету, капсулу, порошок, сироп, эликсир или любую другую лекарственную форму, подходящую для введения.
[114] Указанная фармацевтическая композиция может в некоторых случаях включать фармацевтически приемлемый носитель, который облегчает переработку активного ингредиента в фармацевтически приемлемые композиции. B данном контексте термин "фармацевтически приемлемый носитель" является синонимом с термином "фармакологический носитель" и означает любого носителя, который но существу не характеризуется длительным или постоянным вредным эффектом при введении и охватывает такие термины, как "фармакологически приемлемый носитель, стабилизатор, разбавитель, добавка, дополнительное или вспомогательное вещество". Такой носитель, как правило, смешивают с активным соединением, или допускают разбавление или ограничение активного соединения, при этом носитель может быть твердым, полутвердым или жидким агентом. Подразумевается, что активные ингредиенты могут быть растворимыми или могут быть доставлены в виде суспензии в требуемом носителе или разбавителе. Можно использовать любой из множества фармацевтически приемлемых носителей, включая, без ограничения, водные носители, такие как, например, вода, физиологический раствор, глицин, гиалуроновая кислота и тому подобное; твердые носители, такие как, например, маннит, лактоза, крахмал, стеарат магния, сахарин натрия, тальк, целлюлоза, глюкоза, сахароза, карбонат магния и тому подобное; растворители; дисперсионные среды; покрытия; антибактериальные и противогрибковые агенты; изотопические и задерживающие абсорбцию агенты; или любой другой неактивный ингредиент. Выбор фармакологически приемлемого носителя может зависеть от способа введения. В фармацевтически приемлемых композициях предполагается применение любого фармакологически приемлемого носителя, за исключением тех случаев, когда такой носитель является несовместимым с активным ингредиентом. Не ограничивающие примеры конкретных применений таких фармацевтических носителей можно найти в Pharmaceutical Dosage Forms and Drug Delivery Systems (Howard C. Ansel et al., eds., Lippincott Williams & Wilkins Publishers, 7th ed. 1999); Remington: The Science and Practice of Pharmacy (Alfonso R. Gennaro ed., Lippincott, Williams & Wilkins, 20th ed. 2000); Goodman & Gilman's The Pharmacological Basis of Therapeutics (Joel G. Hardman et al., eds., McGraw-Hill Professional, 10th ed. 2001); и Handbook of Pharmaceutical Excipients (Raymond C. Rowe et al., APhA Publications, 4th edition 2003). Такие действия являются стандартными процедурами, а любые модификации находятся в пределах объема знаний специалиста в данной области техники и определяются после ознакомления с данным документом.
[115] Фармацевтическая композиция, описанная в настоящем документе, может дополнительно включать, без ограничения, другие фармацевтически приемлемые компоненты (или фармацевтические компоненты), включая, без ограничения, буферы, консерванты, агенты, регулирующие тоничность, соли, антиоксиданты, агенты, регулирующие осмолярность, физиологические вещества, фармакологические вещества, объемообразующие агенты, эмульгаторы, смачивающие агенты, подсластители или вкусовые агенты и тому подобное. Для приготовления фармацевтической композиции, описанной в настоящем документе, могут использоваться различные буферы и агенты, регулирующие рН, при условии, что полученный в результате препарат является фармацевтически приемлемым. Такие буферы включают, без ограничения, ацетатные буферы, нитратные буферы, фосфатные буферы, нейтральный буферный солевой раствор, фосфатный буферный солевой раствор и боратные буферы. Подразумевается, что кислоты или основания могут использоваться для регулирования рН композиции, насколько это необходимо. Фармацевтически приемлемые антиоксиданты включают, без ограничения, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол. Пригодные консерванты включают, без ограничения, хлорид бензалкония, хлорбутанол, тимеросал, ацетат фенил ртути, нитрат фенилртути, стабилизированную окси-хлоро композицию и хелатообразователи, такие как, например, DTPA или DTPA-бисамид, кальция DTPA и CaNaDTPA-бисамид. Агенты, регулирующие тоничность, используемые в фармацевтической композиции, включают, без ограничения, соли, такие как, например, хлорид натрия, хлорид калия, маннит или глицерин и другие фармацевтически приемлемые агенты, регулирующие тоничность. Фармацевтическая композиция может быть представлена в виде соли и образована со многими кислотами, включая, но не ограничиваясь ими, соляной, серной, уксусной, молочной, винной, яблочной, янтарной и т.д. Соли, как правило, более растворимы в водных или других протонных растворителях, чем по сравнению с соответствующими свободными основаниями. Подразумевается, что эти и другие вещества, известные в данной области фармакологии, могут быть включены в фармацевтическую композицию. Типичная фармацевтическая композиция, содержащая клостридиальный токсин и ТЕМ, описана в Hunt, et al., Animal Protein-Free Pharmaceutical Compositions, серийный номер патента США 12/331816; и Dasari, et al., Clostridial Toxin Pharmaceutical Compositions, WO/2010/090677, полное содержание которых включено в настоящий документ посредством ссылки.
[116] Выбор пригодных фармацевтически приемлемых носителей будет зависеть от истинной природы желаемой конкретной композиции, например, в зависимости от того, в каком виде необходимо получить композицию по настоящему изобретению: в виде жидкого раствора, лиофилизированного порошка для разведения перед использованием, раствора суспензии, наночастиц, липосом или микроэмульсии.
[117] Выбор пригодного фармацевтически приемлемого носителя также будет зависеть от способа введения. Предпочтительно, носитель является пригодным для выбранного способа введения. Способы введения фармацевтического состава по настоящему изобретению включают, но не ограничены инъекционным, безыгольчатым инъекционным введением (например, Bioject, JetTouch), электродвижущей, трансдермальной доставкой или внутрипузырной инсталляцией. В одном специфическом варианте реализации изобретения состав содержит фармацевтически приемлемый носитель для инсталляции в мочевой пузырь. В одном варианте реализации изобретения фармацевтический носитель содержит полилизин.
[118] Способы лечения
[119] В аспектах настоящего изобретения предлагается, в частности, способ лечения патологических состояний с использованием фармацевтической композиции, содержащей вещество, полученное из клостридий, и по меньшей мере один пермеабилизирующий агент, причем введение фармацевтической композиции по настоящему изобретению предотвращает или ослабляет интенсивность симптома, ассоциированного с патологическим состоянием, которое подлежит лечению. В некоторых вариантах реализации изобретения введение осуществляется путем инъекции. В альтернативных вариантах реализации изобретения введение осуществляют трансдермально, подкожно или место. В дополнительных альтернативных вариантах реализации изобретения введение осуществляют путем внутрипузырной доставки.
[120] В некоторых вариантах реализации настоящего изобретения предлагаются способы лечения заболеваний, нарушений, патологических состояний и т.п., включающие этап введения фармацевтической композиции по настоящему изобретению субъекту, имеющему для этого показания, в количестве, достаточном для улучшения состояния здоровья пациента. В некоторых вариантах реализации изобретения указанные заболевания характеризуются нервно-мышечными нарушениями, такие как, например, заболевания, при которых поражаются мышцы и их иннервация, такие как, например, гиперактивный мочевой пузырь и тому подобное. Некоторые варианты настоящего изобретения относятся к лечению болевого синдрома, такого как, например, лечение головной боли или боли в спине, или мышечной боли, или тому подобное. В некоторых вариантах реализации настоящего изобретения предлагаемые способы включают лечение психических расстройств, в том числе, например, депрессии, тревоги и тому подобного.
[121] Лечение урологических нарушений
[122] В некоторых вариантах реализации настоящего изобретения нарушение включает урологические заболевания и патологические состояния мочевого пузыря, в том числе, по не ограничиваясь ими, гиперактивный мочевой пузырь (ГМП), цистит, рак мочевого пузыря, нейрогенную гиперактивность детрузора (НГД). В одном варианте реализации настоящего изобретения также предлагаются способы лечения пациента, страдающего от синдрома гиперактивного мочевого пузыря (ГМП), такого, например, который возник в результате неврологического нарушения (НГМП), или идиоматического ГМП (ИГМП).
[123] Нейрогенная дисфункция мочевого пузыря представляет собой дисфункцию, которая возникает в результате нарушений нормальной нервной передачи, ассоциированной с мочеиспусканием. Одним из типов нейрогенной дисфункции мочевого пузыря является гиперактивный (спастический или гиперрефлексивный) мочевой пузырь. Гиперактивный нейрогенный мочевой пузырь характеризуется неконтролируемым, частым выпусканием мочи из мочевого пузыря. Возможно уменьшение емкости и неполное опорожнение мочевого пузыря. Спастический мочевой пузырь может быть обусловлен неспособностью детрузора мочевого пузыря ингибировать опорожняющие сокращения до тех пор, пока не накопится достаточное количество мочи. Часто даже при небольшом количестве мочи в мочевом пузыре испытывается сильное желание к мочеиспусканию. Пациент может указывать на наличие императивных позывов, частое мочеиспускание, никтурию и недержание мочи. Другой тип нейрогенной дисфункции мочевого пузыря характеризуется нарушениями расслабления сфинктера мочевого пузыря. Сфинктер может быть спастический. Это вызывает трудности для опорожнения мочевого пузыря, что может привести к задержке мочи и инфекции мочевых путей. При другом типе нейрогенной дисфункции мочевого пузыря происходит одновременное сокращение мышцы детрузора и сфинктера мочевого пузыря, что приводит к задержке мочи. Дисфункция, при которой одновременно сокращается детрузор и сфинктер мочевого пузыря, называется детрузорно-сфинктерная диссинергия (ДСД). Патенты США №7449192; 8062807 и 7968104, каждый из которых включен в настоящий документ посредством ссылки во всей своей полноте, описывают способы лечения пациента с нейрогенной дисфункцией мочевого пузыря путем введения терапевтически эффективного количества токсина ботулизма в стенку мочевого пузыря пациента.
[124] Интерстициальный цистит (ИЦ) является неизлечимым, хроническим, изнуряющим заболеванием мочевого пузыря, которое характеризуется болевым синдромом в мочевом пузыре, хроническим болевым синдромом в области таза, симптомами раздражения при мочеиспускании и стерильной мочой. При ИЦ стенка мочевого пузыря, как правило, воспалительно инфильтрирована с изъязвлением слизистых оболочек и рубцеванием, которое обуславливает сокращение гладких мышц, снижение емкости мочи, гематурию и частое, болезненное мочеиспускание.
[125] В некоторых вариантах реализации настоящего изобретения предлагаемые фармацевтические композиции могут вводиться в мочевой пузырь или близлежащие участки, например, в детрузор, при этом введение состава уменьшает недержание мочи, ассоциированное с гиперактивным мочевым пузырем. В некоторых вариантах реализации изобретения доза может варьироваться от около 10 единиц до около 200 единиц на курс лечения. В некоторых вариантах реализации изобретения составы могут вводиться путем внутрипузырной доставки в мочевой пузырь.
[126] Таким образом, в аспектах настоящего изобретения дополнительно предлагается способ лечения пациента с патологией мочевого пузыря, имеющего для этого показания, включающий: приготовление фармацевтической композиции, описанной в настоящем документе, содержащей вещество, полученное из клостридий, и по меньшей мере один пермеабилизирующий агент, причем пермеабилизирующий агент присутствует в количестве, эффективном для существенного повышения проницаемости стенки мочевого пузыря для вещества, полученного из клостридий, в терапевтически эффективной степени и без необратимого повреждения стенки мочевого пузыря; и инсталляцию фармацевтической композиции в мочевой пузырь через катетер; таким образом, осуществляя лечения патологии мочевого пузыря. В одном варианте реализации изобретения способ дополнительно включает предварительную обработку стенки мочевого пузыря фармацевтической композицией перед этапом инсталляции.
[127] В некоторых вариантах реализации изобретения способ лечения патологии мочевого пузыря у пациента, включающий приготовление раствора, содержащего пермеабилизирующий агент; добавление раствора к веществу, полученному из клостридий, для получения терапевтического состава, инсталляцию терапевтического состава через катетер в мочевой пузырь пациента. В некоторых вариантах реализации изобретения вещество, полученное из клостридий, представляет собой ботулинический токсин. В альтернативных вариантах реализации изобретения вещество, полученное из клостридий, представляет собой ТЕМ. В одном варианте реализации изобретения вещество, полученное из клостридий, представляет собой ботулинический токсин типа А. В некоторых вариантах реализации изобретения пермеабилизирующий агент представляет собой поверхностно-активное вещество. В одном варианте реализации изобретения пермеабилизирующий агент представляет собой неионогенное поверхностно-активное вещество. В определенных вариантах реализации изобретения пермеабилизирующий агент дополнительно содержит катионный полимер. В некоторых вариантах реализации изобретения катионный полимер представляет собой биоадгезивный или мукоадгезивный агент. В некоторых вариантах реализации изобретения мукоадгезивный агент содержит хитозан, аналог хитозана или производное хитозана. В некоторых вариантах реализации изобретения способ включает смешивание раствора, содержащего неионогенное поверхностно-активное вещество и катионный полимер, с ботулиническим токсином.
[128] В другом аспекте настоящего изобретения предлагается способ облегчения симптомов интерстициального цистита (ИЦ) у пациента, причем указанный способ включает: приготовление фармацевтической композиции, содержащей вещество, полученное из клостридий, и по меньшей мере один пермеабилизирующий агент, причем пермеабилизирующий агент присутствует в количестве, эффективном для существенного повышения проницаемости стенки мочевого пузыря для вещества, полученного из клостридий, в терапевтически эффективной степени и без необратимого повреждения стенки мочевого пузыря; и инсталляцию фармацевтической композиции в мочевой пузырь через катетер; таким образом, ослабляя интенсивность симптомов ИЦ.
[129] В другом аспекте указанный состав увеличивает биодоступность вещества, полученного из клостридий, путем предотвращения или минимизации адсорбции вещества, полученного из клостридий, катетерами, поверхностями устройств доставки (шприц, пластырь, микроигла, сконструированный инжектор (Bioject и т.д.), трубками и контейнерами.
[130] В другом аспекте указанный состав увеличивает биодоступность вещества, полученного из клостридий, путем повышения удерживания вещества, полученного из клостридий, на коже или внутренней поверхности стенки мочевого пузыря посредством мукоадгезивных взаимодействий.
[131] Другие патологические нарушения:
[132] Лечение болевого синдрома
[133] В другом варианте реализации настоящего изобретения предлагаются способы лечения болевого синдрома, включающие этап введения фармацевтического состава по настоящему изобретению субъекту, имеющему для этого показания, в количестве, достаточном для ослабления боли. В другом варианте реализации настоящего изобретения пациент страдает от миофасциальной боли, мигренозной головной боли, головной боли напряжения, невропатической боли, лицевой боли, боли в нижней части спины, головной боли в области придаточных пазух носа, боли, связанной с патологией височно-нижнечелюстного сустава, боли, связанной со спастичностью или дистонией мышц шеи, послеоперационной раневой боли или невралгии. Курс лечения может включать несколько этапов лечения.
[134] В одном варианте реализации изобретения пациент страдает от лицевой боли. Субъект, страдающий от лицевой боли, получает, например, от около 4 до 40 Ед фармацевтического состава по настоящему изобретению на курс лечения. Дозы, составляющие больше чем 40 Ед на курс лечения, можно также вводить пациентам с лицевой болью до достижения терапевтического эффекта. Курс лечения может включать несколько этапов лечения.
[135] В одном варианте реализации изобретения пациент страдает от миофасциальной боли. Субъект, страдающий от миофасциальной боли, получает, например, от около 5 до 100 Ед фармацевтического состава по настоящему изобретению на курс лечения. Дозы, составляющие больше чем 100 Ед на курс лечения, можно также вводить пациентам с миофасциальной болью до достижения терапевтического эффекта. Курс лечения может включать несколько этапов лечения.
[136] В одном варианте реализации изобретения пациент страдает от боли в нижней части спины. Субъект, страдающий от боли в нижней части спины, получает, например, от около 15 до 150 Ед фармацевтического состава по настоящему изобретению на курс лечения. Дозы, составляющие больше чем 150 Ед на курс лечения, можно также вводить пациентам с болью в нижней части спины до достижения терапевтического эффекта. Курс лечения может включать несколько этапов лечения.
[137] В одном варианте реализации изобретения пациент страдает от мигренозной головной боли, в том числе пациент страдает от мигренозных головных болей от 4 часов или более 15 и более дней в месяц. Субъект, страдающий от мигренозной головной боли, получает, например, от около 0,5 до 200 Ед фармацевтического состава по настоящему изобретению на курс лечения. Курс лечения может включать несколько этапов лечения.
[138] Например, пациенту, страдающему от мигренозной головной боли, вводят около 0,5 Ед, около 1,0 Ед, около 1,5 Ед, около 2,0 Ед, около 2,5 Ед, около 3,0 Ед, около 3,5 Ед, около 4,0 Ед, около 4,5 Ед, около 5,0 Ед, около 5,5 Ед, около 6,0 Ед, около 6,5 Ед, около 7,0 Ед, около 7,5 Ед, около 8,0 Ед, около 8,5 Ед, около 9,0 Ед, около 9,5 Ед, около 10,0 Ед, около 12 Ед, около 15 Ед, около 17 Ед, около 20 Ед, около 22 Ед, около 25 Ед, около 27 Ед, около 30 Ед, около 32 Ед, около 35 Ед, около 37 Ед, около 40 Ед, около 42 Ед, около 45 Ед, около 47 Ед или около 50 Ед в определенный участок тела. Пациенту с лечебной целью могут вводить фармацевтический состав в несколько участков: от 2 до 35 участков. В одном варианте реализации изобретения пациент, страдающий от мигрени, в общем получает 31 инъекцию, содержащую 5 Ед в 0,1 мл: в мышцу, сморщивающую бровь (2 инъекции но 5 Ед каждая), в мышцу гордецов (1 инъекция с 5 Ед), в лобную мышцу (4 инъекции по 5 Ед каждая), в височную мышцу (8 инъекций по 5 Ед каждая), в затылочную мышцу (б инъекций по 5 Ед каждая), в шейную околопозвоночную мышцу (4 инъекции по 5 Ед каждая) и в трапециевидную мышцу (6 инъекций по 5 Ед каждая). За исключением мышцы гордецов, в которую можно ввести препарат по средней линии, во все мышцы, в некоторых вариантах реализации изобретения, инъекции могут осуществляться билатерально: т.е. половина инъекций будет е левой стороны головы и шеи, а вторая половина - с правой стороны. Дозы, составляющие больше чем 200 Ед на курс лечения, можно также вводить пациентам с мигренозной головной болью до достижения терапевтического эффекта. Курс лечения может включать несколько этапов лечения. В альтернативных вариантах реализации изобретения фармацевтическую композицию вводят подкожно или место.
[139] В одном варианте реализации изобретения пациент страдает от головной боли в области придаточных пазух носа. Субъект, страдающий от головной боли в области придаточных пазух носа, получает, например, от около 4 до 40 Ед фармацевтического состава по настоящему изобретению на курс лечения. В дополнительном примере субъект получает от около 4 до 40 Ед на курс лечения. Дозы, составляющие больше чем 40 Ед на курс лечения, можно также вводить пациентам с головной болью в области придаточных пазух носа до достижения терапевтического эффекта. Курс лечения может включать несколько этапов лечения.
[140] В одном варианте реализации изобретения пациент страдает от головной боли напряжения. Субъект, страдающий от головной боли напряжения, получает, например, от около 5 до 50 Ед фармацевтического состава по настоящему изобретению на курс лечения. В одном варианте реализации изобретения пациент, страдающий от головной боли напряжения, в общем получает 31 инъекцию, содержащую 5 Ед в 0,1 мл: в мышцу, сморщивающую бровь (2 инъекции по 5 Ед каждая), в мышцу гордецов (1 инъекция с 5 Ед), в лобную мышцу (4 инъекции по 5 Ед каждая), в височную мышцу (8 инъекций по 5 Ед каждая), в затылочную мышцу (6 инъекций по 5 Ед каждая), в шейную околопозвоночную мышцу (4 инъекции по 5 Ед каждая) и в трапециевидную мышцу (6 инъекций по 5 Ед каждая). За исключением мышцы гордецов, в которую можно ввести препарат по средней линии, во все мышцы, в некоторых вариантах реализации изобретения, инъекции могут осуществляться билатерально: т.е. половина инъекций будет с левой стороны головы и шеи, а вторая половина - с правой стороны. Дозы, составляющие больше чем 200 Ед на курс лечения, можно также вводить пациентам с головной болью напряжения до достижения терапевтического эффекта. Курс лечения может включать несколько этапов лечения. В альтернативных вариантах реализации изобретения фармацевтический состав можно вводить местно или подкожно.
[141] В одном варианте реализации изобретения пациент страдает от головной боли в области придаточных пазух носа или лицевой боли, ассоциированной с острым или рецидивирующим хроническим синуситом. Например, фармацевтический состав по настоящему изобретению молено вводить в слизистую оболочку носа или подкожные структуры, находящиеся над синусами, при этом введение препарата ослабляет головную боль и/или боль в области лица, ассоциированную с острым или хроническим синуситом. В дополнительных вариантах реализации изобретения любой фармацевтический состав по настоящему изобретению можно вводить в слизистую оболочку носа или подкожные структуры, находящиеся над синусами, такими как один или более из синусов, выбранных из группы, состоящей из: решетчатого; верхнечелюстного; сосцевидного; лобного и клиновидного синуса. В другом варианте реализации изобретения подкожные структуры, находящиеся над синусами, размещены в пределах одной или более из областей, выбранных из группы, состоящей из: лобной, скуловой, височной, заушной и губной области. В одном варианте реализации изобретения множественные инъекции, по 5 Ед каждая, вводят для лечения головной боли в области придаточных пазух носа или лицевой боли, ассоциированной с острым или рецидивирующим хроническим синуситом.
[142] В другом варианте реализации изобретения, пациента страдающего от головной боли в области придаточных пазух носа или лицевой боли, ассоциированной с острым или рецидивирующим хроническим синуситом, лечат путем введения любого из фармацевтических составов по настоящему изобретению в пораженный участок тела пациента. В дополнительном варианте реализации изобретения фармацевтические составы, описанные в настоящем документе, вводят в проекции тройничного нерва, иннервирующего синус.
[143] Пациенты, страдающие от головной боли в области придаточных пазух носа или лицевой боли, ассоциированной с острым или рецидивирующим хроническим синуситом, часто имеют симптомы, включая ринит, гиперсекрецию из синуса и/или гнойные выделения из носа. В одном варианте реализации изобретения, пациенты, получающие фармацевтические составы по настоящему изобретению, имеют симптомы гиперсекреции из синуса и гнойные выделения из носа.
[144] В вариантах реализации настоящего изобретения также предлагаются способы лечения пациента, страдающего от головной боли в области придаточных пазух носа или лицевой боли, ассоциированной с острым или рецидивирующим хроническим синуситом, при этом субъект страдает от невралгии. В некоторых вариантах реализации изобретения невралгия представляет собой невралгию тройничного нерва. В другом варианте реализации изобретения невралгия: ассоциирована с компрессионными силами на чувствительный нерв; ассоциирована с внутренним повреждением нерва, демиелинизирующим заболеванием или генетическим нарушением; ассоциирована с нарушением обмена веществ; ассоциирована с центральным неврологическим сосудистым заболеванием; или ассоциирована с травмой. В другом варианте реализации настоящего изобретения боль ассоциирована с удалением или реконструкцией зубов.
ПРИМЕРЫ
[145] Следующие примеры иллюстрируют варианты реализации и аспекты настоящего изобретения и не предназначены для ограничения объема настоящего изобретения.
[146] Пример 1
[147] Цель данного исследования состояла в том, чтобы оценить эффект ботулинического токсина типа А, известного как БОТОКС®, в одном из восьми составов с наполнителем, вводимых путем инсталляции в мочевой пузырь самкам крыс линии Sprague Dawley. Эффект анализировали через восемь дней после введения, при этом эффективность и переносимость оценивали с помощью иммуногистохимического (ИГХ) и гистопатологического исследования, соответственно.
[148] Положительные контроли: Четырем крысам вводили 10 единиц БОТОКСА® в солевом растворе путем инъекции в мышцу детрузора.
[149] Негативные контроли: Составы, содержащие только наполнитель (как показано в Таблице 1, без добавления БОТОКСА®).
[150] Расщепленный SNAP 25 использовали в качестве биомаркера активности БОТОКСА® на синаптических окончаниях и потенциального индикатора функциональных возможностей способа доставки. В этом исследовании расщепленный SNAP 25 использовали для подтверждения успешного перемещения БОТОКСА® через уротелий. Экспрессию синаптофизина использовали для идентификации синаптических окончаний и для подтверждения специфичности локализации расщепленного SNAP 25. Гистопатологическое исследование проводили с целью оценки влияния препарата на ткани мочевого пузыря.
[151] Самкам крыс весом 150-200 г вводили 0,5 мл наполнителя или наполнитель + 30 Ед БОТОКСА® согласно Таблице 1:
[152] Внутрипузырную инсталляцию состава проводили следующим образом: крыс анестезировали изофлураном и опорожняли мочевой пузырь путем надавливания копчиком пальца на нижнюю часть живота. Во время действия анестетика катетер вводили в мочевой пузырь через мочеиспускательный канал. Затем в мочевой пузырь медленно вводили состав в течение двух минут с объемом дозы 0,5 мл + 0,1 мл (для размещения в мертвом пространстве, образованном катетером). Состав находился в мочевом пузыре в течение 60 минут до окончания действия анестетика. Через одну педелю после инсталляции крыс подвергали эвтаназии.
[153] Мочевые пузыри собирали, фиксировали в 10% формалине и обрабатывали с использованием стандартных гистологических методик. Подготавливали и обрабатывали дополнительные срезы для флуоресцентного иммуногистохимического исследования для выявления расщепленного SNAP 25 и синаптофизина.
[154] Иммунофлуоресценция: Один тканевой блок от каждого животного нарезали с применением криостата (толщиной в 14 мкм) в продольной плоскости и фиксировали микропрепарат. Готовили три микропрепарата из каждого блока, с тремя срезами на каждом микропрепарате, около 140 мкм друг от друга. Два микропрепарата обрабатывали для иммунофлуоресценции. Сначала срезы ткани блокировали для выявления неспецифического сигнала в блокирующем буфере (1X PBS + 0.1% ТХ-100 + 10% нормальная ослиная сыворотка), а затем инкубировали с комбинациями первичных антител, включая антитела к расщепленному SNAP-25 и антитела к синаптофизину, при необходимой концентрации, в блокирующем буфере, в течение ночи при 4°С. После промывания срезы инкубировали с вторичными антителами (Jackson ImmunoRescarch) в течение 2 часов при 4°С и затем снова промывали. Срезы в микропрепаратах покрывали пленкой с использованием Fluoromount-G с 1,5 мкг/мл DAPI. Третий микропрепарат окрашивали гематоксилином и эозином (H&Е) для анатомической оценки.
[155] Анализ и количественная оценка данных: Изображения анализировали и фиксировали либо с помощью светлопольного микроскопа Leica DMLB, флуоресцентного широкопольного микроскопа Nikon Е800, либо конфокального микроскопа Zeiss LSM-710 с использованием программного обеспечения Image-Pro® (MediaCybernectics), Metamorph® (Molecular Devices) или ZEN (Carl Zeiss). Программное обеспечение Imaris® (Bitplane) использовали для высокого разрешения, 3D качественного анализа для установления пространственных отношений нервных волокон. Типы нервных волокон идентифицировали на основании их морфологии и нейрохимии. С целью полуколичественного анализа, в каждом микропрепарате все 3 среза тщательно анализировали под микроскопом и присваивали балл (от 0 до 4) каждому животному либо по степени окрашивания SNAP25197 (как показано на Фиг. 3 и 4), либо по целостности анатомической структуры мочевого пузыря (H&Е) (как показано на Фиг. 5A-D). Средний балл рассчитывали для каждого вида лечения/состава и результаты частично представлены в Таблице 2 и на Фиг. 6.
[156] Составы оценивали на основании следующих данных:
1. Гистологические изменения в стенке мочевого пузыря; при этом диагноз "веретеноклеточный инфильтрат" устанавливали для мочевого пузыря, в котором обнаруживали повышенное количество веретенообразных клеток неопределенного происхождения, инфильтрирующих собственную пластинку (Фиг. 5); реактивные изменения, которые расценивались как нежелательные потенциальные инициаторы развития фиброза; а также
2. Балл расщепленного SNAP 25.
[157] Сводные результаты: Результаты представлены в Таблице 2.
[158] Исследуемые составы: Положительные баллы при иммуногистохимическом исследовании отмечались во всех образцах после интравезикальной инсталляции БОТОКСА®, за исключением составов, содержащих 0,1% (масс./об.) тилоксапола. На Фигуре 6 показаны баллы ИГХ некоторых типичных составов.
Пример 2
[159] Лечение синдрома гиперактивного мочевого пузыря
[160] Этот пример описывает лечение пациентов с гиперрефлексивным мочевым пузырем в результате нейрогенной или идиоматической дисфункции мочевого пузыря.
[161] Несколько пациентов с симптомами гиперрефлексивного мочевого пузыря (инфекция мочевого пузыря, недержание мочи и императивное недержание мочи), обусловленными нейрогенной или идиопатической дисфункцией мочевого пузыря, получали лечение путем инсталляции в мочевой пузырь. Фармацевтическая композиция содержала около 100 единиц БОТОКСА®, 0,1% (масс./об.) Тритон™ Х-100 и 1% (масс./об.) хитозана. Указанную фармацевтическую композицию вводили пациентам в мочевой пузырь путем инсталляции на фоне легкой седации. Через 7 дней после лечения наблюдали значительное увеличение средней максимальной емкости мочевого пузыря и значительное уменьшение среднего максимального давления на детрузор при мочеиспускании.
[162] Пример 3; Увеличение проницаемости стенки мочевого пузыря, индуцированное Тритоном Х-100, было обратимым.
[163] Уроэпителиальные клетки мочевого пузыря человека (CELLnTEC Cat # НВЕР.05) засевали в концентрации около 150000 жизнеспособных клеток на лупку на поликарбонатные мембранные вставки. Вставки помещали внутрь лунок 24-луночных культуральных планшетов. Затем добавляли в лунки среду CELLnTEC CNT-58 (среда для роста) и инкубировали клетки в течение 2 дней при 37°С (5% CO2) до слияния клеток. В конце инкубации среду для роста удаляли и заменяли средой CELLnTEC CNT-21 (дифференцировочная среда). Затем клетки оставляли для дифференцировки на 7 дней, в результате которой создавался 2-3 клеточный человеческий уроэпителиальный слой. Клетки обрабатывали в течение одного часа следующими наполнителями: 0,9% солевой раствор, 0,1% Тритон Х-100 в 0,9% солевом растворе и 0,5% Тритон Х-100 в солевом растворе. Каждый наполнитель анализировали в трех повторах. Клетки обрабатывали каждым видом наполнителя, путем нанесения 0,1 мл на поверхности мембранных вставок, в которых выращивались клетки. После экспозиции растворы наполнителей удаляли из вставок и к каждой вставке добавляли дифференцировочную среду. Затем клетки инкубировали и оставляли для восстановления в течение либо 0, 24, либо 48 часов. Следует отметить, что 0,9% солевой раствор (отрицательный контроль) анализировали только в 0 часов. Затем проводили анализы проницаемости с желатином. Анализы проницаемости с желатином проводили путем удаления среды из каждой вставки с последующим добавлением к каждой вставке 0,1 мл объема 0,1 мг/мл желатина, меченного орегоном зеленым 488, в солевом растворе. Вставки помещали в лунки, содержащие 0,8 мл сбалансированного солевого раствора Эрла. После 1-часовой экспозиции собирали элюат и измеряли флуоресценцию с использованием прибора Envision. С целью определения, отмечалось ли снижение проницаемости для желатина, сопоставляли результаты испытаний за двадцать четыре часа и сорок восемь часов с данными на 0 часов.
[164] Установлено, что количество желатина, которое диффундирует через уротелий in vitro, обработанный 0,1% Тритоном Х-100, было меньше через 24 и 48 часов после восстановления. Эти результаты свидетельствуют о восстановлении проницаемости человеческого уротелия in vitro после обработки 0,1% Тритоном Х-100.
[165] Обычный специалист в данной области техники может осуществить множество изменений и модификаций, не отступая от сущности и объема изобретения. Таким образом, следует понимать, что описанные варианты реализации изобретения изложены только для целей примера, и что варианты реализации изобретения не следует рассматривать как ограничивающие объем нижеследующей формулы изобретения. Поэтому, следует считать, что нижеследующая формула изобретения включает в себя не только сочетание элементов, которые изложены в буквальном смысле, но и все эквивалентные элементы для выполнения по существу аналогичной функции, по существу аналогичными способами с целью получения по существу аналогичного результата. Таким образом, следует понимать, что формула изобретения включает элементы, которые были описаны выше, элементы, которые являются концептуально эквивалентными, и элементы, которые включаю т идеи изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОДАВЛЕНИЕ АЛЛОДИНИИ, ВЫЗВАННОЙ РАКОМ КОСТЕЙ | 2019 |
|
RU2791640C2 |
| УСОВЕРШЕНСТВОВАННАЯ СХЕМА ИНЪЕКЦИИ В МОЧЕВОЙ ПУЗЫРЬ ДЛЯ ВВЕДЕНИЯ БОТУЛОТОКСИНОВ | 2017 |
|
RU2741966C2 |
| СЛИТЫЕ БЕЛКИ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ | 2012 |
|
RU2651492C2 |
| СТАБИЛИЗИРОВАННЫЕ НЕБЕЛКОВЫЕ КОМПОЗИЦИИ КЛОСТРИДИАЛЬНОГО ТОКСИНА | 2017 |
|
RU2762607C2 |
| ЖИДКАЯ КОМПОЗИЦИЯ НЕЙРОТОКСИНА, СТАБИЛИЗИРОВАННАЯ ТРИПТОФАНОМ ИЛИ ТИРОЗИНОМ | 2017 |
|
RU2741497C2 |
| КЛОСТРИДИАЛЬНЫЕ НЕЙРОТОКСИНЫ С ИЗМЕНЕННОЙ ПЕРСИСТЕНТНОСТЬЮ | 2009 |
|
RU2524429C2 |
| КАТИОННЫЕ НЕЙРОТОКСИНЫ | 2015 |
|
RU2733493C2 |
| НЕЙРОТОКСИНЫ, ПРОЯВЛЯЮЩИЕ СОКРАЩЕННУЮ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ | 2010 |
|
RU2582266C2 |
| СКОНСТРУИРОВАННЫЙ БОТУЛИНИЧЕСКИЙ НЕЙРОТОКСИН | 2016 |
|
RU2746736C2 |
| СРЕДСТВА И СПОСОБЫ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННОГО НЕЙРОТОКСИНА | 2010 |
|
RU2571212C2 |

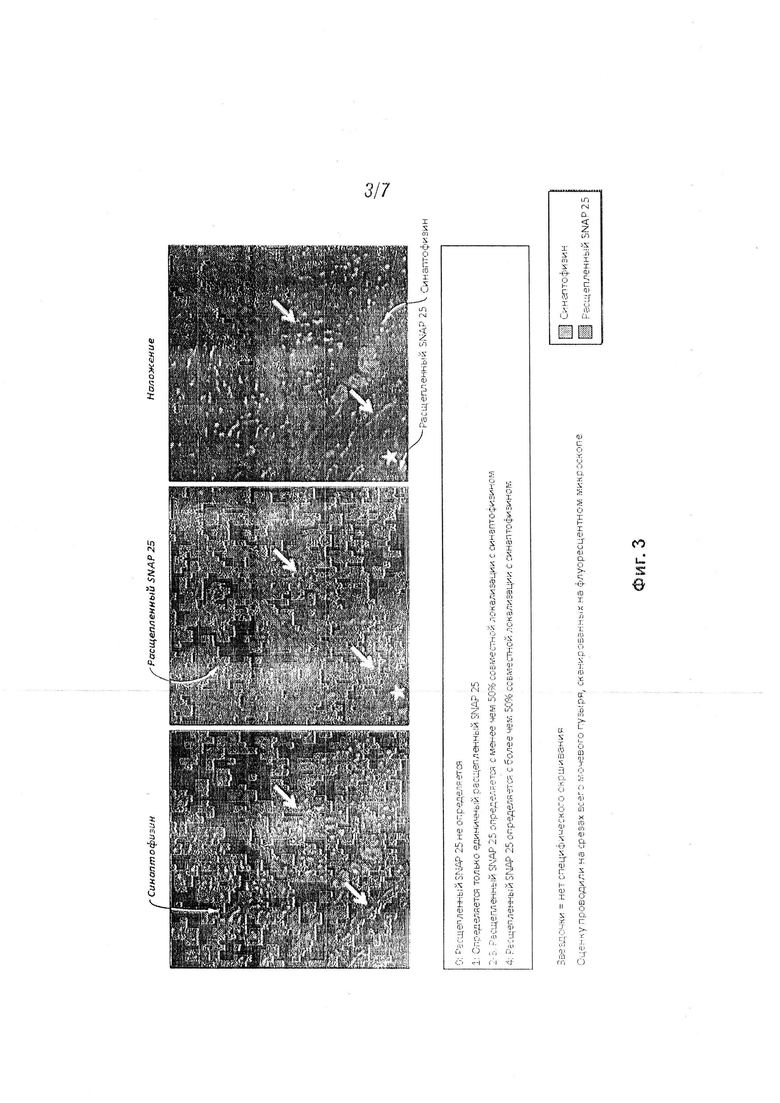

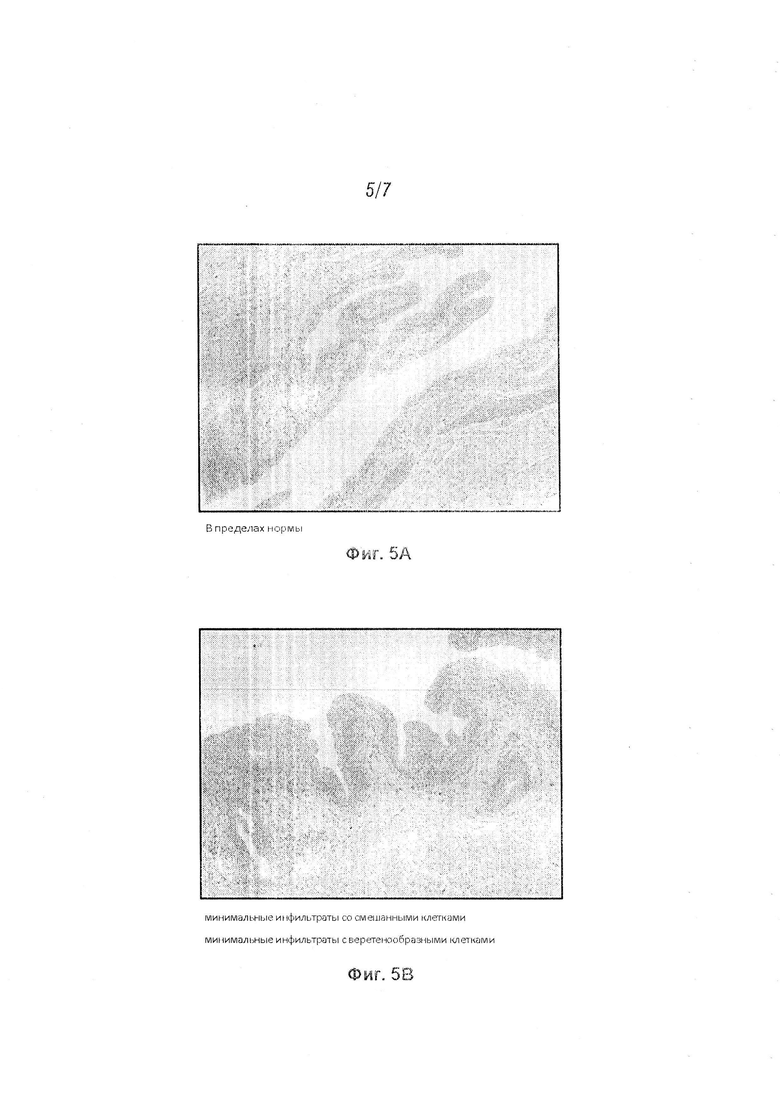
Заявленная группа изобретений относится к области медицины и представляет собой фармацевтическую композицию для лечения нейрогенной или идиопатической дисфункции мочевого пузыря, содержащую терапевтически эффективное количество вещества, полученного из клостридий, и по меньшей мере один пермеабилизирующий агент, причем вещество, полученное из клостридий, является ботулиническим токсином, и причем по меньшей мере один пермеабилизирующий агент содержит неионогенное поверхностно-активное вещество и мукоадгезивное вещество, представляющее собой катионный полимер, и причем по меньшей мере один пермеабилизирующий агент присутствует в количестве, эффективном для существенного и обратимого повышения проницаемости стенки мочевого пузыря для вещества, полученного из клостридий и способ лечения пациента с нейрогенной дисфункцией мочевого пузыря, включающий: внутрипузырную инстилляцию на стенку мочевого пузыря пациента заявленной фармацевтической композиции. Заявленная группа изобретений высокоэффективна для лечения нейрогенной или идиопатической дисфункции мочевого пузыря. 2 н. и 15 з.п. ф-лы. 2 табл., 1 пр.
1. Фармацевтическая композиция для лечения нейрогенной или идиопатической дисфункции мочевого пузыря, содержащая терапевтически эффективное количество вещества, полученного из клостридий, и по меньшей мере один пермеабилизирующий агент, причем вещество, полученное из клостридий, является ботулиническим токсином, и причем по меньшей мере один пермеабилизирующий агент содержит неионогенное поверхностно-активное вещество и мукоадгезивное вещество, представляющее собой катионный полимер, и причем по меньшей мере один пермеабилизирующий агент присутствует в количестве, эффективном для существенного и обратимого повышения проницаемости стенки мочевого пузыря для вещества, полученного из клостридий.
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что поверхностно-активное вещество содержит алкилариловый полиэфир.
3. Фармацевтическая композиция по п. 1, отличающаяся тем, что мукоадгезивное вещество содержит хитозан, аналоги хитозана, производные хитозана или их комбинации.
4. Фармацевтическая композиция по п. 1, отличающаяся тем, что поверхностно-активное вещество присутствует в количестве от 0,01% до 0,5% (масс./об.).
5. Фармацевтическая композиция по п. 2, отличающаяся тем, что мукоадгезивное вещество присутствует в количестве в диапазоне от 0,01% до 5% (масс./об.).
6. Фармацевтическая композиция по п. 2, отличающаяся тем, что поверхностно-активное вещество содержит октоксинол-9.
7. Фармацевтическая композиция по п. 2, отличающаяся тем, что поверхностно-активное вещество содержит ноноксинол-9.
8. Фармацевтическая композиция по п. 6, отличающаяся тем, что поверхностно-активное вещество присутствует в количестве 0,1% (масс./об.).
9. Фармацевтическая композиция по п. 7, отличающаяся тем, что поверхностно-активное вещество присутствует в количестве 0,1% (масс./об.).
10. Способ лечения пациента с нейрогенной дисфункцией мочевого пузыря, включающий: внутрипузырную инстилляцию на стенку мочевого пузыря пациента фармацевтической композиции, причем фармацевтическая композиция содержит терапевтически эффективное количество вещества, полученного из клостридий, и по меньшей мере один пермеабилизирующий агент, причем вещество, полученное из клостридий, является ботулиническим токсином, и причем по меньшей мере один пермеабилизирующий агент содержит неионогенное поверхностно-активное вещество и мукоадгезивное вещество, представляющее собой катионный полимер, и причем по меньшей мере один пермеабилизирующий агент присутствует в количестве, эффективном для существенного повышения проницаемости стенки мочевого пузыря для ботулинического нейротоксина в терапевтически эффективной степени.
11. Способ по п. 10, отличающийся тем, что мукоадгезивное вещество содержит хитозан, аналоги хитозана, производные хитозана или их комбинации.
12. Способ по п. 10, отличающийся тем, что неионогенное поверхностно-активное вещество содержит алкилариловый полиэфир.
13. Способ по п. 10, отличающийся тем, что мукоадгезивное вещество содержит полимерный полифенол.
14. Способ по п. 10, отличающийся тем, что мукоадгезивное вещество содержит полимерный политиол.
15. Способ по п. 10, где неионогенное поверхностно-активное вещество присутствует в количестве от 0,01% до 0,5% (масс./об.).
16. Способ по п. 11, где мукоадгезивное вещество присутствует в количестве от 0,01% до 5% (масс./об.).
17. Способ по п. 12, где неионогенное поверхностно-активное вещество содержит октоксинол-9.
| WO 2010090677 A1, 12.08.2010 | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| RU 2003105461 A, 27.06.2004. | |||
Авторы
Даты
2020-05-15—Публикация
2015-07-30—Подача