Перекрестная ссылка на родственную заявку
Настоящая заявка претендует на приоритет от патентной заявки U.S. Utility Application 14506674, поданной 5 октября 2014 г. При этом находящаяся на рассмотрении и уже акцептованная заявка U.S. Utility Application 14506674 включена путем ссылки во всей полноте по всем пунктам.
Область техники, к которой относится изобретение
Настоящее изобретение в общем касается трансгенных мышей, которые подверглись генетическим изменениям с тем, чтобы экспрессировать липопротеин (а) человека и отключить ген, экспрессирующий витамин С. В частности, два гена, определяющие два белка липопротеина (а) человека - аполипопротеин (а) и ало липопротеин В-100, могут экспрессироваться как индивидуально, так и в комбинации без экспрессии гена витамина С.Данная заявка содержит перечень последовательностей, сданный в виде ASCII-файла под названием RIPLLC018017US1sequence_ST25, дата создания 9/12/2013, а размер текстового ASCII-файла в байтах составляет 2 Кб. Эмбрионы двойных трансгенных мышей, обозначенные как Rath М Human Lipoprotein(a); Gulo(-/-), сданы на хранение под номером Jackson Stock# 912329 в Jackson Laboratory 8 апреля 2013 г.
Уровень техники
На сердечно-сосудистые заболевания приходится половина всех случаев смерти в промышленно развитых странах. За последние десятилетия появился новый фактор риска для этого заболевания - липопротеин (a) (Lp(a)). Было показано, что Lp(a) является независимым фактором риска для инфаркта миокарда (Rhoads GG et al., 1986; Clarke et al., 2009), цереброваскулярных заболеваний (Zenker G. et. al., 1986) и других форм сердечнососудистых заболеваний. Кроме того, установлено, что Lp(a) является важным компонентом атеросклеротических бляшек у человека (Rath М. et al., 1989). Помимо ниацина, в настоящее время нет общепринятого эффективного лечения, доступного в клинической кардиологии для снижения уровня Lp(a) в плазме или предотвращения его отложения внутри сосудистой стенки.
Lp(a) был открыт Kåre Berg в 1963 г. (Berg К. et al., 1963). Он состоит из молекулы липопротеина низкой плотности (LDL) и аполипопротеина (а) (аро(а)) - гликопротеина, прикрепленного к структурному белку LDL - аполипопротеину В-100 (ароВ) через дисульфидные связи. кДНК аро(а) проявляет сильную гомологию с плазминогеном, содержащим несколько повторов завитка, (kringle) IV плазминогена. Вследствие этой гомологии аро(а) связывается с фибриногеном/фибрином и ослабляет фибринолиз (McLean JW et al., 1987).
Lp(a) в основном встречается у человека и человекообразных обезьян, а появление гена аро(а) датируется около 40 миллионов лет назад, примерно во время дивергенции обезьян Старого Света и Нового Света (McLean et al., Nature, 1987). Это был также и тот момент времени в процессе эволюции, когда предки человека потеряли способность к эндогенному синтезу аскорбата из-за мутации в гене, кодирующем гулонолактоноксидазу (GULO), важнейший фермент для превращения глюкозы в аскорбат (витамин С) (Chatterjee IB, 1973; Nitoshimi M et al., 1991).
Значение дефицита аскорбата в инициировании процесса атерогенеза недавно было засвидетельствовано у мышей, неспособных экспрессировать ген L-гулонолактоноксидазы (GULO-/-) (Maeda N et al., 2000).
Roy et al. (2003, US 6512161) обсуждают несколько неудачных попыток создания модели на животных для экспрессии именно Lp(a) на таких моделях, как крысы, мыши и морские свинки и утверждают, что они не всегда представляют метаболизм человека и его заболевания. В своем исследовании они изобрели модель на кроликах, экспрессирующих гены аро(а) человека и ароВ-100 человека. Однако трансгенные кролики, разработанные Roy et al. (2003), тоже не воспроизводят физиологию человека в отношении другого ключевого аспекта метаболизма: в отличие от людей, кролики способны вырабатывать свой собственный витамин С.
Существует потребность в модели двойных трансгенных млекопитающих, проявляющих такие уникальные генетические признаки, с тем, чтобы разработать связанные с ними новые профилактические и терапевтические подходы.
Сущность изобретения
В настоящей заявке приведен способ получения и применения двойных трансгенных млекопитающих (мышей, крыс и других видов млекопитающих), обладающих генами аро(а) и/или ароВ-100 человека и вырабатывающих Lp(a) человека и в то же время не способных производить витамин С. В одном воплощении была получена третья линия трансгенных млекопитающих при скрещивании млекопитающего первой "нокаутной" линии и второй линии трансгенного млекопитающего (это могут быть мыши или другие животные), экспрессирующего набор генов, имеющих человеческую природу, причем первая линия - это "нокаутное" млекопитающее, обладающее нефункциональной L-гулонолактоноксидазой (GULO) (GULO-/-) и поэтому не вырабатывающее витамин С, а вторая линия мышей экспрессирует ген аро(а) человека (аро(а)+)) и вырабатывает аполипопротеин (а) (аро(а)), при этом третья линия трансгенных мышей обладает нефункциональным геном L-гулонолактоноксидазы (GULO-/-) и функциональным геном аро(а) человека (аро(а)+)). Таким образом, третья линия млекопитающих не будет вырабатывать витамин С, но будет вырабатывать аро(а) человека.
В другом воплощении была получена пятая линия трансгенных млекопитающих при скрещивании млекопитающего первой "нокаутной" линии, обладающего нефункциональным геном L-гулонолактоноксидазы (GULO) (GULO-/-), и четвертой линии, экспрессирующей ген ароВ-100 (ароВ100+) человека, причем пятая линия млекопитающих обладает нефункциональным геном L-гулонолактоноксидазы (GULO-/-) и функциональным геном ароВ-100 человека (ароВ100+). Таким образом, пятая линия трансгенных млекопитающих не будет вырабатывать витамин С, но будет вырабатывать аполипопротеин В-100 человека.
В другом воплощении скрещивали третью и пятую линию трансгенных млекопитающих, получая новое двойное трансгенное млекопитающее (это может быть, к примеру, мышь), которое имеет "нокаутный" ген GULO (GULO-/-), функциональный ген ароВ-100 человека (ароВ100+) и функциональный ген аро(а) человека (аро(а)+)). Поэтому новое двойное трансгенное млекопитающее будет вырабатывать аполипопротеин (а) (аро (а)) и/или аполипопротеин В-100 (ароВ-100), а также полные частицы липопротеина (а) (Lp(a)), но не будет вырабатывать витамин С. Эта новая модель двойных трансгенных млекопитающих похожа на человеческую систему по неспособности к эндогенному синтезу аскорбата наряду со способностью к экспрессии аро(а), ароВ-100, а также полных частиц липопротеина (a) (Lp(a)). В данном случае используется модель на мышах, но можно использовать и других млекопитающих и проводить скрещивание, введение генов или делецию генов, получая таких двойных трансгенных млекопитающих, чтобы экспрессировать или подавлять гены человека в любом сочетании.
В одном воплощении представлено млекопитающее - мышь, геном которой не обладает способностью к эндогенному синтезу аскорбата и в то же время экспрессирует аро(а) человека. В другом воплощении представлено двойной трансгенное млекопитающее - мышь, геном которой не обладает способностью к эндогенному синтезу аскорбата и в то же время экспрессирует ароВ-100 человека. В другом воплощении представлено трансгенное млекопитающее - мышь, геном которой не обладает способностью к эндогенному синтезу аскорбата и в то же время вырабатывает Lp(a) человека. Модель на животных может быть создана путем скрещивания, вставки генов или другими методами молекулярной биологии и/или генной инженерии.
В одном воплощении новые двойные трансгенные мыши применяются в качестве модели для исследования сердечно-сосудистых заболеваний (CVD). В другом воплощении двойные трансгенные мыши применяются в качестве модели для лечения заболеваний типа CVD. В другом воплощении двойные трансгенные мыши могут применяться в качестве модели для тестирования новых и старых препаратов для лечения заболеваний, связанных с синтезом Lp(a) и отсутствием продукции витамина С.
В одном воплощении модель двойной трансгенной мыши может применяться для тестирования эффекта различных препаратов, задействованных при ишемической болезни сердца, сердечно-сосудистых заболеваниях, включая заболевания коронарных артерий, цереброваскулярных заболеваниях (инсульт), сосудистых заболеваниях почек, заболеваниях периферических сосудов, аневризмах, тромботических заболеваниях, других формах сосудистых заболеваний, воспалительных заболеваниях, а также инфекционных заболеваниях, нейровоспалительных и нейродегенеративных заболеваниях.
В одном воплощении представлен способ получения двойных трансгенных млекопитающих, у которых отсутствует способность к эндогенному синтезу аскорбата и в то же время вырабатывается аполипопротеин (а) человека либо аполипопротеин В или Lp(a) человека, который включает скрещивание первого млекопитающего, у которого способность к синтезу аскорбата была подвергнута генетической делеции, со вторым млекопитающим, геном которого кодирует аро(а) человека или ароВ-100 человека или же оба этих аполипопротеина таким образом, чтобы они сочетались in vivo у данного трансгенного млекопитающего и вырабатывали полные частицы липопротеина (a) (Lp(a)) человека.
В другом воплощении представлен способ определения того, может ли соединение лечить атеросклероз или нежелательный профиль липидов в плазме, включающий: а) сравнение профиля липидов или степени атеросклероза у первого трансгенного млекопитающего, получавшего диету, которая широко известна как атерогенная, и обработанного данным соединением, с липидным профилем или степенью атеросклероза у второго трансгенного млекопитающего, получавшего такую же атерогенную диету, но не обработанного данным соединением; и b) определение потенциального терапевтического эффекта данного соединения на основании сравнительной оценки липидного профиля или степени атеросклероза у первого и второго трансгенного млекопитающего; причем и первое, и второе млекопитающее являются трансгенными млекопитающими.
В одном воплощении представлен способ лечения, в котором препарат для лечения эффекта высокого уровня Lp(a) в отсутствие или в присутствии таких микронутриентов, как витамин С, наблюдается на таких трансгенных мышах, которые не производят витамин С, но вырабатывают Lp(a) человека.
Композиция, способ и лечение, описанные здесь, могут быть реализованы любым способом для достижения различных аспектов и могут выполняться в подходящем для данного млекопитающего виде.
Краткое описание фигур
На фигурах из прилагаемых чертежей, на которых одинаковые обозначения означают одинаковые элементы, типичные воплощения представлены для примера, а не для ограничения изобретения.
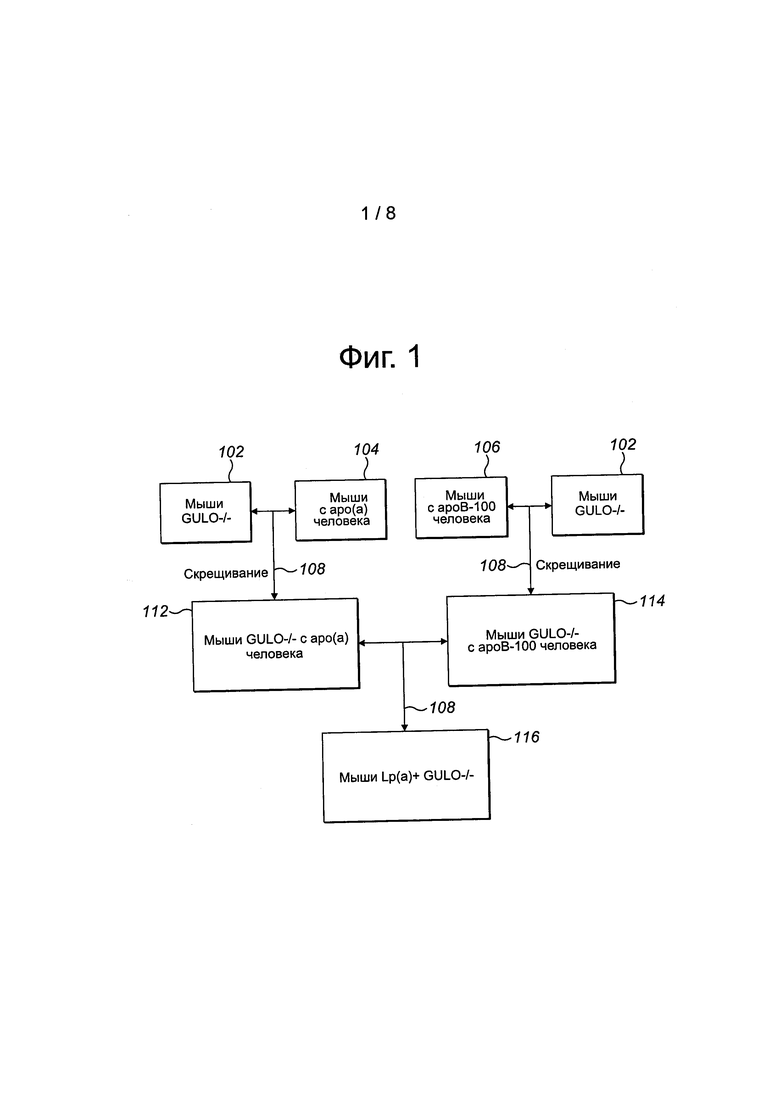
На фиг. 1 представлена схема, использовавшаяся для создания двойных трансгенных мышей.
На фиг. 2 представлена экспрессия связанных через дисульфид аро(а) человека и ароВ-100 человека в виде собранного Lp(a) с липидной глобулой у самцов и самок трансгенных мышей с генами аро(а) человека и аро В-100 человека, но не у самцов и самок трансгенных мышей без обоих генов.
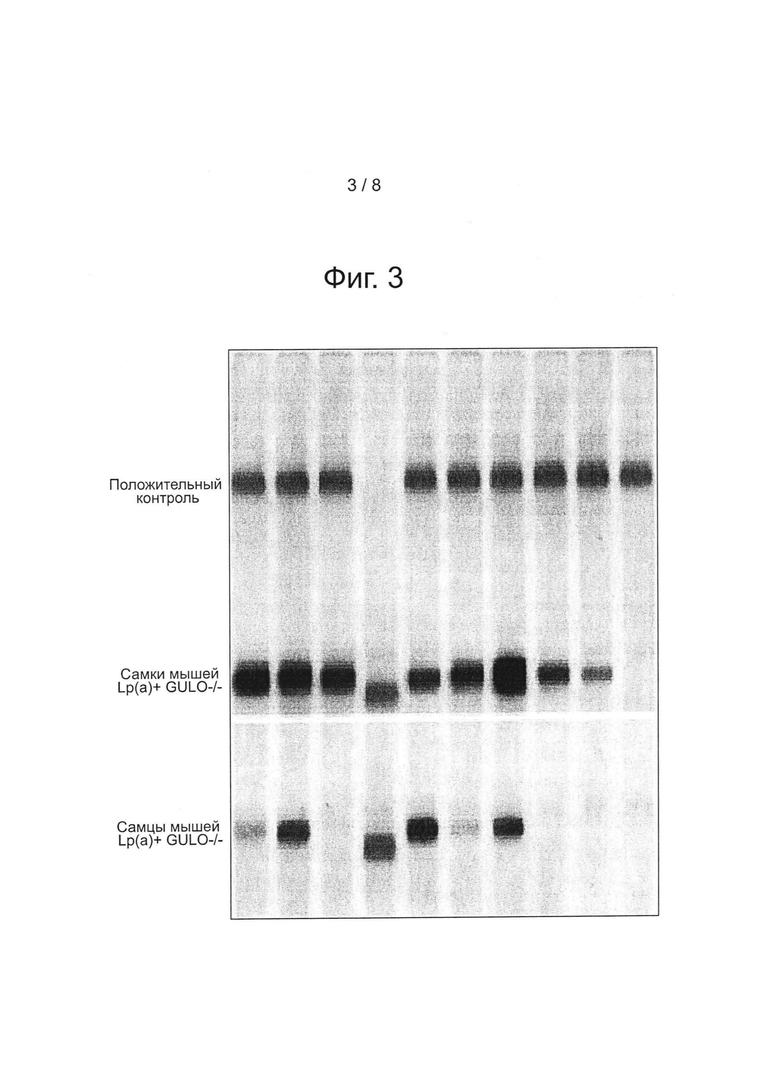
На фиг. 3 представлена экспрессия белка аро(а) человека у самок и самцов мышей.
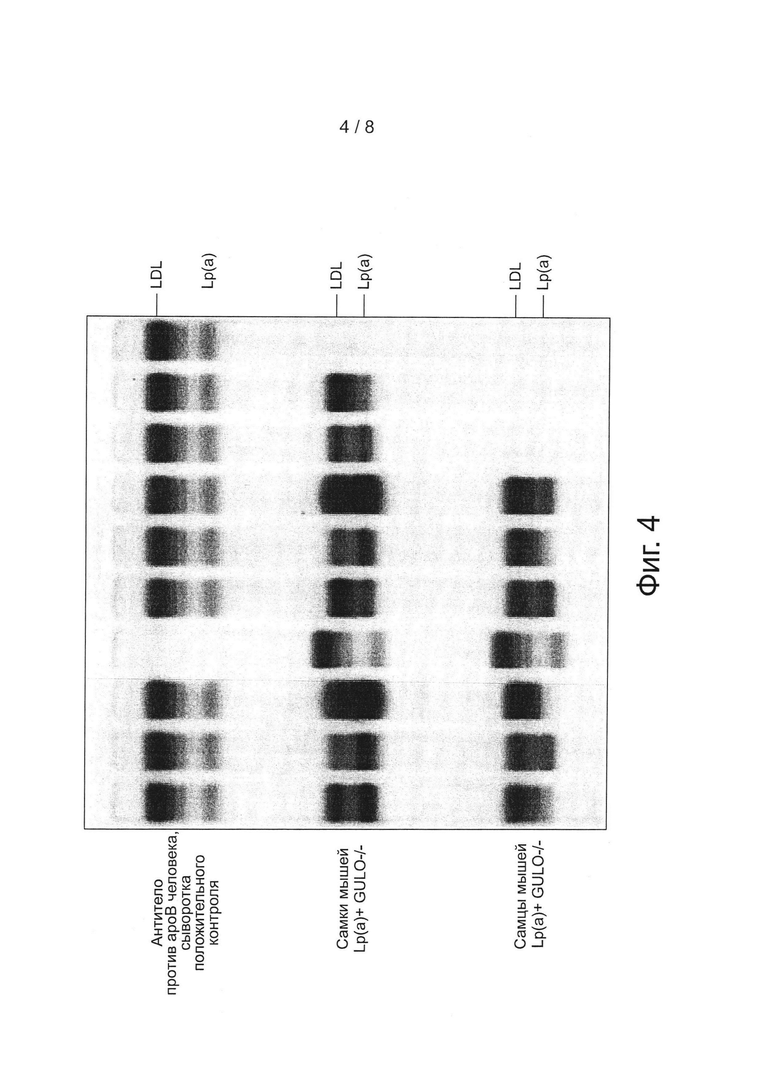
На фиг. 4 представлена экспрессия белка ароВ-100 человека у самцов и самок трансгенных мышей в частицах LDL и частицах Lp(a).
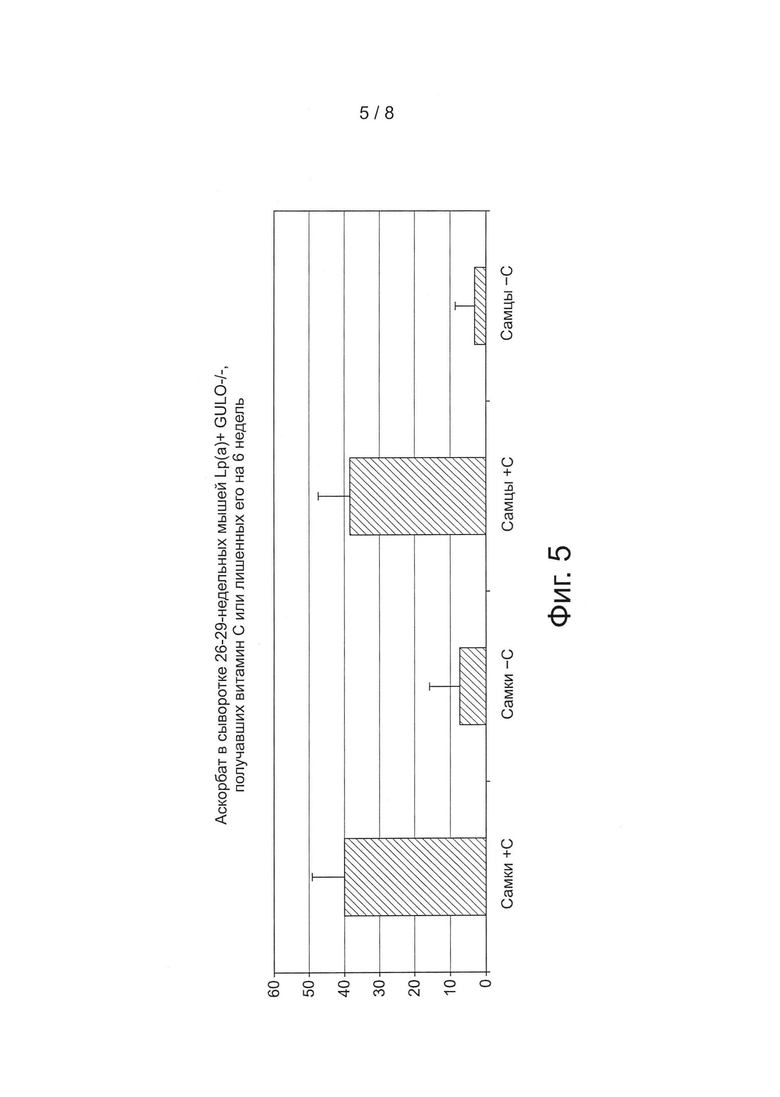
На фиг. 5 представлен уровень аскорбата в сыворотке у самок и самцов трансгенных мышей (26-29 недель) при добавлении в корм витамина С или без добавления витамина С в мкмоль/л (мкМ).
На фиг. 6 представлен профиль холестерина методом электрофореза с иммунофиксацией белков сыворотки (SPIFE) у гипоаскорбемических или получавших с кормом аскорбат мышей Lp(a)+GULO(-/-).
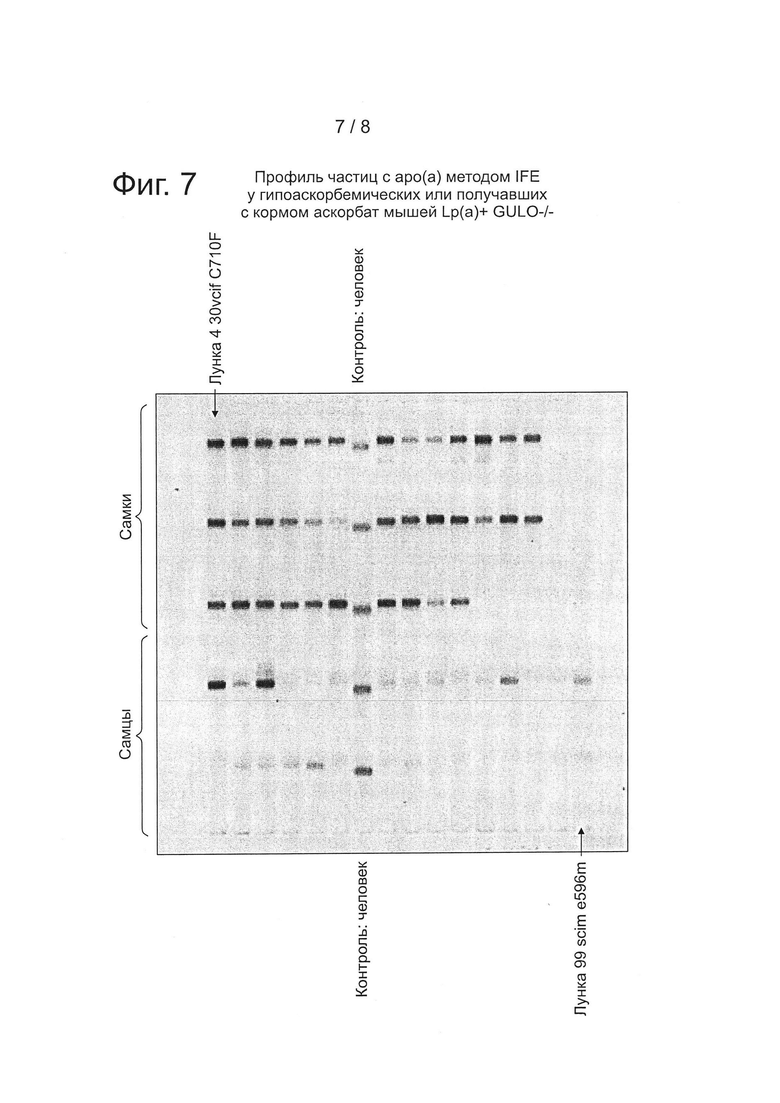
На фиг. 7 представлен профиль частиц с аро(а) методом иммунофиксационного электрофореза (IFE) у гипоаскорбемических или получавших с кормом аскорбат мышей Lp(a)+GULO(-/-).
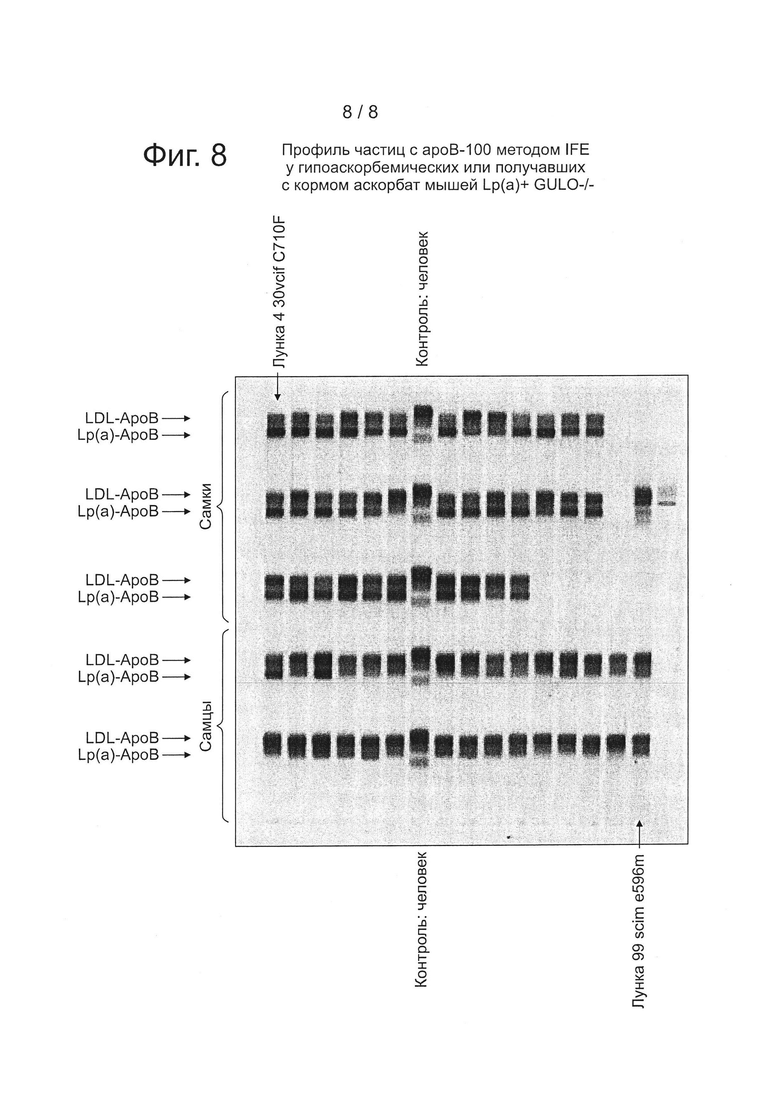
На фиг. 8 представлен профиль частиц с ароВ методом иммунофиксационного электрофореза (IFE) у гипоаскорбемических или получавших с кормом аскорбат мышей Lp(a)+GULO(-/-).
Другие особенности воплощений настоящего изобретения станут понятными из прилагаемых чертежей и из следующего подробного описания.
Раскрытие сущности изобретения
В настоящем изобретении представлены новые двойные трансгенные млекопитающие/мыши, способ скрещивания двойных трансгенных млекопитающих (это могут быть мыши или другие животные) и применение двойных трансгенных млекопитающих /мышей для оценки способов лечения сердечно-сосудистых и связанных с ними заболеваний. Двойные трансгенные мыши экспрессируют гены аполипопротеина (а) и аполипопротеина В-100 человека и вырабатывают ало липопротеин (а) и аполипопротеин В-100, а также полные частицы липопротеина (а) человека, при этом данные мыши не экспрессируют L-гулонолактоноксидазу (GULO-/-) и поэтому не вырабатывает витамин С. Эти новые двойные трансгенные мыши являются идеальной моделью для тестирования фармацевтических соединений на эффективность лечения и применимость для модуляции Lp(a) с помощью различных биологических и/или фармацевтических соединений, в том числе, но без ограничения, диеты, фармацевтических препаратов и способов лечения, влияющих на людей.
Хотя настоящие воплощения и описаны с привлечением конкретных типичных воплощений, однако должно быть ясно, что по этим воплощениям могут проводиться различные модификации и изменения, не отходящие от более широкой сущности и не выходящие за рамки данных воплощений.
Скрещивание млекопитающих/мышей
Модели на животных можно создавать посредством скрещивания, вставки генов или других методов молекулярной биологии и/или генной инженерии. В типичном примере приводится скрещивание "нокаутных" мышей и мышей, содержащих и экспрессирующих конкретный ген человека, получая двойных трансгенных мышей.
Мыши BALB/cBy-Gulo(-/-). Линия BALB/cBy-Gulosfx/J - это спонтанная мутация, картированная по локусу гулонолактоноксидазы, гена для синтеза витамина С. Линия мышей GULO(-/-) (первая "нокаутная" линия трансгенных мышей) была создана из гетерозиготных (гемизиготных) производителей Gulo(+/-), полученных из The Jackson Laboratory (табл. 1). Мышей разводили с добавлением в корм витамина С до тех пор, пока не получили достаточного количества гомозиготных производителей Gulo(-/-).


Содержание мышей Gulo(-/-). Мыши Gulo(-/-) не в состоянии синтезировать собственный витамин С, поэтому этот нутриент должен содержаться в рационе мышей. Витамин С содержался в бидистиллированной питьевой воде, содержащей 150 мг/л аскорбиновой кислоты (Sigma) и 0,01 мМ ЭДТА (Sigma) для стабилизации витамина С от разрушения при взаимодействии со следами металлов. Вода также содержала 10 г/л сахарозы с тем, чтобы замаскировать вкус, противный для мышей. Воду сменяли два раза в неделю. Кроме того, эти мыши получали корм, обогащенный 500 ррm L-аскорбил-полифосфата, стандартным ветеринарным пищевым источником стабильного витамина С, измельченным на фирме Test Diet в виде Modified Custom Lab Diet #5A38.
Мыши с apo(a) человека. Мышей с аро(а) человека (вторая линия трансгенных мышей) получали из регионального центра Mutant Mouse Regional Resource Centers (MMRRC) при поддержке NTH. Эта линия, FVB/N-Tg(LPA, LPAL2, PLG)1Hgc/Mmmh, была создана с помощью YAC в 270 kb, несущей человеческие гены аро(а) и apo(a)-like и плазминогена. Ее подарил Edward М. Rubin, M.D., Ph.D., Lawrence Berkeley National Laboratory. Родоначальных мышей разводили до тех пор, пока не получили достаточное количество мышей дикого типа аро(а)+Gulo для скрещивания. Проводили генотипирование на предмет переноса и наличия трансгена на фирме Transnetyx (Cordova, TN) на отрезанных из хвоста кусочках ткани и отбирали для скрещивания трансгенных мутантов, оказавшихся положительными по аро(а) в геноме.
Мыши с ароВ-100 человека. Мышей с ароВ-100 человека (четвертая линия трансгенных млекопитающих/мышей) получали из Taconic Farms, Inc. по соглашению о научных исследованиях. Эта линия, B6.SJL-Tg(APOB)1102Sgy N20+?, или мыши ароВ-100, была разработана MacRae F. Linton et al. из Gladstone Institute of Cardiovascular Disease путем микроинъекции гена аполипопротеина В-100 человека в зиготы C57BL/6J х SJL. Полученных мышей подвергали обратному скрещиванию с C57BL/6 на протяжении 4 поколений (N4). Taconic получила эту линию из Xenogen Biosciences в мае 1996 г. Мышей поддерживали путем обратного скрещивания гемизиготных мышей Аро(В-100) с инбредными мышами C57BL/6NTac. Гемизиготных мышей разводили так, чтобы получить гомозиготных мышей Аро(В-100). Проводили генотипирование на предмет переноса и наличия трансгена Аро(В-100) человека в геноме на фирме Transnetyx на отрезанных из хвоста кусочках ткани и отбирали трансгенных мутантов для скрещивания.
Стадии скрещивания, ведущие к получению линии мышей, вырабатывающих Lp(a) человека
На рис. 1 представлены различные стадии скрещивания нескольких линий мышей для получения двойных трансгенных мышей. Термины мышь и мыши используются взаимозаменяемо и все они означают мышей в данном описании. Проводили скрещивание (108) мышей с аро(а) человека (104) (вторая линия млекопитающих)+мышей GULO (-/-) (102) (первая "нокаутная" линия млекопитающих), получая третью линию трансгенных млекопитающих/мышей, которая экспрессирует ген аполипопротеина (а) человека (аро(а)+) и в то же время не содержит гена Gulo (GULO-/-) (112). Мышей GULO (-/-) (102) (первая "нокаутная" линия млекопитающих) и мышей с ароВ-100 человека, представленных как четвертая линия млекопитающих (106), скрещивали (108) для получения пятой линии мышей, то есть пятой линии млекопитающих, которая не содержит гена Gulo (GULO-/-), но экспрессирует ген аполипопротеина В-100 человека (ароВ-100+) (114). Таким образом, получили две родоначальные трансгенные линии для дальнейшего скрещивания:
- мыши типа аро(а) человека+ GULO (-/-) - третья линия трансгенных мышей,
- мыши типа ароВ-100 человека+ GULO (-/-) - пятая линия трансгенных мышей.
Скрещивание (108) родоначальных линий для получения линии мышей: Lp(a) человека+ GULO (-/-) (116). Новосозданных производителей линии аро(а) человека+ GULO(-/-) (112) и линии ароВ100 человека+ GULO(-/-) (114) впоследствии скрещивали (108) друг с другом для получения новой линии мышей: Lp(a) человека+ GULO(-/-) (116), то есть аро(а) человека+ароВ-100 человека+ GULO(-/-), которые именуются как линия "Rath M Human Lipoprotein(a); Gulo (-/-)" (116). Эмбрионы двойных трансгенных мышей, обозначенные как Rath M Human Lipoprotein(a); Gulo(-/-), сданы на хранение под номером Jackson Stock# 912329 в Jackson Laboratory 8 апреля 2013 г.
Генотипирование. Генотипирование на локус GULO и его гомозиготность проводили с помощью Taqman FAM Probe Real Time-PCR на фирме Transnetyx на отрезанных из хвоста кусочках ткани стандартными методами выделения ДНК и ПЦР. Наличие трансгена для ароВ-100 человека и аро(а) человека также проверяли на фирме Transnetyx.
Отрезанные из хвоста кусочки ткани брали у мышей под анестезией, а затем отправляли на фирму Transnetyx, где были разработаны следующие наборы зондов и использовались для выявления методом ПНР в реальном времени наличия или отсутствия геномной ДНК (используемые праймеры приведены ниже в табл. 2, 3 и 4). Проводили генотипирование пометов посредством Taqman PCR на кусочках ткани хвоста на фирме Transnetyx и тех, которые были положительны по геномным трансгенам аро(а) и ароВ-100 и в то же время гомозиготны по "нокаутной" мутации гена L-гулонолактоноксидазы, Gulo (-/-), что указывает на дефект синтеза витамина С, отбирали и отмечали как мышей-основателей "Rath М Human Lipoprotein(a); Gulo (-/-)". Из фиг. 2 видно, что у двойных трансгенных мышей образуется связанный через дисульфид липопротеин (а), который приведен как Lp(a) GULOKO F1, F2, M1 и М2. Точно так же видно отсутствие Lp(a) у мышей аро(а)+ без экспрессии ароВ-100 человека и мышей ароВ-100+ без экспрессии аро(а).

Интерпретация результатов генотипирования:
Gulo-1 КО+, Gulo-1 WT+=гемизиготные мыши, вырабатывающие витамин С;
Gulo-1 КО-, Gulo-1 WT+=гомозиготные мыши дикого типа, вырабатывающие витамин С;
Gulo-1 КО+, Gulo-1 WT-=гомозиготные мыши, дефектные по витамину С.
Для скрещивания отбирали мышей, гомозиготных по нокауту, GULO(-/-).
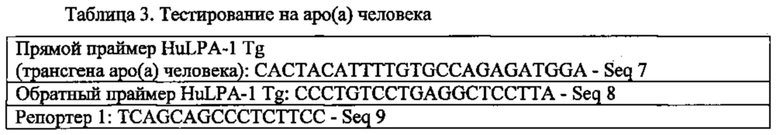
Интерпретация результатов генотипирования: +=положительные по гену аро(а) человека; -=отрицательные по гену аро(а) человека. Для скрещивания отбирали мышей, положительных по трансгену.

Интерпретация результатов генотипирования: +=положительные по гену ароВ-100 человека; -=отрицательные по гену ароВ-100 человека. Для скрещивания отбирали мышей, положительных по трансгену.
Мышей с генотипом Lp(a); GULO(-/-) обозначали как hApo(a)+; hApoB100+; GULO (-/-). Мышей нужно содержать с постоянным добавлением в корм витамина С, как описано выше.
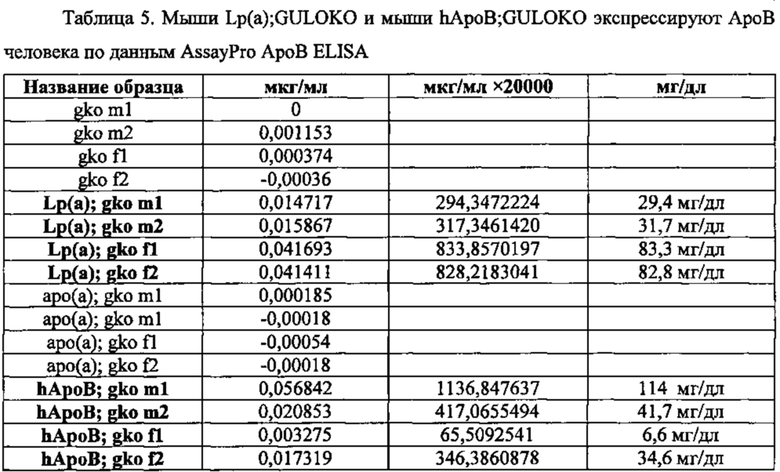
Подтверждение получения трансгенных мышей на уровне белка. Наличие белков аро(а) человека и ароВ-100 человека в сыворотке мышей определяли методом ELISA в сыворотках, полученных от мышей GULO (-/-), мышей аро(а)+GULO (-/-), мышей ароВ+GULO (-/-), и мышей Lp(a)+GULO (-/-).
Белок аро(а) присутствовал в сыворотке как самцов, так и самок мышей до полового созревания. У самцов мышей после полового созревания значительно или полностью подавлялась экспрессия белка аро(а) в связи с повышенным уровнем тестостерона. Экспрессия аро(а) у самцов мышей может быть восстановлена посредством кастрации, непрерывной инфузии гормона роста через осмотический насос или путем биохимической модуляции с помощью диетических, химических или биологических индукторов.
Экспрессия белка ароВ-100 человека. Присутствие белка ароВ-100 человека в сыворотке определяли методом ELISA в сыворотках, полученных от мышей GULO (-/-), мышей аро(а)+GULO(-/-), мышей ароВ+GULO (-/-), и мышей Lp(a)+GULO (-/-).
Присутствие белка ароВ-100 в сыворотке мышей определяли методом иммуноферментного анализа на аполипопротеин человека с помощью Assaypro AssayMax (St. Charles, МО), который специфичен для ароВ-100 человека и не дает перекрестной реакции с ароВ-100 мыши и/или с любыми другими аполипопротеинами (Аро AI, АроС, АроЕ).
Белок ароВ-100 человека обнаруживался в сыворотке мышей hАроВ-100+GULO (-/-), мышей hApoB-100+аро(а)+GULO(-/-), но не мышей аро(а)+GULO (-/-) или мышей GULO (-/-) (табл. 5).
Белок аро(а) присутствовал в сыворотке содержащих ген аро(а) мышей GULO (-/-), содержащих гены аро(а) и ароВ-100 человека мышей GULO (-/-), но не у мышей GULO (-/-) без трансгена и не у мышей GULO (-/-), содержащих только ароВ-100 человека (табл. 6). Эти результаты подтверждают экспрессию и трансляцию трансгена аро(а) человека в сывороточный белок аро(а).
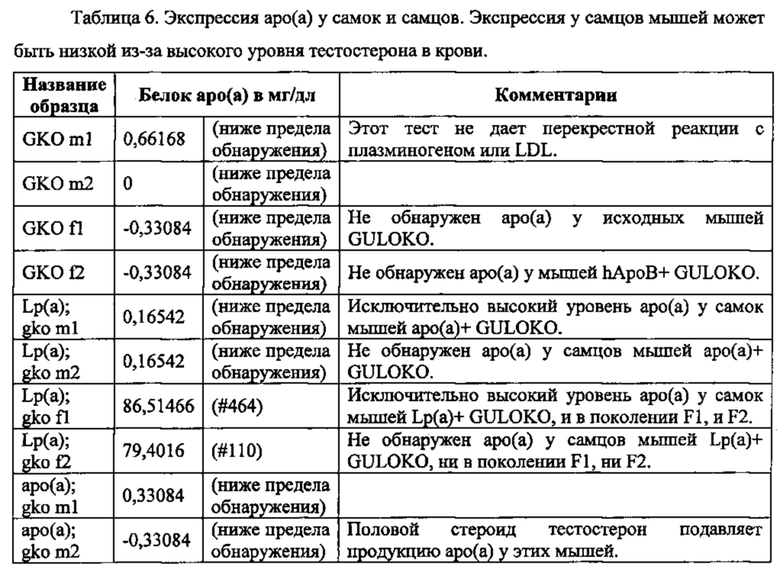

Экспрессия белка аро(а) человека. Наличие белка аро(а) в сыворотке определяли с помощью иммуноферментного анализа Lp(a) фирмы IBL International GmbH, который специфичен для аро(а) человека и не дает перекрестной реакции с плазминогеном или LDL. Выявляются все известные изоформы аро(а).
Экспрессия белков Lp(a) человека. Частицы Lp(a) состоят из белка аро(а) человека, связанного с ароВ-100 человека (основной белок частиц LDL) дисульфидной связью.
Профиль холестерина по методу SPIFE (фиг. 2). Наличие полных частиц липопротеина Lp(a) в сыворотке трансгенных мышей Lp(a)+ GULO(-/-) проверяли методом электрофореза с помощью набора SPIFE Cholesterol Profiling фирмы Helena (Beaumont, ТХ) и иммунофиксационного электрофореза (IFE).
Полоса Lр(а)-холестерин мигрирует на определенном расстоянии относительно LDL-холестерина и HDL-холестерина, причем она обнаруживается в сыворотке мышей Lp(a) человека+ GULO(-/-), но не в сыворотке мышей GULO (-/-), мышей аро(а) человека+ GULO (-/-) или мышей ароВ человека+ GULO (-/-), подтверждая, что для образования полных частиц Lp(a) в сыворотке необходимо присутствие и ароВ-100 человека, и аро(а) человека, и что присутствие одного лишь аро(а) человека недостаточно для получения Lp(a) и он не связывается с LDL мыши через дисульфидные связи. На фиг. 2 самая верхняя полоса в геле соответствует LDL-холестерину, а самая нижняя - HDL-холестерину. Плотные средние полосы, расположенные между полосами LDL и HDL, которые присутствуют на дорожках 16-18, представляют Ер(а)-холестерин из трех различных самок мышей Lp(a)+Gulo (-/-). Эти полосы отсутствуют у тех мышей Gulo (-/-), которые не экспрессируют одновременно трансгены как апо(а) человека, так и апоВ-100 человека. На дорожке 19 представлен сдвиг отношения заряда к массе в результате 24-часовой инкубации сыворотки образца #18 при комнатной температуре, который указывает на то, что небольшой сдвиг в миграции частиц может быть связан с окислением липопротеинов.
Иммунофиксационньш электрофорез (IFE) сыворотки мышей проводили отдельно на содержание аро(а) человека в частицах (фиг. 3) и содержание ароВ-100 человека в частицах (рис. 4), используя антитела, специфичные к аро(а) и к ароВ-100 человека, на Health Diagnostic Laboratory, Inc. (Richmond, VA). Полосы представляют белки apo(a) и ароВ-100, соответственно, у трансгенных мышей и их визуализацию в сыворотке, полученной от самок и самцов мышей.
Проверка отсутствия продукции витамина С у трансгенных линий мышей. Уровень аскорбата (витамина С) в сыворотке мышей GULO(-/-) и новосозданной линии Lp(a)+GULO (-/-) зависит от его поступления с кормом. У мышей, содержащихся на диете с дефицитом витамина С, постепенно уменьшается концентрация витамина С в сыворотке до тех пор, пока не достигнет нулевого уровня или не погибнет мышь. Уровень витамина С в сыворотке крови измеряли с помощью набора Ferric Reducing Ascorbate Assay (FRASC) фирмы Biovision (Mountain View, CA) (фиг. 5).
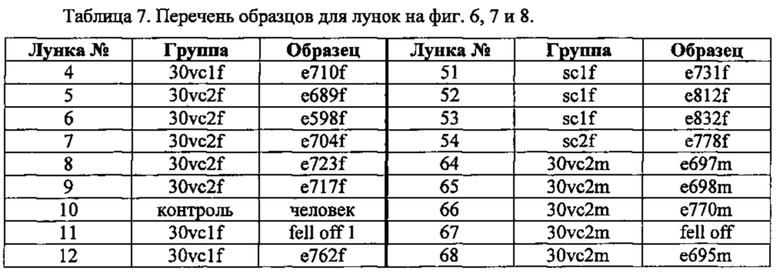
Модулирование липопротеин-холестерина. частиц с аро(а) и частиц с ароВ-100 (фиг. 6, фиг. 7, фиг. 8). Проводили анализ на сыворотках мышей Lp(a)+Gulo(-/-) при добавлении 30 мг/л, 60 мг/л или 150 мг/л аскорбиновой кислоты в питьевую воду, наряду с добавлением 500 ррm витамина С в корм (полное добавление). Было отмечено, что весь спектр холестерина в липопротеинах и/или частиц липопротеинов можно модулировать одним лишь аскорбатом в диете. Эти данные дополняют данные по количеству частиц и в сочетании с данными по нагрузке липопротеинов холестерином полностью подтверждают наличие белка аро(а), белка ароВ-100 человека и связанного через дисульфид Lp(a) в сыворотке этих мышей.
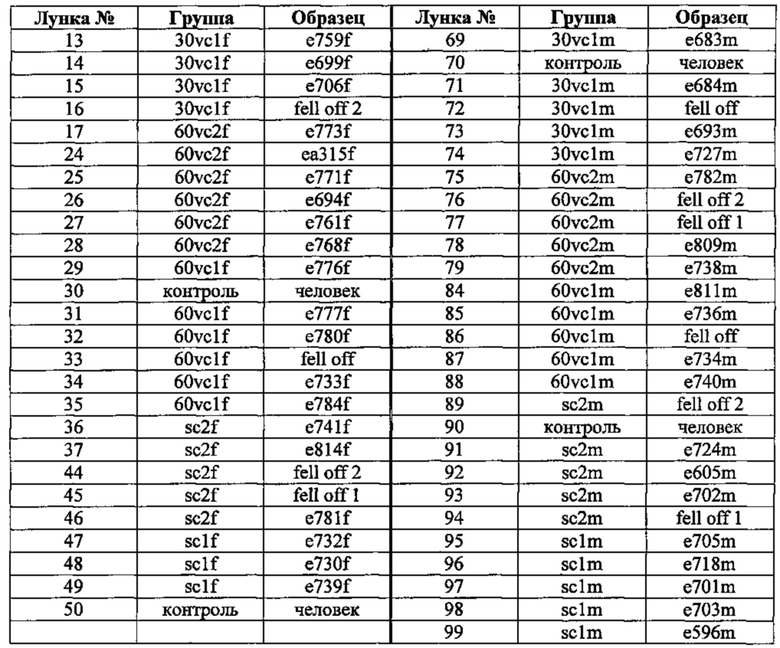
Порядок образцов на фиг. 6-8 соответствует следующему ключу, при этом 30vc означает группу с 30 мг/л витамина С, 60 vc означает группу с 60 мг/л витамина С, a sc означает контрольную группу с полным добавлением (150 мг/л витамина С+500 ррm витамина С в корме). Первые три лунки в каждом ряду не использовались.
Промышленное применение
Получение двойных трансгенных мышей, вьгоабатьтающих Lp(a) человека, но не вырабатывающих витамин С из-за отсутствия гена GULO (GULO-/-), путем скрещивания трансгенных мышей, то есть первой "нокаутной" линии и второй линии, получая третью линию, скрещивания первой "нокаутной" линии и четвертой линии, получая пятую линию, и скрещивания третьей линии и пятой линии, получая двойных трансгенных мышей. Обработка двойных трансгенных мышей модулирующими Lp(a) соединениями с целью выявления профилактических и/или терапевтических подходов для связанных с Lp(a) заболеваний человека. Связанные с Lp(a) заболевания по своей природе являются сердечно-сосудистыми, воспалительными, инфекционными или дегенеративными.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CHA , JOHN CHANG-EUN
NIEDZWIECKI, ALEKSANDRA
RATH, MATTHIAS W
<120> TRANSGENIC MOUSE EXPRESSING HUMAN LIPOPROTEIN (A) WITH DISABLED
VITAMIN C GENE AND ITS USE AS A DISEASE TREATMENT MODEL
<130> RIPLLC018.017US1
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 30
<212> DNA
<213> Mouse
<400> 1
ctagtgtagt ctaggtgata aggatcaact 30
<210> 2
<211> 25
<212> DNA
<213> Mouse
<400> 2
cagctcagag agagaatgaa tcaca 25
<210> 3
<211> 20
<212> DNA
<213> Mouse
<400> 3
ctgacatccc ttaggagttc 20
<210> 4
<211> 20
<212> DNA
<213> Mouse
<400> 4
agatgtgttc caggctgcaa 20
<210> 5
<211> 19
<212> DNA
<213> Mouse
<400> 5
cacacactgc agggtgaca 19
<210> 6
<211> 16
<212> DNA
<213> Mouse
<400> 6
ctgcctgggt gttatc 16
<210> 7
<211> 25
<212> DNA
<213> Human
<400> 7
cactacattt tgtgccagag atgga 25
<210> 8
<211> 20
<212> DNA
<213> Human
<400> 8
ccctgtcctg aggctcctta 20
<210> 9
<211> 16
<212> DNA
<213> Human
<400> 9
tcagcagccc tcttcc 16
<210> 10
<211> 24
<212> DNA
<213> Human
<400> 10
aggtttaact cctcctacct ccaa 24
<210> 11
<211> 21
<212> DNA
<213> Human
<400> 11
tgagggagag ggttccatct t 21
<210> 12
<211> 21
<212> DNA
<213> Human
<400> 12
accagataac aggaagatat g 21
<---


Изобретение относится к области биохимии, в частности к применению мыши, включающей нефункциональный ген GULO (GULO-/-), ген apoB-100 человека и ген apoB(a) человека, экспрессирующей ген apoB-100 человека (apoB-100+) и ген apo(a) человека (apo(a)+), а также не продуцирующей витамин С и продуцирующей Lp(a) человека, для определения возможности соединения лечить связанное с Lp(a) заболевание человека. Изобретение позволяет эффективно тестировать фармацевтические соединения на эффективность и применимость при профилактике и/или лечении заболеваний, связанных с Lp(a) человека. 7 з.п. ф-лы, 8 ил., 7 табл.
1. Применение мыши, которая включает нефункциональный ген GULO (GULO-/-), ген apoB-100 человека и ген apoB(a) человека, экспрессирует ген apoB-100 человека (apoB-100+) и ген apo(a) человека (apo(a)+), не продуцирует витамин С и продуцирует Lp(a) человека, для определения возможности соединения лечить связанное с Lp(a) заболевание человека, в частности включающее получение указанной мыши путем скрещивания первой “нокаутной” линии и второй линии с получением третьей линии, скрещивания первой “нокаутной” линии и четвертой линии с получением пятой линии, и скрещивания третьей линии и пятой линии с получением двойных мышей, и их обработку модулирующими Lp(a) соединениями, где первая “нокаутная” линия мышей включает нефункциональный ген GULO (GULO-/-), вторая линия мышей экспрессирует apo(a) человека (apo(a)+), третья линия мышей включает нефункциональный ген GULO (GULO-/-) и экспрессирует ген apo(a) человека (apo(a)+), четвертая линия мышей включает ген apoB-100 человека (apoB-100+) и пятая линия включает нефункциональный ген GULO (GULO-/-) и экспрессирует apoB-100 человека (apoB-100+).
2. Применение по п. 1, где первая “нокаутная” линия мышей не вырабатывает витамин C.
3. Применение по п. 1 или 2, где вторая линия мышей вырабатывает apo(a) человека.
4. Применение по любому из пп. 1-3, где третья линия мышей не вырабатывает витамин C и вырабатывает ap (a) человека.
5. Применение по любому из пп. 1-4, где пятая линия мышей не вырабатывает витамин C и вырабатывает apoB-100 человека.
6. Применение по любому из пп. 1-5, где двойная мышь включает нефункциональный ген GULO и не продуцирует витамин C и одновременно продуцирует Lp(a) человека.
7. Применение по любому из пп. 1-6, где связанное с Lp(a) заболевание человека является сердечно-сосудистым заболеванием.
8. Применение по любому из пп. 1-7, где связанное с Lp(a) заболевание человека является воспалительным, инфекционным или дегенеративным заболеванием.
| RODGER EJ et al | |||
| Proteomic analysis of aortae from human lipoprotein(a) transgenic mice shows an early metabolic response independent of atherosclerosis, PLoS One, 2012, Vol.7, N.1, e30383 | |||
| NAKATA Y et al | |||
| Vulnerable atherosclerotic plaque morphology in apolipoprotein E-deficient mice unable to make ascorbic Acid, Circulation, 2002, Vol.105, |
Авторы
Даты
2020-05-18—Публикация
2014-10-11—Подача