Перекрестные ссылки на связанные заявки
Данная заявка имеет отношение согласно 35 U.S.С. §119 (е), к находящейся на рассмотрении предварительной заявке №60/348143, поданной 11 января 2002 г., содержание которой включено здесь в виде ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к обладающему питательными свойствами (питательному) фармацевтическому составу и его применению при лечении рака. Более конкретно настоящее изобретение относится к содержащим полифенол фармацевтическим составам, причем содержание полифенолов в них эффективно при лечении рака. Состав по настоящему изобретению используется как средство профилактики и лечения рака, включающее аскорбиновую кислоту, лизин, пролин и, по меньшей мере, одно полифенольное соединение, выбранное из группы, состоящей из галлата эпигаллокатехина, галлата эпикатехина, эпигаллокатехина, эпикатехина и катехина.
Уровень техники
Рак является одной из главнейших причин смерти в индустриальном обществе. Не существует специального лечения рака или мер устранения причин его возникновения, и смертность от рака является одной из самых высоких, по сравнению с другими заболеваниями. Самое распространенные виды лечения - химиотерапия и радиотерапия - не делают различий между здоровой тканью и пораженной раком и обуславливают серьезные побочные эффекты. Таким образом, существует потребность в избирательном виде лечения рака.
Один из ключевых механизмов, который используется раковыми клетками для проникновения и метастазирования в организме включает энзиматическую деструкцию окружающей соединительной ткани. Терапевтические попытки контролировать этот процесс с помощью специальных лекарственных средств не были успешными, и пока не существует средств, пригодных для контролирования метастазирования. Применяемые в настоящее время методики лечения, связанные с химиотерапией и радиотерапией, сосредоточены на разрушении раковых клеток в организме и не направлены на метастазы. Химиотерапия и радиотерапия несут риск возникновения новых очагов рака и, в связи с деструкцией соединительной ткани в организме, могут способствовать распространению раковых клеток.
Для того чтобы расти и распространяться по всему организму, раковые клетки разрушают экстрацеллюлярный матрикс с помощью различных матричных протеиназ (MMPs) и плазмина, чьи активности коррелируют с агрессивностью роста опухоли. Rath и Pauling (1992) установили, что такие компоненты питания как аминокислота лизин и аскорбиновая кислота, действуют как природные ингибиторы протеолиза экстрацеллюлярного матрикса и они способны регулировать рост и распространение опухоли. Эти компоненты питания могут проявлять свое противоопухолевое действие с помощью различных механизмов воздействия, среди которых ингибирование MMPs и укрепление соединительной ткани, окружающей раковые клетки (эффект «инкапсулирования» опухоли).
В US патенте №5962517 описана фармацевтическая композиция для иного медицинского показания (лечение акне). Описанная композиция включает компонент, влияющий на уменьшение акне, по меньшей мере, один из компонентов: корень лопуха или корень щавеля курчавого или композиция на основе катехина; а также компонент, улучшающий состояние кожи, включающий переходный металл. В отношении лечения и/или профилактики рака какие-либо преимущества описанной композиции не выявлены.
В РСТ WO 00/76492 раскрыт питательный состав для лечения заболевания, который содержит производное катехина. Однако, как было показано, биодоступность производных катехина была чрезвычайно низкой (Chem L., Lee M.J., Yand C.S., Drug Metab. Dispos. 25: 1045-1050 (1997); Yang C.S., Chem L., Lee M.J., Balentine D.A., Kuo M.C., Schantz S. Cancer Epidemol. Biomark. Prev.7:351-35 (1998); Bell J.R., Donovan J.L., Wong R., Waterhouse H., German J.B., Walzem R.L., Kasim K. Am. J. Clin. Nutr.71: 103-108 (2000); Sherry Chow H.H., Cai Y., Alberts D.S., Hakim I., Dorr R., Shahi F., Crowell J.A., Yang S.C., Hara H. Cancer Epidemol. Biomark. Prev.10: 53-58 (2001)) и в РСТ WO 00/76492 не описываются средства повышения биодоступности в той мере, как это требуется при лечении и/или профилактике рака.
Demeule et al. показали, что катехины зеленого чая могут обладать ингибирующим эффектом в отношении матричных металлопротеиназ. Однако предложения или какое-нибудь наставление в отношении того, как использовать катехины при лечении и/или профилактике рака, отсутствуют. Установлено, что биодоступность полифенолов в человеческом организме чрезвычайно низка; низкие концентрации катехинов в тканях - главная причина того, что терапевтическая ценность полифенолов, в том числе галлата эпигаллокатехина (EGCG) невысока. Потому существует потребность в изыскании улучшенной фармацевтической композиции, обладающей питательными свойствами, содержащей полифенолы, которая была бы эффективна при лечении неопластических заболеваний и других заболеваний, в том числе и воспалительных.
Существует потребность в безопасном и эффективном натуральном средстве, которое могло бы быть использовано для контроля за процессом распространения рака в организме. Существует также потребность в профилактическом средстве против развития в организме рака или доброкачественных опухолей, и чтобы такое средство могло использоваться пациентами без риска возникновения побочных эффектов, вызванных лечением. Основанные на компонентах питания фармацевтические композиции становятся популярными, т.к. заболеваемость раком в последние годы растет. Необходимость разработки подобных композиций остается актуальной и, по-видимому, будет повышаться.
Раскрытие изобретения
Один аспект настоящего изобретения относится к обладающей питательными свойствами фармацевтической композиции, применяемой при лечении рака, содержащей:
а) производное аскорбиновой кислоты; b) производное L-лизина; с) производное L-пролина; и d) по меньшей мере одно производное полифенола, выбранное из группы, состоящей из галлата эпигаллокатехина, галлата эпикатехина, эпигаллокатехина, эпикатехина и катехина. Соединения а)-с) усиливают способность производного полифенола блокировать пролиферацию раковых клеток и метастазирование.
Предпочтительно производное аскорбиновой кислоты выбирают из группы, состоящей из аскорбиновой кислоты, фармацевтически приемлемых солей аскорбиновой кислоты, эфиров аскорбиновой кислоты и/или их смеси. Предпочтительно фармацевтически приемлемая соль аскорбиновой кислоты представляет собой аскорбат кальция или аскорбат магния. Более предпочтительно, эфир аскорбиновой кислоты представляет собой аскорбил-пальмитат. Предпочтительно производное лизина выбирают из группы, состоящей из гидрохлорида лизина и лизин-фармацевтически приемлемых солей лизина. Предпочтительно производное пролина выбирают из группы, состоящей из гидрохлорида пролина или пролин-фармацевтически приемлемых солей пролина.
Другой аспект заключается в том, что заявленная обладающая питательными свойствами фармацевтическая композиция содержит дополнительно микроэлемент, выбранный из группы, состоящей из селена, меди, марганца, кальция и магния.
Еще один аспект касается того, что заявленная фармацевтическая композиция, обладающая питательными свойствами, содержит также аминокислоту. Предпочтительно этой аминокислотой является аргинин. Более предпочтительно, заявленная питательная фармацевтическая композиция содержит также N-ацетил-цистин.
Еще один аспект данного изобретения касается обладающей питательными свойствами фармацевтической композиции, используемой при лечении рака, содержащей: а) производное аскорбиновой кислоты; b) производное L-лизина; с) производное L-пролина; d) N-ацетил цистеин и е) по меньшей мере одно производное полифенола, выбранное из группы, состоящей из галлата эпигаллокатехина, гаплата эпикатехина, эпигаллокатехина, эпикатехина и катехина. Соединения a)-d) усиливают способность производного полифенола блокировать пролиферацию раковых клеток и метастазирование.
В другом аспекте изобретение обеспечивает обладающую питательными свойствами фармацевтическую композицию, содержащую 250 мг аскорбиновой кислоты, 250 мг аскорбата кальция, 250 мг аскорбата магния, 250 мг аскорбил-пальмитата, 1000 мг полифенолов, 200 мг N-ацетил-цистеина, 1000 мг лизина, 750 мг пролина, 500 мг аргинина, 3 мкг селена, 2 мг меди и 1 мг марганца.
В другом аспекте изобретения предусматривается обладающая питательными свойствами фармацевтическая композиция, содержащая 25 мг аскорбиновой кислоты, 25 мг аскорбата кальция, 25 мг аскорбата магния, 25 мг аскорбил-пальмитата, 200 мг полифенолов, 10 мг N-ацетил-цистеина, 50 мг лизина, 25 мг пролина, 50 мг аргинина, 1 мкг селена, 20 мкг меди, 50 мкг марганца.
В другом аспекте изобретения предусматривается обладающая питательными свойствами фармацевтическая композиция, содержащая 5000 мг аскорбиновой кислоты, 5000 мг аскорбата кальция, 5000 мг аскорбата магния, 5000 мг аскорбил-пальмитата, 5000 мг полифенолов, 1500 мг N-ацетил-цистеина, 5000 мг лизина, 3000 мг пролина, 3000 мг аргинина, 200 мкг селена, 9 мг меди и 10 мг марганца.
В другом аспекте изобретения предусматривается обладающая питательными свойствами фармацевтическая композиция, содержащая 250 мг аскорбиновой кислоты, 250 мг аскорбата кальция, 250 мг аскорбата магния, 250 мг аскорбил-пальмитата, 1000 мг полифенолов, 250 мг N-ацетил-цистеина, 1000 мг лизина, 750 мг пролина, 500 мг аргинина, 100 мкг селена, 2 мг меди, 1 мг марганца, 500 мг кальция и 400 мг магния.
В другом аспекте изобретения предусматривается обладающая питательными свойствами фармацевтическая композиция, содержащая 250 мг аскорбиновой кислоты, 250 мг аскорбата кальция, 250 мг аскорбата магния, 250 мг аскорбил-пальмитата, 1000 мг полифенолов, 200 мг N-ацетил-цистеина, 1000 мг лизина, 750 мг пролина, 500 мг аргинина, 100 мкг селена, 2 мг меди, 1 мг марганца, 500 мг кальция, 400 магния и 200 цитрусовых биофлавоноидов.
Еще в одном аспекте данного изобретения предусматривается обладающая питательными свойствами фармацевтическая композиция, используемая при лечении рака, содержащая: L-лизин, L-пролин, L-аргинин, аскорбиновую кислоту, кальций, магний, полифенолы, N-ацетил-цистин, селен, медь и марганец.
В другом аспекте изобретения предусматривается обладающая питательными свойствами фармацевтическая композиция, содержащая 1000 мг L-лизина, 750 мг L-пролина, 500 мг L-аргинина, 710 мг аскорбиновой кислоты, 22 мг кальция, 50 мг магния, 1000 мг полифенолов, 200 мг N-ацетил-цистеина, 30 мкг селена, 2 мг меди и 1 мг марганца.
В другом аспекте изобретения предусмотрен способ лечения рака у индивидуума, включающий стадию введения пациенту вышеописанной питательной фармацевтической композиции. Предпочтительно рак представляет собой выбранный из группы: меланомный рак, рак молочной железы, рак прямой кишки, рак легкого и рак головного мозга.
В другом аспекте изобретение предусматривает способ лечения воспалительного заболевания, включающий стадию введения пациенту вышеописанной питательной фармацевтической композиции. Предпочтительно воспалительным заболеванием является остеоартрит.
Краткое описание графических материалов
На фиг.1 отражены свойства полифенолов, аскорбата, пролина и лизина ингибировать способность к миграции клеток рака молочной железы человека.
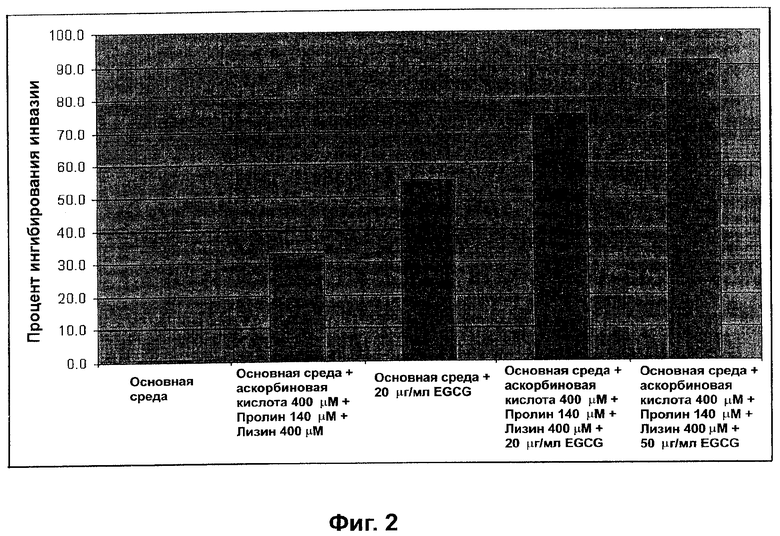
На фиг.2 отражены свойства полифенолов, аскорбата, пролина и лизина ингибировать способность к миграции клеток рака прямой кишки человека.
На фиг.3 отражены свойства полифенолов, аскорбата, пролина и лизина ингибировать способность к миграции меланомных клеток человека.
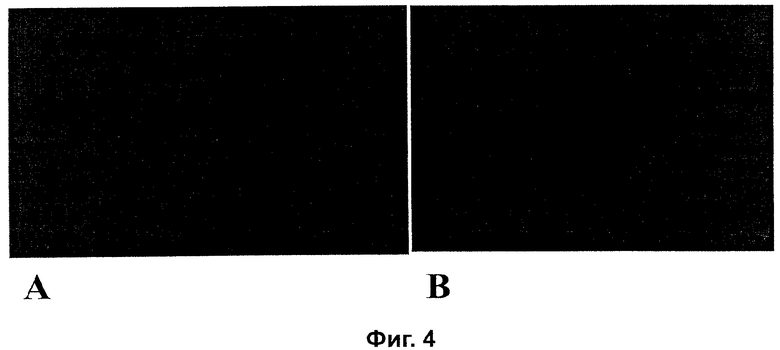
На фиг.4 отражены свойства полифенола, аскорбата, пролина и лизина ингибировать апоптоз клеток меланомы человека.
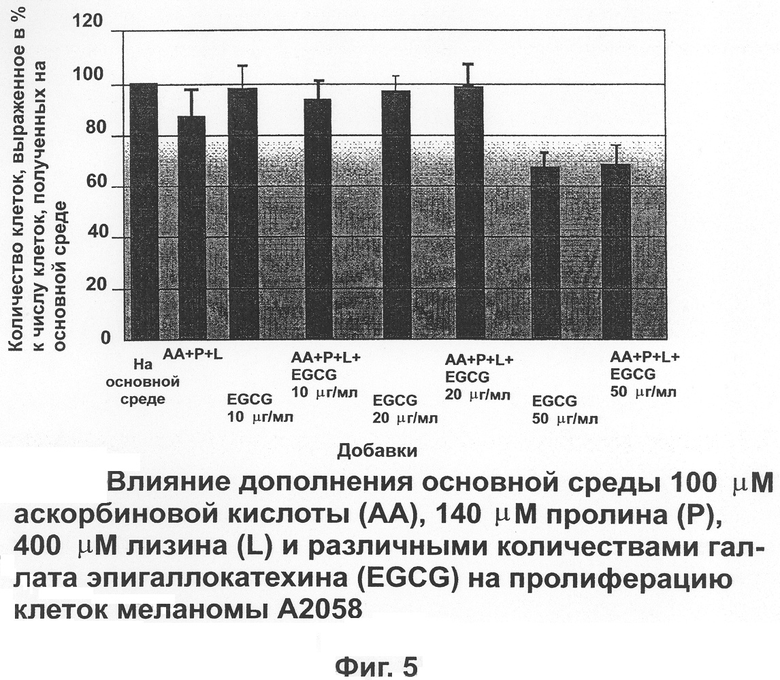
На фиг.5 отражены свойства аскорбиновой кислоты, пролина, лизина и различных количеств EGCG ингибировать пролиферацию клеток меланомы человека (А 2058).
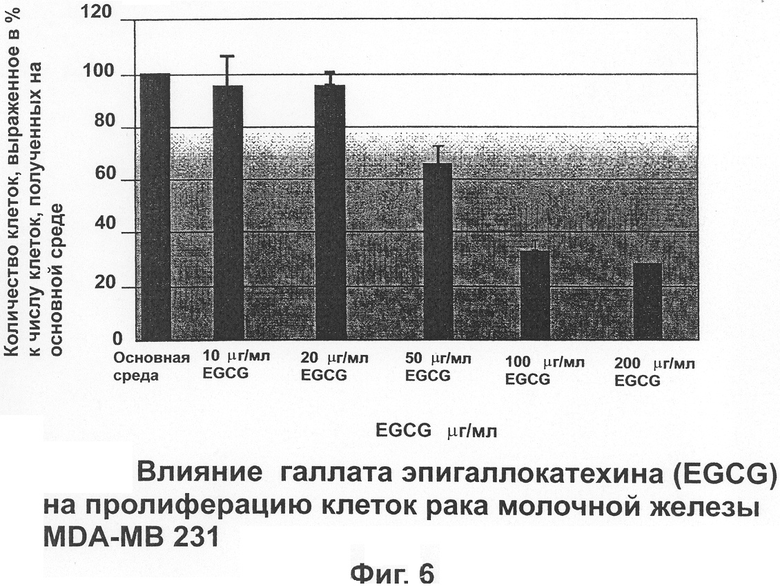
На фиг.6 отражены свойства EGCG ингибировать пролиферацию клеток рака молочной железы человека (MDA-MB 231).
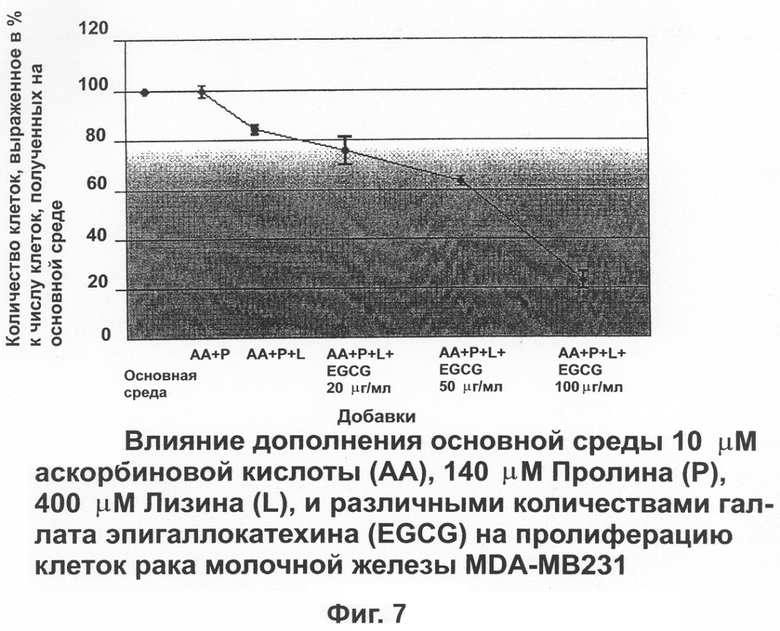
На фиг.7 показано влияние дополнения основной питательной среды аскорбиновой кислотой, пролином, лизином и различньми количествами EGCG на пролиферацию клеток рака молочной кислоты человека (MDA-MB 231).
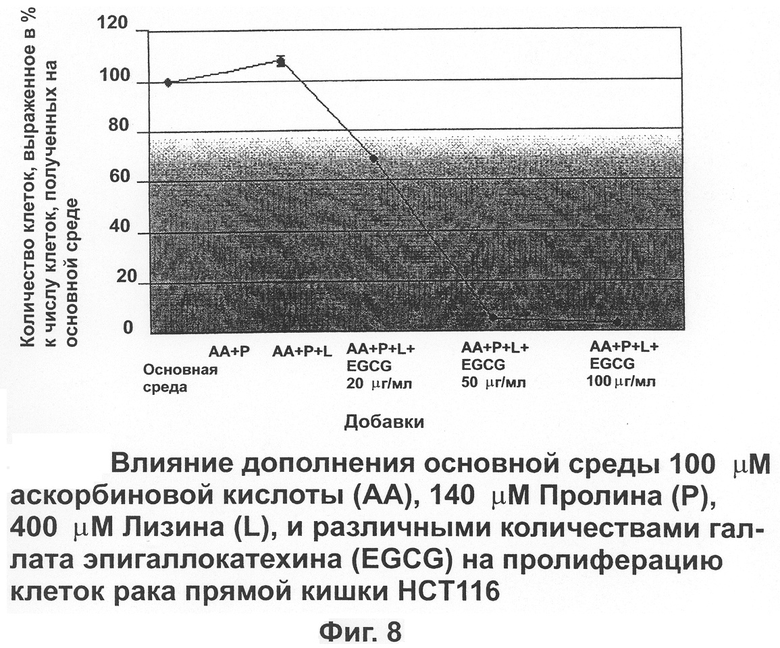
На фиг.8 показано влияние дополнения основной питательной среды аскорбиновой кислотой, пролином, лизином и различными количествами EGCG на пролиферацию клеток рака прямой кишки человека (НСТ 116).
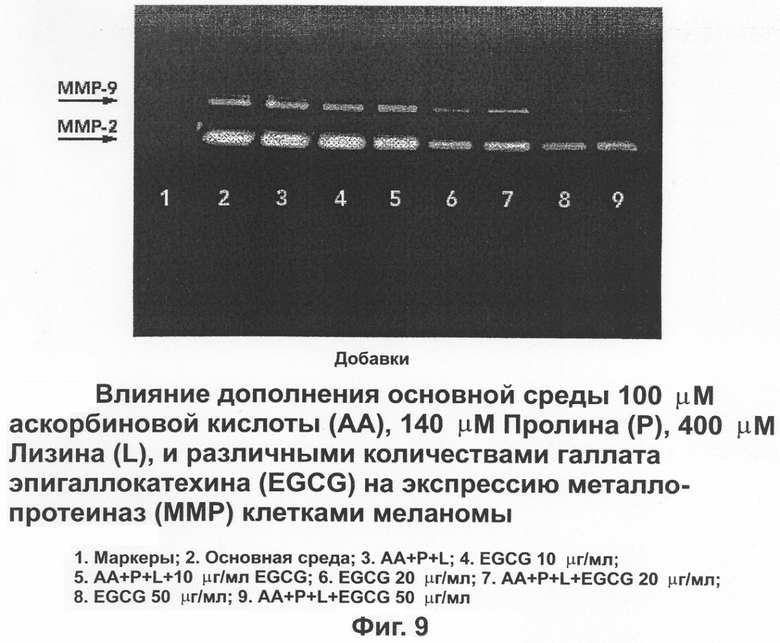
На фиг.9 показано влияние дополнения основной питательной среды аскорбиновой кислотой, пролином, лизином и различными количествами EGCG на экспрессирование матричных металлопротеиназ (ММР) в клетках меланомы человека.
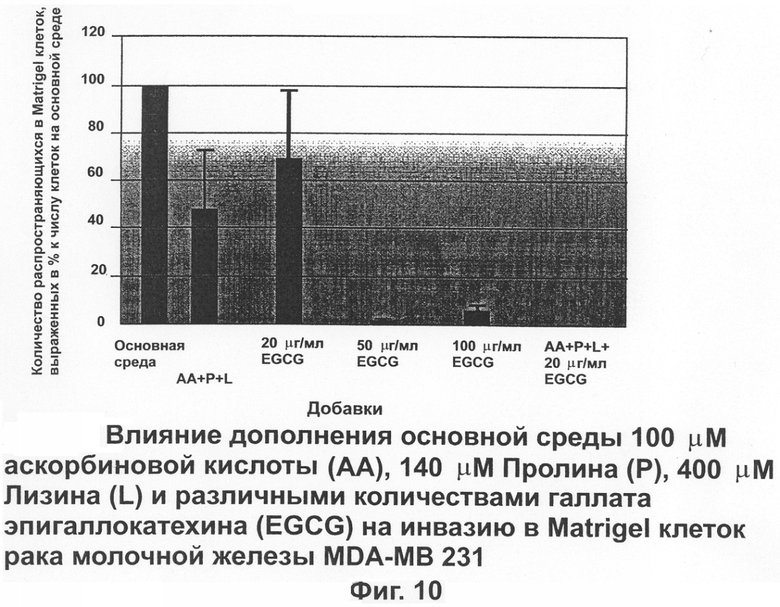
На фиг.10 показано влияние дополнения основной питательной среды аскорбиновой кислотой, пролином, лизином и различными количествами EGCG на проникновение в Matrigel клеток рака молочной железы человека (MDA-MB 231).
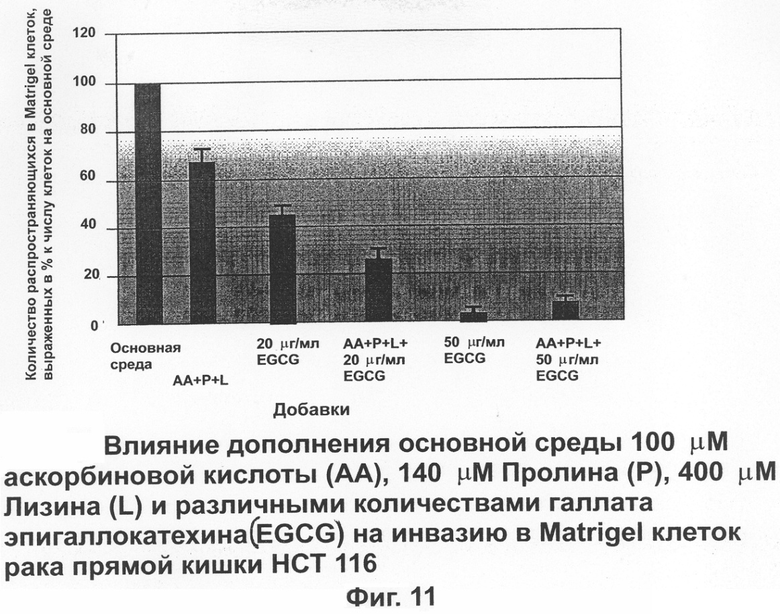
На фиг.11 показано влияние дополнения основной питательной среды аскорбиновой кислотой, пролином, лизином и различными количествами EGCG на проникновение в Matrigel клеток рака прямой кишки человека (НТС 116).
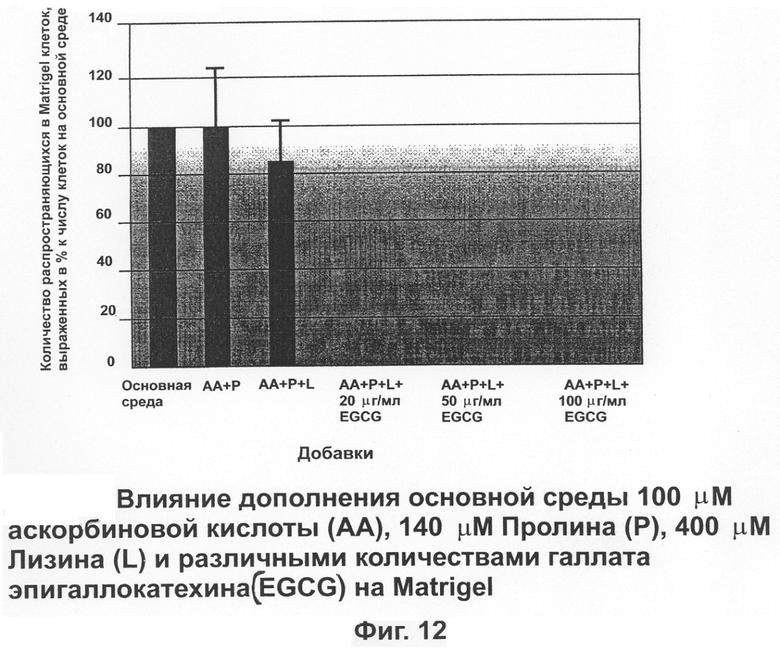
На фиг.12 показано влияние дополнения основной питательной среды аскорбиновой кислотой, пролином, лизином и различными количествами EGCG на снижение количества распространяющихся клеток меланомы человека (А 2058).
Осуществление изобретения
В соответствии с используемым здесь значением термин «лизин» равнозначен L-лизину, «пролин» равнозначен L-пролину, «аргинин» равнозначен «L-аргинину», термин «витамин С» равнозначен аскорбиновой кислоте и может включать «соли или эфиры аскорбиновой кислоты». «MMPs» относится к матричным металлопротеиназам; например, ММР-1, ММР-2, ММР-3, ММР-4, ММР-5, ММР-6, ММР-7, ММР-8, ММР-9, ММР-10, ММР-11 и т.д. «EGCG» означает (-)-эпигаллокатехин-3-галлат, который представляет собой основной полифенольный компонент, содержащийся в зеленом чае. «NHDF» означает нормальный дермальный фибробласт человека, включая хондроциты человека и стромальные (стволовые) клетки человека.
В настоящем изобретении предусматривается обладающая питательными свойствами фармацевтическая композиция аскорбиновой кислоты, лизина, пролина и, по меньшей мере, одного полифенольного производного. Предпочтительно производное аскорбиновой кислоты выбрано из группы, состоящей из аскорбиновой кислоты, солей и эфиров аскорбиновой кислоты. Предпочтительно лизин является гидрохлоридом лизина или фармацевтически приемлемой солью лизина. Предпочтительно пролин является гидрохлоридом пролина или фармацевтически приемлемой солью пролина.
Полифенольные соединения содержатся в экстракте зеленого чая. Они известны также как катехины. Полифенолы содержатся в зеленом чае и, как предполагают, обеспечивают защиту от различных заболеваний, включая рак (Mukhtar H., Ahmed N. Am. J. Clin. Nutr. 71: 1698 S - 1702 S (2000)). Оральное введение зеленого чая повышает проявляемый доксорубицином эффект ингибирования опухоли у мыши.
Высокая противоопухолевая активность катехинов может иметь отношение к их влиянию на несколько факторов, вовлеченных в пролиферацию раковых клеток и их метастазирование. Известно, что катехины вызывают угнетение клеточного цикла в клетках карциномы человека (Ahmad N., Feyes D.K., Nieminen A.L., Agarwal R., Mukhtar H.J., Natl Cancer Inst. 89: 1881-1886 (1997)). Полифенольная фракция зеленого чая также участвует в защите от воспаления и цитокинов, индуцируемых опухолями.
Полифенольные соединения содержатся в зеленом чае в количестве 30% по сухому весу. Они включают флаванолы, флавандиолы, флаваноиды и фенолокислоты. Флаванолов содержится больше всего среди полифенолов зеленого чая и они широко известны как катехины.
В зеленом чае содержится четыре основных катехина: 1) (-)-эпикатехин, 2) (-)-эпикатехин-3-галлат, 3) (-)-эпигаллокатехин и 4) (-)-эпигаллокатехин-3-галлат (EGCG). Среди этих катехинов главной составляющей зеленого чая является EGCG. EGCG является мощным антиоксидантом и может обуславливать противораковую активность зеленого чая. Сообщалось, что катехины проявляют свою антиметастазную активность, предотвращая процесс ангиогенеза (Сао У., Cao R. Nature 398:381 (1999)). Было также показано, что EGCG противостоит активности урокиназы (активатора u-плазминогена) (Jankun J., Selman S.H., Swierez R., Skrzypczak J.E., Nature: 387-567 (1997)), одного из ферментов, наиболее часто экспрессируемых при раке человека. EGCG является предпочтительным полифенольным соединением.
Предпочтительно полифенольное соединение выбирают из группы, включающей галлат эпигаллокатехина, галлат эпикатехина, эпигаллокатехин, эпикатехин, катехины и другие фармацевтически приемлемые полифенольные соли и/или их смеси.
Одной из главных терапевтических задач данной заявки является предотвращение переваривания экстрацеллюлярного матрикса и его восстановление. Аскорбиновая кислота или ее соли (т.е. аскорбаты) необходимы для синтеза коллагена, эластина и других важных соединений, составляющих экстрацеллюлярный матрикс.
Предпочтительно для повышения антираковой активности используют комбинацию аскорбиновой кислоты, пролина и лизина. Более предпочтительно эта комбинация усиливает полифенольные соединения, включающие галлат эпигаллокатехина, галлат эпикатехина, катехина таким образом, что полифенольное соединение действует на уменьшение инвазии раковых клеток и вообще полностью прекращает их инвазию.
Без связи с какой-либо теорией данный питательный фармацевтический состав содержит смесь ингредиентов, включающую полифенолы, и установлено, что эта смесь эффективно действует в процессах блокирования пролиферации и метастазирования. Нами обнаружено, что сочетание компонентов в заявляемом составе, обладающем питательным свойствами, значительно уменьшает инвазию клеток рака или полностью блокирует метастазирование раковых клеток. Таким образом, эта композиция эффективно предотвращает распространение этих раковых клеток. Терапевтическое применение заявленного состава обуславливает эффективное, селективное и безопасное лечение рака молочной железы, прямой кишки и др. органов. Предпочтительно описываемый обладающий питательными свойствами фармацевтический состав может содержать два компонента, ковалентно связанных между собой.
Предпочтительно действенность данной питательной композиции увеличивается при включении соединений, в отношении которых известно, что они оказывают целительное действие на рост и инвазию рака и других опухолей, например, L-аргинин и/или аргининсодержащие соединения. Более предпочтительно - для эффективной профилактики и лечения рака и других опухолей - использовать соль селена, соль меди, соль марганца. Это сочетание может также включать одно или несколько соединений, которые необходимы как коэнзим в цикле Кребса, дыхательной цепи или для других метаболических функций клеток в количестве, эффективном для профилактики и лечения рака или других опухолей.
Настоящий питательный фармацевтический состав может назначаться пациенту в форме капсул, таблеток, порошков, пилюль, инъекций, инфузий, ингаляций, суппозиториев или иных фармацевтических приемлемых носителей и/или средств доставки для профилактики и лечения рака и других опухолей. Предпочтительно питательная фармацевтическая композиция вводится в виде капсул, таблеток или порошков. Более предпочтительно она вводится в виде капсул.
Данная обладающая питательными свойствами фармацевтическая композиция может использоваться для профилактики и лечения рака и других опухолей у конкретного пациента, локализованных в молочной железе, яичниках, шейке матки и других органах женской репродуктивной системы, а также в легком, печени, коже, желудочно-кишечном тракте, мозге, костной ткани и других органах. Предпочтительно данную композицию используют при лечении рака легкого и головного мозга.
Заявляемый обладающий питательными свойствами фармацевтический состав может использоваться при профилактике и лечении инфекционных заболеваний, атеросклероза, рестеноза, других сердечно-сосудистых заболеваний и воспалительных заболеваний. Предпочтительно воспалительным заболеванием является полиартрит.
ММР - Опосредованная активация плазмина
Предполагают, что на MMPs - активность можно повлиять с помощью лизина через плазмин - опосредованные механизмы, хотя и другие механизмы не исключаются. MMPs вырабатываются как проэнзимы и их активация опосредуется частично плазмином и для ее завершения требуется активная форма ММР-3. Механизм активации различных MMPs, разобранный детально Nagase (1997), показывает, что ММР-3 нуждается также в конверсии плазминогена в его активную форму, плазмин. Активный связывающий центр плазминогена имеет сайт, где лизин специфически связывается.
Следовательно, лизин может мешать активации плазминогена (превращению его в плазмин) с помощью активатора плазминогена (Rath and Pauling, 1992), путем связывания с активными точками плазминогена. Тран-экзамовая кислота, синтетический аналог лизина, была использована для ингибирования индуцируемого плазмином протеолиза посредством воздействия на его механизм.
Поскольку активность плазмина необходима для индуцирования различных тканевых MMPs, лизин может препятствовать превращению плазминогена в плазмин и тем самым ингибировать активацию почти всех MMPs. Кроме того, EGCG может вызывать ингибирующий эффект на распад экстрацеллюлярного матрикса посредством ингибирования ММР-2.
Инвазия рака и роль матрикса
Возможно, также воздействовать на инвазию раковых клеток в матриксе путем увеличения стабильности и напряжения соединительной ткани, окружающей раковые клетки, а также способствуя "инкалсулированию" опухоли. Для этого нужно оптимизировать синтез и структуру коллагеновых волокон, для чего необходимо гидроксилирование гидроксипролиновых и гидроксилизиновых остатков в волокнах коллагена. Аскорбиновая кислота может быть необходима для гидроксилирования этих аминокислот. Аскорбиновая кислота и L-лизин в норме не продуцируются в организме человека; следовательно, субоптимальный уровень этих компонентов питания возможен в различных патологических состояниях так же, как и при неправильном питании. Несмотря на то, что пролин может синтезироваться из аргинина, на его синтез или гидроксилирование можно повлиять при патологических состояниях. Так, было показано, что содержание гидроксипролина в метастазирующей ткани опухоли намного ниже, чем в неметастазирующей опухолевой ткани (Chubainskaia et al., 1989). Ряд лекарств, которые уменьшали метастазирование, увеличивали при этом уровень гидроксипролина в тканях (Chubainskaia et al., 1989). Установлено, что содержание гидроксипролина в моче больных раком выше, чем у здоровых или у нераковых больных (Okazaki et al., 1992). Все эти открытия наводят на мысль о вредном воздействии раковых клеток на метаболизм пролина и возможный вызванный этим дефицит пролина у больных раком.
Раковые больные могут иметь незначительные уровни содержания аскорбиновой кислоты. Аскорбиновая кислота может быть цитотоксичной для линий клеток злокачественных опухолей и проявлять антиметастатическое действие. В настоящем изобретении раскрыто, что комбинация аскорбиновой кислоты, пролина, лизина и, по меньшей мере, одного полифенольного соединения проявляет мощный антипролиферативный и антиметастатический эффект в отношении линий раковых клеток. Предпочтительно, описываемая здесь обладающая питательными свойствами фармацевтическая композиция эффективна против клеток меланомы, рака молочной железы и рака прямой кишки. Самое предпочтительное то, что заявляемая фармацевтическая композиция эффективна против клеток рака прямой кишки человека.
Полифенольные соединения (Катехины): EGCG представляет собой один из катехинов, содержащихся в экстракте зеленого чая, и может показывать всплеск ингибиторной активности в отношении клеток рака человека. Лежащий в основе этого механизм однозначно не выяснен. В настоящем изобретении раскрывается неожиданное совпадение, присущее питательному фармацевтическому составу, содержащему аскорбиновую кислоту, пролин, лизин и, по меньшей мере, одно полифенольное соединение, в эффективности блокирования пролиферации и метастазирования раковых клеток.
Обладающая питательными свойствами фармацевтическая композиция настоящего изобретения эффективно блокирует распространение (инвазию) рака молочной железы, прямой кишки, кожи (меланома) и других форм рака. Ингредиенты, содержащиеся в этом питательном составе, являются веществами природного происхождения, и установлено, что будучи использованными в указанных в формуле изобретения интервалах, подтвержденных в описании, они не оказывают побочных токсичных эффектов. Так что данная композиция может также использоваться профилактически, т.е. для эффективного предотвращения рака и других опухолей в организме.
Так как вирусные клетки и другие инвазивные микроорганизмы используют аналогичные протеазы, что и раковые клетки для проникновения в организм, заявляемая здесь композиция может использоваться для эффективной профилактики и лечения вирусных заболеваний и других инфекционных болезней.
Аналогичный механизм активации матричных металлопротеиназ, который используется раковыми клетками для проникновения в матрикс, также способствует дестабилизации атеросклеротических бляшек, вызывающих инфаркты миокарда и инсульты. Следовательно, заявляемая здесь композиция может также использоваться для эффективной профилактики и лечения атеросклероза, рестеноза и других сердечнососудистых заболеваний.
Активация матричных металлопротеиназ, которые используются раковыми клетками для матричной инвазии, является важным, ключевым компонентом в различных состояниях, характеризующихся воспалением. Поэтому заявляемая композиция может использоваться также и для эффективного предотвращения и лечения таких заболеваний как ревматоидный артрит, эмфизема, аллергия, остеоартрит и другие состояния, для которых характерно воспаление.
Обладающая питательными свойствами фармацевтическая композиция настоящего изобретения может назначаться пациенту в форме таблеток, пилюль, инъекций, инфузий, ингаляций, суппозиториев или других фармацевтически приемлемых носителей и/или средств доставки лекарств.
Примеры.
Действие аскорбиновой кислоты, лизина, пролина и, по меньшей мере, одного полифенольного соединения изучалось в отношении их антипролиферативной и антивирусной активности на различных клеточных линиях рака человека. Более конкретно, был проверен один из ингредиентов экстракта зеленого чая (например, галлат эпигаллокатехина (EGCG)).
Материалы и методы
Клетки рака молочной железы человека MDA-MB-231, клетки рака прямой кишки человека НСТ 116, клеточная линия меланомы человека А2058 были получены от АТСС. Нормальные фибробласты кожи человека были получены из GICBO. Если не указано иное, использовалась культуральная среда, полученная из АТСС.
При исследованиях пролиферации клеток рака каждый опыт воспроизводился восемь раз. При изучении инвазии каждый опыт воспроизводился в трех или четырех повторностях.
Изучение клеточной пролиферации
В этих опытах 5×104 клеток рака молочной железы выращивали на среде Liebovitz′a с 10% фетальной сыворотки быка (FBS) в 24-гнездных планшетах. Среда использовалась как таковая (основная), так и с определенными дополнениями. Плашки инкубировали в инкубаторе с подачей воздуха (без дополнения CO2) в течение четырех дней. Клетки рака прямой кишки НСТ 116 выращивали на среде McCoy′a 5A и поддерживали в инкубаторе с подачей воздуха, содержащего 5% СО2. В конце инкубационного периода среду отбрасывали, а клетки в ячейках промывали PBS с последующей инкубацией в течение 3 часов с МТТ красителем. В каждую ячейку добавляли диметилсульфоксид (DMSO, 1 мл). Плашки с DMSO оставляли при комнатной температуре 15 минут (при осторожном перемешивании) и затем измеряли OD раствора в каждой ячейке при 550 нм. Было сделано заключение о том, что OD550 раствора DMSO в каждой ячейке прямо пропорционально количеству клеток. За 100 была принята OD550 обработанной пробы, не содержащей добавок (основная среда).
Изучение инвазии в Matrigel′e
Опыты проводили, используя Matrigel (Becton Dickinson), помещенный в виде вставок в соответствующий 24-гнездный планшет. Производили засев и выращивание фибробластов в ячейках планшета, используя DMEM. Когда фибропласты достигли слияния, среду отбросили и заменили ее 750 μл среды, предназначенной для обработки. Раковые клетки (5×104), суспендированные в 250 μл среды, обогащенной питательными элементами, определенными планом проводимого опыта, были посеяны в гнезда планшета с гелевыми вставками. Таким образом, обе среды на вставке и в ячейке содержали одни и те же добавки. Планшеты со вставками затем инкубировали (в инкубаторе) с подачей воздуха для MDA-MB-231 клеток и в инкубаторе с 5% СО2 для клеток рака прямой кишки и меланомных клеток) в течение 18-20 часов. После инкубации среду из ячеек выбрасывали. С верхней поверхности вставок клетки осторожно соскребали ватным тампоном. Клетки, которые, преодолев барьер, проникли внутрь Matrigel и добрались до нижней поверхности Matrigel, окрасили гемаколоровым красителем (ЕМ Science), они были визуально подсчитаны с помощью микроскопа. Результаты были подвергнуты ANOVA и все возможные пары были протестированы на значимость при р<0,05.
Эта среда в различных опытах дополнялась аскорбиновой кислотой, пролином, лизином и EGCG в указанных концентрациях.
Зимография желатиназы
Зимографию желатиназы проводили в 10% Novex предварительно отлитом (отформованном) полиакриламидном геле (Invitrogen) в присутствии 0,1% желатины. Загружали культуральную среду (20 μл) и проводили SDS-PAGE с трис-глициновым SDS буфером. После электрофореза гели отмывали 5% тритоном Х-100 в течение 30 мин и окрашивали. Параллельно определяли содержание белка и определяли примерную молекулярную массу.
Пример 1.
MDA-MB 231 (АТСС) клетки рака молочной железы засевали на Matrigel вставку в усовершенствованной Matrigel инвазионной камере (BD). Кондиционированную среду нормальных фибробластов кожи человека (Clonetics) с добавлением различных агентов (как показано на Фиг.1) добавляли в ячейку. Камеру инкубировали в течение 24 часов, и клетки, которые прошли через Matrigel мембрану и мигрировали к нижней поверхности мембраны, были подсчитаны. Эти данные показали ингибирующий эффект галлата эпигаллокатехина и комбинации аскорбиновой кислоты, пролина и лизина на инвазию в Matrigel и миграцию MDA-MB 231 клеток рака молочной железы человека.
Пример 2.
НТСТ 116 (АТСС) клетки рака прямой кишки человека засевали на Matrigel вставку в усовершенствованной Matrigel инвазионной камере (BD). Кондиционированную среду нормальных фибробластов кожи человека (Clonetics) с добавлением различных агентов (как показано на Фиг.1) добавляли в ячейку. Камеру инкубировали в течение 24 часов, и клетки, которые прошли через Matrigel мембрану и мигрировали к нижней поверхности мембраны, были подсчитаны. Эти данные показали ингибирующий эффект галлата эпигаллокатехина и комбинации аскорбиновой кислоты, пролина и лизина на инвазию в Matrigel и миграцию НСТ 116 клеток рака прямой кишки человека.
Пример 3.
А 2058 (АТСС) клетки меланомы человека засевали на Matrigel вставку в усовершенствованной Matrigel инвазионной камере (BD). Кондиционированную среду нормальных фибробластов кожи человека (Clonetics) с добавлением различных агентов (как показано на Фиг.1) добавляли в ячейку. Камеру инкубировали в течение 24 часов, и клетки, которые прошли через Matrigel мембрану и мигрировали к нижней поверхности мембраны, были подсчитаны. Эти данные показали ингибирующий эффект галлата эпигаллокатехина и комбинации аскорбиновой кислоты, пролина и лизина на инвазию в Matrigel и миграцию А 2058 клеток меланомы человека.
Пример 4.
В этом эксперименте А 2058 (АТСС) клетки меланомы человека сеяли на Matrigel вставку в усовершенствованной Matrigel инвазионной камере (BD) в присутствии:
А: кондиционированной среды от Normal Human Dermal Fibroblast (Clonetics) и
В: той же среды с добавлением различных компонентов питания, как показано в пояснении к Фиг.4.
После 24 часов инкубации клетки, которые прошли через Matrigel мембрану и переместились к нижней поверхности мембраны, проверили под микроскопом и подсчитали.
Эти данные показывают апоптотический эффект галлата эпигаллокатехина и комбинации аскорбиновая кислота + пролин + лизин на А 2058.
А: Клетки меланомы человека в тканевой культуральной среде.
В: Клетки меланомы человека в тканевой культуральной среде, содержащей аскорбиновую кислоту (100 μM), пролин (140 μМ), лизин (400 μМ) и EGCG (20 (μг/мл). Замечание: клетки были разрушены.
Пример 5.
Исследование пролиферации раковых клеток
Клетки меланомы А 2058.
На фиг.5 показана способность 10, 20 и 50 μг/мл EGCG с добавлением и без добавления лизина, пролина и аскорбиновой кислоты влиять на пролиферацию меланомных клеток. Ни лизин, пролин и аскорбиновая кислота, ни EGCG при концентрации 10 и 20 μг/мл не оказывали значительного эффекта на пролиферацию клеток. Но при 50 μг/мл EGCG существенно уменьшал число клеток вплоть до 30%. Аналогичный эффект наблюдался с лизином, пролином и аскорбиновой кислотой.
Клетки рака молочной железы MDA-MB-231
В этих экспериментах основная среда дополнялась 0, 10, 20, 50, 100 или 200 μг/мл EGCG (Фиг.6). Результаты показывают, что дополнение основной среды 50, 100 или 200 μг/мл EGCG значительно уменьшало число клеток до 66,1±5,3, 33,6±2 и 29,6±0,8% в сравнении с контролем без дополнений соответственно. Концентрации EGCG в клеточной среде до 20 μг/мл не оказывали какого-либо существенного ингибирующего эффекта на пролиферацию клеток.
Изучались также воздействия аскорбиновой кислоты, лизина, пролина и различных концентраций RGCG на пролиферацию клеток рака. На фиг.7 показано незначительно уменьшение числа клеток до 86,1±1,93% за счет аскорбиновой кислоты, лизина и пролина. Добавление к этой комбинации 20, 50 и 100 μг EGCG существенно уменьшало число клеток до 74±5,8, 64,8±1,6 и 22±5% по сравнению с контрольной группой соответственно.
Клетки рака прямой кишки НСТ 116
Несмотря на то, что об ингибирующем эффекте аскорбиновой кислоты, пролина и лизина на пролиферацию клеток рака прямой кишки не объявлялось, комбинация аскорбиновой кислоты, пролина и лизина с 20 μг/мл EGCG существенно снижала число клеток до 69±0,5% (Фиг.8).
Более высокий уровень EGCG в этой комбинации (50 μг/мл) радикально снижал число клеток до 4,6±0,3%.
Антипролиферативная активность комбинаций питательных компонентов, используемых в этих опытах, была разной в зависимости от типа раковых клеток. Для клеток рака молочной железы комбинация аскорбиновой кислоты, пролина и лизина с TGCG показывала более высокие антипролиферативные эффекты, чем когда эти компоненты применялись по отдельности. Ожидалось, что для клеток меланомы и рака прямой кишки сочетание аскорбиновой кислоты, пролина, лизина не будет оказывать воздействия на пролиферацию этих клеток. Однако сочетание этих питательных компонентов с 20 μг/мл EGCG привело к значительному снижению количества клеток рака прямой кишки и не повлияло на клетки меланомы. По-видимому, клетки рака прямой кишки более чувствительны, чем клетки рака молочной железы и клетки меланомы в наименьшей степени к сочетанию аскорбиновой кислоты, пролина, лизина и EGCG. Пролиферация клеток рака прямой кишки была почти полностью снижена (4,6%) при использовании аскорбиновой кислоты, пролина и лизина вместе с 50 μг/мл EGCG.
Пример 6.
Зимографические исследования желатиназы
Влияние EGCG на клетки меланомы на основной среде с дополнениями аскорбиновой кислотой, пролином и лизином в отношении экспрессирования MMPs показано на фиг.9 с помощью зимографии желатиназы. Меланомным клеткам характерны две полосы, соответствующие ММР-2 и ММР-9. Сочетание аскорбиновой кислоты, лизина и пролина не влияет на экспрессию MMPs полос по сравнению с основной средой. Однако EGCG ингибирует экспрессию обеих ММР-2 и ММР-9 в зависимости от дозы. Интенсивность полос для основной среды и сочетания аскорбиновой кислоты, лизина и пролина была одинаковой.
Пример 7.
Исследования инвазии и миграции в экстрацеллюлярном матриксе
Исследовали ингибирующее действие сочетания аскорбиновой кислоты, пролина и лизина, используемых по отдельности и вместе с различными концентрациями EGCG. Изучалось влияние этих комбинаций на экстрацеллюлярный матрикс с использованием отформованных Matrigel матриц, используемых по известной методике для оценки инвазивного потенциала различных линий клеток рака.
Клетки рака молочной железы MDA-MB-231
На фиг.10 показаны результаты инвазии клеток рака молочной железы в Matrigel, инкубированных в присутствии аскорбиновой кислоты, пролина и лизина. Инвазия раковых клеток, проинкубированных в комбинации аскорбиновой кислоты, пролина и лизина уменьшилась до 48,1±22,1% по сравнению с клетками, проинкубированными в среде без добавок. В среде с добавлением только 20 μг/мл EGCG количество инвазирующих клеток снизилось до 69,5±27,4%. Полное ингибирование инвазии в матриксе у клеток рака молочной железы было достигнуто в присутствии более высоких концентрациях (50 (μг/мл и 100 μг/мл).
В другой серии опытов дополнение среды 10 μМ аскорбиновой кислоты снижало инвазию на 36%. Дополнение аскорбиновой кислотой и 140 μМ пролина дополнительно снижало инвазию на 47%. Использование 400 μМ лизина помимо аскорбиновой кислоты и пролина в качестве дополнения еще снижало инвазию на 67%; лизин показывает линейный ответ в увеличении эффектов аскорбиновой кислоты и пролина вплоть до уровня 800 μМ.
На фиг.10 показано, что комбинация аскорбиновой кислоты, пролина и лизина так же, как и 20 μг/мл EGCG эффективна в отношении полного прекращения инвазии раковых клеток сквозь экстрацелюлярный матрикс. Это сочетание делает возможным достижение максимума ингибиторного эффекта на инвазию раковых клеток без необходимости использовать высокие концентрации отдельных питательных компонентов. Аскорбиновая кислота, пролин и лизин вместе с EGCG сделали возможным полностью остановить матричную инвазию клеток рака молочной железы при более низком уровне EGCG (20 μг/мл).
Клетки рака прямой кишки НСТ 116
На фиг.11 показано, что сочетание аскорбиновой кислоты, пролина и лизина существенно снизило инвазию клеток рака прямой кишки до 67,2±3,7%. EGCG используемый сам по себе при 20 μг/мл, уменьшал инвазию до 44,9±3,3%, тогда как сочетание аскорбиновой кислоты, лизина и пролина и 20 μг/мл EGCG имело синергетический эффект, уменьшая инвазию клеток рака до 24,9±4,6%.
Клетки меланомы А 2058
На фиг.12 показано, что комбинация аскорбиновой кислоты, пролина и лизина была эффективной в уменьшении количества распространяющихся клеток до 88,2±4%, однако, это снижение статистически не существенно. Сочетание этих питательных компонентов при самое малое 20 μг/мл EGCG было эффективным в плане снижения распространяющегося количества клеток до нуля.
Эти результаты показывают, что использование аскорбиновой кислоты, пролина и лизина с EGCG позволяют достигнуть резкого снижения числа клеток, распространяющихся и мигрирующих через Matrigel мембрану при более низких уровнях EGCG. Инвазия снижалась до нуля при использовании такого же низкого уровня в 20 μл/мл EGCG вместе с аскорбиновой кислотой, пролином и лизином для клеток рака молочной железы и меланомы. Преимущества результатов этого сочетания не так эффектны для клеток рака прямой кишки, как для клеток рака молочной железы. Уровень содержания EGCG должен был быть 50 μг/мл, чтобы получить 90% уменьшение инвазии этих клеток. В этом исследовании не наблюдалось изменения в экспрессии MMPs у клеток меланомы, хотя EGCG оказывает ингибирующее воздействие на их экспрессию, в зависимости от дозы.
Эти серии опытов отчетливо демонстрируют, что заявляемый обладающий питательными свойствами фармацевтический состав, содержащий аскорбиновую кислоту, пролин, лизин и, по меньшей мере, одно полифенольное соединение, проявляет антипролиферативное и антиинвазивное свойства в отношении раковых клеток.
Пример 8.
Для приготовления питательных фармацевтических композиций приводятся следующие рецептуры компонентов (Таблицы 1-5) и EPICAN FORTE (Таблица 6). Установлено, что эти рецептуры, содержащие аскорбиновую кислоту, пролин, лизин и, по меньшей мере, одно полифенольное соединение, эффективны для блокирования инвазии раковых клеток и метастазирования раковых клеток.
Другие ингредиенты: Капсулы на основе растительного сырья (гидроксипропил-метилцеллюлоза), диоксид кремния, целлюлоза и стеарат магния.
Пример 9.
Влияние EPICAN FORTE™ на раковые клетки человека.
Изучалось влияние EPICAN FORTE™ на клетки рака человека. Были исследованы метастатические параметры, такие как экспрессия матричных металлопротеиназ (MMPs) с помощью желатиназной зимографии, инвазионный потенциал через Matrigel и пролиферация/рост с помощью МТТ-исследования. Подробные протоколы этих исследований приведены ниже. Использовали различные линии клеток рака: рак кожи - клетки меланомы 2058, рак печени - клетки HepG2, фибросаркома - клетки НТ 1080, рак прямой кишки - НСТ 116, рак молочной железы - ER+/-MCF-7 и рак молочной железы ER-/-MDA-MB-231.
В нижеследующих таблицах (Таблицы 7 и 8) показаны все результаты.
Влияние EPICAN FORTE™ на пролиферацию/рост клеточных линий рака человека
Влияние EPICAN FORTE™ на инвазию и миграцию в Matrigel клеток рака человека
Влияние EPICAN FORTETM на экспрессию матричных металлопротеиназ (MMPs) клеточными линиями рака человека:
Клетки меланомы: клетки меланомы дают 2 полосы на желатиназной зимограмме, соответствующие ММР-2 и ММР-9. EPICAN FORTE™ ингибировал экспрессию ММР-2 и ММР-9 в зависимости от дозы. Экспрессия ММР-2 и -9 существенно ингибировалась при концентрации 100 μг/мл EPICAN FORTE™ и не могла быть детектирована при концентрации 1000 μг/мл.
Клетки HepG2: Как и клетки меланомы, клетки HepG2 также показывали 2 полосы, соответствующие ММР-2 и ММР-9. EPICAN FORTETM ингибировал экспрессию ММР-2 и ММР-9 при концентрации 500 и 1000 μг/мл
Фибросаркома НТ-1080: Клетки НТ-1080 показывали 2 полосы: ММР-2 и ММР-9. EPICAN FORTETM также ингибировал экспрессию обеих полос в зависимости от дозы. Очень слабые полосы наблюдались при концентрациях 500 и 1000 μг/мл.
Рак прямой кишки НСТ 116: Клетки рака прямой кишки показали только одну полосу на зимограмме, соответствующую ММР-2, которая вообще исчезла при концентрации 100 μг/мл,
MCF-7 и MDA-MB-231: Эти клеточные линии рака не давали никаких полос MMPs при исследуемых нами концентрациях, которые были бы аналогичны (полосам) других клеточных линий рака.
Инвазия MDA-MB-231 через Matrigel ингибировалась на 50, 60 и 95% при концентрации EPICAN FORTETM 10, 50 и 100 μг/мл соответственно. EPICAN FORTETM не был токсичен для MDA-MB-231 при 10 μл/мл, показывал слабую токсичность при 100 μм. Однако он демонстрировал высокую токсичность при 1000 μг/мл. Ни ММР-2, ни ММР-9 не проявлялись на зимограмме. Для MCF-7 EPICAN FORTETM, напротив, оказался нетоксичным даже при 500 μг/мл и показывая слабую токсичность при 1000 μг/мл. MCF-7 были неинвазивными и не экспрессировали MMPs активности.
EPICAN FORTETM ингибирует экспрессию ММР-2 и ММР-9 в зависимости от дозы. Экспрессия ММР-2 и ММР-9 значительно ингибируется при концентрации 100 μг/мл EPICAN FORTETM и зримо не детектируется при 100 μг/мл. EPICAN FORTE, используемый при концентрациях 10 и 100 μг/мл, не существенно влияет на жизнеспособность клеток, а при 100 μг/мл обладает цитотоксичностью в интервале 10-40%, в зависимости от типа клеток. Инвазия меланомных клеток MDA-MB-231 и сокультуры меланомных клеток с NHDF через Matrigel была существенно ниже (в зависимости от концентрации). Инвазия НТ-1080 клеток через Matrigel ингибировалась на 10%, 50%, 70% и 100% при 10, 100, 200 и 1000 μг/мл соответственно. Интересно, что EPICAN FORTETM не токсичен по отношению к НТ-1080 клеткам при концентрации 100 μг/мл. Эти результаты показывают, что EPICAN FORTE очень эффективен для различных линий клеток рака, а также сокультур. Эти наблюдения позволяют установить, что EPICAN FORTETM может обеспечить терапевтическое средство природного происхождения, которое может рассматриваться как ценное и многообещающее лекарство для лечения рака человека.
Пример 10.
Влияние EPICAN FORTETM на линии клеток рака человека
Изучали воздействие EPICAN FORTE™ на нормальные клетки человека. Применяли условия и параметры, подобные тем, при которых исследовались линии клеток рака, а именно: зимография для MMPs экспрессии, инвазия через Matrigel и пролиферация/рост с помощью МТТ-анализа. Использовались несколько нормальных дермальных фибробластов человека (NHDF), включая человеческие хондроциты и человеческие стволовые клетки.
В нижеследующих таблицах (Таблицы 9, 10 и 11) показано влияние EPICAN FORTETM на пролиферацию/рост, распространение метастазов и продуцирование ММР в нормальных клетках человека:
Влияние EPICAH FORTETM на экспрессию матричных металлпротеиназ (MMPs) нормальными клетками человека проанализировано и в совокупности является следующим.
NHDF:NHDF показывали только одну полосу на зимограмме, соответствующую ММР-2, которая исчезала при концентрации EPICAH FORTE™ 1000 μг/мл.
Хондроциты: Хондроциты также показывали только одну полосу, соответствующую ММР-2. EPICAH FORTETM ингибировал экспрессию ММР-2 в зависимости от дозы. Экспрессия ММР-2 существенно ингибировалась при концентрации EPICAH FORTETM 100 μг/мл и вообще исчезала при концентрации EPICAH FORTETM 200 μг/мл.
Стволовые клетки: Стволовые клетки также показывали только одну полосу, соответствующую ММР-2. EPICAH FORTE™ ингибировал экспрессию ММР-2 в зависимости от дозы. Очень слабая полоса была видна при концентрациях 500 и 100 μг/мл, которая не была видна при концентрациях 200 и 500 μг/мл.
Подводя итоги, можно сказать, что EPICAH FORTETM ингибирует экспрессию ММР-2 в зависимости от дозы. Экспрессия ММР-2 существенно ингибируется при концентрации EPICAH FORTETM 100 μг/мл и практически не определяется при концентрации его 200 μг/мл. Кроме того, установлено также, что инвазия хондроцитов через Matrigel ингибируется на 50%, 85% и 95% при 10 μг/мл, 100 μг/мл и 200 μг/мл. При 500 μг/мл инвазия вообще прекращается (снижается до 0%).
EPICAH FORTE™ не токсичен для хондроцитов даже при концентрации 200 μг/мл. Фактически EPICAH FORTE™ оказывал влияние на пролиферацию клеток, 70% повышение клеточной пролиферации при 200 μг/мл, более чем 70% превышение по сравнению с контролем. Слабый токсический эффект проявлялся только при концентрации 500 μг/мл. Эти результаты показывают, что EPICAH FORTE эффективен в плане ингибирования экспрессии ММР-2 и что EPICAH FORTETM представляет собой новый противовоспалительный состав, содержащий питательные компоненты, отражающий естественную попытку ингибировать ММР и деградацию экстрацеллюлярного матрикса при остеоартрите и других родственных заболеваниях, включая прогрессирующую деградацию хрящей.
Несмотря на то, что только начали работать in vivo опытные линии Epican-Forte, поступили сообщения о двух случаях, подтверждающих действенность Epican-Forte как медикамента для лечения рака.
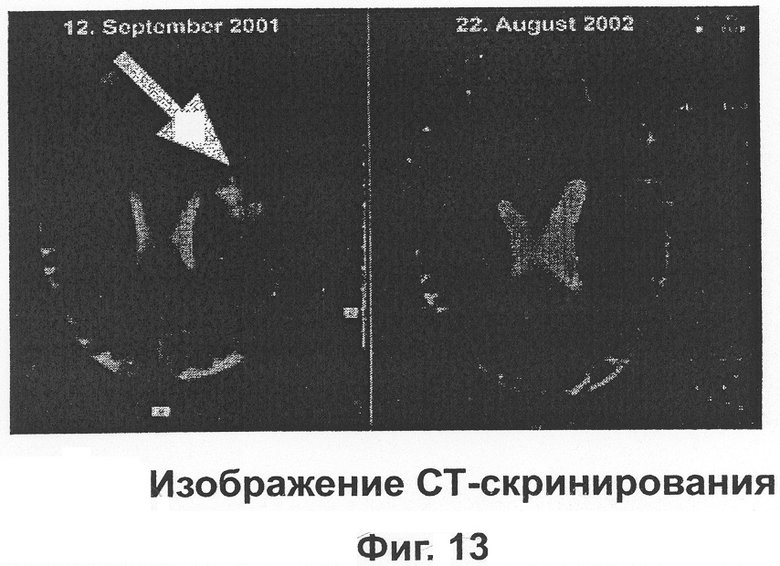
Женщина - пациент с диагнозом рак мозга безуспешно подвергалась химиотерапии и радиотерапии, в конце апреля 2002 года это лечение было прекращено. Как один из шансов она использовала возможность лечиться Epican-Forte в рекомендованных дозах. В конце августа 2002 года MRTS показал, что опухоль исчезла.
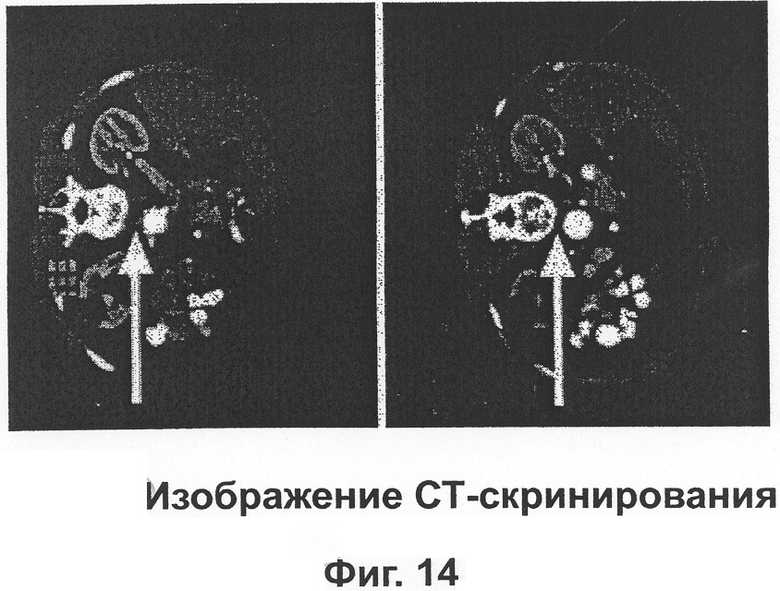
Пациенту - мужчине 64 лет, имеющему заметно повышенный уровень опухолевого маркера PSA в мае 2002 г. (59,9 μг/мл), был поставлен диагноз карцинома простаты с метастазами вдоль лимфатических сосудов аорты. Он начал лечение Epican-Forte в рекомендованных дозах. Тремя месяцами позже PSA уровень упал до 0,9 μг/л. СТ проверка в конце октября 2002 г. показала, что ранее видимые лимфатические метастазы (узлы) были не больше кажущихся, и его простата была нормальных размеров.
Были описаны некоторые варианты данного изобретения. Тем не менее понятно, что могут быть сделаны различные модификации без искажения идеи и объема изобретения.

Настоящее изобретение относится к химико-фармацевтической промышленности и касается фармацевтического состава и его применения при лечении рака. Более конкретно настоящее изобретение относится к содержащим полифенол фармацевтическим композициям, причем содержание полифенолов в них эффективно при лечении рака. Композиции по настоящему изобретению используются как средство профилактики и лечения рака, включающие аскорбиновую кислоту, лизин, пролин и, по меньшей мере, одно полифенольное соединение, выбранное из группы, состоящей из галлата эпигаллокатехина, галлата эпикатехина, эпигаллокатехина, эпикатехина и катехина. Технический результат - заявленные фармацевтические композиции на основе полифенола способны эффективно блокировать пролиферацию раковых клеток и метастазирование. 4 н. и 15 з.п. ф-лы, 14 ил., 10 табл.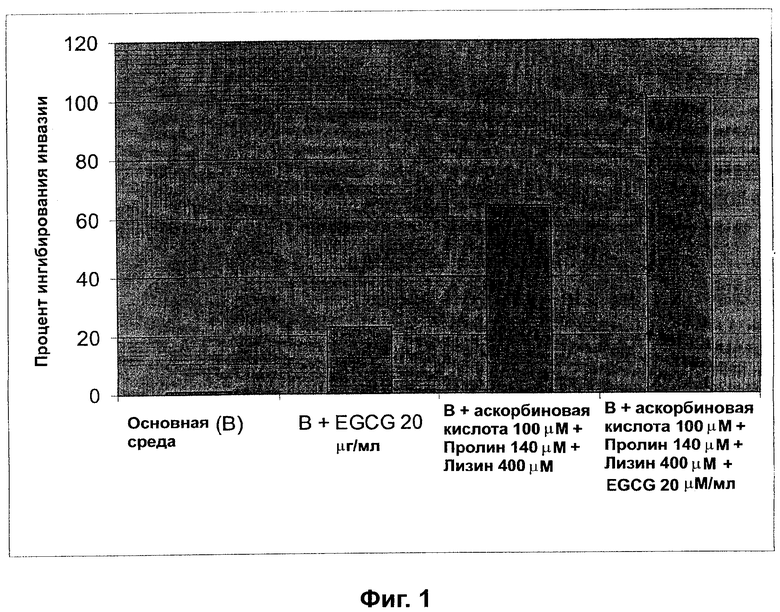
- аскорбиновую кислоту или ее фармацевтически приемлемое производное, выбранное из группы, состоящей из соли аскорбиновой кислоты, сложного эфира аскорбиновой кислоты и/или их смеси;
- фармацевтически приемлемое производное лизина;
- фармацевтически приемлемое производное пролина;
- фармацевтически приемлемое производное аргинина;
- N-ацетил-цистеин;
- по крайней мере, один микроэлемент, выбранный из группы, состоящей из селена, меди, магния, кальция и марганца; и
- по крайней мере, одно производное полифенола, выбранное из группы, состоящей из галлата эпигаллокатехина, галлата эпикатехина, эпигаллокатехина, эпикатехина и катехина.
| DE 4243363 A (KUEBLER ULRICH DR MED), 23.06.1994 | |||
| Приспособление для ускорения отпуска тормоза системы Вестингауза | 1940 |
|
SU57875A1 |
| DEMEULE M., BROSSARD M., PAGE M., GINGRAS D., BELIVEAU R., Matrix metalloproteinase inhibition by green tea catechins, Biochim Biophys Acta | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| AGARWAL R., Cell signaling and regulators of cell cycle as molecular targets for | |||
Авторы
Даты
2007-06-27—Публикация
2003-01-13—Подача