Область техники, к которой относится изобретение
Настоящее изобретение относится к системе нейтронозахватной терапии, в частности – к системе нейтронозахватной терапии, которая может удалить β- амилоидный белок.
Уровень техники
Болезнь Альцгеймера (Alzheimer’s disease, обычно сокращается до AD) – самый распространенный среди старых людей тип слабоумия. Ее основные гистопатологические проявления – старческие пятна, нейрофибриллярные клубки, а также вызванная апоптозом гибель локальных нервных клеток.
Имеются исследования, свидетельствующие о том, что аномальные отложения β-амилоидного белка (Amyloid β-protein, обычно сокращается до Aβ) являются одним из основных механизмов возникновения болезни Альцгеймера. β- амилоидный белок – это полученный вследствие белкового гидролиза белка- предшественник амилоида (APP) с выделением энзимов β и γ полипептид, содержащий в себе 39-43 аминокислот. В человеческом организме наиболее распространены полипептиды, содержащие 40 (Aβ1-40) или 42 (Aβ1-42) аминокислот. В том числе Aβ1-42 намного более токсичен, намного легче образует скопления, формирующие бляшки отложения β-амилоидного белка. Бляшки отложения β-амилоидного белка, сформировавшиеся вследствие отложений β-амилоидного белка, могут повлечь за собой токсичное действие. При нормальном физиологическом состоянии, β-амилоидный белок может быть измерен как в крови, так и в цереброспинальной жидкости. Поэтому можно сказать, что сам β-амилоидный белок не ведет к болезни Альцгеймера, однако отложения β-амилоидный белок являются одной из причин, ведущих к болезни Альцгеймера.
Имеются исследования, свидетельствующие о том, что у пациентов, страдающих болезнью Альцгеймера, в гиппокампе и мозговой коре накопляется большой объем бляшек отложения β-амилоидного белка. Кроме того, снижение объема скопления β-амилоидного белка в мозге может замедлить болезнь Альцгеймера или уменьшить ее симптомы.
β-амилоидный белок разлагается под воздействием множества пептидаз, таких как инсулиновый фермент разложения (IDE) и нейтральная эндопептидаза (NEP). Оба этих фермента являются цинкозависимыми эндопротеазами. Имеются исследования, свидетельствующие о том, что при условии существования IDE и NEP, β-амилоидный белок может очевидно уменьшаться. При условии же дефицита IDE и NEP, каким образом можно разрушить структуру β-амилоидного белка? Уменьшение накоплений β-амилоидного белка стало темой исследования патогенеза болезни Альцгеймера, и даже рассматривается как один из способов лечения болезни Альцгеймера. На сегодняшний день нет какого-то метода, могущего эффективно разрушить структуру β-амилоидного белка.
Краткое описание изобретения
В целях возможности разрушения структуры и удаления β-амилоидного белка, данное изобретение с одной стороны предоставляет систему нейтронозахватной терапии, применяемую для удаления β-амилоидного белка. Она включает в себя: установку нейтронозахватной терапии, а также химическое соединение для специфического связывания β-амилоидного белка, причем соединение содержит нуклиды с крупным сечением захвата тепловых нейтронов;
Полученная от воздействия произведенного упомянутой установкой нейтронозахватной терапии пучка нейтронов на содержащийся в упомянутом выше химическом соединении нуклид энергия разрушает структуру β-амилоидного белка, благодаря чему и осуществляется цель удаления этих патогенных белков.
В реальном применении, выработанный упомянутой установкой нейтронозахватной терапии луч представляет собой смешанный луч, который включает нейтронные лучи, гамма-лучи и другие лучи радиации. Затем, при использования упомянутого луча в процессе удаления β-амилоидного белка задействуется в основном пучок нейтронов в составе смешанного луча.
Нуклиды с крупным сечением захвата тепловых нейтронов содержат, но не ограничиваются 10B, 155Gd или 157Gd. При этом под упомянутыми нуклидами с крупным сечением захвата тепловых нейтронов при условии облучения тепловыми нейтронами с одинаковой энергией подразумеваются нуклиды с сечением захвата тепловых нейтронов больше или равным стократному сечению захвата нейтронов у основных составных элементов человеческого тела (C, H, O, N, P и S). При этом при облучении тепловыми нейтронами с одинаковой энергией наибольшее сечение захвата нейтронов у основного составного элемента тела H, при условии энергии тепловых нейтронов 0.025eV, сечение захвата нейтронов у H составляет 0,2 барн. У 10B сечение захвата тепловых нейтронов составляет 3800 барн, у 155Gd сечение захвата тепловых нейтронов составляет 60700 барн, а у 157Gd сечение захвата тепловых нейтронов составляет 254000 барн. Во всех случаях при облучении тепловыми нейтронами одинаковой энергии сечение захвата тепловых нейтронов более чем в сто раз превышает таковое у элемента H.
Подобный нуклид с большим сечением для задержания тепловых нейтронов может вступать в ядерную реакцию с тепловыми нейтронами, высвобождая как минимум один луч убойной силы. Дистанция излучения данного луча коротка, в основном он лишь может разрушить структуру β-амилоидного белка, с которым упомянутые выше химические соединения специфически связываются, не разрушая при этом другие нормальные ткани с наименьшим для последних риском.
Приоритетным является то, что в системе нейтронозахватной терапии для удаления β-амилоидного белка упомянутые нуклиды с крупным сечением захвата тепловых нейтронов – это 10B, 155Gd или 157Gd.
Нуклид 10B, имеющий крупное сечение захвата тепловых нейтронов, при облучении нейтронным лучом проходит следующие реакции:

Формула реакции I
Использование химического соединения с содержанием бора (10B) по отношению к тепловым нейтронам обладает особенностью сечения высокого захвата. Используются две тяжелые частицы 4He и 7Li, образованные вследствие захвата нейтронов 10B(n,α)7Li и реакции расщепления. Как показывает формула реакции I, средняя энергия двух заряженных частиц составляет примерно 2.33МэВ, имеются такие отличительные черты как высокая линейная передача энергии (LinearEnergyTransfer, LET) и узкий диапазон. Линейная передача энергии и диапазон излучения α-частиц по отдельности составляют 150 кЭв/мкм 8 мкм, а у тяжелой частицы 7Li – 175 кэВ/мкм и 5 мкм. Общий диапазон излучения обеих частиц соответствует размерам одной клетки, поэтому вред от облучения организма можно локализовать на клеточном уровне. Когда борсодержащее химическое соединение специфически связывается с β-амилоидным белком, подходящий для этого источник нейтронного излучения тем более может достичь цели локального разрушения структуры β-амилоидного белка при условии не нанесения особого вреда нормальным тканям.
В упомянутой системе нейтронозахватной терапии для удаления β-амилоидного белка предпочтительным является то, что упомянутая установка нейтронозахватной терапии включает в себя источник нейтронов, блок формирования пучка и коллиматор. При этом упомянутый источник нейтронов применяется для генерации пучка нейтронов. Упомянутый блок формирования пучка находится в задней части упомянутого источника нейтронов и смещает быстрые нейтроны в пучках нейтронов с широким энергетическим спектром, образованным из упомянутого источника нейтронов, до надтепловых или тепловых нейтронов. В обычной ситуации, быстрые нейтроны определяются как нейтроны с энергетической зоной более 40 кЭв, надтепловые нейтроны – с энергетической зоной между 0.5 эВ и 40 кЭв, а тепловые нейтроны – с энергетической зоной менее 0.5 кЭв. Упомянутый коллиматор находится в задней части блока формирования пучка и применяется для сведения упомянутых надтепловых или тепловых нейтронов для большей целенаправленности терапии. По отношению к бляшкам отложения β-амилоидного белка различных размеров используется коллиматор с подходящим диаметром отверстия.
Приоритетным является то, что в упомянутой системе нейтронозахватной терапии для удаления β-амилоидного белка упомянутый источник нейтронов включает в себя источник нейтронов на основе ускорителя или источник нейтронов на основе реактора.
При этом, упомянутый источник нейтронов ускорителя посредством ускорения заряженных частиц (например, пучка протонов) бомбардирует соответствующую ядерную мишень (например, литиевую или бериллиевую мишень). В результате ядерной реакции образуются нейтроны, в самых распространенных ядерных реакциях имеются (d, n), (p, n) и (γ, n).
Упомянутый источник нейтронов реактора – это использование большого количества нейтронов, полученных вследствие расщепления в реакторе атомного ядра. Такой источник нейтронов является самым мощным источником тепловых нейтронов. На стенках реактор раскрываются отверстия, можно вывести нейтроны, и полученная энергия нейтронов является непрерывно распределенной, очень приближенной к распределению Максвелла. С помощью применения определенных мер можно получить пучки нейтронов с различной энергией.
Приоритетным является то, что в упомянутой системе нейтронозахватной терапии для удаления β-амилоидного белка упомянутый блок формирования пучка включает в себя рефлектор и замедлитель. При этом упомянутый рефлектор окружает упомянутый замедлитель и применяется для отражения рассеянных вне блока формирования пучка нейтронов обратно в упомянутый замедлитель. Упомянутый замедлитель применяется для замедления скорости быстрых нейтронов до надтепловых или тепловых нейтронов. При этом рефлектор создан как минимум из одного элемента Pb или Ni; материалом для замедлителя может служить один элемент из Al2O3. BaF2. CaF2. CF2. PbF2. PbF4 и D2O или сочетание нескольких элементов. Также можно в состав вышеупомянутого материала для замедлителя добавить литийсодержащее вещество, например, LiF или Li2CO3 с содержанием 6Li.
При этом, упомянутый блок формирования пучка также включает в себя абсорбер тепловых нейтронов и экран излучения. В том числе, абсорбер тепловых нейтронов составлен из 6Li, а экран излучения включает в себя в себя созданный из Pb фотонный экран и созданный из PE нейтронный экран.
Смежный с замедлителем абсорбер тепловых нейтронов применяется для абсорбции тепловых нейтронов во избежание создания чрезмерной дозы облучения во время лечения на мелком уровне нормальных тканей; экран излучения включает в себя созданный из Pb фотонный экран и созданный из PE нейтронный экран. Применяется для экранирования пропущенных нейтронов или фотонов дабы снизить дозу облучения на нормальные ткани вне зоны облучения. При этом фотонный экран может быть интегрирован в один блок с рефлектором, а нейтронный экран может быть установлен в месте неподалеку от отверстия выхода луча блока формирования пучка.
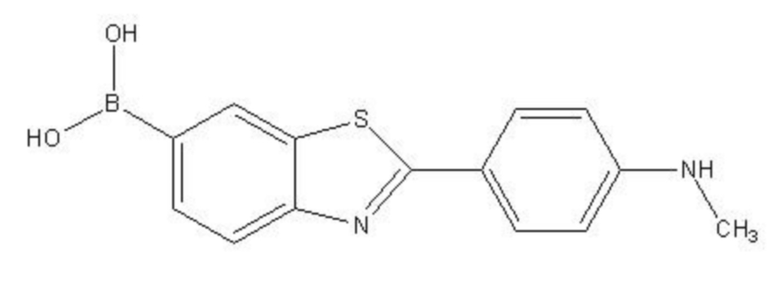
Приоритетным является то, что в упомянуто системе нейтронозахватной терапии для удаления β-амилоидного белка, упомянутое химическое соединение для специфического связывания с β-амилоидным белком, обладает структурной формулой I:

Структурная формула I
Показанное в структурной формуле I химическое соединение является 2-(4- метиламинофенил)-6-дигидроксиборилбензотиазолом. При этом B в составе группы B(OH)2 в упомянутом выше химическом соединении – 10B; Степень распространенности нуклида 10B в природных условиях составляет 19.2%, при практическом применении упомянутые выше химические соединения в процессе удаления β-амилоидного белка, элемент бора в составе группы B(OH)2 в упомянутом 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазоле может быть как 10B, так и 11B. При этом содержание химического соединения, содержащего элемент 10B, определяется в соответствии с реальной необходимостью.
C в составе метиламина в 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазоле может быть 12C или 11C. 2-(4-метиламинофенил)- 6-дигидроксиборилбензотиазол с 11C помимо возможности применения в система нейтронозахватной терапии для удаления β-амилоидного белка, также может определять местоположение β-амилоидного белка в мозговой области, и использоваться в качестве проявителя для снимков PET.
Показанное в структурной формуле I химическое соединение в упомянутой системе нейтронозахватной терапии для удаления β-амилоидного белка играет роль посредника. 10B в составе показанного в структурной формуле I химического соединения в системе нейтронозахватной терапии может захватить нейтроны, излучаемые упомянутой установкой нейтронозахватной терапии, при этом вследствие ядерной реакции выделяется энергия. Данная энергия может разрушить структуру β-амилоидного белка, с которым показанное в структурной формуле I химическое соединение вступает в специфическое сочетания. От этого снижается содержание β-амилоидного белка. Так как показанное в структурной формуле I химическое соединение находится в специфическом сочетании с β-амилоидным белком, а также 10B в химическом соединении может захватывать тепловые нейтроны, то вследствие этого упомянутая система нейтронозахватной терапии во время удаления β-амилоидного белка обладает высокой эффективностью и целенаправленностью.
При этом, показанное в структурной формуле I химическое соединение в системе нейтронозахватной терапии для удаления β-амилоидного белка получено из соединения структурной формулы II:
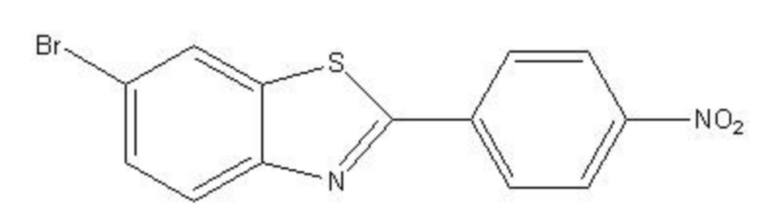
Структурная формула II
Предпочтительно, способ получения показанного в структурной формуле I химического соединения из соединения структурной формулы II включает стадии:
восстановления соединения формулы II с получением 6-бромо-2-(4-аминофенил)-бензотиазола;
получения 6-бромо-2-(4-метиламинофенил)-бензотиазола реакцией формальдегида и 6-бромо-2-(4-аминофенил)-бензотиазола;
получения 2-(4-метиламинофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензотиазола реакцией бис(пинаколато)диборона и 6-бромо-2-(4-метиламинофенил)-бензотиазола; при этом бор в упомянутом биспинаколатодибороне – 10B; и
окисления 2-(4-метиламинофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензотиазола под действием окислителя с получением 2-(4-метиламинобензол)-6-дигидроксиборилбензотиазола формулы I; при этом в качестве окислителя можно выбрать метапериодат натрия, или другой окислитель типа метапериодата натрия.
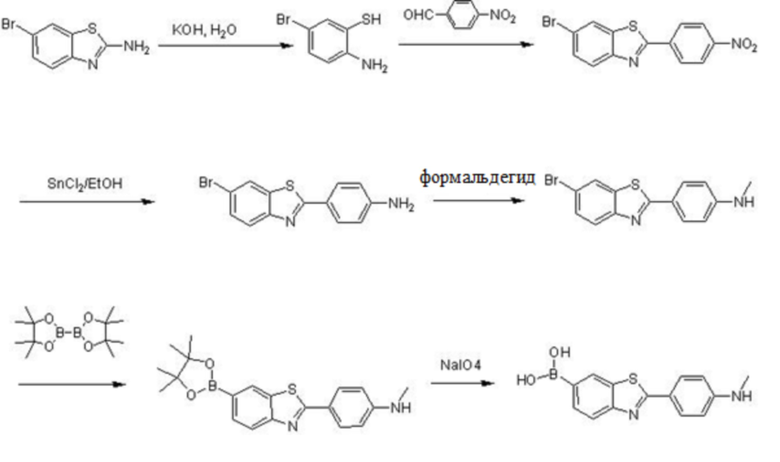
Показанное в структурной формуле I химическое соединение может также быть получено из соединения структурной формулы II согласно следующим стадиям:
получения 2-(4-нитрофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензотиазола реакцией соединения формулы II и бис(пинаколато)дибороном;
получения 2-(4-нитрофенил)-6-дигидроксиборилбензотиазол окислением 2-(4-нитрофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензотиазола под действием окислителя;
получения 2-(4-аминофенил)-6-дигидроксиборилбензотиазола восстановлением 2-(4-нитрофенил)-6-дигидроксиборилбензотиазола под действием восстановителя; и
получения 2-(метиламинофенил)-6-дигидроксиборилбензотиазола формулы I взаимодействием при высокой температуре 2-(4-аминофенил)-6- дигидроксиборилбензотиазола, иодметана и трифторметансульфоната серебра; при этом в качестве упомянутого окислителя предпочтительно выбирается метапериодат натрия.
В указанных выше двух этапах синтеза 2-(4-метиламинофенил)- 6- дигидроксиборилбензотиазола, источник 10B показанного в структурной формуле I химического соединения заключается в 10B используемого реагента биспинаколатодиборона. Как и упомянуто выше, содержание 10B может регулироваться в зависимости от необходимости.
Помимо этого, C в составе иодметана может быть 12C или 11C. Когда C в составе иодметана является 11C, упомянутый 2-(4-метиламинофенил)- 6- дигидроксиборилбензотиазол является радиоактивным химическим соединением, маркированным элементом 11C. Данное химическое соединение, помимо применения в системе нейтронозахватной терапии для удаления β-амилоидного белка, также может выступать в качестве проявителя снимков PET и применяться для фиксирования и отслеживания положения β-амилоидного белка в мозговой области.
Когда C в составе метиламина в показанном в структурной формуле I химическом соединением – это 11C, так как показанное в структурной формуле I химическое соединение обладает характером специфического связывания β-амилоидного белка, то после маркировки показанного в структурной формуле I химического соединения с помощью 11C может быть использована в излучении, связанном с компьютерной томографией с помощью эмиссии позитронов (Positron Emission Computed Tomography, сокращенно PET) в целях отслеживания скопления β-амилоидного белка в местах мозговой области, а также диагностики AD. Необходимо пояснить что даже при маркировании с помощью 11C показанного в структурной формуле I химического соединения, упомянутое выше химическое соединение все также специфически связывает β-амилоидный белок, а также упомянутое выше химическое соединение по-прежнему содержит в себе нуклиды с крупным сечением захвата тепловых нейтронов 10B. Поэтому маркированное с помощью 11C показанное в структурной формуле I химическое соединение по-прежнему обладает функцией удаления β-амилоидного белка в упомянутой системе нейтронозахватной терапии.
Упомянутое в данном изобретении химическое соединение для специфического связывания с β-амилоидным белком не ограничивается показанным в структурной формуле I химическим соединением. Другие соединения, обладающие нуклидами с большим сечением для задержания тепловых нейтронов, а также химические соединения, могущие специфически связывать β- амилоидный белок, находятся в области защиты данного изобретения. Например, как известно техническому персоналу данной области знания, AV-45 тоже может специфически связывать β- амилоидный белок. При замене некоторых элементов или функциональных групп данного химического соединения на группы с содержанием 10B, характер его специфического связывания с β-амилоидным белком не изменяется, а его излучение пучка нейтронов также может разрушить структуру β-амилоидного белка.
Данное изобретение с одной стороны предоставляет систему нейтронозахватной терапии, используемую в установке нейтронозахватной терапии для удаления β- амилоидного белка. Полезные результаты данной системы – целенаправленность и эффективное удаление β-амилоидного белка. С другой стороны, данное изобретение также специально для связанного с патогенезом болезни Альцгеймера β-амилоидным белком предоставляет химическое соединение, специфически связывающее β-амилоидный белок.
Краткое описание графических материалов
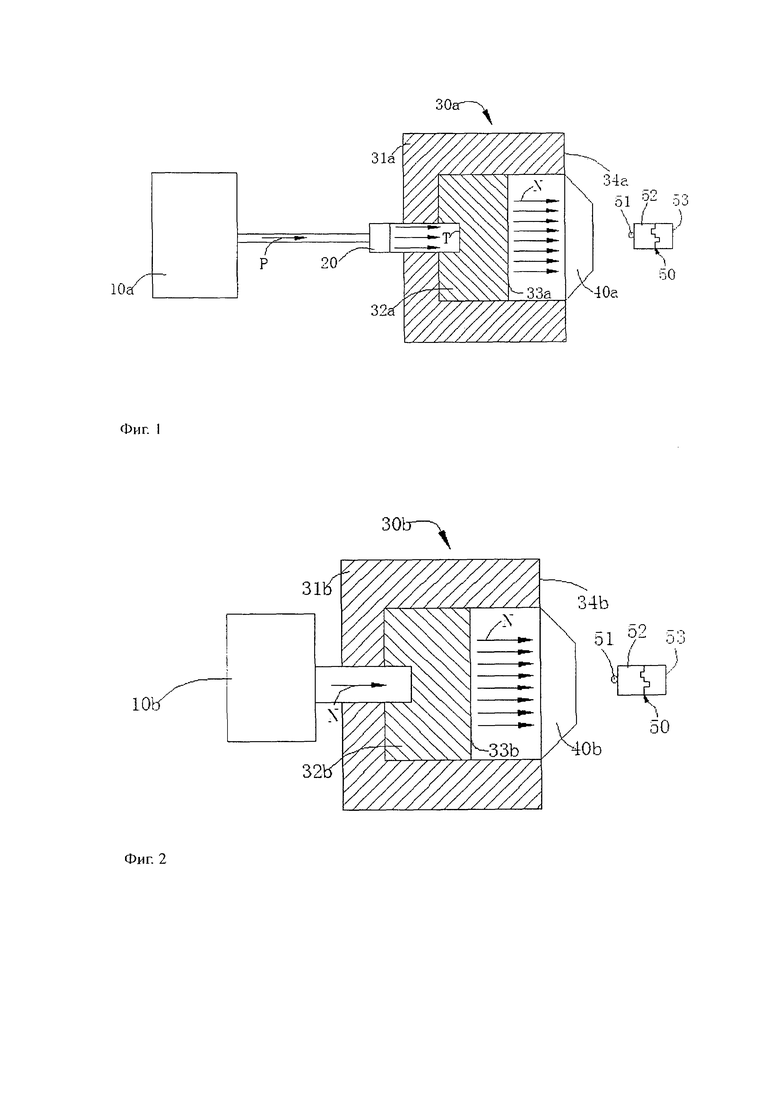
На фиг. 1 представлена плоскостная схема системы нейтронозахватной терапии источника нейтронов ускорителя;
На фиг. 2 представлена плоскостная схема системы нейтронозахватной терапии источника нейтронов реактора;
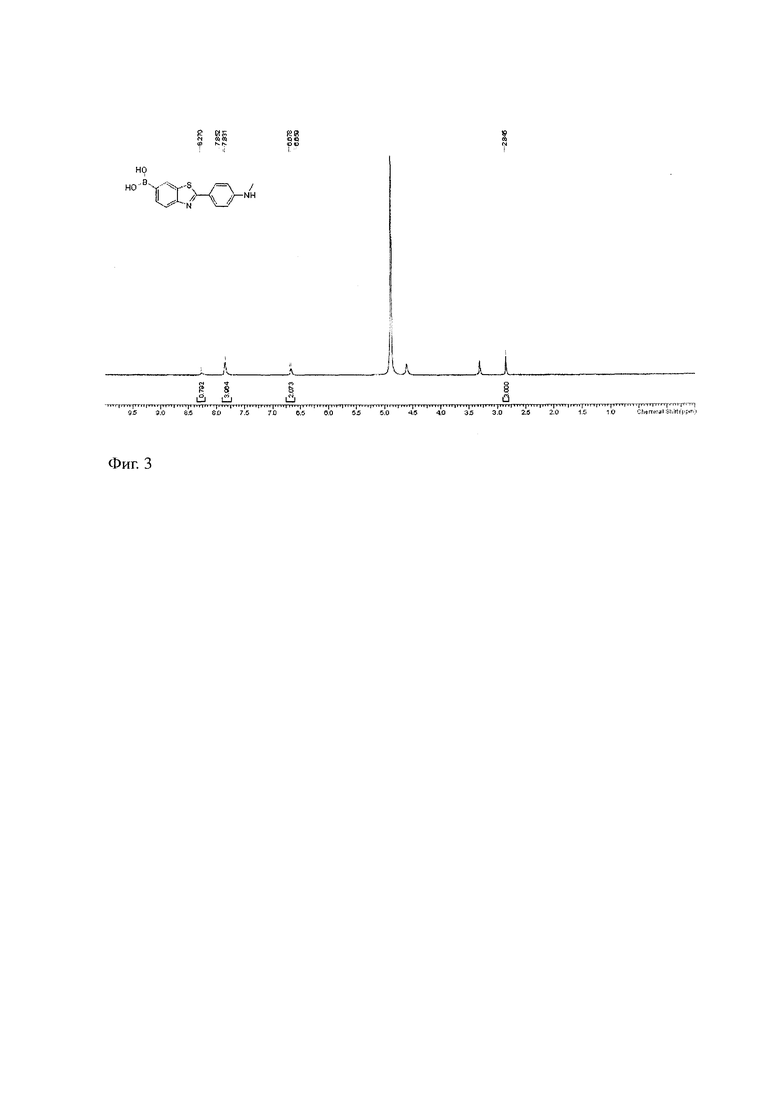
На фиг. 3 представлено изображение 1H ЯМР химического соединения, специфически связывающего β-амилоидный белок. (2-(4-метиламинофенил)-6-дигидроксиборилбензотиазол);
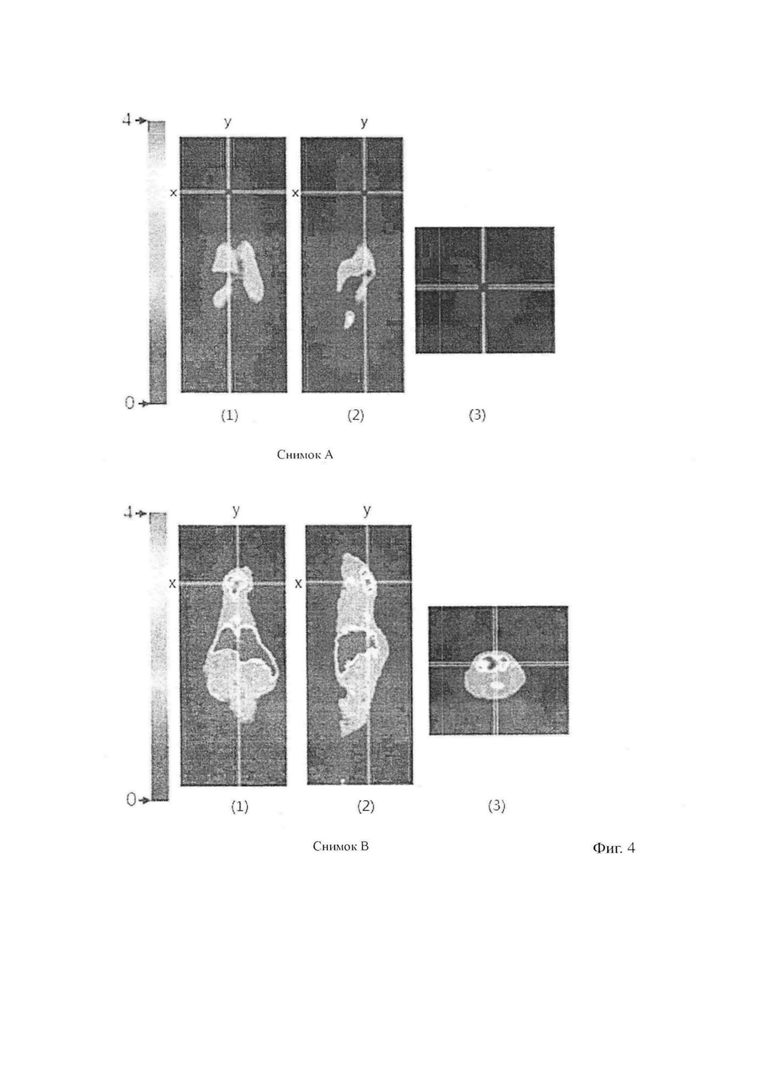
На фиг. 4 представлен снимок PET мозговой области контрольной мыши и мышиной модели SAMP8 после 30 минут вливания по отдельности 2-(4- метиламинофенил)-6-дигидроксиборилбензотиазола с 11C на изображениях A и B;
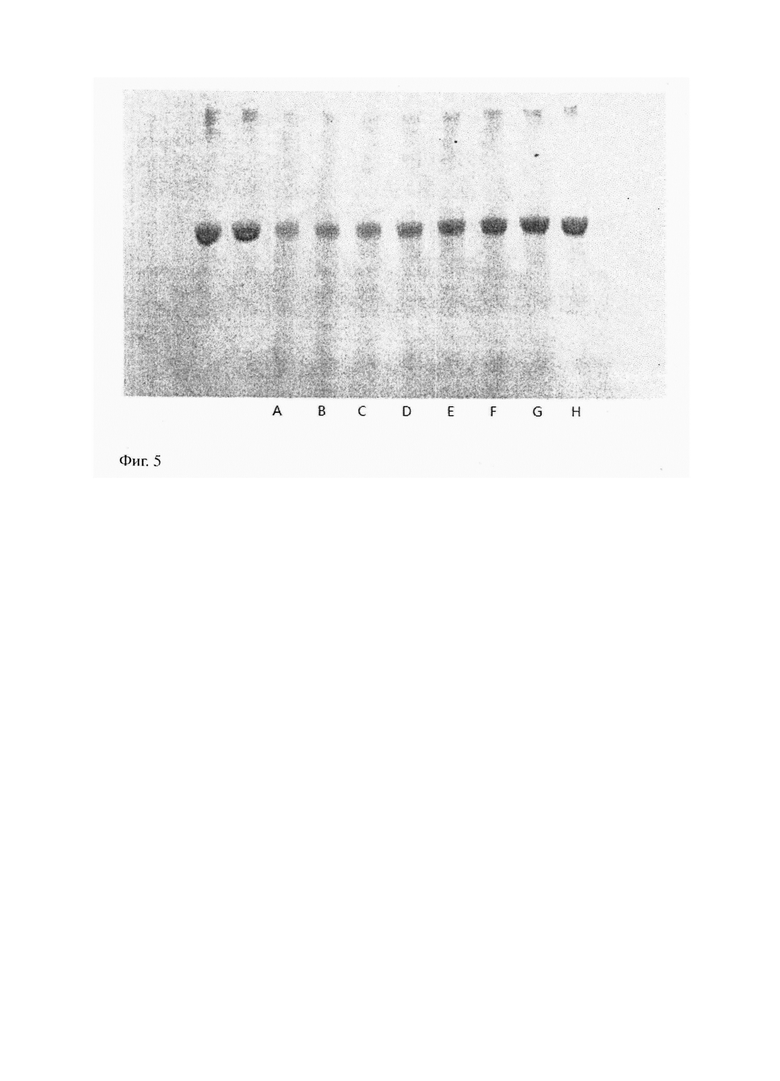
На фиг. 5 представлена SDS-PAGE электрофореграмма после радиационное облучение разными агентами BSA со степенью концентрации 0.18M в среде H310BO3.
Подробное описание изобретения
Приложенная внизу комбинированная схема производит дальнейшее подробное разъяснение к данному изобретению для того, чтобы обладающий мастерством в данной области технический персонал, сверяясь с текстом инструкции, мог предпринимать действия по приведенным данным.
Следует понимать, что все используемые в данном тексте термины вроде “обладает”, “содержит в себе”, а также “включает в себя” никоим образом не исключают наличие или добавление одного или нескольких других составляющих или их соединений.
Энергетическая зона упомянутых в данном тексте быстрых нейтронов более 40 кЭв, энергетическая зона надтепловых нейтронов – между 0.5 эВ и 40 кЭв, а энергетическая зона тепловых нейтронов – менее 0.5 кЭв.
Вариант осуществления данного изобретения показывает возможность в целях целенаправленного удаления β-амилоидного белка или снижения содержание β- амилоидного белка предоставление системы нейтронозахватной терапии. Данная система включает в себя установку нейтронозахватной терапиии химические соединения, могущие связывать β-амилоидный белок. Данное химическое соединение содержит в себе нуклиды с крупным сечением захвата тепловых нейтронов, наиболее распространенные нуклиды имеют 10B, 155Gd и 157Gd. При излучении тепловых нейтронов упомянутой установки нейтронозахватной терапии на нуклиды с крупным сечением захвата тепловых нейтронов влечет за собой ядерную реакцию, и энергия, высвобожденная вследствие этого, разрушает структуру β- амилоидного белка.
Как представлено на фиг. 1 или фиг.2: упомянутая установка нейтронозахватной терапии включает в себя источник нейтронов, блок формирования пучка и коллиматор. При этом блок формирования пучка включает в себя рефлектор, замедлитель, абсорбер тепловых нейтронов и установку экрана излучения. В том числе источник нейтронов включает в себя источник нейтронов ускорителя и источник нейтронов реактора.
В реальном применении системы нейтронозахватной терапии в процессе удаления β-амилоидного белка, в обычной ситуации необходимо внутри блока формирования пучка установки нейтронозахватной терапии отрегулировать быстрые нейтроны поля смешанных излучений до надтепловых нейтронов, а также снизить содержание других вредных лучей поля смешанных излучений. Хотя нуклиды химического соединения, специфически связывающего β-амилоидный белок, – это нуклиды с крупным сечением захвата тепловых нейтронов, но учитывая то, что пучок нейтронов из коллиматора установки нейтронозахватной терапии в процессе достижения химического соединения, специфически связывающего β-амилоидный белок, энергия пучка нейтронов может в определенной степени ослабеть вслед за увеличением энергии химического вещества. При этом пучок нейтронов в процессе достижения химического соединения, специфически связывающего β-амилоидный белок, часто может производить замедление скорости других веществ в неоднородной степени по отношению к энергии нейтронов. Поэтому в целях обеспечения достижения химическим соединением, специфически связывающим β-амилоидный белок, энергии и интенсивности нейтронов, в обычной ситуации необходимо замедлить быстрые нейтроны внутри блока формирования пучка до надтепловых нейтронов и повысить содержание надтепловых нейтронов в вышедшем из коллиматора пучке нейтронов.
Пожалуйста, еще раз обратитесь к фиг. 1. Установка нейтронозахватной терапии в системе нейтронозахватной терапии – это установка нейтронозахватной терапии источника нейтронов в ускорителе. При этом источник нейтронов в ускорителе 10b посредством лучерасширительного устройства расширяет площадь поперечного сечения протонного пучка P, отчего упомянутый протонный пучок P достигает материала мишени T и производит нейтроны. Принцип действия данной реакции таков: протоны, дейтроны и другие заряженные частицы ускоряются ускорителем до энергии, достаточной для сопротивления кулоновскому отталкиванию атомного ядра мишени. В результате ядерной реакции с металлической мишенью образуется дочернее ядро и протоны. При этом как правило материалом металлической мишени служат литий и бериллий. Как правило данным методом образуется поле смешанных излучений. Во время использования данной установки нейтронозахватной терапии к β-амилоидному белку 53, необходимо по возможности снизить лучи других типов, чтобы замедлитель 32a в блоке формирования пучка 30a обладал действием регулирования энергии в упомянутом поле смешанных излучений. Рефлектор 31a отражает обратно рассеянное в других направлениях поле смешанных излучений, чтобы снизить потери нейтронов. Блок формирования пучка 30a также может включать в себя абсорбер тепловых нейтронов 33a, который может абсорбировать тепловые нейтроны с низким уровнем энергии. На внешней чести упомянутого блока формирования пучка 30a имеется однослойная установка экрана излучения 34a, позволяющая избежать утечки излучения и нанесения вреда находящимся вблизи людям. В задней части блока формирования пучка 30a установлен коллиматор 40a. Отрегулированный в блоке формирования пучка 30a луч снова проходит коллиматор 40a для сбора, а также для еще более точного облучения химического соединения 52, содержащего нуклиды с крупным сечением захвата тепловых нейтронов 51, и способного специфически связать патогенный белок 53. Это дополняет использование пучка надтепловых нейтронов.
Пожалуйста, еще раз обратитесь к фиг. 2. Установка нейтронозахватной терапии в системе нейтронозахватной терапии – это установка нейтронозахватной терапии источника нейтронов в реакторе. При этом источник нейтронов реактора 10b передает по трубопроводу проведенный пучок нейтронов на блок формирования пучка 30b. Источник нейтронов реактора 10b и источник нейтронов ускорителя 10a в одинаковой степени производят поле смешанных излучений. Быстрые нейтроны с достаточно высокой энергией в поле смешанных излучений проходят замедлитель 32b в блоке формирования пучка 30b, где замедляются до нейтронов, могущих разрушить конструкцию β- амилоидного белка. Лучи, рассеянные в других направлениях отражаются в рефлекторе 31b и возвращаются в замедлитель 32b для повышения коэффициента использования лучей. Абсорбер тепловых нейтронов 33b в блоке формирования пучка может поглотить тепловые нейтроны с низкой энергией поля смешанных излучений, чтобы еще более увеличить содержание надтепловых нейтронов в пучке нейтронов N. Упомянутый пучок нейтронов N благодаря сбору и формированию в коллиматоре 40b может использоваться для еще более точного облучения химического соединения 52, содержащего нуклиды с крупным сечением захвата тепловых нейтронов 51, и способного специфически связывать патогенный белок 53. Это дополняет использование пучка надтепловых нейтронов.
Показанная на фиг. 1 и фиг. 2 система нейтронозахватной терапии также включает в себя химическое соединение 52, специфически связывающее β-амилоидный белок 53. Данное химическое соединение 52 также включает в себя нуклиды с крупным сечением захвата тепловых нейтронов 51, упомянутое выше химическое соединение 52 в процессе удаления системой нейтронозахватной терапии β-амилоидного белка играет роль посредника. Сначала упомянутое выше химическое соединение 52 в соответствии с характером специфического связывания β-амилоидного белка 53 может распознать β-амилоидный белок и связаться с ним, отчего происходит привязка нуклидов с крупным сечением захвата тепловых нейтронов (10B) 51 и β-амилоидного белка 53, что способствует в данном комплексном веществе 50 при облучении тепловыми нейтронами произведению энергии от реакции тепловых нейтронов с 10B, которая разрушает β-амилоидный белок 53.
Далее на примерах осуществления приводятся дальнейшие разъяснения технического проекта данного изобретения.
Под упомянутым химическим соединением, специфически увязывающемся с β- амилоидным белком, отобранным для примера осуществления данного изобретения подразумевается 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазол. При этом элемент бора в данном химическом соединении – 10B. Также в данном химическом соединении может содержаться радиоактивный элемент 11C. Если не было сделано особых пояснений, то содержание элемента бора в упомянутом борном химическом соединении примера осуществления данного изобретения – 10B.
Вариант осуществления 1
Метод подготовки Метод подготовки химического соединения, специфически увязывающегося с β-амилоидным белком
Показанное в структурной формуле I химическое соединение 2-(4- метиламинофенил)-6-дигидроксиборилбензотиазол может проходить следующие этапы подготовки:

Структурная формула I
1 г 2-(4-нитрофенил)-6-бромобензотиазола растворить в 10 мл этанола, затем добавить 5.39 г SnCl2·2H2O. В данной реакционной системе при 100℃ после 1 часа помешивания образуется 2-(4-аминофенил)-6-бромобензотиазол;
1H ЯМР: 400 МГц DMSO
δ 8.29 (s, 1H), 7.80-7.82 (d, J = 8.8Hz, 1H), 7.74-7.76 (d,J = 8.8Hz, 2H), 7.58-7.60 (m, 1H), 6.65-6.67 (d, J = 8.4Hz, 2H), 5.95 (s,2H).
В 1 г 2-(4-аминофенил)-6-бромобензотиазола добавить 16.4 ммоль формальдегида, затем туда же добавить 10 мл тетрагидрофурана (THF) и 20 мл метанола. После этого единократно добавить 0.886 г натрий метилата для составления реакционного раствора. Упомянутый реакционный раствор при 65℃ в течение 12 часов подвергать реакции смешивания, затем остудить реакционный раствор до 25℃, добавить 620.41 мг борогидрита натрия (NaBH4). Затем повысить температуру реакции до 65℃, и после часа реакции смешения образуется 2-(4- метиламинофенил)-6-бромобензотиазол;
1H ЯМР: 400 МГц CDCl3
δ 7.97 (s, 1H), 7.89-7.91 (d, J = 8.8Hz, 2H), 7.81-7.83 (d, J = 8.8Hz, 1H), 7.52-7.54 (m,1H), 6.64-6.66 (d, J = 8.8Hz, 2H), 2.93 (s, 3H).
Из 100 мг 2-(4-метиламинофенил)-6-бромобензотиазола, 95.46 мг биспинаколатодиборона и 92.23 мг ацетата калия составить реакционную систему, добавить в нее 4 мл THF и 2 мл диметилсульфоксида (DMSO). В условиях азотозаполнения при 20℃ добавить 26.39 мг дихлорида (трифенилфосфин) палладия (Pd(PPh3)2Cl2). На 12 часе реакции смешивания при 90℃ образуется 2-(4-метиламинофенил)- 6-пинаколатодиборонобензотиазол, при этом содержание бора в биспинаколатодибороне – 10B;
В 300 мг 2-(4-метиламинофенил)-6-пинаколатодиборонобензотиазола добавить 20 мл THF и 10 мл воды, затем добавить 875.93 мг метапериодата натрия (NaIO4) для составления реакционной системы, В упомянутой реакционной системе на 12 часу реакции смешивания при 25℃ образуется показанное в структурной формуле I химическое соединение: 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазол. Спектры сканирования 1H ЯМР данного химического соединения показаны на рис. 3.
1H ЯМР: 400 МГц MeOH
δ 8.27 (s, 1H), 7.83-7.85 (m, 4H), 6.66-6.68 (d,J = 7.6 Hz, 2H), 2.85 (s, 3H).
При этом, 2-(4-нитрофенил)-6-бромобензотиазол может пройти следующие этапы подготовки:
В 25 мл калиевого щелока с концентрацией 10 M добавить 5 г 2-амино-6-бромин- бензотиазола, затем добавить 5 мл этиленгликоля для составления смешанного раствора. В результате реакции смешивания упомянутого реактивного раствора при 125℃ в течение 2 часов образуется 2-амино-5-бромотиофенол;
1H ЯМР: 400 МГц DMSO
δ 7.21-7.26 (m, 1H), 6.99 (s, 1H), 6.81-6.72 (m, 1H), 6.39 (s, 1H), 5.72 (s, 2H).
В 2 г 2-амино-5-бромотиофенола добавить 1.48 г нитрофенилформальдегида, затем добавить 40 мл DMSO для составления реактивного раствора. В результате реакции смешивания упомянутого реактивного раствора при 180℃ в течение получаса образуется 2-(4-нитрофенил)-6-бромобензотиазол;
1H ЯМР: 400 МГц DMSO
δ 8.54 (s, 1H), 8.34-8.41 (m, 4H), 8.07-8.09 (d, J = 8.8Hz, 1H), 7.74-7.77 (m, 1H).
Конкретный процесс реакции синтеза упомянутого 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазола в данном примере осуществления показан в формуле реакции II (B в данной формуле реакции – 10B):
Формула реакции II
Вариант осуществления 2
Метод подготовки химического соединения, специфически увязывающегося с β- амилоидным белком
Метод синтеза 2-(4-нитрофенил)-6-бромобензотиазола, использованный в данном примере осуществления, аналогичен методу, показанному в примере осуществления 1.
В 100 мг 2-(4-нитрофенил)-6-бромобензотиазола добавляется 90.91 мг биспинаколатодиборона и 87.84 мг ацетата калия, затем добавляется 4 мл THF и 2 мл DMSO. В условиях азотозаполнения при 20℃ добавляется 25 мг дихлорида (трифенилфосфин) палладия. В упомянутой реакционной системе на 23 часе
реакции при 25℃ образуется 2-(4-нитрофенил)-6-пинаколатодиборонобензотиазол, при этом содержание бора в биспинаколатодибороне – 10B;
1H ЯМР: 400 МГц CDCl3
δ 8.44 (s, 1H), 8.35-8.37 (d, J = 8.8Hz, 2H), 8.28-8.30 (d, J = 8.8Hz, 2H), 8.11-8.13 (d,
J = 8Hz, 1H), 7.96-7.98 (d, J = 8Hz, 1H), 1.40 (s, 12H).
В 539.7 мг 2-(4-нитрофенил)-6-пинаколатодиборонобензотиазола добавляется 30 мл THF и 10 мл воды, затем добавляется 1.51 г метапериодата натрия. В упомянутой реакционной системе на 23 часе реакции при 25℃ образуется 2-(4- нитрофенил)-6-дигидроксиборилбензотиазол;
1H ЯМР: 400 МГц DMSO
δ 8.56 (s, 1H), 8.36-8.42 (m, 4H), 8.29 (m, 2H), 8.10-8.12 (d, J = 8.4Hz, 1H), 8.00 (m, 1H).
В 100 мл метилового спирта добавляется 200 мг активатора Pd/C, затем добавляется 180 мг 2-(4-нитрофенил)-6-дигидроксиборилбензотиазола, что образует реакционную систему. В упомянутой реакционной системе в среде водородного газа происходит вакуумная дегазация, и на 10 минуте реакции при 25℃ образуется 2-(4-аминофенил)-6-дигидроксиборилбензотиазол;
1H ЯМР: 400 МГц MeOH
δ 8.29 (s, 1H), 7.80-7.84 (m, 4H), 6.74-6.76 (d,J = 8.8 Hz, 2H).
После прохождения несущего йодистый метил азота через нагретую до 200℃ трубу трифлата серебра с последующим вхождением на разложение в обезвоженный ацетон 2-(4-аминофенил)-6-дигидроксиборилбензотиазола образуется реакционный раствор, в который после 5 минут реакции при 80℃ добавляется вода для гашения, отчего получается 2-(4метиламинофенил)-6-дигидроксиборилбензотиазол.
При этом C в составе йодистого метила можно рассматривать как радиоактивный 11C, поэтому составленный им 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазол аналогично обладает радиоактивным элементом 11C. По этой причине данное обладающее радиоактивностью химическое соединение может сочетаться с PET в применении для отслеживания скопления β-амилоидного белка в местах области головного мозга, а также для диагностики AD.
1H ЯМР: 400 МГц MeOH
δ 8.27 (s, 1H), 7.83-7.85 (m, 4H), 6.66-6.68 (d,J = 7.6 Hz, 2H), 2.85 (s, 3H).
При этом уголь в составе йодистого метила можно рассматривать как радиоактивный 11C, поэтому составленный им 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазол аналогично обладает радиоактивным элементом 11C. По этой причине данное обладающее радиоактивностью химическое соединение может сочетаться с Micro-PET в применении для отслеживания скопления β-амилоидного белка в местах области головного мозга, а также для диагностики AD.
Процесс реакции в данном примере осуществления показан в формуле реакции III (B в данной формуле реакции – 10B):
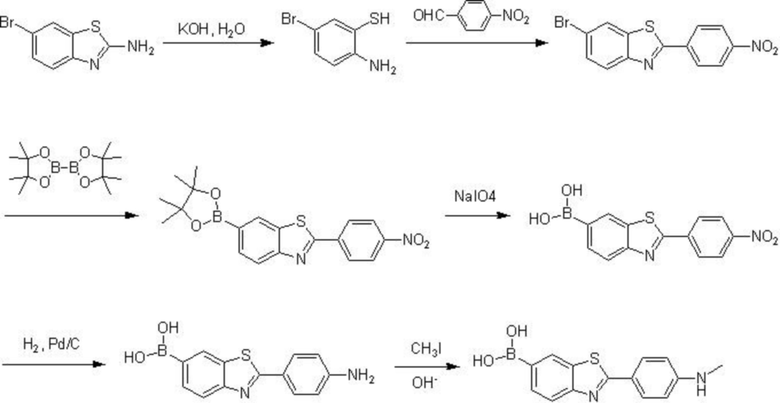
Формула реакции III
Вариант осуществления 3
Испытание на специфическое связывание 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазола с маркером 11C и β-амилоидного белка.
Мышь SAMP8 (senescence accelerated mouse prone 8) – самая распространенная в настоящее время животная модель для изучения AD (болезни Альцгеймера). В ее мозгу присутствует большой объем бляшек отложения амилоидного белка. В данном примере осуществления мышь SAMP8 используется в качестве мышиной модели, а обычная лабораторная мышь – в качестве контрольной мыши. Мышиной модели и контрольной мыши одинаково по 10 месяцев. Обеим мышам по отдельности вливается 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазол с содержанием маркера 11C. Затем с помощью сканирования производится исследование – имеют ли 2-(4-метиламинофенил)- 6дигидроксиборилбензотиазол и β-амилоидный белок специфический характер связывания. По отдельности отбираются мышиная модель и контрольная мышь с весом по 31.5±0.3 г. По отдельности им вливается 31.0±0.6µCi 2-(4- метиламинофенил) дигидроксиборилбензотиазол с маркером 11C. Также с помощью Micro-PET модели INVEON от Siemens производится сканирование, при этом окно сканирования составляет 350-650 кЭв.
Как хорошо знает технический персонал данной области, основной причиной заболевания, приводящей к болезни Альцгеймера, является скопление бляшек отложения β-амилоидного белка в коре головного мозга и гиппокампе. В данном примере осуществления с помощью сканирования Micro-PET и с использованием программы PMOD производится сопоставление областей мозга мышиной модели и контрольной мыши. Также анализируется и определяется абсорбция радиоактивного 2-(4-метиламинофенил)- 6дигидроксиборилбензотиазола в коре головного мозга и гиппокампе мышиной модели SAMP8 и контрольной мыши, чтобы еще больше разъяснить, что данное химическое соединение может специфично сочетаться с бляшками отложения β- амилоидного белка. Конкретные результаты этого показаны в таблицах 1 и 2:
Таблица 1. Впитывание радиоактивного 2-(4-метиламинофенил)- 6- дигидроксиборилбензотиазола в кору головного мозга мышиной модели и
контрольной мыши
По таблице 1 можно видеть, что: на 35 минуте после вливания радиоактивного препарата, удельное значение объема впитывания в коре головного мозга у мышиной модели и контрольной мыши может достигать 2.7, что выше маркированного и немаркированного значений концентрации бора при борной нейтронозахватывающей терапии (2.5). Данные результаты также свидетельствуют о том, что радиоактивный 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазол может эффективно связываться с бляшками отложения β-амилоидного белка, а также накапливаться в очагах болезни. Самое обнадеживающее – то, что при использовании терапии по захвату нейтронов бора к больным болезнью Альцгеймера, места очагов болезни могут принимать большой объем доз излучения, благодаря чему и достигается цель терапии, а также снижается радиоактивное поражение нормальных мозговых тканей.
Таблица 2. Впитывание радиоактивного 2-(4-метиламинофенил)- 6- дигидроксиборилбензотиазола в гиппокамп мышиной модели и контрольной мыши
По таблице 2 можно видеть, что на 25 и 35 минутах после вливания радиоактивного препарата значение в гиппокампе у мышиной модели по сравнению с аналогичным значением у контрольной мыши составляет 3.2, что выше маркированного и немаркированного значений концентрации бора при борной нейтронозахватывающей терапии (2.5). Данные результаты также свидетельствуют о том, что радиоактивный 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазол может эффективно связываться с бляшками отложения β-амилоидного белка, а также накапливаться в очагах болезни.
Мышиная модель SAMP8 – это мышь, заболевшая болезнью Альцгеймера с ускоренным старением, в очагах заболевания, которые локализуются в ее мозговой коре и гиппокампе скоплен большой объем β-амилоидного белка. На примере данных испытаний мышиной модели и контрольной мыши в таблицах 1 и 2, можно увидеть, что у мышиной модели SAMP8, при сравнении с нормальной контрольной мышью, мозговая кора и гиппокамп обладают более мощной абсорбцией 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола. Это также еще больше объясняет специфичность 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазола и β-амилоидного белка. В будущем можно будет еще больше использовать борную нейтронозахватную терапию для излечения болезни Альцгеймера, предоставив тем самым страдающим болезнью Альцгеймера пациентам еще один передовой метод лечения.
На основании результатов анализа таблицы 2, в промежуток времени с 25 по 35 минуту после вливания в мышей радиоактивного 2-(4-метиламинофенил)-6- дигидроксиборилбензотиазола, сравнительное значение радиоактивного препарата в гиппокампе мышиных моделей по сравнению с аналогичным значением у контрольной мыши составило 3.2. Поэтому были отобраны снимки Micro-PET с промежуточным значением 30 минут для дальнейшего сопоставления состояния накапливания в области мозга 2-(4- метиламинофенил)-6-дигидроксиборилбензотиазола.
На фиг. 4 показан PET-сканирование на 30 минуте вливания радиоактивного 2- (4-метиламинофенил)-6-дигидроксиборилбензотиазола, а также снимок, обработанный программой AMIDE. При этом фиг. A – снимок на 30 минуте вливания контрольной мыши радиоактивного препарата. Изображение на фиг. A
(1) – снимок сканирования коронарного среза контрольной мыши, изображение
(2) – плоскостное сканирование вдоль оси Y изображения (1), изображение (3) плоскостное сканирование вдоль оси X изображения(1); на фиг. B показано влияние вливания радиоактивного препарата в мышиную модель SAMP8 на 30 минуте. Аналогичным образом, изображение (1) на фиг. B – снимок плоскостного сканирования мышиной модели, изображение (2) – плоскостное сканирование вдоль оси Y изображения (1), изображение (3) плоскостное сканирование вдоль оси X изображения(1).
Причем находящееся на фиг. A (3) и фиг. B (3) может отражать состояние абсорбции радиоактивного препарата в области мозга. При сопоставлении двух этих изображений, можно увидеть, что область мозга мышиной модели SAMP8 на фиг. B (3) в сравнении с областью мозга контрольной мыши на фиг. A (3) имеет большой объем скопления радиоактивного препарата. При этом известно, что в области мозга мышиной модели имеется большой объем бляшек отложений β-амилоидного белка. Таким образом, можно разъяснить, что 2-(4- метиламинофенил)-6-дигидроксиборилбензотиазол имеет специфическое воздействие на бляшки отложения β-амилоидного белка, а 2-(4- метиламинофенил)-6-дигидроксиборилбензотиазол в будущем может применяться для борной нейтронозахватывающей терапии.
Вариант осуществления 4
Испытания по имитации удаления белка системой нейтронозахватной терапии
В данном примере осуществления борная кислота (H310BO3) используется для замены 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола, при этом элемент бор в борной кислоте (H310BO3) – 10B. С помощью альбумина бычьей сыворотки (BSA) производится имитация β-амилоидного белка. Смешанный раствор, составленный из борной кислоты и альбумина бычьей сыворотки, размешается в среду пучка нейтронов, произведенного установкой нейтронозахватной терапии. Благодаря SDS-PAGE гель-электрофорезу анализируется воздействие нейтронов на альбумин бычьей сыворотки, а также воздействие нейтронов на альбумин бычьей сыворотки в условиях наличия H310BO3.
I. Воздействие нейтронов на альбумин бычьей сыворотки
С помощью сверхчистой воды составить раствор BSA с концентрацией 0.01% (мас./мас.). Составленный раствор хранятся и используются в испытаниях при 4℃. Отобрать 1 мл раствор BSA и поместить его по осевой линии выходного отверстия коллиматора установки нейтронозахватной терапии. При этом упомянутый раствор находится на расстоянии 2 см. от выходного отверстия коллиматора. Настроить установку нейтронозахватной терапии так, чтобы интенсивность нейтронов на выходном отверстии коллиматора составляла 2.4*1011 шт./с. Упомянутый раствор BSA подвергается облучению в данной нейтронной среде в течение двух часов. Кроме того, из упомянутого раствора BSA отбирается 1 мл в качестве контрольного раствора, который не подвергается нейтронному облучению.
Подвергнуть по отдельности раствор BSA и 8 контрольный раствор, подвергшихся нейтронному излучению в течение двух часов, окрашиванию с помощью кумасси бриллиантового голубого красителя и сделать SDS-PAGE гель-электрофорез. С помощью программы Image J произвести по отдельности количественное определение цветов белковых зон на электрофореграммах, соответствующих вышеописанному раствору-образцу и контрольному раствору. Их цифровые значения используются для отображения соответствующего содержания белка, в том числе, содержание BSA в контрольном растворе определяется как 1. При экспериментальных условиях вышеописанного нейтронного излучения, содержание BSA после двух часов нейтронного излучения равно 0.8, то есть содержание снизилось примерно на 20%. Отсюда можно видеть, что радиационное излучение, содержащее в себе пучок нейтронов может влиять на содержание белка.
II. Воздействие нейтронов на альбумин бычьей сыворотки при условии наличия H310BO3
С помощью сверхчистой воды составить растворы BSA и H310BO3, в том числе для упомянутых растворов, концентрация BSA должна быть 0.01% (мас./мас.), а концентрация H310BO3– 0.18M. Составленные растворы хранятся и используются в испытаниях при 4℃, из упомянутого раствора по отдельности отбирается 8 доз (которые нумеруются по отдельности как A, B, C, D, E, F, G и H). Каждая 1 мл доза раствора подвергается облучению с помощью установки нейтронозахватной терапии. 8 растворов по отдельности размещаются по осевой линии выходного отверстия коллиматора установки нейтронозахватной терапии. Раствор A находится на расстоянии 2 см от выходного отверстия коллиматора, раствор B – на 4 см от выхода коллиматора, раствор C – на 6 см, и так далее таким же образом. Помимо того, что пучок на выходном отверстии коллиматора включает в себя нейтронный луч, он также включает в себя гамма-лучи и другие радиационные лучи. В действительности же, основное разрушающее воздействие на белок производит нейтронный луч. Описываемая интенсивность нейтронов в пучке, используемом в данном примере осуществления, и в том числе, интенсивность нейтронов в данном примере осуществления – 2.4*1011 шт./с. 8 растворов подвергаются облучению в данной нейтронной среде в течение двух часов. Кроме того, из упомянутых растворов BSA и H310BO3 отбирается по 1 мл в качестве контрольного раствора, который не подвергается нейтронному облучению.
Подвергнуть по отдельности контрольный раствор и 8 растворов, подвергшихся радиационному излучению, испускаемому установкой нейтронозахватной терапии, окрашиванию с помощью кумасси бриллиантового голубого красителя и сделать SDS-PAGE гель-электрофорез. На рис. 5 показан SDS-PAGE гель- электрофорез контрольного раствора и 8 растворов.
Первые две белковые зоны на фиг. 5 – это BSA в контрольном растворе, остальные по отдельности – подвергшиеся упомянутому радиационному облучению BSA, 8 растворов размещены по центральной линии выходного отверстия коллиматора. Растворы по упомянутой осевой линии содержат H310BO3, а элемент 10B имеет достаточно большое сечение задержания тепловых нейтронов. Поэтому после прохождения нейтронов радиационного излучения, выходящего из выходного отверстия коллиматора, через растворы с содержанием H310BO3, нейтронное облучение в значительной степени снижается. Чем дальше раствор находится от выходного отверстия коллиматора, тем меньше BSA получают дозу нейтронного облучения.
На фиг. 5 можно увидеть, что в сравнении с контрольным образцом, цвета белковых зон подвергшихся нейтронному излучению 8 растворов выцветают в неоднородной степени. Также, чем ближе к выходному отверстию коллиматора, тем бледней цвет белковой зоны раствора. Это говорит о том, что чем больше снижается содержание белка и чем ближе к выходному отверстию коллиматора, тем больше получает раствор дозу нейтронного облучения. Это еще больше объясняет влияние величины объема дозы облучения на содержание BSA. Чем мощней доза облучения, тем меньше содержание BSA в растворе, подвергшемся нейтронному облучению.
С помощью программы Image J производится количественное определение цвета белковых зон BSA на электрофореграммах, соответствующих контрольному раствору и 8 растворам по отдельности. Их цифровые значения используются для отображения соответствующего содержания белка, в том числе, содержание BSA в контрольном растворе определяется как 1. При экспериментальных условиях вышеописанного нейтронного излучения, содержание BSA после двух часов нейтронного излучения показано в таблице 3.
На таблице 3 можно увидеть, что под воздействием нейтронного излучения содержание BSA в растворе снижается в неравномерной степени. После двухчасового нейтронного излучения с интенсивностью нейтронов 2.4*1011 шт./с раствора на расстоянии в 2 см от выходного отверстия коллиматора, содержание BSA в нем составляет всего 5.3%. Это говорит о том, что при условии наличия H310BO3, нейтроны могут в значительной степени разрушить структуру BSA и снизить объем содержания BSA; кроме того, в пределах допустимой экспериментальной погрешности, чем дальше находятся каждый из 8 растворов от выходного отверстия коллиматора, тем больше проявляется общая тенденция снижения содержания в них BSA. Это еще больше объясняет влияние величины объема дозы облучения на содержание BSA.
Таблица 3. Воздействие нейтронов на альбумин бычьей сыворотки при условии наличия H310BO3
Предоставляемое данным изобретением химическое соединение 2-(4- метиламинофенил)-6-дигидроксиборилбензотиазол и H310BO3 в одинаковой мере несут с собой нуклиды с большим сечением для задержания тепловых нейтронов 10B, а также могут специфически связывать β-амилоидный белок, помещая упомянутые выше химические соединения в среду, содержащую β-амилоидный белок. Упомянутые выше химические соединения может сформировать вокруг β-амилоидного белка довольно высокую концентрацию, после чего используя пучок нейтронов из установки нейтронозахватной терапии облучить области накопления упомянутых выше химических соединений. Высвобождаемая при этом энергия может разрушить белковую структуру.
Выше были приведен конкретный пример осуществления для разъяснения данного изобретения. Необходимо отметить то, что вышеприведенный пример осуществления применяется только для последующего разъяснения изобретения и не представляет собой область защиты данного изобретения. Не несущие существенного характера исправления и пересмотр, произведенные другими лицами в соответствии с указаниями данного изобретения также относятся к области защиты данного изобретения.
Заявленное изобретение относится к медицине, а именно к неврологии, и касается системы нейтронозахватной терапии, предназначенной для удаления амилоидного β-белка. Эта система включает устройство для нейтронозахватной терапии и соединение, которое имеет нуклид с большим поперечным сечением захвата теплового нейтрона и способно специфически связываться с амилоидным β-белком. Устройство нейтронозахватной терапии содержит источник нейтронов, тело, формирующее пучок, и коллиматор. Нейтроны, испускаемые источником нейтронов, проходят через тело, формирующее пучок, и замедляются в пучок нейтронов, с энергией определенного диапазона. Нейтронный пучок облучает соединение, и энергия, генерируемая его реакцией, способна разрушить структуру β-амилоидного белка. Система нейтронозахватной терапии обеспечивает замедление развития симптомов болезни Альцгеймера за счет удаления амилоидного β-белка при минимальном повреждении окружающих тканей. 9 з.п. ф-лы, 5 ил., 3 табл.
1. Система нейтронозахватной терапии для удаления β-амилоидного белка, включающая:
установку нейтронозахватной терапии и
соединение для специфического связывания β-амилоидного белка,
причем указанное соединение содержит нуклид с крупным сечением захвата тепловых нейтронов.
2. Система нейтронозахватной терапии для удаления β-амилоидного белка по п. 1, где нуклид с крупным сечением захвата тепловых нейтронов представляет собой 10B, 155Gd или 157Gd.
3. Система нейтронозахватной терапии для удаления β-амилоидного белка по п. 1, где установка нейтронозахватной терапии включает:
источник нейтронов для генерации пучка нейтронов;
блок формирования пучка, располагающийся в задней части источника нейтронов, для смещения быстрых нейтронов в пучке нейтронов с более широким спектром, генерируемым источником нейтронов, в надтепловые нейтроны или тепловые нейтроны; и
коллиматор, расположенный в задней части блока формирования пучка, для сведения надтепловых или тепловых нейтронов.
4. Система нейтронозахватной терапии для удаления β-амилоидного белка по п. 3, где источник нейтронов является источником нейтронов на основе ускорителя или на основе реактора.
5. Система нейтронозахватной терапии для удаления β-амилоидного белка по п. 3, где блок формирования пучка включает:
замедлитель для замедления скорости быстрых нейтронов до надтепловых или тепловых нейтронов; и
рефлектор, окружающий замедлитель, для отражения нейтронов, рассеянных вне блока формирования пучка, обратно в замедлитель.
6. Система нейтронозахватной терапии для удаления β-амилоидного белка по любому из пп. 1-5, где соединение для специфического связывания β-амилоидного белка имеет структурную формулу I:
формула I,
где B в составе группы B(OH)2 в формуле I представляет собой 10B.
7. Система нейтронозахватной терапии для удаления β-амилоидного белка по п. 6, где соединение формулы I получено из 6-бромо-2-(4-нитрофенил)-бензотиазола формулы II:
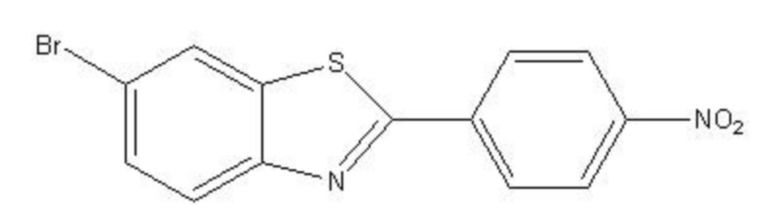
формула II.
8. Система нейтронозахватной терапии для удаления β-амилоидного белка по п. 7, где способ получения соединения формулы I из соединения формулы II включает стадии:
восстановления соединения формулы II с получением 6-бромо-2-(4-аминофенил)-бензотиазола;
получения 6-бромо-2-(4-метиламинофенил)-бензотиазола реакцией формальдегида и 6-бромо-2-(4-аминофенил)-бензотиазола;
получения 2-(4-метиламинофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензотиазола реакцией бис(пинаколато)диборона и 6-бромо-2-(4-метиламинофенил)-бензотиазола; и
окисления 2-(4-метиламинофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензотиазола под действием окислителя с получением 2-(4-метиламинофенил)-6-дигидроксиборилбензотиазола формулы I;
где бор в составе бис(пинаколато)диборона представляет собой 10B.
9. Система нейтронозахватной терапии для удаления β-амилоидного белка по п. 7, где способ получения соединения формулы I из соединения формулы II включает стадии:
получения 2-(4-нитрофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензотиазола реакцией соединения формулы II и бис(пинаколато)диборона;
получения 2-(4-нитрофенил)-6-дигидроксиборилбензотиазола окислением 2-(4-нитрофенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензотиазола под действием окислителя;
получения 2-(4-аминофенил)-6-дигидроксиборилбензотиазола восстановлением 2-(4-нитрофенил)-6-дигидроксиборилбензотиазола под действием восстановителя; и
получения 2-(метиламинофенил)-6-дигидроксиборилбензотиазола формулы I взаимодействием при высокой температуре 2-(4-аминофенил)-6-дигидроксиборилбензотиазола, иодметана и трифторметансульфоната серебра;
где бор в составе бис(пинаколато)диборона представляет собой 10B.
10. Система нейтронозахватной терапии для удаления β-амилоидного белка по п. 9, где C в составе иодметана представляет собой 11C.
| СПОСОБ ФОРМИРОВАНИЯ ПОГЛОЩЕННОЙ ДОЗЫ ИЗЛУЧЕНИЯ ПРИ НЕЙТРОННОЙ ТЕРАПИИ | 2000 |
|
RU2191610C2 |
| WO 2015184731 A1, 10.12.2015 | |||
| CN 103127877 A, 05.06.2013 | |||
| ПАХОМОВА Ю.В | |||
| и др | |||
| "Основные этапы тканевой селекции и пути введения препаратов для бор-нейтронозахватной терапии злокачественных опухолей (литературный обзор) | |||
| Журнал "Медицина и образование в Сибири", 2009, no.6, найдено 15.11.2019 из Интернет: | |||
Авторы
Даты
2020-05-18—Публикация
2016-12-23—Подача