Настоящее изобретение относится к композиции для применения у человека и животного в качестве лекарственного средства для лечения опухолей, синдрома приобретенного иммунодефицита и лейкозов. Композиция по настоящему изобретению для применения у человека и животного в качестве противоопухолевого агента содержит смесь, содержащую или, предпочтительно, состоящую из штамма бактерий Lactobacillus reuteri LRE 03 DSM 23879, который способен сильно стимулировать продукцию провоспалительных цитокинов Th1 (Т-хелперов 1) интерферона INF-гамма, причем указанные цитокины проявляют выраженную противоопухолевую активность, и/или штамма бактерий Lactobacillus salivarius LS06 DSM 26037, который способен сильно стимулировать продукцию дендритных клеток, причем указанные дендритные клетки также проявляют выраженную противоопухолевую активность.
В области онкологии известно, что современная медицинская терапия включает химиотерапию, эндокринную терапию, лечение иммуномодуляторами и лечение молекулярно-направленными лекарственными средствами. Главная цель противоопухолевой химиотерапии заключается в том, чтобы уничтожить опухолевые клетки в любой фазе клеточного цикла и таким образом уменьшить массы как первичной опухоли, так и метастаз.
Известно, что противоопухолевое химиотерапевтическое лечение уменьшает активность иммунной системы и что ослабленная иммунная система не способна защитить организм от вирусных и бактериальных инфекций.
Кроме того известно, что химиотерапия («химия») воздействует главным образом на опухоль, но к сожалению она также оказывает побочные эффекты в отношении здоровых тканей, особенно тканей с быстрой пролиферацией и обновлением, таких как слизистые пищевода, желудка и кишечника, приводя к воспалению слизистой оболочки, тошноте, рвоте, диарее, нарушению всасывания питательных веществ и, следовательно, нарушению питания.
Следовательно, общим свойством всех химиотерапевтических препаратов является: токсичность в отношении костного мозга, что в свою очередь ведет к иммуносупрессии и последующим инфекциям, вызываемым главным образом грамотрицательными бактериями и грибами, такими как Candida, токсичность для эпителия желудочно-кишечного тракта и токсичность для кишечной микрофлоры (химиотерапевтические антибиотики).
Соответственно, было бы желательно иметь натуральную эффективную и хорошо переносимую композицию для того, чтобы уменьшить побочные эффекты, типичные для химиотерапевтического лечения.
Таким образом, по-прежнему сохраняется сильная потребность в вспомогательной терапии для предупреждения и/или уменьшения как симптомов, так и побочных эффектов химиотерапии, применяемой для лечения опухолей.
Кроме того, по-прежнему сохраняется потребность в вспомогательном к химиотерапии лечении, способном воздействовать на иммунную систему путем ее стимуляции (иммуностимуляции), для восстановления ее эффективности, поскольку хорошо известно, что химиотерапия влечет за собой снижение эффективности иммунной системы.
После долгой и интенсивной научно-исследовательской и поисковой деятельности в отношении обширной группы бактериальных штаммов, принадлежащих к различным видам, авторы настоящего изобретения идентифицировали и выбрали определенные бактериальные штаммы, которые подходящим образом соответствуют вышеизложенным потребностям.
Объектом настоящего изобретения является:
- штамм бактерий, принадлежащих к виду Lactobacillus reuteri, идентифицированный как Lactobacillus reuteri LRE03, с депозитарным номером DSM 23879, депонированный 05.08.2010 Probiotical SpA в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ GmbH) в соответствии с Будапештским Договором, и/или
- штамм бактерий, принадлежащих виду Lactobacillus salivarius, идентифицированный как Lactobacillus salivarius LS06, с депозитарным номером DSM 26037, депонированный 06.06.2012 Probiotical SpA в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ GmbH) в соответствии с Будапештским Договором.
Авторы изобретения обнаружили, что штамм бактерий Lactobacillus reuteri LRE03 DSM 23879 проявляет подтвержденную и неожиданную способность (см. экспериментальную часть) стимулировать продукцию провоспалительных цитокинов (Th1) интерферона INF-гамма. Штамм бактерий Lactobacillus reuteri LRE03 DSM 23879 демонстрирует неожиданную иммуностимулирующую активность в отношении эндогенной продукции интерферона гамма INF-гамма. Штамм бактерий Lactobacillus reuteri LRE03 DSM 23879, отобранный авторами изобретения, проявляет неожиданную иммуномодулирующую активность, поскольку он активирует иммунную систему через стимуляцию провоспалительных цитокинов (Th1) интерферона INF-гамма. Стимуляция/продукция эндогенных цитокинов не оказывает токсического действия в отличие от инфузионного введения указанных цитокинов, как в случае экзогенных цитокинов.
Благодаря сильной стимуляции продукции провоспалительных цитокинов (Th1) интерферона INF-гамма штамм бактерий Lactobacillus reuteri LRE03 DSM 23879 способен проявлять эффективное противоопухолевое действие путем противодействия и уменьшения пролиферации опухолевых клеток.
Также авторы изобретения обнаружили, что штамм бактерий Lactobacillus salivarius LS06 DSM 26037 проявляет подтвержденную и неожиданную способность (см. экспериментальную часть) стимулировать продукцию дендритных клеток. Дендритные клетки помогают иммунной системе в защите организмов от внешних атак опасных микроорганизмов, таких как вирусы и бактерии.
Из-за сильной стимуляции им продукции дендритных клеток штамм бактерий Lactobacillus salivarius LS06 DSM 26037 способен проявлять эффективное противоопухолевое действие путем противодействия и уменьшения пролиферации опухолевых клеток.
Объектом настоящего изобретения является (1) смесь бактерий, содержащая или, альтернативно, состоящая из штамма бактерий Lactobacillus reuteri LRE03 DSM 23879 и/или штамма бактерий Lactobacillus salivarius LS06 DSM 26037 для применения у человека или животного в качестве противоопухолевого агента.
В одном воплощении указанная смесь (1) содержит или, альтернативно, состоит из:
- штамма бактерий Lactobacillus reuteri LRE03 DSM 23879 и/или
- штамма бактерий Lactobacillus salivarius LS06 DSM 26037
для применения у человека или животного в лечении опухолей для противодействия и/или уменьшения пролиферации опухолевых клеток в лечении синдрома приобретенного иммунодефицита и лечении лейкозов.
В другом воплощении смесь (1) бактерий содержит или, альтернативно, состоит из:
- штамма бактерий Lactobacillus reuteri LRE03 DSM 23879 и штамма бактерий Lactobacillus salivarius LS06 DSM 26037 в массовом соотношении, составляющем от 1:5 до 5:1, предпочтительно от 1:3 до 3:1, еще более предпочтительно от 1:2 до 2:1 или 1:1.
Смесь (1) бактерий имеет концентрацию бактериальных клеток от 1×108 колониеобразующих единиц (КОЕ)/г смеси до 1×1012 КОЕ/г смеси, предпочтительно от 1×109 КОЕ/г смеси до 1×1011 КОЕ/г смеси. В контексте настоящего изобретения все вышеупомянутые смеси для краткости изложения называют "смесь бактерий или смеси бактерий по настоящему изобретению".
Другим объектом настоящего изобретения является фармацевтическая композиция или композиция для медицинского устройства, под которой подразумевается вещество в соответствии с директивным определением 93/42/ЕЕС, именуемое в дальнейшем для краткости изложения "композиция или композиции по настоящему изобретению", где указанная композиция содержит или, альтернативно, состоит из:
(1) смеси бактерий по настоящему изобретению, как описано выше, и/или
(2) смеси, содержащей или, альтернативно, состоящей из камеди, предпочтительно альгината или его производного, и/или геля, предпочтительно геля Aloe или его производного, и/или
(3) источника легкоусвояемого цинка, и/или
(4) одного или более чем одного эксципиента, и/или добавки, и/или вспомогательного компонента препаратов, соответствующих критериям пищевой чистоты или фармакологической чистоты, приемлемых для организма, предпочтительно таких как фруктоолигосахариды (FOS), зеленый чай, сукралоза и/или мальтодекстрины.
В одном воплощении, которое составляет объект настоящего изобретения, композиция по настоящему изобретению содержит или, альтернативно, состоит из: (1) смеси бактерий по настоящему изобретению и (4) одного или более чем одного эксципиента, и/или добавки, и/или вспомогательного компонента препаратов, соответствующих критериям пищевой чистоты или фармакологической чистоты, приемлемых для организма, где указанная композиция предназначена для применения у человека или животного в противоопухолевом химиотерапевтическом лечении, лечении синдрома приобретенного иммунодефицита и лечении лейкозов.
В другом воплощении, которое составляет объект по настоящему изобретению, композиция по настоящему изобретению содержит или, альтернативно, состоит из: (1) смеси бактерий по настоящему изобретению, (2) смеси, содержащей или, альтернативно, состоящей из геля, предпочтительно геля Aloe или его производного, и (4) одного или более чем одного эксципиента, и/или добавки, и/или вспомогательного компонента препаратов, соответствующих критериям пищевой чистоты или фармакологической чистоты, приемлемых для организма, где указанная композиция предназначена для применения у человека или животного в противоопухолевом химиотерапевтическом лечении, лечении синдрома приобретенного иммунодефицита и лечении лейкозов. Указанная смесь (2) содержит или, альтернативно, состоит из геля, предпочтительно геля Aloe или его производного. Продукт Aloe или его производное предпочтительно представляет собой Aloe arborescens, предпочтительно в лиофилизированной форме. Aloe arborescens предпочтительно находится в лиофилизированной форме и проявляет противовоспалительное действие.
Дополнительно авторы изобретения обнаружили, что активация иммунной системы (IS) композицией по настоящему изобретению происходит путем "двойной биостимуляции". "Двойная биостимуляция" состоит из первой и второй биостимуляций. Первую биостимуляцию получают благодаря присутствию в композиции по настоящему изобретению цинка с очень высокой биодоступностью. Эта биологически доступная форма цинка стимулирует тимус к продукции большего количества (числа) лимфоцитов. Указанные "сверхстимулируемые" тимусом Т-лимфоциты продуцируют нетоксичные эндогенные цитокины, такие как интерферон-гамма, и дендритные клетки.
Вторую биостимуляцию, объединяемую с первой биостимуляцией, вызывает штамм бактерий Lactobacillus reuteri LRE03 DSM 23879 и/или штамм бактерий Lactobacillus salivarius LS06 DSM 26037, которые, в свою очередь, стимулируют лимфоциты, теперь их большее количество вследствие предшествующей стимуляции тимуса цинком, к продукции большего количества цитокинов (особенно INF-гамма и дендритных клеток). Дополнительно к вышеизложенному, имеет место базовый противовоспалительный эффект, обеспечиваемый присутствием Aloe или его производного, предпочтительно Aloe arborescens, предпочтительно в лиофилизированной форме.
Очень высокая биодоступность цинка является следствием того факта, что он находится в форме цинка, "интернализованного" внутри тиндализованной бактериальной клетки штамма бактерий, принадлежащего к виду Bifidobacterium lactis, где предпочтительно штамм, выбранный авторами изобретения, представляет собой штамм бактерий Bifidobacterium lactis Bb 1 DSM 17850, депонированный в DSMZ 23.12.2005, являющийся объектом европейской заявки на патент No. 08789404, включенной в данное описание посредством ссылки.
По существу авторы изобретения обнаружили, что цинк с высокой биодоступностью, "интернализованный" в тиндализованную клетку (инактивированную клетку), обладает способностью активировать иммунную систему (IS), особенно тимус, отвечающий за продукцию Т-лимфоцитов, которые продуцируют нетоксичные эндогенные цитокины, такие как интерферон-гамма, и дендритные клетки.
В другом воплощении, которое составляет объект по настоящему изобретению, композиция по настоящему изобретению содержит или, альтернативно, состоит из: (1) смеси по настоящему изобретению, (2) смеси, содержащей или, альтернативно, состоящей из геля, предпочтительно геля Aloe или его производного, (3) источника цинка с высокой усвояемостью и биодоступностью в форме цинка, "интернализованного" внутри тиндализованной бактериальной клетки штамма бактерий, принадлежащих виду Bifidobacterium lactis, где предпочтительно указанный штамм представляет собой штамм бактерий Bifidobacterium lactis Bb 1 DSM 17850, и (4) одной или более чем одной добавки, и/или вспомогательного компонента препаратов, и/или технологического ингредиента препаратов, соответствующих критериям пищевой чистоты или фармакологической чистоты, приемлемых для организма, где указанная композиция предназначена для применения у человека и животного в противоопухолевом химиотерапевтическом лечении, лечении синдрома приобретенного иммунодефицита и лечении лейкозов. Указанный источник (4) цинка с высокой усвояемостью и биодоступностью присутствует как органический цинк в форме бактериального тиндализованного продукта штамма Bifidobacterium lactis Bb1 DSM 17850 (ProbioZinc®, депонированного 23.12.2005 в DSMZ - Немецкой коллекции микроорганизмов и клеточных культур GmbH BioMan S.r.l. Company (Italy). Тиндализованный бактериальный продукт штамма Bifidobacterium animalis ssp. lactis Bb1 DSM 17850 присутствует в количестве от 10 до 50 мг/г композиции, предпочтительно 20 мг/г композиции.
Все вышеупомянутые композиции по настоящему изобретению эффективно применимы для использования в качестве вспомогательной терапии при противоопухолевом химиотерапевтическом лечении, лечении синдрома приобретенного иммунодефицита и лечении лейкозов.
Наконец, композиция по настоящему изобретению содержит эксципиент, и/или добавку, и/или вспомогательный компонент препаратов, соответствующие критериям пищевой чистоты или фармакологической чистоты, которые обеспечивают возможность изготовления таких фармацевтических форм как порошки, гранулы, таблетки или капсулы. Также она может содержать, например, фруктоолигосахариды FOS, и/или зеленый чай, и/или сукралозу, и/или мальтодекстрины.
Композиция по настоящему изобретению содержит от 1×108 до 1×1012 жизнеспособных бактериальных клеток КОЕ/г композиции, предпочтительно от 1×109 до 1×1011 жизнеспособных бактериальных клеток КОЕ/г композиции. Композиция по настоящему изобретению рекомендована предпочтительно для введения 1-2 раза в сутки в течение 4-12 недель.
Композиция по настоящему изобретению содержит указанное Aloe, предпочтительно лиофилизированное Aloe arborescens в количестве, составляющем от 1 до 25% по массе относительно массы композиции, предпочтительно от 5 до 15% по массе относительно массы композиции. Композиция по настоящему изобретению может содержать лиофилизированное Aloe arborescens (Alagel™), например 1,5 грамм/доза.
В свете ее общего механизма действия, композиция по настоящему изобретению способна делать побочные эффекты химиотерапевтического лечения более переносимыми для индивидуумов с опухолевым заболеванием.
В одном воплощении композиция по настоящему изобретению содержит смесь (1) по настоящему изобретению (имеющую концентрацию бактериальных клеток от 1×108 КОЕ/г смеси до 1×1012 КОЕ/г смеси, предпочтительно от 1×109 КОЕ/г смеси до 1×1011 КОЕ/г смеси), содержащую или, альтернативно, состоящую из:
- штамма бактерий Lactobacillus reuteri LRE03 DSM 23879, или
- штамма бактерий Lactobacillus salivarius LS06 DSM 26037, или
- штамма бактерий Lactobacillus reuteri LRE03 DSM 23879 и штамма бактерий Lactobacillus salivarius LS06 DSM 26037 в массовом соотношении от 1:5 до 5:1, предпочтительно от 1:3 до 3:1, еще более предпочтительно от 1:2 до 2:1 или 1:1, и/или фруктоолигосахаридов FOS, и/или зеленого чая, и/или сукралозы, и/или мальтодекстринов.
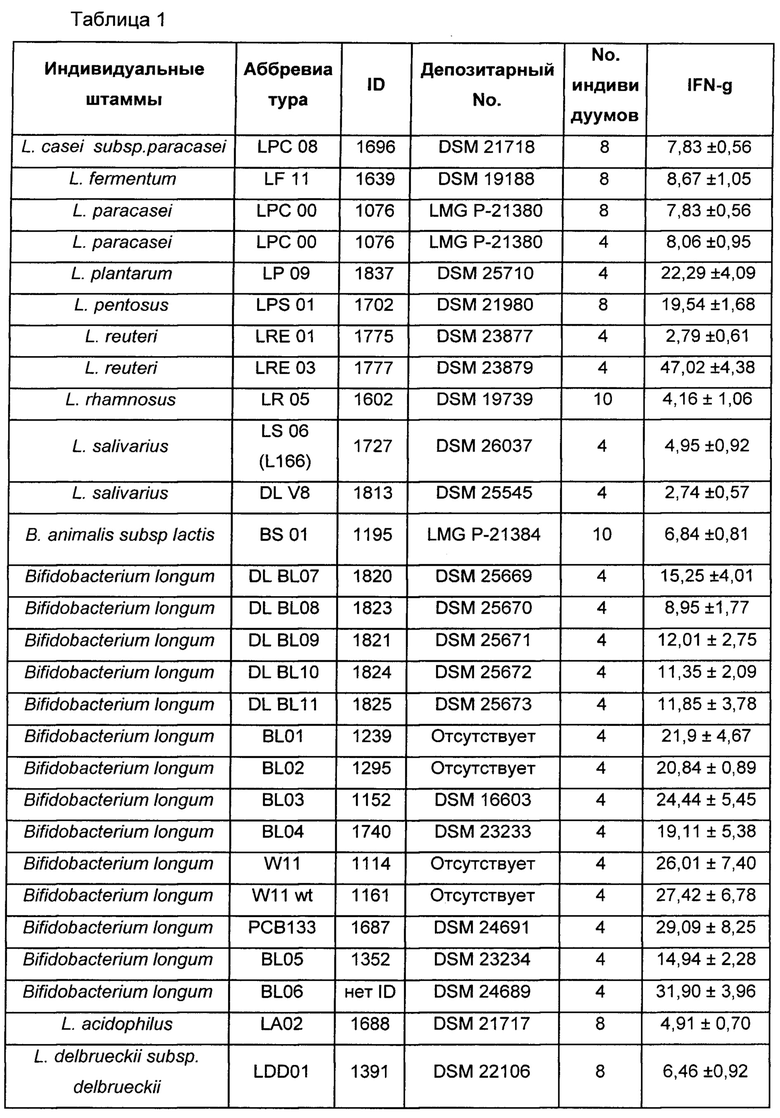
Действительно, штамм L. reuteri LRE03 DSM 23879 обладает способностью значительно стимулировать эндогенную продукцию гамма-интерферона (IFN-γ). Способность штамма L. reuteri LRE03 DSM 23879 индуцировать высвобождение цитокинов, в частности гамма-интерферона INF-гамма, первичными клетками иммунной системы количественно оценивали путем его совместного инкубирования с РВМС (мононуклеарные клетки периферической крови), выделенными из периферической крови здоровых взрослых индивидуумов. Результаты показали стимуляцию секреции IFN-гамма с концентрацией 480 пг/мл, а именно в 47 раз больше, чем в контроле. Продукцию IFN-гамма оценивали в культуральном супернатанте через 5 суток после стимуляции относительно условий без стимуляции (базовый уровень). Гамма-интерферон (IFN-γ) обладает свойствами, препятствующими вирусным и бактериальным инфекциям подобно другим интерферонам и нефизиологической пролиферации клеток, что опосредовано изменениями цитоскелета и клеточной мембраны, модуляциями экспрессии продукта онкогена и регуляцией процесса дифференцировки клеток (задержка почти всех фаз митоза как у нормальных, так и у опухолевых клеток). IFN-γ также демонстрирует основное и характерное иммуномодулирующее действие путем стимуляции активности как клеток, специализированных для иммунного ответа организма, таких как макрофаги, моноциты, нейтрофилы, так и неспециализированных клеток, таких как тромбоциты, эндотелиальные и эпителиальные клетки, фибробласты и клетки паренхимы.
Композиция по настоящему изобретению обеспечивает подходящее количество (2 мг/дозу) легкоусвояемого цинка, "интернализованного" микроорганизмом Bifidobacterium lactis Bb1. Цинк с высокой биодоступностью ("интернализованный") находится в форме тиндализованной (инактивированной) клетки. Эта форма цинка обладает высокой биодоступностью и, следовательно, способностью легче усваиваться организмом. Ион цинка, будучи биодоступным и легко усваиваемым организмом, играет центральную роль и оказывает прямое действие в отношении тимуса, который отвечает за стимуляцию/продукцию лимфоцитов, которые продуцируют больше цитокинов.
Штамм бактерий Bifidobacterium lactis Bb1 DSM 17850 был депонирован в DSMZ 23.12.2005 BioMan S.r.l. Company (Italy). Действительно, штамм бактерий Bifidobacterium lactis Bb 1 DSM 17850 обладает способностью аккумулировать цинк внутри клетки во время своего роста в жидкой культуральной среде. Цинк из рациона, накопленный внутри клетки (ProbioZinc®), обладает усвояемостью в 17 раз выше чем глюконат цинка и в 31,5 раз выше чем сульфат цинка, как показано в исследовании in vitro, проведенном на клетках Сасо-2 в системе Transwell. Высокая усвояемость микроэлемента цинка позволяет эффективно компенсировать условия недостаточности даже при очень низких дозировках. Более того, известно, что цинк играет важную роль в иммунной системе, особенно для тимуса, представляющего собой орган, где происходит образование Т-лимфоцитов, которые, когда дифференцируются в CD4+ Т-лимфоциты (Т-лимфоциты-хелперы), секретируют ряд цитокинов, таких как IL (интерлейкин)-12 и IFN-γ. Указанный механизм действия цинка является синергическим с таковым у штамма L reuteri LRE03 DSM 23879.
В свете ее общего механизма действия, композицию, представляющую собой объект настоящего изобретения, эффективно используют для применения в качестве вспомогательного терапевтического средства у индивидуумов с опухолевыми заболеваниями и подлежащих химиотерапии, а также в антиретровирусном лечении у индивидуумов с синдромом приобретенного иммунодефицита (СПИД) и лечении лейкозов.
Экспериментальная часть
Авторы изобретения протестировали иммуномодулирующие свойства штамма бактерий Lactobacillus reuteri LRE 03 (ID1777) DSM 23879, как описано ниже.
Конкретно, исследование проводили после различных периодов времени стимуляции, для того чтобы проанализировать как цитокины, вовлеченные в врожденный иммунитет, так и те, которые ответственны за приобретенный иммунитет.
а) Бактериальные культуры и условия роста
Во-первых, бактериальные культуры штамма бактерий Lactobacillus reuteri LRE 03 DSM 23879 получали в определенных условиях роста. Штамм культивировали в среде Man Rogosa Sharpe (MRS) на термостатируемой бане при 37°С. Что касается экспериментов по иммуномодулированию после периода роста в течение приблизительно 16 часов, бактерии субкультивировали в течение 6 часов в условиях, описанных выше, для достижения фазы экспоненциального роста. Затем их дважды промывали стерильным фосфатно-солевым буфером (PBS, рН 7,2), физиологический статус и число клеток определяли цитофлуориметрическим методом с использованием набора "Cell Viability Kit with liquid beads", доступного в продаже от Becton Dickinson Company, в соответствии с инструкциями производителя. Соответственно, концентрацию клеток доводили до оптимальной концентрации, установленной в предварительных экспериментах, и использовали в последующих тестах.
б) Отделение мононуклеарных клеток периферической крови
Затем отделяли мононуклеарные клетки периферической крови. Мононуклеарные клетки периферической крови (РВМС) отделяли путем центрифугирования в градиенте плотности. Для этой цели 20 мл "лейкоцитарной пленки" здоровых доноров из Службы переливания крови (Immuno-transfusion Service) Ospedale di Borgomanero (Italy) использовали в каждом эксперименте, таким образом получая средний выход 200×106 РВМС/лейкоцитарная пленка. Количество отделенных клеток определяли путем подсчета клеток в камере Бюркера с использованием раствора Тюрка, который позволяет различить мононуклеарные клетки и полиморфоядерные клетки. Концентрацию клеток доводили до 2×106 клеток/мл в ростовой среде RPMI-1640 (Invitrogen), дополненной 10% инактивированной нагреванием эмбриональной сыворотки крупного рогатого скота (FCS, Gibco), 1% глутамина и 25 мМ Hepes (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота).
в) Стимуляция РВМС
Далее мононуклеарные клетки периферической крови (РВМС) стимулировали бактериальным штаммом. После отделения РВМС стимулировали бактериальным штаммом в течение 1 и 5 суток. Внутренние контроли в каждом эксперименте представляли собой следующее:
Отрицательный контроль: только РВМС
1-суточный контроль: РВМС, стимулированные 1 мкг/мл липополисахарида (LPS; Escherichia coli, серотип 055:В5, Sigma Chemicals Co., St. Louis, MO).
5-суточный контроль: РВМС, стимулированные 1 мкг/мл фитогемагглютинина (PHA-P; Sigma Chemicals Co., St. Louis, MO).
В различные периоды анализа культуры центрифугировали при 1500 об/мин в течение 10 минут. Супернатанты отбирали и хранили при -20°С до анализа. Клетки использовали для последующих тестов.
г) Анализ пролиферации клеток
Затем выполняли анализ пролиферации клеток. Пролиферацию клеток оценивали цитофлуориметрическим методом с использованием протокола мечения ядер бромдезоксиуридином (BrdU). Этот метод был разработан как альтернатива более традиционной системе радиоактивного мечения тимидином, меченным тритием. В частности, к культурам клеток добавляли смесь 5-бром-2'-дезоксиуридина (BrdU) и 2'-дезоксицитидина (dC), каждый в конечной концентрации 20 мкМ. После 16-часового инкубирования при 37°С в увлажненной атмосфере, 5% CO2, анализировали пролиферацию клеток цитофлуориметрическим методом. Культуральные супернатанты собирали и хранили при -20°С до анализа. После фиксирования и пермеабилизации клеточной стенки клеточную ДНК метили анти-BrdU моноклональными антителами (mAb), коньюгированными с FITC (флуоресцеинизотиоцианат) (Becton Dickinson). Клетки анализировали в течение 24 часов от их получения с использованием цитофлуориметра FACScalibur от Becton Dikinson Company и программы анализа CellQuest.
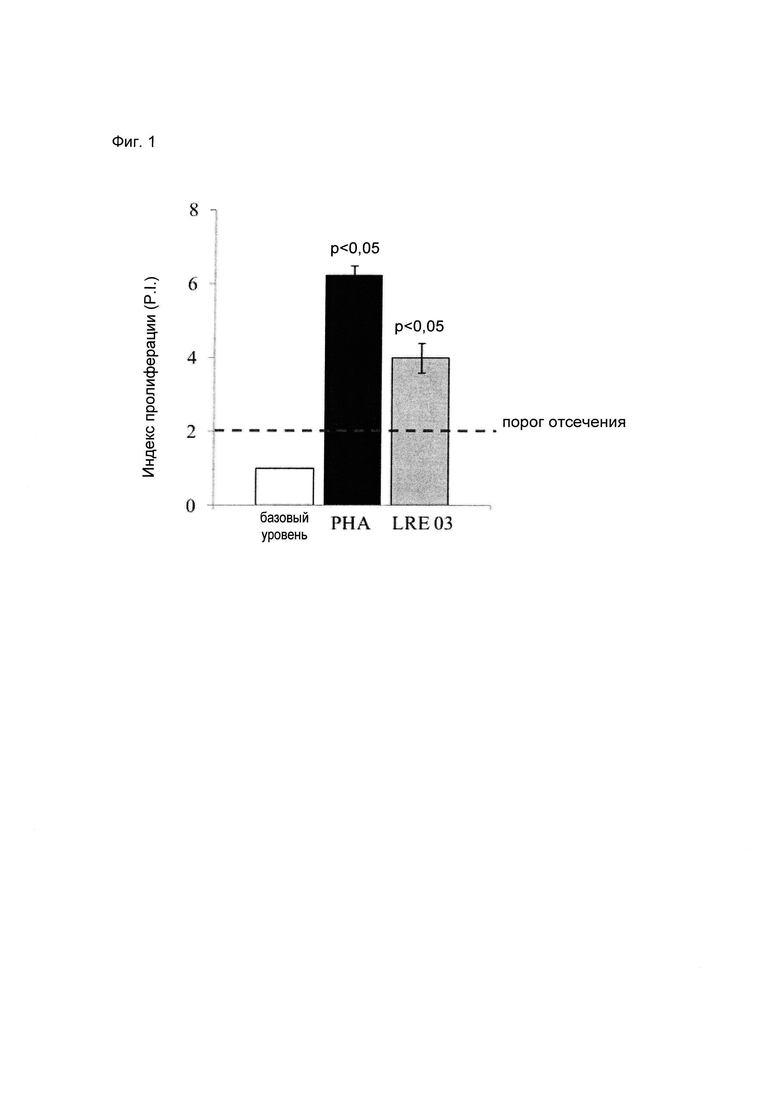
Результаты выражали как индекс пролиферации клеток (P.I.), который рассчитывали как соотношение процента пролиферирующих клеток в присутствии стимулирующего воздействия и процента таких же клеток в отсутствие стимуляции. Величину P.I. больше 2 считали приемлемой (пороговая величина). Во всех экспериментах стимуляция митогеном (РНА) в качестве контроля всегда приводила к величине больше пороговой величины, подтверждая, что РВМС были жизнеспособными и способными к пролиферации.
д) Анализ молекул, характеризующих индивидуальные субпопуляции клеток
Далее проводили анализ молекул, характеризующих индивидуальные субпопуляции клеток. В отношении иммунофенотипической характеристики, клетки инкубировали в течение 30 минут в темноте с различными комбинациями следующих моноклональных антител (mAb), конъюгированных с флуоресцеинизотиоцианатом (FITC), фикоэритрином (РЕ) или перидинин-хлорофилл-протеином (PerCP): CD3, CD4, CD8, CD14, CD16, CD19, CD20, CD56, HLA-DR. После инкубирования образцы промывали, фиксировали раствором, содержащим 1% параформальдегида и хранили при 4°С. В пределах 24 часов после получения образцы анализировали с помощью цитофлуориметра FACScalibur, при этом клетки выбирали так, чтобы исключить из анализа примеси остатков разрушенных клеток.
е) Дозирование цитокинов
Далее выполняли дозирование цитокинов. Концентрацию цитокинов в культуральных супернатантах определяли путем анализа E.L.I.S.A. (твердофазный иммуноферментный анализ). Более конкретно, для дозирования цитокинов (IL-4, IL-10, IFN-γ и IL-12р70) использовали наборы "Human ELISA Ready-SET-Go" от eBioscence Company, San Diego CA.
ж) Статистический анализ
Статистический анализ выполняли с использованием двустороннего парного t-критерия Стьюдента. Величину р менее 0,05 считали значимой.
РЕЗУЛЬТАТЫ
1) Определяли пролиферативный ответ, индуцированный штаммом бактерий Lactobacillus reuteri LRE 03 DSM 23879. Анализ клеточной пролиферации in vitro представляет собой чрезвычайно полезный биологический параметр для исследования функционирования иммунной системы. Для того чтобы проанализировать, может ли тестируемый бактериальный штамм воздействовать на индукцию пролиферации лимфоцитов, мононуклеарные клетки периферической крови (РВМС) стимулировали бактериальным штаммом Lactobacillus reuteri LRE 03 DSM 23879. Фитогемагглютинин (PHA), который представляет собой митогенный стимул, способный индуцировать поликлональную пролиферацию Т-лимфоцитов, использовали в качестве положительного контроля. РВМС выделяли из образцов периферической венозной крови 4 здоровых доноров мужчин возраста 40 лет в среднем (диапазон 21-52 года), из Службы переливания крови (Transfusion Service) Ospedale S.S. Trinita, Borgomanero (Novara).
Как показано на Фиг. 1, где показан индекс пролиферации клеток (P.I., см. описанные выше способы), пролиферативный ответ РВМС во всех условиях стимуляции был значительно выше, чем в отсутствие стимуляции (базовый уровень).
На Фиг. 1 показано среднее ± стандартная ошибка среднего (S.E.M.) по результатам 4 независимых экспериментов. Статистическую значимость рассчитывали с использованием t-критерия Стьюдента. Величины р менее 0,05 следует считать статистически значимыми по сравнению с базовым уровнем (нестимулированные РВМС).
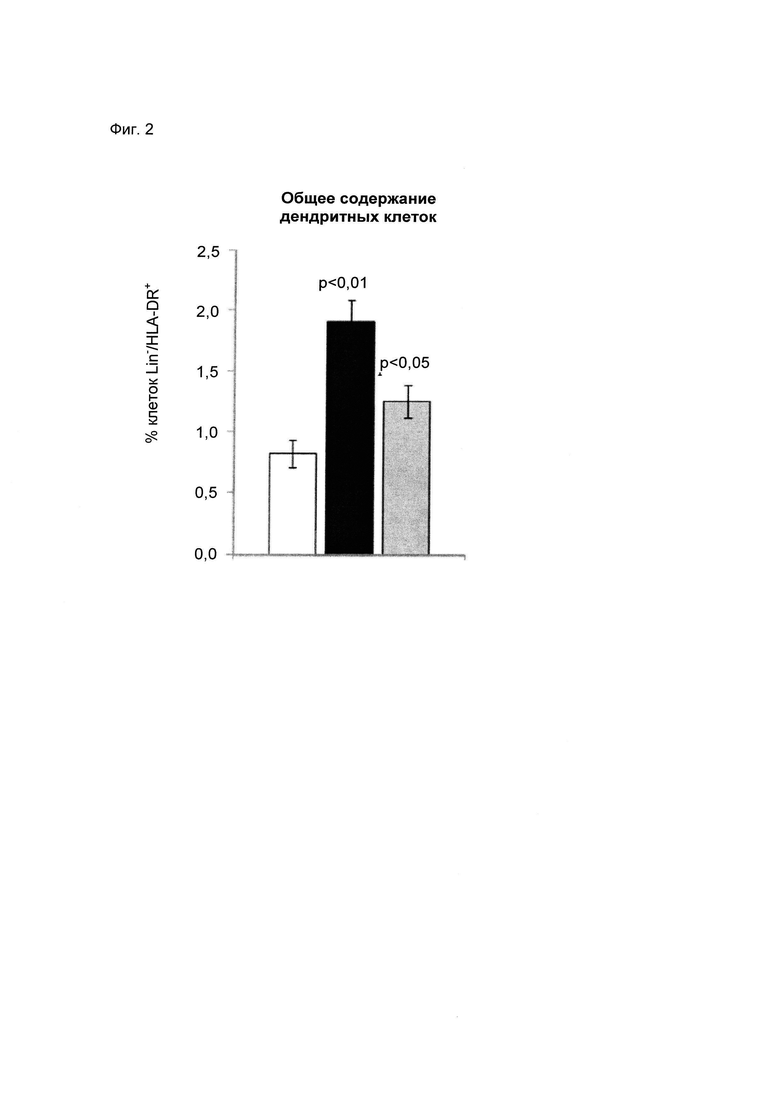
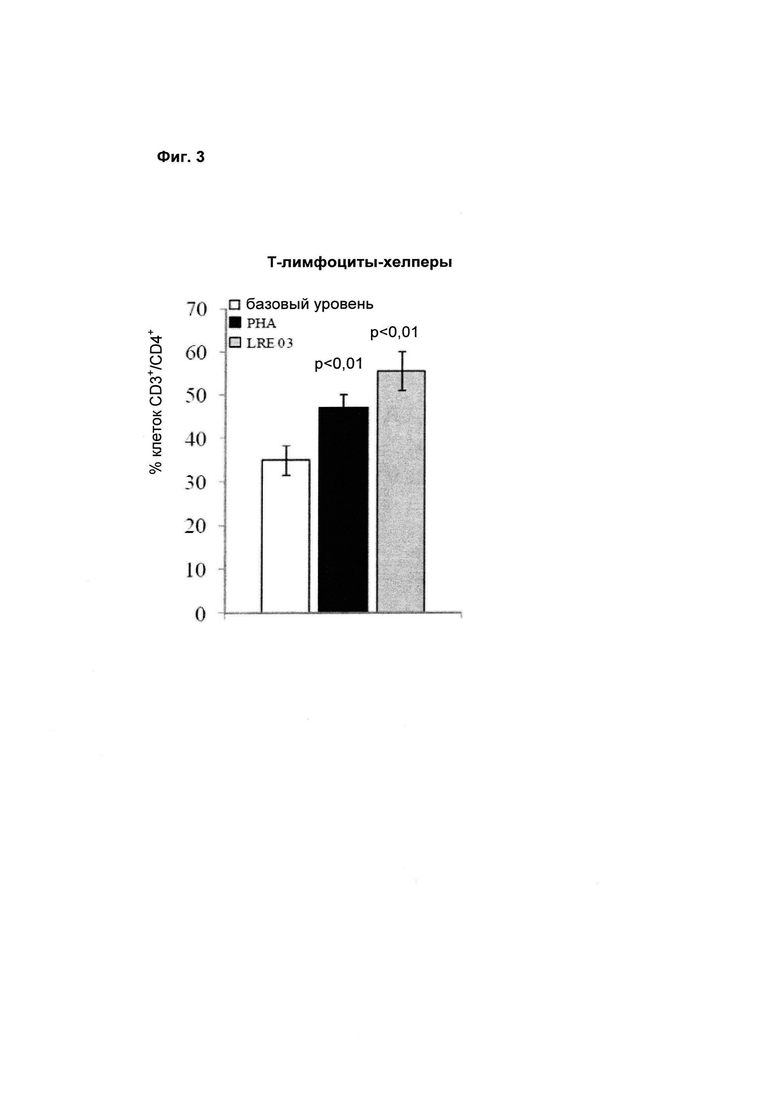
2) Оценивали действие бактериального штамма Lactobacillus reuteri LRE 03 DSM 23879 на различные субпопуляции клеток. Для определения, пролиферация каких субпопуляций клеток была индуцирована после стимуляции тестируемым пробиотическим штаммом, был выполнен многопараметрический анализ проточной цитометрии. На следующих фигурах (Фиг. 2 и Фиг. 3) показано процентное содержание основных субпопуляций клеток, вовлеченных как в врожденный, так и в приобретенный иммунный ответ.
2а) Врожденный иммунитет. Через одни сутки стимуляция бактериальном штаммом Lactobacillus reuteri LRE 03 (DSM 23879) вызывала изменение в общем процентном содержании дендритных клеток (Линия-/HLA-DR+).
На Фиг. 2 показан пролиферативный ответ, среднее ± S.E.M. по результатам 4 независимых экспериментов. Статистическую значимость рассчитывали с использованием t-критерия Стьюдента. Величины р менее 0,05 следует считать статистически значимыми по сравнению с базовым уровнем (нестимулированные РВМС).
2б) Приобретенный иммунитет. Через пять суток стимуляция бактериальным штаммом Lactobacillus reuteri LRE 03 DSM 23879 вызывала значительное увеличение процентного содержания Т-лимфоцитов-хелперов (CD3+/CD4).
На Фиг. 3 показано среднее ± S.E.M. по результатам 12 независимых экспериментов. Статистическую значимость рассчитывали с использованием t-критерия Стьюдента. Величины р менее 0,05 следует рассматривать как статистически значимые по сравнению с базовыми условиями (нестимулированные РВМС).
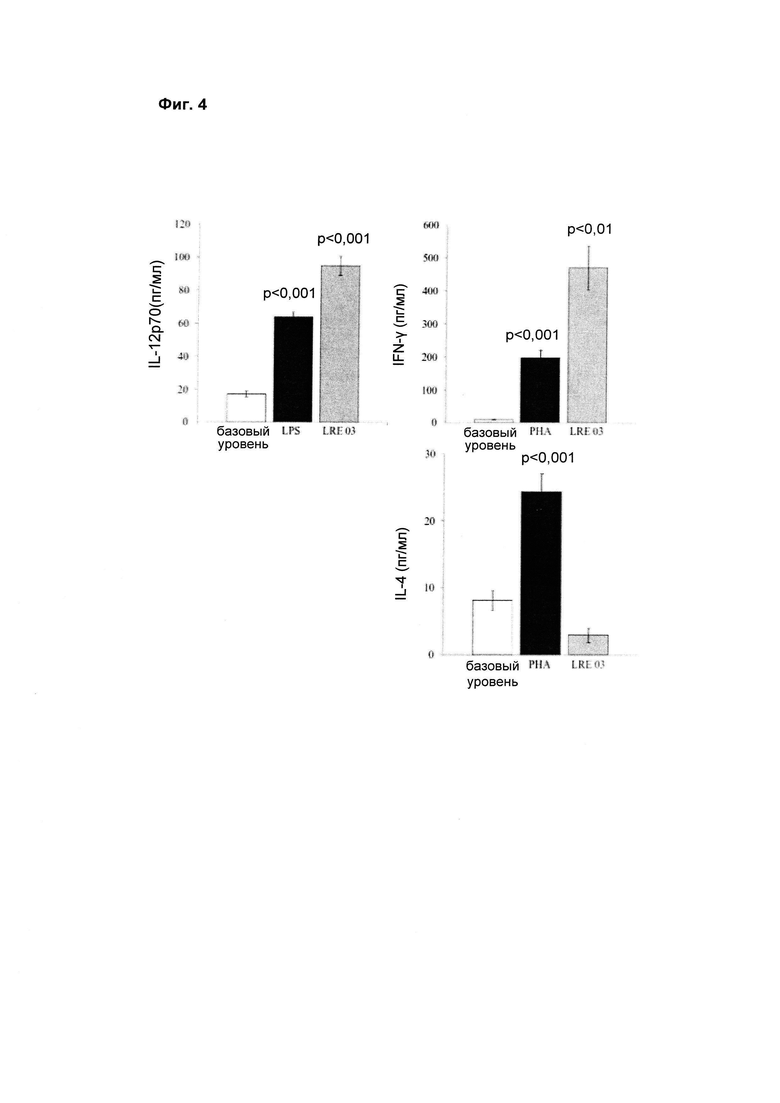
3) Секреция цитокинов. Различный спектр цитокинов, секретируемых субпопуляциями клеток, вовлеченных в иммунные ответы, играет основную роль в выборе эффекторной системы для использования в ответ на специфический антигенный стимул. Т-лимфоциты представляют собой главные эффекторные и регуляторные клетки клеточного иммунитета. В ответ на антиген или патогенный агент Т-клетки синтезируют и секретируют разнообразные цитокины, требуемые для роста и дифференцировки и в качестве активирующих факторов других иммунокомпетентных клеток. Для исследования, будет ли тестируемый бактериальный штамм индуцировать секрецию РВМС различных цитокинов, указанные клетки активировали в течение 1 и 5 суток. Количество цитокинов (IL-12p70, IFN-γ и IL-4), высвобождаемых в культуральные супернатанты, измеряли путем анализа E.L.I.S.A.
4) Цитокины с преимущественно провоспалительным действием. Оценивали индукцию цитокинов IL-12p70 и IFN-γ как основных представителей цитокинов с преимущественно провоспалительным действием. Как показано на Фиг. 4, бактериальный штамм Lactobacillus reuteri LRE 03 (DSM 23879) способен индуцировать значительное увеличение уровня обоих тестируемых цитокинов относительно базовых условий.
5) Цитокины с преимущественно иммунорегуляторным действием. Оценивали индукцию цитокинов IL-4 как основных представителей цитокинов с преимущественно иммунорегуляторным действием. Как показано на Фиг. 4, тестируемый бактериальный штамм Lactobacillus reuteri LRE 03 (DSM 23879) продемонстрировал способность вызывать снижение секреции цитокина IL-4 относительно базовых условий.
На Фиг. 4 показано среднее ± S.E.M. по результатам 4 независимых экспериментов. Статистическую значимость рассчитывали с помощью t-критерия Стьюдента. Величины р менее 0,05 следует рассматривать как статистически значимые по сравнению с базовым уровнем (нестимулированные РВМС). Продукцию цитокинов IL-12p70 оценивали в культуральных супернатантах через 1 сутки стимуляции. Продукцию IFN-γ и IL-4 оценивали в культуральных супернатантах через 5 суток стимуляции.
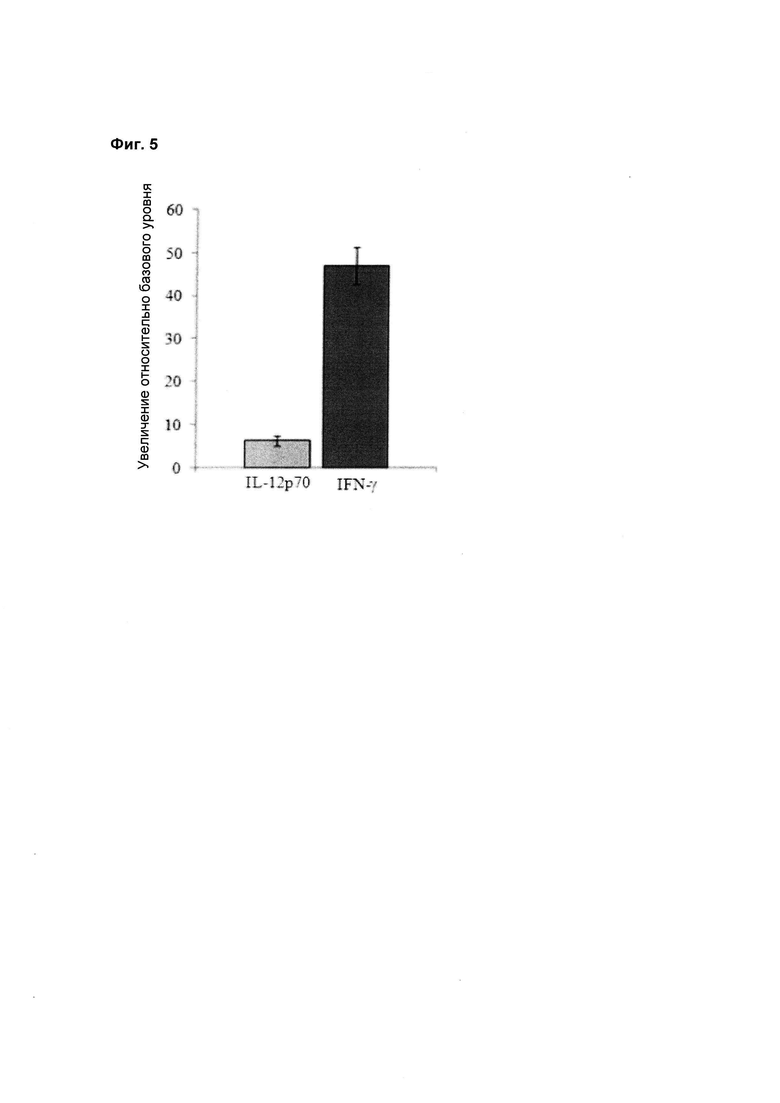
Данные относительно дозировки цитокинов, секретируемых РВМС в результате стимуляции бактериальным штаммом Lactobacillus reuteri LRE 03 DSM 23879, подтвердили способность самого штамма существенно увеличивать уровень провоспалительных цитокинов. Более конкретно, бактериальный штамм Lactobacillus reuteri LRE 03 DSM 23879 увеличивал секрецию цитокина IL-12p70 и цитокина IFN-γ в 6 раз и в 47 раз, соответственно, относительно условий без стимуляции (базовый уровень, Фиг. 5).
В отношении выраженной способности бактериального штамма Lactobacillus reuteri LRE 03 DSM 23879 стимулировать секрецию цитокина IFN-γ, результаты настоящего исследования сравнивали с теми, которые получены в экспериментах на других бактериальных штаммах, которые все принадлежат коллекции Probiotical S.p.A. Более конкретно, сравнивали повышение относительно базового уровня, а именно кратность изменения количества IFN-γ относительно условий без стимуляции (базовый уровень).
Как показано в таблице 1, бактериальный штамм Lactobacillus reuteri LRE 03 (DSM 23879) в результате показал себя наилучшим IFN-γ-индуцирующим агентом по сравнению с обоими штаммами того же самого вида и штаммов различных видов, все из которых принадлежат роду Lactobacillus.
В таблице 1 показано повышение уровня цитокина IFN-γ, индуцированного стимуляцией различными лактобациллами и бифидобактериями по сравнению с базовым уровнем.
Экспериментальная часть
Авторы изобретения протестировали иммуномодулирующие свойства бактериального штамма Lactobacillus salivarius LS 06 DSM 26037 как описано ниже.
Более конкретно, оценивали иммуномодулирующие свойства пробиотического штамма Lactobacillus salivarius LS 06 DSM 26037, ранее охарактеризованного с микробиологической и молекулярной точек зрения, в отношении общего количества циркулирующих дендритных клеток. В частности, после 24 часов стимуляции был проведен многопараметрический анализ проточной цитометрии путем отбора DC (дендритных клеток) из мононуклеарных клеток периферической крови здоровых взрослых доноров.
а) Бактериальные культуры и условия роста
Штамм культивировали в среде Ман-Рогоза-Шарпе (MRS) на термостатируемой бане при 37°С. В отношении экспериментов по иммуномодулированию, после периода роста приблизительно 16 часов бактерии субкультивировали в течение 6 часов в вышеизложенных условиях до достижения экспоненциальной фазы роста. Так, их дважды промывали стерильным фосфатно-солевым буфером (PBS, рН 7,2), физиологический статус и число клеток определяли цитофлуориметрическим методом с использованием набора "Cell Viability Kit with liquid beads", доступного в продаже от Becton Dickinson Company, в соответствии с инструкциями производителя. Затем концентрацию клеток доводили до оптимальной концентрации, установленной в предварительных экспериментах, и использовали в последующих тестах.
б) Отделение мононуклеарных клеток периферической крови
Мононуклеарные клетки периферической крови (РВМС) отделяли путем центрифугирования в градиенте плотности. Для этой цели 20 мл "лейкоцитарной пленки" здоровых доноров из Службы переливания крови (Immuno-transfusion Service) Ospedale di Borgomanero (Italy) использовали в каждом эксперименте, таким образом получая средний выход 200×106 РВМС/лейкоцитарная пленка. Количество отделенных клеток определяли путем подсчета клеток в камере Бюркера с использованием раствора Тюрка, который позволяет различить мононуклеарные клетки и полиморфоядерные клетки. Концентрацию клеток доводили до 2×106 клеток/мл в ростовой среде RPMI-1640 (Invitrogen), дополненной 10% инактивированной нагреванием эмбриональной сыворотки крупного рогатого скота (FCS, Gibco), 1% глутамина и 25 мМ Hepes.
в) Стимуляция РВМС
После отделения РВМС стимулировали бактериальным штаммом в течение 24 часов. Внутренние контроли в каждом эксперименте представляли собой следующее: Отрицательный контроль: только РВМС; 1-суточный контроль: РВМС, стимулированные 1 мкг/мл липополисахарида (LPS; Escherichia coli, серотип 055:В5, Sigma Chemicals Co., St. Louis, MO).
После стимуляции культуры центрифугировали при 1500 об/мин в течение 10 минут. Затем супернатант отбрасывали и клетки использовали в последующих тестах.
г) Общий анализ дендритных клеток
В отношении иммунофенотипической характеристики, клетки инкубировали в течение 30 минут в темноте с различными комбинациями следующих моноклональных антител (mAb), коньюгированных с флуоресцеинизотиоцианатом (FITC) или перидинин-хлорофилл-протеином (PerCP): CD3, CD14, CD16, CD19, CD20, CD56 и HLA-DR. После инкубации образцы промывали, фиксировали раствором, содержащим 1% параформальдегида, и хранили при 4°С. В пределах 24 часов после получения образцы анализировали с помощью цитофлуориметра FACScalibur, при этом клетки выбирали так, чтобы исключить из анализа примеси остатков разрушенных клеток.
д) Статистический анализ
Статистический анализ выполняли с использованием двустороннего парного t-критерия Стьюдента. Величину р менее 0,05 считали значимой.
Результаты: Действие бактериального штамма на дендритные клетки
Для определения действия тестируемого пробиотического штамма на модулирование дендритных клеток проводили многопараметрический анализ проточной цитометрии.
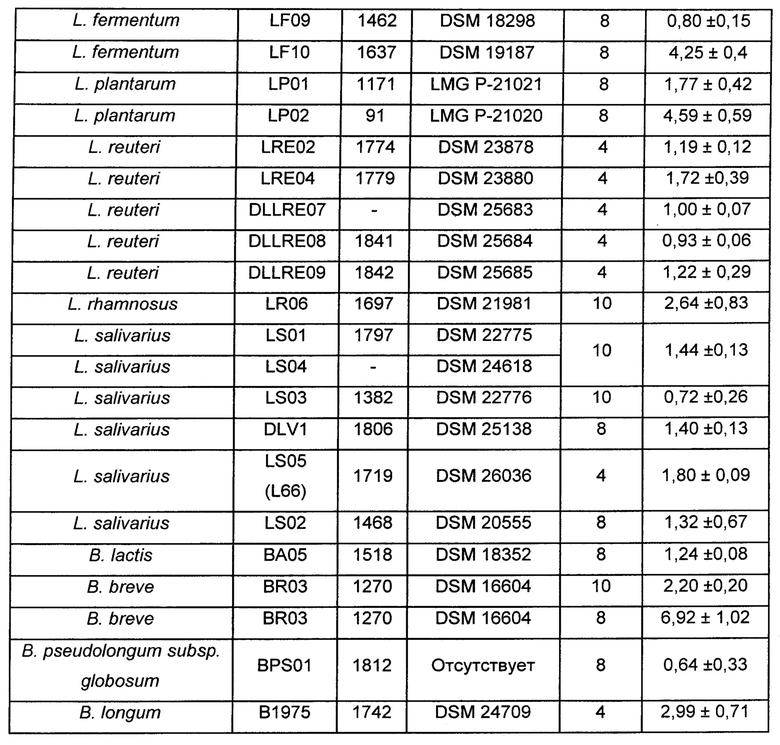
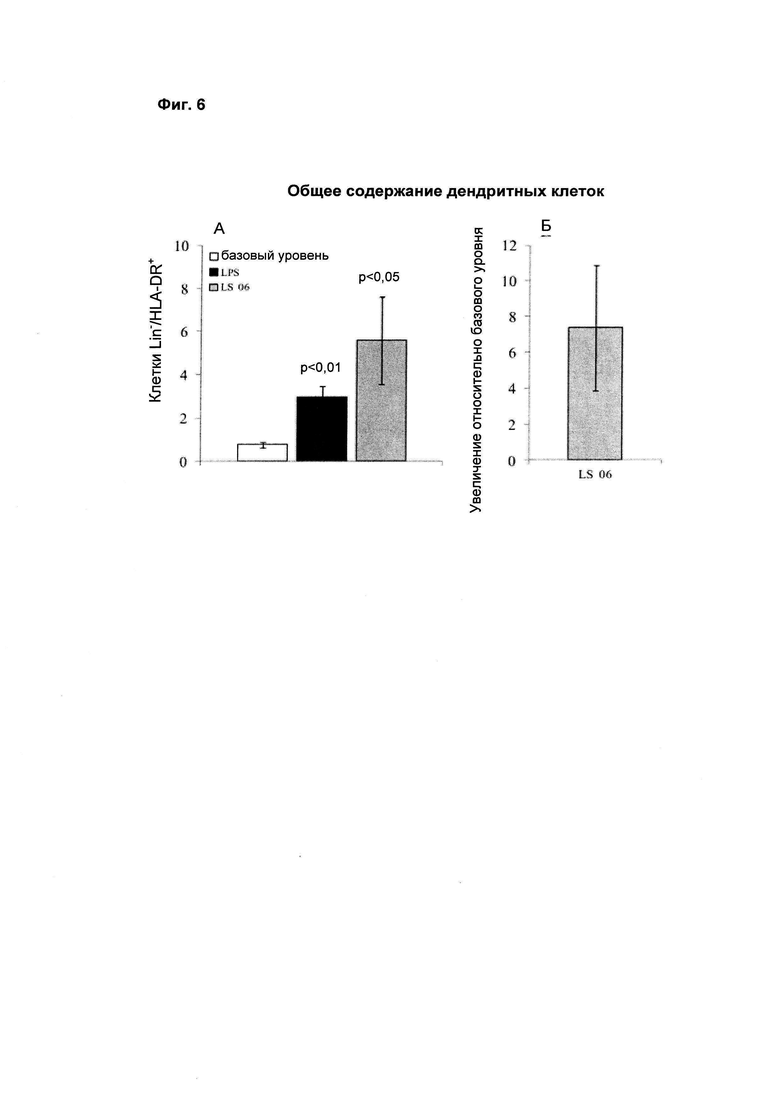
Как показано на Фиг. 6А, через 24 часа стимуляция штаммом LS 06 индуцировала значительное увеличение общего процентного содержания дендритных клеток (Линия-/HLA-DR+).
Более конкретно, бактериальный штамм L. salivarius LS 06 (DSM 26037) увеличивал общее процентное содержание дендритных клеток в 7 раз относительно условий без стимуляции (базовый уровень, Фиг. 6Б).
На Фиг. 6Б показано среднее ± S.E.M. по результатам 12 независимых экспериментов. Статистическую значимость рассчитывали с использованием t-критерия Стьюдента. Величины р менее 0,05 следует рассматривать как статистически значимые по сравнению с базовым уровнем (нестимулированные РВМС).
В таблице 2 показано увеличение количества дендритных клеток, индуцированное стимуляцией различными лактобациллами и бифидобактериями, относительно базового уровня.
Заключение
Данные продемонстрировали, что бактериальный штамм L salivarius LS 06 индуцировал значительное повышение общего процентного содержания DC относительно стандартных базовых условий. В частности, бактерия LS 06 увеличивала в 7 раз общее процентное содержание DC.
Колонизация кишечника бактериями, способными модулировать дендритные клетки, такими как штамм L. salivarius LS 06, охарактеризованный в настоящем исследовании, представляет собой очень важный фактор при заболеваниях, характеризуемых иммунологическим дисбалансом.
Настоящее изобретение относится к фармацевтической промышленности, а именно к композиции для иммуностимуляции при лечении заболеваний, выбранных из опухолевого заболевания при химиотерапевтическом лечении, синдрома приобретенного иммунодефицита и лейкоза. Композиция для иммуностимуляции при лечении заболеваний, выбранных из опухолевого заболевания при химиотерапевтическом лечении, синдрома приобретенного иммунодефицита и лейкоза, содержащая: штамм бактерий, принадлежащих виду Lactobacillus reuteri, идентифицированный как Lactobacillus reuteri LRE03, с депозитарным номером DSM 23879, депонированный 05.08.2010 Probiotical SpA в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ GmbH), и штамм бактерий, принадлежащих виду Lactobacillus salivarius, идентифицированный как Lactobacillus salivarius LS06, с депозитарным номером DSM 26037, депонированный 06.06.2012 Probiotical SpA в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ GmbH), в массовом соотношении от 1:5 до 5:1, где указанная композиция имеет концентрацию бактерий от 1x108 колониеобразующих единиц (КОЕ)/г до 1x1012 КОЕ/г. Вышеописанная композиция является эффективной для иммуностимуляции при лечении заболеваний, выбранных из опухолевого заболевания при химиотерапевтическом лечении, синдрома приобретенного иммунодефицита и лейкоза. 8 з.п. ф-лы, 2 табл., 6 ил.
1. Композиция для иммуностимуляции при лечении заболеваний, выбранных из опухолевого заболевания при химиотерапевтическом лечении, синдрома приобретенного иммунодефицита и лейкоза, содержащая:
- штамм бактерий, принадлежащих виду Lactobacillus reuteri, идентифицированный как Lactobacillus reuteri LRE03, с депозитарным номером DSM 23879, депонированный 05.08.2010 Probiotical SpA в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ GmbH), и
- штамм бактерий, принадлежащих виду Lactobacillus salivarius, идентифицированный как Lactobacillus salivarius LS06, с депозитарным номером DSM 26037, депонированный 06.06.2012 Probiotical SpA в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ GmbH),
в массовом соотношении от 1:5 до 5:1, где указанная композиция имеет концентрацию бактерий от 1x108 колониеобразующих единиц (КОЕ)/г до 1x1012 КОЕ/г.
2. Композиция по п. 1, имеющая концентрацию бактерий от 1x109 КОЕ/г до 1x1011 КОЕ/г.
3. Композиция по п. 1 или 2, где указанная композиция содержит:
- штамм бактерий Lactobacillus reuteri LRE03 DSM 23879 и штамм бактерий Lactobacillus salivarius LS06 DSM 26037 в массовом соотношении от 1:3 до 3:1, предпочтительно от 1:2 до 2:1 или 1:1.
4. Композиция по любому из пп. 1-3, дополнительно содержащая гель Aloe, предпочтительно гель Aloe arborescens; причем еще более предпочтительно гель представляет собой лиофилизированный гель Aloe arborescens.
5. Композиция по любому из пп. 1-4, содержащая лиофилизированный гель Aloe arborescens в количестве от 1 до 25% по массе относительно массы композиции, предпочтительно от 5 до 15% по массе относительно массы композиции.
6. Композиция по любому из пп. 1-5, дополнительно содержащая штамм бактерий, принадлежащих виду Bifidobacterium lactis, идентифицированный как Bifidobacterium lactis Bb 1, с депозитарным номером DSM 17850, депонированный в DSMZ 23.12.2005 BioMan S.r.l. Company, в виде тиндализованного бактериального продукта, где указанный штамм обладает способностью аккумулировать цинк внутри клеток во время его роста в жидкой культуральной среде.
7. Композиция по п. 6, где указанный тиндализованный бактериальный продукт штамма Bifidobacterium animalis ssp. lactis Bb1 DSM 17850 присутствует в количестве от 10 до 50 мг/г композиции, предпочтительно 20 мг/г композиции.
8. Композиция по любому из пп. 1-7, дополнительно содержащая один или более чем один эксципиент, и/или добавку, и/или вспомогательный компонент препаратов, соответствующие критериям пищевой чистоты или фармакологической чистоты, приемлемые для организма, предпочтительно такие, как фруктоолигосахариды (FOS), и/или зеленый чай, и/или сукралоза, и/или мальтодекстрины.
9. Композиция по любому из пп. 1-8, предназначенная для применения у человека и животного в качестве противоопухолевого агента.
| KR 20130048946 A, 13.05.2013 | |||
| US 20130309212 A1, 21.11.2013 | |||
| US 20100143305 А1, 10.06.2010 | |||
| US 6103227 A, 18.08.2000 | |||
| WO 2013034974 A1, 14.03.2013. |
Авторы
Даты
2020-05-20—Публикация
2015-04-30—Подача