Изобретение относится к медицине, а именно к биофизике клеточных мембран человека, к гематологии и может быть использовано для изучения мембран эритроцитов (МЭ) и диагностики различных патологических процессов в крови.
Уровень техники
Известен ряд способов исследования структурных компонент МЭ с помощью различных биофизических и физико-химических методов. В основном известные способы касаются исследований отдельно каждого из элементов мембраны: амплитуды автоколебаний мембраны (фликкеринга), спектринового матрикса, белковых кластеров.
Известен ряд способов, позволяющих оценивать состояние МЭ по эффекту повреждения мембран. В частности, известен тест на механическую хрупкость МЭ (ERYTHROCYTE MECHANICAL FRAGILITY TEST US 2014017718). В соответствии с данным способом осуществляют механическое воздействие на клетки и оценивают уровень гемолиза. Однако при этом оценивают интегральный эффект повреждения всех выше указанных компонентов мембраны.
Следует отметить, что все известные методы, оценивающие механическую хрупкость мембран, также как и приведенный выше, основаны на нарушении структуры мембран и последующем гемолизе клеток. Это означает нарушение целостности МЭ в процессе диагностики. При этом происходит нарушение спектринового матрикса, фликкеринга, белковых комплексов и клеток в целом.
В то же время известны способы изучения мембран, при которых мембраны и клетки не подвергаются разрушительному воздействию.
Известен способ контроля скорости флуктуаций МЭ с помощью цифрового голографического микроскопа (Dynamic parameters based red blood cell membrane fluctuation inspection method and digital holographic microscopy used in the same KR 101805152). Кроме того изучению процесса флуктуаций МЭ (фликкеринг) посвящен ряд научных статей: Madalena Costa, Ionita Ghiran, С.-К. Peng, Anne Nicholson-Weller and Ary L. Goldberger «Complex dynamics of human red blood cell flickering: Alterations with in vivo aging» // Phys Rev E Stat Nonlin Soft Matter Phys. 2008 August; 78 (2 Pt 1): 020901).
Известен метод исследования изменений спектринового матрикса как индикатора клеточной патологии (Method for detecting cellular pathology WO 9002949). Однако используемый при этом иммунохимический метод анализа продуктов распада спектрина - компонента цитоскелета, не позволяет измерить пространственные размеры исследуемого спектринового матрикса.
Известный способ определения уплотненных белково-липидных участков в МЭ различной степени зрелости с помощью компьютерной программы Bio Vision (RU 2390020) включает сочетание оптических и компьютерных методов визуализации интермембранных объектов. Однако разрешающая способность метода остается недостаточной для визуализации нанообъектов мембран клеток крови.
Наиболее близким к заявляемому способу по совокупности существенных признаков является способ интегральной оценки силы белок-липидного взаимодействия в МЭ, в соответствии с которым измеряют параметры флуоресценции, отражающие количество и степень погруженности в липиды мембранных белков (RU 2187112). Принят в качестве прототипа. Однако флюоресцентный метод, предел разрешения которого составляет 500÷1000 нм, не позволяет получить изображения и изучить процессы в исследуемых объектах на расстояниях меньших нескольких длин волн света, что значительно превышает размеры мембранных наноструктур.
Заявляемое изобретение направлено на решение задачи выявления патологических изменений в структурных элементах МЭ.
Использование в лабораторной и клинической практике заявляемого способа позволяет достичь нескольких технических результатов:
• приближение исследуемого объекта (МЭ и ее структуры) к нативным условиям существования за счет сохранения целостности клетки и клеточной мембраны при исследовании;
• одновременное комплексное измерение характеристик основных наноструктур МЭ (элементы фликкеринга, спектриновый матрикс, белковые кластеры);
• одновременная оценка вероятности отклонения характеристик всех трех выше указанных наноструктур от контрольных значений;
• повышение точности исследования наноструктур МЭ за счет высокой разрешающей способности получаемых изображений при использовании метода атомной силовой микроскопии (АСМ),
• возможность количественно оценить степень влияния патологического фактора на состояние крови.
Указанные технические результаты при осуществлении изобретения достигаются за счет того, что также как в известном способе, используют физический способ получения информации о состоянии белков и липидов в мембране без нарушения ее целостности.
Особенность заявляемого способа заключается в том, что осуществляют следующие стадии: сканируют поверхность П клеток с помощью АСМ в поле размером (1,2÷1,6)×(1,2÷1,6) мкм2, осуществляют разложение полученного изображения поверхности П на изображения поверхностей трех пространственных масштабов П1 П2, П3, соответствующих параметрам физиологических структур МЭ: масштаб П1 для которого типовой пространственный период структур данной поверхности L1=400÷900 нм соответствует параметрам фликкеринга МЭ, масштаб П2, для которого типовой пространственный период структур данной поверхности L2=50÷200 нм соответствует параметрам спектринового матрикса МЭ, масштаб П3 для которого типовой пространственный период структур данной поверхности L3=5÷40 нм соответствует параметрам белковых кластеров МЭ. Измеряют высоты h1, h2, h3 выявленных топологических наноструктур на выделенных трех поверхностях; вычисляют средние значения h1cp, h2cp, h3cp и средние квадратичные отклонения σ1, σ2, σ3 этих высот, определяют вероятность отклонения величин высот наноструктур P1, Р2, Р3 для всех трех поверхностей от величин, соответствующих параметрам физиологических структур МЭ в нормальном контрольном мазке. Величина Р1 более 30% для поверхности первого масштаба П1 свидетельствует об отклонении величины амплитуды фликкеринга от нормальных значений, величина Р2 более 30% для поверхности второго масштаба П2 свидетельствует об отклонении физических характеристик спектринового матрикса от нормальных значений, величина Р3 более 30% для поверхности третьего масштаба П3 свидетельствует о возникновении кластеризации интермембранных белков.
Раскрытие сущности изобретения
При воспалительных процессах в организме, при инфицировании организма, при эндогенной и экзогенной интоксикации, при сепсисе, при действии ионизирующего излучения, при длительном хранении донорской крови, при трансфузии и др. в крови развиваются патологические процессы - окислительные, иммунные и др. В результате этого нарушается функционирование клеток крови, в частности красных клеток, следствием чего может стать гипоксия и некроз тканей. Также могут иметь место изменения реологических свойств крови, нарушающие кровоснабжение тканей. При развитии патологических процессов в крови изменяется морфология эритроцитов - форма клеток и/или их слияние, что свидетельствует о нарушении стабильного состояния МЭ. Пусковым механизмом изменения морфологии эритроцитов является нарушение наноструктур в МЭ.
Зарождение и развитие патологических процессов именно на молекулярном уровне в МЭ является индикатором патологического воздействия физико-химических факторов на кровь.
К наноструктурам МЭ можно отнести следующие структурные элементы: элементы фликкеринга, спектриновый матрикс, белковые кластеры.
Различные факторы могут оказать патологическое воздействие на различные исследуемые структуры.
Экспериментально показано, что мембранные флуктуации (поверхность П1) изменяются в зависимости от условий существования эритроцитов, в частности наблюдается различие для молодых и старых клеток, наблюдаются изменения при внедрении малярийного плазмодия в эритроциты, при серповидноклеточной анемии. Также предполагается, что измерение характеристик фликкеринга может быть полезным для оценки клеточных процессов и для диагностики заболеваний (С Monzel and К Sengupta Measuring shape fluctuations in biological Membranes.: 2016 J. Phys. D: Appl. Phys. 49 243002).
Главной функцией спектринового матрикса (поверхность П2) является поддержание стабильности цитоскелета мембраны и ее механических свойств. Клиническими проявлениями нарушения элементов спектринового матрикса является гемолитическая анемия, сфероцитоз, эллиптоцитоз (Zhang Ruil, Zhang ChenYul, Zhao Qi & Li DongHail Spectrin: Structure, function and disease// Sci China Life Sci December (2013) Vol. 56 No. 12: 1076-1085).
Показано, что при длительном хранении донорской крови в специальных растворах при температуре 4°С в МЭ в первые две недели хранения происходит кластеризация белков band 3 в большие агрегаты (поверхность П3), что является одной из причин везикуляции (Brad S. Karon, James D. Hoyer, James R. Stubbs, and David D. Thomas. Changes in Band 3 oligomeric state precede cell membrane phospholipid loss during blood bank storage of red blood cells// Transfusion. 2009 July; 49(7): 1435-144).
Необходимость комплексного определения состояния выше указанных мембранных элементов вызвано тем, что способность эритроцитов к деформации в сосудах диаметром меньшим размеров клеток определяется состоянием всех трех указанных структур одновременно. Кроме этого, характеристики этих элементов структурно и функционально взаимосвязаны. Измерение их по отдельности в разные моменты времени приведет к искажению причинно-следственных связей при анализе процессов в клетке и в мембране.
Способ осуществляют следующим образом.
Предварительно измеряют соответствующие контрольные (нормальные) величины параметров для МЭ 30 здоровых доноров.
Для приближения к нативным условиям сохраняют морфологию эритроцитов при приготовлении мазков монослоя клеток с помощью специального устройства V-sample (Австрия). С помощью АСМ сканирования получают сначала изображения клеток в поле 50÷100 мкм. Затем получают АСМ изображение отдельной выбранной клетки. Получают АСМ изображение поверхности П участка мембраны (1,2÷1,6)×(1,2÷1,6) мкм2. Выбор размеров площади поверхности мембраны определяется размерами изучаемых элементов поверхности - элементы фликкеринга, спектриновый матрикс и мембранные кластеры.
С помощью программного обеспечения АСМ осуществляют разложение полученного изображения поверхности П на три изображения поверхностей трех пространственных масштабов П1, П2, П3, причем П-П1+П2+П3. Эти три изображения соответствуют параметрам физиологических структур МЭ: масштаб П1 для которого типовой пространственный период структур данной поверхности L1=400÷900 нм соответствует параметрам фликкеринга МЭ, масштаб П2, для которого типовой пространственный период структур данной поверхности L2=50÷200 нм соответствует параметрам спектринового матрикса МЭ, масштаб П3 для которого типовой пространственный период структур данной поверхности L3=5÷40 нм соответствует параметрам белковых кластеров МЭ.
Для получения изображения поверхности первого масштаба П1 изображение исходной поверхности П сглаживают фильтром с помощью программного обеспечения АСМ (маска 9 точек), затем из изображения П вычитают изображение П1 и получают изображение П2+П3, его сглаживают фильтром (маска 3 точки) и получают изображение второго масштаба П1, из изображения П2+П3 вычитают изображение П2 и получают изображение поверхности третьего масштаба П3.
Для каждого из трех изображений поверхностей измеряют высоты h1, h2, h3 выявленных топологических наноструктур. Затем вычисляют средние значения h1cp, h2cp, h3cp и средние квадратичные отклонения σ1, σ2, σ3 этих высот.
Для каждого из трех изображений поверхностей вычисляют вероятность Р1, Р2, Р3 того, что величины высот в исследуемом образце выходят за рамки контрольных значений соответствующих поверхностей первого, второго, третьего масштабов.
Величина вероятности указывает на факт отклонения характеристик наноповерхности мембраны от нормальных значений и позволяет количественно оценить степень воздействия на исселуемую структуру i:
• величина Р1 более 30% для поверхности первого масштаба П1 свидетельствует об отклонении амплитуды фликкеринга от нормальных значений,
• величина Р2 более 30% для поверхности второго масштаба П2 свидетельствует об отклонении физических характеристик спектринового матрикса от нормальных значений,
• величина Р3 более 30% для поверхности третьего масштаба П3 свидетельствует о возникновении кластеризации интермембранных белков.
При величине Pi более 60% воздействие на структуру i считают сильным, при величине Pi от 30% до 60% воздействие считают средним (умеренным), при величине Pi от 5% до 30% воздействие считают слабым, при величине Pi менее 5% считают, что данный фактор не проявил изменений структуры i.
Примеры осуществления изобретения
Измерение высот h1, h2, h3 топологических нанодефектов поверхностей трех масштабов П1, П2, П3 МЭ крови здорового человека (контрольный образец) in vitro.
На предметном стекле был приготовлен мазок монослоя клеток из крови здорового донора. Затем полученный мазок был просканирован с помощью АСМ NTEGRA PRIMA (NT-MDT, Зеленоград, РФ). Для сканирования были использованы стандартные кантилеверы NSG01 (5 н/м). Для сканирования были выбраны поля размером 100×100 мкм2 и 10×10 мкм2. Число точек сканирования вдоль одной линии составило 512 и 1024 соответственно.
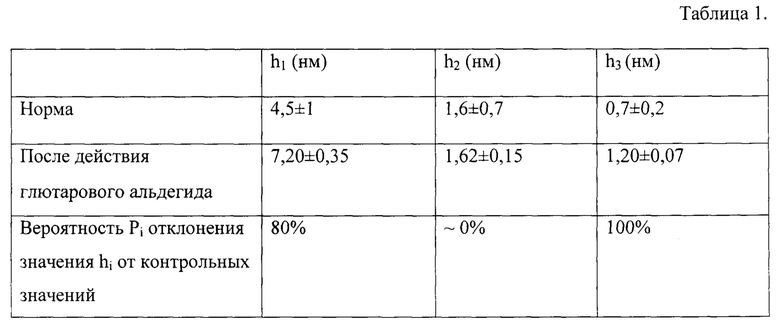
На полученном изображении поверхности клетки была выделен фрагмент площадью 1,2-1,5 × 1,2-1,5 мкм. Эта поверхность была обозначена П. Изображение поверхности П МЭ из крови здорового донора и профиль высот топологии наноповерхности МЭ в заданном сечении, указанном пунктиром, представлены на Фиг. 1.
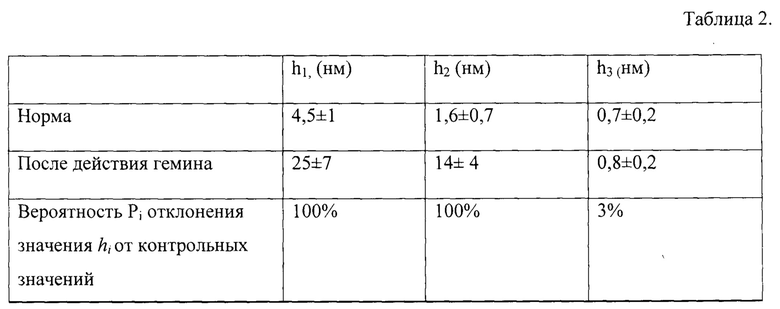
К изображению поверхности П был применен прием сглаживания с использованием фильтров 9×9 с помощью программного обеспечения АСМ. Таким образом было получено изображение поверхности первого масштаба П1 (представлено на Фиг. 2а). Типовой профиль высот топологии наноповерхности в заданном сечении после сглаживания с использованием фильтров 9×9 представлен на Фиг. 2б.
Характерными параметрами профиля топологической структуры наноповерхности эритроцита первого масштаба П1 являются высота h1 и пространственный период L1. Величина L1 - это типовой пространственный период структур да данной поверхности первого масштаба, то есть расстояние между впадинами или пиками на профиле (Фиг. 2б.) Эмпирическим путем установлено, что в норме эти величины составляют h1норм=4,5±1 нм и L1норм=700±150 нм.
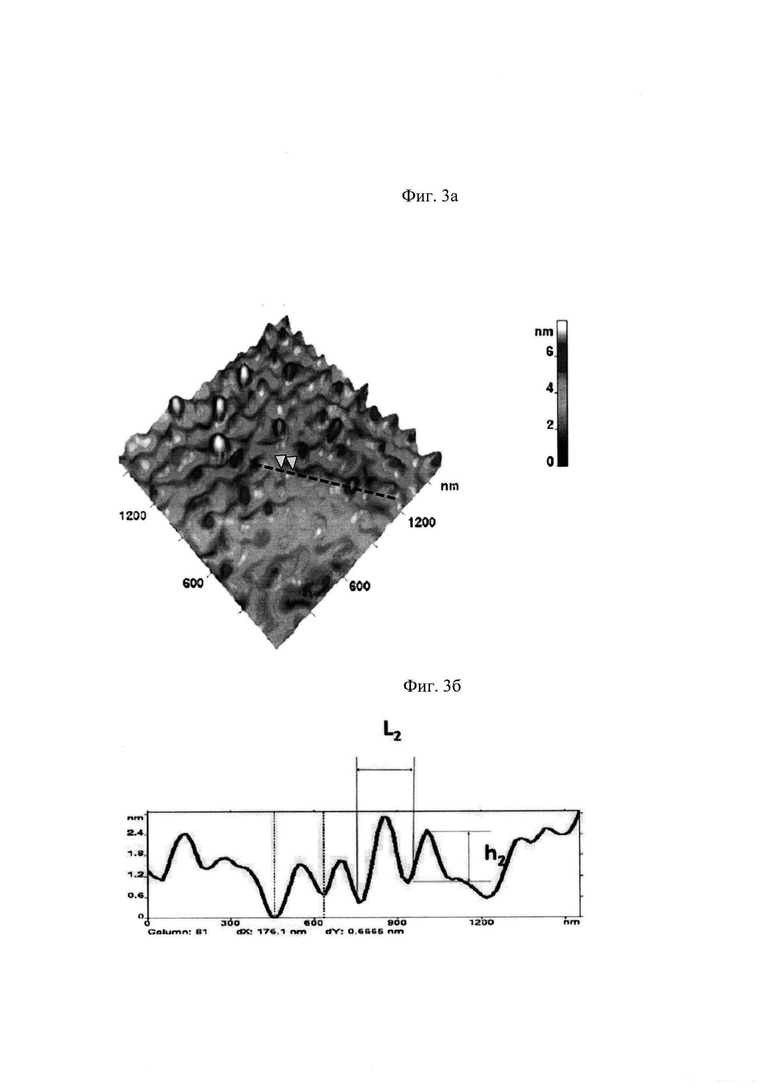
Далее из изображения исходной поверхности П вычитали изображение поверхности П1 и получали поверхность П2+П3. К полученному изображению П2+П3 был применен прием сглаживания с использованием фильтров 3×3 с помощью программного обеспечения АСМ. Таким образом было получено изображение поверхности второго масштаба П2 (представлено на Фиг. 3а). Типовой профиль высот топологии наноповерхности второго масштаба П2 в заданном сечении представлен на Фиг. 3б.
Характерными параметрами профиля топологической структуры наноповерхности эритроцита второго масштаба П2 являются высота h2 и пространственный период L2. Эмпирическим путем установлено, что в норме эти величины составляют h2норм=1,6±0,7 нм и L2норм=120±80 нм.
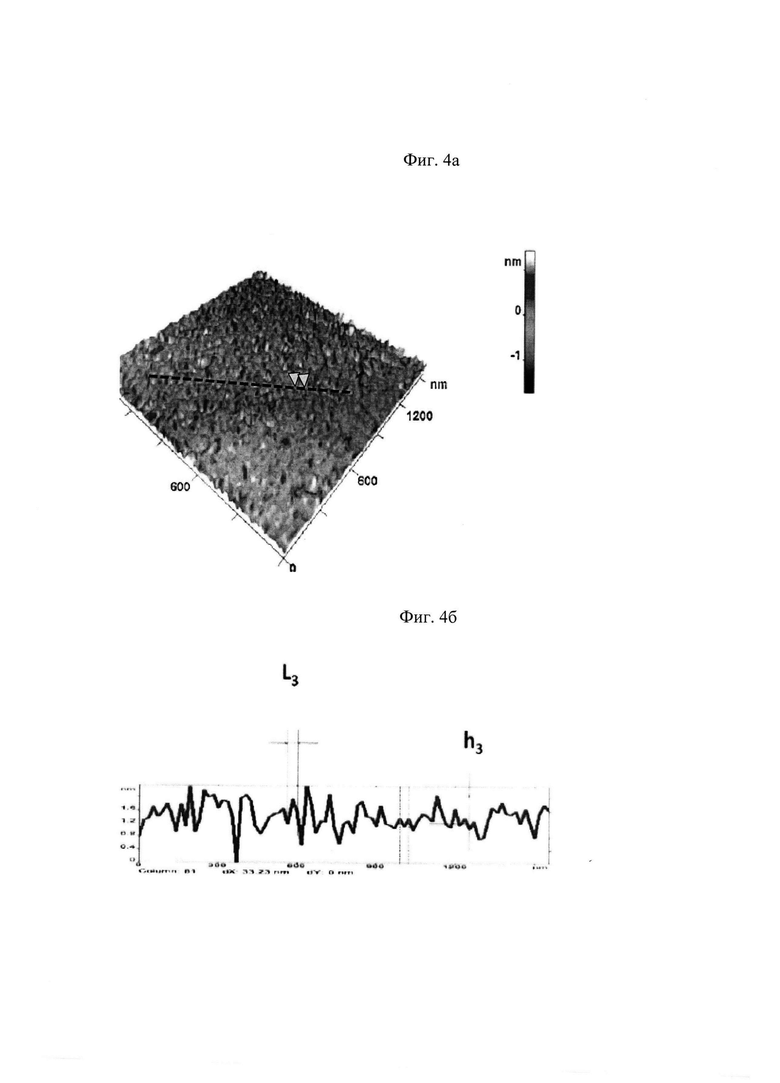
Далее из полученного ранее изображения П2+П3 вычитали изображение поверхности П2. В результате было получено изображение поверхности третьего масштаба П3 (представлено на Фиг. 4а) и соответствующий профиль высот (представлен на Фиг. 4б).
Характерными параметрами профиля топологической структуры наноповерхности эритроцита третьего масштаба П3 являются высота h3 и пространственный период L3. Эмпирическим путем установлено, что в норме эти величины составляют h3норм=0,7±0,2 нм и L3норм 40±10 нм.
2. Изменение наноповерхности МЭ при добавлении фиксатора - глютарового альдегида в кровь (in vitro)
Глютаровый альдегид широко используется для фиксации клеток в процессе их исследования. Однако действие фиксатора приводит к изменениям структуры мембран клеток. Это необходимо принимать во внимание при изучении топологической наноструктуры мембран клеток крови после воздействия на кровь различных физико-химических факторов.
Для исследования действия глютарового альдегида на наноструктуру поверхности мембран эритроцитов авторами были проведены модельные опыты, в которых к 50 мкл эритроцитов, выделенных из крови донора, добавляли 50 мкл 1% глютарового альдегида. Через 10 мин инкубации эритроциты трижды промывали в 0,9% растворе NaCl с помощью центрифуги (RPM 3000 мин-1) и формировали монослой клеток. Получали с помощью АСМ изображения наноповерхности МЭ в трех масштабах и измеряли соответствующие высоты h1глют, h2глют, h3глют. В таблице 1 представлены значения параметров hi=hiсредн±σi для высот поверхностей разного масштаба Пi в контрольном образце и в исследуемом после действия глютарового альдегида, i=1, 2, 3. Представленные результаты свидетельствуют о сильном воздействии глютарового альдегида на амплитуду фликкеринга, а также на кластеры белков. Практически отсутствует воздействие глютарового альдегида на спектриновый матрикс.
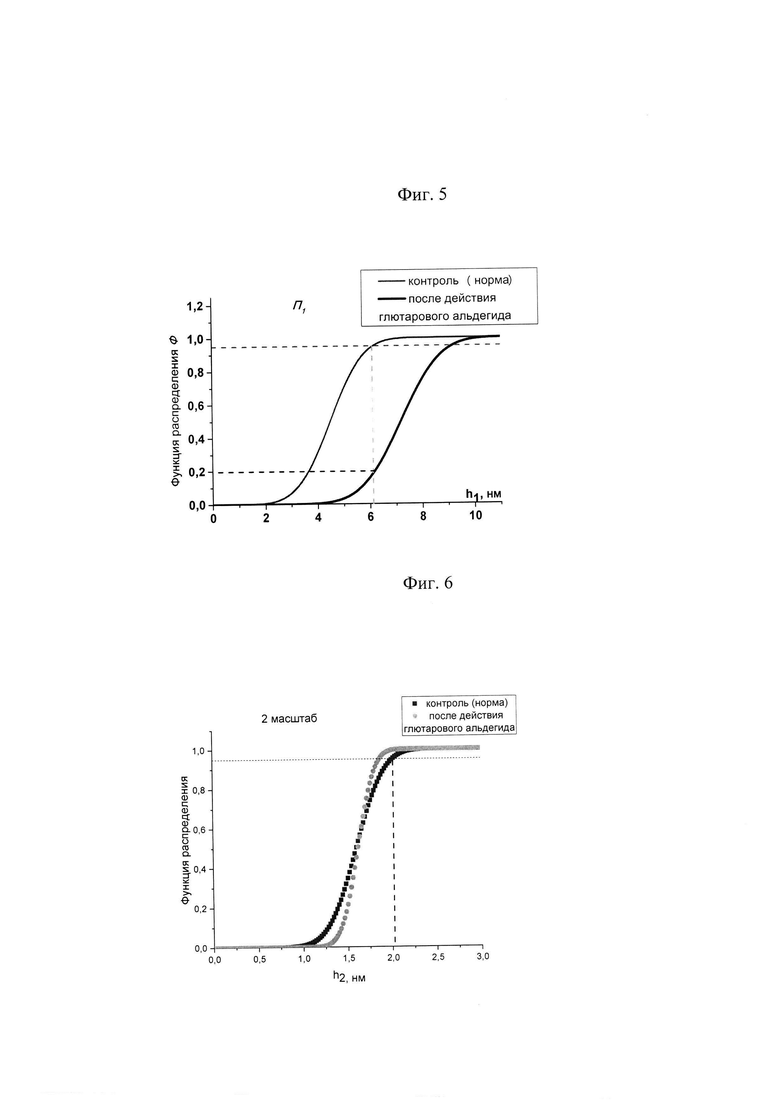
На Фиг. 5 представлены функции распределения высот топологических наноструктур h1 на поверхности первого порядка П1 для мембран контрольных эритроцитов и после действия глютарового альдегида. Доля h1, выходящих из рамок контрольных значений для поверхности первого масштаба П1, составляет в данном случае 80%.
На Фиг. 6 представлены функции распределения высот топологических наноструктур h2 на поверхности второго порядка П2 для мембран контрольных эритроцитов до и после действия глютарового альдегида. Доля h2, выходящих из рамок контрольных значений для поверхности второго масштаба, составляет в данном случае около 0%.
На Фиг. 7 представлены функции распределения высот топологических наноструктур h3 на поверхности третьего порядка П3 для мембран контрольных эритроцитов до и после действия глютарового альдегида. Доля h3, выходящих из рамок контрольных значений для поверхности третьего масштаба, составляет в данном случае 100%.
3. Изменение наноповерхности МЭ при действии гемина на эритроциты in vitro
Гемин - вещество, образующееся при действии соляной кислоты на гемоглобин. При язве желудка кровь может попасть в желудочный сок в результате кровотечения. Под действием соляной кислоты желудочного сока гемоглобин крови постепенно превращается в солянокислый гемин. При окислении гемоглобина двухвалентное железо превращается в трехвалентное. Наличие гемина в крови может вызвать патологические эффекты.
Авторами были проведены модельные опыты, в которых в кровь in vitro добавляли раствор гемина. Для приготовления раствора 50 мг порошка гемина растворяли в 1 мл 0,5 М NaOH в дистиллированной воде. Затем к 1 части этого базового раствора добавляли 5 мл дистиллированной воды. 35 мкл этого раствора гемина добавляли в микроветты, содержащие цельную кровь 140 мкл. Итоговая концентрация гемина в крови составила 2 мМ. Время инкубации гемина в крови составила 5 мин.
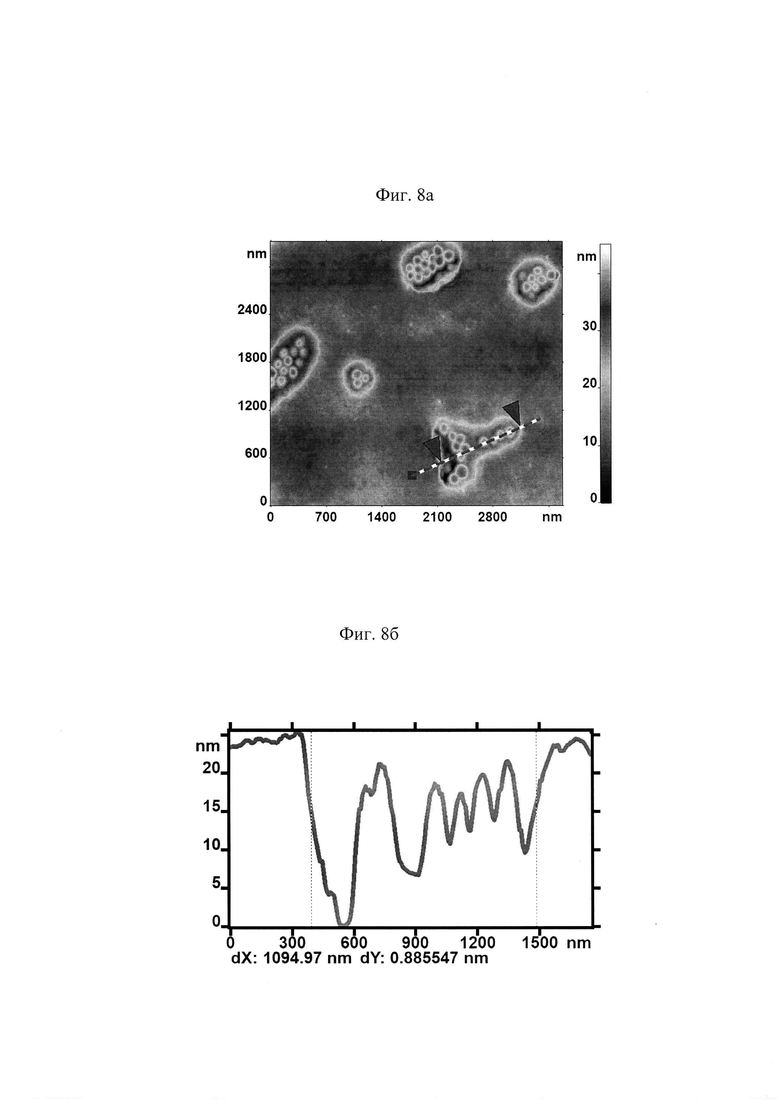
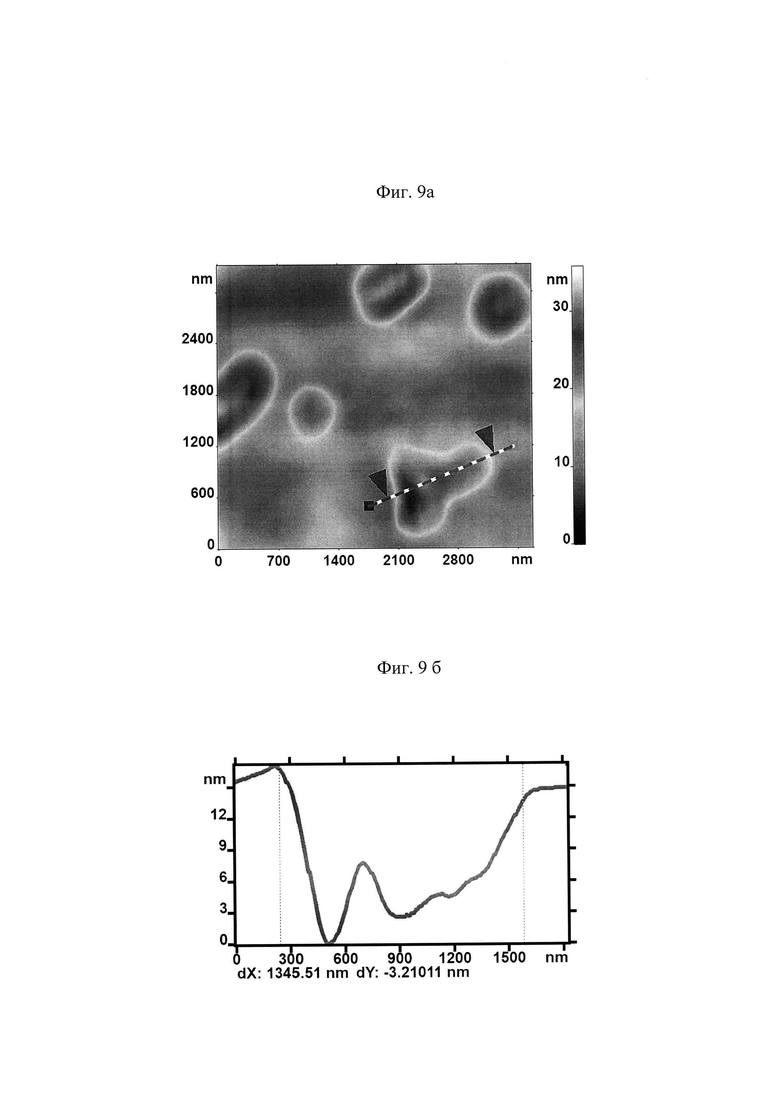
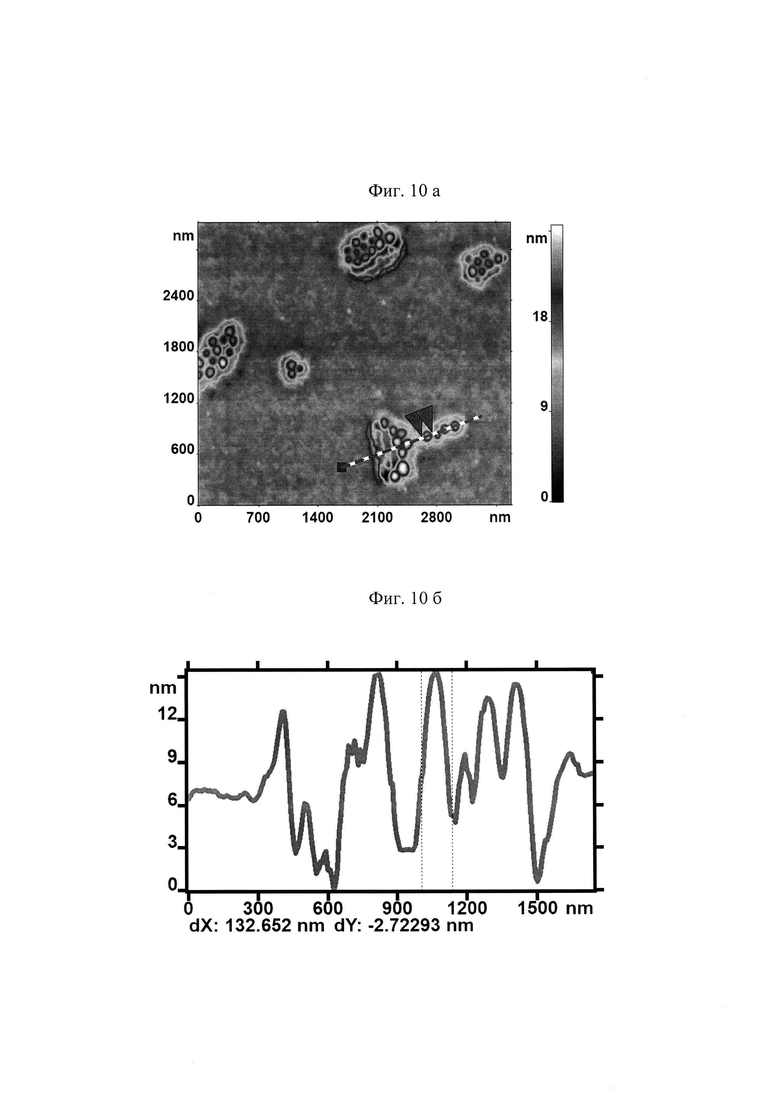
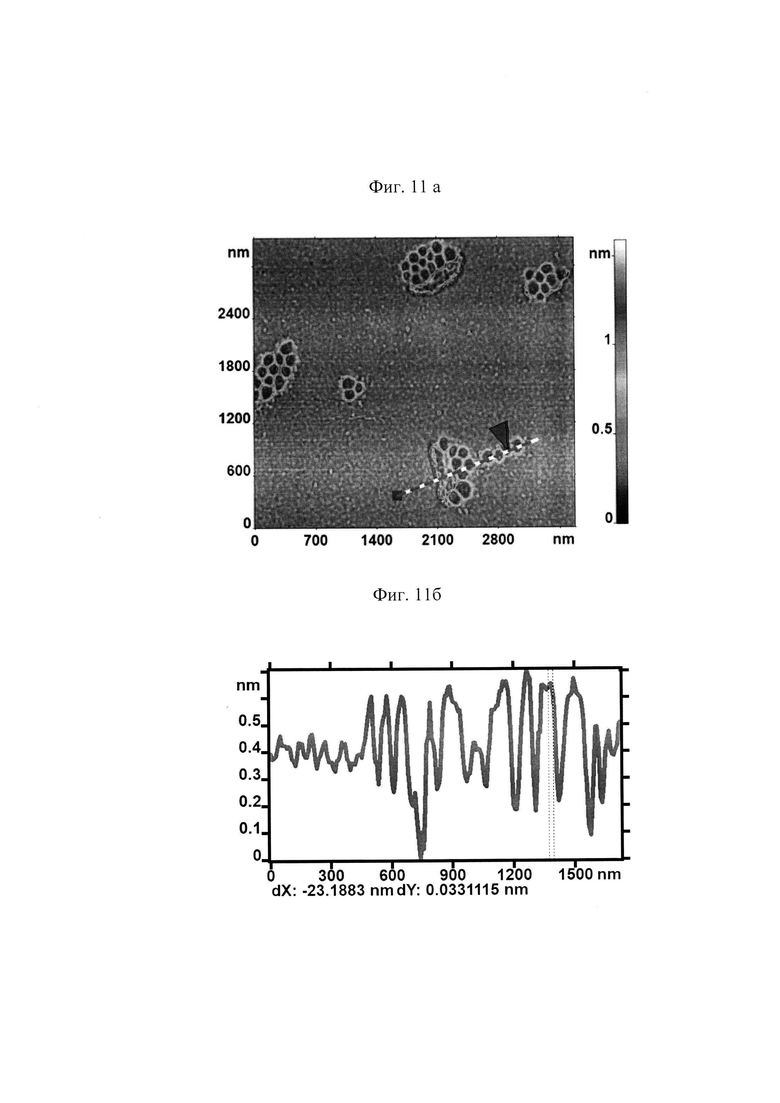
На поверхности МЭ наблюдалось образование доменов с зернистой структурой (представлено на Фиг. 8 а). Профиль поверхности в заданном сечении представлен на рис. 8б.
Для количественной оценки размеров топологических нанодефектов исходную поверхность П разложили на поверхности трех масштабов (представлено на Фиг. 9а, 10а, 11а). Для АСМ изображений каждой поверхности приведены профили высот наноповерхности в заданных сечениях, указанных пунктирными линиями (Фиг. 9б, 10б, 11б).
В таблице 2. приведены средние значения и стандартные отклонения параметров hi для мембран клеток в контрольном образце и в исследуемом после действия гемина.
Наблюдалось существенное изменение средней высоты h1 наноповерхности первого масштаба. Представленные результаты свидетельствуют о сильном воздействии гемина на амплитуду фликкеринга мембраны.
Существенно изменилась средняя высота наноповерхности второго масштаба. Это свидетельствуем о сильном нарушении спектринового матрикса при воздействии гемина на кровь. При этом высота наноповрехности третьего масштаба практически не изменяется. Это свидетельствует о том, что практически отсутствует воздействие гемина на кластеризацию белков.
Таким образом, авторами заявляемого способа определен универсальный поддающийся одновременному измерению комплекс параметров, указывающий на наличие заболевания, физиологического изменения, реакции на лечение, реакции на физико-химическое воздействие (например, на ионизирующее излучение).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки пригодности эритроцитарной взвеси для проведения гемотрансфузии | 2017 |
|
RU2647457C1 |
| Способ определения реологических свойств крови | 2020 |
|
RU2726208C1 |
| СПОСОБ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ СОСТОЯНИЯ БИОЛОГИЧЕСКОГО ОБЪЕКТА ИЛИ ЕГО ЧАСТИ | 2003 |
|
RU2295297C2 |
| Способ оценки тяжести состояния при острых отравлениях топическими деконгестантами у детей | 2021 |
|
RU2766405C1 |
| СПОСОБ ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 2014 |
|
RU2581028C1 |
| СПОСОБ ЛАБОРАТОРНО-ГЕМАТОЛОГИЧЕСКОЙ ДИАГНОСТИКИ СТЕПЕНИ ТЯЖЕСТИ ОСТРОЙ ЛУЧЕВОЙ БОЛЕЗНИ НА ЭТАПАХ МЕДИЦИНСКОЙ ЭВАКУАЦИИ | 2007 |
|
RU2356051C1 |
| СПОСОБ АНАЛИЗА МЕМБРАНОСВЯЗАННОГО ГЕМОГЛОБИНА В ЭРИТРОЦИТАХ С ПОМОЩЬЮ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕИВАНИЯ НА НАНОСТРУКТУРИРОВАННЫХ ПОКРЫТИЯХ | 2013 |
|
RU2546518C2 |
| СПОСОБ ПРОВЕДЕНИЯ ИССЛЕДОВАНИЯ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2010 |
|
RU2450790C2 |
| Способ дифференцированного выбора терапии при острых отравлениях лекарственными препаратами у детей | 2021 |
|
RU2766403C1 |
| СПОСОБ ОБНАРУЖЕНИЯ ЗЕМЛЕТРЯСЕНИЯ | 1993 |
|
RU2090913C1 |

Изобретение относится к медицине, а именно к гематологии, и может быть использовано для выявления патологических изменений в структурных элементах мембран эритроцитов (МЭ). Для этого с помощью атомного силового микроскопа получают изображение поверхности МЭ и раскладывают его на изображения поверхностей трех масштабов П1, П2, П3. При этом масштаб П1 соответствует параметрам фликкеринга МЭ. Масштаб П2 соответствует параметрам спектринового матрикса МЭ. И масштаб П3 соответствует параметрам белковых кластеров МЭ. Измеряют высоты выявленных топологических наноструктур, их средние значения и их средние квадратичные отклонения. Затем определяют вероятность отклонения величин высот наноструктур Р1, Р2, Р3 от нормальных значений в контроле. При этом отклонение величины P1 более 30% для П1 свидетельствует об отклонении величины амплитуды фликкеринга. Величина Р2 более 30% для П2 свидетельствует об отклонении физических характеристик спектринового матрикса. Величина Р3 более 30% для П3 свидетельствует о возникновении кластеризации интермембранных белков. Изобретение позволяет количественно оценить степень влияния патологического фактора на состояние мембран эритроцитов. 2 табл., 11 ил.
Способ выявления патологических изменений в структурных элементах мембран эритроцитов (МЭ), включающий визуализацию поверхности МЭ в монослое клеток, отличающийся тем, что осуществляют следующие стадии: сканируют поверхность П клеток с помощью атомного силового микроскопа в поле размером 1,2÷1,6×1,2÷1,6 мкм2, осуществляют разложение полученного изображения поверхности П на изображения поверхностей трех пространственных масштабов П1, П2, П3, соответствующих параметрам физиологических структур МЭ: масштаб П1, для которого типовой пространственный период структур данной поверхности L1=400÷900 нм соответствует параметрам фликкеринга МЭ, масштаб П2, для которого типовой пространственный период структур данной поверхности L2=50÷200 нм соответствует параметрам спектринового матрикса МЭ, масштаб П3, для которого типовой пространственный период структур данной поверхности L3=5÷40 нм соответствует параметрам белковых кластеров МЭ; измеряют высоты h1, h2, h3 выявленных топологических наноструктур на выделенных трех поверхностях; вычисляют средние значения hicp, h2cp, h3cp и средние квадратичные отклонения σ1, σ2, σ3 этих высот; определяют вероятность отклонения величин высот наноструктур Р1, Р2, Р3 для всех трех поверхностей от величин, соответствующих параметрам физиологических структур МЭ в нормальном контрольном мазке; величина P1 более 30% для поверхности первого масштаба П1 свидетельствует об отклонении величины амплитуды фликкеринга от нормальных значений, величина Р2 более 30% для поверхности второго масштаба П2 свидетельствует об отклонении физических характеристик спектринового матрикса от нормальных значений, величина Р3 более 30% для поверхности третьего масштаба П3 свидетельствует о возникновении кластеризации интермембранных белков.
| СПОСОБ ИНТЕГРАЛЬНОЙ ОЦЕНКИ СИЛЫ БЕЛОК-ЛИПИДНОГО ВЗАИМОДЕЙСТВИЯ В МЕМБРАНЕ ЭРИТРОЦИТА | 2001 |
|
RU2187112C1 |
| US 5383354 A1, 24.01.1995 | |||
| СТАРОДУБЦЕВА М.Н | |||
| и др | |||
| АСМ-диагностика патологии эритроцитов на основе физико-механического образа клеточной поверхности, Проблемы здоровья и экологии, 2015, 2(44), С.100-104 | |||
| KOZLOVA E | |||
| et al | |||
| Transformation of membrane nanosurface of red blood cells under hemin action, Sci Rep | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2020-06-04—Публикация
2019-11-12—Подача