Изобретение относится к медицине, а именно к способам оценки реологических свойств крови, в частности деформируемости эритроцитов (ДЭ), и может быть использовано для диагностики различных патологических реологических процессов в крови.
Уровень техники
К реологическим показателям крови относится, в частности, ДЭ. Для исследования ДЭ используются такие экспериментальные методы как центрифугирование, фильтрация, реоскопия. Однако они либо недостаточно информативны, либо трудоемки по выполнению.
Одним из наиболее удобных методов измерения ДЭ является лазерная дифрактометрия эритроцитов в сдвиговом потоке (эктацитометрия) (Bessis М., Mohandas N.A «Diffractometric method for the measurement of cellular deformability.» Blood Cells, 1975, v. 1, p. 307-313; Musielak M. «Red blood cell-deformability measurement: Review of techniques.» Clinical Hemorheology and Microcirculation, 2009, v. 42, p. 47-64). В частности известен метод, который позволяет провести оперативную и информативную оценку ДЭ, основанный на компьютерной эктацитометрии. Данный метод реализован в приборе, получившим название эктацитометр (А.П. Вохминцев, P.P. Сайфиев, О.В. Фролова «Деформируемость эритроцитов и способы ее клинической диагностики.» Современные наукоемкие технологии. - 2004. - №3 - С. 54-55).
Однако данный метод позволяют оценить среднюю деформируемость в ансамбле клеток, не позволяя провести измерения параметров конкретных клеток.
Известен способ оценки клеточной деформируемости с помощью атомной силовой микроскопии и спектроскопии, который базируется на измерении модуля Юнга мембран эритроцитов (Giovanna Tomaiuolo. Biomechanical properties of red blood cells in health and disease towards microfluidics // (Biomicrofluidics. 2014 Sep; 8(5): 051501. doi: 10.1063/1.4895755). Этот метод, основан на математическом анализе опытных данных и предположении, что коэффициент жесткости, модуль Юнга мембраны эритроцита одинаков для всех точек мембраны и не зависит от глубины прогиба.
Наиболее близким к заявляемому способу по совокупности существенных признаков является Methods and devices for assessing cell properties under controlled gas environments (US2018267021), в котором описан метод изучения ДЭ при перфузии жидкости, содержащей клетки крови, через специальную систему с несколькими последовательными сужениями, в том числе имеющими диаметр сужения меньше, чем диаметр клеток. Такая система является моделью неоднородного силового воздействия на эритроциты по ходу их движения в микроциркуляторном русле и позволяет изучать особенности биомеханических свойств клеток в условиях неодинакового прогиба мембран в результате постепенного увеличения на них внешнего давления. Предполагается, что данный метод может быть использован при изучении деформируемости клеток крови как в норме, так и при различных заболеваниях, при гематологических, терапевтических процедурах, в результате действия фармхимпрепаратов, различных газов.
Однако данный метод не позволяет оценивать свойства индивидуальных клеток крови, в частности упругих свойств мембран конкретных эритроцитов.
Заявляемое изобретение направлено на решение задачи определения реологических свойств крови на модели выявления патологических изменений ДЭ.
Использование в лабораторной и клинической практике заявляемого способа позволяет достичь нескольких технических результатов:
 приближение исследуемого объекта к нативным условиям существования за счет сохранения целостности клетки и клеточной мембраны при исследовании;
приближение исследуемого объекта к нативным условиям существования за счет сохранения целостности клетки и клеточной мембраны при исследовании;
 обеспечение моделирования прогиба мембраны эритроцита, соизмеримого с величиной деформации при физиологических условиях в микроциркуляторном русле, за счет последовательного (шаг Δh=4-5 нм) прогиба мембраны эритроцита с помощью индентора на глубину от 10 до 1200 нм;
обеспечение моделирования прогиба мембраны эритроцита, соизмеримого с величиной деформации при физиологических условиях в микроциркуляторном русле, за счет последовательного (шаг Δh=4-5 нм) прогиба мембраны эритроцита с помощью индентора на глубину от 10 до 1200 нм;
 измерение и оценка глубины однородного линейного прогиба мембран эритроцитов в различных зонах клетки и измерение локального модуля Юнга мембраны.
измерение и оценка глубины однородного линейного прогиба мембран эритроцитов в различных зонах клетки и измерение локального модуля Юнга мембраны.
 повышение точности исследования за счет использования метода атомно-силовой спектроскопии;
повышение точности исследования за счет использования метода атомно-силовой спектроскопии;
 возможность количественной оценки степени влияния патологического фактора на ДЭ и соответственно на реологические свойства крови.
возможность количественной оценки степени влияния патологического фактора на ДЭ и соответственно на реологические свойства крови.
Указанные технические результаты при осуществлении изобретения достигаются за счет того, что также как в известном способе, исследуют биомеханические эффекты в результате постепенной, последовательной ДЭ под давлением внешней силы, без нарушения целостности клеток.
Особенность заявляемого способа заключается в том, что прогиб мембраны эритроцита в капилляре in vivo моделируют in vitro индивидуальным четко пошаговым (шаг Δh=4-5 нм) локальным прогибом мембраны на глубину до 1000-1200 нм, что соизмеримо с физиологической деформацией в микроциркуляторном русле, путем последовательного силового воздействия индентора на клетку. Фиксируют результаты полученной зависимости Fi(hi)эксперим (силовой кривой), где Fi - сила воздействия, hi - глубина прогиба, i=1, …, N, N - число точек регистрации. Определяют минимальную величину прогиба hHz, при которой зависимость силы воздействия от глубины прогиба перестает соответствовать формуле Герца 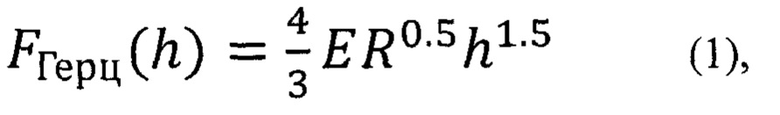 где: FГерц - сила воздействия, Е - модуль Юнга мембраны эритроцита, R - радиус индентора, h - глубина прогиба. Определяют вероятность Р отклонения hHz от контрольных значений hНzконтр=760±280 нм, соответствующих физиологическим условиям существования эритроцитов. Величина Р более 20% свидетельствует об ухудшении реологических свойств крови.
где: FГерц - сила воздействия, Е - модуль Юнга мембраны эритроцита, R - радиус индентора, h - глубина прогиба. Определяют вероятность Р отклонения hHz от контрольных значений hНzконтр=760±280 нм, соответствующих физиологическим условиям существования эритроцитов. Величина Р более 20% свидетельствует об ухудшении реологических свойств крови.
Раскрытие сущности изобретения
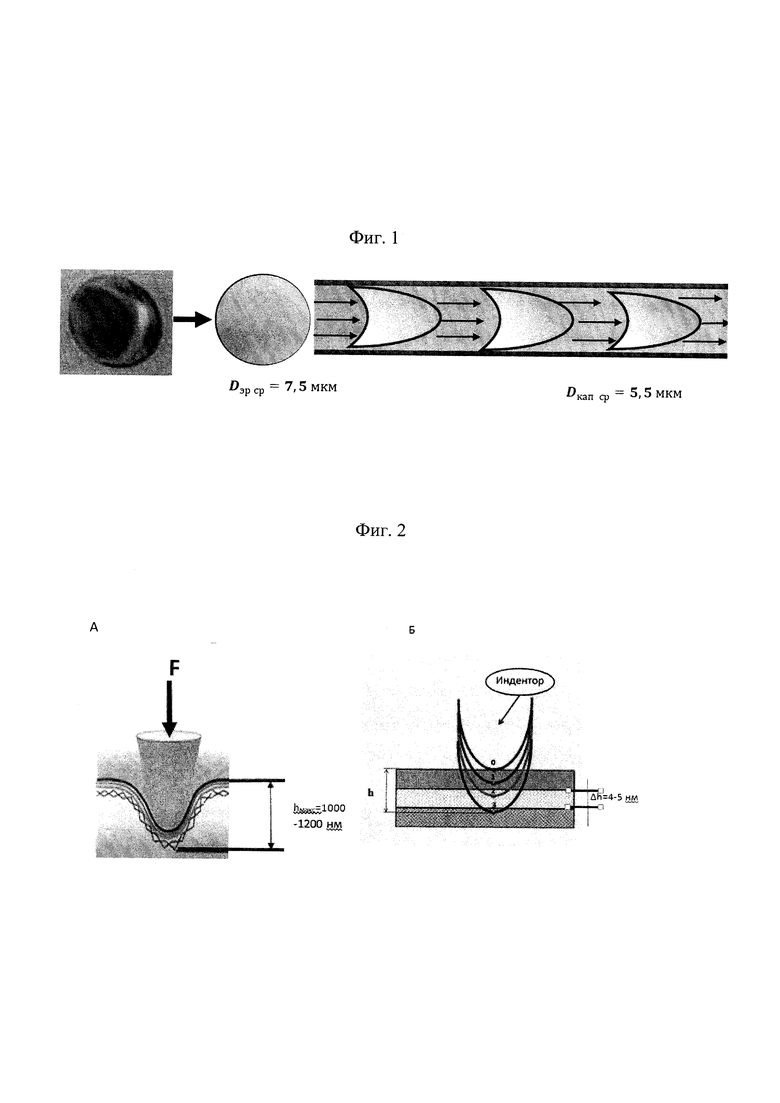
Эффективность периферического кровотока во многом определяется реологическими свойствами крови. Реологические параметры крови определяются прежде всего эритроцитами, которые составляют около 98% от общего объема форменных элементов крови. Изменения реологических свойств клеток крови могут привести к ухудшению ее текучести, блокированию участков капиллярной сети, недостаточному снабжению тканей организма кислородом. В микроциркуляторном русле эритроциты демонстрируют способность к деформируемости, т.е. к обратимому изменению размеров и формы при их прохождении через кровеносные капилляры. ДЭ - это способность эритроцитов изменять свою форму под действием приложенной внешней силы без гемолиза, то есть без разрыва мембраны. Диаметр эритроцитов (Dэp) составляет 7-10 мкм, в то время как диаметр мелких капилляров (Dкап) равен 3-5 мкм, что значительно меньше диаметра эритроцитов. Поэтому при прохождении в микроциркуляторном русле клетки крови должны быть способными к упругой деформации.
ДЭ является одним из основных микрореологических параметров крови (Шилов A.M., Авшалумов А.С., Синицина Е.Н., Марковский В.Б., Полещук О.И. «Изменения реологических свойств крови у больных с метаболическим синдромом.» Регулярные выпуски «РМЖ» №4 от 28.02.2008. С. 200; Левтов В.А., Регирер С.А., Шадрина Н.Х. «Реология крови», М.: Медицина, 1982; Муравьев А.В., Чепоров С.В. «Гемореология (экспериментальные и клинические аспекты реологии крови)» Ярославль, 2009).
При воздействии различных физико-химических факторов, а также при ряде патологических состояний деформационная способность эритроцитов претерпевает существенные изменения. Контроль ДЭ важен при диагностике и лечении заболеваний различного генеза.
ДЭ при прохождении по кровяному руслу обусловлена упругими свойствами мембраны этих клеток, в частности, наличием особой белковой структуры - спектринового матрикса, выстилающей внутреннюю сторону мембраны и называемой цитоскелетом (Нагорнов Ю.С. «Моделирование морфологии и жесткости мембраны эритроцитов после фемтосекундного лазерного облучения» //Российский журнал биомеханики. 2013. Т. 17. №3 (61), с. 112-121).
Под действием гидравлического давления эритроцит в капилляре изгибается за счет упругости спектрина. С учетом диаметра капилляра и эритроцита, каждый эритроцит должен изогнуться с каждой стороны и изменить поперечный размер в среднем на ΔDэр ср=1,2±0,5 мкм.
Схема деформации эритроцита при прохождении их в капилляре при условии, что диаметр капилляра меньше диаметра эритроцита, представлена на Фиг. 1. Механические характеристики мембран эритроцитов, в частности модуль Юнга, должны оставаться постоянными при таких прогибах, что соответствует сохранности конструкции мембраны после прохождения клетки через микрососуды. Нарушение же механических характеристик свидетельствует о нарушении структурных характеристик объекта, о нарушении линейности среды. В этом случае при выходе из капилляра эритроциты могут необратимо изменить механические свойства, что повлияет на реологические свойства крови.
При действии физико-химических факторов на кровь, в том числе при реанимационных мероприятиях, могут происходить конформационные изменения мембранных структур, в частности спектринового матрикса, белковых комплексов, что также приводит к изменению механических свойств эритроцитов и к уменьшению их деформируемости. Это, в свою очередь, приводит к нарушению прохождения эритроцитов через капилляры, ухудшает газообмен, а также может привести к образованию тромбов в микрососудах. В конечном счете, это может вызвать гипоксию тканей и даже их некроз.
ДЭ можно оценивать с помощью атомно-силовой спектроскопии, базируясь на измерении модуля Юнга мембран. В этом случае исследование механических свойств мембран эритроцитов сводится к оценке модуля Юнга мембраны (Е). Модуль Юнга вычисляют из формулы Герца (формула 1) (Giovanna Tomaiuolo. «Biomechanical properties of red blood cells in health and disease towards microfluidics» //(Biomicrofluidics. 2014 Sep; 8(5): 051501. doi: 10.1063/1.4895755).
В формуле Герца подразумевается, что модуль Юнга (Е), характеризующий механические свойства мембраны клетки, является постоянной величиной (Е=const). То есть эта формула применима только для линейных однородных сред, у которых модуль Юнга не зависит от глубины прогиба мембраны.
Мембрана эритроцита в реальности не является однородной средой. Тем не менее, для оценки механических свойств мембран клеток возможно использование формулы Герца или аналогичных формул с учетом геометрии кантилевера.
Сущность заявляемого способа состоит в том, что оценивают минимальную глубину прогиба мембраны hHz, за пределами которого мембрану уже не правомерно рассматривать как однородную линейную упругую среду и соответственно уже нельзя применять формулу Герца (1), в которой модуль Юнга зависит только от собственных биомеханических свойств мембран клеток и не зависит от глубины прогиба мембран.
При h<hHz применима формула Герца (1) для описания деформации мембраны, в которой модуль Юнга остается постоянной величиной (Е=const), другими словами упругие свойства мембраны эритроцита не изменяются по мере прогиба, что свидетельствует об отсутствии нарушений спектринового матрикса. При h>hHz формула Герца (1) уже не применима, поскольку модуль Юнга мембраны не будет постоянной величиной, а будет зависеть от глубины прогиба E(h). Это будет свидетельствовать об изменении структуры и упругих свойств спектринового матрикса. ДЭ в капилляре на величину большую, чем hHz вызовет изменение структуры и упругих свойств спектринового матрикса, что приведет к изменению модуля Юнга мембраны клетки. В результате накопительного эффекта увеличения модуля Юнга мембраны при многократном прохождении каждого эритроцита в капиллярах произойдет снижение деформируемости клеток, а следовательно, изменение реологических свойств крови. Чем меньше глубина hHz, тем больше вероятность снижения ДЭ и нарушения реологических свойств крови.
Величину hHz можно рассматривать как биофизический параметр, описывающий механические свойства мембран эритроцитов. Уменьшение величины hHz в исследуемых образцах (эритроциты при патологии) по сравнению с контрольными (клетки без патологии) свидетельствует о нарушении биомеханических свойств эритроцитов (в частности, упругих характеристик спектринового матрикса), а следовательно, свидетельствует об уменьшении ДЭ, что влияет на реологические свойства крови.
Способ осуществляют следующим образом.
На стекло с полилизином осаждают монослой эритроцитов в фосфатном буфере (рН=7,4), при этом фиксаторы (например, глютаровый альдигид) не используют. Это позволяет приблизить условия измерения параметров деформируемости к нативным условиям существования эритроцитов в крови. Измерение экспериментальных силовых кривых Fi(hi)эксперим проводят с помощью атомно-силовой спектроскопии в жидкостной ячейке. Радиус индентора (зонда) R должен быть не меньше размера ячейки спектринового матрикса (характерный размер 120-150 нм), чтобы зонд мог локально прогнуть мембрану, но при этом не повредил липидный бислой. Оптимальный радиус зонда 150-200 нм.
Атомно-силовой микроскоп позволяет получить изображения клеток в монослое, выбрать среди них исследуемый эритроцит, измерить силовую кривую Fi(hi)эксперим в выбранной локальной области эритроцита. Для этого индентор подводят к поверхности клетки и под действием приложенной к нему силы начинают продавливать мембрану с шагом Δh=4-5 нм. Величину силы устанавливают так, чтобы максимальный прогиб достиг 1000-1200 нм, что соответствует деформации мембраны при физиологических условиях. Для этого устанавливают значение максимальной силы давления на мембрану со стороны индентора 20-50 нН.
На Фиг. 2А представлен прогиб мембраны на глубину h. На Фиг. 2Б схематично представлен пошаговый прогиб мембраны (шаг Δh=4-5 нм) под действием силы со стороны индентора. Показаны три последовательные стадии прогиба.
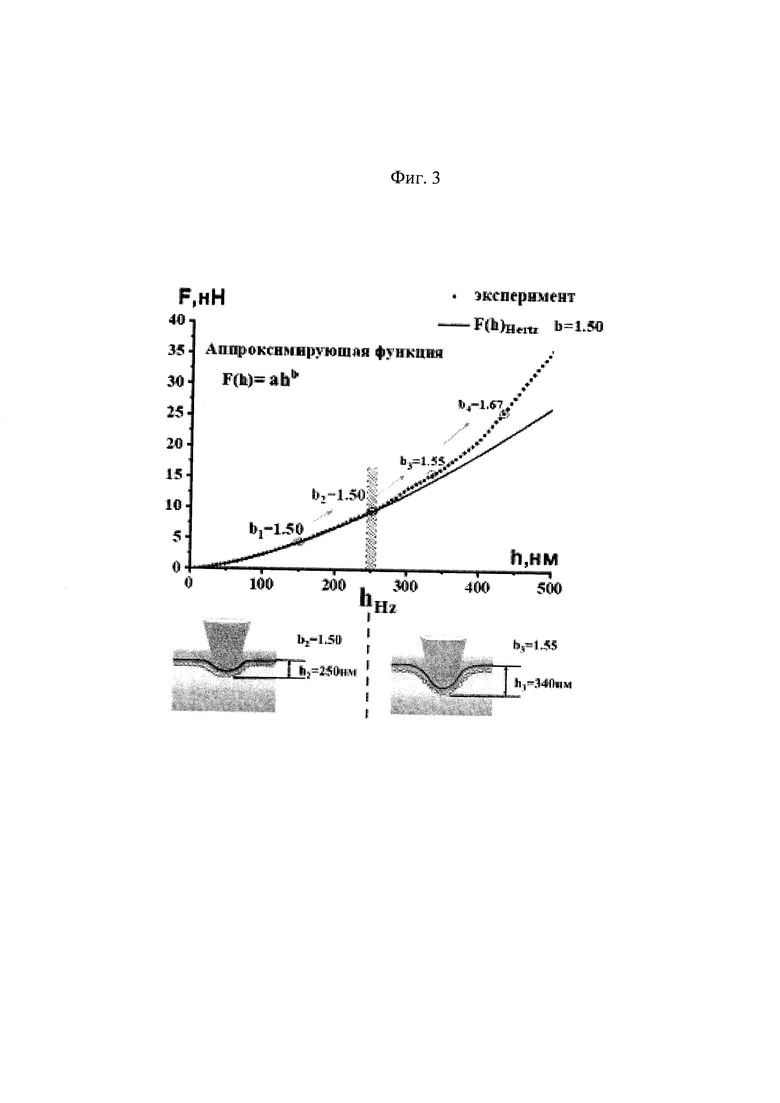
На Фиг. 3 представлены экспериментальная силовая кривая, полученная с помощью метода атомно-силовой спектроскопии (АСС) в виде отдельных точек Fi(hi)эксперим.
Для определения hHz аппроксимируют экспериментальные данные Fi(hi)эксперим теоретической функцией Fаппроксим(h) вида: 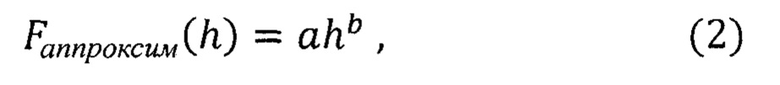
где:
h - глубина прогиба мембраны,
а - коэффициент аппроксимации, зависящий от модуля Юнга мембраны,
b - коэффициент аппроксимации, определяющий форму силовой кривой.
Подбирают коэффициенты аппроксимации а и b аппроксимирующей функции (2). Для нахождения этих коэффициентов и соответственно аппроксимирующей функции (2) используют метод нелинейной регрессии на базе стандартных программ статистической обработки экспериментальных данных (например, Origin Pro (USA)). При аппроксимации статус зависимой переменной присваивают Fi(hi)эксперим. Неизвестными параметрами аппроксимации являются а и b. Эти искомые коэффициенты находят в процессе аппроксимации так, чтобы кривая аппроксимации Fаппроксим(h) описывала бы экспериментальные данные Fi(hi)эксперим наилучшим образом (R-square>0,98).
На Фиг. 3 проиллюстрирована последовательность расчета глубины прогиба hHz. Сначала аппроксимацию экспериментальных данных начинают проводить для небольших глубин прогиба h1=100-150 нм. Находят коэффициент аппроксимации b1 и сопоставляют его с показателем степени 1,5 в формуле Герца (1). Для экспериментальных данных, представленных на Фиг. 3, при величине прогиба h1=150 нм получено, что коэффициент аппроксимации b1=1,5, что совпадает с показателем степени в формуле Герца (1). То есть экспериментальная кривая в диапазоне глубин прогиба от 0 до 150 нм описывается формулой Герца.
Далее увеличивают диапазон глубин прогиба. На Фиг. 3 указан диапазон до h2=250 нм, для которого найдено, что аппроксимирующий коэффициент - 1,5. То есть экспериментальная кривая в диапазоне глубин прогиба от 0 до 250 нм также описывается формулой Герца, причем рассчитанные модули Юнга совпадают при этих величинах прогибов, E1=Е2.
Однако при увеличении глубины прогиба кривая аппроксимации имеет показатель степени больше, чем 1,5. Так при h3=340 нм коэффициент b3=1,55. Это означает, что формула Герца уже не может адекватно описывать экспериментальные данные. Модуль Юнга (Е) уже не является постоянной величиной, он увеличивается, Е3>Е2, что свидетельствует о конформационных изменениях спектринового матрикса при достигнутой величине прогиба.
Таким образом, в данном примере установлено, что hHz=250 нм. Именно эта величина - минимальная глубина прогиба, при которой зависимость силы воздействия от глубины прогиба перестает соответствовать формуле Герца (1).
Установлено, что величина hHz зависит от состояния эритроцитов в результате воздействия на них различных факторов.
Определение hHzконтр для контрольных (нормальных) эритроцитов
В ходе экспериментов были определены контрольные (нормальные) значения hHzконтр для эритроцитов, полученных из крови здоровых доноров. Для этого были приготовлены по 3 образца (монослои клеток на трех стеклах с полилизином) для измерений hHzконтр у 10 здоровых доноров. В каждом образце были измерены hHzконтр для 30 клеток. Измерения показали, что hHzконтр=760±280 нм. Эта величина соизмерима с деформацией клетки в капилляре. Это означает, что после прохождения клеток по капилляру, мембраны эритроцитов не изменяют свои упругие свойства.
Измерение hHz эритроцитов важно для пациентов с различными заболеваниями, в процессе и после терапевтического или хирургического лечения. Особенно важно определение hHz для пациентов, находящихся в критическом состоянии - при сепсисе, при химиотерапии, при лучевой терапии. Наряду с модулем Юнга, величина hHz характеризует биомеханические свойства эритроцитов, а соответственно, деформационную способность клеток. Кроме того измерения hHz важны для модельных экспериментов по влиянию различных фармхимпрепаратов на биомеханические свойства клеток, а именно на ДЭ.
Для определения степени деформируемости мембран эритроцитов каждого образца крови величину hHz измеряют для 70-100 клеток. Этого количества клеток необходимо и достаточно для отражения свойств всего образца клеток.
Вычисляют средние значения hHzcp и средние квадратичные отклонения σHz этих глубин.
Вычисляют вероятность Р отклонения величин hHz в исследуемом образце от контрольных значений hHzконтр. Делают вывод о степени влияния данного фактора на ДЭ в исследуемом образце крови. Это позволяет дать количественную оценку пригодности для трансфузии донорской эритроцитарной взвеси при ее длительном хранении, пригодности крови для перфузии.
Величина вероятности Р указывает на факт отклонения глубины hHz от контрольных (нормальных) значений и позволяет количественно оценить степень воздействия данного фактора на биомеханические свойства, а именно на ДЭ:
 величина Р более 20% свидетельствует о сильном воздействии фактора на величину hHz, а следовательно, на ДЭ;
величина Р более 20% свидетельствует о сильном воздействии фактора на величину hHz, а следовательно, на ДЭ;
 величина Р от 1% до 20% свидетельствует о слабом / умеренном воздействии;
величина Р от 1% до 20% свидетельствует о слабом / умеренном воздействии;
 величина Р менее 1% свидетельствует о том, что данный фактор не повлиял на hHz.
величина Р менее 1% свидетельствует о том, что данный фактор не повлиял на hHz.
Примеры осуществления изобретения
1. Изменение hHz при действии глютарового альдегида (ГА) различной концентрации на эритроциты in vitro.
ГА используют для фиксации мембран клеток. В результате его воздействия происходит кластеризация белков, в частности он воздействует на актиновые комплексы и белки полосы band 3. В результате воздействия ГА мембраны становятся жестче, модуль Юнга увеличивается.
Происходят изменения и величины hHz. Для проведения опытов использовали различные концентрации ГА.
Раствор ГА в концентрации 0% (контроль), 0.4%, 0.8% и 1.6% добавляли к эритроцитам в соотношении 1:1. Клеточную суспензию инкубировали в течение 5 минут. Затем на 4-х раздельных стеклах с полилизином осаждали из соответствующих суспензий с ГА различной концентрации монослой эритроцитов в фосфатном буфере (рН=7,4). Измерение экспериментальных силовых кривых Fi(hi)эксперим проводили с помощью атомно-силовой спектроскопии в жидкостной ячейке. Радиус зонда R=150 нм.
Измеряли силовую кривую Fi(hi)эксперим в выбранной локальной области эритроцита. Для этого индентор подводили к поверхности клетки и под действием приложенной к нему силы, продавливали мембрану с шагом Δh=4-5 нм (Фиг. 1А, Б). Величину силы устанавливали так, чтобы максимальный прогиб достиг 1000-1200 нм. Для этого устанавливали значение максимальной силы давления на мембрану со стороны кантилевера 30-50 нН. Значения hHz определяли на основе 100 силовых кривых, полученных для каждой концентрации ГА.
В таблице приведены значения hHz для различных значений концентраций ГА.

Для каждой концентрации ГА была определена вероятность Р (%) отклонения глубины hHz от контрольных (нормальных) значений, что позволило количественно оценить степень воздействия ГА в заданной концентрации на биомеханические свойства, а именно на ДЭ.
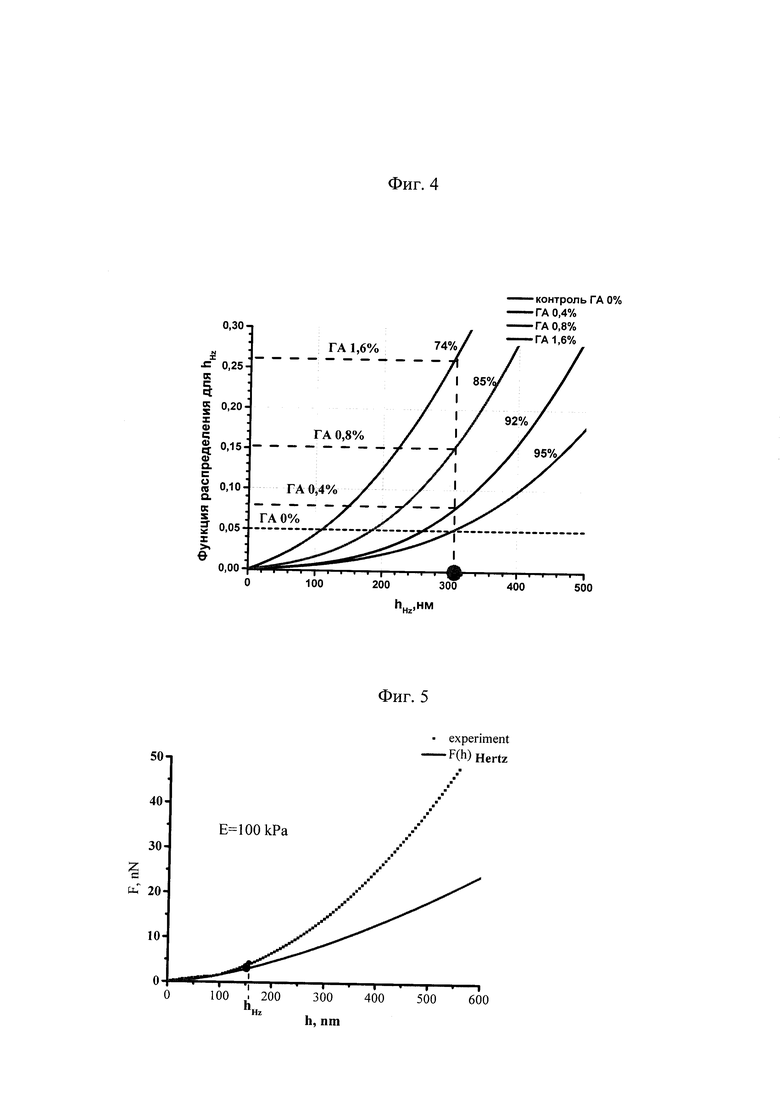
Для этого были построены графики функций распределения для величин hHz, для эритроцитов, на которые подействовали ГА с различной концентрацией (Фиг. 4). Около каждой кривой указана соответствующая концентрация ГА и указана вероятность того, что hHz>310 нм. Критерием выбора этой величины является то, что в контроле 95% клеток имеют hHz>310 нм, а соответственно hHz<310 нм только у 5% клеток. С ростом концентрации ГА доля клеток с hHz>310 нм уменьшается, а соответственно вероятность отклонения от контроля увеличивается, а следовательно возрастает вероятность снижения деформируемости и изменения реологических свойств крови.
Для ГА в концентрации 0,4% вероятность отклонения глубины hHz от нормальных (контрольных) значений составила Р=3%, а для ГА в концентрации 0,8% Р=10%, что свидетельствует о слабом/умеренном влиянии ГА в этом диапазоне концентраций на ДЭ. Для ГА в концентрации 1,6% величина Р=21%, что свидетельствует о сильном влиянии ГА на ДЭ.
2. Изменение hHz при действии гемина различной концентрации на эритроциты
Гемин образуется при действии соляной кислоты на гемоглобин. При окислении гемоглобина двухвалентное железо превращается в трехвалентное. Наличие гемина в крови может вызвать патологические эффекты.
Авторами были проведены модельные опыты, в которых в кровь in vitro добавляли раствор гемина. Для приготовления раствора 50 мг порошка гемина растворяли в 1 мл 0,5 М NaOH в дистиллированной воде. Затем к 1 части этого базового раствора добавляли 5 мл дистиллированной воды. 35 мкл этого раствора гемина добавляли в микроветты, содержащие 140 мкл цельной крови. Итоговая концентрация гемина в крови составила 2 мМ. Время инкубации гемина в крови составила 15 мин.
На Фиг. 5 представлен пример силовой кривой для мембраны одного эритроцита: экспериментальные данные (синие точки) и кривая аппроксимации (красная линия). Для мембраны данной клетки формула Герца перестает адекватно описывать силовую кривую на глубине прогиба, начиная с hHz=159 нм. В результате измерения силовых кривых для мембран 100 клеток получено, что после действия гемина hHz=420±110 нм.
Была определена вероятность Р (%) отклонения глубины hHz от контрольных (нормальных) значений, что позволило количественно оценить степень воздействия гемина в заданной концентрации и при заданном времени воздействия на биомеханические свойства, а именно на ДЭ. Р=59%, что свидетельствует о сильном влиянии гемина в данной концентрации на ДЭ.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления патологических изменений в структурных элементах мембран эритроцитов | 2019 |
|
RU2722898C1 |
| Способ оценки пригодности эритроцитарной взвеси для проведения гемотрансфузии | 2017 |
|
RU2647457C1 |
| СПОСОБ ОЦЕНКИ КАЧЕСТВЕННЫХ ПОКАЗАТЕЛЕЙ ЭРИТРОЦИТСОДЕРЖАЩИХ СРЕД В ПРОЦЕССЕ ИХ ХРАНЕНИЯ | 2014 |
|
RU2542438C1 |
| Способ определения концентраций гемоглобина и его производных в крови | 2017 |
|
RU2663572C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УПРУГОСТИ КЛЕТОК КРОВИ | 2011 |
|
RU2466401C1 |
| Способ определения упругости эритроцитов при гипергликемии в цельной крови | 2023 |
|
RU2826471C1 |
| СПОСОБ ДИАГНОСТИКИ СТРУКТУРНО-ФУНКЦИОНАЛЬНЫХ ИЗМЕНЕНИЙ КЛЕТОК МЕМБРАН ЭРИТРОЦИТОВ И СОСУДОВ У БОЛЬНЫХ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ | 2004 |
|
RU2296505C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННОГО ТОКСИКОЗА У ДЕТЕЙ РАННЕГО ВОЗРАСТА | 1994 |
|
RU2090189C1 |
| УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ ДЕФОРМИРУЕМОСТИ ЭРИТРОЦИТОВ КРОВИ | 2006 |
|
RU2301617C1 |
| ПРОИЗВОДНЫЕ ГЕМИНА, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМКОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2009 |
|
RU2415868C1 |
Изобретение относится к способу определения реологических свойств крови. Способ включает оценку деформируемости эритроцитов под давлением внешней силы без нарушения целостности клеток. Осуществляют исследование образца клеток в нативной среде с использованием атомно-силовой спектроскопии путем пошагового прогиба мембраны каждого эритроцита с помощью индентора до глубины h=1000-1200 нм, с шагом Δh=4-5 нм, фиксируют зависимость Fi(hi)эксперим, где Fi - сила воздействия, hi - глубина прогиба, i=1, …N, N - число точек регистрации, определяют минимальную величину прогиба hHz, при которой зависимость силы воздействия от глубины прогиба перестает соответствовать формуле Герца

где FГерц - сила воздействия, Е - модуль Юнга мембраны эритроцита, R - радиус индентора, h - глубина прогиба, определяют вероятность Р отклонения hHz от контрольных значений hHzконтр=760±280 нм, соответствующих физиологическим условиям существования эритроцитов. Величина Р более 20% свидетельствует об ухудшении реологических свойств крови. Предложенный способ позволяет оценить упругие свойства мембран конкретных эритроцитов и может быть использован для диагностики различных патологических реологических процессов в крови. 5 ил., 1 табл.
Способ определения реологических свойств крови, включающий оценку деформируемости эритроцитов под давлением внешней силы без нарушения целостности клеток, отличающийся тем, что осуществляют исследование образца клеток в нативной среде с использованием атомно-силовой спектроскопии путем пошагового прогиба мембраны каждого эритроцита с помощью индентора до глубины h=1000-1200 нм, с шагом Δh=4-5 нм, фиксируют зависимость Fi(hi)эксперим, где Fi - сила воздействия, hi - глубина прогиба, i=1, …N, N - число точек регистрации, определяют минимальную величину прогиба hHz, при которой зависимость силы воздействия от глубины прогиба перестает соответствовать формуле Герца
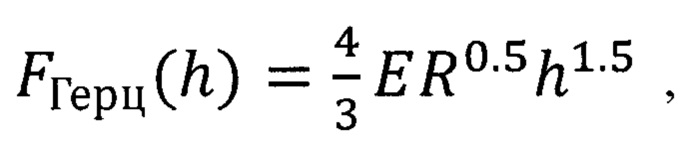
где FГерц - сила воздействия, Е - модуль Юнга мембраны эритроцита, R - радиус индентора, h - глубина прогиба, определяют вероятность Р отклонения hHz от контрольных значений hHzконтр=760±280 нм, соответствующих физиологическим условиям существования эритроцитов, величина Р более 20% свидетельствует об ухудшении реологических свойств крови.
| US 2018267021 A1, 20.09.2018 | |||
| KOZLOVA E | |||
| et al | |||
| Nonlinear Biomechanical Characteristics of Deep Deformation of Native RBC Membranes in Normal State and under Modifier Action, Scanning, 2018, v | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ЧЕРНЫШ А.М | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2020-07-09—Публикация
2020-03-18—Подача