Настоящее изобретение относится к диагностике, мониторингу и/или характеристике заболеваний и состояний, связанных с нарушениями микробиоты желудочно-кишечного (ЖК) тракта. Более конкретно, в настоящем изобретении предложены способы, посредством которых можно оценивать состояние микробиоты ЖК тракта, и определять отклонения от нормального состояния (нормобиоза), т.е. дисбиоз, посредством методики, которая является простой в осуществлении, достоверной и надежной и которая является в достаточной степени гибкой для использования в сочетании с любой методикой измерения содержания микроорганизмов в образце из ЖК тракта. Согласно более конкретным вариантам реализации настоящего изобретения такие отклонения могут быть в определенной степени количественно определены, и, следовательно, в настоящем изобретении предложены способы определения степени дисбиоза ЖК тракта, которая может, в свою очередь, свидетельствовать о тяжести сопутствующего заболевания или состояния или которую можно использовать для мониторинга прогрессирования или для характеристики указанного сопутствующего заболевания или состояния.
ЖК тракт, также называемый пищеварительным трактом или пищеварительным каналом (при этом данные термины можно использовать взаимозаменяемо с ЖК трактом), представляет собой непрерывную последовательность органов, которая начинается ротовой полостью и оканчивается заднепроходным отверстием. По всей длине ЖК тракт колонизирован микроорганизмами множества различных видов. Взятое вместе содержание микроорганизмов в ЖК тракте представляет собой микробиоту ЖК тракта. Относительные количества входящих в состав микроорганизмов или их групп можно считать профилем микробиоты. Вследствие этого, профили микробиоты дают информацию относительно разнообразия микроорганизмов (т.е. количества присутствующих различных с таксономической точки зрения микроорганизмов или различных таксономических групп) в ЖК тракте, а также обеспечивают информацию об относительных количествах присутствующих микроорганизмов или их групп.
Множество заболеваний и состояний или стадий указанных заболеваний и состояний, как считают, связаны с нарушениями микробиоты ЖК тракта или областей ЖК тракта. В некоторых случаях заболевание или состояние может быть вызвано изменением профиля микробиоты (т.е. изменением относительных количеств входящих в состав микроорганизмов и разнообразия данных микроорганизмов) ЖК тракта или областей ЖК тракта, или указанное заболевание или состояние ухудшается в результате указанного изменения. В других случаях заболевание или состояние вызывает формирование профиля микробиоты ЖК тракта, который отличается от нормального состояния, или в результате некоторого механизма приводит к формированию такого профиля микробиоты. В некоторых случаях формирование данного профиля даже может представлять собой адаптивный ответ, направленный на попытку ведения борьбы с патологическим фенотипом заболевания или состояния. Соответственно, посредством оценки состояния микробиоты ЖК тракта и определения отклонения от нормального состояния (нормобиоза), т.е. дисбиоза, можно получить информацию, которая дает возможность проводить диагностику, мониторинг и/или характеристику заболеваний и состояний, связанных с нарушениями микробиоты желудочно-кишечного (ЖК) тракта, или которая дает возможность оценивать риск развития заболевания или состояния, которое, как было определено, связано с нарушением профиля микробиоты, или по меньшей мере является полезной при оценке указанного риска.
Заболевания и состояния, поражающие ЖК тракт, с большой вероятностью приводят к формированию профилей микробиоты, которые отличаются от указанного профиля при нормальном состоянии, например, такие заболевания и состояния как воспалительное заболевание кишечника (ВЗК), болезнь Крона (БК), язвенный колит (ЯК), синдром раздраженного кишечника (СРК), синдром избыточного роста бактерий в тонком кишечнике и варианты рака ЖК тракта (например, рак ротовой полости, глотки, пищевода, желудка, двенадцатиперстной кишки, тощей кишки, подвздошной кишки, слепой кишки, толстой кишки, прямой кишки или заднепроходного отверстия); также существуют доказательства связей между профилями микробиоты ЖК тракта и заболеваниями и состояниями, которые, как считают, не связаны с ЖК трактом, например, раком молочной железы; анкилозирующим спондилитом; неалкогольным стеатогепатитом; атопическими заболеваниями, например, экземой, астмой, атопическим дерматитом, аллергическим конъюнктивитом, аллергическим ринитом и пищевыми аллергиями; метаболическими нарушениями, например, сахарным диабетом (типа 1 и типа 2), ожирением и метаболическим синдромом; неврологическими расстройствами, например, депрессией, рассеянным склерозом, слабоумием и болезнью Альцгеймера; аутоиммунным заболеванием (например, артритом); неполноценностью питания; синдромом хронической усталости и аутизмом. Полагают, что такие нарушения профиля микробиоты ЖК тракта (применительно к относительным количествам и/или разнообразию), которые можно считать эквивалентными дисбалансу микробиоты в ЖК тракте, способствуют патогенезу данных заболеваний, либо вызывая данные заболевания, либо способствуя их прогрессированию. Также полагают, что в дальнейшем будет установлено, что многие другие заболевания имеют причинные связи с нарушениями профиля микробиоты ЖК тракта. Точный механизм, который лежит в основе данной зависимости, до конца не ясен. Очевидно, что нарушение микробиоты ЖК тракта приводит к уменьшению количества популяций определенных микроорганизмов и/или к увеличению количества популяций других и/или к уменьшению разнообразия, что вызывает изменение, или дисбаланс, относительных активностей каждой популяции микроорганизмов. Полагают, что данное изменение активности микроорганизмов вызывает уменьшение благоприятных эффектов (например, синтеза витаминов, короткоцепочечных жирных кислот и полиаминов, всасывания питательных веществ, ингибирования патогенов, метаболизма растительных соединений) и/или увеличение вредных эффектов (секреции эндотоксинов и других токсичных продуктов) с последующими суммарными отрицательными эффектами на общую физиологию хозяина. Затем данные эффекты могут проявляться в виде недомогания и заболевания, например, таких, как указано выше.
Несмотря на то, что на сегодняшний день определение и даже количественное определение относительных количеств микроорганизмов в образце из ЖК тракта и использование таких профилей для диагностики заболевания посредством соотнесения со специфичными профилями, характерными для состояния заболевания, или для исключения диагноза посредством соотнесения со специфичными профилями, характерными для нормального состояния (например, публикации WO 2012080754; WO 2011043654) используются повсеместно, сохраняется потребность в способах, позволяющих определять вероятность того, что пациент страдает от дисбиоза ЖК тракта по сравнению с нормобиотическим состоянием, которые являлись бы простыми в осуществлении, достоверными и надежными и которые являлись бы в достаточной степени гибкими для использования в сочетании с любой методикой измерения уровней микроорганизмов в образце из ЖК тракта, и для которых не требовалось бы проведение сравнения со специфичными стандартными профилями.
Таким образом, согласно первому аспекту в настоящем изобретении предложен способ определения вероятности дисбиоза ЖК тракта у субъекта, причем указанный способ включает:
(i) обеспечение совокупности экспериментальных данных, причем указанная совокупность экспериментальных данных содержит по меньшей мере один профиль микробиоты, причем указанный профиль микробиоты представляет собой профиль относительных уровней множества микроорганизмов или групп микроорганизмов в образце из ЖК тракта указанного субъекта, и причем каждый уровень каждого микроорганизма или группы микроорганизмов представляет собой элемент профиля указанной совокупности экспериментальных данных,
(ii) применение в отношении указанной совокупности экспериментальных данных по меньшей мере одного вектора нагрузки, определенного на основании скрытых переменных в профилях уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта от множества нормальных субъектов, посредством чего обеспечивают первую совокупность проекционных данных,
(iii) применение в отношении указанной первой совокупности проекционных данных транспонированной версии указанного по меньшей мере одного вектора нагрузки, посредством чего обеспечивают вторую совокупность проекционных данных,
(iv) сравнение указанной совокупности экспериментальных данных с указанной второй совокупностью проекционных данных и объединение разностей между соответствующими элементами профиля второй совокупности проекционных данных и совокупности экспериментальных данных и сравнение объединенных разностей с пороговым значением при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта от множества нормальных субъектов и/или множества субъектов, страдающих от дисбиоза,
(v) применение в отношении указанной первой совокупности проекционных данных по меньшей мере одного собственного числа, причем указанное собственное число было определено из указанного по меньшей мере одного вектора нагрузки, и объединение результирующих значений для каждого элемента профиля и сравнение объединенных значений с пороговым значением при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта от множества нормальных субъектов и/или субъектов, страдающих от дисбиоза,
причем этап (v) можно осуществлять до либо после или одновременно с любым из этапов (iii) или (iv), и причем профиль микробиоты с указанными объединенными разностями или указанными объединенными результирующими значениями, превышающими указанные соответствующие пороги при переходе от нормобиотического к дисбиотическому состоянию, свидетельствует о вероятности дисбиоза.
Согласно другим вариантам реализации настоящего изобретения вероятность дисбиоза определяют, если как указанные объединенные разности, так и указанные объединенные результирующие значения превышают свои соответствующие пороги при переходе от нормобиотического к дисбиотическому состоянию.
Способ согласно настоящему изобретению можно также считать способом установления дисбиоза, обнаружения дисбиоза, определения наличия дисбиоза или характеристики дисбиоза. Способ согласно настоящему изобретению можно, вследствие этого, считать включающим этап определения вероятности дисбиоза ЖК тракта, установления дисбиоза, обнаружения дисбиоза, определения наличия дисбиоза или характеристики дисбиоза у субъекта на основании указания вероятности дисбиоза, предоставленного на предыдущих этапах. Результаты такого этапа можно записать и необязательно хранить на подходящем носителе для записи/информационном носителе и/или передать врачу, субъекту или представителю либо доверенному лицу указанного субъекта.
Согласно определенным вариантам реализации настоящего изобретения способ осуществляют с использованием множества профилей микробиоты. Данные профили могут быть получены от одного и того же субъекта, например, как параллельные профили, полученные из одного и того же образца, из различных соответствующих образцов от одного и того же субъекта, например, полученные от субъекта в различные моменты времени, или из различных образцов от указанного субъекта. В качестве альтернативы или дополнительно, вместе с образцами от первого субъекта можно анализировать соответствующие образцы от другого субъекта. Согласно данным вариантам реализации настоящего изобретения может быть удобно упорядочить указанные профили микробиоты в матрицу экспериментальных данных, в которой каждый отдельный элемент профиля выровнен во всем множестве профилей микробиоты.
В конкретном примере данных вариантов реализации настоящего изобретения предложен способ определения вероятности дисбиоза ЖК тракта у субъекта, причем указанный способ включает:
(i) обеспечение множества профилей микробиоты, причем каждый из указанных профилей микробиоты представляет собой профиль относительных уровней множества микроорганизмов или групп микроорганизмов в
(a) образце из ЖК тракта субъекта,
(b) различных соответствующих образцах из ЖК тракта указанного субъекта,
причем каждый профиль микробиоты был получен по существу одинаковым способом, и причем каждый уровень каждого микроорганизма или группы микроорганизмов представляет собой элемент профиля, и упорядочивание указанных профилей микробиоты в матрицу экспериментальных данных, в которой каждый отдельный элемент профиля выровнен во всем множестве профилей микробиоты,
(ii) применение в отношении указанной матрицы экспериментальных данных по меньшей мере одного вектора нагрузки, определенного из скрытых переменных в профилях уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта от множества нормальных субъектов, посредством чего обеспечивают первую матрицу проекционных данных,
(iii) применение в отношении указанной первой матрицы проекционных данных транспонированной версии указанного по меньшей мере одного вектора нагрузки, посредством чего обеспечивают вторую матрицу проекционных данных,
(iv) сравнение указанной матрицы экспериментальных данных с указанной второй матрицей проекционных данных и объединение разностей между соответствующими элементами профиля второй матрицы проекционных данных и матрицы экспериментальных данных и сравнение объединенных разностей в каждом профиле микробиоты с пороговым значением при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующем образце из ЖК тракта от множества нормальных субъектов и/или субъектов, страдающих от дисбиоза, для каждого профиля микробиоты,
(v) применение в отношении указанной первой матрицы проекционных данных по меньшей мере одного собственного числа, причем указанное собственное число было определено из указанного по меньшей мере одного вектора нагрузки, и объединение результирующих значений для каждого элемента профиля из каждого профиля микробиоты в первой матрице проекционных данных и сравнение объединенных значений для каждого профиля микробиоты с пороговым значением при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующем образце из ЖК тракта от множества нормальных субъектов и/или субъектов, страдающих от дисбиоза,
причем этап (v) можно осуществлять до либо после или одновременно с любым из этапов (iii) или (iv), и причем профиль микробиоты с указанными объединенными разностями или указанными объединенными результирующими значениями, превышающими указанные соответствующие пороги при переходе от нормобиотического к дисбиотическому состоянию, свидетельствует о вероятности дисбиоза в ЖК тракте субъекта, от которого был получен данный профиль.
В другом конкретном примере данных вариантов реализации настоящего изобретения предложен способ определения вероятности дисбиоза ЖК тракта у множества субъектов, причем указанный способ включает:
(i) обеспечение множества профилей микробиоты, причем каждый из указанных профилей микробиоты представляет собой профиль относительных уровней множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта указанных субъектов, которые были получены по существу одинаковым способом, и причем каждый уровень каждого микроорганизма или группы микроорганизмов представляет собой элемент профиля, и упорядочивание указанных профилей микробиоты в матрицу экспериментальных данных, в которой каждый отдельный элемент профиля выровнен во всем множестве профилей микробиоты, и осуществление этапов с (ii) по (v) способа согласно настоящему изобретению, описанного выше, причем этап (v) можно осуществлять до либо после или одновременно с любым из этапов (iii) или (iv), и причем профиль микробиоты с указанными объединенными разностями или указанными объединенными результирующими значениями, превышающими указанные соответствующие пороги при переходе от нормобиотического к дисбиотическому состоянию, свидетельствует о вероятности дисбиоза в ЖК тракте субъекта, от которого был получен данный профиль.
В следующих разделах приведено подробное описание способа согласно настоящему изобретению применительно к анализу одного профиля микробиоты. Данное подробное описание применяется с соответствующими изменениями к вышеописанным вариантам реализации настоящего изобретения, в которых множество профилей микробиоты анализируют совместно.
Иными словами, способ согласно настоящему изобретению можно считать способом обнаружения, диагностики или мониторинга дисбиоза ЖК тракта у субъекта, причем профиль микробиоты с указанными объединенными разностями этапа (iv) или указанными объединенными результирующими значениями этапа (v), как правило, обоими из указанных параметров, превышающими указанные соответствующие пороговые значения при переходе от нормобиотического к дисбиотическому состоянию, свидетельствует о дисбиозе.
Дисбиоз определен в настоящей заявке как профиль микробиоты, который отличается или отклоняется от профиля микробиоты, типичного для нормального здорового субъекта, который можно назвать в настоящей заявке «нормобиозом» или «нормобиотическим состоянием». Степень дисбиоза представляет собой меру того, насколько профиль микробиоты отличается от нормального профиля микробиоты, или насколько профиль микробиоты отклоняется от нормального профиля микробиоты. В случае диагностики, мониторинга и/или характеристики заболеваний и состояний, связанных с нарушениями микробиоты ЖК тракта, или в случае оценки риска развития заболевания или состояния, которое, как было определено, связано с нарушением профиля микробиоты, дисбиоз можно более конкретно определить как профиль микробиоты, который отличается от профиля микробиоты, типичного для субъекта, который не страдает от указанного заболевания или состояния или который не подвержен риску развития указанного заболевания или состояния. Типичный профиль микробиоты может быть получен от одного субъекта или даже из одного образца от одного субъекта, но, предпочтительно, будет получен от множества субъектов.
Профиль микробиоты (профиль относительных уровней множества микроорганизмов или групп микроорганизмов) в соответствии со способами согласно настоящему изобретению представляет собой численное представление таких уровней, которое было получено в результате анализа образца ЖК тракта от субъекта. Индивидуальные значения таких уровней (индивидуальные элементы профиля) могут являться качественными, количественными или полуколичественными, предпочтительно, количественными. В соответствующем случае термин «количество» можно использовать вместо термина «уровни».
Профилирование образца ЖК тракта может включать любые подходящие способы, посредством которых можно измерять, предпочтительно, количественно определять уровни микроорганизмов или групп микроорганизмов. Предпочтительно, способы, используемые для получения профилей микробиоты от множества нормальных субъектов и/или множества субъектов, страдающих от дисбиоза, в которых определяют скрытые переменные, например, ортогональные скрытые переменные этапа (и), и пороговые значения этапов (iv) и (v), являются по существу теми же, которые используют для получения по меньшей мере одного профиля микробиоты совокупности экспериментальных данных, несмотря на то, что согласно другим вариантам реализации настоящего изобретения данные способы могут отличаться. В случае если будут использованы различные способы, возможно, будет необходимо рассчитать и применить вектор корректировки, чтобы обеспечить возможность проведения сравнения.
Способы профилирования, пригодные согласно настоящему изобретению, представляют собой, как правило, способы in vitro, которые осуществляют с применением любого образца, отобранного из ЖК тракта.
ЖК тракт, также называемый пищеварительным трактом или пищеварительным каналом (и данные термины можно использовать взаимозаменяемо с ЖК трактом), представляет собой непрерывную последовательность органов, которая начинается ротовой полостью и оканчивается заднепроходным отверстием. Более конкретно, данная последовательность состоит из ротовой полости, глотки, пищевода, желудка, двенадцатиперстной кишки, тонкого кишечника, толстого кишечника и заднепроходного отверстия. Данные органы можно подразделить на верхний ЖК тракт, состоящий из ротовой полости, глотки, пищевода, желудка и двенадцатиперстной кишки, и нижний ЖК тракт, состоящий из тощей кишки, подвздошной кишки (вместе образуют тонкий кишечник), слепой кишки, толстой кишки, прямой кишки (вместе образуют толстый кишечник) и заднепроходного отверстия.
Образец ЖК тракта, пригодный согласно настоящему изобретению, может включать, но не ограничивается указанными, любую жидкость или твердое вещество, отобранное из просвета или с поверхности ЖК тракта, или любой образец любой ткани, образующей органы ЖК тракта. Таким образом, образец может представлять собой любое содержимое просвета ЖК тракта (например, содержимое желудка, содержимое кишечника, слизь и фекалии/кал, или комбинации указанных образцов), а также образцы, полученные из ЖК тракта механическим способом, например, посредством мазка, промывания, аспирации или скобления полости или поверхности ЖК тракта или посредством биопсии ткани/органа ЖК тракта. Образцы фекалий являются предпочтительными. Образец также может являться полученным из части ткани/органа ЖК тракта, которые были удалены хирургическим способом. Образец может представлять собой часть удаленной ткани/органа. Согласно вариантам реализации настоящего изобретения, в которых образец представляет собой образец ткани/органа ЖК тракта, образец может содержать часть слизистой оболочки, подслизистой оболочки, наружного мышечного слоя, адвентициальной оболочки и/или серозной оболочки ткани/органа ЖК тракта. Такие образцы ткани могут быть получены посредством биопсии в течение эндоскопической процедуры. Предпочтительно, образец получен из нижнего ЖК тракта, т.е. из тощей кишки, подвздошной кишки, слепой кишки, толстой кишки, прямой кишки или заднепроходного отверстия. Более предпочтительно, образец представляет собой образец слизи или образец из просвета. Образцы фекалий могут быть отобраны посредством мазка, промывания, аспирации или скобления прямой кишки или заднепроходного отверстия или, в наиболее простом случае, посредством сбора фекалий в процессе или после дефекации.
Образец можно использовать согласно настоящему изобретению в форме, в которой он был изначально получен. Перед использованием в способах согласно настоящему изобретению образец можно также подвергать некоторой степени манипуляции, обработки или очистки. Таким образом, термин «образец» также включает препараты образца, например, относительно чистые или частично очищенные исходные материалы, такие как получистые препараты вышеуказанных образцов. Термин «образец» также включает препараты вышеуказанных образцов, в которых РНК, включая 16S рРНК, подверглась процедуре обратной транскрипции. Также включен продукт микробиологического культивирования указанного образца.
Очистка может являться незначительной, например, может сводиться исключительно к концентрированию твердых веществ или клеток из образца в меньший объем, или к отделению клеток от некоторого количества или всего остатка образца. Типичные методики выделения клеток описаны в публикациях WO 98/51693 и WO 01/53525.
Согласно определенным вариантам реализации согласно настоящему изобретению используют препарат нуклеиновой кислоты из вышеуказанных образцов, предпочтительно, препарат, в котором нуклеиновые кислоты были помечены. Такие препараты включают продукты обратной транскрипции и/или продукты амплификации данных образцов или препаратов нуклеиновых кислот, полученных из указанных образцов. Будет предпочтительно, если преобладающая нуклеиновая кислота препарата нуклеиновой кислоты представляет собой ДНК. Данные препараты включают относительно чистые или частично очищенные препараты нуклеиновой кислоты.
Методики выделения нуклеиновой кислоты из образцов, включая комплексные образцы, многочисленны и хорошо известны в данной области техники и подробно описаны в литературе. Методики, описанные в публикациях WO 98/51693 и WO 01/53525, также можно применять для получения нуклеиновых кислот из вышеуказанных образцов.
Способ согласно настоящему изобретению может включать этап забора образца и/или обработки и/или культивирования образца, в частности, этап амплификации нуклеиновой кислоты, например, амплификации геномной нуклеиновой кислоты, в частности, амплификации нуклеиновой кислоты, содержащей последовательности нуклеотидов, характерные для микроорганизма или группы микроорганизмов.
Если контекст не диктует обратное, термин «соответствующий образец» используют в настоящей заявке для обозначения образцов одинакового типа, которые были получены от различных субъектов и/или в различные моменты времени по существу одинаковым способом, и любую существенную обработку или манипуляцию в отношении которых проводили по существу одинаковым способом.
Способы профилирования микробиоты в образце из ЖК тракта включают, но не ограничены указанными, анализ нуклеиновой кислоты (например, подходы секвенирования нуклеиновой кислоты, подходы на основе гибридизации олигонуклеотидных зондов, подходы амплификации нуклеиновой кислоты на основе праймеров), подходы на основе антител или других специфичных аффинных лигандов, подходы протеомики и метаболомики. Предпочтительно, анализ образца будут осуществлять посредством анализа последовательности нуклеиновой кислоты; данный анализ может принимать форму методики секвенирования. Способ секвенирования по Сэнджеру на основе дидезоксинуклеотидов является хорошо известной и широко используемой методикой секвенирования нуклеиновых кислот. Однако в последнее время получили широкое распространение так называемые подходы секвенирования «следующего поколения» или «второго поколения» (относительно секвенирования по Сэнджеру на основе дидезоксинуклеотидов как подхода «первого поколения»). Данные более новые методики характеризуются высокой производительностью, например, вследствие применения параллелей, например, реакций массового параллельного секвенирования, или вследствие использования менее времязатратных этапов. В различных высокопроизводительных способах секвенирования обеспечивается одномолекулярное секвенирование и применяются методики, такие как пиросеквенирование, секвенирование на основе обратимых терминаторов, секвенирование лигированием на основе расщепляемых зондов, секвенирование лигированием на основе нерасщепляемых зондов, наношарики ДНК и одномолекулярное секвенирование в режиме реального времени.
Анализ секвенирования нуклеиновой кислоты может также, предпочтительно, принимать форму подходов на основе гибридизации олигонуклеотидных зондов, в которых присутствие целевой последовательности нуклеотидов подтверждают посредством обнаружения события специфичной гибридизации между зондом и его мишенью. В данных подходах олигонуклеотидный зонд часто обеспечен как часть более широкой матрицы, например, микроматрицы иммобилизованной нуклеиновой кислоты. Предпочтительно, наборы олигонуклеотидных зондов и связанные способы, описанные в публикациях WO 2012080754 и WO 2011043654, можно использовать для получения профилей микробиоты согласно настоящему изобретению.
Согласно определенным вариантам реализации настоящего изобретения способы согласно настоящему изобретению могут включать этапы, на которых профилируют микробиоту образца ЖК тракта от субъекта, например, посредством любой из вышеописанных методик.
Согласно определенным вариантам реализации настоящего изобретения микроорганизмы или группы микроорганизмов, относительные уровни которых следует определить, являются предварительно выбранными, например, представляют собой микроорганизмы или группы микроорганизмов, которые представляют собой виды-индикаторы и/или виды, вызывающие заболевание или состояние, представляющее интерес. Данное условие однако, не является существенным, поскольку сравнение в рамках способа согласно настоящему изобретению проводят между одними и теми же микроорганизмами.
Таким образом, термин «микроорганизм» в контексте настоящего изобретения может представлять собой любой микробиальный организм, то есть, любой организм, который является микроскопическим, а именно, слишком маленьким, чтобы быть видимым невооруженным глазом, и который может быть обнаружен в ЖК тракте. В частности, в настоящей заявке данный термин включает организмы, которые, как правило, считают микроорганизмами, в частности, бактерии, грибы, археи, водоросли и простейшие. Данный термин, таким образом, в частности, включает организмы, которые являются, как правило, одноклеточными, но которые при определенных условиях могут обладать способностью организовываться в простые совместные колонии или структуры, какие как филаменты, гифы или мицелий (но не истинные ткани). Микроорганизм может являться прокариотическим или эукариотическим и может относиться к любому классу, роду или виду микроорганизмов. Примеры прокариотических микроорганизмов включают, но не ограничены указанными, бактерии, в том числе микоплазмы (например, грамположительные, грамотрицательные бактерии или бактерии, не отвечающие на тест по Граму) и архебактерии. Эукариотические микроорганизмы включают грибы, водоросли и другие, которых классифицируют или которые были классифицированы в таксономическое царство Протисты или которых называют протистами, и включают, но не ограничены указанными, например, простейших, диатомовых, протофитов и грибоподобные плесени.
Согласно предпочтительным вариантам реализации настоящего изобретения группы микроорганизмов могут быть выбраны из Actinobacteria (например, Atopobium, Bifidobacterium), Bacteroidetes (например, Bacteroidia, например, Alistipes, Bacteroides, Prevotella, Parabacteroides, Bacteroidetes (в частности, Bacteroides fragilis), Firmicutes (например, Bacilli, например, Bacillus, Lactobacillus, Pedicoccus, Streptococcus; Clostridia, например, Anaerotruncus, Blautia, Clostridium, Desulfitispora, Dorea, Eubacterium, Faecalibacterium, Ruminococcus; Erysipelotrichia, например, Catenibacterium, Coprobacillus, Unclassified Erysipelotrichaceae; Negativicutes, например, Dialister, Megasphaera, Phascolarctobacterium; Epsilonproteobacteria; Veillonella/Helicobacter (в частности, Dialister invisus, Faecalibacterium prausnitzii, Ruminococcus albus, Ruminococcus bromii, Ruminococcus gnavus, Streptococcus sanguinis, Streptococcus thermophilus)), Proteobacteria (например, Gammaproteobacteria, например, Acinetobacter, Pseudomonas, Salmonella, Citrobacter, Cronobacter, Enterobacter, Shigella, Escherichia), Tenericutes (например, Mollicutes, например, Mycoplasma (в частности, Mycoplasma hominis) и Verrucomicrobia (например, Verrucomicrobiae, например, Akkermansia (в частности, Akkermansia munciphila)).
В случае СРК могут являться важными Firmicutes (Bacilli), Proteobacteria (Shigella/Escherichia), Actinobacteria и Ruminococcus gnavus. Аналогично, в случае ВЗК могут являться важными Proteobacteria (Shigella/Escherichia), Firmicutes, в особенности, Faecalibacterium prausnitzii, и Bacteroidetes (Bacteroides и Prevotella).
Таким образом, согласно определенным вариантам реализации настоящего изобретения указание на профили микробиоты можно считать указанием на профили бактериоты.
Число микроорганизмов или групп микроорганизмов, относительные уровни которых следует определить, не ограничено и, следовательно, может составлять по меньшей мере 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100. Согласно другим вариантам реализации настоящего изобретения данное число может являться меньшим, чем 500, 200, 150, 100, 90, 80, 70, 60 или 50. Любой диапазон, определенный конечными точками любого из данных чисел, включен в настоящую заявку.
Согласно определенным вариантам реализации настоящего изобретения профили микробиоты можно нормировать для подсчета межвыборочной вариации в пределах каждого эксперимента по профилированию и/или межэкспериментальной вариации между каждым циклом эксперимента по профилированию посредством использования соответствующих контролей в процессе или после анализа образцов. Предпочтительно, можно проводить дополнительное нормирование для учета вариаций партий лабораторных расходных материалов и корректировки сигналов фона.
Согласно определенным вариантам реализации настоящего изобретения в отношении каждого элемента профиля микробиоты и/или каждого профиля микробиоты можно применять центрированный вектор, причем указанный вектор получен из среднего значения указанного элемента профиля микробиоты или профиля микробиоты, полученного из соответствующих образцов от множества нормальных субъектов, которые были профилированы тем же способом.
Матрица экспериментальных данных, при использовании, как правило, будет упорядочена таким способом, что каждый образец будет представлен в виде отдельной строки, и каждый микроорганизм или группа микроорганизмов, относительные уровни которых были определены, будут представлены в виде отдельного столбца. Можно использовать обратное упорядочивание относительно указанного.
Термин «скрытые переменные» может означать подсовокупность переменных внутри совокупности данных, которые относятся к потенциально неизвестным корреляциям и тенденциям. Данный термин также включает переменные, которые определены из комбинации исходных переменных в совокупности данных (например, уровень микроорганизма или группы микроорганизмов в образце из ЖК тракта), в особенности, таковые, которые отражают корреляции между переменными и тенденциями в совокупности данных более показательным способом, чем исходные переменные. Таким образом, скрытые переменные, как правило, получены из алгоритмической декомпозиции совокупности данных, например, посредством регрессионного анализа, например, регрессионного анализа методом дробных наименьших квадратов, анализа главных компонент (АГК), канонического анализа корреляций, анализа избыточности, анализа соответствий и канонического анализа соответствий. Скрытые переменные могут являться ортогональными или неортогональными. Ортогональные скрытые переменные представляют собой скрытые переменные, ориентированные перпендикулярно друг к другу. Предпочтительно, скрытые переменные, пригодные в настоящем изобретении, представляют собой ортогональные скрытые переменные.
Скрытые переменные, в частности, ортогональные скрытые переменные, пригодные согласно настоящему изобретению, можно определить посредством любого удобного способа, например, регрессионного анализа методом дробных наименьших квадратов уровней указанного множества микроорганизмов или групп микроорганизмов в образцах ЖК тракта от множества нормальных субъектов, предпочтительно, которых профилировали тем же способом. Согласно определенным вариантам реализации настоящего изобретения ортогональные скрытые переменные определяют посредством ортогонального преобразования в главные компоненты уровней указанного множества микроорганизмов или групп микроорганизмов в образцах ЖК тракта от множества нормальных субъектов, предпочтительно, которых профилировали тем же способом. Согласно предпочтительным вариантам реализации настоящего изобретения ортогональное преобразование в главные компоненты осуществляют посредством АГК, канонического анализа корреляций, анализа избыточности, анализа соответствий и канонического анализа соответствий.
Согласно определенным вариантам реализации настоящего изобретения одна или несколько скрытых переменных представляют собой вектор или векторы нагрузки, пригодные в настоящем изобретении. Другими словами, после определения скрытых переменных никакой дополнительной алгоритмической манипуляции не проводят до того, как указанные скрытые переменные применяют в отношении векторов нагрузки экспериментальных данных.
Согласно определенным вариантам реализации настоящего изобретения в отношении совокупности данных применяют по меньшей мере 2 вектора, например, по меньшей мере 3, 5, 7, 9, 11, 13, 15, 17, 19 или 20 векторов. Согласно другим вариантам реализации настоящего изобретения в отношении совокупности данных применяют не более 50 векторов, например, не более 40, 30, 25, 20 или 15 векторов. Любой диапазон, определенный конечными точками любого из данных чисел, включен в настоящую заявку.
Согласно вариантам реализации настоящего изобретения, в которых указанные векторы нагрузки определяют из ортогональных скрытых переменных, например, посредством АГК, канонического анализа корреляций, анализа избыточности, анализа соответствий и канонического анализа соответствий, число векторов нагрузки, которые можно использовать согласно настоящему изобретению, ограничено числом исследуемых микроорганизмов или групп микроорганизмов или числом образцов из ЖК тракта от множества нормальных субъектов или субъектов, страдающих от дисбиоза, которые были профилированы, в зависимости от того, что меньше: чем больше число исследуемых микроорганизмов или групп микроорганизмов и чем больше число использованных образцов, тем больше число ортогональных скрытых переменных, и, следовательно, связанных векторов, которые могут присутствовать и из которых можно сделать выбор.
Определение скрытых переменных, например, ортогональных скрытых переменных, и/или определение векторов нагрузки из указанных переменных можно осуществлять в рамках способа согласно настоящему изобретению, но более часто можно осуществлять отдельно, либо скрытые переменные, например, ортогональные скрытые переменные, и/или векторы нагрузки могут быть получены из других источников.
Согласно определенным вариантам реализации настоящего изобретения вектор или векторы нагрузки применяют в форме проекционной матрицы.
Согласно предпочтительным вариантам реализации настоящего изобретения применение вектора или векторов нагрузки в отношении экспериментальной совокупности данных включает умножение элементов профиля совокупности данных на вектор или векторы нагрузки, например, в форме проекционной матрицы. Таким образом, данное умножение может представлять собой умножение матриц.
Согласно другим вариантам реализации настоящего изобретения этап (ii), на котором получают первую совокупность проекционных данных, также включает применение по меньшей мере одного собственного (характеристического) числа, определенного из указанного по меньшей мере одного вектора нагрузки, в отношении экспериментальной совокупности данных. Собственное число можно применять до или после вектора нагрузки или одновременно с вектором нагрузки. Применение указанного собственного числа может включать перемножение собственного числа с элементами профиля совокупности экспериментальных данных до или после применения вектора нагрузки в отношении экспериментальной совокупности данных. Согласно другим вариантам реализации настоящего изобретения собственное число можно перемножить с вектором нагрузки до применения в отношении совокупности экспериментальных данных, например, применять перемножение с элементами профиля совокупности экспериментальных данных. В случае необходимости согласно данным вариантам реализации настоящего изобретения указание на собственное число может включать корень, экспоненциальную или логарифмическую формы указанного числа. Указание на умножение включает умножение матриц. Согласно другим вариантам реализации настоящего изобретения, в которых на этапе (ii) применяют множество собственных чисел, собственные числа применяют в форме матрицы с собственными числами, упорядоченными на главной диагонали, но данное условие не является существенным.
Комбинации разностей между соответствующими элементами профиля на этапе (iv) можно достичь любым удобным способом, который приводит к смысловому информационному выходу с данного этапа. Комбинация может представлять собой простую сумму или умножение разностей между каждым соответствующим элементом. Согласно другим вариантам реализации настоящего изобретения может иметь место дополнительная манипуляция, например, применение методики извлечения корня, экспоненциальной или логарифмической методики в отношении каждого элемента и/или каждой разности между каждым соответствующим элементом. Согласно другим вариантам реализации настоящего изобретения объединенными разностями можно также дополнительно манипулировать до сравнения с пороговыми значениями при переходе от нормобиотического к дисбиотическому состоянию.
Согласно предпочтительным вариантам реализации настоящего изобретения комбинация каждой разности между соответствующими элементами включает расчет квадрата каждой указанной разности, а затем суммирование квадратов величины. Согласно таким вариантам реализации настоящего изобретения этап (iii) и этап (iv) до сравнения с пороговыми значениями при переходе от нормобиотического к дисбиотическому состоянию можно выразить как расчет Q-остатков для каждого исследуемого профиля микробиоты.
Согласно предпочтительным вариантам реализации настоящего изобретения применение в отношении указанной первой совокупности проекционных данных по меньшей мере одного собственного числа на этапе (v) включает умножение элементов профиля первой совокупности проекционных данных на собственное число. В случае необходимости согласно данным вариантам реализации настоящего изобретения указание на собственное число может включать корень, экспоненциальную или логарифмическую формы указанного числа. Указание на умножение включает умножение матриц. Согласно другим вариантам реализации настоящего изобретения, в которых на этапе (v) применяют множество собственных чисел, собственные числа применяют в форме матрицы с собственными числами, упорядоченными на главной диагонали, несмотря на то, что данное условие не является существенным Согласно вариантам реализации настоящего изобретения, в которых на этапе (ii) применяют собственное число, то же собственное число можно применять на этапе (v), несмотря на то, что данное условие не является существенным.
Комбинации результирующих значений на этапе (v) можно достичь любым удобным способом, который приводит к смысловому информационному выходу с данного этапа. Комбинация может представлять собой простую сумму или умножение результирующих значений для каждого элемента профиля. Согласно другим вариантам реализации настоящего изобретения может иметь место дополнительная манипуляция, например, применение методики извлечения корня, экспоненциальной или логарифмической методики в отношении каждого результирующего значения для каждого элемента. Согласно другим вариантам реализации настоящего изобретения объединенными результирующими значениями можно также дополнительно манипулировать до сравнения с пороговыми значениями.
Согласно предпочтительным вариантам реализации настоящего изобретения комбинация каждого результирующего значения включает расчет квадрата каждого результирующего значения, а затем суммирование квадратов величины. Согласно таким вариантам реализации настоящего изобретения этап (v) до сравнения с пороговыми значениями можно выразить как расчет Т2 Хотеллинга для каждого исследуемого профиля микробиоты из дисперсии, объясненной скрытыми переменными этапа (ii).
Таким образом, согласно предпочтительному варианту реализации в настоящем изобретении предложен способ определения вероятности дисбиоза ЖК тракта у субъекта, причем указанный способ включает:
(i) обеспечение совокупности экспериментальных данных, причем указанная совокупность экспериментальных данных содержит по меньшей мере один профиль микробиоты, причем указанный профиль микробиоты представляет собой профиль относительных уровней множества микроорганизмов или групп микроорганизмов в образце из ЖК тракта субъекта, и причем каждый уровень каждого микроорганизма или группы микроорганизмов представляет собой элемент профиля указанной совокупности экспериментальных данных,
(ii) применение в отношении указанной совокупности экспериментальных данных по меньшей мере одного вектора нагрузки, определенного из скрытых переменных в профилях уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта от множества нормальных субъектов, в результате чего обеспечивают первую совокупность проекционных данных,
(iii) обеспечение указанной первой совокупности проекционных данных,
(iv) расчет Q-остатка профиля микробиоты из указанной первой совокупности проекционных данных и сравнение Q-остатка профиля микробиоты со значением Q-остатка порога при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта от множества нормальных субъектов и/или субъектов, страдающих от дисбиоза,
(v) расчет Т2 Хотеллинга из указанной первой совокупности проекционных данных для профиля микробиоты из дисперсии, объясненной скрытыми переменными, этапа (ii) и сравнение указанного Т2 Хотеллинга для профиля микробиоты со значением Т2 Хотеллинга порога при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта от множества нормальных субъектов и/или субъектов, страдающих от дисбиоза,
причем этап (v) можно осуществлять до либо после или одновременно с этапом (iv), и причем профиль микробиоты с Q-остатком или Т2 Хотеллинга, превышающими указанные соответствующие пороги, свидетельствует о вероятности дисбиоза.
Пороговые значения при переходе от нормобиотического к дисбиотическому состоянию, с которыми сравнивают комбинацию разностей между соответствующими элементами профиля на этапе (iv) и комбинацию результирующих значений на этапе (v), определяют в соответствующем анализе того же множества микроорганизмов или групп микроорганизмов в соответствующем образце из ЖК тракта от множества нормальных субъектов и/или субъектов, страдающих от дисбиоза. Значения, наблюдаемые у данных субъектов, обеспечат указание на то, где находится порог между нормобиозом и дисбиозом. Чем большее число субъектов будет проанализировано, тем более точно можно определить порог, и, предпочтительно, при определении указанных пороговых значений при переходе от нормобиотического к дисбиотическому состоянию будут проанализированы множество как нормальных субъектов, так и субъектов, страдающих от дисбиоза. Данные пороги представляют собой границу между нормобиозом и дисбиозом для конкретного множества микроорганизмов или групп микроорганизмов в конкретном образце из ЖК тракта, которые были профилированы конкретным способом, и вследствие этого будут отличаться для каждого общего варианта реализации настоящего изобретения, и вследствие этого должны быть получены до момента времени, когда проводят сравнение с исследуемыми образцами.
Соответствующий анализ означает, что пороговые значения определяют с применением по существу тех же способов обработки результатов профилирования соответствующего образца ЖК тракта, что и таковые, использованные для получения комбинации разностей между соответствующими элементами профиля на этапе (iv) и комбинации результирующих значений на этапе (v). Предпочтительно, соответствующий анализ также означает, что пороговые значения определяют с применением по существу того же способа профилирования указанных соответствующих образцов.
Более конкретно, указанные пороговые значения можно определить посредством:
(i) обеспечения совокупности нормобиотических данных, причем указанная совокупность нормобиотических данных содержит по меньшей мере один профиль микробиоты, причем указанный профиль микробиоты представляет собой профиль относительных уровней множества микроорганизмов или групп микроорганизмов в образце из ЖК тракта нормального субъекта, и причем каждый уровень каждого микроорганизма или группы микроорганизмов представляет собой элемент профиля указанной совокупности данных,
(ii) применение в отношении указанной первой совокупности нормобиотических данных того же по меньшей мере одного вектора нагрузки, определенного из скрытых переменных в профилях уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта от множества нормальных субъектов, который применяли в отношении указанной совокупности экспериментальных данных, посредством чего обеспечивают первую совокупность проекционных нормобиотических данных,
(iii) применение в отношении указанной первой совокупности проекционных нормобиотических данных транспонированной версии указанного по меньшей мере одного вектора нагрузки, посредством чего обеспечивают вторую совокупность проекционных нормобиотических данных,
(iv) сравнение указанной совокупности нормобиотических данных с указанной второй совокупностью проекционных нормобиотических данных и объединение разностей между соответствующими элементами профиля второй совокупности проекционных нормобиотических данных и совокупности нормобиотических данных,
(v) применение в отношении указанной первой совокупности проекционных нормобиотических данных по меньшей мере одного собственного числа, причем указанное собственное число было определено из указанного по меньшей мере одного вектора нагрузки, и объединение результирующих значений для каждого элемента профиля,
причем этап (v) можно осуществлять до либо после или одновременно с любым из этапов (iii) или (iv), и причем указанные объединенные разности и указанные объединенные результирующие значения представляют собой указанные соответствующие пороги при переходе от нормобиотического к дисбиотическому состоянию, или по меньшей мере могут обуславливать указанные пороги.
Более конкретно, указанные пороговые значения можно также определить посредством:
(i) обеспечения совокупности дисбиотических данных, причем указанная совокупность дисбиотических данных содержит по меньшей мере один профиль микробиоты, причем указанный профиль микробиоты представляет собой профиль относительных уровней множества микроорганизмов или групп микроорганизмов в образце из ЖК тракта субъекта, страдающего от дисбиоза, и причем каждый уровень каждого микроорганизма или группы микроорганизмов представляет собой элемент профиля указанной совокупности данных,
(ii) применение в отношении указанной первой совокупности дисбиотических данных того же по меньшей мере одного вектора нагрузки, определенного из скрытых переменных в профилях уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта от множества нормальных субъектов, который применяли в отношении указанной совокупности экспериментальных данных, посредством чего обеспечивают первую совокупность проекционных дисбиотических данных,
(iii) применение в отношении указанной первой совокупности проекционных дисбиотических данных транспонированной версии указанного по меньшей мере одного вектора нагрузки, посредством чего обеспечивают вторую совокупность проекционных дисбиотических данных,
(iv) сравнение указанной совокупности дисбиотических данных с указанной второй совокупностью проекционных дисбиотических данных и объединение разностей между соответствующими элементами профиля второй совокупности проекционных дисбиотических данных и совокупности дисбиотических данных,
(v) применение в отношении указанной первой совокупности проекционных дисбиотических данных по меньшей мере одного собственного числа, причем указанное собственное число было определено из указанного по меньшей мере одного вектора нагрузки, и объединение результирующих значений для каждого элемента профиля,
причем этап (v) можно осуществлять до либо после или одновременно с любым из этапов (iii) или (iv), и причем указанные объединенные разности и указанные результирующие значения представляют собой указанные соответствующие пороги при переходе от нормобиотического к дисбиотическому состоянию, или по меньшей мере могут обуславливать указанные пороги.
Как правило, пороговые значения при переходе от нормобиотического к дисбиотическому состоянию выбирают для оптимизации разделения на классы. Иными словами, пороговые значения будут заданы таким образом, чтобы значения, полученные от по меньшей мере 85%, например, по меньшей мере 90%, 95%, 98% или 99% проанализированных нормальных субъектов лежали с одной стороны от порога, а значения, полученные от 85%, например, по меньшей мере 90%, 95%, 98% или 99% проанализированных субъектов, страдающих от дисбиоза, лежали с другой стороны порога.
Согласно вариантам реализации настоящего изобретения, в которых экспериментальные данные являются количественными или полуколичественными, способ согласно настоящему изобретению можно осуществлять образом, который обеспечивает количественное или полуколичественное измерение степени дисбиоза или степени отклонения от нормобиоза. Такие измерения могут характеризоваться преимуществом в контексте диагностики, прогнозирования и/или характеристики заболеваний или состояний, связанных с дисбиозом, поскольку большая степень дисбиоза может свидетельствовать о более тяжелой манифестации заболевания или состояния или конкретного подтипа указанного заболевания или состояния. Такие измерения могут также позволить проводить более точный мониторинг прогрессирования заболевания посредством предоставления большего количества сравнительных данных.
Согласно таким вариантам реализации настоящего изобретения то, насколько комбинация разностей между соответствующими элементами профиля на этапе (iv) и комбинация результирующих значений на этапе (v) отличается от пороговых значений при переходе от нормобиотического к дисбиотическому состоянию, с которыми сравнивают указанные комбинации, будет свидетельствовать о степени дисбиоза (или обеспечит измерение степени дисбиоза либо будет пропорциональной степени дисбиоза).
Согласно более конкретным вариантам реализации настоящего изобретения дисбиоз можно количественно определить посредством объединения комбинации разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатков) и комбинации результирующих значений на этапе (v) (например, Т2 Хотеллинга) в единую метрику дисбиоза. Данной второй комбинации можно достичь любым удобным способом, который приводит к смысловому информационному выходу с данного этапа. Вторая комбинация может представлять собой простую сумму или умножение комбинации разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатков) и комбинации результирующих значений на этапе (v) (например, Т2 Хотеллинга).
Таким образом, в настоящем изобретении предложен способ количественного определения дисбиоза, причем указанный способ включает осуществление вышеописанного способа согласно настоящему изобретению, причем указанные сравнения с порогами при переходе от нормобиотического к дисбиотическому состоянию вместе включают объединение комбинации разностей между соответствующими элементами профиля на этапе (iv) и комбинации результирующих значений на этапе (v) в единую метрику дисбиоза.
Согласно другим вариантам реализации настоящего изобретения может иметь место дополнительная манипуляция, например, применение методики извлечения корня, экспоненциальной или логарифмической методики к комбинации разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатков) и/или комбинации результирующих значений на этапе (v) (например, Т2 Хотеллинга). Согласно следующим вариантам реализации настоящего изобретения в отношении одной или обеих из данных комбинаций можно применять взвешивание (более подробно обсуждается ниже). Согласно другим вариантам реализации настоящего изобретения со второй комбинацией можно также дополнительно манипулировать. Согласно другим вариантам реализации настоящего изобретения рассчитывают евклидово расстояние от нулевой точки как для комбинации разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатков), так и для комбинации результирующих значений на этапе (v) (например, Т2 Хотеллинга). Таким образом, согласно определенным вариантам реализации настоящего изобретения как комбинацию разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатки), так и комбинацию результирующих значений на этапе (v) (например, Т2 Хотеллинга) возводят в квадрат, затем суммируют, после чего определяют квадратный корень данного расчета для получения указанной единой метрики дисбиоза. Данную манипуляцию можно представить следующей формулой (Формула I), где Qres представляет собой комбинацию разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатки), и Т2 представляет собой комбинацию результирующих значений на этапе (v) (например, Т2 Хотеллинга).
Формула I:
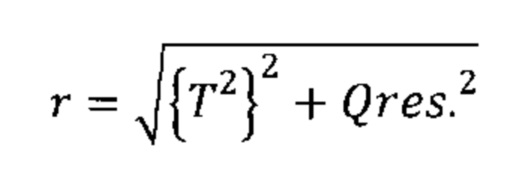
Единая метрика является в высокой степени удобной и обеспечивает преимущества при интерпретации результатов от различных субъектов. Неожиданно было обнаружено, что комбинация разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатки) и комбинация результирующих значений на этапе (v) (например, Т2 Хотеллинга) потенциально коррелируют, и что высокое значение для одной комбинации может быть связано с высоким значением для другой. Было установлено, что простое суммирование данных значений может привести к завышению степени дисбиоза, и в связи с этим использование евклидового расстояния может характеризоваться преимуществом, поскольку снижает риск завышения степени дисбиоза единой метрикой, возникающий в результате простого сложения значений во второй комбинации.
Порог при переходе от нормобиотического к дисбиотическому состоянию для одного и того же множества микроорганизмов или групп микроорганизмов в соответствующем образце из ЖК тракта, выраженный в тех же показателях, что и вышеописанная метрика, можно рассчитать тем же способом из множества нормальных субъектов и/или субъектов, страдающих от дисбиоза, и то, насколько метрика для исследуемого образца отличается от указанного порога, будет пропорционально степени дисбиоза.
Согласно предпочтительным вариантам реализации настоящего изобретения объединение комбинации разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатков) и комбинации результирующих значений на этапе (v) (например, Т2 Хотеллинга) в единую метрику дисбиоза будет включать масштабирование указанной комбинации разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатков) и комбинации результирующих значений на этапе (v) (например, Т2 Хотеллинга), чтобы привести к получению значений аналогичного порядка величины, например, посредством деления комбинации разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатков) и комбинации результирующих значений на этапе (v) (например, Т2 Хотеллинга) на соответствующие пороги при переходе от нормобиотического к дисбиотическому классу (т.е. пороги при переходе от нормобиотического к дисбиотическому состоянию, с которыми проводят сравнение на этапах (iv) и (v), соответственно). Данную манипуляцию можно представить следующей формулой (Формула II), где q представляет собой комбинацию разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатки), и Т2 представляет собой комбинацию результирующих значений на этапе (v) (например, Т2 Хотеллинга).
Формула II:
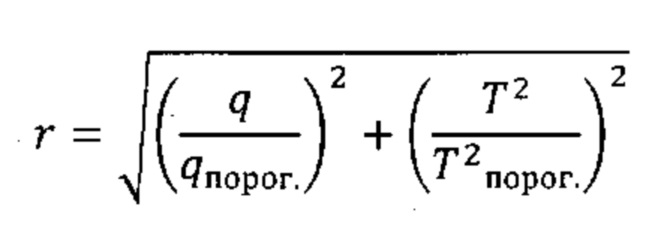
Масштабированная единая метрика является в высокой степени удобной и обеспечивает преимущества при интерпретации результатов от различных субъектов.
Согласно другим вариантам реализации настоящего изобретения с целью количественного определения дисбиоза указанную единую метрику (предпочтительно, указанную масштабированную единую метрику) можно дополнительно откладывать на конечной, предпочтительно, непрерывной числовой шкале от нормобиотического к дисбиотическому состоянию (или наоборот) с разделением на классы (границей между нормобиозом и дисбиозом) в предварительно определенной точке, предпочтительно, в предварительно определенном целом значении на данной конечной числовой шкале, которая представляет собой, или является комбинацией, предпочтительно, суммой, порогов при переходе от нормобиотического к дисбиотическому классу (аналогично масштабированных в случае необходимости) этапов (iv) и (v).
То, насколько указанная единая метрика, определенная для исследуемого образца, отличается от точки разделения классов в направлении максимальной дисбиотической конечной точки шкалы, пропорционально степени дисбиоза. Предпочтительно, часть числовой шкалы между точкой разделения классов и максимальной дисбиотической конечной точкой шкалы подразделена на отдельные области, которые дополнительно способствуют количественному определению дисбиоза. Предпочтительно, указанные области имеют границы в определенных точках, например, целых числах.
Таким образом, в настоящем изобретении предложен способ количественного определения дисбиоза, причем указанный способ включает осуществление вышеописанного способа согласно настоящему изобретению и последующее откладывание указанной единой метрики дисбиоза на конечной, предпочтительно, непрерывной числовой шкале с разделением на классы в предварительно определенной точке, которая представляет собой, или является комбинацией порогов при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), аналогично масштабированных, если применяли масштабирование.
Аналогично, то, насколько указанная единая метрика, определенная для исследуемого образца, отличается от точки разделения классов в направлении максимальной нормобиотической конечной точки шкалы, обратно пропорционально тому, насколько исследуемый образец отклоняется от модельного определения нормы. Для облегчения визуализации данного отклонения часть числовой шкалы между точками разделения классов и максимальной нормобиотической конечной точкой шкалы можно подразделить на отдельные области, которые дополнительно способствуют количественному определению отклонения от модельного определения нормы. Предпочтительно, указанные области содержат пороги в определенных точках, например, целых числах.
Для простоты интерпретации единая метрика может сообщаться применительно к ближайшему порогу между различными областями шкалы или точки разделения классов.
Откладывание указанной единой метрики на такой числовой шкале, т.е. шкале с точкой разделения классов, которая представляет собой, или является комбинацией, предпочтительно, суммой пороговых значений при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), обеспечивает то, что оба элемента метрики вносят вклад в определение степени дисбиоза.
В результате того, что указанная единая метрика представляет собой комбинацию двух различных измерений (комбинации разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатков) и комбинации результирующих значений на этапе (v) (например, Т2 Хотеллинга)), граница классов (при переходе от нормобиоза к дисбиозу), определенная данными измерениями, является двухмерной, и простое суммирование связанных пороговых значений при переходе от нормобиотического к дисбиотическому классу для обоих измерений для определения точки разделения классов на указанной конечной числовой шкале может не обеспечить полное разрешение вариаций между результатами от нормобиотических и дисбиотических образцов, что может наблюдаться на границе или вблизи от границы классов, когда только один из данных показателей превышает свое соответствующее пороговое значение. Вследствие этого при последующем откладывании единой метрики на конечной числовой шкале от нормобиотического к дисбиотическому состоянию (или наоборот) с разделением на классы (границей между нормобиозом и дисбиозом) в предварительно определенной точке для увеличения точности можно задать предварительно определенные точки разделения классов, дифференциально зависящие от того, характеризуется или не характеризуется указанный исследуемый образец по меньшей мере одним из данных измерений, лежащим за пределами соответствующего порогового значения. Согласно данным вариантам реализации настоящего изобретения точка разделения классов для исследуемого образца, который характеризуется по меньшей мере одной из комбинации разностей между соответствующими элементами профиля на этапе (iv) или комбинации результирующих значений на этапе (v), превышающей пороговые значения при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), соответственно, будет соответствовать, или, предпочтительно, являться, таковой одного или другого значения, превышающего пороговые значения при переходе от нормобиотического к дисбиотическому классу этапов (iv) или (v). Также согласно данным вариантам реализации настоящего изобретения точка разделения классов для исследуемого образца, в котором ни одна из комбинации разностей между соответствующими элементами профиля на этапе (iv) или комбинации результирующих значений на этапе (v) не находится за пределами пороговых значений при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), соответственно, будет соответствовать, или, предпочтительно, являться, суммой порогов при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v). Согласно данным вариантам реализации настоящего изобретения термин «соответствует» включает корень, экспоненциальную или логарифмическую формы указанных значений, предпочтительно, квадратный корень из указанных пороговых значений.
Таким образом, в настоящем изобретении предложен способ количественного определения дисбиоза, причем указанный способ включает осуществление вышеописанного способа согласно настоящему изобретению и последующее откладывание единой метрики на конечной числовой шкале с разделением на классы в предварительно определенной точке, причем для исследуемого образца, который характеризуется по меньшей мере одной из комбинации разностей между соответствующими элементами профиля на этапе (iv) или комбинации результирующих значений на этапе (v), превышающей пороговые значения при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), соответственно, указанная точка разделения классов будет соответствовать таковой одного или другого значения, превышающего пороговые значения при переходе от нормобиотического к дисбиотическому классу этапов (iv) или (v), и для исследуемого образца, в котором ни одна из комбинации разностей между соответствующими элементами профиля на этапе (iv) или комбинации результирующих значений на этапе (v) не находится за пределами пороговых значений при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), соответственно, указанная точка разделения классов будет соответствовать сумме порогов при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v).
Согласно данным вариантам реализации настоящего изобретения может быть удобно, если в отношении точки разделения классов применяют репрезентативное значение, которое остается постоянным вне зависимости от истинного значения точки разделения классов, применяемой в отношении исследуемого образца, о котором идет речь, что, таким образом, облегчает использование одной и той же шкалы для представления результатов от нормобиотических или дисбиотических субъектов.
Согласно вариантам реализации настоящего изобретения, в которых часть числовой шкалы между точкой разделения классов и максимальной дисбиотической конечной точкой шкалы подразделена на отдельные области, которые дополнительно способствуют количественному определению дисбиоза, выраженному в виде определенных целых чисел, может иметь преимущество расчет того, когда указанная единая метрика попадает более точно в виде десятичного значения между указанными целыми значениями, посредством чего можно достичь более точного количественного определения дисбиоза. Согласно таким вариантам реализации настоящего изобретения расчет указанных десятичных значений между указанными целыми числами выполняют посредством плотности вероятности или функции распределения вероятности. Множество методик доступны специалисту, способному выбрать из таких методик или объединить их, чтобы удовлетворить свои потребности или разработать новые методики. В качестве неограничивающих примеров можно использовать следующие распределения: логарифмическое нормальное распределение, непрерывное равномерное распределение, дискретное равномерное распределение, нормальное (или гауссово) распределение, распределение Стьюдента, распределение хи-квадрат, F-распределение, логит-нормальное распределение, логарифмическое логистическое распределение, распределение Парето, распределение Бернулли, биномиальное распределение, геометрическое распределение, распределение Пуассона, экспоненциальное распределение, гамма- распределение, бета-распределение. Согласно данным вариантам реализации настоящего изобретения единая метрика также может сообщаться применительно к ближайшему порогу между различными областями шкалы или точки разделения классов, однако более точным является определение того, какой порог является ближайшим, посредством расчета десятичного значения.
Согласно предпочтительным вариантам реализации настоящего изобретения эффекты технической вариации на откладывание экспериментальных данных на указанной конечной числовой шкале, в частности, между указанной точкой разделения классов и указанной максимальной конечной точкой дисбиоза, минимизируют посредством применения взвешивания в отношении комбинации разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатков) и/или комбинации результирующих значений на этапе (v) (например, Т2 Хотеллинга) в течение второго этапа комбинирования. Когда в отношении обеих комбинаций применяют взвешивание, взвешивание может являться одинаковым или может отличаться. Одно из взвешиваний может представлять собой ноль. Подходящее взвешивание можно определить без излишнего труда посредством повторяющегося анализа эталонного образца или множества эталонных образцов, например, образца или образцов от субъекта, страдающего от дисбиоза ЖК тракта, согласно настоящему изобретению и определения того, какие весовые значения, если таковые имеются, в случае каждой комбинации приводят к наиболее стабильному межэкспериментальному выходу.
Согласно предпочтительным вариантам реализации настоящего изобретения данную манипуляцию можно выразить следующей формулой (Формула III), где q представляет собой комбинацию разностей между соответствующими элементами профиля на этапе (iv) (например, Q-остатки), Т2 представляет собой комбинацию результирующих значений на этапе (v) (например, Т2 Хотеллинга), и w представляет собой примененное взвешивание.
Формула III
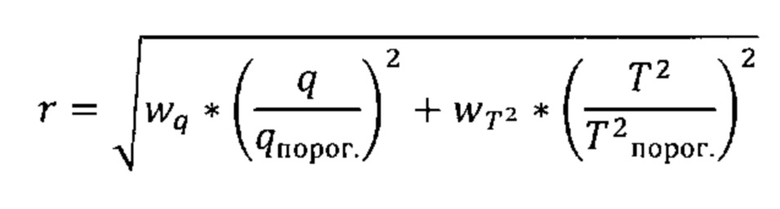
Согласно определенным вариантам реализации настоящего изобретения можно применять взвешивание в отношении анализа образцов, которые характеризуются по меньшей мере одой из комбинации разностей между соответствующими элементами профиля на этапе (iv) или комбинации результирующих значений на этапе (v), превышающей пороговые значения при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), соответственно, но не в отношении анализа исследуемого образца, в котором ни одна из комбинации разностей между соответствующими элементами профиля на этапе (iv) или комбинации результирующих значений на этапе (v) не находится за пределами пороговых значений при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), соответственно.
Согласно определенным вариантам реализации настоящего изобретения способы согласно настоящему изобретению не включают этап, на котором профиль микробиоты из образца ЖК тракта сравнивают, например, напрямую, с соответствующим профилем, репрезентативным для конкретного заболевания или состояния либо стадии указанного заболевания или состояния, или с соответствующим профилем, репрезентативным для здорового субъекта или пациента, страдающего от дисбиоза ЖК тракта.
Как обсуждалось выше, множество заболеваний и состояний или стадий указанных заболеваний или состояний, как считают, связаны с нарушениями микробиоты ЖК тракта или его областей. Вышеописанные способы согласно настоящему изобретению, в частности, количественные или полуколичественные способы, можно вследствие этого использовать для получения и обеспечения информации, значимой для диагностики, мониторинга и/или характеристики заболеваний и состояний, связанных с нарушениями микробиоты ЖК тракта, или для оценки риска развития заболевания или состояния, связанного с нарушением профиля микробиоты ЖК тракта. Как очевидно из обсуждения в настоящей заявке, нарушение профиля микробиоты ЖК тракта можно считать дисбиозом ЖК тракта.
Таким образом, согласно следующему аспекту в настоящем изобретении предложен способ получения информации, значимой для диагностики, мониторинга и/или характеристики заболеваний и состояний, связанных с нарушениями микробиоты ЖК тракта, или для оценки риска развития заболевания или состояния, связанного с нарушением профиля микробиоты ЖК тракта, причем указанный способ включает осуществление способа, как определено выше, и причем продукт указанного способа, как определено выше, указание на вероятность дисбиоза или степень дисбиоза, обеспечивает указанную информацию.
Согласно следующему аспекту в настоящем изобретении предложен способ диагностики, мониторинга и/или характеристики заболевания и состояния, связанных с нарушениями микробиоты ЖК тракта, или оценки риска развития заболевания или состояния, связанного с нарушением профиля микробиоты ЖК тракта, причем указанный способ включает осуществление способа, как определено выше, причем указание на вероятность дисбиоза или степень дисбиоза свидетельствует о наличии или отсутствии, риске развития, прогрессировании или характеристиках указанного заболевания или состояния, связанного с нарушениями микробиоты ЖК тракта. Согласно данным вариантам реализации настоящего изобретения способ может также включать этап постановки диагноза, мониторинга и/или проведения характеристики заболевания или состояния, связанного с нарушениями микробиоты ЖК тракта, или проведения оценки риска развития заболевания или состояния, связанного с нарушением профиля микробиоты ЖК тракта, на основании указания вероятности или степени дисбиоза, предоставленного на предыдущих этапах. Результаты такого последнего этапа можно записать и необязательно хранить на подходящем носителе для записи/информационном носителе и/или передать врачу, субъекту или представителю либо доверенному лицу указанного субъекта.
Согласно определенным вариантам реализации настоящего изобретения указанный способ осуществляют с профилями микробиоты от множества образцов из ЖК тракта, отобранных от пациента в различные временные точки. Данным способом можно исследовать изменения микробиоты ЖК тракта у субъектов в течение времени.
Заболевания и состояния, связанные с нарушениями микробиоты ЖК тракта, т.е. дисбиозом, можно считать таковыми, которые могут быть вызваны или которые могут усугубляться в результате смещения профиля микробиоты ЖК тракта (или его областей), такими, которые вызывают, или которые приводят к появлению профиля микробиоты ЖК тракта (или его областей), который отличается от нормального состояния, или таковые, которые можно характеризовать посредством или идентифицировать на основании появления профиля микробиоты ЖК тракта (или его областей), который отличается от нормального состояния. Примеры таких заболеваний и состояний включают, но не ограничены указанными, функциональные нарушения ЖК тракта, например, воспалительное заболевание кишечника (ВЗК), болезнь Крона (БК), язвенный колит (ЯК), синдром раздраженного кишечника (СРК) и диспепсию; синдром избыточного бактериального роста в тонком кишечнике и варианты рака ЖК тракта (например, рак ротовой полости, глотки, пищевода, желудка, двенадцатиперстной кишки, тощей кишки, подвздошной кишки, слепой кишки, толстой кишки, прямой кишки или заднепроходного отверстия); рак молочной железы; анкилозирующий спондилит; неалкогольный стеатогепатит; атопические заболевания, например, экзему, астму, атопический дерматит, аллергический конъюнктивит, аллергический ринит и пищевые аллергии; метаболические нарушения, например, сахарный диабет (типа 1 и типа 2), ожирение и метаболический синдром; неврологические расстройства, например, депрессию, множественный склероз, слабоумие и болезнь Альцгеймера; аутоиммунное заболевание (например, артрит); неполноценность питания; синдром хронической усталости и аутизм. Согласно предпочтительным вариантам реализации настоящего изобретения способы согласно настоящему изобретению осуществляют в случае СРК.
«Диагноз» означает определение наличия или существования заболевания или состояния или стадии указанного заболевания или состояния в организме. «Мониторинг» означает установление степени или возможных изменений заболевания или состояния, в частности, когда известно, что индивидуум страдает от заболевания или состояния, например, для мониторинга эффектов лечения или развития заболевания или состояния, например, определения пригодности лечения, обеспечения прогноза и/или определения того, находится ли пациент в состоянии ремиссии или обострения заболевания. «Характеристика/характеризация» включает определение свойств конкретного заболевания или состояния субъекта, например, степени или тяжести заболевания или состояния либо подтипа указанного заболевания или состояния, включая вероятность ответа на конкретные терапии.
«Оценка риска развития заболевания или состояния у субъекта» означает определение возможности или вероятности того, что у субъекта разовьется заболевание или состояние. Согласно некоторым вариантам реализации настоящего изобретения данная оценка может быть выражена в виде численной вероятности. Оценка риска может быть основана на степени дисбиоза, определенной способами согласно настоящему изобретению.
«Заболевание» означает состояние патологического расстройства относительно нормы, которое может являться следствием, например, инфекции либо приобретенного или врожденного генетического нарушения.
«Состояние» означает состояние рассудка или тела организма, которое не возникло в результате признанного заболевания, например, наличия агента в организме, такого как токсин, лекарственный препарат или загрязняющее вещество, или беременность.
«Стадия указанного заболевания или состояния» означает различные стадии заболевания или состояния, при которых могут наблюдаться или могут не наблюдаться конкретные физиологические или метаболические изменения, но наблюдаются изменения профиля микробиоты ЖК тракта. Согласно некоторым вариантам реализации настоящего изобретения наблюдаемые изменения профиля микробиоты ЖК тракта могут позволять классифицировать прогрессирование заболевания или состояния, которые не оценивали должным образом ранее.
Субъект может представлять собой любого субъекта-животное, представляющее собой человека или отличное от человека, но, более конкретно, может представлять собой позвоночное животное, например, млекопитающее, включая домашний скот и домашних животных. Предпочтительно, субъект представляет собой человека, и в данном случае термин «пациент» можно использовать взаимозаменяемо с термином «субъект». Субъект может быть любого возраста, например, может представлять собой младенца, ребенка, подростка, юношу или взрослого субъекта, предпочтительно, взрослого субъекта. У людей взрослым считают человека в возрасте по меньшей мере 16 лет, младенцем считают человека в возрасте до 2 лет. Согласно определенным вариантам реализации настоящего изобретения субъект будет представлять собой младенца, согласно другим - субъект будет представлять собой ребенка или взрослого. Субъект может быть подвержен или может быть, предположительно, подвержен риску дисбиоза или медицинского состояния, о котором идет речь (например, СРК и ВЗК и его подкатегорий БК и ЯК).
«Нормальный» или «здоровый» субъект представляет собой субъекта, которого не считают страдающим от недомогания или заболевания или другого медицинского состояния, диагностика которого является целью способа, о котором идет речь, или заболевания, недомогания или другого медицинского состояния, которое является аналогичным указанному заболеванию или характеризуется общими свойствами и симптомами, например, симптомами и свойствами со стороны ЖК. «Нормальный» или «здоровый» ЖК тракт представляет собой ЖК тракт таких субъектов. В качестве альтернативы, «нормальный» или «здоровый» субъект (или ЖК тракт) представляет собой субъекта/ЖК тракт, у которого отсутствует дисбиоз ЖК тракта. Согласно другим вариантам реализации настоящего изобретения нормальный или здоровый субъект будет по существу свободным от серьезного недомогания или заболевания либо других медицинских состояний, или по меньшей мере представляет собой субъекта, у которого отсутствуют наблюдаемые или обнаруживаемые симптомы любого распознанного серьезного недомогания или заболевания. Согласно другим вариантам реализации настоящего изобретения нормальный или здоровый субъект будет свободен от всех недомоганий или заболеваний либо других медицинских состояний, или по меньшей мере у него отсутствуют наблюдаемые или обнаруживаемые симптомы любого распознанного недомогания или заболевание. Предпочтительно, указания на недомогание, заболевание или медицинское состояние представляют собой указание на недомогание, заболевание или медицинское состояние ЖК тракта.
Слово «соответствующий» используют, чтобы выразить то, что субъект, в отношении которого используют данный термин, является таким же, как и другой экземпляр данного субъекта. Таким образом, существенные свойства, которые определяют данного субъекта, являются общими с другим субъектом, несмотря на то, что точные детали могут являться уникальными. Альтернативными терминами могут являться «подходящий», «аналогичный», «согласующийся», «эквивалентный» или «такой же».
Способы согласно настоящему изобретению можно осуществлять на компьютере, системе или устройстве, содержащем программу, приспособленную для осуществления указанных способов или по меньшей мере одного из этапов указанных способов. Таким образом, способы согласно настоящему изобретению могут представлять собой компьютеризированные способы, и в настоящем изобретении также предложены компьютер, система или устройство (оборудование), содержащие программу, приспособленную для осуществления способов согласно настоящему изобретению. Как правило, присутствуют процессор для выполнения программного обеспечения и устройство хранения для накопления экспериментальных данных и результатов одного или нескольких этапов способов согласно настоящему изобретению. Процессор и устройство хранения будут, как правило, находиться во взаимодействии друг с другом. Согласно одному варианту реализации настоящего изобретения компьютер, система или устройство находятся во взаимодействии с сетью, такой как интернет, например, для взаимодействия с лабораториями и клиниками, которые обмениваются экспериментальными данными и/или получают выходные данные способов согласно настоящему изобретению. Система или устройство могут быть дополнительно приспособлены для осуществления профилирования микробиоты или этапа указанного профилирования, например, этапа, который приводит к получению профиля микробиоты, пригодного согласно настоящему изобретению, предпочтительно, частично или полностью автоматизированным способом. В настоящем изобретении также предложен машиночитаемый носитель, содержащий указанную программу, или такая программа сама по себе. Согласно другим аспектам в настоящем изобретении предложены Формулы I, II и III и применение указанных формул в виде способов, описанных в общем виде в настоящей заявке, и конкретных способов согласно настоящему изобретению, приведенных в настоящей заявке.
Результаты (конечные выходные данные) способов согласно настоящему изобретению могут быть представлены на машино- или человекочитаемом носителе или могут передаваться посредством любых подходящих способов, электронного или иного, для восприятия и/или последующей интерпретации специалистом.
Способы согласно настоящему изобретению можно использовать сами по себе в качестве альтернативы другим исследовательским методикам или дополнительно к таким методикам с целью обеспечения информации относительно профилей микробиоты субъекта, например, при диагностике и т.д. заболеваний и состояний, связанных с нарушениями микробиоты ЖК тракта, в частности, с целью диагностики СРК или исключения СРК в качестве объяснения симптомов, которые наблюдаются у субъекта. В случае диагностики СРК, например, способы согласно настоящему изобретению можно использовать в качестве альтернативного или дополнительного диагностического измерения для диагностики с применением методики визуализации, такой как магнитная резонансная визуализации (МРВ), ультразвуковая визуализация, ядерная визуализация, рентгеновская визуализация или эндоскопия либо серологические маркеры ВЗК, например, антитела против Saccharomyces cerevisiae (anti-Saccharomyces cerevisiae antibodies, ASCA) и перинуклеарные антинейтрофильные цитоплазматические антитела (peri-nuclear anti-neutrophil cytoplasmic antibodies, pANCA).
Согласно следующему аспекту способы, описанные выше, могут включать дополнительный этап терапевтического лечения указанного субъекта способом, соответствующим поставленному диагнозу или прогнозу, для облегчения, уменьшения, излечивания или модификации по меньшей мере одного симптома или характеристики заболевания или состояния, связанного с нарушениями микробиоты ЖК тракта, которые наблюдаются у субъекта (например, СРК и т.д.), например, посредством введения фармацевтической композиции (которую можно считать содержащей трансплантаты фекальной микробиоты и микробиальные культуры) и/или осуществления хирургической процедуры, соответствующей для лечения заболевания или состояния и/или для корректировки образа жизни субъекта способом, соответствующим для лечения заболевания или состояния. В этой связи настоящее изобретение можно считать относящимся к способам терапевтического лечения заболеваний или состояний, связанных с нарушениями микробиоты ЖК тракта (например, СРК и т.д.), и к способам регулирования и/или оптимизации таких вариантов лечения. Данные способы могут включать варианты лечения для излечивания или по меньшей мере частичного устранения дисбиоза ЖК тракта субъекта или степени указанного дисбиоза.
Настоящее изобретение будет описано ниже посредством следующих неограничивающих примеров, в которых:
На фигуре 1 представлено распределение показателей ИД (индекса дисбиоза) 1 - 5 для валидационной когорты, как определено в примере 1, демонстрирующее увеличение ИД в ряду от нормальных индивидуумов к пациентам, страдающим от СРК, и, наконец, к пациентам, страдающим от ВЗК.
На фигуре 2 представлены результаты АГК для первых двух главных компонент (ГК) валидационной когорты (n=287) на основании 54 зондов. На две ГК приходится 48% вариации, и точки окрашены в зависимости от А) когорты: желтый - нормальные, синий - СРК и красный - ВЗК; и В) ИД: серый = 1-2, оранжевый = 3, красный = 4, темно-красный = 5.
На фигуре 3 представлен средний нормированный сигнал для первых пяти зондов, отсортированный по абсолютной относительной разности между дисбиотическими (красный) и недисбиотическими (серый) образцами, как определено в примере 1 для А) пациентов, страдающих от СРК (n=109), и В) пациентов, страдающих от ВЗК (n=135). Act; Actinobacteria, B/Prev; Bacteroides/Prevotella, Firm(b); Firmicutes (Bacilli), Firm (c); Firmicutes (Clostridia), F. prau; Faecalibacterium prausnitzii, Pb; Proteobacteria, Rum.g; Ruminococcus gnavus, Sh/Es; Shigella/Escherichia.
На фигуре 4 представлен средний нормированный сигнал зондов, отсортированный по абсолютной относительной разности между дисбиотическими (красный) и недисбиотическими (серый) образцами, как определено в примере 1, для испанской когорты (n=24). Bf; Bifidobacterium, B. ster; Bacteroides stercoris, Parab; Parabacteroides, Pb; Proteobacteria, Sh/Es; Shigella/Escherichia.
На фигуре 5 представлены показатели первых трех главных компонент из АГК нормированных данных от пяти здоровых субъектов, собираемых еженедельно в течение 14 недель (n=64). Одна точка представляет собой один образец донора х, отобранный во временную точку у. На первые три ГК приходится 65% вариации, и точки окрашены в зависимости от донора.
ПРИМЕР 1 - Получение профилей микробиоты ЖК тракта с помощью 54 зондов, нацеленных на множество микроорганизмов или групп микроорганизмов, и с применением одинакового определения дисбиоза у пациентов, страдающих от СРК и страдающих от ВЗК
Материалы и методы
Образцы человека
Образцы фекалий отбирали от 668 взрослых людей (возраст 17-76 лет; 69% женщин), включая нормальных индивидуумов (n=297) и пациентов, страдающих от СРК (n=236) и ВЗК (n=135) (таблица 1). Образцы фекалий отбирали в больницах Норвегии, Швеции, Дании и Испании (72%), а также в офисных помещениях в Осло, Норвегия (28%), с целью достижения гетерогенности. У нормальных доноров отсутствовали клинические признаки, симптомы или данные о наличии в анамнезе ВЗК, СРК или других нарушений, связанных с органами желудочно-кишечного тракта (например, рака толстой кишки). Образцы СРК отбирали в рамках проспективных исследований, в которых для установления СРК использовали Римские диагностические критерии III. Распределение подтипов СРК являлось следующим: 44% СРК-диарея, 22% СРК альтернирующий, 17% СРК-констипация, 11% СРК несубтипированный и 4% СРК смешанный. Диагноз ВЗК был основан на клинических проявлениях, подтвержденных колоноскопией. Из 135 образцов ВЗК 80 (59%) были отобраны от пациентов, не получавших лечение, и 55 (41%) были отобраны от пациентов, страдающих от ВЗК, в стадии ремиссии. Распределение типов ВЗК являлось следующим: 62% ЯК и 38% БК для группы, не получавшей лечение, и 67% ЯК и 33% БК для группы ВЗК в стадии ремиссии. От доноров всех образцов получали информированное согласие вместе с одобрением от местных научных этических комитетов.

А, альтернирующий; К, констипация; БК, болезнь Крона; Д, диарея; СРК, синдром раздраженного кишечника; ВЗК, воспалительное заболевание кишечника; С, смешанный; Н, несубтипированный; ЯК, язвенный колит.
*Точный возраст был известен для доноров 99% из всех использованных образцов.
 Тип СРК был известен для доноров 97% из всех использованных образцов.
Тип СРК был известен для доноров 97% из всех использованных образцов.
 Диагноз БК/ЯК был известен для доноров 99% из всех использованных образцов ВЗК.
Диагноз БК/ЯК был известен для доноров 99% из всех использованных образцов ВЗК.
Забор образцов
Образцы отбирали дома, в офисе или больнице и замораживали в течение 3-5 дней. Образцы фекалий смешивали с буфером для транспортирования и восстановления кала (Roche, Базель, Швейцария) в соотношении 1:3 на вортексе. Все образцы центрифугировали на центрифуге импульсного действия, и по 600 мкл образца переносили в 96-луночный адаптер Lysing Matrix Е (MP Biomedicals Inc., Санта-Ана, Калифорния, США). Образцы лизировали механическим способом дважды при 1800 об./мин. в течение 40 с, с перерывом в течение 40 с в системе FastPrep-96™ (MP Biomedicals Inc.). Лизированные образцы центрифугировали (5 мин., 1300 д, центрифуга PlateSpin II, Kubota, Токио, Япония), и по 250 мкл образцов инкубировали при температуре 65°С в течение 15 мин. с 250 мкл лизирующего буфера BLM и 20 мкл протеазы. Аликвоту каждого обработанного протеазой образца фекалий объемом 400 мкл использовали для экстракции суммарной геномной ДНК согласно инструкциям набора mag™ maxi kit (LGC Genomics, Берлин, Германия), откорректированным для робота для экстракции ДНК MagMAX™ express 96 (Life Technologies, Уолтем, Массачусетс, США).
Праймеры для полимеразной цепной реакции (ПЦР) (нацеленные на ген 16S рРНК) использовали для амплификации фрагментов размером 1180 пар оснований, содержащих семь вариабельных областей (V3-V9). После этого проводили очистку реакции, как описано в публикации Veb∅ et al (Vebo НС, Sekelja M, Nestestog R, et al. Temporal development of the infant gut microbiota in immunoglobulin E-sensitized and nonsensitized children determined by the GA-map infant array. Clin Vaccine Immunol 2011; 18: 1326-1335), с незначительными изменениями.
Анализ образцов: SNE, гибридизация и обнаружение
Матрицы для ПЦР (>75 нг) использовали в реакции однонуклеотидного удлинения (single-nucleotide extension, SNE), описанной в публикации Veb∅ et al, со следующими изменениями: конечный объем 25 мкл, содержащий 0,5 мкМ биотина-11-ддЦТФ (BIOTIN-11-ddCTP, Perkin Elmer, Уолтем, Массачусетс, США), использовали в течение пяти циклов мечения для мечения набора зондов, состоящего из 55 зондов (0,01 мкМ) (54 зонда, нацеленные на бактерии, и универсальный контроль). Комплементарные зонды, присоединенные к карбоксильным магнитным бусинам со штрих-кодом (barcoded magnetic beads, ВМВ, Applied BioCode, Санта-Фе Спрингс, Калифорния, США), гибиридизовали с зондами SNE и количественно определяли с применением анализатора BioCode 1000А (Applied BioCode). Вкратце, образец SNE объемом 10 мкл добавляли в реакционный объем 40 мкл, содержащий 31,2 мкл буфера ВМВ, контроль гибридизации и 1,8 мкл связанных ВМВ. Образцы инкубировали при 700 об./мин., 95°С в течение 3 мин., а затем при 700 об./мин., 45°С в течение 15 мин. в инкубаторе Vortemp™ 56 (Labnet International Inc., Эдисон, Нью-Джерси, США). К каждому образцу добавляли по 25 мкл буфера ВМВ, содержащего 20 мкг/мл ультрачувствительного реактива стрептавидин R-фикоэритрин LumiGrade (Roche), перед инкубацией в течение 90 минут при 700 об./мин., 45°С. Наконец, образцы промывали согласно рекомендациям Applied BioCode. Сигнал гибридизации обрабатывали с помощью программного обеспечения анализатора BioCode 1000А (Applied BioCode). Программное обеспечение обнаруживало и количественно определяло медианы сигналов, количество бусин и меток, и файлы необработанных данных экспортировали для последующего анализа.
Идентификация зондов, выбор, тестирование in silico и in vitro
Для установления и оптимизации наиболее пригодного набора бактериальных зондов собирали данные из предшествующих исследований микробиоты кишечника при ВЗК и СРК на основании предварительно определенных критериев поиска для обеспечения >500 экспериментальных измерений бактерий, связанных с возникновением ВЗК и СРК. Из объединенной совокупности данных 496 последовательностей гена 16S рРНК (консенсусную последовательность (последовательности) для каждого вида, выбранного из всех доступных длинных последовательностей 16S рРНК, очищали во избежание ошибок в последовательностях) из 269 видов бактерий разрабатывали зонды для охвата основных экспериментальных измерений бактерий, взятых из литературы. Все зонды разрабатывали согласно публикации Veb∅ et al с минимальной температурой плавления (Tm), составляющей 60°С, методом частоты встречаемости ближайших соседей для целевой группы, в которой 3'-концевой нуклеотид относительно зонда представляет собой цитозин; требования к зондам нецелевой группы являлись следующими: Tm 30°С или отсутствие цитозина в качестве нуклеотида, прилежащего к 3'-концу зонда. Каждый зонд разрабатывали для нацеливания на вид или группу бактерий, т.е. Faecalibacterium prausnitzii (вид), Lactobacillus (род), Clostridia (класс) и Proteobacteria (тип), на основании последовательности 16S рРНК бактерий (V3-V9). Зонды, которые удовлетворяли целевому обнаружению и нецелевому исключению in silico, оценивали в отношении перекрестного мечения, самомечения и перекрестной гибридизации до того, как проводили конечную валидацию против штаммов бактерий in vitro.
После тестирования in vitro затем выбирали панель из 124 оптимальных зондов с применением способов выбора переменных: важности переменной в проекции, отношения селективности и интервала частных наименьших квадратов с применением данных от выбора нормальных образцов и образцов СРК (данные не показаны). Переменные (зонды) выбирали на основании их способности различать образцы, выделенные от нормальных здоровых индивидуумов и пациентов, страдающих от СРК. Была выбрана итоговая панель из 54 зондов, охватывающая сайты от V3 до V7 последовательности 16S рРНК. Для определения целевой бактерии для каждого зонда исследовали целевую специфичность в отношении бактерий с помощью набора 54 зондов против 368 единичных штаммов бактерий. Как показано в таблице 2, зонды позволили обнаружить бактерии шести типов: Firmicutes, Proteobacteria, Bacteroidetes, Actinobacteria, Tenericutes и Verrucomicrobia, охватывающих 11 таксономических классов и 36 родов бактерий.



Предварительная обработка данных
Для обеспечения высокого уровня качества применяли несколько критериев контроля качества в отношении данных обнаружения для каждого образца: 1) число бусин >2 для каждого зонда; 2) медиана сигнала контроля гибридизации (hybridisation control, HYC) >13000; 3) медиана сигнала фона <500; и 4) медиана сигнала универсального контроля >4500. Сначала применяли нормирование посредством деления интенсивности сигнала каждого зонда в каждом образце на интенсивность сигнала для HYC данного образца и умножения на 1000. Данную манипуляцию осуществляли для учета различий образцов в связи с пипетированием или гибридизацией. Затем применяли нормирование для учета различий циклов анализа посредством деления HYC-нормированного сигнала каждого зонда в каждом образце на медиану HYC-нормированного сигнала каждого зонда для повторов контроля синтетической ДНК и умножения на 1000. До калибровки нормобиотического профиля микробиоты нормированные интенсивности сигнала ниже 15 принимали за 0 с целью удаления низкого фонового шума, и данные центрировали по среднему. Исследуемые и валидационные образцы нормировали, и нормированные сигналы ниже 15 принимали за 0 до центрирования данных по среднему с применением средних сигналов от зондов из нормобиотической эталонной когорты.
Разработка и валидация теста дисбиоза
Для построения нормобиотического профиля микробиоты (модели) использовали анализ главных компонент (АГК). Границу между недисбиотическим и дисбиотическим состоянием определяли посредством расчета доверительных областей для значений Т-квадрата Хотеллинга и Q-статистики, предоставленных результатами АГК в модели. С геометрической точки зрения данная граница соответствует прямоугольнику с одним углом, расположенным в нулевой точке, который классифицирует образцы, расположенные в пределах прямоугольника, как недисбиотические, и образцы, расположенные за его пределами, как дисбиотические. Анализ Т-квадрата и Q-статистики, нормированных доверительным интервалом, продемонстрировал, что евклидово расстояние от нулевой точки характеризуется распределением, подобным логарифмически-нормальному (данные не показаны). Евклидово расстояние от нулевой точки использовали для объединения двух размерностей, и проводили взвешивание, чтобы, при необходимости, зафиксировать эффект Т, возведенного в квадрат, и Q-статистики. Единое числовое представление степени дисбиоза, определенное как индекс дисбиоза (ИД), было получено из логарифмически-нормального распределения посредством соотнесения оцененных частей распределения к различным значениям на шкале от 0 до 5. Значение ИД, составляющее 2, было определено как разделение классов, представленное установленными доверительными интервалами; ИД 2 или ниже является недисбиотической областью, и ИД 3 или выше является дисбиотической областью. Чем более ИД превышает 2, тем больше образец считают отклоняющимся от нормобиоза, например, образец А с ИД=4 находится дальше от нормобиотической эталонной когорты в евклидовом пространстве, чем образец В с ИД=3, таким образом, А является более дисбиотическим, чем В. Шкалу оптимизировали с акцентом на уменьшение технических вариаций между повторами; это означает, что целая часть цифрового выходного сигнала определяется предварительно определенными уровнями евклидового расстояния.
Для создания теста согласно настоящему изобретению выбирали 211 нормальных индивидуумов и случайным образом распределяли в обучающее множество (n=165), предназначенное для конструирования моделей, и тестовое множество (n=46), предназначенное для настройки параметров. Образцы анализировали в двух повторах, и средний нормированный сигнал использовали для обучения и тестирования. Демографические показатели образцов в двух группах являлись аналогичными (таблица 3). Дополнительно в тестовое множество было включено множество пациентов, страдающих от СРК (n=127). Разрабатывали и оценивали некоторое количество моделей, и частоту дисбиоза в тестовом множестве использовали как показатель рабочих характеристик модели. Для конечной модели АГК использовали 15 главных компонент, и определяли 98% доверительный интервал для Т, возведенного в квадрат, и Q-статистики с целью определения разделения классов. Когда модель используют для оценки других образцов, значения за пределами данных границ определяют как дисбиотические.

Для оценки клинико-диагностических рабочих характеристик модели использовали внешнюю валидацию с применением независимого тестового множества, включающего нормальных субъектов, субъектов, страдающих от СРК и ВЗК (n=287) (таблица 4). Все субъекты валидационного множества представляли собой уникальных доноров, которые не были включены в нормальную эталонную популяцию, использованную для калибровки нормобиотического профиля или настройки параметров. Каждый образец обрабатывали с применением финализированного алгоритма, который преобразует данные для каждого образца в одно целое число, т.е. ИД, который представляет собой степень дисбиоза на основании изобилия бактерий и профиля в образце относительно установленного нормобиотического профиля. ИД > 2 представляет собой возможное клинически значимое отклонение микробиотического профиля от такового нормобиотической эталонной популяции. Наконец, рассчитывали частоту дисбиоза. Дополнительно проводили АГК на валидационном множестве для исследования разностей профиля микробиоты между тремя группами субъектов.
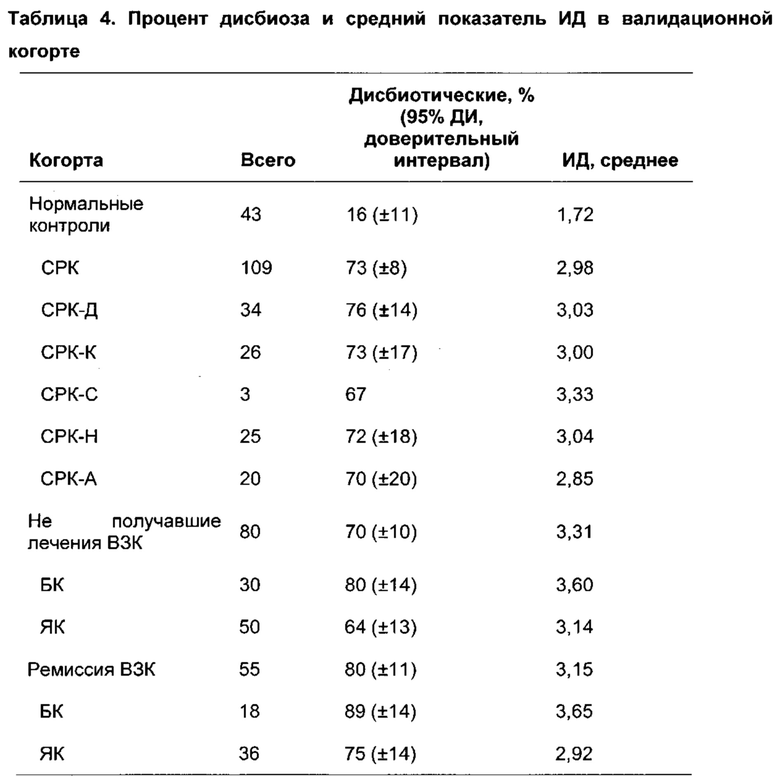
А, альтернирующий; К, констипация; БК, болезнь Крона; Д, диарея; ИД, индекс дисбиоза; ВЗК, воспалительное заболевание кишечника; СРК, синдром раздраженного кишечника; С, смешанный; Н, несубтипированный; ЯК, язвенный колит.
Технически характеристики
Следовали директиве ЕС по диагностическим тестам in vitro для обеспечения соответствия с тестами, имеющими маркировку «СЕ» (знак соответствия европейским директивам качества). Основными оцениваемыми техническими параметрами являлись точность и количественный диапазон теста как на уровне сигнала зонда, так и на уровне конечных выходных данных (т.е. ИД). На уровне зонда точность сигналов (коэффициент вариации [KB], в процентах) варьировала в зависимости от интенсивности необработанного сигнала. Сигналы ниже 500 Е.И. (единиц интенсивности) рассматривали как фоновый шум; вследствие этого измерение дисперсии было неприменимо. Для сигналов свыше 500 Е.И. точность, согласно оценкам, составила 8,4% на основании повторяющихся анализов шести доноров, шести экстракций фекалий на донора в течение 2 дней (n=328). KB ниже 10% принимали за критерий в разработке алгоритма ИД. На основании повторяющихся измерений в 139 дисбиотических образцах в 94% образцов наблюдался KB ниже 10%. Дополнительно оценивали некоторые этапы производственного анализа (данные не показаны).
Вариации фекальной микробиоты в течение времени
Вариации микробиоты в течение времени исследовали как для нормированных данных по всему выбранному набору зондов, так и для результата теста (ИД). Образцы фекалий отбирали от пяти доноров (возраст 24-38 лет; 80% женщин) с интервалом в 1 неделю в течение 14 недель. Проводили АГК нормированных данных, и проводили статистическую оценку вариации сигналов для доноров и времени забора образца (еженедельно) с применением пакета программ R ffmanova, оснащенного многопараметрическим дисперсионным анализом в формате пятьдесят на пятьдесят (ANOVA).
Статистический анализ
Все данные анализировали на платформе GA (Genetic Analysis AS, Осло, Норвегия). Категориальные данные выражали в виде числа субъектов (и процента) с указанным состоянием или клинической переменной, и средним значением, при необходимости. Для исследования значения ИД использовали U-критерий Манна-Уитни. Все критерии являлись двухсторонними, и выбранный уровень значимости составил Р<0,05. Анализ проводили с применением языка статистического вычисления R, версия 3.0.2, и MATLAB 2011b, The MathWorks, Inc., Натик, Массачусетс, Соединенные Штаты.
Результаты
Частота дисбиоза у нормальных субъектов, субъектов, страдающих от СРК и ВЗК
Валидацию описанного в настоящем изобретении теста проводили посредством сравнения частоты дисбиоза в серии из 287 образцов, включая нормальных индивидуумов, которые не были ранее включены в калибровку нормобиотического профиля (n=43), и пациентов, страдающих от СРК (n=109) и ВЗК (n=135) (таблица 3). Результаты для валидационной когорты приведены в таблице 4. Из 43 нормальных образцов, включенных в валидационную когорту, семь (16%), как было определено, являлись дисбиотическими, причем распределение показателей ИД валидационной когорты представлено на фигуре 1. Среди пациентов, страдающих от СРК, 80 из 109 (73%), как было определено, являлись дисбиотическими. В когорте ВЗК 100 из 135 (74%), как было определено, являлись дисбиотическими, включая 56 из 80 (70%) пациентов, не получавших лечения ВЗК, и 44 из 55 (80%) пациентов, страдающих от ВЗК, в состоянии клинической ремиссии. Распределение ИД между пациентами, страдающими от СРК и ВЗК, значительно отличалось (Р < 0,01). Фигура 1 свидетельствует, что распределение показателей ИД для когорты ВЗК демонстрирует большее смещение в сторону большего значения, чем СРК. Аналогично, в обеих когортах ВЗК частота дисбиоза в случае БК (80% и 89%, соответственно) являлась большей, чем в случае ЯК (64% и 75%), со значимым различием значений ИД между БК и ЯК (Р=0,03).
Данный тест также применяли в отношении серии из 43 доступных образцов от нормальных индивидуумов из Дании (n=19; возраст 23-61 год; 63% женщин) и Испании (n=24; возраст 22-56 лет; 50% женщин). Семь из 19 датских образцов, как было определено, являлись дисбиотическими, причем средний ИД составлял 2,16, вследствие чего 37% являлись дисбиотическими (95% ДИ, 15%-59%). Среди испанских образцов 10 из 24, как было определено, являлись дисбиотическими, причем средний ИД составлял 2,58, вследствие чего 42% являлись дисбиотическими (95% доверительный интервал [ДИ], 22%-62%). В то время как результаты для датской нормальной когорты значимо не отличались от нормальной валидационной когорты (Р > 0,05), авторы настоящего изобретения установили, что у 50% (5/10) дисбиотических образцов в испанской когорте наблюдался ИД выше 3.
Профиль бактерий при дисбиозе
Применение АГК в отношении валидационной когорты с использованием нормированных данных для всех 54 зондов продемонстрировало относительную кластеризацию образцов по когортам заболевания. Показатели для первых двух главных компонент (ГК), на которые приходится 48% дисперсии данных, продемонстрировали плотный кластер для нормальных субъектов в нижнем правом углу по сравнению с более разнообразным распространением для субъектов, страдающих от ВЗК и СРК (фигура 2А). Распределение образцов на графике показателей, как было обнаружено, являлось связанным со степенью дисбиоза, и характеризовалось центральным кластером недисбиотических образцов, окруженным образцами со «слабым» дисбиозом (ИД=3) и образцами с наиболее «тяжелым» дисбиозом (ИД=5), разбросанными за пределами данного кластера (фигура 2В). Каждый из первого и второго принципиального компонента в определенной степени отделял нормальные образцы от образцов СРК и ВЗК. Разброс значений ИД подразумевает, что для различных образцов при дисбиозе преобладают различные бактерии. Для дополнительного исследования того, какие группы бактерий наиболее способствовали дисбиозу при ВЗК и СРК, рассчитывали разности общего среднего нормированного сигнала между дисбиотическим и недисбиотическим статусом для каждого из 54 зондов. Доминирующими бактериями, которые способствовали дисбиозу в когорте СРК, являлись Firmicutes (Bacilli), Proteobacteria (Shigella/Escherichia), Actinobacteria и Ruminococcus gnavus (фигура ЗА). Аналогично, доминирующими бактериями в когорте ВЗК являлись Proteobacteria (Shigella/Escherichia), Firmicutes, в особенности, Faecalibacterium prausnitzii и Bacteroidetes (Bacteroides и Prevotella) (фигура ЗВ). Интересно отметить, что Proteobacteria (Shigella/Escherichia) находилась в первой пятерке способствующих дисбиозу групп бактерий как в случае СРК, так и в случае ВЗК, что позволяет высказать предположение о сходстве дисбиоза при СРК и ВЗК. Однако все группы бактерий, которые наибольшим образом способствовали дисбиозу в когорте СРК, продемонстрировали увеличенную интенсивность сигналов зондов по сравнению с недисбиотическими пациентами, в то время как в случае когорты ВЗК как уменьшенные (F. prausnitzii), так и увеличенные интенсивности сигналов зондов наиболее способствовали дисбиозу.
Авторы настоящего изобретения обнаружили один зонд с отличающимся сигналом между образцами из испанской и скандинавской когорт (Р<0,01; поправка Бенджамини-Хохберга). Мишенью зонда являлись Firmicutes (Streptococcus), и данный сигнал, как было обнаружено, был увеличен в испанских образцах по сравнению со скандинавской когортой. Фигура 4 демонстрирует доминирующие бактерии, способствующие дисбиозу в испанских образцах. Как и ожидалось, Proteobacteria (Shigella/Escherichia) вновь, как было обнаружено, являлись способствующими бактериями при дисбиозе. Дополнительно, Bacteroides stercoris и Bifidobacterium способствовали дисбиозу, что потенциально может быть связано с различиями, например, рациона между скандинавскими странами и Средиземноморьем.
Вариация фекальной микробиоты в течение времени
Образцы фекалий отбирали от пяти индивидуумов с интервалами в 1 неделю в течение 14 недель. АГК нормированных данных (n=64) позволил выявить, что наибольшая вариабельность в продолжительном анализе фекальной микробиоты была связана с межсубъектной изменчивостью; доноров можно было однозначно различить по трем первым и наиболее важным ГК на графике показателей (фигура 5). В данном исследовании образцы разделяли на кластеры в зависимости от донора фекалий независимо от времени забора образца. Три первые ГК описывали 65% от суммарной вариабельности данных фекальной микробиоты.
Значимость ГК анализировали с помощью программы ffmanova с применением нормированных данных, и в модель были включены исключительно основные эффекты донора и времени забора образца (еженедельно). Результаты продемонстрировали, что среднее количество вариации между донорами являлось большим, чем таковое в пределах донора (Р<0,001), с объясненными дисперсиями на основе сумм квадратов, составляющими 0,48. Вариация между временем забора образца являлась незначимой (Р=0,26) с объясненными дисперсиями на основе сумм квадратов, составляющими 0,11. Низкий уровень вариации в пределах одного индивидуума в течение времени является критичным при применении теста для мониторинга изменений в течение лечения с целью изменения профиля микробиоты.
Обсуждение
В данном примере авторы настоящего изобретения продемонстрировали рабочие характеристики нового теста микробиоты кишечника, целью которого является установление и характеристика дисбиоза посредством определения отклонения от нормобиоза. Такой диагностический подход отличается от прямой диагностики конкретного заболевания. Характерные множества бактерий необходимы в здоровой нормобиотической микробиоте кишечника, и отклонение будет представлять собой дисбиотическое состояние. Количественное измерение отклонения бактериальной микробиоты делает возможной характеристику дисбиоза в образцах от пациентов, страдающих от СРК и ВЗК, на основе единого диагностического алгоритма, нацеленного на нормобиоз.
Тест согласно настоящему изобретению является воспроизводимым, точным, высокопроизводительным, легким в использовании способом количественного определения степени дисбиоза широкого спектра действия, который по существу подходит для клинического применения. Данный тест позволяет обеспечить алгоритмически полученный ИД на основе изобилия бактерий и профиля в пределах образца. Данный ИД является показателем того, насколько микробном индивидуума отклоняется от такового нормальной эталонной популяции, и потенциально может являться в высокой степени значимым в клинической диагностике и мониторинге прогрессирования состояний, таких как ВЗК и СРК. Стабильность микробиоты кишечника человека является другим важным свойством, если микробиологическая характеристика играет роль в диагностике, лечении и предотвращении заболевания. Было показано, что в микробиоте индивидуума 60% штаммов бактерий сохраняется в течение 5 лет. В соответствующем исследовании авторы настоящего изобретения обнаружили лишь низкую внутрисубъектную вариацию при еженедельном отборе образцов в течение 14 недель.
Тест, описанный в настоящем изобретении, использовали для обнаружения высокой частоты дисбиоза у пациентов, страдающих от СРК и ВЗК, и низкой частоты у нормальных индивидуумов. Зарегистрированные показатели ИД как пациентов, страдающих от ВЗК, в стадии ремиссии, так и пациентов, страдающих от ВЗК, не получавших лечения, значительно превысили порог 2 с частотой дисбиоза, составляющей 80% и 70%, соответственно. У пациентов, страдающих от СРК, диагностированного согласно Римским критериям III, наблюдалась частота 73%, подтверждающая предшествующие наблюдения, тогда как частота у нормальных индивидуумов составила 16%.
Дисбиоз связан с множеством заболеваний, включая СРК, различные формы ВЗК, ожирение и диабет, а также был вовлечен в депрессию и аутизм. В последние годы возникли новые варианты лечения для восстановления баланса микробиоты у дисбиотических пациентов. Сейчас ТФМ (трансплантация фекальной микробиоты) считается наиболее эффективным лечением при рецидиве колита Clostridium difficile, и на сегодняшний день данный подход изучается в клинических исследованиях фазы I-IV при многих вышеупомянутых состояниях (БК, фаза 11/111 NCT01793831; ЯК, фаза I NCT01947101, фаза II NCT01896635, фаза II/III NCT01790061; ВЗК, включая БК и ЯК, фаза IV NCT02033408).
Ключевым препятствием при интерпретации данных ТФМ являлась вариабельность состава бактерий микробиоты донора не только в отношении патогенных организмов, но также в отношении состава существующей в норме микрофлоры, что дополнительно подчеркивает важность установления способа достаточной характеристики как патогенных, так и непатогенных микроорганизмов. Способность характеристики микробиома индивидуума и мониторинга изменений может позволить проводить прогнозирование терапевтического исхода или даже рецидива при таких состояниях. Данный подход может также помочь объяснить, почему пациент не поддается лечению конкретными терапевтическими режимами, и, соответственно, может способствовать корректировке режима. Более того, получение быстрых и воспроизводимых подробных бактериальных профилей нормобиотических и дисбиотических индивидуумов может способствовать продолжению инновационных терапевтических подходов, таких как ТФМ. Таким образом, применение данного теста может оказаться полезным с клинической точки зрения при определении дисбиоза не только у пациентов, страдающих от СРК и ВЗК, но также при других состояниях, когда знания о профиле микробиоты могут оказаться полезными с клинической точки зрения, при последующем мониторинге назначенных режимов лечения и при развитии новых терапевтических подходов.
ПРИМЕР 2 - Репрезентативный анализ образцов с применением 54 зондов, нацеленных на множество микроорганизмов или групп микроорганизмов
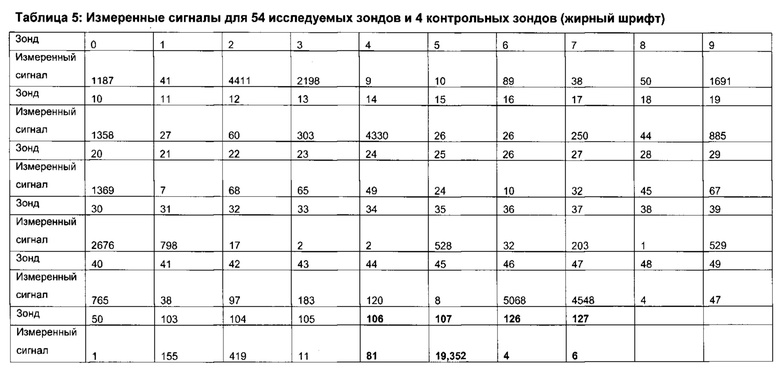
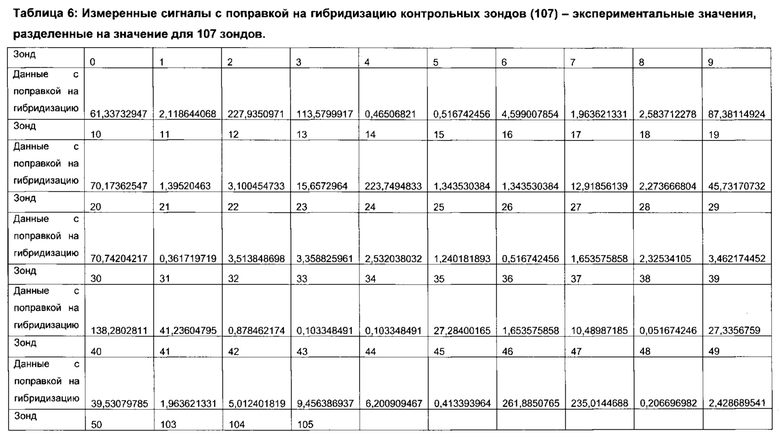

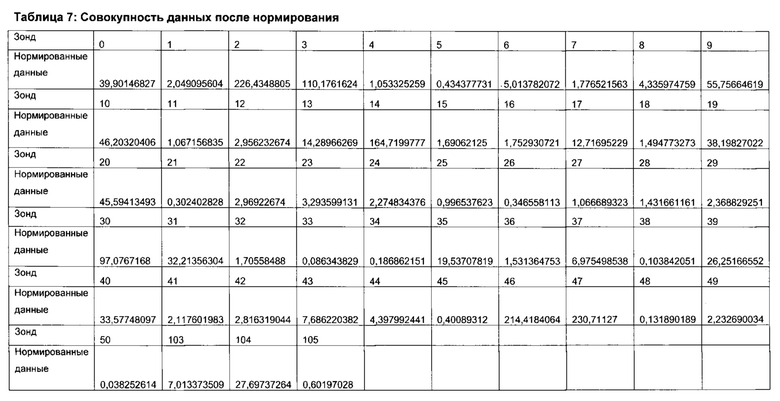
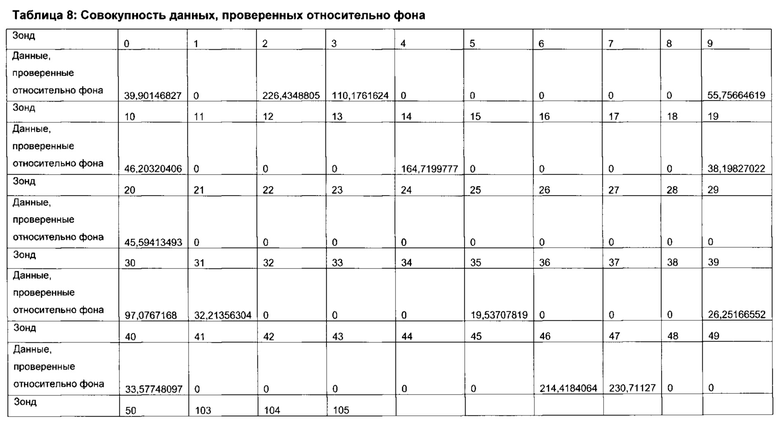

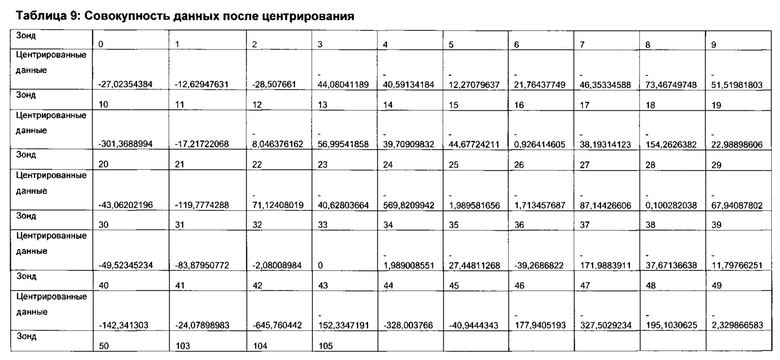


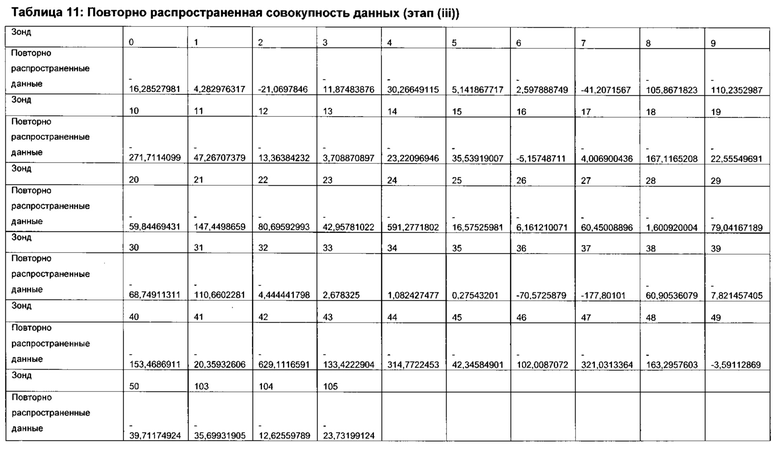


Сумма квадратов разностей (Qres): 27656,3
Сумма значений после применения в отношении спроецированной совокупности данных собственных чисел (таблица 10): 77,30951 (Т2 Хотеллинга; этап (v))
Затем значения Qres и Т2 Хотеллинга сравнивали с предварительно определенными пороговыми значениями при переходе от нормобиотического к дисбиотическому состоянию: [Т2=32,49 и Qres=42834,81]. Дисбиоз подтверждали, когда значение Т2 превышало порог.
Затем Т2 и Qres объединяли в единую метрику с применением квадратов; взвешивания (0,938 и 0,157) и квадратного корня (т.е. Формулы III). Полученное значение составило 2,318146.
Затем полученную единую метрику откладывали на числовой шкале с точкой разделения при переходе от нормобиотического к дисбиотическому классу, составляющей 0,395 (репрезентативное значение 2), и следующими порогами при 1,632 (репрезентативное значение 3), 2,492 (репрезентативное значение 4) и бесконечности при репрезентативном значении 5. В результате этого образец располагался между порогами, представленными значениями 3 и 4 (близко к верхней границе 2,492 на интервале от 3 до 4). Затем точное расположение образца на данной шкале рассчитывали следующим образом:
Рассчитывали суммарную площадь плотности логарифмически-нормального распределения Т между 3 и 4:
0,6820813
0,4840499
0,1980315
(первое значение минус второе равно третье)
Затем рассчитывали площадь плотности логарифмически-нормального распределения между 3 и образцом:
0,6502034
0,4840499
0,1661535
(первое значение минус второе равно третье)
Затем площадь плотности логарифмически-нормального распределения между 3 и образцом делили на площадь плотности логарифмически-нормального распределения между 3 и 4, чтобы найти точное частное: 0,8390257. Затем прибавляли меньшее целое число (3) для получения точного положения на шкале: 3,839026. Данное значение округляли до 4 для включения в отчет.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВСПОМОГАТЕЛЬНЫЙ СПОСОБ ДИАГНОСТИКИ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ СИНДРОМА РАЗДРАЖЕННОГО КИШЕЧНИКА С ПРИМЕНЕНИЕМ КОРРЕКЦИОННОЙ ДИЕТЫ ИЛИ ТРАНСПЛАНТАЦИИ ФЕКАЛЬНОЙ МИКРОБИОТЫ | 2017 |
|
RU2762266C1 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ Lactobacillus plantarum | 2018 |
|
RU2772025C2 |
| КОМПОЗИЦИИ И СПОСОБЫ | 2014 |
|
RU2664479C2 |
| Композиция и способ лечения и профилактики кишечной инфекции и воспаления | 2016 |
|
RU2738803C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА | 2019 |
|
RU2799556C2 |
| НАБОРЫ ОЛИГОНУКЛЕОТИДНЫХ ЗОНДОВ И СПОСОБЫ ПРОФИЛИРОВАНИЯ МИКРОБИОТЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2011 |
|
RU2605913C2 |
| ПРИМЕНЕНИЕ L. REUTERI ДЛЯ ВОССТАНОВЛЕНИЯ ПОСЛЕ ДИСБИОЗА МИКРОБИОТЫ НА РАННИХ ЭТАПАХ РАЗВИТИЯ | 2015 |
|
RU2723687C2 |
| СПОСОБ ДИАГНОСТИКИ ДИСБАЛАНСА МИКРОБИОТЫ РАЗЛИЧНЫХ БИОТОПОВ ЧЕЛОВЕКА И СТЕПЕНИ ЕГО ВЫРАЖЕННОСТИ | 2008 |
|
RU2362808C1 |
| СИСТЕМА ДЕТЕКЦИИ НАИБОЛЕЕ ЗНАЧИМЫХ ПРОКАРИОТИЧЕСКИХ ПРЕДСТАВИТЕЛЕЙ МИКРОБИОТЫ КИШЕЧНИКА ЧЕЛОВЕКА НА ОСНОВЕ ПЦР ПАНЕЛИ | 2017 |
|
RU2680268C1 |
| Способ оценки состояния дисбиоза ротоглотки у детей | 2020 |
|
RU2741709C1 |
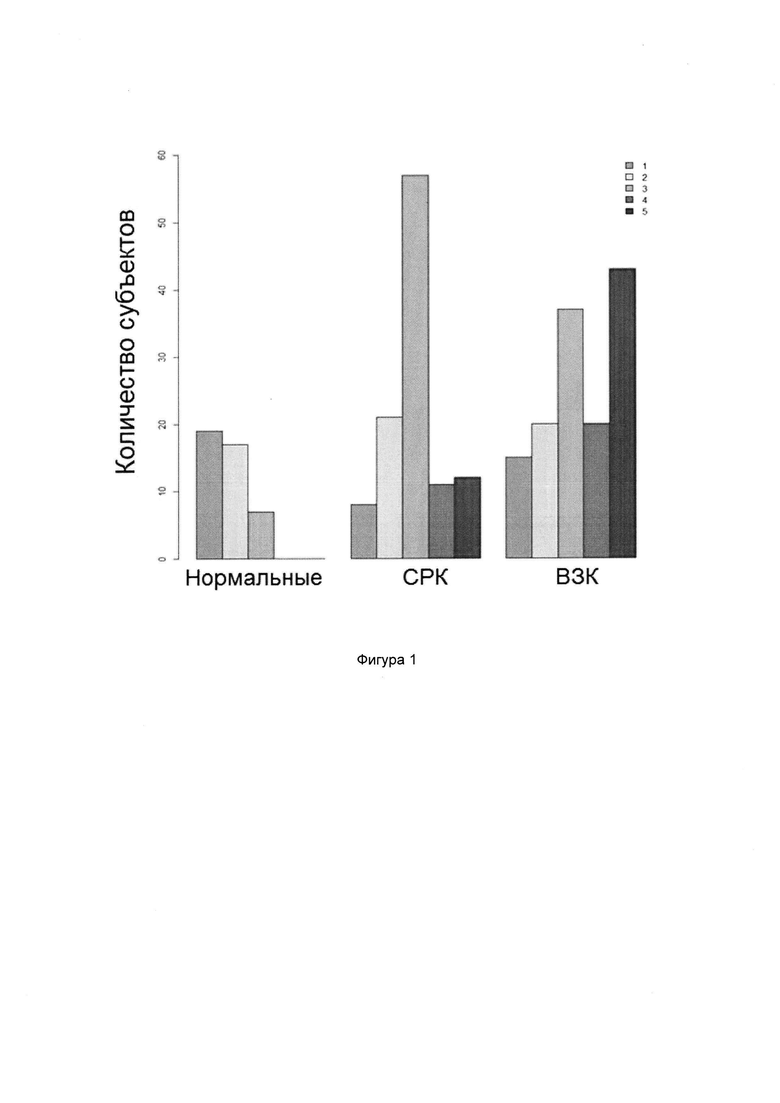
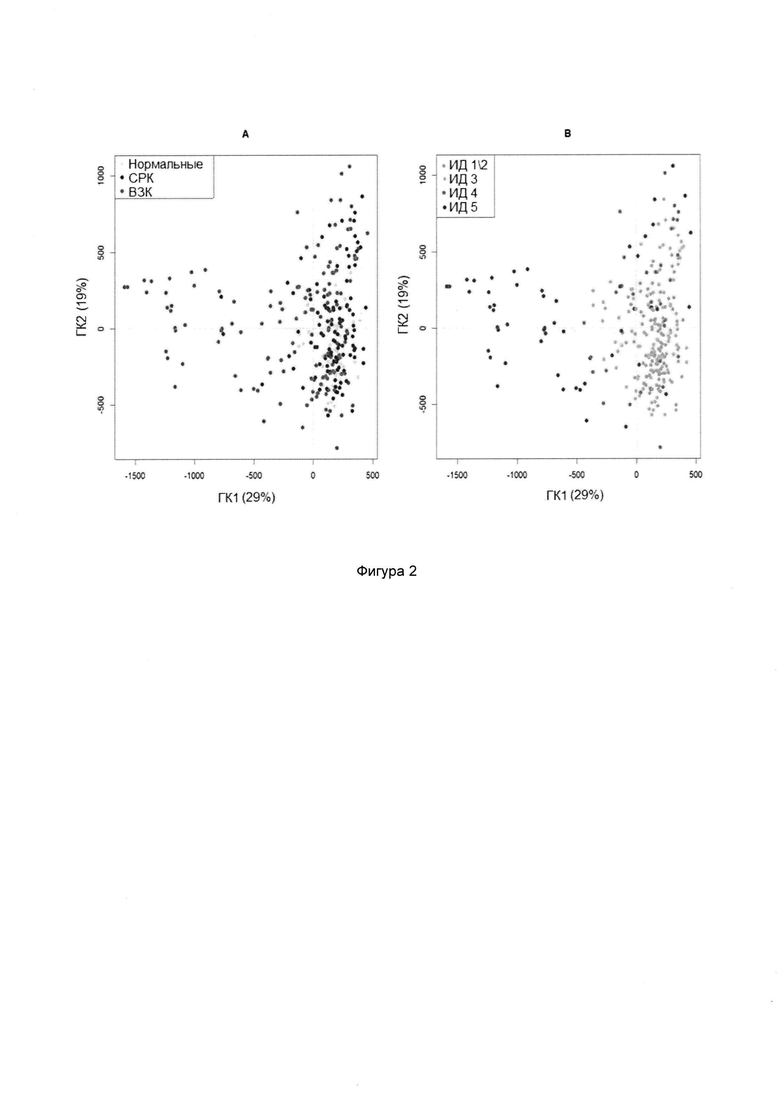
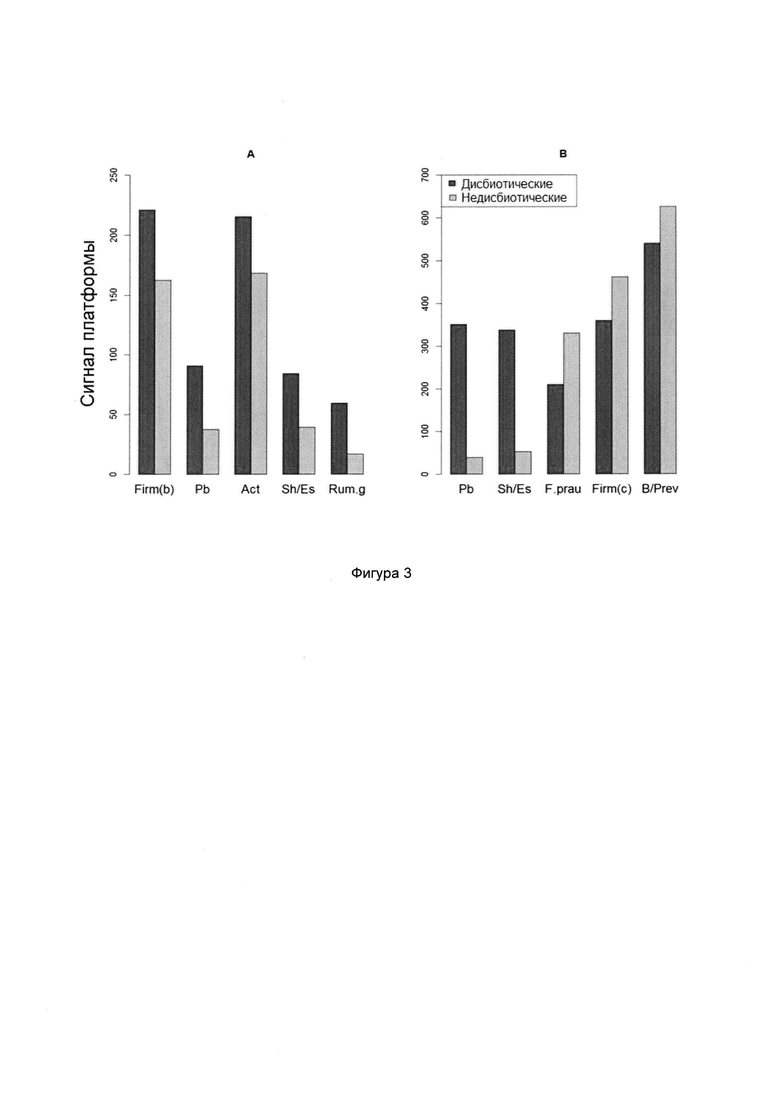
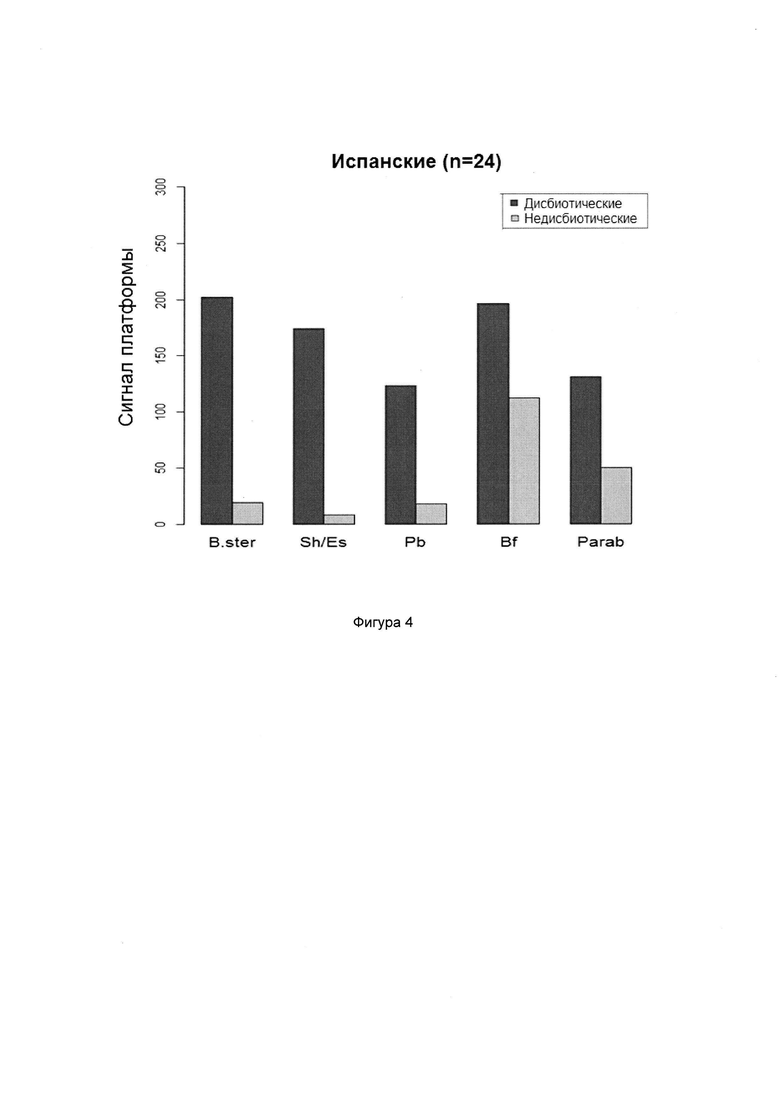
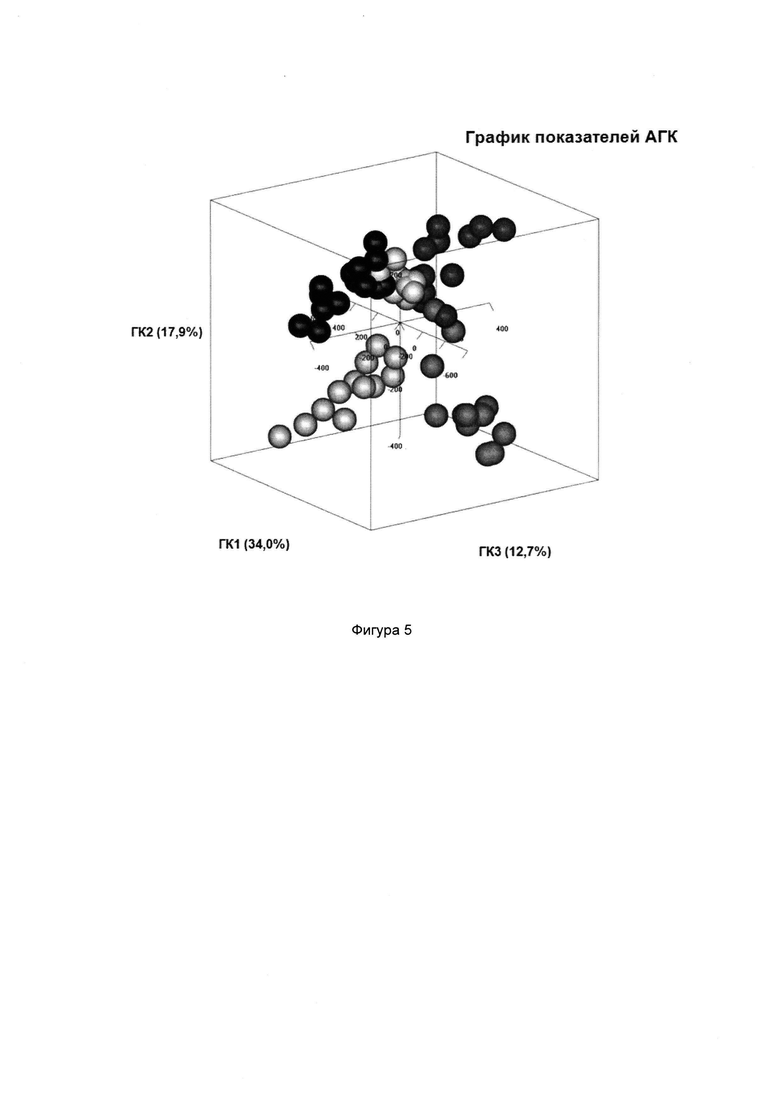
Группа изобретений относится к медицине. Предложен способ определения вероятности дисбиоза ЖК (желудочно-кишечного) тракта у субъекта, способ количественного определения дисбиоза, способ получения информации, значимой для диагностики, мониторинга и/или характеристики заболеваний и состояний, связанных с нарушениями микробиоты ЖК тракта, способ диагностики, мониторинга и/или характеристики заболеваний и состояний, связанных с нарушениями микробиоты ЖК тракта, а также система для определения вероятности дисбиоза ЖК тракта у субъекта. Обеспечение совокупности экспериментальных данных, содержащей по меньшей мере один профиль микробиоты. Причем указанный профиль микробиоты представляет собой профиль относительных уровней множества микроорганизмов или групп микроорганизмов в образце из ЖК тракта указанного субъекта. Применение в отношении указанной совокупности экспериментальных данных по меньшей мере одного вектора нагрузки, представляющего собой по меньшей мере одну ортогональную скрытую переменную, определенную посредством регрессионного анализа уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта множества нормальных субъектов. Посредством чего обеспечивают первую совокупность проекционных данных. Обеспечение указанной первой совокупности проекционных данных. Расчет Q-остатка профиля микробиоты из указанной первой совокупности проекционных данных. Сравнение указанного Q-остатка профиля микробиоты с пороговым значением Q-остатка при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта множества нормальных субъектов и/или субъектов, страдающих от дисбиоза. Расчет T2 Хотеллинга из указанной первой совокупности проекционных данных для профиля микробиоты из дисперсии, объясненной указанными ортогональными скрытыми переменными, определенными посредством регрессионного анализа уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта множества нормальных субъектов. Сравнение T2 Хотеллинга для профиля микробиоты с пороговым значением T2 Хотеллинга при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта множества нормальных субъектов и/или множества субъектов, страдающих от дисбиоза. Причем профиль микробиоты, Q-остаток или T2 Хотеллинга которого превышает указанные соответствующие пороговые значения, свидетельствует о вероятности дисбиоза. Группа изобретений позволяет точно и эффективно определить вероятность дисбактериоза желудочно-кишечного тракта и количественно оценить его степень. 5 н. и 19 з.п. ф-лы, 5 ил., 12 табл.
1. Способ определения вероятности дисбиоза ЖК (желудочно-кишечного) тракта у субъекта, включающий:
(i) обеспечение совокупности экспериментальных данных, причем указанная совокупность экспериментальных данных содержит по меньшей мере один профиль микробиоты, причем указанный профиль микробиоты представляет собой профиль относительных уровней множества микроорганизмов или групп микроорганизмов в образце из ЖК тракта указанного субъекта, и причем каждый уровень каждого микроорганизма или группы микроорганизмов представляет собой элемент профиля указанной совокупности экспериментальных данных,
(ii) применение в отношении указанной совокупности экспериментальных данных по меньшей мере одного вектора нагрузки, где указанный по меньшей мере один вектор нагрузки представляет собой по меньшей мере одну ортогональную скрытую переменную, определенную посредством регрессионного анализа уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта множества нормальных субъектов, посредством чего обеспечивают первую совокупность проекционных данных,
(iii) обеспечение указанной первой совокупности проекционных данных,
(iv) расчет Q-остатка профиля микробиоты из указанной первой совокупности проекционных данных и сравнение указанного Q-остатка профиля микробиоты с пороговым значением Q-остатка при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта множества нормальных субъектов и/или субъектов, страдающих от дисбиоза,
(v) расчет T2 Хотеллинга из указанной первой совокупности проекционных данных для профиля микробиоты из дисперсии, объясненной указанными ортогональными скрытыми переменными, определенными посредством регрессионного анализа уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта множества нормальных субъектов, этапа (ii), и сравнение указанного T2 Хотеллинга для
профиля микробиоты с пороговым значением T2 Хотеллинга при переходе от нормобиотического к дисбиотическому состоянию, определенным в соответствующем анализе указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта множества нормальных субъектов и/или множества субъектов, страдающих от дисбиоза,
причем этап (v) можно осуществлять до либо после или одновременно с этапом (iv), и причем профиль микробиоты, Q-остаток или T2 Хотеллинга которого превышает указанные соответствующие пороговые значения, свидетельствует о вероятности дисбиоза.
2. Способ по п. 1, отличающийся тем, что указанный способ также включает предварительный этап, на котором получают по меньшей мере один указанный профиль микробиоты.
3. Способ по любому из предшествующих пунктов, отличающийся тем, что указанная совокупность экспериментальных данных содержит множество профилей микробиоты, и указанная совокупность экспериментальных данных упорядочена в виде матрицы.
4. Способ по любому из пп. 1-3, отличающийся тем, что указанные ортогональные скрытые переменные определяют посредством ортогонального преобразования в главные компоненты уровней указанного множества микроорганизмов или групп микроорганизмов в соответствующих образцах из ЖК тракта множества нормальных субъектов.
5. Способ по п. 4, отличающийся тем, что указанное ортогональное преобразование в главные компоненты осуществляют посредством по меньшей мере одного регрессионного анализа методом дробных наименьших квадратов, анализа главных компонент, канонического анализа корреляций, анализа избыточности, анализа соответствий и канонического анализа соответствий.
6. Способ по любому из предшествующих пунктов, отличающийся тем, что применяют по меньшей мере 2 вектора нагрузки, предпочтительно, по меньшей мере 3, 5, 7, 9, 11, 13, 15, 17, 19 или 20 векторов нагрузки, и/или не более 50 векторов нагрузки, предпочтительно, не более 40, 30, 25, 20 или 15 векторов нагрузки.
7. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный вектор нагрузки применяют в форме проекционной матрицы.
8. Способ по любому из предшествующих пунктов, отличающийся тем, что указанные профили микробиоты являются количественными или полуколичественными, и при этом указанный способ обеспечивает количественное или полуколичественное измерение степени дисбиоза.
9. Способ количественного определения дисбиоза, при этом указанный способ включает осуществление способа по п. 8, причем указанные сравнения с пороговыми значениями при переходе от нормобиотического к дисбиотическому состоянию в совокупности включают объединение Q-остатка этапа (iv) и T2 Хотеллинга этапа (v) в единую метрику дисбиоза.
10. Способ по п. 9, отличающийся тем, что как для Q-остатка этапа (iv), так и для T2 Хотеллинга этапа (v) рассчитывают евклидово расстояние от нулевой точки.
11. Способ по п. 10, отличающийся тем, что указанное евклидово расстояние от нулевой точки как для Q-остатка, так и T2 Хотеллинга рассчитывают по Формуле I:

12. Способ по любому из пп. 9-11, отличающийся тем, что указанное объединение Q-остатка этапа (iv) и T2 Хотеллинга этапа (v) в единую метрику дисбиоза включает масштабирование указанных Q-остатка этапа (iv) и T2 Хотеллинга этапа (v) для получения значений аналогичного порядка величины.
13. Способ по любому из пп. 9-12, отличающийся тем, что указанную единую метрику откладывают на конечной числовой шкале с разделением на классы нормобиоза и дисбиоза в предварительно определенной точке на указанной конечной числовой шкале, которая представляет собой или является комбинацией порогов при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), аналогично масштабированной, если применялось масштабирование.
14. Способ по любому из пп. 9-12, отличающийся тем, что указанную единую метрику откладывают на конечной числовой шкале с разделением на классы нормобиоза и дисбиоза в предварительно определенной точке на указанной конечной числовой шкале, и причем
(a) для исследуемого образца, содержащего по меньшей мере одно из Q-остатка этапа (iv) или T2 Хотеллинга этапа (v), превышающую пороговые значения при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), соответственно, указанная точка разделения классов соответствует таковой одного или другого значения, превышающего пороговые значения при переходе от нормобиотического к дисбиотическому классу этапов (iv) или (v), аналогично масштабированной, если применялось масштабирование, и
(b) для исследуемого образца, в котором ни один из Q-остатка этапа (iv) или T2 Хотеллинга этапа (v) не находится за пределами пороговых значений при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), соответственно, указанная точка разделения классов соответствует сумме порогов при переходе от нормобиотического к дисбиотическому классу этапов (iv) и (v), аналогично масштабированной, если применялось масштабирование.
15. Способ по любому из пп. 9-14, отличающийся тем, что взвешивание применяют в отношении Q-остатка этапа (iv) и T2 Хотеллинга этапа (v) в течение второго этапа комбинирования, и при этом указанное взвешивание минимизирует эффекты технической вариации.
16. Способ получения информации, значимой для диагностики, мониторинга и/или характеристики заболеваний и состояний, связанных с нарушениями микробиоты ЖК тракта, или оценки риска развития заболевания, или состояния, связанного с нарушением профиля микробиоты ЖК тракта, причем указанный способ включает осуществление способа согласно любому из пп. 1-15, причем результаты указанного способа, как определено выше, обеспечивают указанную информацию.
17. Способ диагностики, мониторинга и/или характеристики заболеваний и состояний, связанных с нарушениями микробиоты ЖК тракта, или оценки риска развития заболевания или состояния, связанного с нарушением профиля микробиоты ЖК тракта, причем указанный способ включает осуществление способа согласно любому из пп. 1-15, при этом указание на вероятность дисбиоза или степень дисбиоза свидетельствует о наличии или отсутствии, риске развития, прогрессировании или характеристиках указанного заболевания или состояния, связанного с нарушениями микробиоты ЖК тракта.
18. Способ по п. 16 или 17, отличающийся тем, что указанное заболевание или состояние, связанное с нарушением микробиоты ЖК тракта, выбрано из функциональных нарушений ЖК тракта, синдрома избыточного роста бактерий в тонком кишечнике, рака ЖК тракта, рака молочной железы, анкилозирующего спондилита; неалкогольного стеатогепатита; атопических заболеваний, метаболических нарушений, неврологических расстройств, аутоиммунных заболеваний, неполноценного питания, синдрома хронической усталости и аутизма.
19. Способ по п. 18, отличающийся тем, что указанное функциональное нарушение ЖК тракта представляет собой СРК (синдром раздраженного кишечника).
20. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный этап получения указанных профилей микробиоты включает анализ нуклеиновой кислоты, предпочтительно, секвенирование нуклеиновой кислоты, гибридизацию олигонуклеотидных зондов, амплификацию нуклеиновой кислоты на основе праймеров; обнаружение на основе антител или других специфичных аффинных лигандов, анализ протеома или анализ метаболома.
21. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный образец из ЖК тракта выбран из
(a) содержимого просвета ЖК тракта, предпочтительно, содержимого желудка, содержимого кишечника, слизи и фекалий/кала или комбинаций указанных образцов,
(b) частей слизистой оболочки, подслизистой оболочки, наружного мышечного слоя, адвентициальной оболочки и/или серозной оболочки ткани/органа ЖК тракта,
(c) нуклеиновой кислоты, полученной из (a) или (b), предпочтительно, в результате обратной транскрипции и/или амплификации нуклеиновой кислоты, или
(d) культуры микроорганизмов (a) или (b).
22. Способ по п. 21, отличающийся тем, что указанный образец из ЖК тракта получен из тощей кишки, подвздошной кишки, слепой кишки, толстой кишки, прямой кишки или заднепроходного отверстия.
23. Система для определения вероятности дисбиоза ЖК тракта у субъекта, содержащая программу, приспособленную для осуществления способа по любому из предшествующих пунктов.
24. Система по п. 23, дополнительно приспособленная для осуществления получения профиля микробиоты или этапа указанного получения профиля.
| VEBO H | |||
| Microbiota analysis in IBS and IBD/NON-IBD patients and normal subjects | |||
| Телефонная трансляция с катодными лампами | 1920 |
|
SU592A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| US 2012238468 A1, 20.09.2012 | |||
| WO 2014153194 A2, 25.09.2014 | |||
| СПОСОБ ВИДОВОЙ ИДЕНТИФИКАЦИИ ЛАКТОБАЦИЛЛ L.casei/paracasei, L.fermentum, L.plantarum И L.rhamnosus | 2012 |
|
RU2508406C2 |
| VEBO H | |||
| Temporal development of the infant gut microbiota in immunoglobulin E-sensitized and nonsensitized | |||
Авторы
Даты
2020-06-09—Публикация
2016-03-24—Подача