Перекрестная ссылка на родственные заявки
В настоящей заявке на патент испрашивается приоритет заявки на японский патент №2015-185254, зарегистрированной в Японии 18 сентября 2015 г. Ее полное содержание включено в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Одним из объектов изобретения, не ограничивающих его объем, являются антитела к IL-8, фармацевтические композиции, содержащие указанные антитела, нуклеиновые кислоты, кодирующие антитела, и клетки-хозяева, содержащие нуклеиновые кислоты. Предложены также способы получения и применения антител к IL-8 и фармацевтической композиции для лечения, например, ассоциированных с IL-8 нарушений.
Предпосылки создания изобретения
Антитела привлекают внимание в качестве фармацевтических средств благодаря их высокой стабильности в плазме и небольшому количеству побочных действий. В продажу поступает целый ряд терапевтических антител IgG-типа, а также много терапевтических антител в настоящее время находится в разработке (Reichert и др., Nat. Biotechnol. 23, 2005, сс. 1073-1078 (NPL1); Pavlou и др., Eur. J. Pharm. Biopharm. 59(3), 2005, сс. 389-396 (NPL2)). При этом, разработаны различные методы для создания терапевтических антител второго поколения; включая методы повышения эффекторной функции, способности связывать антиген, фармакокинетических характеристик или стабильности и уменьшения риска иммуногенности (Kim и др., Mol. Cells. 20 (1), 2005, сс. 17-29 (NPL3)). Доза терапевтических антител, как правило, является очень высокой, и поэтому созданию терапевтических антител препятствуют такие факторы, как сложность получения композиций для подкожного введения и высокая стоимость производства. Методы улучшения фармакокинетических характеристик, фармакодинамических характеристик и способности связываться с антигеном терапевтических антител обеспечивают пути снижения дозы и стоимости производства терапевтических антител.
Замена аминокислотных остатков в константной области является одним из методов улучшения фармакокинетических характеристик антител (Hinton и др., J. Immunol. 176(1), 2006, сс. 346-356 (NPL4); Ghetie и др., Nat. Biotechnol. 15(7), 1997, сс. 637-640) (NPL5). Технология созревания аффинности предложена в качестве метода повышения антигеннейтрализующей способности антитела (Rajpal др., Proc. Natl. Acad. Sci. USA 102(24), 2005, сс. 8466-8471 (NPL6); Wu и др., J. Mol. Biol. 368, 2007, с. 652 ((NPL7)), и она может обеспечивать повышение антигенсвязывающей активности путем интродукции мутации(й) аминокислотного(ых) остатка(ов) в CDR и/или каркасные области вариабельного домена антитела. Повышение антигенсвязывающих свойств антитела может приводить к повышению биологической активности антитела in vitro или к снижению дозы и может также повышать эффективность in vivo (в организме) (Wu и др., J. Mol. Biol. 368, 2007, сс. 652-665 (NPL8)).
Количество антигена, которое может нейтрализоваться одной молекулой антитела, зависит от аффинности антитела к антигену; и поэтому можно нейтрализовать антиген небольшим количеством антитела путем повышения аффинности. Аффинность антитела к антигену можно повышать с помощью различных общепринятых известных методов (см., например, Rajpal и др., Proc. Natl. Acad. Sci. USA 102(24), 2005, сс. 8466-8471 (NPL6)). Кроме того, теоретически возможно нейтрализовать одну молекулу антигена (2 молекулы антигена, когда антитело является двухвалентным) с помощью одной молекулы антитела, если она может ковалентно связываться с антигеном, если повышать аффинность до бесконечности. Однако при этом одно из существующих в настоящее время ограничений при разработке терапевтических антител состоит в том, что одна молекула антитела, как правило, связывается и нейтрализует только одну молекулу антигена (2 молекулы антигена, когда антитело является двухвалентным). В настоящее время опубликованы данные о том, что применение антитела, которое связывается с антигеном в зависимости от pH (ниже в настоящем описании обозначено как «pH-зависимое антитело» или «связывающееся в зависимости от pH антитело»), делает возможным связывание одной молекулы антитела с несколькими молекулами антигена и их нейтрализацию (см., например, WO 2009/125825 (PTL1); Igawa и др., Nat. Biotechnol. 28, 2010, сс. 1203-1207 (NPL9)). pH-зависимое антитело характеризуется сильным связыванием с антигеном в условиях нейтрального pH в плазме и отделяется в результате диссоциации от антигена в условиях кислого pH в эндосоме клетки. После отделения от антигена происходит рециклинг антитела в плазму посредством FcRn, и после этого оно становится свободным, что позволяет ему связываться с другой молекулой антитела и нейтрализовать ее; и таким образом одно pH-зависимое антитело может повторно связываться с несколькими молекулами антигена и нейтрализовать их.
В настоящее время установлено, что способность антитела к рециклингу может обеспечиваться разницей в концентрации ионов кальция (Са) между плазмой и эндосомой и применением антитела, обладающего способностью к взаимодействию с антигеном, что проявляется в зависимости от кальция (в настоящем описании ниже обозначено как «зависящее от концентрации кальция антитело») WO 2012/073992 (PTL2)). (Ниже в настоящем описании pH-зависимое антитело и «зависящее от концентрации ионов кальция антитело» обозначают в целом как «зависящее от pH/концентрации Ca антитело»).
Благодаря связыванию с FcRn антитела IgG-типа имеют продолжительное время удерживания в плазме. Связывание между антителом IgG-типа и FcRn является сильным в условиях кислого pH (например, pH 5,8), но связывание практически не имеет места в условиях нейтрального pH (например, pH 7,4). Антитело IgG-типа поглощается клетками неспецифически и возвращается на клеточную поверхность посредством связывания с FcRn в эндосоме в условиях кислого pH в эндосоме. Затем IgG отделяется в результате диссоциации от FcRn в условиях нейтрального pH в плазме.
Установлено, что pH-зависимое антитело, модифицированное с целью повышения его способности связываться с FcRn в условиях нейтрального pH, обладает способностью повторно связываться с молекулами антигена и элиминировать их из плазмы; и введение указанного антитела позволяет элиминировать антиген из плазмы (WO 2011/122011 (PTL3)). Согласно вышеуказанной публикации pH-зависимое антитело, модифицированное с целью повышения его способности связываться с FcRn в условиях нейтрального pH (например, pH 7,4), может также еще больше ускорять элиминацию антигена по сравнению с pH-зависимым антителом, которое содержит Fc-область нативного антитела IgG-типа (WO 2011/122011 (PTL3)).
При этом, когда в Fc-область антитела IgG-типа интродуцируют мутации для элиминации его способности связываться с FcRn в условиях кислого pH, оно больше не обладает способностью к рециклингу из эндосомы в плазму, что существенно снижает время удерживания антитела в плазме. В связи с этим, описан метод повышения способности к связыванию с FcRn в условиях кислого pH в качестве метода повышения времени удерживания в плазме антитела IgG-типа. Интродукция аминокислотных модификаций в Fc-область антитела IgG-типа для повышения способности к связыванию с FcRn в условиях кислого pH может повышать эффективность рециклинга из эндосомы в плазму, что приводит к повышению времени удерживания в плазме. Например, установлено, что модификации M252Y/S254T/T256E (YTE; Dall'Acqua и др., J. Biol. Chem. 281, 2006, сс. 23514-235249 (NPL10)), M428L/N434S (LS; Zalevsky и др., Nat. Biotechnol. 28, 2010, сс. 157-159 (NPL11)) и N434H (Zheng и др., Clin. Pharm. & Ther. 89(2), 2011, сс. 283-290 (NPL12)) приводят к увеличенному времени полужизни антитела по сравнению с нативным IgG1.
Однако помимо проблемы, связанной с иммуногенностью или высокой скоростью образования агрегатов, которая может повышаться для антитела, содержащего указанный вариант Fc-области, способность связывания которой с FcRn повышается в условиях нейтрального pH или в условиях кислого pH, описано также повышение связывания с антителом к лекарственному средству (ниже в контексте настоящего описания обозначено как «предсуществующее ADA») (например, ревматоидный фактор), которое присутствовало в организме пациента до введения терапевтического антитела (WO 2013/046722 (PTL4), WO 2013/046704 (PTL5)). В WO 2013/046704 (PTL5) описано, что вариант Fc-области, содержащий конкретные мутации (а именно, модификации двух остатков Q438R/S440E согласно EU-нумерации), обладает повышенной способностью связываться с FcRn в условиях кислого pH, а также продемонстрировано существенное снижение связывания с ревматоидным фактором по сравнению с не модифицированной нативной Fc. Однако в WO 2013/046704 (PTL5) не продемонстрировано конкретно, что указанный вариант Fc-области обладает удлиненным временем удерживания в плазме по сравнению с антителом с нативной Fc-областью.
Таким образом, существует потребность в безопасных и более предпочтительных вариантах Fc-области с дополнительно повышенным временем удерживания в плазме, которые не обладают способностью связываться с предсуществующим ADA.
Антитело-обусловленная клеточнозависимая цитотоксичность (ниже в контексте настоящего описания обозначена как «ADCC», комплементзависимая цитотоксичность (ниже в контексте настоящего описания обозначена как «CDC»), антитело зависимый клеточный фагоцитоз (ADCP), представляющий собой фагоцитоз клеток-мишеней, опосредуемый антителом IgG-типа, описаны в качестве эффекторных функций антитела IgG-типа. Для проявления антителом IgG-типа ADCC-активности или ADCP-активности Fc-область антитела IgG-типа должна связываться с рецептором антитела, присутствующим на поверхности эффекторной клетки, такой как клетка-киллер, естественная клетка-киллер или активированный макрофаг (который обозначают как «Fcγ-рецептор», «FcgR», «Fc гамма-рецептор» или «FcγR» в контексте раздела A настоящего описания). Для человека описаны изоформы FcγRIa, FcγRIIa, FcγRIIb, FcγRIIIa и FcγRIIIb в качестве белков семейства FcγR, а также их соответствующие аллотипы (Jefferis и др., Immunol. Lett. 82, 2002, сс. 57-65 (NPL13)). Баланс соответствующих аффинностей антитела к активирующему рецептору, представляющему собой FcγRIa, FcγRIIa, FcγRIIIa или FcγRIIIb, и ингибирующему рецептору, представляющему собой FcγRIIb, является важным элементом оптимизации эффекторных функций антитела.
К настоящему времени описаны разнообразные методы повышения или улучшения активности терапевтического антитела в отношении антигена. Например, способность антитела связываться с активирующим(ими) FcγR играет важную роль в цитотоксичности антитела, и поэтому разработаны антитела, нацеленные на антиген мембранного типа и обладающие повышенной цитотоксичностью в результате повышенного связывания с активирующим(и) FcγR (см., например, WO 2000/042072 (PTL6); WO 2006/019447 (PTL7); Lazar и др., Proc. Nat. Acad. Sci. USA. 103, 2006, сс. 4005-4010 (NPL14); Shinkawa и др., J. Biol. Chem. 278, 2003, сс. 3466-3473 (NPL15); Clynes и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc. 652-656 (NPL16); Clynes и др., Nat. Med. 6, 2000, cc. 443-446 (NPL17)). Аналогично этому, активность связывания с ингибирующим рецептором FcγR (у человека FcγRIIb) играет важную роль в иммуносупрессорной активности, агонистической активности, и поэтому было проведено исследование антител с повышенной активностью связывания с ингибирующим FcγR, мишенью которых является антиген мембранного типа (Li и др., Proc. Nat. Acad. Sci. USA. 109 (27), 2012, cc. 10966-10971 (NPL18)). Кроме того, исследовали, прежде всего в отношении побочных действий, влияние связывания с FcγR антитела, которое связывается с растворимым антигеном (Scappaticci и др., J. Natl. Cancer Inst. 99 (16), 2007, cc. 1232-1239 (NPL19)). Например, когда в качестве лекарственного средства применяют антитело с повышенной способностью связываться с FcγRIIb, то можно ожидать наличия пониженного риска возникновения антител к лекарственному средству (Desai и др., J. Immunol. 178(10), 2007, cc. 6217-6226 (NPL20)).
В последние годы описано, что интродукция аминокислотных модификаций в Fc-область антитела IgG-типа с целью повышения активности антитела, мишенью которого является растворимый антиген, в отношении связывания с активирующим(и) и/или ингибирующим FcγR может дополнительно ускорять элиминацию антигена из сыворотки (WO 2012/115241 (PTL8), WO 2013/047752 (PTL9), WO 2013/125667 (PTL10), WO 2014/030728 (PTL11)). Кроме того, идентифицирован вариант Fc-области, который практически не отличается по своей FcγRIIb-связывающей активности от Fc-области нативного антитела IgG-типа, но обладает пониженной активностью связывания с другими активирующими FcγR (WO 2014/163101 (PTL12)).
Время удерживания в плазме растворимого антигена является очень коротким по сравнению с антителом, которое обладает опосредуемым FcRn механизмом рециклинга и поэтому растворимый антиген может характеризоваться увеличенным временем удерживания в плазме и увеличенной концентрацией в плазме в результате связывания с антителом, которое имеет такой механизм рециклинга (например, с антителом, которое не обладает характеристиками зависящего от pH/концентрации Ca антитела). Таким образом, например, когда растворимый антиген в плазме обладает несколькими типами физиологических функций, то даже, если один из типов физиологических функций блокируется в результате связывания с антителом, концентрация в плазме антигена может ухудшать патогенные симптомы, обусловленные другими физиологическими функциями, в результате увеличенного времени удерживания в плазме и/или увеличенной концентрации антигена, обусловленным/обусловленной связыванием с антителом. В этом случае в дополнение к методу, основанному на использовании вышеприведенных примеров модификаций для повышения способности антитела к элиминации антигена, предложен, например, метод, основанный на использовании образования многовалентного иммунного комплекса, состоящего из нескольких зависящих от pH/концентрации Ca антител и нескольких антигенов, и повышения связывания с FcRn, FcγR, рецептором компонентов комплемента (WO 2013/081143 (PTL13)).
Описано, что даже в том случае, когда Fc-область не является модифицированной, то путем модификации аминокислотного(ых) остатка(ов) посредством изменения заряда указанного(ых) аминокислотного(ых) остатка(ов), который(е) может(гут) экспонироваться на поверхности вариабельной области антитела, с целью повышения или снижения изоэлектрической точки (pI) антитела, можно контролировать время полужизни антитела в крови вне зависимости от типа антигена-мишени или антитела и без существенного снижения антигенсвязывающей активности антитела (WO 2007/114319 (PTL14): методы замены аминокислот главным образом в FR; WO 2009/041643 (PTL15): методы замены аминокислот главным образом в CDR). В указанных документах продемонстрировано, что можно пролонгировать время полужизни антитела в плазме путем снижения pI антитела и, наоборот, укорачивать время полужизни антитела в плазме путем повышения pI антитела.
Касательно модификации заряда аминокислотных остатков в константной области антитела, опубликованы данные о том, что поглощение антигена клетками можно усиливать путем модификации заряда конкретного(ых) аминокислотного(ых) остатка(ов), прежде всего в СН3-домене, для повышения pI антитела и, кроме того, описано, что указанная модификация предпочтительно не влияет на связывание с FcRn (WO 2014/145159 (PTL16)). Установлено также, что модификация заряда аминокислотных остатков в константной области (главным образом в СН1-домене) антитела осуществленная с целью снижения pI, может пролонгировать время полужизни антитела в плазме и в сочетании с мутациями аминокислотных остатков, осуществленными с целью повышения связывания с FcRn, может усиливать связывание с FcRn и пролонгировать время полужизни антитела в плазме (WO 2012/016227 (PTL17)).
Однако, когда указанные методы модификации, разработанные для повышения или снижения pI антитела, объединяют с методами, отличными от методов модификации с целью повышения или снижения связывания с FcRn или FcγR, то остается неясным будет ли этот эффект удлинять время удерживания антитела в плазме или усиливать элиминацию антигена из плазмы.
Внеклеточный матрикс (ЕСМ) представляет собой структуру, которая покрывает клетки in vivo и состоит главным образом из гликопротеинов, таких как коллаген, протеогликан, фибронектин и ламинин. Роль ЕСМ in vivo заключается в создании микроокружения для клеток, обеспечивающего их выживание, а также ЕСМ является важным для осуществления различных клеточных функций, таких как пролиферация клеток и адгезия клеток.
Установлено, что ЕСМ может участвовать в кинетике in vivo белков, вводимых в живой организм. Осуществляли оценку концентрации в крови молекулы VEGF-Trap, которая представляет собой слитый белок VEGF-рецептора и Fc, при ее подкожном введении (Holash и др., Proc. Natl. Acad. Sci., 99(17), 2002, сс. 11393-11398 (NPL21)). Концентрация в плазме вводимой подкожно молекулы VEGF-Trap, которая имеет высокую pI, оказалась низкой и поэтому ее биодоступность была низкой. Модифицированная молекула VEGF-Trap, pI которой снижали с помощью аминокислотных замен, имела более высокую концентрацию в плазме, и ее биодоступность удалось улучшить. Кроме того, изменение биодоступности коррелирует с силой связывания с ЕСМ и, таким образом, ясно, что биодоступность молекулы VEGF-Trap при ее подкожном введении зависит от силы ее связывания с ЕСМ в подкожной области.
В WO 2012/093704 (PTL18) описано, что имеет место обратная корреляция между связыванием антитела с ЕСМ и временем удерживания в плазме и, следовательно, молекулы антител, которые не связываются с ЕСМ, имеют лучшее время удерживания в плазме по сравнению с антителами, которые связываются с ЕСМ.
Так, описаны методы снижения связывания с внеклеточным матриксом с целью улучшения биодоступности белка in vivo и повышения времени удерживания в плазме. В противоположность этому, к настоящему времени не определены преимущества повышения связывания антитела с ЕСМ.
Человеческий IL-8 (интерлейкин 8) является представителем семейства хемокинов, состоящим из 72 или 77 аминокислотных остатков. Понятие «хемокин» является общим названием для семейства белков с молекулярной массой 8-12 кДа и содержащих 4 остатка цистеина, которые образуют межмолекулярные дисульфидные связи. Хемокины подразделяют на СС-хемокин, СХС-хемокин, С-хемокин, СА3С-хемокин на основе расположения цистеина. IL-8 классифицируют как СХС-хемокин, и его обозначают также как CXCL8.
IL-8 существует в растворе в мономерной и гомодимерной форме. Мономер IL-8 содержит антипараллельные β-тяжи и имеет структуру, в которой С-конец α-спирали пересекает и покрывает β-тяжи. Мономер IL-8 в случае состоящей из 72 аминокислот формы IL-8 содержит две дисульфидные перекрестные связи, находящиеся между цистеином 7 и цистеином 34 и между цистеином 9 и цистеином 50. Гомодимеры IL-8 стабилизируются нековалентными связями между β-тяжами двух мономеров, поскольку в гомодимерах отсутствует ковалентное связывание между молекулами.
Экспрессия IL-8 индуцируется в различных клетках, таких как моноциты периферической крови, тканевые макрофаги, NK-клетки, фибробласты и сосудистые эндотелиальные клетки, в ответ на стимуляцию провоспалительными цитокинами (Russo и др., Exp. Rev. Clin. Immunol. 10(5), 2014, сс. 593-619 (NPL22)).
Хемокины, как правило, не поддаются обнаружению или лишь слабо поддаются обнаружению в здоровой ткани, но их высокие уровни обнаружены в областях воспаления, и они участвуют в проявлении воспаления посредством облегчения инфильтрации лейкоцита в области воспаления в ткани. IL-8 представляет собой провоспалительный хемокин, который, как известно, активирует нейтрофилы, усиливает экспрессию молекул клеточной адгезии и повышает адгезию нейтрофилов к сосудистым эндотелиальным клеткам. IL-8 обладает также хемотаксической нейтрофильной активностью, и IL-8, продуцируемый в поврежденной ткани, облегчает хемотаксис нейтрофилов, прикрепленных к сосудистым эндотелиальным клеткам, в ткань и индуцирует воспаление наряду с инфильтрацией нейтрофилов. Известно также, что IL-8 является эффективным ангиогенным фактором для эндотелиальных клеток и участвует в усилении ангиогенеза опухолей.
Воспалительные заболевания, ассоциированные с повышенными (например, избыточными) уровнями IL-8, включают воспалительные заболевания кожи, такие как воспалительный кератоз (например, псориаз), атопический дерматит, контактный дерматит; хронические воспалительные нарушения, включая аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка (SLE) и болезнь Бехчета; воспалительные заболевания кишечника, такие как болезнь Крона и неспецифический язвенный колит; воспалительные заболевания печени, такие как гепатит В, гепатит С, алкогольный гепатит и индуцированный лекарственным средством аллергический гепатит; воспалительные заболевания почек, например, гломерулонефрит; воспалительные респираторные заболевания, такие как бронхит и астма; воспалительные хронические сосудистые заболевания, например, атеросклероз; рассеянный склероз, оральную язву, хордит и воспаление, ассоциированное с применением искусственных органов и/или искусственных кровеносных сосудов. Повышенные (например, избыточные) уровни IL-8 ассоциированы также со злокачественными опухолями, такими как рак яичника, рак легкого, рак предстательной железы, рак желудка, рак молочной железы, меланома, раки головы и шеи и рак почки; со связанным с инфекцией сепсисом; муковисцидозом; и фиброзом легкого (см., например, Russo и др., Exp. Rev. Clin. Immunol. 10(5), 2014, сс. 593-619 (NPL22), публикация полностью включена в настоящее описание в качестве ссылки).
Для некоторых из указанных заболеваний разработаны человеческие антитела к IL-8, обладающие высокой аффинностью, в виде фармацевтических композиций (Desai и др., J. Immunol. 178(10), 2007, сс. 6217-6226 (NPL23)), однако они пока не поступают в продажу. К настоящему времени доступна только одна фармацевтическая композиция, содержащая антитело к IL-8, которое представляет собой антитело к IL-8, которое предназначено для лечения псориаза в качестве средства наружной терапии. Разрабатываются новые антитела к IL-8 для лечения заболеваний.
Перечень ссылок
Патентная литература
[PTL1] WO 2009/125825.
[PTL2] WO 2012/073992.
[PTL3] WO 2011/122011.
[PTL4] WO 2013/046722.
[PTL5] WO 2013/046704.
[PTL6] WO 2000/042072.
[PTL7] WO 2006/019447.
[PTL8] WO 2012/115241.
[PTL9] WO 2013/047752.
[PTL10] WO 2013/125667.
[PTL11] WO 2014/030728.
[PTL12] WO 2014/163101.
[PTL13] WO 2013/081143.
[PTL14] WO 2007/114319.
[PTL15] WO 2009/041643.
[PTL16] WO 2014/145159.
[PTL17] WO 2012/016227.
[PTL18] WO 2012/093704.
Не патентная литература
[NPL1] Reichert и др., Nat. Biotechnol. 23, 2005, cc. 1073-1078.
[NPL2] Pavlou и др., Eur. J. Pharm. Biopharm. 59(3), 2005, cc. 389-396.
[NPL3] Kim и др., Mol. Cells. 20 (1), 2005, cc. 17-29.
[NPL4] Hinton и др., J. Immunol. 176 (1), 2006, cc. 346-356.
[NPL5] Ghetie и др., Nat. Biotechnol. 15(7), 1997, cc. 637-640.
[NPL6] Rajpal и др., Proc. Natl. Acad. Sci. USA 102(24), 2005, cc. 8466-8471.
[NPL7] Wu и др., J. Mol. Biol. 368, 2007, c. 652.
[NPL8] Wu и др., J. Mol. Biol. 368, 2007, cc. 652-665.
[NPL9] Igawa и др., Nat. Biotechnol. 28, 2010, cc. 1203-1207.
[NPL10] Dall'Acqua и др., J. Biol. Chem. 281, 2006, cc. 23514-235249.
[NPL11] Zalevsky и др., Nat. Biotechnol. 28, 2010, cc. 157-159.
[NPL12] Zheng и др., Clin. Pharm. & Ther. 89(2), 2011, cc. 283-290.
[NPL13] Jefferis и др., Immunol. Lett. 82, 2002, сс. 57-65.
[NPL14] Lazar и др., Proc. Nat. Acad. Sci. USA. 103, 2006, cc. 4005-4010.
[NPL15] Shinkawa и др., J. Biol. Chem. 278, 2003, cc. 3466-3473.
[NPL16] Clynes и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc. 652-656.
[NPL17] Clynes и др., Nat. Med. 6, 2000, cc. 443-446.
[NPL18] Li и др., Proc. Nat. Acad. Sci. USA. 109 (27), 2012, cc. 10966-10971.
[NPL19] Scappaticci и др., J. Natl. Cancer Inst. 99 (16), 2007, cc. 1232-1239.
[NPL20] Desai и др., J. Immunol. 178(10), 2007, cc. 6217-6226.
[NPL21] Holash и др., Proc. Natl. Acad. Sci., 99(17), 2002, cc. 11393-11398.
[NPL22] Russo и др., Exp. Rev. Clin. Immunol. 10(5), 2014, cc. 593-619.
[NPL23] Desai и др., J. Immunol. 178(10), 2007, cc. 6217-6226.
Краткое изложение сущности изобретения
Согласно одному из объектов изобретения, не ограничивающих его объем, вариантами осуществления изобретения, указанными в разделе А описания, являются (но, не ограничиваясь только ими) молекулы с улучшенными по сравнению с антителами фармакокинетическими свойствами, такими как зависящие от концентрации ионов антигенсвязывающие свойства, которые улучшают время полужизни в плазме и/или клиренс антигена из плазмы.
Согласно одному из объектов изобретения, не ограничивающих его объем, вариантами осуществления изобретения, указанными в разделе Б описания, являются (но, не ограничиваясь только ими) безопасные и более предпочтительные варианты Fc-области, которые обладают повышенным временем полужизни и пониженной способностью связываться с предсуществующими антителами к лекарственным средствам (ADA).
Согласно одному из объектов изобретения, не ограничивающих его объем, вариантами осуществления изобретения, указанными в разделе В описания, являются (но, не ограничиваясь только ими) антитела к IL-8, которые обладают зависящей от pH аффинностью связывания с IL-8. Дополнительным вариантом осуществления изобретения являются антитела к IL-8, которые обладают способностью быстро по сравнению с референс-антителом элиминировать IL-8 при введении индивидууму. Другим вариантом осуществления изобретения, указанным в разделе В описания, являются антитела к IL-8, которые обладают способностью стабильно сохранять свою IL-8-нейтрализующую активность при введении индивидууму. В некоторых вариантах осуществления изобретения антитела к IL-8 характеризуются пониженной иммуногенностью. Дополнительными вариантами осуществления изобретения, указанными в разделе В описания, являются способы получения и применения вышеописанных антител к IL-8. Другим альтернативным объектом изобретения, не ограничивающим его объем, который указан в разделе В описания, являются новые антитела к IL-8, которые можно включать в фармацевтическую композицию.
Одним из объектов изобретения, не ограничивающих его объем, который указан в разделе А настоящего описания, является неожиданно установленный при создании изобретения факт, что способность зависящего от концентрации ионов антитела (которое представляет собой антитело, содержащее зависящий от концентрации ионов антигенсвязывающий домен («антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов»)) элиминировать антиген из плазмы можно повышать путем модификации по меньшей мере одного из аминокислотных остатков, экспонированных на поверхности антитела, с целью повышения изоэлектрической точки (pI). Согласно другому объекту изобретения, не ограничивающему его объем, установлено, что у зависящего от концентрации ионов антитела с повышенной pI может повышаться также способность связываться с внеклеточным матриксом. Таким образом, не вдаваясь в конкретную теорию, при создании изобретения было установлено, что элиминацию антигена из плазмы можно повышать путем повышения связывания антитела с внеклеточным матриксом.
Согласно одному из объектов изобретения, не ограничивающих его объем, который указан в разделе Б настоящего описания, при создании изобретения проведено тщательное исследование в отношении безопасных и более предпочтительных вариантов Fc-области, которые не обладают способностью связываться с антителами к лекарственным средствам (предсуществующие ADA) и которые дополнительно могли бы обладать улучшенным временем удерживания в плазме. В результате при создании изобретения неожиданно было установлено, что варианты Fc-области, содержащие замену аминокислоты в положении 434 согласно EU-нумерации на Ala (А) и конкретные мутации двух остатков (такие как Q438R/S440E согласно EU-нумерации) в виде комбинации мутаций аминокислотных остатков, являются предпочтительными для поддержания существенного снижения связывания с ревматоидный фактором, наряду с обеспечением удерживания антитела в плазме.
Согласно одному из объектов изобретения, не ограничивающих его объем, который указан в разделе В настоящего описания, при создании изобретения было разработано несколько pH-зависимых антител к IL-8 (антитела к IL-8, которые связываются с IL-8 в зависимости от pH). Путем валидации результатов с использованием различных методов при создании изобретения идентифицированы pH-зависимые антитела к IL-8, которые оказывают воздействие на быструю по сравнении с референс-антителом элиминацию IL-8 при введении индивидууму. Некоторые варианты осуществления изобретения, указанные в разделе В описания, относятся к pH-зависимым антителам в IL-8, которые обладают способностью стабильно сохранять свою IL-8-нейтрализующую активность. В других вариантах осуществления изобретения pH-зависимые антитела к IL-8 обладают пониженной иммуногенностью и очень высокими уровнями экспрессии.
Кроме того, в разделе В описания, изложено успешное получение при создании изобретения антител к IL-8, которые содержат Fc-область, аффинность связывания с FcRn которой при кислом pH повышается по сравнению с аффинностью связывания нативной Fc-области с FcRn. Альтернативно этому, при создании изобретения были успешно получены антитела к IL-8, содержащие Fc-область, аффинность связывания которой с предсуществующими ADA понижена по сравнению с аффинностью связывания нативной Fc-области с предсуществующими ADA. Альтернативно этому, при создании изобретения были успешно получены антитела к IL-8, содержащие Fc-область, время полужизни в плазме которой повышено относительно времени полужизни в плазме нативной Fc-области. Альтернативно этому, при создании изобретения были успешно получены pH-зависимые антитела к IL-8, содержащие Fc-область, аффинность связывания которой с эффекторными рецепторами снижена по сравнению с аффинностью связывания нативной Fc-области с эффекторными рецепторами. Другими объектами изобретения являются идентифицированные при создании изобретения нуклеиновые кислоты, кодирующие вышеуказанные антитела к IL-8. Другим объектом изобретения являются также полученные при создании изобретения хозяева, которые содержат вышеуказанные нуклеиновые кислоты. Другим объектом изобретения является разработанный при создании изобретения способ получения вышеуказанных антител к IL-8, который включает культивирование вышеуказанного хозяина. Другим объектом изобретения является разработанный при создании изобретения способ облегчения элиминации IL-8 из организма индивидуума по сравнению с элиминацией при использовании референс-антитела, который включает введение вышеуказанных антител к IL-8 индивидууму.
Одним из вариантов осуществления изобретения, указанным в разделе А описания, являются (но, не ограничиваясь только ими):
[1] антитело, содержащее антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, у которого изоэлектрическая точка (pI) повышена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела;
[2] антитело по п. [1], где антиген представляет собой растворимый антиген;
[3] антитело по п. [1] или п. [2], в котором антигенсвязывающий домен представляет собой домен, антигенсвязывающая активность которого в условиях высокой концентрации ионов выше, чем в условиях низкой концентрации ионов;
[4] антитело по одному из п.п. [1]-[3], где концентрация ионов представляет собой концентрацию иона водорода (pH) или концентрацию ионов кальция;
[5] антитело по п. [4], для которого отношение KD в кислом диапазоне pH к KD в нейтральном диапазоне pH, KD (кислый диапазон pH)/KD (нейтральный диапазон pH), в отношении антигена составляет 2 или выше;
[6] антитело по одному из п.п. [1]-[5], в котором в антигенсвязывающем домене по меньшей мере один аминокислотный остаток заменен на гистидин или в антигенсвязывающий домен встроен по меньшей мере один гистидин;
[7] антитело по одному из п.п. [1]-[6], которое может усиливать элиминацию антигена из плазмы по сравнению с антителом до модификации;
[8] антитело по одному из п.п. [1]-[7], в котором активность связывания внеклеточного матрикса повышена по сравнению с антителом до модификации;
[9] антитело по одному из п.п. [1]-[8], в котором модификация аминокислотного остатка представляет собой замену аминокислотного остатка;
[10] антитело по одному из п.п. [1]-[9], в котором модификацию аминокислотного остатка выбирают из группы, состоящей из:
(а) замены отрицательно заряженного аминокислотного остатка на незаряженный аминокислотный остаток;
(б) замены отрицательно заряженного аминокислотного остатка на положительно заряженный аминокислотный остаток;
и
(в) замены незаряженного аминокислотного остатка на положительно заряженный аминокислотный остаток;
[11] антитело по одному из п.п. [1]-[10], где антитело содержит вариабельную область и/или константную область и модификация аминокислотного остатка представляет собой модификацию аминокислотного остатка в вариабельной области и/или константной области;
[12] антитело по п. [11], в котором вариабельная область содержит гипервариабельный(ые) участок(и) (CDR) и/или каркасный(ые) участок(и) (FR);
[13] антитело по п. [12], в котором вариабельная область содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, и по меньшей мере один аминокислотный остаток модифицирован в положении в CDR или в FR, выбранном из группы, состоящей из:
(а) положения 1, 3, 5, 8, 10, 12, 13, 15, 16, 18, 19, 23, 25, 26, 39, 41, 42, 43, 44, 46, 68, 71, 72, 73, 75, 76, 77, 81, 82, 82а, 82b, 83, 84, 85, 86, 105, 108, 110 и 112 в FR вариабельной области тяжелой цепи;
(б) положения 31, 61, 62, 63, 64, 65 97 в CDR вариабельной области тяжелой цепи;
(в) положения 1, 3, 7, 8, 9, 11, 12, 16, 17, 18, 20, 22, 37, 38, 39, 41, 42, 43, 45, 46, 49, 57, 60, 63, 65, 66, 68, 69, 70, 74, 76, 77, 79, 80, 81, 85, 100, 103, 105, 106, 107 и 108 в FR вариабельной области легкой цепи; и
(г) положения 24, 25, 26, 27, 52, 53, 54, 55 и 56 в CDR вариабельной области легкой цепи, согласно нумерации Кэбота;
[14] антитело по п. [13], в котором по меньшей мере один аминокислотный остаток модифицирован в положении в CDR или в FR, выбранном из группы, состоящей из:
(а) положение 8, 10, 12, 13, 15, 16, 18, 23, 39, 41, 43, 44, 77, 82, 82а, 82b, 83, 84, 85 и 105 в FR вариабельной области тяжелой цепи;
(б) положение 31, 61, 62, 63, 64, 65 и 97 в CDR вариабельной области тяжелой цепи;
(в) положение 16, 18, 37, 41, 42, 45, 65, 69, 74, 76, 77, 79 и 107 в FR вариабельной области легкой цепи; и
(г) положение 24, 25, 26, 27, 52, 53, 54, 55 и 56 в CDR вариабельной области легкой цепи;
[15] антитело по одному из п.п. [11]-[14], в котором по меньшей мере один аминокислотный остаток модифицирован в положении в константной области, выбранном из группы, состоящей из положения 196, 253, 254, 256, 258, 278, 280, 281, 282, 285, 286, 307, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 373, 382, 384, 385, 386, 387, 389, 399, 400, 401, 402, 413, 415, 418, 419, 421, 424, 430, 433, 434 и 443, согласно EU-нумерации;
[16] антитело по п. [15], в котором по меньшей мере один аминокислотный остаток модифицирован в положении в константной области, выбранном из группы, состоящей из положения 254, 258, 281, 282, 285, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 384, 385, 386, 387, 389, 399, 400, 401, 402, 413, 418, 419, 421, 433, 434 и 443;
[17] антитело по п. [16], в котором по меньшей мере один аминокислотный остаток модифицирован в положении в константной области, выбранном из группы, состоящей из положения 282, 309, 311, 315, 342, 343, 384, 399, 401, 402 и 413, согласно EU-нумерации;
[18] антитело по одному из п.п. [1]-[17], в котором константная область обладает связывающей активностью в отношении Fc гамма-рецептора (FcγR) и у которого FcγR-связывающая активность в условиях нейтрального pH повышена по сравнению с активностью референс-антитела, которое содержит константную область нативного IgG;
[19] антитело по п. [18], где FcγR представляет собой FcγRIIb;
[20] антитело по одному из п.п. [1]-[17], в котором константная область обладает связывающей активностью в отношении одного или нескольких активирующих FcγR, выбранных из группы, состоящей из FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, FcγRIIIb и FcγRIIa и в отношении FcγRIIb и FcγRIIb-связывающая активность сохранена или повышена, а связывающая активность в отношении активирующих FcγR снижена по сравнению с активностями референс-антитела, которое отличается только тем, что содержит константную область нативного IgG;
[21] антитело по одному из п.п. [1]-[20], в котором константная область обладает FcRn-связывающей активностью и в котором FcRn-связывающая активность в условиях нейтрального pH (например, pH 7,4) повышена по сравнению с активностью референс-антитела, которое отличается только тем, что содержит константную область нативного IgG;
[22] антитело по одному из п.п. [1]-[21], которое представляет собой мультиспецифическое антитело, связывающееся по меньшей мере с двумя антигенами;
[23] антитело по одному из п.п. [1]-[22], где антитело представляет собой антитело IgG-типа;
[24] фармацевтическая композиция, содержащая антитело по одному из п.п. [1]-[23];
[25] фармацевтическая композиция по п. [24], предназначенная для усиления элиминации антигена из плазмы;
[26] фармацевтическая композиция по п. [24] или п. [25], предназначенная для усиления связывания антитела с внеклеточным матриксом;
[27] нуклеиновая кислота, кодирующая антитело по одному из п.п. [1]-[23];
[28] вектор, содержащий нуклеиновую кислоту по п. [27];
[29] клетка-хозяин, содержащая вектор по п. [28];
[30] способ получения антитела, содержащего антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, где способ включает культивирование клетки-хозяина по п. [29] и сбор антитела из клеточной культуры;
[30А] способ получения антитела, содержащего антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, где способ включает модификацию по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела, для повышения изоэлектрической точки (pI);
[30Б] способ по п. [30А], в котором по меньшей мере один аминокислотный остаток модифицирован
(I) в положении в CDR или FR, выбранном из группы, состоящей из: (а) положения 1, 3, 5, 8, 10, 12, 13, 15, 16, 18, 19, 23, 25, 26, 39, 41, 42, 43, 44, 46, 68, 71, 72, 73, 75, 76, 77, 81, 82, 82а, 82b, 83, 84, 85, 86, 105, 108, 110 и 112 в FR вариабельной области тяжелой цепи; (б) положения 31, 61, 62, 63, 64, 65 и 97 в CDR вариабельной области тяжелой цепи; (в) положения 1, 3, 7, 8, 9, 11, 12, 16, 17, 18, 20, 22, 37, 38, 39, 41, 42, 43, 45, 46, 49, 57, 60, 63, 65, 66, 68, 69, 70, 74, 76, 77, 79, 80, 81, 85, 100, 103, 105, 106, 107 и 108 в FR вариабельной области легкой цепи; и (г) положения 24, 25, 26, 27, 52, 53, 54, 55 и 56 в CDR вариабельной области легкой цепи, согласно нумерации Кэбота; или
(II) в положении в константной области, выбранном из группы, состоящей из положения 196, 253, 254, 256, 258, 278, 280, 281, 282, 285, 286, 307, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 373, 382, 384, 385, 386, 387, 389, 399, 400, 401, 402, 413, 415, 418, 419, 421, 424, 430, 433, 434 и 443, согласно EU-нумерации;
[31] способ по п. [30А] или п. [30Б], в котором модификация аминокислотного остатка содержит модификацию, выбранную из группы, состоящей из:
(а) замены отрицательно заряженного аминокислотного остатка на незаряженный аминокислотный остаток;
(б) замены отрицательно заряженного аминокислотного остатка на положительно заряженный аминокислотный остаток;
(в) замены незаряженного аминокислотного остатка на положительно заряженный аминокислотный остаток; и
(г) замены или инсерции гистидина в CDR или FR.
[32] способ по одному из п.п. [30] или [30А]-[30В], который дополнительно включает одну или несколько из следующих стадий:
(а) отбор антитела, которое может усиливать элиминацию антигена из плазмы;
(б) отбор антитела с повышенной активностью связывания с внеклеточным матриксом;
(в) отбор антитела с повышенной FcγR-связывающей активностью в условиях нейтрального pH (например, pH 7,4);
(г) отбор антитела с повышенной FcγRIIb-связывающей активностью в условиях нейтрального pH (например, pH 7,4);
(д) отбор антитела с сохраненной или повышенной FcγRIIb-связывающей активностью и пониженной связывающей активностью в отношении одного или нескольких активирующих FcγR, предпочтительно выбранных из группы, состоящей из FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, FcγRIIIb и FcγRIIa;
(е) отбор антитела с повышенной FcRn-связывающей активностью в условиях нейтрального pH (например, pH 7,4);
(ж) отбор антитела с повышенной изоэлектрической точкой (pI);
(з) подтверждение изоэлектрической точки (pI) у собранного антитела и последующий отбор антитела с повышенной изоэлектрической точкой (pI); и
(и) отбор антитела, антигенсвязывающая активность которого изменяется или повышается в зависимости от условий концентрации ионов;
по сравнению с референс-антителом;
Альтернативным вариантом осуществления изобретения, указанным в разделе А описания, является (но не ограничиваясь только ими)
[А1] антитело, имеющее константную область, в котором по меньшей мере один аминокислотный остаток, выбранный из группы сайтов модификации, идентичных сайтам модификации из группы, указанной в п. [15] или п. [16], модифицирован в константной области;
[А2] антитело по п. [А1], которое дополнительно имеет вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, в котором вариабельная область имеет CDR-участки и/или FR-участки и в котором по меньшей мере один аминокислотный остаток, выбранный из группы сайтов модификации, идентичных сайтам модификации из группы, указанной в п. [13] или п. [14], модифицирован в CDR и/или FR;
[A3] антитело, имеющее константную область, в котором по меньшей мере один аминокислотный остаток, выбранный из группы сайтов модификации, идентичных сайтам модификации из группы, указанной в п. [15] или п. [16], модифицирован в константной области для повышения pI;
[А4] антитело по п. [A3], которое дополнительно имеет вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, в котором вариабельная область имеет CDR-участок(и) и/или FR-участок(и), и в котором по меньшей мере один аминокислотный остаток, выбранный из группы сайтов модификации, идентичных сайтам модификации из группы, указанной в п. [13] или п. [14], модифицирован в CDR и/или FR;
[А5] антитело, содержащее антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, где антитело имеет константную область, и в котором по меньшей мере один аминокислотный остаток, выбранный из группы сайтов модификации, идентичных сайтам модификации из группы, указанной в п. [15] или п. [16], модифицирован в константной области;
[А6] антитело по п. [А5], которое дополнительно имеет вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, в котором вариабельная область имеет CDR-участок(и) и/или FR-участок(и), и в котором по меньшей мере один аминокислотный остаток, выбранный из группы сайтов модификации, идентичных сайтам модификации из группы, указанной в п. [13] или п. [14], модифицирован в CDR и/или FR;
[А7] применение антитела по одному из п.п. [1]-[23] и [А1]-[А6] для приготовления лекарственного средства, предназначенного для усиления элиминации антигена из плазмы;
[А8] применение антитела по одному из п.п. [1]-[23] и [А1]-[А6] для приготовления лекарственного средства, предназначенного для повышения связывания с внеклеточным матриксом;
[А9] применение антитела по одному из п.п. [1]-[23] и [А1]-[А6] для элиминации антигена из плазмы; и
[А10] применение антитела по одному из п.п. [1]-[23] и [А1]-[А6] для повышения связывания с внеклеточным матриксом;
[A11] антитело, полученное способом по одному из п.п. [30], [30А], [30Б], [31], [32].
Различными вариантами осуществления изобретения, указанными в разделе А описания, являются комбинации одного или нескольких элементов, указанных выше в любом из [1]-[30], [30А], [30Б], [31], [32] и [А1]-[А11], частично или полностью, если указанная комбинация не является технически невозможной согласно общепринятым техническим сведениям известным в данной области. Например, некоторыми вариантами осуществления изобретения, указанными в разделе А описания, является способ получения модифицированного антитела, содержащего антигенсвязывающий домен, который усиливает элиминацию антигена из плазмы по сравнению с антителом до модификации, где способ включает:
(а) модификацию по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела, присутствующую:
(I) в положении в CDR или FR, выбранном из группы, состоящей из: (а) положения 1, 3, 5, 8, 10, 12, 13, 15, 16, 18, 19, 23, 25, 26, 39, 41, 42, 43, 44, 46, 68, 71, 72, 73, 75, 76, 77, 81, 82, 82а, 82b, 83, 84, 85, 86, 105, 108, 110 и 112 в FR вариабельной области тяжелой цепи; (б) положения 31, 61, 62, 63, 64, 65 и 97 в CDR вариабельной области тяжелой цепи; (в) положения 1, 3, 7, 8, 9, 11, 12, 16, 17, 18, 20, 22, 37, 38, 39, 41, 42, 43, 45, 46, 49, 57, 60, 63, 65, 66, 68, 69, 70, 74, 76, 77, 79, 80, 81, 85, 100, 103, 105, 106, 107 и 108 в FR вариабельной области легкой цепи; и (г) положения 24, 25, 26, 27, 52, 53, 54, 55 и 56 в CDR вариабельной области легкой цепи, согласно нумерации Кэбота; или
(II) в положении в константной области, выбранном из группы, состоящей из положения 196, 253, 254, 256, 258, 278, 280, 281, 282, 285, 286, 307, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 373, 382, 384, 385, 386, 387, 389, 399, 400, 401, 402, 413, 415, 418, 419, 421, 424, 430, 433, 434 и 443, согласно EU-нумерации;
(б) модификацию антигенсвязывающего домена таким образом, чтобы полученная антигенсвязывающая активность изменялась в зависимости от условий концентрации ионов, в котором стадии, указанные в подпунктах (а) и (б), можно осуществлять одновременно или последовательно;
(в) культивирование клетки-хозяина для экспрессии нуклеиновой кислоты, кодирующей модифицированное антитело; и
(г) сбор модифицированного антитела из культуры клетки-хозяина.
В других вариантах осуществления изобретения способ необязательно дополнительно содержит одну или несколько следующих стадий:
(д) отбор антитела, которое может усиливать элиминацию антигена из плазмы;
(е) отбор антитела с повышенной активностью связывания с внеклеточным матриксом;
(ж) отбор антитела с повышенной FcγR-связывающей активностью в условиях нейтрального pH (например, pH 7,4);
(з) отбор антитела с повышенной FcγRIIb-связывающей активностью в условиях нейтрального pH (например, pH 7,4);
(и) отбор антитела с сохраненной или повышенной FcγRIIb-связывающей активностью и пониженной связывающей активностью в отношении одного или нескольких активирующих FcγR, предпочтительно выбранных из группы, состоящей из FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, FcγRIIIb и FcγRIIa;
(к) отбор антитела с повышенной FcRn-связывающей активностью в условиях нейтрального pH (например, pH 7,4);
(л) отбор антитела с повышенной изоэлектрической точкой (pI);
(м) подтверждение изоэлектрической точки (pI) у собранного антитела и последующий отбор антитела с повышенной изоэлектрической точкой (pI); и
(н) отбор антитела, антигенсвязывающая активность которого изменяется или повышается в зависимости от условий концентрации ионов;
по сравнению с антителом до модификации.
Другим вариантом осуществления изобретения, указанным в разделе А описания, является (но не ограничиваясь только ими):
[Г1] способ получения модифицированного антитела с пролонгированным или уменьшенным временем полужизни в плазме по сравнению со временем полужизни до модификации антитела, где способ включает:
(а) модификацию нуклеиновой кислоты, кодирующей антитело до модификации, с целью изменения заряда по меньшей мере одного аминокислотного остатка в положении, выбранном из группы, состоящей из положения 196, 253, 254, 256, 258, 278, 280, 281, 282, 285, 286, 307, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 373, 382, 384, 385, 386, 387, 389, 399, 400, 401, 402, 413, 415, 418, 419, 421, 424, 430, 433, 434 и 443, согласно EU-нумерации;
(б) культивирование клетки-хозяина для экспрессии нуклеиновой кислоты; и
(в) сбор антитела из культуры клеток-хозяев; или
[Г2] способ пролонгирования или уменьшения времени полужизни антитела в плазме, где способ включает модификацию по меньшей мере одного аминокислотного остатка в положении, выбранном из группы, состоящей из положения 196, 253, 254, 256, 258, 278, 280, 281, 282, 285, 286, 307, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 373, 382, 384, 385, 386, 387, 389, 399, 400, 401, 402, 413, 415, 418, 419, 421, 424, 430, 433, 434 и 443, согласно EU-нумерации.
Одним из вариантов осуществления изобретения, указанных в разделе Б описания, является, например (но не ограничиваясь только ими):
[33] вариант Fc-области, содержащий FcRn-связывающий домен, где FcRn-связывающий домен содержит Ala в положении 434; Glu, Arg, Ser или Lys в положении 438; и Glu, Asp или Gln в положении 440 согласно EU-нумерации;
[34] вариант Fc-области по п. [33], где FcRn-связывающий домен содержит Ala в положении 434; Arg или Lys в положении 438; и Glu или Asp в положении 440 согласно EU-нумерации;
[35] вариант Fc-области по п. [33] или п. [34] где FcRn-связывающий домен содержит Ile или Leu в положении 428; и/или Ile, Leu, Val, Thr или Phe в положении 436 согласно EU-нумерации;
[36] вариант Fc-области по п. [35], где FcRn-связывающий домен содержит Leu в положении 428; и/или Val или Thr в положении 436 согласно EU-нумерации;
[37] вариант Fc-области по одному из п.п. [33]-[36], где FcRn-связывающий домен содержит комбинацию аминокислотных замен, выбранную из группы, состоящей из: N434A/Q438R/S440E; N434A/Q438R/S440D; N434A/Q438K/S440E; N434A/Q438K/S440D; N434A/Y436T/Q438R/S440E; N434A/Y436T/Q438R/S440D; N434A/Y436T/Q438K/S440E; N434A/Y436T/Q438K/S440D; N434A/Y436V/Q438R/ S440E; N434A/Y436V/Q438R/S440D; N434A/Y436V/Q438K/S440E; N434A/Y436V/Q438K/S440D; N434A/R435H/F436T/Q438R/S440E; N434A/R435H/F436T/Q438R/S440D; N434A/R435H/F436T/Q438K/S440E; N434A/R435H/F436T/Q438K/S440D; N434A/R435H/F436V/Q438R/S440E; N434A/R435H/F436V/Q438R/S440D; N434A/R435H/F436V/Q438K/S440E; N434A/R435H/F436V/Q438K/S440D; M428L/N434A/Q438R/S440E; M428L/N434A/Q438R/S440D; M428L/N434A/Q438K/S440E; M428L/N434A/Q438K/S440D; M428L/N434A/Y436T/Q438R/S440E; M428L/N434A/Y436T/Q438R/S440D; M428L/N434A/Y436T/Q438K/S440E; M428L/N434A/Y436T/Q438K/S440D; M428L/N434A/Y436V/Q438R/S440E; M428L/N434A/Y436V/Q438R/S440D; M428L/N434A/Y436V/Q438K/S440E; M428L/N434A/Y436V/Q438K/S440D; L235R/G236R/S239K/M428L/N434A/Y436T/Q438R/S440EH L235R/G236R/A327G/A330S/P331S/M428L/N434A/Y436T/Q438R/S440E, согласно EU-нумерации;
[38] вариант Fc-области по п. [37], где FcRn-связывающий домен содержит комбинацию аминокислотных замен, выбранную из группы, состоящей из:
N434A/Q438R/S440E; N434A/Y436T/Q438R/S440E; N434A/Y436V/Q438R/S440E; M428L/N434A/Q438R/S440E; M428L/N434A/Y436T/Q438R/S440E; M428L/N434A/Y436V/Q438R/S440E; L235R/G236R/S239K/M428L/N434A/Y436T/Q438R/S440E и L235R/G236R/A327G/A330S/P331S/M428L/N434A/Y436T/Q438R/S440E, согласно EU-нумерации;
[39] вариант Fc-области по одному из п.п. [33]-[38], FcRn-связывающая активность которого в условиях кислого pH (например, pH 5,8) повышена по сравнению с активностью Fc-области нативного IgG;
[40] вариант Fc-области по одному из п.п. [33]-[39], связывающая активность которого в отношении антитела к лекарственному среду (ADA) не существенно повышается в условиях нейтрального pH по сравнению с активностью Fc-области нативного IgG;
[41] вариант Fc-области по п. [40], где антитело к лекарственному средству (ADA) представляет собой ревматоидный фактор (RF);
[42] вариант Fc-области по одному из п.п. [33]-[41], у которого плазменный клиренс (CL) снижен, время удерживания в плазме увеличено или время полужизни в плазме (t1/2) увеличено по сравнению с параметрами Fc-области нативного IgG;
[43] вариант Fc-области по одному из п.п. [33]-[42], у которого время удерживания в плазме увеличено по сравнению с референс-вариантом Fc-области, содержащим комбинацию аминокислотных замен N434Y/Y436V/Q438R/S440E согласно EU-нумерации;
[44] антитело, содержащее вариант Fc-области по одному из п.п. [33]-[43];
[45] антитело по п. [44], где антитело представляет собой антитело IgG-типа;
[46] фармацевтическая композиция, содержащая антитело по п. [44] или п. [45];
[47] фармацевтическая композиция по п. [46], предназначенная для увеличения времени удерживания антитела в плазме;
[48] нуклеиновая кислота, кодирующая вариант Fc-области по одному из п.п. [33]-[43] или антитело по п. [44] или п. [45];
[49] вектор, содержащий нуклеиновую кислоту по п. [48];
[50] клетка-хозяин, содержащая вектор по п. [49];
[51] способ получения варианта Fc-области, содержащего FcRn-связывающий домен, или антитела, содержащего вариант, который включает культивирование клетки-хозяина по п. [50] и последующий сбор варианта Fc-области или антитела, содержащего вариант, из клеточной культуры;
[52] способ по п. [51], который дополнительно необязательно включает одну или несколько стадий, выбранных из группы, состоящей из следующих стадий:
(а) отбор варианта Fc-области с повышенной FcRn-связывающей активностью в условиях кислого pH по сравнению с активностью Fc-области нативного IgG;
(б) отбор варианта Fc-области, активность связывания которого в отношении антитела к лекарственному средству (ADA) не существенно повышена в условиях нейтрального pH по сравнению с активностью Fc-области нативного IgG;
(в) отбор варианта Fc-области с увеличенным временем удерживания в плазме по сравнению с временем удерживания Fc-области нативного IgG; и
(г) отбор антитела, содержащего вариант Fc-области, которое может усиливать элиминацию антигена из плазмы по сравнению с референс-антителом, содержащим Fc-область нативного IgG; и
[53] способ получения варианта Fc-области, содержащего FcRn-связывающий домен, или антитела, которое содержит вариант, где способ включает такую замену аминокислот, которая приводит к получению варианта Fc-области или антитела, содержащего вариант, который содержит Ala в положении 434; Glu, Arg, Ser или Lys в положении 438; и Glu, Asp или Gln в положении 440 согласно EU-нумерации.
Одним из вариантов осуществления изобретения, указанных в разделе Б описания, является, например (но не ограничиваясь только ими):
[Б1] применение варианта Fc-области по одному из п.п. [33]-[43] или антитела по п. [44] или п. [45] для приготовления лекарственного средства, предназначенного для увеличения времени удерживания в плазме;
[Б2] применение варианта Fc-области по одному из п.п. [33]-[43] или антитела по п. [44] или п. [45] для приготовления лекарственного средства, предназначенного для несущественного повышения активности связывания с антителом к лекарственному средству (ADA) в условиях нейтрального pH по сравнению с Fc-областью нативного IgG;
[Б3] применение варианта Fc-области по одному из п.п. [33]-[43] или антитела по п. [44] или п. [45] для увеличения времени удерживания в плазме;
[Б4] применение варианта Fc-области по одному из п.п. [33]-[43] или антитела по п. [44] или п. [45] для несущественного повышения активности связывания с антителом к лекарственному средству (ADA) в условиях нейтрального pH по сравнению с Fc-областью нативного IgG; и
[Б5] вариант Fc-области или антитело, содержащее вариант, полученный способом по одному из п.п. [51], [52] и [53].
Различными вариантами осуществления изобретения, указанными в разделе Б описания, являются комбинации одного или нескольких элементов, указанных выше в любом из п.п. [33]-[53] и [Б1]-[Б5], частично или полностью, если указанная комбинация не является технически невозможной согласно общепринятым техническим сведениям, известным в данной области. Например, некоторыми вариантами осуществления изобретения, указанными в разделе Б описания, является вариант Fc-области, содержащий FcRn-связывающий домен, где FcRn-связывающий домен может содержать:
(а) Ala в положении 434; Glu, Arg, Ser или Lys в положении 438; и Glu, Asp или Gln в положении 440 согласно EU-нумерации;
(б) Ala в положении 434; Arg или Lys в положении 438; и Glu или r Asp в положении 440 согласно EU-нумерации;
(в) Ile или Leu в положении 428; Ala в положении 434; Ile, Leu, Val, Thr или Phe в положении 436; Glu, Arg, Ser или Lys в положении 438; и Glu, Asp или Gln в положении 440 согласно EU-нумерации;
(г) Ile или Leu в положении 428; Ala в положении 434; Ile, Leu, Val, Thr или Phe в положении 436; Arg или Lys в положении 438; и Glu или Asp в положении 440 согласно EU-нумерации;
(д) Leu в положении 428; Ala в положении 434; Val или Thr в положении 436; Glu, Arg, Ser или Lys в положении 438; и Glu, Asp или Gln в положении 440 согласно EU-нумерации; или
(е) Leu в положении 428; Ala в положении 434; Val или Thr в положении 436; Arg или Lys в положении 438; и Glu или Asp в положении 440 согласно EU-нумерации.
Одним из вариантов осуществления изобретения, указанных в разделе В описания, является, например (но не ограничиваясь только ими):
[54] выделенное антитело к IL-8, связывающееся с человеческим IL-8, которое содержит по меньшей мере одну аминокислотную(ые) замену(ы) по меньшей мере в одном из участков, указанных ниже в подпунктах (а)-(е), и которое связывается с IL-8 pH-зависимым образом:
(а) HVR-H1, содержащий аминокислотную последовательность SEQ ID NO: 67;
(б) HVR-H2, содержащий аминокислотную последовательность SEQ ID NO: 68;
(в) HVR-H3, содержащий аминокислотную последовательность SEQ ID NO: 69;
(г) HVR-L1, содержащий аминокислотную последовательность SEQ ID NO: 70
(д) HVR-L2, содержащий аминокислотную последовательность SEQ ID NO: 71; и
(е) HVR-L3, содержащий аминокислотную последовательность SEQ ID NO: 72;
[55] антитело к IL-8 по п. [54], которое содержит аминокислотные замены тирозина в положении 9 аминокислотной последовательности SEQ ID NO: 68, аргинина в положении 11 аминокислотной последовательности SEQ ID NO: 68 и тирозина в положении 3 аминокислотной последовательности SEQ ID NO: 69;
[56] антитело к IL-8 по п. [54] или п. [55], которое дополнительно содержит аминокислотные замены аланина в положении 6 аминокислотной последовательности SEQ ID NO: 68 и глицина в положении 8 аминокислотной последовательности SEQ ID NO: 68;
[57] антитело к IL-8 по одному из п.п. [54]-[56], которое содержит аминокислотные замены аспарагина в положении 1 аминокислотной последовательности SEQ ID NO: 71, лейцина в положении 5 аминокислотной последовательности SEQ ID NO: 71 и глутамина в положении 1 аминокислотной последовательности SEQ ID NO: 72;
[58] антитело к IL-8 по одному из п.п. [54]-[57], которое содержит (a) HVR-Н1, содержащий аминокислотную последовательность SEQ ID NO: 67, (б) HVR-Н2, содержащий аминокислотную последовательность SEQ ID NO: 73 и (в) HVR-Н3, содержащий аминокислотную последовательность SEQ ID NO: 74;
[59] антитело к IL-8 по одному из п.п. [54]-[58], которое содержит (a) HVR-L1, содержащий аминокислотную последовательность SEQ ID NO: 70, (б) HVR-L2, содержащий аминокислотную последовательность SEQ ID NO: 75 и (в) HVR-L3, содержащий аминокислотную последовательность SEQ ID NO: 76;
[60] антитело к IL-8 по одному из п.п. [54]-[59], которое содержит вариабельную область тяжелой цепи, имеющую SEQ ID NO: 78, и вариабельную область легкой цепи, имеющую SEQ ID NO: 79;
[61] антитело к IL-8 по одному из п.п. [54]-[60], которое содержит Fc-область, обладающую по меньшим мере одним свойством, выбранным из свойств, указанных ниже в подпунктах (а)-(е):
(а) повышенная аффинность связывания Fc-области с FcRn по сравнению с аффинностью связывания с FcRn нативной Fc-области при кислом pH;
(б) пониженная аффинность связывания Fc-области с ранее присутствующим ADA по сравнению с аффинностью связывания нативной Fc с ранее присутствующим ADA;
(в) удлиненное время полужизни в плазме Fc-области по сравнению с временем полужизни в плазме нативной Fc-области;
(г) пониженный плазменный клиренс Fc-области по сравнению с плазменным клиренсом нативной Fc-области; и
(д) пониженная аффинность связывания Fc-области с эффекторным рецептором по сравнении с аффинностью связывания нативной Fc-области с эффекторным рецептором; и
(е) увеличенное связывание с внеклеточным матриксом.
[62] антитело к IL-8 по п. [61], в котором Fc-область содержит аминокислотную(ые) замену(ы) в одном или нескольких положениях, выбранных из группы, состоящей из положения 235, 236, 239, 327, 330, 331, 428, 434, 436, 438 и 440, согласно EU-нумерации;
[63] антитело к IL-8 по п. [62], в котором Fc-область содержит одну или несколько аминокислотную(ых) замену(н), выбранных из группы, состоящей из L235R, G236R, S239K, A327G, A330S, P331S, M428L, N434A, Y436T, Q438R и S440E;
[64] антитело к IL-8 по п. [63], в котором Fc-область содержит аминокислотные замены L235R, G236R, S239K, M428L, N434A, Y436T, Q438R и S440E;
[65] антитело к IL-8 по п. [63], в котором Fc-область содержит аминокислотные замены L235R, G236R, A327G, A330S, P331S, M428L, N434A, Y436T, Q438R и S440E;
[66] антитело к IL-8, которое содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 81, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 82;
[67] антитело к IL-8, которое содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 80, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 82;
[68] выделенная нуклеиновая кислота, кодирующая антитело к IL-8 по одному из п.п. [54]-[67];
[69] вектор, содержащий нуклеиновую кислоту по п. [68];
[70] клетка-хозяин, содержащая вектор по п. [69];
[71] способ получения антитела к IL-8, который включает культивирование хозяина по п. [70];
[72] способ получения антитела к IL-8 по п. [71], который включает выделение антитела из супернатанта культуры;
[73] фармацевтическая композиция, содержащая антитело к IL-8 по одному из п.п. [54]-[67] и фармацевтически приемлемый носитель;
[74] антитело к IL-8 по одному из п.п. [54]-[67], предназначенное для применения в фармацевтической композиции;
[75] антитело к IL-8 по одному из п.п. [54]-[67], предназначенное для применения для лечения нарушения, характеризующегося избытком IL-8;
[76] применение антитела к IL-8 по одному из п.п. [54]-[67] для приготовления фармацевтической композиции, предназначенной для лечения нарушения, характеризующегося избытком IL-8;
[77] способ лечения пациента, который имеет нарушение, характеризующееся избытком IL-8, включающий введение индивидууму антитела к IL-8 по одному из п.п. [54]-[67];
[78] способ усиления элиминации IL-8 из организма индивидуума, включающий введение индивидууму антитела к IL-8 по одному из п.п. [54]-[67];
[79] фармацевтическая композиция, содержащая антитело по одному из п.п. [54]-[67], где антитело связывается с IL-8 и связывается с внеклеточным матриксом; и
[80] способ получения антитела к IL-8, которое содержит вариабельную область с pH-зависимой активностью связывания с IL-8, где способ включает:
(а) оценку связывания антитела к IL-8 с внеклеточным матриксом,
(б) отбор антитела к IL-8 с сильной способностью связываться с внеклеточным матриксом,
(в) культивирование хозяина, который содержит вектор, содержащий нуклеиновую кислоту, которая кодирует антитело и
(г) выделение антитела из культурального раствора.
Альтернативным вариантом осуществления изобретения, указанным в разделе В описания, является:
[В1] применение антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31] для приготовления фармацевтической композиции, предназначенной для подавления накопления IL-8, который обладает биологической активностью;
[В2] применение антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31] для подавления накопления IL-8, который обладает биологической активностью;
[В3] применение антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31] для приготовления фармацевтической композиции, предназначенной для ингибирования ангиогенеза;
[В4] применение антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31] для ингибирования ангиогенеза;
[В5] применение антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31] для приготовления фармацевтической композиции, предназначенной для ингибирования облегчения миграции нейтрофилов;
[В6] применение антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31] для ингибирования облегчения миграции нейтрофилов;
[В7] антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31], предназначенное для применения для подавления накопления IL-8, который обладает биологической активностью;
[В8] способ подавления накопления IL-8, который обладает биологической активностью, где способ включает введение индивидууму антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31];
[В9] фармацевтическая композиция, предназначенная для подавления накопления IL-8, который обладает биологической активностью, содержащая антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31];
[В10] антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31], предназначенное для применения для ингибирования ангиогенеза;
[В11] способ ингибирования ангиогенеза у индивидуума, где способ включает введение индивидууму антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31];
[В12] фармацевтическая композиция, предназначенная для ингибирования ангиогенеза, содержащая антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31];
[В13] антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31], предназначенное для применения для ингибирования облегчения миграции нейтрофилов;
[В14] способ ингибирования облегчения миграции нейтрофилов у индивидуума, где способ включает введение индивидууму антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31];
[В15] фармацевтическая композиция, предназначенная для ингибирования облегчения миграции нейтрофилов, содержащая антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31];
[В16] антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31], предназначенное для применения для лечения нарушения, характеризующегося избытком IL-8;
[В17] применение антитела по одному из п.п. [54]-[67] и [В26]-[В31] для приготовления фармацевтической композиции, предназначенной для лечения нарушения, характеризующегося избытком IL-8;
[В18] применение антитела по одному из п.п. [54]-[67] и [В26]-[В31] для лечения нарушения, характеризующегося избытком IL-8;
[В19] способ лечения нарушения, характеризующегося избытком IL-8, где способ включает введение индивидууму антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31];
[В20] фармацевтическая композиция, предназначенная для лечения нарушения, характеризующегося избытком IL-8, которая содержит антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31];
[В21] антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31], предназначенное для применения для усиления элиминации IL-8;
[В22] применение антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31] для приготовления фармацевтической композиции, предназначенной для усиления элиминации IL-8;
[В23] применение антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31] для усиления элиминации IL-8;
[В24] способ усиления элиминации IL-8 у индивидуума, где способ включает введение индивидууму антитела к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31]; и
[В25] фармацевтическая композиция, предназначенная для усиления элиминации IL-8, которая содержит антитело к IL-8 по одному из п.п. [54]-[67] и [В26]-[В31].
[В26] Антитело к IL-8, в котором Fc-область содержит аминокислотную(ые) замену(ы) в одном или нескольких положениях, выбранных из группы, состоящей из положения 235, 236, 239, 327, 330, 331, 428, 434, 436, 438 и 440, согласно EU-нумерации.
[В27] Антитело к IL-8 по п. [В26], которое содержит Fc-область, обладающую по меньшим мере одним свойством, выбранным из свойств, указанных ниже в подпунктах (а)-(е):
(а) повышенная аффинность связывания Fc-области с FcRn по сравнению с аффинностью связывания с FcRn нативной Fc-области при кислом pH;
(б) пониженная аффинность связывания Fc-области с ранее присутствующим ADA по сравнению с аффинностью связывания нативной Fc с ранее присутствующим ADA;
(в) удлиненное время полужизни в плазме Fc-области по сравнению с временем полужизни в плазме нативной Fc-области;
(г) пониженный плазменный клиренс Fc-области по сравнению с плазменным клиренсом нативной Fc-области; и
(д) пониженная аффинность связывания Fc-области с эффекторным рецептором по сравнении с аффинностью связывания нативной Fc-области с эффекторным рецептором; и
(е) увеличенное связывание с внеклеточным матриксом.
[В28] Антитело к IL-8 по п. [В26] или п. [В27], содержащее Fc-область, которая содержит одну или несколько аминокислотную(ых) замену(замен), выбранную(ых) из группы, состоящей из L235R, G236R, S239K, A327G, A330S, P331S, M428L, N434A, Y436T, Q438R и S440E, согласно EU-нумерации.
[В29] Антитело к IL-8 по п. [С28], содержащее Fc-область, которая содержит одну или несколько аминокислотную(ых) замену(н), выбранную(ых) из группы, состоящей из (a) L235R, G236R, S239K, M428L, N434A, Y436T, Q438R и S440E; или (б) L235R, G236R, A327G, A330S, P331S, M428L, N434A, Y436T, Q438R и S440E, согласно EU-нумерации.
[В30] Антитело к IL-8 по п. [В26], которое содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 81, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 82.
[В31] Антитело к IL-8 по п. [В26], которое содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 80, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 82.
[В32] Выделенная нуклеиновая кислота, кодирующая антитело к IL-8 по одному из п.п. [В26]-[В31].
[В33] Вектор, содержащий нуклеиновую кислоту по п. [В32].
[В34] Клетка-хозяин, содержащая вектор по п. [В33].
[В35] Способ получения антитела к IL-8, который включает культивирование клетки-хозяина по п. [В34].
[В36] Способ получения антитела к IL-8 по одному из п.п. [В26]-[В31], который включает выделение антитела из супернатанта клеточной культуры;
[В37] Фармацевтическая композиция, содержащая антитело к IL-8 по одному из п.п. [В26]-[В31] и фармацевтически приемлемый носитель.
[В38] Способ лечения пациента, который имеет нарушение, характеризующееся избытком IL-8, включающий введение индивидууму антитела к IL-8 по одному из п.п. [В26]-[В31].
[В39] Способ усиления элиминации IL-8 из организма индивидуума, включающий введение индивидууму антитела к IL-8 по одному из п.п. [В26]-[В31].
[В40] Способ ингибирования IL-8, где способ включает приведение в контакт антитела к IL 8 по одному из п.п. [54]-[67] и [В26]-[В31] с IL-8.
[В41] Способ по п. [В40], в котором способ приводит к ингибированию биологической активности IL-8.
Различными вариантами осуществления изобретения, указанными в разделе В описания, являются комбинации одного или нескольких элементов, указанных выше в любом из п.п. [54]-[80] и [В1]-[В41], частично или полностью, если указанная комбинация не является технически невозможной согласно общепринятым техническим сведениям, известным в данной области.
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - изменения концентрации в плазме человеческого IL-6-рецептора у трансгенных по человеческому FcRn мышей, который вводили со связывающим человеческий IL-6-рецептор антителом, которое связывается с человеческим IL-6-рецептором pH-зависимым образом, и константная область которого представляет собой область нативного IgG1 (Low_pI-IgG1), или с антителом с повышенной pI вариабельной области антитела (High_pI-IgG1);
на фиг. 2 - изменения концентрации в плазме человеческого IL-6-рецептора у трансгенных по человеческому FcRn мышей, который вводили индивидуально со связывающим человеческий IL-6-рецептор антителом, которое связывается с человеческим IL-6-рецептором pH-зависимым образом, и у которого подтверждена способность связываться с FcRn в условиях нейтрального pH (Low_pI-F939), и с антителами с повышенной pI вариабельной области антитела (Middle_pI-F939, High_pI-F939);
на фиг. 3 - изменения концентрации в плазме человеческого IL-6-рецептора у трансгенных по человеческому FcRn мышей, который вводили индивидуально со связывающим человеческий IL-6-рецептор антителом, которое связывается с человеческим IL-6-рецептором pH-зависимым образом и у которого FcγR-связывающая активность повышена в условиях нейтрального pH (Low_pI-F1180), и с антителами с повышенной pI вариабельной области антитела (Middle_pI-F1180, High_pI-F1180);
на фиг. 4 - изменения концентрации в плазме человеческого IL-6-рецептора у трансгенных по человеческому FcRn мышей, у которых концентрация в плазме человеческого IL-6-рецептора поддерживается в стабильной состоянии, который вводили индивидуально со связывающим человеческий IL-6-рецептор антителом, которое связывается с человеческим IL-6-рецептором pH-зависимым образом, и у которого константная область представляет собой область нативного IgG1 (Low_pI-IgG1), антителом, которое содержит вариант Fc-области, у которого Fc-область антитела обладает повышенной FcRn-связывающей активностью в условиях нейтрального pH (Low_pI-F11), и с антителами с повышенной pI вариабельной области этих антител (High_pI-IgG1, High_pI-F11);
на фиг. 5 - уровень связывания внеклеточного матрикса каждого из трех типов антител с различными pI, которые связываются с человеческим IL-6-рецептором pH-зависимым образом (Low_pI-IgG1, Middle_pI-IgG1 и Highpl-IgG1), и двух типов антител с различными pI, которые не связываются с человеческим IL-6-рецептором pH-зависимым образом (Low_pI(NPH)-IgG1 и High_pI(NPH)-IgG1). «NPH» в контексте указанного описания А обозначает «не зависит от pH»;
на фиг. 6 - относительные величины уровня связывания человеческого FcγRIIb (по данным BIACORE®) антител, которые содержат вариант Fc-области, у каждого из которых pI повышена путем модификации аминокислотного остатка в константной области антитела Ab1H-P600, которое связывается с IgE pH-зависимым образом, при принятии величины для Ab1H-P600 за 1,00;
на фиг. 7 - относительные величины скорости, с которой антитела, содержащие вариант Fc-области, у каждого из которых pI повышена путем модификации аминокислотного остатка в константной области Ab1H-P600, поглощаются клетками экспрессирующей hFcγRIIb клеточной линии, при оценке, согласно которой величина для Ab1H-P600 принята за 1,00;
на фиг. 8 - уровень связывания Fv4-IgG1, имеющего Fc-область нативного человеческого IgG1, с ревматоидным фактором в сыворотке каждого из страдающих ревматоидным артритом (RA) пациентов;
на фиг. 9 - уровень связывания Fv4-YTE, имеющего вариант Fc-области с повышенной FcRn-связывающей активностью, с ревматоидным фактором в сыворотке каждого из RA-пациентов;
на фиг. 10 - уровень связывания Fv4-LS, имеющего вариант Fc-области с повышенной FcRn-связывающей активностью, с ревматоидным фактором в сыворотке каждого из RA-пациентов;
на фиг. 11 - уровень связывания Fv4-N434H, имеющего вариант Fc-области с повышенной FcRn-связывающей активностью, с ревматоидным фактором в сыворотке каждого из RA-пациентов;
на фиг. 12 - уровень связывания Fv4-F1847m, имеющего вариант Fc-области с повышенной FcRn-связывающей активностью, с ревматоидным фактором в сыворотке каждого из RA-пациентов;
на фиг. 13 - уровень связывания Fv4-F1848m, имеющего вариант Fc-области с повышенной FcRn-связывающей активностью, с ревматоидным фактором в сыворотке каждого из RA-пациентов;
на фиг. 14 - уровень связывания Fv4-F1888m имеющего вариант Fc-области с повышенной FcRn-связывающей активностью, с ревматоидным фактором в сыворотке каждого из RA-пациентов;
на фиг. 15 - уровень связывания Fv4-F1889m имеющего вариант Fc-области с повышенной FcRn-связывающей активностью, с ревматоидным фактором в сыворотке каждого из RA-пациентов;
на фиг. 16 - уровень связывания Fv4-F1927m имеющего вариант Fc-области с повышенной FcRn-связывающей активностью, с ревматоидным фактором в сыворотке каждого из RA-пациентов;
на фиг. 17 - уровень связывания Fv4-F1168m имеющего вариант Fc-области с повышенной FcRn-связывающей активностью, с ревматоидным фактором в сыворотке каждого из RA-пациентов;
на фиг. 18 - средние показатели связывания Fv4-IgG1, который имеет Fc-область нативного человеческого IgG1, и каждого из антител, содержащих новый вариант Fc-области, у которого Fc-область представляет собой вариант Fc-области с повышенной связывающей активностью в отношении каждого FcRn, с ревматоидным фактором в сыворотке RA-пациентов;
на фиг. 19 - изменения концентрации в плазме обезьян циномолгус каждого антитела к человеческому IgE при введении с OHB-IgG1, который представляет собой антитело к человеческому IgE и имеет Fc-область нативного человеческого IgG1, и с каждым из антител, содержащих новый вариант Fc-области, у которых каждая Fc-область представляет собой вариант Fc-области с повышенной связывающей активностью в отношении FcRn (OHB-LS, ОНВ-N434A, OHB-F1847m, OHB-F1848m, OHB-F1886m, OHB-F1889m и OHB-F1927m);
на фиг. 20 - изменения концентрации в плазме антитела к человеческому IL-6-рецептору у трансгенных по человеческому FcRn мышей при введении с Fv4-IgG1, который представляет собой антитело к человеческому IL-6-рецептору и имеет Fc-область нативного человеческого IgG1, или с Fv4-F1718, представляющим собой антитело с повышенной FcRn-связывающей активностью в условиях кислого рН;
на фиг. 21 - сенсограммы, характеризующие связывание с IL-8 H998/L63 и Hr9 при рН 7,4 и рН 5,8, полученные с помощью Biacore-анализа;
на фиг. 22 - изменения концентрации человеческого IL-8 в плазме мышей при введении H998/L63 или H89/L118 мышам в дозе 2 мг/кг в смеси с человеческим IL-8;
на фиг. 23 - изменения концентрации человеческого IL-8 в плазме мышей при введении H89/L118 мышам в дозе 2 мг/кг или 8 мг/кг в смеси с человеческим IL-8;
на фиг. 24 - изменения концентрации человеческого IL-8 в плазме мышей при введении H89/L118 или H553/L118 мышам в дозе 2 мг/кг или 8 мг/кг в смеси с человеческим IL-8;
на фиг. 25А - изменения относительных показателей зависящей от концентрации антитела хемилюминисценции в плазме при использовании антитела Hr9, H89/L118 или H553/L118 перед консервацией;
на фиг. 25Б - изменения относительных показателей зависящей от концентрации антитела хемилюминисценции в плазме при использовании антитела Hr9, H89/L118 или H553/L118 после консервации в течение 1 недели;
на фиг. 25B - изменения относительных показателей зависящей от концентрации антитела хемилюминисценции в плазме при использовании антитела Hr9, H89/L118 или H553/L118 после консервации в течение 2 недель;
на фиг. 26 - прогнозируемая частота встречаемости ADA для каждого из антител к IL-8 (hWS4, Hr9, H89/L118, H496/L118 или H553/L118) и прогнозируемая частота встречаемости ADA для других ранее присутствующих терапевтических антител, оцененная с использованием EpiMatrix;
на фиг. 27 - прогнозируемая частота встречаемости ADA для каждого из антител к IL-8 (H496/L118, H496v1/L118, H496v2/L118, H496v3/L118, H1004/L118 или H1004/L395) и прогнозируемая частота встречаемости ADA для других ранее присутствующих терапевтических антител, оцененная с использованием EpiMatrix;
на фиг. 28А - изменения относительных показателей зависящей от концентрации антитела хемилюминисценции в плазме при использовании антитела Hr9, H89/L118 или H1009/L395-F1886s перед консервацией;
на фиг. 28Б - изменения относительных показателей зависящей от концентрации антитела хемилюминисценции в плазме при использовании антитела Hr9, H89/L118 или H1009/L395-F1886s после консервации в течение 1 недели;
на фиг. 28B - изменения относительных показателей зависящей от концентрации антитела хемилюминисценции в плазме при использовании антитела Hr9, H89/L118 или H1009/L395-F1886s после консервации в течение 2 недель;
на фиг. 29 - изменения концентрации человеческого IL-8 в плазме мышей при введении мышам каждого из H1009/L395, H553/L118 и H998/L63 в смеси с человеческим IL-8;
на фиг. 30 - уровень связывания с внеклеточным матриксом при добавлении Hr9, H89/L118 или H1009/L395 к клеточному матриксу индивидуально или в смеси с человеческим IL-8;
на фиг. 31 - изменения концентрации антитела в плазме мышей при введении антитела, имеющего вариабельную область H1009/L395 и Fc-область, которая не связывается с FcRn (F1942m), при введении индивидуально или в смеси с человеческим IL-8 трансгенным по человеческому FcRn мышам;
на фиг. 32 - прогнозируемая частота встречаемости ADA для H1009/L395 и H1004/L395 и прогнозируемая частота встречаемости ADA для других ранее присутствующих терапевтических антител, оцененная с использованием EpiMatrix;
на фиг. 33 - изменения в концентрации соответствующего антитела к человеческому IL-8 в плазме обезьян циномолгус при введении H89/L118-IgG1, имеющего вариабельную область H89/L118 и Fc-область нативного человеческого IgG1, и каждого антитела, которое имеет вариант Fc-области с повышенной FcRn-связывающей активностью (H89/L118-F1168m, H89/L118-F1847m, H89/L118-F1848m, H89/L118-F1886m, H89/L118-F1889m и H89/L118-F1927m);
на фиг. 34 - связывание антител, которые имеют вариабельную область H1009/L395 и Fc-область которых представляет собой вариант (F1886m, F1886s или F1974m), с каждым из FcγR;
на фиг. 35 - изменения концентрации человеческого IL-8 в плазме мышей при введении антитела к IL-8 трансгенным по человеческому FcRn мышам в смеси с человеческим IL-8. В этом случае антитело к IL-8 представляло собой H1009/L395-IgG1 (2 мг/кг), которое содержит вариабельную область H1009/L395 и Fc-область нативного человеческого IgG1, или H1009/L395-F1886s (2, 5 или 10 мг/кг), которое содержит вариабельную область H1009/L395 и модифицированную Fc-область;
на фиг. 36 - изменения концентрации антитела в плазме обезьян циномолгус при введении Hr9-IgG1 или H89/L118-IgG1, которые оба содержат Fc-область нативного человеческого IgG1 или H1009/L395-F1886s или H1009/L395-F1974m, которые оба содержат модифицированную Fc-область;
на фиг. 37 - временной профиль концентрации IgE в плазме при использовании некоторых антител к IgE у мышей линии C57BL6J в зависимости от модификации вариабельной области антитела;
на фиг. 38 (фиг. 38А-38Г) - сенсограммы, полученные с помощью устройства Octet, отобранных 25 [двадцати пяти] рН-зависимых и/или кальций-зависимых антигенсвязывающих клонов;
фиг. 38Б является продолжением фиг. 38А;
фиг. 38B является продолжением фиг. 38Б;
фиг. 38Г является продолжением фиг. 38B;
на фиг. 39 - временной профиль концентрации С5 в плазме при использовании некоторых биспецифических антител к С5 в мышах линии C57BL6J в зависимости от модификации вариабельной области антитела;
на фиг. 40 - временной профиль концентрации IgE в плазме при использовании некоторых антител к IgE у мышей линии C57BL6J в зависимости от модификации константной области антитела.
Описание вариантов осуществления изобретения
Подробное описание изобретения
Ниже представлены варианты осуществления изобретения, не ограничивающие его объем, указанные в разделах А, Б и В описания изобретения. Все варианты осуществления изобретения, которые описаны в приведенных ниже примерах, представлены с целью правильного понимания их описания, которое приведено также в разделе «Подробное описание изобретения», без ограничений, обусловленных практикой патентования, указами, регламентами или иными правилами, которые могли бы приводить к более узкой интерпретации представленного в примерах содержания в странах, в которых предполагается получать патентное право на основе настоящей заявки на патент.
Раздел А описания или раздел Б описания
Некоторыми из вариантов осуществления изобретения, указанных в разделе А описания, являются антитела, содержащие антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, у которых изоэлектрическая точка (pI) повышена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела (в контексте раздела А описания обозначены также как «зависящие от концентрации ионов антитела с повышенной pI»; а антигенсвязывающие домены антител обозначают также как «зависящие от концентрации ионов антигенсвязывающие домены с повышенной pI»). В основу изобретения положен неожиданно установленный при создании изобретения факт, что элиминацию антигена из плазмы можно облегчать с помощью зависящего от концентрации ионов антитела, изоэлектрическая точка (pI) которого была повышена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела (например, когда антитело вводят in vivo); и тот факт, что связывание антитела с внеклеточным матриксом можно повышать с помощью зависящего от концентрации ионов антитела с увеличенной (повышенной) pI. В основу изобретения, в частности, положен также неожиданно установленный при создании изобретения факт, что указанное благоприятное воздействие зависит от комбинации двух различных факторов: зависящего от концентрации ионов антигенсвязывающего домена или зависящего от концентрации ионов антитела; и антитела, у которого pI повышена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности (в контексте раздела А описания обозначено также как «антитело с повышенной pI»;) и антитела, у которого pI понижена (уменьшена) путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности (в контексте раздела А описания обозначенного как «антитело с пониженной pI»). Таким образом, изобретение относится к типу пионерского изобретения, которое может обеспечивать значительное технологическое усовершенствование в области техники (например, в области медицины), к которой относится раздел А описания.
Например, объектом изобретения является антитело, которое содержит антигенсвязывающий домен и pI которого повышена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела, которое можно дополнительно модифицировать так, чтобы антигенсвязывающая активность антигенсвязывающего домена изменялась в зависимости от условий концентрации ионов, которое также попадает под объем раздела А описании (в контексте раздела А описании указанное антитело обозначают также как «зависящее от концентрации ионов антитело с повышенной pI»).
Например, объектом изобретения является антитело, содержащее зависящий от концентрации ионов антигенсвязывающий домен, в котором по меньшей мере один аминокислотный остаток, который может экспонироваться на поверхности антитела, имеет заряд, отличный от заряда по меньшей мере одного аминокислотного остатка в соответствующей(их) положении(ях) в антителе до модификации (нативное антитело (например, нативное антитело в виде Ig, предпочтительно нативное антитело IgG-типа) или в референс-антителе или родительском антителе (например, антитело до модификации или антитело до или в процессе конструирования библиотеки или т.п.)), и общая pI антитела повышена, которое также подпадает под объем раздела А настоящего описания (такое антитело обозначают также как «зависящее от концентрации ионов антитело с повышенной pI» в контексте раздела А настоящего описания).
Например, объектом изобретения является антитело, содержащее зависящий от концентрации ионов антигенсвязывающий домен, pI которого повышена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела, перед модификацией (например, нативное антитело в виде Ig, предпочтительно нативное антитело IgG-типа) или в референс-антителе или родительском антителе (например, антитело до модификации или антитело до или в процессе конструирования библиотеки или т.п.)), которое также подпадает под объем раздела А настоящего описания (такое антитело обозначают также как «зависящее от концентрации ионов антитело с повышенной pI» в контексте раздела А настоящего описания).
Например, объектом изобретения является антитело, содержащее зависящий от концентрации ионов антигенсвязывающий домен, в котором по меньшей мере один аминокислотный остаток, который может экспонироваться на поверхности антитела, модифицирован с целью повышения pI антитела, которое также подпадает под объем раздела А настоящего описания (такое антитело обозначают также как «зависящее от концентрации ионов антитело с повышенной pI» в контексте раздела А настоящего описания).
В контексте разделов А и Б настоящего описания «аминокислоты» включают не только встречающиеся в естественных условиях аминокислоты, но также и не встречающиеся в естественных условиях аминокислоты. В контексте разделов А и Б настоящего описания аминокислоты или аминокислотные остатки можно обозначать с помощью либо однобуквенного (например, А), либо трехбуквенного кодов (например, Ala), либо их обоих (например, Ala(А)).
В контексте разделов А и Б настоящего описания под «модификацией аминокислоты», «модификацией аминокислотного остатка» или их эквивалентами подразумевается (но не ограничиваясь только ими) химическая модификация одного или большего количества (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10) конкретных аминокислот (остатков) в аминокислотной последовательности антитела внутри молекулы или добавление, делеция, замена или инсерция одного или большего количества (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10) аминокислот в аминокислотной последовательности антитела. Добавление, делецию, замену или инсерцию аминокислот можно осуществлять на уровне нуклеиновой кислоты, кодирующей аминокислотную последовательность, например, с помощью сайтнаправленного мутагенеза (Kunkel и др., Proc. Natl. Acad. Sci. USA 82, 1985, cc. 488-492) или с помощью ПЦР с удлинением перекрытий; посредством созревания аффинности антител или с использованием метода перестановки цепей для тяжелых или легких цепей антитела; или с помощью основанной на пэннинге селекции антигенов с использованием фаговых дисплейных библиотек (Smith и др., Methods Enzymol. 217, 1993, сс. 228-257); и их можно осуществлять индивидуально или в соответствующих комбинациях. Указанную аминокислотную модификацию осуществляют (но не ограничиваясь только этим) путем замены одного или нескольких аминокислотных остатков в аминокислотной последовательности антитела на другую аминокислоту (индивидуально). Добавление, делецию, замену или инсерцию аминокислоты и модификацию аминокислотной последовательности путем гуманизации или химеризации можно осуществлять методами, известными в данной области. Изменение или модификацию аминокислоты (остатка), такую как добавление, делеция, замена или инсерция аминокислоты, можно осуществлять также в вариабельной области антитела или в константной области антитела, которое можно применять для получения рекомбинантных антител в качестве антител, подпадающих под объем раздела А или Б описания.
В одном из вариантов осуществления изобретения, который подпадет под объем разделов А и Б настоящего описания, понятие «замена аминокислот (остатков)» относится к замене на другие аминокислоты (остатки) и ее можно создавать путем изменения характеристик, которые указаны ниже в подпунктах (а)-(в): (а) структура полипептидного каркаса в области складки или спиральной структуры; (б) электрический заряд или гидрофобность в сайте-мишени; или (в) размер боковой цепи.
Аминокислотные остатки классифицируют в следующие группы на основе общих свойств боковой цепи: (1) гидрофобные: норлейцин, Met, Ala, Val, Leu и He; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn и Gln; (3) кислотные: Asp и Glu; (4) оснóвные: His, Lys и Arg; (5) остатки, которые влияют на ориентацию цепи: Gly и Pro; и (6) ароматические: Trp, Tyr и Phe.
Замену аминокислотных остатков в каждой группе обозначают как консервативную замену, а замену аминокислотных остатков между группами обозначают как неконсервативная замена. Замена аминокислотных остатков может представлять собой консервативную замену, неконсервативную замену или их комбинацию. Можно применять приемлемые методы для замены аминокислот на аминокислоты, отличные от встречающихся в естественных условиях аминокислот (Wang и др., Annu. Rev. Biophys. Biomol. Struct. 35, 2006, cc. 225-249; Forster и др., Proc. Natl. Acad. Sci. USA 100(11), 2003, cc. 6353-6357). Можно применять, например, бесклеточную систему трансляции, содержащую тРНК, в которой не встречающаяся в естественных условиях аминокислота слита с супрессорной тРНК, подавляющей амбер-мутацию, комплементарной UAG-кодону (амбер-кодон), который представляет собой стоп-кодон (фирма Clover Direct (Protein Express)).
В контексте указанных разделов А и Б настоящего описания подразумевается, что структура «антигена» не ограничена конкретной структурой, если антиген включает эпитоп, который связывается с антителом. Антиген может представлять собой неорганическую или органическую субстанцию. Антигены могут представлять собой любые лиганды, включая различные цитокины, например интерлейкины, хемокины и факторы роста клеток. Альтернативно этому, объектом изобретения являются, например, рецепторы, которые присутствуют в растворимой форме или которые были модифицированы для приобретения растворимой формы в биологических жидкостях, таких как плазма, которые также можно применять в качестве антигенов. Примеры таких растворимых рецепторов включают (но не ограничиваясь только ими) растворимый IL-6-рецептор, описанный у Mullberg и др., J. Immunol. 152(10), 1994, cc. 4958-4968. Кроме того, антигены могут быть одновалентными (например, растворимый IL-6-рецептор) или многовалентными (например, IgE).
В одном из вариантов осуществления изобретения антигены, которые могут связываться антителом, указанным в разделах А и Б описания, предпочтительно представляют собой растворимые антигены, присутствующие в биологических жидкостях (например, биологических жидкостях, приведенных в качестве иллюстрации в WO 2013/125667, предпочтительно в плазме интерстициальной жидкости, лимфатической жидкости, асцитной жидкости или плевральной жидкости) индивидуумов (в контексте разделов А и Б настоящего описания индивидуумов, которым требуется вводить (которых требуется обрабатывать) антитело, которые фактически могут представлять собой любое животное, например, человека, мышей и т.д.); однако антигены могут представлять собой также мембранные антигены.
В контексте разделов А и Б настоящего описания «пролонгирование времени полужизни в плазме» или «укорочение времени полужизни в плазме» молекулы-мишени (которая может представлять собой антиген или антитело) или эквиваленты этих понятий можно также обозначать более конкретно, используя в дополнение с параметру «время полужизни в плазме» (t1/2) любой другой параметр, такой как среднее время удерживания в плазме, плазменный клиренс (CL) и площадь по кривой концентрация/время (AUC) (Pharmacokinetics: Enshuniyoru Rikai (Understanding through practice (понимание через практику)) Nanzando). Эти параметры можно специфически оценивать, например, осуществляя некомпартментальный анализ согласно протоколу, прилагаемому к программному обеспечению для анализа кинетики in vivo WinNonlin (фирма Pharsight). Обычным специалистам в данной области очевидно, что эти параметры, как правило, коррелируют друг с другом.
В контексте разделов А и Б настоящего описания понятие «эпитоп» относится к антигенной детерминанте в антигене и означает область на антигене с которой связывается антигенсвязывающий домен антитела. Так, эпитоп можно характеризовать, например, на основе его структуры. Альтернативно этому, эпитоп можно характеризовать по антигенсвязывающей активности антитела, которое распознает эпитоп. Когда антиген представляет собой пептид или полипептид, то эпитоп может характеризоваться аминокислотными остатками, которые образуют эпитоп. Альтернативно этому, эпитоп может представлять собой сахарную цепь, эпитоп можно характеризовать на основе специфической структуры сахарной цепи. Антигенсвязывающий домен, указанный в разделах А и Б описания, может связываться с одним эпитопом или с различными эпитопами на антигене.
Линейный эпитоп может представлять собой первичную аминокислотную последовательность. Такой линейный эпитоп, как правило, содержит по меньшей мере три и обычно по меньшей мере пять, например, 8-10 аминокислот или 6-20 аминокислот в качестве уникальной последовательности.
В конформационном эпитопе, как правило, аминокислоты, образующие эпитоп, не присутствуют в виде непрерывной первичной последовательности. Антитело может распознавать конформационный эпитоп в трехмерной структуре пептида или белка. Методы определения конформации эпитопа включают (но не ограничиваясь только ими) рентгеновскую кристаллографию, двумерный ядерный магнитный резонанс, сайтспецифическое спиновое мечение и электронный парамагнитый резонанс (Epitope Mapping Protocols в: Methods in Molecular Biology, под ред. Morris, т. 66, 1996).
В контексте разделов А и Б настоящего описания понятие «антитело» не ограничено конкретным антителом и применяется в его наиболее широком смысле, если оно обладает способностью связываться с антигеном мишени. Примерами антител являются (но не ограничиваясь только ими) хорошо известные канонические антитела (например, нативные иммуноглобулины (сокращенно обозначают «Ig»)) и молекулы и варианты, полученные из них, например, Fab, Fab', F(ab')2, димерные антитела (диабоди), ScFv (Holliger и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc. 6444-6448 (1993); ЕР 404,097; WO 93/11161; Peer и др., Nature Nanotechnology 2, 2007, cc. 751-760), низкомолекулярные антитела (минибоди) (Orita и др., Blood 105, 2005, cc. 562-566), скаффолд-белки, антитела с одним плечом (включая все варианты антител с одним плечом, описанные в WO 2005/063816), мультиспецифические антитела (например, биспецифические антитела: антитела, обладающие специфичностью в отношении двух различных эпитопов, включая антитела, которые распознают различные антигены и антитела, которые распознают различные эпитопы одного и того же антигена). В контексте разделов А и Б настоящего описания «биспецифические антитела» можно получать (но не ограничиваясь только ими), например, в виде молекул антител, которые имеют общую L-цепь, описанных в WO 2005/035756, или с помощью метода, описанного в WO 2008/119353, при осуществлении которого два общих типа антител, имеющих IgG4-подобные константные области, смешивают для обеспечения реакции обмена между двумя типами указанных антител (обычному специалисту в данной области метод известен как «обмен Fab-плечей»). В альтернативном варианте осуществления изобретения антитела могут иметь структуру, в которой вариабельная область тяжелой цепи и вариабельная область легкой цепи сцеплены друг с другом, образуя одну цепь (например, sc(Fv)2). Альтернативно этому, они могут представлять собой антитело подобные молекулы (например, scFv-Fc), полученные в результате сшивания Fc-области (константная область, в которой отсутствует СН1-домен) с scFv (или sc(Fv)2), при этом вариабельную область тяжелой цепи (VH) сшивают с вариабельной областью легкой цепи (VL). Мультиспецифические антитела, состоящие из scFv-Fc, имеют структуру (scFv)2-Fc, в которой первый и второй полипептиды представляют собой структуры VH1-линкер-VL1-Fc и VH2-линкер-VL2-Fc соответственно. Альтернативно этому, они могут представлять собой антитело подобные молекулы, в которых однодоменное антитело сшито с Fc-областью (Marvin и др., Curr. Opin. Drug Discov. Devel. 9(2), 2006, cc. 184-193), содержащие слитые с Fc белки (например, иммуноадгезин) (US 2013/0171138), их функциональные фрагменты, функционально эквивалентные им субстанции и их варианты, модифицированные сахарной цепью. В контексте настоящего описания понятие «нативный IgG (например, нативный IgG1)» относится к полипептидам, которые содержат такую же аминокислотную последовательность, что и встречающийся в естественных условиях IgG (например, нативный IgG1), и которые принадлежит к классу антител, кодируемых в основном геном иммуноглобулина гамма. Нативный IgG может содержать спонтанные мутации и т.п.
Как правило, если антитело имеет структуру, которая практически такая же или подобная структуре нативного IgG, то Y-образная структура четырех цепей (полипептиды двух тяжелых цепей и полипептиды двух легких цепей) может представлять собой базовую структуру. Как правило, тяжелая цепь и легкая цепь могут быть соединены друг с другом через дисульфидную связь (SS-связь) и образовывать гетеродимер. Указанные гетеродимеры могут быть соединены друг с другом через дисульфидную связь и образовывать Y-образный гетеротетрамер. Две тяжелые цепи или две легкие цепи могут быть идентичными или отличаться друг от друга.
Например, антитело IgG-типа можно расщеплять на две единицы Fab (область) и одну единицу Fc (область) путем расщепления папаином, который расщепляет шарнирную область (которую обозначают как «шарнир» в контексте разделов А и Б настоящего описания), в которой тяжелая цепь Fab-области связана с Fc-областью. Как правило, Fab-область содержит антигенсвязывающий домен. Поскольку фагоциты, такие как лейкоциты и макрофаги, имеют рецепторы, которые обладают способностью связываться с Fc-областью (Fc-рецепторы), они могут распознавать через Fc-рецепторы антитела, связанные с антигеном, и осуществлять их фагоцитоз (опсонизация). При этом, Fc-область участвует в опосредовании иммунных реакций, таких как ADCC или CDC и обладает эффекторной функцией, индуцируя реакцию после связывания антитела с антигенами. Известно, что эффекторная функция антитела варьируется в зависимости от типа иммуноглобулина (изотип). Fc-область IgG-класса может представлять собой область, простирающуюся, например, от цистеина в положении 226 или от пролина в положении 230 (EU-нумерация) до С-конца; однако Fc-область не ограничена указанными. Fc-область можно получать путем частичного расщепления моноклонального антитела в виде IgG1, IgG2, IgG3 или IgG4 или других антител протеазой, такой как пепсин, с последующей элюцией адсорбированных фракций из колонки с белком А или белком G.
В контексте разделов А и Б настоящего описания положения аминокислотных остатков в вариабельной области (CDR и/или FR) антитела обозначены согласно Кэботу, в то время как положения аминокислотных остатков в константной области или Fc-области обозначены согласно EU-нумерации, основанной на аминокислотных положениях по Кэботу (Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, Md., 1987 и 1991).
В контексте разделов А и Б настоящего описания понятие «библиотека» может относиться к молекулам (популяциям), таким как множество антител с вариабельностью последовательностей, в которых соответствующие последовательности могут быть одинаковыми или отличаться друг от друга; множество слитых полипептидов, содержащих антитела; или нуклеиновых кислот или полинуклеотидов, кодирующих указанные аминокислотные последовательности, что подробно описано в WO 2013/125667 (например, параграфах 0121-0125). Библиотека может содержать, например, по меньшей мере 104 молекул антител, более предпочтительно по меньшей мере 105 молекул антител, еще более предпочтительно по меньшей мере 106 молекул антител, наиболее предпочтительно по меньшей мере 10 или более молекул антител. Библиотека может представлять собой фаговые библиотеки. Фраза «прежде всего, состоит из» означает, что антитела, которые могут иметь различные антигенсвязывающие активности, составляют определенную часть из многочисленных независимых клонов с различными последовательности в библиотеке. В одном из вариантов осуществления изобретения иммунные библиотеки, которые сконструированы на основе генов антител, полученных из лимфоцитов животных, иммунизированных специфическим антигеном, пациентов, имеющих инфекцию, людей с повышенным титром антител в крови в результате вакцинации или пациентов, страдающих раком или аутоиммунным заболеванием, можно соответствующим образом применять в качестве библиотек рандомизированных вариабельных областей. В альтернативном варианте осуществления изобретения наивные библиотеки, содержащие наивные последовательности (последовательности антител без отклонения в спектре антител), которые конструируют из генов антител, полученных из лимфоцитов здоровых особей, можно также соответствующим образом применять в качестве библиотек рандомизированных вариабельных областей (Gejima и др., Human Antibodies 11, 2002, сс. 121-129); Cardoso и др., Scand. J. Immunol. 51, 2000, сс. 337-344). Аминокислотные последовательности, содержащие наивные последовательности, могут представлять собой последовательности, полученные из указанных наивных библиотек. В альтернативном варианте осуществления изобретения синтетические библиотеки, в которых последовательность CDR из V-гена геномной ДНК или реконструированного функционального V-гена заменена набором синтетических олигонуклеотидов, содержащих последовательность, которая кодирует набор кодонов соответствующей длины, можно также соответствующим образом применять в качестве библиотек рандомизированных вариабельных областей. В этом случае можно также заменять только последовательность CDR3 тяжелой цепи, поскольку вариации последовательностей обнаружены в гене CDR3. Стандартный путь получения разнообразия аминокислот в вариабельной области антитела можно применять для повышения вариаций аминокислотных остатков в положениях, которые могут экспонироваться на поверхности антитела.
В одном из вариантов осуществления изобретения, в котором антитела, указанные в разделе А или Б описания, имеют, например, структуру, практически такую же или подобную структуре нативных антител в виде Ig, они, как правило имеют вариабельные области («V-области») [вариабельная область тяжелой цепи («VH-область») и вариабельная область легкой цепи («VL-область»)] и константные области («С-области»)[«константная область тяжелой цепи («СН-область») и константная область легкой цепи («CL-область»)]. СН-область дополнительна разделяется на три участка: СН1-CH3. Как правило, Fab-область тяжелой цепи содержит VH-область и СН1, а, как правило, Fc-область тяжелой цепи содержит СН2 и CH3. Как правило, шарнирная область локализована между СН1 и СН2. Кроме того, вариабельная область, как правило, содержит гипервариабельные участки («CDR») и каркасные участки («FR»). Как правило, VH-область и VL-область каждая содержит три CDR (CDR1, CDR2 и CDR3) и четыре FR (FR1, FR2, FR3 и FR4). Как правило, шесть CDR в вариабельных областях тяжелой цепи и легкой цепи взаимодействуют и образуют антигенсвязывающий домен антитела. С другой стороны, если присутствует только один CDR, хотя его аффинность связывания антигена, как известно, является более низкой по сравнению с вариантом, когда присутствует шесть CDR, то он все еще сохраняет способность распознавать антиген и связываться с ним.
Антитела в виде Ig подразделяют на несколько классов (изотипов) на основе структурных различий константных областей. У многих млекопитающих на основе структурных различий в константой области определяют пять классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE. Кроме того, у человека IgG имеет четыре подкласса: IgG1, IgG2, IgG3 и IgG4; a IgA имеет два подкласса: IgA1 и IgA2. Тяжелую цепь классифицируют как γ-цепь, μ-цепь, α-цепь, δ-цепь и ε-цепь в соответствии с различиями в константной области, и на основе этих различий существует пять классов (изотипов) иммуноглобулинов: IgG, IgM, IgA, IgD и IgE. С другой стороны, известно два типа легких цепей: λ-цепь и κ-цепь, и все иммуноглобулины имеют любую из указанных двух типов цепей.
В одном из вариантов осуществления изобретения, в котором антитела, указанные в разделе А или Б описания, имеют тяжелую цепь, например тяжелая цепь может представлять собой любую из цепей, выбранную из γ-цепи, μ-цепи, α-цепи, δ-цепи и ε-цепи, или может быть получена из одной из них, а когда антитело, указанное в разделе А и Б описания, имеет легкую цепь, легкая цепь может представлять собой, например, либо κ-цепь, либо λ-цепь, или может быть получена из любой из них. Кроме того, в контексте разделов А и Б настоящего описания антитело может относиться к любому изотипу (например, IgG, IgM, IgA, IgD или IgE) и любому подклассу (например, человеческому IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2; мышиному IgG1, IgG2a, IgG2b и IgG3) или может быть получено из любого из них (но не ограничиваясь только ими).
В контексте разделов А и Б настоящего описания «антигенсвязывающий домен» может иметь любую структуру, если она связывается с представляющим интерес антигеном. Указанные домены могут включать, например, вариабельные области тяжелых цепей и легких цепей антитела (например, 1-6 CDR); модуль, состоящий примерно из 35 аминокислот, обозначенный как А-домен, который входит в авимер (Avimer), белок клеточной мембраны, присутствующий в организме (WO 2004/044011 и WO 2005/040229); аднектин (Adnectin), содержащий 10Fn3-домен, который связывается с белком в гликопротеине фибронектине, экспрессируемом на клеточной мембране (WO 2002/032925); аффибоди (Affibody), имеющий каркас IgG-связывающего домена, состоящего из трехспирального пучка, включающего 58 аминокислот белка (WO 1995/001937); сконструированные белки с анкириновыми повторами (DARPin), которые представляют собой область, экспонируемую на молекулярной поверхности анкиринового повтора (AR), который имеет структуру, в которой повторно уложена субъединица с изгибом, содержащая 33 аминокислотных остатка, две антипараллельной спирали и петлю (WO 2002/020565); антикалины (Anticalins) и другие молекулы, которые представляют собой состоящую из четырех петель область, поддерживающую одну сторону центрально закрученной бочкообразной структуры, состоящей из восьми антипараллельных цепей, которые являются высоко консервативными среди молекул липокаинов, таких как липокаин, ассоциированный с желатиназой нейтрофилов (NGAL) (WO 2003/029462); и вогнутую область, образованную структурой в виде параллельных тяжей внутри подковообразной структуры, образованной уложенными повторами, которые состоят из богатого лейцином повторяющего (LRR) модуля вариабельного рецептора лимфоцитов (VLR), который не имеет иммуноглобулиновой структуры и применяется в системе приобретенной устойчивости у бесчелюстных позвоночных, таких как миноги и миксины (WO 2008/016854). Предпочтительные антигенсвязывающие домены, указанные в разделе А или Б описания, могут представлять собой домены, имеющие вариабельные области тяжелой цепи и легкой цепи антитела IgG-типа и более конкретно, ScFv, одноцепочечные антитела, Fv, scFv2 (одноцепочечный FV2), Fab и F(ab')2.
В одном из вариантов осуществления изобретения, указанном в разделе А описания, «концентрация ионов» не ограничена конкретным видом иона и относится в концентрации ионов водорода (рН) или концентрации ионов металла. В контексте настоящего описания ионы металлов представляют собой ионы элементов группы I за исключением водорода, такие как щелочные металлы и элементы группы меди, элементы группы II, такие как щелочноземельные металлы и элементы группы цинка, элементы группы III за исключением бора, элементы группы IV за исключением углерода и кремния, элементы группы VIII, такие как элементы группы железа и группы платины, элементы, принадлежащие к подгруппе А групп V, VI и VII, и элементы, представляющие собой такие металлы, как сурьма, висмут и полоний. Атомы металлов обладают способностью высвобождать валентные электроны, становясь катионами. Это явление обозначают как тенденция к ионизации. Считается, что металлы с сильной тенденцией к ионизации являются химически активными.
В одном из вариантов осуществления изобретения, указанном в разделе А описания, предпочтительными ионами металлов могут являться ионы кальция, что описано подробно в WO 2012/073992 и WO 2013/125667.
В одном из вариантов осуществления изобретения, указанном в разделе А описания, «условие(я) концентрации ионов» может представлять собой условие(я), влияющее(ие) на различие в биологическом поведении зависящего от концентрации ионов антитела, находящееся между низкой концентрацией ионов и высокой концентрацией ионов. Кроме того, понятие «антигенсвязывающая активность изменяется в зависимости от условий концентрации ионов» может означать, что антигенсвязывающая активность зависящего от концентрации ионов антигенсвязывающего домена или зависящего от концентрации ионов антитела, указанного в разделе А или Б, изменяется в зависимости от того, является ли концентрация ионов низкой или высокой. Такие случаи включают, например (но не ограничиваясь ими), случаи с более высокой (более сильной) или менее сильной (более слабой) антигенсвязывающей активностью при высокой концентрации ионов, чем при низкой концентрации ионов.
В одном из вариантов осуществления изобретения, указанном в разделе А описания, концентрация ионов может представлять собой концентрацию ионов водорода (рН) или концентрацию ионов кальция. Когда концентрация ионов представляет собой концентрацию ионов водорода (рН), то зависящий от концентрации ионов антигенсвязывающий домен обозначают также как «рН-зависимый антигенсвязывающий домен», а когда концентрация ионов представляет собой концентрацию ионов кальция, то его можно обозначать также как «зависящий от концентрации ионов кальция антигенсвязывающий домен».
В одном из вариантов осуществления изобретения в контексте раздела А описания зависящие от концентрации ионов антигенсвязывающие домены, зависящие от концентрации ионов антитела, зависящие от концентрации ионов антигенсвязывающие домены с повышенной pI и зависящие от концентрации ионов антитела с повышенной pI можно получать из библиотек, в основном состоящих из антител, которые отличаются последовательностью (имеют вариабельность), и антигенсвязывающие домены которых содержат по меньшей мере один аминокислотный остаток, который обусловливает изменение антигенсвязывающей активности антигенсвязывающего домена или антитела в зависимости от условий концентрации ионов. Антигенсвязывающие домены предпочтительно могут находиться в вариабельной области легкой цепи (которая может быть модифицирована) и/или вариабельной области тяжелой цепи (которая может быть модифицирована). Кроме того, для создания библиотеки указанные вариабельные области легкой цепи или тяжелой цепи можно объединять с вариабельными областями тяжелой цепи или легкой цепи, сконструированными в виде библиотеки рандомизированных последовательностей вариабельных областей. Когда концентрация ионов представляет собой концентрацию ионов водорода или кальция, то примеры библиотек включают (но не ограничиваясь только ими), например, библиотеки, в которых вариабельные области тяжелой цепи, сконструированные в виде библиотеки рандомизированных последовательностей вариабельных областей, объединяют с последовательностями вариабельных областей легких цепей, в которых аминокислотный(ые) остаток(и) в последовательности зародышей линии, такой ка SEQ ID NO: 1 (Vk1), SEQ ID NO: 2 (Vk2), SEQ ID NO: 3 (Vk3) или SEQ ID NO: 4 (Vk4), заменен(ы) по меньшей мере на один аминокислотный остаток, который может изменять антигенсвязывающую активность в зависимости от концентраций ионов. Кроме того, когда концентрация ионов представляет собой концентрацию ионов кальция, библиотеки включают, например, библиотеки, в которых последовательность вариабельной области тяжелой цепи SEQ ID NO: 5 (6RL №9-IgG1) или SEQ ID NO: 6 (6KC4-1 №8 5-IgG1) объединяют с вариабельными областями легких цепей, сконструированными в виде библиотеки рандомизированных последовательностей вариабельных областей или вариабельными областями легких цепей имеющих последовательность зародышевой линии.
В одном из вариантов осуществления изобретения, когда концентрация ионов представляет собой концентрацию ионов кальция, то высокая концентрация ионов кальция не ограничена конкретными величинами, но может представлять собой концентрацию, выбранную из диапазона от 100 мкМ до 10 мМ, от 200 мкМ до 5 мМ, от 400 мкМ до 3 мМ, от 200 мкМ до 2 мМ или от 400 мкМ до 1 мМ. Предпочтительной может быть также концентрация от 500 мкМ до 2,5 мМ из-за близости к концентрации ионов кальция в плазме in vivo. Низкая концентрация ионов кальция не ограничена конкретными величинами, но может представлять собой концентрацию, выбранную из диапазона от 0,1 до 30, от 0,2 до 20, от 0,5 до 10 или от 1 до 5, или от 2 до 4 мкМ. Концентрация, выбранная из диапазона от 1 до 5 мкм, также может быть предпочтительной из-за близости к концентрации ионов кальция в ранних эндосомах in vivo.
Изменяется ли антигенсвязывающая активность антигенсвязывающего домена или антитела, содержащего домен, в зависимости от условий концентрации ионов металлов (например, концентрации ионов кальция), легко можно определять с помощью известных методов, например, методов, указанных в настоящем описании в контексте раздела А описания или описанных в WO 2012/073992. Например, антигенсвязывающую активность антигенсвязывающего домена или антитела, содержащего домен, можно измерять при низких и высоких концентрациях ионов кальция и сравнивать. В этом случае условия, отличные от концентрации ионов кальция, предпочтительно должны быть одинаковыми. Кроме того, при определении антигенсвязывающей активности условия, отличные от концентрации ионов кальция, можно выбирать соответственно из известных обычному специалисту в данной области. Антигенсвязывающую активность можно определять, например, в условиях HEPES-буфера при 37°C или с помощью BIACORE-анализа (фирма GE Healthcare) или других анализов.
В одном из вариантов осуществления изобретения, указанном в контексте раздела А описании, предпочтительно, чтобы антигенсвязывающая активность зависящего от концентрации ионов антигенсвязывающего домена, зависящего от концентрации ионов антитела, зависящего от концентрации ионов антигенсвязывающего домена с повышенной pI или зависящего от концентрации ионов антитела с повышенной pI, была выше в условиях высокой концентрации ионов кальция, чем в условиях низкой концентрации ионов кальция. В этом случае соотношение между антигенсвязывающей активностью в условиях низкой концентрации ионов кальция и антигенсвязывающей активностью в условиях высокой концентрации ионов кальция не ограничено конкретной величиной; однако величина соотношения KD (константа диссоциации) для антигена в условиях низкой концентрации ионов кальция и величиной KD в условиях высокой концентрации кальция, т.е., KD (3 мкМ Ca)/KD (2 мМ Са), может предпочтительно составлять 2 или выше, более предпочтительно 10 или выше и еще более предпочтительно 40 или выше. Верхний предел величины KD (3 мкМ Ca)/KD (2 мМСа) не ограничен и может представлять собой любую величину, такую как 400, 1000 или 10000.
Когда антиген представляет собой растворимый антиген, то константу диссоциации (KD) можно применять в качестве меры антигенсвязывающей активности. Однако, если антиген представляет собой мембранный антиген, то можно применять кажущуюся константу диссоциации (KD). Константу диссоциации (KD) и кажущуюся константу диссоциации (KD) можно определять известным методами, например, с помощью BIACORE-анализа (фирма GE healthcare), графика Скэтчарда или проточного цитометра.
Альтернативно этому, например, можно применять также константу скорости реакции диссоциации (kd) в качестве другого показателя, характеризующего соотношение антигенсвязывающих активностей. Когда константу скорости реакции диссоциации (kd) применяют вместо константы диссоциации (KD) в качестве показателя, характеризующего соотношение антигенсвязывающих активностей, то величина соотношения константы скорости реакции диссоциации (kd) в условиях низкой концентрации ионов кальция и константы скорости реакции диссоциации (kd) в условиях высокой концентрации ионов кальция, т.е. kd (условия низкой концентрации ионов кальция)/kd (условия низкой концентрации ионов кальция) может составлять предпочтительно 2 или выше, более предпочтительно 5 или выше, еще более предпочтительно 10 или выше и еще более предпочтительно 30 или выше. Верхний предел величины kd (условия низкой концентрации ионов кальция)/kd (условия низкой концентрации ионов кальция) не ограничен и может представлять собой любую величину, такую как 50, 100 или 200.
Когда антиген представляет собой растворимый антиген, то константу скорости реакции диссоциации (kd) можно применять в качестве меры антигенсвязывающей активности. Однако, если антиген представляет собой мембранный антиген, можно применять кажущуюся константу скорости реакции диссоциации (kd). Константу скорости реакции диссоциации (kd) и кажущуюся константу скорости реакции диссоциации (kd) можно определять с помощью известных методов, например, с помощью BIACORE-анализа (фирма GE healthcare) или проточной цитометрии.
Согласно одному из вариантов осуществления изобретения методы получения или скрининга зависящих от ионов кальция антигенсвязывающих доменов или зависящих от ионов кальция антител, антигенсвязывающая активность которых выше в условиях высокой концентрации кальция, чем в условиях низкой концентрации ионов кальция, или их библиотек не ограничены конкретными методами. Методы включают например, описанные в WO 2012/073992 (например, в параграфах 0200-0213).
Такие методы включают, например:
(а) определение антигенсвязывающей активности антигенсвязывающего домена или антитела в условиях низкой концентрации ионов кальция;
(б) определение антигенсвязывающей активности антигенсвязывающего домена или антитела в условиях высокой концентрации ионов кальция; и
(в) отбор антигенсвязывающего домена или антитела, антигенсвязывающая активность которого в условиях низкой концентрации ионов кальция ниже, чем антигенсвязывающая активность в условиях высокой концентрации кальция.
Альтернативно этому, метод может включать, например:
(а) приведение в контакт антигена с антигенсвязывающим доменом или антителом или с их библиотекой в условиях высокой концентрации ионов кальция;
(б) инкубацию антигенсвязывающего домена или антитела, связавшегося с антигеном на стадии (а) в условиях низкой концентрации ионов кальция; и
(в) выделение антигенсвязывающего домена или антитела, отделившегося в результате диссоциации на стадии (б).
Альтернативно этому, метод может включать, например:
(а) приведение в контакт антигена с антигенсвязывающим доменом или антителом, или с их библиотекой в условиях низкой концентрации ионов кальция;
(б) отбор антигенсвязывающего домена или антитела, не связавшегося с антигеном или имеющего низкую антигенсвязывающую активность на стадии (а);
(в) обеспечение возможности антигенсвязывающему домену или антителу, отобранному на стадии (б), связываться с антигеном в условиях высокой концентрации ионов кальция; и
(г) выделение антигенсвязывающего домена или антитела, связавшегося с антигеном на стадии (в).
Альтернативно этому, метод может включать, например:
(а) приведение в контакт антигенсвязывающего домена или антитела или их библиотеки с колонкой с иммобилизованным антигеном в условиях высокой концентрации ионов кальция;
(б) элюцию антигенсвязывающего домена или антитела, связавшегося с колонкой на стадии (а), из колонки в условиях низкой концентрации кальция; и
(в) выделение антигенсвязывающего домена или антитела, элюированного на стадии (б).
Альтернативно этому, метод может включать, например:
(а) обеспечение возможности антигенсвязывающему домену или антителу или их библиотеке проходить через колонку с иммобилизованным антигеном в условиях низкой концентрации ионов кальция для сбора антигенсвязывающего домена или антитела, элюированного без связывания с колонкой;
(б) обеспечение возможности антигенсвязывающему домену или антителу, собранному на стадии (а), связываться с антигеном в условиях высокой концентрации ионов кальция; и
(в) выделение антигенсвязывающего домена или антитела, связавшегося с антигеном на стадии (б).
Альтернативно этому, метод может включать, например:
(а) приведение в контакт антигена с антигенсвязывающим доменом или антителом, или с их библиотекой в условиях высокой концентрации ионов кальция;
(б) получение антигенсвязывающего домена или антитела, связавшегося с антигеном на стадии (а);
(в) инкубацию антигенсвязывающего домена или антитела, полученного на стадии (б), в условиях низкой концентрации ионов кальция; и
(г) выделение антигенсвязывающего домена или антитела, антигенсвязывающая активность которого на стадии (в) слабее, чем критерий отбора на стадии (б).
Каждую стадию указанных различных методов скрининга можно повторять несколько раз или стадии можно объединять соответствующим образом для получения наиболее стабильных молекул. Вышеуказанные условия предпочтительно можно выбирать для условий низкой и высокой концентрации ионов кальция. Тем самым можно получать требуемые зависящие от концентрации ионов кальция домены или зависящие от концентрации ионов кальция антитела.
В контексте раздела А описания в одном из вариантов осуществления изобретения применяемые в качестве исходного продукта антигенсвязывающие домены или антитела, например, могут представлять собой модифицированные антигенсвязывающие домены или антитела, имеющие повышенную pI в результате модификации заряда по меньшей мере одного аминокислотного остатка, который может экспонироваться на их поверхности. В альтернативном варианте осуществления изобретения, когда аминокислоты, которые изменяют связывающую активность зависящего от концентрации ионов антигенсвязывающего домена, интродуцируют в последовательность, то их можно интродуцировать в сочетании с модификацией заряда по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антигенсвязывающего домена или антитела, приводящей к повышению pI.
Альтернативно этому, в контексте раздела А настоящего описания, например, можно применять уже существующие антигенсвязывающие домены или антитела, уже существующие библиотеки (фаговая библиотека и др.); антитела, полученные из гибридом, созданных путем иммунизации животных, или из В-клеток иммунизированных животных или их библиотек; или антигенсвязывающих доменов, антител или библиотек, полученных путем интродукции в них мутаций встречающихся в естественных условиях или не встречающихся в естественных условиях аминокислот, которые могут хелатировать кальций (как описано ниже) (например, библиотек с повышенным содержанием обладающих способностью хелатировать кальций аминокислот или библиотек, в которые интродуцированы обладающие способностью хелатировать кальций аминокислоты в специфические сайты).
В контексте раздела А описания в одном из вариантов осуществления изобретения, в котором концентрация ионов представляет собой концентрацию ионов кальция, не существует ограничения, касающегося типа аминокислот, которые изменяют связывающую активность зависящих от концентрации ионов антигенсвязывающих доменов или зависящих от концентрации ионов антигенсвязывающих доменов с повышенной pI, если они могут образовывать кальций-связывающий мотив. Например, кальций-связывающие мотивы известны специалистам в данной области (см., например Springer и др., Cell 102, 200, сс. 275-277; Kawasaki и др., Protein Prof. 2, 1995, сс. 305-490; Moncrief и др., J. Mol. Evol. 30, 1990, сс. 522-562; Chauvaux и др., Biochem. J. 265, 1990, сс. :261-265; Bairoch и др., FEBS Lett. 269, 1990, сс. 454-456; Davis, New Biol. 2, 1990, сс. 410-419; Schaefer и др., Genomics 25, 1995, сс. 638-643; Economou и др., EMBO J. 9, 1990, сс. 349-354; Wurzburg и др., Structure. 14(6), 2006, сс. 1049-1058). Таким образом, если антигенсвязывающий домен имеет произвольный кальций-связывающий мотив, такой как лектин типа С, например, ASGPR, CD23, MBR или DC-SIGN, то антигенсвязывающую активность домена можно изменять в зависимости от условий концентрации ионов кальция. Такие кальций-связывающие мотивы могут включать, например, в дополнение к описанным выше, кальций-связывающий мотив, включенный в антигенсвязывающий домен, представленный в SEQ ID NO: 7 (который соответствует «Vk5-2»).
В контексте раздела А описания в одном из вариантов осуществления изобретения, в котором концентрация ионов представляет собой концентрацию ионов кальция, аминокислоты, обладающие металл-хелатирующей активностью, можно использовать в качестве аминокислот, которые изменяют связывающую активность зависящих от концентрации ионов антигенсвязывающих доменов или зависящих от концентрации ионов антигенсвязывающих доменов с повышенной pI. Например, можно соответственно применять любые аминокислоты, обладающие металл-хелатирующей активностью, если они могут образовывать кальций-связывающий мотив. В частности, указанные аминокислоты включают аминокислоты, обладающие способностью служить в качестве доноров электронов. Аминокислоты предпочтительно включают (но не ограничиваясь только ими), Ser (S), Thr (Т), Asn (N), Gln (Q), Asp (D) и Glu (E).
Локализация указанных аминокислот, обладающих металл-хелатирующей активностью в антигенсвязывающем домене, не ограничена конкретными положениями. В одном из вариантов осуществления изобретения аминокислоты могут быть локализованы в любом из положений в вариабельной области тяжелой цепи и/или вариабельной области легкой цепи, которые могут образовывать антигенсвязывающий домен. По меньшей мере один аминокислотный остаток, который обусловливает зависящее от концентрации ионов кальция изменения антигенсвязывающей активности антитела, может содержаться, например, в CDR (один или несколько из CDR1, CDR2 и CDR3) и/или FR (один или несколько из FR1, FR2, FR3 и FR4) тяжелой цепи и/или легкой цепи. Аминокислотный(ые) остаток(и) можно помещать, например, в одно или несколько из положений 95, 96, 100а и 101 согласно нумерации Кэбота в CDR3 тяжелой цепи; в одно или несколько положений 30, 31 и 32 согласно нумерации Кэбота в CDR1 легкой цепи; в положение 50 согласно нумерации Кэбота в CDR2 легкой цепи; и/или в положение 92 согласно нумерации Кэбота в CDR3 легкой цепи. Указанные аминокислотные остатки можно помещать индивидуально или в комбинации.
Известно, что тропонин С, кальмодулин, парвалбумин, легкая цепь миозина и другие соединения имеют несколько кальций-связывающих сайтов, и возможно произошли из общего источника в процессе молекулярной эволюции, и в одном из вариантов осуществления изобретения один или несколько из CDR1, CDR2 и CDR3 легкой цепи создавали так, чтобы они содержали их связывающие мотивы. Для описанных выше целей, можно применять, например, домен кадхерина; EF-плечо, входящее в кальмодулин; С2-домен, входящий в протеинкиназу С; Gla-домен, содержащийся в белке фактора IX свертывания крови; С-типе лектина асиалогликопротеинового рецептора или рецептора, связывающего маннозу; А-домен, входящий в LDL-рецептор; аннексии; домен тромбоспондина типа-3; и EGF-подобный домен.
В одном из вариантов осуществления изобретения, в котором концентрация представляет собой концентрацию ионов водорода (рН), то концентрацию протонов, т.е. ядер атома углерода, применяют в качестве синонима водородному показателю (рН). Когда уровень активности иона водорода в водном растворе обозначают как аН+, рН определяют как -log10aH+. Когда ионная сила водного раствора является низкой (например, менее 10-3), аН+ практически эквивалентен силе ионов водорода. Например, ионное произведение воды при 25°C и давлении, равном одной атмосфере, составляет Kw=аН+×аОН=10-14; таким образом, в случае чистой воды, аН+=аОН=10-7. В этом случае рН=7 является нейтральным и водный раствор с рН ниже 7 является кислым, а водный раствор с рН выше 7 является щелочными. Таким образом, условия концентрации ионов водорода могут представлять собой условия, сфокусированные на различиях в биологическом поведении рН-зависимого антитела при высокой концентрации ионов водорода (кислый диапазон рН) и при низкой концентрации ионов водорода (нейтральный диапазон рН) в качестве условий концентрации ионов водорода или рН-условий. Например, в контексте раздела А описания «антигенсвязывающая активность в условиях высокой концентрации ионов водорода (кислый диапазон рН) ниже, чем антигенсвязывающая активность в условиях низкой концентрации ионов водорода (нейтральный диапазон рН)» может означать, что антигенсвязывающая активность зависящего от концентрации ионов антигенсвязывающего домена, зависящего от концентрации ионов антитела, зависящего от концентрации ионов антигенсвязывающего домена с повышенной pI или зависящего от концентрации ионов антитела с повышенной pI слабее при рН, выбранном из рН от 4,0 до 6,5, предпочтительно из рН от 4,5 до 6,5, более предпочтительно из рН от 5,0 до 6,5 и еще более предпочтительно из рН от 5,5 до 6,5, чем при рН, выбранном из рН от 6,7 до 10,0, предпочтительно из рН от 6,7 до 9,5, более предпочтительно из рН от 7,0 до 9,0 и еще более предпочтительно из рН от 7,0 до 8,0. Предпочтительно вышеуказанное выражение может означать, что антигенсвязывающая активность при рН, близком к рН в ранних эндосомах in vivo, слабее, чем активность при рН в плазме in vivo; и в частности, может означать, что антигенсвязывающая активность антитела, например, при рН 5,8 слабее, чем, например, при рН 7,4.
Изменяется ли антигенсвязывающая активность антигенсвязывающего домена или антитела, содержащего домен, в зависимости от условий концентрации ионов водорода, можно легко определять с помощью известных методов, например, методов анализов, указанных в контексте раздела А описания или описанных в WO 2009/125825. Например, антигенсвязывающую активность антигенсвязывающего домена или антитела, содержащего домен, в отношении представляющего интерес антигена можно измерять при низких и высоких концентрациях ионов водорода и сравнивать. В этом случае предпочтительно, чтобы другие условия, отличные от концентрации ионов водорода были, одинаковыми. При осуществлении определения антигенсвязывающей активности обычные специалисты в данной области могут соответствующим образом выбирать условия, отличные от концентрации ионов водорода, и, например измерения можно осуществлять в условиях применения HEPES-буфера при 37°C или с использованием BIACORE-анализа (фирма GE Healthcare) или т.п.
В контексте раздела А указанного описания, если специально не указано иное, то понятие «нейтральный диапазон рН» (который обозначают также как «низкая концентрация ионов водорода», «высокий рН», «условия нейтрального рН» или «нейтральный рН») не ограничено конкретно специфическим значением; однако предпочтительно его можно выбирать из рН от 6,7 до 10,0 из рН от 6,7 до 9,5 из рН от 7,0 до 9,0 или из рН от 7,0 до 8,0. Нейтральный диапазон рН предпочтительно может соответствовать рН 7,4, близкому к рН in vivo в плазме (крови), но для удобства измерений можно применять, например, рН 7,0.
В контексте раздела А указанного описания, если специально не указано иное, то понятие «кислый диапазон рН» (который обозначают также как «высокая концентрация ионов водорода», «низкий рН», «условия кислого рН» или «кислый рН») не ограничено конкретно специфическим значением; однако предпочтительно его можно выбирать из рН от 4,0 до рН 6,5 из рН от 4,5 до 6,5 из рН от 5,0 до 6,5 или от 5,5 до 6,5. Кислый диапазон рН предпочтительно может соответствовать рН 5,8, близкому к in vivo концентрации ионов водорода в ранней эндосоме, но для удобства измерений можно применять, например, рН 6,0.
В одном из вариантов осуществления изобретения в контексте раздела А описания, когда концентрация ионов представляет собой концентрацию ионов водорода, то предпочтительно антигенсвязывающая активность зависящего от концентрации ионов антигенсвязывающего домена, зависящего от концентрации ионов антитела, зависящего от концентрации ионов антигенсвязывающего домена с повышенной pI или зависящего от концентрации ионов антитела с повышенной pI, выше в условиях нейтрального рН, чем в условиях кислого рН. В этом случае соотношение антигенсвязывающей активности в условиях нейтрального рН и антигенсвязывающей активности в условиях кислого рН не ограничено конкретной величиной; однако величина отношения KD (константа диссоциации) для антигена в условиях кислого рН к величине KD в условиях нейтрального рН, т.е., KD (кислый диапазон pH)/KD (нейтральный диапазон рН), (например, KD (рН 5,8)/KD (рН 7,4)) может составлять 2 или выше; 10 или выше; или 40 или выше. Верхний предел величины KD (кислый диапазон pH)/KD (нейтральный диапазон рН) не ограничен конкретной величиной и может иметь любую величину, такую как 400, 1000 или 10000.
В альтернативном варианте осуществления изобретения можно применять также, например, константу скорости реакции диссоциации (kd) в качестве показателя, характеризующего соотношение указанных выше антигенсвязывающих активностей. Когда константу скорости реакции диссоциации (kd) применяют вместо константы диссоциации (KD) в качестве показателя, характеризующего соотношение антигенсвязывающих активностей, то величина соотношения константы скорости реакции диссоциации (kd) для антигена в условиях высокой концентрации ионов водорода и в условиях низкой концентрация ионов водорода, т.е. kd (кислый диапазон pH)/kd (нейтральный диапазон рН) может составлять 2 или выше, 5 или выше, 10 или выше или 30 или выше. Верхний предел величины kd (кислый диапазон pH)/kd (нейтральный диапазон рН) не ограничен конкретной величиной и может иметь любую величину, такую как 50, 100 или 200.
Когда антиген представляет собой растворимый антиген, то величину константу скорости реакции диссоциации (kd) можно применять в качестве меры антигенсвязывающей активности, а, если антиген представляет собой мембранный антиген, то для этой цели можно применять кажущуюся константу скорости реакции диссоциации (kd). Константу скорости реакции диссоциации (kd) и кажущуюся константу скорости реакции диссоциации (kd) можно определять с помощью известных методов, например, с помощью BIACORE-анализа (фирма GE healthcare) или проточного цитометра.
Согласно одному из вариантов осуществления изобретения методы получения или скрининга зависящих от рН антигенсвязывающих доменов или зависящих от рН антител, антигенсвязывающая активность которых выше в условиях нейтрального рН, чем в условиях кислого рН, или их библиотек не ограничены конкретными методами. Методы включают например, описанные в WO 20092/125825 (например, в параграфах 0158-0190).
Такие методы включают, например:
(а) определение антигенсвязывающей активности антигенсвязывающего домена или антитела в условиях кислого рН;
(б) определение антигенсвязывающей активности антигенсвязывающего домена или антитела в условиях нейтрального рН; и
(в) отбор антигенсвязывающего домена или антитела, антигенсвязывающая активность которого в условиях кислого рН ниже, чем в условиях нейтрального рН.
Альтернативно этому, метод может включать, например:
(а) приведение в контакт антигена с антигенсвязывающим доменом или антителом или их библиотекой в условиях нейтрального рН;
(б) инкубацию антигенсвязывающего домена или антитела, связавшегося с антигеном на стадии (а), в условиях кислого рН; и
(в) выделение антигенсвязывающего домена или антитела, отделившегося в результате диссоциации на стадии (б).
Альтернативно этому, метод может включать, например:
(а) приведение в контакт антигена с антигенсвязывающим доменом или антителом или их библиотекой в условиях кислого рН;
(б) отбор антигенсвязывающего домена или антитела, не связавшегося с антигеном или имеющего низкую антигенсвязывающую активность на стадии (а);
(в) обеспечение возможности антигенсвязывающему домену или антителу, отобранному на стадии (б), связываться с антигеном в условиях нейтрального рН; и
(г) выделение антигенсвязывающего домена или антитела, связавшегося с антигеном на стадии (в).
Альтернативно этому, метод может включать, например:
(а) приведение в контакт антигенсвязывающего домена или антитела или их библиотеки с колонкой с иммобилизованным антигеном в условиях нейтрального рН;
(б) элюцию антигенсвязывающего домена или антитела, связавшегося с колонкой на стадии (а), в условиях кислого рН; и
(в) выделение антигенсвязывающего домена или антитела, элюированного на стадии (б).
Альтернативно этому, метод может включать, например:
(а) обеспечение возможности антигенсвязывающему домену или антителу или их библиотеке проходить через колонку с иммобилизованным антигеном в условиях кислого рН для сбора антигенсвязывающего домена или антитела, элюированного без связывания с колонкой;
(б) обеспечение возможности антигенсвязывающему домену или антителу, собранному на стадии (а), связываться с антигеном в условиях нейтрального рН; и
(в) выделение антигенсвязывающего домена или антитела, связавшегося с антигеном на стадии (б).
Альтернативно этому, метод может включать, например:
(а) приведение в контакт антигена с антигенсвязывающим доменом или антителом или их библиотекой в условиях нейтрального рН;
(б) получение антигенсвязывающего домена или антитела, связавшегося с антигеном на стадии (а);
(в) инкубацию антигенсвязывающего домена или антитела, полученного на стадии (б), в условиях кислого рН; и
(г) выделение антигенсвязывающего домена или антитела, антигенсвязывающая активность которого на стадии (в) слабее, чем критерий отбора на стадии (б).
Каждую стадию указанных различных методов скрининга можно повторять несколько раз или стадии можно объединять. Вышеуказанные условия предпочтительно можно выбирать для условий кислого и нейтрального рН. Тем самым можно получать требуемые рН-зависимые антигенсвязывающий домены или рН-зависимые антитела.
В контексте раздела А описания в одном из вариантов осуществления изобретения применяемые в качестве исходного продукта антигенсвязывающие домены или антитела, например, могут представлять собой модифицированные антигенсвязывающие домены или антитела, имеющие повышенную pI в результате модификации заряда по меньшей мере одного аминокислотного остатка, который может экспонироваться на их поверхности. В альтернативном варианте осуществления изобретения, когда аминокислоты, которые изменяют связывающую активность зависящего от концентрации ионов антигенсвязывающего домена интродуцируют в последовательность, то их можно интродуцировать в сочетании с модификацией заряда по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антигенсвязывающего домена или антитела, приводящей к повышению pI.
Альтернативно этому, в контексте раздела А описания настоящего описания, например, можно применять уже существующие антигенсвязывающие домены или антитела, уже существующие библиотеки (фаговая библиотека и др.); антитела, полученные из гибридом, созданных путем иммунизации животных, или из В-клеток иммунизированных животных, или их библиотеки; или антигенсвязывающие домены, антитела или библиотеки, полученные путем интродукции в них мутаций с использованием встречающихся в естественных условиях или не встречающихся в естественных условиях аминокислот с pKa боковой цепи 4,0-8,0 (как описано ниже), например, библиотеки с повышенным содержанием мутаций с использованием встречающихся в естественных условиях или не встречающихся в естественных условиях аминокислот с pKa боковой цепи 4,0-8,0 или библиотеки с интродуцированными в конкретные сайты мутациями с использованием встречающихся в естественных условиях или не встречающихся в естественных условиях аминокислот с pKa боковой цепи 4,0-8,0). Указанный предпочтительный антигенсвязывающий домен может иметь, например, аминокислотную последовательность, в которой по меньшей мере один аминокислотный остаток заменен на аминокислоту(ы) с pKa боковой цепи 4,0-8,0 и/или в которую встроена(н) аминокислота(ы) с pKa боковой цепи 4,0-8,0, как описано в WO 2009/125825.
В одном из вариантов осуществления изобретения в контексте раздела А описания сайт, в который интродуцирована мутация аминокислот с pKa боковой цепи 4,0-8,0, не ограничен конкретным сайтом и мутацию можно интродуцировать в любой сайт, если антигенсвязывающая активность становится более слабой в кислом диапазоне рН, чем в нейтральном диапазоне рН (величина отношения KD (кислый диапазон pH)/KD (нейтральный диапазон рН) повышена или величина отношения kd (кислый диапазон pH)/kd (нейтральный диапазон рН) повышена) по сравнению с вариантом до замены или встраивания. Когда антигенсвязывающий домен имеет вариабельную область или CDR, сайт может находиться внутри вариабельной области или CDR. Обычные специалисты в данной области могут соответствующим образом определять количество замененных или встроенных аминокислот; и это количество может составлять 1 или более. Кроме того, можно изымать путем делеции, встраивать и/или заменять или модифицировать другие r аминокислоты в дополнение к замене или инсерции, описанной выше. Замену или инсерцию аминокислот с pKa боковой цепи 4,0-8,0 можно осуществлять произвольным образом с использованием методов, таких как сканирование гистидином, в которых гистидин используют вместо аланина при осуществлении сканирования аланином, известного обычным специалистам в данной области, и/или антитела, у которых величина отношения KD (кислый диапазон pH)/KD (нейтральный диапазон рН) или величина отношения kd (кислый диапазон pH)/kd (нейтральный диапазон рН) повышена по сравнению с вариантом до введения мутации, можно отбирать среди антигенсвязывающих доменов или антител, полученных в результате произвольной мутации, приводящей к замене или инсерции этих аминокислот или их библиотек.
Кроме того, антигенсвязывающие домены или антитела могут представлять собой предпочтительно домены или антитела, антигенсвязывающая активность которых в нейтральном диапазоне рН до и после введения указанных мутаций не существенно снижается, не существенно уменьшается, является практически идентичной или возрастает; другими словами, активность которых может поддерживаться на уровне, составляющем по меньшей мере 10% или выше, предпочтительно 50% или выше, еще более предпочтительно 80% или выше и еще более предпочтительно 90% или выше или даже на еще более высоком уровне. Если связывающая активность антигенсвязывающего домена или антитела снижается в результате замены или инсерции аминокислот с pKa 4,0-8,0, то связывающую активность можно восстанавливать или повышать например, путем замены, делеции, добавления или инсерции одной или нескольких аминокислот в сайты, отличные от тех, в которых были сделаны указанные выше замены или инсерции.
В альтернативном варианте осуществления изобретения аминокислоты с pKa боковой цепи 4,0-8,0 можно помещать в любое положение внутри вариабельных областей тяжелой цепи и/или легкой цепи, которые могут образовывать антигенсвязывающий домен. По меньшей мере один аминокислотный остаток с pKa боковой цепи 4,0-8,0 можно локализовать, например, в CDR (один или несколько из CDR1, CDR2 и CDR3) и/или FR (один или несколько из FR1, FR2, FR3 и FR4) тяжелой цепи и/или легкой цепи. Указанные аминокислотные остатки включают (но не ограничиваясь только ими) аминокислотные остатки в одном или нескольких из положений 24, 27, 28, 31, 32 и 34 согласно нумерации Кэбота или в CDR1 вариабельной области легкой цепи; аминокислотные остатки в одном или нескольких из положений 50, 51, 52, 53, 54, 55 и 56 согласно нумерации Кэбота или в CDR2 вариабельной области легкой цепи; CDR2; и/или аминокислотные остатки в одном или нескольких из положений 89, 90, 91, 92, 93, 94 и 95А согласно нумерации Кэбота или в CDR3 вариабельной области легкой цепи. Указанные аминокислотные остатки можно включать индивидуально или в комбинации, если антигенсвязывающая активность антитела изменяется в зависимости от условий концентрации ионов водорода.
В одном из вариантов осуществления изобретения в контексте раздела А описания произвольный аминокислотный остаток можно соответственно применять в качестве аминокислотного остатка, который изменяет антигенсвязывающую активность антигенсвязывающего домена или антитела в зависимости от условий концентрации ионов водорода. В частности, указанные аминокислотные остатки могут включать остатки с pKa боковой цепи 4,0-8,0. Указанные аминокислоты, обладающие способностью отдавать электроны, могут включать, например, встречающиеся в естественных условиях аминокислоты, такие как His (Н) и Glu (Е), и не встречающиеся в естественных условиях аминокислоты, такие как аналоги гистидина (US 2009/0035836), м-NO2-Tyr (pKa 7,45), 3,5-Br2-Tyr (pKa 7,21) и 3,5-12-Tyr (pKa 7,38) (Heyl и др., Bioorg. Med. Chem. 11(17), 2003, сс. 3761-3768). Можно применять также аминокислоты с pKa боковой цепи 6,0-7,0, к которым относится, например, His (Н).
В контексте раздела А настоящего описания, если специально не указано иное и если это не является невозможным в данном контексте, очевидно, что изоэлектрическая точка (pI) может представлять собой определенную либо теоретически, либо экспериментально изоэлектрическую точку и ее обозначают также как «pI».
Величину pI можно определять экспериментально, например, с помощью изоэлектрического фокусирования в сочетании с электрофорезом. При этом, теоретическую величину pI можно рассчитывать, например, с помощью программного обеспечения для анализа генной и аминокислотной последовательности (фирмы Genetyx и др.).
В одном из вариантов осуществления изобретения, является ли pI антитела с повышенной pI или антитела, указанного в разделе А описания, повышенной по сравнению с антителом до модификации (нативное антитело (например, нативное антитело в виде Ig, предпочтительно нативное антитело IgG-типа) или референс-антителом (например, антителом до модификации антитела или до или в процессе конструирования библиотеки)), можно определять, осуществляя в дополнение или вместо описанных выше методов оценку фармакокинетических характеристик антитела, используя плазму, например, мышей, крыс, кроликов, собак, обезьян или человека, в сочетании с такими методами, как BIACORE, анализ клеточной пролиферации, ELISA, ферментный иммуноанализ (EIA), радиоиммуноанализ (РИА) или иммунофлуоресцентный анализ.
В контексте раздела А настоящего описания «аминокислотный остаток, который может экспонироваться на поверхности», как правило, означает аминокислотный остаток, локализованный на поверхности полипептида, образующего антитело. «Аминокислотный остаток, локализованный на поверхности полипептида» может означать аминокислотный остаток, боковая цепь которого может иметь контакт с молекулами растворителя (наиболее часто молекулами воды). Однако боковая цепь необязательно должна полностью находиться в контакте с молекулами растворителя и даже, если только часть боковой цепи находится в контакте с молекулами растворителя, то аминокислоту рассматривают как «аминокислотный остаток, локализованный на поверхности». Аминокислотные остатки, локализованные на поверхности полипептида, включают также аминокислотные остатки, локализованные вблизи поверхности антитела, и которые в результате могут влиять на общий электрический заряд другого аминокислотного остатка, даже если боковая цепь которого только частично имеет контакт с молекулами растворителя. Обычные специалисты в данной области могут создавать гомологичную модель полипептида или антитела, например, используя поступающее в продажу программное обеспечение. Альтернативно этому, можно применять методы, известные специалистам в данной области, такие, например, как рентгеновская кристаллография. Аминокислотные остатки, которые могут экспонироваться на поверхности, определяют, например, используя координаты трехмерной модели с применением компьютерной программы, такой как программа InsightII (фирма Accelrys). Сайты, которые могут экспонироваться на поверхности, можно определять с помощью алгоритмов, известных в данной области (например, см. Lee и Richards, J. Mol. Biol. 55, 1971, cc. 379-400; Connolly, J. Appl. Cryst. 16, 1983, cc. 548-558). Сайты, которые могут экспонироваться на поверхности, можно определять с помощью программного обеспечения, пригодного для моделирования белка, и информации о трехмерной структуре, полученной для антитела. Пригодное для этой цели программное обеспечение включает, например, программное обеспечение SYBYL Biopolymer Module (фирма Tripos Associates). Когда в алгоритме требуется ввести задаваемый пользователем параметр «размер», то «размер» образца используемый при расчетах, можно задавать как радиус, равный примерно 1,4 Ангстрем или менее. Кроме того, методы определения областей, которые могут экспонироваться на поверхности, описаны у Pacios (Comput. Chem. 18(4), 1994, cc. 377-386; J. Mol. Model. 1, 1995, cc. 46-53). На основе указанной выше информации можно отбирать пригодные аминокислотные остатки, локализованные на поверхности полипептида, который образует антитело.
Метод повышения pI белка предусматривает, например, уменьшение количества аминокислот с отрицательно заряженной боковой цепью (например, аспарагиновая кислота и глутаминовая кислота) и/или увеличение количества аминокислот с положительно заряженной боковой цепью (например, аргинин, лизин и гистидин) в условиях нейтрального рН. Аминокислотные остатки с отрицательно заряженной боковой цепью имеют отрицательный заряд, соответствующий -1, в условиях рН, который в достаточной степени превышает величину pKa боковой цепи, согласно теории, хорошо известной специалистам в данной области. Например, теоретическая величина pKa для боковой цепи аспарагиновой кислоты составляет 3,9 и боковая цепь имеет отрицательный заряд, соответствующий -1, в условиях нейтрального рН (например, в растворе с рН 7,0). И, наоборот, аминокислоты с положительно заряженной боковой цепью имеют положительный заряд, соответствующий +1, в условиях рН, который в достаточной степени ниже, чем величина pKa их боковой цепи. Например, теоретическая величина pKa для боковой цепи аргинина составляет 12,5 и боковая цепь имеет положительный заряд, соответствующий +1, в условиях нейтрального рН (например, в растворе с рН 7,0). При этом, как известно, аминокислоты, боковые цепи которых не имеют заряда в условиях нейтрального рН (например, в растворе с рН 7,0), включают 15 типов встречающихся в естественных условиях аминокислот, т.е. аланин, цистеин, фенилаланин, глицин изолейцин, лейцин, метионин, аспарагин, пролин, глутамин, серии, треонин, валин, триптофан и тирозин. Само собой разумеется, что аминокислоты, которые можно применять для изменения pI, могут представлять собой не встречающиеся в естественных условиях аминокислоты.
Исходя из вышеуказанного, с помощью метода повышения pI белка в условиях нейтрального рН (например, в растворе с рН 7,0) можно осуществлять изменение заряда представляющего интерес белка на +1, например, путем замены аминокислотами (остатками) с незаряженными боковыми цепями аспарагиновой кислоты или глутаминовой кислоты (боковая цепь которых имеет отрицательный заряд -1) в аминокислотной последовательности белка. Кроме того изменение заряда на +1 можно осуществлять в белке, например, путем замены аргинином или лизином (боковая цепь которых имеет положительный заряд +1) аминокислот с незаряженными боковыми цепями. Кроме того, одновременно можно осуществлять изменение заряда белка на +2 путем замены аргинином или лизином (боковая цепь которых имеет положительный заряд +1) аспарагиновой кислоты или глутаминовой кислоты (боковая цепь которых имеет отрицательный заряд -1). Альтернативно этому, для повышения pI белка аминокислоты с незаряженными боковыми цепями и/или предпочтительно аминокислоты с положительно заряженными боковыми цепями можно добавлять или встраивать в аминокислотную последовательность белка или аминокислоты с незаряженными боковыми цепями и/или предпочтительно аминокислоты с отрицательно заряженными боковыми цепями, присутствующие в аминокислотной последовательности белка, можно изымать путем делеции. Очевидно, что, например, N-концевые и С-концевые аминокислотные остатки белка имеют заряд, присущий их основной цепи (NH3+ аминогруппы на N-конце и СОО- карбонильной группы на С-конце) помимо зарядов, присущих их боковой цепи. Так, pI белка можно повышать, осуществляя в функциональных группах основной цепи определенное добавление, делецию, замену или инсерцию.
Обычным специалистам в данной области должно быть очевидно, что воздействие изменения чистого заряда или pI белка, для получения которого используют модификацию одного или нескольких аминокислот (остатков) в аминокислотной последовательности, с целью присутствия или увеличения электрических зарядов аминокислот (остатков), не зависит только (или в значительной степени) от самих образующий антитело аминокислотных последовательностей или типа антигена-мишени, а скорее зависит от типа и количества аминокислотных остатков, которые добавляют, изымают, заменяют или встраивают.
Антитела, которые были модифицированы так, чтобы обладать повышенной pI, путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела («антитела с повышенной pI» или «антитела с увеличенной pI»), могут более быстро включаться в клетки или могут усиливать элиминацию антигена из плазмы, что описано или высказано в качестве предположения, например, в WO 2007/114319, WO 2009/041643, WO 2014/145159 или WO 2012/016227.
Из нескольких изотипов антител, например, антитело IgG-типа имеет достаточно большую молекулярную массу и поэтому его основной путь метаболизма не предусматривает почечную экскрецию. Известно, что антитело IgG-типа, которое имеет Fc-область в качестве части молекулы, может «реутилизоваться» (осуществлять рециклинг) путем «спасения» через FcRn, и поэтому оно имеет продолжительное время полужизни in vivo. Считается, что антитело IgG-типа метаболизируется в основном посредством метаболического пути в эндотелиальных клетках (Не и др., J. Immunol. 160(2), 1998, сс. 1029-1035). В частности, предполагается, что при неспецифическом проникновении в эндотелиальные клетки, антитела IgG-типа «реутилизируются» путем связывания с FcRn, а антитела IgG-типа, которые не могут связываться, метаболизируются. Время полужизни в плазме антитела IgG-типа может быть укороченным, когда его Fc-область модифицирована так, что его FcRn-связывающая активность понижена. С другой стороны, продемонстрировано, что время полужизни в плазме антитела с повышенной pI зависит от pI с высоким уровнем корреляции, что описано, например, в WO 2007/114319 и WO 2009/041643. В частности, время полужизни в плазме антител с повышенной pI, которые описаны в процитированных выше документах, снижено без модификации аминокислотной последовательности, образующей Fc, что потенциально может приводить к приобретению иммуногенности, и этот результат позволяет предположить, что технология повышения pI находит широкое применение даже в случае тех типов молекул антител, основной путь метаболизма которых представляет собой почечную экскрецию, таких как scFv, Fab или содержащие Fc слитые белки.
Концентрация рН в биологических жидкостях (например, в плазме) соответствует нейтральному диапазону рН. Не вдаваясь в конкретную теорию, можно предположить, что в биологических жидкостях чистый положительный заряд антитела с повышенной pI возрастает вследствие увеличения pI, и в результате антитело привлекается с большей силой посредством физико-химического кулоновского взаимодействия к поверхности эндотелиальной клетки, которая имеет чистый отрицательный заряд, по сравнению с антителами, у которых не повышена pI; посредством неспецифического связывания антитело связывается с ней и проникает в клетки, что приводит к укорочению времени полужизни антитела в плазме или усилению элиминации антигена из плазмы. Кроме того, увеличенная pI антитела повышает проникновение антитела (или комплекса антиген/антитело) в клетки и/или внутриклеточную проницаемость, что, как предполагается, приводит к снижению концентрации антитела в плазме, снижению биодоступности антитела и/или укорочению времени полужизни антитела в плазме; и предполагается, что это явление широко распространено in vivo вне зависимости от типа клеток, типа тканей, типа органа и т.д. Кроме того, на формирование комплекса антитела с антигеном и его проникновение в клетки может влиять не только pI антитела, но также и pI антигена, снижая или повышая проникновение в клетки.
В одном из вариантов осуществления изобретения способы получения и скрининга антител с повышенной pI могут включать, например, методы, описанные в WO 2007/114319 (например, параграфы 0060-0087), WO 2009/041643 (например, параграфы 0115), WO 2014/145159 и WO 2012/016227. Указанный способ может включать, например:
(а) модификацию нуклеиновой кислоты, которая кодирует антитело, содержащее по меньшей мере один аминокислотный остаток, который может экспонироваться на поверхности антитела, которая может модифицировать заряд аминокислотного(ых) остатка(ов) так, чтобы повышалась pI антитела;
(б) культивирование клетки-хозяина, обеспечивающее экспрессию нуклеиновой кислоты; и
(в) сбор антитела из культуры клетки-хозяина.
Альтернативно этому способ может включать, например:
(а') модификацию нуклеиновой кислоты, которая кодирует антитело, содержащее по меньшей мере один аминокислотный остаток, который может экспонироваться на поверхности антитела, так, чтобы модифицировать заряд аминокислотного(ых) остатка(ов);
(б') культивирование клетки-хозяина, обеспечивающее экспрессию нуклеиновой кислоты;
(в') сбор антитела из культуры клетки-хозяина; и
(г') (необязательно с осуществлением подтверждения или измерения) отбор антитела с повышенной pI по сравнению с антителом до модификации. В контексте настоящего описания антитело, применяемое в качестве исходного продукта, или антитело до модификации или референс-антитело может представлять собой, например, зависящее от концентрации ионов антитело. Альтернативно этому, при модификации аминокислотного(ых) остатка(ов) аминокислоту(ы), которая(ые) изменяют связывающую активность зависящего от концентрация ионов антигенсвязывающего домена, можно также включать в последовательность.
Альтернативно этому, способ может просто представлять собой способ, включающий культивирование клетки-хозяина, полученной на стадии (б) или (б') и сбор антитела из клеточной культуры.
В альтернативном варианте осуществления изобретения способ может представлять собой, например, способ получения мультиспецифического антитела, которое содержит первый полипептид и второй полипептид, и необязательно третий полипептид и четвертый полипептид, включающий:
(A) модификацию нуклеиновой(ых) кислоты(т), которая(ые) кодирует(ют) первый полипептид и/или второй полипептид и необязательно третий полипептид и/или четвертый полипептид, любой один или несколько из которых содержит по меньшей мере один аминокислотный остаток, который может экспонироваться на поверхности полипептида, модифицируя заряд аминокислотного(ых) остатка(ов) так, чтобы повышалась pI антитела;
(Б) культивирование клетки-хозяина, обеспечивающее экспрессию нуклеиновой кислоты; и
(B) сбор мультиспецифического антитела из культуры клетки-хозяина.
Альтернативно этому, способ может включать, например:
(А') модификацию нуклеиновой(ых) кислоты(т), которая(ые) кодирует(ют) первый полипептид и/или второй полипептид и необязательно третий полипептид и/или четвертый полипептид, любой один или несколько из которых содержит по меньшей мере один аминокислотный остаток, который может экспонироваться на поверхности полипептида, так, чтобы заряд аминокислотного(ых) остатка(ов) изменялся;
(Б') культивирование клетки-хозяина, обеспечивающее экспрессию нуклеиновой кислоты;
(В') сбор мультиспецифического антитела из культуры клетки-хозяина; и
(Г') (необязательно с осуществлением подтверждения или измерения) отбор антитела с повышенной pI по сравнению с антителом до модификации.
В контексте настоящего описания антитело, применяемое в качестве исходного продукта, или антитело до модификации или референс-антитело может представлять собой, например, зависящее от концентрации ионов антитело. Альтернативно этому, при модификации аминокислотного(ых) остатка(ов) аминокислоту(ы), которая(ые) изменяет(ют) связывающую активность зависящего от концентрация ионов антигенсвязывающего домена, можно также включать в последовательность.
Альтернативно этому, способ может просто представлять собой метод, включающий культивирование клетки-хозяина, полученной на стадии (Б) или (Б'), и сбор антитела из клеточной культуры. В этом случае полипептиды, нуклеиновая(ые) кислота(ы) которых подлежат модификации, могут предпочтительно представлять собой гомомультимер первого полипептид, гомомультимер второго полипептида или гетеромультимер первого и второго полипептидов (и необязательно гомомультимер первого полипептида, гомомультимер четвертого полипептида или гетеромультимер третьего и четвертого полипептидов).
В альтернативном варианте осуществления изобретения способ может представлять собой, например, способ получения гуманизированного или человеческого антитела с укороченным временем полужизни в плазме, который включает: в антителе, которое содержит CDR, выбранный(ые) из группы, состоящей из CDR человеческого происхождения, CDR из животных кроме человека и синтетический(ие) CDR; FR человеческого происхождения; и человеческую константную область, (I) модифицируют по меньшей мере один аминокислотный остаток, который может экспонироваться на поверхности по меньшей мере одной области, выбранной из группы, состоящей из CDR, FR и константной области, с получением аминокислотного(ых) остатка(ов), который(ые) имеет(ют) заряд, отличный от заряда аминокислотного(ых) остатка(ов), присутствующего(их) в соответствующем(их) положении(ях) до модификации, которая приводит к повышению pI антитела.
Альтернативно этому, способ может включать, например, стадии, на которых в антителе, которое содержит CDR, выбранный(ые) из группы, состоящей из CDR человеческого происхождения, CDR из животных кроме человека и синтетический(ие) CDR; FR человеческого происхождения; и человеческую константную область,
(I') модифицируют по меньшей мере один аминокислотный остаток, который может экспонироваться на поверхности по меньшей мере одной области, выбранной из группы, состоящей из CDR, FR и константной области, с получением аминокислотного(ых) остатка(ов), который(ые) имеет(ют) заряд, отличный от заряда аминокислотного(ых) остатка(ов), присутствующего(их) в соответствующем(их) положении(ях) до модификации и
(II') осуществляют (необязательно подтверждение и) отбор антитела с повышенной pI по сравнению с антителом до модификации.
В контексте настоящего описания антитело, применяемое в качестве исходного продукта, или антитело до модификации или референс-антитело может представлять собой, например, зависящее от концентрации ионов антитело. Альтернативно этому, при модификации аминокислотного(ых) остатка(ов) аминокислоту(ы), которая(ые) изменяет(ют) связывающую активность зависящего от концентрация ионов антигенсвязывающего домена, можно также включать в последовательность.
Альтернативно этому, можно, например, применять уже существующие антигенсвязывающие домены или антитела, уже существующие библиотеки (фаговая библиотека и др.); антитела, полученные из гибридом, созданных путем иммунизации животных, или из В-клеток иммунизированных животных или их библиотек; или антигенсвязывающих доменов, антител или библиотек с повышенной pI, полученных путем модификации в описанных выше антигенсвязывающих доменах, антителах или их библиотеках по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности, согласно, например, любому из описанных выше вариантов осуществления изобретения.
В одном из вариантов осуществления изобретения у антител, указанных в разделе А описания, величина pI может предпочтительно быть повышена, например, по меньшей мере на 0,01, 0,03, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5 или более или по меньшей мере на 0,6, 0,7, 0,8, 0,9 или более, и для существенного укорочения времени полужизни антитела в плазме величина pI может быть повышена, например, по меньшей мере на 1,0, 1,1, 1,2, 1,3, 1,4, 1,5 или более или по меньшей мере на 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5 или более или 3,0 или более, по сравнению с антителами до модификации или изменения (нативные антитела (например, нативные антитела в виде Ig, предпочтительно нативные антитела IgG-типа) или референс-антитела или родительские антитела (например, антитела до модификации антитела или до или в процессе конструирования библиотек)). Обычный специалист в данной области в зависимости от цели может общепринятым образом определять оптимальную величину pI для антител, указанных в разделе А описания, с учетом баланса между фармакологическим действием и токсичностью и, например, количества антигенсвязывающих доменов антител или pI антигена. Не вдаваясь в конкретную теорию, можно предположить, что антитела, указанные в разделе А описания, согласно одному из вариантов осуществления изобретения обладают ценными свойствами в дополнение к способности выступать в качестве шаттла между плазмой и клеточными эндосомами и способности одной молекулы антитела повторно связываться с несколькими антигенами благодаря присутствию зависящего от концентрация ионов антигенсвязывающего домена, такими как повышение чистого положительного заряда антитела в результате повышения pI, и это приводит к быстрому поглощению антитела клетками. Эти характеристики должны укорачивать время полужизни антитела в плазме, повышать активность связывания антител с внеклеточным матриксом или повышать элиминацию антитела из плазмы. Специалист в данной области может определять оптимальную величину pI для проявления благоприятных воздействий этих характеристик.
В одном из вариантов осуществления изобретения в контексте раздела А описания по сравнению с антителами до модификации или изменения по меньшей мере одного аминокислотного остатка для повышения pI (нативные антитела (например, нативные антитела в виде Ig, предпочтительно нативные антитела IgG-типа) или референс-антитела или родительские антитела (например, антитела до модификации антитела или до или в процессе конструирования библиотек), которые могут представлять собой зависящие от концентрации ионов антитела), у зависящих от концентрации ионов антител, указанных в разделе А описания, с повышенной pI способность элиминировать антигены из плазмы может повышаться предпочтительно, например, по меньшей мере в 1,1, 1,25, 1,5, 1,75, 2, 2,25, 2,5, 2,75, 3, 3,25, 3,5, 3,75, 4, 4,25, 4,5, 4,75, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5 или 10 раз или более (при введении антител in vivo) или их способность связываться с внеклеточным матриксом может увеличиваться предпочтительно, например, по меньшей мере в 1,1, 1,25, 1,5, 1,75, 2, 2,25, 2,5, 2,75, 3, 3,25, 3,5, 3,75, 4, 4,25, 4,5, 4,75 или 5 раз или более.
В одном из вариантов осуществления изобретения в контексте раздела А описания по сравнению с антителами до интродукции зависящего от концентрации ионов антигенсвязывающего домена (нативные антитела (например, нативные антитела в виде Ig, предпочтительно нативные антитела IgG-типа) или референс-антитела или родительские антитела (например, антитела до модификации антитела или до или в процессе конструирования библиотек), которые могут представлять собой антитела с повышенной pI), у зависящих от концентрации ионов антител, указанных в разделе А описания, с повышенной pI способность элиминировать антигены из плазмы может повышаться предпочтительно, например, по меньшей мере в 1,1, 1,25, 1,5, 1,75, 2, 2,25, 2,5, 2,75, 3, 3,25, 3,5, 3,75, 4, 4,25, 4,5, 4,75, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5 или 10 раз или более (при введении антител in vivo) или их способность связываться с внеклеточным матриксом может увеличиваться предпочтительно, например, по меньшей мере в 1,1, 1,25, 1,5, 1,75, 2, 2,25, 2,5, 2,75, 3, 3,25, 3,5, 3,75, 4, 4,25, 4,5, 4,75 или 5 раз или более.
Согласно одному из вариантов осуществления изобретения методы анализа, применяемые для решения вопроса о том, является ли активность связывания с внеклеточным матриксом у антител, указанных в разделе А описания, повышенной по сравнению с антителами до модификации или изменения (нативные антитела (например, нативные антитела в виде Ig, предпочтительно нативные антитела IgG-типа) или референс-антитела или родительские антитела (например, антитела до модификации антитела или до или в процессе конструирования библиотек), которые могут представлять собой антитела с повышенной pI), не ограничена конкретными методами. Например, анализ можно осуществлять с помощью системы ELISA, которая позволяет обнаруживать связывание между антителом и внеклеточным матриксом, когда антитело добавляют к иммобилизованному на планшете внеклеточному матриксу и добавляют в нему меченое антитело против антитела. Альтернативно этому, как указано в примерах 1-4 в настоящем описании и в WO 2012/093704, можно также применять электрохемилюминисценцию (ECL), которая позволяет с высокой чувствительностью определять способность связываться с внеклеточным матриксом. Этот метод можно осуществлять, например, с использованием ECL-системы, в которой смесь антитела и меченного рутением антитела добавляют к иммобилизованному на планшете внеклеточному матриксу и измеряют связывание между антителами и внеклеточным матриксом на основе электрохемилюминисценции рутения. Концентрацию антитела, в которой его добавляют, можно соответствующим образом регулировать; добавленную концентрацию можно повышать для увеличения чувствительности детекции связывания внеклеточного матрикса. Указанные внеклеточные матриксы можно получать из животных или растений, если они содержат гликопротеины, такие как коллаген, протеогликан, фибронектин, ламинин, энтактин, фибрин и перлекан; предпочтительными могут являться полученные из животных внеклеточные матриксы. Например, можно применять внеклеточные матриксы, полученные из животных, таких как человек, мыши, крысы, обезьяны, кролики или собаки. Например, человеческий нативный внеклеточный матрикс можно применять в качестве индикатора фармакодинамики антител в человеческой плазме. Условия, в которых осуществляют оценку связывания антителом внеклеточного матрикса, предпочтительно могут представлять собой нейтральный диапазон рН (около рН 7,4), который соответствует физиологическим условиям; однако условия не обязательно должны соответствовать нейтральному диапазону и связывание можно оценивать также в кислом диапазоне рН (например, около рН 6,0). Альтернативно этому, при осуществлении оценки связывания антитела с внеклеточным матриксом анализ можно проводить при одновременном присутствии молекулы антигена, с которым связывается антитело, и определять связывающую активность комплекса антиген-антитело с внеклеточным матриксом.
В одном из вариантов осуществления изобретения антитела, указанные в разделе А описания, (в значительной степени) могут сохранять антигенсвязывающую активность по сравнению с антителами до модификации или изменения по меньшей мере одного аминокислотного остатка для повышения pI (нативные антитела (например, нативные антитела в виде Ig, предпочтительно нативные антитела IgG-типа) или референс-антитела или родительские антитела (например, антитела до модификации антитела или до или в процессе конструирования библиотек). В этом случае «(в значительной степени) сохранение антигенсвязывающей активности» может означать наличие активности, составляющей по меньшей мере 50% или более, предпочтительно 60% или более, более предпочтительно 70% или 75% или более и еще более предпочтительно 80%, 85%, 90% или 95% или более по сравнению со связывающей активностью антитела до модификации или изменения. Альтернативно этому, антитела, указанные в разделе А описания, должны сохранять связывающую активность только в той степени, которая позволяет им сохранять их функции, когда они связываются с антигенами, так, аффинность, определенная при 37°С в физиологических условиях, может составлять, например, 100 нМ или менее, предпочтительно 50 нМ или менее, более предпочтительно 10 нМ или менее и еще более предпочтительно 1 нМ или менее.
В одном из вариантов осуществления изобретения, указанном в разделе А описания, понятие «модификация по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела» или эквивалентное понятие может означать, что осуществляют одно или несколько добавлений, делеций, замен и инсерций по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела. Указанная модификация может предпочтительно включать замену по меньшей мере одного аминокислотного остатка.
Замена аминокислотных остатков может включать, например, замену аминокислотных остатков, боковые цепи которых не имеют заряда, на аминокислотные остатки, имеющие отрицательно заряженную боковую цепи, замену аминокислотных остатков, имеющих положительно заряженную боковую цепь, на аминокислотные остатки, боковая цепь которых не имеет заряда, и замену аминокислотных остатков, имеющих положительно заряженную боковую цепь, на аминокислотные остатки, имеющие отрицательно заряженную боковую цепь, в аминокислотной последовательности представляющего интерес антитела, что можно осуществлять индивидуально или в соответствующих комбинациях. Инсерция или добавление аминокислотных остатков может включать, например инсерцию или добавление аминокислот, боковая цепь которых не имеет заряда, и/или инсерцию или добавление аминокислот, имеющих положительно заряженную боковую цепь, в аминокислотную последовательность представляющего интерес антитела, что можно осуществлять индивидуально или в соответствующих комбинациях. Делеция аминокислотных остатков может включать, например, делецию аминокислотных остатков, боковая цепь которых не имеет заряда и/или делецию аминокислотных остатков имеющих отрицательно заряженную боковую цепь, в аминокислотной последовательности представляющего интерес антитела, что можно осуществлять индивидуально или в соответствующих комбинациях.
Обычные специалисты в данной области могут соответствующим образом объединять одно или несколько из указанных добавлений, делеций, замен и инсерций в аминокислотной последовательности представляющего интерес антитела. Модификация, которая может приводить к уменьшению локального заряда аминокислотных остатков, также является приемлемой, поскольку должна повышаться только чистая pI антитела, указанного в разделе А описания. Например, при необходимости антитела, pI которых была повышена (слишком сильно), можно модифицировать для снижения pI (небольшого). Приемлемо также снижать локальный заряд аминокислотных остатков в результате модификации по меньшей мере одного аминокислотного остатка, которую осуществляли одновременно или в другое время для других целей (например, для повышения стабильности антитела или снижения иммуногенности). Такие антитела включают антитела из библиотек, сконструированных для конкретных целей.
В одном из вариантов осуществления изобретения среди аминокислот (остатков), применяемых для модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела, встречающиеся в естественных условиях аминокислоты классифицируют следующим образом: аминокислота с отрицательно заряженной боковой цепью может представлять собой Glu (Е) или Asp (D); аминокислота с незаряженной боковой цепью может представлять собой Ala (A), Asn (N), Cys (С), Gln (Q), Gly (G), His (H), Ile (I), Leu (L), Met (M), Phe (F), Pro (P), Ser (S), Thr (T), Trp (W), Tyr (Y) или Val (V); и аминокислота с положительно заряженной боковой цепью может представлять собой His (Н), Lys (K) или Arg (R).
Как описано подробно в примерах 1-4 в настоящем описании, в растворе с нейтральным рН (например, рН 7,0) практически в 100% лизина и аргинина имеют положительный заряд, когда они присутствуют в виде остатка в антителе, в то время как только примерно 9% остатков гистидина имеют положительный заряд, когда они присутствуют в виде остатка в антителе, а остальная большая часть, вероятно, не имеет никакого заряда. Таким образом, Lys (K) или Arg(R) предпочтительно выбирают в качестве аминокислот с положительно заряженной боковой цепью.
В одном из вариантов осуществления изобретения антитела, указанные в разделе А описания, предпочтительно имеют вариабельную область и/или константную область. Кроме того, вариабельная область может предпочтительно включать вариабельную область тяжелой цепи и/или вариабельную область легкой цепи и/или может предпочтительно иметь CDR (например, один или несколько из CDR1, CDR2 и CDR3) и/или FR (например, один или несколько из FR1, FR2, FR3 и FR4). Константная область предпочтительно может включать константную область тяжелой цепи и/или константную область легкой цепи, и в зависимости от последовательности и типа она может представлять собой, например, константную область IgG-типа (предпочтительно константную область человеческого IgG1-типа, человеческого IgG2-типа, человеческого IgG3-типа или человеческого IgG4-типа, константную область человеческой κ-цепи и константную область человеческой λ-цепи). Можно применять также модифицированные варианты этих константных областей.
В одном из вариантов осуществления изобретения модификация по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела, может представлять собой либо модификацию одной аминокислоты, либо комбинацию модификаций нескольких аминокислот. Предпочтительный способ может включать интродукцию комбинацию замен нескольких аминокислот в сайтах, в которых аминокислоты могут экспонироваться на поверхности антитела. Кроме того (но не ограничиваясь только ими), указанные замены нескольких аминокислот предпочтительно интродуцируют в положения, которые находятся вблизи друг друга в трехмерной структуре. Когда аминокислоты с положительно заряженной боковой цепью (например, Lys (K) или Arg (R)), должны заменять аминокислоты, которые могут экспонироваться на поверхности молекулы антитела (которые предпочтительно представляют собой (но не ограничиваясь только ими) аминокислоты с отрицательно заряженной боковой цепью (например, Glu (Е) или Asp (D)); или когда применяют ранее присутствующие аминокислоты, имеющие положительный заряд (например, Lys (K) или Arg (R)), например, одну или несколько аминокислот (которые могут включать аминокислоты, погруженные внутрь молекулы антитела, в зависимости от ситуации), которые находятся вблизи в трехмерной структуре к аминокислотам, можно также заменять аминокислотами имеющими положительный заряд, для последующего создания уплотненного состояния локального позитивного заряда, локализованного в непосредственной близости в трехмерной структуре. В контексте настоящего описания понятие «в непосредственной близости в трехмерной структуре» не ограничено конкретно; но оно может означать состояние, в котором одна или несколько аминокислотных замен интродуцированы например, в пределах 20 Ангстрем, предпочтительно в пределах 15 Ангстрем и более предпочтительно в пределах 10 Ангстрем. Экспонируется ли представляющий интерес сайт аминокислотной замены на поверхности молекулы антитела или находится ли сайт аминокислотной замены вблизи другой(их) аминокислотной(ых) замены(н) или ранее присутствующих аминокислот, можно оценивать известными методами, такими как рентгеновская кристаллография.
В дополнение к описанным выше, способы получения множества позитивных зарядов в сайтах, близких друг к другу в трехмерной структуре, могут включать способы, в которых применяют аминокислоты, которые исходно имели положительный заряд в константной области нативного IgG. Такие аминокислоты включают, например: аргинин в положениях 255, 292, 301, 344, 355 и 416 согласно EU-нумерации; и лизин в положениях 121, 133, 147, 205, 210, 213, 214, 218, 222, 246, 248, 274, 288, 290, 317, 320, 322, 326, 334, 338, 340, 360, 370, 392, 409, 414 и 439 согласно EU-нумерации. Множество позитивных зарядов можно помещать вблизи друг друга в трехмерной структуре путем замены на положительно заряженную(ые) аминокислоту(ы) в сайтах в трехмерной структуре, близких к указанным положительно заряженным аминокислотам.
Если антитела, указанные в разделе А описания, имеют вариабельную область (которая может быть модифицированной), то аминокислотные остатки, которые не маскируются при связывании с антигеном (т.е. все еще могут экспонироваться на поверхности), могут быть модифицированы и/или аминокислотная модификация может не интродуцироваться в сайты, которые маскируются при связывания с антигеном, или можно осуществлять аминокислотную модификацию, которая не (существенно) ингибирует связывание антигена. Если модифицируют аминокислотные остатки, которые могут экспонироваться на поверхности молекулы антитела, присутствуют в зависящем от концентрации ионов связывающем домене, то аминокислоты антигенсвязывающего домена можно модифицировать таким образом, чтобы модификация не (существенно) снижала связывающую активность аминокислотных остатков, которые могут изменять антигенсвязывающую активность антитела в зависимости от условий концентрации ионов (например, остатков в кальций-связывающем мотиве или в сайте инсерции гистидина и/или сайте с замененным гистидином), или аминокислотные остатки можно модифицировать в сайтах, отличных от сайтов аминокислотных остатков, которые могут изменять антигенсвязывающую активность антитела в зависимости от условий концентрации ионов. С другой стороны, если аминокислотные остатки, которые могут экспонироваться на поверхности молекулы антитела, присутствующие в зависящем от концентрации ионов связывающем домене, уже модифицированы, то тип или положение аминокислотных остатков, которые могут изменять антигенсвязывающую активность антитела в зависимости от условий концентрации ионов, можно выбирать так, чтобы pI антитела не снижалась ниже приемлемого уровня. Если pI антитела снизилась ниже приемлемого уровня, то pI всего антитела можно снижать путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности молекулы антитела.
Последовательности FR с высокой pI предпочтительно можно выбирать (но не ограничиваясь только ими) из последовательностей FR человеческой зародышевой линии или последовательностей областей, которые эквивалентны им, аминокислоты которых можно модифицировать в некоторых случаях.
Если антитела, указанные в разделе А описания, имеют константную область (которая может модифицирована), включающую FcγR-связывающий домен (который может представлять собой домен, связывающийся с любой из изоформ или любым из аллотипов FcγR, указанных ниже) и/или FcRn-связывающий домен, то сайты для модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности константной области, при необходимости могут представлять собой аминокислотные остатки, отличные от остатков в FcγR-связывающем домене и/или в FcRn-связывающем домене. Альтернативно этому, если сайты модификации выбирают из аминокислотных остатков в FcγR-связывающем домене и/или в FcRn-связывающем домене, то может оказаться предпочтительным выбирать сайты, которые не (существенно) влияют на связывающую активность или аффинность связывания FcγR и/или FcRn или, если они могут влиять, то сайты являются биологически или фармакологически приемлемыми.
В одном из вариантов осуществления изобретения сайт по меньшей мере одного аминокислотного остатка, который модифицируют для получения антитела, указанного в разделе А описания, у которого pI повышена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности вариабельной области (которая может быть модифицирована), не ограничен конкретным сайтом; однако указанный сайт можно выбирать из группы, состоящей согласно нумерации Кэбота из: (а) положения 1, 3, 5, 8, 10, 12, 13, 15, 16, 18, 19, 23, 25, 26, 39, 41, 42, 43, 44, 46, 68, 71, 72, 73, 75, 76, 77, 81, 82, 82а, 82b, 83, 84, 85, 86, 105, 108, 110 и 112 в FR вариабельной области тяжелой цепи; (б) положения 31, 61, 62, 63, 64, 65 и 97 в а CDR вариабельной области тяжелой цепи; (в) положения 1, 3, 7, 8, 9, 11, 12, 16, 17, 18, 20, 22, 37, 38, 39, 41, 42, 43, 45, 46, 49, 57, 60, 63, 65, 66, 68, 69, 70, 74, 76, 77, 79, 80, 81, 85, 100, 103, 105, 106, 107 и 108 в FR вариабельной области легкой цепи; и (г) положения 24, 25, 26, 27, 52, 53, 54, 55 и 56 в CDR вариабельной области легкой цепи, где аминокислоту в каждом положении после модификации можно выбирать из любой из аминокислот, описанных выше в понятиях заряда боковой цепи, таких как Lys (K), Arg (R), Gln (Q), Gly (G), Ser (S) или Asn (N) (но не ограничиваясь только ими). В некоторых вариантах осуществления изобретения модифицируют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 вышеуказанных аминокислотных положений. В некоторых вариантах осуществления изобретения модифицируют 1-20, 1-15, 1-10 или 1-5 из вышеуказанных аминокислотных положений.
В одном из вариантов осуществления изобретения из положения(ий), подлежащего(их) модификации, следующее(ие) положение(я) можно использовать для повышения pI антитела, указанного в разделе А, в комбинации с другим(ими) положение(ями), которое(ые) само(и) может(гут) оказывать существенное воздействие на повышение pI антитела. Указанное(ые) положение(я), способствующее(ие) повышению pI, можно выбирать, например, для вариабельной области легкой цепи из группы, состоящей из положений 27, 52, 56, 65 и 69 согласно нумерации Кэбота.
Кроме того, нет ограничений на сайт по меньшей мере одного аминокислотного остатка, который модифицируют в CDR и/или FR; однако такой сайт можно выбирать из группы, состоящей из: (а) положения 8, 10, 12, 13, 15, 16, 18, 23, 39, 41, 43, 44, 77, 82, 82а, 82b, 83, 84, 85 и 105 в FR вариабельной области тяжелой цепи; (б) положения 31, 61, 62, 63, 64, 65 и 97 в CDR вариабельной области тяжелой цепи; (в) положения 16, 18, 37, 41, 42, 45, 65, 69, 74, 76, 77, 79 и 107 в FR вариабельной области легкой цепи; и (г) положения 24, 25, 26, 27, 52, 53, 54, 55 и 56 в CDR вариабельной области легкой цепи. В некоторых вариантах осуществления изобретения модифицируют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 вышеуказанных аминокислотных положений. В некоторых вариантах осуществления изобретения модифицируют 1-20, 1-15, 1-10 или 1-5 из вышеуказанных аминокислотных положений.
Если сайт модификации по меньшей мере одного аминокислотного остатка выбирают, например из группы, содержащей вышеуказанные группы, то тип аминокислоты после модификации в вариабельной области тяжелой цепи представляет собой, например:
(а) 8K, 8R, 8Q, 8G, 8S или 8N для положения 8; (б) 13K, 13R, 13Q, 13G, 13S или 13N для положения 13; (в) 15K, 15R, 15Q, 15G, 15S или 15N для положения 15; (г) 16K, 16R, 16Q, 16G, 16S или 16N для положения 16; (д) 18K, 18R, 18Q, 18G, 18S или 18N для положения 18; (е) 39K, 39R, 39Q, 39G, 39S или 39N для положения 39; (ж) 41K, 41R, 41Q, 41G, 41S или 41N для положения 41; (з) 43K, 43R, 43Q, 43G, 43S или 43N для положения 43; (и) 44K, 44R, 44Q, 44G, 44S или 44N для положения 44; (к) 63K, 63R, 63Q, 63G, 63S или 63N для положения 63; (л) 64K, 64R, 64Q, 64G, 64S или 64N для положения 64; (м) 77K, 77R, 77Q, 77G, 77S или 77N для положения 77; (н) 82K, 82R, 82Q, 82G, 82S или 82N для положения 82; (о) 82аK, 82aR, 82aQ, 82aG, 82aS или 82aN для положения 82а; (п) 82bK, 82bR, 82bQ, 82bG, 82bS или 82bN для положения 82b; (р) 83K, 83R, 83Q, 83G, 83S или 83N для положения 83; (с) 84K, 84R, 84Q, 84G, 84S или 84N для положения 84; (т) 85K, 85R, 85Q, 85G, 85S или 85N для положения 85; или (у) 105K, 105R, 105Q, 105G, 105S или 105N для положения 105. В некоторых вариантах осуществления изобретения модифицируют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 вышеуказанных аминокислотных положений. В некоторых вариантах осуществления изобретения модифицируют 1-20, 1-15, 1-10 или 1-5 из вышеуказанных аминокислотных положений.
Примерами комбинации модифицированных аминокислотных положений в вариабельной области тяжелой цепи являются (но не ограничиваясь только ими), например:
любые два или большее количество положений, выбранных из группы, состоящей из положений 16, 43, 64 и 105; любые два или большее количество положений, выбранных из группы, состоящей из положений 77, 82а и 82b; положения 77 и 85; положения 41 и 44; положения 82а и 82b; положения 82 и 82b; положения 82b и 83; или положения 63 и 64 согласно нумерации Кэбота, где аминокислоту в каждом положении после модификации можно выбирать с точки зрения заряда боковой цепи из любой из описанных выше аминокислот, таких как Lys (K), Arg (R), Gln (Q), Gly (G), Ser (S) или Asn (N) (но не ограничиваясь только ими).
Конкретная комбинация может представлять собой, например, 16Q/43R/64K/105Q; 77R/82aN/82bR; 77R/82aG/82bR; 77R/82aS/82bR; 77R/85G; 41R/44R; 82aN/82bR; 82aG/82bR; 82aS/82bR; 82K/82bR; 82bR/83R; 77R/85R; или 63R/64K.
Аналогично этому, тип аминокислоты после модификации в вариабельной области легкой цепи представляет собой, например: (а) 16K, 16R, 16Q, 16G, 16S или 16N для положения 16; (б) 18K, 18R, 18Q, 18G, 18S или 18N для положения 18; (в) 24K, 24R, 24Q, 24G, 24S или 24N для положения 24; (г) 25K, 25R, 25Q, 25G, 25S или 25N для положения 25; (д) 26K, 26R, 26Q, 26G, 26S или 26N для положения 26; (е) 27K, 27R, 27Q, 27G, 27S или 27N для положения 27; (ж) 37K, 37R, 37Q, 37G, 37S или 37N для положения 37; (з) 41K, 41R, 41Q, 41G, 41S или 41N для положения 41; (и) 42K, 42R, 42Q, 42G, 42S или 42N для положения 42; (к) 45K, 45R, 45Q, 45G, 45S или 45N для положения 45; (л) 52K, 52R, 52Q, 52G, 52S или 52N для положения 52; (м) 53K, 53R, 53Q, 53G, 53S или 53N для положения 53; (н) 54K, 54R, 54Q, 54G, 54S или 54N для положения 54; (о) 55K, 55R, 55Q, 55G, 55S или 55N для положения 55; (п) 56K, 56R, 56Q, 56G, 56S или 56N для положения 56; (р) 65K, 65R, 65Q, 65G, 65S или 65N для положения 65; (с) 69K, 69R, 69Q, 69G, 69S или 69N для положения 69; (т) 74K, 74R, 74Q, 74G, 74S или 74N для положения 74; (у) 76K, 76R, 76Q, 76G, 76S или 76N для положения 76; (ф) 77K, 77R, 77Q, 77G, 77S или 77N для положения 77; (х) 79K, 79R, 79Q, 79G, 79S или 79N для положения 79; и (ц) 107K, 107R, 107Q, 107G, 107S или 107N для положения 107. В некоторых вариантах осуществления изобретения модифицируют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 вышеуказанных аминокислотных положений. В некоторых вариантах осуществления изобретения модифицируют 1-20, 1-15, 1-10 или 1-5 из вышеуказанных аминокислотных положений.
Примерами комбинации модифицированных аминокислотных положений в вариабельной области легкой цепи являются (но не ограничиваясь только ими), например: положения 24 и 27; положения 25 и 26; положения 41 и 42; положения 42 и 76; положения 52 и 56; положения 65 и 79; положения 74 и 77; положения 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 16, 24 и 27; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27 и 37; любые два или большее количество положений, выбранных из группы, состоящей из положений 25, 26 и 37; любые два или большее количество положений, выбранных из группы, состоящей из положений 27, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 41, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 41, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 41 и 42; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 52 и 56; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 6 и 69; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 25, 26, 52 и 56; любые два или большее количество положений, выбранных из группы, состоящей из положений 25, 26, 65 и 69; любые два или большее количество положений, выбранных из группы, состоящей из положений 25, 26, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 27, 41, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 27, 41, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 52, 56, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 52, 56, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 65, 69, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 65, 69, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 18, 24, 45, 79 и 107; любые два или большее количество положений, выбранных из группы, состоящей из положений 27, 52, 56, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 27, 52, 56, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 27, 65, 69, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 27, 65, 69, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 41, 52, 56, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 41, 52, 56, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 41, 65, 69, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 41, 65, 69, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 41, 42, 65 и 69; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 52, 56, 65 и 69; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 65, 69, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 65, 69, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 41, 42, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 52, 56, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 41, 42, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 52, 56, 76 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 24, 27, 74, 76, 77 и 79; любые два или большее количество положений, выбранных из группы, состоящей из положений 52, 56, 65, 69, 74 и 77; любые два или большее количество положений, выбранных из группы, состоящей из положений 52, 56, 65, 69, 76 и 79, согласно нумерации Кэбота, где аминокислоту в каждом положении после модификации можно выбирать из любой из описанных выше аминокислот в понятиях заряда боковой цепи, таких как Lys (K), Arg (R), Gln (Q), Gly (G), Ser (S) или Asn (N) (но не ограничиваясь только ими).
Конкретная комбинация может представлять собой, например, 24R/27Q; 24R/27R; 24K/27K; 25R/26R; 25K/26K; 41R/42K; 42K/76R; 52R/56R; 65R/79K; 74K/77R; 76R/79K; 16K/24R/27R; 24R/27R/37R; 25R/26R/37R; 27R/76R/79K; 41R/74K/77R; 41R/76R/79K; 24R/27R/41R/42K; 24R/27R/52R/56R; 24R/27R/52K/56K; 24R/27R/65R/69R; 24R/27R/74K/77R; 24R/27R/76R/79K; 25R/26R/52R/56R; 25R/26R/52K/56K; 25R/26R/65R/69R; 25R/26R/76R/79K; 27R/41R/74K/77R; 27R/41R/76R/79K; 52R/56R/74K/77R; 52R/56R/76R/79K; 65R/69R/76R/79K; 65R/69R/74K/77R; 18R/24R/45K/79Q/107K; 27R/52R/56R/74K/77R; 27R/52R/56R/76R/79K; 27R/65R/69R/74K/77R; 27R/65R/69R/76R/79K; 41R/52R/56R/74K/77R; 41R/52R/56R/76R/79K; 41R/65R/69R/74K/77R; 41R/65R/69R/76R/79K; 24R/27R/41R/42K/65R/69R; 24R/27R/52R/56R/65R/69R; 24R/27R/65R/69R/74K/77R; 24R/27R/65R/69R/76R/79K; 24R/27R/41R/42K/74K/77R; 24R/27R/52R/56R/74K/77R; 24R/27R/41R/42K/76R/79K; 24R/27R/52R/56R/76R/79K; 24R/27R/74K/76R/77R/79K; 52R/56R/65R/69R/74K/77R; или 52R/56R/65R/69R/76R/79K.
В WO 2007/114319 или WO 2009/041643 уже представлено объяснение или продемонстрировано на основе теоретических данных, моделирования гомологии или экспериментальных методов, что действие повышения pI в результате модификации некоторых аминокислотных остатков в вариабельной области зависит не только (или в значительной степени) от самих аминокислотных последовательностей, из которых состоит антитело, или от типа антигена-мишени, но скорее зависит от типа и количества замененных аминокислотных остатков. Было продемонстрировано, что даже после модификации некоторых аминокислот антигенсвязывающая активность в отношении некоторых типов антигенов (в значительной степени) поддерживается или, как с большей долей вероятности ожидается специалистами в данной области, по меньшей мере должна поддерживаться.
Например, в WO 2009/041643 конкретно продемонстрировано, что в FR тяжелой цепи гуманизированного антитела к глипикану 3, имеющему SEQ ID NO: 8, предпочтительными сайтами модификации аминокислотных остатков, которые могут экспонироваться на поверхности, являются положения 1, 3, 5, 8, 10, 12, 13, 15, 16, 19, 23, 25, 26, 39, 42, 43, 44, 46, 69, 72, 73, 74, 76, 77, 82, 85, 87, 89, 90, 107, 110, 112 и 114 согласно нумерации Кэбота. Также описано, что аминокислотный остаток в положении 97 согласно нумерации Кэбота является предпочтительным, поскольку он экспонируется на поверхности почти всех антител. В WO 2009/041643 продемонстрировано также, что предпочтительными являются аминокислотные остатки в положении 52, 54, 62, 63, 65 и 66 в CDR тяжелой цепи антитела. Продемонстрировано также, что предпочтительными являются аминокислотные остатки в положениях 1, 3, 7, 8, 9, 11, 12, 16, 17, 18, 20, 22, 43, 44, 45, 46, 48, 49, 50, 54, 62, 65, 68, 70, 71, 73, 74, 75, 79, 81, 82, 84, 85, 86, 90, 105, 108, 110, 111 и 112 согласно нумерации Кэбота в FR легкой цепи гуманизированного антитела к глипикану 3, имеющему SEQ ID NO: 9. Продемонстрировано также, что предпочтительными являются аминокислотные остатки в положениях 24, 27, 33, 55, 59 в CDR легкой цепи указанного антитела. Кроме того, в WO 2009/041643 конкретно указано, что аминокислотные остатки в положениях 31, 64 и 65 согласно нумерации Кэбота в CDR тяжелой цепи антитела к человеческому IL-6-рецептору, имеющему SEQ ID NO: 10, представляют собой предпочтительные сайты для модификации аминокислотных остатков, которые могут экспонироваться на поверхности, с сохранением при этом антигенсвязывающей активности. Кроме того, продемонстрировано, что аминокислотные остатки в положениях 24, 27, 53 и 55 согласно нумерации Кэбота в CDR легкой цепи антитела к человеческому IL-6-рецептору, имеющему SEQ ID NO: 11, являются предпочтительными. Кроме того, конкретно установлено, что аминокислотный остаток в положении 31 согласно нумерации Кэбота в CDR тяжелой цепи антитела к человеческому IL-6-рецептору, имеющему SEQ ID NO: 12, является предпочтительным сайтом для модификации аминокислотного остатка, который может экспонироваться на поверхности, с сохранением при этом антигенсвязывающей активности. Установлено также, что аминокислотные остатки в положениях 24, 53, 54 и 55 согласно нумерации Кэбота в CDR легкой цепи антитела к человеческому IL-6-рецептору, имеющему SEQ ID NO: 13, являются предпочтительными. В WO 2009/041643 описано также, что аминокислотные остатки в положениях 61, 62, 64 и 65 согласно нумерации Кэбота в CDR тяжелой цепи антитела к человеческому глипикану 3, имеющему SEQ ID NO: 14, являются предпочтительными сайтами для модификации аминокислотных остатков, которые могут экспонироваться на поверхности, с сохранением при этом антигенсвязывающей активности. Установлено также, что аминокислотные остатки в положениях 24 и 27 согласно нумерации Кэбота в CDR легкой цепи антитела к человеческому глипикану 3, имеющему SEQ ID NO: 15, являются предпочтительными. Продемонстрировано также, что аминокислотные остатки в положениях 61, 62, 64 и 65 согласно нумерации Кэбота в CDR тяжелой цепи антитела к человеческому IL-31-рецептору, имеющему SEQ ID NO: 16, являются предпочтительными сайтами для модификации аминокислотных остатков, которые могут экспонироваться на поверхности, с сохранением при этом антигенсвязывающей активности. В WO 2009/041643 описано также, что аминокислотные остатки в положениях 24 и 54 согласно нумерации Кэбота в CDR легкой цепи антитела к человеческому IL-31-рецептору, имеющему SEQ ID NO: 17, являются предпочтительными. Аналогично этому, в WO 2007/114319 описано, что антитела hA69-PF, hA69-p18, hA69-N97R, hB26-F123e4, hB26-p15 и hB26-PF, которые получали путем модификации заряда одного или нескольких аминокислотных остатков, которые могут экспонироваться на поверхности, характеризовались изменениями pI, что продемонстрировано с помощью изоэлектрического фокусирования, и обладали эквивалентной связывающей активностью в отношении их антигенов фактора IХа или фактора X, по сравнению с антителами до модификации или изменения. Описано также, что, когда эти антитела вводили мышам, то обнаружен высокий уровень корреляции pI каждого антитело с их плазменным клиренсом (CL), временем удерживания в плазме и временем полужизни в плазме (Т1/2). В WO 2007/114319 продемонстрировано также, что аминокислотные остатки в положениях 10, 12, 23, 39, 43, 97 и 105 в вариабельной области являются предпочтительными в качестве сайтов модификации аминокислотных остатков, которые могут экспонироваться на поверхности.
В альтернативном или дополнительном варианте осуществления изобретения, например, с использованием методов рентгеновской кристаллографии или моделей гомологии, сконструированных путем гомологичного моделирования из константной области антитела (предпочтительно человеческой константной области, более предпочтительно константной области человеческого антитела Ig-типа и еще более предпочтительно константной области человеческого антитела IgG-типа, но не ограничиваясь только ими), можно идентифицировать аминокислотные остатки, которые могут экспонироваться на поверхности константной области антитела, для определения сайтов модификации по меньшей мере одного аминокислотного остатка с целью получения антитела, указанного в разделе А описания, с повышенной pI. Сайт модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности константной области, не ограничен конкретным сайтом; однако, сайт предпочтительно можно выбирать из группы, состоящей из: положения 196, 253, 254, 256, 257, 258, 278, 280, 281, 282, 285, 286, 306, 307, 308, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 373, 382, 384, 385, 386, 387, 388, 389, 399, 400, 401, 402, 413, 415, 418, 419, 421, 424, 430, 433, 434 и положения 443, согласно EU-нумерации и предпочтительно можно выбирать из группы, состоящей из: положения 254, 258, 281, 282, 285, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 384, 385, 386, 387, 389, 399, 400, 401, 402, 413, 418, 419, 421, 433, 434 и 443 и предпочтительно также можно выбирать из группы, состоящей из: положения 282, 309, 311, 315, 342, 343, 384, 399, 401, 402 и 413, аминокислоты в каждом положении после модификации можно выбирать из аминокислот, описанных выше в понятиях заряда боковых цепей, таких как Lys (K), Arg (R), Gln (Q) или Asn (N) (но не ограничиваясь только ими). Когда сайт модификации по меньшей мере одного аминокислотного остатка выбирают, например из группы, которая содержит описанные выше группы, например, то тип аминокислот после модификации в каждом сайте может представлять собой следующий:
254K, 254R, 254Q или 254N в положении 254; 258K, 258R, 258Q или 258N в положении 258;
281K, 281R, 281Q или 281N в положении 281; 282K, 282R, 282Q или 282N в положении 282;
285K, 285R, 285Q или 285N в положении 285; 309K, 309R, 309Q или 309N в положении 309;
311K, 311R, 311Q или 311N в положении 311; 315K, 315R, 315Q или 315N в положении 315;
327K, 327R, 327Q или 327N в положении 327; 330K, 330R, 330Q или 330N в положении 330;
342K, 342R, 342Q или 342N в положении 342; 343K, 343R, 343Q или 343N в положении 311;
345K, 345R, 345Q или 345N в положении 345; 356K, 356R, 356Q или 356N в положении 356;
358K, 358R, 358Q или 358N в положении 358; 359K, 359R, 359Q или 359N в положении 359;
361K, 361R, 361Q или 361N в положении 361; 362K, 362R, 362Q или 362N в положении 362;
384K, 384R, 384Q или 384N в положении 384; 385K, 385R, 385Q или 385N в положении 385;
386K, 386R, 386Q или 386N в положении 386; 387K, 387R, 387Q или 387N в положении 387;
389K, 389R, 389Q или 389N в положении 389; 399K, 399R, 399Q или 399N в положении 399;
400K, 400R, 400Q или 400N в положении 400; 401K, 401R, 401Q или 401N в положении 401;
402K, 402R, 402Q или 402N в положении 402; 413K, 413R, 413Q или 413N в положении 413;
418K, 418R, 418Q или 418N в положении 418; 419K, 419R, 419Q или 419N в положении 419;
421K, 421R, 421Q или 421N в положении 421; 433K, 433R, 433Q или 433N в положении 433;
434K, 434R, 434Q или 434N в положении 434; и 443K, 443R, 443Q или 443N в положении 443.
В альтернативном варианте осуществления изобретения сайт модификации по меньшей мере одного аминокислотного остатка и тип аминокислоты после модификации может включать 345R или 345K и/или 430R, 430K, 430G или 435Т согласно EU-нумерации.
В одном из вариантов антител, указанных в разделе А описания, чистую величину pI антитела можно повышать путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности вариабельной области (которая может быть модифицирована), как описано выше, и по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности константной области (которая может быть модифицирована), как описано выше.
В контексте разделов А и Б описания, если антитело, указанное в разделе А или Б описания, представляет собой антитело IgG-типа или полученную из него молекулу, то константная область тяжелой цепи антитела может содержать константную область IgG1-типа, IgG2-типа, IgG3-типа или IgG4-типа. В разделе А или Б описания константная область тяжелой цепи может представлять собой константную область человеческой тяжелой цепи (но не ограничиваясь только ею). Известно несколько аллотипов человеческого IgG. В частности, описано, что существуют некоторые различия в аминокислотной последовательности константной области человеческого IgG между индивидуумами (Methods Mol. Biol. 882, 2012, сс. 635-680; Sequences of proteins of immunological interest, публикация NIH №91-3242). Примеры включают константную область человеческого IgG1 (SEQ ID NO: 18), константную область человеческого IgG2 (SEQ ID NO: 19), константную область человеческого IgG3 (SEQ ID NO: 20) и константную область человеческого IgG4 (SEQ ID NO: 21).
Среди них, например, для человеческого IgG1 известны аллотипы, обозначенные как G1lm1,17 и G1m3. Аллотипы различаются по их аминокислотным последовательностям: G1m1,17 имеет аспарагиновую кислоту в положении 356 и лейцин в положении 358 согласно EU-нумерации, a G1m3 имеет глутаминовую кислоту в положении 356 и метионин в положении 358 согласно EU-нумерации. Однако отсутствуют данные, позволяющие предположить присутствие существенных различий в важных функциях и свойствах антител указанных аллотипов. Таким образом, обычному специалисту в данной области должно быть очевидно, что можно осуществлять различные анализы с использованием конкретных аллотипов и результаты не ограничены аллотипами, которые использовали в примерах и такие же действия ожидаются для любого из аллотипов. В контексте разделов А и Б описания изобретения, когда упоминаются «человеческий IgG1», «человеческий IgG2», «человеческий IgG3» или «человеческий IgG4», аллотипы не ограничены конкретными аллотипами и могут включать все указанные аллотипы.
В альтернативном или дополнительном варианте осуществления изобретения, указанном в разделе А или Б описания, константная область легкой цепи антитела может включать любую константную область типа κ-цепи (IgK) или типа λ-цепи (IgL1, IgL2, IgL3, IgL6 или IgL7). Константная область легкой цепи может предпочтительно представлять собой константную область человеческой легкой цепи (но не ограничиваясь только ею). Известны данные, такие как описанные в «Sequences of proteins of immunological interest)), публикация NIH №91-3242, о нескольких аллотипических последовательностях, связанных с генетическим полиморфизмом константной области человеческой κ-цепи и константной области человеческой λ-цепи. Такие аллотипы включают, например, константную области человеческой κ-цепи (SEQ ID NO: 22) и константную области человеческой λ-цепи (SEQ ID NO: 23). Однако отсутствуют данные, позволяющие предположит присутствие существенных различий в важных функциях и свойствах антител указанных аллотипов. Таким образом, обычному специалисту в данной области должно быть очевидно, что при ссылке на конкретными аллотипы в контексте разделов А и Б настоящего описания, такие же действия ожидаются для любого из аллотипов (ниже в контексте настоящего описания в целом обозначена как константная область нативного (человеческого) IgG (типа)).
Кроме того, поскольку Fc-область нативного антитела IgG-типа составляет часть константной области нативного антитела IgG-типа, то, когда антитела, указанные в разделе А или Б описания, представляют собой, например, антитела IgG-типа или полученные из них молекулы, то антитела могут иметь Fc-область, входящую в константную область нативного IgG (IgG1-, IgG2-, IgG3- или IgG4-типа) (ниже в контексте настоящего описания в целом обозначена как Fc-область нативного (человеческого) IgG (типа)). Fc-область нативного IgG может означать Fc-область, состоящую из такой же аминокислотной последовательности, что и Fc-область, происходящая из встречающегося в естественных условиях IgG. Конкретные примеры родительской Fc-области нативного человеческого IgG могут включать Fc-области, входящие в константную область человеческого IgG1 (SEQ ID NO: 18), константную область человеческого IgG2 (SEQ ID NO: 19), константную область человеческого IgG3 (SEQ ID NO: 20) и константную область человеческого IgG4 (SEQ ID NO: 21), которые описаны выше (Fc-область IgG-класса может обозначать, например, область, простирающуюся от цистеина в положении 226 согласно EU-нумерации до С-конца или от пролина в положение 230 согласно EU-нумерации до С-конца.).
В одном из вариантов осуществления изобретения антитела, указанные в разделах А и Б описания, могут включать варианты, в которых сделана(ы) одна или несколько модификаций, выбранных из аминокислотной замены, добавлении, делеции или инсерции, в константной области нативного (предпочтительно человеческого) IgG (константная область тяжелой цепи и/или константная область легкой цепи) или в Fc-области нативного (предпочтительно человеческого) IgG.
Под объем раздела А описания изобретения подпадают опубликованные в WO 2013/081143 данные о том, что, например, зависящие от концентрации ионов антитела, которые обладают способностью образовывать многовалентные иммунные комплексы с мультимерным антигеном (многовалентные комплексы антиген-антитело), и мультиспецифические, зависящие от концентрации ионов антитела, или мультипаратопные, зависящие от концентрации ионов антитела, которые могут образовывать многовалентные иммунные комплексы (многовалентные комплексы антиген-антитело), путем распознавания двух или большего количества эпитопов на мономерных антигенах могут связываться сильнее с FcγR, FcRn, рецептором комплемента благодаря авидности (суммарная сила связывания между несколькими эпитопами и несколькимие паратопами) через по меньшей мере две или большее количество многовалентных константных областей (которые могут быть модифицированы) или Fc-областей (которые могут быть модифицированы), входящих в молекулы антитела, и в результате эти антитела могут быстрее проникать в клетки. Таким образом, модифицированные с целью повышения pI посредством модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела, зависящие от концентрации ионов антитела, описанные выше, которые обладают способностью образовывать многовалентные иммунные комплексы с мультимерным антигеном или мономерными антигенами, можно применять также в качестве антител, казанных в разделе А описания (зависящие от концентрации ионов антитела с повышенной pI). Обычным специалистам в данной области должно быть очевидно, что зависящие от концентрации ионов антитела с повышенной pI, которые могут образовывать многовалентные иммунные комплексы с мультимерным антигеном или мономерными антигенами, могут быстрее проникать в клетки по сравнению с зависящими от концентрации ионов антителами с повышенной pI, которые не обладают способностью образовывать многовалентные иммунные комплексы. Обычным специалистам в данной области также может быть понятно, что в одном из вариантов осуществления изобретения связывающая активность антител, указанных в разделе А описания, с FcRn и/или FcγR может возрастать в условиях нейтрального рН, и в этом случае зависящие от концентрации ионов антитела с повышенной pI, которые могут образовывать многовалентные иммунные комплексы с мультимерным антигеном или мономерными антигенами, могут еще быстрее проникать в клетки.
В одном из вариантов осуществления изобретения антитела, указанные в разделе А описания, могут представлять собой антитела с одним плечом (включая все варианты антител с одним плечом, которые описаны в WO 2005/063816). Как правило, антитела с одним плечом представляют собой антитела, лишенные одной из двух Fab-областей канонического антитела IgG-типа и их можно получать, например методами, описанными в WO 2005/063816 (но не ограничиваясь только ими). В антителе IgG-типа (но не ограничиваясь только им), которое имеет, например, структуру тяжелой цепи VH-CH1-шарнир-СН2-СН3, когда одна из Fab-областей расщепляется в сайте, более близком к N-концу, чем к шарниру (например, VH или СН1), то антитело должно экпрессироваться в форме, содержащей дополнительную последовательность, а, когда одна из Fab-областей расщепляется в сайте, более близком к С-концу, чем к шарниру (например, СН2), то Fc-область должна иметь неполную форму. Таким образом (но не ограничиваясь только указанным), с точки зрения стабильности молекулы антитела предпочтительно следует получать антитела с одним плечом путем расщепления в шарнирной области (шарнир) одной из двух Fab-областей антитела IgG-типа. Более предпочтительно тяжелую цепь после расщепления следует связывать с нерасщепленной тяжелой цепью через внутримолекулярную дисульфидную связь. В WO 2005/063816 описано, что такие антитела с одним плечом обладают повышенной стабильностью по сравнению с молекулами Fab. Антитела с повышенной или пониженной pI можно создавать также путем создания указанных антител с одним плечом. Кроме того, когда зависящий от концентрации ионов антигенсвязывающий домен интродуцируют в антитела с повышенной pI, представляющие собой антитела с одним плечом, то время полужизни антитела в плазме можно дополнительно укорачивать, клеточное поглощение антитела можно дополнительно повышать, элиминацию антигена из плазмы можно дополнительно усиливать или аффинность антитела к внеклеточному матриксу можно дополнительно увеличивать по сравнению с антителами с повышенной pI, которые не имеют зависящий от концентрации ионов антигенсвязывающий домен.
Не вдаваясь в какую-либо конкретную теорию, в варианте осуществления изобретения, в котором ожидается наличие повышающего проникновение в клетку эффекта антител с одним плечом, можно рассматривать случай (но не ограничиваясь только им), в котором pI растворимого антигена ниже, чем у антител. Чистую величину pI комплекса, состоящего из антител и антигенов, можно рассчитывать с помощью обычных методов, принимая, что комплекс представляет собой индивидуальную молекулу. В этом случае при более низкой pI растворимого антигена имеет место более низкая чистая величина pI комплекса; и при более высокой pI растворимого антигена имеет место более высокая чистая величина pI комплекса. Когда каноническую молекулу антитела IgG-типа (имеющую два Fab) связывают с одним имеющим низкую pI растворимым антигеном, то по сравнению со связыванием с двумя имеющими низкую pI растворимыми антигенами, в последнем случае чистая величина pI комплекса будет ниже. Когда указанное каноническое антитело превращают в антитело с одним плечом, то только один антиген может связываться с одной молекулой антитела; тем самым можно подавлять снижение pI комплекса в результате связывания с вторым антигеном. Другими словами, предполагается, что, когда pI растворимого антигена ниже, чем антитела, то конверсия в антитело с одним плечом позволяет повышать pI комплекса по сравнению с каноническим антителом и тем самым ускорять проникновение в клетки.
Кроме того (но не ограничиваясь только указанным), когда Fab канонической молекулы антитела IgG-типа (имеющей два Fab) имеет более низкую pI, чем Fc, то конверсия в антитело с одним плечом повышает чистую величину pI комплекса, состоящего из антитела с одним плечом и антигена. Кроме того, когда осуществляют указанную конверсию в антитело с одним плечом, то предпочтительно с позиции стабильности антитела с одним плечом расщеплять один из Fab-фрагментов в шарнирной области, локализованной в месте стыка между Fab и Fc. В этом случае можно ожидать, что pI можно эффективно повышать путем выбора сайта, который должен обеспечивать повышение pI антитела с одним плечом до требуемой степени.
Таким образом, обычным специалистам в данной области должно быть очевидно, что вне зависимости (или практически вне зависимости) от самой аминокислотной последовательности антитела и типа растворимого антигена pI антитела можно повышать и, как следствие, поглощение антигена клетками можно ускорять путем превращения антитела в антитело с одним плечом на основе расчета теоретической величины pI антитела (теоретическая величина pI Fc и теоретическая величина pI Fab), теоретической pI растворимого антигена и прогнозирования воздействие различий на их теоретические величины pI.
В одном из вариантов осуществления изобретения антитела, указанные в разделе А или Б описания, могут представлять собой мультиспецифические антитела, и мультиспецифическое антитело может представлять (но не ограничиваясь только им) биспецифическое антитело. Мультиспецифическое антитело может представлять собой мультиспецифическое антитело, которое содержит первый полипептид и второй полипептид. В контексте настоящего описания «мультиспецифическое антитело, которое содержит первый полипептид и второй полипептид» означает антитело, которое связывается по меньшей мере с двумя или большим количеством типов различных антигенов или по меньшей мере с двумя или большим количеством эпитопов в одном и том же антигене. Первый полипептид и второй полипептиды предпочтительно могут содержать вариабельную область тяжелой цепи, и более предпочтительно вариабельная область содержит CDR и/или FR. В другом варианте осуществления изобретения первый полипептид и второй полипептид может предпочтительно каждый содержать константную область тяжелой цепи. В следующем варианте осуществления изобретения мультиспецифическое антитело может содержать третий полипептид и четвертый полипептид, каждый из которых содержит вариабельную область легкой цепи и предпочтительно также константную область легкой цепи. В этом случае первый-четвертый полипептиды можно объединять с получением мультиспецифического антитела.
В одном из вариантов осуществления изобретения, в котором антитела, указанные в разделе А описания, представляют собой мультиспецифические антитела, и мультиспецифические антитела содержат константную область тяжелой цепи, для снижения их pI, например, можно использовать следующие последовательности: последовательность IgG2 или IgG4 в положении 137; последовательность IgG1, IgG2 или IgG4 в положении 196; последовательность IgG2 или IgG4 в положении 203; последовательность IgG2 в положении 214; последовательность IgG1, IgG3 или IgG4 в положении 217; последовательность IgG1, IgG3 или IgG4 в положении 233; последовательность IgG4 в положении 268; последовательность IgG2, IgG3 или IgG4 в положении 274; последовательность IgG1, IgG2 или IgG4 в положении 276; последовательность IgG4 в положении 355; последовательность IgG3 в положении 392; последовательность IgG4 в положении 419; или последовательность IgG1, IgG2 или IgG4 в положении 435. При этом, для повышения их pI, например, можно использовать следующие последовательности: последовательность IgG1 или IgG3 в положении 137; последовательность IgG3 в положении 196; последовательность IgG1 или IgG3 в положении 203; последовательность IgG1, IgG3 или IgG4 в положении 214; последовательность IgG2 в положении 217; последовательность IgG2 в положении 233; последовательность IgG1, IgG2 или IgG3 в положении 268; последовательность IgG1 в положении 274; последовательность IgG3 в положении 276; последовательность IgG1, IgG2 или IgG3 в положении 355; последовательность IgG1, IgG2 или IgG4 в положении 392; последовательность IgG1, IgG2 или IgG3 в положении 419; или последовательность IgG3 в положении 435.
В одном из вариантов осуществления изобретения, в котором антитела, указанные в разделе А описания, содержат две константные области тяжелой цепи, то величины pI двух константных областей тяжелой цепи могут быть одинаковыми или отличаться друг от друга. Указанные константные области тяжелых цепей могут представлять собой константные области тяжелых цепей IgG1, IgG2, IgG3 и IgG4, которые исходно имеют различные pI. Альтернативно этому, можно интродуцировать различия в pI между двумя константными областями тяжелой цепи. Модификация сайтов по меньшей мере одного аминокислотного остатка для интродукции указанного различия в pI в константную область может затрагивать положение(я), указанное(ые) выше или положение(я), выбранное(ые), например из группы, состоящей из положения 137, положения 196, положения 203, положения 214, положения 217, положения 233, положения 268, положения 274, положения 276, положения 297, положения 355, положения 392, положения 419 и положения 435, согласно EU-нумерации константной области тяжелой цепи, как описано в WO 2009/041643. Альтернативно этому, аминокислотный остаток в положении 297, который представляет собой сайт гликозилирования, можно модифицировать для удаления сахарной цепи, поскольку удаление сахарной цепи из константной области тяжелой цепи приводит к изменению pI.
В одном из вариантов осуществления изобретения антитела, указанные в разделе А или Б описания, могут представлять собой поликлональные антитела или моноклональные антитела, и предпочтительными являются происходящие из млекопитающих моноклональные антитела. Моноклональные антитела включают антитела, продуцируемые гибридомами, или полученные с помощью клеток-хозяев, трансформированных с помощью методов генетической инженерии экспрессионными векторами, которые несут гены антитела. Антитела, указанные в разделе А или Б описания, могут представлять собой, например, такие антитела, как химерные антитела, гуманизированные антитела или антитела, созданные путем созревания аффинности, или полученные из них молекулы.
В одном из вариантов осуществления изобретения антитела, указанные в разделе А или Б описания, можно получать (но не ограничиваясь только ими) из любых видов животных (например, человека; или животных кроме человека, таких как мыши, крысы, хомяки, кролики, обезьяны, обезьяны циномолгус, макаки резус, гамабрилы, бабуины, шимпанзе, козы, овцы, собаки, коровы или верблюды) или любых птиц; и антитела предпочтительно получают из человека, обезьян или мышей.
В одном из вариантов осуществления изобретения антитела, указанные в разделе А или Б описания, могут представлять собой антитела Ig-типа и предпочтительно могут представлять собой антитела IgG-типа.
В контексте разделов А и Б настоящего описания Fc-рецептор (который обозначают также как «FcR») означает рецепторный белок, который может связываться с Fc-областью иммуноглобулина (антитело) или полученной из нее молекулой, или с вариантом Fc-области. Например, Fc-рецепторы для IgG, IgA, IgE и IgM обозначают как FcγR, FcαR, FcεR и FcμR соответственно в контексте раздела А настоящего описания. Fc-рецепторы могут представлять собой, например, FcRn (который обозначают также как «неонатальный Fc-рецептор) в контексте разделов А и Б настоящего описания.
В контексте раздела А настоящего описания «FcγR» может означать рецепторный белок, который может связываться с Fc-областью антитела в виде IgG1, IgG2, IgG3 или IgG4 или полученной из нее молекулой, или вариант Fc-области, и может включать любой один или несколько или всех представителей семейства белков, кодируемых в основном геном FcγR. У человека это семейство включает (но не ограничиваясь только ими) Fсγ RI (CD64), в том числе изоформы Fсγ RIa, FcγRIb и Fсγ RIc; FcγRII (CD32), в том числе изоформы Fсγ RIIa (включая аллотипы H131 (тип Н) и R131 (тип R)), FcγRIIb (в том числе FcγRIIb-1 и Fcγ RIIb-2) и FcγRIIc; и Fcγ RIII (CD16), в том числе изоформы FcγRIIIa (включая аллотипы V158 и F158) и FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2) и любые человеческие FcγR изоформы или аллотипы FcγR, которые пока еще не открыты. Кроме того, FcγRIIb1 и FcγRIIb2 описаны в виде сплайсинговых вариантов человеческого FcγRIIb (hFcγRIIb). Кроме того, описан сплайсинговый вариант, обозначенный как FcγRIIb3 (J Exp Med, 170, 1989, cc. 1369-1385). Помимо указанных сплайсинговых вариантов человеческий FcγRIIb включает все сплайсинговые варианты, зарегистрированные в NCBI, которые представляют собой NP_001002273.1, NP_001002274.1, NP_001002275.1, NP_001177757.1 и NP_003992.3. Кроме того, hFcγRIIb включает каждый из описанных ранее генных полиморфизмов, а также FcγRIIb (Li и др., Arthritis Rheum. 48, 2003, cc. 3242-3252; Kono и др., Hum. Mol. Genet. 14, 2005, cc. 2881-2892 и Kyogoju и др., Arthritis Rheum. 46, 2002, cc. 1242-1254) и каждый генный полиморфизм, который будет описан в будущем.
FcγR можно получать из любого организма и он может включать FcγR, полученный из человека, мышей, крыс, кроликов или обезьян (но не ограничен указанными видами). Мышиные FcγR включают (но не ограничиваясь только ими) FcγRI (CD64), FcγRII (CD32), FcγRIII (CD16) и FcγRIII-2 (CD16-2) и любые пока не открытые мышиные FcγR и изоформы или аллотипы FcγR. Указанные предпочтительные FcγR включают, например, человеческий FcγRI (CD64), FcγRIIA (CD32), FcγRIIB (CD32), FcγRIIIA (CD16) или FcγRIIIB (CD16). Поскольку FcγR присутствует в виде мембранной формы in vivo, то его можно использовать в экспериментальных системах после искусственного превращения в соответствующую растворимую форму.
Например, как описано в WO 2014/163101, полинуклеотидная последовательность и аминокислотная последовательность FcγRI могут представлять собой последовательности, представленные в NM_000566.3 и NP_000557.1 соответственно; полинуклеотидная последовательность и аминокислотная последовательность FcγRIIA могут представлять собой последовательности, представленные в ВС020823.1 и ААН20823.1, соответственно; полинуклеотидная последовательность и аминокислотная последовательность FcγRIIB могут представлять собой последовательности, представленные в ВС146678.1 и AAI46679.1, соответственно; полинуклеотидная последовательность и аминокислотная последовательность FcγRIIIA могут представлять собой последовательности, представленные в ВС033678.1 и ААН33678.1 соответственно; полинуклеотидная последовательность и аминокислотная последовательность FcγRIIIB могут представлять собой последовательности, представленные в ВС128562.1 и AAI28563.1 соответственно (показы коды доступа в RefSeq).
FcγRIIa имеет два генных полиморфизма, в которых аминокислота в положении 131 FcγRIIa заменена на гистидин (тип Н) или аргинин (тип R) (J. Exp. Med. 172, 1990, сс. 19-25).
В FcγRI (CD64), который включает FcγRIa, FcγRIb и FcγRIc и FcγRIII (CD16), включающий FcγRIIIa (включая аллотипы V158 и F158), α-цепь, которая связывается с Fc-областью IgG путем ассоциации с общей γ-цепью, которая имеет ITAM (активирующие мотивы на основе тирозина иммунорецептора), передающие сигналы активации внутрь клеток. FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2) представляет собой GPI-заякоренный белок. При этом, цитоплазматический домен FcγRII (CD32), который включает FcγRIIa (включая аллотипы Н131 и R131) и изоформы FcγRIIc, содержит ITAM. Эти рецепторы экспрессируются в основном на иммунных клетках, таких как макрофаги, тучные клетки и антигенпрезентирующие клетки. Сигналы активации, трансдуцированные после связывания этих рецепторов с F-областью IgG, усиливают способность макрофагов к фагоцитозу, производство провопалительных цитокинов, дегрануляцию тучных клеток и повышенную функцию антигенпрезентирующих клеток. FcγR, который обладает способностью трансдуцировать сигналы активации, описанные выше, в контексте разделов А и Б настоящего описания обозначают также как активирующие FcγR.
При этом, цитоплазматический домен FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2) содержит ITIM (ингибирующий мотив на основе тирозина иммунорецептора), который передает ингибирующие сигналы. В В-клетках перекрестное сшивание FcγRIIb и В-клеточного рецептора (BCR) подавляет сигналы активации от BCR, что приводит к подавлению производства антител BCR. В макрофагах перекрестное сшивание FcγRIII и FcγRIIb подавляет способность к фагицитозу и к производству провоспалительных цитокинов. FcγR, который обладает способность трансдуцировать ингибирующие сигналы, описанные выше, в контексте разделов А и Б настоящего описания обозначают также как ингибирующий Fcγ-рецептор.
В контексте раздела А настоящего описания, для решения вопроса о том, повышается ли, (практически) или снижается связывающая активность антитела или Fc-области (варианта) в отношении различных FcγR по сравнению с антителом или Fc-областью (вариантом) до модификации, можно использовать методы, известные обычным специалистам в данной области. Такие методы не ограничены конкретными методами и можно применять методы, описанные в примерах и, например, BIACORE-анализ, в котором используется явление поверхностного плазмонного резонанса (SPR) (Proc. Natl. Acad. Sci. USA 103(11), 2006, cc. 4005-4010). Альтернативно этому, можно использовать, например, ELISA и флуоресцентный метод разделения клеток (FACS), а также скрининг на основе гомогенного анализа усиленной за счет эффекта близости люминисценции (Amplified Luminescent Proximity Homogeneous Assay (ALPHA). В этих анализах внеклеточный домен человеческого FcγR можно использовать в качестве растворимого антигена (например, WO 2013/047752).
Для оценки связывающей активности между FcγR-связывающим доменом, входящим в антитело или Fc-область (вариант), и FcγR, в различных условиях рН можно использовать кислые или нейтральные условия рН. В качестве температуры, при которой осуществляют измерения связывающей активности (аффинность связывания) между FcγR-связывающим доменом и FcγR, можно применять, например, любую температуру между 10°С и 50°С. Предпочтительной температурой для определения связывающей активности (аффинность связывания) между человеческим FcγR-связывающим доменом и FcγR, является, например, 15°С-40°С. Более предпочтительно для определения связывающей активности (аффинность связывания) между FcγR-связывающим доменом и FcγR можно использовать любую температуру от 20°С до 35°С, например, любую из 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 и 35°С. Примером такой температуры является 25°С (но не ограничиваясь только ею).
В одном из вариантов осуществления изобретения, когда антитело, указанное в разделе А или Б описания, имеет константную область (которая может быть модифицирована), константная область может иметь Fc-область или вариант Fc-области (предпочтительно человеческую Fc-область или вариант человеческой Fc-области) и предпочтительно имеет FcγR-связывающий домен, подпадающий под объем раздела А описания, и FcRn-связывающий домен, подпадающий под объем разделов А и Б настоящего описания.
В одном из вариантов осуществления изобретения, в котором антитело, указанное в разделе А описания, обладает FcγR-связывающей активностью, оно может иметь FcγR-связывающий домен, предпочтительно человеческий FcγR-связывающий домен. FcγR-связывающий домен не ограничен конкретным доменом, если антитело обладает связывающей активностью или аффинностью в отношении FcγR при кислом рН и/или нейтральном рН, и он может представлять собой домен, который обладает способностью прямо или косвенно связывать FcγR.
В одном из вариантов осуществления изобретения, в котором антитело, указанное в разделе А описания, обладает FcγR-связывающей активностью, предпочтительно, чтобы FcγR-связывающая активность антитела в условиях нейтрального рН повышалась по сравнению с активностью референс-антитела, которое содержит константную область нативного IgG. Для осуществления сравнения FcγR-связывающей активности двух антител предпочтительно (но не ограничиваясь только указанным), чтобы антитело, указанное в разделе А описания, и референс-антитело, которое содержит константную область нативного IgG, имели идентичные аминокислотные последовательности в областях (например, вариабельной области), предпочтительно отличных от константной области антитела, указанного в разделе А описания, которая была модифицирована в одном или нескольких аминокислотных остатках.
В одном из вариантов осуществления изобретения, в котором антитело, указанное в разделе А описания, обладает FcγR-связывающей активностью или повышенной FcγR-связывающей активностью в условиях нейтрального рН (например, рН 7,4), то, не вдаваясь в конкретную теорию, можно предположить, что антитело обладает комбинацией следующих свойств: способность осуществлять челночное движение между плазмой и клеточной эндосомой и повторно связываться с несколькими антигенами в виде одной молекулы антитела благодаря наличию зависящего от концентрации ионов антигенсвязывающего домена; способность быстро проникать в клетки благодаря повышенной pI и повышенному общему положительному заряду антитела; и способность быстро проникать в клетки благодаря повышенной FcγR-связывающей активности в условиях нейтрального рН. В результате время полужизни антитела в плазме можно дополнительно укорачивать или связывающую активность антитела с внеклеточным матриксом можно дополнительно увеличивать, или элиминацию антигена из плазмы можно дополнительно усиливать; в результате антитело, указанное в разделе А описания, обладает ценными свойствами. Обычный специалист в данной области с помощью общепринятых методов может определять оптимальную для проявления этих свойств величину pI антитела.
В одном из вариантов осуществления изобретения можно получать FcγR-связывающий домен, FcγR-связывающая активность которого выше, чем активность Fc-области или константной области нативного человеческого IgG, в котором сахарная цепь, связанная в положении 297 согласно EU-нумерации, представляет собой содержащую фукозу сахарную цепь, путем модификации аминокислотных остатков в Fc-области или константной области нативного человеческого IgG (см. WO 2013/047752). Кроме того, домен любой структуры, который связывается с FcγR, можно применять в качестве FcγR-связывающего домена. В этом случае FcγR-связывающий домен можно получать без необходимости осуществлять интродукцию аминокислотной модификации и альтернативно этому, его аффинность к FcγR можно повышать путем интродукции дополнительной модификации. Такие FcγR-связывающие домены могут включать Fab-фрагмент антител, которые связываются с FcγRIIIa, однодоменного антитела верблюдовых и антител в виде одноцепочечных Fv, которые описаны у Schlapschly и др., Protein Eng. Des. Sel. 22 (3), 2009 cc. 175-188, Behar и др., Protein Eng. Des. Sel. 21(1), 2008, cc. 1-10 и Kipriyanov и др., J Immunol. 169(1), 2002, cc. 137-144, и FcγRI-связывающий циклический пептид, описанный у Bonetto и др., FASEB J. 23(2), 2009, сс. 575-585. Является ли FcγR-связывающая активность FcγR-связывающего домена выше, чем активность Fc-области или константной области нативного человеческого IgG, в котором сахарная цепь, связанная в положении 297, согласно EU-нумерации представляет собой содержащую фукозу сахарную цепь, можно оценивать соответственно с использованием описанных выше методов.
В одном из вариантов осуществления изобретения, указанном в разделе А описания, исходный FcγR-связывающий домен предпочтительно включает, например, Рс-область(человеческого) IgG или константную область(человеческого) IgG. Если вариант исходной Fc-области или исходной константной области может связываться с человеческим FcγR в нейтральном диапазоне рН, то любую Fc-область или константную область можно применять в качестве исходной Fc-области или исходной константной области. Fc-область или константную область, полученную путем дополнительной модификации исходной Fc-области или исходной константной области, в которой аминокислотный(ые) остаток(и) уже модифицированы по сравнению с Fc-область или константной областью, можно также применять соответственно в качестве Fc-области или константной области, указанной в разделе А описания. Под исходной Fc-областью или исходной константной областью может подразумеваться сам полипептид, композиция, содержащая исходную Fc-область или исходную константную область, или аминокислотная последовательность, соответствующая исходной Fc-области или исходной константной области. Исходная Fc-область или исходная константная область может включать известные Fc-области или известные константные области, полученные с помощью методов рекомбинации. Источник исходной Fc-области или исходной константной области не ограничен конкретным источником и их можно получать из любого организма животных кроме человека или человека. Кроме того, исходный FcγR-связывающий домен можно получать из обезьян циномлгус, мармозеток, макак резус, шимпанзе или человека. Исходную Fc-область или исходную константную область можно предпочтительно получать из человеческого IgG1; однако они не ограничены конкретным классом IgG. Это означает, что Fc-область человеческого IgG1, IgG2, IgG3 или IgG4 можно использовать в качестве приемлемого исходного FcγR-связывающего домена, и это означает также, что в контексте раздела А настоящего описания Fc-область или константную область IgG-класса или подкласса, полученную из любого организма, предпочтительно можно использовать в качестве исходной Fc-области или исходной константной области. Примеры варианта или модифицированной формы нативного IgG описаны в опубликованной известной литературе, например, у Strohl, Curr. Opin. Biotechnol. 20(6), 2009, cc. 685-691; Presta, Curr. Opin. Immunol. 20(4), 2008, cc. 460-470; Davis и др., Protein Eng. Des. Sel. 23(4), 2010, cc. 195-202; в WO 2009/086320, WO 2008/092117; WO 2007/041635; и WO 2006/105338 (но не ограничиваясь только ими).
В одном из вариантов осуществления изобретения аминокислотные остатки исходного FcγR-связывающего домена исходной Fc-области или исходной константной области могут содержать, например, одну или несколько мутаций: например, замены аминокислотными остатками, которые отличаются от остатков в исходной Fc-области или исходной константной области; инсерции одного или нескольких аминокислотных остатков в аминокислотные остатки в исходной Fc-области или исходной константной области; или делеции одного или нескольких аминокислотных остатков из исходной Fc-области или исходной константной области. Аминокислотные последовательности Fc-областей или константных областей после модификаций предпочтительно представляют собой аминокислотные последовательности, содержащие по меньшей мере часть Fc области или константной области, которая может не встречаться в естественных условиях. Такие варианты должны быть идентичными или иметь сходство последовательностей на уровне менее 100% с исходными Fc-областями или исходными константными областями. Например, варианты имеют аминокислотную последовательность, идентичную или сходную примерно на уровне от 75% до менее чем 100%, более предпочтительно примерно от 80% до менее чем 100%, еще более предпочтительно примерно от 85% до менее чем 100%, еще более предпочтительно примерно от 90% до менее чем 100% и еще более предпочтительно примерно от 95% до менее чем 100%, с аминокислотной последовательностью исходной Fc-области или исходной константной области. В примере, который не ограничивает объем изобретения, по меньшей мере одна аминокислота в модифицированной Fc-области или константной области, указанной в разделе А описания, отличается от аминокислоты в исходной Fc-области или исходной константной области.
В одном из вариантов осуществления изобретения Fc-область или константную область, которая обладает FcγR-связывающей активностью в кислом диапазоне рН и/или нейтральном диапазоне рН, которая может входить в антитело, указанное в разделе А описания, можно получать любым методом. В частности, вариант Fc-области или константной области, которая обладает FcγR-связывающей активностью в нейтральном диапазоне рН, можно получать путем модификации аминокислот человеческого антитела IgG-типа, которое можно применять в качестве исходной Fc-области или исходной константной области. Fc-области антитела IgG-типа или константные области антитела IgG-типа, пригодные для модификации, могут включать, например, Fc-области или константные области человеческого IgG (IgG1, IgG2, IgG3 или IgG4 или их варианты) и мутанты, спонтанно образовавшиеся из них. Для Fc-областей или константных областей антител в виде человеческого IgG1, человеческого IgG2, человеческого IgG3 или человеческого IgG4 множество аллотипических последовательностей IgG, связанных с генетическим полиморфизмом, описаны в «Sequences proteins of immunological interest)), публикация NIH №91-3242 и любые из них можно использовать в разделе А описания. В частности, в случае человеческого IgG1 аминокислотная последовательность в положениях 356-358 согласно EU-нумерация может представлять собой либо DEL, либо ЕЕМ.
В другом варианте осуществления изобретения в контексте раздела А описания модификация других аминокислот не ограничена указанными, если варианты обладают FcγR-связывающей активностью в нейтральном диапазоне рН. Аминокислотное(ые) положение(я) указанной модификации описаны, например, в: WO 2007/024249, WO 2007/021841, WO 2006/031370, WO 2000/042072, WO 2004/029207, WO 2004/099249, WO 2006/105338, WO 2007/041635, WO 2008/092117, WO 2005/070963, WO 2006/020114, WO 2006/116260, WO 2006/023403, WO 2013/047752, WO 2006/019447, WO 2012/115241, WO 2013/125667, WO 2014/030728, WO 2014/163101, WO 2013/118858 и WO 2014/030750.
Сайты аминокислотной модификации в константной области или Fc-области, предназначенной для повышения FcγR-связывающей активности в нейтральном диапазоне рН, могут включать, например, одно или несколько положений, выбранных из группы, состоящей из положения: 221, 222, 223, 224, 225, 227, 228, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 243, 244, 245, 246, 247, 249, 250, 251, 254, 255, 256, 258, 260, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 278, 279, 280, 281, 282, 283, 284, 285, 286, 288, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 311, 313, 315, 317, 318, 320, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 339, 376, 377, 378, 379, 380, 382, 385, 392, 396, 421, 427, 428, 429, 434, 436 и 440, согласно EU-нумерации в Fc-области или константной области человеческого антитела IgG-типа, описанные в WO 2013/047752. Модификация указанного аминокислотного остатка может повышать FcγR-связывающую активность Fc-области или константной области антитела IgG-типа в условиях нейтрального рН. В WO 2013/047752 описаны в качестве предпочтительных модификаций в константной области или Fc-области IgG-типа, например, модификация одного или нескольких аминокислотных остатков, выбранных из группы, состоящей из: аминокислоты в положении 221 на Lys или Tyr; аминокислоты в положении 222 на любую из Phe, Trp, Glu и Tyr; аминокислоты в положении 223 на любую из Phe, Trp, Glu и Lys; аминокислоты в положении 224 на любую из Phe, Trp, Glu и Tyr; аминокислоты в положении 225 на любую из Glu, Lys и Trp; аминокислоты в положении 227 на любую из Glu, Gly, Lys и Tyr; аминокислоты в положении 228 на любую из Glu, Gly, Lys и Tyr; аминокислоты в положении 230 на любую из Ala, Glu, Gly и Tyr; аминокислоты в положении 231 на любую из Glu, Gly, Lys, Pro и Tyr; аминокислоты в положении 232 на любую из Glu, Gly, Lys и Tyr; аминокислоты в положении 233 на любую из Ala, Asp, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 234 на любую из Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 235 на любую из Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 236 на любую из Ala, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 237 на любую из Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 238 на любую из Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 239 на любую из Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp и Tyr; аминокислоты в положении 240 на любую из Ala, Ile, Met и Thr; аминокислоты в положении 241 на любую из Asp, Glu, Leu, Arg, Trp и Tyr; аминокислоты в положении 243 на любую из Glu, Leu, Gln, Arg, Trp и Tyr; аминокислоты в положении 244 на His; аминокислоты в положении 245 на Ala; аминокислоты в положении 246 на любую из Asp, Glu, His и Tyr; аминокислоты в положении 247 на любую из Ala, Phe, Gly, His, Ile, Leu, Met, Thr, Val и Tyr; аминокислоты в положении 249 на любую из Glu, His, Gin и Tyr; аминокислоты в положении 250 на Glu или Gin; аминокислоты в положении 251 на Phe; аминокислоты в положении 254 на любую из Phe, Met и Tyr; аминокислоты в положении 255 на любую из Glu, Leu и Tyr; аминокислоты в положении 256 на любую из Ala, Met и Pro; аминокислоты в положении 258 на любую из Asp, Glu, His, Ser и Tyr; аминокислоты в положении 260 на любую из Asp, Glu, His и Tyr; аминокислоты в положении 262 на любую из Ala, Glu, Phe, Ile и Thr; аминокислоты в положении 263 на любую из Ala, Ile, Met и Thr; аминокислоты в положении 264 на любую из Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Trp и Tyr; аминокислоты в положении 265 на любую из Ala, Leu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 266 на любую из Ala, Ile, Met и Thr; аминокислоты в положении 267 на любую из Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp и Tyr; аминокислоты в положении 268 на любую из Asp, Glu, Phe, Gly, He, Lys, Leu, Met, Pro, Gln, Arg, Thr, Val и Trp; аминокислоты в положении 269 на любую из Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 270 на любую из Glu, Phe, Gly, His, Ile, Leu, Met, Pro, Gln, Arg, Ser, Thr, Trp и Tyr; аминокислоты в положении 271 на любую из Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 272 на любую из Asp, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 273 или на Phe, или на Ile; аминокислоты в положении 274 на любую из Asp, Glu, Phe, Gly, His, Ile, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 275 на Leu или на Trp; аминокислоты в положении 276 на любую из Asp, Glu, Phe, Gly, His, Ile, Leu, Met, Pro, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 278 на любую из Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val и Trp; аминокислоты в положении 279 на Ala; аминокислоты в положении 280 на любую из Ala, Gly, His, Lys, Leu, Pro, Gln, Trp и Tyr; аминокислоты в положении 281 на любую из Asp, Lys, Pro и Tyr; аминокислоты в положении 282 на любую из Glu, Gly, Lys, Pro и Tyr; аминокислоты в положении 283 на любую из Ala, Gly, His, Ile, Lys, Leu, Met, Pro, Arg и Tyr; аминокислоты в положении 284 на любую из Asp, Glu, Leu, Asn, Thr и Tyr; аминокислоты в положении 285 на любую из Asp, Glu, Lys, Gln, Trp и Tyr; аминокислоты в положении 286 на любую из Glu, Gly, Pro и Tyr; аминокислоты в положении 288 на любую из Asn, Asp, Glu и Tyr; аминокислоты в положении 290 на любую из Asp, Gly, His, Leu, Asn, Ser, Thr, Trp и Tyr; аминокислоты в положении 291 на любую из Asp, Glu, Gly, His, Ile, Gin и Thr; аминокислоты в положении 292 на любую из Ala, Asp, Glu, Pro, Thr и Tyr; аминокислоты в положении 293 на любую из Phe, Gly, His, Ile, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 294 на любую из Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 295 на любую из Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 296 на любую из Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr и Val; аминокислоты в положении 297 на любую из Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 298 на любую из Ala, Asp, Glu, Phe, His, Ile, Lys, Met, Asn, Gln, Arg, Thr, Val, Trp и Tyr; аминокислоты в положении 299 на любую из Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp и Tyr; аминокислоты в положении 300 на любую из Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val и Trp; аминокислоты в положении 301 на любую из Asp, Glu, His и Tyr; аминокислоты в положении 302 to Ile; аминокислоты в положении 303 на любую из Asp, Gly и Tyr; аминокислоты в положении 304 на любую из Asp, His, Leu, Asn и Thr; аминокислоты в положении 305 на любую из Glu, Ile, Thr и Tyr; аминокислоты в положении 311 на любую из Ala, Asp, Asn, Thr, Val и Tyr; аминокислоты в положении 313 на Phe; аминокислоты в положении 315 на Leu; аминокислоты в положении 317 или на Glu, или на Gin; аминокислоты в положении 318 на любую из His, Leu, Asn, Pro, Gln, Arg, Thr, Val и Tyr; аминокислоты в положении 320 на любую из Asp, Phe, Gly, His, Ile, Leu, Asn, Pro, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 322 на любую из Ala, Asp, Phe, Gly, His, Ile, Pro, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 323 to Ilе; аминокислоты в положении 324 на любую из Asp, Phe, Gly, His, Ile, Leu, Met, Pro, Arg, Thr, Val, Trp и Tyr; аминокислоты в положении 325 на любую из Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 326 на любую из Ala, Asp, Glu, Gly, Ile, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 327 на любую из Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Thr, Val, Trp и Tyr; аминокислоты в положении 328 на любую из Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 329 на любую из Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 330 на любую из Cys, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 331 на любую из Asp, Phe, His, Ile, Leu, Met, Gln, Arg, Thr, Val, Trp и Tyr; аминокислоты в положении 332 на любую из Ala, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp и Tyr; аминокислоты в положении 333 на любую из Ala, Asp, Glu, Phe, Gly, His, Ile, Leu, Met, Pro, Ser, Thr, Val и Tyr; аминокислоты в положении 334 на любую из Ala, Glu, Phe, Ile, Leu, Pro и Thr; аминокислоты в положении 335 на любую из Asp, Phe, Gly, His, Ile, Leu, Met, Asn, Pro, Arg, Ser, Val, Trp и Tyr; аминокислоты в положении 336 на любую из Glu, Lys и Tyr; аминокислоты в положении 337 на любую из Glu, His и Asn; аминокислоты в положении 339 на любую из Asp, Phe, Gly, Ile, Lys, Met, Asn, Gln, Arg, Ser и Thr; аминокислоты в положении 376 или на Ala, или на Val; аминокислоты в положении 377 to either Gly или Lys; аминокислоты в положении 378 to Asp; аминокислоты в положении 379 на Asn; аминокислоты в положении 380 на любую из Ala, Asn и Ser; аминокислоты в положении 382 или на Ala, или на Ile; аминокислоты в положении 385 на Glu; аминокислоты в положении 392 на Thr; аминокислоты в положении 396 на Leu; аминокислоты в положении 421 на Lys; аминокислоты в положении 427 на Asn; аминокислоты в положении 428 или на Phe, или на Leu; аминокислоты в положении 429 на Met; аминокислоты в положении 434 на Trp; аминокислоты в положении 436 на Ile; и аминокислоты в положении 440 на любую из Gly, His, Ile, Leu и Tyr, согласно EU-нумерации. Количество аминокислот, которые можно модифицировать, не ограничено, и можно модифицировать аминокислоту только в одном положении или аминокислоты в двух или большем количестве положений. Комбинации аминокислотных модификаций в двух или большем количестве положений представлены в таблице 5 в WO 2013/047752. Модификацию этих аминокислотных остатков можно также интродуцировать соответственно в антитела, указанные в разделе А описания.
В одном из вариантов осуществления изобретения связывающая активность (FcγR-связывающего домена) антитела, указанного в разделе А описания, в отношении (человеческих) FcγR, таких как один или несколько из FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa и FcγRIIIb, может быть выше, чем активность (Fc-области или константной области) нативного IgG или референс-антитела, содержащего исходную Fc-область или исходную константную область. Например, FcγR-связывающая активность (FcγR-связывающего домена) антитела, указанного в разделе А описания, может составлять 55% или более, 60% или более, 65% или более, 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 95% или более, 100% или более, 105% или более, предпочтительно 110% или более, 115% или более, 120% или более, 125% или более, особенно предпочтительно 130% или более, 135% или более, 140% или более, 145% или более, 150% или более, 155% или более, 160% или более, 165% или более, 170% или более, 175% или более, 180% или более, 185% или более, 190% или более, или 195% или более по сравнению с FcγR-связывающей активностью референс-антитела, в или 2 или более, 2,5 или более, 3 или более, 3,5 или более, 4 или более, 4,5 или более, 5 или более, 7,5 или более, 10 или более, 20 или более, 30 или более, 40 или более, 50 или более, 60 или более, 70 или более, 80 или более, 90 или более или 100 или более раз выше, чем FcγR-связывающая активность референс-антитела.
В другом варианте осуществления изобретения уровень повышения связывающей активности с ингибирующим FcγR (FcγRIIb-1 и/или FcγRIIb-2) (в нейтральном диапазоне рН) может быть выше, чем уровень повышения связывающей активности с активирующим FcγR (FcγRIa: FcγRIb; FcγRIc; FcγRIIIa, включая аллотип V158; FcγRIIIa, включая аллотип F158; FcγRIIIb, включая аллотип FcγRIIIb-NA1; FcγRIIIb, включая аллотип FcγRIIIb-NA2; FcγRIIa, включая аллотип Н131; или FcγRIIa, включая аллотип R131).
В одном из вариантов осуществления изобретения антитело, указанное в разделе А описания, может обладать связывающей активностью в отношении FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2).
В одном из вариантов осуществления изобретения предпочтительные FcγR- связывающие домены, указанные в разделе А описания, включают также, например, FcγR-связывающие домены, связывающая активность которых с конкретным FcγR выше, чем связывающая активность с другим FcγR (FcγR-связывающие домены с избирательной FcγR-связывающей активностью). Когда применяют антитело (или Fc-область в качестве FcγR-связывающего домена), то одна молекула антитела может связываться только с одной молекулой FcγR. Таким образом, одна молекула антитела, находящаяся в связанном с ингибирующим FcγR состоянии, не может связываться с другими активирующими FcγR, и одна молекула антитела, находящаяся в связанном с активирующим FcγR состоянии, не может связываться с другими активирующими FcγR или ингибирующими FcγR.
Как описано выше, активирующий FcγR предпочтительно включает, например, FcγRI (CD64), такой как FcγRIa, FcγRIb или FcγRIc; и FcγRIII (CD16), такой как FcγRIIIa (такой как аллотип V158 или F158) или FcγRIIIb (такой как аллотип FcγRIIIb-NA1 или FcγRIIIb-NA2). А ингибирующий FcγR предпочтительно включает, например, FcγRIIb (такой как FcγRIIb-1 или FcγRIIb-2).
В одном из вариантов осуществления изобретения FcγR-связывающие домены, которые обладают более высокой связывающей активностью в отношении ингибирующего FcγR, чем в отношении активирующего FcγR, можно применять в качестве избирательного FcγR-связывающего домена, входящего в антитело, указанное в разделе А описания. Такие избирательные FcγR-связывающие домены могут включать, например, FcγR-связывающие домены, которые обладают более высокой связывающей активностью в отношении FcγRIIb (такого как FcγRIIb-1 и/или FcγRIIb-2), чем в отношении любого одного или нескольких активирующих FcγR, выбранных из группы, состоящей из: FcγRI (CD64), такой как FcγRIa, FcγRIb или FcγRIc; FcγRIII (CD16), такой как FcγRIIIa (такой как аллотип V158 или F158) или FcγRIIIb (такой как FcγRIIIb-NA1 или FcγRIIIb-NA2); FcγRII (CD32), такой как FcγRIIa (включая аллотип Н131 или R131); HFcγRIIc.
Кроме того, обладает ли FcγR-связывающий домен избирательной связывающей активностью, можно определять путем сравнения связывающей активности в отношении каждого FcγR, осуществляя анализ с помощью описанных выше методов, например, путем сравнения величины (отношения), полученной путем деления величины KD для активирующего FcγR на величину KD для ингибирующего FcγR, более конкретно путем сравнения индекса избирательного действия в отношении FcγR, рассчитанного с помощью приведенного ниже уравнения 1:
Уравнение 1:
индекс избирательного действия в отношении FcγR = величина KD для активирующего FcγR/величина KD для ингибирующего FcγR
В уравнении 1 величина KD для активирующего FcγR означает величину KD для одного или нескольких из: FcγRIa; FcγRIb; FcγRIc; FcγRIIIa, включая аллотип V158 и/или F158; FcγRIIIb, включая FcγRIIIb-NA1 и/или FcγRIIIb-NA2; FcγRIIa, включая аллотип H131 и/или R131; и FcγRIIc; а величина KD для ингибирующего FcγR означает величину KD для FcγRIIb-1 и/или FcγRIIb-2. Активирующий FcγR и ингибирующий FcγR для применения при определении величин KD можно выбирать из любой их комбинации. Например, можно применять величину (отношение), определенную(ое) путем деления величины KD для FcγRIIa, включая аллотип H131, на величину KD для FcγRIIb-1 и/или FcγRIIb-2 (но не ограничиваясь только ими).
Для FcγR индекс избирательного действия может составлять, например: 1,2 или выше, 1,3 или выше, 1,4 или выше, 1,5 или выше, 1,6 или выше, 1,7 или выше, 1,8 или выше, 1,9 или выше, 2 или выше, 3 или выше, 5 или выше, 6 или выше, 7 или выше, 8 или выше, 9 или выше, 10 или выше, 15 или выше, 20 или выше, 25 или выше, 30 или выше, 35 или выше, 40 или выше, 45 или выше, 50 или выше, 55 или выше, 60 или выше, 65 или выше, 70 или выше, 75 или выше, 80 или выше, 85 или выше, 90 или выше, 95 или выше, 100 или выше, 110 или выше, 120 или выше, 130 или выше, 140 или выше, 150 или выше, 160 или выше, 170 или выше, 180 или выше, 190 или выше, 200 или выше, 210 или выше, 220 или выше, 230 или выше, 240 или выше, 250 или выше, 260 или выше, 270 или выше, 280 или выше, 290 или выше, 300 или выше, 310 или выше, 320 или выше, 330 или выше, 340 или выше, 350 или выше, 360 или выше, 370 или выше, 380 или выше, 390 или выше, 400 или выше, 410 или выше, 420 или выше, 430 или выше, 440 или выше, 450 или выше, 460 или выше, 470 или выше, 480 или выше, 490 или выше, 500 или выше, 520 или выше, 540 или выше, 560 или выше, 580 или выше, 600 или выше, 620 или выше, 640 или выше, 660 или выше, 680 или выше, 700 или выше, 720 или выше, 740 или выше, 760 или выше, 780 или выше, 800 или выше, 820 или выше, 840 или выше, 860 или выше, 880 или выше, 900 или выше, 920 или выше, 940 или выше, 960 или выше, 980 или выше, 1000 или выше, 1500 или выше, 2000 или выше, 2500 или выше, 3000 или выше, 3500 или выше, 4000 или выше, 4500 или выше, 5000 или выше, 5500 или выше, 6000 или выше, 6500 или выше, 7000 или выше, 7500 или выше, 8000 или выше, 8500 или выше, 9000 или выше, 9500 или выше, 10000 или выше, или 100000 или выше (но не ограничиваясь только ими).
В одном из вариантов осуществления изобретения (антитело, содержащее) вариант Fc-области или вариант константной области, в котором аминокислота в положении 238 или 328 согласно EU-нумерации человеческого IgG (IgG1, IgG2, IgG3 или IgG4) представляет собой Asp или Glu соответственно, можно предпочтительно использовать в антителах, указанных в разделе А описания, которые содержат вариант Fc-области или вариант константной области, поскольку, как описано конкретно в WO 2013/125667, WO 2012/115241 и WO 2013/047752, они обладают более высокой связывающей активностью в отношении FcγRIIb-1 и/или FcγRIIb-2, чем в отношении FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, включая аллотип V158, FcγRIIIa, включая аллотип F158, FcγRIIIb, включая аллотип FcγRIIIb-NA1, FcγRIIIb, включая аллотип FcγRIIIb-NA2, FcγRIIa, включая аллотип H131, FcγRIIa, включая аллотип R131 и/или FcγRIIc. В этом варианте осуществления изобретения антитела, указанные в разделе А описания, обладают связывающей активностью в отношении всех активирующих FcγR (которые в контексте настоящего описания выбирают из группы, состоящей из FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, FcγRIIIb, FcγRIIa) и FcγRIIb, и их FcγRIIb-связывающая активность сохраняется или возрастает и/или их связывающая активность со всеми активирующими FcγR снижается по сравнению с референс-антителом, которое содержит константную область нативного IgG или Fc-область нативного IgG.
В одном из вариантов осуществления изобретения касательно антител, указанных в разделе А описания, которые содержат вариант Fc-области или вариант константной области, их связывающая активность в отношении FcγRIIb может сохраняться или возрастать и их связывающая активность в отношении FcγRIIa (типа Н) и FcγRIIa (типа R) может снижаться по сравнению с активностью референс-антитела, имеющего константную область или Fc-область нативного IgG. Указанные антитела имеют повышенную избирательность связывания FcγRIIb относительное FcγRIIa.
В контексте раздела А настоящего описания степень, в которой «снижается связывающая активность в отношении всех активирующих FcγR», может составлять (но не ограничиваясь только указанным) 99% или менее, 98% или менее, 97% или менее, 96% или менее, 95% или менее, 94% или менее, 93% или менее, 92% или менее, 91% или менее, 90% или менее, 88% или менее, 86% или менее, 84% или менее, 82% или менее, 80% или менее, 78% или менее, 76% или менее, 74% или менее, 72% или менее, 70% или менее, 68% или менее, 66% или менее, 64% или менее, 62% или менее, 60% или менее, 58% или менее, 56% или менее, 54% или менее, 52% или менее, 50% или менее, 45% или менее, 40% или менее, 35% или менее, 30% или менее, 25% или менее, 20% или менее, 15% или менее, 10% или менее, 5% или менее, 4% или менее, 3% или менее, 2% или менее, 1% или менее, 0,5% или менее, 0,4% или менее, 0,3% или менее, 0,2% или менее, 0,1% или менее, 0,05% или менее, 0,01% или менее, или 0,005% или менее.
В контексте раздела А настоящего описания степень, в которой «FcγRIIb-связывающая активность сохраняется или увеличивается», «связывающая активность в отношении FcγRIIb сохраняется или увеличивается» или «сохранение или увеличение связывающей активности в отношении FcγRIIb», может составлять (но не ограничиваясь только указанным) 55% или выше, 60% или выше, 65% или выше, 70% или выше, 75% или выше, 80% или выше, 85% или выше, 87% или выше, 88% или выше, 89% или выше, 90% или выше, 91% или выше, 92% или выше, 93% или выше, 94% или выше, 95% или выше, 96% или выше, 97% или выше, 98% или выше, 99% или выше, 99.5% или выше, 100% или выше, 101% или выше, 102% или выше, 103% или выше, 104% или выше, 105% или выше, 106% или выше, 107% или выше, 108% или выше, 109% или выше, 110% или выше, 112% или выше, 114% или выше, 116% или выше, 118% или выше, 120% или выше, 122% или выше, 124% или выше, 126% или выше, 128%о или выше, 130% или выше, 132% или выше, 134% или выше, 136% или выше, 138% или выше, 140% или выше, 142% или выше, 144% или выше, 146% или выше, 148% или выше, 150% или выше, 155% или выше, 160% или выше, 165% или выше, 170% или выше, 175% или выше, 180% или выше, 185% или выше, 190% или выше, 195% или выше, превышать в 2 раза или более, 3 или более, 4 или более, 5 или более, 6 или более, 7 или более, 8 или более, 9 или более, 10 или более, 20 или более, 30 или более, 40 или более, 50 или более, 60 или более, 70 или более, 80 или более, 90 или более, 100 или более, 200 или более, 300 или более, 400 или более, 500 или более, 600 или более, 700 или более, 800 или более, 900 или более, 1000 или более, 10000 или более или 100000 раз или более.
В контексте раздела А настоящего описания степень, в которой «связывающая активность в отношении FcγRIIa (типа Н) и FcγRIIa (типа R) снижается» или «снижение связывающей активности в отношении FcγRIIa (типа Н) и FcγRIIa (типа R)», может составлять (но не ограничиваясь только указанным) 99% или менее, 98% или менее, 97% или менее, 96% или менее, 95% или менее, 94% или менее, 93% или менее, 92% или менее, 91% или менее, 90% или менее, 88% или менее, 86% или менее, 84% или менее, 82% или менее, 80% или менее, 78% или менее, 76% или менее, 74% или менее, 72% или менее, 70% или менее, 68% или менее, 66% или менее, 64% или менее, 62% или менее, 60% или менее, 58% или менее, 56% или менее, 54% или менее, 52% или менее, 50% или менее, 45% или менее, 40% или менее, 35% или менее, 30% или менее, 25% или менее, 20% или менее, 15% или менее, 10% или менее, 5% или менее, 4% или менее, 3% или менее, 2% или менее, 1% или менее, 0,5% или менее, 0,4% или менее, 0,3% или менее, 0,2% или менее, 0,1% или менее, 0,05% или менее, 0,01% или менее, или 0,005% или менее.
В контексте раздела А настоящего описания модификации, приводящие к повышению избирательности связывания с FcγRIIb по сравнению с FcγRIIa (типа R), могут предпочтительно представлять собой модификации, которые повышают избирательность связывания с FcγRIIb по сравнению с FcγRIIa (типа Н), могут представлять собой более предпочтительно модификации, указанные в WO 2013/047752, предпочтительные аминокислотные замены для таких модификаций могут включать, например, согласно EU-нумерации: (а) модификацию путем замены Gly в положении 237 на Trp; (б) модификацию путем замены Gly в положении 237 на Phe; (в) модификацию путем замены Pro в положении 238 на Phe; (г) модификацию путем замены Asn в положении 325 на Met; (д) модификацию путем замены Ser в положении 267 на Ile; (е) модификацию путем замены Leu в положении 328 на Asp; (ж) модификацию путем замены Ser в положении 267 на Val; (з) модификацию путем замены Leu в положении 328 на Trp; (и) модификацию путем замены Ser в положении 267 на Gin; (к) модификацию путем замены Ser в положении 267 на Met; (л) модификацию путем замены Gly в положении 236 на Asp; (м) модификацию путем замены Ala в положении 327 на Asn; (н) модификацию путем замены Asn в положении 325 на Ser; (о) модификацию путем замены Leu в положении 235 на Tyr; (п) модификацию путем замены Val в положении 266 на Met; (р) модификацию путем замены Leu в положении 328 на Tyr; (с) модификацию путем замены Leu в положении 235 на Trp; (т) модификацию путем замены Leu в положении 235 на Phe; (у) модификацию путем замены Ser в положении 239 на Gly; (ф) модификацию путем замены Ala в положении 327 на Glu; (х) модификацию путем замены Ala в положении 327 на Gly; (ц) модификацию путем замены Pro в положении 238 на Leu; (ч) модификацию путем замены Ser в положении 239 на Leu; (ш) модификацию путем замены Leu в положении 328 на Thr; (щ) модификацию путем замены Leu в положении 328 на Ser; (э) модификацию путем замены Leu в положении 328 на Met; (аа) модификацию путем замены Pro в положении 331 на Trp; (аб) модификацию путем замены Pro в положении 331 на Tyr; (ав) модификацию путем замены Pro в положении 331 на Phe; (аг) модификацию путем замены Ala в положении 327 на Asp; (ад) модификацию путем замены Leu в положении 328 на Phe; (ае) модификацию путем замены Pro в положении 271 на Leu; (аж) модификацию путем замены Ser в положении 267 на Glu; (аз) модификацию путем замены Leu в положении 328 на Ala; (аи) модификацию путем замены Leu в положении 328 на Ile; (ак) модификацию путем замены Leu в положении 328 Gin; (ал) модификацию путем замены Leu в положении 328 на Val; (ам) модификацию путем замены Lys в положении 326 на Trp; (ан) модификацию путем замены Lys в положении 334 на Arg; (ао) модификацию путем замены His в положении 268 на Gly; (an) модификацию путем замены His в положении 268 на Asn; (ар) модификацию путем замены Ser в положении 324 на Val; (ас) модификацию путем замены Val в положении 266 на Leu; (ат) модификацию путем замены Pro в положении 271 на Gly; (ay) модификацию путем замены Ile в положении 332 на Phe; (аф) модификацию путем замены Ser в положении 324 на Ile; (ах) модификацию путем замены Glu в положении 333 на Pro; (ац) модификацию путем замены Tyr в положении 300 на Asp; (ач) модификацию путем замены Ser в положении 337 на Asp; (аш) модификацию путем замены Tyr в положении 300 на Gin; (ащ) модификацию путем замены Thr в положении 335 на Asp; (аэ) модификацию путем замены Ser в положении 239 на Asn; (ба) модификацию путем замены Lys в положении 326 на Leu; (бб) модификацию путем замены Lys в положении 326 на Ile; (бв) модификацию путем замены Ser в положении 239 на Glu; (бг) модификацию путем замены Lys в положении 326 на Phe; (бд) модификацию путем замены Lys в положении 326 на Val; (бе) модификацию путем замены Lys в положении 326 на Tyr; (бж) модификацию путем замены Ser в положении 267 на Asp; (бз) модификацию путем замены Lys в положении 326 на Pro; (би) модификацию путем замены Lys в положении 326 на His; (бк) модификацию путем замены Lys в положении 334 на Ala; (бл) модификацию путем замены Lys в положении 334 на Trp; (бм) модификацию путем замены His в положении 268 на Gin; (бн) модификацию путем замены Lys в положении 326 на Gin; (бо) модификацию путем замены Lys в положении 326 на Glu; (бп) модификацию путем замены Lys в положении 326 на Met; (бр) модификацию путем замены Val в положении 266 на Ile; (бс) модификацию путем замены Lys в положении 334 на Glu; (бт) модификацию путем замены Tyr в положении 300 на Glu; (бу) модификацию путем замены Lys в положении 334 на Met; (бф) модификацию путем замены Lys в положении 334 на Val; (бх) модификацию путем замены Lys в положении 334 на Thr; (бц) модификацию путем замены Lys в положении 334 на Ser; (бч) модификацию путем замены Lys в положении 334 на His; (бш) модификацию путем замены Lys в положении 334 на Phe; (бщ) модификацию путем замены Lys в положении 334 на Gin; (бэ) модификацию путем замены Lys в положении 334 на Pro; (ва) модификацию путем замены Lys в положении 334 на Tyr; (вб) модификацию путем замены Lys в положении 334 на Ile; (вв) модификацию путем замены Gin в положении 295 на Leu; (вг) модификацию путем замены Lys в положении 334 на Leu; (вд) модификацию путем замены Lys в положении 334 на Asn; (ве) модификацию путем замены His в положении 268 на Ala; (вж) модификацию путем замены Ser в положении 239 на Asp; (вз) модификацию путем замены Ser в положении 267 на Ala; (ви) модификацию путем замены Leu в положении 234 на Trp; (вк) модификацию путем замены Leu в положении 234 на Tyr; (вл) модификацию путем замены Gly в положении 237 на Ala; (вм) модификацию путем замены Gly в положении 237 на Asp; (вн) модификацию путем замены Gly в положении 237 на Glu; (во) модификацию путем замены Gly в положении 237 на Leu; (вп) модификацию путем замены Gly в положении 237 на Met; (вр) модификацию путем замены Gly в положении 237 на Tyr; (вс) модификацию путем замены Ala в положении 330 на Lys; (вт) модификацию путем замены Ala в положении 330 на Arg; (ву) модификацию путем замены Glu в положении 233 на Asp; (вф) модификацию путем замены His в положении 268 на Asp; (вх) модификацию путем замены His в положении 268 на Glu; (вц) модификацию путем замены Lys в положении 326 на Asp; (вч) модификацию путем замены Lys в положении 326 на Ser; (вш) модификацию путем замены Lys в положении 326 на Thr; (вщ) модификацию путем замены Val в положении 323 на Ile; (вэ) модификацию путем замены Val в положении 323 на Leu; (га) модификацию путем замены Val в положении 323 на Met; (гб) модификацию путем замены Tyr в положении 296 на Asp; (гв) модификацию путем замены Lys в положении 326 на Ala; (гг) модификацию путем замены Lys в положении 326 на Asn; и (гд) модификацию путем замены Ala в положении 330 на Met.
Модификации, описанные выше, могут присутствовать только в одном положении или в двух или большем количестве положений в комбинации. Альтернативно этому, указанные предпочтительные модификации могут включать, например, представленные в таблицах 14-15, 17-24 и 26-28 WO 2013/047752, например, варианты человеческой константной области или человеческой Fc-области, в которых аминокислота в положении 238 согласно EU-нумерации представляет собой Asp, а аминокислота в положении 271 согласно EU-нумерации представляет собой Gly в человеческом IgG (IgG1, IgG2, IgG3 или IgG4); кроме того, одно или несколько положение(й) 233, 234, 237, 264, 265, 266, 267, 268, 269, 272, 296, 326, 327, 330, 331, 332, 333 и 396 согласно EU-нумерации может(гут) быть замещено(ы). В этом случае варианты могут включать (но не ограничиваясь только ими) варианты человеческой константной области или человеческой Fc-области, которая содержит одну или несколько аминокислот из:
Asp в положении 233, Tyr в положении 234, Asp в положении 237, Ile в положении 264, Glu в положении 265, любую из Phe, Met и Leu в положении 266, любую из Ala, Glu, Gly и Gin в положении 267, или Asp, или Glu в положении 268, Asp в положении 269, любую из Asp, Phe, Ile, Met, Asn и Gin в положении 272, Asp в положении 296, или Ala, или Asp в положении 326, Gly в положении 327, или Lys, или Arg в положении 330, Ser в положении 331, Thr в положении 332, любую из Thr, Lys и Arg в положении 333 и любую из Asp, Glu, Phe, Ile, Lys, Leu, Met, Gln, Arg и Tyr в положении 396 согласно EU нумерации.
В альтернативном варианте осуществления изобретения антитела, указанные в разделе А описания, содержащие вариант Fc-области или вариант константной области, могут обладать сохраненной или повышенной связывающей активностью в отношении FcγRIIb и сниженной связывающей активностью в отношении FcγRIIa (типа Н) и FcγRIIa (типа R) по сравнению с референс-антителом, содержащим константную область или Fc-область нативного IgG. Предпочтительными сайтами аминокислотных замен для указанных вариантов могут быть описанные в WO 2014/030728, например, аминокислота в положении 238 согласно EU нумерации, и по меньшей мере одно аминокислотное положение, выбранное из группы, состоящей из положения 233, 234, 235, 237, 264, 265, 266, 267, 268, 269, 271, 272, 274, 296, 326, 327, 330, 331, 332, 333, 334, 355, 356, 358, 396, 409 и 419, согласно EU нумерации.
Более предпочтительно варианты могут иметь Asp в положении 238 согласно EU нумерации и по меньшей мере одну аминокислоту, выбранную из группы: Asp в положении 233, Tyr в положении 234, Phe в положении 235, Asp в положении 237, Ilе в положении 264, Glu в положении 265, Phe, Leu или Met в положении 266, Ala, Glu, Gly или Gin в положении 267, Asp, Gin или Glu в положении 268, Asp в положении 269, Gly в положении 271, Asp, Phe, Ile, Met, Asn, Pro или Gin в положении 272, Gin в положении 274, Asp или Phe в положении 296, Ala или Asp в положении 326, Gly в положении 327, Lys, Arg или Ser в положении 330, Ser в положении 331, Lys, Arg, Ser или Thr в положении 332, Lys, Arg, Ser или Thr в положении 333, Arg, Ser или Thr в положении 334, Ala или Gin в положении 355,Glu в положении 356, Met в положении 358, Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp или Tyr в положении 396, Arg в положении 409 и Glu в положении 419, согласно EU нумерации.
В альтернативном варианте осуществления изобретения антитела, указанные в разделе А описания, содержащие вариант Fc-области или вариант константной области, могут обладать сохраненной связывающей активностью в отношении FcγRIIb и сниженной связывающей активностью в отношении всех активирующих FcγR, FcγRIIa (типа R), в частности, по сравнению с референс-антителом, содержащим константную область или Fc-область нативного IgG. Предпочтительные сайты аминокислотной замены таких вариантов могут представлять собой описанные в WO 2014/163101, например, в дополнение к аминокислоте в положении 238 (согласно EU-нумерации), по меньшей мере одно положение аминокислоты, выбранное из положений 235, 237, 241, 268, 295, 296, 298, 323, 324 и 330, согласно EU-нумерации. Более предпочтительно варианты могут иметь Asp в положении 238 согласно EU-нумерации и по меньшей мере одну аминокислоту, выбранную из аминокислоты из группы: Phe в положении 235; Gin или Asp в положении 237; Met или Leu в положении 241; Pro в положении 268; Met или Val в положении 295; Glu, His, Asn или Asp в положении 296; Ala или Met в положении 298; Ilе в положении 323; Asn или His в положении 324; и His или Tyr в положении 330, согласно EU нумерации.
В контексте раздела А настоящего описания уровень «сохраненной связывающей активности в отношении FcγRIIb» может составлять (но не ограничиваясь только указанным) 55% или более, 60% или более, 65% или более, 70% или более, 75% или более, 80% или более, 81% или более, 82% или более, 83% или более, 84% или более, 85% или более, 86% или более, 87% или более, 88% или более, 89% или более, 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более, 99.5% или более, 100% или более, 101% или более, 102% или более, 103% или более, 104% или более, 105% или более, 106% или более, 107% или более, 108% или более, 109% или более, 110% или более, 120% или более, 130% или более, 140% или более, 150% или более, 175% или более или увеличенный более чем в 2 раза или более.
В контексте раздела А настоящего описания вышеуказанный уровень «снижения связывающей активности в отношении всех активирующих FcγR, в частности, FcγRIIa (типа R)» может составлять (но не ограничиваясь только указанным) 74% или менее, 72% или менее, 70% или менее, 68% или менее, 66% или менее, 64% или менее, 62% или менее, 60% или менее, 58% или менее, 56% или менее, 54% или менее, 52% или менее, 50% или менее, 45% или менее, 40% или менее, 35% или менее, 30% или менее, 25% или менее, 20% или менее, 15% или менее, 10% или менее, 5% или менее, 4% или менее, 3% или менее, 2% или менее, 1% или менее, 0,5% или менее, 0,4% или менее, 0,3% или менее, 0,2% или менее, 0,1% или менее, 0,05% или менее, 0,01% или менее или 0,005% или менее.
В WO 2014/030750 описаны также варианты мышиной константной области и Fc-области. В варианте осуществления изобретения антитела, указанные в разделе А или Б описания, могут содержать такой вариант.
В контексте разделов А и Б настоящего описания в отличие от FcγR, который принадлежит к суперсемейству иммуноглобулинов, «FcRn», в частности человеческий FcRn, обладает структурным сходством с полипептидами молекул главного комплекса гистосовместимости (ГКГС) класса I и его последовательность идентична на 22%-29% последовательности молекул ГКГС класса I (Ghetie и др., Immunol. Today 18(12), 1997, сс.592-598). FcRn экспрессируется в виде гетеродимера, состоящего из растворимой β- или легкой цепи (β2-микроглобулин), образующей комплекс с трансмембранной α- или тяжелой цепью. Аналогично ГКГС α-цепь FcRn содержит три внеклеточных домена (α1, α2 и α3) и короткий цитоплазматический домен, связывающий белки с клеточной поверхностью, α1- и α2-домены взаимодействуют с FcRn-связывающим доменом Fc-области антитела (Raghavan и др., Immunity 1, 1994, сс.303-315).
FcRn экспрессируется в материнской плаценте и желточной мешке млекопитающих и участвует в переносе IgG от матери к плоду. Кроме того, в тонком кишечнике новорожденных грызунов при экспрессии FcRn он участвует в переносе материнских IgG через щеточную каемку эпителия из потребленного молозива или молока. FcRn экспрессируется в широком разнообразии других тканей и эндотелиальных клеточных систем различных видов. У взрослых людей FcRn экспрессируется также в сосудистом эндотелии, мышечной сосудистой системе и синусоидальных капиллярах печени. FcRn, вероятно, играет роль в поддержании концентрации IgG в плазме путем связывания с IgG и рециклинга IgG в сыворотке. Как правило, связывание FcRn с молекулами IgG строго зависит от рН. Оптимальное связывание обнаружено в кислом диапазоне рН ниже 7,0.
Полинуклеотидные и аминокислотные последовательности человеческого FcRn можно получать, например, из предшественников, которые представлены в NM_004107.4 и NP_004098.1 (содержащих сигнальную последовательность) соответственно (в скобках представлены коды доступа в RefSeq).
Предшественники образуют комплексы с человеческим β2-микроглубулином in vivo. Таким образом, с использованием известных методов рекомбинантной экспрессии можно получать растворимый человеческий FcRn, обладающий способностью образовывать комплекс с человеческим β2-микроглубулином, для соответствующего применения в различных экспериментальных системах. Указанный растворимый человеческий FcRn можно применять для оценки антител или вариантов Fc-области в отношении их FcRn-связывающей активности. В разделе А или Б описания FcRn не ограничен конкретным FcRn, если он находится в форме, в которой может связываться с FcRn-связывающим доменом; однако предпочтительным FcRn может являться человеческий FcRn.
В контексте разделов А и Б настоящего описания, если антитело или вариант Fc-области обладает FcRn-связывающей активностью, то они могут иметь «FcRn-связывающий домен», предпочтительно человеческий FcRn-связывающий домен. FcRn-связывающий домен не ограничен конкретным доменом, если антитело обладает связывающей активностью или аффинностью к FcRn при кислом рН и/или нейтральном рН; или может представлять домен, который обладает способностью прямо или косвенно связываться с FcRn. Такие домены включают (но не ограничиваясь только ими) Fc-области иммуноглобулинов IgG-типа, альбумина, домена 3 альбумина, антител к FcRn, анти-FcRn пептидов и анти-FcRn скаффолд-молекул, которые обладают способностью непосредственно связываться с FcRn, и молекулы, которые связываются с IgG или альбумином, которые обладают способностью опосредованно связываться с FcRn. В разделе А или Б описания предусматривается также применение доменов, которые обладают FcRn-связывающей активностью в кислом диапазоне рН и/или нейтральном диапазоне рН. Если домены исходно обладают FcRn-связывающей активностью в кислом диапазоне рН и/или нейтральном диапазоне рН, то их можно применять без дополнительной модификации. Если домены обладают лишь слабой или не обладают вообще FcRn-связывающей активностью в кислом диапазоне рН и/или нейтральном диапазоне рН, то аминокислотные остатки в FcRn-связывающем домене антитела или варианте Fc-области можно модифицировать так, чтобы они приобретали FcRn-связывающую активность в кислом диапазоне рН и/или нейтральном диапазоне рН. Альтернативно этому, аминокислоты доменов, которые исходно обладают FcRn-связывающей активностью в кислом диапазоне рН и/или нейтральном диапазоне рН, можно модифицировать для дополнительного повышения их FcRn-связывающей активности. FcRn-связывающую активность в кислом диапазоне рН и/или нейтральном диапазоне рН можно сравнивать до и после аминокислотной модификации для выявления представляющих интерес аминокислотных модификаций для FcRn-связывающих доменов.
FcRn-связывающие домены предпочтительно могут представлять собой области, которые непосредственно связываются с FcRn. Указанные предпочтительные FcRn-связывающие домены включают, например, константные области и Fc-области антител. Однако области, которые могут связываться с полипептидом, обладающим FcRn-связывающей активностью, такие как альбумин и IgG, могут опосредованно связываться с FcRn через альбумин, IgG. Таким образом, FcRn-связывающие области могут представлять собой области, которые связываются с полипептидом, обладающим способностью связываться с альбумином или IgG. Для усиления элиминации антигена из плазмы предпочтительными являются FcRn-связывающие домены, FcRn-связывающая активность которых выше при нейтральном рН, а для улучшения времени удерживания антитела в плазме предпочтительными являются FcRn-связывающие домены, FcRn-связывающая активность которых выше при кислом рН (но не ограничиваясь только указанным). Например, можно отбирать FcRn-связывающие домены, FcRn-связывающая активность которых исходно выше при нейтральном рН или кислом рН. Альтернативно этому, аминокислоты антитела или варианта Fc-области можно модифицировать для придания FcRn-связывающей активности при нейтральном рН или кислом рН. Альтернативно этому, можно повышать уже существующую FcRn-связывающую активность при нейтральном рН или кислом рН.
В контексте разделов А и Б настоящего описания для решения вопроса о том, повышается ли, (практически) сохраняется или снижается FcRn-связывающая активность антитела или Fc-области (варианта) по сравнению с антителом или Fc-областью (вариантом) до модификации, можно применять известные методы, такие как описанные в примерах в настоящем описании, и, например, BIACORE, график Скэтчарда и проточную цитометрию (см. WO 2013/046722). Внеклеточный домен человеческого FcRn можно применять в качестве растворимого антигена в этих анализах. Обычные специалисты в данной области легко могут выбирать условия помимо рН для измерения FcRn-связывающей активности антитела или Fc-области (варианта). Анализ можно осуществлять, например, в условиях MES-буфера и 37°С, как описано в WO 2009/125825. FcRn-связывающую активность антитела или Fc-области (варианта) можно оценивать, например, путем внесения FcRn в качестве аналита на чипе с иммобилизованным антителом.
FcRn-связывающую активность антитела или Fc-области (вариант) можно оценивать на основе константы диссоциации (KD), кажущейся константы диссоциации (кажущаяся KD), константы скорости реакции диссоциации (kd), кажущейся константы скорости реакции диссоциации (кажущаяся kd).
В качестве условий рН для измерения связывающей активности между FcRn и FcRn-связывающим доменом, входящим в антитело или Fc-область (вариант), можно использовать кислые условия рН или нейтральные условия рН. В качестве температурных условий для измерения связывающей активности (аффинность связывания) между FcRn и FcRn-связывающим доменом можно использовать любую температуру от 10°С до 50°С. Для определения связывающей активности (аффинность связывания) между FcRn и человеческим FcRn-связывающим доменом предпочтительно можно использовать температуру от 15°С до 40°С. Более предпочтительно можно использовать любую температуру от 20°С до 35°С, такую как любая из следующих: 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 и 35°С. В качестве примера указанной температуры можно использовать (но не ограничиваясь только ею) 25°С.
В одном из вариантов осуществления изобретения, в котором антитела, указанные в разделе А или Б описания, обладают FcRn-связывающей активностью, они могут иметь FcRn-связывающий домен, предпочтительно человеческий FcRn-связывающий домен. FcRn-связывающий домен не ограничен конкретным доменом, если антитела обладают связывающей активностью или аффинностью для FcRn при кислом рН и/или нейтральном рН, и может представлять собой домен, который обладает способностью непосредственно или опосредованно связываться с FcRn. В одном из конкретных вариантов осуществления изобретения может быть предпочтительным, чтобы антитело, указанное в разделе А или Б описания, обладало, например, повышенной FcRn-связывающей активностью в условиях нейтрального рН по сравнению с референс-антителом, содержащим константную область нативного IgG (см. WO 2013/046722). Для осуществления сравнения FcRn-связывающей активности двух антител предпочтительно (но не ограничиваясь только указанным), чтобы антитело, указанное в разделе А или Б описания, и референс-антитело, которое содержит константную область нативного IgG, имели идентичные аминокислотные последовательности в областях (например, вариабельной области), предпочтительно отличных от, константной области антитела, указанного в разделе А или Б описания, в которой были модифицированы один или нескольких аминокислотных остатков.
В одном из вариантов осуществления изобретения, в котором антитело, указанное в разделе А описания, обладает повышенной FcRn-связывающей активностью в условиях нейтрального рН, то, не вдаваясь в конкретную теорию, можно предположить, что антитело, указанное в разделе А описания, может обладать двумя или большим количеством следующих свойств: способностью осуществлять челночное движение между плазмой и клеточной эндосомой и повторно связываться с множеством антигенов в виде одной молекулы антитела благодаря наличию зависящего от концентрации ионов антигенсвязывающего домена; способностью быстро проникать в клетки благодаря повышенной pI и повышенному общему положительному заряду антитела; и способностью быстро проникать в клетки благодаря повышенной FcRn-связывающей активности в условиях нейтрального рН. В результате время полужизни антитела в плазме можно дополнительно укорачивать или связывающую активность антитела с внеклеточным матриксом можно дополнительно увеличивать или элиминацию антигена из плазмы можно дополнительно усиливать. Обычный специалист в данной области с помощью общепринятых методов может определять оптимальную для проявления этих свойств величину pI антитела.
В разделах А и Б настоящего описания указано, что согласно Yeung и др., J. Immunol. 182, 2009, сс. 7663-7671, активность нативного человеческого IgG1 в отношении связывания с человеческим FcRn характеризуется величиной KD, составляющей 1,7 мМ в кислом диапазоне рН (рН 6,0), а в нейтральном диапазоне рН активность практически не поддается измерению. Таким образом, для повышения FcRn-связывающей активности в нейтральном диапазоне рН может оказаться предпочтительным применять в качестве антитела, указанного в разделе А или Б описания: антитело или вариант константной области или вариант Fc-области, у которого способность связывать человеческий FcRn в кислом диапазоне рН характеризуется KD 20 мкМ или является более сильной и у которого способность связывать человеческий FcRn в нейтральном диапазоне рН сопоставима или сильнее, чем у нативного человеческого IgG; предпочтительно антитело или вариант константной области или вариант Fc-области, у которого способность связывать человеческий FcRn в кислом диапазоне рН характеризуется величиной KD 2,0 мкМ или является более сильной и у которого способность связывать человеческий FcRn в нейтральном диапазоне рН характеризуется величиной KD 40 мкМ или является более сильной; и более предпочтительно антитело или вариант константной области или вариант Fc-области, у которого способность связывать человеческий FcRn в кислом диапазоне рН характеризуется величиной KD 0,5 мкМ или является более сильной и у которого способность связывать человеческий FcRn в нейтральном диапазоне рН характеризуется KD 15 мкМ или является более сильной. Величины KD можно определять с помощью метода, описанного у Yeung и др., J. Immunol. 182, 2009, сс. 7663-7671 (путем иммобилизации антитела на чипе и внесения человеческого FcRn в качестве аналита).
В контексте разделов А и Б настоящего описания в качестве FcRn-связывающего домена можно использовать домен любой структуры, который связывается с FcRn. В этом случае FcRn-связывающий домен можно получать без необходимости интродукции аминокислотной модификации, или аффинность к FcRn можно повышать путем интродукции дополнительной модификации.
В контексте разделов А и Б настоящего описания исходный FcRn-связывающий домен предпочтительно включает, например, Fc-область или константную область (человеческого) IgG. Если вариант исходной Fc-области или исходной константной области может связываться с человеческим FcRn в кислом диапазоне рН и/или нейтральном диапазоне рН, то любую Fc-область или константную область можно применять в качестве исходной Fc-области или исходной константной области. Или Fc-область или константную область, полученную путем дополнительной модификации исходной Fc-области или исходной константной области, в которой аминокислотный(ые) остаток(и) уже модифицирован(ы) относительно Fc-области или константной области, можно также применять соответственно в качестве Fc-области или константной области. Исходная Fc-область или исходная константная область могут включать известные Fc-области, полученные путем рекомбинации. Под исходной Fc-областью или исходной константной областью в зависимости от контекста может подразумеваться сам полипептид, композиция, содержащая исходную Fc-область или исходную константную область, или аминокислотная последовательность, соответствующая исходной Fc-области или исходной константной области. Источник исходной Fc-области или исходной константной области не ограничен конкретным источником и их можно получать из любого организма животных кроме человека или из организма человека. Кроме того, исходный FcγR-связывающий домен можно получать из обезьян циномлгус, мармозеток, макак резус, шимпанзе или человека. Исходную Fc-область или исходную константную область можно предпочтительно получать из человеческого IgG1; однако они не ограничены конкретным классом IgG. Это означает, что Fc-область человеческого IgG1, IgG2, IgG3 или IgG4 можно использовать в качестве приемлемого исходного FcRn-связывающего домена, и это означает также, что Fc-область или константную область IgG-класса или подкласса, полученную из любого организма, предпочтительно можно использовать в качестве исходной Fc-области или исходной константной области. Примеры варианта или модифицированной формы нативного IgG описаны в опубликованной известной литературе, например, у Strohl, Curr. Opin. Biotechnol. 20(6), 2009, сс. 685-691; Presta, Curr. Opin. Immunol. 20(4), 2008, cc. 460-470; Davis и др., Protein Eng. Des. Sel. 23(4), 2010, cc. 195-202; в WO 2009/086320, WO 2008/092117; WO 2007/041635; и WO 2006/105338.
В контексте разделов А и Б настоящего описания аминокислотные остатки исходного FcRn-связывающего домена, исходной Fc-области или исходной константной области могут содержать, например, одну или несколько мутаций: например, замены аминокислотными остатками, которые отличаются от остатков в исходной Fc-области или исходной константной области; инсерции одного или нескольких аминокислотных остатков в аминокислотные остатки в исходной Fc-области или исходной константной области; или делеции одного или нескольких аминокислотных остатков из исходной Fc-области или исходной константной области. Аминокислотные последовательности Fc-областей или константных областей после модификаций предпочтительно могут представлять собой аминокислотные последовательности, содержащие по меньшей мере часть Fc-области или константной области, которая не встречается в естественных условиях. Такие варианты должны быть идентичными или иметь сходство последовательностей на уровне менее 100% с исходными Fc-областями или исходными константными областями. Например, варианты имеют аминокислотную последовательность идентичную или сходную примерно на уровне от 75% до менее чем 100%, более предпочтительно примерно от 80% до менее чем 100%, еще более предпочтительно примерно от 85% до менее чем 100%, еще более предпочтительно примерно от 90% до менее чем 100% и еще более предпочтительно примерно от 95% до менее чем 100%, аминокислотной последовательности исходной Fc-области или исходной константной области. В примере, который не ограничивает объем изобретения, по меньшей мере одна аминокислота в модифицированной Fc-области или константной области, указанной в разделе А или Б описания, является отличной от аминокислоты в исходной Fc-области или исходной константной области.
В контексте разделов А и Б настоящего описания Fc-область или константную область, которая обладает FcRn-связывающей активностью в кислом диапазоне рН и/или нейтральном диапазоне рН, можно получать любым методом. В частности, вариант Fc-области или константной области, которая обладает FcRn-связывающей активностью в кислом диапазоне рН и/или нейтральном диапазоне рН, можно получать путем модификации аминокислот человеческого антитела IgG-типа, которое можно применять в качестве исходной Fc-области или исходной константной области. Fc-области антитела IgG-типа или константные области антитела IgG-типа, пригодные для модификации, могут включать, например, Fc-области или константные области человеческого IgG (IgG1, IgG2, IgG3 или IgG4 или их варианты) и мутанты, спонтанно образовавшиеся из них. Для Fc-областей или константных областей антител в виде человеческого IgG1, человеческого IgG2, человеческого IgG3 или человеческого IgG4 множество аллотипических последовательностей IgG, связанных с генетическим полиморфизмом, описаны в «Sequences proteins of immunological interest)), публикация NIH №91-3242, и любые из них можно использовать в разделе А или Б описания. В частности, в случае человеческого IgGl аминокислотная последовательность в положениях 356-358 согласно EU- нумерация может представлять собой либо DEL, либо ЕЕМ.
В одном из вариантов осуществления изобретения, указанных в разделе А или Б описания, модификация других аминокислот не ограничена указанными, если варианты обладают FcRn-связывающей активностью в кислом диапазоне рН и/или нейтральном диапазоне рН. Сайты аминокислотной модификации для повышения FcRn-связывающей активности в условиях нейтрального рН описаны, например, в WO 2013/046722. Указанные сайты модификации включают, например, одно или несколько положений, выбранных их группы, состоящей из: положений 221-225, 227, 228, 230, 232, 233-241, 243-252, 254-260, 262-272, 274, 276, 278-289, 291-312, 315-320, 324, 325, 327-339, 341, 343, 345, 360, 362, 370, 375-378, 380, 382, 385 to 387, 389, 396, 414, 416, 423, 424, 426-438, 440 и 442, согласно EU-нумерации в Fc-области или константной области человеческого антитела IgG-типа, которые описаны в WO 2013/046722. В WO 2013/046722 описаны также в качестве части предпочтительных модификаций в Fc-области или константной области, например, модификации одной или нескольких аминокислот, выбранных из группы, состоящей из: аминокислоты в положении 256 на Pro, аминокислоты в положении 280 на Lys, аминокислоты в положении 339 на Thr, аминокислоты в положении 385 на His, аминокислоты в положении 428 на Leu и аминокислоты в положении 434 на Trp, Tyr, Phe, Ala или His, согласно EU-нумерации. Количество подлежащих модификации аминокислот не ограничено и модификацию можно осуществлять только в одном положении или в двух или большей количестве положений. Модификация указанных аминокислотных остатков может повышать способность связывания FcRn у Fc-области или константной области антитела IgG-типа в условиях нейтрального рН. Модификацию указанных аминокислотных остатков можно интродуцировать соответственно также в антитела, указанные в разделе А или Б описания.
В дополнительном или альтернативном варианте осуществления изобретения можно также использовать соответствующие сайты аминокислотных модификаций для повышения FcRn-связывающей активности в условиях кислого рН. Из указанных сайтов модификаций один или несколько сайтов модификаций, которые позволяет повышать связывание FcRn также и в нейтральном диапазоне рН, можно применять соответственно в разделе А или Б описания. Указанные сайты модификаций включают, например, описанные в WO 2011/122011, WO 2013/046722, WO 2013/046704 и WO 2013/046722. Сайты аминокислот для указанной модификации константной области или Fc-области человеческого антитела IgG-типа и типы аминокислот после модификации описаны в таблице 1 в WO 2013/046722. В WO 2013/046722 описаны также в качестве особенно предпочтительных сайты модификации в константной области или Fc-области, например, находящиеся в одном или нескольких аминокислотных положениях, выбранных из группы, состоящей из положения 237, 238, 239, 248, 250, 252, 254, 255, 256, 257, 258, 265, 270, 286, 289, 297, 298, 303, 305, 307, 308, 309, 311, 312, 314, 315, 317, 325, 332, 334, 360, 376, 380, 382, 384, 385, 386, 387, 389, 424, 428, 433, 434 и 436, согласно EU-нумерации. Модификация аминокислотных остатков в указанных положениях может также повышать связывание с человеческим FcRn FcRn-связывающего домена в нейтральном диапазоне рН. В WO 2013/046722 описаны также в качестве части предпочтительных модификаций в константной области или Fc-области IgG- типа, например, замена одного или нескольких аминокислотных остатков, выбранных из группы, состоящей из: (а) аминокислоты в положении 237 на Met; (б) аминокислоты в положении 238 на Ala; (в) аминокислоты в положении 239 на Lys; (г) аминокислоты в положении 248 на Ile; (д) аминокислоты в положении 250 на любую из Ala, Phe, Ile, Met, Gln, Ser, Val, Trp и Tyr; (e) аминокислоты в положении 252 на любую из Phe, Trp и Tyr; (ж) аминокислоты в положении 254 на Thr; (з) аминокислоты в положении 255 на Glu; (и) аминокислоты в положении 256 на любую из Asp, Glu и Gin; (к) аминокислоты в положении 257 на любую из Ala, Gly, Ile, Leu, Met, Asn, Ser, Thr и Val; (л) аминокислоты в положении 258 на His; (м) аминокислоты в положении 265 на Ala; (н) аминокислоты в положении 270 на Phe; (о) аминокислоты в положении 286 или на Ala, или на Glu; (п) аминокислоты в положении 289 на His; (р) аминокислоты в положении 297 на Ala; (с) аминокислоты в положении 298 на Gly; (т) аминокислоты в положении 303 на Ala; (у) аминокислоты в положении 305 на Ala; (ф) аминокислоты в положении 307 на любую из Ala, Asp, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp и Tyr; (x) аминокислоты в положении 308 на любую из Ala, Phe, Ile, Leu, Met, Pro, Gin и Thr; (ц) аминокислоты в положении 309 на любую из Ala, Asp, Glu, Pro и Arg; (ч) аминокислоты в положении 311 на любую из Ala, His и Ile; (щ) аминокислоты в положении 312 или на Ala, или на His; (щ) аминокислоты в положении 314 или на Lys, или на Arg; (э) аминокислоты в положении 315 или на Ala, или на His; (аа) аминокислоты в положении 317 на Ala; (аб) аминокислоты в положении 325 на Gly; (ав) аминокислоты в положении 332 на Val; (аг) аминокислоты в положении 334 на Leu; (ад) аминокислоты в положении 360 на His; (ае) аминокислоты в положении 376 на Ala; (аж) аминокислоты в положении 380 на Ala; (аз) аминокислоты в положении 382 на Ala; (аи) аминокислоты в положении 384 на Ala; (ак) аминокислоты в положении 385 или на Asp, или на His; (ал) аминокислоты в положении 386 на Pro; (ам) аминокислоты в положении 387 на Glu; (ан) аминокислоты в положении 389 или на Ala, или на Ser; (ао) аминокислоты в положении 424 на Ala; (aп) аминокислоты в положении 428 на любую из Ala, Asp, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Ser, Thr, Val, Trp и Tyr; (ар) аминокислоты в положении 433 на Lys; (ас) аминокислоты в положении 434 на Ala, Phe, His, Ser, Trp и Tyr; и (ат) аминокислоты в положении 436 на His; согласно EU-нумерации. Количество аминокислот, которые можно модифицировать, не ограничено, и можно модифицировать аминокислоту только в одном положении или аминокислоты в двух или большем количестве положений. Комбинации аминокислотных модификаций в двух или большем количестве положений представлены в таблице 2 в WO 2013/046722. Модификацию этих аминокислотных остатков можно также интродуцировать соответственно в антитела, указанные в разделах А и Б описания.
В одном из вариантов осуществления изобретения FcRn-связывающая активность FcRn-связывающего домена антитела, указанного в разделе А или Б описания, повышена по сравнению с активностью референс-антитела, содержащего исходную Fc-область или исходную константную область нативного IgG, или по сравнению с активностью референс-антитела, содержащего исходную Fc-область или исходную константную область. Так, FcRn-связывающая активность варианта Fc-области или варианта константной области, указанного в разделе А или Б описания, или антитела, содержащего указанный вариант, выше чем у референс-антитела. Это может означать, что при сравнении FcRn-связывающей активности с активностью референс-антитела, активность антитела, указанного в разделе А или Б описания, может составлять, например: 55% или более, 60% или более, 65% или более, 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 95% или более, 100% или более, 105% или более, предпочтительно 110% или более, 115% или более, 120% или более, 125% или более, тоге предпочтительно 130% или более, 135% или более, 140% или более, 145% или более, 150% или более, 155% или более, 160% или более, 165% или более, 170% или более, 175% или более, 180% или более, 185% или более, 190% или более, 195% или более, или превышать в 2 или более, 2,5 или более, 3 или более, 3,5 или более, 4 или более, 4,5 или более или в 5 раз или более.
В одном из вариантов осуществления изобретения аминокислотные последовательности, подлежащие модификации в антителе, указанном в разделе А или Б описания, могут предпочтительно содержать человеческие последовательности (последовательности, присутствующие в нативных полученных из организма человека антителах) для того, чтобы не увеличивать иммуногенность антитела при введении антитела in vivo (предпочтительно в организм человека). Альтернативно этому, после модификации можно интродуцировать мутации в положения, отличные от сайтов аминокислотных модификаций, так, чтобы один или несколько FR (FR1, FR2, FR3 и FR4) заменять на человеческую последовательность. Методы замены FR человеческой последовательностью известны в данной области и включают (но не ограничиваясь только ими) методы, описанные у Ono и др., Mol. Immunol. 36(6), 1999, сс.387-395. Методы гуманизации известны в данной области и включают (но не ограничиваясь только ими) методы, описанные в: Methods 36(1), 2005, сс.43-60).
В одном из вариантов осуществления изобретения последовательности каркасного участка (обозначенные также как «FR-последовательности) тяжелой цепи и/или вариабельной области легкой цепи антитела, указанного в разделе А или Б описания, могут содержать последовательности каркасных участков человеческой зародышевой линии. Когда последовательности каркасных участков представляют собой последовательности полностью человеческой зародышевой линии, то антитело экспрессируют для индукции небольшой иммуногенной реакции или ее отсутствия при введении человеку (например, для лечения или предупреждения определенного заболевания).
FR-последовательности предпочтительно могут включать, например, полностью человеческие FR-последовательности, такие как последовательности, представленные в V-Base (vbase.mrc-cpe.cam.ac.uk/). Указанные FR-последовательности можно применять соответственно в разделе А или Б описания. Последовательности зародышевой линии можно разделять на категории в зависимости от их сходства (Tomllnson и др., J. Mol. Biol. 227, 1992, сс.776-798; Williams и др., Eur. J. Immunol. 23, 1993, сс.1456-1461; и Сох и др., Nat. Genetics 7, 1994, сс.162-168). Предпочтительные последовательности зародышевой линии можно соответственно выбирать из группы Vκ, которую подразделяют на семь подгрупп; группы Vλ, которую подразделяют на десять подгрупп; и группы VH, которую подразделяют на семь подгрупп.
Полностью человеческие VH-последовательности могут предпочтительно включать, например, VH-последовательности из: подгруппы VH1 (например, VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-45, VH1-46, VH1-58 и VH1-69); подгруппы VH2 (например, VH2-5, VH2-26 и VH2-70); подгруппы VH3 (VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-72, VH3-73 и VH3-74); подгруппы VH4 (VH4-4, VH4-28, VH4-31, VH4-34, VH4-39, VH4-59 и VH4-61); подгруппы VH5 (VH5-51); подгруппы VH6 (VH6-1); или подгруппы VH7 (VH7-4 и VH7-81). Они описаны также, например, у Matsuda и др., J. Exp.Med. 188, 1998, сс.1973-1975), и соответственно обычные специалисты в данной области могут создавать антитела на основе информации об указанных последовательностях. Может оказаться предпочтительным применять другую полностью человеческую FR-последовательность или последовательности областей, эквивалентных ей.
Полностью человеческие Vκ-последовательности могут предпочтительно включать, например: А20, А30, L1, L4, L5, L8, L9, L11, L12, L14, L15, L18, L19, L22, L23, L24, O2, O4, O8, O12, O14 или O18, которые классифицируют в качестве подгруппы Vk1; A1, А2, A3, А5, А7, А17, А18, А19, А23, O1 и O11, которые классифицируют в качестве подгруппы Vk2; A11, А27, L2, L6, L10, L16, L20 и L25, которые классифицируют в качестве подгруппы Vk3; В3, которую классифицируют в качестве подгруппы Vk4; В2 (обозначена также как «Vk5-2»), которую классифицируют в качестве подгруппы Vk5; или А10, А14 и А26, которые классифицируют в качестве подгруппы Vk6 (Kawasaki и др., Eur. J. Immunol. 31, 2001, сс.1017-1028; Норре Seyler Biol. Chem. 374, 1993, cc. 1001-1022; Brensing-Kuppers и др., Gene 191, 1997, cc. 173-181).
Полностью человеческие Vλ-последовательности могут предпочтительно включать, например: V1-2, V1-3, V1-4, V1-5, V1-7, V1-9, V1-11, V1-13, V1-16, V1-17, V1-18, V1-19, V1-20 и V1-22, которые классифицируют в качестве подгруппы VL1; V2-1, V2-6, V2-7, V2-8, V2-11, V2-13, V2-14, V2-15, V2-17 и V2-19, которые классифицируют в качестве подгруппы VL2; V3-2, V3-3 и V3-4, которые классифицируют в качестве подгруппы VL3; V4-1, V4-2, V4-3, V4-4 и V4-6, которые классифицируют в качестве подгруппы VL4; или V5-1, V5-2, V5-4 и V5-6, которые классифицируют в качестве подгруппы VL5 (Kawasaki и др., Genome Res. 7, 1997, cc. 250-261).
Как правило, эти FR-последовательности отличаются друг от друга одним или несколькими аминокислотными остатками. Эти FR-последовательности можно применять для модификации аминокислотных остатков антител. Полностью человеческие FR-последовательности, которые можно применять для модификации, включают также, например, KOL, NEWM, REI, EU, TUR, TEI, LAY и РОМ (см., например, процитированные выше Kabat и др., 1991; Wu и др., J. Exp.Med. 132, 1970, сс.211-250).
В контексте разделов А и Б настоящего описания понятие «гибкие остатки» можно относить к вариациям аминокислотных остатков, которые присутствуют в положениях с высоким разнообразием аминокислот, при этом вариабельные области легкой цепи или тяжелой цепи имеют несколько различных аминокислот по сравнению с аминокислотными последовательностями известных и/или нативных антител или антигенсвязывающих доменов. Положения, характеризующиеся высоком разнообразием, как правило, локализованы в CDR. Данные представленные у Kabat, Sequences of Proteins of Immunological Interest (изд-во National Institute of Health Bethesda Md.) (1987 и 1991), могут позволять эффективно определять указанные положения с высоким разнообразием в известных и/или нативных антителах. Кроме того, в нескольких базах данных в Интернете (vbase.mrc-cpe.cam.ac.uk/, bioinf.org.uk/abs/index.html) представлены коллекции последовательностей многочисленных человеческих легких цепей и тяжелых цепей и их локализации. Информация об этих последовательностях и месторасположениях является ценной для определения локализаций гибких остатков. Например (но не ограничиваясь только ими), когда аминокислотный остаток в конкретном положении имеет вариабельность, предпочтительно 2-20, 3-19, 4-18, 5-17, 6-16, 7-15, 8-14, 9-13 или 10-12 аминокислотных остатков, то это положение можно рассматривать в качестве характеризующегося (высоким) разнообразием.
Согласно варианту осуществления изобретения должно быть очевидно, что, когда антитело, указанное в разделе А или Б описания, содержит полную или часть вариабельной области легкой цепи и/или вариабельной области тяжелой цепи, антитело может содержать при необходимости один или несколько соответствующих гибких остатков. Например, последовательность вариабельной области тяжелой цепи и/или легкой цепи, выбранную так, чтобы она имела FR- последовательность, которая исходно содержит аминокислотные остатки, которые изменяют антигенсвязывающую активность антитела в зависимости от условий концентрации ионов (концентрации ионов водорода или концентрации ионов кальция), можно создавать таким образом, чтобы она содержала другие аминокислотные остатки в дополнение к указанным аминокислотным остаткам. В этом случае, например, количество и локализации гибких остатков можно определять также, не ограничиваясь конкретным вариантом осуществления изобретения, если антигенсвязывающая активность антитела, указанного в разделе А или Б описания, изменяется в зависимости от условий концентрации ионов. В частности, CDR-последовательность и/или FR-последовательность тяжелой цепи и/или легкой цепи может содержать по меньшей мере один гибкий остаток. Например, если концентрация ионов представляет собой концентрацию ионов кальция, то гибкие остатки, которые можно интродуцировать в последовательность вариабельной области легкой цепи (указана выше как Vk5-2), включают (но не ограничиваясь только ими) один или несколько аминокислотных остатков в положениях, указанных в таблице 1 или таблице 2. Аналогично этому, соответствующие гибкие остатки можно интродуцировать, например, в зависящее от концентрации ионов антитело или в антитело, не имеющее указанной зависимости от концентрации ионов, содержащее полную или часть вариабельной области легкой цепи и/или вариабельной области тяжелой цепи, в котором по меньшей мере один аминокислотный остаток, который может экспонироваться на поверхности антитела, модифицирован целью повышения pI.
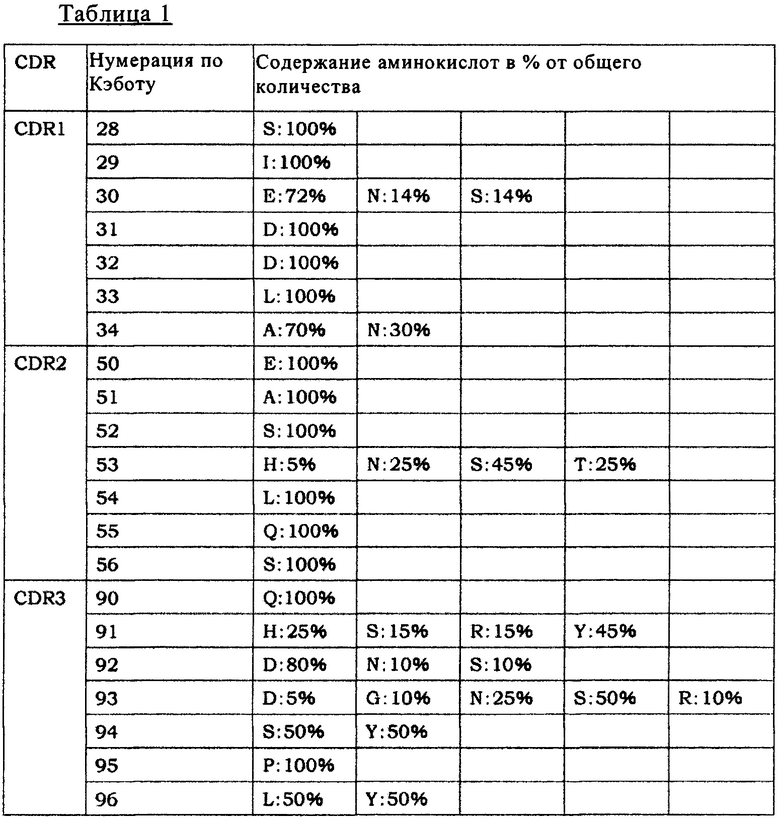
(положения указаны согласно нумерации Кэбота)
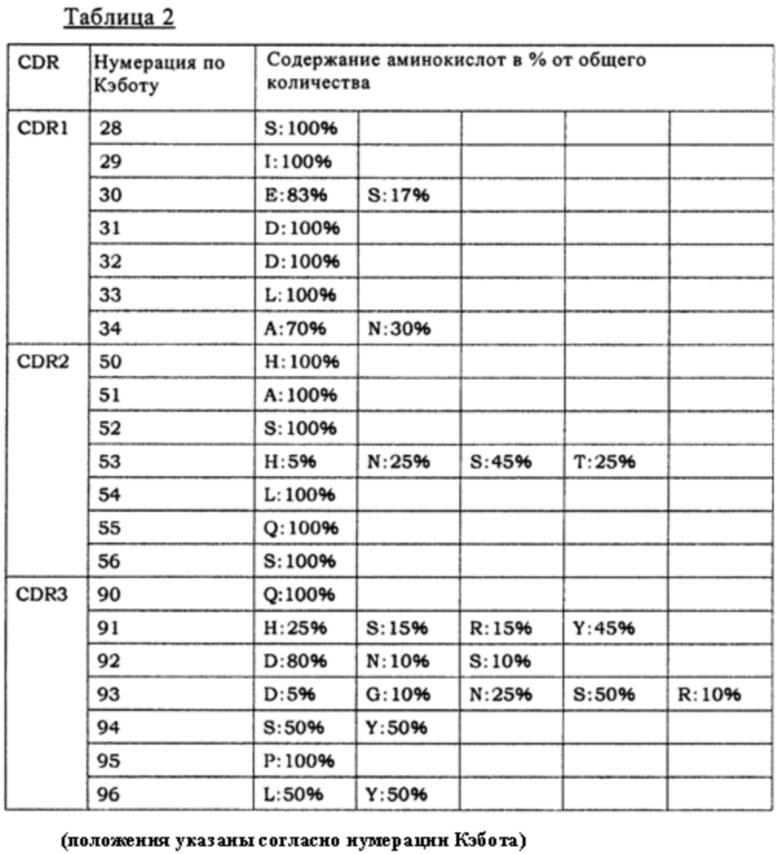
В одном из вариантов осуществления изобретения, когда антитело представляет собой гуманизированное химерное антитело, pI химерного антитела повышают путем модификации одного или нескольких аминокислотных остатков, которые могут экспонироваться на поверхности антитела, с получением гуманизированного антитела, указанного в разделе А или Б описания, с укороченным временем полужизни в плазме по сравнению с химерным антителом, у которого отсутствует указанная модификация. Модификацию аминокислотных остатков, которые могут экспонироваться на поверхности гуманизированного антитела, можно осуществлять до или одновременно с гуманизацией антитела. Альтернативно этому, путем использования гуманизированного антитела в качестве исходного продукта аминокислотные остатки, которые могут экспонироваться на поверхности, можно модифицировать для дополнительного изменения pI гуманизированного антитела.
Adams с соавторами в Cancer Immunol. Immunother. 55(6), 2006, сс. 717-727, описали, что гуманизированные антитела трастузумаб (антиген: HER2), бевацизумаб (антиген: VEGF) и пертузумаб (антиген: HER2), которые гуманизировали с использованием одинаковых FR-последовательностей человеческого антитела, оказались практически сопоставимыми по фармакокинетике в плазме. В частности, можно допустить, что фармакокинетика в плазме является практически сопоставимой, когда гуманизацию осуществляют с использованием одинаковых FR-последовательностей. Согласно одному из вариантов осуществления изобретения, указанному в разделе А описания, концентрацию антигена в плазме снижают, повышая pI антитела путем модификации аминокислотных остатков, которые могут экспонироваться на поверхности антитела, в дополнение к стадии гуманизации. В альтернативном варианте осуществления изобретения, указанном в разделе А или Б описания, можно использовать человеческие антитела. Путем модификации аминокислотных остатков, которые могут экспонироваться на поверхности человеческого антитела, полученного из библиотеки человеческих антител, использования продуцирующих человеческое антитело мышей, рекомбинантной клетки и т.д. и повышения pI человеческого антитела, можно повышать способность исходного полученного человеческого антитела элиминировать антиген из плазмы.
В одном из вариантов осуществления изобретения антитела, указанные в разделе А описания, могут содержать модифицированные сахарные цепи. Антитела с модифицированными сахарными цепями включают, например, антитела с модифицированным гликозилированием (WO 99/54342), антитела, в которых отсутствует фукоза (WO 00/61739; WO 02/31140, WO 2006/067847; WO 2006/067913), и антитела, имеющие сахарные цепи, которые бисекционнируются с помощью GlcNAc (WO 02/79255).
В одном из вариантов осуществления изобретения, антитела, указанные в разделе А или Б описания, можно применять, например, в методах для достижения повышенной противоопухолевой активности в отношении раковых клеток или в методах усиления элиминации из плазмы вредных для организма антигенов.
Альтернативный вариант осуществления изобретения, указанный в разделе А или Б описания, относится к библиотекам зависящих от концентрации ионов антигенсвязывающих доменов с повышенной pI или зависящих от концентрации ионов антител с повышенной pI, которые описаны выше.
Альтернативный вариант осуществления изобретения, указанный в разделе А или Б описания, относится к нуклеиновым кислотам (полинуклеотидам), кодирующим вышеописанные зависящие от концентрации ионов антигенсвязывающие домены с повышенной pI или зависящие от концентрации ионов антитела с повышенной pI. В конкретном варианте осуществления изобретения нуклеиновые кислоты можно получать с помощью соответствующих известных методов. Их конкретные варианты описаны, например, в WO 2009/125825, WO 2012/073992, WO 2011/122011, WO 2013/046722, WO 2013/046704, WO 2000/042072, WO 2006/019447, WO 2012/115241, WO 2013/047752, WO 2013/125667, WO 2014/030728, WO 2014/163101, WO 2013/081143, WO 2007/114319, WO 2009/041643, WO 2014/145159, WO 2012/016227 и WO 2012/093704, каждая из которых полностью включена в настоящее описание в качестве ссылки.
В одном из вариантов осуществления изобретения нуклеиновые кислоты, указанные в разделе А или Б описания, могут представлять собой выделенные или очищенные нуклеиновые кислоты. Нуклеиновые кислоты, кодирующие антитела, указанные в разделе А или Б описания, могут представлять собой любые гены и могут представлять собой ДНК или РНК, или другие аналоги нуклеиновых кислот.
В контексте разделов А и Б настоящего описания, когда аминокислоты антитела являются модифицированными, аминокислотная последовательность антитела до модификации может представлять собой известную последовательность или аминокислотную последовательность вновь полученного антитела. Например, антитела можно получать из библиотек антител или путем клонирования нуклеиновых кислот, которые кодируют антитело, из гибридом или В-клеток, которые продуцируют моноклональные антитела. Методы получения нуклеиновых кислот, кодирующих антитело из гибридом, которые можно применять, включают: осуществление иммунизации с помощью общепринятых методов иммунизации с использованием представляющего интерес антигена или клеток, экспрессирующих представляющий интерес антиген, в качестве сенсибилизирующего антигена; слияние полученных иммунных клеток с известными родительскими клетками с использованием общепринятых методов слияния; скрининг продуцирующих моноклональные антитела клеток (гибридомы) с использованием общепринятых методов скрининга; синтез кДНК вариабельной области (V-область) антитела с использованием обратной транскриптазы из мРНК полученных гибридом; и связывание кДНК с ДНК, кодирующей константную область (С-область) представляющего интерес антитела.
Сенсибилизирующие антигены, которые применяют для получения нуклеиновых кислот, кодирующих описанные выше тяжелую цепь и легкую цепь, включают (но не ограничиваясь только ими) как полные антигены, обладающие иммуногенностью, так и неполные антигены, включая гаптены, которые не обладают иммуногенностью. Например, можно применять полные представляющие интерес белки или пептиды, представляющие собой части белков. Кроме того, известно, что потенциальными антигенами являются субстанции, которые состоят из полисахаридов, нуклеиновых кислот, липидов, и другие композиции. Так, в некоторых вариантах осуществления изобретения антигены для антител, указанных в разделе А или Б описания, не ограничены конкретными антигенами. Антигены можно получать, например, методами, основанными на применении бакуловирусов (см., например, WO 98/46777). Гибридомы можно получать, например, согласно методу G. Kohler и С. Milstein, Methods Enzymol. 73, 1981 сс. 3-46. Когда иммуногенность антигена является низкой, то иммунизацию можно осуществлять, связывая антиген с обладающей иммуногенностью макромолекулой, такой как альбумин. Альтернативно этому, при необходимости растворимые антигены можно получать, связывая антиген с другими молекулами. Когда в качестве антигена применяют трансмембранную молекулу, такую как мембранные антигены (например, рецептор), то часть внеклеточной области мембранного антигена можно применять в виде фрагмента или клетки, экспрессирующие трансмембранную молекулу на их поверхности, можно применять в качестве иммуногена.
В некоторых вариантах осуществления изобретения продуцирующие антитело клетки можно получать путем иммунизации животного соответствующим сенсибилизирующим антигеном, описанным выше. Альтернативно этому, продуцирующие антитело клетки можно получать путем in vitro иммунизации лимфоцитов, которые обладают способностью продуцировать антитела. Различных млекопитающих можно применять для иммунизации и других рутинных процедур, связанных с получением антител. Обычно применяемые животные включают грызунов, зайцеобразных и приматов. Животные могут представлять собой, например, грызунов, таких как мыши, крысы и хомяки; зайцеобразных, таких как кролики; и приматов, включая обезьян, таких как обезьяны циномолгус, макаки резус, бабуины и шимпанзе. Кроме того, известны также трансгенные животные, несущие спектр генов человеческих антител, и этих животных можно применять для получения человеческих антител (см., например, WO 96/34096; Mendez и др., Nat. Genet. 15, 1997, сс. 146-156; WO 93/12227, WO 92/03918, WO 94/02602, WO 96/34096 и WO 96/33735). Вместо использования указанных трансгенных животных можно также получать требуемые человеческие антитела, обладающие антигенсвязывающей активностью, с помощью, например, сенсибилизации человеческих лимфоцитов in vitro требуемыми антигенами или клетками, экспрессирующими требуемые антигены, и последующего слияния сенсибилизированных лимфоцитов с клетками человеческой миеломы, такими как U266 (публикация японского патента № Н01-59878).
Иммунизацию животных можно осуществлять, например, путем соответствующего разведения и суспендирования сенсибилизирующего антигена в забуференном фосфатом физиологическом растворе (ЗФР), физиологическом растворе или других средах и при необходимости смешения с адъювантом для эмульгирования; и последующей инъекции внутрибрюшинно или подкожно животным. Затем сенсибилизирующий антиген, смешанный с неполным адъювантом Фрейнда, можно предпочтительно вводить несколько раз каждые 4- 21 дней. Образование антител можно подтверждать, например, путем измерения титра представляющего интерес антитела в сыворотке животного.
Продуцирующие антитело клетки, полученные из лимфоцитов или животных, иммунизированных требуемым антигеном, можно сливать с клетками миеломы для создания гибридом, используя общепринятые агенты для слияния (например, полиэтиленгликоль) (Goding, Monolonal Antibodies: Principles and Practice, изд-во Academic Press, 1986, cc. 59-103). При необходимости гибридомы культивируют и размножают и оценивают специфичность связывания антител, продуцируемых гибридомами, например, с помощью иммунопреципитации, радиоиммуноанализа (РИА) или твердофазного иммуноферментного анализа (ELISA). Затем, при необходимости, продуцирующие антитело гибридомы, у которых установлена представляющая интерес специфичность, аффинность или активность, можно субклонировать также с помощью таких методов, как серийное разведение.
Нуклеиновые кислоты, кодирующие отобранное антитело, можно клонировать из гибридом или продуцирующих антитело клеток (сенсибилизированные лимфоциты и т.д.) с использованием зондов, которые могут специфически связываться с антителом (например, олигонуклеотидов, комплементарных последовательностям, которые кодируют константные области антитела). Альтернативно этому, нуклеиновые кислоты можно клонировать из мРНК с помощью ОТ-ПЦР. Тяжелые цепи и легкие цепи, предназначенные для применения для производства антител, указанных в разделе А или Б описания, можно получать из антител, которые, например, принадлежат в любому классу и подклассу антител Ig-типа, и IgG может оказаться предпочтительным.
В одном из вариантов осуществления изобретения нуклеиновые кислоты, кодирующие аминокислотные последовательности, которые образуют тяжелую цепь (полную или ее часть) и/или легкую цепь (полную или ее часть) антитела, указанного в разделе А или Б описания, например, модифицируют с помощью методов генетической инженерии. Рекомбинантые антитела с искусственной модификацией последовательностей, например, для снижения гетерологичной антигенности для людей, такие как химерные антитела или гуманизированные антитела, можно соответственно создавать путем, например, модификации нуклеотидных остатков, кодирующих аминокислотные последовательности, ассоциированные с компонентами антител, таких как мышиные антитела, крысиные антитела, кроличьи антитела, антитела хомяков, овечьи антитела или верблюжьи антитела. Химерные антитела можно получать, например, путем лигирования ДНК, кодирующей вариабельную область мышиного антитела, с ДНК, кодирующей константную область человеческого антитела, и встраивания кодирующей последовательности полученной в результате лигирования ДНК, в экспрессионный вектор, последующей интродукции образовавшегося рекомбинантного вектора в хозяина для экспрессии генов. Гуманизированные антитела, которые обозначают также как реконструированные человеческие антитела, представляют собой антитела, в которых FR человеческого антитела сшиты в рамке считывания с CDR антитела, выделенного из млекопитающих кроме человека, такого как мыши, с образованием кодирующей последовательности. ДНК-последовательность, кодирующую указанное гуманизированное антитело, можно синтезировать с помощью ПЦР с перекрывающимися расширениями, используя ряд олигонуклеотидов в качестве матриц. Материалы и экспериментальные методы для осуществления ПЦР с перекрывающимися расширениями описаны в WO 98/13388 и др. Например, ДНК, кодирующую аминокислотную последовательность, например, вариабельной области антитела, указанного в разделе А или Б описания, можно получать с помощью ПЦР с перекрывающимися расширениями, используя ряд олигонуклеотидов, сконструированных так, что они имеют перекрывающиеся нуклеотидые последовательности. Перекрывающиеся ДНК затем сшивают в рамке считывания с ДНК, кодирующей константную область, с получением кодирующей последовательности. ДНК, сшитую указанным выше методом, затем можно встраивать в экспрессионный вектор так, чтобы ДНК могла экспрессироваться, и образовавшийся вектор можно интродуцировать в хозяина или клетку-хозяина. Антитело, кодируемое ДНК, можно экспрессировать путем выращивания хозяина или культивирования клеток-хозяев. Эспрессированное антитело можно очищать соответственно из культуральной среды хозяина или др.(ЕР 239400; WO 96/02576). Кроме того, FR гуманизированного антитела, слитые через CDR, можно отбирать, например, давая возможность CDR образовывать антигенсвязывающий сайт, пригодный для антигена. При необходимости, аминокислотные остатки, которые образуют FR вариабельной области отобранного антитела, например, можно модифицировать с помощью соответствующей замены.
В одном из вариантов осуществления изобретения для экспрессии антител, указанных в разделе А или Б описания, или их фрагментов кассеты нуклеиновых кислот можно клонировать в соответствующих векторах. Для этой цели доступно несколько типов векторов, таких как фагмидные векторы. В целом, фагмидные векторы могут содержать различные элементы, включая регуляторные последовательности, такие как промоторы, или сигнальные последовательности, гены для селекции фенотипа, сайты инициации репликации и другие необходимые элементы.
Методы интродукции требуемых аминокислотных модификаций в антитела известны в данной области. Например, можно конструировать библиотеки путем интродукции по меньшей мере одного модифицированного аминокислотного остатка, который может экспонироваться на поверхности антител, указанных в разделе А или Б описания, и/или по меньшей мере одной аминокислоты, которая может изменять антигенсвязывающую активность антител в зависимости от условий концентрации ионов. Дополнительно, при необходимости, можно добавлять гибкие остатки, используя метод, описанный у Kunkel и др., Methods Enzymol. 154, 1987, сс. 367-382.
Альтернативным вариантом осуществления изобретения, указанным в разделе А описания, являются векторы, содержащие нуклеиновые кислоты, которые кодируют вышеописанный зависящий от концентрации ионов антигенсвязывающий домен с повышенной pI или вышеописанное зависящее от концентрации ионов антитело с повышенной pI. В конкретном варианте осуществления изобретения векторы можно получать, например, аналогично векторам, описанным в WO 2009/125825, WO 2012/073992, WO 2011/122011, WO 2013/046722, WO 2013/046704, WO 2000/042072, WO 2006/019447, WO 2012/115241, WO 2013/047752, WO 2013/125667, WO 2014/030728, WO 2014/163101, WO 2013/081143, WO 2007/114319, WO 2009/041643, WO 2014/145159, WO 2012/016227 или WO 2012/093704, каждая из которых полностью включена в настоящее описание в качестве ссылки.
В одном из вариантов осуществления изобретения нуклеиновые кислоты, кодирующие варианты, указанные в разделе А или Б описания, можно функционально клонировать (встраивать) в соответствующих векторах и интродуцировать в клетки-хозяева. Например, когда в качестве хозяина применяют Е. coli, векторы включают клонирующий вектор, вектор pBluescript (фирма Stratagene) или любые различные поступающие в продажу векторы.
В одном из вариантов осуществления изобретения экспрессионные векторы применяют в качестве векторов, содержащих нуклеиновую кислоту, указанную в разделе А или Б описания. Экспрессионные векторы можно применять для обеспечения экспрессии полипептида in vitro в Е. coli, в культурах клеток или in vivo. Например, можно применять вектор pBEST (фирма Promega) для экспрессии in vitro; вектор рЕТ (фирма Invitrogen) для экспрессии в Е. coli; вектор pME18S-FL3 (GenBank, код доступа № АВ009864) для экспрессии в культуре клеток и вектор pME18S (Takebe и др., Mol. Cell Biol. 8, 1988, сс. 466-472) для экспрессии in vivo. ДНК можно встраивать в векторы общепринятыми методами, например, с помощью реакции в присутствии лигазы с использованием сайтов, распознаваемых рестриктазами (см. Current protocols in Molecular Biology, под ред. Ausubel и др., изд-во Publish. John Wiley & Sons. раздел 11.4-11.11, 1987).
Альтернативным вариантом осуществления изобретения, указанным в разделе А описания, является хозяин или клетки-хозяева, которые содержат вектор, содержащий нуклеиновую кислоту, которая кодирует вышеописанный зависящий от концентрации ионов антигенсвязывающий домен с повышенной pI или вышеописанное зависящее от концентрации ионов антитело с повышенной pI. В конкретном варианте осуществления изобретения хозяина или клетки-хозяева можно получать, например, методами, описанными в WO 2009/125825, WO 2012/073992, WO 2011/122011, WO 2013/046722, WO 2013/046704, WO 2000/042072, WO 2006/019447, WO 2012/115241, WO 2013/047752, WO 2013/125667, WO 2014/030728, WO 2014/163101, WO 2013/081143, WO 2007/114319, WO 2009/041643, WO 2014/145159, WO 2012/016227 или WO 2012/093704, каждая из которых полностью включена в настоящее описание в качестве ссылки.
Тип клетки-хозяина, указанной в разделе А или Б описания, не ограничен конкретным типом, и клетки-хозяева включают, например, бактериальные клетки, такие как Е. coli, а также различные клетки животных. Клетки-хозяева можно соответственно применять в качестве продуцирующих систем для производства и экспрессии антител. Можно применять и эукариотические, и прокариотические клетки.
Эукариотические клетки, которые можно применять в качестве клеток-хозяев, включают, например, клетки животных, клетки растений и грибные клетки. Примеры клеток животных включают клетки млекопитающих, например, СНО (Puck и др., J. Exp. Med. 108, 1995, сс. 945-956), COS, НЕК293, 3Т3, клетки миеломы, ВНK (клетки почки детеныша хомяка), HeLa и Vero; клетки амфибий, например, Xenopus oocyte (Valle и др., Nature 291, 1981, сс. 338-340); и клетки насекомых, например, Sf9, Sf21 и Tn5. Рекомбинантные векторы или другие векторы можно интродуцировать в клетки-хозяева, например, используя методы на основе фосфата кальция, методы на основе DEAE-декстрана, методы, основанные на использовании DOTAP-липосомы (фирма Boehringer-Mannheim), электропорацию и липофекцию.
Растительные клетки, которые, как известно, могут служить в качестве системы производства белков, включают, например, клетки, полученные из Nicotiana tabacum, и клетки, полученные из ряски (Lemna minor). Из этих клеток можно культивировать каллюсы для получения антител, указанных в разделе А или Б описания. Системы производства белков на основе грибных клеток включают системы, основанные на использовании дрожжевых клеток, например, клеток рода Saccharomyces, таких как Saccharomyces cerevisiae и Schizosaccharomyces pombe; и клеток нитчатых грибов, например, рода Aspergillus, таких как Aspergillus niger. Когда применяют прокариотические клетки, то можно использовать системы производства на основе бактериальных клеток. Системы производства на основе бактериальных клеток включают, например, системы на основе Bacillus subtilis, а также Е. coli.
Для получения антитела, указанного в разделе А или Б описания, с использованием клеток-хозяев клетки-хозяева трансформируют экспрессионным вектором, содержащим нуклеиновую кислоту, которая кодирует антитело, указанное в разделе А или Б описания, и культивируют для экспрессии нуклеиновой кислоты. Например, когда в качестве хозяев применяют клетки животных, то культуральные среды могут включать, например, DMEM, MEM, RPMI1640 и IMDM, которые можно применять соответственно в комбинации с добавлением сыворотки, такой как FBS или фетальная телячья сыворотка (FCS). Альтернативно этому, клетки можно культивировать в бессывороточной среде.
С другой стороны, животных или растений можно применять в качестве систем производства in vivo для получения антител, указанных в разделе А или Б описания. Например, нуклеиновую(ые) кислоту(ы), кодирующую(ие) антитело, указанное в разделе А или Б описания, можно интродуцировать в указанных животных или растений для получения антитела in vivo и антитело затем можно собирать из животных или растений.
Когда в качестве хозяина используют животных, то доступны системы производства, основанные на применении млекопитающих или насекомых. Предпочтительные млекопитающие включают (но не ограничиваясь только ими) коз, свиней, овец, мышей и быков (Vicki Glaser, SPECTRUM Biotechnology Applications, (1993)). Можно применять также трансгенных животных.
В одном из примеров, нуклеиновую кислоту, которая кодирует антитело, указанное в разделе А или Б описания, получают в виде слитого гена с геном, кодирующим полипептид, который является специфическим компонентом молока, такого как козий β-казеин. Затем в эмбрионы козы инъецируют полинуклеотидный фрагмент, содержащий слитый ген, и трансплантируют в самку козы. Представляющее интерес антитело можно получать из молока, образующегося в трансгенных козах, которые родились от коз, получивших эмбрион, или из их потомства. Трансгенным козам можно вводить соответствующие гормоны для повышения объема молока, содержащего антитело, продуцируемое козами (Ebert и др., Bio/Technology 12, 1994, сс. 699-702).
Насекомые, применяемые для получения антител, указанных в разделе А или Б описания, включают, например, шелковичного червя. Когда используют шелковичных червей, в их геном встраивают бакуловирус с полинуклеотидом, кодирующим представляющее интерес антитело, для заражения шелковичных червей. Представляющее интерес антитело можно получать из общей воды организма зараженных шелковичных червей (Susumu и др., Nature 315, 1985, сс. 592-594).
Когда для получения антител, указанных в разделе А или Б описания, применяют растения, то можно использовать растения табака. Когда применяют растения табака, то рекомбинантный вектор, полученный в результате инсерции полинуклеотида, который кодирует представляющее интерес антитело, встраивают в растительный экспрессионный вектор, например, pMON 530, можно интродуцировать в бактерии, такие как Agrobacterium tumefaciens. Образовавшиеся бактерии можно использовать для заражения табака, например, Nicotiana tabacum (Ma и др., Eur. J. Immunol. 24, 1994, сс. 131-138) и требуемое антитело получать из листьев зараженного табака. Указанные модифицированные бактерии можно применять также для заражения ряска (Lemna minor) и требуемое антитело получать из клонированных клеток зараженной ряски (Сох и др., Nat. Biotechnol. 24(12), 2006, сс. 1591-1597).
Для того, чтобы секретировать антитело, которое экспрессируется в клетках-хозяевах в полости эндоплазматического ретикулума, в периплазматическом пространстве или во внеклеточной среде, приемлемые секреторные сигналы можно включать в представляющий интерес полипептид. Указанные сигналы могут быть эндогенными для представляющего интерес антитела или могут представлять собой гетерогенный сигнал, известный в данной области.
Антитело, указанное в разделе А или Б описания, полученное согласно описанным выше методам, можно выделять изнутри или снаружи (например, из сред и молока) клеток-хозяев или хозяина и очищать с получением практически чистого и гомогенного антитела. Антитела можно выделять и очищать, например, путем соответствующим образом выбранных и объединенных хроматографических колонок, с помощью фильтрации, ультрафильтрации, обессоливания, осаждения растворителем, экстракции растворителем, дистилляции, иммунопреципитации, электрофореза в полиакриламидном геле в присутствии ДСН, изоэлектрического фокусирования, диализа, перекристаллизации и других методов. Хроматография включает, например, аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, хроматографию с обращенной фазой и адсорбционную хроматографию. Указанную хроматографию можно осуществлять, например, с использованием жидкостной хроматографии, такой как ЖХВР и ЖХВД. Колонки для применения в аффинной хроматографии могут представлять собой колонку с белком А или колонку с белком G. Колонка с белком А включает, например, Hyper D, POROS, Sepharose F.F. (фирма Pharmacia).
Антитело при необходимости можно модифицировать или пептид можно частично удалять обработкой антитела соответствующими модифицирующими белок ферментами до или после очистки антитела. В качестве таких модифицирующих белки ферментов можно использовать, например, трипсин, химотрипсин, лизилэндопептидазу, протеинкиназы и глюкозидазы.
Альтернативным вариантом осуществления изобретения, указанным в разделе А описания, являются методы получения антител, содержащих антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, которые могут включать культивирование клеток-хозяев или выращивание хозяев и сбор антител из культур этих клеток, материалов, секретируемых хозяином, или другими путями, известными в данной области.
Одним из вариантов осуществления изобретения, указанным в разделе А описания, является метод получения, который включает любую одну или большее количество стадий, выбранных из группы, состоящей из: (а) отбора антитела, которое может усиливать элиминацию антигена из плазмы; (б) отбора антитела с повышенной связывающей активностью в отношении внеклеточного матрикса; (в) отбора антитела с повышенной FcγR-связывающей активностью в условиях нейтрального рН; (г) отбора антитела с повышенной FcγRIIb-связывающей активностью в условиях нейтрального рН; (д) отбора антитела с сохраненной или повышенной FcγRIIb-связывающей активностью и пониженной связывающей активностью в отношении одного или нескольких активирующих FcγR, выбранных из группы, состоящей из FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, FcγRIIIb и FcγRIIa; (e) отбора антитела с повышенной FcRn-связывающей активностью в условиях нейтрального рН; (ж) отбора антитела с определенной pI; (з) подтверждения pI собранного антитела и последующего отбора антитела с повышенной pI; и (и) отбора антитела, антигенсвязывающая активность которого изменяется или увеличивается в зависимости от условий концентрации ионов по сравнению с референс-антителом.
В контексте настоящего описания референс-антитело включает (но не ограничиваясь только ими) нативное антитело (например, нативное антитело в виде Ig, предпочтительно нативное антитело IgG-типа) и антитело до модификации (антитело до или в процессе конструирования библиотеки, например, зависящее от концентрации ионов антитело до повышения его pI или антитело с повышенной pI до введения зависящего от концентрации ионов антигенсвязывающего домена).
После получения антител, указанных в разделе А описания, образовавшиеся антитела можно исследовать с помощью анализа фармакокинетики антитела с использованием плазмы, такой как плазма мышей, крыс, кроликов, собак, обезьян, человека, для отбора антител с повышенной способностью элиминировать антиген из плазмы по сравнению с референс-антителом.
Альтернативно этому, после получения антител, указанных в разделе А описания, образовавшиеся антитела можно сравнивать с референс-антителом в отношении способности связываться с внеклеточным матриксом с помощью электрохемилюминисценции или других методов для отбора антител с повышенной способностью связываться с внеклеточным матриксом.
Альтернативно этому, после получения антител, указанных в разделе А описания, образовавшиеся антитела можно сравнивать с референс-антителом в отношении связывающей активности к различным FcγR в условиях нейтрального рН с использованием BIACORE® или других методов для отбора антител с повышенной связывающей активностью в отношении различных FcγR в условиях нейтрального рН. В этом случае различные FcγR могут относиться к представляющему интерес типу FcγR, например, FcγRIIb. Аналогично этому, можно также отбирать антитела, FcγRIIb-связывающая активность (в условиях нейтрального рН) которых сохраняется или повышается, и их связывающая активность в отношении одного или нескольких активирующих FcγR, выбранных и группы, состоящей из FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, FcγRIIIb и FcγRIIa и т.п., снижается. В этих случаях FcγR может представлять собой человеческий FcγR.
Альтернативно этому, после получения антител, указанных в разделе А описания, образовавшиеся антитела можно сравнивать с референс-антителом в отношении FcRn-связывающей активности в условиях нейтрального рН, используя BIACORE или другие известные технологии для отбора антител с повышенной FcRn-связывающей активностью в условиях нейтрального рН. В этом случае FcRn может представлять собой человеческий FcRn.
Альтернативно этому, после получения антител, указанных в разделе А описания, у образовавшихся антител можно определять pI с помощью изоэлектрического фокусирования или других методов для отбора антител с повышенной pI по сравнению с референс-антителом. В этом случае можно отбирать антитела, величина pI которых повышена, например, по меньшей мере на 0,01, 0,03, 0,05, 0,1, 0,2, 0,3, 0,4 или 0,5 или более или по меньшей мере на 0,6, 0,7, 0,8 или 0,9 или более; или антитела, величина pI которых повышена по меньшей мере на 1,0, 1,1, 1,2, 1,3, 1,4 или 1,5 или более, или по меньшей мере на 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4 или 2,5 или более, или 3,0 или более.
Альтернативно этому, после получения антител, указанных в разделе А описания, образовавшиеся антитела можно сравнивать с референс-антителом в отношении связывающей активности с требуемым антигеном в условиях низкой и высокой концентрации ионов, используя BIACORE или другие методы для отбора антител, антигенсвязывающая активность которых изменяется или возрастает в зависимости от условий концентрации ионов. Концентрация ионов может представлять собой, например, концентрацию ионов водорода или концентрацию ионов металлов. Когда концентрация ионов представляет собой концентрацию ионов металлов, то она может представлять собой, например, концентрацию ионов кальция. Изменяется ли или повышается связывающая активность можно оценивать по таким признаком, как, например: (а) измененное или повышенное поглощение антигена клетками; (б) измененная или повышенная способность связываться с различными молекулами антигена несколько раз; (в) измененное или увеличенное снижение концентрации антигена в плазме; или (г) измененное время удерживания антитела в плазме. Альтернативно этому, при необходимости можно объединять любые два или большее количество указанных методов отбора.
Альтернативным вариантом осуществления изобретения, указанным в разделе А описания, являются способы получения или скрининга антител, которые содержат антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, и pI которых увеличена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела («зависящие от концентрации ионов антитела с повышенной pI»). Способы получения можно осуществлять, например, посредством соответствующего объединения при необходимости родственных вариантов осуществления изобретения, указанных в контексте раздела А настоящего описания, например, варианта способов получения или скрининга антител с повышенной pI, описанных выше, а также варианта способов получения зависящих от концентрации ионов кальция антигенсвязывающих доменов или зависящих от концентрации ионов кальция антител, антигенсвязывающая активность которых выше в условиях высокой концентрации ионов кальция, чем в условиях низкой концентрации ионов кальция, или их библиотек, описанных выше, и/или варианта способов получения или скрининга рН-зависимых антигенсвязывающих доменов или рН-зависимых антител, антигенсвязывающая активность которых выше в условиях нейтрального рН, чем в условиях кислого рН, или их библиотек, описанных выше.
Альтернативным вариантом осуществления изобретения, указанным в разделе А описания, является способ получения или скрининга антитела, содержащего антигенсвязывающий домен, способность которого связывать внеклеточный матрикс повышается, когда его антигенсвязывающая активность изменяется в зависимости от условий концентрации ионов и его pI повышена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела («зависящие от концентрации ионов антитела с повышенной pI»). Под объем способа может подпадать повышение pI зависящего от концентрации ионов антитела. Указанный способ можно осуществлять, например, соответствующего объединения при необходимости родственных вариантов осуществления изобретения, описанных в контексте раздела А настоящего описания, например, варианта способа получения или скрининга антител с повышенной pI, описанных выше, а также варианта способов получения или скрининга зависящих от концентрации ионов кальция антигенсвязывающих доменов или зависящих от концентрации ионов кальция антител, антигенсвязывающая активность которых выше в условиях высокой концентрации ионов кальция, чем в условиях низкой концентрации ионов кальция, или их библиотек, описанных выше, и/или варианта способов получения или скрининга рН-зависимых антигенсвязывающих доменов или рН-зависимых антител, антигенсвязывающая активность которых выше в условиях нейтрального рН, чем в условиях кислого рН, или их библиотек, описанных выше. Например, образовавшиеся антитела можно сравнивать с референс-антителом в отношении их способности связывать внеклеточный матрикс с помощью электрохемилюминисценции или других известных технологий для отбора антител с повышенной способностью связываться с внеклеточным матриксом.
В контексте настоящего описания референс-антитело включает (но не ограничиваясь только ими) нативное антитело (например, нативное антитело в виде Ig, предпочтительно нативное антитело IgG-типа) и антитело до модификации (антитело до или в процессе конструирования библиотеки, например, зависящее от концентрации ионов антитело до повышения его pI или антитело с повышенной pI до введения зависящего от концентрации ионов антигенсвязывающего домена).
Альтернативным вариантом осуществления изобретения, указанным в разделе А описания, является способ получения антитела, содержащего антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, где способ включает модификацию по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности антитела, такую, которая приводит к повышению изоэлектрической точки (pI). В некоторых вариантах осуществления изобретения модификация аминокислотного остатка включает модификацию, выбранную из группы, состоящей из: (а) замены отрицательно заряженного аминокислотного остатка на незаряженный аминокислотный остаток; (б) замены отрицательно заряженного аминокислотного остатка на положительно заряженный аминокислотный остаток; и (в) замены незаряженного аминокислотного остатка на положительно заряженный аминокислот остаток. В некоторых вариантах осуществления изобретения по меньшей мере один модифицированный аминокислотный остаток заменен на гистидин. В других вариантах осуществления изобретения антитело содержит вариабельную область и/или константную область и аминокислотный остаток модифицируют в вариабельной области и/или константной области. В других вариантах осуществления изобретения по меньшей мере один аминокислотный остаток, модифицированный согласно способу, находится в положении в CDR или FR, выбранном из группы, которая состоит из: (а) положения 1, 3, 5, 8, 10, 12, 13, 15, 16, 18, 19, 23, 25, 26, 39, 41, 42, 43, 44, 46, 68, 71, 72, 73, 75, 76, 77, 81, 82, 82а, 82b, 83, 84, 85, 86, 105, 108, 110 и 112 в FR вариабельной области тяжелой цепи; (б) положения 31, 61, 62, 63, 64, 65 и 97 в CDR вариабельной область тяжелой цепи; (в) положения 1, 3, 7, 8, 9, 11, 12, 16, 17, 18, 20, 22, 37, 38, 39, 41, 42, 43, 45, 46, 49, 57, 60, 63, 65, 66, 68, 69, 70, 74, 76, 77, 79, 80, 81, 85, 100, 103, 105, 106, 107 и 108 в FR вариабельной области легкой цепи; и (г) положения 24, 25, 26, 27, 52, 53, 54, 55 и 56 в CDR вариабельной области легкой цепи, согласно нумерации Кэбота. В следующих вариантах осуществления изобретения по меньшей мере один аминокислотный остаток, модифицированный согласно способу, находится в положении в CDR или FR, выбранном из группы, которая состоит из: (а) положения 8, 10, 12, 13, 15, 16, 18, 23, 39, 41, 43, 44, 77, 82, 82а, 82b, 83, 84, 85 и 105 в FR вариабельной области тяжелой цепи; (б) положения 31, 61, 62, 63, 64, 65 и 97 в CDR вариабельной области тяжелой цепи; (в) положения 16, 18, 37, 41, 42, 45, 65, 69, 74, 76, 77, 79 и 107 в FR вариабельной области легкой цепи; и (г) положения 24, 25, 26, 27, 52, 53, 54, 55 и 56 в CDR вариабельной области легкой цепи. В некоторых вариантах осуществления изобретения антиген представляет собой растворимый антиген. В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение KD полученного согласно способу антитела для соответствующего ему антигена при кислом рН (например, рН 5,8) и нейтральном рН (например, рН 7,4). В дополнительных вариантах осуществления изобретения способ включает отбор антитела, которое имеет величину отношения KD (кислый диапазон рН (например, рН 5,8))/KD (нейтральный диапазон рН (например, рН 7,4)) для антигена, составляющую 2 или выше. В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение антигенсвязывающей активности антитела, полученного согласно способу, в условиях высокой концентрации ионов (например, концентрации ионов водорода или кальция) и низкой концентрации ионов. В других вариантах осуществления изобретения способ дополнительно включает отбор антитела, которое имеет более высокую антигенсвязывающую активность при высокой концентрации ионов (например, в 2 раза), чем при низкой концентрации ионов. В некоторых вариантах осуществления изобретения, в которых концентрация ионов представляет собой концентрацию ионов кальция, высокую концентрацию ионов кальция можно выбирать из концентрации, составляющей от 100мкМ и до 10мМ, от 200 мкМ и до 5 мМ, от 400 мкМ и до 3мМ, от 200 мкм и до 2 мМ или от 400 мкМ и до 1 мМ. Предпочтительной может являться также концентрация, выбранная из концентрации, составляющей от 500 мкМ и до 2,5 мМ, которая близка к концентрации в плазме (крови) ионов кальция in vivo. В некоторых вариантах осуществления изобретения низкую концентрацию ионов кальция можно выбирать из концентрации, составляющей от 0,1 мкМ и до 30мкМ, от 0,2 мкМ и до 20 мкМ, от 0,5 мкМ и до 10мкМ или от 1 мкМ и до 5 мкМ, или от 2 мкМ и до 4 мкМ. Предпочтительной может являться также концентрация, выбранная из концентрации, составляющей от 1 мкМ до 5 мкМ, которая близка к концентрации ионов кальция в ранних эндосомах in vivo. В некоторых вариантах осуществления изобретения нижним пределом отношения KD (условия низкой концентрации ионов кальция)/КХ) (условия высокой концентрации ионов кальция) (например, KD (3мкм Ca)/KD (2 мкМ Са)) является 2 или более, 10 или более или 40 или более, а верхним пределом является величина 400 или менее, 1000 или менее или 10000 или менее. В некоторых альтернативных вариантах осуществления изобретения нижний предел отношения kd (условия низкой концентрации ионов кальция) /kd (условия высокой концентрации ионов кальция) (например, kd (3мкМ Ca)/kd (2 мкМ Са)) является 2 или более, 5 или более, 10 или более или 30 или более, а верхним пределом является величина 50 или менее, 100 или менее или 200 или менее. В некоторых вариантах осуществления изобретения, в которых концентрация ионов представляет собой концентрацию ионов водорода, низкую концентрацию ионов водорода (нейтральный диапазон рН) можно выбирать из рН от 6,7 до 10,0, рН от 6,7 до 9,5, рН от 7,0 до 9,0 или рН от 7,0 до 8,0. Низкая концентрация ионов водорода предпочтительно может соответствовать рН 7,4, которая близка к рН in vivo в плазме (крови), но для удобства измерений можно применять, например, рН 7,0. В некоторых вариантах осуществления изобретения высокую концентрацию ионов водорода (кислый диапазон рН) можно выбирать из рН от 4,0 до 6,5, рН от 4,5 до 6,5, рН от 5,0 до 6,5 или рН от 5,5 до 6,5. Кислый диапазон рН может предпочтительно соответствовать рН 5,8, которая близка к концентрации ионов водорода in vivo в ранней эндосоме, но для удобства измерений можно применять, например, рН 6,0. В некоторых вариантах осуществления изобретения нижний предел отношения KD (кислый диапазон pH)/KD (нейтральный диапазон рН) (например, KD (рН 5,8)/KD (рН 7,4)) составляет 2 или более, 10 или более или 40 или более, а верхний предел составляет 400 или менее, 1000 или менее или 10000 или менее. В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение элиминации антигена из плазмы после введения антитела, полученного согласно способу, с элиминацией при введении референс-антитела, которое отличается только тем, что не включает модификацию(и), интродуцированную(ые) согласно способу. В других вариантах осуществления изобретения способ дополнительно включает отбор антитела, полученного согласно способу, которое усиливает элиминацию антигена из плазмы (например, в 2 раза) по сравнению с антителом, которое не содержит модификации, интродуцированные согласно способу. В некоторых вариантах осуществления изобретения способ дополнительно включает отбор антитела, полученного согласно способу, которое обладает повышенной способностью связывать внеклеточный матрикс, по сравнению с антителом, которое отличается только тем, что не включает модификацию(и), интродуцированную(ые) согласно способу. В дополнительных вариантах осуществления изобретения способ включает также отбор антитела, полученного согласно способу, которое обладает повышенной способностью связывать внеклеточный матрикс (например, в 2 раза при связывании с антигеном), по сравнению с антителом, которое отличается только тем, что не включает модификацию(и), интродуцированную(ые) согласно способу. В других вариантах осуществления изобретения антитела, полученные согласно способу, (практически) сохраняют антигенсвязывающую активность при сравнении с антителами до модификации или изменения по меньшей мере одного аминокислотного остатка для повышения pI (нативные антитела (например, нативные антитела в виде Ig, предпочтительно нативные антитела IgG-типа) или референс-антитела (например, антитело до модификация или до или в процессе создания библиотеки)). В этом случае «(практически) сохраняет антигенсвязывающую активность» может означать наличие активности, составляющей по меньшей мере 50% или более, предпочтительно 60% или более, более предпочтительно 70% или 75% или более и еще более предпочтительно 80%, 85%, 90% или 95% или более, по сравнению со связывающей активностью антител до модификации или изменения.
Дополнительным вариантом осуществления изобретения, указанным в разделе А описания, является способ получения антитела, содержащего антигенсвязывающий домен, антигенсвязывающая активность которого изменяется в зависимости от условий концентрации ионов, где способ включает модификацию по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности константной области антитела, которая повышает изоэлектрическую точку (pI). В некоторых вариантах осуществления изобретения модификация аминокислотного остатка включает модификацию, выбранную из группы, которая состоит из: (а) замены отрицательно заряженного аминокислотного остатка на незаряженный аминокислотный остаток; (б) замены отрицательно заряженного аминокислотного остатка на положительно заряженный аминокислотный остаток; и (в) замены незаряженного аминокислотного остатка на положительно заряженный аминокислотный остаток. В некоторых вариантах осуществления изобретения по меньшей мере один модифицированный аминокислотный остаток заменен на гистидин. В дополнительных вариантах осуществления изобретения антитело содержит вариабельную область и/или константную область, и аминокислотный остаток модифицируют в вариабельной области и/или константной области. В дополнительных вариантах осуществления изобретения по меньшей мере один аминокислотный остаток, модифицированный согласно способу, находится в положении в константной области, выбранном из группы, которая состоит из положения 196, 253, 254, 256, 258, 278, 280, 281, 282, 285, 286, 307, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 373, 382, 384, 385, 386, 387, 389, 399, 400, 401, 402, 413, 415, 418, 419, 421, 424, 430, 433, 434 и 443, согласно EU-нумерации. В дополнительных вариантах осуществления изобретения по меньшей мере один аминокислотный остаток, модифицированный согласно способу, находится в положении в константной области, выбранном из группы, которая состоит из положения 254, 258, 281, 282, 285, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 384, 385, 386, 387, 389, 399, 400, 401, 402, 413, 418, 419, 421, 433, 434 и 443, согласно EU-нумерации. В следующих дополнительных вариантах осуществления изобретения по меньшей мере один аминокислотный остаток, модифицированный согласно способу, находится в положении в константной области, выбранном из группы, которая состоит из положения 282, 309, 311, 315, 342, 343, 384, 399, 401, 402 и 413, согласно EU-нумерации. В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение антигенсвязывающей активности антитела, полученного согласно способу, в условиях высокой концентрации ионов (например, концентрация ионов водорода или кальция) и низкой концентрации ионов. В дополнительных вариантах осуществления изобретения способ дополнительно включает отбор антитела, которое обладает более высокой антигенсвязывающей активностью при высокой концентрации ионов, чем при низкой концентрации ионов. В некоторых вариантах осуществления изобретения способ включает сравнение элиминации антигена из плазмы после введения антитела, полученного согласно способу, и после введения референс-антитела, которое отличается только тем, что не включает модификацию(и), интродуцированную(ые) согласно способу. В дополнительных вариантах осуществления изобретения способ включает также отбор антитела, полученного согласно способу, которое усиливает элиминацию антигена из плазмы (например, в 2 раза) по сравнению с антителом, которое не содержит модификации, интродуцированные согласно способу. В некоторых вариантах осуществления изобретения способ включает сравнение связывания с внеклеточным матриксом антитела, полученного согласно способу, с антителом, которое отличается только тем, что не включает модификацию(и), интродуцированную(ые) согласно способу. В дополнительных вариантах осуществления изобретения способ включает также отбор антитела, полученного согласно способу, которое обладает повышенной способностью связываться с внеклеточным матриксом (например, в 2 раза при связывании с антигеном) по сравнению с антителом, которое отличается только тем, что не включает модификацию(и), интродуцированную(ые) согласно способу. В некоторых вариантах осуществления изобретения способ включает сравнение связывающей активности в отношении Fc-гамма-рецептора (FcγR) при нейтральном рН (например, рН 7,4) антитела, полученного согласно способу, с активностью референс-антитела, содержащего константную область нативного IgG. В дополнительных вариантах осуществления изобретения способ включает отбор антитела, полученного согласно способу, которое обладает повышенной FcγR-связывающей активностью при нейтральном рН (например, рН 7,4) по сравнению с активностью референс-антитела, содержащего константную область нативного IgG. В некоторых вариантах осуществления изобретения отобранное антитело, полученное согласно способу, обладает повышенной FcγRIIb-связывающей активностью при нейтральном рН. В некоторых вариантах осуществления изобретения отобранное антитело, полученное согласно способу, обладает связывающей активностью в отношении одного или нескольких FcγR, предпочтительно выбранных из группы, которая состоит из FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, FcγRIIIb и FcγRIIa, и в отношении FcγRIIb, и необязательно FcγRIIb-связывающая активность сохраняется или увеличивается, а связывающая активность в отношении активирующих FcγR снижается по сравнению с активностью референс-антитела, которое отличается только тем, что его константная область представляет собой область нативного IgG. В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение FcRn-связывающей активности в условиях нейтрального рН антитела, полученного согласно способу, с референс-антителом, которое отличается только тем, что его константная область представляет собой область нативного IgG. В других вариантах осуществления изобретения способ дополнительно включает отбор антитела, полученного согласно способу, которое имеет повышенную FcRn-связывающую активность в условиях нейтрального рН по сравнению с активностью референс-антитела, которое отличается только тем, что его константная область представляет собой область нативного IgG (например, в 2 раза). В некоторых вариантах осуществления изобретения антитела, полученные согласно способу, (практически) сохраняют антигенсвязывающую активность при сравнении с антителами до модификации или изменения по меньшей мере одного аминокислотного остатка для повышения pI (нативные антитела (например, нативные антитела в виде Ig, предпочтительно нативные антитела IgG -типа) или референс-антитела (например, антитела до модификации антител или до или в процессе создания библиотеки)). В этом случае «(практически) сохраняет антигенсвязывающую активность» может означать наличие активности, составляющей по меньшей мере 50% или более, предпочтительно 60% или более, более предпочтительно 70% или 75% или более и еще более предпочтительно 80%, 85%, 90% или 95% или более, по сравнению со связывающей активностью антител до модификации или изменения.
В дополнительных вариантах осуществления изобретения способ включает модификацию по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности вариабельной области и константной области антитела, для повышения изоэлектрической точки (pI). В других вариантах осуществления изобретения по меньшей мере один аминокислотный остаток, модифицированный согласно способу, находится в указанном выше положении в константной области. В дополнительных вариантах осуществления изобретения по меньшей мере один аминокислотный остаток, модифицированный согласно способу, находится в описанном выше положении в вариабельной области. В следующих вариантах осуществления изобретения по меньшей мере один аминокислотный остаток, модифицированный согласно способу, находится в указанном выше положении в константной области, и по меньшей мере один аминокислотный остаток, модифицированный согласно способу, находится в указанном выше положении в вариабельной области. В некоторых вариантах осуществления изобретения антиген представляет собой растворимый антиген. В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение KD антитела, полученного согласно способу, в отношении соответствующего ему антигена при кислом рН (например, рН 5,8) и нейтральном рН (например, рН 7,4). В дополнительных вариантах осуществления изобретения способ включает отбор антитела, которое имеет величину отношения KD (кислый диапазон рН (например, рН 5,8)) / KD (нейтральный диапазон рН (например, рН 7,4)) в отношении антигена, составляющую 2 или выше. В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение антигенсвязывающей активности антитела, полученного согласно способу, в условиях высокой концентрации ионов (например, концентрации ионов водорода или кальция) и низкой концентрации ионов. В других вариантах осуществления изобретения способ дополнительно включает отбор антитела, которое имеет более высокую антигенсвязывающую активность при высокой концентрации ионов, чем при низкой концентрации ионов. В некоторых вариантах осуществления изобретения, в которых концентрация ионов представляет собой концентрацию ионов кальция, высокую концентрацию ионов кальция можно выбирать из концентрации, составляющей от 100мкМ и до 10мМ, от 200 мкМ и до 5 мМ, от 400 мкМ и до 3мМ, от 200 мкм и до 2 мМ или от 400 мкМ и до 1 мМ. Предпочтительной может являться также концентрация, выбранная из концентрации, составляющей от 500 мкМ и до 2,5 мМ. В некоторых вариантах осуществления изобретения низкую концентрацию ионов кальция можно выбирать из концентрации, составляющей от 0,1мкМ и до 30мкМ, от 0,2 мкМ и до 20 мкМ, от 0,5 мкМ и до 10мкМ или от 1 мкМ и до 5 мкМ, или от 2 мкМ и до 4 мкМ. Предпочтительной может являться также концентрация, выбранная из концентрации, составляющей от 1 мкМ до 5 мкМ. В некоторых вариантах осуществления изобретения нижним пределом отношения KD (условия низкой концентрации ионов кальция)/KD (условия высокой концентрации ионов кальция) (например, KD (3мкм Ca)/KD (2 мкМ Са)) является 2 или более, 10 или более или 40 или более, а верхним пределом является величина 400 или менее, 1000 или менее или 10000 или менее. В некоторых альтернативных вариантах осуществления изобретения нижний предел отношения kd (условия низкой концентрации ионов кальция) /kd (условия высокой концентрации ионов кальция) (например, kd (3мкМ Ca)/kd (2 мкМ Са)) является 2 или более, 5 или более, 10 или более или 30 или более, а верхним пределом является величина 50 или менее, 100 или менее или 200 или менее. В некоторых вариантах осуществления изобретения, в которых концентрация ионов представляет собой концентрацию ионов водорода, низкую концентрацию ионов водорода (нейтральный диапазон рН) можно выбирать из рН от 6,7 до 10,0, рН от 6,7 до 9,5, рН от 7,0 до 9,0 или рН от 7,0 до 8,0. Низкая концентрация ионов водорода предпочтительно может соответствовать рН 7,4, которая близка к рН in vivo в плазме (крови), но для удобства измерений можно применять, например, рН 7,0. В некоторых вариантах осуществления изобретения высокую концентрацию ионов водорода (кислый диапазон рН) можно выбирать из рН от 4,0 до 6,5, рН от 4,5 до 6,5, рН от 5,0 до 6,5 или рН от 5,5 до 6,5. Кислый диапазон рН может, например, соответствовать рН 5,8 или 6,0. В некоторых вариантах осуществления изобретения нижний предел отношения KD (кислый диапазон pH)/KD (нейтральный диапазон рН) (например, KD (рН 5,8)/KD (рН 7,4)) составляет 2 или более, 10 или более или 40 или более, а верхний предел составляет 400 или менее, 1000 или менее или 10000 или менее.
В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение элиминации антигена из плазмы после введения антитела, полученного согласно способу, и после введения референс-антитела, которое отличается только тем, что не включает модификацию(и), интродуцированную(ые) согласно способу. В дополнительных вариантах осуществления изобретения способ включает также отбор антитела, полученного согласно способу, которое усиливает элиминацию антигена из плазмы (например, в 2 раза) по сравнению с антителом, которое не содержит модификации, интродуцированные согласно способу. В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение связывания с внеклеточным матриксом антитела, полученного согласно способу, с антителом, которое отличается только тем, что не включает модификацию(и), интродуцированную(ые) согласно способу. В дополнительных вариантах осуществления изобретения способ включает также отбор антитела, полученного согласно способу, которое обладает повышенной способностью связываться с внеклеточным матриксом (например, в 5 раз при образовании комплекса с антигеном) по сравнению с антителом, которое отличается только тем, что не включает модификацию(и), интродуцированную(ые) согласно способу. В некоторых вариантах осуществления изобретения способ включает сравнение связывающей активности в отношении FcraMMa-рецептора (FcγR) при нейтральном рН (например, рН 7,4) антитела, полученного согласно способу, с активностью референс-антитела, содержащего константную область нативного IgG. В дополнительных вариантах осуществления изобретения способ включает отбор антитела, полученного согласно способу, которое обладает повышенной FcγR-связывающей активностью при нейтральном рН (например, рН 7,4) по сравнению с активностью референс-антитела, содержащего константную область нативного IgG. В некоторых вариантах осуществления изобретения отобранное антитело, полученное согласно способу, обладает повышенной FcγRIIb-связывающей активностью при нейтральном рН. В некоторых вариантах осуществления изобретения отобранное антитело, полученное согласно способу, обладает связывающей активностью в отношении одного или нескольких активирующих FcγR, предпочтительно выбранных из группы, которая состоит из FcγRIa, FcγRIb, FcγRIc, FcγRIIIa, FcγRIIIb и FcγRIIa, и в отношении FcγRIIb, и необязательно FcγRIIb-связывающая активность сохраняется или увеличивается, а связывающая активность в отношении активирующих FcγR снижается по сравнению с активностью референс-антитела, которое отличается только тем, что его константная область представляет собой область нативного IgG. В некоторых вариантах осуществления изобретения способ дополнительно включает сравнение FcRn-связывающей активности в условиях нейтрального рН антитела, полученного согласно способу, с референс-антителом, которое отличается только тем, что его константная область представляет собой область нативного IgG. В других вариантах осуществления изобретения способ дополнительно включает отбор антитела, полученного оогласно способу, которое имеет повышенную FcRn-связывающую активность в условиях нейтрального рН по сравнению с активностью референс-антитела, которое отличается только тем, что его константная область представляет собой область нативного IgG (например, в 2 раза). В дополнительных вариантах осуществления изобретения антитела, полученные согласно способу, (практически) сохраняют антигенсвязывающую активность при сравнении с антителами до модификации или изменения по меньшей мере одного аминокислотного остатка для повышения pI (нативные антитела (например, нативные антитела в виде Ig, предпочтительно нативные антитела IgG-типа) или референс-антитела (например, антитела до модификации антител или до или в процессе создания библиотеки)). В этом случае «(практически) сохраняет антигенсвязывающую активность» может означать наличие активности, составляющей по меньшей мере 50% или более, предпочтительно 60% или более, более предпочтительно 70% или 75% или более и еще более предпочтительно 80%, 85%, 90% или 95% или более, по сравнению со связывающей активностью антител до модификации или изменения.
Альтернативным вариантом осуществления изобретения, указанным в разделе А описания, является антитело, полученное с помощью способа получения или скрининга антител, описанного выше в разделе А описания.
Альтернативным вариантом осуществления изобретения, указанным в разделе А описания, является композиция или фармацевтическая композиция, содержащая антитело, указанное выше в разделе А описания. В одном из вариантов осуществления изобретения фармацевтическая композиция, указанная в разделе А описания, может представлять собой фармацевтическую композицию, предназначенную для ускорения элиминации антигена из биологической жидкости (предпочтительно плазмы и т.д.) индивидуумов и/или для повышения связывания внеклеточного матрикса (когда антитело, указанное в разделе А описания, вводят (наносят) индивидууму (предпочтительно in vivo)). Фармацевтическая композиция, указанная в разделе А описания, необязательно может содержать фармацевтически приемлемый носитель. В контексте настоящего описания понятие «фармацевтические композиции» может, как правило, относиться к агентам, предназначенным для применения для лечения, предупреждения, диагностирования или анализа заболеваний.
Композиции или фармацевтические композиции, указанные в разделе А описания, можно приготавливать соответствующим образом. В некоторых вариантах осуществления изобретения их можно применять парентерально, например, в форме стерильного раствора или суспензии для инъекции в воде или любой другой фармацевтически приемлемой жидкости. Композиции можно соответствующим образом приготавливать в виде стандартной дозы согласно требуемой стандартной надлежащей фармацевтической практике путем объединения соответственно с фармацевтически приемлемыми носителями или средами. Указанные фармацевтически приемлемые носители или среды включают (но не ограничиваясь только ими) стерильную воду, физиологический соляной раствор, растительные масла, эмульгаторы, суспендирующие агенты, поверхностно-активные вещества, стабилизаторы, корригенты, эксципиенты, наполнители, консерванты и связывающие агенты. Количество действующего вещества в композициях можно регулировать таким путем, чтобы доза находилась в приемлемом предварительно определенном диапазоне.
В некоторых вариантах осуществления изобретения композиции или фармацевтические композиции, указанные в разделе А описания, можно вводить парентерально. Композиции или фармацевтические композиции можно соответственно приготавливать, например, в виде инъецируемой, трансназальной, транспульмональной или трансдермальной композиции. Композиции или фармацевтические композиции можно вводить системно или применять место, например, путем внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции или подкожной инъекции.
Некоторыми вариантами осуществления изобретения являются антитела, pI которых повышена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности (антитела с повышенной pI); способы получения указанных антител или применение этих антител для повышения элиминации антигена из плазмы (когда антитела вводят индивидуумам in vivo). Должно быть очевидно, что для таких вариантов осуществления изобретения могут быть применены соответствующим образом объем раздела А настоящего описания и содержание дополнительных примеров. Другими вариантами осуществления изобретения являются антитела, pI которых понижена путем модификации по меньшей мере одного аминокислотного остатка, который может экспонироваться на поверхности («антитела с пониженной pI»); способы получения указанных антител или применение таких антител для улучшения времени удерживания в плазме (когда антитела вводят индивидуумам in vivo). При создании изобретения было установлено, что клеточную интернализацию антитела можно повышать путем увеличения pI посредством интродукции конкретных аминокислотных мутаций в конкретные сайты в аминокислотной последовательности константной области. Обычным специалистам в данной области должно быть очевидно, что время удерживания антитела в плазме можно пролонгировать, так как pI снижена для подавления клеточной интернализации антитела путем интродукции аминокислот с другим зарядом боковых цепей в описанные выше сайты. Должно быть очевидно, что объем раздела А настоящего описания и содержание дополнительных примеров, приведенных в настоящем описании, можно применять соответственно в таких вариантах осуществления изобретения.
Одним из вариантов осуществления изобретения является способ получения модифицированного антитела, время полужизни в плазме которого пролонгировано или укорочено по сравнению с временем полужизни до модификации антитела, где способ включает: (а) модификацию нуклеиновой кислоты, которая кодирует антитело до модификации, для изменения заряда по меньшей мере одного аминокислотного остатка, локализованного в положении, выбранном из группы, которая состоит из положения 196, 253, 254, 256, 257, 258, 278, 280, 281, 282, 285, 286, 306, 307, 308, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 373, 382, 384, 385, 386, 387, 388, 389, 399, 400, 401, 402, 413, 415, 418, 419, 421, 424, 430, 433, 434 и 443, согласно EU-нумерации; (б) культивирование клетки-хозяина для экспрессии модифицированной нуклеиновой кислоты и для производства антитела; и (в) сбор полученного антитела из культуры клетки-хозяина.
Дополнительным вариантом осуществления изобретения является способ пролонгирования или укорочения времени полужизни антитела в плазме, где способ включает модификацию по меньшей мере одного аминокислотного остатка, локализованного в положении, выбранном из группы, которая состоит из положения 196, 253, 254, 256, 257, 258, 278, 280, 281, 282, 285, 286, 306, 307, 308, 309, 311, 315, 327, 330, 342, 343, 345, 356, 358, 359, 361, 362, 373, 382, 384, 385, 386, 387, 388, 389, 399, 400, 401, 402, 413, 415, 418, 419, 421, 424, 430, 433, 434 и 443, согласно EU-нумерации.
Эти способы могут дополнительно включать определение того, является ли время полужизни в плазме собранного и/или модифицированного антитела пролонгированным или укороченным, по сравнению с временем полужизни до модификации антитела.
Для изменения заряда можно использовать аминокислотную(ые) замену(ы). В некоторых вариантах осуществления изобретения замененный(ые) аминокислотный(ые) остаток(и) можно выбирать из группы, состоящей из аминокислотных остатков указанных ниже групп (а) и (б) (но не ограничиваясь только ими): (a) Glu (Е) и Asp (D); и (б) Lys (K), Arg (R) и His (Н).
В некоторых вариантах осуществления изобретения антитело может представлять собой антитело Ig-типа, такое как антитело IgG-типа. В некоторых вариантах осуществления изобретения антитело может представлять собой химерное антитело, гуманизированное антитело или человеческое антитело. В некоторых вариантах осуществления изобретения антитело может представлять собой мультиспецифическое антитело, такое как биспецифическое антитело.
Раздел Б описания
Вариантами осуществления изобретения, указанными в разделе Б описания, являются (но не ограничиваясь только ими) варианты Fc-области, их применения и способы получения.
В контексте разделов А и Б настоящего описания «вариант Fc-области» может означать, например, Fc-область, модифицированную относительно Fc-области нативного антитела IgG-типа, с помощью замены по меньшей мере одной аминокислоты на другую аминокислоту или может относиться к Fc-области, модифицированной относительно указанного варианта Fc-области с помощью дополнительной замены по меньшей мере одной аминокислоты на другую аминокислоту. В контексте настоящего описания варианты такой Fc-области включают не только Fc-области, в которые интродуцирована аминокислотная модификация, но также Fc-области, содержащие такую же аминокислотную последовательность, что и вышеуказанная Fc-область.
Альтернативным вариантом осуществления изобретения, указанным в разделе Б описания, являются варианты Fc-области, содержащие FcRn-связывающий домен, который содержит Ala в положении 434; любую из Glu, Arg, Ser и Lys в положении 438; и любую из Glu, Asp и Gln в положении 440 согласно EU-нумерации (в контексте раздела Б настоящего описания указанный вариант Fc-области обозначают также как «новый вариант Fc-области» для целей наглядности).
На практике варианты Fc-области, указанные в разделе Б описания, можно включать практически в любое антитело (например, мультиспецифические антитела, такие как биспецифические антитела) вне зависимости от типа антигена-мишени. Например, биспецифические антитела к фактору IXa/фактору X можно получать, используя варианты Fc-области, указанные в примере 20 (например, содержащие F8M-F1847mv [F8M-F1847mv1 (SEQ ID NO: 323) и F8M-F1847mv2 (SEQ ID NO: 324) в качестве тяжелых цепей и F8ML (SEQ ID NO: 325) в качестве легкой цепи]; F8M-F1868mv [F8M-F1868mv1 (SEQ ID NO: 326) и F8M-F1868mv2 (SEQ ID NO: 327) в качестве тяжелых цепей и F8ML (SEQ ID NO: 325) в качестве легкой цепи]; и F8M-F1927mv [F8M-F1927mv1 (SEQ ID NO: 328) и F8M-F1927mv2 (SEQ ID NO: 329) в качестве тяжелых цепей и F8ML (SEQ ID NO: 325) в качестве легкой цепи]).
Как описано выше, в WO 2013/046704 описаны такие варианты Fc-области, в которые интродуцирована мутация для повышения их FcRn-связывающей активности в кислых условиях в комбинации со специфической мутацией (репрезентативным примером которой является мутация двух остатков Q438R/S440E согласно EU-нумерации), которые характеризуются в значительной степени пониженным связыванием с ревматоидным фактором. Однако в WO 2013/046704 не описано, что варианты Fc-области, связывание которых с ревматоидным фактором снижено благодаря модификации Q438R/S440E, обладают удлиненным временем удерживания в плазме по сравнению с антителами с нативной Fc-областью. Таким образом, существует необходимость в безопасных и более ценных вариантах Fc-области с улучшенным временем удерживания в плазме, но которые не связываются с ранее присутствующим ADA. При создании изобретения разработаны безопасные и более ценные варианты Fc-области с улучшенным временем удерживания в плазме, но которые не связываются с антителами к лекарственным средствам (с предсуществующими ADA и т.д.). В частности, неожиданно установлено и впервые описано, что варианты Fc-области, которые содержат объединенные мутации аминокислотных остатков, приводящие к замене на Ala (А) аминокислоты в положении 434 согласно EU-нумерации, и специфическую мутацию двух остатков (репрезентативным примером является Q438R/S440E), являются предпочтительными для пролонгирования времени удерживания антитела в плазме с сохранением существенно сниженной способности связываться с ревматоидным фактором.
Таким образом, новые варианты Fc-области, указанные в разделе Б настоящего описания, обладают преимуществом и неожиданными улучшенными свойствами по сравнению с вариантами Fc-области, описанными в WO 2013/046704, которая полностью включена в настоящее описание в качестве ссылки.
Одним из вариантов осуществления изобретения, указанным в разделе Б описания, являются новые комбинации аминокислотных замен в FcRn-связывающем домене, которые повышают FcRn-связывающую активность антител в кислом диапазоне рН и в нейтральном диапазоне рН, в частности, в кислом диапазоне рН.
В одном из вариантов осуществления изобретения вариант Fc-области, указанный в разделе Б описания, содержит Ala в положении 434; любую из Glu, Arg, Ser и Lys в положении 438; и любую из Glu, Asp и Gin в положении 440 согласно EU-нумерации; и более предпочтительно содержит Ala в положении 434; или Arg, или Lys в положении 438; и или Glu, или Asp в положении 440 согласно EU-нумерации. Предпочтительно вариант Fc-области, указанный в разделе Б описания, дополнительно содержит или Ilе, или Leu в положении 428 и/или любую из Ile, Leu, Val, Thr и Phe в положении 436 согласно EU-нумерации. Более предпочтительно вариант Fc-области содержит Leu в положении 428 и/или либо Val, либо Thr в положении 436 согласно EU-нумерации.
В одном из вариантов осуществления изобретения вариант Fc-области, указанный в разделе Б описания, может представлять собой вариант Fc-области нативного антитела в виде Ig и более предпочтительно вариант Fc-области нативного антитела IgG-типа (IgG1-, IgG2-, IgG3- или IgG4-типа). Нативная Fc-область описана, в частности, в контексте разделов А и Б настоящего описания. Более конкретно в разделе Б описания нативная Fc-область может означать не модифицированную или встречающуюся в естественных условиях Fc-область и предпочтительно не модифицированную или встречающуюся в естественных условиях Fc-область нативного антитела в виде Ig, в Fc-области которого аминокислотные остатки остаются не модифицированными. Источником Fc-области антитела может являться Ig, такой как IgM или IgG, например, человеческий IgG1, IgG2, IgG3 или IgG4. В одном из вариантов осуществления изобретения источником может быть человеческий IgG1. При этом понятие «(референс) антитело», содержащее нативную Fc-область, может относиться к антителу, содержащему не модифицированную или встречающуюся в естественных условиях Fc-область.
Положения 428, 434, 438 и 440 являются общими для Fc-областей всех нативных человеческих антител IgG1, IgG2, IgG3 и IgG4. Однако в положении 436 в Fc-области нативные человеческие антитела IgG1, IgG2 и IgG4 несут Tyr (Y), а нативное человеческое антитело IgG3-типа имеет Phe (F). C другой стороны, Stapleton и др., Nature Comm., 2011, с. 599 описали, что человеческие IgG3-аллотипы, которые содержат аминокислотную замену R435H согласно EU-нумерации, обладают временем полужизни в плазме человека, сопоставимым с IgG1. Отсюда при создании изобретения высказано предположение о том, что время удерживания в плазме можно улучшать путем повышения связывания FcRn в кислых условиях путем интродукции аминокислотной замены R435H в комбинации с аминокислотной заменой в положении 436.
В WO 2013/046704 также конкретно описаны замены двух аминокислотных остатков Q438R/S440E, Q438R/S440D, Q438K/S440E и Q438K/S440D согласно EU нумерации, которые приводят к существенному снижению связывания с ревматоидным фактором при объединении с аминокислотной заменой, которая повышает связывание FcRn в кислых условиях.
Таким образом, в предпочтительном варианте осуществления изобретения FcRn-связывающий домен варианта Fc-области, указанного в разделе Б описания, может содержать комбинацию замененных аминокислот, выбранную из группы, которая состоит из: (a) N434A/Q438R/S440E; (б) N434A/Q438R/S440D; (в) N434A/Q438K/S440E; (г) N434A/Q438K/S440D; (д) N434A/Y436T/Q438R/S440E; (е) N434A/Y436T/Q438R/S440D; (ж) N434A/Y436T/Q438K/S440E; (з) N434A/Y436T/ Q438K/S440D; (и) N434A/Y436V/Q438R/S440E; (к) N434A/Y436V/ Q438R/S440D; (л) N434A/Y436V/Q438K/S440E; (м) N434A/Y436V/Q438K/S440D; (н) N434A/R435H/ F436T/Q438R/S440E; (о) N434A/R435H/F436T/Q438R/S440D; (п) N434A/R435H/ F436T/Q438K/S440E; (р) N434A/R435H/F436T/Q438K/S440D; (с) N434A/R435H/F436V/Q438R/S440E; (т) N434A/R435H/F436V/Q438R/S440D; (у) N434A/R435H/F436V/Q438K/S440E; (ф) N434A/R435H/F436V/Q438K/S440D; (х) M428L/N434A/Q438R/S440E; (ц) M428L/N434A/Q438R/S440D; (ч) M428L/N434A/Q438K/ S440E; (ш) M428L/N434A/Q438K/S440D; (щ) M428L/N434A/Y436T/Q438R/ S440E; (э) M428L/N434A/Y436T/Q438R/S440D; (аа) M428L/N434A/Y436T/Q438K/ S440E; (аб) M428L/N434A/Y436T/Q438K/S440D; (ав) M428L/N434A/Y436V/Q438R/ S440E; (аг) M428L/N434A/Y436V/Q438R/S440D; (ад) M428L/N434A/Y436V/Q438K/ S440E; (ае) M428L/N434A/Y436V/Q438K/S440D; (аж) L235R/G236R/S239K/M428L/N434A/ Y436T/Q438R/S440E; и (аз) L235R/G236R/A327G/A330S/P331S/M428L/ N434A/ Y436T/Q438R/S440E, согласно EU-нумерации.
В дополнительном предпочтительном варианте осуществления изобретения FcRn-связывающий домен варианта Fc-области, указанного в разделе Б описания, может содержать комбинацию замененных аминокислот, выбранную из группы, которая состоит из: (a) N434A/Q438R/S440E; (б) N434A/Y436T/Q438R/ S440E; (в) N434A/Y436V/Q438R/S440E; (г) M428L/N434A/Q438R/S440E; (д) M428L/N434A/Y436T/Q438R/S440E; (е) M428L/N434A/ Y436V/Q438R/S440E; (ж) L235R/G236R/S239K/M428L/N434A/Y436T/Q438R/S440E; и (з) L235R/G236R/ A327G/A330S/P331S/M428L/N434A/Y436T/Q438R/S440E, согласно EU-нумерации.
В одном из вариантов осуществления изобретения предпочтительно, чтобы FcRn-связывающая активность варианта Fc-области, указанного в разделе Б описания, повышалась в условиях кислого рН по сравнению с Fc-областью нативного IgG.
Повышение FcRn-связывающей активности (аффинность связывания) FcRn-связывающего домена в диапазоне рН может соответствовать повышению измеренной FcRn-связывающей активности (аффинность связывания) по сравнению с измеренной FcRn-связывающей активностью (аффинность связывания) нативного FcRn-связывающего домена. В этом случае величина отношения KD (нативная Fc-область)/KD (вариант Fc-области, указанный в разделе Б описания), которое характеризует различие в связывающей активности (аффинность связывания), может составлять по меньшей мере 1,5, 2, 3, 4, 5, 10, 15, 20, 50, 70, 80, 100, 500 или 1000 раз. Указанное увеличение может иметь место в кислом диапазоне рН и/или в нейтральном диапазоне рН; однако повышение в кислом диапазоне рН может оказаться предпочтительным с позиции механизма действия, указанного в разделе Б описания.
В некоторых вариантах осуществления изобретения FcRn-связывающая активность (например, при рН 6,0 и 25°С) варианта Fc-области, указанного в разделе Б описания, FcRn-связывающая активность которого повышается в кислом диапазон рН в большей степени, чем Fc-области нативного IgG, например, в 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 50, 75, 100, 200, 500, 1000 раз или более. В некоторых вариантах осуществления изобретения повышенная FcRn-связывающая активность варианта Fc-области в кислом диапазоне рН может быть выше, чем FcRn-связывающая активность Fc-области нативного IgG по меньшей мере в 5 или по меньшей мере в 10 раз.
Манипуляция с FcRn-связывающим доменом путем интродукции аминокислотных замен может иногда снижать стабильность антитела (WO 2007/092772). Белки, имеющие недостаточную стабильность, имеют тенденцию легко образовывать агрегаты в процессе хранения и стабильность фармацевтических белков является очень важной при производстве фармацевтических средств. Так, снижение стабильности, связанное с заменами в Fc-области, может приводить к сложности при разработке стабильных препаратов антител (WO 2007/092772).
Чистота фармацевтических белков касательно мономеров и высокомолекулярных продуктов является важной для разработки фармацевтических средств. После очистки с помощью белка A IgG1 дикого типа не содержит в значительном количестве высокомолекулярные продукты, в то время как манипуляция с FcRn-связывающим доменом, заключающаяся в интродукции замен, может приводить в образованию большого количества высокомолекулярных продуктов. В этом случае указанные высокомолекулярные продукты может требоваться удалять из лекарственной субстанции с помощью стадий очистки.
Аминокислотные замены в антителах могут приводить к отрицательным последствиям, таким как повышение иммуногенности терапевтических антител, что в свою очередь может вызывать цитокиновый «шторм» и/или производство антител к лекарственным средствам (ADA). Клиническая применимость и эффективность терапевтических антител могут ограничиваться ADA, поскольку они влияют на эффективность и фармакокинетику терапевтических антител и иногда вызывают серьезные побочные действия. На иммуногенность терапевтических антител влияет целый ряд факторов, и присутствие эпитопов эффекторных Т-клеток является одним из таких факторов. Аналогично этому, наличие ранее присутствующих антител против терапевтического антитела также может приводить к проблемам. Примером такого ранее присутствующего антитела является ревматоидный фактор (RF), аутоантитело (антитело, направленное против своего белка) к Fc-области антитела (т.е., IgG). Ревматоидный фактор обнаружен, в частности, у пациентов с системной красной волчанкой (SLE) или ревматоидным артритом. У страдающих артритом пациентов RF и IgG сцеплены с образованием иммунных комплексов, участвующих в развитии заболевания. В настоящее время описано гуманизированное анти-CD4 антитело IgG1-типа с мутацией Asn434His, обеспечивающее значительное связывание с ревматоидным фактором (Zheng и др., Clin. Pharmacol. Ther. 89(2), 2011, сс. 283-290). Подробное исследование подтвердило, что мутация Asn434His в человеческом IgG1 увеличивает связывание ревматоидного фактора с Fc-областью антитела по сравнению с родительским человеческим IgG1.
RF представляет собой поликлональное аутоантитело против человеческого IgG. Эпитоп RF в последовательности человеческого IgG варьируется между клонами, эпитоп RF, вероятно, локализован в области раздела СН2/СН3, а также в СН3-домене, который может перекрываться с FcRn-связывающим эпитопом. Таким образом, мутации, приводящие к повышению FcRn-связывающей активности при нейтральном рН, по-видимому, могут повышать также активность связывания с конкретными клонами RF.
В контексте раздела Б описания понятие «антитело к лекарственному средству» или «ADA» может относиться к эндогенному антителу, которое обладает способностью связываться с эпитопом, локализованном на терапевтическом антителе, и в результате может связываться с терапевтическим антителом. Понятие «предсуществующее антитело к лекарственному средству» или «предсуществующее ADA» может относиться к антителу к лекарственному средству, которое присутствует и поддается обнаружению в крови пациента до введения пациенту терапевтического антитела. В некоторых вариантах осуществления изобретения предсуществующее ADA представляет собой человеческое антитело. В других вариантах осуществления изобретения предсуществующее ADA представляет собой ревматоидный фактор.
Связывающую активность Fc-области (вариант) антитела в отношении предсуществующего ADA можно, например, характеризовать с помощью электрохемилюминисцентного (ECL) ответа при кислом рН и/или при нейтральном рН. ECL-анализ описан, например, у Moxness и др., Clin Chem. 51, 2005, сс. 1983-1985 и в примере 6. Анализы можно осуществлять, например, в условиях применения MES-буфера и 37°С. Антигенсвязывающую активность антител можно определять, например, с помощью BIACORE®-анализа.
Связывающую активность в отношении предсуществующего ADA можно оценивать при любой температуре от 10°С до 50°С. В некоторых вариантах осуществления изобретения связывающую активность (аффинность связывания) человеческой Fc-области с человеческим ранее присутствующим ADA определяют при температуре от 15°С до 40°С, например, от 20°С до 25°С или при 25°С. В дополнительном варианте осуществления изобретения взаимодействие между человеческим предсуществующим ADA и человеческой Fc-областью измеряют при рН 7,4 (или рН 7,0) и 25°С.
В контексте раздела Б настоящего описания выражение «связывающая активность в отношении (ранее присутствующего) ADA существенно повышена» или эквивалентное выражение может означать, что измеренная способность связывать (ранее присутствующее) ADA (аффинность связывания) (т.е. KD) варианта Fc-области, указанной в разделе Б описания, или антитела, содержащего ее, повышена, например, в 0,55, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2 или 2,3 раза или более, по сравнению с измеренной способностью связывать (предсуществующее) ADA (аффинность связывания) референс-варианта Fc-области или референс-антитела, содержащего референс-вариант Fc-области. Указанное повышение связывающей активности в отношении предсуществующего ADA может быть обнаружено у индивидуального пациента или в группе пациентов.
В одном из вариантов осуществления изобретения в контексте раздела Б описания понятие «пациенты» или «пациент» может включать всех людей, страдающих заболеванием, которых подвергают лечению терапевтическим антителом (но не ограничено только ими). Пациенты могут представлять собой людей, страдающих аутоиммунным заболеванием, таким как артрит или системная красная волчанка (SLE). Артрит может включать ревматоидный артрит.
В одном из вариантов осуществления изобретения, указанном в разделе Б описания, понятие «связывающая активность в отношении ранее присутствующего ADA существенно повышена у отдельного пациента» может означать, что связывающая активность антитела, содержащего вариант Fc области (например, терапевтического антитела), в отношении ранее присутствующего ADA, измеренная у пациента, повышена по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50% или по меньшей мере на 60% или более по сравнению со связывающей активностью референс-антитела в отношении ранее присутствующего ADA. Альтернативно этому, это может означать, что ECL-ответ антитела предпочтительно превышает 250 или по меньшей мере 500, или по меньшей мере 1000, или даже по меньшей мере 2000. Предпочтительно повышение может представлять собой повышение относительно референс-антитела, ECL-ответ которого составляет менее чем 500 или 250. В частности, ECL-ответ, характеризующий связывающую активность референс-антитела с ранее присутствующим ADA и указанную связывающую активность антитела, имеющего вариант Fc-области, предпочтительно находится в диапазоне от менее чем 250 до по меньшей мере 250, от менее чем 250 до по меньшей мере 500, от менее чем 500 до 500 или более, от менее чем 500 до 1000 или более или от менее чем 500 до по меньшей мере 2000 (но не ограничиваясь только ими).
В одном из вариантов осуществления изобретения выражение «связывающая активность в отношении предсуществующего ADA повышена» может означать, что в группе пациентов измеренная доля пациентов, которые имеют ECL-ответ, составляющий по меньшей мере 500 (предпочтительно по меньшей мере 250), для антитела, содержащего вариант Fc-области с (а) повышенной связывающей активностью в отношении FcRn при кислом рН и (б) повышенной связывающей активностью в отношении предсуществующего ADA при нейтральном рН, увеличена по сравнению с долей пациентов, которые имеют ECL-ответ, составляющий по меньшей мере 500 (предпочтительно по меньшей мере 250 или более), относительно референс-антитела, например, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по сравнению с долей пациентов, которые дают ECL-ответ на референс-антитело.
В одном из вариантов осуществления изобретения, указанном в разделе Б описания, выражение «связывающая активность в отношении предсуществующего ADA снижается» может означать, что измеренная связывающая активность (т.е., KD или ECL-ответ) антитела, содержащего вариант Fc-области, снижена по сравнению с активностью референс-антитела. Указанное снижение может быть обнаружено у индивидуального пациента или в группе пациентов. Выражение «Аффинность антитела, содержащего вариант Fc-области, в отношении ранее присутствующего ADA при нейтральном рН существенно снижается у каждого пациента» может означать, что измеренная связывающая активность в отношении предсуществующего ADA при нейтральном рН, измеренная у пациента, снижается по сравнению со связывающей активностью референс-антитела в отношении предсуществующего ADA, измеренной при нейтральном рН, например, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%.
Альтернативно этому, выражение «связывающая активность антитела, содержащего вариант Fc-области, в отношении предсуществующего ADA существенно снижается у индивидуального пациента» может, например, означать, что ECL-ответ на применяемое антитело, который должен составлять, например, 500 или более (предпочтительно, 1000 или более или 2000 или более), при измерении составлял менее чем 500, предпочтительно менее чем 250 по сравнению с ECL-ответом на референс-антитело.
В предпочтительном варианте осуществления изобретения варианты Fc-областей, указанные в разделе Б описания, и содержащие их антитела имеют низкую связывающую активность в отношении предсуществующего ADA при нейтральном рН. В частности, предпочтительно, чтобы связывающая активность антител, содержащих варианты Fc-областей, указанные в разделе Б описания, в отношении ранее присутствующего ADA при нейтральном рН была ниже или не была существенно увеличена по сравнению со связывающей активностью референс-антитела, содержащего Fc-область нативного IgG, в отношении предсуществующего ADA при нейтральном рН (например, рН 7,4). Выражение «связывающая активность (аффинность связывания) в отношении предсуществующего ADA является низкой или аффинность находится на исходном уровне» может означать, что у индивидуального пациента ECL-ответ составляет менее чем 500 или менее чем 250 (но не ограничиваясь только ими). Выражение «связывающая активность в отношении предсуществующего ADA является низкой в группе пациентов» может означать, например, что ECL-ответ составляет менее 500 у 90%, предпочтительно у 95% и более предпочтительно у 98% пациентов в группе.
Может оказаться предпочтительным отбирать варианты Fc-области, указанные в разделе Б описания, или содержащие их антитела, связывающая активность которых в отношении (предсуществующего) ADA в плазме при нейтральном рН не существенно возрастала и FcRn-связывающая активность которых при нейтральном рН и/или при кислом рН увеличивалась. Предпочтительно FcRn-связывающая активность при кислом рН (например, рН 5,8) увеличивается. В одном из вариантов осуществления изобретения варианты Fc-области предпочтительно не обладают существенно повышенной связывающей активность в отношении ADA в условиях нейтрального рН (например, рН 7,4) по сравнению с Fc-областью нативного IgG, и ADA может представлять собой предсуществующее ADA, предпочтительно ревматоидный фактор (RF).
В одном из вариантов осуществления изобретения может оказаться предпочтительным, чтобы варианты Fc-области, указанные в разделе Б описания, обладали повышенной FcRn-связывающей активностью в условиях кислого рН по сравнению с Fc-областью нативного IgG, и в результате характеризовались пониженным плазменным клиренсом (CL), пролонгированным временем удерживания в плазме или пролонгированным временем полужизни в плазме (t1/2). Корреляция между указанными параметрами известна в данной области.
В одном из вариантов осуществления изобретения может оказаться предпочтительным, чтобы варианты Fc-области, указанные в разделе Б описания, обладали повышенной FcRn-связывающей активностью в условиях кислого рН, но не обладали существенной повышенной ADA-связывающей активностью в условиях нейтрального рН по сравнению с Fc-областью нативного IgG, и они характеризовались пониженным плазменным клиренсом (CL), пролонгированным временем удерживания в плазме или пролонгированным временем полужизни в плазме (t1/2). ADA может представлять ранее присутствующее ADA, предпочтительно ревматоидный фактор (RF).
В одном из вариантов осуществления изобретения варианты Fc-области, указанные в разделе Б описания, обладают преимуществом, поскольку время удерживания их в плазме улучшается по сравнению с референс-вариантом Fc-области, содержащим комбинацию аминокислотных замен N434Y/Y436V/Q438R/S440E согласно EU- нумерации.
В примерах 5-7 описано сравнение времени удерживания в плазме двух вариантов Fc-области: варианта Fc-области F1718 (Fc-область с мутациями, интродуцированными в четыре сайта: N434Y/Y436V/Q438R/S440E), описанная в WO 2013/046704, и нового варианта Fc-области F1848m (интродукция мутаций в четыре сайта: N434A/Y436V/Q438R/S440E). Аминокислотные мутации для двух вариантов Fc-области отличаются только тем, что в положении 434 согласно EU-нумерации интродуцированная аминокислотная мутация представляет собой Y (тирозин) в случае F1718 и А (аланин) в случае F1848m. Однако по сравнению с нативным IgG1 F 1848m характеризуется улучшенным временем удерживания в плазме, в то время как F1718 не обладает таким улучшенным временем удерживания в плазме (см. пример (7-2)). Таким образом, варианты Fc-области, указанные в разделе Б описания, могут предпочтительно иметь улучшенное время удерживания в плазме по сравнению с референс-вариантами Fc-области, содержащими комбинацию аминокислотных замен N434Y/Y436V/Q438R/S440E. Результаты экспериментов, описанных в примерах (5-2) и (7-3), демонстрируют, что среди различных вариантов Fc-области у F1847m, F1886m, F1889m и F1927m дополнительно улучшено время удерживания в плазме относительно F1848m. Таким образом, обычным специалистам в данной области должно быть очевидно, что варианты Fc-области, указанные в разделе Б описания, содержащие F1847m, F1886m, F1889m или F1927m, а также F1848m, обладают улучшенным временем удерживания в плазме по сравнению с референс-вариантами Fc-области, содержащими замены N434Y/Y436V/Q438R/S440E.
Связывание с FcγR или белком системы комплемента может также оказывать неблагоприятное воздействие (например, несоответствующую активацию тромбоцитов). Варианты Fc-области, которые не связываются с эффекторными рецепторами, такими как FcγRIIa-рецептор, могут быть более безопасными и/или обладать большим преимуществом. В некоторых вариантах осуществления изобретения варианты Fc-области, указанные в разделе Б описания, обладают лишь слабой связывающей активностью в отношении эффекторных рецепторов или не связываются с эффекторными рецепторами. Примеры эффекторных рецепторов включают активирующий FcγR, в частности FcγRI, FcγRII и FcγRIII. FcγRI включает FcγRIa, FcγRIb и FcγRIc и их подтипы. FcγRII включает FcγRIIa (имеющий два аллотипа: R131 и Н131) и FcγRIIb. FcγRIII включает FcγRIIIa (который имеет два аллотипа: V158hF158)h FcγRIIIb (который имеет два аллотипа: FcγRIIIb-NA1 и FcγRIIIb-NA2). Антитела, которые обладают лишь слабой связывающей активностью в отношении эффекторных рецепторов или не связываются с эффекторными рецепторами, включают, например, антитела, содержащие молчащую Fc-область, и антитела, у которых отсутствует Fc-область (например, Fab, F(ab)'2, scFv, sc(Fv)2 и димерные антитела).
Примеры Fc-областей, которые обладают лишь слабой связывающей активностью в отношении эффекторных рецепторов или не связываются с эффекторными рецепторами, описаны, например, у Strohl и др., Curr. Op. Biotech. 20(6), 2009, сс. 685-691, и они конкретно включают, например, дегликозилированные Fc-области (N297A и N297Q) и молчащие Fc-области, полученные в результате манипуляции с Fc-областями для придания им молчащих эффекторных функцией (или для подавления иммунитета) (IgG1-L234A/L235A, IgG1-H268Q/A330S/P331S, IgG1-C226S/C229S, IgG1-C226S/C229S/E233P/L234V/L235A, IgG1-L234F/L235E/P331S, IgG2-V234A/G237A, IgG2-H268Q/V309L/A330S/A331S, IgG4-L235A/G237A/E318A и IgG4-L236E). В WO 2008/092117 описаны антитела, содержащие молчащую Fc-область, которая включает замену G236R/L328R, L235G/G236R, N325A/L328R или N325L/L328R согласно EU-нумерации. В WO 2000/042072 описаны антитела, содержащие молчащую Fc-область, которая включает замены в одном или нескольких положениях EU233 (положение 233 согласно EU-нумерации), EU234, EU235 и EU237. В WO 2009/011941 описаны антитела, содержащие молчащую Fc-область, в которой отсутствуют остатки EU231-EU238. У Davis и др., J. Rheum. 34(11), 2007, сс.2204-2210 описаны антитела с молчащей Fc-областью, содержащей замены C220S/C226S/C229S/P238S. У Shields и др., J. Biol. Chem. 276(9), 2001, сс. 6591-6604 описаны антитела, содержащие молчащую Fc-область, которая включает замену D265A. Модификацию указанных аминокислотных остатков можно также соответственно интродуцировать в варианты Fc-области, указанные в разделе Б описания.
Понятие «слабое связывание с эффекторными рецепторами» может означать, что связывающая активность в отношении эффекторных рецепторов составляет, например, 95% или менее, предпочтительно 90% или менее, 85% или менее, 80% или менее, 75% или менее, more предпочтительно 70% или менее, 65% или менее, 60% или менее, 55% или менее, 50% или менее, 45% или менее, 40% или менее, 35% или менее, 30% или менее, 25% или менее, 20% или менее, 15% или менее, 10% или менее, 9% или менее, 8% или менее, 7% или менее, 6% или менее, 5% или менее, 4% или менее, 3% или менее, 2% или менее или 1% или менее относительно нативного IgG или антитела, содержащего Fc-область нативного IgG.
«Молчащая Fc-область» означает вариант Fc-области, содержащий одну или большее количество аминокислотных замен, инсерций, добавлений, делеций и других модификаций, которые снижают связывание с эффекторными рецепторами по сравнению с нативной Fc-областью. Поскольку связывающая активность в отношении эффекторных рецепторов может быть существенно снижена, такие молчащие Fc-области более не могут связываться с эффекторными рецепторами. Молчащие Fc-области могут включать, например, Fc-области, содержащие аминокислотные замены в одном или нескольких положениях, выбранных из группы, которая состоит из: EU234, EU235, EU236, EU237, EU238, EU239, EU265, EU266, EU267, EU269, EU270, EU271, EU295, EU296, EU297, EU298, EU300, EU324, EU325, EU327, EU328, EU329, EU331 и EU332. Модификацию указанных аминокислотных остатков можно также соответственно интродуцировать в варианты Fc-области, указанные в разделе Б описания.
В следующих вариантах осуществления изобретения молчащая Fc-область имеет замену в одном или нескольких положениях, выбранных из группы, которая состоит из: EU234, EU235, EU236, EU237, EU238, EU239, EU265, EU266, EU267, EU269, EU270, EU271, EU295, EU296, EU297, EU298, EU300, EU324, EU325, EU327, EU328, EU329, EU331 и EU332, и предпочтительно группы, которая состоит из: EU235, EU237, EU238, EU239, EU270, EU298, EU325 и EU329, где замену на аминокислотный остаток выбирают из указанного ниже перечня:
Аминокислоту в положении EU234 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Ala, Arg, Asn, Asp, Gln, Glu, Gly, His, Lys, Met, Phe, Pro, Ser и Thr.
Аминокислоту в положении EU235 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Ala, Asn, Asp, Gln, Glu, Gly, His, Ile, Lys, Met, Pro, Ser, Thr, Val и Arg.
Аминокислоту в положении EU236 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, Asn, Gln, His, Leu, Lys, Met, Phe, Pro и Tyr.
Аминокислоту в положении EU237 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Ala, Asn, Asp, Gln, Glu, His, Ile, Leu, Lys, Met, Pro, Ser, Thr, Val, Tyr и Arg.
Аминокислоту в положении EU238 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Ala, Asn, Gln, Glu, Gly, His, Ile, Lys, Thr, Trp и Arg.
Аминокислоту в положении EU239 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Gln, His, Lys, Phe, Pro, Trp, Tyr и Arg.
Аминокислоту в положении EU265 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Ala, Arg, Asn, Gln, Gly, His, Ile, Leu, Lys, Met, Phe, Ser, Thr, Trp, Tyr и Val.
Аминокислоту в положении EU266 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Ala, Arg, Asn, Asp, Gln, Glu, Gly, His, Lys, Phe, Pro, Ser, Thr, Trp и Tyr.
Аминокислоту в положении EU267 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, His, Lys, Phe, Pro, Trp и Tyr.
Аминокислоту в положении EU269 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Ala, Arg, Asn, Gln, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr и Val.
Аминокислоту в положении EU270 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Ala, Arg, Asn, Gln, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr и Val.
Аминокислоту в положении EU271 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, His, Phe, Ser, Thr, Trp и Tyr.
Аминокислоту в положении EU295 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, Asn, Asp, Gly, His, Phe, Ser, Trp и Tyr.
Аминокислоту в положении EU296 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, Gly, Lys и Pro.
Аминокислоту в положении EU297 предпочтительно заменяют на Ala.
Аминокислоту в положении EU298 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, Gly, Lys, Pro, Trp и Tyr.
Аминокислоту в положении EU300 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, Lys и Pro.
Аминокислоту в положении EU324 предпочтительно заменяют либо на Lys, либо на Pro.
Аминокислоту в положении EU325 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Ala, Arg, Gly, His, Ile, Lys, Phe, Pro, Thr, Trp, Tyr и Val.
Аминокислоту в положении EU327 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, Gln, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr и Val.
Аминокислоту в положении EU328 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, Asn, Gly, His, Lys и Pro.
Аминокислоту в положении EU329 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Asn, Asp, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Ser, Thr, Trp, Tyr, Val и Arg.
Аминокислоту в положении EU330 предпочтительно заменяют либо на Pro, либо на Ser.
Аминокислоту в положении EU331 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, Gly и Lys.
Аминокислоту в положении EU332 предпочтительно заменяют на аминокислоту, выбранную из группы, которая состоит из Arg, Lys и Pro.
Молчащая Fc-область предпочтительно может содержать замену либо на Lys, либо на Arg в EU235, замену либо на Lys, либо на Arg в EU237, замену либо на Lys, либо на Arg в EU238, замену либо на Lys, либо на Arg в EU239, замену на Phe в EU270, замену на Gly в EU298, замену на Gly в EU325 или замену либо на Lys, либо на Arg в EU329. Более предпочтительно молчащая Fc-область может содержать замену на аргинин в EU235 или замену на лизин в EU239. Еще более предпочтительно молчащая Fc-область может содержать замены L235R/S239K. Модификацию указанных аминокислотных остатков можно также соответственно интродуцировать в варианты Fc-области, указанные в разделе Б описания.
В одном из вариантов осуществления изобретения антитела, содержащие вариант Fc-области, указанный в разделе Б описания, обладают лишь слабой способностью связывать белок комплемента или не связываются с белками комплемента. В некоторых вариантах осуществления изобретения белок комплемента представляет собой C1q. В некоторых вариантах осуществления изобретения слабая способностью связывать белок комплемента относится к способности связывать белок комплемента, пониженной в 10 или более, 50 или более или 100 раз или более по сравнению со способностью связывать белок комплемента нативного IgG или антитела, содержащего Fc-область нативного IgG. Способность связывать белок комплемента Fc-области можно снижать с помощью аминокислотных модификаций, таких как аминокислотная замена, инсерция, добавление или делеция.
В одном из вариантов осуществления изобретения варианты Fc-области, указанные в разделе Б описания, или антитела, содержащие варианты Fc-области, можно оценивать в отношении связывающей (человеческий) FcRn активности в нейтральном диапазоне рН и/или в кислом диапазоне рН одним и тем же описанным выше методом.
В одном из вариантов осуществления изобретения способ модификации константных областей антитела для получения вариантов Fc-области, указанных в разделе Б описания, может основываться, например, на оценке нескольких изотипов константной области (IgG1, IgG2, IgG3 и IgG4), для выбора изотипов, обладающих пониженной антигенсвязывающей активностью в кислом диапазоне рН и/или обладающих пониженной скоростью диссоциации в кислом диапазоне рН. Альтернативный способ может основываться на интродукции аминокислотных замен в аминокислотную последовательность нативного IgG-изотипа для снижения антигенсвязывающей активности в кислом диапазоне рН (например, рН 5,8) и/или для повышения скорости диссоциации в кислом диапазоне рН. Последовательность шарнирной области константной области антитела сильно варьируется в зависимости от изотипов (IgG1, IgG2, IgG3 и IgG4), и различия в аминокислотной последовательности шарнирной области могут оказывать существенное влияние на антигенсвязывающую активность. Таким образом, изотипы с пониженной антигенсвязывающей активностью в кислом диапазоне рН и/или повышенной скоростью диссоциации в кислом диапазоне рН можно отбирать путем селекции приемлемых изотипов в зависимости от типа антигена или эпитопа. Кроме того, поскольку различия в аминокислотной последовательности шарнирной области могут оказывать существенное влияние на антигенсвязывающую активность, аминокислотные замены в аминокислотных последовательностях нативных изотипов могут быть локализованы в шарнирной области.
Альтернативным вариантом осуществления изобретения, указанным в разделе Б описания, является применение антитела, содержащего описанный выше вариант Fc-области, указанный в разделе описания Б, для ускорения высвобождения антитела, которое было интернализовано в клетки в связанной с антигеном форме, наружу из клеток в свободной от антигена форме. В контексте настоящего описания «высвобождения антитела, которое было интернализовано в клетки в связанной с антигеном форме, наружу из клеток в свободной от антигена форме» не обязательно означает, что антитело, которое было интернализовано в клетки в связанной с антигеном форме, полностью высвобождается наружу из клеток в свободной от антигена форме. Приемлемым является, если доля антител, высвободившихся в свободной от антигена форме наружу из клеток, повышается по сравнению антителами до модификации их FcRn-связывающего домена (например, до повышения FcRn-связывающей активности антитела в кислом диапазоне рН). Предпочтительно, чтобы антитело, высвободившееся наружу из клеток, сохраняло свою антигенсвязывающую активность.
Понятие «способность элиминировать антиген из плазмы» или эквивалентное понятие может относиться к способности элиминировать антиген из плазмы, когда антитело вводят или оно секретируется in vivo. Таким образом, понятие «способность антитела элиминировать антиген из плазмы повышается» может означать, что после введения антитела, например, скорость элиминации антигена из плазмы возрастает по сравнению со скоростью до модификации его FcRn-связывающего домена. Повышение способности антитела элиминировать антиген из плазмы можно оценивать, например, путем введения растворимого антигена и антитела in vivo и измерения концентрации растворимого антигена в плазме после введения. Растворимый антиген может представлять собой связанный с антителом или свободный от антитела антиген и его концентрации можно определять в виде «концентрации в плазме связанного с антителом антигена» и «концентрации в плазме свободного от антитела антигена» соответственно. Последнее понятие является синонимом «концентрация в плазме свободного антигена». Понятие «общая концентрация антигена в плазме» может относиться к сумме концентрации связанного с антителом антигена и концентрации свободного от антитела антигена.
Альтернативным вариантом осуществления изобретения, указанным в разделе Б описания, является способ пролонгирования времени удерживания в плазме антитела, содержащего вариант Fc-области, указанный в разделе Б описания. Нативный человеческий IgG может связываться с FcRn из животных кроме человека. Например, поскольку нативный человеческий IgG может связываться с мышиным FcRn сильнее, чем с человеческим FcRn (Ober и др., Intl. Immunol. 13(12), 2001, сс. 1551-1559), то антитела можно вводить мышам для оценки свойств антител. Альтернативно этому, например, мышей, у которых разрушен их собственный ген FcRn и вместо этого интродуцирован в ген человеческого FcRn, которые экспрессируют его в виде трансгена (Roopenian и др., Meth. Mol. Biol. 602, 2010, сс. 93-104 (2010), также можно использовать для оценки антител.
В контексте разделов А и Б настоящего описания можно определять концентрацию в плазме свободного антигена, не связанного с антителом, или соотношение концентрации свободного антигена и общей концентрации антигена (например, Ng и др., Pharm. Res. 23(1), 2006, сс. 95-103). Альтернативно этому, когда антиген обладает конкретной функцией in vivo, то связан ли антиген с антителом, которое нейтрализует функцию антигена (антагонистическая молекула), можно определять путем оценки, является ли функция антигена нейтрализованной. Является ли функция антигена нейтрализованной, можно определять, измеряя, в частности, in vivo маркер, отражающий функцию антигена. Является ли антиген связанным с антителом, которое активирует функцию антигена (агонистическая молекула), можно оценивать, измеряя, в частности, in vivo маркер, отражающий функцию антигена.
Не накладывается конкретных ограничений на измерения, такие как определение концентрации в плазме свободного антигена, определение соотношения количества в плазме свободного антигена и общего количества в плазме антигена и оценка маркера in vivo; однако измерения предпочтительно следует осуществлять после определенного периода времени после введения антитела. В контексте раздела Б описания «после определенного периода времени после введения антитела» не ограничено конкретным периодом, и период могут определять соответственно обычные специалисты в данной области в зависимости от свойств вводимого антитела и т.д., и он включает, например, 1 день, 3 дня, 7 дней, 14 дней или 28 дня после введения антитела. В контексте настоящего описания понятие «концентрация антигена в плазме» может относиться либо к «общей концентрации антигена в плазме» которая представляет собой сумму концентрации связанного с антителом антигена и концентрации свободного от антитела антигена, либо к «концентрации свободного антигена в плазме», которая представляет собой концентрация свободного от антитела антигена.
Молярное соотношение антигена и антитела можно рассчитывать с помощью формулы: С=А/В, в которой величина А обозначает молярную концентрацию антигена в каждый момент времени, величина В обозначает молярную концентрацию антитела в каждый момент времени, а величина С обозначает отношение молярной концентрации антиген к молярной концентрации антитела (молярное соотношение антиген/антитело) в каждый момент времени.
Меньшая величина С свидетельствует о более эффективной элиминации антигена антителом, а бóльшая величина С свидетельствует о менее эффективной элиминации антигена антителом.
В некоторых объектах изобретения при введении антитела, указанного в разделе Б описания, молярное соотношение антиген/антитело снижается в 2, 5, 10, 20, 50, 100, 200, 500 или 1000 раз или более по сравнению с введением референс-антитела, содержащего Fc-область нативного человеческого IgG в качестве человеческого FcRn-связывающего домена.
Снижение общей концентрации антигена в плазме или молярного соотношения антиген/антитело можно оценивать, используя известные в данной области методы, например, описанные в примерах 6, 8 и 13 WO 2011/122011. Более конкретно, их можно оценивать на основе либо модели, полученной совместной инъекцией антигена-антитела, либо инфузионной модели антигена в стационарном состоянии с использование трансгенной по человеческому FcRn линии мышей 32 или 276 (фирма Jackson Laboratories, Methods Mol. Biol. 602, 2010, cc. 93-104), когда представляющее интерес антитело, указанное в разделе Б описания, не дает перекрестную реакцию с мышиным антигеном-копией. Когда антитело дает перекрестную реакцию с мышиной копией, то оценку можно осуществлять путем простой инъекции антитела в трансгенных по человеческому FcRn мышей линии 32 или 276 (фирма Jackson Laboratories). В основанной на совместной инъекции модели мышам вводят смесь антитела и антигена. В инфузионной модели антигена в стационарном состоянии инфузионный насос, заполненный раствором антигена, имплантируют мышам до достижения постоянной концентрации антигена и затем мышам инъецируют антитело. Всем подопытным мышам вводят одинаковую дозу. Общую концентрацию антигена в плазме, концентрацию свободного антигена в плазме и концентрацию антитела в плазме можно измерять в требуемые моменты времени.
Для оценки долговременных воздействий антитела, указанного в разделе Б описания, общую концентрацию или концентрацию свободного антигена в плазме или молярное соотношение антиген/антитело можно измерять через 2, 4, 67, 14, 28, 56 дней или 84 дня после введения. Другими словами, для оценки свойств антитела можно определять концентрацию антигена в плазме в течение длительного периода времени путем измерения концентрации общего или свободного антигена в плазме или молярное соотношение антиген/антитело через два, четыре, семь, 14, 28, 56 или 84 дня после введения антитела. Снижается ли концентрация антигена в плазме или молярное соотношение антиген/антитело с помощью антитела, можно определять путем оценки указанных снижений в один или нескольких указанных выше моментов времени.
Для оценки кратковременных воздействий антитела, указанного в разделе Б описания, общую концентрацию или концентрацию свободного антигена в плазме или молярное соотношение антиген/антитело можно измерять через 15 мин, 1 ч, 2 ч, 4 ч, 8 ч, 12 ч или 24 ч после введения. Другими словами, для оценки свойств антитела можно определять концентрацию антигена в плазме в течение короткого периода времени путем измерения концентрации общего или свободного антигена в плазме или молярное соотношение антиген/антитело через 2, 4, 7, 14, 28, 56 дней или 84 дня после введения антитела. Другими словами, для оценки свойств антитела можно определять концентрацию антигена в плазме в течение короткого периода времени путем измерения общей концентрации или концентрации свободного антигена в плазме или молярное соотношение антиген/антитело через 15 мин, 1 ч, 2 ч, 4 ч, 8 ч, 12 ч или 24 ч после введения. Если время удерживания в плазме человека определить трудно, то его можно прогнозировать на основе времени удерживания в плазме мышей (например, обычных мышей, трансгенных мышей, экспрессирующих человеческий антиген, или трансгенных мышей, экспрессирующих человеческий FcRn) или обезьян (например, обезьян циномолгус).
Альтернативным вариантом осуществления изобретения, указанным в разделе Б описания, является антитело, содержащее вариант Fc-области, указанный выше в разделе Б описания. Приемлемыми могут являться различные варианты антител, указанных в разделах А и Б настоящего описания, не противоречащие известным техническим знаниям и, если они соответствуют данному контексту.
В одном из вариантов осуществления изобретения антитела, содержащие вариант Fc-области, указанный в разделе Б описания, можно применять в качестве терапевтических антител для лечения больных людей с аутоиммунными заболеваниями, отторжением трансплантата (реакция «трансплантат-против-хозяина»), другими воспалительными заболеваниями или аллергическими заболеваниями, которые описаны в WO 2013/046704.
В одном из вариантов осуществления изобретения антитела, содержащие вариант Fc-области, указанный в разделе Б описания, могут иметь модифицированные сахарные цепи. Антитела с модифицированными сахарными цепями могут включать, например, антитела с модифицированным гликозилированием (WO 99/54342), антитела с дефицитом фукозы (WO 00/61739, WO 02/31140, WO 2006/067847, WO 2006/067913) и антитела, имеющие сахарные цепи, которые бисекционнируются с помощью GlcNAc (WO 02/79255). В одном из вариантов осуществления изобретения антитела могут быть днгликозилированными. В некоторых вариантах осуществления изобретения антитела содержат, например, мутации в сайте гликозилирования тяжелой цепи для ингибирования гликозилирования в этой локализации, что описано в WO 2005/03175. Указанные негликозилированные антитела можно получать путем модификации сайта гликозилирования тяжелой цепи, т.е. путем интродукции замены N297Q или N297A согласно EU-нумерации и экспрессии белков в приемлемых клетках-хозяевах.
Альтернативным вариантом осуществления изобретения, указанным в разделе Б описания, является композиция или фармацевтическая композиция, включающая антитело, содержащее указанный вариант Fc-области. Приемлемыми могут являться различные композиции или фармацевтические композиции, указанные в разделах А и Б настоящего описания, не противоречащие известным техническим знаниям и, если они соответствуют данному контексту. Указанные композиции можно применять для повышения времени удерживания в плазме (у индивидуумов, которым вводят (которых обрабатывают) антитело, указанное в разделе Б описания).
Альтернативным вариантом осуществления изобретения, указанным в разделе Б описания, являются нуклеиновые кислоты, кодирующие вариант Fc-области, или антитела, содержащие вариант Fc-области. Приемлемыми могут являться различные варианты нуклеиновых кислот, указанные в разделах А и Б настоящего описания, не противоречащие известным техническим знаниям и, если они соответствуют данному контексту. Альтернативно этому, в разделе Б описания указаны векторы, содержащие нуклеиновые кислоты. Приемлемыми могут являться их различные варианты, указанные в разделах А и Б настоящего описания, не противоречащие известным техническим знаниям и, если они соответствуют данному контексту. Альтернативно этому, в разделе Б описания указаны хозяева или клетки-хозяева, содержащие векторы. Приемлемыми могут являться их различные варианты, указанные в разделах А и Б настоящего описания, не противоречащие известным техническим знаниям и, если они соответствуют данному контексту.
Альтернативным вариантом осуществления изобретения, указанным в разделе Б описания, являются способы получения варианта Fc-области, содержащего FcRn-связывающий домен, или антитела, содержащего вариант Fc-области, которые включают культивирование клеток-хозяев, описанных выше, или выращивание хозяев, описанных выше, и сбор варианта Fc-области или антитела, содержащего вариант Fc-области, из культуры клеток, продуктов, секретируемых из хозяев. В этом случае раздел Б описания может включать способы получения, которые необязательно включают также одну или несколько следующих стадий: (а) отбор варианта Fc-области с повышенной FcRn-связывающей активностью в условиях кислого рН по сравнению с активностью Fc-области нативного IgG; (б) отбор варианта Fc-области, активность связывания которого в отношении (ранее присутствующего) ADA не существенно повышается в условиях нейтрального рН по сравнению с активностью Fc-области нативного IgG; (в) отбор варианта Fc-области с увеличенным временем удерживания в плазме по сравнению с временем удерживания Fc-области нативного IgG; и (г) отбор антитела, содержащего вариант Fc-области, которое может усиливать элиминацию антигена из плазмы по сравнению с референс-антителом, которое содержит Fc-область нативного IgG.
С позиции оценки времени удерживания в плазме варианта Fc-области, указанного в разделе Б, предпочтительным может являться (но не ограничиваясь только указанным), чтобы антитело, содержащее вариант Fc-области, полученный в разделе Б описания, и «референс-антитело, содержащее Fc-область нативного IgG», сравнение которых осуществляют, были идентичны друг другу за исключением Fc-области. FcRn может представлять собой человеческий FcRn.
Например, после получения антитела, содержащего вариант Fc-области, указанный в разделе Б описания, антитело можно сравнивать с референс-антителом, которое содержит Fc-область нативного IgG, в отношении FcRn-связывающей активности в условиях кислого рН (например, рН 5,8), используя BIACORE® или другие известные методики, для отбора варианта Fc-области или антитела, содержащего вариант Fc-области, FcRn-связывающая активность которого повышена в условиях кислого рН.
Альтернативно этому, например, после получения антитела, содержащего вариант Fc-области, указанный в разделе Б описания, антитело можно сравнивать с референс-антителом, которое содержит Fc-область нативного IgG, в отношении ADA-связывающей активности в условиях нейтрального рН с использованием электрохемилюминисценции (ECL) или известных методик для отбора варианта Fc-области или антитела, содержащего вариант Fc-области, ADA-связывающая активность которого не существенно увеличена в условиях нейтрального рН.
Альтернативно этому, например, после получения антитела, содержащего вариант Fc-области, указанный в разделе Б описания, антитело можно сравнивать с референс-антителом, которое содержит Fc-область нативного IgG, путем осуществления фармакокинетических анализов антитела с использованием плазмы, например, мышей, крыс, кроликов, собак, обезьян или людей для отбора вариантов Fc-области или антител, содержащих вариант Fc-области, для которых продемонстрировано улучшенное время удерживания в плазме индивидуумов.
Альтернативно этому, например, после получения антитела, содержащего вариант Fc-области, указанный в разделе Б описания, антитело можно сравнивать с референс-антителом, которое содержит Fc-область нативного IgG, путем осуществления фармакокинетических анализов антитела с использованием плазмы, например, мышей, крыс, кроликов, собак, обезьян или людей для отбора вариантов Fc-области или антител, содержащих вариант Fc-области, обладающих повышенной способностью элиминировать антиген из плазмы.
Альтернативно этому, например, при необходимости можно соответственно объединять методы отбора, описанные выше.
Одним из вариантов осуществления изобретения, указанного в разделе Б описания, является способ получения варианта Fc-области, содержащего FcRn-связывающий домен, или антитела, содержащего вариант, где способ включает такую замену аминокислот, чтобы образовавшийся вариант Fc-области или антитело, содержащее вариант, включали Ala в положении 434; Glu, Arg, Ser или Lys в положении 438; и Glu, Asp или Gln в положении 440, согласно EU-нумерации. В дополнительном варианте осуществления изобретения указанный способ включает замену аминокислот таким образом, чтобы образовавшийся вариант Fc-области или антитело, содержащее вариант, дополнительно включали Ile или Leu в положении 428 и/или Ile, Leu, Val, Thr или Phe в положении 436, согласно EU-нумерации. В другом варианте осуществления изобретения аминокислоты заменяют таким образом, чтобы образовавшийся вариант Fc-области или антитело, содержащее вариант, полученные согласно способу, включали дополнительно Leu в положении 428 и/или Val или Thr в положении 436 согласно EU-нумерации.
Одним из вариантов осуществления изобретения, указанным в разделе Б описания, является способ получения варианта Fc-области, содержащего FcRn-связывающий домен, или антитела, содержащего вариант, где способ включает замену аминокислот таким образом, чтобы образовавшийся вариант Fc-области или антитело, содержащее вариант, содержали Ala в положении 434; Arg или Lys в положении 438; и Glu или Asp в положении 440 согласно EU-нумерации. В дополнительном варианте осуществления изобретения указанный способ включает замену аминокислот таким образом, чтобы образовавшийся вариант Fc-области или антитело, содержащее вариант, полученные согласно способу, содержали дополнительно Ile или Leu в положении 428 и/или Ile, Leu, Val, Thr, или Phe в положении 436 согласно EU-нумерации. В следующем варианте осуществления изобретения аминокислоты заменяют таким образом, чтобы образовавшийся вариант Fc-области или антитело, содержащее вариант, полученные согласно способу, содержали дополнительно Leu в положении 428 и/или Val или Thr в положении 436 согласно EU-нумерации.
В одном из вариантов осуществления изобретения указанный способ включает замену всех аминокислот в положениях 434, 438 и 440 на Ala; Glu, Arg, Ser или Lys; и Glu, Asp или Gln соответственно. В дополнительном варианте осуществления изобретения указанный способ включает замену аминокислот таким образом, чтобы образовавшийся вариант Fc-области или антитело, содержащее вариант, полученные согласно способу, содержали дополнительно Ile или Leu в положении 428 и/или Ile, Leu, Val, Thr или Phe в положении 436 согласно EU-нумерации. В следующем варианте осуществления изобретения аминокислоты заменяют таким образом, чтобы образовавшийся вариант Fc-области или антитело, содержащее вариант, полученные согласно способу, содержали дополнительно Leu в положении 428 и/или Val или Thr в положении 436 согласно EU-нумерации.
Альтернативным вариантом осуществления изобретения, указанным в разделе Б описания, является вариант Fc-области или антитело, содержащее вариант Fc-области, полученные с помощью любого из способов получения, указанного выше в разделе Б описания.
Альтернативным вариантом осуществления изобретения, указанным в разделе Б описания, являются способы снижения связывающей активности в отношении (предсуществующих) ADA антител, содержащих вариант Fc-области с повышенной FcRn-связывающей активностью при кислом рН; и способы получения вариантов Fc-области с повышенной FcRn-связывающей активностью при кислом рН (например, рН 5,8) и пониженной связывающей активностью в отношении ранее присутствующего ADA, которые включают: (а) получение антитела, содержащего Fc-область (вариант), FcRn-связывающая активность которого при кислом рН повышена по сравнению с референс-антителом; и (б) интродукцию в Fc-область (согласно EU-нумерации) (I) аминокислотной замены на Ala в положении 434; (II) аминокислотной замены на любую из Glu, Arg, Ser и Lys в положении 438; и (III) аминокислотной замены на любую из Glu, Asp и Gln в положении 440, (IV) необязательно аминокислотной замены на Ile или Leu в положении 428; и/или (V) необязательно аминокислотной замены на любую из Ile, Leu, Val, Thr и Phe в положении 436.
В некоторых вариантах осуществления изобретения Fc-домен (вариант), указанный на стадии (а), предпочтительно представляет собой Fc-домен (вариант) человеческого IgG. Кроме того, для повышения FcRn-связывающей активности при кислом рН и снижения связывающей активности в отношении (ранее присутствующего) ADA в нейтральном диапазоне рН (например, рН 7,4), Fc-область (вариант) должна содержать комбинацию заменен аминокислот, выбранную из группы, которая состоит из: (a) N434A/Q438R/S440E; (б) N434A/Q438R/S440D; (в) N434A/Q438K/S440E; (г) N434A/ Q438K/S440D; (д) N434A/Y436T/Q438R/S440E; (е) N434A/Y436T/Q438R/S440D; (ж) N434A/Y436T/Q438K/S440E; (з) N434A/Y436T/Q438K/S440D; (и) N434A/Y436V/Q438R/S440E; (к) N434A/Y436V/Q438R/S440D; (л) N434A/Y436V/Q438K/S440E; (м) N434A/Y436V/Q438K/S440D; (н) N434A/R435H/F436T/Q438R/S440E; (о) N434A/R435H/F436T/Q438R/S440D; (п) N434A/R435H/F436T/Q438K/S440E; (р) N434A/R435H/F436T/Q438K/S440D; (с) N434A/R435H/F436V/Q438R/ S440E; (т) N434A/R435H/F436V/Q438R/S440D; (у) N434A/R435H/F436V/Q438K/S440E; (ф) N434A/R435H/F436V/Q438K/S440D; (х) M428L/N434A/Q438R/S440E; (ц) M428L/N434A/Q438R/ S440D; (ч) M428L/N434A/Q438K/S440E; (ш) M428L/N434A/Q438K/S440D; (щ) M428L/N434A/Y436T/Q438R/S440E; (э) M428L/N434A/Y436T7Q438R/S440D; (аа) M428L/N434A/Y436T/Q438K/S440E; (аб) M428L/N434A/Y436T/Q438K/S440D; (ав) M428L/N434A/Y436V/Q438R/S440E; (аг) M428L/N434A/Y436V/Q438R/S440D; (ад) M428L/N434A/Y436V/Q438K/S440E; (ае) M428L/N434A/Y436V/Q438K/S440D; (аж) L235R/G236R/S239K/M428L/N434A/Y436T/Q438R/S440E; и (аз) L235R/G236R/A327G/A330S/P331S/M428L/N434A/Y436T/Q438R/S440E.
Способы необязательно могут включать также: (в) оценку того, понизилась ли связывающая активность в отношении (ранее присутствующего) ADA антитела, содержащего полученный вариант Fc-области, по сравнению со связывающей активностью референс-антитела.
Альтернативно этому, способы можно применять для усиления высвобождения антитела, которое было интернализовано в клетки в связанной с антигеном форме, наружу из клеток в свободной от антигена форме, без существенного повышения связывающей активности антитела в отношении (ранее присутствующего) ADA при нейтральном рН.
Раздел В описания
Раздел В описания относится к антителам к IL-8, нуклеиновым кислотам, которые кодируют антитела, фармацевтическим композициям, содержащим антитела, способам получения антител и применениям антител для лечения связанных с IL-8 заболеваний, что подробно изложено ниже. Значение приведенных ниже в настоящем описании понятий, относится к всему разделу В описания, и они не противоречат техническим знаниям, известным обычным специалистам в данной области, а также вариантам осуществления изобретения, известным им или общепринятым в данной области техники.
I. Определения, подпадающие под объем раздела В описания
В контексте раздела В настоящего описания «кислый рН» означает рН, который можно выбирать, например, из рН от 4,0 до 6,5. В одном из вариантов осуществления изобретения кислый рН означает (но не ограничиваясь только ими) рН 4,0, рН 4,1, рН 4,2, рН 4,3, рН 4,4, рН 4,5, рН 4,6, рН 4,7, рН 4,8, рН 4,9, рН 5,0, рН 5,1, рН 5,2, рН 5,3, рН 5,4, рН 5,5, рН 5,6, рН 5,7, рН 5,8, рН 5,9, рН 6,0, рН 6,1, рН 6,2, рН 6,3, рН 6,4 или рН 6,5. В конкретном варианте осуществления изобретения понятие кислый рН относится к рН 5,8.
В контексте раздела В настоящего описания «нейтральный рН» означает рН, который можно выбирать, например, из рН от 6,7 до 10,0. В одном из вариантов осуществления изобретения нейтральный рН означает (но не ограничиваясь только ими) рН 6,7, рН 6,8, рН 6,9, рН 7,0, рН 7,1, рН 7,2, рН 7,3, рН 7,4, рН 7,5, рН 7,6, рН 7,7, рН 7,8, рН 7,9, рН 8,0, рН 8,1, рН 8,2, рН 8,3, рН 8,4, рН 8,5, рН 8,6, рН 8,7, рН 8,8, рН 8,9, рН 9,0, рН 9,5 или рН 10,0. В конкретном варианте осуществления изобретения понятие нейтральный рН относится к рН 7,4.
Понятие «IL-8» в контексте раздела В относится к любому нативному IL-8, полученному из любых позвоночных животных, приматов (например, человека, обезьян циномолгус, макак резус) и других млекопитающих (например, собак и кроликов), если специально не указано иное. Понятие «IL-8» относится к полноразмерному IL-8, непроцессированному IL-8, а также любой форме IL-8, образовавшейся в результате процессинга в клетке. Понятие «IL-8» относится также к производным нативного IL-8, например, сплайсинговым вариантам или аллельным вариантам. Пример аминокислотой последовательности человеческого IL-8 представлен в SEQ ID NO: 66.
Понятия «антитело к IL-8» и «антитело, которое связывается с IL-8» относится к антителу, которое обладает способностью связываться с IL-8 с аффинностью, достаточной для того, чтобы антитело можно было применять в качестве диагностического и/или терапевтического агента, мишенью которого является IL-8.
В одном из вариантов осуществления изобретения уровень связывания антитела к IL-8 с неродственным не представляющим собой IL-8 белком составляет менее чем примерно 10% от связывания антитела с IL-8.
Понятие «аффинность» в контексте раздела В описания относится к суммарной силе всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). В контексте настоящего описания, если не указано иное, «аффинность связывания» относится к присущей молекуле аффинности связывания, отражающей взаимодействие по типу 1:1 между компонентами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y, как правило, можно характеризовать с помощью константы диссоциации (KD). Аффинность можно оценивать с помощью общепринятых методов, известных в данной области, включая те, которые представлены в разделе В настоящего описания.
В некоторых вариантах осуществления изобретения антитело, которое связывается с IL-8, может иметь константу диссоциации (KD), составляющую например, ≤1000 нМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, от 10-8 М до 10-13 М, от 10-9 М до 10-13 М).
В контексте раздела В настоящего описания понятие «антитело» используется в его наиболее широком смысле и относится к различным структурам антител, включая (но не ограничиваясь только ими) моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они обладают требуемой антигенсвязывающей активностью.
Понятие «антитело, которое связывается с тем же эпитопом», что референс-антитело, относится к антителу, которое блокирует связывание референс-антитела с его антигеном, например, на 50%, 60%, 70% или 80% или более; и, наоборот, референс-антитело блокирует связывание антитела с его антигеном, например, на 50%, 60%, 70%или 80% или более. Пример конкурентного анализа, который можно применять, представлен в настоящем описании (но не ограничиваясь только им).
Понятие «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или конкретных видов, а остальная часть тяжелой и/или легкой цепи происходит из другого источника или других видов.
Понятие «гуманизированное» антитело относится к химерному антителу, которое содержит аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых вариантах осуществления изобретения гуманизированное антитело может состоять практически по меньшей мере из одной и, как правило, двух вариабельных областей, в которых все или практически все HVR (например, CDR) соответствуют участкам нечеловеческого антитела, а все или практически все FR соответствуют участкам человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела.
Понятие «моноклональное антитело» в контексте раздела В настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов антител, например, содержащих мутации, встречающиеся в естественных условиях или возникающие в процессе производства препарата моноклонального антитела, указанные варианты, как правило, присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной детерминанты антигена. Таким образом, прилагательное «моноклональный» определяет особенность антитела, характеризуя его как полученное из практически гомогенной популяции антител, а не сконструированное в соответствии с требованиями к получению антитела с помощью какого-либо конкретного метода. Например, моноклональные антитела, которые можно применять согласно разделу В настоящего описания, можно создавать с помощью различных технологий, включая (но не ограничиваясь только ими) метод гибридом, методы рекомбинантной ДНК, методы фагового дисплея и методы, основанные на использовании трансгенных животных, которые содержат все или часть локусов человеческого иммуноглобулина, указанные методы и другие приведенные в качестве примера методы получения моноклональных антител представлены в настоящем описании.
В контексте раздела В настоящего описания понятие «нативное антитело» относится к встречающимся в естественных условиях молекулам иммуноглобулинов с различными структурами. В одном из вариантов нативное антитело в виде IgG представляет собой, например, гетеротетрамерный гликопротеин с молекулярной массой примерно 150000 Да, состоящий из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидными мостиками. В направлении от N-конца к С-концу, каждая тяжелая цепь имеет вариабельную область (VH), которую называют также вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следует три константных домена (CH1, СН2 и СН3). Аналогично этому, в направлении от N-конца к С-концу, каждая легкая цепь имеет вариабельную область (VL), которую называют также вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL). Легкая цепь антитела в зависимости от аминокислотной последовательности ее константного домена может принадлежать к одному из двух типов, которые обозначают каппа (κ) и лямбда (λ). Указанные константные домены, которые применяют в разделе В описания, включают домены любого из указанных аллотипов (аллелей) или любого подкласса/изотипа. Константная область тяжелой цепи включает (но не ограничиваясь только ими) константную область нативного антитела IgG-типа (IgG1, IgG2, IgG3 и IgG4). Известные аллели IgG1 включают, например, IGHG1*01, IGHG1*02, IGHG1*03, IGHG1*04 и IGHG1*05 (см. вt imgt.org), и любой из них можно применять в качестве последовательности нативного человеческого IgG1. Последовательность константного домена можно получать из одного аллеля или подкласса/изотипа или из нескольких аллелей или подклассов/изотипов. В частности, указанные антитела включают (но не ограничиваясь только ими) антитело, СН1 которого происходит из IGHG1*01, а СН2 и СН3 происходят из IGHG1*02 и IGHG1*01 соответственно.
Понятие «эффекторные функции» в контексте раздела В описания относится к тем видам биологической активности, которые связаны с Fc-областью антитела, которые варьируются в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антитело-обусловленную клеточнозависимую цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора) и активацию В-клеток (но не ограничиваясь только ими).
Понятие «Fc-область» в контексте раздела В настоящего описания применяют для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Понятие включает нативные Fc-области и варианты Fc-области. Нативная Fc-область обозначает Fc-область нативного антитела.
В одном из вариантов осуществления изобретения Fc-область тяжелой цепи человеческого IgG простирается с Cys226 или с Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) или глицин-лизин (остатки 446-447) Fc-области могут присутствовать или отсутствовать. Если специально не указано иное, то в контексте раздела В настоящего описания нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации EU, которую обозначают также как EU-индекс, описанной у Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Понятие «каркасный участок» или «FR» в контексте раздела В настоящего описания означает остатки вариабельного домена, отличные от остатков гипервариабельного участка (HVR). FR вариабельного домена, как правило, состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, имеют следующее расположение в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
«Человеческий консенсусный каркасный участок» в контексте раздела В настоящего описания представляет собой каркасный участок, в который входят наиболее часто встречающиеся аминокислотные остатки в выбранных последовательностях каркасных участков VL или VH человеческого иммуноглобулина. Как правило, выбор последовательностей VL или VH человеческого иммуноглобулина осуществляют из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу, описанную у Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
В одном из вариантов осуществления изобретения касательно VL подгруппа представляет собой подгруппу κI согласно Kabat и др., выше. В одном из вариантов осуществления изобретения касательно VH подгруппа представляет собой подгруппу III согласно Kabat и др., выше.
Для целей раздела В настоящего описания «акцепторный человеческий каркасный участок» означает каркасный участок, который содержит аминокислотную последовательность каркасного участка (VL) или (VH), происходящую из каркасного участка человеческого иммуноглобулина или человеческого консенсусного каркасного участка. Акцепторный человеческий каркасный участок, «происходящий из» каркасного участка человеческого иммуноглобулина или человеческого консенсусного каркасного участка, может иметь такую же аминокислотную последовательность или может содержать существующие замены в аминокислотной последовательности. В некоторых вариантах осуществления изобретения количество аминокислотных замен составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых вариантах осуществления изобретения последовательность человеческого акцепторного каркасного участка VL идентична последовательности каркасного участка VL человеческого иммуноглобулина или последовательности человеческого консенсусного каркасного участка.
Понятие «вариабельная область» или «вариабельный домен» в контексте раздела В настоящего описания относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела, как правило, имеют сходные структуры, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR) (см., например, Kindt и др., Kuby Immunology, 6-ое изд., изд-во W.H. Freeman and Co., 2007, с. 91). Одного VH- или VL-домена может быть достаточно для обеспечения специфичности связывания антигена. Кроме того, антитела, которые связываются с конкретным антигеном, можно выделять, используя VH- или VL-домен из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов соответственно (см., например, Portolano и др., J. Immunol. 150, 1993, сс. 880-887; Clarkson и др., Nature 352, 1991, сс. 624-628).
Понятие «гипервариабельный участок» или «HVR» в контексте раздела В настоящего описания относится к каждому из участков вариабельного домена антитела, последовательности которых являются гипервариабельными («определяющие комплементарность участки» или «CDR») и/или образуют петли определенной структуры («гипервариабельные петли»), и/или содержат контактирующие с антигеном остатки («контакты с антигеном»). Как правило, антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3).
Примеры HVR включают (но не ограничиваясь только ими): (а) гипервариабельные петли, включающие аминокислотные остатки 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia и Lesk, J. Mol. Biol. 196, 1987, сс. 901-917); (6) CDR, включающие аминокислотные остатки 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (Н2) и 95-102 (Н3) (Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991); (в) области контакта с антигеном, включающие аминокислотные остатки 27с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum и др., J. Mol. Biol. 262, 1996, сс. 732-745); и (г) комбинации остатков, указанных в подпунктах (а), (б) и/или (в), включающие аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (Н2), 93-102 (Н3) и 94-102 (Н3).
Если не указано иное, HVR и другие остатки в вариабельных областях (например, остатки в FR) нумеруют согласно Kabat и др., выше.
«Индивидуум» в контексте раздела В настоящего описания представляет собой млекопитающее. К млекопитающим относятся (но не ограничиваясь только ими) одомашненные животные (например, коровы, овцы, кошки, собаки и лошади), приматы (например, человек и приматы кроме человека, например, обезьяны), кролики и грызуны (например, мыши и крысы). В некоторых вариантах осуществления изобретения индивидуум или субъект представляет собой человека.
«Выделенное» антитело в контексте раздела В настоящего описания представляет собой антитело, которое отделено от компонента его естественного окружения. В некоторых вариантах осуществления изобретения антитело очищают до чистоты, превышающей 95% или 99% по данным, например, электрофоретических анализов (таких, например, как ДСН-ПААГ, изоэлектрическое фокусирование (ИЭФ), капиллярный электрофорез) или хроматографических анализов (таких, например, как ионообменная хроматография или ЖХВР с обращенной фазой). Обзор методов оценки чистоты антител см., например, у Flatman и др., J. Chrom. В 848, 2007, сс. 79-87.
«Выделенная» нуклеиновая кислота в контексте раздела В настоящего описания представляет собой молекулу нуклеиновой кислоты, которая отделена от компонента ее естественного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетке, которая в норме включает молекулу нуклеиновой кислоты, но в которой молекула нуклеиновой кислоты присутствует вне хромосомы или в которой ее локализация на хромосоме отличается от ее встречающейся в естественных условиях локализации на хромосоме.
Понятие «выделенная нуклеиновая кислота, кодирующая антитело к IL-8» в контексте раздела В настоящего описания относится к одной или нескольким молекулам нуклеиновых кислот, кодирующих тяжелые и легкие цепи антитела к IL-8 (или их фрагменты), включая указанную(ые) молекулу(ы) в одном векторе или в различных векторах, и указанную(ые) молекулу(ы) нуклеиновой(ых) кислоты(т), присутствующую(ие) в одном или нескольких положениях в клетке-хозяине.
В контексте раздела В настоящего описания понятия «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используют взаимозаменяемо, и они относятся к клеткам, в которые интродуцирована экзогенная нуклеиновая кислота, включая потомство указанных клеток. К клеткам-хозяевам относятся «трансформанты» и «трансформированные клетки», которые включают первично трансформированную клетку и полученное из нее потомство безотносительно к количеству пересевов. Потомство может не быть полностью идентичным по составу нуклеиновых кислот родительской клетке, но может содержать мутации. Под объем изобретения подпадает мутантное потомство, которое обладает такой же функцией или биологической активностью, которая обнаружена в результате скрининга или селекции у исходной трансформированной клетки.
Понятие «вектор» в контексте раздела В настоящего описания относится к молекуле нуклеиновой кислоты, которая обладает способностью к размножению другой нуклеиновой кислоты, с которой она связана. Понятие включает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он интродуцирован. Некоторые векторы обладают способностью контролировать экспрессию нуклеиновых кислот, с которыми они функционально связаны. Указанные векторы в контексте настоящего описания обозначают как «экспрессионные векторы».
В контексте раздела В настоящего описания понятие «листовка-вкладыш в упаковку» относится к инструкциям, которые обычно входят в поступающие в продажу упаковки терапевтических продуктов, содержащим информацию о показаниях, применении, дозе, пути введения, комбинированной терапии, противопоказаниях и/или мерах предосторожности, которые связаны с применением указанных терапевтических продуктов.
В контексте раздела В настоящего описания «процент (%) идентичности аминокислотной последовательности» относительно полипептидной референс-последовательности определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в полипептидной референс-последовательности, после выравнивая последовательностей и при необходимости интродукции брешей для достижения максимального процента идентичности последовательностей, и не рассматривая какие-либо консервативные замены в качестве компонента при оценке идентичности последовательностей. Сравнительный анализ для целей определения процента идентичности аминокислотных последовательностей можно осуществлять различными путями, известными в данной области, используя, например, публично доступные компьютерные программы, такие как программа BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения величины % идентичности аминокислотных последовательностей получают, используя компьютерную программу для сравнения последовательностей ALIGN-2. Авторство компьютерной программы для сравнения последовательностей ALIGN-2 принадлежит фирме Genentech, Inc., и исходный код был представлен в комплекте с документацией для пользователей в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован как U.S. Copyright Registration № TXU510087. Программа ALIGN-2 публично доступна от фирмы Genentech, Inc., Южный Сан-Франциско, шт. Калифорния, или ее можно компилировать на основе исходного кода. Программу ALIGN-2 можно компилировать для применения в операционной системе UNIX, включая цифровую систему UNIX V4.0D. Все параметры, требуемые для сравнения последовательностей, устанавливаются программой ALIGN-2 и не должны изменяться.
В ситуациях, в которых ALIGN-2 применяют для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей данной аминокислотной последовательности А по сравнению, с или относительно данной аминокислотной последовательности Б (что в альтернативном варианте можно обозначать как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности по сравнению, с или относительно данной аминокислотной последовательности Б), рассчитывают следующим образом: 100 × дробь X/Y, где X обозначает количество аминокислотных остатков, определенных как идентичные совпадения при оценке с помощью программы для сравнительного анализа последовательностей ALIGN-2, где с помощью программы осуществляли сравнение А и Б, и где Y обозначает общее количество аминокислотных остатков в Б. Должно быть очевидно, что, если длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, то % идентичности аминокислотных последовательностей А относительно Б не может быть равен % идентичности аминокислотной последовательности Б относительно А. Если специально не указано иное, то все величины % идентичности аминокислотных последовательностей, указанные в разделе В настоящего описания, получали с использованием описанной в предыдущем параграфе компьютерной программы ALIGN-2.
В контексте раздела В настоящего описания понятие «фармацевтическая композиция» относится к препарату, который находится в такой форме, что он обеспечивает биологическую активность входящего в его состав действующего вещества, которое должно обладать эффективностью, и который не содержит дополнительных компонентов, обладающих неприемлемой токсичностью для индивидуума, которому следует вводить композицию.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от действующего вещества, который является нетоксичным для индивидуума. Фармацевтически приемлемые носители включают (но не ограничиваясь только ими) буфер, эксципиент, стабилизатор или консервант.
В контексте раздела В настоящего описания понятие «лечение» (и его грамматические вариации, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного течения болезни у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики, либо в процессе развития клинической патологии. Требуемыми действиями лечения являются (но не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или временное ослабление болезненного состояния и ремиссия или улучшение прогноза. В некоторых вариантах осуществления изобретения антитело, указанное в разделе В описания, можно применять для замедления развития заболевания или нарушения.
В контексте раздела В настоящего описания понятие «эффективное количество» антитела или фармацевтической композиции, означает количество, эффективное в дозах и в течение периода времени, необходимых для достижения требуемого терапевтического или профилактического результата.
II. Композиции и способы
Один из вариантов осуществления изобретения, указанный в разделе В описания, базируется на применимости антител к IL-8, которые обладают рН-зависимой аффинностью к IL-8, в виде фармацевтических композиций. Антитела, указанные в разделе В описания, применяют, например, для диагностирования или лечения заболеваний, при которых IL-8 присутствует в избыточном количестве.
А. Примеры антител к IL-8
Одним из вариантов осуществления изобретения, указанных в разделе В описания, является антитело к IL-8, обладающее рН-зависимой аффинностью к IL-8.
Одним из вариантов осуществления изобретения, указанных в разделе В описания, является антитело к IL-8, обладающее рН-зависимой аффинностью к IL-8, которое содержит последовательность по меньшей мере с одной, двумя, тремя, четырьмя, пятью, шестью, семью или восемью аминокислотной(ыми) заменой(ами) в следующих аминокислотных последовательностях: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 67; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 68; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 69; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 70; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 71; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 72.
Другим вариантом осуществления изобретения, указанным в разделе В описания, является антитело к IL-8, обладающее рН-зависимой аффинностью к IL-8, которое содержит по меньшей мере одну аминокислотную(ые) замену(ы) по меньшей мере в одной из следующих аминокислотных последовательностей: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 67; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 68; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 69; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 70; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 71; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 72.
Если конкретно не указано иное, то аминокислоты могут быть замещены любой другой аминокислотой. В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит одну или несколько аминокислотную(ых) замену(н) в положении(ях), выбранном(ых) из группы, которая состоит из следующих положений: аспарагиновая кислота в положении 1 в последовательности SEQ ID NO: 67; (б) тирозин в положении 2 в
последовательности SEQ ID NO: 67; (в) тирозин в положении 3 в
последовательности SEQ ID NO: 67; (г) лейцин в положении 4 в
последовательности SEQ ID NO: 67; (д) серин в положении 5 в
последовательности SEQ ID NO: 67; (е) лейцин в положении 1 в
последовательности SEQ ID NO: 68; (ж) изолейцин в положении 2 в
последовательности SEQ ID NO: 68; (з) аргинин в положении 3 в
последовательности SEQ ID NO: 68; (и) аспарагин в положении 4 в
последовательности SEQ ID NO: 68; (к) лизин в положении 5 в
последовательности SEQ ID NO: 68; (л) аланин в положении 6 в
последовательности SEQ ID NO: 68; (м) аспарагин в положении 7 в
последовательности SEQ ID NO: 68; (н) глицин в положении 8 в
последовательности SEQ ID NO: 68; (о) тирозин в положении 9 в
последовательности SEQ ID NO: 68; (п) треонин в положении 10 в
последовательности SEQ ID NO: 68; (р) аргинин в положении 11 в
последовательности SEQ ID NO: 68; (с) глутаминовая кислота в положении 12 в
последовательности SEQ ID NO: 68; (т) тирозин в положении 13 в
последовательности SEQ ID NO: 68; (у) серин в положении 14 в
последовательности SEQ ID NO: 68; (ф) аланин в положении 15 в
последовательности SEQ ID NO: 68; (х) серин в положении 16 в
последовательности SEQ ID NO: 68; (ц) валин в положении 17 в
последовательности SEQ ID NO: 68; (ч) лизин в положении 18 в
последовательности SEQ ID NO: 68; (ш) глицин в положении 19 в
последовательности SEQ ID NO: 68; (щ) глутаминовая кислота в положении 1 в
последовательности SEQ ID NO: 69; (э) аспарагин в положении 2 в
последовательности SEQ ID NO: 69; (аа) тирозин в положении 3 в
последовательности SEQ ID NO: 69; (аб) аргинин в положении 4 в
последовательности SEQ ID NO: 69; (ав) тирозин в положении 5 в
последовательности SEQ ID NO: 69; (аг) аспарагиновая кислота в положении 6 в
последовательности SEQ ID NO: 69; (ад) валин в положении 7 в
последовательности SEQ ID NO: 69; (ае) глутаминовая кислота в положении 8 в
последовательности SEQ ID NO: 69; (аж) лейцин в положении 9 в
последовательности SEQ ID NO: 69; (аз) аланин в положении 10 в
последовательности SEQ ID NO: 69; (аи) тирозин в положении 11 в
последовательности SEQ ID NO: 69; (ак) аргинин в положении 1 в
последовательности SEQ ID NO: 70; (ал) аланин в положении 2 в
последовательности SEQ ID NO: 70; (ам) серин в положении 3 в
последовательности SEQ ID NO: 70; (ан) глутаминовая кислота в положении 4 в
последовательности SEQ ID NO: 70; (ао) изолейцин в положении 5 в
последовательности SEQ ID NO: 70; (ап) изолейцин в положении 6 в
последовательности SEQ ID NO: 70; (ар) тирозин в положении 7 в
последовательности SEQ ID NO: 70; (ас) серин в положении 8 в
последовательности SEQ ID NO: 70; (ат) тирозин в положении 9 в
последовательности SEQ ID NO: 70; (ay) лейцин в положении 10 в
последовательности SEQ ID NO: 70; (аф) аланин в положении 11 в
последовательности SEQ ID NO: 70; (ах) аспарагин в положении 1 в
последовательности SEQ ID NO: 71; (ац) аланин в положении 2 в
последовательности SEQ ID NO: 71; (ач) лизин в положении 3 в
последовательности SEQ ID NO: 71; (аш) треонин в положении 4 в
последовательности SEQ ID NO: 71; (ащ) лейцин в положении 5 в
последовательности SEQ ID NO: 71; (аэ) аланин в положении 6 в
последовательности SEQ ID NO: 71; (ба) аспарагиновая кислота в положении 7 в
последовательности SEQ ID NO: 71; (бб) глутамин в положении 1 в
последовательности SEQ ID NO: 72; (бв) гистидин в положении 2 в
последовательности SEQ ID NO: 72; (бг) гистидин в положении 3 в
последовательности SEQ ID NO: 72; (бд) фенилаланин в положении 4 в
последовательности SEQ ID NO: 72; (бе) глицин в положении 5 в
последовательности SEQ ID NO: 72; (бж) фенилаланин в положении 6 в
последовательности SEQ ID NO: 72; (бз) пролин в положении 7 в
последовательности SEQ ID NO: 72; (би) аргинин в положении 8 в
последовательности SEQ ID NO: 72; и (бк) треонин в положении 9 в
последовательности SEQ ID NO: 72.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит одну или несколько аминокислотную(ых) замену(н) в положении(ях), выбранном(ых) из группы, которая состоит из следующих положений: (а) аланин в положении 6 в
последовательности SEQ ID NO: 68; (б) глицин в положении 8 в
последовательности SEQ ID NO: 68; (в) тирозин в положении 9 в
последовательности SEQ ID NO: 68; (г) аргинин в положении 11 в
последовательности SEQ ID NO: 68; и (д) тирозин в положении 3 в
последовательности SEQ ID NO: 69.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит комбинацию(и) аминокислотных замен в положениях, выбранных из группы, состоящей из следующих положений: (а) аланин в положении 6 в последовательности SEQ ID NO: 68; (б) глицин в положении 8 в последовательности SEQ ID NO: 68; (в) тирозин в положении 9 в последовательности SEQ ID NO: 68; (г) аргинин в положении 11 в последовательности SEQ ID NO: 68; и (д) тирозин в положении 3 в последовательности SEQ ID NO: 69.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит аминокислотные замены в следующих положениях: (а) тирозин в положении 9 в последовательности SEQ ID NO: 68; (б) аргинин в положении 11 в последовательности SEQ ID NO: 68; и (в) тирозин в положении 3 в последовательности SEQ ID NO: 69.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит аминокислотные замены в следующих положениях: (а) аланин в положении 6 в последовательности SEQ ID NO: 68; (б) глицин в положении 8 в последовательности SEQ ID NO: 68; (в) тирозин в положении 9 в последовательности SEQ ID NO: 68; (г) аргинин в положении 11 в последовательности SEQ ID NO: 68; и (д) тирозин в положении 3 в последовательности SEQ ID NO: 69.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит: (а) замену аланина на аспарагиновую кислоту в положении 6 в последовательности SEQ ID NO: 68; (б) замену аргинина на пролин в положении 11 в последовательности SEQ ID NO: 68; и (в) замену тирозина на гистидин в положении 3 в последовательности SEQ ID NO: 69.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит: (а) замену глицина на тирозин в положении 8 в последовательности SEQ ID NO: 68; и (б) замену тирозина на гистидин в положении 9 в последовательности SEQ ID NO: 68.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит: (а) замену аланина на аспарагиновую кислоту в положении 6 в последовательности SEQ ID NO: 68; (б) замену глицина на тирозин в положении 8 в последовательности SEQ ID NO: 68; (в) замену тирозина на гистидин в положении 9 в последовательности SEQ ID NO: 68; (г) замену аргинина на пролин в положении 11 в последовательности SEQ ID NO: 68; и (д) замену тирозина на гистидин в положении 3 в последовательности SEQ ID NO: 69.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 73.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 74.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 67, HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 73, и HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 74.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит одну или несколько аминокислотную(ых) замену(н) в положении(ях), выбранном(ых) из группы, которая состоит из следующих положений: (а) серин в положении 8 в последовательности SEQ ID NO: 70; (б) аспарагин в положении 1 в последовательности SEQ ID NO: 71; (в) лейцин в положении 5 в последовательности SEQ ID NO: 71; и (г) глутамин в положении 1 в последовательности SEQ ID NO: 72. В другом варианте осуществления изобретения антитело к IL-8 содержит комбинацию из любых 2, 3 или всех 4 указанных замен.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит комбинацию(и) аминокислотных замен в положении(ях), выбранном(ых) из группы, которая состоит из следующих положений: (а) серин в положении 8 в последовательности SEQ ID NO: 70; (б) аспарагин в положении 1 в последовательности SEQ ID NO: 71; (в) лейцин в положении 5 в последовательности SEQ ID NO: 71; и (г) глутамин в положении 1 в последовательности SEQ ID NO: 72. В другом варианте осуществления изобретения антитело к IL-8 содержит комбинацию из любых 2, 3 или всех 4 указанных замен.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит аминокислотные замены в положениях: (а) аспарагин в положении 1 в последовательности SEQ ID NO: 71; (б) лейцин в положении 5 в последовательности SEQ ID NO: 71; и (в) глутамин в положении 1 в последовательности SEQ ID NO: 72.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит аминокислотные замены в положениях: (а) серин в положении 8 в последовательности SEQ ID NO: 70; (б) аспарагин в положении 1 в последовательности SEQ ID NO: 71; (в) лейцин в положении 5 в последовательности SEQ ID NO: 71; и (г) глутамин в положении 1 в последовательности SEQ ID NO: 72.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит: (а) замену аспарагина на лизин в положении 1 в последовательности SEQ ID NO: 71; (б) замену лейцина на гистидин в положении 5 в последовательности SEQ ID NO: 71; и (в) замену глутамина на лизин в положении 1 в последовательности SEQ ID NO: 72.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит: (а) замену серина на глутаминовую кислоту в положении 8 в последовательности SEQ ID NO: 70; (б) замену аспарагина на лизин в положении 1 в последовательности SEQ ID NO: 71; (в) замену лейцина на гистидин в положении 5 в последовательности SEQ ID NO: 71; и (в) замену глутамина на лизин в положении 1 в последовательности SEQ ID NO: 72.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 75.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 76.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 70, HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 75, и HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 76.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит аминокислотные замены в следующих положениях: (а) аланин в положении 55 в последовательности SEQ ID NO: 77; (б) глицин в положении 57 в последовательности SEQ ID NO: 77; (в) тирозин в положении 58 в последовательности SEQ ID NO: 77; (г) аргинин в положении 60 в последовательности SEQ ID NO: 77; (д) глутамин в положении 84 в последовательности SEQ ID NO: 77; (е) серин в положении 87 в последовательности SEQ ID NO: 77; и (ж) тирозин в положении 103 в последовательности SEQ ID NO: 77.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит: (а) замену аланина на аспарагиновую кислоту в положении 55 в последовательности SEQ ID NO: 77; (б) замену глицина на тирозин в положении 57 в последовательности SEQ ID NO: 77; (в) замену тирозина на гистидин в положении 58 в последовательности SEQ ID NO: 77; (г) замену аргинина на пролин в положении 60 в последовательности SEQ ID NO: 77; (д) замену глутамина на треонин в положении 84 в последовательности SEQ ID NO: 77; (е) замену серина на аспарагиновую кислоту в положении 87 в последовательности SEQ ID NO: 77; и (ж) замену тирозина на гистидин в положении 103 в последовательности SEQ ID NO: 77.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность SEQ ID NO: 78.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит вариабельную область легкой цепи, которая содержит аминокислотную последовательность SEQ ID NO: 79.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность SEQ ID NO: 78, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность SEQ ID NO: 79. Антитело к IL-8, которое содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 78, и вариабельная область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79, может представлять собой антитело к IL-8, которое связывается IL-8 рН-зависимым образом. Антитело к IL-8, которое содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 78, и вариабельная область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79, может представлять собой антитело к IL-8, которое сохраняет стабильность IL-8-нейтрализующей активности in vivo (например, в плазме). Антитело к IL-8, которое содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 78, и вариабельная область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79, может представлять собой антитело с низкой иммуногенностью.
В альтернативном объекте изобретения антитела к IL-8, указанные в разделе В описания, включают также антитела, обладающие рН-зависимой аффинностью к IL-8 и содержащие по меньшей мере одну аминокислотную замену по меньшей мере в любой из следующих аминокислотных последовательностей: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 102; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 103; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 104; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 105; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 106; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 107.
В альтернативном объекте изобретения антитела к IL-8, указанные в разделе В описания, включают также антитела, обладающие рН-зависимой аффинностью к IL-8 и содержащие по меньшей мере одну аминокислотную замену по меньшей мере в любой из следующих аминокислотных последовательностей: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 108; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 109; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 110; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 111; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 112; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 113.
В альтернативном объекте изобретения антитела к IL-8, указанные в разделе В описания, включают также антитела, обладающие рН-зависимой аффинностью к IL-8 и содержащие по меньшей мере одну аминокислотную замену по меньшей мере в любой из следующих аминокислотных последовательностей: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 114; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 115; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 116; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 117; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 118; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 119.
В альтернативном объекте изобретения антитела к IL-8, указанные в разделе В описания, включают также антитела, обладающие рН-зависимой аффинностью к IL-8 и содержащие по меньшей мере одну аминокислотную замену по меньшей мере в любой из следующих аминокислотных последовательностей: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 120; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 121; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 122; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 123; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 124; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 125.
В альтернативном объекте изобретения антитела к IL-8, указанные в разделе В описания, включают также антитела, обладающие рН-зависимой аффинностью к IL-8 и содержащие по меньшей мере одну аминокислотную замену по меньшей мере в любой из следующих аминокислотных последовательностей: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 126; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 127; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 128; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 129; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 130; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ IDNO: 131.
В альтернативном объекте изобретения антитела к IL-8, указанные в разделе В описания, включают также антитела, обладающие рН-зависимой аффинностью к IL-8 и содержащие по меньшей мере одну аминокислотную замену по меньшей мере в любой из следующих аминокислотных последовательностей: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 132; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 133; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 134; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 135; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 136; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 137.
В альтернативном объекте изобретения антитела к IL-8, указанные в разделе В описания, включают также антитела, обладающие рН-зависимой аффинностью к IL-8 и содержащие по меньшей мере одну аминокислотную замену по меньшей мере в любой из следующих аминокислотных последовательностей: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 138; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 139; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 140; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 141; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 142; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 143.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, обладает нейтрализующей IL-8 активностью. Нейтрализующая IL-8 активность означает способность ингибировать биологическую активность IL-8 или может означать способность ингибировать связывание с рецептором IL-8.
В альтернативном объекте изобретения антитело к IL-8, указанное в разделе В описания, представляет собой антитело к IL-8, которое связывается с IL-8 рН-зависимым образом. В контексте раздела В описания антитело к IL-8, которое связывается IL-8 рН-зависимым образом, означает антитело, аффинность связывания которого с IL-8 при кислом рН ниже по сравнению с аффинностью связывания с IL-8 при нейтральном рН. Например, рН-зависимые антитела к IL-8 включают антитела, которые характеризуются более высокой аффинностью к IL-8 при нейтральном рН, чем при кислом рН. В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, обладает аффинностью к IL-8 при нейтральном рН, которая по меньшей мере в 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 раз или более выше, чем аффинность при кислом рН. Аффинность связывания можно измерять методами поверхностного плазменного резонанса (например, BIACORE®) (но не ограничиваясь только ими). Константу скорости реакции ассоциации (kon) и константу скорости реакции диссоциации (koff) можно рассчитывать с помощью программного обеспечения BIACORE® Т200 Evaluation (фирма GE Healthcare) с использованием простой модели связывания Ленгмюра 1:1 путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Константу равновесия реакции диссоциации ((KD) рассчитывают как соотношение koff/kon. Для скрининга в отношении антител, аффинность связывания которых зависит от рН, можно применять (но не ограничиваясь только ими), ELISA, анализ кинетического исключения (KinExA™) и другие анализы, а также методы поверхностного плазмонного резонанса (такие как BIACORE®). рН-зависимая IL-8-связывающая способность означает способность связываться с IL-8 рН-зависимым образом. Кроме того, обладает ли антитело способностью многократно связываться с IL-8, можно оценивать методами, описанными в WO 2009/125825.
В одном из вариантов осуществления изобретения предпочтительно, чтобы антитело к IL-8, указанное в разделе В описания, имело низкую константу диссоциации (KD) для IL-8 при нейтральном рН. В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при нейтральном рН, составляет, например, 0,3 нМ или менее (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при нейтральном рН, составляет, например, 0,1 нМ или менее (но не ограничиваясь только указанным значением) В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при нейтральном рН, составляет, например, 0,03 нМ или менее (но не ограничиваясь только указанным значением).
В одном из вариантов осуществления изобретения предпочтительно, чтобы антитело к IL-8, указанное в разделе В описания, имело низкую константу диссоциации (KD) для IL-8 при рН 7,4. В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при рН 7,4, составляет, например, 0,3 нМ или менее (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при рН 7,4, составляет, например, 0,1 нМ или менее (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при рН 7,4, составляет, например, 0,03 нМ или менее (но не ограничиваясь только указанным значением)
В одном из вариантов осуществления изобретения предпочтительно, чтобы антитело к IL-8, указанное в разделе В описания, имело высокую константу диссоциации (KD) для IL-8 при кислом рН. В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при кислом рН, составляет, например, 3 нМ или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при кислом рН, составляет, например, 10 нМ или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при кислом рН, составляет, например, 30 нМ или более (но не ограничиваясь только указанным значением).
В одном из вариантов осуществления изобретения предпочтительно, чтобы антитело к IL-8, указанное в разделе В описания, имело высокую константу диссоциации (KD) для IL-8 при рН 5,8. В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при рН 5,8, составляет, например, 3 нМ или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при рН 5,8, составляет, например, 10 нМ или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа диссоциации для антитела, указанного в разделе В, характеризующая связывание с IL-8 при рН 5,8, составляет, например, 30 нМ или более (но не ограничиваясь только указанным значением).
В одном из вариантов осуществления изобретения предпочтительно, чтобы аффинность связывания антитела к IL-8, указанного в разделе В описания, с IL-8 была выше при нейтральном рН, чем при кислом рН.
В одном из вариантов осуществления изобретения соотношение величины константы диссоциации при кислом рН и нейтральном рН [KD (кислый pH)/KD (нейтральный рН)] антитела к IL-8, указанного в разделе В, составляет например, 30 или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения соотношение величин констант диссоциации при кислом рН и нейтральном рН [KD (кислый pH)/KD (нейтральный рН)] антитела к IL-8, указанного в разделе В, составляет например, 100 или более, например, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000 или 9500 (но не ограничиваясь только ими).
В одном из вариантов осуществления изобретения соотношение величины константы диссоциации при рН 5,8 и рН 7,4 [KD (рН 5,8)/KD (рН 7,4)] антитела к IL-8, указанного в разделе В, составляет, например, 30 или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения соотношение величин констант диссоциации при рН 5,8 и рН 7,4 [KD (рН 5,8)/KD (рН 7,4)] антитела к IL-8, указанного в разделе В, составляет например, 100, например, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000 или 9500 (но не ограничиваясь только ими).
В одном из вариантов осуществления изобретения предпочтительно, чтобы антитело к IL-8, указанное в разделе В описания, имело высокую константу скорости реакции диссоциации (koff) при кислом рН. В одном из вариантов осуществления изобретения константа скорости реакции диссоциации антитела, указанного в разделе В описания, при кислом рН составляет, например, 0,003 (1/с) или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа скорости реакции диссоциации антитела, указанного в разделе В описания, при кислом рН составляет, например, 0,005 (1/c) или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа скорости реакции диссоциации антитела, указанного в разделе В описания, при кислом рН составляет, например, 0,01 (1/с) или более (но не ограничиваясь только указанным значением).
В одном из вариантов осуществления изобретения предпочтительно, чтобы антитело к IL-8, указанное в разделе В описания, имело высокую константу скорости реакции диссоциации (koff) при рН 5,8. В одном из вариантов осуществления изобретения константа скорости реакции диссоциации антитела, указанного в разделе В описания, при рН 5,8 составляет, например, 0,003 (1/с) или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа скорости реакции диссоциации антитела, указанного в разделе В описания, при рН 5,8 составляет, например, 0,005 (1/с) или более (но не ограничиваясь только указанным значением). В одном из вариантов осуществления изобретения константа скорости реакции диссоциации антитела, указанного в разделе В описания, при рН 5,8 составляет, например, 0,01 (1/с) или более (но не ограничиваясь только указанным значением).
В одном из вариантов осуществления изобретения предпочтительно, чтобы антитело к IL-8, указанное в разделе В описания, сохраняло стабильную нейтрализующую IL-8 активность в растворе (например, в ЗФР). Сохраняется ли активность в стабильном состоянии в растворе, можно оценивать, определяя, изменяется ли нейтрализующая IL-8 активность антитела, указанного в разделе В описания, добавленного в раствор, после хранения в течение определенного периода времени при определенной температуры относительно активности до добавления в раствор. В одном из вариантов осуществления изобретения период хранения составляет, например, 1, 2, 3 или 4 недели (но не ограничиваясь только ими). В одном из вариантов осуществления изобретения температура хранения составляет, например, 25°С, 30°С, 35°С, 40°С или 50°С (но не ограничиваясь только ими). В одном из вариантов осуществления изобретения температура хранения составляет, например, 40°С (но не ограничиваясь только указанной); а период хранения составляет, например, 2 недели (но не ограничиваясь только указанным). В одном из вариантов осуществления изобретения температура хранения составляет, например, 50°С (но не ограничиваясь только указанной); а период хранения составляет, например, 1 неделю (но не ограничиваясь только указанным).
В одном из вариантов осуществления изобретения предпочтительно, чтобы антитело к IL-8, указанное в разделе В описания, сохраняло стабильную нейтрализующую IL-8 активность in vivo (например, в плазме). Сохраняется ли активность в стабильном состоянии in vivo, можно оценивать, определяя, изменяется ли нейтрализующая IL-8 активность антитела, указанного в разделе В описания, добавленного в плазму животного (например, мыши) или человека, после хранения в течение определенного периода времени при определенной температуры относительно активности до добавления в плазму. В одном из вариантов осуществления изобретения период хранения составляет, например, 1, 2, 3 или 4 недели (но не ограничиваясь только ими). В одном из вариантов осуществления изобретения температура хранения составляет, например, 25°С, 30°С, 35°С или 40°С (но не ограничиваясь только ими). В одном из вариантов осуществления изобретения температура хранения составляет, например, 40°С (но не ограничиваясь только указанной); а период хранения составляет, например, 2 недели (но не ограничиваясь только указанным).
В одном из вариантов осуществления изобретения скорость клеточного поглощения антитела к IL-8, указанного в разделе В описания, выше, когда антитело образует комплекс с IL-8, чем не входящего в комплекс антитела. Антитело к IL-8, указанное в разделе В описания, легче поглощается клетками, когда оно образует комплекс с IL-8 вне клеток (например, в плазме), чем когда оно не образует комплекс с IL-8.
В одном из вариантов осуществления изобретения предпочтительно, чтобы прогнозируемая иммуногенность антитела к IL-8, указанного в разделе В описания, ожидаемая для человека-хозяина, снижалась. «Низкая иммуногенность» может означать (но не ограничиваясь только указанным), например, что после введения антитело к IL-8 не индуцирует иммунный ответ живого организма, по меньшей мере у половины или большего количества индивидуумов, которым антитело вводят в достаточном количестве в течение периода времени, достаточного для достижения терапевтической эффективности. Индукция иммунного ответа может включать производство антител против лекарственного средства. Понятие «низкий уровень производства антитела против лекарственного средства» применяют взаимозаменяемо с понятием «низкая иммуногенность». Уровень иммуногенности в организме человека можно определять с использованием программы предсказания Т-клеточных эпитопов. Указанные программы предсказания Т-клеточных эпитопов включают Epibase (фирма Lonza), iTope/TCED (фирма Antitope), EpiMatrix (фирма EpiVax) и т.д. EpiMatrix представляет собой систему предсказания иммуногенности представляющего интерес белка на основе автоматического конструирования последовательностей пептидных фрагментов путем секционирования аминокислотной последовательности белка, для которого требуется предсказать его иммуногенность, на девять аминокислот и затем расчета их способности связываться с восемью основными аллелями ГКС класса II (DRB1*0101, DRB1*0301, DRB1*0401, DRB1*0701, DRB1*0801, DRB1*1101, DRB1*1301 и DRB1*1501) (Clin. Immunol. 131(2), 2009, cc. 189-201). Последовательности, в которых аминокислоты аминокислотой последовательности антитела к IL-8 были модифицированы, можно анализировать с использованием описанных выше программ предсказания Т-клеточных эпитопов для созданных последовательностей с пониженной иммуногенностью. Предпочтительные сайты аминокислотной модификации для снижения иммуногенности антитела к IL-8, указанного в разделе В описания, включают (но не ограничиваясь только ими) аминокислоты в положении 81 и/или положении 82b согласно нумерации Кэбота в последовательности тяжелой цепи антитела к IL-8, указанной в SEQ ID NO: 78.
Одним из вариантов осуществления изобретения, указанным в разделе В описания, являются способы усиления элиминации IL-8 из организма индивидуума по сравнению с использованием референс-антитела, включающие введение антитела к IL-8, указанного в разделе В описания, индивидууму. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение антитела к IL-8, указанного в разделе В описания, для усиления элиминации IL-8 из организма индивидуума по сравнению с использованием референс-антитела. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является антитело к IL-8, указанное в разделе В описания, предназначенное для применения для усиления элиминации IL-8 из организма индивидуума по сравнению с использованием референс-антитела. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение антитела к IL-8, указанного в разделе В описания, для приготовления фармацевтических композиций, предназначенных для усиления элиминации IL-8 in vivo по сравнению с использованием референс-антитела. Одним из вариантов осуществления изобретения, указанным в разделе В описания, являются фармацевтические композиции, содержащие антитело к IL-8, указанное в разделе В описания, предназначенные для усиления элиминации IL-8 по сравнению с использованием референс-антитела. Одним из вариантов осуществления изобретения, указанным в разделе В описания, являются способы усиления элиминации IL-8 по сравнению с использованием референс-антитела, включающие введение антитела к IL-8, указанного в разделе В описания, индивидууму. В одном из вариантов осуществления изобретения, указанном в разделе В описания, референс-антитело означает антитело к IL-8 до модификации для получения антитела, указанного в разделе В описания, или антитело, аффинность связывания с IL-8 у которого является сильной как при кислом, так и при нейтральном рН. Референс-антитело может представлять собой антитело, содержащее аминокислотную последовательность SEQ ID NO: 83 и 84 или SEQ ID NO: 89 и 87.
Одним из вариантов осуществления изобретения, указанным в разделе В описания, являются фармацевтические композиции, содержащие антитело к IL-8, указанное в разделе В описания, отличающиеся тем, что антитело к IL-8, указанное в разделе В описания, связывается с IL-8 и затем с внеклеточным матриксом. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение антитела к IL-8, указанного в разделе В описания, для получения фармацевтических композиций, отличающихся тем, что антитело к IL-8, указанное в разделе В описания, связывается с IL-8 и затем с внеклеточным матриксом.
В любом из описанных выше вариантов осуществления изобретения антитело к IL-8 может представлять собой гуманизированное антитело.
В одном из объектов изобретения антитело, указанное в разделе В описания, содержит вариабельную область тяжелой цепи по любому из описанных выше вариантов осуществления изобретения и вариабельную область легкой цепи по любому из описанных выше вариантов осуществления изобретения. В одном из вариантов осуществления изобретения антитело, указанное в разделе В описания, содержит вариабельную область тяжелой цепи SEQ ID NO: 78 и вариабельную область легкой цепи SEQ ID NO: 79, и также может содержать пост-трансляционные модификации в указанных последовательностях.
В дополнительном объекте изобретения антитело к IL-8, указанное в любом из приведенных выше вариантов осуществления изобретения, может обладать любыми особенностями, индивидуально или в комбинации, описанными ниже в разделах 1-7.
1. Химерное антитело и гуманизированное антитело
В некоторых вариантах осуществления изобретения антитело, указанное в разделе В описания, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в US №4816567; и у Morrison и др., Proc. Natl. Acad. Sci. USA 81, 1984, cc. 6851-6855. В одном из примеров химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область из антитела мышей, крыс, хомяков, кроликов или приматов кроме человека, таких как обезьяны) и человеческую константную область.
В некоторых вариантах осуществления изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют для снижения иммуногенности для людей, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. Как правило, гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR, например, CDR (или их участки), получают из нечеловеческого антитела, a FR (или их участки) получают из последовательностей человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть человеческой константной области. В некоторых вариантах осуществления изобретения некоторые остатки FR в гуманизированном антителе заменены на соответствующие остатки из нечеловеческого антитела (например, антитела, из которого происходят остатки HVR), например, для сохранения или улучшения специфичности или аффинности антитела.
Сведения о гуманизированных антителах и методах их создания обобщены, например, у Almagro, Front. Biosci. 13, 2008, сс. 1619-1633, и описаны также у Riechmann и др., Nature 332, 1988, сс. 323-329; Queen и др., Proc. Natl. Acad. Sci. USA 86, 1989, сс. 10029-10033; US №№5821337, 7527791, 6982321 и 7087409; Kashmiri и др., Methods 36, 2005, сс. 25-34 (описание трансплантации SDR (а-CDR)); Padlan, Mol. Immunol. 28, 1991, сс. 489-498 (описание «нанесения нового покрытия»); 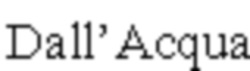 и др., Methods 36, 2005, сс. 43-60 (описание «перестановки FR»); и Osbourn и др., Methods 36, 2005, сс. 61-68 и Klimka и др., Br. J. Cancer 83, 2000, сс. 252-260 (описание подхода «направленной селекции» для перестановки FR).
и др., Methods 36, 2005, сс. 43-60 (описание «перестановки FR»); и Osbourn и др., Methods 36, 2005, сс. 61-68 и Klimka и др., Br. J. Cancer 83, 2000, сс. 252-260 (описание подхода «направленной селекции» для перестановки FR).
Человеческие каркасные участки, которые можно применять для гуманизации, включают (но не ограничиваясь только ими): каркасные участки, выбранные с использованием методов «наилучшего подбора» (см., например, Sims и др., J. Immunol. 151, 1993, сс. 2296-2308; каркасные участки, происходящие из консенсусной последовательности конкретной подгруппы вариабельных областей легких и тяжелых цепей человеческих антител (см., например, Carter и др., Proc. Natl. Acad. Sci. USA 89, 1992, сс. 4285-4289 и Presta и др., J. Immunol. 151, 1993, сс. 2623-2632); человеческие зрелые (с соматическими мутациями) каркасные области или каркасные области человеческой зародышевой линии (см., например, Almagro и Fransson, Front. Biosci. 13, 2008, с. 1619-1633); и каркасные участки, полученные в результате скрининга FR-библиотек (см., например, Васа и др., J. Biol. Chem. 272, 1997, сс.10678-10684 и Rosok и др., J. Biol. Chem. 271, 1996, сс. 22611-22618).
2. Фрагменты антител
В некоторых вариантах осуществления изобретения антитело, указанное в разделе В описания, представляет собой фрагмент антитела. Фрагменты антител включают (но не ограничиваясь только ими) такие фрагменты как Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv и другие описанные ниже фрагменты. Обзор некоторых фрагментов антител см., у Hudson и др., Nat. Med. 9, 2003, сс. 129-134. Обзор scFv-фрагментов см., например, у Plueckthun в: The Pharmacology of Monoclonal Antibodies, под ред. Rosenburg и Moore, изд-во Springer, New York, т. 113, 1994, сс. 269-315; см. также WO 93/16185; и US №№5571894 и 5587458.
Димерные антитела представляют собой фрагменты антител с двумя антигенсвязывающими центрами, которые могут быть двухвалентными или биспецифическими (см., например, ЕР 0404097; WO 1993/01161; Hudson и др., Nat. Med. 9, 2003, сс. 129-134; и Holliger и др., Proc. Natl. Acad. Sci. USA 90, 1993, сс. 6444-6448). Тримерные и тетрамерные антитела описаны также у Hudson и др., Nat. Med. 9, 2003, сс. 129-134).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (фирма Domantis, Inc., Уолтхэм, шт. Массачусетс; см., например, US №6248516 В1). Фрагменты антител можно создавать различными методиками, включая (но не ограничиваясь только ими) протеолитическое расщепление интактного антитела, а также получать с помощью рекомбинантных клеток-хозяев (например, Е. coli или фаг), как указано в разделе В настоящего описания.
3. Человеческое антитело
В некоторых вариантах осуществления изобретения антитело, указанное в разделе В описания, может представлять собой человеческое антитело. Человеческие антитела можно получать, используя различные методики, известные в данной области. Человеческие антитела описаны в целом у van Dijk и van de Winkel, Curr. Opin. Pharmacol. 5, 2001, cc. 368-374 и Lonberg, Curr. Opin. Immunol. 20, 2008, cc. 450-459. Человеческие антитела можно получать путем введения иммуногена трансгенному животному, модифицированному таким образом, чтобы оно продуцировало интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на контрольное заражение антигеном. Указанные животные, как правило, содержат все или часть локусов человеческого иммуноглобулина вместо эндогенных иммуноглобулиновых локусов, которые либо присутствуют вне хромосом, либо интегрированы произвольно в хромосомы животного. У таких трансгенных мышей эндогенные иммуноглобулиновые локусы, как правило, инактивированы. Обзор методов получения человеческих антител в трансгенных животных см. у Lonberg, Nat. Biotech. 23, 2005, сс. 1117-1125 (см., например, также в US №6075181 и US №6150584 описание технологии XENOMOUSE™; в US №5770429 описание технологии HUMAB™; в US №7041870 описание технологии K-М MOUSE™ и в публикации заявки на патент США 2007/0061900 описание технологии VELOCIMOUSE™).
Человеческие вариабельные области из интактных антител, полученных с помощью указанных животных, можно дополнительно модифицировать, например, путем объединения с другой человеческой константной областью.
Человеческие антитела можно создавать с помощью методов на основе гибридом. Описаны клеточные линии человеческой миеломы и мышиной-человеческой гетеромиеломы, предназначенные для получения человеческих моноклональных антител (см., например, Kozbor, J. Immunol. 133, 1984, сс. 3001-3005; Brodeur и др., Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, cc. 51-63 и Boerner и др., J. Immunol. 147, 1991, cc. 86-95). Человеческие антитела, созданные с использованием технологии на основе человеческих В-клеточных гибридом, описаны также у Li и др., Proc. Natl. Acad. Sci. USA 103, 2006, cc. 3557-3562. Дополнительные методы включают методы, описанные, например, в US №7189826 (описание получения моноклональных человеческих антител типа IgM из клеточных линий гибридом), и у Ni, Xiandai Mianyixue 26, 2006, cc. 265-268 (описание человеческих-человеческих гибридом). Технология человеческих гибридом (технология Trioma) описана также у Vollmers и Brandlein, Histology and Histopathology 20, 2005, cc. 927-937 и Vollmers и Brandlein, Methods and Findings in Experimental and Clinical Pharmacology 27, 2005, cc. 185-191. Человеческие антитела можно создавать также путем выделения последовательностей вариабельных доменов Fv-клонов, выбранных из фаговых дисплейных библиотек, для создания которых использовали человеческие антитела. Указанные последовательности вариабельных доменов затем можно объединять с требуемым человеческим константным доменом. Методики отбора человеческих антител из библиотек антител описаны ниже.
4. Антитела, полученные из библиотек
Антитела, указанные в разделе В описания, можно выделять путем скрининга комбинаторных библиотек антител с требуемой активностью или видами активности. Например, в данной области известны разнообразные методы для создания фаговых дисплейных библиотек и скрининга указанных библиотек в отношении антител, обладающих требуемыми характеристиками связывания. Указанные методы обобщены, например, у Hoogenboom и др., Methods in Molecular Biology 178, 2001, cc. 1-37, и описаны также, например, у McCafferty и др., Nature 348, 1990, сс. 552-554; Clackson и др., Nature 352, 1991, сс. 624-628; Marks и др., J. Mol. Biol. 222, 1992, сс. 581-597; Marks и Bradbury, Methods in Molecular Biology 248, 2003, cc. 161-175; Sidhu и др., J. Mol. Biol. 338, 2004, cc. 299-310; Lee и др., J. Mol. Biol. 340, 2004, cc. 1073-1093; Fellouse, Proc. Natl. Acad. Sci. USA 101, 2004, cc. 12467-12472 и Lee и др., J. Immunol. Methods 284, 2004, cc. 119-132.
При осуществлении некоторых методов фагового дисплея популяции VH- и VL-генов клонируют по отдельности с помощью полимеразной цепной реакции (ПЦР) и рекомбинируют произвольно в фаговых библиотеках, которые затем подвергают скринингу в отношении антигенсвязывающего фага согласно методу, описанному у Winter и др., Ann. Rev. Immunol. 12, 1994, сс. 433-455. Фаг, как правило, экспонирует фрагменты антител либо в виде одноцепочечных Fv-фрагментов (scFv), либо в виде Fab-фрагментов.
Альтернативно этому, можно клонировать необработанную («наивную») популяцию (например, из организма человека), получая один источник антител к широкому спектру чужих, а также своих антигенов без какой-либо иммунизации, что описано у Griffiths и др., EMBO J, 12, 1993, сс. 725-734.
И, наконец, «наивные» библиотеки можно получать также методами синтеза путем клонирования не перегруппированных сегментов V-гена из стволовых клеток и с помощью ПЦР-праймеров, содержащих случайную последовательность, для кодирования гипервариабельных CDR3-участков и для осуществления перегруппировки in vitro согласно методу, описанному у Hoogenboom и Winter, J. Mol. Biol. 227, 1992, cc. 381-388. Фаговые библиотеки человеческих антител описаны, например, в следующих патентных публикациях: US №5750373 и публикациях заявок на патент США 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360. В контексте настоящего описания антитела или фрагменты антител, выделенные из библиотек человеческих антител, рассматриваются как человеческие антитела или фрагменты человеческих антител.
5. Мультиспецифическое антитело
В некоторых вариантах осуществления изобретения антитело, указанное в разделе В описания, может представлять собой, например, мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые имеют специфичности, связывающиеся по меньшей мере с двумя различными сайтами.
В некоторых вариантах осуществления изобретения одна из связывающих специфичностей обеспечивает связывание с IL-8, а другая с любым другим антигеном.
В некоторых вариантах осуществления изобретения биспецифические антитела могут связываться с двумя различными эпитопами на IL-8. Биспецифические антитела можно применять также для локализации цитотоксических агентов в клетках, которые экспрессируют IL-8. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
Методики создания мультиспецифических антител включают (но не ограничиваясь только ими) рекомбинантную совместную экспрессию двух пар тяжелых цепей-легких цепей иммуноглобулинов, обладающих различными специфичностями (см. Milstein и Cuello, Nature 305, 1983, сс. 537-540, WO 93/08829 и Traunecker и др., EMBO J. 10,1991, сс. 3655-3659), и технологию «knob-in-hole» (обеспечение взаимодействия по типу «выступ-во впадину», см., например, US №5731168). Мультиспецифические антитела можно получать также путем создания регулируемых электростатических воздействий для получения молекул антитела с гетеродимерными Fc (WO 2009/089004); перекрестного связывания двух или большего количества антител или фрагментов (см., например, US №4676980 и Brennan и др., Science 229, 1985, сс. 81-83); применения лейциновых молний для получения биспецифических антител (см., например, Kostelny и др., J. Immunol. 148, 1992, сс. 1547-1553); применения технологии «димерных антител (диабоди)» для создания фрагментов биспецифических антител (см., например, Hollinger и др., Proc. Natl. Acad. Sci. USA 90, 1993, сс. 6444-6448); и применения димеров одноцепочечных Fv (scFv) (см., например, Gruber и др., J. Immunol. 152, 1994, сс. 5368-5374); и получения триспецифических антител согласно методу, описанному, например, у Tutt и др., J. Immunol. 147, 1991, сс. 60-69).
Под объем настоящего изобретения подпадают также сконструированные антитела с тремя или большим количеством функциональных антигенсвязывающих сайтов, включая «антитела-осьминоги» (см., например, US 2006/0025576).
К антителу или его фрагменту, указанному в разделе В настоящего описания, относится «Fab двойного действия» или «DAF», содержащий антигенсвязывающий сайт, который связывается с IL-8, а также с другим, отличным от него антигеном (см., например, US 2008/0069820).
6. Варианты антител
Аминокислотную последовательность вариантов антитела можно получать путем интродукции соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем синтеза пептидов. Указанные модификации включают, например, делеции и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечной конструкции можно использовать любую комбинацию делеций, инсерций и замен, при условии, что конечная конструкция представляет собой антитело, которое обладает требуемыми характеристиками, указанными в контексте раздела В описания.
Одним из вариантов осуществления изобретения, указанным в разделе В описания, являются варианты антител, имеющие одну или несколько аминокислотных замен. Указанные сайты замен могут находиться в любом из положений в антителе. Аминокислоты, предлагаемые в качестве консервативных замен, представлены в таблице 10 под заголовком «консервативные замены». Аминокислоты, предлагаемые в качестве типичных замен, которые приводят к более существенны изменениям, представлены в таблице 10 под заголовком «типичные замены», и они описаны ниже со ссылкой на классы боковых цепей аминокислот.

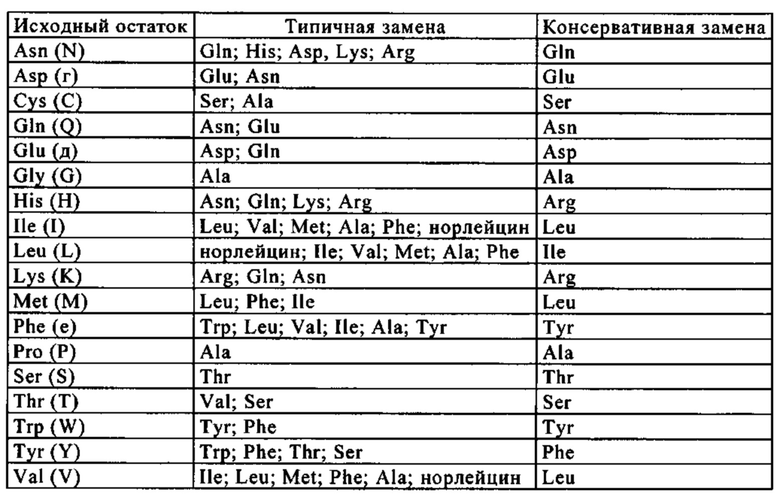
Аминокислоты можно группировать на основе общих свойств боковых цепей следующим образом: (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln; (3) кислотные: Asp, Glu; (4)  : His, Lys, Arg; (5) остатки, которые влияют на ориентацию цепи: Gly, Pro; (6) ароматические: Trp, Tyr, Phe.
: His, Lys, Arg; (5) остатки, которые влияют на ориентацию цепи: Gly, Pro; (6) ароматические: Trp, Tyr, Phe.
Под неконсервативными заменами подразумевают замену представителя одного из указанных классов на представителя из другого класса.
Инсерции в аминокислотные последовательности включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или большее количество остатков, а также инсерции одного или нескольких аминокислотных остатков внутрь последовательности. Примером результата осуществления концевых инсерции является антитело с N-концевым метионильным остатком. Другие инсерционные варианты молекул антител включают слияние N- или С-концов антитела с ферментом (например, для ADEPT (антитело-направляемый фермент пролекарственной терапии) или полипептидом, который удлиняет время полужизни антитела в сыворотке.
7. Варианты гликозилирования
В одном из вариантов осуществления изобретения антитела, указанные в разделе В описания, могут представлять собой гликозилированные антитела. Добавление или делецию сайтов гликозилирования в антителе можно легко осуществлять путем такого изменения аминокислотной последовательности, которое позволяет создавать или удалять сайты гликозилирования.
Если антитело содержит Fc-область, то можно изменять присоединенную к ней сахарную цепь. Нативные антитела, которые продуцируются клетками млекопитающих, как правило, содержат разветвленный биантенный олигосахарид, который, как правило, присоединен с помощью N-связи к Asn297 СН2-домена Fc-области (см., например, Wright и др., TIBTECH 15, 1997, сс. 26-32). Олигосахарид может включать, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стебле» биантенной олигосахаридной структуры. В одном из вариантов осуществления изобретения олигосахарид в антителе, указанном в разделе В описания, модифицируют для создания вариантов антитела с определенными улучшенными свойствами.
8. Варианты Fc-области
В одном из вариантов осуществления изобретения интродуцируют в Fc-область антитела, представленного в разделе В описания, одну или несколько аминокислотных модификаций, создавая тем самым вариант Fc-области. Варианты Fc-области включают варианты, в которых модифицирована(ы) (например, в результате замены) одна, две, три или большее количество аминокислот в нативной последовательности человеческой Fc-области (например, Fc-области человеческого IgG1, IgG2, IgG3 или IgG4).
Антитело к IL-8, указанное в разделе В описания, может содержать Fc-область, которая обладает по меньшей мере одним из приведенных ниже пяти свойств (но не ограничиваясь только ими): (а) повышенная аффинность связывания с FcRn Fc-области относительно аффинности связывания с FcRn нативной Fc-области при кислом рН; (б) пониженная аффинность связывания Fc-области с ранее присутствующим ADA относительно аффинности связывания нативной Fc-области с ранее присутствующим ADA; (в) удлиненное время полужизни в плазме Fc-области относительно времени полужизни в плазме нативной Fc-области; (г) пониженный клиренс из плазмы Fc-области относительно клиренса из плазмы нативной Fc-области; и (д) пониженная аффинность связывания Fc-области с эффекторным рецептором относительно аффинности связывания нативной Fc-области с эффекторным рецептором. В некоторых вариантах осуществления изобретения Fc-область имеет 2, 3 или 4 из перечисленных выше свойств. В одном из вариантов осуществления изобретения варианты Fc-области включают варианты с повышенной аффинностью FcRn-связывания при кислом рН. Варианты Fc-области с повышенной аффинностью FcRn-связывания включают (но ограничиваясь только ими) варианты Fc-области, у которых аффинность FcRn-связывания повышена вплоть до 2, 3, 4, 5, 10, 15, 20, 30, 50 или 100 раз по сравнению с аффинностью FcRn-связывания антитела, содержащего Fc-область нативного IgG.
В одном из вариантов осуществления изобретения вариант Fc-области включает безопасный и обладающий преимуществом вариант Fc-области, который не связывается с предсуществующим ADA и одновременно обладает улучшенным временем полужизни в плазме. В контексте раздела В описания понятие «ADA» относится к эндогенному антителу, обладающему аффинностью связывания с эпитопом на терапевтическом антителе. В контексте раздела В описания, понятие «предсуществующее ADA» относится к поддающемуся обнаружению антителу к лекарственному средству, которое находится в крови пациента до введения пациенту терапевтического антитела. Предсуществующее ADA включает ревматоидный фактор. Варианты Fc-области с низкой аффинностью связывания с предсуществующим ADA включают (но не ограничиваясь только ими) варианты Fc-области аффинность ADA-связывания которых снижена до 1/10 или менее, 1/50 или менее или 1/100 или менее по сравнению с аффинностью ADA-связывания антитела, которое содержит Fc-область нативного IgG.
В одном из вариантов осуществления изобретения вариант Fc-области включает варианты Fc-области, аффинность связывания которых с белками комплемента является низкой, или которые не связываются с белками комплемента. Белки комплемента включают C1q. Варианты Fc-области с низкой аффинностью связывания с белками комплемента включают (но не ограничиваясь только ими) варианты Fc-области, аффинность связывания которых с белками комплемента снижена до 1/10 или менее, 1/50 или менее или 1/100 или менее по сравнению с аффиностью связывания белков комплемента антитела, которое содержит Fc-область нативного IgG.
В одном из вариантов осуществления изобретения вариант Fc-области включает вариант Fc-области, аффинность связывания которого с эффекторными рецепторами является низкой или который не обладает аффинностью связывания с эффекторным рецептором. Эффекторные рецепторы включают (не ограничиваясь только ими) FcγRI, FcγRII и FcγRIII. FcγRI включает (но не ограничиваясь только ими) FcγRIa, FcγRIb и FcγRIc, а также их подтипы. FcγRII включает (но не ограничиваясь только ими) FcγRIIa (который имеет два аллотипа: R131 и Н131) и FcγRIIb. FcγRIII включает (но не ограничиваясь только ими) FcγRIIIa (который имеет два аллотипа: V158 и F158) и FcγRIIIb (который имеет два аллотипа: FcγRIIIb-NA1 и FcγRIIIb-NA2). Варианты Fc-области с низкой аффинностью связывания с эффекторными рецепторами включают (но не ограничиваясь только ими) варианты Fc-области, аффинность связывания которых с эффекторными рецепторами снижена по меньшей мере до 1/10 или менее, 1/50 или менее или 1/100 или менее по сравнению с аффинностью связывания антитела, которое содержит Fc-область нативного IgG.
В одном из вариантов осуществления изобретения вариант Fc-области включает Fc-область, содержащую одну или несколько аминокислотных замен в любом(ых) из положений, выбранном(ых) из группы, которая состоит из положений 235, 236, 239, 327, 330, 331, 428, 434, 436, 438 и 440, согласно EU-нумерации по сравнению с нативной Fc-областью.
В одном из вариантов осуществления изобретения вариант Fc-области включает Fc-область, которая содержит аминокислотные замены в положениях 235, 236, 239, 428, 434, 436, 438 и 440 согласно EU-нумерации, по сравнению с нативной Fc-областью.
В одном из вариантов осуществления изобретения вариант Fc-области включает Fc-область, которая содержит аминокислотные замены в положениях 235, 236, 327, 330, 331, 428, 434, 436, 438 и 440 согласно EU-нумерации, по сравнению с нативной Fc-областью.
В одном из вариантов осуществления изобретения вариант Fc-области включает Fc-область, которая содержит одну или несколько аминокислотных замен, выбранных из группы, которая состоит из L235R, G236R, S239K, A327G, A330S, P331S, M428L, N434A, Y436T, Q438R и S440E.
В одном из вариантов осуществления изобретения вариант Fc-области включает Fc-область, которая содержит аминокислотные замены M428L, N434A, Y436T, Q438R и S440E.
В одном из вариантов осуществления изобретения вариант Fc-области включает Fc-область, которая содержит аминокислотные замены L235R, G236R, S239K, M428L, N434A, Y436T, Q438R и S440E.
В одном из вариантов осуществления изобретения вариант Fc-области включает Fc-область, которая содержит аминокислотные замены L235R, G236R, A327G, A330S, P331S, M428L, N434A, Y436T, Q438R и S440E.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит аминокислотную последовательность SEQ ID NO: 80 и/или аминокислотную последовательность SEQ ID NO: 82. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 80 и/или аминокислотную последовательность SEQ ID NO: 82, может представлять собой антитело к IL-8, которое связывается IL-8 рН-зависимым образом. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 80 и/или аминокислотную последовательность SEQ ID NO: 82, может сохранять стабильную нейтрализующую IL-8 активность in vivo (например, в плазме). Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 80 и/или аминокислотную последовательность SEQ ID NO: 82, может представлять собой антитело с низкой иммуногенностью. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 80 и/или аминокислотную последовательность SEQ ID NO: 82, может содержать Fc-область, аффинность FcRn-связывания которой при кислом рН (например, рН 5,8) повышена по сравнению с аффинностью FcRn-связывания нативной Fc-области при кислом рН. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 80 и/или аминокислотную последовательность SEQ ID NO: 82, может содержать Fc-область, аффинность связывания которой с ранее присутствующим ADA понижена по сравнению с аффинностью связывания нативной Fc-области с ранее присутствующим ADA. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 80 и/или аминокислотную последовательность SEQ ID NO: 82, может содержать Fc-область, время полужизни в плазме которой пролонгировано по сравнению с нативной Fc-областью. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 80 и/или аминокислотную последовательность SEQ ID NO: 82, может содержать Fc-область, аффинность связывания которой с эффекторными рецепторами снижена по сравнению с нативной Fc-областью. В дополнительном варианте осуществления изобретения антитело к IL-8 содержит комбинацию любых из 2, 3, 4, 5, 6 или всех 7 описанных выше свойств.
В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, содержит аминокислотную последовательность SEQ ID NO: 81 и/или аминокислотную последовательность SEQ ID NO: 82. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 81 и/или аминокислотную последовательность SEQ ID NO: 82, может представлять собой антитело к IL-8, которое связывается IL-8 рН-зависимым образом. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 81 и/или аминокислотную последовательность SEQ ID NO: 82, может сохранять стабильную нейтрализующую IL-8 активность in vivo (например, в плазме). Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 81 и/или аминокислотную последовательность SEQ ID NO: 82, может представлять собой антитело с низкой иммуногенностью. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 81 и/или аминокислотную последовательность SEQ ID NO: 82, может содержать Fc-область, аффинность FcRn-связывания которой при кислом рН (например, рН 5,8) повышена по сравнению с аффинностью FcRn-связывания нативной Fc-области при кислом рН. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 81 и/или аминокислотную последовательность SEQ ID NO: 82, может содержать Fc-область, аффинность связывания которой с ранее присутствующим ADA понижена по сравнению с аффинностью связывания нативной Fc-области с ранее присутствующим ADA. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 81 и/или аминокислотную последовательность SEQ ID NO: 82, может содержать Fc-область, время полужизни в плазме которой пролонгировано по сравнению с нативной Fc-областью. Антитело к IL-8, которое содержит аминокислотную последовательность SEQ ID NO: 81 и/или аминокислотную последовательность SEQ ID NO: 82, может содержать Fc-область, аффинность связывания которой с эффекторными рецепторами снижена по сравнению с нативной Fc-областью. В дополнительном варианте осуществления изобретения антитело к IL-8 содержит комбинацию любых из 2, 3, 4, 5, 6 или всех 7 описанных выше свойств.
Некоторые варианты осуществления изобретения относятся к указанному в разделе В описания варианту антитела, который обладает некоторыми, но не всеми эффекторными функциями. Вариант антитела может являться перспективным кандидатом в тех случаях, когда некоторые эффекторные функции (такие как комплемент и ADCC) не являются необходимыми или являются вредными. Можно осуществлять анализы цитотоксичности in vitro и/или in vivo для подтверждения снижения/истощения CDC- и/или ADCC-активности. Например, можно осуществлять анализы связывания Fc-рецептора (FcR) для гарантии того, что у антитела отсутствует способность к связыванию с FcγR (и поэтому, вероятно, отсутствует ADCC-активность), но сохраняется способность связываться с FcRn.
Первичные культивируемые клетки, опосредующие ADCC, т.е. NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные об экспрессии FcR на гематопоэтических клетках обобщены в таблице 3 на с. 464 у Ravetch и Kinet, Annu. Rev. Immunol. 9, 1991, cc. 457-492. Примерами анализов in vitro ADCC-активности представляющей интерес молекулы являются (но не ограничиваясь только ими) анализы, описанные в US №5500362 (см., например, Hellstrom и др., Proc. Natl. Acad. Sci. USA 83, 1986, cc. 7059-7063 и Hellstrom и др., Proc. Nat'l Acad. Sci. USA 82, 1985, cc. 1499-1502); US №5821337 (см. Bruggemann и др., J. Exp. Med. 166, 1987, cc. 1351-1361). В альтернативном варианте можно применять нерадиоактивные методы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ на основе проточной цитометрии (фирма CellTechnology, Inc. Маунтин-Вью, шт. Калифорния); и нерадиоактивный анализ цитотоксичности CytoTox 96® (фирма Promega, Мэдисон, шт. Висконсин). Пригодными для таких анализов эффекторными клетками являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK).
В альтернативном или дополнительном варианте ADCC-активность представляющего интерес варианта антитела можно оценивать in vivo, например, на животной модели, например, как описано у Clynes и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc. 652-656. Можно осуществлять также анализы связывания C1q для подтверждения того, что антитело не может связывать C1q и поэтому у него отсутствует CDC-активность (см., например, описание ELISA для оценки связывания C1q и С3с в WO 2006/029879 и WO 2005/100402). Для оценки активации комплемента можно осуществлять анализ CDC (см., например, Gazzano-Santoro и др., J. Immunol. Methods 202, 1996, cc. 163-171; Cragg и др., Blood 101, 2003, сс. 1045-1052; и Cragg, Blood 103, 2004, cc. 2738-2743). Определение FcRn-связывания и клиренса/времени полужизни in vivo можно осуществлять также с использованием методов, известных в данной области (см., например, Petkova и др., Int'l. Immunol. 18(12), 2006, cc. 1759-1769).
Антитела с пониженной эффекторной функцией включают антитела с заменой одного или нескольких следующих остатков Fc-области, таких как 238, 265, 269, 270, 297, 327 и 329 (см., например, US №6737056). К указанным мутантам Fc относятся мутанты Fc с заменами в двух или большем количестве из следующих аминокислотных положений: 265, 269, 270, 297 и 327, включая так называемый мутант «DANA» Fc-области, несущий замену остатков 265 и 297 на аланин (US №7332581).
Описаны некоторые варианты антител с повышенной или пониженной способностью связываться с FcR (см., например, US №6737056; WO 2004/056312 и Shields и др., J. Biol. Chem. 276, 2001, cc. 6591-6604).
Антитела с удлиненным временем полужизни в крови и улучшенной FcRn-связывающей активностью при кислом рН описаны в US 2005/0014934. Описанные антитела содержат Fc-область с одной или несколькими заменами, которые улучшают связывание Fc-области с FcRn. Указанные варианты Fc-области включают варианты с заменами в одном или нескольких положениях, выбранных из 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434 в Fc-области, например, с заменой положения 434 в Fc-области (US №7371826).
Дополнительные примеры, касающиеся других вариантов Fc-области, описаны также у Duncan, Nature 322, 1988, сс. 738-740; в US №№5648260 и 5624821 и в WO 1994/29351.
9. Производные антител
В некоторых вариантах осуществления изобретения антитело, указанное в разделе В описания, можно дополнительно модифицировать таким образом, чтобы оно содержало дополнительные небелковые фрагменты, известные в данной области и легкодоступные. Фрагменты, пригодные для дериватизации антитела, включают (но не ограничиваясь только ими) водорастворимые полимеры. Примерами водорастворимых полимеров являются (но не ограничиваясь только ими) полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо статистические сополимеры) и декстран- или поли(н-винилпиролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры пропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликольпропиональдегид может иметь преимущество при производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, присоединенных к антителу, может варьироваться и, если присоединено более одного полимера, то они могут представлять собой одинаковые или различные молекулы. В целом, количество и/или тип полимеров, применяемых для дериватизации, можно определять с учетом таких особенностей (но не ограничиваясь только ими), как конкретные свойства или функции антитела, подлежащие усовершенствованию, предполагается ли применение производного антитела в терапии в определенных условиях, и т.д.
Другим вариантом осуществления изобретения являются конъюгаты антитела к IL-8, указанного в разделе В описания, и небелкового фрагмента, которые можно избирательно нагревать, воздействуя на него излучением. В одном из вариантов осуществления изобретения небелковый фрагмент представляет собой углеродную нанотрубку (Kam и др., Proc. Natl. Acad. Sci. USA 102, 2005, cc. 11600-11605). Излучение может иметь любую длину волны и включает (но не ограничиваясь только ими) длины волн, которые не повреждают обычные клетки, но которые нагревают небелковый фрагмент до температуры, при которой уничтожаются клетки, ближайшие к конъюгату: антитело-небелковый фрагмент.
Б. Методы рекомбинации и композиции
Антитела к IL-8, указанные в разделе Б описания, можно получать, используя методы рекомбинации и композиции, например, описанные в US №4816567. Одним из вариантов осуществления изобретения является(ются) выделенная(ые) нуклеиновая(ые) кислота(ы), кодирующая(ие) антитело к IL-8, указанное в разделе В описания. Указанная(ые) нуклеиновая(ые) кислота(ы) может(гут) кодировать аминокислотную последовательность, содержащую VL антитела, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). Следующим вариантом осуществления изобретения является(ются) один или несколько векторов (например, экспрессионных векторов), который(е) содержит(ат) указанную(ые) нуклеиновую(ые) кислоту(ы). Одним из вариантов осуществления изобретения является клетка-хозяин, содержащая указанную(ые) нуклеиновую(ые) кислоту(ы). В одном из указанных вариантов осуществления изобретения клетка-хозяин содержит (например, в результате трансформации указанными векторами): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует VL антитела, и VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует VH антитела. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой эукариотическую клетку (например, клетку яичника китайского хомячка (СНО) или лимфоидную клетку (например, Y0-, NS0-, Sp20-клетку).
Одним из вариантов осуществления изобретения является способ получения антитела к IL-8, указанного в разделе В описания, где способ включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, которая кодирует указанное выше антитело к IL-8, в условиях, пригодных для экспрессии антитела, и необязательно выделение антитела (например, из клетки-хозяина или среды для культивирования клетки-хозяина).
Для рекомбинантного получения антитела к IL-8 нуклеиновую(ые) кислоту(ы), кодирующую(ие) антитело, например, описанную(ые) выше, выделяют и встраивают в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Указанную(ые) нуклеиновую(ые) кислоту(ы) легко можно выделять и секвенировать с использованием общепринятых процедур (например, путем использования олигонуклеотидных зондов, которые обладают способностью специфически связываться с нуклеиновыми кислотами, кодирующими тяжелые и легкие цепи антитела).
Приемлемые клетки-хозяева для клонирования или экспрессии кодирующих антитело векторов включают прокариотические или эукариотические клетки, представленные в разделе В настоящего описания. Например, антитела можно получать в бактериях, в частности, когда не требуется гликозилирование и связанная с Fc эффекторная функция. Сведения об экспрессии фрагментов антитела и полипептидов в бактериях см. например, в US №№5648237, 5789199 и 5840523 (см. также у Charlton в: Methods in Molecular Biology, под ред. Lo В.K.С., изд-во Humana Press, Totowa, NJ, т. 248, 2003, сс. 245-254 описание экспрессии фрагментов антител в Е. coli.) После экспрессии антитело можно выделять из пасты бактериальных клеток в виде растворимой фракции и можно дополнительно очищать.
Помимо прокариотических организмов в качестве хозяев, пригодных для клонирования или экспрессии векторов, которые кодируют антитела, можно использовать эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, пути гликозилирования которых были «гуманизированы», что позволяет получать антитело с частично или полностью человеческой схемой гликозилирования (см. Gerngross, Nat. Biotech. 22, 2004, сс. 1409-1414 и Li и др., Nat. Biotech. 24, 2006, сс. 210-215).
Клетки-хозяева, которые можно использовать для экспрессии гликозилированного антитела, получают также из многоклеточных организмов (беспозвоночных и позвоночных животных). Примерами клеток беспозвоночных являются клетки насекомых, а также можно применять клетки растений. Были выявлены многочисленные штаммы бакуловирусов и соответствующие пригодные для них в качестве хозяев клетки насекомых, прежде всего для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев можно применять также культуры растительных клеток (см., например, US №№5959177, 6040498, 6420548, 7125978 и 6417429 (описание технологии PLANTIBODIES™ для получения антител в трансгенных растениях).
В качестве хозяев можно применять также клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, которые адаптированы к росту в суспензии. Другими примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированная с помощью ОВ40 (COS-7); линия клеток почки эмбриона человека (HEK 293-клетки или клетки линии 293, описанные, например, у Graham и др., J. Gen. Virol., 36, 1977, сс. 59-74); клетки почки детеныша хомяка (ВНК); клетки Сертоли мыши (ТМ4-клетки, описанные, например, у Mather, Biol. Reprod., 23, 1980, сс. 243-251); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76,); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени бычьей крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, у Mather и др., Annals N.Y. Acad. Sci., 383, 1982, сс. 44-68); клетки MRC 5 и клетки FS4.
Другими ценными линиями клеток-хозяев млекопитающих являются клетки яичника китайского хомячка (СНО), включая DHFR--CHO-клетки (Urlaub и др., Proc. Natl. Acad. Sci. USA, 77, 1980, cc. 4216-4220); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор конкретных линий клеток-хозяев млекопитающих, которые можно применять для производства антител, см., например, у Yazaki и Wu, в: Methods in Molecular Biology под ред. В.K.С. Lo, изд-во Humana Press, Totowa, NJ, т. 248, 2003, cc. 255-268.
Антитело, указанное в разделе В описания, полученное культивированием, при котором описанные выше клетки-хозяева несут нуклеиновые кислоты, которые кодируют антитело в условиях, приемлемых для экспрессии антитела, можно выделять изнутри или снаружи клетки-хозяина (среды, молоко и т.д.) и очищать в виде практически гомогеннного антитела. Методы выделения/очистки, которые, как правило, применяют для очистки полипептидов, можно соответственно применять для выделения и очистки антитела; однако методы не ограничены указанными выше примерами. Антитело можно соответственно отделять и очищать, например, с помощью соответствующего отбора и объединения хроматографии на колонках, фильтрации, ультрафильтрации, обессоливания, осаждения растворителем, экстракции растворителем, дистилляции, иммунопреципитации, электрофореза в полиакриламидном геле в присутствии ДСН, изоэлектрического фокусирования, диализа, перекристаллизации и других методов. Хроматография включает, например, аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, хроматографию с обращенной фазой и адсорбционную хроматографию. Указанную хроматографию можно осуществлять, например, с использованием жидкостной хроматографии, такой как ЖХВР и ЖХБР. Колонки для применения в аффинной хроматографии могут представлять собой колонку с белком А или колонку с белком G. Колонка с белком А включает, например, Hyper D, POROS, Sepharose F.F. (фирма Pharmacia) и т.д.
С учетом характеристик антител к IL-8, таких как повышенная активность связывания с внеклеточным матриксом и усиленное поглощение клетками комплексов, описанных выше, в разделе В описания представлены способы отбора антител с повышенной активностью связывания внеклеточного матрикса и антител с усиленным поглощением клетками. Одним из вариантов осуществления изобретения, указанном в разделе В описания, являются способы получения антитела к IL-8, которое содержит вариабельную область, связывающая активность которой с IL-8 зависит от рН, включающие стадии: (а) оценки связывания между антителом к IL-8 и внеклеточным матриксом; (б) отбор антитела к IL-8, отличающегося сильным связыванием с внеклеточным матриксом; (в) культивирование хозяина, который содержит вектор, несущий нуклеиновую кислоту, которая кодирует антитело; и (г) выделение антитела из клеточной среды.
Связывание с внеклеточным матриксом можно оценивать любыми методами, известными обычным специалистам в данной области (но не ограничиваясь конкретно только ими). Например, анализы можно осуществлять, используя систему ELISA для обнаружения связывания между антителом и внеклеточным матриксом, для чего антитело добавляют к иммобилизованному на планшете внеклеточному матриксу и к нему добавляют меченое антитело против антитела. Альтернативно этому, указанные анализы можно осуществлять, например, используя метод электрохемилюминисценции (ECL), в котором смесь антитела и меченного рутением антитела добавляют к иммобилизованному на планшете внеклеточному матриксу и связывание между антителом и внеклеточным матриксом оценивают на основе электрохемилюминисценции рутения.
Антитело к IL-8, связывание которого с внеклеточным матриксом оценивали на описанной выше стадии (а), может представлять собой индивидуальное антитело или находящееся в контакте IL-8. «Отбор антитела к IL-8, отличающегося сильным связыванием с внеклеточным матриксом» на стадии (б) означает, что антитело к IL-8 отбирают на основе критерия, согласно которому величина, характеризующая связывание между внеклеточным матриксом и антителом к IL-8, выше, чем величина, характеризующая связывание между внеклеточным матриксом и контрольным антителом, при оценке связывания с внеклеточным матриксом, и может превышать ее, например, в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 50, 100 раз или более; однако соотношение не ограничено конкретно указанными выше примерами. За исключением присутствия IL-8 предпочтительно условия являются одинаковыми на стадии оценки связывания между антителом к IL-8 и внеклеточным матриксом. Контрольное антитело к IL-8, применяемое для сравнения антител к IL-8 с несколькими модификациями, может представлять собой не модифицированное антитело к IL-8. В этом случае условия предпочтительно являются одинаковыми за исключением присутствия IL-8. В частности, в одном из вариантов осуществления изобретения, указанном в разделе В описания, отбирают антитело с более высокой величиной, характеризующей связывание между внеклеточным матриксом, из нескольких и антител к IL-8, которые не контактируют с IL-8. В другом варианте осуществления изобретения, указанном в разделе В описания, отбирают антитело с более высокой величиной, характеризующей связывание между внеклеточным матриксом, из нескольких антител к IL-8 антител, которые контактируют с IL-8. В альтернативном варианте осуществления изобретения «отбор антитела к IL-8, отличающегося сильным связыванием с внеклеточным матриксом» на стадии (б) означает, что антитело можно отбирать на основе критерия, согласно которому связывание между антителом и внеклеточным матриксом варьирует в зависимости от присутствия IL-8, когда оценивают связывание с внеклеточным матриксом. Соотношение величины, характеризующей связывание с внеклеточным матриксом антитела к IL-8, в контакте с IL-8, и величины, характеризующей связывание с внеклеточным матриксом антитела к IL-8 без контакта с IL-8, может составлять, например, 2-1000. Кроме того, соотношение между величинами может составлять 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000.
В. Анализы
Антитела к IL-8, представленные в разделе В настоящего описания, можно идентифицировать, осуществлять их скрининг или характеризовать их физические/химические свойства и/или виды биологической активности с помощью различных анализов, известных в данной области.
1. Анализы связывания и другие анализы
Согласно одному из объектов изобретения антитела, указанные в разделе В описания, можно оценивать в отношении их антигенсвязывающей активности с помощью известных методов, таких, например, как ELISA, Вестерн-блоттинг, анализ кинетического исключения (KinExA™) и поверхностный плазменный резонанс с использованием такого устройства, как BIACORE (фирма GE Healthcare).
Согласно одному из вариантов осуществления изобретения аффинность связывания можно измерять с использованием BIACORE Т200 (фирма GE Healthcare) следующим образом. Взятый в соответствующем количестве «захватывающий» белок (например, белок A/G (фирма PIERCE)) иммобилизуют на сенсорном чипе СМ4 (фирма GE Healthcare) методом аминного сочетания и дают «захватить» представляющее интерес антитело. Затем разведенный раствор антигена и подвижный буфер (в качестве референс-раствора: например, 0,05% Твин-20, 20 мМ ACES, 150 мМ NaCl, рН 7,4) инъецируют для взаимодействия молекул антигена с антителом, «захваченным» на сенсорном чипе. Сенсорный чип регенерируют, используя 10 мМ раствор глицина × HCl (рН 1,5). Измерения осуществляют при предварительной определенной температуре (например, 37°С, 25°С или 20°С). Константу скорости реакции ассоциации kon (1/Мс) и константу скорости реакции диссоциации koff (1/с), которые обе представляют собой кинетические параметры, рассчитывают на основе сенсограмм, полученных при измерении. KD (М) каждого антитела в отношении антигена рассчитывают на основе этих констант. Каждый параметр рассчитывают с помощью программного обеспечения BIACORE Т200 Evaluation (фирма GE Healthcare).
В одном из вариантов осуществления изобретения IL-8 можно количественно определять согласно описанному ниже методу. Антитело к человеческому IL-8, которое содержит константную область мышиного IgG, иммобилизуют на планшете. Добавляют в виде аликвот на иммобилизованный планшет раствор, содержащий IL-8, связанный с гуманизированным антителом к IL-8, которое не конкурирует с вышеуказанным антителом к человеческому IL-8. После перемешивания добавляют биотинилированное антитело к человеческой легкой цепи Igκ и дают прореагировать в течение некоторого периода времени. Затем добавляют также меченный с помощью сульфо-метки стрептавидин и дают прореагировать в течение некоторого периода времени. Затем добавляют буфер для анализа и немедленно осуществляют измерения с помощью устройства SECTOR Imager 2400 (фирма Meso Scale Discovery).
2. Анализы активности
Одним из объектов изобретения являются анализы для идентификации антитела к IL-8, обладающего биологической активностью. Биологическая активность включает, например, IL-8-нейтрализующую активность и активность в отношении блокады сигналов IL-8. В разделе В описания представлены антитела, обладающие указанной биологической активностью in vivo и/или ex vivo.
Одним из вариантов осуществления изобретения является метод определения уровня нейтрализации IL-8, который не ограничивает объем изобретения, и указанную активность можно определять также с помощью описанных ниже методов. Клеточная линия PathHunter™ СНО-K1 CXCR2 β-аррестин (фирма DiscoveRx, каталожный №93-0202С2) представляет собой искусственную клеточную линию, созданную для экспрессии человеческого CXCR2, известного как человеческий IL-8-рецептор, и испускающую хемилюминисценцию после получения сигналов от человеческого IL-8. После добавления человеческого IL-8 в культуральную среду клеток клетки испускают хемилюминисценцию в зависимости от концентрации добавленного человеческого IL-8. При добавлении человеческого IL-8 в сочетании с антителом к человеческому IL-8 в культуральную среду хемилюминисценция клеток снижается или не поддается обнаружению по сравнению с вариантом без добавления антитела, поскольку антитело к человеческому IL-8 может блокировать трансдукцию сигналов IL-8. В частности, более сильной нейтрализующей активности антитела в отношении человеческого IL-8 соответствует более низкий уровень хемилюминисценции; а более слабой нейтрализующей активности антитела в отношении человеческого IL-8 соответствует более высокий уровень хемилюминисценции. Таким образом, нейтрализующую активность в отношении человеческого IL-8 антитела к человеческому IL-8 можно определять путем оценки указанного выше различия.
Г. Фармацевтические композиции
Фармацевтические композиции, содержащие антитело к IL-8, указанное в контексте раздела В настоящего описания, можно получать путем смешения антитела к IL-8, имеющего необходимую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences, 16-е изд. под ред. Osol А., 1980) в форме лиофилизированных композиций или водных растворов.
Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях, они включают (но не ограничиваясь только ими): буферы, такие как фосфатный, цитратный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и мета-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ).
В контексте настоящего описания примеры фармацевтически приемлемых носителей включают также диспергирующие агенты интерстициальных лекарственных средств, такие как растворимые активные в нейтральной среде гликопротеины гиалуронидаз (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX™, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и методы их применения, в том числе rHuPH20, описаны в публикациях патентов США №№2005/0260186 и 2006/0104968. Согласно одному из объектов изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных композиций антител описаны в US №6267958. Водные композиции антител включают композиции, описанные в US №6171586 и WO 2006/044908, и композиции, описанные в WO 2006/044908, включают гистидин-ацетатный буфер.
В контексте раздела В настоящего описания композиция может содержать также более одного действующего вещества, если это необходимо для конкретного подлежащего лечению показания, предпочтительно вещества с дополнительными видами активности, которые не оказывают отрицательного воздействия друг на друга. Такие действующие вещества должны присутствовать в комбинации в количествах, эффективных для достижения поставленной цели.
Действующие вещества можно включать также в микрокапсулы, например, полученные с помощью методов коацервации или межфазной полимеризации, например в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы введения лекарственного средства (например в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences, 16-е изд., под ред. Osol А., 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, включающие антитело к IL8, указанное в разделе В описания, такие матрицы представляют собой изделия определенной формы, например, пленки или микрокапсулы.
Композиции, предназначенные для применения in vivo, как правило, должны быть стерильными. Стерильность можно легко обеспечивать, например, путем фильтрации через стерильные фильтрующие мембраны.
Д. Терапевтические способы и композиции
В некоторых вариантах осуществления изобретения антитела к IL-8, указанные в разделе В описания, применяют в терапевтических способах.
Одним из объектов изобретения является антитело к IL-8, предназначенное для применения в виде фармацевтической композиции. Альтернативным объектом изобретения является антитело к IL-8, предназначенное для лечения заболевания, при котором IL-8 присутствует в избыточном количестве. Одним из вариантов осуществления изобретения является антитело к IL-8, предназначенное для применения в способах лечения заболевания, при котором IL-8 присутствует в избыточном количестве. Одним из вариантов осуществления изобретения, указанным в разделе В описания, являются способы лечения индивидуума, имеющего заболевание, при котором IL-8 присутствует в избыточном количестве (например, заболевания, связанного с присутствием IL-8 в избыточном количестве), которые включают введение индивидууму в эффективном количестве антитела к IL-8. Другим вариантом осуществления изобретения, указанным в разделе В описания, являются антитела к IL-8, предназначенные для применения в указанных способах. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является фармацевтическая композиция, содержащая в эффективном количестве антитело к IL-8, которую применяют для лечения заболевания, при котором IL-8 присутствует в избыточном количестве. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение антитела к IL-8 для приготовления фармацевтической композиции для лечения заболевания, при котором IL-8 присутствует в избыточном количестве. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение в эффективном количестве антитела к IL-8 для лечения заболевания, при котором IL-8 присутствует в избыточном количестве. Заболевания, при которых IL-8 присутствует в избыточном количестве, включают (но не ограничиваясь только ими) воспалительные заболевания кожи, такие как воспалительный кератоз (например, псориаз), атопический дерматит и контактный дерматит; аутоиммунные заболевания, такие как хронические воспалительные заболевания, включая ревматоидный артрит, системную красную волчанку (SLE) и болезнь Бехчета; воспалительные заболевания кишечника, такие как болезнь Крона и неспецифический язвенный колит; воспалительные заболевания печени, такие как гепатит В, гепатит С, алкогольный гепатит и индуцированный лекарственным средством аллергический гепатит; воспалительные заболевания почек, например, гломерулонефрит; воспалительные респираторные заболевания, такие как бронхит и астма; хронические воспалительные сосудистые заболевания, например, атеросклероз; рассеянный склероз, оральную язву, хордит и воспаление, ассоциированное с применением искусственных органов и/или искусственных кровеносных сосудов; злокачественные опухоли, такие как рак яичника, рак легкого, рак предстательной железы, рак желудка, рак молочной железы, меланома, раки головы и шеи и рак почки; связанный с инфекцией сепсис; муковисцидоз; фиброз легкого; и острое поражение легкого.
Альтернативным вариантом осуществления изобретения, указанным в разделе В описания, является антитело к IL-8, предназначенное для применения для подавления накопления IL-8, обладающего биологической активностью. «Подавления накопления IL-8» можно достигать путем предупреждения повышения количества ранее присутствующего IL-8 in vivo или путем снижения количества ранее присутствующего IL-8 in vivo. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является антитело к IL-8, предназначенное для подавления накопления обладающего биологической активностью IL-8 у индивидуума. В контексте настоящего описания «IL-8, присутствующий in vivo» может относиться к IL-8 в комплексе с антителом к IL-8 или к свободному IL-8; альтернативно этому, может относиться к общему IL-8 в виде суммы. В контексте настоящего описания «присутствует in vivo» может означать «секретируется снаружи клеток in vivo». Одним из вариантов осуществления изобретения, указанным в разделе В описания, является способ подавления накопления IL-8, обладающего биологической активностью, который включает стадию введения в эффективном количестве антитела к IL-8. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является фармацевтическая композиция, предназначенная для подавления накопления IL-8, обладающего биологической активностью, которая содержит в эффективном количестве антитело к IL-8. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение антитела к IL-8 для получения фармацевтической композиции, предназначенной для подавления накопления IL-8, обладающего биологической активностью. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение в эффективном количестве антитела к IL-8 для подавления накопления IL-8, обладающего биологической активностью. В одном из вариантов осуществления изобретения антитело к IL-8, указанное в разделе В описания, подавляет накопление IL-8 по сравнению с антителом к IL-8, которое не обладает рН-зависимой связывающей активностью. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
Альтернативным вариантом осуществления изобретения, указанным в разделе В описания, является антитело к IL-8, предназначенное для применения для ингибирования ангиогенеза (например, неоангиогенеза). Одним из вариантов осуществления изобретения, указанным в разделе В описания, является способ ингибирования неоангиогенеза у индивидуума, который включает введение в эффективном количестве антитела к IL-8 индивидууму, а также антитело к IL-8, предназначенное для применения в способе. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является фармацевтическая композиция, предназначенная для ингибирования неоангиогенеза, которая содержит в эффективном количестве антитело к IL-8. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение антитела к IL-8 для получения фармацевтической композиции, предназначенной для ингибирования неоангиогенеза. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение в эффективном количестве антитела к IL-8 для ингибирования неоангиогенеза. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
Альтернативным вариантом осуществления изобретения, указанным в разделе В описания, является антитело к IL-8, предназначенное для применения для ингибирования облегчения миграции нейтрофилов. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является способ ингибирования облегчения миграции нейтрофилов у индивидуума, которые включают введение в эффективном количестве антитела к IL-8 индивидууму; а также антитело к IL-8, предназначенное для применения в способе. Одним из вариантов осуществления изобретения, указанным в разделе В описания, являются фармацевтические композиции, предназначенные для ингибирования облегчения миграции нейтрофилов у индивидуума, которые содержат в эффективном количестве антитело к IL-8. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение антитела к IL-8 для получения фармацевтической композиции, предназначенной для ингибирования облегчения миграции нейтрофилов у индивидуума. Одним из вариантов осуществления изобретения, указанным в разделе В описания, является применение в эффективном количестве антитела к IL-8 для ингибирования облегчения миграции нейтрофилов у индивидуума. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
Альтернативным вариантом осуществления изобретения, указанным в разделе В описания, является фармацевтическая композиция, содержащая антитело к IL-8, представленная в настоящем описании, например, для применения в любом из указанных выше терапевтических способов. В одном из вариантов осуществления изобретения фармацевтическая композиция содержит антитела к IL-8, указанные в разделе В описания, и фармацевтически приемлемый носитель.
Антитело, указанное в разделе В описания, можно применять либо индивидуально, либо в комбинации другими агентами, предназначенными для терапии. Например, антитело, указанное в разделе В описания, можно вводить совместно по меньшей мере с одним дополнительным терапевтическим средством.
Антитело, указанное в разделе В описания (и необязательно любое дополнительное терапевтическое средство), можно вводить любыми приемлемыми путями, включая парентеральный, внутрилегочный и интраназальный и при необходимости применять для местной обработки, введения в повреждение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование можно осуществлять любым приемлемым путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, в зависимости, в том числе, от того, является ли лечение кратковременным или хроническим. Можно применять различные схемы дозирования, включая (но не ограничиваясь только ими) однократное введение или несколько введений в различные моменты времени, болюсное введение и пульсирующую инфузию.
Предпочтительно антитело, указанное в разделе В описания, включают в состав композиций, дозируют и вводят в соответствии с надлежащей клинической практикой. Рассматриваемые в этом контексте факторы включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину нарушения, область введения агента, метод введения, схему введения и другие факторы, известные практикующим медикам. Антитело можно, но это не является обязательным, включать в композицию в сочетании с одним или несколькими другими агентами, которые в настоящее время применяют для профилактики и лечения рассматриваемого нарушения.
Эффективное количество указанных других агентов зависит от количества антитела, присутствующего в композиции, типа нарушения или лечения и других указанных выше факторов. Их, как правило, применяют в таких же дозах и с использованием таких же путей введения, которые указаны в настоящем описании, или в количестве, составляющем от 1 до 99% от дозы, указанной в разделе В настоящего описания, или в любой дозе и с помощью любого пути, которые по данным эмпирической/клинической оценки являются пригодными.
Для предупреждения или лечения заболевания приемлемая доза антитела, указанного в разделе В описания (при его применении индивидуально или в сочетании с одним или несколькими другими дополнительными терапевтическими средствами), зависит от типа заболевания, подлежащего лечению, типа антитела, серьезности и течения болезни, применяют ли антитело для превентивных или терапевтических целей, предшествующей терапии, истории болезни пациента и ответа на антитело. Антитело можно вводить пациенту однократно или в виде серий обработок. В зависимости от типа и серьезности заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,1-10 мг/кг) антитела может представлять собой начальную возможную дозу для введения пациенту, например, с помощью одной или нескольких отдельных обработок или с помощью непрерывной инфузии. Одним из примеров типичных суточных доз может являться доза, составляющая от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. При использовании повторных введений в течение нескольких дней или более длительного периода времени, в зависимости от состояния, лечение, как правило, следует продолжать до достижения подавления симптомов заболевания. Одним из примеров доз антитела является доза, составляющая от примерно 0,05 до примерно 10 мг/кг. Так, пациенту можно вводить одну или несколько следующих доз: примерно 0,5 мг/кг, например 2,0 мг/кг, например 4,0 мг/кг или, например 10 мг/кг (или любую их комбинацию). Указанные дозы можно вводить дробно, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати, например, примерно шесть доз антитела). Можно применять начальную повышенную ударную дозу с последующим введением одной или нескольких более низких доз. С помощью общепринятых методов и анализов можно легко осуществлять мониторинг действия указанной терапии.
Е. Изделия
Другим объектом изобретения, указанным в разделе В описания, являются изделия, которые содержат продукты, применяемые для лечения, предупреждения и/или диагностирования указанных выше нарушений. Указанное изделие представляет собой контейнер и этикетку или листовку-вкладыш в упаковку, которые размещены на контейнере или вложены в него. Приемлемыми контейнерами являются, например банки, пузырьки, шприцы, пакеты для внутривенного раствора и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностирования состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или пузырек, снабженный пробкой, которую можно прокалывать с помощью иглы для подкожных инъекций). По меньшей мере одно действующее вещество в композиции представляет собой антитело, указанное в разделе В описания. На этикетке или листовке-вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния.
Кроме того, изделие может включать (а) первый контейнер с находящейся в нем композицией, где композиция содержит антитело, указанное в разделе В описания; и (б) второй контейнер с находящейся в нем композицией, где композиция содержит дополнительное цитотоксическое или иное терапевтическое средство. Согласно этим вариантам осуществления изобретения, указанным в разделе В описания, изделие может содержать листовку-вкладыш в упаковку, которая содержит информацию о том, что композиции можно использовать для лечения конкретного состояния. В альтернативном или дополнительном варианте изделие может дополнительно включать второй (или третий) контейнер с фармацевтически приемлемым буфером, таким как бактериостатическая вода для инъекций (БСВИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие продукты, необходимые с коммерческой точки зрения и с точки зрения потребителя, в частности, другие буферы, разбавители, фильтры, иглы и шприцы.
Специалистам в данной области должно быть очевидно на основе общеизвестных в данной области технологических знаний, что раздел В описания может включать все комбинации указанных в настоящем описании полных вариантов осуществления изобретения или их частей, за исключением тех случаев, когда это является технологически неприемлемым.
Разделы А, Б или В описания
Все процитированные в настоящем описании в разделе «Предпосылки создания изобретения» документы, включены в настоящее описание в качестве ссылки.
Следует иметь в виду, что в контексте настоящего описания выражение «и/или» включает значение всех понятий, указанных до и после фразы «и/или», которая включает все комбинации понятий, связанных с фразой соответствующим образом.
Хотя различные элементы описаны в настоящем описании с помощью таких понятий как первый, второй, третий, четвертый и т.д., следует иметь в виду, что такие понятия не накладывают ограничения на элементы. Эти понятия используются только для того, чтобы отличать один элемент от других элементов, и следует иметь в виду, что, например, первый элемент может быть обозначен как второй элемент, и аналогично, второй элемент может быть обозначен как первый элемент без отклонения от объема разделов А, Б и С описания.
Если специально не указано иное, или, если это не является неприемлемым в контексте описания, подразумевается, что все понятия в единственном числе включают также форму множественного числа, и любые понятия, применяемые в настоящем описании во множественном числе, включают также форму единственного числа.
Терминология, применяемая в настоящем описании, используется только для целей описания конкретных вариантов осуществления изобретения и не направлена на ограничение изобретения. Если не указано иное, то все понятия (включая технические и научные понятия), применяемые в настоящем описании, следует интерпретировать как имеющие то же самое значение, которое, как правило, подразумевают обычные специалисты в данной области, к которой относятся разделы А, Б и В описания, и их не следует интерпретировать в идеализированном или излишне формальном смысле.
В контексте настоящего описания подразумевается, что понятие «содержит» определяет присутствие описанных элементов (представителей, стадий, элементов, чисел и т.д.), если из контекста ясно не следует иное; и понятие не исключает присутствия других элементов (представителей, стадий, элементов, чисел и т.д.).
Варианты осуществления изобретения в разделах А, Б и В описания представлены со ссылкой на схематические иллюстрации, которые для ясности могут быть увеличены.
Если из контекста настоящего описания не следует иное, то численные значения, используемые в нем, следует понимать как значения в определенном диапазоне, что находится в технической компетенции обычного специалиста в данной области. Например, выражение «1 мг» следует понимать как «примерно 1 мг» с определенными вариациями. Например, выражение «1-5 элементов» следует понимать так, как если бы было специально написано «1 элемент, 2 элемента, 3 элемента, 4 элемента, 5 элементов», если это не противоречит контексту.
Примеры
Ниже разделы А, Б и В более подробно проиллюстрированы в примерах 1-4 и 21-23, примерах 5-7, 19 и 20 и примерах 8-19 соответственно, но указанные примеры не следует рассматривать как ограничивающие объем изобретения. Следует понимать, что на основе представленного выше общего описания могут быть воплощены на практике и различные другие варианты осуществления изобретения.
Пример 1
Получение рН-зависимых связывающих человеческий IL-6-рецептор человеческих антител с повышенной pI
Fv4-IgG1, описанный в WO 2009/125825, представляет собой антитело, которое связывается с человеческим IL-6-рецептором рН-зависимым образом и содержит VH3-IgG1 (SEQ ID NO: 24) в качестве тяжелой цепи и VL3-CK (SEQ ID NO: 32) в качестве легкой цепи. Для повышения pI Fv4-IgG1, в вариабельную область Fv4-IgG1 интродуцировали аминокислотные замены, которые снижали количество отрицательно заряженных аминокислот (таких как аспарагиновая кислота и глутаминовая кислота), увеличивая при этом количество положительно заряженных аминокислот (таких как аргинин и лизин). Более конкретно, VH3(High_pI)-IgG1 (SEQ ID NO: 25) получали в виде тяжелой цепи с повышенной pI путем замены в тяжелой цепи VH3-IgG1 глутаминовой кислоты в положении 16 на глутамин, глутаминовой кислоты в положении 43 на аргинин, глутамина в положении 64 на лизин и глутаминовой кислоты в положении 105 на глутамин, где положения даны согласно нумерации Кэбота. Аналогично этому VL3(High_pI)-CK (SEQ ID NO: 33) получали в виде легкой цепи с повышенной pI путем замены в легкой цепи VL3-CK серина в положении 18 на аргинин, глутамина в положении 24 на аргинин, глутаминовой кислоты в положении 45 на лизин, глутаминовой кислоты в положении 79 на глутамин и глутаминовой кислоты в положении 107 на лизин, где положения даны согласно нумерации Кэбота. При интродукции замены в положении 79 VL3-CK, одновременно интродуцировали модификации, которые приводили к замене аланина в положении 80 на пролин и аланина в положении 83 на изолейцин, хотя их осуществляли не с целью повышения pI.
С помощью метода, описанного в референс-примере 2, получали следующие антитела: (a) Low_pI-IgG1, содержащее VH3-IgG1 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (б) Middle_pI-IgG1 содержащее VH3-IgG1 в качестве тяжелой цепи и VL3(High_pI)-CK в качестве легкой цепи; и (в) High_pI-IgG1, содержащее VH3(High_pI)-IgG1 в качестве тяжелой цепи и VL3(High_pI)-CK в качестве легкой цепи.
Затем рассчитывали теоретическую величину pI для каждого из полученных антител с помощью программы GENETYX-SV/RC, версия 9.1.0 (фирма GENETYX CORPORATION) с использованием методов, известных в данной области (см., например, Skoog и др., Trends Analyt. Chem. 5(4), 1986, сс. 82-83). Предполагалось, что боковые цепи всех остатков цистеина в молекуле антитела образуют дисульфидные связи, и поэтому при расчете исключали вклад от боковых цепей цистеина в величину pKa.
Рассчитанные теоретические величины pI представлены в таблице 3. В то время как теоретическая величина pI для Low_pI-IgG1 составляла 6,39, величины для Middle_pI-IgG1 и High_pI-IgG1 составляли 8,70 и 9,30 соответственно, это свидетельствует о том, что теоретические величины pI возрастали ступенчатым образом.
В WO 2011/122011 описано Fv4-IgG1-F11 (ниже в настоящее описании обозначено как Low_pI-F11) и Fv4-IgG1-F939 (ниже в настоящее описании обозначено как Low_pI-F939), опосредованное FcRn поглощение клетками которых повышалось после интродукции аминокислотных замен в Fc-область Fv4-IgG1 и придания FcRn-связывающей способности в условиях нейтрального рН. Кроме того, в WO 2013/125667 описано Fv4-IgG1-F1180 (ниже в настоящее описании обозначено как Low_pI-F1180), опосредованное FcγR поглощение которого клетками повышалось после интродукции аминокислотных замен в Fc-область Fv4-IgG1 с целью повышения его FcγR-связывающей способности в условиях нейтрального рН. Одновременно в Fv4-IgG1-F1180 интродуцировали аминокислотную модификацию для повышения удерживания антитела в плазме путем увеличения его связывания с FcRn в условиях кислого рН в эндосомах. Представленные ниже антитела получали путем повышения pI антител, содержащих указанные новые варианты Fc-области.
Более конкретно, в каждой из конструкций VH3-IgG1-F11 (SEQ ID NO: 30) и VH3-IgG1-F939 (SEQ ID NO: 26), описанных в WO 2011/122011, и VH3-IgG1-F1180 (SEQ ID NO: 28), описанной в WO 2013/125667, осуществляли замены глутаминовой кислоты в положении 16 на глутамин, глутаминовой кислоты в положении 43 на аргинин, глутамина в положении 64 на лизин и глутаминовой кислоты в положении 105 на глутамин, где положения даны согласно нумерации Кэбота, для получения VH3(High_pI)-F11 (SEQ ID NO: 31), VH3(High_pI)-F939 (SEQ ID NO: 27) и VH3(High_pI)-F1180 (SEQ ID NO: 29) соответственно в качестве тяжелых цепей с повышенной pI.
С использованием указанных тяжелых цепей с помощью метода, описанного в референс-примере 2, получали следующие антитела: (1) Low_pI-F939, содержащее VH3-IgG1-F939 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (2) Middle_pI-F939, содержащее VH3(High_pI)-F939 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (3) High_pI-F939, содержащее VH3(High_pI)-F939 в качестве тяжелой цепи и VL3(High_pI)-CK в качестве легкой цепи; (4) Low_pI-F1180, содержащее VH3-IgG1-F1180 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (5) Middle_pI-F1180, содержащее VH3-IgG1-F1180 в качестве тяжелой цепи и VL3(High_pI)-CK в качестве легкой цепи; (6) High_pI-F1180, содержащее VH3(High_pI)-F1180 в качестве тяжелой цепи и VL3(High_pI)-CK в качестве легкой цепи; (7) Low_pI-F11, содержащее VH3-IgG1-F11 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; и (8) High_pI-F11, содержащее VH3(High_pI)-F11 в качестве тяжелой цепи и VL3(High_pI)-CK в качестве легкой цепи.
Затем рассчитывали теоретическую величину pI для каждого из полученных антител с помощью программы GENETYX-SV/RC, версия 9.1.0 (фирма GENETYX CORPORATION) с использованием метода, аналогичного описанному ранее. Рассчитанные теоретические величины pI представлены в таблице 3. Для всех антител, содержащих новые варианты Fc-области, теоретические величины pI возрастали ступенчатым образом в следующем порядке: Low_pI, Middle_pI и High_pI.

Пример 2
Приводящие к элиминации антигена воздействия антител с повышенной pI, характеризующихся рН-зависимым связыванием
(2-1) Анализ in vivo антител с pI-регулируемым рН-зависимым связыванием с человеческим рецептором IL-6
Как продемонстрировано ниже, осуществляли анализы in vivo с использованием различных характеризующихся рН-зависимым связыванием с человеческим рецептором IL-6 антител, полученных в примере 1: Low_pI-IgG1, High_pI-IgG1, Low_pI-F939, Middle_pI-F939, High_pI-F939, Low_pI-F1180, Middle_pI-F1180 и High_pI-F1180.
Растворимый человеческий рецептор IL-6 (который обозначают также как «hsIL-6R»), полученный с помощью метода, описанного в референс-примере 3, антитело к человеческому рецептору IL-6 и препарат человеческого иммуноглобулина Sanglopor вводили одновременно трансгенным по человеческому FcRn мышам (B6.mFcRn-/-.hFcRn Tg-мыши линии 32+/+, фирма Jackson Laboratories; см. Methods Mol. Biol. 602, 2010, cc. 93-104) и затем оценивали кинетику in vivo растворимого человеческого рецептора IL-6. Раствор, содержащий смесь растворимого человеческого рецептора IL-6, антитело к человеческому рецептору IL-6 и Sanglopor (в концентрациях 5 мкг/мл, 0,1 мг/мл и 100 мг/мл соответственно), однократно вводили в дозе 10 мл/кг через хвостовую вену. Поскольку антитело к человеческому рецептору IL-6 присутствовало в достаточном избытке по отношению к растворимому человеческому рецептору IL-6, то предполагалось, что почти все количество растворимого человеческого рецептора IL-6 должно связываться с антителом. Кровь собирали через 15 мин, 7 ч, один день, два дня, три дня и семь дней после введения. Собранную кровь сразу же подвергали центрифугированию при 4°С и 15000 об/мин в течение 15 мин с получением плазмы. Отделенную плазму хранили в морозильной камере при -20°С или ниже до осуществления измерений.
(2-2) Измерение концентрации растворимого человеческого рецептора IL-6 в плазме электрохемилюминисцентным методом
Концентрацию растворимого человеческого рецептора IL-6 в плазме мышей измеряли электрохемилюминесцентным методом. Приготавливали образцы растворимого человеческого рецептора IL-6, концентрацию которых доводили до 250, 125, 62,5, 31,25, 15,61, 7,81 или 3,90 пг/мл для построения калибровочной кривой, и образцы плазмы мышей, разведенные в 50 раз, соответственно. Образцы смешивали с моноклональным антителом к человеческому IL-6R (фирма R&D), меченному рутением, с использованием сложного NHS-эфира с сульфо-меткой (фирма Meso Scale Discovery), биотинилированным антителом к человеческому IL-6R (фирма R&D) и тоцилизумабом (номер CAS: 375823-41-9), которое представляло собой антитело, связывающее человеческий рецептор IL-6, и затем давали проходить реакции в течение ночи при 37°С. Конечную концентрацию тоцилизумаба доводили до 333 мкг/мл. Затем реакционные растворы вносили на покрытый стрептавидином планшет Gold Multi-ARRAY (фирма Meso Scale Discovery). После выдерживания в течение еще одного часа при комнатной температуре реакционный раствор отмывали. Затем сразу после внесения на планшет буфера для считывания Read Buffer Т (×4) (фирма Meso Scale Discovery) осуществляли измерения с использованием устройства SECTOR Imager 2400 (фирма Meso Scale Discovery). Концентрацию растворимого человеческого рецептора IL-6 рассчитывали на основе ответа по калибровочной кривой с использованием аналитического программного обеспечения, SOFTmax PRO (фирма Molecular Devices).
Обнаруженные изменения концентрации растворимого человеческого рецептора IL-6 в плазме трансгенных по человеческому FcRn мышей после внутривенного введения представлены на фиг. 1, 2 и 3. На фиг. 1 продемонстрирован эффект повышенной элиминации антигена, когда pI вариабельной области повышали в случае нативной константной области IgG1. На фиг. 2 продемонстрирован эффект повышенной элиминации антигена, когда pI вариабельной области повышали в антителе, для которого была подтверждена способность связываться с FcRn в условиях нейтрального рН (F939). На фиг. 3 продемонстрирован эффект повышенной элиминации антигена, когда pI вариабельной области повышали в антителе, FcγR-связывающая способность которого в условиях нейтрального рН была повышена (F1180).
Во всех случаях было продемонстрировано, что путем повышения pI антител можно повышать скорость элиминации антигена в случае антител с рН-зависимым связыванием. Продемонстрировано также, что путем дальнейшего повышения связывающей способности в отношении FcRn или FcγR в условиях нейтрального рН можно еще больше повышать скорость элиминации антигена по сравнению со случаем, когда повышают только pI у антител с рН-зависимым связыванием (сравнение фиг. 1 с фиг. 2 и 3).
(2-3) Инфузионный анализ in vivo антител с рI-регулируемым рН-зависимым связыванием с человеческим рецептором IL-6
Описанный ниже анализ in vivo осуществляли с использованием различных характеризующихся рН-зависимым связыванием с человеческим рецептором IL-6 антител, полученных в примере 1: Low_pI-IgG1, High_pI-IgG1, Low_pI-F11 и High_pI-F11.
Инфузионный осмотический мининасос (модель 2004; фирма Alzet), содержащий растворимый человеческий рецептор IL-6, имплантировали подкожно в спину трансгенных по человеческому FcRn мышей (B6.mFcRn-/-.hFcRn Tg-мыши линии 32+/+, фирма Jackson Laboratories; Methods Mol. Biol. 602, 2010, cc. 93-104), создавая модельных животных, у которых концентрация растворимого человеческого рецептора IL-6 в плазме поддерживалась на постоянном уровне. Модельным животным вводили антитела к человеческому рецептору IL-6 и после введения оценивали кинетику антител in vivo.
Более конкретно, моноклональное антитело к мышиному CD4, полученное методом, известным в данной области, вводили однократно в дозе 20 мг/кг в хвостовую вену для подавления производства нейтрализующих антител к растворимому человеческому рецептору IL-6, которые могут продуцироваться самой мышью. Затем имплантировали подкожно в спину мыши инфузионный насос, содержащий растворимый человеческий рецептор IL-6 в концентрации 92,8 мкг/мл. Через три дня после имплантации инфузионного насоса в хвостовую вену вводили однократно антитела к человеческому рецептору IL-6 в дозе 1 мг/кг. Кровь брали у мышей через 15 мин, 7 ч, 1 день, 2 дня, 3 или 4 дня, 6 или 7 дней, 13 или 14 дней, 20 или 21 день и 27 или 28 дней после введения антител к человеческому рецептору IL-6. Собранную кровь сразу же центрифугировали при 15000 об/мин и 4°С в течение 15 мин для получения плазмы. Отделенную плазму хранили в морозильной камере при -20°С или ниже до осуществления измерений.
(2-4) Измерение концентрации hsIL-6R в плазме электрохемилюминисцентным методом
Концентрацию hsIL-6R в плазме мышей измеряли электрохемилюминисцентным методом. Образцы hsIL-6R, концентрацию которых доводили до 250, 125, 62,5, 31,25, 15,61, 7,81 или 3,90 пг/мл для построения калибровочной кривой, и анализируемые образцы плазмы мышей, разведенные в 50 раз или более, смешивали с моноклональным антителом к человеческому IL-6R (фирма R&D), меченным рутением с использованием сложного NHS-эфира с сульфо-меткой (фирма Meso Scale Discovery), биотинилированным антителом к человеческому IL-6R (фирма R&D) и тоцилизумабом и давали проходить реакции в течение ночи при 37°С. Конечную концентрацию тоцилизумаба доводили до 333 мкг/мл. Затем реакционные растворы вносили на покрытый стрептавидином планшет Gold Multi-ARRAY (фирма Meso Scale Discovery). После выдерживания в течение еще одного часа при комнатной температуре реакционный раствор отмывали. Затем сразу после внесения на планшет буфера для считывания (Read Buffer Т (×4)) (фирма Meso Scale Discovery) осуществляли измерения с использованием устройства SECTOR Imager 2400 (фирма Meso Scale Discovery). Концентрацию растворимого человеческого IL-6R-рецептора рассчитывали на основе ответа по калибровочной кривой с использованием аналитического программного обеспечения, SOFTmax PRO (фирма Molecular Devices).
Изменения измеренной концентрации человеческого рецептора IL-6 представлены на фиг. 4. Как и в случае антитела, Fc-область которого представляла Fc-область нативного IgG1 (High_pI-IgG1), в случае антитела, которое содержала новый вариант Fc-области с повышенной способностью к связыванию с FcRn в условиях нейтрального рН (High_pI-F11), концентрация растворимого человеческого рецептора IL-6 в плазме снижалась в случае введения антитела с высокой pI (которое обозначают также как «High_pI») по сравнению со случаем введения антитела с низкой pI (которое обозначают также как «Low_pI»).
Не вдаваясь в какую-либо конкретную теорию, результаты, полученные в этих экспериментах, можно объяснить также следующим образом: когда Fc-область вводимого антитела является такой же, что и у нативного антитела в IgG-типа, то считается, что поглощение клетками происходит в основном посредством неспецифического поглощения (пиноцитоз). Следовательно, поскольку клеточная мембрана является отрицательно заряженной, то чем выше pI вводимого комплекса антитело-антиген (т.е. когда заряд молекулы в целом становится более положительным), тем быстрее комплекс может достигать клеточной мембраны и тем легче может осуществляться неспецифическое поглощение. Когда антитело с повышенной pI образует комплекс с антигеном, то этот комплекс в целом характеризуется также повышенным pI по сравнению с комплексом, образованным исходным антителом и антигеном; следовательно, поглощение клетками может возрастать. Таким образом, путем повышения pI антитела, характеризующегося рН-зависимым связыванием с антигеном, можно еще более увеличивать скорость или уровень элиминации антигена из плазмы и поддерживать концентрацию антигена в плазме на более низком уровне.
В этих примерах повышение pI антитела осуществляли путем интродукции аминокислотных замен, которые снижали количество отрицательно заряженных аминокислот и/или увеличивали количество положительно заряженных аминокислот, которые могут экспонироваться на поверхности молекулы антитела в вариабельной области антитела. Специалистам в данной области должно быть очевидно, что эффекты, достигаемые при таком повышении pI, в основном (или практически) не зависят от типа антигена-мишени или аминокислотной последовательности, которую имеет антитело, но можно ожидать, что они должны зависеть от pI. Например, в WO 2007/114319 и WO 2009/041643 в общих чертах описаны следующие положения.
Поскольку молекулярная масса антитела IgG-типа достаточно велика, то его основной путь метаболизма не включает почечную экскрецию. Известно, что антитела IgG-типа, которые имеют Fc, обладают продолжительным временем полужизни, поскольку они подвергаются рециклингу благодаря «пути спасения» FcRn, экспрессируемого в клетках, включая эндотелиальные клетки кровеносных сосудов, и считается, что IgG метаболизируется в основном в эндотелиальных клетках. Более конкретно, считается, что IgG, которые неспецифически поглощаются эндотелиальными клетками, подвергаются рециклингу путем связывания с FcRn, а молекулы, которые не могут связываться с FcRn, метаболизируются. IgG, FcRn-связывающая способность которых снижена, обладают более коротким временем полужизни в крови и, наоборот, время полужизни в крови можно удлинять путем повышения их способности к связыванию с FcRn. Таким образом, в известных ранее методах контроля кинетических характеристик IgG в крови применяли модификацию Fc для изменения его способности к связыванию с FcRn; однако, в рабочих примерах в WO 2007/114319 (в основном касающихся методов замены аминокислот в FR-участке) и WO 2009/041643 (в основном касающейся методов замены аминокислот в CDR-участке) продемонстрировано, что вне зависимости от типа антигена-мишени путем модификации pI вариабельной области антитела можно контролировать его время полужизни в крови без модификации Fc. Считается, что скорость неспецифического поглощения антитела IgG-типа эндотелиальными клетками зависит от физико-химического кулоновского взаимодействия между отрицательно заряженной клеточной поверхностью и антителом IgG-типа. Следовательно, считается, что снижение (повышение) pI антитела IgG-типа и тем самым снижение (повышение) кулоновских взаимодействий снижает (повышает) его неспецифическое поглощение эндотелиальными клетками и, следовательно, снижает (повышает) его метаболизм в эндотелиальных клетках, позволяя тем самым контролировать фармакокинетические характеристики в плазме. Поскольку кулоновское взаимодействие между эндотелиальными клетками и отрицательным зарядом клеточной поверхности является физико-химическим взаимодействием, то считается, что это взаимодействие в основном не зависит от образующей антитело аминокислотной последовательности per se. Следовательно, методы контроля фармакокинетических характеристик в плазме, представленные в настоящем описании, применимы не только к конкретным антителам, но могут широко применяться к любому полипептиду, содержащему вариабельную область антитела. В настоящем описании снижение (повышение) кулоновских взаимодействий означает снижение (повышение) кулоновской силы, представляющей собой силу притяжения и/или повышение (снижение) кулоновской силы, представляющей собой силу отталкивания.
Аминокислотные замены для осуществления указанных выше целей, могут представлять собой одну аминокислотную замену или комбинацию нескольких аминокислотных замен. Некоторые варианты осуществления изобретения относятся к способу интродукции одной аминокислотной замены или комбинации нескольких аминокислотных замен в положении(ях), экспонированном(ых) на поверхности молекулы антитела. Альтернативно этому, несколько интродуцированных аминокислотных замен могут находиться конформационно близко друг к другу. При создании изобретения была выдвинута идея о том, что, например, при замене аминокислот, которые могут экспонироваться на поверхности молекулы антитела, на положительно заряженные аминокислоты (предпочтительно на аргинин или лизин) или при использовании уже существующих положительно заряженных аминокислот (предпочтительно аргинина или лизина), может оказаться предпочтительным дополнительно заменять одну или несколько аминокислот, конформационно близких к указанных аминокислотам (в некоторых случаях даже одну или несколько аминокислот, «погруженных» внутрь молекулы антитела), на положительно заряженные аминокислоты для создания в результате этого состояния с локально сгруппированными положительными зарядами, находящимися в конформационно близких положениях. В контексте настоящего описания определение «конформационно близкое(ие) положение(я)» не накладывает конкретных ограничений, но оно может, например, означать состояние, в котором одну аминокислотную замену или несколько аминокислотных замен интродуцируют в пределах 20 Ангстрем, предпочтительно в пределах 15 Ангстрем или более предпочтительно в пределах 10 Ангстрем друг от друга. Находятся ли представляющие интерес аминокислотные замены в положении, экспонированном на поверхности молекулы антитела, или находятся ли аминокислотные замены в проксимальных положениях, можно определять с помощью известных методов, таких как рентгеновская кристаллография.
Таким образом, учитывая, что pI представляет собой один индикатор, характеризующий общий заряд молекулы, и что заряды, погруженные внутрь молекулы антитела, и заряды, находящиеся на поверхности молекулы антитела, рассматриваются одинаково, при создании изобретения был сделан вывод о том, что путем создания молекулы антитела с широким и всесторонним учетом воздействий от всех зарядов, включая не только pI, но также и поверхностные заряды и локальную кластеризацию зарядов молекул антител, можно дополнительно увеличивать скорость элиминации антигена из плазмы и поддерживать концентрацию антигена в плазме на даже еще более низких уровнях.
Рецепторы, такие как FcRn или FcγR, экспрессируются на клеточной мембране, и считается, что антитела с повышенной аффинностью к FcRn или FcγR в условиях нейтрального рН поглощаются клетками в основном посредством этих Fc-рецепторов. Поскольку клеточная мембрана заряжена отрицательно, то вводимый комплекс антитело-антиген достигает клеточной мембраны быстрее, когда его pI высока (когда заряд молекулы в целом сдвинут в сторону более положительных значений), и поглощение посредством Fc-рецептора может происходить более легко. Следовательно, антитела, которые имеют повышенную аффинность к FcRn или FcγR в условиях нейтрального рН, а также повышенную pI, характеризуются повышенным поглощением клетками посредством Fc-рецепторов, когда они образуют комплекс с антигенами. Следовательно, скорость элиминации антигенов из плазмы с помощью антител, которые связываются с антигенами рН-зависимым образом и обладают повышенной аффинностью к FcRn или FcγR в условиях нейтрального рН, можно повышать путем увеличения их pI и можно поддерживать концентрацию антигена в плазме на более низких уровнях.
Пример 3
Оценка способности антител с рН-зависимым связыванием, имеющих повышенные pI, к связыванию с внеклеточным матриксом
(3-1) Оценка способности к связыванию с внеклеточным матриксом
Следующий эксперимент осуществляли для оценки воздействий придания антителам рН-зависимого антигенсвязывающего свойства и дополнительной модификации pI на их способность к связыванию внеклеточного матрикса.
С помощью метода, сходного с методом, описанным в примере 1, получали три типа антител с различными pI в качестве антител, характеризующихся рН-зависимым связыванием с рецептором IL-6: Low_pI-IgG1, Middle_pI-IgG1 и High_pI-IgG1. В качестве канонических антител, не обладающих рН-зависимым связыванием с рецептором IL-6, с помощью метода, описанного в примере 2, получали Low_pI(NPH)-IgG1, содержащее Н54 (SEQ ID NO: 34) и L28 (SEQ ID NO: 35), и High_pI(NPH)-IgG1, содержащее H(WT) (SEQ ID NO: 36) и L(WT) (SEQ ID NO: 37) соответственно, описанные в WO 2009/125825,.
Для этих антител рассчитывали методом, сходным с методом, описанным в примере 1, теоретическую величину pI, результаты представлены в таблице 4. Продемонстрировано также, что антитела, не обладающие рН-зависимым связыванием с рецептором IL-6, характеризовались повышенным сходством величин pI с антителами, которые обладали рН-зависимым связыванием.
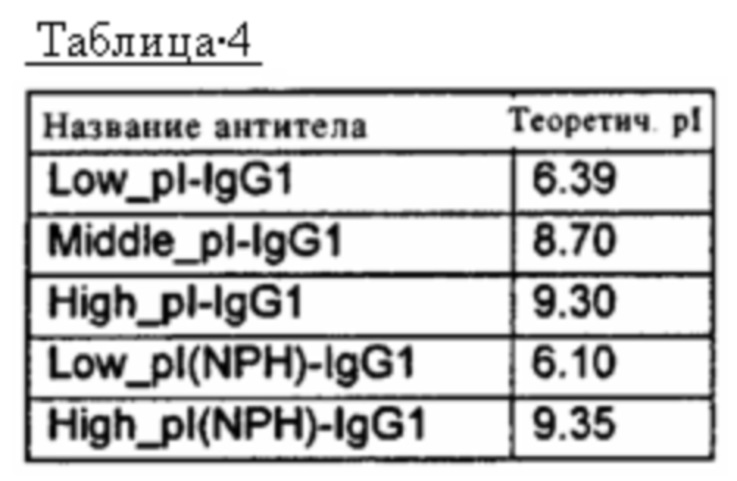
(3-2) Оценка связывания антител с внеклеточным матриксом электрохемилюминисцентным (ECL) методом
Внеклеточный матрикс (матрикс на основе базальной мембраны клеток, BD Matrigel Basement Membrane Matrix; производство фирмы BD) разводили до концентрации 2 мг/мл с использованием TBS (фирма Takara). Разведенный внеклеточный матрикс вносили на 96-луночный планшет MULTI-ARRAY, High bind, Bare (производство фирмы Meso Scale Discovery:MSD) из расчета 5 мкл на лунку и иммобилизовали в течение ночи при 4°С. Затем на планшет вносили 20 мМ ACES-буфер, рН 7,4, содержащий 150 мМ NaCl, 0,05% Твин 20, 0,5% БСА и 0,01% NaN3, для блокирования. Предназначенные для оценки антитела разводили до концентрации 30, 10 и 3 мкг/мл с использованием 20 мМ ACES-буфера, рН 7,4 (ACES-T-буфер), содержащего 150 мМ NaCl, 0.05% Твин 20 и 0.01% NaN3, и затем дополнительно разводили с использованием 20 мМ буфер-буфера, рН 7,4, содержащего 150 мМ NaCl, 0,01% Твин 20, 0,1% БСА и 0,01% NaN3 (буфер для разведения) до достижения конечной концентрации 10, 3,3 и 1 мкг/мл соответственно. Разведенные растворы антитела добавляли на планшет, из которого был удален блокирующий раствор, и планшет встряхивали при комнатной температуре в течение 1 ч. Растворы антител удаляли, добавляли ACES-T-буфер, содержащий 0,25% глутарового альдегида, и затем давали выстаиваться в течение 10 мин, планшет промывали D-ЗФР (производство фирмы Wako Pure Chemical Industries), содержащим 0,05% Твин 20. Антитела для ECL-обнаружения получали путем конъюгирования с сульфо-меткой козьего античеловеческого IgG (гамма) (производство фирмы Zymed Laboratories) с использованием сложного NHS-эфира с сульфо-меткой (производство фирмы MSD). Антитела для обнаружения разводили в буфере для разведения до концентрации 1 мкг/мл, добавляли на планшет и затем встряхивали в темноте при комнатной температуре в течение 1 ч. Антитела для обнаружения удаляли и добавляли 2-кратно разведенный раствор, полученный путем разведения буфера для считывания MSD Read Buffer Т (4×) (производство фирмы MSD) ультрачистой водой; и затем измеряли уровень люминесценции с помощью устройства SECTOR Imager 2400 (производство фирмы MSD).
Результаты представлены на фиг. 5. Установлено, что и для антител, характеризующихся рН-зависимым связыванием, и для антител, которые не характеризовались рН-зависимым связыванием, связывание с внеклеточным матриксом повышалось при увеличении их pI. Кроме того, неожиданно было установлено, что воздействие на повышение связывания с внеклеточным матриксом при увеличении pI оказалось значимым для антител, обладающих рН-зависимым связыванием с антигеном. Другими словами, было установлено, что антитело, связывание которого с антигеном зависит от рН, и которое имеет высокую pI (High_pI-IgG1), обладает более высокой аффинностью к внеклеточному матриксу.
Не вдаваясь в какую-либо конкретную теорию, результаты, полученные в этих экспериментах, можно объяснить также следующим образом. Известно, что интродукция гистидиновых модификаций в вариабельную область антитела является одним из методов придания антителу рН-зависимого антигенсвязывающего свойства (см., например, WO 2009/125825). Гистидин несет имидазоильную группу на своей боковой цепи и является незаряженным в условиях от нейтрального рН до основного рН, но известно, что он является положительно заряженным в условиях кислого рН. Учитывая это свойство гистидина, можно путем интродукции гистидина в вариабельную область антитела, прежде всего в CDR, расположенный(ые) вблизи сайта взаимодействия с антигеном, изменять заряд и конформацию в области взаимодействия с антигеном при переходе от условий нейтрального к условиям кислого рН. Можно ожидать, что такие антитела должны обладать аффинностью к антигену, которая изменяется рН-зависимым образом. Специалистам в данной области должно быть очевидно, что эффекты, полученные в результате такой(их) интродукции(й) гистидина в основном (или практически) не зависит от типа антигена-мишени или аминокислотной последовательности, которую имеет антитело, но зависит от сайта интродукции гистидина или количества интродуцированных остатков гистидина.
В WO 2009/041643 в целом описаны следующие положения: белок-белковые взаимодействия включают гидрофобные взаимодействия, электростатические взаимодействия и водородные связи, и силу такого связывания, как правило, можно характеризовать с использованием константы связывания (аффинность) или кажущейся константы связывания (авидность). рН-зависимое связывание, когда сила связывания изменяется при переходе от условий нейтрального рН (например, рН 7,4) к условиям кислого рН (например, рН 5,5-6,0), зависит от встречающихся в естественных условиях белок-белковых взаимодействий. Например, указанное выше связывание между молекулой IgG и FcRn, который, как известно, является рецептором спасения для молекулы IgG, является сильным в условиях кислого рН и очень слабым в условиях нейтрального рН. Остатки гистидина участвуют во многих белок-белковых взаимодействиях, которые изменяются рН-зависимым образом. Поскольку величина pKa остатка гистидина близка к 6,0-6,5, то состояние протонной диссоциации в остатке гистидина изменяется при переходе между условиями с нейтральным и кислым рН. Более конкретно, остаток гистидина является незаряженным и нейтральным в условиях нейтрального рН и функционирует в качестве акцептора атома водорода; в то время как в условиях кислого рН он является положительно заряженным и функционирует в качестве донора атома водорода. Опубликованы данные о том, что и в случае описанного выше взаимодействия молекула IgG-FcRn остатки гистидина, присутствующие на молекуле IgG, участвуют в рН-зависимом связывании (Martin и др., Mol. Cell. 7(4), 2001, сс. 867-877).
Следовательно, замена остатком гистидина аминокислотного остатка, участвующего в белок-белковом взаимодействии, или интродукция гистидина в сайт взаимодействия, может придавать рН-зависимость белок-белковым взаимодействиям. Аналогичные меры предпринимались в случае белок-белковых взаимодействий между антителом и антигеном; и путем интродукции гистидина в последовательность CDR антитела к лизоциму белка куриного яйца было успешно получено мутантное антитело с пониженной аффинностью к антигену в условиях кислого рН (Ito и др., FEBS Lett. 309(1), 1992, сс. 85-88). Кроме того, опубликованы данные об антителах, которые специфически связываются с антигенами при низком рН в раковых тканях и слабо связываются с соответствующим антигеном в условиях нейтрального рН вследствие интродукции гистидина в последовательность CDR (WO 2003/105757).
При этом, аминокислотный остаток, который интродуцируют для повышения pI, предпочтительно представляет собой лизин, аргинин или гистидин, которые имеют положительно заряженные боковые цепи. Стандартная величина pKa для боковых цепей этих аминокислот составляет: 10,5 для лизина, 12,5 для аргинина и 6,0 для гистидина (Skoog и др., Trends Anal. Chem. 5(4), 1986, сс. 82-83). Как следует из теории кислотно-щелочного баланса, эти величины pKa означают, что в растворе с рН 10,5, 50% боковых цепей лизина являются положительно заряженными, а остальные 50% являются незаряженными. При увеличении рН раствора доля положительно заряженных боковых цепей лизина снижается и в растворе с рН 11,5, которое на 1 единицу рН выше, чем величина pKa лизина, доля положительно заряженных боковых цепей становится равной примерно 9%. С другой стороны, при снижении рН раствора доля положительно заряженных боковых цепей возрастает и в растворе с рН 9,5, которое на 1 единицу рН ниже, чем величина pKa лизина, доля положительно заряженных боковых цепей становится равной примерно 91%. Эта теория работает аналогичным образом и в случае аргинина и гистидина. Более конкретно, в растворе при нейтральном рН (например, рН 7,0) почти 100% лизина или аргинина положительно заряжены, в то время как для гистидина доля положительно заряженных остатков составляет примерно 9%. Следовательно, хотя гистидин является положительно заряженным в условиях нейтрального рН, но поскольку этот уровень низок по сравнению с уровнем лизина или аргинина, лизин и аргинин считаются более предпочтительными аминокислотами для интродукции с целью повышения pI. Кроме того, согласно Holash и др. (Ргос. Natl. Acad. Sci. 99(17), 2002, сс. 11393-11398), хотя интродукция модификаций, которые повышают pI, считается эффективной с точки зрения модификаций, усиливающих связывание внеклеточного матрикса, замены, интродуцирующие лизин или аргинин, рассматриваются по указанным выше причинам как более предпочтительные аминокислотные модификации по сравнению с заменами, интродуцирующими гистидин.
Как впервые установлено при создании изобретения, оказалось возможным обеспечить неожиданное синергетическое повышение аффинности антитела к внеклеточному матриксу путем объединения интродукции гистидина для придания рН-зависимого антигенсвязывающего свойства с приводящей к повышению pI модификацией антитела. Фактически, в то время как pI High_pI-IgG1 составляла 9,30, pI High_pI(NPH)-IgG1 составляла 9,35 и, следовательно, указанная величина для High_pI-IgG1 была немного меньше. Тем не менее, фактическая аффинность High_pI-IgG1 к внеклеточному матриксу была заметно более высокой. Это свидетельствует о том, что аффинность к внеклеточному матриксу не обязательно может объясняться только уровнем pI, и можно утверждать, что этот факт свидетельствует о синергетическом эффекте, обусловленном интродукцией комбинации повышающих pI модификаций и гистидиновых модификаций. Этот результат представляет собой феномен, который является удивительным и неожиданным.
Однако следует отметить, что поскольку на pKa боковых цепей аминокислот в белке большое влияние оказывают окружающие условия, они не всегда совпадают с указанными выше теоретическими величинами pKa. Более конкретно, представленное выше описание основано на общей научной теории; однако можно легко продемонстрировать, что для реальных белков могут иметь место многочисленные исключения. Например, у Hayes и др., J. Biol. Chem. 250(18), 1975, сс. 7461-7472 указано, что когда pKa гистидина, содержащегося в миоглобине, определяли экспериментально, то, хотя полученные величины находились около среднего значения (были центрированы) 6,0, они варьировались от 5,37 до 8,05. Естественно, гистидин, который имеет высокую величину pKa, должен быть в основном положительно заряженным в условиях нейтрального рН. Таким образом, упомянутая выше теория не отрицает повышающего pI воздействия интродукции гистидина также и в случае реальной трехмерной структуры белка. Имеется достаточно оснований предполагать, что аминокислотная модификация, заключающаяся в интродукции гистидина, также, как это продемонстрировано в случае лизина или аргинина, может оказывать повышающее pI воздействие.
Пример 4
Повышение pI путем одной аминокислотной замены в константной области
Известны методы повышения pI антитела, которое связывается с антигеном рН-зависимым образом, путем интродукции аминокислотных замен в вариабельную область антитела. Кроме того, можно осуществлять повышение pI антитела также путем осуществления только одной аминокислотной замены в константной области антитела.
На метод добавления одной аминокислотной замены в константную область антитела для повышения pI не накладываются конкретные ограничения, например, его можно осуществлять согласно методу, описанному в WO 2014/145159. Как и в случае вариабельной области, аминокислотные замены, интродуцируемые в константную область, предпочтительно представляют собой замены, которые снижают количество отрицательно заряженных аминокислот (таких как аспарагиновая кислота или глутаминовая кислота) при увеличении количества положительно заряженных аминокислот (таких как аргинин или лизин).
Положения для интродукции аминокислотных замен в константные области предпочтительно представляют собой (но не ограничиваясь только ими) положения, в которых аминокислотные боковые цепи могут экспонироваться на поверхности молекулы антитела. Предпочтительные примеры включают метод интродукции комбинации нескольких аминокислотных замен в такие положения, в которых они могут экспонироваться на поверхности молекулы антитела. Альтернативно этому несколько интродуцированных аминокислотных замен предпочтительно располагать так, чтобы они находились в конформационной близости друг к другу. Кроме того, несколько интродуцированных аминокислотных замен предпочтительно представляют собой (но не ограничиваясь только ими) замены на положительно заряженные аминокислоты, что в определенных случаях приводит к состоянию, в котором несколько положительных зарядов находятся в конформационно близких положениях. В контексте настоящего описания определение «конформационно близкое положение» не накладывает конкретных ограничений, но оно может, например, означать состояние, в котором одну аминокислотную замену или несколько аминокислотных замен интродуцируют в пределах 20 Ангстрем, предпочтительно в пределах 15 Ангстрем или более предпочтительно в пределах 10 Ангстрем друг от друга. Находятся ли представляющие интерес аминокислотные замены в положении, экспонированном на поверхности молекулы антитела, или находится ли несколько аминокислотных замен в проксимальных положениях, можно определять с помощью известных методов, таких как рентгеновская кристаллография.
Кроме того, метод получения нескольких положительных зарядов в конформационно близких положениях включает, в добавление к вышеуказанным методам метод применения аминокислот, которые исходно имеют положительные заряды, в константной области IgG. Примеры таких положительно заряженных аминокислотных положений включают (а) аргинин в положении 255, 292, 301, 344, 355 или 416 согласно EU нумерации; и (б) лизин в положении 121, 133, 147, 205, 210, 213, 214, 218, 222, 246, 248, 274, 288, 290, 317, 320, 322, 326, 334, 338, 340, 360, 370, 392, 409, 414 или 439 согласно EU нумерации. Путем осуществления замен на положительно заряженную аминокислоту в положении, конформационно близком к указанным положительно заряженным аминокислотам, можно получать несколько положительных зарядов в конформационно близких положениях.
(4-1) Получение рН-зависимых IgE-связывающих антител
С помощью метода, описанного в референс-примере 2, получали представленные ниже три антитела в качестве рН-зависимых антител к человеческому IgE: (1) Ab1, которое представляет собой каноническое антитело, содержащее Ab1H (SEQ ID NO: 38) в качестве тяжелой цепи и Ab1L (SEQ ID NO: 39) в качестве легкой цепи; (2) Ab2, которое представляет собой каноническое антитело, содержащее Ab2H (SEQ ID NO: 40) в качестве тяжелой цепи и Ab2L (SEQ ID NO: 41) в качестве легкой цепи; и (3) Ab3, которое представляет собой каноническое антитело, содержащее Ab3H (SEQ ID NO: 42) в качестве тяжелой цепи и Ab3L (SEQ ID NO: 43) в качестве легкой цепи.
(4-2) Оценка зависимости связывания с человеческим IgE от рН
Аффинность Ab1 к человеческому IgE при рН 7,4 и рН 5,8 оценивали следующим образом. Кинетические анализы для человеческого IgE и Ab1 осуществляли с использованием устройства BIACORE Т100 (фирма GE Healthcare). Измерения осуществляли с использованием в качестве подвижного буфера двух следующих буферов: (1) 1,2 мМ CaCl2/0,05% Твин 20, 20 мМ ACES, 150 мМ NaCl, рН 7,4; и (2) 1,2 мМ CaCl2/0,05% Твин 20, 20 мМ ACES, 150 мМ NaCl, рН 5,8.
Белок A/G (фирма ACTIGEN) в соответствующем количество фиксировали на сенсорном чипе СМ4 (фирма GE Healthcare) с помощью метода аминного сочетания для захвата представляющих интерес антител. Затем осуществляли взаимодействие человеческого IgE с антителами, захваченными на сенсорном чипе, путем инъекции разведенного раствора IgE и подвижного буфера (который применяли в качестве референс-раствора). В качестве подвижного буфера применяли один из указанных выше буферов (1) и (2) и человеческий IgE разводили соответствующим буфером. Для регенерации сенсорного чипа применяли 10 мМ глицин-HCl при рН 1,5. Все измерения осуществляли при 25°С. KD (М) для человеческого IgE рассчитывали для каждого антитела на основе константы скорости реакции ассоциации ka (1/Мс) и константы скорости реакции диссоциации kd (1/с), которые представляют собой кинетические параметры, рассчитанные на основе сенсограмм, полученных при измерениях. Для расчета каждого параметра применяли программное обеспечение BIACORE Т100 Evaluation (фирма GE Healthcare).
Аффинность Ab2 и Ab3 к человеческому IgE при рН 7,4 и рН 5,8 оценивали следующим образом. Связывающую активность (константа диссоциации KD (М)) антител к hIgE в отношении hIgE оценивали с использованием устройства BIACORE Т200 (фирма GE Healthcare). Измерения осуществляли с использованием в качестве подвижных буферов указанных ниже двух буферов: (1) 1,2 мМ CaCl2/0,05% Твин 20, 20 мМ ACES, 150 мМ NaCl, рН 7,4; и (2) 1,2 мМ CaCl2/0,05% Твин 20, 20 мМ ACES, 150 мМ NaCl, рН 5,8.
Соответствующее количество пептида, полученного путем добавления биотина к Lys, присутствующему на С-конце синтезированного химическим путем человеческого глипикана 3 (a.k.a., GPC3), полученного из белка пептида (имеющего аминокислотную последовательность (VDDAPGNSQQATPKDNEISTFHNLGNVHSPLK (SEQ ID NO: 44)) («биотинилированный пептид GPC3»), добавляли на сенсорный чип SA (фирма GE Healthcare) и иммобилизовали на чипе, используя аффинность между стрептавидином и биотином. Инъецировали в соответствующей концентрации hIgE и иммобилизовали на чипе путем захвата биотинилированным пептидом GPC3. В качестве аналита инъецировали в соответствующей концентрации антитело к hIgE и давали взаимодействовать с hIgE на сенсорном чипе. Затем для регенерации сенсорного чипа инъецировали 10 мМ глицин-HCl с рН 1,5. Все измерения проводили при 37°С. Константы скорости реакции ассоциации (1/Мс) и константы скорости реакции диссоциации kd (1/с) рассчитывали на основе анализа результатов измерений путем аппроксимации кривой с помощью программного обеспечения BIACORE Т200 Evaluation (фирма GE Healthcare) и на основе этих величин рассчитывали константы диссоциации KD (М).
Результаты представлены в таблице 5. Для всех антител, т.е. Ab1, Ab2 и Ab3, выявлено рН-зависимое связывание с человеческим IgE и продемонстрировано, что их аффинность в условиях кислого рН (рН 5,8) была резко снижена по сравнению с их аффинностью в условиях нейтрального рН (рН 7,4). Следовательно, можно ожидать, что введение этих антител живому животному будет оказывать ускоряющее воздействие на элиминацию человеческого IgE, являющегося антигеном.

Теоретические величины pI (pI) для Ab1-Ab3, рассчитанные методом, сходным с методом, описанным в примере 1, представлены в таблице 6.
(4-3) Получение антител с повышенной pI путем одной аминокислотной модификации в константной области
Ab1, полученное в примере (4-1), представляет собой антитело, содержащее в качестве константной области константную область нативного человеческого IgG1. Ab1H-Р600 получали путем модификации Fc-области Ab1H, представляющей собой тяжелую цепь Ab1, которая заключалась в замене пролина в положении 238 согласно EU-нумерации на аспарагиновую кислоту и замене серина в положении 298 согласно EU-нумерации на аланин. Кроме того, получали различные Fc-варианты с помощью метода, описанного в референс-примере 2, путем интродукции в Fc-область Ab1H-Р600 различных одиночных аминокислотных замен, указанных в таблицах 7-1 и 7-2 соответственно. Для всех Fc-вариантов в качестве легкой цепи использовали Ab1L (SEQ ID NO: 39). Аффинность указанных антител в отношении hFcγRII2b была сопоставимой с аффинностью варианта Р600 (данные не представлены).
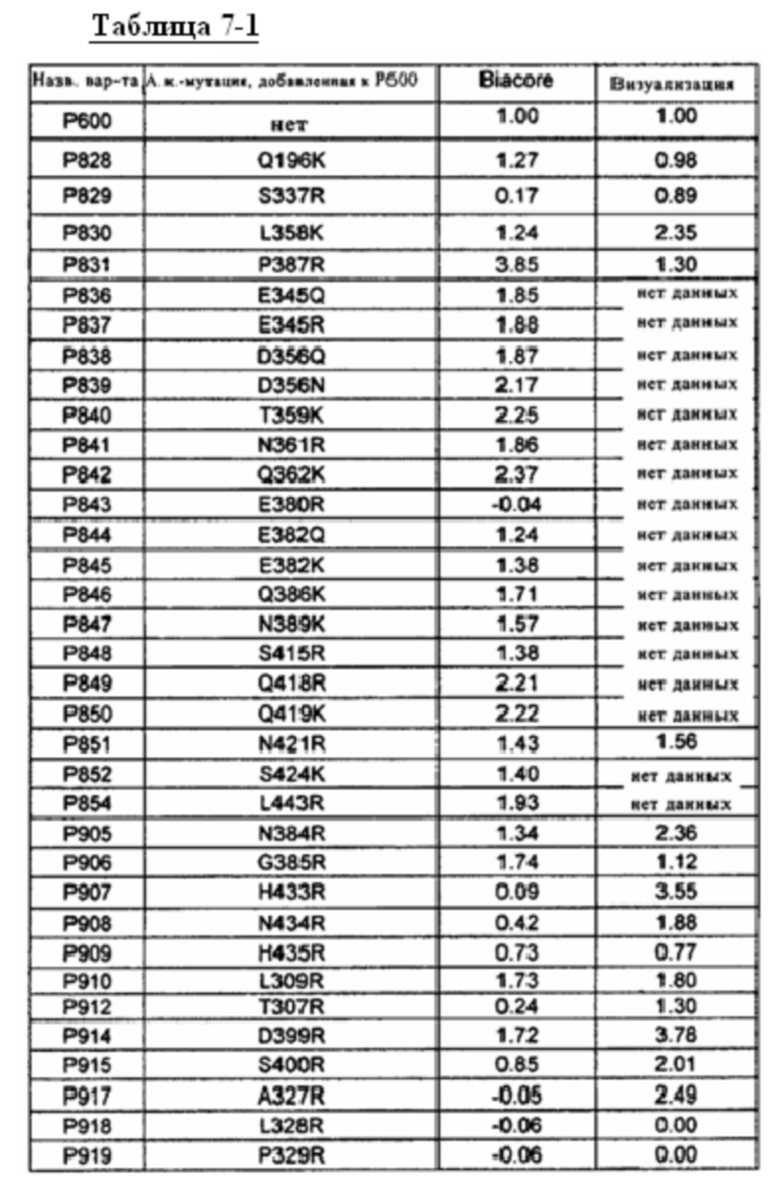
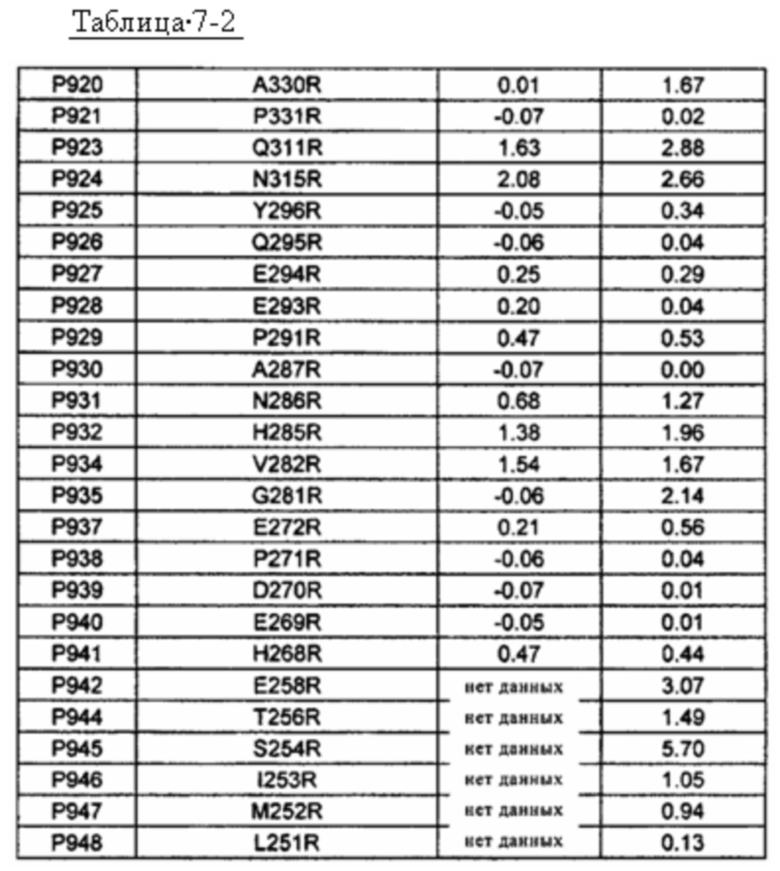
(4-4) Анализ связывания человеческого FcγRIIb методом BIACORE с использованием новых содержащих варианты Fc-области антител
Анализы связывания содержащего вариант Fc-области антитела с растворимым человеческим FcγRIIb (обозначаемый также как «hFcγRIIb») и комплексами антиген-антитело осуществляли с помощью устройства BIACORE® Т200 (фирма GE Healthcare). Растворимый hFcγRIIb получали в форме меченной His молекулы с помощью методов, известных в данной области. Антитело к His в соответствующем количестве фиксировали на сенсорном чипе СМ5 (фирма GE Healthcare) с помощью метода аминного сочетания с использованием набора для захвата His (фирма GE Healthcare) для захвата hFcγRIIb. Затем инъецировали комплекс антитело-антиген и подвижный буфер (в качестве референс-раствора) и давали осуществляться взаимодействию с hFcγRIIb, захваченным на сенсорном чипе. В качестве подвижного буфера использовали 20 мМ N-(2-ацетамидо)-2-аминоэтансульфоновую кислоту, 150 мМ NaCl, 1,2 мМ CaCl2 и 0,05% (масс./об.) Твин 20 с рН 7,4, и соответствующий буфер использовали также для разведения растворимого hFcγRIIb. Для регенерации сенсорного чипа использовали 10 мМ глицин-HCl с рН 1,5. Все измерения осуществляли при 25°С. Анализ проводили на основе связывания (RU), рассчитанного с использованием сенсограмм, полученных при измерениях, и получали относительные величины, принимая уровень связывания Р600 за 1,00. Для расчета параметров применяли программное обеспечение BIACORE® Т100 Evaluation (фирма GE Healthcare). Результаты представлены в таблицах 7-1 и 7-2 (см. колонку, озаглавленную «BIACORE» в таблицах) и на фиг. 6. Продемонстрировано, что несколько Fc-вариантов обладали повышенной аффинностью в отношении hFcγRIIb, фиксированного на сенсорном чипе BIACORE®.
Не вдаваясь в какую-либо конкретную теорию, этот результат можно объяснить следующим образом. Известно, что сенсорный чип BIACORE® является отрицательно заряженным, и это заряженное состояние можно рассматривать как напоминающее поверхность клеточной мембраны. Более конкретно, можно предполагать, что связывание комплекса антиген-антитело с hFcγRIIb, фиксированным на отрицательно заряженном сенсорном чипе BIACORE, напоминает то, которое имеет место при связывании комплекса антиген-антитело с hFcγRIIb, присутствующим на отрицательно заряженной поверхности клеточной мембраны.
Антитела, полученные путем интродукции повышающей pI модификации в Fc-область, представляют собой антитела, в которых заряд Fc-области (константная область) представляет собой больший по величине положительный заряд по сравнению с зарядом до интродукции модификации. Следовательно, можно считать, что кулоновское взаимодействие между Fc-областью (положительный заряд) и поверхностью сенсорного чипа (отрицательный заряд) должно усиливаться в результате повышающей pI аминокислотной модификации. Кроме того, следует ожидать, что такие эффекты должны иметь место также и на отрицательно заряженной поверхности клеточной мембраны; следовательно, можно ожидать также, что они будут оказывать ускоряющее действие на скорость или уровень поглощения клетками in vivo.
Представленные выше результаты показывают, что отношение уровня связывания варианта с hFcγRIIb к уровню связывания Ab1H-Р600 с hFcγRIIb, составляющее примерно 1,2 или более, свидетельствует о сильном воздействии заряда на связывание антитела с hFcγRIIb на сенсорном чипе. Таким образом, модификация, которая, как ожидается, обеспечивает воздействие заряда, представляет собой, например, модификацию в положении 196, 282, 285, 309, 311, 315, 345, 356, 358, 359, 361, 362, 382, 384, 385, 386, 387, 389, 399, 415, 418, 419, 421, 424 или 443 согласно EU-нумерации. Предпочтительной является модификация в положении 282, 309, 311, 315, 345, 356, 359, 361, 362, 385, 386, 387, 389, 399, 418, 419 или 443. Аминокислотная замена интродуцированная в такое положение, предпочтительно представляет собой замену на аргинин или лизин. Другим примером положения аминокислотной мутации, в котором можно ожидать такого обусловленного зарядом эффекта, может служить глутаминовая кислота в положении 430 согласно EU-нумерации. Предпочтительная аминокислотная замена, которую следует интродуцировать в положение 430, представляет собой замену на аргинин или лизин, который является положительно заряженным, или, среди незаряженных остатков, предпочтительно замену на глицин или треонин.
(4-5) Поглощение содержащих вариант Fc-области антител экспрессирующими hFcγRIIb клетками
Для оценки уровня внутриклеточного поглощения экспрессирующей hFcγRIIb клеточной линией осуществляли представленный ниже анализ с использованием содержащих новый вариант Fc-области антител.
Линию клеток MDCK (линия клеток почек собак Madin-Darby), конститутивно экспрессирующих hFcγRIIb, получали с помощью известных методов. С использованием этих клеток оценивали внутриклеточное поглощение комплексов антиген-антитело. Более конкретно, для мечения человеческого IgE (антиген) использовали pHrodoRed (фирма Life Technlogies) согласно утвержденному протоколу и получали комплексы антиген-антитело в растворе культуры с концентрацией антитела 10,8 мг/мл и концентрацией антигена 12,5 мг/мл. Раствор культуры, содержащий комплексы антиген-антитело, добавляли в культуральные планшеты к указанным выше клеткам MDCK, которые конститутивно экспрессируют hFcγRIIb, и инкубировали в течение 1 ч, и затем количественно определяли интенсивность флуоресценции от антигена, поглощенного клетками, с использованием анализатора InCell 6000 (фирма GE healthcare). Количество поглощенного антигена представляли в виде относительных величин в сравнении с величиной для Р600, которую принимали за 1,00.
Результаты представлены в таблицах 7-1 и 7-2 (см. колонку, озаглавленную «визуализация» в таблицах) и на фиг. 7. Для нескольких Fc-вариантов был выявлен высокий уровень флуоресценции от антигена в клетках.
Не вдаваясь в какую-либо конкретную теорию, этот результат можно объяснить следующим образом: антиген и антитело, добавленные в раствор клеточной культуры, образуют комплексы антиген-антитело в растворе культуры. Комплексы антиген-антитело связываются с hFcγRIIb, экспрессируемым на клеточной мембране посредством Fc-области антитела и поглощаются клетками зависящим от рецептора путем. Ab1, применяемое в этом эксперименте, представляло собой антитело, которое связывается с антигеном рН-зависимым образом; следовательно антитело может отделяться в результате диссоциации от антигена. Поскольку диссоциированный антиген является меченным pHrodoRed, как описано выше, он флуоресцирует в эндосомах. Таким образом, следует считать, что большая интенсивность флуоресценции внутри клетки по сравнению с контролем свидетельствует о том, что поглощение комплексов антиген-антитело клетками происходит более быстро и более часто.
В данном случае указанное выше отношение интенсивности флуоресценции от поглощенного клетками антигена в комплексе с вариантами к интенсивности флуоресценции от Ab1H-Р600, составляющее примерно 1,05 или более рассматривали как свидетельство наличия воздействия заряда на поглощение антигена клетками. Отношение интенсивности флуоресценции от поглощенного клетками антигена в комплексе с вариантами к интенсивности флуоресценции от Ab1H-Р600, составляющее примерно 1,5 или более, рассматривали как свидетельство наличия сильного воздействия заряда на поглощение антигена клетками. Таким образом, представленные выше результаты демонстрируют, что путем интродукции приводящей к повышению pI модификации в соответствующее положение в Fc-области, можно ускорять поглощение клетками по сравнению с поглощением до интродукции модификации.
Аминокислотная модификация, которая обеспечивает такое воздействие, представляет собой, например, модификацию в положении 253, 254, 256, 258, 281, 282, 285, 286, 307, 309, 311, 315, 327, 330, 358, 384, 385, 387, 399, 400, 421, 433 или 434, согласно EU-нумерации. Предпочтительно модификация имеет место в положении 254, 258, 281, 282, 285, 309, 311, 315, 327, 330, 358, 384, 399, 400, 421, 433 или 434, согласно EU-нумерации. Аминокислотная замена, интродуцированная в такое положение, предпочтительно представляет собой замену на аргинин или лизин. Положение, в которое интродуцируют аминокислотную замену в константную область с целью повышения pI антитела, может представлять собой (но не ограничиваясь только им), например, аминокислотный остаток в положении 285 согласно EU-нумерации. Альтернативным примером может являться аминокислотная замена аминокислотного остатка в положении 399 согласно EU-нумерации.
Пример 5
Получение Fc-вариантов с повышенным связыванием с FcRn в условиях кислого рН для увеличения времени удерживания в плазме
Известно, что в условиях кислого рН в эндосомах антитела IgG-типа, поглощенные клетками, возвращаются в плазму посредством связывания с FcRn. Таким образом, антитела IgG-типа, как правило, обладают продолжительным временем полужизни в плазме по сравнению с белками, которые не связываются с FcRn. Известны методы, в которых это свойство увеличения времени удерживания антител в плазме путем повышения их аффинности к FcRn в условиях кислого рН реализуют посредством интродукции аминокислотных модификаций в Fc-область антитела. Более конкретно, известны методы увеличения времени удерживания антител в плазме путем повышения их аффинности к FcRn в условиях кислого рН посредством аминокислотных модификаций, таких как модификация M252Y/S254T/T256E (YTE) (Dall'Acqua и др., J. Biol. Chem. 281, 2006, сс. 23514-23524), модификация M428L/N434S (LS) (Zalevsky и др., Nat. Biotechnol. 28, 2010, сс. 157-159) и модификация N434H (Zheng и др., Clinical Pharmacology & Therapeutics 89(2), 2011, сс. 283-290).
С другой стороны, как указано выше, известно также, что Fc-варианты с повышенной аффинностью к FcRn в условиях кислого рН характеризуются нежелательной аффинностью к ревматоидному фактору (RF) (WO 2013/046704).
Поэтому осуществляли представленные ниже исследования с целью получения Fc-вариантов, позволяющих повышать время удерживания в плазме, которые обладают пониженной способностью к связыванию или не обладают способностью к связыванию с ревматоидным фактором.
(5-1) Получение антител, содержащих новый вариант Fc-области
Согласно описанному ниже методу получали Fc-варианты с повышенной аффинностью к FcRn в условиях кислого рН, такие как варианты, содержащие известные модификации: YTE, LS или N434H, и несколько новых Fc-вариантов (F1847m, F1848m, F1886m, F1889m, F1927m и F1168m).
Последовательности, кодирующие тяжелые цепи, в которые интродуцировали аминокислотные модификации в Fc-область тяжелой цепи (VH3-IgG1m) Fv4-IgG1, представляющего собой антитело к человеческому рецептору IL-6, получали с помощью метода, описанного в референс-примере 1. Эти тяжелые цепи использовали для получения указанных ниже антител с помощью метода, описанного в референс-примере 2: (a) Fv4-IgG1, содержащего VH3-IgG1m (SEQ ID NO: 46) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (б) Fv4-YTE, содержащего VH3-YTE (SEQ ID NO: 47) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (в) Fv4-LS, содержащего VH3-LS (SEQ ID NO: 48) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (г) Fv4-N434H, содержащего VH3-N434H (SEQ ID NO: 49) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (д) Fv4-F1847m, содержащего VH3-F1847m (SEQ ID NO: 50) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (е) Fv4-F1848m, содержащего VH3-F1848m (SEQ ID NO: 51) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (ж) Fv4-F1886m, содержащего VH3-F1886m (SEQ ID NO: 52) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (з) Fv4-F1889m, содержащего VH3-F1889m (SEQ ID NO: 53) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; (и) Fv4-F1927m, содержащего VH3-F1927m (SEQ ID NO: 54) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; и (к) Fv4-F1168m, содержащего VH3-F1168m (SEQ ID NO: 55) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи.
(5-2) Кинетический анализ связывания с человеческим FcRn
Антитела, содержащие VH3-IgG1m или указанный выше вариант в качестве тяжелой цепи и L(WT) (SEQ ID NO: 37) в качестве легкой цепи, получали с помощью метода, описанного в референс-примере 2, и оценивали связывающую активность в отношении человеческого FcRn следующим образом.
Кинетические анализы для человеческого FcRn и каждого из антител осуществляли с помощью устройства BIACORE Т100 (фирма GE Healthcare). Белок L (фирма ACTIGEN) в соответствующем количестве фиксировали на сенсорном чипе СМ4 (фирма GE Healthcare) с помощью метода аминного сочетания для захвата представляющих интерес антител. Затем осуществляли взаимодействие человеческого FcRn с антителами, захваченными на сенсорном чипе, путем инъекции разведенного раствора FcRn и подвижного буфера (применяемого в качестве референс-раствора). В качестве подвижного буфера использовали 50 мМ фосфат натрия, 150 мМ NaCl и 0,05% (мас./об.) Твин 20 с рН 6,0, и соответствующий буфер использовали также для разведения FcRn. Для регенерации сенсорного чипа использовали 10 мМ глицин-HCl с рН 1,5. Все измерения осуществляли при 25°С. KD (М) для человеческого IgE рассчитывали для каждого антитела на основе константы скорости реакции ассоциации ka (1/Мс) и константы скорости реакции диссоциации kd (1/с), которые представляют собой кинетические параметры, рассчитанные на основе сенсограмм, полученных при измерениях. Для расчета каждого параметра применяли программное обеспечение BIACORE Т100 Evaluation (фирма GE Healthcare).
Результаты представлены в таблице 8.

Пример 6
Оценка аффинности содержащих вариант Fc-области антител, характеризующихся повышенным связыванием с FcRn в условиях кислого рН, к ревматоидному фактору
Антитела к лекарственным средствам (ADA) влияют на эффективность и фармакокинетические характеристики терапевтических антител и иногда приводят к серьезным побочным действиям; таким образом, клиническая применимость и эффективность терапевтических антител могут ограничиваться в результате производства ADA. Многие факторы влияют на иммуногенность терапевтических антител, и присутствие эпитопов эффекторных Т-клеток является одним из таких факторов. Кроме того, присутствие ADA у пациента перед введением терапевтического антитела (которое обозначают также как «предсуществующее антитело») также может приводить к сходным проблемам. Специфически, в случае терапевтических антител для пациентов с аутоиммунными заболеваниями, такими как ревматоидный артрит (RA), ревматоидный фактор (RF), который представляет собой аутоантитело к человеческому IgG, может вызывать проблему, характерную для «предсуществующего ADA». В настоящее время описано гуманизированное анти-CD4 антитело IgG1-типа с мутацией N434H, обеспечивающее значительное связывание с ревматоидным фактором (Zheng и др., Clin. Pharmacol. Ther. 89(2), 2011, сс. 283-290). Подробное исследование подтвердило, что мутация Asn434His в человеческом IgG1 увеличивает связывание ревматоидного фактора с Fc-областью антитела по сравнению с родительским человеческим IgG1.
Ревматоидный фактор представляет собой поликлональное аутоантитело против человеческого IgG и его эпитопы в человеческом IgG варьируются в зависимости от клона, и они, по-видимому, локализованы в области раздела СН2/СН3, а также в СН3-домене, который может перекрываться с FcRn-связывающим эпитопом. Таким образом, мутации, приводящие к повышению связывающей активности (связывающей аффинности) в отношении FcRn, могут повышать также связывающую активность (связывающую аффинность) в отношении конкретных клонов ревматоидного фактора.
Фактически, касательно Fc с повышенной аффинностью к FcRn при кислом рН или нейтральном рН, известно также, что не только модификация N434H, но также и многие другие аминокислотные модификации сходным образом повышают связывание Fc с ревматоидным фактором (WO 2013/046704).
С другой стороны, в качестве примеров в WO 2013/046704 представлены несколько аминокислотных модификаций, которые избирательно подавляют аффинность к ревматоидному фактору, не оказывая влияния на аффинность к FcRn, и среди них указаны комбинации двух аминокислотных мутаций, а именно Q438R/S440E, Q438R/S440D, Q438K/S440E и Q438K/S440D. Поэтому Q438R/S440E интродуцировали в Fc, обладающую новой повышенной аффинностью в условиях кислого рН, впервые представленную в настоящем описании, для исследования того, можно ли снижать связывание с ревматоидными факторами.
(6-1) Анализ связывания ревматоидного фактора содержащими вариант Fc-области антителами
Анализ связывания с ревматоидным фактором осуществляли с помощью электрохемилюминесценции (ECL) при рН 7,4 с использованием индивидуальных образцов сыворотки (фирма Proteogenex), полученных от 30 страдающих RA пациентов. Смешивали образец 50-кратно разведенной сыворотки, биотинилированное тестируемое антитело (1 мкг/мл) и меченное сложным NHS-эфиром, содержащим сульфо-метку (фирма Meso Scale Discovery), тестируемое антитело (1 мкг/мл) и инкубировали при комнатной температуре в течение 3 ч. После этого смесь добавляли в покрытый стрептавидином 96-луночный планшет MULTI-ARRAY (фирма Meso Scale Discovery) и планшет инкубировали при комнатной температуре в течение 2 ч, после чего промывали. После добавления в каждую лунку буфера для считывания Т (×4) (фирма Meso Scale Discovery) планшет сразу помещали на ридер SECTOR imager 2400 (фирма Meso Scale Discovery) и измеряли хемилюминесценцию.
Результаты анализа представлены на фиг. 8-17. Fv4-IgG1 (фиг. 8), представляющее собой нативный человеческий IgG1, характеризовался лишь слабым связыванием с ревматоидным фактором, в то время как существующие Fc-варианты с повышенным FcRn-связыванием, Fv4-YTE (фиг. 9), Fv4-LS (фиг. 10) и Fv4-N434H (фиг. 11), все характеризовались существенно повышенным связыванием с ревматоидным фактором многих доноров. С другой стороны, все новые варианты Fc-области с повышенным связыванием с FcRn, Fv4-F1847m (фиг. 12), Fv4-F1848m (фиг. 13), Fv4-F1886m (фиг. 14), Fv4-F1889m (фиг. 15), Fv4-F1927m (фиг. 16) и Fv4-F1168m (фиг. 17), характеризовались лишь слабым связыванием с ревматоидным фактором, и это свидетельствовало о том, что связывание с ревматоидным фактором существенно ингибировалось в результате модификаций, повышающих связывание с FcRn.
На фиг. 18 представлены для каждого из вариантов средние величины аффинности, характеризующей связывание с ревматоидным фактором, в сыворотке 30 страдающих RA пациентов. Все шесть новых вариантов обладали более низкой аффинностью, чем три известных ранее варианта (YTE, LS и N434H), и они обладали также более низкой аффинностью к ревматоидному фактору по сравнению с нативным человеческим IgG1. Таким образом, с точки зрения создания для клинических целей терапевтических антител с более высокой аффинностью к FcRn для лечения аутоиммунных заболеваний, таких как ревматоидный артрит и т.п., риск, ассоциированный с ревматоидным фактором, который является проблемой при использовании существующих Fc-вариантов, был уменьшен для Fc-вариантов, впервые представленных в настоящем описании, и, следовательно, они являются более безопасными, чем существующие известные варианты Fc.
Пример 7
Оценка ФК Fc-вариантов с повышенным связыванием с FcRn в условиях кислого рН на обезьянах циномолгус
В примере 7 оценивали эффект увеличения времени удерживания в плазме обезьян циномолгус с помощью представленного ниже метода с использованием содержащих новый вариант Fc-области антител, представленных в настоящем описании, для которых было подтверждено подавление связывания с ревматоидным фактором.
(7-1) Получение содержащих новый вариант Fc-области антител
Получали следующие антитела к человеческому IgE: (a) OHB-IgG1, содержащий OHBH-IgG1 (SEQ ID NO: 56) в качестве тяжелой цепи и OHBL-CK (SEQ ID NO: 57) в качестве легкой цепи; (б) OHB-LS, содержащий OHBH-LS (SEQ ID NO: 58) в качестве тяжелой цепи и OHBL-CK в качестве легкой цепи; (в) OHB-N434A, содержащий OHBH-N434A (SEQ ID NO: 59) в качестве тяжелой цепи и OHBL-CK в качестве легкой цепи; (г) OHB-F 1847m, содержащий ОНВН-F1847m (SEQ ID NO: 60) в качестве тяжелой цепи и OHBL-CK в качестве легкой цепи; (д) OHB-F1848m, содержащий OHBH-F1848m (SEQ ID NO: 61) в качестве тяжелой цепи и OHBL-CK в качестве легкой цепи; (е) OHB-F1886m, содержащий OHBH-F1886m (SEQ ID NO: 62) в качестве тяжелой цепи и OHBL-CK в качестве легкой цепи; (ж) OHB-F1889m, содержащий OHBH-F1889m (SEQ ID NO: 63) в качестве тяжелой цепи и OHBL-CK в качестве легкой цепи; и (з) OHB-F1927m, содержащий OHBH-F1927m (SEQ ID NO: 64) в качестве тяжелой цепи и OHBL-CK в качестве легкой цепи.
(7-2) Анализ ФК антител, содержащих новый вариант Fc-области, в организме обезьян
Оценивали кинетику in vivo антител к человеческому IgE в плазме после введения антител к человеческому IgE обезьянам циномолгус. Раствор антитела к человеческому IgE вводили однократно внутривенно в дозе 2 мг/кг. Сбор крови осуществляли через 5 мин, (два часа), семь часов, один день, два дня, три дня, (четыре дня), семь дней, 14 дней, 21 день, 28 дней, 35 дней, 42 дня, 49 дней и 56 дней после введения. Собранную кровь сразу же подвергали центрифугированию при 4°С и 15000 об/мин в течение 5 мин для получения плазмы. Отделенную плазму хранили в морозильной камере при -80°С или ниже до осуществления измерений. Применяли восемь типов антител к человеческому IgE, а именно OHB-IgG1, OHB-LS, OHB-N434A, OHB-F1847m, OHB-F1848m, OHB-F1886m, OHB-F1889m и OHB-F1927m.
(7-3) Измерение концентрации антител к человеческому IgE в плазме с помощью ELISA
Концентрацию антител к человеческому IgE в плазме обезьян циномолгус измеряли с помощью ELISA. Сначала вносили антитело к каппа-цепи человеческого IgG (фирма Antibody Solution) в планшет Nunc-Immuno Plate, MaxiSorp (фирма Nalge Nunc International) и давали выстаиваться в течение ночи при 4°С с получением планшета с иммобилизованным антителом к каппа-цепи человеческого IgG. Приготавливали образцы для калибровочной кривой с концентрацией в плазме 640, 320, 160, 80, 40, 20 или 10 нг/мл и образцы для измерений в плазме обезьян циномолгус, разведенные в 100 раз или более. Эти образцы для калибровочной кривой и образцы для измерений в плазме, получали путем добавления IgE обезьян циномолгус (продукт, полученный компанией заявителя) в концентрации 1 мкг/мл. После этого образцы вносили в планшет с иммобилизованных антителом к каппа-цепи человеческого IgG и давали выстаиваться при комнатной температуре в течение 2 ч. Затем вносили конъюгированное с HRP антитело к гамма-цепи человеческого IgG (фирма Southern Biotech) и давали выстаиваться при комнатной температуре в течение 1 ч. После этого осуществляли хромогенную реакцию с использованием хромогенного раствора ТМВ (фирма Life Technologies) в качестве субстрата и после прекращения реакции путем добавления 1н. серной кислоты (фирма Wako) измеряли абсорбцию при 450 нм с помощью ридера для микропланшетов. Концентрацию антитела к человеческому IgE в плазме обезьян рассчитывали на основе абсорбции с использованием калибровочной кривой с помощью аналитического программного обеспечения SOFTmax PRO (фирма Molecular Devices). Результаты измерений изменения концентрации антитела к человеческому IgE в плазме обезьян представлены на фиг.19. На основе измеренного изменения концентрации антитела к человеческому IgE в плазме обезьян рассчитывали клиренс в результате элиминации с помощью анализа в определенные моменты времени с использованием программы Phoenix WinNonlin, версия 6.2 (фирма Pharsight Corporation). Рассчитанные фармакокинетические параметры представлены в таблице 9. Образцы, полученные от индивидуумов, которые были позитивные по антителам против введенного образца в плазме, исключали при расчете изменения концентрации антитела к человеческому IgE и клиренса в плазме обезьян.
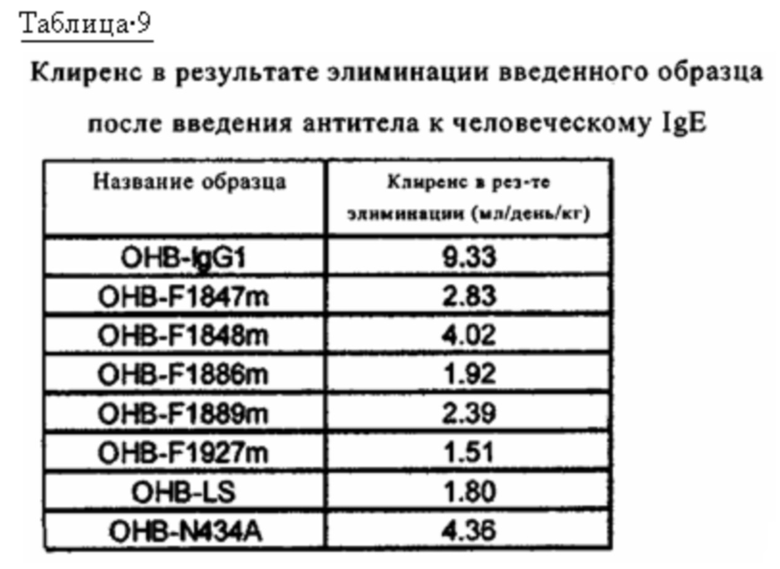
(7-4) Оценка антител к введенным образцам в плазме с помощью электрохемилюминесцентного метода
Антитела в плазме обезьян к введенным образцам измеряли электрохемилюминесцентным методом. Вводимый образец, который был мечен рутением с использованием сложного несущего сульфо-метку NHS-эфира (фирма Meso Scale Discovery), вводимый образец, который был биотинилирован с использованием набора EZ-Link Micro Sulfo-NHS-Biotinylation (фирма Pierce) и образец для измерений в плазме обезьян циномолгус, смешивали в равных количествах и давали выстаиваться в течение ночи при 4°С. Образцы добавляли в 96-луночный покрытый стрептавидином планшет Gold MULTI-ARRAY (фирма Meso Scale Discovery), затем давали осуществляться реакции при комнатной температуре в течение 2 ч и промывали. Затем, сразу после внесения на планшет буфера для считывания Т (×4) (фирма Meso Scale Discovery) осуществляли измерения с использованием устройства SECTOR Imager 2400 (фирма Meso Scale Discovery).
В результате было подтверждено, что все новые Fc-варианты характеризовались значительно увеличенным временем удерживания в плазме по сравнению с Fc-областью нативного IgG1.
(7-5) Анализ ФК Fc-вариантов в организме мышей
Описанный ниже эксперимент осуществляли для сравнения F1718, представляющего собой Fc-вариант, описанный в WO 2013/046704, и F1848m, который представляет собой Fc-вариант, впервые полученный при создании настоящего изобретения, в качестве Fc-вариантов, предназначенных для повышения связывания FcRn при кислом рН.
Последовательности кодирующие тяжелые цепи, в которые интродуцировали аминокислотные модификации в Fc-область тяжелой цепи (VH3-IgG1) Fv4-IgG1 (антитело к человеческому рецептору IL-6), получали с помощью метода, описанного в референс-примере 1. С использованием этих тяжелых цепей получали представленные ниже антитела с помощью метода, описанного в референс-примере 2: (a) Fv4-IgG1, содержащее VH3-IgG1 в качестве тяжелой цепи и VL3-CK в качестве легкой цепи; и (б) Fv4-F1718, содержащее VH3-F1718 (SEQ ID NO: 65) в качестве тяжелой цепи и VL3-CK в качестве легкой цепи.
Указанные выше антитела к человеческому рецептору IL-6 вводили однократно в дозе 1 мг/кг в хвостовую вену трансгенных по человеческому FcRn мышей (B6.mFcRn-/-.hFcRn Tg-мыши линии 32+/+; фирма Jackson Laboratories, Methods Mol. Biol. 602, 2010, сс. 93-104). Кровь собирали через 15 мин, 7 ч, 1 день, 2 дня, 3 дня, 7 дней, 14 дней, 21 день и 28 дней после введения антител к человеческому рецептору IL-6. Собранную кровь сразу же центрифугировали при 15000 об/мин и 4°С в течение 15 мин для получения плазмы. Отделенную плазму хранили в морозильной камере при -20°С или ниже до осуществления измерений.
(7-6) Измерение концентрации антител к человеческому рецептору IL-6 в плазме с помощью ELISA
Концентрацию антител к человеческому рецептору IL-6 в мышиной плазме измеряли с помощью ELISA. Сначала антитело к F(ab')2-фрагменту человеческого IgG (специфическое в отношении гамма-цепи) (фирма SIGMA) вносили в планшет Nunc-Immuno Plate, MaxiSorp (фирма Nalge nunc International) и давали выстаиваться в течение ночи при 4°С для получения планшета с иммобилизованным антителом к человеческому IgG. Приготавливали образцы для калибровочной кривой, содержащие антитело к человеческому рецептору IL-6, при концентрации в плазме 0,8, 0,4, 0,2, 0,1, 0,05, 0,025 или 0,0125 мкг/мл и образцы для измерений в мышиной плазме, разведенные в 100 раз или более. Добавляли 200 мкл растворимого человеческого рецептора IL-6 в концентрации 20 нг/мл к 100 мкл образцов для калибровочной кривой или образцов для измерений в плазме и затем содержащим смесь растворам давали выстаиваться в течение 1 ч при комнатной температуре. После этого смешанные растворы вносили в каждую лунку планшета с иммобилизованным антителом к человеческому IgG и планшету давали выстаиваться в течение 1 ч при комнатной температуре. Затем добавляли биотинилированное антитело к человеческому IL-6R (фирма R&D) и давали осуществляться реакции в течение 1 ч при комнатной температуре. После этого добавляли конъюгат стрептавидин-PolyHRP80 (фирма Stereospecific Detection Technologies) и давали осуществляться реакции в течение 1 ч при комнатной температуре и осуществляли хромогенную реакцию этого реакционного раствора с использованием в качестве субстрата ТМВ One Component HRP Microwell Substrate (фирма BioFX Laboratories). После прекращения реакции путем добавления 1н. серной кислоты (фирма Showa Chemical) измеряли абсорбцию в реакционном растворе в каждой лунке при 450 нм с помощью ридера для микропланшетов. Концентрацию антитела в мышиной плазме рассчитывали на основе абсорбции с использованием калибровочной кривой с помощью аналитического программного обеспечения SOFTmax PRO (фирма Molecular Devices).
Результаты представлены на фиг. 20. Конструкция F1718, которая представляла собой Fc-вариант для повышения связывания FcRn при кислом рН, описанный в WO 2013/046704, не оказывала никакого пролонгирующего эффекта на PK антитела, но обладало временем удерживания в плазме, эквивалентным времени удерживания нативного IgG1.
F1718 имеет четыре мутации, а именно N434Y/Y436V/Q438R/S440E интродуцированные в Fc-область. В отличие от этого, в F1848m, впервые представленную в настоящем описании, были интродуцированы четыре мутации, а именно N434A/Y436V/Q438R/S440E. Единственная разница между аминокислотными мутациями, интродуцированными в указанные два типа Fc-областей, состояла в том, что аминокислотная мутация, интродуцированная в положение 434 согласно EU-нумерации, представляла собой Y (тирозин) в F1718, и А (аланин) в F1848m. В примере (7-2) продемонстрировано, что вариант F1848m характеризовался увеличенным временем удерживания в плазме по сравнению с нативным IgG1, в то время как конструкция F1718 не характеризовалась никаким увеличением времени удерживания в плазме. Следовательно, можно считать, что А (аланин) является предпочтительным (но это не ограничивает объем изобретения) для осуществления аминокислотной мутации, которую следует интродуцировать в положение 434 для увеличения времени удерживания в плазме.
(7-7) Предсказанный балл иммуногенности вариантов Fc
Образование антител к лекарственным средствам (ADA) влияет на эффективность и фармакокинетические характеристики терапевтических антител и приводит в некоторых случаях к серьезным побочным действиям; и следовательно, клиническая применимость и лекарственная эффективность терапевтических антител могут ограничиваться образованием ADA. Известно, что на иммуногенность терапевтических антител влияют многие факторы и, в частности, много раз отмечалась важность эпитопов эффекторных Т-клеток, которые несут терапевтические антитела.
Разработаны «инструменты» in silico для предсказания Т-клеточных эпитопов, такие как Epibase (фирма Lonza), iTope/TCED (фирма Antitope) и EpiMatrix (фирма EpiVax). С использованием этих «инструментов» in silico можно предсказывать Т-клеточные эпитопы в любой аминокислотной последовательности (Walle и др., Expert Opin. Biol. Ther. 7(3), 2007, cc. 405-418) и можно оценивать потенциальную иммуногенность терапевтических антител.
Для расчета баллов иммуногенности оцениваемых вариантов Fc применяли EpiMatrix. EpiMatrix представляет собой систему предсказания иммуногенности представляющего интерес белка на основе автоматического конструирования последовательностей пептидных фрагментов путем секционирования аминокислотной последовательности белка, для которого требуется предсказать его иммуногенность, на девять аминокислот и затем расчета их способности связываться с восемью основными аллелями ГКС класса II (DRB 1*0101, DRB1*0301, DRB1*0401, DRB1*0701, DRB1*0801, DRB1*1101, DRB1*1301 и DRB1*1501) (Clin. Immunol. 131(2), 2009, cc. 189-201).
F1718 и F1756 (N434Y/Y436T/Q438R/S440E), описанные в WO 2013/046704, содержат мутацию N434Y. В отличие от этого новые созданные F1848m и F1847m содержат мутацию N434A.
Баллы иммуногенности для этих четырех вариантов, а именно F1718, F1848m, F1756 и F1847m, рассчитанные согласно описанному выше методу, представлены в таблице 31 в колонке, озаглавленной «EpiMatrix Score». Кроме того, в колонке, озаглавленной «tReg Adjusted Ерх Score», представлены баллы иммуногенности, указанные в колонке, озаглавленной «EpiMatrix Scores», которые были скорректированы на содержание Tregitope. Tregitope представляет собой последовательность пептидного фрагмента, присутствующую в больших количествах главным образом в последовательностях встречающихся в естественных условиях антител, и представляет собой последовательность, которая, как считается, ингибирует иммуногенность путем активации регуляторных Т-клеток (Treg).

Согласно этим результатам данные, представленные как в «EpiMatrix Score», так и «tReg Adjusted Epx Score», свидетельствуют о том, что баллы иммуногенности несущих N434A вариантов F 1848m и F 1847m были более низкими по сравнению с баллами для несущих N434Y вариантов. Это позволяет предположить, что А (аланин) является предпочтительным в качестве аминокислотной мутации, которую требуется интродуцировать в положение 434 для снижения балла иммуногенности.
Пример 8
Получение гуманизированных антител к человеческому IL-8
(8-1) Получение гуманизированного антитела hWS-4 к человеческому IL-8
Гуманизированные антитела к IL-8, описанное в US №6245894, связываются с человеческим IL-8 (hIL-8) и блокируют его физиологическую функцию. Модифицированные гуманизированные антитела к IL-8 можно получать путем объединения последовательностей вариабельной области тяжелой и легкой цепей, описанных в US №6245894, практически с любой из различных известных последовательностей константной области человеческого антитела. Так, на последовательности константной области человеческого антитела указанных модифицированных антител не накладываются конкретные ограничения, но в качестве последовательностей константных областей тяжелой цепи можно использовать последовательности нативного человеческого IgG1 или последовательности нативного человеческого IgG4, а в качестве последовательностей константных областей легкой цепи можно использовать последовательности нативной человеческой каппа-цепи.
Из числа гуманизированных антител к IL-8, описанных в US №6245894, кодирующую последовательность hWS4H-IgG1 (SEQ ID NO: 83), которую объединяли с последовательностью вариабельной области тяжелой цепи RVHg и нативной последовательностью константной области тяжелой цепи человеческого антитела к IgG1, получали методом, описанным в референс-примере 1. Кроме того, кодирующую последовательность hWS4L-k0MT (SEQ ID NO: 84), которая представляла собой объединенную вариабельную область легкой цепи RVLa и последовательность нативной константной области человеческой легкой каппа-цепи, получали согласно методу, описанному в референс-примере 1. Получали антитело, в котором были объединены указанные выше тяжелая цепь и легкая цепь, и его обозначили как гуманизированное антитело WS-4 (ниже в настоящем описании обозначено как hWS-4).
(8-2) Получение гуманизированного антитела Hr9 к человеческому IL-8
Новое гуманизированное антитело получали с использованием человеческих консенсусных последовательностей каркасного участка, отличных от FR, которые использовали в hWS-4.
Более конкретно, гибридную последовательность VH3-23 и VH3-64 использовали в качестве FR1 тяжелой цепи, последовательность, представленную в VH3-15 и VH3-49, использовали в качестве FR2, последовательность, представленную в VH3-72, использовали в качестве FR3 (при условии, что исключали 82а согласно нумерации Кэбота), а последовательность, представленную в JH1, использовали в качестве FR4. Эти последовательности связывали с последовательностями CDR тяжелой цепи hWS-4 с получением Hr9-IgG1 (SEQ ID NO: 85), тяжелой цепи нового гуманизированного антитела.
Затем получали два типа антител, а именно, hWS-4, имеющее hWS4H-IgG1 в качестве тяжелой цепи и hWS4L-k0MT в качестве легкой цепи, и Hr9, имеющее Hr9-IgG1 в качестве тяжелой цепи и hWS4L-k0MT в качестве легкой цепи. В контексте раздела В настоящего описания при ссылке на легкую цепь, в частности на Hr9, ее обозначают как Hr9/hWS4L. Экспрессию антител осуществляли с использованием клеток FreeStyle 293F (фирма Invitrogen) согласно протоколу, приложенному к продукту. Антитела очищали из супернатанта культуры с помощью метода, описанного в референс-примере 2. В результате получали антитела в количествах, указанных в таблице 11.
Неожиданно было установлено, что уровень экспрессии Hr9 был примерно в 8 раз выше, чем уровень экспрессии hWS-4.

(8-3) Активности hWS-4 и Hr9 в отношении связывания человеческого IL-8 Аффинности, характеризующие связывание hWS-4 и Hr9 с человеческим IL-8, определяли согласно описанному ниже методу с использованием устройства BIACORE T200 (фирма GE Healthcare).
Применяли подвижный буфер, имеющий следующий состав: 0,05% Твин 20, 20 мМ ACES и 150 мМ NaCl (pH 7,4). Белок A/G (фирма PIERCE) в соответствующем количестве иммобилизовали на сенсорном чипе СМ4 (фирма GE Healthcare) с помощью метода аминного сочетания и осуществляли захват представляющего интерес антитела. Затем осуществляли взаимодействие человеческого IL-8 с антителом, захваченным на сенсорном чипе, путем инъекции разведенного раствора человеческого IL-8 и подвижного буфера (который применяли в качестве референс-раствора). В качестве подвижного буфера использовали раствор описанного выше состава, и этот буфер использовали также для разведения человеческого IL-8. Для регенерации сенсорного чипа использовали 10 мМ глицин-HCl с pH 1,5. Все измерения осуществляли при 37°С. KD (М) для человеческого IgE рассчитывали для каждого антитела на основе константы скорости реакции ассоциации kon (1/Mc) и константы скорости реакции диссоциации koff (1/c), которые представляют собой кинетические параметры, рассчитанные на основе сенсограмм, полученных при измерениях. Для расчета каждого параметра применяли программное обеспечение BIACORE T100 Evaluation (фирма GE Healthcare).
Результаты представлены в таблице 12. Было подтверждено, что hWS-4 и Hr9 обладали эквивалентными аффинностями связывания с человеческим IL-8.

Для создания содержащих антитело фармацевтических средств важным фактором является уровень производства молекул антитела, и, как правило, желательно, чтобы уровень производства был высоким. Следует особо отметить, что на основе описанных выше исследований была выбрана более пригодная полученная из человеческого консенсусного каркасного участка последовательность для объединения с HVR-последовательностью hWS-4 и получено Hr9, характеризующееся более высоким уровнем производства при сохранении аффинности связывания с человеческим IL-8.
Пример 9
Создание антител с рН-зависимой аффинностью к IL-8
(9-1) Получение антител на основе модификации Hr9 для придания зависимости от рН
Были проведены исследования с целью придания рН-зависимой аффинности к IL-8 антителу Hr9, полученному в примере 8.
Не вдаваясь в какую-либо конкретную теорию, можно считать, что антитела, обладающие рН-зависимой аффинностью к IL-8, могут иметь следующие характеристики in vivo. Антитела, введенные в живой организм, могут более сильно связываться с IL-8 в условиях, в которых поддерживается нейтральное значение рН (например, в плазме), и блокировать его функцию. Часть таких комплексов IL-8/антитело поглощается клетками в результате неспецифического взаимодействия с клеточной мембраной (пиноцитоз) (ниже в настоящем описании обозначен как неспецифическое поглощение). В условиях кислого рН в эндосомах аффинности связывания указанных выше антител с IL-8 становятся слабыми и поэтому антитело отделяется от IL-8 в результате диссоциации. Затем антитела, отделившиеся от IL-8 в результате диссоциации, могут возвращаться наружи из клетки посредством FcRn. Указанные выше антитела, которые возвратились наружу из клетки (в плазму) таким путем, могут снова связываться с другим IL-8 и блокировать его функцию. Предполагается, что антитела, обладающие рН-зависимой аффинностью к IL-8, должны быть способны связываться с IL-8 несколько раз посредством указанного выше механизма.
В отличие от этого, в случае антитела, которое не обладает свойством, присущим указанному выше антителу, молекула антитела обладает способностью нейтрализовать антиген только один раз, но не может нейтрализовать антиген несколько раз. В целом, поскольку антитело IgG-типа имеет два Fab, то одна молекула антитела может нейтрализовать две молекулы IL-8. С другой стороны, антитела, которые могут связываться с IL-8 несколько раз, могут связываться с IL-8 любое количество раз в течение того периода времени, пока они остаются в живом организме. Например, одна молекула обладающего рН-зависимым связыванием с IL-8 антитела, которая поглощается клетками десять раз с момента ее введения до элиминации, может нейтрализовать как максимум 20 молекул IL-8. Следовательно, антитело, которое может связываться несколько раз с IL-8, обладает преимуществом, заключающимся в способности нейтрализовать несколько молекул IL-8 даже в случае небольшого количества антитела. С другой точки зрения, антитело, которое может связываться несколько раз с IL-8, обладает преимуществом, заключающимся в способности поддерживать состояние, в котором оно может нейтрализовать IL-8, в течение более длинного периода времени по сравнению с тем случаем, когда вводят в том же самом количестве антитело, которое не обладает этим свойством. С другой точки зрения, антитело, которое может связываться несколько раз с IL-8, обладает преимуществом, заключающимся в том, что оно способно более сильно блокировать биологическую активность IL-8 по сравнению с тем случаем, когда вводят в том же самом количестве антитело, которое не обладает этим свойством.
Для достижения этих преимуществ интродуцировали аминокислотные модификации, главным образом гистидин, в вариабельные области Hr9-IgG1 и WS4L-k0MT с целью получения антител, которые могут связываться с IL-8 несколько раз. Более конкретно, получали варианты, представленные в таблице 13, с помощью методов, описанных в референс-примерах 1 и 2.
В обозначениях, таких как «Y97H», приведенных в таблице 13, указано положение, в которое интродуцируют мутацию, согласно нумерации Кэбота, аминокислота до интродукции мутации и аминокислота после интродукции мутации. Конкретно, обозначение «Y97H» означает, что аминокислотный остаток в положении 97 согласно нумерации Кэбота заменен с Y (тирозин) на Н (гистидин). Кроме того, когда интродуцируют комбинацию нескольких аминокислотных замен, то ее обозначают следующим образом «N50H/L54H».
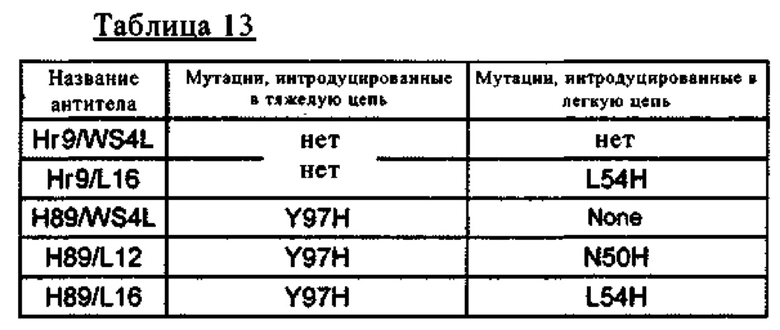
(9-2) рН-зависимая аффинность к IL-8
Аффинность связывания с человеческим IL-8 антител, полученных в примере 9-1, определяли согласно описанному ниже методу с использованием устройства BIACORE T200 (фирма GE Healthcare). Применяли два следующих подвижных буфера: (1) 0,05% Твин 20, 20 мМ ACES, 150 мМ NaCl, pH 7,4; и (2) 0,05% Твин 20, 20 мМ ACES, 150 мМ NaCl, pH 5,8.
Белок A/G (фирма PIERCE) в соответствующем количестве иммобилизовали на сенсорном чипе СМ4 (фирма GE Healthcare) с помощью метода аминного сочетания и осуществляли захват представляющего интерес антитела. Затем осуществляли взаимодействие человеческого IL-8 с антителом, захваченным на сенсорном чипе, путем инъекции разведенного раствора человеческого IL-8 и подвижного буфера (который применяли в качестве референс-раствора). В качестве подвижного буфера использовали любой из растворов описанного выше состава, и этот буфер использовали также для разведения человеческого IL-8. Для регенерации сенсорного чипа использовали 10 мМ глицин-HCl с pH 1,5. Все измерения осуществляли при 37°С. KD (М) для каждого из антител к человеческому IgE рассчитывали на основе константы скорости реакции ассоциации kon (1/Mc) и константы скорости реакции диссоциации koff (1/c), которые представляют собой кинетические параметры, рассчитанные на основе сенсограмм, полученных при измерениях. Для расчета каждого параметра применяли программное обеспечение BIACORE Т 100 Evaluation (фирма GE Healthcare).
Результаты представлены в таблице 14-1. Во-первых, по сравнению с Hr9, Hr9/L16, которое содержит модификацию L54H в легкой цепи, обладало немного более высокой аффинностью связывания с человеческим IL-8 при нейтральном рН (рН 7,4), но более низкой аффинностью связывания с человеческим IL-8 при кислом рН (рН 5,8). С другой стороны, антитела к IL-8 (H89/WS4L, H89/L12 и H89/L16), полученные путем объединения различных легких цепей с Н89, содержащим модификацию Y97H в тяжелой цепи, все характеризовались сниженной аффинностью связывания с человеческим IL-8 при кислом рН, а также сниженной аффинностью связывания с человеческим IL-8 при нейтральном рН.
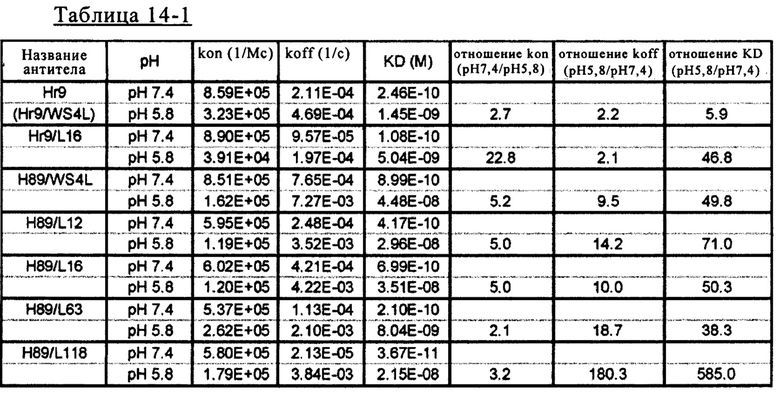
(9-3) Получение и оценка антител, модифицированных для придания рН-зависимости
Оценивали комбинации перспективных модификаций, выявленных в примере 9-2, и новых аминокислотных мутаций и в результате были выявлены следующие комбинации.
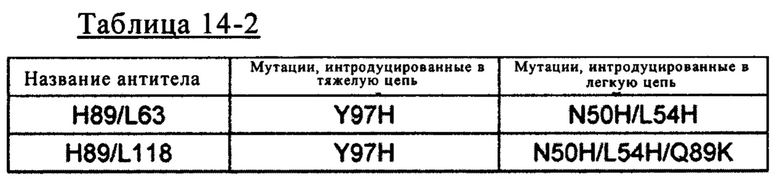
Варианты получали с помощью методов, описанных в референс-примерах 1 и 2, а аффинность связывания с человеческим IL-8 оценивали с помощью метода, сходного с методом, описанным в примере 9-2.
Результаты представлены также в таблице 14. H89/L63, которое имело Н89-IgG1 (SEQ ID NO: 86) в качестве тяжелой цепи и L63-k0MT (SEQ ID NO: 87) в качестве легкой цепи, характеризовались аффинностью связывания с человеческим IL-8 при нейтральном рН (рН 7,4), эквивалентной аффинности Hr9, и сниженной при кислом рН (рН 5,8). Конкретно, обе величины, и koff (константа скорости реакции диссоциации) и KD (константа диссоциации) H89/L63, при рН 5,8 были выше, чем соответствующие величины для Hr9. Это означает, что в условиях кислого рН в эндосомах, H89/L63 обладало способностью быстро высвобождать человеческий IL-8.
Неожиданно было установлено, что H89/L118, которое имеет H89-IgG1 в качестве тяжелой цепи и L118-k0MT (SEQ ID NO: 88) в качестве легкой цепи, обладало более высокой аффинностью связывания (KD) с человеческим IL-8 в условиях нейтрального рН по сравнению с аффинностью Hr9, но более слабой аффинностью связывания (KD) с человеческим IL-8 в условиях кислого рН по сравнению с аффинностью Hr9. Как правило (но это не является ограничением), когда антитела, которые могут несколько раз связываться с антигенами, применяют в качестве фармацевтического продукта, то обладающие рН-зависимым связыванием с антигеном антитела предпочтительно обладают сильной аффинностью связывания (малая величина KD), так что они могут эффективно нейтрализовать антигены в условиях нейтрального рН (например, в плазме). С другой стороны, антитела предпочтительно имеют большую константу скорости реакции диссоциации (koff) и/или низкую аффинностью связывания (большая величина KD), так что они могут быстрее высвобождать антигены в условиях кислого рН (например, в эндосомах). По сравнению с Hr9, H89/L118 приобрело более предпочтительные свойства как в условиях нейтрального рН, так и в условиях кислого рН.
Таким образом, для Hr9 были идентифицированы пригодные аминокислотные модификации, такие как Y97H для его тяжелой цепи и N50H/L54H/Q89K для его легкой цепи. При этом было установлено, что можно создавать характеризующиеся рН-зависимым связыванием с IL-8 антитела, обладающие преимуществами в качестве фармацевтических средств, путем интродукция одной или комбинации нескольких аминокислотных модификаций, выбранных из указанных модификаций (но не ограничиваясь только ими).
Не вдаваясь ни в какую-либо конкретную теорию, можно считать, что при использовании обладающего рН-зависимым связыванием с антигеном антитела в качестве фармацевтического средства важным фактором является то, может или нет введенное в организм антитело высвобождать антиген в эндосоме. В этой связи, по-видимому, важно, чтобы имело место достаточно слабое связывание (большая величина константы диссоциации (KD)) в условиях кислого рН или достаточно быстрая скорость реакции диссоциации (большая величина константы скорости диссоциации (koff)). Поэтому в представленном ниже эксперименте изучали, достаточна ли величина KD или koff H89/L118, измеренная методом BIACORE, для отделения антигена путем диссоциации в эндосоме in vivo.
Пример 10
Получение обладающих высокой аффинностью антител для анализа ФК в организме мышей
Не накладывается конкретных ограничений на методы для подтверждения воздействия антитела на скорость элиминации человеческого IL-8 из организма мышей. В одном из вариантов метод включает введение антитела в виде смеси с человеческим IL-8 мышам и последующее сравнение скорости элиминации человеческого IL-8 из мышиной плазмы.
В рассматриваемом случае желательно, чтобы референс антитело, предназначенное для применения в анализе ФК в организме мышей, обладало достаточно сильной аффинностью связывания как в условиях нейтрального рН, так и в условиях кислого рН. Затем осуществляли поиск модификаций, которые придают Hr9 высокую аффинность, и в результате было создано антитело H998/L63, имеющее H998-IgG1 (SEQ ID NO: 89) в качестве тяжелой цепи и L63-k0MT в качестве легкой цепи.
H998/L63 использовали для оценки аффинности связывания с человеческим IL-8 с помощью метода, сходного с методом, описанным в примере 9-2. Полученные сенсограммы представлены на фиг. 21.
H998/L63 характеризовалось неожиданно низкой скоростью реакции диссоциации как в условиях нейтрального рН, так и в условиях кислого рН, и было установлено, что оно обладало более сильной аффинности связывания с IL-8, чем Hr9. Однако, известно, что вследствие механических ограничений метода BIACORE аналитические величины, такие как константа скорости реакции диссоциации (koff) и константа диссоциации (KD) не могут быть точно рассчитаны в тех случаях, когда белок-белковые взаимодействия характеризуются низкой скоростью реакции диссоциации. Поскольку точные аналитические величины не удалось получить для H998/L63, то аналитические величины для него не представлены в настоящем описании. Однако, полученные в эксперименте результаты свидетельствовали о том, что H998/L63 обладало очень сильной аффинностью связывания как при нейтральном рН, так и при кислом рН, и его можно применять в качестве антитела, используемого для сравнения в анализе ФК в организме мышей.
Пример 11
Анализ ФК в организме мышей с использованием обладающего рН-зависимым связыванием с IL-8 антитела H89/L118
(11-1) Анализ ФК в организме мышей с использованием H89/L118
Скорость элиминации человеческого IL-8 in vivo оценивали с использованием H89/L118, полученного в примере 9, и H998/L63, полученного в примере 10.
Фармакокинетические характеристики человеческого IL-8 оценивали после одновременного введения человеческого IL-8 и антител к человеческому IL-8 мышам (линия C57B L/6J, фирма Charles river). Раствор, содержащий смесь человеческого IL-8 и антитела к человеческому IL-8 (10 мкг/мл и 200 мкг/мл соответственно), вводили в виде однократной дозы 10 мл/кг в хвостовую вену. Поскольку антитело к человеческому IL-8 присутствовало в достаточном избытке, то считалось, что в этот момент времени, почти весь человеческий IL-8 должен быть связан с антителом. Кровь собирали через пять минут, 2 ч, 4 ч, 7 ч, 1 день, 2 дня, 3 дня, 7 дней, 14 дней, 21 день и 28 дней после введения. Собранную кровь сразу же центрифугировали при 15000 об/мин и 4°С в течение 15 мин для получения плазмы. Отделенную плазму хранили в морозильной камере при -20°С или ниже до осуществления измерений.
(11-2) Измерение концентрации человеческого IL-8 в плазме
Концентрацию человеческого IL-8 в мышиной плазме определяли электрохемилюминесцентным методом. Сначала антитело к человеческому IL-8 (полученное в лаборатории заявителей), содержащее константную область мышиного IgG, вносили в 96-луночный планшет MULTI-ARRAY (фирма Meso Scale Discovery) и давали выстаиваться при комнатной температуре в течение 1 ч. Затем для получения планшета с иммобилизованным антителом к человеческому IL-8 применяли раствор ЗФР-Твин, содержащий 5% БСА (мас./об.), для блокирования при комнатной температуре в течение 2 ч. Приготавливали образцы для построения калибровочной кривой, содержащие человеческий IL-8, с концентрацией в плазме 275, 91,7, 30,6, 10,2, 3,40, 1,13 или 0,377 нг/мл и образцы для измерений в мышиной плазме, разведенные в 25 раз или более. Образцы смешивали с hWS-4 и давали прореагировать в течение ночи при 37°С. После этого в каждую лунку планшета с иммобилизованным антителом к человеческому IL-8 вносили по 50 мкл содержащих смесь растворов и раствор перемешивали при комнатной температуре в течение 1 ч. Конечную концентрацию hWS-4 доводили до 25 мкг/мл. Затем после взаимодействия в течение 1 ч с биотинилированным мышиным антителом к легкой каппа-цепи человеческого Ig (фирма BD Pharmingen) при комнатной температуре и затем взаимодействия в течение 1 ч с меченным сульфа-меткой стрептавидином (фирма Meso Scale Discovery) при комнатной температуре вносили буфер Т для считывания (1х) (фирма Meso Scale Discovery) и сразу же осуществляли измерения с помощью устройства SECTOR Imager 2400 (фирма Meso Scale Discovery). Концентрацию человеческого IL-8 рассчитывали на основе ответа с использованием калибровочной кривой с помощью аналитического программного обеспечения SOFT Max PRO (фирма Molecular Devices).
Полученные данные о концентрации человеческого IL-8 в плазме представлены на фиг. 22, а величины клиренса (CL) человеческого IL-8 из мышиной плазмы представлены в таблице 15.
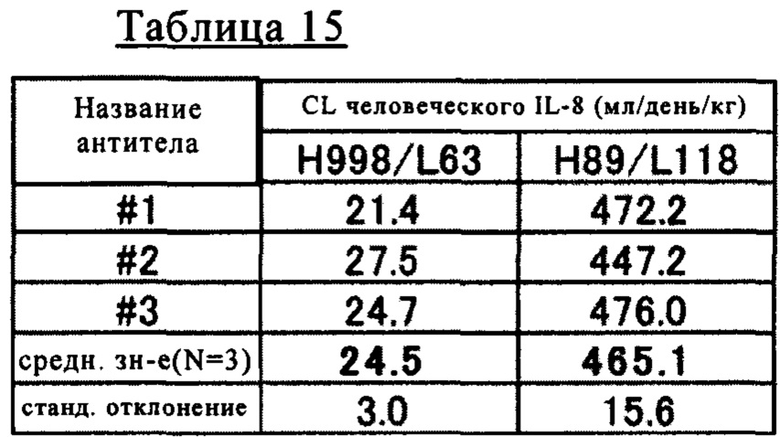
Как следует из фиг. 22, оказалось, что по сравнению с человеческим IL-8, введенным одновременно с H998/L63, человеческий IL-8, введенный одновременно с H89/L118, неожиданно быстро элиминируется из мышиной плазмы. Кроме того, величины CL, которые качественно отражают скорость элиминации человеческого IL-8 из мышиной плазмы, свидетельствуют о том, что скорость элиминации человеческого IL-8 была примерно в 19 раз более высокой в случае H89/L118 по сравнению с H998/L63.
Не вдаваясь в какую-либо конкретную теорию, на основе полученных данных можно сделать следующий вывод. Большая часть человеческого IL-8, введенного одновременно с антителом, связывается с антителом в плазме и присутствует в составе комплексов. Человеческий IL-8, связанный с H998/L63, может существовать в связанном с антителом состоянии даже в условиях кислого рН в эндосоме благодаря присущей антителу сильной аффинности. Следовательно, H998/L63 может возвращаться в плазму посредством FcRn, находясь все еще в составе комплекса с человеческим IL-8; следовательно, когда это происходит, то человеческий IL-8 также возвращается в плазму в то же самое время. Следовательно, большая часть человеческого IL-8, поглощенного клетками, может снова возвратиться в плазму. Это означает, что уровень элиминации человеческого IL-8 из плазмы существенно снижается, если одновременно вводят H998/L63. С другой стороны, как указано ранее, человеческий IL-8, поглощенный клетками в составе комплекса с H89/L118, рН-зависимым IL-8-связывающим антителом, может отделяться в результате диссоциации от антитела в условиях кислого рН в эндосоме. Человеческий IL-8, отделенный в результате диссоциации от антитела, будет расщепляться после переноса в лизосому. Следовательно, рН-зависимое IL-8-связывающие антитела могут значительно ускорять элиминацию человеческого IL-8 по сравнению с IL-8-связывающим антителом, таким как H998/L63, которое обладает сильной аффинностью связывания как при кислом рН, так и при нейтральном рН.
(11-3) Анализ ФК в организме мышей при увеличенной дозе H89/L118
Затем проводили эксперимент по проверке воздействия варьирования дозы H89/L118, который заключался в следующем. После одновременного введения человеческого IL-8 и H89/L118 (2 мг/кг или 8 мг/кг) мышам (линия C57B L/6J, фирма Charles river) оценивали фармакокинетические характеристики человеческого IL-8. Раствор, содержащий смесь человеческого IL-8 (2,5 мкг/мл) и антитела к человеческому IL-8 (200 мкг/мл или 800 мкг/мл), вводили однократно в хвостовую вену в дозе 10 мл/кг. Считалось, что, поскольку антитело к человеческому IL-8 присутствует в достаточном избытке по сравнению с человеческим IL-8, то в это время почти весь человеческий IL-8 должен быть связан с антителом. Кровь собирали через 5 мин, 7 ч, один день, два дня, три дня, семь дней, 14 дней, 21 день и 28 дней после введения. Собранную кровь сразу же центрифугировали при 15000 об/мин и 4°С в течение 15 мин для получения плазмы. Отделенную плазму хранили в морозильной камере при -20°С или ниже до осуществления измерений.
Измерение концентрации человеческого IL-8 в мышиной плазме осуществляли методом, сходным с методом, описанным в примере 11-2. Полученные данные о концентрации человеческого IL-8 в плазме представлены на фиг. 23, а величины клиренса (CL) человеческого IL-8 из мышиной плазмы представлены в таблице 16.

В результате было подтверждено, что по сравнению с группой, которой вводили H89/L118 в дозе 2 мг/кг, в группе, которой вводили антитело в дозе 8 мг/кг, скорость элиминации человеческого IL-8 была примерно в 2 раза медленнее.
Ниже в настоящем описании авторы изобретения описывают на научной основе предполагаемую сущность одного из возможных факторов, обусловливающих указанные выше результаты, однако сущность раздела В не ограничивается сущностью представленного ниже обсуждения.
Предпочтительно, чтобы среди антител, которые возвращаются из эндосомы в плазму посредством FcRn, доля связанных с человеческим IL-8 антител была низкой. Касательно человеческого IL-8, присутствующего в эндосоме, желательно, чтобы его большая доля находилась в свободной форме, не связанной с антителом. Когда человеческий IL-8 вводят вместе с антителом, которое не обладает рН-зависимой аффинностью к IL-8, то считается, что большая часть (почти 100%) человеческого IL-8 в эндосоме присутствует в составе комплексов с антителом, а в свободной форме находится небольшое количество (близкое к 0%). С другой стороны, при введении вместе с обладающим рН-зависимым связыванием с IL-8 антителом (например, H89/L118), определенная доля человеческого IL-8 должна присутствовать в эндосоме в свободной форме. Гипотетически долю свободной формы в этом случае можно определять следующим образом: [доля свободного человеческого IL-8 в эндосоме (%)] = [концентрация свободного человеческого IL-8 в эндосоме]/[общая концентрация человеческого IL-8 в эндосоме] × 100.
Желательно, чтобы доля свободного человеческого IL-8 в эндосоме, которую рассчитывают согласно приведенному выше уравнению, была более высокой и, например, 20% является более предпочтительной величиной, чем 0%, 40% более предпочтительно, чем 20%, 60% более предпочтительно, чем 40%, 80% более предпочтительно, чем 60% и 100% более предпочтительно, чем 80%.
Так, существует корреляция между долей свободного человеческого IL-8 в эндосоме, указанной выше, и аффинностью связывания (KD) и/или константой скорости реакции диссоциации (koff) для человеческого IL-8 при кислом рН. Она заключается в следующем: чем слабее аффинность связывания и/или чем больше скорость реакции диссоциации для человеческого IL-8 при кислом рН, тем выше доля свободного человеческого IL-8 в эндосоме. Однако, в случае обладающих рН-зависимым связыванием с IL-8 антител, которые приводят к тому, что доля свободного человеческого IL-8 в эндосоме близка к 100%, дополнительное ослабление аффинности связывания и/или повышение скорости реакции диссоциации при кислом рН не обязательно приводит к эффективному увеличению доли свободного человеческого IL-8. Легко можно понять, например, что если доля свободного человеческого IL-8 повышается с 99,9% даже до 99,99%, то такая степень повышения может не являться существенной.
Кроме того, согласно общей теории химического равновесия, когда антитело к IL-8 и человеческий IL-8 присутствуют вместе и реакция их связывания и реакция диссоциации достигли равновесия, то доля свободного человеческого IL-8 однозначно определяется тремя параметрами: концентрацией антитела, концентрацией антигена и константой диссоциации (KD). Следовательно, когда концентрация антитела высока, когда концентрация антигена является высокой или когда константа диссоциации (KD) мала, комплексы образуются легко и доля свободного человеческого IL-8 снижается. С другой стороны, когда концентрация антитела низка, когда концентрация антигена низка или когда константа диссоциации (KD) велика, образование комплексов затрудняется и доля свободного человеческого IL-8 увеличивается.
Между тем, в рассматриваемом эксперименте скорость элиминации человеческого IL-8 при введении H89/L118 в дозе 8 мг/кг была ниже, чем в случае, когда антитело вводили в дозе 2 мг/кг. Следовательно, это позволяет предположить, что в эндосоме доля свободного человеческого IL-8 снижалась, когда антитело вводили в дозе 8 мг/кг, по сравнению с тем случаем, когда антитело вводили в дозе 2 мг/кг. Причина этого снижения могла заключаться в том, что увеличение дозы антитела в четыре раза повышало концентрацию антитела в эндосоме и тем самым облегчало формирование комплекса IL-8-антитело в эндосоме. Это означает, что в группе, которой вводили повышенную дозу антитела, доля свободного человеческого IL-8 в эндосоме снижалась и, следовательно, снижалась скорость элиминации человеческого IL-8. Это позволяет также предположить, что когда антитело вводили в дозе 8 мг/кг, величина константы диссоциации (KD) H89/L118 в условиях кислого рН являлась недостаточной для доведения содержания свободного человеческого IL-8 почти до 100%. Более конкретно, если антитело, которое характеризуется большей величиной константы диссоциации (KD) (более слабое связывание) в условиях кислого рН, то оно может достигать состояния, в котором доля свободного IL-8 составляет почти 100%, даже тогда, когда антитело вводят в дозе 8 мг/кг и скорость элиминации человеческого IL-8 эквивалентна той, которая имеет место при введении антитела в дозе 2 мг/кг.
На основе представленных выше данных, для того, чтобы проверить, может ли представляющее интерес обладающее рН-зависимым связыванием с IL-8 антитело обеспечивать долю свободного человеческого IL-8 в эндосоме, составляющую почти 100%, можно проверить (но не ограничиваясь только этим), имеется ли возможность для увеличения степени обусловливающего элиминацию антигена действия in vivo или нет. Например, в одном из методов сравнивают скорость элиминации человеческого IL-8 при использовании нового обладающего рН-зависимым связыванием с IL-8 антитела со скоростью при использовании H89/L118, где новое антитело обладает более слабой аффинностью связывания при кислом рН и/или повышенной скоростью реакции диссоциации при кислом рН по сравнению с H89/L118. В том случае, когда указанное выше новое обладающее рН-зависимым связыванием с IL-8 антитело обусловливает скорость элиминации человеческого IL-8, эквивалентную той, которую обусловливает H89/L118, это позволяет предположить, что аффинность связывания и/или скорость реакции диссоциации H89/L118 при кислом рН уже находится на уровне, достаточном для достижения доли свободного человеческого IL-8 в эндосоме, составляющей почти 100%. С другой стороны, в тех случаях, когда вышеуказанное новое обладающее рН-зависимым связыванием с IL-8 антитело обусловливает более высокую скорость элиминации человеческого IL-8, это позволяет предположить, что имеется возможность повышения аффинности связывания и/или скорости реакции диссоциации H89/L118 при кислом рН.
Пример 12
Получение и оценка обладающего рН-зависимым связыванием с IL-8 антитела H553/L118
(12-1) Получение антитела H553/L118. обладающего рН-зависимой IL-8-связывающей способностью
В данном случае цель авторов изобретения состояла в том, чтобы создать антитела, обладающие еще более слабой аффинностью связывания с человеческим IL-8 в условиях кислого рН и/или более высокой скоростью реакции диссоциации, чем H89/L118.
Для получения модифицированных антител, представленных в таблице 17, интродуцировали аминокислотные модификации, главным образом с использованием гистидина, с помощью метода, сходного с методом, описанным в примере 9, применяя в качестве основы H89/L118. Кроме того, для этих антител определяли аффинность связывания с человеческим IL-8 с помощью метода, сходного с методом, описанным в примере 9-2.
Часть этих результатов представлена в таблице 17. Продемонстрировано, что антитело H553/L118, содержащее H553-IgG1 (SEQ ID NO: 90) в качестве тяжелой цепи и L118-k0MT в качестве легкой цепи, и антитело H496/L118, содержащее H496-IgG1 (SEQ ID NO: 101) в качестве тяжелой цепи и L118-k0MT в качестве легкой цепи, обладали более сильной зависимостью от рН, чем H89/L118.
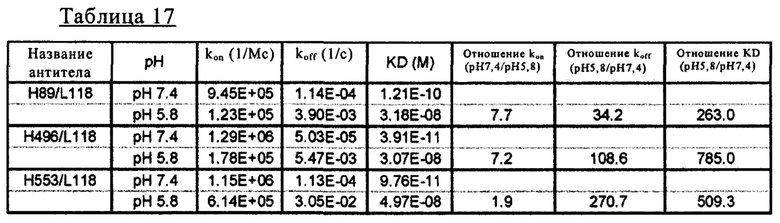
Полученное H553/L118 содержало две аминокислотные модификации, а именно Y55H и R57P, интродуцированные в тяжелую цепь H89/L118. С другой стороны, H496/L118, полученное путем интродукции только R57P в тяжелую цепь H89/L118, обладало повышенной аффинностью связывания с человеческим IL-8 при нейтральный рН, но слабо измененной аффинностью связывания с человеческим IL-8 при кислом рН, по сравнению с H89/L118. Более конкретно, модификация R57P, интродуцированная в H89/L118 представляет собой модификацию, которая повышает аффинность связывания с человеческим IL-8 только при нейтральном рН, не изменяя аффинность связывания при кислом рН. Кроме того, H553/L118, полученное путем интродукции модификации Y55H в тяжелую цепь H496/L118, обладало такой же или слегка повышенной аффинностью связывания при нейтральном рН, но, с другой стороны, пониженной аффинностью связывания при кислом рН по сравнению с H89/L118. Таким образом, интродукция комбинации двух аминокислотных модификаций, Y55H и R57P, в H89/L118 позволяла еще больше повышать способность к снижению аффинности связывания при кислом рН при сохранении или небольшом повышении аффинности связывания при нейтральном рН.
(12-2) Анализ ФК в организме мышей с использованием H553/L118
Оценку скорости элиминации человеческого IL-8 из организма мышей с использованием H553/L118 осуществляли с помощью метода, сходного с методом, описанным в примере 11-2. Полученные данные о концентрации человеческого IL-8 в плазме представлены на фиг. 24, а величины клиренса (CL) человеческого IL-8 из мышиной плазмы представлены в таблице 18.

В результате не было выявлено больших различий между H553/L118 и H89/L118 при сравнении данных, полученных на мышах, которым вводили антитело в дозе 2 мг/кг; однако, при сравнении данных, полученных на мышах, которым вводили антитело в дозе 8 мг/кг, было подтверждено, что H553/L118 ускоряет элиминацию человеческого IL-8 в 2,5 раза или около этого по сравнению с H89/L118. С другой точки зрения, для H553/L118 не было выявлено различия в скорости элиминации человеческого IL-8 при его введении в дозах 2 мг/кг и 8 мг/кг, а для H89/L118 не было обнаружено снижения скорости элиминации антигена, обусловленного увеличением дозы антитела.
Одной из причин (но не ограничиваясь только ей), по которой были получены такие результаты, может быть следующее. H533/L118 обеспечивало эквивалентную скорость элиминации человеческого IL-8 при введении в дозах 2 мг/кг и 8 мг/кг. Это может свидетельствовать о том, что доля свободного IL-8 в эндосоме могла достигать уровня, близкого к 100%, поскольку связывание IL-8 H553/L118 при кислом рН является достаточно слабым даже в условиях введения в дозе 8 мг/кг. Иными словами, это позволяет предположить, что хотя H89/L118 может обеспечивать максимальное действие в отношении элиминации человеческого IL-8 при его введении в дозе 2 мг/кг, его действия могут ослабевать при введении в высокой дозе, составляющей около 8 мг/кг. С другой стороны, H553/L118 может обеспечивать максимальное действие в отношении элиминации человеческого IL-8 даже при введении в высокой дозе 8 мг/кг.
(12-3) Оценка стабильности с использованием H553/L118
Было продемонстрировано, что H553/L118 представляет собой антитело, которое может ускорять элиминацию человеческого IL-8 из организма мышей в большей степени, чем H89/L118. Однако, для того, чтобы это антитело сохраняло ингибирующее действие на человеческий IL-8 в течение длительного периода времени in vivo, важно также, чтобы нейтрализующая IL-8 активность оставалась стабильной (стабильность нейтрализующей IL-8 активности этого антитела) в течение периода времени, пока введенное антитело присутствует in vivo (например, в плазме). Поэтому проводили оценку стабильности указанных антител в мышиной плазме с помощью описанного ниже метода.
Мышиную плазму собирали из крови мышей линии C57BL/6J (фирма Charles River) с помощью метода, известного в данной области. 200 мкл 200 мМ ЗФР (фирма Sigma, P4417) добавляли к 800 мкл мышиной плазмы с получением объема 1 мл. Кроме того, добавляли азид натрия до конечной концентрации 0,1% в качестве антисептика. Затем добавляли к указанной выше плазме каждое из антител (Hr9, H89/L118 и H553/L118) до конечной концентрации 0,2 мг/мл. В этот момент времени отбирали часть образца в качестве исходного образца. Оставшуюся часть образца хранили при 40°С. После хранения в течение одной недели и двух недель отбирали часть каждого образца и использовали в качестве образца, хранившегося в течение одной недели, и образца, хранившегося в течение двух недель. Все образцы замораживали при -80°С и хранили до осуществления анализа.
Затем анализировали антитела к IL-8, содержащиеся в мышиной плазме в отношении их нейтрализующей человеческий IL-8 активности следующим образом: CXCR1 и CXCR2 представляют собой известные рецепторы для человеческого IL-8. PathHunter®, клеточная линия СНО-К1 CXCR2 β-аррестин (фирма DiscoveRx Co., каталожный номер 93-0202С2) экспрессирует человеческий CXCR2 и представляет собой клеточную линию, искусственно созданную таким образом, чтобы испускать электрохемилюминесценцию при передаче опосредованных человеческим IL-8 сигналов. Нейтрализующую человеческий IL-8 активность, которой обладает антитело к человеческому IL-8, можно оценивать (но не ограничиваясь только этим) с использованием указанной клетки. Когда человеческий IL-8 добавляют к раствору культуры клеток, происходит испускание определенного уровня хемилюминесценции, который зависит от концентрации добавленного человеческого IL-8. Когда человеческий IL-8 и антитело к человеческому IL-8 добавляют вместе к раствору культуры, то трансдукция сигнала человеческого IL-8 может блокироваться при связывании антитела к человеческому IL-8 с человеческим IL-8. В результате хемилюминесценция, вызываемая добавлением человеческого IL-8, будет ингибироваться антителом к человеческому IL-8 и хемилюминесценция должна быть слабее, чем в случае, когда антитело не добавляют, или хемилюминесценции может не быть совсем. Следовательно, когда нейтрализующая человеческий IL-8 активность, которой обладает антитело, становится сильнее, то степень хемилюминесценции становится слабее; а когда нейтрализующая человеческий IL-8 активность, которой обладает антитело, становится слабее, то степень хемилюминесценции становится сильнее.
То же самое имеет место и в случае антитела, которое добавляли к мышиной плазме и хранили в течение определенного периода времени. Если нейтрализующая активность антитела в мышиной плазме не изменяется в процессе хранения, то степень указанной выше хемилюминесценции до и после хранения не должна изменяться. С другой стороны, в случае антитела, нейтрализующая активность которого снижается при хранении в мышиной плазме, степень хемилюминесценции при использовании находившегося на хранении антитела должна возрастать по сравнению со степенью до хранения.
Затем указанную выше клеточную линию использовали для изучения вопроса о том, сохраняется ли нейтрализующая активность антитела при хранении в мышиной плазме. Сначала клеточную линию суспендировали в реагенте Cell Plating 0 AssayComplete™ и затем высевали в 384-луночный планшет из расчета 5000 клеток/лунку. Через 1 день после начала культивирования клеток, проводили описанный ниже эксперимент для определения концентрации предназначенного для добавления человеческого IL-8. Серийно разведенные растворы человеческого IL-8, которые содержали конечные концентрации человеческого IL-8 от 45 нМ (400 нг/мл) до 0,098 нМ (0,1 нг/мл), добавляли к раствору клеточной культуры. Затем добавляли реагент для обнаружения согласно протоколу, прилагаемому к продукту, и определяли относительный уровень хемилюминесценции с использованием хемилюминесцентного детектора. На основе полученных данных подтверждали реактивность клеток в отношении человеческого IL-8 и определяли концентрацию человеческого IL-8, пригодную для подтверждения нейтрализующей активности антител к человеческому IL-8. В данном случае концентрацию человеческого IL-8 доводили до 2 нМ.
Затем мышиную плазму с добавленным вышеуказанным антителом к человеческому IL-8 использовали для оценки нейтрализующей активности содержащихся в ней антител. Человеческий IL-8 в определенной выше концентрации и содержащую вышеуказанное антитело к человеческому IL-8 мышиную плазму добавляли к клеточной культуре. Подлежащее добавлению количество мышиной плазмы определяли таким образом, чтобы она содержала ступенчатые концентрации антитела к человеческому IL-8 в диапазоне от 2 мкг/мл (13,3 нМ) до 0,016 мкг/мл (0,1 нМ). Затем добавляли реагенты для обнаружения согласно протоколу, прилагаемому к продукту, и проводили определение относительных уровней хемилюминесценции с использованием хемилюминесцентного детектора.
В данном случае рассчитывали относительные величины, представляющие собой относительные уровни хемилюминесценции для каждой концентрации антитела, принимая средний относительный уровень хемилюминесценции в лунках без добавления человеческого IL-8 и антитела за 0%, и принимая средний относительный уровень хемилюминесценции в лунках, в которые добавляли только человеческий IL-8, но не добавляли антитело, за 100%.
Результаты анализа ингибирования человеческого IL-8 с использованием экспрессирующих человеческий CXCR2 клеток представлены на фиг. 25А, где приведены результаты, полученные для исходного образца (без консервирующей обработки в мышиной плазме), на фиг. 25Б, где приведены результаты, полученные для образцов, хранившихся при 40°С в течение одной недели, и на фиг. 25В, где приведены результаты, полученные для образцов, хранившихся при 40°С в течение двух недель.
Результаты свидетельствуют о том, что не было обнаружено различий между Hr9 и H89/L118 в нейтрализующей человеческий IL-8 активности до и после хранения в мышиной плазме. С другой стороны, для H553/L118 продемонстрировано снижение нейтрализующей человеческий IL-8 активности после хранения в течение двух недель. Следовательно, нейтрализующая человеческий IL-8 активность H553/L118 быстро снижается в мышиной плазме по сравнению с активностью Hr9 и H89/L118, и было установлено, что H553/L118 представляет собой антитело, обладающее нестабильными свойствами с точки зрения нейтрализующей IL-8 активности.
Пример 13
Получение антител с пониженным баллом предсказанной иммуногенности, рассчитанным с использованием системы in silico
(13-1) Балл предсказанной иммуногенности различных связывающих IL-8 антител
Образование антител к лекарственным средствам (ADA) влияет на эффективность и фармакокинетические характеристики терапевтических антител и приводит в некоторых случаях к серьезным побочным действиям; и следовательно, клиническая применимость и лекарственная эффективность терапевтических антител могут ограничиваться образованием ADA. Известно, что на иммуногенность терапевтических антител влияют многие факторы и, в частности, много раз отмечалась важность эпитопов эффекторных Т-клеток в терапевтических антителах.
Разработаны «инструменты» in silico для предсказания Т-клеточных эпитопов, такие как Epibase (фирма Lonza), iTope/TCED (фирма Antitope) и EpiMatrix (фирма EpiVax). С использованием этих «инструменты» in silico можно предсказывать Т-клеточные эпитопы в любой аминокислотной последовательности (Walle и др., Expert Opin. Biol. Ther. 7(3), 2007, ее. 405-418) и можно оценивать потенциальную иммуногенность терапевтических антител.
Для расчета баллов иммуногенности оцениваемых вариантов Fc применяли EpiMatrix. EpiMatrix представляет собой систему предсказания иммуногенности представляющего интерес белка на основе автоматического конструирования последовательностей пептидных фрагментов путем секционирования аминокислотной последовательности белка, для которого требуется предсказать его иммуногенность, на девять аминокислот и затем расчета их способности связываться с восемью основными аллелями ГКС класса II (DRB1*0101, DRB1*0301, DRB1*0401, DRB1*0701, DRB1*0801, DRB1*1101, DRB1*1301 и DRB1*1501) (Clin. Immunol. 131(2), 2009, ее. 189-201).
Баллы иммуногенности тяжелых цепей и легких цепей каждого антитела к IL-8, которые были рассчитаны согласно описанному выше методу, представлены в таблице 19 в колонке, озаглавленной «EpiMatrix Score». Кроме того, в колонке, озаглавленной «tReg Adjusted Epx Score», представлены баллы иммуногенности, указанные в EpiMatrix Score, которые были скорректированы на содержание Tregitope. Tregitope представляет собой последовательность пептидного фрагмента, присутствующую в больших количествах главным образом в последовательностях встречающихся в естественных условиях антител, и представляет собой последовательность, которая, как считается, ингибирует иммуногенность путем активации регуляторных Т-клеток (Treg).
Кроме того, для этих баллов в колонке, озаглавленной «Сумма» представлены сумма баллов для тяжелой и легкой цепей.
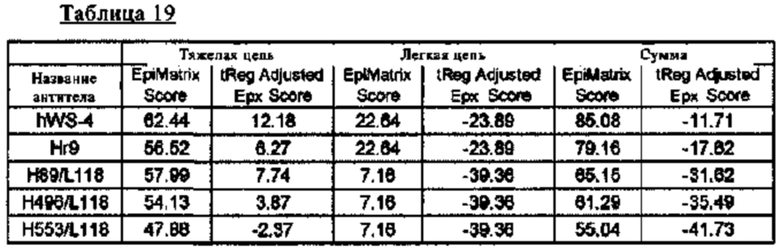
Согласно этим результатам данные, представленные как в «EpiMatrix Score», так и в «tReg Adjusted Epx Score», свидетельствуют о том, что баллы иммуногенности для H89/L118, H496/L118 и H553/L118 являются более низкими по сравнению баллами для hWS-4, которое представляет собой известное гуманизированное антитело к человеческому IL-8.
Кроме того, с использованием EpiMatrix, можно сравнивать предсказанную частоту образования ADA для молекулы антитела как целого путем сравнения баллов для тяжелой цепи и легкой цепи с фактической частотой образования ADA, обусловленного различными поступающими в продажу антителами. Результаты осуществления такого анализа представлены на фиг. 26. Вследствие ограничений, накладываемых системой, на фиг. 26 использованы следующие обозначения: «WS4» для hWS-4, «HR9» для Hr9, «H89L118» для H89/L118, «H496L118» для H496/L118 и «H553L118» для H553/L118.
Известно, что частота образования ADA в организме человека для различных поступающих в продажу антител составляет: 45% для кампата (алемтузумаб), 27% для ритуксана (ритуксимаб) и 14% для зенапакса (даклизумаб), что представлено на фиг. 26. С другой стороны, в то время как частота образования ADA, предсказанная на основе аминокислотных последовательностей, составляла 10,42% для hWS-4, которое представляет собой известное гуманизированное антитело к человеческому IL-8, частоты для новых идентифицированных при создании изобретения антител H89/L118 (5,52%), H496/L118 (4,67%) или H553/L118 (3,45%) были существенно меньше по сравнению с частотой для hWS-4.
(13-2) Получение модифицированных антител с пониженными баллами предсказанной иммуногенности
Как указано выше, баллы иммуногенности для H89/L118, H496/L118 и H553/L118 были меньше, чем для hWS-4; однако, как следует из таблицы 19, баллы иммуногенности для тяжелой цепи больше, чем баллы для легких цепей, это позволяет предположить, что в данном случае еще есть возможность улучшения аминокислотных последовательностей тяжелой цепи, прежде всего с точки зрения иммуногенности. Поэтому осуществляли поиск аминокислотных модификаций вариабельной области тяжелой цепи Н496, которые могут снижать балл иммуногенности. В результате тщательного поиска были найдены три варианта, H496v1, в котором аланин в положении 52с согласно нумерации Кэбота был заменен на аспарагиновую кислоту, H496v2, в котором глутамин в положении 81 был заменен на треонин, и H496v3, в котором серин в положении 82b был заменен на аспарагиновую кислоту. Кроме того, был получен вариант H1004, содержащий все три указанные модификации.
Результаты расчета баллов иммуногенности с помощью метода, сходного с методом, описанным в примере 13-1, представлены в таблице 20.
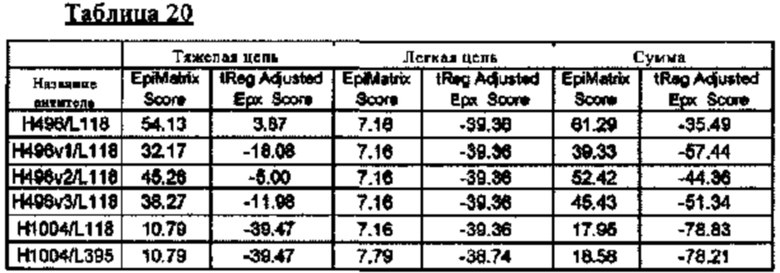
Три тяжелые цепи, H496v1, H496v2 и H496v3, каждая из которых содержит одну модификацию, характеризовались более низкими баллами иммуногенности по сравнению с Н496. Кроме того, в случае H1004, которая содержала комбинацию трех модификаций, было достигнуто существенное улучшение балла иммуногенности.
В данном случае было установлено, что помимо L118, L395 представляет собой легкую цепь, пригодную для использования в комбинации с Н1004. Поэтому при расчете баллов иммуногенности использовали как комбинацию с L118, так и комбинацию с L395. Как продемонстрировано в таблице 20, H1004/L118 и H1004/L395, представляющие собой комбинации тяжелой цепи и легкой цепи, также характеризовались очень низкими баллами иммуногенности.
Затем для указанных комбинаций предсказывали частоту образования ADA с помощью метода, сходного с методом, описанным в примере 13-1. Результаты представлены на фиг. 27. На фиг. 27 использованы следующие обозначения: «V1» для H496v1/L118, «V2» для H496v2/L118, «V3» для H496v3/L118, «H1004L118» для H1004/L118H «H1004L395» для H1004/L395.
Неожиданно было установлено, что H1004/L118 и H1004/L395, которые имели существенно более низкие баллы иммуногенности, характеризовались также улучшенными величинами частоты образования ADA, для них предсказанная величина равна 0%.
(13-3) Измерение IL-8-связывающей аффинности H1004/L395
Получали H1004/L395, которое представляет собой антитело, содержащее H1004-IgG1m (SEQ ID NO: 91) в качестве тяжелой цепи и L395-k0MT (SEQ ID NO: 82) в качестве легкой цепи. Аффинность связывания H1004/L395 с человеческим IL-8 измеряли согласно описанному ниже методу с использованием устройства BIACORE T200 (фирма GE Healthcare).
Применяли два указанных ниже подвижных буфера, измерения проводили при соответствующих температурах: (1) 0,05% Твин20, 40 мМ ACES, 150 мМ NaCl, рН 7,4, 40°С; и (2) 0,05% Твин20, 40 мМ ACES, 150 мМ NaCl, pH 5,8, 37°С.
Белок А/G (фирма PIERCE) в соответствующем количестве иммобилизовали на сенсорном чипе СМ4 (фирма GE Healthcare) с помощью метода аминного сочетания и захватывали представляющие интерес антитела. Затем инъецировали разведенный раствор человеческого IL-8 или подвижный буфер (который применяли в качестве референс-раствора) для осуществления взаимодействия антител, захваченных на сенсорном чипе, с человеческим IL-8. В качестве подвижного буфера использовали один из указанных выше растворов и соответствующие буферы использовали также для разведения человеческого IL-8. Для регенерации сенсорного чипа применяли 25 мМ NaOH и 10 мМ глицин-НС! (рН 1,5). KD (М) для каждого антитела, характеризующую связывание с человеческим IL-8, рассчитывали на основе константы скорости реакции ассоциации kon (1/Mc) и константы скорости реакции диссоциации koff (1/c), которые представляют собой кинетические параметры, рассчитанные на основе сенсограмм, полученных при измерениях. Для расчета каждого параметра применяли программное обеспечение BIACORE T200 Evaluation (фирма GE Healthcare).
Результаты измерений представлены в таблице 21. По сравнению с H89/L118, H1004/L395, имеющее более низкий балл иммуногенности, имело эквивалентную величину KD для человеческого IL-8 при нейтральном рН, но более высокие величины KD и koff при кислом рН; и было установлено, что оно обладало способностью быстро отделяться в результате диссоциации от IL-8 в эндосоме.
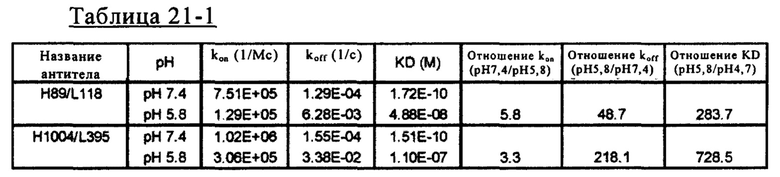
Пример 14
Получение и оценка обладающего рН-зависимым связыванием с IL-8 антитела H1009/L395
(14-1) Получение различных обладающих рН-зависимым связыванием с IL-8 антител
Получали H1004/L395, которое обладает рН-зависимой IL-8-связывающей способностью, а также пониженным баллом иммуногенности, осуществляя оценку согласно методу, описанному в примере 13. После этого проводили специальное исследование для получения вариантов, которые обладали указанными предпочтительными свойствами, а также стабильностью в мышиной плазме.
На основе H1004/L395 получали представленные ниже модифицированные антитела путем интродукции различных модификаций.

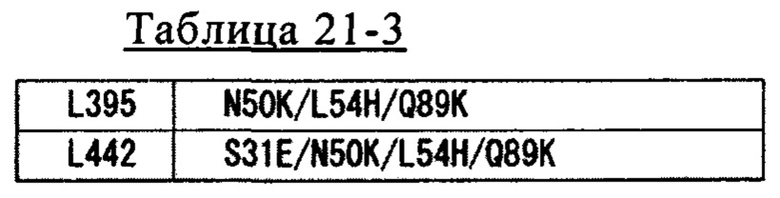
В общей сложности было получено 36 типов антител путем объединения 18 типов тяжелых цепей и двух типов легких цепей, описанных выше. Для этих антител проводили различные оценки согласно описанному ниже методу.
Аффинности связывания с человеческим IL-8 в условиях нейтрального и кислого рН измеряли методом, сходным с методом, описанном в примере 13-3. Из числа полученных результатов в таблице 22 представлены KD при рН 7,4 и KD и koff при рН 5,8.
Затем с помощью описанного ниже метода оценивали стабильность в отношении связывания IL-8 при хранении антител в ЗФР.
Соответствующие антитела подвергали в течение ночи диализу в противотоке D-ЗФР (фирма Sigma-Aldrich) и затем концентрацию каждого из антител доводили до 0,1 мг/мл. В это момент времени некоторые образцы антител собирали в качестве исходных образцов. Оставшиеся образцы хранили при 50°С в течение одной недели и затем собирали в качестве образцов для ускоренного теста при повышенной температуре.
Затем осуществляли измерение методом BIACORE аффинности связывания с IL-8 с использованием исходных образцов и образцов для ускоренного теста при повышенной температуре.
Уровни связывания человеческого IL-8 с модифицированными антителами анализировали с использованием устройства BIACORE T200 (фирма GE Healthcare). Измерения осуществляли при 40°С с использованием 0,05% Твин20, 40 мМ ACES и 150 мМ NaCl с рН 7,4 в качестве подвижного буфера.
Белок A/G (фирма PIERCE) в соответствующем количестве иммобилизовали на сенсорном чипе СМ4 (фирма GE Healthcare) с помощью метода аминного сочетания и захватывали представляющие интерес антитела. Затем инъецировали разведенный раствор человеческого IL-8 или подвижный буфер (который применяли в качестве референс-раствора) для осуществления взаимодействия антител, захваченных на сенсорном чипе, с человеческим IL-8. Подвижный буфер использовали также для разведения человеческого IL-8. Для регенерации сенсорного чипа применяли 25 мМ NaOH и 10 мМ глицин-HCl (рН 1,5). Измеренный уровень связывания человеческого IL-8 и количество антител, захваченных при этом уровне связывания, рассчитывали с помощью программного обеспечения BIACORE T200 Evaluation (фирма GE Healthcare).
Рассчитывали количество связываний человеческого IL-8 на соответствующее 1000 RU количество захваченного антитела для исходных образцов и образцов для ускоренного теста при повышенной температуре. Кроме того, рассчитывали отношение уровня связывания человеческого IL-8 для исходных образцов к уровню связывания для образцов для ускоренного теста при повышенной температуре.
Полученные отношения уровня связывания человеческого IL-8 для исходных образцов к уровню связывания для образцов для ускоренного теста при повышенной температуре также представлены в таблице 22.
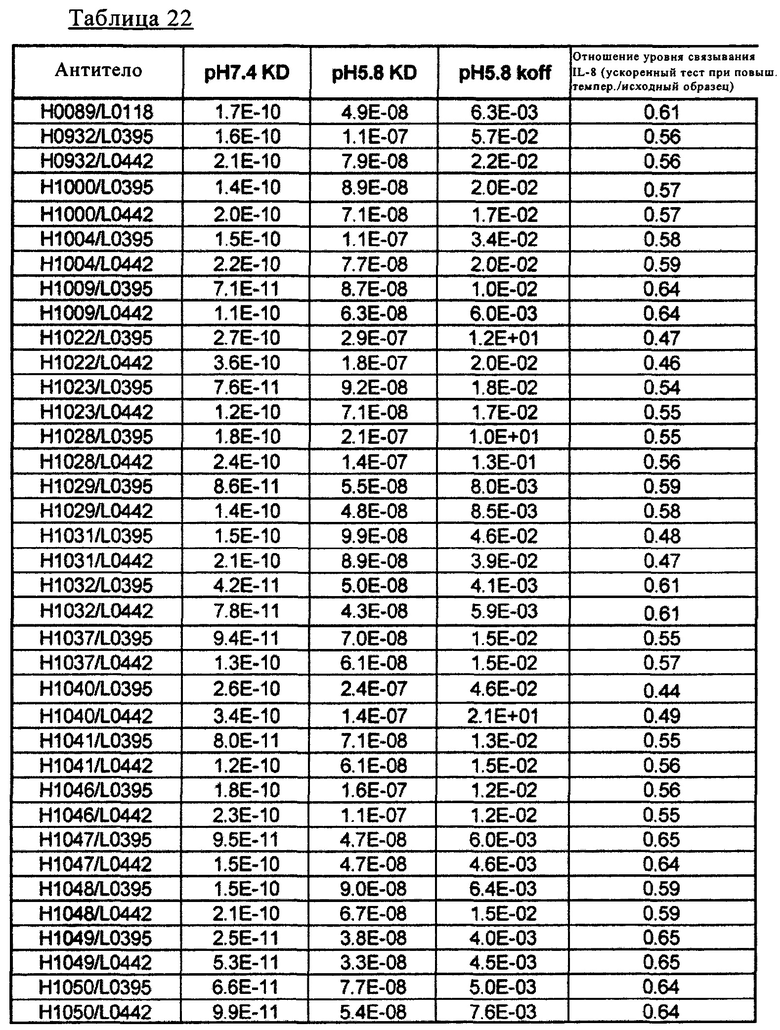
На основе описанного выше исследования было получено антитело H1009/L395, которое представляло собой антитело, содержащее H1009-IgG1m (SEQ ID NO: 92) в качестве тяжелой цепи и L395-k0MT в качестве легкой цепи.
Как продемонстрировано в таблице 22, по сравнению с H89/L118 H1009/L395 обладало немного более высокой аффинностью связывания с человеческим IL-8 при нейтральном рН, но, с другой стороны, пониженной аффинностью связывания при кислый рН, это означает, что его рН-зависимость была еще более сильной. Кроме того, при его нахождении в строгих условиях, таких как 50°С в ЗФР, H1009/L395 обладало несколько более высокой стабильностью касательно связывания с IL-8 по сравнению со стабильностью H89/L118.
Поэтому H1009/L395 было выбрано в качестве антитела, чья нейтрализующая активность в мышиной плазме может поддерживаться на стабильном уровне, при сохранении его рН-зависимой способности к связыванию с IL-8.
(14-2) Оценка стабильности H1009/L395
Затем, методом, аналогичным методу, описанному в примере 12-3, оценивали, сохраняется ли нейтрализующая IL-8 активность H1009/L395 в стабильном состоянии в мышиной плазме. В этом опыте использовали H1009/L395-F1886s, которое более подробно будет описано в примере 19. Это антитело имело такую же вариабельную область, что и H1009/L395, а его константная область имела модификации, повышающие связывание FcRn в условиях кислого рН, и модификации, снижающие его связывание с FcγR, по сравнению с нативным человеческим IgG1. Вариабельная область H1009/L395, прежде всего область вокруг HVR, ответственна за связывание с человеческим IL-8 и нейтрализующую IL-8 активность этого антитела, и считается, что модификации, интродуцированные в константную область, не влияют на указанные свойства.
Оценку стабильности в мышиной плазме осуществляли следующим образом. 150 мкл 200 мМ фосфатного буфера (рН 6,7) добавляли к 585 мкл мышиной плазмы. Затем добавляли азид натрия в качестве антисептика в конечной концентрации 0,1%. Каждое антитело (Hr9, H89/L118 или H1009/L395-F1886s) добавляли к указанной выше мышиной плазме в конечной концентрации 0,4 мг/мл. В этот момент времени часть образца отбирали в качестве исходного образца. Оставшийся образец хранили при 40°С. Через 1 неделю и две недели после начала хранения часть каждого образца отбирали и их использовали в качестве образца, хранившегося в течение 1 недели, и образца, хранившегося в течение 2 недель. Все образцы замораживали при -80°С и хранили вплоть до осуществления каждого анализа.
Измерение нейтрализующей человеческий IL-8 активности осуществляли с использованием экспрессирующих человеческий CXCR2 клеток с помощью метода, аналогичного описанному в примере 12-3. Однако концентрация человеческого IL-8, которую применяли для подтверждения нейтрализующей активности антитела к человеческому IL-8, в этом опыте составляла 1,2 нМ.
Результаты анализа ингибирования человеческого IL-8, полученные с использованием указанных выше антител и экспрессирующих человеческий CXCR2 клеток, приведены на фиг. 28А, где представлены результаты для исходного образца (который не подвергали хранению в мышиной плазме), фиг. 28Б, где представлены результаты для образцов, которые хранили при 40°С в течение 1 недели, и на фиг. 28В, где представлены результаты для образцов, которые хранили при 40°С в течение 2 недель.
В результате неожиданно было установлено, что, нейтрализующая активность H1009/L395-F1886s в отношении человеческого IL-8 сохранялась даже после его хранения в мышиной плазме при 40°С в течение 2 недель и нейтрализующая человеческий IL-8 активность оказалась более стабильной, чем в случае Н553/L118.
(14-3) Анализ ФК в организме мышей с использованием H1009/L395
Скорость элиминации человеческого IL-8 антителом Н1009/Н395 в организме мышей оценивали с использованием следующего метода. В качестве антител применяли H1009/L395, H553/L118 и H998/L63. Введение мышам и сбор крови, а также измерение концентрации человеческого IL-8 в плазме мышей осуществляли с помощью метода, описанного в примере 11.
Полученные в результате данные о концентрации человеческого IL-8 в плазме, представлены на фиг. 29, а данные о величине клиренса человеческого IL-8 (CL) из плазмы мышей представлены в таблице 23.
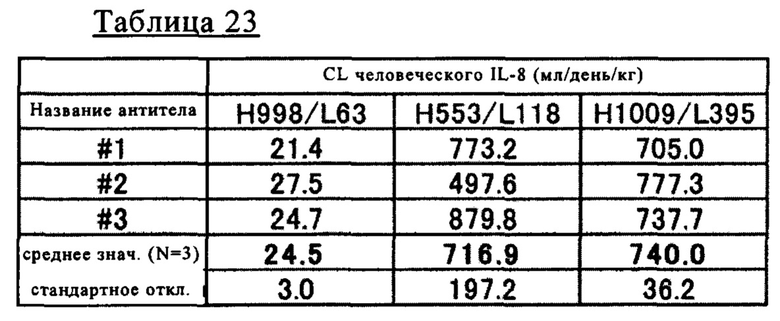
В результате установлено, что скорость элиминации человеческого IL-8 из организма мышей при введении H1009/L395 в дозе 2 мг/кг, была эквивалентна скорости элиминации при введении H553/L118, и установлено, что при применении H1009/L395 достигался практически 100%-ный уровень свободного IL-8 в эндосоме. Установлено, что величина клиренса (CL), которая является количественным показателем скорости элиминации человеческого IL-8 из плазмы мышей, примерно в 30 раз выше, чем при применении H998/L63.
Воздействие повышение скорости элиминации человеческого IL-8 можно объяснять следующим образом (но не ограничиваясь только им). Как правило, в живом организме, в котором концентрации антигенов поддерживаются примерно на постоянном уровне, скорости образования и скорости элиминации антигенов должны также поддерживаться примерно на постоянных уровнях. Когда в таких условиях вводят антитела, даже в тех случаях, когда не оказывается воздействия на скорость образования антигенов, скорости элиминации антигенов могут изменяться из-за образования комплексов антигена с антителом. Как правило, поскольку скорость элиминации антигена выше, чем скорость элиминации антитела, то в таких случаях скорость элиминации антигенов, образующих комплексы с антителом, снижается. Когда скорость элиминации антигена снижается, концентрация антигена в плазме возрастает, но уровень повышения в этом случае можно определят также как соотношение скорости элиминации, когда антиген присутствует в несвязанном состоянии, и скорости элиминации, когда антиген образует комплекс. Это означает, что по сравнению со скоростью элиминации, когда антиген присутствует в несвязанном состоянии, если скорость элиминации при образовании комплекса снижается на 1/10, то концентрация антигена в плазме организма, которому вводят антитело, может повышаться примерно вплоть до 10 раз по сравнению с концентрацией до введения антитела. В контексте настоящего описания клиренс (CL) можно использовать в качестве скорости элиминации. Более конкретно, увеличение концентрации антигена (накопление антигена), которое имеет место после введения антитела в организм, можно определять по CL антигена в каждом варианте условий, т.е. перед введением антитела и после введения антитела.
В настоящем описания наличие примерно 30-кратного различия в CL человеческого IL-8 при введении H998/L63 и H1009/L395 позволяет предположить, что может быть примерно 30-кратное различие между уровнями повышения концентрации человеческого IL-8 в плазме при введении этих антител людям. Кроме того, создание 30-кратного различия в концентрации человеческого IL-8 в плазме свидетельствует о том, что может иметь место также примерно 30-кратное различие в количестве антител, необходимых для полной блокады биологической активности человеческого IL-8 в соответствующих условиях. Это означает, что по сравнению с H998/L63 H1009/L395 может блокировать биологическую активность IL-8 в плазме при использовании примерно 1/30 количества, что представляет собой очень небольшое количество антитела. Кроме того, когда H1009/L395 и H998/L63 вводят индивидуально человеку в одинаковой дозе, то H1009/L395 может блокировать биологическую активность IL-8 в течение более длительного периода времени с большей силой. Для блокады биологической активности IL-8 в течение длительного периода времени необходимо, чтобы IL-8-нейтрализующая активность стабильно сохранялась. Как продемонстрировано в примере 14, эксперименты с использованием мышиной плазмы свидетельствуют о том, что H1009/L395 может сохранять нейтрализующую человеческий IL-8 активность в течение длительного периода времени. Установлено также, что H1009/L395, который обладает такими важными отличительными свойствами, является антителом с предпочтительными воздействиями с точки зрения эффективности в отношении нейтрализации IL-8 in vivo.
Пример 15
Оценка связывания с внеклеточным матриксом с использованием рН-зависимого IL-8-связывающего антитела H1009/L395
Очень высокое (увеличенное в 30 раз) воздействие H1009/L395 в отношении элиминации человеческого IL-8, описанное в примере 14, являлось неожиданным. Известно, что скорость элиминации антигена при введении рН-зависимого антигенсвязывающего антитела зависит от скорости поглощения комплекса антитело-антиген клетками. Это означает, что, если скорость поглощения клетками рН-зависимого антигенсвязывающего антитела повышается при образовании комплекса антиген-антитело комплекс по сравнению с вариантом без образования комплекса, то элиминация антигена рН-зависимым антителом может увеличиваться. Известные методы повышения скорости поглощения антитела клетками включают метод придания антителу FcRn-связывающей способности в условиях нейтрального рН (WO 2011/122011), метод повышения связывающей способности антитела в отношении FcγR (WO 2013/047752) и метод, в котором применяют ускорение формирования комплексов, содержащих многовалентное антитело и многовалентный антиген (WO 2013/081143).
Однако указанные выше методики не использовали для константных областей H1009/L395. Кроме того, хотя известно, что IL-8 образует гомодимер, установлено, что человеческий IL-8, связанный H1009/L395, присутствует в форме мономера, поскольку H1009/L395 распознает образующую гомодимер поверхность человеческого IL-8. Следовательно, это антитело не может образовывать многовалентные комплексы.
Более конкретно, хотя вышеописанные методики не применялись для H1009/L395, H1009/L395 обладает повышенным в 30 раз элиминирующим человеческий IL-8 действием.
В результате при создании изобретения рассматривали в качестве возможного фактора, который может обусловливать вышеуказанные свойства рН-зависимых IL-8-связывающих антител, представителем которых является H1009/L395. Однако в нижеприведенном обсуждении описана лишь возможность, предполагаемая заявителями на основе известного уровня техники, и сущность раздела В описания не ограничивается сущностью представленного ниже обсуждения.
Человеческий IL-8 представляет собой белок с высокой изоэлектрической точкой (р1), и теоретическая изоэлектрическая точка, рассчитанная с помощью известного метода, составляет примерно 10. Это означает, что в условиях нейтрального рН человеческий IL-8 представляет собой белок, заряд которого сдвинут в сторону положительных значений. рН-зависимые IL-8-связывающие антитела, представителем которых является H1009/L395, также представляют собой белки, заряд которых сдвинут в сторону положительных значений, и теоретическая изоэлектрическая точка H1009/L395 составляет примерно 9. Это означает, что изоэлектрическая точка комплекса, образовавшегося в результате связывания H1009/L395, т.е. белка, который имеет высокую изоэлектрическую точку и исходно богат положительными зарядами, с человеческим IL-8, который имеет высокую изоэлектрическую точку, должна быть выше, чем у H1009/L395 в несвязанном состоянии.
Как описано в примере 3, можно предположить, что повышение изоэлектрической точки антитела, что включает увеличение количества положительных зарядов и/или уменьшение количества отрицательных зарядов на антителе, должно повышать неспецифическое поглощение клетками комплекса антитело-антиген. Изоэлектрическая точка комплекса, образованного между антителом к IL-8 и человеческим IL-8, который имеет высокую изоэлектрическую точку, выше, чем изоэлектрическая точка антитела к IL-8 в несвязанном состоянии, и комплекс может быстрее поглощаться клетками.
Как описано ранее, аффинность к внеклеточному матриксу также является фактором, который может влиять на поглощение клетками. Поэтому при создании изобретения определяли, существует ли различие в способности связывать внеклеточный матрикс между антителом в несвязанном состоянии и входящим в комплекс антителом к человеческому IL-8.
Оценка количества антитела, связывающегося с внеклеточным матриксом. с помощью метода ECL (электрохемилюминисценция)
Внеклеточный матрикс (BD Matrigel Basement Membrane Matrix;
производство фирмы BD) разводили до концентрации 2 мг/мл с использованием TBS (фирма Takara). Разведенный внеклеточный матрикс вносили на 96-луночный планшет MULTI-ARRAY, High bind, Bare (производство фирмы Meso Scale Discovery:MSD) из расчета 5 мкл на лунку и иммобилизовали в течение ночи при 4°С. Затем осуществляли блокирование с помощью 20 мМ ACES-буфера, рН 7,4, содержащего 150 мМ NaCl, 0,05% Твин 20, 0,5% БСА и 0,01% NaN3.
Предназначенные для оценки антитела получали следующим образом. Образцы антител, предназначенные для индивидуального добавления, получали путем разведения каждого антитела до концентрации 9 мкг/мл, используя буфер 1 (20 мМ ACES-буфер содержащий 150 мМ NaCl, 0,05% Твин20 и 0,01% NaN3, pH 7,4), а затем дополнительно разводили их буфером 2 (20 мМ ACES-буфер, содержащий 150 мМ NaCl, 0,05% Твин20, 0,1% БСА и 0,01% NaN3, pH 7,4) до конечной концентрации 3 мкг/мл.
С другой стороны, образцы антител, предназначенные для добавления в виде комплекса с человеческим IL-8, получали путем добавления человеческого IL-8 в 10-кратной молярной концентрации относительно антитела к образцу антитела, затем разводили каждое антитело с помощью буфера-1 до получения концентрации антитела 9 мкг/мл соответственно, а затем дополнительно разводили каждое из них с помощью буфера-2 до конечной концентрации антитела 3 мкг/мл. При этом концентрация человеческого IL-8 составляла примерно 0,6 мкг/мл. Смесь встряхивали при комнатной температуре в течение 1 ч для образования комплекса.
Затем разведенные растворы только антитела или антитела в комплексе добавляли на планшет, из которого был удален блокирующий раствор, и планшет встряхивали при комнатной температуре в течение 1 ч. Затем, после удаления раствора, содержащего несвязанное антитело, или раствора, содержащего комплекс, добавляли буфер-1, содержащий 0,25% глутарового альдегида. Затем после выстаивания планшета в течение 10 мин его промывали D-ЗФР (производство фирмы Wako Pure Chemical Industries), содержащим 0,05% Твин 20. Антитела для ECL-обнаружения получали путем конъюгирования с сульфо-меткой козьего античеловеческого IgG (гамма) (производство фирмы Zymed Laboratories) с использованием сложного NHS-эфира с сульфо-меткой (производство фирмы MSD). Антитела для ECL-обнаружения разводили в буфере-2 до концентрации 1 мкг/мл, добавляли на планшет и затем встряхивали в темноте при комнатной температуре в течение 1 ч. Антитела для ECL-обнаружения удаляли и добавляли 2-кратно разведенный раствор, полученный путем разведения буфера для считывания MSD Read Buffer Т (4х) (производство фирмы MSD) ультрачистой водой; и затем измеряли уровень люминесценции с помощью устройства SECTOR Imager 2400 (производство фирмы MSD).
Результаты представлены на фиг. 30. Важно отметить, что все антитела к IL-8, такие как H1009/L395, характеризовались слабой способностью связываться с внеклеточным матриксом в виде несвязанного антитела (-IL8), но связывались с внеклеточным матриксом после образования комплекса с человеческим IL-8 (+hIL8).
Как описано выше, способность антител к IL-8 к приобретению аффинности к внеклеточному матриксу путем связывания с человеческим IL-8 не была объяснена. Кроме того, объединение указанных свойств с рН-зависимым связыванием у IL-8-связывающих антител (но не ограничиваясь только указанным) позволяет повышать скорость элиминации IL-8 более эффективно.
Пример 16
Анализ ФК в организме мышей с использованием не связывающих FcRn антител
Приведенный ниже метод применяли для подтверждения образования комплекса между человеческим IL-8 и а рН-зависимым IL-8-связывающим антителом и повышения поглощения указанного комплекса клетками в организме мышей.
Сначала получали вариант антитела, содержащий вариабельную область H1009/L395 и Fc-область с дефицитом аффинности связывания с различными Fc-рецепторами. В частности, в качестве модификаций, предназначенных для устранения способности связывания с человеческим FcRn в условиях кислого рН, тяжелую цепь H1009-IgG1 подвергали замене на аланин изолейцина в положении 253 и на аспарагиновую кислоту серина в положении 254 согласно EU-нумерации. Кроме того, в качестве модификаций, предназначенных для устранения связывания с мышиными FcγR, лейцин в положении 235 заменяли на аргинин, глицин в положении 236 заменяли на аргинин и серии в положении 239 заменяли на лизин. Получали H1009-F1942m (SEQ ID NO: 93) в качестве тяжелой цепи, содержащей четыре указанные модификации. Кроме того, получали антитело H1009/L395-F 1942m, содержащее H1009-F1942m в качестве тяжелой цепь и L395-k0MT в качестве легкой цепи.
Поскольку антитело, которое имеет указанную Fc-область, обладает дефицитом аффинности связывания с FcRn в условиях кислого рН, оно не переносится из эндосомы в плазму. Следовательно, указанное антитело быстро элиминируется из плазмы в живом организме относительно антитела, которое содержит нативную Fc-область. В этом случае после поглощения клетками антител, которые содержат нативную Fc-область, только их часть, которая не спасается с помощью FcRn, расщепляется после переноса в лизосому, но в случае антител, содержащих Fc-область, которая не обладает аффинностью связывания с FcRn, все антитела, поглощенные клетками, расщепляются в лизосомах. Более конкретно, в случае антител, которые содержат указанную модифицированную Fc-область, скорость элиминации введенного антитела из плазмы может быть эквивалентной скорости включения в клетки. Это означает, что скорость внутриклеточного поглощения антитела, аффинность связывания с FcRn которого устранена, можно определять также путем измерения скорости элиминации этих антител из плазмы.
Далее определяли, повышается ли внутриклеточное поглощение комплекса, образовавшегося между H1009/L395-F1942m и человеческим IL-8, по сравнению с поглощение не включенного в комплекс H1009/L395-F1942m. В частности, определяли, будет ли изменяться скорость элиминации антитела из плазмы, когда антитело вводят индивидуально и когда антитело вводят после образования комплекса с человеческим IL-8.
Соответствующую биокинетику антитела к человеческому IL-8 оценивали в случаях, когда антитело к человеческому IL-8 вводили индивидуально трансгенным по человеческому FcRn мышам (B6.mFcRn-/-.hFcRn Tg-мыши линии 32 +/+; фирма Jackson Laboratories; Methods Mol. Biol. 602, 2010, cc. 93-104) и когда человеческий IL-8 и антитело к человеческому IL-8 вводили одновременно трансгенным по человеческому FcRn мышам. Раствор антитела к человеческому IL-8 (200 мкг/мл) и раствор, содержащий смесь человеческого IL-8(10 мкг/мл) и антитела к человеческому IL-8 (200 мкг/мл), вводили индивидуально однократно в дозе 10 мл/кг в хвостовую вену. В этом случае, поскольку антитело к человеческому IL-8 присутствовало в существенном избытке относительно человеческого IL-8, почти весь человеческий IL-8 должен связаться с антителом. Образцы крови получали через 5 мин, 2 ч, 7 ч, 1 день и 2 дня после введения. Собранную кровь сразу же центрифугировали при 4°С и 15000 об/мин в течение 15 мин для получения плазмы. Отделенную плазму хранили в морозильной камере при -20°С или ниже, до осуществления измерений.
Концентрации антитела к человеческому IL-8 в плазме мышей измеряли электрохемилюминисцентным методом. Сначала давали прореагировать биотинилированному козьему антителу к легкой каппа-цепи человеческого Ig (фирма IBL) с покрытым стрептавидином планшетом Gold Multi-ARRAY (фирма Meso Scale Discovery), который предварительно блокировали в течение ночи при комнатной температуре с использованием раствора ЗФР-Твин, содержащего 5% (мас./об.) БСА, при комнатной температуре в течение 1 ч с получением планшета, с иммобилизованным античеловеческим антителом. Приготавливали образцы для калибровочной кривой, содержащие антитело к человеческому IL-8 в концентрациях 3,20, 1,60, 0,800, 0,400, 0,200, 0,100 и 0,0500 мкг/мл в плазме, и образцы для измерения в мышиной плазме, разведенные в 100 раз или более. Каждый образец смешивали с человеческим IL-8 и затем вносили в планшет с иммобилизованный античеловеческим антителом из расчета 50 мкл на лунку и затем перемешивали при комнатной температуре в течение 1 ч. Конечную концентрацию человеческого IL-8 доводили до 333 нг/мл.
Затем добавляли в планшет антитело к человеческому IL-8 (полученное в лаборатории заявителей), содержащее константную область мышиного IgG, и давали прореагировать при комнатной температуре в течение 1 ч. Кроме того, в планшет добавляли антимышиный IgG (фирма BECKMAN COULTER), меченный рутением, с использованием сложного NHS-эфира с сульфо-меткой (фирма Meso Scale Discovery) и давали прореагировать в течение 1 ч. Затем сразу после добавления в планшет буфера для считывания Т(×1) (фирма Meso Scale Discovery) осуществляли измерение с использованием SECTOR Imager 2400 (фирма Meso Scale Discovery). Концентрацию антитела к человеческому IL-8 рассчитывали на основе ответа с использованием калибровочной кривой с помощью аналитического программного обеспечения SOFTmax PRO (фирма Molecular Devices).
Полученные в результате концентрации антитела в мышиной плазме, представлены на фиг. 31, а данные о клиренсе антитела в соответствующих условиях представлены в таблице 24.

Установлено, что скорость внутриклеточного поглощения комплекса H1009/L395-F1942m и человеческого IL-8 увеличивалась по меньшей мере в 2,2 раза по сравнению со скоростью поглощения H1009/L395-F1942m. Следует отметить, что в контексте настоящего описания указано «по меньшей мере в 2,2 раза», поскольку по указанной ниже причине не исключается возможность того, что значение может фактически составлять 5, 10 или 30 раз. Поскольку скорость элиминации человеческого IL-8 из мышиной плазмы является очень быстрой по сравнению со скоростью элиминации H1009/L395-F1942m, то доля H1009/L395-F1942m, связанного с человеческим IL-8 в плазме, быстро снижается после введения. Более конкретно, даже при введении одновременно с человеческим IL-8, не все H1009/L395-F1942m, присутствующие в плазме, находятся в связанной с человеческим IL-8 форме, и фактически примерно через 7 ч после введения большая их часть уже находится в свободной форме. Поскольку скорость поглощения исследовали в указанных условиях, то даже, если скорость внутриклеточного поглощения комплекса H1009/L395-F1942m и человеческого IL-8 фактически повышалась в 5, 10 или 30 раз по сравнению со скоростью поглощения H1009/L395-F1942m, результаты, полученные с использованием этой экспериментальной системы, отражают это только частично; следовательно, существует вероятность того, что эффект может повышаться более чем в 2,2 раза или т.д. Таким образом, исходя из полученных результатов, согласно которым скорость внутриклеточного поглощения комплекса H1009/L395 и IL-8, как установлено, должна превышать фактическую скорость внутриклеточного поглощения H1009/L395 in vivo, этот эффект не ограничен полученным повышением в 2,2 раза.
Полученные данные можно интерпретировать следующим образом (но не ограничиваясь только указанным). Когда H1009/L395, которое представляет собой рН-зависимое IL-8-связывающее антитело, образует комплекс с человеческим IL-8, то комплекс имеет более высокую изоэлектрическую точку и больший сдвиг в сторону положительного заряда, чем антитело, находящееся в несвязанном состоянии. Одновременно аффинность комплекса к внеклеточному матриксу является более высокой, чем аффинность антитела в несвязанном состоянии. Такие свойства, как повышение изоэлектрической точки и увеличение связывания с внеклеточным матриксом, можно рассматривать в качестве факторов, которые способствуют поглощению антитела клетками in vivo. Кроме того, в проведенных на мышах экспериментах установлено, что внутриклеточное поглощение комплекса H1009/L395 и человеческого IL-8 возрастало в 2,2 раза или более по сравнению со скоростью поглощения H1009/L395. Исходя из вышесказанного, теоретическое объяснение, а также свойства in vitro и явления, обнаруженные in vivo, убедительно подтверждают гипотезу о том, что H1009/L395 и человеческий IL-8 образуют комплекс, что способствует поглощению комплекса клетками и приводит к существенному увеличению элиминации человеческого IL-8.
К настоящему времени известно несколько антител к IL-8, однако отсутствуют данные о повышении аффинности связывания с внеклеточным матриксом после образования комплекса с IL-8 и увеличении поглощения комплексов клетками.
Кроме того, на основе полученных данных об увеличении внутриклеточного поглощения антител к IL-8, когда антитела образуют комплексы с IL-8, можно предположить, что антитела к IL-8, которые могут образовывать комплексы с IL-8 в плазме, быстро поглощаются клетками, а антитела в свободном состоянии, которые не могут образовывать комплексы с IL-8, имеют тенденцию сохраняться в плазме без поглощения клетками. В том случае, когда антитело к IL-8 является рН-зависимым, антитело к IL-8, поглощенное клетками, высвобождает молекулу IL-8 в клетках и затем возвращается в среду вне клеток и после этого может связываться с другой молекулой IL-8; и следовательно увеличение внутриклеточного поглощения после образования комплекса может обладать дополнительным эффектом более сильной элиминации IL-8. Это означает, что отбор антител к IL-8 с повышенной способностью к связыванию с внеклеточным матриксом или антител к IL-8 с повышенным поглощением клетками может также являться еще одним из вариантов осуществления изобретения, указанных в разделе В описания.
Пример 17
Предсказание иммуногенности рН-зависимого IL-8-связываюшего антитела H1009/L395 с использование системы in silico
Далее балл иммуногенности и частоту образования ADA предсказывали для H1009/L395 с помощью метода, аналогичного описанному в примере 13-1.
Результаты представлены в таблице 25 и на фиг. 32. На фиг. 32 H1009/L395 обозначен как «H1009L395».
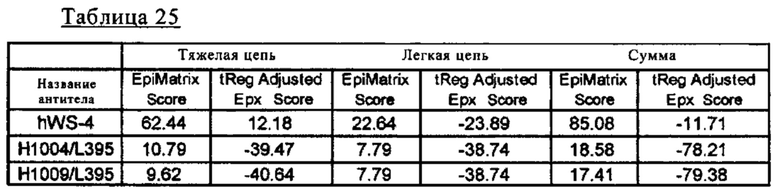
Результаты, представленные в таблице 25, демонстрируют, что H1009/L395 имеет такой же уровень баллов иммуногенности, что и H1004/L395. Кроме того, частота образования ADA, предсказанная для H1009/L395, исходя из результатов, представленных на фиг. 32, составляла 0%, и это также сходно с величиной этого параметра, указанной для H1004/L395.
Таким образом, предсказанная иммуногенность существенно снижалась у H1009/L395 по сравнению с известным антителом к человеческому IL-8 hWS-4. Следовательно, можно предположить, что H1009/L395 должно обладать очень низкой иммуногенностью для людей и должно обладать способностью сохранять стабильную нейтрализующую активность в отношении IL-8 в течение длительного периода времени.
Пример 18
Анализ ФК в организме обезьян циномолгус с использованием варианта H89/L118 с повышенной FcRn-связывающей способностью в условиях кислого pH
Как описано в представленных выше примерах, среди антител, которые имеют константную область нативного IgG1 в качестве их константной области, рН-зависимое IL-8-связывающее антитело H1009/L395 представляло собой антитело с улучшенными свойствами. Однако указанные антитела можно применять также в качестве антител, содержащих аминокислотные замены в константной области, например, содержащих Fc-область с повышенной способностью связываться с FcRn при кислом рН, примеры которых представлены в примере 5. Таким образом, H89/L118 применяли для подтверждения того, что Fc-область с повышенной способностью связываться с FcRn при кислом рН может функционировать также в рН-зависимом IL-8-связывающем антителе.
(18-1) Получение H89/L118 с модифицированной Fc-областью с повышенной способностью связывать FcRn при кислом рН
Различные модификации, повышающие FcRn-связывание, описанные в примере 5-1, интродуцировали в Fc-область H89/L118. В частности, получали следующие варианты путем интродукции модификаций, применяемых в F1847m, F1848m, F1886m, F1889m, F1927m и F1168m, в Fc-область H89-IgG1: (а) конструкцию H89/L118-IgG1, содержащую H89-IgG1m (SEQ ID NO: 94), в качестве тяжелой цепь и L118-K0MT в качестве легкой цепи; (б) H89/L118-F1168m, содержащую H89-F1168m (SEQ ID NO: 95), в качестве тяжелой цепи и L118-K0MT в качестве легкой цепи; (в) H89/L118-F1847m, содержащую Н89-F1847m (SEQ ID NO: 96) в качестве тяжелой цепи и L118-K0MT в качестве легкой цепи; (г) H89/L118-F1848m, содержащую H89-F1848m (SEQ ID NO: 97), в качестве тяжелой цепи и L118-K0MT в качестве легкой цепи; (д) H89/L118-F1886m, содержащую H89-F1886m (SEQ ID NO: 98), в качестве тяжелой цепи и L118-K0MT в качестве легкой цепи; (е) H89/L118-F1889m, содержащую Н89-F1889m (SEQ ID NO: 99), в качестве тяжелой цепь и L118-K0MT в качестве легкой цепи; и (ж) H89/L118-F1927m, содержащую H89-F1927m (SEQ ID NO: 100), в качестве тяжелой цепи и L118-K0MT в качестве легкой цепи. Анализы ФК в организме обезьян циномолгус с использованием этих антител осуществляли с применением описанного ниже метода.
(18-2) Анализы ФК в организме обезьян циномолгус с использованием содержащих новый вариант Fc-области антител
После введения антител к человеческому IL-8 обезьянам циномолгус оценивали биокинетику антител к человеческому IL-8. Раствор антитела к человеческому IL-8 вводили внутривенно однократно в дозе 2 мг/кг. Образцы крови получали через 5 мин, 4 ч, 1 день, 2 дня, 3 дня, 7 дней, 10 дней, 14 дней, 21 день, 28 дней, 35 дней, 42 дня, 49 дней и 56 дней после введения. Собранную кровь сразу же центрифугировали при 4°С и 15000 об/мин в течение 10 мин для получения плазмы. Отделенную плазму хранили в морозильной камере при -60°С или ниже, до осуществления измерений.
Концентрации антитела к человеческому IL-8 в плазме обезьян циномолгус измеряли электрохемилюминисцентным методом. Сначала вносили захватывающее Ат к человеческой каппа-цепи (h-каппа) (фирма Antibody Solutions) в 96-луночный планшет MULTI-ARRAY (фирма Meso Scale Discovery) и перемешивали при комнатной температуре в течение 1 ч. Затем раствор ЗФР-Твин, содержащий 5% (мас./об.) БСА, применяли для блокады в течение 2 ч с получением планшета с иммобилизованным античеловеческим антителом. Приготавливали образцы для калибровочной кривой, содержащие антитело к человеческому IL-8 в концентрациях 40,0, 13,3, 4,44, 1,48, 0,494, 0,165 и 0,0549 мкг/мл в плазме, и приготавливали образцы для измерения в плазме обезьян циномолгус, разведенные в 500 раз или более. Вносили по 50 мкл растворов в каждую лунку планшета с иммобилизованным античеловеческим антителом и растворы перемешивали при комнатной температуре в течение 1 ч. Затем добавляли конъюгированное с биотином репортерное Ат к h-каппа (фирма Antibody Solutions) в вышеуказанный планшет и давали прореагировать при комнатной температуре в течение 1 ч. После дополнительного добавления меченного сульфо-меткой стрептавидина (фирма Meso Scale Discovery) и выдерживания в течение 1 ч комнатной температуре для обеспечения прохождения реакции добавляли в планшет буфер для считывания Т(×1) (фирма Meso Scale Discovery) и сразу же проводили измерение с использованием SECTOR Imager 2400 (фирма Meso Scale Discovery). Концентрацию антитела к человеческому IL-8 рассчитывали на основе ответа с использованием калибровочной кривой с помощью аналитического программного обеспечения SOFTmax PRO (фирма Molecular Devices).
Полученные результаты, характеризующие время полужизни (t1/2) и клиренс (CL) каждого из антител, представлены в таблице 26, и изменения в концентрации антител в плазме обезьян циномолгус представлены на фиг. 33.
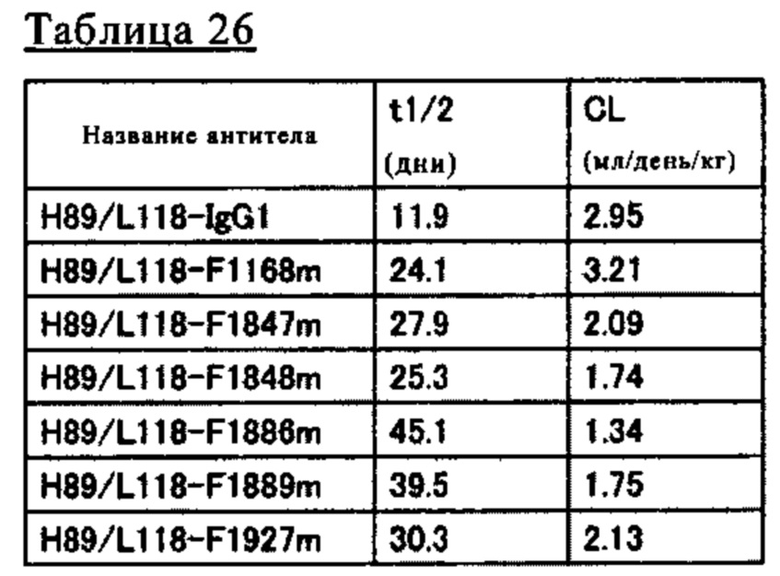
Приведенные выше результаты подтвердили, что все варианты Fc-области характеризовались пролонгированным временем удерживания в плазме по сравнению с антителом, имеющим Fc-область нативного IgG1. В частности, для H89/L118-F1886m обнаружена наиболее предпочтительная кинетика в крови
Пример 19
Fc-область с пониженной связывающей способностью в отношении FcγR
Известно, что Fc-область нативного человеческого IgG1 связывается с Fcγ-рецептором(ами) (обозначенные далее как FcγR) на различных клетках иммунной системы и обладает эффекторными функциями, такими как ADCC и ADCP, в отношении клеток-мишеней.
С одной стороны, IL-8 представляет собой растворимый цитокин, и применяемые в качестве фармацевтических препаратов антитела к IL-8, как ожидается, главным образом должны обладать фармакологическими действиями посредством нейтрализации функций IL-8 в областях, в которых IL-8 присутствует в избыточном количестве. Указанные области, в которых IL-8 присутствует в избыточном количестве, не ограничены конкретными областями, и, например, могут представлять собой области воспаления. Как хорошо известно в указанных областях воспаления собираются и активируются иммунные клетки. Передача нежелательных сигналов активации к этим клеткам через Fc-рецепторы и индукция активности, такой как ADCC и ADCP, в нежелательных клетках не всегда являются нужными. Следовательно, с точки зрения безопасности (но не ограничиваясь только этим) может оказаться предпочтительным, чтобы антитела к IL-8, вводимые in vivo, обладали низкой аффинностью к FcγR.
(19-1) Получение модифицированных антител с пониженной способностью связываться с FcγR
Аминокислотные модификации дополнительно интродуцировали в Fc-область H1009/L395-F1886m для снижения способности связываться с различными FcγR человека и обезьян циномолгус. В частности, H1009-F1886s (SEQ ID NO: 81) получали путем осуществления в тяжелой цепи H1009-F1886m каждой из следующих замен: замена L на R в положении 235, замена G на R в положении 236 и замена S на K в положении 239 согласно EU-нумерации. Аналогично этому, H1009-F1974m (SEQ ID NO: 80) получали путем осуществления в H1009-F1886m замены L на R в положении 235 и замены G на R в положении 236 согласно EU-нумерации и замены области, простирающейся от положения 327 до положения 331 согласно EU-нумерации в последовательности нативного человеческого IgG4. H1009/L395-F1886s и H1009/L395-F1974m получали в виде антител, имеющих указанные тяжелые цепи и L395-k0MT в качестве легкой цепи.
(19-2) Подтверждение аффинности к различным человеческим FcγR
Затем аффинность H1009/L395-F1886s или H1009/L395-F1974m к растворимым формам FcγRIa или FcγRIIIa человека или обезьян циномолгус подтверждали следующим методом.
Анализы для оценки связывания H1009/L395-F1886s или H1009/L395-F1974m с растворимыми формами FcγRIa или FcγRIIIa человека или обезьян циномолгус осуществляли с использованием устройства BIACORE Т200 (фирма GE Healthcare). Растворимые FcγRIa и FcγRIIIa как человека, так и обезьян циномолгус получали в форме меченных His молекул с помощью методов, известных обычным специалистам в данной области. Взятый в соответствующем количестве рекомбинантный белок (r-белок) L (фирма BioVision) иммобилизовывали на сенсорном чипе СМ4 (фирма GE Healthcare) с помощью метода аминного сочетания и захватывали представляющее интерес антитело. Затем растворимый FcγRIa или FcγRIIIa инъецировали с использованием подвижного буфера (применяемого в качестве референс-раствора) и давали взаимодействовать с антителами, захваченными на сенсорном чипе. HBS-EP+ (фирма GE Healthcare) применяли в качестве подвижного буфера, a HBS-EP+ применяли для разведения растворимого FcγRIa или FcγRIIIa. Для регенерации сенсорного чипа применяли 10 мМ глицин-HCl, рН 1,5. Все измерения проводили при 20°С.
Результаты представлены на фиг. 34. В контексте настоящего описания применяли следующую систему обозначений для человеческого FcγRIa, человеческого FcγRIIIa, FcγRIa обезьян циномолгус и FcγRIIIa обезьян циномолгус: hFcγRIa, hFcγRIIIa, cynoFcγRIa и cynoFcγRIIIa соответственно. Установлено, что H1009/L395-F1886m связывается со всеми FcγR, но, с другой стороны, подтверждено, что H1009/L395-F1886s и H1009/L395-F1974m не связываются ни одним из FcγR.
(19-3) Анализ элиминации IL-8 из организма мышей при применении Fc-вариантов
Далее для H1009/L395-F1886s и H1009/L395-F1974m определяли скорость элиминации человеческого IL-8 и время удерживания антител в плазме мышей с помощью следующего эксперимента. В этом случае для оценки применяли три дозы H1009/L395-F1886s, составляющие 2 мг/кг, 5 мг/кг и 10 мг/кг, для того, чтобы оценивать также связанные с повышением дозы антитела эффекты H1009/L395-F1886s.
После одновременного введения человеческого IL-8 и антитела к человеческому IL-8 трансгенным по человеческому FcRn мышам (B6.mFcRn-/-.hFcRn Tg-мыши линии 32 +/+; фирма Jackson Laboratories; Methods Mol. Biol. 602, 2010, cc. 93-104), оценивали биокинетику человеческого IL-8. Раствор, содержащий смесь человеческого IL-8 (10 мкг/мл) и антитела к человеческому IL-8 (200, 500 или 1000 мкг/мл), вводили однократно в дозе 10 мл/кг в хвостовую вену. В этом случае, поскольку антитело к человеческому IL-8 присутствовало в существенном избытке относительно человеческого IL-8, почти весь человеческий IL-8 должен связаться с антителом. Образцы крови получали через 5 мин, 2 ч, 7 ч, 4 ч, 1 день, 2 дня, 3 дня, 7 дней, 14 дней, 21 день и 28 дней после введения. Собранную кровь сразу же центрифугировали при 4°С и 15000 об/мин в течение 15 мин для получения плазмы. Отделенную плазму хранили в морозильной камере при -20°С или ниже, до осуществления измерений.
Концентрацию человеческого IL-8 в плазме мышей измеряли с использованием метода, аналогичного описанному в примере 11. Полученные в результате данные о концентрации человеческого IL-8 в плазме мышей, представлены на фиг. 35, и данные о клиренсе человеческого IL-8 (CL) из плазмы мышей представлены в таблице 27.
Во-первых, установлено, что антитело H1009/L395, содержащее Fc-область нативного IgG1, и H1009/L395-F1886s, содержащее модифицированную Fc-область, обладали эквивалентной способностью элиминировать человеческий IL-8 при сравнении групп, которым антитела вводили в дозе 2 мг/кг.
Кроме того, установлено, что при изменении дозы антитела H1009/L395-F1886s не было обнаружено существенных различий в уровнях клиренса человеческого IL-8 между дозами 2 мг/кг и 10 мг/кг, однако небольшое изменение концентрации IL-8 в плазме обнаружено через 1 день после введения. Эти результаты позволяют с большой долей уверенности предположить, что антитела, содержащие вариабельную область H1009/L395, обладают достаточной способностью элиминировать IL-8 при введении антител в высоких дозах.

(19-4) Анализ ФК Fc-вариантов у обезьян циномолгус
Далее определяли время удерживания антител в плазме обезьян циномолгус с помощью следующего метода с использованием H1009/L395-F1886s или H1009/L395-F1974m.
Биокинетику антитела к человеческому IL-8 оценивали в случае, когда антитело к человеческому IL-8 вводили индивидуально, и в случае, когда человеческий IL-8 и антитело к человеческому IL-8 вводили одновременно обезьянам циномолгус. Раствор антитела к человеческому IL-8 (2 мг/мл) или раствор, содержащий смесь человеческого IL-8 (100 мкг/кг) и антитела к человеческому IL-8 (2 мг/кг), вводили внутривенно однократно в дозе 1 мл/кг. Образцы крови получали через 5 мин, 4 ч, 1 день, 2 дня, 3 дня, 7 дней, 10 дней, 14 дней, 21 дня, 28 дней, 35 дней, 42 дня, 49 дней и 56 дня после введения. Собранную кровь сразу же центрифугировали при 4°С и 15000 об/мин в течение 10 мин для получения плазмы. Отделенную плазму хранили в морозильной камере прим -60°С или ниже, до осуществления измерений.
Концентрацию антитела к человеческому IL-8 в плазме обезьян циномолгус измеряли с помощью метода, описанного в примере 18. Полученные в результате данные о концентрациях антител к человеческому IL-8 в плазме представлены на фиг. 36, а данные, характеризующие время полужизни (t1/2) и клиренс (CL) антител к человеческому IL-8 из плазмы обезьян циномолгус, представлены в таблице 28.
Во-первых, по сравнению с Hr9 и H89/L118, которые имеют Fc-область нативного человеческого IgG1, установлено, что H1009/L395-F1886s, который имеет Fc-область с улучшенными функциями, обладает значительно пролонгированным временем удерживания в плазме.
Кроме того, когда H1009/L395-F1886s вводили одновременно с человеческим IL-8, изменение концентрации в плазме оказалось эквивалентным с изменением, когда антитело вводили индивидуально. На основе полученных данных можно предположить следующее (но не ограничиваясь только указанным). Как описано выше, установлено, что внутриклеточное поглощение комплекса H1009/L395 и человеческого IL-8 выше, чем поглощение не входящего в комплекс H1009/L395. Как правило, считается, что высокомолекулярные белки могут включаться в клетки неспецифически или зависящим от рецептора путем, после чего переноситься в лизосому и расщепляться с помощью различных расщепляющих ферментов, присутствующих в лизосоме. Следовательно, если скорость поглощения белка в клетки повышается, то время удерживания этого белка в плазме, вероятно, также соответственно ухудшается. Однако антитело обладает способностью сохраняться плазме с помощью FcRn в эндосоме; и следовательно, пока функции спасения с помощью FcRn сохраняются на достаточном уровне, на время удерживания в плазме не оказывается воздействие, даже, если скорость внутриклеточного поглощения ускоряется. В данном случае, даже, когда H1009/L395-F1886s вводили одновременно с человеческим IL-8 обезьянам циномолгус, влияние на время удерживания в плазме не обнаружено. Это свидетельствует о возможности того, что хотя уровень поглощения антитела H1009/L395-F1886s клетками возрастает, антитело в достаточной степени спасается с помощью FcRn, в результате чего может выделяться в плазму.
Кроме того, для другого Fc-варианта, H1009/L395-F1974m, также установлено эквивалентное H1009/L395-F1886s время удерживания плазме. Хотя в эти Fc- варианты были интродуцированы различные модификации, которые снижают способность связываться с различными FcγR, как это описано выше, они, как установлено, не влияют на время удерживания в плазме самих антител. Из вышесказанного следует, что, как установлено, время удерживания в плазме обезьян циномолгус обоих антител H1009/L395-F1886s и H1009/L395-F1974m в значительной степени пролонгировано и в достаточной степени является приемлемым по сравнению с антителами, которые имеют Fc-область нативного IgG1.
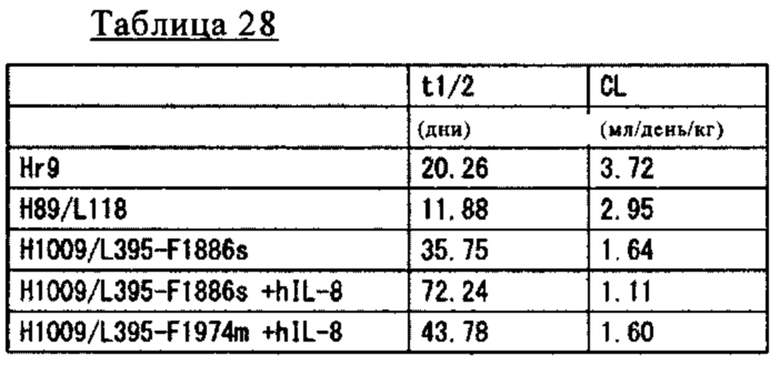
Как продемонстрировано в описанных выше примерах, благодаря рН-зависимой способности связываться с IL-8 в сочетании с быстрым поглощением клетками в виде комплекса с IL-8, H1009/L395 является впервые описанным антителом с существенно увеличенной скоростью элиминации человеческого IL-8 in vivo. Кроме того, аффинность связывания с IL-8 этого антитела в условиях нейтрального рН также повышена по сравнению с известным антителом hWS-4, и антитело может нейтрализовать человеческий IL-8 сильнее в условиях нейтрального рН, соответствующих условиям в плазме. Кроме того, оно представляет собой антитело, обладающее очень высокой стабильностью в условиях плазмы, и у которого нейтрализующая IL-8 активность не снижается после его введения in vivo. Кроме того, H1009/L395, сконструированное на основе Hr9, которое обладает в значительной степени улучшенным выходом при производстве по сравнениюе hWS-4, представляет собой антитело, пригодное для приготовления с позиции выхода при производстве. Кроме того, при предсказании in silico иммуногенности для антитела установлен очень низкий балл иммуногенности, и этот балл является существенно более низким по сравнению с известным антителом hWS-4 и некоторыми другими известными поступающими в продажу антителами. Это означает, что с высокой степени вероятности можно ожидать, что H1009/L395 будет характеризоваться слабой способностью к образованию ADA в организме человека и его можно будет безопасно применять в течение длительного периода времени. Таким образом, по сравнению с известными антителами к человеческому IL-8 H1009/L395 отличается улучшенными качествами в различных аспектах и является очень ценным в качестве фармацевтического агента.
Антитело H1009/L395, которое имеет Fc-область нативного IgG, обладает существенными ценными описанными выше свойствами; однако варианты H1009/L395, которые содержат функционально улучшенную Fc-область, можно также применять соответственно в качестве антител с повышенной возможностью применения. В частности, можно повышать связывание с FcRn в условиях кислого рН для пролонгирования времени удерживания в плазме и для сохранения действий в течение более длительного периода времени. Кроме того, варианты, которые содержат Fc-область с интродуцированной(ыми) модификацией(ями), которая(ые) снижает(ют) способность связываться с FcγR, можно применять в качестве высоко безопасных терапевтических антител во избежание нежелательной активации иммунных клеток и образования цитотоксической активности в организме, которому их вводят. В качестве указанных Fc-вариантов применение F1886s или F1974m, представленных в настоящем описании, является наиболее предпочтительным, но указанные Fc-варианты не ограничены ими; и, если Fc-вариант обладает сходными функциями, то терапевтические антитела, содержащие другие модифицированные Fc-области, применяют в качестве варианта осуществления изобретения в разделе В описания.
В результате, антитела, указанные в разделе В описания, включая H1009/L395-F1886s и H1009/L395-F1974m, которые разработаны при создании настоящего изобретения с использованием всестороннего метода исследования, могут поддерживать условия, при которых биологическая активность человеческого IL-8 сильно ингибируется, оставаясь на безопасном уровне и в течение длительного периода времени. В данном случае были реализованы уровни, которые не могут быть достигнуты с использованием известных антител к IL-8, и можно ожидать, что эти антитела, представленные в разделе В описания, будут применяться в качестве антител к IL-8, представляющих собой высококачественные готовые фармацевтические средства.
Пример 20
Биспецифические антитела к фактору IXa/фактору X
Гуманизированные биспецифические антитела к фактору IXa/фактору X, описанные в WO 2012/067176, связываются с человеческим фактором IXa и фактором X и индуцируют активность в отношении коагрегации крови.
Гуманизированное биспецифическое антитело к фактору IXa/фактору X F8M(Q499-z121/J327-z119/L404-k: Н-цепь (SEQ ID NO: 330)/Н-цепь (SEQ ID NO: 331)/общая L-цепь (SEQ ID NO: 332)), описанное в WO 2012/067176, применяли в этом примере, и F8M содержит две различные Н-цепи и две одинаковые общие L-цепи. F8M получали методом, описанным в примерах в WO 2012/067176.
(20-1) Получение биспецифических антител к фактору IXa/фактору X
Указанные ниже три антитела получали методом, описанным в референс-примере 2 в виде биспецифических антител к фактору IXa/фактору X, сконструированных на основе F8M: (a) F8M-F1847mv, которое представляет собой каноническое антитело, содержащее F8M-F1847mv1 (SEQ ID NO: 323) и F8M-F1847mv2 (SEQ ID NO: 324) в качестве тяжелых цепей и F8ML (SEQ ID NO: 325) в качестве легкой цепи; (б) F8M-F1868mv, которое представляет собой каноническое антитело, содержащее F8M-F1868mv1 (SEQ ID NO: 326) и F8M-F1868mv2 (SEQ ID NO: 327) в качестве тяжелых цепей и F8ML (SEQ ID NO: 325) в качестве легкой цепи; и (в) F8M-F1927mv, которое представляет собой каноническое антитело, содержащее F8M-F1927mv1 (SEQ ID NO: 328) и F8M-F1927mv2 (SEQ ID NO: 329) в качестве тяжелых цепей и F8ML (SEQ ID NO: 325) в качестве легкой цепи.
Последовательности тяжелых цепей включают указанные ниже последовательности одинаковых Fc-вариантов с позиции повышенной способности связываться с FcRn и пониженной способности связываться с ревматоидным фактором, упомянутые в примере 5:

(20-2) Фармакокинетическое исследование моноклональных антител F8M-F1847mv, F8M-F1868mv и F8M-F1927mv в организме обезьян циномолгус
Осуществляли фармакокинетическое исследование каждого из моноклональных антител F8M-F1847mv, F8M-F1868mv и F8M-F1927mv после однократного болюсного внутривенного введения в дозе 0,6 мг/кг самцу обезьян циномолгус. Концентрации в плазме F8M-F1847mv, F8M-F1868mv и F8M-F1927mv определяли с помощью сэндвич-ELISA. Фармакокинетические параметры рассчитывали с помощью программного обеспечения WinNonlin, версия 6.4. Как продемонстрировано в таблице 30, время полужизни F8M-F1847mv, F8M-F1868mv и F8M-F1927mv составляло 29,3, 54,5 и 35,0 дней соответственно. ФК-исследование F8M с использованием обезьян циномолгус осуществляли в другой день в дозе 6 мг/кг и установлено, что время полужизни составляло 19,4 дня. Очевидно, что время полужизни F8M-F1847mv, F8M-F1868mv и F8M-F1927mv длиннее, чем у F8M. Это позволяет предположить, что время полужизни биспецифического антитела к факторам IXa/Х можно удлинять с помощью такой же модификации последовательности Fc-области, которая описана выше в примере 5.

Пример 21
Оценка клиренса IgE из плазмы с использованием вариантов Fab с повышенной pI
В этом примере оценивали приводящие к повышению pI замены в Fab-фрагменте антител, приводящие к усилению клиренса человеческого IgE, с использованием рН-зависимых антигенсвязывающих антител. Метод добавления аминокислотных замен в вариабельную область антитела для повышения pI не ограничен конкретным методом, например, можно применять метод, описанный в WO 2007/114319 или WO 2009/041643. Аминокислотные замены, интродуцированные в вариабельную область, предпочтительно представляют собой замены, которые уменьшают количество отрицательно заряженных аминокислот (таких как аспарагиновая кислота и глутаминовая кислота), увеличивая количество положительно заряженных аминокислот (таких как аргинин и лизин). Кроме того, аминокислотные замены можно интродуцировать в любое положение в вариабельной области антитела. Предназначенные для интродукции аминокислотных замен сайты предпочтительно представляют собой положения, в которых боковые цепи аминокислот могут экспонироваться на поверхности молекулы антитела (но не ограничиваясь только ими).
(21-1) Получение антител с повышенной pI путем модификация аминокислот в вариабельной области
Данные о тестируемых антителах обобщены в таблице 32 и таблице 33.
Тяжелую цепь, Ab1H003 (которую обозначали также как Н003, SEQ ID NO: 144), получали путем интродукции приводящей к повышению pI замены H32R в Ab1H (SEQ ID NO: 38). Другие варианты тяжелых цепей получали также путем интродукции соответствующих замен, представленных в таблице 32, в Ab1H согласно методу, описанному в референс-примере 1. Все варианты тяжелых цепей экспрессировали с Ab1L (SEQ ID NO: 39) в качестве легкой цепи. Данные о рН-зависимом профиле связывания этого антитела обобщены в таблице 5 (Ab1).
Аналогичным образом оценивали также приводящую к повышению pI замену в легкой цепи.
Легкую цепь Ab1L001T (которую обозначали также как L001, SEQ ID NO: 164), получали путем интродукции приводящей к повышению pI замены G16K в Ab1L. Другие варианты легких цепей получали также путем интродукции соответствующих замен, представленных в таблице 33, в Ab1L согласно методу, описанному в референс-примере 1. Все варианты легких цепей экспрессировали с Ab1H в качестве тяжелой цепи.
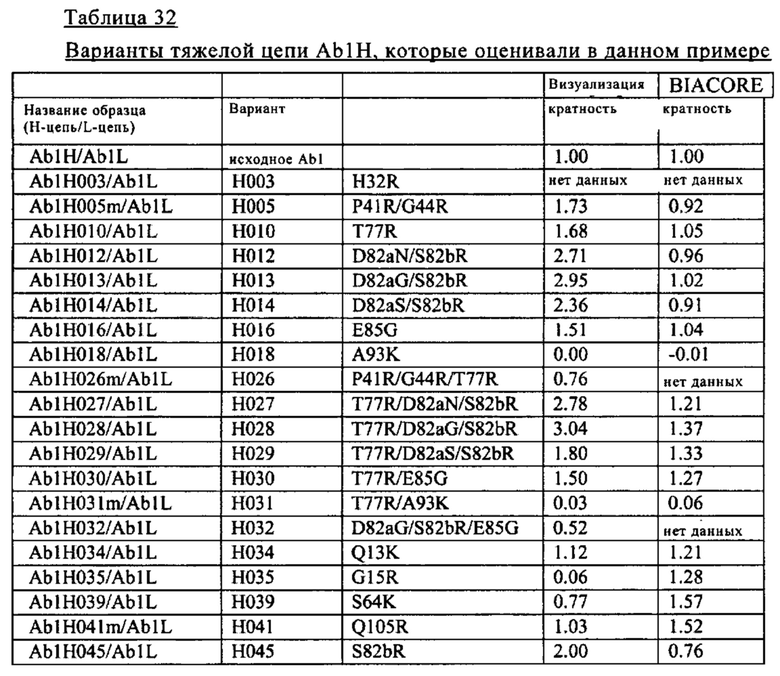
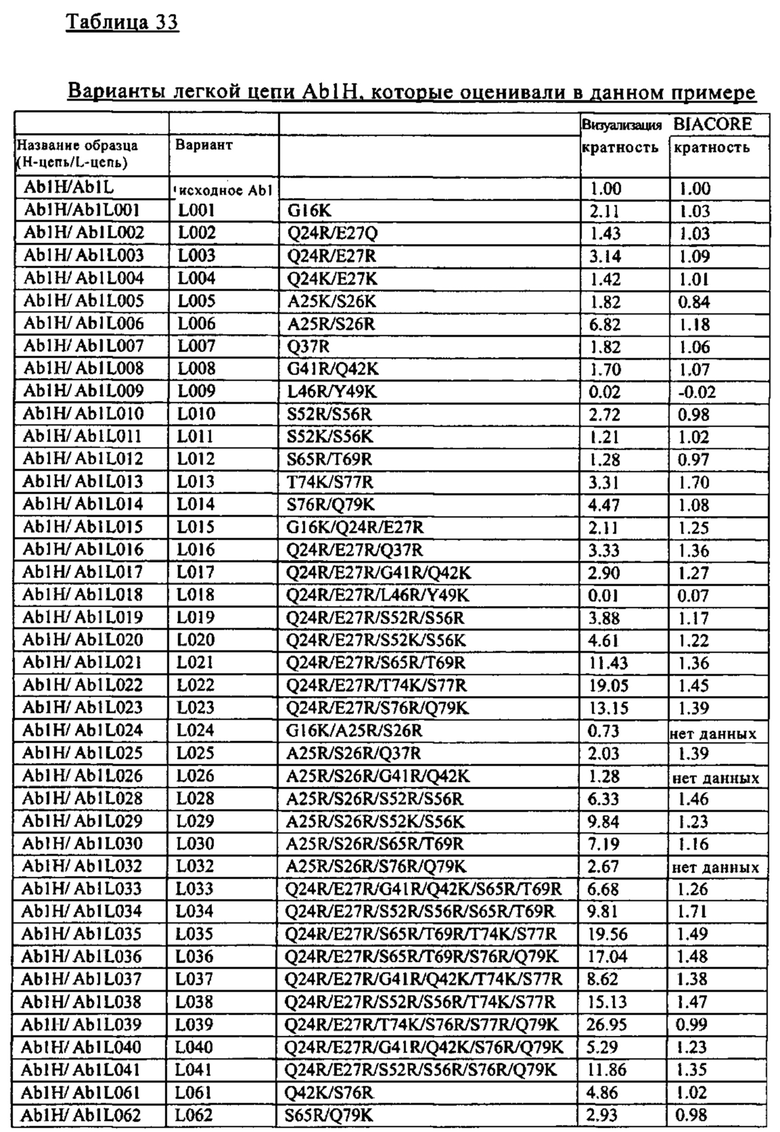
(21-2) Анализ связывания с человеческим FcγRIIb с помощью BIACORE с использованием вариантов с повышенной pI
Вне зависимости от полученных антител, содержащих варианты Fc-области, анализы связывания между растворимым человеческим FcγRIIb и комплексами антиген-антитело осуществляли с использованием BIACORE Т200 (фирма GE Healthcare). Растворимый человеческий FcγRIIb (NCBI, код доступа NM_004001.3) получали с форме меченной His молекулы с помощью известного в данной области метода. Антитело к His в соответствующем количестве фиксировали на сенсорном чипе СМ5 (фирма GE Healthcare) методом аминного сочетания, используя набор для захвата His (фирма GE Healthcare) для иммобилизации человеческого FcγRIIb. Затем инъецировали комплекс антитело-антиген и подвижный буфер (в качестве референс-раствора) и давали пройти взаимодействию с человеческим FcγRIIb, иммобилизованном на сенсорном чипе. 20 мМ N-(2-ацетамидо)-2-аминоэтансульфоновую кислоту, 150 мM NaCl, 1,2 мМ CaCl2 и 0,05% (мас./об.) Твин 20, рН 7,4 применяли в качестве подвижного буфера и соответствующий буфер применяли также для разведения растворимого человеческого FcγRIIb. Для регенерации сенсорного чипа применяли 10 мМ глицин-HCl, рН 1,5. Все измерения проводили при 25°С. Анализы проводили на основе связывания (RU), рассчитанного с использованием сенсограмм, полученных при измерениях, и получали относительные величины, принимая уровень связывания Ab1H/Ab1L (исходное антитело Ab1) за 1,00. Для расчета параметров применяли программное обеспечение BIACORET100 Evaluation (фирма GE Healthcare).
Результаты SPR-анализа обобщены в таблицах 32 и 33. Установлено, что несколько вариантов обладали повышенной способностью связываться с человеческим FcγRIIb, фиксированном на сенсорном чипе BIACORE.
Антитела, полученные путем интродукции приводящей(их) к повышению pI модификации(ий) в вариабельной области, представляют собой антитела, у которых заряд вариабельной области является более положительным по сравнению с антителами до интродукции в них модификации(й). Таким образом, можно считать, что кулоновское взаимодействие между вариабельной областью (положительный заряд) и поверхность сенсорного чипа (отрицательный заряд) должно усиливаться при модификациях аминокислот, которые приводят к повышению pI. Кроме того, предполагается, что указанные эффекты аналогично имеют место на отрицательно заряженной поверхности клеточной мембраны; следовательно, можно ожидать их воздействие на повышение скорости поглощения в клетки in vivo.
В контексте настоящего описания увеличенное примерно в 1,2 или более раз связывание с hFcγRIIb вариантов по сравнению со связыванием с hFcγRIIb исходного Ab1, свидетельствует о сильном обусловленном зарядом действии на связывание антитела с hFcγRIIb на сенсорном чипе.
Среди вариантов тяжелых цепей с повышенной pI антитело с заменой(ами) Q13K, G15R, S64K, T77R, D82aN, D82aG, D82aS, S82bR, E85G или Q105R (согласно нумерации Кэбота), индивидуально или в комбинации, отличалось более высоким связыванием с hFcγRIIb. Предполагается, что одна аминокислотная замена или комбинация этих замен в тяжелой цепи должна(ы) оказывать сильное обусловленное зарядом действие на связывание с hFcγRIIb на сенсорном чипе. Таким образом, одно или несколько положений, которые, как ожидается, должны оказывать воздействие на увеличение скорости или уровня поглощения клетками in vivo, при интродукции приводящих к повышению pI модификаций в вариабельную область тяжелой цепи антитела, могут включать, например, положения 13, 15, 64, 77, 82а, 82b, 85 и 105 согласно нумерации Кэбота. Аминокислотная замена, интродуцированная в указанное(ые) положение(я), может представлять собой аспарагин, глицин, серии, аргинин или лизин и предпочтительно аргинин или лизин.
Среди вариантов легкой цепи с повышенной pI антитело с заменой(ами) G16K, Q24R, A25R, S26R, E27R, Q37R, G41R, Q42K, S52K, S52R, S56K, S56R, S65R, T69R, T74K, S76R, S77R, Q79K (согласно нумерации Кэбота), индивидуально или в комбинации, отличалось более высоким связыванием с hFcγRIIb. Предполагается, что одна аминокислотная замена или комбинация этих замен в легкой цепи должна(ы) оказывать сильное обусловленное зарядом действие на связывание с hFcγRIIb на сенсорном чипе. Таким образом, одно или несколько положений, которые, как ожидается, должны оказывать воздействие на увеличение скорости или уровня поглощения клетками in vivo, при интродукции приводящих к повышению pI модификаций в вариабельную область легкой цепи антитела, могут включать, например, положения 16, 24, 25, 26, 27, 37, 41, 42, 52, 56, 65, 69, 74, 76, 77 и 79 согласно нумерации Кэбота. Аминокислотная замена, интродуцированная в указанное(ые) положение(я), может представлять собой аргинин или лизин.
(21-3) Клеточное поглощение антител, содержащих вариант Fab-области с повышенной pI
Для оценки уровня внутриклеточного поглощения экспрессирующей hFcγRIIb клеточной линией с использованием полученных антител, содержащих вариант Fab-области, осуществляли анализ, аналогичный описанному выше в примере (4-5), при условии, что количество поглощенного антигена выражали в относительных величинах, принимая уровень поглощения при использовании Ab1H/Ab1L (исходное антитело Ab1) за 1,00.
Результаты количественного измерения клеточного поглощения обобщены в таблицах 32 и 33. Сильная флуоресценция антигена в клетках обнаружена при использовании нескольких Fc-вариантов. В контексте настоящего описания увеличенная примерно в 1,5 или более раз интенсивность флуоресценции антигена, поглощенного клетками, при использовании вариантов по сравнению с интенсивностью флуоресценции Ab1, может свидетельствовать о сильном обусловленном зарядом действии на поглощение клетками.
Установлено, что среди применявшихся антител антитело с вариантами тяжелых цепей с повышенной pI с заменой(ами) P41R, G44R, T77R, D82aN, D82aG, D82aS, S82bR или E85G (согласно нумерации Кэбота), индивидуально или в комбинации, приводило к более сильному поглощению антигена клетками. Предполагается, что одна аминокислотная замена или комбинация этих замен в тяжелой цепи должна(ы) оказывать сильное обусловленное зарядом действие на поглощение клетками комплекса антиген-антитело. Таким образом, одно или несколько положений, которые, как ожидается, должны делать поглощение клетками комплекса антиген-антитело более быстрым и более частым при интродукции приводящих к повышению pI модификаций в вариабельную область тяжелой цепи антитела, могут включать, например, положения 41, 44, 77, 82а, 82b или 85, согласно нумерации Кэбота. Аминокислотная замена, интродуцированная в указанное(ые) положение(я), может представлять собой аспарагин, глицин, серии, аргинин или лизин и предпочтительно аргинин или лизин.
Установлено, что из использованных антител антитело с вариантами легких цепей с повышенной pI с заменой(ами) G16K, Q24R, A25R, A25K, S26R, S26K, E27R, E27Q, E27K, Q37R, G41R, Q42K, S52K, S52R, S56R, S65R, T69R, T74K, S76R, S77R или Q79K (согласно нумерации Кэбота), индивидуально или в комбинации, приводило к более сильному поглощению антигена клетками. Предполагается, что одна аминокислотная замена или комбинация этих замен в легкой цепи должна(ы) оказывать сильное обусловленное зарядом действие на поглощение клетками комплекса антиген-антитело. Варианты с 4 или большим количеством аминокислотных замен имели тенденцию оказывать более сильное обусловленное зарядом действие, чем варианты с меньшим количеством аминокислотных замен. Одно или несколько положений, которые, как ожидается, должны поглощение клетками комплекса антиген-антитело более быстрым и более частым при интродукции приводящих к повышению pI модификаций в вариабельную область легкой цепи антитела, могут включать, например, положения 16, 24, 25, 26, 27, 37, 41, 42, 52, 56, 65, 69, 74, 76, 77 или 79, согласно нумерации Кэбота. Аминокислотная замена, интродуцированная в указанное(ые) положение(я), может представлять собой глутамин, аргинин или лизин и предпочтительно аргинин или лизин.
Не вдаваясь в какую-либо конкретную теорию, этот результат можно объяснить следующим образом: антиген и антитело, добавленные в раствор клеточной культуры, образуют комплексы антиген-антитело в культуральном растворе. Комплексы антиген-антитело связываются с человеческим FcγRIIb, экспрессируемом на клеточной мембране, через Fc-область антитела и поглощаются клетками зависимым от рецептора образом. Антитела, применяемые в этом эксперименте, связываются с антигеном рН-зависимым образом; следовательно, антитело может отщепляться в результате диссоциации от антигена в эндосомах (кислые условия рН) внутри клеток. Поскольку отделенный в результате диссоциации антиген транспортируется в лизосому и накапливается в ней, то он испускает флуоресценцию внутри клеток. Таким образом, сильная интенсивность флуоресценции внутри клетки, вероятно, свидетельствует о том, что поглощение комплексов антиген-антитело клетками происходит быстрее и чаще.
(21-4) Оценка клиренса человеческого IgE на полученной путем совместной инъекции мышиной модели
Некоторые антитела к IgE, обладающие рН-зависимым связыванием с антигеном (исходное Ab1, Ab1H/Ab1L013, Ab1H/Ab1L014, Ab1H/Ab1L007), тестировали на полученной путем совместной инъекции мышиной модели для оценки их способности усиливать клиренс IgE из плазмы. Для создания полученной путем совместной инъекции модели мышам линии C57BL6J (фирма Jackson Laboratories) вводили путем одной i.v.-инъекции IgE, предварительной смешанный с антителом к IgE соответственно. Все группы получали 0,2 мг/кг IgE и 1,0 мг/кг антитела к IgE. Общую концентрацию IgE в плазме определяли с помощью ELISA для антител к IgE. Сначала антитело к человеческому IgE (клон 107, фирма МАВТЕСН) вносили в микролуночный планшет (фирма Nalge nunc International) и выдерживали в течение 2 ч при комнатной температуре или в течение ночи при 4°С для получения планшета с иммобилизованным антителом к человеческому IgE. Образцы для построения стандартной кривой и образцы смешивали с избыточным количеством антитела к IgE (полученного в лаборатории заявителей) с получением имеющего однородную структуру иммунного комплекса. Указанные образцы вносили в иммобилизованный антителом к человеческому IgE планшет и выдерживали в течение ночи при 4°С. Затем эти образцы подвергали взаимодействию последовательно с человеческим коровым белком GPC3 (полученным в лаборатории заявителей), биотинилированным антителом к GPC3 (полученным в лаборатории заявителей), конюъгатом стрептавидин-Poly HRP80 (фирма Stereospecific Detection Technologies) в течение 1 ч. После этого добавляли хемолюминисцентный субстрат SuperSignal® ELISA Pico (фирма Thermo Fisher Scientific). Хемилюминисценцию определяли с помощью устройства SpectraMax М2 (фирма Molecular Devices). Концентрацию человеческого IgE рассчитывали с помощью SOFTmax PRO (фирма Molecular Devices). На фиг. 37 представлен профиль зависимости от времени концентрации IgE в плазме мышей линии C57BL6J.
После введения Fab-вариантов с повышенной pI, отличающихся рН-зависимым связыванием антигена, общая концентрация IgE в плазме была ниже, чем при использовании исходного Ab1. Эти результаты свидетельствуют о том, что иммунный комплекс антигена и антитела с повышенной pI, отличающегося рН-зависимым связыванием антигена, может более сильно связываться с рецептором плазматических мембран, такими как FcγR, что повышает клеточное поглощение иммунного комплекса антиген-антитело. Поглощенный клетками антиген может эффективно высвобождаться из антитела внутри эндосомы, что приводит к ускорению элиминации IgE. Концентрация IgE в организме мышей, обработанных Ab1H/Ab1L007, для которого характерна слабая эффективность в опыте in vitro, оказалась выше, чем при использовании других содержащих варианты Fab антител с повышенной pI. Эти результаты также позволяют предположить, что учитывая результаты оценки клиренса антигена из плазмы in vivo, чувствительность описанной выше системы in vitro, которую применяли для определения интенсивности флуоресценции с помощью анализаторы InCell 6000, может быть выше, чем чувствительность системы in vitro BIACORE, описанной выше.
Пример 22
Оценка клиренса С5 из плазмы с использованием Fab-вариантов с повышенной pI
В этом примере оценивали повышающие pI замены в Fab-области антитела для усиления клиренса человеческого IgE с использованием рН-зависимых антигенсвязывающих антител.
(22-П Получение С5 [Экспрессия и очистка рекомбинантного человеческого С5]
Рекомбинантный человеческий С5 (NCBI GenBank, код доступа: NP_001726.2, SEQ ID NO: 207) кратковременно экспрессировали с использованием клеточной линии FreeStyle293-F (фирма Thermo Fisher, Карлсбад, шт. Калифорния, США). Кондиционированные среды, в которых происходила экспрессия человеческого С5, разводили равным объемом воды milliQ, затем вносили на заполненную Q-сефарозой FF или Q-сефарозой HP анионообменную колонку (фирма GE healthcare, Уппсала, Швеция), после чего элюировали с использованием градиента NaCl. Фракции, содержащие человеческий С5, объединяли, затем доводили концентрацию солей и рН до 80 мМ NaCl и рН 6,4 соответственно. Полученный образец наносили на заполненную SP-сефарозой HP катионообменную колонку (фирма GE healthcare, Уппсала, Швеция) и элюировали с использованием градиента NaCl. Фракции, содержащие человеческий С5, объединяли и вносили в СНТ-(керамический гидроксиапатит) колонку (фирма Bio-Rad Laboratories, Геркулес, шт. Калифорния, США). Затем элюат человеческого С5 вносили на заполненную супердексом 200 колонку для гель-фильтрации (фирма GE healthcare, Уппсала, Швеция). Фракции, содержащие человеческий С5, объединяли и хранили при - 150°С. В эксперименте использовали либо полученный в лаборатории заявителей рекомбинантный человеческий С5, либо полученный из плазма человеческий С5 (фирма CALBIOCHEM, каталожный №204888).
Экспрессию и очистку рекомбинантного С5 обезьян циномолгус (NCBI GenBank, код доступа: ХР_005580972, SEQ ID NO: 208) осуществляли точно таким же методом, что и человеческого аналога.
(22-2) Получение синтетической содержащей кальций-связывающий мотив библиотеки
Генная библиотека вариабельных областей тяжелых цепей антител, которые использовали в качестве синтетических библиотек человеческих тяжелых цепей, состояла из 10 библиотек тяжелых цепей. Каркасные участки зародышевой линии VH1-2, VH1-69, VH3-23, VH3-66, VH3-72, VH4-59, VH4-61, VH4-b, VH5-51 и VH6-1 отбирали для этой библиотеки на основе частоты зародышевой линии в популяциях человеческих В-клеток и биофизических свойств семейств V-генов. Синтетическую библиотеку человеческих тяжелых цепей диверсифицировали по антителосвязывающему сайту, имитирующему популяции антител человеческих В-клеток.
Генную библиотеку вариабельных областей легких цепей антител создавали так, чтобы она имела кальций-связывающий мотив, и диверсифицировали по положениям, которые могут принимать участие в распознавании антигенов, с учетом популяций антител человеческих В-клеток. Создание генной библиотеки вариабельных областей легких цепей антител, которая обладает характеристиками кальций-зависимого связывания с антигенами, описано в WO 2012/073992.
Комбинацию библиотеки вариабельных областей тяжелых цепей и библиотеки вариабельных областей легких цепей встраивали в фагмидный вектор и создавали фагмидную библиотеку согласно de Heard и др., Meth. Mol. Biol. 178, 2002, сс. 87-100. Сайт расщепления трипсином интродуцировали в фагмидный вектор в области линкера между Fab и белком pIII. Модифицированный хелперный фаг M13KO7, который имел сайт расщепления трипсином между доменами N2 и СТ в генеIII, применяли для получения экспонирующего Fab фага.
(22-3) Выделение кальций-зависимых антител к С5
Фаговую дисплейную библиотеку разводили TBS, дополненном БСА и CaCl2 в конечных концентрациях 4% и 1,2 мМ соответственно. В качестве метода пэннинга применяли общепринятую селекцию с использованием магнитных гранул в соответствии в общепринятыми протоколами (Junutula и др., J. Immunol. Methods 332(1-2), 2008, сс. 41-52,  и др., J. Immunol. Methods 247 (1-2), 2001, сс. 191-203, Yeung и др., Biotechnol. Prog. 18(2), 2002, сс. 212-220, Jensen и др., Mol. Cell Proteomics 2(2), 2003, сс. 61-69. В качестве магнитных гранул применяли гранулы, покрытые нейтравидином (NeutrAvidin) (Sera-Mag SpeedBeads, покрытые нейтравидином) или гранулы, покрытые стрептавидином (Dynabeads М-280, покрытие стрептавидином). Человеческий С5 (фирма CALBIOCHEM, каталожный №204888) метили с помощью реагента EZ-Link NHS-ПЭГ4-Биотин (фирма PIERCE, каталожный №21329).
и др., J. Immunol. Methods 247 (1-2), 2001, сс. 191-203, Yeung и др., Biotechnol. Prog. 18(2), 2002, сс. 212-220, Jensen и др., Mol. Cell Proteomics 2(2), 2003, сс. 61-69. В качестве магнитных гранул применяли гранулы, покрытые нейтравидином (NeutrAvidin) (Sera-Mag SpeedBeads, покрытые нейтравидином) или гранулы, покрытые стрептавидином (Dynabeads М-280, покрытие стрептавидином). Человеческий С5 (фирма CALBIOCHEM, каталожный №204888) метили с помощью реагента EZ-Link NHS-ПЭГ4-Биотин (фирма PIERCE, каталожный №21329).
На начальном раунде селекции фага фаговую дисплейную библиотеку инкубировали с биотинилированным человеческим С5 (312,5 нМ) в течение 60 мин при комнатной температуре. Фаги, экспонирующие связывающие варианты Fab, затем захватывали с помощью магнитных гранул.
После инкубации с гранулами в течение 15 мин при комнатной температуре гранулы промывали трижды с помощью 1 мл TBS, содержащего 1,2 мМ CaCl2 и 0,1% Твин20 и гранулы промывали дважды с помощью 1 мл TBS, содержащего 1,2 мМ CaCl2. Фаги элюировали путем ресуспендирования гранул с помощью TBS, содержащего 1 мг/мл трипсина, в течение 15 мин. Элюированными фагами заражали ER2738 и «спасали» с помощью хелперного фага. «Спасенные» фаги осаждали полиэтиленгликолем, ресуспендировали с помощью TBS, дополненного БСА и CaCl2 в конечных концентрациях 4% и 1,2 мМ соответственно и применяли в следующем раунде пэннинга.
После 1-ого раунда пэннинга фаги отбирали по признаку зависимости от кальция, в которых антитело связывалось сильнее с С5 в присутствии иона кальция. Во втором и третьем раунде пэннинг осуществляли таким же образом, что и в первом раунде, за исключением применения 50 нМ (второй раунд) или 12,5 нМ (третий раунд) биотинилированного антигена, и, наконец, элюировали с использованием 0,1 мл буфера для элюции (50 мМ MES, 2 мМ ЭДТА, 150 мМ NaCl, рН 5,5) и с приводили в контакт с 1 мкл трипсина (100 мг/мл) для отбора по признаку зависимости от кальция. После селекции отобранные клоны фагов превращали в IgG-формат.
Связывающую способность конвертированных в формат IgG антител к человеческому С5 оценивали в двух различных условиях: определение ассоциации и диссоциации при 1,2 мМ CaCl2-рН 7,4 (20 мМ MES, 150 мМ NaCl, 1.2 мМ CaCl2) и ассоциации при 1,2 мМ CaCl2-рН 7,4 (20 мМ MES, 150 мМ NaCl, 1.2 мМ CaCl2) и диссоциации при 3 мкМ CaCl2-рН 5,8 (20 мМ MES, 150 мМ NaCl, 3 мкМ CaCl2) при 30°С с использованием системы Octet RED384 (фирма Pall Life Sciences). Выделяли 25 клонов, связывание которых с антигеном зависело от рН-кальция. Сенсограммы этих антител представлены на фиг. 38.
(22-4) Идентификация биспецифического антитела к С5
Из клонов, выделенных в примере В-3, отбирали девять зависящих от рН или кальция клонов антител к С5 для дополнительного анализа (CFP0008, 0011, 0015, 0016, 0017, 0018, 0019, 0020, 0021). Интродуцировали несколько аминокислотных замен в вариабельную область тяжелой цепи CFP0016 с помощью метода, хорошо известного обычным специалистам в данной области, для улучшения свойств антител, таких как физико-химические свойства. Этот вариант CFP0016, CFP0016H019, применяли для дополнительного анализа вместо CFP0016. Аминокислотные последовательности VH- и VL-областей указанных девяти антител представлены в таблице 34. В этой таблице обозначения в скобках соответствуют сокращенным обозначениям.

Полноразмерные гены, имеющие нуклеотидные последовательности, кодирующие тяжелую цепь и легкую цепь антител, синтезировали и получали с помощью метода, хорошо известного обычным специалистам в данной области. Экспрессионные векторы тяжелой цепи и легкой цепи получали путем встраивания полученных фрагментов плазмид в векторы для экспрессии в клетках млекопитающих. Полученные экспрессионные векторы секвенировали с помощью метода, хорошо известного обычным специалистам в данной области. Для экспрессии антител полученными плазмидами кратковременно трансфектировали клетки линии FreeStyle293-F (фирма Thermo Fisher Scientific). Очистку из кондиционированных сред, экспрессирующих антитела, осуществляли с помощью метода, хорошо известного обычным специалистам в данной области, используя r-белок А сефарозу Fast Flow (фирма GE Healthcare).
(22-5) Создание и характеризация рН-зависимого биспецифического антитела к С5
Биспецифические антитела, которые распознают два различных эпитопа С5, создавали путем объединения CFP0020 и CFP0018. Биспецифическое антитело получали в IgG-формате, и оно содержало два различных клона Fab в каждом сайте связывания антитела, и получали с помощью метода, хорошо известного обычным специалистам в данной области. В этом биспецифическом антителе IgG-типа две тяжелые цепи содержат отличные друг от друга константные области тяжелых цепей (G1dP1, SEQ ID NO: 227 и G1dN1, SEQ ID NO: 228), что позволяет эффективно образовывать гетеродимер двух тяжелых цепей. Биспецифическое антитело к С5, содержащее сайты связывания МАт к С5 «X» и МАт к С5 «Y», обозначали как «X//Y».
Путем интродукции нескольких аминокислотных замен в CDR тяжелой цепи и легкой цепи с помощью метода, хорошо известного обычным специалистам в данной области, получали вариант, объединенный с легкой цепью 20//18, который обозначали как «оптимизированный 20//18» (состоящий из двух тяжелых цепей: CFP0020H0261-G1dP1, SEQ ID NO: 229 и CFP0018H0012-G1dN1, SEQ ID NO: 230, и общей легкой цепи: CFP0020L233-k0, SEQ ID NO: 231).
Кинетические параметры оптимизированного 20//18, характеризующие взаимодействие с рекомбинантым человеческим С5, оценивали в двух различных условиях (например, (А) ассоциация и диссоциация при рН 7,4 и (Б) ассоциация при рН 7,4 и диссоциация при рН 5,8) при 37°С, используя устройство BIACORE Т200 (фирма GE Healthcare). Белок A/G (фирма Pierce, каталожный №21186) или антитело к человеческому IgG (Fc) (входящие в набор Humab Antidody Capture; фирма GE Healthcare, каталожный №BR-1008-39) иммобилизовывали на чипе серий S СМ4 (фирма GE Healthcare, каталожный №BR-1005-34) с помощью метода аминного сочетания. Антитела к С5 захватывали на иммобилизованной молекуле и затем инъецировали человеческий С5. В качестве подвижных буферов применяли ACES рН 7,4 и рН 5,8 (20 мМ ACES, 150 мМ NaCl, 1,2 мМ CaCl2, 0,05% Твин 20). Кинетические параметры в условиях обоих рН определяли путем подгонки сенсограмм к модели связывания 1:1-RI (без регуляции объемного эффекта), используя программное обеспечение BIACORE Т200 Evaluation, версия 2.0 (фирма GE Healthcare). Кинетические параметры, скорость реакции ассоциации (ka), скорость реакции диссоциации (kd) и аффинность связывания (KD) при рН 7,4 и скорость диссоциации (kd), определенная только путем расчета на фазе диссоциации в условиях каждого рН, представлены в таблице 35. Для оптимизированного 20//18 установлена более быстрая диссоциация при рН 5,8 из комплекса с человеческим С5 по сравнению со скоростью диссоциации при рН 7,4.

(22-6) Получение антител с повышенной pI путем модификации аминокислот в вариабельной области
Данные о тестируемых антителах обобщены в таблицах 36 и 37.
Тяжелую цепь, CFP0020H0261-001-G1dP1 (которую обозначали также как 20Н001, SEQ ID NO: 232), получали путем интродукции повышающей pI замены P41R/G44R в CFP0020H0261-G1dP1 (SEQ ID NO: 229). Аналогично этому, тяжелую цепь, CFP0018H0012-002-G1dN1 (которую обозначали также как 18Н002, SEQ ID NO: 251), получали путем интродукции повышающей pI замены T77R/E85R в CFP0018H0012-G1dN1 (SEQ ID NO: 230). Другие варианты тяжелых цепей получали также путем интродукции соответствующих замен, указанных в таблице 36, в CFP0020H0261-G1dP1 и CFP0018H0012-G1dN1 соответственно согласно методу, описанному в референс-примере 1. Варианты тяжелых цепей как вариантов CFP0020H0261-G1dP1, так и вариантов CFP0018H0012-G1dN1 экспрессировали с CFP0020L233-k0 (SEQ ID NO: 231) в качестве легкой цепи, получая биспецифическое антитело.
Аналогично этому, оценивали также приводящую к повышению pI замену в легкой цепи. Легкую цепь, CFP0020L233-001-k0 (которую обозначали также кака 20L233-001, SEQ ID NO: 271), получали путем интродукции повышающей pI замены G16K в CFP0020L233-k0. Другие варианты легких цепей получали также путем интродукции соответствующих замен, представленных в таблице 37, в CFP0020L233-k0 согласно методу, описанному в референс-примере 1. Все варианты легких цепей экспрессировали с CFP0020H0261-G1dP1 и CFP0018H0012-G1dN1 в качестве тяжелой цепи, получая биспецифическое антитело.
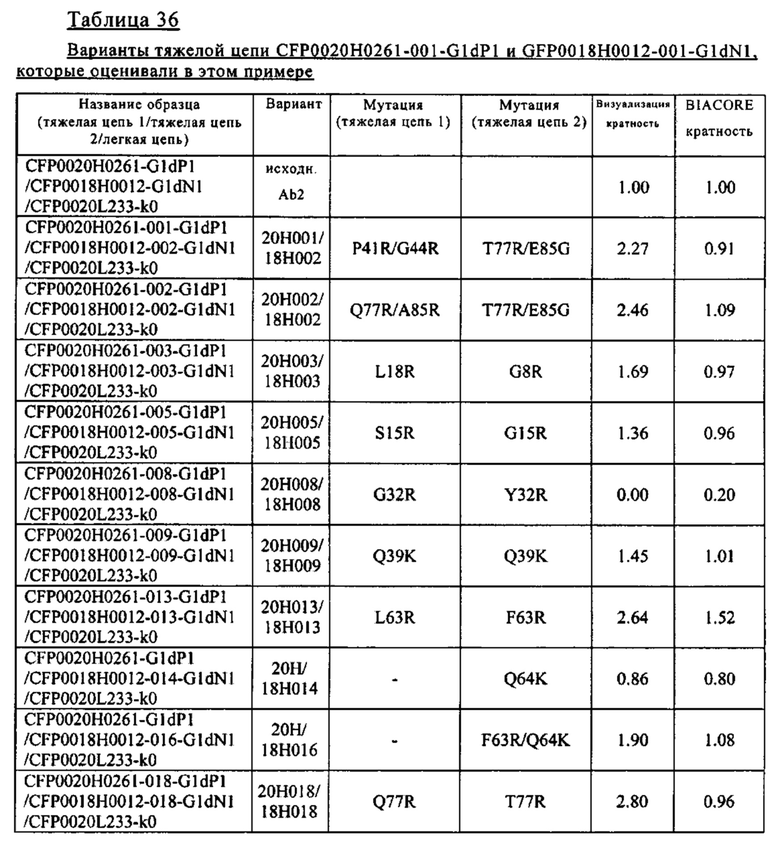
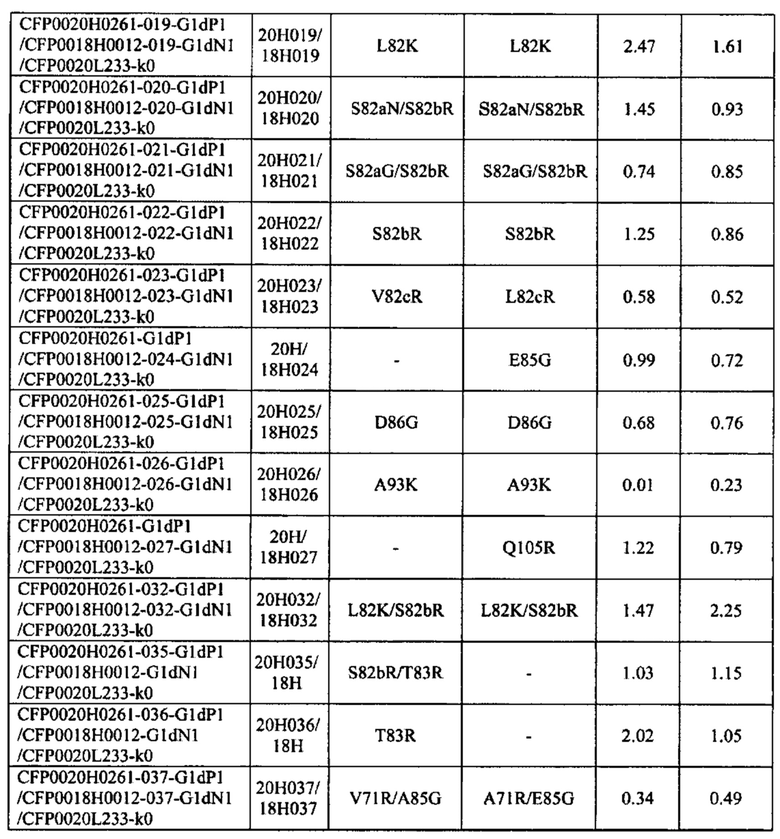
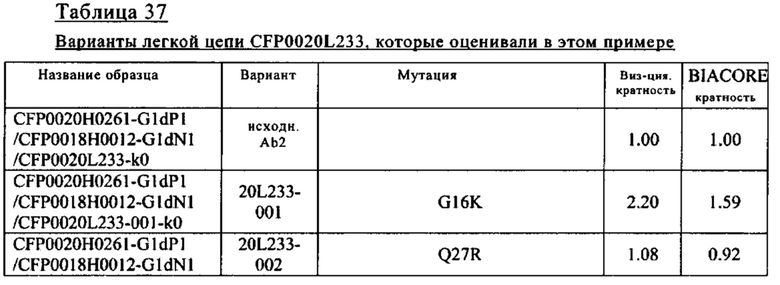
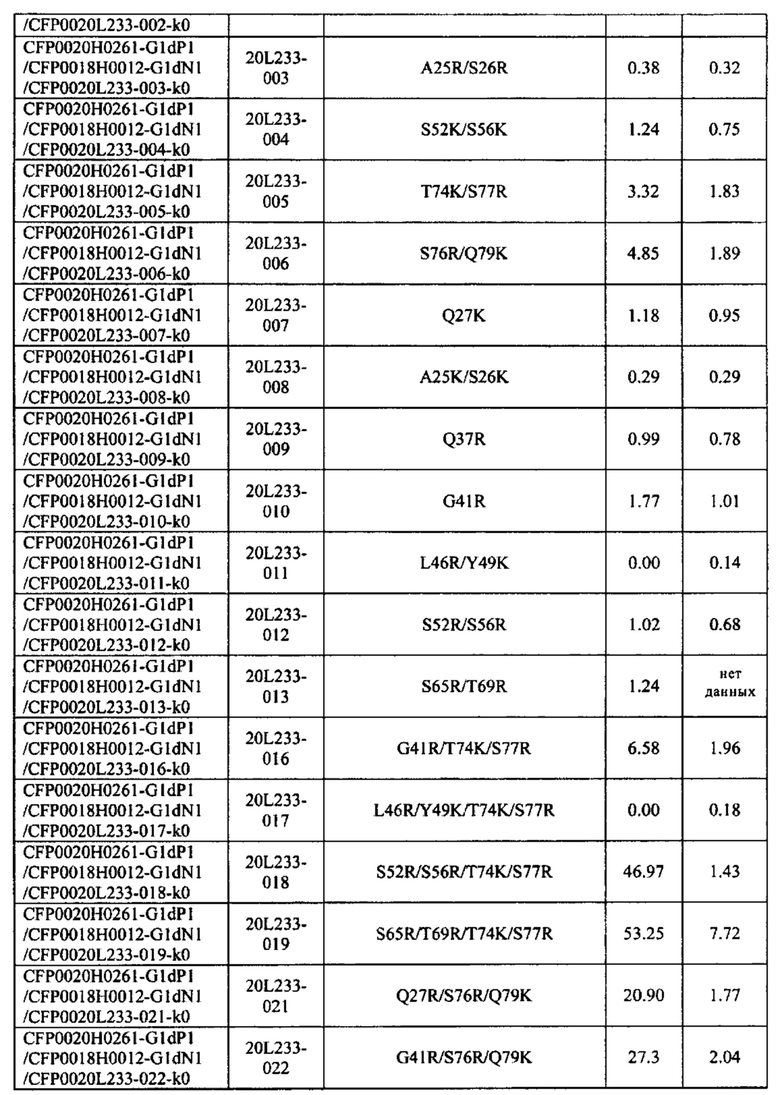
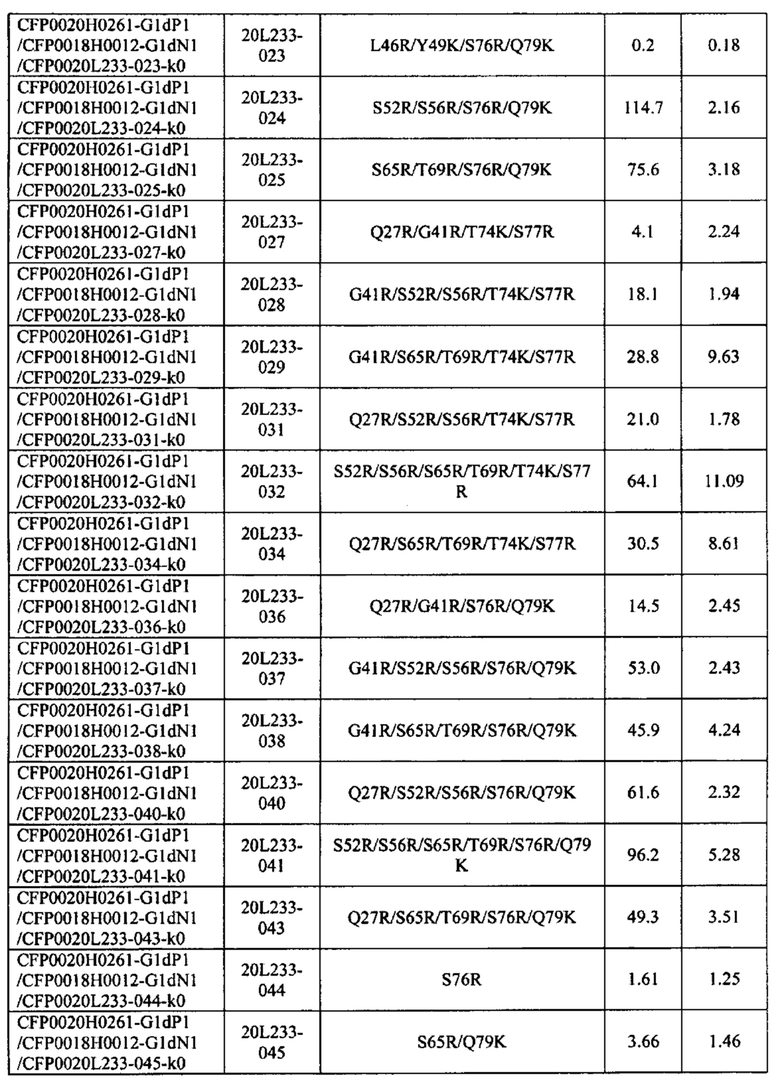
(22-7) Анализ связывания человеческого FcγRIIb с помощью BIACORE с использованием вариантов с повышенной pI
Для полученных антител, содержащих варианты Fc-области, осуществляли анализы связывания между растворимым hFcγRIIb и комплексами антиген-антитело с использованием устройства BIACORE Т200 (фирма GE Healthcare). Растворимый hFcγRIIb получали в форме меченной His молекулы с помощью известного в данной области метода. Антитело к His в соответствующем количестве фиксировали на сенсорном чипе СМ5 (фирма GE Healthcare) методом аминного сочетания, используя набор для захвата His (фирма GE Healthcare) для иммобилизации человеческого FcγRIIb. Затем инъецировали комплекс антитело-антиген и подвижный буфер (в качестве референс-раствора) и давали пройти взаимодействию с человеческим FcγRIIb, иммобилизованном на сенсорном чипе. 20 мМ N-(2-ацетамидо)-2-аминоэтансульфоновую кислоту, 150 мМ NaCl, 1,2 мМ CaCl2 и 0,05% (мас./об.) Твин 20, рН 7,4 применяли в качестве подвижного буфера и соответствующий буфер применяли также для разведения растворимого человеческого FcγRIIb. Для регенерации сенсорного чипа применяли 10 мМ глицин-HCl, рН 1,5. Все измерения проводили при 25°С, Анализы осуществляли на основе связывания (RU), рассчитанного с использованием сенсограмм, полученных при измерениях, и получали относительные величины, принимая уровень связывания CFP0020H0261-G1dP1/CFP0018H0012-G1dN1/CFP0020L233-k0 (исходное антитело Ab2) за 1,00. Для расчета параметров применяли программное обеспечение BIACORET100 Evaluation (фирма GE Healthcare).
Результаты SPR-анализа обобщены в таблицах 36 и 37. Установлено, что несколько вариантов обладали повышенной способностью связываться с hFcγRIIb, фиксированном на сенсорном чипе BIACORE. В контексте настоящего описания увеличенное примерно в 1,2 или более раз связывание с hFcγRIIb вариантов по сравнению со связыванием с hFcγRIIb исходного Ab2 свидетельствует о сильном обусловленном зарядом действии на связывание антитела с hFcγRIIb на сенсорном чипе.
Среди вариантов тяжелой цепи с повышенной pI антитело с заменами L63R, F63R, L82K или S82bR (согласно нумерации Кэбота) отличалось более высоким связыванием с hFcγRIIb. Предполагается, что одна аминокислотная замена или комбинация этих замен в тяжелой цепи должна оказывать сильное обусловленное зарядом действие на связывание с hFcγRIIb на сенсорном чипе. Таким образом, одно или несколько положений, которые, как ожидается, должны оказывать воздействие на увеличение скорости или уровень поглощения клетками in vivo, при интродукции приводящих к повышению pI модификаций в вариабельную(ые) область(и) тяжелой цепи антитела, могут включать, например, положения 63, 82 или, 82b согласно нумерации Кэбота. Аминокислотная замена, интродуцированная в указанное(ые) положение(я), может представлять собой аргинин или лизин.
Среди вариантов легкой цепи с повышенной pI антитело с заменой(ами) G16K, Q27R, G41R, S52R, S56R, S65R, T69R, T74K, S76R, S77R или Q79K (согласно нумерации Кэбота) отличалось более высоким связыванием с hFcγRIIb. Предполагается, что одна аминокислотная замена или комбинация этих замен в легкой цепи должна оказывать сильное обусловленное зарядом действие на связывание с hFcγRIIb на сенсорном чипе. Таким образом, одно или несколько положений, которые, как ожидается, должны оказывать воздействие на увеличение скорости или уровень поглощения клетками in vivo, при интродукции приводящих к повышению pI модификаций в вариабельную область легкой цепи антитела, могут включать, например, положения 16, 27, 41, 52, 56, 65, 69, 74, 76, 77 или 79 согласно нумерации Кэбота. Аминокислотная замена, интродуцированная в указанное(ые) положение(я), может представлять собой аргинин или лизин. Варианты с 4 или большим количеством аминокислотных замен имели тенденцию оказывать более сильное обусловленное зарядом действие, чем варианты с меньшим количеством аминокислотных замен.
(22-8) Клеточное поглощение антител, содержащих вариант Fab-области с повышенной pI
Для оценки уровня внутриклеточного поглощения экспрессирующей hFcγRIIb клеточной линией с использованием полученных антител, содержащих вариант Fab-области, осуществляли следующий анализ.
Линию клеток MDCK (линия клеток почек собак Madin-Darby), конститутивно экспрессирующих hFcγRIIb, получали с помощью известных методов. С использованием этих клеток оценивали внутриклеточное поглощение комплексов антиген-антитело. Более конкретно, для мечения человеческого С5 использовали Alexa555 (фирма Life Technlogies) согласно утвержденному протоколу и получали комплексы антиген-антитело в растворе культуры с концентрацией антитела 10 мг/мл и концентрацией антигена 10 мг/мл. Раствор культуры, содержащий комплексы антиген-антитело, добавляли в культуральные планшеты к указанным выше клеткам MDCK, которые конститутивно экспрессируют hFcγRIIb, и инкубировали в течение 1 ч, и затем количественно определяли интенсивность флуоресценции от антигена, поглощенного клетками, с использованием анализатора InCell 6000 (фирма GE healthcare). Количество поглощенного антигена представляли в виде относительных величин в сравнении с величиной для Ab2, которую принимали за 1,00.
Результаты количественной оценки клеточного поглощения обобщены в таблицах 36 и 37. Сильная флуоресценция, испускаемая антигеном в клетках, обнаружена для нескольких вариантов тяжелых цепей и легких цепей.
В контексте настоящего описания увеличенная примерно в 1,5 или более раз интенсивность флуоресценции антигена, поглощенного клетками, при использовании вариантов по сравнению с интенсивностью флуоресценции при использовании исходного Ab1, свидетельствует о сильном обусловленном зарядом действии на поглощение антигена клетками.
Среди вариантов тяжелой цепи с повышенной pI антитело с заменой(амии) G8R, L18R, Q39K, P41R, G44R, L63R, F63R, Q64K, Q77R, T77R, L82K, S82aN, S82bR, T83R, A85R или E85G (согласно нумерации Кэбота) приводило к более сильному поглощению антигена клетками. Предполагается, что одна аминокислотная замена или комбинация этих замен в тяжелой цепи должна оказывать сильное обусловленное зарядом действие на поглощение комплекса антиген-антитело клетками. Таким образом, одно или несколько положений, которые, как ожидается, должны оказывать воздействие на увеличение скорости или уровень поглощения клетками комплекса антиген-антитело, при интродукции приводящих к повышению pI модификаций в вариабельную(ые) область(и) тяжелой цепи антитела, могут включать, например, положения 8, 18, 39, 41, 44, 63, 64, 77, 82, 82а, 82b, 83 или 85 согласно нумерации Кэбота. Аминокислотная замена, интродуцированная в указанное(ые) положение(я), может представлять собой аспарагин, глицин, серии, аргинин или лизин и предпочтительно аргинин или лизин.
Среди вариантов легкой цепи с повышенной pI антитело с заменами G16K, Q27R, S27R, G41R, S52R, S56R, S65R, T69R, Т74К, S76R, S77R или Q79K (согласно нумерации Кэбота) приводило к более сильному поглощению антигена клетками. Предполагается, что одна аминокислотная замена или комбинация этих замен в тяжелой цепи должна оказывать сильное обусловленное зарядом действие на поглощение комплекса антиген-антитело клетками. Варианты с 4 или большим количеством аминокислотных замен имели тенденцию оказывать более сильное обусловленное зарядом действие, чем варианты с меньшим количеством аминокислотных замен. Как продемонстрировано в примере 21, (21-3), комбинация замен 42K и 76R обладала эффективностью в отношении антитела к IgE. Однако в случае антитела к С5 аминокислота в положении 42 согласно нумерации Кэбота уже представляет собой лизин, поэтому при создании изобретения достигнут эффект, связанный с заменой заряда 42K/76R, с помощью одной замены 76R. Тот факт, что вариант с заменой 76R обладал сильным эффектом, связанным с заменой заряда, также и в антителе к С5, свидетельствует о том, что комбинация 42K/76R оказывает сильный связанный с зарядом эффект вне зависимости от антигена. Таким образом, одно или несколько положений, которые, как ожидается, должны оказывать воздействие на увеличение скорости или уровень поглощения клетками комплекса антиген-антитело, при интродукции приводящих к повышению pI модификаций в вариабельную(ые) область(и) легкой цепи антитела, могут включать, например, положения 16, 27, 41, 52, 56, 65, 69, 74, 76, 77 или 79, согласно Кэбот нумерации. Аминокислотная замена, интродуцированная в указанное(ые) положение(я), может представлять собой аргинин или лизин.
(22-9) Оценка клиренса С5 на полученной путем совместной инъекции мышиной модели
Некоторые биспецифические антитела к С5 (исходное Ab2, 20L233-005, 20L233-006 и 20L233-009) тестировали на полученной совместной инъекцией мышиной модели для оценки их способности усиливать клиренс С5 из плазмы. Для создания полученной путем совместной инъекции модели мышам линии C57BL6J (фирма Jackson Laboratories) вводили путем одной i.v.-инъекции С5, предварительной смешанный с антителом к С5 соответственно. Все группы получали 0,1 мг/кг С5 и 1,0 мг/кг биспецифических антител к С5. Общую концентрацию С5 в плазме определяли с помощью ECLIA для антител к С5. Сначала антитело к человеческому С5 IgG-типа вносили в ECL-планшет и выдерживали в течение ночи при 5°С для получения планшета с иммобилизованным мышиным IgG к человеческому С5. Образцы для построения стандартной кривой и образцы смешивали с кроличьим IgG к человеческому С5. Указанные образцы вносили в планшет с иммобилизованным мышиным IgG к человеческому С5 и выдерживали в течение 1 ч при комнатной температуре. Затем эти образцы подвергали взаимодействию с конъюгированным с HRP антикроличьим IgG (фирма Jackson Immuno Research) в течение 1 ч. После инкубации планшета в течение 1 ч при комнатной температуре добавляли конъюгированное с сульфа-меткой антитело к HRP. ECL-сигнал определяли с помощью устройства SpectraMax М2 (фирма Molecular Devices). Концентрацию человеческого С5 рассчитывали на основе ECL-сигнала стандартной кривой с помощью SOFTmax PRO (фирма Molecular Devices). На фиг. 39 представлен профиль зависимости от времени концентрации С5 в плазме мышей C57BL6J.
По сравнению с исходным Ab2 для всех протестированных в этом опыте биспецифических антител с повышающей(ими) pI заменой(ами) продемонстрирован быстрый клиренс С5 из плазмы. Следовательно, можно предположить, что аминокислотная(ые) замена(ы) T74K/S77R, S76R/Q79K и Q37R в легкой цепи ускоряет(ют) элиминацию иммунного комплекса С5-антитело также и in vivo. Кроме того, элиминация С5 при использовании 20L233-005 и 20L233-006 оказалась более быстрой по сравнению с 20L233-009, что согласуется с данными визуализации in vitro и BIACORE-анализом.
Эти результаты позволяют предположить, что даже для положения(й), влияние которых на клиренс антигена из плазмы in vivo представляется маловероятным при оценке либо в системе in vitro, основанной на оценке интенсивности флуоресценции с помощью анализатора InCell 6000, либо описанной выше системы in vitro BIACORE, можно обнаружить участие в клиренсе при применении более чувствительной системы in vivo. Эти результаты также позволяют предположить, что учитывая результаты оценки клиренса антигена из плазмы in vivo, чувствительность описанной выше системы in vitro, которую применяли для определения интенсивности флуоресценции с помощью анализатора InCell 6000, может быть выше, чем чувствительность описанной выше системы in vitro BIACORE.
Пример 23
Оценка клиренса IgE из плазмы с использованием вариантов Fc-области с повышенной pI
Для усиления клиренса человеческого IgE или человеческого С5 оценивали приводящие к повышению pI замены в Fc-области антител с использованием рН-зависимых антител. Метод добавления аминокислотных замен в константную область антитела для повышения pI не ограничен конкретным методом, но, например, для этой цели можно использовать метод, описанный в WO 2014/145159.
(23-1) Получение антител с повышенной pI путем одной аминокислотной модификации в константной области
Данные о протестированных антителах обобщены в таблице 38. Тяжелую цепь, Ab1H-P1394m (SEQ ID NO: 307), получали путем интродукции повышающей pI замены Q311K в АМН. Другие варианты тяжелых цепей получали также путем интродукции соответствующих замен, представленных в таблице 38, в АМН согласно методу, описанному в референс-примере 1. Все варианты тяжелых цепей экспрессировали с Ab1L в качестве легкой цепи.
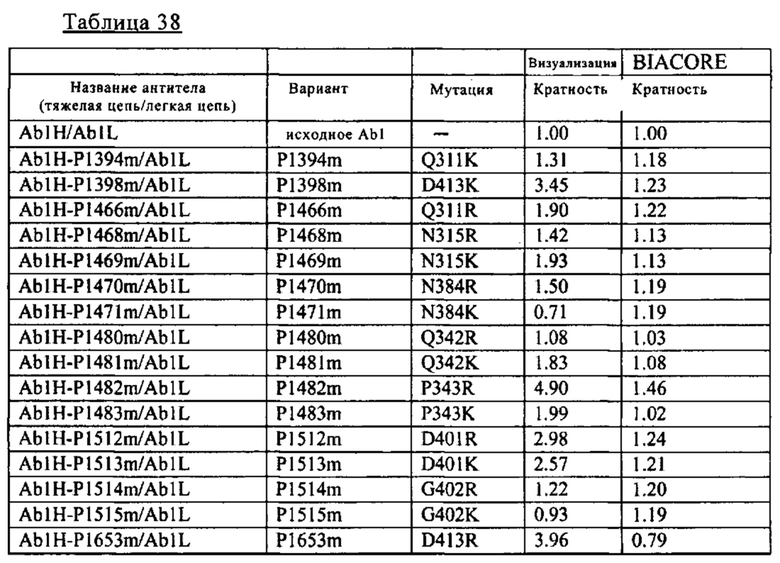
(23-2) Анализ связывания человеческого FcγRIIb с помощью BIACORE при использовании антител, содержащих вариант Fc-области с повышенной pI
Для оценки связанного с зарядом эффекта на FcRyRIIb-связывание комплекса антиген-антитело, полученного с использованием антител, указанных в таблице 38, осуществляли анализ FcRγRIIb-связывания, аналогичный описанному в примере 21, (21-2). Результаты анализа приведены в таблице 38. В контексте настоящего описания увеличенное примерно в 1,2 или более раз связывание с hFcγRIIb при использовании вариантов по сравнению со связыванием с hFcγRIIb исходного Ab1, свидетельствует о сильном обусловленным зарядом действии на связывание антитела с hFcγRIIb на сенсорном чипе.
Среди вариантов с повышенной pI с одной аминокислотной заменой относительно исходного Ab1, для комплекса антиген-антитело, где в качестве антитела использовали несколько вариантов, обозначенных как P1398m, P1466m, P1482m, P1512m, P1513m и P1514m, обнаружено наиболее высокое связывание с hFcγRIIb. Вероятно, одна аминокислотная замена D413K, Q311R, P343R, D401R, D401K, G402R, Q311K, N384R, N384K или G402K может оказывать сильное обусловленное зарядом действие на связывание с hFcγRIIb на сенсорном чипе.
Таким образом, индивидуальное положение, которое, как ожидается, должно влиять на увеличение скорости или уровня поглощения клетками in vivo, при интродукции приводящей к повышению pI модификации в константную область антитела, может включать, например, положения 16, 27, 41, 52, 56, 65, 69, 74, 76, 77 или 79 согласно нумерации Кэбота. Аминокислотная замена, интродуцированная в указанное положение, может представлять собой аргинин или лизин.
(23-3) Клеточное поглощение антител, содержащих вариант Fc-области с повышенной pI
Для оценки уровня внутриклеточного поглощения комплекса антиген-антитело, образованного с использованием антител, указанных в таблице 38, осуществляли анализ визуализации клеток, аналогичный описанному в примере 21, (21-3). Результаты анализа приведены в таблице 38. В контексте настоящего описания увеличенная примерно в 1,5 или более раз интенсивность флуоресценции антигена, поглощенного клетками, при использовании вариантов по сравнению с интенсивностью флуоресценции при использовании исходного Ab1 свидетельствует о сильном обусловленном зарядом действии на поглощение антигена клетками.
Среди вариантов с повышенной pI с одной аминокислотной заменой относительно исходного Ab1, для комплекса антиген-антитело, где в качестве антитела использовали несколько вариантов, таких как P1398m, P1466m, P1469m, P1470m, P1481m, P1482m, P1483m, P1512m, P1513m и P1653m, обнаружено более сильное поглощение антигена клетками. Вероятно, одна аминокислотная замена D413K, Q311R, N315K, N384R, Q342K, P343R, P343K, D401R, D401K или D413R может оказывать сильное обусловленное зарядом действие на поглощение комплекса антиген-антитело клетками. Таким образом, индивидуальное положение, которое, как ожидается, должно влиять на увеличение скорости или уровня поглощения клетками, при интродукции приводящей к повышению pI модификации в константную область антитела, может включать, например, положения 311, 315, 342, 343, 384, 401 или 413, согласно EU-нумерации. Аминокислотная замена, интродуцированная в указанное положение, может представлять собой аргинин или лизин.
(23-4) Оценка клиренса человеческого IgE на полученной путем совместной инъекции мышиной модели
Некоторые антитела к IgE, обладающие рН-зависимым связыванием с антигеном (исходное Ab1, P1466m, P1469m, P1470m, P1480m, P1482m, P1512m, Р 1653m), тестировали на полученной совместной инъекцией мышиной модели для оценки их способности усиливать клиренс IgE из плазмы. Анализы осуществляли методом, аналогичным описанному в примере 21, (21-4). На фиг. 40 представлены профили в зависимости от времени концентрации в плазме мышей линии C57BL6J
После введения вариантов с высокой pI (только с одной аминокислотной заменой) с рН-зависимым связыванием антигена общая концентрация IgE в плазме оказалась ниже, чем при применении исходного Ab1, за исключением P1480m. Вариант P1480m, для которого установлена слабая эффективность в обоих экспериментах in vitro, не ускорял элиминацию IgE. Кроме того, общая концентрация IgE в плазме мышей, обработанных вариантом с высокой pI без рН-зависимым связывания антигена, оказалась существенно выше, чем в случае варианта с высокой pI с рН-зависимым связыванием антигена (данные не представлены). Эти результаты свидетельствует о том, что клеточное поглощение иммунного комплекса антиген-антитело возрастает при интродукции повышающей pI модификации. Антиген, поглощенный клетками в комплексе с рН-зависимым антигенсвязывающим антителом, может эффективно высвобождаться из антитела внутри эндосомы, что приводит к ускорению элиминации IgE. Эти результаты позволяют предположить также, что даже для замены положения, влияние которой на клиренс антигена из плазмы in vivo представляется маловероятным при оценке с использованием описанной выше системы in vitro BIACORE, участие в клиренсе можно обнаружить при применении более чувствительной системы in vivo. Эти результаты позволяют предположить также, что, учитывая результаты оценки клиренса антигена из плазмы in vivo, чувствительность описанной выше системы in vitro, основанной на оценке интенсивности флуоресценции с помощью анализатора InCell 6000, может быть выше, чем чувствительность описанной выше системы in vitro BIACORE.
Референс-пример 1
Конструирование экспрессионных векторов антител IgG-типа с заменой аминокислот
Получали мутанты с использованием системы для сайтнаправленного мутагенеза QuickChange (фирма Stratagene) с помощью метода, описанного в прилагаемой инструкции по эксплуатации. Фрагменты плазмид, содержащие мутанты, встраивали в экспрессионные векторы для клеток животных для конструирования требуемых экспрессионных векторов для Н-цепи и L-цепи. Нуклеотидные последовательности полученных экспрессионных векторов определяли методами, известными в данной области.
Референс-пример 2
Экспрессия и очистка антител IgG-типа
Антитела экспрессировали с помощью следующего метода. Полученную из клеток рака почки человеческого эмбриона клеточную линию HEK293H (фирма Invitrogen) суспендировали в среде DMEM (фирма Invitrogen), дополненной 10% фетальной бычьей сыворотки (фирма Invitrogen). Клетки высевали из расчета 10 мл на чашку в чашки для прикрепленных клеток (диаметром 10 см; фирма CORNING) с плотностью клеток 5-6×105 клеток/мл и культивировали в СО2-инкубаторе (37°С, 5% СО2) в течение 1 дня. Затем среду удаляли аспирацией и добавляли 6,9 мл среды CHO-S-SFM-II (фирма Invitrogen). Полученную плазмиду интродуцировали в клетки методом липофекции. Образовавшиеся супернатанты культуры собирали, центрифугировали (примерно 2000 g, 5 мин, комнатная температура) для удаления клеток и стерилизовали фильтраций через 0,22-мкм фильтр MILLEX®-GV (фирма Millipore) с получением супернатантов. Антитела очищали из полученных супернатантов культур с помощью известных в данной области методов с использованиеме rProtein A Sepharose™ Fast Flow (фирма Amersham Biosciences). Для определения концентрации очищенного антитела измеряли абсорбцию при 280 нм с помощью спектрофотометра. Концентрации антител рассчитывали на основе установленных величин, используя коэффициент абсорбции, рассчитанный методом, который описан у Расе и др., Protein Science 4, 1995, сс. 2411-2423.
Референс-пример 3
Очистка растворимого человеческого IL-6-рецептора
Рекомбинантный растворимый человеческий IL-6-рецептор, который является антигеном, получали описанным ниже методом. Линию СНО-клеток, которая конститутивно экспрессирует растворимый человеческий IL-6-рецептор, состоящий из аминокислотной последовательности, простирающейся с 1 по 357 аминокислоту, начиная с N-конца, который описан у Mullberg и др., J. Immunol. 152, 1994, сс. 4958-4968, конструировали с помощью метода, известного в данной области. Растворимый человеческий IL-6-рецептор экспрессировали путем культивирования этой линии СНО. Растворимый человеческий IL-6-рецептор очищали из супернатанта культуры, полученной в линии СНО, с использованием двух стадий: хроматография на колонке с Blue Sepharose 6 FF и гель-фильтрация с использованием колоночной хроматографии. Фракцию, которую элюировали в виде основного пика на конечной стадии, применяли в качестве окончательного очищенного продукта.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗМЕНЕНИЯ УДЕРЖАНИЯ В ПЛАЗМЕ И ИММУНОГЕННОСТИ АНТИГЕНСВЯЗЫВАЮЩЕЙ МОЛЕКУЛЫ | 2012 |
|
RU2799423C1 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СПОСОБНАЯ К МНОГОКРАТНОМУ СВЯЗЫВАНИЮ ДВУХ ИЛИ БОЛЕЕ МОЛЕКУЛ АНТИГЕНА | 2009 |
|
RU2571225C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СПОСОБНАЯ МНОГОКРАТНО СВЯЗЫВАТЬСЯ С МНОЖЕСТВОМ АНТИГЕННЫХ МОЛЕКУЛ | 2011 |
|
RU2658504C9 |
| БИБЛИОТЕКА ЗАВИСИМЫХ ОТ КОНЦЕНТРАЦИИ ИОНОВ СВЯЗЫВАЮЩИХ МОЛЕКУЛ | 2012 |
|
RU2812861C1 |
| ВАРИАНТ Fc-ОБЛАСТИ | 2014 |
|
RU2757124C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА ДЛЯ УСКОРЕНИЯ ЭЛИМИНАЦИИ АНТИГЕНОВ | 2012 |
|
RU2772771C1 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СПОСОБНАЯ МНОГОКРАТНО СВЯЗЫВАТЬСЯ С МНОЖЕСТВОМ АНТИГЕННЫХ МОЛЕКУЛ | 2011 |
|
RU2642318C2 |
| СПОСОБ ПОЛИПЕПТИДНОЙ МОДИФИКАЦИИ ДЛЯ ОЧИСТКИ ПОЛИПЕПТИДНЫХ МУЛЬТИМЕРОВ | 2010 |
|
RU2606264C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА ДЛЯ УСКОРЕНИЯ ИСЧЕЗНОВЕНИЯ АНТИГЕНА ЧЕРЕЗ FcγRIIB | 2013 |
|
RU2812226C1 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СПОСОБНАЯ К МНОГОКРАТНОМУ СВЯЗЫВАНИЮ ДВУХ ИЛИ БОЛЕЕ МОЛЕКУЛ АНТИГЕНА | 2021 |
|
RU2841525C2 |
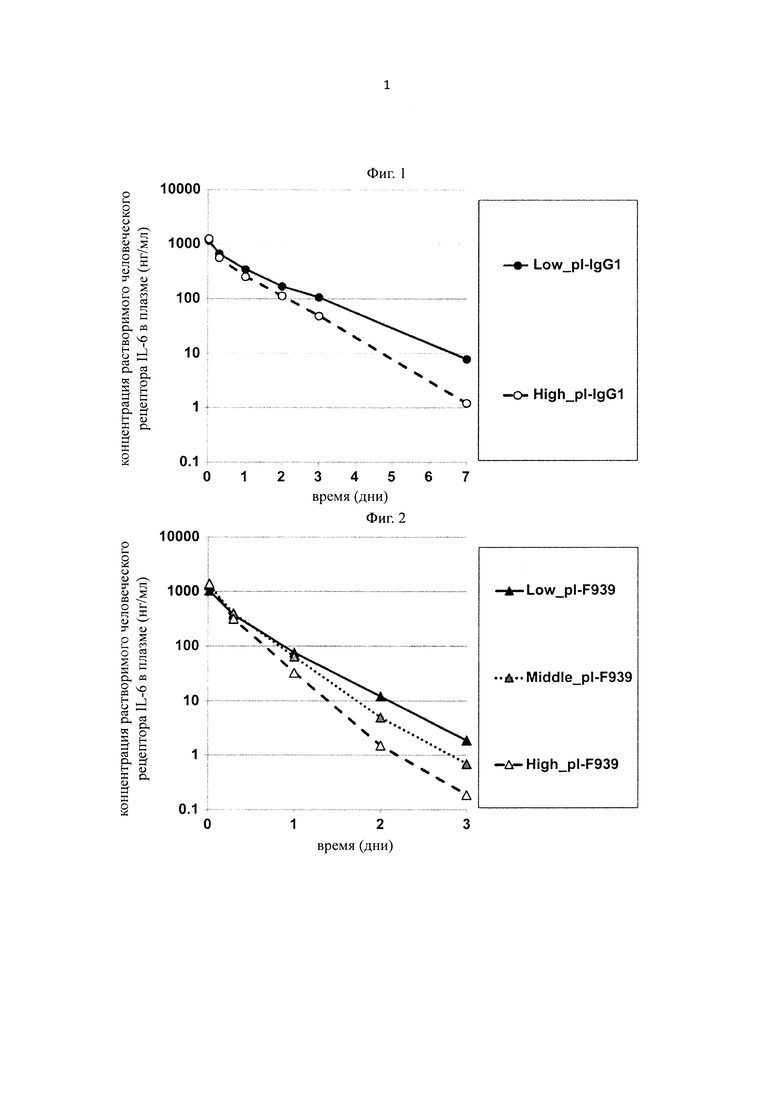


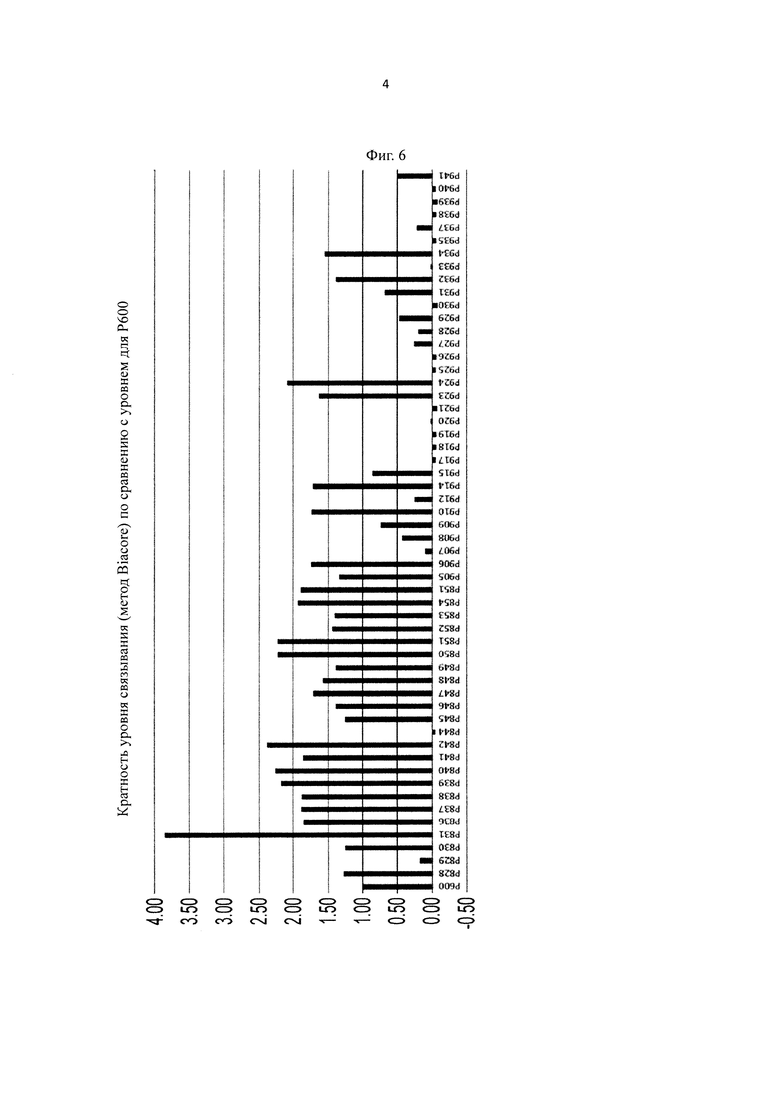
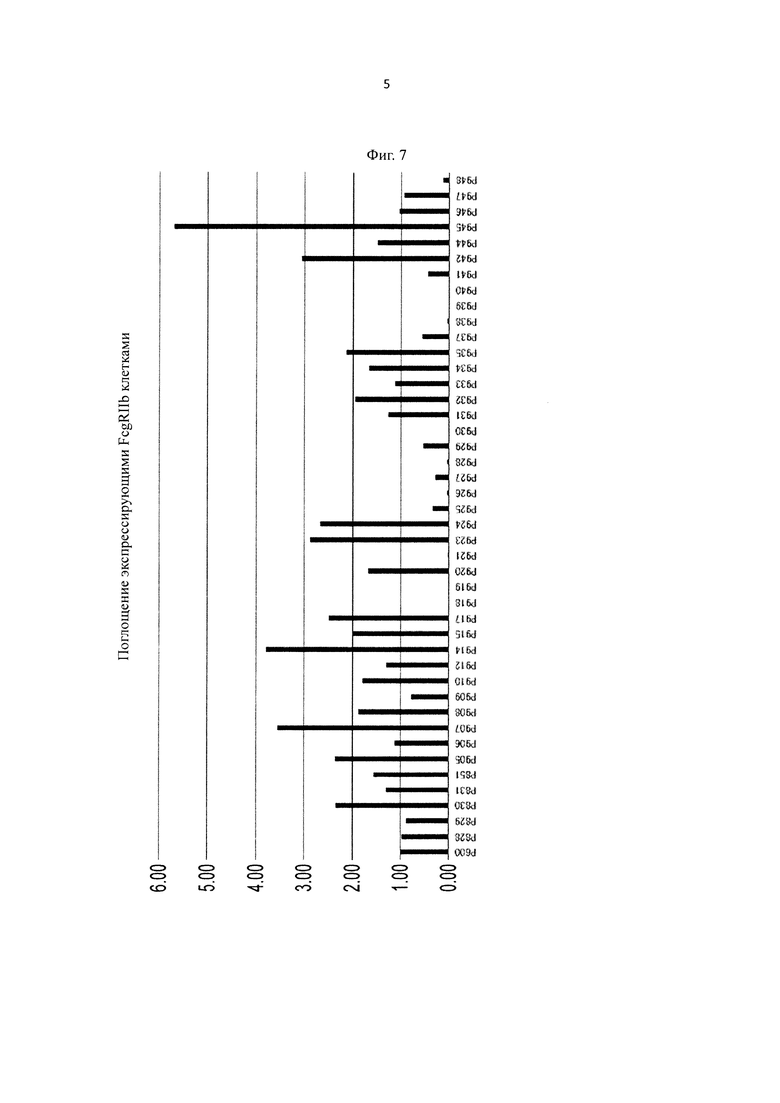
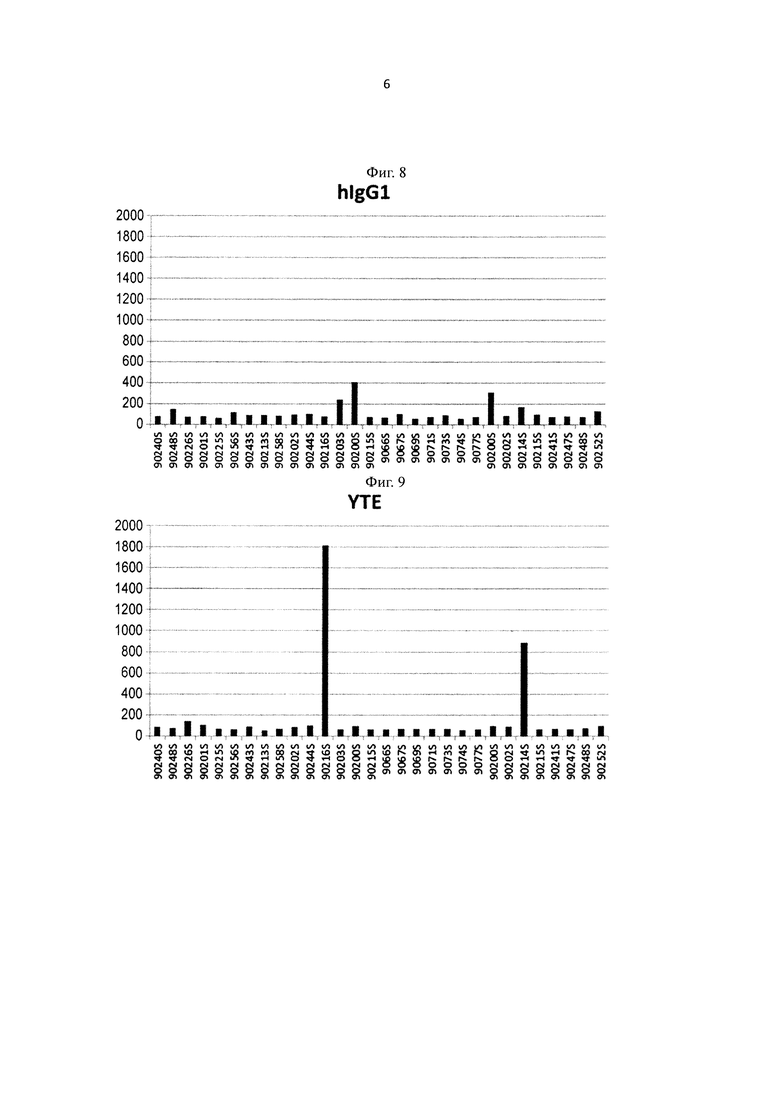
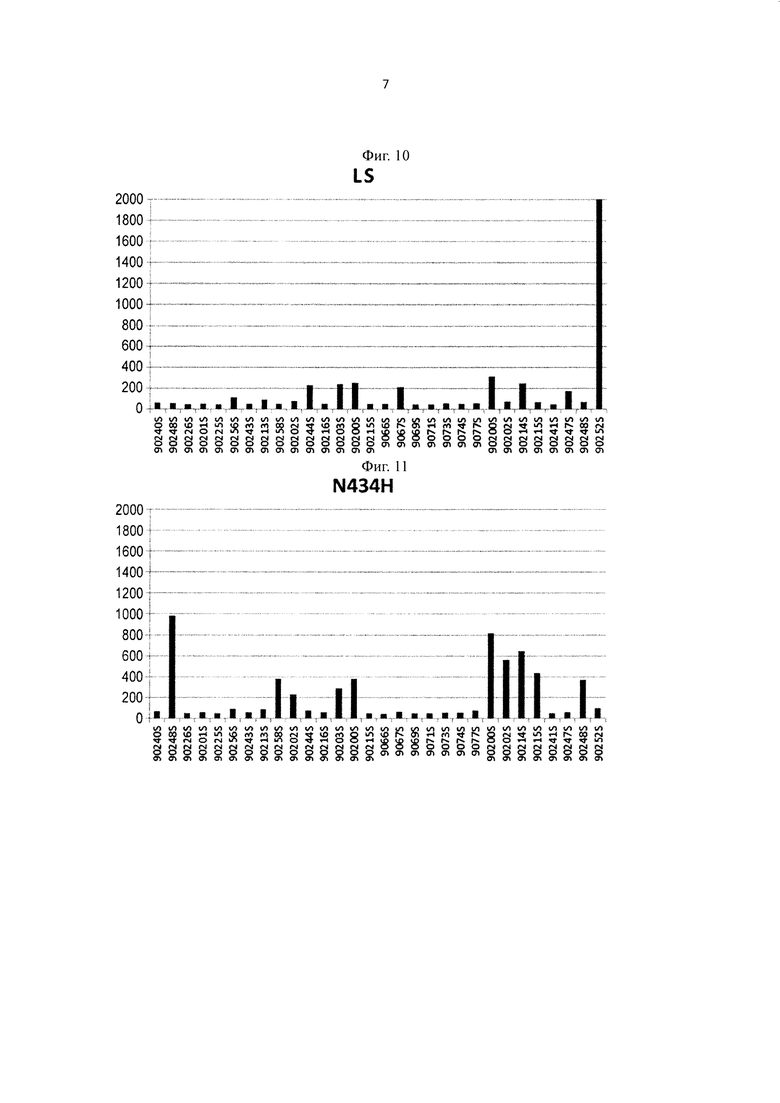

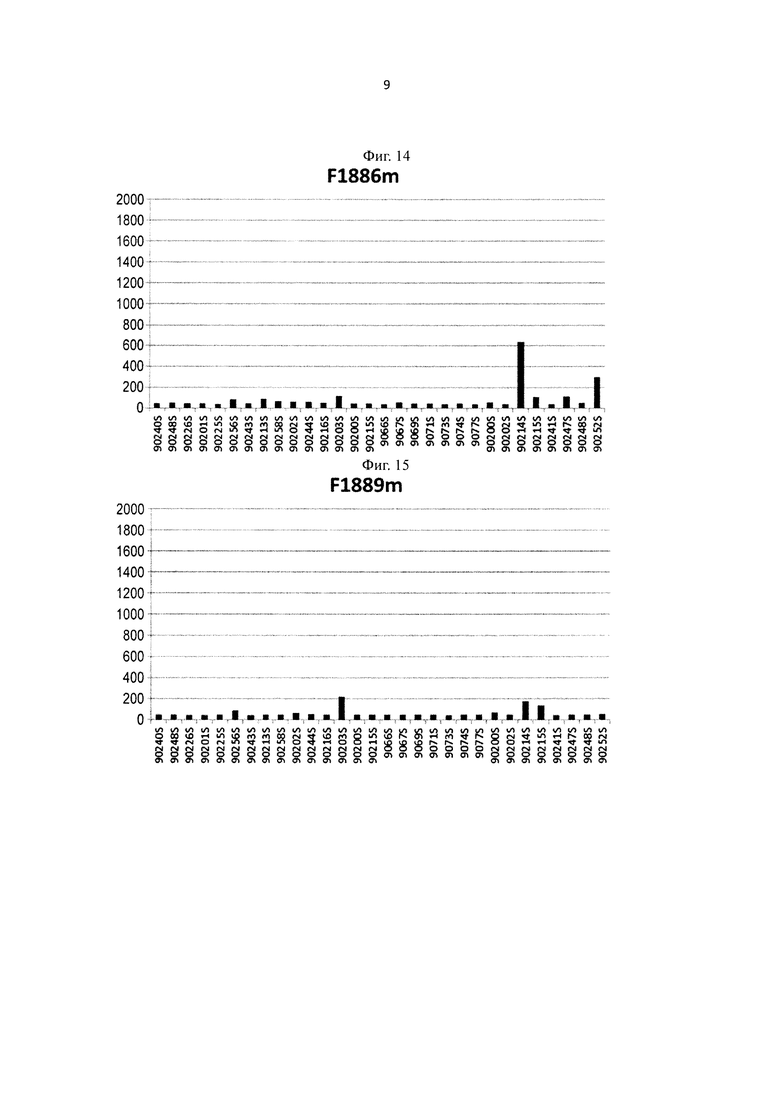

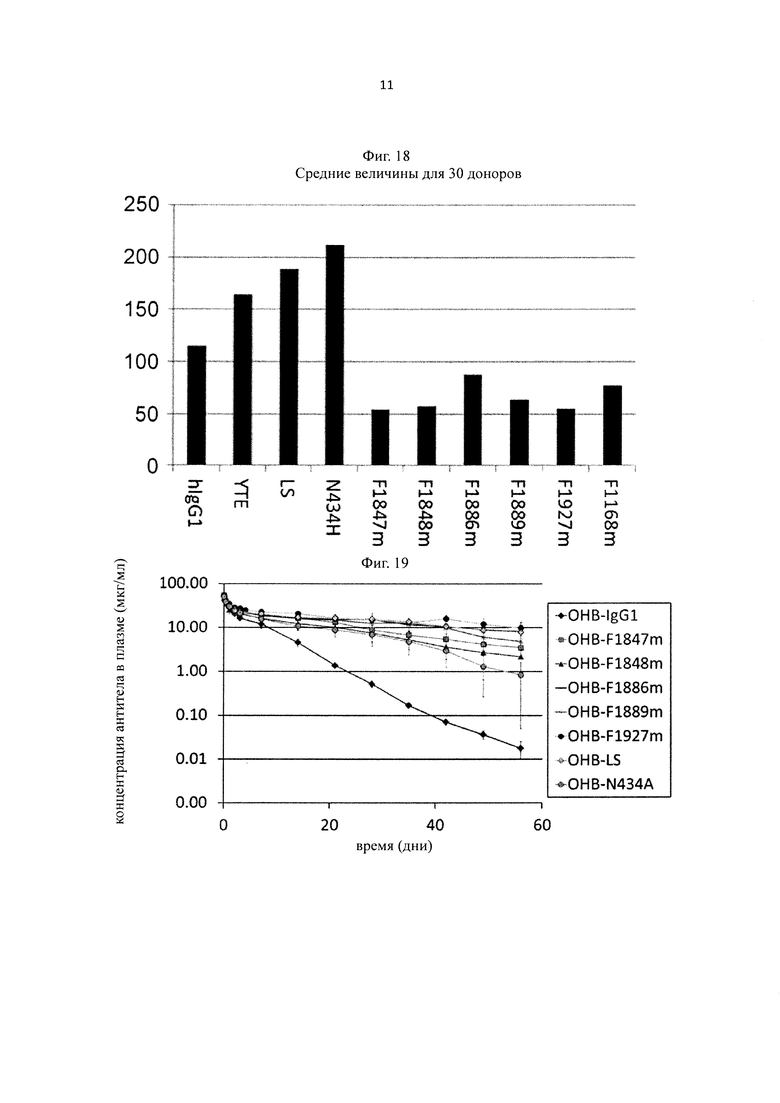
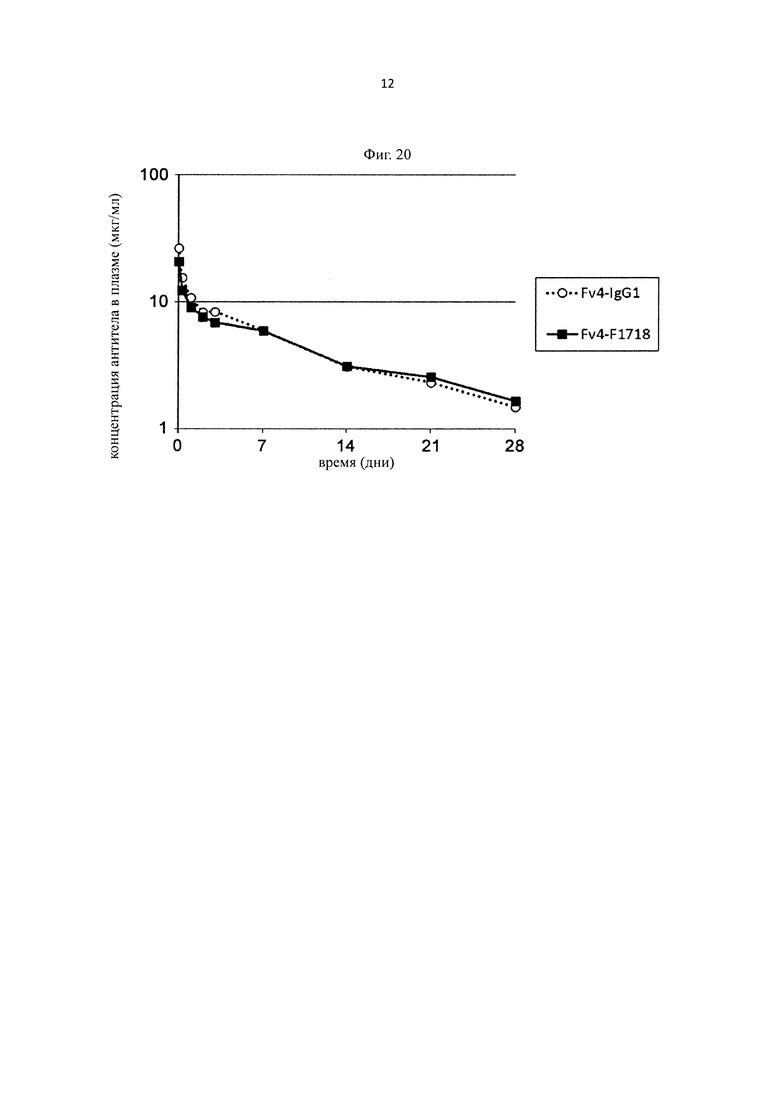
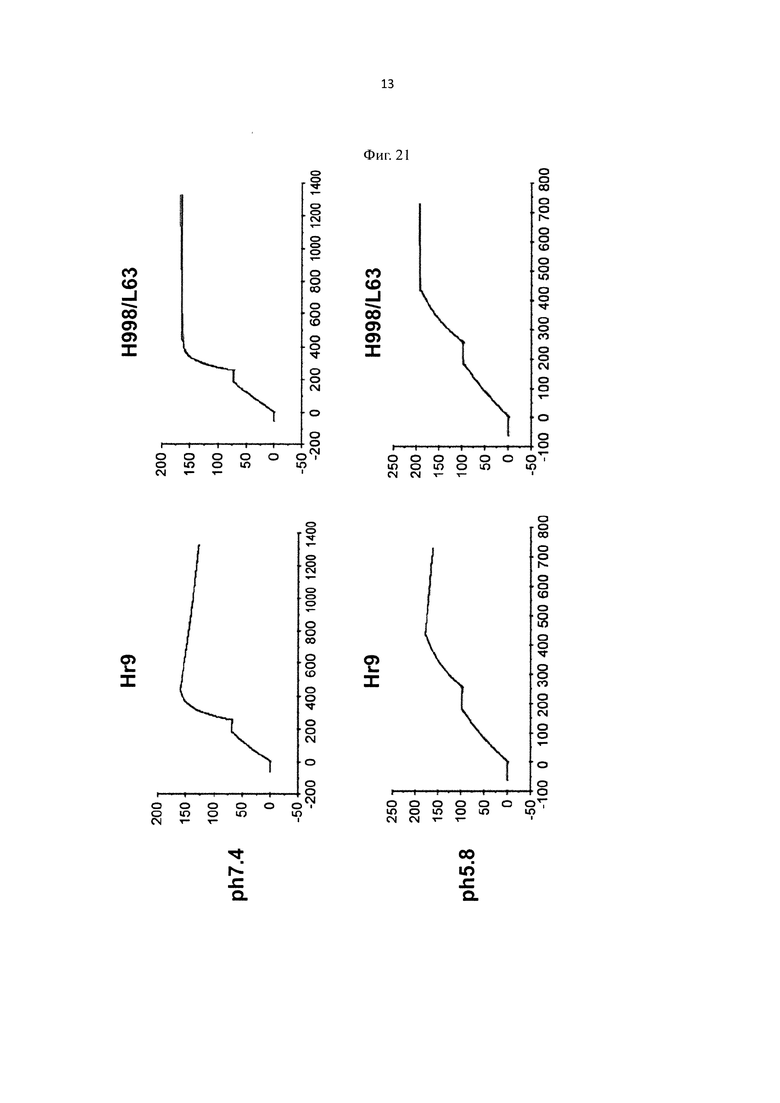
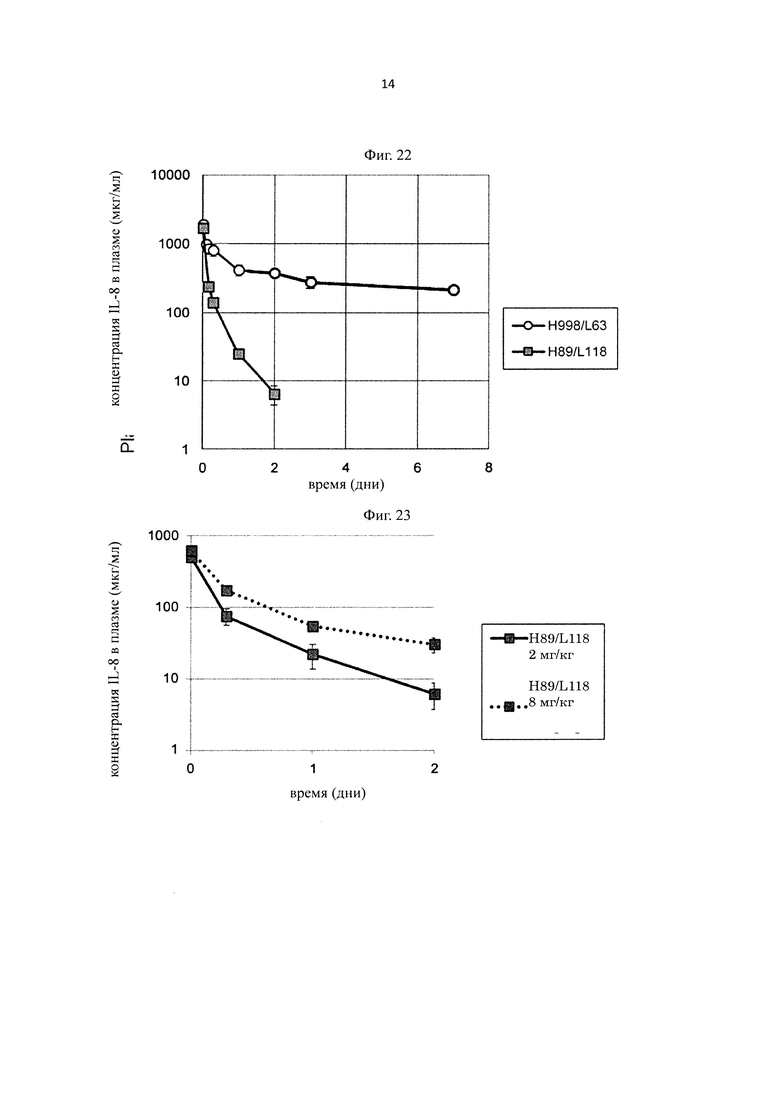

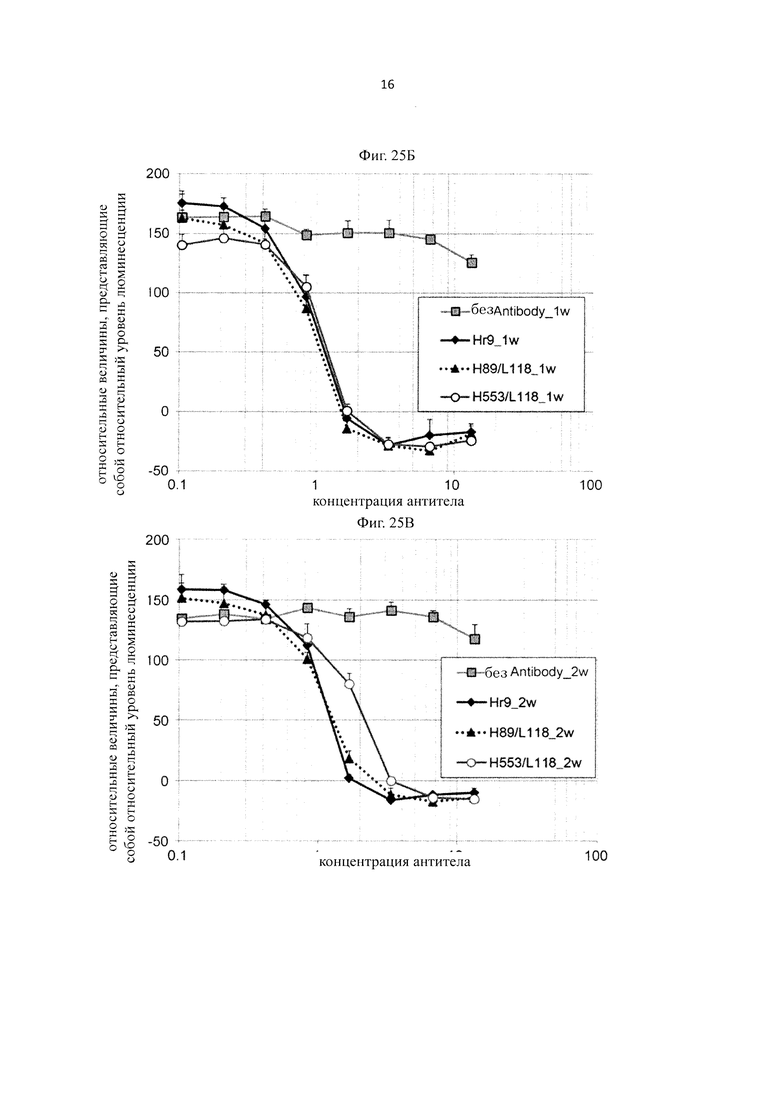
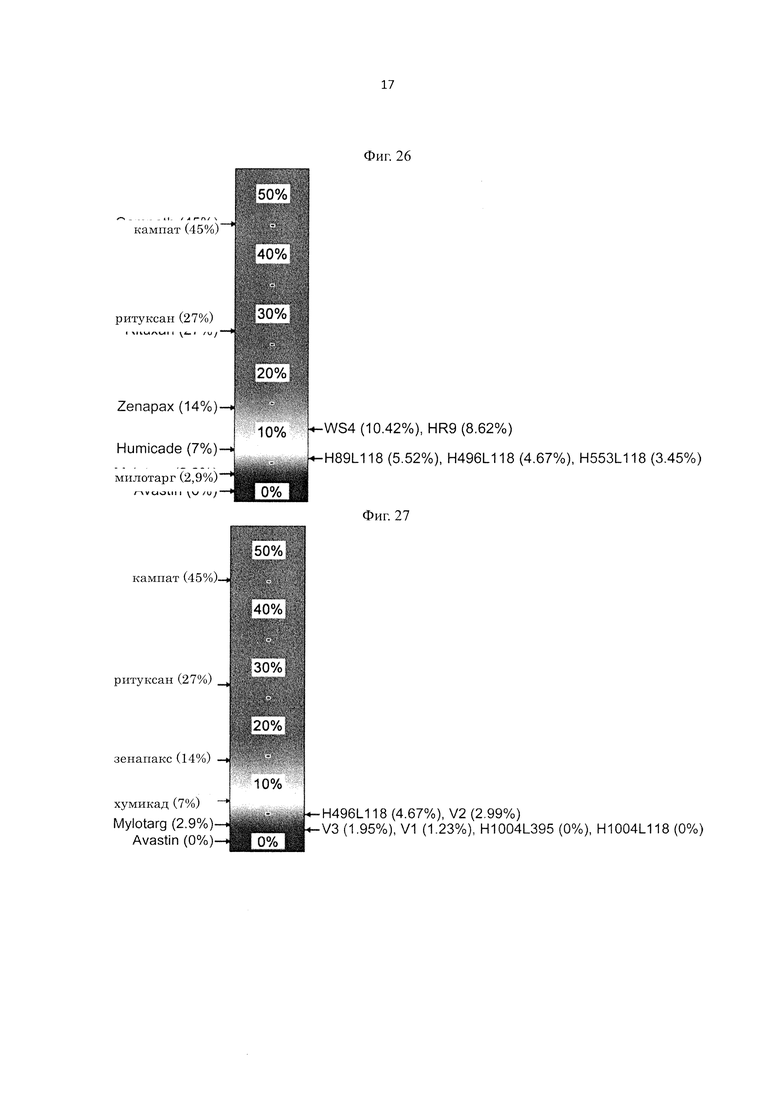
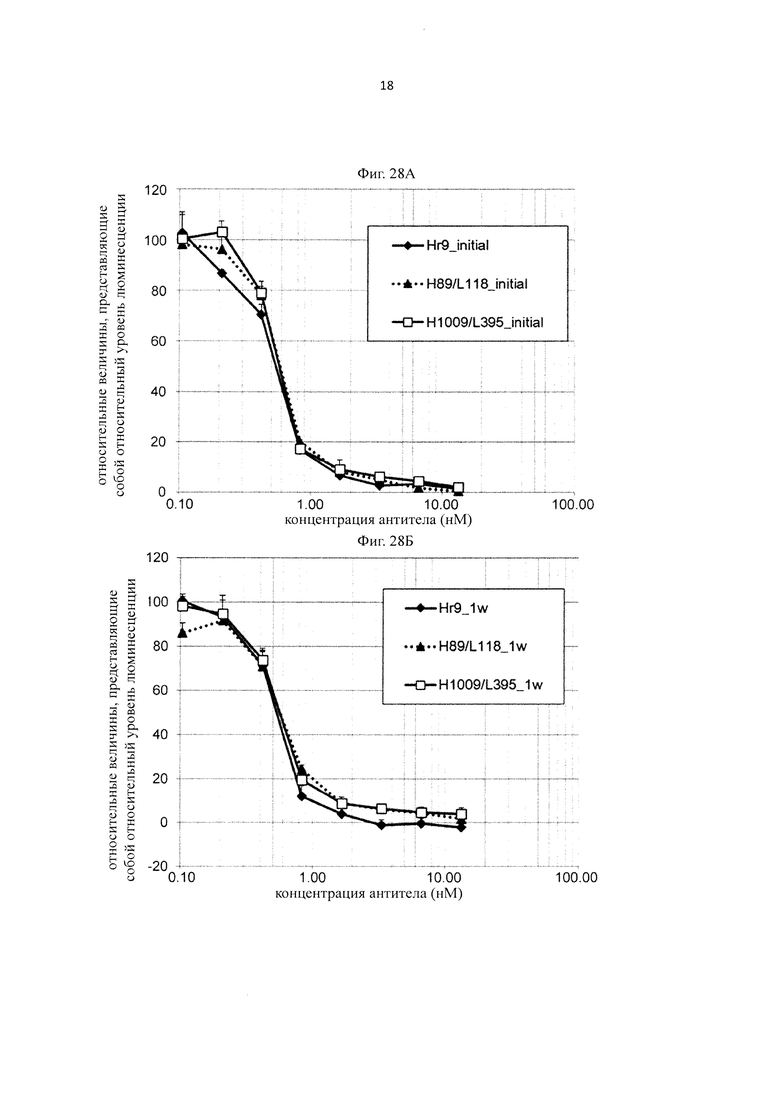
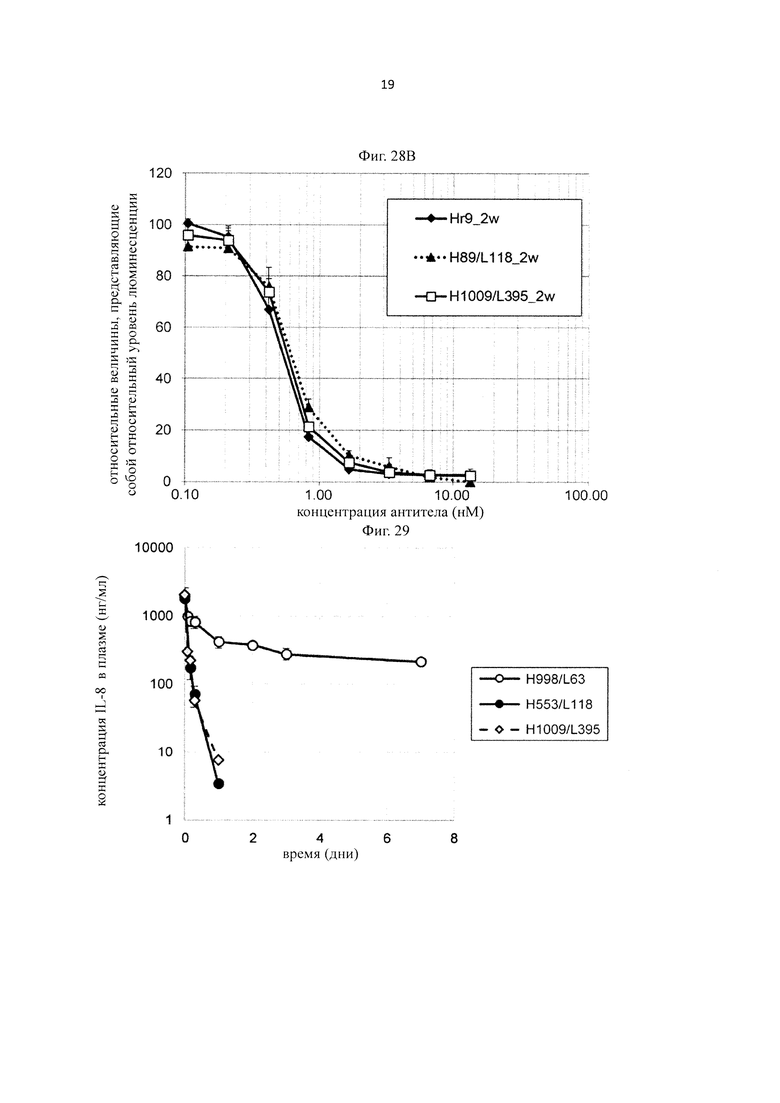
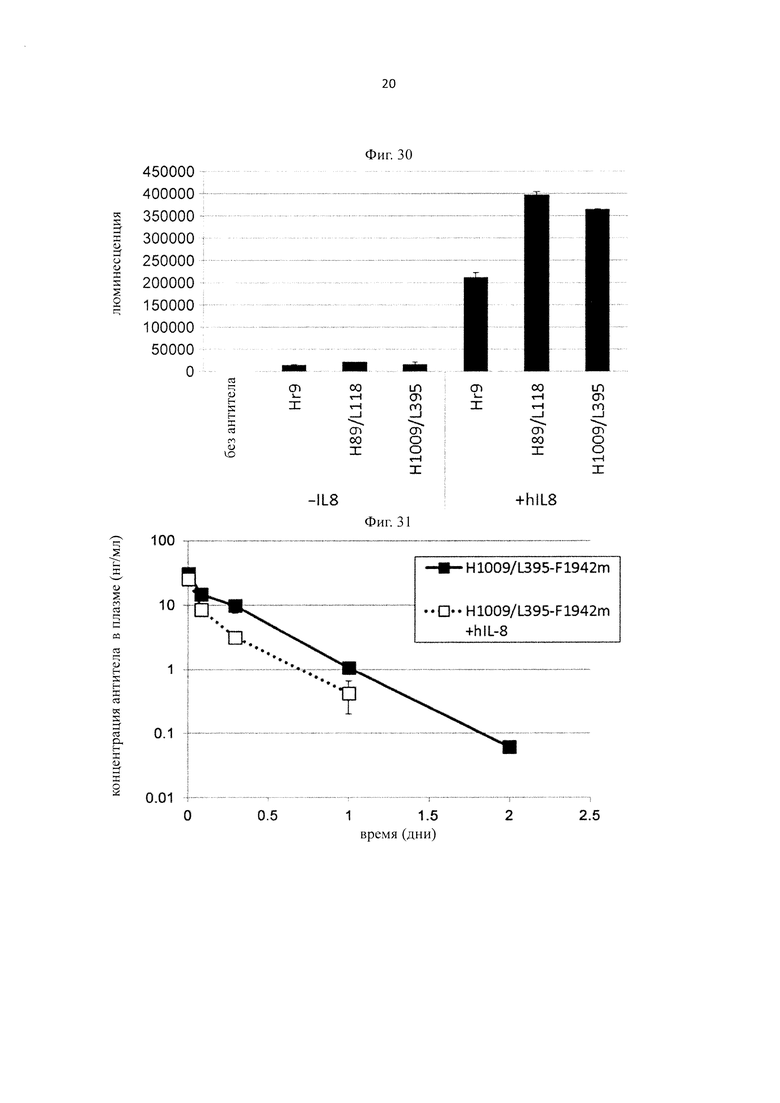
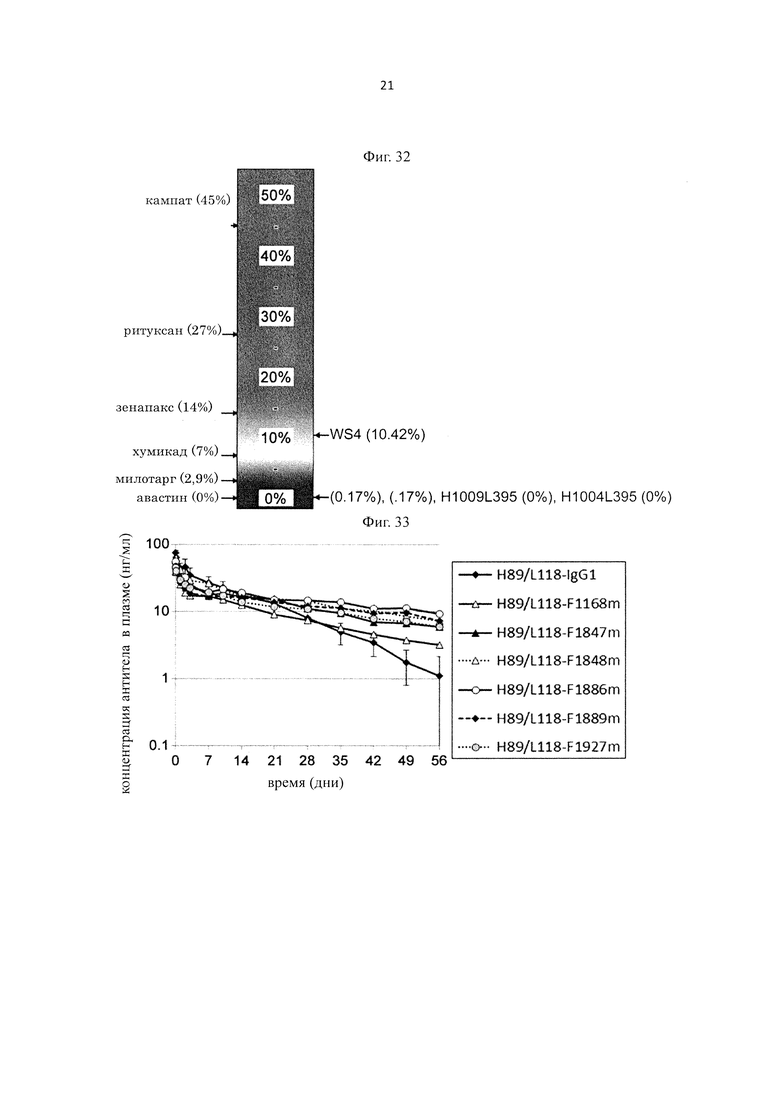

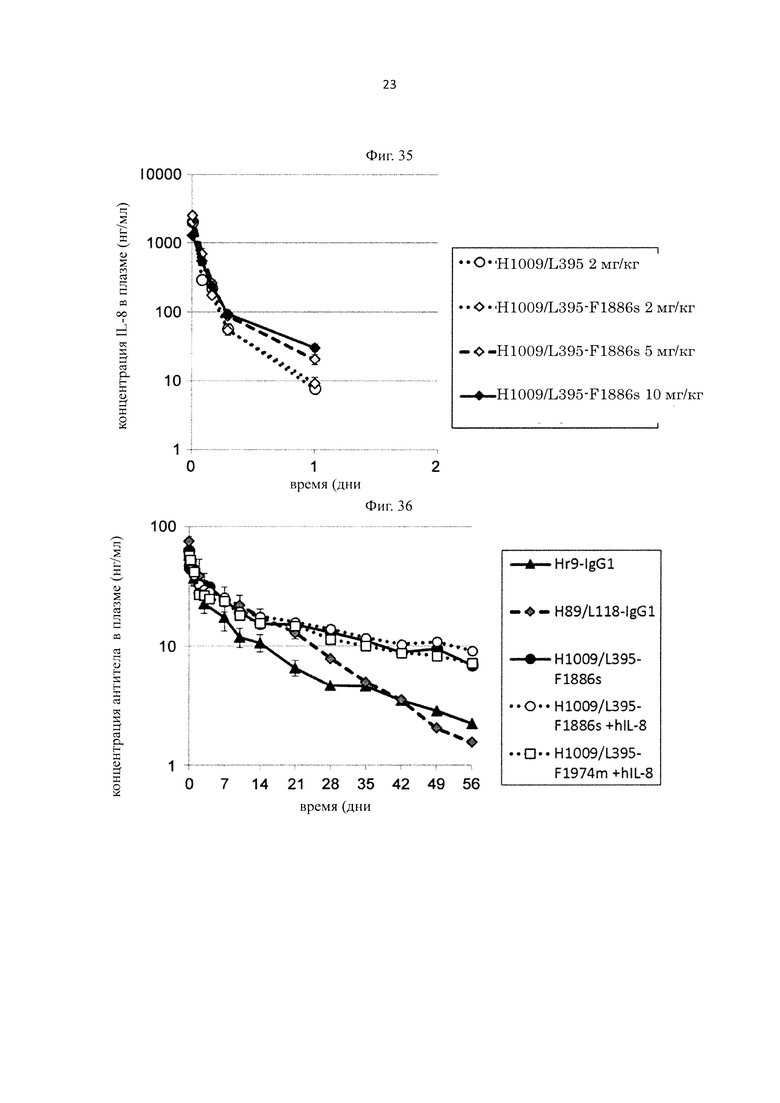
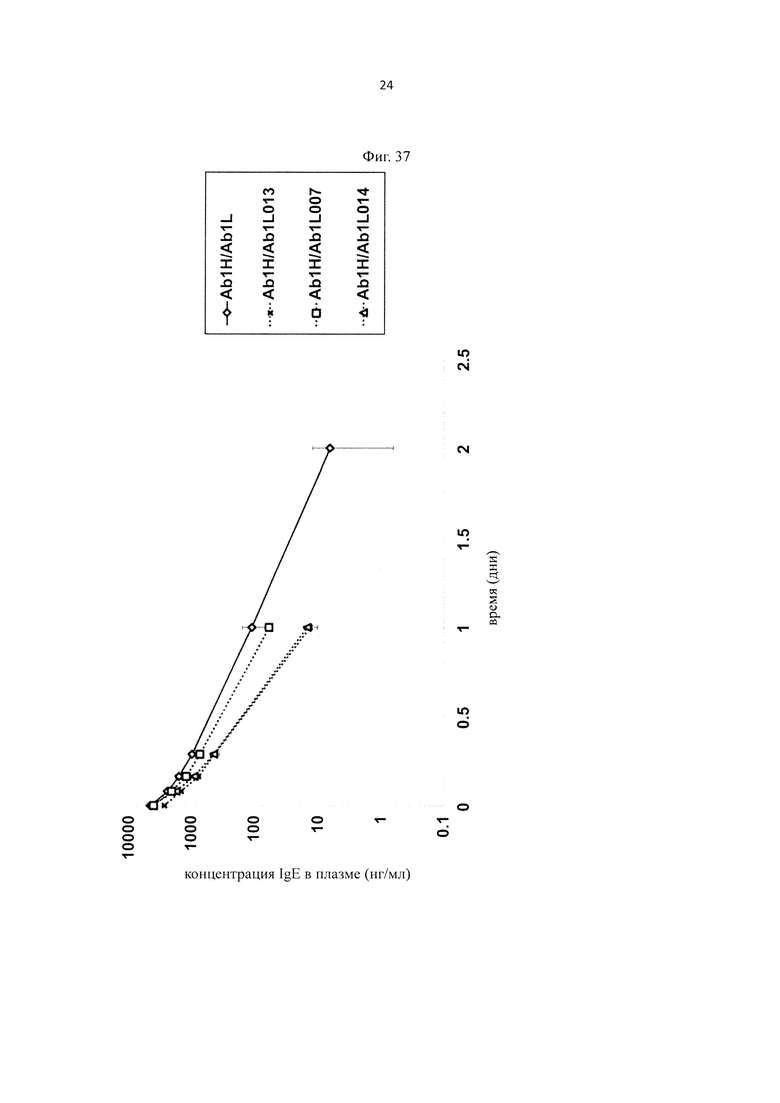
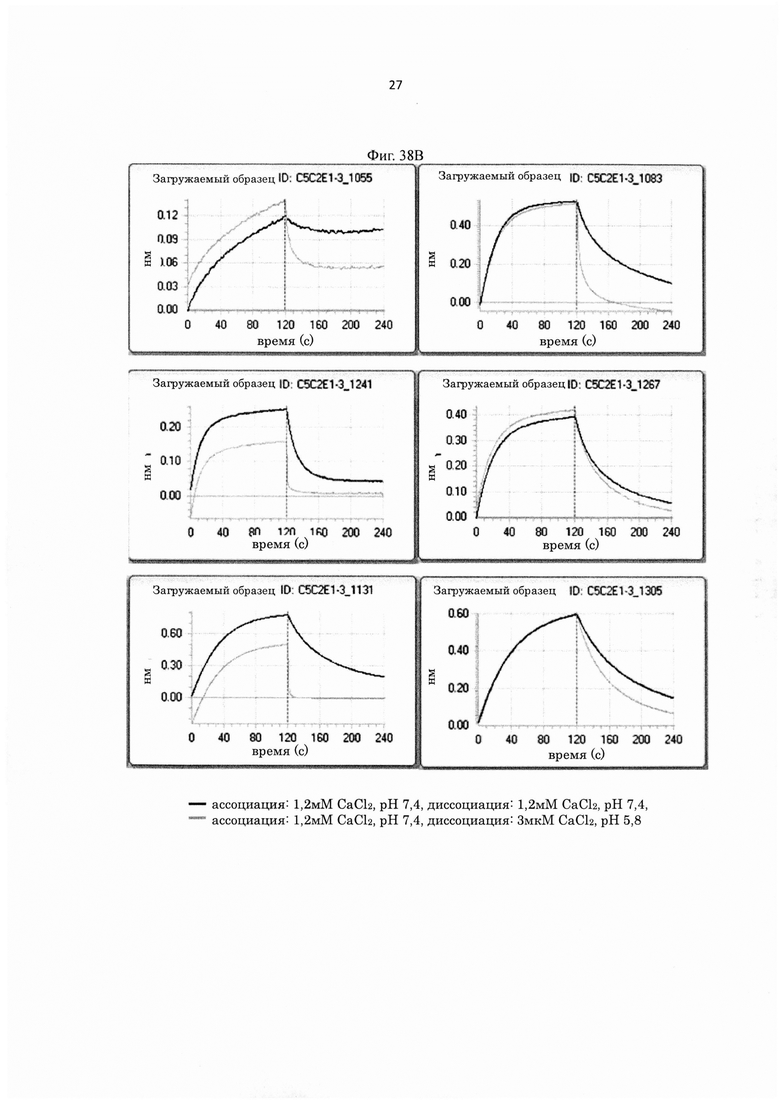
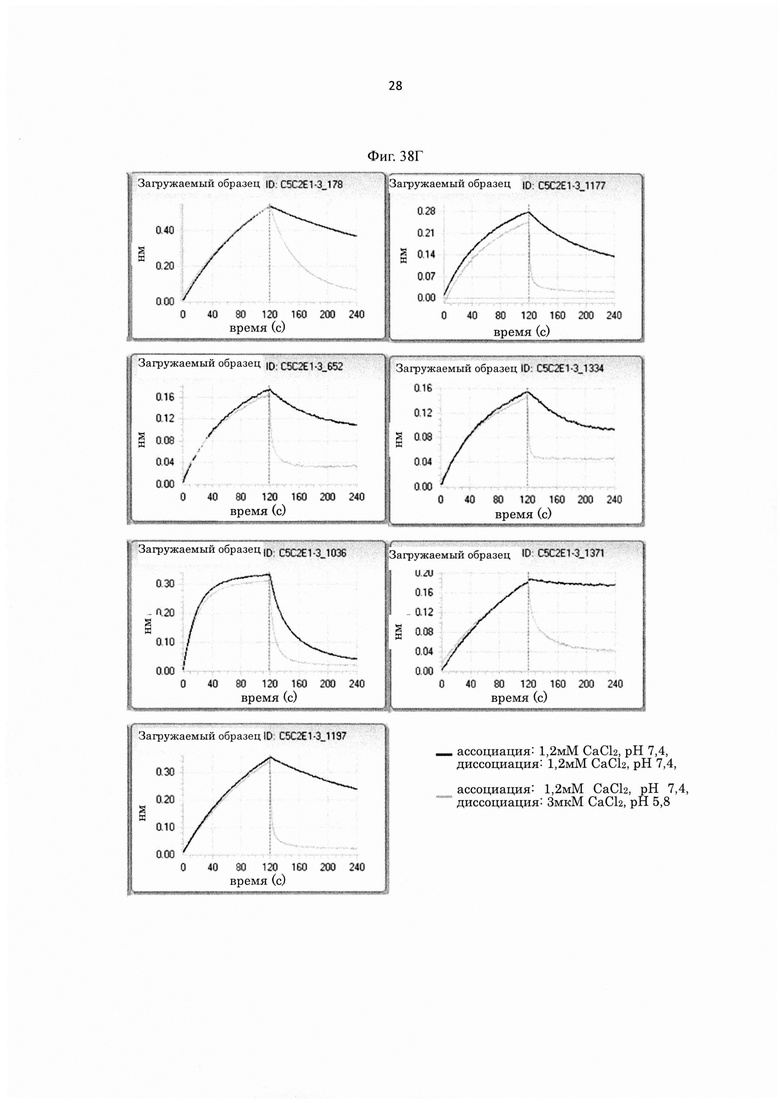
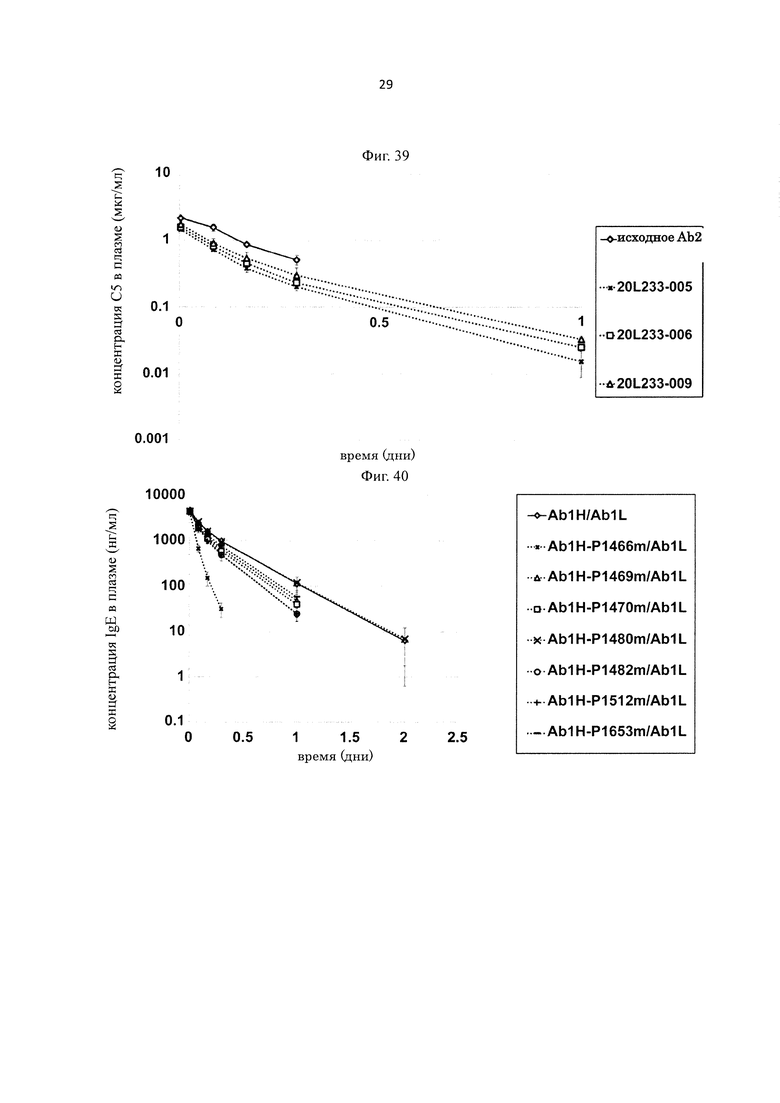
Изобретение относится к области биохимии, в частности к антителу, которое специфически связывается с IL-8. Также раскрыты выделенная нуклеиновая кислота, кодирующая указанное антитело, вектор экспрессии, содержащий указанную нуклеиновую кислоту, клетка-хозяин, содержащая указанный вектор, фармацевтическая композиция, содержащая указанное антитело. Раскрыт способ получения указанного антитела, способ лечения пациента, способ ингибирования ангиогенеза и способ ингибирования облегчения миграции нейтрофилов, с помощью указанного антитела, применение указанного антитела для приготовления фармацевтической композиции. Изобретение позволяет эффективно лечить нарушения, характеризующиеся избытком IL-8. 14 н. и 1 з.п. ф-лы, 40 ил., 42 табл., 23 пр.
1. Выделенное антитело, специфически связывающееся с IL-8, которое содержит (a) HVR-H1, содержащий аминокислотную последовательность SEQ ID NO: 67, (б) HVR-H2, содержащий аминокислотную последовательность SEQ ID NO: 73, (в) HVR-H3, содержащий аминокислотную последовательность SEQ ID NO: 74; (г) HVR-L1, содержащий аминокислотную последовательность SEQ ID NO: 70, (д) HVR-L2, содержащий аминокислотную последовательность SEQ ID NO: 75, и (е) HVR-L3, содержащий аминокислотную последовательность SEQ ID NO: 76.
2. Выделенное антитело, специфически связывающееся с IL-8, которое содержит вариабельную область тяжелой цепи, имеющую SEQ ID NO: 78, и вариабельную область легкой цепи, имеющую SEQ ID NO: 79.
3. Выделенное антитело, специфически связывающееся с IL-8, которое содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 80 или SEQ ID NO: 81, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 82.
4. Выделенная нуклеиновая кислота, кодирующая антитело к IL-8 по одному из пп. 1-3.
5. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 4.
6. Клетка-хозяин для получения антитела по одному из пп. 1-3, которая содержит вектор по п. 5.
7. Способ получения антитела по одному из пп. 1-3, который включает культивирование клетки-хозяина по п. 6.
8. Способ по п. 7, который включает также выделение антитела из культуры клетки-хозяина.
9. Фармацевтическая композиция для лечения нарушения, характеризующегося избытком IL-8, которая содержит эффективное количество антитела по одному из пп. 1-3 и фармацевтически приемлемый носитель.
10. Способ лечения пациента, который имеет нарушение, характеризующееся избытком IL-8, который включает введение индивидууму антитела к IL-8 по одному из пп. 1-3.
11. Применение антитела к IL-8 по одному из пп. 1-3 для приготовления фармацевтической композиции, предназначенной для лечения нарушения, характеризующегося избытком IL-8.
12. Способ ингибирования ангиогенеза у индивидуума, где способ включает введение индивидууму антитела по одному из пп. 1-3.
13. Применение антитела к IL-8 по одному из пп. 1-3 для приготовления фармацевтической композиции, предназначенной для ингибирования ангиогенеза.
14. Способ ингибирования облегчения миграции нейтрофилов у индивидуума, где способ включает введение индивидууму антитела по одному из пп. 1-3.
15. Применение антитела по одному из пп. 1-3 для приготовления фармацевтической композиции, предназначенной для ингибирования облегчения миграции нейтрофилов.
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО, СВЯЗАННОГО С ТРАНСПЛАНТАЦИЕЙ И АУТОИММУННОГО ЗАБОЛЕВАНИЯ | 2007 |
|
RU2495882C2 |
| Устройство оперативной калибровки сейсмических каналов | 1987 |
|
SU1509770A1 |
| US 8568992 B2, 29.10.2013 | |||
| ПРОИЗВОЛЬНЫЙ СОПОЛИМЕР ПРОПИЛЕН-ГЕКСЕНА, ПОЛУЧЕННЫЙ ПРИ ПОМОЩИ КАТАЛИЗАТОРА ЦИГЛЕРА-НАТТА | 2009 |
|
RU2471813C2 |
Авторы
Даты
2020-07-29—Публикация
2016-08-05—Подача