Область техники
Настоящее изобретение относится к способам получения или очистки полипептидных мультимеров, полипептидных мультимеров с измененной способностью связывать белок А и т.д.
Предпосылки к созданию изобретения
Существует несколько описанных ранее способов получения биспецифического антитела класса IgG, имеющего человеческую константную область (антитело класса IgG, которое имеет человеческую константную область и в котором одно из плеч обладает специфической связывающей активностью к антигену А и другое обладает специфической связывающей активностью к антигену В). В общем, биспецифическое антитело класса IgG состоит из двух типов Н-цепей (т.е., Н-цепь к антигену А и Н-цепь к антигену В) и двух типов L-цепей (т.е., L-цепь к антигену А и L-цепь к антигену В). Когда экспрессируется биспецифическое антитело такого класса IgG, то экспрессируются два типа Н-цепей и два типа L-цепей, и существует десять возможных комбинаций для комбинации H2L2. Из них только у одной комбинации есть представляющая интерес специфичность (одно плечо имеет связывающую активность к антигену А и другое имеет связывающую активность, специфическую к антигену В). Таким образом, чтобы получить соответствующее биспецифическое антитело, необходимо очистить единственное нужное антитело из десяти типов антител. Это является чрезвычайно неэффективной и трудной процедурой.
Описываются способы решения данной проблемы, которые используют общую L-цепь так, чтобы у L-цепи к антигену А и L-цепи к антигену В была идентичная аминокислотная последовательность (патентные документы 1 и 2). Когда экспрессируется биспецифическое антитело класса IgG, имеющее такую общую L-цепь, то экспрессируются два типа Н-цепей и один тип общей L-цепи, и существует три возможные комбинации для комбинации H2L2. Одна из этих комбинаций представляет собой представляющее интерес биспецифическое антитело. Эти три комбинации представляют собой: моноспецифическое антитело к антигену А (гомомерная Н-цепь антитела к антигену А), биспецифическое антитело и к антигену А, и к антигену В (гетеромерное антитело с Н-цепью к антигену А и Н-цепь к антигену В), и моноспецифическое антитело к антигену В (гомомерная Н-цепь антитела к антигену В). Так как их соотношение, в общем, составляет 1:2:1, то эффективность экспрессии целевого биспецифического антитела составляет приблизительно 50%. Уже был описан способ последующего улучшения этой эффективности, который допускает гетеромерно связывать два типа Н-цепей (патентный документ 3). Это может увеличить эффективность экспрессии целевого биспецифического антитела приблизительно до 90-95%. В то же время, в способе описано рациональное удаление двух типов гомомерных антител, которые являются примесями, в которых аминокислотные замещения вводятся в вариабельные области двух типов Н-цепей, чтобы придать им различные изоэлектрические точки так, чтобы два типа гомомерных антител и целевое биспецифическое антитело (гетеромерное антитело) могли быть очищены путем ионообменной хроматографии (патентный документ 4). Комбинация вышеуказанных способов позволила эффективно продуцировать биспецифическое антитело (гетеромерное антитело), имеющее константную область человеческого класса IgG.
С другой стороны, в промышленном производстве антител класса IgG должна использоваться стадия очистки с помощью хроматографии с белком А, а ионообменная хроматография в стадии очистки используется не обязательно. Вследствие этого, использование ионообменной хроматографии для получения высокочистого биспецифического антитела приводит к возрастанию производственных затрат. К тому же, так как только одна ионообменная хроматография не может обеспечить полноценный способ очистки фармацевтических веществ, то предпочтительно выполнить более чем одну хроматографическую стадию, чтобы удалить примеси.
В любом случае, предпочтительно, чтобы биспецифические антитела могли быть также очищены высоко с помощью хроматографической стадии, в которой имеется метод разделения, отличающийся от метода ионообменной хроматографии. Желательно, чтобы один из таких методов разделения, хроматография с белком А, которая должна использоваться в промышленном производстве антител класса IgG, могла очищать биспецифические антитела до высокой чистоты.
В описанном ранее способе очистки биспецифического антитела (гетеромерного антитела) с использованием белка А используют биспецифическое антитело, имеющее Н-цепь IgG2a мыши, которая связывается с белком А и Н-цепь IgG2b крысы, которая не связывается с белком А. Сообщалось, что этот способ позволяет очистить целевое биспецифическое антитело с чистотой в 95% путем только стадии очистки на основе белка А (непатентный документ 1 и патентный документ 5). Тем не менее, в этом способе также используется ионообменная хроматография, чтобы улучшить чистоту биспецифического антитела. Другими словами, очистка высокочистого биспецифического антитела не может быть выполнена путем стадии очистки с использованием только хроматографии с белком А. Кроме того, катумаксомаб, биспецифическое антитело, продуцированное описанным выше способом и имеющее Н-цепь IgG2a мыши и Н-цепь IgG2b крысы, имеет время полужизни примерно в 2.1 дня у человека, который намного короче времени полужизни нормального IgG1 человека (от 2 до 3 недель) (непатентный документ 2). Вдобавок к наличию короткого времени полужизни, катумаксомаб является чрезвычайно иммуногенным по причине его мышиных и крысиных константных областей (непатентный документ 3). Таким образом, биспецифическое антитело, полученное такими способами, рассматривается как непригодное в качестве лекарственного средства.
С другой стороны, было предложено, чтобы с точки зрения иммуногенности, константная область IgG3 человека могла быть использована как несвязывающая белок А константная область (непатентный документ 1). Тем не менее, поскольку известно, что Н-цепи IgG1 человека и IgG3 человека почти не связываются друг с другом (непатентный документ 1), то возможно продуцировать целевое биспецифическое антитело с использованием Н-цепи IgG1 человека и Н-цепи IgG3 человека тем же самым способом, применяемым для биспецифического антитела, имеющего Н-цепь IgG2a мыши и Н-цепь IgG2b крысы. Кроме того, время полужизни человеческого IgG3 у человека, как сообщалось, в целом, было короче, чем время полужизни человеческого IgG1, человеческого IgG2, и человеческого IgG4 (непатентные документы 4 и 5). Следовательно, как биспецифическое антитело с использованием IgG2a мыши и IgG2b крысы, биспецифическое антитело с использованием человеческого IgG3 могло бы также иметь короткое время полужизни у человека. Причиной того, что ассоциация Н-цепи редко происходит между человеческим IgG1 и человеческим IgG3, предположительно может быть то, что он является шарнирной последовательностью человеческого IgG3 (непатентный документ 1). Тем временем, причина короткого времени полужизни константной области IgG3 человека еще не была объяснена полностью. Таким образом, до настоящего времени не было отчета относительно биспецифических антител, которые используют константную область IgG3 человека в качестве несвязывающей белок А константной области. Кроме того, также нет отчета относительно способов эффективного продуцирования или очистки высокочистых биспецифических антител, имеющих человеческую константную область и показывающих подобное длительное время полужизни как и IgG1 человека.
Документы известного уровня техники
Патентные документы
Патентный документ 1: WO 98050431
Патентный документ 2: WO 2006109592
Патентный документ 3: WO 2006106905
Патентный документ 4: WO 2007114325
Патентный документ 5: WO 95033844
Непатентные документы
Непатентный документ 1: The Journal of Immunology, 1995, 155:219-225
Непатентный документ 2: J Clin Oncol 26: 2008 (May 20 suppl; abstr 14006)
Непатентный документ 3: Clin Cancer Res 2007 13:3899-3905
Непатентный документ 4: Nat Biotechnol. 2007 Dec; 25(12):1369-72
Непатентный документ 5: J. Clin Invest 1970; 49:673-80
Раскрытие изобретения
[Задачи, решаемые с помощью изобретения]
В общем, обычное антитело класса IgG может быть эффективно получено как высокочистый. IgG вследствие стадии очистки на основе белка А. Тем не менее, получение высокочистого биспецифического антитела требует дополнительной стадии очистки с использованием ионообменной хроматографии. Добавление такой стадии очистки путем ионообменной хроматографией может усложнить получение и увеличить стоимость производства. Таким образом, предпочтительно получать высокочистое биспецифическое антитело только посредством стадии очистки на основе белка А. Объектом настоящего изобретения является предоставление способов, которые используют только стадию очистки на основе белка А для эффективного получения или очистки высокочистого биспецифического антитела класса IgG, имеющего константную область тяжелой цепи человеческого антитела.
Тем не менее, поскольку участок связывания белка А в Fc домене является идентичным с участком связывания FcRn в Fc домене, то предполагается, что будет трудно отрегулировать активность связывать белок А, сохраняя связывание с FcRn человека. Сохранение связывающей способности FcRn человека является очень важным для длительного удержания плазмы (продолжительное время полужизни) у человека, которое характерно для антител класса IgG. Настоящее изобретение предоставляет способы, которые используют только стадию очистки на основе белка А для эффективного получения или очистки высокочистого биспецифического антитела, которое поддерживает время удержания плазмы, сопоставимое с или более продолжительное, чем время удержания плазмы IgG1 человека.
[Средства для решения задач]
Изобретатели настоящего изобретения обнаружили способы, использующие только стадию очистки на основе белка А для эффективной очистки или получения высокочистого полипептидного мультимера, способного связываться с двумя или более антигенами, в частности, полиспецифического антитела класса IgG, имеющего константную область человека, путем изменения его способности связывать белок А.
Кроме того, эти способы были объединены со способами регулирования ассоциации между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью путем модифицирования аминокислот, которые составляют интерфейс, сформированный при ассоциации полипептидов. Посредством этой комбинации настоящее изобретение способствует эффективному получению или очистке соответствующего высокочистого полипептидного мультимера.
Изобретатели настоящего изобретения также обнаружили, что посредством модифицирования аминокислотного остатка в положении 435 (EU нумерация) в константной области тяжелой цепи, способность связывать белок А может быть отрегулирована, сохраняя свое удержание плазмы, сравнимое с или более длительное, чем удержание плазмы IgG1 человека. Основываясь на этом открытии, может быть получено или очищено высокочистое биспецифическое антитело со временем удержания плазмы, сравнимым с или более длительным, чем время удержания IgG1 человека.
Настоящее изобретение основывается на открытиях, описанных выше, и предоставляет от [1] до [55] ниже:
[1] Способ получения полипептидного мультимера, который включает первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, который включает стадии:
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью и ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью; и
(b) сбора продукта экспрессии стадии (а),
где один или более аминокислотных остатков в любом из или обоих первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью были модифицированы, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью.
[2] Способ по [1], где продукт экспрессии собирается с использованием аффинной хроматографии с белком А в стадии (b).
[3] Способ по [1] или [2], где один или более аминокислотных остатков в любом из или обоих первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью были модифицированы, так что существует большее различие между рН растворителя для элюирования первого полипептида, обладающего антигенсвязывающей активностью из белка А и рН растворителя для элюирования второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью из белка А.
[4] Способ по любому из от [1] до [3], где один или более аминокислотных остатков в первом полипептиде, обладающем антигенсвязывающей активностью или втором полипептиде, обладающем антигенсвязывающей активностью или не обладающем антигенсвязывающей активностью были модифицированы для увеличения или уменьшения способности связывать белок А любого из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью.
[5] Способ по любому из от [1] до [4], где один или более аминокислотных остатков в первом полипептиде, обладающем антигенсвязывающей активностью или втором полипептиде, обладающем антигенсвязывающей активностью или не обладающем антигенсвязывающей активностью были модифицированы для увеличения способности связывать белок А любого из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, и уменьшить способность связывать белок А другого полипептида.
[6] Способ по любому из от [1] до [5], где чистота собранного полипептидного мультимера составляет 95% или более.
[7] Способ по любому из от [1] до [6], где первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью включают аминокислотную последовательность Fc домена антитела или аминокислотную последовательность константной области тяжелой цепи антитела.
[8] Способ по [7], где по меньшей мере один аминокислотный остаток, выбранный из аминокислотных остатков положений от 250 до 255, от 308 до 317, и от 430 до 436 (EU нумерация), в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела был модифицирован.
[9] Способ по любому из от [1] до [8], где первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью включают аминокислотную последовательность вариабельной области тяжелой цепи антитела.
[10] Способ по [9], где по меньшей мере один аминокислотный остаток был модифицирован в аминокислотных последовательностях FR1, CDR2, и FR3 вариабельной области тяжелой цепи антитела.
[11] Способ по любому из от [1] до [10], где полипептидный мультимер включает один или два третьих полипептида, обладающих антигенсвязывающей активностью, и стадия (а) включает экспрессию ДНК, которая кодирует третий полипептид, обладающий антигенсвязывающей активностью.
[12] Способ по [11], где третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
[13] Способ по [11] или [12], где полипептидный мультимер дополнительно включает четвертый полипептид, обладающий антигенсвязывающей активностью, и стадия (а) включает экспрессию ДНК, которая кодирует четвертый полипептид, обладающий антигенсвязывающей активностью.
[14] Способ по [13], где, по меньшей мере, один из третьего и четвертого полипептидов, обладающих антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
[15] Способ по [13], где первый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотные последовательности вариабельной области легкой цепи антитела и константной области тяжелой цепи антитела; второй полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность тяжелой цепи антитела; третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотные последовательности вариабельной области тяжелой цепи антитела и константной области легкой цепи антитела; и четвертый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
[16] Способ по любому из от [1] до [15], где полипептидный мультимер представляет собой полиспецифическое антитело.
[17] Способ по [16], где полиспецифическое антитело представляет собой биспецифическое антитело.
[18] Способ по любому из от [1] до [8], который включает первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, не обладающий антигенсвязывающей активностью, и где первый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность антигенсвязывающей области рецептора и аминокислотную последовательность Fc домена антитела, и второй полипептид, не обладающий антигенсвязывающей активностью, включает аминокислотную последовательность Fc домена антитела.
[19] Способ по любому из от [7] до [18], где Fc домен антитела или константная область тяжелой цепи антитела получена из человеческого IgG.
[20] Полипептидный мультимер, полученный способом по любому из от [1] до [19].
[21] Способ очистки полипептидного мультимера, который включает первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, который включает стадии:
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью и ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью; и
(b) сбора продукта экспрессии стадии (а) с помощью аффинной хроматографии с белком А,
где один или более аминокислотных остатков в любом из или обоих первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью были модифицированы, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью.
[22] Способ по [21], где один или более аминокислотных остатков в первом полипептиде, обладающем антигенсвязывающей активностью или втором полипептиде, обладающем антигенсвязывающей активностью или не обладающем антигенсвязывающей активностью были модифицированы, чтобы увеличить или уменьшить способность связывать белок А первого полипептида, обладающего антигенсвязывающей активностью или второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью.
[23] Способ по [20] или [21], где один или более аминокислотных остатков в первом полипептиде, обладающем антигенсвязывающей активностью или втором полипептиде, обладающем антигенсвязывающей активностью или не обладающем антигенсвязывающей активностью были модифицированы для увеличения способности связывать белок А любого из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, и уменьшить способность связывать белок А другого полипептида.
[24] Способ по любому из от [21] до [23], где чистота собранного полипептидного мультимера составляет 95% или более.
[25] Способ по любому из от [21] до [24], где первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью включают аминокислотную последовательность Fc домена антитела или аминокислотную последовательность константной области тяжелой цепи антитела.
[26] Способ по [25], где по меньшей мере один аминокислотный остаток, выбранный из аминокислотных остатков положений от 250 до 255, от 308 до 317, и от 430 до 436 (EU нумерация), в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела был модифицирован.
[27] Способ по любому из от [21] до [26], где первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью включают аминокислотную последовательность вариабельной области тяжелой цепи антитела.
[28] Способ по [27], где по меньшей мере один аминокислотный остаток был модифицирован в аминокислотных последовательностях FR1, CDR2, и FR3 вариабельной области тяжелой цепи антитела.
[29] Способ по любому из от [21] до [28], где полипептидный мультимер включает один или два третьих полипептида, обладающих антигенсвязывающей активностью, и стадия (а) включает экспрессию ДНК, которая кодирует третий полипептид, обладающий антигенсвязывающей активностью.
[30] Способ по [29], где третий полипептид, обладающий антигенсвязывающей активностью включает аминокислотную последовательность легкой цепи антитела.
[31] Способ по [29] или [30], где полипептидный мультимер дополнительно включает четвертый полипептид, обладающий антигенсвязывающей активностью, и стадия (а) включает экспрессию ДНК, которая кодирует четвертый полипептид, обладающий антигенсвязывающей активностью.
[32] Способ по [31], где по меньшей мере один из третьего и четвертого полипептидов, обладающих антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
[33] Способ по [31], где первый полипептид, обладающий антигенсвязывающей активностью включает аминокислотные последовательности вариабельной области легкой цепи антитела и константной области тяжелой цепи антитела; второй полипептид, обладающий антигенсвязывающей активностью включает аминокислотную последовательность тяжелой цепи антитела; третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотные последовательности вариабельной области тяжелой цепи антитела и константной области легкой цепи антитела; и четвертый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
[34] Способ по любому из от [21] до [33], где полипептидный мультимер представляет собой полиспецифическое антитело.
[35] Способ по [34], где полиспецифическое антитело представляет собой биспецифическое антитело.
[36] Способ по любому из от [25] до [35], где Fc домен антитела или константная область тяжелой цепи антитела получена из IgG человека.
[37] Полипептидный мультимер, который включает первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, где способность связывать белок А отличается для первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью.
[38] Полипептидный мультимер по [37], где существует различие между рН растворителя для элюирования первого полипептида, обладающего антигенсвязывающей активностью из белка А и рН растворителя для элюирования второго полипептида, обладающего антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью из белка А.
[39] Полипептидный мультимер по [37] или [38], где первый полипептид, обладающий антигенсвязывающей активностью или второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью включает аминокислотную последовательность Fc домена антитела или аминокислотную последовательность константной области тяжелой цепи антитела, и где, по меньшей мере, один аминокислотный остаток, выбранный из аминокислотных остатков положений от 250 до 255, от 308 до 317, и от 430 до 436 (EU нумерация) в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела был модифицирован.
[40] Полипептидный мультимер по любому из от [37] до [39], где первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью включают аминокислотную последовательность Fc домена антитела или аминокислотную последовательность константной области тяжелой цепи антитела;
где аминокислотный остаток положения 435 (EU нумерация) в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела представляет собой гистидин или аргинин в любом из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью; и
где аминокислотный остаток положения 435 (EU нумерация) в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела в любом из вышеуказанных полипептидов отличается от такового в другом полипептиде.
[41] Полипептидный мультимер по любому из от [37] до [40], где первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью включают аминокислотную последовательность Fc домена антитела или аминокислотную последовательность константной области тяжелой цепи антитела;
где аминокислотный остаток положения 435 (EU нумерация) в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела представляет собой гистидин в любом из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью; и
где аминокислотный остаток положения 435 (EU нумерация) в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела представляет собой аргинин в другом полипептиде.
[42] Полипептидный мультимер по любому из от [37] до [41], где первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью включают аминокислотную последовательность вариабельной области тяжелой цепи антитела, и, по меньшей мере, один аминокислотный остаток был модифицирован в аминокислотных последовательностях FR1, CDR2, и FR3 вариабельной области тяжелой цепи.
[43] Полипептидный мультимер по любому из от [37] до [42], который дополнительно включает один или два третьих полипептида, обладающих антигенсвязывающей активностью.
[44] Полипептидный мультимер по [43], где третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
[45] Полипептидный мультимер по [43] или [44], который дополнительно включает четвертый полипептид, обладающий антигенсвязывающей активностью.
[46] Полипептидный мультимер по [45], где, по меньшей мере, один из третьего и четвертого полипептидов, обладающих антигенсвязывающей активностью включает аминокислотную последовательность легкой цепи антитела.
[47] Полипептидный мультимер по [45], где первый полипептид, обладающий антигенсвязывающей активностью включает аминокислотные последовательности вариабельной области легкой цепи антитела и константной области тяжелой цепи антитела; второй полипептид, обладающий антигенсвязывающей активностью включает аминокислотную последовательность тяжелой цепи антитела; третий полипептид, обладающий антигенсвязывающей активностью включает аминокислотные последовательности вариабельной области тяжелой цепи антитела и константной области легкой цепи антитела; и четвертый полипептид, обладающий антигенсвязывающей активностью включает аминокислотную последовательность легкой цепи антитела.
[48] Полипептидный мультимер по любому из от [37] до [47], который представляет собой полиспецифическое антитело.
[49] Полипептидный мультимер по [48], где полиспецифическое антитело представляет собой биспецифическое антитело.
[50] Полипептидный мультимер по любому из от [37] до [41], который включает первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, не обладающий антигенсвязывающей активностью, и где первый полипептид, обладающий антигенсвязывающей активностью включает аминокислотную последовательность антигенсвязывающей области рецептора и аминокислотную последовательность Fc домена антитела, и второй полипептид, не обладающий антигенсвязывающей активностью включает аминокислотную последовательность Fc домена антитела.
[51] Полипептидный мультимер по любому из от [39] до [50], где Fc домен антитела или константная область тяжелой цепи антитела получена из IgG человека.
[52] Нуклеиновая кислота, кодирующая полипептид, который составляет Полипептидный мультимер по любому из от [20] и [37] до [51].
[53] Вектор, вставленный с нуклеиновой кислотой по [52].
[54] Клетка, включающая нуклеиновую кислоту по [52] или вектор по [53].
[55] Фармацевтическая композиция, включающая Полипептидный мультимер по любому из от [20] и [37] до [51] в качестве действующего ингредиента.
[Осуществление изобретения]
Настоящее изобретение предоставляет способы, которые используют только стадию очистки на основе белка А для эффективной очистки или получения высокочистого полипептидного мультимера, имеющего связывающую активность по отношению к двум или более антигенов (полиспецифическое антитело), путем изменения их способности связывать белок А. Способы настоящего изобретения способствуют эффективной очистке или получению представляющего интерес высокочистого полипептидного мультимера, не ослабляя действия других целевых аминокислотных модификаций. В частности, посредством комбинирования этих способов со способом регулирования ассоциации между двумя областями белка, представляющие интерес полипептидные мультимеры могут быть получены более эффективно или очищены до более высокой чистоты.
Способы настоящего изобретения получения или очистки полиспецифических антител отличаются тем, что аминокислотные остатки в их константной области тяжелой цепи антитела и/или вариабельной области тяжелой цепи антитела являются модифицированными. Аминокислотные модификации настоящего изобретения введены в эти области, чтобы модифицировать их способность связывать белок А. Кроме того, также могут быть получены другие эффекты от представляющей интерес аминокислотной модификации, например, сравнимое или более длительное время удержания плазмы, чем таковое IgG1 человека. Способы настоящего изобретения способствуют эффективному изготовлению высокочистых полиспецифических антител, имеющих такие эффекты аминокислотной модификации.
В общем, получение высокочистых полиспецифических антител класса IgG требует стадии очистки с использованием ионообменной хроматографии. Тем не менее, добавление этой стадии очистки усложняет производство и увеличивает производственные затраты. С другой стороны, очистка, которая использует только ионообменную хроматографию, не может быть достаточно надежной в качестве способа очистки для фармацевтических препаратов. Таким образом, задача состоит в разработке способа получения биспецифического антитела класса IgG с использованием только стадии очистки на основе белка А, или в разработке надежного способа получения с использованием стадии очистки на основе белка А и стадии ионообменной хроматографии.
Краткое описание фигур
На фиг.1 представлен график, показывающий оценку времени удержания плазмы MRA-IgG1 и MRA-z106/z107k у трансгенных мышей с FcRn человека.
На фиг.2 представлена диаграмма, показывающая, что та же самая область в Fc домене антитела связывается с белком А и FcRn.
На фиг.3 показывает динамику концентраций плазмы Q499-z118/J339-z119/L377-k и Q499-z121/J339-z119/L377-k после введения трансгенным мышам с FcRn человека.
На фиг.4 представлено схематическое изображение GC33-IgG1-CD3-scFv молекулы, которая двухвалентно связывается с раковым специфическим антигеном глипикан-3 (GPC3) и моновалентно связывается с Т-клеточным антигеном CD3.
На фиг.5 показан результат анализа эксклюзионной хроматографии очищенных с белком A NTA1L/NTA1R/GC33-k0 и NTA2L/NTA2R/GC33-k0.
На фиг.6 представлено схематическое изображение молекулы анти-GPC3 IgG антитела, которая моновалентно связывается с глипиканом-3.
На фиг.7 показан результат анализа эксклюзионной хроматографии очищенных с белком A NTA4L-cont/NTA4R-cont/GC33-k0, NTA4L-G3/NTA4R-cont/GC33-k0, и NTA4L/NTA4R/GC33-k0.
На фиг.8 показаны хроматограммы NTA4L-cont/NTA4R-cont/GC33-k0, NTA4L-G3/NTA4R-cont/GC33-k0, и NTA4L/NTA4R/GC33-k0, которые были подвержены очистке колоночной хроматографией с белком А с рН градиентным элюированием.
На фиг.9 представлено схематическое изображение молекулы слитого белка Fc альфа рецептор-Fc, который моновалентно связывается с IgA.
На фиг.10 показан результат анализа эксклюзионной хроматографии очищенных с белком A LAL-cont/IAR-cont и IAL/IAR.
На фиг.11 представлена схематическая диаграмма для no1, встречающегося в природе анти-IL-6 рецептор/анти-GPC3 биспецифического антитела.
На фиг.12 представлена схематическая диаграмма для nо2, полученного путем перестановки VH-области и VL-области анти-GPC3 антитела в no1.
На фиг.13 представлена схематическая диаграмма для no3, который был получен путем модифицирования no2, чтобы изменить изоэлектрическую точку каждой цепи.
На фиг.14 представлена схематическая диаграмма для no5, который был получен путем модифицирования no3, чтобы усилить гетеромерную ассоциацию Н-цепей и очистить гетеромерно ассоциированное антитело с использованием белка А.
На фиг.15 представлена схематическая диаграмма для no6, который был получен путем модифицирования no5, чтобы усилить ассоциацию между целевой Н-цепью и целевой L-цепью.
На фиг.16 представлены хроматограммы анти-IL-6 рецептор/анти- GPC3 биспецифических антител no1, nо2, no3, nо5, и no6 в катионообменной хроматографии, чтобы оценить их паттерны экспрессии.
На фиг.17 представлена хроматограмма для no6 КС, элюированного с рН градиентом из колонки HiTrap protein A HP (GE Healthcare).
На фиг.18 представлена хроматограмма анализа катионообменной хроматографии, чтобы оценить главную пиковую фракцию, полученную очисткой фракции для no6, очищенной с белком А, с использованием колонки SP Sepharose HP (GE Healthcare).
Форма осуществления изобретения
Настоящее изобретение предоставляет способы получения полипептидного мультимера, который включает первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью. Способы настоящего изобретения для получения полипептидного мультимера включают стадии:
(а) экспрессии ДНК, кодирующей первый полипептид, обладающий антигенсвязывающей активностью и ДНК, кодирующей второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью; и
(b) сбора продуктов экспрессии стадии (а); где
один или более аминокислотных остатков в любом из или обоих первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью были модифицированы, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью.
Способы настоящего изобретения для получения полипептидного мультимера также могут быть определены как способы получения полипептидного мультимера с измененной способностью связывать белок А.
В настоящем изобретении, "полипептид, обладающий первой антигенсвязывающей активностью" может указываться как "первый полипептид, обладающий антигенсвязывающей активностью". "Полипептид, имеющий вторую антигенсвязывающую активность или не обладающий антигенсвязывающей активностью" может указываться как "второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью". То же самое относится к "полипептиду, имеющему третью антигенсвязывающую активность" и к "полипептиду имеющему четвертую антигенсвязывающую активность", описанным ниже.
В настоящем изобретении, понятие "включать" означает как "включать", так и "состоять из".
Настоящее изобретение также предоставляет способы очистки полипептидного мультимера, который включает первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью. Способы настоящего изобретения для очистки полипептидного мультимера включают стадии:
(а) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью и ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью; и
(b) сбора продуктов экспрессии стадии (а) с помощью аффинной хроматографии с белком А; где
один или более аминокислотных остатков в любом из или обоих первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, были модифицированы, так что способность связывать белок А различается между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью.
Полипептид, обладающий антигенсвязывающей активностью, в котором один или более аминокислотных остатков были модифицированы, может быть получен посредством:
подготовки ДНК, которая кодирует полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью,
модифицирования одного или более нуклеотидов в ДНК;
введения полученной ДНК в клетки, известного специалисту в данной области техники;
культивирования клеток для экспрессии ДНК; и сбора продукта экспрессии.
Таким образом, способы настоящего изобретения для получения полипептидного мультимера также могут быть представлены как способы, включающие стадии:
(a) предоставления ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью и ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью;
(b) изменения одного или более нуклеотидов в каждой или обеих из ДНК стадии (а), которые кодируют первый и второй полипептиды, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью;
(c) введения ДНК стадии (b) в клетки хозяина и культивирование клеток хозяина для экспрессии ДНК; и
(d) сбора продуктов экспрессии стадии (с) из культуры клеток хозяина.
Способы настоящего изобретения для очистки полипептидного мультимера также могут быть представлены как способы, включающие стадию:
(a) предоставления ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью и ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью;
(b) изменения одного или более нуклеотидов в каждой или обеих из ДНК стадии (а), которые кодируют первый и второй полипептиды, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью;
(c) введения ДНК стадии (b) в клетки хозяина и культивирование клеток хозяина для экспрессии ДНК; и
(d) сбора продуктов экспрессии стадии (с) из культуры клеток хозяина с помощью аффинной хроматографии с белком А.
В настоящем изобретении, полипептидный мультимер относится к гетеромерному мультимеру, содержащему первый и второй полипептиды. Предпочтительно, что первый и второй полипептиды, каждый обладают активностью связывания с разным антигеном. Первый и второй полипептиды каждый имеющий разную антигенсвязывающую активность не ограничены отдельно, пока один из полипептидов имеет антигенсвязывающую область (аминокислотная последовательность) отличающуюся от таковой другого полипептида. Например, как показано на фиг.4, описанной ниже, один полипептид может быть слитым с антигенсвязывающей областью, которая отличается от таковой другого полипептида. Альтернативно, как показано на фиг.4, 6, и 9, описанных ниже, один полипептид может быть полипептидом, который моновалентно связывается с антигеном и не имеет антигенсвязывающей области, которой обладает другой полипептид. Полипептидные мультимеры, содержащие такие первый и второй полипептиды, также включены в полипептидные мультимеры настоящего изобретения.
Мультимеры включают димеры, тримеры, и тетрамеры, но не ограничиваются ними.
В настоящем изобретении, первый полипептид и/или второй полипептид могут образовывать мультимер с одним или двумя третьими полипептидами.
Таким образом, настоящее изобретение предоставляет способы получения полипептидного мультимера, включающего первый полипептид, обладающий антигенсвязывающей активностью, второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, и один или два третьих полипептида, обладающих антигенсвязывающей активностью, которые включают стадии:
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует два третьих полипептида, обладающих антигенсвязывающей активностью; и
(b) сбора продуктов экспрессии стадии (а);
или
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, не обладающий антигенсвязывающей активностью, и ДНК, которая кодирует один третий полипептид, обладающий антигенсвязывающей активностью; и
(b) сбора продуктов экспрессии стадии (а);
где один или более аминокислотных остатков в любом из или обоих первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью были модифицированы, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью.
Описанные выше способы также могут быть представлены как способы, включающие стадии:
(a) предоставления ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует два третьих полипептида, обладающих антигенсвязывающей активностью;
(b) изменения одного или более нуклеотидов в каждой или обеих ДНК стадии (а), которые кодируют первый и второй полипептиды, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью;
(c) введения ДНК, которые кодируют первый, второй и два третьих полипептида в клетки хозяина, и культивирования клеток хозяина для экспрессии ДНК; и
(d) сбора продуктов экспрессии стадии (с) из культуры клеток хозяина;
или
(a) предоставления ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, не обладающий антигенсвязывающей активностью, и ДНК, которая кодирует один третий полипептид, обладающий антигенсвязывающей активностью;
(b) изменения одного или более нуклеотидов в каждой или обеих ДНК стадии (а), которые кодируют первый и второй полипептиды, так что существует большее различие в активности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, не обладающим антигенсвязывающей активностью;
(c) введения ДНК, которые кодируют первый, второй и третий полипептиды, в клетки хозяина и культивирования клеток хозяина для экспрессии ДНК; и
(d) сбора продуктов экспрессии стадии (с) из культуры клеток хозяина.
Кроме того, в настоящем изобретении, первый и второй полипептиды могут образовывать мультимер с третьим и четвертым полипептидами.
Таким образом, настоящее изобретение предоставляет способы получения полипептидного мультимера, включающего первый полипептид, обладающий антигенсвязывающей активностью, второй полипептид, обладающий антигенсвязывающей активностью, третий полипептид, обладающий антигенсвязывающей активностью, и четвертый полипептид, обладающий антигенсвязывающей активностью, которые включают стадии:
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует третий полипептид, обладающий антигенсвязывающей активностью и четвертый полипептид, обладающий антигенсвязывающей активностью; и
(b) сбора продуктов экспрессии стадии (а);
где один или более аминокислотных остатков в каждом или обоих из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью были модифицированы, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью.
Описанные выше способы также могут быть представлены как способы, включающие стадии:
(a) предоставления ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует третий полипептид, обладающий антигенсвязывающей активностью и четвертый полипептид, обладающий антигенсвязывающей активностью;
(b) изменения одного или более нуклеотидов в каждой или обеих ДНК стадии (а), которые кодируют первый и второй полипептиды, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью;
(c) введения ДНК, которые кодируют первый, второй, третий и четвертый полипептиды, в клетки хозяина и культивирования клеток хозяина для экспрессии ДНК; и
(d) сбора продуктов экспрессии стадии (с) из культуры клеток хозяина.
Настоящее изобретение предоставляет способы очистки полипептидного мультимера, который включает первый полипептид, обладающий антигенсвязывающей активностью, второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, и один или два третьих полипептида, обладающих антигенсвязывающей активностью, которые включают стадии:
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует два третьих полипептида, обладающих антигенсвязывающей активностью; и
(b) сбора продуктов экспрессии стадии (а);
или
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, не обладающий антигенсвязывающей активностью, и ДНК, которая кодирует один третий полипептид, обладающий антигенсвязывающей активностью; и
(b) сбора продуктов экспрессии стадии (а);
где один или более аминокислотных остатков в любом из или обоих первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью были модифицированы, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью.
Описанные выше способы также могут быть представлены как способы, включающие стадии:
(a) предоставления ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, и ДНК, которая кодирует два третьих полипептида, обладающих антигенсвязывающей активностью;
(b) изменения одного или более нуклеотидов в каждой или обеих ДНК стадии (а), которые кодируют первый и второй полипептиды, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью;
(c) введения ДНК, которые кодируют первый, второй и два третьих полипептида в клетки хозяина и культивирования клеток хозяина для экспрессии ДНК; и
(d) сбора продуктов экспрессии стадии (с) из культуры клеток хозяина;
или
(a) предоставления ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, не обладающий антигенсвязывающей активностью, и ДНК, которая кодирует один третий полипептид, обладающий антигенсвязывающей активностью;
(b) изменения одного или более нуклеотидов в каждой или обеих ДНК стадии (а), которые кодируют первый и второй полипептиды так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, не обладающим антигенсвязывающей активностью;
(c) введения ДНК, которые кодируют первый, второй и третий полипептиды, в клетки хозяина и культивирования клеток хозяина для экспрессии ДНК; и
(d) сбора продуктов экспрессии стадии (с) из культуры клеток хозяина.
Настоящее изобретение также предоставляет способы очистки полипептидного мультимера, который включает первый полипептид, обладающий антигенсвязывающей активностью, второй полипептид, обладающий антигенсвязывающей активностью, третий полипептид, обладающий антигенсвязывающей активностью, и четвертый полипептид, обладающий антигенсвязывающей активностью, которые включают стадии:
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует третий полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует четвертый полипептид, обладающий антигенсвязывающей активностью; и
(b) сбора продуктов экспрессии стадии (а) с помощью аффинной хроматографии с белком А;
где один или более аминокислотных остатков в каждом или обоих из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью были модифицированы, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью.
Описанные выше способы также могут быть представлены как способы, включающие стадии:
(a) предоставления ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, ДНК, которая кодирует третий полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует четвертый полипептид, обладающий антигенсвязывающей активностью;
(b) изменения одного или более нуклеотидов в каждой или обеих ДНК стадии (а), которые кодируют первый и второй полипептиды, так что существует большее различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью;
(c) введения ДНК, которые кодируют первый, второй, третий и четвертый полипептиды в клетки хозяина и культивирования клеток хозяина для экспрессии ДНК; и
(d) сбора продуктов экспрессии стадии (с) из культуры клеток хозяина с помощью аффинной хроматографии с белком А.
В полипептидном мультимере настоящего изобретения, содержащем первый полипептид, второй полипептид, и один или два третьих полипептида, первый и второй полипептиды каждый могут образовывать мультимер (димер) с третьим полипептидом. Кроме того, два полученных димера могут образовывать друг с другом мультимер. Два третьих полипептида могут иметь полностью одинаковую аминокислотную последовательность (могут обладать активностью связывать один и тот же антиген). Альтернативно, третьи полипептиды могут иметь одинаковую аминокислотную последовательность и две или более активности (например, могут обладать активностями связывать два или более разных антигенов). Когда присутствует только один третий полипептид, то третий полипептид может образовывать полипептидный мультимер посредством димеризации с любым из первого полипептида или второго полипептида.
В полипептидном мультимере настоящего изобретения, первый и второй полипептиды предпочтительно имеют связывающую активность к разными антигенами. В то же время, третий полипептид может иметь связывающую активность к тому же самому антигену, как таковую каждого или обоих из первого и второго полипептидов. Альтернативно, третий полипептид может иметь связывающую активность к антигену, отличающемуся от таковой первого и второго полипептидов.
Альтернативно, полипептидный мультимер настоящего изобретения может содержать первый полипептид, второй полипептид, третий полипептид, и четвертый полипептид. В таком полипептидном мультимере, первый полипептид и второй полипептид могут образовывать мультимер (димер) с третьим полипептидом и четвертым полипептидом, соответственно. Например, посредством образования дисульфидных связей между ними, первый полипептид и третий полипептид могут образовывать димер, и второй полипептид и четвертый полипептид могут образовывать димер.
В полипептидном мультимере настоящего изобретения, первый и второй полипептиды предпочтительно имеют связывающую активность к разным антигенам. При этом третий полипептид может иметь связывающую активность к тому же самому антигену как таковую каждого или обоих из первого и второго полипептидов. Альтернативно, третий полипептид может иметь связывающую активность к антигену, отличающемуся от такового первого и второго полипептидов. Кроме того, четвертый полипептид может иметь связывающую активность к тому же самому антигену как таковую каждого или обоих из первого и второго полипептидов. Альтернативно, четвертый полипептид может иметь связывающую активность к антигену, отличающемуся от такового первого и второго полипептидов.
В особенности, например, когда первый и второй полипептиды содержат аминокислотную последовательность тяжелой цепи антитела к антигену А и аминокислотную последовательность тяжелой цепи антитела к антигену В, соответственно, третий и четвертый полипептиды могут содержать аминокислотную последовательность легкой цепи антитела к антигену А и аминокислотную последовательность легкой цепи антитела к антигену В, соответственно. Когда полипептидный мультимер настоящего изобретения имеет третий и четвертый полипептиды, которые содержат две разные аминокислотные последовательности легкой цепи антитела, целевой высокочистый полипептидный мультимер может быть получен или очищен эффективно, создавая р1 значения третьего и четвертого полипептида различными, с использованием способов, описанных ниже, или путем дифференциации их способности связывать белок L, вдобавок к дифференциации способности связывать белок А между первым и вторым полипептидами.
Альтернативно, например, когда первый полипептид имеет аминокислотную последовательность легкой цепи антитела к антигену А, второй полипептид имеет аминокислотную последовательность вариабельной области легкой цепи антитела к антигену В и аминокислотную последовательность константной области тяжелой цепи антитела, третий полипептид имеет аминокислотную последовательность легкой цепи антитела к антигену А, и четвертый полипептид имеет аминокислотную последовательность вариабельной области легкой цепи антитела к антигену В и аминокислотную последовательность константной области легкой цепи антитела, целевой высокочистый полипептидный мультимер, имеющий первый, второй, третий, и четвертый полипептиды также может быть эффективно получен или очищен используя настоящее изобретение. В этом случае, как описано в примере 12 ниже, введение аминокислотных мутаций, чтобы изменить р1 значение полипептида или введение аминокислотных мутаций, чтобы способствовать ассоциации целевых полипептидов (WO 2006/106905) содействует более эффективной очистке или получению целевого полипептидного мультимера, имеющего первый, второй, третий, и четвертый полипептиды с более высокой чистотой. Аминокислотные мутации, которые вводят, чтобы способствовать ассоциации полипептидов могут быть мутациями, используемыми в способах, описанных в Protein Eng. 1996 Jul., 9(7):617-21; Protein Eng Des Sel. 2010 Apr., 23(4): 195-202; J Biol Chem. 2010 Jun. 18, 285(25): 19637-46; WO 2009080254; и такими, в которых два полипептида, имеющие константную область тяжелой цепи, гетеромерно ассоциированы посредством модифицирования СН3 домена константной области тяжелой цепи; и такими, которые используются в способах, описанных в WO 2009080251, WO 2009080252, WO 2009080253, и такими, посредством которых промотируется ассоциация отдельной пары тяжелой цепи и легкой цепи.
В настоящем изобретении, "полипептид, обладающий антигенсвязывающей активностью" относится к пептиду или белку пяти или более аминокислот в длину, имеющему домен (область), способный связываться с белком или пептидом, такими как антиген или лиганд, например, вариабельная область тяжелой цепи или легкой цепи антитела, рецептор, слитый пептид домена рецептор-Fc, скелет, или их фрагмент. В особенности, полипептид, обладающий антигенсвязывающей активностью может содержать аминокислотную последовательность вариабельной области антитела, рецептора, слитого пептида домена рецептор-Fc, скелета, или их фрагмента.
Скелет может быть любым полипептидом пока он является конформационно стабильным полипептидом, способным связывать по меньшей мере один антиген. Подобные полипептиды включают, но не ограничиваются, например, фрагменты вариабельной области антитела, фибронектин, домены белка А, А домены ЛПНП-рецептора, липокалины, и молекулы, указанные в Nygren et al. (Current Opinion in Structural Biology, 7:463-469 (1997); Journal of Immunol. Methods, 290:3-28 (2004)), Binz et al. (Nature Biotech 23:1257-1266 (2005)), и Hosse et al. (Protein Science 15:14-27 (2006)).
Способы получения вариабельных областей антитела, рецепторов, слитых пептидов домена рецептор-Fc, скелета, и их фрагментов известны специалисту в данной области техники.
Такие полипептиды, имеющие антигенсвязывающую активность, могут быть получены от живого организма или произведенного искусственно. Полипептиды могут быть получены из природных белков, синтетических белков, рекомбинантных белков, и т.п. Кроме того, полипептиды могут быть пептидами или фрагментами белка 10 или более аминокислот в длину, которые имеют домен (область), способный связываться с белком или пептидом, такими как антиген или лиганд, пока они имеют способность связываться с антигеном. Полипептиды могут иметь более чем один домен, способный связываться с антигеном (включая лиганд).
Полипептид, обладающий антигенсвязывающей активностью также может относиться к полипептиду, имеющему антигенсвязывающий домен(ы) белка.
В настоящем изобретении, "полипептид, не обладающий антигенсвязывающей активностью" относится к пептиду или белку пяти или более аминокислот в длину, такому как фрагмент антитела, не обладающий антигенсвязывающей активностью, Fc домен, скелет, или их фрагмент. В особенности, полипептид, не обладающий антигенсвязывающей активностью, может содержать аминокислотную последовательность константной области антитела, Fc домен, скелет, или их фрагмент, но аминокислотная последовательность не ограничивается приведенными выше примерами. Полипептид, не обладающий антигенсвязывающей активностью, можно комбинировать с полипептидом, обладающим антигенсвязывающей активностью, чтобы получить полипептидный мультимер, который моновалентно связывается с антигеном.
В настоящем изобретении, первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью может содержать аминокислотную последовательность константной области тяжелой цепи антитела или аминокислотную последовательность Fc домена антитела. Аминокислотная последовательность Fc домена антитела или константной области тяжелой цепи антитела включает, но не ограничивается, аминокислотную последовательность константных областей класса IgG человека и Fc-доменов. Константные области класса IgG человека или Fc-домены могут быть природными IgG1, IgG2, IgG3, или IgG4 изотипами, или могут быть их вариантами.
При этом в настоящем изобретении, третий полипептид, обладающий антигенсвязывающей активностью и четвертый полипептид, обладающий антигенсвязывающей активностью, может содержать аминокислотную последовательность константной области легкой цепи антитела. Аминокислотная последовательность константной области легкой цепи антитела включает, но не ограничивается, аминокислотную последовательность человеческих константных областей типа каппа и человеческих константных областей типа лямбда, и их варианты.
Кроме того, в настоящем изобретении, полипептиды, обладающие антигенсвязывающей активностью, могут содержать аминокислотную последовательность вариабельной области антитела (например, аминокислотные последовательности CDR1, CDR2, CDR3, FR1, FR2, FR3, и FR4).
Кроме того, в настоящем изобретении, полипептиды, обладающие антигенсвязывающей активностью, могут содержать аминокислотную последовательность тяжелой цепи антитела или легкой цепи антитела. Более конкретно, первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, или не обладающий антигенсвязывающей активностью может содержать аминокислотную последовательность тяжелой цепи антитела. При этом третий полипептид, обладающий антигенсвязывающей активностью, и четвертый полипептид, обладающий антигенсвязывающей активностью, может содержать аминокислотную последовательность легкой цепи антитела.
Если целевой полипептидный мультимер является тетрамером, который образован посредством мультимеризации между димером, образованным первым и третьим полипептидами и димером, образованным вторым и четвертым полипептидами, то для полипептидного мультимера настоящего изобретения могут использоваться, например, полипептид, в котором первый и второй полипептиды, обладающие антигенсвязывающей активностью содержат аминокислотную последовательность тяжелой цепи антитела, и полипептид в котором третий и четвертый полипептиды, обладающие антигенсвязывающей активностью, содержат аминокислотную последовательность легкой цепи антитела. Альтернативно, также могут быть использованы полипептид, в котором первый полипептид, обладающий антигенсвязывающей активностью, содержит аминокислотную последовательность тяжелой цепи антитела, полипептид, в котором второй полипептид, обладающий антигенсвязывающей активностью, содержит аминокислотную последовательность вариабельной области легкой цепи антитела и аминокислотную последовательность константной области тяжелой цепи антитела, полипептид, в котором третий полипептид, обладающий антигенсвязывающей активностью, содержит аминокислотную последовательность легкой цепи антитела, и полипептид, в котором четвертый полипептид, обладающий антигенсвязывающей активностью, содержит аминокислотную последовательность вариабельной области тяжелой цепи антитела.
В особенности, полипептидный мультимер настоящего изобретения может быть полиспецифическим антителом.
В настоящем изобретении, "полиспецифическое антитело" относится к антителу, способному специфически связываться с по меньшей мере двумя различными антигенами.
В настоящем изобретении, "различные антигены" относятся не только к различным молекулам антигена по сути, но и также к различным детерминантам антигена, присутствующим в тех же молекулах антигена. Таким образом, например, различные детерминанты антигена, присутствующие в пределах единственной молекулы включены в "различные антигены" настоящего изобретения. В настоящем изобретении, антитела, которые распознают всевозможные различные детерминанты антигена в единственной молекуле, рассматриваются как "антитела, способные специфически связываться с различными антигенами".
В настоящем изобретении, полиспецифические антитела включают, но не ограничиваются, биспецифические антитела, способные специфически связываться с двумя типами антигенов. Предпочтительные биспецифические антитела настоящего изобретения включают антитела IgG типа H2L2 (состоящие из двух типов Н-цепей и двух типов L-цепей), имеющие константную область человеческого IgG. Более конкретно, такие антитела включают, но не ограничиваются, например, химерные антитела, гуманизированные антитела и человеческие антитела класса IgG.
Кроме того, полипептид, обладающий антигенсвязывающей активностью, может быть, например, молекулой, в которой, по меньшей мере, две из вариабельной области тяжелой цепи, вариабельной области легкой цепи, константной области тяжелой цепи, и константной области легкой цепи, связаны вместе как одна цепь. Альтернативно, полипептид может быть антителом, в котором, по меньшей мере, две из вариабельной области тяжелой цепи, вариабельной области легкой цепи, Fc домена (константная область без СН1 домена) и константной области легкой цепи связаны вместе как одна цепь.
В настоящем изобретении, фраза "существует большее различие в способности связывать белок А между полипептидами, обладающими антигенсвязывающей активностью" означает, что способность связывать белок А не является одинаковой (отличается) между двумя или более полипептидами в результате аминокислотных модификаций на поверхности полипептидов, обладающих антигенсвязывающей активностью. Более конкретно, эта фраза означает, что, например, способность связывать белок А первого полипептида, обладающего антигенсвязывающей активностью отличается от таковой второго полипептида, обладающего антигенсвязывающей активностью. Различие способности связывать белок А может быть исследовано, например, с использованием аффинной хроматографии с белком А.
Прочность способности связывать белок А полипептида, обладающего антигенсвязывающей активностью, соотносится с рН растворителя, используемого для элюирования. Чем больше способность связывать белок А полипептида, тем ниже становится рН растворителя, используемого для элюирования. Таким образом, фраза "существует большее различие в способности связывать белок А между полипептидами, обладающими антигенсвязывающей активностью" также может быть представлена как "если два или более полипептида, обладающие антигенсвязывающей активностью, элюируются с использованием аффинной хроматографии с белком А, то каждый полипептид элюируется при разном рН растворителя". Различие в рН растворителей для элюирования составляет 0.1 или более, предпочтительно 0.5 или более, и еще более предпочтительно 1.0 или более, но этим не ограничивается.
Кроме того, в настоящем изобретении, предпочтительно изменить способность связывать белок А без снижения других активностей (например, удержание плазмы) полипептидов, обладающих антигенсвязывающей активностью.
Целевой полипептидный мультимер, который включает первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, или не обладающий антигенсвязывающей активностью, может быть получен или очищен с использованием аффинной хроматографии с белком А, основывающейся на различии способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью. В особенности, например, если полипептидный мультимер настоящего изобретения представляет собой биспецифическое антитело, которое имеет общую L-цепь (т.е., одинаковую аминокислотную последовательность в третьем и четвертом полипептидах), то полипептидный мультимер может быть получен или очищен способом, описанным ниже. Во-первых, клетки хозяина вводятся следующими: нуклеиновая кислота, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью (точнее говоря, первая тяжелая цепь антитела), аминокислота которого в положении 435 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела представляет собой аргинин (R); нуклеиновая кислота, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью (точнее говоря, вторая цепь тяжелой цепи антитела) аминокислота которого в положении 435 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела представляет собой гистидин (Н); и нуклеиновая кислота, которая кодирует третий полипептид, обладающий антигенсвязывающей активностью (общая L-цепь). Клетки культивируют, чтобы экспрессировать ДНК кратковременно. Затем полученные продукты экспрессии загружают в колонку с белком А. После промывания, сначала элюирование осуществляется с высоким рН раствора для элюирования и затем с низким рН раствора для элюирования. Гомомерное антитело, включающее две единицы первой тяжелой цепи антитела и две единицы общей L-цепи, не имеет участка связывания белка А в его константной области тяжелой цепи. При этом биспецифическое антитело, включающее первую тяжелую цепь антитела, вторую тяжелую цепь антитела, и две единицы общей L-цепи, имеет единственный участок связывания белка А в его константной области тяжелой цепи. Гомомерное антитело, включающее две единицы второй тяжелой цепи антитела и две единицы общей L-цепи, имеет два участка связывания белка А в его константной области тяжелой цепи. Как описано выше, способность связывать белок А полипептида соотносится с рН растворителя для элюирования полипептида в аффинной хроматографии с белком А. Чем больше способность связывать белок А, тем меньше становится рН растворителя для элюирования.
Таким образом, если элюирование сначала осуществляется с высоким рН раствора для элюирования и затем с низким рН раствора для элюирования, то антитела элюируют в следующем порядке:
- гомомерное антитело, включающее две единицы первой тяжелой цепи антитела и две единицы общей L-цепи,
- биспецифическое антитело, включающее первую тяжелую цепь антитела, вторую тяжелую цепь антитела, и две единицы общей L-цепи,
- гомомерное антитело, включающее две единицы второй тяжелой цепи антитела и две единицы общей L-цепи.
Это делает возможным получение или очистку полипептидных мультимеров (биспецифических антител), представляющих интерес.
Чистота полипептидных мультимеров, полученных посредством способов получения или очистки настоящего изобретения, составляет, по меньшей мере, 95% или выше (например, 96%, 97%, 98%, 99% или выше).
Модификации аминокислотных остатков, чтобы создать различие в способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью, включают, но не ограничиваются:
(1) модификацию одного или нескольких аминокислотных остатков в аминокислотной последовательности любого из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, так что способность связывать белок А одного из полипептидов увеличивается;
(2) модификацию одного или нескольких аминокислотных остатков в аминокислотной последовательности любого из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, так что способность связывать белок А одного из полипептидов уменьшается; и
(3) модификацию одного или нескольких аминокислотных остатков в первом полипептиде, обладающем антигенсвязывающей активностью и втором полипептиде, обладающем антигенсвязывающей активностью или не обладающем антигенсвязывающей активностью, так что способность связывать белок А любого из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью увеличивается, и способность связывать белок А другого полипептида уменьшается.
В настоящем изобретении, является предпочтительным, что аминокислоты на поверхности полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, являются модифицированными. Кроме того, также предпочтительно принять во внимание снижение влияния модификации на другие активности полипептида.
Таким образом, в настоящем изобретении, предпочтительно модифицировать, например, аминокислотные остатки в следующих положениях (EU нумерация) в Fc домене антитела или константной области тяжелой цепи:
TLMISR в положениях 250-255, VLHQDWLNGK в положениях 308-317, и EALHNHY в положениях 430-436;
предпочтительно, TLMIS в положениях 250-254, LHQD в положениях 309-312, LN в положениях 314 и 315, Е в положении 430, и LHNHY в положениях 432-436;
более предпочтительно, LMIS в положениях 251-254, LHQ в положениях 309-311, L в положении 314, и LHNH в положениях 432-435; и в частности, MIS в положениях 252-254, L в положении 309, Q в положении 311, и NHY в положениях 434-436.
Что касается аминокислотных модификаций вариабельной области тяжелой цепи антитела, то предпочтительные сайты мутации включают FR1, CDR2, и FR3. Более предпочтительно сайты мутации включают, например, положения Н15-Н23, Н56-Н59, Н63-Н72, и Н79-Н83 (EU нумерация).
Из вышеуказанных аминокислотных модификаций, более предпочтительными являются модификации, которые не снижают связывание с FcRn или удержание плазмы у трансгенных мышей с FcRn человека.
Более конкретно, модификации, которые увеличивают способность связывать белок А полипептида, включают, но не ограничиваются, замещение гистидина (His) на аминокислотный остаток в положении 435 (EU нумерация) в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела.
При этом, модификации, которые снижают способность связывать белок А полипептида включают, но не ограничиваются, замещение аргинина на аминокислотный остаток в положении 435 (EU нумерация) в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела.
Что касается вариабельной области тяжелой цепи антитела, то вариабельная область тяжелой цепи подкласса VH3 обладает активностью связывать белок А. Таким образом, чтобы увеличить способность связывать белок А, аминокислотные последовательности в вышеупомянутых сайтах модификации предпочтительно идентичны аминокислотным последовательностям вариабельной области тяжелой цепи подкласса VH3. Чтобы снизить способность связывать белок А, аминокислотные последовательности предпочтительно идентичны аминокислотным последовательностям вариабельной области тяжелой цепи другого подкласса.
Как описано ниже, модификация аминокислотных остатков может быть достигнута путем изменения одного или более нуклеотидов в ДНК, кодирующей полипептид, и экспрессии ДНК в клетках хозяина. Специалист в данной области техники без труда может определить число, сайт, и тип измененных нуклеотидов, зависящий от типа аминокислотных остатков после модификации.
В данной заявке, модификация (изменение) относится к замещению, делеции, присоединению, или вставке или к их комбинациям.
Полипептид, обладающий антигенсвязывающей активностью, может включать другие модификации вдобавок к указанным выше модификациям аминокислотных остатков. Такие дополнительные модификации могут быть выбраны из, например, замещений, делеции, и модификаций аминокислот и их комбинаций. В особенности, все полипептиды, аминокислотные последовательности которых включают модификацию, описанную ниже, включены в настоящее изобретение:
- аминокислотная модификация для увеличения скорости гетеромерной ассоциации двух типов Н-цепей в биспецифическом антителе;
- аминокислотная модификация для стабилизации дисульфидных связей между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью;
- аминокислотная модификация для улучшения удержания плазмы антитела;
- модификация для увеличения стабильности при кислотных условиях;
- модификация для уменьшения гетерогенности;
- модификация для подавления реакции деамидирования;
- модификация для введения различия между изоэлектрическими точками двух типов полипептидов;
- модификация для изменения способности связываться с рецептором FcD.
Аминокислотные модификации описываются ниже.
Аминокислотная модификация для увеличения скорости гетеромерной ассоциации между двумя типами Н-цепей в биспецифическом антителе
Аминокислотные модификации настоящего изобретения могут комбинироваться с аминокислотными модификациями, описанными в WO 2006106905. Не существует ограничения в сайтах модификации, пока аминокислоты образуют интерфейс между двумя полипептидами, обладающими антигенсвязывающей активностью. В особенности, например, если модифицирована константная область тяжелой цепи, то такие модификации включают модификации, которые создают аминокислоты, по меньшей мере, одной из комбинаций положений 356 и 439, положений 357 и 370, и положений 399 и 409 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи первого полипептида, обладающего антигенсвязывающей активностью, имеющие такой же самый электрический заряд; и аминокислоты по меньшей мере одной из комбинаций положений 356 и 439, положений 357 и 370, и положений 399 и 409 (EU нумерация) в константной области тяжелой цепи второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, имеют электрический заряд, противоположный заряду первого полипептида, обладающего антигенсвязывающей активностью. Более конкретно, такие модификации включают, например, введение мутации, которая замещает Glu в положении 356 (EU нумерация) на Lys в аминокислотной последовательности константной области тяжелой цепи любого из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью, и мутации, которая замещает Lys в положении 439 (EU нумерация) на Glu в аминокислотной последовательности константной области тяжелой цепи другого полипептида. Если эти модификации комбинируются с модификациями настоящего изобретения, то целевой полипептид может быть получен с высокой чистотой посредством только очистки на основе белка А.
Альтернативно, целевой полипептидный мультимер, который включает первый, второй, третий, и четвертый полипептиды, обладающие антигенсвязывающей активностью, может быть эффективно получен или очищен с высокой чистотой, если модификация совершается для создания аминокислот в положении 39 (нумерация по Кэбату) в вариабельной области тяжелой цепи и/или в положении 213 (EU нумерация) в константной области тяжелой цепи первого полипептида, обладающего антигенсвязывающей активностью, которые имеют электрический заряд, противоположный заряду аминокислоты в положении 39 (нумерация по Кэбату) в вариабельной области тяжелой цепи и/или аминокислоты в положении 213 (EU нумерация) в константной области тяжелой цепи второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, и аминокислоты в положении 38 (нумерация по Кэбату) и/или аминокислоты в положении 123 (EU нумерация) в вариабельной области легкой цепи третьего полипептида, обладающего антигенсвязывающей активностью, имеют электрический заряд, противоположный заряду аминокислоты в положении 38 (нумерация по Кэбату) и/или аминокислоты в положении 123 (EU нумерация) в вариабельной области легкой цепи четвертого полипептида, обладающего антигенсвязывающей активностью.
Аминокислотная модификация для стабилизации дисульфидных связей между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью
Как описано в опубликованных документах (Mol. Immunol. 1993, 30, 105-108; и Mol. Immunol. 2001, 38, 1-8), гетерогенность IgG4 исключается, и его устойчивая структура может быть поддержана путем замещения Pro на Ser в положении 228 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи IgG4.
Аминокислотная модификация для улучшения удержания плазмы антитела
Для того чтобы регулировать удержание плазмы, возможно комбинировать аминокислотные модификации настоящего изобретения с аминокислотными модификациями, которые изменяют р1 значение антитела. Модификации константных областей включают, например, аминокислотные модификации в положениях 250 и 428 (EU нумерация) и таковые описаны в опубликованных документах (J. Immunol. 2006, 176 (1):346-356; и Nat. Biotechnol. 1997 15 (7):637-640). Модификации вариабельных областей включают аминокислотные модификации, описанные в WO 2007/114319 и WO 2009/041643. Аминокислоты, подлежащие модификации, предпочтительно экспонированы на поверхности полипептида, обладающего антигенсвязывающей активностью. Модификации включают, например, аминокислотное замещение в положении 196 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи. В случае константной области тяжелой цепи IgG4, удержание плазмы может быть усилено, например, путем замещения глутамина на лизин в положении 196 тем самым снижения pI значения.
Кроме того, удержание плазмы может регулироваться посредством изменения FcRn-связывающей способности. Аминокислотные модификации, которые изменяют FcRn-связывающую способность, включают, например, аминокислотные замещения в константной области тяжелой цепи антитела, описанные в опубликованных документах (The Journal of Biological Chemistry vol.276, No.9 6591-6604, 2001; Molecular Cell, Vol.7, 867-877, 2001; Curr Opin Biotechnol. 2009, 20 (6):685-91). Такие аминокислотные замещения включают, например, замещения в положениях 233, 238, 253, 254, 255, 256, 258, 265, 272, 276, 280, 285, 288, 290, 292, 293, 295, 296, 297, 298, 301, 303, 305, 307, 309, 311, 312, 315, 317, 329, 331, 338, 360, 362, 376, 378, 380, 382, 415, 424, 433, 434, 435, и 436 (EU нумерация).
Модификация для улучшения устойчивости при кислотных условиях
Если используется константная область тяжелой цепи IgG4, то устойчивая структура из четырех цепей (H2L2 структура) предпочтительно поддерживается путем подавления конверсии IgG4 в форму полумолекулы при кислотных условиях. Таким образом, аргинин в аминокислотном положении 409 (EU система нумерации), который играет важную роль в поддержании структуры из четырех цепей (Immunology 2002, 105, 9-19) предпочтительно замещен лизином класса IgG1, который поддерживает устойчивую структуру из четырех цепей даже при кислотных условиях. Кроме того, чтобы улучшить кислотную устойчивость IgG2, метионин в аминокислотном положении 397 (EU система нумерации) может быть замещен валином. Эти модификации могут использоваться в комбинации с аминокислотными модификациями настоящего изобретения.
Модификация для уменьшения гетерогенности
Аминокислотные модификации настоящего изобретения могут комбинироваться со способами, описанными в WO 2009041613. В особенности, например, модификация в которой две аминокислоты в С-конце константной области тяжелой цепи IgG1 (т.е., глицин и лизин в положениях 446 и 447 [EU нумерация], соответственно) удалены, может комбинироваться с аминокислотными модификациями, описанными здесь в примерах.
Модификация для подавления реакции деамидирования
Аминокислотные модификации настоящего изобретения могут комбинироваться с аминокислотными модификациями для подавления реакции деамидирования. Реакция деамидирования, как было описано, происходила чаще в сайте, где аспарагин (N) и глицин (G) являются смежными друг с другом (---NG---) (Geiger et al., J. Bio. Chem. (1987) 262:785-794). Если полипептидный мультимер (полиспецифическое антитело) настоящего изобретения имеет сайт, где аспарагин и глицин являются смежными друг с другом, то реакция деамидирования может подавляться путем модифицирования аминокислотной последовательности. В особенности, например, любой или оба из аспарагина и глицина замещены другими аминокислотами. Более конкретно, например, аспарагин замещен аспарагиновой кислотой.
Модификация для введения различия в изоэлектрическую точку между двумя типами полипептидов
Аминокислотные модификации настоящего изобретения могут комбинироваться с аминокислотными модификациями для введения различия в изоэлектрическую точку. Специальные способы описаны, например, в WO 2007/114325. Вдобавок к модификациям настоящего изобретения, аминокислотные последовательности первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью модифицированы так, что существует большее различие в изоэлектрической точке между этими полипептидами. Это способствует эффективному получению или очистке целевого полипептида с высокой чистотой. Кроме того, большее различие в изоэлектрической точке может быть вызвано между третьим полипептидом, обладающим антигенсвязывающей активностью и четвертым полипептидом, обладающим антигенсвязывающей активностью. Это позволяет эффективно получить или очистить с высокой чистотой целевой полипептидный мультимер, включающий первый, второй, третий и четвертый полипептиды. В особенности, когда первый и второй полипептиды каждый включает аминокислотную последовательность тяжелой цепи антитела, сайты модификации включают, например, положения 1, 3, 5, 8, 10. 12, 13, 15, 16, 19, 23, 25, 26, 39, 42, 43, 44, 46, 68, 71, 72, 73, 75, 76, 81, 82b, 83, 85, 86, 105, 108, 110, и 112 (нумерация по Кэбату). Когда третий и четвертый полипептиды каждый включает аминокислотную последовательность легкой цепи антитела, сайты модификации включают, например, положения 1, 3, 7, 8, 9, 11, 12, 16, 17, 18, 20, 22, 38, 39, 41, 42, 43, 45, 46, 49, 57, 60, 63, 65, 66, 68, 69, 70, 74, 76, 77, 79, 80, 81, 85, 100, 103, 105, 106, 107, и 108 (нумерация по Кэбату). А большее различие в изоэлектрической точке может быть вызвано посредством модифицирования по меньшей мере одного из аминокислотных остатков в указанных выше положениях в одном полипептиде, чтобы иметь электрический заряд, и модифицирования по меньшей мере одного из аминокислотных остатков в указанных выше положениях в другом полипептиде, чтобы не иметь заряд или иметь электрический заряд, противоположный указанному выше.
Модификация для изменения способности связываться с Fcγ рецептором
Аминокислотные модификации настоящего изобретения могут комбинироваться с аминокислотными модификациями, которые изменяют (увеличивают или снижают) Fcγ способность связываться с рецептором. Модификации для изменения способности связываться с рецептором Fcγ включают, но не ограничиваются, модификации, описанные в Curr Opin Biotechnol. 2009, 20(6):685-91. В особенности, способность связываться с рецептором Fcγ может быть изменена, например, путем комбинирования модификаций настоящего изобретения с модификацией, которая замещает лейцин в положениях 234 и 235 и аспарагин в положении 272 (EU нумерация) константной области тяжелой цепи IgG1 другими аминокислотами. Аминокислоты после замещения включают, но не ограничиваются, аланин.
Приготовление ДНК, кодирующих полипептиды, обладающие антигенсвязывающей активностью, модификация одного или более нуклеотидов, ДНК экспрессия и извлечение продуктов экспрессии описаны ниже.
Приготовление ДНК, кодирующих полипептиды, обладающие антигенсвязывающей активностью
В настоящем изобретении, ДНК, которая кодирует полипептид, обладающий антигенсвязывающей активностью или полипептид, не обладающий антигенсвязывающей активностью, может быть целой или участком известной последовательности (встречающейся в природе или искусственной последовательности), или их комбинациями. Такие ДНК могут быть получены способами, известными специалисту в данной области техники. ДНК могут быть выделены, например, из библиотек антител, или путем клонирования антителокодирующих генов из гибридом, продуцирующих моноклональные антитела.
Принимая во внимание библиотеки антител, многие уже являются хорошо известными, и специалист в данной области техники может надлежащим образом получить библиотеки антител, поскольку способы получения библиотек антител известны. Например, относительно фаговых библиотек антител, можно сослаться на такой литературный источник как Clackson et al., Nature 1991, 352: 624-8; Marks et al., J. Mol. Biol. 1991, 222: 581-97; Waterhouses et al., Nucleic Acids Res. 1993, 21: 2265-6; Griffiths et al., EMBO J. 1994, 13: 3245-60; Vaughan et al., Nature Biotechnology 1996, 14: 309-14; или японский патент Kohyo № публикации (JP-A) H20-504970 (нерассмотренная на национальной фазе японская публикация, соответствующая неяпонской международной публикации). Кроме того, могут использоваться известные способы, такие как способы, которые используют эукариотические клетки в качестве библиотек (WO 95/15393) и способы рибосомного дисплея. Кроме того, также известны технические приемы получения человеческих антител путем пэннинга, с использованием библиотек человеческих антител. Например, вариабельные области человеческих антител могут экспрессироваться на поверхности фагов как единственная цепь антител (scFvs) с использованием способов фагового дисплея, и могут быть выбраны фаги, которые связываются с антигенами. Генетический анализ выбранных фагов может определить последовательности ДНК, кодирующие вариабельные области человеческих антител, которые связываются с антигенами. Как только выявляются ДНК последовательности scFvs, которые связываются с антигенами, могут быть созданы экспрессирующие векторы, основанные на этих последовательностях, чтобы получить человеческие антитела. Эти способы являются уже хорошо известными, и можно сослаться на WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438, и WO 95/15388.
Что касается способов получения генов, кодирующих антитела из гибридом, в основном, могут применяться известные технические приемы. В особенности, искомые антигены или клетки, экспрессирующие требуемые антигены используют в качестве сенсибилизирующих антигенов для иммунизации в соответствии с обычными способами иммунизации. Иммунокомпетентные клетки, полученные таким образом, сливаются с известными материнскими клетками обычными способами слияния клеток, и моноклональное антитело, продуцирующее клетки (гибридомы) отбирается путем обычных способов отбора. кДНК вариабельных областей антитела (V области) могут быть получены путем обратной транскрипции иРНК полученных гибридом, используя обратную транскриптазу. Антителокодирующие гены могут быть получены посредством зацепления их с ДНК, кодирующими требуемые константные области антитела (С области).
Более конкретно, без ограничений, примерами являются следующие примеры. Сенсибилизирующие антигены для получения генов антитела, кодирующих тяжелые и легкие цепи антитела, включают оба полных антигена с иммуногенностью и неполных антигена, состоящих из гаптенов и таких, которые не проявляют антигенность. Например, могут использоваться непроцессированные белки и частичные пептиды белков, представляющие интерес. Кроме того, известно, что вещества, состоящие из полисахаридов, нуклеиновых кислот, липидов, и т.п. могут становиться антигенами. Таким образом, нет особых ограничений для антигенов в настоящем изобретении. Антигены могут быть приготовлены посредством способов, известных специалисту в данной области техники, и они могут быть приготовлены, например, путем следующих способов, с использованием бакуловирусов (например, WO 98/46777). Гибридомы могут быть изготовлены, например, следующими способами по Milstein et al. (G.Kohler и С.Milstein, Methods Enzymol. 1981, 73: 3-46), и т.п. Если иммуногенность антигена является низкой, то он может быть связан с макромолекулой, которая обладает иммуногенностью, как например, альбумин, и затем использоваться для иммунизации. Кроме того, посредством сшивания антигенов с другими молекулами при необходимости, они могут быть преобразованы в растворимые антигены. Если трансмембранные молекулы, такие как рецепторы, используются в качестве антигенов, то части внеклеточных областей рецепторов могут использоваться как фрагмент, или клетки, экспрессирующие трансмембранные молекулы на их клеточной поверхности могут использоваться как иммуногены.
Антителообразующие клетки могут быть получены путем иммунизации животных с использованием пригодных сенсибилизирующих антигенов, описанных выше. Альтернативно, антителообразующие клетки могут быть приготовлены путем in vitro иммунизации лимфоцитов, которые могут вырабатывать антитела. В качестве животных для иммунизации могут использоваться различные млекопитающие, причем, как правило, используют грызунов, зайцеобразных и приматов. Примеры таких животных включают мышей, крыс и хомяков для грызунов, кроликов для зайцеобразных, и обезьян, включая макак-крабоед, макак резус, гамадрил и шимпанзе для приматов. Кроме того, также известны трансгенные животные, несущие репертуары генов человеческих антител, и человеческие антитела могут быть получены с использованием этих животных (см. WO 96/34096; Mendez et al., Nat. Genet. 1997, 15: 146-56). Вместо использования таких трансгенных животных, например, искомые человеческие антитела, обладающие связывающей активностью к антигенам могут быть получены путем in vitro сенсибилизации человеческих лимфоцитов с требуемыми антигенами или клетками, экспрессирующими требуемые антигены, и затем слияния сенсибилизированных лимфоцитов с человеческими миеломными клетками, такими как U266 (см. японскую патентную заявку Kokoku № публикации (JP-B) H1-59878 (рассмотренная, утвержденная японская патентная заявка, опубликованная на возражение)). Кроме того, требуемые человеческие антитела могут быть получены путем иммунизации трансгенных животных, несущих полный репертуар генов человеческого антитела, с искомыми антигенами (см. WO 93/12227, WO 92/03918, WO 94/02602, WO 96/34096, и WO 96/33735).
Иммунизация животных может осуществляться путем соответствующего разбавления и суспендирования сенсибилизирующего антигена в забуференном фосфатом физиологическом растворе (PBS), физиологическом растворе или т.п., и образования эмульсии посредством смешивания адъюванта в случае необходимости, с последующей внутрибрюшинной или подкожной инъекцией животным. После этого, сенсибилизирующий антиген, смешанный с неполным адъювантом Фрейнда, предпочтительно вводится несколько раз каждый 21 день. Продуцирование антитела может подтверждаться путем измерения титра антитела-мишени в сыворотке животных с использованием обычных способов.
Антителообразующие клетки, полученные от лимфоцитов или животных, иммунизированных искомым антигеном, могут сливаться с миеломными клетками, чтобы выработать гибридомы, с использованием обычных факторов, вызывающих слияние клеток (например, полиэтиленгликоль) (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, 1986, 59-103). При необходимости, клетки гибридомы могут культивироваться и расти, и связывающая специфичность антител, продуцируемых от этих гибридом, может быть измерена с использованием известных способов анализа, таких как иммунопреципитация, радиоиммунологический анализ (RIA), и ферментный иммуносорбентный анализ (ELISA). После этого, гибридомы, которые вырабатывают требуемые антитела, специфичность, сродство или активность которых была определена, могут быть субклонированы способами, такими как серийное разведение.
Затем, гены, кодирующие выбранные антитела могут быть клонированы от гибридом или антителообразующих клеток (сенсибилизированные лимфоциты и т.п.) с использованием проб, которые могут в особенности связываться с антителами (например, олигонуклеотиды дополнительно к последовательностям, кодирующим константные области антитела). Также возможно клонирование из иРНК с использованием RT-PCR. Иммуноглобулины классифицируются на пять различных классов, IgA, IgD, IgE, IgG, и IgM. Эти классы далее разделяются на несколько подклассов (изотипов) (например, IgG-1, IgG-2, IgG-3, и IgG-4; IgA-1 и IgA-2; и т.п.). Тяжелые цепи и легкие цепи, используемые в настоящем изобретении, для выработки антител, в частности не ограничены и могут получаться из антител, принадлежащих к любому из этих классов или подклассов; тем не менее, в особенности предпочтение отдается IgG.
Здесь, возможно модифицировать гены, кодирующие тяжелую цепь и гены, кодирующие легкую цепь с использованием методов генетической инженерии. Генетически модифицированные антитела, такие как химерные антитела, гуманизированные антитела, которые были модифицированы искусственно с целью понижения гетерологичной антигенности и т.п.в отношении людей, могут быть выработаны соответствующим образом при необходимости для антител, таких как мышиные антитела, крысиные антитела, антитела кролика, антитела хомяка, антитела овцы и антитела верблюда. Химерные антитела представляют собой антитела, состоящие из вариабельных областей тяжелой цепи и легкой цепи антител нечеловеческих млекопитающих, таких как мышиное антитело, и константных областей тяжелой цепи и легкой цепи антитела человека. Они могут быть получены путем лигирования ДНК, кодирующей вариабельную область мышиного тела, с ДНК, кодирующей константную область человеческого антитела, их инкорпорирования в экспрессирующий вектор, и введения вектора в хозяина для получения антитела. Гуманизированное антитело, которое также называется реконструированное человеческое антитело, может быть синтезировано посредством ПЦР из числа олигонуклеотидов, произведенных так, что они имеют перекрывающиеся участки в концах ДНК последовательностей, предназначенных для связывания гипервариабельных участков (ГВУ) антитела нечеловеческого млекопитающего, такого как мышь. Полученная ДНК может быть лигирована кДНК, кодирующей константную область человеческого антитела. Лигированная ДНК может быть встроена в экспрессирующий вектор, и вектор может быть введен в хозяина, чтобы вырабатывать антитело (см. ЕР 239400 и WO 96/02576). FRs человеческого антитела, которые лигированы через ГВУ, выбираются, когда ГВУ образует благоприятный антигенсвязывающий центр антитела. При необходимости, аминокислоты в каркасной области вариабельной области антитела могут быть замещены, так что ГВУ реконструированного человеческого антитела образует соответствующий антигенсвязывающий центр антитела (K.Sato et al., Cancer Res. 1993, 53: 851-856). Моноклональные антитела настоящего изобретения включают такие гуманизированные антитела и химерные антитела.
Если антитела настоящего изобретения представляют собой химерные антитела или гуманизированные антитела, то константные области этих антител предпочтительно являются производными от человеческих антител. Например, Сγ1, Сγ2, Сγ3, и Сγ4 могут использоваться для тяжелой цепи, наряду с тем, что Cκ и Сλ могут использоваться для легкой цепи. Кроме того, константная область человеческого антитела может быть модифицированной при необходимости улучшить антитело или его стабильность выработки. Химерное антитело настоящего изобретения предпочтительно включает вариабельную область антитела, производную от нечеловеческого млекопитающего и константную область человеческого антитела. При этом гуманизированное антитело настоящего изобретения предпочтительно включает ГВУ антитела, производного от нечеловеческого млекопитающего, и FRs и С области человеческого антитела. Константные области, производные от человеческих антител включают специфические аминокислотные последовательности, которые варьируются в зависимости от изотипа, такого как IgG (IgG1, IgG2, IgG3, и IgG4), IgM, IgA, IgD, и IgE. Константные области, используемые для приготовления гуманизированных антител настоящего изобретения, могут быть константными областями антител любого изотипа. Предпочтительно используется константная область человеческого IgG, но константные области не ограничиваются ним. При этом нет особого ограничения в FRs, производных от человеческого антитела, которые используются, чтобы приготовить гуманизированные антитела, и они могут быть производными от антитела любого изотипа.
Вариабельные и константные области химерных или гуманизированных антител настоящего изобретения могут быть модифицированы посредством делеции, замещения, инсерции и/или присоединения, до тех пор, пока антитела проявляют ту же самую связывающую специфичность как и исходные антитела.
Химерные и гуманизированные антитела, которые используют полученные от человека последовательности, как предполагают, будут полезны, если вводятся людям в терапевтических целях или т.п., после того как их антигенность в человеческом организме была ослаблена.
В настоящем изобретении, аминокислоты могут быть модифицированы, чтобы изменить биологические свойства антитела.
Минитела (антитела низкого молекулярного веса) пригодны как антитела по причине их in vivo кинетических свойств и низкозатратного производства с использованием Е. coli, растительных клеток или т.п.
Фрагменты антител представляет собой один тип минитела. Минитела включают антитела, которые включают фрагмент антитела в качестве их частичной структуры. Минитела настоящего изобретения в частности не ограничены их структурой или способом получения, до тех пор, пока они обладают антигенсвязывающей способностью. Некоторые минитела обладают большей активностью, чем активность целого антитела (Orita et al., Blood (2005) 105: 562-566). В данной заявке "фрагменты антитела" в частности не ограничены до тех пор, пока они являются частью целого антитела (например, целый IgG). Тем не менее, фрагменты антитела предпочтительно включают вариабельную область тяжелой цепи (VH) или вариабельную область легкой цепи (VL). Предпочтительные фрагменты антитела включают, например, Fab, F(ab’)2, Fab’, и Fv. Аминокислотная последовательность вариабельной области тяжелой цепи (VH) или вариабельной области легкой цепи (VL) во фрагменте антитела может быть модифицирована посредством замещения, делеции, присоединения, и/или инсерции. Кроме того, некоторые участки вариабельной области тяжелой цепи (VH) или вариабельной области легкой цепи (VL) могут быть удалены, до тех пор, пока фрагменты поддерживают их антигенсвязывающую способность. Например, из указанных выше фрагментов антитела, "Fv" является минимальным фрагментом антитела, который включает распознавание полного антигена и связывающие участки. "Fv" представляет собой димер (VH-VL димер), в котором одна вариабельная область тяжелой цепи (VH) и одна вариабельная область легкой цепи (VL) прочно связаны нековалентной связью. Три гипервариабельных участка (ГВУ) каждой вариабельной области образуют антигенсвязывающий центр антитела на поверхности VH-VL димера. Шесть ГВУ предоставляют антителу участок связывания антигена. Тем не менее, даже одна вариабельная область (или половина Fv, включающая только три антиген-специфических ГВУ) обладает способностью распознавать и связывать антиген, хотя его сродство ниже, чем сродство полного участка связывания. Таким образом, такие молекулы, которые меньше, чем Fv также включены во фрагменты антител настоящего изобретения. Кроме того, вариабельные области фрагмента антитела могут быть химеризованы или гуманизированы.
Предпочтительно минитела включают и вариабельную область тяжелой цепи (VH), и вариабельную область легкой цепи (VL). Минитела включают, например, фрагменты антитела, такие как Fab, Fab’, F(ab’)2, и Fv, и scFv (одноцепочечный Fv), которые могут быть приготовлены с использованием фрагментов антитела (Huston et al., Proc. Natl. Acad. Sci. USA (1988) 85: 5879-83; Plickthun "The Pharmacology of Monoclonal Antibodies" Vol.113, Resenburg и Moore (eds.). Springer Verlag, New York, pp.269-315, (1994)); диатела (Holliger et al., Proc. Natl. Acad. Sci. USA (1993) 90:6444-8; EP 404097; WO 93/11161; Johnson et al., Method in Enzymology (1991) 203: 88-98; Holliger et al., Protein Engineering (1996) 9:299-305; Perisic et al., Structure (1994) 2:1217-26; John et al., Protein Engineering (1999) 12(7):597-604; Atwell et al., Mol. Immunol. (1996) 33:1301-12); sc(Fv)2 (Hudson et al., J Immunol. Methods (1999) 231:177-89; Orita et al., Blood (2005) 105:562-566); триатела (Journal of Immunological Methods (1999) 231: 177-89); и тандемные антитела (Cancer Research (2000) 60:4336-41).
Фрагмент антитела может быть приготовлен путем обработки антитела ферментом, например, протеазой, такой как папаин и пепсин (см. Morimoto et al., J. Biochem. Biophys. Methods (1992) 24:107-17; Brennan et al., Science (1985) 229:81). Альтернативно, фрагмент антитела также может быть получен генетической рекомбинацией, основанной на ее аминокислотной последовательности.
Минитело, включающее структуру, которая получается из модификации фрагмента антитела, может быть конструировано с использованием фрагмента антитела, полученного ферментативной обработкой или генетической рекомбинацией. Альтернативно, после конструирования гена, который кодирует полное минитело, и его введения в экспрессирующий вектор, минитело может экспрессироваться в соответствующие клетки хозяина (см., например, Со et al., J. Immunol. (1994) 152:2968-76; Better и Horwitz, Methods Enzymol. (1989) 178:476-96; Pluckthun и Skerra, Methods Enzymol. (1989) 178: 497-515; Lamoyi, Methods Enzymol. (1986) 121:652-63; Rousseaux et al., Methods Enzymol. (1986) 121:663-9; Bird и Walker, Trends Biotechnol. (1991) 9:132-7).
Указанный выше scFv представляет собой одноцепочечный полипептид, включающий две вариабельные области, при необходимости связанные вместе через линкер или т.п. Две вариабельные области, содержащиеся в scFv, типично являются одной VH и одной VL, но scFv может иметь две VH или две VL. В общем, scFv полипептиды включают линкер между VH и VL доменами, образуя таким образом парный участок VH и VL, требуемый для связывания антигена. Пептидный линкер десяти или более аминокислот типично используется в качестве линкера между VH и VL для образования внутримолекулярного парного участка между VH и VL. Тем не менее, линкеры scFv настоящего изобретения не ограничиваются такими пептидными линкерами, до тех пор, пока они не ингибируют образование scFv. Для обзора scFv, см. Pluckthun "The Pharmacology of Monoclonal Antibody", Vol.113 (Rosenburg и Moore ed., Springer Verlag, NY, pp.269-315 (1994)).
При этом, "диатела (Db)" относятся к бивалентным фрагментам антител, конструированных путем слияния генов (Р. Holliger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993); EP 404,097; WO 93/11161; etc.). Диатела представляют собой димеры, включающие две полипептидные цепи, в которой каждая полипептидная цепь в пределах той же самой цепи включает вариабельную область легкой цепи (VL) и вариабельную область тяжелой цепи (VH), связанную через линкер, достаточно короткий, чтобы предотвратить взаимодействие этих двух доменов, например, линкер приблизительно пяти остатков. VL и VH, закодированные на той же самой полипептидной цепи сформируют димер, так как линкер между VL и VH является слишком коротким, чтобы образовать одноцепочечный фрагмент V области. Вследствие этого, диатела имеют два антигенсвязывающих центра антител. В этом случае, если VL и VH, направленные против двух различных эпитопов (а и b) экспрессируются одновременно как комбинации VLa-VHb и VLb-VHa, связанные с линкером приблизительно пяти остатков, то они секретируются как биспецифический Db.
Диатела включают две молекулы scFv, и таким образом имеют четыре вариабельные области. В результате, диатела имеют два участка связывания антигена. В отличие от ситуаций, в которых scFv не образуют димеры, в образовании диатела, длина линкера между VH и VL в каждой scFv молекуле, как правило, составляет примерно пять аминокислот, когда линкер является пептидным линкером. Тем не менее, линкер scFv, который образует диатело, не ограничивается таким пептидным линкером, до тех пор, пока он е ингибирует scFv экспрессию и образование диатела.
Кроме того, является предпочтительным, что минитела и фрагменты антитела настоящего изобретения дополнительно включают аминокислотную последовательность константной области тяжелой цепи антитела и/или аминокислотную последовательность константной области легкой цепи.
Изменение одного или нескольких нуклеотидов
В данном случае, "изменение нуклеотидов" означает, что манипуляция с генами или мутагенез осуществляется, чтобы вставить, удалить или заменить, по меньшей мере, один нуклеотид в ДНК, так что полипептид, закодированный посредством ДНК, имеет аминокислотные остатки, представляющие интерес. В особенности, это означает, что кодон, кодирующий первоначальный аминокислотный остаток, замещен кодоном, кодирующим целевой аминокислотный остаток. Такие нуклеотидные изменения могут вводиться с использованием способов, таких как сайт-направленный мутагенез (см, например, Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488), ПЦР мутагенез, и кассетный мутагенез. В общем, мутантные антитела, биологические свойства которых были улучшены, показывают гомологию и/или сходство аминокислотной последовательности в 70% или выше, более предпочтительно 80% или выше, и даже более предпочтительно 90% или выше (например, 95% или выше, 97%, 98%, 99% и т.д.), по сравнению с аминокислотной последовательностью вариабельной области исходного антитела. В данном случае, гомология и/или сходство последовательностей определяется как соотношение аминокислотных остатков, которые являются гомологичными (тот же самый остаток) или подобными (аминокислотные остатки, классифицированные в той же самой группе, основанной на общих свойствах аминокислотной боковой цепи) к исходным аминокислотным остаткам, после доведения до максимума значения гомологии последовательностей путем осуществления линейной последовательности и введения пробела при необходимости. В общем, аминокислотные остатки природного происхождения подразделяются на следующие группы, основанные на свойствах их боковых цепей: (1) гидрофобные: аланин, изолейцин, валин, метионин, и лейцин; (2) нейтрально гидрофильные: аспарагин, глутамин, цистеин, треонин, и серин; (3) кислотные: аспарагиновая кислота и глутаминовая кислота; (4) основные: аргинин, гистидин и лизин; (5) остатки, которые оказывают воздействие на конформацию цепей: глицин и пролин; и (6) ароматические: тирозин, триптофан, и фенилаланин. Количество модифицированных аминокислот составляет, например, десять, девять, восемь, семь, шесть, пять, четыре, три, два, или один, но не ограничивается этим.
В общем, всего шесть гипервариабельных участков (ГВУ), присутствующих в вариабельных областях тяжелой цепи и легкой цепи, взаимодействуют, чтобы образовать антигенсвязывающий активный центр (антигенсвязывающие активные центры) антитела. Известно, что одна из этих вариабельных областей обладает способностью распознавать и связывать антиген, даже притом, что сродство будет ниже, чем тогда, когда включены все участки связывания. Таким образом, полипептиды настоящего изобретения, обладающие антигенсвязывающей активностью, могут кодировать части фрагмента, содержащего соответствующие антигенсвязывающие активные центры антител тяжелой цепи и легкой цепи до тех пор, пока они поддерживают желаемую антигенсвязывающую активность.
Способы настоящего изобретения обеспечивают эффективное получение, например, искомых полипептидных мультимеров, которые действительно обладают активностью, описанной выше.
В предпочтительной форме осуществления настоящего изобретения, соответствующие аминокислотные остатки, которые будут "модифицированы" могут выбираться из, например, аминокислотных последовательностей вариабельных областей тяжелой цепи и легкой цепи антитела и аминокислотных последовательностей легкой цепи антитела и вариабельной области легкой цепи.
ДНК экспрессия
ДНК, кодирующие модифицированные полипептиды, клонируют (встраивают) в соответствующий вектор и затем вводят в клетки хозяина. Нет особого ограничения в векторах при условии, что они устойчиво переносят встроенные нуклеиновые кислоты. Например, используя Е. coli в качестве хозяина, векторы включают клонирующие векторы. Предпочтительные клонирующие векторы включают векторы pBluescript (Stratagene). Возможно использовать различные коммерчески доступные векторы. Экспрессирующие векторы в особенности пригодны в качестве векторов для получения полипептидных мультимеров или полипептидов настоящего изобретения. Нет никакого особого ограничения для экспрессирующих векторов при условии, что они экспрессируют полипептиды in vitro, в Е. coli, клетках культуры или организмах. Предпочтительные векторы включают, например, векторы pBEST (Promega) для экспрессии in vitro, векторы рЕТ (Invitrogen) для экспрессии в Е. coli; вектор pME18S-FL3 (GenBank Accession No.AB009864) для экспрессии в клетках культуры; и вектор pME18S (Mol. Cell. Biol. 8:466-472 (1988)) для экспрессии в организмах. ДНК могут быть встроены в векторы обычными способами, такими как лигазная реакция с использованием сайтов рестрикционного фермента (Current protocols in Molecular Biology edit. Ausubel et al. (1987) Publish. John Wiley & Sons. Section 11.4-11.11).
Нет никакого особого ограничения для указанных выше клеток хозяина, и в зависимости от назначения могут использоваться различные клетки хозяина. Клетки для экспрессии полипептидов включают, например, бактериальные клетки (например. Streptococcus, Staphylococcus, E. coli, Streptomyces, и Bacillus subtilis), грибковые клетки (например, дрожжи и Aspergillus), клетки насекомых (например, дрозофила S2 и Spodoptera SF9), клетки животных (например, СНО, COS, HeLa, C127, 3Т3, ВНК, HEK293, клетки меланомы Боуэса) и растительные клетки. Векторы могут вводиться в клетки хозяина, используя известные способы, такие как способ преципитации фосфатом кальция, способ электропорации (Current protocols in Molecular Biology edit. Ausubel et al. (1987) Publish. John Wiley & Sons. Section 9.1-9.9), способ липофекции, и способ микроинъекции.
Для того чтобы секретировать экспрессируемые в клетке-хозяине полипептиды в полость эндоплазматического ретикулума, периплазматическое пространство или внеклеточную среду, соответствующие секреторные сигналы могут быть встроены в представляющие интерес полипептиды. Эти сигналы могут быть собственными или чужеродными для целевых полипептидов.
Экспрессирующие векторы для первого, второго, третьего, и четвертого полипептидов могут конструироваться путем вставки ДНК, кодирующих полипептиды индивидуально, в отдельные векторы. Альтернативно, некоторые из ДНК, кодирующих первый, второй, третий, и четвертый полипептиды (например, ДНК, кодирующая первый полипептид и ДНК, кодирующая второй полипептид) могут вставляться в единственный вектор для конструирования экспрессирующих векторов. Если экспрессирующий вектор конструируется вставкой множественных ДНК в единственный вектор, то нет никакого ограничения для комбинации кодирующих полипептид ДНК, которые будут вставлены.
Выделение продуктов экспрессии
Когда полипептиды секретируют в культуральную среду, то продукты экспрессии выделяют посредством сбора среды. Когда полипептиды получают в клетках, то клетки сначала лизируют и затем собирают полипептиды.
Полипептиды могут быть собраны и очищены из культуры рекомбинантных клеток известными способами, включая преципитацию сульфатом аммония или этанолом, экстрагирование кислотой, анионную или катионообменную хроматографию, хроматографию на фосфоцеллюлозе, хроматографию с гидрофобным взаимодействием, аффинную хроматографию, хроматографию с гидроксиапатитом и хроматографию пектина.
Предпочтительно в настоящем изобретении используют аффинную хроматографию с белком А.
Колонки с белком А включают, но не ограничиваются. Hyper D (PALL), POROS (Applied Biosystems), Sepharose F.F. (GE), и ProSep (Millipore). Альтернативно, аффинная хроматография с белком А может осуществляться с использованием полимерной связки лигандом, который имитирует IgG-связывающую способность белка А. К тому же если используется такой имитатор белка А, то целевые полипептидные мультимеры могут выделяться и очищаться путем создания различия в связывающей способности в результате аминокислотных модификаций настоящего изобретения. Такие имитаторы белка А включают, но не ограничиваются, например, mabSelect SuRE (GE Healthcare).
Кроме того, настоящее изобретение предоставляет полипептидные мультимеры, полученные способами изготовления или очистки согласно настоящему изобретению.
Настоящее изобретение также предоставляет полипептидные мультимеры, включающие первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, где способность связывать белок А отличается между первым и вторым полипептидами.
Такие полипептидные мультимеры могут быть получены способами, описанными в данной заявке. Структуры и свойства полипептидных мультимеров описаны выше, и подытожены ниже.
По сравнению с до модификации аминокислот, способность связывать белок А полипептидных мультимеров настоящего изобретения была изменена. Более конкретно, способность связывать белок А была изменена в любом из или обоих первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью. В полипептидном мультимере настоящего изобретения, способность связывать белок А первого полипептида, обладающего антигенсвязывающей активностью отличается от таковой второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью. Таким образом, рН растворителя для элюирования белка А отличается для первого полипептида и второго полипептида в аффинной хроматографии.
Кроме того, первый полипептид и/или второй полипептид могут образовывать мультимер с одним или двумя третьими полипептидами.
Таким образом, настоящее изобретение относится к полипептидным мультимерам, которые включают первый полипептид, обладающий антигенсвязывающей активностью, второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, и один или два третьих полипептида, обладающих антигенсвязывающей активностью, где способность связывать белок А отличается для первого и второго полипептидов. Такие полипептидные мультимеры также могут быть получены способами, описанными в данной заявке.
Полипептидные мультимеры дополнительно могут включать четвертый полипептид. Любой из первого полипептида и второго полипептида может образовывать мультимер с третьим полипептидом, тогда как другой может образовывать еще один мультимер с четвертым полипептидом.
Таким образом, настоящее изобретение относится к полипептидным мультимерам, которые включают первый полипептид, обладающий антигенсвязывающей активностью, второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, третий полипептид, обладающий антигенсвязывающей активностью, и четвертый полипептид, обладающий антигенсвязывающей активностью, где способность связывать белок А отличается для первого и второго полипептидов. Такие полипептидные мультимеры также могут быть получены способами, описанными здесь.
Упомянутый выше первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью, может включать аминокислотную последовательность константной области тяжелой цепи антитела или аминокислотную последовательность Fc домена антитела. Аминокислотная последовательность константной области тяжелой цепи антитела или Fc-домен антитела включает, но не ограничивается, аминокислотную последовательность константной области, производной от человеческого IgG.
При этом упомянутый выше третий полипептид, обладающий антигенсвязывающей активностью и четвертый полипептид, обладающий антигенсвязывающей активностью могут включать аминокислотную последовательность константной области легкой цепи антитела.
Кроме того, полипептиды, обладающие антигенсвязывающей активностью, могут включать аминокислотную последовательность вариабельной области антитела (например, аминокислотные последовательности CDR1, CDR2, CDR3, FR1, FR2, FR3, и FR4).
Указанный выше первый полипептид, обладающий антигенсвязывающей активностью и второй полипептид, обладающий антигенсвязывающей активностью или не обладающий антигенсвязывающей активностью могут включать аминокислотную последовательность тяжелой цепи антитела, или аминокислотную последовательность, включающую вариабельную область легкой цепи антитела и константную область тяжелой цепи антитела. Упомянутый выше третий полипептид, обладающий антигенсвязывающей активностью и четвертый полипептид, обладающий антигенсвязывающей активностью могут включать аминокислотную последовательность легкой цепи антитела, или аминокислотную последовательность, включающую вариабельную область тяжелой цепи антитела и константную область легкой цепи антитела.
Полипептидный мультимер настоящего изобретения может быть полиспецифическим антителом. Полиспецифические антитела настоящего изобретения включают, но не ограничиваются, биспецифические антитела способные к особому связыванию двух типов антигенов.
В полипептидном мультимере настоящего изобретения, один или более аминокислотных остатков были модифицированы, так что существует (большее) различие способности связывать белок А между первым полипептидом, обладающим антигенсвязывающей активностью и вторым полипептидом, обладающим антигенсвязывающей активностью или не обладающим антигенсвязывающей активностью. Как описано выше, сайты модификации включают, но не ограничиваются, например, следующие аминокислотные остатки: TLMISR в положениях 250-255, VLHQDWLNGK в положениях 308-317, EALHNHY в положениях 430-436, предпочтительно TLMIS в положениях 250-254, LHQD в положениях 309-312, LN в положениях 314-315, Е в положении 430, LHNHY в положениях 432-436, более предпочтительно LMIS в положениях 251-254, LHQ в положениях 309-311, L в положении 314, LHNH в положениях 432-435, и в особенности LMIS в положениях 252-254, L в положении 309, Q в положении 311, и NHY в положениях 434-436 (EU нумерация) в Fc домене антитела или константной области тяжелой цепи. При этом, что касается аминокислотных модификаций вариабельной области тяжелой цепи антитела, то предпочтительные сайты модификации включают FR1, CDR2, и FR3.
Более конкретно, полипептидные мультимеры настоящего изобретения включают, но не ограничиваются, полипептидные мультимеры, в которых аминокислотный остаток в положении 435 (EU нумерация) в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела представляет собой гистидин или аргинин в любом из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, в то время как другой полипептид имеет другой аминокислотный остаток в положении 435 (EU нумерация) в аминокислотной последовательности Fc домена антитела или константной области тяжелой цепи антитела.
Кроме того, полипептидные мультимеры настоящего изобретения включают, но не ограничиваются, полипептидные мультимеры, в которых аминокислотный остаток в положении 435 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела представляет собой гистидин в любом из первого полипептида, обладающего антигенсвязывающей активностью и второго полипептида, обладающего антигенсвязывающей активностью или не обладающего антигенсвязывающей активностью, в то время как аминокислотный остаток в положении 435 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела представляет собой аргинин в другом полипептиде.
Кроме того, полипептидные мультимеры настоящего изобретения, включающие первый и второй полипептиды, включают, но не ограничиваются, примеры ниже.
(1) Полипептидные мультимеры, которые включают первый или второй полипептид, включающий аминокислотную последовательность, в которой аминокислотные остатки в положениях 435 и 436 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела, производные от человеческого IgG были модифицированы в гистидин (His) и тирозин (Туr), соответственно.
Такие полипептидные мультимеры включают, но не ограничиваются, например, полипептидные мультимеры, которые включают первый или второй полипептид, включающий аминокислотную последовательность SEQ ID NO:9, 11, 13, или 15.
(2) Полипептидные мультимеры, которые содержат первый или второй полипептид, включающий аминокислотную последовательность, в которой аминокислотные остатки в положениях 435 и 436 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела, производные от человеческого IgG были модифицированы в аргинин (Arg) и фенилаланин (Phe), соответственно.
Такие полипептидные мультимеры включают, но не ограничиваются, например, полипептидные мультимеры, которые включают первый или второй полипептид, включающий аминокислотную последовательность of SEQ ID NO:10 или 12.
(3) Полипептидные мультимеры, которые содержат первый или второй полипептид, включающий аминокислотную последовательность, в которой аминокислотные остатки в положениях 435 и 436 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела, производные от человеческого IgG, были модифицированы в аргинин (Arg) и тирозин (Туr), соответственно.
Такие полипептидные мультимеры включают, но не ограничиваются, например, полипептидные мультимеры, которые включают первый или второй полипептид, включающий аминокислотную последовательность SEQ ID NO:14.
(4) Полипептидные мультимеры, которые содержат первый и второй полипептиды, где любой из полипептидов включает аминокислотную последовательность, в которой аминокислотные остатки в положениях 435 и 436 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела, производные от человеческого IgG, были модифицированы в гистидин (His) и тирозин (Туr), соответственно; и другой полипептид включает аминокислотную последовательность, в которой аминокислотные остатки в положениях 435 и 436 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела были модифицированы в аргинин (Arg) и фенилаланин (Phe), соответственно.
Такие полипептидные мультимеры включают, но не ограничиваются, например, полипептидные мультимеры, которые включают первый полипептид, включающий аминокислотную последовательность SEQ ID NO:9, 11, 13, или 15 и второй полипептид, включающий аминокислотную последовательность SEQ IDNO:10 или 12.
(5) Полипептидные мультимеры, которые содержат первый и второй полипептиды, где любой из полипептидов включает аминокислотную последовательность, в которой аминокислотные остатки в положениях 435 и 436 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела, производные от человеческого IgG, были модифицированы в гистидин (His) и тирозин (Туr), соответственно; и другой полипептид включает аминокислотную последовательность, в которой аминокислотные остатки в положениях 435 и 436 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела были модифицированы в аргинин (Arg) и тирозин (Туr), соответственно.
Такие полипептидные мультимеры включают, но не ограничиваются, например, полипептидные мультимеры, которые включают первый полипептид, включающий аминокислотную последовательность SEQ ID NO:9, 11, 13, или 15 и второй полипептид, включающий аминокислотную последовательность SEQ ID NO:14.
(6) Полипептидные мультимеры, которые содержат первый и второй полипептиды, где любой из полипептидов включает аминокислотную последовательность, в которой аминокислотные остатки в положениях 435 и 436 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела, производные от человеческого IgG были модифицированы в аргинин (Arg) и фенилаланин (Phe), соответственно; и другой полипептид включает аминокислотную последовательность, в которой аминокислотные остатки в положениях 435 и 436 (EU нумерация) в аминокислотной последовательности константной области тяжелой цепи антитела были модифицированы в аргинин (Arg) и тирозин (Туr), соответственно.
Такие полипептидные мультимеры включают, но не ограничиваются, например, полипептидные мультимеры, которые включают первый полипептид, включающий аминокислотную последовательность SEQ ID NO:10 или 12 и второй полипептид, включающий аминокислотную последовательность SEQ ID NO:14.
Указанные выше первый и второй полипептиды дополнительно могут включать вариабельную область тяжелой цепи антитела. Полипептидные мультимеры от (1) до (6) упомянутые выше также могут включать третий полипептид и/или четвертый полипептид.
Кроме того, настоящее изобретение предоставляет полипептидные варианты, которые включают полипептид, содержащий мутацию в аминокислотном остатке в любом положении 435 или 436 (EU нумерация). Такие полипептидные варианты включают, но не ограничиваются, полипептидные варианты, содержащие полипептид, описанный в примерах.
Кроме того, настоящее изобретение предоставляет нуклеиновые кислоты, кодирующие полипептид (полипептид, обладающий антигенсвязывающей активностью), который составляет полипептидный мультимер согласно настоящему изобретению. Настоящее изобретение также предусматривает векторы, несущие такие нуклеиновые кислоты.
Настоящее изобретение также предусматривает клетки хозяина, содержащие указанные выше нуклеиновые кислоты или векторы. Нет никакого особого ограничения для клеток хозяина, и они включают, например, Е. coli и различные растительные и животные клетки. Клетки хозяина могут использоваться, например, в качестве системы продуцирования для получения и экспрессирования полипептидных мультимеров или полипептидов настоящего изобретения. Существуют системы продуцирования in vitro и in vivo для получения полипептидных мультимеров или полипептидов. Системы продуцирования in vitro включают системы, использующие эукариотические клетки и прокариотические клетки.
Эукариотические клетки, которые могут быть использованы как клетки хозяина, включают, например, животные клетки, растительные клетки, и грибковые клетки. Животные клетки включают: клетки млекопитающих, например, СНО (J. Exp. Med. (1995) 108, 945), COS, HEK293, 3Т3, миелома, ВНК (почка новорожденного хомяка), HeLa, и Vero; клетки амфибий, такие как ооциты Xenopus laevis (Valle, et al., Nature (1981) 291: 338-340); и клетки насекомых, такие как Sf9, Sf21, и Tn5. Для экспрессирования полипептидных мультимеров или полипептидов настоящего изобретения пригодным образом могут использоваться CHO-DG44, CHO-DX11B, COS7 клетки, HEK293 клетки, и ВНК клетки. Из животных клеток, клетки СНО в особенности предпочтительны для крупномасштабной экспрессии. Векторы могут вводиться в клетку хозяина, например, с помощью способов с использованием фосфата кальция, способов с использованием диэтиламиноэтилдекстрана, способов с применением катионоактивных липосом DOTAP (Boehringer-Mannheim), способов электропорации или липофекции.
Известно, что растительные клетки, такие как клетки, полученные от Nicotiana tabacum и клетки от Lemna minor, представляют собой системы продуцирования белка, и эти клетки могут использоваться для получения полипептидных мультимеров или полипептидов настоящего изобретения с помощью методов, которыми выращивают каллюсы из этих клеток. Системы экспрессии белков, которые используют грибковые клетки, включая дрожжевые клетки, например, клетки рода сахаромицетов (Saccharomyces cerevisiae, Saccharomyces pombe, и т.п.), и клетки мицелиальных грибов, например, рода аспергилл (Aspergillus niger и т.п.) являются известными, и эти клетки могут использоваться в качестве хозяина для получения полипептидных мультимеров или полипептидов согласно настоящему изобретению.
Если используют прокариотические клетки, то пригодными являются системы продуцирования, использующие бактериальные клетки. Описанные выше системы продуцирования, которые используют бактериальные клетки, включая Bacillus subtilis, а также Е. coli являются известными, и они могут использоваться для получения полипептидных мультимеров или полипептидов согласно настоящему изобретению.
Если полипептидный мультимер или полипептид получают с использованием клетки хозяина согласно настоящему изобретению, то полинуклеотид, кодирующий полипептидный мультимер или полипептид настоящего изобретения может быть экспрессированы с помощью культивирования клетки-хозяина, трансформированной экспрессирующим вектором, включающим полинуклеотид. Культивирование можно осуществлять в соответствии с известными способами. Например, если в качестве хозяина используются животные клетки, то в качестве культуральной среды могут использоваться DMEM, MEM, RPMI 1640, или IMDM. Культуральная среда может использоваться с растворами вспомогательной сыворотки, такими как FBS или фетальная телячья сыворотка (FCS). Альтернативно, клетки могут культивироваться в бессывороточных культурах. Предпочтительная величина рН составляет примерно от 6 до 8, в течение периода культивирования. Инкубация осуществляется обычно при приблизительно от 30 до 40°С в течение примерно от 15 до 200 часов. При необходимости среду меняют, аэрируют или взбалтывают.
С другой стороны, системы для продуцирования полипептидов in vivo включают, например, системы, использующие животных и системы, использующие растения. Целевой полинуклеотид вводят животному или в растение, чтобы получить полипептид в организме животного или растения, и затем полипептид собирают. Понятие "хозяин" согласно настоящему изобретению включает таких животных и растения.
Если используют животных, то пригодными являются системы продуцирования, которые используют млекопитающих или насекомых. Могут использоваться млекопитающие, такие как коза, свинья, овца, мышь и крупный рогатый скот (Vicki Glaser, SPECTRUM Biotechnology Applications (1993)). Когда используют млекопитающих, то могут быть использованы и трансгенные животные.
Например, полинуклеотид, кодирующий полипептидный мультимер или полипептид согласно настоящему изобретению может быть приготовлен в виде гена, слитого с геном, кодирующим полипептид, который определенным образом продуцируется в молоке, такой как β-казеин козы. Затем фрагменты полинуклеотида, содержащие этот слитой ген инъецируют в эмбрионы козы, которые затем вводят обратно в женские особи. Представляющее интерес антитело может быть получено из молока, которое дают трансгенные козы, которые были рождены от коз, получивших эмбрионы, или их потомством. Соответствующим образом трансгенным козам можно вводить гормоны для увеличения объема молока, содержащего антитело, получаемого от трансгенных коз (Ebert et al., Bio/Technology (1994) 12: 699-702).
Для получения полипептидных мультимеров или полипептидов согласно настоящему изобретению могут использоваться насекомые, такие как тутовый шелкопряд. Когда используют тутовый шелкопряд, то бакуловирусы, несущие полинуклеотид, кодирующий представляющий интерес полипептидный мультимер или полипептид, могут использоваться для заражения тутового шелкопряда, так что представляющий интерес полипептидный мультимер или полипептид может быть получен из биологических жидкостей этого тутового шелкопряда (Susumu et al., Nature (1985) 315:592-594).
Растения, используемые для продуцирования полипептидных мультимеров или полипептидов согласно настоящему изобретению включают, например, табак. Если используют табак, то полинуклеотид, кодирующий целевой полипептидный мультимер или полипептид встраивают в экспрессирующий вектор растения, например, pMON 530, и затем вектор вводят в бактерию, такую как Agrobacterium tumefaciens. Затем используют эту бактерию для того, чтобы заразить табак, такой как Nicotiana tabacum, и искомый полипептидный мультимер или полипептид может быть получен из листьев табака (Ма et al., Eur. J. Immunol. (1994) 24: 131-138). Альтернативно, та же самая бактерия может использоваться для заражения Lemna minor, и после клонирования, искомый полипептидный мультимер или полипептид могут быть получены из клеток Lemna minor (Сох К.М. et al., Nat. Biotechnol. 2006 Dec; 24(12): 1591-1597).
Полипептидный мультимер или полипептид, полученный таким образом может быть выделен из внутреннего или внешнего содержимого (такого как среда и молоко) клеток хозяина, и очищен как по сути чистый и гомогенный полипептидный мультимер или полипептид. Способы, используемые для выделения и очистки полипептидного мультимера или полипептида не ограничиваются, и могут применяться способы, используемые при стандартной очистке полипептида. Антитела могут быть выделены и очищены с помощью выбора соответствующей комбинации, например, хроматографических колонок, фильтрации, ультрафильтрации, высаливания, преципитации растворителем, экстракции растворителем, дистилляции, иммунопреципитации, электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, изоэлектрического фокусирования, диализа, рекристаллизация и т.п.
Хроматографические методы включают, например, аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, хроматографию с обращенной фазой и адсорбционную хроматографию (Strategies for Protein Purification и Characterization: A Laboratory Course Manual. Ed Daniel R. Marshak et al., (1996) Cold Spring Harbor Laboratory Press). Хроматографию можно осуществлять с использованием жидкофазной хроматографии, такой как ВЭЖХ и жидкостная экспресс-хроматография белков (FPLC). Примеры колонок для аффинной хроматографии включают колонки с белком А и колонки с белком G. Примеры колонок, которые используют белок А, включают, но не ограничиваются. Hyper D, POROS, и Sepharose F.F. (Pharmacia).
При необходимости, могут быть добавлены модификации и пептиды могут удаляться произвольно из полипептидного мультимера или полипептида посредством обработки соответствующим ферментом модификации белка до или после очистки полипептидного мультимера или полипептида. Такие ферменты модификации белка включают, например, трипсин, химотрипсин, лизил-эндопептидазу, протеинкиназу и глюкозидазу.
Другая предпочтительная форма осуществления настоящего изобретения включает способ получения полипептидного мультимера или полипептида согласно настоящему изобретению, который охватывает стадии культивирования клеток хозяина согласно настоящему изобретению, как описано выше и сбора полипептида из клеточной культуры.
Кроме того, настоящее изобретение относится к фармацевтическим композициям (средствам), содержащим полипептидный мультимер или полипептид согласно настоящему изобретению и фармацевтически приемлемые носители. В настоящем изобретении понятие "фармацевтические композиции", как правило, относится к средствам для лечения или предотвращения, или исследования и диагностирования заболеваний.
Фармацевтические композиции согласно настоящему изобретению могут быть приготовлены способами, известными специалисту в данной области техники. Например, подобные фармацевтические композиции могут применяться парентерально в виде инъекций, которые представляют собой стерилизованные растворы или суспензии, приготовленные с водой или другой фармацевтически приемлемой жидкостью. Например, такие композиции могут быть приготовлены посредством соответствующего соединения с фармацевтически приемлемым носителем или средой, в особенности, стерилизованной водой, физиологическим раствором, растительным маслом, эмульгатором, суспензией, поверхностно-активным веществом, стабилизатором, ароматизирующим веществом, наполнителем, лекарственной основой, консервантом, связующим веществом или т.п., и путем смешивания в виде единичной дозы согласно общепринятым требованиям для приготовления фармацевтических препаратов. В таких препаратах количество активного ингредиента устанавливается таким образом, что достигается надлежащее количество в указанном диапазоне.
Стерильные композиции для инъекций могут быть приготовлены с использованием лекарственных основ, таких как дистиллированная вода для инъекций, в соответствии со стандартными протоколами для композиции.
Водные растворы для инъекции включают, например, физиологический солевой раствор и изотонические растворы, содержащие глюкозу или другие адъюванты (например, D-сорбитол, D-манноза, D-маннитол и хлорид натрия). Можно использовать в комбинации соответствующие солюбилизаторы, например, спирты (этанол и т.п.), полиспирты (пропиленгликоль, полиэтиленгликоль и т.п.), неионогенные ПАВ (полисорбат 80™, НСО-50, и т.п.).
Масла включают кунжутное и соевое масло. В качестве солюбилизаторов в комбинации можно использовать бензилбензоат и/или бензиловый спирт. Также возможно комбинировать буферы (например, фосфатный буфер и буфер ацетата натрия), успокаивающие средства (например, прокаина гидрохлорид), стабилизаторы (например, бензиловый спирт и фенол), и/или антиоксиданты. Как правило, приготовленными инъекционными растворами наполняют соответствующие ампулы.
Фармацевтические композиции согласно настоящему изобретению предпочтительно вводят парентерально. Например, композиции могут находиться в виде инъекций, трансназальных средств, транспульмональных средств или чрескожных средств. Например, такие композиции могут вводиться системно или местно с помощью внутривенного впрыскивания, внутримышечного впрыскивания, внутрибрюшинного впрыскивания, подкожного впрыскивания или т.п.
Способы введения могут выбираться соответствующим образом, принимая во внимание возраст пациента и симптомы. Дозировка фармацевтической композиции, содержащей полипептидный мультимер или полипептид, или полинуклеотид, кодирующий полипептидный мультимер или полипептид, может представлять собой набор, например, в пределах от 0.0001 до 1000 мг/кг массы тела для каждого приема. Альтернативно, дозировка может составлять, например, от 0.001 до 100,000 мг на пациента. Тем не менее, в настоящем изобретении, дозировка не ограничивается в обязательном порядке пределами, описанными выше. Несмотря на то, что дозировка и способ введения варьируются в зависимости от массы тела пациента, возраста, симптомов и т.п., специалист в данной области техники может выбирать соответствующую дозировку и способы введения, принимая во внимание эти факторы.
Полиспецифические антитела согласно настоящему изобретению при необходимости могут быть составлены посредством их соединения с другими фармацевтическими компонентами.
Все литературные источники, касающиеся известного уровня техники, процитированные в данной заявке, включены в ее описание путем ссылки.
Примеры
Ниже настоящее изобретение описывается более подробно со ссылкой на примеры, но не должно истолковываться как ограничиваемое ними.
[Пример 1] Конструирование экспрессирующих векторов для генов антитела и экспрессия соответствующих антител
Были использованы вариабельные области Н-цепи антитела:
Q153 (вариабельная область Н-цепи античеловеческого F.IX антитела, SEQ ID NO:1), Q407 (вариабельная область Н-цепи античеловеческого F.IX антитела, SEQ ID NO:2), J142 (вариабельная область Н-цепи античеловеческого F.X антитела, SEQ ID NO:3), J300 (вариабельная область Н-цепи античеловеческого F.X антитела, SEQ ID NO:4), и MRA-VH (вариабельная область Н-цепи античеловеческого антитела к рецептору интерлейкин-6, SEQ ID NO:5).
Были использованы вариабельные области L-цепи антитела:
L180-k (L-цепь, общая для античеловеческого F.IX антитела и античеловеческого F.X антитела, SEQ ID NO:6), L210-k (L-цепь, общая для античеловеческого F.IX антитела/античеловеческого F.X антитела, SEQ ID NO:7), и MRA-k (L-цепь античеловеческого антитела к рецептору интерлейкин-6, SEQ ID NO:8).
Были использованы константные области Н-цепи антитела:
G4d (SEQ ID NO:9), который был конструирован из IgG4 посредством введения мутации замещения Pro на Ser в положении 228 (EU нумерация) и удаления С-концевого Gly и Lys; z72 (SEQ ID NO:10), который был конструирован из G4d посредством введения следующих мутаций: мутация замещения Arg на His в положении 435 (EU нумерация); мутация замещения Phe на Tyr в положении 436 (EU нумерация); и мутация замещения Pro на Leu в положении 445 (EU нумерация); z7 (SEQ ID NO:11), который был конструирован из G4d посредством введения мутации замещения Lys на Glu в положении 356 (EU нумерация); z73 (SEQ ID NO:12), который был конструирован из z72 посредством введения мутации замещения Glu на Lys в положении 439 (EU нумерация); z106 (SEQ ID NO:13), который был конструирован из z7 посредством введения следующих мутаций: мутация замещения Gln на Lys в положении 196 (EU нумерация); мутация замещения Tyr на Phe в положении 296 (EU нумерация); и мутация замещения Lys на Arg в положении 409 (EU нумерация); z107 (SEQ ID NO:14), который был конструирован из z73 посредством введения следующих мутаций: мутация замещения Gln на Lys в положении 196 (EU нумерация); мутация замещения Tyr на Phe в положении 296 (EU нумерация); мутация замещения Lys на Arg в положении 409 (EU нумерация); и мутация замещения Туr на Phe в положении 436 (EU нумерация); и G1d (SEQ ID NO:15), который был конструирован посредством удаления С-концевого Gly и Lys из IgG1. Мутации замещения Lys на Glu в положении 356 (EU нумерация) и Glu на Lys в положении 439 (EU нумерация) были введены для эффективного образования гетеромерных молекул из соответствующих Н-цепей при продуцировании гетеромерных антител ((WO 2006/106905) PROCESS FOR PRODUCTION OF POLYPEPTIDE BY REGULATION OF ASSEMBLY).
Гены Q153-G4d и Q153-z7 Н-цепи античеловеческого F.IX антитела конструировали посредством зацепления соответственно G4d и z7 ниже от Q153. Ген Н-цепи античеловеческого F.IX Q407-z106 антитела конструировали посредством зацепления z106 ниже от Q407. Гены J142-G4d, J142-z72, и J142-z73 Н-цепи античеловеческого F.X антитела конструировали посредством зацепления соответственно G4d, z72, и z73 ниже от J142. Ген J300-z107 Н-цепи античеловеческого F.X антитела конструировали посредством зацепления z107 ниже от J300. Гены MRA-G1d, MRA-z106, и MRA-z107 Н-цепи античеловеческого антитела к рецептору интерлейкин-6 конструировали посредством зацепления соответственно G1d, z106, и z107 ниже от MRA-VH.
Соответствующие гены антитела (Q153-G4d, Q153-z7, Q407-z106, J142-G4d, J142-z72, J142-z73, J300-z106, MRA-G1d, MRA-z106, MRA-z107, L180-k, L210-k, и MRA-k) вставляли в экспрессирующие векторы животных клеток.
Следующие антитела кратковременно были экспрессированы в FreeStyle293 клетки (Invitrogen) трансфекцией с использованием конструированных экспрессирующих векторов. Как показано ниже, антитела назвали, используя комбинации трансфицированных генов антитела.
MRA-G1d/MRA-k
MRA-z106/MRA-z107/MRA-k
Q153-G4d/J142-G4d/L180-k
Q153-G4d/J142-z72/L180-k
Q153-z7/J142-z73/L180-k
Q407-z106/J300-z107/L210-k
[Пример 2] Оценка условий элюирования для аффинной хроматографии с белком А
Q153-G4d/J142-G4d/L180-k и Q153-G4d/J142-z72/L180-k экспрессировали кратковременно, и среду полученной FreeStyle293 клеточной культуры (в дальнейшем сокращается как КС) использовали как образец для оценки условий элюирования для аффинной хроматографии с белком А. Образцы КС фильтровали через фильтр с размером пор в 0.22 мкм, и загружали в колонку rProtein A Sepharose Fast Flow (GE Healthcare), уравновешенную с D-PBS. Колонку подвергали промыванию 1 и 2 и элюированию от 1 до 5 поэтапно, как показано в таблице 1. Объем КС, который загружали в колонку, доводили до 20 мг антитело/мл смолы. Фракции, элюированные при каждом условии, собирали, и соответствующие элюированные фракции анализировали с помощью катионообменной хроматографии, чтобы определить их компоненты. Для приготовления контрольных вариантов каждую КС загружали в смолу rProtein G Sepharose Fast Flow (GE Healthcare). Образцы, очищенные элюированием по партиям использовали в качестве контрольных вариантов. Так как белок G связывает Fab домен антитела, то все виды антитела (представляющее интерес биспецифическое антитело, в котором два типа Н-цепей ассоциированы гетеромерным способом (гетеромерное антитело) и как примесь моноспецифических гомомерных антител, в которых однотипные Н-цепи ассоциированы гомомерно) в КС могут быть очищены с использованием белка G, независимо от их сродства связывать белок А.
КС, в которой был экспрессирован Q153-G4d/J142-G4d/L180-k или Q153-G4d/J142-z72/L180-k, элюировали из колонки с белком А (элюирование от 1 до 5), и соответствующие элюированные фракции анализировали с помощью катионообменной хроматографии. Что касается Q153-G4d/J142-G4d/L180-k, то анализ показал, что поскольку условие элюирования было изменено от 1 до 5, т.е., поскольку pH буфера элюирования снижался, то композиция антитела элюированных фракций изменялась постепенно в порядке от гомомерного антитела J142-G4d/L180-k к гетеромерному антителу.
Q153-G4d/J142-G4d/L180-k, и затем до гомомерного антитела Q153-G4d/L180-k. Порядок элюирования понимают в соответствии со связывающей способностью для белка А. Это подразумевает, что гомомерное антитело Q153-G4d/L180-k, которое осталось связанным до воздействия с низким pH, обладает большей связывающей способностью для белка А, чем гомомерные виды J142-G4d/L180-k (гомомерное антитело к FX), элюированные при высоком pH. Известно, что вариабельная область J142 представляет собой последовательность, неспособную связывать белок А. В особенности, гомомерные виды J142-G4d/L180-k (гомомерное антитело к FX) имеет два сайта, связывающих белок А; гетеромерное антитело Q153-G4d/J142-G4d/L180-k имеет три; и гомомерное антитело Q153-G4d/L180-k (гомомерное антитело к FX) имеет четыре сайта, связывающих белок А. Таким образом, было обнаружено, что больше сайтов, связывающих белок А, получалось в усиленном связывании белка А, и поэтому для элюирования требовался более низкий pH.
При этом, что касается Q153-G4d/J142-z72/L180-k было обнаружено, что так как условие элюирования было изменено с 1 по 5, то композиция антитела в элюированной фракции изменилась от гетеромерного антитела Q153-G4d/J142-z72/L180-k до гомомерного антитела Q153-G4d/L180-k. Гомомерное антитело J142-z72/L180-k (гомомерное антитело к FX) было почти необнаруживаемым в любых элюированных фракциях. Это означает, что J142-z72/L180-k не обладает способностью связывать белок А. Считается, что отсутствие способности связывать белок А для J142-z72 могло произойти из-за введенной мутации замещения Arg на His в положении 435 (EU нумерация). Гомомерное антитело J142-z72/L180-k (гомомерное антитело к FX) не имеет сайта, связывающего белок А, наряду с тем, что гетеромерное антитело QL53-G4d/J142-z72/L180-k имеет два сайта, связующих белок А, и гомомерное антитело Q153-G4d/L180-k (гомомерное антитело к FIX) имеет четыре. Гомомерное антитело J142-z72/L180-k (гомомерное антитело к FX) проходит через колонку, потому что оно не связывает с белком А. Это является причиной того, почему J142-z72/L180-k не обнаруживался в любых элюированных фракциях. Кроме того, в обоих случаях для Q153-G4d/J142-G4d/L180-k и Q153-G4d/J142-z72/L180-k. было предположено, что гетеромерное антитело и гомомерное антитело Q153-G4d/L180-k (гомомерное антитело к FIX) разделялись друг от друга при рН 3.6 или более низком рН.
[Пример 3] Выделение и очистка гетеромерных антител с помощью хроматографии с белком А
Использовали образцы КС, содержащей следующие антитела:
Q153-G4d/J142-G4d/L180-k
Q153-G4d/J142-z72/L180-k
Q153-z7/J142-z73/L180-k
Q407-z106/J300-z107/L210-k
Образцы КС фильтровали через фильтр с размером пор в 0.22 мкм, и загружали в колонку rProtein A Sepharose Fast Flow (GE Healthcare), уравновешенную с D-PBS. Колонку подвергали промываниям 1 и 2 и элюированиям 1 и 2, как показано в таблице 2 (за исключением того, что Q407-z106/J300-z107/L210-k подвергали только элюированию 1). Условия элюирование устанавливали на основе результата, описанного в примере 2. Объем КС, который загружали в колонку, доводили до 20 мг антитело/мл смолы. Соответствующие фракции, элюированные при каждом условии, собирали и анализировали с помощью катионообменной хроматографии, чтобы идентифицировать их компоненты. Чтобы приготовить контрольные варианты, каждую КС загружали в смолу rProtein G Sepharose Fast Flow (GE Healthcare) таким же самым образом, как описано в примере 2. Образцы, очищенные элюированием по партиям, использовали в качестве контрольных вариантов.
Результат анализа катионообменной хроматографии для каждой элюированной фракции показан в таблице 3 ниже. Значения представляют площадь пика элюирования, выраженного в процентах. За исключением 0153-G4d/J142-G4d/L180-k антитела, гомомерные антитела к FX были почти необнаруживаемыми в любой элюированной фракции. Таким образом, было обнаружено, что не только гомомерное антитело J142-z72 (гомомерное антитело к FX), описанное в примере 2, но и также гомомерные антитела J142-z73 и J300-z107 (гомомерное антитело к FX) были неспособными связываться с белком А. Считается, что отсутствие способности связывать белок А в гомомерном антителе к FX происходило из-за мутации замещения Arg на His в положении 435 (EU нумерация), которую вводили в константную область Н-цепи антитела к FX. Гетеромерное антитело, которое представляет собой целевое биспецифическое антитело, было обнаружено главным образом во фракции элюирования 1. При этом большая часть гомомерных антител к FIX были элюированы элюированием 2, несмотря на то, что они также были обнаружены при очень низком уровне во фракции элюирования 1. По сравнению с Q153-G4d/J142-z72/L180-k, в случаях с Q153-z7/J142-z73/L180-k и Q407-z106/J300-z107/L210-k, пропорция гетеромерного антитела (представляющее интерес биспецифическое антитело) была значительно увеличена во фракции, элюированной при pH 3.6. Таким образом, было показано, что если мутации замещения Lys на Glu в положении 356 (EU нумерация) и Glu на Lys в положении 439 (EU нумерация) для эффективного образования гетеромерных молекул из соответствующих Н-цепей были введены в комбинации с мутацией замещения Arg на His в положении 435 (EU нумерация), то гетеромерное антитело (представляющее интерес биспецифическое антитело) могло быть очищено с чистотой в 98% или выше вследствие только стадии очистки на основе белка А.
Как описано выше, изобретатели настоящего изобретения обнаружили, что основывающееся на различиях в количестве сайтов связывания с белком А между гетеромерным антителом и гомомерными антителами, гетеромерное антитело могло быть выделено и очищено с высокой чистотой вследствие только стадии хроматографии с белком А.
[Пример 4] Оценка фармакокинетики у трансгенных мышей с cRn человека
Как описано в пример 3 выше, изобретатели настоящего изобретения продемонстрировали, что с помощью использования z106 (SEQ ID NO:13) и z107 (SEQ ID NO:14) для соответствующих константных областей Н-цепи биспецифического антитела, гетеромерное антитело (представляющее интерес биспецифическое антитело) могло быть очищено с чистотой в 98% или выше вследствие только стадии с белком А. При этом, утрата сродства связывать белок А вероятно вызвана утратой активности связывать человеческий FcRn, потому что белок А и человеческий FcRn распознают тот же самый сайт в антителе IgG (J Immunol. 2000, 164(10):5313-8). На самом деле, существует описанный способ очистки биспецифического антитела с чистотой в 95% с использованием белка А. Способ использует Н-цепь IgG2b крысы, которая не связывает белок А. Катумаксомаб (биспецифическое антитело), очищенный этим способом имеет время полужизни в приблизительно 2.1 дней у человека. Его время полужизни является значительно короче, чем время полужизни нормального человеческого IgG1, который составляет от 2 до 3 недель (непатентный документ 2). В этом контексте антитела, которые имеют z106 (SEQ ID NO:13) и z107 (SEQ ID NO:14), описанные в примере 3 в качестве константных областей были оценены для их фармакокинетики.
В фармакокинетическом эксперименте для вычисления времени полужизни у человека, фармакокинетика у трансгенных мышей с FcRn человека (B6.mFcRn-/-.hFcRn Tg линия 276 +/+ мыши, Jackson Laboratories) была оценена с помощью следующей методики. MRA-G1d/MRA-k (в дальнейшем сокращается как MRA-IgG1), имеющий константную область IgG1 и MRA-z106/MRA-z107/MRA-k (в дальнейшем сокращается как MRA-z106/z107), который имеет z106/z107 в качестве константной области, каждый был введен мышам внутривенно однократно в дозе 1 мг/кг, и кровь собирали в соответствующие моменты времени. Собранную кровь непосредственно центрифугировали при 15,000 об./мин. и 4°С в течение 15 минут, чтобы получить плазму крови. Отделенную плазму хранили в морозильной камере при -20°С или ниже до использования. Концентрацию плазмы определяли с помощью ELISA.
MRA-IgG1 и MRA-z106/z107k были оценены для их удержание плазмы у трансгенных мышей с FcRn человека. Как показано на фиг.1, результат показывает, что удержание MRA-z106/z107 в плазме было сопоставимым с или дольше, чем удержание MRA-IgG1. Как описано выше, z106/z107, константная область, которая обеспечивает эффективное получение или очистку гетеромерного антитела с высокой чистотой с помощью только стадии очистки на основе белка А, была продемонстрирована, чтобы быть сопоставимой или более высокой с IgG1 человека с точки зрения удержания плазмы.
[Пример 5] Конструирование экспрессирующих векторов для генов антитела и экспрессия соответствующих антител
Были использованы вариабельные области Н-цепи антитела:
Q499 (вариабельная область Н-цепи античеловеческого F.IX антитела, SEQ ID NO:16).
J339 (вариабельная область Н-цепи античеловеческого F.X антитела, SEQ ID NO:17).
Была использована L-цепь антитела:
L377-k (L-цепь, общая для античеловеческого F.IX антитела и античеловеческого F.X антитела, SEQ ID NO:18).
Были использованы константные области Н-цепи антитела:
z118 (SEQ ID NO:19), которая была конструирована из z106, описанной в примере 1, посредством введения мутации замещения Phe на Leu в положении 405 (EU нумерация);
z121 (SEQ ID NO:20), которая была конструирована из z118 посредством введения мутации замещения Arg на His в положении 435 (EU нумерация); и
z119 (SEQ ID NO:21), которая была конструирована из z118 посредством введения мутаций замещения Glu на Lys в положении 356 (EU нумерация) и Lys на Glu в положении 439 (EU нумерация).
Гены Q499-z118 и Q499-z121 Н-цепи античеловеческого F.IX антитела конструировали посредством зацепления соответственно z118 и z121 ниже от Q499. Ген J339-z119 Н-цепи античеловеческого F. Х антитела был конструирован посредством зацепления z119 ниже от J339.
Каждый из генов антитела (Q499-z118, Q499-z121, J339-z119, и L377-k) был вставлен в экспрессирующий вектор животной клетки.
Следующие антитела были экспрессированы кратковременно в FreeStyle293 клетках (Invitrogen) посредством трансфекции с использованием сконструированных экспрессирующих векторов. Как показано ниже, антитела были названы с использованием комбинаций трансфицированных генов антитела.
Q499-z118/J339-z119/L377-k
Q499-z121/J339-z119/L377-k
Указанные выше два антитела отличаются только в аминокислоте положения 435 в EU системе нумерации в Н-цепи античеловеческого F.IX антитела, z118 имеет His в положении 435 и он обладает сродством связывать белок А. При этом z121 имеет Arg в положении 435, и предположительно он не обладает активностью связывать белок А на основе открытия, описанного в примере 2. Q499 предположительно связывается с белком А на основе его последовательности. Таким образом, что касается Q499-z118/J339-z119/L377-k, то гомомерный вид J339-z119/L377-k (гомомерное антитело к FX) имеет два сайта, связывающих белок А; гетеромерное антитело Q499-z118/J339-z119/L377-k имеет три; и гомомерное антитело Q499-z118/L377-k (гомомерное антитело к FIX) имеет четыре сайта, связывающих белок А. При этом, что касается Q499-z121/J339-z119/L377-k, введенного с модификацией, что приводит к потере сродства связывать белок А, гомомерный вид J339-z119/L377-k имеет два сайта, связывающих белок А; гетеромерное антитело Q499-z121/J339-z119/L377-k имеет два; и гомомерное антитело Q499-z121/L377-k имеет два. В особенности, даже если модификация, которая приводит к потере сродства связывать белок А (например, модификация, которая замещает Arg на аминокислоту в положении 435, EU нумерация), была введена только в Н-цепь, которая связывается с белком А через ее вариабельную область, это бы не создало эффекта, который обеспечивает эффективное выделение/очистку гетеромерного антитела с высокой чистотой с помощью только стадии очистки с белком А. Тем не менее, модификация, которая приводит к потере способности связывать белок А, может создавать эффект, если используют MabSelect SuRe (GE Healthcare). MabSelect SuRe представляет собой модифицированный белок А, неспособный связываться с Q499 и хроматографический носитель, используемый в очистке антител. Носитель был разработан, чтобы соответствовать производственным требованиям. Лиганд представляет собой рекомбинантный белок А, который был модифицирован с помощью генной инженерии, чтобы быть устойчивым к щелочным условиям. Большая стабильность рН обеспечивает эффективное и малозатратное промывание NaOH.
Кроме того, носитель отличается тем, что он не связывается с вариабельной областью тяжелой цепи VH3 подкласса, как например, Q499. Принимая во внимание Q499-z118/J339-z119/L377-k, гомомерный вид J339-z119/L377-k имеет два сайта связывания MabSelect SuRe; гетеромерное антитело Q499-z118/J339-z119/L377-k имеет два и гомомерное антитело Q499-z118/L377-k имеет два. При этом, что касается Q499-z121/J339-z119/L377-k, гомомерный вид J339-z119/L377-k имеет два сайта связывания MabSelect SuRe; гетеромерное антитело Q499-z121/J339-z119/L377-k имеет один сайт; и гомомерное антитело Q499-z121/L377-k не имеет ни одного сайта связывания MabSelect SuRe. В особенности, это подразумевает то, что посредством комбинирования модифицированный белок А неспособен связываться с вариабельной областью антитела, как например, MabSelect SuRe, с модификацией, которая приводит к потере сродства связывать белок А, гетеромерное антитело может быть эффективно выделено и очищено с высокой чистотой с помощью только стадии очистки на основе белка А независимо от активности связывать белок А вариабельной области тяжелой цепи.
[Пример 6] Выделение и очистка гетеромерных антител с помощью аффинной хроматографии с использованием модифицированного белка А
КС, в которой был экспрессирован Q499-z118/J339-z119/L377-k или Q499-z121/J339-z119/L377-k, подвергали хроматографическому анализу с использованием модифицированного белка А. Образцы КС фильтровали через фильтр с размером пор в 0.22 мкм, и загружали в колонку Mab Select SuRe (GE Healthcare), уравновешенную с D-PBS. Колонку подвергали промыванию 1 и 2 и элюированию, как показано в таблице 7. Рекомбинантный белок А состоит из пяти доменов (от А до Е), который обладает IgG-связывающей активностью. В Mab Select SuRe, домен В был модифицирован с помощью генной инженерии, чтобы получить тетрамерную структуру. Mab Select SuRe не обладает сродством к вариабельной области антитела, и выгода состоит в том, что это обеспечивает элюирование антитела даже при более мягких условиях по сравнению с обычным рекомбинантным белком А. Кроме того, смола улучшила щелочное сопротивление и способствовала очистку без разборки с использованием от 0.1 до 0.5 М NaOH, и таким образом более подходит для получения. В эксперименте, описанном в этом примере, как показано в таблице 7, 50 мМ уксусной кислоты (рН не был установлен и измеренный рН составлял приблизительно 3.0) использовали для элюирования вместо поэтапного элюирования при рН 3.6 и рН 2.7, описанного в примере 3. Соответствующие элюированные фракции собирали и анализировали с помощью катионообменной хроматографии, чтобы идентифицировать их компоненты. Чтобы приготовить контрольные варианты, каждую КС загружали в смолу rProtein G Sepharose Fast Flow (GE Healthcare) таким же самым образом, как описано в примере 2. Образцы, очищенные с помощью элюирования по партиям использовали в качестве контрольных вариантов.
Затем фракции, элюированные из белка А подвергали ионообменной хроматографии. Колонку SP Sepharose High Performance (GE Healthcare) уравновешивали равновесным буфером (20 мМ буфер фосфата натрия, рН 6.0). Затем фракции, элюированные из белка А нейтрализовали с 1.5 М Tris-HCl, (рН7.4), и три раза разбавляли с равновесным буфером, и загружали. Антитела, связанные с колонкой, элюировали с 25 объемами колонки (ОК) градиента концентрации NaCl от 50 до 350 мМ. Элюированные фракции, содержащие гетеромерное антитело, очищали с помощью гельфильтрационной хроматографии с использованием superdex200. Полученные мономерные фракции собирали, и использовали при оценивании фармакокинетики у трансгенных мышей с FcRn человека, как описано в примере 7.
Результат анализа катионообменной хроматографии каждой элюированной фракции показан в таблицах 8 и 9. Как показано в таблице 8, относительно Q499-z118/J339-z119/L377-k, соотношение компонентов каждой элюированной фракции не очень отличается от соотношения компонентов контрольного варианта. Вероятно, причина заключается в том, что все три вида J339-z119/L377-k (гомомерное антитело к F.X), Q499-z118/L377-k (гомомерное антитело к F.IX), и Q499-z118/J339-z119/L377-k (гетеромерное антитело) имели два сайта связывания для модифицированного белка, и таки образом не было никакого различия в значениях ассоциации/диссоциации во время стадии очистки на основе белка А.
При этом, в случае Q499-z121/J339-z119/L377-k, соотношение Q499-z121/L377-k (гомомерное антитело к F.IX) в элюированной фракции было значительно снижено, по сравнению с контрольным вариантом, как показано в таблице 9. В отличие от соотношений J339-z119/L377-k (гомомерное антитело к F.X) и Q499-z121/J339-z119/L377-k (гетеромерное антитело) в элюированной фракции были относительно увеличены по сравнению с контрольным вариантом наряду с понижением Q499-z121/L377-k. Считалось, что это вследствие того, что J339-z119/L377-k (гомомерное антитело к F.X) имеет два сайта связывания для модифицированного белка А и Q499-z121/J339-z119/L377-k (гетеромерное антитело) имеет один. Тем не менее, Q499-z121/L377-k (гомомерное антитело к F.IX) не имеет сайта связывания, и, следовательно большая часть Q499-z121/L377-k, прошедшего через колонку без связывания с модифицированным белком А.
Как описано выше настоящее изобретение также показывает, что принимая во внимание антитела, вариабельные области которых обладают активностью связывать белок А, когда модифицированный белок А комбинируется с модификацией, которая приводит к потере сродства связывать белок А, одно из гомомерных антител может быть значительно уменьшено, и в результате этого чистота гетеромерного антитела увеличивается с помощью только стадии очистки на основе белка А.
[Пример 7] Оценка фармакокинетики у трансгенных мышей с FcRn человека Q499-z118/J339-z119/L377-k и Q499-z121/J339-z119/L377-k приготовленные, как описано в примере 6 оценивали относительно их фармакокинетики.
Вероятно, будет трудно приспособить активность связывать белок А без потери связывания FcRn человека, потому что белок А и FcRn человека распознают тот же самый сайт в антителе IgG (J Immunol. 2000 164 (10): 5313-8), как показано на фиг.2. Сохранить связывающую способность для FcRn человека является очень важным для продолжительного удержания плазмы (длительное время полужизни) у человека, которое типично для антител класса IgG. В этом контексте фармакокинетику сравнивали между Q499-z118/J339-z119/L377-k и Q499-z121/J339-z119/L377-k, приготовленными, как описано в примере 6.
В фармакокинетическом эксперименте, чтобы спрогнозировать время полужизни у человека, фармакокинетику у трансгенных мышей с FcRn человека (B6.mFcR.n-/-.hFcRn Tg линия 276 +/+ мыши, Jackson Laboratories) оценивали с помощью следующей методики. Q499-z118/J339-z119/L377-k и Q499-z121/J339-z119/L377-k каждый вводили мышам внутривенно однократно в дозе 5 мг/кг, и кровь собирали в соответствующие моменты времени. Собранную кровь тотчас же центрифугировали при 15,000 об./мин. и 4°С в течение 15 минут, чтобы получить плазму крови. Отделенную плазму хранили в морозильной камере при -20°С или ниже до использования. Концентрацию крови определяли с помощью ELISA.
Как показано на фиг.3, результат показывает, что Q499-z118/J339-z119/L377-k и Q499-Z121/J339-z119/L377-k были сопоставимы друг с другом в отношении удержания плазмы. Таким образом, z121/z119, константная область, в которой любая из Н-цепей вводится с модификацией, которая приводит к потере способности связывать белок А, была продемонстрирована, чтобы быть сопоставимой в отношении удержания плазмы с z118/z119, которая не обладает модификацией, которая приводит к потере сродства связывать белок А. Как описано выше, изобретатели настоящего изобретения обнаружили модификацию (например, мутация замещения Arg на аминокислоту в положении 435, EU нумерация), которая приводит к потере способности связывать белок А, но не оказывает влияния на фармакокинетику, и которая способствует эффективному выделению/очистке гетеромерного антитела с высокой чистотой вследствие только стадии очистки на основе белка А независимо от вариабельной области.
[Пример 8] Введение мутаций в СН3 домен GC33-IgG1-CD3-scFv и приготовление сконструированных молекул вследствие только стадии очистки на основе белка А
Введение мутаций для очистки на основе белка А молекулы GC33-IgG1-CD3-scFv
Изобретатели сконструировали молекулу анти-GPC3 IgG антитела, в которой анти-CD3 scFv антитело связывается с одной из двух Н-цепей (Фиг.4). Предполагалось, что эта молекула способна убивать раковые клетки путем рекрутинга Т клеток в раковые клетки вследствие двухвалентного связывания с глипиканом-3 (GPC3), раковым специфическим антигеном, и моновалентного связывания с CD3, Т-клеточным антигеном. Анти-CD3 scFv антитело должно быть связано только с одной из двух Н-цепей, чтобы добиться моновалентного связывания с CD3. В этом случае, необходимо очистить молекулу, образованную посредством гетеромерной ассоциации двух типов Н-цепей.
Таким образом, с использованием того же самого способа, описанного в примере 3, мутация замещения Arg на His в положении 435 (EU нумерация) была введена в одну из Н-цепей. Кроме того, указанную выше мутацию комбинировали с мутациями (замещение Lys на Asp в положении 356, EU нумерация, вводится в одну Н-цепь и замещение Glu на Lys в положении 439, EU нумерация, вводится в другую Н-цепь), описанными в WO 2006/106905 (PROCESS FOR PRODUCTION OF POLYPEPTIDE BY REGULATION OF ASSEMBLY), в качестве модификации для улучшения гетеромерной ассоциации двух Н-цепей. Изобретатели настоящего изобретения испытывали, возможно ли было с комбинированными мутациями очистить представляющую интерес молекулу только с помощью хроматографии с белком А.
Конструирование экспрессирующих векторов для генов антитела и экспрессия соответствующих антител
Ген, кодирующий GPC3 (вариабельная область Н-цепи античеловеческого антитела глипикан-3, SEQ ID NO:22) как вариабельную область Н-цепи антитела был конструирован с помощью способа, известного специалисту в данной области техники. Кроме того, ген, кодирующий GC33-k0 (L-цепь античеловеческого антитела глипикан-3, SEQ ID NO:23) как L-цепь антитела был конструирован с помощью способа, известного специалисту в данной области техники. Кроме того, гены, описанные ниже, были конструированы как константная область Н-цепи антитело с помощью способа, известного специалисту в данной области техники.
LALA-G1d (SEQ ID NO:24), который был конструирован из IgG1 посредством замещения Ala на Leu в положениях 234 и 235 (EU нумерация), и Ala на Asn в положении 297 (EU нумерация), и удаления С-концевого Gly и Lys LALA-G1d-CD3 (SEQ ID NO:25), который был конструирован из LALA-G1d посредством зацепления анти-CD3 scFv (в котором вариабельная область Н-цепи античеловеческого CD3 антитела связывается через пептидный линкер с С концом вариабельной области L-цепи античеловеческого CD3 антитела) LALA-G3S3E-G1d (SEQ ID NO:26), который был конструирован из LALA-G1d посредством замещения Arg на His в положении 435 (EU нумерация) и Glu на Lys в положении 439 (EU нумерация); и
LALA-S3K-G1d-CD3 (SEQ ID NO:27), который был конструирован из LALA-G1d-CD3 посредством замещения Lys на Asp в положении 356 (EU нумерация). Гены NTA1L и NTA1R Н-цепи античеловеческого GPC3 антитела конструировали посредством зацепления соответственно LALA-G1d-CD3 (в котором анти-CD3 scFv антитело связывается с константной областью Н-цепи) и LALA-G1d (константная область Н-цепи) ниже от GPC3, которая является вариабельной областью Н-цепи античеловеческого антитела глипикан-3. Кроме того, гены NTA2L и NTA2R Н-цепи античеловеческого GPC3 антитела были конструированы посредством зацепления анти-CD3 scFv антитела ниже от GPC3 как константной области Н-цепи, и связывания LALA-S3K-G1d-CD3, введенного с мутацией замещения Lys на Asp в положении 356 (EU нумерация) или LALA-G3S3E-G1d, введенного с мутациями замещения Arg на His в положении 435 (EU нумерация) и Glu на Lys в положении 439 (EU нумерация). Конструированные гены перечисляются ниже.
Н-цепь
L-цепь
GC33-k0
Каждый из генов антитела (Н-цепи: NTA1L, NTA1R, NTA2L, и NTA2R; L-цепь: GC33-k0) был вставлен в экспрессирующий вектор животной клетки. Используя способ, известный специалисту в данной области техники, антитела, перечисленные ниже экспрессировали кратковременно в FreeStyle293 клетки (Invitrogen) с помощью трансфекции клеток с конструированными экспрессирующими векторами. Как показано ниже, антитела были названы с использованием комбинаций трансфицированных генов антитела (первая Н-цепь/вторая Н-цепь/L-цепь).
NTA1L/NTA1R/GC33-k0
NTA2L/NTA2R/GC33-k0
Очистка белка экспрессированных образцов и оценивание гетеродимерного выхода
Супернатанты культуры FreeStyle293 клеток (КС), содержащие следующие антитела, использовали как образец.
NTA1L/NTA1R/GC33-k0
NTA2L/NTA2R/GC33-k0
Образцы КС фильтровали через фильтр с размером пор в 0.22 мкм, и загружали в колонку rProtein A Sepharose Fast Flow (GE Healthcare), уравновешенную с D-PBS. Колонку подвергали промыванию 1 и 2 и элюированию 1, как показано в таблице 10. Объем КС, который загружали в колонку, доводили до 20 мг антитела/мл смолы. Соответствующие фракции, элюированные при каждом условии, собирали и анализировали с помощью эксклюзионной хроматографии, чтобы идентифицировать их компоненты.
Результат эксклюзионной хроматографии каждой элюированной фракции показан на фиг.6 и в таблице 11 ниже. Значения представляют площадь пика элюирования, выраженную в процентах. Для NTA1L/NTA1R/GC33-k0 и NTA2L/NTA2R/GC33-k0, гомомерные антитела (антитела с гомомерным NTA1L или гомомерным NTA2L), которые имеют анти-СD3 scFv антитело в обеих цепях, были почти необнаруживаемыми. Это, как полагают, вызвано чрезвычайно низким уровнем экспрессии Н-цепей, содержащих анти-CD3 scFv антитело, потому что уровень экспрессии scFv молекулы в основном является низким. Что касается гомомерных антител, которые не содержат анти-CD3 scFv антитело в их двух цепях, приблизительно 76% гомомерного антитела NTA1R было получено путем наблюдения в случае NTA1L/NTA1R/GC33-k0, в то время как только приблизительно 2% гомомерного антитела NTA2R было получено путем наблюдения в случае NTA2L/NTA2R/GC33-k0. Таким образом, настоящее изобретение показало, что если мутацию замещения Lys на Glu в положении 356 (EU нумерация) и Glu на Lys в положении 439 (EU нумерация) для эффективного образования гетеромерных молекул из соответствующих Н-цепей, комбинировали с мутацией замещения Arg на His в положении 435 (EU нумерация), гетеромерное антитело (представляющее интерес биспецифическое антитело) могло быть эффективно очищено с чистотой в 98% или выше благодаря только лишь стадии очистки на основе белка А.
[Пример 9] Введение мутаций в СН3 домен моновалентных антител и приготовление сконструированной молекулы благодаря только стадии очистки на основе белка А
Введение мутаций для очистки молекул моновалентного антитела с использованием белка А
Обычное анти-GPC3 IgG антитело связывается двухвалентно через две Н-цепи с глипиканом-3 (GPC3), раковым специфическим антигеном. В эксперименте, описанном в этом примере, изобретатели конструировали и оценивали молекулу анти-GPC3 IgG антитела (Фиг.6), которая моновалентно связывается с глипиканом-3. Считается, что по сравнению с обычными двухвалентными антителами, моновалентное связывание молекулы с глипиканом-3 (GPC3), раковым специфическим антигеном, было основано на сродстве, а не на авидности. Таким образом, предполагали, что молекула была способной связываться с антигеном без перекрестного сшивания. Чтобы достичь моновалентного связывания двух Н-цепей с глипиканом-3 (GPC3), одна должна быть Н-цепью, состоящей из шарнирного Fc домена, у которой отсутствует вариабельная область и СН1 домен, в то время как другая является обычной Н-цепью. В этом случае, необходимо очистить молекулу, которая получается в результате гетеромерной ассоциации двух типов Н-цепей.
Таким образом, с использованием того же самого способа, как описано в примере 3, мутация замещения Arg на His в положении 435 (EU нумерация) была введена в одну из Н-цепей. Кроме того, указанную выше мутацию комбинировали с мутациями (замещение Lys на Asp в положении 356, EU нумерация, вводится в одну Н-цепь и замещение Glu на Lys в положении 439, EU нумерация, вводится в другую Н-цепь), описанными в WO 2006/106905 (PROCESS FOR PRODUCTION OF POLYPEPTIDE BY REGULATION OF ASSEMBLY), в качестве модификации, чтобы усилить гетеромерную ассоциацию двух Н-цепей. Изобретатели настоящего изобретения оценивали, возможно ли было с комбинированными мутациями очистить представляющую интерес молекулу с помощью только лишь хроматографии с белком А.
Конструирование экспрессирующих векторов для генов антитела и экспрессия соответствующих антител
Использовали вариабельную область Н-цепи антитела:
GPC3 (вариабельная область Н-цепи античеловеческого антитела глипикан-3, SEQ ID NO:22).
Использовали L-цепь антитела:
GC33-k0 (L-цепь античеловеческого антитела глипикан-3, SEQ ID NO:23).
Использовали константные области Н-цепи антитела:
LALA-G1d (SEQ ID NO:24), который был конструирован из IgG1 посредством введения мутаций замещения Ala на Leu в положениях 234 и 235 (EU нумерация), и Ala на Asn в положении 297 (EU нумерация), и удаления С-концевого Gly и Lys;
LALA-G3-G1d (SEQ ID NO:28), который был конструирован из LALA-G1d посредством введения мутации замещения Arg на His в положении 435 (EU нумерация);
LALA-G3S3E-G1d (SEQ ID NO:26), который был конструирован из LALA-G3-G1d посредством введения мутации замещения Glu на Lys в положении 439 (EU нумерация);
LALA-G1Fc (SEQ ID NO:29), который был конструирован из LALA-G1d путем удаления области положений от 1 до 215 (EU нумерация); и
LALA-G1Fc-S3K (SEQ ID NO:30), который был конструирован из G1Fc посредством введения мутации замещения Lys на Asp в положении 356 (EU нумерация).
Гены NTA4L-cont, NTL4L-G3, и NTA4L Н-цепи античеловеческого GPC3 антитела конструировали посредством зацепления ниже от GPC3 (вариабельная область Н-цепи античеловеческого антитела глипикан-3), соответственно,
LALA-G1d (константная область Н-цепи), LALA-G3-G1d, введенный с мутацией замещения Arg на His в положении 435 (EU нумерация), и LALA-G3S3E-G1d, введенный с мутациями замещения Arg на His в положении 435 (EU нумерация) и Glu на Lys в положении 439 (EU нумерация). Кроме того, Fc гены NTA4R-cont и NTA4R конструировали с использованием LALA-G1Fc (античеловеческий шарнирный Fc домен) и LALA-G1Fc-S3K (шарнирный Fc домен, введенный с мутацией замещения Lys на Asp в положении 356, EU нумерация).
Конструированные гены представляют собой:
Н-цепь
NTA4L-cont: GPC3-LALA-G1d
NTA4L-G3: GPC3 -LALA-G3-G1d
NTA4L: GPC3-LALA-G3S3E-G1d
NTA4R-cont: LALA-G1Fc
NTA4R: LALA-G1Fc-S3K
L-цепь
GC33-k0
Гены антитела (NTA4L, NTA4L-cont, NTA4L-G3, NTA4R, NTA4R-cont, и GC33-k0) каждый были вставлены в экспрессирующий вектор животной клетки. Следующие антитела экспрессировали кратковременно в FreeStyle293 клетках (Invitrogen) посредством трансфекции с использованием конструированных экспрессирующих векторов. Как показано ниже, антитела были названы с использованием комбинаций трансфицированных генов антитела.
NTA4L-cont/NTA4R-cont/GC33-k0
NTA4L-G3/NTA4R-cont/GC33-k0
NTA4L/NTA4R/GC33-k0
Очистка белка экспрессированных образцов и оценивание гетеродимерного выхода
КС, содержащую следующее антитело использовали в качестве образца:
NTA4L-cont/NTA4R-cont/GC33-k0
NTA4L-G3/NTA4R-cont/GC33-k0
NTA4L/NTA4R/GC33-k0
Образцы КС фильтровали через фильтр с размером пор в 0.22 мкм, и загружали в колонку rProtein A Sepharose Fast Flow (GE Healthcare), уравновешенную с D-PBS. Колонку подвергали промыванию 1 и 2 и элюированию, 1 как показано в таблице 12. Объем КС, загружаемый в колонку, доводили до 20 мг антитела/мл смолы. Соответствующие фракции, элюированные при каждом условии, собирали и анализировали с помощью эксклюзионной хроматографии, чтобы идентифицировать их компоненты.
Результат анализа эксклюзионной хроматографии каждой элюированной фракции показан на фиг.7 и в таблице 13 ниже. Значения представляют площадь пика элюирования, выраженную в процентах.
Что касается NTA4L-cont/NTA4R-cont/GC33-k0, гомомерное антитело, которое двухвалентно связывается с GPC3 (гомомерное антитело NTA4L-cont) и гомомерная молекула, которая не имеет GPC3-связывающего домена (гомомерное антитело NTA4R-cont) были элюированы, тогда как представляющее интерес гетеромерное антитело, NTA4L-cont/NTA4R-cont, было обусловлено только 46.5%.
В случае NTA4L-G3/NTA4R-cont/GC33-k0, гомомерное антитело, которое двухвалентно связывается с GPC3 (гомомерное антитело NTA4L-G3) было почти необнаруживаемым, тогда как гомомерная молекула, не имеющая GPC3-связывающего домена (гомомерное антитело NTA4R-cont) было в избытке. Гетеромерное антитело, представляющее интерес, NTA4L-G3/NTA4R-cont, насчитывало 66.7%. В случае NTA4L/NTA4R/GC33-k0, гомомерное антитело, которое двухвалентно связывается с GPC3 (гомомерное антитело NTA4L) было почти необнаруживаемым, и соотношение гомомерной молекулы, не имеющей GPC3-связывающего домена (NTA4R) было значительно снижено, что приводит к существенному увеличению вплоть до 93.0% в соотношении гетеромерного антитела, представляющего интерес, NTA4L/NTA4R. Таким образом, настоящее изобретение показало, что если мутации замещения Lys на Asp в положении 356 (EU нумерация) и Glu на Lys в положении 439 (EU нумерация) для эффективного образования гетеромерных молекул из соответствующих Н-цепей были введены в комбинации с мутацией замещения Arg на His в положении 435 (EU нумерация), то гетеромерное антитело (представляющее интерес биспецифическое антитело) могло быть эффективно очищено с чистотой в 93% или выше благодаря только стадии очистки на основе белка А.
[Пример 10] Приготовление гетеромерных антител вследствие стадии очистки с помощью колоночной хроматографии с белком А с использованием рН градиентного элюирования
Как описано в примере 9, изобретатели настоящего изобретения показали, что в случае антитела, имеющего вариабельную область только в одном плече, гетеромерное антитело могло быть эффективно очищено вследствие только стадии очистки на основе белка А посредством комбинировании мутации замещения Arg на His в положении 435 (EU нумерация) с мутациями (замещение Lys на Asp в положении 356, EU нумерация, вводится в одну Н-цепь, и замещение Glu на Lys в положении 439, EU нумерация, вводится в другую Н-цепь), описанными в WO 2006/106905 (PROCESS FOR PRODUCTION OF POLYPEPTIDE BY REGULATION OF ASSEMBLY). Тем не менее, гетеромерное антитело не очищается с достаточно высокой чистотой исключительно с элюированием 1 (элюирующий буфер: 2 мМ HCl, рН 2.7). Требуется дополнительная стадия очистки.
Затем в этом примере изобретатели настоящего изобретения оценивали можно ли гетеромерное антитело выделить и очистить с высокой чистотой с помощью колоночной хроматографии с белком А, используя элюирование с рН градиентом. Это основывалось на предположении, что большее количество участков связывания белка А приводит к более прочному связыванию гетеромерного антитела с белком А, и в результате для элюирования требуется более низкий рН. Очистка может быть выполнена более эффективно при более низких затратах, когда чистота гетеромерного антитела может быть повышена почти до 100% с использованием такого рН градиентного элюирования. Использовали образцы КС, содержащие следующие антитела:
NTA4L-cont/NTA4R-cont/GC33-k0
NTA4L-G3/NTA4R-cont/GC33-k0
NTA4L/NTA4R/GC33-k0
Образцы КС фильтровали через фильтр с размером пор в 0.22 мкм, и загружали в колонку HiTrap protein A HP (GE Healthcare), уравновешенную с D-PBS. Колонку последовательно подвергали промыванию 1 и 2, и затем элюированию с рН градиентом, используя элюирование А и В, как показано в таблице 14. рН градиентное элюирование выполняли со следующим линейным градиентом: элюирование А/элюирование В=(100:0)→(30:70) в течение 35 минут. Элюированные фракции собирали и анализировали с помощью анализа эксклюзионной хроматографией, чтобы идентифицировать их компоненты.
NTA4L-cont/NTA4R-cont/GC33-k0, NTA4L-G3/NTA4R-cont/GC33-k0, и NTA4L/NTA4R/GC33-k0 очищали с помощью колоночной хроматографии с белком А при условии pH градиентного элюирования. Полученные хроматограммы показаны на фиг.8. Элюирование NTA4L-cont/NTA4R-cont/GC33-k0 в результате дало размытый максимум. При этом pH градиентное Элюирование of NTA4L-G3/NTA4R-cont/GC33-k0 дало два пика элюирования. Пики высоких и низких pHs были отмечены как "Элюирование 1" и "элюирование 2", соответственно. Результат для NTA4L/NTA4R/GC33-k0 был приблизительно таким же самым, как и для NTA4L-G3/NTA4R-cont/GC33-k0, за исключением того, что площадь пика элюирования 2 была меньше.
Результат анализа эксклюзионной хроматографии каждого пика показан в таблице 15. NTA4L-cont/NTA4R-cont/GC33-k0 дал три компонента, элюированных в таком порядке: гомомерное антитело, которое двухвалентно связывается с GPC3 (гомомерное антитело NTA4L-cont), гетеромерное антитело, которое моновалентно связывается с GPC3 (гетеромерное антитело NTA4L-cont/NTA4R-conc), и гомомерная молекула, не имеющая GPC3-связывающего домена (гомомерное антитело NTA4R-cont). Считается, что причина того, почему эти компоненты не были разделены с помощью pH градиентного элюирования, состоит в том, что они имеют то же самое количество (два) сайтов, связывающих белок А. При этом, было обнаружено, что в элюировании 1 для NTA4L-G3/NTA4R-cont/GC33-k0, уровни гомомерного антитела, которое двухвалентно связывается с GPC3 (гомомерное антитело NTA4L-G3) и гомомерной молекулы, не имеющей GPC3-связывающего домена (гомомерное антитело NTA4R-cont) были ниже предела обнаружения, тогда как гетеромерное антитело, которое моновалентно связывается с GPC3 (NTA4L-G3/NTA4R-conc гетеромерное антитело) составляло 99.6%. В элюировании 2, гомомерная молекула, не имеющая GPC3-связывающего домена (гомомерное антитело NTA4R-cont) была обнаружена в количестве 98.8%. Гомомерное антитело NTA4L-G3 проходит через колонку с белком А, потому что оно не может связываться с белком А вследствие мутации замещения Arg на His в положении 435 (EU нумерация). При этом гетеромерное антитело NTA4L-G3/NTA4R-conc имеет единственный сайт связывания белка А, тогда как гомомерное антитело NTA4R-cont имеет два. Большее количество сайтов связывания белка А означает более прочное связывание белка А, и в результате для элюирования требуется более низкий рН. Полагают, что это является причиной того, почему гомомерное антитело NTA4R-cont было элюировано при более низком рН, чем гетеромерное антитело NTA4L-G3/NTA4R-conc. Почти тот же самый результат был получен для NTA4L/NTA4R/GC33-k0. Результат анализа эксклюзионной хроматографии показывает, что соотношение компонентов было сопоставимым с соотношением компонентов для NTA4L-G3/NTA4R-cont/GC33-k0. Имелось различие между хроматограммами с белком А, и соотношение площади пика элюирования 2 к элюированию 1 было меньше в NTA4L/NTA4R/GC33-k0. Соотношение экспрессии гомомерного антитела NTA4R-cont, которое является основным компонентом элюирования 2, было снижено вследствие мутаций, введенных для эффективного генерирования гетеромерного антитела NTA4L-G3/NTA4R-conc. Аминокислотные мутации, описанные выше, улучшали выход очистки гетеромерного антитела и прочность очистки с помощью колоночной хроматографии с белком А с рН градиентным элюированием.
Как описано выше, изобретатели настоящего изобретения показали, что гетеромерное антитело могло быть эффективно выделено и очищено с высокой чистотой вследствие стадии очистки с использованием исключительно колоночной хроматографии с белком А с рН градиентным элюированием.
[Пример 11] Введение мутации в СН3 домен моновалентного Fcalpha рецептор-Fc белка слияния и приготовление сконструированной молекулы при помощи только стадии очистки на основе белка А
Введение мутации в СН3 домен и приготовление моновалентного Fcalpha рецептор-Fc белка слияния при помощи стадии очистки на основе белка А
Обычные Fc рецептор-Fc белки слияния, такие как Eternercept и Abatacept представляют собой гомодимеры, которые могут двухвалентно связываться с лигандами. В эксперименте, описанном в этом примере, изобретатели конструировали и оценивали Fc рецептор-Fc белок слияния, который моновалентно связывается с IgA как лиганд (Фиг.9). Чтобы достичь моновалентного связывания Fcalpha рецептора с IgA, одна из двух Н-цепей Fc рецептор-Fc белка слияния должна быть целой Н-цепью, имеющей шарнирный Fc домен. В этом случае, необходимо очистить молекулу, которая получается из гетеромерной ассоциации двух типов Н-цепей.
Таким образом, с использованием того же самого способа, описанного в примере 6, мутация замещения Arg на His в положении 435 (EU нумерация) была введена в одну из двух Н-цепей. Кроме того, указанную выше мутацию комбинировали с мутациями (замещение Lys на Asp в положении 356, EU нумерация, вводится в одну Н-цепь и замещение Glu на Lys в положении 439, EU нумерация, вводится в другую Н-цепь), описанными в WO 2006/106905 (PROCESS FOR PRODUCTION OF POLYPEPTIDE BY REGULATION OF ASSEMBLY), в качестве модификации для усиления гетеромерной ассоциации двух типов Н-цепей. Изобретатели настоящего изобретения оценивали, возможно ли с комбинированными мутациями очистить молекулу, представляющую интерес, с помощью исключительно хроматографии с белком А.
Конструирование экспрессирующих векторов для генов антитела и экспрессия соответствующих антител
Использованный Fc рецептор представлял собой FcalphaR (рецептор IgAl человека, SEQ ID NO:31).
Использовали сочетание константных областей Н-цепи:
G1Fc (SEQ ID NO:32), которая является человеческим шарнирным Fc доменом, конструированным из IgG1 путем удаления С-концевого Gly и Lys, и остатков положения от 1 до 223 (EU нумерация);
G1Fc-G3S3K (SEQ ID NO:33), которая была конструирована из G1Fc посредством введения мутаций замещения Lys на Asp в положении 356 (EU нумерация) и Arg на His в положении 435 (EU нумерация); и
G1Fc-S3E (SEQ ID NO:34), которая был конструирована из G1Fc посредством введения мутации замещения Glu на Lys в положении 439 (EU нумерация).
FcalphaR-Fc белки слияния IAL-cont и IAL конструировали посредством зацепления ниже от FcalphaR через полипептидный линкер (SEQ ID NO:35), G1Fc (константная область Н-цепи) и G1Fc-G3S3K, введенная с мутациями замещения Lys на Asp в положении 356 (EU нумерация) и Arg на His в положении 435 (EU нумерация).
Кроме того, Fc гены IAR-cont и IAR конструировали для кодирования G1Fc (человеческий шарнирный Fc домен) и G1Fc-S3E (шарнирный Fc домен, введенный с мутацией замещения Glu на Lys в положении 439, EU нумерация), соответственно. Конструированные гены представляли собой:
Н-цепь
IAL-cont: FcalphaR-G1Fc
IAL: FcalphaR-G1Fc-G3S3K
IAR-cont: G1Fc
IAR: G1Fc-S3E
Гены антитела (IAL-cont, IAL, IAR-cont, и IAR) каждый вставляли в экспрессирующий вектор животной клетки.
Следующие антитела экспрессировали кратковременно в FreeStyle293 клетках (Invitrogen) посредством трансфекции с использованием конструированных экспрессирующих векторов. Как показано ниже, антитела были названы с использованием комбинаций трансфицированных генов антитела.
IAL-cont/IAR-cont
IAL/IAR
Очистка белка экспрессированного образца и оценивание гетеродимерного выхода
Использовали образцы КС, содержащие следующее антитело:
IAL-cont/IAR-cont
IAL/IAR
Образцы КС фильтровали через фильтр с размером пор в 0.22 мкм, и загружали в колонку rProtein A Sepharose Fast Flow (GE Healthcare), уравновешенную с D-PBS. Колонку подвергали промыванию 1 и 2 и элюированию 1, как показано в таблице 16. Объем КС, загружаемый в колонку, доводили до 20 мг антитела/мл смолы. Соответствующие фракции, элюированные при каждом условии, собирали и анализировали с помощью эксклюзионной хроматографии, чтобы идентифицировать их компоненты.
Результат анализа эксклюзионной хроматографии каждой элюированной фракции показан на фиг.10 и в таблице 17 ниже. Значения представляют площадь пика элюирования, выраженную в процентном соотношении. Что касается IAL-cont/IAR-cont, гомомерное антитело, которое двухвалентно связывается с IgA (гомомерное антитело IAL-cont) и гомомерная молекула, не имеющая IgA-связывающий сайт (гомомерное антитело IAR-cont) были элюированы, тогда как гетеромерное антитело IAL-cont/IAR-cont, представляющее интерес, насчитывало только 30%. В случае IAL/IAR, гомомерное антитело, которое двухвалентно связывается с IgA (гомомерное антитело IAL) было необнаруживаемым, и пропорция гомомерной молекулы, не имеющей IgA-связывающий сайт (гомомерное антитело IAR) была значительно уменьшена; таким образом, гетеромерное антитело IAL/IAR, представляющее интерес, было существенно увеличено до приблизительно 96%. Таким образом, настоящее изобретение показало, что если мутации замещения Lys на Asp в положении 356 (EU нумерация) и Glu на Lys в положении 439 (EU нумерация) для эффективного образования гетеромерных молекул из соответствующих Н-цепей были введены в комбинации с мутацией замещения Arg на His в положении 435 (EU нумерация), то гетеромерное антитело, представляющее интерес биспецифическое антитело, могли быть эффективно очищено с чистотой в 95% или выше вследствие только стадии очистки на основе белка А.
[Пример 12] Конструирование биспецифического антитела четырехцепочечного класса IgG
Конструирование экспрессирующих векторов для генов антитела и экспрессия соответствующих антител
Биспецифическое антитело к F.IX человека и F.X человека, которое конструировали, как описано в примере 1, состоит из общей L-цепи и двух типов Н-цепей, что каждая распознает различный антиген. Получение биспецифического антитела с такой общей L-цепью является нелегким, потому что для общей последовательности L-цепи трудно распознать два различных типа антигенов. Как описано выше, получение такой общей L-цепи является чрезвычайно трудным. Таким образом, можно предположить, что более предпочтительным выбором является биспецифическое антитело, состоящее из двух типов Н-цепей и двух типов L-цепей, которые распознают два типа антигенов. Если экспрессируются два типа Н-цепей и два типа L-цепей, то они образуют десять типов H2L2 IgG молекул в случайной комбинации. Очень трудно очистить представляющее интерес биспецифическое антитело из десяти типов антител.
В эксперименте, описанном в этом примере, изобретатели настоящего изобретения приготавливали и оценивали биспецифические антитела, состоящие из двух типов Н-цепей и двух типов L-цепей к человеческому IL-6 рецептору и человеческому глипикану-3 (GPC3). Для эффективного приготовления биспецифических антител, состоящих из двух типов Н-цепей и двух типов L-цепей, необходимо усилить ассоциацию Н-цепей и L-цепей к тому же самому антигену, а также гетеромерную ассоциацию двух типов Н-цепей. Кроме того, важно, что биспецифическое антитело с правильной комбинацией может быть очищено из полученных продуктов экспрессии.
Чтобы усилить ассоциацию между Н-цепями и L-цепями к тому же самому антигену, вариабельная область (VH) Н-цепи (GC33-VH-СН1-шарнир-СН2-СН3) и вариабельная область (VL) L-цепи (GC33-VL-CL) для GC33 (анти-GPC3 антитело) были обменены друг с другом для создания Н-цепи GC33-VL-CH1-шарнир-СН2-СН3 и L-цепи (GC33-VH-CL) (VH домен и VL домен поменяли друг с другом). GC33-VL-CH1-шарнир-CH2-CH3 ассоциируется с GC33-VH-CL; тем не менее, его ассоциация с L-цепью (MRA-VL-CL) анти-IL-6 рецептор антитела ингибируется вследствие нестабильности VL/VL взаимодействия. Подобным образом Н-цепь (MRA-VH-СН1-шарнир-СН2-СН3) анти-IL-6 рецептор антитела ассоциируется с MRA-VL-CL; тем не менее, его ассоциация с L-цепью (GC33-VH-CL) анти-GPC3 антитела ингибируется вследствие нестабильности VH/VH взаимодействия. Как описано выше, возможно усилить ассоциацию между Н-цепями и L-цепями к тому же самому антигену. Тем не менее, VH/VH взаимодействие и VL/VL взаимодействие также происходят, несмотря на то, что они менее стабильны, чем VH/VL взаимодействие (для VH/VH, см: FEBS Lett. 2003 Nov 20, 554(3):323-9; J Mol Biol. 2003 Oct 17, 333(2):355-65; for VL/VL, cm: J Struct Biol. 2002 Jun, 138(3):171-86; Proc Natl Acad Sci USA. 1985 Jul, 82(14):4592-6), и таким образом, хотя и нечасто, также происходит неблагоприятная самоассоциация Н-цепей и L-цепей. Поэтому, несмотря на то, что процентное отношение представляющего интерес биспецифического антитела увеличивается путем простого обмена VH домена и VL домена друг с другом, экспрессированные продукты все еще содержат приблизительно десять типов комбинаций.
В общем, чрезвычайно трудно очистить представляющее интерес биспецифическое антитело из десяти типов. Тем не менее, возможно улучшить отделение десяти типов компонентов в ионообменной хроматографии посредством введения модификации, так чтобы у десяти типов компонентов каждый имел изоэлектрическую точку. В этом контексте, MRA-VH, который представляет собой вариабельную область Н-цепи анти-IL-6 рецептор антитела, был модифицирован, чтобы снизить изоэлектрическую точку, и это давало Н54-VH с более низкой изоэлектрической точкой. Таким же образом, MRA-VL, который представляет собой вариабельную область L-цепи анти-IL-6 рецептор антитела, был модифицирован, чтобы снизить изоэлектрическую точку, и это давало L28-VL с более низкой изоэлектрической точкой. Кроме того, GC33-VH, который представляет собой вариабельную область Н-цепи анти-GPC3 антитела, был модифицирован, чтобы увеличить изоэлектрическую точку. Это давало Hu22-VH с увеличенной изоэлектрической точкой.
Комбинация представляющих интерес Н- и L-цепей была улучшена путем обмена VH и VL между Н-цепями и L-цепями анти-GPC3 антитела. Тем не менее, хотя и нечасто, неблагоприятная ассоциация Н-цепь/L-цепь происходит потому, что невозможно полностью подавить H54-VH/Hu22-VH взаимодействие и L28-VL/GC33-VL взаимодействие. Обычная последовательность антитела имеет глутамин в положении 39 в VH. В VH/VH взаимодействии, глутамины, как полагают, образуют водородные связи в интерфейсе VH/VH. Затем, лизин был замещен на глутамин в положении 39 (нумерация по Кэбату), чтобы ослабить H54-VH/Hu22-VH взаимодействие. VH/VH взаимодействие, как таким образом предполагали, будет существенно ослаблено вследствие электростатического отталкивания между двумя лизинами в интерфейсе VH/VH. Затем H54-VH-Q39K и Hu22-VH-Q39K были конструированы посредством замещения лизина на глутамин в положении 39 (нумерация по Кэбату) в последовательностях H54-VH и Hu22-VH. Подобным образом обычная последовательность антитела имеет глутамин в положении 38 в VL. Во взаимодействии VL/VL глутамины, как полагают, образуют водородные связи в интерфейсе VL/VL. Затем глутаминовая кислота была замещена на глутамин в положении 38 (нумерация по Кэбату), чтобы ослабить L28-VL/GC33-VL взаимодействие. Взаимодействие VL/VL, как таким образом предполагали, будет существенно ослаблено вследствие электростатического отталкивания между двумя глутаминовыми кислотами в интерфейсе VL/VL. Затем L28-VL-Q38E и GC33-VL-Q38E были конструированы посредством замещения глутаминовой кислоты на глутамин в положении 39 (нумерация по Кэбату) в последовательностях L28-VL и GC33-VL.
С целью дальнейшего улучшения эффективности экспрессии/очистки представляющего интерес биспецифического антитела, мутация замещения Arg на His в положении 435 (EU нумерация) была введена в одну Н-цепь с использованием того же самого способа, описанного в примере 3. Кроме того, указанную выше мутацию комбинировали с мутациями (замещение Lys на Asp в положении 356, EU нумерация, вводится в одну Н-цепь и замещение Glu на Lys в положении 439, EU нумерация, вводится в другую Н-цепь), описанными в WO 2006/106905 (PROCESS FOR PRODUCTION OF POLYPEPTIDE BY REGULATION OF ASSEMBLY) в качестве модификации, чтобы усилить гетеромерную ассоциацию двух типов Н-цепей. Комбинированные мутации способствуют очистке молекулы, полученной из гетеромерной ассоциации двух типов Н-цепей исключительно с помощью хроматографии с белком А.
В особенности, использовали вариабельные области Н-цепи:
MRA-VH (вариабельная область Н-цепи античеловеческого интерлейкин-6 рецептор антитела, SEQ ID NO:36);
GC33-VH (вариабельная область Н-цепи анти-GPC3 антитела, SEQ ID NO:37);
H54-VH (вариабельная область Н-цепи античеловеческого интерлейкин-6 рецептор антитела, SEQ ID NO:38) с изоэлектрической точкой ниже, чем изоэлектрическая точка MRA-VH;
Hu22-VH (вариабельная область Н-цепи анти-GPC3 антитела, SEQ ID NO:39) с изоэлектрической точкой выше, чем изоэлектрическая точка GC33-VH;
H54-VH-Q39K (SEQ ID NO:40) где Lys замещен на Gln в положении 39 (нумерация по Кэбату) в последовательности H54-VH; и
Hu22-VH-Q39K (SEQ ID NO:41) где Lys замещен на Gln в положении 39 в последовательности Hu22-VH.
Также использовали следующие константные области Н-цепи антитела:
IgG1-LALA-N297A-CH (SEQ ID NO:42) где Ala замещен на Leu в положениях 234 и 235 (EU нумерация), и Ala замещен на Asn в положении 297 (EU нумерация), и С-концевой Gly и Lys удален в последовательности константной области Н-цепи IgG1;
IgG1-LALA-N297A-CHr (SEQ ID NO:43) где последовательность IgG1-LALA-N297A-CH имеет дополнительно два остатка Ser в N конце;
IgG1-LALA-N297A-s3-CH (SEQ ID NO:44) где Glu замещен на Lys в положении 439 (EU нумерация) в последовательности IgG1-LALA-N297A-CH; и
IgG1-LALA-N297A-G3s3-CHr (SEQ ID NO:45) где Lys замещен на Asp в положении 356 (EU нумерация) и Arg замещен на His в положении 435 (EU нумерация) в последовательности IgG1-LALA-N297A-CHr.
При этом были использованы вариабельные области L-цепи антитела:
MRA-VL (вариабельная область L-цепи античеловеческого интерлейкин-6 рецептор антитела, SEQ ID NO:46);
GC33-VL (вариабельная область L-цепи анти-СРСЗ антитела, SEQ ID NO:47);
L28-VL (вариабельная область L-цепи античеловеческого интерлейкин-6 рецептор антитела, SEQ ID NO:48) с изоэлектрической точкой ниже, чем изоэлектрическая точка MRA-VL;
L28-VL-Q38E (SEQ ID NO:49) где Glu замещен на Gln в положении 38 (нумерация по Кэбату) в последовательности L28-VL; и
GC33-VL-Q38E (SEQ ID NO:50) где Glu замещен на Gln в положении 38 (нумерация по Кэбату) в последовательности GC33-VL.
Также использовали следующие константные области L-цепи антитела.
IgG1-CL (константная область L-цепи IgG1, SEQ ID NO:51).
IgG1-CLr (SEQ ID NO:52), который был конструирован путем замещения Arg и Thr на С-концевой Ala и Ser, соответственно, в последовательности IgG1-CL.
Ген no1-Mh-H был конструирован посредством зацепления IgG1-LALA-N297A-CH ниже от MRA-VH.
Ген no1-Mh-L был конструирован посредством зацепления IgG1-CL ниже от MRA-VL.
Ген no1-Gh-H был конструирован посредством зацепления IgG1-LALA-N297A-CH ниже от GC33-VH.
Ген no1-Gh-L был конструирован посредством зацепления IgG1-CL ниже от GC33-VL.
Ген no2-Gh-H был конструирован посредством зацепления IgG1-LALA-N297A-CHr ниже от GC33-VL.
Ген no2-Gh-L был конструирован посредством зацепления IgG1-CLr ниже от GC33-VH.
Ген no3-Ml-H был конструирован посредством зацепления IgG1-LALA-N297A-СН ниже от H54-VH.
Ген no3-Ml-L был конструирован посредством зацепления IgG1-CL ниже от L28-VL.
Ген no3-Ghh-L был конструирован посредством зацепления IgG1-CLr ниже от Hu22-VH.
Ген no5-Мl-Н был конструирован посредством зацепления IgG1-LALA-N297A-s3-CH ниже от H54-VH.
Ген no5-Gh-H был конструирован посредством зацепления IgG1-LALA-N297A-G3s3-CHr ниже от GC33-VL.
Ген no6-Мl-Н был конструирован посредством зацепления IgG1-LALA-N297A-s3-CH ниже от H54-VH-Q39K.
Ген no6-Ml-L был конструирован посредством зацепления IgG1-CL ниже от L28-VL-Q38E.
Ген no6-Gh-H был конструирован посредством зацепления IgG1-LALA-N297A-G3s3-CHr ниже от GC33-VL-Q38E.
Ген no6-Ghh-L был конструирован посредством зацепления IgG1-CLr ниже от Hu22-VH-Q39K.
Соответствующие гены (no1-Mh-H, no1-Mh-L, no1-Gh-H, no1-Gh-L, no2-Gh-H, no2-Gh-L, no3-Ml-H, no3-Ml-L, no3-Ghh-L, no5-Мl-Н, no5-Gh-H, no6-Мl-Н, no6-Ml-L, no6-Gh-H, и no6-Ghh-L) были вставлены в экспрессирующие векторы клетки животного.
Следующие комбинации экспрессирующих векторов были введены в FreeStyle293-F клетки, чтобы краткосрочно экспрессировать каждую сконструированную молекулу.
А. Сконструированная молекула: no1 (Фиг.11)
Описание: природное анти-IL-6 рецептор/анти-СРС3 биспецифическое антитело. Полипептиды, закодированные полинуклеотидами, вставленными в экспрессирующий вектор: no1-Mh-H (SEQ ID NO:53), no1-Mh-L (SEQ ID NO:54), no1-Gh-H (SEQ ID NO:55), и no1-Gh-L (SEQ ID NO:56).
В. Сконструированная молекула: nо2 (Фиг.12)
Описание: конструированная из no1 путем обмена VH и VL доменов анти-GPC3 антитела.
Полипептиды, закодированные полинуклеотидами, вставленными в экспрессирующий вектор: no1-Mh-H, no1-Mh-L, no2-Gh-H (SEQ ID NO:57), и no2-Gh-L (SEQ ID NO:58).
С. Сконструированная молекула: no3 (Фиг.13)
Описание: конструированная из nо2 посредством введения модификации каждой цепи, чтобы изменить ее изоэлектрическую точку.
Полипептиды, закодированные полинуклеотидами, вставленными в экспрессирующий вектор: no3-Ml-H (SEQ ID NO:59), no3-Ml-L (SEQ ID NO:60), и no2-Gh-H, и no3-Ghh-L (SEQ ID NO:61).
D. Сконструированная молекула: nо5 (Фиг.14)
Описание: конструированная из no3 посредством введения модификации, чтобы усилить гетеромерную ассоциацию Н-цепи и модификации, которая способствует очистке на основе белка А антитела, образованного посредством гетеромерной ассоциации.
Полипептиды, закодированные полинуклеотидами, вставленными в экспрессирующий вектор: no5-Ml-H (SEQ ID NO:62), no3-Ml-L, no5-Gh-H (SEQ ID NO:63), и no3-Ghh-L.
E. Сконструированная молекула: no6 (Фиг.15)
Описание: конструированная из no5 посредством введения модификации, чтобы усилить ассоциацию между представляющей интерес Н-цепью и представляющей интерес L-цепью.
Полипептиды, закодированные полинуклеотидами, вставленными в экспрессирующий вектор: no6-Ml-H (SEQ ID NO:64), no6-Ml-L (SEQ ID NO:65), no6-Gh-H (SEQ ID NO:66), и no6-Ghh-L (SEQ ID NO:67).
Культурные супернатанты, отфильтрованные через фильтр с размером пор в 0.22 мкм, загружали в rProtein A Sepharose Fast Flow смолу (GE Healthcare), уравновешенную средой. Смолу элюировали партиями, чтобы очистить молекулы. Так как белок G связывается с Fab доменом антитела, то все виды антитела в КС могут быть очищены с белком G независимо от сродства для белка А.
Конструированные антитела (no1, no2, no3, no5, и no6) оценивали относительно их экспрессии с помощью катионообменной хроматографии (IEC) с использованием ProPac WCX-10 колонки (Dionex), аналитической колонки. Катионообменную хроматографию выполняли при скорости потока в 0.5 мл/мин. с соответствующим градиентом, используя подвижную фазу А (20 мМ MES-NaOH, рН 6.1) и подвижную фазу В (20 мМ MES-NaOH, 250 мМ NaCl, pH 6.1). Результат IEC оценивания каждого антитела показан на фиг.16. Природное анти-IL-6 рецептор/анти-GPC3 биспецифическое антитело no1 дало количество пиков в непосредственной близости друг у другу. Было невозможно определить, какой пик соответствует представляющему интерес биспецифическому антителу. То же самое относилось и к no2, который получается из обмена VH домена и VL домена анти-GPC3 антитела в no1. Пик для представляющего интерес биспецифического антитела мог быть выделен в первый раз в no3, который был модифицирован из no2 посредством введения модификации, чтобы изменить изоэлектрическую точку каждой цепи no2. Пропорция пика, соответствующего представляющему интерес биспецифическому антителу, была значительно увеличена в no5, который был конструирован из no3 посредством введения модификации, чтобы усилить гетеромерную ассоциацию Н-цепи, и модификации, которая позволяет основанную на белке А очистку антитела, образованного посредством гетеромерной ассоциации. Пропорция пика, соответствующего представляющему интерес биспецифическому антителу, была еще увеличена в no6, который был конструирован из no5 посредством введения модификации, чтобы усилить ассоциацию между представляющими интерес Н-цепью и L-цепью.
Затем изобретатели настоящего изобретения оценивали, могло ли представляющее интерес биспецифическое антитело быть очищено из no6 КС с высокой чистотой, используя колонку очистки. Образцы КС фильтровали через фильтр с размером пор в 0.22 мкм, и загружали в колонку HiTrap protein A HP (GE Healthcare), уравновешенную с D-PBS. Колонку последовательно подвергали промыванию 1 и 2 и элюированию с рН градиентом, используя элюирование А и В, как показано в таблице 18. Градиент рН в течение элюирования достигался со следующим линейным градиентом: элюирование А/элюирование В=(100:0)→(35:65) в течение 40 минут.
Результат pH градиентного элюирования No6 показан на фиг.17. Гомомерное антитело, имеющее Н-цепь анти-GРС3 антитела, которая была неспособна связывать белок А, проходящий через белок А; первый пик элюирования соответствовал гетеромерному антителу, имеющему Н-цепь анти-GPC3 антитела и Н-цепь анти-IL-6 рецептор антитела; и второй пик элюирования соответствовал гомомерному антителу, имеющему Н-цепи анти-IL-6 рецептор антитела. Таким образом, изобретатели настоящего изобретения показали, что посредством замещения Arg на His в положении 435 (EU нумерация), гетеромерное антитело, имеющее Н-цепь анти-GPC3 антитела и Н-цепь анти-IL-6 рецептор антитела могло быть очищено исключительно с помощью стадии очистки на основе белка А.
Первую фракцию элюирования загружали в колонку HiTrap SP Sepharose HP (GE Healthcare), уравновешенную с 20 мМ буфера ацетата натрия (pH 5.5). После промывания тем же самым буфером, колонку элюировали с градиентом концентрации NaCl от 0 до 500 мМ. Полученный основной пик анализировали катионообменной хроматографией подобным образом, как описано выше. Результат показан на фиг.18. Представляющее интерес биспецифическое антитело показало очистку с очень высокой чистотой.
Промышленная применимость
Настоящее изобретение предоставляет эффективные способы, основывающиеся на изменении способности связывать белок А, получения или очистки с высокой чистотой полипептидных мультимеров (полиспецифические антитела), обладающих активностью связывания двух или более типов антигенов посредством исключительно стадии очистки на основе белка А. Используя способы настоящего изобретения, представляющие интерес полипептидные мультимеры, могут быть эффективно получены или очищены с высокой чистотой без потери других эффектов, полученных посредством аминокислотных мутаций, представляющих интерес. В частности, когда способы комбинируют со способом регулирования ассоциации между двумя типами доменов белка, целевые полипептидные мультимеры могут быть получены более эффективно или очищены с высокой чистотой.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2663123C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2774414C2 |
| ГЕТЕРОДИМЕРИЗОВАННЫЙ ПОЛИПЕПТИД | 2012 |
|
RU2641256C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2022 |
|
RU2824285C2 |
| МУЛЬТИСПЕЦИФИЧЕСКАЯ СВЯЗЫВАЮЩАЯ АНТИГЕН МОЛЕКУЛА, КОТОРАЯ ОБЛАДАЕТ АЛЬТЕРНАТИВНОЙ ФУНКЦИЕЙ К ФУНКЦИИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2011 |
|
RU2620071C2 |
| ГИПЕРГЛИКОЗИЛИРОВАННЫЕ СВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2708314C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА С РЕГУЛИРУЕМОЙ КОНЪЮГАЦИЕЙ МЕЖДУ ТЯЖЕЛОЙ ЦЕПЬЮ И ЛЕГКОЙ ЦЕПЬЮ | 2012 |
|
RU2681885C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДНОГО ГЕТЕРОМУЛЬТИМЕРА | 2014 |
|
RU2730594C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДНОГО ГЕТЕРОМУЛЬТИМЕРА | 2014 |
|
RU2758952C1 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2015 |
|
RU2812875C1 |








































































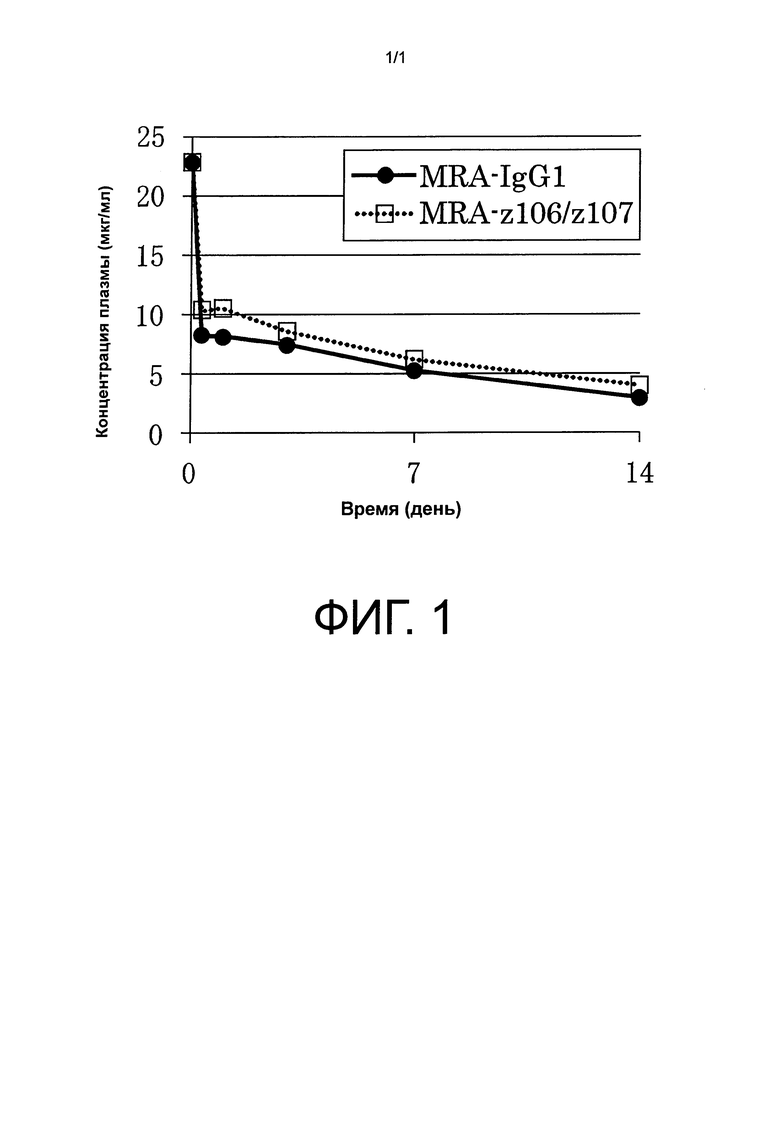
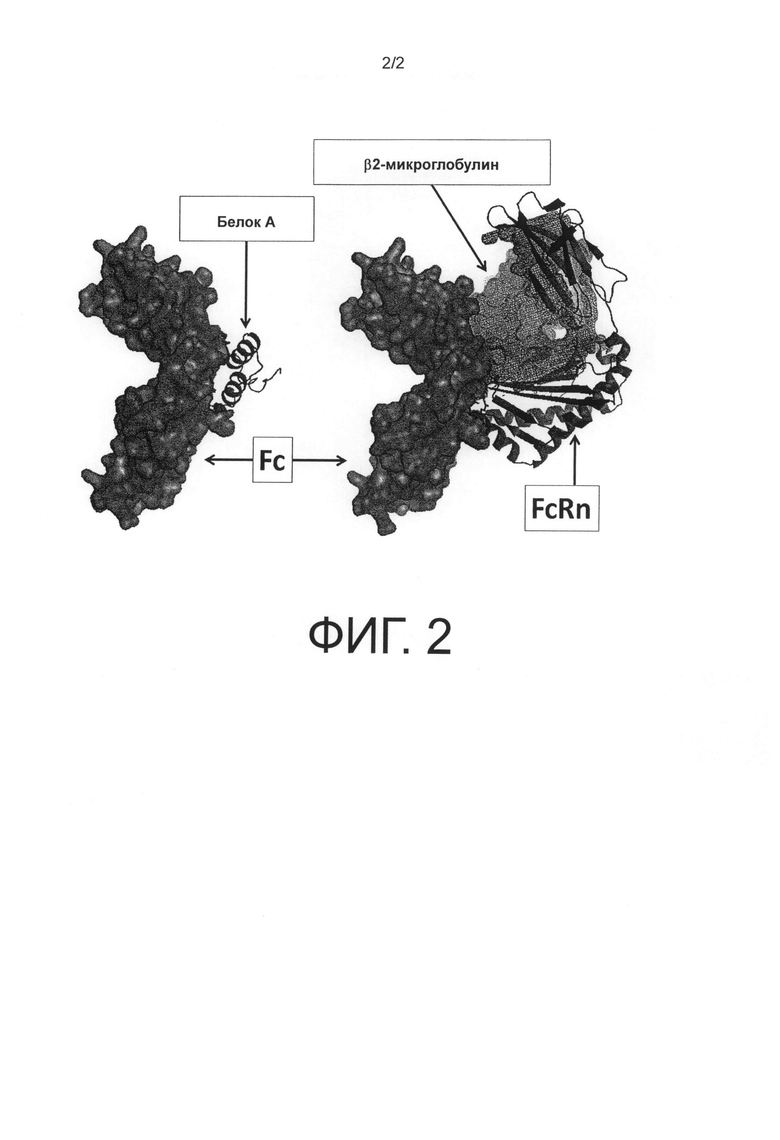
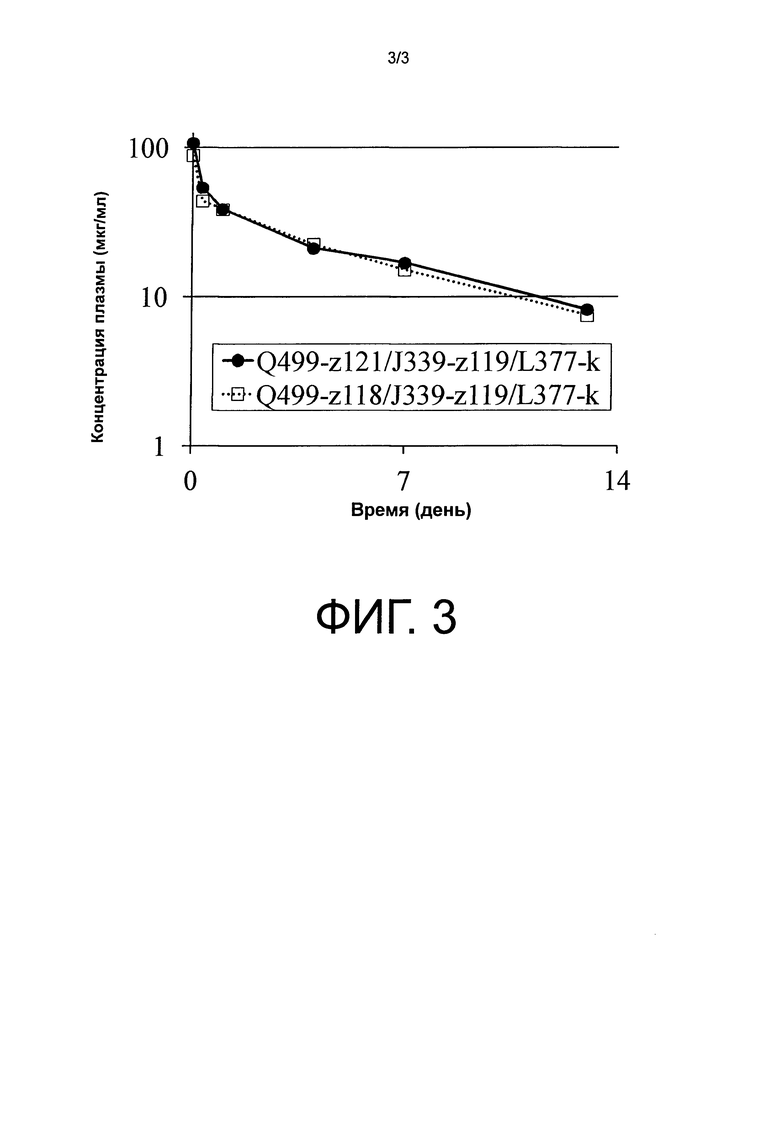
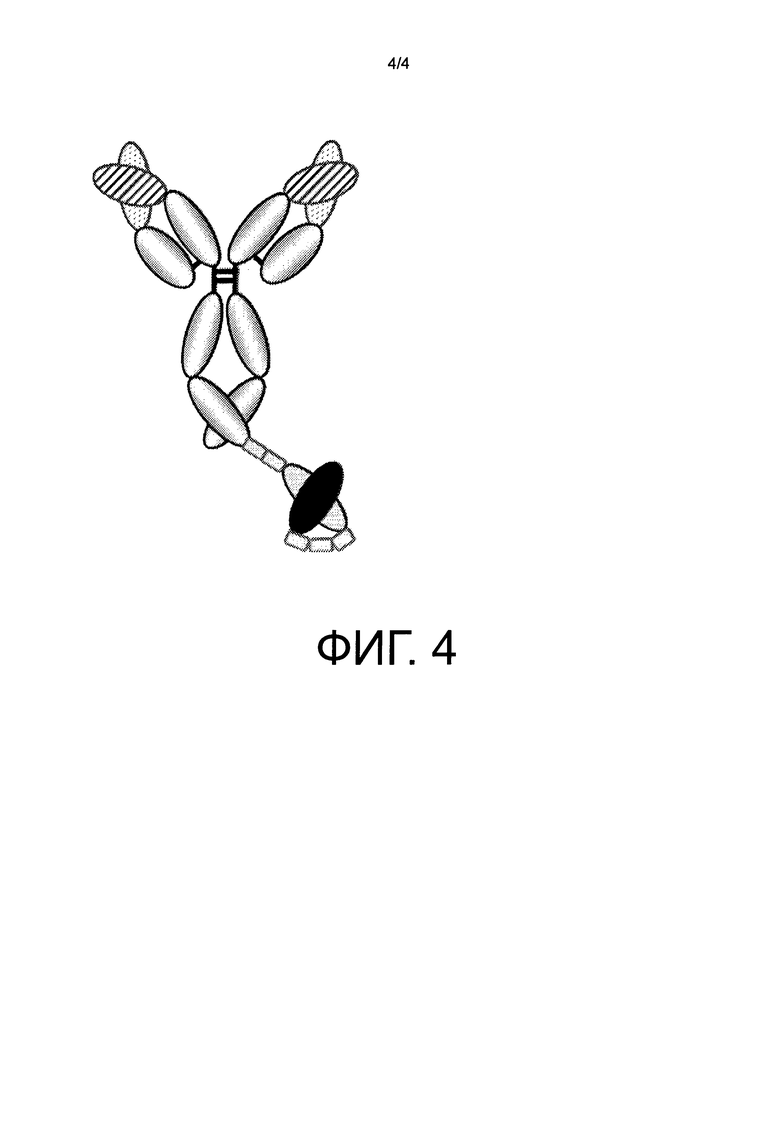
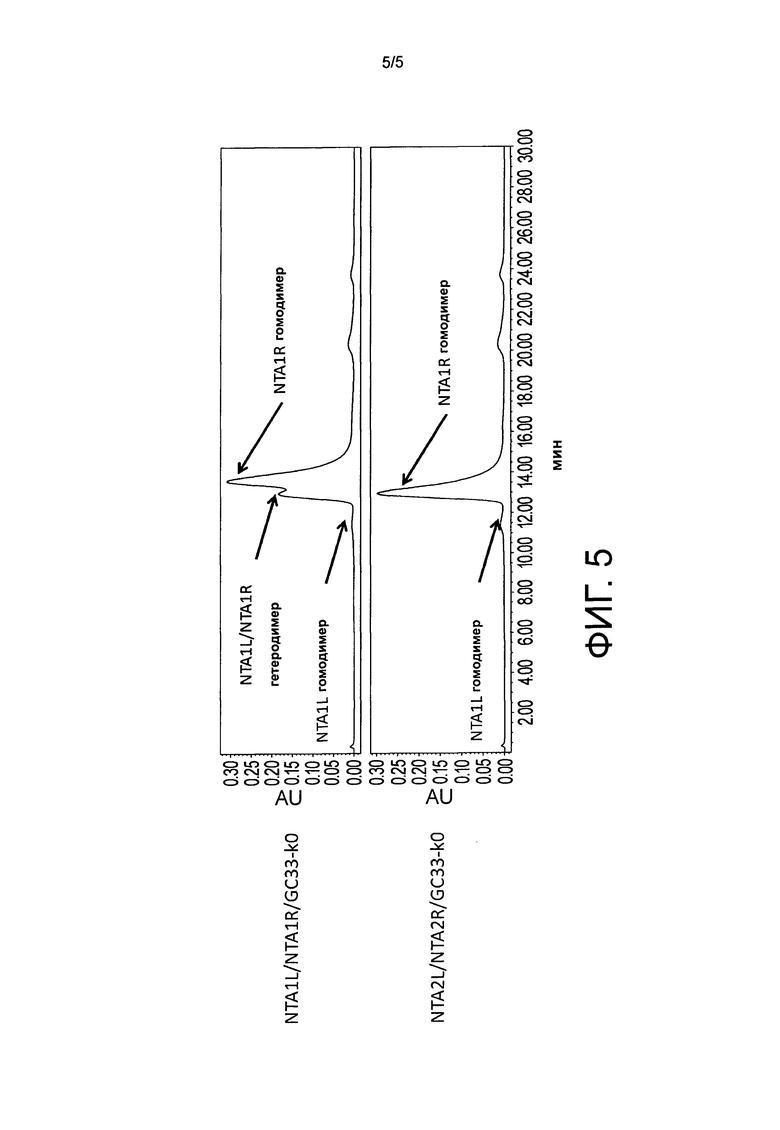
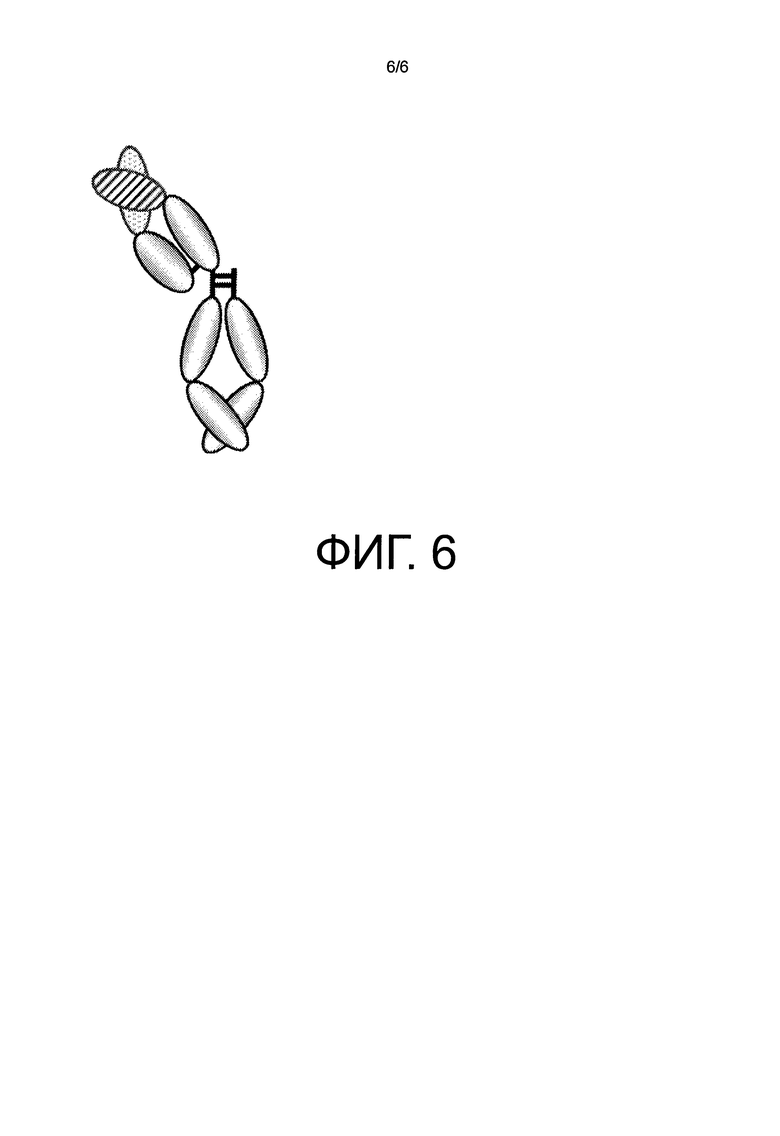
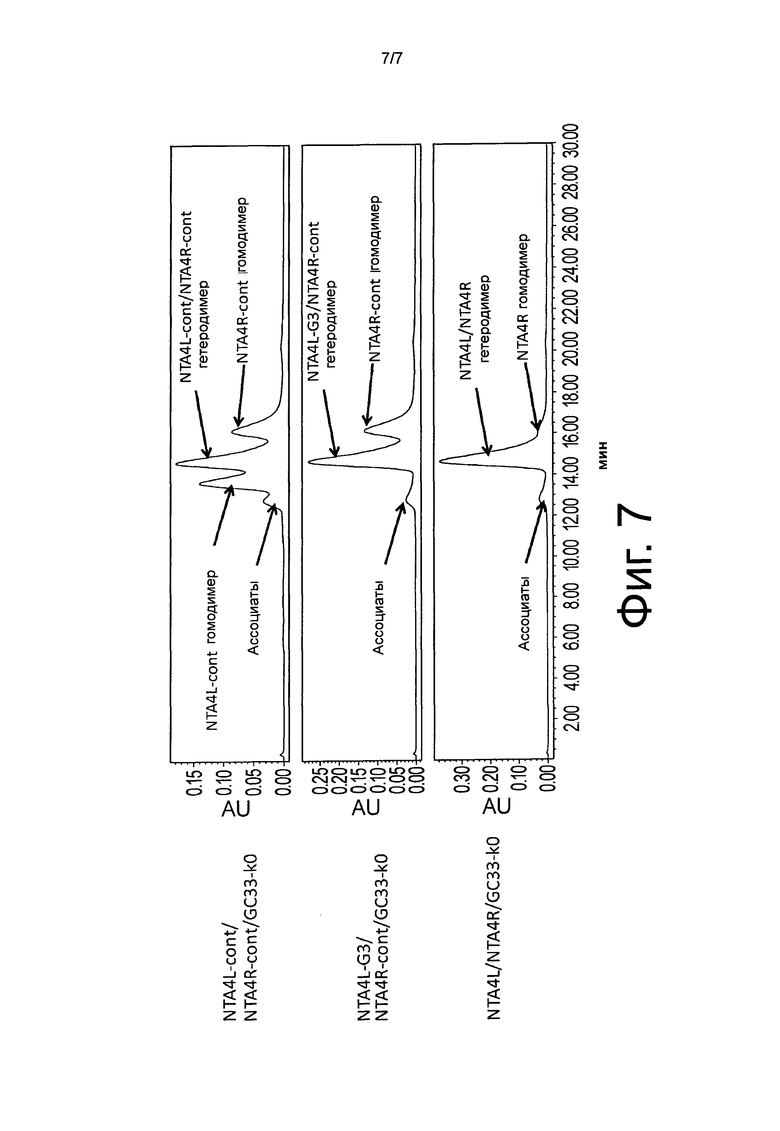
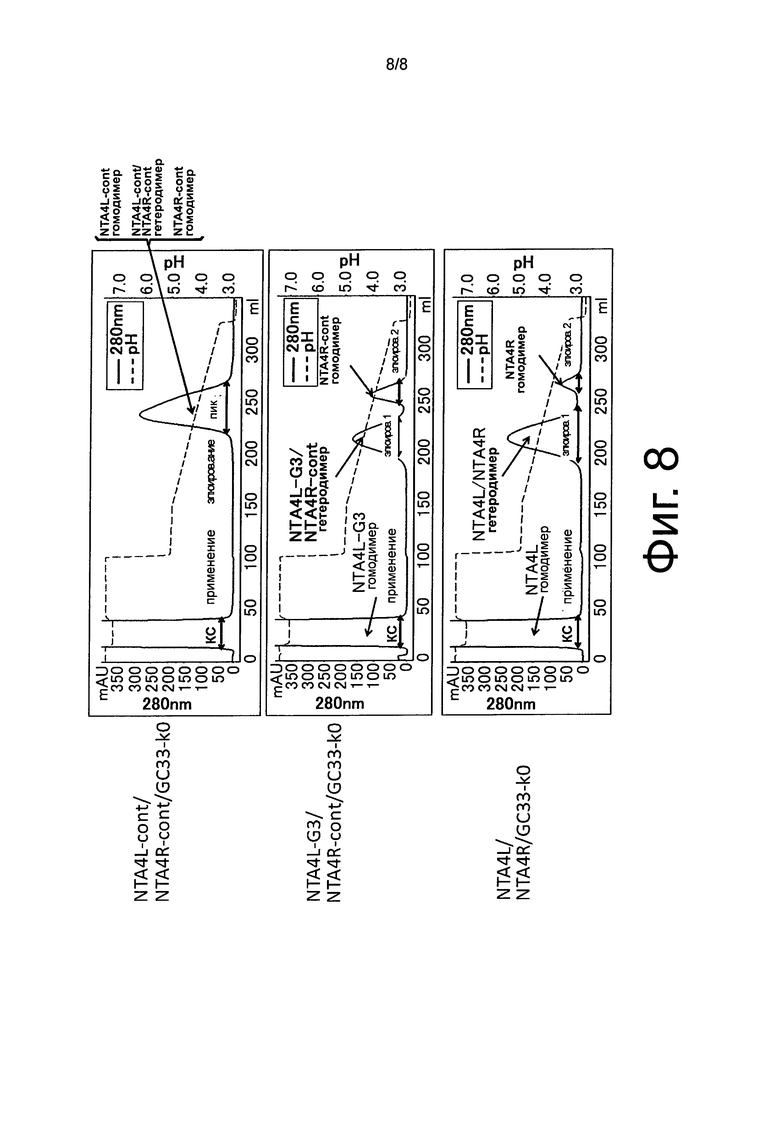
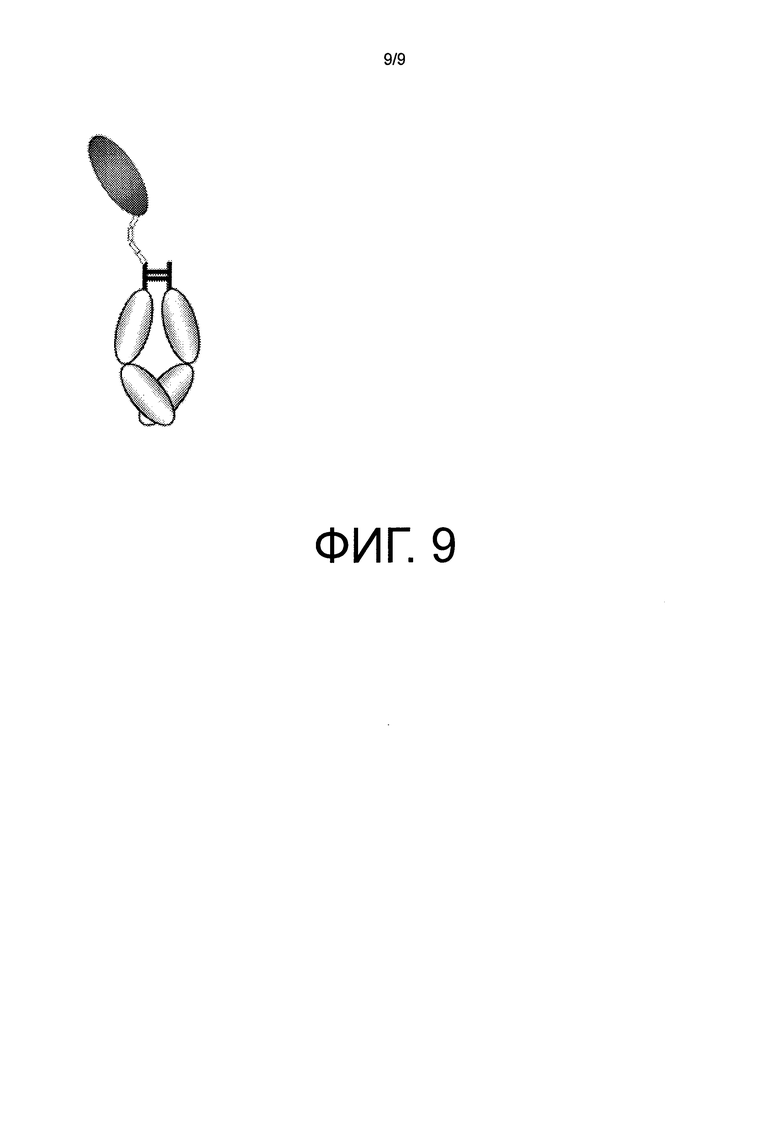
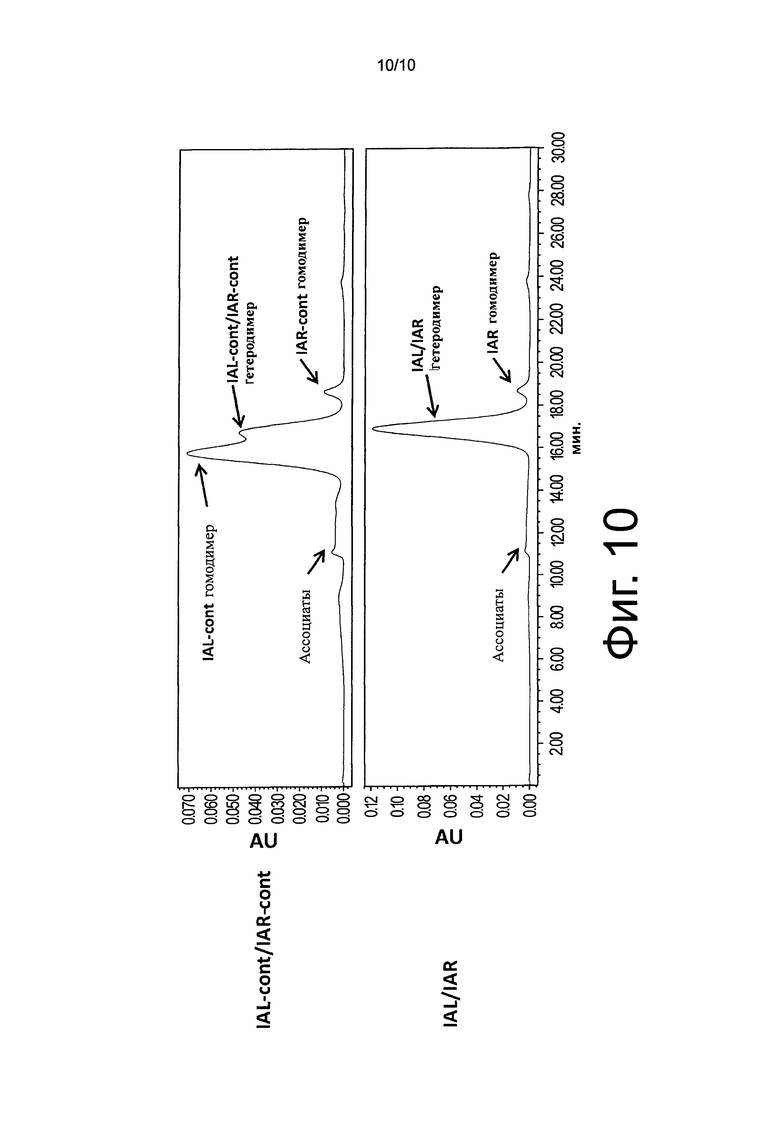
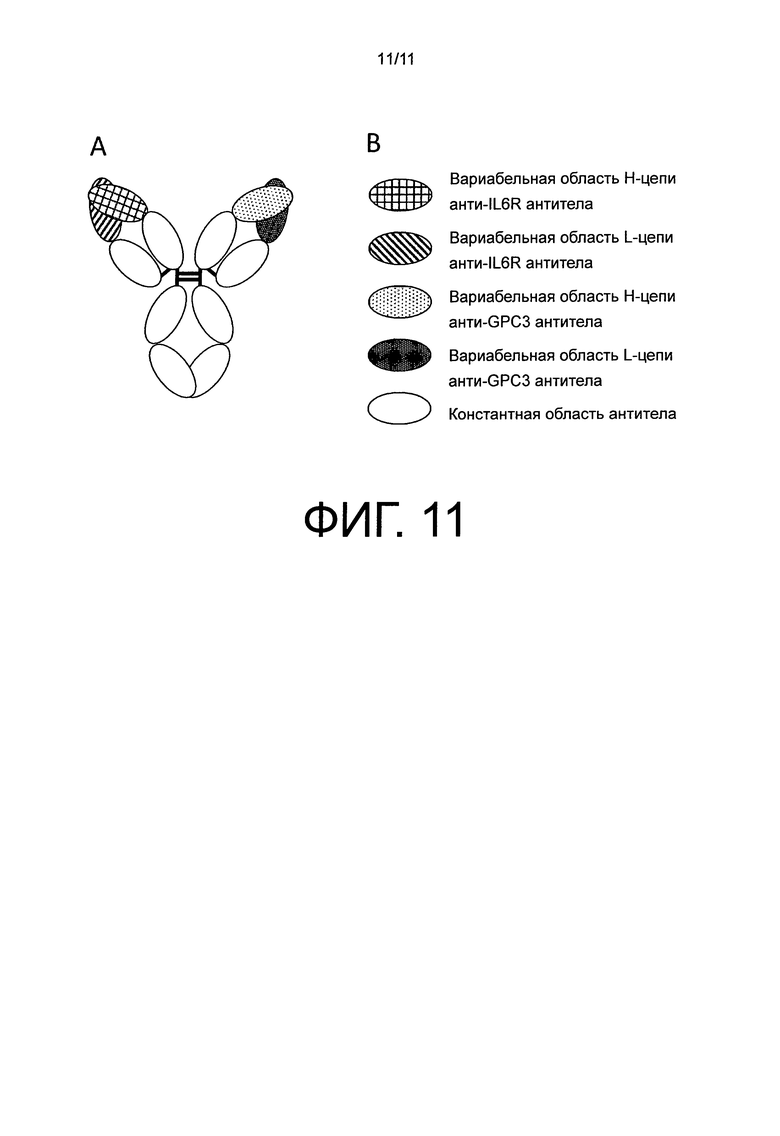
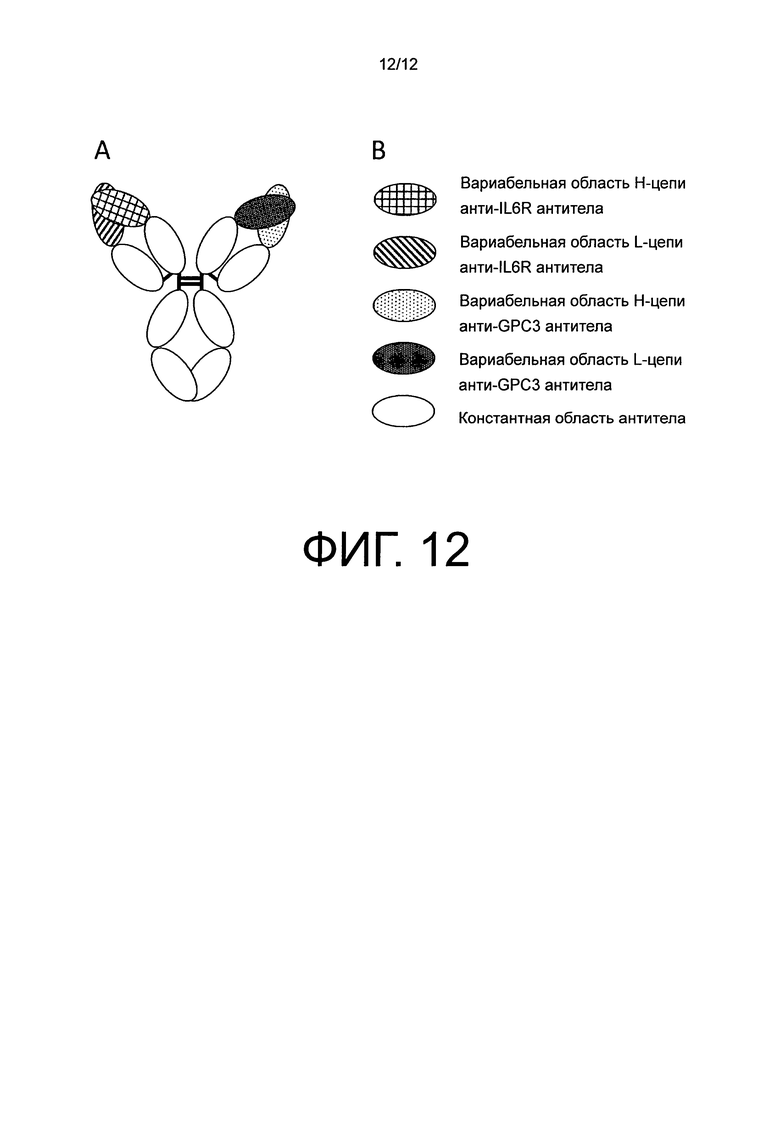
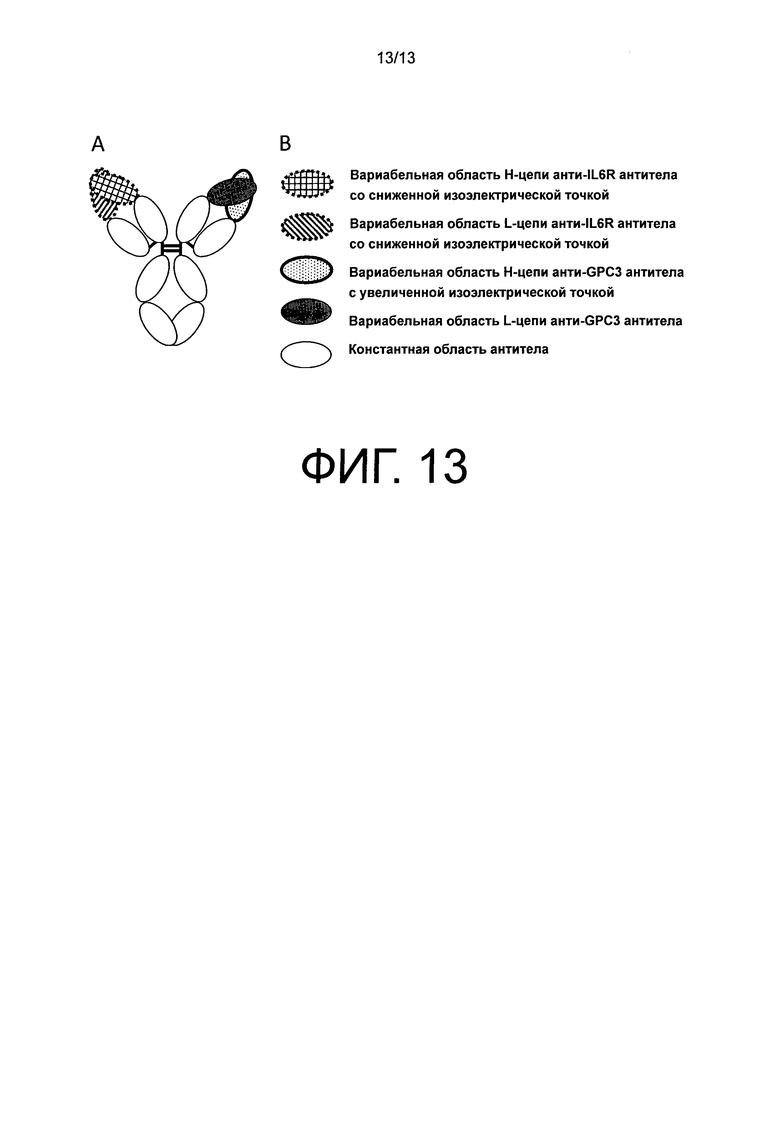

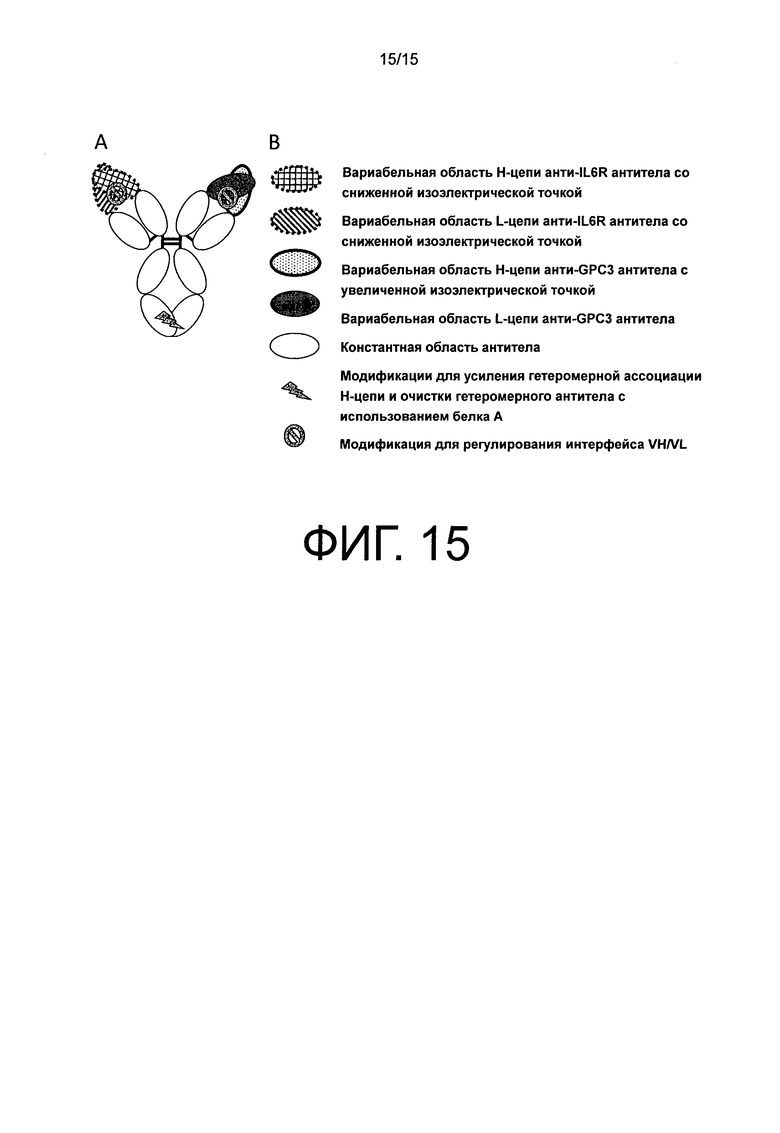
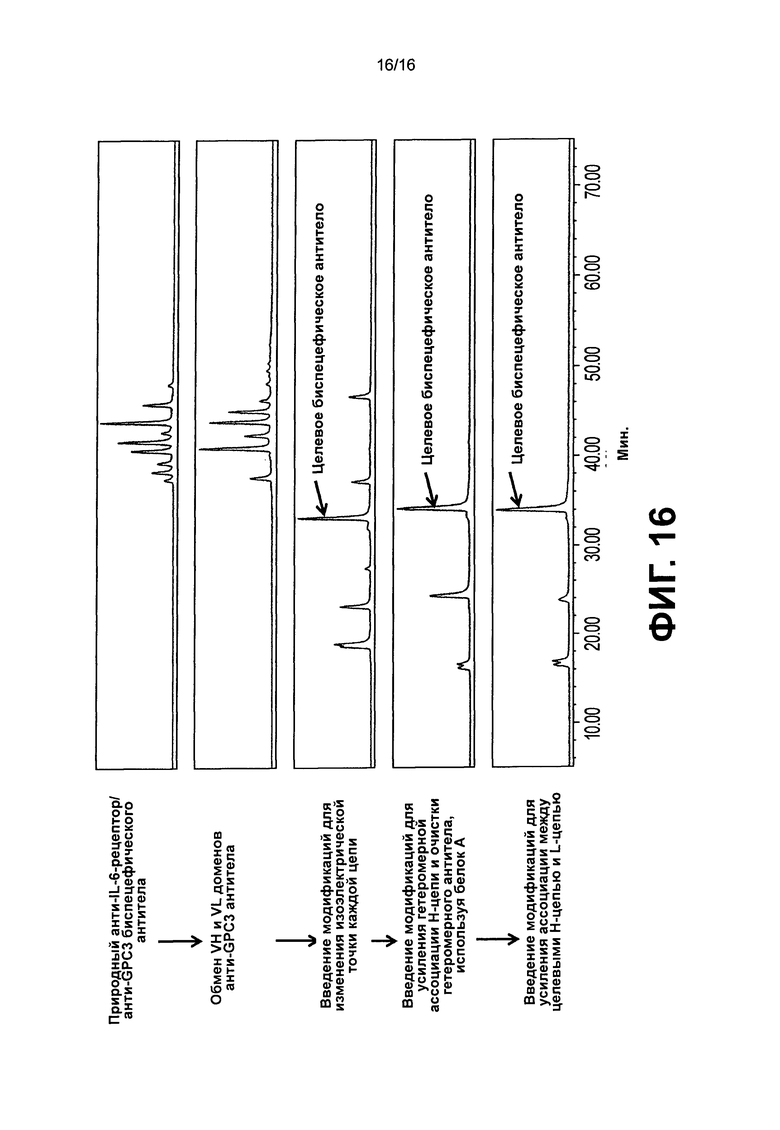
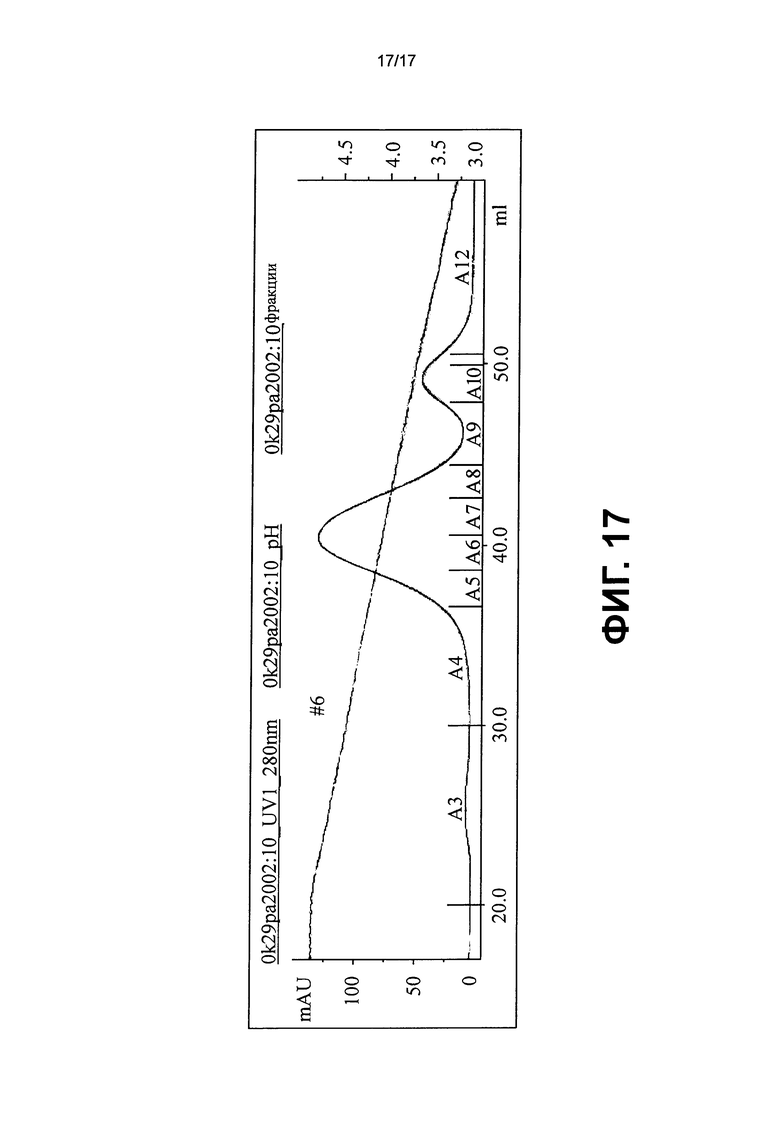
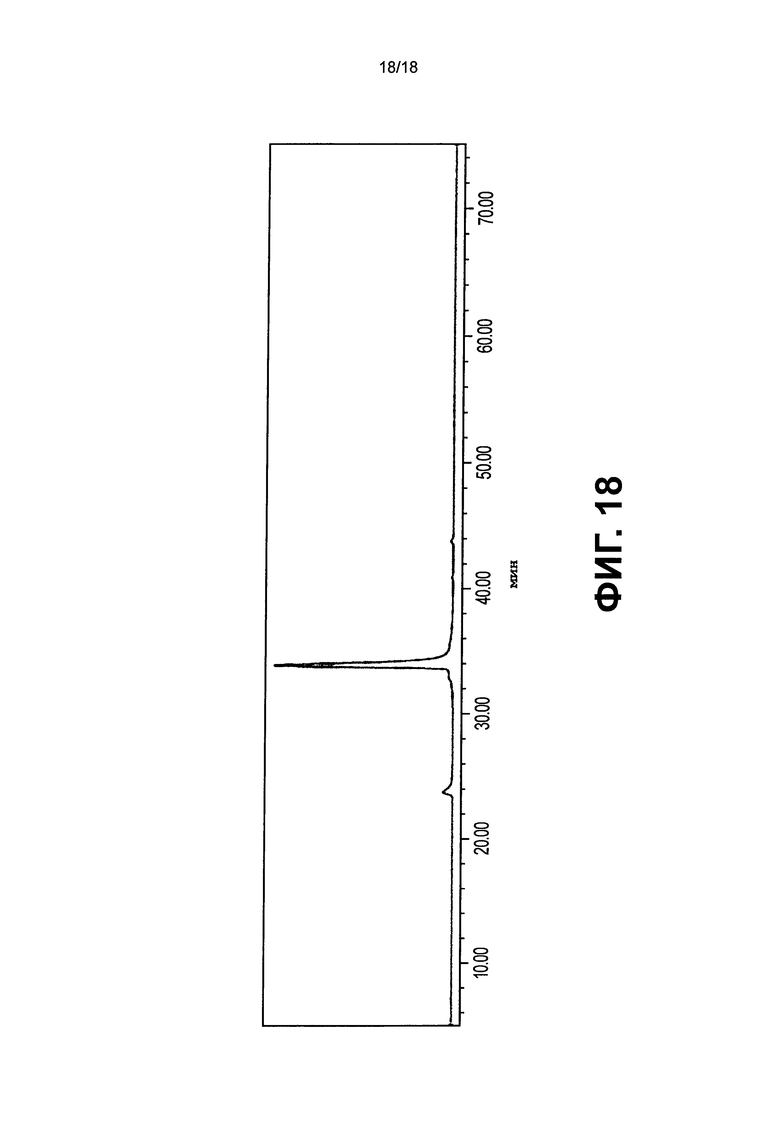
Изобретение относится к биотехнологии и представляет собой способ получения полипептидного мультимера, который включает первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, или помимо первого и второго полипептидов мультимер включает один или два третьих полипептида, обладающих антигенсвязывающей активностью, или помимо первого, второго и третьего полипептидов мультимер включает четвертый полипептид, обладающий антигенсвязывающей активностью, и способ включает стадии: (a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, или экспрессии ДНК, которая кодирует первый, второй и третий полипептиды, обладающие антигенсвязывающей активностью, или экспрессии ДНК, которая кодирует первый, второй, третий и четвертый полипептиды, обладающие антигенсвязывающей активностью; и (b) сбора продукта экспрессии стадии (а) с использованием аффинной хроматографии с белком А. Изобретение позволяет получать мультимеры с антигенсвязывающий активностью с высокой чистотой вследствие только стадии очистки на основе белка А. 7 н. и 37 з.п. ф-лы, 18 ил., 18 табл., 12 пр.
1. Способ получения полипептидного мультимера, который включает первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, или помимо первого и второго полипептидов мультимер включает один или два третьих полипептида, обладающих антигенсвязывающей активностью, или помимо первого, второго и третьего полипептидов мультимер включает четвертый полипептид, обладающий антигенсвязывающей активностью, и способ включает стадии:
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, или экспрессии ДНК, которая кодирует первый, второй и третий полипептиды, обладающие антигенсвязывающей активностью, или экспрессии ДНК, которая кодирует первый, второй, третий и четвертый полипептиды, обладающие антигенсвязывающей активностью; и
(b) сбора продукта экспрессии стадии (а) с использованием аффинной хроматографии с белком А,
где первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, включают аминокислотную последовательность Fc домена антитела или аминокислотную последовательность константной области тяжелой цепи антитела:
где Fc домен антитела или константная область тяжелой цепи антитела получены из человеческого IgG; и
где аминокислотная последовательность Fc домена антитела или константной области тяжелой цепи антитела модифицирована следующим способом (1) и (2):
(1) способом модификации аминокислотного остатка в положении 435 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, и аминокислотного остатка в положении 435 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в гистидин (Н) и аргинин (R) соответственно или в аргинин (R) и гистидин (Н) соответственно; и
(2) способом модификации, включающим по меньшей мере один из указанных ниже способов модификации (i)-(iii):
(i) способ модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда;
модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда;
и модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, на аминокислотные остатки, имеющие электрический заряд, противоположный заряду аминокислотных остатков в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью;
(ii) способ модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда;
модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда;
и модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в аминокислотные остатки, имеющие электрический заряд, противоположный заряду аминокислотных остатков в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью; и
(iii) способ модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда;
модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда;
и модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в аминокислотные остатки, имеющие электрический заряд, противоположный заряду аминокислотных остатков в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью.
2. Способ по п. 1, в котором указанные аминокислотные остатки, имеющие тот же электрический заряд, выбраны из аминокислотных остатков, входящих в следующие группы (а) или (b), и указанные аминокислотные остатки, имеющие противоположный электрический заряд, выбраны из каждой из следующих групп (а) или (b):
(a) глутаминовая кислота (Е), аспарагиновая кислота (D); или
(b) лизин (K), аргинин (R), гистидин (Н).
3. Способ по п. 1 или 2, при котором указанные способы модификации (2) (i)-(iii) представляют собой следующие способы модификации (i)-(iii):
(i) способ модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно; и модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; или
способ модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; и модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R или гистидин (Н) соответственно;
(ii) способ модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно; и модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; или
способ модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; и модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно;
(iii) способ модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно; и модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; или
способ модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; и модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно.
4. Способ по п. 1, где один или более аминокислотных остатков в первом полипептиде, обладающем антигенсвязывающей активностью, или втором полипептиде, обладающем антигенсвязывающей активностью, были модифицированы для увеличения или уменьшения способности связывать белок А или первым полипептидом, обладающим антигенсвязывающей активностью, или вторым полипептидом, обладающим антигенсвязывающей активностью.
5. Способ по п. 1, где один или более аминокислотных остатков в первом полипептиде, обладающем антигенсвязывающей активностью, или втором полипептиде, обладающем антигенсвязывающей активностью, были модифицированы для увеличения способности связывать белок А или первым полипептидом, обладающим антигенсвязывающей активностью, или вторым полипептидом, обладающим антигенсвязывающей активностью, и для уменьшения способности связывать белок А другим полипептидом.
6. Способ по п. 1, где чистота собранного полипептидного мультимера составляет 95% или более.
7. Способ по п. 1, где первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, включают аминокислотную последовательность вариабельной области тяжелой цепи антитела.
8. Способ по п. 7, где по меньшей мере один аминокислотный остаток был модифицирован в аминокислотных последовательностях FR1, CDR2 и FR3 вариабельной области тяжелой цепи антитела.
9. Способ по п. 1, где третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
10. Способ по п. 1, где по меньшей мере один из третьего и четвертого полипептидов, обладающих антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
11. Способ по п. 1, где первый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотные последовательности вариабельной области легкой цепи антитела и константной области тяжелой цепи антитела; второй полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность тяжелой цепи антитела; третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотные последовательности вариабельной области тяжелой цепи антитела и константной области легкой цепи антитела; и четвертый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
12. Способ по п. 1, где полипептидный мультимер представляет собой полиспецифическое антитело.
13. Способ по п. 12, где полиспецифическое антитело представляет собой биспецифическое антитело.
14. Способ по п. 1, который включает первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, и где первый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность антигенсвязывающей области рецептора и аминокислотную последовательность Fc домена антитела и второй полипептид включает аминокислотную последовательность Fc домена антитела.
15. Способ очистки полипептидного мультимера, который включает первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, или помимо первого и второго полипептидов мультимер включает один или два третьих полипептида, обладающих антигенсвязывающей активностью, или помимо первого, второго и третьего полипептидов мультимер включает четвертый полипептид, обладающий антигенсвязывающей активностью, и способ включает стадии:
(a) экспрессии ДНК, которая кодирует первый полипептид, обладающий антигенсвязывающей активностью, и ДНК, которая кодирует второй полипептид, обладающий антигенсвязывающей активностью, или экспрессии ДНК, которая кодирует первый, второй и третий полипептиды, обладающие антигенсвязывающей активностью, или экспрессии ДНК, которая кодирует первый, второй, третий и четвертый полипептиды, обладающие антигенсвязывающей активностью; и
(b) сбора продукта экспрессии стадии (а) с помощью аффинной хроматографии с белком А,
где первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, включают аминокислотную последовательность Fc домена антитела или аминокислотную последовательность константной области тяжелой цепи антитела;
где Fc домен антитела или константная область тяжелой цепи антитела получены из человеческого IgG; и
где аминокислотная последовательность Fc домена антитела или константной области тяжелой цепи антитела модифицирована следующим способом (1) и (2):
(1) способом модификации аминокислотного остатка в положении 435 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, и аминокислотного остатка в положении 435 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в гистидин (Н) и аргинин (R) соответственно или в аргинин (R) и гистидин (Н) соответственно; и
(2) способом модификации, включающим по меньшей мере один из указанных ниже способов модификации (i)-(iii):
(i) способ модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда; и модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда; а также модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, на аминокислотные остатки, имеющие электрический заряд, противоположный заряду аминокислотных остатков в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью;
(ii) способ модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда; и модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда; а также модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в аминокислотные остатки, имеющие электрический заряд, противоположный заряду аминокислотных остатков в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью;
и
(iii) способ модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда; и модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, с сохранением того же электрического заряда; а также модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в аминокислотные остатки, имеющие электрический заряд, противоположный заряду аминокислотных остатков в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью.
16. Способ по п. 15, в котором указанные аминокислотные остатки, имеющие тот же электрический заряд, выбраны из аминокислотных остатков, входящих в следующие группы (а) или (b), и указанные аминокислотные остатки, имеющие противоположный электрический заряд, выбраны из каждой из следующих групп (а) или (b):
(a) глутаминовая кислота (Е), аспарагиновая кислота (D); или
(b) лизин (K), аргинин (R), гистидин (Н).
17. Способ по п. 15 или 16, при котором указанные способы модификации (2) (i)-(iii) представляют собой следующие способы модификации (i)-(iii):
(i) способ модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно; и модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; или способ модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; и модификации аминокислотных остатков в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно;
(ii) способ модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно; и модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; или
способ модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; и модификации аминокислотных остатков в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно; и
(iii) способ модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно; и модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; или
способ модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, в глутаминовую кислоту (Е) или аспарагиновую кислоту (D) соответственно; и модификации аминокислотных остатков в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, в лизин (K), аргинин (R) или гистидин (Н) соответственно.
18. Способ по пп. 15-17, где один или более аминокислотных остатков в первом полипептиде, обладающем антигенсвязывающей активностью, или втором полипептиде, обладающем антигенсвязывающей активностью, были модифицированы для увеличения или уменьшения способности связывать белок А первым полипептидом, обладающим антигенсвязывающей активностью, или вторым полипептидом, обладающим антигенсвязывающей активностью.
19. Способ по пп. 15-17, где один или более аминокислотных остатков в первом полипептиде, обладающем антигенсвязывающей активностью, или втором полипептиде, обладающем антигенсвязывающей активностью, были модифицированы для увеличения способности связывать белок А или первым полипептидом, обладающим антигенсвязывающей активностью, или вторым полипептидом, обладающим антигенсвязывающей активностью, и для уменьшения способности связывать белок А другим полипептидом.
20. Способ по любому из пп. 15-19, где чистота собранного полипептидного мультимера составляет 95% или более.
21. Способ по пп. 15-19, где первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, включают аминокислотную последовательность Fc домена антитела или аминокислотную последовательность константной области тяжелой цепи антитела.
22. Способ по п. 15, где первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, включают аминокислотную последовательность вариабельной области тяжелой цепи антитела.
23. Способ по п. 22, где по меньшей мере один аминокислотный остаток был модифицирован в аминокислотных последовательностях FR1, CDR2 и FR3 вариабельной области тяжелой цепи антитела.
24. Способ по п. 15, где третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
25. Способ по п. 15, где по меньшей мере один третий или четвертый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
26. Способ по п. 15, где первый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотные последовательности вариабельной области легкой цепи антитела и константной области тяжелой цепи антитела; второй полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность тяжелой цепи антитела; третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотные последовательности вариабельной области тяжелой цепи антитела и константной области легкой цепи антитела; и четвертый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
27. Способ по п. 15, где полипептидный мультимер представляет собой полиспецифическое антитело.
28. Способ по п. 27, где полиспецифическое антитело представляет собой биспецифическое антитело.
29. Полипептидный мультимер со способностью связывать белок А, который включает первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, причем способность связывать белок А отличается для первого полипептида, обладающего антигенсвязывающей активностью, и второго полипептида, обладающего антигенсвязывающей активностью,
где первый полипептид, обладающий антигенсвязывающей активностью, или второй полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность Fc домена антитела или аминокислотную последовательность константной области тяжелой цепи антитела,
где Fc домен антитела или константная область тяжелой цепи антитела получены из человеческого IgG; и
обладает следующими признаками (1) и (2):
(1) аминокислотный остаток в положении 435 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, и аминокислотный остаток в положении 435 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, представляют собой гистидин (Н) и аргинин (R) соответственно или аргинин (R) и гистидин (Н) соответственно;
(2) обладает по меньшей мере одним из следующих признаков (i)-(iii):
(i) аминокислотные остатки в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, имеют одинаковый электрический заряд;
аминокислотные остатки в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, имеют одинаковый электрический заряд;
аминокислотные остатки в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, имеют электрический заряд, противоположный заряду аминокислотных остатков в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью;
(ii) аминокислотные остатки в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, имеют одинаковый электрический заряд;
аминокислотные остатки в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, имеют одинаковый электрический заряд;
аминокислотные остатки в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, имеют электрический заряд, противоположный заряду аминокислотных остатков в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью; и
(iii) аминокислотные остатки в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, имеют одинаковый электрический заряд;
аминокислотные остатки в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, имеют одинаковый электрический заряд;
аминокислотные остатки в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, имеют электрический заряд, противоположный заряду аминокислотных остатков в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью;
где указанные аминокислотные остатки, имеющие одинаковый электрический заряд, выбраны из аминокислотных остатков, входящих в следующие группы (а) или (b), и указанные аминокислотные остатки, имеющие противоположный электрический заряд, выбраны из каждой из следующих групп (а) или (b):
(a) глутаминовая кислота (Е), аспарагиновая кислота (D); или
(b) лизин (K), аргинин (R), гистидин (Н).
30. Полипептидный мультимер по п. 29, где существует различие между рН растворителя для элюирования первого полипептида, обладающего антигенсвязывающей активностью, из белка А и рН растворителя для элюирования второго полипептида, обладающего антигенсвязывающей активностью, из белка А.
31. Полипептидный мультимер по п. 29 или 30, где (i)-(iii) признаки (2), представляют собой следующие (i)-(iii):
(i) аминокислотные остатки в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, представляют собой лизин (K), аргинин (R) или гистидин (Н);
аминокислотные остатки в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, представляют собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D);
или
аминокислотные остатки в положениях 356 и 439 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, представляют собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D);
аминокислотные остатки в положениях 356 и 439 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, представляют собой лизин (K), аргинин (R) или гистидин (Н);
(ii) аминокислотные остатки в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, представляют собой лизин (K), аргинин (R) или гистидин (Н);
аминокислотные остатки в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, представляют собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D);
или
аминокислотные остатки в положениях 357 и 370 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, представляют собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D);
аминокислотные остатки в положениях 357 и 370 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, представляют собой лизин (K), аргинин (R) или гистидин (Н);
(iii) аминокислотные остатки в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, представляют собой лизин (K), аргинин (R) или гистидин (Н);
аминокислотные остатки в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, представляют собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D);
или
аминокислотные остатки в положениях 399 и 409 (EU нумерация) в первом полипептиде, обладающем антигенсвязывающей активностью, представляют собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D); аминокислотные остатки в положениях 399 и 409 (EU нумерация) во втором полипептиде, обладающем антигенсвязывающей активностью, представляют собой лизин (K), аргинин (R) или гистидин (Н).
32. Полипептидный мультимер по пп. 29-31, где первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, обладающий антигенсвязывающей активностью, включают аминокислотную последовательность вариабельной области тяжелой цепи антитела и по меньшей мере один модифицированный аминокислотный остаток в аминокислотных последовательностях FR1, CDR2 и FR3 вариабельной области тяжелой цепи.
33. Полипептидный мультимер по пп. 29-31, который дополнительно включает один или два третьих полипептида, обладающих антигенсвязывающей активностью.
34. Полипептидный мультимер по п. 33, где третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
35. Полипептидный мультимер по п. 33 или 34, который дополнительно включает четвертый полипептид, обладающий антигенсвязывающей активностью.
36. Полипептидный мультимер по п. 35, где по меньшей мере один третий или четвертый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
37. Полипептидный мультимер по п. 35, где первый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотные последовательности вариабельной области легкой цепи антитела и константной области тяжелой цепи антитела; второй полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность тяжелой цепи антитела; третий полипептид, обладающий антигенсвязывающей активностью, включает аминокислотные последовательности вариабельной области тяжелой цепи антитела и константной области легкой цепи антитела; и четвертый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность легкой цепи антитела.
38. Полипептидный мультимер по пп. 29-37, который представляет собой полиспецифическое антитело.
39. Полипептидный мультимер по п. 38, где полиспецифическое антитело представляет собой биспецифическое антитело.
40. Полипептидный мультимер по пп. 29-37, который включает первый полипептид, обладающий антигенсвязывающей активностью, и второй полипептид, где первый полипептид, обладающий антигенсвязывающей активностью, включает аминокислотную последовательность антигенсвязывающей области рецептора и аминокислотную последовательность Fc домена антитела и второй полипептид включает аминокислотную последовательность Fc домена антитела.
41. Нуклеиновая кислота, кодирующая полипептид, который составляет полипептидный мультимер по любому из пп. 29-40.
42. Вектор для экспрессии полипептидного мультимера по пп. 15 и 30-40, содержащий нуклеиновую кислоту по п. 41.
43. Клетка, предназначенная для получения полипептидного мультимера по пп. 29-38 и включающая нуклеиновую кислоту по п. 41 или вектор по п. 42.
44. Фармацевтическая композиция для лечения заболеваний человека, связанных с антигенами, с которыми специфически взаимодействует полипептидный мультимер по пп. 29-38, включающая полипептидный мультимер по любому из пп. 29-38 в качестве действующего ингредиента, которая вводится в дозе от 0,001 до 100,000 мг в расчете на одного пациента.
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| WO 2008090960 A1, 31.07.2008 | |||
| WO 2006113767 A2, 26.10.2006 | |||
| БИСПЕЦИФИЧЕСКАЯ МОЛЕКУЛА АНТИТЕЛА ДЛЯ ЛИЗИСА ОПУХОЛЕВЫХ КЛЕТОК, СПОСОБ ПОЛУЧЕНИЯ F(AB') 2 ФРАГМЕНТА БИСПЕЦИФИЧЕСКОЙ МОЛЕКУЛЫ АНТИТЕЛА, МОНОКЛОНАЛЬНОЕ АНТИТЕЛО (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, ФАРМАЦЕВТИЧЕСКИЙ НАБОР ДЛЯ ЛИЗИСА ОПУХОЛЕВЫХ КЛЕТОК (ВАРИАНТЫ), СПОСОБ ЛИЗИСА ОПУХОЛЕВЫХ КЛЕТОК EX VIVO ПРИ АУТОГЕННОЙ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА | 1994 |
|
RU2203319C2 |
Авторы
Даты
2017-01-10—Публикация
2010-12-24—Подача