Родственные заявки
[01] В данной заявке на изобретение испрашивается приоритет по заявке на патент США с регистрационным номером № 62/077127, поданной 7 ноября 2014 г., по заявке на патент США с регистрационным номером № 62 62/115228, поданной 12 февраля 2015 г., и по заявке на патент США с регистрационным номером № 62/119540, поданной 23 февраля 2015 г., содержание которых во всей полноте включено в данное описание посредством ссылки.
Область техники, к которой относится изобретение
[02] Настоящее изобретение относится к композициям, содержащим апилимод, и к способам их использования при лечении меланомы.
Уровень техники изобретения
[03] Меланома представляет собой тяжелую форму онкологического заболевания кожи, которая развивается в клетках (меланоцитах), придающих цвет нашей коже. Меланома является шестым наиболее распространенным онкологическим заболеванием в Соединенных Штатах, и число случаев меланомы, диагностируемых ежегодно, растет быстрее, чем число случаев любого другого онкологического заболевания. Примерно 73870 новых случаев инвазивной меланомы будут диагностированы в США в 2015 году. Приблизительно 9940 человек умрут от меланомы в 2015 году. На долю меланомы приходится менее двух процентов случаев онкологических заболеваний кожи, однако она является причиной подавляющего большинства смертей от онкологического заболевания кожи. В течение жизни у 1 из 50 мужчин и женщин диагностируется меланома кожи.
[04] Меланома на ранней стадии может быть полностью удалена путем проведения хирургической операции в пораженной области. Однако после метастазирования меланомы ее лечение значительно осложняется. В большинстве случаев после метастазирования невозможно полностью устранить или излечить онкологическое заболевание. В зависимости от того, где и насколько распространены метастазы, лечение может включать химиотерапию, хирургию, генную терапию, иммунотерапию, лучевую терапию и их комбинации. Сохраняется потребность в более эффективных и менее токсичных вариантах лечения меланомы.
Сущность изобретения
[05] Настоящее изобретение частично основывается на удивительном открытии, что апилимод представляет собой высоко цитотоксичный агент по отношению к клеткам меланомы, в частности, к клеткам меланомы, которые устойчивы к другим методам лечения и, обладает еще большей активностью в комбинации с некоторыми химиотерапевтическими агентами.
[06] В соответствии с одним аспектом, в настоящем изобретении предлагается композиция для лечения меланомы у нуждающегося в этом субъекта, при этом указанная композиция содержит терапевтически эффективное количество апилимода или его фармацевтически приемлемой соли, сольвата, клатрата, гидрата, полиморфа, пролекарства, аналога или производного. В одном варианте осуществления настоящего изобретения апилимод представляет собой апилимод димезилат. В вариантах осуществления настоящего изобретения композиция представляет собой пероральную лекарственную форму или лекарственную форму, подходящую для внутривенного введения. В вариантах осуществления настоящего изобретения меланома является меланомой на III или IV стадии, представляет собой рефрактерную форму меланомы или является злокачественной или метастатической меланомой.
[07] В вариантах осуществления настоящего изобретения композиция дополнительно включает, по меньшей мере, один дополнительный активный агент. В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент представляет собой терапевтический агент или нетерапевтический агент или их комбинацию. В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент является терапевтическим агентом. В вариантах осуществления настоящего изобретения терапевтический агент выбран из ингибитора протеинкиназы, антинеопластического агента на основе платины, ингибитора топоизомеразы, ингибитора метаболизма нуклеозидов, алкилирующего агента, интеркалирующего агента, связывающего тубулин агента, ингибитора пути PD-1/PDL-1 и их комбинаций. В вариантах осуществления настоящего изобретения терапевтический агент выбран из группы, состоящей из вемурафениба, дакарбазина, темозоломида, Nab-паклитаксела, кармустина, цисплатина, карбоплатина, винбластина, ипилимумаба, пембролизумаба (Keytruda™)), интерлейкина-2 (IL-2, Proleukin™), пембролизумаба (Keytruda™), дабрафениба (Tafinlar™), вемурафениба (Zelboraf™), траметиниба (Mekinist™), дазатиниба (Sprycel™), иматиниба (Gleevec™) и нилотиниба (Tasigna™) и их комбинаций. В вариантах осуществления настоящего изобретения терапевтический агент представляет собой вемурафениб. В вариантах осуществления настоящего изобретения терапевтический агент является ингибитором пути PD-1/PDL-1. В вариантах осуществления настоящего изобретения ингибитор пути PD-1/PDL-1 выбран из пембролизумаба (Keytruda), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (MK-3475), MSB0010718C и MEDI4736.
[08] В вариантах осуществления настоящего изобретения композиция дополнительно включает нетерапевтический агент, выбранный с целью ослабления одного или нескольких побочных эффектов апилимода. В вариантах осуществления настоящего изобретения нетерапевтический агент выбран из группы, состоящей из ондансетрона, гранисетрона, доласетрона и палоносетрона. В вариантах осуществления настоящего изобретения нетерапевтический агент выбран из группы, состоящей из пиндолола и рисперидона.
[09] В соответствии с одним аспектом, в настоящем описании предлагается способ лечения меланомы у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту терапевтически эффективного количества композиции, включающей апилимод, причем апилимод представляет собой собственно апилимод (то есть свободное основание апилимода) или его фармацевтически приемлемую соль, сольват, клатрат, гидрат, полиморф, пролекарство, аналог или производное. В одном варианте осуществления настоящего изобретения апилимод представляет собой апилимод димезилат.
[10] В вариантах осуществления настоящего изобретения способ дополнительно включает введение указанному субъекту, по меньшей мере, одного дополнительного активного агента. По меньшей мере, один дополнительный активный агент может быть терапевтическим агентом или нетерапевтическим агентом или их комбинацией. По меньшей мере, один дополнительный активный агент можно вводить в виде единичной дозы с апилимодом или в виде отдельной лекарственной формы.
[11] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент представляет собой ингибитор тирозинкиназы. В вариантах осуществления настоящего изобретения ингибитор тирозинкиназы представляет собой ингибитор фермента B-Raf. В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент представляет собой вемурафениб. В одном варианте осуществления настоящего изобретения способ включает введение апилимода и вемурафениба совместно по схеме комбинированной терапии, с целью лечения меланомы. В одном варианте осуществления настоящего изобретения меланома представляет собой меланому в поздней стадии. В одном варианте осуществления настоящего изобретения меланома в поздней стадии устойчива к вемурафенибу.
[12] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент представляет собой терапевтический агент, выбранный из группы, состоящей из ингибитора протеинкиназы, антинеопластического агента на основе платины, ингибитора топоизомеразы, ингибитора метаболизма нуклеозидов, алкилирующего агента, интеркалирующего агента, связывающего тубулин агента, ингибитора BRAF и их комбинаций. В вариантах осуществления настоящего изобретения терапевтический агент представляет собой ингибитор протеинкиназы, алкилирующий агент, интеркалирующий агент, связывающий тубулин агент и их комбинации. В вариантах осуществления настоящего изобретения терапевтический агент выбран из группы, состоящей из вемурафениба, ибрутиниба, ритуксимаба, доксорубицина, винкристина, велкада и эверолимуса и их комбинаций. В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент представляет собой терапевтический агент, выбранный из вемурафениба, дакарбазина, темозоломида, Nab-паклитаксела, кармустина, цисплатина, карбоплатина, винбластина, ипилимумаба, пембролизумаба (Keytruda™)), интерлейкина-2 (IL-2, Proleukin™), пембролизумаба (Keytruda™), дабрафениба (Tafinlar™), вемурафениба (Zelboraf™), траметиниба (Mekinist™), дазатиниба (Sprycel™), иматиниба (Gleevec™) и нилотиниба (Tasigna™) и их комбинаций. В вариантах осуществления настоящего изобретения, по меньшей мере, одним дополнительным активным агентом является ингибитор Bcl-2. В одном варианте осуществления настоящего изобретения ингибитор Bcl-2 представляет собой ABT-199 или навитоклакс.
[13] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент является нетерапевтическим агентом, выбранным с целью ослабления одного или нескольких побочных эффектов апилимода. В одном варианте осуществления настоящего изобретения нетерапевтический агент выбран из группы, состоящей из ондансетрона, гранисетрона, доласетрона и палоносетрона. В вариантах осуществления настоящего изобретения нетерапевтический агент выбран из группы, состоящей из пиндолола и рисперидона.
[14] В вариантах осуществления настоящего изобретения композиция представляет собой пероральную лекарственную форму. В других вариантах осуществления настоящего изобретения композиция представляет собой лекарственную форму, пригодную для внутривенного введения. В одном варианте осуществления настоящего изобретения, когда лекарственная форма пригодна для внутривенного введения, введение осуществляется с помощью одной инъекции или с помощью капельницы. В других вариантах осуществления настоящего изобретения композиция представляет собой лекарственную форму, пригодную для местного нанесения в виде крема, лосьона или геля.
[15] В вариантах осуществления способов, приведенных в данном описании, указанным субъектом является человек, больной меланомой. В вариантах осуществления настоящего изобретения нуждающимся в лечении человеком, больным меланомой, является пациент, имеющий меланому в поздней стадии, злокачественную или метастатическую меланому. В вариантах осуществления настоящего изобретения нуждающимся в лечении человеком, больным меланомой, является пациент, онкологическое заболевание которого не поддается стандартному режиму химиотерапии. В вариантах осуществления настоящего изобретения нуждающимся в лечении человеком, больным меланомой, является человек, меланома которого рецидивировала после лечения с использованием стандартных режимов химиотерапии.
[16] В вариантах осуществления настоящего изобретения меланома выбрана из поверхностной распространяющейся меланомы, злокачественного лентиго, акральной лентигинозной меланомы и нодулярной меланомы. В одном варианте осуществления настоящего изобретения стандартная схема химиотерапии включает один или несколько терапевтических агентов, выбранных из группы, состоящей из дакарбазина, темозоломида, Nab-паклитаксела, кармустина, цисплатина, карбоплатина и винбластина. В одном варианте осуществления настоящего изобретения схема иммунотерапии включает один или несколько терапевтических агентов, выбранных из группы, состоящей из антител против CTLA4 (например, ипилимумаба); ингибиторов пути PD-1/PDL-1, в частности, пембролизумаба (Keytruda), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (МК-3475), MSB0010718C и MEDI4736; AMP-224 и интерлейкина-2 (IL-2, альдеслейкин, пролейкин). В одном варианте осуществления настоящего изобретения схема направленной терапии включает один или несколько терапевтических агентов, выбранных из группы, состоящей из ингибиторов BRAF (в частности, дабрафениба (Tafinlar) и вемурафениба (Zelboraf), ингибиторов MEK (в частности, траметиниба (Mekinist)) и ингибиторов KIT (в частности, дазатиниба (Sprycel), иматиниба (Gleevec) и нилотиниба (Tasigna)).
[17] В вариантах осуществления настоящего изобретения указанный способ представляет собой способ лечения меланомы с использованием комбинированной терапии, включающей апилимод и химиотерапевтическое лечение меланомы. В одном варианте осуществления настоящего изобретения апилимод вводят в качестве дополнительной терапии к химиотерапевтическому лечению. В вариантах осуществления настоящего изобретения схема химиотерапевтического лечения включает один или несколько ингибиторов пути PD-1/PDL-1, выбранных из пембролизумаба (Keytruda), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (MK-3475), MSB0010718C и MEDI4736. В вариантах осуществления настоящего изобретения схема химиотерапевтического лечения включает один или более из дакарбазина, темозоломида, Nab-паклитаксела, кармустина, цисплатина, карбоплатина и винбластина, с целью лечения злокачественной или метастатической меланомы. В вариантах осуществления настоящего изобретения схема химиотерапевтического лечения включает один или более из вемурафениба, дабрафениба и траметиниба, с целью лечения метастатической меланомы. В одном из вариантов осуществления настоящего изобретения схема химиотерапевтического лечения включает один или более из интерлейкина-2 и ипилимумаба с высокой дозой.
[18] В вариантах осуществления настоящего изобретения раскрываются способы индуцирования или усиления аутофагии или апоптоза в клетке меланомы. В соответствии с данным вариантом осуществления настоящего изобретения, клетка меланомы может находиться в условиях in vitro или in vivo. В одном варианте осуществления настоящего изобретения клетка меланомы находится условиях in vitro и получена из клеток Yulac614, RPM19951, MEL-JUSO, SK-MEL-2, SK-MEL-31, A101D и A2058. В одном варианте осуществления настоящего изобретения клетка меланомы находится в условиях in vivo у млекопитающего в месте, отличном от кожи. В одном варианте осуществления настоящего изобретения клетка меланомы является меланомой в поздней стадии. В одном варианте осуществления настоящего изобретения клетка меланомы представляет собой метастатическую клетку или клетку, которая метастазировала.
[19] В данном изобретении также предлагается способ идентификации имеющего меланому пациента для лечения с использованием комбинированной терапией, включающей апилимод и вемурафениб, при этом указанный способ включает исследование взятого у субъекта биологического образца онкологического заболевания на наличие одной или нескольких мутаций белка B600F BRAF, мутаций белка V600K BRAF или их генетических эквивалентов, где субъект, имеющий любую из указанных мутаций, идентифицируется как пациент для лечения с использованием комбинированной терапией, включающей апилимод и вемурафениб.
Краткое описание чертежей
[20] Фигура 1: Скрининг клеток меланомы Yulac614 с помощью библиотеки из 500 неутвержденных лекарств с вемурафенибом и без вемурафениба (6 мкМ) идентифицировал апилимод в качестве лекарственного средства, которое в сочетании с вемурафенибом проявляет синергическую активность.
[21] Фигура 2: Построенная по 10 точкам кривая зависимости эффекта от концентрации для одного лишь вемурафениба (58,6-30000 нМ) (черная линия) или вместе с апилимодом (500 нм) (серая линия).
[22] Фигура 3: Значения IC50 в устойчивых к вемурафенибу клеточных линиях, подвергнутых обработке одним лишь вемурафенибом (серые прямоугольники) или комбинацией вемурафениба и апилимода (черные прямоугольники).
[23] Фигура 4: Значения IC50 в устойчивых к вемурафенибу клеточных линиях, подвергнутых обработке одним лишь вемурафенибом (серые прямоугольники) или комбинацией вемурафениба и апилимода (черные прямоугольники).
Подробное описание изобретения
[24] В настоящем изобретении раскрываются композиции и способы, связанные с использованием апилимода для лечения меланомы у субъекта, предпочтительно человека, нуждающегося в подобном лечении. Настоящее описание в общем случае относится к новым применениям апилимода, основанным на неожиданном открытии цитотоксической активности апилимода по отношению к ряду раковых клеток, таких как меланома. Кроме того, в настоящем изобретении предлагаются новые терапевтические подходы к лечению меланомы, основанные на комбинированной терапии с использованием апилимода и, по меньшей мере, одного дополнительного терапевтического агента. Комбинированные терапии, приведенные в данном описании, используют уникальную цитотоксическую активность апилимода, которая может обеспечить синергетический эффект в сочетании с другими терапевтическими агентами, включая, например, противоопухолевые средства.
[25] Используемый в данном описании термин «апилимод» может относиться к собственно апилимоду (т.е. свободному основанию апилимода) или может включать фармацевтически приемлемые соли, сольваты, клатраты, гидраты, полиморфы, пролекарства, аналоги или производные апилимода, как описано ниже. В вариантах осуществления настоящего изобретения апилимод представляет собой апилимод димезилат. Структура апилимода показана в виде формулы I:
[26] Название апилимода в соответствии с классификацией IUPAC: (E)-4-(6-(2-(3-метилбензилиден)гидразинил)-2-(2-(пиридин-2-ил)этокси)пиримидин-4-ил)морфолин), а номер по CAS 541550-19-0.
[27] Апилимод может быть получен, например, в соответствии со способами, описанными в патентах США №№ 7923557 и 7863270 и WO 2006/128129.
[28] В данном описании термин «фармацевтически приемлемая соль» обозначает соль, образованную, например, из кислоты и основной группы композиции апилимода. Примеры солей включают, однако этим не ограничиваясь, такие соли как сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, безилат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (в частности, 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). В предпочтительном варианте соль апилимода включает метансульфонат.
[29] Термин «фармацевтически приемлемая соль» также относится к соли, полученной из композиции апилимода, имеющей кислотную функциональную группу, такую как функциональная группа карбоновой кислоты, и фармацевтически приемлемого неорганического или органического основания.
[30] Термин «фармацевтически приемлемая соль» также относится к соли, полученной из композиции апилимода, имеющей основную функциональную группу, такую как аминофункциональная группа, и фармацевтически приемлемой неорганической или органической кислоты.
[31] Соли приведенных в данном описании соединений могут быть синтезированы из исходного соединения обычными химическими способами, такими как способы, приведенные в монографии Pharmaceutical Salts: Properties, Selection, and Use, P. Hemrich Stalil (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, August 2002. В общем случае подобные соли могут быть получены путем взаимодействия исходного соединения с подходящей кислотой в воде или в органическом растворителе или в смеси указанных двух реагентов.
[32] Одна солевая форма приведенного в данном описании соединения может быть превращена в свободное основание и необязательно в другую солевую форму по способам, хорошо известным специалисту. Например, свободное основание можно получить, пропуская раствор соли через колонку, содержащую неподвижную фазу амина (например, через колонку Strata-NH2). В качестве альтернативы раствор соли в воде можно обработать бикарбонатом натрия с тем, чтобы разложить соли и осадить свободное основание. Затем свободное основание можно объединить с другой кислотой, используя обычные методы.
[33] В данном описании термин «полиморф» означает твердые кристаллические формы соединения по настоящему изобретению (в частности, апилимода) или его комплекса. Различные полиморфы одного и того же соединения могут проявлять разные физические, химические и/или спектроскопические свойства. Различные физические свойства включают в себя, однако этим не ограничиваясь, стабильность (например, к теплу или свету), прессуемость и плотность (важно при приготовлении композиций и продукта), а также скорости растворения (что может повлиять на биодоступность). Различия в стабильности могут быть результатом изменений химической активности (например, в результате различной окисляемости, так что лекарственная форма обесцвечивается быстрее в том случае, когда она состоит из одного полиморфа, чем в том случае, когда она состоит из другого полиморфа) или механических характеристик (например, таблетки крошатся при хранении, по мере того как кинетически предпочтительный полиморф превращается в термодинамически более стабильный полиморф) или в обоих случаях (например, таблетки одного полиморфа более подвержены разрушению при высокой влажности). Различные физические свойства полиморфов могут влиять на их технологическую обработку. Например, один полиморф более склонен к образованию сольватов или может оказаться, что его трудно отфильтровать или отмыть от примесей, чем другой полиморф, например, вследствие распределения его частиц по форме или размерам.
[34] В данном описании термин «гидрат» означает соединение по настоящему изобретению (например, апилимод) или его соль, дополнительно включающее стехиометрическое или нестехиометрическое количество воды, которая связана нековалентными межмолекулярными силами.
[35] В данном описании термин «клатрат» означает соединение по настоящему изобретению (в частности, апилимод) или его соль в форме кристаллической решетки, которая имеет пространства (например, каналы), которые содержат гостевую молекулу (например, растворитель или воду).
[36] В данном описании термин «пролекарство» означает производное приведенного в данном описании соединения (например, апилимода), которое может гидролизоваться, окисляться или иным образом реагировать в биологических условиях (in vitro или in vivo) с образованием соединения по настоящему изобретению. Пролекарства могут стать активными только в результате подобной реакции, протекающей в биологических условиях, или же они могут быть активны в своих не прореагировавших формах. Примеры пролекарств, рассматриваемых в данном изобретении, включают, однако этим не ограничиваясь, аналоги или производные приведенного в данном описании соединения (например, апилимода), которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые аналоги фосфата. Другие примеры пролекарств включают производные соединений любой из формул, раскрытых в данном описании, которые включают фрагменты -NO, -NO2, -ONO или -ONO2. Как правило, пролекарства могут быть получены с использованием хорошо известных методов, таких как описанные в Burgerʹs Medicinal Chemistry and Drug Discovery (1995) 172-178, 949-982 (Manfred E. Wolff ed., 5th ed).
[37] В данном описании термин «сольват» или «фармацевтически приемлемый сольват» означает сольват, образованный путем связывания одной или нескольких молекул растворителя с одним из соединений, приведенных в данном описании (например, с апилимодом). Термин сольват включает гидраты (например, полугидрат, моногидрат, дигидрат, тригидрат, тетрагидрат и т.п.).
[38] В данном описании термин «аналог» относится к химическому соединению, которое структурно сходно с другим соединением, но несколько отличается по составу (в результате замещения одного атома атомом другого элемента или в присутствии конкретной функциональной группа или в результате замещения одной функциональной группы другой функциональной группой). Таким образом, аналог представляет собой соединение, которое сходно или сопоставимо по своей функции и внешнему виду, но не по структуре или происхождению, со сравниваемым соединением. В данном описании термин «производное» относится к соединениям, которые имеют сходную сердцевинную структуру и замещены различными группами, как указано в данном описании.
Меланома
[39] Меланома - тип онкологического заболевания кожи, которое возникает из меланоцитов (пигментсодержащих клеток кожи), которые находятся в эпидермисе кожи. Эпидермис представляет собой верхний или наружный слой двух основных слоев клеток, которые составляют кожу и отделены от более глубоких слоев кожи базальной мембраной. Когда онкологическое заболевание кожи, такое как меланома, прогрессирует, оно обычно проникает в эпидермис и прорастает через мембрану в более глубокие слои кожи, получая доступ к кровоснабжению, что позволяет опухоли метастазировать.
[40] Существует четыре основных типа меланомы. Три из них возникают in situ: это означает, что они занимают только верхние слои кожи и иногда становятся инвазивными; четвертый тип изначально является инвазивным. Инвазивные меланомы представляют собой более тяжелую форму, поскольку они глубже проникли в кожу и могут уже распространиться в другие области организма.
[41] Поверхностная распространяющаяся меланома, безусловно, является наиболее распространенным типом, на который приходится приблизительно 70% всех случаев. Данный тип чаще всего встречается у молодых людей. Как следует из названия, указанная меланома довольно долго развивается вдоль верхнего слоя кожи, прежде чем проникнуть глубже.
[42] Злокачественное лентиго похоже на тип поверхностной распространяющейся меланома, т.к. оно также довольно долго остается вблизи поверхности кожи и обычно выглядит как плоское или слегка приподнятое пятнистое желтовато-коричневое, коричневое или темно-коричневое окрашивание. Данный тип in situ меланомы чаще всего встречается у пожилых людей и возникает на хронически подверженной воздействию солнца, поврежденной коже на лице, ушах, руках и верхних частях туловища. Когда данное онкологическое заболевание становится инвазивным, его называют меланомой типа злокачественного лентиго.
[43] Акральная лентигинозная меланома также распространяется по поверхности, прежде чем проникать глубже. Она совершенно отличается от других типов меланомы, несмотря на то, что обычно выглядит как черное или коричневое изменение цвета под ногтями или на подошвах ног или ладоней рук. Этот тип меланомы иногда встречается у темнокожих людей и часто может развиваться быстрее, чем поверхностная распространяющаяся меланома и злокачественное лентиго. Это самая распространенная меланома среди афроамериканцев и азиатов и реже встречается у кавказцев.
[44] Нодулярная меланома обычно инвазивна уже в то время, когда она впервые диагностирована. Злокачественность распознается, когда нодулярная меланома превращается в шишку. Обычно она имеет черный цвет, но иногда она окрашена в синий, серый, белый, коричневый, коричневый, красный цвет или окрашена в тон кожи.
Методы лечения
[45] В настоящем изобретении приведены способы лечения меланомы у нуждающегося в этом субъекта путем введения указанному субъекту терапевтически эффективного количества апилимода или его фармацевтически приемлемой соли, сольвата, клатрата, гидрата, полиморфа, пролекарства, аналога или производного. В вариантах осуществления настоящего изобретения апилимод представляет собой апилимод димезилат. Кроме того, в настоящем изобретении раскрывается применение апилимода при приготовлении лекарственного средства, предназначенного для лечения меланомы.
[46] В контексте приведенных в настоящем описании способов количество апилимода, вводимого указанному субъекту, представляет собой терапевтически эффективное количество. Термин «терапевтически эффективное количество» относится к количеству, достаточному для лечения, облегчения симптома, снижения тяжести, или достаточному для стабилизации или регресса меланомы у подвергаемого лечению субъекта, или достаточному для усиления или улучшения терапевтического эффекта от другого терапевтического агента, такого как вемурафениб.
[47] В соответствии с приведенными в данном описании способами «субъект, нуждающийся в лечении», представляет собой пациента, имеющего меланому. В соответствии с одним аспектом, пациентом является человек со злокачественной меланомой или меланомой в поздней стадии. В этом контексте «стадия» относится к клинической стадии онкологического заболевания. Например, меланомой в стадии 0-2 или меланомой в стадии 3 или стадии 4. В одном варианте осуществления настоящего изобретения пациентом является человек, имеющий меланому в стадии 3 или стадии 4. Нуждающимся субъектом может быть пациент, который «нечувствителен» или «невосприимчив» к существующим методам терапии, например, онкологическое заболевание субъекта может быть нечувствительным или трудно поддающимся лечению при использовании вемурафениба. В данном контексте термины «нечувствительность» и «невосприимчивость» относятся к ответу пациента на терапию как не являющемуся клинически значимым, в соответствии с определением клинической эффективности в стандартной медицинской практике.
Комбинированная терапия
[48] В данном описании также приведены способы, включающие комбинированную терапию с апилимодом. В данном описании термин «комбинированная терапия» или «совместная терапия» включает введение терапевтически эффективного количества основного терапевтического агента (например, апилимода), по меньшей мере, с одним дополнительным терапевтическим агентом, в качестве компонента специфического режима лечения, предназначенного для достижения положительного эффекта от совместного действия основного терапевтического агента и дополнительного терапевтического агента. «Комбинированная терапия» не включает введение двух или нескольких лечебных соединений в рамках отдельных схем монотерапии, которые случайно и произвольно приводят к благоприятному эффекту, который не предполагался или не прогнозировался.
[49] В одном варианте осуществления настоящего изобретения указанный способ представляет собой способ лечения меланомы с использованием комбинированной терапии, включающей апилимод и программу химиотерапии для лечения меланомы. В одном варианте осуществления настоящего изобретения программа химиотерапии выбрана из дакарбазина, темозоломида, Nab-паклитаксела, кармустина, цисплатина, карбоплатина, винбластина и их комбинаций.
[50] В вариантах осуществления настоящего изобретения, по меньшей мере, одним дополнительным активным агентом может быть терапевтический агент, например, противораковый агент или химиотерапевтический агент против онкологического заболевания, или нетерапевтический агент и их комбинации. Что касается терапевтических агентов, то благоприятный эффект комбинации включает, однако этим не ограничиваясь, совместное фармакокинетическое или фармакодинамическое действие, которое является следствием комбинации терапевтически активных соединений. Что касается нетерапевтических агентов, то полезный эффект комбинации может относиться к уменьшению токсичности, побочного эффекта или неблагоприятного события, связанного с имеющимся в комбинации терапевтически активным агентом.
[51] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный агент является нетерапевтическим агентом, который ослабляет одно или несколько побочных эффектов апилимода, при этом один или несколько побочных эффектов выбраны из любого из тошноты, рвоты, головной боли, головокружения, вестибулярных нарушений, сонливости и стресса. В соответствии с одним аспектом данного варианта осуществления настоящего изобретения, нетерапевтический агент является антагонистом рецептора серотонина, также известного как рецепторы 5-гидрокситриптамина, или рецепторы 5-HT. В соответствии с одним аспектом, нетерапевтический агент является антагонистом рецептора 5-НТ3 или 5-НТ1а. В соответствии с одним аспектом, нетерапевтический агент выбран из группы, состоящей из ондансетрона, гранисетрона, доласетрона и палоносетрона. В соответствии с другим аспектом, нетерапевтический агент выбран из группы, состоящей из пиндолола и рисперидона.
[52] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный агент является терапевтическим агентом. В одном варианте осуществления настоящего изобретения терапевтическим агентом является противораковый агент. В вариантах осуществления настоящего изобретения противораковым агентом является вемурафениб. В одном из вариантов осуществления настоящего изобретения апилимод вводят вместе с вемурафенибом в одной лекарственной форме или в отдельных лекарственных формах. В одном варианте осуществления настоящего изобретения лекарственная форма представляет собой пероральную лекарственную форму. В другом варианте осуществления настоящего изобретения лекарственная форма пригодна для внутривенного введения.
[53] В вариантах осуществления настоящего изобретения противораковый агент представляет собой лечебное средство, которое одобрено для применения при лечении меланомы. Не ограничивающие примеры подобных лекарственных средств включают альдеслейкин, дабрафениб, дакарбазин, DTIC-Dome (даркарбазин), интрон А (рекомбинантный интерферон Alsfa-2b), ипилимумаб, кейтруда (пембролизумаб), мекинист (траметиниб), ниволумаб, пегинтерферон альфа-2b, PEG-Intron (пэгинтерферон альфа-2b), пембролизумаб, пролейкин (альдеслейкин), рекомбинантный интерферон альфа-2b, силатрон (пегонтерферон альфа-2b), тафинлар (дабрафениб), траметиниб, вемурафениб, иервой (ипилимумаб), зелбораф (вермурафениб).
[54] В вариантах осуществления настоящего изобретения противораковый агент выбран из ингибитора EZH2, в частности, EPZ-6438. В одном варианте осуществления настоящего изобретения противораковый агент выбран из таксола, винкристина, доксорубицина, темсиролимуса, карбоплатина, офатумумаба, ритуксимаба и их комбинаций.
[55] В вариантах осуществления настоящего изобретения противораковым агентом является ингибитор Bcl-2. В одном варианте осуществления настоящего изобретения ингибитор Bcl-2 представляет собой ABT-199 или навитоклакс.
[56] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный агент выбран из хлорамбуцила, ифосфамида, доксорубицина, месалазина, талидомида, леналидомида, темсиролимуса, эверолимуса, флударабина, фостаматиниба, паклитаксела, доцетаксела, офатумумаба, ритуксимаба, дексаметазона, преднизолона, CAL-101, ибритумомаба, тозитумомаба, бортезомиба, пентостатина, эндостатина или их комбинаций.
[57] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный агент представляет собой моноклональное антитело, такое как, например, алемтузумаб, бевацизумаб, катумаксомаб, цетуксимаб, эдреколомаб, гемтузумаб, офатумумаб, панитумумаб, ритуксимаб, трастузумаб, экулизумаб, эфализумаб, муромаб-CD3, натализумаб, адалимумаб, афелимомаб, цертолизумаб пегол, голимумаб, инфликсимаб, базиликсимаб, канакинумаб, даклизумаб, меполизумаб, тоцилизумаб, устекинумаб, ибритумомаб тиуксетан, тозитумомаб, абаговомаб, адекатумумаб, алемтузумаб, моноклональное антитело Xmab2513 против CD30, моноклональное антитело MetMab против МЕТ, аполизумаб, апомаб, арцитумомаб, базиликсимаб, биспецифическое антитело 2B1, блинатумомаб, брентуксимаб ведотин, капромаб пендетид, циксутумумаб, даудиксимаб, конатумумаб, дацетузумаб, деносумаб, экулизумаб, эпратузумаб, эртумаксомаб, этарацизумаб, фугитумумаб, фрезолимумаб, галиксимаб, ганитумаб, гемтузумаб озогамицин, глембатумумаб, ибритумомаб, инотузумаб озогамицин, ипилимумаб, лексатумумаб, линтузумаб, линтузумаб, лукатумумаб, мапатумумаб, матузумаб, милатузумаб, моноклональное антитело CC49, нецитумумаб, нимотузумаб, офатумумаб, oреговомаб, пертузумаб, рамакуримаб, ранибизумаб, сиплизумаб, сонепцизумаб, танезумаб, тозитумомаб, трастузумаб, тремелимумаб, тукотузумаб целмолейкин, велтузумаб, визилизумаб, волоциксимаб и залутумумаб.
[58] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный ингибитор представляет собой ингибитор BRAF, ингибитор МЕК, ингибитор PD-1/PD-L1 или ингибитор контрольной точки.
[59] В вариантах осуществления настоящего изобретения ингибитор пути PD-1/PDL-1 выбран из пембролизумаба (Keytruda), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (MK-3475), MSB0010718C и MEDI4736.
[60] В контексте комбинированной терапии введение апилимода может быть одновременным или последовательным по отношению к введению одного или нескольких дополнительных активных агентов. В вариантах осуществления настоящего изобретения введение различных компонентов комбинированной терапии может осуществляться с разной частотой. Один или несколько дополнительных агентов можно вводить до (например, за 5 мин, 15 мин, 30 мин, 45 мин, 1 час, 2 час, 4 час, 6 час, 12 час, 24 час, 48 час, 72 час, 96 час, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель), одновременно или после (например, через 5 мин, 15 мин, 30 мин, 45 мин, 1 час, 2 час, 4 час, 6 час, 12 час, 24 час, 48 час, 72 час, 96 час, 1 недели, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель) введения соединения по настоящему изобретению.
[61] Один или несколько дополнительных активных агентов могут быть составлены для совместного введения с апилимодом в одной лекарственной форме, как указано более подробно в данном описании. Один или несколько дополнительных активных агентов можно вводить отдельно от лекарственной формы, которая содержит апилимод. Когда дополнительный активный агент вводят отдельно от апилимода, он может вводиться тем же самым или другим путем, что и апилимод.
[62] Предпочтительно, введение апилимода в сочетании с одним или несколькими дополнительными агентами обеспечивает синергический ответ у подвергаемого лечению субъекта. В данном контексте термин «синергический» относится к эффективности комбинации, которая является более эффективной, чем аддитивные эффекты лишь одного из лекарственных средств. Синергический эффект комбинированной терапии может позволить использовать более низкие дозы и/или менее частое введение, по меньшей мере, одного агента в комбинации, по сравнению с его дозой и/или частотой вне комбинации. Дополнительные благоприятные эффекты комбинации могут проявляться в предотвращении или уменьшении вредных или нежелательных побочных эффектов, связанных с использованием любого одного из лекарственных средств в комбинации (также называют монотерапией).
[63] «Комбинированная терапия» также охватывает введение лечебного соединения в сочетании с одной или несколькими немедикаментозными терапиями (например, с хирургическим или лучевым лечением). В тех случаях, когда комбинированная терапия дополнительно включает немедикаментозное лечение, указанное немедикаментозное лечение можно проводить в любое подходящее время, при условии, что достигается благоприятный эффект от совместного действия комбинации лечебных соединений и немедикаментозного лечения. Например, в соответствующих случаях полезный эффект все же достигается, когда немедикаментозное лечение временно прекращают и не осуществляют введение лекарственных соединений, возможно, в течение нескольких дней или даже недель.
[64] В соответствии с любым из способов, приведенных в данном описании, терапевтически эффективное количество апилимода может находиться в пределах от приблизительно 0,001 мг/кг до приблизительно 1000 мг/кг, от приблизительно 0,01 мг/кг до приблизительно 100 мг/кг, от приблизительно 10 мг/кг до приблизительно 250 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 15 мг/кг; или в любом интервале, где нижний предел диапазона составляет любое количество от 0,001 мг/кг до 900 мг/кг, а верхний предел диапазона составляет любое количество от 0,1 мг/кг до 1000 мг/кг (например, 0,005 мг/кг и 200 мг/кг, 0,5 мг/кг и 20 мг/кг). Эффективные дозы также будут отличаться, как признано специалистами в данной области техники, в зависимости от заболеваний, лечение которых проводят, способа введения, использования наполнителя и возможности совместного использования с другими методами терапии, такими как использование других агентов. См., например, патент США № 7863270, который включен в данное описание посредством ссылки.
[65] В вариантах осуществления настоящего изобретения апилимод вводят, используя схемы дозирования 30-1000 мг/день (например, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275 или 300 мг/день) в течение, по меньшей мере, 1 недели (в частности, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 36, 48 или более недель). Предпочтительно, апилимод вводят, используя схемы дозирования 100-1000 мг/день в течение 4 или 16 недель. В качестве альтернативы или в дальнейшем апилимод вводят, используя схемы дозирования 100 мг-300 мг два раза в день в течение 8 недель или необязательно в течение 52 недель. Альтернативно или в дальнейшем апилимод вводят, используя схемы дозирования 50 мг-1000 мг два раза в день в течение 8 недель или необязательно в течение 52 недель.
[66] Терапевтически эффективное количество апилимода можно вводить один раз в день, от двух до пяти раз в день, вплоть до двух раз или вплоть до трех раз в день или вплоть до восьми раз в день. В вариантах осуществления настоящего изобретения апилимод вводят три раза в день, два раза в день, один раз в день, в виде цикла из четырнадцати дней подряд (четыре раза в день, три раза в день, или два раза в день, или один раз в день) и 7 дней перерыва в трехнедельном цикле, вплоть до пяти или семи дней (четыре раза в день, три раза в день, или два раза в день, или один раз в день) и с перерывом 14-16 дней в трехнедельном цикле, или один раз каждые два дня, или один раз в неделю, или один раз в каждые 2 недели, или один раз в каждые 3 недели.
[67] «Субъект» в контексте приведенных в данном описании способов, предпочтительно, является пациентом-человеком, но может также включать других млекопитающих. Млекопитающим может быть, например, любое млекопитающее, в частности, человек, примат, позвоночное животное, птица, мышь, крыса, домашняя птица, собака, кошка, корова, лошадь, коза, верблюд, овца или свинья. Термин «пациент» относится к субъекту-человеку.
[68] В настоящем изобретении предлагается также монотерапия для лечения меланомы с использованием апилимода. В данном описании термин «монотерапия» относится к введению единственного активного или терапевтического соединения, в частности, апилимода, нуждающемуся в этом субъекту.
[69] В данном описании термин «терапия», «лечение» или «лечить» описывает лечение и уход за пациентом, с целью борьбы с заболеванием, состоянием или расстройством, и включает введение композиции апилимода для облегчения симптомов или осложнений заболевания, состояния или расстройства, или для устранения заболевания, состояния или расстройства.
[70] В вариантах осуществления настоящего изобретения введение апилимода приводит к устранению симптома или осложнения меланомы, которую лечат, если устранение не требуется. В одном варианте осуществления настоящего изобретения тяжесть симптома снижается. Применительно к онкологическому заболеванию подобные симптомы могут включать клинические маркеры тяжести или прогрессирования, включая степень, до которой опухоль секретируют факторы роста, разрушает внеклеточный матрикс, васкуляризуется, теряет сцепление с соседними тканями или метастазирует, а также количество метастазов.
[71] Лечение меланомы, в соответствии с приведенными в данном описании способами, может привести к уменьшению размера опухоли. Уменьшение размера опухоли можно также назвать «регрессией опухоли». После лечения размер опухоли, предпочтительно, уменьшается на 5% или больше относительно его размера до лечения; более предпочтительно, размер опухоли уменьшается на 10% или больше; более предпочтительно, уменьшается на 20% или больше; более предпочтительно, уменьшается на 30% или больше; более предпочтительно, уменьшается на 40% или больше; еще более предпочтительно, уменьшается на 50% или больше; и наиболее предпочтительно, уменьшается более чем на 75% или больше. Размер опухоли можно измерить с помощью любого воспроизводимого способа измерения. Размер опухоли можно измерить как диаметр опухоли.
[72] Лечение меланомы, в соответствии с приведенными в данном описании способами, может приводить к сокращению объема опухоли. После лечения объем опухоли, предпочтительно, снижается на 5% или больше относительно ее размера до лечения; более предпочтительно, объем опухоли уменьшается на 10% или больше; более предпочтительно, уменьшается на 20% или больше; более предпочтительно, уменьшается на 30% или больше; более предпочтительно, уменьшается на 40% или больше; еще более предпочтительно, уменьшается на 50% или больше; и наиболее предпочтительно, уменьшается на 75% или больше. Объем опухоли можно измерить с помощью любого воспроизводимого способа измерения.
[73] Лечение меланомы, в соответствии с приведенными в данном описании способами, может привести к уменьшению числа опухолей. После лечения число опухолей, предпочтительно, снижается на 5% или больше, по сравнению с их числом до лечения; более предпочтительно, число опухолей снижается на 10% или больше; более предпочтительно, снижается на 20% или больше; более предпочтительно, снижается на 30% или больше; более предпочтительно, снижается на 40% или больше; еще более предпочтительно, снижается на 50% или больше; и наиболее предпочтительно, снижается более чем на 75%. Количество опухолей можно измерить с помощью любых воспроизводимых способов измерения. Число опухолей можно измерить путем подсчета опухолей, видимых невооруженным глазом, или при конкретном увеличении. Предпочтительно, указанное увеличение составляет 2x, 3x, 4x, 5x, 10x или 50x.
[74] Лечение меланомы, в соответствии с приведенными в данном описании способами, может привести к уменьшению числа метастатических поражений в других тканях или органах, удаленных от первичного очага опухоли. После лечения количество метастатических поражений, предпочтительно, снижается на 5% или больше, по сравнению с их числом до лечения; более предпочтительно, количество метастатических поражений снижается на 10% или больше; более предпочтительно, снижается на 20% или больше; более предпочтительно, снижается на 30% или больше; более предпочтительно, снижается на 40% или больше; еще более предпочтительно, снижается на 50% или больше; и наиболее предпочтительно, снижается более чем на 75%. Число метастатических поражений может быть измерено с помощью любых воспроизводимых способов измерения. Число метастатических поражений может быть измерено путем подсчета метастатических поражений, видимых невооруженным глазом, или при конкретном увеличении. Предпочтительно, указанное увеличение составляет 2x, 3x, 4x, 5x, 10x или 50x.
[75] Лечение меланомы, в соответствии с методами, приведенными в данном описании, может привести к увеличению среднего времени выживания популяции прошедших лечение субъектов, по сравнению с популяцией, получавшей только носитель. Среднее время выживания, предпочтительно, увеличивается больше чем на 30 дней; более предпочтительно, больше чем на 60 дней; более предпочтительно, больше чем на 90 дней; и наиболее предпочтительно, больше чем на 120 дней. Увеличение средней продолжительности жизни популяции может быть измерено с помощью любых воспроизводимых способов. Увеличение средней продолжительности жизни популяции может быть определено, например, путем расчета для популяции средней продолжительности жизни после начала лечения с использованием активного соединения. Увеличение средней продолжительности жизни популяции также может быть определено, например, путем расчета для популяции средней продолжительности выживания после завершения первого раунда лечения с использованием активного соединения.
[76] Лечение меланомы в соответствии с методами, приведенными в данном описании, может привести к увеличению среднего времени выживания популяции прошедших лечение субъектов, по сравнению с популяцией, получавшей монотерапию с использованием препарата, который не является апилимодом. Среднее время выживания, предпочтительно, увеличивается больше чем на 30 дней; более предпочтительно, больше чем на 60 дней; более предпочтительно, больше чем на 90 дней; и наиболее предпочтительно, больше чем на 120 дней. Увеличение средней продолжительности жизни популяции может быть определено с помощью любых воспроизводимых способов. Увеличение средней продолжительности жизни популяции может быть определено, например, путем расчета для популяции средней продолжительности жизни после начала лечения с использованием активного соединения. Увеличение средней продолжительности жизни популяции также может быть определено, например, путем расчета для популяции средней продолжительности выживания после завершения первого раунда лечения с использованием активного соединения.
[77] Лечение меланомы в соответствии с методами, приведенными в данном описании, может приводить к уменьшению уровня смертности популяции прошедших лечение субъектов, по сравнению с популяцией, получавшей только носитель. Лечение меланомы, в соответствии с методами, приведенными в данном описании, может привести к уменьшению уровня смертности популяции прошедших лечение субъектов, по сравнению с не прошедшей лечение популяцией. Лечение меланомы в соответствии с методами, приведенными в данном описании, может привести к уменьшению уровня смертности популяции прошедших лечение субъектов, по сравнению с популяцией, получавшей монотерапию с использованием препарата, который не является апилимодом. Уровень смертности снижается, предпочтительно, больше чем на 2%; более предпочтительно, больше чем на 5%; более предпочтительно, больше чем на 10%; и наиболее предпочтительно, больше чем на 25%. Снижение уровня смертности популяции прошедших лечение субъектов может быть определено с помощью любых воспроизводимых способов. Снижение уровня смертности популяции может быть определено, например, путем расчета для популяции среднего числа связанных с заболеванием смертей в единицу времени после начала лечения с использованием активного соединения. Снижение уровня смертности популяции также можно определить, например, путем подсчета для популяции среднего числа смертей, связанных с заболеванием, в единицу времени после завершения первого раунда лечения с использованием активного соединения.
[78] Лечение меланомы, в соответствии с приведенными в данном описании способами, может приводить к уменьшению скорости роста опухоли. После лечения скорость роста опухоли, предпочтительно, снижается, по меньшей мере, на 5%, по сравнению со значением до лечения; более предпочтительно, скорость роста опухоли снижается, по меньшей мере, на 10%; более предпочтительно, снижается, по меньшей мере, на 20%; более предпочтительно, снижается, по меньшей мере, на 30%; более предпочтительно, снижается, по меньшей мере, на 40%; более предпочтительно, снижается, по меньшей мере, на 50%; еще более предпочтительно, снижается, по меньшей мере, на 50%; и наиболее предпочтительно, снижается, по меньшей мере, на 75%. Скорость роста опухоли может быть измерена с помощью любого воспроизводимого способа измерения. Скорость роста опухоли можно измерить по изменению диаметра опухоли в единицу времени. В одном варианте осуществления настоящего изобретения после лечения скорость роста опухоли может быть приблизительно равна нулю и, как определяют, сохраняет тот же размер, в частности, прекратила расти.
[79] Лечение меланомы в соответствии с приведенными в данном описании способами может привести к уменьшению повторного роста опухоли. После лечения повторный рост опухоли, предпочтительно, составляет меньше 5%; более предпочтительно, повторный рост опухоли составляет меньше 10%; более предпочтительно, составляет меньше 20%; более предпочтительно, составляет меньше 30%; более предпочтительно, составляет меньше 40%; более предпочтительно, составляет меньше 50%; еще более предпочтительно, составляет меньше 50%; и наиболее предпочтительно, составляет меньше 75%. Уменьшение повторного роста опухоли может быть определено с помощью любого воспроизводимого способа измерения. Уменьшение повторного роста опухоли определяют, например, путем измерения увеличения диаметра опухоли после предшествующего сокращения опухоли, которая последовала после лечения. На уменьшение повторного роста опухоли указывает то, что опухоли не возникают вновь после прекращения лечения.
[80] В данном описании термин «избирательно» означает тенденцию к более высокой частоте возникновения в одной популяции, чем в другой популяции. Сравниваемые популяции могут быть популяциями клеток. Апилимод, предпочтительно, действует избирательно на гиперпролиферирующие клетки или аномально пролиферирующие клетки, по сравнению с нормальными клетками. В данном описании термин «нормальная клетка» обозначает клетку, которая не может быть классифицирована как часть «клеточно-пролиферативного расстройства». Нормальная клетка не способна к нерегулируемому или аномальному росту или и тому, и другому, что может привести к развитию нежелательного состояния или болезни. Предпочтительно, нормальная ячейка обладает нормально функционирующими механизмами контроля контрольной точки клеточного цикла. Предпочтительно, апилимод действует избирательно таким образом, чтобы регулировать одну молекулярную мишень (например, целевую киназу), но не существенно регулировать другую молекулярную мишень (например, не целевую киназу). В настоящем изобретении предлагается также способ избирательного ингибирования активности фермента, такого как киназа. Предпочтительно, какое-либо событие происходит избирательно в популяции А, по сравнению с популяцией В, если оно возникает в популяции А более чем в два раза чаще, чем в популяции В. Событие возникает избирательно, если оно встречается в популяции А более чем в пять раз чаще. Событие возникает избирательно, если оно возникает в популяции А более чем в десять раз чаще; более предпочтительно, более чем в пятьдесят раз чаще; еще более предпочтительно, более чем в 100 раз чаще; и наиболее предпочтительно, возникает в популяции А более чем в 1000 раз чаще, по сравнению с популяцией В. Например, считается, что гибель клеток происходит избирательно в больных или гиперпролиферирующих клетках, если она возникает более чем в два раза чаще в больных или гиперпролиферирующих клетках, по сравнению с нормальными клетками.
Фармацевтические композиции и составы
[81] В настоящем изобретении предлагаются содержащие апилимод композиции, которые представляют собой фармацевтически приемлемые композиции, пригодные к применению для млекопитающих, предпочтительно, человека. В данном контексте указанные композиции могут дополнительно содержать, по меньшей мере, один фармацевтически приемлемый наполнитель или носитель, при этом его количество эффективно для лечения меланомы. В вариантах осуществления настоящего изобретения апилимод представляет собой апилимод димезилат.
[82] В вариантах осуществления настоящего изобретения апилимод объединяют, по меньшей мере, с одним дополнительным активным агентом в одной лекарственной форме. В одном варианте осуществления настоящего изобретения указанная композиция дополнительно содержит антиоксидант.
[83] В вариантах осуществления настоящего изобретения, по меньшей мере, один указанный дополнительный активный агент представляет собой терапевтический агент, выбранный из группы, состоящей из ингибитора протеинкиназы, антинеопластического агента на основе платины, ингибитора топоизомеразы, ингибитора метаболизма нуклеозидов, алкилирующего агента, интеркалирующего агента, связывающего тубулин агента, ингибитора BRAF и их комбинаций. В вариантах осуществления настоящего изобретения терапевтический агент представляет собой ингибитор протеинкиназы, алкилирующий агент, интеркалирующий агент, связывающий тубулин агент, кортикостероид и их комбинации. В вариантах осуществления настоящего изобретения терапевтический агент выбран из группы, состоящей из вемурафениба, ибрутиниба, ритуксимаба, доксорубицина, преднизолона, винкристина, велкада и эверолимуса и их комбинаций.
[84] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент представляет собой ингибитор BRAF, ингибитор МЕК, ингибитор PD-1/PD-L1 или ингибитор контрольной точки.
[85] В вариантах осуществления настоящего изобретения ингибитор пути PD-1/PDL-1 выбран из пембролизумаба (Keytruda), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (MK-3475), MSB0010718C и MEDI4736.
[86] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент представляет собой терапевтический агент, выбранный из группы, состоящей из дакарбазина, темозоломида, Nab-паклитаксела, кармустина, цисплатина, карбоплатина, винбластина, ипилимумаба, интерлейкина-2 (IL-2, пролейкин), пембролизумаба (Keytruda), дабрафениба (Tafinlar), вемурафениба (Zelboraf), траметиниба (Mekinist), дазатиниба (Sprycel), иматиниба (Gleevec) и нилотиниба (Tasigna) и их комбинаций.
[87] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент является нетерапевтическим агентом, выбранным для снижения интенсивности симптомов одного или нескольких побочных эффектов апилимода. В вариантах осуществления настоящего изобретения нетерапевтический агент выбран из группы, состоящей из ондансетрона, гранисетрона, доласетрона и палоносетрона. В вариантах осуществления настоящего изобретения нетерапевтический агент выбран из группы, состоящей из пиндолола и рисперидона.
[88] В вариантах осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент выбран из ингибитора BRAF, ингибитора пути Raf/MEK/ERK, ингибитора пути mTOR, ингибитора PI3K, двойного ингибитора PI3K/mTOR, ингибитора SRC, ингибитора VEGF, ингибитора Янус-киназы (JAK), ингибитора Raf, ингибитора Erk, ингибитора фарнезилтрансферазы, ингибитора гистондезацетилазы, антимитотического агента, ингибитора истечения множественной лекарственной резистентности, антибиотика и лекарственного препарата на основе моноклональных антител. В одном варианте осуществления настоящего изобретения, по меньшей мере, один дополнительный активный агент выбран из ингибитора фарнезилтрансферазы (например, типифарниба), антимитотического агента (например, доцетаксела), ингибитора гистондезацетилазы (например, вориностата) и ингибитора истечения множественной лекарственной резистентности.
[89] В вариантах осуществления настоящего изобретения ингибитор mTOR выбран из группы, состоящей из рапамицина (также называемого сиролимусом), эверолимуса, темсиролимуса, ридафоролимуса, умиролимуса, зотаролимуса, AZD8055, INK128, WYE-132, Torin-1, аналогов пиразолопиримидина PP242, PP30, PP487, PP121, KU0063794, KU-BMCL-200908069-1, Wyeth-BMCL-200910075-9b, INK-128, XL388, AZD8055, P2281 и P529. См., например, Liu et al. Drug Disc. Today Ther. Strateg., 6(2): 47-55 (2009).
[90] В вариантах осуществления настоящего изобретения ингибитор mTOR представляет собой транс-4-[4-амино-5-(7-метокси-1H-индол-2-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновую кислоту (также известную как OSI-027) и любые ее соли, сольваты, гидраты и другие физические формы, кристаллические или аморфные. См. US 2007/0112005. OSI-027 может быть получена в соответствии с US 2007/0112005, который включен в данное описание посредством ссылки. В одном варианте осуществления настоящего изобретения ингибитор mTOR представляет собой OXA-01. См., например, WO 2013152342 A1.
[91] В вариантах осуществления настоящего изобретения ингибитор PI3K выбран из группы, состоящей из GS-1101 (иделасиб), GDC0941 (пиктилисиб), LY294002, BKM120 (бупарлисиб), PI-103, TGX-221, IC-87114, XL 147, ZSTK474, BYL719, AS-605240, PIK-75, 3-метиладенин, A66, PIK-93, PIK-90, AZD6482, IPI-145 (дувелисиб), TG100-115, AS-252424, PIK294, AS-604850, GSK2636771, BAY 80-6946 (копанлисиб), CH5132799, CAY10505, PIK-293, TG100713, CZC24832 и HS-173.
[92] В вариантах осуществления настоящего изобретения двойной ингибитор PI3K/mTOR выбран из группы, состоящей из GDC-094, WAY-001, WYE-354, WAY-600, WYE-687, Wyeth-BMCL-200910075-16b, Wyeth-BMCL-200910096-27, KU0063794 и KUBMCL-200908069-5, NVP-BEZ235, XL-765, PF-04691502, GDC-0980 (апитолисиб), GSK1059615, PF-05212384, BGT226, PKI-402, VS-558 и GSK2126458. См., в частности, Liu et al. Drug Disc. Today Ther. Strateg., 6(2): 47-55 (2009), который включен в данное описание посредством ссылки.
[93] В вариантах осуществления настоящего изобретения ингибитор пути mTOR представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную малую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, закрытую нуклеиновую кислоту или аптамер), которая связывается с белком (или нуклеиновой кислотой, кодирующей белок) или ингибирует его уровень экспрессии или активность в пути mTOR. Например, полипептид или нуклеиновая кислота ингибируют комплекс 1 mTOR (mTORC1), регуляторный ассоциированный белок mTOR (Raptor), летальный для млекопитающих с SEC13 белком 8 (MLST8), богатый пролином субстрат Akt размером 40 кДа (PRAS40), домен DEP-содержащий mTOR-взаимодействующий белок (DEPTOR), комплекс 2 mTOR (mTORC2), нечувствительный к рапамицину спутник mTOR (RICTOR), подобный бета-субъединице G-белок (GβL), стресс-активируемый взаимодействующий с киназой белок 1 млекопитающих (mSIN1), паксиллин, RhoA, родственный Ras субстрат 1 ботулинического токсина C3 (Rac1), гомолог белка 42 контроля клеточного деления (Cdc42), протеинкиназы Cα (PKCα), серин/треонин протеинкиназу Akt, фосфоинозитид 3-киназу (PI3K) p70S6K, Ras и/или связывающиеся с эукариотическим фактором инициации трансляции 4E (eIF4E) белки (4EBPs), или нуклеиновые кислоты, кодирующие один из указанных белков.
[94] В вариантах осуществления настоящего изобретения ингибитор SRC выбран из группы, состоящей из босутиниба, саракатиниба, дазатиниба, понатиниба, KX2-391, XL-228, TG100435/TG100855 и DCC2036. См., например, Puls et al. Oncologist. 2011 May; 16(5): 566-578. В одном варианте осуществления настоящего изобретения ингибитор SRC представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную малую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, закрытую нуклеиновую кислоту или аптамер), которая связывается с белком SRC и ингибирует уровень экспрессии или активность белка SRC или нуклеиновой кислоты, кодирующей белок SRC.
[95] В вариантах осуществления настоящего изобретения ингибитор VEGF выбран из бевацизумаба, сунитиниба, пазопаниба, акситиниба, сорафениба, регорафениба, ленватиниба и мотесаниба. В одном варианте осуществления настоящего изобретения ингибитор VEGF представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную малую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолиновый олигонуклеотид, закрытую нуклеиновую кислоту или аптамер), которая связывается с белком VEGF и ингибирует уровень экспрессии или активность белка VEGF, рецептора белка VEGF или нуклеиновой кислоты, кодирующей один из указанных белков. Например, ингибитор VEGF представляет собой растворимый рецептор VEGF (например, растворимый рецептор VEGF-C/D (sVEGFR-3)).
[96] В вариантах осуществления настоящего изобретения ингибитор JAK выбран из фацитиниба, руксолитиниба, барицитиниба, CYT387 (номер CAS 1056634-68-4), лестауртиниба, пакритиниба и TG101348 (номер CAS 936091-26-8). В одном варианте осуществления настоящего изобретения ингибитор JAK представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную малую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолиновый олигонуклеотид, закрытую нуклеиновую кислоту или аптамер), который связывается с JAK (в частности, JAK1, JAK2, JAK3 или TYK2) и ингибирует уровень экспрессии или активность JAK или нуклеиновой кислоты, кодирующую белок JAK.
[97] В вариантах осуществления настоящего изобретения ингибитор Raf выбран из PLX4032 (вемурафениб), сорафениба, PLX-4720, GSK2118436 (дабрафениб), GDC-0879, RAF265, AZ 628, NVP-BHG712, SB90885, ZM 336372, GW5074, TAK-632, CEP-32496 и LGX818 (энкорафениб). В одном варианте осуществления настоящего изобретения ингибитор Raf представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную малую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, олигонуклеотид, закрытую нуклеиновую кислоту или аптамер), который связывается с Raf (в частности, A-Raf, B-Raf, C-Raf) и ингибирует уровень экспрессии или активность Raf или нуклеиновой кислоты, кодирующей белок Raf. В одном варианте осуществления настоящего изобретения ингибитор МЕК выбран из AZD6244 (селуметиниб), PD0325901, GSK1120212 (траметиниб), U0126-EtOH, PD184352, RDEA119 (рафаметиниб), PD98059, BIX 02189, MEK162 (биниметиниб), AS-703026 (пимасертиб), SL-327, BIX02188, AZD8330, TAK-733 и PD318088. В одном варианте осуществления настоящего изобретения ингибитор МЕК представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную малую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолиновый олигонуклеотид, закрытую нуклеиновую кислоту или аптамер), который связывается с МЕК (в частности, МЕК-1, МЕК-2) и ингибирует уровень экспрессии или активность МЕК или нуклеиновой кислоты, кодирующей белок МЕК.
[98] В вариантах осуществления настоящего изобретения ингибитор Akt выбран из MK-2206, KRX-0401 (перифосин), GSK690693, GDC-0068 (ипатасертиб), AZD5363, CCT128930, A-674563, PHT-427. В одном варианте осуществления настоящего изобретения ингибитор Akt представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную малую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолиновый олигонуклеотид, закрытую нуклеиновую кислоту или аптамер), который связывается с Akt (в частности, Akt-1, Akt-2, Akt-3) и ингибирует уровень экспрессии или активность Akt или нуклеиновой кислоты, кодирующей белок Akt.
[99] В вариантах осуществления настоящего изобретения ингибитор фарнезилтрансферазы выбран из LB42708 или типифарниба. В одном варианте осуществления настоящего изобретения ингибитор фарнезилтрансферазы представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную малую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолиновый олигонуклеотид, закрытую нуклеиновую кислоту или аптамер), который связывается с фарнезилтрансферазой и ингибирует уровень экспрессии или активность фарнезилтрансферазы или нуклеиновой кислоты, кодирующей белок фарнезилтрансферазу. В одном варианте осуществления настоящего изобретения модулирующий гистон ингибитор выбран из анакардовой кислоты, C646, MG149 (гистонацетилтрансфераза), GSK J4 Hcl (гистондеметилаза), GSK343 (активный против EZH2), BIX 01294 (гистонметилтрансфераза), MK0683 (вориностат), MS275 (энтиностат), LBH589 (панобиностат), трихостатин A, MGCD0103 (моцетиностат), таскинимод, TMP269, некступастат A, RG2833, PDX101 (белиностат).
[100] В вариантах осуществления настоящего изобретения антимитотический агент выбран из гризеофульвина, винорелбина тартрата, паклитаксела, доцетаксела, винкристина, винбластина, эпотилона A, эпотилона B, ABT-751, CYT997 (лексибулин), винфлунин тартрата, фосбретабулина, GSK461364, ON-01910 (ригосертиб), Ro3280, BI2536, NMS-P937, BI 6727 (воласертиб), HMN-214 и MLN0905.
[101] В вариантах осуществления настоящего изобретения полиэфирный антибиотик выбран из монензина натрия, нигерицина, валиномицина, салиномицина.
[102] "Фармацевтическая композиция" представляет собой препарат, содержащий соединения, приведенные в данном описании, в фармацевтически приемлемой форме, которая пригодна для введения субъекту. В данном описании термин «фармацевтически приемлемый» относится к таким соединениям, веществам, композициям, носителям и/или лекарственным формам, которые с медицинской точки зрения пригодны для использования при контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергических реакций или других проблем или осложнений, соизмеримых с разумным соотношением польза/риск.
[103] «Фармацевтически приемлемый наполнитель» означает наполнитель, пригодный для получения фармацевтической композиции, которая обычно безопасна, нетоксична, не является биологически или каким-либо другим образом нежелательной, и включает наполнитель, который приемлем для ветеринарного использования, а также для фармацевтического использования для человека. Примеры фармацевтически приемлемых наполнителей, без ограничения, включают стерильные жидкости, воду, забуференный физиологический раствор, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.), масла, детергенты, суспендирующие агенты, углеводы (в частности, глюкозу, лактозу, сахарозу или декстран), антиоксиданты (например, аскорбиновую кислоту или глутатион), хелатирующие агенты, низкомолекулярные белки или их пригодные смеси.
[104] Фармацевтическая композиция может быть приготовлена в не расфасованном виде или в виде стандартной лекарственной формы. Наиболее удобно готовить фармацевтические композиции в стандартной лекарственной форме для облегчения введения и единообразия дозировки. В данном описании термин «стандартная лекарственная форма» относится к физически дискретным единицам, пригодным в качестве единичных доз для подлежащего лечению субъекта; при этом каждая единица содержит заранее определенное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Требования к стандартным лекарственным формам по настоящему изобретению определяются и напрямую зависят от уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут. Стандартной лекарственной формой может быть ампула, флакон, суппозиторий, драже, таблетка, капсула, пакет для внутривенного вливания или единичный насос в аэрозольном ингаляторе.
[105] Для терапевтических применений дозировки меняются, среди прочих факторов, влияющих на выбранную дозировку, в зависимости от агента, возраста, массы и клинического состояния пациента-реципиента, а также опыта и мнения врача или проводящего терапию специалиста. Как правило, доза должна быть терапевтически эффективной. Дозировка может быть выражена в таких единицах как мг/кг/день (указанная доза может быть скорректирована для массы пациента, выраженной в кг, площади поверхности тела, выраженной в м2, и возраста, выраженного в годах). Эффективным количеством фармацевтической композиции является такое количество, которое обеспечивает объективно идентифицируемое улучшение, отмеченное врачом или другим квалифицированным экспертом. Примером является облегчение симптома расстройства, болезни или состояния. В данном описании термин «эффективный способ дозирования» относится к количеству фармацевтической композиции, требуемому для получения желаемого биологического эффекта у субъекта или в клетке.
[106] Стандартная лекарственная форма может, например, содержать от 1 нг до 2 мг или от 0,1 мг до 2 г; или от 10 мг до 1 г, или от 50 мг до 500 мг, или от 1 мкг до 20 мг; или от 1 мкг до 10 мг; или от 0,1 мг до 2 мг.
[107] Фармацевтические композиции могут иметь любую подходящую форму (например, представлять собой жидкости, аэрозоли, растворы, лекарственные формы для ингаляции, аэрозоли, спреи; или твердые вещества, порошки, мази, пасты, кремы, лосьоны, гели, пластыри и т.п.) для введения любым желаемым путем (например, внутрилегочно, ингаляционно, интраназально, перорально, трансбуккально, сублингвально, парентерально, подкожно, внутривенно, внутримышечно, внутрибрюшинно, внутриплеврально, интратекально, трансдермально, трансмукозально, ректально и т.п.). Например, фармацевтическая композиция по настоящему изобретению может быть приготовлена в виде водного раствора или порошка для введения в виде аэрозоля путем ингаляции или инсуффляции (либо через рот, либо в нос), в виде таблетки или капсулы для перорального введения; в виде стерильного водного раствора или дисперсии, пригодных для введения либо путем прямой инъекцией, либо путем добавления в стерильные инфузионные жидкости для внутривенной инфузии; или в виде лосьона, крема, пенки, пластыря, суспензии, раствора или суппозитория для трансдермального или трансмукозального введения.
[108] Фармацевтическая композиция может быть приготовлена в форме перорально приемлемой лекарственной формы, включая, однако этим не ограничиваясь, капсулы, таблетки, формы для трансбуккального введения, пастилки, лепешки и жидкости для перорального введения в форме эмульсий, водных суспензий, дисперсий или растворов. Капсулы могут содержать смеси соединения по настоящему изобретению с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный крахмал или крахмал тапиоки), сахара, искусственные подсластители, порошкообразные целлюлозы, такие как кристаллическая и микрокристаллическая целлюлоза, тонкодисперсные порошки, желатины, камеди и т.д. В случае таблеток для перорального применения носители, которые обычно используют, включают лактозу и кукурузный крахмал. Можно также добавлять лубриканты, такие как стеарат магния. Для перорального введения в форме капсулы пригодные разбавители включают лактозу и высушенный кукурузный крахмал. Когда водные суспензии и/или эмульсии вводятся перорально, соединение по настоящему изобретению может быть суспендировано или растворено в масляной фазе, объединено с эмульгирующими и/или суспендирующими агентами. Если требуется, могут быть добавлены определенные подсластители и/или ароматизирующие и/или окрашивающие агенты.
[109] Фармацевтическая композиция может быть в форме таблетки. Таблетка может содержать стандартную дозу соединения по настоящему изобретению вместе с инертным разбавителем или носителем, таким как сахар или сахарный спирт, например, лактоза, сахароза, сорбит или маннит. Таблетка может дополнительно содержать разбавитель, отличный от сахара, такой как карбонат натрия, фосфат кальция, карбонат кальция или целлюлоза или ее производное, такое как метилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза, и крахмалы, такие как кукурузный крахмал. Таблетка может дополнительно содержать связующие и гранулирующие агенты, такие как поливинилпирролидон, разрыхлители (например, способные к набуханию поперечно-сшитые полимеры, такие как поперечно-сшитая карбоксиметилцеллюлоза), лубриканты (например, стеараты), консерванты (например, парабены), антиоксиданты (например, BHT), буферные агенты (например, фосфатные или цитратные буферы) и шипучие агенты, такие как смеси цитрат/бикарбонат.
[110] Таблетка может иметь покрытие. Покрытие может представлять собой защитное пленочное покрытие (например, воск или лак) или покрытие, предназначенное для управления высвобождением активного агента, например, для замедленного высвобождения (высвобождения активного вещества после определенного времени задержки после приема внутрь) или для высвобождения в определенном месте в желудочно-кишечном тракте. Последнее может быть достигнуто, например, с использованием энтеросолюбильных покрытий, таких как покрытия, поступающие на рынок под торговой маркой Eudragit®.
[111] Препараты в виде таблеток могут быть приготовлены обычными способами прессования, влажного гранулирования или сухого гранулирования, при этом используют фармацевтически приемлемые разбавители, связующие агенты, лубриканты, разрыхлители, поверхностно-модифицирующие агенты (включая поверхностно-активные вещества), суспендирующие или стабилизирующие агенты, включая, однако этим не ограничиваясь, стеарат магния, стеариновую кислоту, тальк, лаурилсульфат натрия, микрокристаллическую целлюлозу, кальциевое производное карбоксиметилцеллюлозы, поливинилпирролидон, желатин, альгиновую кислоту, камедь акации, ксантановую камедь, цитрат натрия, комплексные силикаты, карбонат кальция, глицин, декстрин, сахарозу, сорбит, дикальцийфосфат, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, тальк, сухие крахмалы и сахарную пудру. Предпочтительные поверхностно-модифицирующие агенты включают неионогенные и анионные поверхностно-модифицирующие агенты. Типичные примеры поверхностно-модифицирующих агентов включают, однако этим не ограничиваясь, полоксамер 188, хлорид бензалкония, стеарат кальция, цетостеариловый спирт, цетомакрогольный эмульгирующий воск, сложные эфиры сорбитана, коллоидный диоксид кремния, фосфаты, додецилсульфат натрия, алюмосиликат магния и триэтаноламин.
[112] Фармацевтическая композиция может быть приготовлена в виде твердой или мягкой желатиновой капсулы. В подобной композиции соединение по настоящему изобретению может находиться в твердой, полутвердой или жидкой форме.
[113] Фармацевтическая композиция может быть приготовлена в виде стерильного водного раствора или дисперсии, пригодных для парентерального введения. В данном описании термин «парентеральный» включает в себя подкожный, внутрикожный, внутривенный, внутримышечный, внутрисуставный, внутриартериальный, интрасиновиальный, интрастернальный, в полость позвоночного канала, внутрисосудистый и внутричерепный способы инъекции или инфузии.
[114] Фармацевтическая композиция может быть приготовлена в виде стерильного водного раствора или дисперсии, пригодных для введения путем прямой инъекции или путем добавления в стерильные инфузионные жидкости для внутривенной инфузии, и содержит растворитель или дисперсионную среду, содержащую воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их пригодные смеси или одно или несколько растительных масел. Растворы или суспензии соединения по настоящему изобретению в виде свободного основания или фармакологически приемлемой соли могут быть приготовлены в воде путем смешивания подходящим образом с поверхностно-активным веществом. Примеры пригодных поверхностно-активных веществ приведены ниже. Дисперсии также могут быть приготовлены, например, в глицерине, жидких полиэтиленгликолях и их смесях в масле.
[115] Фармацевтические композиции для использования в способах по настоящему изобретению могут дополнительно содержать одну или несколько добавок в дополнение к любому носителю или разбавителю (такому как лактоза или маннит), который присутствует в препарате. Одна или несколько добавок могут содержать или состоять из одного или из нескольких поверхностно-активных веществ. Поверхностно-активные вещества, как правило, имеют одну или несколько длинных алифатических цепочек, таких как жирные кислоты, что позволяет им непосредственно встраиваться в липидные структуры клеток для усиления проникновения и абсорбции лекарственного средства. Эмпирическим параметром, обычно используемым для характеристики относительной гидрофильности и гидрофобности поверхностно-активных веществ, является гидрофильно-липофильный баланс (значение «HLB»). Поверхностно-активные вещества с более низкими значениями HLB более гидрофобны и обладают большей растворимостью в масле, тогда как поверхностно-активные вещества с более высокими значениями HLB являются более гидрофильными и обладают большей растворимостью в водных растворах. Таким образом, гидрофильными поверхностно-активными веществами обычно считаются те соединения, у которых значение HLB больше, чем приблизительно 10, а гидрофобными поверхностно-активными веществами являются обычно те, у которых значение HLB меньше, чем приблизительно 10. Однако указанные значения HLB являются лишь ориентиром, поскольку для многих поверхностно-активных веществ значения HLB могут отличаться на величину приблизительно 8 единиц HLB в зависимости от эмпирического метода, выбранного для определения значения HLB.
[116] Среди поверхностно-активных веществ для использования в композициях по настоящему изобретению пригодны полиэтиленгликоль (ПЭГ)-жирные кислоты и моно и диэфиры ПЭГ-жирных кислот, сложные эфиры ПЭГ глицерина, продукты переэтерификации спирт-масло, полиглицериловые жирные кислоты, сложные эфиры пропиленгликолевых жирных кислот, стирол и производные стирола, сложные эфиры полиэтиленгликоля и сорбитановых жирных кислот, простые эфиры полиэтиленгликоля, сахар и его производные, алкилфенолы полиэтиленгликоля, блок-сополимеры полиоксиэтилена-полиоксипропилена (POE-POP), сложные эфиры сорбитановых жирных кислот, ионогенные поверхностно-активные вещества, растворимые в маслах витамины и их соли, водорастворимые витамины и их амфифильные производные, аминокислоты и их соли, а также органические кислоты и их сложные эфиры и ангидриды.
[117] В настоящем изобретении предлагаются также упаковки и наборы, содержащие фармацевтические композиции для использования в способах, приведенных в данном описании. Набор может включать один или несколько контейнеров, выбранных из группы, состоящей из бутылочки, флакона, ампулы, блистерной упаковки и шприца. Указанный набор может дополнительно включать одну или несколько инструкций по применению при лечении и/или предотвращении заболевания, состояния или расстройства по настоящему изобретению, один или несколько шприцев, один или несколько аппликаторов или стерильный раствор, пригодный для восстановления фармацевтической композиции по настоящему изобретению.
[118] Все проценты и отношения, используемые в данном описании, являются массовыми, если не указано иное. Другие отличительные признаки и преимущества настоящего изобретения очевидны из различных примеров. Приведенные примеры иллюстрируют различные компоненты и методологию, пригодные при практическом осуществлении настоящего изобретения. Примеры не ограничивают заявленное изобретение. На основании приведенного описания специалист в данной области техники сможет определить и использовать другие компоненты и методологию, пригодные для осуществления настоящего изобретения.
ПРИМЕРЫ
Пример 1: Синергическая активность апилимода с вемурафенибом
[119] Клетки Yulac614 (устойчивые к вемурафенибу, см. Choi et al., 2014) использовали для проведения исследований комбинаций лекарственных средств, с целью идентификации пар синергических препаратов. Библиотеку из 500 неутвержденных лекарств использовали для проведения скрининга лекарств в присутствии или в отсутствие вемурафениба (при IC20=6 мкМ). Библиотеку препаратов разбавляли из 10 мМ маточного раствора до разведений исходного раствора 5, 0,5 и 0,05 мМ (1000х конечная концентрация), получая конечные концентрации для скрининга 5, 0,5 и 0,05 мкМ.
[120] Библиотеку препаратов 30 нл (с концентрацией 1000х) помещали в соответствующие лунки 384-луночного планшета с черными стенками (Corning #3712). Готовили по два планшета с пятнами лекарственного средства и к ним добавляли клетки Yulac614, которые предварительно обрабатывали с помощью либо ДМСО (конечная концентрация 0,01%), либо вемурафениба (конечная концентрация 6 мкМ). Клетки Yulac614 выращивали в среде OptiMEM (Life Technologies), содержащей 5% FBS (Sigma Aldrich F2442-500ML, партия 12D370), пенициллин/стрептомицин (100X) (CellGro Ref 30-002). По 30 мкл клеток распределяли в лунки с помощью Multidrop Combi (Thermo Fisher Scientific), получая конечную плотность клеток, равную 2000 клеток на лунку.
[121] Планшеты инкубировали в течение 72 час при 37°С в атмосфере с 5% CO2 во влажном инкубаторе. Жизнеспособность клеток определяли с помощью анализа люминесценции CellTiter-Glo® (Promega), следуя инструкциям изготовителя. Жизнеспособность выражали контрольных в процентах от (ДМСО) клеток. Жизнеспособность одного библиотечного препарата сравнивали со смесью библиотечный препарат+вемурафениб и определяли значимые комбинации.
[122] Апилимод был идентифицирован как не получивший одобрения препарат, который в сочетании с вемурафенибом значительно уменьшал жизнеспособность клеток Yulac614, по сравнению с любым одним из указанных лекарственных средств. См. фигуру 1.
[123] Для подтверждения оценки вемурафениб и апилимод клетки Yulac614 высевали в 96-луночные планшеты с плотностью 5000 клеток на лунку с конечным объемом 50 мкл. Вемурафениб тестировали путем построения по 10 точкам кривой ответной реакции от концентрации (58,6-30000 нМ, 2-кратные разведения) в присутствии и в отсутствие апилимода (при IC20=500 нМ). К клеткам добавляли 50 мкл серии 10-точечного разведения лекарственного средства (с 2x концентрацией). Планшеты инкубировали при 37°С в атмосфере с 5% CO2 во влажном инкубаторе. Спустя 72 час после добавления соединения относительную жизнеспособность клеток определяли с помощью люминесцентного анализа CellTiter-Glo® (Promega), следуя инструкциям производителя, и полученные значения выражали в виде процентного отношения к контрольным клеткам, которых обрабатывали носителем (ДМСО) (приняты за 100%). На фиг. 2 представлена 10-точечная кривая зависимости ответной реакции от концентрации только для вемурафениба (58,6-30,000 нМ) (черная линия) или вместе с апилимодом (500 нм) (серая линия). Результаты показывают, что апилимод в сочетании с вемурафенибом более эффективен, чем один лишь вемурафениб, для снижения жизнеспособности клеток Yulac614.
[124] В другом эксперименте клетки Yulac (исходные - чувствительные к вемурафенибу), Yulac 614, Yulac 616, Yulac T-CRAF (все - устойчивые к вемурафенибу), см. Choi et al. 2014) выращивали в среде OptiMEM (Life Technologies), содержащей 5% FBS (Sigma Aldrich F2442-500ML, партия 12D370), пенициллин/стрептомицин (100X) (CellGro Ref. 30-002). Для исследования комбинаций клетки высевали с плотностью 5000 клеток на лунку в 96-луночные планшеты с конечным объемом 50 мкл. Клетки обрабатывали только апилимодом (конечная концентрация 13,7-300 нМ, 3-кратные разведения, в общей сложности 8 разведений), только вемурафенибом (конечная концентрация 13,7-300 нМ, 3-кратные разведения, в общей сложности 8 разведений) или комбинацией каждой концентрации апилимода с каждой концентрацией вемурафениба (матрица 8×8). Клетки обрабатывали за 72 час до того, как оценивали пролиферацию с использованием CellTiterGlo® (Promega). Для расчета синергии использовали CalcuSyn (версия 2.11, Biosoft), чтобы определить показатель аддитивности (CI), как указано Chou et al. (Chou TC, Talalay P. Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors. Adv. Enzyme Regul. 1984; 22:27-55). Авторы настоящего изобретения ограничили анализ для оценки значений CI, которые находились в пределах клинически достижимой концентрации, а также там, где долевой эффект (Fa) превышал 0,70 (т.е. более чем 70%-ное снижение жизнеспособности клеток при использовании комбинации лекарственных средств). Таким образом, комбинации лекарств, дающие значения CI >1, являются антагонистическими, CI=1 являются аддитивными, а CI <1 являются синергическими. Используя этот подход, было установлено, что апилимод оказывает синергическое действие вместе с вемурафенибом в каждой из указанных клеточных линий (см. Таблицу 1). Изменение чувствительности к вемурафенибу под действием апилимода определяли, используя программное обеспечение GraphPad Prism4 для расчета значений IC50. Как показано на фигуре 3, вемурафениб в комбинации с апилимодом при 370 нМ уменьшал величину IC50 в 5,5-25 раз, по сравнению с одним лишь вемурафенибом.
Таблица 1.
[125] Чтобы расширить полученные результаты, для дальнейших исследований с апилимодом была выбрана группа клеточных линий меланомы, которые обладают внутренней резистентностью к вемурафенибу. Клетки A101D, SK-MEL-2, SK-MEL-31, RPMI7951, A2058 (выращенные в среде DMEM, дополненной 10% сывороткой крови эмбрионов коров) и MEL-JUSO (выращенные в среде RPMI, дополненной 10% сывороткой крови эмбрионов коров) получали из ATCC. Клетки высевали с оптимальной плотностью в 96-луночные планшеты с конечным объемом 50 мкл. Клетки обрабатывали только апилимодом (конечная концентрация 78,1-10000 нМ, 2-кратные разведения, в общей сложности 8 разведений), только вемурафенибом (конечная концентрация 234-300 нМ, 2-кратные разведения, в общей сложности 8 разведений) или комбинацией каждой концентрации апилимода с каждой концентрацией вемурафениба (матрица 8×8). Клетки обрабатывали за 72 час до того, как оценивали пролиферацию с использованием CellTiterGlo® (Promega). Для расчета синергии использовали CalcuSyn (версия 2.11, Biosoft), чтобы определить показатель аддитивности (CI), как описано выше. При использовании указанного подхода было установлено, что апилимод оказывает синергическое действие вместе с вемурафенибом в каждой клеточной линии (см. Таблицу 2). Изменение чувствительности к вемурафенибу под действием апилимода определяли с использованием программного обеспечения GraphPad Prism4 для расчета значений IC50. Как показано на фигуре 4, вемурафениб в комбинации с апилимодом при 185 нМ (клетки A101D, RPMI7951, A2058 и MEL-JUSO) или 312 нМ (клетки SK-MEL-2 и SK-MEL-31) уменьшал IC50 в 4,5-25 раз, по сравнению с одним лишь вемурафенибом.
Таблица 2.
Значения показателя аддитивности (CI) для указанных устойчивых к вемурафенибу клеточных линий, обработанных комбинацией вемурафениб и апилимод. Значения CI >1 являются антагонистическими, CI=1 указывают на аддитивный эффект, а CI <1 являются синергическими.
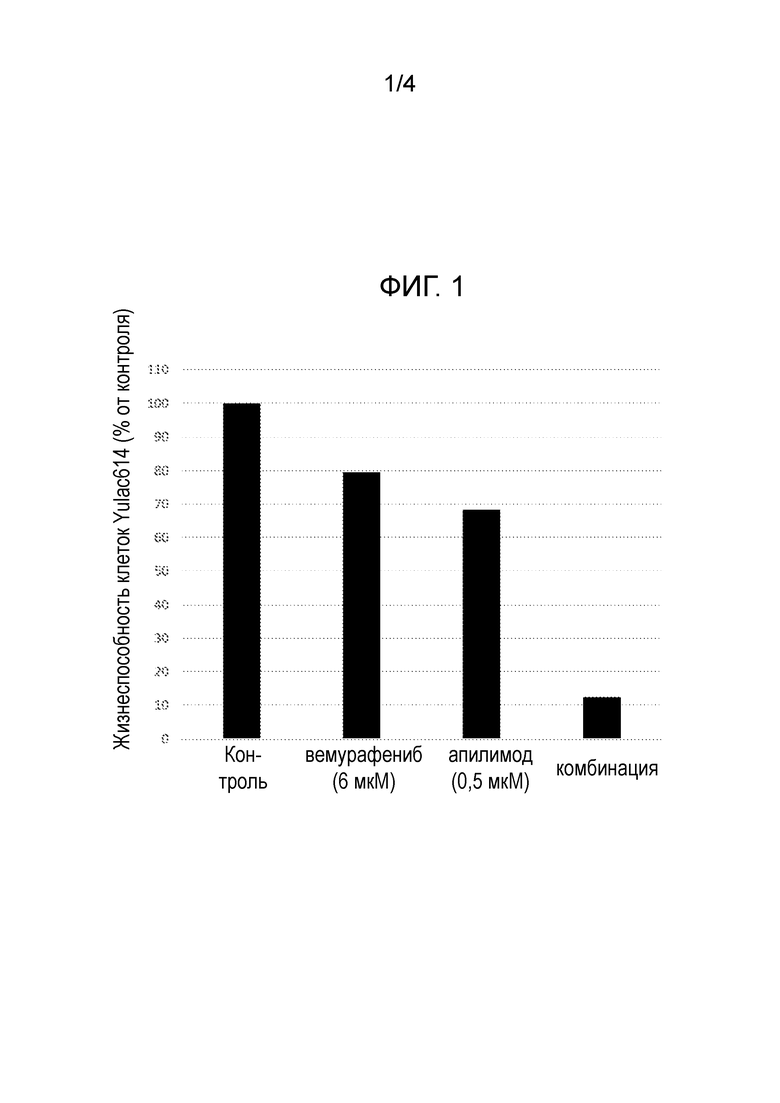
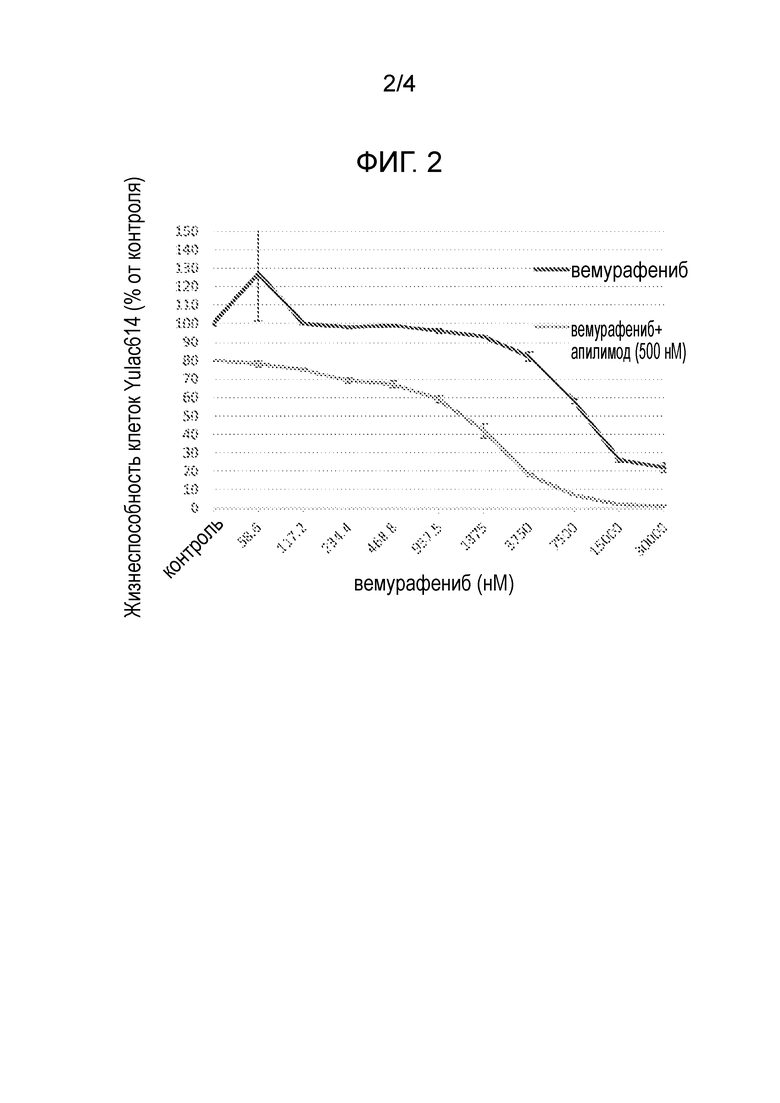
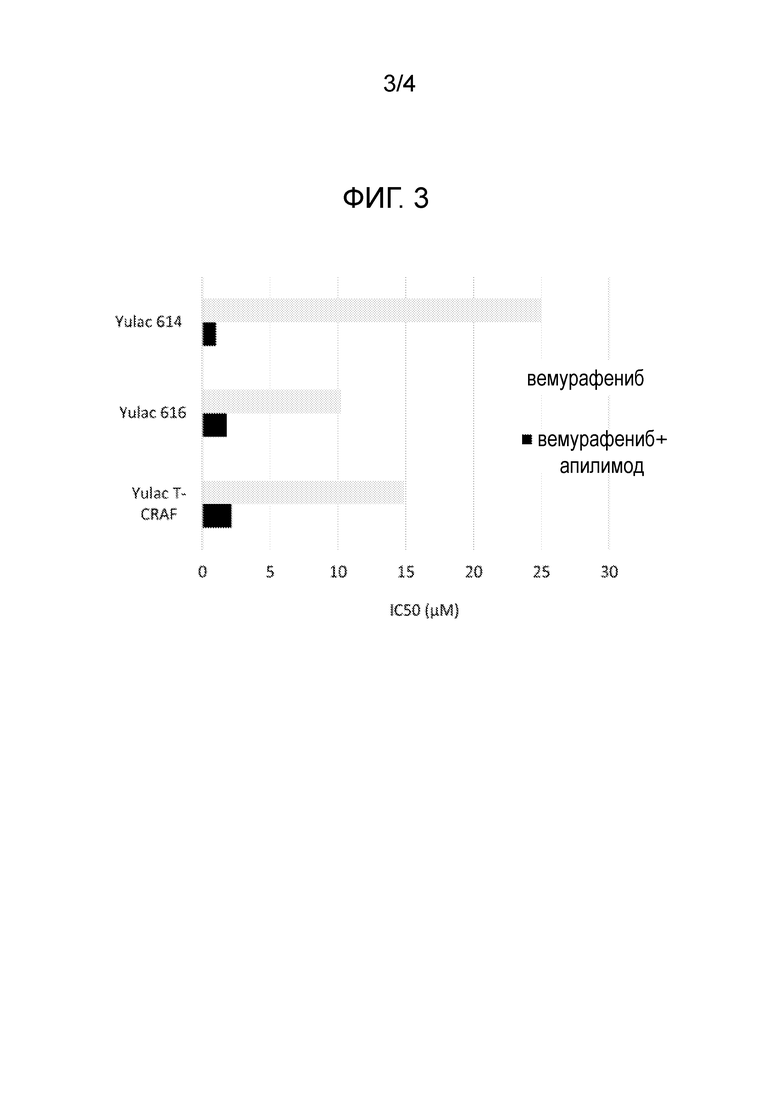
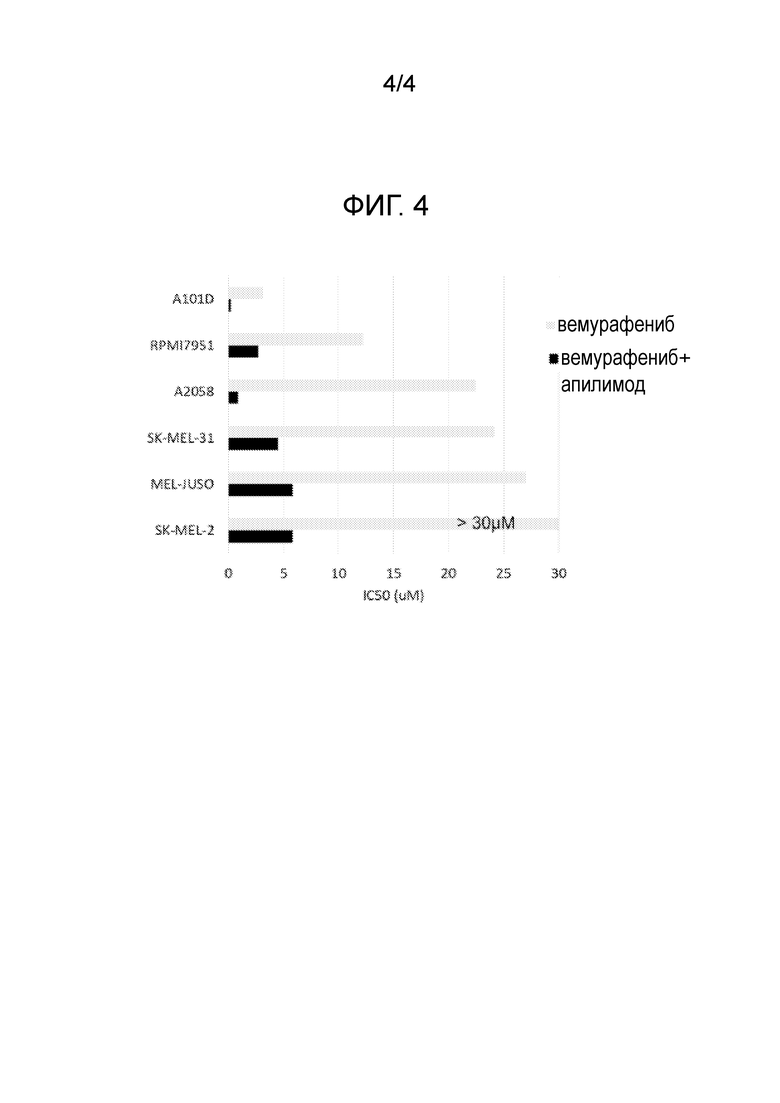
Группа изобретений относится к лечению меланомы. Раскрыто применение композиции, содержащей терапевтически эффективное количество апилимода или его фармацевтически приемлемой соли, для лечения меланомы у субъекта в комбинации с вемурафенибом. Также раскрыт способ идентификации человека как имеющего меланому пациента с целью лечения с применением комбинированной терапии. Группа изобретений обеспечивает синергетический эффект при лечении меланомы. 2 н. и 7 з.п. ф-лы, 4 ил., 2 табл., 1 пр.
1. Применение композиции, содержащей терапевтически эффективное количество апилимода или его фармацевтически приемлемой соли, для лечения меланомы у субъекта в комбинации с вемурафенибом.
2. Применение по п. 1, где фармацевтически приемлемая соль апилимода выбрана из сульфата, цитрата, ацетата, оксалата, хлорида, бромида, иодида, нитрата, бисульфата, фосфата, кислого фосфата, изоникотината, лактата, салицилата, кислого цитрата, тартрата, олеата, танната, пантотената, битартрата, аскорбата, сукцината, малеата, безилата, гентизината, фумарата, глюконата, глюкароната, сахарата, формиата, бензоата, глутамата, метансульфоната, этансульфоната, бензолсульфоната, п-толуолсульфоната и памоата.
3. Применение по п. 2, где фармацевтически приемлемая соль апилимода выбрана из хлорида, метансульфоната, фумарата, лактата, малеата, памоата, фосфата и тартрата.
4. Применение по п. 3, где фармацевтически приемлемая соль апилимода представляет собой апилимода димезилат.
5. Применение по любому из пп. 1-4, где указанная фармацевтическая композиция, содержащая апилимод, является пероральной дозированной формой или дозированной формой, пригодной для внутривенного введения.
6. Применение по любому из пп. 1-5, где указанную фармацевтическую композицию, содержащую апилимод, вводят в виде единичной дозированной формы с вемурафенибом или в виде отдельной дозированной формы.
7. Применение по любому из пп. 1-6, где меланомой является меланома на III или IV стадии.
8. Применение по любому из пп. 1-7, где указанный субъект представляет собой человека.
9. Способ идентификации человека как имеющего меланому пациента с целью лечения с применением комбинированной терапии, включающей апилимод и вемурафениб, при этом указанный метод включает анализ биологического образца онкологического заболевания субъекта на наличие одной или нескольких из мутации белка V600E BRAF, мутации белка V600K BRAF или их генетических эквивалентов, где субъект, имеющий любую из указанных мутаций, идентифицирован как пациент для лечения с применением комбинированной терапии, включающей апилимод и вемурафениб.
| WO 2006128129 A2, 30.11.2006 | |||
| Краткий курс молекулярной фармакологии под ред | |||
| П.В.Сергеева, М., 1975, с.10 | |||
| Холодов Л.Е | |||
| и др | |||
| Клиническая фармакокинетика | |||
| М., "Медицина", 1985, с | |||
| Пуговица | 0 |
|
SU83A1 |
| Харкевич Д.А | |||
| Фармакология: Учебник, 2010, 10-е издание, стр.72-82. | |||
Авторы
Даты
2020-09-09—Публикация
2015-11-06—Подача