РоДСТВЕННАЯ ЗАЯВКА
[01] По этой PCT заявке испрашивается приоритет по патентной заявке США 62/077127, поданной 7 ноября 2014. Этот документ полностью включен в настоящее описание путем ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ
[02] Рассматриваемое описание изобретения относится к композициям, включающим апилимод, и к способам их использования для лечения рака почек.
УРОВЕНЬ ТЕХНИКИ
[03] Апилимод, именуемый также как STA-5326, здесь и далее ʺапилимодʺ, представляет собой эффективный транскрипционный ингибитор IL-12 и IL-23. См. например, Wada et al. Blood 109 (2007): 1156-1164. IL-12 и IL-23 представляют собой воспалительные цитокины, обычно продуцируемые иммунными клетками, такими как B-клетки и макрофаги, в ответ на антигенную стимуляцию. Автоиммунные нарушения и другие нарушения, характеризующиеся хроническими воспалениями, характеризуются частично нарушенным продуцированием указанных цитокинов. Недавно было показано, что в иммунных клетках, селективное ингибирование IL-12/IL-23 транскрипции апилимодом опосредовано непосредственным связыванием апилимода с фосфатидилинозитол-3-фосфат 5-киназой (PIKfyve). См., например, Cai et al. Chemistry и Biol. 20 (2013):912-921. PIKfyve принимают участие в Toll-подобной сигнальной схеме рецептора, что является важным для природного иммунитета.
[04] На основании своей активности в качестве иммуномодулирующего средства и специфического ингибитора IL-12/IL-23, апилимод был предложен как полезное средство для лечения автоиммунных и воспалительных заболеваний и нарушений. См., например, US 6858606 и 6660733 (раскрывающие семейство пиримидиновых соединений, включая апилимод, предположительно полезных для лечения заболеваний и нарушений, характеризующихся сверхсинтезом IL-12 или IL-23, таких как ревматоидный артрит, сепсис, болезнь Крона, рассеянный склероз, псориаз или инсулинозависимый сахарный диабет). Аналогично, предполагают, что апилимод можно использовать для лечения некоторых раков на основании его активности в отношении ингибирования c-Rel или IL-12/23, особенно раков, в которых, как считают, указанные цитокины играют роль в промотировании пролиферационной роли аберрантных клеток. См., например, WO 2006/128129 и Baird et al., Frontiers in Oncology 3:1 (2013, соответственно).
[05] Каждое из трех исследований апилимода сфокусировано на его потенциальной эффективности при автоиммунных и воспалительных заболеваниях. Такие исследования проводят для пациентов с псориазом, ревматоидным артритом и болезнью Крона. В открытом клиническом исследовании для пациентов с псориазом пришли к выводу, что пероральное введение апилимода демонстрирует иммуномодулирующую активность, подтверждающую ингибирование IL-12/IL-23 синтеза для лечения TH1- и TH17-опосредованных воспалительных заболеваний. Wada et al., PLosOne 7:e35069 (April 2012). Но результаты контролируемого исследования ревматоидного артрита и болезни Крона не подтверждают предположения о том, что ингибирование IL-12/IL-23 апилимодом приводит к клиническому улучшению одного из указанных показаний. В рандомизированном, дважды слепом, с контролируемым плацебо фазы II клиническом исследовании апилимода у пациентов с ревматоидным артритом, апилимод не смог изменить синовиальную экспрессию IL-12 и IL-23. Krauz et al., Arthritis & Rheumatism 64:1750-1755 (2012). Авторы пришли к выводу, что ʺрезультаты не подтверждают утверждения о том, что ингибирование IL-12/IL-23 апилимодом способно вызвать значительное клиническое улучшение в RA.ʺ Аналогично, рандомизированное, дважды слепое, с контролируемым плацебо исследование апилимода для лечения активной болезни Крона подтвердило, что, хотя апилимод хорошо переносится, он не проявляет эффективности, которая была бы выше эффективности плацебо. Sands et al Inflamm Bowel Dis. 2010 Jul;16(7):1209-18.
[06] Мишеневый путь рапамицина (mTOR) у млекопитающих представляет собой важный клеточный сигнальный путь, который участвует во множестве физиологических функций, включая клеточный рост, клеточную пролиферацию, метаболизм, белковый синтез и аутофагию (La Plante et al Cell 2012, (149 (2), pp.274-293). mTOR представляет собой киназу, которая объединяет внутриклеточные и внеклеточные сигналы, которые определяют уровни аминокислот, стресса, кислорода, энергии и факторов роста и регулирует клеточную реакцию на такие внешние информационные сигналы. Разрегулирование mTOR участвует в широком круге нарушений и заболеваний, включая рак, ожирение, диабет и нейродегенерацию. Некоторые компоненты mTOR пути были использованы как мишени для лекарственных средств для лечения некоторых из указанных заболеваний. Однако терапевтическая эффективность была ограниченной, например, при лечении некоторых раков, и было показано, что некоторые ингибиторы mTOR обладают вредным эффектом в отношении метаболизма. Гены-онкосупрессоры комплекса туберозного склероза, TSC1 и TSC2, представляют собой негативные регуляторы mTOR.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[07] Настоящее изобретение основано, частично, на неожиданном открытии, что апилимод представляет собой высоко цитотоксичное средство в отношении TSC ноль клеток. В таких клетках, mTOR путь является конститутивно активным. mTOR путь активирован в ряде раков, и в дальнейшем скринировании более 100 линий раковых клеток апилимод демонстрирует противопролиферативную активность в клеточных линиях различных раков, включая почечно-клеточный рак. Кроме того, цитотоксическая активность апилимода в раковых клеточных линиях связана скорее с ингибированием внутриклеточной миграции и соответствующим усилением апоптоза и/или аутофагии, нежели с апилимодным ингибированием IL-12/23 продуцирования, как можно было бы предположить на основании апилимодной иммуномодулирующей активности. Кроме того, скрининг более 450 киназ идентифицировал PIKfyve как единственную, обладающую высокой афинностью, связывающую мишень (Kd=75 pM) для апилимода. В настоящем изобретении предложены новые способы терапевтического использования апилимода при лечении рака почечных клеток.
[08] В одном аспекте, в изобретении предложена композиция для лечения рака почек у субъекта, больного раком почек, причем указанная композиция включает терапевтически эффективное количество апилимода, или его фармацевтически приемлемой соли. В некоторых вариантах апилимод представляет собой димезилат апилимода. В некоторых вариантах композиция представлена в форме, пригодной для перорального или внутривенного введения. В некоторых вариантах композиция дополнительно включает по меньшей мере одно дополнительное активное средство, которое можно выбрать из терапевтических средств или нетерапевтических средств, или комбинации терапевтического средства и нетерапевтического средства. В некоторых вариантах по меньшей мере одно такое дополнительное активное средство представляет собой терапевтическое средство, выбранное из группы, состоящей из ингибитора протеинкиназы, противонеопластического средства на основе платины, ингибитора топоизомеразы, нуклеозидного ингибитора метаболизма, алкилирующего агента, интеркалирующего агента, агента, свзывающего тубулин, и их комбинаций. В некоторых вариантах таким терапевтическим средством является ингибитор протеинкиназы. В некоторых вариантах ингибитор протеинкиназы представляет собой пазопаниб или сорафениб, или их комбинацию. Указанная композиция может дополнительно включать нетерапевтическое средство, выбранное таким образом, чтобы уменьшать один или более из побочных эффектов апилимода. В некоторых вариантах, указанное нетерапевтическое средство выбирают из группы, состоящей из онданестрона, гранисетрона, долсетрона и палоносетрона. В некоторых вариантах указанное нетерапевтическое средство выбирают из группы, состоящей из пиндолола и рисперидона.
[09] В некоторых вариантах указанная композиция включает такое количество димезилата апилимода, которое эффективно для ингибирования активности PIKfyve киназы в раковых клетках субъекта. В некоторых вариантах рак почек может быть невосприимчивым к стандартным методам лечения или может быть метастазирующим. В некоторых вариантах рак почек выбирают из светлоклеточного рака почек, переходно-клеточной карциномы, опухоли Вилмса (нефробластомы), саркомы почек и злокачественных (не раковых) опухолей почек, аденомы почек, онкоцитомы и ангиомиолипомы.
[10] В одном аспекте в настоящем изобретении предложен способ лечения рака почек у нуждающегося в этом субъекта, причем указанный способ включает введение субъекту терапевтически эффективного количества апилимода, или композиции, включающей апилимод, где апилимод представляет собой сам апилимод (т.е., апилимод в форме свободного основания), или его фармацевтически приемлемую соль, сольват, клатрат, гидрат, полиморф, пролекарственное средство, аналог или производное. В одном варианте апилимод представляет собой апилимод в форме свободного основания или в форме димезилата апилимода.
[11] В некоторых вариантах указанный способ дополнительно включает введение субъекту по меньшей мере одного дополнительного активного средства. Такое по меньшей мере одно дополнительное активное средство может быть терапевтическим средством или нетерапевтическим средством. Такое по меньшей мере одно дополнительное активное средство можно вводить в виде одной дозовой формы с апилимодом, или в раздельных дозовых формах из апилимода. В некоторых вариантах такое по меньшей мере одно дополнительное активное средство представляет собой терапевтическое средство, выбранное из группы, состоящей из ингибитора протеинкиназы, противонеопластического средства на основе платины, ингибитора топоизомеразы, нуклеозидного метаболического ингибитора, алкилирующего средства, интеркалирующего средства, связывающего тубулин средстваф, ингибитора PD-1/PDL-1 пути и их комбинаций. В некоторых вариантах указанное терапевтическое средство представляет собой ингибитор протеинкиназы. В некоторых вариантах указанный ингибитор протеинкиназы представляет собой пазопаниб или сорафениб, или их комбинацию. В некоторых вариантах по меньшей мере одно дополнительное активное средство представляет собой терапевтическое средство, выбранное из группы, состоящей из сорафениба (нексавара®), санитиниба (сутента®) темзиролимуса (торисела®), эверолимуса (афинитора®), бевацизумаба (авастина®), пазопаниба (вотриента®), акситиниба (инлиа ®) и их комбинаций. В некоторых вариантах указанное терапевтическое средство представляет собой ингибитор PD-1/PDL-1 пути. В некоторых вариантах ингибитор PD-1/PDL-1 пути выбирают из пебролизумаба (Кейтруда), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (MK-3475), MSB0010718C и MEDI4736.
[12] В некоторых вариантах по меньшей мере одно активное средство представляет собой нетерапевтическое средство, выбранное для облегчения одного или более из побочных эффектов апилимода. В некоторых вариантах такое нетерапевтическое средство выбирают из группы, состоящей из онданестрона, гранисетрона, долсетрона и палоносетрона. В одном варианте нетерапевтическое средство выбирают из группы, состоящей из пиндолола и рисперидона. В одном варианте дозовая форма композиции апилимода представляет собой пероральную дозовую форму. В другом варианте указанная дозовая форма композиции апилимода пригодна для внутривенного введения, причем введение осуществляют, используя одну инъекцию или капельницу.
[13] В одном варианте субъектом является раковый пациент-человек. В одном варианте раковый пациент-человек, который нуждается в лечении апилимодом, представляет собой пациента, рак которого является устойчивым к стандартной схеме химиотерапии. В одном варианте раковый пациент-человек, который нуждается в лечении апилимодом, представляет собой пациента, рак которого рецидивирует после лечения по стандартной схеме химиотерапии. В одном варианте указанный рак представляет собой рак почек. В одном варианте рак почек представляет собой переходно-клеточную карциному, опухоль Вилмса (нефробластому), почечную саркому и злокачественные (не раковые) опухоли почек, аденому почек, онкоцитому и ангиомиолипому. В одном варианте рак почек представляет собой светлоклеточный рак почек.
[14] В одном варианте стандартная схема химиотерапии включает один или более из терапевтических средств, выбранных из группы, состоящей из ибритиниба, ритуксимаба, доксорубицина, преднизолона, винкристина, велкада, циклофосфоамида, дексаметазона и эверолимуса.
[15] В одном варианте способ лечения рака почек с использованием комбинированной терапии включает апилимод и схему химиотерапии для лечения рака почек. В некоторых вариантах схема химиотерапии включает ингибитор PD-1/PDL-1 пути. В некоторых вариантах ингибитор PD-1/PDL-1 пути выбирают из пебролизумаба (Кейтруда), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (MK-3475), MSB0010718C и MEDI4736.
[16] В другом варианте способ представляет собой способ лечения рака почек с использованием комбинированной терапии, включающей апилимод и схему иммунотерапии для лечения рака почек. В одном варианте схема иммунотерапии представляет собой схему, включающую интерлейкин-2 (IL-2) или альфа-интерферон. В одном варианте схема иммунотерапии включает ингибитор PD-1/PDL-1 пути. В некоторых вариантах такой ингибитор PD-1/PDL-1 пути выбирают из пебролизумаба (кейтруда), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (MK-3475), MSB0010718C и MEDI4736.
[17] В некоторых вариантах указанный способ представляет собой способ лечения рака почек с использованием комбинированной терапии, включающей апилимод и ингибитор протеинкиназы для лечения рака почек. В одном варианте указанный ингибитор протеинкиназы представляет собой сорафениб, санитиниб, бевацизумаб, ленватиниб, эверолимус.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
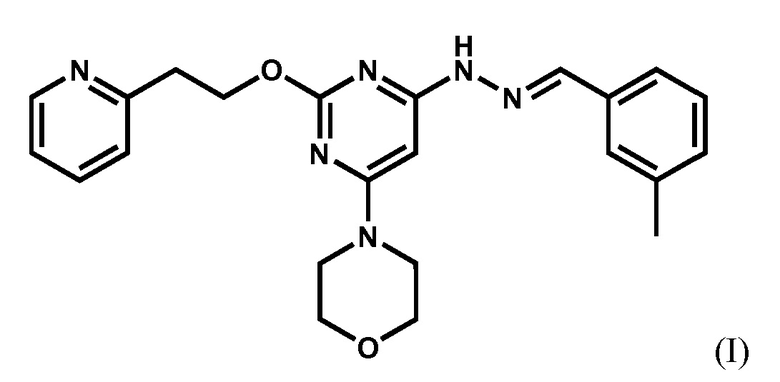
[18] ФИГ. 1: TSC2 дефицитные клетки высокочувствительны к апилимоду (IC50=20 нМ).
[19] ФИГ. 2A: Процент клеточных линий с IC50 менее чем 500 нМ.
[20] ФИГ. 2B: Фибробласты здоровых легких не восприимчивы к индуцированной апилимодом цитотоксичности при столь высоких концентрациях апилимода как 10 мкМ.
[21] ФИГ. 3: Апилимод вызывает дозо-зависимую аутофагию.
[22] ФИГ. 4: Вулканная диаграмма значительных импульсов захвата с использованием CT-689 в концентрации 0,1 мкМ в оптимизированных условиях захвата.
[23] ФИГ. 5: Апилимод связывается с высокой афинностью с PIKfyve (Kd=75 пМ).
[24] ФИГ. 6: Противопролиферативная активность LAM-002 в клеточной лини светлоклеточного рака почек 769-P, Avg. IC50=44 нМ (n=2).
[25] ФИГ. 7: Противопролиферативная активность LAM-002 в клеточной лини светлоклеточного рака почек RCC-MF, Avg. IC50=8 нМ (n=2).
[26] ФИГ. 8: Противопролиферативная активность LAM-002 в клеточной лини светлоклеточного рака почек RCC-ER, Avg. IC50=9 нМ (n=2).
[27] ФИГ. 9: Противопролиферативная активность LAM-002 в клеточной лини светлоклеточного рака почек RCC-FG2, Avg. IC50=32 нМ (n=2).
[28] ФИГ. 10: Противопролиферативная активность LAM-002 в клеточной лини светлоклеточного рака почек RCC-JF, Avg. IC50=60 нМ (n=2).
[29] ФИГ. 11: Противопролиферативная активность LAM-002 в клеточной лини светлоклеточного рака почек 786-O, Avg. IC50=71 нМ (n=2).
[30] ФИГ. 12: Противопролиферативная активность LAM-002 в клеточной лини светлоклеточного рака почек A704, Avg. IC50=11 нМ (n=2).
[31] ФИГ. 13: Противопролиферативная активность LAM-002 в клеточной лини светлоклеточного рака почек RCC-JW, Avg. IC50=27 нМ (n=2).
[32] ФИГ. 14: Комбинация LAM-002+сорафениб в RCC-ER клетках (5 день анализа). A, гистограмма, демонстрирующая жизнеспособность клеток (%); B, определение значения индекса такой комбинации (CI) при ED50, ED75 и ED90.
[33] ФИГ. 15: Комбинация LAM-002+сорафениб в RCC-FG2 клетках (5 день анализа). A, гистограмма, демонстрирующая жизнеспособность клеток (%); B, определение значения индекса такой комбинации (CI) при ED50, ED75 и ED90.
[34] ФИГ. 16: Комбинация LAM-002+сорафениб в RCC-MF клетках (5 день анализа). A, гистограмма, демонстрирующая жизнеспособность клеток (%); B, определение значения индекса такой комбинации (CI) при ED50, ED75 и ED90.
[35] ФИГ. 17: Комбинация LAM-002+сорафениб в 769-P клетках (5 день анализа). A, гистограмма, демонстрирующая жизнеспособность клеток (%); B, определение значения индекса такой комбинации (CI) при ED50, ED75 и ED90.
[36] ФИГ. 18: Комбинация LAM-002+пазопаниб в RCC-ER клетках (5 день анализа). A, гистограмма, демонстрирующая жизнеспособность клеток (%); B, определение значения индекса такой комбинации (CI) при ED50, ED75 и ED90.
[37] ФИГ. 19: Комбинация LAM-002+пазопаниб в RCC-FG2 клетки (5 день анализа). A, гистограмма, демонстрирующая жизнеспособность клеток (%); B, определение значения индекса такой комбинации (CI) при ED50, ED75 и ED90.
[38] ФИГ. 20: Комбинация LAM-002+пазопаниб в RCC-MF клетках (5 день анализа). A, гистограмма, демонстрирующая жизнеспособность клеток (%); B, определение значения индекса такой комбинации (CI) при ED50, ED75 и ED90.
[39] ФИГ. 21: Комбинация LAM-002+пазопаниб в 769-P клетках (5 день анализа). A, гистограмма, демонстрирующая жизнеспособность клеток (%); B, определение значения индекса такой комбинации (CI) при ED50, ED75 и ED90.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ИЗОБРЕТЕНИЯ
[40] Это изобретение относится к композициям и способам, относящимся к использованию апилимода для лечения рака почек у нуждающегося в таком лечении субъекта, предпочтительно, человека. Это изобретение в целом относится к новым способам использования апилимода, основанным на неожиданном открытии цитотоксической активности апилимода против круга раковых клеток как лимфоидного, так и нелимфоидного происхождения, активности, которая четко не связана или не предсказуема из известной иммуномодулирующей активности апилимода и ингибирующей активности IL-12/23.
[41] Кроме того, это изобретение относится к новым терапевтическим подходам к лечению рака, основанным на комбинированной терапии с использованием апилимода и по меньшей мере одного дополнительного терапевтического средства. Раскрытые в описании комбинированные терапии используют уникальную цитотоксическую активность апилимода, что, как показано, обеспечивает синергичный эффект при объединении с другими противоопухолевыми средствами.
[42] В том смысле, как использован в описании, термин ʺапилимодʺ может относиться к самому апилимоду (т.е., апилимоду в форме свободного основания), или может включать фармацевтически приемлемые соли, сольваты, клатраты, гидраты, полиморфы, метаболиты, пролекарственные средства, аналоги или производные апилимода, как раскрыто далее. Структура апилимода представлена в виде формулы I:
[43] Химическое наименование апилимода представляет собой 2-[2-пиридин-2-ил)этокси]-4-N′-(3-метилбензилиден)гидразино]-6-(морфолин-4-ил)пиримидин (IUPAC наименование: (E)-4-(6-(2-(3-метилбензилиден)гидразинил)-2-(2-(пиридин-2-ил)этокси)пиримидин-4-ил)морфолин), и его CAS-номер 541550-19-0.
[44] Апилимод можно получить, например, способом, раскрытым в патентах США № 7923557 и 7863270 и в WO 2006/128129.
[45] В том смысле, как использован в описании, термин "фармацевтически приемлемая соль" означает соль, образованную, например, кислотной и основной группой апилимода. Примеры солей включают, но ими не ограничиваются, такие соли, как сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, безилат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, p-толуолсульфонат и памоат (например, 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)).
[46] Термин "фармацевтически приемлемая соль" также относится к солям, полученным из композиции апилимода, содержащего кислотную функциональную группу, такую как функциональная группа карбоновой кислоты, и фармацевтически приемлемого неорганического или органического основания.
[47] Термин "фармацевтически приемлемая соль" также относится солям, полученным из апилимода, содержащего основную функциональную группу, такую как функциональная аминогруппа, и фармацевтически приемлемой неорганической или органической кислоты.
[48] Соли раскрытых в описании соединений можно синтезировать из исходных соединений обычными химическими способами, такими как способы, раскрытые в Pharmaceutical Salts: Properties, Selection, and Use, P. Hemrich Stalil (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, August 2002. Обычно такие соли можно получить, осуществляя взаимодействие исходных соединений (например, 2-[2-пиридин-2-ил)этокси]-4-N′-(3-метилбензилиден)гидразино]-6-(морфолин-4-ил)пиримидина) с соответствующей кислотой в воде или в органическом растворителе, или в их смеси.
[49] Одну солевую форму раскрытого в описании соединения можно превратить в свободное основание и необязательно в другую солевую форму, используя способы, хорошо известные специалистам в данной области. Например, форму свободного основания можно получить, пропуская раствор соли через колонку, содержащую стационарную фазу амина (например, колонку Strata-NH2). Альтернативно, раствор соли в воде можно обработать бикарбонатом натрия, чтобы разложить соль и высадить свободное основание. Затем свободное основание можно объединить с другой кислотой, используя рутинные способы.
[50] В том смысле, как использован в описании, термин "полиморф" означает твердые кристаллические формы соединений настоящего изобретения (например, 2-[2-пиридин-2-ил)этокси]-4-N′-(3-метилбензилиден)гидразино]-6-(морфолин-4-ил)пиримидина) или его комплексов. Различные полиморфы одного и того же соединения могут проявлять различные физические, химические и/или спектроскопические свойства. Различные физические свойства включают, но ими не ограничиваются, стабильность (например, в отношении тепла или света), прессуемость и плотность (что важно при производстве продуктов и создании лекарственных форм), и скорость растворения (что может повлиять на биодоступность). Различия в стабильности могут возникать из-за химической реакционной способности (например, различного окисления, когда такая дозовая форма обесцвечивается более быстро, когда состоит из одного полиморфа, чем когда состоит из другого полиморфа), или механических характеристик (например, таблетки разрушаются при хранении, когда кинетически более выгодный полиморф превращается в термодинамически более стабильный полиморф) или и то и другое (например, таблетки одного полиморфа более подвержены разрушению в условиях высокой влажности). Различные физические свойства полиморфов могут влиять на их технологические свойства. Например, один полиморф может более легко образовывать сольваты, или его более трудно фильтровать или промывать до состояния без примесей, чем другой полиморф из-за, например, распределения частиц по форме и размерам.
[51] В том смысле, как использован в описании, термин "гидрат" означает соединение изобретения (например, 2-[2-пиридин-2-ил)этокси]-4-N′-(3-метилбензилиден)гидразино]-6-(морфолин-4-ил)пиримидин) или его соль, которое дополнитльно включает стехиометрическое или нестехиометрическое количество воды, связанной нековалентными внутримолекулярными силами.
[52] В том смысле, как использован в описании, термин "клатрат" означает соединение настоящего изобретения (например, 2-[2-пиридин-2-ил)этокси]-4-N′-(3-метилбензилиден)гидразино]-6-(морфолин-4-ил)пиримидин) или его соль, в форме кристаллической решетки, которая содержит пространства (например, каналы), внутри которых заключены ʺгостевые молекулыʺ (например, растворителя или воды).
[53] В том смысле, как использован в описании, термин "пролекарственное средство" означает производное раскрытого в описании соединения (например, 2-[2-пиридин-2-ил)этокси]-4-N′-(3-метилбензилиден)гидразино]-6-(морфолин-4-ил)пиримидина), которое может гидролизоваться, окисляться, или каким-либо другим образом реагировать в биологических условиях (in vitro или in vivo), обеспечивая получение соединения изобретения. Пролекарственные средства могут только становиться активными после таких реакций в биологических условиях, или они могут обладать активностью в своих непрореагировавших формах. Примеры пролекарственных средств, рассматриваемые в изобретении, включают, но ими не ограничиваются, аналоги или производные раскрытых в описании соединений (например, 2-[2-пиридин-2-ил)этокси]-4-N′-(3-метилбензилиден)гидразино]-6-(морфолин-4-ил)пиримидина), которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и их биогидролизуемые фосфатные аналоги. Другие примеры пролекарственных средств включают производные соединений, любых из представленных в описании формул, которые включают -NO, -NO2, -ONO или -ONO2 фрагменты. Пролекарственные средства обычно можно получить, используя хорошо известные способы, такие как те, что раскрыты в Burgerʹs Medicinal Chemistry and Drug Discovery (1995) 172-178, 949-982 (Manfred E. Wolff ed., 5th ed).
[54] В том смысле, как использован в описании, термин ʺсольватʺ или "фармацевтически приемлемый сольват" представляет собой сольват, образованный в результате ассоциации одной или более из молекул растворителя с одним из раскрытых в описании соединений (например, 2-[2-пиридин-2-ил)этокси]-4-N′-(3-метилбензилиден)гидразино]-6-(морфолин-4-ил)пиримидином). Термин сольват включает гидраты (например, полугидрат, моногидрат, дигидрат, тригидрат, тетрагидрат).
[55] В том смысле, как использован в описании, термин ʺаналогʺ относится к химическому соединению, которое структурно аналогично другому, но несколько отличается по композиции (как по замене одного атома на атом другого элемента, или как присутствием конкретной функциональной группы, или заменой одной функциональной группы на другую функциональную группу). Так, аналогом является соединение, которое аналогично или сравнимо по функциям и внешнему виду, но не по структуре или по происхождению сравнтельного соединения. В том смысле, как использован в описании, термин ʺпроизводноеʺ относится к соединениям, которые имеют общую структуру ядра и замещены различными группами, как раскрыто в опсании.
Способы лечения
[56] Это изобретение относится к способам лечения рака почек у нуждающегося в этом субъекта, путем введения субъекту терапевтически эффективного количества апилимода, или его фармацевтически приемлемой соли, сольвата, клатрата, гидрата, полиморфа, пролекарственного средства, аналога или производного.
В одном варианте рак почек представляет собой карциному раковых клеток (RCC). В одном варианте
карциному раковых клеток выбирают из группы, состоящей из светлоклеточной карциномы раковых клеток, папиллярной) карциномы раковых клеток, хромофобной карциномы раковых клеток, других редких типов карцином раковых клеток (например, собирающего протока RCC, мультилокулярной кистозной RCC, медуллярной карциномы, слизеобразующей трубчатой и веретеноклеточной плоскоклеточной карциномы, RCC, связанной с нейробластомой, неклассифицированной карциномой раковых клеток, и метастазирующей RCC. В одном варианте рак почек выбирают из группы, состоящей из переходно-клеточной карциномы, опухоли Вилмса (нефробластомы), саркомы почек и злокачественных (не раковых) опухолей почек, аденомы почек, онкоцитомы и ангиомиолипомы.
[57] Это изобретение также относится к способы, включающие комбинированную терапию для лечения рака. В том смысле, как использованы в описании, термины ʺкомбинированная терапияʺ или ʺкотерапияʺ включают введение терапевтически эффективного количества апилимода как часть специфической схемы лечения, предназначенной для создания благоприятного эффекта от совместного действия апилимода и дополнительного активного соединения. Такое по меньшей мере одно дополнительное соединение может быть терапевтическим средством или нетерапевтическим средством.
Благоприятный эффект такой комбинации включает, но им не ограничивается, фармакокинетическое или фармакодинамическое совместное действие, возникающее в результате комбинации терапевтических соединений. Благоприятный эффект такой комбинации может также относиться к уменьшению токсичности, побочных эффектов, или вредных воздействий, связаннных с другим соединением в комбинации. ʺКомбинированная терапияʺ не включает введение двух или более из указанных терапевтических соединений как части раздельных схем монотерапии, которые случайно и произвольно приводят к благоприятному эффекту, который не преследовался или не предсказывался.
[58] По меньшей мере, одно дополнительное активное соединение может быть терапевтическим соединением, например, противоопухолевым соединением, или противораковым химиотерапевтическим соединением, или нетерапевтическим соединением и их комбинацией. Что касается терапевтических соединений, то благоприятный эффект таких комбинаций включает, но им не ограничивается, фармакокинетическое или фармакодинамическое совместное действие, возникающее в результате комбинации терапевтически активных соединений. Что касается нетерапевтических соединений, то благоприятный эффект такихкомбинаций может быть связан со снижением токсичности, побочных эффектов или вредных воздействий, связанных с терапевтически активным соединением в комбинации.
[59] В одном варианте по меньшей мере одно дополнительное соединение представляет собой нетерапевтическое средство, которое уменьшает один или более из побочных эффектов апилимодной композиции, один или более из побочных эффектов, выбранных из любого из тошноты, рвоты, головной боли, головокружения, дурноты, сонливости и стресса. В одном аспекте рассматриваемого варианта, нетерапевтическое средство является антагонистом серотониновых рецепторов, также известных как 5-гидрокситриптаминовые рецепторы или 5-HT рецепторы. В одном аспекте, нетерапевтическое средство является антагонистом 5-HT3 или 5-HT1a рецепторов. В одном аспекте, нетерапевтическое средство выбирают из группы, состоящей из онданестрона, гранисетрона, доластерона и палоносетрона. В другом аспекте, нетерапевтическое средство выбирают из группы, состоящей из пиндолола и рисперидона.
[60] В одном варианте по меньшей мере одно дополнительное соединение представляет собой терапевтическое средство. В одном варианте терапевтическое средство представляет собой противоопухолевое средство, как подробно раскрыто далее в разделе ʹкомбинированная терапияʹ.
[61] В контексте комбинированной терапии, введение апилимода, или его фармацевтически приемлемой соли, сольвата, клатрата, гидрата, полиморфа, метаболита, пролекарственного средства, аналога или производного, можно осуществлять одновременно или последовательно с введением одного или более из дополнительных активных соединений. В другом варианте, введение различных компонентов комбинированной терапии можно осуществлять с раздичной частотой. Одно или более из дополнительных средство можно вводить до (например, за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недели, 6 недель, 8 недель или 12 недель до), одновременно или последовательно с (например, после 5 минут, 15 минут, 30 минут, 45 минут, 1 часа, 2 часов, 4 часов, 6 часов, 12 часов, 24 часов, 48 часов, 72 часов, 96 часов, 1 недели, 2 недель, 3 недель, 4 недель, 5 недель, 6 недель, 8 недель или 12 недель) введением соединения изобретения.
[62] Одно или более из дополнительных активных соединений можно приготовить для совместного введения с апилимодом в единой дозовой форме, как будет раскрыто более подробно. Одно или более из дополнительных активных средств можно вводить отдельно от дозовой формы, которая включает апилимод. Если дополнительное активное средство вводят отдельно от апилимода, его можно вводить таким же или отличающимся способом введения, что и апилимод.
[63] Предпочтительно, введение композиции, включающей апилимод в комбинации с одним или более из дополнительных активных средств, приводит к синергической реакции организма подлежащего лечению субъекта. В указанном контекстке термин ʺсинергичноʺ относится к эффективности такой комбинации, которая более эффективна, чем аддитивные эффекты любой отдельной терапии. Синергичный эффект комбинированной терапии согласно изобретению позволяет использовать более низкие дозы и/или менее частое введение по меньшей мере одного средства в комбинации, по сравнению с его дозой и/или частотой введения без такой комбинации. Дополнительные благоприятные эффекты таких комбинаций могут проявляться в исчезновении или уменьшении вредных или нежелательных побочных эффектов, связанных с использованием любой из терапий, указанных в комбинации, отдельно (также именуемых монотрапией).
[64] ʺКомбинированная терапияʺ также включает введение соединений настоящего изобретения в дополнительной комбинации с терапиями с нелекарственными средствами (например, хирургическим или радиационным лечением). Если указанная комбинированная терапия дополнительно включает лечение нелекарственным средством, такое лечение нелекарственным средством можно проводить в любое подходящее время, если только достигается благоприятный эффект от совместного действия лечения такой комбинацией терапевтических соединений и нелекарственных средств. Например, в соответствующих случаях такой благоприятный эффект все еще достигается, когда лечение нелекарственным средством временно исключает введение терапевтических соединений, возможно на дни или даже недели.
[65] Лечение нелекарственным средством можно выбрать из химиотерапии, радиационной терапии, гормональной терапии, анти-эстрогенной терапии, генной терапии, хирургии (например, радикальной нефректомии, частичной нефректомии, лапараскопической и роботизированной хирургии), радиочастотной абляции и криоабляции. Например, терапия нелекарственным средством представляет собой удаление яичника (например, для снижения уровня эстрогена в организме), плевральную пункцию (например, для удаления жидкости из груди), парацентез (например, для удаления жидкости из абдомена), хирургическое вмешательство для удаления или ушивания ангиомиолипомы, трансплантацию легких (и необязательно с антибиотиком для предотвращения инфицирования, связанного с трансплантацией), или кислородную терапию (например, через назальную канюлю, содержащую две небольшие пластиковые трубки или назальные канюли, которые размещают в обоех ноздрях, через лицевую маску, которую помещают поверх носа и рта, или через небольшую трубку, вставленную в дыхательное горло через фронтальную часть шеи, также называемую транстрахеальной кислородной терапией).
[66] В одном варианте по меньшей мере одно дополнительное соединение представляет собой средство, которое уменьшает один или более из побочных эффектов апилимода, выбранных из любого из тошноты, рвоты, головной боли, головокружения, дурноты, сонливости и стресса. В одном аспекте рассматриваемого варианта изобретения, указанное дополнительное соединение представляет собой антагонист серотониновых рецепторов, также известных как 5-гидрокситриптаминовые рецепторы или 5-HT рецепторы. В одном аспекте дополнительное соединение представляет собой антагонист 5-HT3 или 5-HT1a рецепторы. В одном аспекте средство выбирают из группы, состоящей из онданестрона, гранисетрона, доластерона и палоносетрона. В другом аспете средство выбирают из группы, состоящей из пиндолола и рисперидона.
[67] В одном варианте по меньшей мере одно дополнительное соединение представляет собой противоопухолевое средство. В одном варианте противоопухолевое средство выбирают из таксола, винкристина, доксорубицина, темзиролимуса, карбоплатина, офатумумаба, ритуксимаба и их комбинаций.
[68] В одном варианте по меньшей мере одно дополнительное соединение выбирают из хлорамбуцила, ифосфамида, доксорубицина, месалазина, талидамида, леналидомида, темзиролимуса, эверолимуса, флударабина, фостаматиниба, паклитакселя, доцетакселя, офатумумаба, ритуксимаба, дексаметазона, преднизона, CAL-101, ибритумомаба, тозитумомаба, бортезомиба, пентостатина, эндостатина или их комбинаций.
[69] В одном варианте по меньшей мере одно дополнительное соединение выбирают из афинитора (эверолимуса), алдеслейкина, авастина (бевацизумаба), акситиниба, бевацизумаба, эверолимуса, IL-2 (алдеслейкина), инлита (акситиниба), интерлейкина-2 (алдеслейкина), нексавара (тозилата сорафениба), гидрохлорида пазопаниба, пролейкина (алдеслейкина), тозилата сорафениба, малата санитиниба, сутента (малата санитиниба), темзиролимуса, торисела (темзиролимуса), вотриента (гидрохлорида пазопаниба) или их комбинаций.
[70] В одном варианте по меньшей мере одно дополнительное соединение направлено на целевую терапию, при которой целью являются раковые специфические гены, белки, или окружающие ткани, которые вносят вклад в рост и выживание раковых клеток. Такой тип лечения блокирует рост и распространение раковых клеток, при этом ограничивая повреждение здоровых клеток.
[71] В одном варианте по меньшей мере одно дополнительное соединение направлено на противоангиогенную терапию, при которой лечение фокусируется на остановке ангиогенеза, который представляет собой процесс создания новых кровеносных сосудов. Так как опухоль нуждается в питании, поставляемом кровеносными сосудами, для роста и разрастания, целью противоангиогенной терапии является ʺголоданиеʺ опухоли. Было показано, что одно противоангиогенное лекарственное средство, бевацизумаб (авастин), замедляет рост опухоли у людей с метастазирующей карциномой почек. Бевацизумаб, объединенный с интерфероном, замедляет рост и разрастание опухоли.
[72] В одном варианте по меньшей мере одно дополнительное соединение направлено на иммунотерапию, также именуемую биологической терапией, целью которой являетися стимуляция природных защитных сил организма на борьбу с раком. В ней используют материалы, или созданные организмом, или созданные в лаборатории, для усиления, воздействия или восстановления функций иммунной системы. Например, интерлейкин-2 (IL-2) представляет собой лекарственное средство, которое использовали для лечения рака почек, также как AM0010 и интерлейкин-15. Они представляют собой клеточные гормоны, называемые цитокинами, продуцируемыми лейкоцитами (белыми клетками крови), которые играют важную роль в функциях иммунной системы, включая разрушение опухолевых клеток. Альфа-интерферон представляет собой другой тип иммунотерапии, используемый для лечения рака почек с метастазами. Интерферон, по-видимому, изменяет белки на поверхности раковых клеток и замедляет их рост. Многие комбинированные терапии, состоящие из IL-2 и альфа-интерферона, для пациентов с метастазирующим раком почек, объединенные с химиотерапией, оказываются более эффективными, чем IL-2 или интерферон отдельно.
[73] В некоторых вариантах по меньшей мере, одним дополнительным средством является ингибитор PD-1/PDL-1 пути. В некоторых вариантах ингибитор PD-1/PDL-1 пути выбирают из пебролизумаба (кейтруда), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (MK-3475), MSB0010718C и MEDI4736.
[74] Другим примером является соединение, называемое ингибитором контрольной точки. Лечение такими соединениями направлено на молекулы, которые служат проверкой и приводят в равновесие иммунные реакции. Блокируя указанные ингибирующие молекулы или, альтернативно, активируя стимулирующие молекулы, такие способы лечения созданы для того, чтобы стимулировать или усилить существовавшие ранее противораковые иммунные реакции. Различные антитела включают PD-1, анти-CD27, B7-H3, KIR, LAG-3, 4-1BB/CD137 и GITR. Примеры соединений включают пебролизумаб (кейтруд, MK-3475, PD-1 антитело), MPDL3280A (PD-L1 антитело), варлилумаб (CDX-1127, анти-CD27 антитело), MGA217 (антитело, направленное на B7-H3), лирилумаб (KIR антитело), BMS-986016 (LAG-3 антитело), урелумаб (4-1BB/CD137 антитело), TRX518 (GITR антитело) и MK-4166 (GITR антитело).
[75] Другим примером является противораковая вакцина, созданная для того, чтобы выработать иммунную реакцию против опухоль-специфических или опухоль-связанных антигенов, вынуждающих иммунную систему атаковать раковые клетки, содержащие указанные антигены. Примеры средств включают AGS-003, DCVax и NY-ESO-1.
[76] Другим примером являются иммунные клетки, которые удалены у пациента, генетически модифицированы или обработаны химическими веществами для повышения их активности, и затем снова введенные пациенту с целью повышения противоопухолевой реакции иммунной системы.
[77] В контексте раскрытых в описании способов количество вводимого субъекту апилимода, представляет собой терапевтически эффективное количество. Термин ʺтерапевтически эффективное количествоʺ относится к количеству, достаточному для лечения, облегчения симптомов, уменьшения тяжести или уменьшения длительности заболевания или нарушения, подлежащего лечению, или для усиления или улучшения терапевтического эффекта другой терапии, или достаточному для демонстрации выявляемого терапевтического эффекта у субъекта. В одном варианте терапевтически эффективное количество композиции апилимода представляет собой количество, эффективное для ингибирования активности PIKfyve киназы.
[78] Эффективное количество апилимода может быть в интервале от около 0,001 мг/кг до около 1000 мг/кг, от около 0,01 мг/кг до около 100 мг/кг, от около 10 мг/кг до около 250 мг/кг, от около 0,1 мг/кг до около 15 мг/кг; или в любом интервале, в котором нижний предел интервала представляет собой любое количество между 0,001 мг/кг и 900 мг/кг и верхний предел интервала представляет собой любое количество между 0,1 мг/кг и 1000 мг/кг (например, 0,005 мг/кг и 200 мг/кг, 0,5 мг/кг и 20 мг/кг). Эффективные дозы также меняются, как известно специалистам в данной области, в зависимости от подлежащего лечению заболевания, способа введения, использования возможности совместного использования с другими способами терапевтического лечения, такими как использование других средств. См., например, патент США № 7863270, включенный в описание по ссылке.
[79] В более специфических аспектах, апилимод вводят в схеме дозирования 30-1000 мг/день (например, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275 или 300 мг/день) в течение по меньшей мере 1 недели (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 36, 48 или более недель). Предпочтительно, апилимод вводят по дозовой схеме 100-1000 мг/день в течение 4 или 16 недель. Альтернативно или последовательно апилимод вводят по дозовой схеме 100-300 мг дважды в день в течение 8 недель, или необязательно, в течение 52 недель. Альтернативно или последовательно, композицию апилимода вводят в дозовом режиме 50 мг-1000 мг дважды в день в течение 8 недель, или необязательно, в течение 52 недель.
[80] Эффективное количество композиции апилимода можно вводить один раз ежедневно, от двух до пяти раз ежедневно, вплоть до двух раз ежедневно или вплоть до трех раз ежедневно, или вплоть до восьми раз ежедневно. В одном варианте композицию апилимода вводят трижды в день ежедневно, дважды в день ежедневно, один раз в день ежедневно, в течение четырнадцати дней (четыре раза ежедневно, три раза ежедневно, или два раза ежедневно, или один раз ежедневно) с 7 дневным перерывом в течение трехнедельного цикла, вплоть до пяти или семи дней (четыре раза ежедневно, три раза ежедневно или два раза ежедневно, или один раз ежедневно) с 14-16 дневным перерывом в течение трехнедельного цикла, или один раз каждые два дня, или один раз в неделю, или один раз каждые две недели, или один раз каждые 3 недели.
[81] Согласно раскрытым в описании способами выражение ʺу нуждающегося в этом субъектаʺ описывает субъекта с раком почек, или субъекта с повышенным риском развития рака почек относительно общей популяции. Нуждающимся в этом субъектом может быть один из ʺнереагирующихʺ на лечение или ʺтрудно поддающихсяʺ доступным в настоящее время способам лечения рака. В указанном контексте термины ʺнереагирующийʺ на лечение и ʺтрудно поддающийсяʺ лечению относятся к реакции субъекта на лечение, как клинически неадекватное для облегчения одного или более из симптомов, связанных с указанным заболеванием или нарушением. В одном аспекте раскрытых в описании способов, у нуждающегося в этом субъекта имеется рак, который трудно поддается лечению стандартными терапевтическими способами, или рак, который дает рецидив после стандартного лечения.
[82] Термин ʺсубъектʺ включает млекопитающих. Таким млекопитающим может быть, например, любое млекопитающее, например, человек, примат, позвоночное, птица, мышь, крыса, домашняя птица, собака, кошка, корова, лошадь, коза, верблюд, овца или свинья. Предпочтительно, млекопитающим является человек. Термин ʺпациентʺ относится к субъекту-человеку.
[83] Это изобретение также относится к монотрапии для лечения рака почек, как раскрыто в описании. В том смысле как использован в описании, термин ʺмонотрапияʺ относится к введению одного активного или терапевтического соединения нуждающемуся в этом субъекту.
[84] В том смысле как использован в описании, термины ʺлечениеʺ, ʺобработкаʺ или ʺлечитьʺ описываюет уход и заботу о пациенте с целью побороть заболевание, состояние или нарушение, и включают введение апилимода для облегчения симптомов или осложнений, связанных с болезнью, состоянием или нарушением, или исключение заболевания, состояния или нарушения.
[85] В том смысле как использованы в описании, термины ʺпрофилактикаʺ, ʺпредотвращениеʺ или ʺпредотвратитьʺ описывают уменьшение или исключение наступления симптомов или осложнений заболевания, состояния или нарушения, и включают введение апилимода для уменьшения наступления, развития или возвращения симптомов заболевания, состояния или нарушения.
[86] В одном варианте такое введение апилимода приводит к исключению симптомов или осложнений подвергающегося лечению рака, однако, полное исключение рака не требуется. В одном варианте снижают тяжесть симптомов заболевания. В контексте рака, такие симптомы включают клинические маркеры тяжести или развития, включая степень, до которой опухоль секретирует факторы роста, уменьшает внеклеточный матрикс, становится васкулизированной, уменьшает адгезию с расположенными рядом тканями, или метастазирует, также как уменьшает число метастазов.
[87] Лечение рака раскрытыми в описании способами может привести к уменьшению размеров опухоли. Уменьшение размеров опухоли можно также называть ʺремиссией опухолиʺ. Предпочтительно, если после лечения, размер опухоли уменьшается на 5% или больше по сравнению с ее размерами до лечения; более предпочтительно, если размер опухоли уменьшается на 10% или больше; более предпочтительно, уменьшается на 20% или больше; более предпочтительно, уменьшается на 30% или больше; более предпочтительно, уменьшается на 40% или больше; еще более предпочтительно, уменьшается на 50% или больше; и наиболее предпочтительно, уменьшается на более чем 75% или больше. Размеры опухоли можно измерить любым воспроизводимым способом измрения. Размеры опухоли можно представить как диаметр опухоли.
[88] Лечение рака согласно раскрытым в описании способам, может привести к уменьшению объема опухоли. Предпочтительно, если после лечения объем опухоли уменьшается на 5% или больше по сравнению с ее размерами до лечения; более предпочтительно, если объем опухоли уменьшается на 10% или больше; более предпочтительно, уменьшается на 20% или больше; более предпочтительно, уменьшается на 30% или больше; более предпочтительно, уменьшается на 40% или больше; еще более предпочтительно, уменьшается на 50% или больше; и наиболее предпочтительно, уменьшается на более чем 75% или больше. Объем опухоли можно измерить любым воспроизводимым способом измерения.
[89] Лечение рака раскрытыми в описании способами может привести к уменьшению числа опухолей. Предпочтительно, если после лечения, число опухолей уменьшается на 5% или больше по сравненю с их числом до лечения; более предпочтительно, если число опухолей уменьшается на 10% или больше; более предпочтительно, уменьшается на 20% или больше; более предпочтительно, уменьшается на 30% или больше; более предпочтительно, уменьшается на 40% или больше; еще более предпочтительно, уменьшается на 50% или больше; и наиболее предпочтительно, уменьшается на более чем 75%. Количество опухолей можно измерить любым воспроизводимым способом измерения. Число опухолей можно измерить, подсчитывая их визуально невооруженным глазом или при специфическом увеличении. Предпочтительно, такое специфическое увеличение составляет 2 ×, 3×, 4×, 5×, 10× или 50×.
[90] Лечение рака раскрытыми в описании способами может привести к уменьшению числа метастатических поражений в других тканях или органах, находящихся на расстоянии от сайта первичной опухоли. Предпочтительно, если после лечения, количество метастазов уменьшается на 5% или больше по сравнению с их количеством до лечения; более предпочтительно, если количество метастазов уменьшается на 10% или больше; более предпочтительно, уменьшается на 20% или больше; более предпочтительно, уменьшается на 30% или больше; более предпочтительно, уменьшается на 40% или больше; еще более предпочтительно, уменьшается на 50% или больше; и наиболее предпочтительно, уменьшается на более чем 75%. Количество метастазов можно измерить любым воспроизводимым способом измерения. Количество метастазов можно измерить, подсчитывая количество метастазов визуально невооруженным глазом или при специфическом увеличении. Предпочтительно, если специфическое увеличение составляет 2×, 3×, 4×, 5×, 10×, или 50×.
[91] Лечение рака раскрытыми в описании способами может привести к увеличению среднего времени выживания популяции подвергнутых лечению субъектов относительно популяции, получившей носитель отдельно. Предпочтительно, если среднее время выживания увеличивается на более чем 30 дней; более предпочтительно, на более чем 60 дней; более предпочтительно, на более чем 90 дней; и наиболее предпочтительно, на более чем 120 дней. Увеличение среднего времени выживания популяции можно измерить любым воспроизводимым способом. Увеличение среднего времени выживания популяции можно измерить, например, подсчитывая для популяции среднюю длительность выживания после начала лечения активным соединением. Увеличение среднего времени выживания популяции можно также измерить, например, подсчитывая для популяции среднюю длительность выживания после завершения первого цикла лечения активным соединением.
[92] Лечение рака раскрытыми в описании способами может привести к увеличению среднего времени выживания популяции подвергнутых лечению субъектов по сравнению с популяцией не подвергавшихся лечению субъектов. Предпочтительно, если среднее время выживания увеличивается на более чем 30 дней; более предпочтительно, на более чем 60 дней; более предпочтительно, на более чем 90 дней; и наиболее предпочтительно, на более чем 120 дней. Увеличение среднего времени выживания популяции можно измерить любым воспроизводимым способом. Увеличение среднего времени выживания популяции можно измерить, например, подсчитывая для популяции среднюю длительность выживания после начала лечения активным соединением. Увеличение среднего времени выживания популяции можно измерить, например, подсчитывая для популяции среднюю длительность выживания после завершения первого цикла лечения активным соединением.
[93] Лечение рака раскрытыми в описании способами может привести к увеличению среднего времени выживания популяции подвергнутых лечению субъектов по сравнению с популяцией субъектов, получавших монотерапию лекарственным средством, которое не является апилимодом. Предпочтительно, если среднее время выживания увеличивается на более чем 30 дней; более предпочтительно, на более чем 60 дней; более предпочтительно, на более чем 90 дней; и наиболее предпочтительно, на более чем 120 дней. Увеличение среднего времени выживания популяции можно измерить любым воспроизводимым способом. Увеличение среднего времени выживания популяции можно измерить, например, подсчитывая для популяции среднюю длительность выживания после начала лечения активным соединением. Увеличение среднего времени выживания популяции можно измерить, например, подсчитывая для популяции среднюю длительность выживания после завершения первого цикла лечения активным соединением.
[94] Лечение рака раскрытыми в описании способами может привести к снижению показателя смертности в популяции подвергнутых лечению субъектов по сравнению с популяцией субъектов, получавшей носитель отдельно. Лечение нарушения, заболевания или состояния раскрытыми в описании способами может привести к снижению показателя смертности в популяции подвергнутых лечению субъектов по сравнению с популяцией не подвергавшихся лечению субъектов. Лечение нарушения, заболевания или состояния раскрытыми в описании способами может привести к снижению показателя смертности в популяции подвергнутых лечению субъектов по сравнению с популяцией субъектов, получавших монотрапию с лекарственным средством, которое не является апилимодом. Предпочтительно, если показатель смертности снижается на более чем 2%; более предпочтительно, на более чем 5%; более предпочтительно, на более чем 10%; и наиболее предпочтительно, на более чем 25%. Снижение показателя смертности популяции подвергнутых лечению субъектов можно измерить любым воспроизводимым способом. Снижение показателя смертности популяции подвергнутых лечению субъектов можно измерить, например, подсчитывая для популяции среднее количество связанных с заболеванием смертей за единицу времени после начала лечения активным оединением. Снижение показателя смертности популяции подвергнутых лечению субъектов можно измерить, например, подсчитывая для популяции среднее количество связанных с заболеванием смертей за единицу времени после завершения первого цикла лечения активным соединением.
[95] Лечение рака раскрытыми в описании способами может привести к снижению скорости роста опухоли. Предпочтительно, если после лечения, скорость роста опухоли уменьшается на по меньшей мере 5% по сравнению со скоростью до лечения; более предпочтительно, если скорость роста опухоли уменьшается на по меньшей мере, 10%; более предпочтительно, уменьшается на по меньшей мере, 20%; более предпочтительно, уменьшается на по меньшей мере, 30%; более предпочтительно, уменьшается на по меньшей мере, 40%; более предпочтительно, уменьшается на по меньшей мере, 50%; еще более предпочтительно, уменьшается на по меньшей мере 50%; и наиболее предпочтительно, уменьшается на по меньшей мере 75%. Скорость роста опухоли можно измерить любым воспроизводимым способом измерения. Скорость роста опухоли можно измерить по изменению диаметра опухоли в единицу времени. В одном варианте после лечения скорость роста опухоли может быть около нуля и ее определяют как сохранение того же самого размера, например, как остановку роста опухоли.
[96] Лечение рака раскрытыми в описании способами может привести к прекращению возобновления роста опухоли. Предпочтительно, если после лечения, возобновление роста опухоли составляет менее 5%; более предпочтительно, возобновление роста опухоли составляет менее 10%; более предпочтительно, менее чем 20%; более предпочтительно, менее чем 30%; более предпочтительно, менее чем 40%; более предпочтительно, менее чем 50%; еще более предпочтительно, менее чем 50%; и наиболее предпочтительно, менее чем 75%. Возобновление роста опухоли можно измерить любым воспроизводимым способом. Возобновление роста опухоли измеряют, например, измеряя увеличение диаметра опухоли после предшествующего сжатия опухоли после лечения. Об уменьшении возобновления роста опухоли свидетельствует отсутствие возобновления роста опухоли после прекращаения лечения.
[97] Лечение или профилактика нарушения клеточной пролиферации раскрытыми в описании способами может привести к уменьшению скорости клеточной пролиферации. Предпочтительно, если после лечения, скорость клеточной пролиферации уменьшается на по меньшей мере, 5%; более предпочтительно, на по меньшей мере, 10%; более предпочтительно, на по меньшей мере, 20%; более предпочтительно, на по меньшей мере, 30%; более предпочтительно, на по меньшей мере, 40%; более предпочтительно, на по меньшей мере, 50%; еще более предпочтительно, на по меньшей мере, 50%; и наиболее предпочтительно, на по меньшей мере, 75%. Скорость клеточной пролиферации можно измерить любым воспроизводимым способом. Скорость клеточной пролиферации можно измерить, например, измеряя число делящихся клеток в ткани образца в единицу времени.
[98] Лечение или профилактика нарушения клеточной пролиферации раскрытыми в описании способами может привести к уменьшению доли пролиферирующих клеток. Предпочтительно, если после лечения, доля пролиферирующих клеток уменьшается на по меньшей мере, 5%; более предпочтительно, на по меньшей мере, 10%; более предпочтительно, на по меньшей мере, 20%; более предпочтительно, на по меньшей мере, 30%; более предпочтительно, на по меньшей мере, 40%; более предпочтительно, на по меньшей мере, 50%; еще более предпочтительно, на по меньшей мере, 50%; и наиболее предпочтительно, на по меньшей мере, 75%. Долю пролиферирующих клеток можно измерить любым воспроизводимым способом. Предпочтительно, если долю пролиферирующих клеток измеряют, например, подсчитывая количество делящихся клеток по сравнению с числом неделящихся клеток в образце ткани. Доля пролиферирующих клеток может быть эквивалентна митотическому индексу.
[99] Лечение или профилактика нарушения клеточной пролиферации согласно раскрытым в описании способам может привести к уменьшению размеров площади или зоны клеточной пролиферации. Предпочтительно, если после лечения размер площади или зоны клеточной пролиферации уменьшается на по меньшей мере, 5% относительно его размера до лечения; более предпочтительно, если уменьшается на по меньшей мере 10%; более предпочтительно, уменьшается на по меньшей мере 20%; более предпочтительно, уменьшается на по меньшей мере 30%; более предпочтительно, уменьшается на по меньшей мере 40%; более предпочтительно, уменьшается на по меньшей мере 50%; еще более предпочтительно, уменьшается на по меньшей мере 50%; и наиболее предпочтительно, уменьшается на по меньшей мере 75%. Размер площади или зоны клеточной пролиферации можно измерить любым воспроизводимым способом. Размер площади или зоны клеточной пролиферации можно измерить как диаметр или ширину площади или зоны клеточной пролиферации.
[100] Лечение или профилактика нарушения клеточной пролиферации согласно раскрытым в описании способам может привести к уменьшению числа или доли клеток, имеющих анормальный вид или морфологию. Предпочтительно, если после лечения число клеток, имеющих анормальный вид или морфологию уменьшается на по меньшей мере 5% относительно его чила до лечения; более предпочтительно, уменьшается на по меньшей мере 10%; более предпочтительно, уменьшается на по меньшей мере 20%; более предпочтительно, уменьшается на по меньшей мере 30%; более предпочтительно, уменьшается на по меньшей мере 40%; более предпочтительно, уменьшается на по меньшей мере 50%; еще более предпочтительно, уменьшается на по меньшей мере 50%; и наиболее предпочтительно, уменьшается на по меньшей мере 75%. Клетки с анормальным видом и морфологией можно измерить любым воспроизводимым способом. Анормальную клеточную морфологию можно измерить с помощью микроскопа, например, используя инверторный микроскоп для тканевых культур. Анормальная клеточная морфология также может принимать форму ядерного плейоморфизма.
[101] В том смысле, как использован в описании, термин ʺселективноʺ означает тенденцию к нахождению с более высокой частотой в одной популяции, чем в другой популяции. Сравниваемые популяции могут быть популяциями клеток. Предпочтительно, апилимод действует селективно на гиперпролиферирующие клетки или анормально пролиферирующие клетки, по сравнению с нормальными клетками. В том смысле как использован в описании, термин ʺнормальная клеткаʺ представляет собой клетку, которую нельзя классифицировать как часть ʺнарушения клеточной пролиферацииʺ. У нормальной клетки отсутствует разрегулированный или анормальный рост, или они оба, что может привести к развитию нежелательного состояния или заболевания. Предпочтительно, если нормальная клетка характеризуется нормально функционирующим механизмом контрольной точки клеточного цикла. Предпочтительно, если апилимод, действует селективно, модулируя одну молекулярную мишень (например, мишеневую киназу), но значительно не модулирует другие молекулярные мишени (например, немишеневую киназу). Это изобретение также относится к способу селективного ингибирования активности фермента, такого как киназа. Предпочтительно, если событие происходит селективно в популяции A относительно популяции B, если оно происходит более чем в два раза чаще в популяции A по сравнению с популяцией B. Событие происходит селективно, если оно происходит более чем в пять раз чаще в популяции A. Событие происходит селективно, если оно происходит более чем в десять раз чаще в популяции A.; более предпочтительно, более чем в пятьдесят раз; еще более предпочтительно, более чем в 100 раз; и наиболее предпочтительно, более чем в 1000 раз 1000 раз более часто в популяции A по сравнению с популяцией B. Например, следует сказать, что гибель клеток происходит селективно в больных или гиперпролиферирующих клетках, если она происходит более чем в два раза чаще в больных или гиперпролиферирующих клетках по сравнению с нормальными клетками.
Фармацевтические композиции и лекарственные формы
[102] Это изобретение относится к фармацевтическим композициям, включающим такое количество апилимода, или его фармацевтически приемлемой соли, сольвата, клатрата, гидрата, полиморфа, метаболита, пролекарственного средства, аналога или производного, в комбинации с по меньшей мере одним фармацевтически приемлемым эксципиентом или носителем, которое эффективно для лечения рака почек и/или эффективно для ингибирования PIKfyve в раковых клетках больного раком субъекта.
[103] В одном варианте апилимод представляет собой апилимод в форме свободного основания. В одном варианте апилимод представляет собой димезилат апилимода.
[104] В одном варианте апилимод объединен с по меньшей мере одним дополнительным активным средством в единой дозовой форме. В одном варианте композиция дополнительно включает антиоксидант.
[105] В некоторых вариантах по меньшей мере одно дополнительное активное средство выбирают из группы, состоящей из алкилирующего агента, интеркалирующего агента, связывающего тубулин агента, кортикостероида и их комбинаций. В одном варианте по меньшей мере одно дополнительное активное средство представляет собой терапевтическое средство, выбранное из группы, состоящей из ибритиниба, ритуксимаба, доксорубицина, преднизолона, винкристина, велкада и эверолимуса, и их комбинаций. В одном варианте по меньшей мере одно дополнительное активное средство представляет собой терапевтическое средство, выбранное из циклофосфамида, гидроксидаунорубицина (также именуемого как доксорубицин или адриамицин™), винкристина (также именуемого как онковин™), преднизона, преднизолона и их комбинаций.
[106] В некоторых вариантах по меньшей мере одно дополнительное активное средство представляет собой нетерапевтическое средство, выбранное таким образом, чтобы облегчить один или более из побочных эффектов композиции апилимода. В одном варианте нетерапевтическое средство выбирают из группы, состоящей из онданестрона, гранисетрона, доластерона и палоносетрона. В одном варианте нетерапевтическое средство выбирают из группы, состоящей из пиндолола и рисперидона.
[107] В некоторых вариантах по меньшей мере одно дополнительное соединение представляет собой ингибитор PD-1/PDL-1 пути. В некоторых вариантах указанный ингибитор PD-1/PDL-1 пути выбирают из пебролизумаба (кейтруда), авелумаба, атезолизумаба (MPDL3280A), ниволумаба (BMS-936558), пидилизумаба (MK-3475), MSB0010718C и MEDI4736.
[108] В некоторых вариантах по меньшей мере одно дополнительное активное средство выбирают из ингибитора mTOR пути, ингибитора TKI, ингибитора PI3K, двойного ингибитора PI3K/mTOR, ингибитора SRC, ингибитора VEGF, ингибитора янус киназы (JAK), ингибитора Raf, ингибитора Erk, ингибитора фарнезилтрансферазы, ингибитора гистондеацетилазы, противомитотического средства, ингибитора множественной лекарственной устойчивости, антибиотика и цитокина. В одном варианте второе терапевтическое средство представляет собой терапевтический цитокин. В одном варианте второе терапевтическое средство представляет собой интерлейкин-2. В другом варианте второе терапевтическое средство выбирают из ингибитора тирозинкиназы (например, эверолимуса, бевацизумаба).
[109] В некоторых вариантах ингибитор mTOR выбирают из группы, состоящей из рапамицина (также именуемого как сиролимус), эверолимуса, темзиролимуса, ридафоролимуса, умиролимуса, зотаролимуса, AZD8055, INK128, WYE-132, торина-1, аналогов пиразолопиримидина PP242, PP30, PP487, PP121, KU0063794, KU-BMCL-200908069-1, Wyeth-BMCL-200910075-9b, INK-128, XL388, AZD8055, P2281 и P529. См., например, Liu et al. Drugs Disc. Today Ther. Strateg., 6(2): 47-55 (2009).
[110] В некоторых вариантах ингибитор mTOR представляет собой транс-4-[4-амино-5-(7-метокси-1H-индол-2-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновую кислоту (также известную как OSI-027), и любые ее соли, сольваты, гидраты и другие физические формы, кристаллические или аморфные. См. US 2007/0112005. OSI-027 можно получить по способу US 2007/0112005, включенному в описание по ссылке. В одном варианте ингибитор mTOR представляет собой OXA-01. См., например, WO 2013152342 A1.
[111] В некоторых вариантах ингибитор PI3K выбирают из группы, состоящей из GS-1101 (иделалисиба), GDC0941 (пиктилисиба), LY294002, BKM120 (бупарлисиба), PI-103, TGX-221, IC-87114, XL 147, ZSTK474, BYL719, AS-605240, PIK-75, 3-метиладенина, A66, PIK-93, PIK-90, AZD6482, IPI-145 (дувелисиба), TG100-115, AS-252424, PIK294, AS-604850, GSK2636771, BAY 80-6946 (копанлисиба), CH5132799, CAY10505, PIK-293, TG100713, CZC24832 и HS-173.
[112] В некоторых вариантах двойной ингибитор PI3K/mTOR выбирают из группы, состоящей из GDC-094, WAY-001, WYE-354, WAY-600, WYE-687, Wyeth-BMCL-200910075-16b, Wyeth-BMCL-200910096-27, KU0063794 и KUBMCL-200908069-5, NVP-BEZ235, XL-765, PF-04691502, GDC-0980 (апитолисиба), GSK1059615, PF-05212384, BGT226, PKI-402, VS-558 и GSK2126458. См., например, Liu et al. Drugs Disc. Today Ther. Strateg., 6(2): 47-55 (2009), включенную в описание по ссылке.
[113] В некоторых вариантах ингибитор mTOR пути представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную маленькую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, запертую нуклеиновую кислоту или аптамер), который связывается с и ингибирует уровень экспрессии или активность белка (или нуклеиновой кислоты, кодирующей указанный белок) на mTOR пути. Например, полипептид или нуклеиновая кислота ингибирует mTOR комплекс 1 (mTORC1), регуляторно-ассоциированный белок mTOR (раптол), летальный для млекопитающих белок 8 с SEC13 (MLST8), богатый пролином Akt субстрат в 40 кДа (PRAS40), DEP домен-содержащий mTOR-взаимодействующий белок (DEPTOR), mTOR комплекс 2 (mTORC2), рапамицин-невосприимчивый компаньон mTOR (RICTOR), бета субъединицу подобную G белку (GβL), стресс-активируемую протеинкиназу млекопитающих, взаимодействующую с белком 1 (mSIN1), паксилин, RhoA, Ras-родственный субстрат 1 токсина ботулина C3 (Rac1), 42 гомолог белка, контролирующего деление клеток (Cdc42), протеинкиназу Cα (PKCα), серин/треонин протеинкиназу Akt, фосфоинозитид 3-киназу (PI3K), p70S6K, Ras, и/или эукариотный фактор инициирования трансляции 4E (eIF4E)-связывающий белки (4EBPs), или нуклеиновую кислоту, кодирующую один из указанных белков.
[114] В некоторых вариантах ингибитор SRC выбирают из группы, состоящей из бозутиниба, саракатиниба, дазатиниба, понатиниба, KX2-391, XL-228, TG100435/TG100855 и DCC2036. См., например, Puls et al. Oncologist. 2011 May; 16(5): 566-578. В одном варианте ингибитор SRC представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную маленькую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, запертую нуклеиновую кислоту, или аптамер), которая связывается с и ингибирует уровень экспрессии или активности SRC белка, или нуклеиновой кислоты, кодирующей SRC белок.
[115] В некоторых вариантах ингибитор VEGF выбирают из бевацизумаба, санитиниба, пазопаниба, акситиниба, сорафениба, регорафениба, ленватиниба и мотазениба. В одном варианте ингибитор VEGF представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную маленькую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолинo, запертую нуклеиновую кислоту или аптамер), которая связывается с и ингибирует уровень экспрессии или активность VEGF белка, белка рецептора VEGF, или нуклеиновую кислоту, кодирующую один из указанных белков. Например, ингибитор VEGF представляет собой растворимый VEGF рецептор (например, растворимый VEGF-C/D рецептор (sVEGFR-3)).
[116] В некоторых вариантах ингибитор JAK выбирают из фацитиниба, руксолитиниба, барицитиниба, CYT387 (CAS номер 1056634-68-4), лестауритиниба, пакритиниба и TG101348 (CAS номер 936091-26-8). В одном варианте ингибитор JAK представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную маленькую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолино, запертую нуклеиновую кислоту или аптамер), которая связывается с и ингибирует уровень экспрессии или активность JAK (например, JAK1, JAK2, JAK3 или TYK2), или нуклеиновую кислоту, кодирующую JAK белок.
[117] В некоторых вариантах ингибитор Raf выбирают из PLX4032 (вемурафениба), сорафениба, PLX-4720, GSK2118436 (дабрфениба), GDC-0879, RAF265, AZ 628, NVP-BHG712, SB90885, ZM 336372, GW5074, TAK-632, CEP-32496 и LGX818 (энкорафениба). В одном варианте ингибитор Raf представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную маленькую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолино, запертую нуклеиновую кислоту, или аптамер) которая связывается с и ингибирует уровень экспрессии или активность Raf (например, A-Raf, B-Raf, C-Raf), или нуклеиновую кислоту, кодирующую Raf белок. В одном варианте ингибитор MEK выбирают из AZD6244 (селуметиниба), PD0325901, GSK1120212 (траметиниба), U0126-EtOH, PD184352, RDEA119 (рафаметиниба), PD98059, BIX 02189, MEK162 (биниметиниба), AS-703026 (пимазеритиба), SL-327, BIX02188, AZD8330, TAK-733 и PD318088. В одном варианте ингибитор MEK представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную маленькую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолинo, запертую нуклеиновую кислоту, или аптамер), которая связывается с и ингибирует уровень экспрессии или активности MEK (например, MEK-1, MEK-2), или нуклеиновую кислоту, кодирующую MEK белок.
[118] В некоторых вариантах ингибитор Akt выбирают из MK-2206, KRX-0401 (перифозина), GSK690693, GDC-0068 (ипатазертиба), AZD5363, CCT128930, A-674563, PHT-427. В одном варианте указанный ингибитор Akt представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную маленькую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолинo, запертую нуклеиновую кислоту, или аптамер), которая связывается с и ингибирует уровень экспрессии или активности Akt (например, Akt-1, Akt-2, Akt-3), или нуклеиновую кислоту, кодирующую Akt белок.
[119] В некоторых вариантах указанный ингибитор фарнезилтрансферазы выбирают из LB42708 или типифарниба. В одном варианте указанный ингибитор фарнезилтрансферазы представляет собой полипептид (например, антитело или его фрагмент) или нуклеиновую кислоту (например, двухцепочечную маленькую интерферирующую РНК, короткую шпилечную РНК, микро-РНК, антисмысловой олигонуклеотид, морфолинo, запертую нуклеиновую кислоту, или аптамер), которая связывается с и ингибирует уровень экспрессии или активность фарнезилтрансферазы или нуклеиновой кислоты, кодирующей
белок фарнезилтрансферазы. В одном варианте модулирующий гистон ингибитор выбирают из анакардиновой кислоты, C646, MG149 (гистон ацетилтрансферазы), GSK J4 Hcl (гистондеметилазы), GSK343 (активного против EZH2), BIX 01294 (гистонметилтрансферазы), MK0683 (вориностата), MS275 (этиностата), LBH589 (панобиностата), трихостатина A, MGCD0103 (моцетиностата), тасквинимода, TMP269, некстурастата A, RG2833, PDX101 (белиностата).
[120] В некоторых вариантах противомитотическое средство выбирают из гризеофульвина, винорелбинтартрата, паклитаксела, доцетаксела, винкристина, винбластина, эпотилона A, эпотилона B, ABT-751, CYT997 (лексибулина), винфлунинтартрата, фосбретабулина, GSK461364, ON-01910 (ригосертиба), Ro3280, BI2536, NMS-P937, BI 6727 (воласертиба), HMN-214 и MLN0905.
[121] В некоторых вариантах ингибитор тирозинкиназы выбирают из вотриента, акситиниба, бортезомиба, бозутиниба, карфилзомиба, кризотиниба, дабрфениба, дазатиниба, эрлотиниба, гефитиниба, ибритиниба, иматиниба, лапатиниба, нилотиниба, пегаптаниба, понатиниба, регорафениба, руксолитиниба, сорафениба, санитиниба, траметиниба, вандетаниба, вемурафениба и висмодегиба.
[122] В одном варианте полиэфирный антибиотик выбирают из монензина натрия, нигерицина, валиномицина, салиномицина.
[123] ʺФармацевтическая композицияʺ представляет собой лекарственную форму, содержащую раскрытые в описании соединения в фармацевтически приемлемой форме, пригодной для введения субъекту. В том смысле как использовано в описании, выражение ʺфармацевтически приемлемыйʺ относится к тем соединениям, материалам, композициям, носителям и/или дозовым формам, которые, в объеме медицинских суждений, пригодны для использования в контакте с тканями человеческих организмов и организмов животных без избыточной токсичности, раздражения, аллергических реакций или других проблем или осложнений, при соответствующем разумном соотношении выгода/риск.
[124] Термин ʺфармацевтически приемлемый эксципиентʺ означает эксципиент, который можно использовать при получении фармацевтических композиций, которые обычно безопасны, нетоксичны и ни биологически, ни каким-либо другим образом не нежелательны, и включают эксципиент, который приемлем для использования в ветеринарии, также как для фармацевтического использования человеком. Примеры фармацевтически приемлемых эксципиентов включают, без ограничений, стерильные жидкости, воду буферные солевые растворы, этанол, полиолы (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.), масла, детергенты, суспендирующие средства, углеводы (например, глюкозу, лактозу, сахарозу или декстран), антиоксиданты (например, аскорбиновую кислоту или глутатион), хелатирующие агенты, низкомолекулярные белки или их подходящие смеси.
[125] Фармацевтические композиции можно получить в объемной или в единичной дозовой форме. Особенно предпочтительно приготавливать фармацевтические композиции в единичной дозовой форме для простоты введения и однородности доз. Термин ʺединичная дозовая формаʺ в том смысле, как использован в описании, относится к физически дискретным единицамм, пригодным в качестве единичных доз для подлежащего лечению субъкта; причем каждая единица содержит заранеее определенное количество активного соединения, которое рассчитано таким образом, чтобы обеспечить необходимый терапевтический эффект, вместе с необходимым фармацевтическим носителем. Спецификация для единичных дозовых форм настоящего изобретения диктуется и непосредственно зависит от уникальных характеристик активного соединения и конкретного терапевтического эффекта, который необходимо обеспечить. Единичная дозовая форма может быть ампулой, пробиркой, суппозиторием, драже, таблеткой, капсулой, пакетом для внутривенного вливания, или простым насосом аэрозольного ингалятора.
[126] При терапевтических применениях такие дозировки меняются в зависимости от используемого средства, возраста, массы и клинического состояния пациента-реципиента, и опыта и знаний клинициста или практикующего врача, способа введения, которые, наряду с другими факторами, влияют на выбранную дозировку. Обычно такой дозой должно быть терапевтически эффективное количество. Дозировки могут быть предоставлены в единицах измерения в мг/кг/день (причем указанные дозы могут быть выражены для массы пациента в кг, для площади поверхности тела в м2 и для возраста в годах). Эффективное количество фармацевтической композиции является таким, которое обеспечивает объективно определяемое улучшение, которое отмечает клиницист или другой квалифицированный наблюдатель. Например, уменьшение симптомов нарушения, заболевания или состояния. В том смысле, как использован в описании, термин ʺв эффективной дозировкеʺ относится к такому количеству фармацевтической композиции, которое обеспечивает необходимый биологический эффект для субъекта или клетки.
[127] Например, единичная дозовая форма может включать от 1 нг до 2 мг, или от 0,1 мг до 2 г; или от 10 мг до 1 г, или от 50 мг до 500 мг или от 1 мкг до 20 мг; или от 1 мкг до 10 мг; или от 0,1 мг до 2 мг.
[128] Фармацевтические композиции могут принимать любые подходящие формы (например, жидкости, аэрозоли, растворы, средства для ингляций, аэрозоли, спреи; или твердые формы, порошки, мази, пасты, кремы, лосьоны, гели, пластыри и т.п.) для введения любым необходимым способом (например, через легкие, путем ингаляций, интраназально, перорально, буккально, сублингвально, парэнтерально, подкожно, внутривенно, внутримышечно, внутрибрюшинно, внутриплеврально, интратекально, трансдермально, трансмукозально, ректально и т.п.). Например, фармацевтические композиции изобретения могут быть в форме водных растворов или порошков для аэрозольного введения путем ингаляций или вдуваний (или через рот, или через нос), в форме таблеток или капсул для перорального введения; в форме стерильных водных растворов или дисперсий, пригодных для введения или путем непосредственных инъекций, или путем добавления к стерильным жидкостям для внутривенных вливаний; или в форме лосьонов, кремов, пенок, пластырей, суспензий, растворов или суппозиториев для трансдермального или трансмукозального введения.
[129] Фармацевтические композиции могут быть в форме перорально приемлемых дозовых форм, включая, но ими не ограничиваясь, капсулы, таблетки, буккальные формы, лепешки, пастилки и жидкости для перорального введения в форме эмульсий, водных суспензий, дисперсий или растворов. Капсулы могут содержать смеси соединений изобретения с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный крахмал или крахмал тапиоки), сахара, искусственные подсластители, порошки целлюлоз, таких как кристаллическая и микрокристаллическая целлюлозы, мука, желатины, смолы, и т.д. В случае таблеток для перорального ведения, обычно используемые носители включают лактозу и кукурузный крахмал. Смазывающие средства, такие как стеарат магния, также могут быть добавлены. Для перорального введения в форме капсул подходящие разбавители включают лактозу и высушенный кукурузный крахмал. Если перорально вводят водные супензии и/или эмульсии, соединения изобретения могут быть суспендированы или растворены в масляной фазе, объединенной с эмульгирующими и/или суспендирующими средствами. При желании, могут быть добавлены некоторые подсластители и/или вкусовые средства и/или красящие средства.
[130] Фармацевтические композиции могут быть в форме таблеток. Такие таблетки могут включать единичные дозы соединений настоящего изобретения вместе с инертным рабавителем или носителем, таким, как сахар или сахарный спирт, например лактоза, сахароза, сорбит или маннит. Такие таблетки могут дополнительно включать разбавители, полученные не из сахара, такие как карбонат натрия, фосфат кальция, карбонат кальция, или целлюлоза или ее производные, такие как метилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза, и крахмалы, такие как кукурузный крахмал. Такие таблетки могут дополнительно включать связующие и способствующие гранулированию средства, такие как поливинилпирролидон, разрыхлители (например, набухающие сшитые полимеры, такие как сшитая карбоксиметилцеллюлоза), смазывающие средства (например, стеараты), консерванты (например, парабены), антиоксиданты (например, BHT), буферирующие средства (например, фосфатные или цитратные буферы), и вспенивающие средства, такие как смеси цитрат/бикарбонат.
[131] Такие таблетки могут быть таблетками с нанесенным покрытием. Покрытия могут быть защитными пленками (например, воском или глазурью) или покрытиями, созданными для того, чтобы контролировать высвобождение активного средства, например с замедленным высвобождением (высвобождение активного средства после заранее определенного промежутка времени после поглощения) или высвобождением в конкретном участке желудочно-кишечного тракта. Последнее можно обеспечить, например, используя желудочные пленки для покрытий, такие как те, что продают под торговой маркой Eudragit®.
[132] Лекарственные формы в виде таблеток можно получить обычным прессованием, влажным гранулированием или сухим гранулированием, и использовать фармацевтически приемлемые разбавители, связывающие средства, смазывающие средства, разрыхлители, модифицирующие поверхность соедства (включая поверхностно активные средства), суспендирующие или стабилизирующие средства, включая, но ими не ограничиваясь, стеарат магния, стеариновую кислоту, тальк, натрийлаурилсульфат, микрокристаллическую целлюлозу, кальцийкарбоксиметилцеллюлозу, поливинилпирролидон, желатин, альгиновую кислоту, смолу акации, ксантангам, цитрат натрия, комплексы силикатов, карбонат кальция, глицин, декстрин, сахарозу, сорбит, дикальцийфосфат, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, тальк, сухие крахмалы и сахарную пудру. Предпочтительные модифицирующие поверхность средства включают неионные и ионные модифицирующие поверхность средства. Представительные примеры модифицирующих поверхность средств включают, но ими не ограничиваются, полоксамер 188, бензалконийхлорид, стеарат кальция, цетостеариловый спрт, цетомакрогольный эмульгирующий воск, сорбитановые сложные эфиры, коллоидный диоксид кремния, фосфаты, додецилсульфат натрия, алюмосиликат магния и триэтанолмин.
[133] Фармацевтические композиция могут быть в форме твердых или мягких желатиновых капсул. Согласно такими лекарственными формами, соединения настоящего изобретения могут быть в твердой, полутвердой или в жидкой форме.
[134] Фармацевтические композиции могут быть в форме стерильных водных растворов или дисперсий, пригодных для парэнтерального введения. Термин парэнтеральный в том смысле, как использован в описании, включает подкожные, внутрикожные, внутривенные, внутримышечные, интраартикулярные, интраартериальные, интрасиновиальные, интрастернальные, интратекальные, внутриочаговые и интракраниальные инъекции и вливания.
[135] Фармацевтические композиции могут быть в форме стерильных водных растворов или дисперсий, пригодных для введения либо непосредственной инъекцией, или путем добавления к стерильным жидкостям для вливаний, и включают растворитель или дисперсионную среду, содержащую воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси, или одно или более из растительных масел. Растворы или суспензии соединений изобретения как в виде свободных оснваний, так и в виде фармакологически приемлемых солей, можно получить в воде соответствующим образом смесей с поверхностно активным средством. Примеры подходящих поверхностно активных средств приводятся далее. Дисперсии также можно получить, например, в глицерине,в жидких полиэтиленгликолях и в их смесях в маслах.
[136] Фармацевтические композиции для использования в способах изобретения могут дополнительно включать одну или более из добавок, помимо любого носителя или разбавителя (таких как лактоза или маннит), которые присутствуют в лекарственном средстве. Одна или более из добавок может включать или состоять из одного или более из поверхностно активных средств. Поверхностно активные средства обычно содержат одну или более из длинных алифатических цепей, таких как жирные кислоты, которые позволяют им встраиваться непосредственно в липидные структуры клеток, облегчая проникновение и абсорбцию лекарственных средств. Эмпирическим параметром, который обычно используют для характеризации относительной гигроскопичности и гидрофобности поверхностно активных средств является значение гидрофильно-липофильного баланса (величина ʺHLBʺ). Поверхностно активные средства с более низкими значениями HLB являются более гидрофобными, и обладают большей растворимостью в маслах, тогда как поверхностно активные средства с более высокими значениями HLB являются более гидрофильными, и обладают более высокой растворимостью в водных растворах. Так, гидрофильными поверхностно активными средствами обычно считают соединения, характеризующиеся значениями HLB более чем около 10, и гидрофобными поверхностно активными средствами обычно считают соединения, характеризующиеся значениями HLB менее чем около 10. Однако указанные значения HLB представляют собой просто примерные значения, так как для многих поверхностно активных средств, значения HLB могут отличаться настолько значительно, как на около 8 единиц HLB, в зависимости от эмпирического способа, выбранного для определения значения HLB.
[137] Среди поверхностно активных средств, которые можно использовать в композициях настоящего изобретения, можно перечислить полиэтиленгликоль (PEG)- жирные кислоты, PEG-моно и ди(сложные)эфиры жирных кислот, PEG сложные эфиры глицерина, продукты трансэтерификации спирта-масел, жирные кислоты полиглицерина, сложные эфиры жирных кислот пропиленгликоля, стерол и производные стерола, сложные эфиры жирных кислот полиэтиленгликольсорбитана, алкиловые эфиры полиэтиленгликоля, сахар и его производные, алкилфенолы полиэтиленгликоля, блок-сополимеры полиоксиэтилен-полиоксипропилена (POE-POP), сложные эфиры жирных кислот сорбитана, ионные поверхностно активные средства, жирорастворимые витамины и их соли, водорастворимые витамины и их амфифильные производные, аминокислоты и их соли и органические кислоты и их сложные эфиры и ангидриды.
[138] Это изобретение также относится к упаковкам и наборам, включающим фармацевтические композиции для использования в способах настоящего изобретения. Такие наборы могут включать один или более из контейнеров, выбранных из группы, состоящей из флаконов, пробирок, ампул, блистерных упаковок и шприцов. Такие наборы могут дополнительно включать одну или более из инструкций по использованию при лечении и/или профилактике заболеваний, состояний или нарушений согласно изобретению, один или более из шприцов, один или более из аппликаторов или стерильных растворов, пригодных для восстановления фармацевтических композиций изобретения.
[139] Все проценты и отношения, использованные в описании, если не указано иначе, даны по массе. Другие особенности и преимущества будут очевидны из различных примеров. Предложенные примеры иллюстрируют различные компоненты и методологию, которые можно использовать на практике, осуществляя настоящее изобретение. Представленные примеры не ограничивают заявленное изобретение. На основании представленного описания специалисты смогут идентифицировать и использовать другие компоненты и методологии, пригодные для осуществления настоящего изобретения.
ПРИМЕРЫ
Пример 1: Апилимод является высоко селективным ингибитором пролиферации клеток TSC2 ноль
[140] Апилимод был использован в высокоэффективном скринировании жизнеспособности клеток с использованием TSC2-/- клеток фибробластов мышиных эмбрионов (MEF-EV). TSC2 ноль клетки содержат конститутивно активные mTOR. Короче, MEF клетки, полученные от TSC2-/- эмбрионов нокаутных мышей (Onda et al., J. Clin. Invest. 104(6):687-95, 1999) инфицируют ретровирусным вектором, кодирующим ген устойчивости к антибиотику гигромицину (MEF-EV), или тем же самым ретровирусным вектором, который также кодирует TSC2 (MEF-TSC2). MEF-EV и MEF-TSC2 линии стабилизируют, используя селекцию по гигромицину.
[141] Клетки выращивают в DMEM среде, содержащей 10% FBS (Omega Scientific) и 2 мм L-глутамина. Замороженные исходные клетки приготавливают для непосредственного использования в HTS анализе. Клетки собирают, осаждают и затем снова суспендируют в 95% FBS и 5% ДМСО в концентрации 1×107 клеток/мл. Аликвоты по одному мл быстро замораживают до -80°C со скоростью 1 град/мин. Затем полученные исходные клетки переносят в пары жидкого азота для длительного хранения.
[142] Для скринирования ампулы оттаивают до 37°C при непрерывном перемешивании только до оттаивания, и затем снова суспендируют в аналитической среде при комнатной температуре и центрифугируют со скоростью 1000 об/мин в течение 5 минут. Полученный осадок снова суспендируют в соответствующем объеме и подсчитывают, используя автоматизированный счетчик клеток, и разбавляют соответствующим образом до конечной концентрации 40000 клеток/мл.
[143] Тестируемые соединения (5 мкл исходного раствора, 6×необходимую конечную концентрацию в лунке) распределяют в 384-луночные аналитические планшеты (Corning 3712), используя жидкостной манипулятор Biomek FX. MEF-EV клетки (1000 клеток на лунку в 25 мкл среды) добавляют в предварительно отформатированные планшеты, используя Thermo Wellmate, безконтактную диспенсерную систему со стандартной кассетной головкой. Планшеты инкубируют в течение 72 часов при 37°C в атмосфере 5% CO2 во влажном инкубаторе.
[144] Жизнеспособность клеток определяют, используя CellTiter-Glo® люминисцентный анализ (Promega) согласно инструкциями изготовителей. Жизнеспособность клеток выражают как процент от непрореагировавших контрольных клеток. Например, для апилимода, MEF-EV жизнеспособность клеток (Среднее +/- станд. откл., n=3) составляет 2,16+/-0,36% и 0,5 мкМ и 1,94+/-0,07% и 5 мкМ.
[145] Активность апилимода в отношении TSC2 дефицитных клеток дополнительно демонстрируют, проверяя дозозависимый эффект по 10 точкам в отношении указанных выше MEF-EV и MEF-TSC2 линий, также как для трех дополнительных пар изогенных линий: (1) (TSC2-/-,
p53-/-) и (TSC2+/-, p53-/-) MEF стабильные линии получены из (TSC2-/-, p53-/-) или (TSC2+/-, p53 -/-) эмбрионов в соответствии со стандартными способами. См., например, Zhang et al. J. Clin. Invest. 112, 1223-33, 2003. (2) ELT3-EV и ELT3-TSC2 стабильные линии получены из клеточной линии опухоли крыс ELT3. ELT3 линия представляет собой принятую модель крысиной опухоли для LAM/TSC. См., например, Howe et al., Am. J. Path. 146, 1568-79, 1995. Такие клетки собирают, инактивируя мутацию в TSC2, что приводит к конститутивной активации mTOR пути. Для создания изогенной пары клеток ELT3, клетки инфицируют ретровирусным вектором, кодирующим ген устойчивости к антибиотику гигромицину (ELT3-EV), или тем же самым ретровирусным вектором, который также кодирует TSC2 (ELT3-TSC2). Клеточные линии ELT3-EV и ELT3-TSC2 затем стабилизируют, используя селекцию по гигромицину. (3) TRI-AML102 и AML103 линии получают из первичного человеческого образца TSC2 ноль, предоставленного Dr. Elizabeth Henske (Fox Chase Cancer Center, Philadelphia, PA). Полученные клетки инфицируют амфотропным ретровирусом LXSN16E6E7, который кодирует HPV16 E6 и E7 открытые считывающие рамки и кассету устойчивости к неомицину. Клетки выращивают и селектируют по неомицину. Отдельные колонии изолируют и замораживают. Кодирующую последовательность для человеческого гена теломеразы (hTERT) с кассетой устойчивости к гигромицину (pLXSN hTERT-hyg плазмида) стабильно экспрессируют в TSC2-/- подтвержденный E6E7 AML клон, используя транфекционный реагент Fugene6 (Roche Applied Science, Indianapolis, IN). TRI-AML102 создают путем стабильной инкорпорации контрольной зеомициновой селекционной плазмиды (pcDNA3.1-zeo), тогда как TRI-AML103 экспрессирует человеческую TSC2 cDNA pcDNA3.1-zeo плазмиду. В результате указанных инженерных процедур получают как TRI102, так и TRI103 клеточные линии, устойчивые к неомицину, гигромицину и зеомицину.
[146] Для дозозависимости по 10 точкам, 750 MEF, 2000 ELT3, или 2000 AML клеток в 100 мкл ростовой среды (DMEM (CellGro 10-017-CV) FBS 10% (Sigma Aldrich F2442-500ML, Lot 12D370) пенициллин/стрептомицин (100×) (CellGro Ref 30-002) высевают в лунки 96-луночного планшета. Через 24 часа после посева клеток, среду удаляют, и добавляют разбавления апилимода (1-500 нМ, 2-кратные разбавления) в 100 мкл ростовой среды (0,1% конечная концентрация ДМСО). Через 72 часа после добавления соединения, определяют относительную жизнеспособность клеток, используя CellTiter-Glo® люминесцентный анализ (Promega), и выражают как процент относительно контрольных клеток, обработанным носителем (ДМСО). Значения IC50 затем рассчитывают из дозо-зависимых кривых, используя XLFIT (IDBS).
[147] TSC2 дефицитные клетки высоко чувствительны к апилимоду (IC50=20 нМ, ФИГ. 1). TSC2-/- p53-/- MEFs демонстрируют повышенную восприимчивость к апилимоду по сравнению с TSC2+/- p53-/- MEFs, о чем свидетельствует приведенная выше степень селективности 1 (2,45).
Таблица 1: IC50 (жизнеспособность) апилимода в различных типах клеток
TSC2-/-
TSC2-/-
p53-/-
TSC2+/-
p53-/-
IC50 (нМ) рассчитывают из дозозависимости по 10 точкам на дозы TSC2-/- дефицитных и сохранившихся линий. Значения IC50 рассчитывают как среднее из двух экспериментов. Степень селективности рассчитывают, деля значения IC50 для TSC2 сохранившихся линий на значения для TSC2-/- линий.
[148] Дополнительно, более высокие концентрации апилимода обладают более высокой эффективностью в отношении TSC2-/- MEF-EV клеток по сравнению с TSC2 сохранившимися MEF-TSC2 клетками. Представленные результаты наряду с тем фактом, что апилимод не является цитотоксичным для мононуклеарных клеток периферической крови (Wada et al., Blood 109, 1156-64, 2007), ни для различных других раковых линий, включая U937, HELA, Jurkat и THP-1 (PCT публикация № WO 2006/128129), дает возможность предположить, что возможен высокий терапевтический индекс для лечения TSC2-/- раковых клетки апилимодом (ФИГ. 2A-2B).
Пример 2: Апилимод является высоко селективным цитотоксическим средством в отношении раковых клеток
[149] Цитотоксическую активность апилимода оценивают, используя стандартный анализ оценки жизнеспособности клеток, такой как CellTiterGlo™ согласно инструкциями изготовителей. 122 человеческие раковые клеточные линии оценивают в отношении восприимчивости к апилимоду. Клеточную линию называют восприимчивой к апилимоду, если IC50 менее чем 500 нМ. 35 клеточных линий были идентифицированы как восприимчивые к индуцированной апилимодом цитотоксичности. Апилимод также высоко селективен в отношении раковых клеток по сравнению с нормальными клетками, и имеет значения IC50 в интервале в 20-200 крат выше, чем у раковых клеток (ФИГ. 2A-2B).
[150] Механизм цитотоксической активности апилимода дополнительно исследуют, оценивая аутофагические вакуоли после 72 часовой обработки в клеточной линии нейроглиомы H4 (IC50 250-300 нМ). Результат аутографии количественно исследуют, используя аутографический детекторный набор Cyto-ID (Enzo) согласно рекомендациями изготовителей. ФИГ. 3 демонстрирует, что апилимод вызывает аутофагию дозозависимым образом.
Пример 3: Апилимод является высоко селективным связующим для PIKfyve киназы
[151] Для определениЯ клеточных мишеней апилимода в раковых клетках, используют полный клеточный лизат, полученный из человеческих клеток нейроглиомы, для идентификации его связывающих партнеров, используя масспектрометрию отрицательных ионов с использованием химической ионизации и электронного захвата (CCMS). Эту работу осуществляют на Caprotec Bioanalytics GmbH, Berlin Germany. См., Michaelis et al., J. Med. Chem., 55 3934-44 (2012) и приведенные там ссылки.
[152] Короче, два варианта соединений захвата, использующих апилимод как функцию селективности, присоединенные в одной ориентации, синтезируют и анализируют, используя ЖХ‐МС 1H-ЯМР, чтобы обеспечить идентичность и чистоту. Условия захвата оптимизируют в полном клеточном лизате H4 (человеческая нейроглиома) раковых клеток, например, минимизируя неспецифические взаимодействия белков с соединениями захвата, концентрации реагентов и белков, для получения максимального связывания белков и соединений захвата и т.д. Одно соединение захвата выбирают для идентификации связующих специфического белка в CCMS экспериментах, используя апилимод в качестве конкурирующего лиганда. Белки, которые детектируют с помощью ЖХ-С в анализе захвата, и которые значительно уменьшены в состязательных контрольных экспериментах, рассматривают как специфические связующие. Такие специфические связующие дополнительно подвергают жестким критериям анализа результатов для определения специфичности после непредвзятой оценки данных. Специфические белковые связующие оценивают согласно изменениями их значений кратности (FC) в экспериментах захвата. Только два белка были идентифицированы как многообещающие кандидаты в мишеневые белки для апилимода: PIKfyve и Vac14. Вулкано график представлен на ФИГ. 4. FC и p-значения для указанных белков в экспериментах с четырьмя различными концентрациями соединения представлены в Таблице 2.
Таблица 2.
2
2
[153] Осуществляют отдельное исследование профилирующей апилимод киназы для идентификации мишеней киназы (DiscoveRx, Fremont, CA). Константу диссоциации (Kd) определяют, используя апилимод в повышающихся концентрациях (0,05-3000 нМ) против PIKfyve, известной мишени апилимода. Эксперимент повторяют дважды и значение Kd определяют равным 0,075 нМ (интервал 0,069-0,081 нМ) (ФИГ. 5).
[154] Затем апилимод скринируют против полномасштабной панели киназ (PIKfyve не включают). Всего 456 киназ, включая относящиеся к заболеванию киназы, анализируют по их способности связываться с апилимодом. Концентрация апилимода при скринировании составляет 1 мкМ, концентрация, которая более, чем в >10000 раз выше чем Kd для апилимод против PIKfyve. Результаты скринирования показывают, что апилимод не связывается ни с одной из 456 тестированных киназ.
[155] Взятые вместе, результаты демонстрируют, что апилимод связывается с высокой селективностью в раковых клетках с одноклеточной киназой, PIKfyve. PIKfyve представляет собой фермент, который связывается с PI(3)P и катализирует образование липидных вторых мессенджеров PI(3,5)P2 и PI(5)P, и другие показали, что апилимод также является эффективным и специфическим ингибитором такой киназы PIKfyve в нормальных клетках. Cai X et al., Chem Biol. 2013 Jul 25; 20(7):912-21. Как более подробно обсуждается далее, для понимания механизма селективной цитотоксичности апилимода против раковых клеток, авторы изобретения провели ряд экспериментов с целью выявления биологической активности апилимода в раковых клетках.
Пример 4: Механизм противоопухолевой активности апилимода
[156] Известно, что апилимод является эффективным ингибитором воспалительных цитокинов IL-12 и IL-23. В тех случаях, когда апилимод был показан для лечения заболевания или нарушения, это было основано на его активности. Хотя клиническое тестирование апилимода сфокусировано на его потенциальной эффективности при автоиммунных и воспалительных заболеваниях, таких как псориаз, ревматоидный артрит и болезнь Крона, существует несколько публикаций, в которых предполагают, что апилимод может быть полезен против раковых заболеваний, и конкретно, против раков, в которых c-Rel или IL-12/23 действуют как пропролиферативные факторы. См., например, WO 2006/128129 и Baird et al., Frontiers in Oncology 3:1 (2013), соответственно. Неожиданно, и в противоположность указанным ожиданиям, предсказанным в отношении апилимодной IL-12/23 ингибиторной активности, авторы не обнаружили корреляции между любой c-Rel экспрессией (c-Rel представляет собой транскрипционный фактор для IL-12/23 генов), IL-12, или IL-23 экспрессией и восприимчивостью к апилимоду в тестированных клеточных линиях. Экспрессию IL-12A, IL-12RB1, IL-12RB2,
IL-12B, IL-23A и IL-23R анализируют в разнообразной группе из 75 раковых клеточных линий (См., Таблицу 3).
Таблица 3. Различные линии раковых клеток
[157] Короче, результаты генной экспресси для CCLE анализируют для 75 раковых клеточных линий, для которых получены кривые дозозависимости от апилимода. Экспрессию каждого интерлейкинового гена сравнивают в восприимчивых (IC50 менее чем 500 нМ) и невосприимчивых (IC50 больше чем 500 нМ) линиях, используя непарный двусторонний критерий Стьюдента. Не обнаружено статистически значимой связи, за одним исключением для IL-23A (p=0,022). Ранее было отмечено, что IL-23A повышены в восприимчивых к апилимоду клеточных линиях немелкоклеточного рака легких, и рекомбинантные IL-23A повышают пролиферацию в линиях немелкоклеточного рака легких (См., Baird et al. 2013, supra). Важно, что статистическая значимость экспрессии IL-23A в восприимчивых линиях рака, по-видимому, полностью управляется всего двумя линиями рака толстой кишки. Кроме того, экспрессия IL-23A не является статистически значимым предсказателем восприимчивости B клеток неходжскинской лимфомы.
Пример 5: Апилимод ингибирует пролиферацию клеток рака почек
[158] Клеточные линии рака почек RCC-MF, RCC-ER, RCC-JF, и RCC-JW выращивают в среде Мак-Коя 5A (Corning), тогда как 786-0, 769-P и RCC-FG2 выращивают в RPMI-1640 (Corning), и A-704 выращивают в MEM (Corning), дополненной 10% FBS (Sigma Aldrich F2442-500ML, Lot 12D370) и пенициллин/стрептомицином (100×) (CellGro Ref 30-002) и высевают с плотностью 1000, 1200, 1000, 4000, 200, 2000, 1200 и 5000 клеток на лунку, соответственно, в 96-луночные планшеты в конечном объеме 50 мкл.
[159] Для отдельных исследований обработок, через 24 часа после посева, клетки обрабатывают мезитилатом апилимода (именуемым в этом примере как просто ʹапилимодʹ или LAM-002), сорафенибом, пазопанибом или санитинибом в конечной концентрации 0,5-10000 нМ (3-кратные разбавления и всего 10 разбавлений). Все разбавления лекарственных средств приготавливают как 2× исходный раствор, и 50 мкл добавляют в соответствующие лунки. Клетки обрабатывают в течение 120 часов перед тем, как оценивают их жизнеспособность, используя CellTiterGlo® (Promega), где относительную люминесценцию необработанных клеток принимают за 100% жизнеспособности, и концентрацию каждого лекарственного средства выражают как процент от необработанных клеток. Значения EC50 определяют, используя программу GraphPad Prism (GraphPad Software, Inc). Короче, сырые данные логарифмически преобразовывают и затем анализируют, используя нелинейную регрессию (подбор кривой), где данные ограничены (нижнее=0, верхнее=100).
[160] Результаты этих отдельных исследований обработки представлены на ФИГ. 6-13 и суммированы в следующей таблице.
Таблица 4: Результаты отдельных исследований обработки в клеточных линиях рака почек
[161] Для расчета синергического взаимодействия между апилимодом и пазопанибом, или сорафенибом, RCC-ER, RCC-FG2, RCC-MF и 769-P клетки высевают, как указано выше. Через 24 часа клетки обрабатывают апилимодом отдельно (конечная концентрация 2-250 нМ; 2-кратное разбавление и всего 8 разбавлений), пазопанибом отдельно (конечная концентрация 78,1-10000 нМ; 2-кратное разбавление и всего 8 разбавлений), или с сорафенибом (конечная концентрация 78,1-10000 нМ; 2-кратное разбавление и всего 8 разбавлений) или комбинацией каждой концентрации апилимода с каждой концентрацией пазопаниба или сорафениба (8×8 матрица). Клетки обрабатывают в течение 120 час перед тем, как оценивают их жизнеспособность, используя CellTiterGlo® (Promega), где относительную люминесценцию необработанных клеток принимают за 100% жизнеспособности, и концентрацию каждого лекарственного средства выражают как процент от необработанных клеток. [162] ФИГ. 14-21 демонстрируют результаты исследований синергизма. Гистограммы на каждой ФИГ. (A) демонстрируют эффект одной концентрации апилимода, одной концентрации пазопаниба и эффект такой комбинации апилимода и пазопаниба (в отдельных концентрациях) в отношении жизнеспособности клеток. Ожидаемое значение, если комбинационные эффекты двух лекарственных средств аддитивны, рассчитывают, используя значение жизнеспособность для апилимода, умноженное на значение жизнеспособности для пазопаниба, и результаты представлены в виде зачерненного столбика. График CI от фракционального эффекта (B) на каждой из ФИГ. демонстрирует индекс комбинации (CI) по определению Chou et al. (Chou TC, Talalay P. Количественный анализ дозозависимого эффекта: объединенные эффекты множества лекарственных средств или ингибиторов ферментов. Adv Enzyme Regul. 1984; 22: 27-55), который используют в качестве меры синергизма и рассчитывают, используя программу CalcuSyn (version 2.11, Biosoft). Этот анализ ограничен доступными значениями CI, которые находятся внутри клинически достижимых концентраций и также, где фракционный эффект (Fa) больше чем 0,75 (т.е., больше чем 75% снижения жизнеспособности клеток с использованием комбинации лекарственных средств). На данных графика CI от фракционного эффекта обозначены как ʹxʹ, и линии демонстрируют доверительный интервал 95%, и комбинации лекарственных средств, дающие CI значения >1 являются антагонистическими, CI=1 являются аддитивными, и CI<1 являются синергичными. Кроме того, значения CI при ED50, ED75 и ED90 представлены для комбинаций апилимода и или пазопаниба или сорафениба. Ту же самую методологию применяют для комбинации апилимома с сорафенибом. В представленной далее таблице 6 суммированы результаты исследований синергизма.
[163] Представленные в описании данные демонстрируют то, что апилимод способен действовать синергично с пазопанибом и с сорафенибом в панели тестированных клеточных линий почек.
Таблица 5: Значения CI при ED50, ED75 и ED90 для комбинации апилимода и пазопаниба в различных клеточных линиях.
Таблица 6: Результаты исследований синергизма
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АПИЛИМОДА | 2016 |
|
RU2738934C2 |
| КОМПОЗИЦИИ АПИЛИМОДА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ КОЛОРЕКТАЛЬНОГО РАКА | 2015 |
|
RU2739992C2 |
| КОМПОЗИЦИИ АПИЛИМОДА И СПОСОБЫ ЕГО ИСПОЛЬЗОВАНИЯ ПРИ ЛЕЧЕНИИИ МЕЛАНОМЫ | 2015 |
|
RU2731908C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К CD25 И Fc ГАММА-РЕЦЕПТОРУ ДЛЯ ЭЛИМИНАЦИИ ОПУХОЛЕСПЕЦИФИЧЕСКИХ КЛЕТОК | 2017 |
|
RU2759970C2 |
| Способы и композиции для лечения опухолей | 2017 |
|
RU2741786C2 |
| ВВЕДЕНИЕ ГИПОКСИЧЕСКИ АКТИВИРУЕМЫХ ПРОЛЕКАРСТВ И СРЕДСТВ, ПРЕПЯТСТВУЮЩИХ АНГИОГЕНЕЗУ, ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2597844C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ АГОНИСТА TLR И КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2011 |
|
RU2603467C2 |
| СОЧЕТАННЫЕ СПОСОБЫ ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ ИНГИБИТОРОВ ALK | 2015 |
|
RU2718914C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ РАКА, СОДЕРЖАЩАЯ СОЕДИНЕНИЕ НА ОСНОВЕ НАФТОХИНОНА И ИНГИБИТОР ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2021 |
|
RU2830359C1 |
| БИОМАРКЕРЫ ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ, ВКЛЮЧАЮЩЕЙ ЛЕНВАТИНИБ И ЭВЕРОЛИМУС | 2016 |
|
RU2745060C2 |
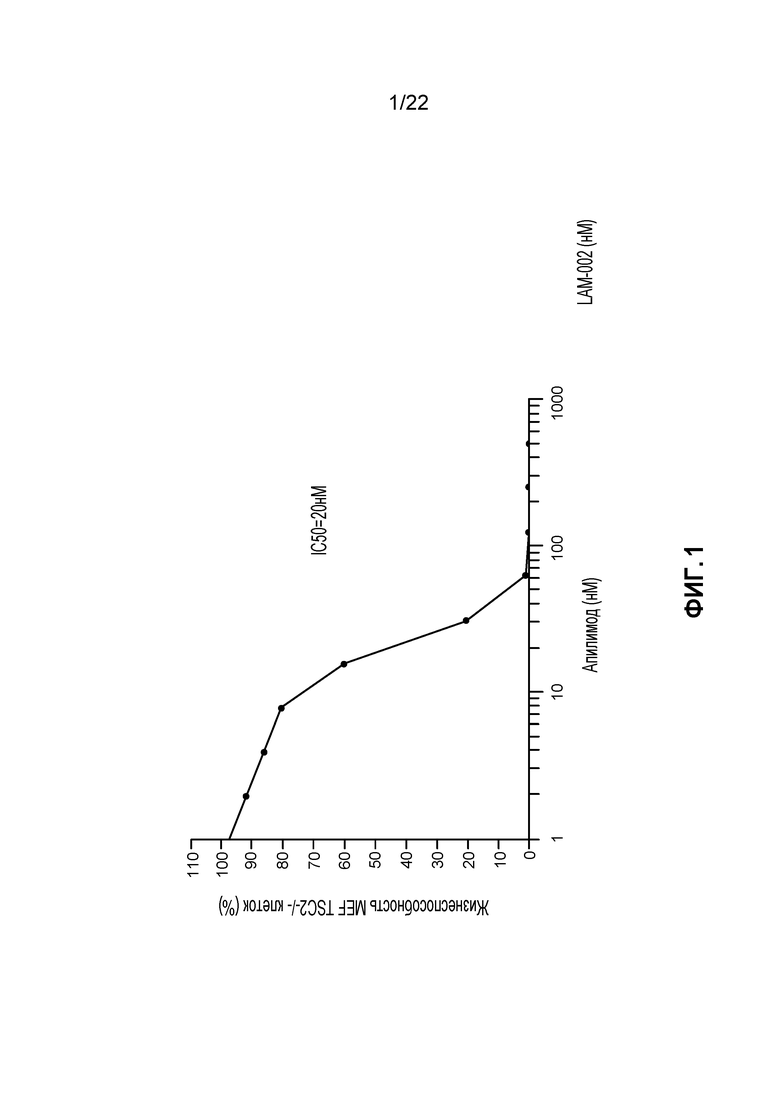
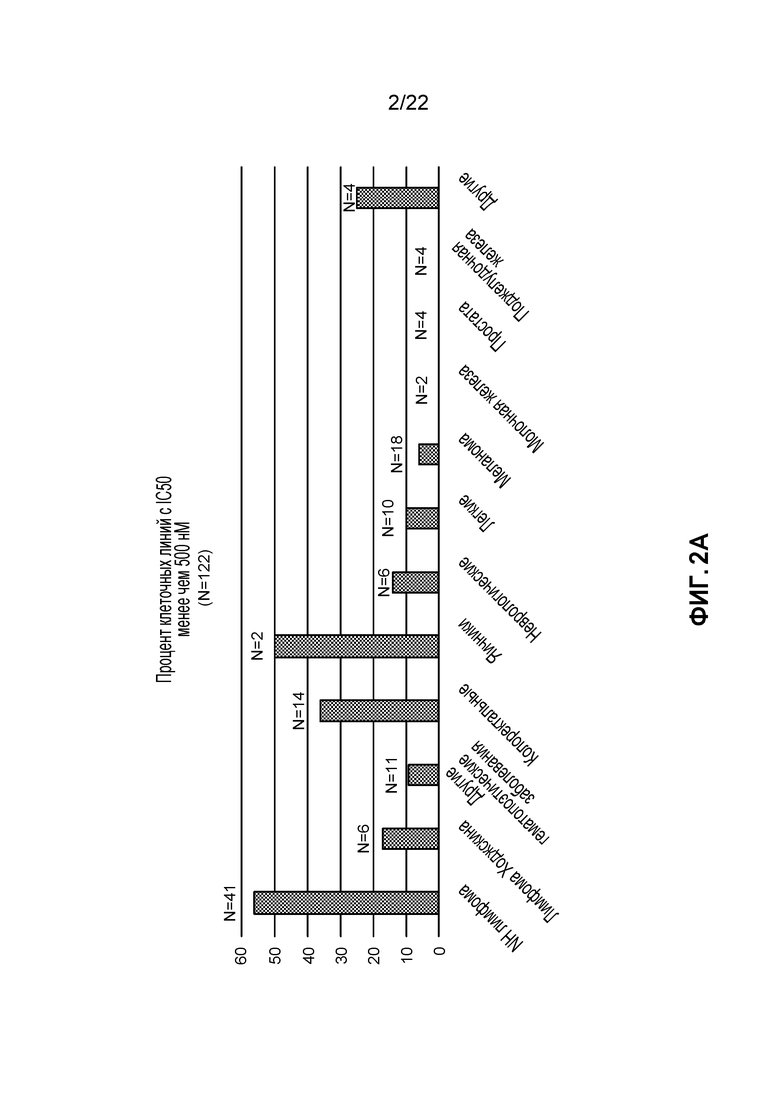
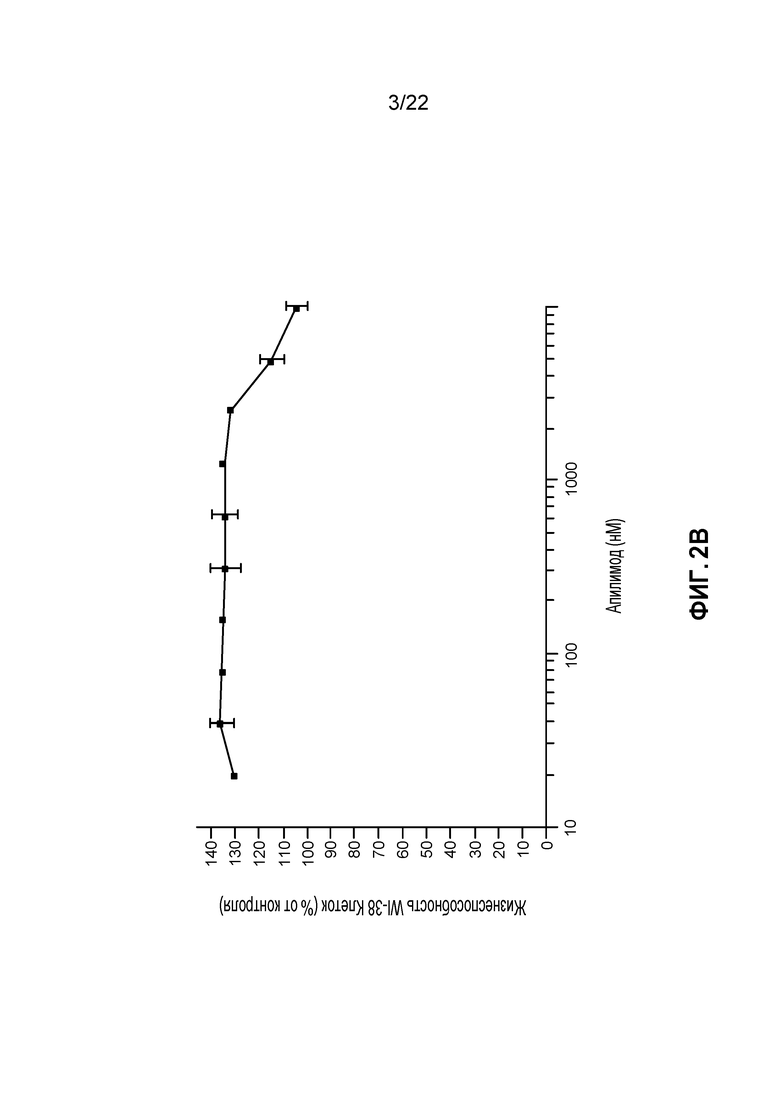
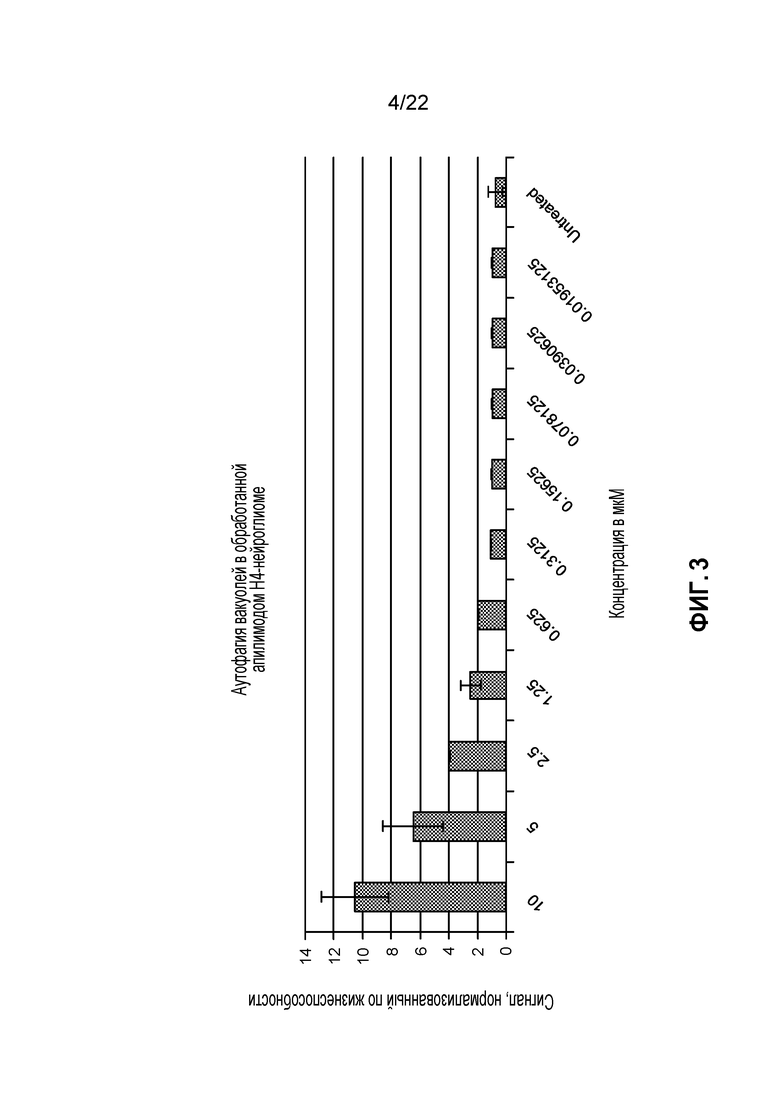
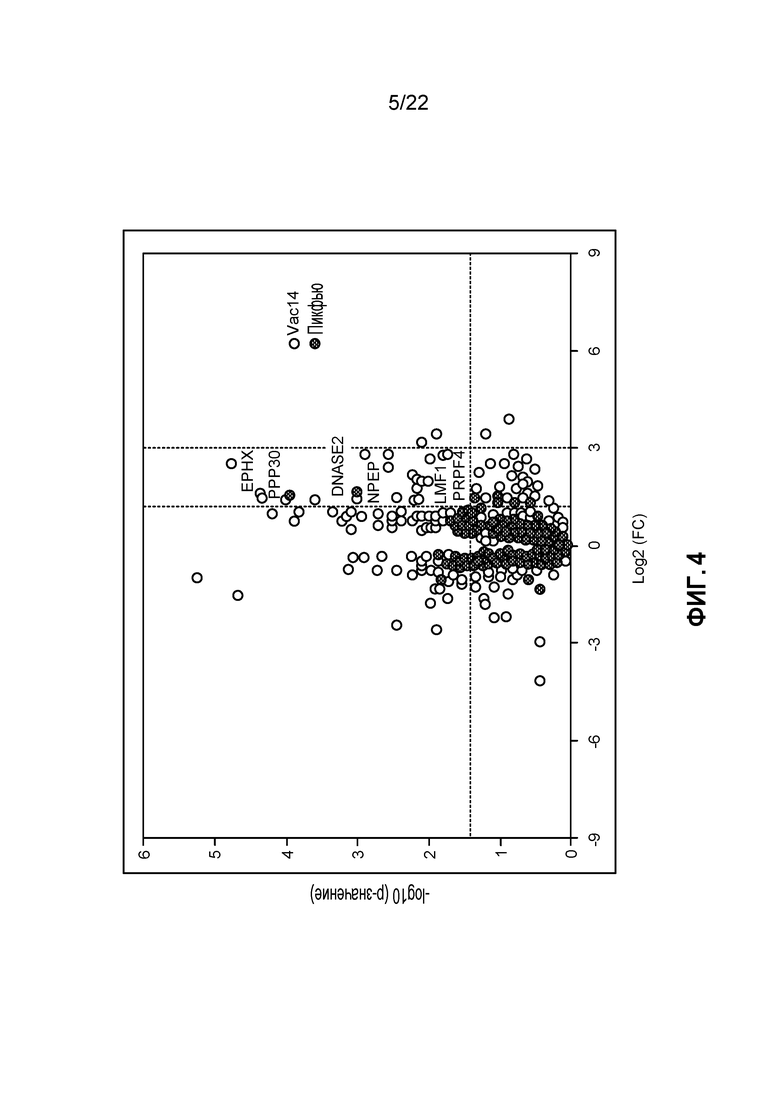
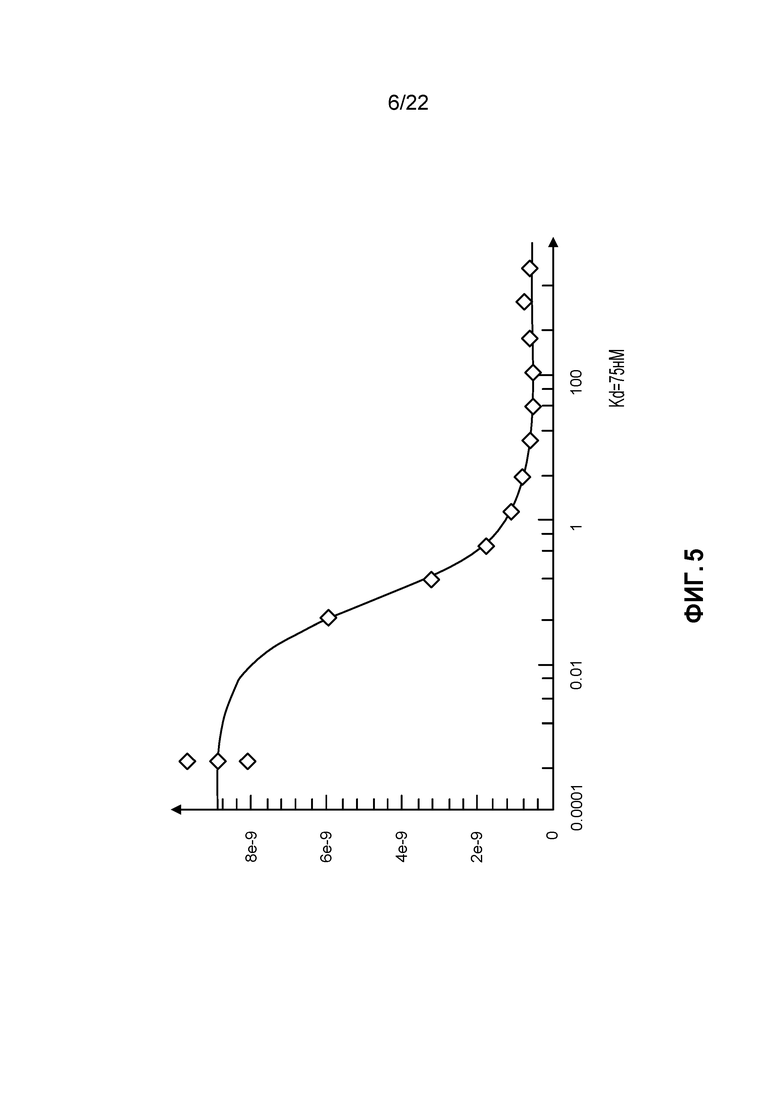
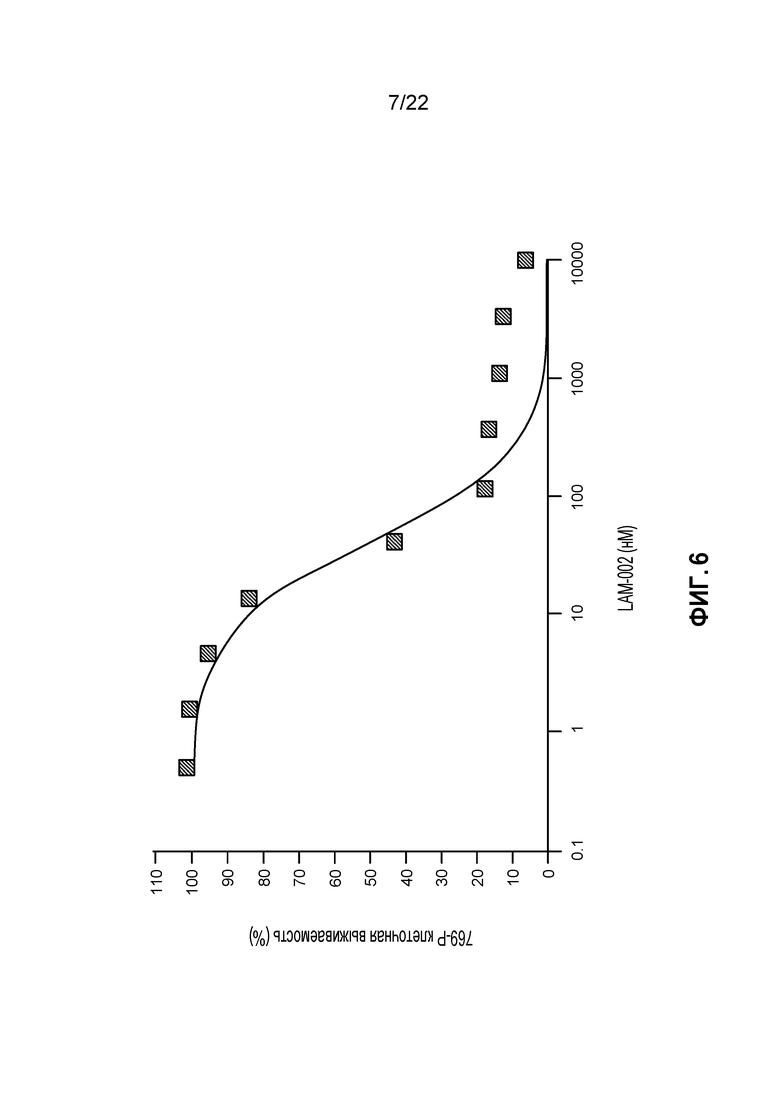
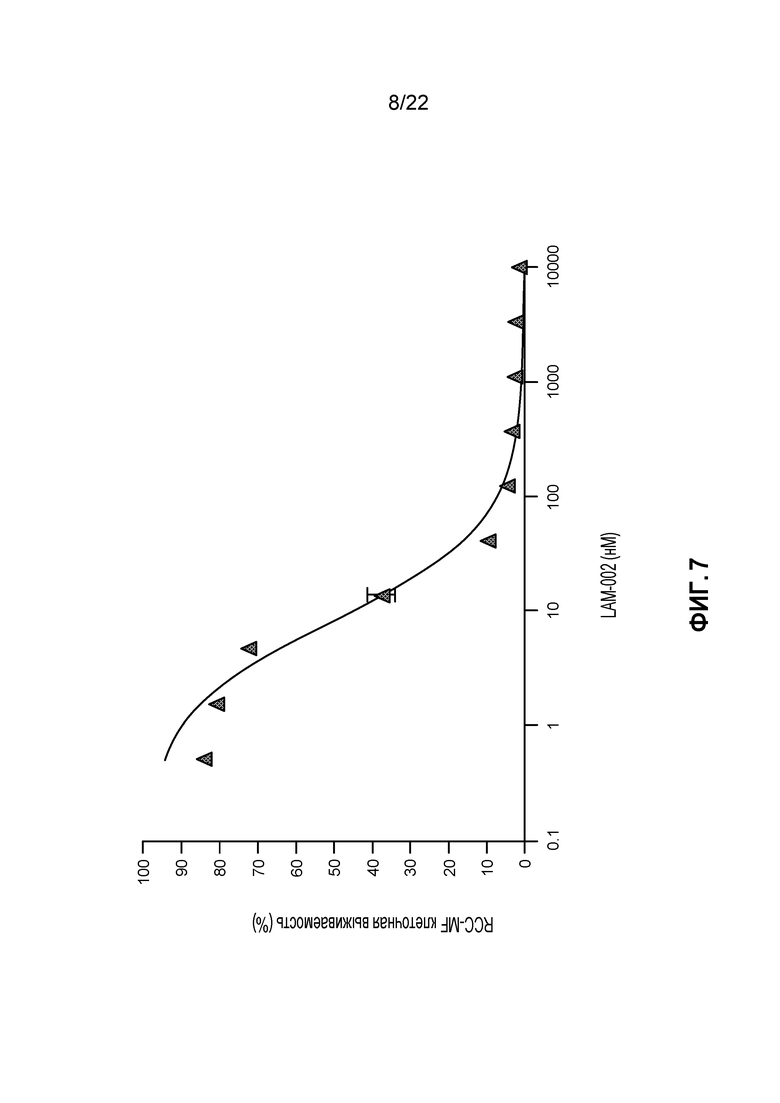
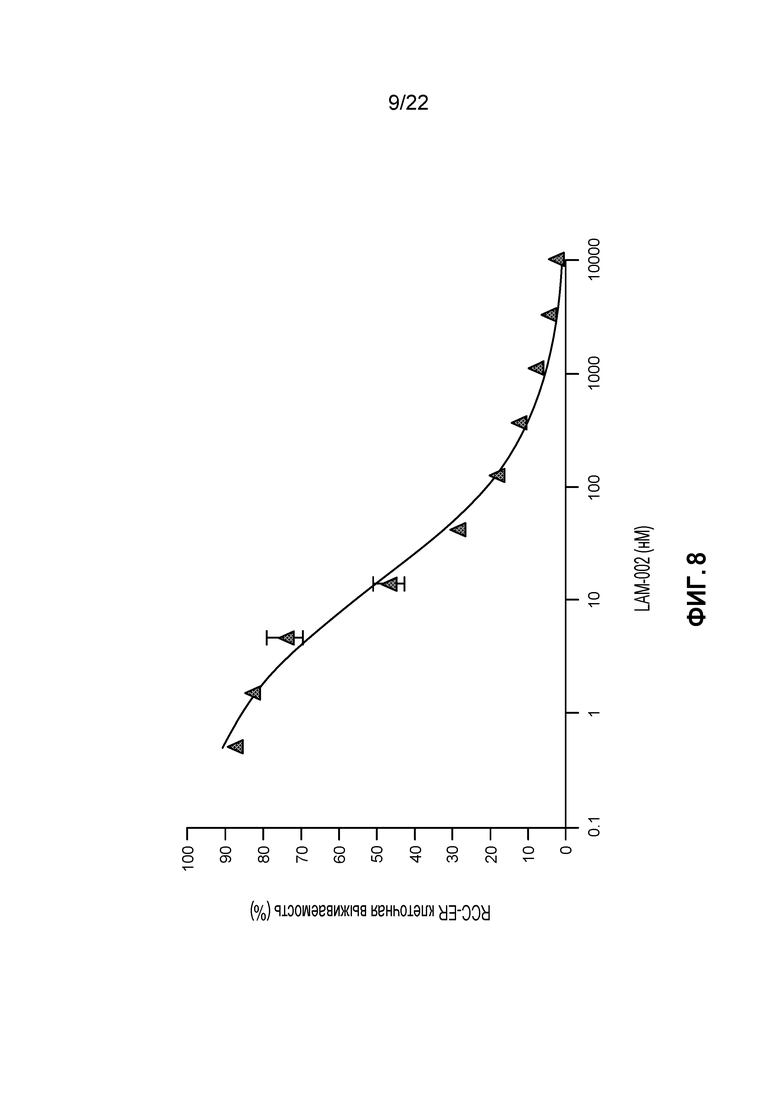

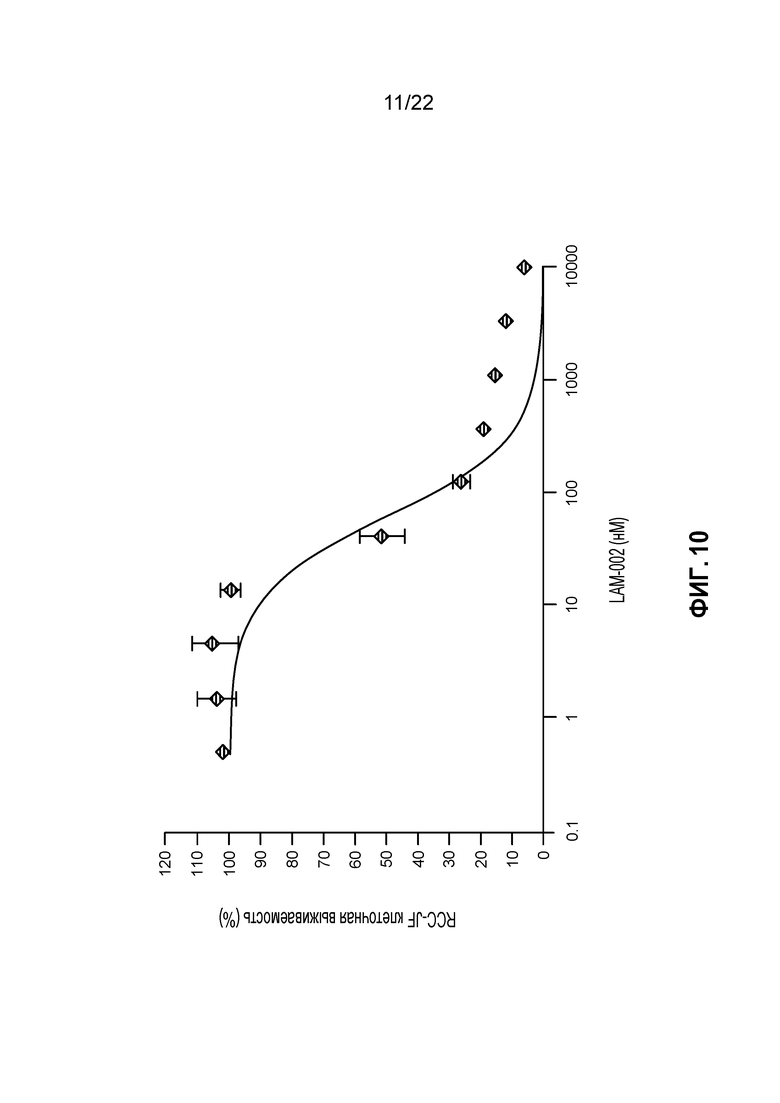
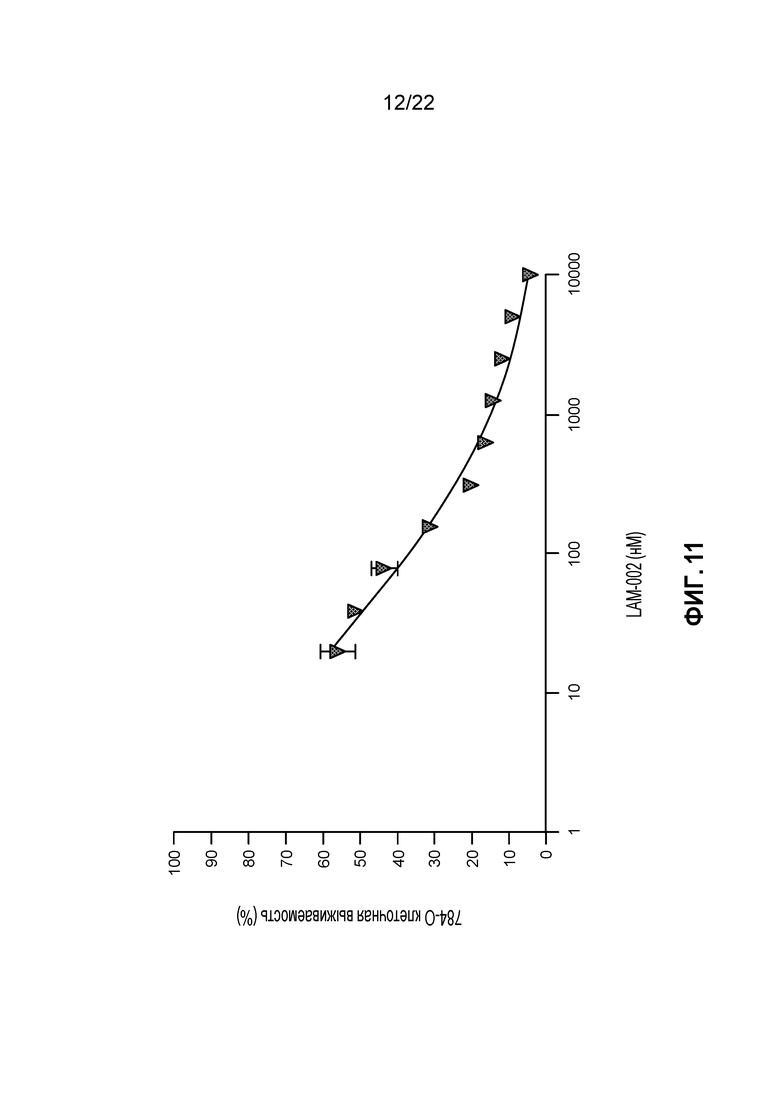
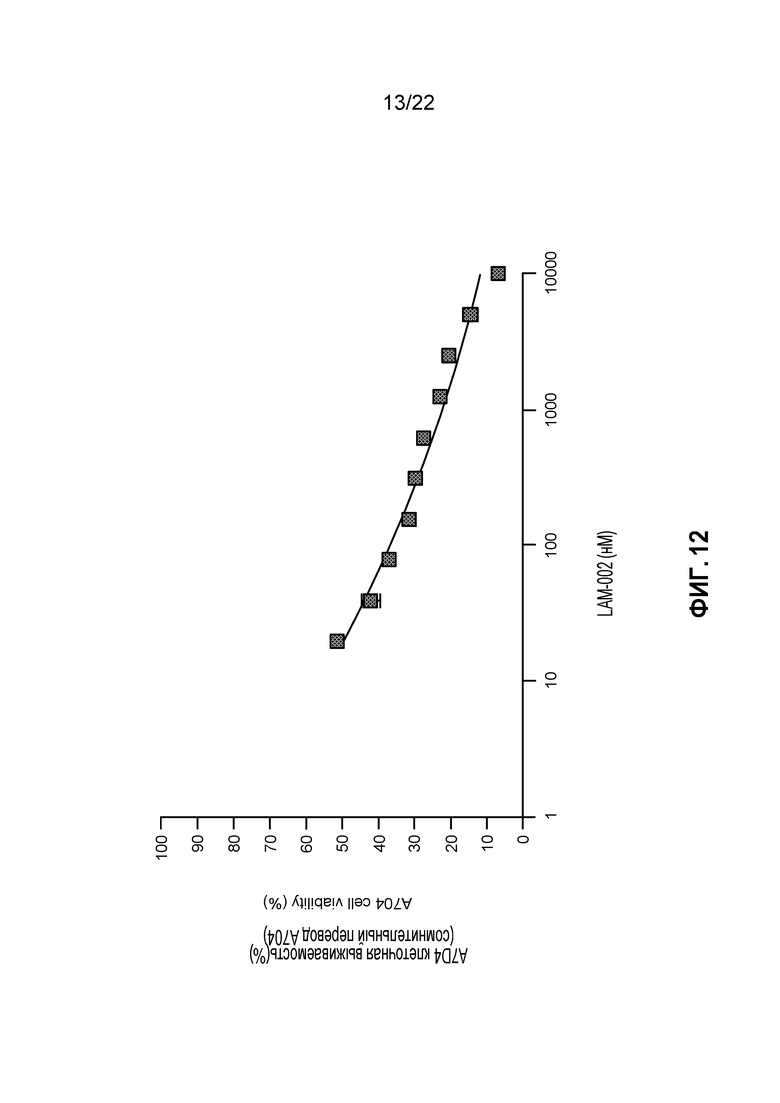
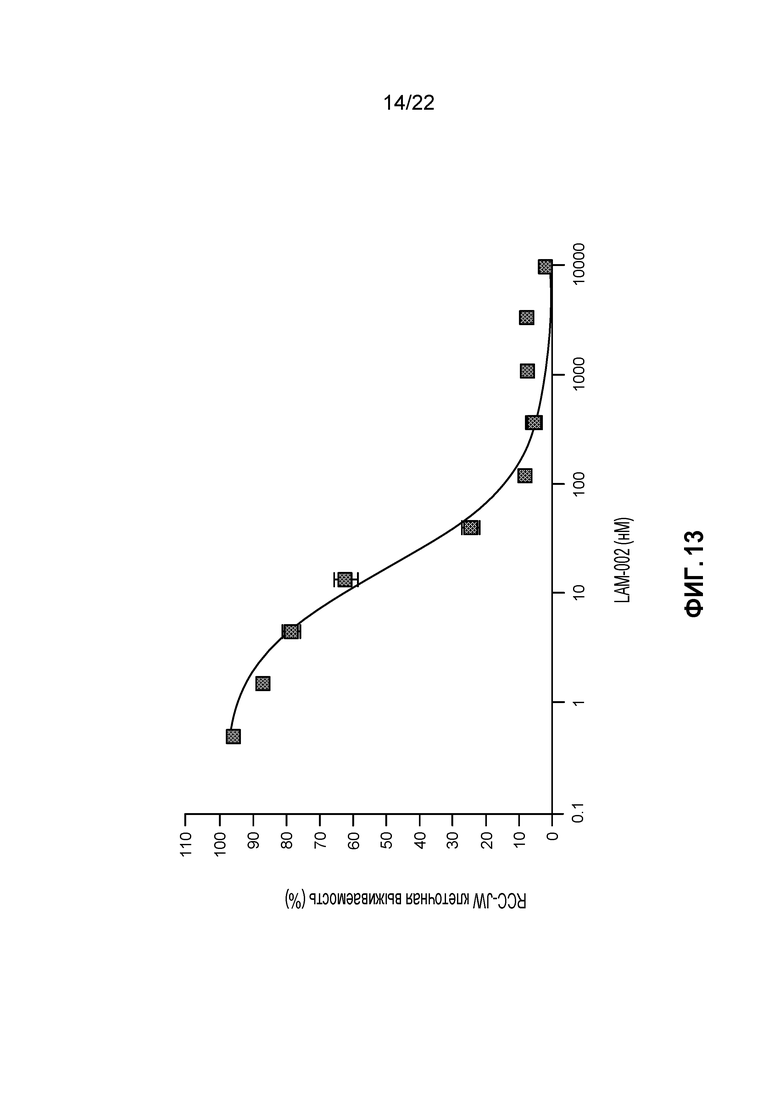
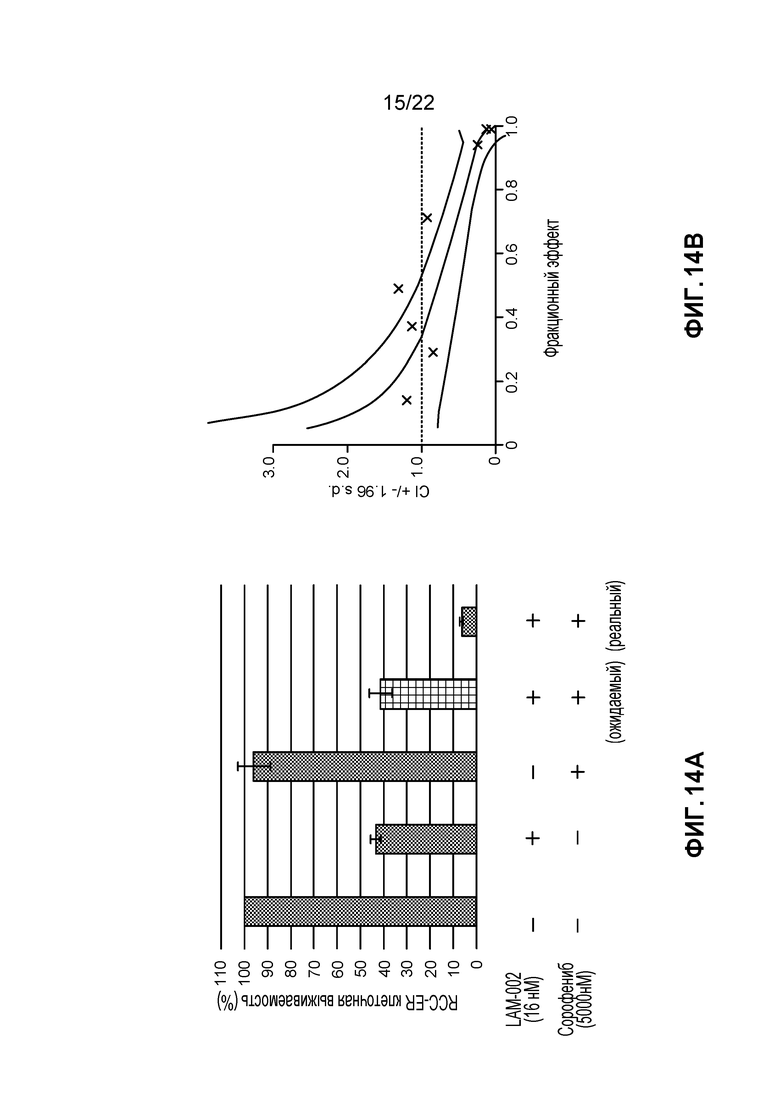
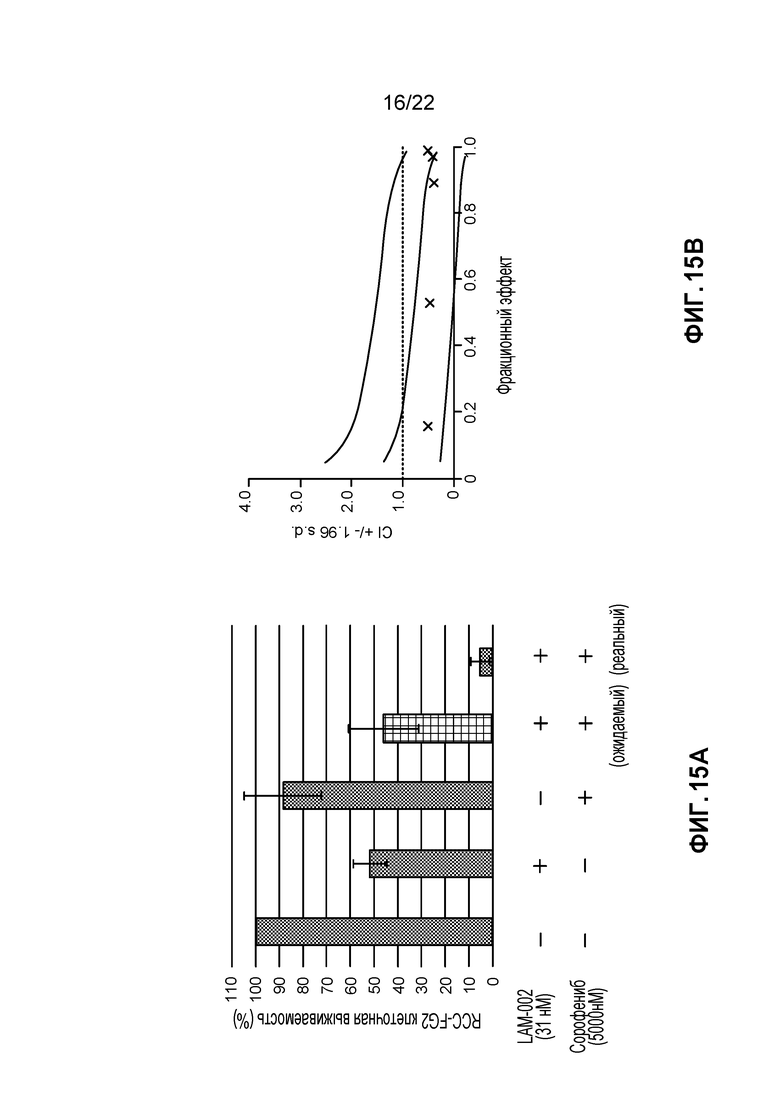
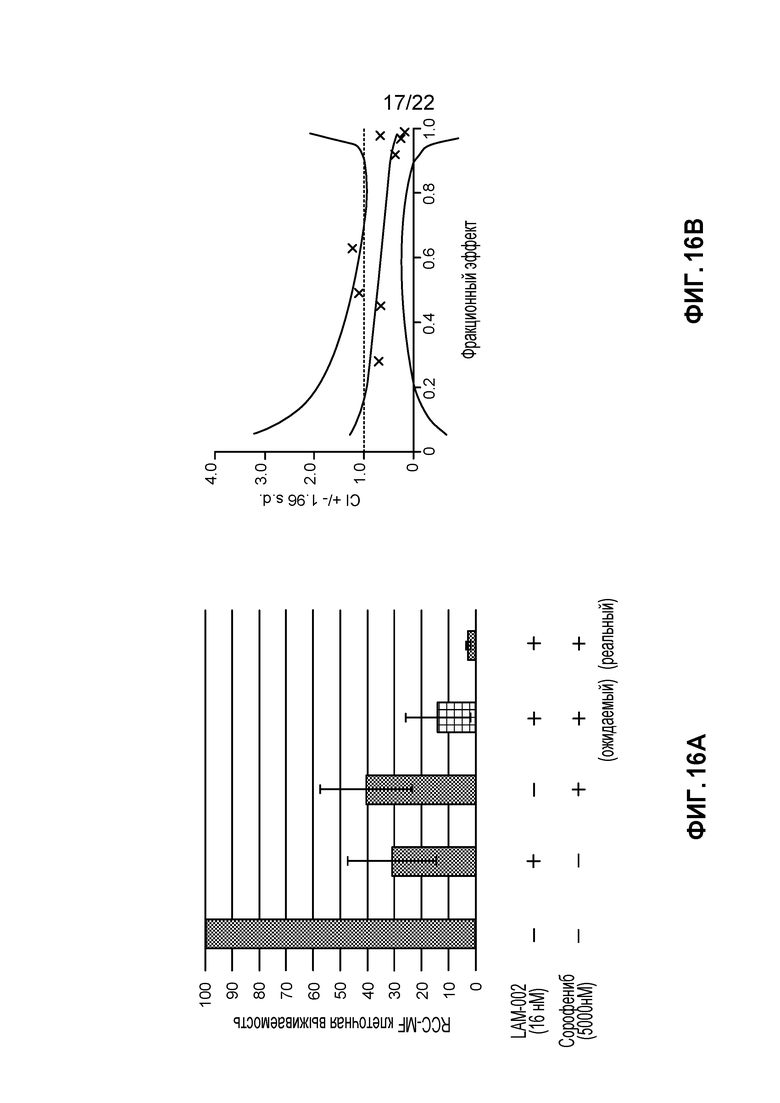
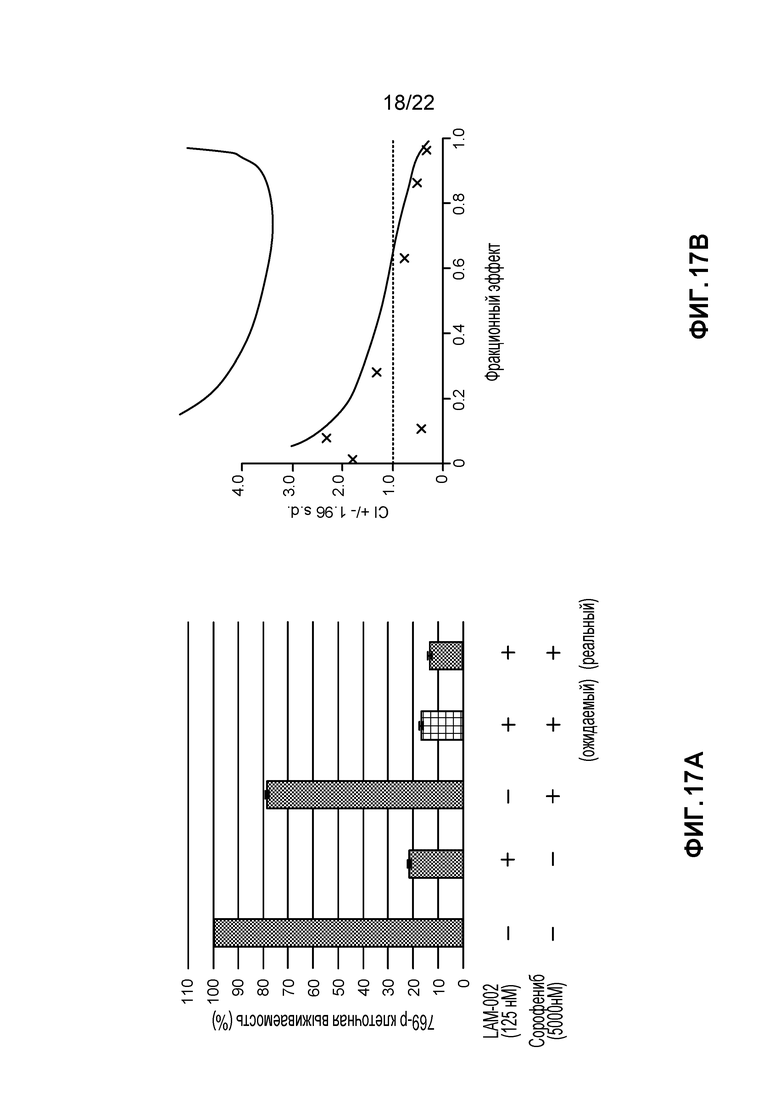
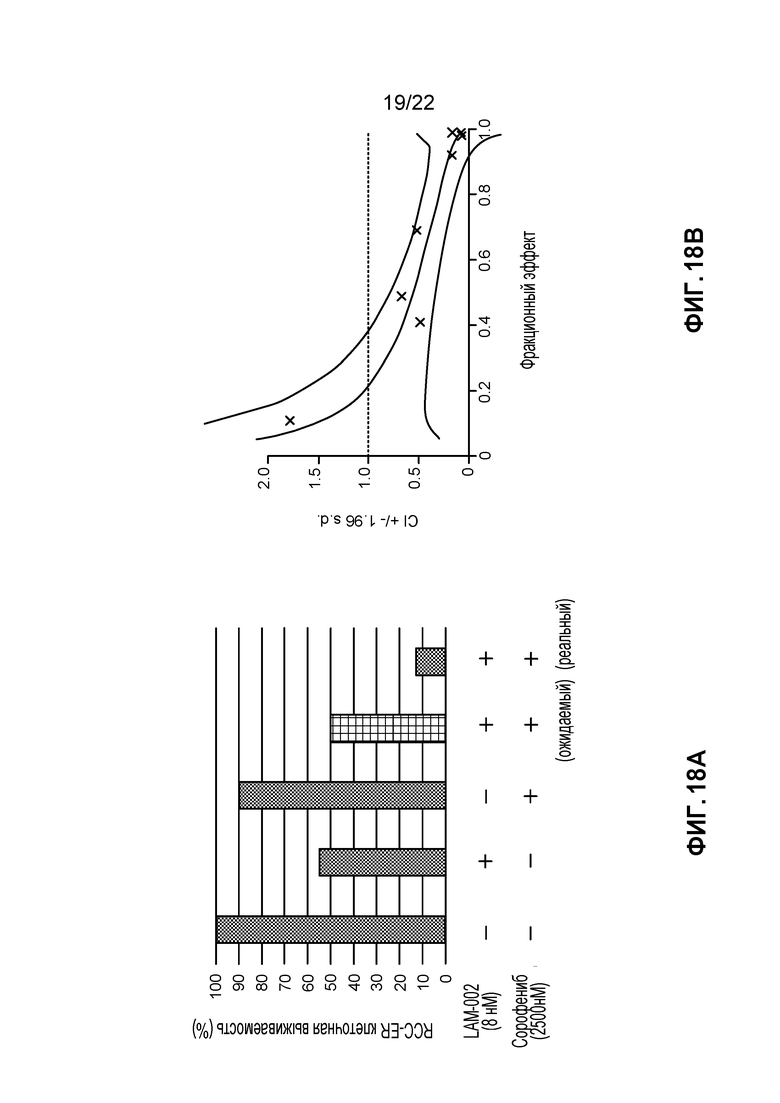
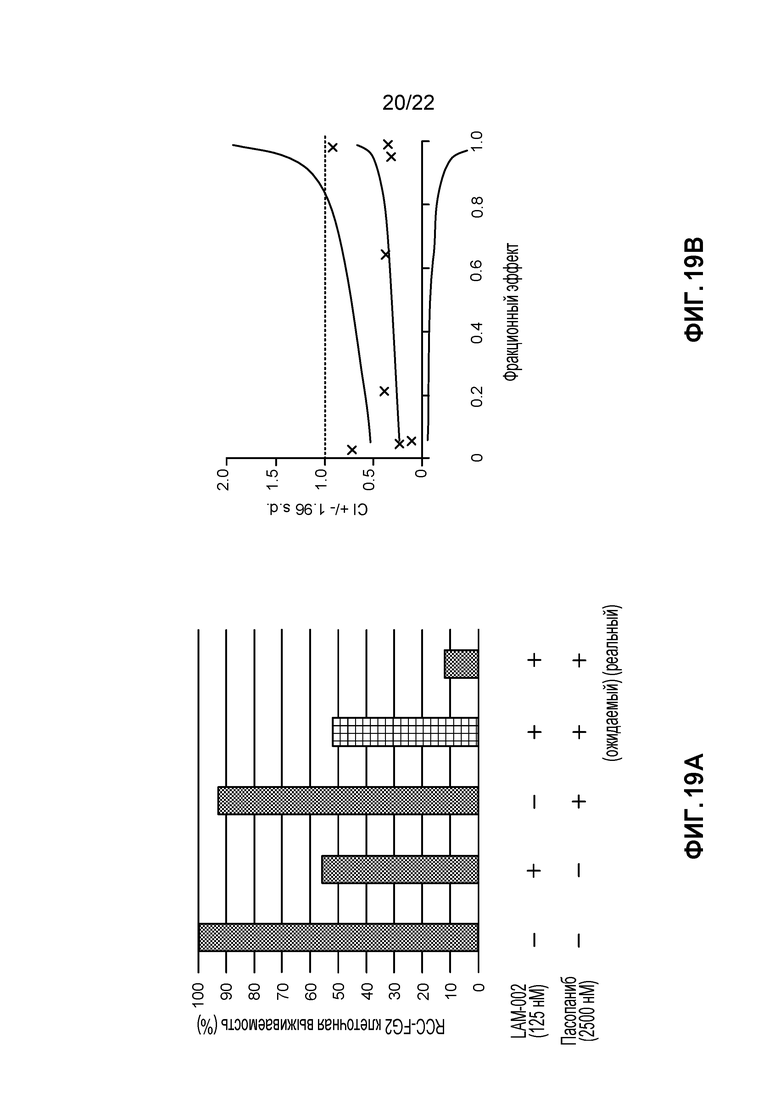
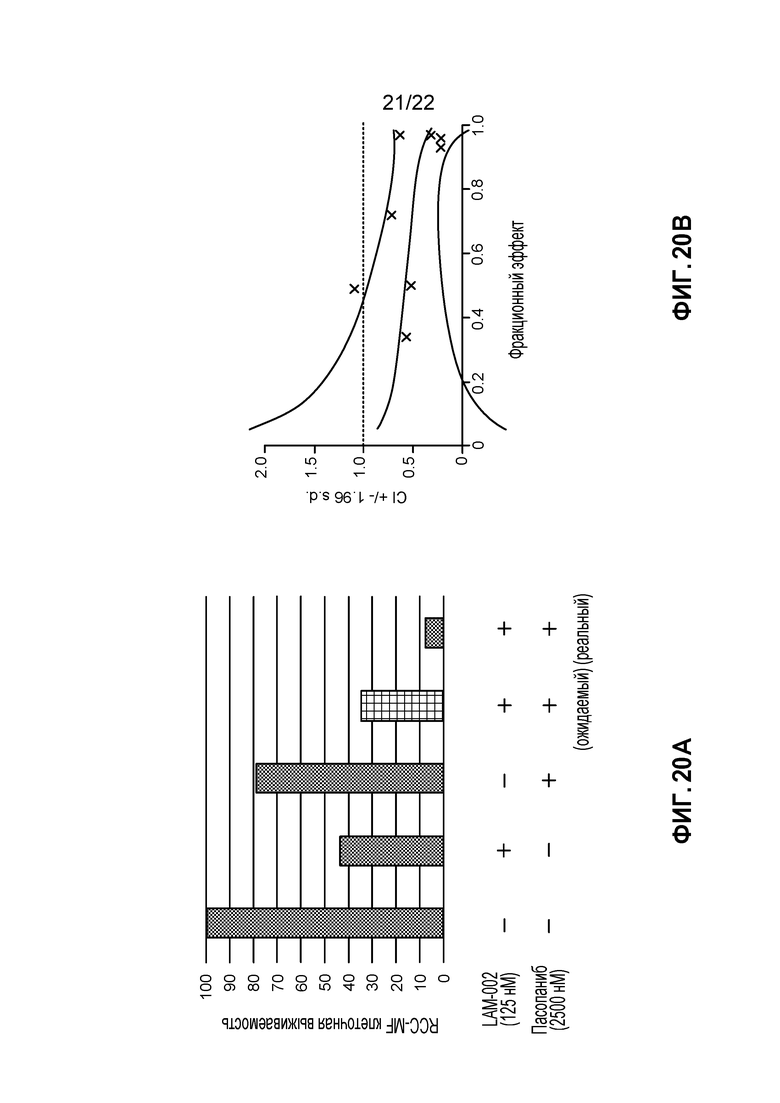
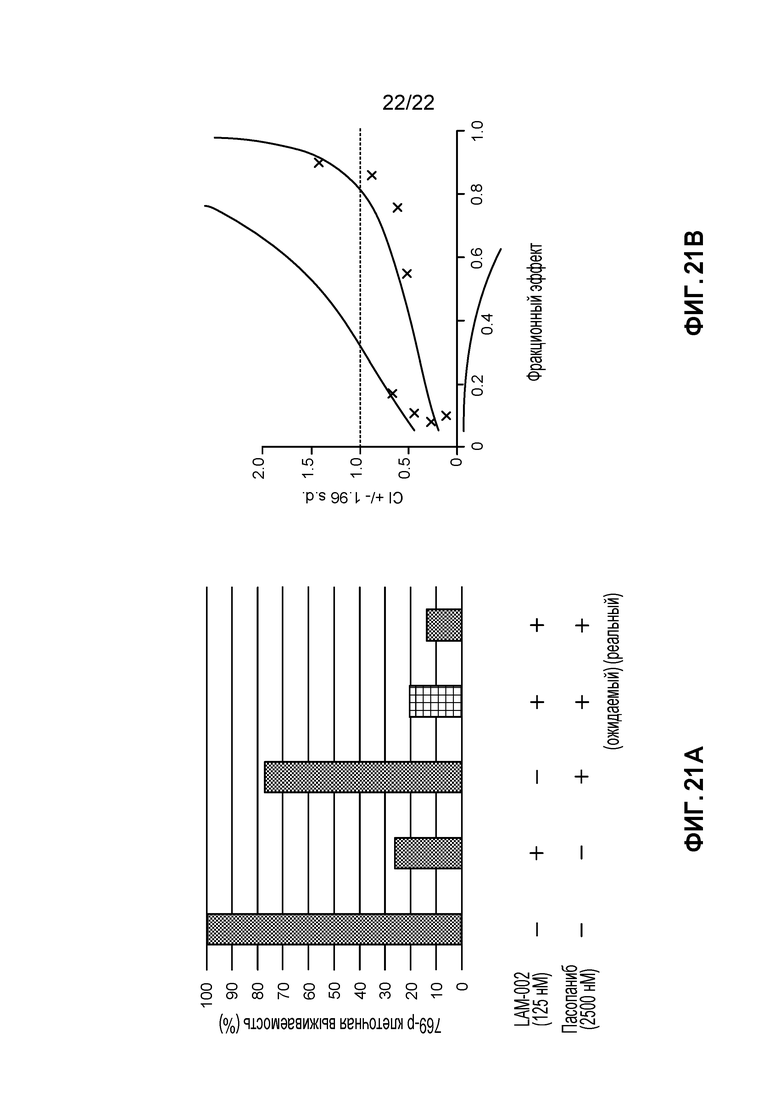
Изобретение относится к фармацевтической промышленности, а именно, к применению композиции для лечения рака почек у субъекта, а также, к способу лечения рака почек у нуждающегося в этом субъекта, способу ингибирования пролиферации раковых клеток почек и способу ингибирования выживания раковых клеток почек композицией. Применение композиции, содержащей терапевтически эффективное количество апилимода или его фармацевтически приемлемой соли, для лечения рака почек у субъекта. Способ лечения рака почек у нуждающегося в этом субъекта, где указанный способ включает введение субъекту терапевтически эффективного количества композиции, включающей апилимод или его фармацевтически приемлемую соль. Способ ингибирования пролиферации раковых клеток почек, где указанный способ включает осуществление контактирования раковых клеток с таким количеством апилимода или его фармацевтически приемлемой соли, которое эффективно ингибирует пролиферацию клеток. Способ ингибирования выживания раковых клеток почек, где указанный способ включает осуществление контактирования раковых клеток с таким количеством апилимода или его фармацевтически приемлемой соли, которое эффективно ингибирует активность PIKfyve киназы в раковых клетках. Вышеописанное применение композиции и способы (варианты) оказывают эффективное лечение рака почек у субъекта. 4 н. и 27 з.п. ф-лы, 21 ил., 6 табл., 5 пр.
1. Применение композиции, содержащей терапевтически эффективное количество апилимода или его фармацевтически приемлемой соли, для лечения рака почек у субъекта.
2. Применение по п. 1, где фармацевтически приемлемая соль выбрана из сульфата, цитрата, ацетата, оксалата, хлорида, бромида, иодида, нитрата, бисульфата, фосфата, кислого фосфата, изоникотината, лактата, салицилата, кислого цитрата, тартрата, олеата, танната, пантотената, битартрата, аскорбата, сукцината, малеата, безилата, гентизината, фумарата, глюконата, глюкароната, сахарата, формиата, бензоата, глутамата, метансульфоната, этансульфоната, бензолсульфоната, п-толуолсульфоната и памоата, в частности, 1,1'-метилен-бис-(2-гидрокси-3-нафтоата).
3. Применение по п. 2, где фармацевтически приемлемая соль выбрана из хлорида, метансульфоната, фумарата, лактата, малеата, памоата, фосфата и тартрата.
4. Применение по п. 3, где фармацевтически приемлемая соль представляет собой димезилат апилимода.
5. Применение по любому из пп. 1-4, где вводят по меньшей мере одно дополнительное активное средство.
6. Применение по п. 5, где по меньшей мере одно дополнительное активное средство выбрано из группы, состоящей из ингибитора протеинкиназы, ингибитора PD-1/PDL-1 пути, ингибитора конечной точки, противонеопластического средства на основе платины, ингибитора топоизомеразы, нуклеозидного ингибитора метаболизма, алкилирующего средства, интеркалирующего средства, связывающего тубулин средства и их комбинаций.
7. Применение по п. 6, где по меньшей мере одно дополнительное активное средство представляет собой ингибитор протеинкиназы.
8. Применение по п. 7, где указанный ингибитор протеинкиназы представляет собой пазопаниб или сорафениб, или их комбинацию.
9. Применение по п. 7, где по меньшей мере одно дополнительное активное средство представляет собой ингибитор тирозинкиназы.
10. Применение по п. 9, где ингибитор тирозинкиназы выбран из группы, состоящей из вотриента, акситиниба, бортезомиба, бозутиниба, карфилзомиба, кризотиниба, дабрфениба, дазатиниба, эрлотиниба, гефитиниба, ибрутиниба, иматиниба, лапатиниба, нилотиниба, пегаптаниба, понатиниба, регорафениба, руксолитиниба, сорафениба, сунитиниба, траметиниба, вандетаниба, вемурафениба и висмодегиба.
11. Применение по п. 10, где ингибитор тирозинкиназы представляет собой кризотиниб.
12. Применение по п. 5, где по меньшей мере одно дополнительное активное средство представляет собой ингибитор VEGF или ингибитор MEK.
13. Применение по п. 12, где ингибитор VEGF выбирают из группы, состоящей из бевацизумаба, сунитиниба, пазопаниба, акситиниба, сорафениба, регорафениба, ленватиниба и мотезаниба.
14. Применение по п. 13, где ингибитор VEGF выбирают из группы, состоящей из сунитиниба, акситиниба, регорафениба, ленватиниба и мотезаниба.
15. Применение по п. 12, где ингибитор MEK выбирают из группы, состоящей из селуметиниба, траметиниба, рафаметиниба, биниметиниба и пимасертиба.
16. Применение по п. 15, где ингибитор MEK выбирают из траметиниба и биниметиниба.
17. Применение по п. 6, где по меньшей мере одно дополнительное активное средство представляет собой ингибитор PD-1/PDL-1 пути.
18. Применение по п. 17, где ингибитор PD-1/PDL-1 пути выбирают из пембролизумаба, авелумаба, атезолизумаба, ниволумаба, пидилизумаба, MSB0010718C и MEDI4736.
19. Применение по любому из пп. 2-18, дополнительно включающее введение средства, выбранного для ослабления одного или более из побочных эффектов апилимода.
20. Применение по п. 19, где средство выбирают из группы, состоящей из ондансетрона, гранисетрона, долсетрона и палоносетрона.
21. Применение по п. 20, где средство выбирают из группы, состоящей из пиндолола и рисперидона.
22. Применение по любому из пп. 1-21, где терапевтически эффективное количество апилимода или его фармацевтически приемлемой соли представляет собой количество, которое эффективно для ингибирования активности PIKfyve киназы в раковых клетках субъекта.
23. Применение по любому из пп. 1-22, где рак почек является устойчивым в отношении стандартного лечения, или является метастазирующим.
24. Применение по любому из пп. 1-23, где указанный рак почек выбирают из светлоклеточного рака почек, переходно-клеточной карциномы, опухоли Вилмса (нефробластомы), почечной саркомы, аденомы почек, онкоцитомы и ангиомиолипомы.
25. Применение по любому из пп. 1-24, где композиция представлена в форме, пригодной для перорального или внутривенного введения.
26. Применение по любому из пп. 1-25, где субъект представляет собой человека.
27. Способ лечения рака почек у нуждающегося в этом субъекта, где указанный способ включает введение субъекту терапевтически эффективного количества композиции, включающей апилимод или его фармацевтически приемлемую соль.
28. Способ по п. 27, где апилимод представляет собой димезилат апилимода.
29. Способ по любому из пп. 27 или 28, где терапевтически эффективное количество апилимода является количеством, которое эффективно ингибирует активность PIKfyve киназы в раковых клетках почек субъекта.
30. Способ ингибирования пролиферации раковых клеток почек, где указанный способ включает осуществление контактирования раковых клеток с таким количеством апилимода или его фармацевтически приемлемой соли, которое эффективно ингибирует пролиферацию клеток.
31. Способ ингибирования выживания раковых клеток почек, где указанный способ включает осуществление контактирования раковых клеток с таким количеством апилимода или его фармацевтически приемлемой соли, которое эффективно ингибирует активность PIKfyve киназы в раковых клетках.
| WO 2006128129 A2, 30.11.2006 | |||
| WO 2006128129 A2, 30.11.2006 | |||
| Cai X, et al | |||
| PIKfyve, a class III PI kinase, is the target of the small molecular IL-12/IL-23 inhibitor apilimod and a player in Toll-like receptor signaling // Chem Biol.- 2013.- Jul 25; 20(7):912-21 | |||
| ДИПЕПТИДНЫЕ ПРОЛЕКАРСТВА И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2486183C9 |
| George K | |||
| Philips, et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2020-07-24—Публикация
2015-11-06—Подача