Изобретение относится к области анализа материалов путем определения их физических свойств, в частности с помощью оптических средств с использованием видимых лучей и может быть использовано в биотехнологическом производстве для контроля процесса выращивания микроводорослей.
Известен способ определения концентрации клеток в суспензии микроорганизмов [1. Государственная Фармакопея Российской Федерации, XIII издание, М., 2015. –Т. 2. – С. 624-627], включающий подсчет клеток в 1 мл суспензии микроорганизмов под микроскопом с использованием счетной камеры Горяева. Микроскоп настраивают таким образом, чтобы была видна нанесенная на камеру сетка и клетки, равномерно распределенные на ней. Считают число клеток в 5 горизонтальных и 15 диагональных ячейках, после чего по формуле определяют число клеток в 1 мл исследуемой суспензии:
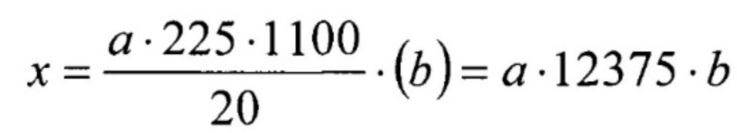 ,
,
где x – число клеток в 1 мл исследуемой суспензии;
а – число клеток в 20 квадратах;
b – разведение исходной суспензии микроорганизма.
Недостатком данного способа является его невысокая точность и большая трудоемкость.
Известен способ оптической оценки концентрации микробных клеток в суспензии [2. RU 2636620 С1, МПК G01N33/483 (2006.01), опубл. 24.11.2017], включающий в себя определение значения волнового экспонента (n) для суспензии микроорганизмов в двух дисперсионных средах с различными показателями преломления, на основе полученных его значений вычисляют для данного штамма микроорганизмов в данных конкретных условиях показатель преломления бактерий (μb) и средний радиус (Rcp) микробных тел. Затем, применяя асимптотическое приближение, находят коэффициент светорассеяния (Кs), с использованием которого по измеренной оптической плотности суспензии определяют концентрацию микроорганизмов (N).
Недостатком этого способа является использование дорогостоящего оборудования, большое количество определяемых параметров и значительные трудозатраты.
Известен способ определения концентрации клеток в суспензии микроводорослей [3. WO 2015120144 А1, МПК G01N21/3577 (2014.01), G01N21/17 (2006.01), G01N21/27 (2006.01), опубл. 13.08.2015], выбранный в качестве прототипа, включающий использование первой платформы формирования изображения, содержащей первую оптическую опорную поверхность, и второй платформы формирования изображения, содержащей вторую оптическую опорную поверхность; позиционирование первой платформы формирования изображения и второй платформы формирования изображения относительно жидкого образца так, что первая оптическая опорная поверхность не погружена в жидкий образец, а вторая оптическая опорная поверхность погружена в жидкий образец; захват оптического сигнала от первой оптической опорной поверхности и второй оптической опорной поверхности; обработку оптического сигнала, чтобы определить первую зону анализа и вторую область анализа, в котором область первого анализа содержит часть первой оптической опорной поверхности, а область второго анализа содержит часть второй оптической опорной поверхности. Первая оптическая поверхность и вторая оптическая поверхность обладают высокой отражательной способностью, обращены в одном направлении, параллельны поверхности жидкого образца и находятся на разных глубинах в жидком образце. В качестве источника света, освещающего первую оптическую опорную поверхность и вторую оптическую базовую поверхность используют искусственный источник света, который излучает одну или несколько длин волн от 300 до 2500 нм. Используют камеру, которая одновременно захватывает изображение оптического сигнала от первой оптической опорной поверхности и второй оптической базовой поверхности.
В качестве показателя концентрации биомассы используют прямое измерение монохроматической оптической плотности на конкретной длине волны в спектрофотометре, значение которой коррелируется с концентрацией биомассы с использованием опубликованных калибровочных кривых. Однако точность указанных корреляций зависит от спецификаций измерения, таких как спектральная ширина полосы и угол приема измерительного прибора, а также спектральное распределение источника света. Кроме того, оптическая плотность образца зависит от местоположения образца.
Для анализа изображений культур водорослей используют специальный компьютерный код, где каждый пиксель цифрового изображения, полученного камерой, представлен цветным вектором [rP, gP, bp], что соответствует интенсивностям красного (от 560 до 700 нм), зеленого (от 490 до 590 нм) и синего 153 (от 410 до 500 нм) пикселей соответственно. Каждый элемент вектора имеет целочисленное значение от 0 до 255 включительно.
Спектральную характеристику обратного рассеянного света используют для диагностики культур, таких как количественное определение концентрации биомассы, обнаружение инвазивных видов и мониторинг здоровья культуры.
Получены корреляции между интенсивностью обратного рассеяния красного, зеленого и синего и концентрациями биомассы зеленой водоросли хлорелла.
Таким образом, для осуществления этого способа необходим мультиспектральный метод визуализации для мониторинга рассеянного света от водорослевых культур и сложный анализ полученных изображений и использованием вычислительного устройства, содержащего процессор и системную память.
Техническим результатом заявленного решения является создание простого способа определения концентрации клеток в суспензии микроводорослей.
Способ определения концентрации клеток в суспензии микроводорослей, также как в прототипе, включает пропускание светового потока через слой суспензии и фиксацию величины светового потока после прохождения этого слоя, причем через слой суспензии микроводорослей пропускают световой поток с длиной волны от 510 до 580 нм и определяют концентрацию клеток в суспензии по калибровочной кривой.
Согласно изобретению пропускают световой поток от помещенного в объем суспензии светодиода с максимальной длиной волны излучения 550 нм, фиксируют величину светового потока после прохождения слоя суспензии фотоприемником, расположенным в объеме суспензии на расстоянии 1 см от светодиода, измеряют напряжение, возникающее при попадании на фотоприемник светового потока, прошедшего через слой суспензии и определяют концентрацию клеток в суспензии микроводорослей по калибровочной кривой, отображающей зависимость концентрации клеток от напряжения.
Использование светового потока с длиной волны от 510 до 580 нм обусловлено тем, что все микроводоросли содержат пигмент хлорофилл, который в этой области не поглощает, поэтому при пропускании светового потока через слой суспензии микроводорослей он поглощается только органеллами клеток, и степень поглощения светового потока пропорциональна концентрации клеток микроводорослей.
По сравнению с прототипом предложенный способ прост в исполнении, продолжительность проведения анализов и его трудоемкость существенно уменьшена. Для выполнения одного анализа требуется не более 2 мин.
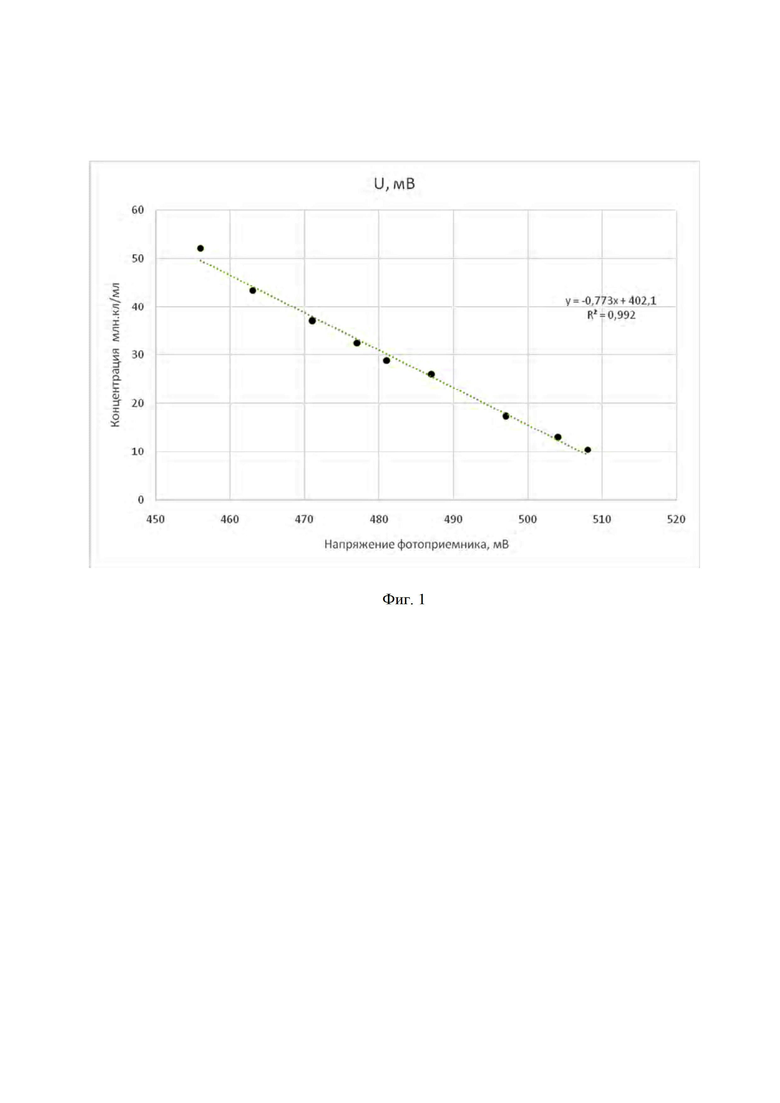
В таблице 1 представлены данные для построения калибровочной кривой, полученной при разбавлении суспензии микроводорослей с известной концентрацией клеток.
На фиг. 1 представлена зависимость концентрации клеток от напряжения на выходе фотоприемника.
Для осуществления способа использовали датчик, содержащий штангу, на которой закреплен фотоприемник, например, BPW 21 (OSRAM), с длиной волны в точке максимальной чувствительности 550 нм. На расстоянии 1 см от фотоприемника на штанге закреплен светодиод с максимальной длиной волны излучения 550 нм. Световой поток светодиода сфокусирован на окно фотоприемника. Выводы светодиода подключены к источнику постоянного тока 12 В. Выводы фотоприемника подключены к милливольтметру.
Перед началом измерений построили калибровочный график. Для этого в емкость, содержащую 1000 мл суспензии хлореллы, выращенной на питательной среде Тамия, с концентрацией клеток 52 млн кл/мл, определенной микроскопическим методом [1], поместили указанный датчик. Подавали напряжение питания на светодиод и регистрировали показание милливольтметра.
Затем последовательно осуществляли добавки питательной среды Тамия в начальный объем суспензии и регистрировали показания миливольтметра, которые представлены в таблице 1. Пересчитали концентрацию клеток в разбавленных объемах с учетом добавленных объемов и исходной концентрации. По полученным данным построили калибровочный график в единицах напряжение/концентрация (фиг. 1).
Для определения концентрации клеток в объем суспензии микроводорослей помещали датчик, подавали напряжение на светодиод и измеряли выходное напряжение фотоприемника. Например, если показания милливольтметра составили 490 мВ, то по калибровочному графику концентрация клеток в суспензии микроводорослей составляет 23 млн кл/мл.
Таблица 1
| название | год | авторы | номер документа |
|---|---|---|---|
| СИСТЕМА ИЗМЕРЕНИЯ ОПТИЧЕСКОЙ ПЛОТНОСТИ КУЛЬТУРЫ МИКРОВОДОРОСЛИ TETRASELMIS VIRIDIS И СПОСОБ ИЗМЕРЕНИЯ ОПТИЧЕСКОЙ ПЛОТНОСТИ КУЛЬТУРЫ МИКРОВОДОРОСЛЕЙ | 2022 |
|
RU2802224C1 |
| Способ микробиологического анализа на основе оптического метода и портативный микробиологический анализатор | 2021 |
|
RU2779840C1 |
| СПОСОБ КОНТРОЛЯ ВЕЩЕСТВА В АТМОСФЕРЕ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2010 |
|
RU2487337C2 |
| ФОТОКОЛОРИМЕТР-РЕФЛЕКТОМЕТР | 1999 |
|
RU2154260C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ФОТОПИГМЕНТОВ ФИТОПЛАНКТОНА, РАСТВОРЁННОГО ОРГАНИЧЕСКОГО ВЕЩЕСТВА И РАЗМЕРНОГО СОСТАВА ВЗВЕСИ В МОРСКОЙ ВОДЕ IN SITU | 2021 |
|
RU2775809C1 |
| Способ количественного определения селективно связанных белков-маркеров заболеваний в планарных ячейках биочипа и устройство для его осуществления | 2021 |
|
RU2776889C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ФОТОСИНТЕЗИРУЮЩИХ МИКРООРГАНИЗМОВ | 2013 |
|
RU2550266C2 |
| БИОСЕНСОР ДЛЯ ОПРЕДЕЛЕНИЯ 2,4,6-ТРИНИТРОТОЛУОЛА | 2010 |
|
RU2437930C1 |
| СПОСОБ ФОРМИРОВАНИЯ ОПТИЧЕСКОГО СПЕКТРА | 2020 |
|
RU2730884C1 |
| Способ и устройство для количественного определения содержания восков и воскоподобных веществ в рафинированных растительных маслах | 2015 |
|
RU2606850C2 |
Изобретение относится к области анализа материалов путем определения их физических свойств с помощью оптических средств. Способ определения концентрации клеток в суспензии микроводорослей включает пропускание через слой суспензии светового потока с длиной волны от 510 до 580 нм, фиксацию величины светового потока после прохождения этого слоя и определение концентрации клеток в суспензии микроводорослей по калибровочной кривой. При этом пропускают световой поток от помещенного в объем суспензии светодиода с максимальной длиной волны излучения 550 нм, фиксируют величину светового потока после прохождения слоя суспензии фотоприемником, расположенным в объеме суспензии на расстоянии 1 см от светодиода, измеряют напряжение, возникающее при попадании на фотоприемник светового потока, прошедшего через слой суспензии, и определяют концентрацию клеток в суспензии микроводорослей по калибровочной кривой, отображающей зависимость концентрации клеток от напряжения. Технический результат заключается в упрощении, в уменьшении продолжительности и снижении трудоемкости анализа. 1 табл., 1 ил.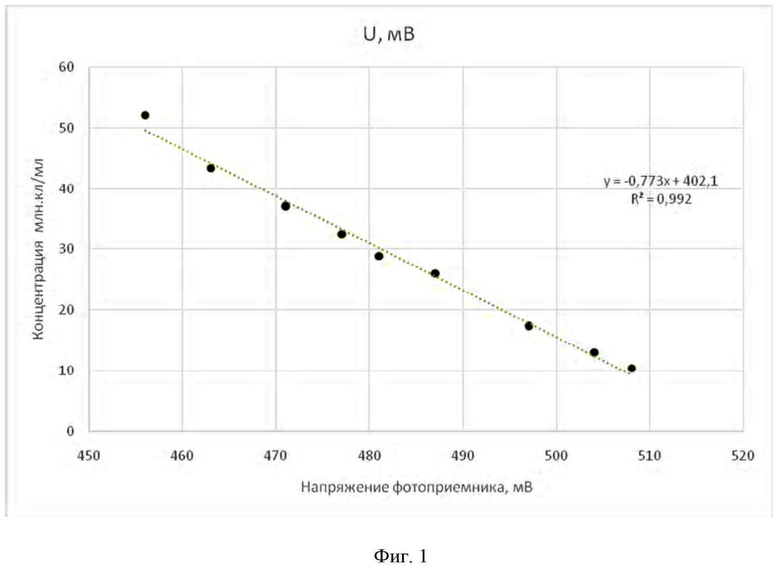
Способ определения концентрации клеток в суспензии микроводорослей, включающий пропускание через слой суспензии светового потока с длиной волны от 510 до 580 нм, фиксацию величины светового потока после прохождения этого слоя, определение концентрации клеток в суспензии микроводорослей по калибровочной кривой, отличающийся тем, что пропускают световой поток от помещенного в объем суспензии светодиода с максимальной длиной волны излучения 550 нм, фиксируют величину светового потока после прохождения слоя суспензии фотоприемником, расположенным в объеме суспензии на расстоянии 1 см от светодиода, измеряют напряжение, возникающее при попадании на фотоприемник светового потока, прошедшего через слой суспензии, и определяют концентрацию клеток в суспензии микроводорослей по калибровочной кривой, отображающей зависимость концентрации клеток от напряжения.
| WO 2015120144 A1, 13.08.2015 | |||
| Способ изготовления покрытий для сварочных электродов | 1941 |
|
SU63536A1 |
| JP 2003284600 A, 07.10.2003 | |||
| Устройство для формования пластического материала | 1930 |
|
SU21097A1 |
Авторы
Даты
2020-09-14—Публикация
2019-12-26—Подача