Родственная заявка
Настоящая заявка является родственной заявкой, приоритет по которой был установлен по предварительной индийской заявке 201641001111, поданной 12 января 2016 г., и которая была полностью включена в настоящий документ.
Уровень техники
Успехи в области биотехнологии подготовили почву для возможности производства различных протеинов для фармацевтических нужд. Однако в отличие от традиционных лекарств протеины являются более крупными и более сложными трехмерными структурами, содержащими многочисленные функциональные группы. Известно, что обычно протеины в растворе нестабильны и чувствительны к pH, температуре и окислению, и поэтому они могут вступать в различные ковалентные и нековалентные реакции, претерпевать изменения или разложения в растворе.
Наиболее часто разложение протеинов идет по пути агрегации, дезаминирования и окисления. Эти пути приводят как к физической, так и к химической нестабильности протеина в растворе. Химическая нестабильность может быть результатом дезаминирования, гидролиза, окисления или дисульфидного обмена, тогда как физическая нестабильность может быть результатом денатурации, агрегации, адсорбции или преципитации.
Агрегация протеина представляет особый интерес в препарате протеина, поскольку она зачастую приводит к снижению биоактивности протеина, что негативно влияет на активность лекарства, а также может вызывать серьезные иммунологические реакции у пациентов. Подразумевается, что химическое разложение терапевтического средства на основе протеина усиливает его аллергенный потенциал. Таким образом, протеины создают присущие им проблемы при составлении препаратов для терапевтического пользования.
В связи с этим стабильность препарата протеина представляет собой один из важнейших критериев гарантии безопасности и системного и эффективного приема. Любая потеря биоактивности протеина в композиции приведет к снижению его эффективной концентрации. Аналогично, любые нежелательные модификации протеина могут привести к потере эффективности, а также увеличить риск побочных эффектов. Поэтому для получения стабильной композиции требуется наличие протеинов, приготовленных в подходящем буфере, который обеспечивает стабильность относительно путей разложения протеинов.
В уровне техники описано применение в препаратах вспомогательных веществ для предупреждения агрегации, денатурации или аналогичных других видов разложения. В качестве стабилизаторов протеинов использовали сахара, такие как сахароза, глюкоза, раффиноза и трегалоза, и многоатомные спирты, такие как глицерин, сорбитол и маннитол. Концентрация сахаров и многоатомных спиртов в любой композиции протеина прямо пропорциональна стабильности протеина (Foster et al., Int. J. Pharm. (1996) 134(1, 2): 193-201). Другие вспомогательные вещества, используемые в препаратах протеинов, включают применение аминокислот, аминосахаров, солей и полоксамеров и т.д.
Выбор вспомогательных веществ при приготовлении препарата протеина определяется различными факторами, в том числе их совместимостью с протеином, а также другими компонентами препарата, способом приема, дозировкой, терапевтическими показаниями и т.д. Поэтому разумный подход к разработке препарата включает скрининг и выбор подходящих условий буфера и вспомогательных веществ, а также их концентраций.
Настоящее изобретение решает задачи предшествующего уровня техники путем разработки стабильного фармацевтического препарата, поддерживающего растворимость протеина, стабильность и биоактивность активного ингредиента.
Раскрытие изобретения
Настоящее изобретение раскрывает стабильный водный препарат антитела, включающий двойную буферную систему, в которой отдельные буферы выбраны из фосфата, аспартата, глутамата и сукцината. Раскрытый препарат антитела обеспечивает повышенную стабильность в течение продолжительного периода времени, даже в условиях ускоренного старения. Этот стабильный препарат подавляет образование нежелательных вариантов антитела, сохраняя таким образом физические, химические или биологические свойства композиции антитела. Кроме того, раскрытый препарат может применяться для ряда разных терапевтических антител.
Краткое описание фигур
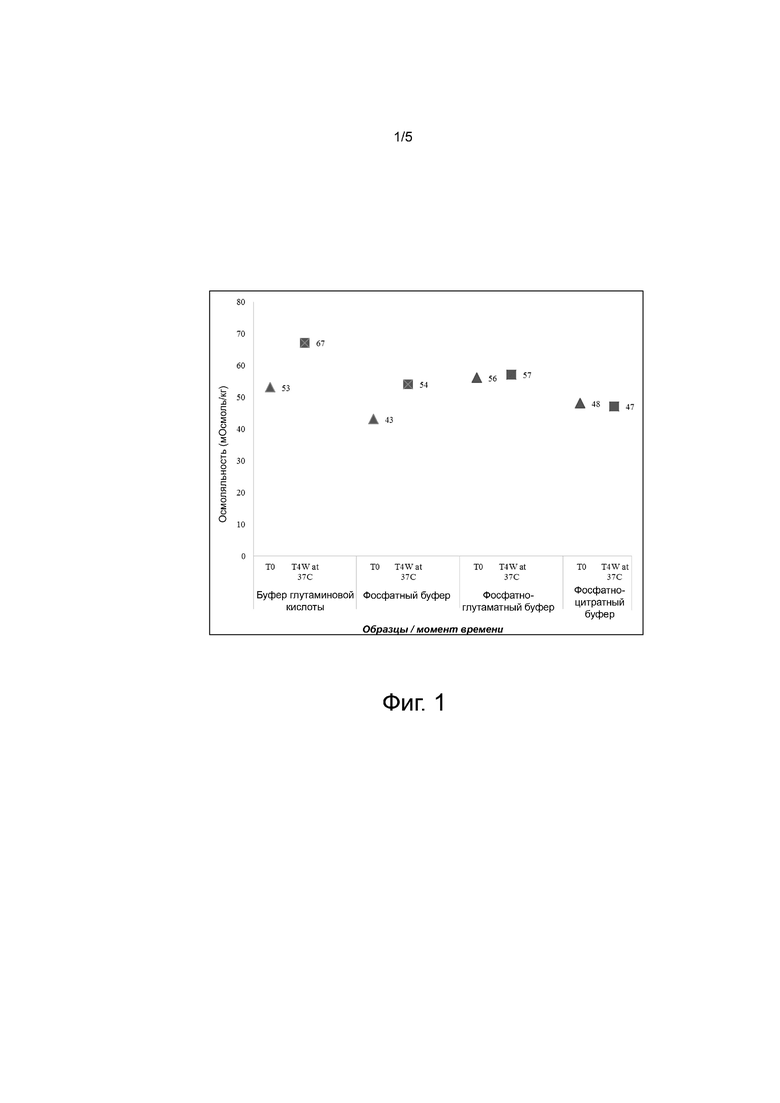
Фиг. 1 - иллюстрирует сдвиг осмоляльности для препарата A-mab в момент T0 и T4 недели при 37°C согласно раскрытию в примере 1.
Фиг. 2 - иллюстрирует динамику процентной доли высокомолекулярных соединений (HMWS) по ЭХ во времени в неблагоприятных условиях (50°C в течение 2 недель) для композиции A-mab.
Фиг. 3 - иллюстрирует динамику процентной доли потерь мономера по ЭХ во времени в неблагоприятных условиях (50°C в течение 2 недель) для композиции A-mab.
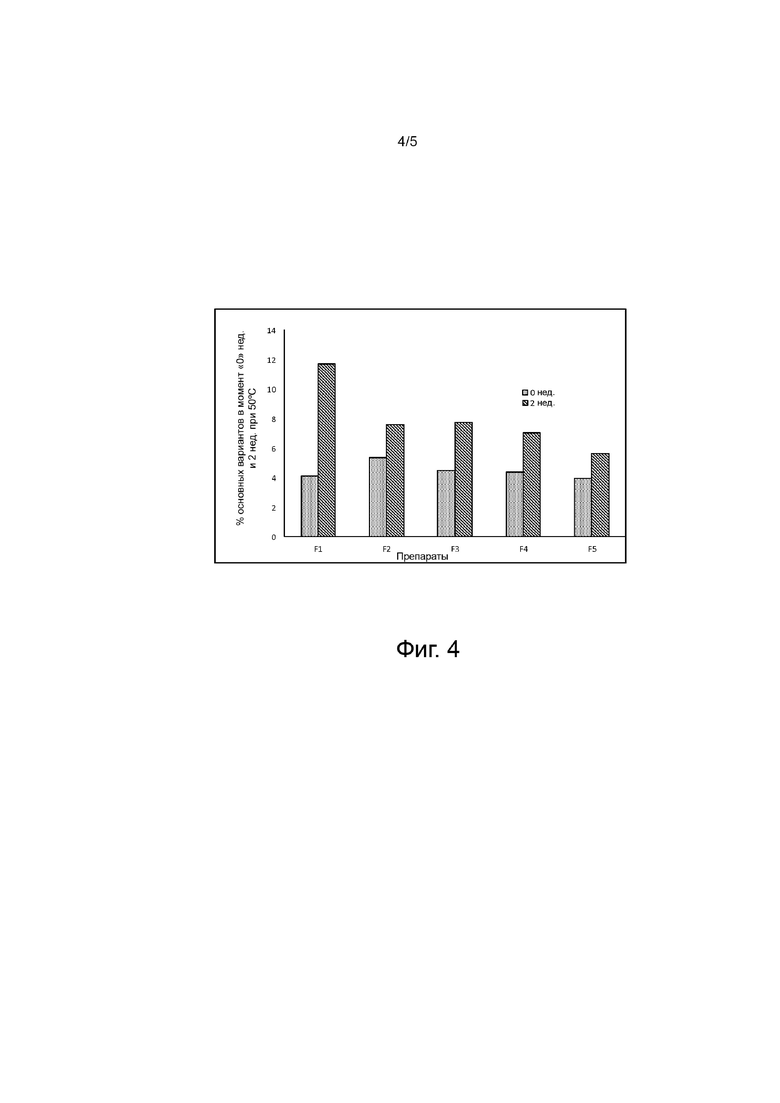
Фиг. 4 - иллюстрирует динамику по IEX процентной доли основных вариантов во времени в неблагоприятных условиях (50°C в течение 2 недель) для композиции A-mab.
Фиг. 5 - иллюстрирует динамику рассеивания света с использованием спектрофотометра NanoDrop во времени в неблагоприятных условиях (50°C в течение 2 недель). Здесь T0 представляет собой данные в день «0», а T1W представляет собой данные через неделю при 50°C для композиции A-mab.
Осуществление изобретения
Настоящее изобретение раскрывает стабильный водный фармацевтический препарат антитела, в котором антитело приготовлено в двойной буферной системе.
В одном из вариантов осуществления изобретения двойная буферная система включает комбинацию любых двух буферов, выбранных из группы, состоящей из фосфата, аспартата, сукцината и глутамата.
В другом варианте осуществления изобретения двойная буферная система состоит из фосфатного буфера и глутаматного буфера.
Один из вариантов осуществления изобретения раскрывает стабильный водный фармацевтический препарат антитела, в котором антитело приготовлено в двойной буферной системе, и который также содержит фармацевтически приемлемые вспомогательные вещества.
В любом из описанных выше вариантов осуществления изобретения антитело, приготовленное в двойной буферной системе, стабильно при 2-8ºC в течение по меньшей мере 2 лет.
В любом из описанных выше вариантов осуществления изобретения антитело, приготовленное в двойной буферной системе, стабильно при 25ºC в течение по меньшей мере 3 месяцев.
В любом из описанных выше вариантов осуществления изобретения антитело, приготовленное в двойной буферной системе, стабильно примерно при 40ºC в течение по меньшей мере 2 недель, более предпочтительно в течение по меньшей мере 4 недель.
В любом из описанных выше вариантов осуществления изобретения антитело, приготовленное в двойной буферной системе, стабильно примерно при 50ºC в течение по меньшей мере 1 недели, более предпочтительно в течение по меньшей мере 2 недель.
В любом из описанных выше вариантов осуществления изобретения антитело, приготовленное в двойной буферной системе, стабильно после трех циклов замораживания-оттаивания, предпочтительно после пяти циклов замораживания-оттаивания.
В другом варианте осуществления изобретение раскрывает препарат антитела, включающий вспомогательные вещества, в котором вспомогательные вещества включают аминокислоты, предпочтительно аминокислоты являются аргинином и/или глицином или их производными и их комбинацией.
Еще в одном варианте осуществления изобретение раскрывает препарат антитела, включающий вспомогательные вещества, в котором вспомогательные вещества включают сахара или сахароспирт, предпочтительно сахара являются маннитолом, сорбитолом, сахарозой и трегалозой или их производными и их комбинацией.
Еще в одном варианте осуществления изобретение раскрывает препарат антитела, включающий вспомогательные вещества, в котором вспомогательные вещества включают поверхностно-активное вещество, предпочтительно поверхностно-активное вещество является полисорбатом 80.
В другом варианте осуществления изобретение раскрывает препарат антитела, включающий вспомогательные вещества, в котором вспомогательные вещества включают соли, более предпочтительно соль является хлоридом натрия.
В любом из описанных выше вариантов осуществления изобретения, pH двойной буферной системы составляет от около 5 до около 7, более предпочтительно pH двойной буферной системы составляет от около 5,2 до около 6,0.
В любом из описанных выше вариантов осуществления изобретения, антитело присутствует в препарате в концентрации по меньшей мере 20 мг/мл, более предпочтительно по меньшей мере 50 мг/мл и еще более предпочтительно по меньшей мере 100 мг/мл.
В любом из описанных выше вариантов осуществления изобретения, антитело в препарате является терапевтическим антителом.
В любом из описанных выше вариантов осуществления изобретения, антитело в препарате выбирают из анти-TNFα антитела, анти-IL-6R антитела, анти-HER2 антитела, более предпочтительно выбирают из группы, состоящей из адалимумаба, тоцилизумаба или трастузумаба.
В одном из вариантов осуществления изобретение раскрывает водный фармацевтический препарат терапевтического антитела, включающий двойную буферную систему, в которой отдельные буферы в двойной буферной системе выбраны из группы, состоящей из фосфата, глутамата, аспартата и сукцината, и в которой препарат стабилен и сохраняет свою биологическую активность.
В другом варианте осуществления изобретение раскрывает водный фармацевтический препарат терапевтического антитела, включающий двойную буферную систему, в которой отдельные буферы в двойной буферной системе выбраны из группы, состоящей из фосфата, глутамата, аспартата и сукцината, и в которой препарат стабилен при 2-8oC в течение по меньшей мере 2 лет или при 25ºC в течение по меньшей мере 3 месяцев или примерно при 40ºC в течение по меньшей мере 2 недель, или примерно при 50ºC в течение по меньшей мере 1 недели, и препарат задерживает снижение содержания мономера в композиции антитела.
Другой вариант осуществления изобретения раскрывает водный фармацевтический препарат, включающий терапевтическое антитело и двойную буферную систему, в которой отдельные буферы в двойной буферной системе выбраны из группы, состоящей из фосфата, глутамата, аспартата и сукцината, и в которой препарат стабилен при 2-8ºC в течение по меньшей мере 2 лет или при 25ºC в течение по меньшей мере 3 месяцев или примерно при 40ºC в течение по меньшей мере 2 недель, или примерно при 50ºC в течение по меньшей мере 1 недели, и препарат задерживает снижение содержания пика определяемого компонента в композиции антитела.
В одном из вариантов осуществления изобретение раскрывает водный фармацевтический препарат, включающий терапевтическое антитело и двойную буферную систему, в которой отдельные буферы в двойной буферной системе выбраны из группы, состоящей из фосфата, глутамата, аспартата и сукцината, и в которой процент выведения терапевтического антитела в двойном буфере повышен по сравнению с одинарной буферной системой.
Еще в одном варианте осуществления изобретение раскрывает водный фармацевтический препарат адалимумаба, включающий фосфатно-глутаматную двойную буферную систему, в которой препарат стабилен при 25ºC в течение 3 месяцев и сохраняет свою биологическую активность.
В одном из вариантов осуществления изобретение раскрывает водный фармацевтический препарат адалимумаба, включающий двойную буферную систему, выбранную из фосфатно-глутаматного буфера или сукцинатно-глутаматного буфера, в котором препарат стабилен при 25ºC в течение 3 месяцев или при 37ºC в течение 4 недель, или при 40ºC в течение 4 недель, или при 50ºC в течение 2 недель, и в котором процентное содержание мономера составляет не менее 90%, более предпочтительно не менее 98%.
В другом варианте осуществления изобретение раскрывает водный фармацевтический препарат адалимумаба, включающий двойную буферную систему, выбранную из фосфатно-глутаматного буфера или сукцинатно-глутаматного буфера, в котором препарат стабилен при 25ºC в течение 3 месяцев или при 37ºC в течение 4 недель, или при 40ºC в течение 4 недель, или при 50ºC в течение 2 недель, и в котором снижение содержания мономера в композиции антитела составляет менее 7,5%, и более предпочтительно менее 2,5%.
Еще в одном варианте осуществления изобретение раскрывает водный фармацевтический препарат адалимумаба, включающий двойную буферную систему, выбранную из фосфатно-глутаматного буфера или сукцинатно-глутаматного буфера, в котором препарат стабилен при 25ºC в течение 3 месяцев, или при 37ºC в течение 4 недель, или при 40ºC в течение 4 недель, или при 50ºC в течение 2 недель, и в котором снижение процентного содержания мономера в композиции антитела составляет не более 10% и более предпочтительно не более 2,5%.
В другом варианте осуществления изобретение раскрывает водный фармацевтический препарат адалимумаба, включающий фосфатно-глутаматную двойную буферную систему, в которой препарат стабилен даже после воздействия многократных циклов замораживания-оттаивания. Препарат стабилен после трех циклов замораживания-оттаивания и/или стабилен после пяти циклов замораживания-оттаивания. Концентрация адалимумаба в нем составляет от около 50 мг/мл до около 100 мг/мл.
Один из вариантов осуществления изобретения раскрывает водный фармацевтический препарат адалимумаба, включающий двойную буферную систему, выбранную из фосфатно-глутаматного буфера или сукцинатно-глутаматного буфера, в котором препарат стабилен при 25ºC в течение 3 месяцев, или при 37ºC в течение 4 недель, или при 40ºC в течение 4 недель, или при 50ºC в течение 2 недель, и в котором процентная доля пика определяемого компонента композиции антитела составляет более 35% и предпочтительно более 65%.
В другом варианте осуществления изобретения раскрыт водный фармацевтический препарат адалимумаба, включающий двойную буферную систему, выбранную из фосфатно-глутаматного буфера или сукцинатно-глутаматного буфера, в котором препарат стабилен при 25ºC в течение 3 месяцев, или при 37ºC в течение 4 недель, или при 40ºC в течение 4 недель, или при 50ºC в течение 2 недель, и в котором снижение доли пика определяемого компонента в композиции антитела составляет в пределах от около 10 до 40%.
Один из вариантов осуществления изобретения раскрывает водный фармацевтический препарат адалимумаба, включающий двойную буферную систему, выбранную из фосфатно-глутаматного буфера или сукцинатно-глутаматного буфера, в котором препарат стабилен при 25ºC в течение 3 месяцев, или при 37ºC в течение 4 недель, или при 40ºC в течение 4 недель, или при 50ºC в течение 2 недель, и в котором снижение процентной доли пика определяемого компонента в композиции антитела составляет в пределах от около 15 до 55%.
Другой вариант осуществления изобретения раскрывает водный фармацевтический препарат тоцилизумаба, включающий сукцинатно-аспартатную двойную буферную систему, в которой препарат стабилен при 40ºC в течение 2 недель, и в котором содержание мономера в композиции антитела составляет не менее 95%.
Еще один вариант осуществления изобретения раскрывает водный фармацевтический препарат тоцилизумаба, включающий сукцинатно-аспартатную двойную буферную систему, в которой препарат стабилен при 40ºC в течение 2 недель, и в котором снижение содержание мономера в композиции антитела составляет не более 2,5%.
Еще один вариант осуществления изобретения раскрывает водный фармацевтический препарат тоцилизумаба, включающий сукцинатно-аспартатную двойную буферную систему, в которой препарат стабилен при 40ºC в течение 2 недель, и в котором снижение процентного содержания мономера в композиции антитела составляет не более 2,5%.
В другом варианте осуществления изобретения раскрыт водный фармацевтический препарат тоцилизумаба, включающий сукцинатно-аспартатную двойную буферную систему, в которой препарат стабилен при 40ºC в течение 2 недель, и в котором содержание пика определяемого компонента в композиции антитела составляет не менее 60%.
Другой вариант осуществления изобретения раскрывает водный фармацевтический препарат тоцилизумаба, включающий сукцинатно-аспартатную двойную буферную систему, в которой препарат стабилен при 40ºC в течение 2 недель, и в котором снижение доли пика определяемого компонента составляет не более 5%.
Еще один вариант осуществления изобретения раскрывает водный фармацевтический препарат тоцилизумаба, включающий сукцинатно-аспартатную двойную буферную систему, в которой препарат стабилен при 40ºC в течение 2 недель, и в котором снижение процентной доли пика определяемого компонента в композиции антитела составляет не более 10 %.
В другом варианте осуществления изобретения раскрыт водный фармацевтический препарат трастузумаба, включающий двойную буферную систему, выбранную из группы, состоящей из фосфатно-глутаматного или сукцинатно-глутаматного буфера, в которой препарат стабилен при 37ºC в течение 2 недель, или при 50ºC в течение 1 недели, и в котором содержание мономера в композиции антитела составляет не менее 95%.
Еще в одном варианте осуществления изобретения раскрыт водный фармацевтический препарат трастузумаба, включающий двойную буферную систему, выбранную из группы, состоящей из фосфатно-глутаматного и сукцинатно-глутаматного буфера, в которой препарат стабилен при 37ºC в течение 2 недель, или при 50ºC в течение 1 недели, и в котором снижение содержания мономера в композиции антитела составляет не более 5,0%.
Еще один вариант осуществления изобретения раскрывает водный фармацевтический препарат трастузумаба, включающий двойную буферную систему, выбранную из группы, состоящей из фосфатно-глутаматного и сукцинатно-глутаматного буфера, в которой препарат стабилен при 37ºC в течение 2 недель, или при 50ºC в течение 1 недели и задерживает снижение содержания мономера в композиции антитела, в котором снижение процентного содержания мономера составляет не более 5,0%.
В одном из вариантов осуществления изобретения раскрыт водный фармацевтический препарат трастузумаба, включающий двойную буферную систему, выбранную из группы, состоящей из фосфатно-глутаматного и сукцинатно-глутаматного буфера, в котором процент выведения в конечном препарате на основе двойного буфера составляет более 50%.
Определения
Термин «антитело» в контексте настоящего документа охватывает целые антитела и любой антигенсвязывающий фрагмент (то есть «антигенсвязывающую часть») или их одиночные цепи или слитый белок. «Антитело» относится к гликопротеину, содержащему по меньшей мере две тяжелых (H) цепи и две легких (L) цепи, соединенных друг с другом дисульфидными связями, или его антигенсвязывающую часть.
Термин «стабильный» препарат относится к препарату, в котором антитело, присутствующее в нем, сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность при хранении.
Изучение стабильности приводит доказательства качества антитела при воздействии различных факторов окружающей среды с течением времени. В «Q1A: Испытание новых лекарственных веществ и лекарственных препаратов на стабильность» Международного Совета по гармонизации (ICH) указано, что данные исследований методом ускоренного старения можно использовать для оценки влияния кратковременных отклонений от нормативных условий хранения в сторону увеличения или уменьшения, которые могут возникать при перевозке антител.
Термин «цикл замораживания-оттаивания» в контексте настоящего документа описывает процесс замораживания лекарственного вещества или лекарственного препарата при низких температурах, таких как -50ºC или даже более низких температурах, таких как -80ºC и последующего оттаивания при комнатной температуре.
Для измерения физического и химического разложения антитела в фармацевтических препаратах имеются различные аналитические методы. Антитело «сохраняет свою физическую стабильность» в фармацевтическом препарате, если оно по существу не имеет признаков агрегации, преципитации и/или денатурации при визуальной оценке цвета и/или прозрачности, или при измерении рассеивания ультрафиолетового света, или при исследовании эксклюзионной хроматографией. Считается, что антитело «сохраняет свою химическую стабильность» в фармацевтическом препарате, если оно не образует вариантов или образует минимальное количество вариантов продукта, которые могут включать варианты, образовавшиеся в результате химической модификации исследуемого антитела, такой как дезаминирование, окисление и т.д. Для исследования химических вариантов продукта могут быть использованы аналитические методы, такие как ионообменная хроматография и гидрофобная ионная хроматография.
Термин «мономер» в контексте настоящего документа описывает антитела, состоящие из двух легкий цепей и двух тяжелых цепей. Анализ содержания мономера в композиции антитела обычно проводят эксклюзионной хроматографией (ЭХ). По принципу разделения ЭХ крупные молекулы или молекулы, имеющие большой молекулярный вес (HMW), вымываются первыми, затем вымываются молекулы меньшего размера или меньшего молекулярного веса. В типичном профиле ЭХ для композиции антитела агрегаты, которые могут включать димеры, мультимеры и т.д., вымываются первыми, затем вымываются мономеры, и последними могут вымываться обрезанные варианты антитела или продукты разложения. В некоторых условиях пик агрегатов или пики продуктов разложения могут не вымываться как пики, разделенные до базовой линии, а иметь вид плеча или необычно широких пиков. Для поддержания соответствующей активности антитела, более конкретно терапевтического антитела, желательно уменьшить образование агрегатов или продуктов разложения и таким образом регулировать содержание мономера на желаемом уровне. Способность подавлять образование агрегатов и продуктов разложения, измеренная по их содержанию в различные моменты времени во время исследований стабильности, может указывать на пригодность этого кандидата препарата для исследуемого антитела. Для проведения ЭХ можно использовать колонку TSK-GEL G3000SWXL (7,8 мм x 30 см) TOSCH для ВЭЖХ в водной среде.
Термин «пик определяемого компонента» в контексте настоящего документа относится к пику, который вымывается в большом количестве (основной пик) при катионообменной хроматографии. Пик, который вымывается раньше, чем пик определяемого компонента при катионообменной хроматографии, с более кислым зарядом относительно пика определяемого компонента называют пиком кислого варианта. Пик, который вымывается позже, чем пик определяемого компонента при катионообменной хроматографии, с более основным зарядом относительно пика определяемого компонента называют пиком основного варианта. Содержание пика определяемого компонента можно определить с помощью ионообменной хроматографии (ИОХ). Существуют два типа ИОХ: катионообменная и анионообменная хроматография. Положительно заряженные молекулы связываются с анионообменными смолами, а отрицательно заряженные молекулы связываются с катионообменными смолами. В типичном катионообменном хроматографическом профиле композиции антитела кислые варианты вымываются первыми, за ними вымывается пик определяемого компонента и потом в конце вымываются основные варианты. Кислые варианты являются результатом модификаций антитела, таких как дезаминирование аспарагиновых остатков. Основные варианты являются результатом неполного удаления остатка(ов) лизина с C-конца. Обычно в антителе остаток лизина присутствует на C-конце тяжелой и легкой цепи. Молекула антитела, содержащая лизин как на конце тяжелой, так и легкой цепи, обозначена как вариант K2, молекула антитела, содержащая остаток лизина на одном конце либо тяжелой, либо легкой цепи, обозначена как вариант K1, и молекула антитела, не содержащая ни одного остатка лизина, обозначена как молекула K0. Фермент карбоксипептидаза B (фермент CP-B) действует на остатки лизина, присутствующие на C-конце в вариантах K2 и K1, и таким образом превращает их в молекулы K0. В зависимости от обстоятельств исследования анализ ИОХ можно проводить на образцах, расщепленных ферментом карбоксипептидазой B (CP-B). В обычных исследованиях стабильности ожидается, что стабильный препарат приведет к уменьшению образования «заряженных» вариантов (кислый и основной варианты) во время исследования и таким образом сведет к минимуму любое уменьшение содержания пика определяемого компонента.
Антитело «сохраняет свою биологическую активность» в фармацевтическом препарате, если антитело биологически функционально для выполнения своего назначения. Например, биологическую активность антитела можно определить исследованиями на клетках in vitro, такими как реакция связывания/нейтрализации антигена, для анти-TNF антитела биологическую активность определяют тестированием нейтрализации TNF-α цитотоксичности.
Термин “процент выведения” относится к пропорции концентрации антитела, полученной в конечном буфере препарата, к концентрации антитела в технологическом буфере, предшествующем этапу приготовления препарата, например, в последнем элюирующем буфере ниже по технологической линии.
Высококонцентрированный препарат антитела относится к препарату, который позволяет вводить субъекту более высокую дозу в объеме, равном или меньшем, чем объем препарата для стандартного лечения.
Фармацевтически приемлемые вспомогательные вещества относятся к добавкам или носителям, которые могут способствовать стабильности антитела в препарате. Вспомогательные вещества могут охватывать стабилизаторы и регуляторы тоничности. Примеры стабилизаторов и регуляторов тоничности включают без ограничения перечисленными сахара, аминокислоты, многоатомные спирты, соли или поверхностно-активные вещества, их производные и их комбинацию.
Сахара и многоатомные спирты могут относиться к моносахаридам, дисахаридам и полисахаридам. Примеры сахаров sugars включают без ограничения перечисленными сахарозу, глюкозу, декстрозу и другие. Дополнительно многоатомный спирт относится к спирту, содержащему несколько гидроксильных групп. Примеры многоатомных спиртов включают без ограничения перечисленными маннитол, сорбитол и другие.
Поверхностно-активное вещество относится к фармацевтически приемлемым вспомогательным веществам, используемым для защиты препаратов протеина от различных неблагоприятных условий, таких как встряхивание, воздействие сдвигового усилия, воздействие высокой температуры и т.д. Подходящие поверхностно-активные вещества включают без ограничения перечисленными сложные эфиры жирных кислот и полиоксиэтилен сорбитана, такие как Tween 20™ или Tween 80™, сополимер полиоксиэтилена и полиоксипропилена (например, полоксамер, плюроник), додецил сульфат натрия (SDS) и т.п. или их комбинацию.
Соли используют в качестве регуляторов тоничности, примеры солей включают без ограничения перечисленными хлорид натрия, хлорид калия, хлорид магния, гидрохлорид аргинина, тиоцианат натрия, тиоцианат аммония, сульфат аммония, хлорид аммония, хлорид кальция, хлорид цинка и/или ацетат натрия.
Одна или несколько аминокислот также могут быть частью препарата антитела и могут быть выбраны из основных аминокислот или гидрофобных аминокислот или их комбинации. Основная аминокислота может быть выбрана из группы, состоящей из аргинина, лизина, гистидина и их солей или их производных, а гидрофобная аминокислота может быть выбрана из группы, состоящей из глицина, аланина, валина, лейцина, фенилаланина, метионина, триптофана и их солей или их производных.
Некоторые особые аспекты и варианты осуществления изобретения более полно описаны в приведенных ниже примерах. При этом эти примеры не следует считать ограничивающими объем изобретения каким-либо образом.
Примеры
Для получения стабильного водного препарата антитела частью экспериментального плана была оценка различных двойных буферов, раскрытых в настоящем изобретении. Оценивали различные двойные буферы для ряда терапевтических антител. Стабильный препарат может дополнительно включать фармацевтически приемлемые вспомогательные вещества. Стабильность препаратов антител в двойной буферной системе оценивали в реальном времени, а также в условиях ускоренного старения. Стабильность антител в препарате на основе двойного буфера исследовали аналитическими методами для выявления химического и физического разложения. Этот препарат антител в двойной буферной системе особенно подходит для антител в высокой концентрации.
Пример 1. Одинарный буфер в сравнении с двойной буферной системой
Был приготовлен препарат адалимумаба (A-mab) 50 мг/мл в одинарных буферных системах и в двойных буферных системах. Одинарная и двойная буферные системы подробно представлены в таблице 1.
Таблица 1
Все упомянутые выше препараты дополнительно содержат полисорбат 80 в конечной концентрации 0,1%.
Стабильность упомянутых выше препаратов адалимумаба оценивали при 37ºC в течение 4 недель, а затем проводили анализ содержания мономера эксклюзионной хроматографией, и также содержание пика определяемого компонента с помощью ионообменной хроматографии, результаты анализов представлены в таблицах 2 и 3. T0 в таблице представляет содержание мономера / пика определяемого компонента в начальный момент времени. Также наблюдали за сдвигом осмоляльности препаратов, представленном на фиг. 1.
Таблица 2
н.о. – не обнаружено
Таблица 3
Как можно видеть из таблицы 2 и таблицы 3, снижение содержания мономера, а также содержания пика определяемого компонента минимально в варианте A-mab, приготовленном на базе фосфатно-глутаматного буфера в сравнении с A-mab в одинарных буферных системах, т.е. в фосфатном буфере или в буфере глутаминовой кислоты, а также с A-mab в другой двойной буферной системе, т.е. цитратно-фосфатной буферной системе. На фиг. 1 представлен сдвиг осмоляльности в момент T0 и T4 недели при 37ºC для A-mab в препаратах, раскрытых в таблице 1.
Пример 2. Препарат адалимумаба в различных двойных буферах и вспомогательные вещества
Был приготовлен препарат адалимумаба 50 мг/мл в двух различных двойных буферных комбинациях, содержащих разные концентрации и комбинацию вспомогательных веществ, подробно представленную в таблице 4. Кроме того, препарат адалимумаб той же концентрации был приготовлен в цитратно-фосфатном буфере, который использовался как контроль.
Таблица 4
20 мМ цитратно-фосфатный буфер
1,2% маннитола
105,45 мМ NaCl
0,1% полисорбата-80,
pH 5,2
23 мМ фосфатно-глутаматный буфер
50 мг/мл сорбитол
15 мМ NaCl
0,1% полисорбата-80
pH 5,2
23 мМ фосфатно-глутаматный буфер
80 мг/мл сахароза
15 мМ NaCl
0,1% полисорбата-80
pH 5,2
23 мМ сукцинантно-глутаматный буфер
80 мг/мл сахароза
15 мМ NaCl
0,1% полисорбата-80
pH 5,2
23 мМ сукцинантно-глутаматный буфер
80 мг/мл трегалоза
15 мМ NaCl
0,1% полисорбата-80
pH 5,2
Стабильность упомянутых выше препаратов адалимумаба оценивали при 50oC в течение 2 недель, стабильность F2 и F4 также оценивали при 25oC в течение 3 месяцев. Кроме того, стабильность F2 также оценивали при 37oC в течение 4 недель.
Затем проводили анализ содержания мономера в препарате эксклюзионной хроматографией, и также содержания пика определяемого компонента с помощью ионообменной хроматографии, результаты анализов представлены в таблицах 5-11. T0 в таблице представляет содержание мономера/пика определяемого компонента в начальный момент времени. На фиг. 2 показан % содержания высокомолекулярных соединений (HMWS)/ агрегатов для препаратов F1-F5, которые хранились при 50oC в момент T0, T1 (неделя 1) и T2 (неделя 2). На фиг. 3 показан % потери мономера для препаратов F1-F5, которые хранились при 50oC через 1 неделю и через 2 недели. На фиг. 4 показан % основных вариантов для препаратов F1-F5, которые хранились при 50oC в течение 0W и 2W (2 недель). На фиг. 5 показано рассеивание света для препаратов F1-F5, которые хранились при 50oC в течение T0 и T1W (1 неделя).
Таблица 5
Таблица 6
Таблица 7
Таблица 8
Таблица 9
Таблица 10
Таблица 11
Кроме того, образцы F1-F5 подвергали воздействию множества циклов замораживания-оттаивания, замораживая указанные образцы до -80ºC с помощью морозильного аппарата для низкотемпературного замораживания и оттаивая при комнатной температуре. Эти циклы замораживания-оттаивания повторяли пять раз, затем образцы анализировали с помощью ЭХ и ИОХ для проверки влияния циклов замораживания-оттаивания на содержание мономера и пика определяемого компонента адалимумаба 50 мг/мл, соответственно, результаты этих анализов представлены в таблице 12 и таблице 13.
Таблица 12
X-указывает число циклов замораживания-оттаивания
Таблица 13
X- указывает число циклов замораживания-оттаивания
Препарат адалимумаба 50 мг/мл был приготовлен в буферах F6 и F7, их состав раскрыт в таблице 14.
Таблица 14
23 мМ фосфатно-глутаматный буфер
30 мг/мл маннитол
30 мМ аргинин
10мМ глицин
15мМ хлорид натрия
pH 5,2
23 мМ фосфатно-глутаматный буфер
30 мг/мл маннитол
50мМ хлорид натрия
pH 5,2
Стабильность упомянутых выше препаратов адалимумаба в F6 и F7 оценивали при 40oC в течение 4 недель. Также оценивали биологическую активность образцов F1, F6 и F7, которые хранили при 25oC в течение 3 месяцев, с помощью стандартной процедуры тестирования нейтрализации TNF-α цитотоксичности, в которой использовали клетки L929, экспрессирующие рецепторы TNF, и рассчитывали среднюю биологическую активность образцов, результаты исследования представлены в таблице 15.
Таблица 15
Затем проводили анализ содержания мономера в препарате эксклюзионной хроматографией, и также анализ содержания пика определяемого компонента с помощью ионообменной хроматографии, результаты анализов представлены в таблицах 16 и 17, соответственно. Данные в таблице 14 приведены для образцов, которые были обработаны карбоксипептидазой -B.
Таблица 16
Таблица 17
На основании этих результатов очевидно, что адалимумаб 50 мг/мл, приготовленный в двойных буферных системах, таких как фосфатно-глутаматный буфер и сукцинантно-глутаматный буфер обладает стабильностью, даже в условиях ускоренного старения.
Пример 3. Препараты с высокой концентрацией антитела
Был приготовлен препарат адалимумаба 100 мг/мл в 20 мМ фосфатно-глутаматной буферной системе, который также содержал другие фармацевтически приемлемые вспомогательные вещества, представленные в таблице 18. При этом фармацевтически приемлемые вспомогательные вещества добавляли в следующей концентрации/диапазонах концентрации: аргинин в диапазоне концентрации от около 40 до 120 мМ; глицин в концентрации около 50 мМ, многоатомные спирты в концентрации 5 - 10 мг/мл и NaСl в концентрации 5-10 мМ. В качестве контроля в этом эксперименте использовали одобренный препарат адалимумаба 100 мг/мл.
Таблица 18
Стабильность упомянутых выше препаратов адалимумаба оценивали при 40oC в течение 4 недель. Затем проводили анализ содержания мономера в препаратах эксклюзионной хроматографией, и также анализ содержания пика определяемого компонента с помощью ионообменной хроматографии, результаты анализов представлены в таблицах 17 и 18. T0 в таблице представляет содержание мономера/пика определяемого компонента в начальный момент времени. Данные в таблице 17 представлены для образцов, которые не были обработаны карбоксипептидазой-B. Далее образцы F8, F9 и F11 подвергали воздействию множества циклов замораживания-оттаивания, замораживая указанные образцы до -80ºC с помощью морозильного аппарата для низкотемпературного замораживания и оттаивая при комнатной температуре. Эти циклы замораживания-оттаивания повторяли пять раз, затем образцы визуально проверяли на наличие взвешенных частиц, результаты проверки представлены в таблице 19. Кроме того, образцы анализировали с помощью ЭХ для проверки влияния циклов замораживания-оттаивания на содержание мономера адалимумаба 100 мг/мл, результаты анализа представлены в таблице 20.
Таблица 19
X- указывает число циклов замораживания-оттаивания
Таблица 20
X- указывает число циклов замораживания-оттаивания
Таблица 21
Таблица 22
На основании этих результатов совершенно очевидно, что препарат адалимумаба 100 мг/мл, приготовленный в двойной буферной системе, такой как фосфатно-глутаматный буфер, демонстрирует более высокую стабильность в условиях ускоренного старения в сравнении с одобренным препаратом адалимумаба 100 мг/мл.
Пример 4. Другие антитела, приготовленные в двойной буферной системе
Был приготовлен препарат 180 мг/мл тоцилизумаба (Toc-mab) в двойной буферной системе содержащей сукцинатно-аспартатную буферную систему, представленную ниже в таблице 23. Одобренный препарат тоцилизумаба 180 мг/мл был приготовлен в гистидиновом буфере и использован в этом эксперименте в качестве контроля.
Таблица 23
Описанные выше препараты тоцилизумаба хранили при 40oC в течение 2 недель. Затем проводили анализ препаратов на содержание мономера эксклюзионной хроматографией, и также анализ на содержание пика определяемого компонента с помощью ионообменной хроматографии, результаты анализов представлены в таблицах 24 и 25. T0 в таблице представляет содержание мономера/пика определяемого компонента в начальный момент времени.
Таблица 24
Таблица 25
На основании этих результатов очевидно, что тоцилизумаб 180 мг/мл, приготовленный в двойной буферной системе, такой как сукцинатно-аспартатный буфер, обладает такой же стабильностью, что и одобренный препарат тоцилизумаба, приготовленном в гистидиновом буфере, в условиях ускоренного старения.
Далее, часть оценки пригодности двойной буферной системы для различных терапевтических антител состояла в приготовлении препарата трастузумаба (T-mab) 21 мг/мл в буферной системе, содержащей двойные буферные системы, такие как фосфат-глутаматный буфер и сукцинантно-глутаматный буфер, который дополнительно содержал фармацевтически приемлемые вспомогательные вещества в соответствии с данными, представленными в таблице 26 ниже. При этом фармацевтически приемлемые вспомогательные вещества добавляли в трастузумаб в следующих диапазонах концентрации: трегалозу в концентрации около 150 мМ, более конкретно 200 мМ; метионин в концентрации 5 мМ; аргинин в концентрации около 25 мМ; сахарозу и сорбитол в диапазоне концентрации от 1,2 до 2% и 0,04 мг/мл полисорбата 20.
Перед приготовлением трастузумаба в двойных буферных системах был проведен этап замены буфера для переноса лекарственной субстанции трастузумаб, полученной в процессе ниже по технологической линии и присутствующей в ином фоновом буфере, в указанный двойной буфер, был рассчитан его процент выведения и представлен в таблице 27.
Таблица 26
Таблица 27
Описанные выше препараты трастузумаба были исследованы методом ускоренного старения выдерживанием указанных образцов при 37oC в течение 2 недель и при 50oC в течение 1 недели. Затем препараты были проанализированы на содержание мономера эксклюзионной хроматографией, результаты анализа представлены в таблице 28. T0 в таблице представляет содержание мономера/пика определяемого компонента в начальный момент времени.
Таблица 28
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТОЙЧИВАЯ ЖИДКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2018 |
|
RU2773747C2 |
| СОСТАВЫ АНТИТЕЛА | 2010 |
|
RU2548772C2 |
| ЖИДКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2015 |
|
RU2719431C2 |
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ С ВЫСОКИМИ КОНЦЕНТРАЦИЯМИ БЕЛКОВ АНТИТЕЛ ЧЕЛОВЕКА ПРОТИВ TNF-АЛЬФА | 2010 |
|
RU2560701C2 |
| Водная фармацевтическая композиция рекомбинантного моноклонального антитела к ФНОα | 2016 |
|
RU2665966C2 |
| УЛУЧШЕННЫЕ ВЫСОКОКОНЦЕТРИРОВАННЫЕ ЖИДКИЕ ПРЕПАРАТЫ АНТИТЕЛ ПРОТИВ TNF-альфа | 2011 |
|
RU2639386C2 |
| Водная фармацевтическая композиция рекомбинантного моноклонального антитела к ФНОа | 2017 |
|
RU2764521C2 |
| СОСТАВ АНТИТЕЛА | 2015 |
|
RU2743681C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, ВКЛЮЧАЮЩИЙ АНТИТЕЛО ПРОТИВ РЕЦЕПТОРА EGF | 2004 |
|
RU2381036C2 |
| СТАБИЛЬНЫЕ ПРЕПАРАТЫ СВЯЗЫВАЮЩЕГО СРЕДСТВА НА ОСНОВЕ IgG4 | 2013 |
|
RU2644214C2 |



Группа изобретений относится к области медицины, а именно к стабильному водному фармацевтическому препарату адалимумаба, включающему комбинацию двух буферов, фосфатного и глутаматного буферов, имеющему значение рН 5,2, при этом препарат ингибирует снижение содержания мономера и содержания пика определяемого компонента адалимумаба, и также относится к стабильному водному препарату адалимумаба, включающему комбинацию двух буферов, фосфатного и глутаматного буферов, аминокислоту и полисорбат, где препарат ингибирует снижение содержания мономера и содержания пика определяемого компонента в композиции адалимумаба, где концентрация адалимумаба составляет 100 мг/мл и pH препарата составляет 5,2, и относится к стабильному водному фармацевтическому препарату адалимумаба, содержащему комбинацию двух буферов, фосфатного и глутаматного буферов, имеющему значение pH 5.2, причем препарат ингибирует снижение содержания мономера в композиции адалимумаба и проявляет стабильность после нескольких циклов замораживания-оттаивания. Группа изобретений обеспечивает получение препарата адалимумаба, который характеризуется физической стабильностью и/или химической стабильностью, а именно демонстрирует стабильность даже в условиях ускоренного старения, таких как 25 °С в течение 3 месяцев, или 37 °С в течение 4 недель, или 40° С в течение 4 недель, или при 50 °С в течение 2 недель, и кроме того препарат адалимумаба в высокой концентрации выдерживает стрессовые условия, вызванные многократным замораживанием и оттаиванием, о чем свидетельствует содержание мономеров (по меньшей мере 98%) адалимумаба. 28 табл., 4 пр., 5 ил.
1. Стабильный водный фармацевтический препарат адалимумаба, включающий комбинацию двух буферов, фосфатного и глутаматного буферов, имеющий значение рН 5,2, при этом препарат ингибирует снижение содержания мономера и содержания пика определяемого компонента адалимумаба.
2. Препарат по п. 1, который дополнительно включает сахар или многоатомный спир, полисорбат 80 и аминокислоту.
3. Препарат по п. 1, в котором концентрация адалимумаба составляет по меньшей мере 50 мг/мл.
4. Препарат по п. 1, где препарат адалимумаба является стабильным при таких следующих условиях ускоренного старения, как 25°C в течение 3 месяцев, или 37°C в течение 4 недель, или 40°C в течение 4 недель, или 50°C в течение 2 недели.
5. Стабильный водный фармацевтический препарат адалимумаба, включающий комбинацию двух буферов, фосфатного и глутаматного буферов, аминокислоту и полисорбат, где препарат ингибирует снижение содержания мономера и содержания пика определяемого компонента композиции адалимумаба, где концентрация адалимумаба составляет 100 мг/мл и рН препарата составляет 5.2.
6. Препарат по п. 1 или 5, отличающийся тем, что процентное содержание мономера адалимумаба в препарате составляет не менее 90%.
7. Препарат по п. 1 или 5, отличающийся тем, что снижение содержания мономера в композиции адалимумаба составляет менее 7,5%.
8. Стабильный водный фармацевтический препарат адалимумаба, содержащий комбинацию двух буферов, фосфатного и глутаматного буферов, имеющий значение рН 5,2, причем препарат ингибирует снижение содержания мономера в композиции адалимумаба и проявляет стабильность после нескольких циклов замораживания-оттаивания.
9. Препарат по п. 8, отличающийся тем, что стабилен после 5 циклов замораживания-оттаивания.
10. Препарат по п. 8, отличающийся тем, что ингибирует снижение содержания мономера и поддерживает содержание мономера до уровня более 98%.
| WO 2014039903 A2, 13.03.2014 | |||
| US 20080071063 A1, 20.03.2008. |
Авторы
Даты
2020-11-20—Публикация
2017-01-11—Подача