ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка притязает на приоритет на основании предварительной заявки на выдачу патента США с регистрационным номером 61/615539, поданной 26 марта 2012 года, которая включена в настоящее описание в виде ссылки в полном объеме.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Антиген LIGHT человека является одной из возможных мишеней цитокинов, которые вовлечены в процессы хронического воспалительного аутоиммунного заболевания. В качестве представителя надсемейства лигандов TNF (TNFSF) LIGHT также известен как TNFSF14 или CD258. LIGHT экспрессируется на поверхности T-клеток при активации строго регулируемым образом. Однако LIGHT также конститутивно присутствует на регистрируемых уровнях на поверхности незрелых дендритных клеток и на T-клетках природных киллеров (NK) кишечника. LIGHT опосредует свои биологические эффекты через связывание трех рецепторов надсемейства TNF, включая рецептор лимфотоксина β (LTβR), медиатор проникновения вируса герпеса (HVEM) и рецептор-ловушку 3 (DcR3). LIGHT-экспрессирующие лимфоциты могут индуцировать IBD-подобные симптомы у человека, и повышение экспрессии LIGHT наблюдали у пациентов с активной формой болезни Крона и другими воспалительными расстройствами, такими как болезнь «трансплантат против хозяина».
CXCR5, также известный как рецептор лимфомы Беркитта (BLR1), CD185, MDR15 и MGC117347, представляет собой сопряженный с G-белком рецептор, который является представителем семейства рецепторов хемокинов CXC. Не подвергнутый процессингу предшественник CXCR5 имеет длину 372 аминокислоты с молекулярной массой 42 кДа. CXCR5 играет роль в миграции и локализации B-клеток в конкретных анатомических компартментах. Нокаутированные мыши не имеют периферических лимфатических узлов, имеют меньше пейеровых бляшек и имеют пониженные уровни B-клеток. CXCL13, также известный как BLC, является лигандом CXCR5. CXCL13 является хемоаттрактантом B-клеток.
Связывающие анти-LIGHT-средства и связывающие анти-CXCR5-средства являются терапевтически значимыми, и существует необходимость в приготовлении таких связывающих средств в виде лекарственных продуктов, которые можно вводить субъектам, особенно человеку, для лечения воспалительных заболеваний.
Чтобы разработать фармацевтический препарат, содержащий связывающее анти-LIGHT-средство или связывающее анти-CXCR5-средство, подходящее для внутривенного или подкожного введения, связывающее средство должно быть сконцентрировано примерно до 20 мг/мл или больше, обычно примерно до 100-150 мг/мл и даже до 250 мг/мл. При таких высоких концентрациях может возникать множество осложнений, включая увеличение вязкости, сдвиг pH, изменение окраски раствора и образование видимых частиц и частиц довидимого диапазона.
Приготовление препаратов таких связывающих средств дополнительно осложняется тем фактом, что такие средства в высокой степени склонны к агрегации при таких высоких концентрациях.
Приготовление препаратов IgG4-антител еще более осложняется тем фактом, что IgG4-антитела имеют тенденцию образовывать полумолекулы при высоких концентрациях в растворе. Однако IgG4-антитела представляют терапевтический интерес, поскольку они обладают пониженной эффекторной функцией.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Для удовлетворения указанных и других потребностей в настоящем изобретении предлагаются высокостабильные препараты связывающего IgG4-средства. Неожиданно были открыты высокостабильные препараты связывающего IgG4-средства в форме жидкостей и лиофилизированных порошков, которые содержат связывающее IgG4-средство и цитратный буфер, при этом pH препарата находится на уровне или ниже как значения pH около 6, так и значения изоэлектрической точки (pI) связывающего средства. Такие препараты улучшены по сравнению с обычными препаратами, которые часто приводят к димеризации связывающего средства, такого как антитело, при увеличении концентрации связывающего средства, такого как антитело, в препарате. В частности, препараты согласно изобретению способствуют снижению количества нежелательных побочных продуктов, включая агрегаты, полумолекулы, продукты распада, низкомолекулярные белки (LMWP), высокомолекулярные белки (HMWP) и перераспределение кислых, основных и нейтральных изоформ связывающего средства, такого как антитело, в препарате.
В некоторых аспектах изобретение относится к стабильному препарату, содержащему: связывающее средство, содержащее, по меньшей мере, часть Fc-области IgG4-антитела; и от примерно 5 до примерно 50 мМ цитрата в качестве буферного средства; при этом pH препарата находится на уровне или ниже как значения pH около 6, так и pI связывающего средства. В некоторых вариантах осуществления изобретения связывающим средством является антитело.
В некоторых вариантах осуществления изобретения связывающее средство или антитело связывается с лимфотоксин-подобным, проявляющим индуцируемую экспрессию и конкурирующим с гликопротеидом D вируса герпеса, за медиатор проникновения вируса герпеса, рецептор, экспрессируемый на лимфоцитах (LIGHT). В конкретных вариантах осуществления изобретения связывающее анти-LIGHT-средство или антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи содержит определяющие комплементарность области (CDR), содержащие аминокислотные последовательности SEQ ID NO:1, 2 и 3, и вариабельная область легкой цепи содержит CDR, содержащие аминокислотные последовательности SEQ ID NO:4, 5 и 6. В других конкретных вариантах осуществления изобретения антитело представляет собой полностью человеческое IgG4 анти-LIGHT-антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8.
В некоторых вариантах осуществления изобретения связывающее средство или антитело связывается с рецептором хемокина C-X-C типа 5 (CXCR5). В конкретных вариантах осуществления изобретения связывающее анти-CXCR5-средство или антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи содержит определяющие комплементарность области (CDR), содержащие аминокислотные последовательности SEQ ID NO:15, 16 и 17, и вариабельная область легкой цепи содержит CDR, содержащие аминокислотные последовательности SEQ ID NO:18, 19 и 20. В других конкретных вариантах осуществления изобретения антитело представляет собой гуманизированное IgG4 анти-CXCR5-антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26.
В некоторых вариантах осуществления изобретения концентрация антитела составляет от примерно 5 до примерно 280 мг/мл. В некоторых конкретных вариантах осуществления изобретения концентрация антитела составляет примерно 150 мг/мл. В других конкретных вариантах осуществления изобретения концентрация антитела составляет примерно 50 мг/мл. В следующих конкретных вариантах осуществления изобретения концентрация антитела составляет примерно 20 мг/мл. В следующих конкретных вариантах осуществления изобретения концентрация антитела составляет примерно 100 мг/мл.
В некоторых вариантах осуществления изобретения концентрация цитрата составляет от примерно 5 до примерно 15 мМ. В некоторых вариантах осуществления изобретения концентрация цитрата составляет примерно 10 мМ. В некоторых вариантах осуществления изобретения цитратный буфер представляет собой дигидрат цитрата натрия.
В некоторых вариантах осуществления изобретения pH препарата составляет от примерно pH 5 до примерно pH 6. В конкретных вариантах осуществления изобретения значение pH препарата выбрано из группы, состоящей из значений pH примерно pH 5,0, примерно pH 5,5 и примерно pH 6,0.
В некоторых конкретных вариантах осуществления изобретения pI связывающего средства или антитела составляет от примерно 6,8 до примерно 7,2. В альтернативных конкретных вариантах осуществления изобретения pI связывающего средства или антитела составляет от примерно 7,6 до примерно 8,4.
В некоторых конкретных вариантах осуществления изобретения препарат дополнительно содержит поверхностно-активное вещество. В некоторых конкретных вариантах осуществления изобретения концентрация поверхностно-активного вещества составляет от примерно 0,001% до примерно 0,1% масс./об. В некоторых вариантах осуществления изобретения поверхностно-активным веществом является полисорбат. В некоторых конкретных вариантах осуществления изобретения полисорбат представляет собой полисорбат 20. В некоторых конкретных вариантах осуществления изобретения концентрация полисорбата 20 составляет примерно 0,005% масс./об. В альтернативных конкретных вариантах осуществления изобретения концентрация полисорбата 20 составляет примерно 0,01% масс./об. В следующих альтернативных конкретных вариантах осуществления изобретения концентрация полисорбата 20 составляет примерно 0,02% масс./об.
В некоторых вариантах осуществления изобретения препарат дополнительно содержит средство для тоничности. В некоторых конкретных вариантах осуществления изобретения концентрация средства для тоничности составляет от примерно 0,1% до примерно 10% масс./об. В некоторых конкретных вариантах осуществления изобретения средством для тоничности является сахарид. В некоторых конкретных вариантах осуществления изобретения сахарид представляет собой маннит. В других конкретных вариантах осуществления изобретения концентрация маннита составляет от примерно 1% до примерно 10% масс./об. В следующих конкретных вариантах осуществления изобретения концентрация маннита составляет примерно 4%. В альтернативных конкретных вариантах осуществления изобретения сахарид представляет собой сахарозу. В некоторых конкретных вариантах осуществления изобретения концентрация сахарозы составляет от примерно 1% до примерно 10% масс./об. В некоторых конкретных вариантах осуществления изобретения концентрация сахарозы составляет примерно 5% масс./об. В альтернативных конкретных вариантах осуществления изобретения концентрация сахарозы составляет примерно 6% масс./об. В следующих конкретных вариантах осуществления изобретения концентрация сахарозы составляет примерно 4,5% масс./об. В следующих конкретных альтернативных вариантах осуществления изобретения средством для тоничности является хлорид натрия. В некоторых конкретных вариантах осуществления изобретения концентрация хлорида натрия составляет от примерно 0,01% до примерно 1%. В некоторых конкретных вариантах осуществления изобретения концентрация хлорида натрия составляет примерно 0,2%. В других конкретных вариантах осуществления изобретения средство для тоничности представляет собой сочетание сахарозы и хлорида натрия. В конкретных вариантах осуществления изобретения концентрация сахарозы составляет от примерно 1% до примерно 10% масс./об. в следующих конкретных вариантах осуществления изобретения концентрация хлорида натрия составляет от примерно 0,01% до примерно 1%. В альтернативных конкретных вариантах осуществления изобретения концентрация сахарозы составляет примерно 6% масс./об. и концентрация хлорида натрия составляет примерно 0,2%. В следующих альтернативных конкретных вариантах осуществления изобретения концентрация сахарозы составляет примерно 4,5% масс./об., и концентрация хлорида натрия составляет примерно 0,2%.
В некоторых вариантах осуществления изобретения препарат дополнительно содержит аминокислоту. В некоторых конкретных вариантах осуществления изобретения концентрация аминокислоты составляет от примерно 0,1% до примерно 5% масс./об. В некоторых конкретных вариантах осуществления изобретения аминокислота представляет собой пролин или аргинин. В конкретных вариантах осуществления изобретения концентрация пролина или аргинина составляет от примерно 1% до примерно 2% масс./об. В других конкретных вариантах осуществления изобретения концентрация пролина составляет примерно 1,5% масс./об. В альтернативных конкретных вариантах осуществления изобретения концентрация аргинина составляет примерно 1% масс./об.
В некоторых вариантах осуществления изобретения препарат представляет собой жидкий препарат. В других конкретных вариантах осуществления изобретения препарат представляет собой лиофилизированный препарат.
В некоторых вариантах осуществления изобретения препарат является стабильным в течение, по меньшей мере, 6 месяцев при +5°C. В альтернативных вариантах осуществления изобретения препарат является стабильным в течение, по меньшей мере, 9 месяцев при +5°C.
В некоторых вариантах осуществления изобретения в препарате наблюдают уменьшенное количество, по меньшей мере, одного побочного продукта, выбранного из группы, состоящей из агрегатов, полумолекул, продуктов распада, низкомолекулярных белков, высокомолекулярных белков и перераспределение кислых/основных/нейтральных изоформ антитела по сравнению либо с эталонным анти-LIGHT-препаратом, содержащим анти-LIGHT-антитело в фосфатно-солевом буфере при pH 7,3, либо с эталонным анти-CXCR5-препаратом, содержащим анти-LIGHT-антитело в фосфатно-солевом буфере при pH 7,3.
В некоторых конкретных вариантах осуществления изобретения изобретение относится к стабильному жидкому препарату антитела, подходящему для подкожного введения, при этом препарат содержит:
a) примерно 150 мг/мл полностью человеческого IgG4-антитела против LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,005% полисорбат 20; и
d) примерно 4% маннит;
при этом pH препарата составляет примерно pH 5,5.
В других конкретных вариантах осуществления изобретения изобретение относится к стабильному жидкому препарату антитела, подходящему для внутривенного введения, при этом препарат содержит:
a) примерно 50 мг/мл полностью человеческого IgG4-антитела против LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8;
b) примерно 10 мМ цитратный буфер; и
c) примерно 0,01% полисорбата 20;
при этом pH препарата составляет примерно pH 5,5.
В следующих конкретных вариантах осуществления изобретения изобретение относится к стабильному лиофилизированному препарату антитела, подходящему для внутривенного введения, при этом препарат содержит:
a) примерно 50 мг/мл полностью человеческого IgG4-антитела против LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,01% полисорбата 20;
d) примерно 5% сахарозы; и
e) примерно 1,5% пролина;
при этом pH препарата составляет примерно pH 5,5.
В альтернативных конкретных вариантах осуществления изобретения изобретение относится к стабильному препарату антитела, содержащему:
a) примерно 20 мг/мл гуманизированного IgG4-антитела против CXCR5 (рецептора хемокина C-X-C типа 5), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,02% полисорбата 20;
d) примерно 6% сахарозы; и
e) примерно 0,2% хлорида натрия;
при этом pH препарата составляет примерно pH 6,0.
В следующих альтернативных конкретных вариантах осуществления изобретения изобретение относится к стабильному препарату антитела, содержащему:
a) примерно 100 мг/мл гуманизированного IgG4-антитела против CXCR5 (рецептора хемокина C-X-C типа 5), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,01% полисорбата 20;
d) примерно 4,5% сахарозы;
e) примерно 0,2% хлорида натрия; и
f) примерно 1% аргинина;
при этом pH препарата составляет примерно pH 6,0.
В некоторых вариантах осуществления изобретения, изобретение относится к набору, содержащему емкость, содержащую: 1) препарат по любому из предшествующих пунктов и 2) ярлык или инструкции по введению и применению препарата. В некоторых вариантах осуществления изобретения ярлык содержит одну или несколько или из следующих инструкций: инструкции по введению препарата, инструкции по применению препарата, инструкции, касающиеся условий хранения препарата, информацию, касающуюся номера партии и серии препарата и/или набора, информацию, касающуюся состава препарата, информацию о безопасности, информацию, касающуюся возможных неблагоприятных реакций, вторичных эффектов и/или побочных эффектов в связи с введением препарата, или информацию, касающуюся возможных показаний и/или противопоказаний препарата.
В некоторых вариантах осуществления изобретения изобретение относится к предварительно наполняемому устройству или предварительно наполняемой емкости, такой как шприц, картридж, флакон, ампула или шприц для самоинъекции, содержащий препарат согласно изобретению.
В некоторых других вариантах изобретение относится к набору, содержащему такой предварительно наполняемый шприц, картридж, флакон, ампулу или шприц для самоинъекции.
В некоторых вариантах изобретение относится к способу лечения воспалительного заболевания кишечника, включающему в себя введение субъекту, нуждающемуся в таком введении, препарата согласно изобретению.
В некоторых других вариантах изобретение относится к способу лечения ревматоидного артрита, включающему в себя введение субъекту, нуждающемуся в таком введении, препарата согласно изобретению.
В некоторых вариантах изобретение относится к препарату для применения в способе диагностики или лечения организма человека или животного. В конкретных вариантах препарат применяют для лечения воспалительного заболевания кишечника. В альтернативных вариантах препарат применяют для лечения ревматоидного артрита.
В некоторых вариантах осуществления изобретения изобретение относится к способу получения препарата согласно изобретению, включающему в себя смешивание компонентов препарата и корректировку pH, при этом получение осуществляют в стерильных условиях или препарат стерилизуют после смешивания компонентов и корректировки pH или обеих процедур.
В некоторых конкретных вариантах осуществления изобретения изобретение относится к способу получения стабильного препарата антитела, включающему в себя: a) получение связывающего анти-LIGHT-средства; b) ресуспендирование связывающего анти-LIGHT-средства в цитратном буфере, имеющем концентрацию от примерно 5 до примерно 50 мМ; и c) доведение значения pH препарата до pH 5,0 - pH 6,0.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 является изображением геля, на котором показаны результаты экспериментов по изоэлектрическому фокусированию в денатурированном состоянии, которые использовали для определения изоэлектрической точки (pI) полностью человеческого IgG4-антитела против LIGHT, содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8, приготовленного в виде препарата в фосфатно-солевом буфере при pH 7,3 в концентрации 5,5 мг/мл («исходный препарат», «PBS-препарат» или «эталонная партия»). Дорожки 1 и 5: набор для калибровки IEF в широком диапазоне pI 5-10,5; дорожки 2 и 4: первая серия эталонной партии; дорожки 3 и 4: вторая серия эталонной партии. Значения pI указаны числами.
Фиг. 2 является изображением SDS-ПААГ-геля, на котором сравнивали разные серии эталонной партии в восстанавливающих и не восстанавливающих условиях. Дорожки 1 и 10: стандарт белка Biorad Precision Plus; дорожка 5: пустая; дорожка 2: первая серия эталонной партии в не восстанавливающих условиях; дорожки 3 и 4: вторая серия эталонной партии в не восстанавливающих условиях; дорожка 6: первая серия эталонной партии в восстанавливающих условиях; дорожки 7 и 8: вторая серия эталонной партии в восстанавливающих условиях; и дорожка 9: контроль системы. Размеры указаны числами в рядах.
На фиг. 3 показан график ELISA, который использовали для определения активности связывания антигена первой и второй серий эталонной партии.
На фиг. 4 показана хроматограмма, полученная при эксклюзивной хроматографии по размеру (SEC) первой серии эталонной партии. Как показано на фиг. 4, при SEC выявляли белки с высокой молекулярной массой (HMWP), например, ди/олигомеры (RRT0.8) или агрегаты, и белки с низкой молекулярной массой (LMWP) или продукты распада. Первая серия эталонной партии имела чистоту с содержанием мономера 97%.
На фиг. 5 показана хроматограмма, полученная при слабо-катионообменной хроматографии в случае первой серии эталонной партии. Как показано на фиг. 5, во время исследований стабильности происходило перераспределение кислых, нейтральных и основных изоформ. Первая серия эталонной партии имела распределение кислых/нейтральных/основных изоформ 42,3/55,6/1,9%.
На фиг. 6 показана термограмма дифференциальной сканирующей калориметрии первой серии эталонной партии. Как показано на фиг. 6, разворачивание трех доменов антитела происходит при 68°C, 75°C и 78°C.
На фиг. 7 показана картина динамического светорассеяния первой серии эталонной партии, которую не подвергали фильтрации. DLS использовали для определения гидродинамического диаметра мономера и потенциальных растворимых агрегатов антитела первой серии эталонной партии.
На фиг. 8 показана картина динамического светорассеяния первой серии эталонной партии, которую подвергали фильтрации. DLS использовали для определения гидродинамического диаметра мономера и потенциальных растворимых агрегатов антитела первой серии эталонной партии.
Фиг. 9 представляет собой схему операций в процессе производства лекарственного продукта в случае препарата с высокой концентрацией антитела.
На фиг. 10 показана картина динамического светорассеяния препарата 14. DLS использовали для определения гидродинамического диаметра мономера и потенциальных растворимых агрегатов антитела.
На фиг. 11 представлена картина геля, показывающая результаты изоэлектрического фокусирования для определения pI (изоэлектрической точки) лидирующего CXCR5-антитела. Дорожки 1,6: набор для калибровки IEF в широком диапазоне pI; дорожки 2,4: эталонное стандартное лидирующее антитело LP08031; и дорожки 3,5: лекарственная субстанция лидирующего антитела, RSN0151.
Фиг. 12 представляет собой картину SDS-ПААГ-геля, на котором сравнивали разные партии лекарственной субстанции в восстанавливающих и не восстанавливающих условиях. Гель также использовали для определения молекулярной массы лидирующего CXCR5-антитела и присутствия каких-либо агрегатов.
Фиг. 13 представляет собой график ELISA, который использовали для определения активности связывания с антигеном лидирующего CXCR5-антитела с 28-мерным пептидом антигена CXCR5.
Фиг. 14 представляет собой хроматограмму SEC подвергнутого стрессу лидирующего CXCR5-антитела. SEC позволяет выявлять белки с высокой молекулярной массой (HMWP), например, ди/олигомеры или агрегаты, и белки с низкой молекулярной массой (LMWP) или продукты распада. Лидирующее CXCR5-антитело имело чистоту 99% по содержанию мономера.
Фиг. 15 представляет собой хроматограмму WCX, которую использовали для определения кислых, нейтральных и основных изоформ лидирующего CXCR5-антитела. Лидирующее CXCR5-антитело имело распределение кислых/нейтральных/основных изоформ 14/85/1%.
На фиг. 16 показано измерение DLS, которое использовали для определения гидродинамического диаметра мономера и потенциальных растворимых агрегатов антитела.
Фиг. 17 представляет собой изображение лидирующего CXCR5-антитела в ацетатном буфере с pH 5,0 (слева) и pH 5,5 (справа); каждый по сравнению с WFI (водой для инъекции) и после термического стресса. Данная фигура показывает, что ацетат является подходящей буферной системой.
Фиг. 18 представляет собой изображение лидирующего CXCR5-антитела в гистидиновом буфере с pH 6,0 (слева), pH 5,5 (в середине) и pH 5,0 (справа); каждый по сравнению с WFI (водой для инъекций) и после термического стресса. На данной фигуре показано, что гистидин является подходящим буфером.
Фиг. 19 представляет собой изображение лидирующего CXCR5-антитела в трис-буфере с pH 7,5 после UF/DF (слева) и после фильтрации (справа); каждый против WFI (воды для инъекций) и после термического стресса. На данной фигуре показано, что трис является несовместимой буферной системой.
Фиг. 20 представляет собой изображение лидирующего CXCR5-антитела в цитратном буфере с pH 6,0 после UF/DF и фильтрации.
Фиг. 21 представляет собой изображение лидирующего CXCR5-антитела в ацетатном буфере pH с 5,5 после UF/DF и фильтрации.
Фиг. 22 представляет собой изображение лидирующего CXCR5-антитела в сукцинатном буфере с pH 5,0 после UF/DF и фильтрации.
Фиг. 23 представляет собой изображение лидирующего CXCR5-антитела в гистидиновом буфере с pH 5,0 после UF/DF и фильтрации.
Фиг. 24 представляет собой изображение лидирующего CXCR5-антитела в аргининовом буфере с pH 6,0 после UF/DF и фильтрации.
На фиг. 25 представлена картина внешнего вида растворов лидирующего CXCR5-антитела LA_09_016 с разными поверхностно-активными веществами (без поверхностно-активного вещества, с полисорбатом 20, полисорбатом 80, лутролом F68, кремофором RH40, солутолом HS15 и SDS) после механического стресса (350 об./мин, 2,5 часа, комнатная температура).
Фиг. 26 представляет собой график, который показывает увеличение количества димеров в условиях ускоренных испытаний, которое анализировали, используя SEC. Можно было наблюдать увеличение образования димеров до 10% после трех месяцев хранения во всех четырех гистидиновых препаратах. В ацетатных препаратах наблюдали повышение содержания димеров до 6%. Во всех четырех цитратных препаратах концентрация димеров была ниже 2% даже после трех месяцев при +40°C.
Фиг. 27 представляет собой график, показывающий увеличение содержания основных изоформ в условиях ускоренных испытаний, которое анализировали с использованием WCX. Гистидин является плохим для стабильности лидирующего CXCR5-антитела в условиях ускоренных испытаний. Можно отметить небольшое увеличение содержания основных изоформ для всех четырех ацетатных препаратов. Интересно, что невозможно было отличить между собой четыре цитратных препарата.
Фиг. 28 представляет собой график, показывающий уменьшение содержания нейтральных изоформ в условиях ускоренных испытаний, которое анализировали с использованием WCX. Данная фигура показывает сильное снижение содержания нейтральных изоформ в случае гистидиновых препаратов. Небольшое снижение наблюдали в ацетате. Цитрат влиял меньше всего.
На фиг. 29 показана разница pH всех четырех препаратов (A-D) в цитратном буферу в условиях ускоренных испытаний. Препараты, в наибольшей степени стабилизирующие pH, забуферены цитратом и особенно препарат B и D.
На фиг. 30 показана разница pH всех четырех препаратов (A-D) в ацетатном буфере в условиях ускоренных испытаний. В забуференных ацетатом растворах лидирующего CXCR5-антитела pH сдвигалось к более высокому значению.
На фиг. 31 показана разница pH всех четырех препаратов (A-D) в гистидиновом буфере в условиях ускоренных испытаний. В забуференных гистидином растворах лидирующего CXCR5-антитела значение pH немного снижалось.
Фиг. 32 представляет собой график, показывающий гидродинамический диаметр CXCR5 LA_09_027 A-D после 3 месяцев хранения при 40°C. В забуференных цитратом препаратах наблюдали только небольшие агрегаты спустя три недели в случае препарата C и после шести недель хранения в случае препарата A. Некоторое количество агрегатов также можно было выявить спустя три месяца в случае препарата B. Но по сравнению с забуференными ацетатом препаратами количество было очень маленьким.
Фиг. 33 представляет собой график, показывающий гидродинамический диаметр CXCR5 LA_09_028 A-D после 3 месяцев хранения при 40°C. В забуференном ацетатом препарате C наблюдали некоторое количество агрегатов <200 нм спустя три недели. В препарате A наблюдали некоторое количество агрегатов через три месяца.
Фиг. 34 представляет собой диаграмму, показывающую влияние возрастающих концентраций лидирующего CXCR5-антитела на Z-среднее. В случае лидирующего CXCR5-антитела наблюдали значимое увеличение гидродинамического диаметра (Z-среднее) при возрастании концентрации антитела.
Фиг. 35 представляет собой диаграмму, показывающую влияние разных стабилизаторов (эксципиентов) на Z-среднее в случае концентрации 100 мг/мл лидирующего CXCR5-антитела после термического стресса. Z-среднее измеряли до и после термического стресса. Стабилизирующий эффект был сходен в случае всех тестированных эксципиентов, но увеличение Z-среднего, в общем, было понижено при использовании в качестве стабилизаторов аминокислот (аргинина, лизина или глицина). Лизин исключали из-за более высокого содержания агрегатов после стресса. Аргинин влиял лучше, чем глицин.
Фиг. 36 представляет собой диаграмму, показывающую влияние разных стабилизаторов на Z-среднее в случае концентрации 100 мг/мл лидирующего CXCR5-антитела после механического стресса. Z-среднее измеряли до и после механического стресса. Такое же снижение Z-среднего было отмечено в присутствии аминокислот. Сахароза оказывала лучшее защитное действие, чем трегалоза от механического стресса. Аргинин и глицин работали лучше в сочетании с NaCl.
Фиг. 37 представляет собой набор графиков, показывающих распределение размера частиц, которое измеряли, используя DLS, лидирующего CXCR5-антитела, приготовленного в виде препарат в 10 мМ цитратном буфере при pH 6, до механического стресса (A) и после механического стресса (B). Виды с более высокой молекулярной массой измеряли, используя DLS, после механического стресса лекарственной субстанции (ЛС).
Фиг. 38 представляет собой набор графиков, показывающих распределение размера частиц, которое измеряли, используя DLS, в прототипных препаратах лекарственного продукта лидирующего CXCR5-антитела (A-D; таблица 111) до (A) и после (B) механического стресса.
ПОДРОБНОЕ ОПИСАНИЕ
A. Определения
Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которые обычно подразумевает специалист в данной области.
Следует отметить, что в используемом в настоящем описании и прилагаемой формуле изобретения смысле формы единственного числа также включают указание и множественного числа, если контекст ясно не диктует иное.
Термин «примерно» или «приблизительно» означает в пределах 10%, например, в пределах 5% (или 1% или меньше) от данного значения или диапазона.
Термины «вводить» или «введение» относятся к действию, осуществляемому в виде инъекции или другой физической доставки пациенту вещества, которое находится вне организма (например, препарата согласно изобретению), такой как мукозальная, интрадермальная, внутривенная, подкожная, внутримышечная доставка и/или любой другой способ физической доставки, описанный в настоящей публикации или известный в данной области. В том случае, когда заболевание или его симптом подвергают лечению, введение вещества обычно происходит после появления заболевания или его симптомов. В том случае, когда заболевание или его симптомы подвергают профилактике, введение вещества обычно происходит до наступления заболевания или его симптомов.
В контексте полипептида термин «аналог» относится к полипептиду, который обладает сходной или идентичной функцией, что и полипептид LIGHT или CXCR5, фрагмент полипептида LIGHT или CXCR5, эпитоп LIGHT или CXCR5 или анти-LIGHT- или анти-CXCR5-антитело, но не обязательно содержит аминокислотную последовательность, сходную или идентичную аминокислотной последовательности полипептида LIGHT или CXCR5, фрагмента полипептида LIGHT или CXCR5, эпитопа LIGHT или CXCR5 или анти-LIGHT- или анти-CXCR5-антитело, или обладает структурой, сходной или идентичной структуре полипептида LIGHT или CXCR5, фрагмента полипептида LIGHT или CXCR5, эпитопа LIGHT или CXCR5 или анти-LIGHT- или анти-CXCR5-антитела. Полипептид, который имеет сходную аминокислотную последовательность, относится к полипептиду, который удовлетворяет, по меньшей мере, одному из следующих условий: (a) полипептид, имеющий аминокислотную последовательность, которая, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95% или, по меньшей мере, на 99% идентична аминокислотной последовательности полипептида LIGHT или CXCR5 (например, SEQ ID NO:9 или SEQ ID NO:14, соответственно), фрагмента полипептида LIGHT или CXCR5, эпитопа LIGHT или CXCR5 или анти-LIGHT- или анти-CXCR5-антитела, описанного в настоящей публикации; (b) полипептид, кодируемый нуклеотидной последовательностью, которая гибридизуется в жестких условиях с нуклеотидной последовательностью, кодирующей полипептид LIGHT или CXCR5, фрагмент полипептида LIGHT или CXCR5, эпитоп LIGHT или CXCR5 или анти-LIGHT- или анти-CXCR5-антитело (или его VH- или VL-область), описанное в настоящей публикации, длиной по меньшей мере, 5 аминокислотных остатков, по меньшей мере, 10 аминокислотных остатков, по меньшей мере, 15 аминокислотных остатков, по меньшей мере, 20 аминокислотных остатков, по меньшей мере, 25 аминокислотных остатков, по меньшей мере, 40 аминокислотных остатков, по меньшей мере, 50 аминокислотных остатков, по меньшей мере, 60 аминокислотных остатков, по меньшей мере, 70 аминокислотных остатков, по меньшей мере, 80 аминокислотных остатков, по меньшей мере, 90 аминокислотных остатков, по меньшей мере, 100 аминокислотных остатков, по меньшей мере, 125 аминокислотных остатков, или по меньшей мере 150 аминокислотных остатков (смотрите, например, Sambrook с соавторами (2001) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Maniatis с соавторами (1982) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, N.Y.); и (c) полипептид, кодируемый нуклеотидной последовательностью, которая, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95% или, по меньшей мере, на 99% идентична нуклеотидной последовательности, кодирующей полипептид LIGHT или CXCR5, фрагмент полипептида LIGHT или CXCR5, эпитоп LIGHT или CXCR5 или анти-LIGHT- или анти-CXCR5-антитело (или его VH- или VL-область), описанные в настоящей публикации. Полипептид со структурой, сходной со структурой полипептида LIGHT или CXCR5, фрагмента полипептида LIGHT или CXCR5, эпитопа LIGHT или CXCR5 или анти-LIGHT- или анти-CXCR5-антитела относится к полипептиду, который имеет вторичную, третичную или четвертичную структуру, сходную со структурой полипептида LIGHT или CXCR5, фрагмента полипептида LIGHT или CXCR5, эпитопа LIGHT или CXCR5 или антитела против LIGHT или CXCR5. Структуру полипептида можно определить способами, известными специалистам в данной области, включая без ограничения рентгеновскую кристаллографию, ядерный магнитный резонанс и кристаллографическую электронную микроскопию.
Чтобы определить идентичность в процентах двух аминокислотных последовательностей или двух последовательностей нуклеиновой кислоты, последовательности выравнивают в целях оптимального сравнения (например, могут быть введены пробелы в последовательность первой аминокислотной последовательности или последовательности нуклеиновой кислоты для оптимального выравнивания со второй аминокислотной последовательностью или последовательностью нуклеиновой кислоты). Затем сравнивают аминокислотные остатки или нуклеотиды в соответствующих положениях аминокислот или положениях нуклеотидов. Если положение в первой последовательность занято таким же аминокислотным остатком или нуклеотидом, как и в соответствующем положении во второй последовательности, то молекулы являются идентичными в таком положении. Идентичность в процентах между двумя последовательностями является функцией количества идентичных положений, имеющихся в последовательностях (т.е., идентичность в % = количество идентичных перекрывающихся положений/общее количество положений ×100%). В одном варианте две последовательности имеют одинаковую длину.
Определение идентичности в процентах между двумя последовательностями (например, аминокислотными последовательностями или последовательностями нуклеиновой кислоты) также можно осуществить, используя математический алгоритм. Не ограничивающим примером математического алгоритма, используемого для сравнения двух последовательностей является алгоритм Карлина и Альтшуля, 1990, Proc. Natl. Acad. Sci. U.S.A. 87: 2264 2268, модифицированный согласно публикации Karlin and Altschul, 1993, Proc. Natl. Acad. Sci. U.S.A. 90: 5873-5877. Такой алгоритм включен в программы NBLAST и XBLAST (Altschul с соавторами, 1990, J. Mol. Biol. 215: 403. Поиск нуклеотидов BLAST может быть осуществлен с использованием набора параметров программы для нуклеотидов NBLAST, например, в случае счета = 100, длина слова = 12, чтобы получить нуклеотидные последовательности, гомологичные представляющим интерес молекулам нуклеиновой кислоты. Поиски белков BLAST можно осуществлять с использованием набора параметров программы XBLAST, например, для счета 50, длина слова = 3, чтобы получить аминокислотные последовательности, гомологичные представляющей интерес молекуле. Чтобы получить выравнивания с пробелами в целях сравнения, можно использовать Gapped BLAST, как описано в работе Altschul с соавторами, 1997, Nucleic Acids Res. 25: 3389 3402. Альтернативно можно использовать PSI BLAST, чтобы осуществить итерационный поиск, который позволяет выявлять отдаленные взаимосвязи между молекулами (там же). При использовании программ BLAST, Gapped BLAST и PSI Blast можно применять параметры соответствующих программ по умолчанию (например, XBLAST и NBLAST) (смотрите, например, National Center for Biotechnology Information (NCBI) в Интернете ncbi dotnlm dot nih dot gov). Другим не ограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Myers и Miller, 1988, CABIOS 4: 11 17. Такой алгоритм включен в программу ALIGN (версия 2.0), которая является частью пакета компьютерных программ для выравнивания последовательностей GCG. При использовании программы ALIGN для сравнения аминокислотных последовательностей можно применять таблицу весов остатков PAM120, штраф за длину пробела 12 и штраф за пробел 4.
Идентичность в процентах между двумя последовательностями можно определить, используя способы, сходные со способами, описанными, допуская или не допуская пробелы. При вычислении идентичности в процентах обычно подсчитывают только точные совпадения.
«Антагонист» или «ингибитор» относится к молекуле, способной ингибировать одну или несколько биологических активностей молекулы-мишени. Антагонисты могут мешать связыванию рецептора с лигандом и наоборот за счет выведения из строя или убивания клеток, активируемых лигандом, и/или мешая активации рецептора или лиганда (например, активации тирозинкиназы) или трансдукции сигнала после связывания лиганда с рецептором. Антагонист может полностью блокировать взаимодействия рецептор-лиганд или может в значительной степени уменьшать такие взаимодействия. Все такие точки вмешательства антагониста следует считать эквивалентными в целях настоящего изобретения.
Например, «антагонист» или «ингибитор» LIGHT относится к молекуле, которая способна ингибировать или иным образом снижать одну или несколько биологических активностей LIGHT, например, в клетке, экспрессирующей LIGHT, или в клетке, экспрессирующей лиганд LIGHT, такой как рецептор LIGHT. Например, в некоторых вариантах антитела согласно изобретению представляют собой антагонистические антитела, которые ингибируют или иным образом снижают секрецию CCL20, IL-8 и/или RANTES из клетки, имеющей экспрессируемый на клеточной поверхности рецептор LIGHT (например, HVEM, LTpR и/или DcR3) в том случае, когда указанное антитело контактирует с указанной клеткой. В некоторых вариантах антагонист LIGHT (например, антагонистическое антитело согласно изобретению) может, например, действовать, ингибируя или иным образом снижая активацию и/или пути передачи клеточного сигнала в клетке, экспрессирующей рецептор LIGHT, тем самым ингибируя опосредованную LIGHT биологическую активность клетки по сравнению с опосредованной LIGHT биологической активностью в отсутствие антагониста. В некоторых вариантах осуществления изобретения анти-LIGHT-антитела являются полностью человеческими, антагонистическими анти-LIGHT-антителами, такими как полностью человеческие моноклональные антагонистические анти-LIGHT-антитела.
Например, «антагонист» или «ингибитор» CXCR5 относится к молекуле, способной ингибировать одну или несколько биологических активностей, таких как передача сигнала через CXCR5. Таким образом, в объем изобретения включены антагонисты (например, нейтрализующие антитела), которые связываются с CXCR5, CXCL13 или другими лигандами CXCR5 или комплексом CXCR5 и его лиганда, такого как CXCL13; варианты или производные аминокислотной последовательности CXCR5 или CXCL13, которые антагонизируют взаимодействие между CXCR5 и лигандом, таким как CXCL13; растворимый CXCR5, необязательно слитый с гетерологичной молекулой, такой как область иммуноглобулина (например, иммуноадгезином); комплекс, содержащий CXCR5 в ассоциации с другим рецептором или биологической молекулой; пептиды с синтетической или нативной последовательностью, которые связываются с CXCR5; и так далее.
Термины «антитело», «иммуноглобулин» или «Ig» могут быть использованы в настоящем описании взаимозаменяемо. Термин антитело включает без ограничения синтетические антитела, моноклональные антитела, рекомбинантно полученные антитела, полиспецифичные антитела (включая биспецифичные антитела), человеческие антитела, гуманизированные антитела, химерные антитела, интраантитела, одноцепочечные Fv (scFv) (например, включая моноспецифичные, биспецифичные и т.д.), верблюдизированные антитела, Fab-фрагменты, F(ab’)-фрагменты, связанные дисульфидными связями Fv (sdFv), анти-идиотипические (анти-Id)-антитела и связывающие эпитоп фрагменты любого из указанных выше. В частности, антитела включают молекулы иммуноглобулинов и иммунологически активные части молекул иммуноглобулинов, т.е. антигенсвязывающие домены или молекулы, которые содержат антигенсвязывающий участок, который специфично связывается с антигеном LIGHT (например, одна или несколько определяющих комплементарность областей (CDR) анти-LIGHT-антитела) или антигеном CXCR5 (например, одна или несколько определяющих комплементарность областей (CDR) анти-CXCR5-антитела). Анти-LIGHT- или анти-CXCR5-антитела могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), любого класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или любого подкласса (например, IgG2a и IgG2b) молекулы иммуноглобулина. В некоторых вариантах анти-LIGHT-антитела являются полностью человеческими, такими как полностью человеческие моноклональные анти- LIGHT-антитела. В некоторых вариантах анти-LIGHT-антитела представляют собой IgG-антитела, человеческие IgG4-антитела. Альтернативно в некоторых вариантах анти-CXCR5-антитела являются гуманизированными, такие как гуманизированные моноклональные анти-CXCR5-антитела. В некоторых вариантах анти-CXCR5-антитела представляют собой IgG-антитела, гуманизированные IgG4-антитела.
В используемом в настоящем описании смысле термин «анти-LIGHT-антитело» означает антитело или полученный из него полипептид (производное), который специфично связывается с LIGHT человека, который определен в настоящем описании, включая без ограничения молекулы, которые ингибируют или в значительной степени снижают связывание LIGHT с его лигандами или ингибируют активность LIGHT.
В используемом в настоящем описании смысле термин «анти-CXCR5-антитело» означает антитело или полученный из него полипептид (производное), который специфично связывается с CXCR5 человека, который определен в настоящем описании, включая без ограничения молекулы, которые ингибируют или в значительной степени снижают связывание CXCR5 с его лигандами или ингибируют активность CXCR5.
Термин «B-клеточная активность» означает более высокие уровни, чем уровни нормальных B-клеток, которые могут быть локальными, или доказательство биологического проявления или функции B-клетки, например экспрессии антител, присутствия или активности тирозинкиназы Братона, экспрессии или присутствия CD19, экспрессии или присутствия активирующего фактора B-клеток и так далее.
Термин «связывающее средство» означает любую молекулу, такую как антитело, ми-РНК, нуклеиновая кислота, аптамер, белок или низкомолекулярное органическое соединение, которая связывается или специфично связывается с LIGHT или CXCR5, или ее вариант или фрагмент.
Термин «побочный продукт» включает нежелательные продукты, которые снижают или уменьшают долю терапевтического/профилактического связывающего средства, такого как антитело, в данном препарате. Например, типичные побочные продукты включают агрегаты антитела, фрагменты антитела, например, получаемые при распаде антитела в результате дезамидирования или гидролиза, или их смеси. Обычно агрегаты представляют собой комплексы, которые имеют более высокую молекулярную массу, чем мономерное антитело. Продукты распада антитела могут включать, например, фрагменты антитела, например, возникающие в результате дезамидирования или гидролиза. Обычно продукты распада представляют собой комплексы, которые имеют более низкую молекулярную массу, чем мономерное антитело. В случае IgG-антитела такие продукты распада имеют молекулярную массу меньше чем примерно 150 кДа.
Подразумевается, что термины «композиция» и «препарат» охватывают продукт, содержащий указанные ингредиенты (например, анти-LIGHT-антитело или анти-CXCR5-антитело) необязательно в указанных количествах, а также любой продукт, который получают, прямо или опосредованно, в результате сочетания конкретных ингредиентов, необязательно в указанных количествах.
Термины «константная область» или «константный домен» относятся к находящейся на карбоксильном конце части легкой и тяжелой цепей, которая непосредственно не вовлечена в связывание антитела с антигеном, но проявляет различные эффекторные функции, такие как взаимодействие с рецептором Fc. Термины относятся к части молекулы иммуноглобулина, имеющей более консервативную аминокислотную последовательность по сравнению с другой частью иммуноглобулина, вариабельным доменом, который содержит антигенсвязывающий участок. Константный домен содержит домены CH1, CH2 и CH3 тяжелой цепи и домен CHL легкой цепи.
Термин «CXCR5» относится к встречающейся в природе известной молекуле, найденной на лимфоцитах, в частности, на B-клетках, и в частности, на наивных B-клетках; к такой молекуле, выделенной из таких клеток; к такой молекуле, получено рекомбинантно с использованием известных материалов и способов и с использованием нуклеиновой кислоты, кодирующей CXCR5; а также к частям CXCR5, таким как внеклеточный (EC) домен, который сохраняет характеристики и свойства, имеющие отношение к практическому осуществлению настоящего изобретения, такие как связывание CXCL13. Растворимая молекула CXCR5 может по существу состоять из EC-домена CXCR5, который содержит примерно шестьдесят первых аминокислот молекулы, то есть, амино-концевую часть CXCR5.
CXCR5 не является неразборчивым рецептором. CXCL13 является лигандом CXCR5 и экспрессируется конститутивно на стромальных клетках, таких как фолликулярные дендритные клетки, и в лимфоидных тканях. CXCL13 специфично привлекает B-клетки и небольшую подгруппу T-клеток, называемых хелперными фолликулярными T-клетками, TFH. Это не может быть неожиданным, учитывая множество взаимодействий между популяциями T-клеток и B-клеток в иммунной системе. Кроме того, активированные T-клетки индуцируют или осуществляют повышающую регуляцию экспрессии CXCR5. Было обнаружено, что инфильтрация лимфоцитов в третичные эктопические зародышевые центры (GC) хорошо коррелирует с возрастающей тяжестью заболевания и нарушением толерантности при некоторых расстройствах, в случае которых имеются такие атипичные подобные лимфатическим узлам структуры. В случае использования мышиных моделей in vivo, таких как мыши CXCR5-/- и CXCL13-/-, отсутствие либо рецептора, либо лиганда приводит к измененной тонкой структуре GC вследствие измененной локализации возможного взаимодействия T- и B-клеток. Такие мыши также защищены от развития тяжелого индуцированного коллагеном артрита (CIA). Так как CXCR5 избирательно экспрессируется на зрелых B-клетках, которые связаны с патогенезом RA, блокирование такого рецептора будет модулировать артритогенную реакцию у пораженных заболеванием людей. Показано, что лечение ревматоидного артрита биологическими средствами (т.е., анти-TNFa- и анти-CD20-антителами, ритуксимабом) является клинически эффективным; в частности, было показано, что у пациентов, получающих направленную на B-клетки терапию, наблюдается длительное улучшение клинических признаков и симптомов. Избирательное целенаправленное действие на CXCR5, который экспрессируется только на зрелых B-клетках и T-клетках, являющихся помощниками B-клеток, не будет влиять на развитие B-клеток или вызывать иммунную недостаточность у пациента. В отличие от ритуксимаба анти-CXCR5-антитело согласно настоящему изобретению является нейтрализующим антителом, которое не опосредует клеточную цитотоксичность.
«CXCR5-заболевание» представляет недомогание, расстройство, заболевание, состояние, аномалию и так далее, которое характеризуется или вызвано сверхэкспрессией или повышенными уровнями CXCL13 или другого лиганда CXCR5, повышенными уровнями B-клеток, повышенными уровнями B-клеточной активности, повышенными уровнями CXCR5 или нарушенным метаболизмом и активностью CXCR5.
Термин «эпитоп» относится к локализованной области на поверхности антигена, такого как полипептид LIGHT или CXCR5 или фрагмент полипептида LIGHT или CXCR5, которая может быть связана с одной или несколькими антигенсвязывающими областями связывающего средства, такого как антитело, и которая обладает антигенной или иммуногенной активностью у животного, такого как млекопитающее, такого как человек, которая способна вызывать иммунный ответ. Эпитоп, обладающий иммуногенной активностью, является частью полипептида, который вызывает гуморальный ответ у животного. Эпитоп, обладающий антигенной активностью, является частью полипептида, с которым специфично связывается антитело, и такую активность определяют любым способом, известным в данной области, например, таким как иммуноанализ. Антигенные эпитопы не должны быть обязательно иммуногенными. Эпитопы обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты или боковые группы сахаров, и имеют конкретные характеристики трехмерной структуры, а также конкретные характеристики заряда. Область полипептида, вносящая вклад в эпитоп, может представлять собой непрерывно следующие друг за другом аминокислоты полипептида, или эпитоп может быть образован двумя или несколькими непрерывно не следующими друг за другом областями полипептида. Эпитоп может являться или может не являться признаком трехмерной поверхности антигена. В некоторых вариантах эпитоп LIGHT или CXCR5 является признаком трехмерной поверхности полипептида LIGHT или CXCR5 (например, в тримерной форме полипептида LIGHT). В других вариантах эпитоп LIGHT является линейным признаком полипептида LIGHT или CXCR5 (например, в тримерной форме или мономерной форме полипептида LIGHT). Анти-LIGHT- или анти-CXCR5-антитела могут специфично связываться с эпитопом мономерной (денатурированной) формы LIGHT или CXCR5, эпитопом тримерной (нативной) формы LIGHT или CXCR5 или обеих мономерной (денатурированной) формы и тримерной (нативной) формы LIGHT или CXCR5. В конкретных вариантах анти-LIGHT-антитела специфично связываются с эпитопом тримерной формы LIGHT, но не связывают специфично мономерную форму LIGHT.
Термин «эксципиенты» относится к инертным веществам, которые обычно применяют в качестве разбавителя, наполнителя, консерванта, связывающего средства, стабилизатора и т.д. для лекарственных средств, и включает без ограничения белки (например, сывороточный альбумин, и т.д.), аминокислоты (например, аспарагиновую кислоту, глутаминовую кислоту, лизин, аргинин, глицин, гистидин и т.д.), жирные кислоты и фосфолипиды (например, алкилсульфонаты, каприлат и т.д.), поверхностно-активные вещества (например, SDS, полисорбат, неионогенное поверхностно-активное вещество и т.д.), сахариды (например, сахарозу, мальтозу, трегалозу и т.д.) и полиолы {например, маннит, сорбит и т.д.). Смотрите также публикацию Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Easton, Pa., которая включена в настоящее описание в виде ссылки в полном объеме.
В контексте пептида или полипептида термин «фрагмент» относится к пептиду или полипептиду, который содержит аминокислотную последовательность, меньшую, чем полноразмерная аминокислотная последовательность. Такой фрагмент может возникать, например, в результате укорочения амино-конца, укорочения карбоксильного конца и/или внутренней делеции остатка(ов) из аминокислотной последовательности. Фрагменты могут возникать, например, в результате альтернативного сплайсинга РНК или в результате активности протеаз in vivo. В некоторых вариантах фрагменты hLIGHT или hCXCR5 включают в себя полипептиды, содержащие аминокислотную последовательность, состоящую, по меньшей мере, из 5 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 10 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 15 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 20 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 25 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 40 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 50 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 60 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 70 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 80 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 90 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 100 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 125 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 150 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 175 непрерывно следующих друг за другом аминокислотных остатков, по меньшей мере, 200 непрерывно следующих друг за другом аминокислотных остатков или, по меньшей мере, 250 непрерывно следующих друг за другом аминокислотных остатков аминокислотной последовательности полипептида LIGHT или CXCR5 или антитела, которое специфично связывается с полипептидом LIGHT или CXCR5. В конкретном варианте фрагмент полипептида LIGHT или CXCR5 или антитела, которое специфично связывается с антигеном LIGHT или CXCR5, сохраняет, по меньшей мере 1, по меньшей мере 2 или по меньшей мере 3 функции полипептида или антитела.
Термины «полностью человеческое антитело» или «человеческое антитело» используют в настоящем описании взаимозаменяемо, и они относятся к антителу, которое содержит человеческую вариабельную область и вероятно человеческую константную область. В конкретных вариантах термины относятся к антителу, которое содержит вариабельную область и константную область человеческого происхождения. «Полностью человеческие» анти-LIGHT-антитела в некоторых вариантах также могут охватывать антитела, которые связывают полипептиды LIGHT и кодируются последовательностями нуклеиновой кислоты, которые являются встречающимися в природе соматическими вариантами последовательности нуклеиновой кислоты иммуноглобулина зародышевой линии человека. В конкретном варианте анти-LIGHT-антитела являются полностью человеческими антителами. Термин «полностью человеческое антитело» включает антитела, имеющие вариабельные и константные области, соответствующие последовательностям иммуноглобулина зародышевой линии человека, которые описаны Kabat с соавторами (смотрите Kabat с соавторами (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Способы получения полностью человеческих антител известны в данной области.
Фраза «рекомбинантное человеческое антитело» включает человеческие антитела, которые получены, экспрессированы, созданы или выделены основанными на рекомбинации способами, такие как антитела, экспрессированные с использованием рекомбинантного экспрессирующего вектора, введенного в результате трансфекции в клетку-хозяина, антитела, выделенные из библиотеки рекомбинантных комбинаторных человеческих антител, антитела, выделенные из организма животного (например, мыши или коровы), которое является трансгенным и/или трансхромосомным по генам иммуноглобулина человека (смотрите, например, Taylor, L. D. с соавторами (1992) Nucl. Acids Res. 20: 6287-6295), или антитела, полученные, экспрессированные, созданные или выделенные любыми другими способами, в которые вовлечен сплайсинг последовательностей генов иммуноглобулинов человека с другими последовательностями ДНК. Такие рекомбинантные человеческие антитела могут иметь вариабельные и константные области, полученные из последовательностей иммуноглобулинов зародышевой линии человека (смотрите Kabat, E. A. с соавторами (1991), Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Однако в некоторых вариантах такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или, в том случае, когда используют животного, трансгенного по последовательностям Ig человека, соматическому мутагенезу in vivo), и поэтому аминокислотные последовательности областей VH и VL рекомбинантных антител представляет собой последовательности, которые, хотя и получены из последовательностей VH и VL зародышевой линии человека и являются родственными таким последовательностям, могут не существовать в природе в репертуаре человеческих антител зародышевой линии in vivo.
Оба термина, «связывающее IgG4-средство» или «связывающее средство, содержащее, по меньшей мере, часть Fc-области IgG4», относятся к связывающим средствам, описанным в настоящей публикации, которые содержат, по меньшей мере, фрагмент Fc IgG4. В некоторых вариантах фрагмент содержит 10, 20, 30, 40, 50, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210 или 220 аминокислот Fc-области IgG4. В других вариантах фрагмент содержит 10-50, 50-100, 100-150 или 150-200 аминокислот Fc-области IgG4. В других вариантах часть Fc-области IgG4 может иметь некоторую гомологию с Fc-областью IgG4. Например, связывающее IgG4-средство может включать в себя часть белка с гомологией по отношению к Fc-области IgG4, составляющей более чем 50, 60, 70, 80, 90, 93, 95, 96, 97, 98, 99 или 100%. Примеры Fc-областей IgG4 описаны на протяжении настоящего описания.
Термин «тяжелая цепь» при использовании в отношении антитела относится к пяти разным типам, называемым альфа (α), дельта (Δ), эпсилон (ε), гамма (γ) и мю (μ), основанным на аминокислотной последовательности константного домена тяжелой цепи. Указанные отличающиеся типы тяжелых цепей хорошо известны в данной области и обуславливают пять классов антител, IgA, IgD, IgE, IgG и IgM, соответственно, включая четыре подкласса IgG, а именно IgG1, IgG2, IgG3 и IgG4. В некоторых вариантах тяжелая цепь представляет собой тяжелую цепь человека.
«Гуманизированные» формы антител животных, отличных от человека (например, мыши), являются химерными иммуноглобулинами, цепями иммуноглобулинов или их фрагментами (такими как Fv, Fab, Fab’, F(ab’)2 или другие связывающие мишень подпоследовательности антител), которые содержат последовательности, полученные из иммуноглобулина животного, отличного от человека, по сравнению с человеческим антителом. В общем, гуманизированное антитело будет содержат существенную часть одного и обычно двух вариабельных доменов, в которых все или большинство CDR-областей соответствуют CDR-областям иммуноглобулина животного, отличного от человека, и все или большинство FR-областей являются FR-областями матричной последовательности иммуноглобулина человека. Гуманизированное антитело также может содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно часть выбранной матрицы иммуноглобулина человека. В общем, целью является получение молекулы антитела, которая является минимально иммуногенной для человека. Таким образом, вероятно одна или несколько аминокислот в одной или нескольких CDR также могут быть заменены на аминокислоту, которая является менее иммуногенной для человека-хозяина, по существу без снижения функции специфичного связывания одной или нескольких CDR по отношению к CXCR5 или CXCL13. Альтернативно, FR могут быть FR животного, отличного от человека, но наиболее иммуногенные аминокислоты заменяют менее иммуногенными аминокислотами. Однако прививка CDR, которая осуждается выше, не является единственным способом получения гуманизированного антитела. Например, модификация только CDR-областей может быть недостаточной, так как нередко каркасные остатки играют роль в определении трехмерной структуры петель CDR и общей аффиности антитела по отношению к его лиганду. Следовательно, на практике можно осуществить любые способы, чтобы модифицировать исходную молекулу антитела животного, отличного от человека так, чтобы она была менее иммуногенной для человека, и глобальная идентичность последовательности с человеческим антителом не всегда является обязательной. Таким образом, гуманизацию также можно осуществлять, например, лишь заменой только нескольких остатков, в частности, остатков, которые экспонированы на молекуле антитела, а не погружены в молекуле и, следовательно, не являются легко доступными для иммунной системы хозяина. Такой способ описан в настоящей публикации в отношении замены «подвижных» или «гибких» остатков на молекуле антитела, при этом целью является снижение или ослабление иммуногенности полученной в результате молекулы, не затрагивая специфичности антитела по отношению к его эпитопу или детерминанте. Смотрите, например, Studnicka et al., Prot Eng 7(6)805-814, 1994; Mol Imm 44:1986-1988, 2007; Sims et al., J Immunol 151:2296 (1993); Chothia et al., J Mol Biol 196:901 (1987); Carter et al., Proc Natl Acad Sci USA 89:4285 (1992); Presta et al., J Immunol 151:2623 (1993), WO 2006/042333 и патент США № 5869619.
«Изолированное» или «очищенное» связывающее средство, такое как антитело, по существу не содержит клеточного материала или других примесных белков из клеточного или тканевого источника, из которого получено связывающее средство, или по существу не содержит химических предшественников или других химических веществ в случае химического синтеза. Например, выражение «по существу не содержит клеточного материала» включает препараты антитела, в которых антитело отделено от клеточных компонентов клеток, из которых оно выделено или рекомбинантно получено. Таким образом, антитело, которое по существу не содержит клеточного материала, включает препараты антитела, содержащие менее чем примерно 30%, 20%, 10% или 5% (в расчете на сухую массу) гетерологичного белка (также называемого в настоящем описании «загрязняющим белком»). Когда антитело получают основанным на рекомбинации способом, также желательно, чтобы оно по существу не содержало культуральной среды, т.е., чтобы культуральная среда составляла менее чем примерно 20%, 10% или 5% от объема препарат белка. Когда антитело получают в результате химического синтеза, в некоторых вариантах оно по существу не содержит химических предшественников или других химических веществ, т.е., оно отделено от химических предшественников или других химических веществ, которые вовлечены в синтез белка. Соответственно, такие препараты антитела содержат менее чем примерно 30%, 20%, 10%, 5% (в расчете на сухую массу) химических предшественников или соединений, отличных от представляющего интерес антитела. В некоторых вариантах анти-LIGHT- или анти-CXCR5-антитела являются выделенными или очищенными.
Термины «LIGHT человека», «hLIGHT» или «полипептид hLIGHT» и сходные термины относятся к полипептидам («полипептиды», «пептиды» и «белки» используют в настоящем описании взаимозаменяемо), содержащим аминокислотную последовательность SEQ ID NO:9, и родственным полипептидам, включая их SNP-варианты. В некоторых вариантах родственные полипептиды включают аллельные варианты (например, SNP-варианты); варианты сплайсинга; фрагменты; производные; варианты с заменой, делецией и инсерцией; слитые полипептиды; и межвидовые гомологи, которые сохраняют активность LIGHT и/или достаточны для того, чтобы вызвать иммунный анти-LIGHT-ответ. Также включены растворимые формы LIGHT, которые достаточны для того, чтобы вызвать иммунологический анти-LIGHT-ответ. Как будет понятно специалистам в данной области, связывающее анти-LIGHT-средство, такое как антитело, может связываться с полипептидом LIGHT, полипептидным фрагментом, антигеном и/или эпитопом, так как эпитоп является частью более крупного антигена, который является частью более крупного полипептидного фрагмента, который в свою очередь является частью более крупного полипептида. hLIGHT может существовать в тримерной (нативной) или мономерной (денатурированной) форме.
Термины «CXCR5 человека», «hCXCR5» или «полипептид hCXCR5» и сходные термины относятся к полипептидам («полипептиды», «пептиды» и «белки» используют в настоящем описании взаимозаменяемо), содержащим аминокислотную последовательность SEQ ID NO:14, и родственным полипептидам, включая их SNP-варианты. В некоторых вариантах родственные полипептиды включают аллельные варианты (например, SNP-варианты); варианты сплайсинга; фрагменты; производные; варианты с заменой, делецией и инсерцией; слитые полипептиды; и межвидовые гомологи, которые сохраняют активность CXCR5 и/или достаточны для того, чтобы вызвать иммунный анти- CXCR5-ответ. Также включены растворимые формы CXCR5, которые достаточны для того, чтобы вызвать иммунологический анти-CXCR5-ответ. Как будет понятно специалистам в данной области, связывающее анти-CXCR5-средство, такое как антитело, может связываться с полипептидом CXCR5, полипептидным фрагментом, антигеном и/или эпитопом, так как эпитоп является частью более крупного антигена, который является частью более крупного полипептидного фрагмента, который в свою очередь является частью более крупного полипептида.
Термин «нумерация согласно Кабату» и подобные термины известны в данной области и относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е., гипервариабельными), чем другие аминокислотные остатки в вариабельной области тяжелой и легкой цепей антитела или его антигенсвязывающей части (Kabat et al. (1971) Ann. NY Acad. Sci. 190:382-391 and, Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242).
В случае вариабельной области тяжелой цепи гипервариабельная область обычно находится в диапазоне от 31 до 35 положения аминокислот для CDR1, от 50 до 65 положения аминокислот для CDR2 и от 95 до 102 положения аминокислот для CDR3. В случае вариабельной области легкой цепи гипервариабельная область обычно находится в диапазоне от 24 до 34 положения аминокислот для CDR1, от 50 до 56 положения аминокислот для CDR2 и от 89 до 97 положения аминокислот для CDR3.
Термин «легкая цепь» при использовании в отношении антитела относится к двум разным типам, называемым каппа (κ) или лямбда (λ), на основании аминокислотной последовательности константных доменов. Аминокислотные последовательности легкой цепи хорошо известны в данной области. В некоторых вариантах легкая цепь представляет собой легкую цепь человека.
Термины «контролировать», «осуществлять контроль» и «контроль» относятся к полезному эффекту, который получает субъект в результате терапии (например, профилактическим или терапевтическим средством), который не приводит к излечению инфекции. В некоторых вариантах субъекту вводят одно или несколько терапевтических средств (например, профилактических или терапевтических средств, таких как препарат согласно изобретению), чтобы «контролировать» заболевание, опосредованное LIGHT (например, хроническое заболевание кишечника, IBD, болезнь Крона, язвенный колит или GVHD) или CXCR5-опсоредованное заболевание (например, ревматоидный артрит), один или несколько их симптомов, для того, чтобы предотвратить прогрессирование или ухудшение состояния при заболевании.
Термин «моноклональное антитело» относится к антителу, полученному из популяции гомогенных или по существу гомогенных антител, и каждое моноклональное антитело обычно будет узнавать один эпитоп антигена. В некоторых вариантах «моноклональное антитело» представляет собой антитело, продуцируемое одной гибридомой или другой клеткой. Термин «моноклональное» не ограничен каким-либо конкретным способом получения антитела. Например, моноклональные антитела могут быть получены способом, основанным на гибридомах, который описан в Kohler с соавторами (Nature, 256: 495 (1975)), или могут быть выделены из фаговых библиотек. Другие способы получения клональных клеточных линий и экспрессируемых ими моноклональных антител хорошо известны в данной области (смотрите, например, главу 11 в: Short Protocols in Molecular Biology, (2002) 5th Ed., Ausubel et al., eds., John Wiley and Sons, New York).
Термин «фармацевтически приемлемый означает одобренный контролирующим органом федерального правительства или правительства штата или указанный в списке в фармакопее США, Европейской фармакопее или других общеизвестных фармакопеях для применения на животных и более конкретно на человека.
Под «фармацевтически приемлемым эксципиентом» подразумевают любое инертное вещество, которое объединяют с активной молекулой, такой как моноклональное антитело, для получения отвечающей требованиям или удобной дозированной формы. «Фармацевтически приемлемый эксципиент» представляет собой эксципиент, который является нетоксичным для реципиентов в используемых дозах и концентрациях и совместим с другими ингредиентами препарата, содержащего моноклональное антитело.
Термины «предотвращать», «предотвращение» и «профилактика» относятся к полному или частичному ингибированию развития, рецидива, появления или распространения LIGHT-опосредованного или CXCR5-опосредованного заболевания и/или связанного с ним симптома, которое является результатом введения терапевтического средства или сочетания терапевтических средств, предлагаемых в настоящем изобретении (например, сочетания профилактических или терапевтических средств, таких как препарат согласно изобретению).
Термин «профилактическое средство» относится к любому средству, которое может полностью или частично ингибировать развитие, рецидив, появление или распространение LIGHT-опосредованного или CXCR5-опосредованного заболевания и/или связанного с ним симптома у субъекта. В некоторых вариантах термин «профилактическое средство» относится к препарату согласно изобретению. В некоторых других вариантах термин «профилактическое средство» относится к другому средству, отличному от препарата согласно изобретению. В некоторых вариантах профилактическим средством является средство, которые, как известно, является применимым или применялось или применяется в настоящее время для профилактики LIGHT-опосредованного или CXCR5-опосредованного заболевания и/или связанного с ним симптома или препятствует появлению, развитию, прогрессированию и/или снижает тяжесть LIGHT-опосредованного или CXCR5-опосредованного заболевания и/или связанного с ним симптома. В конкретных вариантах профилактическим средством является полностью человеческое анти-LIGHT-антитело, такое как полностью человеческое моноклональное анти-LIGHT-антитело или гуманизированное анти-CXCR5-антитело, такое как гуманизированное моноклональное анти-CXCR5-антитело.
Термин «антиген LIGHT» относится к такой части полипептида LIGHT, с которой специфично связывается связывающее средство, такое как антитело. Антиген LIGHT также относится к аналогу или производному полипептида LIGHT или его фрагмента, с которые специфично связывается связывающее средство, такое как антитело. В некоторых вариантах антиген LIGHT является мономерным антигеном LIGHT или тримерным антигеном LIGHT. Область полипептида LIGHT, вносящего вклад в эпитоп, может представлять собой область, образованную соседними аминокислотами полипептида, или эпитоп может быть образован двумя или более областями полипептида, которые не являются соседними областями в полипептиде. Эпитоп может являться или может не являться трехмерным поверхностным признаком антигена. Локализованная область на поверхности антигена LIGHT, которая способна вызывать иммунный ответ, представляет собой эпитоп LIGHT. Эпитоп может являться трехмерным поверхностным признаком антигена или не являться таковым.
Термин «антиген CXCR5» относится к такой части полипептида CXCR5, с которой специфично связывается связывающее средство, такое как антитело. Антиген CXCR5 также относится к аналогу или производному полипептида CXCR5 или его фрагмента, с которые специфично связывается связывающее средство, такое как антитело. Область полипептида CXCR5, вносящего вклад в эпитоп, может представлять собой область, образованную соседними аминокислотами полипептида, или эпитоп может быть образован двумя или более областями полипептида, которые не являются соседними областями в полипептиде. Эпитоп может являться или может не являться трехмерным поверхностным признаком антигена. Локализованная область на поверхности антигена CXCR5, которая способна вызывать иммунный ответ, представляет собой эпитоп CXCR5. Эпитоп может являться трехмерным поверхностным признаком антигена или не являться таковым.
Термины «заболевание, опосредованное LIGHT» и «расстройство, опосредованное hLIGHT» используют взаимозаменяемо, и они относятся к любому заболеванию, которое полностью или частично вызвано или является результатом влияния LIGHT. В некоторых вариантах LIGHT аномально (например, в высокой степени) экспрессируется на поверхности клетки. В некоторых вариантах LIGHT может подвергаться аномальной повышающей регуляции в конкретном типе клеток. В других вариантах нормальная, аномальная или избыточная передача сигналов в клетке вызвана связыванием LIGHT с лигандом LIGHT. В некоторых вариантах лигандом LIGHT является рецептор LIGHT (например, HVEM, LTβR или DCR3), например, рецептор, который экспрессируется на поверхности клетки, такой как эпителиальная клетка ободочной кишки. В некоторых вариантах заболеванием, опосредованным LIGHT, является хроническое заболевание кишечника, воспалительное заболевание кишечника (IBD), такое как болезнь Крона (CD) или язвенный колит (UC). В других вариантах заболеванием, опосредованным LIGHT, является болезнь «трансплантат против хозяина» (GVHD).
Термины «заболевание, опосредованное CXCR5» и «расстройство, опосредованное CXCR5» используют взаимозаменяемо, и они относятся к любому заболеванию, которое полностью или частично вызвано или является результатом влияния CXCR5. В некоторых вариантах CXCR5 аномально (например, в высокой степени) экспрессируется на поверхности клетки. В некоторых вариантах CXCR5 может подвергаться аномальной повышающей регуляции в конкретном типе клеток. В других вариантах нормальная, аномальная или избыточная передача сигналов в клетке вызвана связыванием CXCR5 с лигандом CXCR5. В некоторых вариантах лигандом CXCR5 является CXCL13. В некоторых вариантах заболеванием, опосредованным CXCR5, является ревматоидный артрит (RA).
Термин «сахарид» относится к классу молекул, которые являются производными многоатомных спиртов. Сахариды обычно называют углеводами, и они могут содержать разные количества единиц сахара (сахарида), например, моносахариды, дисахариды и полисахариды.
Термины «специфично связывается» или «специфичное связывание» означают специфичное связывание с антигеном или его фрагментом и неспецифичное связывание с другими антигенами. Например, антитело, которое специфично связывается с антигеном, может связываться с другими пептидами или полипептидами с более низкой аффинностью, которую определяют, например, используя радиоиммуноанализы (РИА), твердофазные иммуноферментные анализы (ELISA), BIACORE или другие анализы, известные в данной области. Антитела или их варианты или фрагменты, которые специфично связываются с антигеном, могут быть перекрестно реактивными по отношению к родственным антигенам. В некоторых вариантах антитела или их варианты или фрагменты, которые специфично связываются с антигеном, перекрестно не взаимодействуют с другими антигенами. Антитело или его вариант илиа фрагмент, который специфично связывается с антигеном LIGHT или CXCR5, может быть идентифицирован, например, с использованием иммуноанализов, BIAcore или других способов, известных специалистам в данной области. Обычно специфичное или избирательное взаимодействие будет давать сигнал, превышающий фоновый сигнал или шум, по меньшей мере, в два раза и более обычно превышающий фон более чем в 10 раз. Обсуждение, имеющее отношение к специфичности антител, смотрите, например, в Paul, ed., 1989, Fundamental Immunology Second Edition, Raven Press, New York, 332-336.
«Стабильный» или «стабилизированный» препарат представляет собой препарат, в котором связывающее средство, такое как антител согласно настоящему изобретению, по существу сохраняет свою физическую стабильность, идентичность, целостность и/или химическую стабильность, идентичность, целостность, и/или биологическую активность при хранении. Различные аналитические способы измерения стабильности белка доступны в данной области, и обзор приведен, например, в публикации Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991), и в публикации Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность может быть измерена при выбранной температуре и других условиях хранения в течение выбранного периода времени. Стабильность можно определить, по меньшей мере, одним из способов, выбранным из группы, состоящей из визуального осмотра, SDS-ПААГ, IEF, HPSEC, RFFIT и ELISA каппа/лямбда. Например, антитело «сохраняет свою физическую стабильность» в фармацевтическом препарате, если в нем не наблюдают признаков агрегации, преципитации и/или денатурации при визуальном осмотре окраски и/или прозрачности или в случае измерения УФ-светорассеяния, в SDS-ПААГ или с использованием эксклюзионной хроматографии по размеру (высокого давления) (HPSEC). В некоторых вариантах в случае применения препаратов согласно изобретению 5% или меньше, обычно 4% или меньше, обычно 3% или меньше, более обычно 2% или меньше и, в частности, 1% или меньше антител образуют агрегаты, судя по измерения с использованием HPSEC или любого другого подходящего способа измерения образования агрегатов. Например, антитело считают стабильным в конкретном препарате, если мономер антитела имеет чистоту примерно 90%, обычно примерно 95%, в частности, примерно 98% после некоторого предварительно определяемого периода времени в определенных условиях хранения в конкретном препарата. Химическую стабильность можно оценить, выявляя и количественно определяя химически измененные формы белка. Химическое изменение может включать в себя модификацию по размеру (например, урезание), которую можно оценить, используя, например, (HP)SEC, SDS-ПААГ и/или времяпролетную масс-спектрометрию с матрично-активируемой лазерной десорбцией/ионизацией (MALDI/TOF MS). Другие типы химического изменения включают изменение заряда (например, возникающее в результате дезамидирования), которое можно оценить, например, ионообменной хроматографией. Антитело «сохраняет свою биологическую активность» в фармацевтическом препарате в данный момент времени, если биологическая активность антитела в данный момент времени составляет, по меньшей мере, примерно 90% (в пределах ошибок анализа) от биологической активности, наблюдаемой в момент получения фармацевтического препарата, которую определяют, например, в анализе связывания антигена или в анализе нейтрализации вируса.
Термины «субъект» и «пациент» используют взаимозаменяемо. В используемом в настоящем описании смысле субъектом обычно является млекопитающее, такое как млекопитающее, не относящееся к приматам (например, коровы, свиньи, лошади, кошки, собаки, крысы и т.д.), или примат (например, обезьяна и человека) и в некоторых вариантах человек. В одном варианте субъектом является млекопитающее, такое как человек, имеющий опосредованное LIGHT или опосредованное CXCR5 заболевание. В другом варианте субъектом является млекопитающее, такое как человек, для которого существует риск развития опосредованного LIGHT или опосредованного CXCR5 заболевания.
Термин «терапевтически эффективное количество» относится к количеству терапевтического средства (например, препарата согласно изобретению), которое достаточно для снижения и/или ослабления тяжести и/или продолжительности данного заболевания и/или родственного ему симптома. Такой термин также охватывает количество, необходимое для уменьшения или ослабления развития или прогрессирования данного заболевания, уменьшения или ослабления рецидива, развития или возникновения данного заболевания, и/или для улучшения или усиления профилактического или терапевтического эффекта(-ов) другого терапевтического средства (например, терапевтического средства, отличного от препарата согласно изобретению). В некоторых вариантах терапевтически эффективное количество антитела согласно изобретению составляет от примерно 0,1 мг/кг (мг антитела на кг массы субъекта) до примерно 100 мг/кг. В некоторых вариантах терапевтически эффективное количество антитела, предлагаемого в настоящем изобретении, составляет примерно 0,1 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, 3 мг/кг, 5 мг/кг, примерно 10 мг/кг, примерно 15 мг/кг, примерно 20 мг/кг, примерно 25 мг/кг, примерно 30 мг/кг, примерно 35 мг/кг, примерно 40 мг/кг, примерно 45 мг/кг, примерно 50 мг/кг, примерно 60 мг/кг, примерно 70 мг/кг, примерно 80 мг/кг примерно 90 мг/кг или примерно 100 мг/кг (или количество в диапазоне между указанными значениями). В некоторых вариантах «терапевтически эффективное количество» в используемом в настоящем описании смысле также относится к количеству антитела согласно изобретению, необходимому для достижения конкретного результата (например, ингибирования биологической активности LIGHT в клетке, такого как ингибирование секреции CCL20, IL-8 или RANTES из клетки; или ингибирования биологической активности CXCR5 в клетке, такой как связывание с CXCL13).
Термин «терапевтическое средство» относится к любому средству, которое можно использовать для лечения, оказания помощи или ослабления LIGHT-опосредованного или CXCR5-опосредованного заболевания и/или связанного с ним симптома. В некоторых вариантах термин «терапевтическое средство» относится к препарату согласно изобретению. В некоторых других вариантах термин «терапевтическое средство» относится к другому средству, отличному от препарата согласно изобретению. Предпочтительно терапевтическим средством является средство, которое, как известно, полезно или было использовано или используется в настоящее время для лечения, оказания помощи или ослабления LIGHT-опосредованного или CXCR5-опосредованного заболевания или одного или нескольких связанных с ним симптомов.
Термин «терапия» относится к любому протоколу, способу и/или средству, которые можно использовать для профилактики, контролирования, лечения и/или ослабления заболевания, опосредованного LIGHT (например, IBD или GVHD), или заболевания, опосредованного CXCR5 (например, ревматоидного артрита). В некоторых вариантах термины «средства терапии» и «терапия» относятся к биологической терапии, поддерживающей терапии и/или другим способам терапии, применимым для профилактики, контролирования, лечения и/или ослабления заболевания, опосредованного LIGHT, или заболевания, опосредованного CXCR5, известным специалисту в данной области, например медицинскому персоналу.
Термины «лечить», «лечение» и «процесс лечения» относятся к уменьшению или ослаблению прогрессирования, тяжести и/или продолжительности опосредованного LIGHT заболевания (например, хронического заболевания кишечника, IBD или GVHD) или опосредованного CXCR5 заболевания (например, ревматоидного артрита) в результате введения одного или нескольких средств лечения (включая без ограничения введение одного или нескольких терапевтических средств (включая без ограничения введение одного или нескольких профилактических или терапевтических средств, таких как препарат согласно изобретению). В конкретных вариантах в случае LIGHT такие термины относятся к уменьшению или ингибированию связывания LIGHT с HVEM, уменьшению или ингибированию связывания LIGHT с LTβR, уменьшению или ингибированию связывания LIGHT с DcR3, уменьшению или ингибированию продукции или секреции CCL20 из клетки субъекта, экспрессирующей рецептор LIGHT, уменьшению или ингибированию продукции или секреции IL-8 из клетки субъекта, экспрессирующей рецептор LIGHT, уменьшению или ингибированию продукции или секреции RANTES из клетки субъекта, экспрессирующей рецептор LIGHT, и/или ингибированию или уменьшению одного или нескольких симптомов, связанных с заболеванием, опосредованным LIGHT, таким как хроническое заболевание кишечника, IBD или GVHD. В конкретных вариантах в случае CXCR5 такие термины относятся к уменьшению или ингибированию связывания CXCR5 с CXCL13 и/или ингибированию или уменьшению одного или нескольких симптомов, ассоциированных с опосредованным CXCR5 заболеванием, таким как ревматоидный артрит.
Термин «вариабельная область» или «вариабельный домен» относится к части легких и тяжелых цепей, обычно примерно к 120-130 аминоконцевым аминокислотам в тяжелой цепи и примерно 100-110 аминокислотам в легкой цепи, которые сильно отличаются по последовательности в разных антителах и используются в связывании и обеспечении специфичности каждого конкретного антитела по отношению к его конкретному антигену. Вариабельность последовательностей сконцентрирована в областях, называемых областями, определяющими комплементарность (CDR), тогда как более консервативные области в вариабельном домене называют каркасными областями (FR). CDR легких и тяжелых цепей главным образом ответственны за взаимодействие антитела с антигеном. Нумерация положений аминокислот, используемая в настоящем описании, соответствует EU Index, как описано в публикации Kabat с соавторами (1991) Sequences of proteins of immunological interest (U.S. Department of Health and Human Services, Washington, D. C.) 5th ed. («Kabat с соавторами»). В предпочтительных вариантах вариабельная область является вариабельной областью человека.
B. Препараты и компоненты препаратов
Как указано ранее, неожиданно были открыты препараты согласно изобретению в форме жидкостей и лиофилизированных порошков, которые содержат связывающее IgG4-средство и цитратный буфер, при этом pH препарата находится на уровне или ниже как значения pH около 6, так и значения изоэлектрической точки (pI) связывающего средства. Препараты согласно изобретению в значительной степени улучшены по сравнению с обычными препаратами связывающего IgG4-средства (например, препаратами на основе фосфатно-солевого буфера (PBS)), которые образуют нежелательные побочные продукты при увеличении концентрации связывающего средства в препарате. В частности, препараты согласно изобретению имеют уменьшенное количество агрегатов, полумолекул, продуктов распада, низкомолекулярных белков (LMWP), высокомолекулярных белков (HMWP) и перераспределение кислых, основных и нейтральных изоформ связывающего средства в препаратах.
i. Связывающие анти-LIGHT-средства и их варианты и фрагменты
В некоторых вариантах препараты согласно изобретению включают в себя связывающее анти-LIGHT-средство. Связывающие средства могут представлять собой любую молекулу, такую как антитело, миРНК, нуклеиновая кислота, аптамер, белок или низкомолекулярное органическое соединение, которое связывается или специфично связывается с LIGHT, или их вариант или фрагмент. В некоторых вариантах связывающее средство представляет собой анти-LIGHT-антитело или его вариант или его антигенсвязывающий фрагмент. Анти-LIGHT-антитела специфично связываются с белком LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), полипептидным фрагментом или эпитопом. Молекула LIGHT может быть получена из любого вида. В некоторых вариантах молекула LIGHT получена от человека, и в данном случае известна как «hLIGHT». hLIGHT имеет следующую аминокислотную последовательность, которая указана в виде SEQ ID NO:9:
1 MEESVVRPSV FVVDGQTDIP FTRLGRSHRR QSCSVARVGL GLLLLLMGAG 51 LAVQGWFLLQ LHWRLGEMVT RLPDGPAGSW EQLTQERRSH EVNPAAHLTG 101 ANSSLTGSGG PLLWETQLGL AFLRGLSYHD GALVVTKAGY YYIYSKVQLG 150 GVGCPLGLAS TITHGLYKRT PRYPEELELL VSQQSPCGRA TSSSRVWWDS 200 SFLGGVVHLE AGEEVVVRVL DERLVRLRDG TRSYFGAFMV (SEQ ID NO: 9).
В некоторых иллюстративных вариантах анти-LIGHT-антитело является гуманизированным антителом, полностью человеческим антителом или его вариантом или его антигенсвязывающим фрагментом. В некоторых вариантах анти-LIGHT-антитела предотвращают связывание LIGHT с его рецепторами и ингибируют биологическую активность LIGHT (например, LIGHT-опосредованную продукцию или секрецию CCL20, IL-8 или RANTES из клеток, экспрессирующих лиганд LIGHT, такой как рецептор LIGHT рецептор (например, HVEM, LTpR и/или DcR3).
В некоторых конкретных вариантах анти-LIGHT-антитело содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность любой одной или нескольких из следующих определяющих комплементарность областей (CDR):
HCDR1 - GYNWH (SEQ ID NO:1);
HCDR2 - EITHSGSTNYNPSLKS (SEQ ID NO:2); или
HCDR3 - EIAVAGTGYYGMDV (SEQ ID NO:3).
В других конкретных вариантах анти-LIGHT-антитело содержит вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность любой одной или нескольких из следующих определяющих комплементарность областей (CDR):
LCDR1 - RASQGINSAFA (SEQ ID NO:4);
LCDR2 - DASSLES (SEQ ID NO:5); или
LCDR3 - QQFNSYPLT (SEQ ID NO:6).
В одном конкретном варианте анти-LIGHT-антитело содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотные последовательности SEQ ID NO:1, 2 и 3.
В другом конкретном варианте анти-LIGHT-антитело содержит вариабельную область легкой цепи (VL), содержащую аминокислотные последовательности SEQ ID NO:4, 5 и 6.
В более конкретных вариантах анти-LIGHT-антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотные последовательности SEQ ID NO:1, 2 и 3; и вариабельную область легкой цепи, содержащую аминокислотные последовательности SEQ ID NO:4, 5 и 6.
В конкретных вариантах анти-LIGHT-антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7:


Положения 1-122: вариабельная область тяжелой цепи (VH). CDR (определяющие комплементарность области согласно определению Кабата) подчеркнуты.
Положения 123-448: константная область IgG4 человека (SwissProt IGHG4_HUMAN с двумя мутациями S241P и L248E, согласно нумерации по Кабату).
В других конкретных вариантах анти-LIGHT-антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8:

Положения 1-107: вариабельная область легкой цепи (VL). CDR (определяющие комплементарность области согласно определению Кабата) подчеркнуты.
Положения 108-214: константная область Cκ человека.
В следующих вариантах анти-LIGHT-антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8.
В некоторых вариантах анти-LIGHT-антитело содержит тяжелую цепь, полученную из аминокислотной последовательности SEQ ID NO:10, которая может кодироваться последовательностью нуклеиновой кислоты SEQ ID NO:11.



Аминокислоты 1-19: сигнальный пептид.
Аминокислоты 20-141: вариабельная область (VH) 124F19k2.
Аминокислоты 142-конец: константная область hIgG4 PE.
Нуклеиновые кислоты 1-57: нуклеиновые кислоты, кодирующие сигнальный пептид.
Нуклеиновые кислоты 58-423: нуклеиновые кислоты, кодирующие вариабельную область (VH) 124F19k2.
Нуклеиновые кислоты 424-конец: нуклеиновые кислоты, кодирующие константную область hIgG4 PE.
В альтернативных конкретных вариантах анти-LIGHT-антитело содержит легкую цепь, полученную из аминокислотной последовательности SEQ ID NO:12, которая может кодироваться последовательностью нуклеиновой кислоты SEQ ID NO:13.


Аминокислоты 1-22: сигнальный пептид.
Аминокислоты 23-129: вариабельная область (VL) 124F19k2/
Аминокислоты 130-конец: константная область hKappa.
Нуклеиновые кислоты 1-66: нуклеиновые кислоты, кодирующие сигнальный пептид.
Нуклеиновые кислоты 67-387: нуклеиновые кислоты, кодирующие вариабельную область (VL) 124F19k2.
Нуклеиновые кислоты 388-конец: нуклеиновые кислоты, кодирующие константную область hKappa.
В одном варианте осуществления изобретения анти-LIGHT-антитело является полностью человеческим антителом. Примеры изотипов полностью человеческих антител включают IgA, IgD, IgE, IgG и IgM. В некоторых вариантах анти-LIGHT-антитело является IgG-антителом. Существуют четыре формы IgG. В некоторых вариантах анти-LIGHT-антитело является IgG4-антителом. В некоторых вариантах осуществления изобретения анти-LIGHT-антитело является полностью человеческим IgG4-антителом.
В некоторых вариантах анти-LIGHT-антитело, кроме того, содержит константную область, например, константную область IgG человека. В некоторых вариантах константная область представляет собой константную область IgG4 человека. В дополнительных вариантах константная область представляет собой модифицированную константную область IgG4 человека. В других вариантах константная область представляет собой константную область Cκ человека.
В некоторых вариантах осуществления изобретения анти-LIGHT-антитело является полностью человеческим IgG4-анти-LIGHT-антителом, содержащим тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8 («лидирующее LIGHT-антитело»). В альтернативных вариантах осуществления изобретения анти-LIGHT-антитело является полностью человеческим IgG4-анти-LIGHT-антителом, содержащим вариабельную область тяжелой цепи и вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи содержит 3 определяющих комплементарность области (CDR), содержащих аминокислотные последовательности SEQ ID NO:1, 2 и 3, и вариабельная область легкой цепи содержит 3 CDR, содержащих аминокислотные последовательности SEQ ID NO:4, 5 и 6. Идентификация, выделение, приготовление и характеристика анти-LIGHT-антител, включая анти-LIGHT-антитело, содержащее аминокислотную последовательность тяжелой цепи, содержащую последовательность SEQ ID NO:7, и аминокислотную последовательность легкой цепи, содержащую последовательность SEQ ID NO:8, были подробно описаны в патенте США № 8058402, соответствующем публикации PCT WO 2008/027338, которые включены в настоящее описание в виде ссылки.
Некоторые варианты препаратов согласно изобретению также включают в себя варианты связывающих анти-LIGHT-средств, таких как антитела. В частности, препараты согласно изобретению могут содержать варианты анти-LIGHT-антитела, которое является полностью человеческим IgG4-анти-LIGHT-антителом, содержащим тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8. Варианты анти-LIGHT-антитела могут иметь сходные физико-химические свойства на основании их высокого сходства, и поэтому также включены в объем изобретения. Варианты определяют как антитела с аминокислотной последовательностью, которая, по меньшей мере, на 95%, по меньшей мере, на 97%, например, по меньшей мере, на 98% или 99% гомологичны анти-LIGHT-антителу и способны конкурировать за связывание с полипептидом LIGHT, фрагментом полипептида LIGHT или эпитопом LIGHT. В некоторых вариантах осуществления изобретения варианты будут ослаблять, нейтрализовать или иным образом ингибировать биологическую активность LIGHT (например, LIGHT-опосредованную продукцию или секрецию CCL20, IL-8 или RANTES из клеток, экспрессирующих лиганд LIGHT, такой как рецептор LIGHT (например, HVEM, LTpR и/или DcR3). Определение конкуренции за связывание с мишенью можно осуществить обычными способами, известными специалисту в данной области. В некоторых вариантах осуществления изобретения варианты представляют собой человеческие антитела, и в некоторых вариантах являются молекулами IgG4. В некоторых вариантах осуществления изобретения вариант, по меньшей мере, на 95%, 96%, 97%, 98% или 99% идентичен по аминокислотной последовательности лидирующему антителу. Термин «вариант» относится к антителу, которое содержит аминокислотную последовательность, которая изменена на одну или несколько аминокислот по сравнению с аминокислотными последовательностями анти-LIGHT-антитела. Вариант может иметь консервативные модификации последовательности, включая аминокислотные замены, модификации, добавления и делеции.
Примеры модификаций включают без ограничения гликозилирование, ацетилирование, пегилирование, фосфорилирование, амидирование, дериватизацию известными защитными/блокирующими группами, протеолитическое расщепление и связывание с клеточным лигандом или другим белком. Модификации аминокислот можно вводить стандартными способами, известными в данной области, такими как сайт-специфичный мутагенез, молекулярное клонирование, сайт-специфичный мутагенез с использованием олигонуклеотидов и случайный опосредованный ПЦР мутагенез, в нуклеиновую кислоту, кодирующую антитела. Консервативные аминокислотные замены включают замены, при которых аминокислотный остаток заменяют аминокислотным остатком, имеющим сходные структурные или химические свойства. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в данной области. Такие семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан). Специалисту в данной области будет понятно, что также можно использовать другие классификации семейств аминокислотных остатков, отличные от классификации, приведенной выше. Кроме того, вариант может иметь неконсервативные аминокислотные замены, например, замену аминокислоты аминокислотным остатком, обладающим другими структурными или химическими свойствами. Сходные небольшие изменения также могут включать делеции или инсерции аминокислот или и то и другое. Руководство по определению того, какие аминокислотные остатки могут быть заменены, модифицированы, встроены или делетированы без снижения иммунологической активности, можно найти, используя компьютерные программы, хорошо известные в данной области. Можно использовать компьютерные алгоритмы, наряду с другими такие как Gap или Bestfit, которые известны специалисту в данной области, чтобы оптимально выравнивать сравниваемые аминокислотные последовательности и определять сходные или идентичные аминокислотные остатки. Варианты могут иметь такие же или другие, либо более высокие, либо более низкие, аффинности связывания по сравнению с анти-LIGHT-антителом, но при этом все еще оставаться способными специфично связываться с LIGHT, и могут иметь такую же, более высокую или более низкую биологическую активность по сравнению с активностью анти-LIGHT-антитела.
Варианты осуществления изобретения также включают антигенсвязывающие фрагменты связывающих анти-LIGHT-средств, таких как антитела. Термин «антигенсвязывающий домен», «антигенсвязывающая область», «антигенсвязывающий фрагмент» и подобные термины относятся к такой части антитела, которая содержит аминокислотные остатки, которые взаимодействуют с антигеном и придают связывающему средству специфичность и аффинность по отношению к антигену (например, области, определяющие комплементарность (CDR)). Антигенсвязывающая область может быть получена от любого вида животного, такого как грызуны (например, кролик, крыса или хомячок), и человека. В некоторых вариантах антигенсвязывающая область может иметь человеческое происхождение. Не ограничивающие примеры антигенсвязывающих фрагментов включают: Fab-фрагменты, F(ab’)2-фрагменты, Fd-фрагменты, Fv-фрагменты, одноцепочечные молекулы Fv (scFv), dAb-фрагменты и минимальные единицы узнавания, состоящие из аминокислотных остатков, которые имитируют гипервариабельную область антитела.
В некоторых вариантах осуществления изобретения связывающие анти-LIGHT-средства (или их вариант или их антигенсвязывающий фрагмент) будут ослаблять, нейтрализовать или иным образом ингибировать биологическую активность LIGHT in vivo (например, LIGHT-опосредованную продукцию или секрецию CCL20, IL-8 или RANTES из клетки, экспрессирующей рецептор LIGHT, например, HVEM, LTpR и/или DcR3).
В некоторых вариантах осуществления изобретения связывающие анти-LIGHT-средства (или их вариант или их антигенсвязывающий фрагмент) являются антагонистическими связывающими средствами, которые ослабляют, нейтрализуют или иным образом ингибируют биологическую активность LIGHT in vivo (например, LIGHT-опосредованную продукцию или секрецию CCL20, IL-8 или RANTES из клеток, экспрессирующих лиганд LIGHT, такой как рецептор LIGHT (например, HVEM, LTpR и/или DcR3).
В некоторых вариантах связывающее анти-LIGHT-средство (или его вариант или его антигенсвязывающий фрагмент) присутствует в препаратах в количестве от примерно 5 мг/мл до примерно 280 мг/мл, например, от примерно 5 мг/мл до примерно 200 мг/мл, от примерно 50 мг/мл до примерно 250 мг/мл, от примерно 100 мг/мл до примерно 250 мг/мл, от примерно 50 мг/мл до примерно 200 мг/мл и от примерно 100 мг/мл до примерно 200 мг/мл. Например, связывающее анти-LIGHT-средство может присутствовать в препарате в количестве примерно 5 мг/мл, примерно 10 мг/мл, примерно 15 мг/мл, примерно 20 мг/мл, примерно 25 мг/мл, примерно 30 мг/мл, примерно 35 мг/мл, примерно 40 мг/мл, примерно 45 мг/мл, примерно 50 мг/мл, примерно 55 мг/мл, примерно 60 мг/мл, примерно 65 мг/мл, примерно 70 мг/мл, примерно 75 мг/мл, примерно 80 мг/мл, примерно 85 мг/мл, примерно 90 мг/мл, примерно 95 мг/мл, примерно 100 мг/мл, примерно 105 мг/мл, примерно 110 мг/мл, примерно 115 мг/мл, примерно 120 мг/мл, примерно 125 мг/мл, примерно 130 мг/мл, примерно 135 мг/мл, примерно 140 мг/мл, примерно 145 мг/мл, примерно 150 мг/мл, примерно 155 мг/мл, примерно 160 мг/мл, примерно 165 мг/мл, примерно 170 мг/мл, примерно 175 мг/мл, примерно 180 мг/мл, примерно 185 мг/мл, примерно 190 мг/мл, примерно 195 мг/мл, примерно 200 мг/мл, примерно 205 мг/мл, примерно 210 мг/мл, примерно 215 мг/мл, примерно 220 мг/мл, примерно 225 мг/мл, примерно 230 мг/мл, примерно 235 мг/мл, примерно 240 мг/мл, примерно 245 мг/мл, примерно 250 мг/мл, примерно 255 мг/мл, примерно 260 мг/мл, примерно 265 мг/мл, примерно 270 мг/мл, примерно 275 мг/мл или примерно 280 мг/мл.
В альтернативных вариантах связывающее анти-LIGHT-средство может присутствовать в препарате в количестве от примерно 5 до примерно 25 мг/мл, от примерно 26 до примерно 50 мг/мл, от примерно 51 до примерно 75 мг/мл, от примерно 76 до примерно 100 мг/мл, от примерно 101 до примерно 125 мг/мл, от примерно 126 до примерно 150 мг/мл, от примерно 151 до примерно 175 мг/мл, от примерно 176 до примерно 200 мг/мл, от примерно 201 мг/мл до примерно 225 мг/мл, от примерно 226 мг/мл до примерно 250 мг/мл, от примерно 251 до примерно 280 мг/мл, от примерно 5 до примерно 10 мг/мл, от примерно 40 до примерно 60 мг/мл, от примерно 75 до примерно 85 мг/мл или от примерно 140 до примерно 160 мг/мл.
В некоторых иллюстративных вариантах связывающее анти-LIGHT-средство присутствует в препарате в количестве от примерно 50 мг/мл до примерно 170 мг/мл, от примерно 100 мг/мл до примерно 160 мг/мл, например, примерно 150 мг/мл. Альтернативно связывающее анти-LIGHT-средство присутствует в количестве примерно 50 мг/мл. В другом иллюстративном варианте полностью человеческое IgG4-анти-LIGHT антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8, присутствует в препарате в количестве, составляющем примерно 150 мг/мл.
ii. Связывающие анти-CXCR5-средства и их варианты и фрагменты
В некоторых вариантах препараты согласно изобретению включают в себя связывающее анти-CXCR5-средство. Связывающие средства могут представлять собой любую молекулу, такую как антитело, миРНК, нуклеиновая кислота, аптамер, белок или низкомолекулярное органическое соединение, которое связывается или специфично связывается с CXCR5, или их вариант или фрагмент. В некоторых вариантах связывающее средство представляет собой анти-CXCR5-антитело или его вариант или его антигенсвязывающий фрагмент. Анти-CXCR5-антитела специфично связываются с белком CXCL13 (также известным как BLC), полипептидным фрагментом или эпитопом. Молекула CXCR5 может быть получена из любого вида. В некоторых вариантах молекула CXCR5 получена от человека, и в данном случае известна как «hCXCR5». hCXCR5 имеет следующую аминокислотную последовательность, которая указана в виде SEQ ID NO:14:

В некоторых иллюстративных вариантах анти-CXCR5-антитело является гуманизированным антителом, полностью человеческим антителом или его вариантом или его антигенсвязывающим фрагментом. В некоторых вариантах анти-CXCR5-антитела предотвращают связывание CXCR5 с его лигандами и ингибируют биологическую активность CXCR5 (например, связывание CXCR5 с CXCL13).
В некоторых конкретных вариантах анти-CXCR5-антитело содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность любой одной или нескольких из следующих определяющих комплементарность областей (CDR):
HCDR1 - GFSLIDYGVN (SEQ ID NO:15);
HCDR2 - VIWGDGTTY (SEQ ID NO:16); или
HCDR3 - IVY (SEQ ID NO:17).
В других конкретных вариантах анти-CXCR5-антитело содержит вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность любой одной или нескольких из следующих определяющих комплементарность областей (CDR):
LCDR1 - RSSKSLLHSSGKTYLY (SEQ ID NO:18);
LCDR2 - RLSSLA (SEQ ID NO:19); или
LCDR3 - MQHLEYPYT (SEQ ID NO:20).
В одном конкретном варианте анти-CXCR5-антитело содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотные последовательности SEQ ID NO:15, 16 и 17.
В другом конкретном варианте анти-CXCR5-антитело содержит вариабельную область легкой цепи (VL), содержащую аминокислотные последовательности SEQ ID NO:18, 19 и 20.
В более конкретных вариантах анти-CXCR5-антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотные последовательности SEQ ID NO:15, 16 и 17; и вариабельную область легкой цепи, содержащую аминокислотные последовательности SEQ ID NO:18, 19 и 20.
В конкретных вариантах анти-CXCR5-антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:21:

В другом конкретном варианте анти-CXCR5-антитело содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:22:
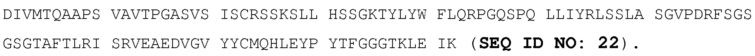
В более конкретных вариантах анти-CXCR5 антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:21; и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:22.
В некоторых вариантах анти-CXCR5-антитело, кроме того, содержит константную область, например, константную область IgG человека. В некоторых вариантах константная область представляет собой константную область IgG4 человека. В дополнительных вариантах константная область представляет собой модифицированную константную область IgG4 человека. В некоторых вариантах константная область IgG4 человека имеет следующие модификации: S241P (смотрите ниже в SEQ ID NO:23 жирным шрифтом), L248E (смотрите ниже в SEQ ID NO:23 жирным шрифтом), и не имеет концевого лизина, чтобы избежать гетерогенности. В некоторых вариантах константная область IgG4 содержит аминокислотную последовательность SEQ ID NO:23:


В других вариантах константная область представляет собой константную область Cκ человека. В некоторых вариантах константная область Cκ содержит аминокислотную последовательность SEQ ID NO:24:

В конкретных вариантах анти-CXCR5 антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25:

Положения 1-111: вариабельная область тяжелой цепи (VH). CDR (определяющие комплементарность области согласно определению Кабата) подчеркнуты.
Положения 112-432: константная область IgG4 человека (SwissProt IGHG4_HUMAN, включающая следующие модификации: S241P, L248E и отсутствие концевого лизина, чтобы избежать гетерогенности).
В других конкретных вариантах анти-CXCR5-антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26:

Положения 1-112: вариабельная область легкой цепи (VL). CDR (определяющие комплементарность области, согласно определению Кабата) подчеркнуты.
Положения 113-182: константная область Cκ человека.
В следующих вариантах анти-CXCR5 антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26.
В некоторых вариантах анти-CXCR5-антитело, кроме того, содержит лидерную последовательность. Лидерная последовательность в некоторых вариантах содержит аминокислотную последовательность длиной 1-30 аминокислот, например 25-25 аминокислот, и обычно 19 аминокислот. Тяжелая цепь, легкая цепь или обе, и тяжелая и легкая цепь, могут содержать лидерную последовательность. В некоторых вариантах лидерная последовательность содержит аминокислотную последовательность SEQ ID NO:16: MGWSCIILFLVATATGVHS (SEQ ID NO:27).
В конкретных вариантах анти-CXCR5 антитело содержит тяжелую цепь, полученную из аминокислотной последовательности SEQ ID NO:28:

Положения 1-19: лидерная последовательность.
Положения 20-130: вариабельная область тяжелой цепи (VH). CDR (определяющие комплементарность области, согласно определению Кабата) подчеркнуты.
Положения 131-456: константная область IgG4 человека (SwissProt IGHG4_HUMAN, включающая следующие модификации: S241P, L248E и отсутствие концевого лизина, чтобы избежать гетерогенности).
В других конкретных вариантах анти-CXCR5 антитело содержит легкую цепь, полученную из аминокислотной последовательности SEQ ID NO:29:

Положения 1-19: лидерная последовательность.
Положения 20-131: вариабельная область легкой цепи (VL). CDR (определяющие комплементарность области, согласно определению Кабата) подчеркнуты.
Положения 132-238: константная область Cκ человека.
В следующих вариантах анти-CXCR5-антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:28, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:29.
В некоторых вариантах осуществления изобретения анти-CXCR5-антитело представляет собой гуманизированное или a полностью человеческое антитело. Примеры изотипов гуманизированных и полностью человеческих антител включают IgA, IgD, IgE, IgG и IgM. В некоторых вариантах анти-CXCR5-антитело представляет собой IgG-антитело. Существует четыре формы IgG. В некоторых вариантах анти-CXCR5-антитело представляет собой IgG4-антитело. В некоторых вариантах осуществления изобретения анти-CXCR5-антитело представляет собой гуманизированное IgG4-антитело.
В некоторых вариантах осуществления изобретения анти-CXCR5-антитело является гуманизированным IgG4-анти-CXCR5-антителом, содержащим тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26 («лидирующее CXCR5-антитело»). В альтернативных вариантах осуществления изобретения анти-CXCR5-антитело является гуманизированным IgG4-анти-CXCR5-антителом, содержащим вариабельную область тяжелой цепи и вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи содержит 3 определяющих комплементарность области (CDR), содержащие аминокислотные последовательности SEQ ID NO:15, 16 и 17, и вариабельная область легкой цепи содержит 3 CDR, содержащих аминокислотные последовательности SEQ ID NO:18, 19 и 20. Идентификация, выделение, приготовление и характеристика анти-CXCR5-антител, включая анти-CXCR5-антитело, содержащее аминокислотную последовательность тяжелой цепи, содержащую последовательность SEQ ID NO:25, и аминокислотную последовательность легкой цепи, содержащую последовательность SEQ ID NO:26, были подробно описаны в публикации PCT WO 2009/032661, которая включена в настоящее описание в виде ссылки.
Некоторые варианты препаратов согласно изобретению также содержат варианты связывающих анти-CXCR5-средств, таких как антитела. В частности, препараты согласно изобретению могут содержать варианты анти-CXCR5-антитела, которое является гуманизированным IgG4-анти-CXCR5-антителом, содержащим тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26. Варианты анти-CXCR5-антитела могут иметь сходные физико-химические свойства на основе их высокого сходства, и поэтому также включены в объем изобретения. Варианты определяют как антитела с аминокислотной последовательностью, которая, по меньшей мере, на 95%, по меньшей мере, на 97%, например, по меньшей мере, на 98% или 99% гомологичны анти-CXCR5-антителу и способна конкурировать за связывание с полипептидом CXCR5, фрагментом полипептида CXCR5 или эпитопом CXCR5. В некоторых вариантах осуществления изобретения варианты буду ослаблять, нейтрализовать или иным образом ингибировать биологическую активность CXCR5 (например, связывание CXCL13 с CXCR5). Определение конкуренции за связывание с мишенью можно осуществить обычными способами, известными специалисту в данной области. В некоторых вариантах осуществления изобретения варианты представляют собой человеческие антитела, и в некоторых вариантах являются молекулами IgG4. В некоторых вариантах осуществления изобретения вариант, по меньшей мере, на 95%, 96%, 97%, 98% или 99% идентичен по аминокислотной последовательности лидирующему антителу. Термин «вариант» относится к антителу, которое содержит аминокислотную последовательность, которая изменена на одну или несколько аминокислот по сравнению с аминокислотными последовательностями анти-CXCR5-антитела. Вариант может иметь консервативные модификации последовательности, включая аминокислотные замены, модификации, добавления и делеции.
Примеры модификаций включают без ограничения гликозилирование, ацетилирование, пегилирование, фосфорилирование, амидирование, дериватизацию известными защитными/блокирующими группами, протеолитическое расщепление и связывание с клеточным лигандом или другим белком. Модификации аминокислот можно вводить стандартными способами, известными в данной области, такими как сайт-специфичный мутагенез, молекулярное клонирование, сайт-специфичный мутагенез с использованием олигонуклеотидов и случайный опосредованный ПЦР мутагенез, в нуклеиновую кислоту, кодирующую антитела. Консервативные аминокислотные замены включают замены, при которых аминокислотный остаток заменяют аминокислотным остатком, имеющим сходные структурные или химические свойства. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в данной области. Такие семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан). Специалисту в данной области будет понятно, что также можно использовать другие классификации семейств аминокислотных остатков, отличные от классификации, приведенной выше. Кроме того, вариант может иметь неконсервативные аминокислотные замены, например, замену аминокислоты аминокислотным остатком, обладающим другими структурными или химическими свойствами. Сходные небольшие изменения также могут включать делеции или инсерции аминокислот или и то и другое. Руководство по определению того, какие аминокислотные остатки могут быть заменены, модифицированы, встроены или делетированы без снижения иммунологической активности, можно найти, используя компьютерные программы, хорошо известные в данной области. Можно использовать компьютерные алгоритмы, наряду с другими такие как Gap или Bestfit, которые известны специалисту в данной области, чтобы оптимально выравнивать сравниваемые аминокислотные последовательности и определять сходные или идентичные аминокислотные остатки. Варианты могут иметь такие же или другие, либо более высокие, либо более низкие, аффинности связывания по сравнению с анти-CXCR5-антителом, но при этом все еще оставаться способными специфично связываться с CXCR5, и могут иметь такую же, более высокую или более низкую биологическую активность по сравнению с активностью анти-CXCR5-антитела.
Варианты осуществления изобретения также включают антигенсвязывающие фрагменты связывающих анти-CXCR5-средств, таких как антитела. Термин «антигенсвязывающий домен», «антигенсвязывающая область», «антигенсвязывающий фрагмент» и подобные термины относятся к такой части антитела, которая содержит аминокислотные остатки, которые взаимодействуют с антигеном и придают связывающему средству специфичность и аффинность по отношению к антигену (например, области, определяющие комплементарность (CDR)). Антигенсвязывающая область может быть получена от любого вида животного, такого как грызуны (например, кролик, крыса или хомячок), и человека. В некоторых вариантах антигенсвязывающая область может иметь человеческое происхождение. Неограничивающие примеры антигенсвязывающих фрагментов включают: Fab-фрагменты, F(ab’)2-фрагменты, Fd-фрагменты, Fv-фрагменты, одноцепочечные молекулы Fv (scFv), dAb-фрагменты и минимальные единицы узнавания, состоящие из аминокислотных остатков, которые имитируют гипервариабельную область антитела.
В некоторых вариантах осуществления изобретения связывающие анти-CXCR5-средства (или их вариант или их антигенсвязывающий фрагмент) будут ослаблять, нейтрализовать или иным образом ингибировать биологическую активность CXCR5 in vivo (например, связывание CXCL13 c CXCR5).
В некоторых вариантах осуществления изобретения связывающие анти-CXCR5-средства (или их вариант или их антигенсвязывающий фрагмент) являются антагонистическими связывающими средствами, которые ослабляют, нейтрализуют или иным образом ингибируют биологическую активность CXCR5 in vivo (например, связывание CXCL13 с CXCR5).
В некоторых вариантах связывающее анти-CXCR5-средство (или его вариант или его антигенсвязывающий фрагмент) присутствует в препаратах в количестве от примерно 5 мг/мл до примерно 280 мг/мл, например, примерно 5 мг/мл до примерно 200 мг/мл, примерно 5 мг/мл до примерно 125 мг/мл, от примерно 5 мг/мл до примерно 75 мг/мл, от примерно 5 мг/мл до примерно 50 мг/мл и от примерно 5 мг/мл до примерно 25 мг/мл. Например, связывающее анти-CXCR5-средство может присутствовать в препарате в количестве примерно 5 мг/мл, примерно 10 мг/мл, примерно 15 мг/мл, примерно 20 мг/мл, примерно 25 мг/мл, примерно 30 мг/мл, примерно 35 мг/мл, примерно 40 мг/мл, примерно 45 мг/мл, примерно 50 мг/мл, примерно 55 мг/мл, примерно 60 мг/мл, примерно 65 мг/мл, примерно 70 мг/мл, примерно 75 мг/мл, примерно 80 мг/мл, примерно 85 мг/мл, примерно 90 мг/мл, примерно 95 мг/мл, примерно 100 мг/мл, примерно 105 мг/мл, примерно 110 мг/мл, примерно 115 мг/мл, примерно 120 мг/мл, примерно 125 мг/мл, примерно 130 мг/мл, примерно 135 мг/мл, примерно 140 мг/мл, примерно 145 мг/мл, примерно 150 мг/мл, примерно 155 мг/мл, примерно 160 мг/мл, примерно 165 мг/мл, примерно 170 мг/мл, примерно 175 мг/мл, примерно 180 мг/мл, примерно 185 мг/мл, примерно 190 мг/мл, примерно 195 мг/мл, примерно 200 мг/мл, примерно 205 мг/мл, примерно 210 мг/мл, примерно 215 мг/мл, примерно 220 мг/мл, примерно 225 мг/мл, примерно 230 мг/мл, примерно 235 мг/мл, примерно 240 мг/мл, примерно 245 мг/мл, примерно 250 мг/мл, примерно 255 мг/мл, примерно 260 мг/мл, примерно 265 мг/мл, примерно 270 мг/мл, примерно 275 мг/мл или примерно 280 мг/мл.
В альтернативных вариантах связывающее анти-CXCR5-средство может присутствовать в препарате в количестве от примерно 5 до примерно 25 мг/мл, от примерно 26 до примерно 50 мг/мл, от примерно 51 до примерно 75 мг/мл, от примерно 76 до примерно 100 мг/мл, от примерно 101 до примерно 125 мг/мл, от примерно 126 до примерно 150 мг/мл, от примерно 151 до примерно 175 мг/мл, от примерно 176 до примерно 200 мг/мл, от примерно 201 мг/мл до примерно 225 мг/мл, от примерно 226 мг/мл до примерно 250 мг/мл, от примерно 251 до примерно 280 мг/мл, от примерно 5 до примерно 25 мг/мл, от примерно 40 до примерно 60 мг/мл, от примерно 75 до примерно 85 мг/мл или от примерно 90 до примерно 110 мг/мл.
В некоторых иллюстративных вариантах связывающее анти-CXCR5-средство присутствует в препарате в количестве примерно 20 мг/мл. Альтернативно связывающее анти-CXCR5-средство присутствует в количестве примерно 100 мг/мл. В другом иллюстративном варианте гуманизированное-IgG4-анти-CXCR5-антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26, присутствует в препарате в количестве примерно 20 мг/мл или 100 мг/мл.
iii. Буферные средства
Препараты согласно изобретению содержат цитратный буфер в качестве буферного средства. Буферное средство поддерживает физиологически подходящий pH. Кроме того, буферное средство повышает изотоничность и химическую стабильность препарата. В некоторых вариантах цитратный буфер присутствует в препаратах в концентрации от примерно 0,5 мМ до примерно 50 мМ, например, от примерно 5 мМ до примерно 15 мМ. Например, цитратный буфер может присутствовать в препарате в концентрации примерно 5 мМ, примерно 6 мМ, примерно 7 мМ, примерно 8 мМ, примерно 9 мМ, примерно 10 мМ, примерно 11 мМ, примерно 12 мМ, примерно 13 мМ, примерно 14 мМ, примерно 15 мМ, примерно 16 мМ, примерно 17 мМ, примерно 18 мМ, примерно 19 мМ, примерно 20 мМ, примерно 21 мМ, примерно 22 мМ, примерно 23 мМ, примерно 24 мМ, примерно 25 мМ, примерно 26 мМ, примерно 27 мМ, примерно 28 мМ, примерно 29 мМ, примерно 30 мМ, примерно 31 мМ, примерно 32 мМ, примерно 33 мМ, примерно 34 мМ, примерно 35 мМ, примерно 36 мМ, примерно 37 мМ, примерно 38 мМ, примерно 39 мМ, примерно 40 мМ, примерно 41 мМ, примерно 42 мМ, примерно 43 мМ, примерно 44 мМ, примерно 45 мМ, примерно 46 мМ, примерно 47 мМ, примерно 48 мМ, примерно 49 мМ и примерно 50 мМ. В некоторых вариантах цитратный буфер присутствует в препарате в концентрации от примерно 7 мМ до примерно 13 мМ, такой как от примерно 9 мМ до примерно 11 мМ. В некоторых вариантах цитратный буфер присутствует в концентрации примерно 10 мМ.
В некоторых вариантах препараты согласно изобретению имеют pH, равный или ниже pH 6. В некоторых вариантах pH препаратов находится в диапазонах от примерно 5,0 до примерно 6,0. Например, pH препаратов может составлять примерно 5,0, примерно 5,1, примерно 5,2, примерно 5,3, примерно 5,4, примерно 5,5, примерно 5,6, примерно 5,7, примерно 5,8, примерно 5,9 и примерно 6,0. В некоторых вариантах pH препаратов может быть в диапазоне от примерно 5,5 до примерно 6,0. В некоторых вариантах pH составляет либо примерно 5,5, либо примерно 6,0. Значение pH препарата можно измерить любыми способами, известными специалистам в данной области. Способы измерения pH включают использованием pH-метра с микроэлектродом. pH препарата можно корректировать, используя любые способы, известные в данной области. Примерами химических соединений для изменения pH препаратов являются хлористоводородная кислота (HCl) и гидроксид натрия (NaOH).
В некоторых вариантах препараты согласно изобретению имеют значение pH, равное или ниже изоэлектрической точки (pI) связывающего средства, такого как антитело. Изоэлектрическая точка означает значение pH, при котором конкретная молекула или поверхность не несет суммарного электрического заряда. pI связывающего анти-LIGHT- или анти-CXCR5-средства может быть определена любыми способами, известными специалистам в данной области. В некоторых вариантах pI анти-LIGHT- или анти-CXCR5-антитела определяют, используя изоэлектрическое фокусирование в денатурированном состоянии. Как показано на фиг. 1, pI полностью человеческого IgG4-анти-LIGHT-антитела, содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8, составляет 6,8-7,2. Как показано на фиг. 11, pI гуманизированного IgG4-анти-CXCR5-антитела, содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26, составляет 7,6-8,4.
iv. Поверхностно-активные вещества
Препараты согласно изобретению необязательно могут дополнительно содержать поверхностно-активное вещество, которое также известно как стабилизирующее средство. Поверхностно-активные вещества/стабилизирующие средства представляют собой химические соединения, которые взаимодействуют и стабилизируют биологические молекулы и/или основные фармацевтические эксципиенты в препарате. В некоторых вариантах поверхностно-активные вещества могут быть использованы вместе с хранением при более низкой температуре. Поверхностно-активные вещества обычно защищаю связывающее средство от индуцируемых на границе раздела воздух/раствор стрессов и индуцируемых на поверхности раствора стрессов, которые в противном случае могут приводить к агрегации белков. Поверхностно-активные вещества могут включать без ограничения полисорбаты, глицерин, дикарбоновые кислоты, щавелевую кислоту, янтарную кислоту, фумаровую кислоту, фталевые кислоты и их сочетания. Специалистам в данной области известно, что можно использовать другие поверхностно-активные вещества, например, неионогенные или ионогенные детергенты, при условии, что они являются фармацевтически приемлемыми, т.е. подходящими для введения субъектам. Поверхностно-активным веществом в некоторых вариантах является полисорбат. Примеры полисорбатов включают полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 65 и полисорбат 80.
В иллюстративных вариантах поверхностно-активное вещество присутствует в препаратах в количестве от примерно 0,001% до примерно 0,1% (масс./об.). Например, поверхностно-активное вещество может присутствовать в препаратах в количестве примерно 0,001% (масс./об.), примерно 0,002% (масс./об.), примерно 0,003% (масс./об.), примерно 0,004% (масс./об.), примерно 0,005% (масс./об.), примерно 0,006% (масс./об.), примерно 0,007% (масс./об.), примерно 0,008% (масс./об.), примерно 0,009% (масс./об.), примерно 0,01% (масс./об.), примерно 0,02% (масс./об.), примерно 0,03% (масс./об.), примерно 0,04% (масс./об.), примерно 0,05% (масс./об.), примерно 0,06% (масс./об.), примерно 0,07% (масс./об.), примерно 0,08% (масс./об.), примерно 0,09% (масс./об.) и примерно 0,1% (масс./об.). В конкретных вариантах поверхностно-активное вещество присутствует в препаратах в количестве от примерно 0,003% до примерно 0,05% (масс./об.), от примерно 0,004% до примерно 0,025% (масс./об.) или от примерно 0,005% до примерно 0,02% (масс./об.), например, примерно 0,005% (масс./об.). Например, полисорбат 20 может присутствовать в количестве от примерно 0,001% до примерно 0,1% (масс./об.), от примерно 0,002% до примерно 0,01% (масс./об.), от примерно 0,003% до примерно 0,008% (масс./об.) и от примерно 0,004% до примерно 0,006% (масс./об.), например, примерно 0,005% (масс./об.). В альтернативных вариантах полисорбат 20 присутствует в количестве от примерно 0,001% до примерно 0,1% (масс./об.), от примерно 0,005% до примерно 0,05% (масс./об.) и от примерно 0,0075% до примерно 0,025% (масс./об.), например, примерно 0,01% (масс./об.). В следующих альтернативных вариантах полисорбат 20 присутствует в количестве от примерно 0,001% до примерно 0,1% (масс./об.), от примерно 0,005% до примерно 0,05% (масс./об.) и от примерно 0,01% до примерно 0,03% (масс./об.), например, примерно 0,02% (масс./об.).
v. Средства для тоничности
Препараты согласно изобретению необязательно могут дополнительно содержать средство для тоничности. Обычно средства для тоничности используют для того, чтобы скорректировать или поддержать осмоляльность препаратов, чтобы сделать ее ближе к осмотическому давлению жидкостей организма, таких как кровь или плазма. Средства для тоничности также могут поддерживать уровни связывающего средства в препарате. Отчасти, средство для тоничности вносит вклад в сохранение уровня, соотношения или доли терапевтически активного связывающего средства, присутствующего в препарате. В используемом в настоящем описании смысле термин «тоничность» относится к характеристике биологических компонентов в жидкой среде или растворе. Изотоничные растворы имеют такое же осмотическое давление, как и плазма крови, и могут быть внутривенно инфузированы субъекту без изменения осмотического давления плазмы крови субъекта. Действительно, в некоторых вариантах осуществления изобретения средство для тоничности присутствует в количестве, достаточного для того, чтобы сделать препарат подходящим для внутривенной инфузии. Часто средство для тоничности служит в качестве объемообразующего агента, а также стабилизатора. Как таковое средство для тоничности может обеспечивать возможность преодоления связывающим средством различных стрессов, таких как замораживание и скалывание. Средства для тоничности могут включать без ограничения сахариды, сахара, глицерин, сорбит, маннит, хлорид натрия, хлорид калия, хлорид магния и другие неорганические соли. Специалистам в данной области известно, что можно использовать другие средства для тоничности, при условии, что они являются фармацевтически приемлемыми, т.е., подходящими для введения субъектам.
В некоторых вариантах средство для тоничности присутствует в препаратах в количестве от примерно 0,1% to 10% (масс./об.). Например средство для тоничности может присутствовать в препарате в количестве примерно 0,1% (масс./об.), примерно 0,2% (масс./об.), примерно 0,3% (масс./об.), примерно 0,4% (масс./об.), примерно 0,5% (масс./об.), примерно 0,6% (масс./об.), примерно 0,7% (масс./об.), примерно 0,8% (масс./об.), примерно 0,9% (масс./об.), примерно 1% (масс./об.), примерно 2% (масс./об.), примерно 3% (масс./об.), примерно 4% (масс./об.), примерно 4,5% (масс./об.), примерно 5% (масс./об.), примерно 5,5% (масс./об.), примерно 6% (масс./об.), примерно 7% (масс./об.), примерно 8% (масс./об.), примерно 9% (масс./об.) и примерно 10% (масс./об.). Альтернативно средство для тоничности может присутствовать в препарате в количестве от примерно 2% до примерно 8% (масс./об.), от примерно 3% до примерно 7% (масс./об.) и от примерно 4% до примерно 6% (масс./об.). В следующих альтернативных вариантах средство для тоничности может присутствовать в препарате в количестве от примерно 0,1% до примерно 1%, от примерно 0,1% до примерно 0,5%, от примерно 0,1 до примерно 0,3% и примерно 0,2%.
В некоторых иллюстративных вариантах средством для тоничности является сахарид. Примеры сахаридов включают глюкозу, сахарозу, мальтозу, трегалозу, декстрозу, ксилит, фруктозу и маннит. Например, маннит может присутствовать в количестве от примерно 1% до примерно 10% (масс./об.), от примерно 2% до примерно 8% (масс./об.) или от примерно 3% до примерно 5% (масс./об.), например, примерно 4% (масс./об.). Альтернативно, сахароза может присутствовать в количестве от примерно 1% до примерно 10% (масс./об.), от примерно 3% до примерно 8% (масс./об.) или от примерно 4% до примерно 6% (масс./об.), например, примерно 4,5, 5, 5,5 или 6% (масс./об.).
В некоторых других иллюстративных вариантах средством для тоничности является хлорид натрия. Например, хлорид натрия может присутствовать в количестве примерно 0,1% (масс./об.), примерно 0,2% (масс./об.), примерно 0,3% (масс./об.), примерно 0,4% (масс./об.), примерно 0,5% (масс./об.), примерно 0,6% (масс./об.), примерно 0,7% (масс./об.), примерно 0,8% (масс./об.), примерно 0,9% (масс./об.) и примерно 1% (масс./об.). Альтернативно, хлорид натрия может присутствовать в препарате в количестве от примерно 0,1% до примерно 1%, от примерно 0,1% до примерно 0,5%, от примерно 0,1 до примерно 0,3% и примерно 0,2%.
В следующих иллюстративных вариантах препараты могут содержать одно или несколько средство для тоничности. Например, препараты могут содержать одно или несколько из указанных выше средств для тоничности в указанных выше концентрациях. В некоторых конкретных вариантах препараты могут содержать сахарозу и хлорид натрия, при этом концентрации и сахарозы и хлорида натрия составляют от примерно 0,1% до примерно 10% (масс./об.). В некоторых вариантах концентрация сахарозы составляет примерно 6% и концентрация хлорида натрия составляет примерно 0,2%. Альтернативно концентрация сахарозы составляет примерно 4,5%, и концентрация хлорида натрия составляет примерно 0,2%.
В некоторых вариантах осуществления изобретения осмоляльность препаратов находится в диапазоне от примерно 200 мОсм/кг до примерно 350 мОсм/кг, от примерно 270 мОсм/кг до примерно 330 мОсм/кг, от примерно 280 мОсм/кг до примерно 320 мОсм/кг или от примерно 290 мОсм/кг до примерно 310 мОсм/кг, например, примерно 300 мОсм/кг. Другими словами препараты согласно изобретению в некоторых вариантах являются по существу изотоничными, т.е. имеющими по существу такое же осмотическое давление, как и кровь человека. Осмоляльность может быть измерена любыми способами, известными специалистам в данной области, такими как способы, основанные на использовании осмометров давления пара или криоскопические осмометры. Осмоляльность препаратов согласно изобретению, например, можно регулировать, используя одно или несколько средств для тоничности, описанных в настоящей публикации.
vi. Аминокислоты
Препараты согласно изобретению необязательно могут дополнительно содержать аминокислоту. Примеры аминокислот включают без ограничения глицин, аланин, аспарагиновую кислоту, лизин, серин, тирозин, цистеин, глутамин, метионин, аргинин и пролин. В иллюстративных вариантах аминокислота присутствует в препаратах в количестве от примерно 0,1% до 5% (масс./об.). Например, аминокислота может присутствовать в препарате в количестве примерно 0,1% (масс./об.), примерно 0,2% (масс./об.), примерно 0,3% (масс./об.), примерно 0,4% (масс./об.), примерно 0,5% (масс./об.), примерно 0,6% (масс./об.), примерно 0,7% (масс./об.), примерно 0,8% (масс./об.), примерно 0,9% (масс./об.), примерно 1,0% (масс./об.), примерно 1,1% (масс./об.), примерно 1,2% (масс./об.), примерно 1,3% (масс./об.), примерно 1,4% (масс./об.), примерно 1,5% (масс./об.), примерно 1,6% (масс./об.), примерно 1,7% (масс./об.), примерно 1,8% (масс./об.), примерно 1,9% (масс./об.), примерно 2,0% (масс./об.), примерно 3% (масс./об.), примерно 4% (масс./об.) и примерно 5% (масс./об.). Альтернативно, аминокислота присутствует в препарате в количестве от примерно 1,3% до примерно 1,8% (масс./об.) или от примерно 1,4% до примерно 1,6% (масс./об.), например, примерно 1,5% (масс./об.). В следующих альтернативных вариантах аминокислота присутствует в препарате в количестве от примерно 0,5% до примерно 1,5% (масс./об.) или от примерно 0,8% до примерно 1,2% (масс./об.), например, примерно 1,0% (масс./об.). Примером аминокислоты является пролин или аргинин. Например, пролин может присутствовать в препарате в количестве от примерно 1% до примерно 2%, (масс./об.) от примерно 1,3% до примерно 1,8% (масс./об.), от примерно 1,4% до примерно 1,6% (масс./об.), например, примерно 1,5% (масс./об.). Альтернативно, аргинин может присутствовать в препарате в количестве от примерно 0,5% до примерно 1,5% (масс./об.) или от примерно 0,8% до примерно 1,2% (масс./об.), например, примерно 1,0% (масс./об.).
vii. Другие эксципиенты
Кроме того, препараты согласно изобретению могут содержать другие эксципиенты, включая без ограничения, воду для инъекций, разбавители, солюбилизаторы, успокоительные средства, дополнительные буферы, неорганические или органические соли, антиоксиданты или тому подобные. Однако в некоторых вариантах препараты согласно изобретению не содержат других эксципиентов, за исключением эксципиентов, описанных выше. Другие фармацевтически приемлемые носители, эксципиенты или стабилизаторы, такие как описанные в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980), могут быть включены в препарат, при условии, что они не оказывают неблагоприятного влияния на требуемые характеристики препарата. В конкретном варианте препарат по существу не содержит консервантов, хотя в альтернативных вариантах консерванты могут быть при необходимости добавлены. Например, в лиофилизируемые препараты могут быть включены криопротекторы или лиопротекторы.
viii. Жидкие или лиофилизированные препараты
Препараты согласно изобретению могут представлять собой либо жидкие препараты, либо лиофилизированные препараты. В некоторых вариантах препараты являются жидкими препаратами. В некоторых вариантах жидкие препараты являются готовыми препаратами для инъекции. Альтернативно, препараты могут быть в виде лиофилизированных порошков. В некоторых вариантах лиофилизированные порошки приготовлены для объединения с растворителем непосредственно перед введением.
ix. Примеры препаратов
В одном иллюстративном варианте осуществления изобретения изобретение относится к стабильному жидкому препарату антитела, подходящему для подкожного введения, при этом препарат содержит:
a) более чем примерно 80 мг/мл, например, примерно 150 мг/мл, полностью человеческого IgG4-антитела против LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,005% (масс./об.) полисорбата 20; и
d) примерно 4% (масс./об.) маннита;
при этом pH препарата составляет примерно pH 5,5.
В некоторых иллюстративных вариантах такой препарат может быть произведен следующим образом:
a) растворение примерно 10 мМ дигидрата цитрата натрия в воде для инъекций и доведением pH буферного раствора примерно до pH 5,5, например, с использованием либо хлористоводородной кислоты, либо гидроксида натрия;
b) добавление более чем примерно 80 мг/мл, например, примерно 150 мг/мл, полностью человеческого IgG4-антитела против LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8, примерно 4% (масс./об.) маннита и 0,005% (масс./об.) полисорбата 20 к буферному раствору, полученному на стадии a) с перемешиванием в сосуде, изготовленном из инертного материала, вплоть до полного растворения, и затем доведение pH полученного препарата примерно до pH 5,5 с использованием либо хлористоводородной кислоты, либо гидроксида натрия, и затем добавление буферного раствора со стадии a) с доведением до конечной массы получаемого препарата;
c) фильтрование препарата, полученного на стадии b) в асептических условиях с использованием стерилизованного, совместимого мембранного фильтра, имеющего номинальный размер пор 0,2 мкм, и затем стерилизация препарата фильтрованием в асептических условиях в стерилизованные емкости, изготовленные из инертного материала, с использованием стерилизованного совместимого мембранного фильтра, имеющего номинальный размер пор 0,2 мкм;
d) наполнение препаратом, полученным на стадии c), в асептических условиях в стерилизованные флаконы, которые закрывают пробками и вальцуемыми колпачками с фланцем; и необязательно
e) осмотр емкостей, полученных на стадии d) в отношении крупных посторонних примесей, не нарушенной герметичности и видимых частиц.
В другом иллюстративном варианте осуществления изобретения изобретение относится к стабильному жидкому препарату антитела, подходящему для внутривенного введения, при этом препарат содержит:
a) от примерно 5 до примерно 80 мг/мл, например, примерно 50 мг/мл, полностью человеческого IgG4-антитела против LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8;
b) примерно 10 мМ цитратный буфер; и
c) примерно 0,01% (масс./об.) полисорбата 20;
при этом pH препарата составляет примерно pH 5,5.
В альтернативном иллюстративном варианте осуществления изобретения изобретение относится к стабильному лиофилизованному препарату антитела, подходящему для внутривенного введения, при этом препарат содержит:
a) от примерно 5 до примерно 80 мг/мл, например, примерно 50 мг/мл, полностью человеческого IgG4-антитела против LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,01% (масс./об.) полисорбата 20;
d) примерно 5% (масс./об.) сахарозы; и
e) примерно 1,5% (масс./об.) пролина;
при этом pH препарата составляет примерно pH 5,5.
В иллюстративном варианте осуществления изобретения изобретение относится к стабильному препарату антитела, содержащему:
a) примерно 20 мг/мл гуманизированного IgG4-антитела против CXCR5 (рецептор хемокина C-X-C типа 5), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,02% полисорбата 20;
d) примерно 6% сахарозы; и
e) примерно 0,2% хлорида натрия;
при этом pH препарата составляет примерно pH 6,0.
В альтернативном иллюстративном варианте осуществления изобретения изобретение относится к стабильному препарату антитела, содержащему:
a) примерно 100 мг/мл гуманизированное IgG4-антитела против CXCR5 (рецептор хемокина C-X-C типа 5), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,01% полисорбата 20;
d) примерно 4,5% сахарозы;
e) примерно 0,2% хлорида натрия; и
f) примерно 1% аргинина;
при этом pH препарата составляет примерно pH 6,0.
x. Стабильность
Препараты согласно изобретению являются стабильными при 5°C в течение, по меньшей мере, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или больше, и обычно, по меньшей мере, примерно 12, 18 или 24 месяцев или больше. В иллюстративных вариантах они являются стабильными при 5°C в течение, по меньшей мере, примерно 6 месяцев или больше. В других иллюстративных вариантах они являются стабильными при 5°C в течение, по меньшей мере, примерно 9 месяцев. В следующих иллюстративных вариантах они являются стабильными при 5°C в течение, по меньшей мере, примерно 1 года или больше, и обычно примерно 2 года.
C. Способы введения
В некоторых вариантах осуществления изобретения препараты подходят для введения парентерально, внутривенно, внутримышечно, интрадермально, подкожно или для комбинации указанных введений. Препараты согласно изобретению подходят для доставки различными способами.
В некоторых вариантах осуществления изобретения препарат вводят внутривенно. Например, препараты, содержащие 80 мг/мл связывающего IgG4-средства, такого как антитела, или меньше желательно вводить внутривенно. Таким образом, препараты обычно являются стерильными. Способы получения стерильных препаратов хорошо известны в данной области и включают, например, фильтрование через стерильные фильтрационные мембраны или автоклавирование ингредиентов препарата за исключением антител примерно при 120°C в течение примерно 30 минут. Например, изобретение относится к стабильному жидкому препарату антитела, подходящему для внутривенного введения, при этом препарат содержит: a) от примерно 5 до примерно 80 мг/мл, например, примерно 50 мг/мл, полностью человеческого IgG4-антитела против LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8; b) примерно 10 мМ цитратный буфер; и c) примерно 0,01% (масс./об.) полисорбата 20; при этом pH препарата составляет примерно pH 5,5. Альтернативно, изобретение относится к стабильному препарату антитела, содержащему: a) примерно 20 мг/мл гуманизированного IgG4-антитела против CXCR5 (рецептор хемокина C-X-C типа 5), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26; b) примерно 10 мМ цитратный буфер; c) примерно 0,02% полисорбата 20; d) примерно 6% сахарозы; и e) примерно 0,2% хлорида натрия; при этом pH препарата составляет примерно pH 6,0.
В некоторых вариантах осуществления изобретения препарат вводят подкожно. Например, препараты, содержащие более 80 мг/мл связывающего IgG4-средства, такого как антитело, желательно вводить подкожно. В конкретном варианте желательно вводить субъектам подкожно стабильный жидкий препарат антитела, содержащий: a) примерно 150 мг/мл полностью человеческого IgG4-антитела против LIGHT (лимфотоксин-подобный, проявляет индуцируемую экспрессию и конкурирует с гликопротеидом D HSV за HVEM, рецептор, экспрессируемый T-лимфоцитами), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8; b) примерно 10 мМ цитратный буфер; c) примерно 0,005% (масс./об.) полисорбата 20; d) примерно 4% (масс./об.) маннита; и при этом pH препарата составляет примерно pH 5,5. Альтернативно, изобретение относится к стабильному препарату антитела, содержащему: a) примерно 100 мг/мл гуманизированного IgG4-антитела против CXCR5 (рецептор хемокина C-X-C типа 5), содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26; b) примерно 10 мМ цитратный буфер; c) примерно 0,01% полисорбата 20; d) примерно 4,5% сахарозы; e) примерно 0,2% хлорида натрия; и f) примерно 1% аргинина; при этом pH препарата составляет примерно pH 6,0.
D. Дозы и дозированные формы
Эффективные дозы препаратов согласно изобретению варьируют в зависимости от многих разных факторов, включая способы введения, участок-мишень, физиологическое состояние субъекта, о того, является ли субъект человеком или животным, других вводимых лекарственных средств и от того, является ли лечение профилактическим или терапевтическим. Обычно субъектом является человек, но также можно лечить млекопитающих, отличных от человека. Может требоваться титрование доз лечения, чтобы оптимизировать безопасность и эффективность.
Препараты согласно изобретению можно вводить во многих случаях. Интервалы между отдельными дозами быть разными: введение может быть ежедневно, еженедельно, раз в две недели, ежемесячно или ежегодно. Интервалы также могут быть нерегулярными. В некоторых способах дозу корректируют, чтобы получить определенную концентрация в плазме связывающего средства, такого как антитело. Дозы и частота будут варьировать в зависимости от времени полужизни связывающего анти-LIGHT- или анти-CXCR5-средства, такого как антитело, в организме субъекта. В общем, человеческие антитела имеют более длительное время полужизни, затем следуют гуманизированные антитела, химерные антитела и антитела животных, отличных от человека.
В следующих вариантах изобретение относится к стандартной фармацевтической дозе, содержащей терапевтически эффективное количество препарата согласно изобретению для лечения одного или нескольких заболеваний у субъекта посредством введения дозированной формы субъекту. В некоторых вариантах субъектом является человек. Человек может быть взрослым или может быть ребенком. Термин «фармацевтическая стандартная дозированная форма» относится к физически дискретной единице, подходящей в качестве разовых доз для субъектов, подвергаемых лечению, при этом каждая единица содержит предварительно определяемое количество активного соединения, вычисляемое так, чтобы получить требуемый терапевтический/профилактический эффект, вместе с необходимым цитратным буфером и pH.
Стандартная дозированная форма может быть в виде емкости, содержащей препарат. Подходящие емкости включают без ограничения герметично закрытые ампулы, флаконы, бутылочки, шприцы и пробирки. Емкости могут быть сделаны из множества материалов, таких как стекло или пластмасса, и могут иметь стерильный доступ для проникновения (например, емкость может представлять собой флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). В некоторых вариантах емкость представляет собой флакон. Обычно емкость должна поддерживать стерильность и стабильность препарата.
В конкретных вариантах препараты упакованы во флаконы объемом 2 мл, которые изготавливают из прозрачного бесцветного стекла типа I и закрывают пробками (покрытый фторполимером бромбутил), герметизируемыми вальцуемыми колпачками с фланцем (полипропилен). В некоторых вариантах флаконы заполняют 1,2 мл препаратов так, чтобы флакон содержал избыточный объем примерно 0,2 мл на флакон и извлекаемый объем 1,0 мл. Например, то означает, что составляющее дозу количество анти-LIGHT-антитела (например, 150 мг/мл) будет содержаться в 1 мл раствора.
В конкретном варианте препараты вторично упаковывают в емкость, такую как картонная коробка, которая защищает флаконы от света.
E. Способы лечения
Кроме того, в настоящем изобретении предлагаются способы лечения LIGHT-опосредованного заболевания или расстройства, при этом способы включают в себя введение субъекту препарата согласно изобретению. Изобретение, кроме того, относится к препарату согласно изобретению для применения в описанном в настоящей публикации способе лечения LIGHT-опосредованного заболевания или расстройства. В некоторых вариантах LIGHT-опосредованным заболевание является хроническое заболевание кишечника или воспалительное заболевание кишечника (IBD), такое как болезнь Крона (CD) или язвенный колит (UC). В других вариантах LIGHT-опосредованным заболеванием является болезнь «трансплантат против хозяина» (GVHD).
Также в настоящем изобретении предлагаются способы лечения CXCR5-опосредованного заболевания или расстройства, при этом способы включают в себя введение субъекту препарата согласно изобретению. Изобретение, кроме того, относится к препарату согласно изобретению для применения в описанном в настоящей публикации способе лечения CXCR-5-опосредованного заболевания или расстройства. В некоторых вариантах связывающее анти-CXCR5-средство используют для снижения признаков и симптомов, ингибирования прогрессирования структурного повреждения, индукции основного клинического ответа и предотвращения потери трудоспособными у взрослых пациентов с активным ревматоидным артритом (RA) от умеренной до тяжелой формы, у которых имел место неадекватный ответ на одно или несколько модифицирующих заболевание противоревматических лекарственных средств (DMARD), таких как метотрексат (MTX) или антагонисты TNFα. Связывающее анти-CXCR5-средство можно применять в сочетании с DMARD или анти-TNFα-агонистами.
В некоторых вариантах препараты согласно изобретению можно вводить в сочетании с одним или несколькими терапевтическими средствами (например, терапевтическими средствами, которые не являются препаратами согласно изобретению, которые вводят в настоящее время для профилактики, лечения, контролирования и/или ослабления LIGHT-опосредованного заболевания или CXCR5-опосредованного заболевания. Использование термина «в сочетании» не ограничивает порядок, в котором вводят терапевтические средства субъекту. Первое терапевтическое средство можно вводить до (например, за 1 минуту, 45 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель), одновременно или после (например, через 1 минуту, 45 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель) введения второго терапевтического средства субъекту, который имел, имеет или является чувствительным к LIGHT-опосредованному заболевание или CXCR5-опосредованному заболеванию. Можно вводить любое дополнительное терапевтическое средство в любом порядке с другими дополнительными терапевтическими средствами. Не ограничивающие примеры терапевтических средств, которые можно вводить в сочетании с антителом согласно изобретению, включают одобренные противовоспалительные средства, перечисленные в Фармакопеи США и/или настольном справочнике врача.
F. Наборы
Некоторые варианты осуществления изобретения включают набор, содержащий препарат согласно изобретению. Набор может дополнительно содержать одну или несколько емкостей, содержащих фармацевтически приемлемые эксципиенты, и включает в себя другие материалы, желательные с коммерческой точки зрения и с точки зрения потребителя, включая фильтры, иглы и шприцы. Вместе с наборами могут быть предоставлены инструкции, которые обычно вкладывают в коммерческие упаковки терапевтических, профилактических или диагностических продуктов, которые содержат информацию, например, о показаниях, применении, дозах, производстве, введении, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических, профилактических или диагностических продуктов. Набор также может быть снабжен ярлыком, который может представлять собой любой носитель данных (например, информационный листок, самоклеющуюся этикетку, чип, штамп или штрих-код), содержащий информацию. В некоторых вариантах инструкции и т.д., которые перечислены выше, могут находится внутри или на этикетке. Набор может дополнительно содержать устройство для введения препарата, и в частности, устройство, которое содержит препарат, т.е., предварительно заполняемое устройство, такое как без ограничения предварительно заполняемый шприц или предварительно заполняемый автоинжектор. Набор также может содержать емкость, содержащую препарат, т.е., предварительно заполняемую емкость, такую как предварительно заполняемый флакон, картридж, саше или ампулу.
G. Сочетание разных вариантов
В контексте настоящего изобретения любой из описанных в настоящей публикации вариантов можно сочетать с одним или несколькими другими описанными в настоящей публикации вариантами, если ясно не указано обратное. В частности, любое из описанных в настоящей публикации связывающих средств и антител и описанных в настоящей публикации препаратов можно применять в сочетании с любым из наборов, предварительно заполняемых устройств или предварительно заполняемых емкостей или можно применять в способах лечения или медицинских применениях, которые описаны в настоящей публикации в связи с соответствующим антителом (например, стабильные препараты, содержащие анти-LIGHT-антитела или анти-CXCR5-антитела можно сочетать с любым из описанных в настоящей публикации наборов, емкостей или устройств). Любое из описанных в настоящей публикации связывающих средств, специфично связывающих антиген (например, связывающее средство, специфично связывающее LIGHT, или связывающее средство, специфично связывающее CXCR5), также можно применять в любом из способов лечения, которые описаны в настоящей публикации в связи с соответствующими антителами (т.е. анти-LIGHT или анти-CXCR5) и наоборот.
ПРИМЕРЫ
Чтобы помочь проиллюстрировать изобретение, предлагаются следующие примеры. Примеры никоим образом не предназначены для ограничения объема изобретения. В общем, при практическом осуществлении настоящего изобретения используют, если не указано иное, обычные способы приготовления фармацевтических препаратов, химии, молекулярной биологии, методику рекомбинации ДНК, иммунологии, такие методики получения антител, и стандартные способы получения полипептидов, которые описаны, например, в Sambrook, Fritsch and Maniatis, Molecular Cloning: Cold Spring Harbor Laboratory Press (1989); Antibody Engineering Protocols (Methods in Molecular Biology), volume 51, Ed.: Paul S., Humana Press (1996); Antibody Engineering: A Practical Approach (Practical Approach Series, 169), Eds.: McCafferty J. et al., Humana Press (1996); Antibodies: A Laboratory Manual, Harlow and Lane, Cold Spring Harbor Laboratory Press (1999); and Current Protocols in Molecular Biology, Eds. Ausubel et al., John Wiley & Sons (1992).
Анти-LIGHT
Полностью человеческое IgG4-антитело против LIGHT, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8 («лидирующее LIGHT-антитело»), использовали в примерах 1-9, чтобы определить оптимальные условия приготовления препаратов.
МАТЕРИАЛЫ
Партия лекарственной субстанции
Лидирующее антитело, приготовленное в фосфатно-солевом буфере (PBS) в концентрации 5,5 мг/мл и при pH 7,3 («исходный препарат», «PBS-препарат» или «эталонная партия»), использовали в следующих примерах.
Эксципиенты
В таблице 1 показаны эксципиенты, которые использовали в следующих примерах и которые были выбраны в соответствии с их приемлемостью/пригодностью для применения в случае парентеральных продуктов.
Эксципиенты, используемые в данном исследовании
СПОСОБЫ
Следующие способы использовали для производства экспериментальных препаратов и препаратов согласно изобретению, содержащих лучшее LIGHT-антитело.
Приготовление и состав буферов
Все буферы готовили при перемешивании, чтобы растворить соответствующие эксципиенты. pH корректировали, используя 0,1 М HCl или 0,1 М NaOH. Общая концентрация всех буферов составляла 10 мМ.
Приготовление и состав маточных растворов эксципиентов
Все маточные растворы готовили при перемешивании, чтобы растворить эксципиенты. Концентрация приводили в виде массы/массу (масс./масс.).
Стерильная фильтрация образцов
Все образцы, растворы, буферы и т.д. стерильно фильтровали (0,22 мкм), используя мембрану Sartopore-2. Образцы фильтровали в стерилизованные бутылки или флаконы и закрывали в асептических условиях в боксах, чтобы предотвратить микробиологическую контаминацию.
Тестирование с использованием механического стресса
Механический стресс со скоростью встряхивания 350/минуту в течение 2,5 часа при комнатной температуре осуществляли, используя горизонтальный лабораторный встряхиватель с расстоянием 26 мм (инкубатор-встряхиватель из Buhler Company). Флаконы 2R наполняли 1 мл раствора, при этом свободное пространство составляло примерно 2,5 мл. Тестирование с использованием механического стресса планировали и осуществляли во время первого предварительного исследования компонентов для производства препарата и во время соответствующих исследований для выбора поверхностно-активного вещества.
Тестирование с использованием термического стресса
Термический стресс использовали в качестве стресс-теста во время всех стадий программы предварительного исследования компонентов-кандидатов. Образцы хранили при +40°C в течение либо 24, либо 7 суток, в зависимости от исследования.
Аналитические способы при заполнении и последующей обработке препаратов
Следующие аналитические способы использовали при заполнении и последующей обработке препаратов в следующих примерах.
Внешний вид
Внешний вид растворов антител проверяли визуально и дополнительно документировали, фотографируя цифровой камерой.
pH
Все измерения pH осуществляли, используя pH-метр с микроэлектродом.
Концентрация с использованием УФ
Концентрации белка во всех растворах антител измеряли против буфера, используя NanoDrop ND1000. Концентрации белка близкие или ниже 5 мг/мл разбавляли 1:3, тогда как белки в более высоких концентрациях, около 20 мг/мл, разбавляли 1:20 и измеряли оптическую плотность при 215 нм и 280 нм.
Динамическое светорассеяние (DLS)
Гидродинамический диаметр молекулы измеряли, используя лазерное светорассеяние. Образцы стерильно фильтровали перед аналитическим исследованием, если наблюдали мутность, таким образом, можно было выявлять только растворимые агрегаты.
Дифференциальная сканирующая калориметрия (DSC)
Аликвоты большинства образцов предварительных препаратов исследовали с помощью DSC, используя VPCapillary DSC из Microcal, и сканировали на устройстве с автоматическим отбором проб, используя параметры 90°C/час и время фильтра 2 секунды. Образцы объемом 400 мкл помещали в 96-луночные планшеты и анализировали в отношении температуры разворачивания Tm.
Осмолярность
Осмолярность измеряли, используя автоматический осмометр Knaur.
Плотность
Плотность препаратов измеряли, используя вискозиметр с падающим шариком DMA4500 Anton Paar.
Аналитические способы в биоаналитике FF
Следующие аналитические способы использовали в биоаналитике при заполнении и последующих процедурах в следующих экспериментах.
Эксклюзионная хроматография по размеру (SEC)
Агрегаты, а также продукты распада лидирующего антитела количественно оценивали, используя эксклюзионную ГЖ-хроматографию по размеру. Тестирование осуществляли, используя изократическую ВЭЖХ и колонку SUPERDEX 200 10/300.
SDS-ПААГ в восстанавливающих и не восстанавливающих условиях
Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-ПААГ) использовали для анализа целостности молекул (например, полумолекул) и чистоты. Такой электрофоретический анализ осуществляли, используя 4-12% градиентные гели в восстанавливающих и не восстанавливающих условиях. Белки визуализировали окрашиванием Кумасси после электрофоретического разделения.
Обмен слабыми катионами (WCX)
Слабокатионообменную хроматографию использовали для исследования гетерогенности заряда антитела. Представляли процентное содержание основных, нейтральных и кислых форм. Тест осуществляли, используя прерывистую высокоэффективную жидкостную хроматографию (ВЭЖХ) и колонку ProPac WCX 10.
Твердофазный иммуноферментный анализ с использованием антигена (антиген-ELISA)
Антиген-ELISA осуществляли для того, чтобы определить функциональность антитела. Связывающие свойства по отношению к нативному белку LIGHT оценивали в сравнении с современным стандартом антитела. Такую эффективность выражали в виде относительного показателя EC50.
Изоэлектрическое фокусирование (IEF)
Осуществляли IEF. Изоэлектрическая картина была специфичной для лидирующего антитела и служила в качестве идентификационного теста. Распад можно было наблюдать на основании другой картины зарядов.
Хранение
Все буферные растворы, растворы эксципиентов и образцы хранили при 5°C (±3°C), если не указано иное.
КРАТКОЕ ОПИСАНИЕ ВСЕХ ПРИГОТОВЛЕННЫХ И ПРОАНАЛИЗИРОВАННЫХ ПРЕПАРАТОВ
В таблице 2, приведенной ниже, показано сводная характеристика всех препаратов, приготовленных и проанализированных в следующих примерах. Каждый из препаратов содержал лидирующее LIGHT-антитело в указанной концентрации.
Сводная характеристика всех приготовленных и проанализированных препаратов
ПРИМЕР 1 - Характеристика препарата в фосфатно-солевом буфере (PBS) и ассоциированных с ним недостатков
В данном примере характеризовали эталонную партию. Как указано в разделе «Материалы» выше, эталонная партия содержит лидирующее LIGHT-антитело, приготовленное в фосфатно-солевом буфере (PBS) в концентрации 5,5 мг/мл и при pH 7,3, и полученное в растворах для исследованиях Vitry (BioSCP).
Изоэлектрическое фокусирование (IEF) использовали для определения изоэлектрической точки (pI) лидирующего антитела. pI лидирующего LIGHT-антитела было вычислено теоретически и равно 6,28, и затем измеряли изоэлектрическим фокусированием в денатурированном состоянии, используя стандартные способы, известные в данной области. Как показано на фиг. 1, главные полосы показывают, что pI лидирующего LIGHT-антитела составляет 6,8-7,2.
SDS-ПААГ использовали для идентификации молекулярной массы мономера антитела, потенциальных агрегатов или присутствия полумолекул. На фиг. 2 показан SDS-ПААГ-гель, в котором сравнивали разные серии эталонной партии в восстанавливающих и не восстанавливающих условиях. ELISA использовали для определения антигенсвязывающей активности лидирующего LIGHT-антитела. На фиг. 3 показан график ELISA, который использовали для определения антигенсвязывающей активности первой и второй серий эталонной партии.
SEC использовали для определения присутствия агрегатов, а также продуктов распада первой серии эталонной партии. Как показано на фиг. 4, эксклюзионная хроматография по размеру выявила высокомолекулярные белки (HMWP), например, ди/олигомеры (RRT0.8) или агрегаты, и низкомолекулярные белки (LMWP) или продукты распада. Первая серия эталонной партии имела чистоту 97% по содержанию мономера.
WCX использовали для исследования гетерогенности заряда первой серии эталонной партии. Как показано на фиг. 5 происходило перераспределение кислых, нейтральных и основных изоформ во время исследований стабильности. Первая серия эталонной партии имела распределение кислых/нейтральных/основных изоформ 42,3/55,6/1,9%.
DSC использовали для анализа температуры разворачивания Tm первой серии эталонной партии. Как показано на фиг. 6 три домена антитела разворачивались при 68°C, 75°C и 78°C.
DLS использовали для определения гидродинамического диаметра мономера антитела и потенциальных растворимых агрегатов. Как показано на фиг. 7 и 8, определен гидродинамический диаметр, составляющий примерно 10 нм, но агрегаты в PBS не наблюдали. Однако агрегаты не наблюдали и в цитратном буфере (фиг.10).
ПРИМЕР 2 - Разработка забуференных цитратом препаратов и ассоциированные с ними преимущества
Исходный буфер, фосфатно-солевой буфер (PBS) с pH 7,3, был в отношении pH очень близок к изоэлектрической точке (pI) лидирующего антитела (смотрите пример 1). Кроме того, в исходном препарате наблюдали агрегаты; полумолекулы; продукты распада; низкомолекулярные белки (LMWP); высокомолекулярные белки (HMWP); и перераспределения кислых, основных и нейтральных изоформ антитела (смотрите пример 1). Таким образом, существовала потребность в улучшенном препарате, который не имеет таких недостатков.
Тестировали препараты лидирующего LIGHT-антитела (полностью человеческого IgG4-антитела против LIGHT, содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8), содержащие 10 мМ цитратный буфер с pH 5, 5,5 и 6, с полисорбатом 20 или без него. В таблице 3 показаны результаты анализа первой серии эталонной партии и различных экспериментальных препаратов лидирующего LIGHT-антитела, приготовленных в цитрате с pH 5,0 и 5,5 и 6,0, с полисорбатом 20 или без него. Агрегаты были обнаружены при измерениях с использованием динамического светорассеяния (DLS) в случае эталонной партии, но не обнаружены во всех других тестированных препаратах. Tm, которую измеряли с использованием дифференциальной сканирующей калориметрии (мкDSC), показала, что чем выше pH, тем более высокую термодинамическую стабильность можно предполагать. Но в случае высококонцентрированных препаратов антител pH нужно выбирать ниже pI антитела.
Как показано в таблице 4, данные эксклюзионной хроматографии по размеру (SEC) показали значимо сниженное количество высокомолекулярных белков (HMWP) в случае лидирующего LIGHT-антитела в цитратном буфере по сравнению с эталонной партией (фосфатный буфер с pH 7,3). Напротив, не смогли выявить различий при использовании SDS-ПААГ (таблица 5).
Результаты анализа препаратов
Данные SEC препаратов
Данные SDS-ПААГ препаратов
ПРИМЕР 3 - Разработка препаратов антител с высокой концентрацией
С учетом улучшений, обеспечиваемых забуференным цитратом препаратом антител из примера 2, компоненты цитратного буфера оптимизировали для повышенных концентраций лидирующего LIGHT-антитела. В таблице 6 показаны результаты анализа первой серии препаратов антител с высокой концентрацией (примерно 40 мг/мл): высококонцентрированного препарата в фосфатно-солевом буфере (PBS) с pH 7,3 (препарата 2) или цитрате с pH 5,5 с полисорбатом 20 (препарата 4).
Результаты анализа препаратов 2 и 4
Незначительно уменьшенное содержание мономера наблюдали после концентрирования раствора белка в цитратном буфере. Кроме того, концентрация димеров была снижена и количество высокомолекулярных белков (HMWP) также могло быть значимо уменьшено (смотрите таблицу 7). Напротив, количество таких примесей и побочных продуктов увеличивалось при увеличении концентрации в фосфатном буфере. В случае SDS-ПААГ-анализа различия могут не выявляться (таблица 8).
Данные SEC для препаратов 2 и 4
Данные SDS-ПААГ для препаратов 2 и 4
ПРИМЕР 4 - разработка лиофилизированных препаратов антител
Чтобы проверить возможность лиофилизации, получали разные лиофилизированные экспериментальные препараты и подвергали анализу на стабильность. Концентрацию лидирующего LIGHT-антитела увеличивали до 50 мг/мл.
В таблице 9 показана программа лиофильной сушки, которую использовали в данном примере.
Программа лиофильной сушки
В таблице 10 показаны результаты анализа первой серии эталонной партии и различные экспериментальные лиофилизированные препараты лидирующего LIGHT-антитела, приготовленного в различных сочетаниях цитратного буфера, сахарозы, полисорбата 20 и пролина.
Как показано в таблице 11, количество высокомолекулярных белков (HMWP) может быть явно снижено при использовании цитратного буфера. Не наблюдали различий в содержании димеров в течение периода хранения при 40°C. Наблюдали повышение содержания низкомолекулярных белков (LMWP) после лиофильной сушки. Как указано ранее, такие различия могут не выявляться в SDS-ПААГ-анализе (таблица 12).
Аналитические данные для препаратов 6-6.2 и 11
Данные SEC для препаратов 6.1-6.2 и 11
Данные SDS-ПААГ для препаратов 6.1-6.2 и 11
ПРИМЕР 5 - Исследование повышенной стабильности
Исследование повышенной стабильности осуществляли с использованием цитратного и гистидинового буферов. В таблице 13 показаны результаты анализа первой серии эталонной партии и различных экспериментальных препаратов лидирующего LIGHT-антитела, приготовленного в различных сочетаниях цитратного буфера или гистидинового буфера. Причем, содержащий цитрат препарат согласно изобретению во всех экспериментах очевидно функционировал лучше, чем гистидиновый. В частности, содержащие цитрат препараты имели более высокое содержание мономера по сравнению как с серией эталонной партии, так и с гистидином (таблица 13) и содержание низкомолекулярных белков (LMWP) и высокомолекулярных белков (HMWP) также было значимо ниже (таблица 14). Как указано ранее, такие различия не могут быть выявлены в SDS-ПААГ-анализе (таблица 15).
Данные анализа препаратов 7, 8, 9 и 10
SEC-анализ препаратов 7 и 8 и 9 и 10
Данные SDS-ПААГ для препаратов 7 и 8 и 9 и 10
ПРИМЕР 6 - разработка препаратов с высокой концентрацией антитела для подкожного введения
На основе успешных результатов, полученных в случае забуференных цитратом препаратов из примеров 2-5, разрабатывали препараты антител с высокой концентраций (150 мг/мл), подходящие для подкожного введения. Разработку препарата осуществляли, используя лидирующее LIGHT-антитело, с целью разработки жидкой дозированной формы с приемлемым сроком годности при хранении в условиях от +2 до +8°C. Предварительные исследования стрессового воздействия показали образование довидимых и видимых частиц, высокомолекулярных видов и больше видов с основными свойствами. Поэтому указанные параметры контролировали во время скрининга препаратов-кандидатов, используя визуальную оценку, динамическое светорассеяние, светотень, эксклюзионную хроматографию по размеру, электрофорез в полиакриламидном геле с додецилсульфатом натрия и слабокатионообменную хроматографию. Использовали разные жидкие препараты в предварительных испытаниях компонентов-кандидатов и препаратов перед отбором клинического препарата. Согласно полученным данным препарат в 10 мМ цитратном буфере, доведенном до pH 5,5 (препарат 14) был отобран для дальнейшей разработки. Значение pH препарата находится в области оптимальной физической и химической стабильности лекарственной субстанции и приемлемой физиологической переносимости (например, осмолярности).
Как показано в таблице 16, препарат 14 является раствором для инъекций и представляет собой водный, стерильный и прозрачный раствор, содержащий лидирующее LIGHT-антитело, дигидрат цитрата натрия (буферное средство), полисорбат 20 (стабилизатор) и маннит (средство для тоничности). Раствор гидроксида натрия и хлористоводородную кислоту использовали для корректировки pH до значения 5,5.
Все эксципиенты были растворимыми и хорошо переносимыми фармакопейными стандартными эксципиентами для парентеральных препаратов и они перечислены в Европейской Фармакопеи и Фармакопеи США.
Состав
a Компоненты перечислены согласно их фармакопейным названиям. Если существует больше одной фармакопейной статьи, другие названия приведены в скобках вместе с указанием фармакопейного источника.
b Ссылка приведена на действующую редакцию Фармакопеи.
ПРИМЕР 7 - технология производства подкожного препарата антитела
Разработали соответствующую правилам GMP технологию производства подкожного препарата с высокой концентрацией антитела (препарат 14) из примера 6. Процедура производства состоит из стадий растворения, корректировки pH, стерильной фильтрации, заполнения и упаковки.
Лекарственную субстанцию (лидирующее LIGHT-антитело) получали в жидкой форме в буфере для препарата (10 мМ цитратный буфер, pH 5,5). Все эксципиенты были растворимыми в воде, и их растворяли в исходной водной части буфера для препарата во время производства. Затем общий объем раствора лекарственной субстанции разбавляли таким же буфером для препарата, чтобы получить концентрацию 150 мг/мл лидирующего LIGHT-антитела. Общий объем раствора тщательно перемешивали, чтобы облегчить процесс растворения и гарантировать гомогенность.
Стерилизацию фильтрованием осуществляли (согласно Европейской фармакопеи и фармакопеи США), используя фильтры, задерживающие бактерии, имеющие номинальные размер пор 0,2 мкм. Осуществляли дополнительный процесс фильтрации перед «стерилизацией фильтрованием», чтобы обеспечить низкую биологическую нагрузку. Отбор проб для определения биологической нагрузки осуществляли до стадии предварительного фильтрования, а также стадии стерильного фильтрования.
Приготовление и заполнение стерилизованным раствором подходящих емкостей осуществляли в асептических условиях. Такая процедура соответствует фармакопейным статьям и родственным руководствам, которые требуют стерилизации фильтрованием и последующей асептической обработки. Оборудование, которое контактирует с продуктом после стадии «стерилизации фильтрованием», стерилизовали нагреванием или паром, используя утвержденный способ (согласно Европейской фармакопеи/фармакопеи США).
Флаконы заполняли примерно до 1,2 мл, чтобы обеспечить извлекаемый объем 1,0 мл. Флаконы объемом 2 мл изготовлены из прозрачного бесцветного стекла типа I и их закрывают пробками (покрытый фторполимером бромбутил), герметизируемыми вальцуемыми колпачками с фланцем (полипропилен). Материалы для первичной упаковки удовлетворяют требованиям Европейской фармакопеи и фармакопеи США. Применимость материалов для первичной упаковки подтверждали результатами проверки стабильности. Несовместимости с используемым материалом для первичной упаковки не наблюдали. Вторичная упаковка обеспечивает защиту продукта от света.
Совместимость со шприцами для применения оценивали, используя шприцы 3 разных размеров и диаметров игл (от 25 до 28 калибра), на растворе лекарственного продукта. Не получали различий по качеству продукта. Совместимость испытывали в течение периода времени, составляющего 8 часов.
Препарат 14 получали сериями по 5 л, состав которых показан в таблице 17. Однако размер серии можно корректировать в соответствии с клиническими потребностями.
Состав серии
a Флаконы заполняли до объема 1,2 мл, чтобы обеспечить извлекаемый объем 1,0 мл. Поэтому размер серии 6,0 л теоретически дает в результате 5000 флаконов.
b для корректировки pH.
с рассчитывали в соответствии с плотностью конечного раствора лекарственного продукта (1,05705 мг/мл).
Процесс производства и контроль процесса при получении препарата 14 показаны на блок-схеме на фиг. 9. Производство серии включало в себя следующие стадии:
I. Дигидрат цитрата натрия растворяли в воде для инъекций при перемешивании в сосуде, изготовленном из инертного материала (например, нержавеющей стали или стекла), вплоть до полного растворения. При необходимости значение pH доводили до 5,5, используя разбавленную хлористоводородную кислоту (например, 0,1 M хлористоводородную кислоту) и/или раствор гидроксида натрия (например, 0,1 М гидроксид натрия).
II. Лидирующее антитело, маннит и полисорбат 20 разбавляли в буферном растворе, полученном на стадии 1, при перемешивании в сосуде, изготовленном из инертного материала (например, нержавеющей стали или стекла), вплоть до полного растворения. При необходимости значение pH доводили до 5,5, используя разбавленную хлористоводородную кислоту (например, 0,1 M хлористоводородную кислоту) и/или раствор гидроксида натрия (например, 0,1 М гидроксид натрия). Буферный раствор со стадии 1 (остаток) добавляли, чтобы довести до конечной массы.
III. a) Предварительная фильтрация:
Раствор, полученный на стадии II фильтровали в асептических условиях, используя стерилизованный совместимый мембранный фильтр (например, из полиэфирсульфона или дифторида поливинилидена), имеющий номинальный размер пор 0,2 мкм.
b) Стерилизация фильтрованием:
Раствор, полученный на стадии III.a стерилизовали фильтрованием в асептических условиях в стерилизованные емкости, изготовленные из инертного материала (например, нержавеющей стали или стекла), используя стерилизованный совместимый мембранный фильтр (например, из полиэфирсульфона или дифторида поливинилидена), имеющий номинальный размер пор 0,2 мкм.
IV. Раствор, полученный на стадии III.b, фильтровали в асептических условиях в стерилизованные флаконы, которые закрывали пробками и вальцуемыми колпачками с фланцем.
V. Емкости со стадии IV осматривали в отношении крупных посторонних примесей, не нарушенной герметичности и видимых частиц.
VI. Осмотренные емкости со стадии V дополнительно упаковывали в подходящие емкости (например, картонные коробки).
Кроме того, использовали DLS для определения гидродинамического диаметра мономера антитела и потенциальных растворимых агрегатов. Как показано на фиг. 10, агрегаты не наблюдали в цитратном буфере. Однако, как показано на фиг. 7 и 8, агрегаты наблюдались в PBS. Вследствие более высокой концентрации антитела наблюдали увеличение Z-среднего до 28 нм по сравнению с образцом в PBS.
ПРИМЕР 8 - Профиль стабильности подкожного препарата антитела
Профиль стабильности клинической серии (серии 2) согласно примеру 7 оценивали в отношении хранения в долговременных и в ускоренных условиях испытания согласно руководству ICH. Образцы упаковывали и хранили в прозрачных и бесцветных флаконах объемом 2 мл (стекло типа I), закрытых пробками (покрытый фторполимером бромбутил) и вальцуемыми колпачками с фланцем (полипропилен).
Осуществляли следующие тесты при проверке стабильности: внешний вид (прозрачность, цвет), анализ (антиген-ELISA, УФ), чистота (SEC, SDS-ПААГ в восстанавливающих и не восстанавливающих условиях), целостность молекул (SDS-ПААГ в не восстанавливающих условиях), гетерогенность заряда (слабокатионообменная хроматография, изоэлектрическое фокусирование), pH, стерильность, бактериальные эндотоксины, материал в виде частиц (видимые и довидимые частицы) и целостность упаковки.
Образцы хранили в перевернутом и прямом положении. Результаты хранения в перевернутом положении представляли как более жесткое условие. Данные о стабильности при -20°C, +5°C и +25°C представлены таблицах 18-20, соответственно. Исследования физических, химических и биологических свойств при хранения в условиях длительного тестирования подтвердили хорошую стабильность лекарственного продукта при 5°C (смотрите таблицу 19). В условиях ускоренного тестирования (+25°C) выявили только небольшое снижение чистоты с использованием эксклюзионной хроматографии по размеру (смотрите таблицу 20). Таким образом, было подтверждено, что лекарственный продукт следует хранить при температуре от +2°C до +8°C, защищенным от света.
Долговременная стабильность лекарственного продукта при -20°C
Долговременная стабильность лекарственного продукта при +5°C
Стабильность лекарственного продукта в ускоренных условиях при +25°C
ПРИМЕР 9 - Разработка препарата со сверхвысокой концентрацией антитела для подкожного введения
На основе успешных результатов, полученных в случае забуференных цитратом препаратов с концентрациями антитела вплоть до 150 мг/мл в примере 7, разрабатывали препараты антител с более высокой концентрацией (до 250 мг/мл), подходящие для подкожного введения.
Предварительные данные показали, что препарат с концентрациями антитела выше 150 мг/мл может приводить к более высокой вязкости, влияющей на применение препарата.
Сверхвысокие концентрации в случае препарата 14
Как показано в таблице 21, вязкость снижается при более низких концентрациях антитела, все еще оставаясь в приемлемом диапазоне при более высокой концентрации, приготовленной с использованием препарата 14. На все другие параметры сверхвысокие концентрации, по-видимому, не влияли или оказывали только слабое влияние.
Как показано в таблице 22, концентрации антитела не влияла на стабильность препаратов, о чем свидетельствовали идентичные данные о стабильности в течение 1 месяца в условиях долговременного исследования и стрессовых условиях.
Данные о стабильности в течение 1 месяца препаратов лидирующего антитела во сверхвысокой концентрацией
Предварительное исследование компонентов-кандидатов для препарата анти-CXCR5 (20 мг/мл)
Гуманизированное IgG4 анти-CXCR5-антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:26 («лидирующее CXCR5-антитело») использовали в примерах 10-12, чтобы определить оптимальные условия приготовления препарата в случае препарата с концентрацией 20 мг/мл.
Лидирующее антитело представляет собой гуманизированное моноклональное антитело (мАт), специфичное по отношению к CXCR5 человека, имеющее сконструированный IgG4-каркас, содержащий 2 аминокислотных замены, направленных на восстановление полумолекул (S241P) и эффекторные функции (L248E). Белковая структура лидирующего CXCR5-антитела состоит из двух легких каппа-цепей, каждая из которых имеет молекулярную массу приблизительно 24 кДа, и двух тяжелых цепей IgG4, каждая из которых имеет молекулярную массу приблизительно 48 кДа, связанных дисульфидными мостиками. Каждая легкая цепь состоит из 219 аминокислотных остатков, и каждая тяжелая цепь состоит из 437 аминокислотных остатков.
Данные, представленные в примерах 10-12, собирали во время мероприятий по предварительному исследованию компонентов-кандидатов, проводимых в отношении лидирующего CXCR5-антитела и получаемого из него лекарственного продукта для внутривенного и подкожного введения. Целью предварительных исследований компонентов-кандидатов было получение хорошей стабильности забуференных раствором лидирующего CXCR5-антитела с нужной концентрацией 20 мг/мл, при этом особое значение придавали агрегационному поведению лидирующего CXCR5-антитела и присущей ему тенденции образовывать полумолекулы, так как лидирующее антитело представляет собой антитело подкласса IgG4, которое склонно к агрегации и образованию частиц.
МАТЕРИАЛЫ
Лекарственная субстанция (DS)
Серию лидирующего CXCR5-антитела RSN0151 готовили в PBS, pH 7,2, в концентрации 5,13 мг/мл.
Эксципиенты
В таблице 23 показаны эксципиенты, которые были использованы во время предварительных исследований компонентов-кандидатов.
Эксципиенты, используемые во время предварительного исследования компонентов-кандидатов
СПОСОБЫ
Следующие способы использовали для получения экспериментальных препаратов и препаратов согласно изобретению, содержащих лидирующее CXCR5-антитело.
Приготовление и состав буферов
Все буферы готовили при постоянном перемешивании, чтобы растворить соответствующие эксципиенты. pH корректировали, используя 0,1 М HCl или 0,1 М NaOH. Общая концентрация всех буферов составляла 10 мМ.
Приготовление и состав маточных растворов эксципиентов
Все маточные растворы готовили при постоянном перемешивании, чтобы растворить эксципиенты. Концентрация приводили в виде массы/массу (масс./масс.).
UF/DF - небольшой масштаб
UF/DF-эксперименты осуществляли, используя устройство Vivaspin (Sartorius Stedim, Gottingen, Germany) с мембраной Hydrosart и пределом отсечения 30 кДа для удаления фосфатного буфера и его замены соответствующими буферами и для увеличения концентрации. Такие устройства помещали в обычную лабораторную центрифугу (Multifuge 3S, Haereus, Germany) и центрифугировали при 2000 об./мин (860 G, радиус ротора 192 мм) при +5°C.
UF/DF - большой масштаб
UF/DF-эксперименты осуществляли, используя устройства Vivaflow (Sartorius Stedim, Gottingen, Germany) с мембраной Hydrosart и пределом отсечения 30 кДа для удаления фосфатного буфера и его замены соответствующими буферами и для увеличения концентрации. Оборудование помещали в бокс в асептических условиях и процесс осуществляли при комнатной температуре.
Стерильная фильтрация образцов
Все образцы, растворы, буферы и т.д. стерильно фильтровали (0,22 мкм), используя мембрану Sartopore-2. Образцы фильтровали в стерилизованные бутылки или флаконы и закрывали в асептических условиях в боксах, чтобы предотвратить микробиологическую контаминацию.
Тестирование с использованием механического стресса
Механический стресс со скоростью встряхивания 350/минуту в течение 2,5 часов при комнатной температуре осуществляли, используя горизонтальный лабораторный встряхиватель с расстоянием 26 мм (инкубатор-встряхиватель из Buhler Company). Флаконы 2R наполняли 1 мл раствора, при этом свободное пространство составляло примерно 2,5 мл.
Тестирование с использованием механического стресса планировали и осуществляли во время первого предварительного исследования компонентов для производства препарата. Так как результаты анализа не дали какой-либо дополнительной информации по сравнению с тестированием в условиях термического стресса во время подбора буфера или выбора pH, такой тест использовали только во время выбора поверхностно-активного вещества.
Тестирование с использованием термического стресса
Термический стресс использовали в качестве стресс-теста во время всех стадий программы предварительного исследования компонентов-кандидатов. Образцы хранили при +40°C в течение либо 24, либо 7 суток, либо 3 месяцев, в зависимости от исследования.
Аналитические способы при заполнении и последующей обработке препаратов
Следующие аналитические способы использовали при заполнении и последующей обработке препаратов в следующих примерах.
Внешний вид
Внешний вид растворов антител проверяли визуально и дополнительно документировали, фотографируя цифровой камерой.
pH
Все измерения pH осуществляли, используя pH-метр с микроэлектродом.
Концентрация с использованием УФ
Концентрации белка во всех растворах антител измеряли против буфера, используя NanoDrop ND1000. Концентрации белка близкие или ниже 5 мг/мл разбавляли 1:3, тогда как белки в более высоких концентрациях, около 20 мг/мл, разбавляли 1:20 перед измерение оптической плотности при 215 нм и 280 нм.
Динамическое светорассеяние (DLS)
Гидродинамический диаметр молекулы измеряли, используя лазерное светорассеяние. Образцы стерильно фильтровали перед аналитическим исследованием, если наблюдали мутность, таким образом, можно было выявлять только растворимые агрегаты.
Тестирование с использованием тиофлавина-T
Измерения флуоресценции некоторых образцов предварительных препаратов осуществляли, используя Tecan GENios Plus, XFLOUR4. Образцы подвергали механическому стрессу (4 часа при +37°C, скорость встряхивания 300 единиц/мин и расстояние 26 мм в инкубаторе-встряхивателе из Buhler company). Спектры флуоресценции тиофлавина-T измеряли при комнатной температуре. 10 мкл раствора тиофлавина-T (10,1 мМ в воде сверхвысокой степени очистки) добавляли к 1 мл препаратов и осторожно перемешивали. Затем смесь набирали в черную V-образную пробирку Эппендорф и затем разносили в 96-луночный планшет (100 мкл на лунку).
Тест с тиофлавином-T использовали в начале предварительных исследований компонентов-кандидатов для препарата, чтобы выявить нерастворимые агрегаты. Но так как такие агрегаты можно было наблюдать визуально по мутности раствора, такой способ не использовали для всей программы предварительных исследований компонентов-кандидатов.
Дифференциальная сканирующая калориметрия (DSC)
Аликвоты образцов предварительных препаратов исследовали с помощью DSC, используя VPCapillary DSC из Microcal, и сканировали на устройстве с автоматическим отбором проб, используя параметры 90°C/час и время фильтра 2 секунды. Образцы объемом 400 мкл помещали в 96-луночные планшеты и анализировали в отношении температуры разворачивания Tm.
Осмолярность
Осмолярность измеряли, используя автоматический осмометр Knaur.
Плотность
Плотность препаратов измеряли, используя вискозиметр с падающим шариком DMA4500 Anton Paar.
Аналитические способы в биоаналитике FF
Эксклюзионная хроматография по размеру (SEC)
Олигомеры/димеры антител количественно оценивали, используя эксклюзионную хроматографию по размеру. Тестирование осуществляли, используя изократическую ВЭЖХ и колонку SUPERDEX 200 10/300.
SDS-ПААГ в восстанавливающих и не восстанавливающих условиях
Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-ПААГ) использовали для анализа целостности молекул (например, полумолекул) и появления продуктов распада. Такой электрофоретический анализ осуществляли, используя 15% гомогенные гели в восстанавливающих и не восстанавливающих условиях. Белки визуализировали окрашиванием серебром после электрофоретического разделения.
WCX
Слабокатионообменную хроматографию (WCX) использовали для исследования гетерогенности заряда антитела. Представляли процентное содержание основных, нейтральных и кислых форм. Тест осуществляли, используя прерывистую ВЭЖХ и колонку ProPac WCX 10.
Антиген-ELISA
Антиген-ELISA осуществляли для того, чтобы определить функциональность антитела. Связывающие свойства по отношению к 28-мерному пептиду антигена CXCR5 оценивали в сравнении с современным стандартом антитела. Такую эффективность выражали в виде относительного показателя EC50.
Изоэлектрическое фокусирование (IEF)
Осуществляли IEF.
Хранение
Все буферные растворы, растворы эксципиентов и образцы хранили при 5°C, если не указано иное.
КРАТКОЕ ОПИСАНИЕ ВСЕХ ПРИГОТОВЛЕННЫХ И ПРОАНАЛИЗИРОВАННЫХ ПРЕПАРАТОВ
В таблице 24, приведенной ниже, показано сводная характеристика всех препаратов, которые были приготовлены и проанализированы в примерах 10-12. Каждый из препаратов содержал лидирующее CXCR5-антитело. PBS означает фосфатно-солевой буфер. PB означает фосфатный буфер. PS означает полисорбат. LA означает лидирующее CXCR5-антитело.
Сводная характеристика всех приготовленных и проанализированных препаратов
Пример 10 - Препарат в фосфатном буфере
Далее приведен обзор результатов, полученных при характеристике лекарственной субстанции лидирующего CXCR5-антитела в фосфатном буфере.
IEF
pI (изоэлектрическая точка) лидирующего CXCR5-антитела была вычислена теоретически и равна 7,6, что подтверждали изоэлектрическим фокусированием в денатурированном состоянии (pI 7,6-8,4). Смотрите фиг. 11.
SDS-ПААГ
SDS-ПААГ использовали для определения молекулярной массы мономера антитела, потенциальных агрегатов или присутствия полумолекул. На фиг. 12 показан пример SDS-ПААГ-геля для сравнения разных серий лекарственной субстанции в восстанавливающих и не восстанавливающих условиях.
ELISA
На фиг. 13 показан пример графика ELISA для определения антигенсвязывающей активности лидирующего антитела.
SEC
Как показано на фиг. 14, эксклюзионная хроматография по размеру выявляла высокомолекулярные белки (HMWP), например, ди/олигомеры или агрегаты и низкомолекулярные белки (LMWP) или продукты распада. Серия лидирующего CXCR5-антитела имела чистоту 99% по содержанию мономера.
WCX
Слабокатионообменная хроматография лидирующего антитела, как показано на фиг. 15, выявила гетерогенность заряда. Во время исследований стабильности изменялось распределение кислых пиков и возрастало процентное содержание основных изоформ. Лидирующее CXCR5-антитело имело распределение кислых/нейтральных/основных изоформ 14/85/1%.
Динамическое светорассеяние
Как показано на фиг. 16, DLS использовали для определения гидродинамического диаметра мономера антитела и потенциальных растворимых агрегатов.
В заключение, лидирующее антитело может быть стабильным в PBS, но образование агрегатов легко может быть вызвано сдвиговыми силами или световым стрессом.
Кроме того, pH PBS близко к pI лидирующего CXCR5-антитела. Поэтому препарат следует готовить, по меньшей мере, на один шаг pH ниже pI.
В таблице 25 показано 3 результата трехмесячного исследования стабильности лидирующего CXCR5-антитела. Лидирующее антитело хранили при разных температурах и анализировали через один и три месяца.
Результаты анализа 3-месячного исследования стабильности лекарственной субстанции
Данные о 3-месячной стабильности лидирующего CXCR5-антитела, забуференного в PBS, не выявили значимых изменений при хранении в условиях +5°C и -20°C. Спустя 3 месяца в условиях ускоренных испытаний (+25°C) не наблюдали значимых изменений. Дополнительные полосы, которые анализировали в SDS-ПААГ и Вестерн-блот-анализах, показывали увеличение основных и уменьшение кислых изоформ, свидетельствуя о продуктах распада.
Пример 11 - Оптимизация буфера и pH
В PBS с pH 7,2 наблюдали агрегацию и распад после циклов замораживания/размораживания и после хранения в замороженном состоянии. Таким образом, было необходимо найти другой буфер и лучший диапазон pH. Кроме того, PBS не подходит для замораживания растворов, так как происходит сдвиг pH.
Использовали 30 разных буферов с разными pH и системы буферов, чтобы выбрать наилучший диапазон pH. Такие эксперименты проводили в очень небольшом масштабе и подробно анализировали.
Скрининг для выбора наилучшего буфера и pH - небольшой масштаб (выход 5 мл)
Результаты анализа суммированы в таблице 40, таблице 41, таблице 42 и таблице 43.
На фиг. 17 и фиг. 18 показан внешний вид двух подходящих буферных систем (ацетат и гистидин) после термического стресса. Для дальнейшей оценки были выбраны pH 5,5 в ацетате и pH 5,0 в гистидине. Для сравнения на фиг. 19 показан внешний вид несовместимой буферной системы (трис-буфер).
Следующие буферы были выбраны для тестирования в большем масштабе UF/DF:
- Цитрат 10 мМ, pH 6
- Ацетат 10 мМ, pH 5,5
- Сукцинат 10 мМ, pH 5
- Гистидин 10 мМ, pH 5
- Аргинин 10 мМ, pH 6
Скрининг для выбора наилучшего буфера и pH - большой масштаб (выход приблизительно 20 г)
После того, как смогли выбрать наилучшие буферы и pH получали большие количества лидирующего CXCR5-антитела в каждой буферной системе, используя систему Sartorius Vivaflow. Каждую серию подвергали аналитическому тестированию, и результаты описаны ниже.
Цитратный буфер 10 мМ, pH 6 (LA_09_016)
Была осуществлена стадия UF/DF и получен только слегка мутный раствор; трудности во время стерильной фильтрации не встречались. Не наблюдали увеличения гидродинамического диаметра, который анализировали в DLS.
Результаты анализа свидетельствовали об отсутствии увеличения количества димеров и отсутствии изменений среди основных или кислых изоформ по сравнению с материалом серии лидирующего CXCR5-антитела. Смотрите таблицу 26 и фиг. 20.
Результаты анализа лидирующего антитела в цитратном буфере, pH 6
Ацетатный буфер 10 мМ, pH 5,5 (LA_09_017)
Была осуществлена стадия UF/DF, но был получен мутный раствор; происходило засорение фильтр во время стерильной фильтрации.
Результаты анализа свидетельствовали об отсутствии увеличения количества димеров и отсутствии изменений среди основных или кислых изоформ по сравнению с материалом серии лидирующего CXCR5-антитела. Смотрите таблицу 27 и фиг. 21.
Результаты анализа лидирующего антитела в ацетатном буфере, pH 5,5
Сукцинатный буфер 10 мМ, pH 5 (LA_09_018)
Стерильную фильтрацию после UF/DF было трудно осуществить из-за засорения фильтра. Выход 12 г был очень низким.
Результаты анализа показали небольшое снижение количества димеров и отсутствие изменение среди основных или кислых изоформ по сравнению с материалом серии лидирующего CXCR5-антитела. После механического стресса концентрация димеров незначительно увеличивалась и пик кислых изоформ при WCX снижался, тогда как пик основных изоформ увеличивался. Смотрите таблицу 28 и фиг. 22.
Результаты анализа лидирующего антитела в сукцинатном буфере, pH 5
Гистидиновый буфер 10 мМ, pH 5 (LA_09_019)
Стерильная фильтрация после UF/DF была очень затруднена вследствие засорения фильтра. Выход 10,5 г был очень низким.
Результаты анализа показали небольшое снижение количества димеров и отсутствие изменений среди основных или кислых изоформ по сравнению с материалом серии лидирующего CXCR5-антитела. После механического стресса концентрация димеров слегка увеличивалась и пик кислых изоформ при WCX снижался, тогда как пик основных изоформ увеличивался. Смотрите таблицу 29 и фиг. 23.
Результаты анализа лидирующего антитела в гистидиновом буфере, pH 5
Аргининовый буфер 10 мМ, pH 6 (LA_09_020)
Осуществление стерильной фильтрации после UF/DF было сильно затруднено. DLS показало широкий пик, соответствующий гидродинамическому диаметру 21,08 нм, который может свидетельствовать об образовании димеров.
Результаты анализа показали небольшое увеличение количества димеров от 0,29% в серии лидирующего CXCR5-антитела до 0,49% в аргинине. После механического стресса обнаружено 0,61% димеров и выявлено увеличение количества основных изоформ при WCX. Смотрите таблицу 30 и фиг. 24.
Результаты анализа лидирующего антитела в аргининовом буфере, pH 5
В заключение, три из пяти партий были совместимы с лидирующим CXCR5-антителом в концентрации 20 мг/мл:
- цитрат pH 6,0
- ацетат pH 5,5
- гистидин pH 5,0
Такие партии характеризовали в отношении совместимости и стабильности более подробно.
Пример 12 - Совместимость с эксципиентами
Все указанные выше партии использовали для исследований совместимости с поверхностно-активными веществами. Исследования совместимости осуществляли с использованием лидирующего CXCR5-антитела и четырех выбранных буферов. Сукцинат с pH 5,0 и аргинин с pH 6,0 больше не тестировали с эксципиентами, так как такие буферы были не совместимы с лидирующим CXCR5-антителом. Эксципиенты классифицировали следующим образом:
- поверхностно-активные вещества;
- сахара;
- соли;
- другие (аминокислоты, консерванты)
Механический стресс (скорость встряхивания 350/мин, 2,5 часа, комнатная температура) применяли для тестирования влияния поверхностно-активных веществ, и термический стресс (+40°C, одна неделя) использовали для тестирования всех других эксципиентов.
Поверхностно-активные вещества
Ориентировочные исследования по отбору типа поверхностно-активных веществ (LA_08_001) и концентрации поверхностно-активных веществ (LA_09_003; 0,01%, 0,05%, и 0,1%) показали, что концентрация 0,01% была достаточной для предотвращения видимых агрегатов. Следующие поверхностно-активные вещества были не подходящими для лидирующего CXCR5-антитела: PVP K12 и K17, так как оба приводили к мутности перед применением механического стресса. Кроме того, было показано, что ионогенные поверхностно-активные вещества, такие как додецилсульфат натрия, были несовместимы с растворами белка лидирующего CXCR5-антитела.
В качестве примера на фиг. 25 показан внешний вид разных забуференных цитратом растворов с разными поверхностно-активными веществами после механического стресса, и в сравнении с раствором без какого-либо поверхностно-активного вещества. Результаты анализа собраны в таблице 44 и таблице 45.
Другие эксципиенты
После термического стресса при +40°C в течение одной недели и проведения анализа можно было сделать выбор эксципиентов, совместимых с лидирующим CXCR5-антителом в разных буферных системах.
Некоторые эксципиенты не могли тестировать во всех четырех буферных системах, так как был доступен только небольшой объем образца.
После рассмотрения всех аналитических данных эксципиенты, указанные в таблице 31, идентифицировали как совместимые с лидирующим CXCR5-антителом. Такие эксципиенты не приводили к значимому увеличению количества димеров, HMWP или основных изоформ, анализируемых с использованием SEC и WCX.
Все измерения гидродинамических диаметров показали наличие острого пика мономера, и Tm в случае подходящих эксципиентов не снижалось по сравнению с лидирующим CXCR5-антителом в соответствующей буферной системе. Все аналитические данные суммированы в таблице 46, таблице 47, таблице 48 и таблице 49.
Совместимость всех тестированных эксципиентов в разных буферных системах
В заключение, исследования совместимости поверхностно-активных веществ ясно показали, что полисорбат 20 подходит для всех выбранных буферов в сочетании с лидирующим CXCR5-антителом в концентрации 20 мг/мл. Поверхностно-активное вещество предотвращает образование частиц во время механического стресса. Почти все другие поверхностно-активные веществ приводили к увеличению HMWP.
Следующие эксципиенты были выбраны для приготовления разных прототипных препаратов: NaCl, трегалоза (сахароза более или менее сравнима с трегалозой в отношении стабильности) и аргинин-HCl.
3-МЕСЯЧНОЕ ИССЛЕДОВАНИЕ СТАБИЛЬНОСТИ ПРОТОТИПОВ
Чтобы помочь в разработке препарата лидирующего CXCR5-антитела, получали двенадцать прототипных препаратов и поместили для оценки стабильности в разные условия (-20°C, +5°C и +40°C) на три месяца.
Были выбраны три разных буферных системы на основе описанного ранее скрининга буфера, pH и эксципиентов.
Цитрат с pH 6,0 (номер препарата LA_09_027), ацетат с pH 5,5 (LA_09_028) и гистидин с pH 5,0 (LA_09_029) использовали в виде 10 мМ буферных растворов с 20 мг/мл лидирующего антитела и четырьмя разными сочетаниями эксципиентов (таблица 32).
Указанные четыре эксципиенты показали многообещающие результаты после скрининга эксципиентов. NaCl был выбран для корректировки осмолярности, трегалоза выбрана для корректировки тоничности и для того, чтобы при необходимости присутствовал сахар в случае выбора лиофилизации. Кроме того, трегалоза может стабилизировать антитело, и аргинин-HCl был также выбран в качестве стабилизатора. Обнаружено, что полисорбат 20 полезен для предотвращения агрегации во время механического стресса.
В следующих пунктах показаны выбранные данные, которые собраны во время исследования стабильности с целью выбора наилучшей буферной системы и наилучших эксципиентов для разработки препарата. В таблице 33 собраны все условия хранения, временные точки и способы анализа.
Составы четырех разных вариантов препаратов
Условия хранения и временные точки для аналитического тестирования
*подходящий
К сожалению, данные о 3-месячной стабильности лидирующего CXCR5-антитела в PBS-буфере не были сравнимы со стабильностью прототипа из-за различий серий и разных условий ускоренного тестирования.
Эксклюзионная хроматография по размеру (SEC)
На фиг. 26 можно ясно видеть увеличение образования димеров до 10% после трех месяцев хранения во всех четырех гистидиновых препаратах. В ацетатных препаратах наблюдали увеличение содержания димеров до 6%. Во всех четырех цитратных препаратах концентрация димеров была ниже 2% даже после трех месяцев при +40°C.
Слабокатионообменная хроматография (WCX)
Так как определение нейтральных, основных и кислых изоформ является хорошим показателем стабильности разных препаратов, такие способы использовали, чтобы дополнить данные SEC.
На фиг. 27 можно снова видеть, что гистидин является плохим для стабильности лидирующего CXCR5-антитела в условиях ускоренных испытаний. Небольшое увеличение основных изоформ можно отметить в случае всех четырех ацетатных препаратов, но интересно, что в случае цитратных препаратов невозможно было отличить четыре препарата. Кроме того, на фиг. 28 показано сильное снижение содержания нейтральных изоформ в случае гистидиновых препаратов и небольшое снижение в случае ацетата. И снова лидирующее CXCR5-антитело было меньше всего подвержено влиянию в цитрате.
SDS-ПААГ
Результаты измерений в SDS-ПААГ можно найти в таблицах результатов в приложении. Смотрите таблицы 37-61.
Температура разворачивания (Tm)
Температуру разворачивания можно использовать для прогнозирования стабильности разных препаратов, и ее измеряли в данном случае, используя оборудование Microcal. Чем выше Tm, тем более многообещающими были препараты. Точность измерений Tm составляла +/-0,4°C.
Между цитратными и ацетатными препаратами почти не было отмечено различий по Tm в точке T0. Кроме того, препараты A, B и D имели немного более высокую Tm по сравнению с C. Все препараты A, B и D содержат трегалозу.
Гистидиновые препараты имели значительно более низкую Tm во всех случаях.
Температуры разворачивания в T0
Так как pH представляет наибольший интерес и важен для стабильности раствора антитела, контролировали pH. На следующих фигурах показана разница pH между T0, T1, T2 и T3 при хранении в условиях ускоренных испытаний.
Наиболее стабилизирующими pH препаратами являются забуференные цитратом препараты, и особенно препараты B и D (фиг.29). В забуференных ацетатом растворах лидирующего CXCR5-антитела pH было сдвинуто в сторону более высоких значений (фиг.30). В забуференных гистидином растворах pH немного снижался (фиг.31).
DLS
Гидродинамический диаметр мономера и потенциальных растворимых агрегатов измеряли, используя динамическое светорассеяние.
Только после хранения в условиях ускоренных испытаний (+40°C) можно было наблюдать растворимые агрегаты < 200 нм. такие агрегаты в основном возникали в забуференном гистидином препарате LA_09_029 A, C, D после 3 недель хранения.
В забуфренных цитратом препаратах наблюдали только небольшие агрегаты (фиг.32) после трех недель в препарате C и после шести недель хранения в препарате A. Некоторые агрегаты также можно было выявить после трех месяцев в препарате B. Но по сравнению с забуференными ацетатом препаратами количество было очень небольшим.
В забуференном ацетатом препарате LA_09_028 C наблюдали некоторое количество агрегатов < 200 нм после трех недель, а после трех месяцев также и в препарате A. Смотрите фиг. 33.
УФ
Контролируя концентрацию белка по измерениям в УФ, не наблюдали значимых различий между всеми временными точками, образцами и препаратами. Так как объем образца был очень маленьким, концентрацию измеряли с использованием оборудования Nanodrop. Результаты варьировали в пределах +/-5%. Для получения подробной информации смотрите таблицы 50-61.
Внешний вид
После трехмесячного периода хранения все образцы оставались прозрачными и бесцветными без какой-либо мутности даже в гистидине. Такое наблюдение также показывает, что все измеренные агрегаты в DLS были растворимыми. Нерастворимые и агрегаты довидимого диапазона можно выявить на основе измерения оптического затемнения с использованием HIAC.
HIAC
Частицы довидимого диапазона выявляли в T0 и после трех недель хранения при +5°C. В таблице 36 можно ясно видеть, что образование частиц, главным образом, наблюдается в ацетатном буфере. Интересно, что гистидин давал хорошие результаты в случае всех четырех разных препаратов. В случае цитратных препаратов A, B и C также были хорошие результаты. Так как уровень частиц >10 мкм и >25 мкм и значения для всех препаратов были намного ниже пределов, определенных в Европейской фармакопеи и фармакопеи США, то образование частиц не рассматривали.
Осмолярность
Количественную оценку эксципиентов для корректировки осмолярности осуществляли перед изготовлением образцов путем расчетов, так как объем образцов не был известен в случае ориентировочных экспериментов. Поэтому осмолярность была ниже, чем должна быть (в идеале от 280 до 320 мОсмоль/кг), таблица 35. Дополнительные исследования для более точной корректировки будут осуществлены во время исследований по оптимизации препарата.
Осмолярность в T0 для все прототипных препаратов
Таблица 36
Количество частиц в миллилитре для двух отдельных образцов в T0 и после 3 недель хранения при +5°C, которое анализировали по оптическому затемнению (HIAC)
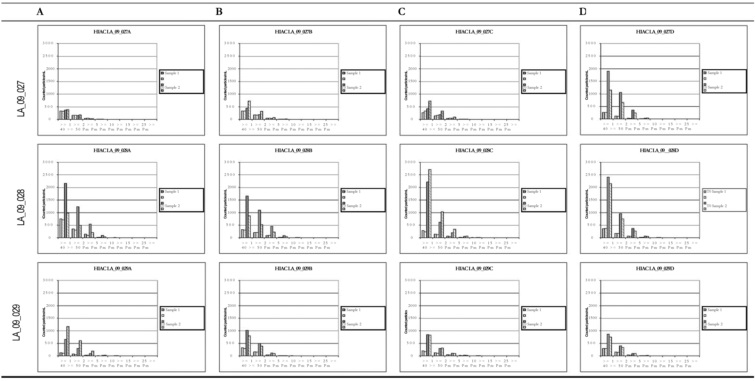
Заключение
В заключение, в цитратном буфере, ацетатном буфере и гистидиновом буфере не наблюдали изменений после хранения при +5°C и -20°C, и только небольшое увеличение уровня продуктов распада наблюдали в случае ацетатного буфера через 3 месяца.
Хранение лидирующего CXCR5-антитела в условиях ускоренных испытаний приводило к значимым изменениям ЛС. В то время как в цитратном буфере наблюдали только небольшие изменения, в ацетатном буфере наблюдали значимое увеличение продуктов распада и продуктов агрегации и снижение нейтральных изоформ относительно кислых или основных изоформ.
Огромное влияние на лидирующее CXCR5-антитело наблюдали в условиях ускоренных испытаний (до 29,6% высокомолекулярных белков и до 8,2% ди/олигомеров и до 1,3% низкомолекулярных белков). Также, катионообменная хроматография выявила снижение уровня нейтральных изоформ до 50%.
Целевая концентрация 20 мг/мл может быть достигнута в случае всех тестированных буферов, например, цитрата, ацетата и гистидина.
Диапазон pH стабильного лекарственного препарата может быть определен как pH 5-6,5.
Были успешно проведены две стали увеличения масштаба (4 мл/E 100 мл - 1000 мл UF/DF) с использованием трех выбранных буферов.
Оценивали и аналитически подтвердили уменьшение образования агрегатов при использовании 0,01% полисорбата 20 во всех выбранных буферах после механического стресса (скорость встряхивания 350/мин, 2,5 часа, комнатная температура).
При добавлении 0,01% полисорбата 20 можно было наблюдать отсутствие или снижение HMWP и, следовательно, может быть достигнуто повышение фильтрационной способности (0,22 мкм).
Количество димеров/олигомеров в высокой степени зависело от буфера и pH, и его анализировали, используя SEC, SDS-ПААГ и DLS.
Характеристика лекарственной субстанции
Молекула лидирующего CXCR5-антитела была высоко стабильной в отношении распада или образования полумолекул, но оказалось, что во время предварительного исследования компонентов-кандидатов лидирующее CXCR5-антитело, растворенное в PBS при pH 7,2, имело тенденцию к агрегации. Поэтому такой буфер был неподходящим с точки зрения долговременной стабильности. Образование видимых и довидимых частиц во время хранения или циклов замораживания/размораживания следует тщательно контролировать во время разработки препарата и исследований стабильности.
Наилучший буфер и выбор pH
После выбора наилучшего буфера и pH обнаружили, что цитратный буфер 10 мМ с pH 6,0, является подходящим для растворов, содержащих 20 мг/мл лидирующего CXCR5-антитела. 10 мМ гистидиновый буфер, pH 5, или 10 мМ ацетатный буфер, pH 5,5, могут служить в качестве резервных вариантов.
Исследование совместимости с эксципиентами
Следующие эксципиенты рекомендованы для препаратов-прототипов:
- полисорбат 20,
- трегалоза/сахароза,
- NaCl,
- аргинин-HCl.
Следующие эксципиенты не рекомендованы для разработки:
- бензиловый спирт,
- мальтоза,
- маннит,
- декстран,
- лизин-HCl.
Исследование стабильности препарата-прототипа в течение 3 месяцев
Наблюдали превосходную стабильность 20 мг/мл лидирующего CXCR5-антитела в цитратном буфере с pH 6,0, ацетатном буфере с pH 5,5 и гистидиновом буфере с pH 5,0 при +5°C и -20°C после трех месяцев хранения. Небольшой распад при +40°C (<5% снижение содержания мономера) наблюдали в цитратном буфере, тогда как в ацетатном буфере наблюдали низкое, но значимое, а в гистидиновом буфере сильное увеличение артефактов.
Во всех тестированных препаратах наблюдали значимое снижение образования частиц во время хранения по сравнению с обнаруженным воспроизведенным препаратом в PBS, pH 7,2.
Таким образом, в таком предварительном исследовании компонентов-кандидатов рекомендуется использование 10 мМ цитратного буфера с pH 6 для лекарственной субстанции и лекарственного препарата лидирующего CXCR5-антитела. Стерильный профильтрованный буферный раствор, содержащий 20 мг/мл лидирующего CXCR5-антитела, и повышающие стабильность эксципиенты должны быть допущены при соблюдении рекомендации по хранению при +5°C во флаконах.
Для корректировки тоничности можно использовать трегалозу и NaCl, а полисорбат 20 следует использовать для предотвращения образования агрегатов.
Возможность осуществления UF/DF-экспериментов либо для замены буферной системы, и/либо для повышения концентрации мАт от 5 мг/мл до 20 мг/мл можно показать в разных масштабах.
Таблица 37
Пояснения к оценке данных
Оценка данных предварительного исследования компонентов препарата лидирующего CXCR5-антитела
Результаты предварительного тестирования упаковочного материала (оценка данных)
Результаты предварительных тестов разных стрессов (оценка данных)
Таблицы 40-61 (см. графическую часть)
Исследования анти-CXCR5-препаратов (20 мг/мл)
Данные, описанные в примерах 13-16, собирали во время исследований препаратов в отношении лидирующего CXCR5-антитела и его лекарственного продукта для внутривенного и подкожного введения. Целью исследований препаратов было получение стабильного прозрачного или слегка опалесцирующего и бесцветного или слегка желтоватого, визуально не содержащего частиц раствора лидирующего CXCR5-антитела для инъекций для фазы I.
МАТЕРИАЛЫ
Лекарственная субстанция (DS)
Две серии лекарственной субстанции использовали для таких исследований препарата. Одну готовили в фосфатно-солевом буфере (PBS), а другую готовили в цитратном буферу. Смотрите таблицу 62.
Имеющиеся серии лекарственной субстанции
Эксципиенты
В таблице 63 показаны эксципиенты, которые использовали во время исследования препарата.
Эксципиенты
СПОСОБЫ
Приготовление образца
Ультрафильтрацию/диафильтрацию осуществляли в небольшом масштабе, используя устройства VivaSpin с мембраной Hydrosart и предел отсечения 30 кДа. Материал RSN концентрировали от 5 мг/мл до 20 мг/мл и фосфатный буфер (PBS) заменяли либо на 10 мМ цитратный буфер с pH 6,0, либо ацетатный буфер с pH 5,5, либо гистидиновый буфер с pH 5,0. Элементы VivaSpin помещали при комнатной температуре (КТ) в обычную лабораторную центрифугу и центрифугировали со скоростью 2000 об./мин. Раствор фильтровали через 0,2 мкм Minisart перед аналитическим тестированием. Все образцы хранили при температуре от +2° до +8°C, плотно закрытыми и защищенными от света вплоть до аналитического тестирования в T0 и после однонедельного термического стресса при +40°C или после механического стресса в течение 2,5 часов, 300 об./мин при КТ (только в случае оценки концентрации полисорбата 20).
Способы анализа
Следующие способы использовали для анализа образцов:
Применяемые способы анализа
* Некоторые образцы будут проанализированы.
**SDS-ПААГ будет осуществлен в том случае, когда SEC показывает необычные результаты.
Пример 13 - Дополнительная оптимизация pH
Предварительные исследования компонентов препарата показали, что 10 мМ цитратный буфер с pH 6,0 является наилучшим буфером с меньшей тенденцией агрегации лидирующего CXCR5-антитела. Чтобы получить pH-профиль в цитратном буфере, оценивали стабильность, зависимую от ступенчатого изменения pH от pH 5,0 до 7,0. Вследствие ограниченной доступности лекарственной субстанции подробный pH-скрининг осуществляли только с использованием 10 мМ цитратного буфера. Образцы брали в T0 и после однонедельного термического стресса при +40°C. Смотрите таблицы 65-69.
Общие сведения об образцах
Результаты T0
Результаты T=1 неделя +40°C
* Необычный результат вследствие ошибки разбавления
Результаты ASD, T0
Результаты T=1 неделя +40°C
В заключение, данные подтверждают результаты, уже полученные во время предварительных исследований компонентов-кандидатов: повышение pH вызывает снижение содержания мономера и увеличении доли димеров. В образцах при +40°C при более низком pH-значении наблюдали снижение HMW вплоть до pH 6,0 и затем увеличение вплоть до pH 5,0.
Пример 14 - Дополнительная оптимизация буфера
Затем цитратный, ацетатный и гистидиновый (в качестве резервного буфера) буферы подвергали скринингу в концентрации 5/10/25/50 мМ при выбранных pH-значениях. Смотрите таблицы 70-84.
Общие сведения об образцах - цитратный буфер рН 6,0
Результаты после T0
Результаты после T=1 неделя при +40°C
Результаты T0
Результаты после термического стресса 1 неделя/+40°C
Общие сведения об образцах - гистидиновый буфер рН 5,0
Результаты после T0
* Низкие значения вследствие ошибки разбавления образца.
Результаты после T=1 неделя при +40°C
Результаты ASD T0
* не анализировали из-за ошибки разведения.
Результаты после термического стресса 1 неделя/+40°C
* не анализировали из-за ошибки разведения.
Общие сведения об образцах -ацетатный буфер рН 5,5
Результаты после T0
Результаты после T=1 неделя при +40°C
Результаты T0
Результаты после термического стресса 1 неделя/+40°C
В заключение, данные подтверждают результаты, полученные в ходе предварительных исследований компонентов-кандидатов. При использовании цитрата в качестве буферного средства содержание мономера немного выше, чем в случае ацетатного буфера и гистидинового буфера. В случае гистидина наблюдается высокая степень агрегации даже в T0, что затрудняет приготовление образца для анализа. Значимое различие между тестируемыми концентрациями буфера не концентрация не могли выявить при измерениях, поэтому все три буфера цитратный, гистидиновый и ацетатный можно использовать в концентрации 10 мМ.
Пример 15 - Дополнительная оптимизация поверхностно-активных веществ
На основании предварительных испытаний компонентов-кандидатов добавление неионогенного поверхностно-активного вещества полисорбата 20 (0,01%) оказывало полезное влияние на стабильность, поэтому осуществляли дальнейшую оценку его концентрации, добавляя полисорбат в соответствующие буферы в следующих концентрациях: 0,0025%/0,005%/0,01%/0,02%. Смотрите таблицы 85-94.
Общие сведения об образцах в ацетатном буфере
Результаты после T0
Результаты после механического стресса 300 об./мин/150 мин
Результаты T0
Результаты после механического стресса 300 об./мин/150 мин
Общие сведения об образцах в цитратном буфере
Результаты после T0
Результаты после T=1 неделя при +40°C
Результаты T0
Результаты после механического стресса 300 об./мин/150 мин
В заключение, значимых различий в образцах, содержащих ацетатный или цитратный буфер с разными концентрациями полисорбата не были выявлены при измерении. Чтобы защиту мАт от механического стресса в течение более длительного периода времени, чем время тестирования, составляющее 150 мин, концентрация полисорбата была установлена на уровне 0,2 мг/мл. Такое количество также было предложено на основании предварительных исследований компонентов препарата.
Пример 16 - Дополнительная оптимизация изотоничности
В ходе предварительных исследований компонентов препарата определили NaCl, трегалозу и аргинин-HCl в качестве добавок в целях изотоничности и стабильности. Затем количество аргинина-HCl уменьшили вследствие меньшего влияния на стабильность мАт. В зависимости от концентрации буфера и значения pH количество средства для изотоничности/стабилизатора подбирали так, чтобы добиться осмоляльности, по меньшей мере, 240 мОсмоль/кг согласно Европейской фармакопеи.
Использование трегалозы было проблематично, так как она не является фармакопейным эксципиентом и дорого стоит. Во время предварительных исследований компонентов-кандидатов сахароза вызывала немного больше агрегации, но ее не исследовали и не проверяли в последующих исследованиях. Поэтому были запланировано новое кратковременной исследование стабильности в течение четырех недель с включением трегалозы, а также сахарозы в 10 мМ цитратный и ацетатный буфер и температурами хранения +5°, +25° и +40°C. Смотрите таблица 95-103.
Тонкую корректировку осмоляльности до, по меньшей мере, 240 мОсмоль/кг осуществляли, используя NaCl.
Общие сведения об образцах
Результаты T0
Результаты Т=4 недели, +5°С
Результаты Т=4 недели, +25°С
Результаты Т=4 недели, +40°С
Результаты T0
Результаты после термического стресса 4 недели/+5°C
Результаты после термического стресса 4 недели/+25°C
Результаты после термического стресса 4 недели/+40°C
В заключение, не было обнаружено значимых различий между цитратным и ацетатным буфером при измерении, и не было видимых различий в условиях ускоренных испытаний между трегалозой и сахарозой. Цитратный буфер с сахарозой был выбран для дальнейших исследований.
Определение параметров производства ЛП
Серию ЛС в цитратном буфере использовали для определения измеряемых параметров процесса производства. Предварительные исследования компонентов-кандидатов показали, что ЛС не была чувствительной к окислению, и что во время производства требовалась защита от света или подача слоя азота или продувка азотом. Использовали стандартное стеклянное оборудование, а также силиконовые трубки (SaniTech65).
Порядок добавления
Эксперименты по оценке порядка добавления были ограничены из-за небольшого объема разведения ЛС.
ЛС взвешивали в стеклянной бутылке, добавляли полисорбат 20 в качестве первого эксципиента, сахарозу в качестве второго эксципиента и NaCl в качестве третьего эксципиента и вливали цитратный буфер 10 мМ pH 6,0, чтобы разбавить содержимое ЛС до 20 мг/мл.
Скорость и время перемешивания
Скорость перемешивания устанавливали на значении 100 об./мин, чтобы уменьшить механический стресс для ЛС. Из-за того факта, что все эксципиенты были растворимыми в воде, было установлено время перемешивания 5 минут.
Контроль параметров контроля и IPC
Контроль параметров, таких как внешний вид, мутность, плотность и вязкость и IPC, таких как значение pH и осмоляльность, проверяли обычным способом во время производства образца согласно следующей таблице 104:
Проблем во время производства не наблюдали. Пределы осмоляльности были установлены на основе измеренных данных.
Процесс фильтрации
Согласно предварительным исследованиям компонентов-кандидатов полиэфирсульфон представлял собой подходящую мембрану для стерильной фильтрации (Sartorius, 0,22 мкм). Не могли наблюдать потенциальных сдвигов pH после фильтрации, так как скорость и время фильтрации имели стандартные значения для фильтрации водного раствора. Проверку целостности фильтра осуществляли обычным образом без каких-либо проблем.
Процесс заполнения
Исследовали стандартное оборудование, изготовленное из нержавеющей стали, такое как нагнетающий насос и игла для заполнения. Также контролировали продолжительность и скорость заполнения. Определяли извлекаемый объем наполняемого ЛП. Требовалось использовать для наполнения объем больше на 0,2 мл, чтобы гарантировать извлекаемый объем 1,5 мл.
Совместимость материалов
Все предварительные исследования компонентов-кандидатов и исследования препаратов осуществляли в стекле, используемом в стандартном оборудовании для производства, которое также рекомендовано для оборудования, используемого в производства в соответствии с GMP.
Моющие средства
Очистку производственного оборудования осуществляли согласно соответствующим СОП, используя посудомоечную машину и стандартное моющее средство Neodisher®. До это обычно осуществляли ручную предварительную промывку водой для инъекций. Не наблюдали опасного влияния моющих средств.
Краткое описание дополнительных исследований препаратов лидирующего CXCR5-антитела (20 мг/мл)
Для выбора лекарственного препарата лидирующего CXCR5-антитела для фазы I был выбран цитрат 10 мМ с pH 6,0 в качестве буфера, превосходящего гистидин и ацетат. Значение pH раствора установили на уровне 6,0, так как повышение или снижение значения pH означает уменьшение содержания мономера. Концентрацию буфера установили на уровне средней концентрации 10 мМ, хотя не было значимого различия между концентрациями 5-50 мМ.
Полисорбат 20 был выбран в качестве поверхностно-активного вещества в концентрации 0,2 мг/мл (0,02%), достаточной для стабилизации ЛС в условиях механического стресса.
Сахароза была выбрана в качестве стабилизатора против термического стресса, предпочтительного по сравнению с трегалозой. Концентрация сахарозы была установлена на уровне 60 мг/мл (6%).
NaCl может быть использован в качестве средства для изотоничности в концентрации 2,0 мг/мл (0,2%), чтобы добиться осмоляльности ЛП примерно 300 мОсмоль/кг.
ИССЛЕДОВАНИЯ ПРЕПАРАТА АНТИ-CXCR5 (100 МГ/МЛ)
Данные, приведенные в примерах 17-21, собирали в ходе исследований препаратов в отношении лидирующего CXCR5-антитела и его лекарственного продукта для внутривенного и подкожного введения. Целью исследований препаратов было получение стабильного прозрачного или слегка опалесцирующего и бесцветного или слегка желтоватого, визуально не содержащего частиц раствора лидирующего CXCR5-антитела для инъекций для фазы I.
Способы
Приготовление образца
UF/DF осуществляли в небольшом масштабе, используя устройства Vivaspin с мембраной Hydrosart и пределом отсечения 30 кДа. Материал RSN концентрировали от примерно 20 мг/мл до 100 мг/мл. Все растворы были уже в буфере для конечного препарата (10 мМ цитратный буфер с pH 6,0).
Элементы VivaSpin помещали при комнатной температуре в обычную лабораторную центрифугу и центрифугировали при 2000 об./мин. Раствор фильтровали через 0,2 мкм Minisart перед аналитическим тестированием.
Все образцы хранили при температуре от +2° до +8°C, плотно закрытыми и защищенными от света вплоть до аналитического тестирования в T0 и после однонедельного термического стресса при +40°C или после механического стресса.
Способы анализа
Следующие способы использовали для анализа образцов:
Используемые способы анализа
* Некоторые образцы будут проанализированы.
** SDS-ПААГ может быть осуществлен в том случае, когда SEC показывает необычные результаты.
Пример 17 - Скрининг эксципиентов
В предварительных исследованиях компонентов-кандидатов идентифицировали 10 мМ цитратный буфер с pH 6,0 как наилучший буфер с наименьшей тенденцией к агрегации лидирующего CXCR5-антитела. В предварительных исследованиях с использованием концентрации 20 мг/мл был выбран препарат, содержащий 10 мМ цитратный буфер, 60 мг/мл (6%) сахарозы, 2 мг/мл (0,2%) NaCl и 0,2 мг/мл (0,02%) полисорбата 20. Такие эксципиенты плюс некоторые альтернативные варианты тестировали для того, чтобы подтвердить применимость выбранного препарата в случае более высокой концентрации (100 мг/мл).
Разные препараты подвергали термическому стрессу при 40°C в течение 7 суток и механическому стрессу при 100 об./мин в течение 5 часов. Кроме того, скринингу подвергали температуру разворачивания для разных препаратов с концентрацией 100 мг/мл, используя DSC (дифференциальную сканирующую калориметрию).
Тестировали следующие эксципиенты:
Сахароза → 60 мг/мл
Трегалоза → 60 мг/мл
Аргинин → 30 мг/мл
Лизин → 30 мг/мл
Глицин → 30 мг/мл
NaCl или маннит добавляли в качестве средства для изотоничности. Для снижения вязкости солей не требовалось (около 2,1 сП).
Результаты для T0 и T=7 дней показаны в таблице 106.
Скрининг эксципиентов
Термический стресс
Ни в одном из образцов не наблюдали мутность до или после стресса.
В случае лизина наблюдали: сдвиг pH до 9,8, очень высокую тенденцию к агрегации, очень сильное повышение уровня кислых и основных изоформ и полосы высокой молекулярной массы в SDS-ПААГ. В результате он был исключен из дальнейшего рассмотрения.
В препаратах с маннитом наблюдали плохое связывание в анализе ELISA после стресса. В результате NaCl является предпочтительным средством для изотоничности.
В случае сахарозы наблюдали немного более улучшенную химическую стабильность по сравнению с трегалозой, но были видны дополнительные полосы в SDS-ПААГ после стресса (в обоих случаях).
Аргинин (особенно в присутствии NaCl) и глицин имели сходные профили SEC, но дополнительных полос не наблюдалось в SDS-ПААГ после стресса.
Образование ассоциированных белков, измеряемое с использованием динамического светорассеяния (DLS)
В случае лидирующего CXCR5-антитела наблюдали значимое увеличение гидродинамического диаметра (Z-среднее) при возрастании концентрации (фиг.34). Такое поведение было полностью обратимо при разведении. Для дальнейшего исследования такого явления измеряли разные концентрации лидирующего CXCR5-антитела, используя аналитическое ультрацентрифугирование (AUC), и агрегация была исключена. Вывод, сделанный в результате исследования AUC, заключался в том, что такое поведение является следствием образования ассоциированных белков.
Исследовали влияние перечисленных выше эксципиентов на такое поведение, и результаты показаны на фиг. 35. Z-среднее измеряли до и после термического стресса. Стабилизирующий эффект был сходен в случае всех тестированных эксципиентов, но повышение Z-среднего обычно становилось меньше при использовании аминокислот в качестве стабилизаторов (аргинин, лизин или глицин). Лизин был исключен вследствие более высокого содержания агрегатов после стресса. Аргинин влиял лучше, чем глицин. Обе аминокислоты рассматривали для окончательного дизайна эксперимента для выбора наилучшего сочетания эксципиентов.
Механический стресс
Препараты с лизином были исключены, а также все препараты, содержащие маннит. Данные SEC не показали влияния стресса на тестированные образцы. Смотрите таблицу 107.
Механический стресс
Такое снижение Z-среднего отмечали в присутствии аминокислот. Сахароза оказывала лучшее защитное действие, чем трегалоза, от механического стресса. Аргинин и глицин работали лучше в сочетании с NaCl. Смотрите фиг. 36.
Скрининг с использованием дифференциальной сканирующей калориметрии (DSC)
Скрининговое исследование для определения температуры разворачивания лидирующего CXCR5-антитела осуществляли, используя дифференциальную сканирующую калориметрию (DSC). Скринингу подвергали сахарозу, трегалозу, аргинин и глицин.
Результаты определения Tm перечислены в таблице 108.
Влияние разных эксципиентов на значения Tm лидирующего CXCR5-антитела
Все препараты были в 10 мМ цитратном буфере с pH 6.
На основании Tm1 сахароза и трегалоза давали наивысшие значения. Аргинин работал лучше в сочетании с NaCl.
В заключение, собранные данные свидетельствуют, что конечный препарат лидирующего CXCR5-антитела в концентрации 100 мг/мл может содержать сочетание сахара (в некоторых вариантах сахарозы) и аминокислоты (в некоторых вариантах, аргинина или глицина) в присутствии NaCl в качестве средства для изотоничности.
Пример 18 - Скрининг поверхностно-активных веществ
Оценивали полисорбат в качестве стабилизатора для защиты лидирующего CXCR5-антитела как от термического, так и от механического стрессов.
Тестировали полисорбат 20 и 80 в двух разных концентрациях: 0,1 и 0,2 мг/мл.
Термический стресс
DLS показало отсутствие эффекта при добавлении полисорбата после термического стресса. Образование HMW и фрагментов после 7-дневного хранения при 40°C отмечали во всех образцах, которые регистрировали, используя SEC. Дополнительных полос в SDS-ПААГ не выявлено. Слабые изменения наблюдали после термического стресса, но различий между PS20 и PS80, а также между 2 концентрациями не наблюдали (данные не показаны).
Механический стресс
DLS показало отсутствие изменений после механического стресса. В случае полисорбата 20 не наблюдали агрегации после механического стресса. В случае полисорбата 80 наблюдали образование агрегатов после механического стресса. Дополнительных полос в SDS-ПААГ (данные не показаны) не наблюдали.
В заключение, полисорбат 20 явился желательным поверхностно-активным веществом вследствие превосходства в отношении механической стабилизации лидирующего CXCR5-антитела.
Пример 19 - предварительный отбор препарата-прототипа с использованием DSC
На основании скрининга эксципиентов и скрининговых исследований поверхностно-активных веществ было предложено 12 разных сочетаний эксципиентов (смотрите таблицы 109 и 110).
Температуру разворачивания для всех препаратов определяли, используя DSC, и полученные значения Tm, а также осмоляльность для каждого препарата перечислены в таблицах 109 и 110.
Исследование для предварительного отбора сочетаний эксципиентов для препаратов-прототипов (аргинин) с использованием DSC
Также перечислены значения Tm и осмоляльность.
Исследование для предварительного отбора сочетаний эксципиентов для препаратов-прототипов (глицин) с использованием DSC
Также перечислены значения Tm и осмоляльность.
Не наблюдали больших различий среди препаратов по Tm, но осмоляльность сильно варьировала. Предварительный отбор препаратов-прототипов осуществляли на основе Tm и осмоляльности. Соответственно, в каждой группе эксципиентов (аргинин и глицин), выбирали наибольшее значение Tm (независимо от осмоляльности). Кроме того, также выбирали наибольшее значение Tm в изотонической области.
Пример 20 - Поисковое исследование стабильности прототипа
Описанный выше выбор прототипа привел к получению 4 препаратов-прототипов, которые перечислены в таблице 111. Такие препараты тестировали в отношении механического стресса (100 об./мин в течение 5 часов), 5 циклов замораживания/размораживания и изотермического стресса при 5, 20 и 40°C.
Препараты-прототипы для препарата, содержащего 100 мг/мл лидирующего CXCR5-антитела
Механическая стабильность
Лидирующее CXCR5-антитело в 10 мМ цитратном буфере с pH 6 без добавления каких-либо эксципиентов (препарат ЛС) также подвергали стрессу параллельно с препаратами-прототипами. Виды молекул с высокой молекулярной массой измеряли, используя DLS, после механического стресса ЛС (фиг.37), стресса, при которого не наблюдали изменений во всех тестированных препаратах после механического стресса. Образование агрегатов после механического стресса измеряли, используя эксклюзионную хроматографию по размеру (SEC), и результаты показаны в таблице 112. В общем, 4 препарата были в равной мере стабильными в условиях механического стресса, за исключением препарата A, в котором с использованием SEC было обнаружено больше HMW после механического стресса. Смотрите фиг. 38.
Результаты эксклюзионной хроматографии по размеру (SEC) препаратов-прототипов до и после механического стресса
Стабильность при замораживании/размораживании
Не выявлено значимых различий ни для ЛС, ни для ЛП, после 5 циклов замораживания/размораживания. Таким образом, не должно быть проблем с нестабильностью при замораживании и размораживании (данные не показаны).
Поисковое исследование стабильности прототипа
Препараты-прототипы хранили при -20, 5, 20 и 40°C. Их анализировали в начале исследования, через 1 месяц, через 3 месяца и через 6 месяцев. Препараты выбирали на основе результатов 3-месячного исследования (таблицы 113-115). Результаты показали, что препарат B был наилучшим в отношении SEC, WCX и частиц подвидимого диапазона, особенно при 40°C.
Результаты эксклюзионной хроматографии по размеру (SEC) препаратов-прототипов через 3 месяца
Результаты слабокатионообменной хроматографии (WCX) препаратов-прототипов через 3 месяца
Частицы довидимого диапазона, измеряемые по оптическому затемнению в T нулевое и через 3 месяца (5°C)
В заключение, исследования показали лучшие результаты для препарата LA_10_102_B. Такой препарат имел концентрацию 100 мг/мл лидирующего CXCR5-антитела в 10 мМ цитратном буфере, pH 6, и содержал следующие эксципиенты:
Пример 21 - Данные, подтверждающие стабильность препарата 100 мг/мл
Дополнительные исследования стабильности осуществляли, используя препарат, содержащий 100 мг/мл лидирующего CXCR5-антитела, идентифицированный в примере 20. Дополнительные исследования осуществляли при -20, 5 и 25°C. Результаты показаны в таблицах 116-118.
Данные о стабильности препарата, содержащего 100 мг/мл лидирующего CXCR5-антитела, при -20°C
Данные о стабильности препарата, содержащего 100 мг/мл лидирующего CXCR5-антитела, при 5°C
Данные о стабильности препарата, содержащего 100 мг/мл лидирующего CXCR5-антитела, при 25°C
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВЫ НА ОСНОВЕ АНТИТЕЛА | 2017 |
|
RU2769326C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К LAG-3, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2771384C2 |
| СОСТАВЫ НА ОСНОВЕ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ К IL-4/IL-13 | 2014 |
|
RU2690850C2 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, СОДЕРЖАЩИЙ МОЛЕКУЛЫ АНТИТЕЛ С УЛУЧШЕННЫМИ СВОЙСТВАМИ | 2010 |
|
RU2565809C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ОЧИЩЕННЫЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2793783C1 |
| СТАБИЛЬНЫЙ ЖИДКИЙ ПРЕПАРАТ АНТИТЕЛА | 2009 |
|
RU2518278C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИТЕЛ К CD40 И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778572C1 |
| КОМПОЗИЦИИ АНТИ-PD-1 АНТИТЕЛ | 2019 |
|
RU2772781C2 |
| ПРЕПАРАТ, СОДЕРЖАЩИЙ АНТИТЕЛО | 2017 |
|
RU2748046C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CXCR5, ИХ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2571515C2 |
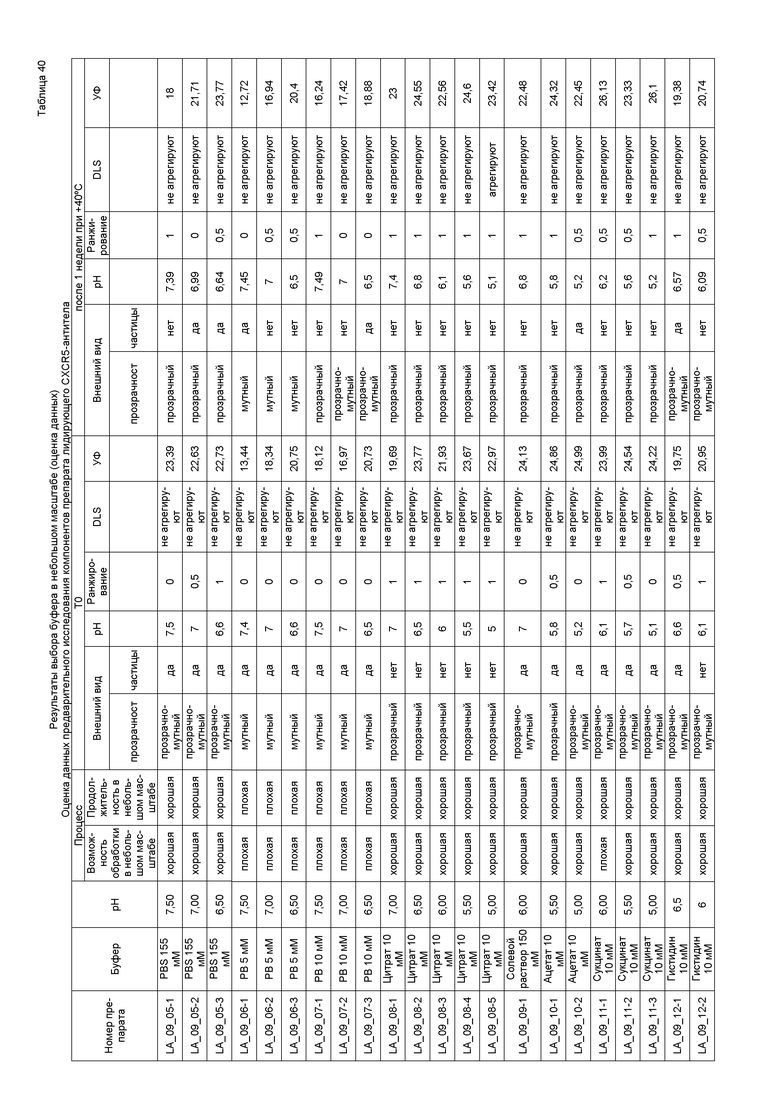


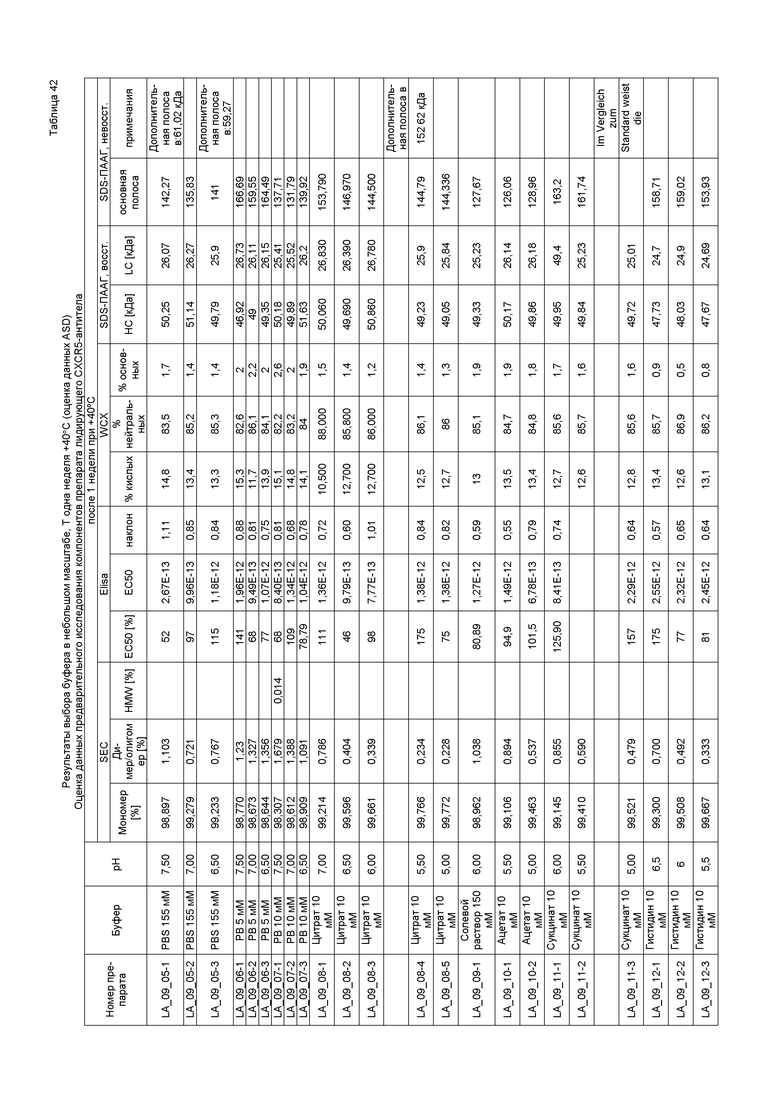



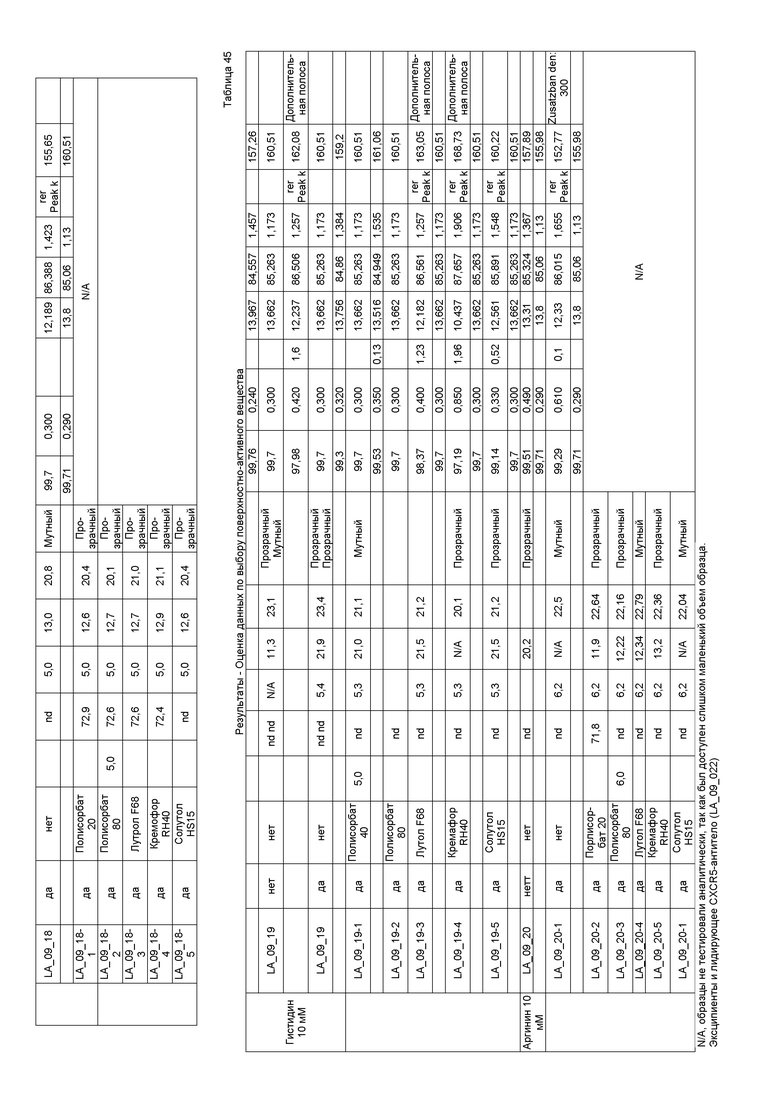
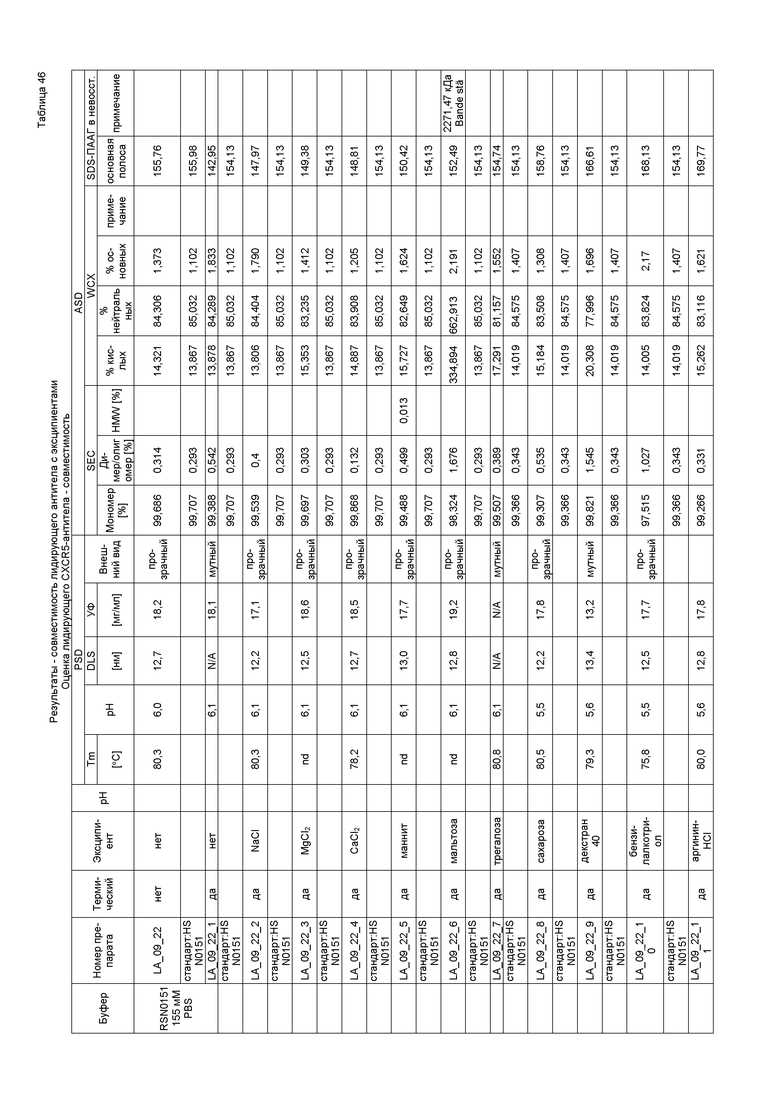
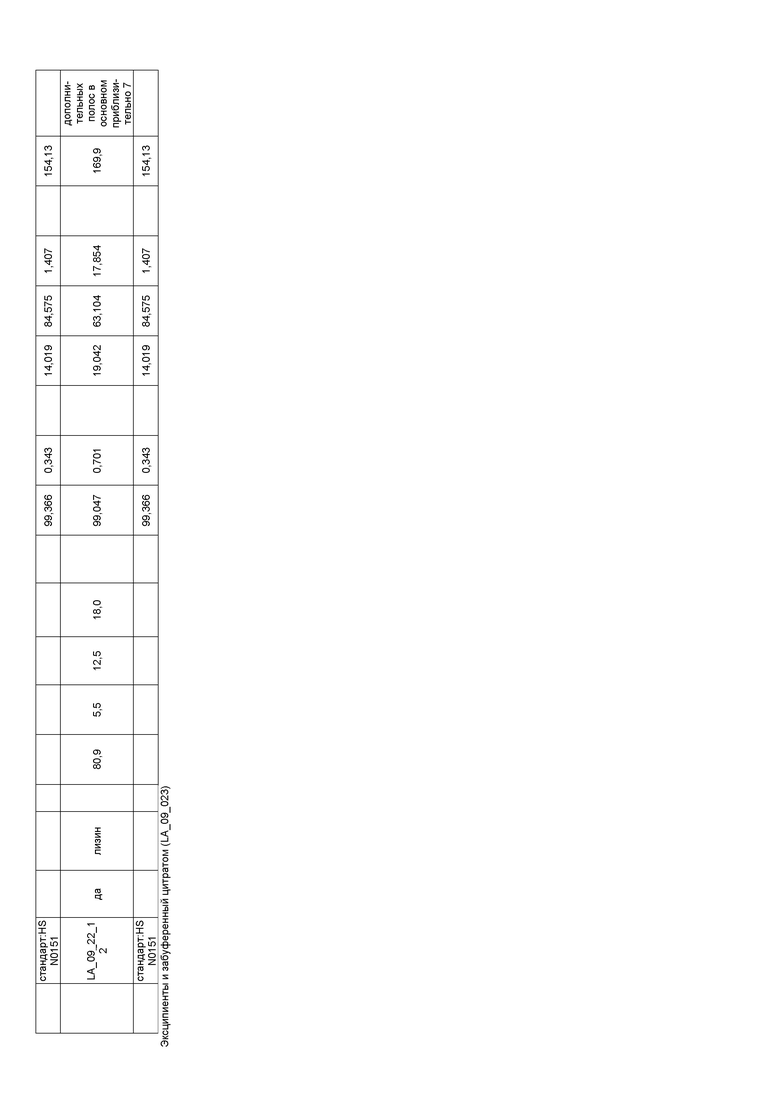
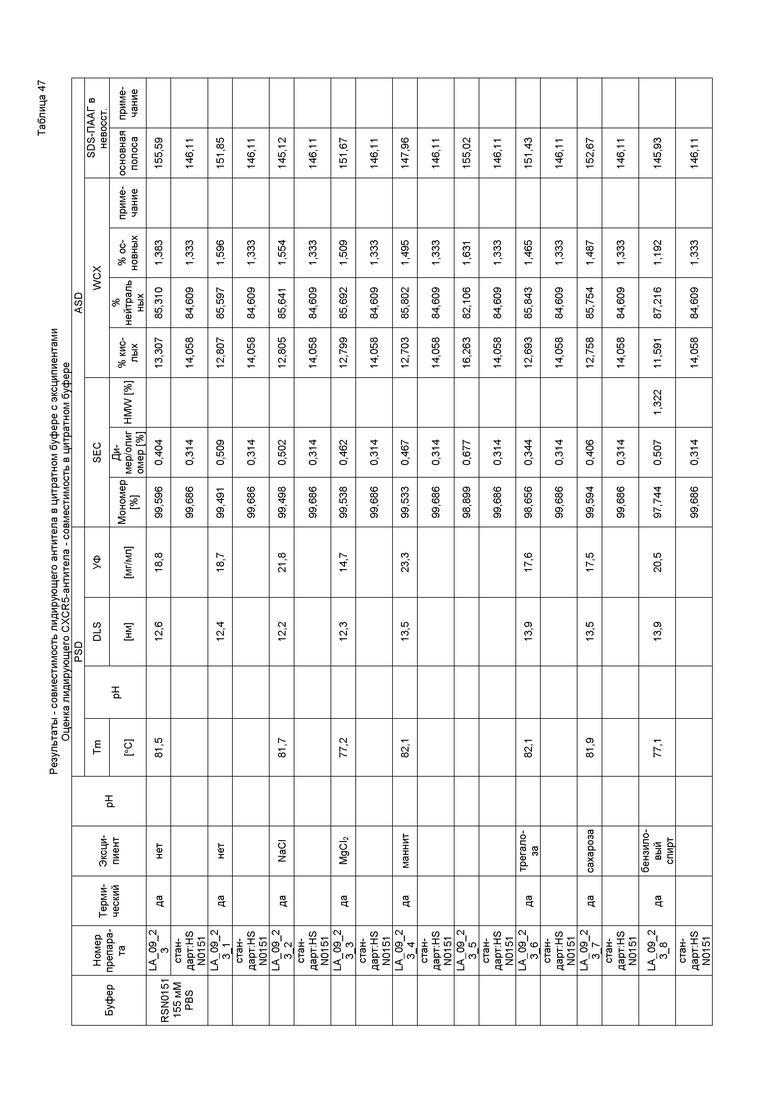
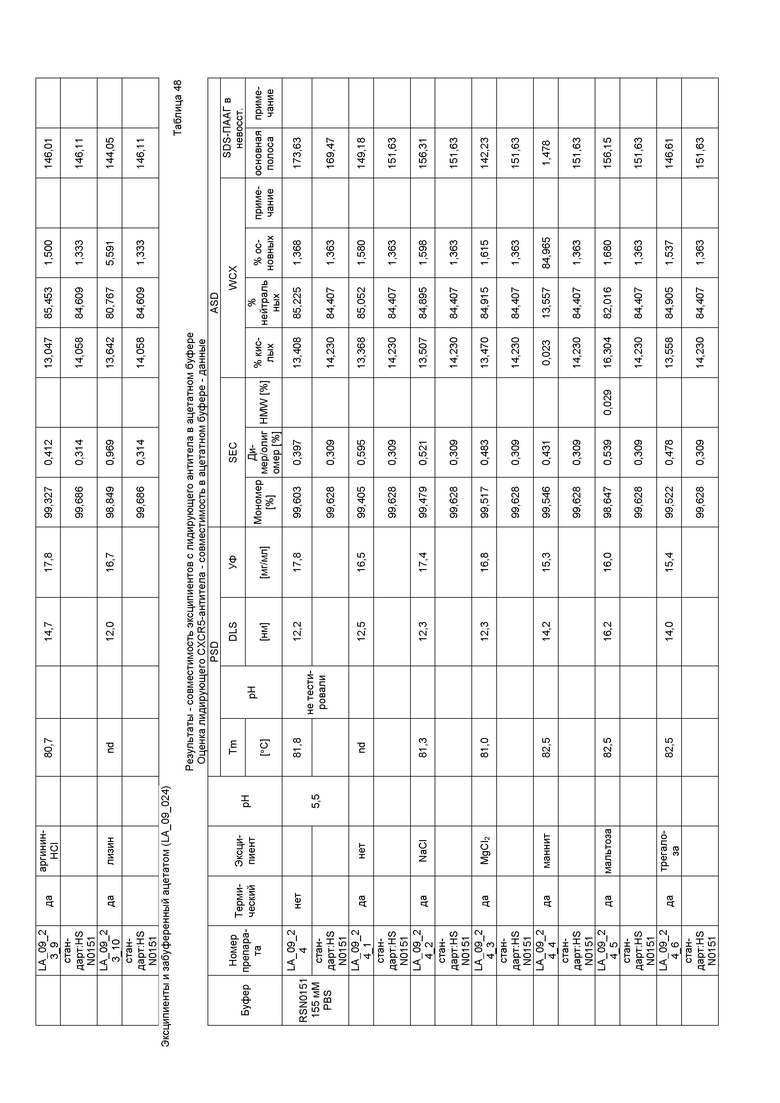

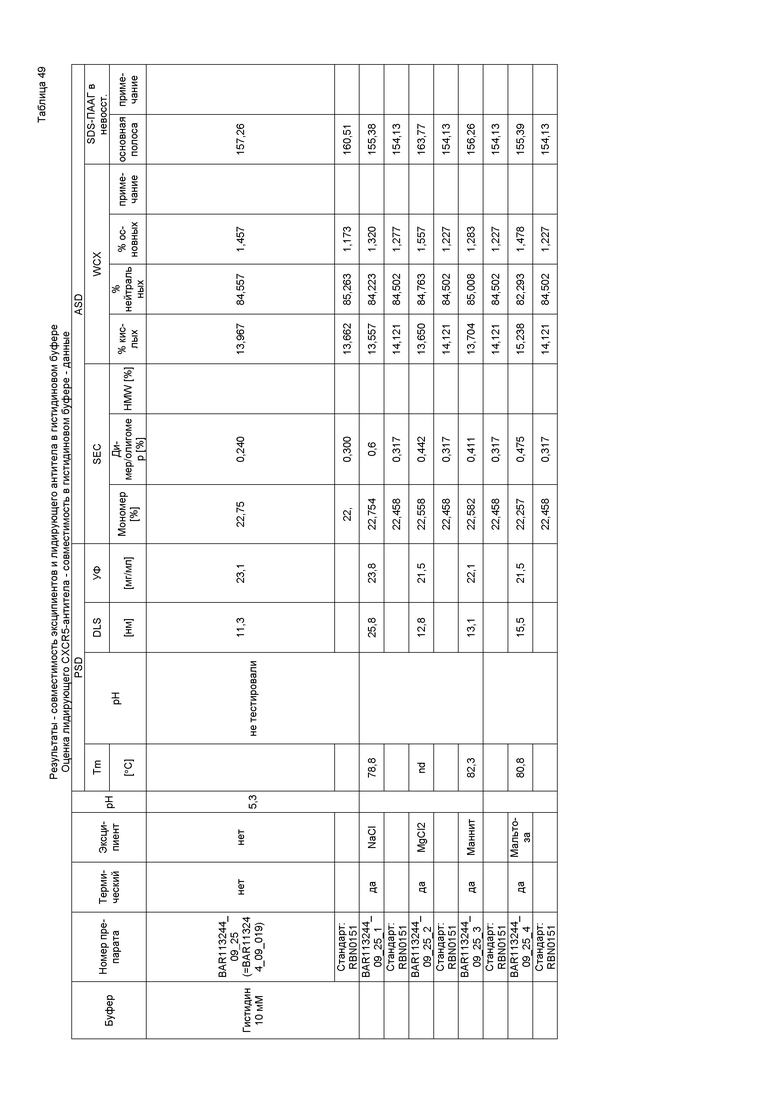
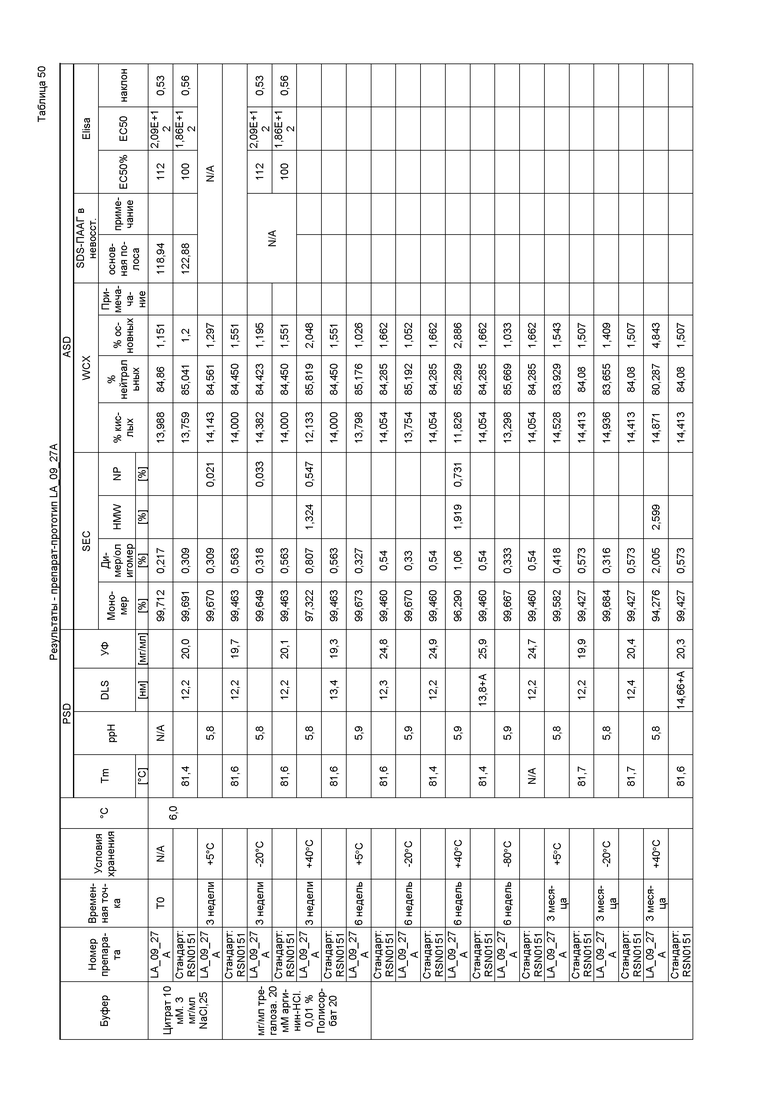
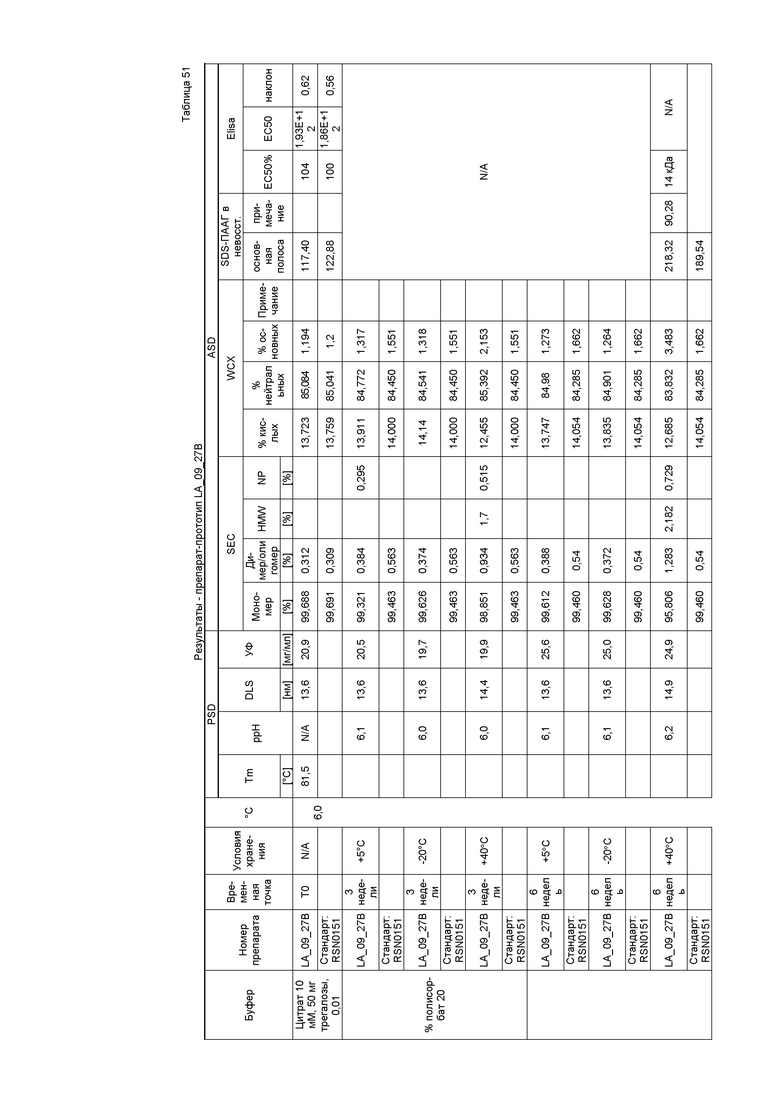
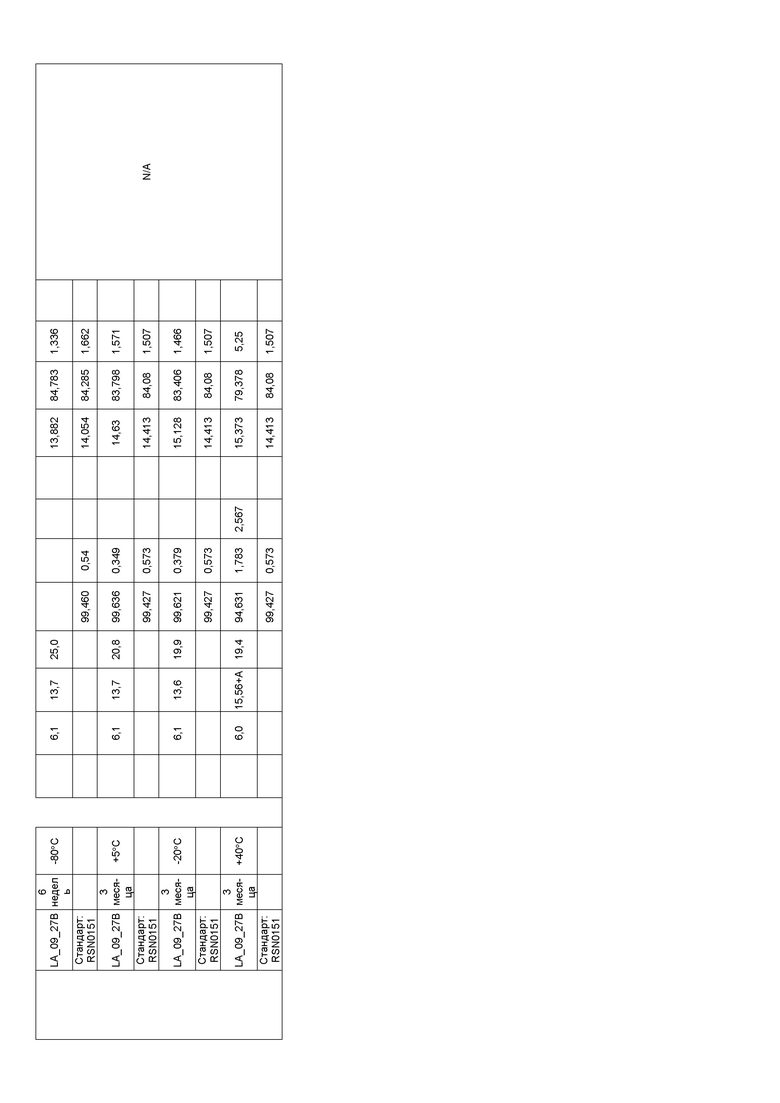
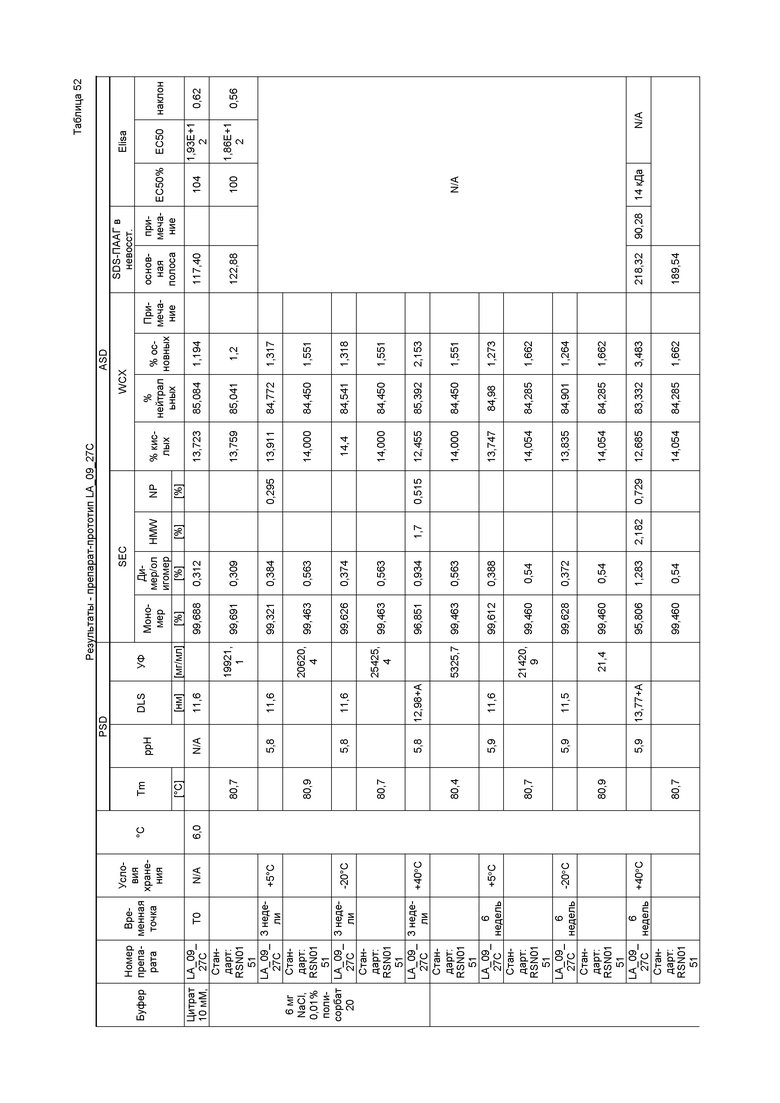


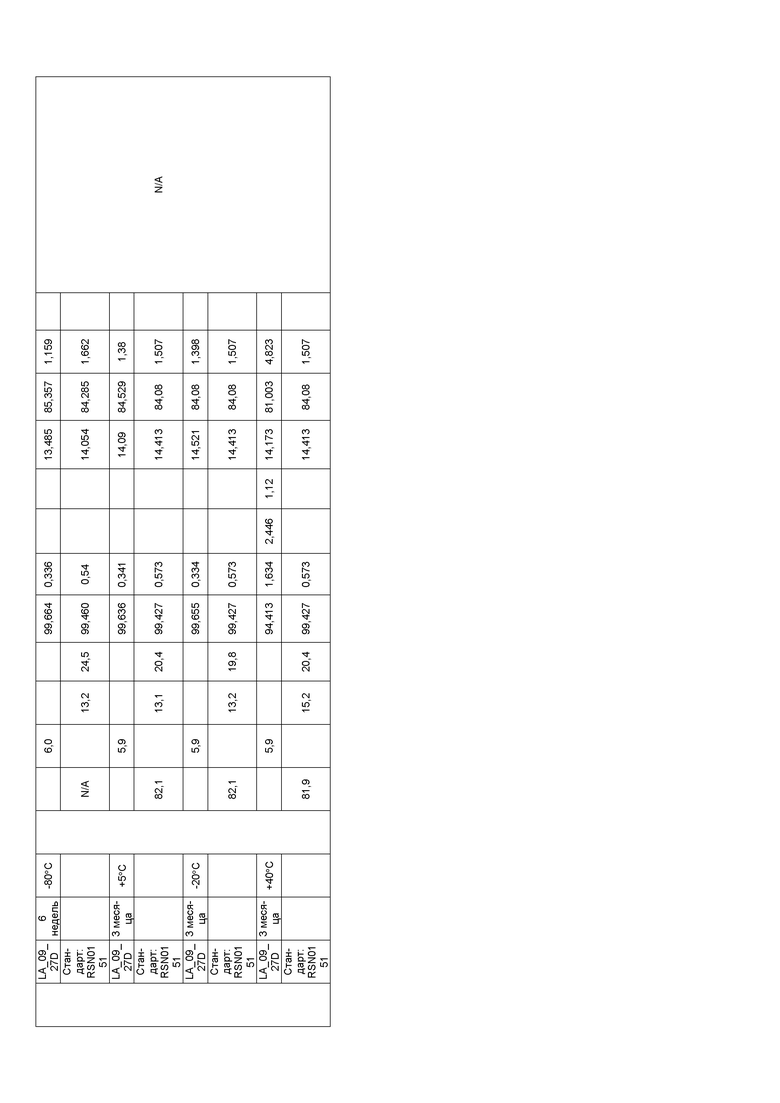
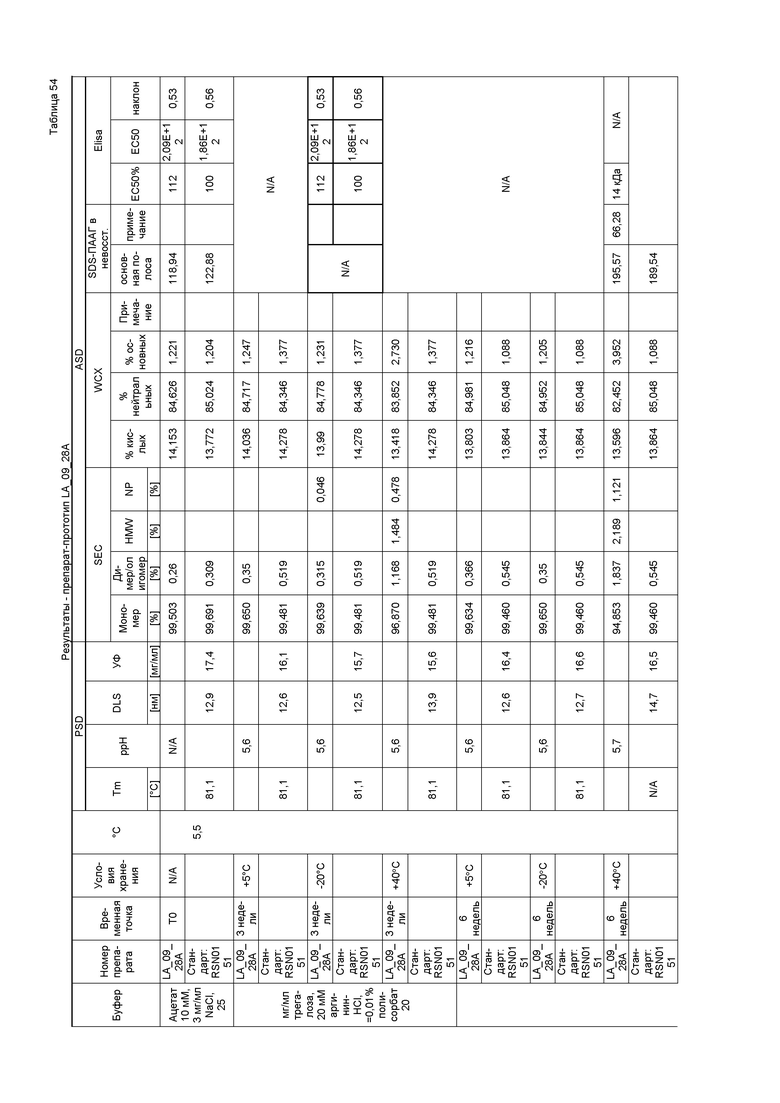

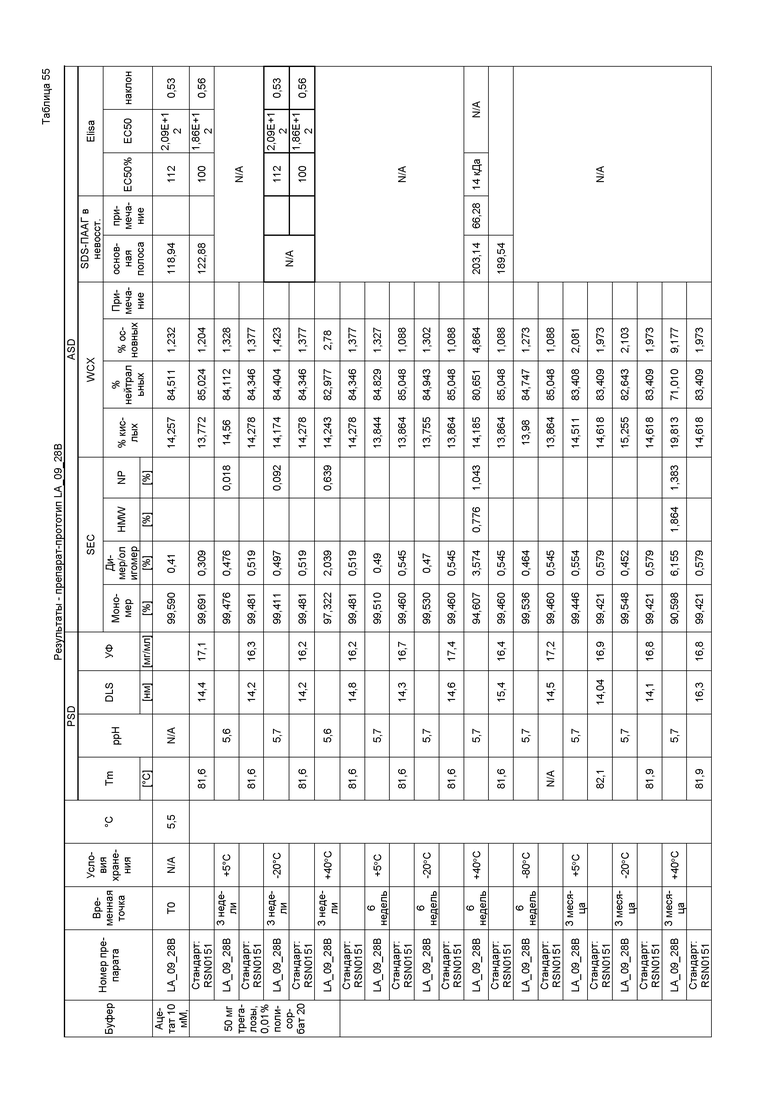
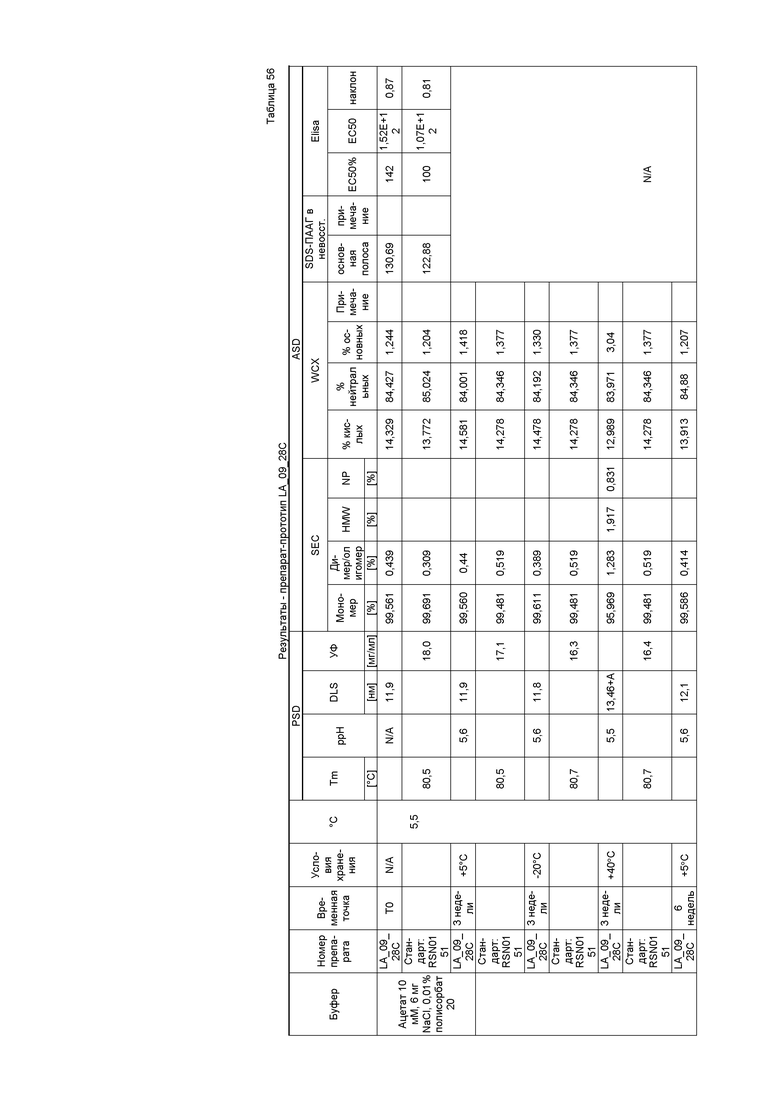

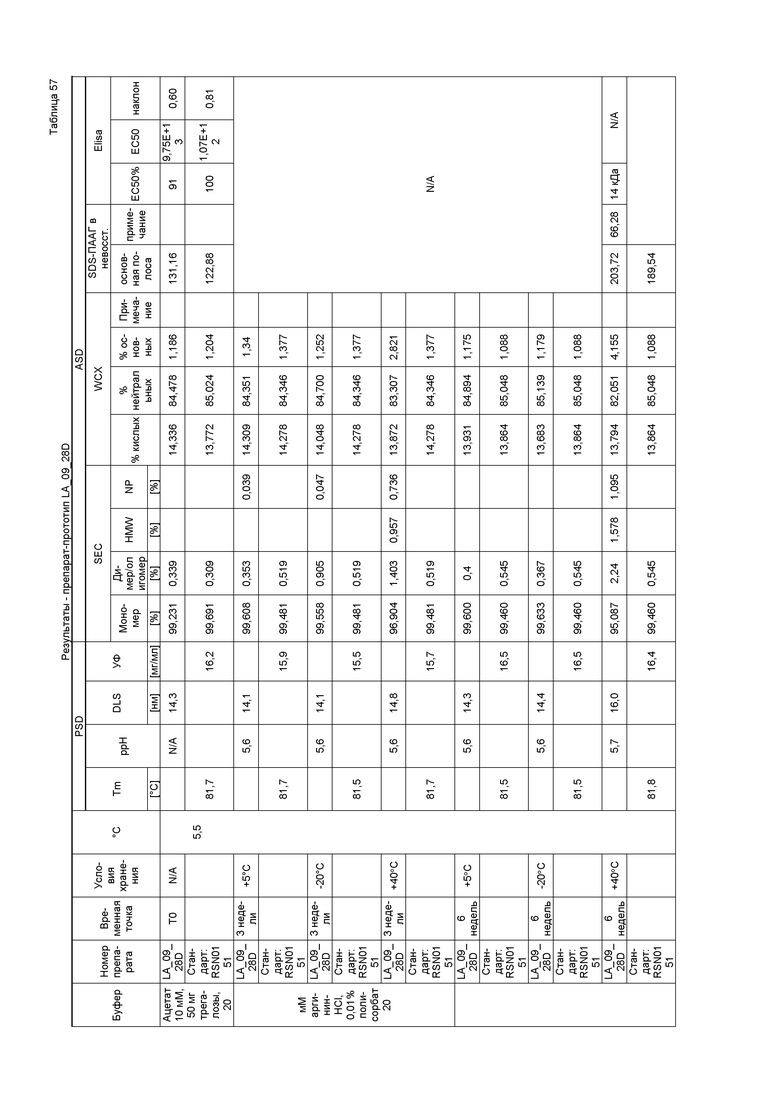

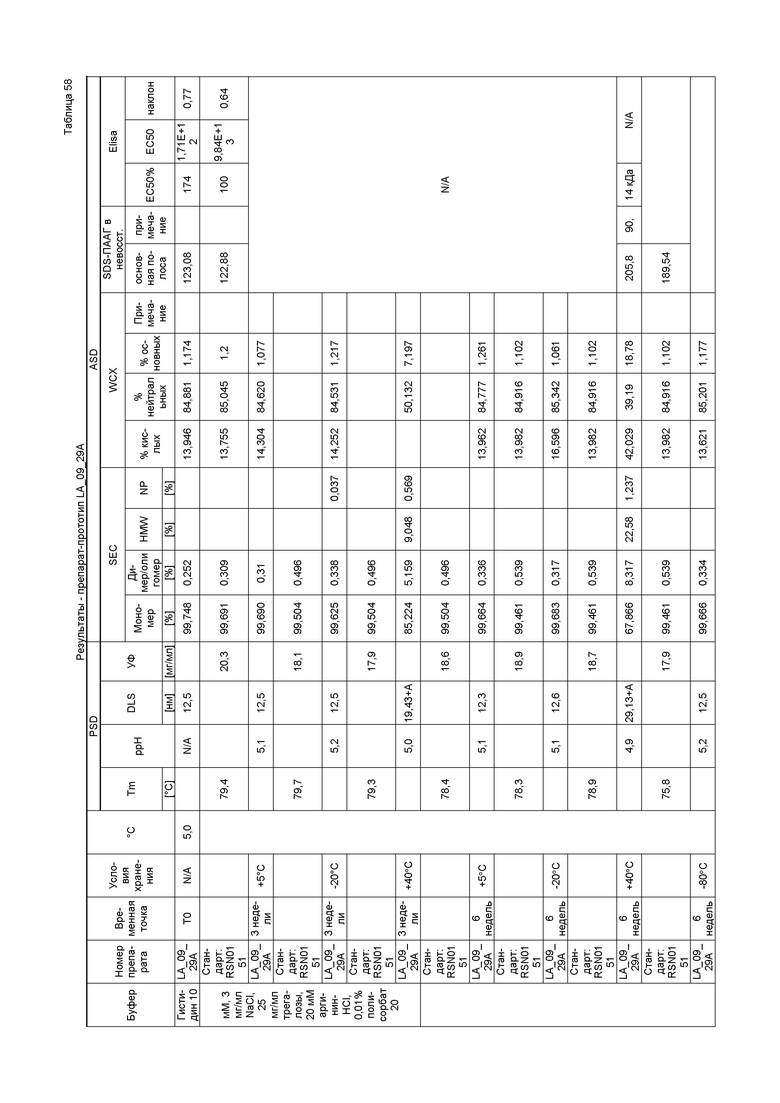
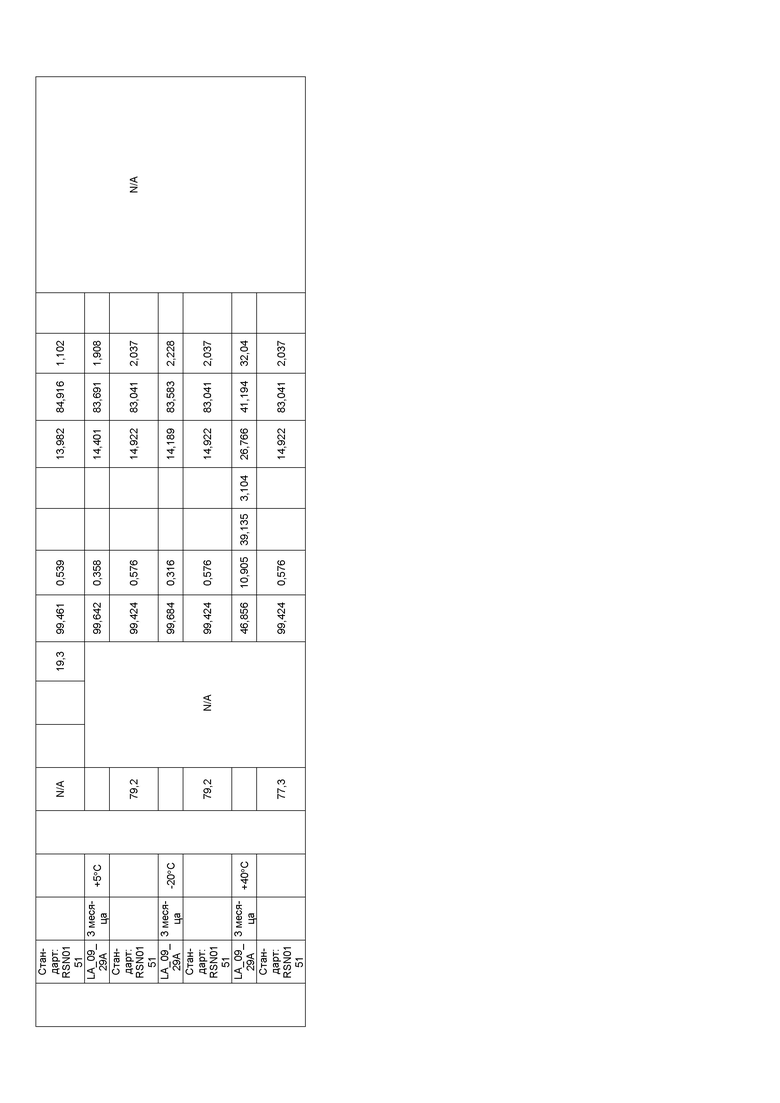
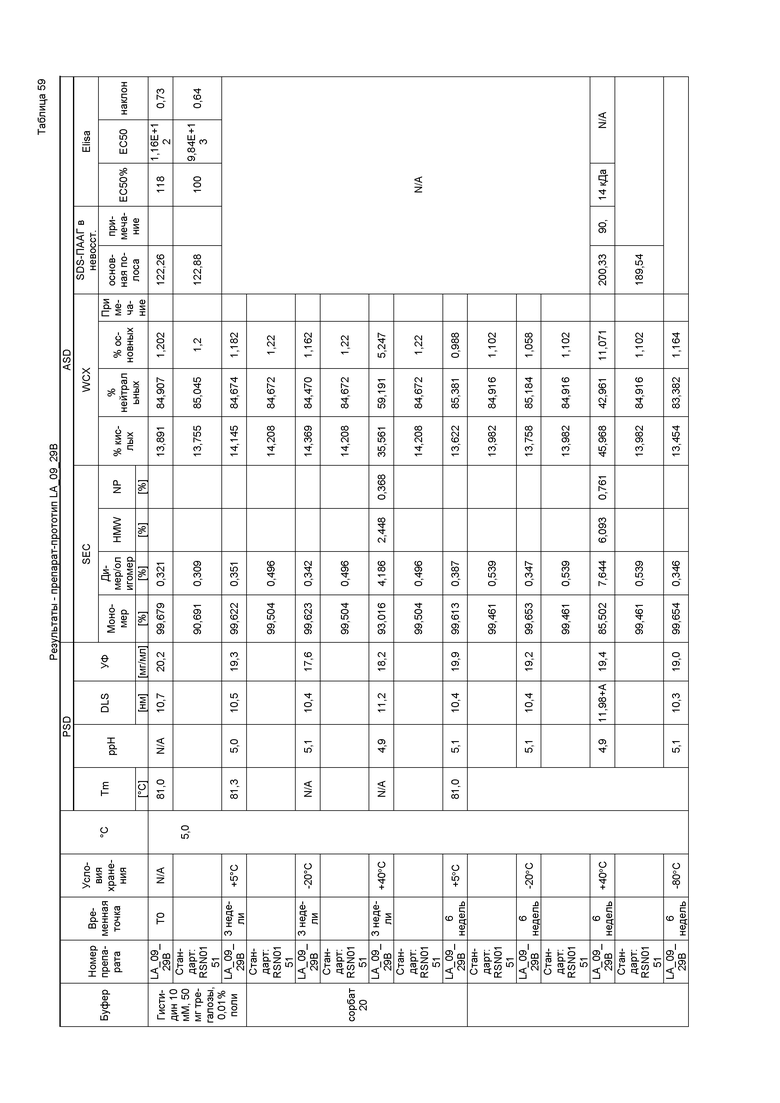


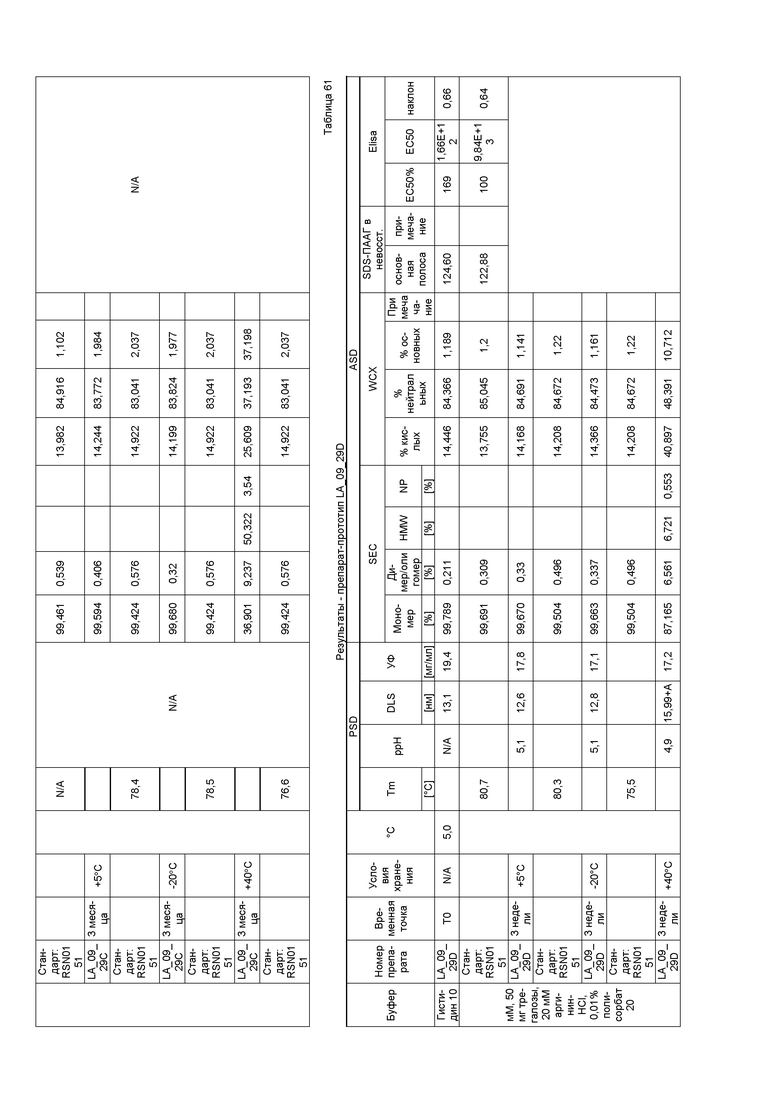




























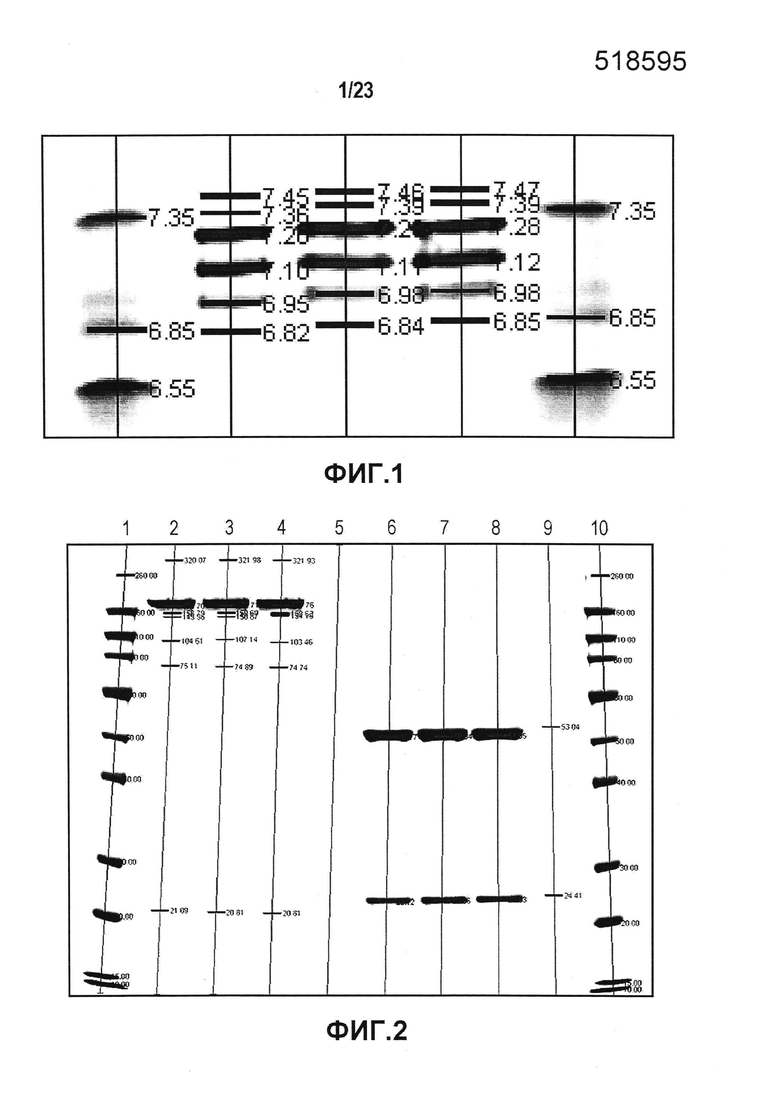
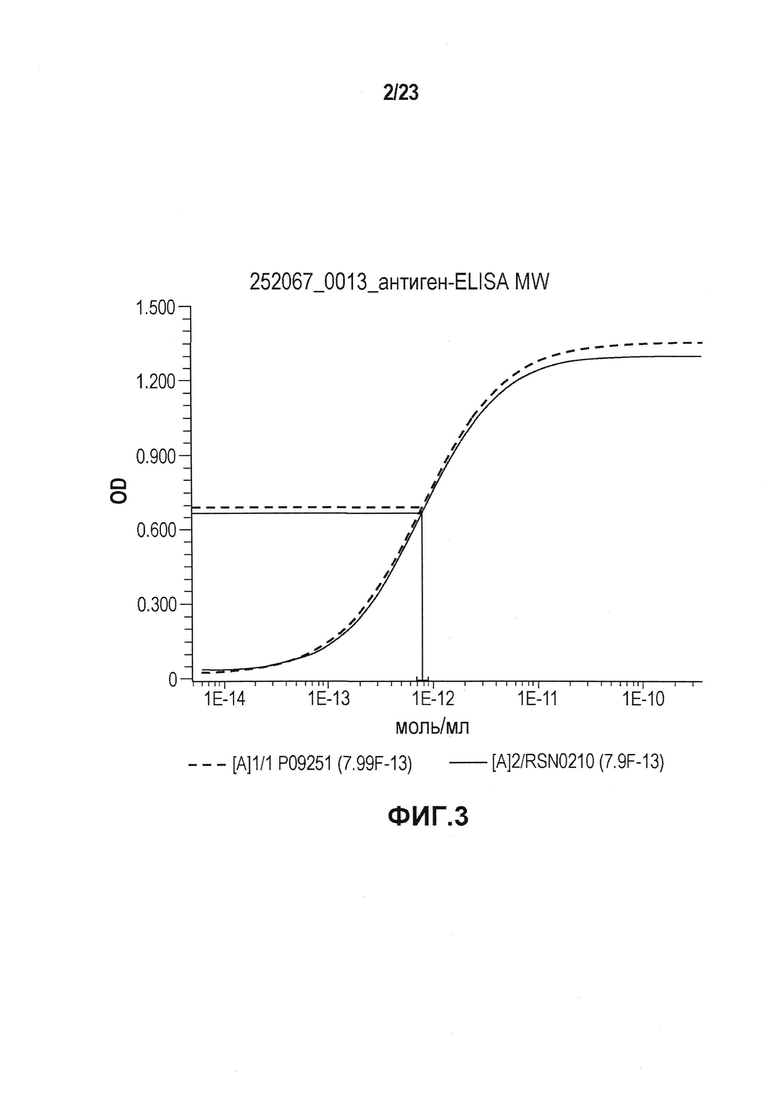
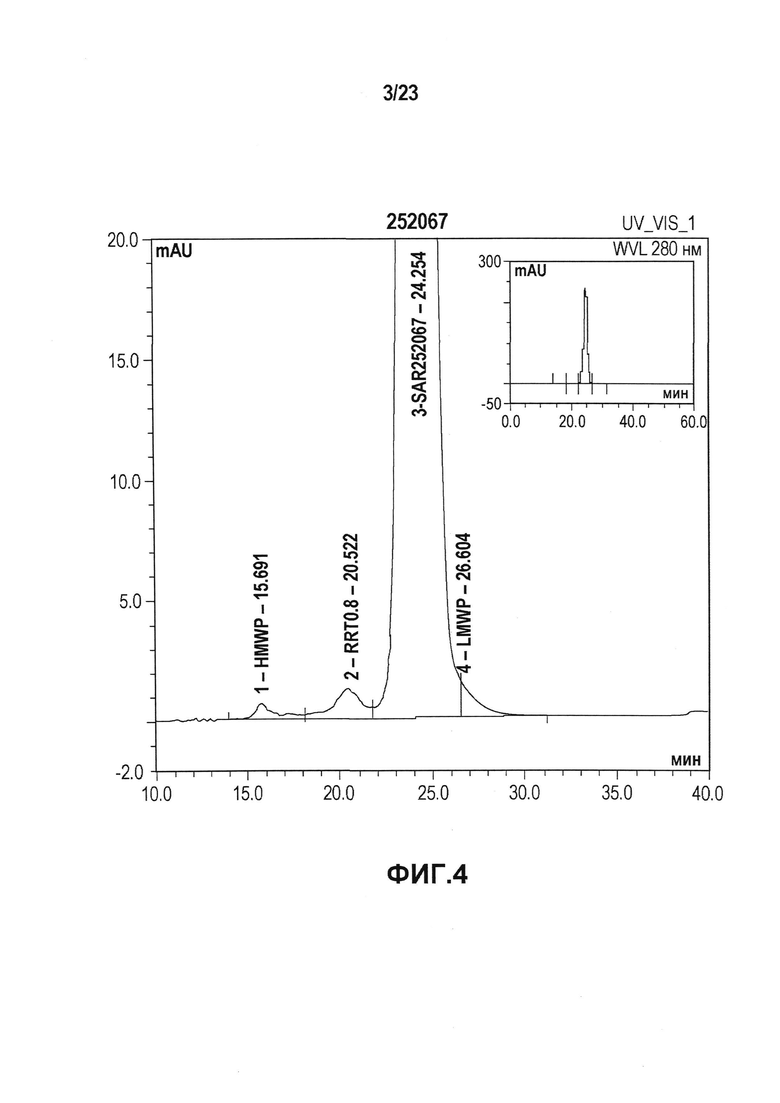
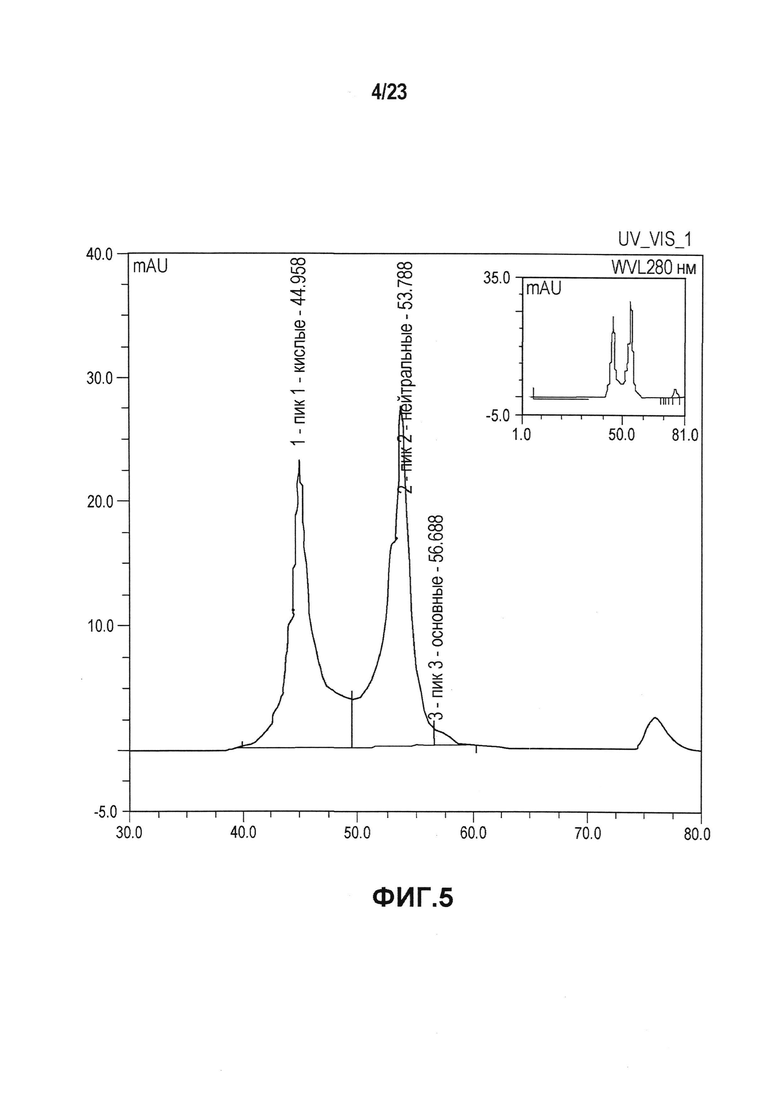
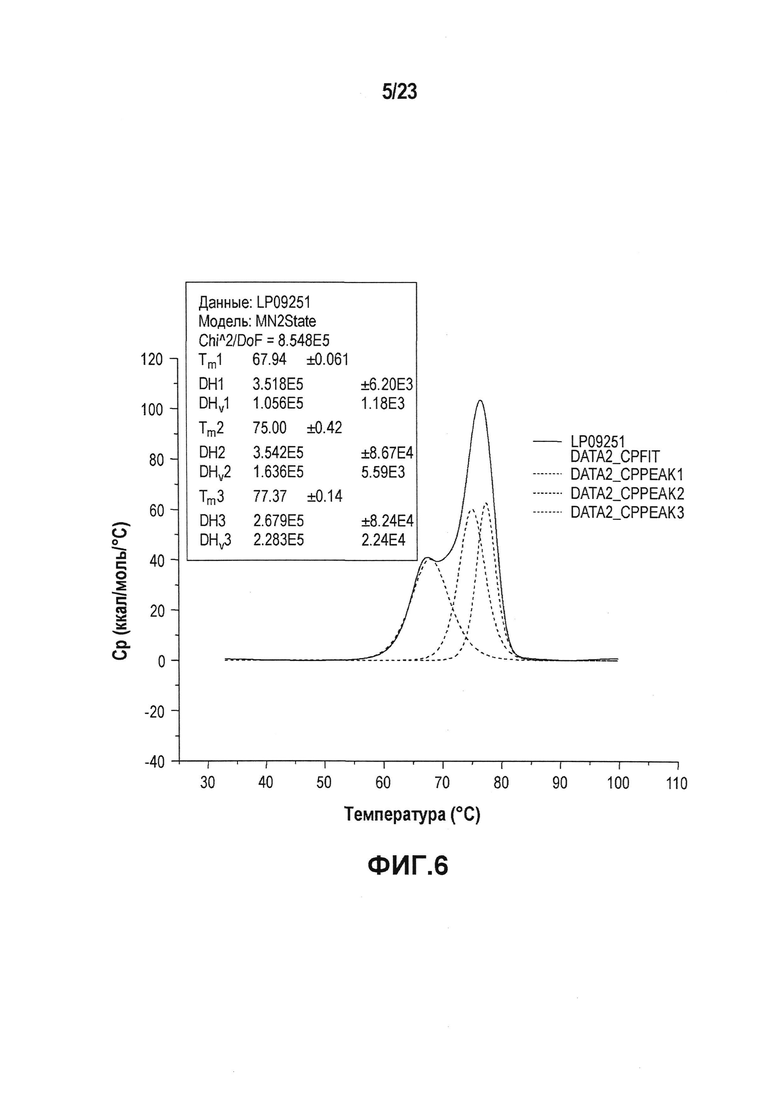
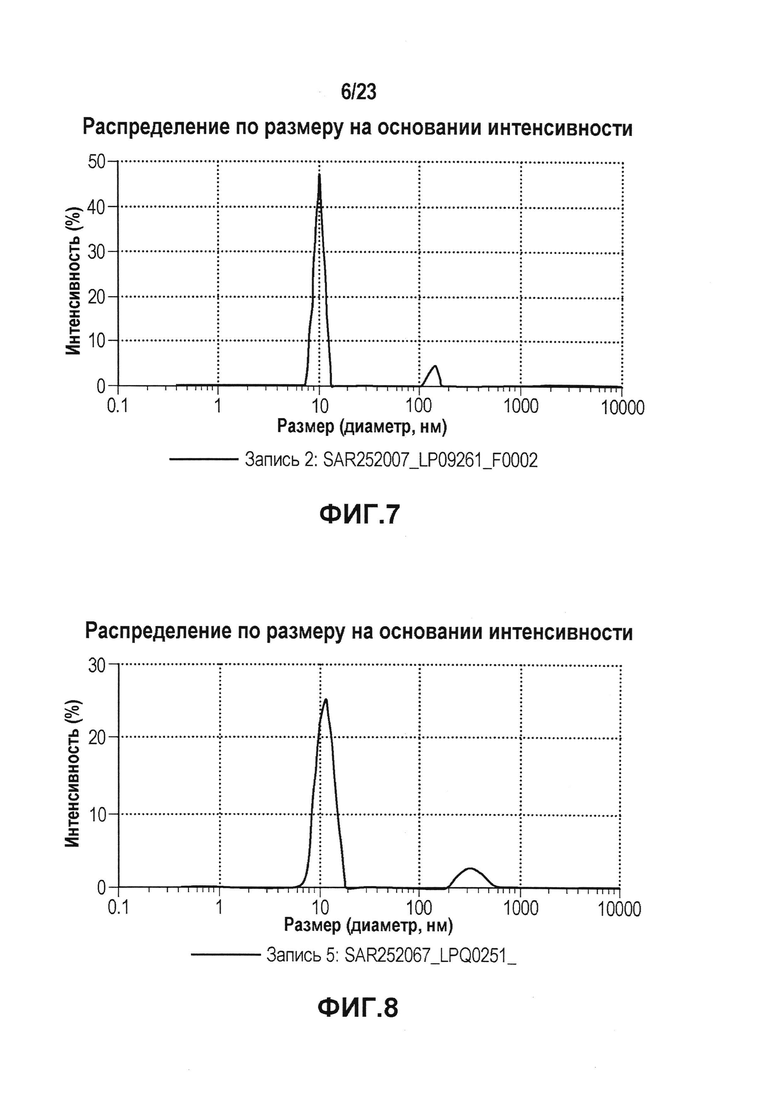
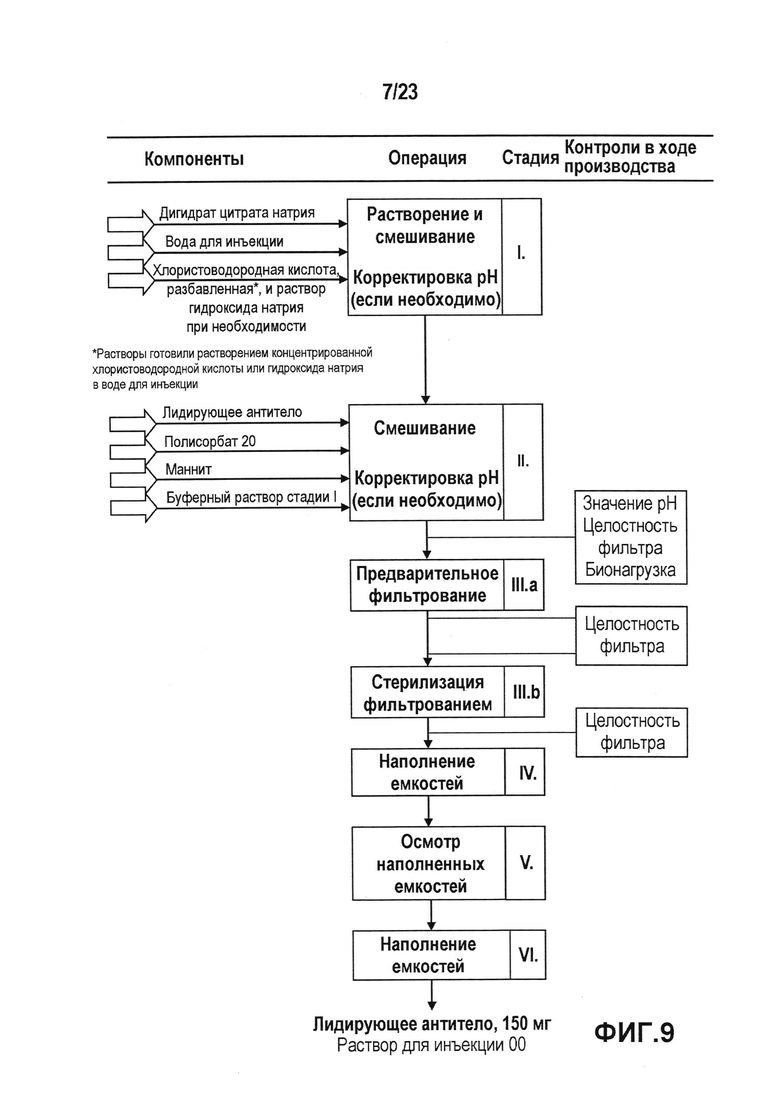
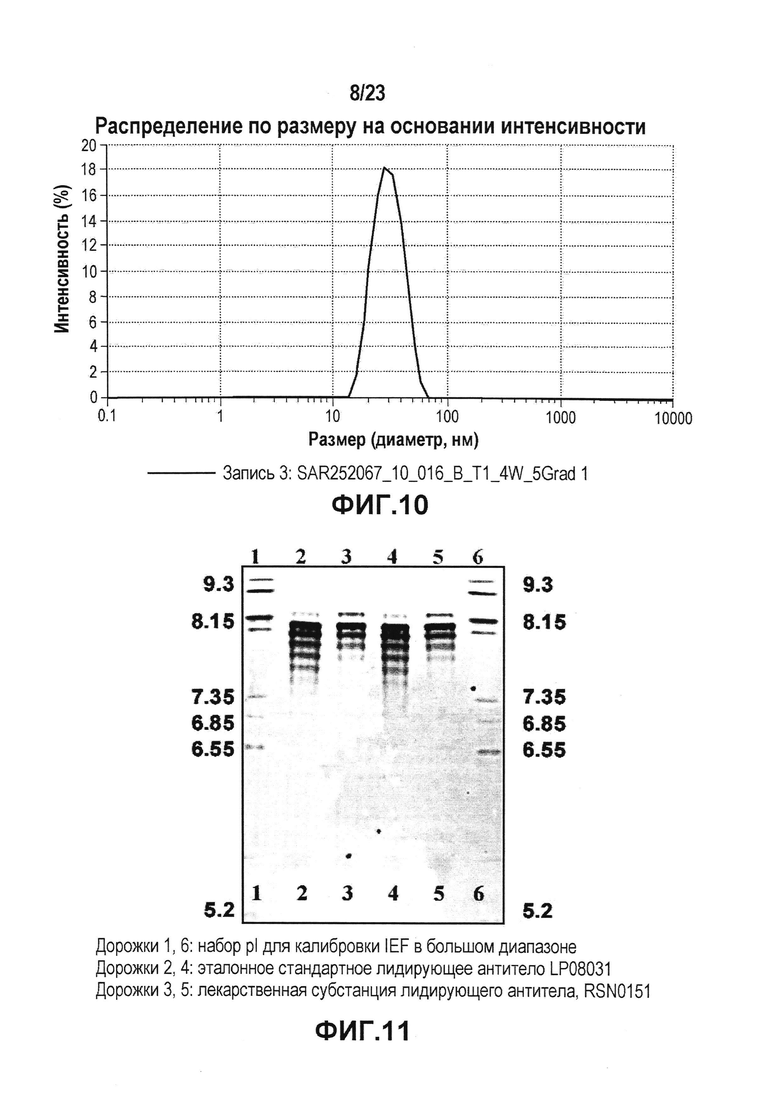
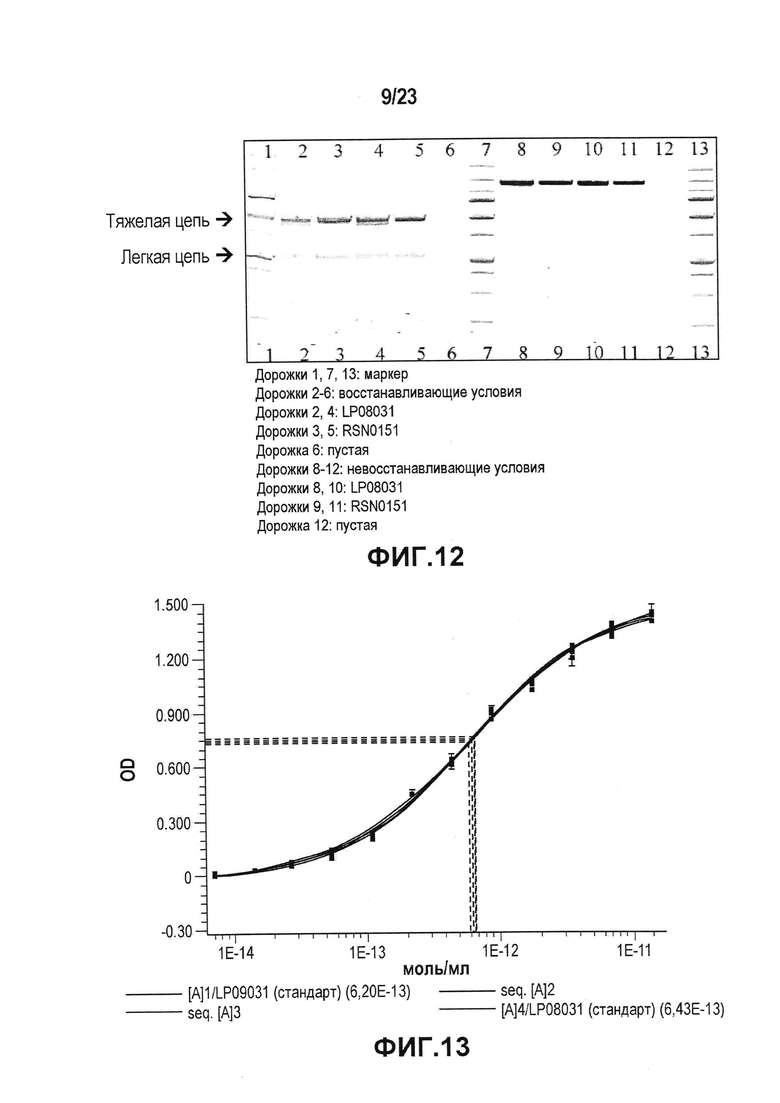
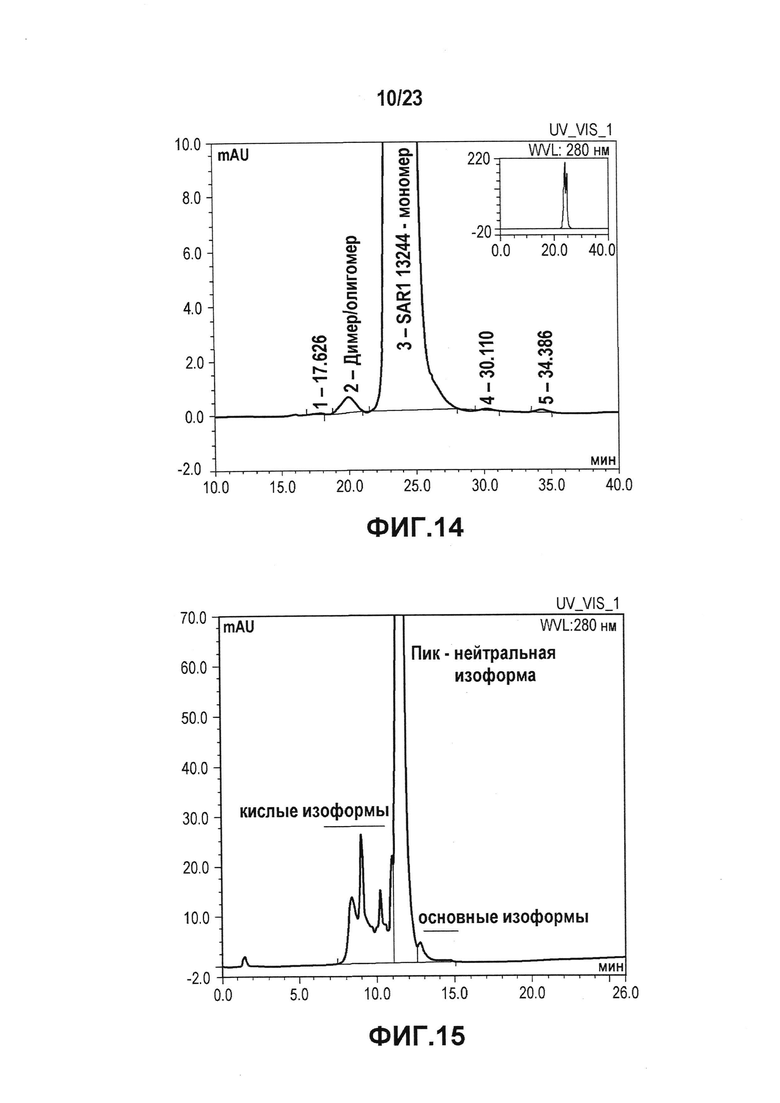
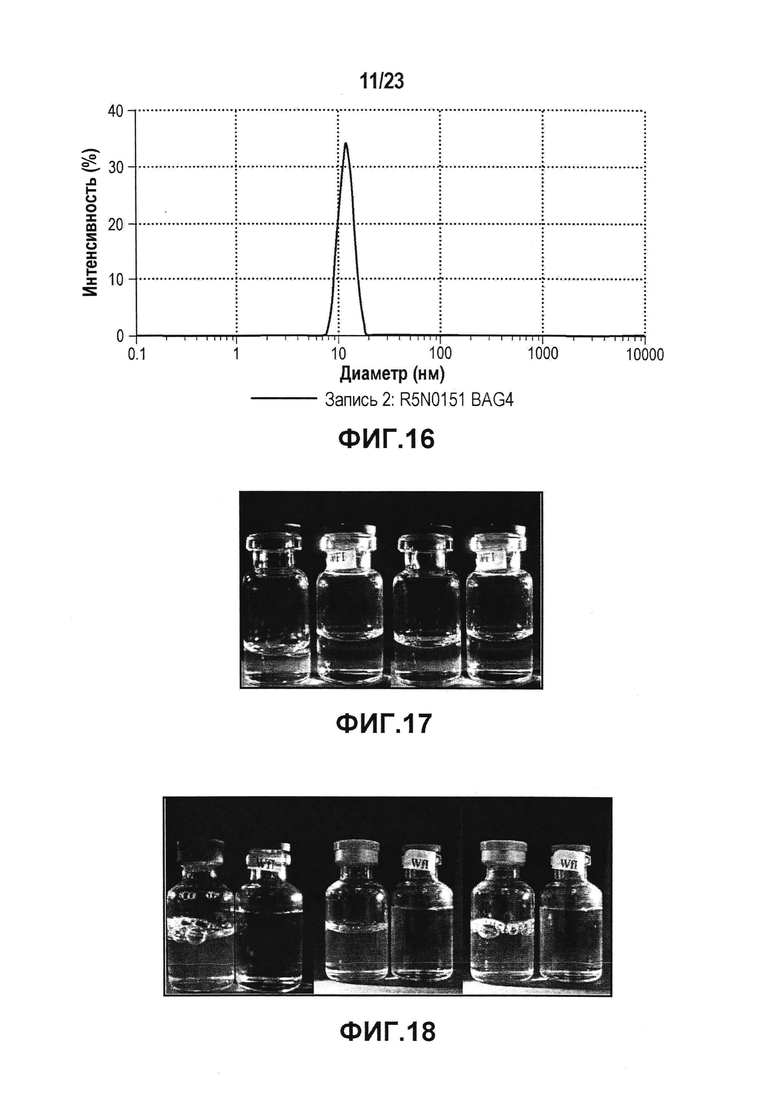



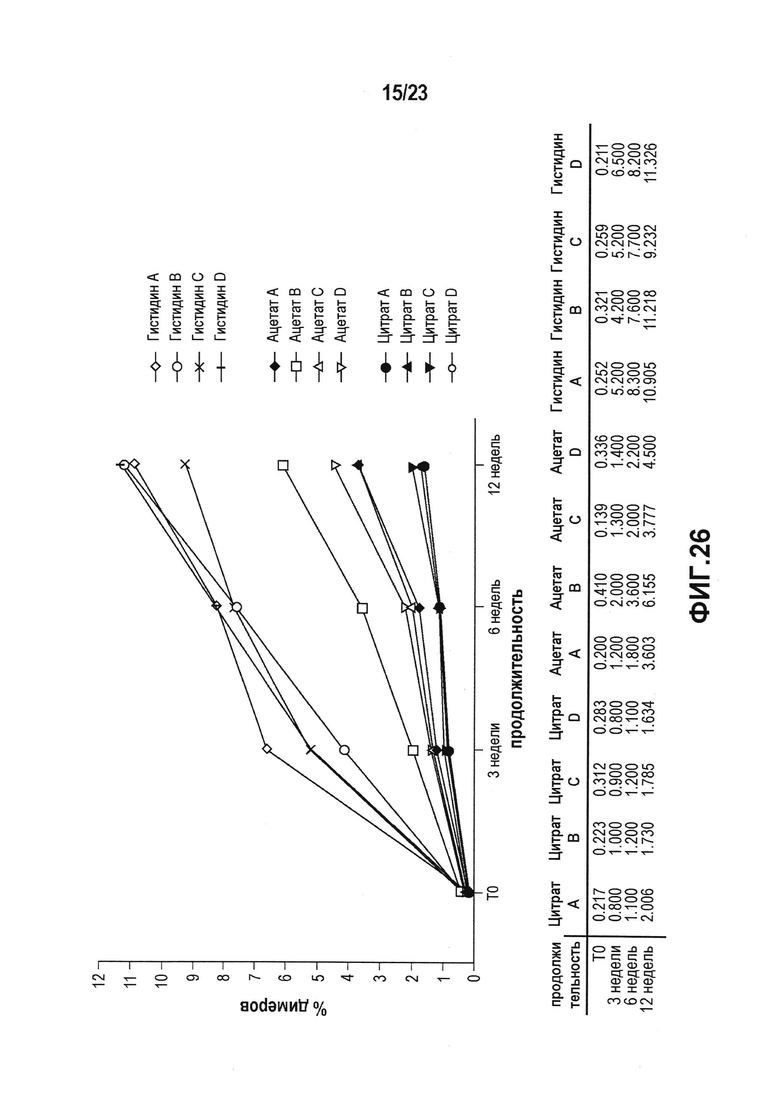
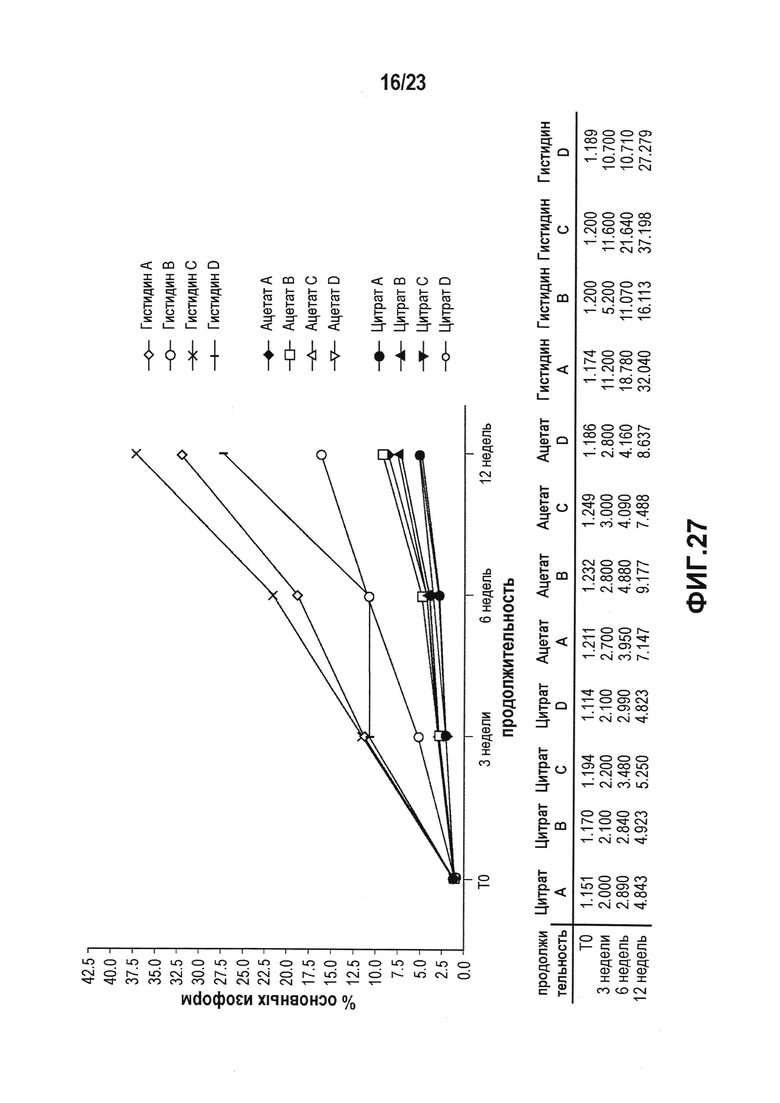
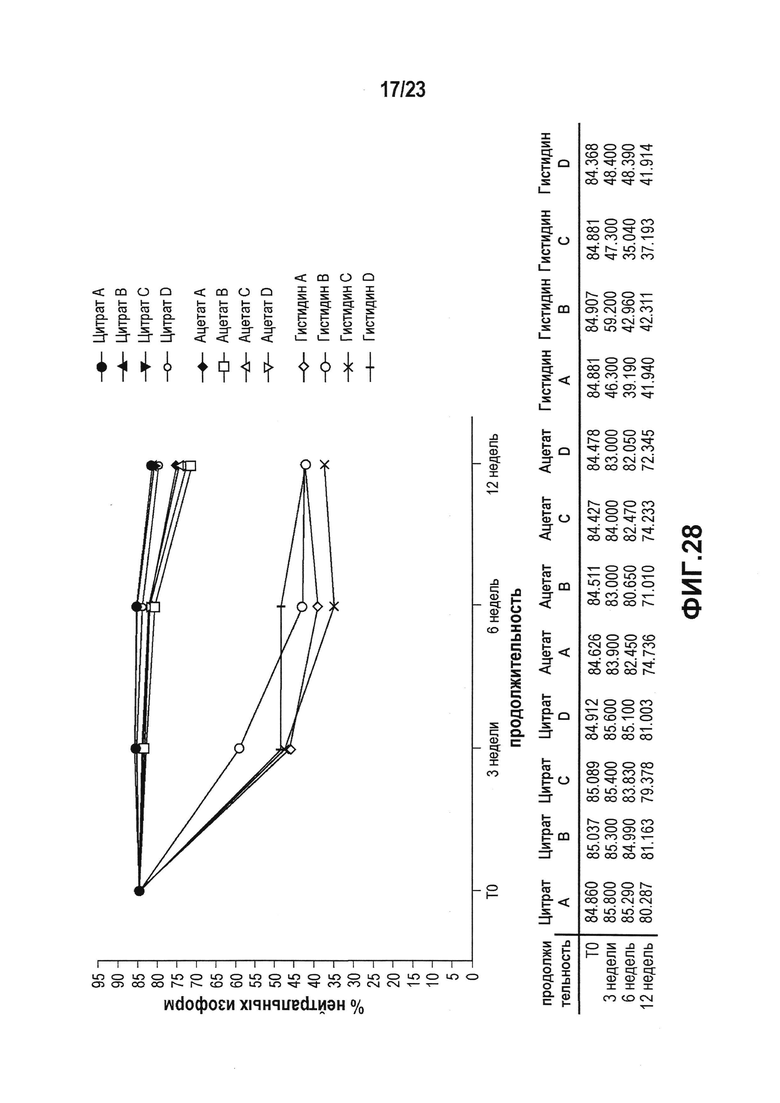
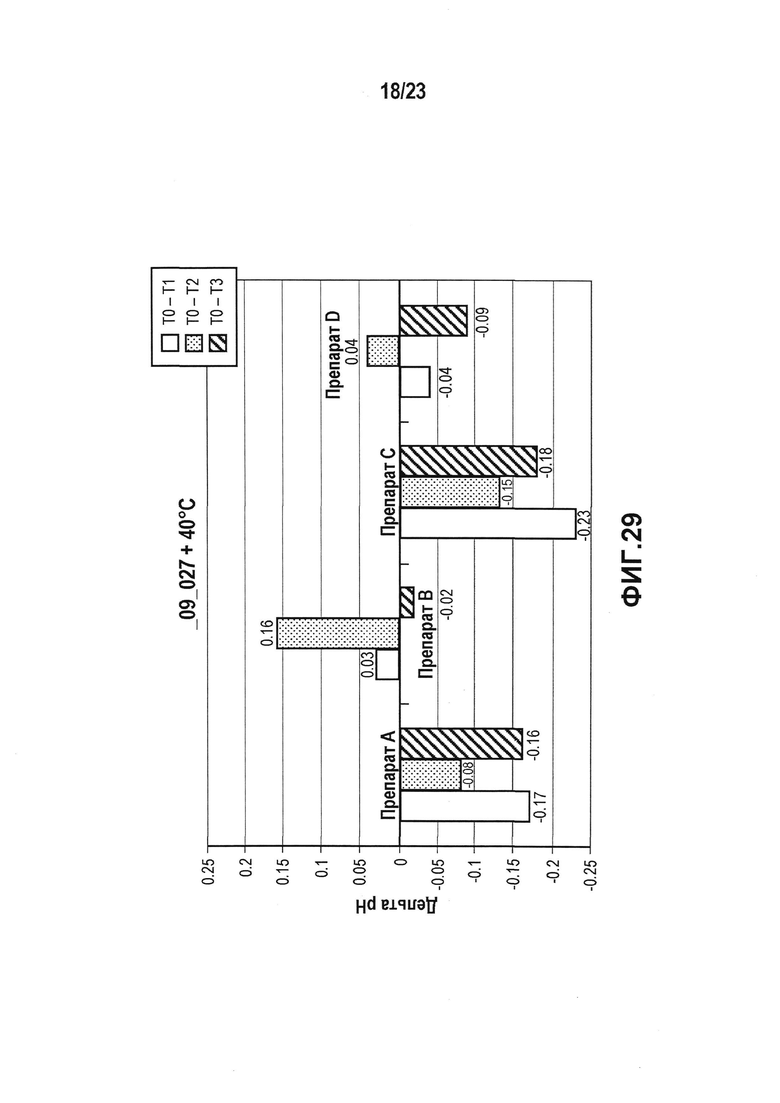
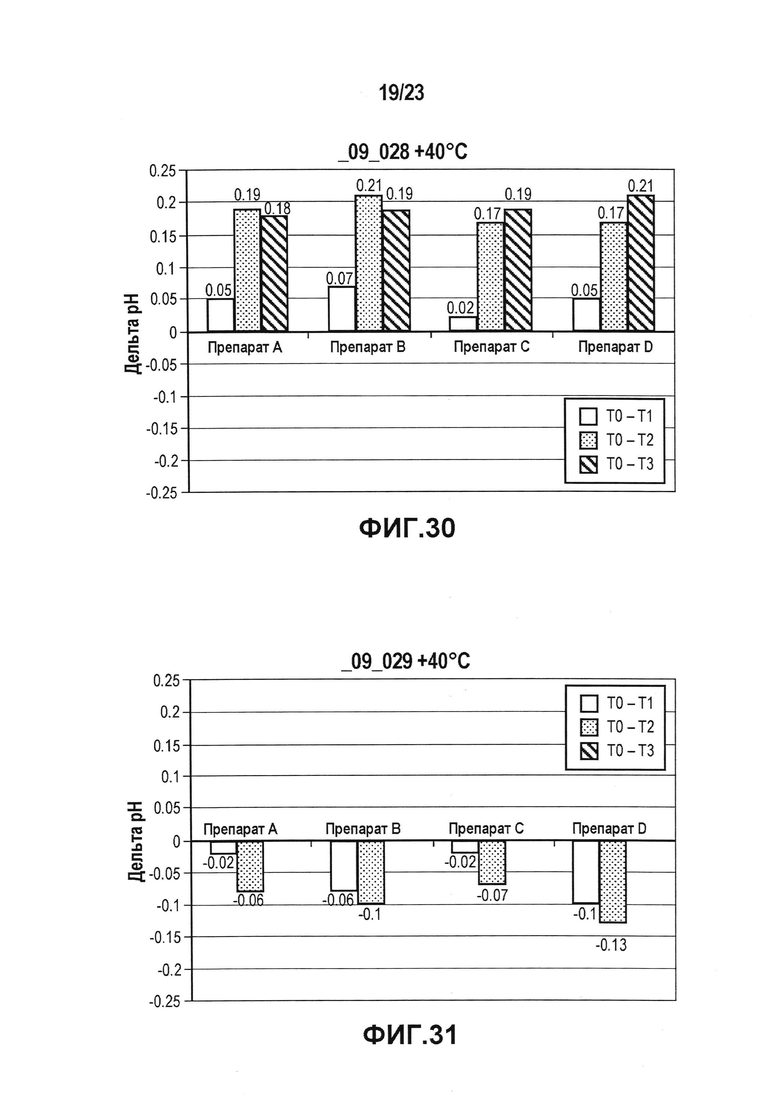
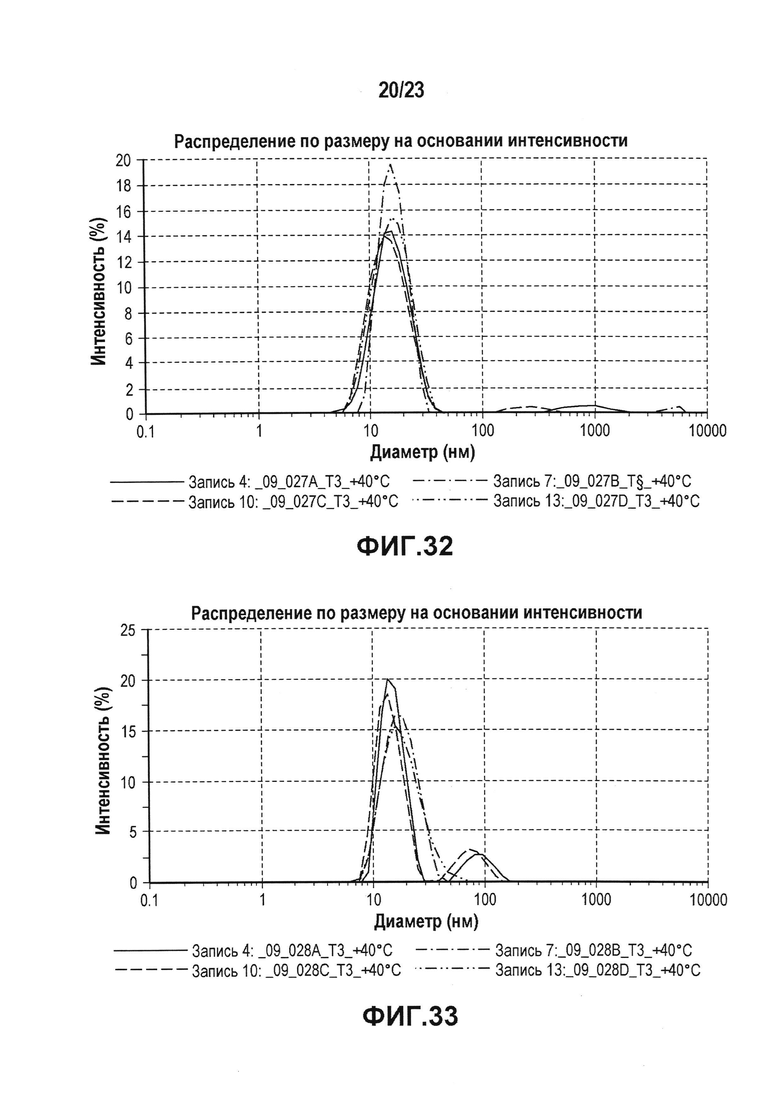
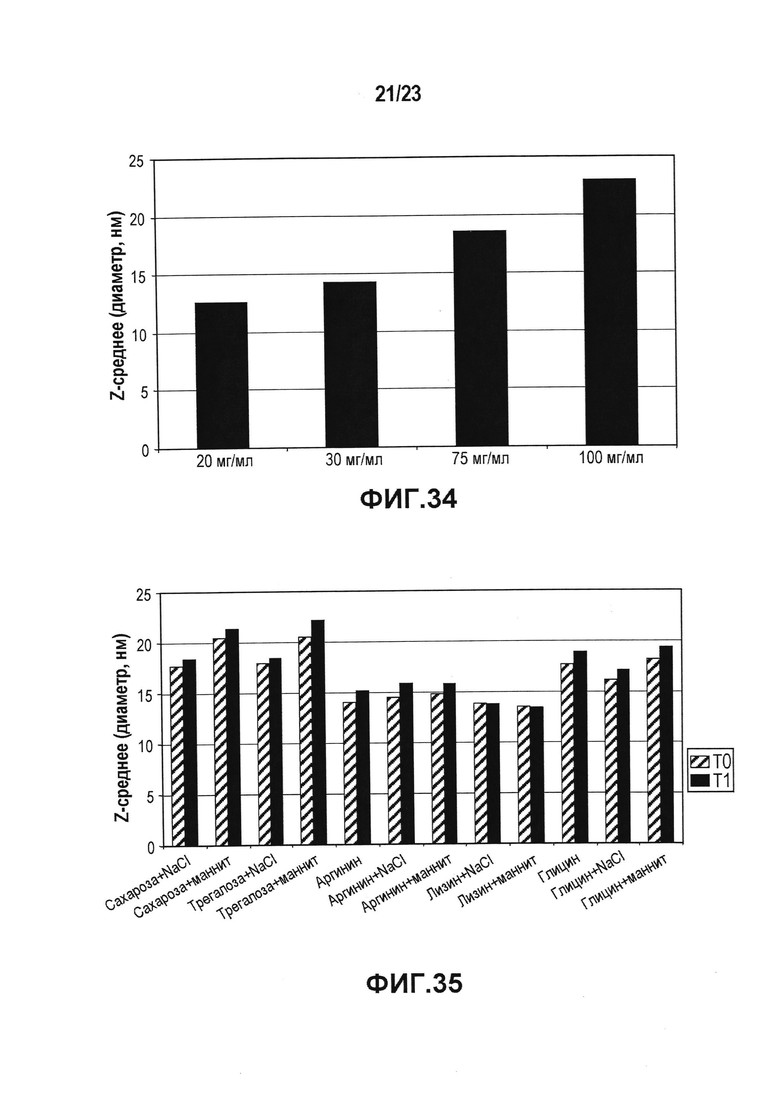
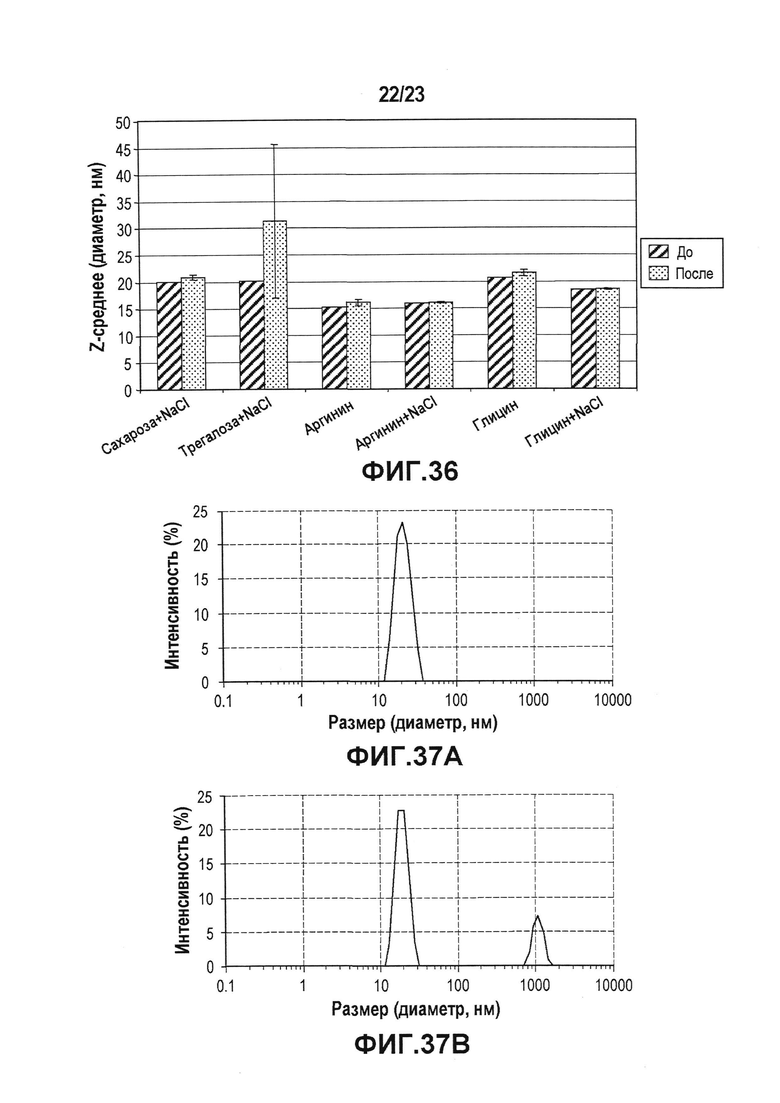
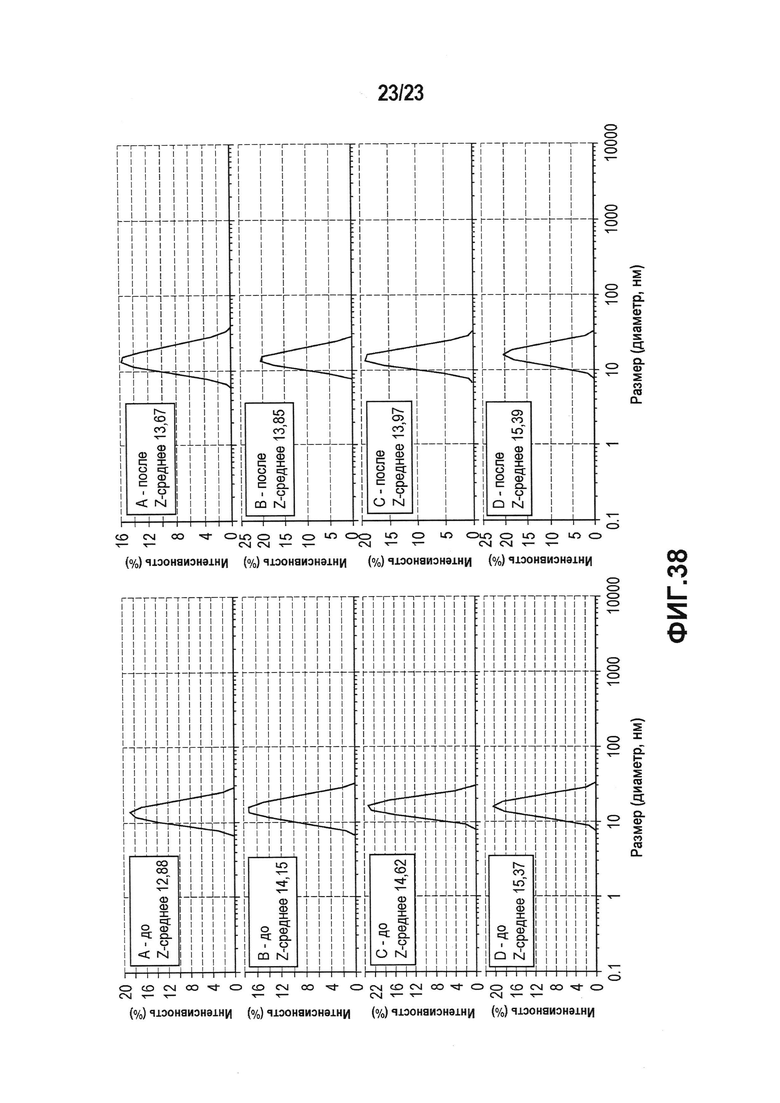
Изобретение относится к препарату для лечения опосредованных рецептором хемокина С-Х-С типа 5 (CXCR5) заболеваний. Препарат содержит от примерно 5 мг/мл до примерно 100 мг/мл IgG4-антитела, которое связывается с рецептором хемокина С-Х-С типа 5 (CXCR5) и от примерно 5 до примерно 50 мМ цитрата в качестве буферного средства; при этом рН препарата находится на уровне или ниже как значения рН около 6, так и значения pI антитела. Изобретение обеспечивает получение стабильного препарата, который может быть использован для лечения опосредованных рецептором хемокина С-Х-С типа 5 (CXCR5) заболеваний. 8 з.п. ф-лы, 38 ил., 117 табл., 21 пр.
1. Стабильный препарат для лечения опосредованных рецептором хемокина С-Х-С типа 5 (CXCR5) заболеваний, содержащий: от примерно 5 мг/мл до примерно 100 мг/мл IgG4-антитела, которое связывается с рецептором хемокина С-Х-С типа 5 (CXCR5) и содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи содержит определяющие комплементарность области (CDR), содержащие аминокислотные последовательности SEQ ID NO: 15, 16 и 17, и вариабельная область легкой цепи содержит CDR, содержащие аминокислотные последовательности SEQ ID NO: 18, 19 и 20, и от примерно 5 до примерно 50 мМ цитрата в качестве буферного средства; при этом рН препарата находится на уровне или ниже как значения рН около 6, так и значения pI антитела.
2. Препарат по п. 1, в котором антитело представляет собой гуманизированное IgG4-антитело против CXCR5, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 26.
3. Препарат по п. 1, в котором препарат представляет собой жидкий препарат.
4. Препарат по п. 1, в котором препарат является лиофилизированным препаратом.
5. Препарат по п. 1, в котором препарат является стабильным в течение, по меньшей мере, 6 месяцев при +5°С.
6. Препарат по п. 1, в котором препарат является стабильным в течение, по меньшей мере, 9 месяцев при +5°С.
7. Препарат по п. 1, в котором в препарате наблюдают уменьшенное количество, по меньшей мере, одного побочного продукта, выбранного из группы, состоящей из агрегатов, полумолекул, продуктов распада, низкомолекулярных белков, высокомолекулярных белков и перераспределение кислых/основных/нейтральных изоформ антитела по сравнению с эталонным анти-CXCR5-препаратом, содержащим анти-LIGHT-антитело в фосфатно-солевом буфере с рН 7,3.
8. Препарат по п. 1, содержащий:
a) примерно 20 мг/мл гуманизированного IgG4-антитела против CXCR5, содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 26;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,02% полисорбата 20;
d) примерно 6% сахарозы; и
e) примерно 0,2% хлорида натрия;
при этом рН препарата составляет примерно 6,0.
9. Препарат по п. 1, содержащий:
a) примерно 100 мг/мл гуманизированного IgG4-антитела против CXCR5, содержащего тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 26;
b) примерно 10 мМ цитратный буфер;
c) примерно 0,01% полисорбата 20;
d) примерно 4,5% сахарозы;
e) примерно 0,2% хлорида натрия; и
f) примерно 1% аргинина;
при этом рН препарата составляет примерно 6,0.
| WO 2004071439 A2, 26.08.2004 | |||
| WO 2008157409 A1, 24.12.2008 | |||
| WO 2009032661 A1, 12.03.2009 | |||
| ISHIKAWA T | |||
| et al., Influence of pH on Heat-Induced Aggregation and Degradation of Therapeutic Monoclonal Antibodies, Biol Pharm Bull | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| LI Y | |||
| et al., High throughput formulation screening for global aggregation behaviors of three monoclonal antibodies, J Pharm Sci | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| СЕДЫШЕВ С.Х | |||
| и др., IgG4-связанное системное заболевание | |||
| Современный взгляд на "старые" болезни, Научно-практическая ревматология, 2012, т.54, No.5, стр.64-72. | |||
Авторы
Даты
2018-02-08—Публикация
2013-03-26—Подача