Изобретение относится к области медицины и химико-фармацевтической промышленности, в частности к стабильной комбинированной фармацевтической композиции, которая может найти применение для лечения различных форм бактериально инфицированной экземы, а также дерматомикозов, кандидоза и разноцветного лишая, особенно при локализации поражений в паховой области и в крупных складках кожи.
Лечение дерматозов приобретает особую важность в связи с увеличением их частоты, в том числе среди детей, а также в связи с учащением тяжелых форм этих заболеваний, осложненных различной инфекцией. Дерматозами страдает до 15% населения планеты, что определяет актуальность и социально-экономическую значимость проблемы.
По данным исследования, проведенного сотрудниками дерматологического отделения НИИ медицинской микологии им. Н.П. Кашкина в 2009 г., больные дерматозами сочетанной этиологии (ДСЭ) составили 17% среди всех больных, находившихся на лечении в стационаре в течение года. По мнению авторов, наиболее частой причиной развития ДСЭ являлась длительная непрерывная терапия монокомпонентными топическими препаратами. Таким образом, значительное место в лечении хронических дерматозов принадлежит рационально подобранной наружной терапии.
Среди широкого круга применяемых для этой цели лекарственных средств особую роль играют препараты, содержащие глюкокортикоиды. Глюкокортикоиды оказывают на организм сложное многостороннее влияние, обладают сильной противовоспалительной активностью, с которой не могут конкурировать другие лекарственные средства, а также гипосенсибилизирующими и иммунодепрессивными свойствами.
В патенте США 4489070, 1984 г.приводятся сведения о фармацевтической композиции на основе бетаметазона дипропионата с коммерческим названием "Diprosone", которая дополнительно содержит основу, состоящую из липофильного компонента (минеральное масло, петролатум) и гидрофильного компонента (пропиленгликоль и вода), эмульгатор (моноцетиловый эфир полиэтиленгликоля, цетостеариловый спирт), регулятор рН (фосфорная кислота), консервант (4-хлор-м-крезол) и буферный агент (одноосновный натрийфосфат). Указанный состав, как и аналогичные лекарственные средства на основе бетаметазона (патенты США 4070462, 1978 г., 4370322, 1983 г., 4489070, 1984 г., 4489071, 1984 г.), не проявляет активности в отношении вирусной, бактериальной и грибковой инфекций, которая является основным побочным эффектом наружной терапии глюкокортикоидов и приводит к возникновению и обострению осложнений в ходе лечения. Возникновение побочных эффектов обусловлено действием глюкокортикоидов на пролиферацию кератиноцитов, фибробластов и жировых клеток: ингибирование пролиферации кератиноцитов приводит к истончению эпидермиса, задержке заживления раневых поверхностей, повышает восприимчивость кожи к инфекции.
Основным путем снижения возникновения побочных эффектов и усиления действия бетаметазона является разработка комбинированных лекарственных форм, которые содержат дополнительные активные вещества.
В патенте РФ 2223097 описывается комбинированное наружное средство для лечения дерматозов, содержащее в дополнении к глюкокортикоидам антибактериальный и противогрибковый компоненты. Антибактериальный компонент представлен неомицином или гентамицином, которые относятся к аминогликозидам широкого спектра действия 1 и 2 поколению соответственно. Эффективны по отношению к грамотрицательной микрофлоре и некоторым грамположительным коккам. Неомицин препятствует также развитию вторичного воспаления при высвобождении из погибших трихомонад не полностью фагоцитированных микроорганизмов (Степаненко В.И., Коган Б.Г. Комбинированное лечение монотрихомонадной и миксттрихомонадной урогенитальной инфекции у женщин. Препарат Тержинан - рациональное сочетание лекарственных компонентов и широты спектра терапевтической эффективности.// Тезисы научно-практической конференции «Особенности инфекционных процессов нижнего отдела половых путей», Киев, 2003). Гентамицин действует на штаммы стафилококков, устойчивые к пенициллину. Резистентность микроорганизмов к гентамицину развивается медленно. Гентамицин применяют и при инфекциях мочевых путей (хронический пиелонефрит, цистит, уретрит). Известно и его применение в виде геля при хронических уретритах (Молочков В.А., Ильин И.И. Хронический уретрогенный простатит. - М.: Медицина, 1998).
Задача настоящего изобретения заключается в создании фармацевтической композиции в виде мягкой лекарственной формы, которая комплексно воздействует на больные ткани и проявляет многонаправленный терапевтический эффект противовоспалительный, противозудный, антиэкссудативный, антибактериальный, противогрибковый и регенерирующее действие
Поставленная задача решается предлагаемой фармацевтической композицией для наружного применения, включающая в качестве активных веществ комбинацию антибиотика аминогликозидного ряда, противогрибковый компонент (производное имидазола), глюкокортикостероид и агент, стимулирующий процесс регенерации тканей.
В качестве антибиотика аминогликозидного ряда используется гентамицин, неомицин, тобрамицин, нетилмицин или их фармацевтически приемлемые соли. Терапевтически эффективное количество неомицина и гентамицина лежит в пределах от 0,001 до 1,0 г. Данный диапазон определен с учетом рекомендуемых суточных дозировок этих компонентов. Рекомендуемые дозировки неомицина по данным РЛС составляют в среднем 0,1-0,2 г на прием, суточная - 0,4 г, возможно использование до 1 г неомицина, а для местного применения используется 0,5% и 2% мазь. В практике применяется также 0,1% мазь. Максимальная разовая (суточная) доза для 0,5% мази - 25-50 г (50-100 г), для 2% - 5-10 г (10-20 г) соответственно (по данным РЛС). Расчеты максимальной дозы неомицина для топического применения показывают, что она может составить 0,5 г, что в 1,25 раз превышает суточную дозу для перорального приема. При расчете минимальной дозировки неомицина учитывали содержание этого компонента в комплексных средствах, в частности: в составе комплексного средства Тержинан содержится 100 мг (100 тыс. ЕД) неомицина сульфата, что соответствует его разовой дозе при пероральном введении. В капсулах Полижинакс содержится 35000 ME неомицина сульфата (35 мг), а в составе крема Пимафукорт - 3500 ME неомицина сульфата (3,5 мг) в 1 г крема (последний взят за минимальное количество). Таким образом, минимальная концентрация неомицина может составить 0,0035 г, а максимальная - 0,5 г. Рекомендуемые суточные дозировки гентамицина по данным РЛС составляют в среднем 3-4 мг/кг массы тела (в ряде случаев от 1 мг/кг до 5 мг/кг), что при расчете для индивидуального дозирования для взрослых доза составит в среднем 0,26 г (от 0,06 г до 0,41 г) (данные РЛС). При проведении расчетов брали среднюю массу тела человека 75 кг с учетом колебания массы тела взрослого человека 55-110 кг. При парентеральном введении дозы всех аминогликозидов должны рассчитываться на килограмм массы тела. Учитывая, что аминогликозиды плохо распределяются в жировой ткани, у пациентов с массой тела, превышающей идеальную более чем на 25%, должна быть проведена коррекция дозы. При этом рассчитанную на фактическую массу тела суточную дозу следует эмпирически снизить на 25%. В то же время у истощенных пациентов доза увеличивается на 25%. (Практическое руководство по антимикробной химиотерапии/ Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. - Смоленск: МАКМАХ, 2007. - 464 с.).
При расчете терапевтически эффективного количества гентамицина, учитывали, что разница между минимальной и максимальной концентрациями для неомицина составила 142,8 раза, а максимальная доза неомицина для топического применения в 1,25 раз выше дозы для перорального приема. Таким образом, максимальная концентрация для гентамицина составляет - 0,51 г, а минимальная - 0,0036 г. При округлении получаем диапазон от 0,004 до 0,5 г.
Противовоспалительный компонент из группы глюкокортикостероидов выбирают из преднизолона, гидрокортизона, мометазона, гидрокортизона или их фармацевтически приемлемых солей. Глюкокортикостероиды обладают хорошо выраженным противовоспалительным действием. Наиболее выраженный клинический эффект оказывают препараты, содержащие топические глюкокортикостероиды (ГКС), благодаря значительной противовоспалительной, противоаллергической, противозудной активности (Adcock I.M. Molecular mechanisms of glucocorticoid actions // Pulm. Pharm. Ther - 2000 - Vol. 13 - Supp. 3 - P. 115-126.; Короткий Н.Г., Таганов A.B., Тихомиров A.A. Современная наружная и физиотерапия дерматозов. М: «Экзамен», 2007. - 703 с.). При этом гидрокортизон и преднизолон относятся к препаратам системного действия, мометазон и гидрокортизона 17-бутират - к препаратам для местного применения. По степени противовоспалительной активности при местном применении мометазон относятся к препаратам 3 группы (высокой активности) (Российский национальный согласительный документ по атопическому дерматиту, 2004 - http://www.consilium-medicum.com/medicum/article/12634/). Глюкокортикостероиды широко используют для местного лечения и профилактики аллергических ринитов. Длительное лечение назальными глюкокортикостероидами (в течение 1-5,5 лет) в терапевтических дозах не сопровождается развитием атрофии слизистой носа, т.е. может применяться и для местного лечения в гинекологии (LaForce С., Use of nasal steroids in managing allergic rhinitis. J. Allergy Clin. Immunol., 1999, v. 103, p. 338-394; Passalacqua G., Albano M., Canonica G.W. et al. Position paper. Inhaled and nasal steroids: safety aspects. Allergy, 2000, v. 55, p. 16-32).
При определении минимальных и максимальных дозировок компонентов учитывали, что преднизолон обладает большей примерно в 4-5 раз активностью по сравнению с гидрокортизоном (Кукес В.Г. Клиническая фармакология. - М. - 1999. - 528 с.) и при местной терапии используют от 0,1 до 1 г мази (крема, геля, суспензии и т.п.), содержащих ГКС, в зависимости от площади нанесения, что будет соответствовать 0,001-0,01 г гидрокортизона или преднизолона. В наружной терапии активно используются современные мази и крема, содержащие 0,1% мометазона фуроата и 0,1% гидрокортизона 17-бутирата (Короткий Н.Г., Тихомиров А.А., Гамаюнов Б.Н. Сравнительная эффективность Момата (мометазона фуроата) и гидрокортизона 17-бутирата в наружной терапии атопического дерматита у детей // РМЖ. - 2008. - Т. 16. - №18. - С. 1183-1189). Поскольку применяемая концентрация для гидрокортизона 17-бутират и мометазона ниже в 10-50 раз (в среднем в 30 раз) по сравнению с гидрокортизоном, то могут быть установлены следующие минимальные и максимальные дозы - 0,0003 г и 0,003 г для интравагинального введения.
Противогрибковый компонент из ряда производных имидазола может быть выбран из бифоназола, бутоконазола, изоконазола, клотримазола, кетоконазола, миконазола, оксиконазола, тиоконазола, эконазола или их фармацевтически приемлемых солей. Указанная группа азолов для местного применения является наиболее эффективной и малотоксичной из представленных противогрибковых средств для местного применения. Азолы имеют широкий спектр противогрибкового действия, оказывают преимущественно фунгистатический эффект. Азолы для системного применения активны в отношении большинства возбудителей поверхностных и инвазивных микозов, включая Candida spp. (в т.ч. Candida albicans, Candida tropicalis), Cryptococcus neoformans, Coccidioides immitis, Histoplasma capsulatum, Blastomyces dermatitidis, Paraccoccidioides brasiliensis.
Терапевтически эффективные количество противогрибкового компонента из группы имидазолов для местного применения в гинекологии находится в диапазоне от 0,05 до 0,5 г на дозу. Данный диапазон рассчитан на основании данных справочников ВИДАЛЬ и РЛС о разрешенных концентрациях противогрибковых компонентов группы имидазолов в средствах для местного применения (1-2%), используемой дозы (обычно не превышает 20-50 г готовой лекарственной формы, что соответствует 0,2-1,0 г активного вещества, в среднем - 0,5 г активного вещества), а также с учетом сведений о том, что дозировка используемых для местной терапии противогрибковых компонентов на 3-4 порядка превышает таковую для системных препаратов (Лещенко В.М. ГРИБКОВЫЕ ИНФЕКЦИИ КОЖИ. Современные антимикотики в дерматологии. - CONSILIUM MEDICUM. - 2004. - 6(3). - С. 86-91), а разница между терапевтически эффективным минимальным и максимальным количеством противогрибковых компонентов группы имидазолов для системного применения составляет один порядок (например, для флуконазола - от 0,05 до 0,4 г).
Четвертый компонентом фармацевтической композиции по изобретению является агент, стимулирующий процесс регенерации тканей. В качестве указанного агента могут быть использованы депротеинизированный гемодериват из крови телят, цинка гиалуронат, метилурацил, декспантенол. Так, декспантенол является одним из традиционных средств, способствующих регенерации кожных покровов. Декспантенол переходит в организме в пантотеновую кислоту, которая является составной частью коэнзима А и участвует в процессах ацетилирования, углеводном и жировом обмене, в синтезе ацетилхолина, ГКС, порфиринов; стимулирует регенерацию кожи, слизистых оболочек, нормализует клеточный метаболизм, ускоряет митоз и увеличивает прочность коллагеновых волокон. Оказывает регенерирующее, витаминное, метаболическое и слабое противовоспалительное действие. Способствует восстановлению рогового слоя кожи за счет процесса кератинизации (EbnerF, HellerA, RippkeF, TauschI, 2006; BiroK, ThaciD, OchsendorfFRetal., 2003). Низкая молекулярная масса декспантенола, гидрофильность и низкая полярность делают возможным проникновение активных веществ во все слои кожи. (Видаль, 2007).
С учетом вышеизложенного разработана стабильная фармацевтическая композиция противовоспалительного, антибактериального, противогрибкового, регенерирующего действия для наружного применения, содержащая гентамицин, мометазон, эконазол или их фармацевтически приемлемые соли, декспантенол, а также дополнительные вспомогательные вещества. Особенностью композиции, отличающей ее от аналогов является то, что мометазон или его фармацевтически приемлемая соль в составе композиции имеет следующий профиль распределения размеров частиц: 100% частиц менее 20 мкм и 90% частиц менее 10 мкм; эконазол или его фармацевтически приемлемая соль в композиции имеет следующий профиль распределения размеров частиц: 100% частиц менее 100 мкм и 90% частиц менее 50 мкм.
Содержание активных компонентов в композиции по изобретению (гентамицина, декспантенола, мометазона, эконазола или их фармацевтически приемлемых солей) составляет мас. %:
гентамицин или его фармацевтически приемлемая соль 0,01-1,0
декспантенол 0,5-10,0
мометазон или его фармацевтически приемлемая соль 0,05-1,5
эконазол или его фармацевтически приемлемая соль 0,1-5,0
В качестве фармацевтически приемлемой соли гентамицина в композиция может содержать гентамицина сульфат, в качестве фармацевтически приемлемой соли мометазона - мометазона фуроат, в качестве фармацевтически приемлемой соли эконазола - эконазола нитрат.
Дополнительной отличительной особенностью композиции по изобретению является то, что около 10 мас. % мометазона или его фармацевтически приемлемой соли растворено в композиции.
В качестве вспомогательных веществ композиция может содержать парафин жидкий или вазелиновое масло или минеральное масло, цетостеариловый спирт, пропиленгликоль, макрогола 6 цетостеариловый эфир, макрогола 25 цетостеариловый эфир, натрия дигидрофосфата дигидрат или одноосновный натрия фосфат, воду очищенную или другие фармацевтически приемлемые вспомогательные вещества.
В наиболее предпочтительном варианте композиции по изобретению содержит указанные вспомогательные вещества при следующем соотношении компонентов мас. %:
парафин жидкий или вазелиновое масло или минеральное масло 5-20
цетостеариловый спирт 2-8
пропиленгликоль 1-7
макрогола 6 цетостеариловый эфир 0,5-5
макрогола 25 цетостеариловый эфир 0,5-7
натрия дигидрофосфата дигидрат или одноосновный натрия фосфат 0,01-0,1
воду очищенную до 100
Фармацевтическая композиция по изобретению может быть выполнена в виде крема, геля, линимента или мази.
Конкретные примеры осуществления изобретения представлены в таблице 2.
Технология приготовления лекарственной формы на дифильной эмульсионной основе
В емкость загружают липофильные компоненты и эмульгаторы. Нагревают до 75-80°С при перемешивании. Воду в количестве 80% от расчетного нагревают до температуры 75-80°С и прибавляют к расплаву липофильных компонентов. Проводят эмульгирование и охлаждают массу до 40-45°С. Декспантенол помешают в емкость и добавляют воду, нагретую до 40-45°С, перемешивают до полного растворения декспантенола. Гентамицин, эконазол и мометазон смешивают с пропиленгликолем в отдельной емкости. В готовую кремовую основу вводят при перемешивании раствор декспантенола и суспензию действующих веществ. Перемешивают до получения гомогенного крема, охлаждают до температуры 25-30°С. Фасуют в тубы.
В качестве липофильных компонентов могут применяться углеводороды, например вазелиновое масло, вазелин, парафин, производные жирных кислот и спиртов - ланолин, пчелиный воск, изопропилмиристат, цетилпальмитат, триглицериды.
Примерами гидрофильного компонента основы является вода, гликоли и макроголы.
В качестве эмульгаторов могут быть использованы высокомолекулярные спирты, оксиалкильные производные высокомол. спиртов и жиров, твины, спены, жиросахара или их смеси.
Технология приготовления лекарственной формы на дифильной абсорбционной основе
В емкость загружают эмульгаторы и нагревают при перемешивании до температуры 70-75°С. загружают в ту же емкость ПЭО 1500 и часть ПЭО 400. Гомогенизируют и охлаждают до температуры 40-45°С. Смешивают оставшуюся часть ПЭО 400 с декспантенолом до однородной массы, вводят эконазол, гентамицин и мометазон и перемешивают до однородной массы. Вводят действующие вещества в основу и гомогенизируют. Охлаждают до температуры 25-30°С. Фасуют в тубы.
Технология приготовления лек формы на ПЭО основе
В емкость загружают ПЭО 1500 и часть ПЭО 400. Нагревают при перемешивании до получения расплава. Охлаждают до температуры 40-45°С. Смешивают оставшуюся часть ПЭО 400 с декспантенолом до однородной массы, вводят эконазол, гентамицин и мометазон и перемешивают до однородной массы. Вводят действующие вещества в основу и гомогенизируют. Охлаждают до температуры 25-30°С. Фасуют в тубы. Полученные композиции удовлетворяют требованиям на фармацевтическое средство. Результаты изготовления составов представлены в таблице.
Исследование специфической фармакологической активности.
Были проведены доклинические исследования состава 3 по настоящему изобретению, изучены его специфическая фармакологическая активность в сравнении с препаратом Тридерм и его общетоксическое действие. Объем доклинических испытаний определялся «Правилами доклинической оценки безопасности фармакологических средств (CLP)» (РД 64-126-91. М., 1992) и «Руководством по экспериментальному (доклиническому) изучению новых фармакологических средств» М., ОАО «Медицина», 2005. - С. 48-49, С. 695-709, С. 763-827.
Эксперименты по специфической фармакологической активности проводили на крысах. Острое воспаление у крыс вызывали субплантарным введением 1% раствора каррагенина в дозе 0,1 мл. Исследуемый препарат и препарат сравнения наносили накожно профилактически за 2 и 1 час до введения флогогенного агента. Контрольным животным наносили эквиобъемное количество вазелинового масла. Репаративное действие препарата изучали на модели термических ожогов бедра крыс. Лечение ожогов начинали через 24 часа. Контрольным животным раны обрабатывали основой крема состав 3. Влияние препаратов на фазу формирования рубца осуществляли на модели линейных кожных ран у крыс. Лечение начинали через 24 часа. Контрольным животным наносили основу состава 3. Определение антибактериального и антигрибкового действия проводили методом двукратных серийных разведений на жидких или плотных питательных средах. Испытания проводили на культурах тест-микроорганизмов, рекомендованных ГФ XI для контроля антимикробной активности препаратов. Контрольный сектор чашек засевали с жидких питательных сред, не содержащих препарат.
Исследование показало, что состав 3 обладает усиленной противовоспалительной активностью в сравнении с препаратом Тридерм. По влиянию на процессы ограничения воспалительных изменений, динамику заживления ран состав 3 превосходит действие крема Тридерм. Препарат способствует более раннему уменьшению поверхности раневого дефекта, сокращает сроки формирования рубца, обладает более выраженным антиэкссудативным действием, препятствует развитию вторичного инфицирования ран. По антимикробной активности состав 3 превосходит действие Тридерма. Основными чувствительными микроорганизмами являются Грамположительные бактерии, а также грибы. Оценка чувствительности тест-культур бактерий и грибов к действию состава 3 и Тридерма рассмотрены в таблице 1.
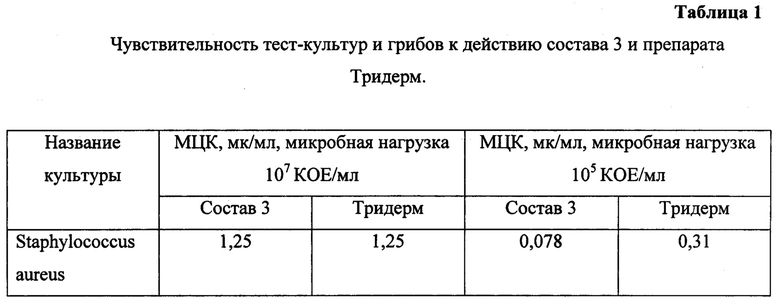
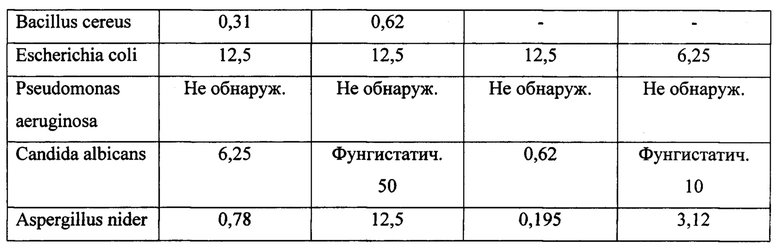
Исследование общетоксического действия.
Объем доклинических исследований определялся «Правилами доклинической оценки безопасности фармакологических средств (CLP)» (РД 64-126-91. М., 1992) и «Руководством по экспериментальному (доклиническому) изучению новых фармакологических средств» М., ОАО «Медицина», 2005. - 827 с.
Опыты были выполнены на беспородных белых крысах и кроликах обоего пола (Рапполово, Санкт-Петербург).
При исследовании были определены параметры токсичности препарата с составом 3 по настоящему изобретению в остром эксперименте. В хроническом эксперименте было изучено влияние препарата при тренсдермальном введении крысам в дозах 300 и 3000 и кроликам в дозах 30 и 300 (по готовой лекарственной форме) на общее состояние и поведение животных, интегральные показатели и показатели, характеризующие основной обмен, на функцию сердечно-сосудистой системы, морфологический состав и биохимические показатели периферической крови и костного мозга, на патоморфологические и гистологические показатели.
Обработка данных при статистической оценке результатов выполнялась в основном с помощью простого сравнения средних по t-критерию Стьюдента, также использовались методы дисперсионного анализа.
Полученные данные некропсии продемонстрировали, что состав 3 по настоящему изобретению не вызвал у животных патологических изменений головного мозга, внутренних и органов, а также не обладает местно-раздражающим действием.
При изучении хронической токсичности препарата с составом 3 по настоящему изобретению показано, что ежедневная в течение 30 дней аппликация препарата на выстриженную и частично скарифицированную кожу крысам и кроликам обоего пола в дозах 300 и 3000 мг/кг и 30 и 300 мг/кг, соответственно, (по готовой лекарственной форме) не приводит к развитию патологических сдвигов со стороны общего состояния и поведения животных, не оказывает токсического воздействия на сердечно-сосудистую деятельность, морфологический состав, биохимические и другие показатели периферической крови и костного мозга, на функциональное состояние печени и почек, белковый, углеводный, жировой и электролитный виды обмена веществ, не вызывает дистрофических, деструктивных, очаговых склеротических изменений в паренхиматозных клетках и строме внутренних органов, а также не оказывает местно-раздражающего действием на месте нанесения.
Технический результат предлагаемого технического решения заключается в повышении эффективности фармацевтической композиции с противовоспалительным, противогрибковым, антимикробным и регенерирующим действием в сравнении с соответствующими аналогами, в снижении риска развития побочных эффектов как от действия самих действующих веществ, так и от продуктов метаболизма инфекций, а также не оказывающей системного воздействия на организм.
Повышение эффективности достигается за счет: (1) ослабления побочных действий каждого компонента и усиления лечебного эффекта от их совокупности; (2) введения в состав фармацевтической композиции агент, стимулирующий процесс регенерации тканей, а также (3) синергического эффекта входящих компонентов.
Таким образом, применение заявляемой фармацевтической композиции обеспечивает повышение эффективности лечения, сокращение сроков достижения лечебного эффекта и увеличение периодов ремиссии.
Полученная фармацевтическая композиция обладает противовоспалительным, антибактериальным, противогрибковым действием, а также стимулирует процесс регенерации тканей. Фармацевтическая композиция может найти применение для лечения дерматозов воспалительного генеза с сопутствующей бактериальной и микотической инфекцией или высокой вероятностью присоединения вторичной инфекции, простого и аллергического дерматита, атопического дерматита, ограниченного нейродермита, экземы, дерматомикозов, простого хронического лишая.
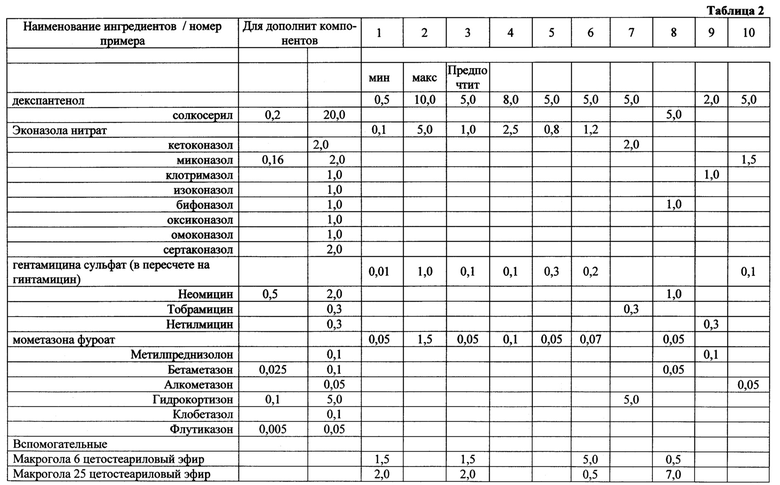
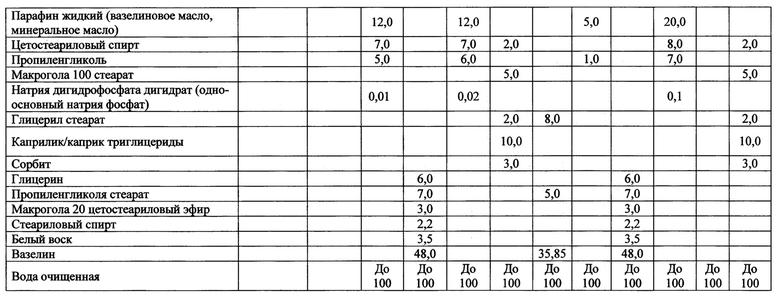
Группа изобретений относится к области медицины и химико-фармацевтической промышленности. Фармацевтическая композиция противовоспалительного, антибактериального, противогрибкового, регенерирующего действия для наружного применения содержит 0,01-1 мас. % гентамицина, 0,05-1,5 мас. % мометазона, 0,1-5 мас. % эконазола или их фармацевтически приемлемых солей, 0,5-10 мас. % декспантенола, а также дополнительные вспомогательные вещества, при этом мометазон или его фармацевтически приемлемая соль в композиции имеет размер частиц менее 20 мкм для 100% частиц и менее 10 мкм для 90% частиц, эконазол или его фармацевтически приемлемая соль в композиции имеет размер частиц менее 100 мкм для 100% частиц и менее 50 мкм для 90% частиц. Также раскрыто применение фармацевтической композиции для лечения заболеваний и состояний кожи, выбранных из дерматозов воспалительного генеза с сопутствующей бактериальной и микотической инфекцией, дерматозов с высокой вероятностью присоединения вторичной бактериальной и микотической инфекции, простого дерматита, аллергического дерматита, атопического дерматита, ограниченного нейродермита, экземы, дерматомикозов, простого хронического лишая. 2 н. и 6 з.п. ф-лы, 2 табл., 1 пр.
1. Фармацевтическая композиция противовоспалительного, антибактериального, противогрибкового, регенерирующего действия для наружного применения, содержащая гентамицин, мометазон, эконазол или их фармацевтически приемлемые соли, декспантенол, а также дополнительные вспомогательные вещества, при этом мометазон или его фармацевтически приемлемая соль в композиции имеет размер частиц менее 20 мкм для 100% частиц и менее 10 мкм для 90% частиц, эконазол или его фармацевтически приемлемая соль в композиции имеет размер частиц менее 100 мкм для 100% частиц и менее 50 мкм для 90% частиц, и содержание гентамицина, мометазона, эконазола или их фармацевтически приемлемых солей и декспантенола в композиции составляет, мас. %:
2. Фармацевтическая композиция по п. 1, которая в качестве фармацевтически приемлемой соли гентамицина содержит гентамицина сульфат, в качестве фармацевтически приемлемой соли мометазона содержит мометазона фуроат, в качестве фармацевтически приемлемой соли эконазола содержит эконазола нитрат.
3. Фармацевтическая композиция по п. 1, в которой содержание гентамицина сульфата, мометазона фуроата, эконазола нитрата и декспантенола в композиции составляет, мас. %:
4. Фармацевтическая композиция по п. 1, в которой около 10 мас. % мометазона или его фармацевтически приемлемой соли растворено в композиции.
5. Фармацевтическая композиция по п. 1, которая в качестве вспомогательных веществ содержит парафин жидкий или вазелиновое масло или минеральное масло, цетостеариловый спирт, пропиленгликоль, макрогола 6 цетостеариловый эфир, макрогола 25 цетостеариловый эфир, натрия дигидрофосфата дигидрат или одноосновный натрия фосфат, воду очищенную.
6. Фармацевтическая композиция по п. 1, в которой содержание вспомогательных веществ в композиции составляет мас. %:
7. Фармацевтическая композиция по п. 1, которая выполнена в виде крема, геля, линимента или мази.
8. Применение фармацевтической композиции по п. 1 для лечения заболеваний и состояний кожи, выбранных из дерматозов воспалительного генеза с сопутствующей бактериальной и микотической инфекцией, дерматозов с высокой вероятностью присоединения вторичной бактериальной и микотической инфекции, простого дерматита, аллергического дерматита, атопического дерматита, ограниченного нейродермита, экземы, дерматомикозов, простого хронического лишая.
| КОМБИНИРОВАННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ КОЖНЫХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2223097C1 |
| WO 2017091167 A1, 01.06.2017. | |||
Авторы
Даты
2020-11-23—Публикация
2018-04-28—Подача