ОБЛАСТЬ ТЕХНИКИ
[0001]
Настоящее изобретение относится к подавляющему адгезию биологического компонента материалу и очистителю крови, содержащему подавляющий адгезию биологического компонента материал.
УРОВЕНЬ ТЕХНИКИ
[0002]
Стандартные медицинские материалы известны в качестве контаминантов для биологических компонентов и вызывают адгезию тромбоцитов и белков и биологические реакции, что ведет к серьезным проблемам. Кроме того, в стандартных очистителях крови, таких как модули искусственной почки, тромбоциты и белки прилипают к поверхностям материалов в очистителе крови, что ведет к ухудшению эффективности фракционирования и водопроницаемости. В частности, в непрерывных очистителях крови, подлежащих использованию для лечения острой почечной недостаточности, необходимо непрерывное использование в течение от одних до нескольких суток. Следовательно, важно задать спецификации, которые гарантируют подавление адгезии тромбоцитов и белков, таким образом позволяя выдерживать использование в течение длительного периода времени.
[0003]
Кроме того, в отношении материалов, отличных от медицинских материалов, например, разделяющих материалов, подлежащих использованию для очистки антител или тому подобного, имеют такую проблему, что степень восстановления снижается из-за адгезии антител к поверхности разделяющего материала. До настоящего времени предприняты попытки к решению такой проблемы посредством гидрофилизации поверхности медицинского материала и проведены различные исследования.
[0004]
В патентном документе 1 раскрыт полимер на основе полисульфона, в котором посредством выполнения формования при смешивании поливинилпирролидона в качестве гидрофильного полимера на этапе раствора допанта для формирования мембраны, гидрофильность придают мембране для того, чтобы подавлять контаминацию.
[0005]
В патентном документе 2 раскрыта полимерная разделяющая мембрана на основе полисульфона, в которой покрывающий слой, который сделан нерастворимым посредством сшивки излучением, формируют после того, как полимер приводят в контакт с раствором гидрофильного полимера, такого как поливинилпирролидон.
[0006]
В патентных документах 3 и 4 раскрыта разделяющая мембрана из полимера на основе полисульфона, где сополимер винилпирролидона/винилацетата иммобилизуют на поверхности.
[0007]
Кроме того, в патентном документе 5 раскрыта разделяющая мембрана из полимера на основе полисульфона, где на поверхности иммобилизуют жирорастворимый витамин и поли(2-гидроксиалкилметакрилат).
ДОКУМЕНТЫ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0008]
Патентный документ 1: публикация японского патента № 2-18695
Патентный документ 2: выложенная публикация японского патента № 6-238139
Патентный документ 3: выложенная публикация японского патента № 2010-104984
Патентный документ 4: выложенная публикация японского патента № 2011-173115
Патентный документ 5: международная публикация № WO 2013/015046
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, ПОДЛЕЖАЩИЕ РЕШЕНИЮ С ПОМОЩЬЮ ИЗОБРЕТЕНИЯ
[0009]
Однако в способах, описанных в патентных документах 1 и 2, трудно формировать покрывающий слой по причине слабого взаимодействия между гидрофильным полимером, таким как поливинилпирролидон, и полимером на основе полисульфона в качестве гидрофобного полимера. Следовательно, для того, чтобы придавать гидрофильность поверхности с помощью этого способа, необходимо использовать большое количество гидрофильного полимера в растворе допанта для формирования мембраны, или необходимо ограничивать гидрофильный полимер тем, который совместим с полимером, подлежащим использованию в качестве подложки.
[0010]
С другой стороны, в способах описанных в патентных документах 3 и 4, винилацетатное звено взаимодействует с гидрофобной подложкой для того, чтобы усовершенствовать введение эффективности сополимера, чтобы можно было эффективно выполнять гидрофилизацию, но используют сополимер винилпирролидона/винилацетата, который представляет собой коммерчески доступный полимер, и структурное решение, подходящее для подавления адгезии тромбоцитов и белков, не принимают во внимание вовсе. Фактически, авторы настоящего изобретения получали медицинский материал на основе способов, описанных в патентных документах 3 и 4, и в результате обнаруживали, что тромбоциты и белки прилипали к медицинскому материалу, когда медицинский материал находился в контакте с кровью или тому подобным в течение длительного периода времени.
[0011]
Способ, описанный в патентном документе 5, направлен на усовершенствование антиоксидантной эффективности, и его не оценивали на антитромбогенность. Кроме того, конструкция поверхности, связанная с расположением, иммобилизацией и т. п. полимера, важна при гидрофилизации поверхности медицинского материала, но этот момент не описан вовсе.
[0012]
Таким образом, цель настоящего изобретения состоит в том, чтобы предоставлять подавляющий адгезию биологического компонента материал, который способен подавлять адгезию тромбоцитов и белков, даже когда входит в контакт с кровью или тому подобным.
РЕШЕНИЯ ПРОБЛЕМ
[0013]
Белки, содержащиеся в крови, и т. д. легко прилипают к гидрофобной поверхности и, следовательно, считают важным, чтобы вся поверхность контакта медицинского материала обладала гидрофильностью. Это может быть обусловлено тем, что, когда белок подходит к поверхности материала, происходит изменение структуры белка более высокого порядка, чтобы экспонировать гидрофобный сайт внутри белка, и гидрофобный сайт гидрофобно взаимодействует с поверхностью материала.
[0014]
С другой стороны, известно, что адгезию белков и т. п. не удается подавлять, когда поверхность контакта медицинского материала покрывают гидрофильным полимером, таким как полиэтиленгликоль или поливиниловый спирт. Это может быть обусловлено тем, что, когда поверхность контакта медицинского материала обладает чрезмерно высокой гидрофильностью, происходит дестабилизация структуры белка и, следовательно, адгезию белка нельзя подавлять в достаточной мере.
[0015]
Авторы настоящего изобретения проводили всесторонние исследования для того, чтобы решать описанные выше проблемы, и в результате разработали подавляющие адгезию биологического компонента материалы, которые значительно подавляют адгезию тромбоцитов и белков и которые можно использовать, даже когда они находятся в контакте с кровью или тому подобным, в течение длительного периода времени, и очиститель крови с использованием подавляющего адгезию биологического компонента материала. Подавляющие адгезию биологического компонента материалы и очиститель крови представляют собой следующее:
(1) подавляющий адгезию биологического компонента материал, содержащий подложку, имеющую функциональный слой с полимером, иммобилизованным на поверхности, которая находится в контакте с биологическим компонентом, полимер содержит звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, в котором число атомов углерода в алифатической цепи в сигнале иона насыщенной алифатической монокарбоновой кислоты, обнаруживаемом при анализе композиции поверхности функционального слоя с помощью аппарата TOF-SIMS, составляет от 2 до 20, и пик, происходящий из сложноэфирной группы, присутствует в XPS измерении поверхности функционального слоя;
(2) подавляющий адгезию биологического компонента материал в соответствии с (1), в котором сигнал иона насыщенной алифатической монокарбоновой кислоты получают из гомополимера или сополимера сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, содержащего сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты, и обладает антитромбогенностью;
(3) подавляющий адгезию биологического компонента материал в соответствии с (1) или (2), в котором число атомов углерода в алифатической цепи в сигнале иона насыщенной алифатической монокарбоновой кислоты составляет от 2 до 9;
(4) подавляющий адгезию биологического компонента материал в соответствии с любым одним из (1)-(3), в котором, при XPS измерении поверхности функционального слоя, процентная доля площади пика углерода, происходящего из сложноэфирной группы, составляет 0,5-25 (атомн. %), где общая площадь пиков, получаемых из углерода составляет 100 (атомн. %);
(5) подавляющий адгезию биологического компонента материал в соответствии с любым одним из (1)-(4), в котором, при ATR-IR измерении поверхности функционального слоя, пик присутствует в каждом из диапазона 1711-1751 см-1 и диапазона 1549-1620 см-1, и усредненное соотношение площади пика AC=O в диапазоне 1711-1751 см-1 и площади пика AC=C в диапазоне 1549-1620 см-1 (AC=O/AC=C) составляет 0,01 до 1,0;
(6) подавляющий адгезию биологического компонента материал в соответствии с (5), в котором пик, присутствующий в диапазоне 1549-1620 см-1, получают из ароматических групп в полимере на основе полисульфона;
(7) подавляющий адгезию биологического компонента материал в соответствии с (5) или (6), в котором пик присутствует в диапазоне 1617-1710 см-1 при ATR-IR измерении поверхности функционального слоя;
(8) подавляющий адгезию биологического компонента материал в соответствии с (7), в котором пик, присутствующий в диапазоне 1617-1710 см-1, получают из амидной связи в гидрофильном полимере, содержащем звено винилпирролидона, звено винилкапролактама, звено винилацетамида или звено акриламида;
(9) подавляющий адгезию биологического компонента материал в соответствии с любым одним из (1)-(8), который используют для очистки крови; и
(10) очиститель крови, содержащий подавляющий адгезию биологического компонента материал в соответствии с любым одним из (1)-(9).
ЭФФЕКТ ИЗОБРЕТЕНИЯ
[0016]
Подавляющий адгезию биологического компонента материал по настоящему изобретению может подавлять адгезию тромбоцитов и белков.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0017]
Далее в настоящем описании настоящее изобретение описано подробно.
[0018]
Подавляющий адгезию биологического компонента материал по настоящему изобретению включает подложку, которая имеет функциональный слой с полимером, иммобилизованным на поверхности, которая находится в контакте с биологическим компонентом, полимер содержит звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, где число атомов углерода в алифатической цепи в сигнале иона насыщенной алифатической монокарбоновой кислоты, обнаруживаемом в анализе композиции поверхности функционального слоя посредством времяпролетного вторичного ионного масс-спектрометра (далее в настоящем описании иногда обозначаемого как аппарат TOF-SIMS), составляет 2 до 20, и пик, происходящий из сложноэфирной группы, присутствует в XPS измерении поверхности функционального слоя.
[0019]
«Насыщенная алифатическая монокарбоновая кислота» обозначает вещество, содержащее одну карбоксигруппу и насыщенную алифатическую углеводородную группу, связанную с атомом углерода, в карбоксигруппе, и ее примеры включают уксусную кислоту, пропановую кислоту и масляную кислоту.
[0020]
Термин «насыщенный алифатический» обозначает, что все углерод-углеродные связи представляют собой одинарные связи, а кратная связь, как в ароматической группе, отсутствует.
[0021]
«Число атомов углерода в алифатической цепи» обозначает число атомов углерода в насыщенной алифатической углеводородной группе, связанной с атомом углерода в карбоксигруппе карбоновой кислоты. Например, когда число атомов углерода в алифатической цепи составляет 1, карбоновая кислота представляет собой уксусную кислоту, и когда число атомов углерода в алифатической цепи составляет 2, карбоновая кислота представляет собой пропановую кислоту. Когда число атомов углерода в алифатической цепи мало, насыщенная алифатическая монокарбоновая кислота обладает плохой подвижностью, так что адгезия белков и тромбоцитов легко возникает. С другой стороны, когда число атомов углерода в алифатической цепи велико, насыщенная алифатическая монокарбоновая кислота имеет высокую гидрофобность, что ведет к увеличению гидрофобного взаимодействия с тромбоцитами и белками. Как результат, происходит адгезия тромбоцитов и белков. Следовательно, в подавляющем адгезию биологического компонента материале по настоящему изобретению число атомов углерода в алифатической цепи в сигнале иона насыщенной алифатической монокарбоновой кислоты составляет от 2 до 20, предпочтительно от 2 до 9, более предпочтительно от 2 до 5.
[0022]
Насыщенная алифатическая углеводородная группа может включать не только линейную структуру, такую как этильная группа, н-пропильная группа, н-бутильная группа, н-пентильная группа или н-гексильная группа, но также разветвленную структуру, такую как изопропильная группа или третичная бутильная группа, циклическую структуру, такую как циклопропильная группа или циклобутильная группа, и простую эфирную связь, сложноэфирную связь или тому подобное в алифатической цепи. Однако структура, имеющая анионную функциональную группу, такую как группа сульфоновой кислоты или карбоксильная группа на конце, исключена. Это обусловлено тем, что анионная функциональная группа на конце алифатической цепи не только дестабилизирует структуры тромбоцитов и белков и вызывает адгезию тромбоцитов и белков к поверхности подавляющего адгезию биологического компонента материала, но также индуцирует нежелательные биологические реакции, такие как активация брадикинина и активация комплемента. С точки зрения стоимости производства карбоновой кислоты, насыщенная алифатическая углеводородная группа предпочтительно представляет собой линейную структуру или разветвленную структуру, более предпочтительно линейную структуру. Кроме того, с точки зрения легкодоступности карбоновой кислоты и простоты полимеризации, предпочтительно насыщенная алифатическая углеводородная группа состоит только из атомов углерода и атомов водорода.
[0023]
«Биологический компонент» обозначает вещество, полученное из организма, такое как сахар, белок или тромбоцит. Предпочтительно, биологический компонент представляет собой вещество, содержащееся в текучем веществе организма, таком как кровь, слеза или цереброспинальная жидкость. В частности, в качестве мишени для подавляющего адгезию биологического компонента материала, обладающего антитромбогенностью, вещество, содержащееся в крови, является предпочтительным.
[0024]
«Полимер, содержащий звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты» обозначает гомополимер или сополимер сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, содержащий сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты. Кроме того, с точки зрения подавления адгезии биологических компонентов материалом, сополимер, содержащий сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты, является предпочтительным. Примеры сополимера включают привитые сополимеры, в которых ветвящаяся часть содержит звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, а стеблевая часть содержит другие звенья.
[0025]
«Иммобилизация» обозначает, что полимер химически или физически связывают с подложкой, и способом для этого является, например, иммобилизация сшивкой посредством экспонирования излучению.
[0026]
«Функциональный слой» обозначает слой, который находится в контакте с биологическим компонентом, таким как кровь. В случае, например, половолоконной мембраны искусственной почки, функциональный слой представляет собой внутреннюю сторону половолоконной мембраны, через которую течет кровь.
[0027]
«Подложка» относится к компоненту, объемное содержание которого является наибольшим среди компонентов, которые образуют подавляющий адгезию биологического компонента материал.
[0028]
«Подавляющий адгезию биологического компонента материал» обозначает материал, который подавляет адгезию биологических компонентов на поверхности материала. Примеры продукта, в котором используют материал, включают медицинские материалы, подлежащие использованию для имплантации в организме или экстракорпоральной циркуляции, разделяющие материалы, подлежащие использованию для очистки гликопротеинов и антител, и аналитические материалы для измерения концентрации компонента в текучем веществе организма, и т. д. Подавляющий адгезию биологического компонента материал обозначает материал, содержащий подложку в качестве по меньшей мере части материала, и включает отдельно подложку или подложку, иммобилизованную на подходящем армирующем материале или смешанную с ним.
[0029]
«Антитромбогенность» обозначает, что подавляют адгезию белков и тромбоцитов среди биологических компонентов.
[0030]
«Медицинский материал» обозначает материалы, которые используют при нахождении в контакте с биологическими компонентами, содержащимися преимущественно в крови и текучем веществе организма, и его примеры включают плоские мембраны, половолоконные мембраны и трубки. Примеры продукта, в котором используют медицинский материал, включают очистители крови по типу модулей искусственной почки или разделителей плазмы, которые включают разделяющую мембрану, кровяные контуры, мешки для хранения крови, катетеры, стенты и контактные линзы.
[0031]
Предпочтительно, подавляющий адгезию биологического компонента материал по настоящему изобретению обладает антитромбогенностью. В этом случае, подавляющий адгезию биологического компонента материал по настоящему изобретению предпочтительно представляет собой антитромботический медицинский материал, поскольку он превосходен, в частности, в отношении подавления адгезии белков и тромбоцитов, содержащихся в крови и текучем веществе организма.
[0032]
В подавляющем адгезию биологического компонента материале по настоящему изобретению предпочтительно сигнал иона насыщенной алифатической монокарбоновой кислоты получают от гомополимера или сополимера насыщенного алифатического монокарбонового сложного винилового эфира, содержащего сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты. То есть, предпочтительно насыщенная алифатическая монокарбоновая кислота образует сложноэфирную связь и существует в виде сложного эфира насыщенной алифатической монокарбоновой кислоты на поверхности функционального слоя подавляющего адгезию биологического компонента материала. Карбоксигруппа обладает высокой гидрофильностью и дестабилизирует структуры тромбоцитов и белков. С другой стороны, сложноэфирная группа не обладает чрезмерно высокой гидрофильностью или гидрофобностью и, следовательно, едва ли вызывает адгезию тромбоцитов и белков. В подавляющем адгезию биологического компонента материале по настоящему изобретению предпочтительно сигнал иона насыщенной алифатической монокарбоновой кислоты получают из гомополимера или сополимера насыщенного алифатического монокарбонового сложного винилового эфира, содержащего сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты, и обладает антитромбогенностью.
[0033]
Комбинируя анализ композиции с помощью аппарата TOF-SIMS и измерение рентгеновской электронной спектроскопии (XPS), расположение сложного эфира насыщенной алифатической монокарбоновой кислоты на самой внешней поверхности приблизительно 10 нм.
[0034]
Сначала пик, получаемый из иона карбоксилата сложного эфира насыщенной алифатической монокарбоновой кислоты, обнаруживают посредством анализа композиции с использованием аппарата TOF-SIMS, и затем структуру карбоновой кислоты обнаруживают посредством анализа массы (m/z). При анализе композиции с помощью аппарата TOF-SIMS, ионные импульсы (первичные ионы) применяют к поверхности образца, помещенного в сверхвысокий вакуум, ионам (вторичным ионам), высвобождаем из поверхности образца, придают определенную кинетическую энергию, и направляют их во времяпролетный анализатор массы. Каждый из вторичных ионов, ускоренных с использованием одной и той же энергии, проходит через анализатор на скорости, соответствующей массе, и, поскольку расстояние до детектора является постоянным, время, затраченное для того, чтобы достичь детектора, (время пролета) представляет собой функцию массы, и распределение времени пролета точно измеряют для получения распределения масс вторичных ионов, т. е. спектра масс.
[0035]
Например, когда вторичный отрицательный ион обнаруживают с использованием Bi3++ в качестве частиц первичных ионов, пик при m/z=59,02 соответствует C2H3O2-, т. е. уксусной кислоте (число атомов углерода в алифатической цепи составляет 1). Кроме того, пик при m/z=73,04 соответствует C3H5O2-, т. е. пропановой кислоте (число атомов углерода в алифатической цепи составляет 2).
[0036]
Условия анализа композиции с помощью аппарата TOF-SIMS представляют собой следующее.
[0037]
Область измерения имеет размер 200 мкм × 200 мкм, напряжение ускорения первичных ионов составляет 30 кВ и ширина импульса составляет 5,9 нм. Глубина обнаружения в этом способе анализа составляет не больше чем несколько нанометров. Здесь, когда ионная сила карбоновой кислоты составляет 0,4% или меньше на основе общей силы вторичных ионов, считают, что значение ионной силы карбоновой кислоты относится к шуму, и определяют, что ион карбоновой кислоты отсутствует.
[0038]
Кроме того, при XPS измерении, пик углерода, получаемый из сложноэфирной группы (COO), появляется от +4,0 до 4,2 эВ из основного пика CHx или C-C (приблизительно 285 эВ) и, следовательно, понятно, что карбоновая кислота образует сложноэфирную связь. Значение, измеряемое при 90° в качестве угла измерения, используют в XPS. Когда измерение осуществляют при угле измерения 90°, осуществляют обнаружение в области глубиной приблизительно 10 нм от поверхности. Здесь, когда соотношение площади пика, происходящего из сложноэфирной группы, и общей площади пиков, получаемых из углерода, составляет 0,4% или меньше, значение площади пика считают относящимся к шуму и определяют, что сложноэфирная группа отсутствует.
[0039]
Комбинация двух описанных выше результатов, показывает, расположен ли сложный эфир насыщенной алифатической монокарбоновой кислоты на поверхности функционального слоя или нет, т. е. поверхности, которая находится в контакте с биологическим компонентом.
[0040]
Количество сложного эфира насыщенной алифатической монокарбоновой кислоты на поверхности функционального слоя подавляющего адгезию биологического компонента материала можно определять посредством измерения количества углерода, получаемого из сложноэфирной группы, посредством рентгеновской электронной спектроскопии (XPS). В подавляющем адгезию биологического компонента материале по настоящему изобретению, площадь пика углерода, происходящего из сложноэфирной группы, где общая площадь пиков, получаемых из углерода, составляет 100 (атомн. %), предпочтительно составляет 0,5-25 (атомн. %) при XPS измерении поверхности функционального слоя. Для того чтобы проявлять эффект подавления адгезии белков и тромбоцитов, соотношение площадей пика углерода, происходящего из сложноэфирной группы, предпочтительно составляет 0,5 (атомн. %) или больше, более предпочтительно 1,0 (атомн. %) или больше, еще более предпочтительно 1,5 (атомн. %) или больше. С другой стороны, в зависимости от типа подавляющего адгезию биологического компонента материала, подлежащего использованию, обнаруживают, что происходит ухудшение собственной эффективности подавляющего адгезию биологического компонента материала, когда количество сложного эфира насыщенной алифатической монокарбоновой кислоты чрезмерно велико. Например, в очистителе крови, таком как искусственная почка, ухудшение эффективности разделения происходит, когда количество полимера чрезмерно велико, и, следовательно, процентная доля площади пика углерода, происходящего из сложноэфирной группы, предпочтительно составляет 25 (атомн. %) или меньше, более предпочтительно 20 (атомн. %), еще более предпочтительно 10 (атомн. %) или меньше. Любые предпочтительные нижние пределы можно комбинировать с любыми предпочтительными верхними пределами.
[0041]
При XPS измерении, измерения выполняют в двух различных местах на поверхности функционального слоя подавляющего адгезию биологического компонента материала, и используют усредненное значение для двух мест. Пик углерода, получаемый из сложноэфирной группы (COO), можно определять посредством деления пика для пика, возникающего при от +4,0 до 4,2 эВ из основного пика, получаемого из CH или C-C в C1s. Посредством вычисления соотношения площади пика, происходящего из сложноэфирной группы, и общей площади пиков, полученных из углерода, определяют количество углерода (атомн. %), происходящего из сложноэфирной группы. Более конкретно, пик C1s состоит из пяти компонентов: компонента, происходящего преимущественно из CHx, C-C, C=C или C-S, компонента, происходящего преимущественно из C-O или C-N, компонента, происходящего из π-π* сателлита, компонента, происходящего из C=O, и компонента, происходящего из COO. Вышеуказанные пять компонентов образуются делением пика. Компонент, происходящий из COO, представляет собой пик, возникающий при от +4,0 до 4,2 эВ из основного пика CHx или C-C (приблизительно 285 эВ). Соотношение площадей пиков каждого компонента вычисляют, округляя до второго десятичного разряда.
[0042]
Здесь предпочтительно полимер, содержащий звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, иммобилизуют на подложке посредством химической реакции или реакции сшивания. Это направлено на предотвращение элюирования полимера, когда биологический компонент, такой как кровь, входит в контакт с поверхностью подавляющего адгезию биологического компонента материала.
[0043]
Способ иммобилизации сложного эфира насыщенной алифатической монокарбоновой кислоты конкретно не ограничен, и его примеры включают способ, в котором подложку и карбоновую кислоту смешивают и конденсируют во время формования; и способ, в котором подложку погружают в раствор, содержащий карбоновую кислоту или сложный эфир карбоновой кислоты, и сложный эфир карбоновой кислоты связывают с помощью реакции, обусловленной экспонированием излучению или теплом. В частности, способ с использованием полимера, содержащего звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, где число углеродов в алифатической цепи составляет 2 или больше и 20 или меньше, предпочтительно используют, поскольку полимер вводят в подавляющий адгезию биологического компонента материал с высокой эффективностью и легко осаждают на поверхности функционального слоя.
[0044]
Здесь «звено» относится к повторяющемуся звену в гомополимере или сополимере, получаемым посредством полимеризации мономеров. Например, звено сложного винилового эфира карбоновой кислоты относится к повторяющемуся звену в гомополимере, получаемому посредством полимеризации мономера сложного винилового эфира карбоновой кислоты, или повторяющемуся звену, получаемому из мономера сложного винилового эфира карбоновой кислоты, в сополимере, получаемом посредством сополимеризации мономера винила карбоновой кислоты.
[0045]
Например, плоскую полиэтилентерефталатную мембрану, подлежащую использованию для искусственного кровеносного сосуда и т. д., погружают в водный раствор полимера, и экспонируют излучению, чтобы сшивать и иммобилизовать полимер. С точки зрения подавления адгезии тромбоцитов, концентрация водного раствора полимера предпочтительно составляет 0,01 м. д. или больше, более предпочтительно 0,1 м. д. или больше. Число прилипающих тромбоцитов предпочтительно составляет 20 или меньше, более предпочтительно 10 или меньше, на площадь 4,3×103 мкм2. Число прилипающих тромбоцитов можно измерять с помощью способа, как описано далее. Кроме того, в случае кровяного контура, предпочтительно использовать кровяной контур с полимером, иммобилизованным на внутренней поверхности трубки или тому подобного, которая образует контур, внутренняя поверхность преимущественно находится в контакте с кровью или тому подобным. В катетере, стенте или тому подобном полимер можно иммобилизовать на поверхности (металлического) материала, которая преимущественно находится в контакте с кровью или тому подобным.
[0046]
Кроме того, в качестве способа иммобилизации полимера, содержащего звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, на поверхности подложки, можно использовать образование ковалентной связи посредством химической реакции. Полимер можно иммобилизовать на поверхности подложки, например, посредством проведения реакции реакционноспособной группы, такой как гидроксигруппа, карбоксигруппа, аминогруппа, группа сульфоновой кислоты или алкилгалогенидная группа, на поверхности подложки с реакционноспособной группой, введенной в конец основной цепи или боковой цепи полимера.
[0047]
Примеры способа введения реакционноспособной группы в поверхность подложки включают способ, в котором мономер, имеющий реакционноспособную группу, полимеризуют для получения подложки, которая имеет реакционноспособную группу на своей поверхности; и способ, в котором реакционноспособную группу вводят посредством обработки озоном или обработки плазмой после полимеризации.
[0048]
Примеры способа введения реакционноспособной группы в конец основной цепи полимера включают способ с использованием инициатора, имеющего реакционноспособную группу, например, 2,2'-азобис[2-метил-N-(2-гидроксиэтил)пропионамид] или 4,4'-азобис(4-циановалериановая кислота).
[0049]
Примеры способа введения реакционноспособной группы в боковую цепь полимера включают способ, в котором мономер, имеющий реакционноспособную группу, например, глицидилметакрилат или сложный N-гидроксисукцинимидный эфир метакриловой кислоты, сополимеризуют при условии не затруднения действия/функции полимера.
[0050]
Когда среднечисловая молекулярная масса полимера, содержащего звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, чрезмерно мала, может быть невозможно в достаточной мере проявлять эффект при иммобилизации полимера на поверхности подавляющего адгезию биологического компонента материала, так что может быть сложно подавлять адгезию тромбоцитов и белков, и, следовательно, среднечисловая молекулярная масса предпочтительно составляет 1000 или больше, более предпочтительно 5000 или больше. С другой стороны, верхний предел среднечисловой молекулярной массы полимера конкретно не ограничен, но когда среднечисловая молекулярная масса чрезмерно велика, эффективность введения полимера в поверхность подавляющего адгезию биологического компонента материала может быть снижена, и, следовательно, среднечисловая молекулярная масса предпочтительно составляет 1000000 или меньше, более предпочтительно 500000 или меньше, еще более предпочтительно 100000 или меньше. Среднечисловую молекулярную массу гомополимера или сополимера можно измерять посредством гельпроникающей хроматографии (GPC), как описано далее.
[0051]
Конкретные примеры гомополимера сложного винилового эфира насыщенной алифатической монокарбоновой кислоты включают поливинилпропаноат, поливинилпивалат, поливинилдеканоат и поливинилметоксиацетат, и поливинилпропаноат (число атомов углерода в алифатической цепи составляет 2), поливинилбутилат (число атомов углерода в алифатической цепи составляет 3), поливинилпентаноат (число атомов углерода в алифатической цепи составляет 4), поливинилпивалат (число атомов углерода в алифатической цепи составляет 4) и поливинилгексаноат (число атомов углерода в алифатической цепи составляет 5) являются предпочтительными, поскольку они не обладают чрезмерно высокой гидрофобностью.
[0052]
Мономер для сополимеризации со сложным виниловым эфиром насыщенной алифатической монокарбоновой кислоты конкретно не ограничен, и его примеры включают гидрофобные мономеры, типичными представителями которых являются мономеры на основе алкилметакрилатов, мономеры на основе алкилакрилатов, мономеры на основе стирола и т. п.; и гидрофильные мономеры, типичными представителями которых являются мономеры винилового спирта, мономеры акрилоилморфолина, мономеры на основе винилпиридина, мономеры на основе винилимидазола, мономеры винилпирролидона и т. п. Здесь предпочтительно сополимеризовать гидрофильный мономер с точки зрения управления гидрофильностью всего сополимера. В частности, мономеры, имеющие амидную связь, простую эфирную связь или сложноэфирную связь, являются предпочтительными, поскольку они не обладают чрезмерно высокой гидрофильностью, и их более легко сбалансировать с гидрофобным мономером, по сравнению с мономерами, имеющими карбоксигруппу или группу сульфоновой кислоты. В частности, мономеры винилацетамида, имеющие амидную связь, мономеры винилпирролидона и мономеры винилкапролактама являются более предпочтительными. Среди них мономеры винилпирролидона являются еще более предпочтительными, поскольку полимер имеет низкую токсичность. Примеры сополимера, содержащего сложный виниловый эфир карбоновой кислоты, включают сополимеры винилового спирта/винилпентаноата и сополимеры винилпирролидона/винилгексаноата.
[0053]
Здесь «гидрофильный мономер» определяют как мономер, гомополимер которого легко растворим в воде. Здесь термин «легко растворимый в воде» обозначает, что растворимость в 100 г чистой воды при 20°C составляет больше 1 г, предпочтительно 10 г или больше.
[0054]
С точки зрения подавления адгезии биологических компонентов посредством подавляющего адгезию биологического компонента материала, молярная доля сложного винилового эфира насыщенной алифатической монокарбоновой кислоты во всем сополимере, содержащем сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты, предпочтительно составляет 10% или больше и 90% или меньше, более предпочтительно 20% или больше и 80% или меньше. Когда молярная доля чрезмерно велика, гидрофобность всего сополимера возрастает так, что легко возникает адгезия белков и тромбоцитов. С другой стороны, когда молярная доля чрезмерно мала, гидрофильность всего сополимера может возрастать, вызывая дестабилизацию структуры/денатурацию тромбоцитов и белков, что ведет к возникновению адгезии. В качестве способа вычисления молярной доли осуществляют измерение, например, ядерного магнитного резонанса (ЯМР), и вычисляют молярную долю по площади пика. Когда молярную долю нельзя вычислять посредством измерения ЯМР, поскольку пики перекрывают друг друга, молярную долю можно вычислять посредством элементного анализа.
[0055]
Другие мономеры, например, мономеры, содержащие реакционноспособную группу, такую как гидроксигруппа, карбоксигруппа или глицидиловая группа, можно сополимеризовать при условии не затруднения действия/функции полимера, содержащего сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты.
[0056]
В качестве последовательности звеньев в сополимере, содержащем сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты, можно упомянуть, например, блок-сополимер, чередующийся сополимер, статистический сополимер или тому подобное. Среди них, чередующийся сополимер или статистический сополимер является предпочтительным, поскольку сополимер в целом имеет малое распределение гидрофильности/гидрофобности. В частности, статистический сополимер является более предпочтительным, поскольку синтез не осложнен. Сополимер, в котором по меньшей мере часть мономерной последовательности не упорядочена, является статистическим сополимером.
[0057]
Полимер, содержащий звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, можно синтезировать с помощью способа цепи полимеризации, типичным представителем которого является, например, способ радикальной полимеризации с использованием инициатора на азооснове, но способ синтеза ограничен этим.
[0058]
Полимер, содержащий звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, получают посредством, например, следующего способа получения, но способ получения не ограничен этим.
[0059]
Смешивают мономер сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, полимеризационный растворитель и инициатор полимеризации и смесь смешивают при перемешивании в атмосфер* азота при предварительно определяемой температуре в течение предварительно определяемого периода времени для того, чтобы осуществлять реакцию полимеризации. В случае необходимости, осуществляют сополимеризацию с гидрофильным мономером или гидрофобным мономером. Реакционную жидкость охлаждают до комнатной температуры для того, чтобы останавливать реакцию полимеризации и помещают в растворитель, такой как гексан. Осажденный преципитат извлекают и сушат при пониженном давлении для получения полимера, содержащего звено сложного винилового эфира карбоновой кислоты.
[0060]
Реакционная температура в реакции полимеризации предпочтительно составляет от 30 до 150°C, более предпочтительно от 50 до 100°C, еще более предпочтительно от 70 до 80°C.
[0061]
Давление в реакции полимеризации предпочтительно равно атмосферному давлению.
[0062]
Время реакции в реакции полимеризации надлежащим образом выбирают в соответствии с условиями, такими как реакционная температура, но предпочтительно оно составляет 1 час или больше, более предпочтительно 3 часа или больше, еще более предпочтительно 5 часов или больше. Когда время реакции мало, в полимере может оставаться большое количество не прореагировавшего мономера. С другой стороны, время реакции предпочтительно составляет 24 часа или меньше, более предпочтительно 12 часов или меньше. Когда время реакции велико, побочные реакции, такие как получение образования димеров, могут легко возникать, таким образом затрудняя управление молекулярной массой.
[0063]
Полимеризационный растворитель, подлежащий использованию в реакции полимеризации, конкретно не ограничен до тех пор, пока он представляет собой растворитель, совместимый с мономером, и, например, используют растворитель на основе простого эфира, такой как диоксан или тетрагидрофуран, растворитель на основе амида, такой как N,N-диметилформамид, растворитель на основе сульфоксида, такой как диметилсульфоксид, растворитель на основе ароматического углеводорода, такой как бензол или толуол, растворитель на основе спирта, такой как метанол, этанол, изопропиловый спирт, амиловый спирт или гексанол, вода или тому подобное, но с точки зрения токсичности предпочтительно использовать растворитель на основе спирта или воду.
[0064]
В качестве инициатора полимеризации для реакции полимеризации используют, например, инициатор фотополимеризации или инициатор термической полимеризации. Инициатор полимеризации, который образует любое из радикала, катиона и аниона, можно использовать, но предпочтительно используют радикальный инициатор полимеризации, поскольку он не вызывает разложение мономера. В качестве радикального инициатора полимеризации используют, например, азоинициатор, такой как азобисизобутиронитрил, азобисдиметилвалеронитрил или диметил азобис(изобутират), или пероксидный инициатор, такой как пероксид водорода, бензоилпероксид, ди-трет-бутилпероксид или пероксид дикумила.
[0065]
Растворитель, в который помещают реакцию полимеризации после остановки реакции полимеризации, конкретно не ограничен до тех пор, пока он представляет собой растворитель, в котором преципитируют полимер, и, например, используют растворитель на основе углеводорода, такой как пентан, гексан, гептан, октан, нонан или декан, или растворитель на основе простого эфира, такой как простой диметиловый эфир, простой этилметиловый эфир, простой диэтиловый эфир или простой дифениловый эфир.
[0066]
Полимер, подлежащий использованию в качестве подложки в настоящем изобретении, конкретно не ограничен, и его примеры включают полимеры на основе полисульфонов, полистирол, полиуретан, полиэтилен, полипропилен, поликарбонат, поливинилиденфторид, полиакрилонитрил, полиметилметакрилат, поливинилхлорид и сложный полиэфир. В частности, предпочтительно полимер, подлежащий использованию в качестве подложки, имеет ароматическую группу с точки зрения придания достаточной прочности подавляющему адгезию биологического компонента материалу. В частности, полимер на основе полисульфона предпочтительно используют, поскольку легко формировать плоскую мембрану или половолоконную мембрану, и легко наносить полимер, содержащий звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты,.
[0067]
Иммобилизируемое количество полимера, содержащего звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, на поверхности функционального слоя подавляющего адгезию биологического компонента материала также может представлять собой количественно, определяемое с помощью спектроскопии полного отражения инфракрасного излучения (ATR-IR). При ATR-IR возможно осуществлять измерение для анализа композиции вплоть до глубины в несколько мкм от поверхности.
[0068]
Когда поверхность функционального слоя подавляющего адгезию биологического компонента материала содержит полимер, содержащий звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, пик абсорбции инфракрасного излучения, происходящий из сложноэфирной группы C=O, возникает в диапазоне 1711-1751 см-1. Кроме того, когда подложка состоит из полимера, имеющего ароматическую группу, пик абсорбции инфракрасного излучения, происходящий из ароматической группы C=C, возникает в диапазоне 1549-1620 см-1. В подавляющем адгезию биологического компонента материале по настоящему изобретению предпочтительно пик, присутствующий в диапазоне 1549-1620 см-1, предпочтительно происходит из ароматической группы в полимере на основе полисульфона. Причина, почему полимер на основе полисульфона является предпочтительным, описана ниже.
[0069]
При количественном определении иммобилизируемого на поверхности количества полимера, содержащего звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, посредством ATR-IR, соотношение площади (AC=O) пика абсорбции инфракрасного излучения, происходящего из сложноэфирной группы C=O, при 1711-1751 см-1 и площади (AC=C) пика абсорбции инфракрасного излучения, происходящего из ароматической группы C=C, при 1549-1620 см-1 (AC=O/AC=C) измеряют в трех произвольных местах на поверхности функционального слоя одного подавляющего адгезию биологического компонента материала, и его усредненное значение определяют как иммобилизируемое на поверхности количество полимера.
[0070]
В подавляющем адгезию биологического компонента материале по настоящему изобретению, предпочтительно при ATR-IR измерении поверхности функционального слоя пик присутствует в каждом из двух диапазонов 1711-1751 см-1 и 1549-1620 см-1, и усредненное значение соотношения площади пика AC=O в диапазоне 1711-1751 см-1 и площади пика AC=C в диапазоне 1549-1620 см-1 (AC=O/AC=C) составляет от 0,01 до 1,0. Для достаточного подавления адгезии белков и тромбоцитов к подавляющему адгезию биологического компонента материалу, иммобилизируемое на поверхности количество полимера, содержащего звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, т. е. усредненное значение (AC=O/AC=C) предпочтительно составляет 0,01 или больше, более предпочтительно 0,02 или больше, еще более предпочтительно 0,03 или больше. Верхний предел иммобилизируемого на поверхности количества полимера, содержащего звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, конкретно не ограничен, но когда иммобилизируемое на поверхности количество полимера чрезмерно велико, количество элюата может возрастать и, следовательно, иммобилизируемое на поверхности количество полимера предпочтительно составляет 1,0 или меньше, более предпочтительно 0,9 или меньше, еще более предпочтительно 0,8 или меньше. Любой из предпочтительных нижних пределов можно комбинировать с любым из предпочтительных верхних пределов. Однако когда иммобилизируемое на поверхности количество составляет 0,005 или меньше, значение иммобилизируемого на поверхности количества считают относящимся к шуму и определяют, что отсутствует полимер, содержащий звено сложного винилового эфира карбоновой кислоты.
[0071]
Примеры полимера, имеющего ароматическую группу, включают полимеры на основе полисульфона, полистирол, сложный полиэфир и полиамид. Среди них, предпочтительно используют полимеры на основе полисульфона, поскольку легко формировать плоскую мембрану или половолоконную мембрану и легко наносить полимер, содержащий звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты. Описанный выше способ представляет собой способ количественного определения, где подложкой является полимер, имеющий ароматическую группу, и, когда подложка состоит из другого материала, другой пик можно надлежащим образом выбирать для того, чтобы осуществлять вычисление.
[0072]
Подложка, которая имеет ароматическую группу, в целом имеет высокую гидрофобность и, следовательно, может содержать гидрофильный полимер.
[0073]
Предпочтительно, гидрофильный полимер содержит амидную связь, поскольку она не обладает чрезвычайно высокой гидрофильностью.
[0074]
Примеры гидрофильного полимера, содержащего амидную связь, включают гидрофильные полимеры, получаемые посредством (со)полимеризации винилкапролактама, винилпирролидона, винилацетамида, акриламида или его производного. Среди них предпочтительно используют гидрофильный полимер, получаемый посредством полимеризации винилпирролидона, поскольку он обладает благоприятной формуемостью и прядомостью, с полимером, имеющим ароматическую группу, таким как полимер на основе полисульфона, и также служит в качестве порообразующего средства при формировании половолоконной мембраны.
[0075]
Здесь термин «гидрофильный полимер» определяют как полимер, легко растворимый в воде. Здесь термин «легко растворимый в воде» обозначает, что растворимость в 100 г чистой воды при 20°C составляет больше чем 1 г, предпочтительно 10 г или больше.
[0076]
Присутствие гидрофильного полимера, содержащего амидную связь на поверхности подавляющего адгезию биологического компонента материала, можно подтвердить посредством наблюдения пика в диапазоне 1617-1710 см-1 при ATR-IR измерении. То есть, в подавляющем адгезию биологического компонента материале по настоящему изобретению предпочтительно пик присутствует в диапазоне 1617-1710 см-1 при ATR-IR измерении поверхности функционального слоя. Кроме того, в подавляющем адгезию биологического компонента материале по настоящему изобретению предпочтительно пик в диапазоне 1617-1710 см-1 происходит из амидной связи в гидрофильном полимере, содержащем звено винилпирролидона, звено винилкапролактама, звено винилацетамида или звено акриламида. Причина, по которой предпочтительно пик присутствует в диапазоне 1617-1710 см-1, т. е. содержится амидная связь или амидную связь получают из каждого из указанных выше звеньев, состоит в том, что описано выше.
[0077]
В качестве относительного содержания гидрофильного полимера, содержащего амидную связь на поверхности подавляющего адгезию биологического компонента материала, соотношение площади (AN-C=O) пика, происходящего из амидной связи, и площади (AC=C) пика ароматической группы (AN-C=O/AC=C) измеряют в трех произвольных местах на поверхности функционального слоя одного подавляющего адгезию биологического компонента материала, и его усредненное значение определяют как относительное содержание гидрофильного полимера. Относительное содержание гидрофильного полимера, т. е. усредненное значение (AN-C=O/AC=C), предпочтительно составляет 0,01 или больше, более предпочтительно 0,1 или больше, еще более предпочтительно 0,5 или больше. Кроме того, нет конкретного верхнего предела относительного содержания гидрофильного полимера, когда количество гидрофильных звеньев чрезмерно велико, количество элюата с поверхности подавляющего адгезию биологического компонента материала может возрастать, и, следовательно, усредненное относительное содержание (AN-C=O/AC=C) предпочтительно составляет 50 или меньше, более предпочтительно 10 или меньше, еще более предпочтительно 5 или меньше. Любой из предпочтительных нижних пределов можно комбинировать с любым из предпочтительных верхних пределов. Однако когда усредненное значение (AN-C=O/AC=C) составляет 0,005 или меньше, значение усредненного относительного содержания считают относящимся к шуму, и определяют, что отсутствует гидрофильный полимер, содержащий амидную связь.
[0078]
Кроме того, очиститель крови в соответствии с настоящим изобретением, содержит подавляющий адгезию биологического компонента материал по настоящему изобретению.
[0079]
Например, очиститель крови может представлять собой разделяющую мембрану, формируемую так, что в качестве одного компонент для формирования разделяющей мембраны в качестве одной формы подавляющего адгезию биологического компонента материала, полимер иммобилизуют на поверхности мембраны (в частности, внутренней поверхности, которую часто приводят в контакт с кровью), для подавления адгезии компонентов крови, и разделяющую мембрану заключают в корпус. Формой разделяющей мембраны предпочтительно является половолоконная мембрана с точки зрения эффективности очистки крови.
[0080]
«Использование для очистки крови» обозначает, что продукт используют с целью удаления продуктов обмена и вредных веществ из крови.
[0081]
«Очиститель крови» относится к продукту, имеющему по меньшей мере в своей части медицинский материал, предназначенный для удаления продуктов обмена и вредных веществ из крови посредством циркулирования крови вне организма, и его примеры включают модули искусственной почки и колонки для адсорбции экзотоксинов.
[0082]
Очиститель крови используют, пока он находится в контакте с кровью в течение длительного периода времени, например, приблизительно 4 часа в случае модуля искусственной почки, используемого для лечения хронической почечной недостаточности и 1 от суток до нескольких суток для непрерывной фильтрации крови, используемой для лечения острой почечной недостаточности. Таким образом, происходит адгезия тромбоцитов и белков, что ведет к ухудшению эффективности фракционирования и водопроницаемости. Кроме того, поскольку модуль искусственной почки и непрерывный фильтр крови подвергают фильтрованию изнутри наружу половолоконной мембраны для удаления продуктов обмена и вредных веществ из крови, в частности, легко возникает адгезия тромбоцитов и белков.
[0083]
«Разделяющая мембрана» обозначает мембрану, которая избирательно удаляет конкретное вещество, содержащееся в жидкости, подлежащей обработке, такой как кровь или водный раствор, посредством адсорбции или на основе размера вещества. В качестве способа получения разделяющей мембраны, например, способ, в котором мембрану формируют и затем покрывают полимером, является предпочтительным, и используют способ, в котором полимер в форме раствора (предпочтительно водного раствора) приводят в контакт с поверхностью пленки. Дополнительные конкретные примеры включают способ, в котором раствор полимера пропускают с предварительно определяемой скоростью потока, и способ, в котором мембрану погружают в раствор. Кроме того, также можно упомянуть способ, в котором условия задают с тем, чтобы полимер целенаправленно помещать на поверхность мембраны в способе, в котором полимер добавляют в раствор допанта для формирования мембраны и прядут смесь.
[0084]
Основное сырье разделяющей мембраны предпочтительно представляет собой полимер на основе полисульфона. Здесь «полимер на основе полисульфона» представляет собой полимер, имеющий ароматическое кольцо, сульфонильную группу и группу простого эфира в основной цепи, и его примеры включают полисульфон, полиэфирсульфон и полиарилэфирсульфон. Здесь «основное сырье» обозначает сырье, содержащееся в количестве 90% по массе или больше на основе общего полимера на основе полисульфона.
[0085]
В качестве основного сырья разделяющей мембраны, например, предпочтительно используют полимер на основе полисульфона, представленный химической формулой со следующей формулой (1) и/или (2), но основное сырье разделяющей мембраны не ограничено этим. В формуле n представляет собой целое число, равное 1 или больше, предпочтительно от 30 до 100, более предпочтительно от 50 до 80. Когда n имеет некоторое распределение, усредненное значение распределения определяют как n.
[0086]
[Химическая формула 1]
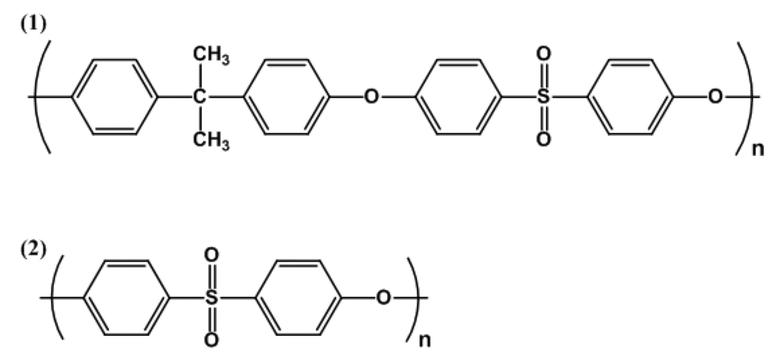
[0087]
[В формуле n представляет целое число, равное 1 или больше.]
Полимер на основе полисульфона, который можно использовать для модуля разделяющей мембраны, предпочтительно представляет собой полимер, состоящий только из повторяющегося звена, представленного формулой (1) и/или (2), но может представлять собой сополимер, получаемый сополимеризацией с мономером, отличным от мономера, получаемого из повторяющегося звена, представленного формулой (1) и/или (2), или его модифицированным продуктом. Соотношение сополимеризации указанного выше другого мономера в сополимере, получаемом сополимеризацией с указанным выше другим мономером, предпочтительно составляет 10% по массе или меньше на основе общего полимера на основе полисульфона.
[0088]
Примеры полимера на основе полисульфона, которые можно использовать для модуля разделяющей мембраны, включают полимеры на основе полисульфона, такие как Udel Polysulfone P-1700 и P-3500 (производства Solvay), Ultrason (зарегистрированный товарный знак) S3010 и S6010 (производства BASF SE), VICTREX (производства Sumitomo Chemical Co., Ltd.), Radel (зарегистрированный товарный знак) A (производства Solvay) и Ultrason (зарегистрированный товарный знак) E (производства BASF SE).
[0089]
Существуют различные способы получения модуля разделяющей мембраны, в зависимости от использования модуля разделяющей мембраны, и в качестве одного их аспекта, способ можно разделять на стадию получения разделяющей мембраны и стадию встраивания разделяющей мембраны в модуль. При получении модуля разделяющей мембраны, обработку посредством экспонирования излучению можно осуществлять перед стадией встраивания разделяющей мембраны в модуль, или можно осуществлять после стадии встраивания разделяющей мембраны в модуль. Когда модуль разделяющей мембраны в настоящем изобретении представляет собой модуль разделяющей мембраны для медицинского использования, предпочтительно осуществлять обработку облучением γ-лучами в качестве обработки экспонированием излучению после стадии встраивания разделяющей мембраны в модуль, поскольку одновременно можно осуществлять стерилизацию.
[0090]
Описан один из примеров способа получения модуля половолоконной мембраны, подлежащего использованию в очистителе крови.
[0091]
Примеры способа получения половолоконной мембраны для встраивания в очиститель крови включают следующий способ. А именно, полисульфон и поливинилпирролидон (массовое соотношение предпочтительно от 20:1 до 1:5, более предпочтительно от 5:1 до 1:1) растворяют в смешанном растворителе из хорошего растворителя (предпочтительно N,N-диметилацетамида, диметилсульфоксида, N,N-диметилформамида, N-метилпирролидона, диоксана или тому подобного) и плохого растворителя (предпочтительно воды, этанола, метанола, глицерина или тому подобного) для полисульфона, чтобы получать раствор допанта (концентрация предпочтительно от 10 до 30% по массе, более предпочтительно от 15 до 25% по массе), и, во время выгрузки раствора допанта из фильеры в форме двойного кольца, текучее вещество просвета подают во внутреннюю часть, и раствор допанта пропускают через сухую секцию и затем направляют в коагуляционную ванну. Здесь, поскольку влажность сухой секции влияет на раствор допанта, протекание разделения фаз вблизи внешней поверхности ускоряют посредством подачи влаги с внешней поверхности мембраны во время прохождения сухой секции, чтобы можно было увеличивать диаметр поры, что ведет к снижению сопротивления проникновению/диффузии при диализе. Однако когда относительная влажность чрезмерно высока, коагуляция раствора допанта на внешней поверхности преобладает, так что диаметр поры склонен скорее к уменьшению, что ведет к увеличению сопротивления проникновению/диффузии при диализе. Следовательно, относительная влажность предпочтительно составляет от 60 до 90%. Кроме того, предпочтительно использовать текучее вещество просвета, имеющее композицию на основе растворителя, используемую для раствора допанта с точки зрения технологической пригодности. Например, когда используют N,N-диметилацетамид, используют водный раствор с концентрацией текучего вещества просвета предпочтительно от 45 до 80% по массе, более предпочтительно от 60 до 75% по массе.
[0092]
Здесь хороший растворитель обозначает растворитель, в котором целевой полимер растворим в количестве 10% по массе или больше при 20°C. Плохой растворитель обозначает растворитель, в котором целевой полимер растворим в количестве меньше чем 10% по массе при 20°C.
[0093]
Способ встраивания половолоконной мембраны в модуль конкретно не ограничен, и его примеры включают следующий способ. Сначала половолоконную мембрану обрезают до необходимой длины, и формируют пучок из необходимого числа кусков, который помещают в цилиндрический корпус. Затем закрывают оба конца временно и помещают заливочное средство на оба конца половолоконной мембраны. Здесь способ, в котором заливочное средство помещают, пока модуль вращают с использованием центрифуги, представляет собой предпочтительный способ, поскольку заливочное средство набивают единообразно. После отвердевания заливочного средства, половолоконную мембрану режут с обеих концевых частей с тем, чтобы открывать с обоих концов, чтобы получать модуль половолоконной мембраны.
[0094]
Полимер на основе полисульфона, используемый в качестве основного сырья половолоконной мембраны, в целом имеет высокую гидрофобность, и, следовательно, когда полимер на основе полисульфона используют в качестве половолоконной мембраны как он есть, легко возникает адгезия органических веществ, таких как белки. Таким образом, предпочтительно используют половолоконную мембрану, в которой полимер, содержащий звено сложного эфира карбоновой кислоты, иммобилизуют на поверхности функционального слоя. В частности, с точки зрения усовершенствования гидрофильности поверхностного функционального слоя, предпочтительно используют полимер, содержащий звено сложного эфира карбоновой кислоты, сополимеризованное с гидрофильным звеном. Примеры способа введения полимер в поверхность функционального слоя включают способ, в котором раствор полимера приводят в контакт с половолоконной мембраной в модуле: и способ, в котором во время прядения половолоконной мембраны, текучее вещество просвета, содержащее полимер, приводят в контакт со внутренней частью половолоконной мембраны.
[0095]
Когда водный раствор полимера, содержащего звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, подают через половолоконную мембрану в модуль и вводят в поверхность, достаточное количество полимера не вводят в поверхность, когда концентрация полимера в водном растворе чрезмерно мала. Следовательно, концентрация полимера в водном растворе предпочтительно составляет 10 м. д. или больше, более предпочтительно 100 м. д. или больше, еще более предпочтительно 300 м. д. или больше. Когда концентрация полимера в водном растворе чрезмерно велика, количество элюата из модуля может возрастать, и, следовательно, концентрация полимера в водном растворе предпочтительно составляет 100000 м. д. или меньше, более предпочтительно 10000 м. д. или меньше.
[0096]
Когда полимер, содержащий звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, не растворяют в воде в предварительно определяемой концентрации, полимер можно растворять в смешанном растворителе из воды и органического растворителя, в котором половолоконная мембрана нерастворима, или органическом растворителе, который совместим с водой и в котором половолоконная мембрана не растворима. Примеры органического растворителя, который можно использовать для органического растворителя или смешанного растворителя, включают, но не ограничиваясь этим, растворители на основе спирта, такие как метанол, этанол и пропанол.
[0097]
Кроме того, когда соотношение органического растворителя в смешанном растворителе возрастает, половолоконная мембрана может набухать, что ведет к снижению прочности. Следовательно, массовая доля органического растворителя в смешанном растворителе предпочтительно составляет 60% или меньше, более предпочтительно 10% или меньше, еще более предпочтительно 1% или меньше.
[0098]
Кроме того, с точки зрения усовершенствования гидрофильности половолоконной мембраны в целом, предпочтительно смешивают полимер на основе полисульфона и полимер, содержащий гидрофильное звено, и смесь прядут.
[0099]
Для того чтобы предотвращать элюирование полимера, содержащего введенное звено сложного винилового эфира карбоновой кислоты, во время использования, предпочтительно, после введения в поверхность подавляющего адгезию биологического компонента материала, полимер подвергают экспонированию излучению или термической обработке, чтобы сделать его нерастворимым, чтобы иммобилизовать полимер на поверхности подавляющего адгезию биологического компонента материала.
[0100]
Для экспонирования излучению можно использовать α-лучи, β-лучи, γ-лучи, рентгеновские лучи, ультрафиолетовые лучи, электронный пучок или тому подобное. Здесь очистители крови, такие как искусственные почки, подлежат обязательной стерилизации перед отгрузкой, и в последние годы способ стерилизации излучением с использованием γ-лучей или электронных пучков интенсивно используют с точки зрения низкой остаточной токсичности и удобства. Следовательно, предпочтительно используют способ стерилизации излучением, пока водный раствор, в котором растворяют полимер для использования в настоящем изобретении, находится в контакте с половолоконной мембраной в медицинском модуле разделяющей мембраны, поскольку нерастворимости полимера можно достичь параллельно со стерилизацией.
[0101]
Когда половолоконную мембрану стерилизуют и преобразуют одновременно в подавляющем адгезию биологического компонента материале, доза облучения излучением предпочтительно составляет 15 кГр или больше, более предпочтительно 25 кГр или больше. Это обусловлено тем, что доза облучения 15 кГр или больше эффективна для стерилизации модуля очистки крови или тому подобного с использованием γ-лучей. Кроме того, доза облучения предпочтительно составляет 100 кГр или меньше. Это обусловлено тем, что когда доза облучения составляет больше чем 100 кГр, полимер может легко подвергаться трехмерной сшивке, разложению фрагмента сложноэфирной группы в звене сложного винилового эфира карбоновой кислоты или тому подобному, что ведет к ухудшению совместимости с кровью.
[0102]
Антиоксидант можно использовать для подавления реакции сшивания при экспонировании излучению. Антиоксидант обозначает вещество, которое обладает свойством легко отдавать электроны другим молекулам, и его примеры включают, но не ограничиваясь этим, водорастворимые витамины, такие как витамин C, полифенолы и растворители на основе спиртов, такие как метанол, этанол и пропанол. Эти антиоксиданты можно использовать по отдельности или в комбинации из двух или больше из них. Когда антиоксидант используют для медицинского модуля разделяющей мембраны, необходимо принимать во внимание безопасность и, следовательно, предпочтительно используют антиоксидант, обладающий низкой токсичностью, такой как этанол или пропанол.
[0103]
В очистителе крови, таком как модуль искусственной почки, может происходить не только ухудшение эффективности фракционирования и проницаемости из-за адгезии белков и тромбоцитов, но также может быть невозможно продолжать экстракорпоральную циркуляцию, поскольку кровь не может течь в половолоконную мембрану из-за свертывания крови. В пределах 60 минут после приведения мембраны в контакт с кровью наступает заметная адгезия тромбоцитов и белков на внутренней части половолоконной мембраны, и, следовательно, эффективность половолоконной мембраны можно оценивать посредством измерения относительного количества адгезии фибриногена на внутренней поверхности половолоконной мембраны после циркуляции крови в течение 60 минут.
[0104]
Говорят, что свертывание крови и активация компонентов крови начинается с адгезии фибриногена на поверхности подавляющего адгезию биологического компонента материала в качестве начальной точки, т. е. можно говорить, что чем меньше количество адгезии фибриногена, тем вывшее антитромбогенность подавляющего адгезию биологического компонента материала.
[0105]
В настоящем изобретении, количество адгезии фибриногена на половолоконной мембране можно измерять способом, как описано далее. Для того чтобы предотвращать зависящие от крови вариации количества адгезии фибриногена, измерение половолоконной мембраны в искусственной почке «Toraylight» CX производства Toray Industries, Inc. осуществляют параллельно в качестве контроля и вычисляют количество адгезии относительно контроля.
[0106]
В настоящем изобретении, фраза «обладающий антитромбогенностью» обозначает, что относительное количество адгезии фибриногена составляет 90% или меньше, предпочтительно 55% или меньше. С точки зрения подавления свертывания крови и активации компонентов крови, относительное количество адгезии фибриногена на подавляющем адгезию биологического компонента материале предпочтительно составляет 25% или меньше, более предпочтительно 20% или меньше, еще более предпочтительно 15% или меньше.
[0107]
С другой стороны, подавляющий адгезию биологического компонента материал по настоящему изобретению также можно использовать для разделяющих материалов и аналитических материалов. Примеры разделяющего материала включают разделяющие мембраны для очистки антител. Разделяющую мембрану для очистки антител используют для удаления примесей, таких как нежелательные белки, чтобы очищать антитела, такие как IgG, IgM, IgA, IgD и IgE от сыворотки, асцита или среды клеточной культуры, и она имеет такую проблему, что антитела прилипают к поверхности разделяющей пленки, что ведет к снижению степени восстановления. Используя подавляющий адгезию биологического компонента материал по настоящему изобретению, можно подавлять снижение степени восстановления. Например, при очистке IgG, степень восстановления зависит от способа использования разделяющей мембраны, но предпочтительно составляет 50% или больше, более предпочтительно 55% или больше, еще более предпочтительно 60% или больше с точки зрения стоимости.
[0108]
Примеры аналитического материала включают датчики уровня глюкозы крови. Датчик уровня глюкозы крови измеряет концентрацию глюкозы в текучем веществе организма, таком как сыворотка, и имеет такую проблему, что белки в текучем веществе организма прилипают к поверхности чувствительного элемента так, что невозможно распознавать глюкозу, что ведет к снижению чувствительности. Используя подавляющий адгезию биологического компонента материал по настоящему изобретению, можно подавлять снижение чувствительности.
ПРИМЕРЫ
[0109]
Настоящее изобретение проиллюстрировано далее со ссылкой на примеры, но следует понимать, что настоящее изобретение не рассматривают как ограниченное ими.
<Способ оценки>
(1) Среднечисловая молекулярная масса
Получали 0,1 Н раствор LiNO3 в воде/метаноле=50/50 (объемное соотношение) и использовали в качестве раствор для проявки GPC. 2 мг полимера растворяли в 2 мл этого раствора. 100 мкл раствора полимера впрыскивали в GPC, соединенную с колонкой (Tosoh GMPWXL). Скорость потока составляла 0,5 мл/мин и время измерения составляло 30 минут. Обнаружение осуществляли с использованием дифференциального детектора показателя преломления RID-10A (производства Shimadzu Corporation) и вычисляли среднечисловую молекулярную массу по пику, происходящему из полимера, который появлялся при времени элюирования приблизительно 15 минут. Среднечисловую молекулярную массу вычисляли с округлением до десятичного разряда десятых долей. Стандартный образец полиэтиленоксида (от 0,1 кДа до 1258 кДа) производства Agilent Company использовали для получения калибровочной кривой.
(2) Молярная доля звена сложного винилового эфира карбоновой кислоты
2 мг сополимера растворяли в 2 мл хлороформа-D (99,7%) (Wako Pure Chemical Industries, Ltd., 0,05 об./об. %, с TMS) и раствор добавляли в пробирку для ЯМР образцов и проводили измерение ЯМР (сверхпроводящий FTNMR EX-270: производства JEOL Ltd.). Температура равна комнатной температуре и совокупное число составляло 32. По результату этого измерения вычисляли значение AVC/(APVP+AVC)×100 в качестве молярной доли звена сложного винилового эфира карбоновой кислоты, где площадь области, окруженной базовой линией, и пик, наблюдаемый в диапазоне от 2,7 до 4,3 м. д. и получаемый из протона (3H), связанного с атомом углерода смежно с атомом азота в винилпирролидоне, представляет собой 3APVP, а площадь области, окруженной базовой линией, и пик, наблюдаемый в диапазоне от 4,3 до 5,2 м. д. и получаемый из протона (1H), связанного с углеродом в α-положении в сложном виниловом эфире карбоновой кислоты, представляет собой AVC. Этот способ является примером измерения молярной доли в сополимере винилпирролидона и сложного винилового эфира карбоновой кислоты, и в случае сополимера, содержащего комбинацию других мономеров, выбирают подходящий пик, происходящий из протона, и определяют молярную долю. Молярную долю вычисляли с округлением до единиц.
(3) Измерение TOF-SIMS
В случае половолоконной мембраны, мембрану обрезали и разрезали на полуцилиндрические формы с одним краем и осуществляли измерение в трех различных местах на поверхности (внутренняя поверхность) функционального слоя половолоконной мембраны. В случае мембраны, отличной от половолоконной мембраны, такой как плоская мембрана, поверхность функционального слоя экспонировали в случае необходимости и осуществляли измерение в трех различных местах на поверхности функционального слоя. Измеряемый образец споласкивали ультрачистой водой, затем сушили при комнатной температуре и 0,5 торр в течение 10 часов, и затем подвергали измерению. Использовали следующие измерительный аппарат и условия.
Измерительный аппарат: TOF. SIMS 5 (производства ИОН-TOF Company)
Первичный ион: Bi3++
Напряжение ускорения первичного иона: 30 кВ
Ширина импульса: 5,9 нс
Полярность вторичного иона: отрицательная
Число сканирований: 64 сканирования/цикл
Время цикла: 140 мкс
Диапазон измерения: 200×200 мкм2
Диапазон масс (m/z): от 0 до 1500
По получаемому спектру масс m/z проверяли, присутствуют или нет ионы карбоновой кислоты на поверхности подавляющего адгезию биологического компонента материала. Когда ионная сила карбоновой кислоты составляет 0,4% или меньше на основе общей вторичной ионной силы, значение ионной силы карбоновой кислоты считают относящимся к шуму и определяют, что карбоновая кислота отсутствует.
(4) Измерение рентгеновской электронной спектроскопии (XPS)
В случае половолоконной мембраны, мембрану обрезали и разрезали на полуцилиндрические формы с одной краевой кромкой и осуществляли измерение в двух различных местах на поверхности (внутренней поверхности) функционального слоя половолоконной мембраны. В случае мембраны, отличной от половолоконной мембраны, такой как плоская мембрана, поверхность функционального слоя экспонировали в случае необходимости, и осуществляли измерение в двух различных местах на поверхности функционального слоя. Измеряемый образец споласкивали ультрачистой водой, затем сушили при комнатной температуре и 0,5 торр в течение 10 часов и затем подвергали измерению. Использовали следующие измерительный аппарат и условия.
[0110]
Измерительный аппарат: ESCALAB 220i XL (производства VG Corporation)
Возбужденный рентгеновский луч: монохроматический Al Kα 1,2 Гр (1486,6 эВ)
Диаметр рентгеновского луча: 0,15 мм
Угол вылета фотоэлектронов: 90° (наклон детектора относительно поверхности образца)
Пик C1s состоит из пяти компонентов: компонента, получаемого преимущественно из CHx, C-C, C=C или C-S, компонента, получаемого преимущественно из C-O или C-N, компонента, получаемого из π-π* сателлита, компонента, получаемого из C=O, и компонента, получаемого из COO. Вышеуказанные пять компонентов образуются делением пика. Компонент, получаемый из COO, представляет собой пик, возникающий при от+4,0 до 4,2 эВ из основного пика CHx или C-C (приблизительно 285 эВ). Соотношение площадей пиков каждого компонента вычисляли с округлением до второго десятичного разряда. Когда процентная доля площади пика составляла 0,4% или меньше в результате деления пика, пик считали неподдающимся обнаружению.
(5) ATR-IR измерение
Половолоконную мембрану обрезали и разрезали на полуцилиндрические формы с одной краевой кромкой, споласкивали ультрачистой водой и затем сушили при комнатной температуре и 0,5 торр в течение 10 часов для того, чтобы получать образец для измерения поверхности. В случае мембраны, отличной от половолоконной мембраны, такой как плоская мембрана, поверхность функционального слоя экспонировали в случае необходимости, споласкивали ультрачистой водой и затем сушили при комнатной температуре и 0,5 торр в течение 10 часов для того, чтобы получать образец для измерения поверхности. Поверхность функционального слоя высушенного образца измеряли способом микроскопической ATR с использованием IRT-3000 производства JASCO Corporation. Измерение осуществляли с видимым полем (апертурой), установленным на 100 мкм × 100 мкм, диапазоном измерений, установленным на 3 мкм × 3 мкм и совокупным числом, установленным на 30. Эталонную линию проводили на длине волны 1549-1620 см-1 в получаемом спектре, и площадь части, окруженной эталонной линией и положительной частью спектра, определяли как площадь (AC=C) пика, происходящего из ароматической группы C=C из полисульфона. Аналогичным образом, эталонную линию проводили на 1711-1751 см-1, и площадь части, окруженной эталонной линией и положительной частью спектра, определяли как площадь (AC=O) пика, происходящего из сложноэфирной группы. Однако в зависимости от типа звена сложного винилового эфира карбоновой кислоты и типа полимера на основе полисульфона, пик может смещаться приблизительно на±10 см-1, и в этом случае эталонную линию проводят повторно, в зависимости от ситуации.
Указанную выше операцию осуществляли посредством выполнения измерения в трех различных местах на одной и той же половолоконной мембране и вычисления усредненного значения (AC=O/AC=C), и использовали значение, получаемое округлением усредненного значения до третьего десятичного разряда.
Кроме того, эталонную линию проводили на пике 1617-1710 см-1, и площадь части, окруженной эталонной линией и положительной частью спектра, определяли как площадь (AN-C=O) пика, происходящего из сложноэфирной группы. Указанную выше операцию осуществляли посредством выполнения измерения в трех различных местах на одной и той же половолоконной мембране и вычисления усредненного значения (AN-C=O/AC=C), и использовали значение, получаемое округлением усредненного значения до третьего десятичного разряда.
(6) Способ тестирования адгезии тромбоцитов к плоской мембране
Двустороннюю ленту прикрепляли к круглой полистироловой пластине диаметром 18 мм, и фиксировали на ней плоскую мембрану, обрезанную до 0,5 см квадрата. Когда поверхность плоской мембраны имеет контаминанты, царапины, складки и т. п., может быть невозможно осуществлять точную оценку, поскольку тромбоциты прилипают к этим частям. Следовательно, использовали плоскую мембрану, не содержащую контаминанты, царапины и складки. Круглую пластину прикрепляли к цилиндрически обрезанной пробирке Falcon (зарегистрированный товарный знак) (18 мм диаметром, № 2051) таким образом, что поверхность, связанную с плоской мембраной, помещали внутри цилиндра, и пропуск заполняли Parafilm. Внутреннюю часть цилиндрической пробирки промывали физиологическим солевым раствором и затем заполняли физиологическим солевым раствором. Брали венозную кровь человека и затем незамедлительно добавляли гепарин до 50 Ед/мл. Физиологический солевой раствор из цилиндрической пробирки выбрасывали, затем в цилиндрическую пробирку помещали 1,0 мл крови и встряхивали при 37°C в течение 1 часа в пределах 10 минут после взятия крови. После этого плоскую мембрану промывали в 10 мл физиологического солевого раствора, иммобилизовали компоненты крови с использованием физиологического солевого раствора с 2,5% глутаральдегидом и промывали плоскую мембрану в 20 мл дистиллированной воды. Промытую плоскую мембрану сушили при пониженном давлении и 20°C и 0,5 торр в течение 10 часов. Плоскую мембрану прикрепляли к стойке для образца в сканирующем электронном микроскопе двусторонней лентой. После этого распылением формировали тонкую мембрану Pt-Pd на поверхности плоской мембраны для того, чтобы получать образец. Поверхность плоской мембраны наблюдали с использованием полевого эмиссионного сканирующего электронного микроскопа (S800 производства Hitachi, Ltd.) при увеличении 1500× и считали число прилипающих тромбоцитов в видимом поле (4,3×103 мкм2). Когда прилипало 50 тромбоцитов или больше, число прилипающих тромбоцитов принимали равным 50 и решали, что мембрана не обладает эффектом подавления адгезии тромбоцитов. Усредненное число прилипающих тромбоцитов в 20 различных видимых полях вблизи центра плоской мембраны определяли в качестве числа прилипающих тромбоцитов (число/4,3×103 мкм2). Когда используют электронный микроскоп с другой площадью видимого поля, можно надлежащим образом выполнять преобразование с тем, чтобы получать число прилипающих тромбоцитов (число/4,3×103 мкм2).
(7) Измерение относительного количества адгезии фибриногена
4 мл свежей крови человека, содержащей 15% раствор ACD-A, пропускали через модуль половолоконной мембраны при скорости потока 1 мл/мин в течение 1 часа. Модуль половолоконной мембраны промывали в течение 20 минут посредством подачи раствора фосфатного буфера (PBS) через него, затем отрезали 10 см полого волокна от минимодуля и наконец отрезали отрезок приблизительно 2 мм и помещали в пробирку Eppendorf. Промывание осуществляли с использованием PBS (1 мл × 3 раза, промывание повторяли, когда оставалась кровь). Tween-20 (Katayama Chemical., Ltd) корректировали до 0,05% по массе с использованием PBS (далее в настоящем описании сокращенно PBS-T). Снятое молоко растворяли в PBS-T в концентрации 0,1% по массе и три раза осуществляли промывание раствором. Антитело против фибриногена человека (HPR) разводили в 10000 раз с использованием 0,1% по массе раствора снятого молока/PBS-T, добавляемого в количестве 1 мл, и затем поворачивали и перемешивали на вращателе при комнатной температуре в течение 2 часов. Промывание осуществляли два раза в 0,1% по массе растворе снятого молока/PBS-T, после чего следовало промывание два раза в 0,1% по массе растворе снятого молока/PBS. Добавляли 1 мл раствора TMBone и перемешивали на микросмешивателе. Реакцию останавливали посредством добавления 200 мкл 6 Н соляной кислоты с учетом степени развития окраски (реакцией управляют с тем, чтобы поглощение в контроле, как описано далее, попадало в диапазон от 1 до 1,5). Поглощение при 450 нм измеряли с использованием аппарата для измерения поглощения: считыватель микропланшетов MPR-A4i (производства Tosoh Corporation). По поглощению (Ac) контроля («Toraylight» CX) и поглощению (As) целевого образца определяли относительное количество адгезии фибриногена в соответствии со следующей формулой.
Относительное количество адгезии (%)фибриногена=As/Ac × 100
Когда относительное количество адгезии фибриногена измеряют для мембраны, отличной от половолоконной мембраны, 4 мл свежей крови человека приводят в контакт с функциональным слоем образца в течение 1 часа с помощью такого способа, как погружение в кровь, и образец промывают с использованием раствора фосфатного буфера (PBS). После этого поглощение измеряют аналогичным образом, как в случае половолоконной мембраны, и вычисляют относительное количество адгезии фибриногена. Для контроля используют материал перед иммобилизацией полимера, содержащий звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, на функциональном слое.
(8) Способ модельного тестирования очистки антитела
Получали 10 мл плазмы человека, содержащей 100 мг IgG (получают из сыворотки человека, Oriental Yeast Co., Ltd.) и пропускали через модуль разделяющей мембраны для очистки антител в течение 1 часа при скорости потока 3 мл/мин и скорости потока фильтрования 1,5 мл/мин при скорости потока подачи PBS 1,5 мл/мин. Внутреннюю поверхность разделяющей мембраны промывали в 5 мл PBS, и раствор добавляли в плазму после циркуляции для получения восстанавливающего раствора. Степень восстановления IgG вычисляли как (масса IgG, содержащегося в восстанавливающем растворе)/(масса IgG, содержащегося в начальной плазме) × 100%. Массу IgG вычисляли посредством измерения концентрации IgG с использованием набора для ELISA (производства Funakoshi Co., Ltd.) и умножения значения количества раствора.
[0111]
<Способ получения модуля половолоконной мембраны>
18 массовых частей полисульфона (Udel P-3500 производства Teijin Amoco Co., Ltd.) и 9 массовых частей поливинилпирролидона (K30 производства BASF SE) добавляли к 72 массовым частям N,N-диметилацетамида и 1 массовой части воды, и смесь нагревали при 90°C в течение 14 часов до растворения. Раствор допанта для формирования пленки выгружали из двойной цилиндрической фильеры с отверстием, имеющей внешний диаметр 0,3 мм и внутренний диаметр 0,2 мм, раствор, содержащий 57,5 массовой части N,N-диметилацетамида и 42,5 массовой части воды, выгружали в качестве текучего вещества сердцевины, и, после пропускания раствора через сухой отрезок 350 мм, раствор направляли в коагуляционную ванну со 100% водой, чтобы получать половолоконную мембрану. Получаемая половолоконная мембрана имела внутренний диаметр 200 мкм и толщину 40 мкм. 50 половолоконных мембран вставляли в пластмассовую трубку и пластмассовую трубку фиксировали по обоим концам адгезивом для того, чтобы получать пластмассовый трубчатый минимодуль, имеющий эффективную длину 100 мм. Водный раствор с полимером, растворенным в нем, подавали от стороны впуска крови к стороне впуска диализата в минимодуле. Кроме того, 0,1% масс. водный раствор этанола подавали от стороны впуска крови к стороне впуска диализата и от стороны впуска крови к стороне выпуска крови модуля половолоконной мембраны, и затем применяли γ-лучи 25 кГр для получения модуля половолоконной мембраны.
(Пример 1)
Статистический сополимер винилпирролидона/винилгексаноата получали следующим способом. Смешивали 16,2 г мономера винилпирролидона (Wako Pure Chemical Industries, Ltd.), 20,8 г мономера винилгексаноата (Tokyo Chemical Industry Co., Ltd.), 56 г изопропанола (Wako Pure Chemical Industries, Ltd.) в качестве полимеризационного растворителя и 0,35 г азобисдиметилбутиронитрила в качестве инициатора полимеризации, и смесь перемешивали при 70°C в течение 8 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры, концентрировали и концентрированный остаток помещали в гексан. Осажденный белый преципитат собирали и сушили при пониженном давлении и 50°C в течение 12 часов для получения 25,0 г статистического сополимера винилпирролидона/винилгексаноата. Результаты измерения 1H-ЯМР показывали, что молярная доля звена винилгексаноата составляла 40%. Результат измерения GPC показывал, что среднечисловая молекулярная масса составляла 2200.
[0112]
1,0% масс. водный раствор этанола с 300 м. д. полученного статистического сополимера винилпирролидона/винилгексаноата, растворенного в нем, подавали от стороны впуска крови к стороне впуска диализата модуля половолоконной мембраны, полученного с помощью способа получения модуля половолоконной мембраны. Кроме того, 0,1% масс. водный раствор этанола подавали от стороны впуска крови к стороне впуска диализата и от стороны впуска крови к стороне выпуска крови модуля половолоконной мембраны, и затем применяли γ-лучи 25 кГр для того, чтобы получать модуль половолоконной мембраны.
[0113]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир гексановой кислоты присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1711-1751 см-1, 1617-1710 см-1 и 1549-1620 см-1. Результат ATR-IR измерения показывал, что количество сополимера, иммобилизованного на внутренней поверхности половолоконной мембраны, (усредненное значение соотношения площади AC=O пика в диапазоне 1711-1751 см-1 и площади AC=C пика в диапазоне 1549-1620 см-1 (AC=O/AC=C)) составляло 0,03. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны. Результат измерения показывал, что относительное количество адгезии составляло 12%, как показано в таблице 1.
(Пример 2)
Модуль половолоконной мембраны получали аналогичным образом, как в примере 1, за исключением того, что концентрацию сополимера во время получения модуля половолоконной мембраны меняли с 300 м. д. на 500 м. д.
[0114]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир гексановой кислоты присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1711-1751 см-1, 1617-1710 см-1 и 1549-1620 см-1. Результат ATR-IR измерения показывал, что количество сополимера, иммобилизованного на внутренней поверхности половолоконной мембраны, (усредненное соотношение площади AC=O пика в диапазоне 1711-1751 см-1 и площади AC=C пика в диапазоне 1549-1620 см-1 (AC=O/AC=C)) составляло 0,08. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны. Результат измерения показывал, что относительное количество адгезии составляло 7%, как показано в таблице 1.
(Пример 3)
Статистический сополимер винилпирролидона/винилпропаноата получали следующим способом. Смешивали 19,5 г мономера винилпирролидона, 17,5 г мономера винилпропионата, 56 г т-амилового спирта в качестве полимеризационного растворителя и 0,175 г 2,2'-азобис(2,4-диметилвалеронитрила) в качестве инициатора полимеризации и смесь перемешивали при 70°C в течение 6 часов. Реакционную жидкость охлаждали до комнатной температуры для того, чтобы останавливать реакцию, концентрировали и затем помещали в гексан. Осажденный белый преципитат собирали и сушили при пониженном давлении для получения 21,0 г сополимера.
[0115]
Результат измерения 1H-ЯМР показывал, что молярная доля звена винилпропаноата составляла 40%. Кроме того, результат измерения GPC показывал, что среднечисловая молекулярная масса составляла 16500.
[0116]
Модуль половолоконной мембраны получали аналогичным образом, как в примере 1, за исключением того, что статистический сополимер винилпирролидона/винилпропаноата использовали вместо статистического сополимера винилпирролидона/винилгексаноата.
[0117]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир пропановой кислоты присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1711-1751 см-1, 1617-1710 см-1 и 1549-1620 см-1. Количество сополимера, иммобилизованного на внутренней поверхности половолоконной мембраны, (усредненное соотношение площади AC=O пика в диапазоне 1711-1751 см-1 и площади AC=C пика в диапазоне 1549-1620 см-1 (AC=O/AC=C)) составляло 0,06. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны. Результат измерения показывал, что относительное количество адгезии составляло 5%, как показано в таблице 1.
(Пример 4)
Модуль половолоконной мембраны получали аналогичным образом, как в примере 1, за исключением того, что статистический сополимер винилпирролидона/винилвалерата (молярная доля звена винилвалерата: 40%, среднечисловая молекулярная масса: 3900) использовали вместо статистического сополимера винилпирролидона/винилгексаноата.
[0118]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир валериановой кислоты присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1711-1751 см-1, 1617-1710 см-1 и 1549-1620 см-1. Количество сополимера, иммобилизованного на внутренней поверхности половолоконной мембраны, (усредненное соотношение площади AC=O пика в диапазоне 1711-1751 см-1 и площади AC=C пика в диапазоне 1549-1620 см-1 (AC=O/AC=C)) составляло 0,02. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны, и результат показывал, что относительное количество адгезии составляло 25%, как показано в таблице 1.
(Пример 5)
Модуль половолоконной мембраны получали аналогичным образом, как в примере 1, за исключением того, что 100 м. д. статистического сополимера винилацетамида/винилпивалата (молярная доля звена винилпивалата: 50%, среднечисловая молекулярная масса: 7700) использовали вместо 300 м. д. статистического сополимера винилпирролидона/винилгексаноата.
[0119]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир пивалевой кислоты присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1711-1751 см-1, 1617-1710 см-1 и 1549-1620 см-1. Количество сополимера, иммобилизованного на внутренней поверхности половолоконной мембраны, (усредненное соотношение площади AC=O пика в диапазоне 1711-1751 см-1 и площади AC=C пика в диапазоне 1549-1620 см-1 (AC=O/AC=C)) составляло 0,06. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны, и результат показывал, что относительное количество адгезии составляло 9%, как показано в таблице 1.
(Сравнительный пример 1)
Модуль половолоконной мембраны получали аналогичным образом, как в примере 1, за исключением того, что поливинилпирролидон («K90» производства BASF SE) использовали вместо статистического сополимера винилпирролидона/винилгексаноата.
[0120]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир карбоновой кислоты не присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1617-1710 см-1 и 1549-1620 см-1, но пик не присутствовал в диапазоне 1711-1751 см-1. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны. Результат измерения показывал, что относительное количество адгезии составляло 90%, как показано в таблице 1.
(Сравнительный пример 2)
Модуль половолоконной мембраны получали аналогичным образом, как в примере 1, за исключением того, что статистический сополимер винилпирролидона/винилацетата («Kollidon VA64» производства BASF SE) использовали вместо статистического сополимера винилпирролидона/винилгексаноата. Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир уксусной кислоты присутствовал на поверхности функционального слоя половолоконной мембраны.
[0121]
Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1711-1751 см-1, 1617-1710 см-1 и 1549-1620 см-1. Показано, что количество сополимера, иммобилизованного на внутренней поверхности половолоконной мембраны, (усредненное соотношение площади AC=O пика в диапазоне 1711-1751 см-1 и площади AC=C пика в диапазоне 1549-1620 см-1 (AC=O/AC=C)) составляло 0,04. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны, и результат показывал, что относительное количество адгезии составляло 60%, как показано в таблице 1.
(Сравнительный пример 3)
Модуль половолоконной мембраны получали аналогичным образом, как в примере 1, за исключением того, что статистический сополимер винилпирролидона/винилацетата («Kollidon VA64» производства BASF SE) использовали вместо статистического сополимера винилпирролидона/винилгексаноата, концентрацию сополимера во время получения модуля половолоконной мембраны меняли с 300 м. д. на 1000 м. д., и воду использовали полностью вместо 0,1% масс. водного раствора этанола.
[0122]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир уксусной кислоты присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1711-1751 см-1, 1617-1710 см-1 и 1549-1620 см-1. Количество сополимера, иммобилизованного на внутренней поверхности половолоконной мембраны, (усредненное соотношение площади AC=O пика в диапазоне 1711-1751 см-1 и площади AC=C пика в диапазоне 1549-1620 см-1 (AC=O/AC=C)) составляло 0,12. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны, и результат показывал, что относительное количество адгезии составляло 65%, как показано в таблице 1.
(Сравнительный пример 4)
1,0% масс. водный раствор этанола подавали от стороны впуска крови к стороне впуска диализата модуля половолоконной мембраны, полученного с помощью способа получения модуля половолоконной мембраны. Затем 0,1% масс. водный раствор этанола подавали от стороны впуска крови к стороне впуска диализата и от стороны впуска крови к стороне выпуска крови модуля половолоконной мембраны, и затем γ-лучи 25 кГр применяли для того, чтобы получать модуль половолоконной мембраны.
[0123]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир карбоновой кислоты не присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1617-1710 см-1 и 1549-1620 см-1, но в диапазоне 1711-1751 см-1 пик не присутствовал. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны, и результат показывал, что относительное количество адгезии составляло 110%, как показано в таблице 1.
(Сравнительный пример 5)
Модуль половолоконной мембраны получали аналогичным образом, как в сравнительном примере 4, за исключением того, что 1,0% масс. водный раствор гексанола использовали полностью вместо 1,0% масс. водного раствора этанола.
[0124]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир карбоновой кислоты не присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1617-1710 см-1 и 1549-1620 см-1, но в диапазоне 1711-1751 см-1 пик не присутствовал. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны, и результат показывал, что относительное количество адгезии составляло 73%, как показано в таблице 1.
(Сравнительный пример 6)
Модуль половолоконной мембраны получали аналогичным образом, как в примере 1, за исключением того, что блок-сополимер винилпирролидона/винилацетата (молярная доля винилацетатного звена: 40%, среднечисловая молекулярная масса: 4600) использовали вместо статистического сополимера винилпирролидона/винилгексаноата, и концентрацию сополимера во время получения модуля половолоконной мембраны меняли с 300 м. д. на 30 м. д.
[0125]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир уксусной кислоты присутствовал на поверхности функционального слоя половолоконной мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1711-1751 см-1, 1617-1710 см-1 и 1549-1620 см-1. Количество сополимера, иммобилизованного на внутренней поверхности половолоконной мембраны, (усредненное соотношение площади AC=O пика в диапазоне 1711-1751 см-1 и площади AC=C пика в диапазоне 1549-1620 см-1 (AC=O/AC=C)) составляло 0,04. Измеряли относительное количество адгезии фибриногена на полученном модуле половолоконной мембраны, и результат показывал, что относительное количество адгезии составляло 83%, как показано в таблице 1.
[0126]
[Таблица 1]
[0127]
<Способ получения плоской мембраны>
Полимер растворяли в хлороформе (Wako Pure Chemical Industries, Ltd.) и корректировали концентрацию до 1% по массе. 1 мл раствора полимера капали на предметное стекло диаметром 2 см и сушили естественным путем при 20°C в течение 1 часа. Посредством облучения γ-лучами (25 кГр), полимер сшивали и иммобилизовали на поверхности стекла, чтобы получать плоскую мембрану.
(Пример 6)
Плоскую мембрану получали с помощью способа получения плоской мембраны, используя гомополимер поливинилпропаноата (среднечисловая молекулярная масса: 15500) в качестве полимера.
[0128]
Осуществляли TOF-SIMS измерение и XPS измерение получаемой плоской мембраны, и результат показывал, что присутствовал сложный эфир пропановой кислоты. Проводили тест адгезии тромбоцитов, и результат показывал, что, как показано в таблице 2, число прилипающих тромбоцитов составляло 6, и значительно подавляли адгезию тромбоцитов.
(Пример 7)
Плоскую мембрану получали с помощью способа получения плоской мембраны, используя статистический сополимер винилпирролидона/винилдеканоата (молярная доля винилового звена декановой кислоты: 40%, среднечисловая молекулярная масса: 35000) в качестве полимера.
[0129]
Осуществляли TOF-SIMS измерение и XPS измерение получаемой плоской мембраны, и результат показывал, что присутствовал сложный эфир декановой кислоты. Проводили тест адгезии тромбоцитов, и результат показывал, что, как показано в таблице 2, число прилипающих тромбоцитов составляло 11, и значительно подавляли адгезию тромбоцитов.
(Пример 8)
Плоскую мембрану получали с помощью способа получения плоской мембраны, используя статистический сополимер винилпирролидона/винилгексаноата (молярная доля винилового звена гексановой кислоты: 40%, среднечисловая молекулярная масса: 2200) в качестве полимера.
[0130]
Осуществляли TOF-SIMS измерение и XPS измерение получаемой плоской мембраны, и результат показывал, что присутствовал сложный эфир гексановой кислоты. Проводили тест адгезии тромбоцитов, и результат показывал, что, как показано в таблице 2, число прилипающих тромбоцитов составляло 0, и значительно подавляли адгезию тромбоцитов.
(Пример 9)
Плоскую мембрану получали с помощью способа получения плоской мембраны, используя статистический сополимер винилпирролидона/винилпропаноата (молярная доля винилового звена пропановой кислоты: 40%, среднечисловая молекулярная масса: 16500) в качестве полимера.
[0131]
Осуществляли TOF-SIMS измерение и XPS измерение получаемой плоской мембраны, и результат показывал, что присутствовал сложный эфир пропановой кислоты. Проводили тест адгезии тромбоцитов, и результат показывал, что, как показано в таблице 2, число прилипающих тромбоцитов составляло 1, и значительно подавляли адгезию тромбоцитов.
(Пример 10)
Плоскую мембрану получали с помощью способа получения плоской мембраны, используя статистический сополимер винилацетамида/винилпивалата (молярная доля винилового звена пивалевой кислоты: 30%, среднечисловая молекулярная масса: 5500) в качестве полимера.
[0132]
Осуществляли TOF-SIMS измерение и XPS измерение получаемой плоской мембраны, и результат показывал, что присутствовал сложный эфир пивалевой кислоты. Проводили тест адгезии тромбоцитов, и результат показывал, что, как показано в таблице 2, число прилипающих тромбоцитов составляло 2, и значительно подавляли адгезию тромбоцитов.
(Сравнительный пример 7)
Проводили тест адгезии тромбоцитов на необработанном предметное стекле, на котором не иммобилизовали полимер.
[0133]
Результат показывал, что число прилипающих тромбоцитов составляло 50, как показано в таблице 2.
(Сравнительный пример 8)
Плоскую мембрану получали с помощью способа получения плоской мембраны, используя поливинилпирролидон («K30» производства BASF SE) в качестве полимера.
[0134]
Осуществляли TOF-SIMS измерение и XPS измерение получаемой плоской мембраны, и результат показывал, что сложный эфир карбоновой кислоты не присутствовал. Проводили тест адгезии тромбоцитов, и результат показывал, что число прилипающих тромбоцитов составляло 47, и адгезию тромбоцитов не подавляли.
(Сравнительный пример 9)
Плоскую мембрану получали с помощью способа получения плоской мембраны, используя статистический сополимер винилпирролидона/винилацетата (молярная доля винилового звена уксусной кислоты: 20%, среднечисловая молекулярная масса: 3200) в качестве полимера.
[0135]
Осуществляли TOF-SIMS измерение и XPS измерение получаемой плоской мембраны, и результат показывал, что присутствовал сложный эфир уксусной кислоты. Проводили тест адгезии тромбоцитов, и результат показывал, что число прилипающих тромбоцитов составляло 43, и адгезию тромбоцитов не подавляли.
[0136]
[Таблица 2]
[0137]
<Способ получения модуля разделяющей мембраны для очистки антител>
Модуль разделяющей мембраны получали аналогичным образом, как в способе получения модуля половолоконной мембраны, за исключением того, что текучее вещество сердцевины меняли на 65 массовых частей N,N-диметилацетамида и 35 массовых частей воды.
(Пример 11)
0,1% масс. водный раствор этанола с 50 м. д. статистического сополимера винилпирролидона/винилпропаноата (молярная доля звена винилпропаноата: 20%, среднечисловая молекулярная масса: 12500), растворенного в нем, подавали от стороны впуска крови к стороне впуска диализата модуля разделяющей мембраны, полученного с помощью способа получения модуль разделяющей мембраны для очистки антител. После этого, γ-лучи 25 кГр применяли для того, чтобы получать модуль разделяющей мембраны.
[0138]
Результаты TOF-SIMS измерения и XPS измерения показывали, что сложный эфир пропановой кислоты присутствовал на поверхности функционального слоя разделяющей мембраны. Кроме того, результаты ATR-IR измерения показывали, что пики присутствовали в диапазонах 1711-1751 см-1, 1617-1710 см-1 и 1549-1620 см-1. Результат ATR-IR измерения показывал, что количество сополимера, иммобилизованного на внутренней поверхности разделяющей мембраны, (усредненное соотношение площади AC=O пика в диапазоне 1711-1751 см-1 и площади AC=C пика в диапазоне 1549-1620 см-1 (AC=O/AC=C)) составляло 0,01. Проводили модельный тест очистки антитела, и результат показывал, что степень восстановления IgG составляла 70%.
(Сравнительный пример 10)
Раствор полимера не подавали, и γ-лучи 25 кГр применяли для того, чтобы получать модуль разделяющей мембраны. Осуществляли TOF-SIMS измерение и XPS измерение получаемой разделяющей мембраны, и результат показывал, что сложный эфир карбоновой кислоты не присутствовал. Проводили модельный тест очистки антитела, и результат показывал, что степень восстановления IgG составляла 45%.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0139]
Подавляющий адгезию биологического компонента материал по настоящему изобретению обладает превосходной биосовместимостью, и способен подавлять адгезию биологических компонентов, таких как тромбоциты и белки, и, следовательно, его можно подходящим образом использовать в качестве медицинского материала или разделяющего материала или аналитического материала для биологических компонентов. Подавляющий биоадгезию материал по настоящему изобретению можно использовать в течение длительного периода времени благодаря подавлению адгезии биологических компонентов, и, следовательно, его можно подходящим образом использовать в качестве материала для очистителя крови.
Изобретение имеет отношение к подавляющему адгезию биологического компонента материалу и очистителю крови, содержащему такой материал. Представленный материал содержит подложку, которая имеет функциональный слой с полимером, иммобилизованным на поверхности, который находится в контакте с биологическим компонентом. Полимер содержит звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты. Биологический компонент содержит тромбоциты и/или белки. Полимер сополимеризован с гидрофильным мономером, причем гидрофильный мономер выбран из группы, состоящей из мономеров винилового спирта, мономеров акрилоилморфолина, мономеров на основе винилпиридина, мономеров на основе винилимидазола, мономеров винилпирролидона и мономеров винилацетамида. Число атомов углерода в алифатической цепи в сигнале иона насыщенной алифатической монокарбоновой кислоты, обнаруживаемом в анализе композиции поверхности функционального слоя с помощью аппарата TOF-SIMS, составляет от 2 до 20. Пик, характеризующий присутствие сложноэфирной группы, присутствует при XPS измерении поверхности функционального слоя. Сигнал иона насыщенной алифатической монокарбоновой кислоты характеризует наличие сополимера, содержащего сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты, обладающего антитромбогенностью. Технический результат – получение подавляющего адгезию биологического компонента материала, который способен подавлять адгезию тромбоцитов и белков, даже когда вступает в контакт с кровью или тому подобным. 2 н. и 9 з.п. ф-лы, 2 табл., 21 пр.
1. Подавляющий адгезию биологического компонента материал, который содержит:
подложку, которая имеет функциональный слой с полимером, иммобилизованным на поверхности, который находится в контакте с биологическим компонентом, полимер содержит звено сложного винилового эфира насыщенной алифатической монокарбоновой кислоты, где
биологический компонент содержит тромбоциты и/или белки,
полимер сополимеризован с гидрофильным мономером,
причем гидрофильный мономер выбран из группы, состоящей из мономеров винилового спирта, мономеров акрилоилморфолина, мономеров на основе винилпиридина, мономеров на основе винилимидазола, мономеров винилпирролидона и мономеров винилацетамида,
число атомов углерода в алифатической цепи в сигнале иона насыщенной алифатической монокарбоновой кислоты, обнаруживаемом в анализе композиции поверхности функционального слоя с помощью аппарата TOF-SIMS, составляет от 2 до 20, и
пик, характеризующий присутствие сложноэфирной группы, присутствует при XPS измерении поверхности функционального слоя.
в котором сигнал иона насыщенной алифатической монокарбоновой кислоты характеризует наличие сополимера, содержащего сложный виниловый эфир насыщенной алифатической монокарбоновой кислоты и обладающего антитромбогенностью.
2. Подавляющий адгезию биологического компонента материал по п. 1, в котором число атомов углерода в алифатической цепи в сигнале иона насыщенной алифатической монокарбоновой кислоты составляет от 2 до 9.
3. Подавляющий адгезию биологического компонента материал по п .1 или 2, в котором при XPS измерении поверхности функционального слоя процентная доля площади пика углерода, характеризующего наличие сложноэфирной группы, составляет 0,5-25 (атомн.%), где общая площадь пиков, характеризующих наличие углерода, составляет 100 (атомн.%).
4. Подавляющий адгезию биологического компонента материал по любому одному из пп. 1-3, у которого при ATR-IR измерении поверхности функционального слоя пик присутствует в каждом из двух диапазонов 1711-1751 см-1 и 1549-1620 см-1, и усредненное значение соотношения площади пика AC=O в диапазоне 1711-1751 см-1 и площади пика AC=C в диапазоне 1549-1620 см-1 (AC=O/AC=C) составляет от 0,01 до 1,0.
5. Подавляющий адгезию биологического компонента материал по п. 4, в котором пик, присутствующий в диапазоне 1549-1620 см-1, характеризует наличие ароматических групп в полимере на основе полисульфона.
6. Подавляющий адгезию биологического компонента материал по п. 4 или 5, у которого пик присутствует в диапазоне 1617-1710 см-1 при ATR-IR измерении поверхности функционального слоя.
7. Подавляющий адгезию биологического компонента материал по п. 6, у которого пик, присутствующий в диапазоне 1617-1710 см-1, характеризует наличие амидной связи в гидрофильном полимере, содержащем звено винилпирролидона, звено винилкапролактама, звено винилацетамида или звено акриламида.
8. Подавляющий адгезию биологического компонента материал по любому одному из пп. 1-7, который используют для очистки крови.
9. Подавляющий адгезию биологического компонента материал по любому одному из пп. 1-8, где подложка включает полимеры на основе полисульфонов, полистирол, полиуретан, полиэтилен, полипропилен, поликарбонат, поливинилиденфторид, полиакрилонитрил, полиметилметакрилат, поливинилхлорид, сложный полиэфир и стекло.
10. Подавляющий адгезию биологического компонента материал по любому одному из пп. 1-9, где гидрофильный мономер выбран из группы, состоящей из мономеров винилпирролидона и мономеров винилацетамида.
11. Очиститель крови, содержащий подавляющий адгезию биологического компонента материал по любому одному из пп. 1-10.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| МОДУЛЬ ПОЛОВОЛОКОННЫХ МЕМБРАН И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2005 |
|
RU2369429C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРОМБОРЕЗИСТЕНТНОГО ПОЛИМЕРНОГО МАТЕРИАЛА | 2014 |
|
RU2556996C1 |
| МЕДИЦИНСКОЕ УСТРОЙСТВО ИЗ ПОЛИОЛЕФИНА | 2010 |
|
RU2553430C2 |
| СОСТАВ ПЛЕНКООБРАЗУЮЩЕГО ДЛЯ ПОЛУЧЕНИЯ ПОЛИМЕРНОЙ ПОЛУПРОНИЦАЕМОЙ МЕМБРАНЫ | 1992 |
|
RU2026108C1 |
| ГИДРОФИЛЬНОЕ ПОЛИМЕРНОЕ СОЕДИНЕНИЕ, ИМЕЮЩЕЕ АНТИКОАГУЛЯНТНЫЙ ЭФФЕКТ | 2010 |
|
RU2539566C2 |
| Упругая сцепная муфта | 1929 |
|
SU21937A1 |
| Композиция для получения ультрафильтрационных мембран | 1989 |
|
SU1616935A1 |
| JP 6165926 A, 14.06.1994. | |||
Авторы
Даты
2020-12-11—Публикация
2017-07-28—Подача