Настоящее изобретение относится к ингибиторам ферментов, которые являются ингибиторами калликреина плазмы, и к фармацевтическим композициям, содержащим их и применению данных ингибиторов.
Уровень техники настоящего изобретения
Гетероциклические производные настоящего изобретения представляют собой ингибиторы калликреина плазмы и имеют ряд терапевтических применений, в частности в лечении проницаемости сосудов сетчатки, связанной с диабетической ретинопатией и диабетическим отеком желтого пятна.
Калликреин плазмы представляет собой трипсиноподобную сериновую протеазу, которая может высвобождать кинины из кининогена (смотри K. D. Bhoola et al., "Kallikrein-Kinin Cascade", Encyclopedia of Respiratory Medicine, p483-493; J. W. Bryant et al., "Human plasma kallikrein-kinin system: physiological and biochemical parameters" Cardiovascular and haematological agents in medicinal chemistry, 7, p234-250, 2009; K. D. Bhoola et al., Pharmacological Rev., 1992, 44, 1; и D. J. Campbell, "Towards understanding the kallikrein-kinin system: insights from the measurement of kinin peptides", Brazilian Journal of Medical and Biological Research 2000, 33, 665-677). Он представляет собой важный член естественного каскада свертывания крови, хотя его роль в данном каскаде не включает высвобождение брадикинина или ферментативного расщепления. Прекалликреин плазмы кодируется одним геном и синтезируется в печени. Он секретируется гепатоцитами в виде неактивного прекалликреина плазмы, который циркулирует в плазме в виде гетеродимерного комплекса, связанного с высокомолекулярным кининогеном, который активируется, давая активный калликреин плазмы. Кинины представляют собой эффективные медиаторы воспаления, которые действует через рецепторы, связанные с G-белком, и антагонисты кининов (такие как антагонисты брадикинина) ранее исследовались в качестве потенциальных терапевтических агентов для лечения ряда заболеваний (F. Marceau and D. Regoli, Nature Rev., Drug Discovery, 2004, 3, 845-852).
Считается, что калликреин плазмы участвует в воспалительных заболеваниях. Основным ингибитором калликреина плазмы является ингибитор эстеразы серпина C1. Пациенты, у которых присутствует генетический дефект ингибитора эстеразы C1, страдают от наследственного ангионевротического отека (HAE), который приводит в результате к периодическому опуханию лица, рук, горла, желудочно-кишечного тракта и гениталий. Пузыри, образующиеся при острых эпизодах, содержат большие количества калликреина плазмы, который расщепляет высокомолекулярный кининоген, высвобождая брадикинин, приводящий к увеличению проницаемости сосудов. Было показано, что лечение большими белковыми ингибиторами калликреина плазмы эффективно лечит HAE предотвращением высвобождения брадикинина, который вызывает повышенную проницаемость сосудов (A. Lehmann "Ecallantide (DX-88), a plasma kallikrein inhibitor for the treatment of hereditary angioedema and the prevention of blood loss in on-pump cardiothoracic surgery" Expert Opin. Biol. Ther. 8, p.1187-99).
Система калликреин плазмы-кинин аномально избыточна у пациентов с запущенным диабетическим отеком желтого пятна. Недавно было опубликовано, что калликреин плазмы способствует дисфункции сосудов сетчатки у крыс с диабетом (A. Clermont et al. "Plasma kallikrein mediates retinal vascular dysfunction and induces retinal thickening in diabetic rats" Diabetes, 2011, 60, p.1590-98). Более того, введение ингибитора калликреина плазмы ASP-440 нормализует и проницаемость сосудов сетчатки и нарушения тока крови в сетчатке у крыс с диабетом. Следовательно, ингибитор калликреина плазмы должен быть применим в качестве терапии, снижающей проницаемость сосудов сетчатки, связанной с диабетической ретинопатией и диабетическим отеком желтого пятна.
Калликреин плазмы также участвует в коагуляции крови. Естественную систему свертывания можно активировать фактором XII (FXII). После активации FXII (до FXIIa), FXIIa запускает образование фибрина посредством активации фактора XI (FXI), таким образом, приводя в результате к свертыванию крови. Калликреин плазмы представляет собой ключевой компонент в естественной системе свертывания, поскольку он активирует FXII до FXIIa, таким образом, приводя в результате к активации естественного пути свертывания. Более того, FXIIa также активирует дополнительный прекалликреин плазмы, приводя в результате к калликреину плазмы. Это приводит к положительному усилению системы калликреина плазмы и естественного пути свертывания (Tanaka et al. (Thrombosis Research 2004, 113, 333-339); Bird et al. (Thrombosis and Haemostasis, 2012, 107, 1141-50).
Контакт FXII в крови с отрицательно заряженными поверхностями (такими как поверхности внешних труб или мембраны оксигенатора, которые проходит кровь при операции в условиях искусственного кровообращения) вызывает конформационное изменение в зимогене FXII, приводя в результате к небольшому количеству активного FXII (FXIIa). Образование FXIIa запускает образование калликреина плазмы, приводящее в результате к свертыванию крови, как описано выше. Активация FXII до FXIIa может также возникать в теле при контакте с отрицательно заряженными поверхностями на различных источниках (например, бактериях при сепсисе, РНК из разрушающихся клеток), таким образом, приводя в результате к синдрому диссеминированного внутрисосудистого свертывания (Tanaka et al. (Thrombosis Research 2004, 113, 333-339)).
Следовательно, ингибирование калликреина плазмы могло бы ингибировать каскад свертывания крови, описанный выше и, таким образом, могло бы быть полезным в лечении внутрисосудистого свертывания и свертывания крови при операции в условиях искусственного кровообращения, когда свертывание крови нежелательна. Например, Katsuura et al. (Thrombosis Research, 1996, 82, 361-368) показали, что введение ингибитора калликреина плазмы, PKSI-527, для синдрома диссеминированного внутрисосудистого свертывания, вызванного LPS, значительно подавляло снижение количества тромбоцитов и уровня фибриногена, а также увеличение уровня FDP, которое обычно возникает при синдроме диссеминированного внутрисосудистого свертывания. Bird et al. (Thrombosis and Haemostasis, 2012, 107, 1141-50) показали, что время свертывания крови увеличивается, и тромбооразование значительно снижается у мышей с дефицитом калликреина плазмы. Revenko et al. (Blood, 2011, 118, 5302-5311) показали, что снижение уровней прекалликреина плазмы у мышей, применяя обработку антисмысловыми олигонуклоетидами, приводило в результате к антитромботическим эффектам. Tanaka et al. (Thrombosis Research 2004, 113, 333-339) показали, что контакт крови с DX-88 (ингибитор калликреина плазмы) приводил в результате к увеличению времени активированного свертывания (ACT). Lehmann et al. (Expert Opin. Biol. Ther. 2008, 1187-99) показали, что экаллантид (ингибитор калликреина плазмы), как обнаружено, задерживает вызываемое контактом свертывание. Lehmann et al. заключили, что экаллантид ʺобладает in vitro антикоагулянтным действием, поскольку он ингибирует естественный путь свертывания ингибированием калликреина плазмыʺ.
Калликреин плазмы также участвует в ингибировании активации тромбоцитов и, следовательно, остановке кровотечения. Активация тромбоцитов представляет собой одну из наиболее ранних стадий гемостаза, которая приводит к образованию тромбоцитарного тромба и быстрой остановке кровотечения поле повреждения кровеносных сосудов. В месте повреждения сосуда, взаимодействие между экспонированным коллагеном и тромбоцитами является важным для удержания и активации тромбоцитов и последующей остановки кровотечения.
После активации, калликреин плазмы связывается с коллагеном и, посредством этого, препятствует опосредованной коллагеном активации тромбоцитов, опосредованной GPVI рецепторами (Liu et al. (Nat Med., 2011, 17, 206-210)). Как обсуждается выше, ингибиторы калликреина плазмы ослабляют активацию прекалликреина плазмы ингибированием активации, опосредованной калликреином плазмы, фактора XII и, посредством этого, ослабляя положительное усиление калликреиновой системы системой контактной активации.
Следовательно, ингибирование калликреина плазмы ослабляет связывание калликреина плазмы с коллагеном, таким образом, ослабляя участие калликреина плазмы в остановке кровотечения. Следовательно, ингибиторы калликреина плазмы могли бы быть пригодными в лечении геморрагического инсульта и кровотечения после оперативной хирургии. Например, Liu et al. (Nat Med., 2011, 17, 206-210) показали, что системное введение низкомолекулярного PK ингибитора, ASP-440, снижало увеличение гематомы у крыс. Внутримозговая гематома может возникать после внутримозгового кровоизлияния и быть вызвана кровотечением из кровеносных сосудов в окружающие ткани мозга, как результат повреждения сосудов. Модель кровотечения при геморрагическом инсульте, сообщаемая Liu et al., создавалась хирургическим вмешательством, включающим разрез мозговой паренхимы, который повреждал кровеносные сосуды. Данные продемонстрировали, что ингибирование калликреина плазмы ослабляло кровотечение и объем гематомы после оперативной хирургии. Björkqvist et al. (Thrombosis and Haemostasis, 2013, 110, 399- 407) показали, что апротинин (белок, который ингибирует сериновые протеазы, включая калликреин плазмы) можно применять для снижения послеоперационного кровотечения.
Другие осложнения диабета, такие как геморрагический инсульт, нефропатия, кардиомиопатия и невропатия, все из которых связаны с калликреином плазмы, можно также считать мишенями для ингибитора калликреина плазмы.
Синтетические и низкомолекулярные ингибиторы калликреина плазмы описаны ранее, например, Garrett et al. ("Peptide aldehyde…." J. Peptide Res. 52, p62-71 (1998)), T. Griesbacher et al. ("Involvement of tissue kallikrein but not plasma kallikrein in the development of symptoms mediated by endogenous kinins in acute панкреатит in rats" British Journal of Pharmacology 137, p692-700 (2002)), Evans ("Selective dipeptide inhibitors of kallikrein" WO03/076458), Szelke et al. ("Kininogenase inhibitors " WO92/04371), D. M. Evans et al. (Immunolpharmacology, 32, p.115-116 (1996)), Szelke et al. ("Kininogen inhibitors " WO95/07921), Antonsson et al. ("New peptides derivatives" WO94/29335), J. Corte et al. (ʺSix membered heterocycles useful as serine protease inhibitorsʺ WO2005/123680), J. Stürzbecher et al. (Brazilian J. Med. Biol. Res 27, p.1929-34 (1994)), Kettner et al. (US 5,187,157), N. Teno et al. (Chem. Pharm. Bull. 41, p.1079-1090 (1993)), W. B. Young et al. ("Small molecule inhibitors of plasma kallikrein " Bioorg. Med. Chem. Letts. 16, p2034-2036 (2006)), Okada et al. ("Development of potent and selective plasmin and plasma kallikrein inhibitors and studies on the structure-activity relationship" Chem. Pharm. Bull. 48, p.1964-72 (2000)), Steinmetzer et al. ("Trypsin-like serine protease inhibitors and their preparation and use" WO08/049595), Zhang et al. ("Discovery of highly potent small molecule kallikrein inhibitors " Medicinal Chemistry 2, p545-553 (2006)), Sinha et al. ("Inhibitors of plasma kallikrein" WO08/016883), Shigenaga et al. (ʺPlasma kallikrein inhibitorsʺ WO2011/118672), и Kolte et al. (ʺBiochemical characterization of a novel high-affinity and specific kallikrein inhibitorʺ, British Journal of Pharmacology (2011), 162(7), 1639-1649). Также, Steinmetzer et al. (ʺSerine protease inhibitorsʺ WO2012/004678) описывают циклизованные пептидные аналоги, которые представляют собой ингибиторы человеческого плазмина и калликреина плазмы.
В настоящее время, ни один низкомолекулярный синтетический ингибитор калликреина плазмы не одобрен для медицинского применения. Молекулы, описанные на известном уровне техники, страдают от ограничений, таких как плохая селективность среди родственных ферментов, таких как KLK1, тромбин и другие сериновые протеазы, и низкая пероральная биодоступность. Большие белковые ингибиторы калликреина плазмы создают риск анафилактических реакций, как сообщалось для экаллантида. Таким образом, существует необходимость в соединениях, которые селективно ингибируют калликреин плазмы, но не вызывают анафилаксию и которые являются перорально доступными. Более того, значительное большинство молекул известного уровня техники содержат очень полярные и ионизируемые гуанидиновую или амидиновую функциональные группы. Хорошо известно, что данные функциональные группы могут ограничивать кишечную проницаемость и, следовательно, перорольную биодоступность. Например, сообщалось Tamie J. Chilcote and Sukanto Sinha (ʺASP-634: An Oral Drug Candidate for Diabetic MacularEdemaʺ, ARVO 2012 May 6th - May 9th, 2012, Fort Lauderdale, Florida, Presentation 2240), что ASP-440, бензамидин, страдает от низкой пероральной биодоступности. Кроме того, сообщалось, что поглощение можно улучшить созданием лекарственного средства, такого как ASP-634. Однако, хорошо известно, что пролекарства могут страдать от ряда недостатков, например, низкой химической стабильности и потенциальной токсичности инертного носителя или в результате образования непредусмотренных метаболитов. В другом сообщении, индоламиды заявляют как соединения, которые могут преодолеть проблемы, связанные с лекарственными средствами, обладающими плохими или неприемлемыми ADME-tox и физико-химическим свойствами, хотя ингибирование калликреина плазмы не было представлено или заявлено (Griffioen et al., ʺIndole amide derivatives and related compounds for use in the treatment of neurodegenerative diseasesʺ, WO2010, 142801).
BioCryst Pharmaceuticals Inc. сообщало об открытие перорально доступного ингибитора калликреина плазмы BCX4161 (ʺBCX4161, An Oral Kallikrein Inhibitor: Safety and Pharmacokinetic Results Of a Phase 1 Study In Healthy Volunteersʺ, Journal of Allergy and Clinical Immunology, Volume. 133, Issue 2, Supplement, February 2014, page AB39 и ʺA Simple, Sensitive and Selective Fluorogenic Assay to Monitor Plasma Kallikrein inhibitory Activity of BCX4161 in Activated Plasmaʺ, Journal of Allergy and Clinical Immunology, Volume. 133, Issue 2, Supplement February 2014, page AB40). Однако человеческие дозы были относительно большими, в настоящий момент тестируемые в предварительном исследовании клинической эффективности при дозах 400 мг три раза в день.
Есть только несколько сообщений об ингибиторах калликреина плазмы, которые не содержат гуанидиновую или амидиновую функциональные группы. Один пример представляет собой Brandl et al. (ʺN-((6-amino-pyridin-3-yl)methyl)-heteroaryl-carboxamides as inhibitors of plasma kallikreinʺ WO2012/017020), который описывает соединения, которые содержат аминопиридиновую функциональную группу. Пероральная эффективность в модели крыс продемонстрирована при относительно высоких дозах 30 мг/кг и 100 мг/кг, но о фармакокинетическом профиле не сообщалось. Таким образом, еще неизвестно, будут ли данные соединения обеспечивать достаточную пероральную биодоступность или эффективность для продвижения в клинику. Другие примеры представляют собой Brandl et al. (ʺAminopyridine derivatives as plasma kallikrein inhibitorsʺ WO2013/111107) и Flohr et al. (ʺ5-membered heteroarylcarboxamide derivatives as plasma kallikrein inhibitorsʺ WO2013/111108). Однако ни один из данных документов не дает любых in vivo данных и, следовательно, еще неизвестно, будут ли данные соединения обеспечивать достаточную пероральную биодоступность или эффективность для продвижения в клинику. Другой пример представляет собой Allan et al. ʺBenzylamine derivativesʺ WO2014/108679.
Следовательно, существует необходимость в разработке новых ингибиторов калликреина плазмы, которые будут применимы в лечении широкого спектра расстройств, в частности для снижения проницаемости сосудов сетчатки, связанной с диабетической ретинопатией и диабетическим отеком желтого пятна. Предпочтительные соединения будут обладать хорошим фармакокинетическим профилем и в частности будут пригодными в качестве лекарственных средств для пероральной доставки.
Сущность настоящего изобретения
Настоящее изобретение относится к серии гетероциклических производных, которые являются ингибиторами калликреина плазмы. Данные соединения демонстрируют хорошую селективность к калликреину плазмы и являются потенциально пригодными в лечении снижения остроты зрения, диабетической ретинопатии, отека желтого пятна, наследственного ангионевротического отека, диабета, панкреатита, геморрагического инсульта, нефропатии, кардиомиопатии, невропатии, воспалительного заболевания кишечника, артрита, воспаления, септического шока, гипотензии, рака, синдрома расстройства дыхания у взрослых, синдрома диссеминированного внутрисосудистого свертывания, свертывания крови при операции в условиях искусственного кровообращения и кровотечения после оперативной хирургии. Кроме того, настоящее изобретение относится к фармацевтическим композициям ингибиторов, к применению композиций в качестве терапевтических агентов, и способам лечения, применяя данные композиции.
Настоящее изобретение относится к соединениям, близко родственным или попадающим в объем, но специально не описанным, нашей родственной заявки PCT/GB2015/053615 (WO2016/083820).
В первом аспекте, настоящее изобретение относится к соединениям, выбранным из группы, состоящей из:
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-фтор-5-метоксипиридазин-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-N-[(5-метоксипиридазин-3-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-N-[(6-метоксипиримидин-4-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
3-(диметиламино)-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-циано-2-метоксипиридин-4-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-циано-3-фтор-2-метоксипиридин-4-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-N-[(4-метоксипиримидин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-3,5-диметилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-циано-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-цианопиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[3-(дифторметил)-4-метоксипиридин-2-ил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-цианопиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-фторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-хлор-3-фторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-5-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-5-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-циано-5-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-3-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-циано-6-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[6-(дифторметил)-3-фтор-4-метоксипиридин-2-ил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-(дифторметил)-3-фтор-4-метоксипиридин-2-ил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3,5-дифторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-6-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-хлор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(5-метокси-1-метилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-хлор-5-метокси-1-метилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-метокси-1,4-диметилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-хлор-1-метилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(2,6-дифтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2,6-дифтор-3,5-диметоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-метокси-2-метилфенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-карбамоил-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(диметиламино)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(2-циано-5-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(диметиламино)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-{[5-метокси-2-(трифторметил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-{[2-(дифторметил)-5-метоксифенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-фтор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2,6-дифтор-3-метоксифенил)метил]-3-(диметиламино)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиперидин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
3-амино-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(диметиламино)-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(диметиламино)-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(диметиламино)-N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-{[5-хлор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-хлор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-хлор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-N-{[2-(1,2,3,4-тетразол-1-ил)фенил]метил}пиразол-4-карбоксамида;
3-(метоксиметил)-N-{[2-метил-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-6-фторфенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
и их фармацевтически приемлемых солей и сольватов.
В следующем аспекте настоящего изобретения также обеспечивают соединение, выбранное из группы, состоящей из:
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-N-[(4-метоксипиримидин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-цианопиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-фторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3,5-дифторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-6-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-хлор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-хлор-1-метилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
и их фармацевтически приемлемых солей и сольватов.
В другом аспекте настоящего изобретения также обеспечивают соединение, выбранное из группы, состоящей из:
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
N-[(3-циано-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-цианопиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[3-(дифторметил)-4-метоксипиридин-2-ил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-5-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-3-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-циано-6-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[6-(дифторметил)-3-фтор-4-метоксипиридин-2-ил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)пиразол-4-карбоксамида;
3-амино-N-[(2,6-дифтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-метокси-2-метилфенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-карбамоил-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(диметиламино)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(2-циано-5-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-фтор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
N-[(2-циано-6-фторфенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
и их фармацевтически приемлемых солей и сольватов.
В следующем аспекте настоящего изобретения, также обеспечивают соединение, выбранное из группы, состоящей из:
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
и их фармацевтически приемлемых солей и сольватов.
В следующем аспекте настоящего изобретения также обеспечивают соединение, выбранное из группы, состоящей из:
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-N-[(6-метоксипиримидин-4-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
3-(диметиламино)-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-циано-2-метоксипиридин-4-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-N-[(4-метоксипиримидин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-3,5-диметилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-цианопиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-цианопиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-фторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-5-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-3-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3,5-дифторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-6-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-хлор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(5-метокси-1-метилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-хлор-1-метилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(2,6-дифтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-метокси-2-метилфенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-карбамоил-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(диметиламино)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-фтор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
3-амино-N-{[5-хлор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-хлор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-хлор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-N-{[2-(1,2,3,4-тетразол-1-ил)фенил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида; и их фармацевтически приемлемых солей и сольватов.
В следующем аспекте настоящего изобретения также обеспечивают соединение, выбранное из группы, состоящей из:
3-амино-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
3-(диметиламино)-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-циано-2-метоксипиридин-4-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-3,5-диметилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-цианопиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-фторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-3-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-хлор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)пиразол-4-карбоксамида;
3-амино-N-[(2,6-дифтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-метокси-2-метилфенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-карбамоил-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(диметиламино)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-фтор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
3-амино-N-{[5-хлор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-хлор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-хлор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-N-{[2-(1,2,3,4-тетразол-1-ил)фенил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида; и их фармацевтически приемлемых солей и сольватов.
В следующем аспекте настоящего изобретения также обеспечивают соединение, выбранное из группы, состоящей из:
3-амино-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
N-[(4-метокси-3-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)пиразол-4-карбоксамида;
3-амино-N-[(2,6-дифтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-карбамоил-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(диметиламино)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-3-(метоксиметил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
3-амино-N-{[5-хлор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-хлор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида; и их фармацевтически приемлемых солей и сольватов.
В следующем аспекте настоящего изобретения также обеспечивают соединение, выбранное из группы, состоящей из:
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
и их фармацевтически приемлемых солей и сольватов.
В еще следующем аспекте настоящего изобретения также обеспечивают соединение, выбранное из группы, состоящей из:
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида
и их фармацевтически приемлемых солей и сольватов.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой 1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой 1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения, также обеспечивают соединение, которое представляет собой 1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой N-[(3-фтор-4-метоксипиридин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В предпочтительном аспекте настоящего изобретения также обеспечивают соединение, которое представляет собой N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамид; или его фармацевтически приемлемую соль или сольват.
В еще следующем аспекте настоящего изобретения, также обеспечивают соединение, выбранное из группы, состоящей из:
N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-фтор-5-метоксипиридазин-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-N-[(5-метоксипиридазин-3-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-N-[(6-метоксипиримидин-4-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-циано-2-метоксипиридин-4-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-циано-3-фтор-2-метоксипиридин-4-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-N-[(4-метоксипиримидин-2-ил)метил]-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-3,5-диметилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-циано-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-цианопиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[3-(дифторметил)-4-метоксипиридин-2-ил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-цианопиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-хлор-3-фторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-хлор-3-фторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-5-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-5-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-циано-5-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-метокси-3-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-циано-6-метоксипиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[6-(дифторметил)-3-фтор-4-метоксипиридин-2-ил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-(дифторметил)-3-фтор-4-метоксипиридин-2-ил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3,5-дифторпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-6-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-фтор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(3-хлор-4-метилпиридин-2-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-N-[(3-фтор-4-метоксипиридин-2-ил)метил]-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(5-метокси-1-метилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-хлор-5-метокси-1-метилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-метокси-1,4-диметилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(4-хлор-1-метилпиразол-3-ил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2,6-дифтор-3,5-диметоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(5-метокси-2-метилфенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-карбамоил-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-фтор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({5-[(2-оксопиридин-1-ил)метил]пиридин-2-ил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-3-(метоксиметил)-1-({6-[(2-оксопиридин-1-ил)метил]пиридин-3-ил}метил)пиразол-4-карбоксамида;
N-[(2-циано-5-метоксифенил)метил]-1-({4-[(5-фтор-2-оксопиридин-1-ил)метил]фенил}метил)-3-(метоксиметил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиперидин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(6-циано-2-фтор-3-метоксифенил)метил]-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-хлор-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-хлор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-N-{[2-(1,2,3,4-тетразол-1-ил)фенил]метил}пиразол-4-карбоксамида;
3-(метоксиметил)-N-{[2-метил-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-[(2-циано-6-фторфенил)метил]-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
и их фармацевтически приемлемых солей и сольватов.
В еще следующем аспекте настоящего изобретения, также обеспечивают соединение, выбранное из группы, состоящей из:
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(4-метилпиразол-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)-3-(трифторметил)пиразол-4-карбоксамида;
3-амино-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-амино-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(диметиламино)-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
3-(диметиламино)-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамида;
N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-1-{[6-(пирролидин-1-ил)пиридин-3-ил]метил}-3-(трифторметил)пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
1-{[6-(3,3-дифторпирролидин-1-ил)пиридин-3-ил]метил}-N-{[5-метокси-2-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамида;
и их фармацевтически приемлемых солей и сольватов.
В другом аспекте настоящее изобретение относится к пролекарству соединения настоящего изобретения или его фармацевтически приемлемой соли.
В еще следующем аспекте, настоящее изобретение относится к N-оксиду соединения настоящего изобретения или его пролекарству или фармацевтически приемлемой соли.
Ясно, что определенные соединения настоящего изобретения могут находиться в сольватированных, например, гидратированной, а также несольватированных формах. Ясно, что настоящее изобретение включает все данные сольватированные формы.
Терапевтические применения
Как упоминалось выше, соединения настоящего изобретения являются эффективными и селективными ингибиторами калликреина плазмы. Следовательно, они являются пригодными в лечении заболеваний, для которых повышенная активность калликреина плазмы представляет собой причинный фактор.
Соответственно, настоящее изобретение относится к соединению настоящего изобретения для применения в медицине.
Настоящее изобретение также относится к применению соединения настоящего изобретения в получении лекарственного средства для лечения или предотвращения заболевания или состояния, в которое вовлечена активность калликреина плазмы.
Настоящее изобретение также относится к соединению настоящего изобретения для применения в лечении или предотвращении заболевания или состояния, в которое вовлечена активность калликреина плазмы.
Настоящее изобретение также относится к способу лечения заболевания или состояния, в которое вовлечена активность калликреина плазмы, включающему введение нуждающемуся в лечении субъекту терапевтически эффективного количества соединения настоящего изобретения.
В первом аспекте, заболевание или состояние, в которое вовлечена активность калликреина плазмы, выбрано из снижения остроты зрения, диабетической ретинопатии, диабетического отека желтого пятна, наследственного ангионевротического отека, диабета, панкреатита, геморрагического инсульта, нефропатии, кардиомиопатии, невропатии, воспалительного заболевания кишечника, артрита, воспаления, септического шока, гипотензии, рака, синдрома расстройства дыхания у взрослых, синдрома диссеминированного внутрисосудистого свертывания, свертывания крови при операции в условиях искусственного кровообращения и кровотечения после оперативной хирургии.
В предпочтительном аспекте, заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой проницаемость сосудов сетчатки, связанную с диабетической ретинопатией и диабетическим отеком желтого пятна.
В альтернативном предпочтительном аспекте, заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой наследственный ангионевротический отек.
В альтернативном предпочтительном аспекте, заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой диабетический отек желтого пятна.
В другом аспекте, заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой окклюзию вены сетчатки.
Комбинационная терапия
Соединения настоящего изобретения можно вводить в комбинации с другими терапевтическими агентами. Подходящие комбинационные терапии включают соединение настоящего изобретения в комбинации с одним или более агентами, выбранными из агентов, которые ингибируют фактор роста тромбоцитов (PDGF), фактор роста эндотелия (VEGF), интегрина альфа5бета1, стероидов, других агентов, которые ингибируют калликреин плазмы, и других ингибиторов воспаления. Конкретные примеры терапевтических агентов, которые можно комбинировать с соединениями настоящего изобретения, включают агенты, описанные в EP2281885A и S. Patel in Retina, 2009 Jun;29(6 Suppl):S45-8.
При применении комбинационной терапии, соединения настоящего изобретения и указанные комбинационные агенты могут присутствовать в одной или различных фармацевтических композициях, и их можно вводить отдельно, последовательно или одновременно.
В другом аспекте, соединения настоящего изобретения можно вводить в комбинации с лазерной терапией сетчатки. Комбинация лазерной терапии с интравитреальной инъекцией ингибитора VEGF для лечения диабетического отека желтого пятна является известной (Elman M, Aiello L, Beck R, et al. ʺRandomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edemaʺ. Ophthalmology. 27 April 2010).
Определения
Термин "алкил" включает насыщенные углеводородные остатки, включая:
- линейные группы из вплоть до 10 атомов углерода (C1-C10), или вплоть до 6 атомов углерода (C1-C6), или вплоть до 4 атомов углерода (C1-C4). Примеры данных алкильных групп включают, но не ограничиваются, C1-метил, C2-этил, C3-пропил и C4-н-бутил.
- Разветвленные группы из 3-10 атомов углерода (C3-C10), или вплоть до 7 атомов углерода (C3-C7), или вплоть до 4 атомов углерода (C3-C4). Примеры данных алкильных групп включают, но не ограничиваются, C3-изопропил, C4-втор-бутил, C4-изобутил, C4-трет-бутил и C5-неопентил.
Причем каждая необязательно замещена, как указано выше.
Циклоалкил представляет собой моноциклический насыщенный углеводород из 3-7 атомов углерода, или 3-6 атомов углерода, или 3-5 атомов углерода. Необязательно, циклоалкил может быть замещен заместителем, выбранным из алкила, алкокси и NR12R13; где R12 и R13 независимо выбраны из H и алкила, или R12 и R13, вместе с азотом, с которым они соединены, образуют 4-, 5-, 6- или 7-членное гетероциклическое кольцо, которое может быть насыщенным или ненасыщенным с 1 или 2 двойными связями и которое может быть необязательно моно- или дизамещенным заместителями, выбранными из оксо, алкила, алкокси, OH, F и CF3. Циклоалкильные группы могут содержать 3-7 атомов углерода, или 3-6 атомов углерода, или 3-5 атомов углерода, или 3-4 атома углерода. Примеры подходящих моноциклических циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Термин "алкокси" включает O-соединенные углеводородные остатки, включая:
- линейные группы из 1-6 атомов углерода (C1-C6), или 1-4 атомов углерода (C1-C4). Примеры данных алкокси групп включают, но не ограничиваются, C1-метокси, C2-этокси, C3-н-пропокси и C4-н-бутокси.
- разветвленные группы из 3-6 атомов углерода (C3-C6) или 3-4 атомов углерода (C3-C4). Примеры данных алкокси групп включают, но не ограничиваются, C3-изопропокси и C4-втор-бутокси и трет-бутокси.
Причем каждая необязательно замещена, как указано выше.
Если не указано иначе, галоген выбран из Cl, F, Br и I.
Арил представляет собой, как определено выше. Обычно, арил будет необязательно замещен 1, 2 или 3 заместителями. Необязательные заместители выбраны из заместителей, указанных выше. Примеры подходящих арильных групп включают фенил и нафтил (причем каждый необязательно замещен, как указано выше). Предпочтительно арил выбран из фенила, замещенного фенила (где указанные заместители выбраны из заместителей, указанных выше) и нафтила.
Гетероарил представляет собой, как определено выше. Обычно, гетероарил будет необязательно замещен 1, 2 или 3 заместителями. Необязательные заместители выбраны из заместителей, указанных выше. Примеры подходящих гетероарильных групп включают тиенил, фуранил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридинил, пиридазинил, пиримидинил, пиразинил, индолил, бензимидазолил, бензотриазолил, хинолинил и изохинолинил (необязательно замещенные, как указано выше).
Термин "N-присоединенный", такой как в "N-присоединенный пирролидинил", обозначает то, что гетероциклоалкильная группа присоединена к остатку молекулы через кольцевой атом азота.
Термин "O-присоединенный", как в "O-присоединенной углеводородном остатке", обозначает то, что углеводородный остаток присоединен к остатку молекулы через атом кислорода.
В группах, таких как -(CH2)1-3-арил, "-" обозначает место присоединения заместителя к остатку молекулы.
"Фармацевтически приемлемая соль" обозначает физиологически или токсикологически переносимую соль и включает, при необходимости, фармацевтически приемлемые соли присоединения основания и фармацевтически приемлемые соли присоединения кислоты. Например, (i) когда настоящего изобретения содержит одну или более кислых групп, например, карбокси группы, фармацевтически приемлемые соли присоединения основания, которые могут образовываться, включают соли натрия, калия, кальция, магния и аммония, или соли с органическими аминами, такими как, диэтиламин, N-метилглюкамин, диэтаноламин или аминокислоты (например, лизин) и подобными; (ii) когда настоящего изобретения содержит основную группу, такую как аминогруппа, фармацевтически приемлемые соли присоединения кислоты, которые могут образовываться, включают гидрохлориды, гидробромиды, сульфаты, фосфаты, ацетаты, цитраты, лактаты, тартраты, мезилаты, сукцинаты, оксалаты, фосфаты, эзилаты, тозилаты, бензолсульфонаты, нафталиндисульфонаты, малеаты, адипаты, фумараты, гиппураты, камфораты, ксинафоаты, п-ацетамидобензоаты, дигидроксибензоаты, гидроксинафтоаты, сукцинаты, аскорбаты, олеаты, бисульфаты и подобные.
Полусоли кислот и оснований можно также получать, например, гемисульфатные и гемикальциевые соли.
Что касается обзора подходящих солей, смотри "Handbook of Pharmaceutical Salts: Properties, Selection and Use" Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002).
ʺПролекарствоʺ относится к соединению, которое может превращаться in vivo метаболически (например, гидролизом, восстановлением или окислением) в соединение настоящего изобретения. Подходящие группы для получения пролекарств описаны в 'The Practice of Medicinal Chemistry, 2ое изд. стр. 561-585 (2003) и в F. J. Leinweber, Drug Metab. Res., 1987, 18, 379.
Соединения настоящего изобретения могут находиться в несольватированных и сольватированных формах. Термин 'сольват' применяют в настоящем изобретении для описания молекулярного комплекса, содержащего соединение настоящего изобретения и стехиометрическое количество одной или более молекул фармацевтически приемлемого растворителя, например, этанола. Термин 'гидрат' применяют, когда растворитель представляет собой воду.
Когда соединения настоящего изобретения присутствует в виде одной или более геометрических, оптических, энантиомерных, диастереомерных и таутомерных форм, включая, но не ограничиваясь, цис- и транс-формы, E- и Z-формы, R-, S- и мезо-формы, кето- и енольные формы, если не указано иначе, ссылка на конкретное соединение включает все данные изомерные формы, включая их рацемические и другие смеси. При необходимости, данные изомеры можно выделить из их смеси применением или приспособлением известных способов (например, хроматографических способов и способов перекристаллизации). При необходимости, данные изомеры можно получить применением или приспособлением известных способов (например, асимметрическим синтезом).
Ссылка на конкретное соединение также включает все изотопные варианты.
В контексте настоящего изобретения, ссылка в настоящем изобретении на "лечение" включает ссылки на терапевтическое, паллиативное и профилактическое лечение.
Общие способы
Соединения настоящего изобретения необходимо оценить на их биофармацевтические свойства, такие как растворимость и стабильность в растворе (при всех pH), проницаемость и т.д., для того чтобы выбрать самую подходящую лекарственную форму и путь введения для лечения предполагаемого заболевания. Их можно вводить отдельно или в комбинации с одним или более другими соединениями настоящего изобретения или в комбинации с одним или более другими лекарственными средствами (или любой их комбинацией). В общем, их будут вводить в виде состава в сочетании с одним или более фармацевтически приемлемыми вспомогательными веществами. Термин 'вспомогательное вещество' применяют в настоящем изобретении для описания любого ингредиента, отличного от соединения (соединений) настоящего изобретения, которое может придавать или функциональные (т.е., контроль скорости высвобождения лекарственного средства) и/или нефункциональные (т.е., вспомогательное вещество, используемое в производственном процессе или разбавитель) характеристики составам. Выбор вспомогательного вещества будет, в большой степени, зависеть от факторов, таких как конкретный путь введения, влияние вспомогательного вещества на растворимость и стабильность, и свойств лекарственной формы.
Соединения настоящего изобретения, предполагаемые для фармацевтического применения, можно вводить в твердом или жидком виде, таком как таблетка, капсула или раствор. Фармацевтические композиции, пригодные для доставки соединений настоящего изобретения, и способы их получения являются известными специалисту в данной области техники. Данные композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences, 19ое издание (Mack Publishing Company, 1995).
Соответственно, настоящее изобретение относится к фармацевтической композиции, содержащей соединение настоящего изобретения и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
Для лечения заболеваний, таких как проницаемость сосудов сетчатки, связанная с диабетической ретинопатией и диабетическим отеком желтого пятна, соединения настоящего изобретения можно вводить в форме, пригодный для инъекции в глазничную область пациента, в частности, в форме, пригодной для интравитреальной инъекции. Предусмотрено, что составы, пригодные для данного применения, будут в форме стерильных растворов соединения настоящего изобретения в подходящей водной среде. Композиции можно вводить пациенту под надзором лечащего врача.
Соединения настоящего изобретения можно также вводить непосредственно в ток крови, в подкожную ткань, мышцы или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, интравентрикулярное, внутриуретральное, интрастернальное, интракраниальное, внутримышечное, внутрисуставное и подкожное введение. Подходящие устройства для парентерального введения включают игольчатые (включая микроигольчатые) инжекторы, безугольные инжекторы и способы инфузии.
Парентеральные составы обычно представляют собой водные или масляные растворы. Когда раствор является водным, вспомогательные вещества, такие как сахара (включая, но не ограничиваясь, глюкозу, маннитол, сорбитол и т.д.), соли, сахара и буферные агенты (предпочтительно до pH 3-9), но, для некоторых применений, их можно более удобно формулировать в виде стерильного неводного раствора или в виде высушенной формы, которую будут применять в сочетании с подходящей средой, такой как стерильная апирогенная вода.
Парентеральные составы могут включать имплантанты, полученные из разлагаемых полимеров, таких как полиэфиры (т.е., полимолочная кислота, полилактид, полилактид-согликолид, поликапролактон, полигидроксибутират), полиортоэфиры и полиангидриды. Данные составы можно вводить хирургическим разрезом подкожной ткани, мышечной ткани или непосредственно в конкретные органы.
Получение парентеральных составов в стерильных условиях, например, лиофилизацией, можно легко осуществлять, применяя стандартные фармацевтические способы, хорошо известные специалистам в данной области техники.
Растворимость соединений настоящего изобретения, применяемых в получении парентеральных растворов, можно увеличивать применением подходящих способов формулирования, таких как включение сорастворителей и/или агентов, увеличивающих растворимость, таких как поверхностно-активные соединения, мицеллярные структуры и циклодекстрины.
В одном варианте осуществления, соединения настоящего изобретения можно вводить перорально. Пероральное введение может включать проглатывание, так что соединение проникает в желудочно-кишечный тракт, и/или буккальным, лингвальным или сублингвальным введением, с помощью которого соединение проникает в кровяной поток непосредственно изо рта.
Составы, пригодные для перорального введения, включают твердые прессованные массы, твердые микрочастицы, полутвердые и жидкие формы (включая системы с несколькими фазами или дисперсные системы), такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости, эмульсии или порошки; пастилки (включая пастилки с жидким наполнением); жвачку; гели; быстро диспергируемые лекарственные формы; пленки; капсулы; спреи; и буккальные/мукоадгезивные пластыри.
Составы, пригодные для перорального введения, можно также разрабатывать для доставки соединений настоящего изобретения способом с немедленным высвобождением или способом с замедленной скоростью, где высвобождение можно задерживать, делать пульсирующим, контролировать, поддерживать, или задерживать и поддерживать или модифицировать способом, который оптимизирует терапевтическую эффективность указанных соединений. Способы доставки соединений поддерживающим скорость способом являются известными в данной области техники и включают полимеры медленного высвобождения, которые можно формулировать с указанными соединениями для контролирования их высвобождения.
Примеры полимеров, поддерживающих скорость высвобождения, включают разлагаемые и неразлагаемые полимеры, которые можно применять для высвобождения указанных соединений диффузией или комбинацией диффузии и разрушения полимера. Примеры полимеров, поддерживающих скорость высвобождения, включают гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, этилцеллюлозу, карбоксиметилцеллюлозу натрия, поливиниловый спирт, поливминилпирролидон, ксантановую камедь, полиметакрилалы, полиэтиленоксид и полиэтиленгликоль.
Жидкие (включая системы с несколькими фазами и дисперсные системы) составы включают эмульсии, растворы, сиропы и эликсиры. Данные составы можно предоставлять в виде наполнений в мягких или твердых капсулах (полученных, например, из желатина или гидроксипропилметилцеллюлозы), и они обычно содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более эмульгаторов и/или суспендирующих агентов. Жидкие составы можно также получить растворением твердого содержимого, например, из саше.
Соединения настоящего изобретения можно также применять в виде быстро растворяющихся, быстро распадающихся лекарственных форм, таких как формы, описанные в Liang and Chen, Expert Opinion in Therapeutic Patents, 2001, 11 (6), 981-986.
Состав таблеток обсуждается в Pharmaceutical Dosage Forms: Tablets, Vol. 1, H. Lieberman и L. Lachman (Marcel Dekker, New York, 1980).
Для введения пациентам, являющимся людьми, суммарная дневная доза соединений настоящего изобретения обычно находится в диапазоне 0,1 мг-10000 мг, или 1 мг-5000 мг, или 10 мг-1000 мг, в зависимости, конечно, от пути введения. При введении интравитреальной инъекцией предусматриваются низкие дозы от 0,0001 мг (0,1 мкг) до 0,2 мг (200 мкг) в глаз, или от 0,0005 мг (0,5 мкг) до 0,05 мг (50 мкг) на глаз.
Суммарную дозу будут вводить в виде одной или раздельных доз, и она может, на усмотрение врача, выходить за пределы стандартного диапазона, указанного в настоящем изобретении. Данные дозы основаны на среднем человеческом субъекте, имеющем вес приблизительно 60-70 кг. Лечащий врач может легко определить дозы для субъектов, чей вес выходит за пределы данного диапазона, таких как дети и пожилые люди.
Способы получения
Соединения настоящего изобретения можно получить согласно способам следующих схем и примеров, применяя подходящие материалы, и они дополнительно проиллюстрированы конкретными примерами, приводимыми в настоящем изобретении ниже. Более того, применяя способы, описанные в настоящем изобретении, специалист в данной области техники может легко получить дополнительные соединения, которые попадают в пределы объема заявленного настоящего изобретения. Однако соединения, показанные в примерах, не следует рассматривать как образующие единственный класс, который рассматривают как настоящее изобретение. Примеры дополнительно иллюстрируют детали получения соединений настоящего изобретения. Специалисту в данной области техники ясно, что известные варианты условий и способов следующих способов получения можно применять для получения данных соединений.
Соединения настоящего изобретения можно выделять в виде их фармацевтически приемлемых солей, таких как соли, описанные ранее в настоящем изобретении выше.
Может быть необходимо защищать реакционноспособные функциональные группы (например, гидрокси, амино, тио или карбокси) в промежуточных соединениях, применяемых в получении соединений настоящего изобретения для того, чтобы избежать нежелательного участия в реакции, приводящего к образованию соединений. Можно применять общепринятые защитные группы, например, группы, описанные T. W. Greene and P. G. M. Wuts в ʺProtective groups in organic chemistryʺ John Wiley and Sons, 4ое издание, 2006. Например, стандартная защитная группа для аминогруппы, пригодная для применения в настоящем изобретении, представляет собой трет-бутоксикарбонил (Boc), которая легко удаляется обработкой кислотой, такой как трифторуксусная кислота или хлористовородная кислота в органическом растворителе, таком как дихлорметан. Альтернативно, защитная группа аминогруппы может представлять собой бензилоксикарбонильную (Z) группу, которую можно удалять гидрированием с палладиевым катализатором в атмосфере водорода, или 9-флуоренилметилоксикарбонильную (Fmoc) группу, которую можно удалять растворами вторичных органических аминов, таких как диэтиламин или пиперидин, в органическом растворителе. Карбоксильные группы обычно защищают в виде эфиров, таких как метил, этил, бензил или трет-бутил, все из которых можно удалить гидролизом в присутствии оснований, таких как гидроксид лития или натрия. Бензильные защитные группы можно также удалять гидрированием с палладиевым катализатором в атмосфере водорода, тогда как трет-бутильные группы можно также удалять трифторуксусной кислотой. Альтернативно, трихлорэтилэфирную защитную группу удаляют цинком в уксусной кислоте. Стандартная защитная группа для гидрокси группы, пригодная для применения в настоящем изобретении, представляет собой метиловый эфир, условия деблокирования включают кипячение с обратным холодильником в 48% водной HBr в течение 1-24 часов или перемешивание с трибромидом бора в течение 1-24 часов. Альтернативно, когда гидрокси группу защищают в виде бензилового эфира, условия деблокирования включают гидрирование с палладиевым катализатором в атмосфере водорода.
Примеры способов получения, которые можно применять для получения 4-карбоксиимидазолов, описаны в EP 1426364 A1 (ʺImidazole-derivatives as factor Xa inhibitorsʺ, стр. 27-28).
Соединения согласно общей формуле I ниже можно получить, применяя общепринятые способы получения, например, но не ограничиваясь, способ, приведенный на схеме 1.
Соединения формулы (I) определены следующим образом:
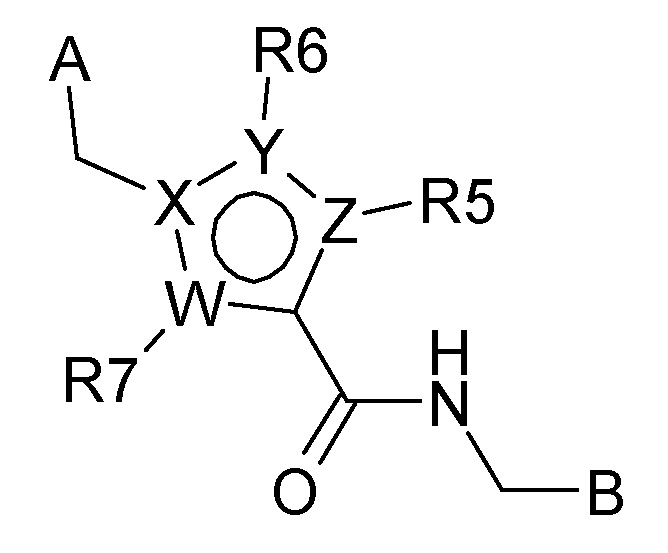
формула (I)
где
B представляет собой фенил, замещенный 1-4 заместителями, выбранными из алкилаb, алкокси, OH, галогена, CN, гетероарила, COOR8, NHCOR8, CONR8R9, OCF3 и CF3;
или B выбран из бензотиофенила, бензофуранила, бензоморфолинила и 5 или 6 членного гетероциклического кольца, содержащего один или более гетероатомов, выбранных из N, O и S; где указанное 5 или 6 членное гетероциклическое кольцо может быть ароматическим или неароматическим; и где указанный бензотиофенил, указанный бензофуранил, указанный бензоморфолинил или указанное 5 или 6 членное гетероциклическое кольцо замещено 1-3 заместителями, выбранными из алкилаb, алкокси, OH, оксо, галогена, CN, гетероарила, COOR8, NHCOR8, CONR8R9, OCF3 и CF3;
W представляет собой C, и X, Y и Z независимо выбраны из C, N, O и S, так что кольцо, содержащее W, X, Y и Z, представляет собой пятичленный ароматический гетероцикл;
R5 и R6 независимо отсутствуют или независимо выбраны из H, алкила, циклоалкила, алкокси, галогена, OH, арила, гетероарила, N-присоединенного пирролидинила, N-присоединенного пиперидинила, N-присоединенного морфолинила, N-присоединенного пиперазинила, -NR8R9, CN, COOR8, CONR8R9, -NR8COR9 и CF3; где, по меньшей мере, один из R5 и R6 присутствует и не является H;
R7 представляет собой H;
A выбран из арила и гетероарила; где арил замещен 1, 2 или 3 заместителями, независимо выбранными из алкила, алкокси, метилендиокси, этилендиокси, OH, галогена, CN, гетероарила, -(CH2)0-3-O-гетероарила, арилаb, -O-арилаb, -(CH2)1-3-арилаb, -(CH2)1-3-гетероарила, -COOR10, -CONR10R11, -(CH2)0-3-NR10R11, OCF3 и CF3; и гетероарил замещен 1, 2 или 3 заместителями, независимо выбранными из алкила, алкокси, OH, OCF3, галогена, CN, арила, -(CH2)1-3-арила, -(CH2)0-3-NR10R11, гетероарилаb, -COOR10, -CONR10R11 и CF3;
R8 и R9 независимо выбраны из H и алкила;
алкил представляет собой линейный насыщенный углеводород, содержащий вплоть до 10 атомов углерода (C1-C10), или разветвленный насыщенный углеводород из 3-10 атомов углерода (C3-C10); алкил можно необязательно замещать 1 или 2 заместителями, независимо выбранными из (C1-C6)алкокси, OH, CN, CF3, COOR10, CONR10R11, фтора и NR10R11;
алкилb представляет собой линейный насыщенный углеводород, содержащий вплоть до 6 атомов углерода, или разветвленный насыщенный углеводород из 3-6 атомов углерода (C3-6); алкилb можно необязательно замещать 1 или 2 заместителями, независимо выбранными из (C1-C6)алкокси, OH, CN, CF3, COOR10, CONR10R11 и фтора;
циклоалкил представляет собой моноциклический насыщенный углеводород из 3-6 атомов углерода;
алкокси представляет собой линейный O-присоединенный углеводород из 1-6 атомов углерода (C1-C6) или разветвленный O-присоединенный углеводород из 3-6 атомов углерода (C3-C6); алкокси можно необязательно замещать 1 или 2 заместителями, независимо выбранными из OH, CN, CF3, COOR10, CONR10R11, фтора и NR10R11;
арил представляет собой фенил, бифенил или нафтил; арил можно необязательно замещать 1, 2 или 3 заместителями, независимо выбранными из алкила, алкокси, метилендиокси, этилендиокси, OH, галогена, CN, гетероарила, -(CH2)0-3-O-гетероарила, арилаb, -O-арилаb, -(CH2)1-3-арилаb, -(CH2)1-3-гетероарила, -COOR10, -CONR10R11, -(CH2)0-3-NR10R11, OCF3 и CF3;
арилb представляет собой фенил, бифенил или нафтил, который можно необязательно замещать 1, 2 или 3 заместителями, независимо выбранными из алкила, алкокси, OH, галогена, CN, -COOR10, -CONR10R11, CF3 и NR10R11;
гетероарил представляет собой 5, 6, 9 или 10 членное моно- или бициклическое ароматическое кольцо, содержащее, при возможности, 1, 2, 3 или 4 кольцевых члена, независимо выбранные из N, NR8, S и O; гетероарил можно необязательно замещать 1, 2 или 3 заместителями, независимо выбранными из алкила, алкокси, OH, OCF3, галогена, CN, арила, -(CH2)1-3-арила, -(CH2)0-3-NR10R11, гетероарилаb, -COOR10, -CONR10R11 и CF3;
гетероарилb представляет собой 5, 6, 9 или 10 членное моно- или бициклическое ароматическое кольцо, содержащее, при возможности, 1, 2 или 3 кольцевых члена, независимо выбранные из N, NR8, S и O; где гетероарилb можно необязательно замещать 1, 2 или 3 заместителями, независимо выбранными из алкила, алкокси, OH, галогена, CN, арила, -(CH2)1-3-арила, -COOR10, -CONR10R11, CF3 и NR10R11;
R10 и R11 независимо выбраны из H, алкила, арилаb и гетероарилаb, или R10 и R11, вместе с атомом азота, с которым они соединены, образуют содержащее углерод 4-, 5-, 6- или 7-членное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, S и O, которое может быть насыщенным или ненасыщенным с 1 или 2 двойными связями и которое может быть необязательно моно- или дизамещенным заместителями, выбранными из оксо, алкила, алкокси, OH, галогена и CF3;
и таутомеры, изомеры, стереоизомеры (включая энантиомеры, диастереомеры и их рацемические и скалемические смеси), их фармацевтически приемлемые соли и сольваты.
На схеме 1, амин 2 конденсируют с кислотой 1, получая соединение 3. Данную конденсацию обычно проводят, применяя стандартные условия конденсации, такие как гидроксибензотриазол и карбодиимид, такой как водорастворимый карбодиимид, в присутствии органического основания. Другие стандартные способы конденсации включают реакцию кислот с аминами в присутствии гексафторфосфата 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметиламиния, гексафторфосфата(V) 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония, гексафторфосфата бензотриазол-1-илокситриспирролидинoфосфония или гексафторфосфата бромтриспирролидинофосфония, в присутствии органических оснований, таких как триэтиламин, диизопропилэтиламин или N-метилморфолин. Альтернативно, образование амида можно осуществлять через хлорангидрид кислоты в присутствии органического основания. Данные хлорангидриды кислот можно получить способами, хорошо известными в литературе, например, реакцией кислоты с оксалилхлоридом или тионилхлоридом. Альтернативно, образование амида можно осуществлять активацией карбоновой кислоты, применяя карбонилдиимидазол.
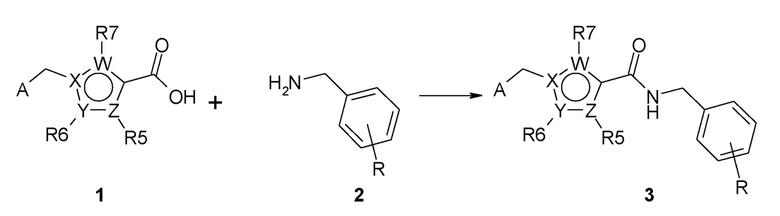
Схема 1
Альтернативно, соединения настоящего изобретения можно получить, применяя способ, показанный на схеме 2a. Кислоту 4 можно конденсировать с амином 2, применяя подходящие способы конденсации, как описано ранее, получая соединение 5. На обычной второй стадии азот гетероциклического кольца алкилируют соединением 6, получая соединение 7. Алкилирование можно осуществлять в присутствии основания, такого как карбонат калия, карбонат цезия, карбонат натрия или гидрид натрия, в данном случае уходящая группа представляет собой галогенид или сульфонат. Альтернативно, алкилирование можно осуществлять, применяя спирт в условиях реакции Мицунобу, в присутствии трифенилфосфина.
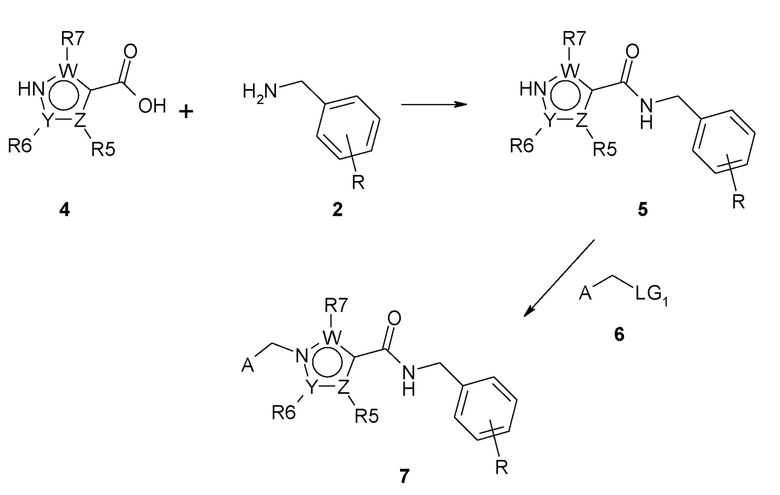
Схема 2a
В варианте схемы 2a соединения общей формулы I можно получить, применяя способ, показанный на схеме 2b. Схема 2b отличается от схемы 2a тем, что фрагмент Y является эквивалентным N, следовательно, можно применять стратегию с защитными группами, и стадии получения осуществлять в отличном порядке. Пиразолкарбоновую кислоту, защищенную в виде эфира (PG), как описано ранее, соединение 8, алкилировали соединением 6. Алкилирование можно осуществлять в присутствии основания, такого как карбонат калия, карбонат цезия, карбонат натрия или гидрид натрия, в данном случае уходящая группа представляет собой галогенид или сульфонат. Альтернативно, алкилирование можно осуществлять, применяя спирт в условиях реакции Мицунобу, в присутствии трифенилфосфина. В данном случае есть два азота для осуществления алкилирования и, следовательно, есть возможность образования двух региоизомеров 9 и 10. Соединения 9 и 10 можно разделить на данной стадии или последующей стадии получения, применяя способы разделения, хорошо известные специалисту в данной области техники, например, хроматографией или фракционной кристаллизацией. Защитную группу соединения 9 удаляют гидролизом, получая соответствующую кислоту 11, применяя стандартные способы, как описано ранее. Соединение 11 можно конденсировать с амином 2, применяя подходящие способы конденсации, как описано ранее, получая соединение 12.
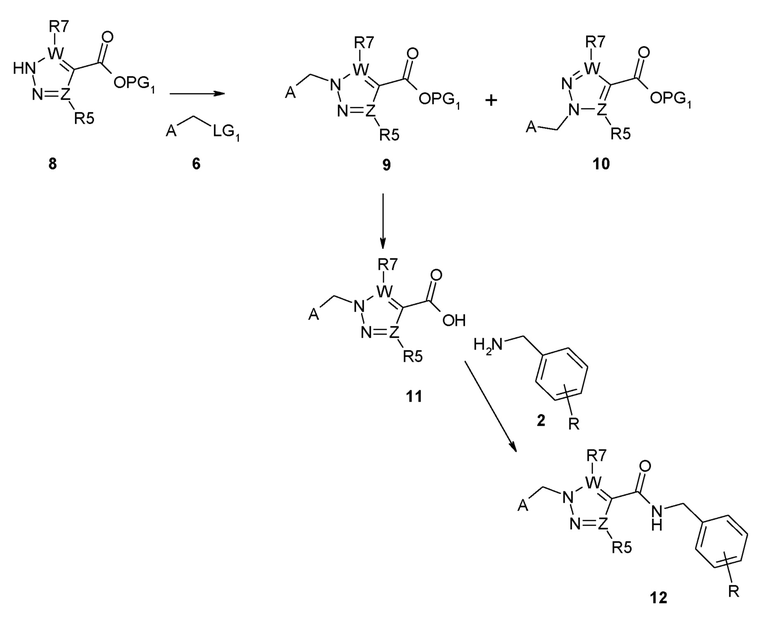
Схема 2b
Альтернативно, соединения согласно настоящему изобретению можно получить, применяя способ, показанный на схеме 3. Пиррол 17 можно получить в две стадии, первая из которых включает реакцию натриевой соли алкилкетоацетата 13, обычно защищенного защитной группой (PG), как описано ранее, с хлоркетоном 14 в присутствии основания, такого как карбонат калия, получая соединение 15, которое на обычной второй стадии реагирует с амином 16 в присутствии кислоты, такой как, но не ограничиваясь, производные серной кислоты, например п-толуолсульфокислота, давая соединение 17, которое на обычной третьей стадии, впоследствии гидролизуют до соответствующей кислоты 18, применяя стандартные способы, как описано ранее. На стандартной четвертой стадии кислоту 18 можно конденсировать с амином 2, применяя подходящие способы конденсации, как описано ранее, получая соединение 19.
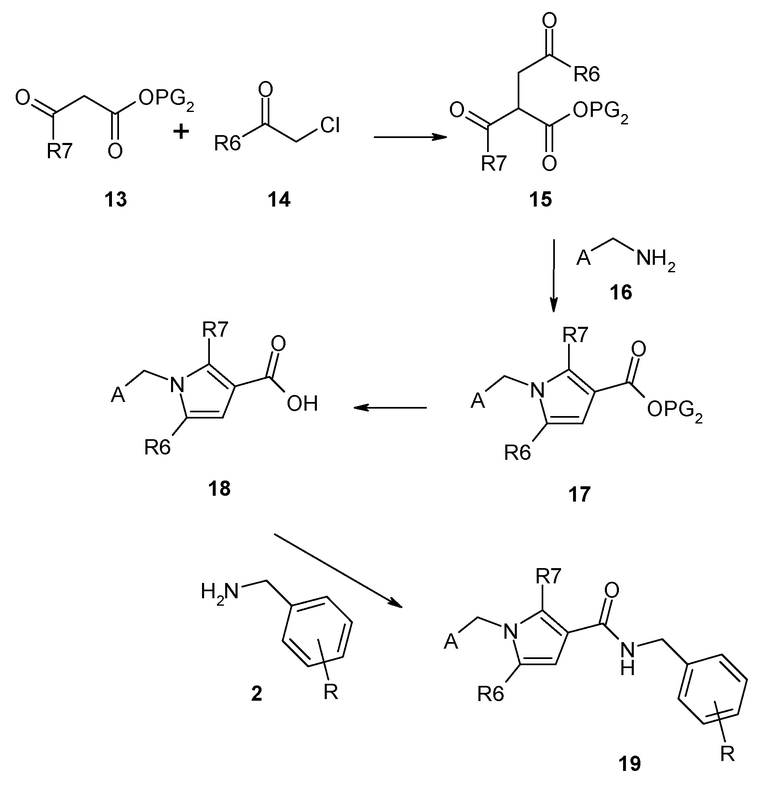
Схема 3
Амин, соединение 2, можно получить, применяя общепринятые способы получения, например, но не ограничиваясь, способы, показанные на схеме 4. Нитрил соединения 20 восстанавливают стандартными восстанавливающими агентами, включая, но не ограничиваясь, алюмогидрид лития, боргидрид натрия, боргидрид натрия и хлорид никеля, боргидрид натрия и хлорид кобальта, боран и каталитическое гидрирование над катализатором, таким как палладий, платина или никель Ренея. В некоторых случаях, например, когда восстанавливающий агент представляет собой боргидрид натрия или применяют каталитическое гидрирование, можно осуществлять in situ защиту полученной в результате аминогруппы, например, получая в результате карбамат 21, например, трет-бутоксикарбамат. Это может быть полезно для обеспечения, например, очистки хроматографией промежуточного соединения 21. Затем, защитную группу удаляют, применяя стандартные условия, как описано ранее, получая соединение 2.
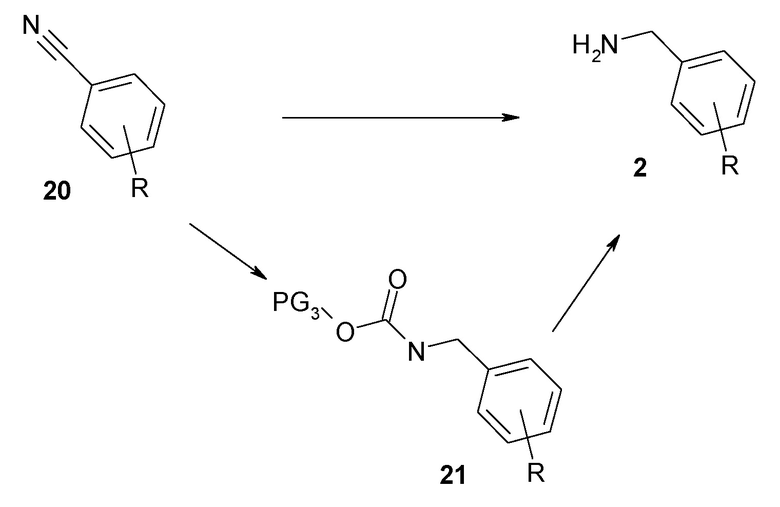
Схема 4
Примеры
Настоящее изобретение проиллюстрировано следующими неограничивающими примерами, в которых применяют следующие сокращения и определения:
Все реакции проводили в атмосфере азота, если не указано иначе.
1H ЯМР спектры регистрировали на Bruker (400МГц) спектрометре относительно дейтерированного растворителя и при комнатной температуре.
Молекулярные ионы получали, применяя LCMS, которую осуществляли, применяя Chromolith Speedrod RP-18e колонку, 50×4,6 мм, с линейным градиентом 10%-90% 0,1% HCO2H/MeCN в 0,1% HCO2H/H2O в течение 13 минут, скорость потока 1,5 мл/мин, или применяя Agilent, X-Select, кислый, 5-95% MeCN/вода в течение 4 мин. Данные собирали, применяя Thermofinnigan Surveyor MSQ масс-спектрометр с электроспрей ионизацией в сочетании с Thermofinnigan Surveyor LC системой.
Когда продукты очищали флэш-хроматографией, 'силикагель' относится к силикагелю для хроматографии, 0,035-0,070 мм (220-440 меш) (например Merck silica gel 60), и прикладывали давление азота вплоть до 10 фунтов на квадратный дюйм, ускоряя элюирование с колонки. Очистку обращено-фазовой препаративной ВЭЖХ осуществляли, применяя Waters 2525 систему бинарного градиентного насоса при скоростях потока обычно 20 мл/мин, применяя Waters 2996 детектор с фотодиодной матрицей.
Все растворители и продажные реагенты применяли, как они были получены.
Химические названия генерировали, применяя автоматизированное программное обеспечение, такое как Autonom программное обеспечение, обеспечиваемое как часть ISIS Draw пакета от MDL Information Systems или Chemaxon программное обеспечение, обеспечиваемое как компонент MarvinSketch или как компонент IDBS E-WorkBook.
A. 1-(4-Гидроксиметилбензил)-1H-пиридин-2-он
4-(Хлорметил)бензиловый спирт (5,0 г, 31,93 ммоль) растворяли в ацетоне (150 мл). Добавляли 2-гидроксипиридин (3,64 г, 38,3 ммоль) и карбонат калия (13,24 г, 95,78 ммоль), и реакционную смесь перемешивали при 50°C в течение 3 часов, после чего растворитель удаляли в вакууме, и остаток растворяли в хлороформ (100 мл). Данный раствор промывали водой (30 мл), соляным раствором (30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), элюент 3% MeOH/97% CHCl3, получая белый твердый остаток, идентифицированный как 1-(4-гидроксиметилбензил)-1H-пиридин-2-он (5,30 г, 24,62 ммоль, 77% выход).
[M+Na]+=238
B1. 1-(4-Хлорметилбензил)-1H-пиридин-2-он
1-(4-Гидроксиметилбензил)-1H-пиридин-2-он (8,45 г, 39,3 ммоль), сухой DCM (80 мл) и триэтиламин (7,66 мл, 55,0 ммоль) охлаждали в бане со льдом. Добавляли метансульфонилхлорид (3,95 мл, 51,0 ммоль) и перемешивали в бане со льдом в течение 15 мин. Баню со льдом удаляли, и перемешивание продолжали при комнатной температуре в течение ночи. Реакционную смесь распределяли между DCM (100 мл) и насыщенным водным раствором NH4Cl (100 мл). Водный слой экстрагировали дополнительным DCM (2×50 мл), и объединенные органические слои промывали соляным раствором (50 мл), сушили над Na2SO4, фильтровали и концентрировали, получая 1-(4-хлорметилбензил)-1H-пиридин-2-он (8,65 г, 36,6 ммоль, 93% выход) в виде бледно-желтого твердого остатка.
[MH]+=234,1
B2. 1-(4-Бромметилбензил)-1H-пиридин-2-он
1-(4-Гидроксиметилбензил)-1H-пиридин-2-он (2,30 г, 6,97 ммоль) растворяли в DCM (250 мл). К данному раствору добавляли трибромид фосфора (5,78 г, 21,37 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и разбавляли CHCl3 (250 мл). Фильтрат промывали насыщенным NaHCO3 (водн.) (30 мл), водой (30 мл), соляным раствором (30 мл), сушили (Na2SO4) и упаривали в вакууме, получая белый твердый остаток, который идентифицировали как 1-(4-бромметилбензил)-1H-пиридин-2-он (2,90 г, 10,43 ммоль, 98%).
[M+H]+=277,7
C. Метил 3-(метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоксилат
Карбонат калия (519 мг, 3,76 ммоль) добавляли к раствору метил 3-(метоксиметил)-1H-пиразол-4-карбоксилата (320 мг, 1,88 ммоль; CAS no. 318496-66-1 (полученному согласно способу, описанному в WO 2012/009009)) и 1-(4-(хлорметил)бензил)пиридин-2(1H)-она (527 мг, 2,26 ммоль) в DMF (5 мл) и нагревали при 60 °C в течение ночи. Реакционную смесь разбавляли EtOAc (50 мл) и промывали соляным раствором (2×100 мл), сушили над сульфатом магния, фильтровали и упаривали в вакууме. Неочищенный продукт очищали флэш-хроматографией (40 г колонка, 0-100% EtOAc в изогексане), получая два региоизомера. Второй изомер, элюирующийся с колонки, собирали, получая метил 3-(метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоксилат (378 мг, 1,01 ммоль, 53,7% выход) в виде бесцветной смолы.
[MH]+=368,2
D. 3-(Метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоновая кислота
К метил 3-(метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоксилату (3,77 г, 10,26 ммоль) в THF (5 мл) и MeOH (5 мл) добавляли 2M NaOH раствор (15,39 мл, 30,8 ммоль) и перемешивали при комнатной температуре в течение ночи. Добавляли 1M HCl (50 мл) и экстрагировали EtOAc (50 мл). Органический слой промывали соляным раствором (50 мл), сушили над сульфатом магния, фильтровали и упаривали в вакууме, получая 3-(метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоновую кислоту (1,22 г, 3,45 ммоль, 33,6% выход) в виде белого порошка.
[MH]+=354,2
G. [4-(4-Метилпиразол-1-илметил)фенил]метанол
4-(Хлорметил)бензиловый спирт (5,47 г, 34,9 ммоль) растворяли в ацетоне (50 мл). Добавляли 4-метилпиразол (2,86 г, 34,9 ммоль) и карбонат калия (5,07 г, 36,7 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 18 часов и при 60 °C в течение 30 часов, после чего растворитель удаляли в вакууме, и остаток растворяли в EtOAc (100 мл). Данный раствор промывали водой (30 мл), соляным раствором (30 мл), сушили (MgSO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), градиент элюента 10-80% EtOAc в изогексане, фракции объединяли и упаривали в вакууме, получая белый твердый остаток, идентифицированный как [4-(4-метилпиразол-1-илметил)фенил]метанол (3,94 г, 18,90 ммоль, 54% выход).
[MH]+=203
H. 1-(4-Хлорметилбензил)-4-метил-1H-пиразол
[4-(4-Метилпиразол-1-илметил)фенил]метанол (2,03 г, 10,04 ммоль) и триэтиламин (1,13 г, 11,54 ммоль) растворяли в DCM (40 мл). К данному раствору добавляли по каплям метансульфонилхлорид (1,26 г, 11,04 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и разбавляли CHCl3 (250 мл). Смесь промывали насыщенным NH4Cl (30 мл), водой (30 мл), соляным раствором (30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), градиент элюента 0-60% EtOAc в изогексане, фракции объединяли и упаривали в вакууме, получая белый твердый остаток, идентифицированный как 1-(4-хлорметилбензил)-4-метил-1H-пиразол (1,49 г, 6,62 ммоль, 60% выход).
[MH]+=221, 223
M. Этиловый эфир 3-амино-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты
1-(4-Бромметилбензил)-1H-пиридин-2-он (850 мг, 3,06 ммоль) растворяли в DMF (10 мл). Добавляли этиловый эфир 5-амино-1H-пиразол-4-карбоновой кислоты (522 мг, 3,36 ммоль) и карбонат цезия (1,99 г, 6,11 ммоль), и реакционную смесь перемешивали при 50 °C в течение 18 часов, после чего реакционную смесь разбавляли EtOAc (100 мл). Данный раствор промывали водой (30 мл), соляным раствором (30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), градиент элюента от 30% петролейный эфир/70% EtOAc до 100% EtOAc, получая два региоизомера. Второй изомер, покидающий колонку, собирали, получая этиловый эфир 3-амино-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты (480 мг, 1,36 ммоль, 45% выход) в виде белого твердого остатка.
[MH]+=353,1
N. 3-Амино-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновая кислота
Этиловый эфир 3-амино-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты (480 мг, 1,36 ммоль) растворяли в THF (50 мл) и воде (5 мл). Добавляли гидроксид лития (16 3 мг, 6,81 ммоль). Реакционную смесь перемешивали при 50°C в течение 18 часов, после чего летучие компоненты удаляли в вакууме, и водный остаток промывали CHCl3 (150 мл). Водный слой подкисляли 1M HCl до pH7 и экстрагировали CHCl3 (3×50 мл). Объединенные экстракты промывали водой (30 мл), соляным раствором (30 мл), сушили (Na2SO4) и упаривали в вакууме, получая белый твердый остаток, идентифицированный как 3-амино-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновая кислота (370 мг, 1,14 ммоль, 84% выход).
[MH]+=325,2
P. трет-бутиловый эфир (2-Фтор-3-метоксибензил)карбаминовой кислоты
2-Фтор-3-метоксибензонитрил (500 мг, 3,31 ммоль) растворяли в метаноле (40 мл). Данный раствор охлаждали до 0°C. Добавляли гексагидрат хлорида никеля (II) (79 мг, 0,33 ммоль) и ди-трет-бутилдикарбонат (1,44 г, 6,62 ммоль), с последующим добавлением порциями боргидрида натрия (876 мг, 23,16 ммоль). Реакционную смесь перемешивали, нагревали до комнатной температуры и перемешивали в течение 3 дней. MeOH удаляли в вакууме. Остаток растворяли в CHCl3 (150 мл), промывали насыщенным NaHCO3 (водн.) (50 мл), водой (50 мл), соляным раствором (50мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали хроматографией (силикагель), элюент 20% EtOAc/80% петролейный эфир, получая белый твердый остаток, идентифицированный как трет-бутиловый эфир (2-фтор-3-метоксибензил)карбаминовой кислоты (540 мг, 0,2 ммоль, 64% выход).
[MH]+=255,8
Q. Гидрохлорид 2-фтор-3-метоксибензиламина
трет-Бутиловый эфир (2-Фтор-3-метоксибензил)карбаминовой кислоты (600 мг, 2,35 ммоль) растворяли в 4M HCl в диоксане (40 мл). Через 2 часа при комнатной температуре растворитель удаляли в вакууме, получая бледно-желтый твердый остаток, идентифицированный как гидрохлорид 2-фтор-3-метоксибензиламина (414 мг, 2,17 ммоль, 92% выход).
[MH]+=155,9
T. 1-трет-Бутил 4-этил 3-аминопиразол-1,4-дикарбоксилат
К этиловому эфиру 5-амино-1H-пиразол-4-карбоновой кислоты (250 мг, 1,61 ммоль) в DCM (10 мл) добавляли ди-трет-бутилдикарбонат (352 мг, 1,61 ммоль) и диизопропилэтиламин (702 мкл, 521 мг, 4,03 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли DCM, добавляли воду, разделяли, промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали в вакууме. Флэш-хроматография давала 1-трет-бутил 4-этил 3-аминопиразол-1,4-дикарбоксилат в виде белого твердого остатка (122 мг, 30% выход).
[MH]+=256,2
U. Этил 3-ацетамидо-1H-пиразол-4-карбоксилат
Смесь 1-трет-бутил 4-этил 3-аминопиразол-1,4-дикарбоксилата и ацетилхлорида перемешивали при 0°C, затем кипятили с обратным холодильником в течение 2 часов. Избыточный ацетилхлорид удаляли в вакууме. Добавляли воду, и полученную в результате смесь перемешивали в течение 18 часов при комнатной температуре. Осадок собирали фильтрованием в вакууме и сушили, получая этил 3-ацетамидо-1H-пиразол-4-карбоксилат в виде белого твердого остатка (46 мг). Водный фильтрат экстрагировали DCM (4×15 мл) и объединенные органические слои сушили (MgSO4), фильтровали и концентрировали в вакууме, получая дополнительную порцию этил 3-ацетамидо-1H-пиразол-4-карбоксилата (48 мг) (суммарный выход 94 мг, 99%).
[MH]+=197,8
V. эфир 5-диметиламино-1H-пиразол-4-карбоновой кислоты
Эфир 5-Амино-1H-пиразол-4-карбоновой кислоты (1,0 г, 6,45 ммоль) растворяли в метаноле (200 мл) и раствор продували азотом. Добавляли формальдегид (37% по весу, 4,5 мл, 21,18 ммоль), с последующим добавлением 10% Pd/C (1,0 г). Реакционную смесь встряхивали на Parr гидрогенизаторе при 10 фунт/кв. дюйм в течение 18 часов. Реакционную смесь фильтровали через целит, удаляя катализатор, и остаток промывали метанолом (200 мл) и водой (20 мл). Объединенные фильтраты упаривали в вакууме. Неочищенный остаток растирали с метанолом/диэтиловым эфиром, и фильтрат концентрировали, получая бесцветное масло, идентифицированный как заявленное в заголовке соединение (1,1 г, 6,00 ммоль, 93% выход).
[MH]+= 183,7
Справочные примеры
Справочные примеры A-G соответствуют примерам 1, 2, 3, 41, 77, 83 и 126 нашей родственной заявки PCT/GB2015/053615 (WO2016/083820).
Справочный пример H соответствует примеру 88 нашей родственной заявки PCT/GB2015/053615 (WO2016/083820).
Справочные примеры I и J являются аналогами примеров 7 и 27 WO2103/111108.
Справочный пример K представляет собой аналог примера 79 настоящий заявки.
Справочный пример A
N-(3,5-Диметоксибензил)-3-(метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоксамид
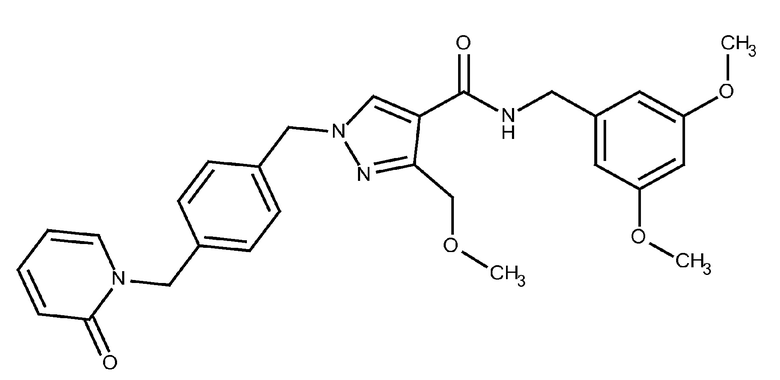
К смеси 3-(метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоновой кислоты (80 мг, 0,226 ммоль), (3,5-диметоксифенил)метамина (45,4 мг, 0,272 ммоль) и HATU (95 мг, 0,249 ммоль) в безводном DCM (1,5 мл) и безводном DMF (0,3 мл) добавляли N,N-диизопропилэтиламин (99 мкл, 0,566 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме, и остаток очищали флэш-хроматографией, загружая в DCM, элюируя градиентом 1-10% MeOH (содержащем 0,3% NH3)/DCM, получая смолу. Ее растворяли в ацетонитриле (0,5 мл) и добавляли воду (3 мл), получая осадок. Его обрабатывали ультразвуком, затем фильтровали и сушили в вакууме, получая N-(3,5-диметоксибензил)-3-(метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоксамид (76 мг, 0,150 ммоль, 66,1% выход) в виде липкого бледно-желтого твердого остатка.
ЯМР (d6-DMSO) δ: 3,20 (3H, с), 3,71 (6H, с), 4,32 (2H, д, J=5,8Гц), 4,53 (2H, с), 5,07 (2H, с), 5,28 (2H, с), 6,22 (1H, тд, J=6,7, 1,4Гц), 6,37 (1H, т, J=2,3Гц), 6,40 (1H, дд, J=9,2, 1,4Гц), 6,44 (2H, д, J=2,3Гц), 7,20-7,29 (4H, м), 7,41 (1H, ддд, J=9,1, 6,6, 2,1Гц), 7,76 (1H, дд, J=6,8, 2,1Гц), 8,24 (1H, с), 8,32 (1H, т, J=5,9Гц).
[MH]+=503,3
Справочный пример B
2-фтор-3-метоксибензиламид 3-Амино-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты
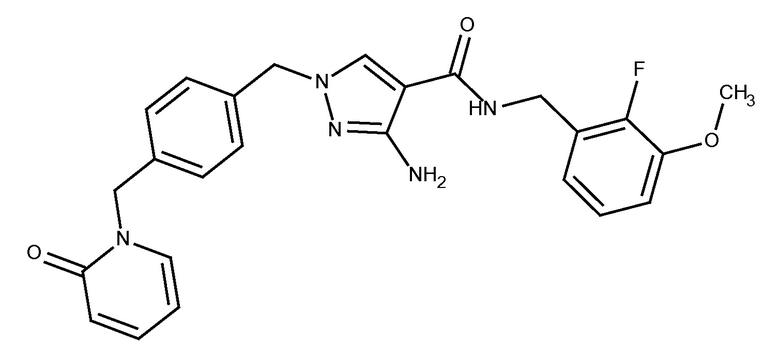
3-Амино-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновую кислоту (75 мг, 0,23 ммоль) растворяли в DCM (20 мл) и DMF (1 мл). Данный раствор охлаждали до 0 °C. Добавляли гидрохлорид 2-Фтор-3-метоксибензиламина (53 мг, 0,28 ммоль), с последующим добавлением HOBt (34 мг, 0,25 ммоль) и триэтиламина (70 мг, 0,69 ммоль). Затем добавляли водорастворимый карбодиимид (53 мг, 0,28 ммоль). Реакционную смесь перемешивали, нагревали до комнатной температуры и перемешивали в течение 3 дней. Смесь разбавляли хлороформом (200 мл) и промывали NaHCO3 (водн.) (50 мл), водой (50 мл) и соляным раствором (50 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), элюент 4% MeOH/96% CHCl3, получая белый твердый остаток, идентифицированный как 2-фтор-3-метоксибензиламид 3-амино-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты (92 мг, 0,20 ммоль, 86% выход).
[MH]+=462,2
1H ЯМР: (d6-DMSO) δ: 3,82 (3H, с), 4,36 (2H, д, J=5,7Гц), 5,04 (2H, с), 5,07 (2H, с), 5,38 (2H, с), 6,21-6,24 (1H, м), 6,39 (1H, т, J=0,7Гц), 6,86-6,87 (1H, м), 7,04-7,07 (2H, м), 7,20 (2H, д, J=8,1Гц), 7,26 (2H, д, J=8,1Гц), 7,39-7,43 (1H, м), 7,76 (1H, дд, J=6,6, 1,6Гц), 8,00 (1H, с), 8,27 (1H, т, J=5,9Гц).
Справочный пример C
2-Фтор-3-метоксибензиламид 1-(7-хлорхинолин-3-илметил)-3-метоксиметил-1H-пиразол-4-карбоновой кислоты
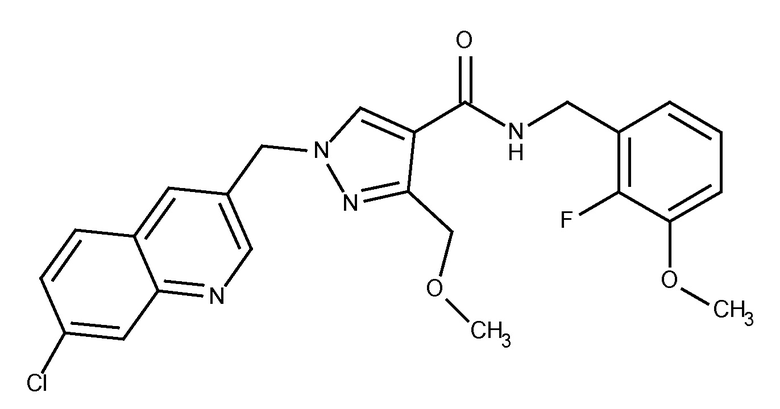
(7-Хлорхинолин-3-ил)метанол
7-Хлорхинолин-3-карбоновую кислоту (500 мг, 2,4 ммоль) растворяли в безводном THF (20 мл) и охлаждали до -20 °C. К данному раствору добавляли триэтиламин (1,0 мл, 7,23 ммоль) и изобутилхлороформиат (0,38 мл, 2,9 ммоль). Реакционную смесь перемешивали при -20 °C в течение 20 мин, и затем выливали в раствор боргидрида натрия (731 мг, 19 ммоль) в воде (2 мл) при 0 °C. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 часов. Смесь разбавляли EtOAc (50 мл), и слои разделяли. Органический слой промывали водой (20 мл), соляным раствором (20 мл), сушили (Na2SO4), фильтровали и упаривали в вакууме, получая желтый твердый остаток. Твердый остаток очищали хроматографией на силикагеле, элюируя EtOAc/петролейный эфир, получая (7-хлорхинолин-3-ил)метанол в виде грязно-белого твердого остатка, 134 мг, 29% выход.
[MH]+=194,1
3-Бромметил-7-хлорхинолин
(7-Хлорхинолин-3-ил)метанол (134 мг, 0,692 ммоль) растворяли в DCM (5 мл). Добавляли PBr3 (65 мкл, 0,692 ммоль), и реакционную смесь перемешивали в течение 3 часов при комнатной температуре. После завершения, реакционную смесь гасили разбавленным NaHCO3 (водн.) (10 мл). Слои разделяли, и органический слой промывали водой (10 мл) и соляным раствором (10 мл). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме, получая желтый твердый остаток, идентифицированный как 3-бромметил-7-Хлорхинолин (78 мг, 44% выход).
[MH]+=257,6
Метиловый эфир 1-(7-хлорхинолин-3-илметил)-3-метоксиметил-1H-пиразол-4-карбоновой кислоты
Метил 3-(метоксиметил)-1H-пиразол-4-карбоксилат (51 мг, 0,304 ммоль; CAS no. 318496-66-1 (полученный согласно способу, описанному в WO 2012/009009)) растворяли в DMF (2 мл) и обрабатывали карбонатом калия (84 мг, 0,608 ммоль) и 3-бромметил-7-хлорхинолином (78 мг, 0,304 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли EtOAc (60 мл) и воду (20 мл), и слои разделяли. Органический слой промывали водой (3×10 мл), соляным раствором (10 мл), сушили (MgSO4), фильтровали и упаривали в вакууме. Остаток очищали хроматографией, элюируя EtOAc/петролейный эфир, получая два изомерных продукта. Более быстро элюирующийся продукт идентифицировали как побочный региоизомер. Медленно элюирующийся продукт давал желтое масло, и его идентифицировали как метиловый эфир 1-(7-хлорхинолин-3-илметил)-3-метоксиметил-1H-пиразол-4-карбоновой кислоты (53 мг, 50% выход).
[MH]+=345,8
1-(7-Хлорхинолин-3-илметил)-3-метоксиметил-1H-пиразол-4-карбоновая кислота
К метиловому эфиру 1-(7-хлорхинолин-3-илметил)-3-метоксиметил-1H-пиразол-4-карбоновой кислоты (53 мг, 0,153 ммоль) в этаноле (10 мл) добавляли гидроксид натрия (61 мг, 1,53 ммоль), и реакционную смесь нагревали при интенсивном кипячении в течение 4,5 часов. Смесь охлаждали и концентрировали в вакууме. Остаток разбавляли водой (5 мл), доводили pH до 3,6 2M HCl и экстрагировали смесью 90% хлороформ/10% изопропиловый спирт (6×15 мл). Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали в вакууме, получая 1-(7-хлорхинолин-3-илметил)-3-метоксиметил-1H-пиразол-4-карбоновую кислоту в виде бледно-желтого твердого остатка (50 мг, 98% выход).
[MH]+=332
2-Фтор-3-метоксибензиламид 1-(7-Хлорхинолин-3-илметил)-3-метоксиметил-1H-пиразол-4-карбоновой кислоты
1-(7-Хлорхинолин-3-илметил)-3-метоксиметил-1H-пиразол-4-карбоновую кислоту (25 мг, 0,075 ммоль) растворяли в DCM (5 мл) при 0°C. К раствору добавляли триэтиламин (52 мкл, 0,377 ммоль), HOBt (12 мг, 0,09 ммоль) и водорастворимый карбодиимид (20 мг, 0,106 ммоль). Через 15 мин добавляли гидрохлорид 2-фтор-3-метоксибензиламина (14 мг, 0,075 ммоль), и реакционную смесь нагревали до комнатной температуры и перемешивали в течение выходных. Реакционную смесь разбавляли CHCl3 (50 мл) и промывали насыщенным водным NaHCO3 (20 мл), с последующей промывкой водой (20 мл) и соляным раствором (20 мл). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией, элюируя смесью 6% метанол/94% DCM, получая белый твердый остаток (16 мг, 45% выход), идентифицированный как 2-фтор-3-метоксибензиламид 1-(7-хлорхинолин-3-илметил)-3-метоксиметил-1H-пиразол-4-карбоновой кислоты.
[MH]+=469
1H ЯМР (DMSO): 3,20 (3H, с), 3,82 (3H, с), 4,41 (2H, д, J=5,8Гц), 4,54 (2H, с), 5,57 (2H, с), 6,87-6,91 (1H, м), 7,03-7,09 (2H, м), 7,67 (1H, дд, J=8,8, 2,1Гц), 8,07 (1H, д, J=8,8Гц), 8,10 (1H, д, J=1,9Гц), 8,30 (1H, д, J=1,7Гц), 8,37 (1H, с), 8,39 (1H, т, J=5,8Гц), 8,92 (1H, д, J=2,2Гц)
Справочный пример D
3-Фтор-4-метоксипиридин-2-карбонитрил
В большую пробирку для СВЧ-нагревания, цианомедь (1,304 г, 14,56 ммоль) добавляли к раствору 2-бром-3-фтор-4-метоксипиридина (1 г, 4,85 ммоль) в DMF (5 мл). Реакционную пробирку герметично закрывали и нагревали при 100°C в течение 16 часов. Реакционную смесь разбавляли водой (20 мл) и EtOAc (20 мл). Густую суспензию обрабатывали ультразвуком и добавляли дополнительную воду (40 мл) и EtOAc (2×50 мл) при обработке ультразвуком, разрушая выпадающий твердый остаток. Объединенные слои фильтровали через слой целита и органический слой отделяли, промывали соляным раствором (50 мл), сушили над сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении, получая бледно-зеленый твердый остаток, идентифицированный как требуемое соединение, 3-фтор-4-метоксипиридин-2-карбонитрил (100 мг, 0,578 ммоль, 12% выход)
трет-бутиловый эфир (3-Фтор-4-метоксипиридин-2-илметил)карбаминовой кислоты.
3-Фтор-4-метоксипиридинe-2-карбонитрил (100 мг, 0,578 ммоль) растворяли в безводном метаноле (10 мл, 247 ммоль) и добавляли гексагидрат хлорида никеля (14 мг, 0,058 ммоль), с последующим добавлением ди-трет-бутилдикарбоната (255 мг, 1,157 ммоль). Полученный в результате бледно-зеленый раствор охлаждали в бане со льдом и солью до -5°C, и затем добавляли порциями боргидрид натрия (153 мг, 4,05 ммоль), поддерживая температуру реакции ~0°C. Темно-коричневый раствор перемешивали при 0°C и медленно нагревали до комнатной температуры, и затем перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь упаривали досуха при 40°C, получая черный остаток, который разбавляли DCM (10 мл) и промывали бикарбонатом натрия (10 мл). Образовывалась эмульсия, поэтому органическую фазу отделяли картриджем для разделения фаз и концентрировали. Неочищенную жидкость очищали хроматографией, элюируя EtOAc/изогексан, получая заявленное в заголовке соединение, трет-бутиловый эфир (3-фтор-4-метоксипиридин-2-илметил)карбаминовой кислоты, в виде прозрачного желтого масла (108 мг, 62% выход)
[MH]+=257
гидрохлоридная соль C-(3-Фтор-4-метоксипиридин-2-ил)метиламина
трет-Бутиловый эфир (3-фтор-4-метоксипиридин-2-илметил)карбаминовой кислоты (108 мг, 0,358 ммоль) растворяли в изопропиловом спирте (1 мл) и затем добавляли HCl (6N в изопропиловом спирте) (1 мл, 0,578 ммоль) при комнатной температуре и перемешивали при 40°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, и затем растирали с эфиром, обрабатывали ультразвуком, и затем декантировали, получая кремовый твердый остаток (75 мг, 55% выход), идентифицированный как гидрохлоридная соль C-(3-фтор-4-метоксипиридин-2-ил)метиламина.
[MH]+=157
(3-фтор-4-метоксипиридин-2-илметил)амид 3-метоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты
3-(Метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоновую кислоту (75 мг, 0,212 ммоль), гидрохлоридную соль C-(3-Фтор-4-метоксипиридин-2-ил)метиламина (49 мг, 0,212 ммоль) и HATU (89 мг, 0,233 ммоль) суспендировали в безводном DCM (3 мл), к которому добавляли триэтиламин (177 мкл, 1,270 ммоль), обрабатывали ультразвуком, и затем перемешивали при комнатной температуре в течение 4 часов. Растворитель удаляли при пониженном давлении, и полученный в результате остаток гасили раствором хлорида аммония (5 мл). Образовывался грязно-белый твердый остаток, который обрабатывали ультразвуком, фильтровали при пониженном давлении, промывали водой, и затем помещали в вакуумную печь при 40 °C в течение ночи. Неочищенный материал очищали хроматографией, элюируя (1% аммиак-метанол)/DCM, получая (3-фтор-4-метоксипиридин-2-илметил)амид 3-метоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты в виде белого твердого остатка (67 мг, 64% выход)
[MH]+=492
ЯМР (d6-DMSO) δ: 3,25 (3H, с), 3,92 (3H, с), 4,46-4,57 (4H, м), 5,07 (2H, с), 5,28 (2H, с), 6,22 (1H, тд, J=1,4, 6,7Гц), 6,39 (1H, ддд, J=0,7, 1,4, 9,2Гц), 7,17-7,28 (5H, м), 7,41 (1H, ддд, J=2,1, 6,6, 8,9Гц), 7,75 (1H, ддд, J=0,7, 2,1, 6,8Гц), 8,21-8,29 (2H, м), 8,42 (1H, т, J=5,4Гц)
Справочный пример E
6-Бром-2-фтор-3-метоксибензойная кислота
К суспензии 2-фтор-3-метоксибензойной кислоты (10 г, 58,8 ммоль) в уксусной кислоте (50 мл) и воде (50 мл) при комнатной температуре добавляли по каплям бром (6,06 мл, 118 ммоль). Затем, реакционную смесь нагревали при 60°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, и белый осадок фильтровали. Твердый остаток промывали водой (200 мл) и изогексаном (50 мл), получая 6-бром-2-фтор-3-метоксибензойную кислоту в виде белого твердого остатка, 12,098 г, 82% выход.
[MH]+=249/251
(6-Бром-2-фтор-3-метоксифенил)метанол
К перемешиваемому раствору 6-бром-2-фтор-3-метоксибензойной кислоты (4,13 г, 16,58 ммоль) в THF (20 мл) добавляли 4-метилморфолин (1,914 мл, 17,41 ммоль), и затем изобутилхлорформиат (2,15 мл, 16,58 ммоль). Через 1 час реакционную смесь фильтровали, удаляя любые образовавшиеся соли, твердый остаток промывали дополнительным THF (10 мл). Фильтрат и промывки объединяли и охлаждали до 0 °C в бане со льдом, и затем добавляли NaBH4 (0,659 г, 17,41 ммоль) в холодной воде (10 мл) одной порцией (выделялся газ), затем нагревали до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь гасили аккуратным добавлением 1M HCl (30 мл) до получения кислого pH. Продукт экстрагировали в диэтиловый эфир (150 мл). Затем, органический слой промывали 2M NaOH (2×100 мл), удаляя исходную карбоновую кислоту, затем подкисляли промывкой 1M HCl (100 мл), с последующей промывкой соляным раствором (100 мл), сушили над сульфатом магния, фильтровали, и растворитель удаляли в вакууме. Неочищенный продукт очищали хроматографией, элюируя 0-50% EtOAc/изогексан, получая (6-бром-2-фтор-3-метоксифенил)метанол в виде бесцветного масла, 1,37 г, 50% выход.
[MH]+=217/219
1-Бром-2-хлорметил-3-фтор-4-метоксибензол
Раствор (6-бром-2-фтор-3-метоксифенил)метанола (500 мг, 2,127 ммоль) в безводном DCM (4 мл) обрабатывали триэтиламином (415 мкл, 2,98 ммоль), с последующей обработкой метансульфонилхлоридом (214 мкл, 2,77 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь распределяли между DCM (50 мл) и насыщенным водным NH4Cl (40 мл). Органический слой собирали, и водный слой экстрагировали дополнительным DCM (40 мл). Объединенные органические слои промывали водой (40 мл), соляным раствором (40 мл), сушили (Na2SO4), фильтровали и концентрировали. Неочищенный материал очищали хроматографией, элюируя градиентом 0-30% EtOAc/изогексан, получая 1-бром-2-хлорметил-3-фтор-4-метоксибензол (468 мг, 86% выход) в виде белого твердого остатка.
2-(6-Бром-2-фтор-3-метоксибензил)изоиндол-1,3-дион
К раствору 1-бром-2-хлорметил-3-фтор-4-метоксибензолу (460 мг, 1,815 ммоль) в безводном DMF (5 мл) добавляли фталимид калия (403 мг, 2,178 ммоль), и смесь нагревали при 90 °C в течение ночи. Смесь разбавляли EtOAc (75 мл) и промывали водой (3×35 мл), соляным раствором (35 мл), сушили (Na2SO4), фильтровали и концентрировали до желтого твердого остатка. Неочищенный материал очищали флэш-хроматографией, элюируя градиентом 0-50% EtOAc/изогексан. Требуемый продукт, 2-(6-бром-2-фтор-3-метоксибензил)изоиндол-1,3-дион, выделяли в виде белых игольчатых кристаллов, 372 мг, 56% выход.
[MH]+=364,0/366,0
6-Бром-2-фтор-3-метоксибензиламин
Суспензию 2-(6-бром-2-фтор-3-метоксибензил)изоиндол-1,3-диона (0,368 г, 1,011 ммоль) в метаноле (7,5 мл) обрабатывали гидразингидратом (0,064 мл, 1,314 ммоль), и реакционную смесь кипятили с обратным холодильником в течение 5 часов. Неочищенную смесь загружали непосредственно на SCX колонку (8 г), промывали MeOH и элюировали 1% NH3/MeOH, получая 6-бром-2-фтор-3-метоксибензиламин (204 мг, 85% выход) в виде желтого масла
[MH]+=233,9/235,9
6-Бром-2-фтор-3-метоксибензиламид 3-метоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты
В 25 мл колбу загружали 3-(метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоновую кислоту (130 мг, 0,368 ммоль), 6-бром-2-фтор-3-метоксибензиламин (86 мг, 0,368 ммоль), HATU (154 мг, 0,405 ммоль), безводный DCM (3 мл) и безводный DMF (0,5 мл). Добавляли N,N-диизопропилэтиламин (160 мкл, 0,920 ммоль), и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали в вакууме и растворяли в MeOH (4 мл), затем очищали SCX, промывали MeOH, элюировали 1% NH3/MeOH. Остаток дополнительно очищали хроматографией, элюируя градиентом 0-10% MeOH (содержащим 0,3% NH3)/DCM, получая 6-бром-2-фтор-3-метоксибензиламид 3-метоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты (191 мг, 89% выход) в виде белой пены.
[MH]+=569,2/571,2
6-Циано-2-фтор-3-метоксибензиламид 3-метоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты
К дегазированному раствору дицианоцинка (24,13 мг, 0,205 ммоль) и 6-бром-2-фтор-3-метоксибензиламида 3-метоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты (90 мг, 0,158 ммоль) в диметилацетамиде (1,2 мл) добавляли тетракис(трифенилфосфин)палладий(0) (18,26 мг, 0,016 ммоль), и нагревали при 110°C в течение ночи. Смесь очищали хроматографией элюируя градиентом 0-10% (0,3% NH3/MeOH)/DCM, получая 6-циано-2-фтор-3-метоксибензиламид 3-метоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты aв виде бледно-желтой пены, 21 мг, 25% выход.
[MH]+=516,3
1H ЯМР (d6-DMSO) δ: 3,21 (3H, с), 3,92 (3H, с), 4,47-4,55 (4H, м), 5,06 (2H, с), 5,27 (2H, с), 6,21 (1H, тд, J=6,7, 1,4Гц), 6,39 (1H, д, J=9,1Гц), 7,17-7,31 (5H, м), 7,40 (1H, ддд, J=8,9, 6,6, 2,1Гц), 7,67 (1H, дд, J=8,6, 1,5Гц), 7,75 (1H, дд, J=6,8, 2,1Гц), 8,20 (1H, с), 8,40 (1H, т, J=5,2Гц)
Справочный пример F
2-Хлор-3-фтор-6-метоксибензальдегид
В охлажденную на льду колбу, содержащую метанол (8 мл, 198 ммоль), медленно добавляли гидрид натрия (1,318 г, 33,0 ммоль). После завершения добавления охлаждающую баню удаляли, и затем нагревали до комнатной температуры. Во второй колбе (250 мл колбе) 2-хлор-3,6-дифторбензальдегид (5 г, 27,5 ммоль) растворяли в смеси безводного метанола (60 мл, 1483 ммоль) и THF (25 мл, 305 ммоль) и нагревали до 60°C. В это время при 60°C медленно добавляли к реакционной смеси раствор метоксида натрия. После завершения добавления реакционную смесь нагревали при 60°C в течение ночи. Растворитель удаляли при пониженном давлении, получая светло-желтый твердый остаток, который гасили водой (100 мл), обрабатывали ультразвуком, и затем перемешивали в течение 30 мин. Полученный в результате желтый осадок фильтровали, промывали водой, и затем сушили при пониженном давлении перед переносом в вакуумную печь при 40°C в течение ночи. Неочищенный остаток очищали хроматографией, элюируя EtOAc/изогексан, получая требуемое соединение, 2-хлор-3-фтор-6-метокси-бензальдегид, в виде грязно-белого твердого остатка, 3,19 г, 61% выход.
[MH]+=189/191
2-Хлор-3-дифторметил-1-фтор-4-метоксибензол
2-Хлор-3-фтор-6-метоксибензальдегид (2 г, 10,61 ммоль) растворяли в безводном DCM (30 мл, 466 ммоль) в атмосфере баллона, заполненного азотом, и охлаждали в бане со льдом и солью. К раствору добавляли по каплям трифторид диэтиламиносеры (4,20 мл, 31,8 ммоль), получая желтый раствор. Реакционную смесь перемешивали при 0°C в течение 5 минут, и затем охлаждающую баню удаляли, и реакционную смесь нагревали до комнатной температуры в течение ночи. Реакционную смесь медленно гасили насыщенным бикарбонатом натрия (100 мл), органический слой отделяли, промывали соляным раствором (100 мл) и сушили, применяя картридж для разделения фаз. Растворитель удаляли при пониженном давлении, получая оранжевое масло, которое очищали хроматографией, элюируя EtOAc/изогексан. 2-Хлор-3-дифторметил-1-фтор-4-метоксибензол (1,0 г, 43% выход) выделяли в виде бледно-желтого масла, которое затвердевало при стоянии.
2-Дифторметил-6-фтор-3-метоксибензонитрил
2-Хлор-3-дифторметил-1-фтор-4-метоксибензол (1 г, 4,75 ммоль) растворяли в безводном диметилацетамиде (7 мл, 74,7 ммоль), к которому добавляли дицианоцинк (0,558 г, 4,75 ммоль). Азот барботировали через реакционную смесь в течение 20 минут, затем добавляли трис(дибензилиденацетон)дипалладий (0) (0,087 г, 0,095 ммоль) и [1,1'бис(дифенилфосфино)ферроцен]дихлорпалладиевый (II) комплекс с дихлорметаном (0,139 г, 0,190 ммоль). Реакционную смесь нагревали при 150°C в течение ночи в атмосфере азота. Реакционную смесь гасили водой (100 мл), и затем экстрагировали EtOAc (3×200 мл). Объединенные органические слои промывали соляным раствором (3×200 мл), сушили над сульфатом магния, фильтровали и упаривали при пониженном давлении, получая темно-коричневое масло. Неочищенный продукт очищали хроматографией, элюируя EtOAc/изогексан, получая 2-дифторметил-6-фтор-3-метокси-бензонитрил (182 мг, 17% выход) в виде коричневого твердого остатка.
[MH]+=202,1
трет-Бутиловый эфир (2-дифторметил-6-фтор-3-метоксибензил)карбаминовой кислоты
2-(Дифторметил)-6-фтор-3-метоксибензонитрил (182 мг, 0,778 ммоль) растворяли в безводном метаноле (5 мл, 124 ммоль), к которому добавляли гексагидрат хлорида никеля (19 мг, 0,078 ммоль), с последующим добавлением ди-трет-бутилдикарбоната (343 мг, 1,556 ммоль). Полученный в результате бледно-зеленый раствор охлаждали в бане со льдом до -5°C, и затем добавляли порциями боргидрид натрия (206 мг, 5,45 ммоль), поддерживая температуру реакции ~0°C. Темно-коричневый раствор перемешивали при 0 °C и медленно нагревали до комнатной температуры в течение ночи. Растворитель удаляли при пониженном давлении, и затем распределяли между DCM (10 мл) и водой (10 мл). Водный слой экстрагировали DCM (2×10 мл). Объединенные органические слои промывали соляным раствором (10 мл), сушили, применяя картридж для разделения фаз, и концентрировали в вакууме. Неочищенный продукт очищали хроматографией, элюируя EtOAc/изогексан, получая трет-бутиловый эфир (2-дифторметил-6-фтор-3-метоксибензил)карбаминовой кислоты в виде белого воскообразного остатка (158 мг, 63% выход).
[MNa]+=328
Гидрохлорид 2-дифторметил-6-фтор-3-метоксибензиламина
трет-Бутиловый эфир (2-дифторметил-6-фтор-3-метоксибензил)карбаминовой кислоты (158 мг, 0,492 ммоль) растворяли в изопропиловом спирте (1 мл), и затем добавляли HCl (6N в изопропиловом спирте) (1 мл, 0,778 ммоль) и перемешивали при 40 °C в течение 1 часа. Образовывался грязно-белый осадок, и его собирали фильтрованием в вакууме и промывали изопропиловым спиртом (1 мл), получая требуемый продукт, гидрохлорид 2-дифторметил-6-фтор-3-метокси-бензиламина, в виде грязно-белого твердого остатка (43 мг, 22% выход).
[MH]+=206
2-Дифторметил-6-фтор-3-метоксибензиламид 3-метоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты
3-(Метоксиметил)-1-(4-((2-оксопиридин-1(2H)-ил)метил)бензил)-1H-пиразол-4-карбоновую кислоту (58 мг, 0,162 ммоль), гидрохлоридную соль 2-дифторметил-6-фтор-3-метоксибензиламина (40,2 мг, 0,163 ммоль) и HATU (68,3 мг, 0,180 ммоль) суспендировали в безводном DCM (3 мл), к которому добавляли триэтиламин (91 мкл, 0,653 ммоль), обрабатывали ультразвуком, и затем перемешивали при комнатной температуре в течение 3 часов. Растворитель удаляли при пониженном давлении, и остаток гасили раствором хлорида аммония (5 мл), получая в результате бледно-коричневый твердый остаток, который перемешивали при комнатной температуре в течение выходных. Твердый остаток фильтровали при пониженном давлении, промывали водой, сушили при пониженном давлении, и затем помещали в сушильный шкаф при 50°C в течение 3 часов. Требуемый продукт, 2-дифторметил-6-фтор-3-метоксибензиламид 3-этоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновой кислоты (74 мг, 83% выход), выделяли в виде сыпучего кремового твердого остатка.
[MH]+=541,2
ЯМР (d6-DMSO) δ 3,12 (3H, с), 3,83 (3H, с), 4,43 (2H, с), 4,52-4,59 (2H, м), 5,05 (2H, с), 5,25 (2H, с), 6,21 (1H, тд, J=1,4, 6,7Гц), 6,39 (1H, дт, J=1,0, 9,2Гц), 7,15-7,44 (8H, м), 7,75 (1H, ддд, J=0,7, 2,1, 6,8Гц), 8,08 (1H, т, J=4,9Гц), 8,22 (1H, с).
Справочный пример G
5-Бромметил-2-фторпиридин
2-фтор-5-метилпиридин (5,0 г, 45 ммоль) растворяли в 1,2-дихлопентане (120 мл). К данному раствору добавляли N-бромсукцинимид (9,61 г, 54 ммоль) и изобисизобутиронитрил (739 мг, 4,5 ммоль). Реакционную смесь перемешивали при кипячении с обратным холодильником (95°C) в течение 5 часов, затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь разбавляли CHCl3 (50 мл) и промывали насыщенным NaHCO3 (1×20 мл), водой (1×20 мл), с последующей промывкой соляным раствором (1×20 мл), сушили (Na2SO4) и фильтровали через PS бумагу, и упаривали в вакууме. Остаток очищали хроматографией (силикагель), элюируя 10% EtOAc, 90% петролейным эфиром, получая бесцветное масло, идентифицированное как 5-бромметил-2-фторпиридин, 5,9 г, 69% выход.
[MH]+=191,876
ЯМР (CDCl3): 4,46 (2H, с), 6,93 (1H, дд, J=8,4, 3,0Гц), 7,84 (1H, тд, J=7,8, 2,6Гц), 8,23 (1H, д, J=2,2Гц)
Этиловый эфир 1-(6-Фторпиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновой кислоты
Этил 3-трифторметил-1H-пиразол-4-карбоксилат (1,57 г, 7,53 ммоль) растворяли в DMF (20 мл), добавляли 5-бромметил-2-фторпиридин (1,3 г, 6,84 ммоль) и карбонат цезия (6,69 г, 20,53 ммоль). Реакционную смесь перемешивали при 50°C в течение 18 часов, после чего реакционную смесь разбавляли EtOAc (100 мл), данный раствор промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и фильтровали через PS бумагу и упаривали в вакууме. Остаток очищали хроматографией (силикагель), элюируя 85% петролейным эфиром, 15% EtOAc, получая белый пенообразный остаток (1,26 г, 58% выход), идентифицированный как этиловый эфир 1-(6-фторпиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновой кислоты.
[MMeCN]+=358,75
1-(6-Фторпиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновая кислота
Этиловый эфир 1-(6-Фторпиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновой кислоты (1,26 г, 3,97 ммоль) растворяли в THF (50 мл) и воде (5 мл), затем добавляли гидроксид лития (476 мг, 19,86 ммоль). Реакционную смесь перемешивали при 50 °C в течение 18 часов, после чего растворитель концентрировали в вакууме, и остаток растворяли в EtOAc (50 мл). Водный слой экстрагировали и подкисляли 1M HCl до pH2 и экстрагировали CHCl3 (3×50 мл). Объединенные экстракты промывали водой (1×30 мл), с последующей промывкой соляным раствором (1×30 мл), сушили (Na2SO4) и фильтровали через PS бумагу, и упаривали в вакууме. Остаток очищали хроматографией (силикагель), элюируя 3% MeOH, 97% CHCl3, получая бесцветное масло, идентифицированное как 1-(6-фторпиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновая кислота, 946 мг, 82% выход.
[MH]+=289,82
1-(6-Пирролидин-1-ил-пиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновая кислота
1-(6-Фторпиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновую кислоту (300 мг, 1,04 ммоль) растворяли в диоксане (25 мл) и пирролидине (2 мл), и реакционную смесь перемешивали при 80°C в течение 18 часов. После завершения, реакционную смесь разбавляли EtOAc (100 мл), данный раствор промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и фильтровали через PS бумагу, и упаривали в вакууме. Остаток очищали хроматографией, элюируя 1% AcOH, 9% MeOH, 90% CHCl3, получая белый пенообразный остаток (267 мг, 76% выход), идентифицированный как 1-(6-пирролидин-1-ил-пиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновая кислота.
[MH]+=340,72
2-Фтор-3-метоксибензиламид 1-(6-пирролидин-1-илпиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновой кислоты
Гидрохлорид 2-Фтор-3-метоксибензиламина (56 мг, 0,294 ммоль) и 1-(6-пирролидин-1-ил-пиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновую кислоту (100 мг, 0,294 ммоль) объединяли и растворяли в DCM (10 мл) при 0°C. К раствору добавляли HOBt (48 мг, 0,353 ммоль), триэтиламин (205 мкл, 1,469 ммоль) и водорастворимый карбодиимид (79 мг, 0,411 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 дней. Реакционную смесь разбавляли CHCl3 (50 мл) и добавляли насыщенный водный NaHCO3 (20 мл). Органический слой отделяли, сушили (MgSO4), фильтровали и концентрировали. Неочищенный продукт очищали хроматографией, элюируя MeOH/DCM, получая требуемый продукт, 2-фтор-3-метоксибензиламид 1-(6-пирролидин-1-ил-пиридин-3-илметил)-3-трифторметил-1H-пиразол-4-карбоновой кислоты, в виде белого твердого остатка, 95 мг, 68% выход.
[MH]+=478,0
1H ЯМР (DMSO) δ: 1,90-1,94 (4H, м), 3,31-3,37 (4H, м), 3,82 (3H, с), 4,39 (2H, д, J=5,6Гц), 5,26 (2H, с), 6,44 (1H, д, J=8,6Гц), 6,85-6,90 (1H, м), 7,03-7,10 (2H, м), 7,50 (1H, дд, J=8,8, 2,4Гц), 8,14 (1H, д, J=2,3Гц), 8,36 (1H, д, J=0,6Гц), 8,74 (1H, т, J=5,8Гц)
СПРАВОЧНЫЙ ПРИМЕР H
N-{[2-Фтор-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамид
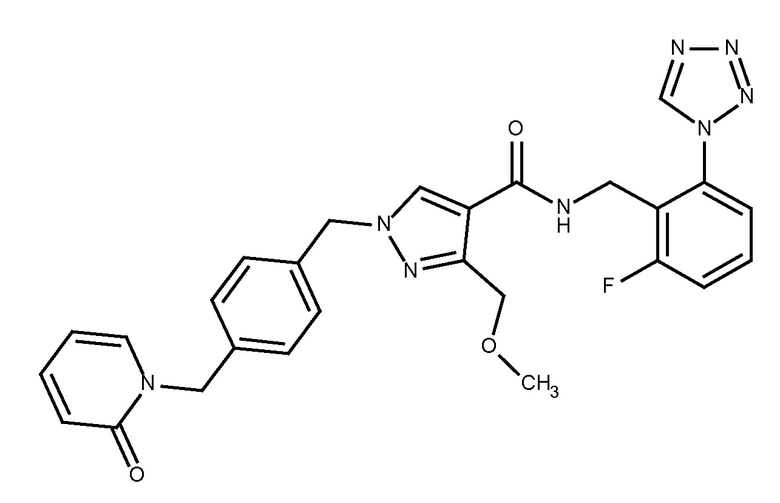
[M+H]+=529,3
1H ЯМР: (d6-DMSO) 3,18 (3H, с), 4,26 (2H, д, J=5,0Гц), 4,42 (2H, с), 5,06 (2H, с), 5,24 (2H, с), 6,19-6,23 (1H, м), 6,38 (1H, д, J=9,2Гц), 7,19 (2H, д, J=8,1Гц), 7,24 (2H, д, J=8,2Гц), 7,38-7,45 (2H, м), 7,56-7,65 (2H, м), 7,74 (1H, дд, J=6,8, 1,8Гц), 8,11 (1H, с), 8,18 (1H, т, J=5,2Гц), 9,84 (1H, с)
IC50 (человеческий PKal)=1,1 нМ
IC50 (человеческий KLK1)=>40000 нМ
Справочный пример I
Аналог примера 7 из WO 2013/111108
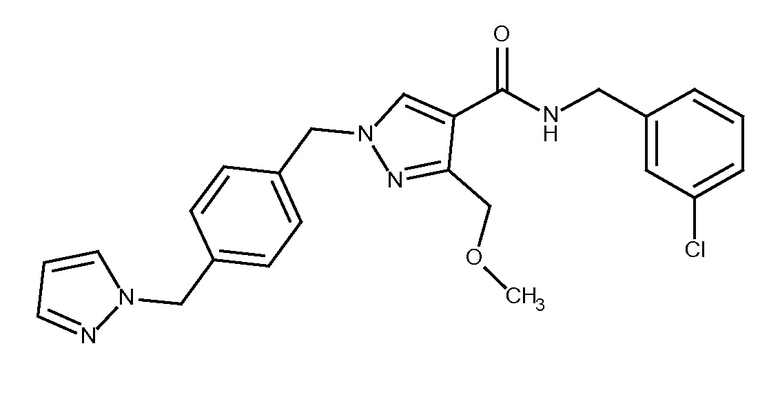
Справочный пример J
Аналог примера 27 из WO 2013/111108
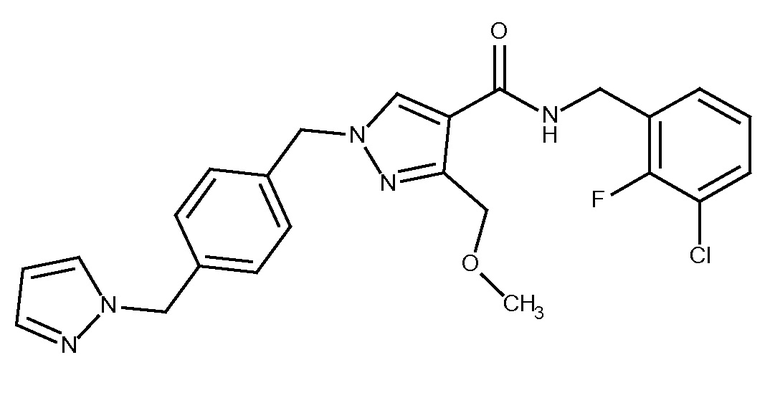
Справочный пример K
Аналог примера 79 настоящей заявки.
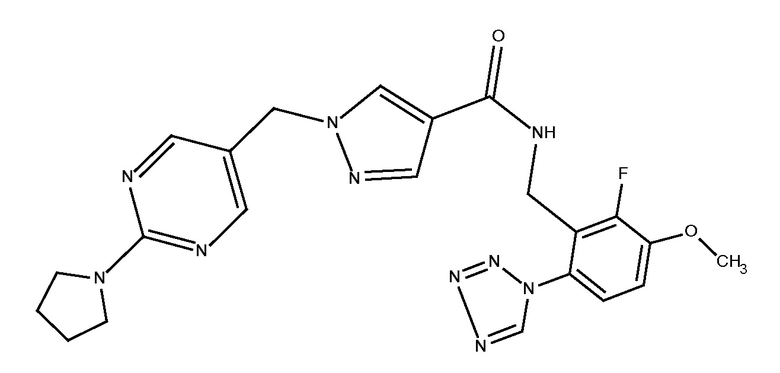
Примеры настоящего изобретения
ПРИМЕР 39
N-{[2-Фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамид
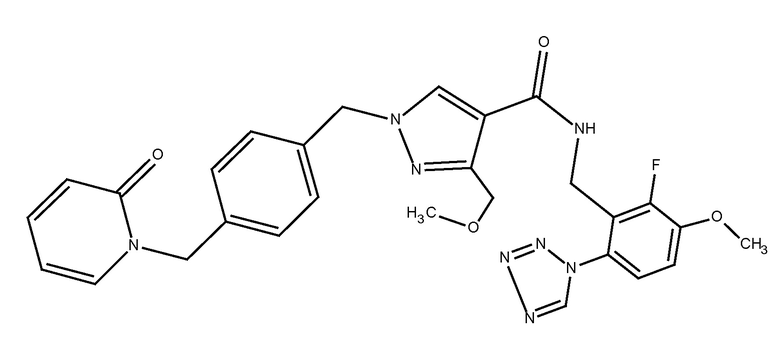
A. Метиловый эфир 6-трет-бутоксикарбониламино-2-фтор-3-метоксибензойной кислоты
Метил 6-бром-2-фтор-3-метоксибензоат (2,0 г, 7,6 ммоль) растворяли в диоксане (50 мл). Добавляли трет-бутилкарбамат (980 мг, 8,4 ммоль), 4,5-(бис(дифенилфосфено)-9,9-диметилксантен (440 мг, 0,76 ммоль), ацетат палладия (II) (171 мг, 0,76 ммоль) и карбонат цезия (4,95 г, 15,2 ммоль), и реакционную смесь перемешивали в атмосфере азота при 100°C в течение 18 часов, после чего реакционную смесь разбавляли EtOAc (100 мл), фильтровали через целит, и остаток промывали EtOAc (50 мл). Объединенные фильтраты упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), элюент 10% EtOAc, 90% петролейный эфир, получая желтое масло, которое отверждалось при стоянии, и его идентифицировали как метиловый эфир 6-трет-бутоксикарбониламино-2-фтор-3-метокси-бензойной кислоты (2,09 г, 6,97 ммоль, 92%).
B. трет-бутиловый эфир (3-Фтор-2-гидроксиметил-4-метоксифенил)-карбаминовой кислоты
Метиловый эфир 6-трет-бутоксикарбониламино-2-фтор-3-метоксибензойной кислоты (480 мг, 1,6 ммоль) растворяли в THF (50 мл) и охлаждали до 0°C в атмосфере азота. Добавляли по каплям 2M раствор боргидрида лития в THF (1,6 мл,3,21 ммоль). Через 18 часов при комнатной температуре медленно добавляли насыщенный водный хлорид аммония, и реакционную смесь экстрагировали EtOAc (3×50мл). Объединенные органические экстракты промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), элюент 60% EtOAc, 40% петролейный эфир, получая белый твердый остаток, идентифицированный как трет-бутиловый эфир (3-фтор-2-гидроксиметил-4-метоксифенил)карбаминовой кислоты (426 мг, 1,57 ммоль, 98%).
[MH]+=277,7
C. (6-Амино-2-фтор-3-метоксифенил)метанол
трет-Бутиловый эфир (3-Фтор-2-гидроксиметил-4-метоксифенил)карбаминовой кислоты (426 мг, 1,57 ммоль) растворяли в 4M HCl в диоксане (50 мл). Через один час при комнатной температуре растворитель удаляли в вакууме, получая белый твердый остаток, идентифицированный как (6-амино-2-фтор-3-метоксифенил)метанол (320 мг, 1,54 ммоль, 98%).
D. (2-Фтор-3-метокси-6-тетразол-1-ил-фенил)метанол
(6-Амино-2-фтор-3-метоксифенил)метанол (320 мг, 1,54 ммоль) растворяли в уксусной кислоте (20 мл). Добавляли триметилортоформиат (491 мг, 4,62 ммоль) и азид натрия (301 мг, 4,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, после чего реакционную смесь выливали в воду (50 мл) и экстрагировали EtOAc (2x 100 мл). Данный раствор промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), элюент 60% EtOAc, 40% петролейный эфир, получая желтое масло, идентифицированное как (2-фтор-3-метокси-6-тетразол-1-ил-фенил)метанол (160 мг, 0,71 ммоль, 46%).
[M+H]+=225,2
E. 1-(2-Бромметил-3-фтор-4-метоксифенил)-1H-тетразол
(2-Фтор-3-метокси-6-тетразол-1-ил-фенил)метанол (160 мг, 0,71 ммоль) растворяли в дихлорметане (50 мл). К данному раствору добавляли трибромид фосфора (386 мг, 1,43 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и разбавляли CHCl3 (100 мл), промывали насыщенным NaHCO3 (1×30 мл), водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме, получая белый твердый остаток, идентифицированный как 1-(2-бромметил-3-фтор-4-метоксифенил)-1H-тетразол, который применяли без дополнительной очистки (204 мг, 71 ммоль, 100%).
[M+H+MeCN]+=330,1
F. 1-(2-Азидометил-3-фтор-4-метоксифенил)-1H-тетразол
1-(2-Бромметил-3-фтор-4-метоксифенил)-1H-тетразол (205 мг, 0,71 ммоль) растворяли в DMF (20 мл). Добавляли азид натрия (93 мг, 1,43 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, после чего реакционную смесь разбавляли EtOAc (100мл). Данный раствор промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), элюент 60% петролейный эфир, 40% EtOAc, получая белый твердый остаток, идентифицированный как 1-(2-азидометил-3-фтор-4-метоксифенил)-1H-тетразол (128 мг, 0,51 ммоль, 72%).
[M+H+MeCN]+=291,2
G. 2-Фтор-3-метокси-6-тетразол-1-илбензиламин
1-(2-Азидометил-3-фтор-4-метоксифенил)-1H-тетразол (128 мг, 0,51 ммоль) растворяли в MeOH (40 мл) Данный раствор гидрировали над 10% Pd/C (50 мг) при атмосферном давлении в течение 2 часов, после чего катализатор отфильтровывали через целит, и остаток промывали MeOH (100 мл). Объединенные фильтраты упаривали в вакууме, получая желтое масло, идентифицированное как 2-фтор-3-метокси-6-тетразол-1-илбензиламин (100 мг, 0,45 ммоль, 87%).
H. N-{[2-Фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-({4-[(2-оксопиридин-1-ил)метил]фенил}метил)пиразол-4-карбоксамид
3-Метоксиметил-1-[4-(2-оксо-2H-пиридин-1-илметил)бензил]-1H-пиразол-4-карбоновую кислоту (65 мг, 0,18 ммоль) растворяли в DCM (30 мл). Добавляли при комнатной температуре гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (84 мг, 0,22 ммоль) и N,N-диизопропилэтиламин (48 мг, 0,37 ммоль). Через 20 мин добавляли 2-фтор-3-метокси-6-тетразол-1-ил-бензиламин (43 мг, 0,19 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли CHCl3 (50 мл) и промывали насыщенным NaHCO3 (водн.) (1×30 мл), водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме, получая желтое масло. Остаток очищали флэш-хроматографией (силикагель), элюент 5% MeOH, 95% CHCl3, получая белый твердый остаток, идентифицированный как заявленное в заголовке соединение (111 мг, 0,2 ммоль, 47%).
[MH]+=559,4
1H ЯМР: (d6-DMSO) δ: 3,18 (3H, с), 3,94 (3H, с), 4,22 (2H, д, J=4,8Гц), 4,41 (2H, с), 5,06 (2H, с), 5,24 (2H, с), 6,20-6,23 (1H, м), 6,39 (1H, д, J=9,0Гц), 7,19 (2H, д, J=8,2Гц), 7,24 (2H, д, J=8,2Гц), 7,33-7,43 (3H, м), 7,75 (1H, дд, J=6,8, 1,9Гц), 8,11 (1H, с), 8,15 (1H, т, J=5,2Гц), 9,73 (1H, с).
ПРИМЕР 86
1-{[2-(3,3-Дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамид
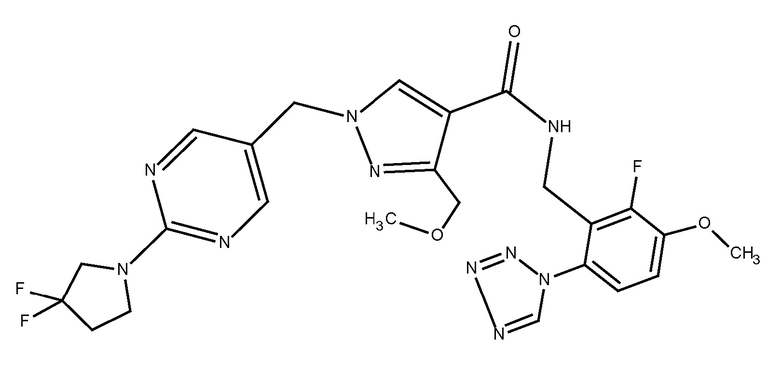
 A. этиловый эфир 2-(3,3-дифторпирролидин-1-ил)пиримидин-5-карбоновой кислоты
A. этиловый эфир 2-(3,3-дифторпирролидин-1-ил)пиримидин-5-карбоновой кислоты
Этил-2-хлорпиримидин-5-карбоксилат (1,5 г, 8,04 ммоль) растворяли в диоксане (50 мл). Добавляли гидрохлорид 3,3-дифторпирролидина (1,73 г, 12,06 ммоль) и триэтиламин (2,44 г, 24,1 ммоль), и реакционную смесь перемешивали при 80°C в течение 18 часов, после чего реакционную смесь разбавляли EtOAc (100 мл). Данный раствор промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), элюент 1% MeOH, 99% CHCl3, получая бледно-желтый твердый остаток, идентифицированный как этиловый эфир 2-(3,3-дифторпирролидин-1-ил)пиримидин-5-карбоновой кислоты (1,4 г, 5,44 ммоль, 68% выход).
[MH]+=258,2
B. [2-(3,3-Дифторпирролидин-1-ил)пиримидин-5-ил]метанол
Этиловый эфир 2-(3,3-дифторпирролидин-1-ил)пиримидин-5-карбоновой кислоты (1,4 г, 5,44 ммоль) растворяли в толуоле (50 мл). Данный раствор охлаждали до -78°C в атмосфере азота и добавляли по каплям DIBAL (1M раствор в толуоле) (16,33 мл, 16,33 ммоль). Через 90 минут при данной температуре реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь охлаждали до 0°C и добавляли по каплям 2M HCl, с последующим добавлением ледяной воды (50 мл). Осадок отфильтровывали через целит, и фильтрат подщелачивали до pH9 карбонатом натрия. Органический слой отделяли, и водный слой экстрагировали EtOAc (3×100 мл). Объединенные органические экстракты промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), элюент 4% MeOH, 96% CHCl3, получая белый твердый остаток, идентифицированный как [2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метанол (650 мг, 3,02 ммоль, 55% выход).
[MH]+=216,3
C. 2-(3,3-Дифторпирролидин-1-ил)пиримидин-5-илметиловый эфир уксусной кислоты
[2-(3,3-Дифторпирролидин-1-ил)пиримидин-5-ил]метанол (650 мг, 3,02 ммоль) растворяли в DCM (50 мл). Данный раствор охлаждали до 0 °C, добавляли уксусный ангидрид (463 мг, 4,53 ммоль), 4-(диметиламино)пиридин (185 мг, 1,51 ммоль) и пиридин (1,2 г, 15,1 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 2 часов, после чего реакционную смесь разбавляли CHCl3 (50 мл), промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), элюент 80% петролейный эфир, 20% EtOAc, получая белый твердый остаток, идентифицированный как 2-(3,3-дифторпирролидин-1-ил)-пиримидин-5-илметиловый эфир уксусной кислоты (737 мг, 2,87 ммоль, 95% выход).
[MH]+=258,2
D. метиловый эфир 2-[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-илметил]-5-метоксиметил-1H-пиразол-4-карбоновой кислоты
2-(3,3-Дифторпирролидин-1-ил)-пиримидин-5-илметиловый эфир уксусной кислоты (695 мг, 2,7 ммоль) растворяли в сухом ацетонитриле (50 мл). К данному раствору добавляли метил 3-(метоксиметил)-1H-пиразол-4-карбоксилат (CAS no. 318496-66-1 (полученный согласно способу, описанному в WO 2012/009009)) (460 мг, 2,7 ммоль) и триметилсилилтрифлат (1,076 мл, 5,95 ммоль). Реакционную смесь перемешивали при 80 °C в течение 18 часов, после чего растворитель удаляли в вакууме, и остаток растворяли в EtOAc (50 мл), промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме. Остаток очищали флэш-хроматографией (силикагель), градиент элюента от 30% петролейный эфир, 70% EtOAc до 100% EtOAc, получая два изомерных продукта. Более быстро элюируемый продукт идентифицировали как побочный региоизомер. Более медленно элюирующийся продукт давал желтое масло, и его идентифицировали как метиловый эфир 2-[2-(3,3-дифторпирролидин-1-ил)-пиримидин-5-илметил]-5-метоксиметил-1H-пиразол-4-карбоновой кислоты (210 мг, 0,57 ммоль, 21% выход).
[MH]+=368,3
E. 1-[2-(3,3-Дифторпирролидин-1-ил)пиримидин-5-илметил]-3-метоксиметил-1H-пиразол-4-карбоновая кислота
Метиловый эфир 2-[2-(3,3-Дифторпирролидин-1-ил)пиримидин-5-илметил]-5-метоксиметил-1H-пиразол-4-карбоновой кислоты (210 мг, 0,57 ммоль) растворяли в THF (50 мл) и воде (5 мл). Добавляли гидроксид лития (68 мг, 2,86 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, после чего реакционную смесь концентрировали в вакууме, и остаток подкисляли 1M HCl до pH2 и экстрагировали CHCl3 (3 x50 мл). Объединенные экстракты промывали водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме, получая белый твердый остаток, идентифицированный как 1-[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-илметил]-3-метоксиметил-1H-пиразол-4-карбоновая кислота (130 мг, 0,37 ммоль, 64% выход).
[MH]+=354,2
F. 1-{[2-(3,3-Дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамид
1-[2-(3,3-Дифторпирролидин-1-ил)пиримидин-5-илметил]-3-метоксиметил-1H-пиразол-4-карбоновую кислоту (130 мг, 0,37 ммоль) растворяли в DCM (30 мл). Добавляли при комнатной температуре гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (167 мг, 0,44 ммоль) и N,N-диизопропилэтиламин (143 мг, 1,1 ммоль). Через 20 минут добавляли 2-фтор-3-метокси-6-тетразол-1-илбензиламин (90 мг, 0,40 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли CHCl3 (50 мл) и промывали насыщенным NaHCO3 (водн.) (1×30 мл), водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме, получая желтое масло. Остаток очищали флэш-хроматографией (силикагель), элюент 4% MeOH, 96% CHCl3, получая белый твердый остаток, идентифицированный как 1-{[2-(3,3-дифторпирролидин-1-ил)пиримидин-5-ил]метил}-N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)пиразол-4-карбоксамид (112 мг, 0,2 ммоль, 55% выход).
[MH]+=559,3
1H ЯМР (d6-DMSO) δ: 2,50-2,57 (2H, м), 3,18 (3H, с), 3,69 (2H, т, J=7,4 Гц), 3,87 (2H, т, J=12,2Гц), 3,94 (3H, с), 4,22 (2H, д, J=4,7Гц), 4,41 (2H, с), 5,15 (2H, с), 7,37-7,41 (2H, м), 8,09 (1H, с), 8,14 (1H, т, J=5,2 Гц), 8,41 (2H, с), 9,73 (1H, с)
ПРИМЕР 79
N-{[2-Фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамид
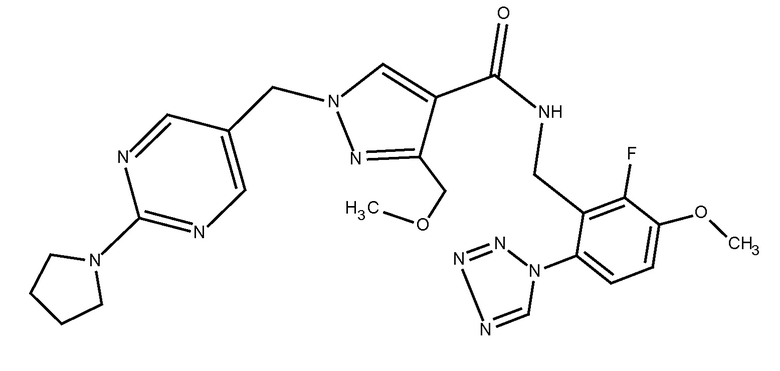
A. N-{[2-Фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамид
3-Метоксиметил-1-(2-пирролидин-1-ил-пиримидин-5-илметил)-1H-пиразол-4-карбоновую кислоту (CAS no. 1938129-73-7 (полученную согласно способу, описанному в WO 2016083816)) (200 мг, 0,63 ммоль) растворяли в DCM (30 мл). Добавляли при комнатной температуре гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (287 мг, 0,76 ммоль) и N,N-диизопропилэтиламин (244 мг, 1,89 ммоль). Через 20 минут добавляли 2-фтор-3-метокси-6-тетразол-1-илбензиламин (143 мг, 0,64 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли CHCl3 (50 мл) и промывали насыщенным NaHCO3 (водн.) (1×30 мл), водой (1×30 мл), соляным раствором (1×30 мл), сушили (Na2SO4) и упаривали в вакууме, получая желтое масло. Остаток очищали флэш-хроматографией (силикагель), элюент 4% MeOH, 96% CHCl3, получая белый твердый остаток, идентифицированный как N-{[2-фтор-3-метокси-6-(1,2,3,4-тетразол-1-ил)фенил]метил}-3-(метоксиметил)-1-{[2-(пирролидин-1-ил)пиримидин-5-ил]метил}пиразол-4-карбоксамид (230 мг, 0,44 ммоль, 70% выход).
[MH]+=523,4
1H ЯМР (d6-DMSO) δ: 1,89-1,92 (4H, м), 3,18 (3H, с), 3,45 (4H, т, J=6,7Гц), 3,93 (3H, с), 4,21 (2H, д, J=4,6Гц), 4,42 (2H, с), 5,10 (2H, с), 7,33-7,41 (2H, м), 8,07 (1H, с), 8,15 (1H, т, J=4,9 Гц), 8,33 (2H, с), 9,73 (1H, с)
Таблица 1
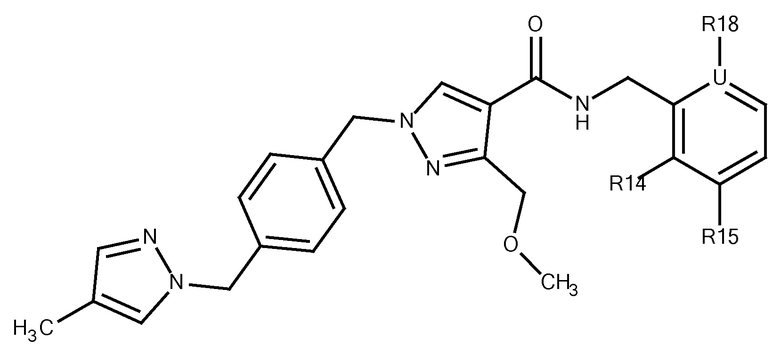
Таблица 2
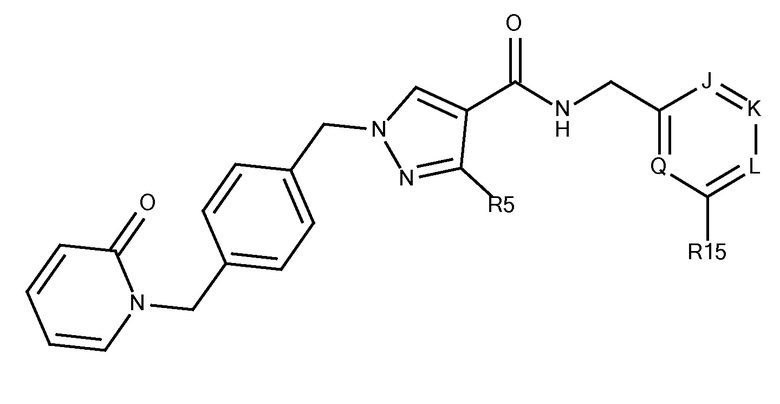
Таблица 3
Таблица 4
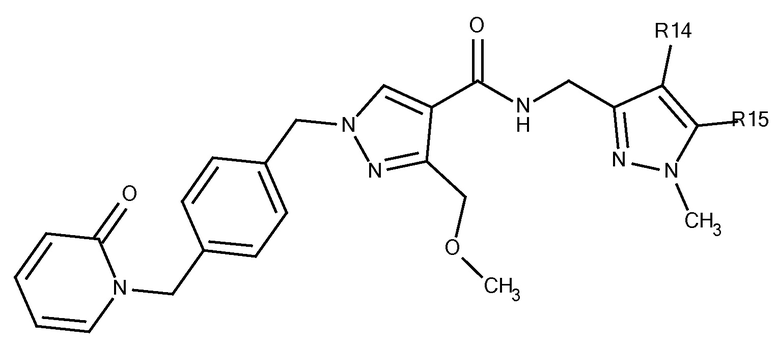
Таблица 5
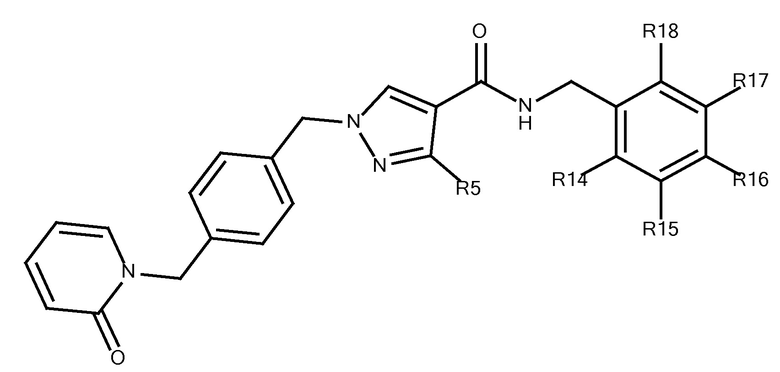
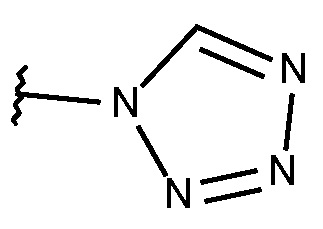


Таблица 6
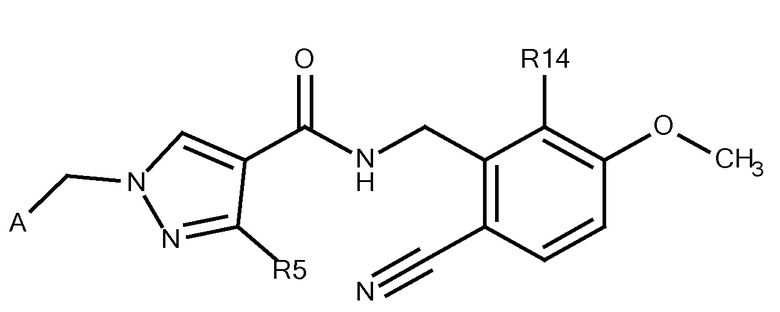
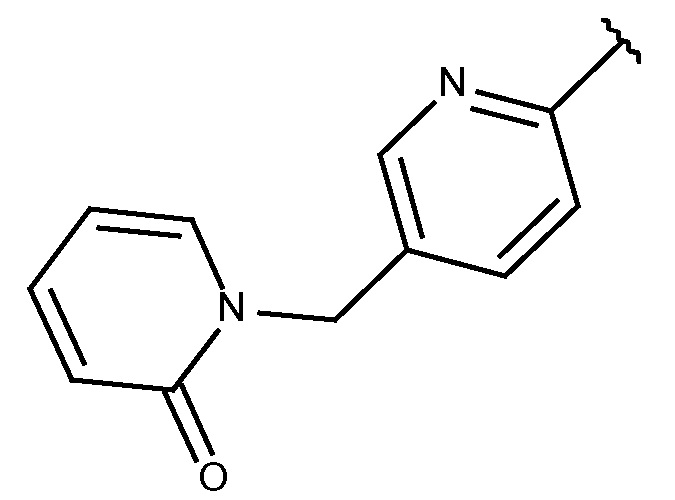
Таблица 7
Таблица 1a
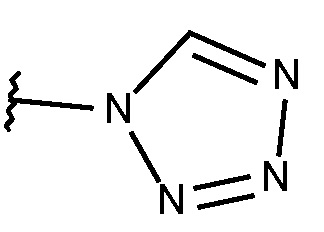


Таблица 5a
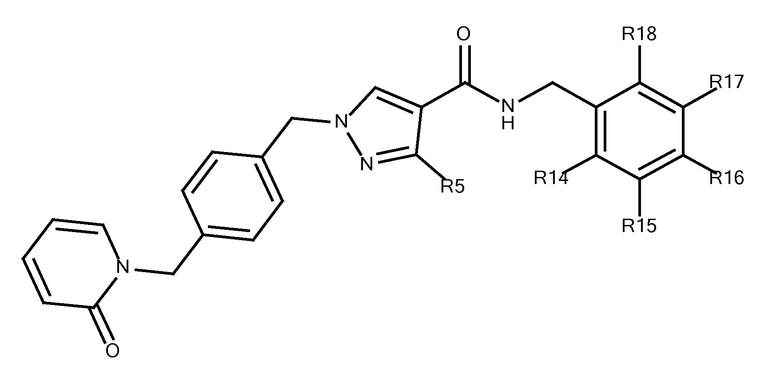
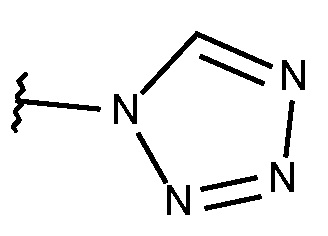












Таблица 7a
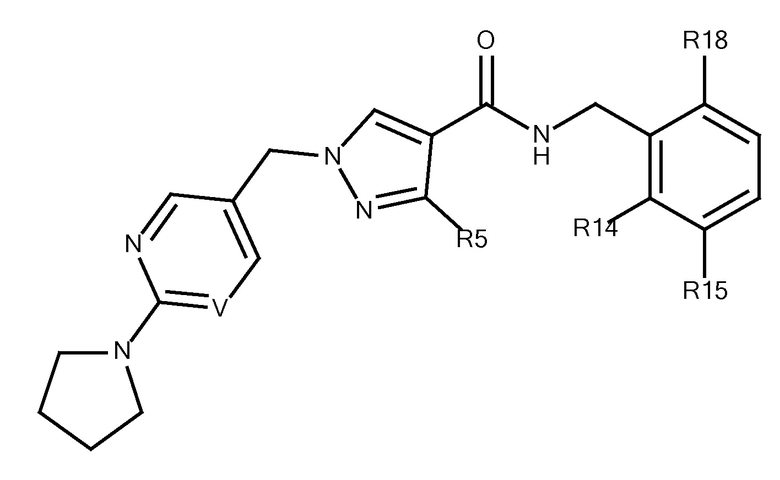
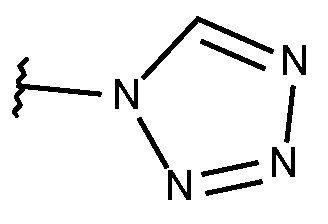








Таблица 7b
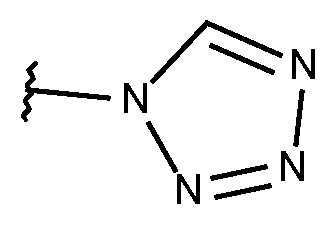



Таблица 8: названия соединений
Таблица 9: ЯМР данные примеров (растворитель d6 DMSO)
Биологические способы
Способность соединений формулы (I) ингибировать калликреин плазмы можно определить, применяя следующие биологические анализы:
Определение IC50 для калликреина плазмы
Ингибирующую калликреин плазмы активность in vitro определяли, применяя стандартные опубликованные способы (смотри, например, Johansen et al., Int. J. Tiss. Reac. 1986, 8, 185; Shori et al., Biochem. Pharmacol., 1992, 43, 1209; Stürzebecher et al., Biol. Chem. Hoppe-Seyler, 1992, 373, 1025). Человеческий калликреин плазмы (Protogen) выдерживали при 25°C с флуорогенным субстратом H-DPro-Phe-Arg-AFC и различными концентрациями испытуемого соединения. Остаточную активность фермента (первоначальную скорость реакции) определяли измерением изменения оптического поглощения при 410 нм, и определяли величину IC50 для испытуемого соединения.
Данные, полученные в данном испытании, показаны в таблице 10.
Определение Ki для калликреина плазмы
Ингибирующую калликреин плазмы активность in vitro определяли, применяя стандартные опубликованные способы (например, Johansen et al., Int. J. Tiss. Reac. 1986, 8, 185; Shori et al., Biochem. Pharmacol., 1992, 43, 1209; Stürzebecher et al., Biol. Chem. Hoppe-Seyler, 1992, 373, 1025). Человеческий калликреин плазмы (Protogen) выдерживали при 25 °C с 10 концентрациями испытуемого соединения и 8 концентрациями флуорогенного субстрата H-DPro-Phe-Arg-AFC, охватывая диапазон, по меньшей мере, ½×Km-5×Km. Остаточную активность фермента (первоначальную скорость реакции) определяли измерением изменения флуоресценции при 410 нм. Величину Ki для испытуемого соединения определяли, применяя уравнение для смешанной модели ингибирования (на основе уравнения 3,2 в: RA Copeland, Evaluation of Enzyme Inhibitors in Drug Discovery, Wiley 2005) в GraphPad Prism. Уравнение смешанной модели включает конкурентное, неконкурентное и бесконкурентное ингибирование в качестве частных случаев и параметр альфа, указывающий на механизм ингибирования.
Данные, полученные в данном испытании, показаны в таблице 11.
Отобранные соединения дополнительно скринировали на ингибирующую активность относительно родственного фермента KLK1. Способность соединений формулы (I) ингибировать KLK1 можно определить, применяя следующий биологический анализ:
Определение IC50 для KLK1
Ингибирующую KLK1 активность in vitro определяли, применяя стандартные опубликованные способы (смотри, например Johansen et al., Int. J. Tiss. Reac. 1986, 8, 185; Shori et al., Biochem. Pharmacol., 1992, 43, 1209; Stürzebecher et al., Biol. Chem. Hoppe-Seyler, 1992, 373, 1025). Человеческий KLK1 (Callbiochem) выдерживали при 25°C с флуорогенным субстратом H-DVal-Leu-Arg-AFC и различными концентрациями испытуемого соединения. Остаточную активность фермента (первоначальную скорость реакции) определяли измерением изменения оптического поглощения при 410 нм, и определяли величину IC50 для испытуемого соединения.
Данные, полученные в данном испытании, показаны в таблице 10.
Отобранные соединения дополнительно скринировали на ингибирующую активность относительно родственного фермента FXIa. Способность соединений формулы (I) ингибировать FXIa можно определить, применяя следующий биологический анализ:
Определение % ингибирования для FXIa
Ингибирующую FXIa активность in vitro определяли, применяя стандартные опубликованные способы (смотри, например, Johansen et al., Int. J. Tiss. Reac. 1986, 8, 185; Shori et al., Biochem. Pharmacol., 1992, 43, 1209; Stürzebecher et al., Biol. Chem. Hoppe-Seyler, 1992, 373, 1025). Человеческий FXIa (Enzyme Research Laboratories) выдерживали при 25°C с флуорогенным субстратом Z-Gly-Pro-Arg-AFC и 40 мкМ испытуемого соединения (или альтернативно при различных концентрациях испытуемого соединения для того, чтобы определить IC50). Остаточную активность фермента (первоначальную скорость реакции) определяли измерением изменения оптического поглощения при 410 нм, и определяли величину IC50 для испытуемого соединения.
Данные, полученные в данном испытании, показаны в таблице 10.
Ингибирующую фактор XIIa активность in vitro определяли, применяя стандартные опубликованные способы (смотри, например, Shori et al., Biochem. Pharmacol., 1992,43, 1209; Baeriswyl et al., ACS Chem. Biol., 2015, 10 (8) 1861; Bouckaert et al., European Journal of Medicinal Chemistry 110 (2016) 181). Человеческий фактор XIIa (Enzyme Research Laboratories) выдерживали при 25°C с флуорогенным субстратом H-DPro-Phe-Arg-AFC и различными концентрациями испытуемого соединения. Остаточную активность фермента (первоначальную скорость реакции) определяли измерением изменения оптического поглощения при 410 нм, и определяли величину IC50 для испытуемого соединения.
Данные, полученные в данном испытании, показаны в таблице 10.
Таблица 10
Таблица 11
Определение ферментативной селективности
Человеческие сериновые протеолитические ферменты плазмин, тромбин и трипсин анализировали на ферментативную активность, применяя подходящий флуорогенный субстрат. Протеазную активность измеряли, отслеживая накопление испускаемой субстратом флуоресценции в течение 5 минут. Линейную скорость увеличения флуоресценции в минуту выражали в виде активности в процентах (%). Km для расщепления каждого субстрата определяли стандартным преобразованием уравнения Михаэлиса-Ментен. Испытания ингибиторов проводили при концентрации субстрата Km, и активности рассчитывали в виде концентрации ингибитора, дающей 50% ингибирование (IC50) неингибированной ферментативной активности (100%).
Данные, полученные в данных испытаниях, показаны в таблице 12 ниже:
Таблица 12 (данные по селективности)
Данные по растворимости
Растворимость определяли в воде и 0,1N HCl (водн.). Испытуемые соединения выдерживали при 1 мг/мл в течение 24 часов при 37 °C на качающей платформе (500 об/мин). Образцы отбирали через 1, 4 и 24 часов и центрифугировали при 15000 g в течение 10 мин. Концентрацию испытуемого соединения в надосадочной жидкости определяли LCMS относительно стандартной кривой.
In vitro ADME данные
In vitro проницаемость определяли, применяя Caco-2 модель для перорального поглощения. Способ приспосабливали на основе стандартных опубликованных способов (Wang Z, Hop C.E., Leung K.H. and Pang J. (2000) J Mass Spectrom 35(1); 71-76). Caco-2 монослои формировали в BiocoatTM HTS волокнистой коллагеновой 24-луночной мультилуночной системе со вставками (1,0 мкм, PET мембрана, Corning 354803), в которой 200000 клеток высевали в каждой вставке и выдерживали в течение 3 дней перед применением в испытании на проницаемость. Для данного анализа 50 мкМ испытуемое соединение добавляли к апикальной стороне вставок и выдерживали в течение 1 часа при 37 °C на качающейся платформе (120 об/мин). Транспорт с апикальной на базолатеральную сторону определяли измерением испытуемого соединения в обеих ячейках LCMS после 1 часа выдерживания. Целостность Caco-2 монослоев подтверждали двумя способами, (i) сравнением трансэпителиального электрического сопротивления перед и после эксперимента (TEER) и, (ii) оценкой проницаемости люцифера желтого.
Собственный клиренс определяли, применяя стандартные опубликованные способы (Obach RS (1999) Drug Metab Dispos 27(11); 1350-135). Микросомы печени крысы или человека (0,5 мг/мл; Corning) выдерживали с 5 мкМ испытуемым соединением при 37 °C на качающейся платформе (150 об/мин). Образцы отбирали через 0, 6, 12, 18, 24 и 60 минут, и концентрации испытуемого соединения определяли LCMS относительно калибровочной кривой. Собственный клиренс (Clint) рассчитывали, применяя способ, описанный Obach (Obach RS et al. (1997) J Pharmacol Exp Ther 283: 46-58.) или Lau (Lau YY et al (2002). Drug Metab Dispos 30: 1446-1454).
x10-6 см/с)
Связывание с белками плазмы (PPB) и прогнозируемый клиренс
Фракцию, несвязанную в плазме, определяли, применяя ThermoScientificTM PierceTM способ быстрого равновесного диализа (одноразовый планшет с вставками, 8K MWCO). 5 мкМ испытуемое соединение добавляли в человеческую или крысиную плазму (300 мкл) и подвергали диализу относительно 146,5 мМ фосфатного буфера (500 мкл) в течение 5 часов при 37°C, встряхивая при 1200 об/мин. Эталонные образцы из плазмы, не подвергнутой диализу, отбирали перед выдерживанием, обеспечивая оценку извлечения. Концентрации испытуемого соединения определяли в ячейках с плазмой и буфером LCMS относительно калибровочной кривой. Фракцию, несвязанную в плазме, определяли, применяя стандартный способ (Waters NJ et al (2008) J Pharm Sci 97(10); 4586-95). Результаты представлены в виде процента связывания с белками плазмы (%PPB).
Прогнозируемый плазменный клиренс (Clp) рассчитывали, применяя общепринятую модель (Rowland M, Benet LZ, and Graham GG. Clearance concepts in pharmacokinetics. J Pharmacokinet Biopharm. (1973) 1:123-136.), одну из нескольких моделей, которую можно применять для экстраполирования данных in vitro. Модель допускает мгновенное и полное смешение лекарственного средства в печени и представляет собой функцию собственного клиренса, печеночного кровотока и свободной фракции лекарственного средства в крови. Прогнозируемый плазменный клиренс в мл/мин/кг представляли в виде процента печеночного кровотока (LBF).
Фармакокинетика
Фармакокинетические исследования соединений в таблице 13 проводили для оценки фармакокинетики после однократной пероральной дозы мужским особям крыс линии Спраг Доули. Двум крысам давали одну пероральную дозу 5 мл/кг номинальной 2 мг/мл (10 мг/кг) композиции испытуемого соединения в среде. После введения доз, образцы крови собирали в течение 24 часов. Моменты времени отбора образцов были следующими: 5, 15 и 30 минут, затем 1, 2, 4, 6, 8 и 12 часов. После отбора образцов, образцы крови центрифугировали, и фракцию плазмы анализировали на концентрацию испытуемого соединения LCMS. Данные о пероральном воздействии, полученные в данных исследованиях, показаны ниже:
Таблица 13: Данные о пероральном воздействии
| название | год | авторы | номер документа |
|---|---|---|---|
| N-((ГЕТ)АРИЛМЕТИЛ)-ГЕТЕРОАРИЛ-КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ПЛАЗМЕННОГО КАЛЛИКРЕИНА | 2015 |
|
RU2707870C2 |
| N-((ГЕТ)АРИЛМЕТИЛ)-ГЕТЕРОАРИЛ-КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ПЛАЗМЕННОГО КАЛЛИКРЕИНА | 2015 |
|
RU2821520C2 |
| ПОЛИМОРФНЫЕ МОДИФИКАЦИИ N-[(3-ФТОР-4-МЕТОКСИПИРИДИН-2-ИЛ)МЕТИЛ]-3-(МЕТОКСИМЕТИЛ)-1-({ 4-[(2-ОКСОПИРИДИН-1-ИЛ)МЕТИЛ]ФЕНИЛ} МЕТИЛ)ПИРАЗОЛ-4-КАРБОКСАМИДА И ИХ СОЛИ | 2017 |
|
RU2756273C2 |
| ИНГИБИТОРЫ ФЕРМЕНТОВ | 2014 |
|
RU2674028C2 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ДИГИДРОПИРИМИДИНКАРБОКСАМИДА В КАЧЕСТВЕ ИНГИБИТОРОВ RHO-КИНАЗЫ | 2017 |
|
RU2778478C2 |
| ПРОИЗВОДНЫЕ 2-(ФЕНИЛ ИЛИ ПИРИД-3-ИЛ)АМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ БОГАТОЙ ЛЕЙЦИНОМ ПОВТОРНОЙ КИНАЗЫ 2 (LRRK2) ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2012 |
|
RU2647849C2 |
| ЗАМЕЩЕННЫЕ ПИРИДИНОВЫЕ И ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2014 |
|
RU2802185C2 |
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЙ АМИНО-ПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ПРОСТАГЛАНДИНА D2 | 2005 |
|
RU2417990C2 |
| БЕНЗИЛАМИНОВЫЕ ПРОИЗВОДНЫЕ | 2014 |
|
RU2660421C2 |
| ФАРМАЦЕВТИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ Axl | 2011 |
|
RU2573834C2 |
Изобретение относится к соединению, выбранному из группы, состоящей из:
 ;
; 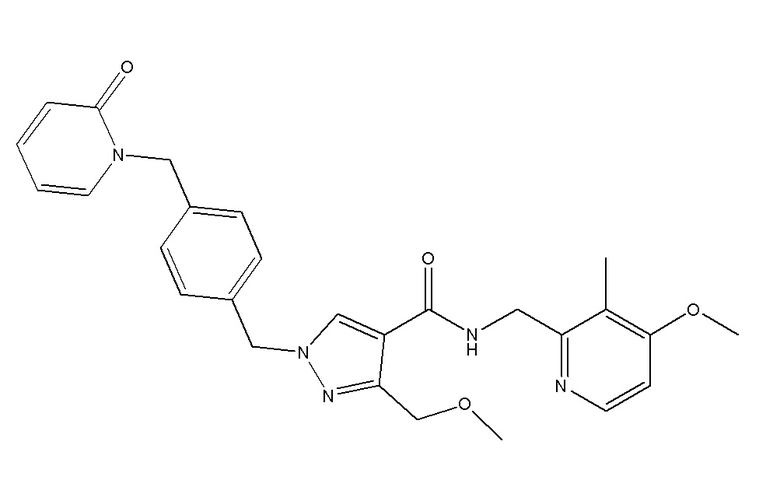 ;
;
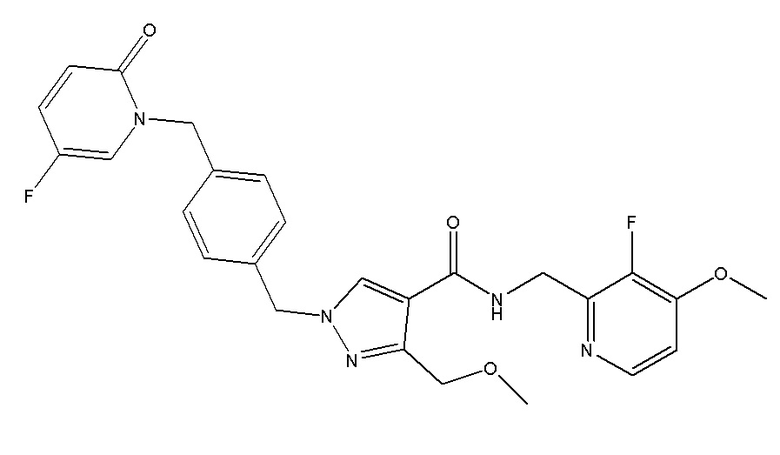 ;
; 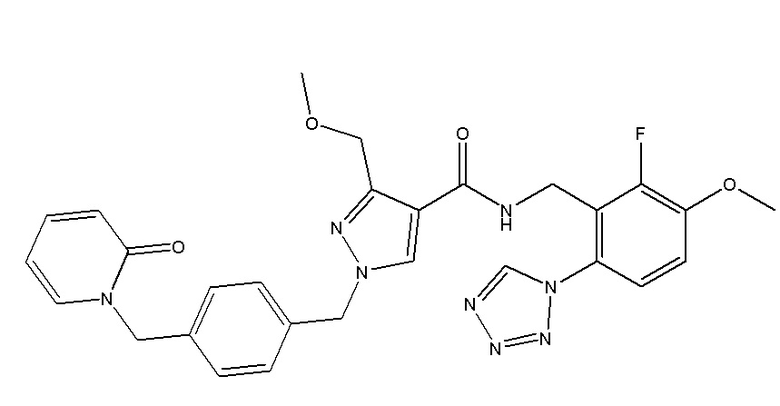 ;
;
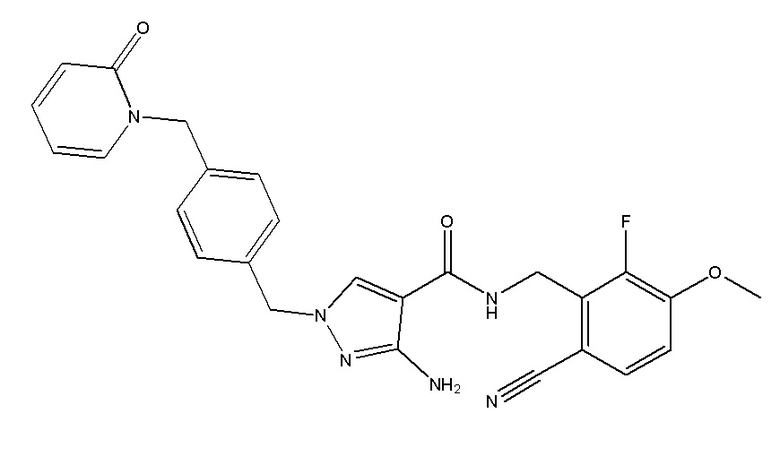 ;
; 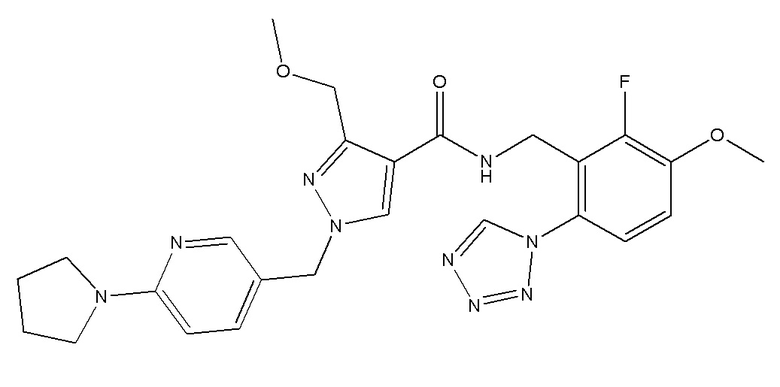 ;
;
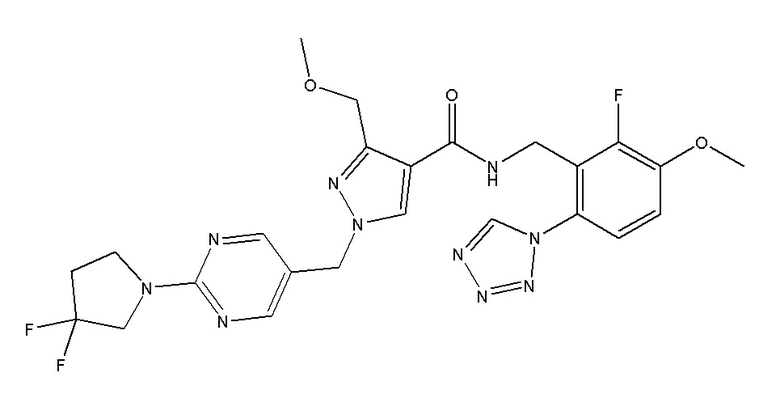 ; и его фармацевтически приемлемых солей и сольватов. Также предложены фармацевтическая композиция, применение соединения или его фармацевтически приемлемой соли или сольвата для получения лекарственного средства и способ лечения заболевания или состояния, в которое вовлечена активность калликреина плазмы. Предложенное соединение представляет собой ингибитор калликреина плазмы и имеет ряд терапевтических применений, в частности в лечении проницаемости сосудов сетчатки, связанной с диабетической ретинопатией и диабетическим отеком желтого пятна. 4 н. и 23 з.п. ф-лы, 17 табл., 14 пр.
; и его фармацевтически приемлемых солей и сольватов. Также предложены фармацевтическая композиция, применение соединения или его фармацевтически приемлемой соли или сольвата для получения лекарственного средства и способ лечения заболевания или состояния, в которое вовлечена активность калликреина плазмы. Предложенное соединение представляет собой ингибитор калликреина плазмы и имеет ряд терапевтических применений, в частности в лечении проницаемости сосудов сетчатки, связанной с диабетической ретинопатией и диабетическим отеком желтого пятна. 4 н. и 23 з.п. ф-лы, 17 табл., 14 пр.
1. Соединение, выбранное из группы, состоящей из:
 ;
;
 ;
;
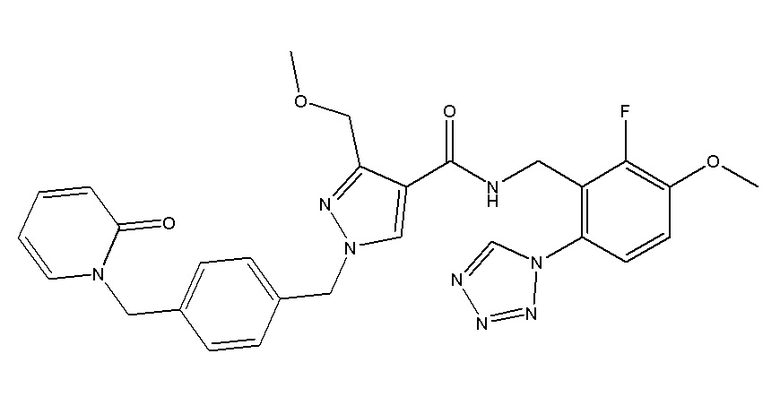
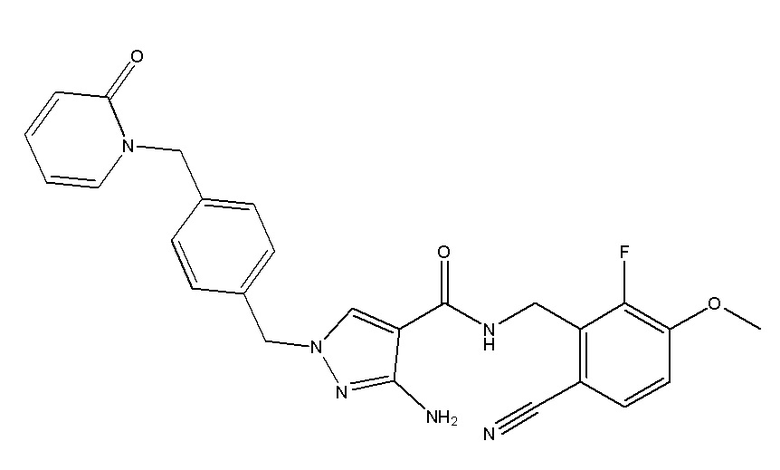 ;
;
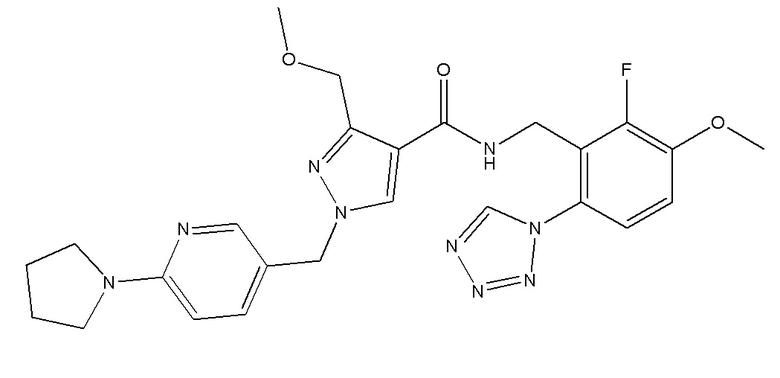 ;
;
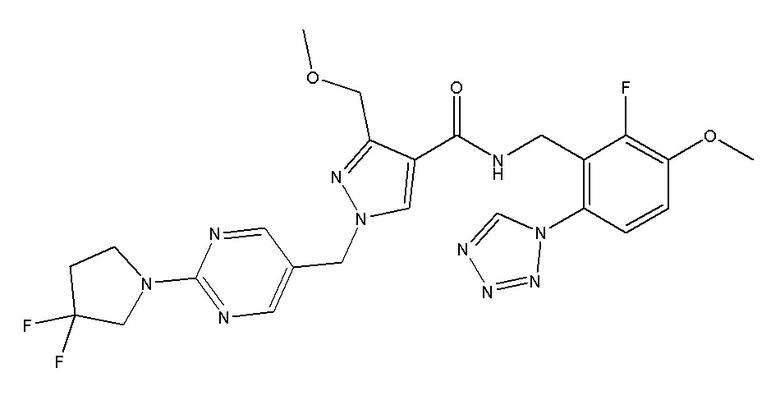 ;
;
и его фармацевтически приемлемых солей и сольватов.
2. Соединение по п.1, выбранное из:
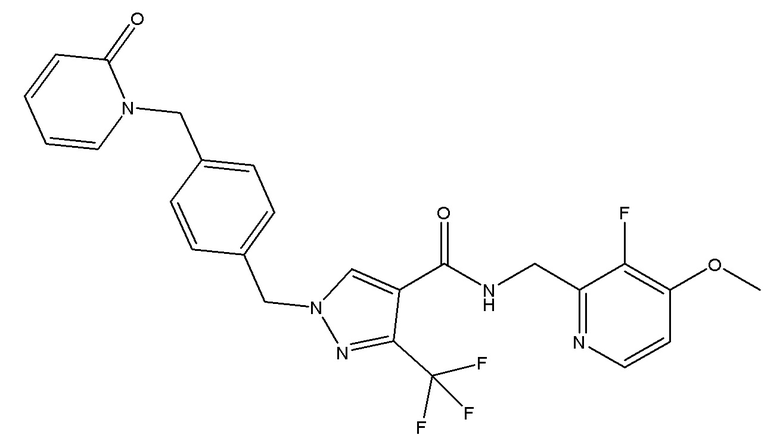 ;
;
и его фармацевтически приемлемых солей и сольватов.
3. Соединение по п.1, выбранное из:
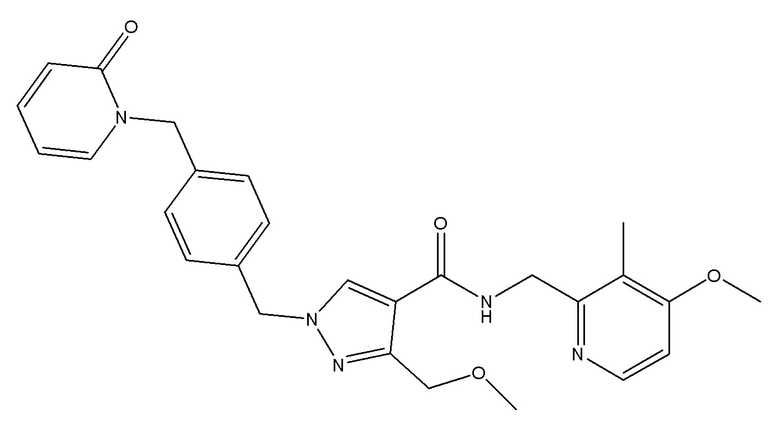 ;
;
и его фармацевтически приемлемых солей и сольватов.
4. Соединение по п.1, выбранное из:
 ;
;
и его фармацевтически приемлемых солей и сольватов.
5. Соединение по п.1, выбранное из:
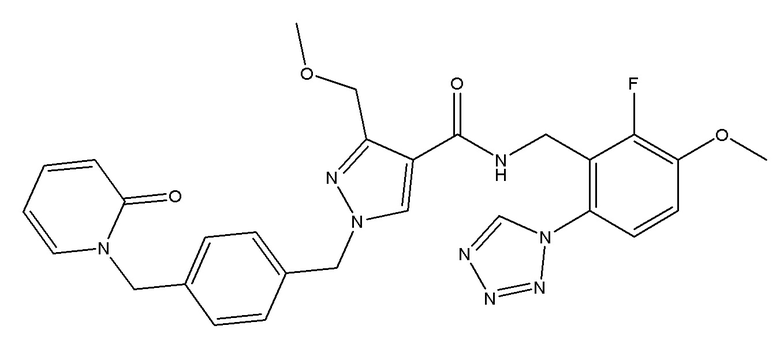 ;
;
и его фармацевтически приемлемых солей и сольватов.
6. Соединение по п.1, выбранное из:
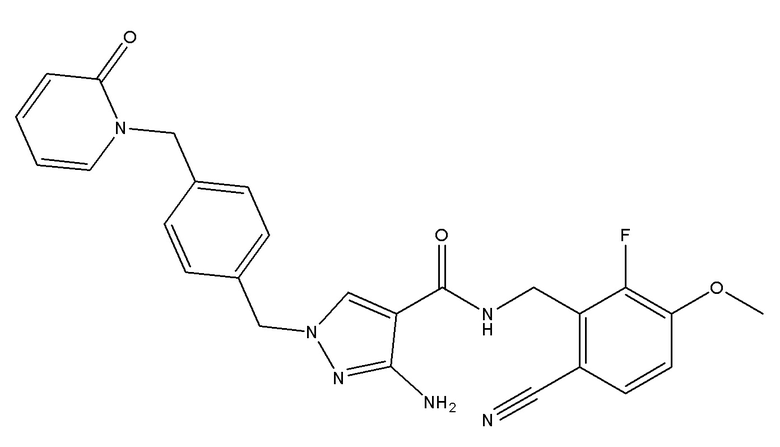 ;
;
и его фармацевтически приемлемых солей и сольватов.
7. Соединение по п.1, выбранное из:
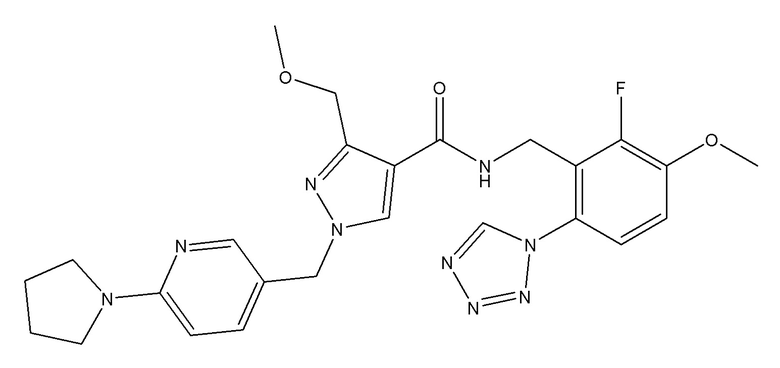 ;
;
и его фармацевтически приемлемых солей и сольватов.
8. Соединение по п.1, выбранное из:
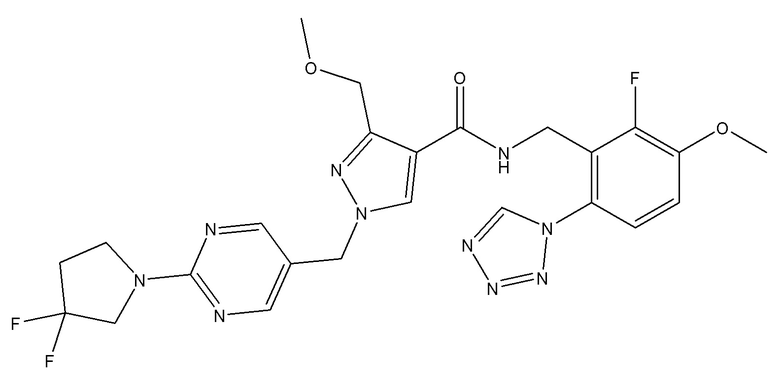 ;
;
и его фармацевтически приемлемых солей и сольватов.
9. Фармацевтическая композиция, предназначенная для ингибирования калликреина плазмы, содержащая терапевтически эффективное количество соединения или его фармацевтически приемлемой соли или сольвата по любому из пп.1-8 и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
10. Применение соединения или его фармацевтически приемлемой соли или сольвата по любому из пп.1-8 для получения лекарственного средства для лечения или предотвращения заболевания или состояния, в которое вовлечена активность калликреина плазмы.
11. Способ лечения заболевания или состояния, в которое вовлечена активность калликреина плазмы, включающий введение нуждающемуся в лечении субъекту терапевтически эффективного количества соединения или его фармацевтически приемлемой соли или сольвата по любому из пп.1-8.
12. Соединение или его фармацевтически приемлемая соль или сольват по любому из пп.1-8 для применения в способе лечения заболевания или состояния, в которое вовлечена активность калликреина плазмы.
13. Применение по п.10, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, выбрано из снижения остроты зрения, диабетической ретинопатии, диабетического отека желтого пятна, наследственного ангионевротического отека, диабета, геморрагического инсульта, воспалительного заболевания кишечника, артрита, воспаления, синдрома расстройства дыхания у взрослых, синдрома диссеминированного внутрисосудистого свертывания, свертывания крови при операции в условиях искусственного кровообращения и кровотечения после оперативной хирургии.
14. Способ по п.11, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, выбрано из снижения остроты зрения, диабетической ретинопатии, диабетического отека желтого пятна, наследственного ангионевротического отека, диабета, геморрагического инсульта, воспалительного заболевания кишечника, артрита, воспаления, синдрома расстройства дыхания у взрослых, синдрома диссеминированного внутрисосудистого свертывания, свертывания крови при операции в условиях искусственного кровообращения и кровотечения после оперативной хирургии.
15. Соединение или его фармацевтически приемлемая соль или сольват по п.12, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, выбрано из снижения остроты зрения, диабетической ретинопатии, диабетического отека желтого пятна, наследственного ангионевротического отека, диабета, геморрагического инсульта, воспалительного заболевания кишечника, артрита, воспаления, синдрома расстройства дыхания у взрослых, синдрома диссеминированного внутрисосудистого свертывания, свертывания крови при операции в условиях искусственного кровообращения и кровотечения после оперативной хирургии.
16. Применение по п.10, где заболевание или состояние, опосредованное калликреином плазмы, представляет собой наследственный ангионевротический отек.
17. Способ по п.11, где заболевание или состояние, опосредованное калликреином плазмы, представляет собой наследственный ангионевротический отек.
18. Соединение или его фармацевтически приемлемая соль или сольват по п.12, где заболевание или состояние, опосредованное калликреином плазмы, представляет собой наследственный ангионевротический отек.
19. Применение по п.10, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой диабетический отек желтого пятна.
20. Способ по п.11, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой диабетический отек желтого пятна.
21. Соединение или его фармацевтически приемлемая соль или сольват по п.12, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой диабетический отек желтого пятна.
22. Применение по п.10, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой проницаемость сосудов сетчатки, связанную с диабетической ретинопатией и диабетическим отеком желтого пятна.
23. Способ по п.11, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой проницаемость сосудов сетчатки, связанную с диабетической ретинопатией и диабетическим отеком желтого пятна.
24. Соединение или его фармацевтически приемлемая соль или сольват по п.12, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой проницаемость сосудов сетчатки, связанную с диабетической ретинопатией и диабетическим отеком желтого пятна.
25. Применение по п.10, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой окклюзию вены сетчатки.
26. Способ по п.11, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой окклюзию вены сетчатки.
27. Соединение или его фармацевтически приемлемая соль или сольват по п.12, где заболевание или состояние, в которое вовлечена активность калликреина плазмы, представляет собой окклюзию вены сетчатки.
| WO 2014108679 A1, 17.07.2014 | |||
| WO 2013111108 A1, 01.08.2013 | |||
| WO 2012017020 A1, 09.02.2012 | |||
| EA 201200917 A1, 28.12.2012. |
Авторы
Даты
2020-12-24—Публикация
2017-05-31—Подача