ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к соединениям, которые модулируют функцию киназы LRRK2 и полезны для лечения опосредованных киназой LRRK2 заболеваний и состояний, таких как болезнь Паркинсона.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь диффузных телец Леви и болезнь Гентингтона, поражают миллионы человек. Болезнь Паркинсона представляет собой хроническое, прогрессирующее расстройство двигательной системы, которым страдает приблизительно один из 1000 человек, при этом на долю наследственной болезни Паркинсона приходится 5-10% из всех пациентов. Причиной болезни Паркинсона является прогрессирующая потеря дофаминовых нейронов среднего мозга, в результате чего у пациентов нарушается способность направлять и контролировать свои передвижения. Первичными симптомами болезни Паркинсона являются дрожание, ригидность, медлительность движений и нарушение балансирования. У многих пациентов с болезнью Паркинсона имеются и другие симптомы, например эмоциональная переменчивость, потеря памяти, речевые затруднения и расстройства сна.
Ген, кодирующий белок богатой лейцином повторной киназы 2 (LRRK2), был идентифицирован в связи с наследственной болезнью Паркинсона (Paisan-Ruiz et al., Neuron, Vol. 44(4), 2004, pp 595-600; Zimprich et al., Neuron, Vol. 44(4), 2004, 601-607). Исследования in vitro показали, что мутация, ассоциированная с болезнью Паркинсона, приводит к повышению активности киназы LRRK2 и снижению скорости гидролиза GTP, по сравнению с диким типом (Guo et al., Experimental Cell Research, Vol. 313(16), 2007, pp. 3658-3670). Антитела против киназы LRRK2 использовали для мечения в стволе головного мозга телец Леви, связанных с болезнью Паркинсона, а также кортикальных антител, связанных с деменцией с тельцами Леви, что свидетельствует о возможной важной роли киназы LRRK2 в формировании телец Леви и патогенезе, связанном с данными заболеваниями (Zhou et al., Molecular Degeneration, 2006, 1:17 doi:10.1186/1750-1326-1-17). Было также выявлено, что ген киназы LRRK2 потенциально связан с повышением подверженности болезни Крона и подверженности лепре (Zhang et al., New England J. Med. Vol. 361 (2009) pp. 2609-2618.
Киназа LRRK2 также связана с переходом умеренных когнитивных нарушений в болезнь Альцгеймера (WO 2007/149789); индуцированной L-Dopa дискинезией (Hurley et al., Eur. J. Neurosci., Vol. 26, 2007, pp. 171-177; расстройствами ЦНС, связанными с дифференциацией предшественников нейронов (Milosevic et al., Neurodegen., Vol. 4, 2009, p. 25); различными видами рака, такими как рак почек, молочной железы, простаты, крови и легких, а также острый миелогенный лейкоз (WO 2011/038572); папиллярными почечными и тироидными карциномами (Looyenga et al., www.pnas.org/cgi/doi/10.1073/pnas.1012500108); множественной миеломой (Chapman et al., Nature Vol. 471, 2011, pp. 467-472); амиотрофическим боковым склерозом (Shtilbans et al., Amyotrophic Lateral Sclerosis "Early Online 2011, pp. 1-7); ревматоидным артритом (Nakamura et al., DNA Res. Vol. 13(4), 2006, pp. 169-183); и анкилозирующим спондилитом (Danoy et al., PLoS Genetics, Vol. 6(12), 2010, e1001195, pp. 1-5).
Таким образом, соединения и композиции, эффективно модулирующие активность киназы LRRK2, могут обеспечивать лечение для нейродегенеративных заболеваний, таких как болезнь Паркинсона и деменция с тельцами Леви, для расстройств ЦНС, таких как болезнь Альцгеймера и индуцированная L-Dopa дискинезия, для различных видов рака, таких как рак почек, молочной железы, простаты, крови, папиллярного рака и рак легких, острый миелогенный лейкоз и множественная миелома, и для воспалительных заболеваний, таких как лепра, болезнь Крона, амиотрофический боковой склероз, ревматоидный артрит и анкилозирующий спондилит. В частности, существует необходимость в соединениях, обладающих сродством к киназе LRRK2, селективных по отношению к киназе LRRK2 над другими киназами, такими как JAK2, и которые могут обеспечивать эффективные лекарственные средства для лечения нейродегенеративных расстройств, таких как болезнь Паркинсона.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает соединения формулы I:
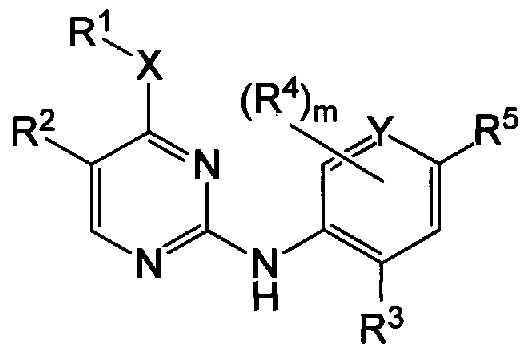
или его фармацевтически приемлемые соли, где:
m равно от 0 до 3;
X представляет собой: -NRa-; -O-; или -S(O)r-, при этом r равно от 0 до 2, a Ra представляет собой водород или C1-6-алкил;
Υ представляет собой C или Ν;
R1 представляет собой: C1-6-алкил; C1-6-алкенил; C1-6-алкинил; галоген-C1-6-алкил; C1-6-алкокси-C1-6-алкил; гидрокси-C1-6-алкил; амино-C1-6-алкил; C1-6-алкилсульфонил-C1-6-алкил; C3-6-циклоалкил, возможно замещенный C1-6-алкилом; C3-6-циклоалкил-C1-6-алкил, в котором C3-6-циклоалкильная группа возможно замещена C1-6-алкилом; тетрагидрофуранил; тетрагидрофуранил-C1-6-алкил; оксетанил; или оксетан-C1-6-алкил;
или R1 и Ra совместно с атомами, к которым они присоединены, могут образовывать кольцо, включающее от трех до шести членов, которое возможно содержит дополнительные гетероатомы, выбранные из O, N и S, и которое замещено оксогруппой, галогеном или C1-6-алкилом;
R2 представляет собой: галоген; C1-6-алкоксигруппу; цианогруппу; C1-6-алкинил; C1-6-алкенил; галоген-C1-6-алкил; галоген-C1-6-алкоксигруппу; C3-6-циклоалкил, в котором C3-6-циклоалильная группа возможно замещена C1-6-алкилом; C3-6-циклоалкил-C1-6-алкил, в котором C3-6-циклоалильная группа возможно замещена C1-6-алкилом; тетрагидрофуранил; тетрагидрофуранил-C1-6-алкил; ацетил; оксетанил; или оксетан-C1-6-алкил;
R3 и R4 каждый независимо представляет собой: галоген; C1-6-алкил; C1-6-алкоксигруппу; C3-6-циклоалкилоксигруппу; галоген-C1-6-алкил; или галоген-C1-6-алкоксигруппу; и
R5 представляет собой 5-членную гетероарильную группу, возможно замещенную одним или более R6; и
R6 представляет собой: C1-6-алкил; C3-6-циклоалкил; C3-6-циклоалкил-C1-6-алкил; галоген; галоген-C1-6-алкил; C1-6-алкоксигруппу; гетероциклил; оксогруппу; или -C(O)-NRbRc, при этом Rb и Rc каждый независимо представляет собой водород или C1-6-алкил.
Настоящее изобретение также предлагает фармацевтические композиции, включающие предложенные соединения, способы применения предложенных соединения, и способы получения предложенных соединений.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Если не указано иное, ниже следующие термины, используемые в настоящей Заявке, включая описание и формулу изобретение, имеют раскрытое ниже значение. Следует отметить, что используемые в описании и прилагаемой формуле изобретения формы единственного числа включают ссылку на форму множественного числа, если контекст ясно не указывает на обратное.
Термин "алкил" означает моновалентную линейную или разветвленную насыщенную углеводородную группу, состоящую только из атомов углерода и водорода, включающую от одного до двенадцати атомов углерода. Термин "низший алкил" обозначает алкильную группу, включающую от одного до шести атомов углерода, т.е. C1-C6-алкил. Примеры алкильных групп включают, без ограничения, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил, н-гексил, октил, додецил и т.п.
Термин "алкенил" означает линейный моновалентный углеводородный радикал, включающий от двух до шести атомов углерода, или разветвленный моновалентный углеводородный радикал, включающий от трех до шести атомов углерода, содержащий по меньшей мере одну двойную связь, например этенил, пропенил и т.п.
Термин "алкинил" означает линейный моновалентный углеводородный радикал, включающий от двух до шести атомов углерода, или разветвленный моновалентный углеводородный радикал, включающий от трех до шести атомов углерода, содержащий по меньшей мере одну тройную связь, например, этинил, пропинил и т.п.
Термин "алкилен" означает линейный насыщенный двухвалентный углеводородный радикал, включающий от одного до шести атомов углерода, или разветвленный насыщенный двухвалентный углеводородный радикал, включающий от трех до шести атомов углерода, например, метилен, этилен, 2,2-диметилэтилен, пропилен, 2-метилпропилен, бутилен, пентилен и т.п.
Термины "алкокси" и "алкилокси", которые можно использовать равнозначно, означают группу формулы -OR, при этом R представляет собой алкильную группу, раскрытую в данном описании. Примеры алкоксигрупп включают, без ограничения, метокси-, этокси-, изопропоксигруппу и т.п.
Термин "алкоксиалкил" обозначает группу формулы Ra-O-Rb-, в которой Ra представляет собой алкил, a Rb представляет собой алкилен, раскрытые в данном описании. Примеры алкоксиалкильных групп включают, например, 2-метоксиэтил, 3-метоксипропил, 1-метил-2-метоксиэтил, 1-(2-метоксиэтил)-3-метоксипропил и 1-(2-метоксиэтил)-3-метоксипропил.
Термин "алкоксиалкокси" обозначает группу формулы -Ο-R-Rʹ, в которой R представляет собой алкилен, a Rʹ представляет собой алкоксигруппу, раскрытые в данном описании.
Термин "алкилкарбонил" обозначает группу формулы -C(O)-R, в которой R представляет собой алкил, раскрытый в данном описании.
Термин "алкоксикарбонил" обозначает группу формулы -C(O)-R, в которой R представляет собой алкоксигруппу, раскрытую в данном описании.
Термин "алкилкарбонилалкил" обозначает группу формулы -R-C(O)-R, в которой R представляет собой алкилен, a Rʹ представляет собой алкил, раскрытые в данном описании.
Термин "алкоксикарбонилалкил" обозначает группу формулы -R-C(O)-R, в которой R представляет собой алкилен, a Rʹ представляет собой алкоксигруппу, раскрытые в данном описании.
Термин "алкоксикарбонилалкокси" обозначает группу формулы -O-R-C(O)-Rʹ, в которой R представляет собой алкилен, a Rʹ представляет собой алкоксигруппу, раскрытые в данном описании.
Термин "гидроксикарбонилалкокси" обозначает группу формулы -O-R-C(O)-OH, в которой R представляет собой алкилен, раскрытый в данном описании.
Термин "алкиламинокарбонилалкокси" обозначает группу формулы -O-R-C(O)-NHRʹ, в которой R представляет собой алкилен, a Rʹ представляет собой алкил, раскрытые в данном описании.
Термин "диалкиламинокарбонилалкокси" обозначает группу формулы -O-R-C(O)-NRʹRʺ, в которой R представляет собой алкилен, a Rʹ и Rʺ представляют собой алкил, раскрытый в данном описании.
Термин "алкиламиноалкокси" обозначает группу формулы -O-R-NHRʹ, в которой R представляет собой алкилен, a Rʹ представляет собой алкил, раскрытые в данном описании.
Термин "диалкиламиноалкокси" обозначает группу формулы -O-R-NRʹRʹ, в которой R представляет собой алкилен, a Rʹ и Rʺ представляют собой алкил, раскрытые в данном описании.
Термин "алкилсульфонил" обозначает группу формулы -SO2-R, в которой R представляет собой алкил, раскрытый в данном описании.
Термин "алкилсульфонилалкил" обозначает группу формулы -Rʹ-SO2-Rʺ, в которой Rʹ представляет собой алкилен, a Rʺ представляет собой алкил, раскрытые в данном описании.
Термин "алкилсульфонилалкокси" обозначает группу формулы -O-R-SO2-Rʹ, в которой R представляет собой алкилен, a Rʹ представляет собой алкил, раскрытые в данном описании.
Термин "амино" обозначает группу формулы -NRRʹ, в которой R и Rʹ каждый независимо представляет собой водород или алкил, раскрытый в данном описании. Таким образом, термин "амино" включает алкиламиногруппу (в которой один из R и Rʹ представляет собой алкил, а другой представляет собой водород) и диалкиламиногруппу (в которой R и Rʹ оба представляют собой алкил).
Термин "аминокарбонил" обозначает группу формулы -C(O)-R, в которой R представляет собой аминогруппу, раскрытую в данном описании.
Термин "алкоксиамино" обозначает группу формулы -NR-ORʹ, в которой R представляет собой водород или алкил, a Rʹ представляет собой алкил, раскрытые в данном описании.
Термин "алкилсульфанил" обозначает группу формулы -SR, в которой R представляет собой алкил, раскрытый в данном описании.
Термин "аминоалкил" обозначает группу -R-Rʹ, в которой Rʹ представляет собой аминогруппу, a R представляет собой алкилен, раскрытые в данном описании. Термин "аминоалкил" включает аминометил, аминоэтил, 1-аминопропил, 2-аминопропил и т.п. Аминогруппа "аминоалкила" может быть однократно или дважды замещена алкилом, давая, соответственно "алкиламиноалкил" и "диалкиламиноалкил". Термин "алкиламиноалкил" включает метиламинометил, метиламиноэтил, метиламинопропил, этиламиноэтил и т.п. Термин "диалкиламиноалкил" включает диметиламинометил, диметиламиноэтил, диметиламинопропил, N-метил-N-этиламиноэтил и т.п.
Термин "аминоалкокси" обозначает группу -OR-Rʹ, в которой Rʹ представляет собой аминогруппу, a R представляет собой алкилен, раскрытые в данном описании.
Термин "алкилсульфониламидо" обозначает группу формулы -NRʹSO2-R, в которой R представляет собой алкил, a Rʹ представляет собой водород или алкил.
Термин "аминокарбонилоксиалкил" или "карбамилалкил" обозначает группу формулы -R-O-C(O)-NRʹRʺ, в которой R представляет собой алкилен, a Rʹ и Rʺ каждый независимо представляет собой водород или алкил, раскрытый в данном описании.
Термин "алкинилалкокси" обозначает группу формулы -O-R-Rʹ, в которой R представляет собой алкилен, a Rʹ представляет собой алкинил, раскрытые в данном описании.
Термин "арил" означает моновалентную циклическую ароматическую углеводородную группу, состоящую из моно-, би- или трициклической ароматической кольцевой системы. Арильная группа может быть (не обязательно) замещенной, как раскрыто в данном описании. Примеры арильных групп включают, без ограничения: фенил, нафтил, фенантрил, флюоренил, инденил, пенталенил, азуленил, оксидифенил, бифенил, метилендифенил, аминодифенил, дифенилсульфидил, дифенилсульфонил, дифенилизопропилиденил, бензодиоксанил, бензофуранил, бензодиоксилил, бензопиранил, бензоксазинил, бензоксазинонил, бензопиперадинил, бензопиперазинил, бензопирролидинил, бензоморфолинил, метилендиоксифенил, этилендиоксифенили т.п., которые могут быть (не обязательно) замещены, как раскрыто в данном описании.
Термины "арилалкил" и "аралкил", которые можно использовать равнозначно, означают радикал -RaRb, в котором Ra представляет собой алкиленовую группу, a Rb представляет собой арильную группу, раскрытые в данном описании; примерами арилалкила являются, например, фенилалкилы, такие как бензил, фенилэтил, 3-(3-хлорфенил)-2-метилпентил и т.п.
Термин "арилсульфонил" обозначает группу формулы -SO2-R, в которой R представляет собой арил, раскрытый в данном описании.
Термин "арилокси" обозначает группу формулы -O-R, в которой R представляет собой арил, раскрытый в данном описании.
Термин "аралкилокси" обозначает группу формулы -O-R-Rʺ, в которой R представляет собой алкилен, a Rʹ представляет собой арил, раскрытые в данном описании.
Термины "карбокси" или "гидроксикарбонил", которые можно использовать равнозначно, означают группу формулы -C(O)-OH.
Термин "цианоалкил" обозначает группу формулы -Rʹ-Rʺ, в которой Rʹ представляет собой алкилен, раскрытый в данном описании, a Rʺ представляет собой цианогруппу или нитрил.
Термин "циклоалкил" означает моновалентную насыщенную карбоциклическую группу, состоящую из моно- или бициклической кольцевой системы. В частности, циклоалкил может быть незамещенным или замещенным алкилом. Циклоалкил может быть (необязательно) замещен, как раскрыто в данном описании. Если не указано иное, циклоалкил, возможно, содержит один или более заместителей, при этом каждый заместитель представляет собой независимо гидроксигруппу, алкил, алкоксигруппу, галоген, галогеналкил, аминогруппу, моноалкиламиногруппу или диалкиламиногруппу. Примеры циклоалкильной группы включают, без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п., включая его частично ненасыщенные (циклоалкенил) производные.
Термин "циклоалкилалкил" обозначает группу формулы -Rʹ-Rʺ, в которой Rʹ представляет собой алкилен, a Rʺ представляет собой циклоалкил, раскрытые в данном описании.
Термин "циклоалкилалкокси" обозначает группу формулы -O-R-Rʹ, в которой R представляет собой алкилен, a Rʹ представляет собой циклоалкил, раскрытые в данном описании.
Термин "гетероарил" означает моноциклический или бициклический радикал, включающий от 5 до 12 кольцевых атомов, содержащий по меньшей мере одно ароматическое кольцо, включающее один, два или три кольцевых гетероатома, выбранных из Ν, O или S, при этом остальные атомы в кольце представляют собой атомы углерода, и при этом подразумевается, что место присоединения гетероарильного радикала находится на ароматическом кольце. Гетероарильное кольцо может быть замещено, как раскрыто в данном описании. Примеры гетероарильных групп включают, без ограничения, возможно замещенный имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиразинил, тиенил, бензотиенил, тиофенил, фуранил, пиранил, пиридил, пирролил, пиразолил, пиримидил, хинолинил, изохинолинил, бензофурил, бензотиофенил, бензотиопиранил, бензимидазолил, бензооксазолил, бензооксадиазолил, бензотиазолил, бензотиадиазолил, бензопиранил, индолил, изоиндолил, триазолил, триазинил, хиноксалинил, пуринил, хиназолинил, хинолизинил, нафтиридинил, птеридинил, карбазолил, азепинил, диазепинил, акридинил и т.п., каждый из которых может быть замещен, как раскрыто в данном описании.
Термин "гетероарилалкил" или "гетероаралкил" обозначает группу формулы -R-Rʹ, в которой R представляет собой алкилен, a Rʹ представляет собой гетероарил, раскрытые в данном описании.
Термин "гетероарилсульфонил" обозначает группу формулы -SO2-R, в которой R представляет собой гетероарил, раскрытый в данном описании.
Термин "гетероарилокси" обозначает группу формулы -O-R, в которой R представляет собой гетероарил, раскрытый в данном описании.
Термин "гетероаралкилокси" обозначает группу формулы -O-R-Rʺ, в которой R представляет собой алкилен, a Rʹ представляет собой гетероарил, раскрытые в данном описании.
Термины "галоген" и "галид", которые можно использовать равнозначно, относятся к следующим заместителям: фтор, хлор, бром или иод.
Термин "галогеналкил" означает алкил, раскрытый в данном описании, в котором один или более атомов водорода замещены одинаковыми или различными или атомами галогена. Примеры галогеналкилов включают -CH2Cl, -CH2CF3, -CH2CCl3, перфторалкил (например, -CF3) и т.п.
Термин "галогеналкокси" обозначает группу формулы -OR, в которой R представляет собой галогеналкил группу, раскрытую в данном описании. Примером галогеналкоксигруппы является дифторметоксигруппа.
Термин "гетероциклоамино" означает насыщенное кольцо, в котором по меньшей мере один кольцевой атом представляет собой Ν, NH или N-алкил, а остальные атомы в кольце образуют алкиленовую группу.
Термин "гетероциклил" означает моновалентную насыщенную группу, включающую от одного до трех колец, включая один, два, три или четыре гетероатомов (выбранных из азота, кислорода или серы). Такое гетероциклилическое кольцо может быть замещено, как раскрыто в данном описании. Примеры гетероциклилических групп включают, без ограничения, возможно замещенный пиперидинил, пиперазинил, морфолинил, тиоморфолинил, азепинил, пирролидинил, азетидинил, тетрагидропиранил, тетрагидрофуранил, оксетанил и т.п. Такие гетероциклические группы могут быть замещены, как раскрыто в данном описании.
Термин "гетероциклилалкил" обозначает группу формулы -R-Rʹ, в которой R представляет собой алкилен, a Rʹ представляет собой гетероциклил, раскрытые в данном описании.
Термин "гетероциклилокси" обозначает группу формулы -OR, в которой R представляет собой гетероциклил, раскрытый в данном описании.
Термин "гетероциклилалкокси" обозначает группу формулы -OR-Rʹ, в которой R представляет собой алкилен, a Rʹ представляет собой гетероциклил, раскрытый в данном описании.
Термин "гетероциклилсульфонил" обозначает группу формулы -SO2-R, в которой R представляет собой гетероциклил, раскрытый в данном описании.
Термин "гидроксиалкокси" обозначает группу формулы -OR, в которой R представляет собой гидроксиалкил, раскрытый в данном описании.
Термин "гидроксиалкиламино" обозначает группу формулы -NR-Rʹ, в которой R представляет собой водород или алкил, a Rʹ представляет собой гидроксиалкил, раскрытые в данном описании.
Термин "гидроксиалкиламиноалкил" обозначает группу формулы -R-NRʹ-Rʺ, в которой R представляет собой алкилен, Rʹ представляет собой водород или алкил, а Rʺ представляет собой гидроксиалкил, раскрытые в данном описании.
Термин "гидроксикарбонилалкил" или "карбоксиалкил" обозначает группу формулы -R-(CO)-OH, в которой R представляет собой алкилен, раскрытый в данном описании.
Термин "гидроксикарбонилалкокси" обозначает группу формулы -O-R-C(O)-OH, в которой R представляет собой алкилен, раскрытый в данном описании.
Термины "гидроксиалкилоксикарбонилалкил" или "гидроксиалкоксикарбонилалкил" обозначает группу формулы -R-C(O)-O-R-OH, в которой каждый R представляет собой алкилен и может быть одинаковым или различаться.
Термин "гидроксиалкил" обозначает алкильную группу, раскрытую в данном описании, замещенную одной или более, например, одной, двумя или тремя гидроксигруппами, при условии что один и тот же атом углерода не несет более одной гидроксигруппы. Отдельные примеры включают, без ограничения, гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 1-(гидроксиметил)-2-метилпропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил и 2-(гидроксиметил)-3-гидроксипропил.
Термин "гидроксициклоалкил" означает циклоалкил группу, раскрытую в данном описании, в которой один, два или три атома водорода в циклоалкильном радикале замещены гидроксигруппой. Отдельные примеры включают, без ограничения, 2-, 3-или 4-гидроксициклогексил и т.п.
Термины "алкоксигидроксиалкил" и "гидроксиалкоксиалкил", которые можно использовать равнозначно, обозначают алкил, раскрытый в данном описании, замещенный по меньшей мере одной гидроксигруппой и по меньшей мере одной алкоксигруппой. Таким образом, термины "алкоксигидроксиалкил" и "гидроксиалкоксиалкил" охватывают, например, 2-гидрокси-3-метоксипропан-1-ил и т.п.
Термины "мочевина" или "уреидо" обозначают группу формулы -NRʹ-C(O)-NRʺRʺʹ, в которой Rʹ, Rʺ и Rʹʹʹ каждый независимо представляет собой водород или алкил.
Термин "карбамат" обозначает группу формулы -O-C(O)-NRʹRʺ, в которой Rʹ и Rʺ каждый независимо представляет собой водород или алкил.
Термин "карбокси" обозначает группу формулы -O-C(O)-OH.
Термин "сульфонамидо" обозначает группу формулы -SO2-NRʹRʺ, в которой Rʹ, Rʺ и Rʹʹʹ каждый независимо представляет собой водород или алкил.
Термин "возможно замещенный", если он использован в сочетании с группами "арил", "фенил", "гетероарил", "циклоалкил" или "гетероциклил", означает, что такая группа может быть незамещенной (т.е. все открытые валентности заняты атомами водорода) или замещенной определенными группами, указанными в данном описании.
Термин "уходящая группа" обозначает группу в общепринятом значении, связанном с синтетической органической химией, т.е., атом или группу, которые можно заместить в условиях реакции замещения. Примеры уходящих групп включают, без ограничения, галоген, алкан- или ариленсульфонилоксигруппу, такую как метансульфонилокси-, этансульфонилокси-, тиометил-, бензолсульфонилокси-, тозилокси- и тиенилоксигруппу, дигалогенфосфиноилоксигруппу, возможно замещенную бензилоксигруппу, изопропилокси-, ацилоксигруппу и т.п.
Термин "модулятор" обозначает молекулу, которая взаимодействует с мишенью. Подобные взаимодействия включают, без ограничения, агонист, антагонист и т.п., раскрытые в данном описании.
Термин "возможный" или "возможно" означает, что описанное далее событие или обстоятельство может, но не обязательно, иметь место, и что такое описание включает случае, когда указанные событие или обстоятельство имеют место, а также случаи, когда они не имеют место.
Термины "заболевание" и "болезненное состояние" обозначает любое заболевание, состояние, симптом, расстройство или назначение.
"Инертный органический растворитель" или "инертный растворитель" обозначает растворитель, инертный в условиях реакции, описанной вместе с данным растворителем, включая например, бензол, толуол, ацетонитрил, тетрагидрофуран, Ν,Ν-диметилформамид, хлороформ, метиленхлорид или дихлорметан, дихлорэтан, диэтиловый эфир, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропанол, изопропанол, трет-бутанол, диоксан, пиридин и т.п. Если не указано противоположное, растворители, используемые в реакциях по настоящему изобретению, представляют собой инертные растворители.
Термин "фармацевтически приемлемый" обозначает полезный при изготовлении фармацевтической композиции, которая в общем случае безопасна, не токсична и не является нежелательной с биологической или иной точки зрения, и включает материалы, приемлемые для фармацевтического применения в ветеринарии и у человека.
Термин "фармацевтически приемлемые соли" соединения обозначает соли, которые являются фармацевтически приемлемыми, как раскрыто в данном описании, и обладают желаемой фармакологической активностью исходного соединения.
Следует понимать, что все ссылки на фармацевтически приемлемые соли включают формы добавления растворителя (сольваты) или кристаллические формы (полиморфы), раскрытые в данном описании, той же самой соли добавления кислоты.
Термин "защитная группа" или "протекторная группа" обозначает группу, которая селективно блокирует один реакционно-способный сайт в соединении с несколькими функциональными группами, так чтобы химическую реакцию можно было проводить селективно по другому незащищенному реакционно-способному сайту, в общепринятом значении, связанном с синтетической химией. Некоторые способы по настоящему изобретению основаны на защитных группах, применяемых с целью блокировки реакционно-способного атома азота и/или кислорода, присутствующего в реактантах. Например, термины "амино-протекторная группа" и "азот-протекторная группа" используются в данном тексте и означают такие органические группы, которые предназначены для защиты атома азота от нежелательных реакций в процессе синтеза. Примеры азот-протекторных групп включают, без ограничения, трифторацетил, ацетамидогрупппу, бензил (Bn), бензилоксикарбонил (карбобензилокси, CBZ), п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, трет-бутоксикарбонил (BOC) и т.п. Специалисту в данной области техники известно, как подобрать группу, которую можно будет легко удалить и которая выдержит последующие реакции.
Термин "сольваты" обозначает формы добавления растворителя, содержащие либо стехиометрическое, либо нестехиометрическое количество растворителя. Некоторые соединения имеют тенденцию захватывать фиксированное молярное соотношение молекул растворителя в твердом кристаллическом состоянии, образуя таким образом сольват. Если растворителем является вода, то получаемый сольват представляет собой гидрат, если растворителем является спирт, то получаемый сольват представляет собой алкоголят. Гидраты образуются при сочетании одной или более молекул воды с одним из веществ, при этом вода сохраняет свое молекулярное состояние как H2O, и при этом такое сочетание способно давать один или более гидратов.
Термин "болезнь Паркинсона" обозначает дегенеративное расстройство центральной нервной системы, в результате которого нарушаются двигательные навыки, речь, и/или когнитивная функция. Симптомы болезни Паркинсона могут включать, например, мышечную ригидность, тремор, замедление физических движений (брадикинезия) и потеря физического движения (акинезия).
Термин "деменция с тельцами Леви", также называемое "болезнь диффузных телец Леви" и "кортикальная болезнь телец Леви" обозначает нейродегенеративное расстройство, которое характеризуется анатомическим присутствием телец Леви в головном мозге.
Термин "субъект" обозначает млекопитающих и не-млекопитающих. Термин "млекопитающее" обозначает любого представителя класса млекопитающих, включая, без ограничения, человека; нечеловекообразных приматов, таких как шимпанзе и других видов обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы и свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки; и т.п. Примеры не-млекопитающих включают, без ограничения, птиц и т.п. Термин "субъект" не связан с конкретным возрастом или полом.
Термин "терапевтически эффективное количество" обозначает количество соединения, которого оказывается достаточно, при введении его субъекту с целью лечения болезненного заболевания, для осуществления такого лечения для данного болезненного состояния. "Терапевтически эффективное количество" будет варьироваться в зависимости от соединения, болезненного состояния, на которое направлено лечение, тяжести заболевания, на которое направлено лечение, возраста и относительного здоровья субъекта, способа и формы введения, мнения лечащего врача или ветеринара и других факторов.
Термины "как определено выше" и "как определено в данном описании", в случаях, когда они относятся к переменной, включают посредством ссылки широкое определение этой переменной, а также частные определения, если такие имеются.
Термин "лечение" болезненного состояния включает в том числе ингибирование болезненного состояния, т.е. купирование развития болезненного состояния или его клинических симптомов и/или облегчение болезненного состояния, т.е. достижение временной или постоянной регрессии болезненного состояния или его клинических симптомов.
Термины "обработка", "введение в контакт" и "введении в реакцию", если они относятся к химической реакции, обозначают добавление или смешение двух или более реагентов в подходящих условиях для получения целевого и/или желаемого продукта. Следует понимать, что реакция, в ходе которой получают целевой и/или желаемый продукт, не обязательно является результатом непосредственного сочетания двух реагентов, которые были изначально добавлены, т.е. возможно образование одного или более промежуточных продуктов, которые образуются в смеси, что в конечном итоге приводит к получению целевого и/или желаемого продукта.
Термин "C1-6" в комбинации с любым термином в данном описании обозначает ряд от одного атома углерода до шести атомов углеродов, т.е. 1, 2, 3, 4, 5 или 6 атомов углерода, "C2-6" обозначает ряд от двух атомов углерода до атомов шести углерода, т.е. 2, 3, 4, 5 или 6 атомов углерода, "C3-6" обозначает ряд от трех атомов углерода до шести атомов углерода, т.е. 3, 4, 5, или 6 углерод.
НОМЕНКЛАТУРА И СТРУКТУРЫ
В целом, номенклатура и химические названия, используемые в настоящей Заявке, основаны на программном обеспечении ChembioOffice™ (CambridgeSoft™). Любая открытая валентность на атоме углерода, кислорода, серы или азота в структурах указывает на присутствие атома водорода, если не указано иное. Если азот-содержащее гетероарильное кольцо показано с открытой валентностью на атоме азота, и на гетероарильном кольце показаны переменные, такие как Ra, Rb или Rc, такие переменные могут быть связаны или присоединены к открытой валентности азота. Если в структуре присутствует хиральный центр, но конкретная стереохимия не показана для данного хирального центра, такая структура охватывает оба энантиомера, связанных с данным хиральным центром. Если показанная структура может существовать в нескольких таутомерных формах, такая структура охватывает все такие таутомеры. Подразумевается, что атомы, представленные в структурах, охватывают все природные изотопы таких атомов. Таким образом, например, подразумевается, что атомы водорода, представленные в настоящем описании, включают дейтерий и тритий, а атомы углерода включают изотопы C13 и C14.
СОЕДИНЕНИЯ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Настоящее изобретение предлагает соединения формулы I:

или его фармацевтически приемлемые соли,
при этом:
m равно от 0 до 3;
X представляет собой: -NRa-; -O-; или -S(O)r-, при этом r равно от 0 до 2, a Ra представляет собой водород или C1-6-алкил;
Υ представляет собой C или Ν;
R1 представляет собой: C1-6-алкил; C1-6-алкенил; C1-6-алкинил; галоген-C1-6-алкил; C1-6-алкокси-C1-6-алкил; гидрокси-C1-6-алкил; амино-C1-6-алкил; C1-6-алкилсульфонил-C1-6-алкил; C3-6-циклоалкил, возможно замещенный C1-6-алкилом; C3-6-циклоалкил-C1-6-алкил, в котором C3-6-циклоалильная группа возможно замещена C1-6-алкилом; тетрагидрофуранил; тетрагидрофуранил-C1-6-алкил; оксетанил; или оксетан-C1-6-алкил;
или R1 и Ra совместно с атомами, к которым они присоединены, могут образовывать кольцо, включающее от трех до шести членов, которое возможно содержит дополнительные гетероатомы, выбранные из O, N и S, и которое замещено оксогруппой, галогеном или C1-6-алкилом;
R2 представляет собой: галоген; C1-6-алкоксигруппу; цианогруппу; C1-6-алкинил; C1-6-алкенил; галоген-C1-6-алкил; галоген-C1-6-алкоксигруппу; C3-6-циклоалкил, в котором C3-6-циклоалильная группа возможно замещена C1-6-алкилом; C3-6-циклоалкил-C1-6-алкил, в котором C3-6-циклоалильная группа возможно замещена C1-6-алкилом; тетрагидрофуранил; тетрагидрофуранил-C1-6-алкил; ацетил; оксетанил; или оксетан-C1-6-алкил;
R3 и R4 каждый независимо представляет собой: галоген; C1-6-алкил; C1-6-алкоксигруппу; C3-6-циклоалкилоксигруппу; галоген-C1-6-алкил; или галоген-C1-6-алкоксигруппу; и
R5 представляет собой 5-членную гетероарильную группу, возможно замещенную одним или более R6; и
R6 представляет собой: C1-6-алкил; C3-6-циклоалкил; C3-6-циклоалкил-C1-6-алкил; галоген; галоген-C1-6-алкил; C1-6-алкоксигруппу; гетероциклил; оксогруппу; или -C(O)-NRbRc, где Rb и Rc каждый независимо представляет собой водород или C1-6-алкил.
В частных воплощениях формулы I,
m равно от 0 до 1;
X представляет собой NH;
Υ представляет собой C или Ν;
R1 представляет собой C1-6-алкил
R2 представляет собой галоген или галоген-C1-6-алкил;
R3 и R4 каждый независимо представляет собой: галоген; C1-6-алкил или C1-6-алкоксигруппу;
R5 представляет собой 5-членную гетероарильную группу, возможно содержащую в качестве заместителя одну или более групп R6; и
R6 представляет собой: C1-6-алкил; C1-6-алкоксигруппу; гетероциклил или -C(О)-NRbRc, где Rb и Rc каждый независимо представляет собой водород или -C1-6-алкил.
В частных воплощениях формулы I, R1 и Ra совместно с атомами, к которым они присоединены, могут образовывать кольцо, включающее от трех до шести членов, которое возможно содержит дополнительные гетероатомы, выбранные из O, N и S, и которое может быть замещено оксогруппой, галогеном или C1-6-алкилом.
В частных воплощениях формулы I, R1 и Ra совместно с атомами, к которым они присоединены, образуют пяти- или шестичленное кольцо.
В частных воплощениях формулы I, R1 и Ra совместно с атомами, к которым они присоединены, образуют пирролидинил, пиперидинил или оксазолидинонил.
В частных воплощениях формулы I R2 представляет собой ацетил.
В частных воплощениях формулы I, если R1 представляет собой циклопропил, циклобутил, циклопропил-C1-6-алкил или циклобутил-C1-6-алкил, то X представляет собой -O-.
В частных воплощениях формулы I m равно от 0 до 2.
В частных воплощениях формулы I m равно 0 или 1.
В частных воплощениях формулы I m равно 0.
В частных воплощениях формулы I m равно 1.
В частных воплощениях формулы I r равно 0.
В частных воплощениях формулы I r равно 2.
В частных воплощениях формулы I X представляет собой -NRa- или -O-.
В частных воплощениях формулы I X представляет собой -NRa.
В частных воплощениях формулы I X представляет собой -O-.
В частных воплощениях формулы I X представляет собой -S(O)n-.
В частных воплощениях формулы I X представляет собой -NH- или -O-.
В частных воплощениях формулы I Υ представляет собой C.
В частных воплощениях формулы I Υ представляет собой N.
В частных воплощениях формулы I Ra представляет собой водород.
В частных воплощениях формулы I Ra представляет собой C1-6-алкил.
В частных воплощениях формулы I R1 представляет собой: C1-6-алкил; галоген-C1-6-алкил; C1-6-алкокси-C1-6-алкил; амино-C1-6-алкил; C1-6-алкилсульфонил-C1-6-алкил; C3-6-циклоалкил; или C3-6-циклоалкил-C1-6-алкил.
В частных воплощениях формулы I R1 представляет собой: C1-6-алкил; C3-6-циклоалкил, возможно замещенный C1-6-алкилом; или C3-6-циклоалкил-C1-6-алкил, в котором C3-6-циклоалильная группа возможно замещена C1-6-алкилом.
В частных воплощениях формулы I R1 представляет собой: C1-6-алкил; галоген-C1-6-алкил; C1-6-алкокси-C1-6-алкил; амино-C1-6-алкил; C1-6-алкилсульфонил-C1-6-алкил; тетрагидрофуранил; тетрагидрофуранил-C1-6-алкил; оксетанил; или оксетан-C1-6-алкил.
В частных воплощениях формулы I R1 представляет собой: C1-6-алкил; галоген-C1-6-алкил; C1-6-алкокси-C1-6-алкил; амино-C1-6-алкил; или C1-6-алкилсульфонил-C1-6-алкил.
В частных воплощениях формулы I R1 представляет собой C1-6-алкил.
В частных воплощениях формулы I R1 представляет собой галоген-C1-6-алкил.
В частных воплощениях формулы I R1 представляет собой C1-6-алкокси-C1-6-алкил.
В частных воплощениях формулы I R1 представляет собой амино-C1-6-алкил.
В частных воплощениях формулы I R1 представляет собой C1-6-алкилсульфонил-C1-6-алкил, возможно замещенный C1-6-алкилом.
В частных воплощениях формулы I R1 представляет собой C3-6-циклоалкил, возможно замещенный C1-6-алкилом.
В частных воплощениях формулы I R1 представляет собой C3-6-циклоалкил-C1-6-алкил, в котором C3-6-циклоалильная группа возможно замещена C1-6-алкилом.
В частных воплощениях формулы I R1 представляет собой тетрагидрофуранил.
В частных воплощениях формулы I R1 представляет собой тетрагидрофуранил-C1-6-алкил и оксетанил.
В частных воплощениях формулы I R1 представляет собой или оксетан-C1-6-алкил.
В частных воплощениях формулы I R1 представляет собой: метил; этил; н-пропил; изопропил; изобутил; 3,3-диметилпропил; циклопропил; циклобутил; циклопентил; циклогексил; циклопропилметил; циклобутилметил; циклопентилметил; циклопропилэтил; метоксиэтил; оксетанил; или тетрагидрофуранилметил.
В частных воплощениях формулы I R1 представляет собой: метил; этил; н-пропил; изопропил; изобутил; 3,3-диметилпропил; циклопентил; циклогексил; циклопропилметил; циклобутилметил; циклопентилметил; циклопропилэтил; метоксиэтил; оксетанил; или тетрагидрофуранилметил.
В частных воплощениях формулы I R1 представляет собой: метил; этил; н-пропил; изопропил; изобутил; 3,3-диметилпропил; циклопентил; циклогексил; циклопентилметил; метоксиэтил; оксетанил; или тетрагидрофуранилметил.
В частных воплощениях формулы I R1 представляет собой: метил; этил; н-пропил; изопропил; или изобутил.
В частных воплощениях формулы I R1 представляет собой метил или этил.
В частных воплощениях формулы I R1 представляет собой метил.
В частных воплощениях формулы I R1 представляет собой этил.
В частных воплощениях формулы I R1 представляет собой: циклопропил; циклобутил; циклопентил; циклогексил; циклопропилметил; циклобутилметил; циклопентилметил; или циклопропилэтил.
В частных воплощениях формулы I R1 представляет собой: циклопентил; циклогексил; или циклопентилметил.
В частных воплощениях формулы I R2 представляет собой: галоген; C1-6-алкоксигруппу; галоген-C1-6-алкил; галоген-C1-6-алкоксигруппу; C3-6-циклоалкил, в котором C3-6-циклоалильная группа возможно замещена C1-6-алкилом; C3-6-циклоалкил-C1-6-алкил, в котором C3-6-циклоалильная группа возможно замещена C1-6-алкилом; тетрагидрофуранил; тетрагидрофуранил-C1-6-алкил; оксетанил; или оксетан-C1-6-алкил.
В частных воплощениях формулы I R2 представляет собой: галоген; C1-6-алкоксигруппу; галоген-C1-6-алкил; цианогруппу; C1-6-алкинил; C1-6-алкенил; C3-6-циклоалкил; или C3-6-циклоалкил-C1-6-алкил.
В частных воплощениях формулы I R2 представляет собой: галоген; C1-6-алкоксигруппу; галоген-C1-6-алкил; цианогруппу; C3-6-циклоалкил; или C3-6-циклоалкил-C1-6-алкил.
В частных воплощениях формулы I R2 представляет собой: галоген; C1-6-алкоксигруппу; галоген-C1-6-алкил; C3-6-циклоалкил; или C3-6-циклоалкил-C1-6-алкил.
В частных воплощениях формулы I R2 представляет собой: галоген; галоген-C1-6-алкил; или цианогруппу.
В частных воплощениях формулы I R2 представляет собой: галоген; или галоген-C1-6-алкил.
В частных воплощениях формулы I R2 представляет собой галоген.
В частных воплощениях формулы I R2 представляет собой C1-6-алкоксигруппу.
В частных воплощениях формулы I R2 представляет собой галоген-C1-6-алкоксигруппу.
В частных воплощениях формулы I R2 представляет собой галоген-C1-6-алкил. В частных воплощениях формулы I R2 представляет собой C3-6-циклоалкил. В частных воплощениях формулы I R2 представляет собой C3-6-циклоалкил-C1-6-алкил.
В частных воплощениях формулы I R2 представляет собой тетрагидрофуранил.
В частных воплощениях формулы I R2 представляет собой тетрагидрофуранил-C1-6-алкил.
В частных воплощениях формулы I R2 представляет собой оксетанил.
В частных воплощениях формулы I R2 представляет собой оксетан-C1-6-алкил.
В частных воплощениях формулы I R2 представляет собой галоген, трифторметил или цианогруппу.
В частных воплощениях формулы I R2 представляет собой хлор, трифторметил или цианогруппу.
В частных воплощениях формулы I R2 представляет собой хлор или трифторметил.
В частных воплощениях формулы I R2 представляет собой фтор, хлор или бром.
В частных воплощениях формулы I R2 представляет собой хлор.
В частных воплощениях формулы I R2 представляет собой фтор.
В частных воплощениях формулы I R2 представляет собой бром.
В частных воплощениях формулы I R2 представляет собой трифторметил.
В частных воплощениях формулы I R2 представляет собой метоксигруппу.
В частных воплощениях формулы I R2 представляет собой цианогруппу.
В частных воплощениях формулы I R2 представляет собой C1-6-алкинил.
В частных воплощениях формулы I R2 представляет собой C1-6-алкенил.
В частных воплощениях формулы I R3 представляет собой C1-6-алкил;
В частных воплощениях формулы I R3 представляет собой галоген.
В частных воплощениях формулы I R3 представляет собой C1-6-алкил.
В частных воплощениях формулы I R3 представляет собой C1-6-алкоксигруппу.
В частных воплощениях формулы I R3 представляет собой галоген или C1-6-алкоксигруппу.
В частных воплощениях формулы I R3 представляет собой C3-6-циклоалкилоксигруппу.
В частных воплощениях формулы I R3 представляет собой галоген-C1-6-алкил.
В частных воплощениях формулы I R3 представляет собой галоген-C1-6-алкоксигруппу.
В частных воплощениях формулы I R3 представляет собой галоген или метоксигруппу.
В частных воплощениях формулы I R3 представляет собой фтор, хлор или метоксигруппу.
В частных воплощениях формулы I R3 представляет собой фтор или хлор.
В частных воплощениях формулы I R3 представляет собой метоксигруппу.
В частных воплощениях формулы I R3 представляет собой метил.
В частных воплощениях формулы I R3 представляет собой хлор.
В частных воплощениях формулы I R3 представляет собой фтор.
В частных воплощениях формулы I R4 представляет собой C1-6-алкил.
В частных воплощениях формулы I R4 представляет собой галоген.
В частных воплощениях формулы I R4 представляет собой C1-6-алкил.
В частных воплощениях формулы I R4 представляет собой С1-6-алкоксигруппу.
В частных воплощениях формулы I R4 представляет собой галоген-C1-6-алкил.
В частных воплощениях формулы I R4 представляет собой галоген-C1-6-алкоксигруппу.
В частных воплощениях формулы I R4 представляет собой галоген или метоксигруппу.
В частных воплощениях формулы I R4 представляет собой фтор, хлор, метил или метоксигруппу.
В частных воплощениях формулы I R4 представляет собой фтор, хлор или метоксигруппу.
В частных воплощениях формулы I R4 представляет собой фтор или хлор.
В частных воплощениях формулы I R4 представляет собой метоксигруппу.
В частных воплощениях формулы I R4 представляет собой метил.
В частных воплощениях формулы I R4 представляет собой хлор.
В частных воплощениях формулы I R4 представляет собой фтор.
В частных воплощениях формулы I R4 представляет собой C3-6-циклоалкилоксигруппу.
В частных воплощениях формулы I R5 представляет собой: (5-(метоксиметил)-3-метил-1H-пиразол-1-ил; 1-(оксетан-3-ил)-1H-пиразол-4-ил; 1,3,5-триметил-1H-пиразол-4-ил)фенил; 1,3-диметил-1H-пиразол-4-ил; 1,5-диметил-1H-пиразол-4-ил; 1H-1,2,4-триазол-1-ил; 1H-тетразол-1-ил; 1-метил-1H-1,2,3-триазол-5-ил; 1-метил-1H-имидазол-2-ил; 1-метил-1H-имидазол-5-ил; 1-метил-1H-пиразол-4-ил; 1-метил-1H-пиразол-5-ил; 1-метил-1H-тетразол-5-ил; 1-триметил-1H-пиразол-5-ил; 2H-тетразол-5-ил; 2-метил-2H-тетразол-5-ил; 3,5-диметилизоксазол-4-ил; 3-метил-1,2,4-оксадиазол-5-ил; 4-метил-4H-1,2,4-триазол-3-ил; 5-(метоксиметил)-1H-тетразол-1-ил; 5-(метоксиметил)-3-метил-1H-пиразол-1-ил; 5-метил-1,3,4-оксадиазол-2-ил; 5-метил-1H-тетразол-1-ил; изоксазол-4-ил; оксазол-2-ил; (тиазол-4-ил)пиридин-3-ил или (тиазол-5-ил)пиридин-3-ил.
В частных воплощениях формулы I R5 представляет собой: оксазолил; тиазолил; пиразолил; имидазолил; изоксазолил; изотиазолил; оксадиазолил; тиадиазолил; триазолил; или тетразолил; каждый из которых, возможно, замещен одним или более R6.
В частных воплощениях формулы I R5 представляет собой: пиразолил; имидазолил; оксадиазолил; тиадиазолил; триазолил; или тетразолил; каждый из которых, возможно, замещен одним или более R6.
В частных воплощениях формулы I R5 представляет собой: пиразолил; оксадиазолил; триазолил; или тетразолил; каждый из которых, возможно, замещен одним или более R6.
В частных воплощениях формулы I R5 представляет собой: оксадиазолил; триазолил; или тетразолил; каждый из которых, возможно, замещен одним или более R6.
В частных воплощениях формулы I R5 представляет собой оксазолил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой тиазолил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой пиразолил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой имидазолил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой изоксазолил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой изотиазолил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой оксадиазолил; тиадиазолил; триазолил; или тетразолил; возможно замещенные одним или более R6.
В частных воплощениях формулы I R5 представляет собой тиадиазолил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой триазолил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой тетразолил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой тиазол-5-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой тиазол-4-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой тиазол-2-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой оксазол-5-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой оксазол-4-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой оксазол-2-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой изотиазол-2-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой изотиазол-3-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой изотиазол-4-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой изоксазол-2-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой изоксазол-3-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой изоксазол-4-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой имидазол-2-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой имидазол-1-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой имидазол-4-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой имидазол-5-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой пиразол-1-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой пиразол-3-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой пиразол-4-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой пиразол-5-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой 1,2,3-триазол-1-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой 1,2,3-триазол-4-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой 1,2,3-триазол-5-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой 1,2,4-триазол-1-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой 1,2,4-триазол-3-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой 1,2,4-триазол-5-ил, возможно замещенный одним или более R6.
В частных воплощениях формулы I R5 представляет собой 1,3,4-оксадиазол-2-ил, возможно замещенный радикалом R6.
В частных воплощениях формулы I R5 представляет собой 1,2,4-оксадиазол-3-ил, возможно замещенный радикалом R6.
В частных воплощениях формулы I R5 представляет собой 1,2,4-оксадиазол-5-ил, возможно замещенный радикалом R6.
В частных воплощениях формулы I R5 представляет собой 1,3,4-тиадиазол-2-ил, возможно замещенный радикалом R6.
В частных воплощениях формулы I R5 представляет собой 1,2,4-тиадиазол-3-ил, возможно замещенный радикалом R6.
В частных воплощениях формулы I R5 представляет собой 1,2,4-тиадиазол-5-ил, возможно замещенный радикалом R6.
В частных воплощениях формулы I R5 представляет собой тетразол-1-ил, возможно замещенный радикалом R6.
В частных воплощениях формулы I R5 представляет собой тетразол-5-ил, возможно замещенный радикалом R6.
В частных воплощениях формулы I R5 представляет собой: тиазол-5-ил; тиазол-4-ил; оксазол-2-ил; изоксазол-4-ил; 3,5-диметилизоксазол-4-ил; 1-метил-1H-имидазол-2-ил; 1-метил-1H-имидазол-5-ил; 1,3,5-триметил-1H-пиразол-4-ил; 1-метил-1H-пиразол-5-ил; 1-метил-1H-пиразол-4-ил; 1,3-диметил-1H-пиразол-4-ил; 1,5-диметил-1H-пиразол-4-ил; 5-(диметиламинокарбонил)-1-метил-1H-пиразол-4-ил; 1-(оксетан-3-ил)-1H-пиразол-4-ил; 5-(метоксиметил)-3-метил-1H-пиразол-1-ил; 1-метил-1H-1,2,3-триазол-5-ил; 1H-1,2,4-триазол-1-ил; 4-метил-4H-1,2,4-триазол-3-ил; 5-метил-1,3,4-оксадиазол-2-ил; 3-метил-1,2,4-оксадиазол-5-ил; 1-метил-1H-тетразол-5-ил; 2-метил-2H-тетразол-5-ил; 1H-тетразол-1-ил; 2H-тетразол-5-ил; 5-метил-1H-тетразол-1-ил; или 5-(метоксиметил)-1H-тетразол-1-ил.
В частных воплощениях формулы I R5 представляет собой: 1-метил-1H-имидазол-2-ил; 1-метил-1H-имидазол-5-ил; 1,3,5-триметил-1H-пиразол-4-ил; 1-метил-1H-пиразол-5-ил; 1-метил-1H-пиразол-4-ил; 1,3-диметил-1H-пиразол-4-ил; 1,5-диметил-1H-пиразол-4-ил; 5-(диметиламинокарбонил)-1-метил-1H-пиразол-4-ил; 1-(оксетан-3-ил)-1H-пиразол-4-ил; 5-(метоксиметил)-3-метил-1H-пиразол-1-ил; 1-метил-1H-1,2,3-триазол-5-ил; 1H-1,2,4-триазол-1-ил; 4-метил-4H-1,2,4-триазол-3-ил; 5-метил-1,3,4-оксадиазол-2-ил; 3-метил-1,2,4-оксадиазол-5-ил; 1-метил-1H-тетразол-5-ил; 2-метил-2H-тетразол-5-ил; 1H-тетразол-1-ил; 2H-тетразол-5-ил; 5-метил-1H-тетразол-1-ил; или 5-(метоксиметил)-1H-тетразол-1-ил.
В частных воплощениях формулы I R5 представляет собой: 1-метил-1H-1,2,3-триазол-5-ил; 1H-1,2,4-триазол-1-ил; 4-метил-4H-1,2,4-триазол-3-ил; 5-метил-1,3,4-оксадиазол-2-ил; 3-метил-1,2,4-оксадиазол-5-ил; 1-метил-1H-тетразол-5-ил; 2-метил-2H-тетразол-5-ил; 1H-тетразол-1-ил; 2H-тетразол-5-ил; 5-метил-1H-тетразол-1-ил; или 5-(метокси метил)-1H-тетразол-1-ил.
В частных воплощениях формулы I R5 представляет собой: 1-метил-1H-имидазол-2-ил; или 1-метил-1H-имидазол-5-ил.
В частных воплощениях формулы I R5 представляет собой: 1,3,5-триметил-1H-пиразол-4-ил; 1-метил-1H-пиразол-5-ил; 1-метил-1H-пиразол-4-ил; 1,3-диметил-1H-пиразол-4-ил; 1,5-диметил-1H-пиразол-4-ил; 5-(диметиламинокарбонил)-1-метил-1H-пиразол-4-ил; 1-(оксетан-3-ил)-1H-пиразол-4-ил; или 5-(метоксиметил)-3-метил-1H-пиразол-1-ил.
В частных воплощениях формулы I R5 представляет собой: 1-метил-1H-1,2,3-триазол-5-ил; 1H-1,2,4-триазол-1-ил; или 4-метил-4H-1,2,4-триазол-3-ил.
В частных воплощениях формулы I R5 представляет собой: 5-метил-1,3,4-оксадиазол-2-ил; или 3-метил-1,2,4-оксадиазол-5-ил.
В частных воплощениях формулы I R5 представляет собой: 1-метил-1H-тетразол-5-ил; 2-метил-2H-тетразол-5-ил; 1H-тетразол-1-ил; 2H-тетразол-5-ил; 5-метил-1H-тетразол-1-ил; или 5-(метоксиметил)-1H-тетразол-1-ил.
В частных воплощениях формулы I R5 представляет собой тиазол-5-ил.
В частных воплощениях формулы I R5 представляет собой тиазол-4-ил.
В частных воплощениях формулы I R5 представляет собой изоксазол-4-ил.
В частных воплощениях формулы I R5 представляет собой 3,5-диметилизоксазол-4-ил.
В частных воплощениях формулы I R5 представляет собой 1-метил-1H-имидазол-2-ил.
В частных воплощениях формулы I R5 представляет собой 1-метил-1H-имидазол-5-ил.
В частных воплощениях формулы I R5 представляет собой 1,3,5-триметил-1H-пиразол-4-ил.
В частных воплощениях формулы I R5 представляет собой 1-метил-1H-пиразол-5-ил.
В частных воплощениях формулы I R5 представляет собой 1-метил-1H-пиразол-4-ил.
В частных воплощениях формулы I R5 представляет собой 1,3-диметил-1H-пиразол-4-ил.
В частных воплощениях формулы I R5 представляет собой 1,5-диметил-1H-пиразол-4-ил.
В частных воплощениях формулы I R5 представляет собой 5-(диметиламинокарбонил)-1-метил-1H-пиразол-4-ил.
В частных воплощениях формулы I R5 представляет собой 1-(оксетан-3-ил)-1H-пиразол-4-ил.
В частных воплощениях формулы I R5 представляет собой 5-(метоксиметил)-3-метил-1H-пиразол-1-ил.
В частных воплощениях формулы I R5 представляет собой 1-метил-1H-1,2,3-триазол-5-ил.
В частных воплощениях формулы I R5 представляет собой 1H-1,2,4-триазол-1-ил. В частных воплощениях формулы I R5 представляет собой 4-метил-4H-1,2,4-триазол-3-ил.
В частных воплощениях формулы I R5 представляет собой 5-метил-1,3,4-оксадиазол-2-ил.
В частных воплощениях формулы I R5 представляет собой 3-метил-1,2,4-оксадиазол-5-ил.
В частных воплощениях формулы I R5 представляет собой 1-метил-1H-тетразол-5-ил.
В частных воплощениях формулы I R5 представляет собой 2-метил-2H-тетразол-5-ил.
В частных воплощениях формулы I R5 представляет собой 1H-тетразол-1-ил.
В частных воплощениях формулы I R5 представляет собой 2H-тетразол-5-ил.
В частных воплощениях формулы I R5 представляет собой 5-метил-1H-тетразол-1-ил.
В частных воплощениях формулы I R5 представляет собой 6-(метоксиметил)-1H-тетразол-1-ил.
В частных воплощениях формулы I R6 представляет собой C1-6-алкил.
В частных воплощениях формулы I R6 представляет собой C3-6-циклоалкил.
В частных воплощениях формулы I R6 представляет собой C3-6-циклоалкил-C1-6-алкил.
В частных воплощениях формулы I R6 представляет собой галоген.
В частных воплощениях формулы I R6 представляет собой галоген-C1-6-алкил.
В частных воплощениях формулы I R6 представляет собой C1-6-алкоксигруппу.
В частных воплощениях формулы I R6 представляет собой гетероциклил.
В частных воплощениях формулы I R6 представляет собой оксогруппу.
В частных воплощениях формулы I R6 представляет собой -C(O)-NRbRc, где Rb и Rc каждый независимо представляет собой водород или -C1-6-алкил.
В частных воплощениях объектом настоящего изобретения являются соединения формулы II
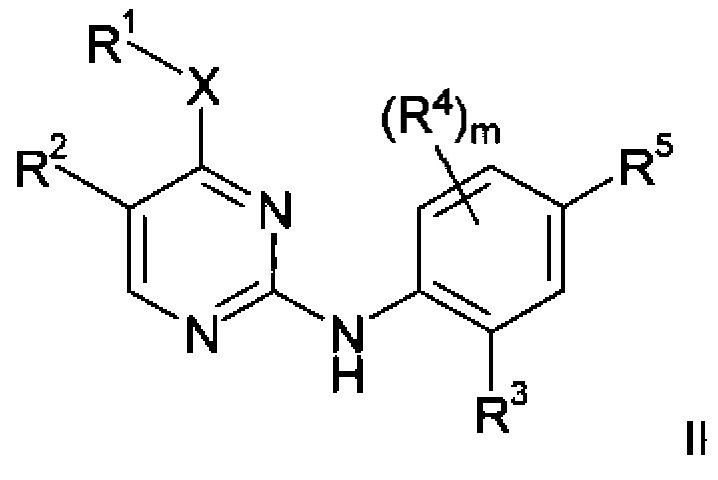
где m, X, R1, R2, R3, R4 и R5 таковы, как раскрыто в данном описании для формулы I.
В частном воплощении настоящее изобретение относится к соединению формулы I, выбранному из группы, состоящей из следующих соединений:
N2-(2-хлор-4-(2H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-4-(1-метил-1H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-4-(2-метил-2H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1H-1,2,4-триазол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1-метил-1H-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1-метил-1H-имидазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-метокси-6-(тиазол-5-ил)пиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-метокси-6-(тиазол-4-ил)пиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-метокси-6-(оксазол-2-ил)пиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
5-хлор-N2-(4-(изоксазол-4-ил)-2-метоксифенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1H-имидазол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
N2-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(2-метил-2H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1-метил-1H-имидазол-2-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
Ν2-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
Ν2-(2-хлор-5-метокси-4-(1-метил-1H-имидазол-5-ил)фенил)-Ν4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1,3,5-триметил-1H-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1-метил-1H-пиразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-(3,5-диметилизоксазол-4-ил)-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1H-тетразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1-метил-1H-пиразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N4-этил-N2-(5-фтор-2-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1-метил-1H-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
5-хлор-N2-(2-хлор-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-хлор-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1H-пиразол-4-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-хлор-5-метокси-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-хлор-5-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метилпиримидин-2,4-диамин,
N2-(4-(1,3-диметил-1H-пиразол-4-ил)-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-(1,5-диметил-1H-пиразол-4-ил)-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(4-метил-4H-1,2,4-триазол-3-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
4-(2-фтор-5-метокси-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)фенил)-N,N,1-триметил-1H-пиразол-5-карбоксамид,
N2-(5-фтор-2-метокси-4-(5-метил-1H-тетразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
Ν2-(5-фтор-2-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(1-(оксетан-3-ил)-1H-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-5-метил-4-(5-метил-1H-тетразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(5-(метоксиметил)-1H-тетразол-1-ил)-5-метилфенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(5-(метоксиметил)-3-метил-1H-пиразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(5-(метоксиметил)-3-метил-1H-пиразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин и
N2-(5-фтор-2-метокси-4-(5-(метоксиметил)-1H-тетразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин.
Настоящее изобретение также относится к композиции, включающей фармацевтически приемлемый носитель и соединение, раскрытое в настоящем описании.
Настоящее изобретение также относится к способу лечения болезни Паркинсона, включающему введение субъекту, который в этом нуждается, эффективного количества соединения, раскрытого в настоящем описании.
Настоящее изобретение также относится к соединению формулы I, раскрытому в настоящем описании, для применения в профилактике или лечении болезни Паркинсона.
Настоящее изобретение также относится к фармацевтической композиции, раскрытой в настоящем описании, которая полезна для профилактики или лечения болезни Паркинсона.
Настоящее изобретение также относится к соединению формулы I, раскрытому в настоящем описании, для изготовления лекарственного средства для профилактики или лечения болезни Паркинсона.
Настоящее изобретение также предлагает способ лечения заболевания или состояния, опосредованного или иным образом связанного с рецептором киназы LRRK2, включающий введение субъекту, который в этом нуждается, эффективного количества соединения по настоящему изобретению.
Указанное заболевание может представлять собой нейродегенеративное заболевание, например болезнь Паркинсона, болезнь Гентингтона или деменцию с тельцами Леви.
Указанное заболевание может представлять собой расстройство ЦНС, такое как болезнь Альцгеймера и индуцированная L-Dopa дискинезия.
Указанное заболевание может представлять собой рак или пролиферативное расстройство, такое как рак почек, молочной железы, простаты, крови, папиллярный рак или рак легких, острый миелогенный лейкоза или множественная миелома.
Указанное заболевание может представлять собой воспалительное заболевание, такое как лепра, болезнь Крона, амиотрофический боковой склероз, ревматоидный артрит и анкилозирующий спондилит.
Настоящее изобретение также предлагает способ повышения когнитивной памяти, включающий введение субъекту, который в этом нуждается, эффективного количества соединения по настоящему изобретению.
Избранные соединения в соответствии со способами по настоящему изобретению приведены ниже в экспериментальных примерах.
СИНТЕЗ
Соединения по настоящему изобретению можно получить различными способами, представленными в наглядных схемах реакций синтеза, приведенных и описанных ниже.
Исходные вещества и реагенты, используемые при получении этих соединений, в общем случае либо имеются в продаже у коммерческих поставщиков, таких как Aldrich Chemical Co., либо могут быть получены способами, известными специалистам в данной области техники, с помощью процедур, на которые даны ссылки, например: Fieser and Fieserʹs Reagents for Organic Synthesis; Wiley & Sons: New York, 1991, Volumes 1-15; Roddʹs Chemistry of Carbon Compounds, Elsevier Science Publishers, 1989, Volumes 1-5 and Supplemental; Organic Reactions, Wiley & Sons: New York, 1991, Volumes 1-40. Ниже следующие схемы реакций синтеза являются лишь иллюстрацией некоторых способов, которыми можно синтезировать соединения по настоящему изобретению, и возможны различные модификации в этих схемах реакций синтеза, которые можно рекомендовать специалисту в данной области техники, обратившемуся к содержанию настоящей Заявки.
Исходные вещества и промежуточные продукты в схемах реакций синтеза можно выделять и очищать стандартными способами, включая, без ограничения, фильтрацию, перегонку, кристаллизацию, хроматографию и т.п. Можно получать характеристики таких веществ стандартными средствами, включая физические константы и данные спектрального анализа.
Если не указано обратное, описанные реакции можно проводить в инертной атмосфере при атмосферном давлении при температуре реакции в интервале примерно от -78°C до 150°C, например, приблизительно от 0°C до 125°C, или в целях удобства приблизительно при комнатной температуре, например, около 20°C.
Ниже на Схеме A представлен один способ синтеза, который можно применять для получения конкретных соединений формулы I или формулы II, при этом X, m, R1, R2, R3, R4 и R5 таковы, как раскрыто в данном описании.

На стадии 1 в Схеме A дихлорпиримидин вводят в реакцию с реагентом b с получением производного пиримидина c. Реакцию на стадии 1 можно проводить в полярном растворителе. В тех осуществлениях настоящего изобретения, когда X представляет собой -O- (т.е., реагент b представляет собой спирт), реакцию на стадии 1 можно проводить в присутствии основания.
На стадии 2 пиримидин с вводят в реакцию с анилином d с получением фениламинопиридина формулы I по настоящему изобретению. Реакцию на стадии 2 можно проводить в полярном протонном растворителе и в присутствии кислоты, такой как HCl. Многие производные анилина d имеются в продаже или их можно легко получить из нитробензолов, как показано ниже в Примерах.
Существует множество вариаций способа по Схеме A, очевидных специалисту в данной области техники. Подробности получения соединения по настоящему изобретению описаны ниже в Примерах.
ВВЕДЕНИЕ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Настоящее изобретение охватывает фармацевтические композиции, включающие по меньшей мере одно соединение по настоящему изобретению или его индивидуальный изомер, рацемическую или нерацемическую смесь изомеров или его фармацевтически приемлемую соль или сольват, совместно по меньшей мере с одним фармацевтически приемлемым носителем и, возможно, другими терапевтическими и/или профилактическими ингредиентами.
В целом, соединение по настоящему изобретению вводят в терапевтически эффективном количестве любым из принятых способов введения для агентов, имеющих подобное предназначение. Подходящие диапазоны доз обычно составляют 1-500 мг в сутки, например 1-100 мг в сутки, и наиболее предпочтительно 1-30 мг в сутки, в зависимости от различных факторов, таких как тяжесть заболевания, подлежащего лечению, возраст и относительное здоровье субъекта, эффективность используемого соединения, способ и форма введения, показания, по которым было назначено введение, а также предпочтения и опыт лечащего врача. Средний специалист в области лечения таких заболеваний без лишних экспериментов, основываясь на личных знаниях и материалах данной Заявки, способен установить терапевтически эффективное количество соединения по настоящему изобретению для конкретного заболевания.
Соединения по настоящему изобретению можно вводить в виде лекарственных форм, включая те, которые пригодны для орального (включая трансбуккальное и сублингвальное), ректального, назального, местного, пульмонального, вагинального или парентерального введения (включая внутримышечное, внутриартериальное, интратекальное, подкожное и внутривенное) или в форме, пригодной для введения путем ингаляции или инсуффляции. Как правило, применяют пероральный способ введения с удобным суточным режимом дозирования, который можно подбирать в соответствии с тяжестью заболевания.
Соединение или соединения по настоящему изобретению, объединенные с одним или более подходящими адъювантами, носителями или разбавителями, мо входить в фармацевтические композиции и дозированные лекарственные формы. Фармацевтические композиции и дозированные лекарственные формы можно составлять из обычных ингредиентов в обычном соотношении, с добавлением (или без добавления) дополнительных активных веществ или основ, а лекарственные формы с однократной дозировкой могут содержать любое подходящее эффективное количество активного компонента в соответствии с целевым диапазоном суточных доз, которые предполагается использовать. Фармацевтические композиции можно применять в виде твердых субстанций, таких как таблетки или заполненные капсулы, полутвердых лекарственных форм, порошков, лекарственных форм с замедленным высвобождением, либо жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или заполненные капсулы для орального применения; или в форме суппозиториев для ректального или вагинального введения; или в форме стерильных растворов для инъекций для парентерального применения.
Лекарственные формы, содержащие примерно один (1) мг активного компонента или, в более широком диапазоне, примерно от 0,01 миллиграмм до примерно ста (100) миллиграмм на таблетку, представляют собой подходящие в соответствующих случаях типичные дозированные лекарственные формы.
Соединения по настоящему изобретению можно включать в композиции в виде большого разнообразия лекарственных форм для орального введения. Фармацевтические композиции и лекарственные формы могут включать соединение или соединения по настоящему изобретению или их фармацевтически приемлемые соли в качестве активных компонентов. Фармацевтически приемлемые носители могут быть как твердыми, так и жидкими. Твердые лекарственные формы включают порошки, таблетки, пилюли, капсулы, саше, суппозитории и гранулы для рассасывания. Твердый носитель может представлять собой одно или более веществ, которые могут также представлять собой разбавители, ароматизаторы, солюбилизаторы, лубриканты, суспендирующие вещества, связующие вещества, консерванты, вещества для улучшения распадаемости таблеток или инкапсулирующие материалы. В порошках таким носителем обычно является тонкоизмельченное твердое вещество, которое представляет собой смесь с тонкоизмельченным активным компонентом. В случае таблеток активный компонент обычно смешивают с носителем, обладающим необходимой связывающей способностью, в подходящем соотношении и изготовляют таблетки желаемых формы и размера. Порошки и таблетки предпочтительно содержат от примерно одного (1) до примерно семидесяти (70) процентов активного вещества. Подходящие носители включают, без ограничения, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, карбоксиметилцеллюлозу натрия, низкоплавкий воск, какао-масло и т.п. Предполагается, что термин "изготовление" включает приготовление лекарственной формы активного вещества с инкапсулирующим материалом в качестве носителя, с получением капсулы, в которой активный компонент, с носителями или без, окружен носителем, который с ним связан. Аналогичным образом, сюда включены саше и пастилки для рассасывания. Таблетки, порошки, капсулы, пилюли, саше и пастилки для рассасывания могут быть в виде твердых форм, пригодных для орального введения.
Другие формы, подходящие для орального введения, включают жидкие лекарственные формы, включая эмульсии, сиропы, эликсиры, водные растворы, водные суспензии, или твердые лекарственные формы, которые непосредственно перед применением требуется переводить в жидкие лекарственные формы. Эмульсии можно изготавливать в растворах, например в водных растворах пропиленгликоля, или же они могут содержать эмульгирующие вещества, например лецитин, сорбитан моноолеат или камедь. Водные растворы могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих красителей, ароматизаторов, стабилизаторов и загустителей. Водные суспензии можно приготовить путем диспергирования мелкоизмельченного активного компонента в воде с вязким материалом, такими как природные или синтетический каучуки, смолы, метилцеллюлоза, карбоксиметилцеллюлоза натрия и другие хорошо известные суспендирующие вещества. Твердые формы включают растворы, суспензии и эмульсии, и могут содержать, помимо активного компонента, красители, корригенты, стабилизаторы, буферы, искусственные и натуральные подсластители, диспергирующие вещества, загустители, солюбилизаторы и т.п.
Соединения по настоящему изобретению могут быть включены в лекарственные формы для парентерального введения (например, путем инъекции, например болюсной инъекции или непрерывной инфузии) или могут быть представлены в виде дозированных лекарственных форм: ампулы, предварительно заполненные шприцы, контейнеры для инфузий в малом объеме или многодозовые контейнеры с добавленным консервантом. Такие композиции могут быть в виде таких форм, как суспензии, растворы или эмульсии на масляной или водной основе, например растворы в водном полиэтиленгликоле. Примеры маслянистых или неводных носителей, разбавителей, растворителей или основ включают пропиленгликоль, полиэтиленгликоль, растительные масла (например, оливковое масло) и органические эфиры для инъекций (например, этилолеат), а также могут содержать агенты, применяемые для конкретных лекарственных форм, например консерванты, увлажняющие, эмульгирующие или суспендирующие, стабилизирующие и/или диспергирующие агенты. Как вариант, активный компонент может быть в форме порошка, который получают путем асептического извлечения стерильного твердого вещества, или путем лиофилизации из раствора для восстановления перед применением с помощью подходящей основы, например, стерильной апирогенной воды.
Соединения по настоящему изобретению можно включать в лекарственные формы для местного нанесения на эпидерму в виде мазей, кремов или лосьонов, или в виде трансдермального пластыря. Мази и кремы, например, можно составлять на водной или масляной основе, с добавлением подходящих загустителей и/или гелеобразующих агентов. Лосьоны можно составлять на водной или масляной основе и, как правило, они содержат один или более эмульгаторов, стабилизаторов, диспергирующих веществ, суспендирующих веществ, загустителей или красителей. Лекарственные формы, предназначенные для местного введения в рот, включают: пастилки для рассасывания, содержащие действующие вещества на ароматизированной основе, как правило, на основе сахарозы, камеди или траганта; пастилки, содержащие активный компонент на инертной основе, такой как желатин и глицерин или сахароза и камедь; и ополаскиватели для рта, содержащие активный компонент в подходящем жидком носителе.
Соединения по настоящему изобретению можно также включать в лекарственную форму для введения в виде суппозиториев. Сначала расплавляют низкоплавкий воск, например смесь глицеридов жирной кислоты или какао-масло, и равномерно диспергируют активный компонент, например, путем перемешивания. Расплавленную гомогенную смесь затем разливают в формы удобного размера и оставляют для охлаждения и затвердевания.
Соединения по настоящему изобретению можно включать в лекарственную форму для вагинального введения. Такие формы включают пессарии, тампоны, кремы, гели, пасты, пены или спрэи, которые содержат, помимо активного компонента, подходящие носители, известные в данной области техники.
Соединения, представляющие собой объект настоящего изобретения, можно включать в лекарственную форму для назального введения. Такие растворы или суспензии вводят непосредственно в носовую полость обычными способами, например, с помощью флакона-капельницы, пипетки или спрэя. Такие лекарственные формы можно изготавливать в формах с однократной или многократной дозировкой. В последнем случае для флакона-капельницы или пипетки это обеспечивают за счет введения пациенту подходящего, предварительно определенного объема раствора или суспензии. В случае спрэя это обеспечивают, например, за счет дозировочного распыляющего пульверизатора.
Соединения по настоящему изобретению можно включать в лекарственную форму для аэрозольного введения, в частности, в дыхательные пути, включая интраназальное введение. При этом соединение, как правило, должно присутствовать в виде частиц небольшого размера, например порядка пяти (5) микрон или меньше. Такой размер частиц можно получить способами, известными в данной области техники, например путем микронизации. Активный компонент поставляют в аэрозольных баллонах под давлением с подходящим пропеллентом, таким как хлорфторуглерод (CFC), например, дихлордифторметан, трихлорфторметан или дихлортетрафторэтан, или диоксид углерода, или же с другим подходящим газом. Аэрозоль может также в целях удобства содержать поверхностно-активное вещество, например лецитин. Дозу лекарственного вещества можно контролировать с помощью градуированного клапана. Как вариант, активные компоненты можно предоставлять в форме сухого порошка, например в виде порошковой смеси соединения на подходящей порошковой основе, такой как лактоза, крахмал, производные крахмала, например гидроксипропилметил-целлюлоза и поливинилпирролидин (PVP). Порошковый носитель образует гель в носовой полости. Порошковую композицию можно изготавливать в виде лекарственной формы со стандартной дозировкой, например в капсулах или картриджах, например, в желатиновых капсулах или в блистерных упаковках, из которых порошок может быть введен посредством ингалятора.
По желанию можно изготавливать лекарственные формы с кишечнорастворимой оболочкой, приспособленные для введения с замедленным или контролируемым высвобождением активного компонента. Например, соединения по настоящему изобретению быть включены в трансдермальные или подкожные средства доставки лекарственных веществ. Такие системы доставки имеют преимущество, если необходимо замедленное высвобождение соединения и если критично соблюдение пациентом схемы лечения. Соединения в трансдермальных системах доставки часто нанесены на твердую подложку, которую можно приклеивать к коже. Интересующее соединение можно также комбинировать с веществами, способствующими проникновению, такими как Азон (1-додецилазациклогептан-2-он). Системы доставки с замедленным высвобождением внедряют подкожно в подкожный слой хирургическим путем или с помощью инъекции. Подкожные имплантанты содержат соединение в липид-растворимой мембране, такой как силиконовой каучук, или в биодеградируемом полимере, таком как полимер молочной кислоты.
Фармацевтические препараты можно предоставлять в виде дозированных лекарственных форм. В таких формах препарат разделен на единицы доз, содержащие подходящие количества активного компонента. Дозированная лекарственная форма может представлять собой упакованный препарат, упаковку, содержащую дискретные количества препарата, например упакованные таблетки, капсулы, а также порошки во флаконах или ампулах. Кроме того, дозированная лекарственная форма может сама по себе представлять собой капсулу, таблетку, саше или пастилку для рассасывания, или может представлять собой подходящее количество любых из перечисленных форм в упакованном виде.
Другие подходящие фармацевтические носители и их лекарственные формы описаны в литературе (Remington: The Science and Practice of Pharmacy 1995, edited by E.W. Martin, Mack Publishing Company, 19th edition, Easton, Pennsylvania). Примеры фармацевтических лекарственных форм, содержащих соединение по настоящему изобретению, описаны ниже.
Полезность
Соединения по настоящему изобретению полезны для лечения заболеваний или состояний, опосредованных киназой LRRK2, включая нейродегенеративные заболеваний, такие как болезнь Паркинсона, болезнь диффузных телец Леви и болезнь Гентингтона, и для улучшения когнитивной памяти в целом у субъектов, которые в этом нуждаются.
ПРИМЕРЫ
Ниже представленные способы получения и примеры приведены, чтобы помочь специалисту в данной области техники более четко понять и осуществить настоящее изобретение. Их не следует рассматривать как ограничение объема настоящего изобретения, но лишь как его наглядное представление и пример.
Если не указано иное, все значения температуры, включая точки плавления (т.е., MP) выражены в градусах Цельсия (°C). Следует понимать, что реакция, в результате которой получают указанный и/или желаемый продукт, не обязательно является результатом сочетания двух реагентов, которые были изначально добавлены, т.е. возможно образование одного или более промежуточных продуктов в смеси, что в конечном итоге приводит к получению указанного и/или желаемого продукта. Ниже следующие аббревиатуры используются в Способах получения и Примерах.
СПИСОК СОКРАЩЕНИЙ
Способ получения 1: 2-хлор-5-фтор-N-метилпиримидин-4-амин
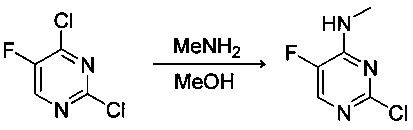
В круглодонную колбу на 250 мл с магнитным мешальником добавляли 9,0 г 5-фтор-2,4-дихлор-пиримидина, 40 мл метанола и 15 мл 8 Μ метиламина в этаноле. Реакционную смесь нагревали (слабо экзотермическая реакция) и перемешивали при комнатной температуре в течение ~30 мин. Анализ с помощью ТСХ (1:1 EtOAc : гептан) и LCMS показал завершение реакции. Реакционную смесь концентрировали с получением 9,77 г неочищенного вещества, которое очищали на колонке с силикагелем, прогоном в градиенте от 1% до 10% MeOH в DCM в течение 35 мин с получением 6,77 г чистого 2-хлор-5-фтор-N-метилпиримидин-4-амина.
Этот же способ применяли для получения соединений, представленных ниже в Таблице 1, с использованием подходящих имеющихся в продаже замещенных 2,4-дихлор-пиримидинов и аминов.

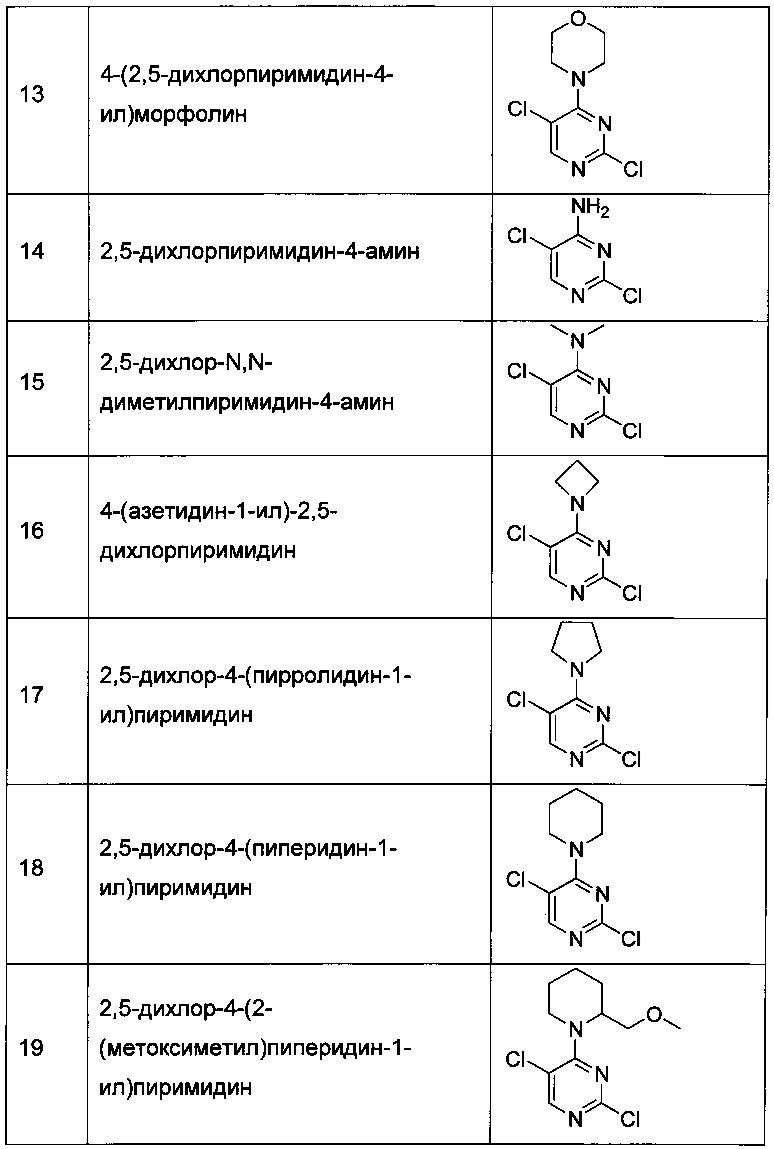
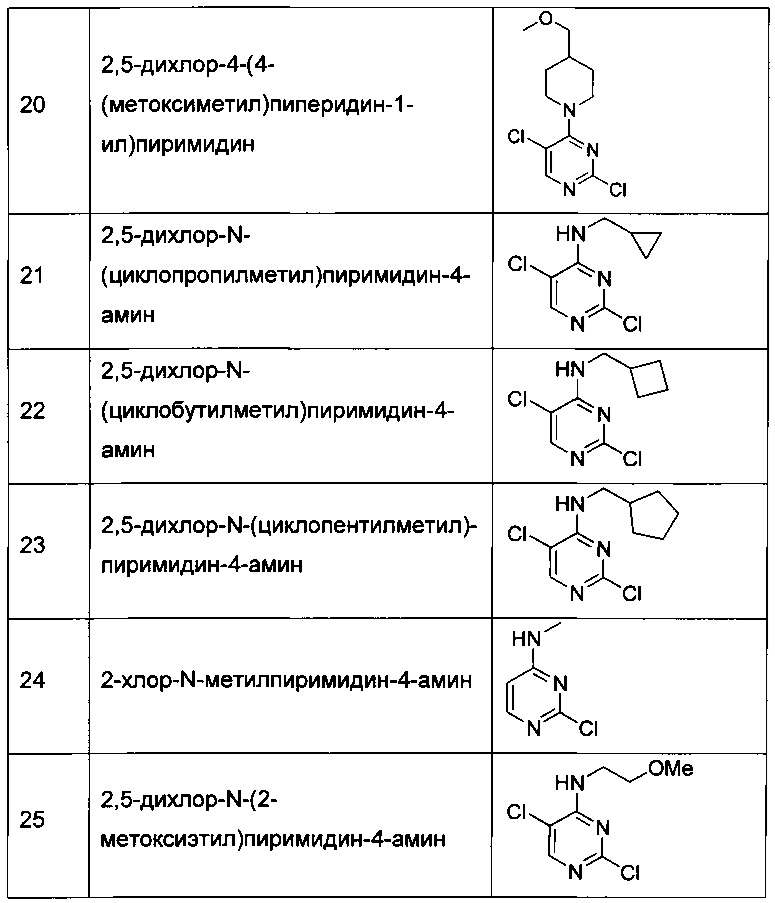
Способ получения 2: 2,5-дихлор-4-метоксипиримидин
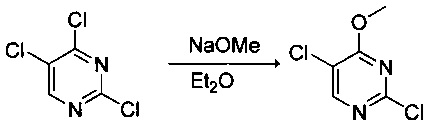
В круглодонную колбу на 250 мл с магнитным мешальником добавляли 1 г 5-хлор-2,4-дихлорпиримидина и 15 мл диэтилового эфира. Эту смесь охлаждали до 0°C на ледяной бане и затем медленно добавляли 1 эквивалент метоксида натрия в метаноле (полученного реакцией 120 мг натрия с 4 мл метанола при комнатной температуре). Реакционную смесь перемешивали в течение ночи при комнатной температуре и анализировали с помощью LCMS. Полученный белый осадок фильтровали и твердое вещество промывали холодным метанолом. После высушивания получали 0,98 г чистого 2,5-дихлор-4-метоксипиримидина, и это вещество использовали без дополнительной очистки.
Этот же способ применяли для получения соединений, приведенных ниже в Таблице 2, с использованием подходящих имеющихся в продаже спиртов и подходящим образом замещенных 2,4-дихлорпиримидинов.
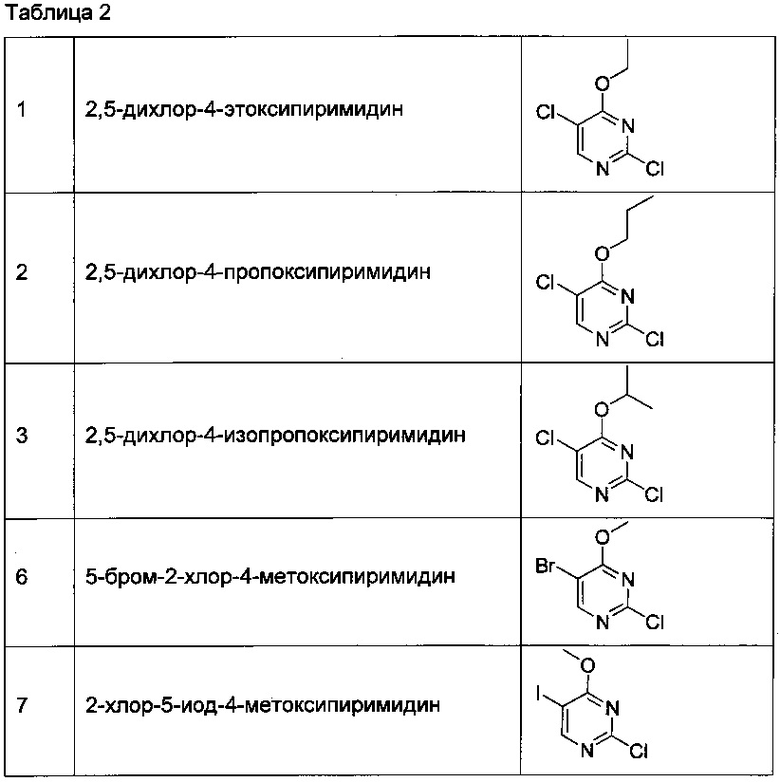
Пример 1: N2-(2-хлор-4-(2H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
Стадия 1: 3-хлор-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)бензонитрил
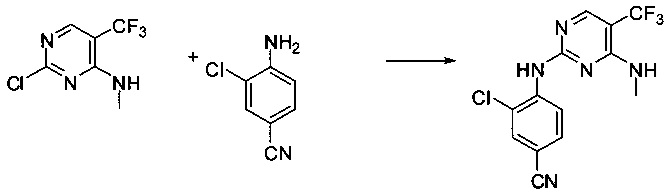
Смесь 2-хлор-N-метил-5-(трифторметил)пиримидин-4-амина (211 мг; 1 ммоль), 4-амино-3-хлорбензонитрила (305 мг; 2 ммоль), карбоната цезия (0,65 г; 2 ммоль), ксантфоса (17 мг; 0,03 ммоль) и Pd2(dba)3 (5 мг; 0,02 ммоль) в диоксане (3 мл) обрабатывали ультразвуком на ультразвуковой бане в течение 1 мин. Эту смесь затем дегазировали в токе азота в течение 5 мин. Трубку запаивали и реакционную смесь нагревали при 100°C в течение 18 ч. Реакционную смесь охлаждали и разбавляли этилацетатом (15 мл). Органический слой промывали водой (2×20 мл) и объединенные водные экстракты дополнительно промывали этилацетатом (2×15 мл). Объединенные органические слои пропускали через картридж для фазового разделения и растворитель удаляли при пониженном давлении. Очистка остатка хроматографией на колонке с силикагелем (0-100% этилацетат/изогексан) давала 3-хлор-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)бензонитрил в виде белого твердого вещества (140 мг; 45%). 1H ЯМР (400 МГц, CDCl3): δ 8,85 (d, J=8,8, 1H); 8,23 (d, J=1,1, 1H); 7,80 (s, 1H); 7,68 (d, J=1,9, 1H); 7,58-7,53 (m, 1H); 5,32 (s br, 1H); 3,11 (d, J=4,7, 3H).
Стадия 2: N2-(2-хлор-4-(2H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин

К раствору 3-хлор-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)-бензонитрила (135 мг; 6,41 ммоль) в DMF (2 мл) добавляли азид натрия (80 мг; 1,24 ммоль) и хлорид аммония (66 мг; 1,24 ммоль). Эту смесь нагревали при 125°C в течение 18 ч. Эту смесь охлаждали, фильтровали и полученное твердое вещество промывали этилацетатом. Фильтрат концентрировали при пониженном давлении и неочищенный остаток разбавляли водой (5 мл) и диэтиловым эфиром (5 мл). Образовавшийся осадок фильтровали и промывали дополнительными порциями воды и диэтилового эфира. Твердое вещество выпаривали совместно с дихлорметаном и метанолом и затем высушивали в вакуумном сушильном шкафу с получением N2-(2-хлор-4-(2H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина (130 мг; 85%). LCMS (ESCI_formic_MeCN): [MH+]=371 при 3,11 мин. 1H ЯМР (400 МГц, DMSO): δ 8,94 (s, 1H); 8,26-8,19 (m, 2H); 8,14 (d, J=2,0, 1H); 8,03-7,96 (m, 1H); 7,30-7,22 (m, 1H); 2,89 (t, J=4,4, 3H).
Примеры 2 и 3: N2-(2-хлор-4-(2-метил-2H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин и N2-(2-хлор-4-(1-метил-1H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
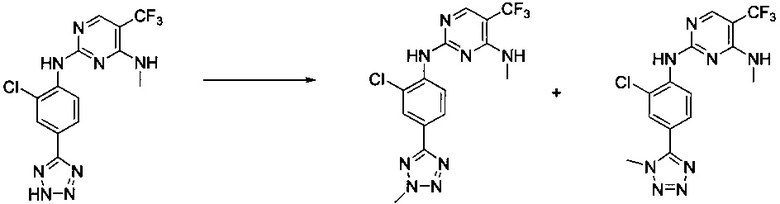
Смесь N2-(2-хлор-4-(2H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамина (80 мг; 0,22 ммоль), K2CO3 (45 мг; 0,32 ммоль) и метилиодида (15 мкл; 0,24 ммоль) в ацетоне (2 мл) нагревали при 40°C в течение 1 ч. Эту смесь охлаждали и фильтровали. Фильтрат концентрировали при пониженном давлении и неочищенный остаток очищали хроматографией на колонке с силикагелем (0-100% этилацетат/изогексан) с получением N2-(2-хлор-4-(2-метил-2H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина (58 мг; 70%). LCMS (10 cm_ESCI_Formic_MeCN): [MH+]=385 при 4,31 мин. 1H ЯМР (400 МГц, CDCl3): δ 8,76 (d, J=8,7, 1H); 8,23-8,19 (m, 2H); 8,05 (dd, J=8,7, 2,0, 1H); 7,72 (s, 1H); 5,29 (s, 1H); 4,40 (s, 3H); 3,12 (d, J=4,7, 3H).
Выделяли также изомерный N2-(2-хлор-4-(1-метил-1H-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин (10 мг; 12%). LCMS (10 cm_ESCI_Formic_MeCN): [MH+]=385 при 3,8 мин. 1H ЯМР (400 МГц, CDCl3): δ 8,90 (d, J=8,7, 1H); 8,24 (s, 1H); 7,86 (d, J=2,1, 1H); 7,79 (s, 1H); 7,68 (dd, J=8,8, 2,1, 1H); 5,33 (s, 1H); 4,22 (s, 3H); 3,13 (d, J=4,7, 3H).
Пример 4: N2-(2-метокси-4-(1H-1,2,4-триазол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
Стадия 1: 2-метокси-4-(1H-1,2,4-триазол-1-ил)анилин

Смесь 4-бром-2-метоксианилина (208 мг; 1,03 ммоль), 1,2,4-триазола (80 мг; 1,13 ммоль), Cs2CO3 (0,67 г; 2,06 ммоль) и Cul (20 мг; 0,103 ммоль) в DMF нагревали при 110°C в течение 20 ч. Вносили дополнительные порции 1,2,4-триазола (0,1 г; 1,44 ммоль), Cs2CO3 (0,67 г; 2,06 ммоль) и Cul (0,1 г; 0,52 ммоль) и эту смесь нагревали еще в течение 72 ч при 110°C.Эту смесь охлаждали, разбавляли этилацетатом (20 мл) и промывали водой (2×20 мл). Объединенные водные смывы обратно экстрагировали этилацетатом (20 мл). Объединенные органические слои пропускали через картридж для фазового разделения и растворитель удаляли при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (0-100% этилацетат/изогексан) давала 2-метокси-4-(1H-1,2,4-триазол-1-ил)анилин в виде светло-красного твердого вещества (92 мг; 47%). 1Н ЯМР (400 МГц, CDCl3): δ 8,41 (s, 1H); 8,05 (s, 1H); 7,11 (d, J=2,3, 1H); 6,99 (dd, J=8,3, 2,3, 1H); 6,74 (d, J=8,3, 1H); 3,97 (s, 2H); 3,92 (s, 3H).
Стадия 2: Ν2-(2-метокси-4-(1H-1,2,4-триазол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
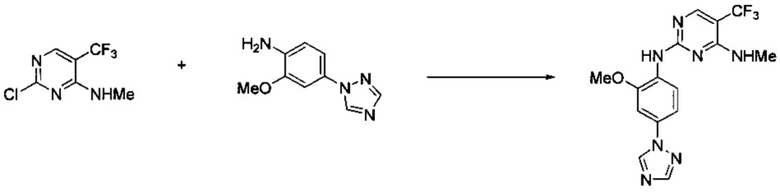
Смесь 2-хлор-N-метил-5-(трифторметил)пиримидин-4-амина (80 мг; 0,38 ммоль), 2-метокси-4-(1H-1,2,4-триазол-1-ил)анилина (72 мг; 0,38 ммоль) и п-толуолсульфоновой кислоты (72 мг; 0,38 ммоль) в диоксане (2 мл) нагревали при 100°C в течение 1 ч. Эту смесь охлаждали и фильтровали. Твердое вещество делили между дихлорметаном (10 мл) и насыщенным водным раствором NaHCO3 (10 мл) и полученный продукт экстрагировали дихлорметаном (3×10 мл). Объединенные органические слои пропускали через картридж для фазового разделения и растворитель удаляли при пониженном давлении. Очистка остатка хроматографией на колонке с силикагелем (0-100% этилацетат/изогексан) давала остаток, который обрабатывали смесью метанол/диэтиловый эфир с получением N2-(2-метокси-4-(1H-1,2,4-триазол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина в виде белого твердого вещества (34,5 мг; 25%). LCMS (10 cm_ESCI_Formic_MeCN): [MH+]=366 при 3,13 мин. 1H ЯМР (400 МГц, DMSO): δ 9,29 (s, 1H); 8,33 (d, J=8,7, 1H); 8,24-8,15 (m, 3H); 7,53 (d, J=2,4, 1H); 7,45 (dd, J=8,7, 2,4, 1H); 7,23 (d, J=5,2, 1H); 3,97 (s, 3 H); 2,92 (d, J=4,4, 3H).
Пример 5: Ν2-(2-Метокси-4-(1-метил-1H-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
Стадия 1: N2-(4-бром-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
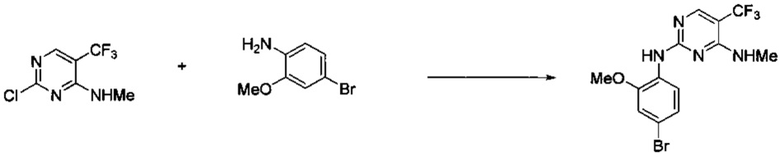
Смесь 2-хлор-N-метил-5-(трифторметил)пиримидин-4-амина (0,5 г; 2,36 ммоль), 4-бром-2-метоксианилина (0,72 г; 0,38 ммоль) и п-толуолсульфоновой кислоты (0,49 г; 2,6 ммоль) в диоксане (10 мл) нагревали при 100°C в течение 2 ч. Эту смесь охлаждали, фильтровали и полученное твердое вещество промывали диоксаном. Твердое вещество высушивали в вакуумном сушильном шкафу с получением неочищенного N2-(4-бром-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина (1,31 г), который использовали на следующей стадии без дополнительной очистки.
Стадия 2: Ν2-(2-метокси-4-(1-метил-1H-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
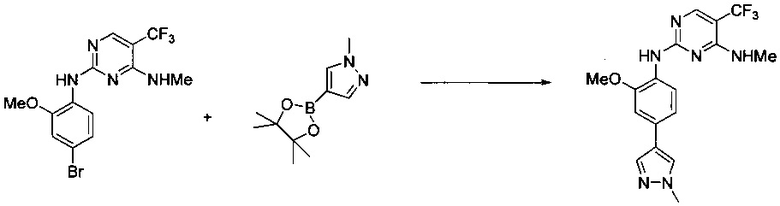
Смесь N2-(4-бром-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина (0,365 г; 1 ммоль), Pd(PPh3)4 (115 мг; 0,1 ммоль), K2CO3 (0,415 г; 3 ммоль) и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (0,415 г; 2 ммоль) в диоксане (10 мл) и воде (1,25 мл) дегазировали в токе азота в течение 10 мин. Реакционную трубку запаивали и эту смесь обучали в микроволновом шкафу при 100°C в течение 20 мин. Смесь охлаждали и концентрировали при пониженном давлении. Остаток делили между этилацетатом (20 мл) и водой (20 мл) и полученный продукт экстрагировали этилацетатом (2×20 мл). Объединенные органические слои пропускали через картридж для фазового разделения и растворитель удаляли при пониженном давлении. Очистка остатка хроматографией на колонке с силикагелем (0-100% этилацетат/изогексан) давала остаток, который обрабатывали диэтиловым эфиром с получением N2-(2-метокси-4-(1-метил-1H-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина в виде грязно-белого твердого вещества (94 мг; 25%). LCMS (10 cm_ESCI_Formic_MeCN): [MH+]=379 при 3,11 мин. 1H ЯМР (400 МГц, CDCl3): δ 8,49 (d, J=8,4, 1H); 8,17 (s, 1H); 7,76-7,68 (m, 2H); 7,58 (s, 1H); 7,10 (dd, J=8,4, 1,9, 1H); 6,98 (d, J=1,9, 1H); 5,20 (s, 1H); 3,95 (s, 6H); 3,12 (d, J=4,7, 3H).
Пример 6: N2-(5-фтор-2-метокси-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
Стадия 1: 2-фтор-5-метокси-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)бензойная кислота
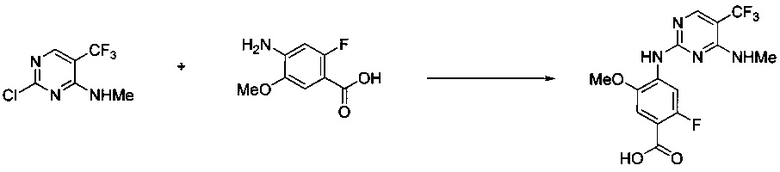
2-Фтор-5-метокси-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)-бензойную кислоту получали способом, описанным в Примере 5, стадия 1 с помощью 4-амино-2-фтор-5-метоксибензойной кислоты (1,35 г; количеств.).
Стадия 2: N2-(5-фтор-2-метокси-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
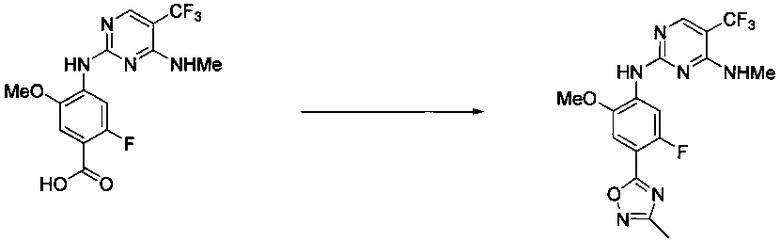
Смесь 2-фтор-5-метокси-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)бензойной кислоты (0,1 г; 0,28 ммоль), HATU (127 мг; 0,33 ммоль) и DIPEA (60 мкл; 6,33 ммоль) в DMF (2 мл) перемешивали при комнатной температуре в течение 5 мин. Добавляли Nʹ-гидроксиацетимидамид (25 мг; 0,33 ммоль) и эту смесь перемешивали при комнатной температуре в течение 30 мин, а затем при 100°C в течение 18 ч. Вносили дополнительное количество HATU (127 мг; 0,33 ммоль), DIPEA (60 мкл; 6,33 ммоль) и Nʹ-гидроксиацетимидамид (25 мг; 0,33 ммоль) и реакционную смесь нагревали при 100°C еще в течение 8 ч. Эту смесь охлаждали и разбавляли этилацетатом (10 мл). Органический слой промывали насыщенным водным раствором NaHCO3 (2×5 мл) и объединенные водные смывы дополнительно экстрагировали этилацетатом (2×10 мл). Объединенные органические слои пропускали через картридж для фазового разделения и растворитель удаляли при пониженном давлении. Очистка остатка хроматографией на колонке с силикагелем (0-100% этилацетат/изогексан) давала N2-(5-фтор-2-метокси-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин в виде белого твердого вещества (16 мг; 15%). LCMS (10 cm_ESCI_Formic_MeCN): [MH+]=399 при 4,51 мин. 1H ЯМР (400 МГц, CDCl3): δ 8,67 (d, J=13., 1H); 8,23 (s, 1H); 8,01 (s, 1H); 7,48 (d, J=6,1, 1H); 5,33 (s, 1H); 4,00 (s, 3H); 3,16 (d, J=4,7, 3H); 2,51-2,44 (m, 3H).
Пример 7: N2-(2-хлор-5-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
Стадия 1: 5-хлор-2-метокси-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)бензойная кислота
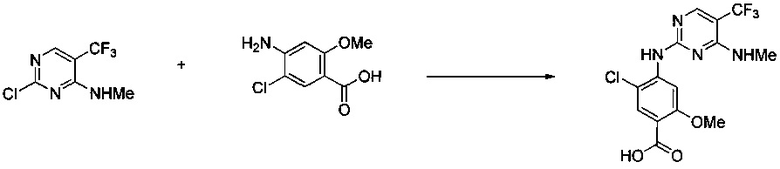
5-Хлор-2-метокси-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)-бензойную кислоту получали способом, описанным в Примере 5, стадия 1, с помощью 4-амино-5-хлор-2-метоксибензойной кислоты (1,01 г; количеств.).
Стадия 2: Nʹ-ацетоил-5-хлор-2-метокси-4-(4-(метиламино)-5-(трифторметил)-пиримидин-2-иламино)бензогидразид
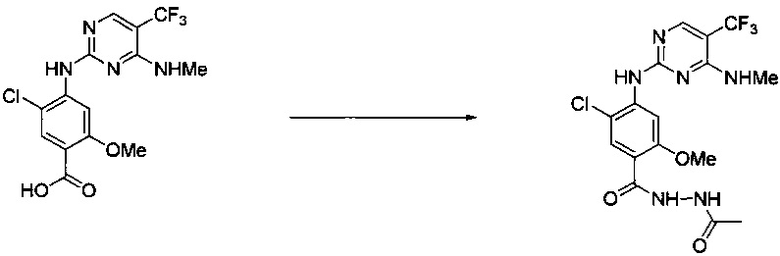
Суспензию 5-хлор-2-метокси-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)бензойной кислоты (144 мг; вещество с 50% чистотой, 0,19 ммоль), HATU (85 мг; 0,22 ммоль), уксусного гидразида (16 мг; 0,22 ммоль) и DIPEA (81 мкл; 0,46 ммоль) в дихлорметане (4 мл) перемешивали при комнатной температуре в течение 18 ч. Эту смесь разбавляли дихлорметаном (10 мл) и промывали насыщенным водным раствором NaHCO3 (10 мл). В водном слое оставалось твердое вещество; его отфильтровывали, промывали водой и затем суспендировали в метаноле. Твердое вещество собирали фильтрацией и высушивали в вакуумном сушильном шкафу с получением Nʹ-ацетоил-5-хлор-2-метокси-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)бензогидразида в виде белого твердого вещества (68 мг; 85%). Это вещество использовали не следующей стадии без дополнительной очистки.
Стадия 3: N2-(2-хлор-5-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
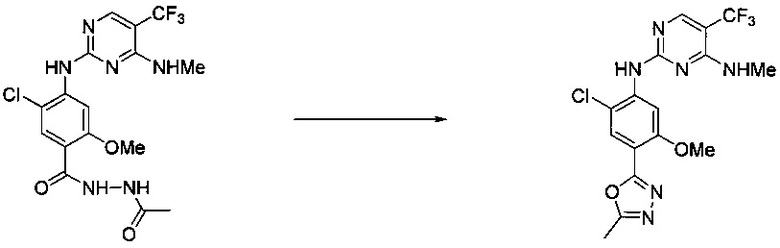
Смесь Nʹ-ацетоил-5-хлор-2-метокси-4-(4-(метиламино)-5-(трифторметил)-пиримидин-2-иламино)бензогидразида (68 мг; 0,16 ммоль), и 1-метокси-N-триэтиламмониосульфонилметанимидата (реактив Бургесса) (75 мг; 0,32 ммоль) в THF (4 мл) облучали в микроволновом шкафу при 150°C в течение 30 мин. Вносили дополнительную порцию реактива Бургесса (75 мг; 0,32 ммоль) и реакционную смесь облучали еще 30 мин при 150°C в микроволновом шкафу. Реакционную смесь концентрировали и неочищенный остаток очищали хроматографией на колонке с силикагелем (0-100% этилацетат/изогексан) с получением остатка, который обрабатывали смесью диэтиловый эфир/метанол с получением N2-(2-хлор-5-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина в виде белого твердого вещества (28 мг; 43%). HPLC (15 cm_Формic_Ascentis_HPLC_CH3CN): при 9,15 мин. LCMS (10 cm_ESCI_Formic_MeCN): [MH+]=415 при 4,00 мин. 1H ЯМР (400 МГц, CDCl3): δ 8,62 (s, 1H); 8,25 (s, 1H); 7,95 (s, 1H); 7,80 (s, 1H); 5,34 (s, 1H); 4,01 (s, 3H); 3,15 (d, J=4,7, 3H); 2,61 (s, 3H).
Пример 8: N2-(2-метокси-4-(1-метил-1H-имидазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин

Смесь N2-(4-бром-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина (0,151 г; 0,4 ммоль), Pd(dppf)Cl2 (33 мг; 0,04 ммоль) и 1-метил-5-(трибутилстаннил)-1H-имидазола (297 мг; 0,8 ммоль) в диоксане (5 мл) дегазировали в токе азота в течение 10 мин. Реакционную трубку запаивали и нагревали при 100°C в течение 18 ч. Эту смесь охлаждали и концентрировали при пониженном давлении. Остаток делили между этилацетатом (20 мл) и водой (20 мл) и полученный продукт экстрагировали этилацетатом (2×20 мл). Объединенные органические слои пропускали через картридж для фазового разделения и растворитель удаляли при пониженном давлении. Очистка с помощью препаративной ВЭЖХ давала Ν2-(2-метокси-4-(1-метил-1H-имидазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин в виде бежевого твердого вещества (64 мг; 42%). LCMS (10 cm_ESCI_Bicarb_MeCN): [MH+]=379 при 3,59 мин. 1H ЯМР (400 МГц, DMSO): δ 8,33 (d, J=8,3, 1H); 8,21 (s, 1H); 8,10 (s, 1H); 7,72 (s, 1H); 7,23 (d, J=5,2, 1H); 7,16-7,07 (m, 3H); 3,95 (s, 3H); 3,74 (s, 3H); 2,96 (d, J=4,3, 3H).
Пример 9: N2-(4-метокси-6-(тиазол-5-ил)пиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
Стадия 1: 6-хлор-4-метоксипиридин-3-амин
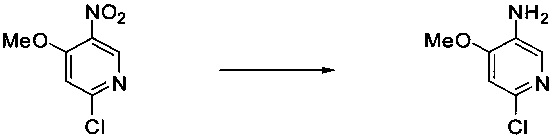
Смесь 2-хлор-4-метокси-5-нитропиридина (208 мг; 1,10 ммоль), хлорида аммония (295 мг; 5,52 ммоль) и порошкообразного железа (246 мг; 4,41 ммоль) в этаноле (5 мл) и воде (0,5 мл) нагревали при 80°C в течение 18 ч. Эту смесь охлаждали и фильтровали через картридж с Celite и промывали метанолом. Объединенные фильтрат и смыв выпаривали и остаток делили между DCM (10 мл) и водой (10 мл), органическую фазу дополнительно промывали водой (10 мл), водные смывы объединяли и экстрагировали с помощью DC Μ (3×5 мл). Органические экстракты объединяли и фильтровали через гидрофобную фритту, и растворитель удаляли путем выпаривания с получением продукта в виде грязно-белого твердого вещества (155 мг; 89%). 1H ЯМР (400 МГц, CDCl3): δ 7,73 (s, 1H); 6,71 (s, 1H); 3,90 (s, 3 Н); 3,71 (s, 2H).
Стадия 2: N2-(6-хлор-4-метоксипиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
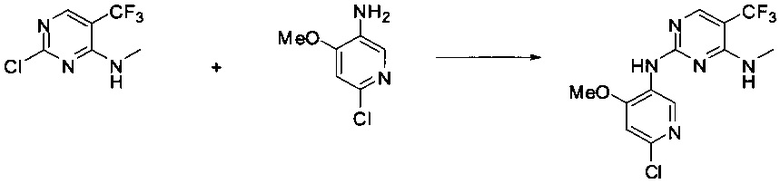
Смесь 2-хлор-N-метил-5-(трифторметил)пиримидин-4-амина (211 мг; 1 ммоль), 6-хлор-4-метоксипиридин-3-амина (150 мг; 0,95 ммоль) и п-толуолсульфоновой кислоты (190 мг; 1 ммоль) в 1,4-диоксане (2 мл) нагревали при 100°C в течение 1 ч. Эту смесь охлаждали и фильтровали, твердое вещество промывали диоксаном и высушивали в вакууме с получением продукта в виде кремового твердого вещества (436 мг; >100%). 1Н ЯМР (400 МГц, DMSO): δ 9,82 (s, 1H); 8,76 (s, 1H); 8,44 (s, 2H); 7,38 (s, 1H); 4,00 (s, 3H); 2,99-2,92 (m, 3H).
Стадия 3: N2-(4-метокси-6-(тиазол-5-ил)пиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
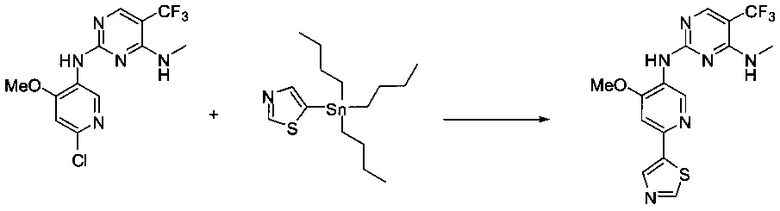
N2-(4-Метокси-6-(тиазол-5-ил)пиридин-3-ил)-N4-метил-5-(трифторметил-)пиримидин-2,4-диамин получали способом, описанным в Примере 7, с помощью N2-(6-хлор-4-метоксипиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамина и 5-(трибутилстаннил)тиазола. LCMS (10 cm_ESCI_Formic_MeCN): [MH+]=383 при 2,60 мин. 1Н ЯМР δ (ppm) (CDCl3): 9,65 (1H, s), 8,9 (1H, d, J=2,1), 8,2 (1H, d, J=1,1), 8,1 (1H, d, J=2,1), 7,75 (1H, s), 7,55 (1H, s), 5,27 (1H, s), 4,1 (3H, s), 3,2 (3H, d, J=4,7).
Пример 10: 5-хлор-N2-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин
Стадия 1: 4-амино-3-метокси-N-метилбензамид
4-Амино-3-метокси-N-метилбензамид получали способом, описанным в Примере 7, с помощью 4-амино-3-метоксибензойной кислоты и метиламина гидрохлорида.
Стадия 2: 4-(5-хлор-4-(метиламино)пиримидин-2-иламино)-3-метокси-N-метилбензамид
4-(5-Хлор-4-(метиламино)пиримидин-2-иламино)-3-метокси-N-метилбензамид получали способом, описанным в Примере 7, с помощью 4-амино-3-метокси-N-метилбензамида и 2,5-дихлор-N-метилпиримидин-4-амина. 1H ЯМР δ (ppm) (CDCl3): 8,58 (1H, d, J=8,4), 7,95-7,92 (1H, m), 7,70 (1H, s), 7,45 (1H, d, J=1,9), 6,09 (1H, s), 5,30 (1H, s), 4,03-3,95 (3H, m), 3,15-3,09 (3H, m), 3,02 (3H, t, J=4,8).
Стадия 3: 5-хлор-N2-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин

Смесь 4-(5-хлор-4-(метиламино)пиримидин-2-иламино)-3-метокси-N-метилбензамида (112 мг; 0,35 ммоль) и 2-пиридилдифенилфосфина (373 мг; 1,42 ммоль) продували азотом в течение 10 мин. Добавляли безводный THF (2 мл), а затем по каплям вносили диизопропилазодикарбоксилат (0,28 мл; 1,42 ммоль). Добавляли по каплям дифенилфосфорилазид (0,31 мл; 1,42 ммоль) в течение 5 мин. Эту смесь нагревали при 45°C в атмосфере азота в течение 18 ч. Смесь разбавляли этилацетатом (20 мл) и промывали насыщенным раствором гидрокарбоната натрия (2×10 мл). Объединенные водные смывы обратно экстрагировали этилацетатом (10 мл), объединенные органические экстракты фильтровали через гидрофобную фритту и выпаривали. Очистка полученного остатка хроматографией на колонке с силикагелем (0-100% этилацетат/изогексан) с последующей обработкой диэтиловым эфиром давала 5-хлор-N2-(2-метокси-4-(1-метил-1H-тетразол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин в виде белого твердого вещества (45 мг; 38%). LCMS (10 cm_ESCI_Bicarb_MeCN): [MH+]=347 при 2,67 мин. 1H ЯМР (400 МГц, CDCl3): δ 8,76 (d, J=8,5, 1H); 7,96 (s, 1H); 7,75 (s, 1H); 7,40 (d, J=1,9, 1H); 7,3 (d, J=2,0, 1H); 5,35 (s, 1H); 4,21 (s, 3H); 4,00 (s, 3H); 3,13 (d, J=4,9, 3H).
Пример 11: N2-(2-хлор-5-метокси-4-(1-метил-1H-1,2,3-триазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин
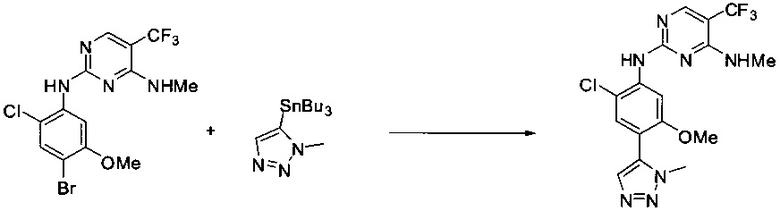
Смесь N2-(4-бром-2-хлор-5-метоксифенил)-N4-метил-5-(трифторметил)-пиримидин-2,4-диамина (50 мг; 0,12 ммоль), 1-метил-5-(трибутилстаннил)-1H-1,2,3-триазол (68 мг; 0,18 ммоль) и Pd(dppf)2Cl2 (10 мг; 0,012 ммоль) в диоксане (4 мл) дегазировали в токе азота в течение 10 мин. Реакционную смесь нагревали до 100°C в течение 18 ч. Вносили дополнительные количества 1-метил-5-(трибутилстаннил)-1H-1,2,3-триазола (68 мг; 0,18 ммоль) и Pd(dppf)2Cl2 (10 мг; 0,012 ммоль) и эту смесь выдерживали при 100°C еще в течение 24 ч, после чего вносили дополнительное количество 1-метил-5-(трибутилстаннил)-1H-1,2,3-триазола (68 мг; 0,18 ммоль) и Pd(dppf)2Cl2 (10 мг; 0,012 ммоль). Смесь выдерживали при 100°C еще в течение 48 ч. Смесь охлаждали и концентрировали досуха в вакууме, и остаток делили между DCM и водой. Отделенную органическую фазу концентрировали досуха в вакууме и остаток очищали с помощью ОФ-ВЭЖХ; полученный продукт выделяли в виде кремового твердого вещества (22 мг; 44%). LCMS (ESCI_Formic_MeCN): [MH+]=414 при 3,45 мин. 1Н ЯМР δ (DMSO-d6): 8,58 (s, 1H); 8,16 (s, 1H); 7,98 (s, 1H); 7,71 (s, 1H); 7,42 (s, 1H); 7,24 (d, J=5,1, 1H); 3,82 (s, 3H); 3,76 (s, 3H); 2,87 (d, J=4,4, 3H).
Соединения в приведенных выше Примерах, а также дополнительные соединения, полученные такими же способами, приведены ниже в Таблице 3 вместе с величинами Ki киназы LRRK2 (выраженными в мкмоль).
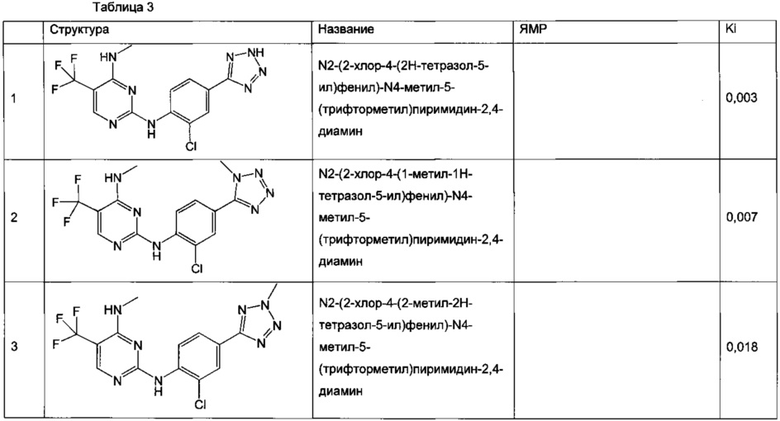
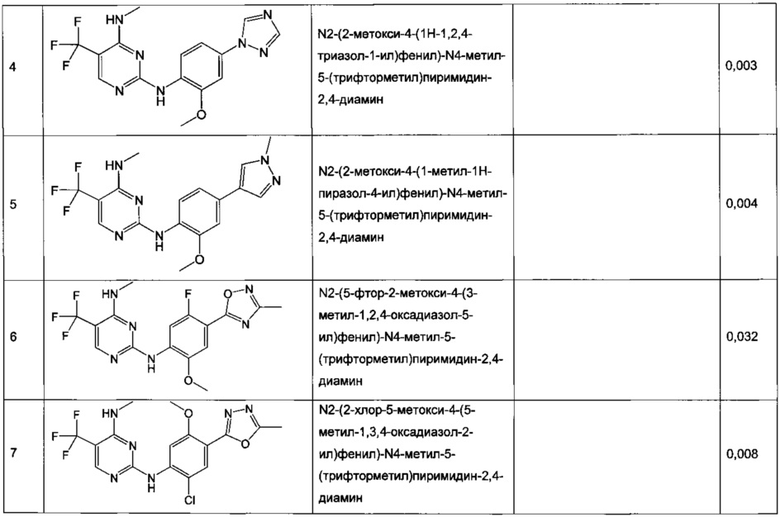
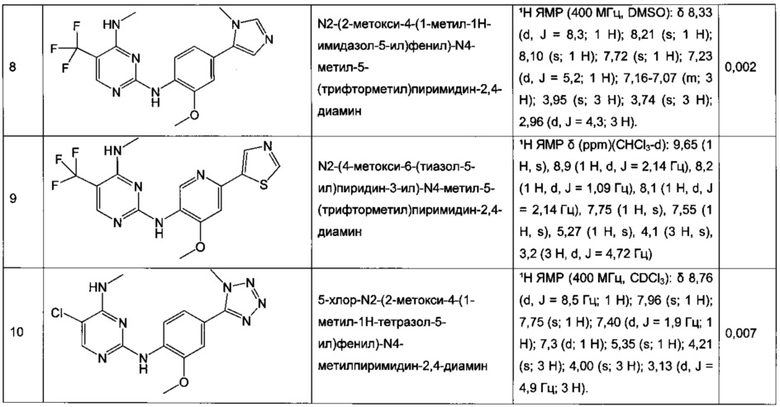
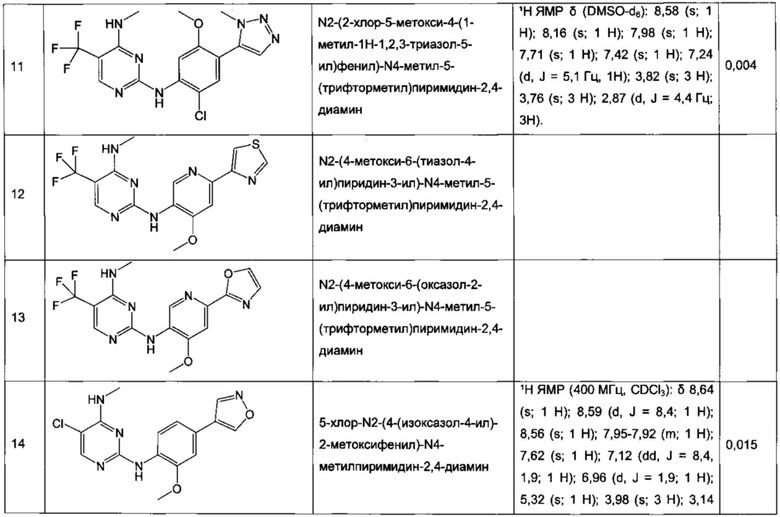

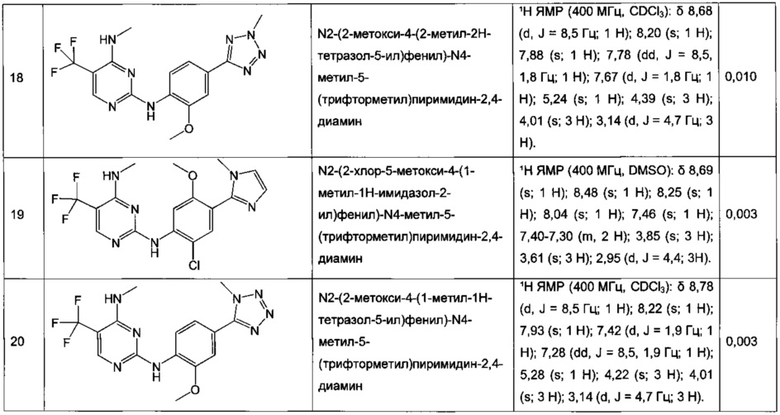
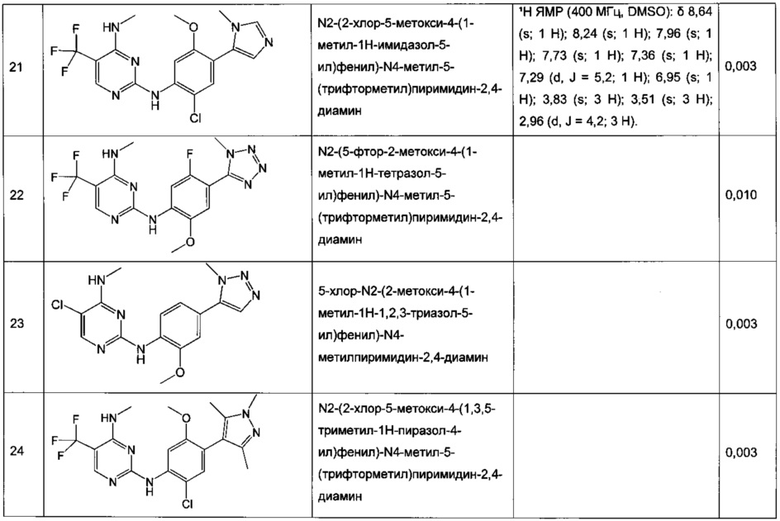

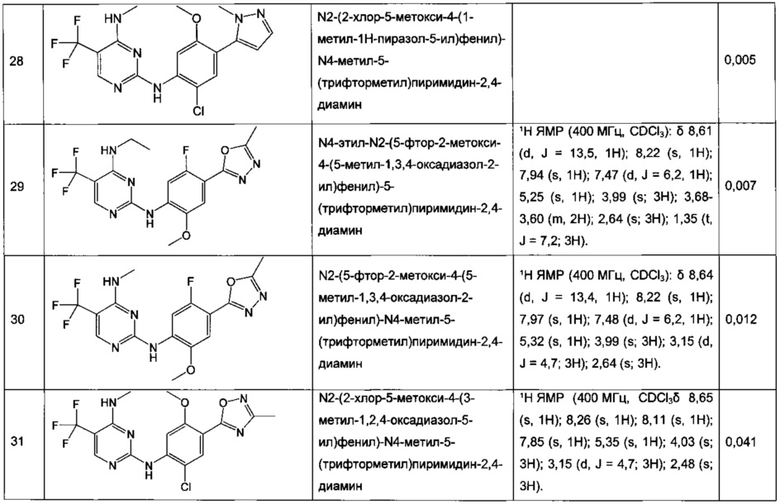
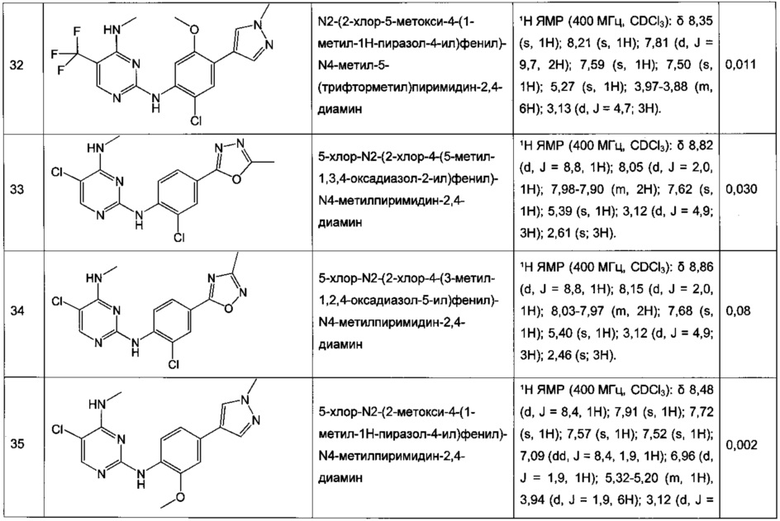
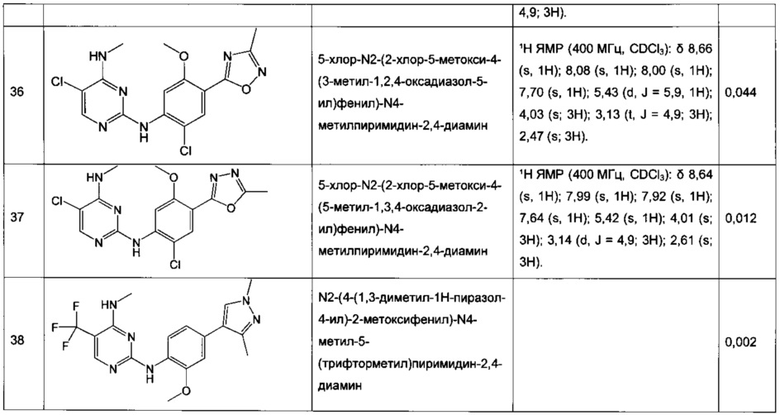
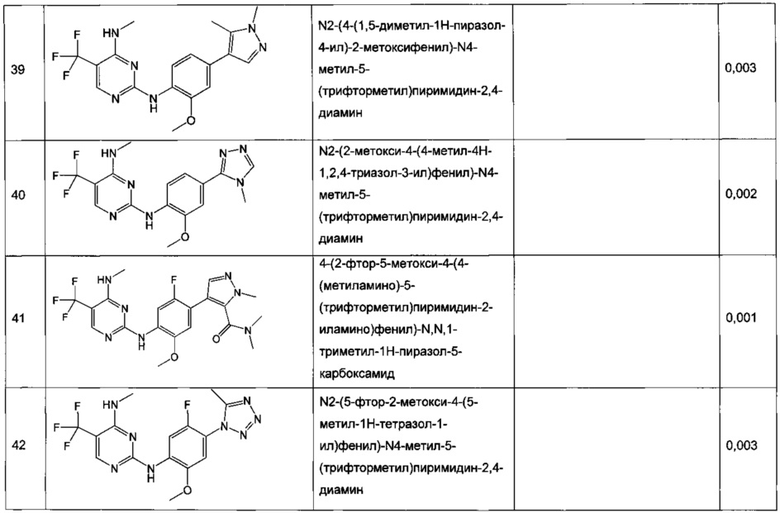
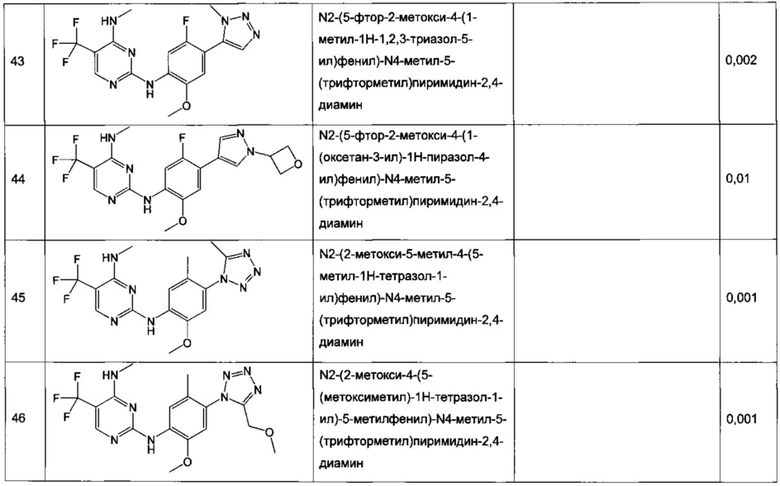
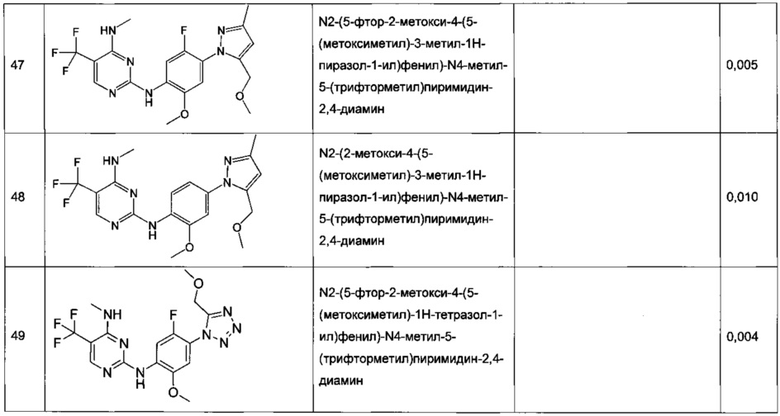
Пример 12. Анализ киназы LRRK2 in vitro с помощью системы LabChip
Данный анализ применяли для оценки способности соединений ингибировать активность киназы LRRK2, путем определения величин Kiapp, IC50 или процентной доли ингибирования. На полипропиленовом микропланшете инкубировали совместно киназу LRRK2, флюоресцентно-меченный пептидный субстрат, АТФ и тестируемое соединение. С помощью системы LabChip 3000 (Caliper Life Sciences), после проведения реакции, разделяли субстрат в ходе капиллярного электрофореза на две фракции: фосфорилированный и нефосфорилированный. Относительное количество каждой из фракций определяли количественно по интенсивности флюоресценции. Величину Ki для киназы LRRK2 определяли по уравнению:
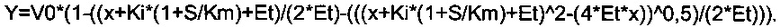
Величины Ki в Таблице 4 и в любом ином месте в настоящем описании выражены в мкМ.
Использованы следующие условия анализа и материалы:
Конечные условия анализа:
ATPapp Kms:
Материалы:
Подготовка планшета с соединениями:
Для получения серийных разведений наносили по 34,6 мкл DMSO на дорожки 3-24. Для получений контролей наносили по 37,5 мкл DMSO на дорожки 1 и 2 рядов A и P. a, d и 50 мкл 25 мкл G-028831 (Staurosporine) наносили на дорожки 1 и 2, ряд B. Для образцов: исходя из 100 мкМ, вносили по 37,5 мкл DMSO на дорожки 1 и 2, затем по 12,5 мкл 10 мМ соединения; исходя из 10 мкМ, наносили по 78 мкл DMSO на дорожки 1 и 2, по затем 2 мкл 10 мМ соединения; и исходя из 1 мкМ, наносили по 25 мкМ соединения (2 мкл 10 мМ соединения + 798 мкл DMSO) на пустые дорожки 1 и 2. Для получения серийных разведений 1:3,16 использовали высокоточный инструмент ("PLK_BM_serial_halflog").
Приготовление АТФ
АТФ разбавляли до 282,1 мкМ в Полном киназном буфере (конечная концентрация 130 мкМ).
Приготовление Полной (Total) и Холостой (Blank) пробы
Разбавляли субстрат в Полном реакционном буфере до 4 мкМ. Объединяли равные объемы Полного реакционного буфера и 4 мкМ субстрата для получения холостой пробы. Объединяли равные объемы Полного реакционного буфера и 4 мкМ субстрата, и к объединенному раствору добавляли киназу LRRK2 в 2-кратной конечной концентрации.
Ход анализа
На полипропиленовый микропланшет с объемом лунок 50 мкл добавляли вручную 5 мкл в лунку смеси буфер/субстрат в лунки с холостой пробой. Для инициации киназной реакции использовали Biomek FX ("PLK SAR 23 ATP"). В соответствующие лунки вносили следующие смеси:
2 мкл соединения + 23 мкл АТФ;
5 мкл в лунку смеси соединение / АТФ на планшет для анализа;
5 мкл в лунку смеси киназа / субстрат на планшет для анализа.
Планшет инкубировали в течение 2 ч в темноте. Для остановки киназной реакции использовали Biomek FX ("PLK Stop"), и вносили по 10 мкл в лунку стоп-раствора на Планшет для анализа. Результаты считывали на приборе LabChip 3000.
Протокол Lab Chip 3000
Осуществляли прогон LabChip 3000 в программе "LRRK2 IC50" со следующими рабочими установками.
Пример 13. Лантан-скрининговый анализ связывания киназы LRRK2 in vitro
Данный анализ применяли для оценки способности соединений ингибировать активность киназы LRRK2 путем определения величин Kiapp, IC50 или процентной доли ингибирования. На 384-луночных планшетах с неглубокими лунками ProxiPlate F black, инкубировали вместе киназу LRRK2, меченные Eu антитела к GST, киназную метку 236 Alexa Fluor® и тестируемое соединение.
Связывание метки Alexa Fluor® с киназой детектировали путем добавления меченых Eu антител к GST. Связывание метки и антител с киназой вызывает высокий резонансный перенос энергии флюоресценции (FRET), при этом замещение метки ингибитором киназы приводит к потере FRET.
Применяли следующие условия анализа и материалы.
Конечные условия анализа:
Материалы:
Подготовка планшетов с соединениями
Приготовить серийные разведения соединений (10 мМ сток) 1:3,16 (20 мкл + 43,2 мкл) в 100% DMSO. Получить 12 точек для построения кривой. Разбавить каждую концентрацию 1:33,3 (3 мкл + 97 мкл) в реакционном буфере. Перенести по 5 мкл на планшет для анализа. Конечная верхняя тестируемая концентрация составляет 100 мкМ.
Приготовление холостой и полной пробы
В Реакционном буфере в лунки для полной и холостой пробы внести 5 мкл DMSO (3%), и внести 5 мкл Меченных Eu антител к GST (6 нМ) в лунки для холостой пробы.
Ход анализа
Добавить 5 мкл смеси LRRK2 (30 нМ) / меченных Eu антител к GST (6 нМ) в лунки с соединением и полной пробой. Внести по 5 мкл киназной метки (25,5 нМ) во все лунки. Инкубировать планшеты при комнатной температуре в течение 1 ч на шейкере для планшетов (осторожное встряхивание). Провести считывание на ридере PerkinElmer EnVision, по протоколу HTRF.
Обработка данных
Рассчитать соотношение: (665/620)×10000. Вычесть среднее значение фона из всех полученных точек. Рассчитать процентную долю от контроля для каждой тестовой величины. Нанести на график процентную долю от контроля в зависимости от концентрации соединения. Рассчитать величину Ki (сглаживание кривой в программе XLfit по уравнению Моррисона (Morrison)).
Результаты представляли как Ki в мкМ. Уравнение для Ki:
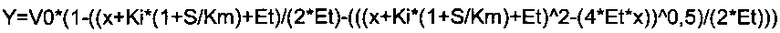
где Et=4 нМ
kd (метки) = 8,5 нМ
концентрация метки (S) = 8,5 нМ.
Пример 14. Животная модель болезни Паркинсона
Болезнь Паркинсона можно вызвать у мышей и приматов введением 1-метил-4-фенилтетрагидропиридина (MPTP), селективного нигростриального дофаминэргического нейротоксина, который вызывает потерю стриарного дофамина (DA) маркеров нервных окончаний. Соединения по настоящему изобретению можно оценить по их эффективности в лечении болезни Паркинсона, с применением индуцированной MPTP нейродегенерации, следуя в целом процедуре, описанной в литературе (Saporito et al., J. Pharmacology (1999) Vol. 288, pp. 421-427).
Вкратце, MPTP растворяют в PBS в концентрациях 2-4 мг/мл, и мышам (самцы C57 весом 20-25 г) проводят подкожную инъекцию от 20 до 40 мг/кг. Соединения по настоящему изобретению растворяют в полиэтиленгнликоле гидроксистеарате и разводят в PBS. Мышам вводят 10 мл/кг раствора соединения путем подкожной инъекции за 4-6 ч перед введением MPTP, и затем ежедневно в течение 7 суток. В день последней инъекции мышь забивают и средний мозг блокируют и пост-фиксируют в параформальдегиде. Стриатум извлекают отдельно, взвешивают и хранят при -70°C.
Собранный таким образом стриатум анализируют на содержание дофамина и его метаболитов дигидроксифенилуксусной кислоты и гомованильной кислоты путем ВЭЖХ с электрохимической детекцией, как описано в литературе (Sonsalla et al., J. Pharmacol. Exp. Ther. (1987) Vol. 242, pp. 850-857). Стриатум можно также исследовать с помощью тирозингидроксилазного анализа (Okunu et al., Anal Biochem (1987) Vol. 129, pp. 405-411) путем измерения выделения 14CO2, связанного с опосредованной тирозин-гидроксилазой конверсией меченого тирозина до L-dopa. Кроме того, стриатум можно исследовать с помощью анализа моноамин-оксидазы-B, как описано в литературе (White et al., Life Sci. (1984), Vol. 35, pp. 827-833), а также путем мониторинга захвата дофамина (Saporito et al., (1992) Vol. 260, pp. 1400-1409).
Несмотря на то, что настоящее изобретение описано со ссылкой на конкретные его осуществления, специалисту в данной области техники следует понимать, что можно осуществить различные модификации и замену эквивалентами без выхода за пределы истинной сущности и объема настоящего изобретения. Кроме того, можно осуществить множество модификаций, чтобы привести конкретную ситуацию, материал, композицию материалов, способ, стадию или стадии способа, в соответствие с объективной сущности и объемом настоящего изобретению. Подразумевается, что все такие модификации охвачены объемом прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АМИНОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ БОГАТОЙ ЛЕЙЦИНОМ ПОВТОРНОЙ КИНАЗЫ 2 (LRRK2) | 2012 |
|
RU2634716C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛАМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ОБОГАЩЕННОЙ ЛЕЙЦИНОВЫМИ ПОВТОРАМИ КИНАЗЫ 2 | 2013 |
|
RU2637947C2 |
| ФТОР-18 И УГЛЕРОД-11 МЕЧЕНЫЕ РАДИОЛИГАНДЫ ДЛЯ ТОМОГРАФИИ С ПОЗИТРОННОЙ ЭМИССИЕЙ (РЕТ), ВИЗУАЛИЗИРУЮЩЕЙ LRRK2 | 2012 |
|
RU2650641C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛАМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ОБОГАЩЕННОЙ ЛЕЙЦИНОВЫМИ ПОВТОРАМИ КИНАЗЫ 2 (LRRK2) ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ БОЛЕЗНИ ПАРКИНСОНА | 2013 |
|
RU2637948C2 |
| ГЕТЕРОЦИКЛИЛЬНЫЕ ПИРИМИДИНОВЫЕ АНАЛОГИ В КАЧЕСТВЕ ИНГИБИТОРОВ Tук2 | 2013 |
|
RU2641895C2 |
| СПОСОБЫ И МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2788174C2 |
| СПОСОБЫ И МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2788163C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИНА | 2011 |
|
RU2528386C2 |
| ПРОИЗВОДНЫЕ N2-(2-ФЕНИЛ)-ПИРИДО[3,4-d]ПИРИМИДИН-2,8-ДИАМИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ MPS1 ИНГИБИТОРА | 2015 |
|
RU2693460C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИН-2,4-ДИАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА, ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ РАКА | 2022 |
|
RU2831452C2 |
Изобретение относится к новым соединениям формулы I или их фармацевтически приемлемым солям. Соединения обладают свойствами модулятора активности богатой лейцином повторной киназы 2 (LRRK2) и могут быть использованы для применения в профилактике или лечении болезни Паркинсона. В формуле I
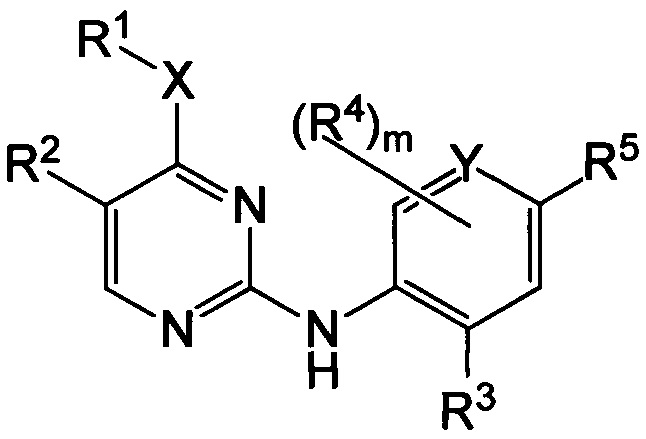
m равно 0 или 1; X представляет собой -NRa-; a Ra представляет собой водород; Y представляет собой С или N; R1 представляет собой C1-6-алкил; R2 представляет собой галоген или галоген-С1-6-алкил; R3 и R4 каждый независимо представляет собой галоген, С1-6-алкил или C1-6-алкоксигруппу; R5 представляет собой 5-членную гетероарильную группу, содержащую в кольце 1-4 гетероатома, выбранных из азота, кислорода и серы, возможно замещенную одним или более R6; и R6 представляет собой: C1-6-алкил; галоген; галоген-С1-6-алкил; C1-6-алкоксигруппу; 4-6-членный насыщенный гетероциклил с атомом кислорода в качестве гетероатома; метоксиметил или -C(O)-NRbRc, где Rb и Rc каждый независимо представляет собой водород или -C1-6-алкил. 4 н. и 17 з.п. ф-лы, 3 табл., 14 пр.
1. Соединение формулы I:
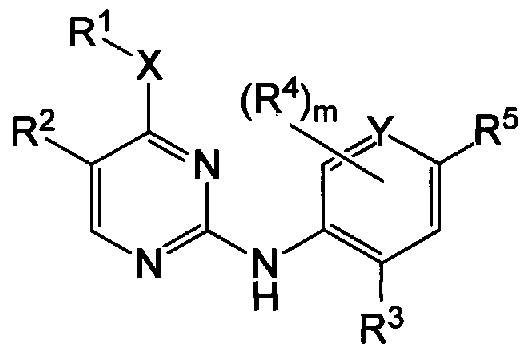
или его фармацевтически приемлемая соль,
в котором:
m равно 0 или 1;
X представляет собой -NRa-; a Ra представляет собой водород;
Y представляет собой С или N;
R1 представляет собой C1-6-алкил;
R2 представляет собой галоген или галоген-С1-6-алкил;
R3 и R4 каждый независимо представляет собой галоген, С1-6-алкил или C1-6-алкоксигруппу;
R5 представляет собой 5-членную гетероарильную группу, содержащую в кольце 1-4 гетероатома, выбранных из азота, кислорода и серы, возможно замещенную одним или более R6; и
R6 представляет собой C1-6-алкил; галоген; галоген-С1-6-алкил; C1-6-алкоксигруппу; 4-6-членный насыщенный гетероциклил с атомом кислорода в качестве гетероатома; метоксиметил или -C(O)-NRbRc,
где Rb и Rc каждый независимо представляет собой водород или -C1-6-алкил.
2. Соединение по п. 1, в котором R1 представляет собой метил или этил.
3. Соединение по п. 1, в котором R2 представляет собой хлор или трифторметил.
4. Соединение по п. 1, в котором R3 представляет собой галоген или С1-6-алкоксигруппу.
5. Соединение по п. 1, в котором R3 представляет собой метоксигруппу.
6. Соединение по п. 1, в котором m равно 0.
7. Соединение по п. 1, в котором R4 представляет собой галоген или метоксигруппу.
8. Соединение по п. 1, в котором R5 представляет собой пиразолил; имидазолил; оксадиазолил; тиадиазолил; триазолил или тетразолил; каждый из которых, возможно, замещен одним или более R6.
9. Соединение по п. 1, в котором R5 представляет собой: пиразолил; оксадиазолил; триазолил; или тетразолил; каждый из которых, возможно, замещен одним или более R6.
10. Соединение по п. 1, в котором R5 представляет собой оксадиазолил; триазолил или тетразолил; каждый из которых, возможно, замещен одним или более R6.
11. Соединение по п. 1, в котором R5 представляет собой пиразолил, возможно замещенный одним или более R6.
12. Соединение по п. 1, в котором R5 представляет собой оксадиазолил; тиадиазолил; триазолил или тетразолил, возможно замещенный одним или более R6.
13. Соединение по п. 1, в котором R5 представляет собой триазолил, возможно замещенный одним или более R6.
14. Соединение по п. 1, в котором R5 представляет собой тетразолил, возможно замещенный одним или более R6.
15. Соединение по п. 1, в котором R5 представляет собой 1-метил-1Н-имидазол-2-ил; 1-метил-1Н-имидазол-5-ил; 1,3,5-триметил-1Н-пиразол-4-ил; 1-метил-1Н-пиразол-5-ил; 1-метил-1Н-пиразол-4-ил;
1,3-диметил-1Н-пиразол-4-ил; 1,5-диметил-1Н-пиразол-4-ил; 5-(диметиламинокарбонил)-1-метил-1Н-пиразол-4-ил; 1-(оксетан-3-ил)-1Н-пиразол-4-ил; 5-(метоксиметил)-3-метил-1Н-пиразол-1-ил;
1-метил-1Н-1,2,3-триазол-5-ил; 1Н-1,2,4-триазол-1-ил; 4-метил-4Н-1,2,4-триазол-3-ил; 5-метил-1,3,4-оксадиазол-2-ил; 3-метил-1,2,4-оксадиазол-5-ил; 1-метил-1Н-тетразол-5-ил;
2-метил-2Н-тетразол-5-ил; 1Н-тетразол-1-ил; 2Н-тетразол-5-ил; 5-метил-1Н-тетразол-1-ил или 5-(метоксиметил)-1Н-тетразол-1-ил.
16. Соединение по п. 1, выбранное из группы, состоящей из следующих соединений:
N2-(2-хлор-4-(2Н-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-4-(1-метил-1Н-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-4-(2-метил-2Н-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1Н-1,2,4-триазол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1-метил-1Н-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1-метил-1Н-имидазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-метокси-6-(тиазол-5-ил)пиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1Н-тетразол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1-метил-1Н-1,2,3-триазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-метокси-6-(тиазол-4-ил)пиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-метокси-6-(оксазол-2-ил)пиридин-3-ил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
5-хлор-N2-(4-(изоксазол-4-ил)-2-метоксифенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1Н-имидазол-2-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1Н-имидазол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
N2-(2-метокси-4-(1-метил-1Н-1,2,3-триазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(2-метил-2Н-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1-метил-1Н-имидазол-2-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1-метил-1Н-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1-метил-1Н-имидазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(1-метил-1Н-тетразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1Н-1,2,3-триазол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1,3,5-триметил-1Н-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1-метил-1Н-пиразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-(3,5-диметилизоксазол-4-ил)-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(1Н-тетразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1-метил-1Н-пиразол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N4-этил-N2-(5-фтор-2-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-хлор-5-метокси-4-(1-метил-1Н-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
5-хлор-N2-(2-хлор-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-хлор-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-метокси-4-(1-метил-1Н-пиразол-4-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-хлор-5-метокси-4-(3-метил-1,2,4-оксадиазол-5-ил)фенил)-N4-метилпиримидин-2,4-диамин,
5-хлор-N2-(2-хлор-5-метокси-4-(5-метил-1,3,4-оксадиазол-2-ил)фенил)-N4-метилпиримидин-2,4-диамин,
N2-(4-(1,3-диметил-1Н-пиразол-4-ил)-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(4-(1,5-диметил-1Н-пиразол-4-ил)-2-метоксифенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(4-метил-4Н-1,2,4-триазол-3-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
4-(2-фтор-5-метокси-4-(4-(метиламино)-5-(трифторметил)пиримидин-2-иламино)фенил)-N,N,1-триметил-1H-пиразол-5-карбоксамид,
N2-(5-фтор-2-метокси-4-(5-метил-1Н-тетразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(1-метил-1Н-1,2,3-триазол-5-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(1-(оксетан-3-ил)-1Н-пиразол-4-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-5-метил-4-(5-метил-1Н-тетразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(5-(метоксиметил)-1Н-тетразол-1-ил)-5-метилфенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(5-фтор-2-метокси-4-(5-(метоксиметил)-3-метил-1Н-пиразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
N2-(2-метокси-4-(5-(метоксиметил)-3-метил-1Н-пиразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин и
N2-(5-фтор-2-метокси-4-(5-(метоксиметил)-1Н-тетразол-1-ил)фенил)-N4-метил-5-(трифторметил)пиримидин-2,4-диамин,
или его фармацевтически приемлемая соль.
17. Фармацевтическая композиция, обладающая свойствами модулятора активности богатой лейцином повторной киназы 2 (LRRK2), включающая:
(a) фармацевтически приемлемый носитель и
(b) терапевтически эффективное количество соединения или его фармацевтически приемлемой соли по любому из пп. 1-16.
18. Способ лечения болезни Паркинсона, опосредованной LRRK2, включающий введение субъекту, который в этом нуждается, эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп. 1-16.
19. Соединение или его фармацевтически приемлемая соль по любому из пп. 1-16 для применения в профилактике или лечении болезни Паркинсона.
20. Фармацевтическая композиция по п. 17, которая полезна для профилактики или лечения болезни Паркинсона.
21. Применение соединения или его фармацевтически приемлемой соли по любому из пп. 1-16 для изготовления лекарственного средства для профилактики или лечения болезни Паркинсона.
| ИНГИБИРУЮЩИЕ CDK-КИНАЗЫ ПИРИМИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2002 |
|
RU2330024C2 |
| Anthony A Estrada; et al | |||
| Discovery of Highly Potent, Selective, and Brain-Penetrable Leucine-Rich Repeat Kinase 2 (LRRK2) Small Molecule Inhibitors Journal of Medicinal Chemistry, 2012, Vol:55, Nr:22, Page(s):9416 - 9433 | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2018-03-21—Публикация
2012-11-28—Подача