ОБЛАСТЬ ТЕХНИКИ
[0001] В настоящем изобретении предложены высокостабильные композиции, содержащие аморфный карбонат кальция, стабилизированный полифосфатами или бисфосфонатами, а также способы их получения, обработки и применения.
УРОВЕНЬ ТЕХНИКИ
[0002] Кальций является одним из наиболее известных и широко распространенных минералов. Кальций считается одним из наиболее важных минералов в организме человека. Он требуется для поддержания минеральной плотности кости, необходим для экзоцитоза нейротрансмиттеров, принимает участие в сокращении клеток мускулатуры, заменяет натрий в качестве деполяризующего минерала в сердце и задействован во многих других физиологических функциях. Благодаря тому, что он задействован при ряде медицинских состояний, кальций широко используется в качестве пищевой добавки. Добавки на основе кальция часть получают с применением карбоната кальция.
[0003] Карбонат кальция может присутствовать в нескольких кристаллических формах или в виде аморфного карбоната кальция (АСС). АСС является наименее стабильной формой, но имеет самую высокую растворимость в воде. Аморфный карбонат кальция быстро и полностью кристаллизуется в один из пяти более стабильных полиморфов в течение нескольких минут при приведении в контакт с водой или даже влагой.
[0004] В природе АСС используется множеством организмов, главным образом, ракообразными и другими беспозвоночными, у которых развилась способность стабилизации АСС в резервуарах для временного хранения минералов. Указанным организмам требуется исключительно эффективный источник минералов для периодической мобилизации, всасывания и осаждения кальция в периоды линьки. У некоторых ракообразных, таких как речные раки, большие количества АСС хранятся в специальных органах временного хранения, называемых гастролитами, которые развиваются непосредственно перед линькой.
[0005] В природе АСС стабилизирован биологическим полимерами (макромолекулами), такими как хитин и белки, которые предотвращают кристаллизацию аморфной фазы до начала указанных явлений. В нескольких публикациях было показано, что кристаллизацию аморфного карбоната кальция можно предотвращать или снижать с применением стабилизирующих полимеров и отдельных соединений. В WO 2009/053967 описано, что АСС образует осадок с фосфорилированными пептидами, который сохраняет стабильность по меньшей мере в течение месяца.
[0006] В WO 2014/024191 описан способ получения АСС, стабилизированного молекулами, образующими водородные связи, и органическим растворителем в качестве стабилизаторов. В одном из примеров было показано, что полученный АСС сохранял стабильность в суспензии по меньшей мере 3 часа примерно при 20°C при использовании фосфосерина в качестве стабилизатора или по меньшей мере 10 часов при использовании сахарозы.
[0007] В Clarkson et al., J. Chem. Soc, Faraday Trans., 1992, 88, 243-249, сообщается об исследовании самопроизвольного осаждения карбоната кальция из водных растворов. Кларксон показал, что наличие трифосфата в количестве нескольких PPM отсрочивает нуклеацию кристаллической фазы СаСО3.
[0008] В Sawada, Pure and Applied Chemistry, 1997, 69, 921-928, исследовали механизм образования и превращения полиморфов карбоната кальция и его подавление фосфорсодержащими соединениями. Савада показал, что EDTMP, органический тетра-фосфонат, содержащий две аминогруппы, в высокой концентрации может предотвращать превращение различных полиморфов карбоната кальция. Савада также подтвердил, что адсорбция EDTMP кальцитом происходит значительно дольше по сравнению с фосфатами, это указывает на более прочное связывание и комплексообразование EDTMP с атомами Са по сравнению с фосфатами.
[0009] В заявке на патент США №2013/0190441 описаны стабилизированные сферические частицы карбоната кальция и сделан акцент на том, что указанные частицы являются подходящими наполнителями для полимеров. Частицы могут быть стабилизированы органическим поверхностно-активным веществом. Указанные частицы могут сохранять стабильность в маточном растворе в течение 5 дней, что было показано в примерах с применением фосфоната EDTMP в качестве стабилизатора.
[0010] В Nebel et al,  , 2008, 47(17) 7874-9, проводили исследование фаз карбоната кальция, кальцита, арагонита, ватерита, моногидрокальцита (моногидрата карбоната кальция) и икаита (гексагидрата карбоната кальция) путем твердофазной ЯМР спектроскопии (1Н и 13С).
, 2008, 47(17) 7874-9, проводили исследование фаз карбоната кальция, кальцита, арагонита, ватерита, моногидрокальцита (моногидрата карбоната кальция) и икаита (гексагидрата карбоната кальция) путем твердофазной ЯМР спектроскопии (1Н и 13С).
[0011] Описанные способы стабилизации АСС обеспечивают ограниченный период сохранения стабильности АСС в аморфной форме. Кроме того, в большинстве из описанных выше способов применяют органические стабилизаторы и/или растворители. Одним из способов увеличения стабильности АСС является получение АСС с применением органического растворителя, такого как спирт, наиболее предпочтительно этанол.
[0012] Использование указанных растворителей на производстве может создавать угрозу для здоровья и безопасности, увеличивать затраты при производстве и на выделение отработанных растворителей для предотвращения проблем, связанных с окружающей средой и безопасностью. Наличие указанных растворителей или их следов в суспензиях, предназначенных для медицинского введения и применения в средах in vitro, является нежелательным.
[0013] Некоторые стабилизаторы, которые могут сохранять стабильность АСС в присутствии воды или влаги, являются неприемлемыми для употребления животным или человеком вследствие токсичности и нежелательных явлений.
[0014] Существует очевидная неудовлетворенная потребность в новых стабильных композициях АСС, которые можно применять в пищевой или фармацевтической промышленности, а также в высокоэффективных способах их получения в промышленном масштабе.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0015] Согласно настоящему изобретению было показано, что неорганический полифосфат или бисфосфонат может стабилизировать аморфный карбонат кальция в течение продолжительного периода времени даже в водной суспензии.
[0016] Согласно одному из аспектов в настоящем изобретении предложена твердая композиция, содержащая аморфный карбонат кальция (АСС) и неорганический полифосфат или его фармацевтически приемлемую соль в качестве стабилизатора, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС (мольное отношение Р:Са) составляет по меньшей мере примерно 1:90, и композиция сохраняет стабильность в течение по меньшей мере 7 дней.
[0017] В одном из вариантов реализации композиция может иметь мольное отношение Р:Са от примерно 1:28 до примерно 1:3 или от примерно 1:25 до примерно 1:5. В других вариантах реализации содержание Са составляет от примерно 20 масс. % до примерно 38 масс. %, от примерно 30 масс. % до примерно 38% или от примерно 30 масс. % до примерно 36 масс. %. Указанные композиции сохраняют стабильность в твердой форме по меньшей мере 1, 3 или 6 месяцев. В других вариантах реализации указанные композиции могут сохранять стабильность в течение 1 года или даже 2 лет.
[0018] В определенных вариантах реализации стабилизатор представляет собой неорганический полифосфат, такой как трифосфат, гексаметафосфат или пирофосфат. Указанные композиции могут быть охарактеризованы типовыми спектрами FT-IR и/или термограммой ДСК. Указанные спектры FT-IR имеют пики поглощения при 865 см-1; и 1400 см-1 с плечом при 1470 см-1, соответствующие карбонату; и при 1130 см-1, соответствующий фосфату, и термограмма ДСК содержит экзотермический пик в диапазоне от 365°C до 550°C.
[0019] Любая из указанных выше композиций может иметь форму порошка.
[0020] Как предложено в соответствии с основными принципами настоящего изобретения, АСС в твердой композиции согласно настоящему изобретению сохраняет стабильность, в результате чего указанная композиция содержит менее 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция после хранения в течение продолжительного периода времени, например, по меньшей мере 7 дней.
[0021] В изобретение также включена композиция согласно настоящему изобретению в виде суспензии, дополнительно содержащая водный носитель. Таким образом, согласно другому аспекту в настоящем изобретении предложена суспензия, содержащая твердую композицию согласно настоящему изобретению. Согласно одному из вариантов реализации суспензия содержит твердую композицию, содержащую аморфный карбонат кальция (АСС) и неорганический полифосфат или его фармацевтически приемлемую соль в качестве стабилизатора, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС (мольное отношение Р:Са) составляет по меньшей мере примерно 1:90, и твердая композиция сохраняет стабильность в течение по меньшей мере 7 дней. В указанной суспензии АСС сохраняет стабильность по меньшей мере в течение периода времени, выбранного из 1,2, 7, 14 дней, 1 и 3 месяцев.
[0022] Суспензия согласно настоящему изобретению содержит менее чем примерно 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция.
[0023] Согласно другому аспекту в настоящем изобретении предложена твердая композиция, содержащая аморфный карбонат кальция (АСС) и бисфосфонат или его фармацевтически приемлемую соль в качестве стабилизатора, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС (мольное отношение Р:Са) составляет по меньшей мере примерно 1:90, и композиция содержит от 5 масс. % до примерно 30 масс. % воды и сохраняет стабильность в течение по меньшей мере 7 дней. Согласно некоторым вариантам реализации композиция содержит от 10 масс. % до примерно 30 масс. % или от примерно 10 масс. % до примерно 20 масс. % воды.
[0024] Согласно некоторым вариантам реализации бисфосфонат представляет собой этидроновую кислоту, золедроновую кислоту, медроновую кислоту или алендроновую кислоту.
[0025] Согласно некоторым вариантам реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3 или от примерно 1:25 до примерно 1:5. В других вариантах реализации содержание Са составляет от примерно 20 масс. % до примерно 38 масс. %, от примерно 30 масс. % до примерно 38% или от примерно 30 масс. % до примерно 36 масс. %. Указанные композиции сохраняют стабильность в твердой форме в течение по меньшей мере 1, 3 или 6 месяцев. В других вариантах реализации указанная композиция может сохранять стабильность в течение 1 года или даже 2 лет.
[0026] Любая из указанных выше композиций может иметь форму порошка.
[0027] Согласно некоторым вариантам реализации композиция содержит менее чем примерно 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция.
[0028] В изобретение также включена композиция согласно настоящему изобретению в виде суспензии, дополнительно содержащая водный носитель. Таким образом, согласно дополнительному аспекту в настоящем изобретении предложена суспензия, содержащая твердую композицию согласно настоящему изобретению. В одном из вариантов реализации суспензия содержит твердую композицию, содержащую аморфный карбонат кальция (АСС) и бисфосфонат или его фармацевтически приемлемую соль в качестве стабилизатора, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС (мольное отношение Р:Са) составляет по меньшей мере примерно 1:90, и твердая композиция содержит от примерно 5 масс. % до примерно 30 масс. % воды и сохраняет стабильность в течение по меньшей мере 7 дней.
[0029] Согласно одному из вариантов реализации в указанной суспензии АСС сохраняет стабильность по меньшей мере в течение периода времени, выбранного из 1, 2, 7, 14 дней, 1 или 3 месяцев.
[0030] Согласно одному из вариантов реализации суспензия содержит менее 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция.
[0031] Композиции или суспензии согласно настоящему изобретению не содержат органические растворители. В некоторых вариантах реализации композиции или суспензии согласно настоящему изобретению также могут содержать одну или более органических кислот.
[0032] Композиции или суспензии согласно настоящему изобретению предназначены для введения млекопитающему, например, человеку. Композиция согласно настоящему изобретению подходит для употребления с пищей, тем не менее, ее также можно вводить любым известным приемлемым биомедицинским способом введения.
[0033] Согласно описанию изобретения композиция или суспензия согласно настоящему изобретению может быть получена в виде фармацевтической, нутрицевтической или косметической композиции, в качестве пищевой добавки или продукта лечебного питания.
[0034] Согласно одному из аспектов в настоящем изобретении предложена фармацевтическая, нутрицевтическая или косметическая композиция, пищевая добавка или продукт лечебного питания, содержащие композицию или суспензию согласно настоящему изобретению.
[0035] Согласно некоторым вариантам реализации любые фармацевтические композиции или суспензии согласно настоящему изобретению подходят для применения для лечения заболевания или состояния, восприимчивого к лечению карбонатом кальция. Согласно некоторым вариантам реализации заболевание или состояние выбрано из группы, состоящей из боли, гиперпролиферативных заболеваний, поражений кожи, неврологических расстройств, иммунологических нарушений, сердечно-сосудистых заболеваний, легочных заболеваний, нарушений питания, нарушений репродуктивной системы, скелетно-мышечных нарушений, инфекционных заболеваний и заболеваний зубов.
[0036] Согласно другому аспекту в настоящем изобретении предложен способ получения композиции согласно настоящему изобретению в виде суспензии, включающий смешение водных растворов (i) источника кальция, (ii) стабилизатора и (iii) источника карбоната для осаждения стабилизированного аморфного карбоната кальция, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС составляет по меньшей мере примерно 1:28.
[0037] Согласно дополнительному аспекту в настоящем изобретении предложен способ получения композиции в виде суспензии, содержащей стабилизированный аморфный карбонат кальция (АСС), включающий стадии: а) растворения источника кальция и стабилизатора в воде для получения раствора; b) добавления водного раствора источника карбоната в раствор, полученный на стадии (а), для осаждения аморфного карбоната кальция (АСС) и получения таким образом водной суспензии АСС; и с) добавления водного раствора стабилизатора в суспензию, полученную на стадии (b), для получения суспензии стабилизированного АСС, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС составляет по меньшей мере примерно 1:90.
[0038] Способ может дополнительно включать фильтрование реакционной суспензии для получения осадка, сушку и измельчение осадка для получения порошка. В предпочтительном варианте реализации во время способа получения не добавляют органический растворитель. Способ также включает любые модификации указанного способа для получения композиции с улучшенной стабильностью.
[0039] Согласно другому аспекту в настоящем изобретении предложен способ лечения заболевания или состояния, восприимчивого к лечению карбонатом кальция, включающий введение эффективного количества композиции согласно настоящему изобретению.
[0040] Настоящее изобретение станет в более полной мере понятным и очевидным после изучения последующего подробного описания, а также прилагаемых фигур.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0041] На фиг. 1 показана типовая дифрактограмма XRD АСС, стабилизированного 10% трифосфата (композиция TP-10%, 100% АСС).
[0042] На фиг. 2 показана типовая дифрактограмма XRD АСС, стабилизированного пирофосфатом (Pyr-5%), небольшая часть которого превратилась в кристаллическую форму (94% АСС).
[0043] На фиг. 3 показана типовая дифрактограмма XRD АСС, стабилизированного гексаметафосфатом (НМР-5%, 89% АСС).
[0044] На фиг. 4 показана типовая дифрактограмма XRD АСС с PS 5% и 5% СА (100% CCC).
[0045] На фиг. 5 показана типовая термограмма ДСК АСС, стабилизированного полифосфатом: ТР-6%, показан экзотермический пик при 414°C.
[0046] На фиг. 6 показаны типовые спектры поглощения FT-IR: АСС-ТР3% (фиг. 6А); АСС-ТР4% (фиг. 6В); АСС-ТР6% (фиг. 6С); АСС-10% (фиг. 6D); АСС-НМР6% (фиг. 6Е); АСС-НМР10% (фиг. 6F); АСС-Pyr6% (фиг. 6G) и АСС-Ryr10% (фиг. 6Н).
[0047] На фиг. 7 показаны типовые спектры поглощения FT-IR ACC-PS1%-CA5%.
[0048] На фиг. 8 показана смертность мышей в период 13-27 дней после инъекции клеток 4Т1 согласно примеру 16.
[0049] На фиг. 9 показан индекс клинических признаков в период 0-27 дней после инъекции клеток 4Т1 согласно примеру 16.
[0050] На фиг. 10 показана масса тела мышей в различных группах согласно примеру 16.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0051] Согласно одному из аспектов в настоящем изобретении предложена твердая композиция, содержащая аморфный карбонат кальция (АСС) и неорганический полифосфат или его фармацевтически приемлемую соль в качестве стабилизатора, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС (мольное отношение Р:Са) составляет по меньшей мере примерно 1:90, и композиция сохраняет стабильность в течение по меньшей мере 7 дней.
[0052] Термины «аморфный карбонат кальция» и «АСС», которые используют в настоящем описании взаимозаменяемо, относятся к некристаллической форме карбоната кальция. АСС может содержать различные количества адсорбированной воды и может включать небольшие количества других элементов, которые образуют карбонатные композиции, например, карбонат натрия, карбонат калия и карбонат магния.
[0053] Термин «стабилизатор» или «стабилизирующий агент», которые используют в настоящем описании взаимозаменяемо, относятся к любому веществу, которые сохраняют карбонат кальция в аморфной форме при получении, введении в состав и/или хранении АСС. В некоторых вариантах реализации стабилизатор представляет собой неорганический полифосфат или его фармацевтически приемлемые соли. В других вариантах реализации стабилизатор представляет собой бисфосфонат или его фармацевтически приемлемые соли. В некоторых вариантах реализации композиция может содержать один или более вторичных стабилизаторов. Указанные вторичные стабилизаторы могут представлять собой известные органические соединения, применяемые в качестве стабилизаторов АСС, например, органические соединения, содержащие карбоксильные, амино-, фосфатные, фосфонатные и другие функциональные группы, которые имеют тенденцию к образованию связей, хелатов или комплексов с атомами Са, такие как лимонная кислота, лактат, фосфосерин, глюконат и т.д.
[0054] Термины «неорганический полифосфат» и «полифосфат», которые используют в настоящем описании взаимозаменяемо, относятся к неорганической линейной или циклической цепи фосфатных групп, соединенных фосфоангидридными связями.
[0055] Термины «мольное отношение и «мольное отношение Р:Са» относятся к мольному отношению атомов Р в стабилизаторе к атомам Са в АСС.Термин более чем и по меньшей мере 1:90 относится к мольному отношению Р:Са, составляющему 1 к 90 или менее, например, 1:80, 1:70, 1:60, 1:50, 1:40, 1:30, 1:20, 1:10, 1:5 и т.д., а также к любому значению в интервалах между указанными значениями.
[0056] Термин «стабильный» используют в настоящем описании для указания на то, что карбонат кальция сохраняется в аморфной форме в течение периода времени, например, по меньшей мере примерно 7 дней в твердой форме, содержащей примерно 30% или менее кристаллического карбоната кальция.
[0057] Согласно любому из приведенных выше вариантов реализации композиция сохраняет стабильность в течение по меньшей мере 7 дней. Согласно некоторым вариантам реализации композиция сохраняет стабильность в течение по меньшей мере 1 месяца. Согласно другим вариантам реализации композиция сохраняет стабильность в течение по меньшей мере 3 месяцев. Согласно дополнительному варианту реализации композиция сохраняет стабильность в течение 6 месяцев. Согласно определенным вариантам реализации композиция сохраняет стабильность в течение по меньшей мере 1 года. Согласно конкретному варианту реализации композиция сохраняет стабильность в течение по меньшей мере 2 лет.
[0058] В некоторых вариантах реализации АСС не кристаллизуется вообще. Согласно другим вариантам реализации некоторая часть АСС превращается в кристаллический карбонат кальция. В некоторых вариантах реализации не более 30% АСС превращаются в кристаллическую форму, и, таким образом, композиция содержит менее 30% кристаллического карбоната кальция (ССС) от общего количества карбоната кальция. В определенных вариантах реализации композиция содержит менее 25%, менее 20%, менее 15%, менее 10% или менее 5% ССС от общего количества карбоната кальция. Наличие АСС и ССС в твердой композиции, а также их отношение, можно измерять любым известным способом. Неограничивающим примером являются измерения путем рентгеновской дифракции (XRD), такие как определено в экспериментальной части.
[0059] Согласно некоторым вариантам реализации мольное отношение Р:Са составляет от примерно 1:90 до примерно 1:1. В одном из вариантов реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:35 до примерно 1:2. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:30 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3. В других вариантах реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:20 до примерно 1:5. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:20 до примерно 1:6. В конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:15 до примерно 1:5. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5.
[0060] Согласно некоторым вариантам реализации твердая композиция согласно настоящему изобретению содержит АСС, где содержание Са в композиции составляет от примерно 1 масс. % до примерно 39 масс. %. Термины «содержание Са» и «содержание кальция», которые используют в настоящем описании взаимозаменяемо, относятся к содержанию кальция в АСС в конечной композиции. В других вариантах реализации содержание Са составляет от примерно 5 масс. % до примерно 38 масс. %. В другом варианте реализации содержание Са составляет примерно 10 масс. %, примерно 15 масс. % или от примерно 20 масс. % до примерно 38 масс. %. В дополнительных вариантах реализации содержание Са составляет от примерно 25 масс. % до примерно 38 масс. %. В дополнительных вариантах реализации содержание Са составляет от примерно 27 масс. % до 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В конкретном варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %.
[0061] В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от примерно 20 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от примерно 1:28 до примерно 1:3, и содержание Са составляет от примерно 25 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от примерно 1:28 до примерно 1:3, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %.
[0062] Согласно любому из приведенных выше вариантов реализации твердая композиция содержит менее 30 масс. % воды. Согласно другим вариантам реализации композиция содержит менее 20 масс. % воды. Согласно другим вариантам реализации композиция содержит менее 15 масс. % воды. Согласно дополнительным вариантам реализации композиция содержит более 5% воды, но менее 30 масс. % воды. Согласно некоторым вариантам реализации композиция содержит от примерно 5 масс. % до примерно 25 масс. % воды. Согласно другому варианту реализации композиция содержит от примерно 10 масс. % до примерно 20 масс. % воды. Согласно дополнительным вариантам реализации композиция содержит от примерно 10 масс. % до примерно 25 масс. % воды.
[0063] Согласно любому из приведенных выше вариантов реализации неорганический полифосфат или его фармацевтически приемлемая соль содержит от 2 до 10 фосфатных групп, например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 фосфатных групп. Неограничивающими примерами указанных полифосфатных солей являются соли Na, K, Mg, Mn и Zn. Согласно некоторым вариантам реализации неорганический полифосфат выбран из трифосфата, пирофосфата и гексаметафосфата. Согласно другому варианту реализации стабилизатор представляет собой трифосфат или его фармацевтически приемлемые соли, такие как трифосфат натрия. Термины «трифосфат» и «триполифосфат» используют в настоящем описании взаимозаменяемо. Согласно дополнительному варианту реализации стабилизатор представляет собой гексаметафосфат или его фармацевтически приемлемые соли, такие как гексаметафосфат натрия. Согласно одному из вариантов реализации стабилизатор представляет собой пирофосфат или его фармацевтически приемлемые соли, такие как пирофосфат натрия. Согласно некоторым вариантам реализации АСС стабилизирован любой комбинацией указанных стабилизаторов.
[0064] Как продемонстрировано ниже, полифосфат в композиции сохраняет стабильность и не расщепляется, не разлагается или не разрушается при получении состава или хранении.
[0065] Как предложено в настоящем описании, композиция, содержащая неорганические полифосфаты, имеет типовые спектры FT-IR, характеризующиеся несколькими пиками поглощения. Согласно некоторым вариантам реализации композиция характеризуется спектром FT-IR, имеющим пики примерно при 865 см-1; примерно при 1400 см-1 с плечом примерно при 1470 см-1, соответствующие карбонату; и примерно при 1130 см-1, соответствующий фосфату. Термин «примерно» при использовании в настоящей заявки в отношении пиков, наблюдаемых на спектре FT-IR, обозначает ± 4 см-1 относительно указанного значения. Согласно некоторым вариантам реализации композиция характеризуется спектром FT-IR, таким как показано на фиг. 6, например, таким как показано на фиг. 6А, 6В, 6С, 6D, 6Е, 6F, 6G или 6Н.
[0066] Согласно некоторым вариантам реализации композиция содержит неорганический полифосфат, такой как определено выше в настоящем описании, который характеризуется термограммами дифференциальной сканирующей калориметрии (ДСК), содержащими экзотермический пик, связанный с кристаллизацией АСС, в диапазоне от 365°C до 550°C, где анализ ДСК проводят в неокислительных условиях со скоростью нагрева 10°C /мин. Согласно определенным вариантам реализации экзотермический пик находится в диапазоне от 365°C до 430°C.
[0067] Согласно некоторым вариантам реализации стабилизатор представляет собой неорганический полифосфат, выбранный из трифосфата, пирофосфата, гексаметафосфата и их фармацевтически приемлемых солей, и мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:35 до примерно 1:2. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:30 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. В дополнительных вариантах реализации содержание Са составляет от примерно 25 масс. % до 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В других вариантах реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от примерно 25 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от 1:28 до примерно 1:3, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %.
[0068] Согласно любому из приведенных выше вариантов реализации композиция имеет форму порошка. Согласно некоторым вариантам реализации частицы АСС в порошке имеют размер менее чем примерно 100 мкм. В некоторых вариантах реализации частицы АСС имеют размер от примерно 100 мкм до примерно 5 мкм. В других вариантах реализации размер частиц составляет от примерно 50 мкм до примерно 5 мкм или от примерно 30 до примерно 5 мкм. В одном из конкретных вариантов реализации частицы имеют размер менее 50 мкм, менее 40 мкм, менее 30 мкм, менее 20 мкм или менее 10 мкм. Согласно некоторым вариантам реализации по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% частиц АСС имеют размер менее 5 мкм.
[0069] Термин «частица» при использовании в настоящем описании относится к дискретной микрочастице или наночастице АСС, стабилизированного стабилизатором, таким как определено выше в настоящем описании, а также к их агрегатам или агломератам. Согласно некоторым вариантам реализации частицы представляют собой первичные частицы стабилизированного АСС. Исходные наночастицы имеют размер в диапазоне от 5 до 500 нм или от 10 до 300 нм или от 20 до 100 нм. Указанные наночастицы немедленно агломерируют и агрегируют с образованием значительно более крупных вторичных частиц. Указанные агрегаты и агломераты затем можно разрушать способами измельчения и растворения с образованием более мелких частиц. Согласно другим вариантам реализации частицы представляют собой агломераты или агрегаты первичных частиц, т.е. вторичные частицы.
[0070] В одном из вариантов реализации композиция имеет форму порошка, стабилизатор представляет собой неорганический полифосфат, выбранный из трифосфата, пирофосфата и гексаметафосфата, и мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:35 до примерно 1:2. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:30 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. В дополнительных вариантах реализации содержание Са составляет от примерно 25 масс. % до 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. %» до примерно 38 масс. %. В других вариантах реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от 25 масс. % до 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от 1:28 до примерно 1:3, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от 30 масс. % до 36 масс. %. Указанные композиции могут быть охарактеризованы спектром FT-IR, термограммой ДСК или одновременно и спектром FT-IR и термограммой ДСК, такими как определено выше в настоящем описании.
[0071] Согласно одному из вариантов реализации в изобретении предложена суспензия, содержащая твердую композицию согласно настоящему изобретению согласно любому из вариантов реализации, описанных в настоящей заявке.
[0072] Согласно некоторым вариантам реализации в изобретении предложена композиция в виде суспензии, содержащей композицию согласно любому из приведенных выше вариантов реализации и водный носитель. Термин «водный носитель» при использовании в настоящем описании относится к водному носителю, в котором вводят, диспергируют и/или суспендируют АСС. Неограничивающие примеры водных носителей включают воду и растворы на водной основе (например, солевой раствор).
[0073] Согласно некоторым вариантам реализации композиция в виде суспензии содержит твердую композицию, содержащую АСС и неорганический полифосфат или его фармацевтически приемлемую соль в качестве стабилизатора, где мольное отношение Р:Са составляет по меньшей мере примерно 1:90, в водном носителе. Согласно некоторым вариантам реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:35 до примерно 1:2. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:30 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. Указанные композиции могут иметь содержание Са от примерно 25 масс. % до 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В других вариантах реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от примерно 25 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от 1:28 до примерно 1:3, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. Согласно определенным вариантам реализации твердая композиция характеризуется спектром FT-IR, имеющим пики примерно при 865 см-1; примерно при 1400 см-1 с плечом примерно при 1470 см-1, соответствующие карбонату; и примерно при 1130 см-1, соответствующий фосфату. В других вариантах реализации указанные твердые композиции характеризуются термограммой ДСК, содержащей экзотермический пик, связанный с кристаллизацией АСС, в диапазоне от 365°C до 550°C, где анализ ДСК проводят в неокислительных условиях со скоростью нагрева 10°C /мин. В дополнительных вариантах реализации указанная композиция характеризуется одновременно спектром FT-IR и термограммой ДСК, такими как определено выше в настоящем описании.
[0074] Согласно некоторым вариантам реализации АСС в композиции в виде суспензии сохраняет стабильность в течение по меньшей мере 1 дня. Согласно некоторым вариантам реализации АСС в композиции в виде суспензии сохраняет стабильность в течение по меньшей мере 2 дней. Согласно дополнительному варианту реализации АСС в композиции в виде суспензии сохраняет стабильность в течение 7 дней. Согласно другому варианту реализации АСС в композиции в виде суспензии сохраняет стабильность в течение 14 дней. Согласно другим вариантам реализации АСС в композиции в виде суспензии сохраняет стабильность в течение по меньшей мере 1 месяца. Согласно дополнительным вариантам реализации АСС в композиции в виде суспензии сохраняет стабильность в течение по меньшей мере 3 месяцев. Согласно одному из вариантов реализации АСС сохраняет стабильность по меньшей мере в течение периода времени, выбранного из 1, 2, 7, 14 дней, 1 и 3 месяцев.
[0075] Как определено выше, композиция согласно настоящему изобретению, например, твердая композиция или композиция в виде суспензии, является стабильной. Согласно любому из приведенных выше вариантов реализации композиция содержит менее 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция. Согласно другим вариантам реализации композиция содержит менее 5% ССС. Согласно дополнительному варианту реализации композиция содержит менее 10% ССС. Согласно другим вариантам реализации композиция содержит менее 15% ССС. Согласно другому варианту реализации композиция содержит менее 20% ССС. В других вариантах реализации композиция содержит менее 25% или менее 30% ССС от общего количества карбоната кальция.
[0076] Согласно любому из приведенных выше вариантов реализации композиция согласно настоящему изобретению, т.е. твердая композиция или композиция в виде суспензии, не содержит органические растворители. Термин «не содержит» при использовании в настоящем описании, относится к композиции, в которой количество органического растворителя не поддается обнаружению. В предпочтительном варианте реализации в способах обработки и суспендирования в целом не применяют какие-либо органические растворители, и, следовательно, АСС не содержит какие-либо органические растворители. Описанные органические растворители представляют собой растворители, которые применяют при обработке пищевых продуктов и лекарственных средств. Указанные органические растворители являются полярными и растворимы или смешиваются с водой. В некоторых вариантах реализации указанный органический растворитель может представлять собой этанол или ацетон. Таким образом, в одном из вариантов реализации композиция согласно настоящему изобретению не содержит этанол.
[0077] Согласно любому из приведенных выше вариантов реализации композиция согласно настоящему изобретению, т.е. твердая композиция или композиция в виде суспензии, дополнительно содержит одну или более органических кислот.
[0078] Согласно некоторым вариантам реализации органическая кислота выбрана из группы, состоящей из лимонной кислоты, винной кислоты, яблочной кислоты, аскорбиновой кислоты, молочной кислоты, уксусной кислоты, щавелевой кислоты, малоновой кислоты, глютаконовой кислоты, янтарной кислоты, малеиновой кислоты, молочной кислоты и аконитовой кислоты.
[0079] Согласно любому из приведенных выше вариантов реализации композиция согласно настоящему изобретению может содержать один или более вторичных стабилизаторов. Вторичный стабилизатор может представлять собой неорганическое или органическое соединение, содержащее функциональные группы, которые могут связывать или образовывать хелаты с атомами Са. Вторичный стабилизатор в некоторых вариантах реализации может содержаться в более низком количестве по сравнению с первым стабилизатором. В некоторых вариантах реализации указанный вторичный стабилизатор, как таковой, не обеспечивает стабильность, такую как определено выше в настоящем описании. В других вариантах реализации вторичный стабилизатор идентичен первому стабилизатору. В некоторых вариантах реализации вторичный стабилизатор представляет собой органическое соединение, содержащее функциональные группы, такие как карбоксильные группы, амины, гидроксил, фосфаты или фосфонаты, которые могут образовывать прочные связи с атомами Са.
[0080] Согласно любому из приведенных выше вариантов реализации композиция предназначена для введения млекопитающему. Термин «млекопитающее» относится к человеку и млекопитающим, отличным от человека. В одном из вариантов реализации млекопитающее представляет собой человека. В другом варианте реализации млекопитающее представляет собой млекопитающее, отличное от человека, выбранное из крупного рогатого скота, свиней, овец, коз, лошадей, мулов, ослов, бизонов или верблюдов.
[0081] Согласно любому из приведенных выше вариантов реализации композиция подходит для употребления с пищей.
[0082] Согласно определенным вариантам реализации твердая композиция, содержащая АСС, стабилизированный трифосфатом, пирофосфатом или гексаметафосфатом, имеет мольное отношение Р:Са от примерно 1:28 до примерно 1:3, содержит от примерно 10 масс. % до примерно 25 масс. % воды и сохраняет стабильность в течение по меньшей мере 1 месяца. В определенном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. Согласно определенному варианту реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. В дополнительных вариантах реализации содержание Са составляет от примерно 25 масс. % до 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %). В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от 25 масс. % до 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от 30 масс. % до 36 масс. %. Согласно некоторым вариантам реализации композиция сохраняет стабильность в течение по меньшей мере 3 месяцев. Согласно другим вариантам реализации композиция сохраняет стабильность в течение 6 месяцев. Согласно дополнительному варианту реализации композиция сохраняет стабильность в течение 1 года. Согласно другому варианту реализации композиция содержит менее 20% или менее 10% кристаллического карбоната кальция от общего количества карбоната кальция. Согласно некоторым вариантам реализации композиция имеет форму порошка. Согласно некоторым вариантам реализации композиция не содержит органические растворители. Согласно некоторым вариантам реализации указанная композиция характеризуется спектром FT-IR, имеющим пики примерно при 865 см-1; примерно при 1400 см-1 с плечом примерно при 1470 см-1, соответствующие карбонату; и примерно при 1130 см-1, соответствующий фосфату. В других вариантах реализации указанная композиция характеризуется термограммой ДСК, содержащей экзотермический пик, связанный с кристаллизацией АСС, в диапазоне от 365°C до 550°C, где анализ ДСК проводят в неокислительных условиях со скоростью нагрева 10°C/мин. В дополнительных вариантах реализации указанная композиция может быть охарактеризована одновременно спектром FT-IR и термограммой ДСК, такими как определено выше в настоящем описании.
[0083] Согласно одному из вариантов реализации твердая композиция АСС, стабилизированного трифосфатом, например, трифосфатом натрия, где мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, содержит от примерно 10 масс. % до примерно 25 масс. % воды и сохраняет стабильность в течение по меньшей мере 7 дней, содержит менее 30% кристаллического карбоната кальция от общего количества карбоната кальция и не содержит органические растворители. Согласно другому варианту реализации твердая композиция, содержащая АСС, стабилизированный гексаметафосфатом, например, гексаметафосфатом натрия, где мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, содержит от примерно 10 масс. % до примерно 25 масс. % воды и сохраняет стабильность в течение по меньшей мере 1 месяца, содержит менее 30% кристаллического карбоната кальция от общего количества карбоната кальция и не содержит органические растворители. Согласно дополнительному варианту реализации твердая композиция согласно настоящему изобретению, содержащая аморфный карбонат кальция (АСС), стабилизированный пирофосфатом, например, пирофосфатом натрия, где мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, содержит от примерно 10 масс. % до примерно 25 масс. % воды и сохраняет стабильность в течение по меньшей мере 1 месяца, содержит менее 30% кристаллического карбоната кальция от общего количества карбоната кальция и не содержит органические растворители. Согласно любому из приведенных выше вариантов реализации указанные композиции имеют содержание Са от примерно 30 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. Согласно некоторым вариантам реализации композиция сохраняет стабильность в течение по меньшей мере 3 месяцев. Согласно другим вариантам реализации композиция сохраняет стабильность в течение 6 месяцев. Согласно дополнительному варианту реализации композиция сохраняет стабильность в течение 1 года. Согласно другому варианту реализации композиция содержит менее 20% или менее 10% кристаллического карбоната кальция от общего количества карбоната кальция. Согласно некоторым вариантам реализации композиция имеет форму порошка. Указанная композиция может быть охарактеризована спектром FT-IR, имеющим пики примерно при 865 см-1; примерно при 1400 см-1 с плечом примерно при 1470 см-1, соответствующие карбонату; и примерно при 1130 см-1, соответствующий фосфату. В других вариантах реализации указанные композиции могут быть охарактеризованы термограммой ДСК, содержащей экзотермический пик, связанный с кристаллизацией АСС, в диапазоне от 365°C до 550°C, где анализ ДСК проводят в неокислительных условиях со скоростью нагрева 10°C/мин. В дополнительных вариантах реализации указанная композиция может быть охарактеризована одновременно спектром FT-IR и термограммой ДСК, такими как определено выше в настоящем описании. Согласно некоторым вариантам реализации указанная композиция дополнительно содержит органическую кислоту, такую как определено выше в настоящем описании. Согласно некоторым вариантам реализации композиция характеризуется спектром FT-IR, таким как показано на фиг. 6, например, таким как показано на фиг. 6А, 6В, 6С, 6D, 6Е, 6Е, 6F, 6G или 6Н.
[0084] Согласно одному из вариантов реализации твердая композиция согласно настоящему изобретению, содержащая АСС, стабилизированный трифосфатом, например, трифосфатом натрия, где мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, содержит от примерно 10 масс. % до примерно 25 масс. % воды, имеет содержание Са от примерно 30 масс. % до примерно 38 масс. %, сохраняет стабильность в течение по меньшей мере 1 месяца, содержит менее 20% кристаллического карбоната кальция от общего количества карбоната кальция и не содержит органические растворители. Согласно другому варианту реализации твердая композиция согласно настоящему изобретению, содержащая АСС, стабилизированный гексаметафосфатом, например, гексаметафосфатом натрия, где мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, содержит от примерно 10 масс. % до примерно 25 масс. % воды, имеет содержание Са от примерно 30 масс. % до примерно 38 масс. %, сохраняет стабильность в течение по меньшей мере 1 месяца, содержит менее 20% кристаллического карбоната кальция от общего количества карбоната кальция и не содержит органические растворители. Согласно дополнительному варианту реализации твердая композиция согласно настоящему изобретению, содержащая АСС, стабилизированный пирофосфатом, например, пирофосфатом натрия, где мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, содержит от примерно 10 масс. % до примерно 25 масс. % воды, имеет содержание Са от примерно 30 масс. % до примерно 38 масс. %, сохраняет стабильность в течение по меньшей мере 1 месяца, содержит менее 20% кристаллического карбоната кальция от общего количества карбоната кальция и не содержит органические растворители. Согласно любому из приведенных выше вариантов реализации композиция имеет форму порошка. Согласно некоторым вариантам реализации композиция характеризуется спектром FT-IR, имеющим пики примерно при 865 см-1; примерно при 1400 см-1 с плечом примерно при 1470 см-1, соответствующие карбонату; и примерно при 1130 см-1, соответствующий фосфату. В других вариантах реализации указанные композиции могут быть охарактеризованы термограммой ДСК, содержащей экзотермический пик, связанные с кристаллизацией АСС, в диапазоне от 365°C до 550°C, где анализ ДСК проводят в неокислительных условиях со скоростью нагрева 10°C/мин. В дополнительных вариантах реализации указанная композиция характеризуется одновременно спектром FT-IR и термограммой ДСК, такими как определено выше в настоящем описании. Согласно некоторым вариантам реализации указанная композиция дополнительно содержит органическую кислоту, такую как определено выше в настоящем описании. В некоторых вариантах реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. Согласно некоторым вариантам реализации композиция сохраняет стабильность в течение по меньшей мере 3 месяцев. Согласно другим вариантам реализации композиция сохраняет стабильность в течение 6 месяцев. Согласно дополнительному варианту реализации композиция сохраняет стабильность 1 год. Согласно другому варианту реализации композиция содержит менее 10% кристаллического карбоната кальция от общего количества карбоната кальция. Согласно некоторым вариантам реализации композиция характеризуется спектром FT-IR, таким как показано на фиг. 6, например, таким как показано на фиг. 6А, 6В, 6С, 6D, 6Е, 6Е, 6F, 6G или 6Н.
[0085] Согласно определенным вариантам реализации композиция согласно любому из приведенных выше вариантов реализации получена в виде фармацевтической, нутрицевтической или косметической композиции, в качестве пищевой добавки или продукта лечебного питания. Согласно одному из вариантов реализации композиция получена в виде фармацевтической композиции. Согласно другому варианту реализации композиция получена в виде нутрицевтической композиции. Согласно дополнительному варианту реализации композиция получена в виде пищевой добавки. Согласно другому варианту реализации композиция получена в виде продукта лечебного питания.
[0086] Термин «фармацевтическая композиция» при использовании в настоящем описании относится к композиции, содержащей стабилизированный АСС, такой как описано в настоящей заявке, в качестве активного агента, совместно с одним или более фармацевтически приемлемыми носителями.
[0087] Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемое вспомогательное вещество» при использовании в настоящем описании относится к любым и всем растворителям, диспергирующим средам, консервантам, антиоксидантам, покрытиям, изотоническим агентам и агентам, отсрочивающим всасывание, поверхностно-активным веществам и т.д., которые являются совместимыми с введением фармацевтического средства. Применение указанных сред и агентов в отношении фармацевтически активных веществ хорошо известно в данной области техники. Композиции могут содержать другие активные соединения, обеспечивающие вспомогательные, дополнительные или улучшенные терапевтические функции.
[0088] Термины «фармацевтически приемлемый» и «фармакологически приемлемый» включают молекулярные частицы и композиции, которые не вызывают нежелательные, аллергические или другие неблагоприятные реакции при введении животному или человеку соответствующим образом.
[0089] При использовании в настоящем описании термин «нутрицевтическая композиция» относится к композиции, подходящей для применения у человека или животных, содержащей один или более натуральных продуктов, имеющих терапевтическую активность, которые обеспечивают благоприятное действие на состояние здоровья или связаны с предотвращением или ослаблением заболевания.
[0090] Термин «пищевая добавка» используют для обозначения продукта, содержащего указанную композицию и предназначенного для дополнения пищи за счет обеспечения питательных веществ, которые являются благоприятными для здоровья согласно любым приемлемым постановлениям, таким как, директивы ЕС. Например, пищевая добавка может представлять собой капсулу или таблетку для проглатывания или порошок или небольшую ампулу для смешения с пищей и обеспечения благоприятного действия на состояние здоровья.
[0091] Термин «косметическая композиция» при использовании в настоящем описании, например, относится к местным композициям для ухода за кожей человека.
[0092] При использовании в настоящем описании термин «продукт лечебного питания» относится к продукту питания, специально предназначенному для диеты для борьбы с заболеваний или нарушением у субъекта.
[0093] В одном из вариантов реализации в настоящем изобретении предложена пищевая добавка, содержащая композицию, такую как определено в любом из приведенных выше вариантов реализации. В других вариантах реализации в настоящем изобретении предложена фармацевтическая композиция, содержащая композицию, такую как определено в любом из приведенных выше вариантов реализации. В одном из вариантов реализации фармацевтическая композиция или пищевая добавка содержит твердую композицию, содержащую АСС и неорганический полифосфат или его фармацевтически приемлемые соли в качестве стабилизатора, где мольное отношение Р:Са составляет по меньшей мере примерно 1:90, и композиция сохраняет стабильность в течение по меньшей мере 7 дней. В одном из вариантов реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:35 до примерно 1:2. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:30 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. В некоторых вариантах реализации содержание Са составляет от примерно 25 масс. % до 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от примерно 25 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от 1:28 до примерно 1:3, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. Согласно некоторым вариантам реализации твердая композиция содержит менее 30 масс. % воды. Согласно другим вариантам реализации композиция содержит менее 20 масс. % воды. Согласно определенным вариантам реализации композиция содержит от 5 масс. % до примерно 30 масс. % воды. Согласно другому варианту реализации композиция содержит от 5 масс. % до примерно 25 масс. % воды. Согласно другому варианту реализации твердая композиция содержит от примерно 10 масс. % до примерно 20 масс. % воды. Согласно дополнительным вариантам реализации твердая композиция содержит от примерно 10 масс. % до примерно 20 масс. % воды. Согласно некоторым вариантам реализации неорганический полифосфат выбран из пирофосфата, трифосфата и гексаметафосфата. Согласно одному из вариантов реализации стабилизатор представляет собой пирофосфат или его фармацевтически приемлемые соли, такие как пирофосфат натрия. Согласно другому варианту реализации стабилизатор представляет собой трифосфат или его фармацевтически приемлемые соли, такие как трифосфат натрия. Согласно дополнительному варианту реализации стабилизатор представляет собой гексаметафосфат или его фармацевтически приемлемые соли, такие как гексаметафосфат натрия. Согласно определенным вариантам реализации указанная твердая композиция характеризуется спектром FT-IR, имеющим пики примерно при 865 см-1; примерно при 1400 см-1 с плечом примерно при 1470 см-1, соответствующие карбонату; и примерно при 1130 см-1, соответствующий фосфату. В других вариантах реализации указанная композиция может быть охарактеризована термограммой ДСК, содержащей экзотермический пик, соответствующий кристаллизации АСС, в диапазоне от 365°С до 550°С, где анализ ДСК проводят в неокислительных условиях со скоростью нагрева 10°С/мин. В дополнительных вариантах реализации указанная композиция может быть охарактеризована одновременно спектром FT-IR и термограммой ДСК, такими как определено выше в настоящем описании. Согласно одному из вариантов реализации композиция имеет форму порошка. Согласно другому варианту реализации твердая композиция содержит менее 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция. Согласно некоторым вариантам реализации композиция не содержит органические растворители.
[0094] Согласно некоторым другим вариантам реализации фармацевтическая или пищевая добавка содержит композицию согласно настоящему изобретению в виде суспензии, такой как определено выше в настоящем описании. По определению указанная композиция в виде суспензии содержит твердую композицию согласно настоящему изобретению.
[0095] Согласно некоторым вариантам реализации фармацевтическая композиция или пищевая добавка содержит твердую композицию, содержащую АСС, стабилизированный трифосфатом, например, трифосфатом натрия, где мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, композиция содержит от примерно 10 масс. % до примерно 25 масс. % воды и сохраняет стабильность в течение по меньшей мере 1 месяца, содержит менее 30% кристаллического карбоната кальция от общего количества карбоната кальция и не содержит органические растворители. Согласно другим вариантам реализации твердая композиция, содержащая АСС, стабилизированный гексаметафосфатом, например, гексаметафосфатом натрия, где мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, содержит от примерно 10 масс. % до примерно 25 масс. % воды, содержит менее 30% кристаллического карбоната кальция от общего количества карбоната кальция и не содержит органические растворители. В дополнительном варианте реализации твердая композиция, содержащая АСС, стабилизированный пирофосфатом, например, пирофосфатом натрия, где мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, содержит от примерно 10 масс. % до примерно 25 масс. % воды, содержит менее 30% кристаллического карбоната кальция от общего количества карбоната кальция и не содержит органические растворители. В дополнительных вариантах реализации указанная композиция имеет содержание Са от примерно 30 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. Согласно некоторым вариантам реализации указанная композиция характеризуется спектром FT-IR, имеющим пики примерно при 865 см-1; примерно при 1400 см-1 с плечом примерно при 1470 см-1, соответствующие карбонату; и примерно при 1130 см-1, соответствующий фосфату. В других вариантах реализации указанная композиция характеризуется термограммой ДСК, содержащей экзотермический пик, связанный с кристаллизацией АСС, в диапазоне от 365°С до 550°C, где анализ ДСК проводят в неокислительных условиях со скоростью нагрева 10°C/мин. В дополнительных вариантах реализации указанная композиция может быть охарактеризована одновременно спектром FT-IR и термограммой ДСК, такими как определено выше в настоящем описании.
[0096] Фармацевтическая, нутрицевтическая или косметическая композиция, пищевая добавка или продукт лечебного питания согласно любому из приведенных выше вариантов реализации можно получать в любой известной форме, подходящей для введения. Неограничивающими примерами указанных препаратов являются таблетки, формованные пастилки, пастилы, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы или сиропы или эликсиры. Фармацевтические композиции, предназначенные для перорального применения, которые можно получать согласно любому известному в данной области техники способу получения фармацевтических композиций, могут дополнительно содержать один или более агентов, выбранных из подсластителей, вкусоароматических добавок, красителей и консервантов для обеспечения фармацевтически простых и привлекательных для потребителя препаратов.
[0097] Согласно определенным вариантам реализации фармацевтическая, нутрицевтическая или косметическая композиция, пищевая добавка или продукт лечебного питания согласно любому из приведенных выше вариантов реализации включены в состав таблетки, капсулы, микроинкапсулированных пеллет, порошка, суспензии, мази и функционального продукта питания, в состав для трансбуккального введения или для введения путем ингаляции.
[0098] Согласно некоторым вариантам реализации фармацевтическая композиция согласно настоящему изобретению предназначена для применения для лечения заболевания или состояния, восприимчивого к лечению карбонатом кальция. Согласно некоторым вариантам реализации заболевание или состояние выбрано из группы, состоящей из боли, гиперпролиферативных заболеваний, поражений кожи, неврологических расстройств, иммунологических нарушений, сердечно-сосудистых заболеваний, легочных заболеваний, нарушений питания, нарушений репродуктивной системы, скелетно-мышечных нарушений, инфекционного заболевания и заболевания зубов. Согласно одному конкретному варианту реализации заболевание представляет собой раковое заболевание.
[0099] Согласно некоторым вариантам реализации в настоящем изобретении предложено применение композиции согласно любому из приведенных выше вариантов реализации для получения лекарственного средства для лечения заболевания или состояния, восприимчивого к лечению карбонатом кальция. Согласно некоторым вариантам реализации заболевание или состояние выбрано из группы, состоящей из боли, гиперпролиферативных заболеваний, поражений кожи, неврологических расстройств, иммунологических нарушений, сердечно-сосудистых заболеваний, легочных заболеваний, нарушений питания, нарушений репродуктивной системы, скелетно-мышечных нарушений, инфекционного заболевания и заболевания зубов. Согласно одному конкретному варианту реализации заболевание представляет собой раковое заболевание.
[0100] Согласно другому аспекту в настоящем изобретении предложена твердая композиция, содержащая аморфный карбонат кальция (АСС) и бисфосфонат или его фармацевтически приемлемую соль в качестве стабилизатора, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС (мольное отношение Р:Са) составляет по меньшей мере примерно 1:90, и композиция содержит от 5 масс. % до примерно 30 масс. % воды и сохраняет стабильность в течение по меньшей мере 7 дней.
[0101] Согласно некоторым вариантам реализации мольное отношение Р:Са составляет от примерно 1:90 до примерно 1:1. В одном из вариантов реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:35 до примерно 1:2. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:30 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3. В других вариантах реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:20 до примерно 1:5. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:20 до примерно 1:6. В конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:15 до примерно 1:5. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5.
[0102] В одном из вариантов реализации твердая композиция согласно настоящему изобретению содержит АСС, где содержание Са составляет от примерно 1 масс. % до примерно 39 масс. %. В других вариантах реализации содержание Са составляет от примерно 5 масс. % до примерно 38 масс. %. В другом варианте реализации содержание Са составляет примерно 10 масс. %, примерно 15 масс. % или от примерно 20 масс. % до примерно 38 масс. %. В дополнительных вариантах реализации содержание Са составляет от примерно 25 масс. % до примерно 38 масс. %. В дополнительных вариантах реализации содержание Са составляет от примерно 27 масс. % до 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В конкретном варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %.
[0103] В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от примерно 25 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от примерно 1:28 до примерно 1:3, и содержание Са составляет от примерно 27 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от примерно 1:28 до примерно 1:3, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %.
[0104] Термин «бисфосфонат» относится к соединению с двумя PO3 (фосфонатными) группами, ковалентно связанными с атомом углерода.
[0105] Согласно некоторым вариантам реализации бисфосфонат выбран из группы, состоящей из этидроновой кислоты, золедроновой кислоты, медроновой кислоты. алендроновой кислоты и их фармацевтически приемлемых солей, неограничивающими примерами бисфосфонатных солей являются соли Na, K, Mg, Mn и Zn.
[0106] Согласно некоторым вариантам реализации стабилизатор представляет собой этидроновую кислоту или ее фармацевтически приемлемые соли. Согласно другому варианту реализации стабилизатор представляет собой золедроновую кислоту или ее фармацевтически приемлемые соли. Согласно дополнительному варианту реализации стабилизатор представляет собой медроновую кислоту или ее фармацевтически приемлемые соли. Согласно определенным вариантам реализации стабилизатор представляет собой алендроновую кислоту или ее фармацевтически приемлемые соли.
[0107] Согласно любому из приведенных выше вариантов реализации композиция согласно настоящему изобретению может содержать один или более вторичных стабилизаторов, таких как определено выше в настоящем описании. Вторичный стабилизатор может представлять собой неорганическое или органическое соединение, содержащее функциональные группы, которые могут образовывать связи или хелаты с атомами Са. Вторичные стабилизатор в некоторых вариантах реализации может содержаться в более низком количестве по сравнению с первым стабилизатором. В некоторых вариантах реализации указанный вторичный стабилизатор, как таковой, не обеспечивает стабильность, такую как определено выше в настоящем описании. В других вариантах реализации вторичный стабилизатор идентичен первому стабилизатору.
[0108] В некоторых вариантах реализации вторичный стабилизатор представляет собой органическое соединение, содержащее функциональные группы, такие как карбоксильные группы, амино-, гидроксилы, фосфаты или фосфонаты, которые могут образовывать прочные связи с атомами Са.
[0109] Согласно любому из приведенных выше вариантов реализации твердая композиция содержит более 5% воды, но менее 30 масс. % воды. Согласно одному из вариантов реализации композиция содержит более 10% воды, но менее 30 масс. % воды. Согласно некоторым вариантам реализации композиция содержит от 5 масс. % до примерно 25 масс. % воды. Согласно другому варианту реализации композиция содержит от примерно 10 масс. % до примерно 20 масс. % воды. Согласно дополнительным вариантам реализации композиция содержит от примерно 10 масс. % до примерно 25 масс. % воды.
[0110] Композиция согласно настоящему изобретению сохраняет стабильность в течение продолжительного периода времени. Согласно некоторым вариантам реализации композиция сохраняет стабильность в течение по меньшей мере 1 месяца. Согласно другому варианту реализации композиция сохраняет стабильность в течение по меньшей мере 3 месяцев. Согласно дополнительному варианту реализации композиция сохраняет стабильность в течение 6 месяцев. Согласно определенному варианту реализации композиция сохраняет стабильность в течение по меньшей мере 1 года. Согласно конкретному варианту реализации композиция сохраняет стабильность в течение по меньшей мере 2 лет.
[0111] В некоторых вариантах реализации не более 30% АСС превращаются в кристаллическую форму, и, таким образом, композиция содержит менее 30% кристаллического карбоната кальция (ССС) от общего количества карбоната кальция. В определенных вариантах реализации композиция содержит менее 25%, менее 20%, менее 15%, менее 10% или менее 5% ССС от общего количества карбоната кальция.
[0112] Согласно любому из приведенных выше вариантов реализации композиция имеет форму порошка. Согласно некоторым вариантам реализации частицы АСС в порошке имеют размер менее чем примерно 100 мкм. В некоторых вариантах реализации частицы АСС имеют размер от примерно 100 мкм до примерно 5 мкм. В других вариантах реализации размер частиц составляет от примерно 50 мкм до примерно 5 мкм или от примерно 30 до примерно 5 мкм. В одном конкретном варианте реализации частицы имеют размер менее 50 мкм, менее 40 мкм, менее 30 мкм, менее 20 мкм или менее 10 мкм. Согласно некоторым вариантам реализации по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% частиц АСС имеют размер менее 5 мкм.
[0113] Согласно другому варианту реализации композиция имеет форму порошка, стабилизатор выбран из этидроновой кислоты, золедроновой кислоты, медроновой кислоты, алендроновой кислоты и их фармацевтически приемлемых солей, и мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:35 до примерно 1:2. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:30 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. В дополнительных вариантах реализации содержание Са составляет от примерно 25 масс. % до 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от 25 масс. % до 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от 1:28 до примерно 1:3, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от 30 масс. % до 36 масс. %. Согласно некоторым вариантам реализации композиция содержит более 5 масс. % или от 10 масс. % до примерно 30 масс. % воды. В определенных вариантах реализации композиция содержит менее 25%, менее 20%, менее 15%, менее 10% или менее 5% ССС от общего количества карбоната кальция.
[0114] Согласно одному из вариантов реализации в изобретении предложена суспензия, содержащая твердую композицию согласно настоящему изобретению. Согласно определенным вариантам реализации твердая композиция соответствует любому из приведенных выше вариантов реализации.
[0115] Согласно одному из вариантов реализации в изобретении предложена композиция в виде суспензии, содержащей композицию согласно любому из приведенных выше вариантов реализации и водный носитель.
[0116] Согласно некоторым вариантам реализации АСС в композиции в виде суспензии сохраняет стабильность в течение по меньшей мере 1 дня. Согласно некоторым вариантам реализации АСС в композиции в виде суспензии сохраняет стабильность в течение 2 дней. Согласно дополнительному варианту реализации АСС в композиции в виде суспензии сохраняет стабильность в течение 7 дней. Согласно другому варианту реализации АСС в композиции в виде суспензии сохраняет стабильность в течение 14 дней. Согласно другим вариантам реализации АСС в композиции в виде суспензии сохраняет стабильность в течение по меньшей мере 1 месяца. Согласно дополнительным вариантам реализации АСС в композиции в виде суспензии сохраняет стабильность в течение по меньшей мере 3 месяцев. Согласно одному из вариантов реализации АСС сохраняет стабильность по меньшей мере в течение периода времени, выбранного из 1,2, 7, 14 дней, 1 и 3 месяцев.
[0117] Как определено выше, композиция согласно настоящему изобретению является стабильной. Согласно любому из приведенных выше вариантов реализации композиция содержит менее 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция. Согласно другим вариантам реализации композиция содержит менее 5% ССС. Согласно дополнительному варианту реализации композиция содержит менее 10% ССС. Согласно другим вариантам реализации композиция содержит менее 15% ССС. Согласно другому варианту реализации композиция содержит менее 20% ССС. В других вариантах реализации композиция содержит менее 25% или менее 30% ССС от общего количества карбоната кальция.
[0118] Согласно некоторым вариантам реализации композиция не содержит органические растворители.
[0119] Согласно любому из приведенных выше вариантов реализации композиция согласно настоящему изобретению, т.е. твердая композиция или композиция в виде суспензии, дополнительно содержит одну или более органических кислот, таких как определено выше в настоящем описании.
[0120] Согласно любому из приведенных выше вариантов реализации композиция согласно настоящему изобретению, например, суспензия, может содержать вторичный стабилизатор, такой как определено выше в настоящем описании.
[0121] Согласно любому из приведенных выше вариантов реализации композиция подходит для употребления с пищей.
[0122] Согласно определенным вариантам реализации композиция согласно любому из приведенных выше вариантов реализации получена в виде фармацевтической, нутрицевтической или косметической композиции, пищевой добавки или продукта медицинского питания. Согласно одному из вариантов реализации композиция получена в виде фармацевтической композиции.
[0123] В одном из вариантов реализации в настоящем изобретении предложена пищевая добавка, содержащая композицию, такую как определено в любом из приведенных выше вариантов реализации. В другом варианте реализации в настоящем изобретении предложена фармацевтическая композиция, содержащая композицию, такую как определено в любом из приведенных выше вариантов реализации. В одном из вариантов реализации композиция представляет собой твердую композицию, содержащую АСС и бисфосфонат, такой как этидроновая кислота, золедроновая кислота, медроновая кислота, алендроновая кислота и их фармацевтически приемлемые соли, в качестве стабилизатора, где мольное отношение Р:Са составляет по меньшей мере примерно 1:90, и композиция содержит от 5 масс. % до примерно 30 масс. % воды и сохраняет стабильность в течение по меньшей мере 7 дней. В одном из вариантов реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:35 до примерно 1:2. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:30 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. В некоторых вариантах реализации содержание Са составляет от примерно 25 масс. % до примерно 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от примерно 25 масс. % до примерно 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от примерно 1:28 до примерно 1:3, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от примерно 1:25 до примерно 1:5, и содержание Са составляет от 30 масс. % до 36 масс. %. Согласно некоторым вариантам реализации твердая композиция содержит от 5 масс. % до примерно 25 масс. % воды. Согласно другому варианту реализации твердая композиция содержит от примерно 10 масс. % до примерно 20 масс. % воды. Согласно дополнительным вариантам реализации твердая композиция содержит от примерно 10 масс. % до примерно 20 масс. % воды. Согласно любому из приведенных выше вариантов реализации твердая композиция содержит менее 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция. Согласно некоторым вариантам реализации композиция не содержит органические растворители. Согласно другому варианту реализации композиция дополнительно содержит органическую кислоту.
[0124] Согласно некоторым другим вариантам реализации фармацевтическая или пищевая добавка содержит композицию согласно настоящему изобретению в виде суспензии, такой как определено выше в настоящем описании. По определению указанная композиция в виде суспензии содержит твердую композицию согласно настоящему изобретению.
[0125] Согласно определенным вариантам реализации фармацевтическая, нутрицевтическая или косметическая композиция, пищевая добавка или продукт лечебного питания согласно любому из приведенных выше вариантов реализации включены в состав таблетки, капсулы, микроинкапсулированных пеллеты, порошка, суспензии, мази и функционального продукта питания, в состав для трансбуккального введения или для введения путем ингаляции.
[0126] Согласно некоторым вариантам реализации фармацевтическая композиция согласно настоящему изобретению предназначена для применения для лечения заболевания или состояния, восприимчивого к лечению карбонатом кальция. Согласно некоторым вариантам реализации заболевание или состояние выбрано из группы, состоящей из боли, гиперпролиферативных заболеваний, поражений кожи, неврологических расстройств, иммунологических нарушений, сердечно-сосудистых заболеваний, легочных заболеваний, нарушений питания, нарушений репродуктивной системы, скелетно-мышечных нарушений, инфекционного заболевания и заболевания зубов. Согласно одному конкретному варианту реализации заболевание представляет собой раковое заболевание.
[0127] Согласно определенным аспектам в настоящем изобретении предложена твердая композиция, содержащая аморфный карбонат кальция (АСС), стабилизированный стабилизатором, выбранным из группы, состоящей из неорганического полифосфата, бисфосфоната и их фармацевтически приемлемых солей, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС (мольное отношение Р:Са) составляет по меньшей мере примерно 1:90, и композиция сохраняет стабильность в течение по меньшей мере 7 дней.
[0128] Согласно другому аспекту в настоящем изобретении предложен способ получения композиции в виде суспензии, содержащей стабилизированный аморфный карбонат кальция (АСС) и неорганический полифосфат, бисфосфонат или их фармацевтически приемлемые соли в качестве стабилизатора, включающий смешение водных растворов: (i) источника кальция, (ii) стабилизатора и (iii) источника карбоната, для осаждения стабилизированного аморфного карбоната кальция, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС составляет по меньшей мере примерно 1:28.
[0129] Согласно дополнительному аспекту в настоящем изобретении предложен способ получения композиции в виде суспензии, содержащей стабилизированный аморфный карбонат кальция (АСС), включающий стадии:
a) растворения источника кальция и стабилизатора в воде для получения раствора;
b) добавления водного раствора источника карбоната в раствор, полученный на стадии (а), для осаждения аморфного карбоната кальция (АСС) и получения таким образом водной суспензии АСС; и
c) добавления водного раствора стабилизатора в суспензию, полученную на стадии (b), для получения суспензии стабилизированного АСС, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС составляет по меньшей мере примерно 1:90.
[0130] Термин «водный раствор» при использовании в настоящем описании относится к любому раствору на водной основе, который может растворять все отмеченные выше источники или их часть при температуре окружающей среды.
[0131] Согласно некоторым вариантам реализации стабилизатор такой, как определено выше в настоящем описании. Согласно некоторым вариантам реализации стабилизатор представляет собой неорганический полифосфат или его фармацевтически приемлемые соли, такой как определено выше в настоящем описании. Согласно другим вариантам реализации стабилизатор представляет собой бисфосфонат, такой как определено выше в настоящем описании.
[0132] Согласно определенному аспекту способ получения композиции согласно настоящему изобретению включает стадии:
a) растворения источника кальция и неорганического полифосфата в воде для получения раствора;
b) добавления водного раствора источника карбоната в раствор, полученный на стадии (а), для осаждения аморфного карбоната кальция (АСС) и получения таким образом водной суспензии АСС; и
c) добавления водного раствора неорганического полифосфата в суспензию, полученную на стадии (b), для получения суспензии стабилизированного АСС,
где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС составляет по меньшей мере примерно 1:90.
[0133] Согласно некоторым вариантам реализации способ включает добавление одного стабилизатора во время осаждения АСС и добавление второго стабилизатора после осаждения АСС. Стабилизаторы, применяемые на первой и второй стадии, могут представлять собой одинаковые или различные стабилизаторы согласно настоящему изобретению.
[0134] Согласно некоторым вариантам реализации неорганический фосфат является таким, как определено выше. В одном конкретном варианте реализации полифосфат содержит от 2 до 10 фосфатных групп. Согласно другим вариантам реализации неорганический полифосфат выбран из группы, состоящей из пирофосфата, трифосфата, гексаметафосфата и их фармацевтически приемлемых солей.
[0135] Согласно некоторым вариантам реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1 или от примерно 1:25 до примерно 1:5. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:35 до примерно 1:2. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:30 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:28 до примерно 1:3. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:4. В дополнительном варианте реализации мольное отношение Р:Са составляет от примерно 1:20 до примерно 1:5. В другом варианте реализации мольное отношение Р:Са составляет от примерно 1:20 до примерно 1:6. В конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:15 до примерно 1:5. В другом конкретном варианте реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5.
[0136] В определенных вариантах реализации содержание Са составляет от примерно 25 масс. % до 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации содержание Са составляет от примерно 30 масс. % до примерно 36 масс. %.
[0137] В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:40 до примерно 1:1, и содержание Са составляет от 25 масс. % до 38 масс. %. В некоторых вариантах реализации мольное отношение составляет от 1:28 до примерно 1:3, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В другом варианте реализации мольное отношение составляет от 1:25 до примерно 1:5, и содержание Са составляет от 30 масс. % до 36 масс. %.
[0138] Согласно любому из приведенных выше вариантов реализации источник кальция представляет собой любую водорастворимую соль кальция, и источник карбоната представляет собой любую водорастворимую соль карбоната. В одном из вариантов реализации источник кальция представляет собой хлорид кальция. Согласно другому варианту реализации источник карбоната представляет собой карбонат натрия.
[0139] Согласно некоторым вариантам реализации способ включает фильтрование реакционной суспензии для получения влажного порошкового продукта («осадка»). Фильтрование можно проводить любым способом, известным в данной области техники, таким как фильтрование через воронку Бюхнера, воронку с нутч-фильтром.
[0140] Согласно некоторым вариантам реализации способ дополнительно включает промывку осадка водным раствором. В одном конкретном варианте реализации водный раствор представляет собой чистую воду. В частности промывка необходима для удаления побочных продуктов и избытка солей, таких как хлорид натрия, или любых избытков источников реагентов, описанных выше.
[0141] Согласно некоторым вариантам реализации способ включает сушку осадка. Сушку можно проводить любым способом, известным в данной области техники. Неограничивающими примерами сушки являются сушка в печи, вакуумной печи, печи с ленточным конвейером, сушку распылением, лиофилизацию или сушку в микроволновой печи. Порошок также можно сушить в активном токе сухого воздуха или путем размещения порошка в помещении с хорошей циркуляцией воздуха.
[0142] Согласно некоторым вариантам реализации способ включает дополнительное превращения осадка в небольшие частицы. В одном из вариантов реализации способ включает измельчение осадка для получения порошка. В других вариантах реализации разрушение включает измельчение, гранулирование и другие широко применяемые способы..
[0143] Согласно некоторым вариантам реализации способ включает измельчение осадка до порошка,, где размер частиц порошка составляет от примерно 300 мкм до примерно 5 мкм. В одном конкретном варианте реализации частицы имеют размер менее 50 мкм, менее 40 мкм, менее 30 мкм, менее 20 мкм или менее 10 мкм. Согласно некоторым вариантам реализации по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% частиц АСС имеют размер менее 5 мкм.
[0144] Твердая композиция, полученная способом согласно любому из приведенных выше вариантов реализации, сохраняет стабильность, такую как определено выше в настоящем описании. Согласно некоторым вариантам реализации твердая композиция сохраняет стабильность в течение по меньшей мере 7 дней. Согласно другому варианту реализации композиция сохраняет стабильность в течение по меньшей мере 1 месяца. Согласно другим вариантам реализации композиция сохраняет стабильность в течение по меньшей мере 3 месяцев.. Согласно дополнительному варианту реализации композиция сохраняет стабильность в течение 6 месяцев. Согласно определенному варианту реализации композиция сохраняет стабильность в течение по меньшей мере 1 года. Согласно конкретному варианту реализации композиция сохраняет стабильность в течение по меньшей мере 2 лет.
[0145] Согласно некоторым вариантам реализации стабилизатор представляет собой бисфосфонат или его фармацевтически приемлемую соль, и твердая композиция содержит от 5 масс. % до примерно 30 масс. % воды.
[0146] Согласно некоторым вариантам реализации способ включает дополнительное суспендирование твердой композиции согласно настоящему изобретению в водном носителе.
[0147] Согласно любому из приведенных выше вариантов реализации в способе получения не добавляют органический растворитель. Таким образом, полученная композиция не содержит какие-либо следы органических растворителей. Таким образом, предложенный способ получения является значительно более экологически безвредным и безопасным по сравнению со способами, известными в данной области техники, в которых применяют этанол или другие органические жидкости в качестве растворителя или сорастворителя.
[0148] Согласно одному из вариантов реализации способ получения композиции согласно настоящему изобретению включает стадии:
a) растворения источника кальция и неорганического полифосфата в воде;
b) добавления водного раствора источника карбоната в раствор, полученный на стадии (а), для осаждения аморфного карбоната кальция;
c) добавления водного раствора неорганического полифосфата в суспензию, полученную на стадии (b), для получения стабилизированного АСС;
d) фильтрования реакционной суспензии для получения осадка;
e) промывки осадка водой;
f) сушки осадка; и
g) измельчения осадка до порошка,
где во время получения не добавляют органический растворитель, неорганический полифосфат представляет собой трифосфат, гексаметафосфат или пирофосфат, мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5. Согласно некоторым вариантам реализации содержание Са составляет от примерно 25% до примерно 38 масс. %. В других вариантах реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В дополнительных вариантах реализации содержание Са составляет от по меньшей мере примерно 30 масс. % до примерно 36 масс. %. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. Согласно некоторым вариантам реализации по меньшей мере 90% частиц АСС имеют размер менее 5 мкм.
[0149] Согласно некоторым вариантам реализации способ включает добавление одного или более вторичных стабилизаторов. Указанные вторичные стабилизаторы могут представлять собой известные органические соединения, применяемые в качестве стабилизаторов АСС, например, органические соединения, содержащие карбоксильные, амино-, фосфатные, фосфонатные и другие функциональные группы, которые имеют тенденцию к образованию связей, хелатов или комплексов с атомами Са, такие как лимонная кислота, лактат, фосфосерин, глюконат.
[0150] Согласно другому варианту реализации способ получения композиции согласно настоящему изобретению включает стадии:
a) растворения источника кальция и бисфосфоната в воде;
b) добавления водного раствора источника карбоната в раствор, полученный на стадии (а), для осаждения аморфного карбоната кальция;
c) добавления водного раствора бисфосфоната в суспензию, полученную на стадии (b), для получения стабилизированного АСС;
d) фильтрования реакционной суспензии для получения осадка;
e) промывки осадка водой;
f) сушки осадка; и
g) измельчения осадка до порошка,
где во время получения не добавляют органический растворитель, мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, и композиция содержит от 5 масс. % до примерно 30 масс. % воды. Согласно некоторым вариантам реализации содержание Са составляет от примерно 25% до примерно 38 масс. %. В других вариантах реализации содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. В дополнительных вариантах реализации содержание Са составляет от по меньшей мере примерно 30 масс. % до примерно 36 масс. %. В определенных вариантах реализации мольное отношение Р:Са составляет от примерно 1:25 до примерно 1:5, и содержание Са составляет от примерно 30 масс. % до примерно 38 масс. %. Согласно некоторым вариантам реализации по меньшей мере 90% частиц АСС имеют размер менее 5 мкм. Согласно другому варианту реализации композиция содержит от 10 масс. % до примерно 30 масс. % или от примерно 10 масс. % до примерно 20 масс. % воды.
[0151] Согласно некоторым вариантам реализации способ включает добавление одного или более вторичных стабилизаторов. Указанные вторичные стабилизаторы могут представлять собой известные органические соединения, применяемые в качестве стабилизаторов АСС, например, органические соединения, содержащие карбоксильные, амино-, фосфатные, фосфонатные и другие функциональные группы, которые имеют тенденцию к образованию связей, хелатов или комплексов с атомами Са, такие как лимонная кислота, лактат, фосфосерин, глюконат.
[0152] Согласно другому аспекту в настоящем изобретении предложен способ лечения заболевания или состояния, восприимчивого к лечению карбонатом кальция, включающий введение эффективного количества композиции согласно настоящему изобретению.
[0153] Согласно некоторым вариантам реализации композиция представляет собой твердую композицию, такую как определено выше в настоящем описании.
[0154] Согласно одному из вариантов реализации способ включает введение твердой композиции, содержащей аморфный карбонат кальция (АСС) и неорганический полифосфат или его фармацевтически приемлемую соль в качестве стабилизатора, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС (мольное отношение Р:Са) составляет по меньшей мере примерно 1:90, и композиция сохраняет стабильность в течение по меньшей мере 7 дней.
[0155] Согласно другому варианту реализации способ включает введение твердой композиции, содержащей аморфный карбонат кальция (АСС), стабилизированный стабилизатором, выбранным из группы, состоящей из неорганического полифосфата, бисфосфоната и их фармацевтически приемлемых солей, где мольное отношение атомов Р в стабилизаторе к атомам Са в АСС (мольное отношение Р:Са) составляет по меньшей мере примерно 1:90, и композиция содержит от 5 масс. % до примерно 30 масс. % воды и сохраняет стабильность в течение по меньшей мере 7 дней.
[0156] Согласно некоторым вариантам реализации в настоящем изобретении предложено применение композиции согласно любому из приведенных выше вариантов реализации для получения лекарственного средства для лечения заболевания или состояния, восприимчивого к лечению карбонатом кальция. Согласно некоторым вариантам реализации заболевание или состояние выбрано из группы, состоящей из боли, гиперпролиферативных заболеваний, поражений кожи, неврологических расстройств, иммунологических нарушений, сердечно-сосудистых заболеваний, легочных заболеваний, нарушений питания, нарушений репродуктивной системы, скелетно-мышечных нарушений, инфекционного заболевания и заболевания зубов. Согласно одному конкретному варианту реализации заболевание представляет собой раковое заболевание.
[0157] Термин «лечение» состояния или пациента при использовании в настоящем описании относится к принятию мер для обеспечения благоприятных или желательных результатов, включая клинические результаты. Благоприятные или желательные клинические результаты включают, но не ограничиваются ими, облегчение или ослабление одного или более симптомов, связанных с заболеванием.
[0158] Термин «эффективное количество» при использовании в настоящем описании относится к количеству композиций, содержащих стабилизированный АСС, которое является достаточным для лечения заболевания или состояния.
[0159] Термин «восприимчивый» при использовании в настоящем описании относится к любому заболеванию или состоянию, при котором присутствует ответ на введение карбоната кальция и которое может быть излечено карбонатом кальция.
[0160] «Введение» или «способ введения» вещества, соединения или агента субъекту можно проводить с использованием одного из различных способов, известных специалистам в данной области техники. Например, соединение или агент можно вводить энтерально или парентерально. «Энтерально» относится к введению в желудочно-кишечный тракт, включая прием внутрь, подъязычное или ректальное введение. Парентеральное введение включает внутривенное, внутрикожное, внутримышечное, интраперитонеальное, подкожное, глазное, подъязычное, интраназальное введение, введение путем ингаляции, интраспинальное, внутримозговое и чрескожное введение (за счет всасывания, например, через капилляры в коже). Соединение или агент также можно соответствующим образом вводить с использованием многократно используемых или биоразлагаемых полимерных устройств или других устройств, например, пластырей и помп, или составов, обеспечивающих продолжительное, замедленное или контролируемое высвобождение соединения или агента. Введение также можно проводить, например, один раз, несколько раз и/или в течение одного или более продолжительных периодов времени. Согласно некоторым аспектам введение включает непосредственное введение, включая самостоятельное введение, и непрямое введение, включая назначение лекарственного средства или продукта лечебного питания. Например, при использовании в настоящем описании лечащий врач, который проводит инструктаж пациента по самостоятельному введению лекарственного средства или продукта лечебного питания или по приему лекарственного средства или продукта лечебного питания, который вводит другой человек, и/или который назначает пациенту лекарственное средство или продукт лечебного питания, вводит лекарственное средство или продукт лечебного питания пациенту.
[0161] Согласно некоторым вариантам реализации заболевание или состояние выбрано из группы, состоящей из боли, гиперпролиферативных заболеваний, поражений кожи, неврологических расстройств, иммунологических нарушений, сердечно-сосудистых заболеваний, легочных заболеваний, нарушений питания, нарушений репродуктивной системы, скелетно-мышечных нарушений, инфекционного заболевания и заболевания зубов. Согласно одному конкретному варианту реализации заболевание представляет собой раковое заболевание.
[0162] При использовании в настоящем описании термин «примерно», если он относится к измеряемой величине, такой как количество, продолжительность во времени и т.д., исключая пики на спектрах FT-IR, для которых термин «примерно» определен конкретно, включают погрешности +/-10% или +/-5%, +/-1% или даже +/-0,1% от указанного значения.
[0163] Настоящее изобретение в целом было описано выше и станет более понятным после изучения последующих примеров, которые приведены для иллюстрации и не ограничивают настоящее изобретение.
ПРИМЕРЫ
Материалы и способы
[0164] В экспериментах использовали следующие материалы: хлорид кальция (78%); карбонат натрия; лимонную кислоту; фосфосерин (PS); трифосфат натрия (90%); гексаметафосфат (НМР) натрия (90%); этанол (95%); пирофосфат (Pyr) натрия (90%); одноосновный фосфат натрия (безводный), этидроновую кислоту (ЕТ) (60% водный раствор); золедроновую кислоту (ZA): медроновую кислоту (МА) и хлороводородную кислоту.
Определение концентрации стабилизатора
[0165] Концентрацию стабилизатора во всех примерах, приведенных ниже, определяли следующим образом:
[0166] % стабилизатора = (количество добавляемого изначально стабилизатора (в г)/количество добавляемого изначально CaCl2 (в г)) × 100
[0167] Взаимосвязь между различными концентрациями стабилизаторов и мольным отношением Р:Са приведена в таблице 4.
Оценка стабильности
[0168] Стабильность АСС в суспензии или в виде порошка исследовали путем отбора проб с различными интервалами и оценки количества кристаллического карбоната кальция, выраженного в процентах от начального количества. Количество кристаллической фазы карбоната кальция в образце оценивали способом рентгеновской дифракции (XRD).
[0169] Сбор данных XRD - экспериментальная часть
[0170] Данные рентгеновской дифракции собирали на порошковом дифрактометре Panalytical (Philips 1050/70 или Empyrean), оборудованном графитовым монохроматором отраженного луча, обеспечивающим облучение Си-Kα, и эксплуатируемом при V=40 кВ, I=30 мА. Сканирование проводили в диапазоне 15-50° или 24-36° 2θ с шагом ~ 0,03°. Указанный интервал содержит основные пики кальцита (отражение (104) при 29,3°±0,2° 2-тета) и ватерита (отражения (100), (101) и (102) при 24,8°, 27,0° и 32,7°±0,2° 2-тета, соответственно).
[0171] Данные рентгеновской дифракции собирали на порошковом дифрактометре Rigaku (MiniFlex 600 Benchtop), оборудованном графитовым монохроматором отраженного луча, обеспечивающем облучение Cu-Kα, и эксплуатируемом при V=40 кВ, I=15 мА. Сканирование проводили в диапазоне 26-34° 2θ с шагом ~ 0,02°. Указанный интервал содержит основные пики кальцита (отражение (104) при 29,3°±0,2° 2-тета) и ватерита (отражения (101) и (102) при 24,8°, 27,0° и 32,7°±0,2° 2-тета, соответственно).
[0172] Проводили сравнение образцов с калибровочным графиком, построенным с использованием стандартных образцов, содержащих известные количества и отношения аморфного и кристаллического (такого как кальцит или ватерит) карбоната кальция.
Пример 1. Стабильность порошковых композиций АСС, стабилизированного полифосфатами или одноосновным фосфатом
[0173] Получали порошковые композиции АСС, стабилизированного различными стабилизаторами (трифосфатом (TP), гексаметафосфатом (НМР), пирофосфатом (Pyr), одноосновным фосфатом (РМ) или лимонной кислотой (СА)). В типовом способе смешивали растворы кальция (300 мл воды, 24 г хлорида кальция и стабилизатор) и раствор карбоната (200 мл воды и 17,3 г карбоната натрия) для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора (100 мл воды и стабилизатор; содержание стабилизаторов в растворах кальция и стабилизатора приведено в таблице 1; взаимосвязь между различными концентрациями стабилизаторов и мольным отношением Р:Са приведена в таблице 4) для получения суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок водой. Получали порошок путем сушки осадка. Стабильность АСС в порошке исследовали путем XRD согласно описанию раздела материалов и способов; результаты приведены в таблицах 2 и 3. Типовые спектры XRD приведены на фиг. 1-3.
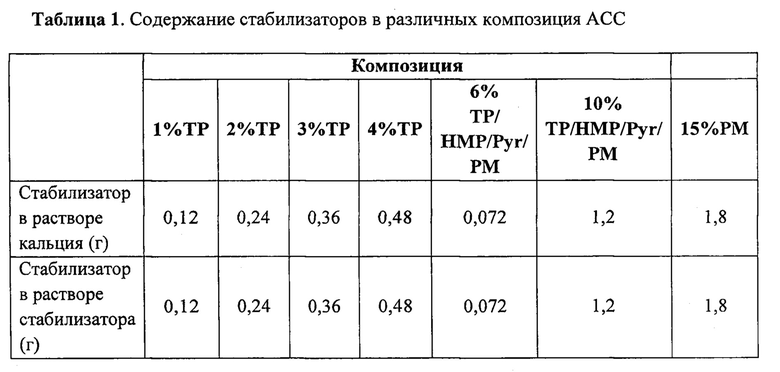
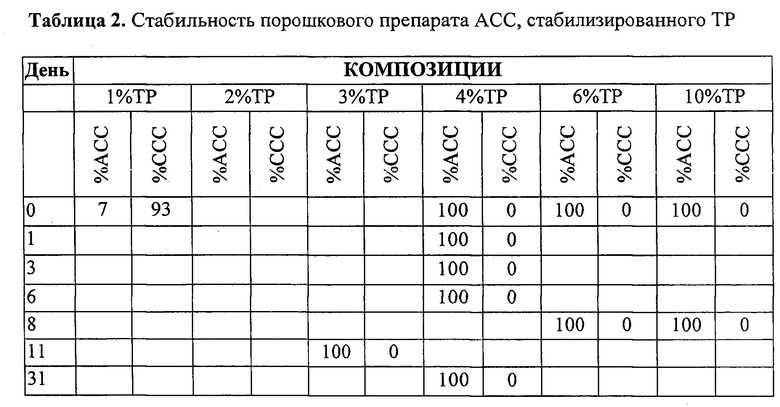

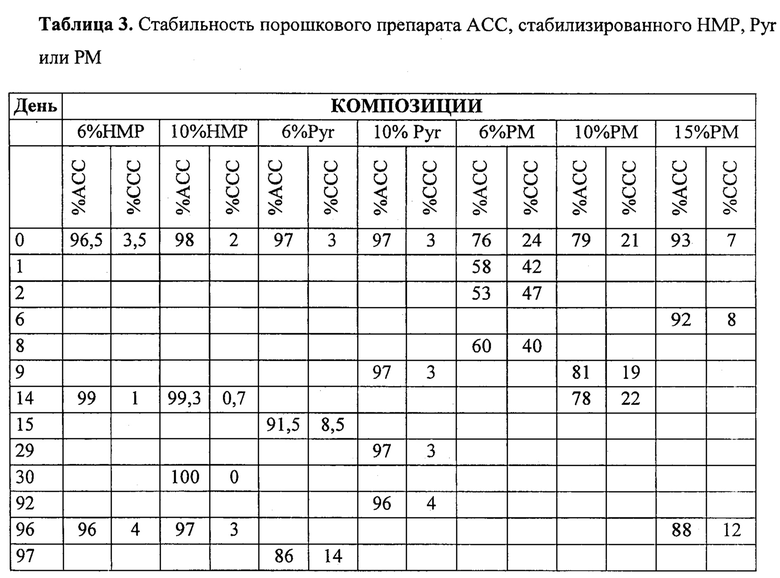
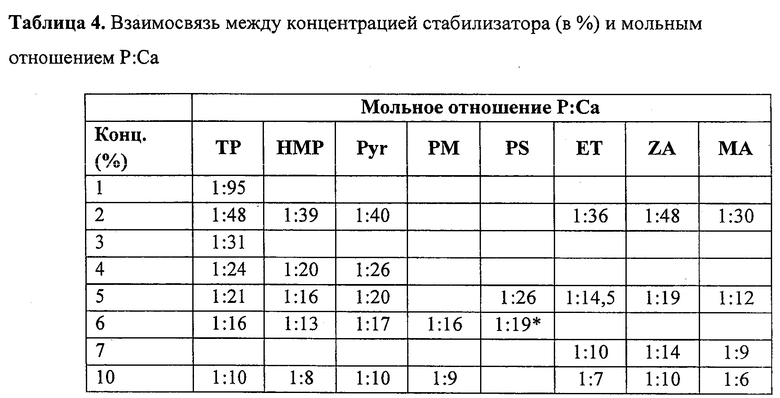

Пример 2. Стабильность АСС, стабилизированного полифосфатами или фосфосерином, в суспензии
[0174] Получали несколько суспензий АСС, стабилизированного различными стабилизаторами. В типовом способе смешивали растворы кальция (1 л воды, 21,6 г хлорида кальция и стабилизатор (TP, НМР, Pyr или PS) и раствор карбоната (800 мл воды и 15,6 г карбоната натрия) для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора (200 мл воды и стабилизатор; содержание стабилизаторов в растворах кальция и стабилизатора приведено в таблице 4) для получения суспензии стабилизированного АСС. Результаты исследования стабильности приведены в таблице 5.
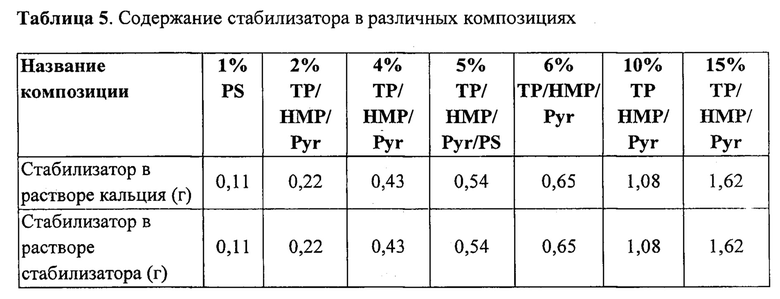
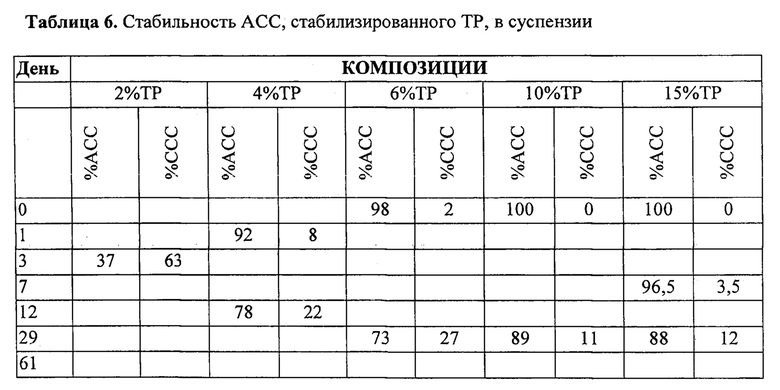

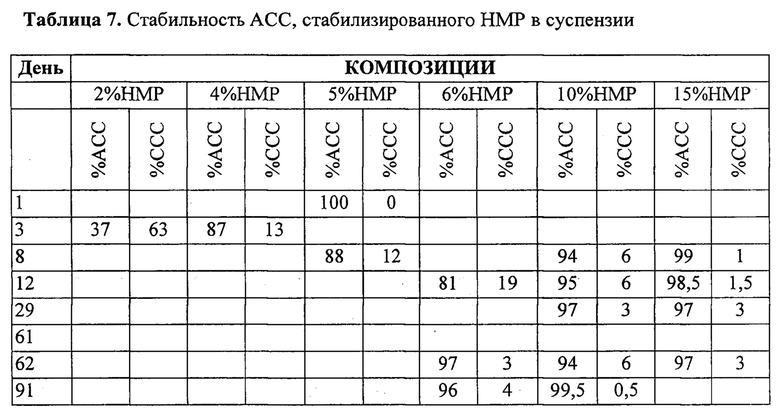
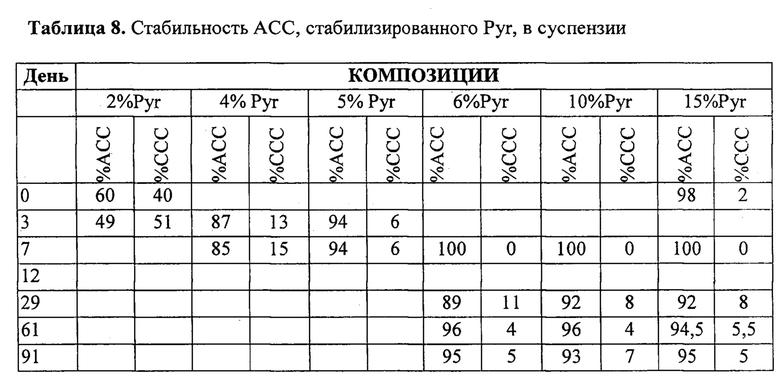
[0175] Было показано, что фосфосерин в концентрации 1% или 5% не стабилизировал АСС в суспензии; карбонат кальция полностью превращался в кристаллическую форму уже через 4 часа (данные композиции PS-5% см., например, фиг. 4).
Пример 3. Стабильность суспендированного повторно АСС, стабилизированного этидроновой кислотой
[0176] Получали несколько суспензий АСС, стабилизированного этидроновой кислотой. В типовом способе смешивали растворы кальция (600 мл воды, 12 г хлорида кальция и этидроновую кислоту (60% водный раствор)) и раствор карбоната (100 мл воды и 8,65 г карбоната натрия) для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора (300 мл воды и этидроновую кислоту; содержание этидроновой кислоты в растворах кальция и стабилизатора приведено в таблице 9) для получения суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок водой. Получали суспензию путем диспергирования осадка в 1100 мл воды. Исследовали стабильность АСС в суспензии, результаты приведены в таблице 10.
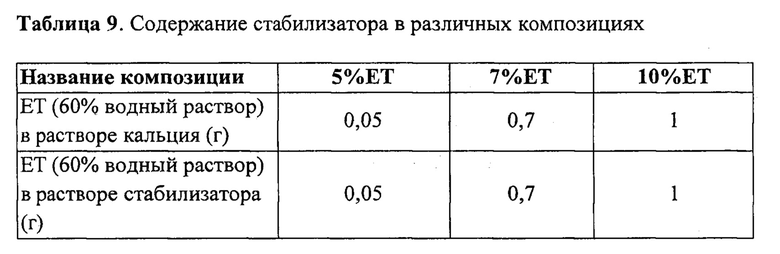
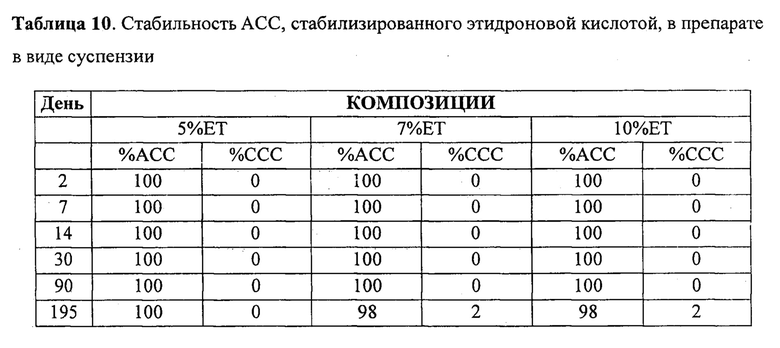
Пример 4. Стабильность повторно суспендированного АСС, стабилизированного комбинацией лимонной кислоты с НМР, TP или PS
[0177] Две порошковые композиции (называемые 6%НМР-1%СА и 10%НМР-1%СА) АСС, стабилизированного лимонной кислотой и НМР, получали следующим образом: смешивали растворы кальция (100 мл воды, 11,76 г хлорида кальция, 0,12 г лимонной кислоты и 0,35 г или 0,59 г НМР) и раствор карбоната (100 мл воды и 8,48 г карбоната натрия) для осаждения АСС. В суспензии АСС добавляли раствор стабилизатора (20 мл воды и 0,35 г или 0,59 г НМР) для получения суспензии стабилизированного АСС (суспензии 6%НМР-1%СА и 10%НМР-1%СА содержали 0,7 и 1,18 г НМР, соответственно). Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок водой.
[0178] Две порошковые композиции (называемые 6,8%PS-6%CA-Et-OH и 5%PS-6%CA-Et-ОН) АСС, стабилизированного лимонной кислотой и фосфосерином, получали следующим образом: смешивали растворы кальция (100 мл воды, 11,76 г хлорида кальция, 0,12 г лимонной кислоты и 0,8 г или 0,59 г фосфосерина (для композиции 6,8%PS-6%CA и 6%PS-6%СА, соответственно)) и раствор карбоната (100 мл воды и 8,48 г карбоната натрия) для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора (20 мл воды и 0,59 г лимонной кислоты) и 50 мл этанола для получения суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок этанолом.
[0179] Полученный порошок диспергировали в 1100 мл воды для получения суспензии и исследовали стабильность АСС согласно описанию в разделе материалов и способов. Результаты приведены в таблице 11.
[0180] Порошковые композиции (10%ТР-1%СА) АСС, стабилизированного лимонной кислотой и фосфосерином, получали следующим образом: смешивали растворы кальция (300 мл воды, 24 г хлорида кальция, 0,24 г лимонной кислоты и 1,2 г трифосфата) и раствор карбоната (200 мл воды и 17,3 г карбоната натрия) для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора (100 мл воды и 1,2 г трифосфата) для получения суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок водой. Полученный порошок диспергировали в 792 мл воды для получения суспензии и исследовали стабильность АСС согласно описанию в разделе материалов и способов. Результаты приведены в таблице 11.
[0181] Порошковые композиции (5%PS-5%CA-Et-OH) АСС, стабилизированного лимонной кислотой и фосфосерином, получали следующим образом: смешивали растворы кальция (100 мл воды, 11,76 г хлорида кальция, 0,12 г лимонной кислоты и 0,6 г фосфосерина) и раствор карбоната (100 мл воды и 8,48 г карбоната натрия) для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора (20 мл воды и 0,48 г лимонной кислоты) и 50 мл этанола для получения суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок этанолом. Получали порошок путем сушки осадка. 8 г порошка АСС повторно суспендировали в 792 г воды. Результаты приведены в таблице 11.
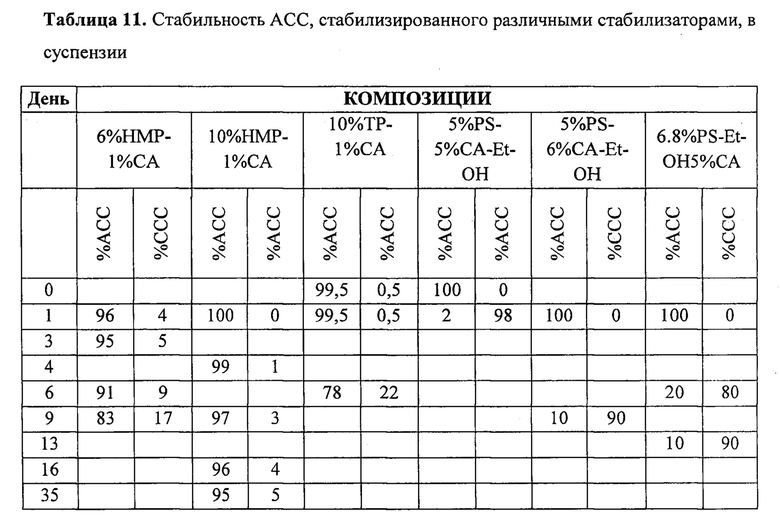
Пример 5. Стабильность суспендированного повторно АСС, стабилизированного НМР, в присутствии хлороводородной кислоты
[0182] Четыре порошковые композиции АСС, стабилизированного НМР, получали следующим образом: смешивали растворы кальция (100 мл воды, 12 г хлорида кальция, 1 г хлороводородной кислоты, 8%, и НМР) и раствор карбоната (100 мл воды и 8,65 г карбоната натрия) для осаждения АСС. В суспензии АСС добавляли раствор стабилизатора (50 мл воды и НМР; содержание НМР в растворах кальция и стабилизатора приведено в таблице 12) для получения суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок водой. Полученный порошок диспергировали в 1100 мл воды для получения суспензии. Исследовали стабильность АСС в суспензии согласно приведенному выше описанию, результаты приведены в таблице 13.
Таблица 12. Количество НМР (в граммах) в различных порошковых композициях 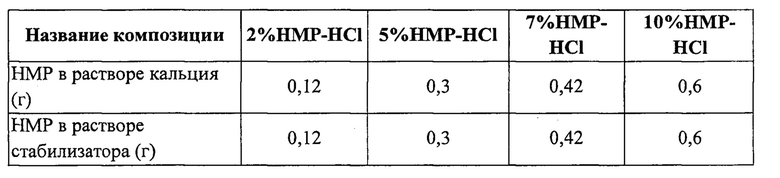
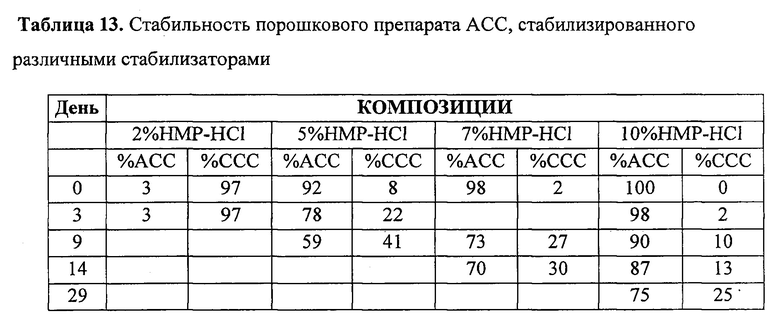
Пример 6. Влияние различных полифосфатов на стабильность суспендированного повторно АСС
[0183] Три порошковые композиции (называемые 10%НМР, 10%Pyr и 10%ТР) АСС получали следующим образом: смешивали растворы кальция (100 мл воды, 12 г хлорида кальция и 0,6 г НМР, PyroP или TP) и раствор карбоната (100 мл воды и 8,65 г карбоната натрия) для осаждения АСС. В суспензии АСС добавляли раствор стабилизатора (300 мл воды и 0,6 г НМР, PyroP или TP) для получения суспензии стабилизированного АСС (суспензии 10%НМР, 10%Pyr и 10%ТР содержали 1,2 г НМР, PyroP или TP, соответственно). Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок водой. Полученный порошок диспергировали в 1100 мл для получения суспензии и исследовали стабильность. Результаты приведены в таблице 14.


Пример 7. Стабильность АСС, стабилизированного бисфосфонатами
[0184] Получали несколько суспензий стабилизированного АСС с различным содержанием стабилизаторов. В типовом способе смешивали растворы кальция (100 мл или 200 мл воды, 12 г хлорида кальция и стабилизатор) и раствор карбоната (100 мл воды и 8,65 г карбоната натрия) для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора (300 мл воды и стабилизатор; содержание стабилизаторов в растворах кальция и стабилизатора приведено в таблице 15) с получением суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок водой. Получали суспензию путем диспергирования осадка в воде. Полученный порошок диспергировали в 1100 мл воды, исследовали стабильность АСС в суспензии. Результаты приведены в таблице 16.
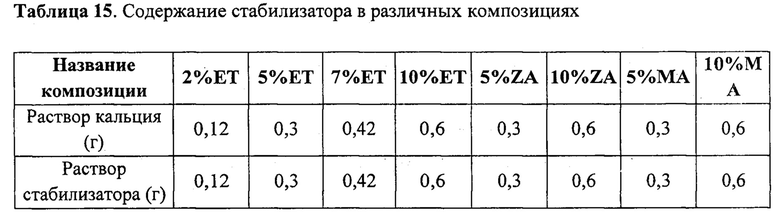
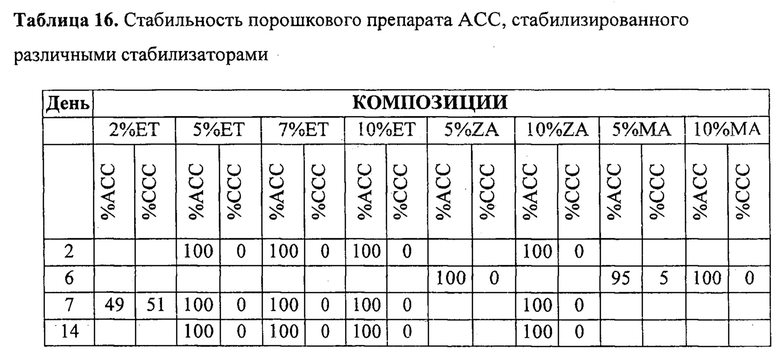
Пример 8. Стабильность повторно суспендированного АСС, стабилизированного лимонной и этидроновой кислотами и этанолом
[0185] В типовом способе раствор кальция содержал 100 мл воды, 11,76 г хлорида кальция, 0,12 г лимонной кислоты и 0,59 г этидроновой кислоты. Раствор карбоната содержал 100 мл воды и 8,48 г карбоната натрия. Раствор стабилизатора содержал 20 мл воды и 0,59 г лимонной кислоты. 50 мл этанола использовали в качестве органического растворителя. Смешивали растворы кальция и карбоната для осаждения АСС, в суспензию АСС добавляли раствор стабилизатора и этанол с получением суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку Бюхнера, промывали осадок этанолом. Получали суспензию путем диспергирования осадка в воде. Исследовали стабильность АСС, результаты приведены в таблице 17.
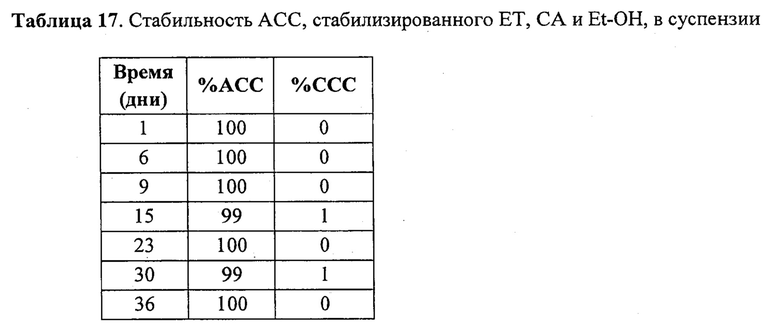
Пример 9. Стабильность суспензий АСС-трифосфат, имеющих различную концентрацию АСС.
[0186] 10%ТР-0.06%Са
[0187] Раствор кальция, содержащий 2 л воды, 8,66 г хлорида кальция и 0,433 г трифосфата, смешивали с раствором карбоната, содержащим 1800 мл воды и 6,24 г карбоната натрия, для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора, содержащий 200 мл воды и 0,433 г трифосфата, для получения суспензии стабилизированного АСС.
[0188] 10%ТР-1%Са
[0189] Раствор кальция, содержащий 300 мл воды, 24 г хлорида кальция и 1,2 г трифосфата, смешивали с раствором карбоната, содержащим 200 мл воды и 17,3 г карбоната натрия, для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора, содержащий 100 мл воды и 1,2 г трифосфата, для получения суспензии стабилизированного АСС. Исследовали стабильность указанных суспензий, результаты приведены в таблице 18.
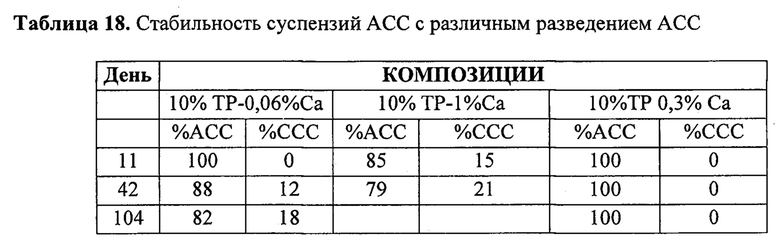
[0190] Согласно результатам можно увидеть, что концентрация АСС в суспензии значительно не влияла на стабильность АСС.
Пример 10. Состав высушенного порошка АСС
[0191] Содержание различных соединений, таких как атомы фосфора в фосфатах и кальция, в порошковом препарате АСС, стабилизированного различными стабилизаторами, полученном согласно описанию примера 1, исследовали способом с использованием индуктивно-связанной плазмы (ИСП). Результаты приведены в таблице 19.
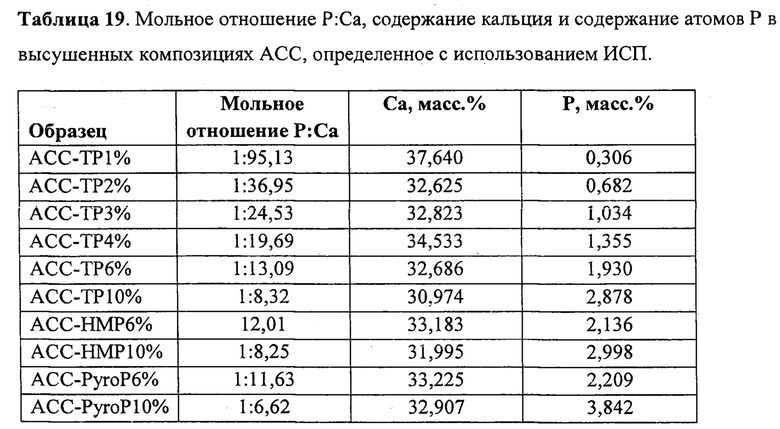
[0192] Можно увидеть, что содержание Са в твердой порошковой композиции АСС, стабилизированного различными стабилизаторами, составляет примерно 30-40 масс. %.
Пример 11. Получение увеличенной партии порошка АСС-ТР10%
[0193] В типовом способе раствор кальция содержал 11 л воды, 1,2 кг хлорида кальция и 60 г трифосфата. Раствор карбоната содержал 10 л воды и 864 г карбоната натрия. Раствор стабилизатора содержал 1 л воды и 60 г трифосфата. Смешивали растворы кальция и карбоната для осаждения АСС, в суспензию АСС добавляли раствор стабилизатора с получением суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку с нутч-фильтром, промывали осадок водой. Получали порошок путем сушки осадка. Стабильность полученного порошка приведена в таблице 20.

Пример 12. Анализ твердотельной ЯМР-спектроскопии
Способ
[0194] Все эксперименты MAS-ЯМР проводили на спектрометре с узким входным отверстием Bruker Advance III 500 МГц с использованием 4 мм зонда двойного резонанса MAS.
[0195] Эксперименты 13С CPMAS проводили со скоростью вращения 8 кГц с использованием 2,5 мкс 1Н 90° импульса, времени смешения 2 мс и 5 с задержки между повторными циклами сбора данных. Химические сдвиги выражены относительно адамантана (38,55, 29,497 ppm).
[0196] Эксперименты 31Р CPMAS проводили со скоростью вращения 10 кГц с использованием 2,5 мкм 1Н 90° импульса, времени смешения 3 мс и 5 с задержки между повторным циклами сбора данных. Химические сдвиги выражены относительно Na2HPO4 (6,5 ppm).
[0197] Погрешность пиков составляет ± 0,5 ppm.
Результаты и обсуждение
[0198] Все образцы анализировали путем рентгеновской порошковой дифракции перед проведением измерений ЯМР CP-MAS, было показано, что содержание аморфной фазы составляло примерно 100% за исключением АСС-ТР1%, см. таблицу 21 ниже.
[0199] На всех спектрах 13С SS-ЯМР наблюдали один пик (см. таблицу 21 ниже), который соответствовал атому углерода в карбонатном ионе АСС, при 168,7±0,5 ppm. Таким образом, различные количества (%) определенных полифосфатных молекул или различных полифосфатных стабилизаторов в АСС не влияли на химические сдвиги, наблюдаемые на спектрах 13С CP-MAS; атом углерода в карбонатном ионе «воспринимает» одинаковое пространственное окружение во всех системах независимо от содержания фосфора или химической структуры.
[0200] На спектре 31Р ЯМР количество пиков (один для PS, два для Pyro-Р, три для TP) отражает количество атомов фосфора в каждой молекуле и определяет различное пространственное окружение. НМР имеет три пика, но при этом содержит шесть атомов фосфора, что может быть связано с наложением пар пиков или с тем, что каждый из двух атомов фосфора в фосфате имеет примерно одинаковое пространственное окружение. При различных концентрациях АСС-ТР (3% по сравнению с 6% и 10%) наблюдают различия в сигналах верхнего поля (+3,7 по сравнению с +2,8 и +3,0). Так как проводили однократное измерение образцов, которые были выделены из одного препарата, авторы настоящего изобретения решили не проводить оценку указанных различий.
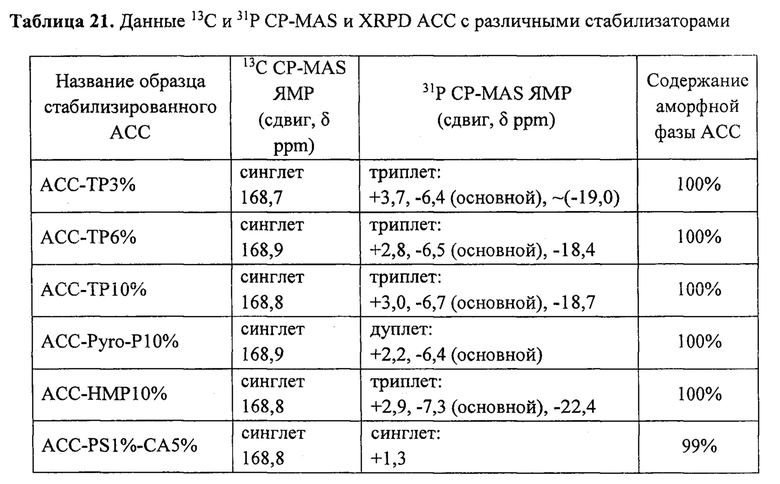

[0201] Согласно приведенным результатам можно увидеть, что все неорганические фосфаты не вступали во взаимодействия и не разрушались или не разлагались на более мелкие соединения.
Пример 13. Анализ дифференциальной сканирующей калориметрии (ДСК) АСС, стабилизированного полифосфатами
[0202] Анализ ДСК проводили в неокислительных условиях, обеспечиваемых за счет продувания газообразного азота с расходом 80 мл/мин, температуру повышали от 30°C до 600°C со скоростью 10°C/мин.
[0203] Термограммы ДСК АСС с добавками аналогов фосфора содержали широкий эндотермический пик в диапазоне примерно 50-250°C (пик примерно при 128°C), который возникал в результате испарения поглощенной воды. Экзотермический пик появлялся при более высокой температуре примерно 367-414°C в случае TP (типовая термограмма приведена на фиг. 5).
[0204] Для пика кристаллизации АСС с добавками трифосфата в различных концентрациях (масс/масс), например, 2%, 3%, 4%, 6%, наблюдают увеличение экзотермических пиков, связанных с температурой кристаллизации: 367°C, 389°C, 400°C и 414°C, соответственно. Анализ ДСК указывал на то, что превращение АСС в кристаллическую фазу при нагревании ускоряется при снижении концентрации стабилизатора АСС. Таким образом, стабильность порошка АСС при нагревании зависит от концентрации стабилизатора, чем выше концентрация, тем выше стабильность при нагревании. Это может указывать на то, что АСС имеет повышенную физическую стабильность в условиях окружающей среды при высоком уровне стабилизатора.
Пример 14. Анализ FT-IR АСС, стабилизированного полифосфатами
[0205] На спектре FT-IR образцов присутствует выраженный пик примерно при 1400 см-1 с плечом примерно при 1470 см-1 и дополнительный средний пик примерно при 865 см-1, соответствующий карбонату (СО3)2. Все пики измерены с точностью ± 4 см-1. Указанные пики имеют одинаковую интенсивность в случае стабилизаторов TP, НМР и PS АСС и различных количеств TP (%) в АСС (фиг. 6). Это является дополнительным подтверждением наблюдения, сделанного в твердотельном ЯМР, касающегося того, что карбонил в молекуле «воспринимает» одинаковое пространственное окружение во всех системах независимо от содержания фосфора или химической структуры.
[0206] Небольшой пик примерно при 1130 см-1 соответствует фосфату. Пик фосфата снижался до наименьшего уровня в случае ACC-PS1%-5%CA и постепенно увеличивался до наивысшего уровня при концентрации TP от 3% до 10%, где максимум соответствовал 10% ТР. На фиг. 6 приведено сравнение АСС, стабилизированного пирофосфатом (фиг. 6G-6H), трифосфатом (фиг. 6A-6D), гексаметафосфатом (фиг. 6E-6F) в одинаковой концентрации стабилизатора 10% (масс./масс). Таким образом, можно проводить различия между различными структурами стабилизаторов путем изучения интенсивности пиков примерно при 1130 см-1. Вкратце: увеличение интенсивности пика отражает увеличение процентного содержания фосфатного стабилизатора в АСС, если сравнивать одинаковые фосфатные молекулы, имеющие различное содержание в % в АСС, или увеличение чиста атомов фосфора в фосфатной молекуле, если сравнивать различные фосфатные молекулы в качестве стабилизаторов, имеющих одинаковое содержание в % в АСС.
[0207] Пики Са3(PO4)2, который может образовываться в результате побочной реакции CaCl2 с фосфатным стабилизатором, обнаружены не были. Разложение с образованием Са3(PO4)2 не наблюдали.
[0208] Также присутствует широкий и небольшой пик примерно при 3300 см-1, который соответствует воде в гидратированном АСС.
Пример 15. Содержание воды в твердой композиции АСС, стабилизированного различными стабилизаторами
[0209] Для определения содержания воды в твердых препаратах АСС, стабилизированного различными стабилизаторами, использовали термогравиметрический анализ. Использовали оборудование ТГА Q500 V20.13 / Universal V4.5A ТА со следующей программой нагрева: КТ-1000°C, скорость нагрева: 10°C/мин. Расход N2: 80 мл/мин, масса образца: ~ 10-15 мг, один повтор.
[0210] На кривых ТГА явно наблюдали два процесса с потерей массы: первый можно соотнести с высвобождением воды в диапазоне от КТ до примерно 300°С, и второй в диапазоне температур примерно 500-800°С - с разложением карбоната кальция. По оценкам содержание воды в образцах АСС-ТР могло составлять примерно 17-18%. Результаты приведены в таблице 22.

Пример 16. Эффективность АСС в модели метастазов в кости у мышей.
Цель и задачи
[0211] Задачей настоящего исследования являлась оценка возможной терапевтической эффективности АСС, стабилизированного трифосфатом (АСС-ТР), в отношении развития и прогрессирования метастазов в кости в мышиной модели при использовании интраперитонеальных (и.п.) инъекций. Модель индуцировали путем внутрикостной инокуляции опухолевых клеток 4Т1 (клетки, изначально выделенные из опухоли молочной железы мышей). Исследовали АСС в двух концентрациях. Проводили их сравнение с CaCl2, используемым в качестве контрольного источника кальция, и с общепринятым способом лечения метастазов в кости (бисфосфонат - алендроновая кислота).
Исследуемые изделия
[0212] Введение АСС путем интраперитонеальной инъекции (и.п.):
[0213] Препарат 5 мкм порошка АСС, стабилизированного 10% TP, и препарат 1%СА
[0214] АСС с 1% элементного кальция получали следующим образом: Смешивали раствор кальция, содержащий 100 мл воды, 12 г хлорида кальция, 0,12 г лимонной кислоты и 0,06 г трифосфата, с раствором карбоната, содержащим 100 мл воды и 8,65 г карбоната натрия, для осаждения АСС. В суспензию АСС добавляли раствор стабилизатора, содержащий 50 мл воды и 0,6 г трифосфата, для получении суспензии стабилизированного АСС. Затем отфильтровывали АСС через воронку Бюхнера и промывали осадок водой. Получали частицы порошка после сушки и измельчения осадка. Проводили дополнительное измельчение до достижения размера частиц 5 микрометров.
[0215] Композиции АСС-ТР в солевом растворе
[0216] Получали две композиции АСС-ТР:
[0217] Состав 1 (называемый АСС1): 0,33 г порошка АСС, измельченного до 5 мкм, добавляли в 100 мл солевого раствора до конечной концентрации 0,1% кальция (1 мг/мл).
[0218] Состав 2 (называемый АСС1): 0,50 г порошка АСС, измельченного до 5 мкм, добавляли в 100 мл солевого раствора до конечной концентрации 0,15% кальция (1 мг/мл).
[0219] Суспензию перемешивали на вортексе. 200 мкл суспензии интраперитонеально инъецировали 6 раз в неделю мышам с использованием 1 мл шприца с иглой калибра 25G.
[0220] Бисфосфонат - алендроновая кислота
[0221] 100 мг алендроновой кислоты (Sigma, кат. № А4978) растворяли в 10 мл солевого раствора до получения маточного раствора с концентрацией 10 мг/мл. Затем готовили раствор с концентрацией 0,1 мг/мл (разбавление 1:100). 120 мкл 10 мг/мл маточного раствора растворяли в 11880 мкл.
[0222] Использовали раствор в конечной концентрации 2 мкг/мл. Таким образом, 0,6 мл 0,1 мг/мл маточного раствора растворяли в 29,4 мл солевого раствора. Раствор для инъекции готовили непосредственно перед инъекцией. Маточный раствор хранили при -20°C.
[0223] 200 мкл суспензии инъецировали подкожно 3 раза в неделю с использованием 1 мл шприца с иглой калибра 25G.
[0224] Хлорид кальция
[0225] 0,35 г CaCl2 растворяли в 100 мл солевого раствора до достижения конечной концентрации 0,1% кальция (1 мг/мл). 200 мкл суспензии инъецировали интраперитонеально 6 раз в неделю мышам с использованием 1 мл шприца с иглой калибра 25G.
Дизайн исследования
[0226] Было разработано исследование для оценки возможной терапевтической эффективности АСС-ТР при использовании интраперитонеальных (и.п.) инъекций в отношении развития и прогрессирования метастазов в кости в мышиной модели. Модель ракового заболевания индуцировали путем инъекций раковых клеток внутрь большеберцовой кости. Инъекции внутрь большеберцовой кости используют, если необходимо изучить взаимосвязь раковых клеток и кости после метастазирования опухоли, таким образом, их рассматривают как наиболее подходящие для указанных исследований.
[0227] Было сделано предположение о том, что так как все исследуемые изделия, содержащие кальций, и контроль вводили путем и.п.инъекций, то любое возможное терапевтическое действие АСС будет определяться свойствами АСС, но не способом введения.
[0228] В эксперименте использовали самок мышей (BALB/c, возрастом 9 недель). Разброс массы тела животных в начале исследования не превышал ± 20% от средней массы для пола. Начальная масса тела составляла 16-19 г. Мышей оставляли для акклиматизации на 5 дней перед началом эксперимента.
[0229] Животных размещали в полиэтиленовых клетках (6/клетку) с размерами 35×30×15 см, с верхней решеткой из нержавеющей стали, через которую давали гранулированный корм и питьевую воду в пластиковой бутыли; подстилка: использовали стерилизованную паром чистую рисовую шелуху (Harlan, Sani-chip кат. №: 2018SC+F), материал подстилки заменяли в клетке раз в неделю.
[0230] Количество употребляемого корма и воды измеряли и фиксировали раз в неделю.
Процедура эксперимента
[0231] Первый день введения контроля или исследуемых изделий определяли как «день 1». В день «0» исследования всех мышей анестезировали путем интраперитонеальной инъекции кетамина (80 мг/кг) и ксилазина (5 мг/кг). Проводили инъекции внутрь большеберцовой кости клеток 4Т1 (CRL-2539, В1) в дозе 70×103 клеток, объем дозы составлял 10 мкл животному.
[0232] Интраперитонеально вводили контроль или исследуемые изделия, содержащие кальций, с использованием иглы калибра 25G ежедневно (6 дней в неделю), начиная от 1 дня до завершения исследования. Алендроновую кислоту вводили подкожно один раз в день 3 дня в неделю.
[0233] В день инъекции 15 животных были исключены из исследования в связи с гибелью после процедуры инъекции под анестезией. Смертность мышей была случайной и не зависела от времени инъекции. Тем не менее, в каждой группе оставалось достаточное количество мышей для статистического анализа Количество мышей в каждой группе подробно описано в таблице 23.
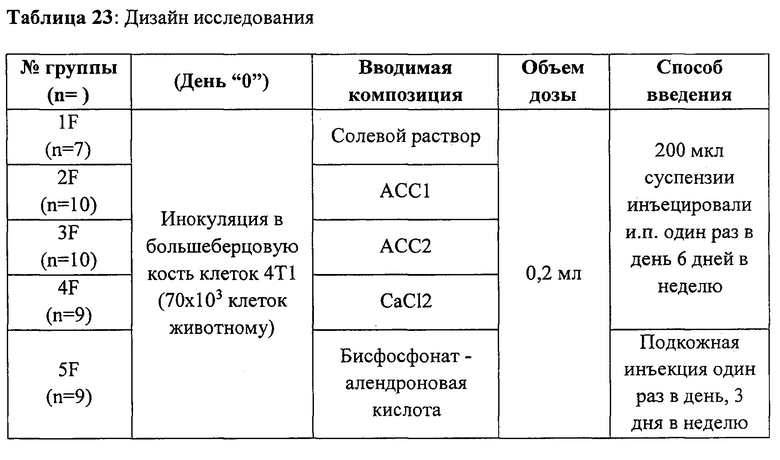
[0234] Исследование завершали в «день 27» для групп 1F, 2F, 5F и в «день 23» для групп 3F, 4F. После завершения исследования (день 23 и день 27) животных анестезировали путем удушения СО2.
Наблюдения и оценка
[0235] Записывали следующие измеряемые параметры и наблюдения: (i) смертность и заболеваемость (ежедневно); (ii) наблюдаемые клинические признаки (два раза в неделю); (iii) измеренную массу тела (один раз в неделю и после завершения исследования); (iv) рентгенографический анализ; и (v) количество употребляемого корма и воды (один раз в неделю).
Клинические наблюдения
[0236] Вплоть до завершения исследования у всех животных наблюдали клинические признаки два раза в неделю.
[0237] Проводили наблюдения каких-либо изменений кожи, шерсти, глаз, слизистых мембран, дыхания, появления секретов и экскрементов (например, диареи). Также были включены изменения походки, осанки и реакции на уход, включая необычное поведение, тремор, конвульсии, сонливость и кому.
[0238] Отмечали все наблюдаемые отклонения, признаки токсичности, состояния агонии и случаи гибели перед завершением исследования.
[0239] Животных, которых гуманно умерщвляли во время исследования, при интерпретации результатов исследования рассматривали в качестве животных, умерших во время исследования.
Рентгенографический анализ
[0240] Проводили рентгеновское исследование в день «0» и день «20» (рентгеновский излучатель Girth 8015).
[0241] Проводили исследование цифровых рентгенограмм (полученных в день 20) на наличие остеолитических поражений в частности в левой большеберцовой кости (место инокуляции).
Результаты
[0242] Проводили анализ развития опухоли у мышей путем рентгенографической микрографической оценки в день 0 и день 20, было показано, у каких мышей происходило развитие опухоли. Нарушения в кости определяли по истощению кости, снижению плотности и появлению разрывов в кости на рентгеновских микрограммах. Мыши, у которых во время исследования не развивались никакие опухоли, таким образом, были исключены из конечной статистики.
[0243] В день 20 у всех животных наблюдали сильный отек мягкой ткани вокруг кости. Это было связано с тяжелым повреждением, выявленным на рентгеновской микрограмме кости. Кроме того, увеличивался уровень смертности, и у животных появлялись тяжелые клинические признаки, т.е. пилоэрекция, затрудненное дыхание, сутулость и хромота.
[0244] На основании приведенных выше результатов было решено завершить исследование в день 23 для групп 4F и 3F, в которых вводили CaCl2 и АСС2, соответственно, и в день 27 после инъекции для групп 1F, 2F и 5F, в которых вводили солевой раствор, АСС1 и ALN, соответственно.
[0245] Уровень смертности мышей приведен на фиг. 8, в группе 2F, обозначенной АСС1, в которой вводили 0,1% кальция, наблюдали наивысший уровень выживаемости на протяжении всего исследования. До дня 22 в группе АСС1 не погибла ни одна мышь. В группе 1F, солевой раствор, в которой не проводили лечение, гибель мышей не наблюдали до дня 20. Тем не менее, уровень выживаемости в указанной группе был значительно ниже и к завершению дня 27 составлял 40% выживаемости по сравнению с 80% выживаемостью в группе АСС1. В группе АСС2, где мышам вводили 0,15% кальция, ни одна мышь не погибла до дня 19, и был продемонстрирован схожий уровень выживаемости с группой, в которой вводили солевой раствор, вплоть до дня 23. В группе, в которой вводили ALN, бисфосфонат, также ни одна мышь не погибла до дня 19, но уровень выживаемости был ниже. В группе, в которой вводили CaCl2, первая мышь погибла в день 16. Тем не менее, уровень выживаемости в указанной группе был выше 75% до дня 23 исследования.
[0246] Тенденция, выявленная в полученных выше результатах, повторилась и в случае индекса клинических признаков (фиг. 9). Повышенный индекс клинических признаков соответствует обнаружению более высокого числа клинических признаков, и пониженный индекс соответствует обнаружению более низкого числа клинических признаков. В группе АСС1, в которой вводили 0,1% кальция, обеспеченного из АСС, отмечали наименьший индекс клинических признаков на протяжении всего исследования. В группе 1F, солевой раствор, в которой не проводили лечение, индекс был схожим вплоть до дня 20, тем не менее, в период от дня 20 до дня 27 наблюдали быстрое проявление клинических признаков у мышей. В группах АСС2 и CaCl2 клинические признаки имели схожие профили по сравнению друг с другом, что также соответствовало уровням выживаемости. Дополнительная корреляция была обнаружена в группе ALN, в которой отмечали наивысший индекс клинических признаков, т.е. наихудшее состояние здоровья мышей в группе.
[0247] Можно увидеть, что группа 2F, в которой вводили АСС1, на протяжении всего исследования вплоть до дня 27 имела наименьший индекс клинических признаков по сравнению со всеми другими группами.
[0248] Изменения массы тела в процентах во всех группах свидетельствовали о схожем балансе массы тела на протяжении эксперимента в отсутствие значительных различий между группами, что можно увидеть на фиг. 10. Линия флуктуаций на графике зависимости массы тела является характерной для всех групп и вероятно вызвана потерей массы тела мыши перед смертью, таким образом, после гибели и исключения мыши из статистики появляется ложный сдвиг графика. Так как приведены средние значения изменений массы тела в процентах, то в группах с небольшим количеством животных наблюдали повышенный эффект флуктуаций.
Вывод:
[0249] Наилучшие характеристики имел состав АСС1. В указанной группе вводили 0,1% кальция, обеспеченного из АСС-ТР. В группе на всем протяжении исследования был продемонстрирован наивысший уровень выживаемости и наименьший индекс клинических признаков. Сильная корреляция обоих показателей подчеркивает положительный терапевтический эффект АСС1 у мышей с опухолевыми клетками 4Т1.
[0250] При введении состава АСС2 такой же положительный терапевтический эффект, что и для АСС формулы 1, продемонстрирован не был. АСС2 содержал 0,15% элементного кальция. Несмотря на то, что смертельная доза кальция в два раза превышает вводимое количество, вероятно, указанная доза была слишком высокой, что приводило к ухудшению состояния здоровья.
[0251] Наихудшие характеристики были продемонстрированы для состава бисфосфоната - алендроновой кислоты. Лекарственные средства на основе бисфосфонатов вводят пациентам с онкологией в составе схемы лечения. Имеются противоречивые данные о возможном улучшении выживаемости мышей при применении бисфосфонатов (Ben-Aharon I et al. (2013) PLoS ONE 8 (8)).
[0252] Состав CaCl2 содержал 0,1% элементного кальция, что было схожим с количеством кальция, содержащимся в АСС1. Тем не менее, в указанной группе был продемонстрирован самый низкий процент выживаемости и повышенное количество клинических признаков. Можно предположить, что за терапевтический эффект АСС отвечает не только ион кальция, так как схожий эффект для хлорида кальция отсутствует.Это может быть связано с дополнительным механизмом действия молекулы АСС в аморфном состоянии или с карбонатным ионом.
Пример 17. Введение АСС путем ингаляции в комбинации с пероральным введением пациентам с раковым заболеванием
[0253] Проводили неконтролируемое открытое исследование испытательной клинической поддерживающей терапии для оценки улучшения качества жизни у неизлечимых пациентов с солидным распространенным раком в поздней стадии (с поражением легких или без него) при лечении путем перорального введения аморфного карбоната кальция (АСС) совместно с ингаляцией.
Популяция исследования:
[0254] Участвуют 20 субъектов с солидными злокачественными образованиями, имеющими или не имеющими метастазы в легких, у которых способ лечения ракового заболевания оказался неэффективным.
[0255] Режим дозирования
[0256] Пероральная лекарственная форма
[0257] DENSITY получен в виде капсуловидной таблетки, содержащей АСС, а также микрокристаллическую целлюлозу, Plasdone K-25, стеариновую кислоту и стеарат магния в качестве неактивных вспомогательных веществ.
[0258] Каждая капсуловидная таблетка DENSITY содержит 666 мг АСС в качестве АФИ (т.е. аморфный СаСО3 + Aerosil + стабилизаторы лекарственного вещества), что соответствует 500 мг СаСО3, и эквивалентно 200 мг элементного кальция (далее доза относится к количеству элементного кальция). Вводят до девяти таблеток DENSITY в день, максимальная доза кальция составляет 1800 мг/день.
[0259] Ингалируемая лекарственная форма
[0260] Состав для ингаляции получен из 1% АСС (т.е. 0,3% кальция) + воды для инъекции в виде стерильной суспензии (8 мл два раза в день).
[0261] Начальная доза DENSITY у всех субъектов составляет 600 мг в день, общую дневную дозу повышают до 1800 мг, и проводят ингаляцию 1% АСС в 8 мл воды два раза вдень.
[0262] Процедура исследования
[0263] Участвуют двадцать (20) субъектов, у которых была диагностирована поздняя стадия солидного рака (с поражением легких или без него) и другой способ лечения ракового заболевания был неэффективным, вводят перорально АСС в дозе до 1800 мг в виде DENSITY совместно с ингалируемым 1% раствором АСС, стабилизированного полифосфатом.
[0264] Начальная доза: 600 мг АСС перорально (3 таблетки, по одной таблетке три раза в день), повышают по 200 мг через день до достижения максимальной дозы 1800 мг. Ингалируемый АСС; 1% АСС в 8 мл солевого раствора один раз в день, повышают через 3 дня до максимальной дозы ингалируемого 1% АСС в 8 мл солевого раствора два раза в день.
[0265] Проводят оценку уровня кальция в исследованиях значений уровня кальция в сыворотке, скорректированного на уровень альбумина (СА), перед каждым повышением дозы.
Конечные результаты
[0266] Программа испытательной поддерживающей клинической терапии для оценки улучшения качества жизни субъекта, включающей определение:
- снижения боли на основании индекса ВАШ
- отказа от приема опиатов, определяемого по дозе и/или количеству обезболивающих продуктов
- функционального улучшения на основании ECOG PS
- выживаемости по сравнению с оценкой лечащего врача или историческими данными хосписа
- изменения насыщения артериальной крови кислородом при измерении пульсоксиметром
Конечные результаты оценки (безопасности):
- доля субъектов в процентах с DLT, вызывающей гиперкальцемию, для каждой дозы
- доля субъектов с любой DLT для каждой дозы
[0267] Основные показатели жизнедеятельности
[0268] Рост и вес измеряют согласно протоколу. (Указывают положение и время проведения указанного измерения - например, X минут после отдыха).
[0269] Для всех фаз исследования основные показатели жизнедеятельности (температуру, периферическое артериальное давление, пульс и частоту дыхания) определяют у субъекта после отдыха в течение 5 минут.
[0270] Температуру измеряют термометром на всех фазах исследования.
[0271] Периферическое артериальное давление (систолическое, диастолическое) измеряют путем сфигмоманометрии на всех фазах исследования.
[0272] Пульс измеряют с использованием калиброванных стандартных измерительных устройств.
[0273] Частоту дыхания измеряют путем наблюдения экскурсии грудной клетки в течение как минимум 30 секунд.
[0274] Проводят медицинский осмотр всех основных систем органов, включая исследование прямой кишки и таза. Вес и рост измеряют и записывают согласно протоколу.
[0275] Исследователь планирует использовать экспертное суждение при определении клинической значимости какого-либо факта, обнаруженного при медицинском осмотре.
[0276] Медицинский осмотр
[0277] Медицинский осмотр проводится и регистрируется исследователем или квалифицированным сотрудником. Любые аномальные данные, отнесенные исследователем к клинически значимым, должны быть отмечены в соответствующих модулях ИРК (например, нежелательное явление, медицинская история).
[0278] При отслеживании положительных и отрицательных результатов у пациента за улучшение принимают один или более следующих показателей:
- функциональное улучшение на основании ECOG PS;
- продление выживаемости по сравнению по меньшей мере с оценкой лечащего врача или историческими данными хосписа
- увеличение насыщения артериальной крови кислородом при определении пульсоксиметром
- снижение боли (шкала ВАШ), включающее по меньшей мере один из показателей: снижение интенсивности, частоты и продолжительности.
[0279] При выборе режима дозирования АСС измеренные значения уровня кальция в крови или его изменения можно использовать как важный фактор, в соответствии с которым регулируют дозировку для данного пациента. Например, усиление или даже развитие гиперкальцемии могут являться причинами снижения дневной дозировки и/или разделения дозы АСС на более мелкие дозы, которые необходимо принимать чаще.
Несмотря на то, что были проиллюстрированы и описаны определенные варианту реализации изобретения, должно быть очевидным, что изобретение не ограничено вариантами реализации, описанными в настоящей заявке. Специалистам в данной области техники будут понятны разнообразные модификации, изменения, вариации, замены и эквиваленты, не выходящие за рамки сущности и объема настоящего изобретения, описанного в последующей формуле изобретения.
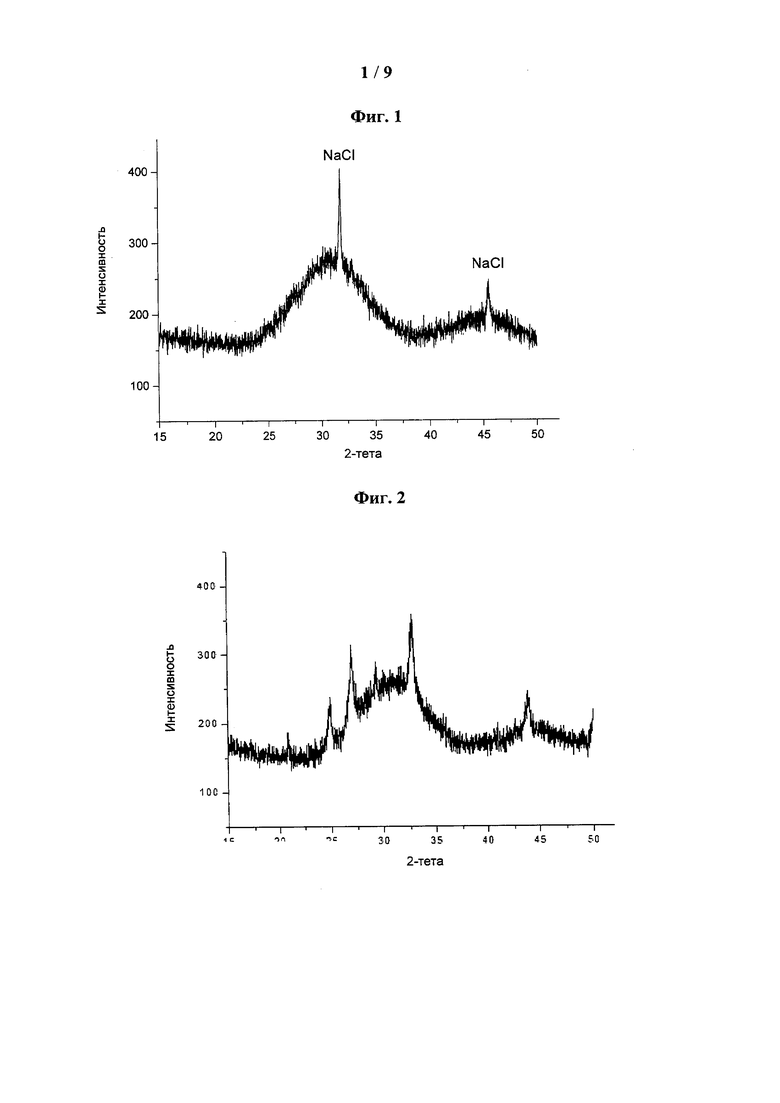
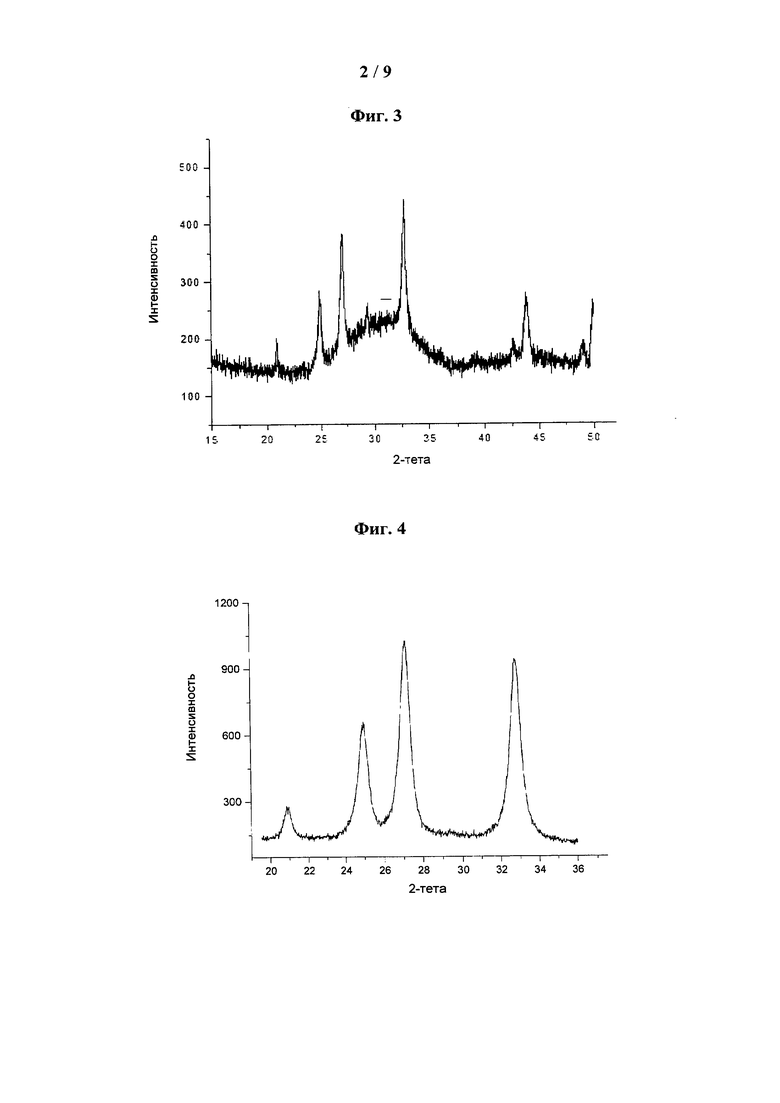
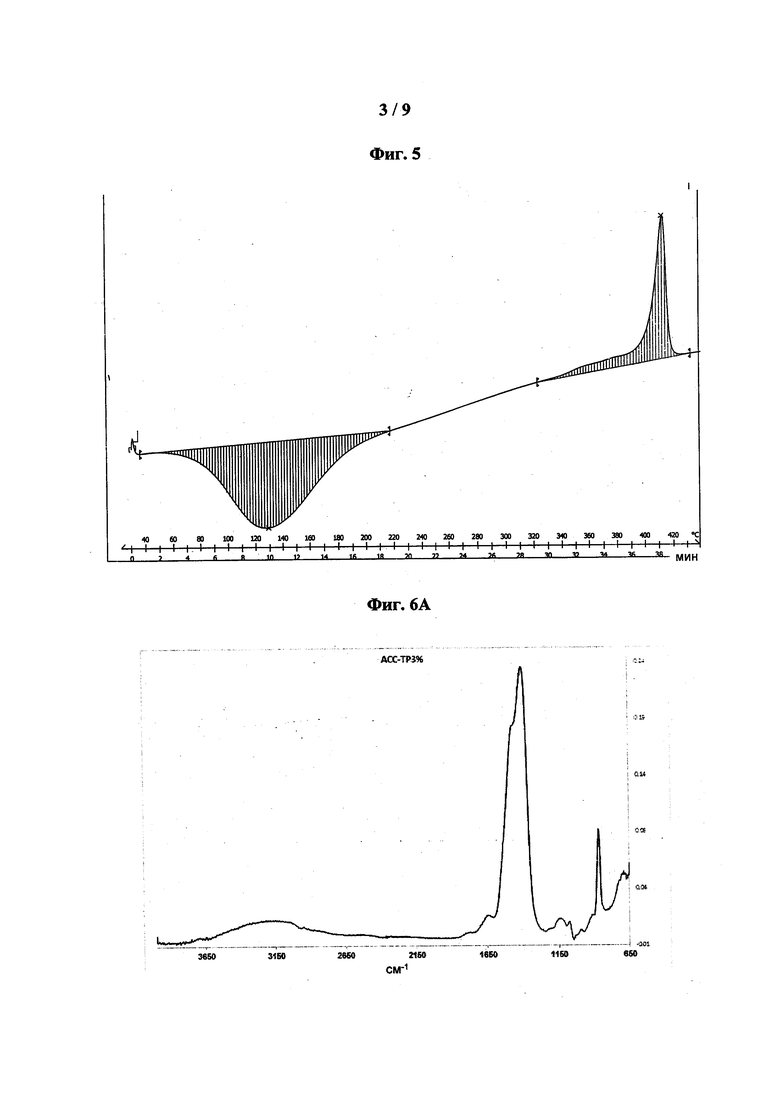
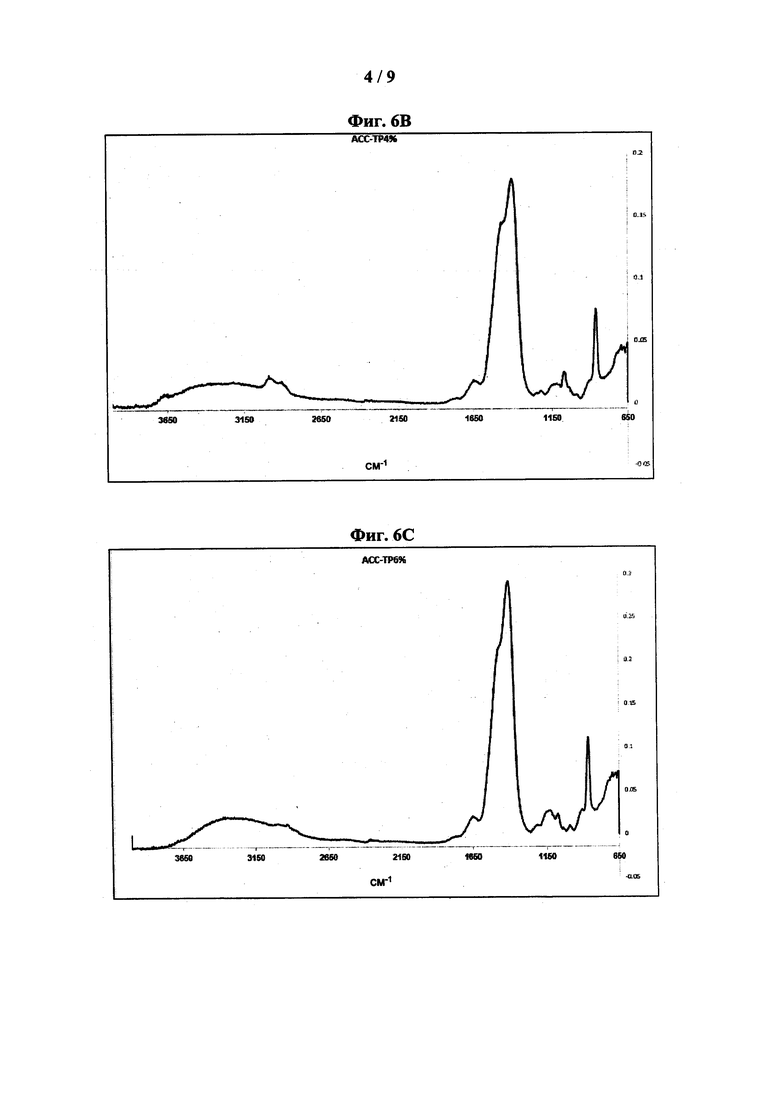
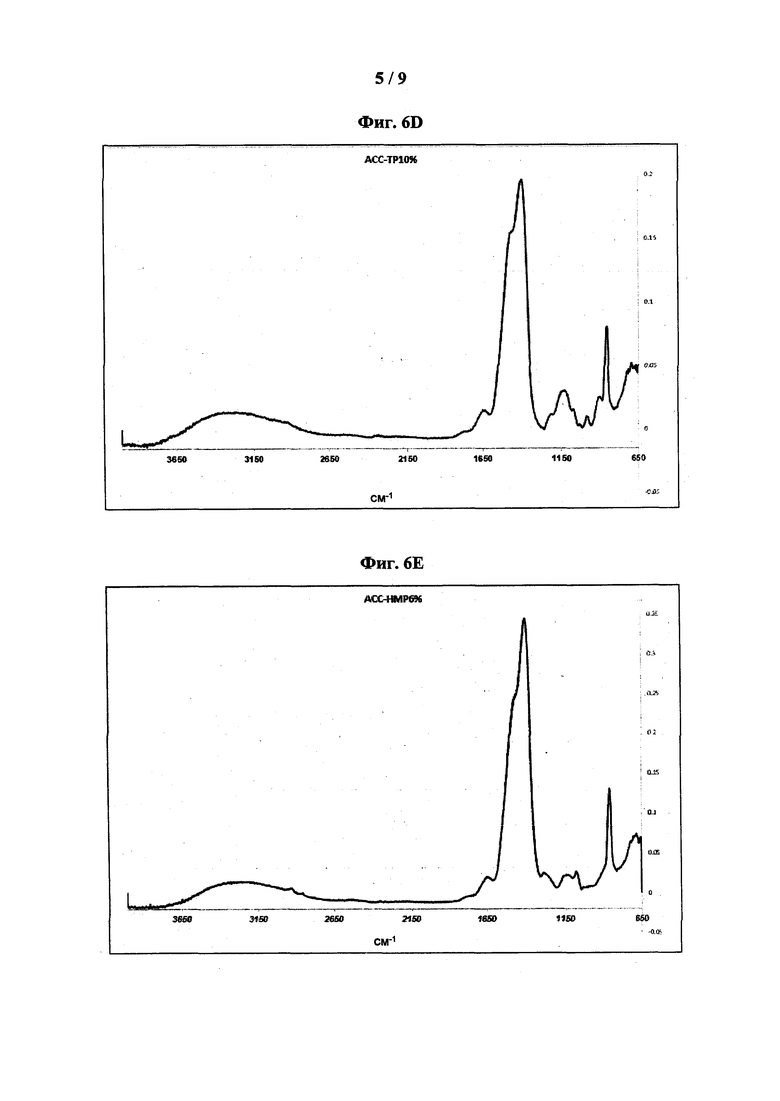
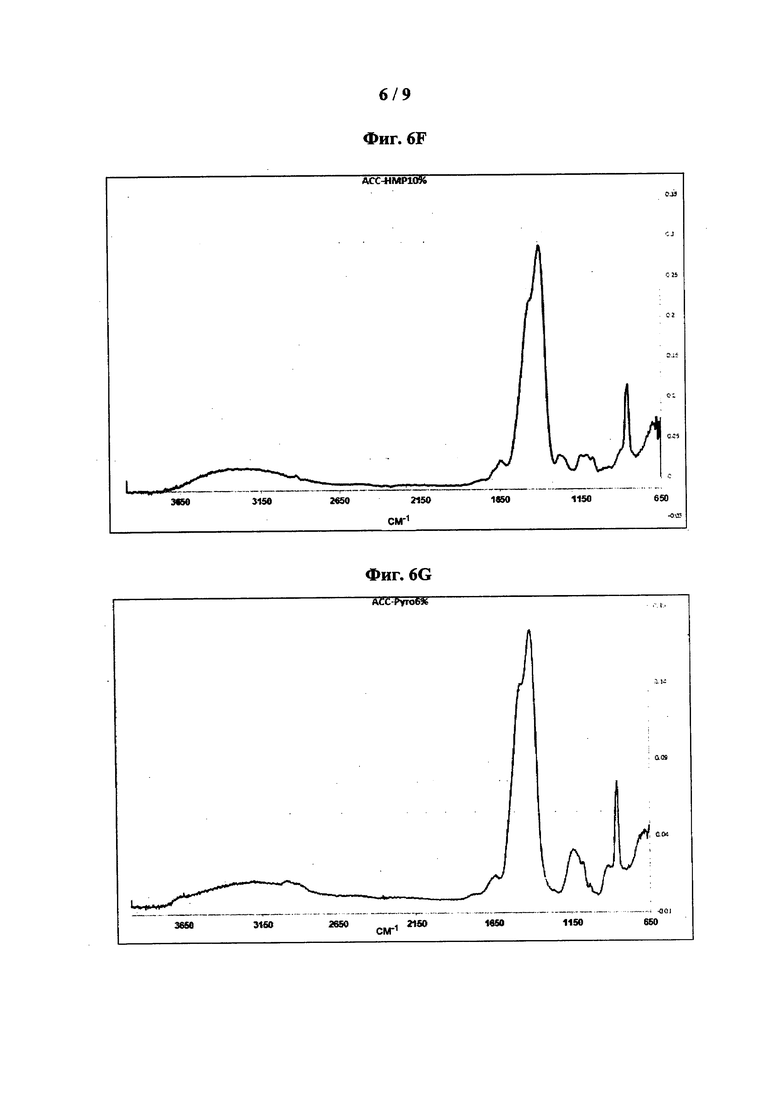
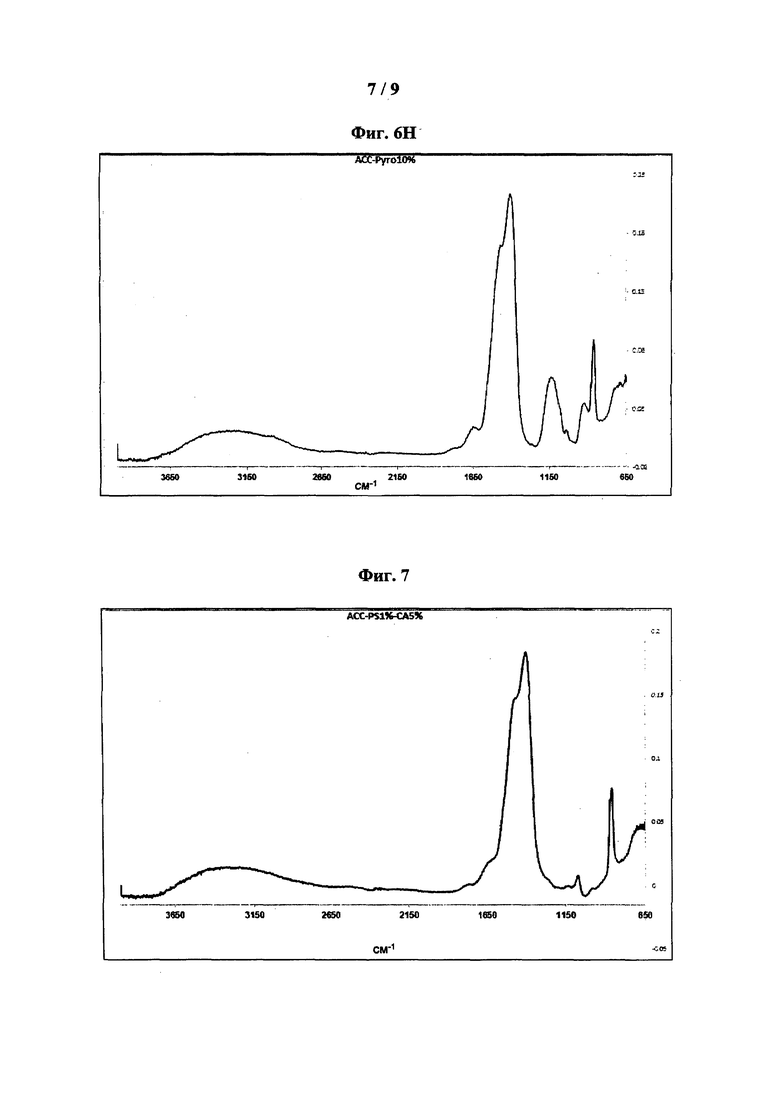
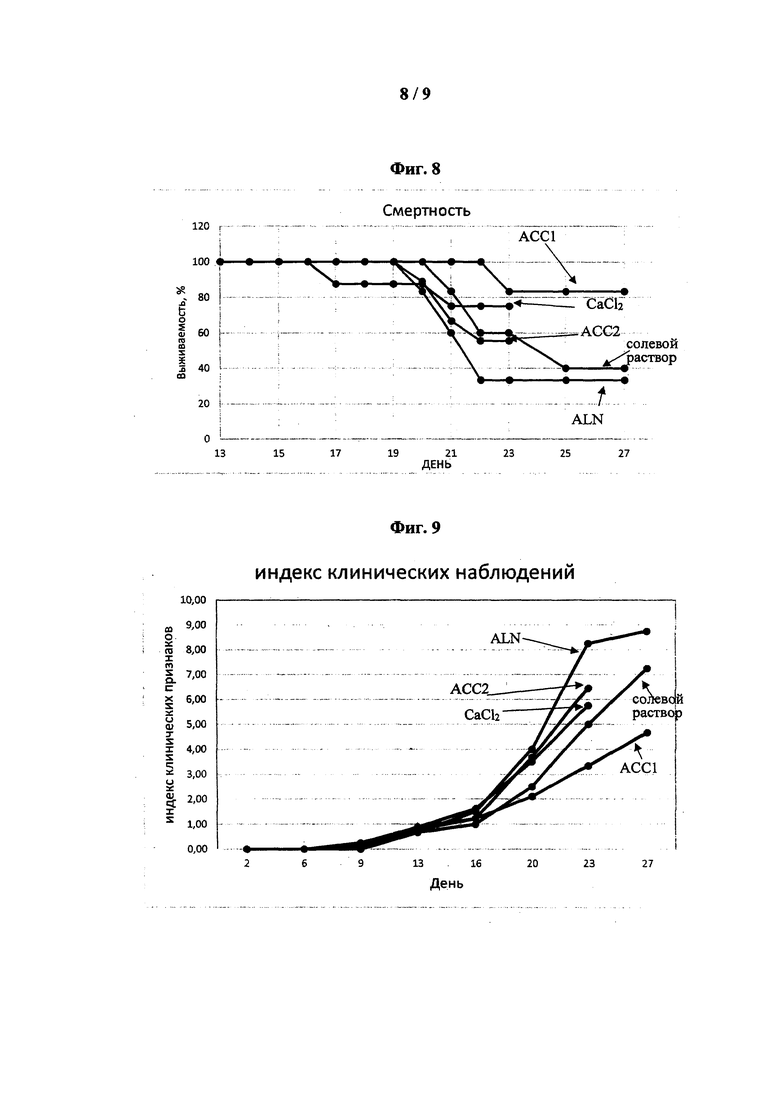
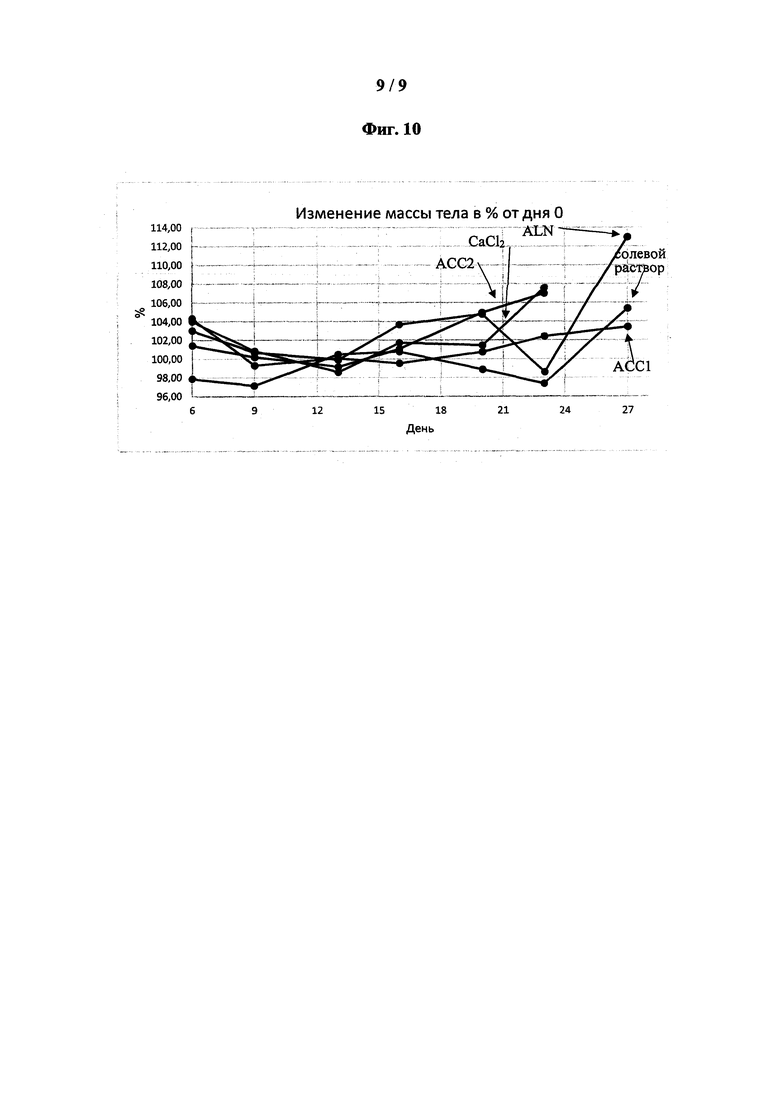
Изобретение имеет отношение к вариантам твердой композиции и вариантам композиции в виде суспензии для применения в фармацевтической и пищевой промышленности, вариантам способа получения композиции в виде суспензии, а также к способу лечения заболевания или состояния, восприимчивого к лечению карбонатом кальция Твердая композиция содержит аморфный карбонат кальция (ACC), неорганический полифосфат или его фармацевтически приемлемые соли в качестве стабилизатора. При этом мольное отношение атомов P в стабилизаторе к атомам Ca в ACC (мольное отношение P:Ca) составляет по меньшей мере 1:90, и композиция сохраняет стабильность в течение по меньшей мере 7 дней. Технический результат - получение стабильных композиций АСС, которые можно применять в пищевой или фармацевтической промышленности, реализация высокоэффективных способов их получения в промышленном масштабе. 7 н. и 46 з.п. ф-лы, 10 ил., 23 табл., 17 пр.
1. Твердая композиция для применения в фармацевтической и пищевой промышленности, содержащая аморфный карбонат кальция (ACC), неорганический полифосфат или его фармацевтически приемлемые соли в качестве стабилизатора, где мольное отношение атомов P в стабилизаторе к атомам Ca в ACC (мольное отношение P:Ca) составляет по меньшей мере 1:90, и композиция сохраняет стабильность в течение по меньшей мере 7 дней.
2. Твердая композиция по п. 1, отличающаяся тем, что мольное отношение P:Ca составляет от 1:90 до 1:1.
3. Твердая композиция по п. 2, отличающаяся тем, что мольное отношение P:Ca составляет от 1:40 до 1:1 или от 1:25 до 1:5.
4. Твердая композиция по любому из пп. 1-3, отличающаяся тем, что указанная композиция сохраняет стабильность в течение по меньшей мере 1 месяца, по меньшей мере 3 месяцев, по меньшей мере 6 месяцев или по меньшей мере 1 года.
5. Твердая композиция по любому из пп. 1-4, отличающаяся тем, что указанный неорганический полифосфат содержит от 2 до 10 фосфатных групп.
6. Твердая композиция по п. 5, отличающаяся тем, что указанный неорганический полифосфат выбран из группы, состоящей из трифосфата, пирофосфата, гексаметафосфата и их фармацевтически приемлемых солей.
7. Твердая композиция по любому из пп. 1-6, отличающаяся тем, что указанная композиция содержит менее чем 30 масс.% воды.
8. Твердая композиция по п. 7, содержащая от 10 масс.% до 20 масс.% воды.
9. Твердая композиция по любому из пп. 1-8, отличающаяся тем, что указанная композиция характеризуется спектрами FT-IR, имеющими пики поглощения при 865 см-1; при 1400 см-1 с плечом при 1470 см-1, соответствующие карбонату; и при 1130 см-1, соответствующий фосфату.
10. Твердая композиция по любому из пп. 1-9, характеризующаяся термограммой ДСК, содержащей экзотермический пик, связанный с кристаллизацией ACC, в диапазоне от 365°C до 550°C, где анализ ДСК проводят в неокислительных условиях со скоростью нагрева 10°C/мин.
11. Твердая композиция по любому из пп. 1-10, отличающаяся тем, что указанная композиция имеет форму порошка.
12. Композиция в виде суспензии для применения в фармацевтической и пищевой промышленности, содержащая твердую композицию по любому из пп. 1-10 и водный носитель.
13. Композиция в виде суспензии по п. 12, отличающаяся тем, что ACC сохраняет стабильность в указанной суспензии по меньшей мере в течение периода времени, выбранного из группы, состоящей из 1, 2, 7, 14 дней, 1 и 3 месяцев.
14. Композиция по любому из пп. 1-13, содержащая менее 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция.
15. Композиция по любому из пп. 1-14, отличающаяся тем, что указанная композиция не содержит органические растворители.
16. Композиция по любому из пп. 1-15, отличающаяся тем, что указанная композиция дополнительно содержит одну или более органических кислот.
17. Композиция по п. 16, отличающаяся тем, что указанная органическая кислота выбрана из группы, состоящей из лимонной кислоты, винной кислоты, яблочной кислоты, аскорбиновой кислоты, молочной кислоты, уксусной кислоты, щавелевой кислоты, малоновой кислоты, глютаконовой кислоты, янтарной кислоты, малеиновой кислоты и аконитовой кислоты.
18. Композиция по любому из пп. 1-17, отличающаяся тем, что указанная композиция приготовлена для введения млекопитающему.
19. Композиция по п. 18, отличающаяся тем, что указанное млекопитающее представляет собой человека.
20. Композиция по п. 18 или 19, отличающаяся тем, что указанная композиция подходит для употребления с пищей.
21. Композиция по любому из пп. 1-20, отличающаяся тем, что указанная композиция приготовлена в виде фармацевтической композиции, в виде пищевой добавки или продукта лечебного питания.
22. Композиция по п. 21, приготовленная в виде таблетки, капсулы, микроинкапсулированных пеллет, порошка, суспензии, мази, функционального продукта питания, состава для трансбуккального введения или для введения путем ингаляции.
23. Твердая композиция для применения в фармацевтической и пищевой промышленности, содержащая аморфный карбонат кальция (ACC) и бисфосфонат или его фармацевтически приемлемые соли в качестве стабилизатора, где мольное отношение атомов P в стабилизаторе к атомам Ca в ACC (мольное отношение P:Ca) составляет по меньшей мере 1:90, и композиция содержит от 5 масс.% до 30 масс.% воды и сохраняет стабильность в течение по меньшей мере 7 дней.
24. Твердая композиция по п. 23, отличающаяся тем, что мольное отношение P:Ca составляет от 1:90 до 1:1, от 1:40 до 1:1 или от 1:25 до 1:5.
25. Твердая композиция по пп. 23 и 24, отличающаяся тем, что указанный бисфосфонат выбран из группы, состоящей из этидроновой кислоты, золедроновой кислоты, медроновой кислоты, алендроновой кислоты и их фармацевтически приемлемых солей.
26. Твердая композиция по любому из пп. 23-25, содержащая от 10 масс.% до 20 масс.% воды.
27. Твердая композиция по любому из пп. 23-26, отличающаяся тем, что указанная композиция сохраняет стабильность в течение по меньшей мере 1 месяца, 3 месяцев, 6 месяцев или 1 года.
28. Твердая композиция по любому из пп. 23-27, отличающаяся тем, что указанная композиция имеет форму порошка.
29. Композиция в виде суспензии для применения в фармацевтической композиции, в виде пищевой добавки или продукта лечебного питания, содержащая твердую композицию по любому из пп. 23-28 и водный носитель.
30. Композиция в виде суспензии по п. 29, отличающаяся тем, что ACC сохраняет стабильность в суспензии по меньшей мере в течение периода времени, выбранного из группы, состоящей из 1, 2, 7, 14 дней, 1 и 3 месяцев.
31. Композиция по любому из пп. 23-30, содержащая менее 1%, 5%, 10% или 30% кристаллического карбоната кальция от общего количества карбоната кальция.
32. Композиция по любому из пп. 23-31, отличающаяся тем, что указанная композиция не содержит органические растворители.
33. Композиция по любому из пп. 23-32, отличающаяся тем, что указанная композиция дополнительно содержит одну или более органических кислот.
34. Композиция по любому из пп. 23-33, отличающаяся тем, что указанная композиция приготовлена в виде фармацевтической композиции, пищевой добавки или продукта лечебного питания.
35. Способ получения композиции в виде суспензии по любому из пп. 12, 13, 29 или 30, содержащей стабилизированный аморфный карбонат кальция (ACC) и полифосфат, бисфосфонат или их фармацевтически приемлемые соли в качестве стабилизатора, причем способ включает смешение водных растворов: (i) источника кальция, (ii) стабилизатора и (iii) источника карбоната, для осаждения стабилизированного аморфного карбоната кальция, где мольное отношение атомов P в стабилизаторе к атомам Ca в ACC составляет по меньшей мере 1:28.
36. Способ по п. 35, отличающийся тем, что указанный стабилизатор представляет собой неорганический полифосфат или его фармацевтически приемлемые соли.
37. Способ получения композиции в виде суспензии по п. 12 или 13, содержащей стабилизированный аморфный карбонат кальция (ACC) и неорганический полифосфат, причем способ включает стадии:
a) растворения источника кальция и неорганического полифосфата в воде для получения раствора;
b) добавления водного раствора источника карбоната в раствор, полученный на стадии (a), для осаждения аморфного карбоната кальция (ACC) и получения таким образом водной суспензии ACC; и
c) добавления водного раствора неорганического полифосфата в суспензию, полученную на стадии (b), для получения суспензии стабилизированного ACC,
где мольное отношение атомов P в стабилизаторе к атомам Ca в ACC составляет по меньшей мере 1:90.
38. Способ по любому из пп. 35-37, отличающийся тем, что указанный неорганический полифосфат содержит от 2 до 10 фосфатных групп.
39. Способ по п. 38, отличающийся тем, что указанный неорганический полифосфат выбран из группы, состоящей из трифосфата, пирофосфата, гексаметафосфата и их фармацевтически приемлемых солей.
40. Способ по любому из пп. 35-39, отличающийся тем, что мольное отношение P:Ca составляет от 1:25 до 1:5.
41. Способ по любому из пп. 35-40, отличающийся тем, что источник кальция представляет собой хлорид кальция, и/или источник карбоната представляет собой карбонат натрия.
42. Способ по любому из пп. 35-41, дополнительно включающий фильтрование реакционной суспензии для получения осадка.
43. Способ по п. 42, дополнительно включающий промывку осадка водным раствором.
44. Способ по п. 42 или 43, дополнительно включающий сушку осадка.
45. Способ по п. 44, дополнительно включающий измельчение осадка для получения порошка.
46. Способ по п. 45, отличающийся тем, что размер частиц ACC составляет от 100 мкм до 5 мкм.
47. Способ по любому из пп. 44-46, отличающийся тем, что указанная композиция сохраняет стабильность в течение по меньшей мере 7 дней.
48. Способ по п. 35, отличающийся тем, что указанный стабилизатор представляет собой бисфосфонат, и композиция содержит более 5% воды.
49. Способ по п. 48, отличающийся тем, что указанная композиция содержит от 5 масс.% до 30 масс.% воды.
50. Способ по любому из пп. 35-49, отличающийся тем, что ни на одной стадии получения не добавляют органический растворитель.
51. Способ лечения заболевания или состояния, восприимчивого к лечению карбонатом кальция, включающий введение эффективного количества композиции по любому из пп. 1-34.
52. Способ по п. 51, отличающийся тем, что указанное заболевание или состояние выбрано из группы, состоящей из боли, гиперпролиферативных заболеваний, поражений кожи, неврологических расстройств, иммунологических нарушений, сердечно-сосудистых заболеваний, легочных заболеваний, нарушений питания, нарушений репродуктивной системы, скелетно-мышечных нарушений, инфекционного заболевания и заболевания зубов.
53. Способ по п. 52, отличающийся тем, что указанное заболевание представляет собой раковое заболевание.
| WO 2014122658 A1, 14.08.2014 | |||
| WO 2008041236 A2, 10.04.2008 | |||
| Sawada К., The mechanisms of crystallization and transformation of calcium carbonate, Pure and Applied Chemistry, 1997, v | |||
| Способ приготовления пищевого продукта сливкообразной консистенции | 1917 |
|
SU69A1 |
| Meiron O.E | |||
| et al., Solubility and Bioavailability of Stabilized Amorphous Calcium Carbonate, Journal of bone and mineral Research, 2011, v.26, | |||
Авторы
Даты
2020-12-25—Публикация
2016-06-02—Подача