Изобретение относится к области биотехнологии, в частности к антителам, имитирующим морфин-специфические антигенные свойства и способным связываться с опиоидными рецепторами.
В настоящее время, по данным федерального статистического управления Минздрава России, среди зарегистрированных больных наркоманией подавляющее большинство составляют больные с зависимостью от опиатов (78,4%) [Киржанова В.В., Григорова Н.И. О заболевании наркологическими расстройствами в 2014 г. // Вопросы наркологии, 2015; 4: 19-28]. В этой связи в нашей стране проводится активный поиск эффективных путей лечения и профилактики опиатной зависимости. Лечение и профилактика наркомании тесно связаны с разработкой новых эффективных методов иммунотерапии с применением высокоспецифических вакцин к психоактивным веществам (ПАВ).
В мире широко применяется вакцинация против наркотической зависимости с применением конъюгатов высокомолекулярных соединений, таких как холерный токсин или гемоцианин улитки, и ПАВ [Bonese K.F., Wainer В.Н., Fitch F.W, Rothberg R.M., Schuster C.R. Changes in heroin self-administration by a rhesus monkey after morphine immunization // Nature, 1974; 252(5485):708-710; Anton В., Salazar A., Flores A., Matus M., Marin R., Hernandez J., Leff P. Vaccines against morphine/heroin and its use as effective medication for preventing relapse to opiate addictive behaviors // Human Vaccines, 2009; 5(4):214-229]. При таком способе вакцинации индуцируются антитела, специфичные не только к наркотикам, но и к эндогенным опиоидным пептидам. Так, предлагается вакцина, содержащая в качестве антигена алкалоиды опия, которая вызывает образование в организме антител к героину и морфину. Антитела образуют комплекс с героином, вводимым в организм, и таким образом уменьшается его проникновение в мозг (CN 1196955 А, 28.10.1998). Данный подход вступает в противоречие с действующим в РФ Федеральным законом №3-ФЗ от 08.01.1998 «О наркотических средствах и психотропных веществах», запрещающим лечение наркомании наркотическими средствами. Одним из наиболее перспективных направлений является создание вакцины на основе вторичных антиидиотипических антител - Ab2. Известен способ вакцинации от наркотической зависимости с применением моноклональных антиидиотипических (мАи) антител к кокаину [Schabacker D.S., Kirschbaum K.S., Segre М. Exploring the feasibility of an anti-idiotypic cocaine vaccine: analysis of the specificity of anticocaine antibodies (Ab1) capable of inducing Ab2b anti-idiotypic antibodies // Immunology, 2000; 100:48-56].
Поскольку метаболитами героина у человека являются не только 6-моноацетилморфин, морфин и морфин-6-глюкуронид, но и морфин-3-глюкуронид [Берзина А.Г., Гамалея Н.Б. и др. Методологические подходы к разработке вакцины для лечения зависимости от опиатов // Наркология, 2015; 11(167):25-31], для лечения и профилактики зависимости от этих опиатов, а также для разработки методов специфической диагностики первоначально были получены мышиные моноклональные антитела (мАт) 3К11, которые узнают 3-Окарбоксиметильный эфир морфина, коньюгированный с БСА [патент на изобретение РФ №2702002].
Технической задачей, решаемой авторами, являлось получение мАи антител к мАт 3К11, способных специфически связываться с опиоидными рецепторами и при вакцинации животных индуцировать выработку антител третьего поколения Ab3 к производным морфина.
Технический результат достигался созданием мАи антитела АИ-К11В, которое с высокой аффинностью KD 3,2 нМ связывается с идиотипом антитела 3К11, индуцирует при иммунизации выработку антител, специфически распознающих производные морфина, то есть проявляет антигенные свойства морфина, и связывается с опиоидными рецепторами.
Антиидиотипическое моноклональное антитело АИ-К11В содержит вариабельную область тяжелой цепи по SEQ ID NO: 3 и вариабельную область легкой цепи по SEQ ID NO: 4, а также гипервариабельные участки вариабельной области тяжелой цепи по SEQ ID NO: 5-7 и гипервариабельные участки вариабельной области легкой цепи по SEQ ID NO: 8-10.
Полученное мАи антитело АИ-К11В связывается с опиоидными рецепторами клеток глиобластомы человека линии T98G. АИ-К11В при иммунизации кролика индуцирует выработку Ab3 антител, которые связывают 6-гемисукцинильный (ГСМ), 3-О-карбоксиметильный (КММ) и 2-р-карбокси-фенилазометильный (ФАМ) эфиры морфина, конъюгированные с БСА с помощью бифункционального реагента 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорида по методикам, описанным в статье: Берзина А.Г., Гамалея Н.Б., Ульянова Л.И, Шестаков К.А., Ульянова М.А., Капанадзе К.Д., Станкова Н.В., Ревякин А.О., Фокин Ю.В., Кротов Г.И., Родченков Г.М. Методологические подходы к разработке вакцины для лечения зависимости от опиатов // Наркология, 2015; 11(167):25-31.
Технология получения антитела включала в себя иммунизацию животных антигеном, представляющим собой мАт 3К11, коньюгированное с гемоцианином лимфы улитки (KLH) по методике, описанной в: Hermanson G.T. Bioconjugate Techniques. ISBN 9780123705013, Academic Press Inc., 2008.
Для отбора позитивных продуцентов мАи антител при постановке иммуноферментного анализа (ИФА) использовали в качестве сорбированного на планшетах антигена мАт 3К11, на последней стадии анализа детекцию специфических антител проводили конъюгатом 3К11-пероксидаза хрена.
Свойства и структура антитела иллюстрируются следующими графическими материалами:
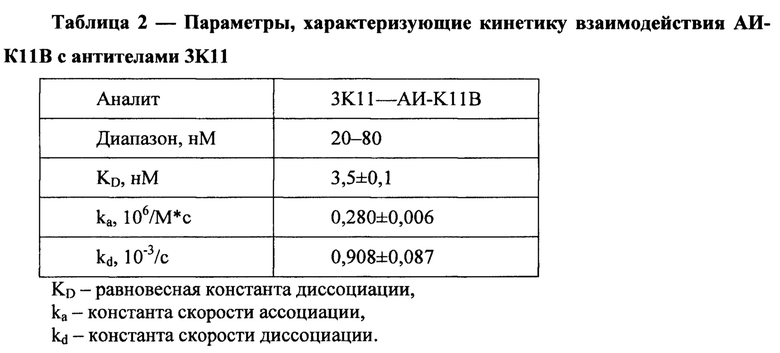
На Фиг. 1 представлены результаты электрофореза в 4-20% полиакриламидном геле мышиного моноклонального антитела АИ-К11В;
а - восстанавливающие условия;
б - маркеры молекулярного веса (кД);
в - невосстанавливающие условия.
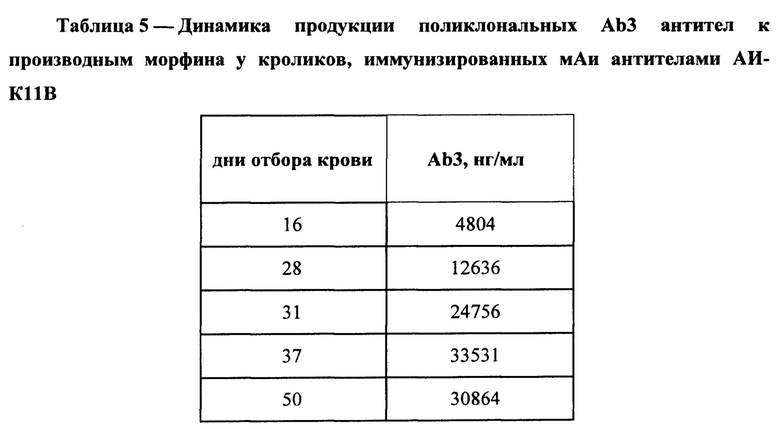
На Фиг. 2 представлена кривая конкурентного подавления антителами АИ-К11В связывания конъюгата мАт 3К11 - пероксидаза хрена с производным морфина КММ-БСА.
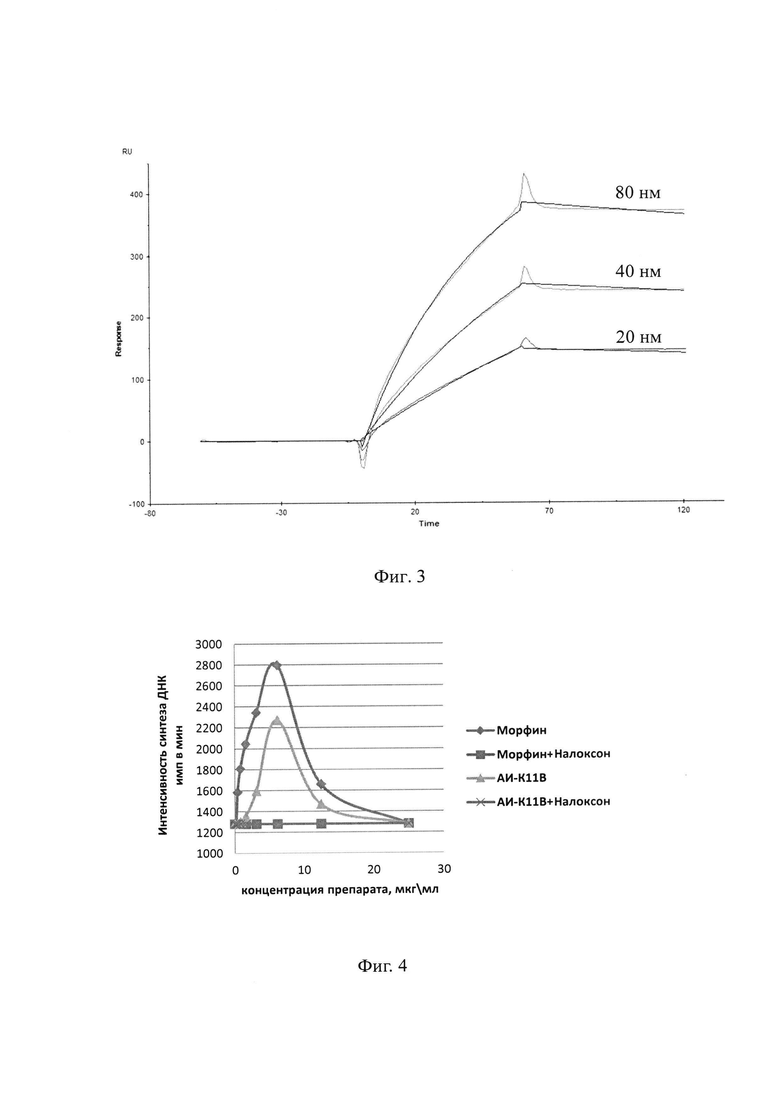
На Фиг. 3 представлены сенсограммы связывания 20, 40 и 80 нМ АИ-К11В с СМ5-чипом, на котором сорбированы антитела к мышиным IgG, после пропускания 80 нМ 3К11В. По оси абсцисс время в секундах, по оси ординат ответ (RU).
На Фиг. 4 демонстрируется влияние АИ-К11В и морфина на интенсивность синтеза ДНК (имп/мин), отражающую пролиферативную активность в культурах клеточной линии глиобластомы человека T98G в условиях свободного и сочетанного с налоксоном действия.
Сущность и промышленная применимость изобретения поясняются следующими примерами:
Пример 1. Получение антигенов для иммунизации и скрининга гибридом, иммунизация мышей и отбор гибридомы АИ-К11В.
Пример 1.1. Получение антигена. Для иммунизации использовали конъюгат гемоцианина лимфы улитки (KLH) с моноклональными антителами 3К11 (3K11-KLH), приготовленный по ранее описанной методике [Hermanson Greg Т., Bioconjugate Techniques. ISBN 0-12-342336-8, Academic Press Inc., 1996]. При постановке ИФА использовали антитела 3К11, коньюгированные с пероксидазой хрена по описанной методике [там же]. Приготовленные конъюгаты мАт 3К11 аликвотировали и хранили при -80°С.
Пример 1.2. Иммунизация мышей и скрининг гибридомы. Мышей линии Balb/c иммунизировали полученным как описано в примере 1.1. препаратом 3K11-KLH. Для этого эмульгированный в полном адъюванте Фрейнда (ПАФ) антиген в дозе 10 мкг на мышь вводили в подошвенный апоневроз задних конечностей. На 30-й день после иммунизации животным вводили внутривенно 5 мкг мАт 3К11 в физиологическом растворе. На 4-й день после инъекции животных умерщвляли цервикальной дислокацией и выделяли спленоциты и лимфоциты паховых и брюшных лимфоузлов. Полученные клетки смешивали с клетками миеломы мыши линии SP 2/0 в соотношении 2:1. Гибридизацию клеток проводили в 50% растворе полиэтиленгликоля (ПЭГ) с молекулярной массой 1500 Да в течение 1,5 мин с последующим 4-кратным добавлением через 1 мин среды RPMI-1640 в объеме, равном объему раствора ПЭГ. После слияния клетки дважды отмывали культуральной средой и высевали в 96-луночные культуральные планшеты с суточными перитонеальными макрофагами (5⋅103 клеток на лунку) из расчета 5⋅104 клеток миеломы на лунку. Селекцию гибридов проводили в среде RPMI-1640 с добавлением 10% фетальной бычьей сыворотки (Sigma, США), содержащей: 4⋅10-4 М гипоксантина, 4⋅10-7 М аминоптерина и 1,6⋅10-5 М тимидина [Pandey S. Hybridoma technology for production of monoclonal antibodies // Int. J. Pharm. Sci. Res., 2010; 1:88-94].
Скрининг антител проводили с помощью ИФА, используя в качестве антигена для адсорбции на твердой фазе мАт 3К11. Связавшиеся антитела затем выявляли конъюгатом 3К11-пероксидаза хрена (Sigma, США), приготовленным по протоколу производителя.
Первичный отбор позитивных клонов проводили по связыванию секретеруемых антител с мАт 3К11, в качестве негативного контроля использовали мАт 6G1, связывающие ГСМ-БСА, и IgG-фракцию иммуноглобулинов мыши. Для этого в лунках полистирольных планшетов Corning (Sigma, США) в посадочном буфере (20 мМ боратный буфер, рН 8,0, содержащий 0,15 М NaCl) сорбировали одно из антител: мАт 3К11, 6G1 или IgG мыши с концентрацией 1,5 мкг/мл в течение 20 часов во влажной камере при комнатной температуре. По окончании сорбции планшеты отмывали промывочным буфером (посадочный буфер, содержащий 0,05% Tween-20). В лунки вносили 100 мкл промывочного буфера, содержащего 10% мышиной сыворотки и 50 мкл культуральной среды. Планшеты инкубировали 1 час при перемешивании при 37°С. Затем в промытый планшет вносили раствор коньюгата 3К11-пероксидаза хрена в концентрации 100 нг/мл. Планшеты инкубировали в течение 1 часа при перемешивании при 37°С, после чего тщательно отмывали и проводили окрашивание с помощью раствора субстрата тетраметилбензидина (ХЕМА, Россия).
Для подтверждения специфичности мАи антител из отобранных позитивных клонов к мАт 3К11 проводили конкурентный ИФА. В лунки полистирольных планшетов Corning (Costar) вносили 5 мкг/мл КММ-БСА в 20 мМ боратном буфере с рН 8,0, содержащем 0,15 М NaCl, и инкубировали в течение 20 часов во влажной камере. По окончании сорбции планшеты отмывали промывочным буфером (20 мМ боратный буфер с рН8,0, содержащий 0,15 М NaCl и 0,05% Tween-20). Предварительно мАи антитела в концентрации 0; 6,25; 12,5; 25; 50; 100 и 200 нг/мл инкубировали в течение 30 мин при комнатной температуре с коньюгатом 3К11-пероксидаза хрена в концентрации 200 нг/мл, а затем вносили в каждую лунку по 100 мкл полученных растворов. Результаты конкурентного анализа представлены на Фиг. 2.
На основе проведенного скрининга был отобран клон sAИ-К11B, продуцирующий специфические антитела к мАт 3К11. Свойства моноклонального антитела АИ-К11В приведены в Таблице 1. Представлены данные по изотипу моноклонального антитела АИ-К11В и специфичности к IgG-мыши, мАт 3К11 и мАт 6G1.

В результате последующего культивирования, криоконсервирования и контроля чистоты клеток был получен штамм гибридомы sAИ-К11B, продуцент моноклонального антитела АИ-К11В.
Пример 2. Исследование свойств моноклонального антитела АИ-К11В.
Пример 2.1. Очистка мАт АИ-К11В.
Антитело АИ-К11В выделяли из асцитной жидкости мышей линии Balb/c с внутрибрюшинно привитой гибридомой sAИ-К11В методом гельпроникающей хроматографии на сорбенте HW-65S (TosoHaas, Japan) согласно инструкции.
Пример 2.2. Изучение молекулярных свойств антитела АИ-К11В.
Обсчет, проведенный по результатам электрофореза в 4-20% полиакриламидном геле с додецилсульфатом натрия, показал, что молекулярная масса основной части препарата антител АИ-К11В в невосстанавливающих условиях составляет около 800 кДа, т.е. представлена пентамером иммуноглобулина класса IgM (Фиг. 1в), в то время как в восстанавливающих условиях антитело диссоциирует на тяжелую (70 кДа) и легкую (25 кДа) цепи (Фиг. 1а). Изотип антитела АИ-К11В, установленный с помощью набора «Mouse monoclonal antibody isotyping reagents» (Sigma, США), - IgM. Препараты очищенного антитела АИ-К11B использовали для изучения его биологических свойств.
Пример 2.3. Исследование биологических свойств моноклонального антитела АИ-К11В.
Пример 2.3.1. Аффинность взаимодействия антиидиотипического антитела АИ-К11В с идиотипом антитела 3К11 оценивали методом поверхностного плазмонного резонанса с использованием анализатора BiaCore X100 и стандартных СМ5 чипов (GE Healthcare, Австрия). Чип с антителами к IgG мыши был получен с помощью Mouse Antibody Capture Kit (GE Helthcare - BR100838) согласно инструкции производителя: на оптический сенсор СМ5 были иммобилизованы антитела к IgG мыши с помощью метода амидной иммобилизации. Чип активировали эквимолярной смесью N-этил-N'-диметиламинопропилкарбодиимида и N-гидроксисукцинимида (0,2 М), затем со скоростью 5 мкл/мин в течение 18 минут инъецировали раствор антител к IgG мыши (20 мкг/мл) в 10 мМ натрий-ацетатном буфере, рН 5,0. Затем свободные группы чипа блокировали 1 М этаноламином, рН 8,5.
Исследование взаимодействия АИ-К11В с 3К11 проводили в буфере HBS-P+ (150 мМ NaCl, 10 мМ Hepes-NaOH, рН 7,5, 0,05% полиоксиэтиленсорбитан) по следующей схеме: чип с антителами к IgG мыши уравновешивали буфером HBS-P 1 минуту. Затем 1,5 минуты над чипом пропускали антитела 3К11 с концентрацией 80 нМ. Чип промывали в течение 3 минут и наносили 1 минуту АИ-К11В. Чип повторно промывали 3 минуты и проводили 1 минуту десорбции с помощью 10 мМ Gly-HCl, рН 1,7. После 3 циклов с последовательным увеличением концентрации АИ-К11В 20, 40 и 80 нМ рассчитывали равновесную константу диссоциации (KD) антител 3К11 и АИ-К11В. Полученные результаты представлены в Таблице 2 и на Фиг. 3.
Пример 2.3.2. Изучение биологической активности моноклональных антител АИ-К11В проводили на модели пролиферативной реакции перевиваемой клеточной линии глиобластомы человека T98G in vitro. На поверхности клеток этой линии выявлено присутствие большого количества μ- и κ-опиоидных рецепторов и незначительного количества δ-опиоидных рецепторов [Lazarczyk М., Matyja Е., Lipkowski A.W. А comparative study of morphine stimulation and biphalin inhibition of human glioblastoma T98G cell proliferation in vitro // Peptides, 2010; 31:1606-1612].
На Фиг. 4 представлены данные по стимуляции морфином и АИ-К11В синтеза ДНК в культуре клеток. Показано нейтрализующее действие налоксона при совместном введении препаратов.
Как видно из полученных данных, мАт клона sAИ-К11B, как и морфин, обладает способностью усиливать синтез ДНК в культуре клеточной линии глиобластомы человека T98G. Этот эффект блокируется действием налоксона, который при совместном введении полностью устраняет стимулирующий эффект. Следует отметить, что блокада действия морфина налоксоном осуществляется на уровне опиоидных рецепторов, присутствующих на культивируемых клетках. Следовательно, мАт АИ-К11В также способно связываться с опиатными рецепторами.
Пример 2.3.3. Изучение иммуногенных свойств мАи АИ-К11В на кроликах породы Советская шиншилла. В Таблице 3 схематично представлен способ иммунизации кролика мАи антителами АИ-К11В для получения Ab3 антител.

Определение специфичности Ab3 в сыворотке крови кроликов проводили методом ИФА. В качестве антигенов использовали: КММ-БСА, ФАМ-БСА, ГСМ-БСА, БСА как негативный контроль, которые иммобилизовали на дно лунок планшетов для ИФА путем инкубации 10 мкг/мл белка в 20 мМ боратном буфере, рН 8,0, содержащем 0,15 М NaCl (посадочный буфер), в течение 20 часов при комнатной температуре. По окончании сорбции планшеты отмывали промывочным буфером (посадочный буфер, содержащий 0,05% Tween-20) и в лунки вносили по 100 мкл тестируемых Ab3 антител кролика. Планшеты инкубировали в течение 1 часа при перемешивании при 37°С. Затем в трижды промытый планшет вносили растворы конъюгата пероксидазы хрена с антивидовыми антителами козы против иммуноглобулинов кролика или мыши (Sigma, США) с концентрацией 0,5 мкг/мл. Планшеты инкубировали в течение 1 часа при перемешивании при 37°С, после чего тщательно отмывали и проводили окрашивание с помощью раствора субстрата тетраметилбензидина (ХЕМА, Россия).
Установлено, что Ab3 антитела кролика, вакцинированного мАи антителом АИ-К11В, специфичны ко всем тестируемым производным морфина (Таблица 4).

Для определения временной динамики образования антител кровь из ушной вены кроликов отбирали на 16, 28, 31, 37 и 50 дни после последней иммунизации. Уровень антител Ab3 в сыворотке крови кроликов определяли методом ИФА. В этом варианте анализа на дне лунок планшетов для ИФА иммобилизовали смесь конъюгатов КММ-БСА, ФАМ-БСА и ГСМ-БСА путем инкубации раствора, содержащего в посадочном буфере по 5 мкг/мл каждого конъюгата в течение 20 часов. По окончании сорбции антигена планшеты отмывали промывочным буфером и в лунки вносили по 100 мкл тестируемых сывороток кролика, которые предварительно готовили в виде десятикратных серийных разведений. В качестве стандарта для определения концентрации специфических антител в сыворотках иммунных животных использовали выделенные с помощью иммуноаффинной хроматографии антитела Ab1 кролика, иммунизированного конъюгатами КММ-БСА и ГСМ-БСА. Все дальнейшие стадии анализа совпадали с завершающими стадиями при определении специфичности антител. По калибровочной кривой зависимости интенсивности OD450 от концентрации антител с учетом разведения определяли содержание Ab3 в сыворотке. Результаты динамики продукции Ab3 у кроликов, иммунизированных АИ-К11В, представлены в Таблице 5.
Пример 3. Синтез и секвенирование ДНК, кодирующей вариабельные части легкой и тяжелой цепей моноклонального антитела АИ-К11В.
Из клеток гибридомы sАИ-К11В выделяли РНК, на матрице которой с помощью наборов синтетических праймеров (Immunogenetics Information System http://www.imgt.org) были амплифицированы фрагменты ДНК, кодирующие вариабельные области тяжелой (VH) и легкой (VL) цепей антитела. Полученные фрагменты ДНК были клонированы в вектор pAL-ТА (Евроген) и секвенированы с использованием внешних праймеров (М13). Последовательности фрагментов ДНК, кодирующих VH и VL, представлены на SEQ ID NO: 1 и SEQ ID NO: 2, вычисленные аминокислотные последовательности VH и VL представлены на SEQ ID NO: 3 и SEQ ID NO: 4. Анализ последовательностей аминокислот вариабельных областей тяжелой и легкой цепей моноклонального антитела 3К11 производили по Кэботу (Kabat Е.А., Wu Т.Т., Perry Н., Gottesman К. and Foeller С. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition. NIH Publication №91:3242), что позволило выделить участки CDR, определяющие комплементарность антитела антигену (Таблица 5).
Моноклональное антитело АИ-К11В по настоящему изобретению может служить основой для создания химерных и гуманизированных антител, пригодных для создания вакцины и лекарственных препаратов, блокирующих биологическую активность морфина.
Заявители просят рассмотреть представленные материалы заявки «Моноклональное антиидиотипическое антитело АИ-К11В, обладающее антигенными свойствами морфина» на предмет выдачи патента РФ на изобретение.
| название | год | авторы | номер документа |
|---|---|---|---|
| Моноклональное антиидиотипическое антитело АИ-G1, обладающее антигенными свойствами морфина | 2019 |
|
RU2717989C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО 3К11 К ПРОИЗВОДНЫМ МОРФИНА | 2018 |
|
RU2702002C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО 6G1 К ПРОИЗВОДНЫМ МОРФИНА | 2018 |
|
RU2703494C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО СС3-4 К КОНФОРМАЦИОННОМУ ЭПИТОПУ С3 ЧЕЛОВЕКА, ШТАММ ГИБРИДНОЙ ДНК МЫШИ РККК(П)764Д - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА СС3-4 | 2015 |
|
RU2584582C1 |
| ИММУНОГЕН ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАВИСИМОСТИ ОТ ОПИАТОВ | 2013 |
|
RU2548802C1 |
| Моноклональное антитело к С-концевому фрагменту антимюллерова гормона | 2021 |
|
RU2770003C1 |
| Моноклональное антитело к С-концевому фрагменту антимюллерова гормона | 2021 |
|
RU2764795C1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К С-КОНЦЕВОМУ ФРАГМЕНТУ АНТИМЮЛЛЕРОВА ГОРМОНА | 2018 |
|
RU2765689C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СВЯЗЫВАЮЩЕЕСЯ С ГЛИКОПРОТЕИНОМ ВИРУСА ЭБОЛА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО, И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ | 2015 |
|
RU2630304C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СВЯЗЫВАЮЩЕЕСЯ С ГЛИКОПРОТЕИНОМ ВИРУСА ЭБОЛА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО, И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ | 2015 |
|
RU2639533C2 |







Изобретение относится к антителам, имитирующим морфин-специфические антигенные свойства и способным связываться с опиоидными рецепторами. Полученное моноклональное антитело АИ-К11В связывается с опиатными рецепторами и индуцирует при иммунизации антитела, специфически распознающие производные морфина. 2 з.п. ф-лы, 6 табл., 3 пр., 4 ил.
1. Моноклональное антитело АИ-К11В против антитела к производным морфина, обладающее антигенными свойствами морфина и содержащее гипервариабельные участки тяжелой цепи с последовательностями SEQ ID NO: 5-7 и гипервариабельные участки легкой цепи с последовательностями SEQ ID NO: 8-10.
2. Моноклональное антитело по п. 1, имеющее последовательность вариабельной области тяжелой цепи по SEQ ID NO: 3 и последовательность вариабельной области легкой цепи по SEQ ID NO: 4.
3. Моноклональное антитело по п. 2, кодируемое ДНК, содержащей последовательности нуклеотидов по SEQ ID NO: 1 и SEQ ID NO: 2.
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО 3К11 К ПРОИЗВОДНЫМ МОРФИНА | 2018 |
|
RU2702002C1 |
| KASHANIAN S | |||
| et al., Preparation and Characterization of Monoclonal Antibody against Digoxin, Hybridoma and Hybridomics, 2002, Vol.21, N5, pp.375-379 | |||
| ТРОФИМОВ А.В | |||
| и др., Антиидиотипические моноклональные антитела к морфину: получение, свойства и перспективы использования, Биомедицина, 2019, т.15, н.2, стр.63-68 | |||
Авторы
Даты
2021-03-24—Публикация
2020-03-03—Подача