Предлагаемое изобретение относится к области органической химии, а именно, к химии энергоемких гетероциклических соединений, конкретно, к новым, неописанным в литературе, замещенным [(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразанам, общей формулы:
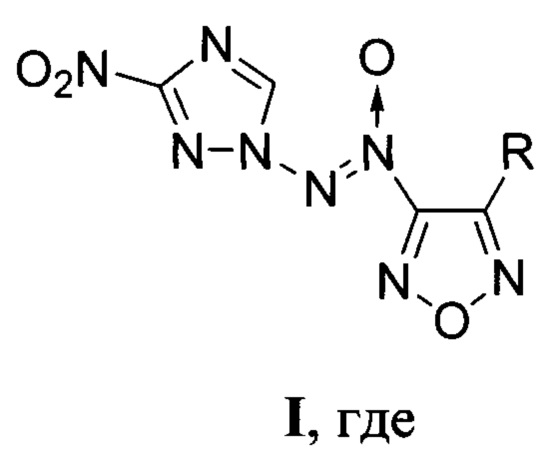
R=NH2 (Ia), NO2 (Iб), 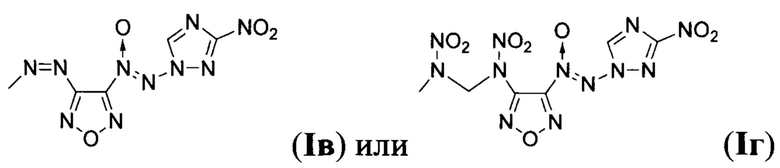
и к способу их получения
Соединения общей формулы I могут найти применение в качестве окислителей и энергоемких наполнителей смесевых твердых ракетных топлив.
В литературе описаны два структурно аналогичных 4-[арил-ONN-азокси]-4H-1,2,4-триазола (по данным базы SciFinder CAS American Chemical Society), общей формулы II:
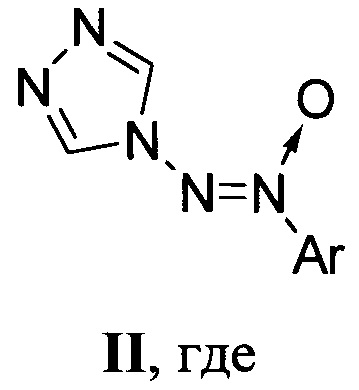
Ar=2-MeC6H4 (IIa), 2,4,6-Cl3C6H2 (IIб).
(R.М. Moriarty, Т.Е. Hopkins, I. Prakash, В.K. Vaid, R.K. Vaid, "Hypervalent Iodine Oxidation of Amines in the Presence of Nitroso Compounds: A Method for the Preparation of Unsymmetrically Substituted Azoxy Compounds", Synth. Commun., 1990, 20, 2353-2357; С.E. Семенов, A.M. Чураков, Л.Ф. Чертанова, Ю.А. Стреленко, С.Л. Иоффе, В.А. Тартаковский, "Синтез 1-(2,4,6-трихлорфенил)-2-(1,2,4-триазол-4-ил)диазен-1-оксида", Изв. АН, Сер. Хим., 1992, 41, 362-364).
Описанные структурно аналогичные 4-[арил-ONN-азокси]-4H-1,2,4-триазолы II не являются высокоэнергетическими соединениями.
Также в литературе описано аналогичное высокоэнергетическое производное фуразана (по данным базы SciFinder CAS American Chemical Society), формулы III:
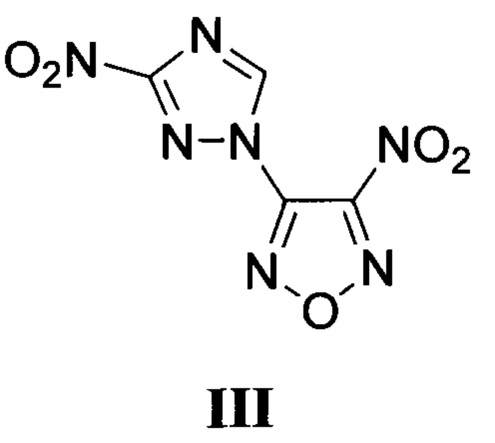
(WO 2008/102092, 28.08.2008; RU 2453545 C2, 20.06.2012).
Описанное структурно аналогичное производное фуразана III характеризуется невысокой энтальпией образования, что делает малоэффективным применение соединения III в качестве компонента твердых ракетных топлив.
Технической задачей предполагаемого изобретения является изыскание соединений ряда [(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]фуразанов, характеризующихся высоким энергетическим потенциалом, а также разработка способа их получения.
Поставленная техническая задача достигается новыми неописанными в литературе замещенными [(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]-фуразанами общей формулы:
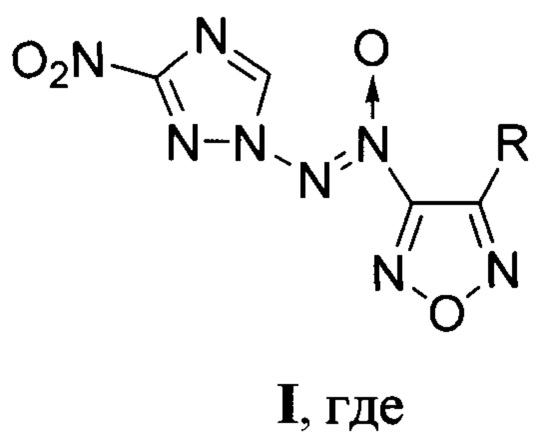
R=NH2 (Ia), NO2 (Iб), 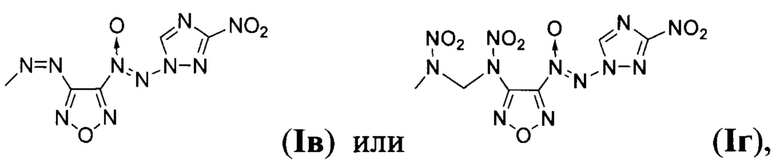
и способом их получения.
Предлагаемые соединения общей формулы I являются первыми высокоэнергетическими веществами, содержащими в своей молекуле как азоксигруппу, связанную с атомом азота пятичленного гетероцикла, так и другие эксплозофорные заместители.
Известные 4-[арил-ONN-азокси]-4H-1,2,4-триазолы II также содержат азоксигруппу, связанную с атомом азота пятичленного гетероцикла, но не являются высокоэнергетическими веществами, так как не содержат в своей молекуле эксплозофорных заместителей.
Известный 3-нитро-4-(3-нитро-1H-1,2,4-триазол-1-ил)фуразан (III) содержит эксплозофорные фрагменты (нитротриазол и нитрофуразан), но не содержит в своей молекуле азоксигруппу и характеризуется невысокой энтальпией образования, что делает малоэффективным применение соединения III в качестве компонента твердых ракетных топлив.
Предлагаемые соединения общей формулы I в отличие от соединений II и III характеризуется наличием в одной молекуле как энергоемкой азоксигруппы, связанной с атомом азота триазольного цикла, так и других эксплозофорных заместителей, таких как азо- и метилендинитраминовая группы, что обеспечивает более высокую энтальпию образования и улучшенный кислородный баланс данных соединений.
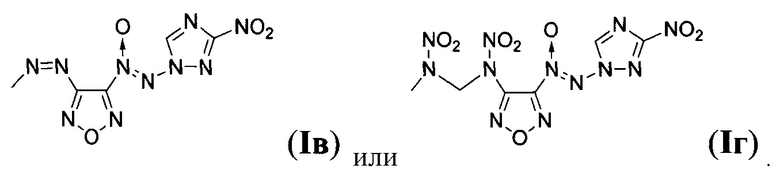
Предложен также способ получения замещенных 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразанов общей формулы I заключающийся в том, что 1-амино-3-нитро-1H-1,2,4-триазол (IV) подвергают взаимодействию с 2,2,2-трифтор-N-(4-нитрозофуразан-3-ил)ацетамидом (V) и дибромизоциануратом (ДБИ) в апротонном органическом растворителе при пониженной температуре, полученный при этом 2,2,2-трифторо-N-{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}ацетамид (VI) обрабатывают кислотой в полярном протонном органическом растворителе в присутствии воды, образующийся при этом 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразан (Ia) выделяют либо, в случае получения 3-нитро-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Iб), Ia подвергают взаимодействию с избытком азотного ангидрида в апротонном органическом растворителе при пониженной температуре, либо, в случае получения 3,3-(E)-диазен-1,2-диилбис{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]фуразана} (Iв), Ia обрабатывают перманганатом калия в водном растворе соляной кислоты, либо, в случае получения N,N'-динитро-N,N'-бис{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (Iг), Ia подвергают взаимодействию с формальдегидом в среде апротонного органического растворителя в присутствии кислоты и полученный при этом N,N'-бис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамин (VII) обрабатывают азотным ангидридом в апротонном органическом растворителе при пониженной температуре с последующим выделением N,N'-динитро-N,N'-бис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (Iг).
Процессы получения целевых продуктов Ia, Iб, Iв и Iг протекают по следующей схеме:
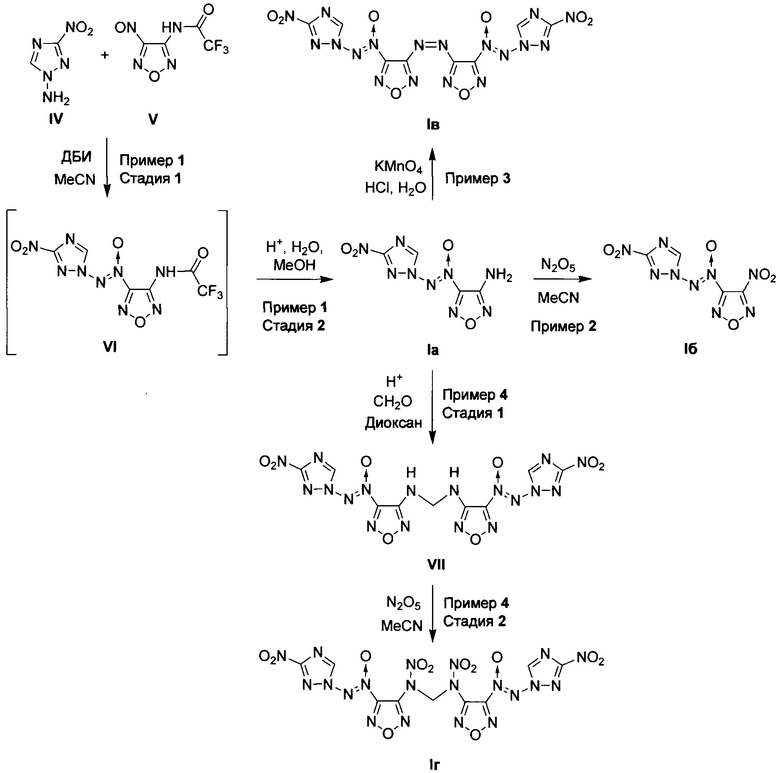
В качестве апротонного органического растворителя на стадии получения 2,2,2-трифторо-N-{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}ацетамида (VI) используют, например, ацетонитрил. Процесс проводят при температуре от 0 до 25°С.
В качестве полярного протонного органического растворителя на стадии получения 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Ia) используют, например, метанол, а в качестве кислоты, например, трифторуксусную кислоту. Процесс проводят при температуре от 0 до 25°С. В качестве апротонного органического растворителя на стадии получения 3-нитро-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Iб) используют, например, ацетонитрил. Процесс проводят при температуре от -20 до 5°С.
На стадии получения 3,3-(E)-диазен-1,2-диилбис{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]фуразана} (Iв) процесс проводят при температуре от 40 до 60°С.
В качестве апротонного органического растворителя на стадии получения N,N'-бис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (VII) используют, например, диоксан, а в качестве кислоты, например, серную кислоту. Процесс проводят при температуре от 20 до 30°С.
В качестве апротонного органического растворителя на стадии получения N,N'-динитро-N,N'-бис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (Iг) используют, например, ацетонитрил. Процесс ведут при температуре от 0 до 5°С.
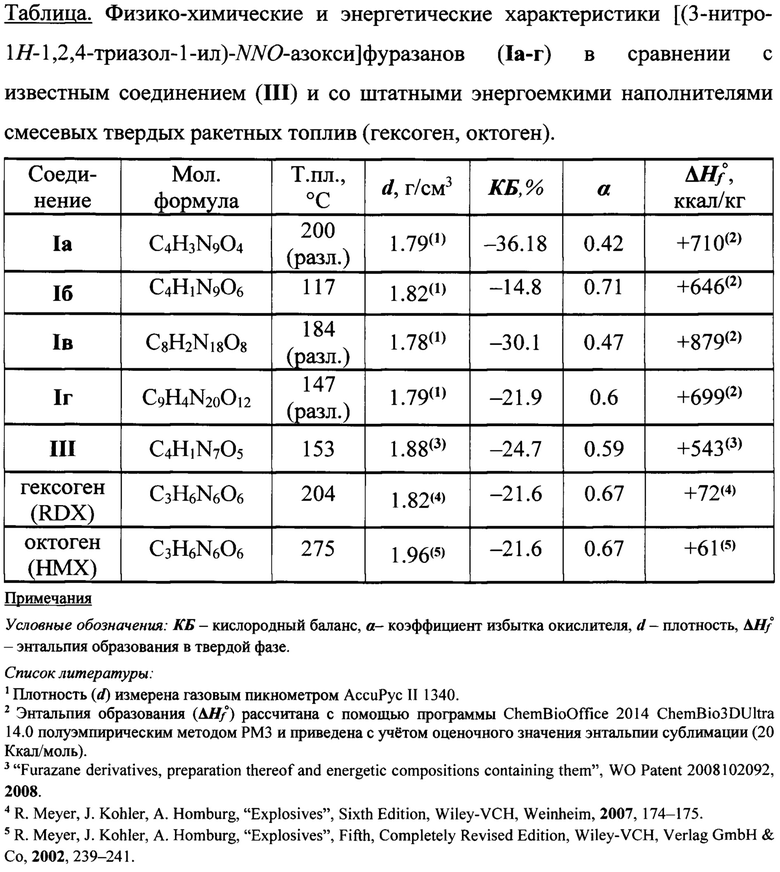
Техническим результатом настоящего изобретения является создание соединений нового типа [(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразанов общей формулы I, имеющих в своей структуре эксплозофорные триазольный и фуразановый циклы, соединенные N-азокси мостиком и разработка способа их получения. Соединения Ia-г по энтальпии образования, а соединение Iб и по коэффициенту избытка окислителя (α) значительно превосходят такие штатные энергоемкие наполнители смесевых твердых ракетных топлив, как гексоген (RDX) и октоген (НМХ). Соединения Ia-г имеют более высокую энтальпию образования, а в случае соединений Iб и Iг и более высокий коэффициент избытка окислителя (α) чем известное энергоемкое соединение III (см. Таблицу). Благодаря сочетанию высокой энтальпии образования, высокой плотности и оптимального содержания кислорода, соединения общей формулы I могут представить интерес в качестве окислителей и энергоемких наполнителей смесевых твердых ракетных топлив.
Исходный 1-амино-3-нитро-1H-1,2,4-триазол (IV) получен из 3-нитро-1H-1,2,4-триазола по опубликованной методике (P. Yin, J. Zhang, С.Не, D.А. Parrish, J.М. Shreeve, "Polynitro-substituted pyrazoles and triazoles as potential energetic materials and oxidizers", J. Mater. Chem. A, 2014, 2, 3200-3208). Исходный 2,2,2-трифтор-N-(4-нитрозофуразан-3-ил)ацетамид (V) получен из 3-амино-4-нитрозофуразана по опубликованной методике (Л.В. Батог, В.Ю. Рожков, Е.В. Шатунова, М.И. Стручкова, "Синтез и превращения 4-амино-4'-(4-нитро-1Н-1,2,3-триазол-1-ил)- и 4-амино-4'-(1,2,3-триазоло[4,5-с]-1,2,5-оксадиазол-5-ил)-3,3'-(NNO)-азокси-1,2,5-оксадиазолов", Изв. АН, Сер. Хим., 2008,57, 159-163).
Исходный дибромизоцианурат (ДБИ) получен из циануровой кислоты по опубликованной методике (W. Gottardi, "Reaction of bromine with alkali cyanurates", Monatsh. Chem., 1967, 98, 507-512).
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1.
Стадия 1. Получение 2,2,2-трифторо-N-{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}ацетамида (VI).
К раствору 2,2,2-трифтор-N-(4-нитрозофуразан-3-ил)ацетамида (V) (10.10 г, 48.1 ммоля) в сухом MeCN (55 мл) при 0°С и перемешивании прибавили одной порцией ДБИ (14.90 г, 51.9 ммоля), а затем прибавили 1-амино-3-нитро-1Н-1,2,4-триазол (IV) (5.00 г, 38.4 ммоля) небольшими порциями в течение 10 мин. Полученную суспензию перемешивали при 0°С в течение 2 ч, осадок отфильтровали, промыли CH2Cl2 (2×15 мл) и фильтрат упарили досуха. Полученный сырой 2,2,2-трифторо-N-{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}ацетамид (VI) использовали на следующей стадии без дополнительной очистки.
Стадия 2. Получение 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Ia).
2,2,2-Трифторо-N-{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}ацетамид (VI), полученный на стадии 1, растворили в МеОН (40 мл), затем добавили воду (14 мл) и трифторуксусную кислоту (2.8 мл) и оставили на ночь при 0°С. Осадок отфильтровали, промыли AcOEt (3×5 мл), высушили в вакууме. Получили 5.4 г (58%) 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Ia) в виде желтых кристаллов. ДСК (5°С⋅мин-1): Тпл.=200°С, Тразл.=200°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 264.0205 [M+Na]+. C4H3N9O4. Вычислено: т/z: 264.0200 [M+Na]+. Пикнометрическая плотность 1.79 г/см3. ИК-спектр (KBr), ν/см-1: 3471 с, 3311 ср, 3157 ср, 1630 с, 1561 ср, 1519 с, 1427 ср, 1420 ср, 1383 сл, 1348 сл, 1304 ср, 1230 сл, 1216 сл, 1170 ср. Спектр ЯМР 1Н (ацетон-d6, δ, м.д., 500.13 МГц): 6.60 (уш. с, 2Н, NH2), 9.97 (с, 1Н, Н(5')). Спектр ЯМР 13С (ацетон-d6, δ, м.д., J/Гц, 125.76 МГц): 145.5 (С(5')), 150.7 (уш., С(3) или С(4)), 151.7 (уш. т, С(3) или С(4), J=5.6 Hz), 160.8 (уш., С(3')). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 36.14 МГц): -29 (C-NO2, 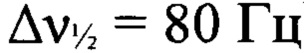 ), -74 (N(O)=N,
), -74 (N(O)=N, 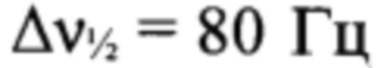 ), -135 (N-1' и N-4',
), -135 (N-1' и N-4', 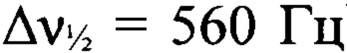 ), -340 (NH2,
), -340 (NH2, 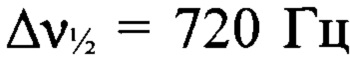 ). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 50.70 МГц): 27.7, -3.2 (атомы азота фуразанового цикла), -29.5 (С-NO2), -57.3 (N(O)=N), -74.2 (N(O)=N), -91 (N-2'), -136.7 (N-1' или N-4'), -137.8 (N-1' или N-4'), -333.4 (NH2).
). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 50.70 МГц): 27.7, -3.2 (атомы азота фуразанового цикла), -29.5 (С-NO2), -57.3 (N(O)=N), -74.2 (N(O)=N), -91 (N-2'), -136.7 (N-1' или N-4'), -137.8 (N-1' или N-4'), -333.4 (NH2).
Пример 2. Получение 3-нитро-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Iб).
К раствору 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Ia) (3.4 г, 14.1 ммоля), в сухом MeCN (30 мл) при -20°С прибавили при перемешивании N2O5 (15.23 г, 141.0 ммоль). Реакционную смесь нагрели до 0-5°С и выдержали при этой температуре в течение 14 суток. Затем реакционную смесь сконцентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент - петролейный эфир-AcOEt (3: 1)). Получили 2.44 г (64%) 3-нитро-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси] фуразана (Iб) в виде белых кристаллов. ДСК (5°С⋅мин-1): Тпл.=117°С, Тн.разл.=226°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 293.9930 [M+Na]+. C4HN9O6. Вычислено: m/z: 293.9942 [M+Na]+. Пикнометрическая плотность 1.82 г/см3. ИК-спектр (KBr), ν/cm-1: 1590 с, 1557 с, 1525 с, 1432 ср, 1386 сл, 1360 ср, 1301 с, 1243 сл, 1201 ср, 1162 сл, 1130 ср. Спектр ЯМР 1Н (ацетон-d6, δ, м.д., 600.13 МГц): 10.16 (с, 1Н, Н(5')). Спектр ЯМР 13С (ацетон-d6, δ, м.д., J/Гц, 150.90 МГц): 145.9 (С(5')), 151.4 (уш. с, С(4)), 155.3 (уш. т, С(3), J=20.5 Hz), 161.0 (уш., С(3')). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 43.37 МГц): -31 (C-NO2 (триазол), 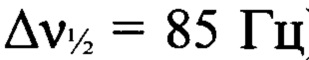 ), -41 (C-NO2 (фуразан),
), -41 (C-NO2 (фуразан), 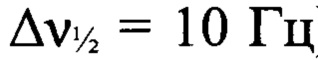 ), -88 (N(O)=N,
), -88 (N(O)=N, 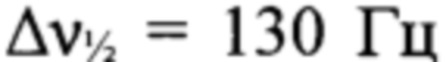 ). Спектр ЯМР 15N (ацетон-d6, **, м.д., 60.83 МГц): 44.0, 42.3 (атомы азота фуразанового цикла), -30.1 (C-NO2 (триазол)), -40.9 (C-NO2 (фуразан)), -48.6 (N(O)=N), -87.7 (N(O)=N), -91.0 (N-2'), -134.8 (N-1' или N-4'), -135.3 (N-1' или N-4').
). Спектр ЯМР 15N (ацетон-d6, **, м.д., 60.83 МГц): 44.0, 42.3 (атомы азота фуразанового цикла), -30.1 (C-NO2 (триазол)), -40.9 (C-NO2 (фуразан)), -48.6 (N(O)=N), -87.7 (N(O)=N), -91.0 (N-2'), -134.8 (N-1' или N-4'), -135.3 (N-1' или N-4').
Пример 3. Получение 3,3'-(E)-диазен-1,2-диилбис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана} (Iв).
К суспензии 3-амино-4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Ia) (1.5 г, 6 ммолей) в концентрированной соляной кислоте (25 мл) прибавили по каплям при перемешивании раствор перманганата калия (1.19 г, 7.5 ммоля) в воде (45 мл) в течение 1 ч. Реакционную массу нагрели до 55°С и перемешивали при этой температуре в течение 4 ч. Осадок отфильтровали, промыли водой (15 мл), AcOEt (4×6 мл), высушили в вакууме. Получили 1.4 г (94%) 3,3'-(E)-диазен-1,2-диилбис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана} (Iв) в виде светло-желтых кристаллов. ДСК (5°С⋅мин-1): Тн.разл.=184°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 479.0371 [М+Н]+. C8H2N18O8. Вычислено: m/z: 479.0376 [М+Н]+. Пикнометрическая плотность 1.78 г/см3. ИК-спектр (KBr), ν/см-1: 1571 с, 1523 с, 1502 ср, 1429 с, 1381 сл, 1295 с, 1240 сл, 1213 сл, 1162 с. Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., 600.13 МГц): 10.16 (с, 1Н, Н(5')). Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 150.90 МГц): 145.4 (С(5')), 153.5 (С(3) или С(4)), 156.8 (С(3) или С(4)), 159.5 (С(3')). Спектр ЯМР 14N (ДМСО-d6, δ, м.д., 43.37 МГц): -27 (C-NO2, 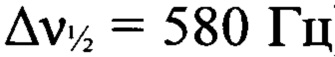 ), -79 (N(O)=N,
), -79 (N(O)=N, 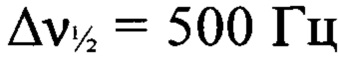 ). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 60.83 МГц): 143.4 (N=N), 35.4, 31.1 (атомы азота фуразанового цикла), -29.5 (C-NO2), -50.4 (N(O)=N), -81.1 (N(O)=N), -91.5 (N-2'), -135.6 (N-1' или N-4'), -135.9 (N-Г или N-4').
). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 60.83 МГц): 143.4 (N=N), 35.4, 31.1 (атомы азота фуразанового цикла), -29.5 (C-NO2), -50.4 (N(O)=N), -81.1 (N(O)=N), -91.5 (N-2'), -135.6 (N-1' или N-4'), -135.9 (N-Г или N-4').
Пример 4.
Стадия 1. Получение N,N'-бис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (VII).
К раствору 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Ia) (1.0 г, 4.1 ммоля) в диоксане (7 мл) прибавили при перемешивании 37%-ный формалин (0.15 мл, 5.7 ммоль) и 96%-ную H2SO4 (0.66 мл, 11.9 ммоля) и перемешивали полученную смесь при 20°С в течение 40 мин. Затем реакционную смесь вылили в воду (20 мл) и экстрагировали AcOEt (4×20 мл). Объединенный органический слой промыли водой (10 мл), насыщенным водным раствором хлорида натрия (10 мл), сушили над сульфатом магния и сконцентрировали в вакууме. Остаток кипятили в CH2Cl2, осадок отфильтровали. Получили 0.98 г (96%) N,N'-бис{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (VII) в виде желтых кристаллов, т.пл. 212-214°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 517.0508 [M+Na]+. C9H6N18O8. Вычислено: m/z: 517.0508 [M+Na]+. ИК-спектр (KBr), ν/cm-1: 3418 ср, 3399 ср, 3169 сл, 1612 с, 1562 с, 1534 ср, 1515 с, 1497 ср, 1421 с, 1403 ср, 1367 ср, 1301 с, 1236 сл, 1211 сл, 1174 с, 1115 ср, 1064 сл. Спектр ЯМР 1Н (ацетон-d6, δ, м.д., J/Гц, 500.13 МГц): 5.26 (т, 2Н, СН2, J=5.0 Гц), 7.38 (т, 1Н, NH, J=5.5 Гц), 9.96 (с, 1Н, Н(5')). Спектр ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц, 600.13 МГц): 5.00 (т, 2Н, СН2, J=5.7 Гц), 7.54 (т, 1Н, NH, J=5.5 Гц), 10.05 (с, 1Н, Н(5')). Спектр ЯМР 13С (ацетон-d6, δ, м.д., 125.76 МГц): 54.9 (СН2), 145.6 (С(5')), 150.5 (уш., С(4)), 151.0 (С(3)), 160.9 (уш., С(3')). Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 150.90 МГц): 53.8 (СН2), 145.2 (С(5')), 149.5 (С(4)), 150.0 (С(3)), 159.4 (С(3')). Спектр ЯМР 13С (без развязки протонов) (ДМСО-d6, δ, м.д., J/Гц, 150.90 МГц): 53.8 (т, СН2, J=153.2 Гц), 145.2 (д, С(5'), J=238.3 Гц), 149.5 (С(4)), 150.0 (С(3)), 159.4 (д, С(3'), J=14.4 Гц). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 36.14 МГц): -29 (C-NO2, 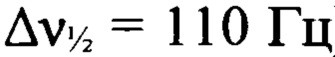 ), -76 (N(O)=N,
), -76 (N(O)=N, 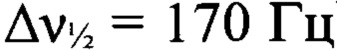 ). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 60.83 МГц): 27.7, -4.8 (атомы азота фуразанового цикла), -29.6 (C-NO2), -57.1 (N(O)=N), -75.8 (N(O)=N), -91.9 (N-2'), -136.4 (N-1' или N-4'), -137.7 (N-1' или N-4'), -316.1 (NH).
). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 60.83 МГц): 27.7, -4.8 (атомы азота фуразанового цикла), -29.6 (C-NO2), -57.1 (N(O)=N), -75.8 (N(O)=N), -91.9 (N-2'), -136.4 (N-1' или N-4'), -137.7 (N-1' или N-4'), -316.1 (NH).
Стадия 2. Получение N,N'-динитро-N,N'-бис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (Iг).
К раствору N,N'-бис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (VII) (1.0 г, 2 ммоля) в сухом MeCN (15 мл) при -20°С прибавили при перемешивании N2O5 (0.44 г, 4.1 ммоля). Реакционную смесь нагрели до 0°С и перемешивали при этой температуре в течение 1 ч. Реакционную смесь сконцентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент - петролейный эфир-AcOEt (2:1, затем 1.5:1)). Получили 0.7 г (59%) N,N'-динитро-N,N'-бис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (Iг) в виде бледно-желтых кристаллов. ДСК (5°С⋅мин-1): Тн.разл.=147°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 602.0654 [M+NH4]+. C9H4N20O12. Вычислено: m/z: 602.0656 [М+NH4]+. Пикнометрическая плотность 1.79 г/см3. ИК-спектр (KBr), ν/cm-1: 3178 сл, 1609 с, 1566 с, 1520 ср, 1425 ср, 1376 сл, 1285 с, 1245 сл, 1179 сл, 1109 сл, 1078 сл, 1043 сл. Спектр ЯМР 1Н (ацетон-d6, δ, м.д., 600.13 МГц): 6.99 (с, 2Н, СН2), 10.06 (с, 1Н, Н(5')). Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., 500.13 МГц): 6.84 (с, 2 Н, СН2,), 10.16 (с, 1 Н, Н(5')). Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 125.76 МГц): 64.9 (СН2), 145.3 (С(3)), 145.5 (С(5')), 153.9 (С(4)), 159.6 (С(3')). Спектр ЯМР 13С (без развязки протонов) (ДМСО-d6, δ, м.д., J/Гц, 125.76 МГц): 64.9 (т, СН2, J=165.1 Гц), 145.3 (С(3)), 145.5 (д, С(5'), J=240.4 Гц), 154.0 (С(4)), 159.6 (д, С(3'), J=14.4 Гц). Спектр ЯМР 14N (ацетон-d6, δ, м.д. 43.37 МГц): -31 (C-NO2, 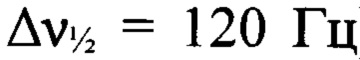 ), -44 (N-NO2,
), -44 (N-NO2, 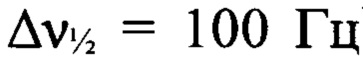 ), -83 (N(O)=N,
), -83 (N(O)=N, 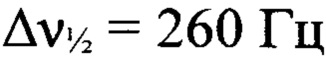 ). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 50.70 МГц): 40.9, 36.4 (атомы азота фуразанового цикла), -30.1 (C-NO2), -42.7 (N-NO2), -53.4 (N(O)=N), -82.3 (N(O)=N), -92.0 (N-2'), -135.4 (N-1' или N-4'), -137.0 (N-1' или N-4'), -208.2 (N-NO2).
). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 50.70 МГц): 40.9, 36.4 (атомы азота фуразанового цикла), -30.1 (C-NO2), -42.7 (N-NO2), -53.4 (N(O)=N), -82.3 (N(O)=N), -92.0 (N-2'), -135.4 (N-1' или N-4'), -137.0 (N-1' или N-4'), -208.2 (N-NO2).
| название | год | авторы | номер документа |
|---|---|---|---|
| Замещенные [(3,4-динитро-1H-пиразол-1-ил)-NNO-азокси]фуразаны и способ их получения | 2020 |
|
RU2756321C1 |
| Соли 3-амино-4-(1Н-тетразол-5-ил-NNO-азокси)фуразана и способы их получения | 2023 |
|
RU2804394C1 |
| 1,1'-(Е)-Диазен-1,2-диилбис[3-(нитро-NNO-азокси)-1Н-1,2,4-триазол] и способ его получения | 2022 |
|
RU2782118C1 |
| Замещенные (циано-NNO-азокси)фуразаны и способ их получения | 2021 |
|
RU2775006C1 |
| 7-Нитро-3-(нитро-NNO-азокси)[1,2,4]триазоло[5,1-с][1,2,4]триазин-4-амин и способ его получения | 2019 |
|
RU2697843C1 |
| 3-Амино-4-{ [4-(нитро-NNO-азокси)фуразан-3-ил]-NNO-азокси} фуразан и способ его получения | 2021 |
|
RU2768870C1 |
| 8,10-Динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксид и способ его получения | 2017 |
|
RU2643363C1 |
| 3-(ТРИНИТРОМЕТИЛ-ONN-АЗОКСИ)-4-НИТРАМИНОФУРАЗАНЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2485108C1 |
| СПОСОБ ПОЛУЧЕНИЯ [1,2,3,4]ТЕТРАЗИНО[5,6-е][1,2,3,4]ТЕТРАЗИН-1,3,6,8-ТЕТРАОКСИДА | 2015 |
|
RU2593993C1 |
| Производные 3-(5-нитратометил-1Н-1,2,3-триазол-1-ил)-4-нитро-1,2,5-оксадиазола и способ их получения | 2023 |
|
RU2817968C1 |
Изобретение относится к замещенным [(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразанам общей формулы I, которые могут найти применение в качестве окислителей и энергоемких наполнителей смесевых твердых ракетных топлив. В формуле I R=NH2 (Ia), NO2 (Iб),
Изобретение относится также к способу получения этих соединений, который заключается в том, что 1-амино-3-нитро-1H-1,2,4-триазол (IV) подвергают взаимодействию с 2,2,2-трифтор-N-(4-нитрозофуразан-3-ил)ацетамидом (V) и дибромизоциануратом (ДБИ) в апротонном органическом растворителе при пониженной температуре. Полученный при этом 2,2,2-трифторо-N-{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}ацетамид (VI) обрабатывают кислотой в полярном протонном органическом растворителе в присутствии воды. Образующийся при этом 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразан (Iа) выделяют. В случае получения 3-нитро-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Iб) соединение Ia подвергают взаимодействию с избытком азотного ангидрида в апротонном органическом растворителе при пониженной температуре. В случае получения 3,3-(Е)-диазен-1,2-диилбис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана} (Iв) соединение Ia обрабатывают перманганатом калия в водном растворе соляной кислоты. В случае получения N,N'-динитро-N,N'-бис{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (Iг) соединение Ia подвергают взаимодействию с формальдегидом в среде апротонного органического растворителя в присутствии кислоты и полученный при этом N,N'-бис{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамин (VII) обрабатывают азотным ангидридом в апротонном органическом растворителе при пониженной температуре с последующим выделением полученного при этом соединения Iг. Технический результат: более высокая энтальпия образования и улучшенный кислородный баланс соединений. 2 н. и 1 з.п. ф-лы, 1 табл., 4 пр.
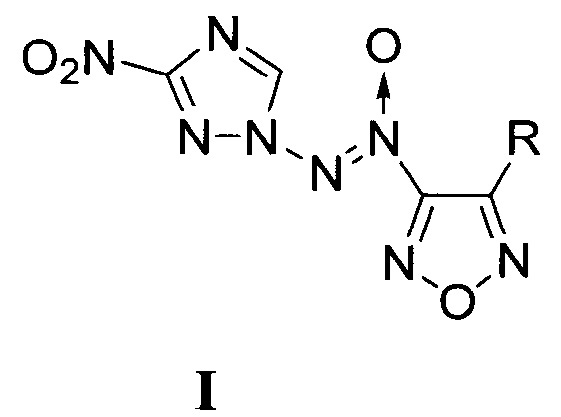
1. Замещенные [(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразаны общей формулы
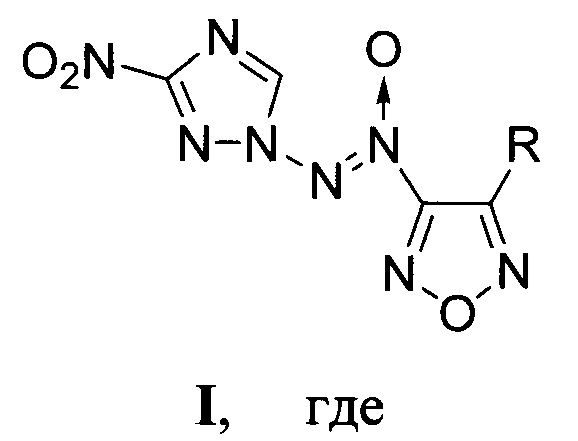
R = NH2 (Ia), NO2 (Iб), 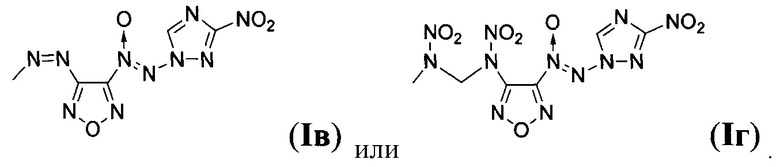
2. Замещенные [(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразаны общей формулы I по п. 1 в качестве окислителей и энергоемких наполнителей смесевых твердых ракетных топлив.
3. Способ получения замещенных 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразанов общей формулы I по п. 1, заключающийся в том, что 1-амино-3-нитро-1H-1,2,4-триазол (IV) подвергают взаимодействию с 2,2,2-трифтор-N-(4-нитрозофуразан-3-ил)ацетамидом (V) и дибромизоциануратом (ДБИ) в апротонном органическом растворителе при пониженной температуре, полученный при этом 2,2,2-трифторо-N-{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}ацетамид (VI) обрабатывают кислотой в полярном протонном органическом растворителе в присутствии воды, образующийся при этом 3-амино-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразан (Iа) выделяют, либо, в случае получения 3-нитро-4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана (Iб), соединение Ia подвергают взаимодействию с избытком азотного ангидрида в апротонном органическом растворителе при пониженной температуре, либо, в случае получения 3,3-(Е)-диазен-1,2-диилбис{4-[(3-нитро-1H-1,2,4-триазол-1-ил)-NNO-азокси]фуразана} (Iв), соединение Ia обрабатывают перманганатом калия в водном растворе соляной кислоты, либо, в случае получения N,N'-динитро-N,N'-бис{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамина (Iг), соединение Ia подвергают взаимодействию с формальдегидом в среде апротонного органического растворителя в присутствии кислоты и полученный при этом N,N'-бис{4-[(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]-фуразан-3-ил}метандиамин (VII) обрабатывают азотным ангидридом в апротонном органическом растворителе при пониженной температуре с последующим выделением полученного при этом соединения Iг.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| CN 108314660 A, 24.07.2018 | |||
| БИС(ФТОРДИНИТРОМЕТИЛ-ONN-АЗОКСИ)АЗОКСИФУРАЗАН И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2581050C1 |
| 7-Нитро-3-(нитро-NNO-азокси)[1,2,4]триазоло[5,1-с][1,2,4]триазин-4-амин и способ его получения | 2019 |
|
RU2697843C1 |
| СПОСОБ ПОЛУЧЕНИЯ [1,2,3,4]ТЕТРАЗИНО[5,6-е][1,2,3,4]ТЕТРАЗИН-1,3,6,8-ТЕТРАОКСИДА | 2015 |
|
RU2593993C1 |
| V.P.ZELENOV et al., 2-Alkyl-4-amino-5-(tert-butyl-NNO-azoxy)-2H-1,2,3-triazole 1-oxides: synthesis and reduction, RUSSIAN CHEMICAL BULLETIN, 2014, V.63, No.1, p.123-129. | |||
Авторы
Даты
2021-04-27—Публикация
2020-10-15—Подача